ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка заявляет приоритет согласно предварительной патентной заявке США № 61/396800, поданной 2 июня 2010 г, и предварительной патентной заявке США № 61/449513, поданное 4 марта 2011 г, содержание которых полностью включено в настоящий документ путем ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к способам и композициям для лечения рака мочевого пузыря посредством введения композиций, содержащих наночастицы, которые включают таксан и альбумин.
УРОВЕНЬ ТЕХНИКИ
Рак мочевого пузыря находится на пятом месте среди наиболее распространенных раков в Северной Америке. Рак мочевого пузыря без инвазии в мышечную оболочку трудно поддается лечению, и до 50 процентов пациентов, получающих лекарственные средства инфузией в мочевой пузырь (интравезикальные агенты), будут иметь рецидив рака. Типичным способом лечения второй линии для пациентов с высокой стадией рака мочевого пузыря без инвазии в мышечную оболочку, у которых стандартное интравезикальное лечение было неудачным, является хирургическое удаление мочевого пузыря целиком, цистэктомия. Однако, многим пациентам противопоказано хирургическое лечение, или они от него отказываются. По оценке американского онкологического общества (American Cancer Society) в 2009 г. в Соединенных Штатах приблизительно у 70980 человек был диагностирован рак мочевого пузыря, и около 18170 человек умерло от данного заболевания. Распространенность рака мочевого пузыря в Соединенных Штатах превышает 500000 человек.
Рак мочевого пузыря с метастазами лечат агентами на основе платины. Несмотря на исходную чувствительность к схемам химиотерапии на основе цисплатина, долгосрочная частота контроля запущенного или метастатического заболевания остается менее 5%. В настоящее время не существует стандартной химиотерапии второй линии для метастатического уротелиального рака, который ранее лечили с использованием схем на основе платины. В данном случае широко используются паклитаксел и доцетаксел, несмотря на то, что общая частота положительной реакции на лечение составляет менее 20%.
Частота рецидивов рака мочевого пузыря представляет собой дополнительную проблему при лечении рака мочевого пузыря. Например, до 50% пациентов, которых лечили с использованием БЦЖ (бациллы Кальметта-Герена) по поводу рака мочевого пузыря без инвазии в мышечную оболочку, будут иметь рецидив в течение 5 лет. Повторные курсы лечения с использованием БЦЖ являются неудачными с частотой до 80%. Частота положительной реакции на лечение с использованием современных интравезикальных лекарственных средств второй линии в среднем составляет менее 20%.
Таксаны (такие как паклитаксел и доцетаксел) представляют собой класс дитерпеноидных лекарственных средств, которые обладают противоопухолевой активностью в отношении целого ряда злокачественных опухолей человека. Паклитаксел первоначально был выделен из коры тиса, и было известно его действие, препятствующее нормальной функции разрушения микротрубочек. Паклитаксел связывается с β-субъединицами тубулина, строительными блоками микротрубочек, вызывая гиперстабилизацию структур микротрубочек. Получающаяся структура паклитаксел/микротрубочка неспособна разъединяться, что останавливает митоз и ингибирует ангиогенез.
Композиции наночастиц на основе альбумина были разработаны как система для доставки лекарственных средств, которые практически не растворяются в воде, таких как таксаны. См., например, патенты США №№ 5916596, 6506405, 6749868 и 6537579, а также патентные публикации США №№ 2005/0004002 и 2007/0082838. В технологии наночастиц на основе альбумина используются природные свойства белка альбумина транспортировать и доставлять практически не растворимые в воде лекарственные средства в область болезни. Указанные наночастицы легко включаются в собственные транспортные процессы в организме и способны использовать тяготение опухоли к альбумину, что делает возможной доставку более высоких концентраций активного лекарственного средства в наночастицах в область-мишень. Помимо этого, технология наночастиц на основе альбумина предлагает способность улучшать растворимость лекарственных средств без использования токсичных химических агентов, таких как растворители, в процессе введения, что потенциально улучшает безопасность путем устранения связанных с растворителями побочных эффектов.
Описание всех публикаций, патентов, патентных заявок и опубликованных патентных заявок целиком приводится в настоящем документе путем ссылок.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение в некоторых вариантах своего осуществления относится к способу лечения рака мочевого пузыря у индивидуума, который в этом нуждается, включающему введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие таксан и альбумин (далее в настоящем документе композиция также называется "композицией наночастиц" или "композицией наночастиц таксана"). В некоторых вариантах осуществления настоящего изобретения таксаном является паклитаксел. В некоторых вариантах осуществления настоящего изобретения таксаном является доцетаксел. В некоторых вариантах осуществления настоящего изобретения альбумин представляет собой человеческий сывороточный альбумин. В некоторых вариантах осуществления настоящего изобретения наночастицы включают паклитаксел (или доцетаксел), покрытый альбумином. В некоторых вариантах осуществления настоящего изобретения средний размер наночастиц в композиции наночастиц не превышает приблизительно 200 нм (например, менее чем приблизительно 200 нм). В некоторых вариантах осуществления настоящего изобретения композиция содержит композицию наночастиц паклитаксела, стабилизированных альбумином (Nab-паклитаксел ((Abraxane®)). В некоторых вариантах осуществления настоящего изобретения композиция представляет собой Nab-паклитаксел ((Abraxane®).
Таким образом, например, в некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря у индивидуума, который в этом нуждается, включающему введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие таксан и альбумин, в которой таксан покрыт альбумином. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря у индивидуума, который в этом нуждается, включающему введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие таксан и альбумин, где средний размер наночастиц в композиции наночастиц не превышает приблизительно 200 нм (например, менее чем приблизительно 200 нм). В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря у индивидуума, который в этом нуждается, включающему введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие таксан и альбумин, где таксан покрыт альбумином и где средний размер наночастиц в композиции наночастиц не превышает приблизительно 200 нм (например, менее, чем приблизительно 200 нм). В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря у индивидуума, который в этом нуждается, включающему введение индивидууму эффективного количества композиции, содержащей Nab-паклитаксел. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря у индивидуума, который в этом нуждается, включающему введение индивидууму эффективного количества Nab-паклитаксела. В некоторых вариантах осуществления настоящего изобретения композицию вводят внутривенно. В некоторых вариантах осуществления настоящего изобретения композицию вводят интравезикулярно.
Также разработаны способы комбинированной терапии для лечения рака мочевого пузыря. Так, в некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря у индивидуума, который в этом нуждается, включающему введение индивидууму (а) эффективного количества композиции, содержащей наночастицы, включающие таксан и альбумин; и (b) эффективного количества одного другого агента. Композицию наночастиц и другой агент можно вводить одновременно или последовательно. В некоторых вариантах осуществления настоящего изобретения композицию вводят параллельно. В некоторых вариантах осуществления настоящего изобретения таксан представляет собой паклитаксел. В некоторых вариантах осуществления настоящего изобретения таксан представляет собой доцетаксел. В некоторых вариантах осуществления настоящего изобретения альбумин представляет собой человеческий сывороточный альбумин. В некоторых вариантах осуществления настоящего изобретения наночастицы включают паклитаксел (или доцетаксел), покрытый альбумином. В некоторых вариантах осуществления настоящего изобретения средний размер наночастиц в композиции наночастиц не превышает приблизительно 200 нм (например, менее чем приблизительно 200 нм). В некоторых вариантах осуществления настоящего изобретения композиция содержит композицию наночастиц паклитаксела, стабилизированных альбумином (Nab-паклитаксел ((Abraxane®)). В некоторых вариантах осуществления настоящего изобретения композиция представляет собой Nab-паклитаксел ((Abraxane®).
В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря у индивидуума, который в этом нуждается, включающему введение индивидууму (а) эффективного количества композиции, содержащей наночастицы, включающие таксан и альбумин; и (b) эффективного количества агента на основе платины (такого как карбоплатин). В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря у индивидуума, который в этом нуждается, включающему введение индивидууму (а) эффективного количества композиции, содержащей наночастицы, включающие таксан и альбумин; и (b) эффективного количества антиметаболита (такого как нуклеозидный аналог, например, гемцитабин). В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря у индивидуума, который в этом нуждается, включающему введение индивидууму (а) эффективного количества композиции, содержащей наночастицы, включающие таксан и альбумин; (b) эффективного количества агента на основе платины (такого как карбоплатин) и (с) эффективного количества антиметаболита (такого как нуклеозидный аналог, например, гемцитабин). В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря у индивидуума, который в этом нуждается, включающему введение индивидууму (а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел, покрытый альбумином (такой как Abraxane®); (b) эффективного количества карбоплатина и (с) эффективного количества гемцитабина. В некоторых вариантах осуществления настоящего изобретения способ выполняют с использованием схемы вспомогательного лечения.
Рак мочевого пузыря, который можно лечить способами, описанными в настоящем документе, включает, без ограничения, рак мочевого пузыря с метастазами, рак мочевого пузыря без инвазии в мышечную оболочку или рак мочевого пузыря, рефрактерный к стандартным лекарственным средствам (таким как БЦЖ) или рецидивирующий после лечения стандартным лекарственным средством. В некоторых вариантах осуществления настоящего изобретения рак мочевого пузыря представляет собой рак мочевого пузыря без инвазии в мышечную оболочку, рефрактерный к БЦЖ. В некоторых вариантах осуществления настоящего изобретения рак мочевого пузыря представляет собой рак мочевого пузыря, рефрактерный к платине. В некоторых вариантах осуществления настоящего изобретения рак мочевого пузыря представляет собой уротелиальную карциному с метастазами, рефрактерную к платине. В некоторых вариантах осуществления настоящего изобретения лечение представляет собой лечение первой линии. В некоторых вариантах осуществления настоящего изобретения лечение представляет собой лечение второй линии.
В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря у индивидуума, который в этом нуждается, включающему интравезикулярное введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие таксан и альбумин. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря без инвазии в мышечную оболочку у индивидуума, который в этом нуждается, включающему интравезикулярное введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие таксан и альбумин. В некоторых вариантах осуществления настоящего изобретения у индивидуума наблюдается прогрессирование после более ранней терапии рака мочевого пузыря. В некоторых вариантах осуществления настоящего изобретения индивидуум является рефрактерным к более ранней терапии рака мочевого пузыря. В некоторых вариантах осуществления настоящего изобретения у индивидуума наблюдается рецидив рака мочевого пузыря. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря без инвазии в мышечную оболочку, рефрактерного к БЦЖ, у индивидуума, который в этом нуждается, включающему интравезикулярное введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие таксан и альбумин. В некоторых вариантах осуществления настоящего изобретения количество композиции наночастиц составляет от приблизительно 100 мг до приблизительно 600 мг, включая, например, количество от приблизительно 150 до приблизительно 500 мг (такое как приблизительно 500 мг). В некоторых вариантах осуществления настоящего изобретения композицию наночастиц вводят один раз в неделю.
В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря у индивидуума, который в этом нуждается, включающему внутривенное введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие таксан и альбумин. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря с метастазами (такого как метастатическая уротелиальная карцинома) у индивидуума, который в этом нуждается, включающему внутривенное введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие таксан и альбумин. В некоторых вариантах осуществления настоящего изобретения рак мочевого пузыря представляет собой рак мочевого пузыря, рефрактерный к платине. В некоторых вариантах осуществления настоящего изобретения рак мочевого пузыря представляет собой метастатическую уротелиальную карциному, рефрактерную к платине. В некоторых вариантах осуществления настоящего изобретения количество композиции наночастиц составляет от приблизительно 150 до приблизительно 350 мг/м2, такое как от приблизительно 260 до приблизительно 300 мг/м2. В некоторых вариантах осуществления настоящего изобретения композицию наночастиц вводят один раз в три недели.
Способы, описанные в настоящем документе, можно использовать для одной или более из следующих целей: облегчения одного или более симптомов рака мочевого пузыря, задержки прогрессирования рака мочевого пузыря, сокращения размеров опухоли в мочевом пузыре пациента, ингибирования роста раковой опухоли мочевого пузыря, продления периода выживания без заболевания, продления периода времени до прогрессирования заболевания мочевого пузыря, предотвращения или задержки появления метастазов рака мочевого пузыря, уменьшения (такого как при облучении) ранее существовавших метастазов рака мочевого пузыря, уменьшения частоты или нагрузки ранее существовавших метастазов рака мочевого пузыря, предотвращения рецидива рака мочевого пузыря.
Также описаны композиции (такие как фармацевтические композиции), лекарственное средство, наборы и единичные дозированные формы, пригодные для способов, описанных в настоящем документе. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря у индивидуума, который в этом нуждается, включающему введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие таксан и альбумин. В некоторых вариантах осуществления настоящего изобретения рак мочевого пузыря представляет собой рак мочевого пузыря без инвазии в мышечную оболочку. В некоторых вариантах осуществления настоящего изобретения рак мочевого пузыря является рефрактерным к лечению БЦЖ, митомицином С или интерфероном. В некоторых вариантах осуществления настоящего изобретения, согласно любому из вариантов в настоящем параграфе, композицию наночастиц вводят интравезикулярно. В некоторых вариантах осуществления настоящего изобретения, согласно любому из вариантов в настоящем параграфе, композицию наночастиц вводят в дозе от приблизительно 150 мг до приблизительно 500 мг. В некоторых вариантах осуществления настоящего изобретения, согласно любому из вариантов в настоящем параграфе, композицию наночастиц вводят один раз в неделю.
В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рефрактерного к платине рака мочевого пузыря (такого как рак мочевого пузыря с метастазами, рефрактерный к платине) у индивидуума, который в этом нуждается, включающему введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие таксан и альбумин. В некоторых вариантах осуществления настоящего изобретения композицию наночастиц вводят внутривенно. В некоторых вариантах осуществления настоящего изобретения, согласно любому из вариантов в настоящем параграфе, композицию наночастиц вводят в дозе приблизительно от 260 мг/м2 до 300 мг/м2. В некоторых вариантах осуществления настоящего изобретения, согласно любому из вариантов в настоящем параграфе, композицию наночастиц вводят один раз в три недели.
В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря у индивидуума, который в этом нуждается, включающему одновременное введение индивидууму (а) эффективного количества композиции, содержащей наночастицы, включающие таксан и альбумин; (b) эффективного количества агента на основе платины; и (с) эффективного количества антиметаболита. В некоторых вариантах осуществления настоящего изобретения рак мочевого пузыря представляет собой рак мочевого пузыря, рефрактерный к платине. В некоторых вариантах осуществления настоящего изобретения, согласно любому из вариантов в настоящем параграфе, рак представляет собой местно запущенный рак мочевого пузыря. В некоторых вариантах осуществления настоящего изобретения, согласно любому из вариантов в настоящем параграфе, рак представляет собой рак мочевого пузыря с инвазией в мышечную оболочку. В некоторых вариантах осуществления настоящего изобретения, согласно любому из вариантов в настоящем параграфе, композицию наночастиц вводят внутривенно. В некоторых вариантах осуществления настоящего изобретения, согласно любому из вариантов в настоящем параграфе, композицию наночастиц вводят в дозе от приблизительно 260 до приблизительно 300 мг/м2. В некоторых вариантах осуществления настоящего изобретения, согласно любому из вариантов в настоящем параграфе, агентом на основе платины является карбоплатин. В некоторых вариантах осуществления настоящего изобретения, согласно любому из вариантов в настоящем параграфе, антиметаболитом является гемцитабин. В некоторых вариантах осуществления настоящего изобретения, согласно любому из вариантов в настоящем параграфе, карбоплатин вводят внутривенно при AUC приблизительно 5. В некоторых вариантах осуществления настоящего изобретения, согласно любому из вариантов в настоящем параграфе, гемцитабин вводят внутривенно в дозе приблизительно 800 мг/м2.
В некоторых вариантах осуществления настоящего изобретения, согласно любому из вариантов в трех вышеуказанных параграфах таксан представляет собой паклитаксел.
В некоторых вариантах осуществления настоящего изобретения, согласно любому из вариантов в четырех вышеуказанных параграфах наночастицы в композиции имеют средний диаметр не более чем приблизительно 200 нм (такой как средний диаметр менее чем приблизительно 200 нм). В некоторых вариантах осуществления настоящего изобретения, согласно любому из вариантов в настоящем параграфе, таксан в наночастицах покрыт альбумином. В некоторых вариантах осуществления настоящего изобретения, согласно любому из вариантов в настоящем параграфе, рак мочевого пузыря представляет собой уротелиальную карциному.
В некоторых вариантах осуществления настоящего изобретения, согласно любому из вариантов в пяти вышеуказанных параграфах рак мочевого пузыря представляет собой низкодифференцированный рак мочевого пузыря.
Приведенные и другие аспекты и преимущества настоящего изобретения будут очевидны из последующего подробного описания и прилагаемой формулы изобретения. Следует понимать, что одно, несколько или все свойства различных вариантов осуществления настоящего изобретения, описанных в настоящем документе, можно комбинировать с получением других вариантов осуществления настоящего изобретения.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фиг.1 показывает процентную долю изменения размеров опухоли у 45 пациентов с рефрактерным к платине раком мочевого пузыря, которых лечили препаратом Abraxane®.
Фиг.2 показывает графики выживания Каплана-Мейера без прогрессирования заболевания для пациентов с рефрактерным к платине раком мочевого пузыря, которых лечили препаратом Abraxane®.
Фиг.3 показывает графики общего выживания Каплана-Мейера для пациентов с рефрактерным к платине раком мочевого пузыря, которых лечили препаратом Abraxane®.
Фиг.4 показывает эффект прогностических факторов, влияющих на общее выживание, для пациентов с рефрактерным к платине раком мочевого пузыря, которых лечили препаратом Abraxane®.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам и композициям для лечения рака мочевого пузыря посредством введения композиции, содержащей наночастицы, которые включают таксан и альбумин.
Заявители установили, что композиция, содержащая наночастицы, которые включают альбумин и таксан, а именно, Nab-паклитаксел, является высокоэффективной для лечения рака мочевого пузыря. Например, в исследовании с участием 18 пациентов, которых ранее неудачно лечили бациллой Кальметта-Герена (БЦЖ), у 28% пациентов, как было установлено, наблюдался полный ответ через 12 недель лечения Nab-паклитакселом посредством интравезикулярного введения. Во время II фазы исследования с использованием Nab-паклитаксела для лечения второй линии рефрактерной к платине метастатической уротелиальной карциномы, Nab-паклитаксел, как было показано, продемонстрировал долю ответов 33% и клиническую пользу 58%, что в настоящее время является одной из самых высоких частот ответов, о которых сообщалось, для исследования УК второй линии. Nab-паклитаксел показал также общую долю ответов 44% (13/29) и долю контроля заболевания 76% (22/29) в фазе II исследования с использованием внутривенного введения Nab-паклитаксела в качестве терапии второй линии у пациентов с метастатической уротелиальной карциномой. Nab-паклитаксел, таким образом, является особенно пригодным для лечения рака мочевого пузыря, включая как неинвазивный, так и метастатический рак мочевого пузыря.
Соответственно, настоящая заявка относится к способу лечения рака мочевого пузыря у индивидуума, который в этом нуждается, включающему введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие таксан и альбумин.
Также описаны композиции (такие как фармацевтические композиции), лекарственное средство, наборы и единичные дозированные формы, пригодные для способов, описанных в настоящем документе.
Определения
Используемый в настоящем документе термин "лечение" представляет собой подход для получения благоприятных или желательных результатов, включая клинические результаты. Для целей настоящего изобретения благоприятные или желательные клинические результаты включают, без ограничения, один или более из следующего: облегчение одного или более из симптомов заболевания, уменьшение степени заболевания, стабилизацию заболевания (например, предотвращение или задержку ухудшения заболевания), предотвращение или задержку распространения заболевания (например, метастазов), предотвращение или задержку рецидивирования заболевания, уменьшение частоты рецидивирования заболевания, задержку или замедление прогрессирования заболевания, улучшение состояния заболевания, обеспечение ремиссии (частичной или полной) заболевания, уменьшение дозы одного или более лекарственных средств, требующихся для лечения заболевания, задержку прогрессирования заболевания, повышение качества жизни и/или пролонгирование выживания. Под "лечением" также подразумевается уменьшение патологических последствий рака мочевого пузыря. Способы по настоящему изобретению подразумевают один или более указанных аспектов лечения.
Термин "индивидуум" относится к млекопитающему и включает, без ограничения, человека, крупный рогатый скот, лошадь, кошку, собаку, грызуна или примата.
Термин индивидуум "с риском" относится к индивидууму, который входит в группу риска развития рака мочевого пузыря. Индивидуум "с риском" может иметь или не иметь поддающееся выявлению заболевание и может иметь или не иметь поддающееся выявлению заболевание до использования способов лечения, описанных в настоящем документе. "С риском" означает, что у индивидуума имеется один или более так называемых факторов риска, которые представляют собой измеряемые параметры, которые коррелируют с развитием рака мочевого пузыря, описанные в настоящем документе. У индивидуума, имеющего один или более из указанных факторов риска, имеется более высокая вероятность развития рака мочевого пузыря, чем у индивидуума, не имеющего фактора (факторов) риска.
"Схема вспомогательного лечения" относятся к клинической терапии, в которой индивидуум имел историю рака мочевого пузыря и обычно (но не обязательно) реагировал на лечение, которое включает, без ограничения, оперативное вмешательство (например, хирургическую резекцию), облучение и химиотерапию. Однако, в силу своей истории рака мочевого пузыря, указанные пациенты считаются входящими в группу риска развития заболевания. Лечение или введение с использованием "схемы вспомогательного лечения" относится к последующему способу лечения. Степень риска (например, когда индивидуум при использовании схемы вспомогательного лечения считался входящим в группу "высокого риска" или "низкого риска") зависит от нескольких факторов, чаще всего, от степени заболевания, которая имелась при первичном лечении.
"Схема нового вспомогательного лечения" относятся к клиническим условиям, в которых осуществляется способ перед основным/радикальным лечением.
Используемый в настоящем документе термин "задержка" развития рака мочевого пузыря означает отсрочивать, затруднять, замедлять, задерживать, стабилизировать и/или откладывать развитие заболевания. Указанная задержка может продолжаться в течение различных периодов времени, в зависимости от анамнеза заболевания и/или индивидуума, подвергаемого лечению. Как очевидно для специалиста, достаточная или значительная задержка может фактически заключать предотвращение в том, что у индивидуума заболевание не развивается. Способ, который "задерживает" развитие рака мочевого пузыря, представляет собой способ, который уменьшает вероятность развития заболевания в данных временных рамках и/или уменьшает распространение заболевания в данных временных рамках, по сравнению с неиспользованием данного способа. Указанные сравнения обычно основываются на клинических исследованиях с использованием статистически значимого количества субъектов. Развитие рака мочевого пузыря может быть выявлено с использованием стандартных методов, включая, без ограничения, компьютерную аксиальную томографию (CAT scan), магнитно-резонансную томографию (МРТ), ультразвуковое исследование, исследования свертывания крови, артериографию, биопсию, цитологию мочи и цистоскопию. Развитие также может относиться к прогрессированию рака мочевого пузыря, которое может быть сначала невыявляемым и включает появление, рецидив и начало.
Используемый в настоящем документе термин "комбинированное лекарственное средство" означает, что первый агент вводят в сочетании с другим агентом. "В сочетании" относится к введению одного лекарственного средства, помимо другого лекарственного средства, такому как введение композиции наночастиц, описанных в настоящем документе, в добавление к введению другого агента одному и тому же индивидууму. В указанном смысле "в сочетании" относится к введению одного лекарственного средства до, во время или после доставки другого лекарственного средства индивидууму.
Термин "эффективное количество", используемый в настоящем документе, относится к количеству соединения или композиции, достаточному для лечения конкретного расстройства, состояния или заболевания, такого как улучшение, облегчение, уменьшение или приостановку одного или более его симптомов. Что касается рака мочевого пузыря, эффективное количество включает количество, достаточное для уменьшения размеров опухоли и/или для уменьшения скорости роста опухоли (такого как подавление роста опухоли) или для предотвращения или замедления нежелательной пролиферации клеток в раковой опухоли мочевого пузыря. В некоторых вариантах осуществления настоящего изобретения эффективное количество представляет собой количество, достаточное для замедления развития рака мочевого пузыря. В некоторых вариантах осуществления настоящего изобретения эффективное количество представляет собой количество, достаточное для предотвращения или замедления рецидива. В некоторых вариантах осуществления настоящего изобретения эффективное количество представляет собой количество, достаточное для уменьшения частоты рецидивов у индивидуума. Эффективное количество можно вводить за одно или более введений. В случае рака мочевого пузыря эффективное количество лекарственного средства может (i) уменьшать количество клеток рака мочевого пузыря; (ii) уменьшать размер опухоли; (iii) ингибировать, задерживать, замедлять до некоторой степени и, предпочтительно, останавливать инфильтрацию клеток в периферические органы; (iv) ингибировать (т.е., замедлять до некоторой степени и, предпочтительно, останавливать) метастазирование опухоли; (v) ингибировать рост опухоли; (vi) предотвращать или отсрочивать возникновение и/или рецидив опухоли; (vii) уменьшать частоту рецидивов опухоли и/или (viii) облегчать до некоторой степени один или более симптомов, связанных с раком мочевого пузыря.
Термин "одновременное введение", используемый в настоящем документе, означает, что первое лекарственное средство и второе лекарственное средство в комбинированном лекарственном средстве вводят с интервалом времени не более приблизительно 15 минут, таким как не более приблизительно 10, 5 или 1 минуты. Когда первое и второе лекарственные средства вводят одновременно, первое и второе лекарственные средства могут содержаться в одной и той же композиции (например, в композиции, содержащей и первое, и второе лекарственное средство) или в разных композициях (например, первое лекарственное средство содержится в одной композиции, а второе лекарственное средство содержится в другой композиции).
Используемый в настоящем документе термин "последовательное введение" означает, что первое лекарственное средство и второе лекарственное средство в комбинированном лекарственном средстве вводят с интервалом времени более приблизительно 15 минут, таким как более приблизительно 20, 30, 40, 50, 60 или более минут. Первым можно вводить первое лекарственное средство или второе лекарственное средство. Первое и второе лекарственные средства содержатся в разных композициях, которые могут содержаться в одной и той же или разных упаковках или наборах.
Используемый в настоящем документе термин "параллельное введение" означает, что первое лекарственное средство и второе лекарственное средство в комбинированном лекарственном средстве накладываются друг на друга.
Используемый в настоящем документе термин "фармацевтически приемлемый" или "фармацевтически совместимый" означает материал, который в биологическом или ином аспекте не является нежелательным, например, материал может быть инкорпорирован в фармацевтическую композицию, введенную пациенту, не вызывая никаких значительных нежелательных биологических эффектов или не взаимодействуя неблагоприятным образом с любым из других компонентов композиции, в которой он содержится. Фармацевтически приемлемые носители или эксципиенты, предпочтительно, отвечают требующимся стандартам токсикологического и производственного тестирования и/или включены в руководство по неактивным ингредиентам (Inactive Ingredient Guide) управления по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA).
Понятно, что аспекты и варианты осуществления настоящего изобретения, описанные в настоящем документе, включают "состоящие из" и/или "состоящие, главным образом, из" аспектов и вариантов осуществления настоящего изобретения.
Ссылка на "приблизительную" величину или параметр в настоящем документе включает (и описывает) вариации, которые направлены на указанную величину и параметр per se. Например, описание, относящееся к "приблизительно Х" включает описание "Х".
Используемые в настоящем документе и в прилагающейся формуле изобретения формы единственного числа включают и формы во множественном числе, если контекст ясно не указывает на иное.
Способы лечения рака мочевого пузыря
Изобретение относится к способам лечения рака мочевого пузыря у индивидуума (например, человека), включающим введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие таксан и альбумин.
В некоторых вариантах осуществления настоящего изобретения способ включает введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие таксан и альбумин, в которой таксан в наночастицах покрыт альбумином. В некоторых вариантах осуществления настоящего изобретения способ включает введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие таксан и альбумин (такой как человеческий сывороточный альбумин). В некоторых вариантах осуществления настоящего изобретения паклитаксел в наночастицах покрыт альбумином. В некоторых вариантах осуществления настоящего изобретения размер наночастиц в композиции составляет не более чем приблизительно 200 нм (такой как менее чем приблизительно 200 нм). В некоторых вариантах осуществления настоящего изобретения композиция содержит Nab-паклитаксел. В некоторых вариантах осуществления настоящего изобретения композиция представляет собой Nab-паклитаксел.
В некоторых вариантах осуществления настоящего изобретения рак мочевого пузыря представляет собой рак мочевого пузыря низкой стадии. В некоторых вариантах осуществления настоящего изобретения рак мочевого пузыря представляет собой низкодифференцированный рак мочевого пузыря. В некоторых вариантах осуществления настоящего изобретения рак мочевого пузыря является инвазивным. В некоторых вариантах осуществления настоящего изобретения рак мочевого пузыря является неинвазивным. В некоторых вариантах осуществления настоящего изобретения рак мочевого пузыря представляет собой рак мочевого пузыря без инвазии в мышечную оболочку.
В некоторых вариантах осуществления настоящего изобретения рак мочевого пузыря представляет собой переходно-клеточный рак или уротелиальную карциному (такую как метастатическая уротелиальная карцинома), включая, без ограничения, папиллярные опухоли и плоскоклеточные раки. В некоторых вариантах осуществления настоящего изобретения рак мочевого пузыря представляет собой метастатическую уротелиальную карциному. В некоторых вариантах осуществления настоящего изобретения рак мочевого пузыря представляет собой уротелиальную карциному мочевого пузыря. В некоторых вариантах осуществления настоящего изобретения рак мочевого пузыря представляет собой уротелиальную карциному мочеточника. В некоторых вариантах осуществления настоящего изобретения рак мочевого пузыря представляет собой уротелиальную карциному уретры. В некоторых вариантах осуществления настоящего изобретения рак мочевого пузыря представляет собой уротелиальную карциному почечной лоханки.
В некоторых вариантах осуществления настоящего изобретения рак мочевого пузыря представляет собой плоскоклеточный рак. В некоторых вариантах осуществления настоящего изобретения рак мочевого пузыря представляет собой неплоскоклеточный рак. В некоторых вариантах осуществления настоящего изобретения рак мочевого пузыря представляет собой аденокарциному. В некоторых вариантах осуществления настоящего изобретения рак мочевого пузыря представляет собой мелкоклеточный рак.
В некоторых вариантах осуществления настоящего изобретения рак мочевого пузыря представляет собой рак мочевого пузыря ранней стадии, неметастатический рак мочевого пузыря, неинвазивный рак мочевого пузыря, рак мочевого пузыря без инвазии в мышечную оболочку, первичный рак мочевого пузыря, локально запущенный рак мочевого пузыря (такой как нерезектабельный локально запущенный рак мочевого пузыря), метастатический рак мочевого пузыря, рак мочевого пузыря в ремиссии, прогрессирующий рак мочевого пузыря или рецидивирующий рак мочевого пузыря. В некоторых вариантах осуществления настоящего изобретения рак мочевого пузыря является локализованным резектабельным, локализованным нерезектабельным или нерезектабельным. В некоторых вариантах осуществления настоящего изобретения рак мочевого пузыря представляет собой низкодифференцированный рак без инвазии в мышечную оболочку, который является рефрактерным к стандартной инфузионной терапии в мочевой пузырь (интравезикулярной терапии).
Способы, описанные в настоящем документе, можно использовать для лечения индивидуума (например, человека), у которого был диагностирован или заподозрен рак мочевого пузыря. В некоторых вариантах осуществления настоящего изобретения индивидуумом является человек. В некоторых вариантах осуществления настоящего изобретения возраст индивидуума составляет 35, 40, 45, 50, 55, 60, 65, 70, 75, 80 или 85 лет. В некоторых вариантах осуществления настоящего изобретения индивидуумом является мужчина. В некоторых вариантах осуществления настоящего изобретения индивидуумом является женщина. В некоторых вариантах осуществления настоящего изобретения индивидуум отказался от операции. В некоторых вариантах осуществления настоящего изобретения индивидуум является с медицинской точки зрения неоперабельным. В некоторых вариантах осуществления настоящего изобретения индивидуум имеет клиническую стадию Ta, Tis, T1, T2, T3a, T3b или Т4.
В некоторых вариантах осуществления настоящего изобретения у индивидуума имеется рецидив рака мочевого пузыря (такой как рак мочевого пузыря стадии Ta, Tis, T1, T2, T3a, T3b или Т4) после одного или более лекарственных средств. В некоторых вариантах осуществления настоящего изобретения стандартным лекарственным средством является БЦЖ. В некоторых вариантах осуществления настоящего изобретения лекарственным средством является митомицин С. В некоторых вариантах осуществления настоящего изобретения лекарственным средством является интерферон. В некоторых вариантах осуществления настоящего изобретения стандартное лекарственное средство вводят интравезикулярно. В некоторых вариантах осуществления настоящего изобретения у индивидуума имеется рецидив рака мочевого пузыря (такой как рак мочевого пузыря стадии Ta, Tis, T1, T2, T3a, T3b или Т4) после лечения агентом на основе платины (таким как карбоплатин).
В некоторых вариантах осуществления настоящего изобретения индивидуум является рефрактерным в отношении одного или более стандартных лекарственных средств. В некоторых вариантах осуществления настоящего изобретения стандартным лекарственным средством является БЦЖ. В некоторых вариантах осуществления настоящего изобретения лекарственным средством является митомицин С. В некоторых вариантах осуществления настоящего изобретения стандартное лекарственное средство вводят интравезикулярно. В некоторых вариантах осуществления настоящего изобретения лекарственным средством является интерферон. В некоторых вариантах осуществления настоящего изобретения у индивидуума имеется рецидив рака мочевого пузыря (такой как рак мочевого пузыря стадии Ta, Tis, T1, T2, T3a, T3b или Т4) после лечения агентом на основе платины (таким как карбоплатин).
В некоторых вариантах осуществления настоящего изобретения у индивидуума имеется рак мочевого пузыря на ранней стадии, неметастатический рак мочевого пузыря, первичный рак мочевого пузыря, запущенный рак мочевого пузыря, локально запущенный рак мочевого пузыря, например, метастатический рак мочевого пузыря, рак мочевого пузыря в ремиссии, прогрессирующий рак мочевого пузыря или рецидивирующий рак мочевого пузыря. В некоторых вариантах осуществления настоящего изобретения индивидуум является резистентным к лечению рака мочевого пузыря другими агентами (такими как композиция таксана, не состоящая из наночастиц, например, Taxol® или Taxotere®, агенты на основе платины, БЦЖ, митомицин С или интерферон). В некоторых вариантах осуществления настоящего изобретения индивидуум исходно отвечал на лечение рака мочевого пузыря другими агентами (такими как композиция таксана, не состоящая из наночастиц, например, Taxol® или Taxotere®, агенты на основе платины или БЦЖ), но после лечения заболевание прогрессировало.
В некоторых вариантах осуществления настоящего изобретения индивидуумом является человек, у которого имеется один или более симптомов, связанных с раком мочевого пузыря. В некоторых вариантах осуществления настоящего изобретения у индивидуума имеется рак мочевого пузыря на ранней стадии. В некоторых вариантах осуществления настоящего изобретения у индивидуума имеется рак мочевого пузыря на поздней стадии. В некоторых вариантах осуществления настоящего изобретения у индивидуума имеется генетическая или иная предрасположенность (например, фактор риска) к развитию рака мочевого пузыря. В некоторых вариантах осуществления настоящего изобретения индивидуумы с риском развития рака мочевого пузыря включают индивидуумов, имеющих родственников, у которых был рак мочевого пузыря, и индивидуумов, чей риск был установлен путем анализа генетических или биохимических маркеров. В некоторых вариантах осуществления настоящего изобретения индивидуум является положительным по экспрессии SPARC (например, на основе стандарта IHC). В некоторых вариантах осуществления настоящего изобретения индивидуум является отрицательным по экспрессии SPARC. В некоторых вариантах осуществления настоящего изобретения у индивидуума имеется мутация в FGFR2. В некоторых вариантах осуществления настоящего изобретения у индивидуума имеется мутация в р53. В некоторых вариантах осуществления настоящего изобретения у индивидуума имеется мутация в MIB-1. В некоторых вариантах осуществления настоящего изобретения у индивидуума имеется мутация в FEZ1/LZTS1, PTEN, CDKN2A/MTS1/P6, CDKN2B/INK4B/P15, TSC1, DBCCR1, HRAS1, ERBB2 и NF1.
В некоторых вариантах осуществления настоящего изобретения у индивидуума имеется частичная или полная моносомия (такая как моносомия 9). В некоторых вариантах осуществления настоящего изобретения у индивидуума имеется делеция в хромосоме 11р. В некоторых вариантах осуществления настоящего изобретения у индивидуума имеется делеция в хромосоме 13q. В некоторых вариантах осуществления настоящего изобретения у индивидуума имеется делеция в хромосоме 17р. В некоторых вариантах осуществления настоящего изобретения у индивидуума имеется делеция в хромосоме 1р. В некоторых вариантах осуществления настоящего изобретения у индивидуума имеется утрата хромосомы 8р12-22.
В некоторых вариантах осуществления настоящего изобретения у индивидуума имеется избыточная экспрессия р73, c-myc или циклина D1.
Способы, описанные в настоящем документе, можно осуществлять на практике с использованием схемы вспомогательного лечения. В некоторых вариантах осуществления настоящего изобретения способ осуществляют на практике с использованием схемы нового вспомогательного лечения, т.е., способ можно осуществлять перед основным/радикальным лечением. В некоторых вариантах осуществления настоящего изобретения способ используют для лечения индивидуума, который ранее подвергался лечению. Любой из способов лечения, описанных в настоящем документе, можно использовать для лечения индивидуума, который ранее не подвергался лечению. В некоторых вариантах осуществления настоящего изобретения способ используют как лечение первой линии. В некоторых вариантах осуществления настоящего изобретения способ используют как лечение второй линии.
Способы, описанные в настоящем документе, являются пригодными для различных аспектов лечения рака мочевого пузыря. Некоторые варианты осуществления настоящего изобретения относятся к способу ингибирования пролиферации клеток рака мочевого пузыря (такой как опухолевый рост рака мочевого пузыря) у индивидуума, включающему введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие таксан и альбумин. В некоторых вариантах осуществления настоящего изобретения клеточная пролиферация ингибируется по меньшей мере приблизительно на 10% (включая, например, по меньшей мере 20%, 30%, 40%, 60%, 70%, 80%, 90% или 100%). В некоторых вариантах осуществления настоящего изобретения таксан представляет собой паклитаксел. В некоторых вариантах осуществления настоящего изобретения таксан в наночастицах в композиции вводят внутривенно.
В некоторых вариантах осуществления настоящее изобретение относится к способу ингибирования метастазирования рака мочевого пузыря у индивидуума, включающему введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие таксан и альбумин. В некоторых вариантах осуществления настоящего изобретения метастазирование ингибируется по меньшей мере приблизительно на 10% (включая, например, по меньшей мере 20%, 30%, 40%, 60%, 70%, 80%, 90% или 100%). В некоторых вариантах осуществления настоящее изобретение относится к ингибированию метастазирования в лимфоузел. В некоторых вариантах осуществления настоящее изобретение относится к ингибированию метастазирования в легкое. В некоторых вариантах осуществления настоящего изобретения таксан представляет собой паклитаксел. В некоторых вариантах осуществления настоящего изобретения таксан в наночастицах в композиции вводят внутривенно.
В некоторых вариантах осуществления настоящее изобретение относится к способу уменьшения (такого как при облучении) ранее существовавших метастазов рака мочевого пузыря (таких как метастазы в легких или метастазы в лимфоузлах) у индивидуума, включающему введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие таксан и альбумин. В некоторых вариантах осуществления настоящего изобретения метастазирование ингибируется по меньшей мере приблизительно на 10% (включая, например, по меньшей мере 20%, 30%, 40%, 60%, 70%, 80%, 90% или 100%). В некоторых вариантах осуществления настоящее изобретение относится к ингибированию метастазирования в лимфоузел. В некоторых вариантах осуществления настоящее изобретение относится к ингибированию метастазирования в легкое. В некоторых вариантах осуществления настоящего изобретения таксан представляет собой паклитаксел. В некоторых вариантах осуществления настоящего изобретения таксан в наночастицах в композиции вводят внутривенно.
В некоторых вариантах осуществления настоящее изобретение относится к способу уменьшения частоты или нагрузки ранее существовавших метастазов рака мочевого пузыря (таких как метастазы в легких или метастазы в лимфоузлах) у индивидуума, включающему введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие таксан и альбумин. В некоторых вариантах осуществления настоящего изобретения таксан представляет собой паклитаксел. В некоторых вариантах осуществления настоящего изобретения таксан в наночастицах в композиции вводят внутривенно.
В некоторых вариантах осуществления настоящее изобретение относится к способу уменьшения размера опухоли рака мочевого пузыря у индивидуума, включающему введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие таксан и альбумин. В некоторых вариантах осуществления настоящего изобретения размер опухоли уменьшается по меньшей мере приблизительно на 10% (включая, например, по меньшей мере 20%, 30%, 40%, 60%, 70%, 80%, 90% или 100%). В некоторых вариантах осуществления настоящего изобретения таксан представляет собой паклитаксел. В некоторых вариантах осуществления настоящего изобретения таксан в наночастицах в композиции вводят внутривенно.
В некоторых вариантах осуществления настоящее изобретение относится к способу пролонгирования времени до прогрессирования рака мочевого пузыря у индивидуума, включающему введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие таксан и альбумин. В некоторых вариантах способ пролонгирует время до прогрессирования заболевания по меньшей мере на 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 недель. В некоторых вариантах осуществления настоящего изобретения таксан представляет собой паклитаксел. В некоторых вариантах осуществления настоящего изобретения таксан в наночастицах в композиции вводят внутривенно.
В некоторых вариантах осуществления настоящее изобретение относится к способу пролонгирования времени выживания индивидуума, имеющего рак мочевого пузыря, включающему введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие таксан и альбумин. В некоторых вариантах способ пролонгирует время выживания индивидуума по меньшей мере на 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 18 или 24 месяца. В некоторых вариантах осуществления настоящего изобретения таксан представляет собой паклитаксел. В некоторых вариантах осуществления настоящего изобретения таксан в наночастицах в композиции вводят внутривенно.
В некоторых вариантах осуществления настоящее изобретение относится к способу облегчения одного или более симптомов у индивидуума, имеющего рак мочевого пузыря, включающему введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие таксан и альбумин. В некоторых вариантах осуществления настоящего изобретения таксан в наночастицах в композиции вводят внутривенно.
Способы введения композиции, содержащей наночастицы, включающие таксан и альбумин, в некоторых вариантах осуществления настоящего изобретения осуществляют в сочетании с введением одного другого агента.
В некоторых вариантах осуществления настоящего изобретения вводят два или более химиотерапевтических агента, помимо таксана в композиции наночастиц. Указанные два или более химиотерапевтических агента могут (но не обязательно) принадлежать к различным классам химиотерапевтических агентов.
Также описаны фармацевтические композиции, включающие наночастицы, включающие таксан и альбумин (такой как человеческий сывороточный альбумин), для применения в любом из способов лечения рака мочевого пузыря, описанных в настоящем документе.
Дозирование и способ введения композиций наночастиц
Доза композиции наночастиц таксана, введенная индивидууму (такому как человек) может варьировать в зависимости от конкретной композиции, способа введения и типа рака мочевого пузыря, подвергаемого лечению. В некоторых вариантах осуществления настоящего изобретения количество композиции является эффективным для получения объективного ответа (такого как частичный ответ или полный ответ). В некоторых вариантах осуществления настоящего изобретения количество композиции наночастиц таксана является достаточным для получения полного ответа у индивидуума. В некоторых вариантах осуществления настоящего изобретения количество композиции наночастиц таксана является достаточным для получения частичного ответа у индивидуума. В некоторых вариантах осуществления настоящего изобретения введенное количество композиции наночастиц таксана (например, когда вводится только композиция) является достаточным для получения общей доли ответов более приблизительно 20%, 30%, 40%, 50%, 60% или 64% в популяции индивидуумов, которых лечили композицией наночастиц таксана. Ответы индивидуума на лечение способами, описанными в настоящем документе, можно определить, например, на основе уровней RECIST, цистоскопии (с биопсией или без биопсии), биопсии, цитологии и КТ.
В некоторых вариантах осуществления настоящего изобретения количество композиции наночастиц таксана является достаточным для получения отрицательной биопсии у индивидуума. В некоторых вариантах осуществления настоящего изобретения количество композиции является эффективным для получения ответа (частичного или полного) на основе цитологии мочи. В некоторых вариантах осуществления настоящего изобретения количество композиции наночастиц таксана является достаточным для получения как отрицательной биопсии, так и ответа (частичного или полного) на основе цитологии мочи.
В некоторых вариантах осуществления настоящего изобретения количество композиции наночастиц таксана является недостаточным для того, чтобы вызвать системную токсичность, такую как системная токсичность класса 2, 3 или 4, такую как гематурия, дизурия, задержка мочи, частота/императивность мочеиспускания или спазм мочевого пузыря.
В некоторых вариантах осуществления настоящего изобретения количество композиции является достаточным для пролонгирования выживания индивидуума без прогрессирования заболевания. В некоторых вариантах осуществления настоящего изобретения количество композиции является достаточным для пролонгирования общего выживания индивидуума. В некоторых вариантах осуществления настоящего изобретения количество композиции (например, когда вводится только композиция) является достаточным для получения клинической пользы более чем приблизительно у 50%, 60%, 70% или 77% индивидуумов в популяции, которых лечили композицией наночастиц таксана.
В некоторых вариантах осуществления настоящего изобретения количество композиции является достаточным для уменьшения размера опухоли, уменьшения количества раковых клеток или уменьшения скорости роста опухоли по меньшей мере приблизительно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или 100% по сравнению с соответствующими размером опухоли, количеством клеток рака мочевого пузыря или скоростью роста опухоли у того же субъекта до лечения или по сравнению с соответствующей активностью у других субъектов, не получающих лечения. Стандартные способы можно использовать для измерения величины указанного эффекта, такие как анализы in vitro с очищенный ферментом, анализы на клеточной основе, модели на экспериментальных животных или испытания на людях.
В некоторых вариантах осуществления настоящего изобретения количество таксана (например, пакситаксела) в композиции меньше уровня, который индуцирует токсикологический эффект (т.е., эффект свыше клинически приемлемого уровня токсичности) или находится на таком уровне, когда потенциальный побочный эффект может контролироваться или переноситься, когда композицию вводят индивидууму.
В некоторых вариантах осуществления настоящего изобретения количество композиции приближается к максимальной переносимой дозе (МПД) композиции при одной и той же схеме введения. В некоторых вариантах осуществления настоящего изобретения количество композиции превышает приблизительно 80%, 90%, 95% или 98% МПД.
В некоторых вариантах осуществления настоящего изобретения количество таксана (например, пакситаксела) в композиции находится в следующих пределах: от приблизительно 0,1 мг до приблизительно 1000 мг, от приблизительно 0,1 мг до приблизительно 2,5 мг, от приблизительно 0,5 мг до приблизительно 5 мг, от приблизительно 5 мг до приблизительно 10 мг, от приблизительно 10 мг до приблизительно 15 мг, от приблизительно 15 мг до приблизительно 20 мг, от приблизительно 20 мг до приблизительно 25 мг, от приблизительно 20 мг до приблизительно 50 мг, от приблизительно 25 мг до приблизительно 50 мг, от приблизительно 50 мг до приблизительно 75 мг, от приблизительно 50 мг до приблизительно 100 мг, от приблизительно 75 мг до приблизительно 100 мг, от приблизительно 100 мг до приблизительно 125 мг, от приблизительно 125 мг до приблизительно 150 мг, от приблизительно 150 мг до приблизительно 175 мг, от приблизительно 175 мг до приблизительно 200 мг, от приблизительно 200 мг до приблизительно 225 мг, от приблизительно 225 мг до приблизительно 250 мг, от приблизительно 250 мг до приблизительно 300 мг, от приблизительно 300 мг до приблизительно 350 мг, от приблизительно 350 мг до приблизительно 400 мг, от приблизительно 400 мг до приблизительно 450 мг, от приблизительно 450 мг до приблизительно 500 мг, от приблизительно 500 мг до приблизительно 600 мг, от приблизительно 600 мг до приблизительно 700 мг, от приблизительно 700 мг до приблизительно 800 мг, от приблизительно 800 мг до приблизительно 900 мг или от приблизительно 900 мг до приблизительно 1000 мг. В некоторых вариантах осуществления настоящего изобретения количество таксана (например, пакситаксела) в эффективном количестве композиции (например, в единичной дозированной форме) находится в пределах приблизительно от 5 мг до 500 мг, таких как от приблизительно 30 мг до приблизительно 300 мг или от приблизительно 50 мг до приблизительно 200 мг. В некоторых вариантах осуществления настоящего изобретения количество таксана (например, пакситаксела) в эффективном количестве композиции (например, в единичной дозированной форме) находится в пределах приблизительно от 150 мг до 500 мг, включая, например, приблизительно 150 мг, приблизительно 225 мг, приблизительно 250 мг, приблизительно 300 мг, приблизительно 325 мг, приблизительно 350 мг, приблизительно 375 мг, приблизительно 400 мг, приблизительно 425 мг, приблизительно 450 мг, приблизительно 475 мг или приблизительно 500 мг. В некоторых вариантах осуществления настоящего изобретения концентрация таксана (например, пакситаксела) в композиции является разведенной (приблизительно 0,1 мг/мл) или концентрированной (приблизительно 100 мг/мл), включая, например, от приблизительно 0,1 до приблизительно 50 мг/мл, от приблизительно 0,1 до приблизительно 20 мг/мл, от приблизительно 1 до приблизительно 10 мг/мл, от приблизительно 2 до приблизительно 8 мг/мл, от приблизительно 4 до приблизительно 6 мг/мл или приблизительно 5 мг/мл. В некоторых вариантах осуществления настоящего изобретения концентрация таксана (например, пакситаксела) составляет по меньшей мере приблизительно 0,5 мг/мл, 1,3 мг/мл, 1,5 мг/мл, 2 мг/мл, 3 мг/мл, 4 мг/мл, 5 мг/мл, 6 мг/мл, 7 мг/мл, 8 мг/мл, 9 мг/мл, 10 мг/мл, 15 мг/мл, 20 мг/мл, 25 мг/мл, 30 мг/мл, 40 мг/мл или 50 мг/мл.
Типичные эффективные количества таксана (например, пакситаксела) в композиции наночастиц включают, без ограничения, по меньшей мере приблизительно 25 мг/м2, 30 мг/м2, 50 мг/м2, 60 мг/м2, 75 мг/м2, 80 мг/м2, 90 мг/м2, 100 мг/м2, 120 мг/м2, 125 мг/м2, 150 мг/м2, 160 мг/м2, 175 мг/м2, 180 мг/м2, 200 мг/м2, 210 мг/м2, 220 мг/м2, 250 мг/м2, 260 мг/м2, 300 мг/м2, 350 мг/м2, 400 мг/м2, 500 мг/м2, 540 мг/м2, 750 мг/м2, 1000 мг/м2 или 1080 мг/м2 таксана (например, пакситаксела). В различных вариантах осуществления настоящего изобретения композиция содержит менее чем приблизительно 350 мг/м2, 300 мг/м2, 250 мг/м2, 200 мг/м2, 150 мг/м2, 120 мг/м2, 100 мг/м2, 90 мг/м2, 50 мг/м2 или 30 мг/м2 таксана (например, пакситаксела). В некоторых вариантах осуществления настоящего изобретения количество таксана (например, пакситаксела) на одно введение составляет менее приблизительно 25 мг/м2, 22 мг/м2, 20 мг/м2, 18 мг/м2, 15 мг/м2, 14 мг/м2, 13 мг/м2, 12 мг/м2, 11 мг/м2, 10 мг/м2, 9 мг/м2, 8 мг/м2, 7 мг/м2, 6 мг/м2, 5 мг/м2, 4 мг/м2, 3 мг/м2, 2 мг/м2 или 1 мг/м2. В некоторых вариантах осуществления настоящего изобретения эффективное количество таксана (например, пакситаксела) в композиции находится в одном из следующих пределов: от приблизительно 1 до приблизительно 5 мг/м2, от приблизительно 5 до приблизительно 10 мг/м2, от приблизительно 10 до приблизительно 25 мг/м2, от приблизительно 25 до приблизительно 50 мг/м2, от приблизительно 50 до приблизительно 75 мг/м2, от приблизительно 75 до приблизительно 100 мг/м2, от приблизительно 100 до приблизительно 125 мг/м2, от приблизительно 125 до приблизительно 150 мг/м2, от приблизительно 150 до приблизительно 175 мг/м2, от приблизительно 175 до приблизительно 200 мг/м2, от приблизительно 200 до приблизительно 225 мг/м2, от приблизительно 225 до приблизительно 250 мг/м2, от приблизительно 250 до приблизительно 300 мг/м2, от приблизительно 300 до приблизительно 350 мг/м2 или от приблизительно 350 до приблизительно 400 мг/м2. В некоторых вариантах осуществления настоящего изобретения эффективное количество таксана (например, пакситаксела) в композиции составляет приблизительно от 5 до 300 мг/м2, такое как от приблизительно 100 до приблизительно 150 мг/м2, приблизительно 120 мг/м2, приблизительно 130 мг/м2 или приблизительно 140 мг/м2.
В некоторых вариантах любого из приведенных выше аспектов настоящего изобретения эффективное количество таксана (например, пакситаксела) в композиции составляет по меньшей мере приблизительно 1 мг/кг, 2,5 мг/кг, 3,5 мг/кг, 5 мг/кг, 6,5 мг/кг, 7,5 мг/кг, 10 мг/кг, 15 мг/кг, 20 мг/кг, 25 мг/кг, 30 мг/кг, 35 мг/кг, 40 мг/кг, 45 мг/кг, 50 мг/кг, 55 мг/кг или 60 мг/кг. В различных вариантах осуществления настоящего изобретения эффективное количество таксана (например, пакситаксела) в композиции составляет менее чем 350 мг/кг, 300 мг/кг, 250 мг/кг, 200 мг/кг, 150 мг/кг, 100 мг/кг, 50 мг/кг, 25 мг/кг, 20 мг/кг, 10 мг/кг, 7,5 мг/кг, 6,5 мг/кг, 5 мг/кг, 3,5 мг/кг, 2,5 мг/кг или 1 мг/кг таксана (например, пакситаксела).
Типичная частота введения композиций наночастиц включает, без ограничения, один раз каждый день, один раз каждые два дня, один раз каждые три дня, один раз каждые четыре дня, один раз каждые пять дней, один раз каждые шесть дней, один раз в неделю без перерыва, три из четырех недель, один раз каждые три недели, один раз каждые две недели или две из трех недель. В некоторых вариантах осуществления настоящего изобретения композицию вводят приблизительно один раз каждые 2 недели, один раз каждые 3 недели, один раз каждые 4 недели, один раз каждые 6 недель или один раз каждые 8 недель. В некоторых вариантах осуществления настоящего изобретения композицию вводят по меньшей мере приблизительно 1 раз, 2 раза, 3 раза, 4 раза, 5 раз, 6 раз или 7 раз (т.е., ежедневно) в неделю. В некоторых вариантах осуществления настоящего изобретения интервалы между введениями составляют менее приблизительно 6 месяцев, 3 месяцев, 1 месяца, 20 дней, 15 дней, 14 дней, 13 дней, 12 дней, 11 дней, 10 дней, 9 дней, 8 дней, 7 дней, 6 дней, 5 дней, 4 дней, 3 дней, 2 дней или 1 дня. В некоторых вариантах осуществления настоящего изобретения интервалы между введениями составляют более приблизительно 1 месяца, 2 месяцев, 3 месяцев, 4 месяцев, 5 месяцев, 6 месяцев, 8 месяцев или 12 месяцев. В некоторых вариантах осуществления настоящего изобретения в схеме введения перерыв отсутствует. В некоторых вариантах осуществления настоящего изобретения интервал между введениями составляет не более приблизительно недели.
В некоторых вариантах осуществления настоящего изобретения частота введения составляет по одному разу в течение двух дней один раз, два раза, три раза, четыре раза, пять раз, шесть раз, семь раз, восемь раз, девять раз, десять раз и одиннадцать раз. В некоторых вариантах осуществления настоящего изобретения частота введения составляет по одному разу в течение двух дней пять раз. В некоторых вариантах осуществления настоящего изобретения таксан (например, паклитаксел) вводят в течение периода времени по меньшей мере десять дней, в то время как интервалы между введениями составляют более чем приблизительно два дня, и в то время как доза таксана (например, паклитаксела) в каждое введение составляет от приблизительно 0,25 до приблизительно 250 мг/м2, от приблизительно 0,25 до приблизительно 150 мг/м2, от приблизительно 0,25 до приблизительно 75 мг/м2, такая как от приблизительно 0,25 до приблизительно 25 мг/м2 или от приблизительно 25 до приблизительно 50 мг/м2.
Введение композиции можно продлевать на продолжительный период времени, такой как приблизительно от одного месяца до приблизительно семи лет. В некоторых вариантах осуществления настоящего изобретения композицию вводят в течение периода времени по меньшей мере приблизительно 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 18, 24, 30, 36, 48, 60, 72 или 84 месяца.
В некоторых вариантах осуществления настоящего изобретения доза таксана (например, паклитаксела) в композиции наночастиц может находится в пределах 5-400 мг/м2, если использовать 3-недельную схему, или 5-250 мг/м2 (в таких пределах как 80-150 мг/м2, например, 100-120 мг/м2), если использовать недельную схему. Например, количество таксана (например, паклитаксела) составляет от приблизительно 60 до приблизительно 300 мг/м2 (например, приблизительно 260 мг/м2) при использовании 3-недельной схемы.
Другие примеры схем введения композиции наночастиц (например, композиции наночастиц паклитаксел/альбумин) включают, без ограничения, 100 мг/м2 еженедельно, без перерыва; 75 мг/м2 еженедельно, 3 из четырех недель; 100 мг/м2 еженедельно, 3 из четырех недель; 125 мг/м2 еженедельно, 3 из четырех недель; 125 мг/м2 еженедельно, 2 из трех недель; 130 мг/м2 еженедельно, без перерыва; 175 мг/м2, один раз каждые 2 недели; 260 мг/м2, один раз каждые 2 недели; 260 мг/м2, один раз каждые 3 недели; 180-300 мг/м2, один раз каждые 3 недели; 60-175 мг/м2 еженедельно, без перерыва; 20-150 мг/м2 два раза в неделю; и 150-250 мг/м2 два раза в неделю. Частоту введения композиции можно изменять в течение курса лечения по усмотрению лечащего врача.
В некоторых вариантах осуществления настоящего изобретения индивидуума лечат в течение по меньшей мере одного, двух, трех, четырех, пяти, шести, семи, восьми, девяти или десяти циклов лечения.
Композиции, описанные в настоящем документе, позволяют производить инфузию композиции индивидууму в течение периода времени инфузии менее приблизительно 24 часов. Например, в некоторых вариантах осуществления настоящего изобретения композицию вводят в течение периода времени инфузии менее приблизительно 24 часов, 12 часов, 8 часов, 5 часов, 3 часов, 2 часов, 1 часа, 30 минут, 20 минут или 10 минут. В некоторых вариантах осуществления настоящего изобретения композицию вводят в течение периода времени инфузии менее приблизительно 30 минут.
Другая типичная доза таксана (в некоторых вариантах осуществления настоящего изобретения - паклитаксела) в композиции наночастиц включает, без ограничения, приблизительно 50 мг/м2, 60 мг/м2, 75 мг/м2, 80 мг/м2, 90 мг/м2, 100 мг/м2, 120 мг/м2, 160 мг/м2, 175 мг/м2, 200 мг/м2, 210 мг/м2, 220 мг/м2, 260 мг/м2 и 300 мг/м2. Например, дозировка паклитаксела в композиции наночастиц может находиться в пределах приблизительно 100-400 мг/м2 при использовании 3-недельной схемы или приблизительно 50-250 мг/м2 при использовании недельной схемы.
Композиции наночастиц можно вводить индивидууму (такому как человек) различными путями, включая, например, внутривенный, интраартериальный, интраперитонеальный, интрапульмонарный, пероральный, ингаляционный, интравезикулярный, внутримышечный, интратрахеальный, подкожный, интраокулярный, интратекальный, чресслизистый и трансдермальный. В некоторых вариантах осуществления настоящего изобретения можно использовать композицию с замедленным непрерывным высвобождением. В некоторых вариантах осуществления настоящего изобретения композицию вводят внутривенно. В некоторых вариантах осуществления настоящего изобретения композицию вводят интравезикулярно. В некоторых вариантах осуществления настоящего изобретения композицию вводят интраартериально. В некоторых вариантах осуществления настоящего изобретения композицию вводят интраперитонеально.
Типичные варианты осуществления настоящего изобретения
В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря (такого как уротелиальная карцинома) у индивидуума, включающему введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие таксан и альбумин. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря (такого как уротелиальная карцинома) у индивидуума, включающему введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие таксан, покрытый альбумином. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря (такого как уротелиальная карцинома) у индивидуума, включающему введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие таксан и альбумин и имеющие средний диаметр не более чем приблизительно 200 нм. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря (такого как уротелиальная карцинома) у индивидуума, включающему введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие таксан, покрытый альбумином, и имеющие средний диаметр не более чем приблизительно 200 нм. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря (такого как уротелиальная карцинома) у индивидуума, включающему введение индивидууму эффективного количества композиции, содержащей Nab-паклитаксел. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря (такого как уротелиальная карцинома) у индивидуума, включающему введение индивидууму эффективного количества Nab-паклитаксела.
В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря (такого как уротелиальная карцинома) у индивидуума, включающему интравезикулярное введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие таксан и альбумин. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря (такого как уротелиальная карцинома) у индивидуума, включающему интравезикулярное введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие таксан, покрытый альбумином. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря (такого как уротелиальная карцинома) у индивидуума, включающему интравезикулярное введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие таксан и альбумин и имеющие средний диаметр не более чем приблизительно 200 нм. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря (такого как уротелиальная карцинома) у индивидуума, включающему интравезикулярное введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие таксан, покрытый альбумином, и имеющие средний диаметр не более чем приблизительно 200 нм. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря (такого как уротелиальная карцинома) у индивидуума, включающему интравезикулярное введение индивидууму эффективного количества композиции, содержащей Nab-паклитаксел. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря (такого как уротелиальная карцинома) у индивидуума, включающему интравезикулярное введение индивидууму эффективного количества Nab-паклитаксела.
В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря (такого как метастатическая уротелиальная карцинома) у индивидуума, включающему внутривенное введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие таксан и альбумин. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря (такого как метастатическая уротелиальная карцинома) у индивидуума, включающему внутривенное введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие таксан, покрытый альбумином. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря (такого как метастатическая уротелиальная карцинома) у индивидуума, включающему внутривенное введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие таксан и альбумин и имеющие средний диаметр не более чем приблизительно 200 нм. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря (такого как метастатическая уротелиальная карцинома) у индивидуума, включающему внутривенное введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие таксан, покрытый альбумином, и имеющие средний диаметр не более чем приблизительно 200 нм. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря (такого как метастатическая уротелиальная карцинома) у индивидуума, включающему внутривенное введение индивидууму эффективного количества композиции, содержащей Nab-паклитаксел. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря (такого как метастатическая уротелиальная карцинома) у индивидуума, включающему внутривенное введение индивидууму эффективного количества Nab-паклитаксела. В некоторых вариантах осуществления настоящего изобретения лечение представляет собой лечение второй линии.
В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рефрактерного к платине рака мочевого пузыря (такого как рефрактерный к платине рак мочевого пузыря с метастазами, например, рефрактерная к платине метастатическая уротелиальная карцинома) у индивидуума, включающему введение (такое как внутривенное введение) индивидууму эффективного количества композиции, содержащей наночастицы, включающие таксан и альбумин. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рефрактерного к платине рака мочевого пузыря (такого как рефрактерный к платине рак мочевого пузыря с метастазами, например, рефрактерная к платине метастатическая уротелиальная карцинома) у индивидуума, включающему введение (такое как внутривенное введение) индивидууму эффективного количества композиции, содержащей наночастицы, включающие таксан, покрытый альбумином. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рефрактерного к платине рака мочевого пузыря (такого как рефрактерный к платине рак мочевого пузыря с метастазами, например, рефрактерная к платине метастатическая уротелиальная карцинома) у индивидуума, включающему введение (такое как внутривенное введение) индивидууму эффективного количества композиции, содержащей наночастицы, включающие таксан и альбумин и имеющие средний диаметр не более чем приблизительно 200 нм. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рефрактерного к платине рака мочевого пузыря (такого как рефрактерный к платине рак мочевого пузыря с метастазами, например, рефрактерная к платине метастатическая уротелиальная карцинома) у индивидуума, включающему введение (такое как внутривенное введение) индивидууму эффективного количества композиции, содержащей наночастицы, включающие таксан, покрытый альбумином, и имеющие средний диаметр не более чем приблизительно 200 нм. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рефрактерного к платине рака мочевого пузыря (такого как рефрактерный к платине рак мочевого пузыря с метастазами, например, рефрактерная к платине метастатическая уротелиальная карцинома) у индивидуума, включающему введение (такое как внутривенное введение) индивидууму эффективного количества композиции, содержащей Nab-паклитаксел. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рефрактерного к платине рака мочевого пузыря (такого как рефрактерный к платине рак мочевого пузыря с метастазами, например, рефрактерная к платине метастатическая уротелиальная карцинома) у индивидуума, включающему введение (такое как внутривенное введение) индивидууму эффективного количества Nab-паклитаксела.
В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рефрактерного к платине рака мочевого пузыря (такого как рефрактерный к платине рак мочевого пузыря с метастазами, например, рефрактерная к платине метастатическая уротелиальная карцинома) у индивидуума, включающему введение индивидууму от приблизительно 100 до приблизительно 300 мг/м2 (такое как приблизительно 260 мг/м2) композиции, содержащей наночастицы, включающие таксан и альбумин. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рефрактерного к платине рака мочевого пузыря (такого как рефрактерный к платине рак мочевого пузыря с метастазами, например, рефрактерная к платине метастатическая уротелиальная карцинома) у индивидуума, включающему внутривенное введение индивидууму от приблизительно 100 до приблизительно 300 мг/м2 (такое как приблизительно 260 мг/м2) композиции, содержащей наночастицы, включающие таксан, покрытый альбумином. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рефрактерного к платине рака мочевого пузыря (такого как рефрактерный к платине рак мочевого пузыря с метастазами, например, рефрактерная к платине метастатическая уротелиальная карцинома) у индивидуума, включающему введение индивидууму от приблизительно 100 до приблизительно 300 мг/м2 (такое как приблизительно 260 мг/м2) композиции, содержащей наночастицы, включающие таксан и альбумин и имеющие средний диаметр не более чем приблизительно 200 нм. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рефрактерного к платине рака мочевого пузыря (такого как рефрактерный к платине рак мочевого пузыря с метастазами, например, рефрактерная к платине метастатическая уротелиальная карцинома) у индивидуума, включающему введение индивидууму от приблизительно 100 до приблизительно 300 мг/м2 (такое как приблизительно 260 мг/м2) композиции, содержащей наночастицы, включающие таксан, покрытый альбумином, и имеющие средний диаметр не более чем приблизительно 200 нм. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рефрактерного к платине рака мочевого пузыря (такого как рефрактерный к платине рак мочевого пузыря с метастазами, например, рефрактерная к платине метастатическая уротелиальная карцинома) у индивидуума, включающему введение индивидууму от приблизительно 100 до приблизительно 300 мг/м2 (такое как приблизительно 260 мг/м2) композиции, содержащей Nab-паклитаксел. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рефрактерного к платине рака мочевого пузыря (такого как рефрактерный к платине рак мочевого пузыря с метастазами, например, рефрактерная к платине метастатическая уротелиальная карцинома) у индивидуума, включающему введение индивидууму от приблизительно 100 до приблизительно 300 мг/м2 (такое как приблизительно 260 мг/м2) Nab-паклитаксела. В некоторых вариантах осуществления настоящего изобретения композицию вводят один раз каждые три недели. В некоторых вариантах осуществления настоящего изобретения композицию вводят три из четырех недель.
В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рефрактерного к платине рака мочевого пузыря (такого как рефрактерный к платине рак мочевого пузыря с метастазами, например, рефрактерная к платине метастатическая уротелиальная карцинома) у индивидуума, включающему введение индивидууму от приблизительно 100 до приблизительно 300 мг/м2 (такое как приблизительно 260 мг/м2) композиции, содержащей наночастицы, включающие таксан и альбумин, в котором композицию вводят внутривенно один раз каждые три недели. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рефрактерного к платине рака мочевого пузыря (такого как рефрактерный к платине рак мочевого пузыря с метастазами, например, рефрактерная к платине метастатическая уротелиальная карцинома) у индивидуума, включающему внутривенное введение индивидууму от приблизительно 100 до приблизительно 300 мг/м2 (такое как приблизительно 260 мг/м2) композиции, содержащей наночастицы, включающие таксан, покрытый альбумином, в котором композицию вводят внутривенно один раз каждые три недели. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рефрактерного к платине рака мочевого пузыря (такого как рефрактерный к платине рак мочевого пузыря с метастазами, например, рефрактерная к платине метастатическая уротелиальная карцинома) у индивидуума, включающему введение индивидууму от приблизительно 100 до приблизительно 300 мг/м2 (такое как приблизительно 260 мг/м2) композиции, содержащей наночастицы, включающие таксан и альбумин и имеющие средний диаметр не более чем приблизительно 200 нм, в котором композицию вводят внутривенно один раз каждые три недели. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рефрактерного к платине рака мочевого пузыря (такого как рефрактерный к платине рак мочевого пузыря с метастазами, например, рефрактерная к платине метастатическая уротелиальная карцинома) у индивидуума, включающему введение индивидууму от приблизительно 100 до приблизительно 300 мг/м2 (такое как приблизительно 260 мг/м2) композиции, содержащей наночастицы, включающие таксан, покрытый альбумином, и имеющие средний диаметр не более чем приблизительно 200 нм, где композицию вводят внутривенно один раз каждые три недели. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рефрактерного к платине рака мочевого пузыря (такого как рефрактерный к платине рак мочевого пузыря с метастазами, например, рефрактерная к платине метастатическая уротелиальная карцинома) у индивидуума, включающему введение индивидууму от приблизительно 100 до приблизительно 300 мг/м2 (такое как приблизительно 260 мг/м2) композиции, содержащей Nab-паклитаксел, в котором композицию вводят внутривенно один раз каждые три недели. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рефрактерного к платине рака мочевого пузыря (такого как рефрактерный к платине рак мочевого пузыря с метастазами, например, рефрактерная к платине метастатическая уротелиальная карцинома) у индивидуума, включающему введение индивидууму от приблизительно 100 до приблизительно 300 мг/м2 (такое как приблизительно 260 мг/м2) Nab-паклитаксела, где композицию вводят внутривенно один раз каждые три недели.
В некоторых вариантах осуществления настоящее изобретение относится к способу уменьшения размеров опухоли рака мочевого пузыря (такого как уротелиальная карцинома) у индивидуума, включающему введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие таксан и альбумин (например, Nab-паклитаксела). В некоторых вариантах осуществления настоящего изобретения композицию вводят интравезикулярно. В некоторых вариантах осуществления настоящего изобретения композицию вводят внутривенно. В некоторых вариантах осуществления настоящего изобретения рак мочевого пузыря представляет собой рефрактерный к платине рак мочевого пузыря. В некоторых вариантах осуществления настоящего изобретения рак мочевого пузыря представляет собой рефрактерный к платине рак мочевого пузыря с метастазами. В некоторых вариантах осуществления настоящего изобретения композицию наночастиц (например, Nab-паклитаксел) вводят в качестве лечения второй линии. В некоторых вариантах осуществления настоящего изобретения от приблизительно 100 до приблизительно 300 мг/м2 (такое как приблизительно 260 мг/м2) композиции наночастиц (например, Nab-паклитаксела) вводят индивидууму внутривенно. В некоторых вариантах осуществления настоящее изобретение относится к способу уменьшения размеров опухоли рака мочевого пузыря (такого как уротелиальная карцинома) у индивидуума, где рак мочевого пузыря представляет собой рефрактерный к платине рак мочевого пузыря, включающему внутривенное введение индивидууму от приблизительно 100 до приблизительно 300 мг/м2 (такое как приблизительно 260 мг/м2) композиции, содержащей наночастицы, включающие таксан и альбумин (например, Nab-паклитаксела). В некоторых вариантах осуществления настоящее изобретение относится к способу уменьшения размеров опухоли рака мочевого пузыря (такого как уротелиальная карцинома) у индивидуума, где рак мочевого пузыря представляет собой рефрактерный к платине рак мочевого пузыря с метастазами, включающему внутривенное введение индивидууму от приблизительно 100 до приблизительно 300 мг/м2 (такое как приблизительно 260 мг/м2) композиции, содержащей наночастицы, включающие таксан и альбумин (например, Nab-паклитаксела).
В некоторых вариантах осуществления настоящее изобретение относится к способу продления периода времени до прогрессирования рака мочевого пузыря (такого как уротелиальная карцинома) у индивидуума, включающему введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие таксан и альбумин (например, Nab-паклитаксела). В некоторых вариантах осуществления настоящего изобретения композицию вводят интравезикулярно. В некоторых вариантах осуществления настоящего изобретения композицию вводят внутривенно. В некоторых вариантах осуществления настоящего изобретения рак мочевого пузыря представляет собой рак мочевого пузыря с метастазами. В некоторых вариантах осуществления настоящего изобретения рак мочевого пузыря представляет собой рефрактерный к платине рак мочевого пузыря. В некоторых вариантах осуществления настоящего изобретения рак мочевого пузыря представляет собой рефрактерный к платине рак мочевого пузыря с метастазами. В некоторых вариантах осуществления настоящего изобретения композицию наночастиц (например, Nab-паклитаксел) вводят в качестве лечения второй линии. В некоторых вариантах осуществления настоящего изобретения от приблизительно 100 до приблизительно 300 мг/м2 (такое как приблизительно 260 мг/м2) композиции наночастиц (например, Nab-паклитаксела) вводят индивидууму внутривенно. В некоторых вариантах осуществления настоящее изобретение относится к способу продления периода времени до прогрессирования рефрактерного к платине рака мочевого пузыря (такого как рефрактерная к платине уротелиальная карцинома) у индивидуума, включающему внутривенное введение индивидууму от приблизительно 100 до приблизительно 300 мг/м2 (такое как приблизительно 260 мг/м2) композиции, содержащей наночастицы, включающие таксан и альбумин (например, Nab-паклитаксела). В некоторых вариантах осуществления настоящее изобретение относится к способу продления периода времени до прогрессирования рефрактерного к платине рака мочевого пузыря с метастазами (такого как рефрактерная к платине метастатическая уротелиальная карцинома) у индивидуума, включающему внутривенное введение индивидууму от приблизительно 100 до приблизительно 300 мг/м2 (такое как приблизительно 260 мг/м2) композиции, содержащей наночастицы, включающие таксан и альбумин (например, Nab-паклитаксела).
В некоторых вариантах осуществления настоящее изобретение относится к способу продления периода выживания индивидуума, имеющего рак мочевого пузыря (такой как уротелиальная карцинома), включающему введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие таксан и альбумин (например, Nab-паклитаксела). В некоторых вариантах осуществления настоящего изобретения композицию вводят интравезикулярно. В некоторых вариантах осуществления настоящего изобретения композицию вводят внутривенно. В некоторых вариантах осуществления настоящего изобретения рак мочевого пузыря представляет собой рак мочевого пузыря с метастазами. В некоторых вариантах осуществления настоящего изобретения рак мочевого пузыря представляет собой рефрактерный к платине рак мочевого пузыря. В некоторых вариантах осуществления настоящего изобретения рак мочевого пузыря представляет собой рефрактерный к платине рак мочевого пузыря с метастазами. В некоторых вариантах осуществления настоящего изобретения композицию наночастиц (например, Nab-паклитаксел) вводят в качестве лечения второй линии. В некоторых вариантах осуществления настоящего изобретения от приблизительно 100 до приблизительно 300 мг/м2 (такое как приблизительно 260 мг/м2) композиции наночастиц (например, Nab-паклитаксела) вводят индивидууму внутривенно. В некоторых вариантах осуществления настоящее изобретение относится к способу продления периода выживания индивидуума, имеющего рефрактерный к платине рак мочевого пузыря (такой как рефрактерная к платине уротелиальная карцинома), включающему внутривенное введение индивидууму от приблизительно 100 до приблизительно 300 мг/м2 (такое как приблизительно 260 мг/м2) композиции, содержащей наночастицы, включающие таксан и альбумин (например, Nab-паклитаксела). В некоторых вариантах осуществления настоящее изобретение относится к способу продления периода выживания индивидуума, имеющего рефрактерный к платине рак мочевого пузыря с метастазами (такой как рефрактерная к платине метастатическая уротелиальная карцинома), включающему внутривенное введение индивидууму от приблизительно 100 до приблизительно 300 мг/м2 (такое как приблизительно 260 мг/м2) композиции, содержащей наночастицы, включающие таксан и альбумин (например, Nab-паклитаксела).
В некоторых вариантах осуществления настоящее изобретение относится к способу ингибирования клеточной пролиферации (такой как опухолевый рост рака мочевого пузыря) рака мочевого пузыря (такого как уротелиальная карцинома) у индивидуума, включающему введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие таксан и альбумин (например, Nab-паклитаксела). В некоторых вариантах осуществления настоящего изобретения композицию вводят интравезикулярно. В некоторых вариантах осуществления настоящего изобретения композицию вводят внутривенно. В некоторых вариантах осуществления настоящего изобретения рак мочевого пузыря представляет собой рак мочевого пузыря с метастазами. В некоторых вариантах осуществления настоящего изобретения рак мочевого пузыря представляет собой рефрактерный к платине рак мочевого пузыря. В некоторых вариантах осуществления настоящего изобретения рак мочевого пузыря представляет собой рефрактерный к платине рак мочевого пузыря с метастазами. В некоторых вариантах осуществления настоящего изобретения композицию наночастиц (например, Nab-паклитаксел) вводят в качестве лечения второй линии. В некоторых вариантах осуществления настоящего изобретения от приблизительно 100 до приблизительно 300 мг/м2 (такое как приблизительно 260 мг/м2) композиции наночастиц (например, Nab-паклитаксела) вводят индивидууму внутривенно. В некоторых вариантах осуществления настоящее изобретение относится к способу ингибирования клеточной пролиферации (такой как опухолевый рост рака мочевого пузыря) рака мочевого пузыря (такого как рефрактерная к платине уротелиальная карцинома) у индивидуума, включающему внутривенное введение индивидууму от приблизительно 100 до приблизительно 300 мг/м2 (такое как приблизительно 260 мг/м2) композиции, содержащей наночастицы, включающие таксан и альбумин (например, Nab-паклитаксела). В некоторых вариантах осуществления настоящее изобретение относится к способу ингибирования клеточной пролиферации (такой как опухолевый рост рака мочевого пузыря) рефрактерного к платине рака мочевого пузыря с метастазами (такого как рефрактерная к платине метастатическая уротелиальная карцинома) у индивидуума, включающему внутривенное введение индивидууму от приблизительно 100 до приблизительно 300 мг/м2 (такое как приблизительно 260 мг/м2) композиции, содержащей наночастицы, включающие таксан и альбумин (например, Nab-паклитаксела).
В некоторых вариантах осуществления настоящее изобретение относится к способу ингибирования метастазирования рака мочевого пузыря (такого как уротелиальная карцинома) у индивидуума, включающему введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие таксан и альбумин (например, Nab-паклитаксела). В некоторых вариантах осуществления настоящего изобретения композицию вводят интравезикулярно. В некоторых вариантах осуществления настоящего изобретения композицию вводят внутривенно. В некоторых вариантах осуществления настоящего изобретения рак мочевого пузыря представляет собой рефрактерный к платине рак мочевого пузыря с метастазами. В некоторых вариантах осуществления настоящего изобретения композицию наночастиц (например, Nab-паклитаксел) вводят в качестве лечения второй линии. В некоторых вариантах осуществления настоящего изобретения от приблизительно 100 до приблизительно 300 мг/м2 (такое как приблизительно 260 мг/м2) композиции наночастиц (например, Nab-паклитаксела) вводят индивидууму внутривенно. В некоторых вариантах осуществления настоящее изобретение относится к способу ингибирования метастазирования рака мочевого пузыря (такого как уротелиальная карцинома), где рак мочевого пузыря представляет собой рефрактерный к платине рак мочевого пузыря с метастазами, у индивидуума, включающему внутривенное введение индивидууму от приблизительно 100 до приблизительно 300 мг/м2 (такое как приблизительно 260 мг/м2) композиции, содержащей наночастицы, включающие таксан и альбумин (например, Nab-паклитаксела).
В некоторых вариантах осуществления настоящее изобретение относится к способу уменьшения (такого как при облучении) ранее существовавших метастазов (таких как метастазы в легких или метастазы в лимфоузлах) рака мочевого пузыря (такого как уротелиальная карцинома) у индивидуума, включающему введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие таксан и альбумин (например, Nab-паклитаксела). В некоторых вариантах осуществления настоящего изобретения композицию вводят интравезикулярно. В некоторых вариантах осуществления настоящего изобретения композицию вводят внутривенно. В некоторых вариантах осуществления настоящего изобретения рак мочевого пузыря представляет собой рефрактерный к платине рак мочевого пузыря с метастазами. В некоторых вариантах осуществления настоящего изобретения композицию наночастиц (например, Nab-паклитаксел) вводят в качестве лечения второй линии. В некоторых вариантах осуществления настоящего изобретения от приблизительно 100 до приблизительно 300 мг/м2 (такое как приблизительно 260 мг/м2) композиции наночастиц (например, Nab-паклитаксела) вводят индивидууму внутривенно. В некоторых вариантах осуществления настоящее изобретение относится к способу уменьшения (такого как при облучении) ранее существовавших метастазов (таких как метастазы в легких или метастазы в лимфоузлах) рака мочевого пузыря (такого как уротелиальная карцинома), где рак мочевого пузыря представляет собой рефрактерный к платине рак мочевого пузыря с метастазами, у индивидуума, включающему внутривенное введение индивидууму от приблизительно 100 до приблизительно 300 мг/м2 (такое как приблизительно 260 мг/м2) композиции, содержащей наночастицы, включающие таксан и альбумин (например, Nab-паклитаксела).
В некоторых вариантах осуществления настоящее изобретение относится к способу уменьшения частоты или нагрузки ранее существовавших метастазов (таких как метастазы в легких или метастазы в лимфоузлах) рака мочевого пузыря (такого как уротелиальная карцинома) у индивидуума, включающему введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие таксан и альбумин (например, Nab-паклитаксела). В некоторых вариантах осуществления настоящего изобретения композицию вводят интравезикулярно. В некоторых вариантах осуществления настоящего изобретения композицию вводят внутривенно. В некоторых вариантах осуществления настоящего изобретения рак мочевого пузыря представляет собой рефрактерный к платине рак мочевого пузыря с метастазами. В некоторых вариантах осуществления настоящего изобретения композицию наночастиц (например, Nab-паклитаксел) вводят в качестве лечения второй линии. В некоторых вариантах осуществления настоящего изобретения от приблизительно 100 до приблизительно 300 мг/м2 (такое как приблизительно 260 мг/м2) композиции наночастиц (например, Nab-паклитаксела) вводят индивидууму внутривенно. В некоторых вариантах осуществления настоящее изобретение относится к способу уменьшения частоты или нагрузки ранее существовавших метастазов (таких как метастазы в легких или метастазы в лимфоузлах) рака мочевого пузыря (такого как уротелиальная карцинома), где рак мочевого пузыря представляет собой рефрактерный к платине рак мочевого пузыря с метастазами, у индивидуума, включающему внутривенное введение индивидууму от приблизительно 100 до приблизительно 300 мг/м2 (такое как приблизительно 260 мг/м2) композиции, содержащей наночастицы, включающие таксан и альбумин (например, Nab-паклитаксела).
Способы введения комбинированных лекарственных средств
Схемы введения лекарственных средств, описанные в разделе выше, используются как для монотерапии, так и для комбинированной терапии. Способы введения для методов комбинированной терапии описаны далее.
В некоторых вариантах осуществления настоящего изобретения композицию наночастиц и другой агент вводят одновременно. В случае, когда лекарственные средства вводят одновременно, лекарственное средство в наночастицах и другой агент могут содержаться в одной и той же композиции (например, в композиции, содержащей и наночастицы, и другой агент) или в отдельных композициях (например, наночастицы содержаться в одной композиции, а другой агент - в другой композиции).
В некоторых вариантах осуществления настоящего изобретения композицию наночастиц и другой агент вводят последовательно. Первой можно вводить композицию наночастиц или первым можно вводить другой агент. Композиция наночастиц и другой агент содержатся в отдельных композициях, которые могут содержаться в одной и той же или в разных упаковках.
В некоторых вариантах осуществления настоящего изобретения введение композиции наночастиц и другого агента является параллельным, т.е., период введения композиции наночастиц и период введения другого агента накладываются друг на друга. В некоторых вариантах осуществления настоящего изобретения введение композиции наночастиц и другого агента не является параллельным.
В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря у индивидуума, который в этом нуждается, включающему введение индивидууму (а) эффективного количества композиции, содержащей наночастицы, включающие таксан и альбумин; и (b) эффективного количества агента на основе платины (такого как карбоплатин). В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря у индивидуума, который в этом нуждается, включающему введение индивидууму (а) эффективного количества композиции, содержащей наночастицы, включающие таксан и альбумин; и (b) эффективного количества агента на основе платины (такого как карбоплатин). В некоторых вариантах осуществления настоящего изобретения введение композиции наночастиц и агента на основе платины является параллельным. В некоторых вариантах осуществления настоящего изобретения способ выполняют с использованием схемы нового вспомогательного лечения. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря у индивидуума, который в этом нуждается, включающему введение индивидууму (а) эффективного количества композиции, содержащей наночастицы, включающие таксан и альбумин; и (b) эффективного количества антиметаболита (такого как нуклеозидный аналог, например, гемцитабин). В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря у индивидуума, который в этом нуждается, включающему введение индивидууму (а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел, покрытый альбумином (такой как Abraxane®); и (b) эффективного количества антиметаболита (такого как нуклеозидный аналог, например, гемцитабин). В некоторых вариантах осуществления настоящего изобретения введение композиции наночастиц и антиметаболита является параллельным. В некоторых вариантах осуществления настоящего изобретения способ выполняют с использованием схемы нового вспомогательного лечения.
В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря у индивидуума, который в этом нуждается, включающему введение индивидууму (а) эффективного количества композиции, содержащей наночастицы, включающие таксан и альбумин; (b) эффективного количества агента на основе платины (такого как карбоплатин) и (с) эффективного количества антиметаболита (такого как нуклеозидный аналог, например, гемцитабин). В некоторых вариантах осуществления настоящего изобретения введение композиции наночастиц, агента на основе платины и антиметаболита является параллельным. В некоторых вариантах осуществления настоящего изобретения способ выполняют с использованием схемы нового вспомогательного лечения. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря у индивидуума, который в этом нуждается, включающему введение индивидууму (а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел, покрытый альбумином (такой как Abraxane®); (b) эффективного количества карбоплатина и (с) эффективного количества гемцитабина. В некоторых вариантах осуществления настоящего изобретения способ выполняют с использованием схемы нового вспомогательного лечения. В некоторых вариантах осуществления настоящего изобретения введение композиции наночастиц, карбоплатина и гемцитабина является параллельным.
В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря (такого как уротелиальная карцинома) у индивидуума, который в этом нуждается, включающему введение (например, параллельное введение) индивидууму (а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел, покрытый альбумином (такой как Abraxane®); (b) эффективного количества карбоплатина и (с) эффективного количества гемцитабина. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря (такого как уротелиальная карцинома) у индивидуума, который в этом нуждается, включающему введение (например, параллельное введение) индивидууму (а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел, покрытый альбумином (такой как Abraxane®); (b) эффективного количества карбоплатина и (с) эффективного количества гемцитабина, где способ выполняют с использованием схемы нового вспомогательного лечения. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря (такого как уротелиальная карцинома) у индивидуума, который в этом нуждается, включающему внутривенное введение (например, параллельное введение) индивидууму (а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел, покрытый альбумином (такой как Abraxane®); (b) эффективного количества карбоплатина и (с) эффективного количества гемцитабина. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря (такого как уротелиальная карцинома) у индивидуума, который в этом нуждается, включающему внутривенное введение (например, параллельное введение) индивидууму (а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел, покрытый альбумином (такой как Abraxane®); (b) эффективного количества карбоплатина и (с) эффективного количества гемцитабина, где способ выполняют с использованием схемы нового вспомогательного лечения. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря (такого как уротелиальная карцинома) у индивидуума, который в этом нуждается, включающему введение (например, параллельное введение) индивидууму (а) приблизительно 260 мг/м2 композиции, содержащей наночастицы, включающие паклитаксел, покрытый альбумином (такой как Abraxane®); (b) карбоплатина с AUC приблизительно 5-6 и (с) приблизительно 800-1000 мг/м2 гемцитабина. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря (такого как уротелиальная карцинома) у индивидуума, который в этом нуждается, включающему введение (например, параллельное введение) индивидууму (а) приблизительно 260 мг/м2 композиции, содержащей наночастицы, включающие паклитаксел, покрытый альбумином (такой как Abraxane®); (b) карбоплатина с AUC приблизительно 5-6 и (с) приблизительно 800-1000 мг/м2 гемцитабина, где способ выполняют с использованием схемы нового вспомогательного лечения.
В некоторых вариантах осуществления настоящее изобретение относится к способу лечения локально запущенного рака мочевого пузыря (такого как локально запущенная уротелиальная карцинома) у индивидуума, который в этом нуждается, включающему введение (например, параллельное введение) индивидууму (а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел, покрытый альбумином (такой как Abraxane®); (b) эффективного количества карбоплатина и (с) эффективного количества гемцитабина. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения локально запущенного рака мочевого пузыря (такого как локально запущенная уротелиальная карцинома) у индивидуума, который в этом нуждается, включающему введение (например, параллельное введение) индивидууму (а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел, покрытый альбумином (такой как Abraxane®); (b) эффективного количества карбоплатина и (с) эффективного количества гемцитабина, где способ выполняют с использованием схемы нового вспомогательного лечения. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения локально запущенного рака мочевого пузыря (такого как локально запущенная уротелиальная карцинома) у индивидуума, который в этом нуждается, включающему внутривенное введение (например, параллельное введение) индивидууму (а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел, покрытый альбумином (такой как Abraxane®); (b) эффективного количества карбоплатина и (с) эффективного количества гемцитабина. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения локально запущенного рака мочевого пузыря (такого как локально запущенная уротелиальная карцинома) у индивидуума, который в этом нуждается, включающему внутривенное введение (например, параллельное введение) индивидууму (а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел, покрытый альбумином (такой как Abraxane®); (b) эффективного количества карбоплатина и (с) эффективного количества гемцитабина, где способ выполняют с использованием схемы нового вспомогательного лечения. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения локально запущенного рака мочевого пузыря (такого как локально запущенная уротелиальная карцинома) у индивидуума, который в этом нуждается, включающему введение (например, параллельное введение) индивидууму (а) приблизительно 260 мг/м2 композиции, содержащей наночастицы, включающие паклитаксел, покрытый альбумином (такой как Abraxane®); (b) карбоплатина с AUC приблизительно 5-6 и (с) приблизительно 800-1000 мг/м2 гемцитабина. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения локально запущенного рака мочевого пузыря (такого как локально запущенная уротелиальная карцинома) у индивидуума, который в этом нуждается, включающему введение (например, параллельное введение) индивидууму (а) приблизительно 260 мг/м2 композиции, содержащей наночастицы, включающие паклитаксел, покрытый альбумином (такой как Abraxane®); (b) карбоплатина с AUC приблизительно 5-6 и (с) приблизительно 800-1000 мг/м2 гемцитабина, где способ выполняют с использованием схемы нового вспомогательного лечения.
В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рефрактерного к платине рака мочевого пузыря (такого как рефрактерная к платине уротелиальная карцинома) у индивидуума, который в этом нуждается, включающему введение (например, параллельное введение) индивидууму (а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел, покрытый альбумином (такой как Abraxane®); (b) эффективного количества карбоплатина и (с) эффективного количества гемцитабина. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рефрактерного к платине рака мочевого пузыря (такого как рефрактерная к платине уротелиальная карцинома) у индивидуума, который в этом нуждается, включающему введение (например, параллельное введение) индивидууму (а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел, покрытый альбумином (такой как Abraxane®); (b) эффективного количества карбоплатина и (с) эффективного количества гемцитабина, где способ выполняют с использованием схемы нового вспомогательного лечения. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рефрактерного к платине рака мочевого пузыря (такого как рефрактерная к платине уротелиальная карцинома) у индивидуума, который в этом нуждается, включающему внутривенное введение (например, параллельное введение) индивидууму (а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел, покрытый альбумином (такой как Abraxane®); (b) эффективного количества карбоплатина и (с) эффективного количества гемцитабина. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рефрактерного к платине рака мочевого пузыря (такого как рефрактерная к платине уротелиальная карцинома) у индивидуума, который в этом нуждается, включающему внутривенное введение (например, параллельное введение) индивидууму (а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел, покрытый альбумином (такой как Abraxane®); (b) эффективного количества карбоплатина и (с) эффективного количества гемцитабина, где способ выполняют с использованием схемы нового вспомогательного лечения. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рефрактерного к платине рака мочевого пузыря (такого как рефрактерная к платине уротелиальная карцинома) у индивидуума, который в этом нуждается, включающему введение (например, параллельное введение) индивидууму (а) приблизительно 260 мг/м2 композиции, содержащей наночастицы, включающие паклитаксел, покрытый альбумином (такой как Abraxane®); (b) карбоплатина с AUC приблизительно 5-6 и (с) приблизительно 800-1000 мг/м2 гемцитабина. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рефрактерного к платине рака мочевого пузыря (такого как рефрактерная к платине уротелиальная карцинома) у индивидуума, который в этом нуждается, включающему введение (например, параллельное введение) индивидууму (а) приблизительно 260 мг/м2 композиции, содержащей наночастицы, включающие паклитаксел, покрытый альбумином (такой как Abraxane®); (b) карбоплатина с AUC приблизительно 5-6 и (с) приблизительно 800-1000 мг/м2 гемцитабина, где способ выполняют с использованием схемы нового вспомогательного лечения.
В некоторых вариантах осуществления настоящее изобретение относится к способу лечения мышечно-инвазивного рака мочевого пузыря (такого как мышечно-инвазивная уротелиальная карцинома) у индивидуума, который в этом нуждается, включающему введение (например, параллельное введение) индивидууму (а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел, покрытый альбумином (такой как Abraxane®); (b) эффективного количества карбоплатина и (с) эффективного количества гемцитабина. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения мышечно-инвазивного рака мочевого пузыря (такого как мышечно-инвазивная уротелиальная карцинома) у индивидуума, который в этом нуждается, включающему введение (например, параллельное введение) индивидууму (а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел, покрытый альбумином (такой как Abraxane®); (b) эффективного количества карбоплатина и (с) эффективного количества гемцитабина, где способ выполняют с использованием схемы нового вспомогательного лечения. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения мышечно-инвазивного рака мочевого пузыря (такого как мышечно-инвазивная уротелиальная карцинома) у индивидуума, который в этом нуждается, включающему внутривенное введение (например, параллельное введение) индивидууму (а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел, покрытый альбумином (такой как Abraxane®); (b) эффективного количества карбоплатина и (с) эффективного количества гемцитабина. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения мышечно-инвазивного рака мочевого пузыря (такого как мышечно-инвазивная уротелиальная карцинома) у индивидуума, который в этом нуждается, включающему внутривенное введение (например, параллельное введение) индивидууму (а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел, покрытый альбумином (такой как Abraxane®); (b) эффективного количества карбоплатина и (с) эффективного количества гемцитабина, где способ выполняют с использованием схемы нового вспомогательного лечения. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения мышечно-инвазивного рака мочевого пузыря (такого как мышечно-инвазивная уротелиальная карцинома) у индивидуума, который в этом нуждается, включающему введение (например, параллельное введение) индивидууму (а) приблизительно 260 мг/м2 композиции, содержащей наночастицы, включающие паклитаксел, покрытый альбумином (такой как Abraxane®); (b) карбоплатина с AUC приблизительно 5-6 и (с) приблизительно 800-1000 мг/м2 гемцитабина. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения мышечно-инвазивного рака мочевого пузыря (такого как мышечно-инвазивная уротелиальная карцинома) у индивидуума, который в этом нуждается, включающему введение (например, параллельное введение) индивидууму (а) приблизительно 260 мг/м2 Abraxane®; (b) карбоплатина с AUC приблизительно 5-6 и (с) приблизительно 800-1000 мг/м2 гемцитабина, где способ выполняют с использованием схемы нового вспомогательного лечения.
В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря у индивидуума, который в этом нуждается, включающему введение (например, параллельное введение) индивидууму (а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел, покрытый альбумином (такой как Abraxane®); (b) эффективного количества карбоплатина и (с) эффективного количества гемцитабина, где способ выполняют с использованием схемы нового вспомогательного лечения. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря у индивидуума, который в этом нуждается, включающему введение (например, параллельное введение) индивидууму (а) приблизительно 260 мг/м2 Abraxane®; (b) карбоплатина с AUC приблизительно 5-6 и (с) приблизительно 800-1000 мг/м2 гемцитабина. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения локально запущенного рака мочевого пузыря у индивидуума, который в этом нуждается, включающему внутривенное введение (например, параллельное введение) индивидууму (а) приблизительно 260 мг/м2 Abraxane®; (b) карбоплатина с AUC приблизительно 5-6 и (с) приблизительно 800-1000 мг/м2 гемцитабина. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения локально запущенного рака мочевого пузыря у индивидуума, который в этом нуждается, с использованием схемы нового вспомогательного лечения, включающему внутривенное введение (например, параллельное введение) индивидууму (а) приблизительно 260 мг/м2 Abraxane®; (b) карбоплатина с AUC приблизительно 5-6 и (с) приблизительно 800-1000 мг/м2 гемцитабина. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря у индивидуума, который в этом нуждается, включающему внутривенное введение (например, параллельное введение) индивидууму (а) приблизительно 260 мг/м2 Abraxane®; (b) карбоплатина с AUC приблизительно 5 и (с) приблизительно 800 мг/м2 гемцитабина. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения локально запущенного рака мочевого пузыря у индивидуума, который в этом нуждается, включающему внутривенное введение (например, параллельное введение) индивидууму (а) приблизительно 260 мг/м2 Abraxane®; (b) карбоплатина с AUC приблизительно 5 и (с) приблизительно 800 мг/м2 гемцитабина. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения локально запущенного рака мочевого пузыря у индивидуума, который в этом нуждается, с использованием схемы нового вспомогательного лечения, включающему внутривенное введение (например, параллельное введение) индивидууму (а) приблизительно 260 мг/м2 Abraxane®; (b) карбоплатина с AUC приблизительно 5 и (с) приблизительно 800 мг/м2 гемцитабина. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря у индивидуума, который в этом нуждается, включающему внутривенное введение (например, параллельное введение) индивидууму (а) приблизительно 260 мг/м2 Abraxane® на день 1 каждого цикла; (b) карбоплатина с AUC приблизительно 5-6 на день 1 каждого цикла и (с) приблизительно 800-1000 мг/м2 гемцитабина на дни 1 и 8 каждого цикла. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения локально запущенного рака мочевого пузыря у индивидуума, который в этом нуждается, включающему внутривенное введение (например, параллельное введение) индивидууму (а) приблизительно 260 мг/м2 Abraxane® на день 1 каждого цикла; (b) карбоплатина с AUC приблизительно 5-6 на день 1 каждого цикла и (с) приблизительно 800-1000 мг/м2 гемцитабина на дни 1 и 8 каждого цикла. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения локально запущенного рака мочевого пузыря у индивидуума, который в этом нуждается, с использованием схемы нового вспомогательного лечения, включающему внутривенное введение (например, параллельное введение) индивидууму (а) приблизительно 260 мг/м2 Abraxane® на день 1 каждого цикла; (b) карбоплатина с AUC приблизительно 5-6 на день 1 каждого цикла и (с) приблизительно 800-1000 мг/м2 гемцитабина на дни 1 и 8 каждого цикла.
В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рефрактерного к платине рака мочевого пузыря у индивидуума, который в этом нуждается, включающему внутривенное введение (например, параллельное введение) индивидууму (а) приблизительно 260 мг/м2 Abraxane®; (b) карбоплатина с AUC приблизительно 5-6 и (с) приблизительно 800-1000 мг/м2 гемцитабина. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рефрактерного к платине рака мочевого пузыря у индивидуума, который в этом нуждается, с использованием схемы нового вспомогательного лечения, включающему внутривенное введение (например, параллельное введение) индивидууму (а) приблизительно 260 мг/м2 Abraxane®; (b) карбоплатина с AUC приблизительно 5-6 и (с) приблизительно 800-1000 мг/м2 гемцитабина. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рефрактерного к платине рака мочевого пузыря у индивидуума, который в этом нуждается, включающему внутривенное введение (например, параллельное введение) индивидууму (а) приблизительно 260 мг/м2 Abraxane®; (b) карбоплатина с AUC приблизительно 5 и (с) приблизительно 800 мг/м2 гемцитабина. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рефрактерного к платине рака мочевого пузыря у индивидуума, который в этом нуждается, с использованием схемы нового вспомогательного лечения, включающему внутривенное введение (например, параллельное введение) индивидууму (а) приблизительно 260 мг/м2 Abraxane®; (b) карбоплатина с AUC приблизительно 5 и (с) приблизительно 800 мг/м2 гемцитабина. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рефрактерного к платине рака мочевого пузыря у индивидуума, который в этом нуждается, включающему внутривенное введение (например, параллельное введение) индивидууму (а) приблизительно 260 мг/м2 Abraxane® на день 1 каждого цикла; (b) карбоплатина с AUC приблизительно 5-6 на день 1 каждого цикла и (с) приблизительно 800-1000 мг/м2 гемцитабина на дни 1 и 8 каждого цикла. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рефрактерного к платине рака мочевого пузыря у индивидуума, который в этом нуждается, с использованием схемы нового вспомогательного лечения, включающему внутривенное введение (например, параллельное введение) индивидууму (а) приблизительно 260 мг/м2 Abraxane® на день 1 каждого цикла; (b) карбоплатина с AUC приблизительно 5-6 на день 1 каждого цикла и (с) приблизительно 800-1000 мг/м2 гемцитабина на дни 1 и 8 каждого цикла.
В некоторых вариантах осуществления настоящее изобретение относится к способу лечения мышечно-инвазивного рака мочевого пузыря у индивидуума, который в этом нуждается, включающему внутривенное введение (например, параллельное введение) индивидууму (а) приблизительно 260 мг/м2 Abraxane®; (b) карбоплатина с AUC приблизительно 5-6 и (с) приблизительно 800-1000 мг/м2 гемцитабина. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения мышечно-инвазивного рака мочевого пузыря у индивидуума, который в этом нуждается, с использованием схемы нового вспомогательного лечения, включающему внутривенное введение (например, параллельное введение) индивидууму (а) приблизительно 260 мг/м2 Abraxane®; (b) карбоплатина с AUC приблизительно 5-6 и (с) приблизительно 800-1000 мг/м2 гемцитабина. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рака мочевого пузыря у индивидуума, который в этом нуждается, включающему внутривенное введение (например, параллельное введение) индивидууму (а) приблизительно 260 мг/м2 Abraxane®; (b) карбоплатина с AUC приблизительно 5 и (с) приблизительно 800 мг/м2 гемцитабина. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения мышечно-инвазивного рака мочевого пузыря у индивидуума, который в этом нуждается, включающему внутривенное введение (например, параллельное введение) индивидууму (а) приблизительно 260 мг/м2 Abraxane®; (b) карбоплатина с AUC приблизительно 5 и (с) приблизительно 800 мг/м2 гемцитабина. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения мышечно-инвазивного рака мочевого пузыря у индивидуума, который в этом нуждается, с использованием схемы нового вспомогательного лечения, включающему внутривенное введение (например, параллельное введение) индивидууму (а) приблизительно 260 мг/м2 Abraxane®; (b) карбоплатина с AUC приблизительно 5 и (с) приблизительно 800 мг/м2 гемцитабина. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения мышечно-инвазивного рака мочевого пузыря у индивидуума, который в этом нуждается, включающему внутривенное введение (например, параллельное введение) индивидууму (а) приблизительно 260 мг/м2 Abraxane® на день 1 каждого цикла; (b) карбоплатина с AUC приблизительно 5-6 на день 1 каждого цикла и (с) приблизительно 800-1000 мг/м2 гемцитабина на дни 1 и 8 каждого цикла. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения рефрактерного к платине рака мочевого пузыря у индивидуума, с использованием схемы нового вспомогательного лечения, который в этом нуждается, включающему внутривенное введение (например, параллельное введение) индивидууму (а) приблизительно 260 мг/м2 Abraxane® на день 1 каждого цикла; (b) карбоплатина с AUC приблизительно 5-6 на день 1 каждого цикла и (с) приблизительно 800-1000 мг/м2 гемцитабина на дни 1 и 8 каждого цикла.
В некоторых вариантах осуществления настоящее изобретение относится к способу уменьшения размеров опухоли у индивидуума с раком мочевого пузыря, включающему введение (например, параллельное введение) индивидууму (а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел, покрытый альбумином (такой как Abraxane®); (b) эффективного количества карбоплатина и (с) эффективного количества гемцитабина, где способ выполняют с использованием схемы нового вспомогательного лечения. В некоторых вариантах осуществления настоящее изобретение относится к способу уменьшения размеров опухоли у индивидуума с раком мочевого пузыря, включающему внутривенное введение (например, параллельное введение) индивидууму (а) приблизительно 260 мг/м2 Abraxane®; (b) карбоплатина с AUC приблизительно 5-6 и (с) приблизительно 800-1000 мг/м2 гемцитабина. В некоторых вариантах осуществления настоящее изобретение относится к способу уменьшения размеров опухоли у индивидуума с локально запущенным раком мочевого пузыря, включающему внутривенное введение (например, параллельное введение) индивидууму (а) приблизительно 260 мг/м2 Abraxane®; (b) карбоплатина с AUC приблизительно 5-6 и (с) приблизительно 800-1000 мг/м2 гемцитабина. В некоторых вариантах осуществления настоящее изобретение относится к способу уменьшения размеров опухоли у индивидуума с локально запущенным раком мочевого пузыря, с использованием схемы нового вспомогательного лечения, включающему внутривенное введение (например, параллельное введение) индивидууму (а) приблизительно 260 мг/м2 Abraxane®; (b) карбоплатина с AUC приблизительно 5-6 и (с) приблизительно 800-1000 мг/м2 гемцитабина. В некоторых вариантах осуществления настоящее изобретение относится к способу уменьшения размеров опухоли у индивидуума с раком мочевого пузыря, включающему внутривенное введение (например, параллельное введение) индивидууму (а) приблизительно 260 мг/м2 Abraxane®; (b) карбоплатина с AUC приблизительно 5 и (с) приблизительно 800 мг/м2 гемцитабина. В некоторых вариантах осуществления настоящее изобретение относится к способу уменьшения размеров опухоли у индивидуума с локально запущенным раком мочевого пузыря, включающему внутривенное введение (например, параллельное введение) индивидууму (а) приблизительно 260 мг/м2 Abraxane®; (b) карбоплатина с AUC приблизительно 5 и (с) приблизительно 800 мг/м2 гемцитабина. В некоторых вариантах осуществления настоящее изобретение относится к способу уменьшения размеров опухоли у индивидуума с локально запущенным раком мочевого пузыря, включающему внутривенное введение (например, параллельное введение) индивидууму, с использованием схемы нового вспомогательного лечения, (а) приблизительно 260 мг/м2 Abraxane®; (b) карбоплатина с AUC приблизительно 5 и (с) приблизительно 800 мг/м2 гемцитабина.
Также описаны фармацевтические композиции, наборы и лекарственные средства, включающие композицию наночастиц, агенты на основе платины и антиметаболит. Например, в некоторых вариантах осуществления настоящее изобретение относится к фармацевтической композиции (или лекарственному средству) для лечения рака мочевого пузыря, включающей (а) эффективное количество композиции, содержащей наночастицы, включающие паклитаксел, покрытый альбумином (такой как Abraxane®); (b) эффективное количество карбоплатина и (с) эффективное количество гемцитабина. В некоторых вариантах осуществления настоящее изобретение относится к набору, включающему (а) эффективное количество композиции, содержащей наночастицы, включающие паклитаксел, покрытый альбумином (такой как Abraxane®); (b) эффективное количество карбоплатина и (с) эффективное количество гемцитабина. В некоторых вариантах осуществления настоящего изобретения набор дополнительно включает инструкцию по лечению рака мочевого пузыря.
В некоторых вариантах осуществления настоящее изобретение относится к фармацевтической композиции (или лекарственному средству) для лечения рака мочевого пузыря, включающей (а) приблизительно 260 мг/м2 Abraxane®; (b) карбоплатина с AUC приблизительно 5-6 и (с) приблизительно 800-1000 мг/м2 гемцитабина. В некоторых вариантах осуществления настоящее изобретение относится к набору, включающему (а) приблизительно 260 мг/м2 Abraxane®; (b) карбоплатина с AUC приблизительно 5-6 и (с) приблизительно 800-1000 мг/м2 гемцитабина. В некоторых вариантах осуществления настоящего изобретения набор дополнительно включает инструкцию по лечению рака мочевого пузыря (например, локально запущенного рака мочевого пузыря; локально запущенного рака мочевого пузыря с использованием схемы нового вспомогательного лечения).
Композиции наночастиц
Композиции наночастиц, описанные в настоящем документе, включают наночастицы, включающие (в различных вариантах осуществления настоящего изобретения - состоящие, преимущественно из) таксан (такой как паклитаксел) и альбумин (такой как человеческий сывороточный альбумин). Наночастицы лекарственных средств, плохо растворяющихся в воде (таких как таксан), описаны, например, в патентах США №№ 5916596, 6506405, 6749868 и 6537579, а также в патентных публикациях США №№ 2006/0004002, 2006/0263434 и 2007/0082838, патентной заявке РСТ WO08/137148, каждый из которых полностью включен в настоящий документ в качестве ссылки.
В некоторых вариантах осуществления настоящего изобретения композиция содержит наночастицы со средним диаметром не более чем приблизительно 1000 нанометров (нм), таким как не более приблизительно 900, 800, 700, 600, 500, 400, 300, 200 и 100 нм. В некоторых вариантах осуществления настоящего изобретения средний диаметр наночастиц составляет не более чем приблизительно 200 нм. В некоторых вариантах осуществления настоящего изобретения средний диаметр наночастиц составляет не более чем приблизительно 150 нм. В некоторых вариантах осуществления настоящего изобретения средний диаметр наночастиц составляет не более чем приблизительно 100 нм. В некоторых вариантах осуществления настоящего изобретения средний диаметр наночастиц составляет от приблизительно 20 до приблизительно 400 нм. В некоторых вариантах осуществления настоящего изобретения средний диаметр наночастиц составляет от приблизительно 40 до приблизительно 200 нм. В некоторых вариантах осуществления настоящего изобретения частицы являются способными проходить через фильтр для стерилизации.
В некоторых вариантах осуществления настоящего изобретения наночастицы, описанные в настоящем документе, имеют средний диаметр не более чем приблизительно 200 нм, включая, например, не более чем приблизительно 190, 180, 170, 160, 150, 140, 130, 120, 110, 100, 90, 80, 70 или 60 нм. В некоторых вариантах осуществления настоящего изобретения по меньшей мере приблизительно 50% (например, по меньшей мере приблизительно 60%, 70%, 80%, 90%, 95% или 99%) наночастиц в композиции имеют средний диаметр не более чем приблизительно 200 нм, включая, например, не более приблизительно 190, 180, 170, 160, 150, 140, 130, 120, 110, 100, 90, 80, 70 или 60 нм. В некоторых вариантах осуществления настоящего изобретения по меньшей мере приблизительно 50% (например, по меньшей мере приблизительно 60%, 70%, 80%, 90%, 95% или 99%) наночастиц в композиции попадают в пределы от приблизительно 20 до приблизительно 400 нм, включая, например, от приблизительно 20 до приблизительно 200 нм, от приблизительно 40 до приблизительно 200 нм, от приблизительно 30 до приблизительно 180 нм и в любые из от приблизительно 40 до приблизительно 150 нм, от приблизительно 50 приблизительно до 120 нм и от приблизительно 60 до приблизительно 1.
В некоторых вариантах осуществления настоящего изобретения альбумин имеет сульфгидрильные группы, которые могут образовывать дисульфидные связи. В некоторых вариантах осуществления настоящего изобретения по меньшей мере приблизительно 5% (включая, например, по меньшей мере приблизительно 10%, 15%, 20%, 25%, 30%, 40%, 50%, 60%, 70%, 80% или 90%) альбумина в той части композиции, которая представлена наночастицами, являются поперечно сшитыми (например, поперечно сшитыми через одну или более дисульфидных связей).
В некоторых вариантах осуществления настоящего изобретения наночастицы включают таксан (такой как паклитаксел), покрытый альбумином (таким как человеческий сывороточный альбумин). В некоторых вариантах осуществления настоящего изобретения композиция содержит таксан как в форме наночастиц, так не в форме наночастиц, где по меньшей мере 50%, 60%, 70%, 80%, 90%, 95% или 99% таксана в композиции находятся в форме наночастиц. В некоторых вариантах осуществления настоящего изобретения таксан в наночастицах составляет более чем приблизительно 50%, 60%, 70%, 80%, 90%, 95% или 99% наночастиц по массе. В некоторых вариантах осуществления настоящего изобретения наночастицы имеют неполимерный матрикс. В некоторых вариантах осуществления настоящего изобретения наночастицы включают ядро из таксана, которое практически не содержит полимерных материалов (таких как полимерный матрикс).
В некоторых вариантах осуществления настоящего изобретения композиция содержит альбумин как в части композиции, представленной наночастицами, так и в части композиции, не представленной наночастицами, где по меньшей мере приблизительно 50%, 60%, 70%, 80%, 90%, 95% или 99% альбумина в композиции находятся в части композиции, не представленной наночастицами.
В некоторых вариантах осуществления настоящего изобретения массовое соотношение альбумина (такого как человеческий сывороточный альбумин) и таксана в композиции наночастиц составляет приблизительно 18:1 или менее, такое как приблизительно 15:1 или менее, например, приблизительно 10:1 или менее. В некоторых вариантах осуществления настоящего изобретения массовое соотношение альбумина (такого как человеческий сывороточный альбумин) и таксана в композиции находится в пределах от приблизительно 1:1 до приблизительно 18:1, от приблизительно 2:1 до приблизительно 15:1, от приблизительно 3:1 до приблизительно 13:1, от приблизительно 4:1 до приблизительно 12:1, от приблизительно 5:1 до приблизительно 10:1. В некоторых вариантах осуществления настоящего изобретения массовое соотношение альбумина и таксана в части композиции, представленной наночастицами, составляет приблизительно от 1:2, 1:3, 1:4, 1:5, 1:10, 1:15 или менее. В некоторых вариантах осуществления настоящего изобретения массовое соотношение альбумина (такого как человеческий сывороточный альбумин) и таксана в композиции составляет от приблизительно 1:1 до приблизительно 18:1, от приблизительно 1:1 до приблизительно 15:1, от приблизительно 1:1 до приблизительно 12:1, от приблизительно 1:1 до приблизительно 10:1, от приблизительно 1:1 до приблизительно 9:1, от приблизительно 1:1 до приблизительно 8:1, от приблизительно 1:1 до приблизительно 7:1, от приблизительно 1:1 до приблизительно 6:1, от приблизительно 1:1 до приблизительно 5:1, от приблизительно 1:1 до приблизительно 4:1, от приблизительно 1:1 до приблизительно 3:1, от приблизительно 1:1 до приблизительно 2:1, от приблизительно 1:1 до приблизительно 1:1.
В некоторых вариантах осуществления настоящего изобретения композиция наночастиц имеет одну или более приведенных выше характеристик.
Наночастицы, описанные в настоящем документе, могут быть представлены в форме сухой композиции (такой как лиофилизированная композиция) или могут быть суспендированы в биосовместимой среде. Подходящие биосовместимые среды включают, без ограничения, воду, буферные водные среды, физиологический раствор, буферный физиологический раствор, необязательно буферные растворы аминокислот, необязательно буферные растворы белков, необязательно буферные растворы сахаров, необязательно буферные растворы витаминов, необязательно буферные растворы синтетических полимеров, жиросодержащие эмульсии и т.п.
В некоторых вариантах осуществления настоящего изобретения фармацевтически приемлемый носитель включает человеческий сывороточный альбумин. Человеческий сывороточный альбумин (HSA) представляет собой хорошо растворимый глобулярный белок Mr 65K и состоит из 585 аминокислот. HSA представляет собой наиболее распространенный белок плазмы и отвечает за 70-80% коллоидного осмотического давления человеческой плазмы. Аминокислотная последовательность HAS содержит всего 17 дисульфидных мостиков, один свободный тиол (Cys 34) и единственный триптофан (Trp 214). Внутривенное введение раствора HAS показано для профилактики и лечения гиповолемического шока (см., например, Tullis, JAMA, 237, 355-360, 460-463 (1997)) и Houser et al., Surgery, Gynecology and Obstetrics, 150, 811-816 (1980)) и, в сочетании с обменным переливанием, для лечения гипербилирубинемии новорожденных (см., например, Finlayson, Seminars in Thrombosis and Hemostasis, 6, 85-120, (1980)). Другие альбумины рассматриваются, такие как бычий сывороточный альбумин. Использование нечеловеческих альбуминов могло бы быть подходящим, например, в контексте использования указанных композиций у млекопитающих, не являющихся человеком, таком как ветеринария (включая домашних питомцев и сельскохозяйственных животных).
Человеческий сывороточный альбумин (HSA) имеет множество гидрофобных сайтов связывания (всего восемь для жирных кислот, эндогенного лиганда HSA) и связывается с разнообразным рядом таксанов, особенно с нейтрально и отрицательно заряженными гидрофобными соединениями (Goodman et al., The Pharmaceutical Basis of Therapeutics, 9-е издание, McGraw-Hill New York (1996)). Было высказано предположение о двух высокоаффинных сайтах связывания в субдоменах HSA IIA и IIIA, которые представляют собой сильно удлиненные гидрофобные карманы с заряженными остатками лизина и аргинина близ поверхности, которые действуют как точки прикрепления для полярных лигандов (см., например, Fehske et al., Biochem. Pharmacol., 30, 687-92 (198a), Vorum, Dan. Med. Bull., 46, 379-99 (1999), Kragh-Hansen, Dan. Med. Bull., 1441, 131-40 (1990), Curry et al., Nat. Struct. Biol., 5, 827-35 (1998), Sugio et al., Protein. Eng., 12, 439-46 (1999), He et al., Nature, 358, 209-15 (199b) и Carter et al., Adv. Protein. Chem., 45, 153-203 (1994)). Паклитаксел и пропофол, как было показано, связываются с HSA (см., например, Paal et al., Eur. J. Biochem., 268(7), 2187-91 (200a), Purcell et al., Biochim. Biophys. Acta, 1478(a), 61-8 (2000), Altmayer et al., Arzneimittelforschung, 45, 1053-6 (1995) и Garrido et al., Rev. Esp. Anestesiol. Reanim., 41, 308-12 (1994)). Помимо этого, доцетаксел, как было показано, связывается с белками человеческой плазмы (см., например, Urien et al., Invest. New Drugs, 14(b), 147-51 (1996)).
Альбумин (такой как человеческий сывороточный альбумин) в композиции обычно служит носителем для таксана, т.е., альбумин в композиции способствует более легкому суспендированию таксана в водной среде или помогает поддерживать суспензию, по сравнению с композициями, не включающими альбумин. Данный факт может позволить избежать применения токсичных растворителей (или поверхностно-активных агентов) для солюбилизации таксана, и, таким образом, может уменьшить один или более побочных эффектов введения таксана индивидууму (такому как человек). Так, в некоторых вариантах осуществления настоящего изобретения композиция, описанная в настоящем документе, практически не содержит (или вовсе не содержит) поверхностно-активных агентов, таких как кремофор (включая Cremophor EL® (BASF)). В некоторых вариантах осуществления настоящего изобретения композиция наночастиц практически не содержит (или вовсе не содержит) поверхностно-активных агентов. Композиция "практически не содержит кремофора" или "практически не содержит поверхностно-активного агента", если количество кремофора или поверхностно-активного агента не достаточно для того, чтобы вызвать один или более побочных эффектов у индивидуума после того, как индивидууму ввели композицию наночастиц. В некоторых вариантах осуществления настоящего изобретения композиция наночастиц содержит менее приблизительно 20%, 15%, 10%, 7,5%, 5%, 2,5%, или 1% органического растворителя или поверхностно-активного агента.
Количество альбумина в композиции, описанной в настоящем документе, будет варьироваться в зависимости от других компонентов композиции. В некоторых вариантах осуществления настоящего изобретения композиция содержит альбумин в количестве, которое является достаточным для стабилизации таксана в водной суспензии, например, в форме стабильной коллоидной суспензии (такой как стабильная суспензия наночастиц). В некоторых вариантах осуществления настоящего изобретения альбумин присутствует в количестве, которое уменьшает скорость оседания таксана в водной среде. Для композиций, содержащих частицы, количество альбумина также зависит от размера и плотности наночастиц таксана.
Таксан "стабилизирован" в водной суспензии, если он остается суспендированным в водной среде (как, например, без видимой преципитации или седиментации) в течение продолжительного периода времени, такого как по меньшей мере приблизительно 0,1, 0,2, 0,25, 0,5, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 24, 36, 48, 60 или 72 часа. Суспензия обычно, но не обязательно, является подходящей для введения индивидууму (такому как человек). Стабильность суспензии обычно (но не обязательно) оценивают при температуре хранения (такой как комнатная температура (такая как 20-25°С) или условиях охлаждения (таких как 4°С)). Например, суспензия является стабильной при температуре хранения, если в ней не наблюдается образование хлопьев или агломерация частиц, видимых невооруженным глазом или под оптическим микроскопом с увеличение в 1000 раз, в течение приблизительно пятнадцати минут после изготовления суспензии. Стабильность также можно оценивать при ускоренным тестовых условиях, таких как температура выше приблизительно 40°С.
В некоторых вариантах осуществления настоящего изобретения альбумин присутствует в количестве, которое является достаточным для стабилизации таксана в водной суспензии при определенной концентрации. Например, концентрация таксана в композиции составляет от приблизительно 0,1 до приблизительно 100 мг/мл, включая, например, от приблизительно 0,1 до приблизительно 50 мг/мл, от приблизительно 0,1 до приблизительно 20 мг/мл, от приблизительно 1 до приблизительно 10 мг/мл, от приблизительно 2 до приблизительно 8 мг/мл, от приблизительно 4 до приблизительно 6 мг/мл, приблизительно 5 мг/мл. В некоторых вариантах осуществления настоящего изобретения концентрация таксана составляет по меньшей мере приблизительно 1,3 мг/мл, 1,5 мг/мл, 2 мг/мл, 3 мг/мл, 4 мг/мл, 5 мг/мл, 6 мг/мл, 7 мг/мл, 8 мг/мл, 9 мг/мл, 10 мг/мл, 15 мг/мл, 20 мг/мл, 25 мг/мл, 30 мг/мл, 40 мг/мл и 50 мг/мл. В некоторых вариантах осуществления настоящего изобретения альбумин присутствует в количестве, которое является достаточным для того, чтобы избежать использования поверхностно-активных агентов (таких как кремофор), таким образом, что композиция не содержит или практически не содержит поверхностно-активного агента (такого как кремофор).
В некоторых вариантах осуществления настоящего изобретения композиция, в жидкой форме, содержит от приблизительно 0,1% до приблизительно 50% (масс./об.) (например, приблизительно 0,5% (масс./об.), приблизительно 5% (масс./об.), приблизительно 10% (масс./об.), приблизительно 15% (масс./об.), приблизительно 20% (масс./об.), приблизительно 30% (масс./об.), приблизительно 40% (масс./об.) или приблизительно 50% (масс./об.)) альбумина. В некоторых вариантах осуществления настоящего изобретения композиция, в жидкой форме, содержит от приблизительно 0,5% до приблизительно 5% (масс./об.) альбумина.
В некоторых вариантах осуществления настоящего изобретения массовое соотношение альбумина, например, человеческого сывороточного альбумина, и таксана в композиции наночастиц является таким, чтобы достаточное количество таксана связывалось или транспортировалось в клетку. В то время как массовое соотношение альбумина и таксана будет необходимо оптимизировать для разных комбинаций альбумина и таксана, обычно массовое соотношение альбумина, например, человеческого сывороточного альбумина, и таксана (масс./масс.) составляет от приблизительно 0,01:1 до приблизительно 100:1, от приблизительно 0,02:1 до приблизительно 50:1, от приблизительно 0,05:1 до приблизительно 20:1, от приблизительно 0,1:1 до приблизительно 20:1, от приблизительно 1:1 до приблизительно 18:1, от приблизительно 2:1 до приблизительно 15:1, от приблизительно 3:1 до приблизительно 12:1, от приблизительно 4:1 до приблизительно 10:1, от приблизительно 5:1 до приблизительно 9:1 или приблизительно 9:1. В некоторых вариантах осуществления настоящего изобретения массовое соотношение альбумина и таксана составляет приблизительно 18:1 или менее, 15:1 или менее, 14:1 или менее, 13:1 или менее, 12:1 или менее, 11:1 или менее, 10:1 или менее, 9:1 или менее, 8:1 или менее, 7:1 или менее, 6:1 или менее, 5:1 или менее, 4:1 или менее или 3:1 или менее. В некоторых вариантах осуществления настоящего изобретения массовое соотношение альбумина (такого как человеческий сывороточный альбумин) и таксана в композиции составляет от приблизительно 1:1 до приблизительно 18:1, от приблизительно 1:1 до приблизительно 15:1, от приблизительно 1:1 до приблизительно 12:1, от приблизительно 1:1 до приблизительно 10:1, от приблизительно 1:1 до приблизительно 9:1 или от приблизительно 1:1 до приблизительно 8:1, от приблизительно 1:1 до приблизительно 7:1, от приблизительно 1:1 до приблизительно 6:1, от приблизительно 1:1 до приблизительно 5:1, от приблизительно 1:1 до приблизительно 4:1, от приблизительно 1:1 до приблизительно 3:1, от приблизительно 1:1 до приблизительно 2:1, от приблизительно 1:1 до приблизительно 1:1.
В некоторых вариантах осуществления настоящего изобретения альбумин позволяет вводить композицию индивидууму (такому как человек) без значительных побочных эффектов. В некоторых вариантах осуществления настоящего изобретения альбумин (такой как человеческий сывороточный альбумин) присутствует в количестве, которое является эффективным для уменьшения одного или более побочных эффектов введения таксана человеку. Термин "уменьшение одного или более побочных эффектов введения таксана" относится к уменьшению, облегчению, устранению или избеганию одного или более нежелательных эффектов, вызываемых таксаном, а также побочных эффектов, вызываемых носителями (такими как растворители, которые делают таксаны пригодными для инъекции), использующимися для доставки таксана. Указанные побочные эффекты включают миелосупрессию, нейротоксичность, гиперчувствительность, воспаление, раздражение вен, флебит, боль, раздражение кожи, периферическую нейропатию, нейтропеническую лихорадку, анафилактическую реакцию, венозный тромбоз, эстравазацию и их комбинации. Указанные побочные эффекты, однако, являются просто примером, и другие побочные эффекты или комбинации побочных эффектов, связанные с таксанами, могут быть уменьшены.
В некоторых вариантах осуществления настоящего изобретения композиция наночастиц включает Abraxane® (Nab-паклитаксел). В некоторых вариантах осуществления настоящего изобретения композиция наночастиц представляет собой Abraxane® (Nab-паклитаксел). Abraxane® представляет собой композицию паклитаксела, стабилизированного человеческим альбумином USP, который может быть диспергирован в непосредственно инъецируемом физиологическом растворе. При диспергировании в подходящей водной среде, такой как 0,9% раствор хлорида натрия для инъекций или 5% раствор декстрозы для инъекций, Abraxane® формирует стабильную коллоидную суспензию паклитаксела. Средний размер наночастиц в коллоидной суспензии составляет приблизительно 130 нанометров. Поскольку HSA легко растворяется в воде, Abraxane® можно повторно растворять с получением широкого ряда концентраций, от разбавленного (0,1 мг/мл паклитаксела) до концентрированного (20 мг/мл паклитаксела), включая, например, приблизительно от 2 мг/мл до 8 мг/мл, приблизительно 5 мг/мл.
Способы получения композиции наночастиц известны специалистам. Например, наночастицы, содержащие таксаны (такие как паклитаксел) и альбумин (такой как человеческий сывороточный альбумин), можно изготавливать в условиях высоких сдвигающих сил (например, обработкой ультразвуком, гомогенизацией под высоким давлением и т.п.). Указанные способы описаны, например, в патентах США №№ 5916596, 6506405, 6749868 и 6537579, а также в патентных публикациях США №№ 2005/0004002, 2007/0082838, 2006/0263434 и заявке РСТ WO08/137148.
Кратко, таксан (такой как паклитаксел) растворяют в органическом растворителе, и раствор можно добавлять к раствору альбумина. Смесь подвергают гомогенизации под высоким давлением. Органический растворитель затем можно удалить выпариванием. Полученную дисперсию можно в дальнейшем лиофилизировать. Подходящий органический растворитель включает, например, кетоны, сложные эфиры, простые эфиры, хлорированные растворители и другие растворители, известные специалистам. Например, органический растворитель может представляют собой метиленхлорид или хлороформ/этанол (например, с соотношением 1:9, 1:8, 1:7, 1:6, 1:5, 1:4, 1:3, 1:2, 1:1, 2:1, 3:1, 4:1, 5:1, 6:1, 7:1, 8:1 или 9:1.
Другие компоненты в композициях наночастиц
Наночастицы, описанные в настоящем документе, могут присутствовать в композиции, которая содержит другие агенты, эксципиенты или стабилизаторы. Например, для увеличения стабильности с помощью повышения отрицательного дзета-потенциала наночастиц можно добавлять определенные отрицательно заряженные компоненты. Указанные отрицательно заряженные компоненты включают, без ограничения, желчные соли желчных кислот, состоящие из гликохолевой кислоты, холевой кислоты, хенодезоксихолевой кислоты, таурохолевой кислоты, гликохенодезоксихолевой кислоты, таурохенодезоксихолевой кислоты, литохолевой кислоты, урсодезоксихолевой кислоты, дегидрохолевой кислоты и других; фосфолипиды, включая фосфолипиды на основе лецитина (яичного желтка), которые включают следующие фосфатидилхолины: пальмитоилолеоилфосфатидилхолин, пальмитоиллинолеоилфосфатидилхолин, стеароиллинолеоилфосфатидилхолин, стеароилолеоилфосфатидилхолин, стеароиларахидоилфосфатидилхолин и дипальмитоилфосфатидилхолин. Другие фосфолипиды включают L-α-димиристоилфосфатидилхолин (DMPC), диолеилфосфатидилхолин (DOPC), дистеароилфосфатидилхолин (DSPC), гидрогенизированный соевый фосфатидилхолин (HSPC) и другие родственные соединения. Отрицательно заряженные поверхностно-активные агенты или эмульгаторы также являются подходящими в качестве добавок, например, холестерилсульфат натрия и т.п.
В некоторых вариантах осуществления настоящего изобретения композиция является подходящей для введения человеку. В некоторых вариантах осуществления настоящего изобретения композиция является подходящей для введения млекопитающим, таким как, в ветеринарном контексте, домашние питомцы и сельскохозяйственные животные. Существует большое разнообразие подходящих составов композиции наночастиц (см., например, патенты США №№ 5916596 и 6096331). Следующие композиции и способы являются только примерами и ни в коей мере не являются ограничительными. Композиции, подходящие для перорального введения, могут состоять из (а) жидких растворов, таких как эффективное количество соединения, растворенное в разбавителях, таких как вода, солевой раствор или апельсиновый сок, (b) капсул, саше или таблеток, содержащих заранее определенное количество активного ингредиента в виде твердых веществ или гранул, (с) суспензий в подходящей жидкости и (d) подходящих эмульсий. Таблетированные формы могут включать один или более из следующих агентов: лактозы, маннита, кукурузного крахмала, картофельного крахмала, микрокристаллической целлюлозы, аравийской камеди, желатина, коллоидного диоксида кремния, кроскармеллозы натрия, талька, стеарата магния, стеариновой кислоты и других наполнителей, красителей, разбавителей, буферных агентов, увлажняющих агентов, консервантов, корригентов и фармакологически совместимых эксципиентов. Лепешки могут включать активный ингредиент в корригенте, обычно в сахарозе и аравийской камеди или трагаканте, а также и пастилки, включающие активный ингредиент в инертной основе, такой как желатин и глицерин, или в сахарозе и аравийской камеди, эмульсии, гели и т.п., содержащие, помимо активного ингредиента, эксципиенты, известные специалистам.
Примеры подходящих носителей, эксципиентов и разбавителей включают, без ограничения, лактозу, декстрозу, сахарозу, сорбит, маннит, крахмалы, аравийскую камедь, фосфат кальция, альгинаты, трагакант, желатин, силикат кальция, микрокристаллическую целлюлозу, поливинилпирролидон, целлюлозу, воду, солевой раствор, сироп, метилцеллюлозу, метил- и пропилгидроксибензоаты, тальк, стеарат магния и минеральное масло. Композиции могут дополнительно содержать лубриканты, увлажняющие агенты, эмульгирующие и суспендирующие агенты, консерванты, подсластители или корригенты.
Композиции, подходящие для парентерального введения, включают водные и неводные, изотонические стерильные растворы для инъекций, которые могут содержать антиоксиданты, буферы, бактериостатики и растворенные вещества, которые делают композицию совместимой с кровью предполагаемого реципиента, и водные и неводные стерильные суспензии, которые могут включать суспендирующие агенты, солюбилизаторы, загустители, стабилизаторы и консерванты. Композиции могут быть представлены в герметичных контейнерах, содержащих одну дозу или множество доз, таких как ампулы и флаконы, и могут храниться в высушенном замораживанием (лиофилизированном) состоянии, требующем только добавления стерильного жидкого эксципиента, например, воды для инъекций, непосредственно перед использованием. Изготавливаемые непосредственно перед использованием растворы и суспензии для инъекций, можно получать из стерильных порошков, гранул и таблеток, описанных ранее. Композиции для инъекций являются предпочтительными.
В некоторых вариантах осуществления настоящего изобретения композицию изготавливают с рН в пределах от приблизительно 4,5 до приблизительно 9,0, включая, например, пределы рН от приблизительно 5,0 до приблизительно 8,0, от приблизительно 6,5 до приблизительно 7,5 и от приблизительно 6,5 до приблизительно 7,0. В некоторых вариантах осуществления настоящего изобретения величина рН композиции составляет не менее приблизительно 6, включая, например, не менее приблизительно 6,5, 7 или 8 (такая как приблизительно 8). Композицию также можно изготавливать таким образом, чтобы она была изотоничной по отношению к крови, путем добавления подходящего модификатора тоничности, такого как глицерин.
Наборы, лекарственные средства и композиции
Изобретение относится также к наборам, лекарственным средствам, композициям и единичным дозированным формам для применения в любом из способов, описанных в настоящем документе.
Наборы по настоящему изобретению включают один или более контейнеров, включающих композиции наночастиц, содержащих таксан, (или единичные дозированные формы, и/или изделия) и/или другой агент (такой как агенты, описанные в настоящем документе), и в некоторых вариантах осуществления настоящего изобретения дополнительно включают инструкции по применению в соответствии с любым из способов, описанных в настоящем документе. Набор может дополнительно включать описание выбора индивидуума, подходящего для лечения. Инструкции, прилагающиеся к наборам по настоящему изобретению, обычно представляют собой написанные на этикетке или на вкладыше в упаковку инструкции (например, листок бумаги, вложенный в набор), однако машиночитаемые инструкции (например, инструкции, записанные на магнитных или оптических запоминающих устройствах) также являются приемлемыми.
Например, в некоторых вариантах осуществления настоящего изобретения, набор включает а) композицию, содержащую наночастицы, включающие таксан и альбумин (такой как человеческий сывороточный альбумин), и b) инструкции по введению композиции наночастиц для лечения рака мочевого пузыря. В некоторых вариантах осуществления настоящего изобретения, набор включает а) композицию, содержащую наночастицы, включающие таксан и альбумин (такой как человеческий сывороточный альбумин), b) эффективное количество одного другого агента, в котором другой агент ингибирует разрушение микротрубочек, и с) инструкции по введению (такому как интравезикулярное или внутривенное введение) композиции наночастиц и других агентов для лечения рака мочевого пузыря. Наночастицы и другие агенты могут быть представлены в отдельных контейнерах или в одном контейнере. Например, набор может включать одну отдельную композицию или две или более композиций, где одна композиция содержит наночастицы и одна композиция содержит другой агент.
Наборы по настоящему изобретению представлены в удобной упаковке. Удобная упаковка включает, без ограничения, флаконы, бутылки, банки, гибкие упаковки (например, запечатанные лавсановые или пластиковые мешки) и т.п. Наборы могут необязательно содержать дополнительные компоненты, такие как буферы и пояснительная информация. Таким образом, настоящая заявка относится к изделиям, которые включают флаконы (такие как запечатанные флаконы), бутылки, банки, гибкие упаковки и т.п.
Инструкции, относящиеся к использованию композиций наночастиц, обычно включают информацию о дозах, схемах введения и пути введения для предполагаемого лечения. Контейнеры могут представлять собой стандартные дозы, упаковки с большим количеством содержимого (например, упаковки, содержащие множество доз) или субстандартные дозы. Например, можно изготавливать наборы, которые содержат достаточные дозы таксана (такого как таксан), как описано в настоящем документе, для обеспечения эффективного лечения индивидуума в течение продолжительного периода времени, такого как неделя, 8 дней, 9 дней, 10 дней, 11 дней, 12 дней, 13 дней, 2 недели, 3 недели, 4 недели, 6 недель, 8 недель, 3 месяца, 4 месяца, 5 месяцев, 7 месяцев, 8 месяцев, 9 месяцев или более. Наборы также могут включать множество стандартных доз таксана и фармацевтических композиций, а также инструкции по использованию, и могут быть упакованы в количествах, достаточных для хранения и использования в аптеках, например, больничных аптеках и аптеках, изготавливающих лекарственные средства.
Также описаны лекарственные средства, композиции и единичные дозированные формы, пригодные для способов, описанных в настоящем документе. В некоторых вариантах осуществления настоящего изобретения описано лекарственное средство (или композиция) для применения для лечения рака мочевого пузыря, содержащее наночастицы, включающие таксан и альбумин (такой как человеческий сывороточный альбумин). В некоторых вариантах осуществления настоящего изобретения описано лекарственное средство (или композиция или единичная дозированная форма) для применения для лечения рака мочевого пузыря в сочетании с другим агентом, содержащее наночастицы, включающие таксан и альбумин (такой как человеческий сывороточный альбумин), где другой агент ингибирует разрушение микротрубочек. В некоторых вариантах осуществления настоящего изобретения описано лекарственное средство (или композиция или единичная дозированная форма) для применения для лечения рака мочевого пузыря, содержащее наночастицы, включающие таксан и альбумин (такой как человеческий сывороточный альбумин), и один другой агент, где один другой агент ингибирует разрушение микротрубочек.
Специалистам будет понятно, что несколько вариантов осуществления настоящего изобретения являются возможными в пределах объема и идеи настоящего изобретения. Далее изобретение будет описано более подробно с помощью следующих неограничивающих примеров. Следующие примеры дополнительно иллюстрируют изобретения, но, разумеется, не должны истолковываться как ограничивающие каким-либо образом его объем.
ПРИМЕРЫ
Пример 1. Испытания фазы I, касающиеся интравезикулярного введения связанного с альбумином паклитаксела в форме наночастиц для лечения рефрактерного к БЦЖ рака мочевого пузыря без инвазии в мышечную оболочку
Данный пример демонстрирует активность Nab-паклитаксела для лечения рака мочевого пузыря без инвазии в мышечную оболочку при интравезикулярном введении.
Критерии включения в испытания
Критерии включения в испытания включали рецидивирующие низкодифференцированные (НД) Та, Т1 и Tis переходно-клеточные карциномы, неудачно леченные ранее по меньшей мере одной схемой с использованием стандартного интравезикулярного лекарственного средства (включая БЦЖ, митомицин С или интерферон). Пациенты являются неоперабельными в силу сопутствующих заболеваний или отказа от цистэктомии.
Введение лекарственного средства
Nab-паклитаксел, растворенный в 0,9% растворе хлорида натрия до концентрации 5 мг/мл, вводили интравезикулярно один раз в неделю в течение 6 недель через стерильный катетер, который стоял в течение 2 часов. Первоначальная доза составляла 150 мг, а затем дозу постепенно повышали до достижения максимальной доставляемой дозы (МДД) 500 мг/100 мл. Сывороточные уровни Nab-паклитаксела определяли спустя 2 часа после опорожнения с использованием жидкостной хроматографии высокого давления.
Оценка лечения
Главной конечной точкой была дозоограничивающая токсичность (по шкале критериев общей токсичности NCI 3 и 4) и МДД; второстепенной конечной точкой была частота ответов. Эффективность оценивали с использованием цистоскопии с биопсией, цитологии и КТ. Токсичность классифицировали в соответствии с NCICTC 3.0. Системную дозоограничивающую токсичность (ДОТ) определяли как системную токсичность класса 2, 3, 4. Локализованную ДОТ определяли как гематурию, дизурию, задержку мочи, частоту/императивность мочеиспускания или спазм мочевого пузыря класса 3 и 4. Последующую оценку осуществляли через 12 недель после первой инстилляции с помощью цистоскопии, биопсии и цитологии мочи.
Таблица 1 показывает эскалацию дозы фазы I (по три пациента, леченных каждой дозой), согласно схеме эскалации дозы по методу Фибоначчи.
Таблица 2 показывает демографические характеристики пациентов
Таблица 3 показывает связанную с лечением токсичность NCICTC в зависимости от уровня дозы у 15 пациентов, прошедших полный курс лечения (все виды токсичности были 1 класса)
У двенадцати из 18 пациентов (56%) имелись локальные виды токсичности класса 1, при наибольшей распространенности дизурии. Не наблюдались локальные виды токсичности класса 2, 3 или 4, и не прослеживалось очевидной корреляции между дозой и токсичностью. После 108 интравезикулярных инстилляций системной токсичности не наблюдалось.
Не наблюдалось системного всасывания Nab-паклитаксела вплоть до дозы 375 мг. Из 18 пролеченных пациентов сывороточный уровень Nab-паклитаксела не определялся (<10 нг/мл) у 17/18 пациентов. У одного пациента был выявлен уровень 16,8 нг/мл при дозе 450 мг, что было в три раза ниже средних сывороточных уровней, выявленных после стандартного внутривенного введения. Токсичность класса 2 или выше, связанная с введением Nab-паклитаксела, не наблюдалась.
Таблица 4 показывает индивидуальные клинические исходы по результатам 12-недельной цистоскопии и биопсии
У пяти из 18 оценивавшихся пациентов наблюдался полный ответ (отрицательная биопсия и цитология мочи). Из 13 пациентов с рецидивом у одного наблюдалось прогрессирование стадии при оценке после лечения.
Эксперимент показывает, что интравезикулярно вводившийся Nab-паклитаксел имел минимальную локальную токсичность и системное всасывание и обеспечивает благоприятную частоту ответов при лечении рефрактерного рака мочевого пузыря без инвазии в мышечную оболочку.
Пример 2. Испытания фазы II Nab-паклитаксела в качестве лекарственного средства второй линии у пациентов с метастатической уротелиальной карциномой
Данный эксперимент показывает эффект Nab-паклитаксела у пациентов с метастатическим уротелиальным раком, у которых лечение первой линии на основе цисплатина по поводу метастатического заболевания было безуспешным.
Пациенты с нерезектабельным локально запущенным или метастатическим уротелиальным раком мочевого пузыря, уретры или почечной лоханки, у которых наблюдалось прогрессирования заболевания во время или после химиотерапии первой линии на основе платины, были включены в данное открытое, двухстадийное, мультицентровое клиническое испытание. Главные критерии включения включали поддающееся оценке заболевание с преимущественно переходно-клеточной гистологией. Статус ECOG 0-2 и адекватная функция органа. Пациенты, леченные ранее таксанами по поводу метастатического заболевания, с ранее существовавшей нейропатией класса ≥1 или неконтролируемыми метастазами в головной мозг или другими заболеваниями, исключались.
Критерии включения
Возраст ≥18 лет
Статус ECOG ≤2
Локально запущенное или метастатическое заболевание
Гистологически подтвержденная переходно-клеточная карцинома (ПКК) (смешанные гистологии допускались, если ПКК являлась ГЛАВНЫМ компонентом)
Обязательно получал ранее один химиотерапевтический агент, включая платину (по меньшей мере один цикл) по поводу метастатического/рецидивирующего заболевания
Новая вспомогательная или вспомогательная химиотерапия считалась первой линией, если у пациента наблюдалось прогрессирование в течение 12 месяцев после последней дозы
Не получал таксаны по поводу метастатического заболевания
Ранее применявшиеся таксаны допускались при использовании схемы вспомогательного или нового вспомогательного лечения, если прошло >12 месяцев после последней дозы.
Критерии исключения
Ранее применявшийся таксан по поводу метастатического заболевания (или <12 месяцев после новых вспомогательных или вспомогательных таксанов)
Ранее существовавшая периферическая нейропатия >1 по критериям NCI-CTC
Беременные или кормящие женщины
Неконтролируемые метастазы в головном мозге или лептоменингеальные метастазы (леченные метастазы допускались, если оба известных поражения и медикаментозное лечение, например, стероидами, по данному поводу являются стабильными)
Тяжелое или сопутствующее заболевание
Застойная сердечная недостаточность класса II-IV в анамнезе
Другие злокачественные опухоли, за исключением базально-клеточной карциномы кожи или рака шейки матки in situ или непредвиденного рака предстательной железы (Т1а, Глисон <7 ПСА <10 нг/мл) или любые другие опухоли <5 лет до отбора для испытаний
Получение лекарственного средства, находящегося на стадии клинических испытаний, или лучевая терапия за <30 дней до отбора для испытаний
Пациенты, не использующие адекватную контрацепцию
Лечение
Nab-паклитаксел (Abraxane®) 260-300 мг/м2 внутривенно каждые 3 недели в течение 30 минут. Максимальное количество циклов отсутствует, пациенты могли проходить лечение до прогрессирования заболевания, неприемлемой токсичности и/или добровольного прекращения испытаний. Премедикации не требовалось.
Оценка
Клиническую оценку, общий анализ крови и биохимический анализ крови осуществляли на исходном этапе и перед каждым циклом, с КТ грудной клетки, брюшной полости и таза, которые повторяли каждые 2 цикла.
Перед лечением: получали и оценивали анамнез, физикальное исследование, стандартные анализы крови в течение 7 дней вхождения в исследование, КТ грудной клетки, брюшной полости, таза и костей (если имелось повышение содержания щелочной фосфатазы или боли в костях) и визуализация головного мозга (по клиническим показаниям) в течение 28 дней вхождения в исследование.
Во время лечения: оценивали анамнез, физикальное исследование, стандартные анализы крови каждые 3 недели, КТ грудной клетки, брюшной полости, таза каждые 2 месяца.
Конечные точки:
Главной конечной точкой являлся определенный по критериям RECIST объективный ответ. Пациенты, отвечавшие на лечение, имели подтвердающие результаты КТ, выполненной в течение по меньшей мере одного месяца после документальной фиксации ответа. Вторичными конечными точками являлись продолжительность ответа, доля контроля заболевания (стабильное заболевание ≥16 недель, ПО или ЧО), ВБЗ, общая выживаемость, безопасность и переносимость.
Дизайн исследования
Nab-паклитаксел заслуживает дальнейшего исследования, если частота ответов составляет >20%.
Двухстадийная схема: для проверки нулевой гипотезы о том, что P≤0,050 по сравнению с альтернативой, что Р≥0,200, имеет объем выборки 26,66 и вероятность досрочного завершения 0,717.
Если не эффективно, имеется 0,046 вероятность заключения, что это именно так (мишень для данной величины = 0,050). Если эффективно, имеется 0,098 вероятность заключения, что это именно так (мишень для данной величины = 0,100).
Двухстадийная схема
Стадия 1: 21 пункт. Если >1 ответ, переходят на стадию 2.
Стадия 2: Добавляют дополнительные 20 пунктов.
Предполагая 10-15% долю выбывания, общий прирост составит 48-50 пунктов.
Демографические характеристики и прирост
Таблица 5 показывает демографические характеристики пациентов
Предварительный ответ, стадия I
Таблица 6 показывает предварительные ответы пациентов, леченных Nab-паклитакселом.
За период 24 месяца прирост к данному исследованию 2 линии метастатической ПКК был быстрым (50 пунктов/5 введений). Nab-паклитаксел обычно хорошо переносился и показал предварительную ДОО 44% (13/29) и долю контроля заболевания (ПО+ЧО+СЗ) 76% (22/29).
Пример 3А. Испытания фазы II Nab-паклитаксела в качестве единственного агента у пациентов с рефрактерной к платине метастатической уротелиальной карциномой (УК) второй линии
В данном мультицентровом исследовании фазы II оценивали эффективность и переносимость Nab-паклитаксела в качестве единственного агента у пациентов с рефрактерной к платине метастатической УК.
Методы
Пациентов с поддающейся измерению УК, прогрессировавшей во время или после химиотерапии первой линии на основе платины, включали в данное двухстадийное испытание. ABI-007 вводили в/в в дозе 260 мг/м2 каждые 3 недели до прогрессирования. Клиническую оценку, общие анализы крови и биохимические анализы крови осуществляли каждый цикл с повторно определяющей стадию КТ каждые 2 цикла.
Результаты
48 пациентов были включены со следующими базовыми характеристиками. Мужчины:женщины 40:8; средний возраст 68 лет; общее состояние больного по шкале ECOG 0:1:2, 15:24:8. 248 циклов было проведено с медианой 5,5 цикла/пункт, с требующимися уменьшениями дозы 17/49 пунктов (35%). Наиболее частыми неблагоприятными событиями (НС) были алопеция (12%), усталость (12%), боль (12%), нейропатия (9%) и тошнота (4%). Наиболее частыми НС класса 3+ были боль (45%), гипертензия (14%), усталость (8%), тугоподвижность суставов (5%), нейропатия (4%) и слабость (4%).
Сорок пациентов поддавались оценке на предмет ответа: 1 (2,5%) имел полный ответ (ПО), 11 (28%) имели частичные ответы (ЧО), 9 (23%) имели стабильное заболевание (СЗ) и 20 (49%) имели прогрессирующее заболевание. Один пациент не поддавался оценке на предмет ответа, у 7 пациентов оценку было производить слишком рано.
Единственный агент ABI-007 хорошо переносился с долей ответов (ПО+ЧО) 33% (12/36) и долей клинической пользы (ПО+ЧО+СЗ) 58% (21/36), представляя собой один из наиболее высоких долей ответов в настоящее время для лечения УК второй линии.
Пример 3В. Испытания фазы II Nab-паклитаксела в качестве единственного агента у пациентов с рефрактерной к платине метастатической уротелиальной карциномой (УК) второй линии
Главной целью данного исследования была оценка эффективности с использованием доли ответа опухоли (ДОО) Nab-паклитаксела при второй линии у пациентов с УК. Вторичной целью была оценка доли контроля заболевания (ДКЗ), выживания без прогрессирования (ВБП), общего выживания (ОВ), а также безопасности и переносимости.
Методы
Пациентов с поддающимся измерению заболеванием, общим состоянием 0-2, прогрессированием во время или после химиотерапии первой линии на основе платины включали в данное двухстадийное испытание. Nab-паклитаксел вводили в/в в дозе 260 мг/м2 каждые 3 недели до прогрессирования, непереносимой токсичности или добровольного выхода из исследования. Физикальное исследование и анализы крови осуществляли каждые три недели, а КТ грудной клетки/брюшной полости/таза проводили каждые 2 цикла.
Главные критерии включения
Гистологически подтвержденная ПКК мочевых путей
Измеримое давнее или нерезектабельное локальное заболевание
Прогрессирование или ≤1 года химиотерапия на основе платины
Общее состояние больного 0-2
Почечная функция (СКФ >40 мл/мин)
Ранее таксаны не вводились
Результаты
Было включено 48 пациентов, и их главные исходные характеристики и лечение суммированы в таблицах 7А и 7В. Фиг.7 показывает процентную долю изменения размеров опухоли у 45 пациентов. Частичный ответ (ЧО) был достигнут у 15 пациентов (32%), а стабильное заболевание (СЗ) наблюдалось у 10 пациентов (21%), что составило долю контроля заболевания (ДКЗ=ЧО+СЗ) 25 пациентов (53%). У 22 пациентов (47%) наблюдалось прогрессирование заболевания, а один пациент не поддавался оценке (таблица 8).
Основные исходные характеристики и лечение
1 24 пункта
2 8 пунктов
n (%)
В качестве вторичных целей оценивали выживание без прогрессирования (ВБП) и общее выживание (ОВ). Выживание без прогрессирования составляло 6 месяцев (95% CI 3,9-8,5 мес.; фиг.2), а общее выживание (ОВ) составляло 10,8 (94% CI 5,8-16,9 мес.; фиг.3). Помимо этого, оценивали прогностические факторы, влияющие на общее выживание. Гемоглобин ≥100 г/л, общее состояние больного (PS) ≤1, более 5 месяцев от последней химиотерапии и наличие контроля заболевания показали положительное влияние на общее выживание (фиг.4). Наиболее распространенные виды общей токсичности, величины токсичности 3+ и причины прекращения лечения суммированы в таблицах 8-10.
Наиболее распространенные виды общей токсичности
Частота
n (%)
n (%)
Токсичность класса 3+
Причины прекращения лечения
Заключение
В целом Nab-паклитаксел хорошо переносился и показал высшие доли ответов на единственный агент при второй линии УК. ДОО составляла 32%, а ДКЗ составляла 53% в данном исследовании. Выживание без прогрессирования составляло 6 месяцев, а общее выживание составляло 10,8 месяца. Главными видами токсичности были усталость, боль и нейропатия. Помимо этого, PS статус, уровни гемоглобина, время от последней химиотерапии и способность достигать контроля заболевания появились как важные прогностические маркеры для общего выживания.
Пример 4А. Испытания фазы II новых вспомогательных ABI-007, карбоплатина и гемцитабина (ACG) у пациентов с локально запущенной карциномой мочевого пузыря
Комбинированную терапию ABI-007, карбоплатином и гемцитабином изучали у пациентов с локально запущенной карциномой мочевого пузыря. Главной конечной точкой исследования была доля пациентов с пПО к цистэктомии.
Методы
Пригодные для исследования пациенты имели рак мочевого пузыря T2-4,N0,M0 или Тлюбой,N1-3,M0 с ECOG PS 0-1, и адекватной функцией костного мозга (содержание гранулоцитов >1500/мм3, тромбоциты >100000/мм3 и гемоглобин >9,0 г/дл), печени (трансаминазы <2,5× верхней границы нормы, щелочная фосфатаза 2,5× верхней границы нормы и билирубин <1,5 мг/дл) и почек (сывороточный креатинин <2,0 мг/дл и/или клиренс креатинина >40 мл/мин). Пациентов лечили внутривенным введением ABI-007 в дозе 260 мг/м2 и карбоплатина (площадь-мишень под кривой = 5) на день 1 и гемцитабином в дозе 800 мг/м2 на день 1 и 8, с последующей радикальной цистэктомией после трех циклов лечения.
Результаты
27 пациентов включили в исследование на сегодняшний день. По клиническому определению стадии, 20 пациентов имели заболевание Т2, 5 имели Т3, 2 имели заболевание Т4 и 2 имели узловое увеличение. Все пациенты поддавались оценке на токсичность, и 22 пациента поддавались оценке на ответ. Троих пациентов исключили из оценки на ответ из-за изменения в схеме введения, 1 пациента исключили из-за отказа от цистэктомии, и 1 пациента исключили из-за его ухода из исследования. 25/27 пациентов получили все три цикла (всего 78 циклов); в 26 циклах было уменьшение дозы из-за токсичности. Все пациенты имели преходящую нейтропению класса 3-4, и 17 пациентов получали филграстим, но только у двух была нейтропения с лихорадкой. Шесть пациентов имели пПО, и еще 5 имели остаточную карциному in situ (CIS), и 1 имел заболевание Т1 к цистэктомии. 54% поддающихся оценке пациентов не имело мышечно-инвазивного заболевания к цистэктомии.
Заключение
Новая вспомогательная терапия ACG является эффективной при раке мочевого пузыря с долей пПО, приближающейся к 30%, и приблизительно столько же пациентов имели CIS, но не остаточное инвазивное заболевание. Токсичность для костного мозга является достоверной, но контролируемой.
Пример 4В. Испытания фазы II новых вспомогательных ABI-007, карбоплатина и гемцитабина (ACG) у пациентов с локально запущенной карциномой мочевого пузыря
Главной целью данного открытого исследования с дизайном Minimax двухстадийного прироста была оценка доли патологического полного ответа (пПО) после трех циклов новой вспомогательной терапии ACG у пациентов с мышечно-инвазивной уротелиальной карциномой.
Критерии включения
Рак мочевого пузыря T2-4,N0,M0 или Тлюбой,N1-3,M0
ECOG PS 0-1
Гематология: содержание гранулоцитов ≥1500/мм3, тромбоциты ≥100000/мм3 и гемоглобин ≥9,0 г/дл
Печень: АСТ и АЛТ ≤2,5× ВГН, щелочная фосфатаза ≤2,5× ВГН и билирубин ≤1,5 мг/дл
Почки: креатинин ≤2,0 мг/дл и/или клиренс креатинина ≥40 мл/мин
Методы
Пациентов лечили в/в, в течение 30 мин инфузией ABI-007 в дозе 260 мг/м2 и карбоплатина (площадь-мишень под кривой = 5) в/в, в течение 15 мин на день 1 и гемцитабином в/в, в течение 30 мин инфузией в дозе 800 мг/м2 на день 1 и 8.
Результаты
27 пациентов включили в исследование на сегодняшний день, и их исходные характеристики суммированы в таблице 11. 25/27 пациентов получили все три цикла (всего 78 циклов); в 26 циклах было уменьшение дозы. Все пациенты имели нейтропению класса 3-4, 17 пациентов получали GCSF (филграстин), 2 пациента имели эпизоды нейтропении с лихорадкой. Другими распространенными видами токсичности были алопеция (27) и нейропатия (5). 6 пациентов показали патологический полный ответ (27% поддающихся оценке пациентов), и 5 пациентов имели остаточную карциному in situ (pCIS), и 1 имел заболевание пТ1. 11/22 пациентов (50%) не имели остаточного мышечно-инвазивного заболевания.
Заключение
ACG хорошо переносилась; преходящая нейтропения была наиболее распространенным видом токсичности. Патологический полный ответ наблюдался у 27% поддающихся оценке пациентов на сегодняшний день. У 50% пациентов остаточного мышечно-инвазивного заболевания не обнаружено.
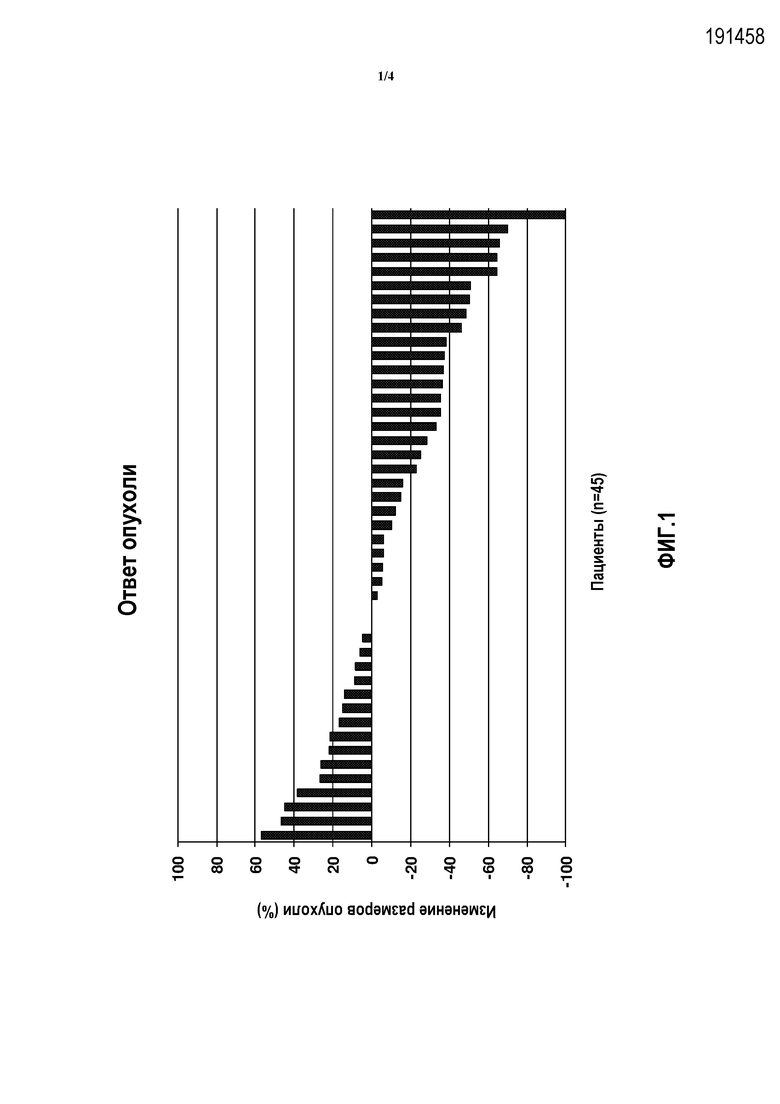
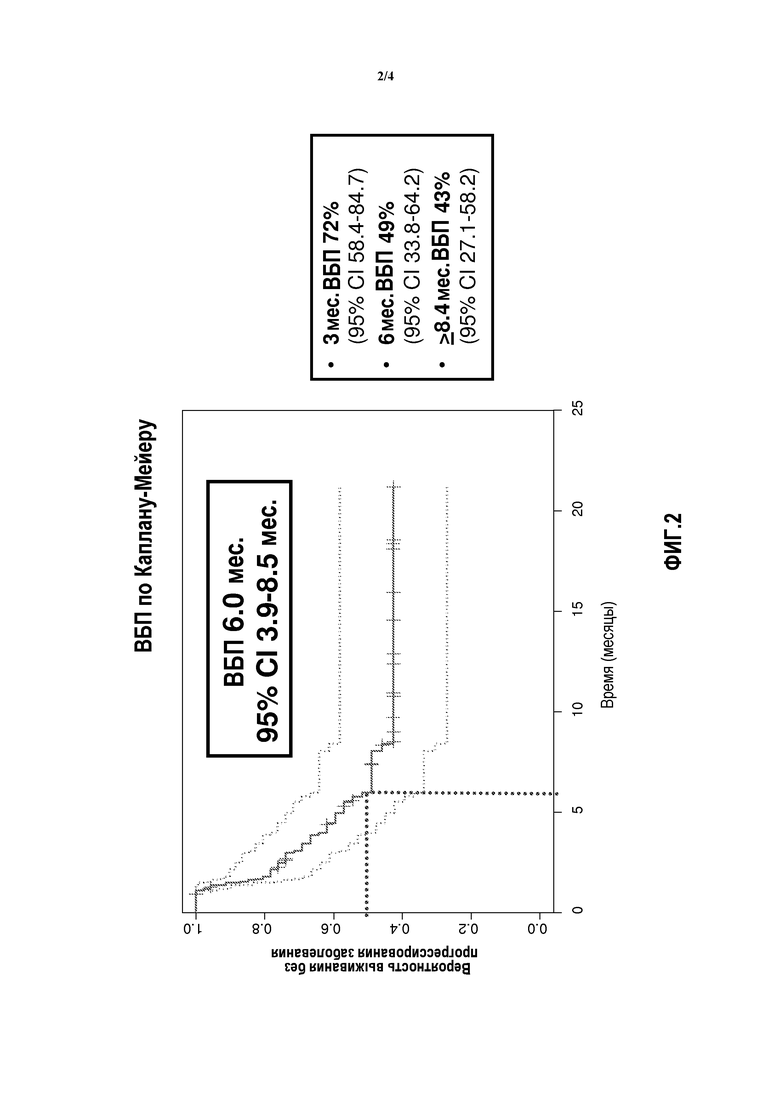

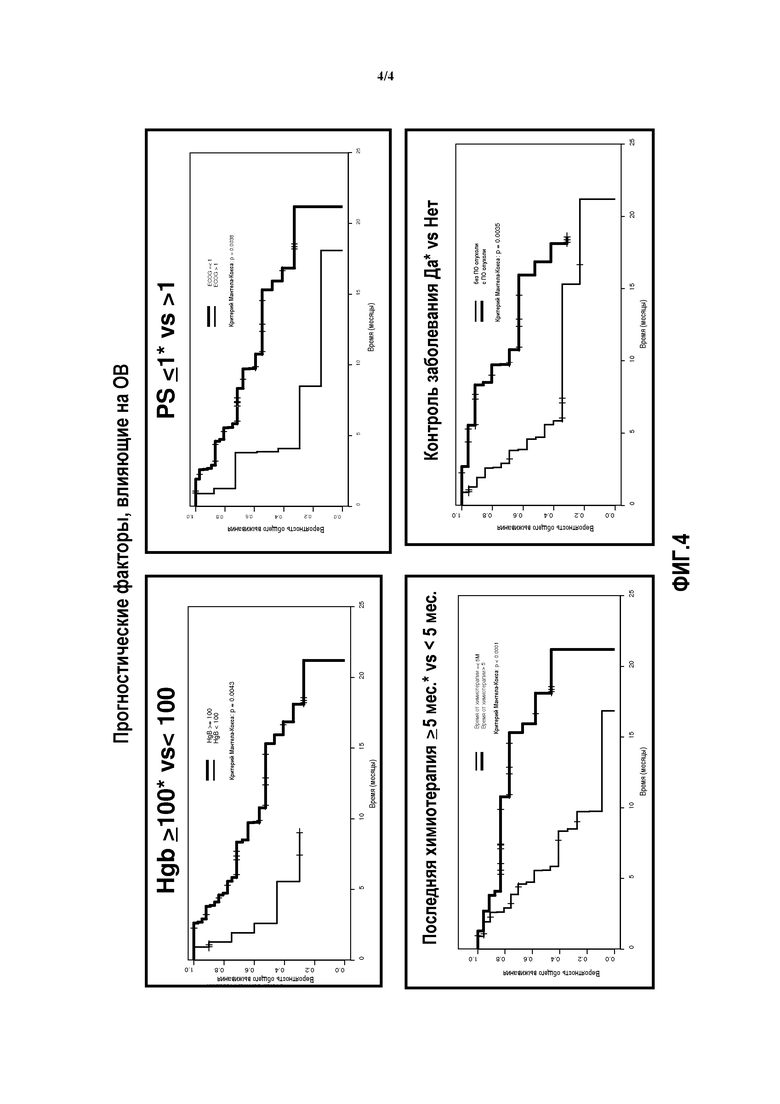
Группа изобретений относится к области медицины, а именно к онкологии, и предназначена для лечения рака мочевого пузыря. Способ лечения рака мочевого пузыря без инвазии в мышечную оболочку у индивидуума включает введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие паклитаксел и альбумин. Наночастицы в композиции имеют средний диаметр не более чем 200 нм. Композицию вводят интравезикулярно в дозе от 100 до 600 мг. Способ лечения рефрактерного к платине рака мочевого пузыря включает введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие паклитаксел и альбумин. Композицию вводят одновременно с эффективным количеством карбоплатина и эффективным количеством гемцитабина. Карбоплатин вводят внутривенно с AUC 5-6 и гемцитабин вводят внутривенно в дозе 800-1000 мг/м2. Использование группы изобретений позволяет повысить эффективность лечения рака мочевого пузыря. 2 н. и 23 з.п. ф-лы, 4 ил., 11 табл., 4 пр.
1. Способ лечения рака мочевого пузыря без инвазии в мышечную оболочку у индивидуума, который в этом нуждается, включающий введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие паклитаксел и альбумин, где наночастицы в композиции имеют средний диаметр не более чем 200 нм, и где композицию вводят интравезикулярно в дозе от 100 до 600 мг.
2. Способ по п. 1, где рак мочевого пузыря является рефрактерным к лечению БЦЖ, митомицином С или интерфероном.
3. Способ по п. 1, где композицию вводят в дозе от 150 мг до 500 мг.
4. Способ по п. 1, где композицию вводят один раз в неделю.
5. Способ по п. 1, где композицию вводят в комбинации с по меньшей мере одним другим агентом.
6. Способ по п. 1, где паклитаксел в наночастицах покрыт альбумином.
7. Способ по п. 1, где рак мочевого пузыря представляет собой уротелиальную карциному.
8. Способ по п. 1, где рак мочевого пузыря представляет собой низкодифференцированный рак мочевого пузыря.
9. Способ по п. 1, где индивидуум представляет собой человека.
10. Способ по п. 1, где альбумин представляет собой человеческий альбумин.
11. Способ по п. 1, где альбумин представляет собой человеческий сывороточный альбумин.
12. Способ лечения рефрактерного к платине рака мочевого пузыря у индивидуума, который в этом нуждается, включающий введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие паклитаксел и альбумин, где композицию вводят одновременно с эффективным количеством карбоплатина и эффективным количеством гемцитабина, где карбоплатин вводят внутривенно с AUC 5-6, и гемцитабин вводят внутривенно в дозе 800-1000 мг/м2.
13. Способ по п. 12, где рак мочевого пузыря представляет собой мышечно-инвазивный рак мочевого пузыря.
14. Способ по п. 12, где композицию вводят внутривенно.
15. Способ по п. 14, где композицию вводят в дозе 260-300 мг/м2.
16. Способ по п. 12 где карбоплатин вводят внутривенно с AUC 5.
17. Способ по п. 12, где гемцитабин вводят внутривенно в дозе 800 мг/м2.
18. Способ по п. 12, где наночастицы в композиции имеют средний диаметр не более чем 200 нм.
19. Способ по п. 12, где наночастицы в композиции имеют средний диаметр менее чем 200 нм.
20. Способ по п. 19, где паклитаксел в наночастицах покрыт альбумином.
21. Способ по п. 19, где рак мочевого пузыря представляет собой уротелиальную карциному.
22. Способ по п. 19, где рак мочевого пузыря представляет собой низкодифференцированный рак мочевого пузыря.
23. Способ по п. 19, где индивидуум представляет собой человека.
24. Способ по п. 19, где альбумин представляет собой человеческий альбумин.
25. Способ по п. 19, где альбумин представляет собой человеческий сывороточный альбумин.
| US 6544544 B2, 08.04.2003 | |||
| WO 2008060651 A2, 22.05.2008 | |||
| WO 2006089290 A1, 24.08.2006 | |||
| WO 9963110 A1, 09.12.1999 | |||
| MAHA HUSSAIN et al | |||
| Combination Paclitaxel, Carboplatin, and Gemcitabine Is an Active Treatment for Advanced Urothelial Cancer, Journal of Clinical Oncology, Vol 19, No 9 (May 1), 2001: pp 2527-2533 | |||
| КОМПОЗИЦИИ И СПОСОБЫ ДОСТАВКИ ФАРМАКОЛОГИЧЕСКИХ АГЕНТОВ | 2003 |
|
RU2361615C2 |
| ZANCONG SHEN et al | |||
| Intravesical Treatments of Bladder Cancer: Review, Pharmaceutical Research, Vol | |||
| Видоизменение пишущей машины для тюркско-арабского шрифта | 1923 |
|
SU25A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| ПРИСПОСОБЛЕНИЕ ДЛЯ ПЕРЕВОДА ТРАМВАЙНЫХ СТРЕЛОК С ВАГОНА | 1924 |
|
SU1502A1 |
| LAUDANO MA et al | |||
| Long-term clinical outcomes of a phase I trial of intravesical docetaxel in the management of non-muscle-invasive bladder cancer refractory to standard intravesical therapy, Urology | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| GURU SONPAVDE et al | |||
| Novel agents for advanced bladder cancer, Ther Adv Med Oncol (2009) 1(1) 37-50, р | |||
| Пишущая машина | 1922 |
|
SU37A1 |
Авторы
Даты
2017-06-06—Публикация
2011-05-20—Подача