2420-184354RU/031
Родственные заявки
Настоящая заявка испрашивает приоритет предварительной заявки 60/654245, поданной 18 февраля 2005 г., которая полностью включена сюда в качестве ссылки.
Область техники, к которой относится изобретение
Настоящее изобретение относится к способам и композициям для лечения пролиферативных заболеваний путем введения комбинации таксана и, по меньшей мере, одного другого или других лечебных средств, а также других методов лечения, которые можно использовать при лечении пролиферативных заболеваний. В частности, изобретение относится к применению наночастиц, содержащих паклитаксел и альбумин (таких как AbraxaneTM) в комбинации с другими химиотерапевтическими средствами или облучением, которые можно применять для лечения рака.
Описание предшествующего уровня техники
Отсутствие реакции значительного числа опухолей на медикаментозную и/или лучевую терапию представляет собой серьезную проблему при лечении рака. Действительно, это одна из основных причин того, почему многие из наиболее распространенных форм рака человека еще устойчивы к эффективному химиотерапевтическому вмешательству, несмотря на достижения в области химиотерапии.
В настоящее время рак в первую очередь лечат одним или комбинацией трех типов лечения: хирургического лечения, лучевой терапии и химиотерапии. Хирургическое лечение представляет собой традиционный подход, при котором вся или часть опухоли удаляется из организма. В целом, хирургическое лечение эффективно только для лечения ранних стадий рака. Хотя хирургическое лечение иногда эффективно при удалении опухолей, локализующихся в определенных участках, например, в молочной железе, ободочной кишке и коже, его нельзя использовать ни при лечении опухолей, расположенных в других областях, недоступных для хирургов, ни при лечении диссеминированных неопластических состояний, таких как лейкоз. Более чем 50% лиц, страдающих раком, ко времени, когда у них поставлен диагноз, больше не являются кандидатами на эффективное хирургическое лечение. Хирургические процедуры могут увеличить количество метастазов опухолей через систему кровообращения во время операции. Большинство лиц, страдающих раком, не умирают от рака во время постановки диагноза или операции, а скорее от метастазов и рецидива рака.
Другие способы лечения также часто неэффективны. Лучевая терапия эффективна только у лиц, которые имеют клинически локализованное заболевание на ранних или средних стадиях рака, и она неэффективна на поздних стадиях рака с метастазами. Облучение, в целом, направлено на определенную область тела индивидуума, которая содержит патологическую пролиферативную ткань, для доведения до максимума дозы, поглощенной патологической тканью, и минимизации дозы, поглощенной расположенной рядом нормальной тканью. Однако трудно (или невозможно) селективно направить терапевтическое облучение на патологическую ткань. Таким образом, нормальная ткань, расположенная рядом с патологической тканью, также подвержена воздействию потенциально повреждающих доз облучения в течение всего курса лечения. Имеются также некоторые способы лечения, которые требуют воздействия облучения на весь организм индивидуума при процедуре, называемой «полное облучение тела» или «TBI». Поэтому эффективность радиотерапевтических методик в разрушении патологических пролиферативных клеток уравновешивается связанными с ними цитотоксическими эффектами на расположенные рядом нормальные клетки. Ввиду этого, методики лучевой терапии имеют присущий им низкий терапевтический индекс, что приводит к неадекватному лечению большинства опухолей. Даже самые лучшие радиотерапевтические методики могут привести к неполной редукции опухоли, рецидиву опухоли, увеличению опухолевой нагрузки и индукции устойчивых к облучению опухолей.
Химиотерапия включает прерывание клеточной репликации или клеточного метаболизма. Химиотерапия может быть эффективной, но имеются тяжелые побочные эффекты, например, рвота, лейкопения, потеря волос, потеря массы тела и другие токсические эффекты. Ввиду крайне токсичных побочных эффектов многие индивидуумы, страдающие раком, не могут успешно завершить полную схему химиотерапии. Вызванные химиотерапией побочные эффекты оказывают значительное воздействие на качество жизни индивидуума и могут оказывать большое влияние на соблюдение предписанного лечения. Кроме того, неблагоприятные побочные эффекты при применении химиотерапевтических средств представляют собой, в целом, высокую ограничивающую дозу токсичность (DLT) при введении этих препаратов. Например, мукозит представляет собой основную ограничивающую дозу токсичность для нескольких противораковых средств, включая антиметаболитные цитотоксические средства 5-фторурацил, метотрексат и противоопухолевые антибиотики, такие как доксорубицин. Многие из этих вызванных химиотерапией побочных эффектов в случае, если они тяжелые, могут привести к госпитализации или требовать лечения анальгетиками для лечения боли. Некоторые индивидуумы, страдающие раком, умирают от химиотерапии вследствие низкой переносимости химиотерапии. Крайне выраженные побочные эффекты противораковых препаратов вызваны низкой целевой специфичностью таких препаратов. Препараты циркулируют через большинство здоровых органов индивидуума, а также предполагаемые опухоли-мишени. Низкая целевая специфичность, которая вызывает побочные эффекты, также снижает эффективность химиотерапии, потому что лишь часть препаратов правильно нацелена. Эффективность химиотерапии, кроме того, снижается низким удерживанием противораковых препаратов внутри опухолей-мишеней.
Ввиду тяжести и большого количества новообразований, опухолей и рака имеется большая потребность в эффективных способах лечения таких заболеваний или расстройств, которые преодолевают недостатки хирургического, химиотерапевтического и лучевого лечения.
Проблемы химиотерапевтических средств
Проблема лекарственной устойчивости является причиной дополнительного значения комбинированной химиотерапии, поскольку терапия и должна избежать возникновения устойчивых клеток, и уничтожить ранее существующие клетки, которые уже устойчивы к лекарственным препаратам.
Лекарственная устойчивость представляет собой название, которое характеризует обстоятельство, при котором заболевание не реагирует на лечение лекарственным препаратом или препаратами. Лекарственная устойчивость может быть или эндогенной, означающей, что заболевание никогда не реагировало на препарат или препараты, или она может быть приобретенной, означающей, что заболевание прекращает реагировать на препарат или препараты, на которые заболевание ранее реагировало. Устойчивость к множеству препаратов (MDR) представляет собой специфический тип лекарственной устойчивости, которая характеризуется перекрестной устойчивостью заболевания более чем к одной функциональности и/или структурно не связанных препаратов. Устойчивость к множеству препаратов в области онкологии более детально обсуждается в документах «Detoxification Mechanisms and Tumor Cell Resistance to Anticancer Drugs» Kuzmich и Tew, в частности, раздел VII «The Multidrug-Resistant Phenotype (MDR)» Medical Research Reviews, Vol.11, No.2, 185-217, (раздел VII, pp.208-213) (1991); и в «Multidrug Resistance and Chemosensitization: Therapeutic Implications for Cancer Chemotherapy» Georges, Sharom и Ling, Advances in Pharmacology, Vol.21, 185-220 (1990).
Одна форма устойчивости к множеству препаратов (MDR) опосредуется связанным с мембраной энергетически зависимым насосом выходящего потока 170-180 кД, обозначенным как Р-гликопротеид (P-gp). Было показано, что Р-гликопротеид играет основную роль в эндогенной и приобретенной устойчивости ряда человеческих опухолей к гидрофобным, натуральным продуктовым препаратам. Препараты, которые действуют в качестве субстратов для P-gp и в последующем детоксифицируются им, включают алкалоиды винки (винкристин и винбластин), антрациклины (адриамицин) и эпиподофиллотоксины (этопозид). Хотя связанная с P-gp MDR представляет собой основную детерминанту при устойчивости опухолевых клеток к химиотерапевтических средствам, ясно, что феномен MDR является многофакторным и включает ряд различных механизмов.
Основным осложнением химиотерапии рака и противовирусной химиотерапии является повреждение клеток костного мозга или подавление их функции. В частности, химиотерапия повреждает или разрушает гематопоэтические клетки-предшественники, в первую очередь обнаруживаемые в костном мозге и селезенке, нарушая продукцию новых клеток крови (гранулоцитов, лимфоцитов, эритроцитов, моноцитов, тромбоцитов и т.д.). Например, лечение лиц, страдающих раком, 5-фторурацилом снижает количество лейкоцитов (лимфоцитов и/или гранулоцитов) и может привести к повышенной восприимчивости индивидуумов к инфекции. Многие индивидуумы, страдающие раком, умирают от инфекции или других последствий гематопоэтической недостаточности вследствие химиотерапии. Химиотерапевтические средства могут также привести к субнормальному образованию тромбоцитов, что создает склонность к кровотечению. Ингибирование продукции эритроцитов может привести к анемии. У некоторых индивидуумов, страдающих раком, риск повреждения гематопоэтической системы или других важных тканей часто ограничивает возможность увеличения химиотерапевтических доз химиотерапевтических средств до достаточно высокого уровня, обеспечивающего хорошую противоопухолевую или противовирусную эффективность. Циклы химиотерапии повторными или высокими дозами могут быть ответственны за тяжелое истощение запасов стволовых клеток, ведущее к серьезным долгосрочным гематопоэтическим последствиям и истощению костного мозга.
Предотвращение или защита от побочных эффектов химиотерапии принесли бы большую пользу лицам, страдающим раком. По поводу угрожающих жизни побочных эффектов усилия были сконцентрированы на изменении дозы схем введения химиотерапевтических средств для снижения побочных эффектов. Становятся доступными другие варианты, такие как применение фактора, стимулирующего колонии гранулоцитов (G-CSF), фактора, стимулирующего колонии гранулоцитов-макрофагов (GM-CSF), эпидермального ростового фактора (EGF), интерлейкина 11, эритропоэтина, тромбопоэтина, фактора развития и роста мегакариоцитов, фактора стволовых клеток, FLT-лиганда, а также интерлейкинов 1, 3, 6 и 7 для увеличения количества нормальных клеток в различных тканях перед началом химиотерапии (см. Jimenez и Yunis, Cancer Research 52:413-415; 1992). Хотя механизмы защиты этими факторами не полностью понятны, они вероятнее всего связаны с увеличением количества нормальных имеющих решающее значение клеток-мишеней перед лечением цитотоксическими средствами, а не с увеличенным выживанием клеток после химиотерапии.
Нацеливание химиотерапевтических средств для лечения опухолей
И рост, и метастазирование солидных опухолей являются зависимыми от ангиогенеза (Folkman, J. Cancer Res., 46, 467-73 (1986); Folkman, J. Nat. Cancer Inst., 82, 4-6 (1989); Folkman et al., «Tumor Angiogenesis» Chapter 10, pp.206-32, in The Molecular Basis of Cancer, Mendelsohn et al., eds. (W.B. Saunders, 1995)). Например, было показано, что опухоли, которые увеличиваются до диаметра более чем 2 мм, должны получить свое собственное кровоснабжение, и они достигают этого индукцией роста новых капиллярных кровеносных сосудов. После того как эти новые кровеносные сосуды внедряются в опухоль, они обеспечивают поступление питательных веществ и ростовых факторов, существенных для роста опухоли, а также служат средством для проникновения опухолевых клеток в систему кровообращения и метастазирования в отдаленные участки, такие как печень, легкие или кости (Weidner, New Eng. J. Med., 324(1), 1-8 (1991)). При использовании в качестве лекарственных препаратов у животных, пораженных опухолями, естественные ингибиторы ангиогенеза могут предотвратить рост мелких опухолей (O’Reilly et al., Cell, 79, 315-28 (1994)). Действительно, в некоторых протоколах применение таких ингибиторов ведет к обратному развитию и состоянию покоя опухолей даже после прекращения лечения (O’Reilly et al., Cell, 88, 277-85 (1997)). Более того, подача ингибиторов ангиогенеза в определенные опухоли может потенцировать их реакцию на другие схемы лечения (например, химиотерапию) (см., например, Teischer et al., Int. J. Cancer, 57, 920-25 (1994)).
Протеин и тирозин киназы катализируют фосфорилирование определенных остатков тирозила в различных белках, участвующих в регуляции роста и дифференциации клеток (A.F. Wilks, Progress in Growth Factor Research, 1990, 2, 97-111; S.A. Courtneidge, Dev. Supp.l, 1993, 57-64; J.A. Cooper, Semin. Cell Biol., 1994, 5(6), 377-387; R.F. Paulson, Semin. Immunol., 1995, 7(4), 267-277; A.C. Chan, Curr. Opin. Immunol., 1996, 8(3), 394-401). Протеин тирозин киназы можно широко классифицировать как рецепторные (например, EGFr, c-erbB-2, c-met, tie-2, PDGFr, FGFr) или не рецепторные (например, c-src, Ick, Zap70) киназы. Неадекватная или неконтролируемая активация многих из этих киназ, т.е., было показано, что аберрантная активность протеин тирозин киназы, например, путем избыточной экспрессии или мутации, приводит к неконтролируемому клеточному росту. Например, повышенная активность рецептора эпидермального ростового фактора (EGFR) была вовлечена в патологический процесс при немелкоклеточном раке легких, мочевого пузыря и раковых опухолях головы и шеи, а повышенная активность c-erbB-2 – при раке молочной железы, яичников, желудка и поджелудочной железы. Таким образом, ингибирование протеин тирозин киназ должно быть полезным в качестве лечения по поводу таких опухолей, как те, которые описаны выше.
Ростовые факторы представляют собой вещества, которые вызывают пролиферацию клеток обычно связыванием со специфическими рецепторами на клеточных поверхностях. Эпидермальный ростовой фактор (EGF) вызывает пролиферацию разнообразных клеток in vivo и требуется для роста большинства культивированных клеток. Рецептор EGF представляет собой распределенный по мембране гликопротеид 170-180 кД, который можно выявить на широком разнообразии типов клеток. Внеклеточный N-концевой домен рецептора является высоко гликозилированным и связывает антитела против EGF, которые селективно связываются с EGFR. Средства, которые конкурентно связываются с EGFR, использовались для лечения определенных типов рака, поскольку многие опухоли мезодермального и эктодермального происхождения избыточно экспрессируют рецептор EGF. Например, было показано, что рецептор EGF избыточно экспрессирован во многих глиомах, плоскоклеточных карциномах, карциномах молочных желез, меланомах, инвазивных карциномах мочевого пузыря и раковых опухолях пищевода. Попытки использовать систему EGFR для противоопухолевой терапии, в целом, включали применение моноклональных антител против EGFR. Кроме того, исследования с первичными опухолями молочных желез показали корреляцию между высокой экспрессией EGFR и наличием метастазов, более высокими скоростями пролиферации и более коротким выживанием индивидуумов.
Herlyn et al. в патенте США № 5470571 описывают применение меченого радиоактивной меткой Mab 425 для лечения глиом, которые экспрессируют EGFR. Herlyn et al. сообщают, что антитела против EGFR могут или стимулировать, или ингибировать рост и пролиферацию раковых клеток. Сообщалось, что другие моноклональные антитела, имеющие специфичность к EGFR, или отдельно, или конъюгированному с цитотоксическим соединением, эффективны для лечения определенных типов рака. Bendig et al. в патенте США № 5558864 описывают терапевтические моноклональные антитела (Mab) против EGFR для конкурентного связывания с EGFR. Heimbrook et al. в патенте США № 5690928 описывают применение EGF, конденсированного с полученными из вида Pseudomonas эндотоксинами для лечения рака мочевого пузыря. Brown et al. в патенте США № 5859018 описывают способ лечения заболеваний, характеризуемых клеточной гиперпролиферацией, опосредованной, наряду с другими факторами, EGF.
Методы введения химиотерапевтических средств
Людей, у которых диагностирован рак, часто лечат одним или множественными химиотерапевтическими средствами для уничтожения раковых клеток в первичном опухолевом участке или в отдаленных участках, куда метастазировал рак. Химиотерапевтическое лечение обычно проводится одной или несколькими большими дозами или в течение различных периодов времени, от нескольких недель до нескольких месяцев. Однако химиотерапия повторными циклами или высокими дозами может быть ответственна за увеличенную токсичность и тяжелые побочные эффекты.
Новые исследования свидетельствуют о том, что метрономная химиотерапия, частое введение цитотоксических средств низкими дозами без длительных перерывов, без введения препаратов нацелена на активированные эндотелиальные клетки в сосудистой сети опухоли. Ряд преклинических исследований продемонстрировал более высокую противоопухолевую эффективность, сильные антиангиогенные эффекты и сниженную токсичность и побочные эффекты (например, миелосуппрессию) метрономных схем по сравнению со схемами введения максимальных переносимых доз (MTD) (Bocci et al., Cancer Res, 62:6938-6943, (2002); Bocci et al., PNAS, vol, 100(22):12917-12922, (2003); и Bertolini et al, Cancer Res, 63(15):4342-4346, (2003)). Остается неясным, все ли химиотерапевтические препараты оказывают одинаковые эффекты, или некоторые лучше подходят для таких схем, чем другие. Тем не менее, представляется, что метрономная химиотерапия эффективна в преодолении некоторых из основных недостатков, связанных с химиотерапией.
Химиотерапевтические средства
Было показано, что паклитаксел оказывает значительные антинеопластические и противораковые эффекты при устойчивом к медикаментозной терапии раке яичников и показал превосходную противоопухолевую активность при широком разнообразии моделей опухолей, а также ингибирует ангиогенез при использовании в очень низких дозах (Grant et al., Int. J. Cancer, 2003). Однако плохая растворимость паклитаксела в воде создает проблему для введения людям. Действительно, доставка препаратов, которым присуща нерастворимость или плохая растворимость в водной среде, может быть серьезно нарушена, если пероральная доставка неэффективна. Соответственно, используемые в настоящее время препаративные формы паклитаксела (например, Taxol®) требуют Cremophor® для солюбилизации препарата. Присутствие Cremophor® в этой препаративной форме было связано с тяжелыми реакциями гиперчувствительности у животных (Lorenz et al., Agents Actions 7:63-67 (1987)) и людей (Weiss et al., J. Clin. Oncol. 8:1263-68 (1990)) и, следовательно, требует предварительного введения индивидуумам кортикостероидов (дексаметазона) и антигистаминных препаратов. Сообщалось также, что клинически релевантные концентрации носителя препаративной формы Cremophor® EL в Taxol® сводит к нулю антиангиогенную активность паклитаксела, свидетельствуя о том, что может потребоваться применение этого средства или других противораковых препаратов, включенных в состав Cremophor® EL, в гораздо более высоких дозах, чем те, которые предполагаются для достижения эффективной метрономной химиотерапии (Ng et al., Cancer Res., 64:821-824 (2004)). Таким образом, может быть нивелировано преимущество отсутствия нежелательных побочных эффектов, связанных со схемами низких доз паклитаксела в сравнении с обычной химиотерапией MTD. См. также патентную публикацию США № 2004/0143004; WO 00/64437.
AbraxaneTM представляет собой лишенный Cremophor® EL связанный с альбумином паклитаксел в виде наночастиц
Преклинические модели показали значительное улучшение безопасности и эффективности AbraxaneTM, по сравнению с Taxol® (Desai et al., EORTC-NCI-AACR, 2004), и у индивидуумов с метастатическим раком молочных желез (O'Shaughnessy et al., San Antonio Breast Cancer Symposium, Abstract #1122, Dec. 2003). Возможно, это связано с отсутствием поверхностно-активных веществ (например, Cremophor® или Tween® 80, используемых соответственно в Taxol® и Taxotere®) в Abraxane® и/или предпочтительным использованием механизма транспорта на основе альбумина, использующего gp60/кавеолы на микрососудистых эндотелиальных клетках (Desai et al., EORTC-NCI-AACR, 2004). Кроме того, было показано, что и Cremophor®, и Tween® 80 сильно ингибируют связывание паклитаксела с альбумином, возможно, воздействуя на транспорт, основанный на альбумине (Desai et al., EORTC-NCI-AACR, 2004).
IDN5109 (Ortataxel) представляет собой новый таксан, проходящий в настоящее время фазу II испытания, выбранный за его отсутствие перекрестной устойчивости в линиях опухолевых клеток, экспрессирующих фенотип, устойчивый к множеству препаратов (MDR/Pgp), ингибирование Р-гликопротеина (Pgp) (Minderman; Cancer Chemother. Pharmacol. 2004; 53:363-9). Ввиду его гидрофобности, IDN5109 в настоящее время включен в состав в поверхностно-активном веществе Tween® 80 (тот же носитель, что и Taxotere®). Удаление поверхностно-активных веществ из препаративных форм таксана в случае связанного с альбумином паклитаксела в виде наночастиц (AbraxaneTM) проявило улучшения безопасности и эффективности в сравнении с их аналогами, содержащими поверхностно-активные вещества (O'Shaughnessy et al., San Antonio Breast Cancer Symposium, Abstract #1122, Dec. 2003). Tween® 80 также сильно ингибировал связывание таксана, паклитаксела с альбумином, возможно нарушая основанный на альбумине транспорт лекарственных препаратов через рецептор gp60 на микрососудистых эндотелиальных клетках (Desai et al., EORTC-NCI-AACR, 2004).
О противоопухолевой активности колхицина, который является основным алкалоидом осеннего крокуса Colchicum autumnale, и африканской глориозы Gloriosa superba впервые сообщалось в начале XX века. Выяснение его структуры было окончательно завершено по рентгеновским исследованиям и ряду случаев полного синтеза (см. Shiau et al., J. Pharm. Sci. 1978, 67(3) 394-397). Считают, что колхицин представляет собой митотический яд, в частности, в тимусных, кишечных и гематопоэтических клетках, который действует в качестве веретенного яда и блокирует кинез. Считают, что его воздействие на митотическое веретено представляет особый случай его воздействий на различные организованные, лабильные, волоконные системы, связанные со структурой и движением.
Димер тиоколхицина IDN5404 был выбран, благодаря его активности в подгруппе клеток яичников человека, устойчивой к цисплатину и топотекану A2780-CIS и A2780-TOP. Этот эффект был связан с двойными механизмами действия, т.е. активностью микротрубочек, как в алкалоидах винки, и ингибирующим эффектом топоизомеразы I, отличным от камптотецина (Raspaglio, Biochemical Pharmacology 69:113-121 (2005)).
Было обнаружено, что композиции таксана в виде наночастиц (такие как связанный с альбумином паклитаксел (AbraxaneTM)) имеют значительно более низкую токсичность, чем другие таксаны, подобные Taxol® и Taxotere®, со значительно улучшенными исходами и по безопасности, и по эффективности.
Было обнаружено, что комбинированная химиотерапия, например, комбинирование одного или более химиотерапевтических средств или других способов лечения, например, комбинирование химиотерапии с облучением или хирургическим лечением, более успешна, чем соответственно отдельные химиотерапевтические средства или отдельные способы лечения.
Другие ссылки включают патентную публикацию США № 2006/0013819; патентную публикацию США № 2006/0003931; WO 05/117986; WO 05/117978 и WO 05/000900.
Требуются более эффективные способы лечения по поводу пролиферативных заболеваний, в частности, рака.
Описания всех публикаций, патентов и патентных заявок и опубликованных патентных заявок, приводимых здесь, полностью включены сюда в качестве ссылки.
Краткое описание сущности изобретения
Настоящее изобретение предоставляет способы лечения пролиферативных заболеваний, таких как рак. Изобретение предоставляет способы комбинированной терапии для лечения пролиферативных заболеваний (таких как рак), включающие: а) первое лечение, содержащее введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел) и носитель-белок (такой как альбумин), и b) второе лечение, такое как химиотерапия, лучевая терапия, хирургическое лечение или их комбинация. В другом аспекте предоставляются способы введения индивидууму композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел) и носитель-белок (такой как альбумин), на основании метрономной схемы.
В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, содержащий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин), и b) эффективного количества, по меньшей мере, одного другого химиотерапевтического средства. В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан и белок (такой как AbraxaneTM), и b) эффективного количества, по меньшей мере, одного другого химиотерапевтического средства. В некоторых вариантах осуществления химиотерапевтическое средство представляет собой любой из (а в некоторых вариантах осуществления выбран из группы, состоящей из) антиметаболитов (включая аналоги нуклеозидов); средства на основе платины, алкилирующие агенты, ингибиторы тирозин киназы, антрациклиновые антибиотики, алкалоиды винки, ингибиторы протеасом, макролиды и ингибиторы топоизомеразы. В некоторых вариантах осуществления химиотерапевтическое средство представляет собой средство на основе платины, такое как карбоплатин.
В некоторых вариантах осуществления композиция, содержащая наночастицы (также именуемая «композицией в виде наночастиц»), и химиотерапевтическое средство вводятся одновременно, или в одной и той же композиции, или в отдельных композициях. В некоторых вариантах осуществления композиция в виде наночастиц и химиотерапевтическое средство вводятся последовательно, т.е. композиция в виде наночастиц вводится или перед или после введения химиотерапевтического средства. В некоторых вариантах осуществления введение композиции в виде наночастиц и химиотерапевтического средства происходит одновременно, т.е. периоды введения композиции в виде наночастиц и химиотерапевтического средства перекрывают друг друга. В некоторых вариантах осуществления введение композиции в виде наночастиц и химиотерапевтического средства происходит не одновременно. Например, в некоторых вариантах осуществления, введение композиции в виде наночастиц прекращается перед введением химиотерапевтического средства. В некоторых вариантах осуществления введение химиотерапевтического средства прекращается перед введением композиции в виде наночастиц.
В некоторых вариантах осуществления первое терапевтическое средство таксан представляет собой паклитаксел, связанный с альбумином в виде частиц, описанный, например, в патенте США № 6566405, и имеющийся в продаже под торговым названием AbraxaneTM. Кроме того, первое терапевтическое средство таксан также считается представляющим собой доцетаксел, связанный с альбумином в виде наночастиц, описанный, например, в опубликованной заявке на патент США 2005/0004002А1.
В другом аспекте предоставляется способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий: а) первое лечение, включающее введение индивидууму композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин), и b) второе лечение, включающее лучевую терапию, хирургическое лечение или их комбинацию. В некоторых вариантах осуществления предоставляется способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий: а) первое лечение, включающее введение индивидууму композиции, содержащей наночастицы, включающие паклитаксел и альбумин (такой как AbraxaneTM), и b) второе лечение, включающее лучевую терапию, хирургическое лечение или их комбинацию. В некоторых вариантах осуществления второе лечение представляет собой лучевую терапию. В некоторых вариантах осуществления второе лечение представляет собой хирургическое лечение. В некоторых вариантах осуществления первое лечение проводится перед вторым лечением. В некоторых вариантах осуществления первое лечение проводится после второго лечения.
В другом аспекте способ включает проведение у млекопитающего, имеющего пролиферативное заболевание (такое как рак), комбинированного лечения, включающего первое лечение, включающее таксан, и второе лечение, выбранное из группы, состоящей из химиотерапевтического средства и облучения, или их комбинации. Комбинированное лечение можно проводить любыми из разнообразных путей, такими как последовательно или одновременно, и, в случае последовательного лечения, таксан можно вводить перед или после второго лечения, хотя предпочтительно, чтобы первое лечение, включающее таксан, проводилось первым. Также понятно, что второе лечение может включать более чем одно химиотерапевтическое средство.
Настоящее изобретение также предоставляет метрономные схемы лечения. В некоторых вариантах осуществления предоставляется способ введения композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин), где композиция в виде наночастиц вводится в течение периода, по меньшей мере, 1 месяц, где интервал между каждым введением составляет не более чем примерно 1 неделю, и где доза токсана при каждом введении составляет от примерно 0,25% до примерно 25% его максимальной переносимой дозы в соответствии с традиционными схемами введения. В некоторых вариантах осуществления предоставляется способ введения композиции, содержащей наночастицы, включающие паклитаксел и белок (такой как AbraxaneTM), где композиция в виде наночастиц вводится в течение периода, по меньшей мере, 1 месяц, где интервал между каждым введением составляет не более чем примерно 1 неделю, и где доза паклитаксела при каждом введении составляет от примерно 0,25% до примерно 25% его максимальной переносимой дозы в соответствии с традиционными схемами введения. В некоторых вариантах осуществления доза таксана (такого как паклитаксел, например, AbraxaneTM) на введение составляет менее чем примерно любая из доз, составляющих 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 18%, 20%, 22%, 24% или 25% максимальной переносимой дозы. В некоторых вариантах осуществления композиция в виде наночастиц вводится, по меньшей мере, с любой частотой из 1, 2, 3, 4, 5, 6, 7 (т.е. ежедневно) раз в неделю. В некоторых вариантах осуществления интервалы между введениями составляют менее чем примерно любой из периодов 7 дней, 6 дней, 5 дней, 4 дня, 3 дня, 2 дня и 1 день. В некоторых вариантах осуществления композиция в виде наночастиц вводится в течение периода, по меньшей мере, любой длительности из 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 18, 24, 30 и 36 месяцев.
В некоторых вариантах осуществления предоставляется способ введения композиции, содержащей наночастицы, включающие таксан и белок (такой как альбумин), где таксан вводится в течение периода, по меньшей мере, 1 месяц, где интервал между каждым приемом больше, чем, по меньшей мере, 1 неделя, и где доза таксана при каждом введении составляет от примерно 0,25 мг/м2 до примерно 25 мг/м2. В некоторых вариантах осуществления предоставляется способ введения композиции, содержащей наночастицы, включающие паклитаксел и альбумин (такой как AbraxaneTM), и белок-носитель (такой как альбумин), где паклитаксел вводится в течение периода, по меньшей мере, 1 месяц, где интервал между каждым введением составляет не более чем примерно 1 неделю, и где доза таксана при каждом введении составляет от примерно 0,25 мг/м2 до примерно 25 мг/м2. В некоторых вариантах осуществления доза таксана (такого как паклитаксел, например, AbraxaneTM) на введение составляет менее чем примерно любая из доз, составляющих 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 18, 20, 22 и 25 мг/м2. В некоторых вариантах осуществления композиция в виде наночастиц вводится, по меньшей мере, с любой частотой из 1, 2, 3, 4, 5, 6, 7 (т.е. ежедневно) раз в неделю. В некоторых вариантах осуществления интервалы между каждым введением составляют менее чем примерно любой из периодов 7 дней, 6 дней, 5 дней, 4 дня, 3 дня, 2 дня и 1 день. В некоторых вариантах осуществления композиция в виде наночастиц вводится в течение периода, по меньшей мере, любой длительности из 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 18, 24, 30 и 36 месяцев.
Способы по изобретению в целом включают введение композиции, содержащей наночастицы, включающие таксан и белок-носитель. В некоторых вариантах осуществления композиция в виде наночастиц содержит наночастицы, включающие паклитаксел и альбумин. В некоторых вариантах осуществления наночастицы паклитаксела/альбумина имеют средний диаметр не более чем примерно 200 нм. В некоторых вариантах осуществления композиция паклитаксела/альбумина в виде наночастиц по существу не содержит (например, не содержит) поверхностно-активное вещество (такое как Cremophor). В некоторых вариантах осуществления соотношение между массой альбумина и паклитаксела в композиции составляет примерно 18:1 или менее, например, примерно 9:1 или менее. В некоторых вариантах осуществления паклитаксел покрыт альбумином. В некоторых вариантах осуществления наночастицы паклитаксела/альбумина имеют средний диаметр не более чем примерно 200 нм, и композиция паклитаксела/альбумина по существу не содержит (например, не содержит) поверхностно-активное вещество (такое как Cremophor). В некоторых вариантах осуществления наночастицы паклитаксела/альбумина имеют средний диаметр не более чем примерно 200 нм, и паклитаксел покрыт альбумином. Предусмотрены также другие комбинации указанных выше характеристик. В некоторых вариантах осуществления композиция в виде наночастиц представляет собой AbraxaneTM. Композиции в виде наночастиц, содержащие другие таксаны (такие как доцетаксел и ортатаксел), могут также иметь одну или более из указанных выше характеристик.
Эти и другие аспекты и преимущества настоящего изобретения станут очевидными из последующего подробного описания и прилагаемой формулы изобретения. Следует понимать, что одно, некоторое или все свойства описанных здесь различных вариантов осуществления могут комбинироваться для образования других вариантов осуществления настоящего изобретения.
Краткое описание чертежей
На фиг.1А показано воздействие ABI-007 на ангиогенез аортальных колец крыс. На фиг.1В показано воздействие ABI-007 на пролиферацию эндотелиальных клеток человека. На фиг.1С показано воздействие ABI-007 на формирование трубки из эндотелиальных клеток.
На фиг.2 показано определение оптимальной биологической дозы ABI-007 для метрономного введения. Показаны уровни жизнеспособных циркулирующих эндотелиальных предшественников (СЕР) в периферической крови мышей Balb/cJ в ответ на возрастающие дозы ABI-007. Untr’d = необработанный контроль; S/A = контроль носителя солевой раствор/альбумин. Ограниченные отрезки = средняя величина ± стандартная ошибка. * значимо отличается (p<0,05) от необработанного контроля.
На фиг.3А и 3В показаны воздействия ABI-007 и таксола, используемых в метрономной схеме или схеме MTD, на рост опухоли MDA-MB-231 (А) и PC3 (B) у мышей SCID, пораженных опухолью. На фиг.3С и 3D показаны воздействия ABI-007 и таксола, используемых в метрономной схеме или схеме MTD, на массу тела мышей SCID, пораженных опухолью MDA-MB-231 (С) и PC3 (D).
На фиг.4А и 4В показаны изменения уровней жизнеспособных циркулирующих эндотелиальных предшественников (СЕР) в периферической крови мышей SCID, пораженных опухолью MDA-MB-231 (фиг.4А) и PC3 (фиг.4В), после лечения А, солевым раствором/альбумином; В, Cremophor EL контролем; С, метрономным таксолом 1,3 мг/кг; D, E и F, метрономным ABI-007 3, 6 и 10 мг/кг, соответственно; G, MTD таксолом; H, MTD ABI-007. Ограниченные отрезки = средняя величина ± стандартная ошибка. а значимо отличается (p<0,05) от контроля носителя солевого раствора/альбумина. b значимо отличается (p<0,05) от контроля носителя Cremophor EL.
На фиг.5А показана плотность микрососудов в опухоли ксенотрансплантатов MDA-MB-231 (■) и PC3 (□), обработанных А, солевым раствором/альбумином; В, Cremophor EL контролем; С, метрономным таксолом 1,3 мг/кг; D, E и F, метрономным ABI-007 3, 6 и 10 мг/кг, соответственно; G, MTD таксолом; H, MTD ABI-007. Ограниченные отрезки = средняя величина ± стандартная ошибка. На фиг.5В и 5C показана корреляция между плотностью микрососудов в опухоли и количеством жизнеспособных СЕР в периферической крови у мышей SCID, пораженных опухолью MDA-MB-231 (фиг.5В) и PC3 (фиг.5С).
На фиг.6 показаны воздействия ABI-007 и таксола, используемых в метрономной схеме или схеме MTD, на ангиогенез, вызванный основным фактором роста фибробластов (bFGF) в пробках из матригеля, инъецированных подкожно в бока мышей Balb/cJ. Виды обработки: А, солевым раствором/альбумином; В, Cremophor EL контролем; С, метрономным таксолом 1,3 мг/кг; D, E и F, метрономным ABI-007 3, 6 и 10 мг/кг, соответственно; G, MTD таксолом; H, MTD ABI-007. Матригель, имплантированный без bFGF (-bFGF) служил в качестве отрицательного контроля. Ограниченные отрезки = средняя величина ± стандартная ошибка.
На фиг.7А и фиг.7В показана цитотоксическая активность nab-рапамицина в комбинации с AbraxaneTM на сосудистые гладкомышечные клетки. Цитотоксичноть оценивали окрашиванием гомодимером-1 этидия (фиг.7А) или окрашиванием кальцеином (фиг.7В).
На фиг.8 показана цитотоксическая активность nab-рапамицина в комбинации с AbraxaneTM на модели ксенотрансплантата карциномы ободочной кишки человека НТ29.
На фиг.9 показана цитотоксическая активность nab-17-AAG в комбинации с AbraxaneTM на модели ксенотрансплантата карциномы легких человека Н358.
Подробное описание изобретения
Настоящее изобретение предоставляет способы комбинированного лечения, включающего первое лечение, включающее введение наночастиц, содержащих таксан и белок-носитель (такой как альбумин), в сочетании со вторым лечением, таким как облучение, хирургическое лечение, введение, по меньшей мере, одного другого химиотерапевтического средства или их комбинацию. Изобретение также предоставляет способы метрономной терапии.
Настоящее изобретение включает открытие того, что AbraxaneTM, ввиду его превосходящей противоопухолевой активности и сниженной токсичности и побочных эффектов, можно вводить в комбинации с другими терапевтическими препаратами и/или способами лечения и можно также применять при метрономной химиотерапии. Ввиду значительно улучшенных профилей безопасности при композициях, содержащих наночастицы лекарственного препарата/белка-носителя (таких как AbraxaneTM), заявители считают, что комбинированная химиотерапия с такими композициями в виде наночастиц (такими как AbraxaneTM) более эффективна, чем комбинированная химиотерапия с другими лекарственными препаратами. Кроме того, применение композиции в виде наночастиц (такой как AbraxaneTM), в комбинации с облучением, также считается более эффективным, чем комбинация других средств с облучением. Таким образом, композиции в виде наночастиц (в частности, композиции в виде наночастиц паклитаксела/альбумина, такие как AbraxaneTM), при использовании в комбинации с другими химиотерапевтическими средствами или при комбинации с другими способами лечения, должны быть очень эффективными и преодолеть недостатки хирургического лечения, лучевой терапии и химиотерапии при лечении пролиферативных заболеваний (таких как рак).
Настоящее изобретение в одном варианте осуществления представляет собой первое лечение, включающее введение таксана, такого как AbraxaneTM, в комбинации со вторым лечением, таким как другое химиотерапевтическое средство или средства, или им подобные, для лечения пролиферативных заболеваний, таких как рак. Первое лечение, включающее таксан, и второе лечение можно проводить у млекопитающего, имеющего пролиферативное заболевание, последовательно, или их можно проводить совместно, и даже проводить одновременно в одной и той же фармацевтической композиции.
Далее, было обнаружено, что схема метрономного введения с использованием AbraxaneTM более эффективна, чем традиционная схема введения MTD той же лекарственной композиции. Было также обнаружено, что такие схемы метрономного введения AbraxaneTM более эффективны, чем метрономное введение Taxol®.
Описанные здесь способы, в целом, можно применять для лечения заболеваний, в частности, пролиферативных заболеваний. Используемый здесь термин «лечение» представляет собой подход к получению благоприятных или желательных клинических результатов. В целях настоящего изобретения, благоприятные или желательные клинические результаты включают без ограничения любой эффект из облегчения одного или более симптомов, уменьшения степени заболевания, стабилизирования (т.е. не ухудшающегося) болезненного состояния, предотвращения или задержки распространения (например, метастазирования) заболевания, предотвращения или задержки возникновения или рецидива заболевания, задержки или замедления прогрессирования заболевания, облегчения патологического состояния и его ремиссии (частичной или полной). Термин «лечение» также охватывает уменьшение патологического последствия пролиферативного заболевания. Способы по изобретению предусматривают любой один или более из этих аспектов лечения.
Используемый здесь термин «пролиферативное заболевание» определяется как опухолевое заболевание (включая доброкачественное или раковое) и/или любые метастазы, независимо от локализации опухоли или метастаза, конкретнее, опухоль, выбранную из группы, включающую один или более из (и в некоторых вариантах осуществления выбрано из группы, состоящей из) рака молочной железы, рака мочеполовой системы, рака легких, рака желудочно-кишечной системы, эпидермоидного рака, меланомы, рака яичников, рака поджелудочной железы, нейробластомы, рака ободочной и прямой кишки, рака головы и шеи. В более широком смысле изобретения, пролиферативное заболевание может быть, кроме того, выбрано из гиперпролиферативных состояний, таких как гиперплазии, фиброз (в частности, легочный, но также другие типы фиброза, такие как почечный фиброз), ангиогенез, псориаз, атеросклероз и пролиферация гладких мышц в кровеносных сосудах, такая как стеноз или рестеноз после ангиопластики. В некоторых вариантах осуществления пролиферативное заболевание представляет собой рак. В некоторых вариантах осуществления пролиферативное заболевание представляет собой не раковое заболевание. В некоторых вариантах осуществления пролиферативное заболевание представляет собой доброкачественную или злокачественную опухоль. Когда здесь ранее и в последующем упоминается опухоль, опухолевое заболевание, карцинома или рак, также подразумеваются, альтернативно или в дополнение, независимо от локализации опухоли и/или метастаза, метастазы в первоначальный орган или ткань и/или в любой другой участок.
Используемый здесь термин «эффективное количество» относится к количеству соединения или композиции, достаточному для лечения определенного расстройства, состояния или заболевания, например, облегчения, паллиативного лечения, уменьшения и/или задержки возникновения одного или более его симптомов. В отношении различных форм рака или другой нежелательной клеточной пролиферации, эффективное количество включает количество, достаточное для того, чтобы вызвать сморщивание опухоли и/или уменьшение скорости роста опухоли (например, подавить рост опухоли) или предотвратить или отсрочить другую нежелательную клеточную пролиферацию. В некоторых вариантах осуществления эффективное количество представляет собой количество, достаточное для задержки развития. В некоторых вариантах осуществления эффективное количество представляет собой количество, достаточное для предотвращения или задержки возникновения и/или рецидива. Эффективное количество можно вводить одним или более введениями. В случае рака, эффективное количество препарата или композиции может: (i) уменьшить количество раковых клеток; (ii) уменьшить размер опухоли; (iii) ингибировать, в некоторой степени замедлить и предпочтительно прекратить инфильтрацию раковых клеток в периферические органы; (iv) ингибировать (т.е. в некоторой степени замедлить и предпочтительно остановить) метастазирование опухоли; (v) ингибировать рост опухоли; (vi) предотвратить или отсрочить возникновение и/или рецидив опухоли; и/или (vii) в некоторой степени облегчить один или более симптомов, связанных с раком.
В некоторых вариантах осуществления предоставляется способ лечения первичной опухоли. В некоторых вариантах осуществления предоставляется способ лечения метастатического рака (то есть рака, который метастазировал из первичной опухоли). В некоторых вариантах осуществления предоставляется способ лечения рака на поздней стадии (стадиях). В некоторых вариантах осуществления предоставляется способ лечения рака молочных желез (который может быть HER2-положительным или HER2-отрицательным), включая, например, запущенный рак молочных желез, рак молочных желез IV стадии, местно запущенный рак молочных желез и метастатический рак молочных желез. В некоторых вариантах осуществления предоставляется способ лечения рака легких, включая, например, немелкоклеточный рак легких (NSCLC, такой как запущенный NSCLC), мелкоклеточный рак легких (SCLC, такой как запущенный SCLC) и запущенные солидные злокачественные опухоли в легких. В некоторых вариантах осуществления предоставляется способ лечения любого из видов рака яичников, рака головы и шеи, злокачественных поражений желудка, меланомы (включая метастатическую меланому), рака ободочной и прямой кишки, рака поджелудочной железы и солидных опухолей (таких как запущенные солидные опухоли). В некоторых вариантах осуществления предоставляется способ уменьшения клеточной пролиферации и/или миграции клеток. В некоторых вариантах осуществления предоставляется способ лечения любого из следующих заболеваний: рестеноз, стеноз, фиброз, ангиогенез, псориаз, атеросклероз и пролиферация гладкомышечных клеток. Настоящее изобретение также предоставляет способы задержки развития любого из описанных здесь пролиферативных заболеваний.
Термин «индивидуум» обозначает млекопитающее, включая людей. Индивидуум включает без ограничения людей, коров, лошадей, кошек, собак, грызунов или приматов. В некоторых вариантах осуществления индивидуум представляет собой человека. У индивидуума (такого как человек) может быть запущенное заболевание или заболевание меньшей степени, такое как низкая опухолевая нагрузка. В некоторых вариантах осуществления индивидуум находится на ранней стадии пролиферативного заболевания (такого как рак). В некоторых вариантах осуществления индивидуум находится на запущенной стадии пролиферативного заболевания (такого как запущенный рак). В некоторых вариантах осуществления индивидуум является HER2-положительным. В некоторых вариантах осуществления индивидуум является HER2-отрицательным.
Способы могут осуществляться по адъювантной схеме. «Адъювантная схема» относится к клинической ситуации, при которой у индивидуумов в анамнезе было пролиферативное заболевание, в частности, рак, и в целом (но не обязательно) он реагировал на лечение, которое включает без ограничения хирургическое лечение (такое как хирургическая резекция), лучевую терапию и химиотерапию. Однако ввиду наличия у них в анамнезе пролиферативного заболевания (такого как рак), эти индивидуумы считаются имеющими риск развития заболевания. Лечение или проведение «адъювантной схемы» относится к последующему способу лечения. Степень риска (т.е. когда индивидуум, получающий лечение по адъювантной схеме, считается имеющим «высокий риск» или «низкий риск») зависит от нескольких факторов, чаще всего - степени заболевания при первом лечении. Предоставляемые здесь способы можно также осуществлять по не адъювантной схеме, т.е. способ может проводиться перед первичным/окончательным лечением. В некоторых вариантах осуществления индивидуум ранее получал лечение. В некоторых вариантах осуществления индивидуум ранее не получал лечение. В некоторых вариантах осуществления лечение представляет собой лечение первой линии.
Понятно, что описанные здесь аспекты и варианты осуществления изобретения включают «состоящие» и/или «по существу состоящие из» аспектов и вариантов осуществления.
Комбинированное лечение химиотерапевтическим средством
Настоящее изобретение предоставляет способы лечения пролиферативного заболевания (такого как рак) у индивидуума, включающие введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин); и b) эффективного количества, по меньшей мере, одного другого химиотерапевтического средства. В некоторых вариантах осуществления таксан представляет собой любой из (и в некоторых вариантах осуществления состоит по существу из) паклитаксела, доцетаксела и ортатаксела. В некоторых вариантах осуществления композиция в виде наночастиц включает AbraxaneTM. В некоторых вариантах осуществления химиотерапевтическое средство представляет собой любое из (и в некоторых вариантах осуществления, выбранное из группы, состоящей из) антиметаболитных средств (включая нуклеозидные аналоги), средств на основе платины, алкилирующих агентов, ингибиторов тирозин киназы, антрациклиновых антибиотиков, алкалоидов винки, ингибиторов протеасом, макролидов и ингибиторов топизомеразы.
В некоторых вариантах осуществления способ включает введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел и альбумин; и b) эффективного количества, по меньшей мере, другого химиотерапевтического средства. В некоторых вариантах осуществления наночастицы паклитаксела/альбумина имеют средний диаметр не более чем примерно 200 нм. В некоторых вариантах осуществления композиция паклитаксела/альбумина в виде наночастиц по существу не содержит (например, не содержит) поверхностно-активное вещество (такое как Cremophor). В некоторых вариантах осуществления массовое отношение альбумина к паклитакселу в композиции составляет примерно 18:1 или менее, например, примерно 9:1 или менее. В некоторых вариантах осуществления паклитаксел покрыт альбумином. В некоторых вариантах осуществления наночастицы паклитаксела/альбумина имеют средний диаметр не более чем примерно 200 нм, и композиция паклитаксела/альбумина по существу не содержит (например, не содержит) поверхностно-активное вещество (такое как Cremophor). В некоторых вариантах осуществления наночастицы паклитаксела/альбумина имеют средний диаметр не более чем примерно 200 нм, и паклитаксел покрыт альбумином. В некоторых вариантах осуществления композиция в виде наночастиц представляет собой AbraxaneTM.
В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества AbraxaneTM и b) эффективного количества, по меньшей мере, одного другого химиотерапевтического средства. Предпочтительными лекарственными комбинациями для последовательного или совместного введения или одновременного введения с AbraxaneTM являются те, которые обеспечивают усиленную антипролиферативную активность, по сравнению с отдельными компонентами, особенно предпочтительны комбинации, которые приводят к регрессии пролиферативных тканей и/или излечивают пролиферативное заболевание.
Описанные здесь химиотерапевтические средства могут представлять собой сами средства, их фармацевтически приемлемые соли и их фармацевтически приемлемые сложные эфиры, а также стереоизомеры, энантиомеры, рацемические смеси и им подобные. Описанное здесь химиотерапевтическое средство или средства можно вводить так же как фармацевтическую композицию, содержащую средство (средства), где фармацевтическая композиция включает фармацевтически приемлемый носитель-основу, или подобный компонент.
Химиотерапевтическое средство может присутствовать в композиции в виде наночастиц. Например, в некоторых вариантах осуществления, предоставляется способ лечения пролиферативного заболевания (такого как рак) у индивидуума, содержащий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин); и b) эффективного количества композиции, содержащей наночастицы, включающие, по меньшей мере, одно химиотерапевтическое средство и белок-носитель (такой как альбумин). В некоторых вариантах осуществления способ включает введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел и альбумин (такие как AbraxaneTM); и b) эффективного количества композиции, содержащей наночастицы, включающие, по меньшей мере, одно химиотерапевтическое средство и белок-носитель (такой как альбумин). В некоторых вариантах осуществления химиотерапевтическое средство представляет собой любое из (а в некоторых вариантах осуществления выбранное из группы, состоящей из) тиоколхицина или его производных (таких как димерный тиоколхицин, включая, например, nab-5404, nab-5800 и nab-5801), рапамицина или его производных и гелданамицина или его производных (таких как 17-аллиламиногелданамицин (17-AAG)). В некоторых вариантах осуществления химиотерапевтическое средство представляет собой рапамицин. В некоторых вариантах осуществления химиотерапевтическое средство представляет собой 17-AAG.
Здесь предоставляется иллюстративный и неограничивающий перечень предусмотренных химиотерапевтических средств. Подходящие химиотерапевтические средства включают, например, алкалоиды винки, средства, которые прерывают образование микротрубочек (такие как колхицины и их производные), антиангиогенные средства, терапевтические антитела, средства, нацеленные на EGFR, средства, нацеленные на тирозин киназу (такие как ингибиторы тирозин киназы), комплексы переходных металлов, ингибиторы протеасом, антиметаболиты (такие как аналоги нуклеозидов), алкилирующие агенты, агенты на основе платины, антрациклиновые антибиотики, ингибиторы топоизомеразы, макролиды, терапевтические антитела, ретиноиды (такие как полностью транс-ретиноевые кислоты или их производные), гельданамицин или его производные (такие как 17-AAG) и другие стандартные химиотерапевтические средства, хорошо известные в данной области.
В некоторых вариантах осуществления химиотерапевтическое средство представляет собой любое из (а в некоторых вариантах осуществления выбранное из группы, состоящей из) адриамицина, колхицина, циклофосфамида, актиномицина, блеомицина, дуанорубицина, доксорубицина, эпирубицина, митомицина, метотрексата, митоксантрона, фторурацила, карбоплатина, кармустина (BCNU), метил-CCNU, цисплатина, этопозида, интерферонов, камптотецина и его производных, фенестерина, таксанов и их производных (например, паклитаксела и его производных, таксотера и его производных и им подобных), топотекана, винбластина, винкристина, тамоксифена, пипосульфана, nab-5404, nab-5800, nab-5801, иринотекана, НКР, ортатаксела, гемцитабина, Herceptin®, винорелбина, Doxil®, капецитабина, Alimta®, Avastin®, Velcade®, Tarceva®, Neulasta®, лапатиниба, сорафениба, их производных, химиотерапевтических средств, известных в данной области, и им подобных. В некоторых вариантах осуществления химиотерапевтическое средство представляет собой композицию, содержащую наночастицы, включающие производное тиоколхицина и белок-носитель (такой как альбумин).
В некоторых вариантах осуществления химиотерапевтическое средство представляет собой антинеопластическое средство, включающее без ограничения карбоплатин, Navelbine® (винорелбин), антрациклин (Doxil®, лапатиниб (GW57016), Herceptin®, гемцитабин (Gemzar®), капецитабин (Xeloda®), Alimta®, цисплатин, 5-фторурацил, эпирубицин, циклофосфамид, Avastin®, Velcade® и т.д.
В некоторых вариантах осуществления химиотерапевтическое средство представляет собой антагонист других факторов, которые участвуют в опухолевом росте, таких как EGFR, ErbB2 (также известный как Herb), ErbB3, ErbB4 или TNF. Иногда, может быть благоприятно также введение индивидууму одного или более цитокинов. В некоторых вариантах осуществления терапевтическое средство представляет собой средство, ингибирующее рост. Подходящие дозировки для средства, ингибирующего рост, являются те, которые используются в настоящее время и могут быть снижены ввиду комбинированного действия (синергии) средства, ингибирующего рост, и таксана.
В некоторых вариантах осуществления химиотерапевтическое средство представляет собой химиотерапевтическое средство, отличное от антитела против VEGF, антитела против HER2, интерферона и антагониста HGFβ.
Упоминаемое здесь химиотерапевтическое средство относится к химиотерапевтическому средству или его производным, и, соответственно, изобретение предусматривает и включает любой из этих вариантов осуществления (средства; средство или производное (производные)). «Производные» или «аналоги» химиотерапевтического средства или химической части включают без ограничения соединения, которые структурно аналогичны химиотерапевтическому средству или его фрагменту или относятся к тому же общему химическому классу, что и химиотерапевтическое средство или его фрагмент. В некоторых вариантах осуществления химиотерапевтическое средство или его фрагмент сохраняет химическое и/или физическое свойство (включая, например, функциональность), аналогичное, химиотерапевтическому средству или его фрагменту.
В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин), и b) эффективного количества ингибитора тирозин киназы. В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел и альбумин (такой как AbraxaneTM), и b) эффективного количества ингибитора тирозин киназы. Подходящие ингибиторы тирозин киназы включают, например, иматиниб (Gleevec®), гефитиниб (Iressa®), Tarceva, Sutent® (сунитиниб малат) и лапатиниб. В некоторых вариантах осуществления ингибитор тирозин киназы представляет собой лапатиниб. В некоторых вариантах осуществления ингибитор тирозин киназы представляет собой Tarceva. Tarceva представляет собой мелкомолекулярный ингибитор человеческого эпидермального ростового фактора типа 1/рецептора эпидермального ростового фактора (HER1/EGFR), который в клиническом испытании фазы III продемонстрировал увеличенное выживание индивидуумов с запущенным немелкоклеточным раком легких (NSCLC). В некоторых вариантах осуществления предоставляется способ лечения рака молочных желез, включая лечение метастатического рака молочных желез и лечение рака молочных желез в неоадъювантной схеме. В некоторых вариантах осуществления предоставляется способ лечения запущенной солидной опухоли. В некоторых вариантах осуществления предоставляется способ ингибирования пролиферации опухолей, экспрессирующий EGFR, у млекопитающего, включающий введение млекопитающему, пораженному такими опухолями, AbraxaneTM и гефитиниба, где гефитиниб вводится пульсирующим введением.
В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин), и b) эффективного количества антиметаболического средства (такого как аналог нуклеозидов, включая, например, аналоги пуринов и аналоги пиримидина). В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел и альбумин (такой как AbraxaneTM), и b) эффективного количества антиметаболического средства. «Антиметаболическое средство» представляет собой средство, которое структурно аналогично метаболиту, но не может использоваться организмом продуктивным образом. Многие антиметаболические средства препятствуют продукции нуклеиновых кислот, РНК и ДНК. Например, антиметаболит может представлять собой нуклеозидный аналог, который включает без ограничения азацитидин, азатиоприн, капецитабин (Xeloda®), цитарабин, кладрибин, цитозин арабинозид (ara-C, цитозар), доксифлуридин, фторурацил (такой как 5-фторурацил), UFT, гидроксимочевину, гемцитабин, меркаптопурин, метотрексат, тиогуанин (такой как 6-тиогуанин). Другие антиметаболиты включают, например, L-аспарагиназу (элспа), декарбазин (DTIC), 2-деокси-D-глюкозу и прокарбазин (матулан). В некоторых вариантах осуществления нуклеозидный аналог представляет собой любой из (а в некоторых вариантах осуществления выбран из группы, состоящей из) гемцитабина, фторурацила и капецитабина. В некоторых вариантах осуществления способ предназначен для лечения метастатического рака молочной железы или местно запущенного рака молочной железы. В некоторых вариантах осуществления способ предназначен для лечения первой линии метастатического рака молочной железы. В некоторых вариантах осуществления способ предназначен для лечения рака молочной железы по адъювантной схеме. В некоторых вариантах осуществления способ предназначен для лечения любого NSCLC, метастатического рака ободочной и прямой кишки, рака поджелудочной железы или запущенной солидной опухоли.
В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин), и b) эффективного количества алкилирующего агента. В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, содержащий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел и альбумин (такой как AbraxaneTM), и b) эффективного количества алкилирующего агента. Подходящие алкилирующие агенты включают без ограничения циклофосфамид (цитоксан), мехлоретамин, хлорамбуцил, мелфалан, кармустин (BCNU), тиотепа, бусульфан, алкилсульфонаты, этиленимины, аналоги азотистого иприта, эстрамустин натрий фосфат, ифосфамид, нитрозомочевины, ломустин и стрептозоцин. В некоторых вариантах осуществления алкилирующий агент представляет собой циклофосфамид. В некоторых вариантах осуществления циклофосфамид вводится перед введением композиции в виде наночастиц. В некоторых вариантах осуществления способ предназначен для лечения рака молочной железы на ранней стадии. В некоторых вариантах осуществления способ предназначен для лечения рака молочной железы в адъювантной или неоадъювантной схеме лечения.
В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин), и b) эффективного количества средства на основе платины. В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел и альбумин (такой как AbraxaneTM), и b) эффективного количества средства на основе платины. Подходящие средства на основе платины включают без ограничения карбоплатин, цисплатин и оксалиплатин. В некоторых вариантах осуществления средство на основе платины представляет собой карбаплатин. В некоторых вариантах осуществления способ предназначен для лечения рака молочной железы (HER2-положительного или HER2-отрицательного, включая метастатический рак молочной железы и запущенный рак молочной железы); рака легких (включая лечение первой линии запущенного NSCLC, NSCLC, SCLC и запущенных солидных злокачественных опухолей в легких); рака яичников; рака головы и шеи; и меланомы (включая метастатическую меланому).
В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин), и b) эффективного количества антрациклинового антибиотика. В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел и альбумин (такой как AbraxaneTM) и белок-носитель (такой как альбумин), и b) эффективного количества антрациклинового антибиотика. Подходящий антрациклиновый антибиотик включает без ограничения Doxil®, актиномицин, дактиномицин, даунорубицин (дауномицин), доксорубицин (адриамицин), эпирубицин, идарубицин, митоксантрон, валрубицин. В некоторых вариантах осуществления антрациклин представляет собой любой из (и в некоторых вариантах осуществления выбран из группы, состоящей из) Doxil®, эпирубцина и доксорубицина. В некоторых вариантах осуществления способ предназначен для лечения ранней стадии рака молочной железы. В некоторых вариантах осуществления способ предназначен для лечения рака молочной железы в адъювантной или неоадъювантной схеме.
В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин), и b) эффективного количества алкалоида винки. В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел и альбумин (такой как AbraxaneTM) и белок-носитель (такой как альбумин), и b) эффективного количества алкалоида винки. Подходящие алкалоиды винки включают, например, винбластин, винкристин, виндезин, винорелбин (Navelbine®) и VP-16. В некоторых вариантах осуществления способ предназначен для лечения рака молочной железы IV стадии и рака легких.
В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин), и b) эффективного количества макролида. В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел и альбумин (такой как AbraxaneTM) и белок-носитель (такой как альбумин), и b) эффективного количества макролида. Подходящие макролиды включают, например, рапамицин, карбомицин и эритромицин. В некоторых вариантах осуществления макролид представляет собой рапамицин или его производное. В некоторых вариантах осуществления способ предназначен для лечения солидной опухоли.
В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин), и b) эффективного количества ингибитора топоизомеразы. В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел и альбумин (такой как AbraxaneTM) и белок-носитель (такой как альбумин), и b) эффективного количества ингибитора топоизомеразы. В некоторых вариантах осуществления химиотерапевтическое средство представляет собой ингибитор топоизомеразы, включая, например, ингибитор топоизомеразы I и топоизомеразы II. Иллюстративные ингибиторы топоизомеразы I включают без ограничения камптотецин, такой как иринотекан и топотекан. Иллюстративные ингибиторы топоизомеразы II включают без ограничения амсакрин, этопозид, этопозид фосфат и тенипозид.
В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин), и b) эффективного количества антиангиогенного средства. В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел и альбумин (такой как AbraxaneTM) и белок-носитель (такой как альбумин), и b) эффективного количества антиангиогенного средства. В некоторых вариантах осуществления способ предназначен для лечения метастатического рака молочных желез, рака молочной железы в адъювантной схеме или в неоадъювантной схеме, рака легких (такого как лечение первой линии запущенного NSCLC и NSCLC), рака яичников и меланомы (включая метастатическую меланому).
В данной области были идентифицированы и известны многие антиангиогенные средства, включая средства, перечисленные Carmeliet и Jain (2000). Антиангиогенное средство может быть естественно встречающимся или нет. В некоторых вариантах осуществления химиотерапевтическое средство представляет собой антиангиогенный пептид. Например, ранее сообщалось, что обладающие антиангиогенной активностью мелкие синтетические про-апоптозные пептиды включают 2 функциональных домена, один, нацеленный на рецепторы CD13 (аминопептидаза N) на опухолевых доменах, а другой - разрушающий митохондриальную мембрану после интернализации (Nat. Med. 1999, 5(9):1032-8). Было обнаружено, что димерный пептид второго поколения, CNGRC-GG-d(KLAKLAK)2, названный НКР (пептид-«охотник-убийца»), обладает улучшенной противоопухолевой активностью. Соответственно, в некоторых вариантах осуществления, антиангиогенный пептид представляет собой НКР. В некоторых вариантах осуществления антиангиогенное средство отличается от антитела против VEGF (такого как Avastin®).
В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин), и b) эффективного количества ингибитора протеасомы. В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел и альбумин (такой как Abraxane™) и белок-носитель (такой как альбумин), и b) эффективного количества ингибитора протеасомы, такого как бортезомиб (Velcade).
В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин), и b) эффективного количества терапевтического антитела. В некоторых вариантах осуществления изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел и альбумин (такой как Abraxane™) и белок-носитель (такой как альбумин), и b) эффективного количества терапевтического антитела. Подходящие терапевтические антитела включают без ограничения антитело против VEGF (такое как Avastin® (бевакизумаб)), антитело против HER2 (такое как Herceptin® (трастузумаб)), Erbitux® (цетуксимаб), Campath (алемтузумаб), Myelotarg (гемтузумаб), Zevalin (ибритумомаб тиуекстан), Rituxan (ритуксимаб) и Bexxar (тоситумомаб). В некоторых вариантах осуществления химиотерапевтическое средство представляет собой Erbitux® (цетуксимаб). В некоторых вариантах осуществления химиотерапевтическое средство представляет собой терапевтическое антитело, отличное от антитела против VEGF или HER2. В некоторых вариантах осуществления способ предназначен для лечения HER2-положительного рака молочной железы, включая лечение запущенного рака молочных желез, лечение метастатического рака молочных желез, лечение рака молочной железы в адъювантной схеме и лечение рака молочной железы в неоадъювантной схеме. В некоторых вариантах осуществления способ предназначен для лечения метастатического рака молочных желез, рака молочной железы в адъювантной схеме и рака молочной железы в неоадъювантной схеме, рака легких (такого как при лечении первой линии запущенного NSCLC и NSCLC), рака яичников, рака головы и шеи и меланомы (включая метастатическую меланому). Например, в некоторых вариантах осуществления, предоставляется способ лечения HER2-положительного метастатического рака молочной железы у индивидуума, включающий введение индивидууму 125 мг/м2 композиции паклитаксела/альбумина в виде наночастиц (такой как Abraxane™) 1 раз в неделю в течение 3 недель с перерывом в течение 4-ой недели, одновременно с введением Herceptin®.
В некоторых вариантах осуществления 2 или более химиотерапевтических средств вводятся в дополнение к таксану в композиции в виде наночастиц. Эти 2 или более химиотерапевтических средства могут (но необязательно) относиться к различным классам химиотерапевтических средств. Здесь представлены примеры этих комбинаций. Предусмотрены также другие комбинации.
В некоторых вариантах осуществления предоставляется способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин), и b) эффективного количества антиметаболита (такого как аналог нуклеозида, например, гемцитабин) и с) антрациклинового антибиотика (такого как эпирубицин). В некоторых вариантах осуществления предоставляется способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел и альбумин (такой как Abraxane™), b) эффективного количества антиметаболита (такого как аналог нуклеозида, например, гемцитабин) и с) эффективного количества антрациклинового антибиотика (такого как эпирубицин). В некоторых вариантах осуществления способ предназначен для лечения рака молочной железы в неоадъювантной схеме. Например, в некоторых вариантах осуществления, предоставляется способ лечения местно запущенного/воспалительного рака у индивидуума, включающий введение индивидууму 220 мг/м2 композиции паклитаксела/альбумина в виде наночастиц (такой как Abraxane™) 1 раз в 2 недели, 2000 мг/м2 гемцитабина 1 раз в 2 недели и 50 мг/м2 эпирубицина 1 раз в 2 недели. В некоторых вариантах осуществления предоставляется способ лечения рака молочной железы у индивидуума в адъювантной схеме, включающий введение индивидууму 175 мг/м2 композиции паклитаксела/альбумина в виде наночастиц (такой как Abraxane™) 1 раз в 2 недели, 2000 мг/м2 гемцитабина 1 раз в 2 недели и 50 мг/м2 эпирубицина 1 раз в 2 недели.
В некоторых вариантах осуществления предоставляется способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин), b) эффективного количества средства на основе платины (такого как карбоплатин) и с) терапевтического антитела (такого как антитело против HER2 (такое как Herceptin®) и антитела против VEGF (такого как Avastin®)). В некоторых вариантах осуществления предоставляется способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел и альбумин (такой как Abraxane™), b) эффективного количества средства на основе платины (такого как карбоплатин) и с) терапевтического антитела (такого как антитело против HER2 (такое как Herceptin®) и антитело против VEGF (такое как Avastin®)). В некоторых вариантах осуществления способ предназначен для лечения любого из запущенного рака молочной железы, метастатического рака молочной железы, рака молочной железы в адъювантной схеме и рака легких (включая NSCLC и запущенного NSCLC). В некоторых вариантах осуществления предоставляется способ лечения метастатического рака у индивидуума, включающий введение индивидууму 75 мг/м2 композиции паклитаксела/альбумина в виде наночастиц (такой как Abraxane™) и карбоплатина, AUC (площадь под кривой) =2, где введение проводят 1 раз в неделю в течение 3 недель с перерывом в течение 4-ой недели. В некоторых вариантах осуществления способ, кроме того, включает введение примерно 2-4 мг/кг Herceptin®.
В некоторых вариантах осуществления предоставляется способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин), b) эффективного количества средства на основе платины (такого как карбоплатин) и с) алкалоида винки (такого как Navelbine®). В некоторых вариантах осуществления предоставляется способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел и альбумин (такой как Abraxane™), b) эффективного количества средства на основе платины (такого как карбоплатин) и с) алкалоида винки (такого как Navelbine®). В некоторых вариантах осуществления способ предназначен для лечения рака легких.
В некоторых вариантах осуществления предоставляется способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин), b) эффективного количество алкилирующего средства (такого как циклофосфамид) и с) антрациклинового антибиотика (такого как адриамицин). В некоторых вариантах осуществления предоставляется способ лечения пролиферативного заболевания (такого как рак) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел и альбумин, b) эффективного количества алкилирующего средства (такого как циклофосфамид) и с) антрациклинового антибиотика (такого как адриамицин). В некоторых вариантах осуществления способ предназначен для лечения ранней стадии рака молочной железы. В некоторых вариантах осуществления способ предназначен для лечения рака молочной железы в адъювантной или неоадъювантной схеме. Например, в некоторых вариантах осуществления, предоставляется способ лечения композиции ранней стадии рака молочной железы у индивидуума, включающий введение 260 мг/м2 композиции паклитаксела/альбумина в виде наночастиц (такой как Abraxane™), 60 мг/м2 адриамицина и 600 мг/м2 циклофосфамида, где введение проводят 1 раз в 2 недели.
Другие варианты осуществления представлены в таблице 1. Например, в некоторых вариантах осуществления, предоставляется способ лечения запущенного рака молочной железы у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел и альбумин (такой как Abraxane™), b) эффективного количества карбоплатина. В некоторых вариантах осуществления способ, кроме того, включает введение индивидууму эффективного количества Herceptin®. В некоторых вариантах осуществления предоставляется способ лечения метастатического рака молочной железы у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел и альбумин (такой как Abraxane™), b) эффективного количества гемцитабина. В некоторых вариантах осуществления предоставляется способ лечения запущенного немелкоклеточного рака легких у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие паклитаксел и альбумин (такой как Abraxane™), b) эффективного количества карбоплатина.
В некоторых вариантах осуществления предоставляется композиция, содержащая наночастицы, включающие таксан (такой как паклитаксел, доцетаксел или ортатаксел) и белок-носитель (такой как альбумин), и, по меньшей мере, одно другое химиотерапевтическое средство. Описанные здесь композиции могут содержать эффективные количества таксана и химиотерапевтического средства для лечения пролиферативного заболевания (такого как рак). В некоторых вариантах осуществления химиотерапевтическое средство и таксан присутствуют в композиции в заданном соотношении, таком как массовые соотношения, описанные здесь. В некоторых вариантах осуществления изобретение предоставляет синергическую композицию эффективного количества композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел, доцетаксел или ортатаксел), и эффективное количество, по меньшей мере, одного другого химиотерапевтического средства.
В некоторых вариантах осуществления изобретение предоставляет фармацевтические композиции, содержащие наночастицы, включающие таксан и белок-носитель (такой как альбумин), для применения при лечении пролиферативного заболевания (такого как рак), где указанное применение включает одновременное и/или последовательное введение, по меньшей мере, одного другого химиотерапевтического средства. В некоторых вариантах осуществления изобретение предоставляет фармацевтическую композицию, содержащую химиотерапевтическое средство для применения при лечении пролиферативного заболевания (такого как рак), где указанное применение включает одновременное и/или последовательное введение композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин). В некоторых вариантах осуществления изобретение предоставляет содержащие таксан композиции в виде наночастиц и композиции, содержащие одно другое химиотерапевтическое средство для одновременного и/или последовательного применения для лечения пролиферативного заболевания (такого как рак).
Способы введения
Композиции, содержащие наночастицы, включающие таксан (также именуемые «композицией в виде наночастиц»), и химиотерапевтическое средство можно вводить одновременно (т.е. одновременное введение) и/или последовательно (т.е. последовательное введение).
В некоторых вариантах осуществления композиция в виде наночастиц и химиотерапевтическое средство (включая описанные здесь специфические химиотерапевтические средства) вводятся одновременно. Используемый здесь термин «одновременное введение» означает, что композиция в виде наночастиц и химиотерапевтическое средство вводятся с разделением во времени не более чем примерно 15 минут, например, не более чем примерно любой период из 10, 5 или 1 минуты. Когда препараты вводятся одновременно, препарат в виде наночастиц и химиотерапевтическое средство могут содержаться в одной и той же композиции (например, композиции, включающей и наночастицы, и химиотерапевтическое средство) или в отдельных композициях (например, наночастицы содержатся в одной композиции, а химиотерапевтическое средство содержится в другой композиции). Например, таксан и химиотерапевтическое средство могут присутствовать в одной композиции, содержащей, по меньшей мере, 2 различных вида наночастиц, где некоторые из наночастиц в композиции включают таксан и белок-носитель, а некоторые из других наночастиц в композиции включают химиотерапевтическое средство и белок-носитель. Изобретение предусматривает и охватывает такие композиции. В некоторых вариантах осуществления в наночастицах содержится только таксан. В некоторых вариантах осуществления одновременное введение препарата в композиции в виде наночастиц и химиотерапевтического средства может комбинироваться с дополнительными дозами таксана и/или химиотерапевтического средства.
В некоторых вариантах осуществления композиция в виде наночастиц и химиотерапевтическое средство вводятся последовательно. Используемый здесь термин «последовательное введение» означает, что препарат в композиции в виде наночастиц и химиотерапевтическое средство вводятся с разделением во времени более чем примерно 15 минут, например, более чем примерно любой из периодов 20, 30, 40, 50, 60 или более минут. Сначала можно вводить любой препарат из композиции в виде наночастиц и химиотерапевтического средства. Композиция в виде наночастиц и химиотерапевтическое средство содержатся в отдельных композициях, которые могут содержаться в одной и той же или различных упаковках.
В некоторых вариантах осуществления введение композиции в виде наночастиц и химиотерапевтического средства происходит одновременно, т.е. периоды введения композиции в виде наночастиц и химиотерапевтического средства перекрывают друг друга. В некоторых вариантах осуществления введение композиции в виде наночастиц и химиотерапевтического средства происходит не одновременно. Например, в некоторых вариантах осуществления, введение композиции в виде наночастиц прекращается перед тем, как вводится химиотерапевтическое средство. В некоторых вариантах осуществления введение химиотерапевтического средства прекращается перед тем, как вводится композиция в виде наночастиц. Период времени между этими двумя не одновременными введениями может находиться в диапазоне от примерно 2 до 8 недель, например, примерно 4 недели.
Частоту введения содержащей препараты композиции в виде наночастиц и химиотерапевтического средства можно регулировать в течение курса лечения на основании суждений проводящего лечение врача. При отдельном введении, содержащую препараты композицию в виде наночастиц и химиотерапевтическое средство можно вводить с различной частотой введения или интервалами. Например, содержащую препараты композицию в виде наночастиц можно вводить 1 раз в неделю, в то время как химиотерапевтическое средство можно вводить более или менее часто. В некоторых вариантах осуществления можно использовать препаративную форму продолжительного высвобождения содержащей препараты композиции в виде наночастиц и/или химиотерапевтического средства. В данной области известны различные препаративные формы и устройства для достижения пролонгированного высвобождения.
Композицию в виде наночастиц и химиотерапевтическое средство можно вводить, используя одинаковый путь введения, или различные пути введения. В некоторых вариантах осуществления (и для одновременного, и для последовательного введения) таксан в композиции в виде наночастиц и химиотерапевтическое средство вводятся в заданной дозе. Например, в некоторых вариантах осуществления массовое соотношение между таксаном в композиции в виде наночастиц и химиотерапевтическим средством составляет примерно один к одному. В некоторых вариантах осуществления массовое соотношение может составлять от примерно 0,001 до примерно 1 и от примерно 1000 до примерно 1, или от примерно 0,01 до примерно 1 и от 100 до примерно 1. В некоторых вариантах осуществления массовое соотношение между таксаном и химиотерапевтическим средством в композиции в виде наночастиц составляет любую величину из 100:1, 50:1, 30:1, 10:1, 9:1, 8:1, 7:1, 6:1, 5:1, 4:1, 3:1, 2:1 и 1:1. В некоторых вариантах осуществления массовое соотношение между таксаном в композиции в виде наночастиц и химиотерапевтическим средством составляет любую величину из 1:1, 2:1, 3:1, 4:1, 5:1, 6:1, 7:1, 8:1, 9:1, 30:1, 50:1, 100:1. Предусмотрены другие соотношения.
Дозы, требуемые для таксана и химиотерапевтического средства, могут (необязательно) быть ниже, чем обычно требуемые при отдельном введении каждого средства. Таким образом, в некоторых вариантах осуществления, препарат в композиции в виде наночастиц и/или химиотерапевтическое средство вводятся в субтерапевтическом количестве. «Субтерапевтическое количество» или «субтерапевтический уровень» относятся к количеству, которое меньше, чем терапевтическое количество. То есть, менее чем количество, обычно применяемое, когда препарат в композиции в виде наночастиц и/или химиотерапевтическое средство вводятся отдельно. Снижение может быть отражено с точки зрения количества, вводимого при данном введении, и/или количества, вводимого в течение данного периода времени (сниженная частота).
В некоторых вариантах осуществления вводится количество химиотерапевтического средства, достаточное для обеспечения возможности снижения обычной дозы препарата в композиции в виде наночастиц, требуемой для обеспечения такой же степени лечения, по меньшей мере, примерно на любую величину из 5%, 10%, 20%, 30%, 50%, 60%, 70%, 80%, 90% или более. В некоторых вариантах осуществления вводится количество химиотерапевтического средства, достаточное для обеспечения возможности снижения обычной дозы химиотерапевтического средства, требуемой для обеспечения такой же степени лечения, по меньшей мере, примерно на любую величину из 5%, 10%, 20%, 30%, 50%, 60%, 70%, 80%, 90% или более.
В некоторых вариантах осуществления доза таксана в композиции в виде наночастиц и химиотерапевтического средства снижается по сравнению с соответствующей обычной дозой каждого из них при отдельном введении. В некоторых вариантах осуществления таксан в композиции в виде наночастиц и химиотерапевтическое средство вводятся на субтерапевтическом, т.е. сниженном уровне. В некоторых вариантах осуществления доза композиции в виде наночастиц и/или химиотерапевтического средства по существу меньше, чем установленная максимальная токсическая доза (MTD). Например, доза композиции в виде наночастиц и/или химиотерапевтического средства меньше, чем примерно 50%, 40%, 30%, 20% или 10% MTD.
Можно использовать комбинацию описанных здесь конфигураций введения. Описанные здесь способы комбинированного лечения можно выполнять отдельно или в сочетании с другим лечением, таким как хирургическое лечение, облучение, химиотерапия, иммунотерапия, генная терапия и им подобные. Кроме того, лицо, имеющее повышенный риск развития пролиферативного заболевания, может получать способы лечения для ингибирования и/или задержки развития заболевания.
Как будет понятно средним специалистам в данной области, соответствующие дозы химиотерапевтических средств будут приблизительно представлять собой дозы, уже используемые при клинических схемах лечения, где химиотерапевтические средства вводятся отдельно или в комбинации с другими химиотерапевтическими средствами. Изменение дозировки, вероятно, произойдет в зависимости от подвергающегося лечению состояния. Как описано выше, в некоторых вариантах осуществления химиотерапевтические средства можно вводить при сниженном уровне дозировки.
Описанную здесь композицию в виде наночастиц можно вводить индивидууму (например, человеку) различными путями, такими как перентерально, включая внутривенное, внутриартериальное, внутрибрюшинное, внутрилегочное, пероральное, ингаляционное, интравезикулярное, внутримышечное, интратрехеальное, подкожное, внутриглазное, подоболочечное или трансдермальное введение. Например, композицию в виде наночастиц можно вводить ингаляцией для лечения заболеваний дыхательных путей. Композицию можно применять для лечения заболеваний дыхательных путей, таких как пневмосклероз, облитерирующий бронхиолит, рак легких, бронхоальвеолярная карцинома и им подобные. В некоторых вариантах осуществления композиция в виде наночастиц вводится внутривенно. В некоторых вариантах осуществления композиция в виде наночастиц вводится перорально.
Частота введения композиции в виде наночастиц зависит от природы комбинированного лечения и определенного заболевания, подвергаемого лечению. Иллюстративная частота введения включает без ограничения 1 раз в неделю без перерыва; 1 раз в неделю в течение трех из четырех недель; 1 раз в 3 недели; 1 раз в 2 недели; 1 раз в неделю в течение двух из трех недель. См. также таблицу 1.
Доза таксана в композиции в виде наночастиц будет варьироваться в зависимости от природы комбинированной терапии и конкретного подвергаемого лечению заболевания. Доза должна быть достаточной для получения желательной реакции, такой как терапевтическая или профилактическая реакция против конкретного заболевания. Иллюстративная доза таксана (в некоторых вариантах осуществления - паклитаксела) в композиции в виде наночастиц включает без ограничения примерно любую из доз 50 мг/м2, 60 мг/м2, 75 мг/м2, 80 мг/м2, 90 мг/м2, 100 мг/м2, 120 мг/м2, 160 мг/м2, 175 мг/м2, 200 мг/м2, 210 мг/м2, 220 мг/м2, 260 мг/м2 и 300 мг/м2. Например, доза таксана в композиции в виде наночастиц может находиться в диапазоне от 100 до 400 мг/м2, при введении по 3-х недельной схеме, или 50-250 мг/м2, при введении по еженедельной схеме. См. также таблицу 1.
Другие иллюстративные схемы введения композиции в виде наночастиц (такой как композиция паклитаксела/альбумина в виде наночастиц) включают без ограничения 100 мг/м2 1 раз в неделю без перерыва; 75 мг/м2 1 раз в неделю 3 из четырех недель; 100 мг/м2 1 раз в неделю 3 из четырех недель; 125 мг/м2 1 раз в неделю 3 из четырех недель; 125 мг/м2 1 раз в неделю 2 из 3 недель; 130 мг/м2 1 раз в неделю без перерыва; 175 мг/м2, 1 раз в 2 недели; 260 мг/м2 1 раз в 2 недели; 260 мг/м2 1 раз в 3 недели; 180-300 мг/м2 каждые 3 недели; 60-175 мг/м2 1 раз в неделю без перерыва. Кроме того, таксан (отдельно или в комбинированной терапии) можно вводить, следуя метрономной схеме введения, описанной здесь.
Иллюстративные схемы введения для комбинированной терапии композицией в виде наночастиц (такой как композиция паклитаксела/альбумина в виде наночастиц, например, AbraxaneTM) и другими средствами включают без ограничения 125 мг/м2 1 раз в неделю 2 из трех недель плюс 825 мг/м2 Xeloda® 1 раз в день; 260 мг/м2 1 раз в 2 недели плюс 60 мг/м2 адриамицина и 600 мг/м2 циклофосфамида 1 раз в 2 недели; 220-340 мг/м2 1 раз в 3 недели плюс карбоплатин, AUC=6, 1 раз в 3 недели; 100-150 мг/м2 1 раз в неделю плюс карбоплатин, AUC=6, 1 раз в 3 недели; 175 мг/м2 1 раз в 2 недели плюс 2000 мг/м2 гемцитабина и 50 мг/м2 эпирубицина 1 раз в 2 недели; и 75 мг/м2 1 раз в неделю 3 из 4 недель плюс карбоплатин, AUC=2, 1 раз в неделю 3 из 4 недель.
В некоторых вариантах осуществления композиция в виде наночастиц и химиотерапевтическое средство вводятся в соответствии с любой из схем введения, описанных в таблице 1.
В некоторых вариантах осуществления предоставляется способ лечения рака молочных желез у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел) и альбумин, и b) эффективного количества, по меньшей мере, одного другого химиотерапевтического средства, как представлено в рядах 1-35 в таблице 1. В некоторых вариантах осуществления введение композиции в виде наночастиц и химиотерапевтического средства может производиться в соответствии с любой из схем введения, как указано в рядах 1-35 в таблице 1. В некоторых вариантах осуществления предоставляется способ лечения метастатического рака молочной железы у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел) и альбумин, и b) эффективного количества, по меньшей мере, одного другого химиотерапевтического средства, как представлено в рядах 2, 4-8 и 10-15 в таблице 1. В некоторых вариантах осуществления введение композиции в виде наночастиц и химиотерапевтического средства может производиться в соответствии с любой из схем введения, как указано в рядах 2, 4-8 и 10-15 в таблице 1.
В некоторых вариантах осуществления предоставляется способ лечения запущенного рака молочной железы у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел) и альбумин, и b) эффективного количества, по меньшей мере, одного другого химиотерапевтического средства, как представлено в рядах 1-16 в таблице 1. В некоторых вариантах осуществления введение композиции в виде наночастиц и химиотерапевтического средства может производиться в соответствии с любой из схем введения, как указано в рядах 1-16 в таблице 1. В некоторых вариантах осуществления предоставляется способ лечения рака молочной железы IV стадии у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел) и альбумин, и b) эффективного количества, по меньшей мере, одного другого химиотерапевтического средства, как представлено в ряду 3 в таблице 1. В некоторых вариантах осуществления введение композиции в виде наночастиц и химиотерапевтического средства может производиться в соответствии с любой из схем введения, как указано в ряду 3 в таблице 1.
В некоторых вариантах осуществления предоставляется способ лечения рака молочной железы у индивидуума в адъювантной схеме, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел) и альбумин, и b) эффективного количества, по меньшей мере, одного другого химиотерапевтического средства, как представлено в рядах 18-24 в таблице 1. В некоторых вариантах осуществления введение композиции в виде наночастиц и химиотерапевтического средства может производиться в соответствии с любой из схем введения, как указано в рядах 18-24 в таблице 1.
В некоторых вариантах осуществления предоставляется способ лечения рака молочной железы у индивидуума в неоадъювантной схеме, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел) и альбумин, и b) эффективного количества, по меньшей мере, одного другого химиотерапевтического средства, как представлено в рядах 25-35 в таблице 1. В некоторых вариантах осуществления введение композиции в виде наночастиц и химиотерапевтического средства может производиться в соответствии с любой из схем введения, как указано в рядах 25-35 в таблице 1.
В некоторых вариантах осуществления предоставляется способ лечения рака легких у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел) и альбумин, и b) эффективного количества, по меньшей мере, одного другого химиотерапевтического средства, как представлено в рядах 36-48 в таблице 1. В некоторых вариантах осуществления введение композиции в виде наночастиц и химиотерапевтического средства может производиться в соответствии с любой из схем введения, как указано в рядах 36-48 в таблице 1.
В некоторых вариантах осуществления предоставляется способ лечения NSCLC (включая лечение первой линии запущенного NSCLC и NSCLC) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел) и альбумин, и b) эффективного количества, по меньшей мере, одного другого химиотерапевтического средства, как представлено в рядах 36-40 и 42-43 в таблице 1. В некоторых вариантах осуществления введение композиции в виде наночастиц и химиотерапевтического средства может производиться в соответствии с любой из схем введения, как указано в рядах 36-40 и 42-43 в таблице 1. В некоторых вариантах осуществления предоставляется способ лечения запущенных солидных злокачественных опухолей в легких у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел) и альбумин, и b) эффективного количества, по меньшей мере, одного другого химиотерапевтического средства, как представлено в ряду 41 в таблице 1. В некоторых вариантах осуществления введение композиции в виде наночастиц и химиотерапевтического средства может производиться в соответствии со схемами введения, как указано в ряду 41 в таблице 1. В некоторых вариантах осуществления предоставляется способ лечения SCLC у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел) и альбумин, и b) эффективного количества, по меньшей мере, одного другого химиотерапевтического средства, как представлено в ряду 48 в таблице 1. В некоторых вариантах осуществления композиция в виде наночастиц и химиотерапевтическое средство вводятся в соответствии со схемами введения, как указано в ряду 48 в таблице 1.
В некоторых вариантах осуществления предоставляется способ лечения рака яичников у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел) и альбумин, и b) эффективного количества, по меньшей мере, одного другого химиотерапевтического средства, как представлено в рядах 49-52 в таблице 1. В некоторых вариантах осуществления введение композиции в виде наночастиц и химиотерапевтического средства может производиться в соответствии с любой из схем введения, как указано в рядах 49-52 в таблице 1.
В некоторых вариантах осуществления предоставляется способ лечения рака головы и шеи у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел) и альбумин, и b) эффективного количества, по меньшей мере, одного другого химиотерапевтического средства, как представлено в рядах 53-55 в таблице 1. В некоторых вариантах осуществления введение композиции в виде наночастиц и химиотерапевтического средства может производиться в соответствии с любой из схем введения, как указано в рядах 53-53 в таблице 1.
В некоторых вариантах осуществления предоставляется способ лечения солидной опухоли (включая запущенную солидную опухоль) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел) и альбумин, и b) эффективного количества, по меньшей мере, одного другого химиотерапевтического средства, как представлено в рядах 56-59 в таблице 1. В некоторых вариантах осуществления введение композиции в виде наночастиц и химиотерапевтического средства может производиться в соответствии с любой из схем введения, как указано в рядах 56-59 в таблице 1.
В некоторых вариантах осуществления предоставляется способ лечения меланомы (включая метастатическую меланому) у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел) и альбумин, и b) эффективного количества, по меньшей мере, одного другого химиотерапевтического средства, как представлено в рядах 60-63 в таблице 1. В некоторых вариантах осуществления введение композиции в виде наночастиц и химиотерапевтического средства может производиться в соответствии с любой из схем введения, как указано в рядах 60-63 в таблице 1.
В некоторых вариантах осуществления предоставляется способ лечения метастатического рака ободочной и прямой кишки у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел) и альбумин, и b) эффективного количества, по меньшей мере, одного другого химиотерапевтического средства, как представлено в ряду 64 в таблице 1. В некоторых вариантах осуществления введение композиции в виде наночастиц и химиотерапевтического средства может производиться в соответствии с любой из схем введения, как указано в ряду 64 в таблице 1.
В некоторых вариантах осуществления предоставляется способ лечения рака поджелудочной железы у индивидуума, включающий введение индивидууму: а) эффективного количества композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел) и альбумин, и b) эффективного количества, по меньшей мере, одного другого химиотерапевтического средства, как представлено в рядах 65-66 в таблице 1. В некоторых вариантах осуществления введение композиции в виде наночастиц и химиотерапевтического средства может производиться в соответствии с любой из схем введения, как указано в рядах 65-66 в таблице 1.
дозировка
Carbo AUC=2
д 1, 8, 15, q4wk×6
Herceptin® 4 мг/кг в 1 неделю, 2 мг/кг все последующие недели
(+ Herceptin®)
Herceptin®
(± G-CSF)
Navelbine® 15 мг/м2,
L2: АВХ 90 мг/м2,
Navelbine® 20 мг/м2,
L3: АВХ 100 мг/м2,
Navelbine® 22,5 мг/м2,
L4: АВХ 110 мг/м2,
Navelbine® 25 мг/м2,
L5: АВХ 125 мг/м2,
Navelbine® 25 мг/м2,
qwk все уровни
qwk×2/3,
Xeloda® 825 мг/м2 д 1-14 q3wk
1-ой линии МВС ABX + Xeloda®
гемцитабин
гемцитабин 1000 мг/м2
qwk×2/3
лапатиниб
лапатиниб
qwk×3/4,
лапатиниб, начиная с 1000 мг/день × 2 дня
(+ Herceptin®)
q2wk×6 с последующим введением
FEC: 4 цикла (+ Herceptin® для HER2+ пациенток)
qwk д 1, 8, 15,
карбоплатин AUC=2 qwk д 1, 8, 15,
Avastin® 10 мг/м2
q2wk
ER-, PR-)
qwk + Avastin® в сравнении с АВХ 260 мг/м2
q2wk + Avastin®, в сравнении с АВХ 260 мг/м2
q3wk + Avastin®
qwk×3/4
+ Avastin®
в сравнении с
Taxol® + Avastin® qwk
гемцитабин
д 1 q3wk,
гемцитабин 1250 мг/м2
д 1, 8 q3wk
G-CSF
(+ Herceptin®)
АВХ 260 мг/м2 q2wk×4
(+ Herceptin® для HER2+ положительных пациенток)
Адъювантная схема
G-CSF
(+ Herceptin®)
Адъювантная схема
в сравнении с АС с последующим введением Taxol®
Rx длительность 16 недель
Адъювантная схема
(+ G-CSF)
G-CSF q2wk
Rx длительность 16 недель
Адъювантная схема
(+ Avastin®)
Адъювантная схема
q2wk или q3wk
Адъювантная схема
q2wk×4
Адъювантная схема
(+ Herceptin®)
эпирубицина 100 мг/м2 (без Herceptin®)
или
эпирубицин 75 мг/м2 (с Herceptin® для HER2+ пациенток),
циклофосфамид 500 мг/м2 q3wk
Неоадъювантная схема
гемцитабин +
эпирубицин
Плечо 2:
Адъювантная схема:
гемцитабин 2000 мг/м2,
АВХ 220 мг/м2
q2wk×4
Неоадъювантная схема
с последующим введением
Navelbine® + Herceptin®
Неоадъювантная схема
(+ Herceptin®)
+АС
в сравнении с
АС с последующим введением ABX + карбоплатина
в сравнении с АС с последующим введением ABX + карбоплатина + Herceptin®
Неоадъювантная схема
капецитабин
Xeloda® 850 мг/м2 д 1-14 q3wk×4
Неоадъювантная схема
карбоплатин
(+ Avastin®)
карбоплатин qwk
(+ Avastin® у HER2+ пациенток)
Неоадъювантная схема
карбоплатин +
Herceptin® +
Avastin®
карбоплатин AUC=5,
+ Herceptin®
+ Avastin®
4-недельный цикл × 6
Неоадъювантная схема
лапатиниб
лапатиниб 1000 мг/д
Неоадъювантная схема
капецитабин
Xeloda® 1000 мг/м2 д 1-14 q3wk×4
Неоадъювантная схема
Avastin® + АС
(+ G-CSF)
Avastin® с последующим введением А qwk + С 1 раз в день в сравнении с
Taxol® qwk ± Avastin®
с последующим введением А qwk + С 1 раз в день
Неоадъювантная схема
Неоадъювантная схема
карбоплатин +
Avastin®
карбоплатин AUC=6 q3wk
4 цикла
карбоплатин
L2: ABX 260 мг/м2,
L3: ABX 300 мг/м2,
Когорты 1-4: ABX q3wk,
Когорты 5-7: ABX 1 раз в неделю,
Когорта 8: 75 дополнительных пациентов,
карбоплатин фиксированно при AUC=6 q3wk
карбоплатин
в сравнении с
карбоплатином AUC=6 + Taxol®: 225 мг/м2
карбоплатин
д 1, 8, 15,
карбоплатин AUC=6 q4wk,
уточнение: ABX 125 мг/м2
д 1, 8, 15
карбоплатин +
Avastin®
карбоплатин
д 1, 8, 15 q4wk,
Плечо 2: ABX 220, 260, 300, 340 мг/м2
q3wk,
Плечо 3: ABX 100, 125, 150 мг/м2 д 1, 8,
карбоплатин AUC=6 во всех плечах
гемцитабин или
ABX +
Avastin®
гемцитабин
карбоплатин +
Avastin®
карбоплатин AUC=6 q3wk
+ Avastin®
Alimta®
пемтрексед 500 мг q3wk
карбоплатин AUC=6 q3wk
карбоплатин AUC=6
ABX q3w,
карбоплатин AUC=6, оба плеча
карбоплатином AUC=6 в обоих плечах
Avastin® 10 мг/м2 q2wk
5-фторурацил + цисплатин
5-фторурацил 750 мг/м2 CIV×5,
цисплатин 75 мг/м2 д 1 с последующей рентгено-терапией и хирургическим лечением
5-фторурацил + цисплатин
цисплатин 75 мг/м2 д 1 ± АВХ д 1 с последующей рентгено-терапией и хирургическим лечением
цетуксимаб
1-ой линии локально запущенного или метастати-ческого рака головы и шеи
рапамицин
рапамицин 5-40 мг с увеличением дозы
сатраплатин
гемцитабин
гемцитабин 1000 мг/м2 д 1 и д 8
гефитиниб, начиная с 1000 мг в день × 2
Avastin®
Avastin®
карбоплатин
сорафениб
д 2-19,
карбоплатин AUC=6 д 1
Используемое здесь обозначение (например, в таблице 1) «АВХ» относится к AbraxaneTM; ПЦ572016 относится к лапатинибу; Xel относится к капецитабину или Xeloda®; бевакцизумаб также известен как Avastin®; трастузумаб также известен как Herceptine®; пемтрексед также известен как Alimta®; цетуксимаб также известен как Erbitux®; гефитиниб также известен как Iressa®; FEC относится к комбинации 5-фторурацила, эпирубицина и циклофосфамида; АС относится к комбинации адриамицина плюс циклофосфамида; ТАС относится к одобренной FDA (Федеральной Администрацией по пищевым продуктам и лекарственным средствам) схеме адъювантной терапии рака молочной железы; RAD001 относится к производному рапамицина; NSCLC относится к немелкоклеточному раку легких; а SCLC относится к мелкоклеточному раку легких.
Используемое здесь (например, в таблице 1) обозначение AUC относится к площади под кривой; q4wk относится к дозе, вводимой 1 раз в 4 недели; q3wk относится к дозе, вводимой 1 раз в 3 недели; q2wk относится к дозе, вводимой 1 раз в 2 недели; qwk относится к дозе, вводимой 1 раз в неделю; qwk×3/4 относится к дозе, вводимой 1 раз в неделю в течение 3 недель при 4-ой неделе, свободной от введения; qwk×2/3 относится к дозе, вводимой 1 раз в неделю в течение 2 недель при 3-ей неделе, свободной от введения.
Комбинированная терапия с лучевой терапией и хирургическим лечением
В другом аспекте настоящее изобретение предоставляет способ лечения пролиферативного заболевания (такого как рак), включающий первое лечение, включающее введение таксана (в частности, наночастиц, включающих таксан) и белок-носитель, и второе лечение, включающее лучевую терапию и/или хирургическое лечение.
В некоторых вариантах осуществления способ включает: а) первое лечение, включающее введение индивидууму композиции, содержащей наночастицы, включающие эффективное количество таксана и белок-носитель (такой как альбумин), и b) второе лечение, включающее лучевую терапию, хирургическое лечение или их комбинацию. В некоторых вариантах осуществления таксан покрыт белком-носителем (таким как альбумин). В некоторых вариантах осуществления второе лечение представляет собой лучевую терапию. В некоторых вариантах осуществления второе лечение представляет собой хирургическое лечение.
В некоторых вариантах осуществления способ включает: а) первое лечение, включающее введение индивидууму композиции, содержащей наночастицы, включающие паклитаксел и альбумин, и b) второе лечение, включающее лучевую терапию, хирургическое лечение или их комбинацию. В некоторых вариантах осуществления таксан покрыт белком-носителем (таким как альбумин). В некоторых вариантах осуществления второе лечение представляет собой лучевую терапию. В некоторых вариантах осуществления второе лечение представляет собой хирургическое лечение. В некоторых вариантах осуществления наночастицы паклитаксела/альбумина имеют средний диаметр не более чем примерно 200 нм. В некоторых вариантах осуществления композиция паклитаксела/альбумина в виде наночастиц по существу не содержит (например, лишена) поверхностно-активного вещества (такого как Cremophor). В некоторых вариантах осуществления весовое отношение альбумина к паклитакселу в композиции составляет примерно 18:1 или менее, например, примерно 9:1 или менее. В некоторых вариантах осуществления паклитаксел покрыт альбумином. В некоторых вариантах осуществления наночастицы паклитаксела/альбумина имеют средний диаметр не более чем примерно 200 нм, и композиция паклитаксела/альбумина в виде наночастиц по существу не содержит (например, лишена) поверхностно-активного вещества (такого как Cremophor). В некоторых вариантах осуществления наночастицы паклитаксела/альбумина имеют средний диаметр не более чем примерно 200 нм, и паклитаксел покрыт альбумином. В некоторых вариантах осуществления композиция в виде наночастиц представляет собой AbraxaneTM.
Композицию в виде наночастиц можно вводить перед облучением и/или хирургическим лечением, после облучения и/или хирургического лечения или одновременно с облучением и/или хирургическим лечением. Например, введение композиции в виде наночастиц может предшествовать или следовать за облучением и/или хирургическим лечением с интервалами в диапазоне от минут до недель. В некоторых вариантах осуществления период времени между первым и вторым лечением таков, чтобы таксан и облучение/хирургическое лечение были еще способны оказать преимущественно комбинированный эффект на клетку. Например, таксан (такой как паклитаксел) в композиции в виде наночастиц можно вводить в любую из точек времени менее чем примерно через 1, 3, 6, 9, 12, 18, 24, 48, 60, 72, 84, 96, 108, 120 часов перед облучением и/или хирургическим лечением. В некоторых вариантах осуществления композиция в виде наночастиц вводится менее чем примерно за 9 часов до облучения и/или хирургического лечения. В некоторых вариантах осуществления композиция в виде наночастиц вводится в любую из точек времени менее чем примерно через 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 дней перед облучением и/или хирургическим лечением. В некоторых вариантах осуществления таксан (такой как паклитаксел) в композиции в виде наночастиц вводится в любую из точек времени менее чем примерно через 1, 3, 6, 9, 12, 18, 24, 48, 60, 72, 84, 96, 108, 120 часов после облучения и/или хирургического лечения. В некоторых вариантах осуществления может быть желательно значительное продление периода времени лечения, где между двумя курсами лечения проходит от нескольких дней до нескольких недель.
Предусмотренное здесь облучение включает, например, γ-лучи, рентгеновские лучи (внешний пучок) и направленную доставку радиоизотопов к опухолевым клеткам. Предусмотрены также другие формы повреждающих ДНК факторов, такие как микроволны и УФ облучение. Облучение можно подавать одной дозой или серией небольших доз по схеме фракционированной дозы. Предусмотренное здесь количество облучения находится в диапазоне от примерно 1 до примерно 100 Гр, включая, например, от примерно 5 до примерно 80, от примерно 10 до примерно 50 Гр, или примерно 10 Грэй. Общую дозу можно подавать по фракционированной схеме. Например, схема может включать фракционированные отдельные дозы по 2 Грэя. Диапазоны доз для радиоизотопов варьируются в широких пределах и зависят от периода полураспада изотопа, силы и типа испускаемого излучения.
Когда облучение включает использование радиоактивных изотопов, то изотоп может быть сопряженно связан с нацеливающим агентом, таким как терапевтическое антитело, которое несет радионуклеотид к ткани-мишени. Подходящие радиоактивные изотопы включают без ограничения астатин211, 14углерод, 51хром, 36хлор, 57железо, 58кобальт, медь67, 152Eu, галлий67, 3водород, йод123, йод131 индий111, 59ион, 32фосфор, рений186, 75селен, 35серу, технеций99m и/или иттрий90.
В некоторых вариантах осуществления облучение подается индивидууму так, чтобы обеспечить возможность снижения обычной дозы таксана (такого как паклитаксел) в композиции в виде наночастиц, требуемой для обеспечения такой же степени лечения, по меньшей мере, примерно на любую величину из 5%, 10%, 20%, 30%, 50%, 60%, 70%, 80%, 90% или более. В некоторых вариантах осуществления вводится такое количество таксана в композиции в виде наночастиц, которое достаточно для обеспечения возможности снижения обычной дозы облучения, требуемой для обеспечения такой же степени лечения, по меньшей мере, примерно на любую величину из 5%, 10%, 20%, 30%, 50%, 60%, 70%, 80%, 90% или более. В некоторых вариантах осуществления доза таксана (такого как паклитаксел) в композиции в виде наночастиц и облучения снижены по сравнению с соответствующей обычной дозой каждого из них при отдельном применении.
В некоторых вариантах осуществления комбинация введения композиции в виде наночастиц и лучевой терапии создают сверхаддитивный эффект. В некоторых вариантах осуществления таксан (такой как паклитаксел) в композиции в виде наночастиц вводится однократно в дозе 90 мг/кг, а облучение производится 5 раз при 80 Гр/д.
Описанное здесь хирургическое лечение включает резекцию, при которой вся или часть раковой ткани физически удаляется, иссекается и/или разрушается. Резекция опухоли относится к физическому удалению, по меньшей мере, части опухоли. В дополнение к резекции опухоли хирургическое лечение включает лазерную хирургию, криохирургию, электрохирургию и хирургию, контролируемую микроскопией (хирургию Mohs). Также предусмотрено удаление поверхностных, предраковых или здоровых тканей.
Лучевую терапию и/или хирургическое лечение можно проводить в дополнение к введению химиотерапевтических средств. Например, индивидууму может быть сначала введена содержащая таксан композиция в виде наночастиц и, по меньшей мере, одно другое химиотерапевтическое средство, а в последующем он может подвергаться лучевой терапии и/или хирургическому лечению. Альтернативно, индивидуума можно сначала лечить лучевой терапией и/или хирургическим лечением, за которым затем следует введение композиции в виде наночастиц и, по меньшей мере, одного другого химиотерапевтического средства. Предусмотрены также другие комбинации.
Описанное выше введение композиций в виде наночастиц в сочетании с введением химиотерапевтического средства в равной степени применимо к тем, которые вводятся в сочетании с лучевой терапией и/или хирургическим лечением.
В некоторых вариантах осуществления композиция таксана в виде наночастиц и лучевой терапии и/или химиотерапевтическое средство вводятся в сочетании с облучением в соответствии с любой из схем введения, описанных в таблице 2.
В некоторых вариантах осуществления предоставляется способ лечения NSCLC у индивидуума, включающий: а) первое лечение, включающее введение индивидууму композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел) и альбумин, и b) второе лечение, включающее облучение, как представлено в рядах 1-5 в таблице 2. В некоторых вариантах осуществления введение композиции в виде наночастиц и химиотерапевтического средства может производиться в соответствии с любой из схем введения, как указано в рядах 1-5 в таблице 2.
В некоторых вариантах осуществления предоставляется способ лечения рака головы и шеи у индивидуума, включающий: а) первое лечение, включающее введение индивидууму композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел) и альбумин, и b) второе лечение, включающее облучение, как представлено в рядах 6-9 в таблице 2. В некоторых вариантах осуществления введение композиции в виде наночастиц и химиотерапевтического средства может производиться в соответствии с любой из схем введения, как указано в рядах 6-9 в таблице 2.
В некоторых вариантах осуществления предоставляется способ лечения рака поджелудочной железы у индивидуума, включающий: а) первое лечение, включающее введение индивидууму композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел) и альбумин, и b) второе лечение, включающее облучение, как представлено в ряду 10 в таблице 2. В некоторых вариантах осуществления введение композиции в виде наночастиц и химиотерапевтического средства может производиться в соответствии с любой из схем введения, как указано в ряду 10 в таблице 2.
В некоторых вариантах осуществления предоставляется способ лечения злокачественных поражений желудка у индивидуума, включающий: а) первое лечение, включающее введение индивидууму композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел) и альбумин, и b) второе лечение, включающее облучение, как представлено в ряду 11 в таблице 2. В некоторых вариантах осуществления введение композиции в виде наночастиц и химиотерапевтического средства может производиться в соответствии с любой из схем введения, как указано в ряду 11 в таблице 2.
карбоплатин +
облучение
карбоплатин +
облучение
карбоплатин +
облучение
карбоплатин +
облучение
облучение c последующим введением АВХ q3wk + карбоплатина
цетуксимаб + облучение
карбоплатин +
5-фторурацил + гидроксимочевина + облучение
карбоплатин AUC=2
с последующим введением
одновременного химиолучевого лечения
ABX 100 мг/м2,
5-фторурацил 600 мг/м2,
гидроксимочевина 5000 мг 2 раза в день
карбоплатин + Erbitux® + облучение
Erbitux® 400 мг/м2 д 7, 250 мг/м2 qwk×7,
карбоплатин AUC=1,5 qwk×7
IMRT
гемцитабин +
облучение
цисплатин +
облучение
В некоторых вариантах осуществления изобретение предоставляет фармацевтические композиции, содержащие наночастицы, включающие таксан (такой как паклитаксел) и белок-носитель (такой как альбумин), для применения при лечении пролиферативного заболевания (такого как рак), где указанное применение включает второе лечение, включающее лучевую терапию, хирургическое лечение или их комбинации.
Метрономная терапия
Изобретение также предоставляет схему метрономной терапии. Предоставляется способ введения индивидууму композиции, содержащей наночастицы, включающие таксан (такой как паклитаксел, доцетаксел или ортатаксел) и белок-носитель (такой как альбумин), на основе схемы метрономного введения. Эти способы применимы к способам лечения, задерживающим развитие, или к другим клиническим схемам и конфигурациям, описанным здесь. Например, в некоторых вариантах осуществления, способы можно применять для лечения пролиферативных заболеваний (таких как рак).
Используемый здесь термин «схема метрономного введения» относится к частому введению таксана без длительных перерывов в дозе ниже установленной максимальной переносимой дозы посредством традиционной схемы с перерывами (также далее именуемой здесь «стандартной схемой MTD» или «стандартным курсом MTD»). При метрономном введении в течение определенного периода времени в конечном счете вводится такая же, более низкая или более высокая, кумулятивная доза, которая была бы введена посредством стандартной схемы MTD. В некоторых случаях это достигается расширением временной рамки и/или частоты проведения курса введения, в то же время уменьшая количество, вводимое с каждой дозой. В целом, таксан, вводимый посредством схемы метрономного введения по настоящему изобретению, лучше переносится индивидуумом. Метрономное введение можно также именовать поддерживающим введением или хроническим введением.
В некоторых вариантах осуществления предоставляется способ введения композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин), где композиция в виде наночастиц вводится в течение периода, по меньшей мере, 1 месяц, где интервал между каждым введением составляет не более чем примерно 1 неделю, и где доза таксана при каждом введении составляет примерно от 0,25% до примерно 25% максимальной переносимой дозы при соблюдении традиционной схемы введения. В некоторых вариантах осуществления предоставляется способ введения композиции, содержащей наночастицы, включающие паклитаксел и альбумин, где композиция в виде наночастиц вводится в течение периода, по меньшей мере, 1 месяц, где интервал между каждым введением составляет не более чем примерно 1 неделю, и где доза таксана при каждом введении составляет примерно от 0,25% до примерно 25% максимальной переносимой дозы при соблюдении традиционной схемы введения.
В некоторых вариантах осуществления дозировка таксана (такого как паклитаксел) в композиции в виде наночастиц на введение составляет менее чем примерно любая из долей 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 18%, 20%, 22%, 24% или 25% MTD для того же таксана (такого как паклитаксел), в той же препаративной форме при соблюдении данной традиционной схемы введения. Традиционная схема введения относится к схеме введения, которая в целом установлена в клиническом учреждении. Например, традиционная схема введения для AbraxaneTM представляет собой трехнедельную схему, т.е. введение композиции 1 раз в 3 недели.
В некоторых вариантах осуществления введение таксана (такого как паклитаксел) составляет от примерно 0,25% до примерно 25% соответствующей величины MTD, включая, например, любую долю от примерно 0,25% до примерно 20%, от примерно 0,25% до примерно 15%, от примерно 0,25% до примерно 10%, от примерно 0,25% до примерно 20%, и от примерно 0,25% до примерно 25% соответствующей величины MTD. Величина MTD для таксана при соблюдении традиционной схемы введения известна, или ее может легко определить специалист в данной области. Например, величина MTD при введении AbraxaneTM в соответствии с традиционной трехнедельной схемой введения составляет примерно 300 мг/м2.
В некоторых вариантах осуществления предоставляется способ введения композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин), где композиция в виде наночастиц вводится в течение периода, по меньшей мере, 1 месяц, где интервал между каждым введением составляет не более чем примерно 1 неделя, и где доза таксана при каждом введении составляет примерно от 0,25 мг/м2 до примерно 25 мг/м2. В некоторых вариантах осуществления предоставляется способ введения композиции, содержащей наночастицы, включающие паклитаксел и альбумин, где композиция в виде наночастиц вводится в течение периода, по меньшей мере, 1 месяц, где интервал между каждым введением составляет не более чем примерно 1 неделю, и где доза таксана при каждом введении составляет примерно от 0,25 мг/м2 до примерно 25 мг/м2.
В некоторых вариантах осуществления доза таксана (такого как паклитаксел) при каждом введении составляет менее чем примерно любая из доз 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 18, 20, 22, 25 или 30 мг/м2. Например, доза таксана (такого как паклитаксел) может находиться в диапазоне от примерно 0,25 мг/м2 до примерно 30 мг/м2, от примерно 0,25 мг/м2 до примерно 25 мг/м2, от примерно 0,25 мг/м2 до примерно 15 мг/м2, от примерно 0,25 мг/м2 до примерно 10 мг/м2, от примерно 0,25 мг/м2 до примерно 5 мг/м2.
Частота введения таксана (такого как паклитаксел) в композиции в виде наночастиц включает без ограничения любую частоту из, по меньшей мере, 1 раза в неделю, 2 раз в неделю, 3 раз в неделю, 4 раз в неделю, 5 раз в неделю или 1 раза в день. Обычно, интервал между каждым введением составляет менее чем примерно 1 неделю, например, менее чем примерно любой из периодов 6, 5, 4, 3, 2 или 1 день. В некоторых вариантах осуществления интервал между каждым введением является постоянным. Например, введение можно проводить 1 раз в день, 2 раза в день, 3 раза в день, 4 раза в день, 5 раз в день или 1 раз в неделю. В некоторых вариантах осуществления введение можно проводить 2 раза в день, 3 раза в день или чаще.
Описанные здесь схемы метрономного введения могут продолжаться в течение продолжительного периода времени, например, от примерно 1 месяца до примерно трех лет. Например, схема введения может продолжаться в течение периода примерно 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 18, 24, 30 и 36 месяцев. В целом в схеме введения нет перерывов.
Кумулятивная доза таксана (такого как паклитаксел), введенная по метрономной схеме, может быть выше, чем доза таксана, введенная в соответствии со стандартной схемой введения MTD в течение такого же периода времени. В некоторых вариантах осуществления кумулятивная доза таксана, введенная по метрономной схеме, равна или ниже дозы таксана, введенной в соответствии со стандартной схемой введения MTD в течение такого же периода времени.
Понятно, что изложенные здесь положения представлены только в качестве примеров, и что схему метрономного введения можно составить обычным способом в соответствии с предоставленными здесь положениями и на основании индивидуальной стандартной схемы MTD, и что схема метрономного введения, использованная в этих экспериментах, просто служит в качестве одного примера возможных изменений интервала и длительности введения, которые внесены в стандартную схему MTD, для достижения оптимальной схемы метрономного введения.
Описанную здесь схему метрономного введения можно применять отдельно в виде лечения пролиферативного заболевания, или проводить в контексте комбинированной терапии, такой как описанные здесь способы комбинированной терапии. В некоторых вариантах осуществления схему введения метрономной терапии можно применять в комбинации или в сочетании с другими назначенными способами лечения посредством стандартных схем MTD. Под термином «в комбинации или в сочетании» подразумевается, что метрономная схема введения по настоящему изобретению проводится или в то же самое время, что и стандартная схема MTD принятых способов лечения, или между курсами индукционной терапии для продления благоприятного эффекта, достигнутого у индивидуума индукционной терапией, с намерением продолжить ингибирование роста опухоли без нежелательного нанесения вреда здоровью индивидуума или способности индивидуума выдержать следующий курс индукционной терапии. Например, схема метрономной терапии может быть принята после первоначального, короткого курса химиотерапии MTD. Композиции в виде наночастиц, вводимые на основе описанной здесь метрономной схемы введения, можно также вводить индивидууму (такому как человек) различными путями, например, парентерально, включая внутривенное, внутриартериальное, внутрилегочное, пероральное, ингаляционное, внутрипузырное, внутримышечное, интратрахеальное, подкожное, внутриглазное, подоболочечное или трансдермальное введение. Например, композицию в виде наночастиц можно ввести ингаляцией для лечения заболеваний дыхательных путей. Композицию можно применять для лечения респираторных заболеваний, таких как пневмосклероз, облитерирующий бронхиолит, рак легких, бронхоальвеолярная карцинома и им подобные. В некоторых вариантах осуществления композиция в виде наночастиц вводится перорально.
Ниже представлены некоторые различные иллюстративные варианты осуществления.
В некоторых вариантах осуществления предоставляется способ введения композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин), где композиция в виде наночастиц вводится в течение периода, по меньшей мере, 1 месяц, где интервал между каждым введением составляет не более чем примерно 1 неделю, и где доза таксана при каждом введении составляет от примерно 0,25% до примерно 25% максимальной переносимой дозы при соблюдении традиционной схемы введения. В некоторых вариантах осуществления таксан покрыт белком-носителем (таким как альбумин). В некоторых вариантах осуществления доза таксана на введение составляет менее чем любая из долей 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 18%, 20%, 22%, 24% или 25% его максимальной переносимой дозы. В некоторых вариантах осуществления таксан вводится, по меньшей мере, с любой частотой из 1, 2, 3, 4, 5, 6, 7 (т.е. ежедневно) раз в неделю. В некоторых вариантах осуществления интервалы между каждым введением составляют менее чем любой из интервалов 7 дней, 6 дней, 5 дней, 4 дня, 3 дня, 2 дня и 1 день. В некоторых вариантах осуществления таксан вводится в течение периода, составляющего, по меньшей мере, любой из сроков 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 18, 24, 30 и 36 месяцев.
В некоторых вариантах осуществления предоставляется способ введения композиции, содержащей наночастицы, включающие паклитаксел и альбумин, где интервал между каждым введением составляет не более чем примерно 1 неделю, и где доза таксана при каждом введении составляет от примерно 0,25% до примерно 25% его максимальной переносимой дозы при соблюдении традиционной схемы введения. В некоторых вариантах осуществления наночастицы паклитаксела/альбумина имеют средний диаметр не более чем примерно 200 нм. В некоторых вариантах осуществления композиция паклитаксела/альбумина в виде наночастиц по существу не содержит (например, не содержит) поверхностно-активный агент (такой как Cremophor). В некоторых вариантах осуществления массовое отношение альбумина к паклитакселу в композиции составляет примерно 18:1 или менее, например, примерно 9:1 или менее. В некоторых вариантах осуществления паклитаксел покрыт альбумином. В некоторых вариантах осуществления наночастицы паклитаксела/альбумина имеют средний диаметр не более чем примерно 200 нм, и композиция паклитаксела/альбумина по существу не содержит (например, не содержит) поверхностно-активное вещество (такое как Cremophor). В некоторых вариантах осуществления наночастицы паклитаксела/альбумина имеют средний диаметр не более чем примерно 200 нм, и паклитаксел покрыт альбумином. В некоторых вариантах осуществления композиция в виде наночастиц представляет собой AbraxaneTM.
В некоторых вариантах осуществления предоставляется способ введения композиции, содержащей наночастицы, включающие таксан и белок-носитель (такой как альбумин), где композиция в виде наночастиц вводится в течение периода, по меньшей мере, 1 месяц, где интервал между каждым введением составляет не более чем примерно 1 неделя, и где доза таксана при каждом введении составляет от примерно 0,25 мг/м2 до примерно 25 мг/м2. В некоторых вариантах осуществления таксан покрыт белком-носителем (таким как альбумин). В некоторых вариантах осуществления доза таксана на введение составляет менее чем любая из доз 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 18, 20, 22 и 25 мг/м2. В некоторых вариантах осуществления таксан вводится, по меньшей мере, с любой частотой из 1, 2, 3, 4, 5, 6, 7 (т.е. ежедневно) раз в неделю. В некоторых вариантах осуществления интервалы между каждым введением составляют менее чем любой из интервалов 7 дней, 6 дней, 5 дней, 4 дня, 3 дня, 2 дня и 1 день. В некоторых вариантах осуществления таксан вводится в течение периода, составляющего, по меньшей мере, любой из сроков 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 18, 24, 30 и 36 месяцев.
В некоторых вариантах осуществления предоставляется способ введения композиции, содержащей наночастицы, включающие паклитаксел и альбумин, где композиция в виде наночастиц вводится в течение периода, по меньшей мере, 1 месяц, где интервал между каждым введением составляет не более чем примерно 1 неделя, и где доза таксана при каждом введении составляет от примерно 0,25 мг/м2 до примерно 25 мг/м2. В некоторых вариантах осуществления наночастицы паклитаксела/альбумина имеют средний диаметр не более чем примерно 200 нм. В некоторых вариантах осуществления композиция паклитаксела/альбумина в виде наночастиц по существу не содержит (например, не содержит) поверхностно-активный агент (такой как Cremophor). В некоторых вариантах осуществления массовое отношение альбумина к паклитакселу в композиции составляет примерно 18:1 или менее, например, примерно 9:1 или менее. В некоторых вариантах осуществления паклитаксел покрыт альбумином. В некоторых вариантах осуществления наночастицы паклитаксела/альбумина имеют средний диаметр не более чем примерно 200 нм, и композиция паклитаксела/альбумина по существу не содержит (например, не содержит) поверхностно-активный агент (такой как Cremophor). В некоторых вариантах осуществления наночастицы паклитаксела/альбумина имеют средний диаметр не более чем примерно 200 нм, и паклитаксел покрыт альбумином. В некоторых вариантах осуществления композиция в виде наночастиц представляет собой AbraxaneTM.
В некоторых вариантах осуществления AbraxaneTM (или другие композиции паклитаксела/альбумина в виде наночастиц) вводится в дозе от примерно 3 мг/кг до примерно 10 мг/кг в день. В некоторых вариантах осуществления AbraxaneTM вводится в дозе от примерно 6 мг/кг до примерно 10 мг/кг в день. В некоторых вариантах осуществления AbraxaneTM вводится в дозе от примерно 6 мг/кг в день. В некоторых вариантах осуществления AbraxaneTM вводится в дозе от примерно 3 мг/кг в день.
Изобретение также предоставляет композиции для применения в описанных здесь метрономных схемах. В некоторых вариантах осуществления предоставляется композиция, содержащая наночастицы, включающие таксан и белок-носитель (такой как альбумин), где указанная композиция вводится индивидууму посредством метрономной схемы введения, такой как схема введения, описанная здесь.
Другие аспекты изобретения
В других аспектах предоставляются способы лечения пролиферативных заболеваний, включающие введение композиции, содержащей наночастицы, включающие таксан (включая паклитаксел, доцетаксел или ортатаксел) и белок-носитель (такой как альбумин). В некоторых вариантах осуществления предоставляется способ лечения рака, включающий введение композиции, содержащей наночастицы, включающие ортатаксел и белок-носитель (такой как альбумин).
В некоторых вариантах осуществления предоставляются способы лечения пролиферативных заболеваний, включающие введение композиции, содержащей наночастицы, включающие тиоколхицин или его производные (такие как димерный тиоколхицин) и белок-носитель (такой как альбумин). В некоторых вариантах осуществления предоставляется способ лечения рака, включающий введение композиции, содержащей наночастицы, включающие димерный тиоколхицин и белок-носитель (такой как альбумин). В некоторых вариантах осуществления композиция в виде наночастиц представляет собой любую из (а в некоторых вариантах осуществления выбрана из группы, состоящей из) Nab-5404, Nab-5800 и Nab-5801.
В некоторых вариантах осуществления предоставляется способ лечения рака, включающий введение композиции, содержащей наночастицы, включающие паклитаксел, где композиция в виде наночастиц вводится в соответствии с любой из схем введения, описанных в таблице 3. В некоторых вариантах осуществления рак представляет собой устойчивый к таксану метастатический рак молочной железы.
дозировка
Плечо 2: АВХ 260 мг/м2 q2wk,
Плечо 3: АВХ 260 мг/м2 q3wk
в сравнении с
таксолом 175 мг/м2 q3wk
Плечо 3: таксол 1 раз в неделю
Плечо 2: АВХ qwk
Дозы TBD
в сравнении с
АВХ 260 мг/м2 q3wk
АВХ 150 мг/м2 (ранее не получавшие лечение) qwk×3/4
(ABI-007)
гические злокачественные поражения
Композиции в виде наночастиц
Описанные здесь композиции в виде наночастиц содержат наночастицы, включающие (в различных вариантах осуществления по существу состоящие из) таксан (такой как паклитаксел) и белок-носитель (такой как альбумин). Наночастицы плохо растворимых в воде лекарственных препаратов (таких как таксан) были описаны, например, в патентах США №№ 5916596; 6506405 и 6537579, а также в патентной публикации США № 2005/0004002A1. Хотя представленное ниже описание относится к таксану, понятно, что то же относится к другим лекарственным препаратам, таким как рапамицин, 17-AAG и димерный тиоколхицин.
В некоторых вариантах осуществления композиция включает наночастицы с усредненным или средним диаметром не более чем примерно 1000 нанометров (нм), например, не больше, чем примерно любая величина из 900, 800, 700, 600, 500, 400, 300, 200 и 100 нм. В некоторых вариантах осуществления усредненный или средний диаметр наночастиц составляет не более чем примерно 200 нм. В некоторых вариантах осуществления усредненный или средний диаметр наночастиц составляет не более чем примерно 150 нм. В некоторых вариантах осуществления усредненный или средний диаметр наночастиц составляет не более чем примерно 100 нм. В некоторых вариантах осуществления усредненный или средний диаметр наночастиц составляет от примерно 20 до примерно 400 нм. В некоторых вариантах осуществления усредненный или средний диаметр наночастиц составляет от примерно 40 до примерно 200 нм. В некоторых вариантах осуществления наночастицы могут стерилизоваться фильтрацией.
Описанные здесь наночастицы могут присутствовать в сухой препаративной форме (такой как лиофилизированная композиция) или могут быть суспендированы в биологически совместимой среде. Подходящие биологически совместимые среды включают без ограничения воду, забуференные водные среды, солевой раствор, забуференный солевой раствор, необязательно, забуференные растворы аминокислот, необязательно, забуференные растворы белков, необязательно, забуференные растворы сахаров, необязательно, забуференные растворы витаминов, необязательно, забуференные растворы синтетических полимеров, содержащие липиды, и им подобные.
Термин «белки» относится к полипептидам или полимерам аминокислот любой длины (включая полную длину или фрагменты), которые могут быть линейными или разветвленными, включать модифицированные аминокислоты и/или быть прерванными не аминокислотами. Этот термин также охватывает аминокислотный полимер, который был модифицирован или естественно, или вмешательством, например, образованием дисульфидной мостиковой связи, гликозилированием, липидированием, ацетилированием, фосфорилированием или любой другой манипуляцией или модификацией. В этот термин также включены, например, полипептиды, содержащие один или более аналогов аминокислоты (включая, например, неестественные аминокислоты, и т.д.), а также другие модификации, известные в данной области. Описанные здесь белки могут быть естественно встречающимися, т.е. полученными или происходящими из натурального источника (такого как кровь), или синтезированными (например, химически синтезированными или синтезированными методиками рекомбинантной ДНК).
Примеры подходящих белков-носителей включают белки, обычно обнаруживаемые в крови или плазме, которые включают без ограничения альбумин, иммуноглобулин, включая IgA, липопротеины, аполипопротеин В, альфа-кислый гликопротеин, бета-2-макроглобулин, тироглобулин, трансферин, фибронектин, фактор VII, фактор VIII, фактор IX, фактор X и им подобные. В некоторых вариантах осуществления белок-носитель представляет собой не кровяной белок, такой как казеин, α-лактальбумин и β-лактоглобулин. Белки-носители могут быть или натуральными по происхождению или полученными синтетически. В некоторых вариантах осуществления фармацевтически приемлемый носитель включает альбумин, такой как человеческий сывороточный альбумин. Человеческий сывороточный альбумин (HSA) представляет собой высоко растворимый глобулярный белок с Mr 65K и состоит из 585 аминокислот. HSA представляет собой самый изобильный белок в плазме, и он определяет 70-80% коллоидного осмотического давления человеческой плазмы. Аминокислотная последовательность HSA содержит всего 17 дисульфидных мостиковых связей, один свободный тиол (Cys 34) и один триптофан (Trp 214). Внутривенное применение раствора HSA было показано для профилактики и лечения гиповолюмического шока (см., например, Tullis, JAMA, 237, 355-360, 460-463, (1977) и Houser et al., Surgery, Gynecology and Obstetrics, 150, 811-816 (1980)) и в сочетании с обменным переливанием крови при лечении гипербилирубинемии новорожденных (см., например, Finlayson, Seminars in Thrombosis and Hemostasis, 6, 85-120, (1980)). Предусмотрены другие альбумины, такие как бычий сывороточный альбумин. Применение таких не человеческих альбуминов может быть целесообразным, например, в контексте применения этих композиций у млекопитающих, отличных от человека, например, в ветеринарии (включая домашних и сельскохозяйственных животных).
Человеческий сывороточный альбумин (HSA) имеет множественные гидрофобные участки связывания (всего 8 для жирных кислот, эндогенного лиганда HSA) и связывает разнообразный набор таксанов, особенно нейтральных и отрицательно заряженных гидрофобных соединений (Goodman et al., The Pharmacological Basis of Therapeutics, 9th ed, McGraw-Hill New York (1996)). 2 высоко аффинных сайта связывания были предложены в субдоменах IIA и IIIA HSA, которые представляют собой высоко удлиненные гидрофобные карманы с заряженными остатками лизина и аргинина около поверхности, которые функционируют в качестве точек прикрепления для полярных лигандных признаков. (См., например, Fehske et al., Biochem. Pharmcol, 30, 687-92 (198a), Vorum, Dan. Med. Bull, 46, 379-99 (1999), Kragh-Hansen, Dan. Med. Bull, 1441, 131-40 (1990), Curry et al., Nat. Struct. Biol, 5, 827-35 (1998), Sugio et al, Protein. Eng., 12, 439-46 (1999), He et al., Nature, 358, 209-15 (1996) и Carter et al., Adv. Protein. Chem., 45, 153-203 (1994)). Было показано, что паклитаксел и пропофол связывают HSA (см., например, Paal et al., Eur. J. Biochem., 268(7), 2187-91 (2000), Purcell et al., Biochim. Biophys. Acta, 1478(a), 61-8 (2000), Altmayer et al., Arzneimittelforschung, 45, 1053-6 (1995) и Garrido et al., Rev. Esp. Anestestiol. Reanim., 41, 308-12 (1994)). Дополнительно показано, что доцетоксел связывается с человеческими плазма протеинами (см., например, Urien et al., Invest. New Drugs, 14(b), 147-51 (1996)).
Белок-носитель (такой как альбумин) в композиции в целом служит в качестве носителя для таксана, т.е. белок-носитель в композиции делает таксан легче суспендируемым в водной среде или помогает поддерживать суспензию, по сравнению с композициями, не включающими белок-носитель. Это может позволить избежать применения токсичных растворителей (или поверхностно-активных веществ) для солюбилизации таксана и, посредством этого, может уменьшить один или более побочных эффектов введения таксана индивидууму (такому как человек). Таким образом, в некоторых вариантах осуществления, описанная здесь композиция по существу не содержит (например, не содержит) поверхностно-активных веществ, таких как Cremophor (включая Cremophor EL® (BASF)). В некоторых вариантах осуществления композиция в виде наночастиц по существу не содержит (например, не содержит) поверхностно-активных веществ. Композиция «по существу не содержит» или «по существу не содержит поверхностно-активное вещество Cremophor», если количество Cremophor или поверхностно-активного вещества в композиции недостаточно для того, чтобы вызвать один или более побочных эффектов у индивидуума, когда композиция в виде наночастиц вводится индивидууму.
Количество белка-носителя в описанной здесь композиции будет варьироваться в зависимости от других компонентов композиции. В некоторых вариантах осуществления композиция включает белок-носитель в количестве, которое достаточно для стабилизации таксана в водной суспензии, например, в форме устойчивой коллоидной суспензии (такой как устойчивая суспензия наночастиц). В некоторых вариантах осуществления белок-носитель содержится в количестве, которое снижает скорость осаждения таксана в водной среде. Для композиций, содержащих частицы, количество белка-носителя также зависит от размера и плотности наночастиц таксана.
Таксан «стабилизирован» в водной суспензии, если он остается суспендированным в водной среде (например, без видимой преципитации или осаждения) в течение продолжительного периода времени, такого как, по меньшей мере, любого из периодов примерно 0,1, 0,2, 0,25, 0,5, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 24, 36, 48, 60 или 72 часа. Суспензия в целом, но необязательно, подходит для введения индивидууму (такому как человек). Растворимость суспензии в целом (но необязательно) оценивается при температуре хранения (такой как комнатная температура (например, 20-25ºС) или в условиях охлаждения (например, 4ºС)). Например, суспензия устойчива при температуре хранения, если она не проявляет флоккуляции или агломерации частиц, видимой невооруженным глазом, или при осмотре под оптическим микроскопом при увеличении в 1000 раз, примерно через 15 мин после приготовления суспензии. Устойчивость можно также оценить в условиях ускоренного тестирования, например, при температуре, которая выше, чем примерно 40ºС.
В некоторых вариантах осуществления белок-носитель присутствует в количестве, которое достаточно для стабилизации таксана в водной суспензии в определенной концентрации. Например, концентрация таксана в композиции составляет от примерно 0,1 до примерно 100 мг/мл, включая, например, любую концентрацию из от примерно 0,1 до примерно 50 мг/мл, от примерно 0,1 до примерно 20 мг/мл, от примерно 1 до примерно 10 мг/мл, от примерно 2 до примерно 8 мг/мл, от примерно 4 до примерно 6 мг/мл, примерно 5 мг/мл. В некоторых вариантах осуществления концентрация таксана составляет, по меньшей мере, любую из величин 1,3 мг/мл, 1,5 мг/мл, 2 мг/мл, 3 мг/мл, 4 мг/мл, 5 мг/мл, 6 мг/мл, 7 мг/мл, 8 мг/мл, 9 мг/мл, 10 мг/мл, 15 мг/мл, 20 мг/мл, 25 мг/мл, 30 мг/мл, 40 мг/мл и 50 мг/мл. В некоторых вариантах осуществления белок-носитель присутствует в количестве, которое позволяет избегать использования поверхностно-активных веществ (таких как Cremophor), так что композиция не содержит или по существу не содержит поверхностно-активное вещество (такое как Cremophor).
В некоторых вариантах осуществления композиция, в жидкой форме, включает от примерно 0,1% до примерно 50% (масс./об.) (например, примерно 0,5% (масс./об.), примерно 5% (масс./об.), примерно 10% (масс./об.), примерно 15% (масс./об.), примерно 20% (масс./об.), примерно 30% (масс./об.), примерно 40% (масс./об.) или примерно 50% (масс./об.)) белка-носителя. В некоторых вариантах осуществления композиция, в жидкой форме, включает от примерно 0,5% до примерно 5% (масс./об.) белка-носителя.
В некоторых вариантах осуществления массовое отношение белка-носителя, например, альбумина, к таксану в композиции в виде наночастиц таково, что достаточное количество таксана связывается с клеткой или транспортируется ею. Хотя массовое отношение белка-носителя к таксану нужно будет оптимизировать для различных комбинаций белка-носителя и таксана, в целом массовое отношение белка-носителя, например, альбумина, к таксану (масс./масс.) составляет от примерно 0,01:1 до примерно 100:1, от примерно 0,02:1 до примерно 50:1, от примерно 0,05:1 до примерно 20:1, от примерно 0,1:1 до примерно 20:1, от примерно 1:1 до примерно 18:1, от примерно 2:1 до примерно 15:1, от примерно 3:1 до примерно 12:1, от примерно 4:1 до примерно 10:1, от примерно 5:1 до примерно 9:1, или примерно 9:1. В некоторых вариантах осуществления массовое отношение белка-носителя к таксану составляет примерно любую величину из 18:1 или менее, 15:1 или менее, 14:1 или менее, 13:1 или менее, 12:1 или менее, 11:1 или менее, 10:1 или менее, 9:1 или менее, 8:1 или менее, 7:1 или менее, 6:1 или менее, 5:1 или менее, 4:1 или менее и 3:1 или менее.
В некоторых вариантах осуществления белок-носитель позволяет вводить композицию индивидууму (такому как человек) без значительных побочных эффектов. В некоторых вариантах осуществления белок-носитель (такой как альбумин) содержится в количестве, которое эффективно для снижения одного или более побочных эффектов введения таксана человеку. Термин «снижение одного или более побочных эффектов введения таксана» относится к уменьшению, облегчению или устранению одного или более нежелательных эффектов, вызванных таксаном, а также побочных эффектов, вызванных носителями доставки (такими как растворители, которые делают таксаны подходящими для инъекции), используемыми для доставки таксана. Такие побочные эффекты включают, например, миелосуппрессию, нейротоксичность, гиперчувствительность, воспаление, раздражение вен, флебит, боль, раздражение кожи, периферическую нейропатию, нейтропеническую лихорадку, анафилактическую реакцию, венозный тромбоз, экстравазацию, и их комбинации. Однако эти побочные эффекты являются просто иллюстративными, и можно уменьшить другие побочные эффекты или комбинацию побочных эффектов, связанных с таксаном.
В некоторых вариантах осуществления композиция включает AbraxaneTM. AbraxaneTM представляет собой препаративную форму паклитаксела, стабилизированного человеческим альбумином по USP (Фармакопее США), который можно диспергировать в непосредственно инъецируемом физиологическом растворе. При дисперсии в подходящей водной среде, такой как 0,9% хлорид натрия для инъекций или 5% декстроза для инъекций, AbraxaneTM образует устойчивую коллоидную суспензию паклитаксела. Средний размер наночастиц в коллоидной суспензии составляет примерно 130 нм. Поскольку HSA свободно растворим в воде, AbraxaneTM можно растворять в широком диапазоне концентраций - от разведенного (0,1 мг/мл паклитаксела) до концентрированного (20 мг/мл паклитаксела), включая, например, от примерно 2 мг/мл до примерно 8 мг/мл, примерно 5 мг/мл.
Способы изготовления композиций в виде наночастиц известны в данной области. Например, наночастицы, содержащие таксаны (такие как паклитаксел) и белок-носитель (такой как альбумин) можно получить в условиях действия сил высокого сдвига (например, обработкой ультразвуком, гомогенизацией высоким давлением или им подобных). Эти способы описаны, например, в патентах США №№ 5916596; 6506405 и 6537579, а также в патентной публикации США № 2005/0004002A1.
Вкратце, таксан (такой как доцетаксел) растворяют в органическом растворителе, и растворитель можно добавить к раствору человеческого сывороточного альбумина. Смесь подвергают гомогенизации высоким давлением. Затем органический растворитель можно удалить выпариванием. Полученную дисперсию можно далее лиофилизировать. Подходящие органические растворители включают, например, кетоны, сложные эфиры, простые эфиры, хлорированные растворители и другие растворители, известные в данной области. Например, органический растворитель может представлять собой метиленхлорид и хлороформ/этанол (например, при соотношении 1:9, 1:8, 1:7, 1:6, 1:5, 1:4, 1:3, 1:2, 1:1, 2:1, 3:1, 4:1, 5:1, 6:1, 7:1, 8:1 или 9:1).
Другие компоненты в композициях в виде наночастиц
Описанные здесь наночастицы могут присутствовать в композиции, которая включает другие агенты, эксципиенты или стабилизаторы. Например, для увеличения устойчивости увеличением отрицательного зета потенциала наночастиц можно добавить определенные отрицательно заряженные компоненты. Такие отрицательно заряженные компоненты включают без ограничения желчные соли, состоящие из гликохолевой кислоты, холевой кислоты, хенодеоксихолевой кислоты, таурохолевой кислоты, гликохенодеоксихолевой кислоты, таурохенодеоксихолевой кислоты, литохолевой кислоты, урсодеоксихолевой кислоты, дигидрохолевой кислоты и других; фосфолипиды, включая лецитин (яичный желток), на основе фосфолипидов, которые включают следующие фосфатидилхолины: пальмитоилолеоилфосфатидилхолин, пальмитоиллинолеоилфосфатидилхолин, стеароиллинолеоилфосфатидилхолин, стеароилолеоилфосфатидилхолин, стеароиларахидоилфосфатидилхолин и дипальмитоилфосфатидилхолин. Другие фосфолипиды, включая L-α-димиристоилфосфатидилхолин (DMPC), диолеоилфосфатидилхолин (DOPC), дистеариолфосфатидилхолин (DSPC), гидрированный соевый фосфатидилхолин (HSPC) и другие родственные соединения. Отрицательно заряженные поверхностно-активные вещества или эмульгаторы также подходят в качестве добавок, например, холестерилсульфат натрия и ему подобные.
В некоторых вариантах осуществления композиция подходит для введения человеку. В некоторых вариантах осуществления композиция подходит для введения млекопитающему, например, в ветеринарии, домашним и сельскохозяйственным животным. Имеется широкое разнообразие подходящих препаративных форм композиции в виде наночастиц (см., например, патенты США №№ 5916596 и 6096331). Следующие препаративные формы и способы являются просто иллюстративными и ни в коей мере не ограничивающими. Препаративные формы, подходящие для перорального введения могут состоять из (а) жидких растворов, таких как эффективное количество соединения, растворенного в разбавителях, таких как вода, солевой раствор или апельсиновый сок, (b) капсул, саше или таблеток, каждая из которых содержит заданное количество активного ингредиента в виде твердых веществ или гранул, (с) суспензий в соответствующей жидкости и (d) подходящих эмульсий. Таблетированные формы могут включать одно или более из следующих веществ: лактозы, маннита, кукурузного крахмала, картофельного крахмала, микрокристаллической целлюлозы, акации, желатина, коллоидного диоксида кремния, кроскармеллозы натрия, талька, стеарата магния, стеариновой кислоты и других эксципиентов, красителей, разбавителей, забуферивающих агентов, смачивающих агентов, консервантов, ароматизирующих агентов и фармакологически совместимых эксципиентов. Формы в виде лепешек могут включать активный ингредиент в ароматической добавке, обычно сахарозе и акации или трагаканте, а также формы в виде пастилок могут включать активный ингредиент в инертной основе, такой как желатин и глицерин, или сахароза и акация, эмульсии, гели и им подобные, содержащие в дополнение к активному ингредиенту такие эксципиенты, которые известны в данной области.
Примеры подходящих носителей, эксципиентов и разбавителей включают без ограничения лактозу, декстрозу, сахарозу, сорбит, маннит, крахмалы, смолу акации, фосфат кальция, альгинаты, трагакант, желатин, силикат кальция, микрокристаллическую целлюлозу, поливинилпирролидон, целлюлозу, воду, солевой раствор, сироп, метилцеллюлозу, метил- и пропилгидроксибензоаты, тальк, стерата магния и минеральное масло. Препаративные формы могут, кроме того, включать смазывающие агенты, смачивающие агенты, эмульгирующие и суспендирующие агенты, консервирующие агенты, подслащивающие агенты или ароматизирующие агенты.
Препаративные формы, подходящие для парентерального введения, включают водные и неводные, изотонические стерильные инъекционные растворы, которые могут содержать антиоксиданты, буферы, бактериостатические средства и растворимые вещества, которые делают препаративную форму совместимой с кровью предполагаемого реципиента, и водные и неводные стерильные суспензии, которые могут включать суспендирующие агенты, солюбилизаторы, загущающие агенты, стабилизаторы и консерванты. Препаративные формы могут быть представлены в герметичных контейнерах, содержащих стандартную дозу или множественные дозы, такие как ампулы и флакончики, и могут храниться в засушенном, замороженном (лиофилизированном) состоянии, требующем только добавления стерильного жидкого эксципиента, например, воды для инъекций, непосредственно перед применением. Приготавливаемые непосредственно перед введением инъекционные растворы и суспензии можно получить из стерильных порошков, гранул и таблеток ранее описанного вида. Предпочтительны инъецируемые препаративные формы.
В некоторых вариантах осуществления композиция составляется так, чтобы диапазон рН был от примерно 4,5 до примерно 9,0, включая, например, диапазоны рН в любом из промежутков от примерно 5,0 до примерно 8,0, от примерно 6,5 до примерно 7,5 и от примерно 6,5 до примерно 7,0. В некоторых вариантах осуществления композиция составляется так, чтобы ее рН был не менее чем примерно 6, включая, например, не менее чем примерно любая из величин 6,5, 7 или 8 (например, примерно 8). Композиция также может быть изотоничной с кровью за счет добавления растворимых модификаторов тоничности, таких как глицерин.
Наборы
Изобретение также предоставляет наборы для применения в настоящих способах. Наборы по изобретению включают один или более контейнеров, включающих содержащие таксан композиции в виде наночастиц (или стандартные лекарственные формы и/или изделия изготовления) и/или химиотерапевтическое средство и, в некоторых вариантах осуществления, кроме того, включающих инструкции по применению в соответствии с любым из описанных здесь способов. Набор может, кроме того, включать описание выбора индивидуума, подходящего для лечения. Инструкции, поставляемые с наборами по изобретению, обычно представляют собой письменные инструкции на этикетке или упаковочном вкладыше (например, листе бумаги, включенном в набор), но также доступны инструкции, считываемые машиной (например, инструкции на носителе в виде магнитного или оптического накопительного диска).
В некоторых вариантах осуществления набор включает а) композицию, содержащую наночастицы, включающие таксан и белок-носитель (такой как альбумин), b) эффективное количество, по меньшей мере, одного другого химиотерапевтического средства и с) инструкции по одновременному или последовательному введению наночастиц и химиотерапевтического средства для лечения пролиферативного заболевания (такого как рак). В некоторых вариантах осуществления таксан представляет собой любой из паклитаксела, доцетаксела и ортатаксела. В некоторых вариантах осуществления набор содержит наночастицы, включающие а) композицию, содержащую наночастицы, включающие паклитаксел и альбумин (такие как AbraxaneTM), b) эффективное количество, по меньшей мере, одного другого химиотерапевтического средства и с) инструкции по одновременному или последовательному введению наночастиц и химиотерапевтического средства для эффективного лечения пролиферативного заболевания (такого как рак).
В некоторых вариантах осуществления набор содержит а) композицию, содержащую наночастицы, включающие таксан и белок-носитель (такой как альбумин), b) композицию, содержащую наночастицы, включающие, по меньшей мере, одно другое химиотерапевтическое средство и белок-носитель (такой как альбумин), и с) инструкции по одновременному или последовательному введению композиций в виде наночастиц для лечения пролиферативного заболевания (такого как рак). В некоторых вариантах осуществления набор содержит наночастицы, включающие а) композицию, содержащую наночастицы, включающие паклитаксел и альбумин (такие как AbraxaneTM), b) композицию, содержащую наночастицы, включающие, по меньшей мере, одно другое химиотерапевтическое средство и белок-носитель (такой как альбумин), и с) инструкции по одновременному и/или последовательному введению композиций в виде наночастиц для эффективного лечения пролиферативного заболевания (такого как рак).
Наночастицы и химиотерапевтическое средство могут присутствовать в отдельных контейнерах или в одном контейнере. Понятно, что набор может включать одну отдельную композицию или 2 или более композиций, где одна композиция содержит наночастицы, а другая композиция содержит химиотерапевтическое средство.
Наборы по изобретению находятся в подходящей упаковке. Подходящие упаковки включают без ограничения флакончики, бутыли, банки, гибкую упаковку (например, запаянные мешочки Mylar или пластиковые мешочки) и им подобные. Наборы могут необязательно предоставлять дополнительные компоненты, такие как буферы, и интерпретирующую информацию.
Инструкции, относящиеся к применению композиций в виде наночастиц, в целом включают информацию, относящуюся к дозировке, схеме введения и пути введения для предполагаемого лечения. Контейнеры могут представлять собой стандартные дозы, объемные упаковки (например, упаковки с множественными дозами) или субстандартные дозы. Например, могут быть предоставлены наборы, которые содержат достаточные дозировки таксана (такого как раскрытые здесь таксаны) для обеспечения эффективного лечения индивидуума в течение продолжительного периода, такого как любой из периодов 1 неделя, 2 недели, 3 недели, 4 недели, 6 недель, 8 недель, 3 месяца, 4 месяца, 5 месяцев, 7 месяцев, 8 месяцев, 9 месяцев или более. Наборы могут также включать множественные стандартные дозы таксана и фармацевтических композиций и инструкции по применению, упакованные в количествах, достаточных для хранения и применения в аптеках, например, больничных аптеках, и аптеках, готовящих препаративные формы.
Специалисту в данной области будет понятно, что в пределах объема и сущности настоящего изобретения можно осуществить несколько вариаций. Следующие примеры дополнительно иллюстрируют изобретение, но их, конечно, не следует рассматривать как в какой-то мере ограничивающие его объем.
ПРИМЕРЫ
Пример 1. Улучшенная реакция и сниженная токсичность AbraxaneTM по сравнению с Taxol® в фазе III исследования AbraxaneTM, вводимого 1 раз в 3 недели.
Значительно сниженная частота нейтропении и гиперчувствительности, отсутствие потребности в премедикации стероидами, более короткая длительность нейропатии, более короткое время вливания и более высокая доза.
ABI-007 (AbraxaneTM), первый биологически взаимодействующий связанный с альбумином паклитаксел в форме наночастиц, не содержащий какого-либо растворителя, сравнивали с паклитакселом на основе Cremophor® (Taxol®) у индивидуумов с метастатическим раком молочной железы (МВС). Эту фазу III исследования проводили для подтверждения преклинических исследований, демонстрирующих более высокую эффективность и сниженную токсичность ABI-007, по сравнению с Taxol®. Лица методом слепой выборки были включены в группы, получавшие 3-недельные циклы или ABI-007 в дозе 260 мг/м2 (внутривенно) в течение 30 мин без премедикации (n=229), или Taxol® в дозе 175 мг/м2 внутривенно в течение 3 часов с премедикацией (n=225). ABI-007 продемонстрировал значительно более высокие частоты реакции по сравнению с Taxol® (33% в сравнении с 19%; р=0,001) и значительно более продолжительное время до прогрессирования опухоли (23,0 в сравнении с 16,9 неделями; HR (выраженная реакция на лечение) =0,75; р=0,006). Наблюдалась тенденция к более длительному общему выживанию у лиц, которые получали ABI-007 (65,0 в сравнении с 55,7 неделями; р=0,374). При незапланированном анализе ABI-007 увеличил выживание у лиц, получавших лечение в виде терапии второй или больших линий (56,4 в сравнении с 46,7 неделями; HR=0,73; р=0,024). Частота нейтропении 4-ой степени была значительно ниже в группе ABI-007 (9% в сравнении с 22%; p<0,001), несмотря на дозу паклитаксела, превышающую на 49%. Сенсорная нейропатия 3-ей степени чаще наблюдалась в группе ABI-007, чем в группе Taxol® (10% в сравнении с 2%; p<0,001), но она легко устранялась и быстрее наступало улучшение (медиана 22 дня), чем для Taxol® (медиана 73 дня). Ни у одного индивидуума в группе ABI-007, несмотря на отсутствие премедикации и более короткое время введения, не возникли тяжелые (3-ей или 4-ой степени) реакции гиперчувствительности, связанные с лечением. Напротив, в группе Taxol®, несмотря на стандартную премедикацию, возникли реакции гиперчувствительности 3 типа (боль в грудной клетке: 2 индивидуума; аллергические реакции: 3 индивидуума). В соответствии с протоколом в группе ABI-007 индивидуумам обычно не вводили кортикостероиды и антигистаминные препараты; однако премедикацию вводили по поводу рвоты, миалгии/артралгии или анорексии у 18 индивидуумов (8%) в группе ABI-007 в 2% циклов лечения, тогда как 224 индивидуума (>99%) в группе Taxol® получали премедикацию в 95% циклов. Единственной клинической биохимической величиной, которая заметно отличалась в двух плечах лечения, были более высокие уровни глюкозы в сыворотке у индивидуумов, получавших лечение Taxol®, у которых также была более высокая частота гипергликемии, отмеченная как АЕ (неблагоприятные эффекты) (15 [7%] в сравнении с 3 [1%]; р=0,003). В целом, в этой отдельной популяции ABI-007 продемонстрировал большую эффективность и благоприятный профиль безопасности по сравнению с Taxol®. Улучшенный терапевтический показатель и устранение премедикации стероидами, требовавшейся для таксанов на основе растворителей, делают этот связанный с альбумином паклитаксел в виде наночастиц важным достижением в лечении МВС.
Пример 2. Введение AbraxaneTM 1 раз в неделю у лиц с устойчивым к таксанам метастатическим раком молочной железы
Недавно проведенная фаза II клинического исследования показала, что введение AbraxaneTM (паклитаксела, связанного с альбумином в виде наночастиц) в дозе 125 мг/м2 привело к длительному прекращению прогрессирования заболевания у лиц с метастатическим раком молочной железы, заболевание у которых прогрессировало, хотя их лечили Taxol® или Taxotere® (то есть, индивидуумов, которые устойчивы к таксанам).
Считают, что AbraxaneTM представляет первую биологически взаимодействующую композицию, которая использует рецепторно-опосредованный (gp60) путь, который, как обнаружено, является неотъемлемой частью для достижения высоких внутриклеточных концентраций активного ингредиента - паклитаксела. Эта фаза II исследования включала 75 лиц с устойчивым к таксанам метастатическим раком молочной железы. AbraxaneTM вводили 1 раз в неделю путем 30-минутного вливания в дозе 125 мг/м2 без премедикации стероидами/антигистаминными препаратами или профилактики G-CSF. Индивидуумы повторно через каждые 28 дней получали 1 раз в неделю 3 дозы с последующей 1 неделей отдыха. В отличие от Taxol® или Taxotere®, которые содержат детергенты, которые могут ингибировать захват опухолью, механизм действия связанного с альбумином паклитаксела в виде наночастиц может привести к улучшенным исходам, особенно у этой отдельной популяции, которую трудно лечить.
В частности, данные показали, что, несмотря на эту высокую еженедельную дозу 125 мг/м2 у этой отдельной популяции с предварительным лечением высокими дозами и ранее подвергавшейся действию таксанов, только у 3 из 75 индивидуумов (4%) пришлось прекратить введение AbraxaneTM вследствие периферической нейропатии. Кроме того, 80% лиц, которые испытали периферическую нейропатию 3 степени, были обычно способны возобновить лечение после задержки только на 1 или 2 недели и продолжали получать AbraxaneTM в сниженной дозе в среднем в течение 4 дополнительных месяцев. Это быстрое улучшение согласовывалось с наблюдением заявителей в фазе III испытания, что периферическая нейропатия, вызванная одним паклитакселом (т.е. без Cremophor®), быстро уменьшается по сравнению с периферической нейропатией, вызванной Taxol®. Эти наблюдения при клинических испытаниях AbraxaneTM предоставляют первую клиническую возможность оценки эффектов самого химиотерапевтического средства, паклитаксела, и дифференцировать их от эффектов растворителей. На основании опыта проведения и фаз II, III полученные данные свидетельствуют о том, что периферическая нейропатия, вызванная AbraxaneTM, несравнима с периферической нейропатией, вызванной Taxol® или Taxotere® в отношении длительности и воздействия на индивидуума.
В отношении клинического опыта лечения периферической нейропатии после введения Taxol® или Taxotere®, организация Abraxis Oncology недавно завершила опрос 200 онкологов, которых спрашивали о том, сколько времени, по их мнению, потребовалось для улучшения состояния и/или устранения периферической нейропатии, вызванной Taxol®: 25% сообщили: «7-12 месяцев», а еще 23% сообщили: «никогда не устранялась»; в отношении Taxotere®, соответствующие процентные доли составили 29% и 7%. Эти данные согласуются с указаниями в упаковочных вкладышах Taxotere® и Taxol®.
Анализ данных фазы II демонстрирует, что AbraxaneTM активен у этой отдельной популяции с неблагоприятным прогнозом (87% с поражением висцеральных органов (легких и печени), 69%>3 метастатических участков, 88% рост опухоли при введении таксанов) устойчивых к таксанам индивидуумов с метастатическим раком молочной железы. Наблюдения включали 44% случаев прекращения прогрессирования заболевания у лиц, устойчивых к Taxotere®, и 39% случаев прекращения прогрессирования заболевания у лиц, устойчивых к Taxol®. Из тех лиц, заболевание которых прогрессировало при введении одного Taxotere® в группе с метастатическими поражениями (n=27), после введения AbraxaneTM 1 раз в неделю была отмечена частота реакции, составившая 19%. Из тех лиц, заболевание которых прогрессировало при введении одного Taxol® в группе с метастатическими поражениями (n=23), после введения AbraxaneTM 1 раз в неделю была отмечена частота реакции, составившая 13%.
Было обнаружено, что AbraxaneTM хорошо переносим при введении 1 раз в неделю в течение 30 мин без профилактического введения стероидов или G-CSF: нейтропения 4 степени = 3% (без G-CSF); анемия 4 стадии = 1%; отсутствие тяжелых реакций гиперчувствительности (несмотря на отсутствие премедикации). У этих лиц, получавших интенсивное предварительное лечение, 75% лиц лечили всей высокой дозой AbraxaneTM 125 мг/м2 1 раз в неделю без снижения дозы вследствие токсических воздействий/неблагоприятных явлений. Из лиц, у которых развилась сенсорная нейропатия 3-ей степени, 77% были способны возобновить лечение AbraxaneTM в сниженной дозе (75-100 мг/м2), и они получили в среднем 12,2 (диапазон от 1 до 28) дополнительных доз AbraxaneTM. Было примечательным отметить, что из тех лиц, которые возобновили лечение AbraxaneTM, 80% (8 из 10) были способны возобновить прием препарата через 14 дней после снижения нейропатии до 1-2-ой степени. Эти результаты подтверждают наблюдения в фазе III основного испытания AbraxaneTM в дозе 260 мг/м2, вводимой 1 раз в 3 недели, в котором также было отмечено быстрое улучшение (медиана 22 дня). Взятые вместе, эти 2 клинических испытания свидетельствуют о том, что при введении одного паклитаксела возникающая нейропатия представляется кратковременной и легко устранимой.
AbraxaneTM использует путь на основе рецептора gp60 на эндотелиальных клетках микрососудов, и было показано, что Taxol® не транспортировался этим механизмом. Кроме того, связывающий альбумин белок, SPARC, был избыточно экспрессирован в опухолях молочных желез и может играть роль в увеличенном внутриопухолевом накоплении AbraxaneTM. Предложенный механизм свидетельствовал о том, что попав в интерстиций опухоли, комплекс альбумин-паклитаксел связался со SPARC, который присутствовал на поверхности опухолевой клетки, и быстро интернализировался в опухолевую клетку нелизосомным механизмом.
Кроме того, поверхностно-активные вещества/растворители, обычно используемые в современных препаративных формах таксанов, такие как Cremophor®, Tween® 80 и TPGS, сильно ингибируют связывание паклитаксела с альбумином, посредством этого ограничивая трансэндотелиальный транспорт. Дополнительные представленные данные показали статистически улучшенную эффективность AbraxaneTM, в сравнении с Taxotere®, в ксенотрансплантате карциномы молочной железы в одинаковой дозе.
В заключение, 75% лиц лечили полной высокой дозой без уменьшения дозы. Данные указывают на быстрое улучшение состояния при периферической нейропатии при введении одного связанного с альбумином паклитаксела в виде наночастиц, без растворителя Cremophor®. Дополнительные данные предоставляют еще одно доказательство того, что механизм действия может играть важную роль в улучшении отельных исходов.
Пример 3. AbraxaneTM (ABI-007) действует синергически с нацеленными антиангиогенными про-апоптозными пептидами (НКР) в ксенотрансплантатах человеческой опухоли MDA-MB-435
Ранее сообщалось об антиангиогенной активности мелких синтетических про-апоптозных пептидов, составленных из двух функциональных доменов, один нацелен на рецепторы CD13 (аминопептидаза N) на опухолевых микрососудах, а другой разрушает митохондриальную мембрану после интернализации. См. Nat Med. 1999 Sep; 5(9):1032-8. Было обнаружено, что димерный пептид второго поколения, CNGRC-GG-d(KLAKLAK)2, названный НКР (пептид-«охотник»-«убийца»), обладает повышенной противоопухолевой активностью. Поскольку антиангиогенные агенты, такие как Avastin®, проявляют синергизм в комбинации с цитотоксическими агентами, такими как 5-фторурацил, заявители оценили комбинацию антиангиогенного НКР с AbraxaneTM (ABI-007), паклитаксела с альбумином в виде наночастиц, который транспортируется рецептором gp60 в сосудистом эндотелии (Desai, SABCS 2003), в ксенотрансплантатах опухоли молочной железы человека MDA-MB-435.
Методы: Ксенотрансплантаты человеческих опухолей MDA-MB-435 были установлены при среднем объеме опухолей 100 мм3; мышей методом рандомизации делили на группы по 12-13 животных и лечили НКР, AbraxaneTM, или НКР и AbraxaneTM. НКР вводили внутривенно (250 мкм) 1 раз в неделю 16 недель. AbraxaneTM вводили внутривенно ежедневно в течение 5 дней в дозе 10 мг/кг в день только в течение первой недели лечения. Использованная доза AbraxaneTM была существенно ниже MTD (30 мг/кг в день, 4 раза в день × 5) для предотвращения полной регрессии опухоли; таким образом, можно было отметить эффект НКР.
Результаты: Через 19 недель лечения объем опухоли в группе НКР (4,372 мм3±2,470; р<0,05) или ABI-007 (3,909 мм3±506; p<0,01, в сравнении с контролем) был значительно уменьшен по сравнению с контрольной группой (10,298 мм3±2,570; p<0,05). Комбинация ABI-007 и НКР значительно уменьшала объем опухоли в сравнении с монотерапией (411 мм3±386; p<0,01, монотерапия AbraxaneTM или монотерапия НКР). Эти виды лечения хорошо переносились.
Вывод: Комбинация AbraxaneTM (ABI-007), связанного с альбумином паклитаксела в виде наночастиц, с сосудистым нацеливающим антиангиогенным димерным пептидом НКР (CNGRC-GG-d(KLAKLAK)2) против ксенотрансплантата опухоли молочной железы человека MDA-MB-435 проявила значительное уменьшение объема опухоли по сравнению с монотерапией каждым средством отдельно. Полученные результаты свидетельствуют о том, что комбинация AbraxaneTM с антиангиогенными средствами, такими как НКР или, возможно, Avastin®, может быть благоприятной.
Пример 4. Метрономная терапия ABI-007: Антиангиогенная и противоопухолевая активность связанного с альбумином паклитаксела в виде наночастиц
Пример 4а
Методы: Антиангиогенную активность ABI-007 оценивали с помощью анализов аортальных колец крыс, пролиферации эндотелиальных клеток пупочной вены человека (HUVEC) и формированием трубок. Оптимальную дозу ABI-007 для метрономной терапии определяли измерением уровней циркулирующих эндотелиальных предшественников (СЕР) в периферической крови мышей Balb/c, не имеющих опухолей (n=5/группу; введение: 1-30 мг/кг внутрибрюшинно, 4 раза в день × 7), проточной цитометрией (Shaked et al., Cancer Cell, 7:101-111 (2005)). В последующем, оценивали противоопухолевые эффекты метрономной (4 раза в день; внутрибрюшинно) и MTD (4 раза в день × 5, 1 цикл; внутривенно) терапии ABI-007 и Taxol® и сравнивали у мышей SCID, несущих ксенотрансплантаты рака молочной железы MDA-MD-231 и рака предстательной железы человека РС3.
Результаты: ABI-007 в количестве 5 нМ значимо (р<0,05) ингибировал разрастание микрососудов аорты крыс, пролиферацию эндотелиальных клеток человека и формирование трубок, соответственно, на 53%, 24% и 75%. На основании измерений СЕР установили, что оптимальная доза ABI-007 для метрономной терапии составляла 6-10 мг/кг. Метрономная терапия ABI-007 (6 мг/кг), но не Taxol® (1,3 мг/кг), значительно (р<0,05) подавляла рост опухоли в обеих моделях ксенотрансплантатов. Ни ABI-007, ни Taxol®, введенные метрономно, не вызывали какой-либо потери массы тела. Хотя MTD ABI-007 (30 мг/кг) ингибировала рост опухоли эффективнее, чем MTD Taxol® (13 мг/кг), значимая потеря массы тела была отмечена при первой. Представляет интерес, что противоопухолевый эффект метрономной терапии ABI-007 приближался к такому MTD Taxol®.
Вывод: ABI-007 проявляет высокую антиангиогенную и противоопухолевую активность при применении в метрономном режиме.
Пример 4b
Анализ аортальных колец крыс. 12-луночные планшеты для тканевой культуры покрывали Matrigel (Collaborative Biomedical Products, Bedford, MA) и предоставляли возможность образоваться гелю в течение 30 мин при 37°С и 5% СО2. Грудные аорты иссекали у 8-10-недельных самцов крыс Sprague-Dawley, разрезали на поперечные срезы длиной 1 мм, помещали на покрытые Matrigel лунки и покрывали дополнительным количеством Matrigel. После застывания второго слоя Matrigel кольца покрывали EGM-II и инкубировали в течение ночи при 37°С и 5% СО2. EGM-II состоит из базальной среды эндотелиальных клеток (EBM-II; Cambrex, Walkersville, MD) плюс факторов роста эндотелиальных клеток, предоставленных в виде EGM-II Bulletkit (Cambrex). Культуральную среду в последующем заменяли EBM-II с добавлением 2% FBS (фетальной телячьей сыворотки), 0,25 мкг/мл амфотерицина В и 10 мкг/мл гентамицина. Аортальные кольца обрабатывали EBM-II, содержащим носитель (0,9% солевой раствор/альбумин), карбоксиамидотриазола (CAI; 12 мкг/мл) или ABI-007 (0,05-10 нМ паклитаксела), в течение 4 дней и фотографировали на 5-й день. CAI, известное антиангиогенное средство, использовали в концентрации, более высокой, чем клинически достижимая, в качестве положительного контроля. Эксперименты повторяли 4 раза, используя аорты от 4 различных крыс. Площадь ангиогенного прорастания, представленную в квадратных пикселях, количественно определяли, используя программное обеспечение Adobe Photoshop 6.0.
Как показано на фиг.1А, ABI-007 значительно ингибировал разрастание аортальных микрососудов зависимым от концентрации образом относительно контроля носителя, достигая статистической значимости (p<0,05) при 5 нМ (ингибирование на 53%) и 10 нМ (ингибирование на 68%). Количество альбумина, присутствовавшее при каждой концентрации одного ABI-007, не ингибировало ангиогенез.
Анализ пролиферации эндотелиальных клеток. Эндотелиальные клетки человеческой пупочной вены (HUVEC; Cambrex) поддерживали в EGM-II при 37°С и 5% СО2. HUVEC высевали на 12-луночные планшеты при плотности 30000 клеток/лунку и давали возможность прикрепиться в течение ночи. Затем культуральную среду аспирировали и в каждую лунку добавляли свежую культуральную среду, содержащую или носитель (0,9% солевой раствор/альбумин), или ABI-007 (0,05-10 нМ паклитаксела). Через 48 часов клетки трипсинизировали и подсчитывали счетчиком Coulter Z1 (Coulter Corp., Hialeah, FL). Все эксперименты повторяли 3 раза.
Как показано на фиг.1В, пролиферация эндотелиальных клеток человека значительно ингибировалась ABI-007 при 5 нМ и 10 нМ, соответственно, на 36% и 41%.
Анализ формирования трубок эндотелиальными клетками. 8-луночные камеры предметных стекол покрывали Matrigel и давали возможность образоваться гелю при 37°С и 5% СО2 в течение 30 мин. Затем HUVEC высевали при 30000 клетках/лунку в EGM-II, содержащий или носитель (0,9% солевой раствор/альбумин), или ABI-007 (0,05-10 нМ паклитаксела) и инкубировали при 37°С и 5% СО2 в течение 16 ч. После инкубации предметные стекла промывали PBS (солевым раствором с фосфатным буфером), фиксировали в 100% метаноле в течение 10 с и окрашивали раствором Diff Quick II (Dade Behring Inc., Newark, DE) в течение 2 мин. Для анализа формирования трубок каждую лунку фотографировали цифровым фотоаппаратом, используя объектив 2,5х. Пороговый уровень был установлен для маскировки окрашенных трубок. Соответствующую площадь измеряли в виде количества пикселей, используя программное обеспечение MetaMorph (Universal Imaging, Downingtown, PA). Эксперименты повторяли 3 раза.
Как показано на фиг.1С, ABI-007 блокировал формирование трубок на 75% и при 5 нМ, и 10 нМ.
Определение оптимальной биологической дозы ABI-007 in vivo измерением циркулирующих эндотелиальных клеток (СЕС) и циркулирующих эндотелиальных предшественников (СЕР). Самок 6-8-недельных мышей Balb/cJ методом рандомизации включали в следующие 8 групп (n=5 каждая): не получавшие лечение, получавшие лечение внутрибрюшинной инъекцией болюса или носителя лекарственного препарата (0,9% солевой раствор/альбумин), или ABI-007 в дозе паклитаксела 1, 3, 6, 10, 15 или 30 мг/кг 1 раз в день в течение 7 дней. В конце периода лечения образцы крови брали пункцией сердца и собирали в содержащие EDTA пробирки «vacutainer» (Becton Dickinson, Franklin Lakes, NJ). CEC и CEP подсчитывали, используя четырехцветную проточную цитометрию. Моноклональные антитела, специфичные для CD45, использовали для исключения CD45 + гематопэтические клетки. СЕС и их субпопуляцию СЕР изображали, используя маркеры мышиного эндотелия киназы 1 фетальной печени/рецептора 2 VEGF (flk-1/VEGFR2), CD13 и CD117 (BD Pharmingen, San Diego, CA). Ядерное окрашивание (Procount; BD Biosciences, San Jose, CA) выполняли для исключения возможности помех тромбоцитов или клеточных фрагментов точности подсчета СЕС и СЕР. После лизиса эритроцитов клеточные суспензии оценивали FACSCalibur (BD Biosciences), используя аналитические «ворота», предназначенные для исключения мертвых клеток, тромбоцитов и клеточных фрагментов. Получали, по меньшей мере, 100000 событий/образец для анализа процентной доли СЕС и СЕР. Затем абсолютное число СЕС и СЕР подсчитывали в виде процентной доли событий, отмеченных в рамках подсчета СЕС и СЕР, умноженной на общее количество лейкоцитов. Определяли процентные доли окрашенных клеток и сравнивали с соответствующими отрицательными контролями. Положительное окрашивание определяли как большее, чем неспецифическое фоновое окрашивание. 7-аминоактиномицин D (7AAD) использовали для подсчета жизнеспособных клеток относительно апоптозных и мертвых клеток.
На фиг.2 показано, что ABI-007, вводимый внутрибрюшинно 1 раз в день в течение 7 дней в дозе 3, 10-30 мг/кг, значительно снижал уровни СЕР у мышей Balb/cJ, не имеющих опухоли. Однако ABI-007 в дозе 10-30 мг/кг был связан со значительным снижением количества лейкоцитов, указывающим на токсичность. Хотя снижение уровней СЕР ABI-007 в дозе 6 мг/кг не достигало статистической значимости, уменьшение количества лейкоцитов не было очевидным. Поэтому, был сделан вывод, что оптимальная биологическая доза для метрономного лечения ABI-007 in vivo составляла от 3 до 10 мг/кг. В одном исследовании метрономное лечение Taxol® в дозе 1,3, 3, 6 или 13 мг/кг, вводимых внутрибрюшинно в течение 7 дней, значимо не снижало жизнеспособные уровни СЕР, тогда как метрономное лечение Taxol® в дозе 30 мг/кг или выше привело к тяжелой токсичности и, в конечном счете, смертности у мышей. Ранее сообщалось, что внутрибрюшинное введение Taxol® в дозах, обычно используемых в клинике, привело к захвату паклитаксела в мицеллы Cremophor® EL в брюшной полости и, следовательно, незначительной концентрации паклитаксела в плазме (Gelderblom et al., Clin. Cancer Res. 8:1237-41 (2002)). Это могло бы объяснить, почему дозы метрономного Taxol® (1,3, 3, 6 или 13 мг/кг), которые не вызвали смерть, не смогли изменить уровни жизнеспособных СЕР. В этом случае внутрибрюшинное введение метрономного Taxol® в дозе 1,3 мг/кг совсем не отличалось бы от метрономного Taxol® в дозе 13 мг/кг. Поэтому для последующих экспериментов была выбрана более низкая доза, 1,3 мг/кг, для минимизации количества Cremophor® EL на введение паклитаксела.
Противоопухолевые эффекты ABI-007 в метрономной схеме и при введении MTD, по сравнению с Taxol® в метрономной схеме и при введении MTD. Линию клеток человеческого рака предстательной железы РС3 и линию клеток рака молочной железы человека MDA-MD-231 получали из Американской коллекции типовых культур (Manassas, VA). Клетки РС3 (5×106) инъецировали подкожно 6-8-недельным самцам мышей SCID, тогда как клетки MDA-MD-231 (2×106) имплантировали ортотопически в жировую подушечку молочной железы самок мышей SCID. Когда объем первичной опухоли достигал приблизительно 150-200 мм3, животных методом рандомизации включали в 8 групп (n=5-10/группу). Каждую группу лечили или контролем носителя 0,9% солевого раствора/альбумина, или контролем носителя Cremophor® EL, или метрономным Taxol® (1,3 мг/кг внутрибрюшинно 4 раза в день), или метрономным ABI-007 (3, 6 или 10 мг/кг паклитаксела внутрибрюшинно 4 раза в день), или MTD Taxol® (13 мг/кг внутрибрюшинно 4 раза в день × 5, 1 цикл), или MTD ABI-007 (30 мг/кг паклитаксела внутривенно 4 раза в день × 5, 1 цикл). Перпендикулярные диаметры опухолей измеряли циркулем 1 раз в неделю и рассчитывали их объемы. В конце периода лечения образцы крови брали пункцией сердца у мышей из всех групп. Подсчитывали СЕС и СЕР, как описано здесь.
В отличие от Taxol® (1,3 мг/кг) метрономный ABI-007 (3, 6 или 10 мг/кг), введенный внутрибрюшинно 1 раз в день в течение 4 недель, значительно (p<0,05) ингибировал рост и опухолей MDA-MB-231, и PC3 (фиг.3А и фиг.3В). Ни ABI-007, ни Taxol®, введенные метрономно, не вызывали никакой потери массы тела (фиг.3С и фиг.3D). Хотя MTD ABI-007 (30 мг/кг) ингибировал рост опухоли эффективнее, чем MTD Taxol® (13 мг/кг), при первом наблюдалась значительная потеря массы тела, указывающая на токсичность. Кроме того, у 2 из 5 мышей, получавших лечение MTD ABI-007, проявились признаки паралича в одной конечности через 6 дней после последней дозы препарата. Паралич был преходящим и разрешился в пределах 24-48 часов. Представляет интерес, что противоопухолевый эффект метрономного ABI-007 в дозе 6 мг/кг приближался к противоопухолевому эффекту MTD Taxol® на модели ксенотрансплантата MDA-MB-231 (фиг.3А). Представляется, что увеличение дозы метрономного ABI-007 до 10 мг/кг не придало более выраженного ингибирования роста опухоли. Напротив, метрономный ABI-007 вызывал более выраженную противоопухолевую реакцию в дозе 10 мг/кг, чем в дозах 3 и 6 мг/кг в ксенотрансплантатах РС3 (фиг.3В).
Метрономный ABI-007 значительно снижал уровни жизнеспособных СЕР зависимым от дозы образом у мышей, несущих опухоль MDA-MB-231 (фиг.4А). Уровни жизнеспособных СЕР также проявили зависимое от дозы уменьшение реакции на метрономный ABI-007 у мышей, несущих опухоль РС3, но достигли статистической значимости только при 10 мг/кг (фиг.4В). Уровни СЕР не изменялись метрономным Taxol® на обеих моделях ксенотрансплантатов (фиг.4А и 4В).
Исследовали воздействия метрономного и MTD ABI-007 и метрономного и MTD Taxol® на внутриопухолевую плотность микрососудов. Срезы толщиной 5 мкм, полученные из замороженных опухолей MDA-MB-231 и РС3, окрашивали H&E (гематоксилином и эозином) для гистологического исследования стандартными способами, известными специалисту в данной области. Для выявления микрососудов срезы окрашивали крысиным противомышиным CD31/PECAM-1 антителом (1:1000, BD Pharmingen) с последующим окрашиванием сопряженно связанного с техасским красным козьим противокрысиным вторичным антителом (1:200, Jackson ImmunoResearch Laboratories, Inc., West Grove, PA). Одиночный микрососуд был выявлен в виде дискретного кластера или одиночной клетки, положительно окрашенной на CD31/PECAM-1d, и присутствие просвета не требовалось для балльной оценки в качестве микрососуда. MVD для каждой опухоли выражали в виде средней величины трех наиболее плотно окрашенных полей, идентифицированных объективом 20х на системе флюоресцентной микроскопической визуализации Zeiss AxioVision 3.0. Анализировали 4-5 различных опухолей на каждый контроль носителя или группу лечения.
Представлялось, что в опухолях MDA-MB-231 метрономный ABI-007 в дозе 6 и 10 мг/кг, а также MTD ABI-007 незначительно снижали плотность микрососудов, хотя статистическая значимость не была достигнута (фиг.5А). Оказалось, что в опухолях РС3 метрономный ABI-007 в дозе 3 и 10 мг/кг снижал MVD, но без достижения статистической значимости (фиг.5А). Представляет интерес, что существовала значимая корреляция между MVD и уровнем жизнеспособных СЕР на модели MDA-MB-231 (фиг.5В; r=0,76, P=0,04), но не в РС3 (фиг.5С; r=0,071, P=0,88).
Проводили оценку ангиогенеза in vivo. Выполняли анализ перфузии с пробкой из матригеля при небольших модификациях способов, известных специалисту в данной области. Вкратце, 0,5 мл матригеля с добавкой 500 нг/мл основного фактора роста фибробластов (bFGF; R&D Systems Inc., Minneapolis, MN) инъецировали подкожно в 0-ой день в бока 10-недельных самок мышей Balb/cJ. На 3-й день животных методом случайной выборки включали в 8 групп (n=5 в каждой). Каждую группу лечили или контрольным носителем 0,9% солевого раствора/альбумина, или контролем носителя Cremophor® EL, или метрономным Taxol® (1,3 мг/кг внутрибрюшинно 4 раза в день), метрономным ABI-007 (3, 6 или 10 мг/кг паклитаксела внутрибрюшинно 4 раза в день), MTD Taxol® (13 мг/кг внутривенно 4 раза в день × 5), или MTD ABI-007 (30 мг/кг паклитаксела внутривенно 4 раза в день × 5). В качестве отрицательного контроля, пяти дополнительным самкам мышей Balb/cJ аналогичного возраста инъецировали один матригель. На 10-й день всем животным инъецировали внутривенно 0,2 мл 25 мг/мл FITC-декстрана (Sigma, St. Louis, MO). В последующем брали образцы плазмы. Пробки из матригеля удаляли, инкубировали с диспазой (Collaborative Biomedical Products, Bedford, MA) в течение ночи при 37°С и затем гомогенизировали. Показания флюоресценции получали с использованием считывающего устройства флюоресценции, планшет FL600 (Biotech Instruments, Winooski, VT). Ангиографическая реакция была выражена в виде отношения флюоресценции пробки матригеля к флюоресценции плазмы.
Оказалось, что ABI-007 в дозе 6 или 10 мг/кг уменьшает ангиогенез, хотя ингибирование не достигало статистической значимости (фиг.6). Представлялось, что ангиогенез не изменялся метрономным ABI-007 в дозе 3 мг/кг, MTD ABI-007, MTD и метрономным Taxol® относительно соответствующих контролей носителей (фиг.6). Эти наблюдения были аналогичны описанным здесь внутриопухолевым MVD результатам.
Пример 5. Nab-5109, связанный с наночастицами альбумина IDN5109 (nab-5109), проявляет повышенную эффективность и сниженную токсичность в сравнении с препаративной формой Tween® (Tween®-5109, ортатакселом)
Методы: nab-5109 в виде наночастиц получали, используя nab-технологию, и характеризовали рассеянием лазерного света. Nab-5109 и Tween-5109 тестировали против ксенотрансплантата карциномы ободочной кишки человека Pgp+DLD-1 (которая, как известно, устойчива против паклитаксела и доцетаксела – Vredenburg et al., JNCI93:1234-1245, 2001) у «голых» мышей (n=5/группу) в дозах 50 мг/кг (Tween®-5109, ранее показанный как MTD) и 75 мг/кг (nab-5109), вводимый 4 раза в день 3 дня × 4 внутривенно. Использовали также контрольные группы PBS и человеческого сывороточного альбумина (HSA).
Результаты: Nab-5109 давал наночастицы со средним размером ZAve=119 нм и Зета потенциал = 32,7 мВ. Nab-5109 лиофилизировали в сухой порошок, который легко диспергировался в солевом растворе. In vivo, имелась значимо большая потеря массы тела (ANOVA (вариационный анализ), p<0,001) у животных, несущих опухоль, при лечении Tween®-5109 (50 мг/кг, потеря массы тела 8,8%), чем при лечении nab-5109 (75 мг/кг, потеря массы тела 3,4%), указывая на существенно более низкую токсичность nab-5109, несмотря на 50% более высокую дозу. Наблюдалось значимое подавление опухоли nab-5109 и Tween®-5109 (ANOVA, p<0,0001 в сравнении с контролями) при задержке роста опухоли, соответственно, на 36 и 28 дней для nab-5109 (75 мг/кг) и Tween®-5109 (50 мг/кг). Nab-5109 был эффективнее, чем Tween®-5109 (ANOVA, p=0,0001) в подавлении роста опухоли. Не было различий между PBS и HSA с контрольной группой в отношении токсичности и эффективности.
Вывод: Связанный с альбумином nab-5109 в виде наночастиц был успешно получен, и его можно было вводить в дозе, на 50% выше, чем Tween®-5109 при более низкой токсичности, несмотря на более высокую дозу. При этой более высокой дозе, 75 мг/кг (4 раза в день 3 дня × 4), nab-5109 проявил существенно повышенную эффективность при ксенотрансплантате карциномы ободочной кишки человека Pgp+DLD-1 по сравнению с Tween®-5109.
Пример 6. Связанные с наночастицами альбумина (nab) димерные тиоколхицины nab-5404, nab-5800 и nab-5801: Сравнительная оценка противоопухолевой активности в сравнении с AbraxaneTM и иринотеканом
Методы: Колхицины в виде наночастиц получали, используя технологию nab. Цитотоксичность оценивали in vitro, противоопухолевую активность in vivo (против ксенотрансплантата опухоли ободочной кишки человека НТ29) у «голых» мышей сравнивали с иринотеканом и AbraxaneTM. Уровни доз для nab-колхицинов и иринотекана составляли 20 мг/кг и 40 мг/кг, вводимые 4 раза в день 3 дня × 4 внутривенно. AbraxaneTM вводили в его MTD, 30 мг/кг, вводимые 4 раза в день × 5.
Результаты: Гидрофобные димеры тиоколхицина давали наночастицы со средним размером ZAve (нм) 119, 93 и 84, соответственно, для nab-5404, nab-5800 и nab-5801. Суспензии наночастиц стерилизовали через фильтры 0,22 мкм и лиофилизировали. In vitro, nab-5404 был самым активным из трех аналогов против МХ-1 (p≤0,0005, ANOVA), (IC50 (мкг/мл): 18, 36 и 77, соответственно, для nab-5404, nab-5800 и nab-5801), а также против ксенотрансплантата НТ29 in vivo (p≤0,0001, ANOVA). Объем опухоли подавлялся на 93%, 79% и 48%, соответственно, при дозах nab-5404 40 мг/кг, 30 мг/кг и 20 мг/кг. Напротив, объем опухоли подавлялся на 31%, 16% и 21% только nab-5800; и на 17%, 30% и 23% nab-5801, соответственно, в дозе 40 мг/кг, 30 мг/кг и 20 мг/кг. Nab-5404 был эффективнее, чем иринотекан, при всех уровнях доз (p≤0,008, ANOVA) при подавлении объемов опухоли иринотеканом только на 48%, 34% и 29% при уровнях доз, соответственно, 40 мг/кг, 30 мг/кг и 20 мг/кг. При сравнении с AbraxaneTM Nab-5404 был активнее при эквитоксической дозе (ETD) на основании равной потери массы тела (p<0,0001, ANOVA). Объем опухоли подавлялся на 93% nab-5404 (40 мг/кг, 4 раза в день 4 дня × 3) и на 80% AbraxaneTM (30 мг/кг, 4 раза в день × 5) в их соответствующих ETD.
Выводы: Технологию Nab использовали для превращения 3 гидрофобных димерных тиоколхицинов (IDN5404, IDN5800, IDN5801) в наночастицы, подходящие для внутривенного введения. nab-5404 был более сильнодействующим, чем иринотекан в равной дозе. В эквитоксичной дозе, определяемой потерей массы тела, nab-5404 был более сильнодействующим, чем AbraxaneTM. Эти данные оправдывают дальнейшее исследование nab-5404.
Пример 7. AbraxaneTM в сравнении с Taxotere®: Преклиническое сравнение токсичности и эффективности
Методы: Токсичность AbraxaneTM и Taxotere® сравнивали в исследовании с изменяемой дозой у «голых» мышей, получавших препараты по схеме q4d×3. Уровни доз были для Taxotere® 7, 15, 22, 33 и 50 мг/кг, а для АВХ – 15, 30, 60, 120 и 240 мг/кг. Противоопухолевую активность AbraxaneTM и Taxotere® сравнивали у «голых» мышей с ксенотрансплантатами человеческой опухоли молочной железы МХ-1 в дозе 15 мг/кг 1 раз в неделю в течение 3 недель.
Результаты: В исследовании на мышах с повышением дозы максимальная переносимая доза Taxotere® составила 15 мг/кг, а летальная доза (LD100) составила 50 мг/кг. Напротив, MTD AbraxaneTM составила от 120 до 240 мг/кг, а LD100 составила 240 мг/кг. В опухолевом исследовании AbraxaneTM был эффективнее, чем равные дозы Taxotere®, в ингибировании опухолевого роста (79,8% в сравнении с 29,1%, p<0,0001, ANOVA).
Вывод: Связанный с альбумином паклитаксел в виде наночастиц (AbraxaneTM) превосходил Taxotere® при модели опухоли МХ-1 при тестировании в равных дозах. Кроме того, токсичность AbraxaneTM была значительно ниже, чем токсичность Taxotere®, что позволило бы вводить AbraxaneTM на существенно более высоких уровнях. Эти результаты аналогичны повышенному терапевтическому индексу, наблюдавшемуся при AbraxaneTM, по сравнению с Taxol®, и свидетельствуют о том, что присутствие поверхностно-активных веществ может нарушить транспорт, противоопухолевую активность и увеличить токсичность таксанов. Проводятся исследования на дополнительных моделях опухолей, сравнивающие AbraxaneTM и Taxotere®.
Пример 8. Связанный с альбумином димер тиоколхицина в виде наночастиц (nab-5404) с двойными механизмами действия на тубулин и топоизомеразу-1: Оценка активности in vitro и in vivo
Методы: IDN5404 тестировали на цитотоксическую активность, используя карциному молочной железы MCF7-S и ее устойчивый к многим препаратам вариант MCF7-R (pgp+). Также оценивали его цитотоксичность против набора клеточных линий человеческой опухоли NCI-60. Связанный с альбумином nab-5404 в виде наночастиц вводили внутривенно, используя различные схемы, мышам SCID, которым подкожно имплантировали ксенотрансплантат человеческой опухоли яичников А121.
Результаты: Материнское соединение колхицин продемонстрировало против клеточных линий MCF7 ингибирование опухолевого роста при величине IC50 (концентрация, ингибирующая на 50%) для клеток MCF7-S при 3,9±0,2 нМ. Устойчивый вариант MCF7-R продемонстрировал IC50 66±8,6 нМ, приблизительно 17-кратное увеличение вследствие устойчивости к лекарственным препаратам. IDN5404 продемонстрировал повышенную активность против обеих клеточных линий, проявляя величины IC50, соответственно, 1,7±0,1 и 40±3,8 нМ. Эти результаты были подтверждены в пределах набора клеточных линий человеческих опухолей NCI 60 при IDN5404, имеющем среднюю IC50<10-8M и более чем 10-кратную устойчивость между клеточными линиями MCF7-S и MCF7-R. Алгоритм COMPARE (сравнить) идентифицировал IDN5404 как связывающее тубулин соединение, аналогичное алкалоидам винки, подтверждая ранее полученные результаты. Эффективность и токсичность nab-5404 in vivo против ксенотрансплантата опухоли яичников А121 была зависимой от дозы и схемы. Nab-5404 в виде наночастиц был хорошо переносим и способен вызвать полную регрессию и излечение в дозе 24 мг/кг, введенной внутривенно 4 раза в день × 5 дней, 5 из 5 мышей выжили в течение длительного времени (LTS) без свидетельств наличия опухоли. Однако увеличение дозировки до 30 мг/кг привело к 5 из 5 случаев гибели мышей в результате токсического действия. При схеме q3d×4 доза 30 мг/кг привела к получению 4 из 5 мышей с LTS, а доза 50 мг/кг привела к 5 из 5 случаев гибели мышей в результате токсического действия. При использовании схемы q7d×3 доза 40 мг/кг привела к получению 3 из 5 мышей с LTS, а при дозе 50 мг/кг были отмечены 4 мыши с LTS.
Выводы: IDN5404, новый димер тиоколхицина, с двойным механизмом действия проявил активность на клеточных линиях, экспрессирующих pgp, устойчивых к цисплатину и топотекану. In vivo, связанный с альбумином nab-5404 в виде наночастиц был активен против ксенотрансплантатов опухоли яичников А121.
Пример 9. Исследование комбинации AbraxaneTM и других средств
Благодаря отмеченным выше преимущественным свойствам AbraxaneTM (АВХ, связанного с альбумином паклитаксела в виде наночастиц), он применялся и применяется в ряде исследований при различных способах введения и схемах, и в комбинации с другими онкологическими препаратами, а также с лучевой терапией. Они перечислены ниже:
При метастатическом раке молочной железы эти исследования включают:
L2: ABX 90, Nav 20;
L3: ABX 100, Nav 22,5; L4: ABX 110, Nav 25;
L5: ABX 125, Nav 25 qwk
Исследования неоадъювантных схем лечения при раке молочной железы включают:
Адъювантное лечение: Gem 2000, ABX 220, Neul 6 мг д 1 q2wk×4
Xel 1000 мг/м2 д 1-14,
q3wk×4
При раке легких исследования включают:
Когорта 2: АВХ 1 раз в неделю. Дозы TBD
Исследования на предстательной железе включают:
1-ой линии рака предстательной железы
Исследования при раке яичников включают:
Исследования химиолучевой терапии включают:
Другие исследования включают:
Пример 10. Комбинация препаратов в виде наночастиц по изобретению с другими средствами и способами лечения
Более низкая токсичность описанных здесь лекарственных средств в виде наночастиц по изобретению позволяет комбинировать их с другими онкологическими препаратами и другими способами лечения при более благоприятном исходе. Они включают формы в виде наночастиц паклитаксела, доцетаксела, других таксанов и аналогов, гелданомицинов, колхицинов и аналогов, комбретастатинов и аналогов, гидрофобных пиримидиновых соединений, ломаивитицинов и аналогов, включая соединения со структурами ядра ломаивитицина, эпотилонов и аналогов, дискодермолида и аналогов и им подобные. Препараты по изобретению можно комбинировать с паклитакселом, доцетакселом, карбоплатином, цисплатином, другими платинами, доксорубицином, эпирубицином, циклофосфамидом, ифосфамидом, гемцитабином, капецитабином, винорелбином, топотеканом, иринотеканом, тамоксифеном, камптотецинами, 5-фторурацилом, EMP, этопозидом, метотрексатом и им подобными.
Пример 11. Комбинация AbraxaneTM с карбоплатином и Herceptin®
Комбинация Taxol® и карбоплатина проявила значительную эффективность против метастатического рака молочной железы. При схеме введения 1 раз в неделю в этой комбинации Taxol® можно вводить в дозе только до 80 мг/м2. Более высокие дозы не переносимы ввиду токсичности. Кроме того, HER-2-положительные пациентки получают большую выгоду, когда в схему их лечения включен Herceptin®. Это открытое исследование фазы II было проведено для определения синергического терапевтического эффекта ABI-007 (AbraxaneTM) с этими средствами. Настоящее исследование было инициировано для оценки безопасности и противоопухолевой активности ABI-007/карбоплатина с Herceptin® у пациенток с HER-2-положительным заболеванием. ABI-007 вводили в комбинации с карбоплатином и Herceptin®, вводимыми внутривенно 1 раз в неделю пациенткам с HER-2-положительным запущенным раком молочной железы. Когорта из 3 лиц получала ABI-007 в дозе 75 мг/м2 внутривенно с последующим вливанием карбоплатина при целевой AUC=2 1 раз в неделю и Herceptin® (4 мг/кг в 1-ю неделю и 2 мг/кг во все последующие недели) в течение 1 цикла. Эти лица переносили препарат очень хорошо, поэтому для последующих циклов и лиц доза ABI-007 была увеличена до 100 мг/м2. К настоящему времени лечение получили 6 пациенток. Из 4 лиц, у которых проводилась оценка для выявления реакции, все 4 (100%) проявили реакцию на лечение. Следует отметить, что ввиду более низкой токсичности AbraxaneTM, можно было вводить более высокую общую дозу паклитаксела, по сравнению с Taxol®, при итоговых благоприятных последствиях для пациенток.
Пример 12. Комбинация AbraxaneTM с карбоплатином
Комбинация Taxol® и карбоплатина проявила значительную эффективность при раке легких. В настоящее время проводится другое исследование AbraxaneTM в комбинации с карбоплатином по схеме введения 1 раз в 3 недели у лиц, страдающих раком легких.
Пример 13. Применение AbraxaneTM в комбинации с облучением
Пример 13а
AbraxaneTM в комбинации с клинической лучевой терапией усиливает терапевтическую эффективность и снижает обычную токсичность для тканей. AbraxaneTM применяется для увеличения терапевтического воздействия лучевой терапии на опухоли; для усиления реакции опухоли на однократное и фракционированное облучение; для усиления обычной тканевой реакции на облучение и для увеличения терапевтического соотношения лучевой терапии.
Используется карцинома яичников мышей, обозначенная как ОСа-I, которая была обширно исследована. Сначала определяется оптимальное время введения AbraxaneTM относительно локального облучения опухоли для обеспечения максимальной противоопухолевой эффективности. Опухоли генерируются в правой задней конечности мышей внутримышечной инъекцией опухолевых клеток, и лечение начинается, когда опухоли достигают размера 8 мм. На мышей воздействуют однократной дозой облучения 10 Гр, одной дозой AbraxaneTM, вводимой в различное время за 5 дней до 1-го дня после облучения. Применяется доза AbraxaneTM величиной от дозы, равной максимальной переносимой дозе паклитаксела, до дозы, примерно в 1,5 раза превышающей ее, доза 90 мг/кг. Итог эффективности представляет собой задержку роста опухоли. Группы состоят из 8 мышей каждая. Опухоли генерируют и лечат, как описано в примере 1. Итог эффективности представляет собой задержку роста опухоли. Опухоли облучают 5, 7,5 или 10 Гр, подаваемыми или одной дозой. Или фракционированными дозами по 1, 1,5 или 2 Грэя облучения 1 раз в день в течение 5 последовательных дней. Поскольку AbraxaneTM удерживается в опухоли в течение нескольких дней и оказывает свой усиливающий эффект при каждой из пяти ежедневных фракций, то AbraxaneTM вводится однократно в начале схемы облучения. Поскольку конечной целью клинической лучевой терапии является достижение излечения от опухоли, то определяется потенциальная способность AbraxaneTM усиливать излечимость опухоли лучевой терапией. Используется такая же схема, как описано для исследования задержки роста опухоли фракционированным облучением, за исключением того, что диапазон доз от 2 до 16 Гр подается ежедневно в течение 5 последовательных дней (общая доза облучения от 10 до 80 Гр). За опухолями наблюдают в течение срока до 120 дней после облучения для выявления обратного развития или повторного роста, когда определяется TCD50 (доза облучения, необходимая для получения локального излечения от опухоли у 50% животных). Производятся 2 анализа TCD50: для изолированного применения облучения и AbraxaneTM плюс облучения, и каждый анализ состоит из 10 облученных доз для групп, содержащих по 15 мышей каждая. Для обеспечения увеличения терапевтического воздействия любое средство, усиливающее действие облучения, включая AbraxaneTM, должно увеличивать реакцию на облучения больше, чем увеличение обычного повреждения ткани облучением. Оценивают повреждение слизистой оболочки тощей кишки, высоко пролиферативной ткани, на которую воздействуют таксаны. Используют анализ микроколоний тощей кишки для определения выживания эпителиальных клеток крипт в тощей кишке мышей, подвергнутых облучению. Мышей подвергают облучению всего тела (WBI) при суточных дозах рентгеновского излучения от 3 до 7 Гр в течение 5 последовательных дней. Мышей лечат AbraxaneTM в эквивалентной дозе паклитаксела 80 мг/кг, вводимой внутривенно за 24 часа до первой дозы WBI, и забивают через 3,5 дня после последней дозы WBI. Тощую кишку готовят для гистологического исследования и подсчитывают количество регенерировавшихся крипт в поперечном срезе тощей кишки. Для построения расхождения кривых выживания количество регенерировавшихся крипт превращают в количество выживших клеток.
Пример 13 b
Целью этого исследования была оценка того, обладает ли ABI-007 (а) в качестве единственного средства противоопухолевой активностью против синергической карциномы яичников OCa-I, и (b) усиливает ли он реакцию на облучение опухолей OCa-I при схеме комбинированного лечения, как описано в предыдущем примере, со следующими модификациями.
Клетки опухоли OCa-I инъецировали в заднюю конечность мышей С3Н. Когда опухоль выросла до среднего диаметра 7 мм, начинали лечение одним локальным облучением (10 Грэй) пораженной опухолью конечности, одним введением ABI-007 в дозе 90 мг/кг, или обоими методами. Для определения оптимальной схемы лечения ABI-007 вводили от 5 дней до 9 часов перед облучением, а также через 24 часа после облучения. Исход лечения представляла собой абсолютная задержка роста опухоли (AGD), определяемая как разность в днях роста от 7 до 12 мм в диаметре между подвергнутой лечению и не леченой опухолью. Для групп, получавших лечение комбинацией ABI-007 и облучения, фактор усиления (EF) рассчитывали как отношение разности в днях роста от 7 до 12 мм между опухолями, подвергнутыми лечению комбинацией, и опухолями, подвергнутыми лечению одним ABI-007, к AGD опухолей, подвергнутых лечению только облучением. Для оценки усиливающего воздействие облучения эффекта ABI-007 для схемы фракционного облучения на исход излечения от опухоли выполняли анализ TCD50 и анализировали через 140 дней после лечения. Общие дозы от 5 до 80 Гр по 5 фракций в день подавали или отдельно, или в комбинации с ABI-007 за 24 часа до первой дозы облучения.
ABI-007 в качестве единственного средства значительно продлевал задержку роста опухоли OCa-I (37 дней) в сравнении с 16 днями для опухолей, не подвергнутых лечению. ABI-007 в качестве единственного средства был эффективнее, чем одна доза 10 Грэй, которая привела к задержке, составившей 29 дней. Для схем комбинированного лечения ABI-007, введенный в любое время до 5 дней перед облучением, давал сверхаддитивный противоопухолевой эффект. EF составил 1,3, 1,4, 2,4, 2,3, 1,9 и 1,6 при интервалах между лечением, соответственно, 9 часов, 24 часа и 2, 3, 4 и 5 дней. Когда ABI-007 вводили после облучения, эффект комбинированного противоопухолевого лечения был меньше, чем аддитивный. Комбинированное лечение ABI-007 и облучением также оказывало существенный эффект на излечение от опухоли, сдвигая TCD50 55,3 Гр для опухолей, подвергнутых лечению только облучением, до 43,9 Гр для опухолей, подвергнутых лечению комбинацией (EF 1,3).
Этот эксперимент продемонстрировал, что ABI-007 обладает противоопухолевой активностью в качестве единственного средства против OCa-I и усиливает эффект лучевой терапии при введении за несколько дней до нее. Как ранее было продемонстрировано для паклитаксела и доцетаксела, усиление эффекта облучения, вероятно, является результатом воздействия множественных механизмов, причем преобладающим является остановка клеточного цикла в G2/M при коротких интервалах между лечением и реоксигенация опухоли при более длительных интервалах.
Пример 14. Комбинация AbraxaneTM и ингибиторов тирозин киназы
Пульсирующее введение гефитиниба в комбинации с применением AbraxaneTM можно применять для ингибирования пролиферации опухолей, экспрессирующих EGFr. 120 «голых» мышей инокулировали клетками опухоли ВТ474 для получения, по меньшей мере, 90 мышей, несущих ксенотрансплантаты опухолей ВТ474, и делили на 18 экспериментальных плечей (по 5 мышей каждое). Мыши плеча 1 получали контрольные внутривенные инъекции. Все другие мыши получали 1 раз в неделю внутривенные инъекции AbraxaneTM в дозе 50 мг/кг в течение 3 недель. В плече 2 мыши получали только AbraxaneTM. В плечах 3, 4, 5, 6, 7, 8 мыши получали AbraxaneTM 1 раз в неделю, чему предшествовало пульсирующее введение гефитиниба в течение 2 дней в увеличивающихся дозах. В плечах 9, 10, 11, 12, 13 мыши получали AbraxaneTM 1 раз в неделю, чему предшествовало пульсирующее введение гефитиниба в течение 1 дня в увеличивающихся дозах. В плечах 14, 15, 16, 17, 18 мыши получали AbraxaneTM 1 раз в неделю наряду с ежедневным введением гефитиниба в увеличивающихся дозах. Устанавливали максимальную переносимую дозу гефитиниба, которую можно вводить при 1- или 2-дневном ведении AbraxaneTM 1 раз в неделю или при непрерывном введении AbraxaneTM. Кроме того, измерение противоопухолевых реакций определит, существует ли связь между дозой и реакцией, и имеет ли преимущества 2-дневное или 1-дневное пульсирующее введение. Эти данные используют для выбора оптимальной дозы гефитиниба при пульсирующем введении и оптимальной дозы при непрерывном ежедневном введении гефитиниба с AbraxaneTM.
120 «голых» мышей инокулировали клетками опухоли ВТ474 для получения 90 мышей, несущих опухоли. Этих мышей делили на 6 групп (по 15 каждая). Мыши плеча 1 получали контрольные внутривенные инъекции. Мыши плеча 2 получали AbraxaneTM в дозе 50 мг/кг внутривенно 1 раз в неделю в течение 3 недель. Мыши плеча 3 получали перорально гефитиниб в дозе 150 мг/кг/день. Мыши плеча 4 получали AbraxaneTM в дозе 50 мг/кг наряду с ежедневным введением гефитиниба в ранее установленной дозе. Мыши плеча 5 получали AbraxaneTM в дозе 50 мг/кг, которому предшествовало пульсирующее введение гефитиниба в ранее установленной дозе и с ранее установленной длительностью. Мышам плеча 6 проводили пульсирующее введение только гефитиниба 1 раз в неделю в ранее установленной дозе. После лечения в течение 3 недель мышей наблюдали до тех пор, пока контроли не достигли максимально допустимых размеров опухоли.
Пример 15. Фаза II исследования введения nabTM-паклитаксела (AbraxaneTM), карбоплатина с трастузумабом® 1 раз в неделю в качестве лечения первой линии запущенного HER-2 положительного рака молочной железы
Целью этого исследования была оценка (1) безопасности и переносимости и (2) объективной частоты введения 1 раз в неделю ударной дозы трастузумаба/AbraxaneTM/карбоплатина в качестве цитотоксической терапии первой линии для пациенток с запущенным/метастатическим (аденокарцинома IV стадии) раком молочной железы, избыточно экспрессирующим HER-2. Трастузумаб представляет собой моноклональное антитело, также известное как Herceptin®, которое связывается с внеклеточным сегментом рецептора erbB2.
Вкратце, в исследование были включены пациентки без недавней цитотоксической или лучевой терапии. Дозы AbraxaneTM увеличивали с 75 мг/м2 в виде 30-минутных внутривенных вливаний на 1, 8, 15 день до 100 мг/м2 для последующих циклов в соответствии со стандартным правилом 3+3. Карбоплатин AUC=2 вводили в виде 30-60-минутных внутривенных вливаний в 1, 8, 15 дни и в течение первоначального 29-дневного цикла. Трастузумаб вводили в виде 30-90-минутных внутривенных вливаний в 1, 8, 15 22 дни в дозе 4 мг/кг в 1-ю неделю и 2 мг/кг все последующие недели.
У 8 из 9 пациенток, у которых можно было произвести оценку реакции (подтвержденной плюс не подтвержденной), частота реакции составила 63% при стабильном заболевании в 38% случаев. Самыми частыми видами токсичности были нейтропения (3-ей степени: 44%; 4-ой степени: 11%) и лейкоцитопения (33%).
Эти результаты свидетельствуют о том, что трастузумаб плюс AbraxaneTM плюс карбоплатин продемонстрировали высокую степень противоопухолевой активности с приемлемой переносимостью в качестве лечения первой линии по поводу МВС.
Пример 16. Фаза II испытания капецитабина плюс nabTM-паклитаксел (AbraxaneTM) при лечении первой линии метастатического рака молочной железы
Целью этого исследования фазы II была оценка безопасности, эффективности (время до прогрессирования и общее выживание) и качества жизни пациенток с МВС, которые получали капецитабин в комбинации с AbraxaneTM. Капецитабин представляет собой фторпиримидинкарбамат, также известный как Xeloda®, который, как было показано, обладает существенной эффективностью при отдельном применении и в комбинации с таксанами при лечении МВС.
В этом открытом, одноплечевом исследовании, AbraxaneTM в дозе 125 мг/м2 вводили внутривенным вливанием в 1-й день и 8-й день 1 раз в 3 недели плюс капецитабин 825 мг/м2, вводимый перорально 2 раза в день с 1 по 14-й дни 1 раз в 3 недели. У пациенток не проводили предшествующей химиотерапии по поводу метастатического заболевания, и они не получали предшествующего лечения капецитабином и предшествующего лечения фторпиримидином и химиотерапии паклитакселом, проводимой в виде адъювантной схемы.
В исследование были включены 12 пациенток с анализом безопасности, завершенным у первых 6 пациенток, и частотой реакции, которую можно было оценить после 2 циклов, у первых 8 пациенток. Не было случаев необычной или неожиданной токсичности при отсутствии случаев токсичности 4 степени или нейропатии, большей, чем нейропатия 1 степени. Данные по реакции были подтверждены только по первым 2 циклам лечения (первая точка оценки) у 6 пациенток. 2 пациентки завершили 6 циклов. 2 пациентки завершили 6 циклов при 1 частичной реакции и одном стабильном заболевании. Из первых 8 пациенток после 2 циклов было 2 частичных реакции и 4 пациентки со стабильным заболеванием.
Эти результаты показывают, что комбинация капецитабина и AbraxaneTM, вводимого 1 раз в неделю в эффективных дозах, может применяться, и к настоящему времени новые случаи токсичности не выявлены. Связанная с AbraxaneTM токсичность представляла собой главным образом нейтропению без клинических последствий, и синдром кистей и стоп представлял собой основную токсичность капецитабина.
Пример 17. Поисковое исследование введения ударных доз доксорубицина плюс циклофосфамида с последующим введением nabTM-паклитаксела (AbraxaneTM) у пациенток с ранней стадией рака молочной железы
Целью этого исследования была оценка токсичности доксорубицина (адриамицина) плюс циклофосфамида с последующим введением AbraxaneTM при ранней стадии рака молочной железы.
У пациенток была операбельная, подтвержденная аденокарцинома молочной железы ранней стадии. Пациентки получали доксорубицин (адриамицин) в дозе 60 мг/м2 плюс циклофосфамид 600 мг/м2 (АС) 1 раз в 2 недели в течение 4 циклов с последующим введением AbraxaneTM в дозе 260 мг/м2 1 раз в 2 недели в течение 4 циклов.
30 пациенток получили 4 цикла АС, и 27 из 29 пациенток получили 4 цикла AbraxaneTM; 33% пациенток получили пегфилграстим (Neulasta®) по поводу отсутствия восстановления ANC (абсолютного количества нейтрофилов) во время введения AbraxaneTM. У 9 пациенток (31%) было снижение дозы AbraxaneTM ввиду негематологической токсичности. Всего у 9 пациенток была периферическая нейропатия (PN) 2 степени, и у 4 пациенток была PN 3 степени; степень PN снизилась ≥1 степень в пределах медианы 28 дней.
Эти результаты указывают на то, что лечение ударной дозой доксорубицина (60 мг/м2) плюс циклофосфамидом (600 мг/м2) 1 раз в 2 недели в течение 4 циклов с последующим введением ударной дозы AbraxaneTM (260 мг/м2) 1 раз в 2 недели в течение 4 циклов хорошо переносилось пациентками с ранней стадией рака молочной железы.
Пример 18. Введение nabTM-паклитаксела (AbraxaneTM) в качестве лечения первой линии метастатического рака молочной железы при добавлении трастузумаба у Her-2/neu-положительных пациенток
Целью настоящего исследования было продвижение введения Abraxane 1 раз в неделю к схеме лечения первой линии и добавление трастузумаба для Her-2/neu-положительных пациенток.
В это открытое исследование фазы II были включены и 20 HER-2-положительных пациенток и 50 HER-2-отрицательных пациенток с локально запущенным или метастатическим раком молочной железы. AbraxaneTM вводили в дозе 125 мг/м2 30-минутным внутривенным вливанием в 1, 8 и 15-й день с последующей неделей отдыха. Трастузумаб вводили одновременно с исследованием лечения у пациенток, которые были HER-2-положительными. Первичным исходом была частота реакции, а вторичными исходами были время до прогрессирования (ТТР), общее выживание (OS) и токсичность.
В популяции безопасности 23 пациентки к настоящему времени получили в среднем 3 цикла AbraxaneTM. Самым частым связанным с лечением неблагоприятным явлением была нейтропения 3 степени (8,7%) при отсутствии неблагоприятных явлений 4 степени. 1 из 4 оцениваемых пациенток реагировала на лечение.
Пример 19. Фаза I испытания nabTM-паклитаксела (AbraxaneTM) и карбоплатина
Целью настоящего исследования было определение максимальной переносимой дозы AbraxaneTM (и 1 раз в неделю, и 1 раз в 3 недели) с карбоплатином AUC=6 и сравнение эффектов последовательности введения на фармакокинетику (РК).
В исследование были включены пациенты с гистологически или цитологически документированным злокачественным процессом, который прогрессировал после «стандартного лечения». Пациенты в плече 1 получали AbraxaneTM 1 раз в 3 недели в формате увеличения дозы на основании данных о токсичности в 1 цикле (220, 260, 300, 340 мг/м2) 1 раз в 3 недели с последующим введением карбоплатина AUC=6. Пациенты в плече 2 получали 1 раз в неделю (дни 1, 8, 15 с последующей 1 неделей без введения) AbraxaneTM (100, 125, 150 мг/м2) с последующим введением карбоплатина AUC=6. Для части РК исследования после введения AbraxaneTM следовало введение карбоплатина в 1 цикле, и порядок введения был обратным в цикле 2 при уровнях РК, определяемых в первые 6, 24, 48 и 72 часа.
При схеме введения 1 раз в 3 недели нейтропения, тромбоцитопения и нейропатия были самыми частыми видами токсичности 3/4 степени (3/17 каждый). При схеме введения 1 раз в неделю нейтропения 5/13 была самым частым видом токсичности 3/4 степени. Самыми лучшими реакциями на введение 1 раз в неделю в самой высокой дозе 125 мг/м2 (n=6) были 2 частичных реакции (рак поджелудочной железы, меланома) и 2 стабильных заболевания (NSCLC). Наилучшими реакциями на введение 1 раз в 3 недели в самой высокой дозе 340 мг/м2 (n=5) были 1 стабильное заболевание (NSCLC) и 2 частичных реакции (SCLC, пищеводный).
Эти данные указывают на активность комбинации AbraxaneTM и карбоплатина. MTD для введения 1 раз в неделю составила 300 мг/м2, а для введения 1 раз в 3 недели составила 100 мг/м2.
Пример 20. Фаза II испытания ударных доз гемцитабина, эпирубицина и nabTM-паклитаксела (AbraxaneTM) (GEA) при локально запущенном/воспалительном раке молочной железы
В фазе II открытого исследования режим индукционной/неоадъювантной терапии вводили перед локальным вмешательством. Схема лечения представляла собой гемцитабин 2000 мг/м2 внутривенно 1 раз в 2 недели в течение 6 циклов, эпирубицин 50 мг/м2 1 раз в 2 недели в течение 6 циклов, AbraxaneTM 175 мг/м2 1 раз в 2 недели в течение 6 циклов с пегфилграстимом 6 мг подкожно на 2-ой день 1 раз в 2 недели. Режим индукционной/неоадъювантной терапии после локального вмешательства представлял собой гемцитабин 2000 мг/м2 1 раз в 2 недели в течение 4 циклов, AbraxaneTM 220 мг/м2 1 раз в 2 недели в течение 4 циклов и пегфилграстим 6 мг подкожно на 2-ой день 1 раз в 2 недели. Пациентками были женщины с гистологически подтвержденной локально запущенной/воспалительной аденокарциномой молочной железы.
Пример 21. Цитотоксическая активность nab-рапамицина в комбинации с AbraxaneTM в отношении сосудистых гладкомышечных клеток
Сосудистые гладкомышечные клетки (VSMC) высевали на 96-луночные планшеты в присутствии возрастающих концентраций nab-рапамицина и 0 мкМ, 1 мкМ, 10 мкМ или 100 мкМ AbraxaneTM (ABI-007). Для оценки цитотоксического эффекта nab-рапамицина и AbraxaneTM обработанные VSMC окрашивали гомодимером-1 этидия (Invitrogen, Carlsbad CA) и анализировали на наличие красной флюоресценции. Гомодимер-1 этидия представляет собой высоко аффинную, флюоресцентную краску нуклеиновых кислот, которая способна проходить только через нарушенные мембраны мертвых клеток для окрашивания нуклеиновых кислот. Как показано на фиг.7А, nab-рапамицин, сам по себе, проявлял зависимое от дозы уничтожение клеток, как продемонстрировано увеличивающейся флюоресценцией. Уничтожение клеток nab-рапамицином не усиливалось AbraxaneTM в концентрации 1 мкМ или 10 мкМ; однако, оно значительно усиливалось AbraxaneTM в концентрации 100 мкМ (ANOVA, p<0,0001). Клетки, окрашенные гомодимером-1 этидия, как показано на фиг.7А, также контактировали с кальцеином. Кальцеин АМ (Invitrogen) представляет собой не флюоресцентную молекулу, которая гидролизуется во флюоресцентный кальцеин неспецифичными цитозольными эстеразами. Живые клетки, контактировавшие с АМ кальцеина, проявляют ярко зеленую флюоресценцию, т.к. они способны генерировать флюоресцентный продукт и удерживать его. Как показано на фиг.7В, nab-рапамицин проявил зависимую от дозы цитотоксическую активность, что проявлялось уменьшенным количеством флюоресцентного окрашивания кальцеином. Снижение флюоресценции усиливалось совместной инкубацией с AbraxaneTM зависимым от дозы образом. Статистический анализ методом ANOVA (методом вариационного анализа) дал p<0,0001 при всех концентрациях препарата AbraxaneTM.
Пример 22. Цитотоксическая активность nab-рапамицина в комбинации с AbraxaneTM против ксенотрансплантата опухоли НТ29 (карциномы ободочной кишки человека)
«Голым» мышам в правый бок имплантировали 106 клеток НТ29. Лечение начинали, когда опухоли становились пальпируемыми и были объемом больше, чем 100-200 мм3. Мышей методом случайной выборки включали в 4 группы (n=8 на группу). Группа 1 получала солевой раствор 3 раза в неделю в течение 4 недель внутривенно; группа 2 получала AbraxaneTM в дозе 10 мг/кг в день в течение 5 дней внутрибрюшинно; группа 3 получала nab-рапамицин в дозе 40 мг/кг 3 раза в неделю в течение 4 недель внутривенно; и группа 4 получала и nab-рапамицин (40 мг/кг 3 раза в неделю в течение 4 недель внутривенно), и AbraxaneTM (10 мг/кг в день в течение 5 дней внутрибрюшинно). Как показано на фиг.8, подавление опухоли было больше для комбинированного лечения AbraxaneTM плюс nab-рапамицин, чем для любой группы лечения одним препаратом.
Пример 23. Цитотоксическая активность nab-17-AAG в комбинации с AbraxaneTM против ксенотрансплантата опухоли Н358 (карцинома легких человека)
«Голым» мышам в правый бок имплантировали 107 клеток Н358. Лечение начинали, когда опухоли становились пальпируемыми и были объемом больше, чем 100-200 мм3. Мышей методом случайной выборки включали в 4 группы (n=8 на группу). Группа 1 получала солевой раствор 3 раза в неделю в течение 4 недель внутривенно; группа 2 получала AbraxaneTM в дозе 10 мг/кг в день в течение 5 дней внутрибрюшинно; группа 3 получала nab-17-AAG в дозе 80 мг/кг 3 раза в неделю в течение 4 недель внутривенно; и группа 4 получала и nab-17-AAG (80 мг/кг 3 раза в неделю в течение 4 недель внутривенно), и AbraxaneTM (10 мг/кг в день в течение 5 дней внутрибрюшинно). Как показано на фиг.9, подавление опухоли было больше для комбинированного лечения nab-17-AAG плюс AbraxaneTM, чем для любой группы лечения одним препаратом.
Хотя представленное выше изобретение было описано в некоторых деталях путем иллюстрации и примера в целях ясности и понимания, для специалистов в данной области очевидно, что в него могут быть внесены определенные небольшие изменения и модификации. Поэтому, описание и примеры не следует рассматривать как ограничивающие объем изобретения.
Все ссылки, включая публикации, патентные заявки и патенты, приведенные здесь, включены сюда в качестве ссылки в той же степени, как если бы каждая ссылка была отдельно и специально указана как включенная в качестве ссылки и полностью изложенная здесь.
Здесь описаны предпочтительные варианты осуществления настоящего изобретения, включая наилучший способ реализации изобретения, известный заявителям. Варианты этих предпочтительных вариантов осуществления могут стать очевидными средним специалистам в данной области по прочтении предыдущего описания. Заявители ожидают, что специалисты используют такие варианты соответствующим образом, и заявители предполагают, что изобретение будет осуществлено иным образом, чем конкретно описано в настоящем описании. Соответственно, настоящее изобретение включает все модификации и эквиваленты предмета изобретения, приведенного в прилагаемой формуле изобретения, что допускается применяемым законодательством. Кроме того, при отсутствии других указаний или ясных противоречий с контекстом, любая комбинация описанных выше элементов во всех возможных их вариантах охватывается изобретением.
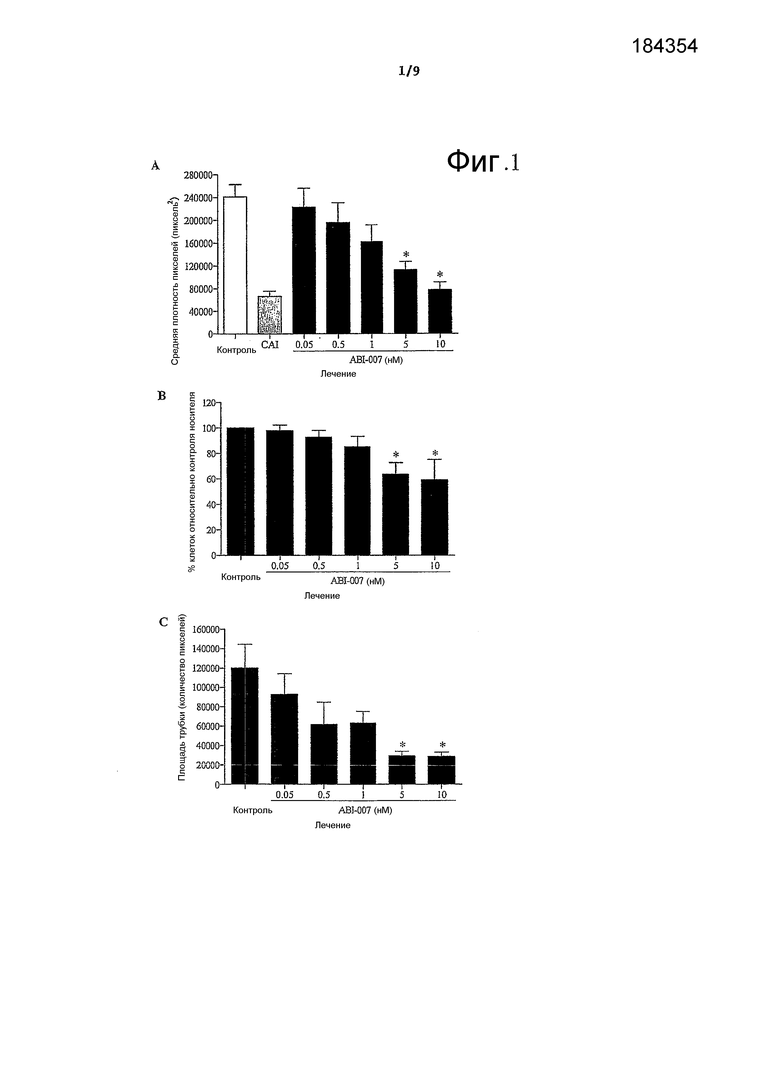
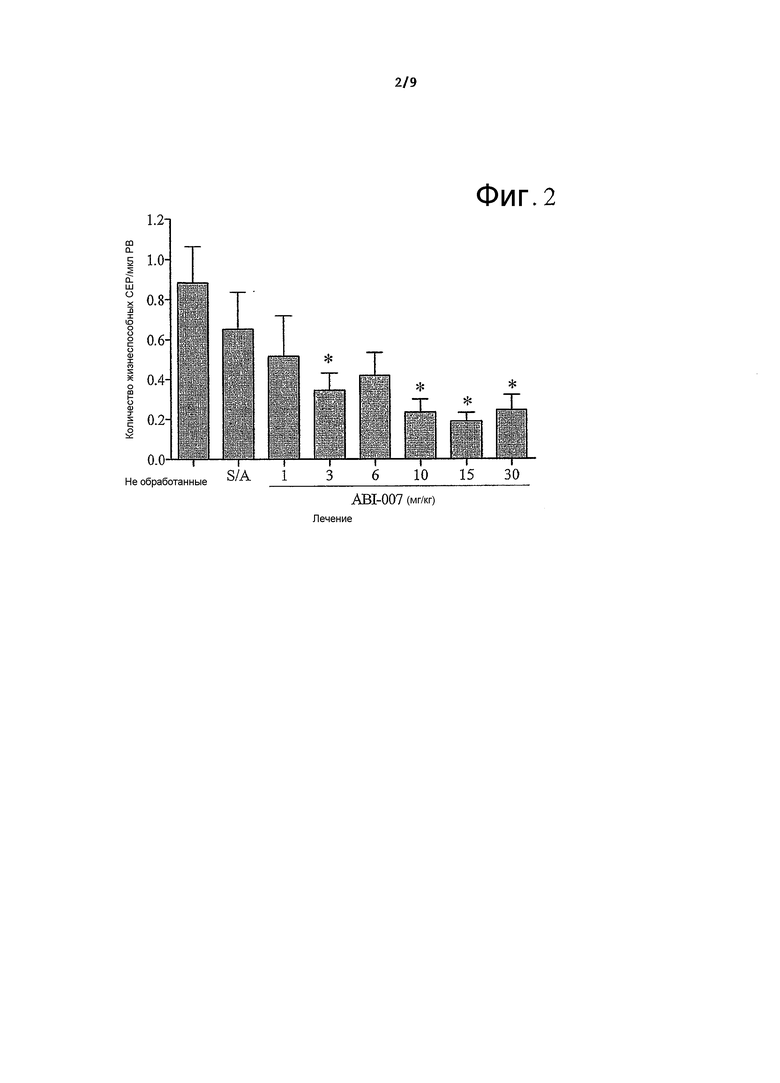

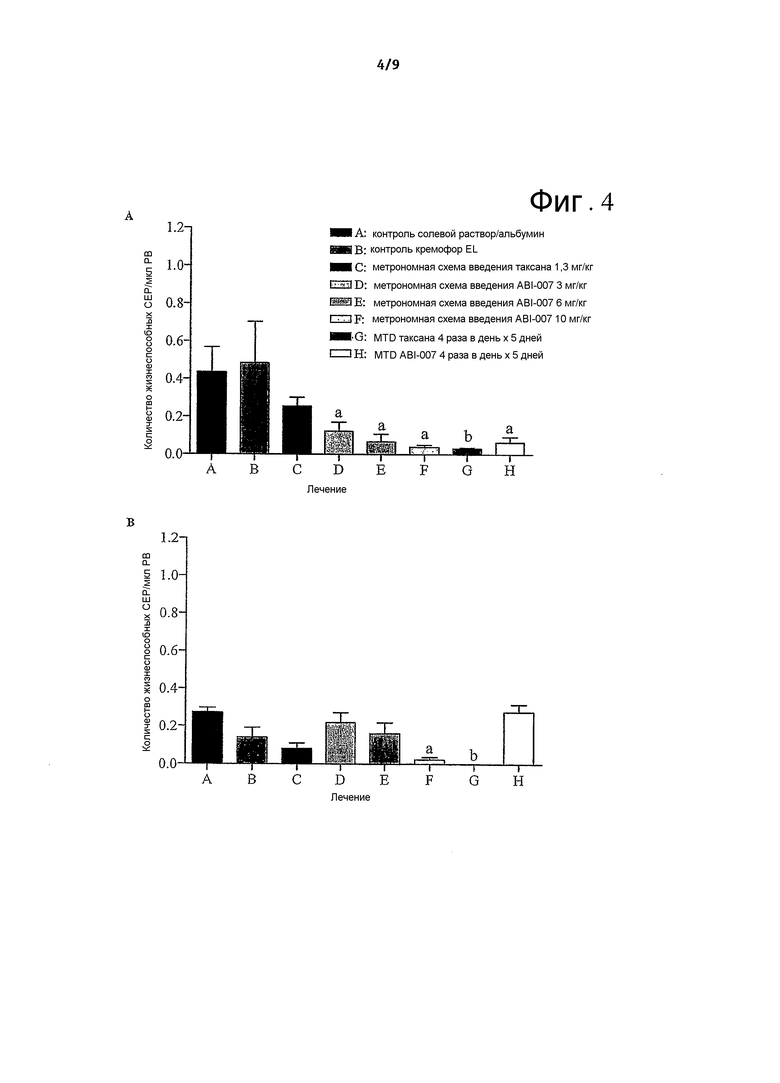
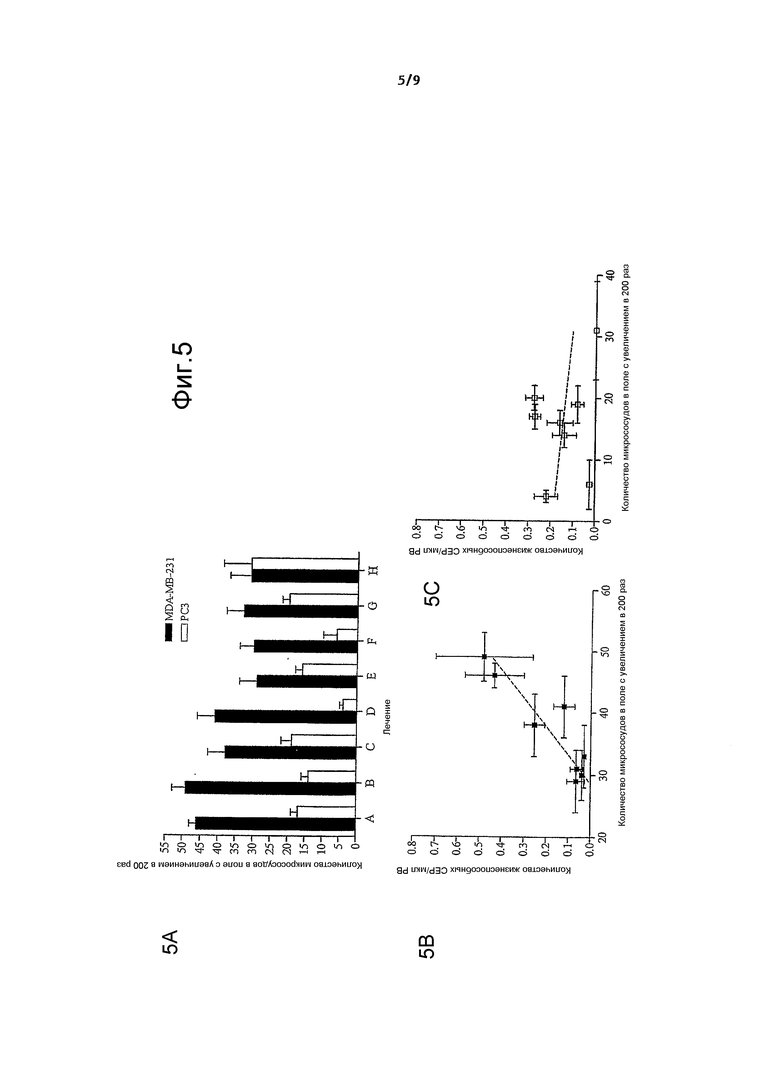
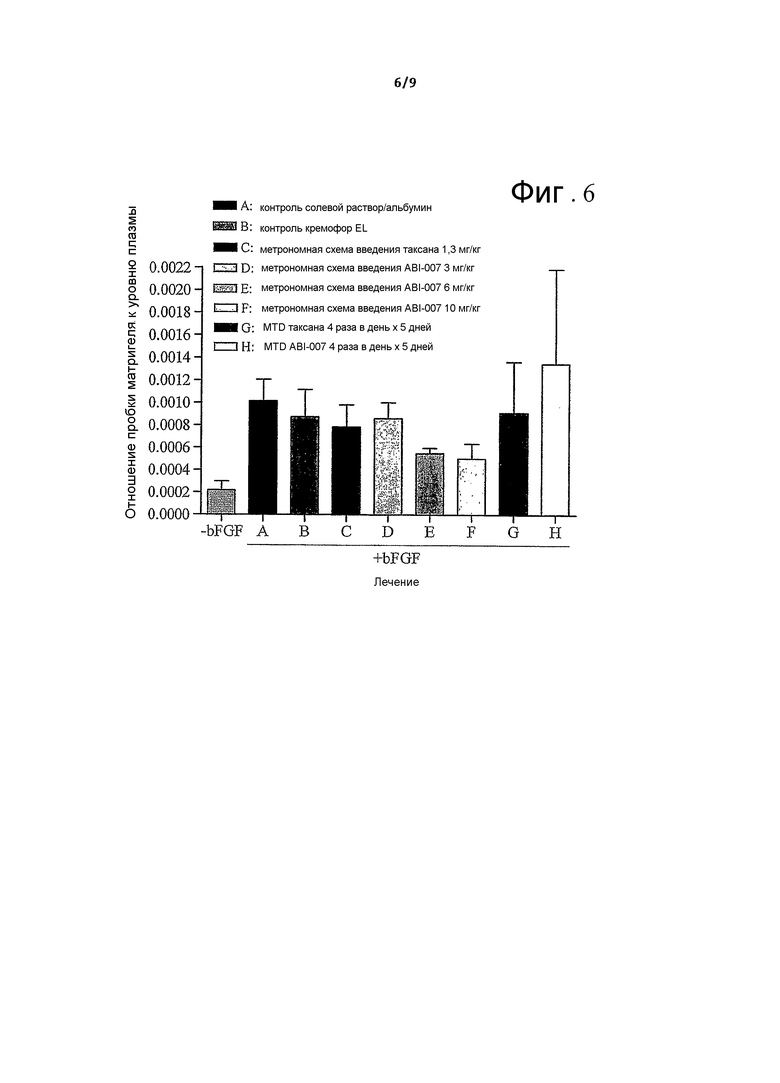
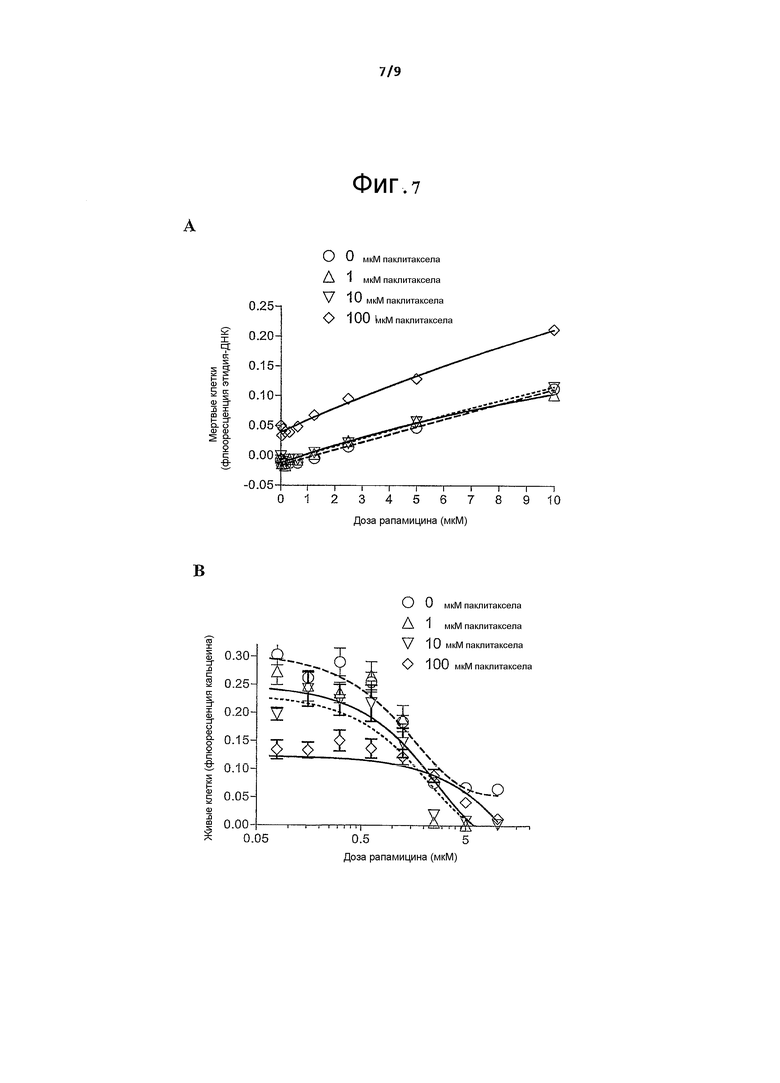
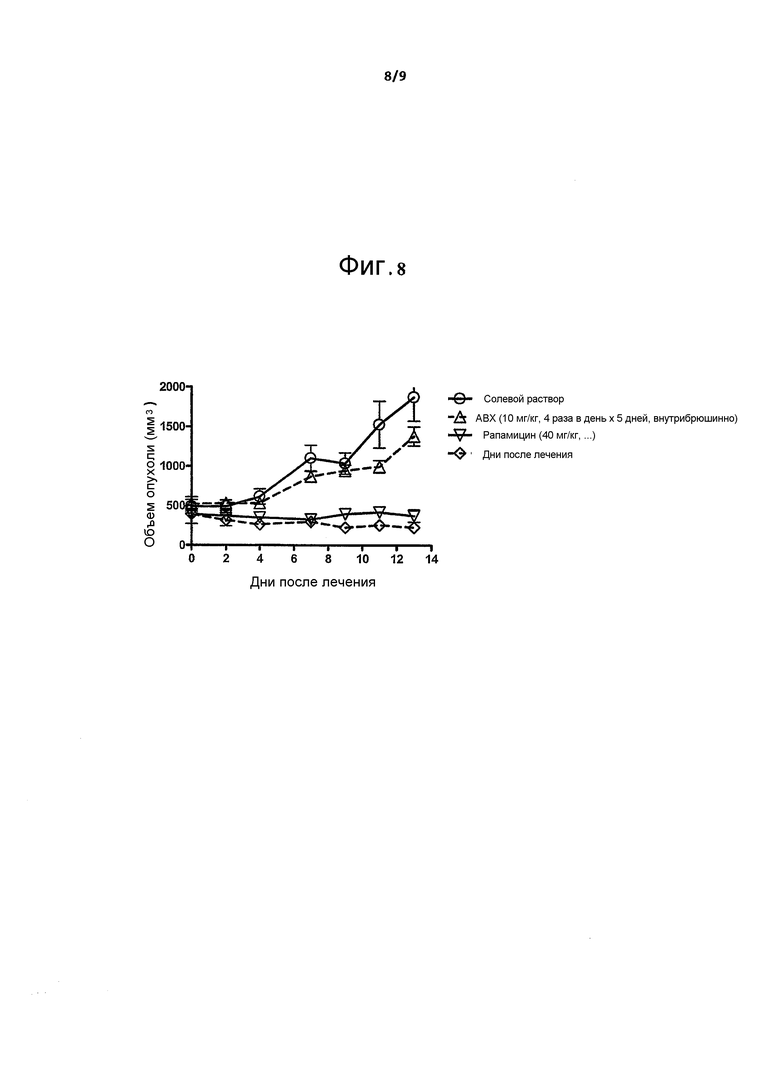
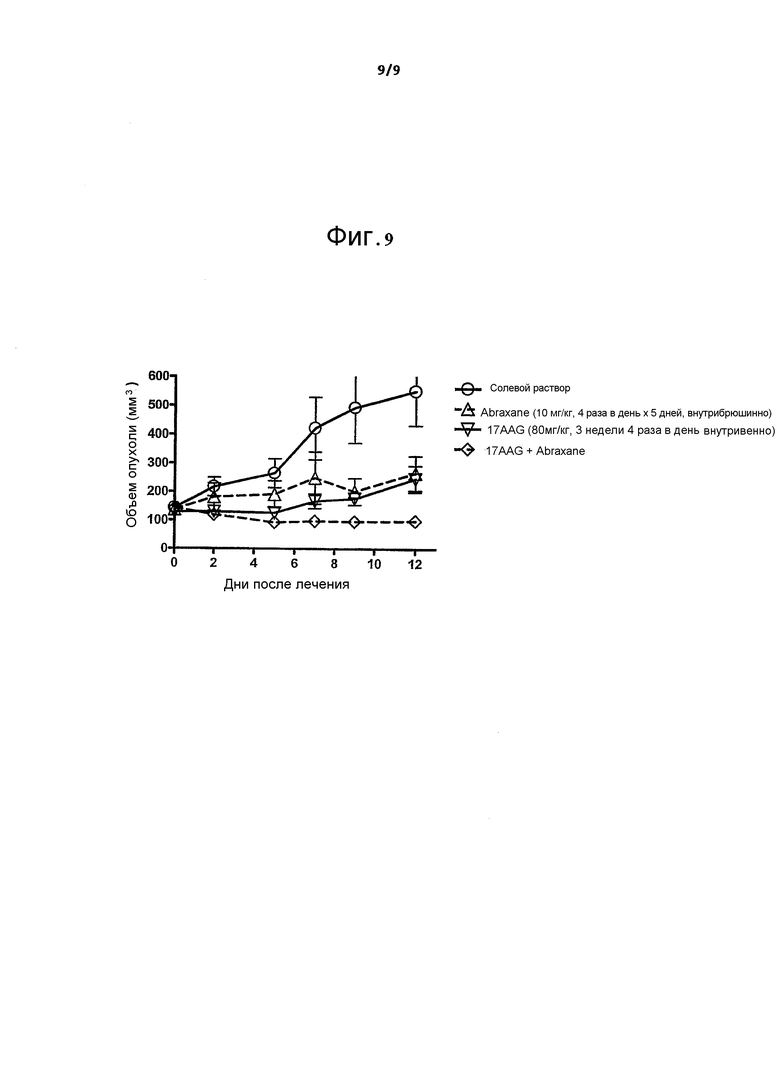
Изобретение относится к медицине, а именно к онкологии, и может быть использовано для лечения рака яичников у индивидуума. При этом лечение включает: a) первое лечение, включающее введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие паклитаксел и белок-носитель, и b) второе лечение, включающее лучевую терапию, где первое лечение проводят перед вторым лечением. Изобретение обеспечивает лечение рака яичников у пациента. 21 з.п. ф-лы, 9 ил., 3 табл., 23 пр.
1. Способ лечения рака яичников у индивидуума, включающий:
a) первое лечение, включающее введение индивидууму эффективного количества композиции, содержащей наночастицы, включающие паклитаксел и белок-носитель, и
b) второе лечение, включающее лучевую терапию, где первое лечение проводят перед вторым лечением.
2. Способ по п. 1, где композиция содержит наночастицы, включающие паклитаксел, покрытый белком-носителем.
3. Способ по п. 1, где белок-носитель представляет собой альбумин.
4. Способ по п. 3, где альбумин представляет собой человеческий сывороточный альбумин.
5. Способ по п. 1, где средний диаметр наночастиц в композиции составляет не больше чем примерно 200 нм.
6. Способ по п. 5, где средний диаметр наночастиц, содержащих паклитаксел и белок-носитель не больше чем приблизительно 150 нм.
7. Способ по п. 6, где средний диаметр наночастиц, содержащих паклитаксел и белок-носитель не больше чем приблизительно 130 нм.
8. Способ по п. 1, где массовое отношение белка-носителя к паклитакселу составляет менее чем примерно 18:1.
9. Способ по п. 1, где массовое отношение белка-носителя в композиции составляет 10:1 или менее.
10. Способ по п. 1, где соотношение между массой альбумина и паклитаксела составляет примерно 9:1.
11. Способ по п. 10, где композиция в виде наночастиц, по существу, свободна от Cremophor.
12. Способ по п. 1, где индивидуум представляет собой человека.
13. Способ по п. 1, где композиция пригодна для введения внутривенно.
14. Способ по п. 1, где рак является устойчивым к лечению паклитакселом или доцетакселом.
15. Способ по п. 1, где композицию, содержащую паклитаксел и белок-носитель, вводят в дозе 50-250 мг/м2.
16. Способ по п. 18, где композицию, содержащую паклитаксел и белок-носитель, вводят в дозе 60-175 мг/м2.
17. Способ по п. 1, дополнительно включающий введение одного или нескольких дополнительных химиотерапевтических средств.
18. Способ по п. 17, где одно или несколько дополнительных химиотерапевтических средств выбрано из группы, состоящей из антиметаболитов, средств на основе платины, алкилирующих агентов, ингибиторов тирозинкиназы, антрациклиновых антибиотиков, алкалоидов винки, ингибиторов протеасом, макролидов, терапевтических антител, антиангиогенных средств и ингибиторов топоизомеразы.
19. Способ по п. 1, где композицию наночастиц вводят менее чем за 10 дней до лучевой терапии.
20. Способ по п. 1, где композицию наночастиц вводят менее чем за 5 дней до лучевой терапии.
21. Способ по п. 1, где композицию наночастиц вводят менее чем за 120 часов до лучевой терапии.
22. Способ по п. 1, где композицию наночастиц вводят от 9 часов до 5 дней перед облучением.
| BELLON J.R | |||
| et al | |||
| Concurrent radiation therapy and paclitaxel or docetaxel chemotherapy in high-risk breast cancer | |||
| Int J Radiat Oncol Biol Phys | |||
| ЩИТОВОЙ ДЛЯ ВОДОЕМОВ ЗАТВОР | 1922 |
|
SU2000A1 |
| 0 |
|
SU189522A1 | |
| N.K | |||
| IBRAHIM et al | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| SAFRAN H et al | |||
| Paclitaxel and concurrent radiation therapy for locally advanced adenocarcinomas of the pancreas, stomach, and gastroesophageal junction | |||
| Semin Radiat Oncol | |||
| Металлический водоудерживающий щит висячей системы | 1922 |
|
SU1999A1 |
| FORNENTI S.C | |||
| et al | |||
| Concurrent paclitaxel and radiation therapy for breast cancer | |||
| Semin Radiat Oncol | |||
| Металлический водоудерживающий щит висячей системы | 1922 |
|
SU1999A1 |
| J | |||
| L | |||
| BLUM et al | |||
| Long term disease control in taxane-refractory metastatic breast cancer treated with nab paclitaxel | |||
| Journal of Clinical Oncology, 2004 ASCO Annual Meeting Proceedings (Post-Meeting Edition) | |||
| Машина для добывания торфа и т.п. | 1922 |
|
SU22A1 |
| Печь для сжигания твердых и жидких нечистот | 1920 |
|
SU17A1 |
| American Pharmaceutical Partners Presents Data on High Dose Weekly ABRAXANE(TM) in Taxane-Refractory Metastatic Breast Cancer Patients | |||
| Насос | 1917 |
|
SU13A1 |
| Печь для сжигания твердых и жидких нечистот | 1920 |
|
SU17A1 |
Авторы
Даты
2017-10-02—Публикация
2012-02-22—Подача