Область техники, к которой относится изобретение
Изобретение относится к области медицины, стоматологии и клинико-лабораторной диагностики, в частности к определению степени обсемененности пародонта человека компонентом нормальной микрофлоры (потенциальным антагонистом пародонтопатогенов) Streptococcus sanguinis. Предметом изобретения является тест-система на основе ПЦР в реальном времени, позволяющая оценить степень обсемененности пародонта S. sanguinis.
Высокая обсемененность пародонта пациента S. sanguinis свидетельствует о его высокой устойчивости к гиперколонизации такими пародонтопатогенами, как Tannerella forsythensis и Treponema denticola, и в меньшей степени Porphyromonas gingivalis и Prevotella intermedia. Низкая представленность S. sanguinis в микробиоценозе пародонта конкретного пациента или его полное отсутствие является прогностическим признаком, свидетельствующим о повышенном риске сверхкритической колонизации пародонта патогенами и последующем развитии хронического генерализованного пародонтита (ХГП). Наибольшей эффективности при оценке состояния пародонта можно добиться за счет параллельного измерения представленности в микробиоценозе пародонта патогенов: Aggregatibacter actinomycetemcomitans, Porphyromonas gingivalis, Prevotella intermedia, Tannerella forsythensis и Treponema denticola [1-5] и S. sanguinis. Данный подход позволяет прогнозировать динамику развития заболевания и производить оценку результативности курса лечения, пройденного пациентом.
Уровень техники
В настоящее время основной причиной развития пародонтита считается колонизация пародонта пародонтопатогенами красного комплекса по Сокранскому: Aggregatibacter actinomycetemcomitans, Porphyromonas gingivalis, Prevotella intermedia, Tannerella forsythensis и Treponema denticola [6]. Все существующие методы лечения ХГП (антибиотикотерапия, фотодинамическая терапия, озонотерапия, использование инфракрасного лазера, аппараты типа «Вектор») направлены на снижение обсемененности пародонта этими видами бактерий. Специалисты и сами пациенты наблюдают положительный эффект от использования этих средств, однако, как правило, он оказывается неустойчивым: в срок от нескольких месяцев до нескольких лет пациенты, склонные к ХГП, вынуждены проходить повторные курсы лечения. Причины индивидуальной склонности пациентов к рецидивированию инфекции пародотопатогенов остаются неясными, однако можно предполагать, что они связаны с недостаточной представленностью в микробиоценозе пародонта бактерий-протекторов - антагонистов патогенов. В настоящее время в диагностике пародонтита не применяется анализ компонентов микробиоценоза пародонта, способных препятствовать его гиперколонизации патогенами. В целом, в литературе практически не уделяется внимания этому вопросу.
Одной из работ, в которой рассматривается вопрос наличия на пародонте как патогенной, так и протекторной микрофлоры, является статья «Идентификация ключевых элементов нормальной и патогенной микрофлоры, определяющей состояние пародонта, методом NSG-секвенирования банков 16S-рДНК бактериальных консорциумов пародонта» [7]. В этой работе с применением метода NGS-секвенирования выявлены 6 родов потенциальных пародонтопротекторов и 8 родов потенциальных пародонтопатогенов, имеющих отношение к риску возникновения агрессивного (но не хронического) пародонтита. У лиц со здоровым пародонтом было выявлено статистически достоверное доминирование рода Veillonella, которое, таким образом, предложено рассматривать в качестве критерия здоровья пародонта. В качестве кандидатных пародонтопротекторов предложены также роды Streptococcus, Bergeyella, Granulicatella, Kingella и Corynebacterium.
Известны следующие аналоги данного изобретения:
Патент №2306341, дата публикации 20.09.2007 (с 08.04.2010 патент прекратил действие, но может быть восстановлен): «Набор реагентов для определения ДНК пародонтопатогенных микробов Prevotella intermedia sensu stricto, Bacteroides forsythus, Treponema denticola, Actinobacillus actinomycetemcomitans, Porphyromonas gingivalis при помощи мультиплексной полимеразной цепной реакции»
Это изобретение позволяет определить пять парадонтопатогенов в одном образце с помощью мультиплексной ПЦР, что достигается использованием комбинации 16s rDNA - праймеров в определенных концентрациях.
Набор содержит также комплект для подготовки пробы и положительный и отрицательный контрольные образцы. Анализ продуктов ПЦР осуществляется методом электрофореза.
Патент №2420591, дата публикации 10.06.2011. Изобретение представляет собой набор синтетических олигонуклеотидов для выявления ДНК пародонтопатогенного микроорганизма Porphyromonas gingivalis. Техническим результатом, на достижение которого направлено данное решение, является достоверное обнаружение указанной бактерии в биологическом материале, забранном с помощью стоматологических зондов. Указанный результат достигается путем использования при постановке ПЦР набора синтетических олигонуклеотидов для выявления ДНК пародонтотопагенного микроорганизма Porphyromonas gingivalis.
Патент №2420589, дата публикации 10.06.2011. Изобретение представляет собой набор синтетических олигонуклеотидов для выявления ДНК пародонтопатогенного микроорганизма Prevotella intermedia. Техническим результатом, на достижение которого направлено данное решение, является достоверное обнаружение указанной бактерии в биологическом материале, забранном с помощью стоматологических зондов. Указанный результат достигается путем использования при постановке ПНР набора синтетических олигонуклеотидов для выявления ДНК пародонтотопагенного микроорганизма Prevotella intermedia, включающего в себя праймеры.
Патент №2420592, дата публикации 10.06.2010. Изобретение представляет собой набор синтетических олигонуклеотидов для выявления ДНК пародонтопатогенного микроорганизма Actinobacillus actinomycetemcomitans. Техническим результатом, на достижение которого направлено данное решение, является достоверное обнаружение указанной бактерии в биологическом материале, забранном с помощью стоматологических зондов.
Указанный результат достигается путем использования при постановке ПЦР набора синтетических олигонуклеотидов для выявления ДНК пародонтопатогенного микроорганизма Actinobacillus actinomycetemcomitans.
Во всех перечисленных патентах предлагается оценивать обсемененность пародонта патогенными микроорганизмами, для чего предлагаются тест-системы, включающие наборы соответствующих синтетических олигонуклеотидов (праймеры и зонды) для проведения ПЦР.
Предлагаемое изобретение отличается тем, что предлагается оценивать уровень обсемененности пародонта бактерией - антагонистом патогенных микроорганизмов (парадонтопротектором) методом ПЦР-РВ для чего предлагается тест-система, содержащая набор праймеров и зондов, а также способ оценки состояния пародонта человека на предмет устойчивости к развитию хронического генерализованного пародонтита.
Раскрытие изобретения
Нами предлагается способ оценки состояния пародонта человека на предмет устойчивости к развитию хронического генерализованного пародонтита, вызываемого Treponema denticola и/или Tannerella forsythensis, в котором в качестве специфического маркера используется ДНК бактерии-пародонтопротектора S. Sanguinis.
Техническим результатом изобретения является метод достоверного обнаружения S. sanguinis в биологическом материале с возможностью количественной оценки ДНК бактерии в пародонтальном смыве.
Данный результат достигается путем использования при проведении ПНР набора синтетических олигонуклеотидов для выявления ДНК пародонтопротекторного микроорганизма S. sanguinis по принципу ПНР в реальном времени, включающего в себя праймеры и зонд:
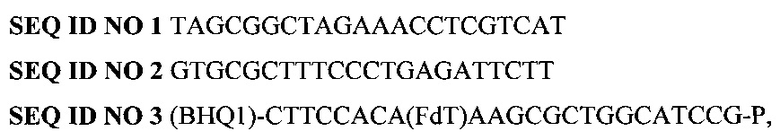
где BHQ1 означает присоединенный к 5'-концевому нуклеотиду темновой гаситель флуоресценции, a FdT - флуоресцентный краситель FAM, присоединенный к нуклеотиду Т.
Забор биологического материала из пародонтального кармана у пациентов осуществляется при помощи стерильных бумажных эндодонтических штифтов (размер №30-35), которые затем помещают в пробирку с реактивом «Проба-Рапид» (ООО «НПО ДНК-Технология», Россия) объемом 0,5 мл и транспортируют в лабораторию в охлажденном состоянии. Обработку материала проводят в срок не более 6 ч. Забор проводят в двух повторностях от каждого пациента.
Выделение суммарной ДНК пародонтального смыва осуществляют при помощи набора реагентов «Проба-ГС» (ООО «НПО ДНК-Технология», Россия) в соответствии с инструкцией к набору реагентов. Препарат ДНК, соответствующий 1/10 объема одного смыва (50 мкл), растворяют в 50 мкл элюирующего раствора (комплектация «Проба-ГС»). В качестве матрицы для проведения одной ПЦР-реакции используют 5 мкл полученного препарата.
Методика проведения ПЦР в реальном времени:
1. В промаркированные полипропиленовые пробирки для ПЦР в реальном времени (Axygen) объемом 200 мкл вносят компоненты реакционной смеси для выполнения ПЦР.
Состав буфера на одну реакцию (20 мкл смеси), мкл:
- 18 - ПЦР буфер (Комплект реагентов для ПЦР амплификации, ООО «НПО ДНК-Технология», Россия);
- 1,695 - вода;
- 0,27 - dNTP 25 мкМ;
- 0,014 - праймер 1,100 мкМ;
- 0,014 - праймер 2, 100 мкМ;
- 0,007 - зонд, меченный флуорофором Fam и гасителем BHQ, 50 мкМ.
В каждую пробирку вносят каплю расплавленного парафина для разграничения компонентов реакционной смеси до начала реакции.
Праймеры для выявления S. sanguinis, представляющие собой синтетические олигонуклеотиды к маркерному участку генома S. sanguinis SK36 длиной 232 п.н. - локусу ср000387.1 гена IgA1-специфичная протеаза, вводятся в реакцию с целью обеспечения амплификации продукта. Зонд, специфичный к этому же участку ДНК, имеет в своем составе флуоресцентную метку и гаситель флуоресценции, а его 3'-конец не способен к удлинению ДНК-полимеразой за счет блокировки гидроксильной группы. В случае образования специфического продукта ДНК зонд специфически взаимодействует с ним и частично разрушается ДНК-полимеразой. При этом действие гасителя на флуоресцентную метку в пределах молекулы зонда прекращается за счет их разобщения, что ведет к возрастанию уровня флуоресценции зонда. Сигнал флуоресценции реакционной смеси считывается термоциклером с оптической системой детекции в реальном времени или с некоторой периодичностью (например, один раз за цикл амплификации). Интенсивность флуоресценции зонда позволяет оценивать концентрацию образовавшегося продукта, что, в свою очередь, зависит от эффективности соединения праймеров с ДНК-матрицей, количества исследуемого материала и других параметров. Иными словами, праймеры обеспечивают протекание реакции, а зонд - оценку ее результатов.
2. Ex tempora приготавливают разведенный раствор Taq-полимеразы (Комплект реагентов для ПЦР амплификации, ООО «НПО ДНК-Технология», Россия), смешивая стоковый раствор фермента и воду в соотношении: 0,5 мкл полимеразы на 10 мкл ПЦР буфера (Комплект реагентов для ПЦР амплификации, ООО «НПО ДНК-Технология», Россия) в расчете на одну реакцию. В каждую промаркированную пробирку вносят по 10 мкл свежеразведенного раствора Taq-полимеразы, не повреждая слой парафина, и 5 мкл раствора анализируемой ДНК. В каждую пробирку вносят по капле минерального масла, не повреждая слой парафина.
3. Отрицательный контрольный образец (ОКО) - образец, который вводится в определение без использования ДНК. Взамен нее в пробирку добавляют 5 мкл деионизованной воды. ОКО необходим для контроля возможного загрязнения реактивов продуктами ранее проведенных реакций. Положительный результат в этом образце требует аннулировать результаты тестирования всей серии, Определение должно быть повторено с применением вновь приготовленных реагентов.
4. Пробирки устанавливают в термоциклер ДТ-322 (ООО «НПО ДНК-Технология», Россия) или аналогичный по техническим возможностям. Общий объем реакционной смеси составляет 35 мкл.
Параллельно с определением специфических последовательностей ДНК S. sanguinis проводится определение общей бактериальной массы в образце (нормировочный параметр), для чего параллельно проводят реакцию ПЦР в реальном времени с использованием следующих олигонуклеотидных праймеров и зонда:
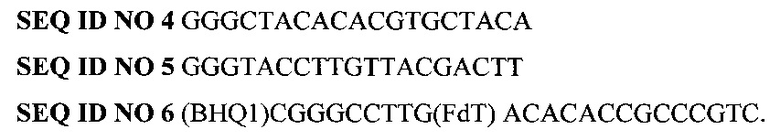
где BHQ1 означает присоединенный к 5'-концевому нуклеотиду темновой гаситель флуоресценции, a FdT - флуоресцентный краситель FAM, присоединенный к нуклеотиду Т.
Реакционную смесь для определения общей бактериальной массы проводят по методике, идентичной описанной для определения специфических последовательностей ДНК S. sanguinis за исключением того, что вместо праймеров SEQ ID NO 1 и SEQ ID NO 2 используют праймеры SEQ ID NO 4 и SEQ ID NO 5, а вместо зонда SEQ ID NO 3 используют зонд SEQ ID NO 6 в эквивалентных молярных концентрациях.
Реакцию проводят со следующими параметрами циклирования:
Программа амплификации:
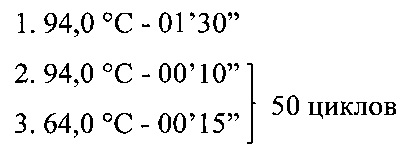
Настройки анализа, устанавливаемые на приборе:
Метод - Геометрический (Ср) (BF), cr=9, vt=10, tp=30, tv=5
Для каждой реакции программное обеспечение термоциклера автоматически вычисляет величину порогового цикла Ct.
Нормировку сигнала при определении специфических последовательностей ДНК S. sanguinis для каждого образца проводят, вычисляя величину «относительного Ct». Для этого из величины абсолютного Ct, полученных при определении специфических последовательностей ДНК S. sanguinis (усредненного по двум образцам одной серии) вычитают усредненную величину Ct общей бактериальной массы для того же образца серии.
Нормальная обсемененность пародонта фиксируется при условии, что величина относительного Ct для S. sanguinis составляет 15,0 циклов или более.
Осуществление изобретения:
Клинический материал был собран на базе МГМСУ им. А.И. Евдокимова. Было обследовано 153 пациента жителя Москвы и Московской области, в возрасте от 16 до 70 лет. Основным критерием для постановки диагноза ХГП являлось разрушение зубодесневого прикрепления. Степень тяжести устанавливали на основании глубины пародонтальных карманов и степени деструкции костной ткани.
Клинические данные о состоянии пародонта пациентов выражали в баллах, как описано в работе [8]: степень выраженности заболевания (от 1 до 5), глубина пародонтального кармана (от 0 до 4). Возраст пациентов учитывался путем включения их в одну из групп: <30, 30-50, >50 лет.
Биологический материал из пародонтальных карманов исследовали, отбирая содержимое с помощью стерильных бумажных эндодонтических штифтов, которые затем помещали в пробирку с реактивом «Проба-Рапид» (ООО «НПО ДНК-Технология», Россия) объемом 0,5 мл (пародонтальные смывы) и транспортировали в лабораторию в охлажденном состоянии в течение 6 ч. Забор проводили в двух повторностях от каждого пациента, на стадии выделения ДНК и проведения ПЦР-анализа каждая повторность обрабатывалась отдельно.
Суммарную ДНК пародонтального смыва пациентов выделяли при помощи набора реагентов «Проба-ГС» (ООО «НПО ДНК-Технология», Россия) в соответствии с инструкцией к набору реагентов. Препарат ДНК, соответствующий 1/10 объема одного смыва (50 мкл), растворяли в 50 мкл элюирующего раствора (комплектация «Проба-ГС»). В качестве матрицы для проведения одной ПЦР-реакции использовали 5 мкл полученного препарата.
Для каждого образца проводили семь параллельных определений следующих параметров:
1. Определение специфических последовательностей ДНК S. sanguinis с применением праймеров SEQ ID NO 1 и SEQ ID NO 2 и зонда SEQ ID NO 3.
2. Определение общей бактериальной массы в образце с применением праймеров SEQ ID NO 4 и SEQ ID NO 5 и зонда SEQ ID NO 6.
3. Определение специфических последовательностей пародонтопатогенов по Сокранскому: Aggregatibacter actinomycetemcomitans, Porphyromonas gingivalis, Prevotella intermedia, Tannerella forsythensis и Treponema denticola с использованием методики и олигонуклеотидов, описанных ранее [5].
С целью нормировки сигнала (учета разброса в количестве взятого биоматериала и эффективности экстракции ДНК) для каждого образца определяли величину относительного Ct как для S. sanguinis, так и для пародонтопатогенов. Для этого из величины абсолютного Ct для специфического набора праймеров и зонда, усредненного по двум образцам одной серии, вычитали усредненную величину Ct общей бактериальной массы для тех же двух образцов серии. Статистической обработке подвергали данные, выраженные в форме относительного Ct.
Статистическую обработку данных проводили с помощью пакета Statistica 8.0 для Windows по стандартным методикам вариационного анализа. Для проверки гипотезы о достоверности отличий пар выборок по исследуемому параметру (относительный Ct для S. sanguinis и пародонтопатогенов) использовали непараметрический критерий Манна-Уитни. При анализе корреляций между исследуемыми параметрами в пределах выборки использовали корреляционный анализ по методу Спирмана. Во всех случаях уровень статистической значимости принимали за 95% (р≤0,05).
Исследуемая выборка (153 человека) включала группу контроля в размере 75 человек (пациенты без признаков пародонтита), средний возраст в группе 28 лет и группу случая (пациенты с диагнозом гингивит, ХГП легкой, средней и тяжелой степени), средний возраст составил 42 года. Можно сказать, что в группу контроля попало больше пациентов из более молодой возрастной категории, в то время как группа пациентов с ХГП оказалась более возрастной. Такой результат связан с объективными причинами: хронический пародонтит является возрастным заболеванием, что осложняет задачу подбора молодых пациентов с диагнозом ХГП (чаще в молодом возрасте речь идет об агрессивном пародонтите) и возрастных пациентов с высокой степенью сохранности пародонта.
Соотношение в выборке мужчин и женщин составило соответственно 61 и 92 человека (соотношения возрастов с разницей ±1 год соответствует значениям всей выборки). Внутри выборки женщин соотношения распределялись следующим образом: женщины из группы контроля - 51 пациент, женщины с диагнозом ХГП - 41 пациент; в группе мужчин группа контроля составила 27 человек, ХГП - 34 пациента.
Статистическая обработка результатов с помощью непараметрического критерия Манна-Уитни позволила доказать существенные различия в уровне обсемененности пародонта S. sanguinis при сравнении группы пациентов с диагнозом пародонтит и группы контроля. Значение параметра R в сравниваемых выборках достигло 5, вместе с тем параметр р (достоверность различий) составил 4,6⋅10-7. В данном случае можно говорить о жесткой корреляции высокой обсемененности пародонта S. sanguinis у пациентов из контрольной группы. Это позволяет говорить о протективных свойствах бактерии S. sanguinis и целесообразности ее включения в тест-систему для оценки состояния пародонта, путем анализа не только представленности на пародонте патогенной микрофлоры (Aggregatibacter actinomycetemcomitans, Porphyromonas gingivalis, Prevotella intermedia, Tannerella forsythensis и Treponema denticola), но и анализа его обсемененности пародонтопротекторами (в том числе S. sanguinis).
При сравнении представленности S. sanguinis в выборках мужчин и женщин статистически значимых различий обнаружено не было. Однако, проанализировав уровень обсемененности S. sanguinis в выборках здоровые мужчины - мужчины с диагнозом пародонтит, было установлено достоверное превышение уровня обсемененности S. sanguinis в группе здоровых мужчин (R=2,9; р=4⋅10-3). При сравнении выборок здоровые женщины - женщины с диагнозом пародонтит положительная корреляция между высоким уровнем обсемененности пародонта S. sanguinis и степенью его сохранности оказалась еще более жесткой (R=4; р=3,5⋅10-5).
Полученные результаты свидетельствуют о том, что обсемененность пародонта бактерией-пародонтопротектором S. sanguinis не зависит на прямую от пола пациента, но находится в связи с уровнем обсемененности пародонта определенными патогенами. Это наблюдение свидетельствуют о том, что S. sanguinis может рассматриваться в качестве непосредственного антогониста Tannerella forsythensis и Treponema denticola.
Для оценки корреляций между величинами относительных Ct для S. sanguinis и для основных пародонтопатогенов по Сокранскому (Aggregatibacter actinomycetemcomitans, Porphyromonas gingivalis, Prevotella intermedia, Tannerella forsythensis и Treponema denticola) был применен критерий Спирмана. Анализ результатов показал, что наибольшую отрицательную корреляцию можно видеть в парах S. sanguinis с Tannerella forsythensis (R=3,16, при p=1,6⋅10-3) и Treponema denticola (R=2,8, при p=5⋅10-3). Менее жесткие обратные корреляции были получены при сравнении «относительных Ct» S. sanguinis и P. gingivalis (R=2,3, при p=2⋅10-2). Сходные значения получены для пары S. sanguinis - P. intermedia: R=2 при p=4⋅10-2. Достоверной корреляции между уровнями обсемененности пародонта S. sanguinis и A. actinomycetemcomitans не обнаружено.
Список использованных источников
1. Зорина О.А., Кулаков А.А., Грудянов А.И., Петрухина Н.Б., Борискина О.А., Авраамова Т.В., Турчанинова М.А., Ребриков Д.В. Патент РФ №2420589. Набор синтетических олигонуклеотидов для выявления ДНК пародонтопатогенного микроорганизма Prevotella intermedia методом полимеразной цепной реакции. Заявка от 21.04.2010. Опубл. 10.06.2011.
2. Зорина О.А., Кулаков А.А., Грудянов А.И., Петрухина Н.Б., Борискина О.А., Авраамова Т.В., Турчанинова М.А., Ребриков Д.В. Патент РФ №2420591. Набор синтетических олигонуклеотидов для выявления ДНК пародонтопатогенного микроорганизма Porphyromonas gingivalis методом полимеразной цепной реакции. Заявка от 21.04.2010. Опубл. 10.06.2011.
3. Зорина О. А., Кулаков А. А., Грудянов А.И., Петрухина Н.Б., Борискина О.А., Авраамова Т.В., Турчанинова М.А., Ребриков Д.В. Патент РФ №2420592. Набор синтетических олигонуклеотидов для выявления ДНК пародонтопатогенного микроорганизма Actinobacillus actinomycetemcomitans методом полимеразной цепной реакции. Заявка от 21.04.2010. Опубл. 10.06.2011.
4. Ребриков Д.В., Зорина О.А., Петрухина Н.Б., Борискина О.А., Беркутова И.С., Аймадинова Н.К. Патент РФ №2510857. Набор синтетических олигонуклеотидов для выявления ДНК пародонтопатогенного микроорганизма Treponema denticola методом полимеразной цепной реакции. Заявка от 24.02.2012. Опубл. 10.04.2014.
5. Шибаева А.В., Ребриков Д.В., Трубникова Е.В., Айвазова Р.А. и соавт. Способ оценки обсемененности пародонта патогенными бактериями с применением полимеразной цепной реакции в реальном времени. Заявка на патент на изобретение №2015120411 от 29.05.2015.
6. Ximenez-Fyvie L.A., Haffajee A.D., Socransky S.S. Comparison of the microbiota of supra- and subgingival plaque in health and periodontitis. J. Clin. Periodontol. 2000. V. 27. №9. P. 648-657.
7. Зорина O.A., Шибаева A.B., Трубникова E.B., Ребриков Д.В., Шевелев А.Б. Идентификация ключевых элементов нормальной и патогенной микрофлоры, определяющей состояние пародонта, методом NSG-секвенирования банков 168-рДНК бактериальных консорциумов пародонта. Стоматология. 2014. Том 93. №6. С. 25-31.
8. Armitage G.С.Development of a classification system for periodontal diseases and conditions. Annals ofperiodontology. 1999. №4. P. 1-6.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ оценки состояния пародонта человека на устойчивость к развитию хронического генерализованного пародонтита на основании количественного определения бактерии-пародонтопротектора Veillonella parvula методом ПЦР в реальном времени | 2015 |
|
RU2619172C1 |
| Способ оценки обсемененности пародонта патогенными бактериями с применением полимеразной цепной реакции в реальном времени | 2015 |
|
RU2607046C2 |
| НАБОР СИНТЕТИЧЕСКИХ ОЛИГОНУКЛЕОТИДОВ ДЛЯ ВЫЯВЛЕНИЯ ДНК ПАРОДОНТОПАТОГЕННОГО МИКРООРГАНИЗМА Tannerella forsythensis МЕТОДОМ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ | 2012 |
|
RU2535988C2 |
| СПОСОБ ОДНОМОМЕНТНОЙ ЭЛИМИНАЦИИ ПАРОДОНТОПАТОГЕНОВ В ЗАВИСИМОСТИ ОТ ИХ КЛИНИЧЕСКИ ЗНАЧИМЫХ ТИТРОВ И КЛИНИЧЕСКОГО СОСТОЯНИЯ ТКАНЕЙ ПАРОДОНТА | 2018 |
|
RU2679803C1 |
| НАБОР СИНТЕТИЧЕСКИХ ОЛИГОНУКЛЕОТИДОВ ДЛЯ ВЫЯВЛЕНИЯ ДНК ПАРОДОНТОПАТОГЕННОГО МИКРООРГАНИЗМА Treponema denticola МЕТОДОМ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ | 2012 |
|
RU2510857C2 |
| НАБОР СИНТЕТИЧЕСКИХ ОЛИГОНУКЛЕОТИДОВ ДЛЯ ВЫЯВЛЕНИЯ ДНК ПАРОДОНТОПАТОГЕННОГО МИКРООРГАНИЗМА Candida albicans МЕТОДОМ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ | 2012 |
|
RU2510856C2 |
| Способ оценки прогрессирования хронического пародонтита и набор реагентов для его осуществления | 2021 |
|
RU2777783C1 |
| НАБОР СИНТЕТИЧЕСКИХ ОЛИГОНУКЛЕОТИДОВ ДЛЯ ВЫЯВЛЕНИЯ ДНК ПАРОДОНТОПАТОГЕННОГО МИКРООРГАНИЗМА Porphyromonas gingivalis МЕТОДОМ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ | 2010 |
|
RU2420591C1 |
| НАБОР СИНТЕТИЧЕСКИХ ОЛИГОНУКЛЕОТИДОВ ДЛЯ ВЫЯВЛЕНИЯ ДНК ПАРОДОНТОПАТОГЕННОГО МИКРООРГАНИЗМА Prevotella intermedia МЕТОДОМ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ | 2010 |
|
RU2420589C1 |
| НАБОР СИНТЕТИЧЕСКИХ ОЛИГОНУКЛЕОТИДОВ ДЛЯ ВЫЯВЛЕНИЯ ДНК ПАРОДОНТОПАТОГЕННОГО МИКРООРГАНИЗМА Actinobacillus actinomycetemcomitans МЕТОДОМ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ | 2010 |
|
RU2420592C1 |
Изобретение относится к биотехнологии и стоматологии и клинико-лабораторной диагностике. Описан способ оценки состояния пародонта человека на предмет устойчивости к развитию хронического генерализованного пародонтита, вызываемого Treponema denticola и/или Tannerella forsythensis. Согласно изобретению в качестве специфического маркера используется уровень обсемененности пародонта бактерией-пародонтопротектором Streptococcus sanguinis, определяемый методом полимеразной цепной реакции в реальном времени с использованием специфических праймеров и зонда. Высокая обсемененность пародонта пациента S. sanguinis свидетельствует о его высокой устойчивости к гиперколонизации такими пародонтопатогенами, как Tannerella forsythensis и Treponema denticola, и в меньшей степени Porphyromonas gingivalis и Prevotella intermedia. Низкая представленность S. sanguinis в микробиоценозе пародонта конкретного пациента или его полное отсутствие является прогностическим признаком, свидетельствующим о повышенном риске сверхкритической колонизации пародонта патогенами и последующем развитии хронического генерализованного пародонтита (ХГП). Наибольшей эффективности при оценке состояния пародонта можно добиться за счет параллельного измерения представленности в микробиоценозе пародонта патогенов: Aggregatibacter actinomycetemcomitans, Porphyromonas gingivalis, Prevotella intermedia, Tannerella forsythensis и Treponema denticola [1-5] и S. sanguinis. Данный подход позволяет прогнозировать динамику развития заболевания и производить оценку результативности курса лечения, пройденного пациентом. 2 з.п. ф-лы.
1. Способ оценки состояния пародонта человека на предмет устойчивости к развитию хронического генерализованного пародонтита, вызываемого Treponema denticola и/или Tannerella forsythensis, отличающийся тем, что в качестве специфического маркера используется уровень обсемененности пародонта бактерией-пародонтопротектором Streptococcus sanguinis, определяемый методом полимеразной цепной реакции в реальном времени с использованием специфических праймеров и зонда, и при фиксации низкого уровня обсемененности S. sanguini риск развития хронического генерализованного пародонтита оценивается как высокий.
2. Способ по п. 1, отличающийся тем, что для выявления ДНК Streptococcus sanguinis используются специфические праймеры и зонд:
SEQ ID NO 1 TAGCGGCTAGAAACCTCGTCAT
SEQ ID NO 2 GTGCGCTTTCCCTGAGATTCTT
SEQ ID NO 3 (BHQ1)-CTTCCACA(FdT)AAGCGCTGGCATCCG-P,
где BHQ1 означает присоединенный к 5'-концевому нуклеотиду темновой гаситель флуоресценции, a FdT - флуоресцентный краситель FAM, присоединенный к нуклеотиду Т.
3. Способ по п. 1, отличающийся тем, что определяется абсолютное значение порогового цикла и величина Ct общей бактериальной массы для того же образца с примерением универсальных праймеров специфичных к бактериальной 16S рДНК и зонда:
SEQ ID NO 4 GGGCTACACACGTGCTACA
SEQ ID NO 5 GGGTACCTTGTTACGACTT
SEQ ID NO 6 (BHQ1)CGGGCCTTG(FdT) ACACACCGCCCGTC,
где BHQ1 означает присоединенный к 5'-концевому нуклеотиду темновой гаситель флуоресценции, a FdT - флуоресцентный краситель FAM, присоединенный к нуклеотиду Т, после чего вычисляется параметр Ct для специфической последовательности S. sanguinis и общей бактериальной массы в образце и проводится нормировка: из усредненного по двум или большему числу независимых определений абсолютному значению Ct для специфического набора праймеров и зонда вычитают усредненную величину Ct общей бактериальной массы для того же образца серии; нормальная обсемененность пародонта фиксируется при условии, что величина относительного Ct для S. sanguinis составляет 15,0 циклов и менее, большее число циклов указывает на низкую обсемененность.
| СПОСОБ ДИАГНОСТИКИ СТЕПЕНИ ТЯЖЕСТИ ПАРОДОНТИТА | 2008 |
|
RU2386394C1 |
| СПОСОБ ОЦЕНКИ ЭФФЕКТИВНОСТИ ПРОВЕДЕНИЯ ПЕРИОДИЧЕСКИ ПОВТОРЯЕМЫХ ЛЕЧЕБНО-ПРОФИЛАКТИЧЕСКИХ МЕРОПРИЯТИЙ ПРИ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЯХ ПАРОДОНТА У ГРУППЫ НАСЕЛЕНИЯ | 2005 |
|
RU2290076C1 |
| СПОСОБ ОЦЕНКИ СТЕПЕНИ ТЯЖЕСТИ ЗАБОЛЕВАНИЯ ПАРОДОНТА | 2014 |
|
RU2546102C1 |
Авторы
Даты
2017-06-07—Публикация
2015-11-03—Подача