ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым рекомбинантным слитым белкам, таким как молекулы на основе антител человека, называемые вакцинотелами, которые способны запускать как T-клеточный, так и B-клеточный иммунный ответ. Настоящее изобретение также относится к способу лечения злокачественной опухоли или инфекционного заболевания, например, множественной миеломы или гриппа, посредством этих специфических слитых белков.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
ДНК-вакцинация является технически простым способом индукции иммунных ответов. Однако успех для мелких животных еще не воспроизведен в клинических исследованиях. В настоящее время последовало несколько стратегий для увеличения эффективности ДНК-вакцин.
Нацеливание белковых антигенов на антигенпредставляющие клетки (APC) может улучшать T- и B-клеточные ответы. Молекулы рекомбинантных иммуноглобулинов (Ig) хорошо подходят для этой цели. Например, короткими антигенными эпитопами можно заменять петли между β-цепями в константных доменах Ig, в то время как направленную доставку антигена получают, снабжая рекомбинантный Ig вариабельными (V) областями, специфическими для поверхностных молекул на APC. Однако такой способ не подходит для более крупных антигенов, содержащих неопределенные эпитопы, кроме того, рекомбинантные молекулы Ig с короткими T-клеточными эпитопами не могут вызывать образование антител против конформационных эпитопов. Для преодоления этих ограничений получены гомодимерные ДНК-вакцины (вакцинотела) на основе Ig, экспрессирующие инфекционные или опухолевые антигены размером по меньшей мере 550 а.к. с сохранением конформационных эпитопов.
Лиганд хемокинов (с C-C мотивом) 3 (CCL3) представляет собой белок, который у человека кодирован геном CCL3. CCL3, также известный как воспалительный белок-1α макрофагов (MIP-1α), представляет собой цитокин, принадлежащий к семейству CC-хемокинов, вовлеченных при остром воспалительном состоянии в рекрутирование и активацию полиморфноядерных лейкоцитов. В то время как CCL3 мыши представляет собой ген с одной копией, кодирующий зрелый хемокин из 69 аминокислот, гомолог человека дуплицирован и мутирован с образованием двух неаллельных вариантов, LD78α (CCL3) и LD78β (CCL3-L1), где оба обладают 74% гомологией с CCL3 мыши.
До настоящего времени ни одной ДНК-вакцины не одобрено для использования для человека из-за отсутствия эффективности. Не существует также эффективной вакцины, доступной для нескольких инфекционных заболеваний. В частности, ни одной терапевтической противораковой ДНК-вакцины не одобрено для использования для человека.
WO 2004/076489 относится к рекомбинантным молекулам на основе антител человека, называемых вакцинотелами, способным запускать как T-клеточный, так и B-клеточный иммунный ответ.
US20070298051 относится к использованию MIP-1-альфа для усиления иммунного ответа на иммуноген у млекопитающего.
EP920522 относится к полинуклеотидной векторной вакцине, содержащей продукт кДНК-мишени, содержащей нуклеотидную последовательность, кодирующую цитокин или хемокин.
Fredriksen AB et al. (Mol Ther 2006; 13: 776-85) относится к ДНК-вакцинам, нацеливающим опухолевый антиген на антигенпредставляющие клетки.
Fredriksen AB and Bogen B (Blood 2007; 110: 1797-805) относится к слитым ДНК-вакцинам хемокин мыши - идиотип.
ЦЕЛЬ ИЗОБРЕТЕНИЯ
Целью вариантов осуществления изобретения является предоставление слитых белков, способных запускать эффективный иммунный ответ даже для слабых антигенов, таких как идиотипические антигены, полученные, например, из клеток миеломы.
Кроме того, целью вариантов осуществления изобретения является предоставление полинуклеотидов, таких как полинуклеотид ДНК, кодирующих слитый белок, запускающий эффективный иммунный ответ даже против слабых антигенов, таких как идиотипические антигены, происходящие, например, из клеток миеломы. Эти полинуклеотиды можно использовать в качестве иммуностимулирующей композиции или вакцины против злокачественной опухоли или инфекционного заболевания, характеризующихся специфическим для заболевания или ассоциированным с заболеванием антигеном.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Автор(ы) настоящего изобретения обнаружили, что хемокин человека LD78β, его как полноразмерные, так и укороченные варианты, пригодны для использования в качестве нацеливающих групп, направляющих антигенные эпитопы к поверхности APC. Хемокин или его укороченный вариант связаны с рецепторами хемокинов на поверхности APC в форме гомодимерной белковой конструкции, что облегчает связывание двух идентичных хемокинов для обеспечения более эффективных нацеливания и передачи сигнала. Кроме того, гомодимерная конструкция обеспечивает то, что два идентичных антигенных эпитопа доставляют к APC, которые, в свою очередь, представляют их T-клеткам. Даже при относительно большом размере гомодимерных белковых конструкций, клетки являются способными продуцировать и экспортировать интактные молекулы.
Так, в первом аспекте, настоящее изобретение относится к гомодимерному белку из двух идентичных аминокислотных цепей, где каждая аминокислотная цепь содержит нацеливающую группу, содержащую аминокислотную последовательность, обладающую по меньшей мере 80% идентичностью последовательности 5-70 из SEQ ID NO: 1, и антигенную группу, где нацеливающая группа и антигенная группа соединены через мотив для димеризации.
Во втором аспекте настоящее изобретение относится к гомодимерному белку из двух идентичных аминокислотных цепей, где каждая аминокислотная цепь содержит нацеливающую группу, содержащую аминокислоты 3-70 из SEQ ID NO: 1, и антигенную группу, где нацеливающая группа и антигенная группа соединены через мотив для димеризации.
В третьем аспекте настоящее изобретение относится к молекуле нуклеиновой кислоты, кодирующей мономерный белок, который может формировать гомодимерный белок по изобретению.
В следующем аспекте настоящее изобретение относится к гомодимерному белку по изобретению; для использования в качестве лекарственного средства.
В следующем аспекте настоящее изобретение относится к молекуле нуклеиновой кислоты, кодирующей мономерный белок, который может формировать гомодимерный белок по изобретению; для использования в качестве лекарственного средства.
В следующем аспекте настоящее изобретение относится к фармацевтической композиции, содержащей гомодимерный белок по изобретению.
В следующем аспекте настоящее изобретение относится к фармацевтической композиции, содержащей молекулу нуклеиновой кислоты, кодирующую мономерный белок, который может формировать гомодимерный белок по изобретению.
В следующем аспекте настоящее изобретение относится к клетке-хозяину, содержащей молекулу нуклеиновой кислоты, кодирующую мономерный белок, который может формировать гомодимерный белок по изобретению.
В следующем аспекте настоящее изобретение относится к способу получения гомодимерного белка по изобретению, где способ включает:
a) трансфекцию популяции клеток молекулой нуклеиновой кислоты по изобретению;
b) культивирование популяции клеток;
c) сбор и очистку гомодимерного белка, экспрессированного из популяции клеток.
В следующем аспекте настоящее изобретение относится к вакцине против злокачественной опухоли или инфекционного заболевания, содержащей иммунологически эффективное количество гомодимерного белка по изобретению или молекулу нуклеиновой кислоты, кодирующую мономерный белок, который может формировать гомодимерный белок по изобретению, где указанная вакцина является способной запускать как T-клеточный, так и B-клеточный иммунный ответ, и где указанный гомодимерный белок содержит антигенную группу, связанную с указанной злокачественной опухолью или инфекционным заболеванием.
В следующем аспекте настоящее изобретение относится к иммуномодулирующей или иммуностимулирующей композиции против злокачественной опухоли или инфекционного заболевания, содержащей иммунологически эффективное количество гомодимерного белка по изобретению или молекулы нуклеиновой кислоты, кодирующей мономерный белок, который может формировать гомодимерный белок по изобретению, где указанная иммуномодулирующая или иммуностимулирующая композиция является способной запускать как T-клеточный, так и B-клеточный иммунный ответ, и где указанный гомодимерный белок содержит антигенную группу, связанную с указанной злокачественной опухолью или инфекционным заболеванием.
В следующем аспекте настоящее изобретение относится к способу лечения злокачественной опухоли или инфекционного заболевания у пациента, где способ включает введение нуждающемуся в этом пациенту гомодимерного белка по изобретению или молекулы нуклеиновой кислоты, кодирующей мономерный белок, который может формировать гомодимерный белок по изобретению, где указанный гомодимерный белок содержит антигенную группу, связанную с указанной злокачественной опухолью или инфекционным заболеванием.
ПОДПИСИ К ФИГУРАМ
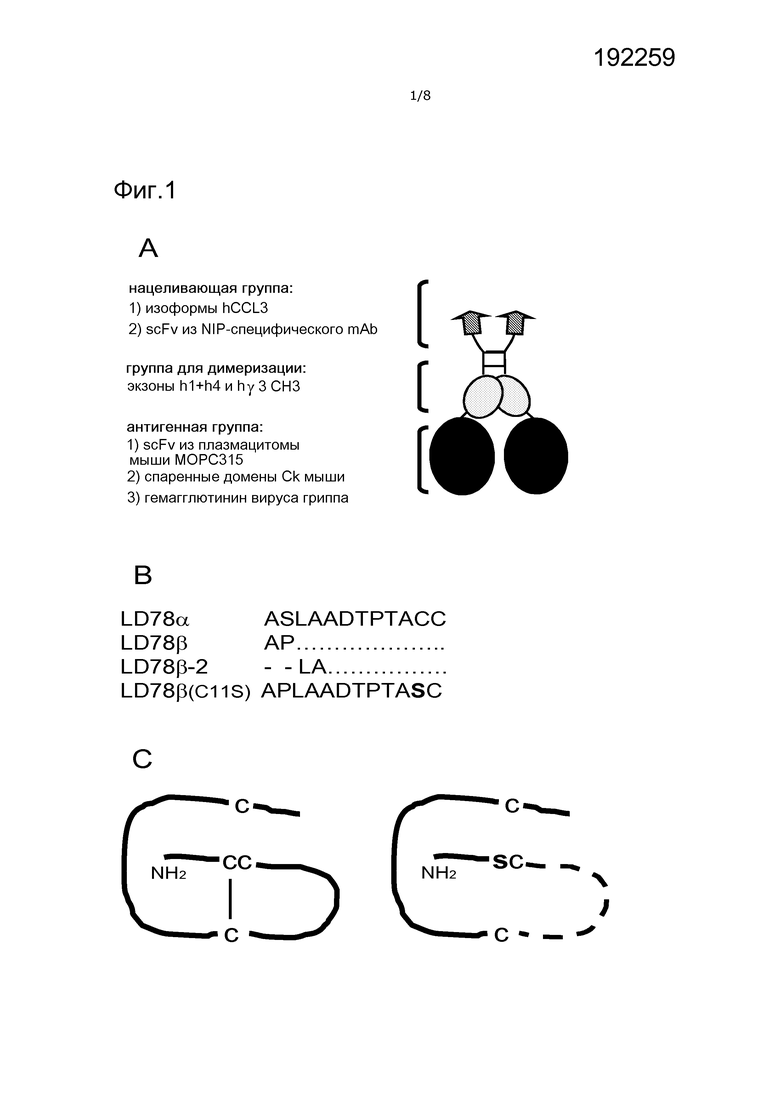
Фигура 1. Слитые вакцины, используемые в этом исследовании. (A) Схематическая структура слитого белка гомодимерный хемокин-антиген (вакцинотела). Указаны нацеливающая группа, группа для димеризации и антигенная группа, также как фрагменты, экспрессированные в различных группах. Во всех конструкциях группа для димеризации и шарнир происходят из IgG3 человека. Линкер G3S2G3SG соединяет экзоны шарнира h1+h4 с доменом CH3. Линкер GLSGL соединяет CH3 и антигенную группу, в то время как линкер (G4S)3 соединяет VH и VL в антигенной группе. (B) Последовательности NH2-конца (а.к. 1-12) изоформ CCL3 человека, и контроль для них с точечной мутацией (C11S, указанный жирным). Штрих обозначает делецию. (C) Точечная мутация C11S предположительно разрушает S-S мостик в структуре хемокина (справа).
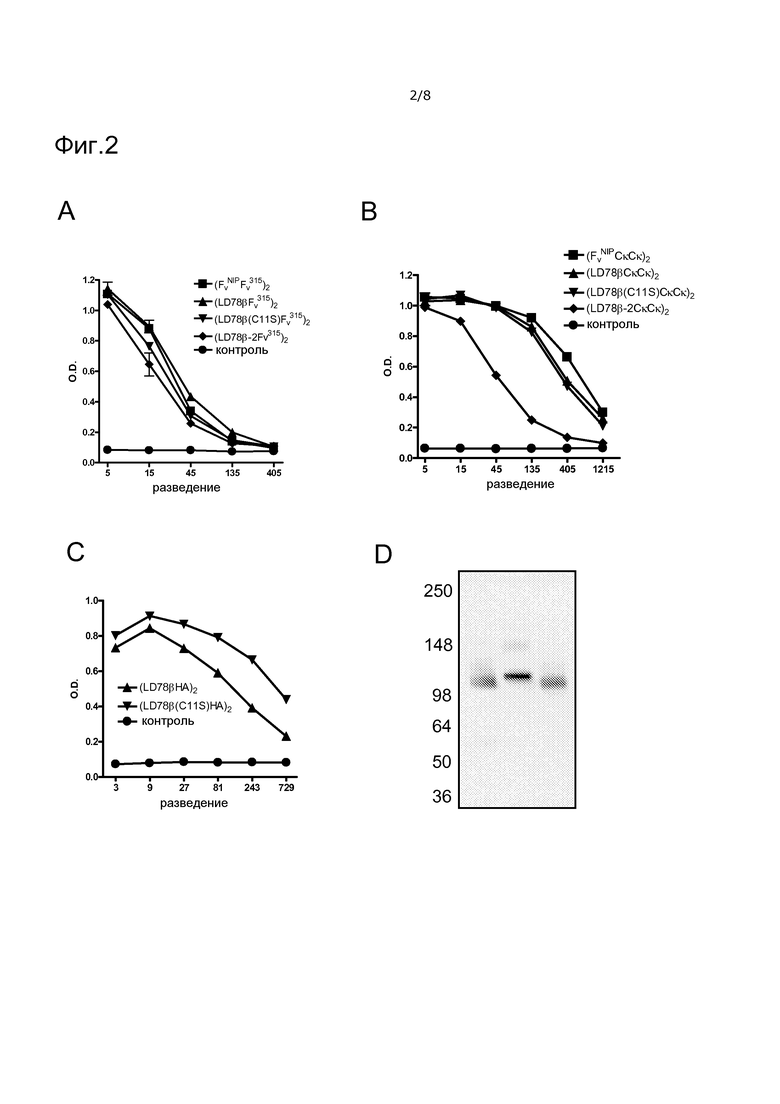
Фигура 2. Характеризация LD78-экспрессирующих вакцинотел посредством ELISA и вестерн-блоттинга.
Супернатанты временно трансфицированных клеток 293E, собранные на сутки 5, тестировали в ELISA с использованием mAb, специфических для различных компонентов молекул вакцинотел. (A), кодирующие scFv315 вакцинотела с указанными нацеливающими группами оценивали посредством связывания с покрытием DNP-BSA (связывает scFv315) и детекции с помощью биотинилированного HP6017 (связывает мотив для димеризации CH3). (B), кодирующие CκCκ вакцинотела с указанными нацеливающими группами оценивали посредством связывания с покрытием 187.1 mAb (связывает Cκ мыши) и детекции с помощью биотинилированного mAb 187.1. (C), кодирующие HA вакцинотела с указанными нацеливающими группами оценивали посредством связывания с MCA878-G (против мотива для димеризации CH3) и детекции с помощью биотинилированного mAb H36-4-52 против HA. (D), Вестерн-блоттинг вакцинотел с использованием в качестве зонда биотинилированного HP6017 в невосстанавливающих условиях. Слева направо, (LD78Fv315)2, (LD78βC11SFv315)2 и (LD78-2Fv315)2.
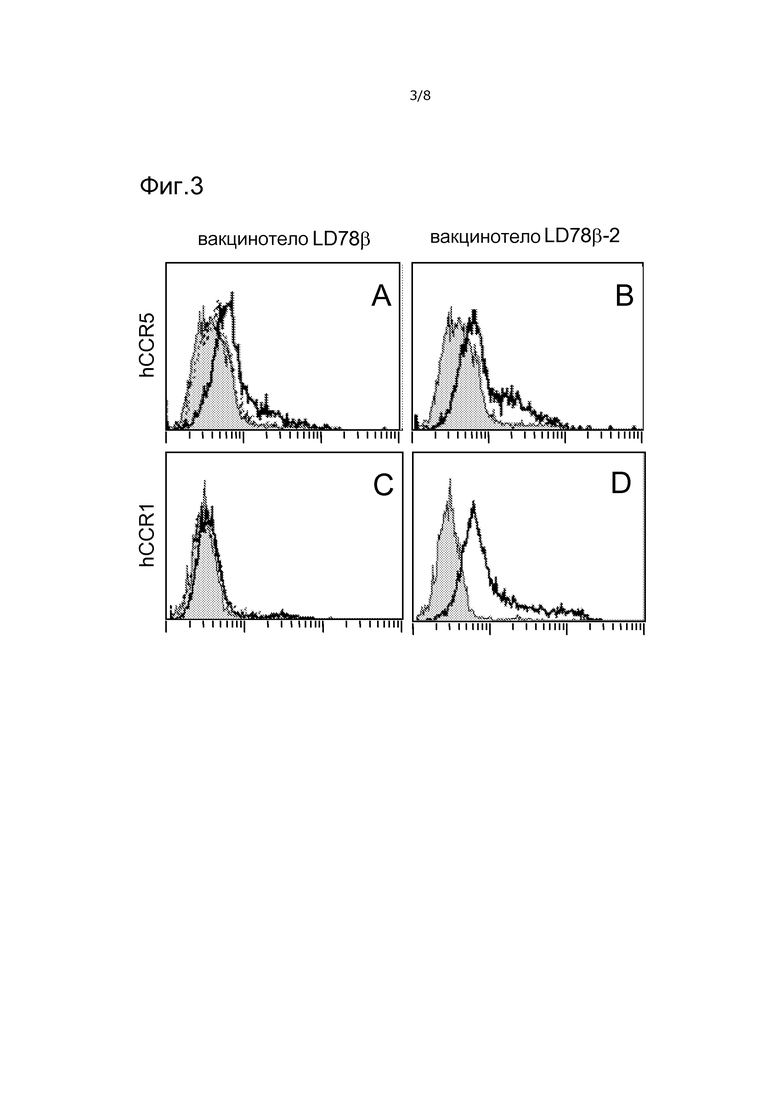
Фигура 3. Белки вакцинотела LD78β связывают рецепторы хемокинов на клетках человека. Указанные гомодимерные белки при 25 мкг/мл смешивали с клетками HEK 293, стабильно трансфицированными CCR5 человека (A, B), или CCR1 человека (C, D). Связанные белки вакцинотела детектировали посредством биотинилированного mAb Ab2.1-4, специфического для антигенной группы scFv315, затем PE-стрептавидина. Жирные линии: вакцинотела (LD78βFv315)2 (A, C) и (LD78β-2Fv315)2 (B, D). Пунктирная линия в (A): (LD78β(C11S)Fv315)2. Закрашенная гистограмма: только биотинилированное mAb Ab2.1-4 и PE-стрептавидин.
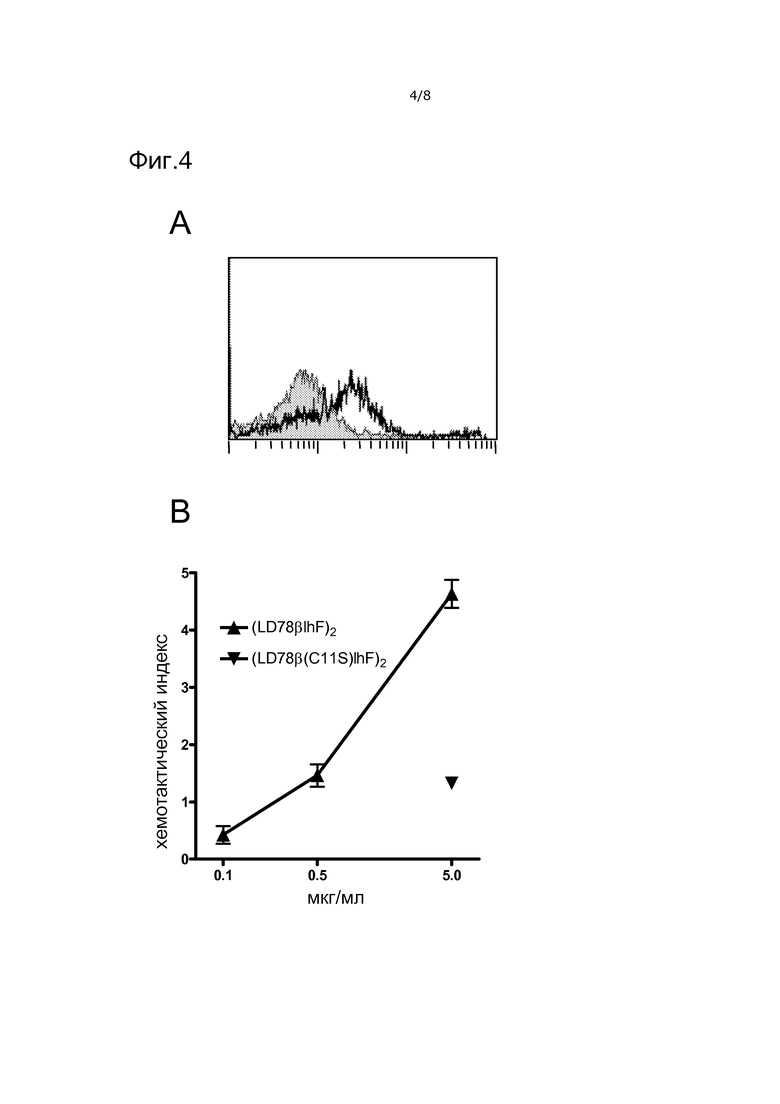
Фигура 4. Белки вакцинотела LD78β связывают рецепторы хемокинов мыши и индуцируют хемотаксис клеток мыши. Вакцинотело (LD78βFv315)2 (незакрашенная гистограмма), но не вариант C11S (закрашенная гистограмма), связывается со спленоцитами CD11b+ BALB/c (A) и обладает хемотактической активностью для лимфоцитарных клеток Esb/MP (B).
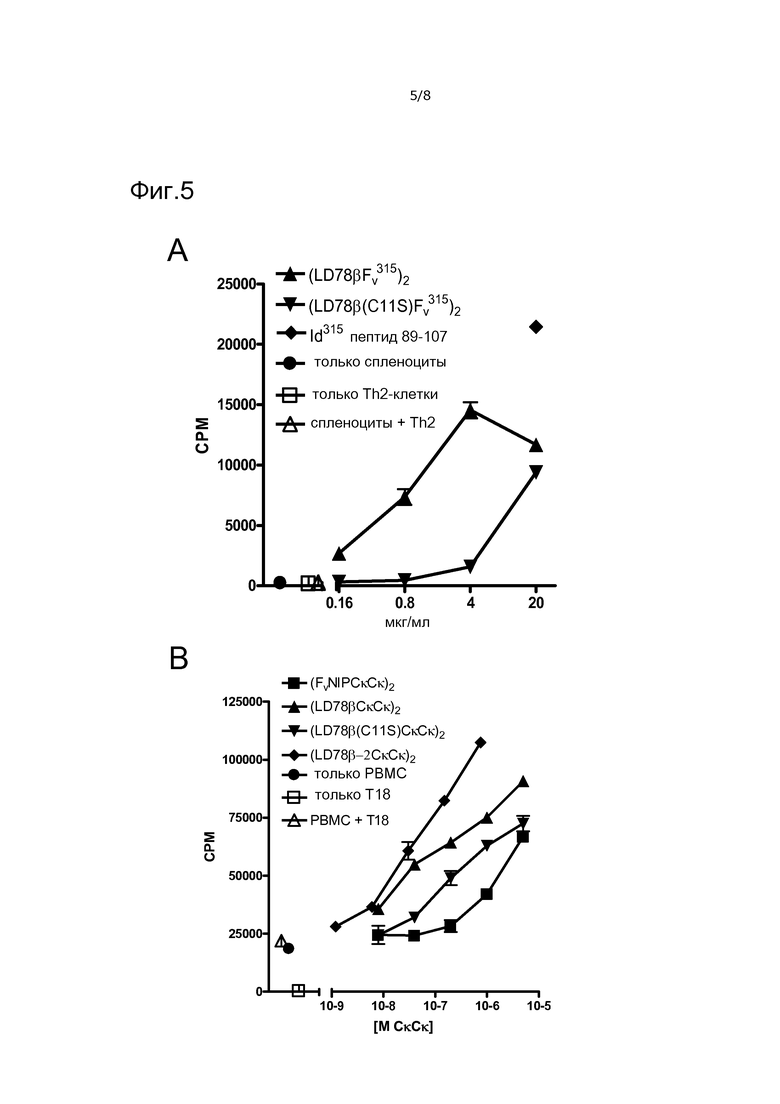
Фигура 5. Вакцинотело с нацеливающей группой LD78β эффективно доставляет антиген к APC мыши (A) и человека (B) для рестрицированного по MHC класса II представления CD4+ T-клеткам. (A) Различные количества очищенных вакцинотел, обладающих scFv315 в качестве антигенной группы, смешивали с облученными (8 Гр) спленоцитами BALB/c, с последующим добавлением Id(λ2315)-специфических Th2 T-клеток от трансгенных по TCR мышей. Затем 48-часовые культуры сенсибилизировали 3H-тимидином в течение 24 час. (B) Различные количества содержащих Cκ мыши супернатантов вакцинотел (выраженные как молярная концентрация (M) CκCκ) от временно трансфицированных клеток 293E смешивали с DR4*01 PBMC, которые затем облучали и смешивали со специфическими для CK мыши T18 T-клетками. Через 48 часов планшет сенсибилизировали 3H-тимидином в течение 24 часов.
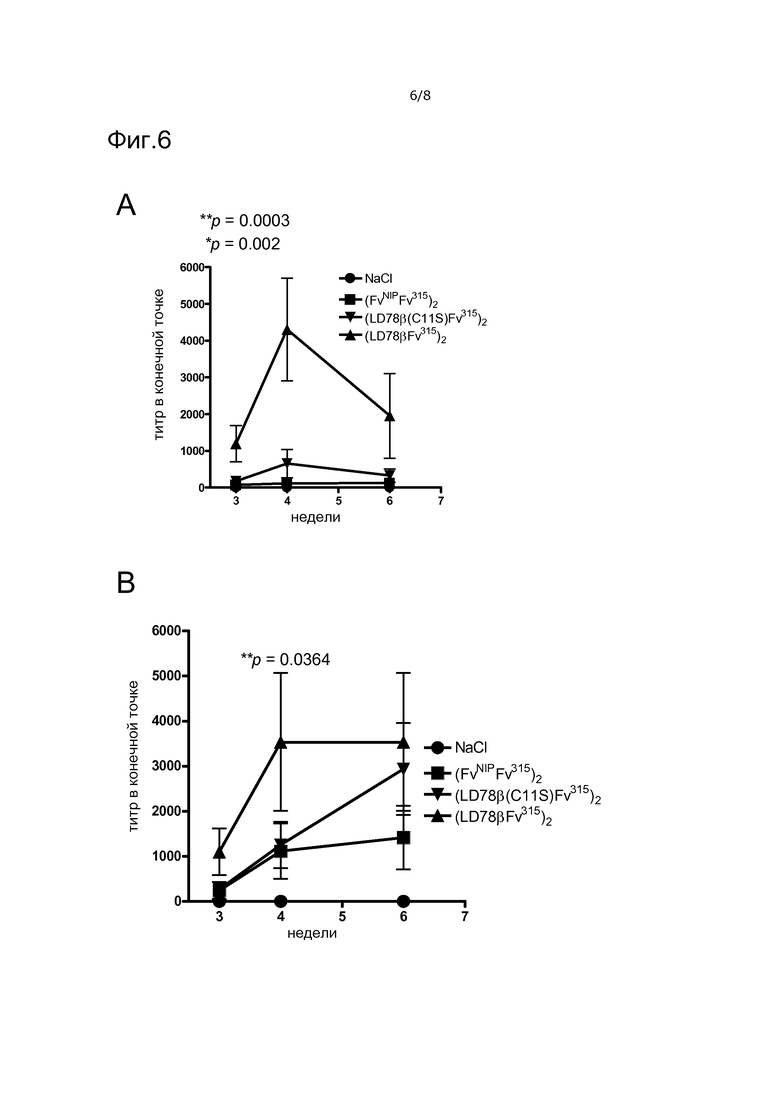
Фигура 6. Иммунные ответы против Id315 у мышей, иммунизированных ДНК вакцинотела LD78βFv315. Мышей иммунизировали внутрикожным введением ДНК с немедленной последующей электропорацией участка инъекции. Указаны тип вакцинотел и контролей. Сыворотку, полученную через 3 недели, тестировали на антитела анти-Id IgG1 (A) или IgG2a (B), связывающие белок миеломы M315. Показано среднее вплоть от 7 мышей на группу, значения p относятся к LD78β по сравнению LD78β (C11S) (*), и к LD78β по сравнению с вакцинотелом (FvNIP)2 (**) на неделе 4.
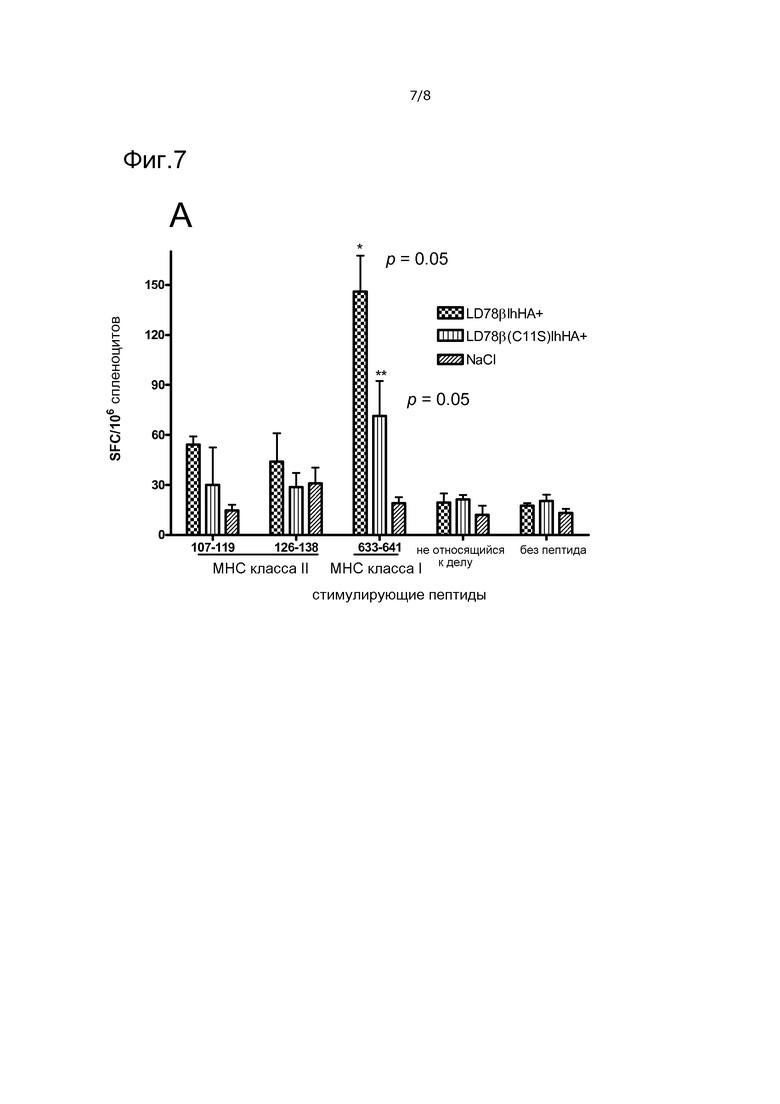
Фигура 7. Индукция ответов специфических для гемагглютинина вируса гриппа CD4+ и CD8+ T-клеток посредством LD78β-вакцинотел. Мышей (n=3) иммунизировали внутрикожным введением ДНК с немедленной последующей электропорацией участка инъекции (Dermavax, Cytopulse, USA). Типы вакцинотел и контролей указаны. Мышей умерщвляли через 3 недели, и индивидуальные суспензии спленоцитов использовали в анализах ELISPOT с указанными рестрицированными по MHC класса II и класса I синтетическими пептидами HA или с не относящимся к делу пептидом. Оценивали ответы IFNγ, значения p относятся к LD78β по сравнению с LD78βC11S и LD78β по сравнению с 0,9% NaCl (*), и к LD78βC11S по сравнению с 0,9% NaCl (**).
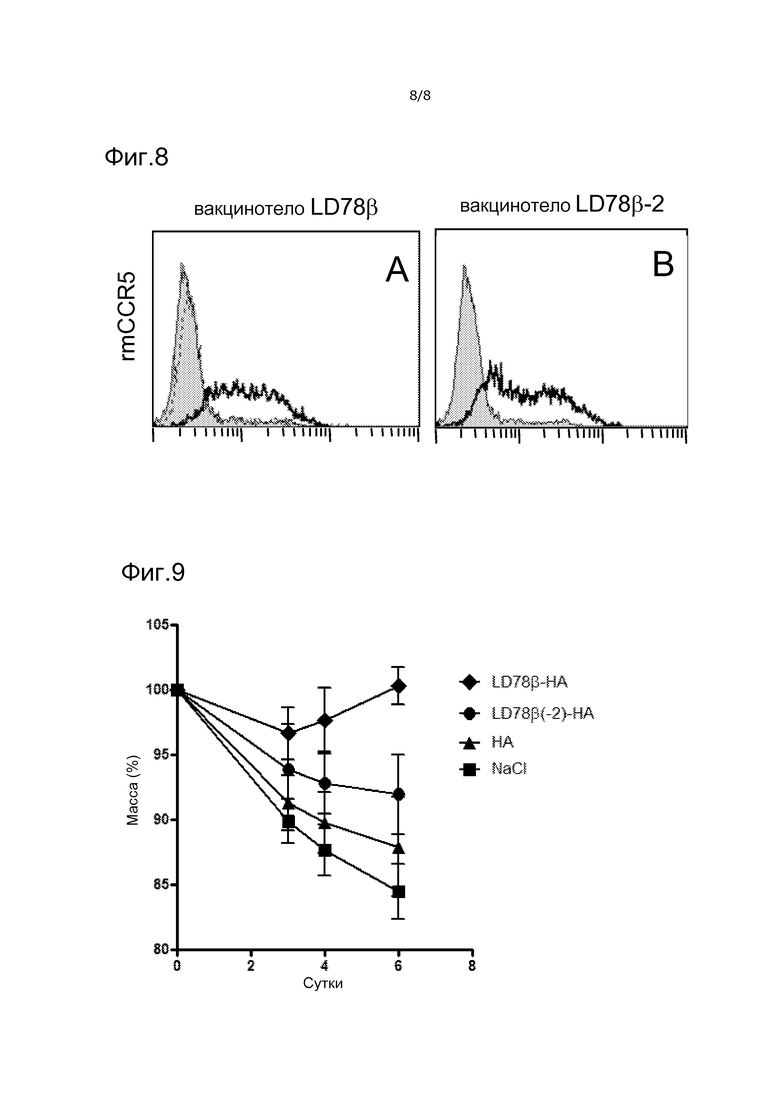
Фигура 8. Вакцинотела LD78β связываются с CCR5 макака-резуса. Белки вакцинотела при 25 мкг/мл смешивали с HEK 293, стабильно трансфицированными CCR5 макака-резуса. Связанные белки вакцинотела детектировали посредством биотинилированного mAb Ab2.1-4, специфического для антигенной группы scFv315, затем PE-стрептавидина. Жирной линией указаны вакцинотела (LD78βFv315)2 в (A) и (LD78β-2Fv315)2 в (B). Пунктирной линией в (A) указано вакцинотело (LD78β(C11S)Fv315)2. Как в A, так и в B закрашенные гистограммы обозначают только биотинилированное mAb Ab2.1-4 и PE-стрептавидин.
Фигура 9. Защита против летального заражения гриппом. Мышей Balb/c иммунизировали один раз внутрикожно с помощью 25 мкг ДНК в сочетании с электропорацией (DermaVax), и заражали через l4 суток (n=6/группу) летальной дозой вируса гриппа PR8 (H1N1).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Эффективность ДНК-вакцин необходимо увеличивать. Многообещающим способом для мышей является конструирование ДНК, кодирующей слитый белок, нацеливающий антиген на антигенпредставляющие клетки (APC) через рецепторы хемокинов. Является критическим расширение этого способа для улучшенных ДНК-вакцин для крупных животных и человека. По настоящему изобретению хемокины MIP-Ια человека можно сливать с различными антигенными группами. Слитые белки сохраняют функциональную активность и конформационную правильность нацеливающих и антигенных групп, соответственно. Слитые белки могут улучшать способность к ответу клональных CD4+ T-клеток человека. Более того, поскольку слитые белки LD78β связывают рецепторы хемокинов мышей, ДНК-вакцины для человека можно тестировать на мышах. Слитые вакцины ДНК LD78β по настоящему изобретению индуцируют улучшенные ответы T-клеток и антител у мышей после инъекции плазмиды и электропорации кожи. Ответы CD8+ T-клеток являются особенно усиленными, что указывает на эффективное перекрестное примирование. Авторы настоящего изобретения доказали, что укороченный на две аминокислоты с NH2-конца вариант LD78β обладает превосходным связыванием с клетками мыши по сравнению с полноразмерным LD78β in vitro. Неожиданно, для полноразмерного варианта LD78β показали превосходный эффект в модели на мышах in vivo. Авторы настоящего изобретения обнаружили, что белки LD78β-вакцины связывают CCR5 макака-резуса, предваряя направленную ДНК иммунизацию у не относящихся к человеку приматов.
Вакцинотела по настоящему изобретению могут представлять собой рекомбинантные гомодимерные вакцины на основе Ig, где каждая цепь состоит из нацеливающей группы, непосредственно присоединенной к шарниру Ig и CH3, комбинация которых индуцирует ковалентную гомодимеризацию (фиг. 1A).
В то время как CCL3 мыши представляет собой ген с одной копией, кодирующий зрелый хемокин из 69 а.к., гомолог человека дуплицирован и мутирован с образованием двух неаллельных вариантов, LD78α (CCL3) и LD78β (CCL3-L1), где оба обладают 74% гомологией с CCL3 мыши. Два варианта разделяют 96% гомологию, где различия представляют собой S или P в положении 2 и перемену местами G и S в положениях 39 и 47.
По настоящему изобретению варианты и различные антигенные группы CCL3 человека можно конструировать и экспрессировать как функциональные белки. В частности, настоящее изобретение относится к использованию LD78β и его природных изоформ в слитых вакцинах для нацеливания доставки антигена на антигенпредставляющие клетки.
Целью вакцинотел по настоящему изобретению является улучшение иммуногенности вакцин (иммуностимулирующих композиций). В объем настоящего изобретения включены ДНК-вакцины, кодирующие слитый белок, нацеливающие доставку антигена на рецепторы LD78β на профессиональных антигенпредставляющих клетках.
Авторы настоящего изобретения обнаружили, что вакцинотела, содержащие LD78β или его NH2-укороченные варианты, связывали клетки, экспрессирующие CCR1 и/или CCR5 (рецепторы для LD78β) мыши или макака-резуса, или человека in vitro и давали возможность усиленной доставки антигена in vitro, также как увеличенных гуморальных и клеточных иммунных ответов in vivo после инъекции ДНК и электропорации, по сравнению с контрольными, не нацеленными вакцинотелами.
Рекомбинантные белки по настоящему изобретению могут представлять собой подобные антителам человека молекулы, пригодные для лечения множества типов злокачественных опухолей или инфекционных заболеваний, включая множественную миелому. Эти молекулы, обозначаемые также как вакцинотела, связывают APC и являются способными запускать как T-клеточный, так и B-клеточный иммунный ответ. Более того, вакцинотела образуют двухвалентную связь с APC для стимуляции более эффективной индукции сильного иммунного ответа. Вакцинотела содержат димер из мономерных звеньев, состоящих из нацеливающей группы со специфичностью к молекуле поверхности APC, присоединенных через мотив для димеризации, такой как шарнирная область и домен Cy3, к антигенной группе, где последняя находится на COOH-конце или NH2-конце. Настоящее изобретение также относится к последовательности ДНК, кодирующей этот рекомбинантный белок, к экспрессирующим векторам, содержащим эти последовательности ДНК, к линиям клеток, содержащим указанные экспрессирующие векторы, к лечению млекопитающих, предпочтительно посредством иммунизации ДНК вакцинотела, РНК вакцинотела или белком вакцинотелом, и, наконец, к лекарственным средствам и набору, содержащим указанные молекулы.
Мотив для димеризации в белках по настоящему изобретению можно конструировать с включением шарнирной области и иммуноглобулинового домена (например, домена Cy3), например, карбокси-концевого домена C (домена CH3), или последовательности, которая является по существу гомологичной указанному домену C. Шарнирная область может происходить из Ig и вносить вклад в димеризацию посредством формирования межцепьевой ковалентной связи (связей), например, дисульфидного мостика (мостиков). Кроме того, она функционирует как гибкий спейсер между доменами, позволяющий двум нацеливающим группам одновременно связываться с двумя молекулами-мишенями на APC, экспрессированными на различных расстояниях. Домены иммуноглобулинов вносят вклад в гомодимеризацию посредством нековалентных взаимодействий, например, гидрофобных взаимодействий. В предпочтительном варианте осуществления домен CH3 происходит из IgG. Эти мотивы для димеризации можно заменять другими группами для мультимеризации (например, из других изотипов/подклассов Ig). Предпочтительно, мотив для димеризации происходит из природных белков человека, таких как IgG человека.
Следует понимать, что мотив для димеризации может иметь любую ориентацию по отношению к антигенной группе и нацеливающей группе. В одном варианте осуществления антигенная группа находится на COOH-конце мотива для димеризации с нацеливающей группой на N-конце мотива для димеризации. В другом варианте осуществления антигенная группа находится на N-конце мотива для димеризации с нацеливающей группой на COOH-конце мотива для димеризации.
В международной заявке WO 2004/076489, содержание которой таким образом приведено в качестве ссылки, описаны последовательности нуклеиновой кислоты и векторов, которые можно использовать по настоящему изобретению.
Белки по настоящему изобретению могут является пригодными для индукции иммунного ответа против любого полипептида любого происхождения. Любую антигенную последовательность достаточной длины, содержащую специфический эпитоп, можно использовать в качестве антигенной группы в белках по изобретению. Минимальная длина такой антигенной группы может составлять приблизительно 9 аминокислот. Соответственно, в некоторых вариантах осуществления антигенная группа содержит аминокислотную последовательность по меньшей мере из 9 аминокислот, соответствующих по меньшей мере приблизительно 27 нуклеотидам в последовательности нуклеиновой кислоты, кодирующей такую антигенную группу. Такая антигенная последовательность может происходить из белков злокачественных опухолей или инфекционных агентов. Примерами таких последовательностей злокачественных опухолей являются теломераза, более конкретно hTERT, тирозиназа, антиген меланомы TRP-1/TRP-2, специфический антиген предстательной железы и идиотипы. Инфекционные агенты могут иметь бактериальное происхождение, например, антигены туберкулеза и OMP31 бруцеллеза, или вирусное происхождение, более конкретно, происходящие из HIV последовательности, подобные, например, происходящим из gp120 последовательностям, гликопротеин D из HSV-2, и антигены вируса гриппа, подобные гемагглютинину, нуклеопротеину и M2. Вставка таких последовательностей в формате вакцинотела может также приводить к активации обеих ветвей иммунного ответа. Альтернативно, антигенная группа может представлять собой антитела или их фрагменты, такие как C-концевой scFv, происходящий из моноклональных Ig, продуцируемых клетками миеломы или лимфомы, называемых также M-компонент миеломы/лимфомы у пациентов с B-клеточной лимфомой или множественной миеломой. Такой scFv представляет идиотипический антиген.
В одном конкретном варианте осуществления, также используемом в примерах, описанных в настоящем документе, антигенная группа белка по настоящему изобретению представляет собой scFv белка миеломы M315, полученного из плазмацитомы MOPC315.4 BALB/c. Легкая цепь λ2315 M315 несет три определенных соматических мутации в петле CDR3 и функционирует как модель идиотипического T-клеточного эпитопа в хорошо определенной системе (Bogen, Malissen et al. 1986; Bogen and Lambris 1989).
Иммунизация посредством белка вакцинотела, ДНК вакцинотела или РНК вакцинотела, где две последние выполняют, например, посредством внутримышечной или внутрикожной инъекции с последующей электропорацией или без нее, все являются целесообразными способами.
Нацеливающая группа белков по изобретению нацеливает белок на APC посредством связывания с рецепторами хемокинов.
Белки по настоящему изобретению можно собирать на уровне генов, и трансфицировать ДНК подходящую клетку-хозяина, такую как клетки NSO, клетки 293E, клетки CHO или клетки COS-7. Трансфектанты продуцируют и секретируют рекомбинантные белки.
Настоящее изобретение относится к лекарственному средству, содержащему вышеописанные белки, последовательности ДНК/РНК или экспрессирующие векторы на рекомбинантной основе по изобретению. Когда это целесообразно, это лекарственное средство, кроме того, содержит фармацевтически совместимый носитель. Пригодные носители и составление таких лекарственных средств известны специалисту в данной области. Пригодные носители представляют собой, например, общепринятые забуференные фосфатом растворы солей, воду, эмульсии, например, эмульсии масло/вода, увлажняющие средства, стерильные растворы и т.д. Лекарственные средства можно вводить перорально или парентерально. Способы парентерального введения включают местное, внутриартериальное, внутримышечное, подкожное, интрамедуллярное, интратекальное, интравентрикулярное, внутривенное, внутрибрюшинное или интраназальное введение. Пригодную дозу определяет лечащий врач, и она зависит от различных факторов, например, возраста, пола и массы пациента, вида введения и т.д.
Более того, настоящее изобретение относится к вакцинной композиции или иммуностимулирующим композициям против злокачественной опухоли или инфекционных заболеваний, содержащим иммунологически эффективное количество нуклеиновой кислоты, кодирующей молекулу по изобретению, или ее вырожденных вариантов, где указанная композиция является способной запускать как T-клеточный, так и B-клеточный иммунный ответ. Настоящее изобретение также относится к набору, содержащему ДНК, РНК или белок вакцинотела для диагностических, медицинских или научных целей.
Кроме того, изобретение относится к способу получения рекомбинантной молекулы по изобретению, включающему трансфекцию популяции клеток вектором, содержащим молекулу по изобретению; культивирование популяции клеток; сбор рекомбинантного белка, экспрессированного из популяции клеток; и очистку экспрессированного белка.
Вышеописанные нуклеотидные последовательности можно предпочтительно вставлять в вектор, пригодный для генотерапии, например, под контролем специфического промотора, и вводить в клетки. В предпочтительном варианте осуществления вектор, содержащий указанную последовательность ДНК, представляет собой вирус, например, аденовирус, вирус осповакцины или аденоассоциированный вирус. Ретровирусы являются особенно предпочтительными. Примерами подходящих ретровирусов являются, например, MoMuLV или HaMuSV. С целью генотерапии последовательности ДНК/РНК по изобретению можно также транспортировать к клеткам-мишеням в форме коллоидных дисперсий. Они содержат, например, липосомы или липоплексы.
Настоящее изобретение относится также к использованию полипептидов или доменов или мотивов внутри полипептидов, обладающих какой-либо степенью идентичности последовательности или гомологии последовательности с аминокислотной последовательностью (последовательностями), определенными в настоящем документе, или с полипептидом, обладающим специфическими свойствами, определенными в настоящем документе. Настоящее изобретение относится, в частности, к пептидам, обладающим какой-либо степенью идентичности последовательности с SEQ ID NO: 1 или его гомологами. В настоящем документе термин «гомолог» обозначает молекулу, обладающую идентичностью последовательности с рассматриваемыми аминокислотными последовательностями или с рассматриваемыми нуклеотидными последовательностями, где рассматриваемая аминокислотная последовательность предпочтительно представляет собой SEQ ID NO: 1.
В одном аспекте гомологичная аминокислотная последовательность и/или нуклеотидная последовательность должна обеспечивать и/или кодировать полипептид, который сохраняет функциональную активность и/или улучшает активность полипептида из SEQ ID NO: 1.
В настоящем контексте гомологичную последовательность принимают как включающую в себя аминокислотную последовательность, которая может являться по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентичной рассматриваемой последовательности. Как правило, гомологи содержат такие же активные участки и т.д., как и рассматриваемая аминокислотная последовательность. Хотя гомологию можно также рассматривать в отношении сходства (т.е. аминокислотных остатков, обладающих сходными химическими свойствами/функциями), в контексте настоящего изобретения она предпочтительно выражает гомологию в отношении идентичности последовательности.
Сравнения идентичности последовательностей можно проводить визуально или, более обычно, с помощью легко доступных программ сравнения последовательностей. В этих коммерчески доступных компьютерных программах используют комплексные алгоритмы сравнения для сравнения двух или более последовательностей, которые наилучшим образом отражают эволюционные события, которые могут приводить к различию (различиям) между двумя или более последовательностями. Таким образом, эти алгоритмы работают с системой балльной оценки с вознаграждением за выравнивание идентичных или сходных аминокислот и штрафом за вставку пропусков, расширения пропусков и выравнивание не сходных аминокислот. Система балльной оценки алгоритмов сравнения включает в себя:
i) присвоение штрафного балла каждый раз при вставке пропуска (балл штрафа за открытие),
ii) присвоение штрафного балла каждый раз при расширении существующего пропуска на дополнительное положение (балл штрафа за расширение),
iii) присвоение высоких баллов при выравнивании идентичных аминокислот, и
iv) присвоение различных баллов при выравнивании неидентичных аминокислот.
Большинство программ для выравнивания позволяют модификацию штрафов за пропуски. Однако является предпочтительным использование значений по умолчанию при использовании такого программного обеспечения для сравнений последовательностей.
Баллы, данные за выравнивание неидентичных аминокислот, присваивают согласно матрице баллов, называемой также матрицей замен. Баллы, представленные в таких матрицах замен, отражают то, что вероятность замены одной аминокислоты на другую в ходе эволюции варьирует и зависит от физической/химической природы аминокислоты, подлежащей замене. Например, вероятность замены полярной аминокислоты на другую полярную аминокислоту выше по сравнению с заменой на гидрофобную аминокислоту. Таким образом, матрица баллов приписывает наивысший балл для идентичных аминокислот, более низкий балл для не идентичных, но сходных аминокислот, и даже более низкий балл для не идентичных, не сходных аминокислот. Наиболее часто используемыми матрицами баллов являются матрицы PAM (Dayhoff et al. (1978), Jones et al. (1992)), матрицы BLOSUM (Henikoff and Henikoff (1992)) и матрица Gonnet (Gonnet et al. (1992)).
Пригодные компьютерные программы для проведения такого выравнивания включают в себя, но без ограничения, Vector NTI (Invitrogen Corp.) и программы ClustalV, ClustalW и ClustalW2 (Higgins DG & Sharp PM (1988), Higgins et al. (1992), Thompson et al. (1994), Larkin et al. (2007). Подборка различных инструментов для выравнивания доступна с сервера ExPASy Proteomics на www.expasy.org. Другим примером программного обеспечения, которое может проводить выравнивание последовательностей, является BLAST (Базовый инструментарий поиска локальных блоков), который является доступным с web-страницы Национального центра биотехнологической информации, которую в настоящее время можно найти на http://www.ncbi.nlm.nih.gov/, и который впервые был описан в Altschul et al. (1990) J. Mol. Biol. 215; 403-410.
После получения выравнивания от программного обеспечения можно рассчитать % сходства и % идентичности последовательности. Программное обеспечение, как правило, выполняет это как часть сравнения последовательностей и получает числовой результат.
В одном варианте осуществления является предпочтительным использование программного обеспечения ClustalW для проведения выравниваний последовательностей. Предпочтительно, выравнивание с помощью ClustalW проводят со следующими параметрами для попарного выравнивания:
ClustalW2, например, сделан доступным в интернет Европейским институтом биоинформатики на web-странице EMBL-EBI www.ebi.ac.uk под tools - sequence analysis - ClustalW2. В настоящее время точный адрес инструмента ClustalW2 представляет собой www.ebi.ac.uk/Tools/clustalw2.
В другом варианте осуществления является предпочтительным использование программы Align X в Vector NTI (Invitrogen) для проведения выравнивания последовательностей. В одном варианте осуществления Exp10 можно использовать с параметрами по умолчанию:
Штраф за открытие пропуска: 10
Штраф за расширение пропуска: 0,05
Диапазон штрафа за расстояние между пропусками: 8
Матрица баллов: blosum62mt2
Таким образом, настоящее изобретение относится также к использованию вариантов, гомологов и производных любой аминокислотной последовательности белка, полипептида, мотива или домена, как определено в настоящем документе, в частности, вариантов, гомологов и производных SEQ ID NO: 1.
Последовательности, в частности, последовательности вариантов, гомологов и производных SEQ ID NO: 1, могут также обладать делециями, вставками или заменами аминокислотных остатков, которые образуют молчащую замену и приводят в результате к функционально эквивалентному веществу. Преднамеренные замены аминокислот можно осуществлять на основании сходства полярности, заряда, растворимости, гидрофобности, гидрофильности и/или амфипатической природы остатков, при условии, что сохраняется вторичная связывающая активность вещества. Например, отрицательно заряженные аминокислоты включают аспарагиновую кислоту и глутаминовую кислоту; положительно заряженные аминокислоты включают лизин и аргинин; и аминокислоты с незаряженными полярными концевыми группами, обладающие сходными значениями гидрофильности, включают лейцин, изолейцин, валин, глицин, аланин, аспарагин, глутамин, серин, треонин, фенилаланин и тирозин.
Настоящее изобретение относится также к консервативным заменам (как замещение, так и замену применяют в настоящем документе для обозначения обмена существующего аминокислотного остатка на альтернативный остаток), которые могут происходить, т.е. к замене подобного подобным, например, основного на основной, кислого на кислый, полярного на полярный и т.д. Может происходить также неконсервативная замена, т.е. одного класса остатков на другой или, альтернативно, включение вставки неприродных аминокислот, таких как орнитин (далее в настоящем документе обозначенный как Z), диаминомасляная кислота-орнитин (далее в настоящем документе обозначенный как B), норлейцин-орнитин (далее в настоящем документе обозначенный как O), пиридилаланин, тиенилаланин, нафтилаланин и фенилглицин.
Консервативные замены, которые можно выполнять, находятся, например, в пределах групп основных аминокислот (аргинин, лизин и гистидин), кислых аминокислот (глутаминовая кислота и аспарагиновая кислота), алифатических аминокислот (аланин, валин, лейцин, изолейцин), полярных аминокислот (глутамин, аспарагин, серин, треонин), ароматических аминокислот (фенилаланин, триптофан и тирозин), гидроксиаминокислот (серин, треонин), больших аминокислот (фенилаланин и триптофан) и малых аминокислот (глицин, аланин).
Можно выполнять также замены на неприродные аминокислоты, включая альфа* и альфа-дизамещенные* аминокислоты, N-алкиламинокислоты*, молочную кислоту*, галогенидные производные природных аминокислот, такие как трифтортирозин*, p-Cl-фенилаланин*, p-Br-фенилаланин*, p-I-фенилаланин*, L-аллилглицин*, β-аланин*, L-α-аминомасляную кислоту*, L-γ-аминомасляную кислоту*, L-α-аминоизомасляную кислоту*, L-ε-аминокапроновую кислоту*, 7-аминогептановую кислоту*, L-метионинсульфон#*, L-норлейцин*, L-норвалин*, п-нитро-L-фенилаланин*, L-гидроксипролин*, L-тиопролин*, метильные производные фенилаланина (Phe), такие как 4-метил-Phe*, пентаметил-Phe*, L-Phe(4-амино)#, L-Tyr(метил)*, L-Phe(4-изопропил)*, L-Tic (l,2,3,4-тетрагидроизохинолин-3-карбоновую кислоту)*, L-диаминопропионовую кислоту# и L-Phe(4-бензил)*. Пометка * использована для целей обсуждения выше (относительно гомологичной или неконсервативной замены) для обозначения гидрофобной природы производного, в то время как # использована для обозначения гидрофильной природы производного, #* обозначает амфипатические характеристики.
Варианты аминокислотных последовательностей могут включать в себя пригодные спейсерные группы, которые можно вставлять между двумя аминокислотными остатками последовательности, включая алкильные группы, такие как метильные, этильные или пропильные группы в дополнение к аминокислотным спейсерам, таким как остатки глицина или β-аланина. Дополнительная форма варианта, включающая в себя присутствие одного или нескольких аминокислотных остатков в пептоидной форме, хорошо известна специалистам в данной области. Во избежание неясностей, «пептоидную форму» используют для обозначения вариантов аминокислотных остатков, где группа заместителя α-углерода находится на атоме азота остатка, а не на атоме α-углерода. Способы получения пептидов в пептоидной форме известны в данной области, например, Simon RJ et al. (1992), Horwell DC. (1995).
В одном варианте осуществления вариант нацеливающей группы, используемый в гомодимерном белке по настоящему изобретению, представляет собой вариант, обладающий последовательностью аминокислот 5-70 SEQ ID NO: 1 и обладающий по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 78%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью аминокислотной последовательности.
В одном аспекте предпочтительно белок или последовательность, используемые по настоящему изобретению, находятся в очищенной форме. Термин «очищенный» означает, что данный компонент присутствует на высоком уровне. Компонент желательно представляет собой преобладающий активный компонент в композиции.
«Вариант» или «варианты» относятся к белкам, полипептидам, группам, мотивам, доменам или нуклеиновым кислотам. Термин «вариант» можно использовать взаимозаменяемо с термином «мутант». Варианты включают в себя вставки, замены, трансверсии, усечения и/или инверсии в одном или нескольких положениях в аминокислотной или нуклеотидной последовательности, соответственно. Фразы «вариант полипептида», «полипептид», «вариант» и «вариант фермента» обозначают полипептид/белок, обладающий аминокислотной последовательностью, которая была модифицирована из аминокислотной последовательности SEQ ID NO: 1. Варианты полипептидов включают в себя полипептид, обладающий конкретным процентом, например, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%, идентичности последовательности SEQ ID NO: 1, или аминокислотной последовательности 5-70 SEQ ID NO: 1.
«Варианты нуклеиновых кислот» могут включать в себя последовательности, которые являются комплементарными последовательностям, способным гибридизоваться с нуклеотидными последовательностями, представленными в настоящем документе. Например, вариант последовательности является комплементарным последовательностям, способным гибридизоваться в строгих условиях, например, 50°C и 0,2X SSC (1X SSC=0,15 M NaCl, 0,015 M цитрат натрия, pH 7,0), c нуклеотидными последовательностями, представленными в настоящем документе. Более конкретно, термин вариант включает в себя последовательности, которые являются комплементарными последовательностям, способным гибридизоваться в высоко строгих условиях, например, 65°C и 0,1X SSC, с нуклеотидными последовательностями, представленными в настоящем документе. Температура плавления (Tm) варианта нуклеиновой кислоты может составлять приблизительно на 1, 2 или 3°C ниже, чем Tm нуклеиновой кислоты дикого типа. Варианты нуклеиновых кислот включают в себя полинуклеотид, обладающий конкретным процентом, например, 80%, 85%, 90%, 95% или 99%, идентичности последовательности с нуклеиновой кислотой, кодирующей SEQ ID NO: 1, или кодирующий мономерный белок, который может формировать гомодимерный белок по изобретению.
Термин «гомодимерный белок», как применяют в настоящем документе, относится к белку, содержащему две идентичных цепи аминокислот, или субъединицы, удерживаемые вместе, как один, димерный, белок водородными связями, ионными (зарядными) взаимодействиями, истинными ковалентными дисульфидными связями, или какой-либо комбинацией этих взаимодействий.
Термин «мотив для димеризации», как применяют в настоящем документе, относится к последовательности аминокислот между антигенной группой и нацеливающей группой, содержащей шарнирную область и необязательный второй домен, который может вносить вклад в димеризацию. Этот второй домен может представлять собой иммуноглобулиновый домен, и необязательно шарнирная область и второй домен соединены через линкер. Соответственно, мотив для димеризации служит для соединения антигенной группы и нацеливающей группы, но также содержит шарнирную область, которая облегчает димеризацию двух мономерных белков в гомодимерный белок по изобретению.
Термин «нацеливающая группа», как применяют в настоящем документе, относится к группе, доставляющей белок с его антигеном к APC мыши или человека для рестрицированного по MHC класса II представления CD4+ T-клеткам или для обеспечения перекрестного представления CD8+ T-клеткам посредством рестрикции по MHC класса I.
Термин «антигенная группа», как применяют в настоящем документе, относится к любой молекуле, такой как пептид, которая способна быть специфически узнанной антителом или другим компонентом иммунной системы, таким как поверхностный рецептор на T-клетках. В это определение включены также иммуногены, способные индуцировать иммунный ответ, такие как идиотипические иммуногены антител. Термины «эпитоп» или «антигенный эпитоп» используют для обозначения дискретной молекулярной поверхности, такой как молекулярная поверхность, обеспечиваемая короткой пептидной последовательностью в пределах антигенной группы. В некоторых вариантах осуществления антигенная группа содержит два или более антигенных эпитопа.
Термин «шарнирная область» относится к пептидной последовательности гомодимерного белка, облегчающей димеризацию, например, через формирование межцепьевой ковалентной связи (связей), например, дисульфидного мостика (мостиков). Шарнирная область может происходить из Ig, например, шарнирные экзоны h1+h4 Ig, такого как IgG3.
Термин «иммуностимулирующая композиция», как применяют в настоящем документе, относится к любой терапевтической композиции, способной активировать иммунную систему, например, посредством активации или ингибирования функций лимфоцитов, в частности, функций T-клеток, подобных активации T-клеток.
Конкретные варианты осуществления изобретения
В некоторых вариантах осуществления антигенная группа представляет собой ассоциированный со злокачественной опухолью или специфический для злокачественной опухоли антиген.
Термин «ассоциированный со злокачественной опухолью антиген» обозначает любой антиген, который не обязательно является специфическим для конкретной злокачественной опухоли, но сверхэкспрессирован на поверхности злокачественных клеток этой злокачественной опухоли. Термин можно использовать взаимозаменяемо с термином «антигены злокачественной опухоли».
В некоторых вариантах осуществления антигенная группа представляет собой антигенный scFv. В некоторых вариантах осуществления линкер, такой как линкер (G4S)3, соединяет VH и VL в антигенном scFv. В некоторых вариантах осуществления антигенный scFv происходит из моноклонального Ig, продуцируемого клетками миеломы или лимфомы.
В некоторых вариантах осуществления антигенная группа представляет собой теломеразу или ее функциональную часть. В некоторых вариантах осуществления теломераза представляет собой hTERT.
В некоторых вариантах осуществления антигенная группа представляет собой антиген меланомы. В некоторых вариантах осуществления антиген меланомы представляет собой тирозиназу, TRP-1 или TRP-2.
В некоторых вариантах осуществления антигенная группа представляет собой антиген рака предстательной железы. В некоторых вариантах осуществления антиген рака предстательной железы представляет собой PSA.
В некоторых вариантах осуществления антигенная группа представляет собой антиген рака шейки матки. В некоторых вариантах осуществления антиген рака шейки матки выбран из списка, состоящего из вируса папилломы человека E1, E2, E4, E6 и E7.
В некоторых вариантах осуществления антигенная группа происходит из бактерии.
В некоторых вариантах осуществления происходящая из бактерии антигенная группа представляет собой антиген туберкулеза.
В некоторых вариантах осуществления происходящая из бактерии антигенная группа представляет собой антиген бруцеллеза.
В некоторых вариантах осуществления антигенная группа происходит из вируса.
В некоторых вариантах осуществления происходящая из вируса антигенная группа происходит из HIV. В некоторых вариантах осуществления происходящая из HIV антигенная группа происходит из gp120 или Gag.
В некоторых вариантах осуществления антигенная группа выбрана из списка, состоящего из гемагглютинина (HA), нуклеопротеина и антигена M2 вируса гриппа; антигена гликопротеина D вируса простого герпеса 2; и антигена вируса папилломы человека, такого как любой, выбранный из списка, состоящего из E1, E2, E6, E7, L1 и L2.
В некоторых вариантах осуществления мотив для димеризации содержит шарнирную область и, необязательно, другой домен, облегчающий димеризацию, такой как иммуноглобулиновый домен, необязательно присоединенный через линкер.
В некоторых вариантах осуществления шарнирная область происходит из Ig, например, происходит из IgG3.
В некоторых вариантах осуществления шарнирная область обладает способностью формировать одну, две или несколько ковалентных связей. В некоторых вариантах осуществления ковалентная связь представляет собой дисульфидный мостик.
В некоторых вариантах осуществления иммуноглобулиновый домен мотива для димеризации представляет собой карбоксиконцевой домен C или последовательность, по существу гомологичную указанному домену C. В некоторых вариантах осуществления карбоксиконцевой домен C происходит из IgG.
В некоторых вариантах осуществления иммуноглобулиновый домен мотива для димеризации обладает способностью к гомодимеризации.
В некоторых вариантах осуществления иммуноглобулиновый домен мотива для димеризации обладает способностью к гомодимеризации посредством нековалентных взаимодействий. В некоторых вариантах осуществления нековалентные взаимодействия представляют собой гидрофобные взаимодействия.
В некоторых вариантах осуществления домен для димеризации не содержит домен CH2.
В некоторых вариантах осуществления мотив для димеризации состоит из шарнирных экзонов h1 и h4, соединенных через линкер с доменом CH3 IgG3 человека.
В некоторых вариантах осуществления линкер, который соединяет шарнирную область и другой домен, облегчающий димеризацию, такой как иммуноглобулиновый домен, представляет собой линкер G3S2G3SG.
В некоторых вариантах осуществления антигенная группа и мотив для димеризации соединены через линкер, такой как линкер GLSGL.
В некоторых вариантах осуществления нацеливающая группа содержит аминокислоты 3-70 из SEQ ID NO: 1.
В некоторых вариантах осуществления нацеливающая группа состоит из аминокислот 5-70 из SEQ ID NO: 1.
В некоторых вариантах осуществления нацеливающая группа состоит из аминокислот 3-70 из SEQ ID NO: 1.
В некоторых вариантах осуществления нацеливающая группа состоит из аминокислот 1-70 из SEQ ID NO: 1.
В некоторых вариантах осуществления гомодимерный белок не содержит аминокислоты 1-70 из SEQ ID NO: 1.
В некоторых вариантах осуществления нацеливающая группа содержит аминокислоты 3-70 из SEQ ID NO: 2.
В некоторых вариантах осуществления нацеливающая группа состоит из аминокислот 5-70 из SEQ ID NO: 2.
В некоторых вариантах осуществления нацеливающая группа состоит из аминокислот 3-70 из SEQ ID NO: 2.
В некоторых вариантах осуществления нацеливающая группа состоит из аминокислот 1-70 из SEQ ID NO: 2.
В некоторых вариантах осуществления гомодимерный белок не содержит аминокислоты 1-70 из SEQ ID NO: 2.
В некоторых вариантах осуществления нацеливающая группа состоит из не более чем 68 аминокислот, например, из 68, 67 или 66 аминокислот.
В некоторых вариантах осуществления нацеливающая группа не содержит аминокислотной последовательности AP в положениях 1 и 2 нацеливающей группы.
В некоторых вариантах осуществления гомодимерный белок представляет собой первый гомодимерный белок, обладающий увеличенной аффинностью по сравнению с аффинностью второго гомодимерного белка, где второй гомодимерный белок отличается от указанного первого гомодимерного белка только обладанием нацеливающей группой, состоящей из аминокислот 1-70 из SEQ ID NO: 2; где увеличенная аффинность имеет место в отношении любого из рецепторов хемокинов, выбранного из CCR1, CCR3 и CCR5. В некоторых вариантах осуществления молекула нуклеиновой кислоты по изобретению содержится в векторе.
В некоторых вариантах осуществления молекулу нуклеиновой кислоты по изобретению составляют для введения пациенту для индукции продукции гомодимерного белка у указанного пациента.
В некоторых вариантах осуществления вакцина или иммуностимулирующая композиция по изобретению содержит фармацевтически приемлемый носитель и/или адъювант.
В некоторых вариантах осуществления злокачественная опухоль, которую лечат посредством вакцины или иммуностимулирующей композиции, или фармацевтической композиции по настоящему изобретению, представляет собой множественную миелому или лимфому, злокачественную меланому, HPV-индуцированные злокачественные опухоли, рак предстательной железы, рак молочной железы, рак легкого, рак яичника и/или рак печени.
В некоторых вариантах осуществления инфекционное заболевание, которое лечат посредством вакцины или иммуностимулирующей композиции, или фармацевтической композиции по настоящему изобретению, выбрано из списка, состоящего из гриппа, герпеса, CMV, HPV, HBV, бруцеллеза, HIV, HSV-2 и туберкулеза.
Пронумерованные варианты осуществления изобретения:
1. Гомодимерный белок из двух идентичных аминокислотных цепей, где каждая аминокислотная цепь содержит нацеливающую группу, содержащую аминокислотную последовательность, обладающую по меньшей мере 80% идентичностью последовательности 5-70 из SEQ ID NO: 1, и антигенную группу, где нацеливающая группа и антигенная группа соединены через мотив для димеризации.
2. Гомодимерный белок по варианту осуществления 1, где антигенная группа представляет собой антигенный scFv.
3. Гомодимерный белок по вариантам осуществления 1 или 2, где линкер, такой как линкер (G4S)3, соединяет VH и VL в антигенном scFv.
4. Гомодимерный белок по любому из вариантов осуществления 1-3, где антигенный scFv происходит из моноклонального Ig, продуцируемого клетками миеломы или лимфомы.
5. Гомодимерный белок по варианту осуществления 1, где антигенная группа представляет собой теломеразу или ее функциональную часть.
6. Гомодимерный белок по варианту осуществления 5, где указанная теломераза представляет собой hTERT.
7. Гомодимерный белок по варианту осуществления 1, где антигенная группа происходит из бактерии.
8. Гомодимерный белок по варианту осуществления 7, где происходящая из бактерии антигенная группа выбрана из антигена туберкулеза и антигена бруцеллеза.
9. Гомодимерный белок по варианту осуществления 1, где антигенная группа происходит из вируса.
10. Гомодимерный белок по варианту осуществления 9, где происходящая из вируса антигенная группа происходит из HIV.
11. Гомодимерный белок по варианту осуществления 10, где происходящая из HIV антигенная группа происходит из gp120 или Gag.
12. Гомодимерный белок по варианту осуществления 9, где антигенная группа выбрана из списка, состоящего из гемагглютинина (HA), нуклеопротеина и антигена M2 вируса гриппа; и антигена гликопротеина D вируса простого герпеса 2.
13. Гомодимерный белок по варианту осуществления 1, где антигенная группа представляет собой ассоциированный со злокачественной опухолью или специфический для злокачественной опухоли антиген.
14. Гомодимерный белок по варианту осуществления 13, где антигенная группа злокачественной опухоли представляет собой антиген меланомы, такой как антигены меланомы тирозиназа, TRP-1 или TRP2.
15. Гомодимерный белок по варианту осуществления 13, где антигенная группа злокачественной опухоли представляет собой антиген рака предстательной железы, такой как антиген рака предстательной железы PSA.
16. Гомодимерный белок по варианту осуществления 13, где антигенная группа злокачественной опухоли представляет собой антиген рака шейки матки, такой как антиген рака шейки матки, выбранный из списка, состоящего из E1, E2, E4, E6, E7, L1 и L2.
17. Гомодимерный белок по любому из вариантов осуществления 1-16, где мотив для димеризации содержит шарнирную область и, необязательно, другой домен, облегчающий димеризацию, такой как иммуноглобулиновый домен, необязательно присоединенный через линкер.
18. Гомодимерный белок по варианту осуществления 17, где шарнирная область происходит из Ig, например, происходит из IgG3.
19. Гомодимерный белок по любому из вариантов осуществления 17-18, где шарнирная область обладает способностью формировать одну, две или несколько ковалентных связей.
20. Гомодимерный белок по любому из вариантов осуществления 17-19, где ковалентная связь представляет собой дисульфидный мостик.
21. Гомодимерный белок по любому из вариантов осуществления 17-20, где иммуноглобулиновый домен мотива для димеризации представляет собой карбоксиконцевой домен C или последовательность, по существу гомологичную указанному домену C.
22. Гомодимерный белок по варианту осуществления 21, где карбоксиконцевой домен C происходит из IgG.
23. Гомодимерный белок по любому из вариантов осуществления 17-22, где иммуноглобулиновый домен мотива для димеризации обладает способностью к гомодимеризации.
24. Гомодимерный белок по любому из вариантов осуществления 17-23, где указанный иммуноглобулиновый домен мотива для димеризации обладает способностью к гомодимеризации посредством нековалентных взаимодействий.
25. Гомодимерный белок по варианту осуществления 24, где указанные нековалентные взаимодействия представляют собой гидрофобные взаимодействия.
26. Гомодимерный белок по любому из вариантов осуществления 1-25, где указанный домен для димеризации не содержит домен CH2.
27. Гомодимерный белок по любому из вариантов осуществления 1-26, где мотив для димеризации состоит из шарнирных экзонов h1 и h4, соединенных через линкер с доменом CH3 IgG3 человека.
28. Гомодимерный белок по любому из вариантов осуществления 17-27, где указанный линкер представляет собой линкер G3S2G3SG.
29. Гомодимерный белок по любому из вариантов осуществления 1-28, где указанные антигенная группа и мотив для димеризации соединены через линкер, такой как линкер GLSGL.
30. Гомодимерный белок по любому из вариантов осуществления 1-29, где указанная нацеливающая группа содержит аминокислоты 3-70 из SEQ ID NO: 1.
31. Гомодимерный белок по любому из вариантов осуществления 1-29, где указанная нацеливающая группа состоит из аминокислот 5-70 из SEQ ID NO: 1.
32. Гомодимерный белок по любому из вариантов осуществления 1-29, где указанная нацеливающая группа состоит из аминокислот 3-70 из SEQ ID NO: 1.
33. Гомодимерный белок по любому из вариантов осуществления 1-30, где указанная нацеливающая группа состоит из аминокислот 1-70 из SEQ ID NO: 1.
34. Гомодимерный белок по любому из вариантов осуществления 1-29, где гомодимерный белок не содержит аминокислоты 1-70 из SEQ ID NO: 1.
35. Гомодимерный белок по любому из вариантов осуществления 1-29, где указанная нацеливающая группа содержит аминокислоты 3-70 из SEQ ID NO: 2.
36. Гомодимерный белок по любому из вариантов осуществления 1-29, где указанная нацеливающая группа состоит из аминокислот 5-70 из SEQ ID NO: 2.
37. Гомодимерный белок по любому из вариантов осуществления 1-29, где указанная нацеливающая группа состоит из аминокислот 3-70 из SEQ ID NO: 2.
38. Гомодимерный белок по любому из вариантов осуществления 1-29, где указанная нацеливающая группа состоит из аминокислот 1-70 из SEQ ID NO: 2.
39. Гомодимерный белок по любому из вариантов осуществления 1-29, где гомодимерный белок не содержит аминокислоты 1-70 из SEQ ID NO: 2.
40. Гомодимерный белок по любому из вариантов осуществления 1-32, 35-37, где каждая указанная нацеливающая группа состоит из не более чем 68 аминокислот, например, из 68, 67 или 66 аминокислот.
41. Гомодимерный белок по любому из вариантов осуществления 1-30, 35, где указанная нацеливающая группа не содержит аминокислотную последовательность AP в положениях 1 и 2 нацеливающей группы.
42. Гомодимерный белок по любому из вариантов осуществления 1-41, где гомодимерный белок обладает увеличенной аффинностью для любого из рецепторов хемокинов, выбранного из CCR1, CCR3 и CCR5, по сравнению с аффинностью такого же гомодимерного белка, где нацеливающая группа состоит из аминокислот 1-70 из SEQ ID NO:2.
43. Молекула нуклеиновой кислоты, кодирующая мономерный белок, который может формировать гомодимерный белок по любому из вариантов осуществления 1-42.
44. Молекула нуклеиновой кислоты по варианту осуществления 43, содержащаяся в векторе.
45. Молекула нуклеиновой кислоты по вариантам осуществления 43 или 44, составленная для введения пациенту для индукции продукции гомодимерного белка у указанного пациента.
46. Гомодимерный белок по любому из вариантов осуществления 1-42 или молекула нуклеиновой кислоты по вариантам осуществления 43 или 44 для использования в качестве лекарственного средства.
47. Фармацевтическая композиция, содержащая гомодимерный белок по любому из вариантов осуществления 1-42 или молекулу нуклеиновой кислоты по вариантам осуществления 43 или 44.
48. Клетка-хозяин, содержащая молекулу нуклеиновой кислоты по вариантам осуществления 43 или 44.
49. Способ получения гомодимерного белка по любому из вариантов осуществления 1-42, где способ включает:
a) трансфекцию популяции клеток молекулой нуклеиновой кислоты по вариантам осуществления 43 или 44;
b) культивирование указанной популяции клеток;
c) сбор и очистку гомодимерного белка, экспрессированного из указанной популяции клеток.
50. Вакцина против злокачественной опухоли или инфекционного заболевания, содержащая иммунологически эффективное количество гомодимерного белка по любому из вариантов осуществления 1-42 или молекулы нуклеиновой кислоты по вариантам осуществления 43 или 44, кодирующей мономерный белок, который может формировать гомодимерный белок, где указанная вакцина является способной запускать как T-клеточный, так и B-клеточный иммунный ответ, и где указанный гомодимерный белок содержит антигенную группу, специфическую для указанных злокачественной опухоли или инфекционного заболевания.
51. Вакцина по варианту осуществления 50, дополнительно содержащая фармацевтически приемлемый носитель и/или адъювант.
52. Вакцина по вариантам осуществления 50 или 51, где указанная злокачественная опухоль представляет собой множественную миелому или лимфому, злокачественную меланому, HPV-индуцированные злокачественные опухоли, рак предстательной железы, рак молочной железы, рак легкого, рак яичника и/или рак печени.
53. Вакцина по варианту осуществления 50 или 51, где указанное инфекционное заболевание выбрано из списка, состоящего из туберкулеза, гриппа, герпеса, CMV, HPV, HBV, HIV, бруцеллеза и/или HSV-2.
54. Способ лечения злокачественной опухоли или инфекционного заболевания у пациента, где способ включает введение нуждающемуся в этом пациенту гомодимерного белка по любому из вариантов осуществления 1-42 или молекулы нуклеиновой кислоты по вариантам осуществления 43 или 44, кодирующей мономерный белок, который может формировать гомодимерный белок, где указанный гомодимерный белок содержит антигенную группу, специфическую для указанных злокачественной опухоли или инфекционного заболевания.
ПРИМЕР 1
Мыши и линии клеток
Мышей BALB/c получали из Taconic (Ry, Denmark). Трансгенные по Id(λ2315)-специфическому T-клеточному рецептору (TCR) мыши описаны (см. Bogen B et al. Eur J Immunol 1992 Mar; 22(3): 703-9 и Snodgrass HR et al. Eur J Immunol 1992 Aug; 22(8): 2169-72). TCR узнает а.к. 91-101 легкой цепи λ2315, продуцируемой IgA плазмацитомы мыши MOPC315, представленные на молекулах I-Ed класса II. Исследования были одобрены Национальным комитетом по экспериментам на животных (Oslo, Norway). Клетки MOPC 315.4 (IgA, λ2315), HEK 293 и HEK 293E были из ATCC. HEK 293, стабильно трансфицированные hCCR5 и hCCR1, любезно предоставлены Mario Mellado (Madrid, Spain) и Zack Howard (Frederick, MD), соответственно. HEK 293, стабильно трансфицированные (GenBank AF005660) макака-резуса, получены из Pfizer Inc., (Groton, CT). Клетки лимфомы мыши Esb/MP любезно предоставлены Jo Van Damme (Leuven, Belgium).
Клонирование MIP1a/CCL3 человека (кодирующие LD78α или LD78β вакцинотела)
Гены, кодирующие зрелые LD78α и LD78β (GenBank NM_002983 и NG_004113, соответственно), амплифицировали с кДНК обогащенных по CD14, происходящих из костного мозга моноцитов здорового донора. Прямые праймеры (участок рестрикции BsmI, курсивом) представляли собой:
LD78α: GGTGTGCATTCCGCATCACTTGCTGCTGAC (SEQ ID NO: 3);
LD78β: GGTGTGCATTCCGCACCACTTGCTGCTGAC (SEQ ID NO: 4);
и обратный праймер (участок рестрикции BsiWI, курсивом) представлял собой
GACGTACGACTCACCTGCAACTCAGCTCCAGGTC (SEQ ID NO: 5). LD78β-2 длиной 68 а.к. (3-70) клонировали с использованием прямого праймера (участок рестрикции BsmI, курсивом):
GGTGTGCATTCCCTTGCTGCTGACACGCC (SEQ ID NO: 6).
LD78α и LD78β с точечными мутациями, несущие остаток S вместо C в положении 11, получали посредством quick change PCR с использованием следующих праймеров: прямого CCGACCGCCTCCTGCTTCAG (SEQ ID NO: 7) и обратного CTGAAGCAGGAGGCGGTCGG (SEQ ID NO: 8). Амплифицированные гены хемокинов вставляли в нацеливающую кассету конструкции вакцинотела IlhFpLNOH2 (см. Fredriksen AB et al. Mol Ther 2006 Apr; 13(4): 776-85) посредством использования участков рестрикции BsmI/BsiWI. Полученная конструкция вакцинотела кодировала гомодимерные белки с происходящими из hCCL3 нацеливающими группами и scFv MOPC315 в ориентации VH-VL в качестве антигенной группы, соединенные мотивом для гомодимеризации, состоящим из шарнирных экзонов h1 и h4 и домена CH3 IgG3 человека.
Антигенную группу (scFv315) в вакцинотелах, описанных выше, заменяли на любой из спаренных доменов Cκ мыши (Tunheim G et al. Vaccine 2007 Jun 11; 25(24): 4723-34) или гемагглютинин (HA) вируса гриппа из H1N1 A/Puerto Rico/8/34 (Mt. Sinai) (G. Grodeland, рукопись готовится к печати).
Оценка продукции вакцинного белка
Супернатанты временно трансфицированных клеток 293E тестировали в следующих ELISA.
Вакцинотела scFv315: DNP-BSA (связывается с M315) в качестве покрытия и биотинилированное моноклональное HP6017 (против мотива для димеризации CH3) для детекции; вакцинотела для HA: MCA878G (против мотива для димеризации CH3) в качестве покрытия и биотинилированное mAB H36-4-52 против HA для детекции; вакцинотела для CκCκ мыши: mAb 187.1 (связывается с CK мыши) в качестве покрытия и биотинилированное 187.1 для детекции.
Продукция, очистка, количественная оценка и протеомная характеризация белков вакцинотел
Белки вакцинотела, обладающие scFv315 в качестве антигенной группы, аффинно очищали из супернатантов стабильно трансфицированных клеток NS0 на колонках с сефарозой и DNP (связывается с M315). Очищенные белки наносили на 4-20% трис-глициновый гель. После переноса на мембрану белки детектировали с помощью биотинилированных mAb HP6017 или Ab2-1.4 (связывается с M315), затем с помощью стрептавидина с HRP. Белки вакцинотела количественно оценивали посредством метода Бредфорд и ELISA с использованием BSA и вакцинотела mCCL3 (см. Fredriksen AB et al. Mol Ther 2006 Apr; 13(4): 776-85) в качестве стандартов, соответственно. Полосы белка, соответствующие вакцинотелам LD78β и LD78β-2 с Fv315, вырезали из окрашенного Кумасси полиакриламидного геля и подвергали трипсиновому расщеплению в геле, как описано ранее.
Связывание с CCR5 и CCR1 человека и мыши
Белки вакцинотела в концентрациях в диапазоне от 0,2 до 25 мкг/мл использовали для окрашивания исходных или стабильно трансфицированных клеток HEK 293 или спленоцитов BALB/c (отобранных по FSC/SSC и на CD11b+ CD3-клеток). Связанные белки вакцинотела детектировали посредством биотинилированного HP6017 (связывается с CH3 hIgG3) или Ab2-1.4 (связывается с M315) mAb, затем посредством стрептавидина PE. Клетки анализировали на FACScalibur.
Анализ хемотаксиса
Миграцию клеток in vitro оценивали с помощью 24-луночного планшета transwell (Corning), как описано ранее. Поликарбонатные мембраны с порами 8 мкм или 5 мкм использовали для клеток HEK 293 и Esb/MP, соответственно. Рекомбинантные хемокины были из Peprotech. Результаты (среднее ± SE образцов в двух повторах) представлены как хемотактический индекс, определенный как кратность увеличения количества мигрирующих клеток в присутствии хемотактических факторов по сравнению со спонтанной миграцией клеток (т.е., в присутствии только среды).
Анализы стимуляции T-клеток
Спленоциты BALB/c облучали (8 Гр) и смешивали с белками вакцинотелами, содержащими scFv315, в концентрации в диапазоне от 20 до 0,04 мкг/мл перед добавлением поляризованных in vitro Id315-специфических Th2-клеток, полученных от TCR-трансгенных мышей. Пептид Id, соответствующий последовательности 89-107 λ2315, использовали в качестве положительного контроля.
PBMC человека от трех различных здоровых доноров с DR4*01 смешивали с супернатантами от временно трансфицированных клеток 293E, содержащих белки вакцинотела с CκCκ мыши в качестве антигенной группы, перед облучением (20 Гр) и добавлением клона T18 T-клеток, который узнает а.к. 40-48 Ck мыши, представленные посредством DR4*01. Через 48 часов планшеты сенсибилизировали 3H-тимидином в течение 24 часов до сбора.
Иммунизации мышей
ДНК вакцинотел очищали с использованием системы для очистки плазмид Endofree-mega (Qiagen). 25 мкл раствора 0,5 мг/мл ДНК вакцинотела в стерильном 0,9% NaCl инъецировали внутрикожно в нижний отдел спины мышей, с обеих сторон, с последующей электропорацией с использованием Dermavax (Cytopulse, Sweden). Группы состояли из 3-7 мышей.
Измерение антител против Id315
У мышей отбирали кровь через три, четыре и шесть недель после однократной иммунизации. Белок миеломы M315 (IgA, λ2) использовали в качестве покрытия, и Ab против Id315 в сыворотке мыши детектировали посредством биотинилированного антитела против IgGla мыши или антитела против IgG2aa мыши (BD Pharmingen). Рассчитывали титры в конечных точках.
Анализ Elispot
Планшеты Millipore Multiscreen (Millipore, Billerca, MA, USA) покрывали антителами против IFNγ мыши (AN18) (12 пг/мл) и затем блокировали в течение 2 часов с помощью RPMI-1640 (Invitrogen, NY, USA), содержащей 10% FCS. Отдельные клетки спленоциты получали индивидуально от мышей, вакцинированных ДНК 3 неделями ранее HA-содержащими вакцинотелами или NaCl, и инкубировали в течение ночи при 105, 5×105 и 2,5×105 клеток/лунку с одним из следующих происходящих из HA пептидов от ProImmune (Oxford, UK): SVSSFERFEIPK (а.к. 107-119, I-Ed-рестрицированный), HNTNGVTAACSHEG (а.к. 126-138, I-Ad-рестрицированный) или IYSTVASSL (а.к. 633-641, Kd-рестрицированный). Планшеты промывали в PBS и адгерентные клетки лизировали посредством пятиминутной инкубации в деионизированной воде перед инкубацией с биотинилированным антителом против IFNγ мыши (1 мкг/мл) (XMG1.2, Pharmingen) и конъюгатом стрептавидина с щелочной фосфатазой (1:3000) (GE Healthcare, Little Chalfont Buckinghamshire, UK). Продуцирующие IFNγ клетки детектировали с использованием набора BCIP/NBT (Zymed Laboratories Inc, Carlsbad, CA, USA), и расчет проводили с помощью KS EliSpot версии 4.3.56 от Zeiss в системе визуализации Zeiss Axioplan 2 (объектив: Epiplan-Neofluar 5x, 442320).
Вакцинация мышей конструкциями вакцинотело-HA.
Мышей подвергали анестезии, выбривали и вакцинировали внутрикожно 25 мкл ДНК (0,5 мг/мл) с каждой стороны в нижний отдел спины мышей с немедленной последующей электропорацией кожи (DermaVax/CytoPulse). Через 14 суток мышам проводили анестезию гипнормом/дормикумом и заражали 20 мкл (5xLD50) вируса гриппа (A/Puerto Rico/8/34 (Mt. Sinai). После заражения мышей взвешивали и тщательно контролировали клинические признаки.
Конструирование и экспрессия вакцинотел на основе CCL3 человека
Конструировали гомодимерные вакцинотела, обладающие различными нацеливающими группами на основе hCCL3, происходящей из Ig человека группой для гомодимеризации и различными антигенными группами, как указано на фиг. 1A. NH2-концевая последовательность а.к. использованных LD78α, LD78β, LD78β-2 и предположительный эффект точечной мутации C11S на структуру хемокина LD78β(C11S) показаны на фиг. 1B и 1C, соответственно. Все вакцинотела были экспрессированы на сравнимых уровнях временно трансфицированными клетками 293E, за исключением вакцинотел LD78β-2, которые были систематически экспрессированы в меньшей степени (фиг. 2 A-C).
Целостность белков вакцинотел, обладающих scFv315 в качестве антигенной группы, тестировали посредством SDS-PAGE, где являлись видимыми отдельные полосы приблизительно 110 кДа, которые после блоттинга на мембрану возможно было окрашивать соответствующими mAb (фиг. 2D и данные, не представленные для других конструкций). Кажущееся увеличение размера мутантного (C11S) вакцинотела, по-видимому, обусловлено увеличением радиуса Стокса из-за уничтожения S-S связи (фиг. 1C). В восстанавливающих условиях наблюдали отдельные полосы приблизительно 55 кДа, соответствующие мономерам, как можно было ожидать (данные не представлены).
NH2-концевую последовательность а.к. белков вакцинотел LD78β определяли дополнительно, поскольку клетки NS0 или эмбриональная бычья сыворотка в культуральной среде могли обладать активностью CD26, приводящей к посттрансляционной модификации LD78β. Анализ расщеплений трипсином белков вакцинотел LD78βΙhΡ и LD78β-2IhF посредством масс-спектрометрии MALDI-TOF показал исключительно сигналы при m/z 1988,89 и m/z 1820,78, соответствующие N-концевым пептидам APLAADTPTACCFSYTSR (SEQ ID NO: 9) и LAADTPTACCFSYTSR (SEQ ID NO: 10), соответственно (данные не представлены). Таким образом, чистые полноразмерные LD78β или NH2-усеченные LD78β-2 вакцинотела можно экспрессировать и очищать из стабильно трансфицированных клеток NS0.
Вакцинотела и NH2-усеченный вариант LD78β связывают рецепторы хемокинов человека и мыши
Принимая во внимание изменчивость экспрессии CCR5 между индивидуумами, HEK 293, стабильно трансфицированные hCCR5, а не PBMC, использовали для функциональных исследований. Вакцинотела LD78β и LD78β-2, но не их эквивалент с точечной мутацией, связывали клетки HEK 293, трансфицированные hCCR5 (фиг. 3A, B и не представленные данные). Для NH2-усеченного вакцинотела LD78β-2 показали более сильное связывание, чем для полноразмерного вакцинотела LD78β. Вакцинотело LD78β с точечной мутацией (C11S) не связывало трансфицированные hCCR5 клетки (фиг. 3A). Вакцинотела LD78β-2, но не LD78β, также связывали экспрессирующие hCCR1 клетки HEK 293 (фиг. 3C, D и не представленные данные), что согласуется с предшествующими публикациями. Не присутствовало окрашивания исходных, не трансфицированных клеток HEK 293 (не показано).
Вакцинотело LD78β, но не его эквивалент с точечной мутацией, связывало спленоциты CD11b+ BALB/c (фиг. 4A) и индуцировало хемотаксис клеток Esb/MP (фиг. 4 B), таким образом, предоставляя обоснование для тестирования экспрессирующих LD78β вакцинотел на мышах.
Доставка антигена к APC посредством рецепторов хемокинов улучшает ответы T-клеток in vitro в мышиных и человеческих системах
Спленоциты BALB/c, смешанные с вакцинотелами LD78β, зкспрессирующими антигенную группу scFv315, индуцировали пролиферацию Id315-специфических Th2-клеток от трансгенных по TCR мышей (фиг. 5A). Сходные вакцинотела, в которые введена мутация C11S, обладали в ~100 раз уменьшенной способностью стимулировать T-клетки. При сравнении эквимолярных концентраций вакцинотела LD78β и пептида Id, содержащего мутации в CDR3, обнаружили, что вакцинотело являлось вплоть до 30 раз более эффективным, чем пептид при нагрузке APC для представления антигена (не показано).
Что касается ответов T-клеток человека, вакцинотела LD78β, экспрессирующие CκCκ мыши в качестве модельного антигена, смешивали с PBMC донора и клональными T18 CD4+ T-клетками, которые узнают а.к. 40-48 CK мыши в контексте DR4*01. Различие между LD78β дикого типа и LD78β с точечной мутацией являлось менее выраженным, чем в мышиной системе (фиг. 5B). Более того, направленная доставка антигена показана посредством превосходства LD78β над не нацеленным NIP-специфическим вакцинотелом (фиг. 5B). Важно, что вакцинотела LD78β-2 превосходили вакцинотела LD78β. Сходные результаты получены с использованием трех различных доноров (не показано).
Улучшенный анти-Id гуморальный ответ индуцирован у мышей посредством вакцинотел LD78β, содержащих scFv315
VH+VL Id белка миеломы M315 является очень слабым аутоантигеном, фактически для детекции анти-Id антител были необходимы схема активной иммунизации и неполный адъювант Фрейнда. Авторы настоящего изобретения таким образом тестировали, развиваются ли анти-Id антитела у мышей после внутрикожной инъекции ДНК вакцинотела LD78βscFv315, комбинированной с электропорацией. Ответы анти-Id315 IgG1 (фиг. 6A) и IgG2a (фиг. 6B) детектировали у мышей, которых иммунизировали кодирующими LD78 вакцинотелами, дополнительно показав, что конформационная целостность scFv315 сохраняется в вакцинотеле LD78β (фиг. 6). Ответы IgG1 регистрировали в значительно меньшей степени у мышей, которым вводили вакцинотело с точечной мутацией C11S, в то время как различие для IgG2a не являлось значимым. Более того, статистически значимо более низкие ответы Ab наблюдали как для IgG1, так и IgG2a у мышей, которых иммунизировали не нацеленными контрольными вакцинотелами (против NIP). Этот результат в целом позволяет предполагать, что направленная доставка антигена улучшает ответы антител на слабый собственный антиген модельной опухоли.
Индукция CD4+ и CD8+ T-клеточных ответов, специфических для гемагглютинина вируса гриппа у мышей после введения вакцинотела
Индукцию ответов CD8+ T-клеток исследовали на модели гриппа, где гемагглютинин (HA) служил в качестве антигена-мишени. Известно, что HA из штамма A/Puerto Rico/8/34 (Mt. Sinai) (H1N1) экспрессирует три эпитопа, на которые отвечают мыши BALB/c (H-2d). Два из них являются рестрицированными по MHC класса II, SVSSFERFEIPK (SEQ ID NO: 11) (а.к. 107-119), рестрицированный по I-Ed, и HNTNGVTAACSHEG (SEQ ID NO: 12) (а.к. 126-138), рестрицированный по I-Ad, соответственно. Третий эпитоп, IYSTVASSL (SEQ ID NO: 13) (а.к. 633-641), является рестрицированным по MHC класса I (Kd). После однократной внутрикожной иммунизации ДНК вакцинотела LD78β и электропорации, значительно увеличенные ответы IFNγ на эпитоп класса I наблюдали для нацеленных вакцинотел по сравнению с ненацеленными (C11S) вакцинотелами и ложной иммунизацией (NaCl) (фиг. 7A). Ответы на эпитопы класса II были немного повышены, но эффект нацеливания не являлся значимым (только одну иммунизацию проводили в настоящих экспериментах) (фиг. 7A).
Вакцинотело LD78β связывается с CCR5 макака-резуса
CCR5 является консервативным во многих видах, включая обезьян. Гены CCR5 человека и макака обладают очень близкой гомологией а.к. (98%). Подобно человеку, макаки обладают двумя изоформами CCL3. Вакцинотела LD78β и LD78β-2 связывали зависимым от дозы образом экспрессирующие CCR5 макака-резуса клетки HEK293, в то время как LD78β с точечной мутацией C11S не связывало такие же клетки (фиг. 8 и не представленные данные). Этот результат показывает, что вакцинотела с LD78β и LD78β-2, предназначенные для использования для человека, можно тестировать не только на мышах, как выше, но также на макаке-резус, до какого-либо использования для человека.
Вакцинотело LD78β-HA, но не вакцинотело LD78β-2-Ηα защищает мышей от гриппа.
Как показано на фиг. 9, мышей вакцинировали любой из двух форм LD78β, LD78β или LD78β-2. Показано, что полноразмерный вариант LD78β обладал превосходным эффектом в отношении защиты мышей от инфекции гриппа.
ПОСЛЕДОВАТЕЛЬНОСТИ:
LD78β (SEQ ID NO: 1):
APLAADTPTACCFSYTSRQIPQNFIADYFETSSQCSKPSVIFLTKRGRQVCADPSEEWVQKYVSDLELSA
LD78α (SEQ ID NO: 2):
ASLAADTPTACCFSYTSRQIPQNFIADYFETSSQCSKPGVIFLTKRSRQVCADPSEEWVQKYVSDLELSA
| название | год | авторы | номер документа |
|---|---|---|---|
| ВАКЦИНЫ ПРОТИВ HPV | 2012 |
|
RU2644201C2 |
| ИММУНОТЕРАПЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ОСНОВЕ ДРОЖЖЕЙ С BRACHYURY | 2012 |
|
RU2690180C2 |
| ИММУНОТЕРАПЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ОСНОВЕ ДРОЖЖЕЙ С BRACHYURY | 2012 |
|
RU2619850C2 |
| КОНЪЮГАТЫ И КОМПОЗИЦИИ ДЛЯ ИММУНОТЕРАПИИ И ПРОТИВООПУХОЛЕВОГО ЛЕЧЕНИЯ | 2010 |
|
RU2597989C2 |
| ПОЛИПЕПТИДЫ И ПОЛИНУКЛЕОТИДЫ И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ИММУНОЛОГИЧЕСКИХ НАРУШЕНИЙ И РАКА | 2012 |
|
RU2623161C2 |
| МОДИФИЦИРОВАННЫЙ БИОТИН-СВЯЗЫВАЮЩИЙ БЕЛОК, СЛИТЫЕ БЕЛКИ НА ЕГО ОСНОВЕ И ИХ ПРИМЕНЕНИЕ | 2012 |
|
RU2632651C2 |
| КОВАЛЕНТНЫЕ ДИАНТИТЕЛА И ИХ ПРИМЕНЕНИЕ | 2009 |
|
RU2593720C2 |
| АНТИТЕЛА К БЕЛКУ ПРОГРАММИРУЕМОЙ КЛЕТОЧНОЙ СМЕРТИ 1 | 2018 |
|
RU2812915C2 |
| КОМПОЗИЦИЯ И СПОСОБ ДЛЯ ИММУНИЗАЦИИ, СПОСОБ ПРОДУЦИРОВАНИЯ НЕПРИРОДНОГО, УПОРЯДОЧЕННОГО И ПОВТОРЯЮЩЕГОСЯ МАССИВА АНТИГЕНОВ И ОБОЛОЧЕЧНЫЙ БЕЛОК | 2002 |
|
RU2295973C2 |
| КОМПОЗИЦИЯ И СПОСОБ ДЛЯ ИММУНИЗАЦИИ, СПОСОБ ПРОДУЦИРОВАНИЯ НЕПРИРОДНОГО УПОРЯДОЧЕННОГО И ПОВТОРЯЮЩЕГОСЯ МАССИВА АНТИГЕНОВ | 2002 |
|
RU2438701C2 |




Изобретение относится к биохимии, в частности к молекуле нуклеиновой кислоты, которая кодирует аминокислотную цепь, способную формировать димерный белок, и к указанному димерному белку. Указанный димерный белок применяют в качестве вакцины. Он содержит две идентичные аминокислотные цепи, каждая из которых содержит нацеливающую группу – MIP1α человека – и антигенную группу, соединенные с помощью мотива для димеризации. Настоящее изобретение также раскрывает фармацевтическую композицию и вакцину против злокачественного заболевания, содержащую указанный димерный белок или молекулу нуклеиновой кислоты, а также клетку-хозяин и способ для продукции указанного димерного белка. Настоящее изобретение благодаря использованию в качестве нацеливающей группы MIP1α человека, который доставляет антиген в антигенпрезентирующие клетки, позволяет получать вакцины, индуцирующие антиген-специфический CD8+ Т-клеточный ответ. 7 н. и 85 з.п. ф-лы, 9 ил., 1 пр.
1. Молекула нуклеиновой кислоты, кодирующая аминокислотную цепь, которая может формировать димерный белок, содержащий две аминокислотные цепи, где каждая аминокислотная цепь содержит нацеливающую группу, содержащую аминокислотную последовательность, обладающую по меньшей мере 80% идентичностью последовательности 5-70 из SEQ ID NO: 1, и антигенную группу, где нацеливающая группа и антигенная группа соединены через мотив для димеризации, при этом указанный димерный белок подходит для использования в качестве вакцины.
2. Молекула нуклеиновой кислоты по п. 1, где указанная нацеливающая группа содержит аминокислоты 3-70 из SEQ ID NO: 1.
3. Молекула нуклеиновой кислоты по п. 1, где указанная нацеливающая группа состоит из аминокислот 5-70 из SEQ ID NO: 1.
4. Молекула нуклеиновой кислоты по п. 1, где указанная нацеливающая группа состоит из аминокислот 3-70 из SEQ ID NO: 1.
5. Молекула нуклеиновой кислоты по п. 1, где указанная нацеливающая группа состоит из аминокислот 1-70 из SEQ ID NO: 1.
6. Молекула нуклеиновой кислоты по п. 1, где антигенная группа представляет собой антигенный scFv.
7. Молекула нуклеиновой кислоты по п. 1, где линкер, такой как линкер (G4S)3, соединяет VH и VL в антигенном scFv.
8. Молекула нуклеиновой кислоты по п. 1, где антигенный scFv происходит из моноклонального Ig, продуцируемого клетками миеломы или лимфомы.
9. Молекула нуклеиновой кислоты по п. 1, где антигенная группа представляет собой теломеразу или ее функциональную часть.
10. Молекула нуклеиновой кислоты по п. 9, где указанная теломераза представляет собой hTERT.
11. Молекула нуклеиновой кислоты по п. 1, где антигенная группа происходит из бактерии.
12. Молекула нуклеиновой кислоты по п. 11, где происходящая из бактерии антигенная группа выбрана из антигена туберкулеза и антигена бруцеллеза.
13. Молекула нуклеиновой кислоты по п. 1, где антигенная группа происходит из вируса.
14. Молекула нуклеиновой кислоты по п. 13, где происходящая из вируса антигенная группа происходит из HIV.
15. Молекула нуклеиновой кислоты по п. 14, где происходящая из HIV антигенная группа происходит из gp120 или Gag.
16. Молекула нуклеиновой кислоты по п. 13, где антигенная группа выбрана из списка, состоящего из гемагглютинина (НА), нуклеопротеина и антигена М2 вируса гриппа; антигена гликопротеина D вируса простого герпеса 2; и антигена вируса папилломы человека, такого как выбранный из списка, состоящего из Е1, Е2, Е6, Е7, L1 и L2.
17. Молекула нуклеиновой кислоты по п. 1, где антигенная группа представляет собой ассоциированный со злокачественной опухолью или специфический для злокачественной опухоли антиген.
18. Молекула нуклеиновой кислоты по п. 17, где антигенная группа злокачественной опухоли представляет собой антиген меланомы, такой как антигены меланомы тирозиназа, TRP-1 или TRP2.
19. Молекула нуклеиновой кислоты по п. 17, где антигенная группа злокачественной опухоли представляет собой антиген рака предстательной железы, такой как антиген рака предстательной железы PSA.
20. Молекула нуклеиновой кислоты по п. 17, где антигенная группа злокачественной опухоли происходит из вируса папилломы человека, например, антиген рака шейки матки, выбранный из списка, состоящего из Е1, Е2, Е4, Е6 и Е7.
21. Молекула нуклеиновой кислоты по п. 1, где мотив для димеризации содержит шарнирную область и, необязательно, другой домен, облегчающий димеризацию, такой как иммуноглобулиновый домен, необязательно присоединенный через линкер.
22. Молекула нуклеиновой кислоты по п. 21, где шарнирная область происходит из Ig, например, происходит из IgG3.
23. Молекула нуклеиновой кислоты по п. 21, где шарнирная область обладает способностью формировать одну, две или несколько ковалентных связей.
24. Молекула нуклеиновой кислоты по п. 21, где ковалентная связь представляет собой дисульфидный мостик.
25. Молекула нуклеиновой кислоты по п. 21, где иммуноглобулиновый домен мотива для димеризации представляет собой карбоксиконцевой домен С или последовательность, по существу гомологичную указанному домену С.
26. Молекула нуклеиновой кислоты по п. 25, где карбоксиконцевой домен С происходит из IgG.
27. Молекула нуклеиновой кислоты по п. 21, где иммуноглобулиновый домен мотива для димеризации обладает способностью к гомодимеризации.
28. Молекула нуклеиновой кислоты по п. 21, где указанный иммуноглобулиновый домен обладает способностью к гомодимеризации посредством нековалентных взаимодействий.
29. Молекула нуклеиновой кислоты по п. 28, где указанные нековалентные взаимодействия представляют собой гидрофобные взаимодействия.
30. Молекула нуклеиновой кислоты по п. 1, где указанный домен для димеризации не содержит домен СН2.
31. Молекула нуклеиновой кислоты по п. 1, где мотив для димеризации состоит из шарнирных экзонов h1 и h4, соединенных через линкер с доменом CH3 IgG3 человека.
32. Молекула нуклеиновой кислоты по любому из пп. 21-31, где указанный линкер представляет собой линкер G3S2G3SG.
33. Молекула нуклеиновой кислоты по п. 1, где указанная антигенная группа и мотив для димеризации соединены через линкер, такой как линкер GLSGL.
34. Молекула нуклеиновой кислоты по п. 1, где указанная нацеливающая группа содержит аминокислоты 1-70 из SEQ ID NO: 2.
35. Молекула нуклеиновой кислоты по п. 1, где указанная нацеливающая группа содержит аминокислоты 3-70 из SEQ ID NO: 2.
36. Молекула нуклеиновой кислоты по п. 1, где указанная нацеливающая группа состоит из аминокислот 5-70 из SEQ ID NO: 2.
37. Молекула нуклеиновой кислоты по п. 1, где указанная нацеливающая группа состоит из аминокислот 3-70 из SEQ ID NO: 2.
38. Молекула нуклеиновой кислоты по любому из пп. 1-4, 6-31, 33-36, где каждая указанная нацеливающая группа состоит из не более чем 68 аминокислот, например, из 68, 67 или 66 аминокислот.
39. Молекула нуклеиновой кислоты по любому из пп. 1-4, 6-31, 33-36, где указанная нацеливающая группа не содержит аминокислотную последовательность АР в положениях 1 и 2 нацеливающей группы.
40. Молекула нуклеиновой кислоты по п. 1, кодирующая первый димерный белок, обладающий увеличенной аффинностью по сравнению с аффинностью второго димерного белка, где второй димерный белок отличается от указанного первого димерного белка только обладанием нацеливающей группой, состоящей из аминокислот 1-70 из SEQ ID NO: 2; где увеличенная аффинность имеет место в отношении любого из рецепторов хемокинов, выбранного из CCR1, CCR3 и CCR5.
41. Молекула нуклеиновой кислоты по любому из пп. 1-40, содержащаяся в векторе.
42. Молекула нуклеиновой кислоты по любому из пп. 1-41, составленная для введения пациенту для индукции продукции димерного белка у указанного пациента.
43. Молекула нуклеиновой кислоты по пп. 1-42 для применения в качестве вакцины.
44. Димерный белок из двух идентичных аминокислотных цепей, где каждая аминокислотная цепь содержит нацеливающую группу, содержащую аминокислотную последовательность, обладающую по меньшей мере 80% идентичностью последовательности 5-70 из SEQ ID NO: 1, и антигенную группу, где нацеливающая группа и антигенная группа соединены через мотив для димеризации, при этом указанный димерный белок подходит для использования в качестве вакцины.
45. Димерный белок по п. 44, где указанная нацеливающая группа содержит аминокислоты 3-70 из SEQ ID NO: 1.
46. Димерный белок по п. 44, где указанная нацеливающая группа состоит из аминокислот 5-70 из SEQ ID NO: 1.
47. Димерный белок по п. 44, где указанная нацеливающая группа состоит из аминокислот 3-70 из SEQ ID NO: 1.
48. Димерный белок по п. 44, где указанная нацеливающая группа состоит из аминокислот 1-70 из SEQ ID NO: 1.
49. Димерный белок по п. 44, где антигенная группа представляет собой антигенный scFv.
50. Димерный белок по п. 44, где линкер, такой как линкер (G4S)3, соединяет VH и VL в антигенном scFv.
51. Димерный белок по п. 44, где антигенный scFv происходит из моноклонального Ig, продуцируемого клетками миеломы или лимфомы.
52. Димерный белок по п. 44, где антигенная группа представляет собой теломеразу или ее функциональную часть.
53. Димерный белок по п. 52, где указанная теломераза представляет собой hTERT.
54. Димерный белок по п. 44, где антигенная группа происходит из бактерии.
55. Димерный белок по п. 54, где происходящая из бактерии антигенная группа выбрана из антигена туберкулеза и антигена бруцеллеза.
56. Димерный белок по п. 44, где антигенная группа происходит из вируса.
57. Димерный белок по п. 56, где происходящая из вируса антигенная группа происходит из HIV.
58. Димерный белок по п. 57, где происходящая из HIV антигенная группа происходит из gp120 или Gag.
59. Димерный белок по п. 56, где антигенная группа выбрана из списка, состоящего из гемагглютинина (НА), нуклеопротеина и антигена М2 вируса гриппа; антигена гликопротеина D вируса простого герпеса 2; и антигена вируса папилломы человека, такого как выбранный из списка, состоящего из Е1, Е2, Е6, Е7, L1 и L2.
60. Димерный белок по п. 44, где антигенная группа представляет собой ассоциированный со злокачественной опухолью или специфический для злокачественной опухоли антиген.
61. Димерный белок по п. 60, где антигенная группа злокачественной опухоли представляет собой антиген меланомы, такой как антигены меланомы тирозиназа, TRP-1 или TRP2.
62. Димерный белок по п. 60, где антигенная группа злокачественной опухоли представляет собой антиген рака предстательной железы, такой как антиген рака предстательной железы PSA.
63. Димерный белок по п. 60, где антигенная группа злокачественной опухоли происходит из вируса папилломы человека, например, антиген рака шейки матки, выбранный из списка, состоящего из Е1, Е2, Е4, Е6 и Е7.
64. Димерный белок по п. 44, где мотив для димеризации содержит шарнирную область и, необязательно, другой домен, облегчающий димеризацию, такой как иммуноглобулиновый домен, необязательно присоединенный через линкер.
65. Димерный белок по п. 64, где шарнирная область происходит из Ig, например, происходит из IgG3.
66. Димерный белок по п. 64, где шарнирная область обладает способностью формировать одну, две или несколько ковалентных связей.
67. Димерный белок по п. 66, где ковалентная связь представляет собой дисульфидный мостик.
68. Димерный белок по п. 64, где иммуноглобулиновый домен мотива для димеризации представляет собой карбоксиконцевой домен С или последовательность, по существу гомологичную указанному домену С.
69. Димерный белок по п. 68, где карбоксиконцевой домен С происходит из IgG.
70. Димерный белок по п. 64, где иммуноглобулиновый домен мотива для димеризации обладает способностью к гомодимеризации.
71. Димерный белок по п. 64, где указанный иммуноглобулиновый домен обладает способностью к гомодимеризации посредством нековалентных взаимодействий.
72. Димерный белок по п. 71, где указанные нековалентные взаимодействия представляют собой гидрофобные взаимодействия.
73. Димерный белок по п. 44, где указанный домен для димеризации не содержит домен СН2.
74. Димерный белок по п. 44, где мотив для димеризации состоит из шарнирных экзонов h1 и h4, соединенных через линкер с доменом СН3 IgG3 человека.
75. Димерный белок по любому из пп. 64-74, где указанный линкер представляет собой линкер G3S2G3SG.
76. Димерный белок по п. 44, где указанная антигенная группа и мотив для димеризации соединены через линкер, такой как линкер GLSGL.
77. Димерный белок по п. 44, где указанная нацеливающая группа содержит аминокислоты 3-70 из SEQ ID NO: 2.
78. Димерный белок по п. 44, где указанная нацеливающая группа состоит из аминокислот 5-7 0 из SEQ ID NO: 2.
79. Димерный белок по п. 44, где указанная нацеливающая группа состоит из аминокислот 3-70 из SEQ ID NO: 2.
80. Димерный белок по п. 44, где указанная нацеливающая группа состоит из аминокислот 1-70 из SEQ ID NO: 2.
81. Димерный белок по любому из пп. 44-47, 49-73, 75-79, где каждая указанная нацеливающая группа состоит из не более чем 68 аминокислот, например, из 68, 67 или 66 аминокислот.
82. Димерный белок по любому из пп. 44-47, 49-73, 75-79, где указанная нацеливающая группа не содержит аминокислотную последовательность АР в положениях 1 и 2 нацеливающей группы.
83. Димерный белок по п. 44, который представляет собой первый димерный белок, обладающий увеличенной аффинностью по сравнению с аффинностью второго димерного белка, где второй димерный белок отличается от указанного первого димерного белка только наличием нацеливающей группы, состоящей из аминокислот 1-70 из SEQ ID NO: 2; где увеличенная аффинность имеет место в отношении любого из рецепторов хемокинов, выбранного из CCR1, CCR3 и CCR5.
84. Димерный белок по п. 44 для применения в качестве лекарственного средства.
85. Фармацевтическая композиция для применения в качестве вакцины, содержащая димерный белок по любому из пп. 44-83 или молекулу нуклеиновой кислоты по любому из пп. 1-43 и фармацевтически приемлемый носитель и/или адъювант.
86. Клетка-хозяин для продукции димерного белка, содержащая молекулу нуклеиновой кислоты по любому из пп. 1-43, кодирующую аминокислотную цепь, которая может формировать димерный белок, содержащий две аминокислотные цепи, где каждая аминокислотная цепь содержит нацеливающую группу, содержащую аминокислотную последовательность, обладающую по меньшей мере 80% идентичностью последовательности 5-70 из SEQ ID NO: 1, и антигенную группу, где нацеливающая группа и антигенная группа соединены через мотив для димеризации, при этом указанный димерный белок подходит для использования в качестве вакцины.
87. Способ получения димерного белка по любому из пп. 44-83, где способ включает:
a) трансфекцию популяции клеток молекулой нуклеиновой кислоты по любому из пп. 1-43;
b) культивирование указанной популяции клеток;
c) сбор и очистку димерного белка, экспрессированного из указанной популяции клеток.
88. Вакцина против злокачественной опухоли или инфекционного заболевания, содержащая иммунологически эффективное количество димерного белка по любому из пп. 44-83 или молекулы нуклеиновой кислоты по любому из пп. 1-43, кодирующей мономерный белок, который может формировать димерный белок, где указанная вакцина является способной запускать как Т-клеточный, так и В-клеточный иммунный ответ, и где указанный димерный белок содержит антигенную группу, специфическую для указанных злокачественной опухоли или инфекционного заболевания.
89. Вакцина по п. 88, дополнительно содержащая фармацевтически приемлемый носитель и/или адъювант.
90. Вакцина по п. 88 или 89, где указанная злокачественная опухоль представляет собой множественную миелому или лимфому, злокачественную меланому, HPV-индуцированные злокачественные опухоли, рак предстательной железы, рак молочной железы, рак легкого, рак яичника и/или рак печени.
91. Вакцина по п. 88 или 89, где указанное инфекционное заболевание выбрано из списка, состоящего из туберкулеза, гриппа, герпеса, CMV, HPV, HBV, HIV, бруцеллеза и/или HSV-2.
92. Способ лечения злокачественной опухоли или инфекционного заболевания у пациента, где способ включает введение нуждающемуся в этом пациенту димерного белка по любому из пп. 44-83 или молекулы нуклеиновой кислоты по любому из пп. 1-43, кодирующей мономерный белок, который может формировать димерный белок, где указанный димерный белок содержит антигенную группу, специфическую для указанных злокачественной опухоли или инфекционного заболевания.
| FREDRIKSEN AGNETE B | |||
| et al., Chemokine-idiotype fusion DNAvaccines are potentiated by bivalency and xenogeneic sequences, BLOOD, 15.09.2007, Vol.110, NO.6, PP.1797-1805 | |||
| US 5646016 А, 08.07.1997 | |||
| SCHALL T | |||
| et al., Human Macrophage Inflammatory Protein α (MIP-lα and MIP-1β Chemoklnes Attract Distinct Populations of Lymphocytes, J | |||
| Exp | |||
| Med., 1993, Vol.177, pp.1821-1825 | |||
| FREDRIKSEN AGNETE B., et al., DNA Vaccines Increase Immunogenicity of Idiotypic Tumor Antigen by Targeting Novel Fusion Proteins to Antigen-Presenting Cells, Molecular therapy, 2006, Vol.13, No.4, pp.776-785 | |||
| ДНК-ВАКЦИНЫ ПРОТИВ ОПУХОЛЕВОГО РОСТА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2004 |
|
RU2343195C2 |
Авторы
Даты
2017-06-30—Публикация
2011-06-24—Подача