Область техники, к которой относится изобретение
Настоящее изобретение относится к области иммунологии и более конкретно к области композиций, способных стимулировать как врожденный иммунный ответ, так и адаптивный иммунный ответ индивидуума. Эти композиции пригодны для лечения всех заболеваний, требующих более высокой активности иммунной системы, таких как опухолевые и инфекционные заболевания.
Известный уровень техники
Интерлейкин 15 (IL15 или IL 15) представляет собой жизненно важный цитокин для активности NK, NKT клеток и CD8 Т-лимфоцитов памяти. Он осуществляет свою функцию, действуя через рецептор, состоящий из 3 субъединиц, известных как α, β и γ. Субъединицы β и γ являются общими с рецептором IL-2. α Цепь рецептора IL15 является уникальной для IL15 и необходима для секреции цитокинов во внеклеточную среду [Duitman, E.H., et al., Mol Cell Biol, 2008. 28:4851-61] и «представляет» IL15 субъединицам IL15Rβ и IL15Rγ.
Благодаря стимулирующим свойствам для иммунной системы этот интерлейкин обладает противоопухолевыми свойствами, зависимыми от присутствия NK клеток (Suzuki, 2001, J. Leuokoc. Biol., 69:531-537) и Т-клеток (Hazama, 1999, Br. J. Cancer, 80:1420-1426, Meazza, 2000, Int. J. Cancer, 87:574-581 и Klebanoff, 2004, Proc. Natl. Acad. Sci. USA, 2004, 101:1969-1974). IL15 вовлечен также в защиту против вирусных инфекций и в развитие и поддержание Т-клеточного иммунного ответа при иммунизации и развитии дендритных клеток.
Следовательно, IL15 может быть полезным терапевтическим агентом для лечения заболеваний, в которые вовлечена иммунная система. Однако исследованиям функции IL15 in vivo частично препятствуют отсутствие доступного рекомбинантного IL15 и низкий уровень секреции, наблюдаемый при экспрессии IL15 с природного гена. Более того, большинство цитокинов имеют очень низкий период полужизни в плазме, обусловленный тем, что они продуцируются in vivo местно и транзиторно. Следовательно, использование IL15 in vivo требует применения относительно высоких доз и частого введения, приводя к различным вторичным эффектам, которые могут возникать у больных раком, не переносящих лечение.
С целью преодоления этих недостатков IL15 используют в противоопухолевом лечении в сочетании с другими видами лечения, такими как антитела против CD-40, IL-7 или IL-6 [Chou, P.C., et al., 2009, Vet Immunol Immunopathol, 130:25-34; Lin, C.Y., et al., Cancer Lett, 2008. 272(2): p. 285-95; Zhang, M., et al., Proc Natl Acad Sci USA, 2009, 106:7513-8 и Cha, E., et al., Breast Cancer Res Treat, 2009]. Эти сочетания вызывают синергичный эффект, делая возможным достижение сходного действия при более низких дозах IL15.
Другая возможность повышения активности IL15 состоит в его совместном введении со слитым белком, который включает константную область иммуноглобулина и растворимую область α цепи рецептора IL15, что вызывает 50-кратное повышение активности IL15 (Rubinstein M.P. et al., 2006, Proc. Natl. Acad. Sci. USA, 103:9166-71 и Stoklasek T.A. et al., 2006, J. Immunol.; 177:6072-80).
Недавно было показано, что полипептид, образованный аминокислотами с 1 по 77 аминоконца α цепи рецептора IL15 (так называемым «доменом Sushi»), является агонистом IL15 (Mortier, E., et al., J Biol Chem, 2006, 281(3); p. 1612-9). Таким образом, введение слитого белка, содержащего указанный домен и IL15, вызывает более сильное противоопухолевое действие, чем действие IL15, приводя к 65% снижению легочных метастазов опухоли B16F10 и к снижению количества метастазов опухоли HCT-116 человека, имплантированной в слепую кишку голых мышей [Bessard, A., et al., Mol Cancer Ther, 2009, 8(9): p. 2736-45].
Другая альтернатива достижения улучшения эффекта IL15 без возникновения нежелательных вторичных эффектов состоит в модификации молекулы с точки зрения повышения периода ее полужизни. Таким образом, в патенте США US2006257361 описываются слитые белки, включающие константную область иммуноглобулина и IL15, обладающие после введения более высоким периодом полужизни в сыворотке по сравнению с немодифицированным IL15.
Однако в данной области техники существует потребность в альтернативных составах IL15, в которых белок поддерживает свою стимулирующую иммунный ответ активность, но позволяет вторичным эффектам, связанным с IL15, снижаться в максимально возможной степени.
Краткое изложение сущности изобретения
В первом аспекте изобретение относится к композиции, включающей совместно или раздельно,
(i) первый компонент, выбранный из группы
(a) полипептида, включающего полипептид Apo A или его функционально эквивалентный вариант, обладающий по меньшей мере 70% идентичностью с указанным полипептидом Apo A, и
(b) полинуклеотида, кодирующего полипептид Apo A или его функционально эквивалентный вариант, обладающий по меньшей мере 70% идентичностью с указанным полипептидом Apo A, и
(ii) второй компонент, выбранный из группы
(a) IL15 или его функционально эквивалентного варианта, обладающего по меньшей мере 70% идентичностью с IL15, и
(b) полинуклеотида, кодирующего IL15 или его функционально эквивалентный вариант, обладающий по меньшей мере 70% идентичностью с IL15, и
(iii) третий компонент, выбранный из группы
(a) домена Sushi альфа цепи рецептора IL15 или его функционально эквивалентного варианта, обладающего по меньшей мере 70% идентичностью с доменом Sushi альфа цепи рецептора IL15, и
(b) полинуклеотида, кодирующего домен Sushi альфа цепи рецептора IL15 или его функционально эквивалентный вариант, обладающий по меньшей мере 70% идентичностью с доменом Sushi альфа цепи рецептора IL15.
Во втором аспекте изобретение относится к слитому белку, включающему
(i) область A, образованную полипептидом Apo A или его функционально эквивалентным вариантом, обладающим по меньшей мере 70% идентичностью с указанным полипептидом Apo A,
(ii) область B, образованную IL15 или его функционально эквивалентным вариантом, обладающим по меньшей мере 70% идентичностью с IL15, и
(iii) область C, образованную доменом Sushi альфа цепи рецептора IL15 или его функционально эквивалентным вариантом, обладающим по меньшей мере 70% идентичностью с доменом Sushi альфа цепи рецептора IL15.
В дополнительных аспектах изобретение относится к полинуклеотиду, кодирующему слитый белок по изобретению, к вектору или генной конструкции, включающим полинуклеотид по изобретению, к клетке-хозяину, включающей слитый белок по изобретению, к полинуклеотиду по изобретению, к вектору по изобретению или к генной конструкции по изобретению.
В другом аспекте изобретение относится к фармацевтической композиции, включающей композицию по изобретению, слитый белок по изобретению, полинуклеотид по изобретению, вектор или генная конструкция по изобретению, клетку-хозяина по изобретению и фармацевтически приемлемый носитель.
В другом аспекте изобретение относится к способу стимуляции in vitro экспансии антигенспецифических Т-лимфоцитов, включающему контактирование популяции лимфоцитов, экспонированных ранее in vivo с указанным антигеном, с композицией по изобретению, слитым белком по изобретению, полинуклеотидом по изобретению, вектором или генной конструкцией по изобретению, клеткой-хозяином по изобретению.
Кроме того, изобретение относится к композиции по изобретению, слитому белку по изобретению, полинуклеотиду по изобретению, вектору или генной конструкции по изобретению, клетке-хозяину по изобретению для применения в медицине или для лечения заболеваний, которые требуют стимуляции иммунного ответа индивидуума.
Краткое описание фигур
Фиг.1. Кинетика экспрессии hIL15 (нг/мл) во времени t (ч: часы). Группы мышей C57B16, получавшие гидродинамическую инъекцию плазмид pApo-hIL15+pSushi, pApo-hIL15, phIL15+pSushi, phIL15, pApo или физиологический раствор (S). Через 8, 24, 96, 168 и 240 часов получали кровь и концентрацию hIL15 в сыворотке определяли методом ELISA. Показано среднее и стандартное отклонение среднего репрезентативного эксперимента с 2-3 животными на группу. Результаты статистически обрабатывали с помощью анализа ANOVA с повторными измерениями с последующим тестом Бонферрони. Статистические различия наблюдаются между уровнями hIL15 через 8 и 24 часа у группы с pApo-hIL15 по сравнению с другими группами (p<0,001).
Фиг.2. Определение функциональной пролиферации при гидродинамическом введении pApo-hIL15 совместно с pSushi. Клетки CTLL2 культивировали в серийных разведениях сывороток, полученных через 24 часа после обработки мышей pApo-hIL15 и pApo-hIL15+pSushi. Через 48 часов в качестве пролиферативного индекса (имп/мин) исследовали включение меченного тритием тимидина в клетки CTLL2, выявив, что сыворотки мышей, обработанных pApo-hIL15 и pSushi одновременно, индуцировали более высокую степень пролиферации, чем сыворотки мышей, обработанных только pApo-hIL15 (p<0,001). Показано среднее и стандартное отклонение среднего репрезентативного эксперимента с 4-5 животными на группу. Результаты статистически обрабатывали с помощью ANOVA с повторными измерениями.
Фиг.3. Повышение общего количества и процента CD8+ Т-клеток относительно суммарных спленоцитов в зависимости от времени (t (д) в днях). Группы мышей C57B16, получавших гидродинамическую инъекцию различных конструкций плазмид, забивали на 3, 4, 5, 6 и 7 дни и селезенки удаляли. Измеряли количество CD8+ Т-клеток (A), процент CD8+ Т-клеток относительно суммарных спленоцитов (B), количество CD8+CD44+ Т-клеток памяти (C) и процент CD8+CD44+ Т-клеток памяти относительно суммарных спленоцитов (D). У группы мышей, которым вводили плазмиды pApo-hIL15 и pSushi (■), представлено более высокое количество CD8+ Т-клеток относительно других групп: pApo-hIL15 (□), phIL15+pSushi (▲), phIL15 (∆), pApo (○) и физиологический раствор в качестве носителя (*). Показано среднее и стандартное отклонение среднего репрезентативного эксперимента с 2 животными на группу. Данные анализировали с помощью анализ ANOVA с повторными измерениями с последующим тестом Бонферрони, сравнивая группу pApo-hIL15+pSushi и группу phIL15+pSushi, *p<0,05; **p<0,001; ***p<0,0001.
Фиг.4. Повышение процента CD8+ Т-клеток относительно суммарного количества лимфоцитов в печени в зависимости от времени (t (д) в днях). Мыши C57B16 получали гидродинамическое введение различных конструкций. Через 3, 4, 5, 6 и 7 дней животных забивали и выделяли печень. Измеряли процент CD8+ Т-клеток относительно суммарного количества лимфоцитов. У группы мышей, которым вводили плазмиды pApo-hIL15 и pSushi (■), представлен более высокий процент CD8+ Т-клеток, чем у оставшихся групп: pApo-hIL15 (□), phIL15+pSushi (▲), phIL15 (∆), pApo (○) и физиологический раствор в качестве носителя (*). Показано среднее и стандартное отклонение среднего репрезентативного эксперимента с 2 животными на группу. Данные анализировали с помощью анализа ANOVA с повторными измерениями с последующим тестом Бонферрони, сравнивая группу pApo-hIL15+pSushi и группу phIL15+pSushi, *p<0,05; **p<0,001; ***p<0,0001.
Фиг.5. Повышение суммарного количества и процента CD8+ Т-клеток относительно лимфоцитов периферической крови. Мышам C57B16 гидродинамически вводили различные конструкции с phIL15. Через 3, 4, 5 и 6 дней получали кровь и измеряли процент CD8+ Т-лимфоцитов (A), CD8+CD44+ Т-клеток памяти (B), и проценты эффекторных клеток памяти CD8+CD44+CD62L- (C) и центральных клеток памяти CD8+CD44+CD62L+ (D). Во всех исследованных популяциях у группы мышей, получавших плазмиды pApo-hIL15 и pSushi (■), представлен более высокий процент CD8+ Т-клеток относительно других групп: pApo-hIL15 (□), phIL15+pSushi (▲), phIL15 (∆), pApo (●), pSushi (▽) и физиологический раствор в качестве носителя (*). Показано среднее и стандартное отклонение среднего репрезентативного эксперимента с 3 животными на группу. Данные анализировали с помощью анализа ANOVA с повторными измерениями с последующим тестом Бонферрони, сравнивая группы pApo-hIL15+pSushi и группы phIL15+pSushi, *p<0,05; **p<0,001; ***p<0,0001.
Фиг.6. Противоопухолевый эффект конструкций в зависимости от времени (t (д), в днях) в модели подкожной опухоли CT26. Мыши Balb/c получали 5×105 клеток CT26 подкожно и через 3 дня им гидродинамически вводили pApo-hIL15, pApo-hIL15+pSushi, phIL15, phIL15+pSushi, pApo или физиологический раствор (S). Опухоли измеряли в мм2 с использованием цифрового штангенциркуля каждые 2 дня (A) с выявлением времени выживания животных (% SV) (B). У мышей, которым вводили плазмиды pApo-hIL15 и pSushi, как наблюдалось, представлена задержка опухолевого роста и более высокая степень выживаемости по сравнению с мышами из других групп. Показано среднее и стандартное отклонение среднего репрезентативного эксперимента с 8 животными на группу.
Фиг.7. Противоопухолевый эффект плазмид в зависимости от времени (t (д): в днях) в модели подкожной опухоли MC38. Мышам C57B16 вводили 5×105 клеток MC38 подкожно и через 6 дней им гидродинамически вводили pApo-hIL15, pApo-hIL15+pSushi, phIL15, phIL15+pSushi, pApo или физиологический раствор (S). Опухоли измеряли в мм2 с использованием цифрового штангенциркуля каждые 2 дня (A) с выявлением времени выживания животных (% SV) (B). У мышей, которым вводили плазмиды pApo-hIL15 и pSushi, как наблюдалось, представлена задержка опухолевого роста. Показано среднее и стандартное отклонение среднего репрезентативного эксперимента.
Фиг.8. Антиметастатический эффект различных плазмид в модели внутриселезеночной опухоли MC38. Мышам C57B16 внутриселезеночно вводили 5×105 клеток MC38 подкожно и на следующий день им гидродинамически вводили pApo-hIL15, pApo-hIL15+pSushi, phIL15, phIL15+pSushi, pApo или физиологический раствор (S). Через 19 дней мышей забивали и делили на 3 группы: I: мыши, умершие из-за печеночных метастазов или генерализованных метастазов; II: мыши, имеющие метастазов в части печеночной ткани; III: мыши, не имеющие печеночных метастазов. Показаны данные репрезентативного эксперимента.
Фиг.9. Действие различных плазмид у мышей, «нокаутных» по рецептору α IL15. Четырем мышам с отсутствующим рецептором α IL15 гидродинамически вводили плазмиды pApo-hIL15 и pSushi, phIL15 и pSushi, pApo и pApo-hIL15. Животных забивали через 5 дней, выделяли селезенку и измеряли селезеночные популяции NK клеток и CD8+ Т-лимфоцитов памяти с помощью проточной цитометрии с использованием маркера CD3 для дифференциации. Фигура также включает популяции NK клеток и CD8+ Т-клеток памяти немутантной мыши C57B16. Показан процент NK клеток (A), CD8+ Т-лимфоцитов (B) и субпопуляции CD8+CD44+ (C). Указаны проценты клеток относительно суммарных спленоцитов.
Фиг.10. Повышение суммарного количества спленоцитов и CD8+ Т-клеток и NK1.1 клеток. Группам мышей C57B16 гидродинамически вводили плазмиды: 1) pmSushi-mIL15-mApo; 2) pApo-hIL15 в сочетании с pSushi (pApo-hIL15+pSushi); 3) pApo-hIL15; 4) phIL15 в сочетании с pSushi (phIL15+pSushi); 5) phIL15 и 6) pApo. Через 6 дней животных забивали и извлекали селезенку. Исследование с помощью проточной цитометрии было сделано для A) суммарной популяции спленоцитов; B) CD8+ Т-лимфоцитов памяти (CD8+CD3+); и C) NK клеток (NK1.1+CD3+). У группы мышей, которым вводили pmSushi-mIL15-mApo, было представлено более высокое количество CD8+ Т-клеток по отношению к суммарным спленоцитам по сравнению с другими группами. Показано среднее и стандартное отклонение среднего репрезентативного эксперимента с 2-3 животными на группу. Данные анализировали с помощью однофакторного анализа ANOVA с последующим тестом Бонферрони, сравнивая группу pmSushi-mIL15-mApo с оставшимися группами с введением плазмид, кодирующих указанные белки, *p<0,05; **p<0,001; ***p<0,0001.
Фиг.11. Сравнение влияния изоформ IL15 человека или мыши на рост общего количества спленоцитов и на процент CD8+ Т-клеток и NK клеток от общего количества спленоцитов. Группам мышей C57BL/6 гидродинамически вводили плазмиды: 1) pmIL15; 2) phIL15; 3) pmIL15 в сочетании с pSushi; и 4) phIL15 в сочетании с pSushi. Через 4 дня животных забивали и извлекали селезенки, подсчитывая общее количество спленоцитов (A), количество CD8 Т-клеток относительно суммарного количества спленоцитов (B), и количество NK клеток относительно суммарного количества спленоцитов (C). Показано среднее и стандартное отклонение среднего (где это применимо) репрезентативного эксперимента с 1-2 животными на группу. Данные анализировали с помощью теста Крускалла-Уоллиса с последующим множественным сравнением с использованием критерия Данна. На фигуре показано, что mIL15 и hIL15 повышают количество спленоцитов, CD8 Т-клеток и NK клеток в селезенке сходным образом.
Фиг.12. Влияние гибрида mSushi с mIL15 и ApoAI на процент NK клеток в селезенке (A) и в печени (B). Группам мышей C57BL/6 гидродинамически вводили плазмиды: 1) pmSushi-mIL15-mApo, вводимую в разных дозах 1 мкг/мышь, 2,5 мкг/мышь и 5 мкг/мышь, соответственно; и 2) pmSushi-mIL15 в сочетании с pApo, обе вводили в тех же самых 3 дозах. Через 4 дня животных забивали и извлекали селезенки (A) и печени (B), выделяя маркированные NK клетки (NK1.1+CD3+). При всех исследованных дозах у группы мышей с введением плазмиды pmSushi-mIL15-mApo был представлен более высокий процент NK клеток по сравнению с другими группами. Показан каждый повтор и среднее репрезентативного эксперимента с 2-3 животными на группу. Данные анализировали с помощью однофакторного анализа ANOVA.
Фиг.13. Противоопухолевый эффект гибрида mSushi с mIL15 и ApoAI в модели подкожной опухоли MC38. Мышам C57B16 вводили 5×105 клеток MC38 подкожно и через 8 и 19 дней им гидродинамически вводили плазмиды: 1) pApo; 2) pmSushi-mIL15-mApo и 3) pApo-hIL15 в сочетании с pSushi (pApo-hIL15+pSushi). Опухоли измеряли в мм2 с использованием цифрового штангенциркуля каждые 2-3 дня. У мышей, которым вводили pmSushi-mIL15-mApo, как наблюдалось, представлена задержка опухолевого роста. Показано среднее и стандартное отклонение репрезентативного эксперимента с 5-9 животными на группу.
Подробное описание изобретения
Авторы настоящего изобретения неожиданно обнаружили, что совместное введение нуклеиновой кислоты, кодирующей слитый белок, включающий IL15, соединенный с белком ApoA, вместе с доменом sushi α цепи рецептора IL15 (в настоящем описании далее IL15αR-sushi), придает более высокую активность IL15, чем наблюдаемая при совместном введении IL15 и IL15αR-sushi. Указанная более высокая активность является не только результатом получаемых более высоких и более длительно сохраняющихся уровней IL15, как показано в примере 3 настоящего изобретения, но также результатом способности индуцировать пролиферацию CTLL2 клеток (пример 4 настоящего изобретения), способности стимулировать пролиферацию внутриселезеночных CD8 Т-лимфоцитов и CD8 Т-клеток памяти, внутрипеченочных CD8 Т-лимфоцитов и CD8 Т-лимфоцитов крови (пример 5 настоящего изобретения), а также результатом более сильного противоопухолевого эффекта в двух экспериментальных моделях опухолей (пример 7 настоящего изобретения) и антиметастатического эффекта (пример 8 настоящего изобретения).
Не основываясь без необходимости на какой-либо теории, считается, что синергичное действие, возникающее в результате введения IL15 в форме слитого белка с ApoA, является результатом действия IL15 в тканях-мишенях, которые экспрессируют на своей клеточной поверхности рецепторы ApoA, таким образом, что IL15 может осуществлять свое действие на отличные или дополнительные ткани по сравнению с теми, которые считались ими до сих пор. Эта гипотеза поддерживается синергичным эффектом, наблюдаемым также у мышей с делецией гена рецептора α IL15.
Еще более неожиданным является выявление того, что введение нуклеиновой кислоты, кодирующей и разрешающей экспрессию тройного слитого белка, включающего белок ApoA1, соединенный с IL15 и IL15αR-sushi, вызывает пролиферацию CD8 лимфоцитов и NK клеток намного сильнее, чем пролиферация, получаемая при введении нуклеиновой кислоты, кодирующей IL15, либо одной, либо в сочетании с другой, кодирующей IL15αR-sushi, или с нуклеиновой кислотой, кодирующей слитый белок ApoA1 с IL15, либо одной, либо в сочетании с другой, кодирующей IL15αR-sushi.
Композиции по изобретению
Таким образом, в первом аспекте изобретение относится к композиции, включающей совместно или раздельно,
(i) первый компонент, выбранный из группы
(a) полипептида, включающего полипептид Apo A или его функционально эквивалентный вариант, обладающий по меньшей мере 70% идентичностью с указанным полипептидом Apo A, и
(b) полинуклеотида, кодирующего полипептид Apo A или его функционально эквивалентный вариант, обладающий по меньшей мере 70% идентичностью с указанным полипептидом Apo A, и
(ii) второй компонент, выбранный из группы
(a) IL15 или его функционально эквивалентного варианта, обладающего по меньшей мере 70% идентичностью с IL15, и
(b) полинуклеотида, кодирующего IL15 или его функционально эквивалентный вариант, обладающий по меньшей мере 70% идентичностью с IL15, и
(iii) третий компонент, выбранный из группы
(a) домена Sushi альфа цепи рецептора IL15 или его функционально эквивалентного варианта, обладающего по меньшей мере 70% идентичностью с доменом Sushi альфа цепи рецептора IL15, и
(b) полинуклеотида, кодирующего домен Sushi альфа цепи рецептора IL15 или его функционально эквивалентный вариант, обладающий по меньшей мере 70% идентичностью с доменом Sushi альфа цепи рецептора IL15.
Применяемый в настоящем описании термин «композиция» относится композиции веществ, содержащих указанные компоненты, другими словами полипептид Apo A, IL15 и домен Sushi альфа цепи рецептора IL15, а также любой другой продукт, прямо или непрямо происходящий из сочетания различных компонентов в любом их количестве. Специалист в данной области техники должен понимать, что композиция может быть составлена в виде единой композиции или может быть представлена как состав каждого из компонентов отдельно, так чтобы они могли объединяться для совместного использования в форме объединенного препарата. Композиция может представлять собой набор частей, где каждый компонент составлен и упакован отдельно.
Термин «белок», применяемый в настоящем описании наравне с полипептидом, относится к аминокислотной цепи любой длины, в которой различные аминокислоты соединены друг с другом пептидными связями или дисульфидными мостиками.
Применяемый в настоящем описании термин «полинуклеотид» относится к полимеру, образованному вариабельным количеством мономеров, где мономеры представляют собой нуклеотиды, включая рибонуклеотиды, а также дезоксирибонуклеотиды. Полинуклеотиды включают мономеры, модифицированные метилированием, а также немодифицированные формы. Термины «полинуклеотид» и «нуклеиновая кислота» используются в настоящем изобретении без их различия, и включают мРНК, кДНК и рекомбинантные полинуклеотиды. При применении в настоящем описании полинуклеотиды не ограничиваются полинуклеотидами, представленными в природе, и включают также полинуклеотиды, в которых присутствуют неприродные нуклеотидные аналоги и межнуклеотидные связи. Неограничивающие примеры этого типа неприродных структур включают полинуклеотиды, в которых сахар отличается от рибозы, полинуклеотиды, в которых появляются фосфодиэфирные связи 3'-5' и 2'-5', полинуклеотиды, в которых появляются инвертированные связи (3'-3' и 5'-5'), и разветвленные структуры. Полинуклеотиды по изобретению включают также неприродные межнуклеотидные связи, такие как в пептидо-нуклеиновых кислотах (PNA), блокированных нуклеиновых кислотах (LNA), C1-C4 алкилфосфонатные связи метилфосфоната, связи фосфорамидатного, C1-C6 алкилфосфотриэфирного, фосфортиоатного и фосфордитиоатного типа. В любом случае полинуклеотиды по изобретению сохраняют способность гибридизоваться с нуклеиновыми кислотами-мишенями сходным с природными полинуклеотидами способом.
Первый компонент композиции по изобретению
Первый компонент композиции по изобретению выбран из группы полипептида Apo A или его функционально эквивалентного варианта и нуклеиновой кислоты, кодирующей полипептид Apo A или его функционально эквивалентный вариант.
Применяемый в настоящем описании термин «полипептид Apo A» относится к любому члену семейства Apo A, образующего часть липопротеидов высокой плотности (ЛПВП), и способному специфически взаимодействовать с рецепторами на поверхности клеток печени, гарантируя тем самым свою способность транспортировать представляющие интерес молекулы к этому органу, совместно с белком Apo A. Предпочтительно молекулы Apo A, которые могут быть использованы в настоящем изобретении, выбраны из группы ApoA-I, ApoA-II, ApoA-III, ApoA-IV и ApoA-V или их функционально эквивалентных вариантов.
В предпочтительном варианте осуществления белок Apo A, который используют в настоящем изобретении, представляет собой белок ApoA-I. ApoA-I в контексте настоящего изобретения понимается как форма зрелого белка пре-проАроА-I, который образует часть липопротеидов высокой плотности (ЛПВП). ApoA-I синтезируется в виде предшественника (пре-проАроА-I), содержащего сигнальную последовательность секретируемых белков, которая удаляется, создавая путь для секреции предшественника. Сигнальная последовательность состоит из 18 аминокислот, пропептид из 6 и форма зрелого белка из 243 аминокислот. Предпочтительно используется форма зрелого белка, не имеющего сигнального пептида и после процессинга. В предпочтительном варианте осуществления белок ApoA-I происходит от человека, и его аминокислотная последовательность представляет собой последовательность, представленную SEQ ID NO:1 (номер поступления UniProt P02647). В другом предпочтительном варианте осуществления белок ApoA-I происходит от мышей, в частности, от мыши, и его аминокислотная последовательность представляет собой последовательность, представленную SEQ ID NO:2 (номер поступления UniProt Q00623). В другом предпочтительном варианте осуществления белок ApoA-I происходит от мышей, в частности, от крысы, и его аминокислотная последовательность представляет собой последовательность, представленную SEQ ID NO:3 (номер поступления UniProt P04639).
«Функционально эквивалентный вариант ApoA-I» понимается как обозначающий все те полипептиды, которые происходят в результате вставки, замены или делеции одной или более аминокислот в указанной выше последовательности ApoA-I, поддерживая по существу интактной их способность взаимодействовать с так называемым «рецептором-мусорщиком класса B типа I» (SR-BI), образующим рецептор ЛПВП, представленный в клетках печени. Способность взаимодействовать с рецептором ЛПВП определяют главным образом как описано Monaco et al (EMBO J., 1987, 6:3253-3260), или путем исследований связывания ApoA-I с мембраной гепатоцитов, или с помощью определения способности ApoA-I или его вариантов ингибировать связывание ЛПВП с рецепторами мембран гепатоцитов. Предпочтительно константа диссоциации связывания варианта ApoA-I с мембранами гепатоцитов составляет по меньшей мере 10-8 М, 10-7 М, 10-6 М, 10-5 М или 10-4 М.
В контексте настоящего изобретения рассматриваемые варианты ApoA-I включают полипептиды, сходные или идентичные полипептидам ApoA-I по меньшей мере на 70%, 72%, 74%, 76%, 78%, 80%, 90% или 95%. Степень идентичности между двумя полипептидами определяют с использованием алгоритмов компьютерных программ и способов, широко известных специалистам в данной области техники. Степень идентичности между двумя аминокислотными последовательностями предпочтительно определяют с использованием алгоритма BLASTP (BLAST Manual, Altschul, S. et al., NCBI NLM NIH Bethesda, Md. 20894, Altschul, S. et al., J., 1990, Mol. Biol. 215:403-410).
Предпочтительно варианты ApoA-I, используемые в контексте изобретения, имеют большой период полужизни в сыворотке относительно указанного выше ApoA-I, делая возможным достижение уровней [вариантов] ApoA-I в сыворотке, более высоких, чем уровни, наблюдаемые у ApoA-I. Методы определения периода полужизни белка в сыворотке и, в частности, ApoA-I, известны в данной области техники и включают среди прочего использование методов, основанных на метаболическом промечивании маркерными белками, описанных Eisenberg, S. et al (J.Lipid Res., 1973,14:446-458), Blum et al. (J. Clin. Invest., 1977, 60:795-807) и Graversen et al (J Cardiovasc Pharmacol., 2008, 51:170-177). Примером указанных вариантов, имеющих более высокий период полужизни, является, например, вариант, известный как Milano (который содержит мутацию R173C).
Первый компонент по изобретению может представлять собой нуклеиновую кислоту, которая кодирует по меньшей мере один из ApoA и вариантов ApoA, указанных выше. Таким образом, в случае нуклеиновой кислоты, кодирующей ApoA, она может происходить от человека, соответствуя последовательности с номером поступления NCBI X02162 (SEQ ID NO:4), от мышей, соответствуя последовательности с номером поступления NCBI X64262 (SEQ ID NO:5), от крысы, соответствуя последовательности с номером поступления NCBI M00001 (SEQ ID NO:6).
Специалист в данной области техники должен понимать, что нуклеиновой кислоте, составляющей первый компонент по изобретению, необходимо экспрессироваться внутри клетки и в конечном итоге в вести к секреции в среду, в связи с чем последовательность, кодирующая ApoA или его функционально эквивалентный вариант, может присутствовать на 5'-конце последовательности, кодирующей сигнал секретируемых белков. Выражение «сигнальная последовательность для секретируемых белков» при применении в настоящем изобретении относится к аминокислотной последовательности, способной стимулировать доступ к секреторному пути для всех тех белков, которые презентируют указанную последовательность на их N-концевом участке. Подходящие сигнальные последовательности для использования в настоящем изобретении включают среди прочего сигнальную последовательность тканевого активатора плазминогена (tPA), гормона роста, GM-CSF и иммуноглобулинов и, в частности, Igκ или IgVχ. Предпочтительно сигнальная последовательность, составляющая часть компонента A по изобретению, представляет собой сигнальную последовательность самого ApoA, как определено ранее.
Альтернативно, первый компонент по изобретению может представлять собой нуклеиновую кислоту, идентичную по последовательности по меньшей мере на 70% по меньшей мере на 75% по меньшей мере на 80% по меньшей мере на 85% по меньшей мере на 90% по меньшей мере на 91% по меньшей мере на 92% по меньшей мере на 93% по меньшей мере на 94% по меньшей мере на 95% по меньшей мере на 96% по меньшей мере на 97% по меньшей мере на 98% по меньшей мере на 99% любым указанным выше последовательностям, где процент идентичности определяется с использованием алгоритмов типа GAP, BESTFIT или FASTA, чья компьютерная разработка представлена в Wisconsin Genetics Software Package Release 7 (Wisconsin Genetics Software Package Release 7,0, Genetics Computer Group,575 Science Dr., Madison, Wis.) и которая использует локальные алгоритмы Smith and Waterman (adv. Appl. Math., 1981, 2:482), Needleman and Wunsch (J. Mol. Biol. 1970, 48: 443) или Pearson and Lipman (Proc. Natl. Acad. Sci. (U.S.A.), 1988, 85:2444) с использованием для различных параметров величин по умолчанию.
Альтернативно первый компонент композиции по изобретению представляет собой полинуклеотид, кодирующий ApoA или его вариант, способный специфически гибридизоваться с любой из природных последовательностей, соответствующих ApoA различных указанных ранее млекопитающих. «Полинуклеотиды, способные специфически гибридизоваться с полинуклеотидом-мишенью», в контексте настоящего изобретения понимаются как обозначающие те полинуклеотиды, которые способны гибридизоваться в жестких условиях, жесткие условия понимаются как обозначающие условия, которые дают возможность гибридизоваться двум нуклеиновым кислотам при температуре, например, приблизительно 65°С, в растворе 6×SSC, 0,5% SDS, 5% растворе Денхардта и неспецифической денатурированной ДНК в концентрации 100 мкг/мл любого другого раствора с эквивалентной ионной силой и с последующей стадией отмывки при 65°С в присутствии раствора, например, 0,2% SSC и 0,1% SDS, и любого другого раствора с эквивалентной ионной силой. Тем не менее, жесткие условия могут быть адаптированы специалистом в данной области техники в соответствии с размером последовательности, подвергаемой гибридизации, в соответствии с содержанием ГЦ и в соответствии с другими параметрами. Пригодные методы для выбора подходящих условий гибридизации описаны Sambrook et al., 2001 (Molecular Cloning: A Laboratory Manual, 3rd Edition, Laboratory Press, cold Spring Harbor, New York).
Второй компонент композиции по изобретению
Второй компонент по изобретению выбран из группы IL15 или его функционально эквивалентного варианта и нуклеиновой кислоты, кодирующей IL15 или его функционально эквивалентный вариант.
Термин «IL15» или «IL-15» при использовании в настоящем изобретении относится к цитокину, выделение, клонирование и последовательность которого описаны Grabstein et al. (патент США US5747024 и Grabstein et al., 1994, Science 246: 965-968). Термин IL15 включает любую полипептидную форму с аминокислотной последовательностью природного IL15. Примеры IL15, которые могут быть использованы, создавая часть композиций и слитых белков по изобретению, включают IL15 грызунов (мыши, крысы, хомячка), человека, приматов, собак, кошек, свиней, лошадей, коров, овец и тому подобного. Полипептиды IL15 млекопитающих, которые могут составлять часть композиций и слитых белков по изобретению, включают без ограничения IL15, происходящий от человека, чья аминокислотная последовательность представляет собой последовательность, представленную в P40933 (SEQ ID NO:7); IL15 мыши, чья аминокислотная последовательность представлена в P48346 (SEQ ID NO:8); IL15 крысы, чья аминокислотная последовательность представлена в P97604 (SEQ ID NO:9); IL15 кошки, чья аминокислотная последовательность представлена в O97687 (SEQ ID NO:10) и IL15 быка, чья аминокислотная последовательность представляет собой последовательность, представленную в Q28028 (SEQ ID NO:11).
«Функционально эквивалентный вариант IL15» понимается как обозначающий все те полипептиды, которые возникают в результате вставки, замены или делеции одной или более аминокислот в указанных выше последовательностях IL15 и которые поддерживают по существу интактной по меньшей мере одну из функций IL15, где указанная функция выбрана из:
- способности стимулировать пролиферацию CD8+ Т-клеток, определенную, например, с помощью метода, описанного Montes, et al, (Clin. Exp. Immunol., 2005, 142:292-302), основанного на инкубации популяции периферических мононуклеарных клеток крови с пептидом-антигеном в присутствии варианта IL15 с последующим определением процента клеток, которые могут быть меченными специфическими антителами против CD8,
- способности стимулировать активацию NK клеток после презентации в преобразованном виде дендритными клетками. Эта способность может быть определена путем измерения включения меченного тритием тимидина в часть CD56+ NK клеток в присутствии IL15 или путем измерения секреции NK клетками цитокина GM-CSF. Методы определения обеих функций IL15 описаны Carson, W. et al. (J.Exp.med., 1994, 180:1395-1403), в отношении макрофагов и нейтрофилов,
- способности IL15 ингибировать опосредуемый Fas апоптоз предшественников В-клеток, как описано Demirci et al. (Cell Mol Immunol. 2004, 1:123-8), который может быть определен с использованием стандартных методов определения апоптоза, таких как TUNEL или определение фрагментации ДНК с помощью гель-электрофореза и окрашивания бромидом этидия.
В контексте настоящего изобретения рассматриваемые варианты IL15 включают полипептиды, сходные или идентичные полипептидам IL15 млекопитающих, указанным выше по меньшей мере на 70%, 72%, 74%, 76%, 78%, 80%, 90% или 95%. Степень идентичности между двумя полипептидами определяют с использованием алгоритмов компьютерных программ и способов, широко известных специалистам в данной области техники. Степень идентичности между двумя аминокислотными последовательностями предпочтительно определяют с использованием алгоритма BLASTP (BLAST Manual, Altschul, S. et al., NCBI NLM NIH Bethesda, Md. 20894, Altschul, S. et al., J., 1990, Mol. Biol. 215:403-410).
Второй компонент по изобретению может представлять собой нуклеиновую кислоту, которая кодирует по меньшей мере один из природного IL15 и указанных выше вариантов IL15. Нуклеиновые кислоты, кодирующие IL15 млекопитающих, могут быть получены из депозитариев и включают без ограничения полинуклеотиды, чьи последовательности определены с помощью номеров поступления U14407 (человек, SEQ ID NO:12), U14332 (мышь, SEQ ID NO:13), U69272 (крыса, SEQ ID NO:14), AF108148 (кошка, SEQ ID NO:15) и U42433 (бык, SEQ ID NO:16).
Указанные полинуклеотиды включают полинуклеотиды, идентичные по последовательности по меньшей мере на 70% по меньшей мере на 75% по меньшей мере на 80% по меньшей мере на 85% по меньшей мере на 90% по меньшей мере на 91% по меньшей мере на 92% по меньшей мере на 93% по меньшей мере на 94% по меньшей мере на 95% по меньшей мере на 96% по меньшей мере на 97% по меньшей мере на 98% по меньшей мере на 99% любым указанным выше последовательностям, где процент идентичности определяется с использованием одного из алгоритмов, указанных выше.
Альтернативно, полинуклеотиды, образующие второй компонент по изобретению, представляют собой полинуклеотиды, способные специфически гибридизоваться с указанными ранее полинуклеотидами. Методы определения способности полинуклеотидов специфически гибридизоваться с последовательностью-мишенью подробно описаны в контексте первого компонента по изобретению.
Специалист в данной области техники должен понимать, что нуклеиновая кислота, составляющая второй компонент по изобретению, может встречаться как оперативно связанная с сигнальной последовательностью, позволяющей секретироваться в среду IL15 или его функционально эквивалентному варианту. Подходящие сигнальные последовательности для использования по настоящему изобретению включают последовательности, указанные ранее в контексте первого компонента по изобретению. Предпочтительно, сигнальная последовательность, образующая часть второго компонента композиции по изобретению, представляет собой сигнальную последовательность самого IL15, как определено ранее, или сигнальную последовательность одного из иммуноглобулинов, в частности, Igκ или IgVχ.
Третий компонент композиции по изобретению
Третий компонент по изобретению выбран из группы домена sushi альфа цепи рецептора IL15 или его функционально эквивалентного фрагмента.
Выражение «домен sushi альфа цепи рецептора IL15» (в настоящем описании далее IL15Rα-sushi) при использовании в настоящем изобретении относится к аминокислотной последовательности, которая находится во внеклеточном домене альфа цепи рецептора IL15 и которая соответствует последовательности, начинающейся с первого цистеина, кодируемого первым экзоном гена альфа цепи рецептора IL15, и кончающейся цистеином, кодируемым экзоном 4 гена альфа цепи рецептора IL15. Альтернативно, домен sushi определяется как последовательность, начинающаяся с первого цистеинового остатка альфа цепи рецептора IL15 после сигнальной последовательности и кончающаяся четвертым цистеиновым остатком после сигнальной последовательности в указанной выше последовательности. Подходящие домены sushi для использования в настоящем изобретении включают домен sushi альфа цепи рецептора IL15, происходящего от человека, соответствующей последовательности с номером поступления UniProt NP_002180 и чей домен sushi соответствует последовательности
CPPPMSVE HADIWVKSYS LYSRERYICN SGFKRKAGTS SLTECVLNKA TNVAHWTTPS LKC (SEQ ID NO:17)
и домен sushi альфа цепи рецептора IL15 мыши, соответствующей последовательности с номером поступления Swiss-Prot Q60819 и чей домен Sushi соответствует последовательности
CPPPV SIEHADIRVK NYSVNSRERY VCNSGFKRKA GTSTLIECVI NKNTNVAHWT TPSLKC (SEQ ID NO:18).
«Функционально эквивалентный вариант домена sushi альфа цепи рецептора IL15» понимается как обозначающий все те полипептиды, которые возникают в результате вставки, замены или делеции одной или более аминокислот в последовательности любых из указанных ранее последовательностей доменов sushi, происходящих от человека или мышей, и которые поддерживают по существу интактной их способность связываться с IL15 и усиливать пролиферативный эффект IL15 в клетках, экспрессирующих низкоаффинный рецептор IL15 (например, в клетках линий Mo-7e или 32Dβ), как описано Mortier et al. (J. Biol. Chem., 2006, 281:1612-1619).
В контексте настоящего изобретения рассматриваемые варианты IL15Rα-sushi включают полипептиды, сходные или идентичные полипептидам, указанным выше по меньшей мере на 70%, 72%, 74%, 76%, 78%, 80%, 90% или 95%. Степень идентичности между двумя полипептидами определяют с использованием алгоритмов компьютерных программ и способов, широко известных специалистам в данной области техники. Степень идентичности между двумя аминокислотными последовательностями предпочтительно определяют с использованием алгоритма BLASTP (BLAST Manual, Altschul, S. et al., NCBI NLM NIH Bethesda, Md. 20894, Altschul, S. et al., J., 1990, Mol. Biol. 215:403-410).
Третий компонент по изобретению может представлять собой нуклеиновую кислоту, которая кодирует по меньшей мере один домен sushi альфа цепи рецептора IL15, природный и его варианты, как указано выше. Нуклеиновые кислоты, кодирующие IL15Rα-sushi млекопитающих, могут быть получены из последовательностей соответствующих альфа цепей, найденных в депозитариях нуклеиновых кислот, и включают без ограничения последовательности, кодирующие IL15Rα-sushi альфа цепи рецептора IL15 человека (номера поступления NCBI, соответствующие U31628, SEQ ID NO:19) и мыши (номер поступления NCBI: U22339, SEQ ID NO:20).
Указанные полинуклеотиды включают полинуклеотиды, идентичные по последовательности по меньшей мере на 70% по меньшей мере на 75% по меньшей мере на 80% по меньшей мере на 85% по меньшей мере на 90% по меньшей мере на 91% по меньшей мере на 92% по меньшей мере на 93% по меньшей мере на 94% по меньшей мере на 95% по меньшей мере на 96% по меньшей мере на 97% по меньшей мере на 98% по меньшей мере на 99% любым указанным выше последовательностям, где процент идентичности определяется с использованием любого из алгоритмов, указанных выше.
Альтернативно, полинуклеотиды, образующие третий компонент по изобретению, представляют собой полинуклеотиды, способные специфически гибридизоваться с указанными ранее полинуклеотидами. Методы определения способности полинуклеотидов специфически гибридизоваться с последовательностью-мишенью подробно описаны в контексте первого компонента по изобретению.
Специалист в данной области техники должен понимать, что нуклеиновая кислота, составляющая второй компонент по изобретению, может встречаться как оперативно связанная с сигнальной последовательностью, позволяющей домену sushi или его функционально эквивалентному варианту секретироваться в среду. Подходящие сигнальные последовательности для использования по настоящему изобретению включают последовательности, указанные ранее в контексте первого компонента по изобретению. Предпочтительно, сигнальная последовательность, образующая часть второго компонента композиции по изобретению, представляет собой сигнальную последовательность самой альфа цепи рецептора IL15, как определено ранее, или сигнальную последовательность одного из иммуноглобулинов, в частности, Igκ или IgVχ.
В предпочтительном варианте осуществления третий компонент композиций по изобретению представляет собой полинуклеотид, включающий или состоящий из последовательности, идентифицированной как SEQ ID NO:21, которая кодирует полипептид, включающий домен Sushi рецептора IL15RA человека, перед которым находится его собственный сигнальный пептид (SEQ ID NO:22).
Композиции по изобретению могут быть составлены из полипептидов или полинуклеотидов различных видов животных. Тем не менее, в предпочтительном варианте осуществления три компонента происходят от одних и тех же видов животных. В предпочтительном варианте осуществления три компонента происходят от человека. В другом предпочтительном варианте осуществления три компонента происходят от мышей.
Композиции, в которых первый и второй компоненты образуют единую молекулу
Авторы настоящего изобретения обнаружили, что можно получить синергичное влияние в отношении противоопухолевой активности IL15, когда первый и второй компоненты композиции по изобретению образует часть единой молекулы. В этом случае композиции по изобретению представляют собой сдвоенные композиции, образованные первым компонентом, который в свою очередь включает первый и второй компоненты, указанные выше, и второй компонент, который соответствует третьему компоненту, определенному выше. Специалист в данной области техники должен понимать, что если первый и второй компоненты композиции представляют собой полипептиды, указанная единая молекула представляет собой слитый белок, включающий (i) полипептид Apo A или его функционально эквивалентный вариант и (ii) IL15 или его функционально эквивалентный вариант.
Термин «слитый белок» при применении в настоящем изобретении относится к полипептидам, включающим две или более области от различных или гетерологичных белков.
Альтернативно, в случае, когда оба, первый и второй компоненты композиции являются полинуклеотидами, указанная единая молекула представляет собой полинуклеотид, кодирующий слитый белок, включающий (i) полипептид, включающий полипептид Apo A или его функционально эквивалентный вариант и (ii) IL15 или его функционально эквивалентный вариант.
В том случае, когда первый и второй компоненты имеют пептидную природу, изобретением охватываются композиции, в которых первый компонент находится в N-концевом положении относительно второго компонента, и композиции, в которых первый компонент находится в C-концевом положении относительно второго компонента.
В том случае, когда первый и второй компоненты имеют полинуклеотидную природу, изобретением охватываются композиции, в которых первый компонент находится в 5'-положении относительно второго компонента, и композиции, в которых первый компонент находится в 3'-положении относительно второго компонента.
В обоих случаях возможно прямое взаимодействие первого и второго компонентов, другими словами C-концевой участок первого компонента связывается с N-концевым участком второго компонента, или C-концевой участок второго компонента связывается с N-концевым участком первого компонента, или 3'-конец первого компонента связывается с 5'-концом второго компонента, и композиции, в которых 3'-конец второго компонента связывается с 5'-концом первого компонента.
Альтернативно в другом аспекте в изобретении охватываются композиции, в которых соединение первого и второго компонентов осуществляется через пептидный линкер (в случае первого и второго компонентов являющийся линкером полипептидной природы) или через последовательность, кодирующую пептидный линкер (в случае первого и второго компонентов являющийся линкером полинуклеотидной природы).
Термин «пептидный линкер», «линкер», «соединитель», «спейсер» или их грамматические эквиваленты при применении в настоящем изобретении относится к молекуле, которая соединяет две молекулы и которая часто позволяет соединенным молекулам приобрести функциональную конфигурацию. Линкерный пептид предпочтительно включает по меньшей мере две аминокислоты по меньшей мере три аминокислоты по меньшей мере пять аминокислот по меньшей мере десять аминокислот по меньшей мере 15 аминокислот по меньшей мере 20 аминокислот по меньшей мере 30 аминокислот по меньшей мере 40 аминокислот по меньшей мере 50 аминокислот по меньшей мере 60 аминокислот по меньшей мере 70 аминокислот по меньшей мере 80 аминокислот по меньшей мере 90 аминокислот или приблизительно 100 аминокислот.
Подходящие линкеры для применения в настоящем изобретении включают:
- Линкеры, включающие 2 или более аминокислоты, выбранные из группы, состоящей из глицина, серина, аланина и треонина, такие как без ограничения линкеры с последовательностью SGGTSGSTSGTGST (SEQ ID NO:23), AGSSTGSSTGPGSTT (SEQ ID NO:24), GGSGGAP (SEQ ID NO:25) и GGGVEGGG (SEQ ID NO:26), описанные Muller, K.M. et al. (Methods. Enzimology, 2000, 328: 261-281).
- Линкеры, основанные на остатках 53-56 тетранектина, которые образуют β-складку в тетранектине и на остатках 57-59, которые образуют виток в тетранектине (Nielsen, B.B, et al., FEBS Lett. 412: 388-396, 1997), такие как линкер последовательности GTKVHMK (SEQ ID NO:27).
- Линкеры, основанные на подпоследовательности линкерной складки 3 фибронектина, соответствующей аминокислотам 1992-2102, такие как линкер PGTSGQQPSVGQQ (SEQ ID NO:28), соответствующий номерам аминокислот 2037-2049, и внутри которого фрагмент подпоследовательности GTSGQ (SEQ ID NO:29), соответствующий остаткам аминокислот 2038-2042 более предпочтителен.
- Линкер, основанный на последовательности из 10 остатков аминокислот верхней шарнирной области IgG3 мышей, такой как линкер с последовательностью PKPSTPPGSS (SEQ ID NO:30), который использован для продукции димерных антител посредством закрученной спирали (Pack P. and Pluckthun, A., 1992, Biochemistry 31:1579-1584).
- Линкерный пептид с последовательностью APAETKAEPMT (SEQ ID NO:31).
- Линкерный пептид с последовательностью GGSGGGGSGGGSGGGGSLQ (SEQ ID NO:32).
- Линкерный пептид с последовательностью GAP.
Альтернативно, два компонента конъюгатов по изобретению могут быть соединены с помощью пептида, чья последовательность содержит сайт-мишень для расщепления протеазой, тем самым позволяя отделить ApoA-I от компонента (ii). Подходящие сайты расщепления протеазами для включения в полипептиды по изобретению включают сайт расщепления энтерокиназой (сайт расщепления DDDDK, SEQ ID NO:33), фактором Xa (сайт расщепления IEDGR, SEQ ID NO:34), тромбином (сайт расщепления LVPRGS, SEQ ID NO:35), протеазой TEV (сайт расщепления ENLYFQG, SEQ ID NO:36), протеазой PreScission (сайт расщепления LEVLFQGP, SEQ ID NO:37), интеинами и сходными молекулами. В предпочтительном варианте осуществления сайт расщепления представляет собой сайт для протеазы, экспрессируемой в опухолевых тканях, в тканях с воспалением или в печени таким образом, что отделение Apo A и компонента (ii) имеет место как только конъюгат достигает печени. В предпочтительном варианте осуществления линкер содержит сайт узнавания металлопротеиназой 9 матрикса (сайт расщепления LFPTS, SEQ ID NO:38).
Хотя изобретение иллюстрируется композициями, в которых как компонент, происходящий в результате соединения первого и второго компонентов (слитый белок Apo A с IL15) так и третий компонент (домен Sushi α цепи рецептора IL15) используются в форме нуклеиновой кислоты, изобретение не ограничивается композициями, в которых оба компонента представляют собой нуклеиновые кислоты и наоборот охватывает в качестве альтернатив композиции, в которых первый и/или второй компонент являются полипептидами. Таким образом, изобретение охватывает композиции, образованные:
- Полипептидом, включающим слитый белок, образованный Apo A и IL15, и полипептидом, включающим домен sushi α цепи рецептора IL15.
- Полипептидом, включающим слитый белок, образованный Apo A и IL15, и полинуклеотидом, кодирующим полипептид, включающий домен sushi α цепи рецептора IL15.
- Полинуклеотидом, кодирующим полипептид, включающий слитый белок, образованный Apo A и IL15, и полипептидом, включающим домен sushi α цепи рецептора IL15.
- Полинуклеотидом, кодирующим полипептид, включающий слитый белок, образованный Apo A и IL15, и полинуклеотидом, кодирующим полипептид, включающий домен sushi α цепи рецептора IL15.
Отношение между компонентами, образующими часть композиций по изобретению, должно зависеть от агента-индуктора первого и второго компонентов, используемых в каждом конкретном случае, а также от требуемого применения. Таким образом, изобретение охватывает композиции, в которых отношение между количествами двух компонентов может находиться в диапазоне между 50:1 и 1:50, в частности между 20:1 и 1:20, между 10:1 и 1:10 или между 5:1 и 1:5.
В случае композиций, в которых первый и второй компоненты образуют единую молекулу, каждый из компонентов может происходить от различных видов, хотя для компонентов, образующих часть единой молекулы, предпочтительно происхождение от одних и тех же видов. Таким образом, в предпочтительном варианте осуществления Apo A или его функционально эквивалентный вариант происходит от человека и IL15 или его функционально эквивалентный вариант происходит от человека. В другом предпочтительном варианте осуществления Apo A или его функционально эквивалентный вариант происходит от мыши и IL15 или его функционально эквивалентный вариант происходит от мыши.
В предпочтительном варианте осуществления единая молекула, образующая первый компонент композиции, образована полипептидом ApoAI, происходящим от человека, и IL15, происходящим от человека, разделенными линкером, презентирующими последовательность GAP. Полинуклеотид, кодирующий указанный гибрид, представляет собой последовательность, идентифицированную в настоящем изобретении как SEQ ID NO:39.
В другом предпочтительном варианте осуществления единая молекула, образующая первый компонент композиции, образована полипептидом ApoAI, происходящим от мышей, и IL15, происходящим от человека, разделенными линкером, презентирующим последовательность GAP. Полинуклеотид, кодирующий указанный гибрид, представляет собой последовательность, идентифицированную в настоящем изобретении как SEQ ID NO:40.
В другом предпочтительном варианте осуществления единая молекула, образующая первый компонент композиции, образована полипептидом ApoAI, происходящим от мышей, и IL15, происходящим от мышей, разделенными линкером, презентирующим последовательность GAP. Полинуклеотид, кодирующий указанный гибрид, представляет собой последовательность, идентифицированную в настоящем изобретении как SEQ ID NO:41.
Полипептид, включающий домен Sushi альфа цепи рецептора IL15 или его функционально эквивалентный вариант может происходить от человека или мышей. Однако, если компоненты, образующие единую молекулу, оба происходят от человека, предпочтительно, чтобы домен Sushi альфа цепи рецептора IL15 или его функционально эквивалентный вариант также происходил от человека. Альтернативно, если компоненты, образующие единую молекулу, оба происходят от мышей, предпочтительно, чтобы домен Sushi альфа цепи рецептора IL15 или его функционально эквивалентный вариант также происходил от мышей.
В другом аспекте в изобретении рассматривается слитый белок, включающий ApoA или его функционально эквивалентный вариант и IL15 или его функционально эквивалентный вариант. Термины «ApoA», «IL15», «функционально эквивалентный вариант ApoA», «функционально эквивалентный вариант IL15» подробно объяснены выше и используются по существу таким же образом в равной степени в случае слитых белков.
Слитые белки могут представлять полипептид ApoA в N-концевом положении относительно IL-15 или полипептид IL-15 в N-концевом положении относительно Apo A. Сходно оба компонента могут быть соединены прямо или через линкер, который может представлять собой любой из линкеров, указанных в настоящем изобретении. Кроме того, компоненты могут происходить от человека или мышей, так что в изобретении рассматриваются гибриды ApoA и IL15, происходящие от человека, гибриды ApoA и IL15, происходящие от мышей, и гибриды ApoA и IL15, где ApoA происходит от человека и IL15 происходит от мышей, а также гибриды ApoA и IL15, где ApoA происходит от мышей и IL15 происходит от человека.
В предпочтительных вариантах осуществления изобретения слитые белки Apo A и IL15 соответствуют полипептидам, имеющим последовательности SEQ ID NO:39, SEQ ID NO:40 и SEQ ID NO:41.
Слитый белок по изобретению
В другом аспекте изобретение относится к слитому белку, включающему
(i) область A, образованную полипептидом Apo A или его функционально эквивалентным вариантом, идентичным по меньшей мере на 70% указанному полипептиду Apo A,
(ii) область B, образованную IL15 или его функционально эквивалентным вариантом, идентичным по меньшей мере на 70% IL15 и
(iii) область C, образованную доменом Sushi альфа цепи рецептора IL15 или его функционально эквивалентным вариантом, идентичным по меньшей мере на 70% домену Sushi альфа цепи рецептора IL15.
Область A слитого белка по существу совпадает с первым компонентом композиций по изобретению, что означает, что это было подробно описано выше.
Область B слитого белка по существу совпадает со вторым компонентом композиций по изобретению, что означает, что это было подробно описано выше.
Область C слитого белка по существу совпадает с третьим компонентом композиций по изобретению, что означает, что это было подробно описано выше.
Специалист в данной области техники должен понимать, что слитый белок по изобретению может иметь различное расположение областей A, B и C. Таким образом, в изобретении рассматривается:
- слитый белок, у которого область A находится в N-концевом участке, область B находится в центральной части и область C находится в C-концевом участке,
- слитый белок, у которого область A находится в N-концевом участке, область C находится в центральной части и область B находится в C-концевом участке,
- слитый белок, у которого область B находится в N-концевом участке, область A находится в центральной части и область C находится в C-концевом участке,
- слитый белок, у которого область B находится в N-концевом участке, область C находится в центральной части и область A находится в C-концевом участке,
- слитый белок, у которого область C находится в N-концевом участке, область A находится в центральной части и область B находится в C-концевом участке,
- слитый белок, у которого область C находится в N-концевом участке, область B находится в центральной части и область A находится в C-концевом участке.
Кроме того, области A, B и/или C могут быть соединены прямо, другими словами, так что C-концевая аминокислота одной области соединяется пептидной связью с N-концевой аминокислотой другой области. Альтернативно, различные области соединяются друг с другом пептидным линкером. Подходящие линкеры для слитого белка по изобретению являются по существу такими же, что и используемые в композиции по изобретению, и подробно описаны выше. Специалист в данной области техники должен понимать, что слитый белок по изобретению может содержать один или два пептидных линкера в зависимости от того связываются ли линкером друг с другом только две из трех областей или линкерами связываются все три области.
В предпочтительном варианте осуществления конструкция слитого белка представляет собой тип C-B-A, другими словами он включает в направлении с N- к C-концу домен Sushi IL15Rα (область C), IL15 (область B) и ApoAI (область A). В еще более предпочтительном варианте осуществления области C и B разделены линкером типа GGSGGGGSGGGSGGGGSLQ (SEQ ID NO:32). В другом варианте осуществления области B и A разделены линкером типа GAP. В еще более предпочтительном варианте осуществления области C и B разделены линкером типа GGSGGGGSGGGSGGGGSLQ (SEQ ID NO:32) и области B и A разделены линкером типа GAP.
Хотя слитые белки по изобретению проиллюстрированы слитыми белками, у которых области A, B и C происходят от мышей, специалист в данной области техники должен понимать, что в изобретении рассматриваются слитые белки, в которых каждая из областей A, B и C могут иметь различное происхождение, в пределах различных вариантов областей, указанных выше.
Таким образом, в предпочтительном варианте осуществления слитый белок включает область A, происходящую от человека или мышей, область B, происходящую от человека или мышей, область C, происходящую от человека или мышей. В еще более предпочтительном варианте осуществления три области происходят от одного и того же организма. Таким образом, в еще более предпочтительном варианте осуществления области A, B и C происходят от мышей. В другом предпочтительном варианте осуществления области A, B и C происходят от человека.
В предпочтительном варианте осуществления конструкция слитого белка представляет собой тип C-B-A, где три компонента происходят от человека и где обе области C и B, а также области B и A соединены пептидными линкерами. В предпочтительном варианте осуществления слитый белок включает в направлении с N- к C-концу домен sushi IL15Rα человека (область C), IL15 человека (область B) и ApoAI человека (область A). В еще более предпочтительном варианте осуществления области C и B разделены линкером типа GGSGGGGSGGGSGGGGSLQ. В другом варианте осуществления области B и A разделены линкером типа GAP. В еще более предпочтительном варианте осуществления области C и B разделены линкером типа GGSGGGGSGGGSGGGGSLQ и области B и A разделены линкером типа GAP. В предпочтительном варианте осуществления слитый белок включает последовательность, представленную SEQ ID NO:42.
В другом предпочтительном варианте осуществления слитый белок включает в направлении с N- к C-концу домен sushi IL15Rα мышей (область C), IL15 мышей (область B) и ApoAI мышей (область A). В еще более предпочтительном варианте осуществления области C и B разделены линкером типа GGSGGGGSGGGSGGGGSLQ. В другом варианте осуществления области B и A разделены линкером типа GAP. В еще более предпочтительном варианте осуществления области C и B разделены линкером типа GGSGGGGSGGGSGGGGSLQ и области B и A разделены линкером типа GAP. В предпочтительном варианте осуществления слитый белок включает последовательность, представленную SEQ ID NO:43.
Полинуклеотиды, генные конструкции, векторы и клетки-хозяева по изобретению
В другом аспекте в изобретении рассматривается полинуклеотид, кодирующий слитый белок по изобретению. Учитывая, что слитый белок по изобретению осуществляет свою функцию во внеклеточной среде, удобно, чтобы полинуклеотид кодировал слитый белок по изобретению с сигнальной последовательностью, которая позволяет слитому белку поступать на путь секреции и осуществлять секрецию слитого белка в среду. Подходящие сигнальные последовательности для использования совместно со слитым белком включают либо сигнальную последовательность любого из компонентов слитого белка (сигнальную последовательность Apo A, сигнальную последовательность IL15 или сигнальную последовательность α цепи рецептора IL15), либо любые сигнальные последовательности, указанные выше в контексте первого компонента композиции по изобретению, другими словами, подходящие сигнальные последовательности тканевого активатора плазминогена (tPA), гормона роста, GM-CSF и иммуноглобулинов и, в частности, сигнальные последовательности Igκ или IgVχ.
В предпочтительном варианте осуществления полинуклеотид по изобретению включает последовательность, представленную SEQ ID NO:44, кодирующую слитый белок или конъюгат, включающий домен Sushi, происходящий от человека, IL15, происходящий от человека, и ApoA1, происходящий от человека, где домен Sushi и IL15 разделены линкером с последовательностью GGSGGGGSGGGSGGGGSLQ, где IL15 и ApoA1 разделены линкером с последовательностью GAP и где гибриду предшествует сигнальная последовательность альфа цепи рецептора IL-15, происходящая от человека.
В предпочтительном варианте осуществления полинуклеотид по изобретению включает последовательность, представленную SEQ ID NO:45, кодирующую слитый белок или конъюгат, включающий домен Sushi, происходящий от мышей, IL15, происходящий от мышей, и ApoA1, происходящий от мышей, где домен Sushi и IL15 разделены линкером с последовательностью GGSGGGGSGGGSGGGGSLQ, где IL15 и ApoA1 разделены линкером с последовательностью GAP и где гибриду предшествует сигнальная последовательность альфа цепи рецептора IL-15, происходящая от мышей.
Полинуклеотид, который кодирует слитый белок по изобретению, может быть оперативно связан с областью, регулирующей экспрессию, тем самым давая начало генной конструкции. Следовательно, в другом аспекте изобретение относится к генной конструкции, включающему полинуклеотид по изобретению. Предпочтительно, конструкция включает полинуклеотид по изобретению, помещенный под оперативный контроль последовательностей, которые регулируют экспрессию полинуклеотида по изобретению. Специалист в данной области техники должен понимать, что полинуклеотиды по изобретению должны достигать ядра ткани-мишени и в нем транскрибироваться и транслироваться, вызывая повышение биологически активного слитого белка.
В принципе любой промотор может быть использован для генных конструкций по настоящему изобретению при условии, что указанный промотор совместим с клетками, в которых должен экспрессироваться полинуклеотид. Таким образом, подходящие промоторы для осуществления настоящего изобретения включают без необходимого ограничения конститутивные промоторы, такие как промоторы, происходящие из геномов эукариотных вирусов, таких как вирус полиомы, аденовирус, SV40, CMV, вирус саркомы птиц, вирус гепатита B, промотор гена металлотионеина, промотор гена тимидинкиназы вируса простого герпеса, области LTR ретровирусов, промотор гена иммуноглобулинов, промотор гена актина, промотор гена EF-1альфа, а также индуцибельные промоторы, для которых экспрессия белка зависит от добавления молекулы или экзогенного сигнала, такого как система тетрациклина, система NFkB/система УФ света, система Cre/Lox и промотор гена белка теплового шока, регулируемые промоторы РНК-полимеразы II, описанные в патенте WO/2006/135436, а также специфичные тканевые промоторы.
Полинуклеотиды по изобретению или включающие их генные конструкции могут образовывать часть вектора. Таким образом, в другом аспекте изобретение относится к вектору, который включает полинуклеотид или генная конструкция по изобретению. Специалист в данной области техники должен понимать, что не существует ограничений в отношении типа вектора, который может быть использован, так указанный вектор может представлять собой клонирующий вектор, подходящий для воспроизведения и для получения подходящих полинуклеотидов или генных конструкций, или экспрессионные векторы в различных гетерологичных организмах, подходящих для очистки конъюгатов. Таким образом, подходящие векторы в соответствии с настоящим изобретением включают экспрессионные векторы у прокариот, такие как pUC18, pUC19, Bluescript и его производные, mp18, mp19, pBR322, pMB9, ColEI, pCRI, RP4, фаги и «челночные» векторы, такие как pSA3 и pAT28, экспрессионные векторы в дрожжах, такие как векторы плазмидного типа 2-micra, интегративные плазмиды, векторы YEP, центромерные плазмиды и тому подобное, экспрессионные векторы в клетках насекомых, такие как векторы серий pAC и серий pVL, экспрессионные векторы в растениях, такие как векторы серий pIBI, pEarleyGate, pAVA, pCAMBIA, pGSA, pGWB, pMDC, pMY, pORE и тому подобное, и экспрессионные векторы в представленных выше эукариотных клетках, хорошо обоснованные в вирусных векторах (аденовируса, вирусов, связанных с аденовирусом, а также ретровируса и лентивируса) в дополнение к векторам, не относящимся к вирусным, таким как pSilencer 4.1-CMV (Ambion), pcDHA3, pcDNA3.1/hyg pHCMV/Zeo, pCR3.1, pEFI/His, pIND/GS, pRc/HCMV2, pSV40/Zeo2, pTRACER-HCMV, pUB6/V5-His, pVAXI, pZeoSV2, pCI, pSVL и pKSV-10, pBPV-1, pML2d и pTDTI.
Вектор по изобретению может быть использован для трансформации, трансфекции или инфицирования клеток, предрасположенных к трансформации, трансфекции или инфицированию указанным вектором. Указанные клетки могут быть прокариотными или эукариотными. В качестве примера вектор, в который введена указанная последовательность ДНК, может представлять собой плазмиду или вектор, который при введении в клетку-хозяина интегрируется в геном указанной клетки и реплицируется совместно с хромосомой (или хромосомами), в которые он был интегрирован. Указанный вектор может быть получен общепринятыми методами, известными специалистам в данной области техники (Sambrook et al., 2001, цитированный выше).
Следовательно, в другом аспекте изобретение относится к клетке, включающей полинуклеотид, генная конструкция или вектор по изобретению, в результате чего возможно трансформировать, трансфецировать или инфицировать клетку конструкцией или вектором, предлагаемым в данном изобретении. Трансформированные, трансфецированные или инфицированные клетки могут быть получены с помощью традиционных методов, известных специалистам в данной области техники (Sambrook et al., 2001, цитированный выше). В конкретном варианте осуществления указанная клетка-хозяин представляет собой клетку животных, трансфецированную или инфицированную подходящим вектором.
Подходящие клетки-хозяева для экспрессии конъюгатов по изобретению включают без ограничения клетки млекопитающих, растений, насекомых, грибов и бактерий. Бактериальные клетки включают без ограничения клетки грамположительных бактерий, такие как штаммы рода Bacillus, Streptomyces и Staphylococcus, и клетки грамотрицательных бактерий, такие как клетки рода Escherichia и Pseudomonas. Клетки грибов включают предпочтительно клетки дрожжей, такие как Saccharomyces, Pichia pastoris и Hansenula polymorpha. Клетки насекомых включают без ограничения клетки Drosophila и клетки Sf9. Клетки растений включают среди прочего клетки хлебных злаков, таких как зерновые, лекарственных или декоративных растений или луковичных. Подходящие для настоящего изобретения клетки млекопитающих включают линии эпителиальных клеток (свиньи и т.д.), линии клеток остеосаркомы (человека и т.д.), линии клеток нейробластомы (человека и т.д.), эпителиальные карциномы (человека и т.д.), глиальные клетки (мышей и т.д.), линии клеток печени (обезьяны и т.д.), клетки CHO (яичника китайского хомячка), клетки COS, клетки BHK, клетки HeLa, 911, AT1080, A549, 293 или PER.C6, клетки NTERA-2 ECCs человека, клетки D3 линии mESCs, эмбриональные стволовые клетки человека, такие как HS293 и BGV01, SHEF1, SHEF2 и HS181, клетки NIH3T3, 293N, REH и MCF-7 и клетки hMSCs.
Способы in vitro по изобретению
Описана способность IL15 стимулировать пролиферацию сенситизированных к антигену Т-лимфоцитов. Таким образом, показано, что контактирование с IL15 популяции выделенных лимфоцитов, предварительно экспонированных с определенным антигеном, приводит к повышению пролиферации лимфоцитов. Эта разросшаяся популяция лимфоцитов может быть использована в адоптивной иммунотерапии, в результате которой ее затем повторно вводят больному, от которого исходно получали указанную первоначальную популяцию. Следовательно, в другом аспекте изобретение относится к методу in vitro стимуляции экспансии антигенспецифических Т-лимфоцитов, включающему контактирование популяции лимфоцитов, предварительно экспонированных с указанным антигеном, с композицией по изобретению, слитым белком по изобретению, полинуклеотидом по изобретению, вектором по изобретению, генной конструкцией по изобретению или клеткой-хозяином по изобретению.
Термин «экспансия» используется в настоящем изобретении без отличий от пролиферации и должен пониматься как клеточное деление или клеточный рост. Экспансия может быть определена с использованием широко известных методов, таких как, например, методы, описанные в Transplantation (1999) 67:605-613.
Выражение «антигенспецифические Т-лимфоциты» при использовании в настоящем изобретении относится к популяции лимфоцитов, способных узнавать специфический антиген. Обычно лимфоциты выделяют от больного, который был экспонирован с указанным антигеном. Альтернативно, антиген может быть введен в контакт с популяцией лимфоцитов в искусственной антигенпрезентирующей системе, как описано в патентах США US6828150 и US6787154.
Термин «антиген» при использовании в настоящем изобретении относится к любому веществу, способному запускать иммунный ответ у индивидуума, который интолерантен к указанному антигену. Антиген может происходить от самого индивидуума, в этом случае он представляет собой аутоантиген, или он может представлять собой аллоантиген, другими словами, антиген, происходящий от индивидуума того же самого вида. Альтернативно, антиген может представлять собой ксеноантиген, другими словами, антиген, происходящий от индивидуума отличного вида.
Лимфоциты, которые могут быть использованы в способе по настоящему изобретению, включают без ограничения цитотоксические Т-лимфоциты (CTL), Т-хелперные клетки, активированные лимфокинами клетки, инфильтрирующие опухоль лимфоциты (TILS), NK клетки, наивные клетки, клетки памяти, гамма-дельта-Т-клетки, NKT клетки, а также клеточные популяции, включающие вариабельные количества одной или более из указанных выше клеток. В предпочтительном варианте осуществления лимфоциты представляют собой CTL. Подходящие методы получения CTL для последующей экспансии in vitro с использованием способа по изобретению широко известны специалисту в данной области техники и включают без ограничения выделение из периферической крови, из пуповинной крови, из тканей, содержащих лимфоциты. В предпочтительном варианте осуществления лимфоциты выделяют с помощью дренажа лимфатических узлов больных, страдающих конкретным заболеванием.
После выделения лимфоцитов их вводят в контакт с композицией по изобретению, слитым белком по изобретению, полинуклеотидом по изобретению, вектором по изобретению, генной конструкцией по изобретению или клеткой-хозяином по изобретению в условиях, подходящих для того, чтобы имела место экспансия лимфоцитов. Общие условия для антигенспецифической экспансии CTL могут быть определены в соответствии с хорошо известными методами [например, Carter J. et al., Immunology, 57 (1), 123-129, (1996)] и они могут быть обычным образом оптимизированы специалистом в данной области техники. Обычно контактирование лимфоцитов с композицией, слитым белком, полинуклеотидом, вектором, генной конструкцией или клеткой-хозяином по изобретению осуществляется с помощью культивирования лимфоцитов в среде, подходящей для указанных клеток. Клетки могут культивироваться в общепринятых условиях в подходящей среде для выращивания лимфоцитов, которая включает минимально необходимую среду или среду RPMI 1640. С целью стимуляции клеточного роста, необходимой пролиферации и жизнеспособности могут быть добавлены факторы, включая сыворотку, например, сыворотку плодов телят или сыворотку человека, и антибиотики, например, пенициллин, стрептомицин. Лимфоциты сохраняют в условиях, необходимых для поддержания роста, например, при подходящей температуре приблизительно 37°С и атмосфере, например, воздух плюс 5% CO2.
В предпочтительном варианте осуществления лимфоциты могут быть обработаны путем введения в контакт лимфоцитов с антигеном, против которого они специфичны, перед их стимуляцией с использованием компонентов по изобретению для стимуляции их активации in vitro. Это особенно необходимо в случае больных с опухолями, продуцирующими иммуносупрессорные вещества. Для достижения этого необходимо стимулировать культуру лимфоцитов соответствующим антигеном. Обычно антиген презентируется Т-клетке таким образом, что сигнал запускается в Т-клетке через комплекс TCR/CD3. Предпочтительно, чтобы антиген презентировался Т-клетке с помощью антигенпрезентирующей клетки.
Выражение «антигенпрезентирующая клетка» при применении в настоящем изобретении относится к клетке, которая вносит вклад в создание иммунного ответа посредством презентации антигена Т-лимфоцитам. Антигенпрезентирующие клетки включают дендритные клетки, мононуклеарные фагоциты, В-лимфоциты или клетки Лангерганса. Антигенпрезентирующие клетки могут быть выделены, например, из костного мозга, крови, тимуса, эпидермиса, печени или эмбриональной печени.
В том случае, когда антиген представляет собой опухолевый антиген, можно использовать экстракт аутологичной опухоли и/или рекомбинантный опухолевый антиген. В том случае, когда антиген происходит от патогена, активация лимфоцитов перед экспансией может быть осуществлена с использованием инфицированной патогеном клетки, например, патогенном, презентирующим вирусные антигены.
В способе экспансии антигенспецифических CTL по настоящему изобретению предпочтительно, чтобы обработка клеток композициями, слитыми белками по изобретению осуществлялась в присутствии антитела против CD3 и предпочтительно моноклонального антитела против CD3 человека и более предпочтительно OKT3. Концентрация антител против CD3 в течение процесса экспансии особенно не ограничивается и составляет, например, от 0,001 до 100 мг/мл и более предпочтительно от 0,01 до 100 мг/мл. Дополнительно или альтернативно клетки можно культивировать совместно с антителом против CD28 и более предпочтительно с моноклональным антителом против CD28 человека. Дополнительно или альтернативно клетки можно культивировать совместно со стимулирующим лимфоциты фактором, таким как лектин. Кроме того, один или более из этих компонентов может быть иммобилизован на твердой фазе.
Кроме того, в способе экспансии антигенспецифических CTL по настоящему изобретению клетки могут культивироваться совместно с питающими клетками в соответствии с условиями. В принципе не существует ограничений в отношении типа питающих клеток, которые могут быть использованы, при условии, что указанные питающие клетки содействуют белку или композиции по изобретению или агентам, указанным в предшествующем абзаце, в их способности стимулировать пролиферацию CTL. Предпочтительно подходящие питающие клетки включают без ограничения мононуклеарные клетки периферической крови (PBMC) и аутологичные или неаутологичные клетки EBV-B. Обычно питающие клетки обрабатывают в момент использования для устранения их пролиферативной способности предпочтительно путем обработки рентгеновскими лучами или цитотоксическими агентами, такими как митомицин.
Цитотоксическая активность популяции лимфоцитов, полученной следуя способу по изобретению, может быть определена с использованием хорошо известных методов. Например, можно определять способность лимфоцитов вызывать лизис маркированных клеток-мишеней и определять секрецию маркированного вещества. Альтернативно, цитотоксическая активность может быть определена путем идентификации уровня цитокина (например, GM-CSF и IFN-γ), продуцируемого лимфоцитами или клеткой-мишенью. Альтернативно, цитотоксическая активность может быть определена путем введения лимфоцитов в контакт со специфическим антителом цитотоксических лимфоцитов, помеченным первой флуоресцентной молекулой, и комплексом, образованным пептидом-антигеном и главным комплексом гистосовместимости, помеченным второй флуоресцентной молекулой, с последующим определением клеток, меченных обеими молекулами с помощью проточной цитометрии.
Популяции лимфоцитов, увеличивающиеся в соответствии со способами по настоящему изобретению, особенно выгодно использовать при адоптивной иммунотерапии, другими словами для повторного введения индивидуумам, которым требуется более высокий иммунный ответ против специфического антигена. Предпочтительно Т-лимфоциты используются аутологически, другими словами повторно вводятся индивидууму, от которого их исходно получали.
Фармацевтические композиции по изобретению
Композиции, полинуклеотиды и слитые белки по изобретению пригодны для лечения заболеваний, для которых необходима пролонгированная доза IL15. Следовательно, в другом аспекте изобретение относится к фармацевтическому препарату, включающему терапевтически эффективное количество композиции, слитого белка, полинуклеотида, генной конструкции, вектора, клетки-хозяина по изобретению и фармацевтически приемлемый наполнитель или носитель.
Предпочтительные наполнители для использования в настоящем изобретении включают сахара, крахмалы, целлюлозы, камеди и белки. В предпочтительном варианте осуществления фармацевтическую композицию по изобретению составляют в фармацевтической форме для введения в твердом виде (например, таблетки, капсулы, лепешки, гранулы, суппозитории, кристаллические или аморфные стерильные твердые вещества, которые могут быть восстановлены с получением жидких форм, и т.д.), жидком виде (например, растворы, суспензии, эмульсии, эликсиры, лосьоны, мази и т.д.) или полутвердом виде (гели, мази, кремы и тому подобное). Фармацевтические композиции по изобретению можно вводить любым путем, включая, но не ограничиваясь этим, пероральный, внутривенный, внутримышечный, внутриартериальный, внутримозговой, интратекальный, внутрь желудочка, чрескожный, подкожный, внутрибрюшинный, интраназальный, кишечный, местный, подъязычный или ректальный путь. Пересмотр различных форм введения активных ингредиентов, подлежащих использованию наполнителей и процедур их производства можно найти в Tratado de Farmacia Galénica, C. Fauli I Trillo, Luzán 5, S.A. de Ediciones, 1993 и в Remington's Pharmaceutical Sciences (A.R. Gennaro, Ed.), 20th edition, Williams & Wilkins PA, USA (2000). Примеры фармацевтически приемлемых наполнителей известны в данной области техники и включают физиологические растворы, забуференные фосфатом, воду, эмульсии, такие как эмульсии масло/вода, различные типы увлажняющих агентов, стерильные растворы и т.д. Композиции, включающие указанные наполнители, могут быть составлены с помощью традиционных методов, известных в данной области техники.
Альтернативно, композиции и соединения по изобретению могут быть составлены в виде нанолипочастиц в тех случаях, когда композиция включает белок ApoA или гибрид ApoA и второго компонента (IL15 или домена Sushi альфа-цепи рецептора IL15), или в тех случаях, когда в изобретении рассматривается слитый белок, включающий Apo A, IL15 и домен Sushi IL15RA). Образование нанолипочастицы основывается на том, что ApoA является главным компонентом липопротеидов высокой плотности (ЛПВП).
В контексте настоящего изобретения термин «нанолипочастица» является эквивалентом терминов «липопротеид» или «липопротеидная частица», которые можно использовать взаимозаменяемо. Нанолипочастица понимается как обозначение любой водорастворимой частицы, образованной ядром из неполярных липидов (таких как эстерифицированный холестерин и триглицериды), покрытым наружным слоем, образуемым апопротеинами, фосфолипидами и свободным холестерином.
Нанолипочастицы или липопротеиды классифицируются по их плотности как хиломикроны, липопротеиды очень низкой плотности (ЛПОНП), липопротеиды промежуточной плотности (ЛППП), липопротеиды низкой плотности (ЛПНП), и липопротеиды высокой плотности (ЛПВП). Различные свойства липопротеидов представлены в таблице 1.
В более конкретном варианте осуществления нанолипочастица представляет собой липопротеид типа ЛПВП, отличающийся тем, что он имеет состав, указанный в таблице выше, и тем, что аполипопротеины, которые образуют белковую фракцию, представляют собой Apo A, Apo C, Apo D и Apo E.
Нанолипочастицы могут быть получены с помощью традиционных методов, известных специалистам в данной области техники. В качестве иллюстрации, нанолипочастицы могут быть получены in vitro путем добавления холестерина и фосфатидилхолина к слитому белку, как описано в Lerch et al. (Vox Sang, 1996, 71: 155-164), или in vivo с использованием животного, отличного от человека, которое экспрессирует конъюгат по изобретению в печени, обеспечивая образование нанолипочастиц, которые секретируются в сыворотку, откуда они могут быть выделены.
В случае фармацевтической композиции по изобретению, включающей нуклеиновые кислоты (полинуклеотиды по изобретению, векторы или генные конструкции), изобретением предусматриваются специально получаемые фармацевтические композиции для введения указанных нуклеиновых кислот. Фармацевтические композиции могут включать указанные нуклеиновые кислоты в незащищенной форме, иными словами, в отсутствие соединений, защищающих нуклеиновые кислоты от разрушения нуклеазами организма, что обеспечивает преимущество исключения токсичности, связанной с реагентами, используемыми для трансфекции. Подходящие пути введения незащищенных соединений включают внутрисосудистый, внутрь опухоли, внутричерепной, внутрибрюшинный, внутриселезеночный, внутримышечный, под сетчатку, подкожный, слизистый, местный и пероральный путь (Templeton, 2002, DNA Cell Biol., 21:857-867). Альтернативно, нуклеиновые кислоты можно вводить в виде части липосом, конъюгатов с холестерином или конъюгатов с соединениями, способными содействовать транслокации через клеточные мембраны, такими как пептид Tat, берущий начало от белка TAT ВИЧ-1, третья спираль гомеодомена белка антеннапедий D.melanogaster, белок VP22 вируса простого герпеса, олигомеры аргинина и пептиды, такие как описанные в WO07069090 (Lindgren, A., et al., 2000, Trends Pharmacol. Sci, 21:99-103, Schwarze, S.R. et al., 2000, Trends Pharmacol. Sci, 21:45-48, Lundberg, M et al., 2003, Mol. Therapy 8:143-150 и Snyder, E.L. and Dowdy, S.F., 2004, Pharm. Res. 21:389-393). Альтернативно, полинуклеотид можно вводить в виде части плазмидного вектора или вирусного вектора, предпочтительно векторов на основе аденовируса, в аденоассоциированных вирусах или в ретровирусах, таких как вирусы на основе вируса лейкоза мышей (MLV) или лентивирусы (ВИЧ, FIV, EIAV).
В другом варианте осуществления композиции, слитые белки и полинуклеотиды по изобретению вводят с помощью так называемого «гидродинамического введения», как описано Liu, F., et al., (Gene Ther, 1999, 6:1258-66). В соответствии с упомянутым выше методом соединения вводят в организм внутрисосудистым путем при высокой скорости и объеме, что приводит к высокому уровню трансфекции при более широком распределении. Было показано, что эффективность проникновения внутрь клетки прямо зависит от объема вводимой жидкости и скорости инъекции (Liu et al., 1999, Science, 305:1437-1441). Для мышей оптимум введения составляет величины 1 мл/10 г массы тела на протяжении периода 3-5 секунд (Hodges et al., 2003, Exp. Opin. Biol. Ther, 3:91-918). Точный механизм, обеспечивающий трансфекцию клеток in vivo полинуклеотидами после их гидродинамического введения, известен не полностью. Полагают, что в случае мышей введение через хвостовую вену происходит в более высоком ритме, чем сердцебиение, вызывая аккумуляцию жидкости в верхней полой вене. Эта жидкость затем поступает в сосуды органов и затем посредством создания окон в указанных выше сосудах поступает во внесосудистое пространство. Таким путем полинуклеотиды входят в контакт с клетками органа-мишени перед смешиванием с кровью и тем самым снижают возможность их разрушения нуклеазами.
Композиции по изобретению можно вводить в дозах менее 10 мг на килограмм массы тела, предпочтительно менее 5, 2, 1, 0,5, 0,1, 0,05, 0,01, 0,005, 0,001, 0,0005, 0,0001, 0,00005 или 0,00001 мг на каждый кг массы тела и менее 200 нмоль агента, иными словами, приблизительно 4,4×1016 копий на кг массы тела или менее 1500, 750, 300, 150, 75, 15, 7,5, 1,5, 0,75, 0,15 или 0,075 нмоль на кг массы тела. Единицу дозы можно вводить путем инъекции, ингаляции или местного введения. Бифункциональные полинуклеотиды и композиции по изобретению можно вводить прямо в орган, в котором экспрессируется целевая мРНК, и в этом случае их следует вводить в интервале от 0,00001 мг до 3 мг на орган или предпочтительно от 0,0001 до 0,001 мг на орган, приблизительно от 0,03 мг до 3,0 мг на орган, приблизительно от 0,1 мг до 3,0 мг на орган или от 0,3 мг до 3,0 мг на орган.
Доза должна зависеть от тяжести и ответа подлежащего лечению состояния, и продолжительность ее введения может варьировать от нескольких дней до нескольких месяцев или до признаков смягчения состояния. Оптимум дозы может быть определен путем периодического измерения концентраций агента в организме больного. Оптимум дозы может быть определен на основании величин EC50, полученных в ходе предшествующих тестов in vitro или in vivo на животных моделях. Единицу дозы можно вводить раз в день или реже чем раз в день, предпочтительно реже, чем раз в 2, 4, 8 или 30 дней. Альтернативно, можно вводить исходную дозу и затем одну или несколько поддерживающих доз, обычно в меньшем количестве по сравнению с исходной дозой. Поддерживающий режим может включать лечение больного дозами, варьирующими между 0,01 мкг и 1,4 мг/кг массы тела в день, например, 1, 0,1, 0,01, 0,001 или 0,00001 мг на кг массы тела в день. Поддерживающие дозы вводят предпочтительно по большей части каждые 5, 10 или 30 дней. Лечение должно продолжаться на протяжении периода, который обычно зависит от типа нарушения, которым страдает больной, его тяжести и состояния больного. После лечения должно отслеживаться изменение состояния больного для определения того, следует ли увеличить дозу в случае отсутствия ответа заболевания на лечение или снизить дозу в случае обнаружения улучшения заболевания или нежелательных побочных эффектов.
Суточную дозу можно вводить в виде однократной дозы или в виде двух или более доз в зависимости от конкретных обстоятельств. Если требуется повторное введение или частые введения, целесообразно имплантировать устройство для введения, такое как насос, полупостоянный катетер (внутривенный, внутрибрюшинный, в подпаутинное пространство или внутрисуставный) или резервуар.
Терапевтическое применение композиций и слитых белков по изобретению
В дополнительном аспекте изобретение относится также к композициям, слитым белкам и полинуклеотидам по изобретению для использования в медицине.
Композиции по изобретению способны стимулировать пролиферацию CD8 лимфоцитов селезенки, печени и периферической крови in vivo (смотрите пример 5 изобретения), оказывать противоопухолевое действие на различных моделях колоректальной аденокарциномы (смотрите примеры 6 и 7) и проявлять антиметастатическое действие (смотрите пример 8). Эти эффекты вместе с доказательством способности IL15 стимулировать клеточную активность NK позволяют использовать соединения и композиции по изобретению для лечения больных, для которых полезна стимуляция врожденного (опосредуемого клетками NK) или приобретенного (опосредуемого CD8 лимфоцитами) иммунного ответа.
Поэтому в другом аспекте изобретение относится к композиции по изобретению, слитому белку по изобретению, полинуклеотиду по изобретению, вектору или генной конструкции по изобретению или клетке-хозяину по изобретению для использования для стимуляции иммунного ответа индивидуума.
Предпочтительно композицию по изобретению, слитый белок по изобретению, полинуклеотид по изобретению, вектор или генная конструкция по изобретению или клетку-хозяина по изобретению используют для лечения заболевания, при котором необходима активация иммунной системы в ответ на антиген.
Альтернативно, изобретение относится к использованию композиции по изобретению, слитого белка по изобретению, полинуклеотида по изобретению, вектора или генной конструкции по изобретению или клетки-хозяина по изобретению для получения лекарства для стимуляции иммунного ответа индивидуума на антиген или для лечения заболевания, при котором необходима активация иммунной системы.
Альтернативно, изобретение относится к методу индукции стимуляции иммунного ответа индивидуума на антиген или лечения заболевания, при котором необходима активация иммунной системы, который включает введение указанному индивидууму композиции по изобретению, слитого белка по изобретению, полинуклеотида по изобретению, вектора или генной конструкции по изобретению или клетки-хозяина по изобретению.
Выражение «стимуляция иммунного ответа индивидуума», применяемый в настоящем изобретении, относится к инициации иммунного ответа против конкретного антигена у индивидуума, где указанный ответ осуществляется в первый раз, а также к повторной активации иммунного ответа у индивидуумов, у которых указанный иммунный ответ уже имел место. Ясно, что иммунный ответ может включать и врожденный, и приобретенный иммунный ответ и может включать либо гуморальный, либо клеточный ответ.
Таким образом, способность соединений и композиций по изобретению повышать иммунный ответ на конкретный антиген может быть полезной для лечения заболеваний, связанных с наличием указанного антигена в организме, которые включают заболевания, вызываемые вирусными инфекциями, если дело касается вирусного антигена, заболевания, вызываемые бактериальными инфекциями, если дело касается бактериального антигена, заболевания, вызываемые грибковыми инфекциями, если дело касается грибкового антигена, аллергии, если дело касается аллергена, заболевания, вызываемые паразитарной инвазией, если дело касается паразитарного антигена, и/или опухоли, если дело касается антигена, специфичного для клеток опухоли. Таким образом, в предпочтительных вариантах осуществления заболевание, при котором требуется активация иммунной системы, выбирают из группы инфекционного заболевания и неопластического заболевания.
Заболевания, вызываемые вирусными инфекциями, которые можно лечить с помощью соединений и сочетаний по изобретению, включают, но не ограничиваются этим, заболевания, вызываемые инфекциями вирусом ВИЧ-1 (СПИД), вирусом герпеса человека, таким как вирус простого герпеса (простой герпес, генитальный герпес), цитомегаловирусом (мононуклеоз, ретинит, гепатит), вирусом Эпштейна-Барра (инфекционный мононуклеоз, лимфома Буркитта и носоглоточная карцинома) и вирусом опоясывающей оспы (ветряной оспы, опоясывающего герпеса); вирусами гепатита, такими как вирус гепатита B или вирус гепатита C, парамиксовирусом, таким как респираторно-синцитиальный вирус, вирус парагриппа, вирус краснухи, вирус кори, вирус свинки, вирус папилломы человека; флавивирусом, таким как вирус желтой лихорадки, вирус лихорадки денге, вирус клещевого энцефалита или вирус японского энцефалита) и ротавирусом. Другие типы вирусных инфекций, которые можно лечить с использованием соединений и сочетаний по настоящему изобретению, подробно описаны в Fundamental Virology, second edition, eds. Fields, B. N. and Knipe, D. M. (Raven Press, New York, 1991).
Заболевания, вызываемые бактериальными инфекциями, которые можно лечить с использованием соединений и сочетаний по изобретению, включают, но не ограничиваются этим, заболевания, вызываемые микроорганизмами рода Escherichia, Enterobacter, Salmonella, Staphylococcus, Shigella, Listeria, Aerobacter, Helicobacter, Klebsiella, Proteus, Pseudomonas, Streptococcus, Chlamydia, Mycoplasma, Pneumococcus, Neisseria, Clostridium, Bacillus, Corynebacterium, Mycobacterium, Campylobacter, Vibrio, Serratia, Providencia, Chromobacterium, Brucella, Yersinia, Haemophilus или Bordetella.
Заболевания, вызываемые грибковыми инфекциями, которые можно лечить с использованием соединений и сочетаний по изобретению, включают, но не ограничиваются этим, кандидоз, аспергиллез, гистоплазмоз, криптококковый менингит и тому подобное.
Паразитарные инфекции, которые можно лечить с использованием соединений и сочетаний по изобретению, включают, но не ограничиваются этим, малярию, инфекцию Pneumocystis jiroveci, пневмонию, сонную болезнь, лейшманиоз, криптоспоридиоз, токсоплазмоз и трипаносомоз.
Нарушения аллергического типа, которые можно лечить с использованием соединений и композиций по изобретению, включают, но не ограничиваются этим, аллергии, вызываемые контактом с пыльцой (аллергенами пыльцы с деревьев, растений, кустарников и травы), аллергии, вызываемые контактом с аллергенами насекомых (вдыхаемые аллергены, аллергены из слюны и яда), аллергенами перхоти и шерсти животных и пищевыми аллергенами.
Конъюгаты и композиции по изобретению также пригодны для лечения гиперпролиферативных заболеваний. Применяемое в настоящем изобретении выражение «пролиферативное заболевание» относится к заболеваниям, вызываемым, или приводящим к несоответствующим высоким уровням клеточного деления, несоответствующим низким уровням апоптоза или обоим и включают как первичные опухоли, так и метастазы. Термин «первичная опухоль» относится к опухоли в первичном месте образования этой опухоли. Используемый в настоящем изобретении термин «метастаз» относится к процессу, посредством которого опухоль распространяется на ткани организма, отличные от исходного места образования опухоли.
В контексте изобретения «лечение гиперпролиферативного заболевания» или «лечение опухоли» понимается как обозначение введения соединений и композиций по изобретению для предотвращения или задержки появления симптомов, осложнений или биохимических показателей рака или опухоли, для смягчения этих симптомов или для профилактики или ингибирования ее роста и прогрессии, таких как, например, появление метастазов. Лечение может быть профилактическим лечением для задержки появления заболевания или для предотвращения проявления клинических или доклинических симптомов или для терапевтического лечения с целью исключения или смягчения симптомов после проявления заболевания или в связи с его хирургическим или радиотерапевтическим лечением.
Рак, подлежащий лечению в контексте настоящего изобретения, может быть раком или опухолью любого типа. Эти опухоли или рак включают, но не ограничиваются этим, злокачественные образования, локализованные в ободочной кишке, брюшной полости, кости, молочной железе, пищеварительной системе, печени, поджелудочной железе, брюшине, эндокринных железах (надпочечниках, паращитовидной железе, гипофизе, семенниках, яичниках, тимусе, щитовидной железе), глазу, голове и шее, нервной системе (центральной и периферической), лимфатической системе, почечной лоханке, коже, мягкой ткани, селезенке, грудной клетке и мочеполовом аппарате и, конкретнее, включают детскую острую лимфобластную лейкемию, острую лимфобластную лейкемию, острую лимфоцитарную лейкемию, острую миелоидную лейкемию, адренокортикальную карциному, (первичный) гепатоцеллюлярный рак взрослых, (первичный) рак печени взрослых, острую лимфоцитарную лейкемию взрослых, острую миелоидную лейкемию взрослых, болезнь Ходжкина взрослых, лимфому Ходжкина взрослых, лимфоцитарную лейкемию взрослых, неходжскинскую лимфому взрослых, первичный рак печени взрослых, саркому мягких тканей взрослых, связанную со СПИДом лимфому, связанные со СПИДом злокачественные опухоли, рак заднего прохода, астроцитому, рак желчного пути, рак мочевого пузыря, рак кости, глиому ствола мозга, опухоли мозга, рак молочной железы, рак почечной лоханки и мочеточника, первичную лимфому центральной нервной системы, лимфому центральной нервной системы, астроцитому мозжечка, астроцитому мозга, рак шейки матки, детский (первичный) гепатоцеллюлярный рак, детский (первичный) рак печени, детскую острую лимфобластную лейкемию, детскую острую миелоидную лейкемию, детскую глиому ствола мозга, детскую астроцитому мозжечка, детскую астроцитому мозга, детские внечерепные опухоли герминативных клеток, болезнь Ходжкина детей, лимфому Ходжкина детей, детскую глиому зрительного пути и гипоталамуса, детскую лимфобластную лейкемию, детскую медуллобластому, детскую неходжскинскую лимфому, детские опухоли надтенториальной примитивной нейроэктодермы и эпифиза, детский первичный рак печени, детскую рабдомиосаркому, детскую саркому мягких тканей, детскую глиому зрительного пути и гипоталамуса, хроническую лимфоцитарную лейкемию, хроническую миелоидную лейкемию, рак ободочной кишки, кожную T-клеточную лимфому, карциному эндокринных клеток островков поджелудочной железы, рак эндометрия, эпендимому, эпителиальный рак, рак пищевода, саркому Эвинга и родственные опухоли, рак экзокринной части поджелудочной железы, внечерепную опухоль герминативных клеток, внегонадную опухоль герминативных клеток, рак внепеченочного желчного пути, рак глаза, рак молочной железы у женщин, болезнь Гоше, рак желчного пузыря, рак желудка, желудочно-кишечную карциноидную опухоль, желудочно-кишечные опухоли, опухоли герминативных клеток, гестационную трофобластную опухоль, триколейкемию, рак головы и шеи, гепатоцеллюлярный рак, болезнь Ходжкина, лимфому Ходжкина, гипергаммаглобулинемию, гипофарингиальный рак, раки кишечника, внутриглазную меланому, карциному клеток островков, рак клеток островков поджелудочной железы, саркому Капоши, рак почки, рак гортани, рак губы и рта, рак печени, рак легкого, лимфопролиферативные нарушения, макроглобулинемию, рак молочной железы у мужчин, злокачественную мезотелиому, злокачественную тимому, медуллобластому, меланому, мезотелиому, скрытый первичный метастатический сквамозный рак шеи, первичный метастатический сквамозный рак шеи, метастатический сквамозный рак шеи, множественную миелому, множественную миелому/ неоплазию плазматических клеток, миелодиспластический синдром, миелогенную лейкемию, миелоидную лейкемию, миелопролиферативные нарушения, рак околоносовой пазухи и носовой полости, рак носоглотки, нейробластому, неходжскинсую лимфому во время беременности, немеланомный рак кожи, немелкоклеточный рак легкого, метастатический сквамозный рак шеи со скрытой первичной локализацией, щечно-глоточный рак, злокачественную фиброзную остеосаркому-Z, остеосаркому-W, злокачественную фиброзную гистиоцитому, злокачественную фиброзную остеосаркому/гистиоцитому кости, эпителиальный рак яичника, рак герминативных клеток яичника, потенциальную опухоль яичника с низкой злокачественностью, рак поджелудочной железы, парапротеинемии, пурпуру, рак паращитовидной железы, рак пениса, феохромоцитому, опухоль гипофиза, неоплазию плазматических клеток/множественную миелому, первичную лимфому центральной нервной системы, первичный рак печени, рак предстательной железы, рак прямой кишки, рак клеток почки, рак почечной лоханки и мочеточника, ретинобластому, рабдомиосаркому, рак слюнных желез, саркоидоз, саркомы, синдром Сезари, рак кожи, мелкоклеточный рак легкого, рак тонкого кишечника, саркому мягких тканей, сквамозный рак шеи, рак желудка, опухоли эпифиза и надтенториальной примитивной нейроэктодермы, T-клеточную лимфому, рак семенника, тимому, рак щитовидной железы, переходно-клеточный рак почечной лоханки и мочеточника, переходный рак почечной лоханки и мочеточника, трофобластные опухоли, рак клеток почечной лоханки и мочеточника, рак мочеиспускательного канала, рак матки, саркому матки, рак влагалища, глиому зрительного пути и гипоталамуса, рак вульвы, макроглобулинемию Вальденстрема, опухоль Вильмса и любое другое гиперпролиферативное заболевание, а также неоплазию, локализованную в системе ранее упомянутого органа.
Композиции вакцины по изобретению
Соединения и композиции по изобретению также пригодны в качестве адъювантов в вакцинах для повышения ответа больного на антиген. Таким образом, в другом аспекте изобретение относится к композиции вакцины, включающей антиген и композицию, слитый белок, полинуклеотид, генную конструкцию, вектор или клетку-хозяина по изобретению.
Применяемый в настоящем изобретении термин «вакцина» или «композиция вакцины» относится к композиции, включающей по меньшей мере один интересующий антиген, которая обеспечивает активацию иммунного ответа индивидуума на указанный антиген. Назначение вакцин заключается в активации иммунитета, опосредуемого и клетками, и антителами. Предпочтительно клеточный иммунитет включает стимуляцию ответа T-клеток, преимущественно ответ, опосредуемый CD4+ и/или ответ CD8+ T-клеток.
Применяемый в настоящем изобретении термин «адъювант» относится к иммунологическому агенту, способному активировать иммунную систему, что обеспечивает более интенсивный и более эффективный иммунный ответ на вакцину по сравнению с ответом, который был бы получен в результате введения вакцины без адъюванта. Типичные ответы на адъюванты включают, но не ограничиваются этим, активацию, пролиферацию и/или дифференцировку клеток иммунной системы (B-клеток, T-клеток, дендритных клеток, антигенпрезентирующих клеток, макрофагов, клеток NK), повышение или снижение экспрессии маркеров и цитокинов, повышение титров IgA, IgM и/или IgG, спленомегалию (повышение клеточности селезенки), гиперплазию, образование инфильтратов в разных органах и другие типы ответов, которые могут быть количественно оценены экспертом в данной области техники с помощью стандартных методов.
Таким образом, вакцины, которые могут быть использованы в сочетании с сочетаниями и соединениями по изобретению, включают вакцины, презентирующие один или более антигенов, выбранных из группы вирусного антигена, бактериальных антигенов, грибкового антигена, аллергена или антигена окружающей среды и опухолевого антигена.
Вирусные антигены, пригодные для использования в вакцинах, включают антигены ВИЧ-1 (такие как tat, nef, gp120 или gp160, gp40, p24, gag, env, vif, vpr, vpu, rev), вирусов герпеса человека (такие как gH, gL gM gB gC gK gE или gD или их производные) или немедленный ранний белок, такой как ICP27, ICP47, ICP4, ICP36 VHS1 или VHS2, цитомегаловируса, особенно человеческого (такой как gB или его производные), вирусов Эпштейна-Барра (такой как gP350 или его производные), вирусов опоясывающей оспы (такие как gPI, II, III и IE63) или вируса гепатита, такого как вирус гепатита B (например, поверхностный антиген гепатита B или ядерный антиген гепатита), вируса гепатита C (например, ядерные антигены E1, NS3 или NS5), парамиксовируса, такого как респираторно-синцитиальный вирус (такие как протеины F и G или их производные), вируса парагриппа, вируса кори (такие как протеины E1 и E2), вируса ветряной оспы, вируса свинки, вируса папилломы человека (например, HPV6, 11, 16, 18, например, L1, L2, E1, E2, E3, E4, E5, E6, E7), флавивируса (например, вируса желтой лихорадки, вируса лихорадки денге, вируса клещевого энцефалита, вируса японского энцефалита) или клеток, инфицированных вирусами гриппа, такие как протеины HA, NP, NA или M или их сочетания), антигены ротавируса (такие как VP7sc и другие компоненты ротавируса) и тому подобное (смотрите Fundamental Virology, second edition, eds. Fields, B. N. and Knipe, D. M. (Raven Press, New York, 1991) по поводу дополнительных примеров вирусных антигенов.
Бактериальные антигены или производные, пригодные для использования в вакцинах, которые могут быть использованы с соединениями и сочетаниями по изобретению, включают антигены Neisseria spp, включая N. gonorrhea и N. meningitides (белки, связывающие трансферрин, белки, связывающие лактоферрин, PilC и адгезины); антигены S. pyogenes (такие как белки M или их фрагменты и протеаза C5A); антигены S. agalactiae, S. mutans; H. ducreyi; Moraxella spp, включая M catarrhalis, известная также как Branhamella catarrhalis (такие как низкомолекулярные и высокомолекулярные адгезины и инвазины); антигены Bordetella spp, включая B. pertussis (например, Parapertussis и B. bronchiseptica (такие как пертактин, коклюшный токсин или их производные, волокнистый гемагглютинин, аденилатциклаза, фимбрия); антигены Micobacterium spp., включая M. tuberculosis, M. bovis, M. leprae, M. avium, M. paratuberculosis, M. smegmatis; Legionella spp, включая L. pneumophila; (например, ESAT6, антиген 85A, -B или -С, MPT 44, MPT59, MPT45, HSPIO, HSP65, HSP70, HSP 75, HSP90, PPD 19 кДа [Rv3763], PPD 38 кДа [Rv 0934]); антигены Escherichia spp, включая энтеротоксигенную E. coli (например, факторы колонизации, термолабильный токсин или его производные, термостабильный токсин или его производные), антигены энтрогеморрагической E. coli и энтеропатогенной E. coli (например, токсин, сходный с токсином Shiga, или его производные); антигены Vibrio spp, включая V. cholera (например, холерный токсин или его производные); антигены Shigella spp, включая S. sonnei, S. dysenteriae, S. flexnerii; Yersinia spp, включая Y. enterocolitica (например, белок Yop); антигены Y. pestis, Y. pseudotuberculosis; Campylobacter spp, включая C. jejuni (например, токсины, адгезины и инвазины); антигены Salmonella spp, включая S. typhi, S. paratyphi, S. choleraesuis, S. enteridis; Listeria spp., L. monocytogenes; Helicobacter spp, включая H. pylori (например, уреазу, каталазу, вакуолизирующий токсин); антигены Pseudomonas spp, включая P. aeruginosa; Staphylococcus spp., включая S. aureus, S. epidermidis; Enterococcus spp., включая E. faecalis, E. faecium; Clostridium spp., включая C. tetani (например, токсин тетании и его производное); антигены C. botulinum (например, токсин ботулизма и его производное), антигены C. difficile (например, токсины A или B клостридия и их производные); антигены Bacillus spp., включая B. anthracis (например, токсин сибирской язвы и его производные); Corynebacterium spp., включая C. diphtheriae (например, дифтерийный токсин и его производные); антигены Borrelia spp., включая B. burgdorferi (например, OspA, OspC, DbpA, DbpB); антигены B. garinii (например, OspA, OspC, DbpA, DbpB), B. afzelii (например, OspA, OspC, DbpA, DbpB), антигены B. andersonfi (например, OspA, OspC, DbpA, DbpB), антигены B. hermsii; Ehrlichia spp., включая E. equi и агент гранулоцитарного эрлихиоза человека; Rickettsia spp, включая R. rickettsii; Chlamydia spp., включая C. trachomatis (например, MOMP, гепаринсвязывающие белки); антигены Chlamydia pneumoniae (например, MOMP, гепаринсвязывающие белки), антигены C. psittaci; Leptospira spp., включая L. interrogans; Treponema spp., включая T. pallidum (например, редкие белки наружной мембраны), антигены T. denticola, T. hyodysenteria; антигены Plasmodium spp., включая P. falciparum; Toxoplasma spp. и T. gondii (например, SAG2, SAGS, Tg34); антигены Entamoeba spp., включая E. histolytica; Babesia spp., включая B. microti; Trypanosoma spp., включая T. cruzi; Giardia spp., включая G. lamblia; Leishmania spp., включая L. major; Pneumocystis spp., включая P. carinii; Trichomonas spp., включая T. vaginalis; Schisostoma spp., включая S. mansoni.
Антигены дрожжей или берущие начало от дрожжей, таких как Candida spp., включая C. albicans; Cryptococcus spp., включая C. neoformans; антигены M. tuberculosis (такие как Rv2557, Rv2558, RPFs; Rv0837c, Rv1884c, Rv2389c, Rv2450, Rv1009, aceA (Rv0467), PstS1, (Rv0932), SodA (Rv3846), Rv2031c 16 кДа, Tb Ra12, Tb H9, Tb Ra35, Tb38-1, Erd 14, DPV, MTI, MSL, mTTC2 и hTCC1); антигены Chlamydia, такие как белок с высокой молекулярной массой (HMWP), ORF3 (документ EP 366412) и возможные мембранные белки (Pmp); антигены Streptococcus spp, включая S. pneumoniae (PsaA, PspA, стрептолизин, холинсвязывающие белки, белковый антиген пневмолизин и их мутантные детоксицированные производные); антигены, берущие начало от Haemophilus spp., включая H. influenzae типа B (например, PRP и его конъюгаты); антигены неклассифицируемой H. influenzae (такие как OMP26, высокомолекулярные адгезины, P5, P6, белок D и липопротеин D и фимбрин и пептиды, берущие начало от фимбрина или варианты множественных копий их слитых белков); антигены, берущие начало от Plasmodium falciparum (такие как RTS.S, TRAP, MSP1, AMA1, MSP3, EBA, GLURP, RAP1, RAP2, секвестрин, PfEMP1, Pf332, LSA1, LSA3, STARP, SALSA, PfEXP1, Pfs25, Pfs28, PFS27/25, Pfs16, Pfs48/45, Pfs230 и их аналоги в Plasmodium spp.).
Грибковые антигены, пригодные для использования в вакцинах, которые могут быть использованы с соединениями и сочетаниями по изобретению, включают, но не ограничиваются этим, например, компоненты грибкового антигена Candida; грибковые антигены Histoplasma, такие как белок теплового шока 60 (HSP60) и другие компоненты грибковых антигенов Histoplasma; грибковые антигены криптококка, такие как полисахариды капсулы и другие компоненты грибковых антигенов криптококка; грибковые антигены кокцидии, такие как антигены сферулы и другие компоненты грибковых антигенов кокцидии; и грибковые антигены Tinea, такие как трихофитин и другие компоненты грибковых антигенов кокцидии.
Антигены простейших, пригодные для использования в вакцинах, которые могут быть использованы с соединениями и сочетаниями по изобретению, включают, но не ограничиваются этим, антигены Plasmodium falciparum, такие как антигены поверхности мерозоита, антигены поверхности спорозоита, антигены циркумспорозоита, антигены поверхности гаметоцита/гаметы, антиген цельной крови pf, 55/RESA и другие компоненты плазмоидных антигенов; антигены Toxoplasma, такие как SAG-I, p30 и другие компоненты антигенов Toxoplasma; антигены шистосомы, такие как глутатион-S-трансфераза, парамиозин и другие компоненты антигена шистосомы; антиген Leishmania и другие антигены Leishmania tales, такие как gp63, липофосфогликан и связанный с ним белок и другие компоненты антигена Leishmania; и антигены Trypanosoma cruzi, такие как антиген 75-77 кДа, антиген 56 кДа и другие компоненты антигена Trypanosoma.
Аллергены или антигены окружающей среды, пригодные для использования в вакцинах, которые могут быть использованы с соединениями и сочетаниями по изобретению, включают, но не ограничиваются этим, антигены, берущие начало от образующихся в природе аллергенов, таких как аллергены пыльцы (аллергены пыльцы с деревьев, растений, кустарников и травы), аллергены насекомых (вдыхаемые аллергены, аллергены из слюны и яда), аллергены перхоти и шерсти животных и пищевые аллергены. Важные аллергены пыльцы с деревьев, трав и растений происходят от таксономических отрядов Fagales, Oleales, Pinales и Platanaceae, включая среди прочих березу (Betula), ольху (Alnus), лесной орех (Corylus), граб (Carpinus) и оливу (Olea), кедр (Cryptomeria и Juniperus), банановое дерево (Platanus), отряда Poales, включая среди прочих травы родов Lolium, Poa, Cynodon, Dactylis, Holcus, Phalaris, Secale и Sorghum, отрядов Asterales и Urticales, включая среди других растения родов Ambrosia, Artemisia и Parietaria. Другие аллергенные антигены, которые могут быть использованы, включают аллергены клещей домашней пыли родов Dermatophagoides и Euroglyphus, амбарных клещей, например, Lepidoglyphys, Glycyphagus и Tyrophagus, аллергены тараканов, комаров и блох, например, Blatella, Periplaneta, Chironomus и Ctenocepphalides, аллергены млекопитающих, таких как кошка, собака и лошадь, аллергены птиц, аллергены яда, включая аллергены из жала или укусов насекомых, таких как представители таксономического отряда Hymenoptera, включая пчел (надсемейство Apidae), ос и муравьев (надсемейство Formicoidae). Еще более аллергенные антигены, которые могут быть использованы, включают вдыхаемые грибковые аллергены, такие как аллергены родов Altemaria и Cladosporium.
Опухолевые антигены, пригодные для использования в вакцинах, которые могут быть использованы с соединениями и сочетаниями по изобретению, включают, но не ограничиваются этим, MAGE, MART-1/Melan-A, gp100, дипептидилпептидазу IV (DPPIV), белок, связывающий аденозиндезаминазу (ADAbp), циклофилин b, антиген, связанный с толстым кишечником (CRC)-0017-1A/GA733, карциноэмбриональный антиген (CEA) и его антигенные эпитопы CAP-1 и CAP-2, etv6, aml1, специфичный для простаты антиген (PSA) и его антигенные эпитопы PSA-1, PSA-2 и PSA-3, специфичный для простаты мембранный антиген (PSMA), CD3-ζ цепь рецептора T-клеток, семейство MAGE опухолевых антигенов (например, MAGE-A1, MAGE-A2, MAGE-A3, MAGE-A4, MAGE-A5, MAGE-A6, MAGE-A7, MAGE-A8, MAGE-A9, MAGE-A10, MAGE-A11, MAGE-A12, MAGE-Xp2 (MAGE-B2), MAGE-Xp3 (MAGE-B3), MAGE-Xp4 (MAGE-B4), MAGE-C1, MAGE-C2, MAGE-C3, MAGE-C4, MAGE-C5), семейство GAGE опухолевых антигенов (например, GAGE-1, GAGE-2, GAGE-3, GAGE-4, GAGE-5, GAGE-6, GAGE-7, GAGE-8, GAGE-9), BAGE, RAGE, LAGE-1, NAG, GnT-V, MUM-1, CDK4, тирозиназу, p53, семейство MUC, HER2/neu, p21ras, RCAS1, α-фетопротеин, E-кадгерин, α-катенин, 13-катенин, γ-катенин, p120ctn, gp100Pme1117, PRAME, NY-ESO-1, cdc27, белок аденоматозного полипоза ободочной кишки (APC), фодрин, коннексин 37, идиотипический Ig, p15, gp75, ганглиозиды GM2 и GD2, вирусные продукты, такие как белки вируса папилломы человека, семейство Smad опухолевых антигенов, lmp-1, P1A, кодируемый EBV ядерный антиген (EBNA)-1, гликогенфосфорилазу мозга, SSX-1, SSX-2 (HOM-MEL-40), SSX-3, SSX-4, SSX-5, SCP-1 и CT-7 и c-erbB-2, антигены острой лифобластной лейкемии (etv6, amll, циклофилин b), B-клеточной лимфомы (идиотипический Ig), глиомы (E-кадгерин, a-катенин, 13-катенин, 7-катенин, p120ctn), рака пузыря (p21ras), билиарного рака (p21ras), рака молочной железы (семейство MUC, HER2/neu, c-erbB-2), карциномы шейки матки (p53, p21ras), карциномы ободочной кишки (p21ras, HER2/neu, c-erbB-2, семейство MUC), антиген, связанный с толстым кишечником (CRC)-0017-1A/GA733, APC), антигены хориокарциномы (CEA), рака эпителиальных клеток (циклофилин b), рака желудка (HER2/neu, c-erbB-2, гликопротеид ga733), рака легкого (CEA, MAGE-3, NY-ESO-1), лейкемии, берущей начало от лимфоидных клеток (циклофилин b), меланомы (белок p15, gp75, карциноэмбриональный антиген, ганглиозиды GM2 и GD2, Melan-A/MART-1, cdc27, MAGE-3, p21ras, gp100Pme1117), миеломы (семейство MUC, p21ras), немелкоклеточного рака легкого (HER2/neu, c-erbB-2), носоглоточного рака (lmp-1 EBNA-1), рака яичника (семейство MUC, HER2/neu, c-erbB-2), рака предстательной железы (специфичный для простаты антиген (PSA) и его антигенные эпитопы PSA-1, PSA-2 и PSA-3, PSMA, HER2/neu, c-erbB-2, гликопротеид ga733), рака почки (HER2/neu, c-erbB-2), сквамозноклеточных раков шейки матки и пищевода (вирусные продукты, такие как белки вируса папилломы человека), рака семенника (NY-ES0-1) и T-клеточной лейкемии (эпитопы HTLV-1).
Компоненты композиций по изобретению и, в особенности, гибрид ApoA и IL15 или полинуклеотид, кодирующий указанный гибрид, и домен Sushi альфа цепи рецептора IL15 или нуклеиновая кислота, кодирующая указанный домен, могут быть представлены в виде единого состава (например, в виде таблетки или капсулы, включающей фиксированное количество каждого компонента) или, в другом случае, могут быть представлены в виде раздельных составов для последующего сочетания для совместного, последовательного или раздельного введения. Предусматривается также составление композиций по изобретению в виде набора или частей, где компоненты составляются раздельно, но упаковываются в один и тот же контейнер.
Специалист в данной области техники должен понимать, что составление первого и второго компонентов композиций по изобретению может быть сходным, иными словами, они могут быть составлены сходным образом (например, в виде таблеток или пилюль), обеспечивающим введение одним и тем же путем. В варианте осуществления, в котором различные компоненты составлены раздельно, в блистерной упаковке могут быть представлены два компонента. Каждая блистерная упаковка обычно содержит лекарства, подлежащие употреблению в течение дня. Если необходимо, чтобы лекарства вводились несколько раз в день, лекарства, соответствующие каждому введению, могут быть уложены в отдельные секции блистерной упаковки, предпочтительно с отметкой на каждой секции блистерной упаковки времени дня, в которое их следует вводить. Альтернативно, компоненты композиции по изобретению могут быть составлены разным образом, так что разные компоненты вводят раздельно. Так, например, возможно, чтобы первый компонент был составлен в виде таблетки или капсулы для перорального введения, а второй компонент был составлен для внутривенного введения.
Композиции по изобретению вводят в соответствии с методами, известными специалисту в данной области техники, включая, но не ограничиваясь этим, внутривенное, пероральное, назальное парентеральное, местное, чрескожное, ректальное и подобное введение.
Ниже изобретение описывается посредством следующих примеров, которые носят исключительно иллюстративный, а не ограничивающий объем изобретения характер.
ПРИМЕРЫ
Пример 1. Происхождение и конструирование плазмид
1.1 Экстракция РНК
Суммарную РНК печени мыши выделяли из индивидуальных образцов с помощью реагента TRI (Sigma, Madrid, Испания). Концентрацию и чистоту образцов определяли по поглощению при 260 и 280 нм с коррекцией фона при 320 нм с помощью спектрофотометра (Biophotometer, Eppendorf).
1.2 ОТ-ПЦР синтез суммарной кДНК
Суммарную РНК (3 мкг) обрабатывали ДНКазой I и подвергали обратной транскрипции в кДНК с помощью M-MLV RT в присутствии RNase OUT (все реагенты от Invitrogen, Carfsbed, CA). Было получено 25 мкл суммарной кДНК печени. Реакционную смесь инкубировали в течение 1 час при 37°С, денатурировали в течение 1 мин при 95°С и оставляли при 4°С. Образцы использовали немедленно для ПЦР или хранили при -20°С.
1.3 Клонирование кДНК аполипопротеина A-I мыши (mApoA1) и получение плазмиды pCMV-mApoA1
pCMV-mApoA1 (pApo) включает последовательность SEQ ID NO:1, кодирующую полипептид, включающий аполипопротеин A-I мыши (Apoa1), предваряемый его собственным сигнальным пептидом, и который функционально связан с промотором цитомегаловируса;
Были сконструированы смысловой праймер FwATGmApoA1: 5'-ATGAAAGCTGTGGTGCTGGC-3' (SEQ ID NO:46),
и антисмысловой праймер RvTGAmApoA1: 5'-TCACTGGCAGTCAGAGTCT-3' (SEQ ID NO:47).
кДНК mApoA1 амплифицировали (всего 795 нуклеотидов, 72 нуклеотида, кодирующих сигнальный пептид, и 723 нуклеотида, кодирующих природный белок) с помощью ПЦР на суммарной кДНК печени с использованием BioTaq ДНК-полимеразы (Bioline, London, UK): 5 мин 94°С, 30 циклов по 40 сек при 94°С, 40 сек при 55°С и 40 сек при 72°С и затем 7 мин при 72°С в термоциклере 2720 (Applied Biosystems, Foster City, США). Продукт ПЦР разгоняли в агарозном геле 1% агарозы D-1 с низкой EEO (Pronadisa, Madrid, Испания) с очисткой фрагмента геля с помощью набора для экстракции гелей QIAquick (Qiagen, Valencia, CA). Очищенную кДНК mApoA1 клонировали в соответствии с инструкциями производителя в экспрессионный вектор pcDNATM3.1/V5-His TOPO® TA (Invitrogen, Carfsbed, CA), который будет обозначаться как pCMV-mApoA1 или также как pApo. Наконец, полученная последовательность была подтверждена секвенированием.
1.4 Клонирование кДНК интерлейкина 15 человека (hIL15) и получение плазмиды pCMV-hIL15
pCMV-hIL15 (phIL15) включает SEQ ID NO:2, кодирующую полипептид, включающий IL15 человека, предваряемый сигнальным пептидом цепи IgVχ, и которая функционально связана с промотором цитомегаловируса;
Были сконструированы смысловой праймер FwAscIhIL15:
5'-AATAATGGCGCGCCGAACTGGATAGATG-3' (SEQ ID NO:48), который вводит последовательность из 9 нуклеотидов (GGCGCGCCC), которая составляет сайт рестрикции для фермента AscI на 5'-конце;
и антисмысловой праймер RvNotIhIL15:
5'-GTTCATCAACACGTCCTGAGCGGCCGC-3' (SEQ ID NO:49), который вводит последовательность из 8 нуклеотидов (GCGGCCGC), которая составляет сайт рестрикции для фермента NotI на 5'-конце.
кДНК hIL15 (всего 345 нуклеотидов) амплифицировали с помощью ПЦР на экспрессионной плазмиде pVkL/IL-15IRESneo (Meazza et al. Eur. J. Immunol. 1997; 27:1049-1054). Эта плазмида содержит последовательность, кодирующую зрелый человеческий IL15, предваряемый цепью IgVχ, под контролем промотора цитомегаловируса. Для ее обозначения будет использоваться термин pCMV-hIL15 или phIL15.
ПЦР проводили с использованием фермента клонирования высокоточной ПЦР EasyA (Stratagene, Cedar Creek, TX, США). Использовали следующие условия амплификации: 2 мин 95°С, 30 циклов из 40 сек при 95°С, 30 сек при 57°С и 45 сек при 72°С и затем 7 мин при 72°С в термоциклере 2720 (Applied Biosystems, Foster City, США). Продукт ПЦР разгоняли в агарозном геле 1% агарозы D-1 с низкой EEO (Pronadisa, Madrid, Испания) с очисткой фрагмента геля с помощью набора для экстракции гелей QIAquick (Qiagen, Valencia, CA). Очищенную кДНК hIL15 клонировали в соответствии с инструкциями производителя в экспрессионный вектор pTrcHis2 TOPO® TA (Invitrogen, Carfsbed, CA), который будет обозначаться как pTrcHis2-hIL15. Наконец, полученная последовательность была подтверждена секвенированием.
1.5 Конструирование плазмиды pCMV-Apo-hIL15 (pApo-hIL15), кодирующей слитый ген mApoA1 и hIL15
pCMV-Apo-hIL15 (pApo-hIL15) включает последовательность SEQ ID NO:40, которая кодирует слитый белок, включающий аполипопротеин A-I мыши, соединенный с IL15 человека с помощью линкера GAP, и которая функционально связана с промотором цитомегаловируса; и
был сконструирован антисмысловой праймер RvAscImApoA1:
5'-GGCGCGCCCTGGGCAGTCAGAGTCTCGC-3' (SEQ ID NO:50), который вводит последовательность из 9 нуклеотидов (GGCGCGCCC), которая составляет сайт рестрикции для фермента AscI на 3'-конце гена ApoA1 и удаляет стоп-кодон. Эта добавленная последовательность рестрикции должна транслироваться в короткий линкерный пептид GAP, который должен придавать некоторую подвижность составляющим белкам.
Амплификацию производили с помощью ПЦР с использованием в качестве матрицы pCMV-mApoA1 (смотрите пример 1.3) и праймеров FwATGmApoA1 и RvAscImApoA1, с ДНК-полимеразным ферментом BioTaq (bioline, London, UK), 5 мин 94°С, 30 циклов из 40 сек при 94°С, 40 сек при 57°С и 40 сек при 72°С и затем 7 мин при 72°С в термоциклере 2720 (Applied Biosystems Foster City, США). Продукт ПЦР (804 нуклеотида) разгоняли в агарозном геле 1% агарозы D-1 с низкой EEO (Pronadisa, Madrid, Испания) с очисткой фрагмента геля с помощью набора для экстракции гелей QIAquick (Qiagen, Valencia, CA). Очищенную кДНК mApoA1-AscI клонировали в соответствии с прилагаемыми инструкциями в экспрессионный вектор pcDNATM3.1/V5-His TOPO® TA (Invitrogen, Carfsbed, CA), который будет обозначаться как pCMV-mApoA1-AscI. Наконец, полученная последовательность была подтверждена секвенированием.
Параллельно гидролизовали матрицу pTrcHis2-hIL15 (смотрите пример 1.4) в течение 50 мин при 37°С с помощью фермента AscI и буфера 4 (New England Biolabs). Продукт гидролиза разгоняли в агарозном геле 1% агарозы D-1 с низкой EEO (Pronadisa, Madrid, Испания) с очисткой фрагмента геля с помощью набора для экстракции гелей QIAquick (Qiagen, Valencia, CA). Очищенную ДНК AscI-hIL15-pTrcHis2 затем гидролизовали в течение 50 мин при 37°С с помощью фермента NotI, 1×БСА и буфера 3 (New England Biolabs). Продукт гидролиза разгоняли в агарозном геле 1% агарозы D-1 с низкой EEO (Pronadisa, Madrid, Испания) с очисткой фрагмента геля с помощью набора для экстракции гелей QIAquick (Qiagen, Valencia, CA) с получением очищенной ДНК AscI-hIL15-NotI (345 нуклеотидов).
Для осуществления слияния генов плазмиду pCMV-mApoA1-AscI гидролизовали в течение 50 мин при 37°С с помощью фермента AscI и буфера 4 (New England Biolabs). Продукт гидролиза разгоняли в агарозном геле 1% агарозы D-1 с низкой EEO (Pronadisa, Madrid, Испания) с очисткой фрагмента геля с помощью набора для экстракции гелей QIAquick (Qiagen, Valencia, CA). Очищенную ДНК pCMV-mApoA1 затем гидролизовали в течение 50 мин при 37°С с помощью фермента NotI, 1×БСА и буфера 3 (New England Biolabs), используя преимущество наличия сайта рестрикции в скелете pcDNA 3.1 V5-His TOPO® TA. Продукт гидролиза разгоняли в агарозном геле 1% агарозы D-1 с низкой EEO (Pronadisa, Madrid, Испания) с очисткой фрагмента геля с помощью набора для экстракции гелей QIAquick (Qiagen, Valencia, CA). Вектор pCMV-mApoA1, раскрытый с помощью AscI и NotI, соединяли со вставкой AscI-hIL15-NotI в соотношении 1:3 (вектор:вставка) с помощью T4 ДНК-лигазы с высокой концентрацией и в качестве буферного раствора 2×буфера для быстрого лигирования (Promega Madison, WI, США), инкубируя смесь в течение 10 мин при комнатной температуре. Затем производили трансформацию бактерий Top10 (Invitrogen, Carfsbed, CA). Трансформированные бактерии подвергали селекции на основе их роста в чашках Петри со средой LB с ампициллином, поскольку вектор содержит ген резистентности к этому антибиотику. Из позитивных бактерий экстрагировали плазмидную ДНК с помощью метода MiniPrep (Qiagen, Германия) для последующего гидролиза 2 мкг указанной плазмиды ферментами AscI/PmeI (New England Biolabs) и выделения полученного указанного продукта гидролиза с помощью электрофореза в 1% агарозном геле для проверки наличия вставки. Полученная плазмида 6669 nts в настоящем описании обозначается как pCMV-Apo-hIL15 или также как pApo-hIL15.
1.6 Происхождение плазмиды pSushi
Плазмида, обозначаемая в контексте настоящего изобретения как pCMV-Sushi (pSushi), соответствует плазмиде IL15RΔMD, ранее описанной Duitmann et al. (Duitman, E.H., et al., Mol Cell Biol, 2008; 28: 4851-4861), любезно предоставленной авторами данной работы.
pCMV-Sushi (pSushi) содержит последовательность SEQ ID NO:20, кодирующую полипептид, который включает домен Sushi α-цепи рецептора IL15 мыши (IL15ra), предваряемый сигнальным пептидом Igκ, и которая функционально связана с промотором цитомегаловируса.
1.7 Клонирование кДНК интерлейкина 15 мыши (mIL15) и получение плазмиды pCMV-mSushi-mIL15 (pmSushi-mIL15)
pCMV-mSushi-mIL15 (pmSushi-mIL15) включает последовательность, кодирующую полипептид, который включает домен Sushi α-цепи рецептора IL15 мыши (IL15ra), соединенный с IL15 мыши с помощью гибкого линкера типа GGSGGGGSGGGSGGGGSLQ (SEQ ID NO:32).
Ген, кодирующий домен Sushi, соединенный с IL15 мыши, сопровождающийся двумя стоп-кодонами, окруженный одним сайтом рестрикции NheI на 3'-конце и другим сайтом рестрикции XhoI на 5'-конце, был синтезирован с помощью GENEART AG (GENEART AG, BioPark, Josef-Engert-Straße 11, 93053 Regensburg, Германия) и вставлен в плазмиду pSecTag2/Hygro A (Invitrogen, Frankfurter Straße 129B, 64293 Darmstadt, Германия).
Экспрессия домена Sushi, соединенного с IL15 мыши, находится под контролем промотора цитомегаловируса, а его секреция управляется сигнальным пептидом цепи Igκ V-J2.
1.8 Конструирование плазмиды pCMV-mSushi-mIL15-mApoA1 (pmSushi-mIL15-mApo), кодирующей гибрид mSushi, mIL15 и mApoA1
pCMV-mSushi-mIL15-mApoA1 включает последовательность SEQ ID NO:45, кодирующую слитый белок, включающий домен Sushi α цепи рецептора IL15 мыши (IL15ra), IL15 мыши и аполипопротеин A-I мыши.
Были созданы праймеры для амплификации последовательности Sushi, соединенной с IL15 мыши, и для одновременного присоединения к ней последовательности из 9 нуклеотидов (GGCGCGCCC), которая составляет сайт рестрикции ферментом AscI на 3'-конце гена и устраняет стоп-кодон. Эта добавленная последовательность рестрикции должна обеспечивать клонирование с последовательностью Apo, которая содержит последовательность AscI на 5'-конце, и должна транслироваться в короткий линкерный пептид GAP, который должен придавать определенную подвижность составляющим белкам.
Праймеры представляли собой:
Fw Sushi 5'-ATGGAGACAGACACCCTGCTG-3' (SEQ ID NO:51)
Rv IL15 AscI: 5'-GGGCGCGCCGCTGGTGTTGATGAACAT-3' (SEQ ID NO:52)
Последовательность амплифицировали с помощью ПЦР, используя в качестве матрицы pmSushi-mIL15, описанную в предшествующем примере, и праймеры Fw Sushi и Rv IL15 AscI с ферментом ДНК-полимеразой BioTaq (Bioline, London, UK), 1 мин, 94°С, 30 циклов по 30 сек при 94°С, 30 сек при 58°С и 45 сек при 72°С, затем 2 мин при 72°С в термоциклере 2720 (Applied Diosystems Foster City, US). разгоняли в агарозном геле 1% агарозы D-1 с низкой EEO (Pronadisa, Madrid, Spain), очищали фрагмент геля с использованием набора для экстракции геля QIAquick (Qiagen, Valencia, CA). Очищенную ДНК клонировали, следуя прилагаемым инструкциям, в экспрессионный вектор pcDNA™3.1/V5-His TOPO® TA (Invitrogen, Carfsbed, CA), обозначая как pCMV-mSushi-mIL15-AscI. Наконец, правильность полученной последовательности подтверждали секвенированием.
Для осуществления соединения генов плазмиду pCMV-mIFN-AscI-mApo (описанную в патентной заявке WO2009150284 и включающую полинуклеотид, кодирующий слитый белок между mIFN и mApo) гидролизовали в течение 50 мин при 37°С с помощью ферментов AscI и Ncol в буфере 4 (New England Biolabs). Продукт гидролиза разгоняли в агарозном геле 1% агарозы D-1 с низкой EEO (Pronadisa, Madrid, Spain) и верхнюю полосу, содержащую открытый вектор без последовательности IFN, очищали, выделяя из геля, с использованием набора для экстракции геля QIAquick (Qiagen, Valencia, CA). Плазмиду pCMV-mSushi-mIL15-AscI гидролизовали с использованием тех же ферментов и условий. В этом случае очищали нижнюю полосу, содержащую фрагмент mSushi-mIL15. Оба очищенных фрагмента соединяли в отношении 1:3 (вектор: вставка) с использованием ДНК-лигазы T4 c высокой концентрацией и в качестве буфера раствора 2× буфера для быстрого лигирования (Promega Medison, WI, U.S.), инкубируя смесь в течение 10 мин при комнатной температуре. Затем трансформировали бактерии Top10 (Invitrogen, Carfsbed, CA). Трансформированные бактерии отбирали по их росту в чашках Петри в среде LB с ампициллином, так как вектор содержит ген устойчивости к этому антибиотику. Плазмидную ДНК экстрагировали из позитивных бактерий с использованием способа MiniPrep (Qiagen, Germany) для последующего гидролиза 2 мкг указанной плазмиды ферментами AscI/PmeI (New England Biolabs) и разделения с помощью электрофореза продукта указанного гидролиза в 1% агарозном геле для проверки присутствия вставки. Полученная плазмида обозначается в настоящем описании далее как pCMV-mSushi-mIL15-mApoA1 или также как pmSushi-mIL15-mApo.
Пример 2. Экспериментальные модели
2.1. Животные
Эксперименты выполняли на самках иммунокомпетентных BALB/c и C57BL/6 мышей возрастом между 5-7 недель (Harlan, Barselona, Spain). Для гена IL15Rα использовали «нокаутных» мышей (Lodolce et al. IL15 receptor maintains lymphoid homeostasis by supporting lymphocyte homing and proliferation. Immunity 1998; 9: 669-676). С животными работали в соответствии с этическими правилами для экспериментов на животных в специальных условиях, свободных от внешних патогенов.
2.2. Обработка животных
Каждую плазмидную ДНК (10 мкг) ресуспендировали в 1,8 мл 0,9% сыворотки в физиологическом растворе (Braun), вводили в хвостовую вену с помощью гидродинамической инъекции с использованием игл 27,5G и шприцов на 2,5 мл (Beckton-Dickinson, Spain). Образцы крови получали из ретроорбитального пространства после ингаляторной анестезии изофлураном (Forane, Abbott). Сыворотку получали путем двух последовательных центрифугирований при 9,1×g в течение 5 минут и хранили при -20°С. Парентеральную анестезии осуществляли с помощью внутрибрюшинного введения 200 мкл/мышь смеси 9:1 кетамина (имальгена) и ксилазина (ромпуна).
2.3. Клеточные линии
Линия клеток CT26 происходит от колоректальной аденокарциномы мышей BALB/C и была индуцирована канцерогеном N-нитрозо-N-метилуретаном.
Линия MC38 происходит от аденокарциномы мышей.
Обе линии культивировали в полной среде RPMI-1640 (Gibco-BRL, Paisley, UK) с добавлением 10% сыворотки плодов телят (FCS), инактивированной при 56°С, 2 мМ глутамина, 100 Е/мл стрептомицина, 100 мг/мл пенициллина, 1% β-меркаптоэтанола 5.10-3. Описанные клетки культивировали в увлажненных камерах для инкубации при 37°С и в атмосфере 5% CO2. Культуральные чашки и сосуды получали от Greiner Bio-one (Essen, Germany).
2.4. Определение hIL15
Уровни hIL15 в сыворотке определяли с помощью теста ELISA в 96-луночных плоскодонных планшетах NUNC MaxiSorp с использованием набора ELISA (Set Human IL 15, BD Biosiences, San Diego, CA, US), следуя инструкциям производителя.
2.5. Проточная цитометрия
Клеточные популяции исследовали с помощью проточной цитометрии. Для осуществления этого использовали кровь, полученную ретроорбитально, а также клетки из селезенки и печени животных. Солидные органы инкубировали в течение 15 мин с раствором коллагеназы и ДНКазы для облегчения дезинтеграции клеток, которая осуществлялась с помощью Cell Strainer© (BC Falcon, Bedford, MA, US). Лимфоциты печени выделяли центрифугированием клеточной суспензии в 35% растворе Percoll© (GE Healthcare, Uppsala, Sweden). Для каждой печени использовали следующие реагенты: 1,6 мл PBS 10×, 15,8 мл Percoll©, 200 Е гепарина (Mayne Pharma, Madrid, Spain) и 28 мл RPMI (Gibco, Invitrogen, Grand Island, NY, US).
Все исследуемые клеточные суспензии обрабатывали трис-NH4Cl буфером в течение 5 минут для лизиса эритроцитов.
Клетки ресуспендировали в 50 мкл PBS и инкубировали в течение 10 мин при 4°С в темноте со смесью соответствующих антител. Затем проводили две отмывки и их анализировали в цитометре FACScalibur© (BD Bioscience, San Diego, CA, US). Последующий анализ данных осуществляли с использованием программы Flow Jo, версии 5.7.2.
Используемые антитела представляли собой NK1.1-PE, CD3-FITC, CD8-PE, CD44-APC, CD62L-PE, CD8-PECy7 и NK1.1-APC (BD-Pharmamingen, BD Science, San Diego, CA, US).
2.6. Статистический анализ данных
Данные анализировали статистически с использованием компьютерной программы Prism 5 (GraphPad Software, Inc.). Данные по показателю опухолей записывали на графиках Каплана-Мейера. Данные, изучаемые в различное время, анализировали с помощью ANOVA с повторными измерениями с последующим тестом Бонферрони. Значимые различия величин рассматривались как составляющие p<0,05.
Пример 3. Циркулирующие уровни hIL15 после гидродинамического введения плазмидных конструкций
Для исследования уровней hIL15 в мышиной сыворотке создавали группы из 2-3 мышей и каждой мыши гидродинамически вводили 10 мкг соответствующей плазмиды (или сочетания плазмид). Плазмиды, вводимые различным группам, представляли собой: pApo-hIL15, pApo-hIL15+pSushi, phIL15, phIL15+pSushi, pApo или физиологический раствор (S).
Образцы сыворотки получали через 8, 24, 96, 168 и 240 часов, и концентрацию hIL15 в них определяли с помощью сендвич-метода ELISA. Сыворотки мышей, получавших контрольную плазмиду, которая экспрессировала ApoA1, не содержали определяемых уровней hIL15 (фиг.1). У мышей, которым вводили плазмиду, экспрессирующую hIL15, через 8 час присутствовали максимальные концентрации hIL15, которые быстро снижались (фиг.1). Однако у мышей, получавших плазмиды, кодирующие ApoA1-hIL15 (с или без сопутствующего введения плазмиды pSushi), через 8 час присутствовали более высокие концентрации hIL15 в сыворотке, которые продолжали расти до 24 ч. Через 168 часов все еще было можно определить hIL15 у мышей, обработанных ApoA1-hIL15 в отличие от того, что наблюдалось у мышей с введением phIL15 (фиг.1). Следовательно, конструкции, экспрессирующие слитые белки ApoA1-hIL15, вызывают достижение более высоких и более длительно поддерживающихся циркулирующих уровней hIL15.
Заключается, что гидродинамическое введение плазмиды pApo-hIL15 индуцирует высокие концентрации hIL15, намного превышающие концентрации, продуцируемые введением phIL15.
Пример 4. Функциональный тест на CTLL2 клетках
Для исследования фармакодинамических эффектов плазмиды pApo-hIL15 проводили функциональный тест с использованием CTLL2 клеток, которые требуют IL-2 или IL15 для пролиферации (Meazza et al. Expression of two interleukin-15 mRNA isoforms in human tumors does not correlate with secretion: role of different signal peptides. Eur J Immunol 1997; 1049-1054).
Плазмиды вводили гидродинамически, и образцы сыворотки получали через 24 ч. Удаление комплемента из сыворотки осуществляли тепловой денатурацией (45 минут, 56°С) и ее добавляли к культурам CTLL2 клеток на 48 ч, и измеряли клеточную пролиферацию с использованием меченного тритием тимидина. Концентрацию hIL15 в сыворотке измеряли с использованием коммерческого набора ELISA сендвич-методом. В случае эквимолярных количеств hIL15 мышиная сыворотка, обработанная pApo-hIL15+pSushi, индуцировала более интенсивную пролиферацию CTLL2 клеток (фиг.2).
Следовательно, заключается, что совместное введение плазмиды pSushi с pApo-hIL15 повышает их биологическое действие. Плазмидные конструкции ApoA1 в соединении с hIL15, проявляют более высокое индуцирующее действие на пролиферацию CTLL2 клеток, чем при введении плазмиды, кодирующей sushi домен (pSushi) IL15Rα.
Пример 5. Стимуляция пролиферации CD8 лимфоцитов
Для исследования потенциального иммуностимулирующего действия конструкций, экспрессируемых в печени в результате гидродинамического введения, сначала анализировали рост количества CD8 Т-клеток в селезенке. Для осуществления этого плазмиды вводили гидродинамически, и через 3, 4, 5, 6 и 7 дней селезенки дезинтегрировали с получением суспензии одиночных клеток, подсчитывали суммарное количество клеток, и после маркирования CD8 Т-лимфоцитов антителами против CD3, против CD8 и против CD44 их анализировали с помощью многоцветной проточной цитометрии. Совместное введение плазмид pApo-hIL15 и pSushi повышало количество CD8 Т-лимфоцитов в селезенке в более высокой степени, чем при других вариантах введения (фиг.3A). То же самое происходило с количеством CD8 Т-лимфоцитов памяти, определяемых как CD3+, CD8+, CD44hi клетки (фиг.3C). Процент CD8 Т-клеток и CD8 клеток памяти относительно суммарных спленоцитов также был более высоким в группе мышей, которым вводили плазмиды pApo-hIL15 и pSushi по сравнению с другими группами (фиг.3B и 3D).
Процент CD8 Т-лимфоцитов анализировали также относительно лимфоцитов, присутствующих в печени мышей, обработанных различными плазмидами. Для осуществления этого плазмиды гидродинамически вводили и через 3, 4, 5, 6 и 7 дней печени дезинтегрировали, лимфоциты выделяли центрифугированием в растворе Percoll© и после маркирования CD8 Т-лимфоцитов антителами против CD3 и против CD8 их анализировали с помощью проточной цитометрии. У мышей, которым совместно вводили плазмиды pApo-hIL15 и pSushi, в печени представлен более высокий процент CD8 Т-лимфоцитов, чем у мышей остальных групп (фиг.4).
Затем процент CD8 Т-лимфоцитов анализировали относительно лимфоцитов, присутствующих в периферической крови мышей, обработанных различными плазмидами. Для осуществления этого плазмиды гидродинамически вводили и через 3, 4, 5 и 6 дней получали образцы крови, и CD8 Т-лимфоциты маркировали антителами против CD3, против CD8 и против CD62L. Их анализировали с помощью проточной цитометрии. У мышей, которым совместно вводили плазмиды pApo-hIL15 и pSushi, представлен более высокий процент CD8 Т-лимфоцитов в периферической крови, чем у мышей остальных групп на 5 и 6 дни после обработки (фиг.5A). Более высокий процент CD8 Т-лимфоцитов памяти (CD8+ CD44+) наблюдался также в этой группе (фиг.5B) и в субпопуляциях CD8 эффекторных Т-клеток памяти (CD8+ CD44+ CD62L-) и CD8 центральных клетках памяти (CD8+ CD44+ CD62L+) (фиг.5C и 5d).
Исследования количества и процента CD8 Т-лимфоцитов показывают, что введение pApo-hIL15 и pSushi индуцирует более многочисленные популяции CD8 Т-лимфоцитов в селезенке, печени и периферической крови, чем введение других плазмид. Конкретно, введение pApo-hIL15 и pSushi ведет к существенно более высокой популяции CD8 Т-лимфоцитов в селезенке, печени и крови, чем введение конструкций phIL15 и pSushi.
Пример 6. Противоопухолевое действие конструкций на основе ApoA1 и hIL15 в модели подкожной опухоли CT26
Для исследования противоопухолевого действия конструкций на основе ApoA1 и hIL15, вводимых гидродинамически, была выбрана модель подкожной опухоли Balb/c мышей, индуцированной клеточной линией CT26, происходящей от колоректальной аденокарциномы. 5×105 клеток на мышь вводили подкожно и обрабатывали через 3 дня различными конструкциями на основе ApoA1, hIL15 и Sushi. Размер опухолей измеряли, рассчитывая произведение 2 диаметров, два раза в неделю цифровым штангенциркулем. Мышей забивали, когда размер превышал 246 мм2.
Задержку опухолевого роста, которая не была статистически достоверной, наблюдали в группе мышей, обработанных pApo-hIL15 и pSushi (фиг.6A). 25% мышей, обработанных pApo-hIL15 и pSushi, выживали в течение 50 дней после инокуляции опухоли и не демонстрировали видимых признаков опухоли (фиг.6B). 14% мышей, обработанных плазмидой pApo, выживали, как и 11% мышей, обработанных pApo-hIL15. Ни одной мыши с опухолью не выжило из групп с другой обработкой. Эти данные показывают, что обработка pApo-hIL15 и pSushi оказывает определенное противоопухолевое действие в модели подкожной опухоли CT26.
Пример 7. Противоопухолевое действие конструкций на основе ApoA1 и hIL15 в модели подкожной опухоли MC38
Для продолжения исследования противоопухолевого действия конструкций на основе ApoA1 и hIL15 была выбрана другая модель подкожной опухоли. Мышам C57B16 вводили подкожно 5×105 клеток линии MC38 и через 6 дней обрабатывали различными конструкциями на основе ApoA1, hIL15 и Sushi мышей, имеющих опухолевые узлы. Размер опухолей измеряли, рассчитывая произведение 2 диаметров, два раза в неделю цифровым штангенциркулем и мышей забивали, когда размер превышал 246 мм2.
Задержку опухолевого роста, которая не была статистически достоверной, наблюдали в группе мышей, обработанных pApo-hIL15 и pSushi (фиг.7a). 37,6% мышей, обработанных pApo-hIL15 и pSushi, выживали в течение 64 дней от инокуляции опухоли и не демонстрировали видимых признаков опухоли (фиг.7b). 16,7% мышей, обработанных плазмидой pApo, выживали, как и 40% мышей, обработанных pApo-hIL15, и 17% мышей, обработанных phIL15, и 33% мышей, которые получали только физиологический раствор (S). Ни одной мыши из группы phIL15+pSushi не выжило.
Эти данные указывают на то, что обработка pApo-hIL15 и pSushi обладает определенным противоопухолевым действием в модели подкожной опухоли MC38.
Пример 8. Антиметастатическое действие конструкций на основе ApoA1 и hIL15 в модели внутриселезеночной опухоли MC38
Исследование противоопухолевого действия конструкций на основе ApoA1 и hIL15 было продолжено в модели внутриселезеночного введения опухолевых клеток, которые дают печеночные метастазы.
Мышам C57B16 вводили внутриселезеночно 5×105 клеток линии MC38 на мышь и обрабатывали на следующий день различными конструкциями на основе ApoA1, hIL15 и pSushi.
Через 19 дней мышей забивали и выявляли количество метастазов, присутствующих в печени. Мыши были разделены на 3 группы в соответствии с количеством метастазов: I - мыши, погибшие из-за массивных печеночных метастазов или генерализованного метастаза (невозможно выявить здоровую печеночную ткань при первом рассмотрении); II - мыши, презентирующие метастазы в части печеночной ткани; III - мыши без печеночных метастазов.
В группе мышей, обработанных pApo-hIL15 и pSushi, у 71% представлена печень без метастазов, против 30% мышей, обработанных pApo-hIL15, 25% мышей, обработанных phIL15+pSushi, 20% мышей, получавших физиологический раствор (S) и 0% мышей, групп phIL15 и pApo (фиг.8).
Из этих данных заключается, что введение pApo-hIL15 и pSushi вызывает более эффективные антиметастатические эффекты, чем другие конструкции, исследованные в модели внутриселезеночной опухоли MC38.
Пример 9. Действие введения конструкций на основе ApoA1 и hIL15 на мышей, «нокаутных» по α рецептору IL15
Исследование иммуностимулирующих эффектов конструкций на основе ApoA1 и hIL15 продолжено на мышах, лишенных α рецептора IL15. Эти мыши имеют характерный фенотип, так как у них отсутствуют NK клетки и содержится малое количество CD8 Т-клеток памяти (Lodolce et al. 1998; 9: 669-676).
Цель этого эксперимента состояла в выявлении того, может ли pApo-hIL15 и pSushi модифицировать этот фенотип. Четырем мышам вводили, одной - плазмиды pApo-hIL15 и pSushi, одной - phIL15 и pSushi, одной - pApo и наконец, одной - pApo-hIL15. Через пять дней мышей забивали, селезенку удаляли и исследовали популяции NK клеток и CD8 Т-лимфоцитов памяти в селезенке с помощью проточной цитометрии (фиг.9).
У мыши, получавшей плазмиды pApo-hIL15 и pSushi, представлено 1,02% процента NK клеток, намного выше, чем у мыши, получавшей pApo (0,39%). Что касается CD8 Т-лимфоцитов памяти мышей, получавших pApo-hIL15 и pSushi, то CD8+ CD44+ клетки составляли 1,47% относительно суммарных спленоцитов. Этот процент сходен с процентом, который достигается с одной конструкцией pApo-hIL15. Этот эксперимент показывает, что введение конструкций pApo-hIL15 и pSushi частично покрывает фенотип «нокаутных» мышей по α рецептору IL15, индуцируя проценты NK клеток и CD8 Т-клеток памяти в селезенке более высокие, чем проценты, получаемые с остальными исследованными конструкциями.
Пример 10. Действие введения тройной конструкции на основе гибрида Sushi, IL15 и ApoA1
Для исследования потенциального иммуностимулирующего действия плазмиды pmSushi-mIL15-mApo с тройной конструкцией, описанным в примере 1.8, был выполнен новый тест на пролиферацию CD8 лимфоцитов сходным образом, что и описанный в примере 5.
Для осуществления этого были созданы группы C57BL/6 мышей (2-3 животных на опытную группу), которым гидродинамически вводили тестируемую плазмиду (2,5 мкг/мышь). Через шесть дней селезенки дезинтегрировали с получением суспензии одиночных клеток, подсчитывали суммарное количество клеток, и после маркирования CD8 Т-лимфоцитов антителами против CD3, против CD8 и против CD44 и NK клеток антителами против CD3, против NK1.1 их анализировали с помощью многоцветной проточной цитометрии.
Плазмиды, тестируемые в различных экспериментальных группах, представляли собой:
- pmSushi-mIL15-mApo;
- pApo-hIL15 в сочетании с pSushi (pApo-hIL15+pSushi);
- pApo-hIL15;
- phIL15 в сочетании с pSushi (phIL15+pSushi);
- phIL15; и
- pApo.
В этом тесте заметно более высокая пролиферация количества клеток селезенки наблюдалась в группе животных, обработанных плазмидой pmSushi-mIL15-mApo, которая кодирует тройной слитый белок, по сравнению с остальными экспериментальными группами (фиг.10A). Сходно, обработка pmSushi-mIL15-mApo индуцировала весьма существенно более высокую пролиферацию количества CD8 Т-лимфоцитов (фиг.10B) и NK клеток (фиг.10C), чем наблюдаемая при других типах обработки.
Пример 11. Влияние конструкций, кодирующих IL15 мыши и IL15 человека, на стимуляцию пролиферации CD8 Т-клеток и NK клеток в селезенке мыши
Было проведено сравнительное исследование стимулирующей активности конструкций, кодирующих молекулы mIL15 и hIL15, в отношении количества спленоцитов путем гидродинамического введения соответствующих плазмид (10 мкг/мышь) совместно с плазмидой pSushi или без нее. Через четыре дня селезенки дезинтегрировали с получением суспензии одиночных клеток, подсчитывали суммарное количество клеток, и после маркирования CD8 Т-лимфоцитов антителами против CD3 и против CD8 и NK клеток антителами против NK1.1 и против CD3, их анализировали с помощью многоцветной проточной цитометрии.
Введение плазмиды pmIL15 и плазмиды phIL15 индуцировало сходное количество спленоцитов, а также сходные проценты CD8 Т-клеток и NK клеток (фиг.11). Таким же образом, когда плазмиды pmIL15 или phIL15 вводили совместно с pSushi, было обнаружено, что в селезенках мышей, которым вводили плазмиду, кодирующую белок человека, представлен более высокий процент CD8 Т-клеток и NK клеток, хотя эта тенденция была статистически недостоверной (тест Крускалла-Уоллиса).
Пример 12. Влияние гибрида mSushi с mIL15 и Apo на процент NK клеток в селезенке и печени.
Плазмида pmSushi-mIL15-mApo, кодирующая тройной слитый белок, повышает количество NK клеток в селезенке и в печени в более высокой степени, чем плазмида pmSushi-mIL15 при совместном введении с плазмидой pApo.
Были созданы группы мышей C57BL/6, которым гидродинамически вводили тестируемые плазмиды:
- pmSushi-mIL15-mApo в дозе 1 мкг/мышь;
- pmSushi-mIL15-mApo в дозе 2,5 мкг/мышь;
- pmSushi-mIL15-mApo в дозе 5 мкг/мышь;
- pmSushi-mIL15 в сочетании с pApo в дозе 1 мкг/мышь;
- pmSushi-mIL15 в сочетании с pApo в дозе 2,5 мкг/мышь; и
- pmSushi-mIL15 в сочетании с pApo в дозе 5 мкг/мышь.
Через четыре дня селезенки дезинтегрировали с получением суспензии одиночных клеток, и печеночные лимфоидные клетки выделяли центрифугированием в Percoll©. NK клетки метили антителами против NK1.1 и против CD3 и анализировали с помощью многоцветной проточной цитометрии. Введение pmSushi-mIL15-mApo индуцировало присутствие более высокого процента NK клеток в селезенке и в печени, чем совместное введение pmSushi-mIL15 и pApo (pSushi-mIL15+pApo) (фиг.12).
Пример 13. Противоопухолевое действие тройной конструкции на основе гибрида Sushi, IL15 и ApoA1 в модели подкожной опухоли MC38
Для продолжения исследования противоопухолевого действия плазмиды pmSushi-mIL15-mApo с тройной конструкцией, описанным в примере 1.8, была выбрана модель подкожной опухоли. Мышам C57B16 вводили подкожно 5×105 клеток линии MC38 и обрабатывали через 8 и 19 дней различными конструкциями. Тестируемые плазмиды в различных экспериментальных группах представляли собой:
- pApo;
- pmSushi-mIL15-mApo;
- pApo-hIL15 в сочетании с pSushi (pApo-hIL15+pSushi).
Для осуществления этого были выявлены группы мышей C57BL/6, имеющих опухолевые узлы; 5 мышей получали pApo; 8 мышей получали pmSushi-mIL15-mApo и 9 мышей получали pApo-hIL15+pSushi путем гидродинамического введения тестируемых плазмид pApo (1 мкг/мышь), pmSushi-mIL15-mApo (1 мкг/мышь) и pApo-hIL15+pSushi (10 мкг/мышь, каждой мыши). Размер опухолей измеряли, рассчитывая произведение 2 диаметров, два раза в неделю цифровым штангенциркулем, и мышей забивали, когда размер превышал 246 мм2.
Задержку опухолевого роста, которая не была статистически достоверной, наблюдали в группе мышей, обработанных pmSushi-mIL15-mApo, которая кодирует тройной слитый белок (фиг.13). 33,3% мышей, обработанных pmSushi-mIL15-mApo, не демонстрировало видимой опухоли к концу исследования (через 29 дней после инокуляции) и только у 33,3% мышей выявлялись опухоли с поверхностью >40 мм2. 20% мышей, обработанных плазмидой pApo, демонстрировали видимую опухоль в день забоя (29 день) и у 80% мышей выявлялась опухоль с поверхностью >40 мм2, тогда как ни у одной мыши, обработанной pApo-hIL15+pSushi, не наблюдалось отсутствия опухолей к концу исследования (29 день) и 80% мышей имели опухоль с поверхностью >40 мм2, несмотря на то, что они получали отдельные плазмиды в дозе в 10 раз более высокой, чем доза тройного гибрида.
Эти данные указывают на то, что обработка pmSushi-mIL15-mApo обладает определенными противоопухолевыми эффектами в модели подкожной опухоли MC38.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОНЪЮГАТЫ ДЛЯ ВВЕДЕНИЯ БИОЛОГИЧЕСКИ АКТИВНЫХ СОЕДИНЕНИЙ | 2009 |
|
RU2567667C2 |
| ИММУНОЦИТОКИНЫ НА ОСНОВЕ IL-15 И IL-R[альфа] ДОМЕНА SUSHI | 2012 |
|
RU2644671C2 |
| ГЕТЕРОДИМЕРНЫЙ БЕЛОК IL-15 И ЕГО ПРИМЕНЕНИЯ | 2014 |
|
RU2689717C2 |
| АГЕНТЫ И СПОСОБЫ, ОСНОВАННЫЕ НА ПРИМЕНЕНИИ ДОМЕНА EDA ФИБРОНЕКТИНА | 2006 |
|
RU2430738C2 |
| ПРОФИЛАКТИЧЕСКАЯ ПРОТИВОРАКОВАЯ ВАКЦИНА | 2004 |
|
RU2556128C2 |
| ПРОФИЛАКТИЧЕСКАЯ ПРОТИВОРАКОВАЯ ВАКЦИНА | 2004 |
|
RU2385163C2 |
| БЕЛКОВЫЙ КОМПЛЕКС ИНТЕРЛЕЙКИНА 15 И ЕГО ПРИМЕНЕНИЕ | 2015 |
|
RU2711979C2 |
| БИОЛОГИЧЕСКИ АКТИВИРУЕМЫЕ ЛЕКАРСТВЕННЫЕ СРЕДСТВА НА ОСНОВЕ ЦИТОКИНОВ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2819307C2 |
| СЛИТЫЙ БЕЛОК ТЕЛОМЕРАЗНОЙ ОБРАТНОЙ ТРАНСКРИПТАЗЫ, КОДИРУЮЩИЕ ЕГО НУКЛЕОТИДЫ И ИХ ПРИМЕНЕНИЕ | 2007 |
|
RU2473691C2 |
| РЕКОМБИНАНТНЫЙ БЕЛОК, НЕСУЩИЙ ЭПИТОПЫ ВИРУСА ПАПИЛЛОМЫ ЧЕЛОВЕКА, ВСТРОЕННЫЕ В БЕЛОК АДЕНИЛАТЦИКЛАЗУ ИЛИ ЕГО ФРАГМЕНТ, ЕГО ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2005 |
|
RU2441022C2 |



























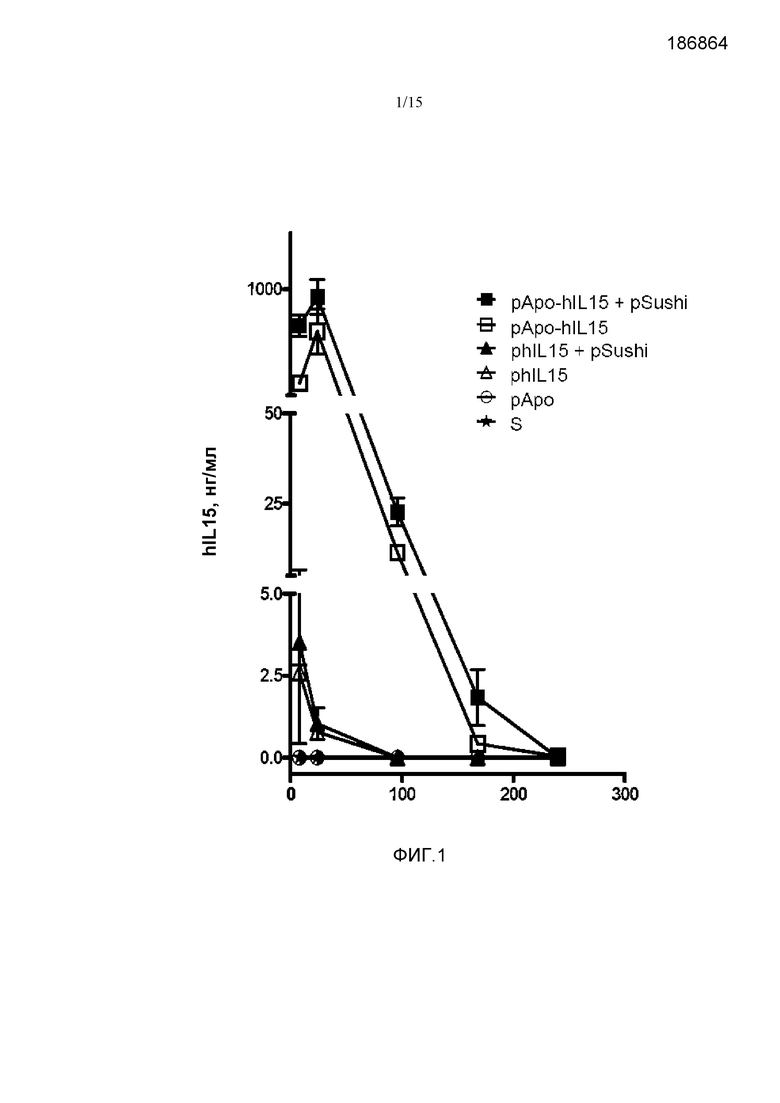
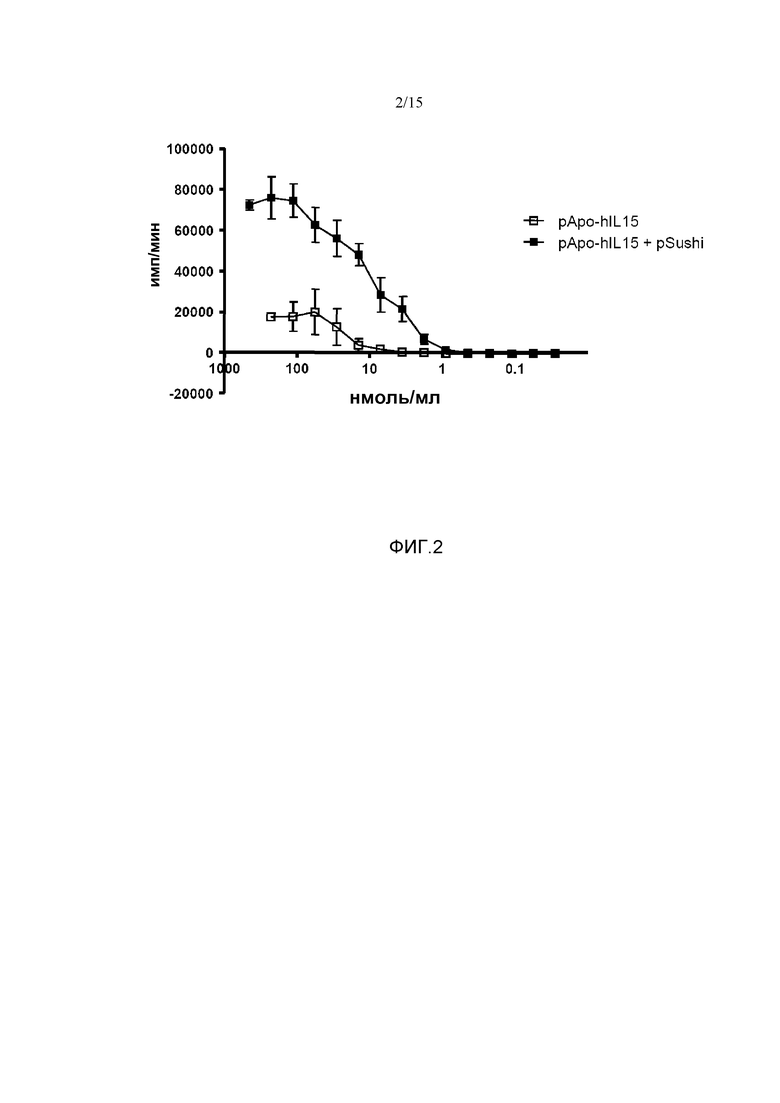

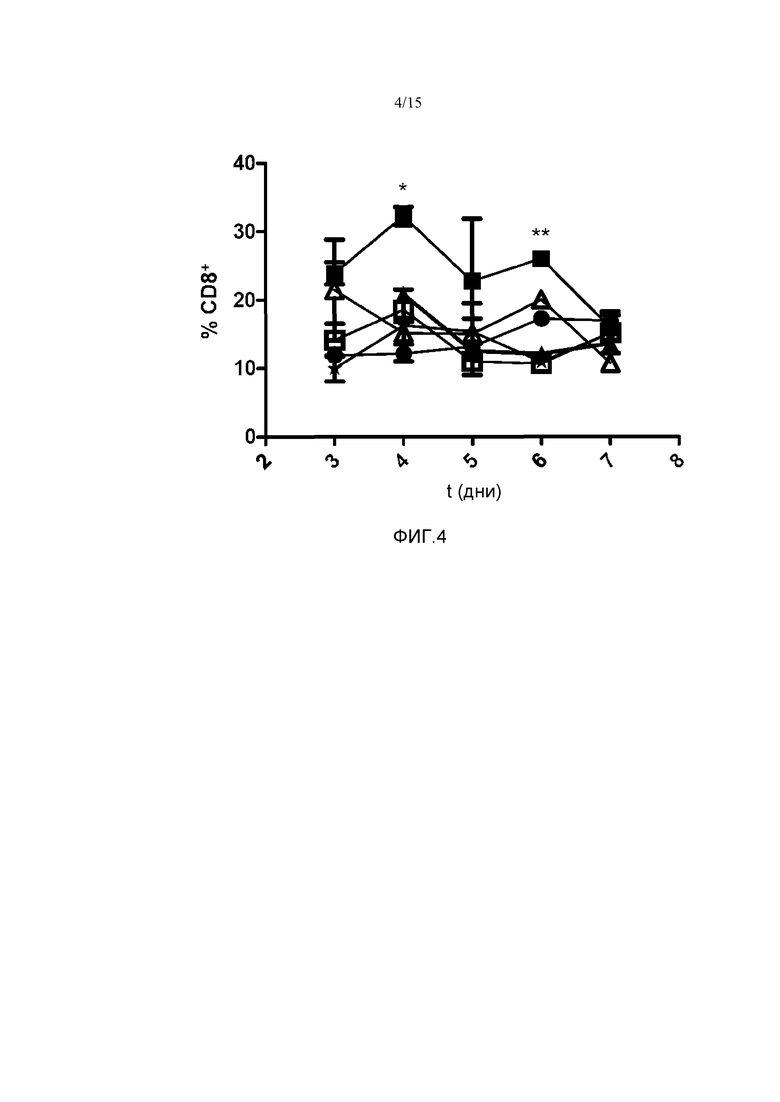
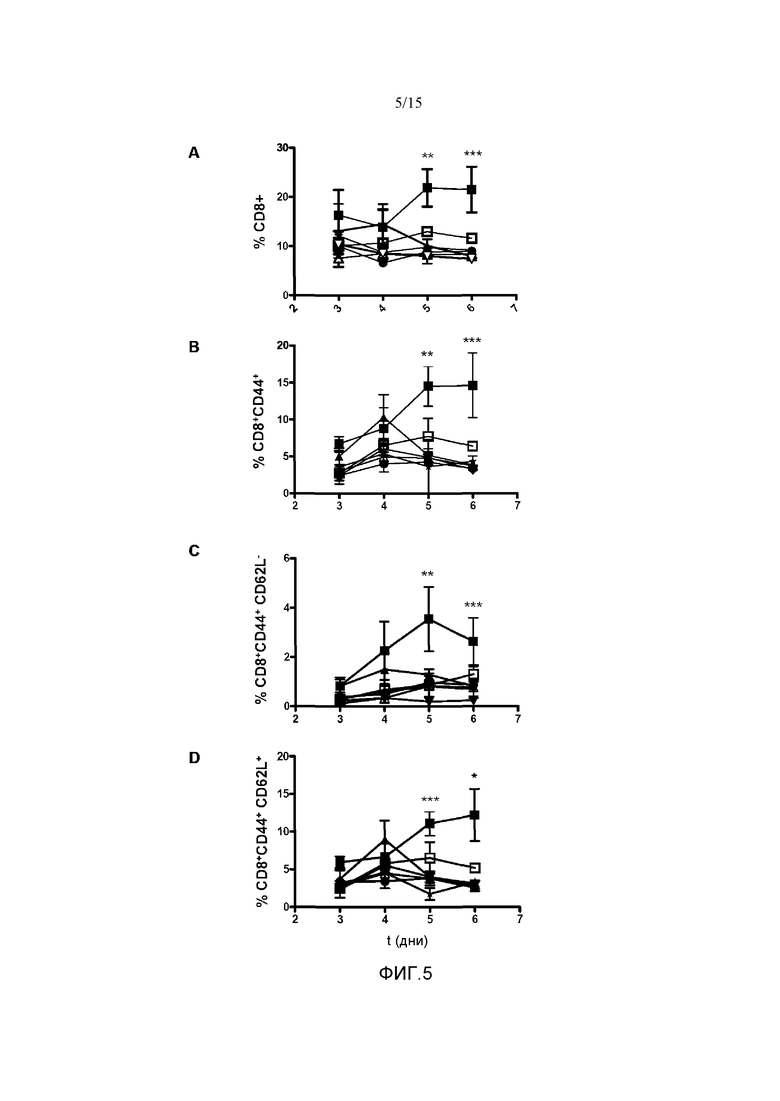
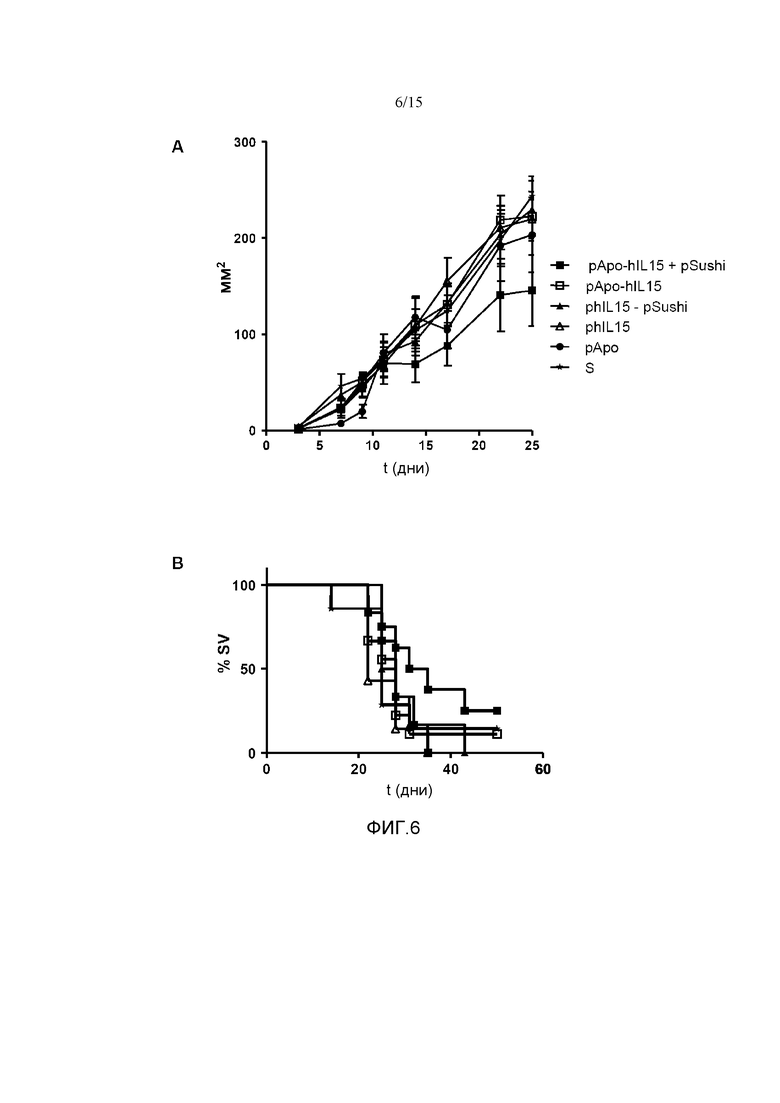
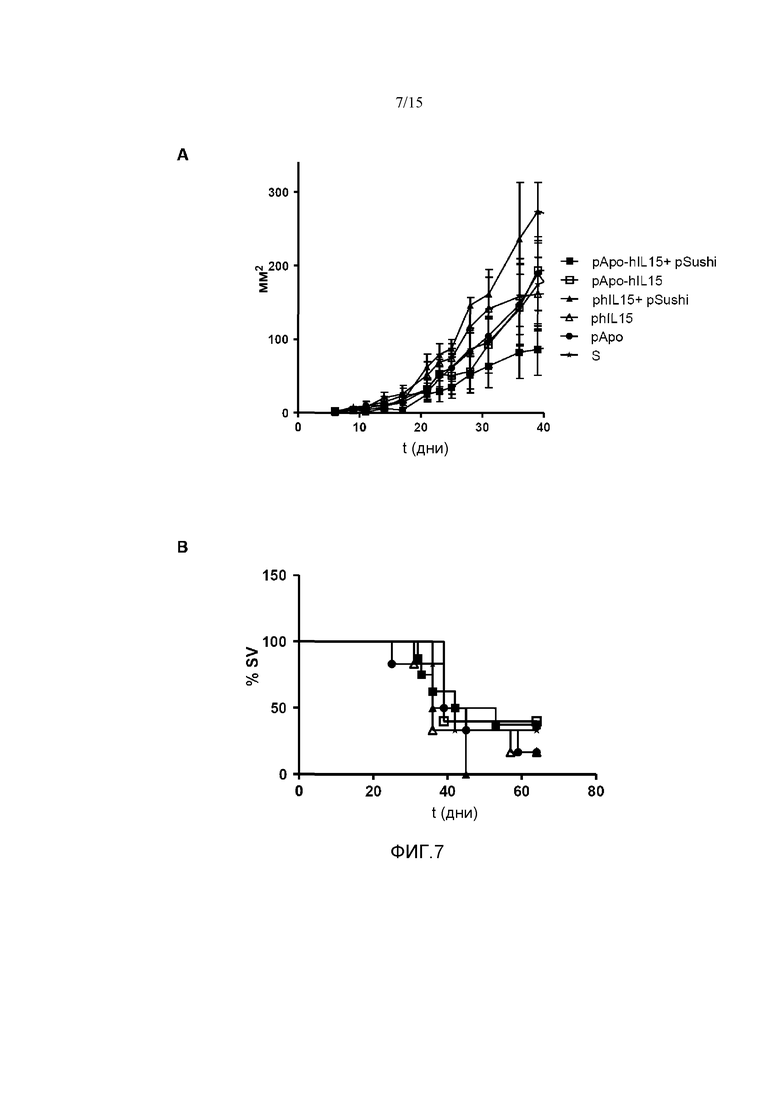
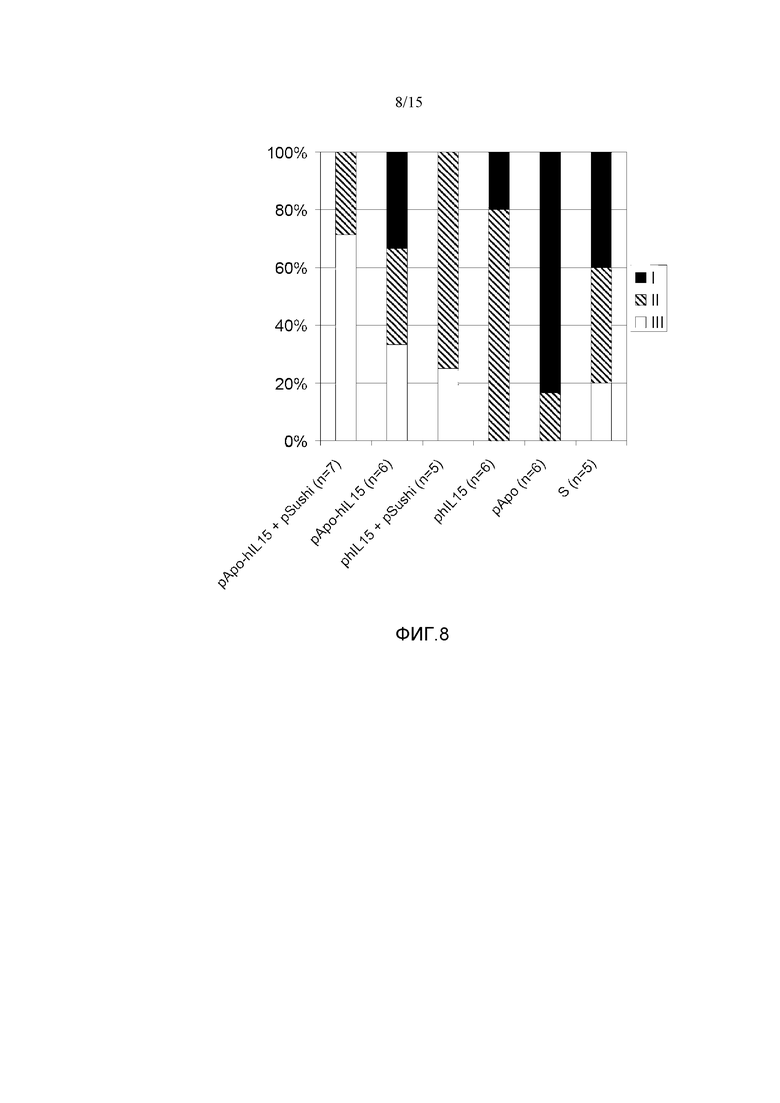
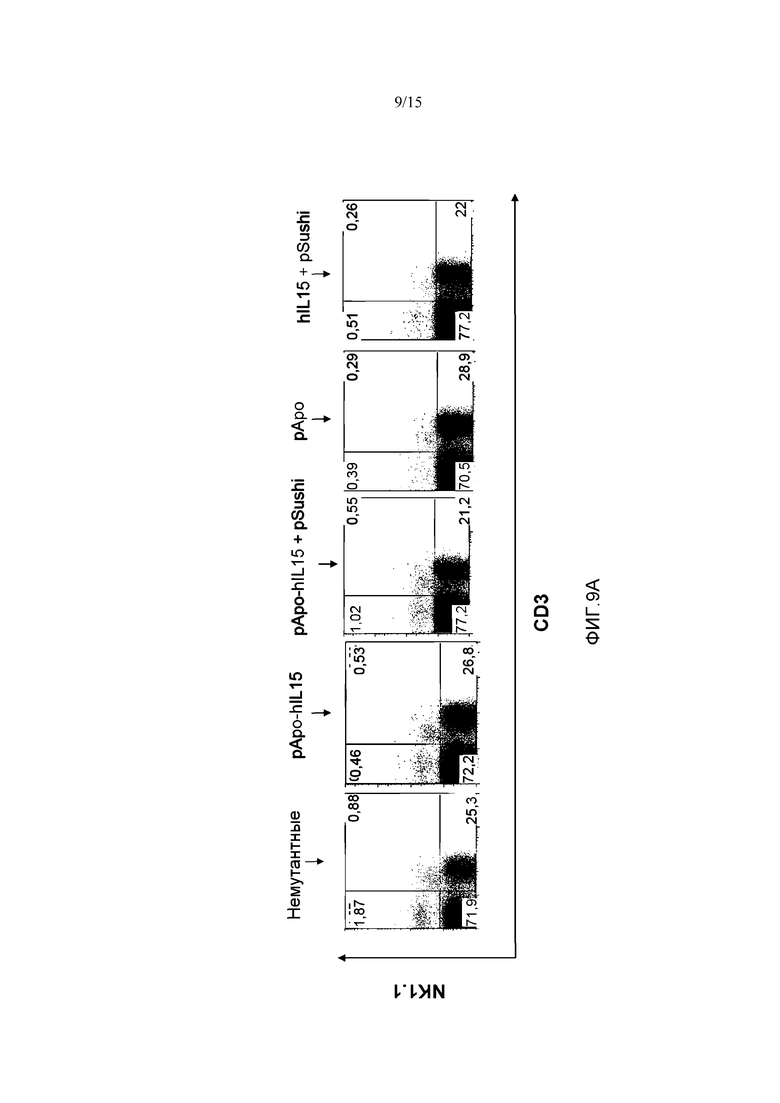
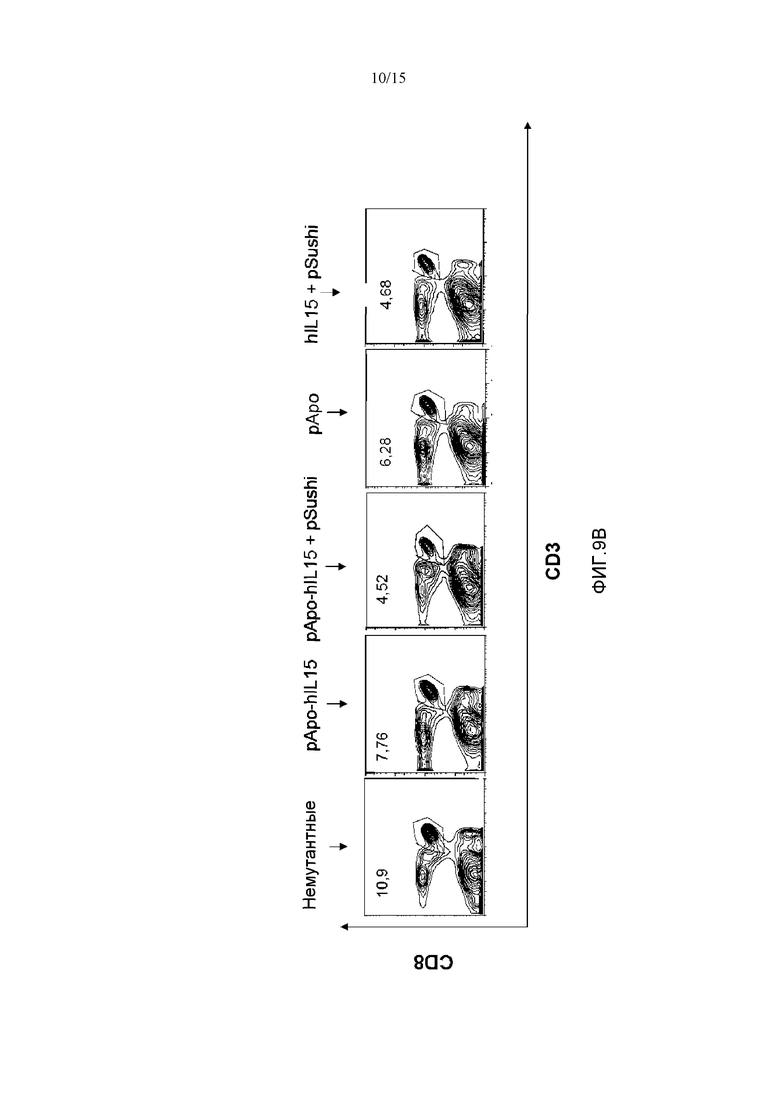
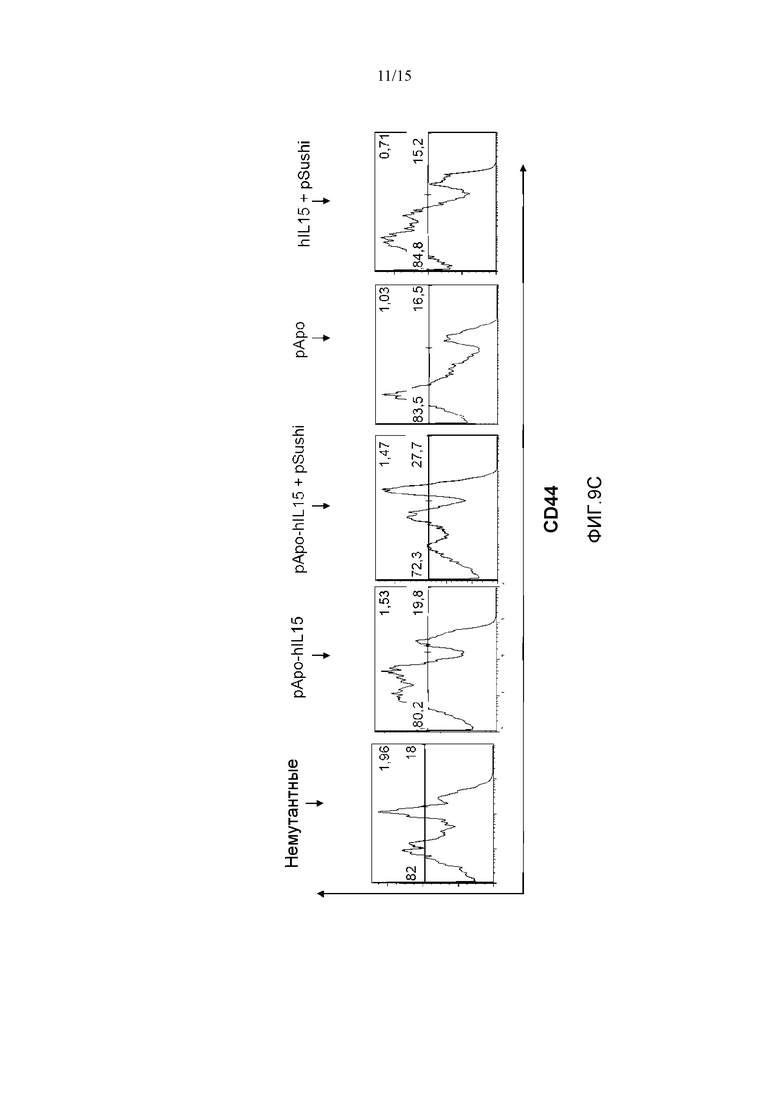
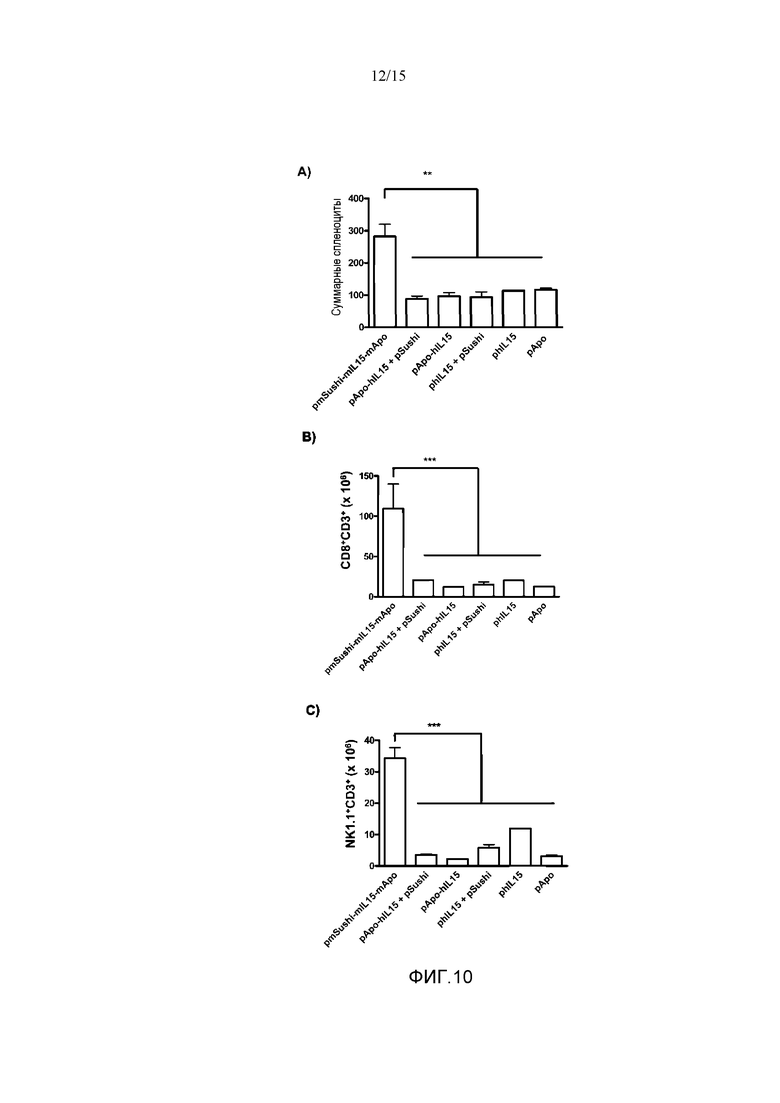
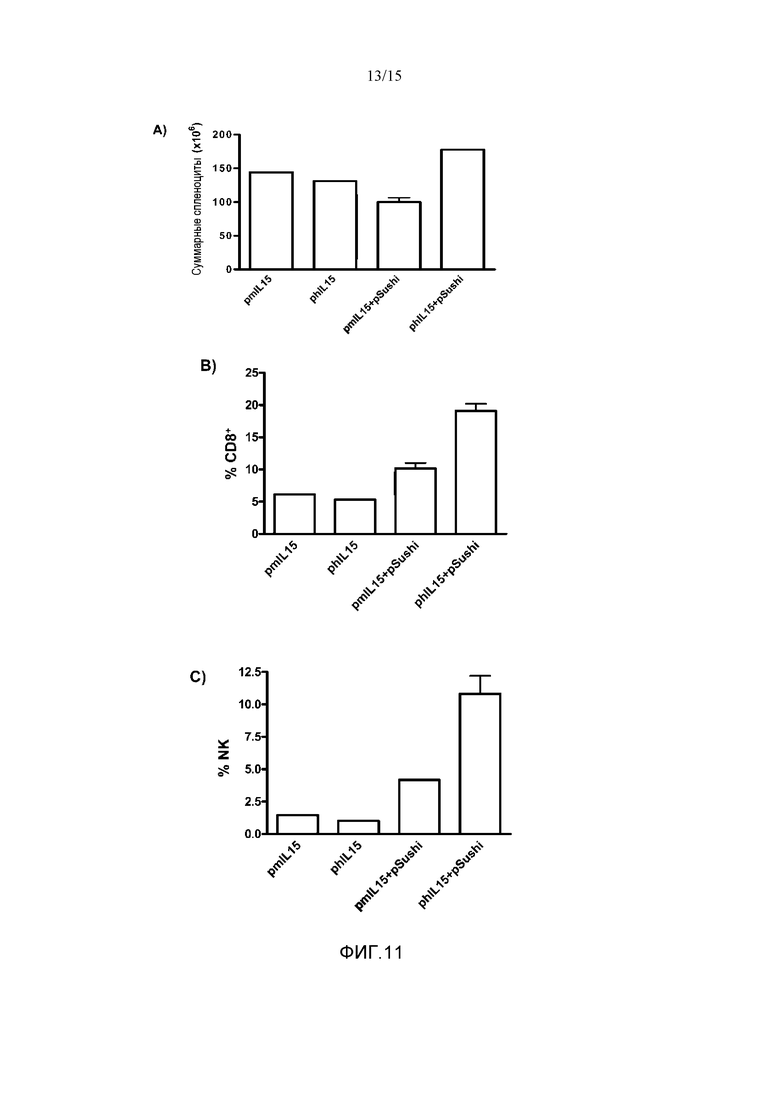
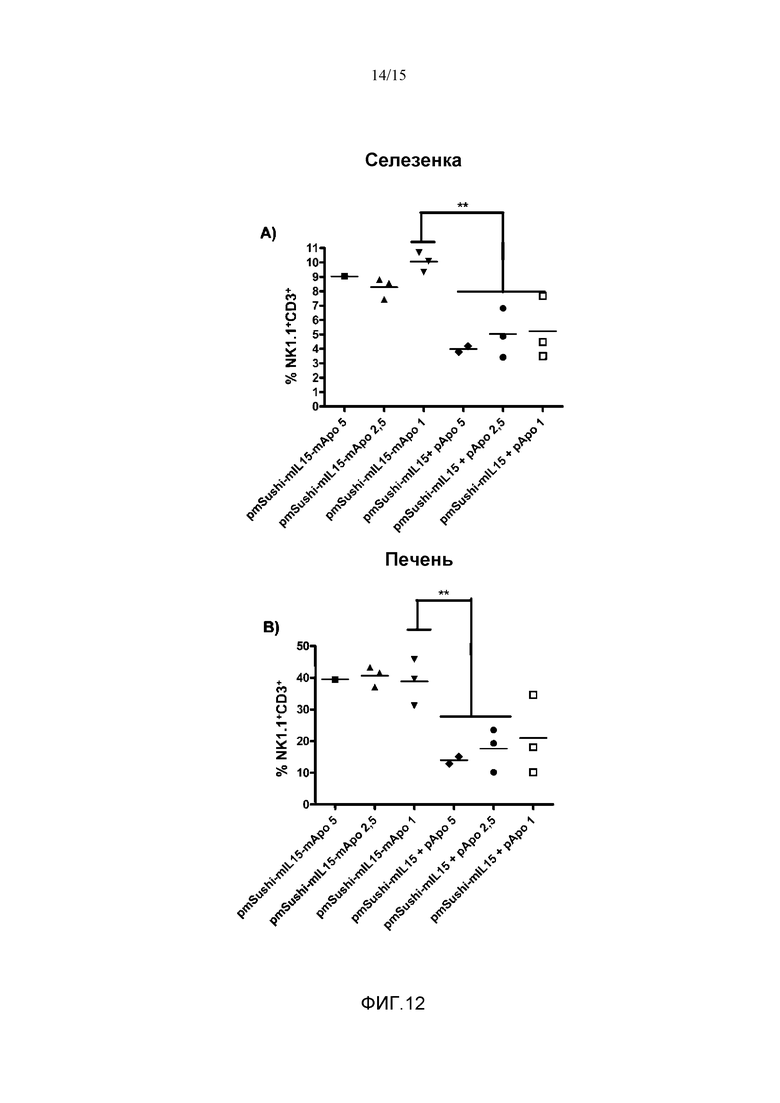
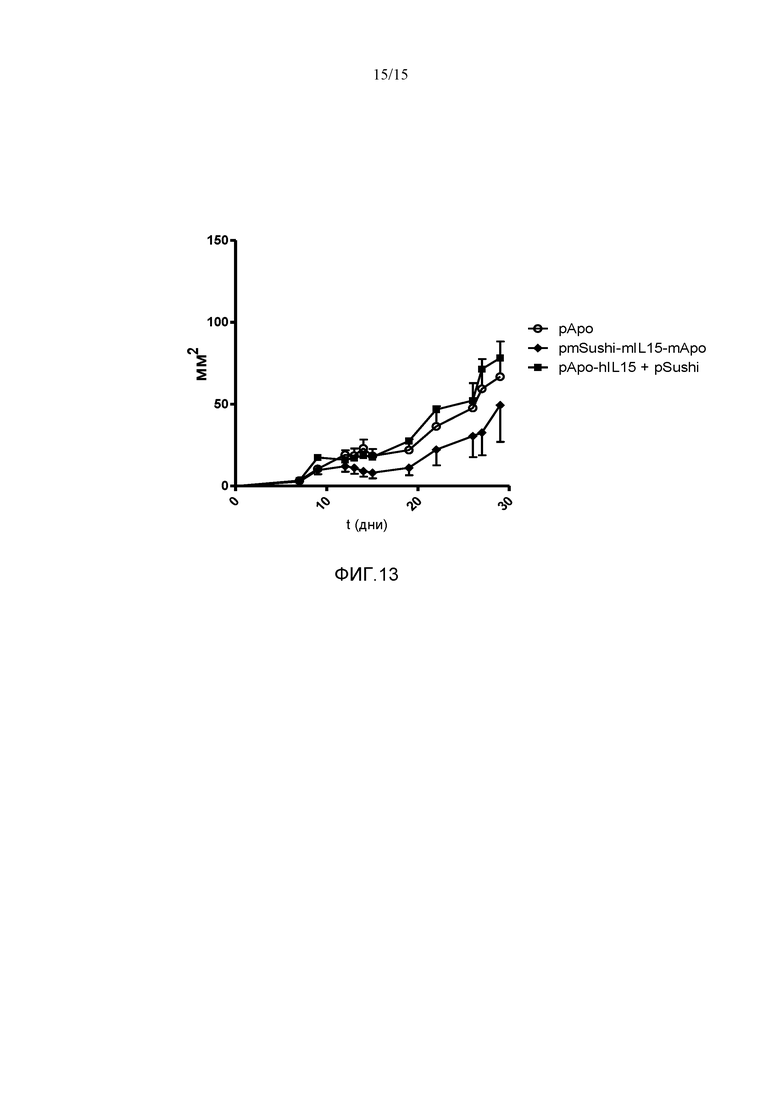
Изобретение относится к области биотехнологии, конкретно к иммунологии, и может быть использовано в медицине. Композицию, основанную на совместном применении ApoA, интерлейкина 15 и домена Sushi альфа цепи рецептора IL15, используют для стимулирования противоопухолевого иммунного ответа у субъекта. Использование ApoA1 совместно с IL15 и доменом sushi IL15ra обеспечивает синергетический эффект в отношении стимуляции противоопухолевого иммунного ответа у млекопитающего за счет усиления экспансии противоопухолевых CTL. 10 н. и 8 з.п. ф-лы, 13 ил., 13 пр.
1. Композиция для стимулирования противоопухолевого иммунного ответа у субъекта, содержащая
a. в качестве первого компонента полипептид, включающий полипептид Аро А или его функционально эквивалентный вариант, обладающий по меньшей мере 80% идентичностью с указанным полипептидом Аро А;
b. в качестве второго компонента IL15 или его функционально эквивалентный вариант, обладающий по меньшей мере 80% идентичностью с IL15; и
c. в качестве третьего компонента домен Sushi альфа цепи рецептора IL15 или его функционально эквивалентный вариант, обладающий по меньшей мере 80% идентичностью с доменом Sushi альфа цепи рецептора IL15;
или
(i) в качестве первого компонента полинуклеотид, кодирующий полипептид Аро А или его функционально эквивалентный вариант, обладающий по меньшей мере 80% идентичностью с указанным полипептидом Аро А;
(ii) в качестве второго компонента полинуклеотид, кодирующий IL15 или его функционально эквивалентный вариант, обладающий по меньшей мере 80% идентичностью с IL15; и
(iii) в качестве третьего компонента полинуклеотид, кодирующий домен Sushi альфа цепи рецептора IL15 или его функционально эквивалентный вариант, обладающий по меньшей мере 80% идентичностью с доменом Sushi альфа цепи рецептора IL15.
2. Композиция по п. 1, где первый и второй компоненты образуют часть единой молекулы и где
a. если первый и второй компоненты представляют собой полипептиды, указанная единая молекула представляет собой слитый белок, включающий полипептид Аро А или его функционально эквивалентный вариант, обладающий по меньшей мере 80% идентичностью с указанным полипептидом Аро А, и IL15 или его функционально эквивалентный вариант, обладающий по меньшей мере 80% идентичностью с IL15, и
b. если первый и второй компоненты представляют собой полинуклеотиды, указанная единая молекула представляет собой полинуклеотид, кодирующий слитый белок, включающий полипептид, включающий полипептид Аро А или его функционально эквивалентный вариант, обладающий по меньшей мере 80% идентичностью с указанным полипептидом Аро А, и IL15 или его функционально эквивалентный вариант, обладающий по меньшей мере 80% идентичностью с IL15.
3. Композиция по п. 2, где расположение первого и второго компонентов указанной единой молекулы выбрано из группы, состоящей из
a. первого компонента, локализованного на N-конце или в 5′-положении относительно второго компонента, и
b. первого компонента, локализованного на С-конце или в 3′-положении относительно второго компонента.
4. Композиция по любому из пп. 1-3, где
а. Аро А или его функционально эквивалентный вариант, обладающий по меньшей мере 80% идентичностью с Аро А, происходит от человека или от мышей;
b. IL15 или его функционально эквивалентный вариант, обладающий по меньшей мере 80% идентичностью с IL15, происходит от человека или от мышей, и/или
c. полипептид, включающий домен Sushi альфа цепи рецептора IL15 или его функционально эквивалентный вариант, обладающий по меньшей мере 80% идентичностью с доменом Sushi альфа цепи рецептора IL15, происходит от человека или от мышей.
5. Набор частей для стимулирования противоопухолевого иммунного ответа у субъекта, содержащий: а. в качестве первого компонента полипептид, включающий полипептид Аро А или его функционально эквивалентный вариант, обладающий по меньшей мере 80% идентичностью с указанным полипептидом Аро А;
b. в качестве второго компонента IL15 или его функционально эквивалентный вариант, обладающий по меньшей мере 80% идентичностью с IL15; и
c. в качестве третьего компонента домен Sushi альфа цепи рецептора IL15 или его функционально эквивалентный вариант, обладающий по меньшей мере 80% идентичностью с доменом Sushi альфа цепи рецептора IL15;
или
(i) в качестве первого компонента полинуклеотид, кодирующий полипептид Аро А или его функционально эквивалентный вариант, обладающий по меньшей мере 80% идентичностью с указанным полипептидом Аро А;
(ii) в качестве второго компонента полинуклеотид, кодирующий IL15 или его функционально эквивалентный вариант, обладающий по меньшей мере 80% идентичностью с IL15; и
(iii) в качестве третьего компонента полинуклеотид, кодирующий домен Sushi альфа цепи рецептора IL15 или его функционально эквивалентный вариант, обладающий по меньшей мере 80% идентичностью с доменом Sushi альфа цепи рецептора IL15.
6. Слитый белок для стимулирования противоопухолевого иммунного ответа у субъекта, включающий
(i) область А, образованную полипептидом Аро А или его функционально эквивалентным вариантом, идентичным по меньшей мере на 80% указанному полипептиду Аро А,
(ii) область В, образованную IL15 или его функционально эквивалентным вариантом, идентичным по меньшей мере на 80% IL15, и
(iii) область С, образованную доменом Sushi альфа цепи рецептора IL15 или его функционально эквивалентным вариантом, идентичным по меньшей мере на 80% домену Sushi альфа цепи рецептора IL15,
где области А, В и С непосредственно соединены или где по меньшей мере одна из связей между областями А, В и С осуществляется посредством пептидного линкера.
7. Слитый белок по п. 6, где расположение областей А, В и С в направлении от N- к С-концу в указанном слитом белке выбрано из группы, состоящей из А-В-С, А-С-В, В-А-С, В-С-А, С-А-В и С-В-А.
8. Слитый белок по п. 6 или 7, где по меньшей мере одна из связей между областями А, В и С устанавливается через пептидный линкер.
9. Слитый белок по п. 6 или 7, где
а. Аро А или его функционально эквивалентный вариант, обладающий по меньшей мере 80% идентичностью с Аро А, происходит от человека или от мышей,
b. IL15 или его функционально эквивалентный вариант, обладающий по меньшей мере 80% идентичностью с IL15, происходит от человека или от мышей, и/или
c. полипептид, включающий домен Sushi альфа цепи рецептора IL15 или его функционально эквивалентный вариант, обладающий по меньшей мере 80% идентичностью с доменом Sushi альфа цепи рецептора IL15, происходит от человека или от мышей.
10. Полинуклеотид для стимулирования противоопухолевого иммунного ответа у субъекта, кодирующий слитый белок по п. 6 или 7.
11. Вектор для экспрессии слитого белка по п. 6 или 7, включающий полинуклеотид по п. 10.
12. Генная конструкция для экспрессии слитого белка по п. 6 или 7, включающая полинуклеотид по п. 10.
13. Клетка-хозяин для экспрессии слитого белка по п. 6 или 7, включающая вектор по п. 11 или генную конструкцию по п. 12.
14. Фармацевтическая композиция для стимулирования противоопухолевого иммунного ответа у субъекта, включающая терапевтически эффективное количество композиции по любому из пп. 1-4, слитого белка по п. 6 или 7, полинуклеотида по п. 10, вектора по п. 11, или генной конструкции по п. 12, или клетки-хозяина по п. 13 и фармацевтически приемлемый носитель.
15. Способ in vitro стимуляции экспансии противоопухолевых антигенспецифических Т-лимфоцитов, включающий контактирование популяции лимфоцитов, предварительно экспонированных in vivo с указанным антигеном, с композицией по любому из пп. 1-4, слитым белком по п. 6 или 7, полинуклеотидом по п. 10, вектором по п. 11, или генной конструкцией по п. 12, или клеткой-хозяином по п. 13.
16. Способ in vitro по п. 14, где лимфоциты предварительно подвергаются активации in vitro путем контактирования лимфоцитов с антигеном, с которым были экспонированы указанные выше Т-лимфоциты.
17. Применение композиции по любому из пп. 1-4, набора частей по п. 5, слитого белка по п. 6 или 7, полинуклеотида по п. 10, вектора по п. 11, или генной конструкции по п. 12, или клетки-хозяина по п. 13 для производства лекарственного средства для лечения неопластического заболевания, требующего стимуляции противоопухолевого иммунного ответа у субъекта.
18. Применение по п. 17, где неопластическое заболевание выбрано из группы опухоли и метастаза.
| DUBOIS SIGRID ET AL., Preassociation of IL-15 with IL-15R alpha-IgG1-Fc enhances its activity on proliferation of NK and CD8(+)/CD44(high) T cells and its antitumor action, JOURNAL OF IMMUNOLOGY, 2008, v | |||
| Переносный кухонный очаг | 1919 |
|
SU180A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Поршневой насос | 1925 |
|
SU2099A1 |
| US 2002156007 A1, 24.10.2002 | |||
| Торфодобывающая машина с вращающимся измельчающим орудием | 1922 |
|
SU87A1 |
| AU2008201887 A1, 22.05.2008 | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
Авторы
Даты
2016-09-20—Публикация
2010-12-10—Подача