Область техники, к которой относится изобретение
Настоящее изобретение относится к композиции для применения при стимуляции ангиогенеза в кишечнике, всасывания питательных веществ и переносимости энтерального питания и/или при профилактике и/или лечении воспалительных поражений кишечника, например некротизирующего энтероколита, и/или при выздоровлении после повреждения кишечника и хирургического вмешательства. Эта композиция предназначена для применения у млекопитающих, предпочтительно у людей, более предпочтительно - у детей.
Уровень техники
В неонатальный период, особенно у недоношенных детей, происходит ускоренное образование кровеносных сосудов в слизистой оболочке кишечника. Неоваскуляризация и восстановление поврежденных сосудов также имеют большое значение при заживлении после повреждений кишечника и/или хирургического вмешательства. Неоваскуляризация и восстановительные процессы в сосудах происходят в ходе ангиогенеза.
У детей, особенно недоношенных или родившихся с низкой массой тела, возможно недоразвитие кишечной сосудистой системы и вследствие этого пониженное кровоснабжение слизистой оболочки кишечника (Reber KM, Nankervis СА, Nowicki РТ. Newborn intestinal circulation. Physiology and pathophysiology. Clin Perinatol 2002; 29(1): 23-39).
Из-за недостаточного кровотока возможна задержка развития кишечника, нарушение всасывания питательных веществ и переносимости энтерального питания, нарушение моторики кишечника; считается, что неадекватное кровоснабжение является причинным фактором в патогенезе некротизирующего энтероколита (Nankervis СА, Giannone PJ, Reber KM. The neonatal intestinal vasculature: contributing factors to necrotizing enterocolitis. Semin Perinatol 2008; 32(2): 83-91).
Некротизирующий энтероколит поражает в основном недоношенных новорожденных детей. Он является наиболее частой причиной неотложных состояний, подлежащих хирургическому вмешательству. Около 12% недоношенных новорожденных детей с массой тела менее 1500 г становятся жертвой некротизирующего энтероколита. Смертность составляет от 20% до 50%; клинические проявления включают стриктуры, спайки и синдром короткого кишечника.
Какого-то одного причинного фактора некротизирующего энтероколита не установлено. В настоящее время считается, что это заболевание является результатом сочетания ряда факторов. Незрелый кишечник в ответ на питание реагирует аномально и развивается острая воспалительная реакция, ведущая к некрозу кишечника. С некротизирующим колитом также связаны некоторые патологические проявления в постнатальный период, включая аномалии сердца, обтурацию кровеносных сосудов кишечника, инфекцию или гастрошизис.
У недоношенных детей некротизирующий энтероколит обычно развивается в первые 7-10 суток после начала питания. У доношенных детей некротизирующий энтероколит бывает в первые 1-4 суток после рождения, если питание началось в первый день. Чем больше гестационный возраст, тем меньше риск этого заболевания. В неонатальный период незрелая сосудистая система очень чувствительна к воздействиям из окружающей среды, которые могут приводить к катастрофическим изменениям кровотока. Предполагается, что первым этапом патогенеза некротизирующего энтероколита может быть повреждения слизистой оболочки кишечника, обусловленное сужением сосудов вследствие ишемии и нарушения реперфузии стенки кишечника. Согласно одной из теорий, связывающих повреждение слизистой оболочки кишечника с питанием, при появлении в пищеварительном тракте источника питательных веществ имеет место чрезмерное размножение бактерий, что приводит к их проникновению через ранее поврежденную слизистую оболочку (Nankervis СА, Giannone PJ, Reber KM. The neonatal intestinal vasculature: contributing factors to necrotizing enterocolitis. Semin Perinatol 2008; 32(2): 83-91).
Предотвратить некротизирующий энтероколит трудно. У недоношенных детей, получающих грудное молоко или молозиво, он встречается реже, чем при вскармливании искусственными смесями (Schanler RJ, Lau С, Hurst NM, Smith EO 2005 Randomized trial of donor human milk versus preterm formula as substitutes for mothers' own milk in the feeding of extremely premature infants. Pediatrics 116: 400-406). Однако грудным молоком - материнским или даже донорским - можно обеспечить ребенка далеко не всегда.
Лечение некротизирующего энтероколита состоит в прекращении кормления, назогастральном дренаже, введении антибиотиков в течение 7-14 суток и внутривенном питании. Необходимо также следить за гидратационным статусом, уровнем электролитов, свертываемостью крови и потребностью в кислороде. В 60-80% случаев некротизирующего колита у грудных детей лечение успешно и симптомы исчезают без хирургического вмешательства. После операции кормление начинают через некоторое время и крайне постепенно. Однако отсутствие энтерального питания приводит к остановке роста и ухудшению жизнеспособности ребенка; в результате возрастают преждевременная заболеваемость и смертность, развиваются пожизненные нарушения, например нарушения умственного развития.
В 20-40% случаев некротизирующего энтероколита приходится прибегать к хирургическому вмешательству, когда предпринятое лечение не помогло или произошла перфорация (разрыв) кишечника. Целью операции является удаление только некротизированной (совершенно омертвевшей) части кишки, так чтобы оставить пограничные участки в надежде на то, что они сохранят жизнеспособность. Однако хирургическое лечение приводит к синдрому короткого кишечника, из-за которого возможны перманентное расстройство пищеварения, непереносимость пищевых продуктов и ухудшение качества жизни.
Данное изобретение относится к композиции для применения при стимуляции ангиогенеза в кишечнике, всасывания питательных веществ, переносимости энтерального питания; и/или при профилактике и/или лечении воспалительных поражений кишечника, например некротизирующего энтероколита; и/или при выздоровлении после повреждения и/или хирургического вмешательства в области кишечника, в частности у грудных и маленьких детей, предпочтительно грудных, родившихся недоношенными или с низкой массой тела (LBW), или с задержкой внутриутробного роста (IUGR), или с недостаточностью внутриутробного питания, и/или с повреждением кишечника, и/или после хирургического вмешательства.
В более общем смысле существует нужда в подобном вмешательстве в питание детенышей млекопитающих, в частности грудных и прочих детей, предпочтительно грудных детей, но также и молодняка домашних питомцев.
Существует нужда в таком вмешательстве, которое бы обеспечивало поддержание или улучшение ангиогенеза в кишечнике у человека и животных, в частности у детенышей млекопитающих.
Сущность изобретения
Авторы данного изобретения обнаружили удивительный факт: введение смеси определенных олигосахаридов в сочетании с по меньшей мере одной длинноцепочечной полиненасыщенной жирной кислотой (LC-PUFA) и по меньшей мере одним пробиотиком необычайно эффективно в отношении стимуляции ангиогенеза в кишечнике, всасывания питательных веществ, переносимости энтерального питания; и/или при профилактике и/или лечении воспалительных поражений кишечника, такого как некротизирующего энтероколита; и/или при выздоровлении после повреждения и/или хирургического вмешательства в области кишечника.
Соответственно, настоящим изобретением предлагается композиция, содержащая по меньшей мере одну длинноцепочечную полиненасыщенную жирную кислоту, по меньшей мере один пробиотик и смесь олигосахаридов, причем указанная смесь включает по меньшей мере один N-ацетилированный олигосахарид, по меньшей мере один сиалированный олигосахарид и по меньшей мере один нейтральный олигосахарид, для применения при стимуляции всасывания питательных веществ и ангиогенеза в кишечнике, переносимости энтерального питания; и/или при профилактике и/или лечении воспалительных поражений кишечника, такого как некротизирующего энтероколита; и/или при выздоровлении после повреждения и/или хирургического вмешательства в области кишечника.
Композиция согласно изобретению является предпочтительно питательной композицией. Длинноцепочечную полиненасыщенную жирную кислоту выбирают предпочтительно из арахидоновой кислоты (ARA) и докозагексаеновой кислоты (DHA), более предпочтительно LC-PUFA является смесью арахидоновой и гексаеновой кислот.
Пробиотик предпочтительно выбирают из пробиотических бактериальных штаммов, более предпочтительно пробиотиком служат лактобациллы или бифидобактерии. В одном из предпочтительных воплощений данного изобретения пробиотиком являются Lactobacillus rhamnosus, Bifidobacterium lactis и Lactobacillus reuteri.
Нейтральный олигосахарид выбирают предпочтительно из фруктоолигосахаридов (FOS) и галктоолигосахаридов (GOS), причем предпочтительны галактоолигосахариды.
В одном из воплощений данного изобретения смесь олигосахаридов может происходить из животного молока, например одной или более из следующих животных: корова, коза, овца или буйволица. Например, смесь олигосахаридов может быть получена путем фракционирования коровьего молока и последующей ферментативной обработки.
Во втором воплощении данного изобретения смесь олигосахаридов может быть получена с использованием ферментативных, химико-ферментативных и/или химических средств.
В третьем воплощении данного изобретения смесь олигосахаридов может быть получена с помощью методов ферментации с использованием дрожжей и/или бактериальных клеток. Например, для этого можно использовать дрожжевые и/или бактериальные клетки, в которых (в результате генетической модификации или без нее) экспрессируются такие ферменты, как гликозидазы и/или гликозилтрансферазы.
Композиция согласно изобретению предпочтительно используется применительно к грудным детям, родившимся недоношенными или с низкой массой тела, или с задержкой внутриутробного роста (IUGR), или с недостаточностью внутриутробного питания и/или с повреждением кишечника и/или после хирургического вмешательства.
Раскрытие изобретения
В настоящем документе нижеследующие термины употребляются в указанных здесь значениях.
Термин «ребенок» означает человеческое существо в возрасте от момента рождения до начала периода полового созревания. Взрослым здесь называется человек старше, чем ребенок.
Термин «грудной ребенок» означает ребенка в возрасте до 12 месяцев.
Термин «недоношенный грудной ребенок» (или «преждевременно родившийся грудной ребенок») означает грудного ребенка, появившегося на свет ранее 37-й недели внутриутробного возраста.
Термин «грудной ребенок с низкой массой тела» означает грудного ребенка, масса тела которого при рождении была меньше 2500 граммов.
Термин «маленький ребенок» означает ребенка в возрасте от 1 года до 3 лет.
Термин «смесь для искусственного вскармливания грудных детей» означает пищевой продукт, предназначенный для специфического пищевого использования грудными детьми в первые 4-6 месяцев жизни и удовлетворяющий своим составом пищевые потребности указанной категории лиц (статья 1.2 Директивы Еврокомиссии 91/321/EEC от 14 мая 1991 г. касательно смесей для питания грудных детей и последующих (для детей старше 6 месяцев) питательных смесей).
Термин «смесь для питания недоношенных детей» означает питательную смесь, предназначенную для кормления детей, родившихся раньше срока.
Термин «обогатитель грудного молока» означает питательную добавку, используемую для увеличения калорийности и количества белков, минеральных веществ и витаминов в грудном молоке, которым кормят недоношенных грудных детей или грудных детей с низкой массой тела.
Термин «смесь для подрастающих младенцев» означает пищевой продукт, предназначенный для специфического пищевого использования грудными детьми в возрасте старше 4 месяцев жизни и составляющий основной жидкий компонент постепенно становящегося все более разнообразным рациона указанной категории лиц.
Термин «начальная смесь для искусственного вскармливания грудных детей» означает пищевой продукт, предназначенный для специфического пищевого использования грудными детьми в первые 4 месяца жизни.
Термин «детское питание» означает пищевые продукты, предназначенные для специфического пищевого использования грудными детьми в первые годы жизни.
Термин «смесь на зерновой основе для питания грудных детей» означает пищевой продукт, предназначенный для специфического пищевого использования грудными детьми в первые годы жизни.
Термин «молочная смесь при прикорме» означает напиток на основе молока, адаптированного к специфическим пищевым потребностям маленьких детей.
Термин «период отлучения от груди» означает период времени, в течение которого в питании ребенка грудное молоко или смесь для искусственного вскармливания частично или полностью заменяется другими пищевыми продуктами из рациона ребенка.
Выражение «стимуляция всасывания питательных веществ, ангиогенеза в кишечнике и переносимости энтерального питания» означает поддержку всасывания питательных веществ, ангиогенеза в кишечнике и переносимости энтерального питания. Например, это включает предотвращение ишемии. Термин «энтеральный» означает «через желудочно-кишечный тракт».
Выражение «профилактика и/или лечение воспалительного поражения кишечника» означает предотвращение и снижение частоты и/или встречаемости и/или тяжести и/или продолжительности воспалительного поражения кишечника. Встречаемость относится к числу любых воспалительных поражений кишечника. Частота относится к числу тех же воспалительных поражений кишечника. Указанная профилактика включает снижение частоты и/или степени тяжести указанных воспалительных поражений кишечника в последующей жизни. Выражение «в последующей жизни» включает проявления после окончания вмешательства. Проявления «в последующей жизни» могут происходить предпочтительно в течение 2-4 недель, 2-12 месяцев или лет (например, 2, 5, 10 лет) после окончания указанного вмешательства. Примером воспалительного поражения кишечника является некротизирующий энтероколит.
Выражение «выздоровление после повреждения кишечника и/или хирургического вмешательства в этой области» означает поддержку заживления и восстановления после повреждения кишечника и/или хирургического вмешательства в этой области.
Термин «питательная композиция» означает композицию, которая служит питанием индивида. Эту питательную композицию обычно принимают через рот, интрагастрально или внутривенно; она обычно включает источник липидов или жиров и источник белков.
Термин «синтетическая смесь» означает смесь, полученную химическими и/или биологическими средствами; она может быть химически идентична природной смеси, присутствующей в молоке млекопитающих.
Термин «гипоаллергенная композиция» означает композицию, которая вряд ли может вызвать аллергические реакции.
Термин «пробиотик» означает препарат клеток микроорганизмов или компоненты клеток микроорганизмов или их метаболиты, обладающие благотворным влиянием на здоровье и самочувствие организма-хозяина (см. Salminen S, Ouwehand A. Benno Y. et al. "Probiotics: how should they be defined" Trends Food Sci. Technol. 1999: 10 107-10).
Термин «олигосахарид» означает углевод, степень полимеризации которого составляет от 2 до 20 включительно, за исключением лактозы.
Термин «нейтральный олигосахарид» означает олигосахарид, не несущий электрического заряда и не содержащий N-ацетильный остаток.
Термин «сиалированный олигосахарид» означает олигосахарид, содержащий остаток сиаловой кислоты (например, N-ацетилнейраминовой кислоты и/или N-гликолилнейраминовой кислоты).
Термин «N-ацетилированный олигосахарид» означает олигосахарид, содержащий по меньшей мере одну гексозу, несущую N-ацетильный остаток.
В настоящем документе содержание в процентах указывается для отношения масса/масса, если не оговорено иного.
В одном из аспектов данного изобретения предлагается композиция, содержащая
- по меньшей мере одну длинноцепочечную полиненасыщенную жирную кислоту,
- по меньшей мере один пробиотик и
- смесь олигосахаридов, причем указанная смесь содержит по меньшей мере один N-ацетилированный олигосахарид, выбираемый из группы, включающей GalNAcα1,3Galβ1,4Glc (=3'GalNAc-lac = N-ацетилгалактозаминиллактоза) и Galβ1,6GalNAcα1,3Galβ1,4Glc (=6'Gal-3Gal-3GalNAc-lac = галактозил-N-ацетилгалактозаминиллактоза), Galb1,4GlcNAcb1,3Galb1,4Glc (лакто-N-неотетраоза) и Galb1,3GlcNAcb1,3Galb1,4Glc (лакто-N-тетраоза), по меньшей мере один сиалированный олигосахарид, выбираемый из группы, включающей NeuAcα2,3Galβ1,4Glc (=3'-сиалиллактоза) и NeuAcα2,6Galβ1,4Glc (=6'-сиалиллактоза) и по меньшей мере один нейтральный олигосахарид. выбираемый из группы, состоящей из Galβ1,6Gal (=β1,6-дигалактозид); Galβ1,6Galβ1,4Glc (=6'Gal-lac); Galβ1,6Galβ1,6Glc; Galβ1,3Galβ1,3Glc; Galβ1,3Galβ1,4Glc (=3'Gal-lac); Galβ1,6Galβ1,6Galβ1,4Glc (=6',6-diGal-lac); Galβ1,6Galβ1,3Galβ1,4Glc (=6',3-diGal-lac); Galβ1,3Galβ1,6Galβ1,4Glc (=3',6-diGal-lac); Galβ1,3GaId1,3Galβ1,4Glc (=3',3-diGal-lac); Galβ1,4Galβ1,4Glc (=4'Gal-lac); and Galβ1,4GaIβ1,4Galβ1,4Glc (=4',4-diGal-lac); и Fuca1,2Galb1,4Glc (=2' фукозиллактоза, или FL),
для применения при стимуляции всасывания питательных веществ и ангиогенеза в кишечнике, переносимости энтерального питания; и/или при профилактике и/или лечении воспалительных поражений кишечника, например некротизирующего энтероколита; и/или при выздоровлении после повреждения и/или хирургического вмешательства в области кишечника.
Во втором своем аспекте данное изобретение относится к композиции, содержащей по меньшей мере одну длинноцепочечную полиненасыщенную жирную кислоту, по меньшей мере один пробиотик и смесь олигосахаридов, которая содержит:
- 0,25-20 масс.%, предпочтительно 0,3-10 масс.%, более предпочтительно 0,3-5 масс.% и еще более предпочтительно около 0,5 масс.% относительно общей массы смеси олигосахаридов и по меньшей мере один N-ацетилированный олигосахарид,
- 0,5-30 масс.%, предпочтительно 0,75-15 масс.%, более предпочтительно 0,75-10 масс.%и еще более предпочтительно около 1 масс.% относительно общей массы смеси олигосахаридов и по меньшей мере один сиалированный олигосахарид, и
- 50-99,3 масс.%, предпочтительно 20-80 масс.%, более предпочтительно 10-50 масс.% и еще более предпочтительно около 50 масс.% относительно общей массы смеси олигосахаридов и по меньшей мере один нейтральный олигосахарид,
для применения при стимуляции всасывания питательных веществ и ангиогенеза в кишечнике, переносимости энтерального питания; и/или при профилактике и/или лечении воспалительных поражений кишечника, например некротизирующего энтероколита; и/или при выздоровлении после повреждения и/или хирургического вмешательства в области кишечника.
Согласно одному из предпочтительных воплощений данного изобретения смесь олигосахаридов берется в количестве 0,5-70%, более предпочтительно 1-20%, еще более предпочтительно 2-5%, относительно общей массы композиции.
Олигосахариды определяют их структурой, используя следующие обозначения: GalNAc это N-ацетилгалактозамин, GlcNAc - N-ацетилглюкозамин, Gal - галактоза, NeuAc - N-ацетилнейраминовая кислота, Fuc - фукоза, Glc - глюкоза.
Смесь олигосахаридов в композиции согласно изобретению может быть единственным источником олигосахаридов в ней.
В первом воплощении данного изобретения нейтральный олигосахарид предпочтительно выбирают из фруктоолигосахаридов и галактоолигосахаридов, предпочтительно из галактоолигосахаридов, например из упомянутых выше.
Во втором воплощении данного изобретения независимо от первого воплощения (или в зависимости от него) нейтральный олигосахарид предпочтительно является 2'-фукозиллактозой (FL). В том случае фукозиллактоза предпочтительно входит в группу нейтральных олигосахаридов в смеси олигосахаридов в ходе ее получения.
Нейтральный олигосахарид может быть получен в виде смеси путем смешивания покупных компонентов. Так, синтетические галактоолигосахариды, например Galβ1,6Gal, Galβ1,6Galβ1,4Glc, Galβ1,6Galβ1,6Glc, Galβ1,3Galβ1,3Glc, Galβ1,3Galβ1,4Glc, Galβ1,6Galβ1,6Galβ1,4Glc, Galβ1,6Galβ1,3Galβ1,4Glc Galβ1,3Galβ1,6Galβ1,4Glc, Galβ1,3GaIβ1,3Galβ1,4Glc, Galβ1,4Galβ1,4Glc и Galβ1,4GaIβ1,4Galβ1,4Glc и их смеси, имеются в продаже под торговым названием Vivinal® (компания Friesland Campina, Нидерланды) и Elix'or®. Олигосахариды производятся также компаниями Dextra Laboratories, Sigma-Aldrich Chemie GmbH и Kyowa Hakko Kogyo Co., Ltd. Или же можно получить галктоолигосахариды и/или фукозилированные олигосахариды при помощи ферментов - специфических гликозилтрансфераз и/или гликозидаз, например галактозилтрансфераз и/или фукозилтрансфераз, и/или галактозидаз, и/или фукозидаз.
Фукозилгалактоза представляет собой фукозилированный олигосахарид (то есть олигосахарид, содержащий остаток фукозы). Этот фукозилированный олигосахарид можно выделить хроматографическими или фильтрационными методами из природных источников, например молока животных. Или же его можно получить биотехнологическими методами, используя специфические фукозилтрансферазы и/или фукозидазу путем ферментативной обработки, используя рекомбинантные или природные ферменты, либо путем ферментации микроорганизмами. В последнем случае используются либо от природы экспрессирующиеся в микроорганизмах ферменты и субстраты либо образовавшиеся в результате генно-инженерных манипуляций.
Согласно изобретению можно использовать индивидуальные (один микроорганизм) культуры и/или смеси культур. Образование фукозилированного олигосахарида можно инициировать субстратом-акцептором, начиная с любой степени полимеризации (DP) от DP=1 и далее. Или же фукозилированные олигосахариды можно получать путем химического синтеза из лактозы и свободной фукозы. Также фукозилированные олигосахариды можно приобрести готовыми; они производятся, например, компанией Kyowa, Hakko, Kogyo Co., Ltd. (Япония).
Согласно изобретению сиалированные олигосахариды выбирают из группы, включающей 3'-сиалиллактозу и 6'-сиалиллактозу. Сиалированные олигосахариды предпочтительно содержат и 3'-сиалиллактозу, и 6'-сиалиллактозу. В этом воплощении данного изобретения соотношение 3'-сиалиллактоза/6'-сиалиллактоза составляет предпочтительно от 5:1 до 1:2.
3'- и 6'-формы сиалилактозы можно ввести в композицию согласно изобретению, включив в нее какой-либо природный их источник, например животное молоко, или же их можно выделить из такого природного источника с помощью хроматографических или фильтрационных методов. Также 3'- и 6'-формы сиалилактозы можно получить биотехнологическими методами, используя специфические сиалилтрансферазы или сиалиллидазы, нейраминидазы путем ферментативной обработки, используя рекомбинантные или природные ферменты, путем химического синтеза либо путем ферментации микроорганизмами. В последнем случае используются либо от природы экспрессирующиеся в микроорганизмах ферменты и субстраты либо образовавшиеся в результате генно-инженерных манипуляций. Можно использовать индивидуальные (один микроорганизм) культуры и/или смеси культур. Образование сиалилолигосахарида можно инициировать субстратом-акцептором, начиная с любой степени полимеризации (DP) от DP=1 и далее. Или же формы сиалилактозы можно получать путем химического синтеза из лактозы и свободной N'-ацетилнейраминовой кислоты (сиаловой кислоты). Также формы сиалиллактозы можно приобрести готовыми; они производятся, например, компанией Kyowa, Hakko, Kogyo Co., Ltd. (Япония).
N-Ацетилированные олигосахариды можно получить, включив в композицию согласно изобретению какой-либо природный их источник, например животное молоко. Или же N-ацетилированные олигосахариды можно получить, воздействуя глюкозаминидазами и/или галактозаминидазами на N-ацетилглюкозу и/или N-ацетилгалактозу. для этой цели можно использовать с равным успехом N-ацетилгалактозилтрансферазы или N-ацетилгликозилтрансферазы. N-ацетилированные олигосахариды можно получить также ферментативными методами, используя соответствующие ферменты (рекомбинантные или природные) и/или путем ферментации микроорганизмами. В последнем случае используются либо от природы экспрессирующиеся в микроорганизмах ферменты и субстраты либо образовавшиеся в результате генно-инженерных манипуляций. Можно использовать индивидуальные (один микроорганизм) культуры и/или смеси культур. Образование N-ацетилированных олигосахаридов можно инициировать субстратами-акцепторами, начиная с любой степени полимеризации (DP) от DP=1 и далее, еще одна возможность - химическое превращение кетогексоз (например, фруктозы) - свободных или связанных с олигосахаридами (например, лактулозой) в N-ацетилгексозамин или олигосахарид, содержащий N-ацетилгексозамин, как описано в работе Wrodnigg, Т.М.; Stutz, А.Е. (1999) Angew. Chem. Int. Ed. 38: 827-828.
Лакто-N-неотетраозу (LNnT) и лакто-N-тетраозу (LNT) можно синтезировать путем ферментативного переноса сахаридной группировки от соединения-донора на соединение-акцептор, используя гликозилгидролазы и/или гликозилтрансферазы, как описано, например, в патенте США №5,288,637 и публикации WO 96/10086. Или же лакто-N-неотетраозу (LNnT) можно получить путем химического превращения кетогексоз (например, фруктозы)) - свободных или связанных с олигосахаридами (например, лактулозой) - в N-ацетилгексозамин или олигосахарид, содержащий N-ацетилгексозамин, как описано в работе Wrodnigg, Т.М.; Stutz, А.Е. (1999) Angew. Chem. Int. Ed. 38: 827-828. Полученный таким образом N-ацетиллактозамин можно затем перенести на акцептор-лактозу.
N-Ацетилированные олигосахариды предпочтительно выбирают из группы, включающей лакто-N-неотетраозу и лакто-N-тетраозу. Предпочтительно лакто-N-неотетраоза и лакто-N-тетраоза входят в группу сиалированных олигосахаридов в олигосахаридной смеси в процессе ее получения.
Пробиотические бактериальные штаммы, присутствующие в композиции согласно изобретению, можно выбирать из любых штаммов, отвечающих определению пробиотика и имеющих приемлемый (для композиции, в которую они должны быть включены) срок хранения. Например, если данная композиция входит в состав смеси для кормления грудных детей, то необходимо, чтобы указанная смесь оставалась стабильной и эффективной до 12 месяцев. Пробиотический бактериальный штамм, используемый согласно изобретению. - это предпочтительно лактобациллы или бифидобактерии.
Примерами предпочтительных видов рода Lactobacillus являются Lactobacillus rhamnosus, Lactobacillus paracasei и Lactobacillus reuteri. Особенно предпочтительны штаммы Lactobacillus rhamnosus АТСС 53103, Lactobacillus rhamnosus CGMCC 1.3724, Lactobacillus reuteri DSM 17938 и Lactobacillus paracasei CNCM 1-2116. Еще более предпочтительны в качестве пробиотика Lactobacillus rhamnosus, который включает Lactobacillus rhamnosus АТСС 53103 и Lactobacillus rhamnosus CGMCC 1.3724.
Штамм Lactobacillus rhamnosus АТСС 53103 производства компании Valio Оу (Финляндия) имеется в продаже под торговым названием LGG, штамм Lactobacillus reuteri DSM 17938 продается фирмой BioGaia А.В под торговым названием Reuteri.
Примеры предпочтительных видов рода Bifidobacterium включают Bifidobacterium lactis, Bifidobacterium longum, Bifidobacterium breve и Bifidobacterium infanti. Особенно предпочтительны следующие штаммы: Bifidobacterium lactis CNCM 1-3446, имеющийся в продаже, например, под торговым названием Bb12 (предоставляется компанией Christian Hansen, Дания); Bifidobacterium longum АТСС ВАА-999, предоставляемый компанией Morinaga Milk Industry Co. Ltd. (Япония) под торговым названием ВВ536; Bifidobacterium breve, предоставляемый компанией Danisco под торговым названием Bb-03; Bifidobacterium breve, предоставляемый компанией Morinaga под торговым названием М-16V; Bifidobacterium infantis, предоставляемый компанией Procter & Gamble Со. под торговым названием Bifantis, и Bifidobacterium breve, предоставляемый компанией Institut Rosell (Lallemand) под торговым названием R0070.
Согласно изобретению пробиотик выбирают из пробиотических бактериальных штаммов, предпочтительно пробиотик согласно изобретению относится к лактобациллам или бифидобактериям, более предпочтительно - к видам Lactobacillus rhamnosus, Lactobacillus reuteri и Bifidobacterium lactis.
В композиции согласно изобретению пробиотик может присутствовать в весьма различных количествах (в процентном отношении) - при условии, что во взятом количестве он обеспечивает описанный эффект. Однако предпочтительно, чтобы в композиции согласно изобретению выбранный пробиотик присутствовал в количестве, эквивалентном 10е2 - 10е12 КОЕ данного пробиотического бактериального штамма, более предпочтительно от 10е6 до 10е9 КОЕ на 1 грамм композиции. Это включает возможность того, что бактерии живые, инактивированные или мертвые или что они представлены фрагментами, например ДНК, компонентами клеточной стенки, внутриклеточными компонентами или клеточными метаболитами. Иными словами, количество бактерий, содержащихся в композиции, выражается с точки зрения способности данного количества бактериальных клеток образовывать колонии, как если бы все эти клетки были живые, - независимо от того, живые ли они на самом деле, инактивированные или мертвые, фрагментированы ли они или присутствуют в виде смеси любых или всех этих состояний.
Композиция согласно изобретению содержит по меньшей мере одну длинноцепочечную полиненасыщенную жирную кислоту (LC-PUFA), которая обычно относится к классу омега-3 (n-3) или омега-6 (n-6). n-3 LC-PUFA может содержать 20 или 22 атома углерода. С20 или С22 n-3 LC-PUFA предпочтительно присутствуют в количестве, составляющем по меньшей мере 0,1 масс.% от всех жирных кислот в композиции, n-3 LC-PUFA предпочтительно является докозагексаеновой кислотой (DHA, С22:6, n-3). n-6 LC-PUFA может содержать 20 или 22 атома углерода. С20 или С22 n-6 LC-PUFA предпочтительно присутствуют в количестве, составляющем по меньшей мере 0,1 масс.% от всех жирных кислот в композиции, n-6 LC-PUFA предпочтительно является арахидоновой кислотой (ARA, С20:4, n-6). Источниками длинноцепочечных полиненасыщенных жирных кислот могут быть, например, яичные липиды, жиры грибов, рыбий жир с низким содержанием эйкозапентаеновой кислоты или жиры водорослей. LC-PUFA в композиции согласно изобретению могут быть представлены небольшим количеством масел с высоким содержанием предобразованной арахидоновой кислоты и докозагексаеновой кислоты, например рыбьего жира или жиров микроорганизмов.
Композиция согласно изобретению является предпочтительно питательной композицией, более предпочтительно - синтетической питательной композицией. В этом случае она может быть смесью для кормления недоношенных грудных детей, обогатителем женского молока, начальной смесью для питания грудных детей (до 6 месяцев), смесью для питания подрастающих грудных детей (от 6 месяцев до года), детской питательной смесью, зерновой смесью для грудных детей, детской молочной смесью при прикорме (для детей 1-3 лет), лечебным пищевым продуктом для клинического питания или питательной добавкой, используемой, как правило, в условиях госпитализации и/или после выписки из больницы. Питательная добавка может быть предназначена для детей, в частности для недоношенных грудных детей, или для взрослых. Указанная композиция является предпочтительно продуктом для кормления недоношенных грудных детей, например питательной смесью для недоношенных грудных детей, обогатителем женского молока или питательной добавкой для недоношенных грудных детей. По одному из воплощений данного изобретения указанная композиция является предпочтительно питательной смесью для недоношенных грудных детей, обогатителем женского молока или питательной добавкой. Композиция согласно изобретению может также быть продуктом для детей или взрослых, например йогуртом или лечебным пищевым продуктом, а также продуктом для питания домашних питомцев.
По одному из особенно предпочтительных воплощений данного изобретения предлагаемая композиция предназначена для применения у грудных и маленьких детей, родившихся раньше срока или с низкой массой тела или у которых имела место задержка внутриутробного развития и/или недостаточность внутриутробного питания, и/или повреждение кишечника и/или хирургическое вмешательство.
Композиция согласно изобретению может быть предназначена для применения до и/или в ходе и/или после периода отлучения от груди.
Данное изобретение включает также применение предлагаемой композиции в качестве синтетического питательного агента при стимуляции всасывания питательных веществ и ангиогенеза в кишечнике, переносимости энтерального питания; и/или при профилактике и/или лечении воспалительных поражений кишечника, например некротизирующего энтероколита; и/или при выздоровлении после повреждения и/или хирургического вмешательства в области кишечника.
Все упомянутые выше применения предназначены в особенности для грудных и маленьких детей, предпочтительно для грудных детей в случае человека. Но эти применения предназначены также для молодняка домашних питомцев.
Композиции и применения согласно изобретению особенно подходят для грудных и маленьких детей, предпочтительно для грудных детей, родившихся раньше срока или с низкой массой тела или у которых имела место задержка внутриутробного развития и/или недостаточность внутриутробного питания, и/или повреждение кишечника и/или хирургическое вмешательство.
Авторы настоящего изобретения не хотели бы вдаваться в теоретические рассуждения, полагая, что эффективность сочетания смеси олигосахаридов в описанной выше композиции в отношении ангиогенеза в кишечнике и всасывания питательных веществ, переносимости энтерального питания и/или профилактики и/или лечения воспалительных поражений кишечника, например некротизирующего энтероколита, и/или выздоровления после повреждения и/или хирургического вмешательства в области кишечника может быть результатом синергического действия иммуномодулирующих эффектов, инициируемых пробиотическими бактериальными штаммами, и длинноцепочечными полиненасыщенными жирными кислотами путем их стимуляции специфической смесью олигосахаридов.
Смесь олигосахаридов, длинноцепочечные полиненасыщенные жирные кислоты и пробиотические бактериальные штаммы можно вводить индивиду в составе одной и той же композиции или же последовательно.
Если речь идет о грудных детях, родившихся раньше срока или с низкой массой тела, то композиция согласно изобретению является предпочтительно питательной композицией, например потребляемой в жидком виде. Это может быть полноценная в смысле питательной ценности смесь, например смесь для вскармливания (недоношенных) грудных детей, питательная добавка, обогатитель женского молока, смесь для подрастающих младенцев или молочная смесь при прикорме. Если же речь идет о детенышах других млекопитающих, то композиция согласно изобретению может быть пищей для домашних питомцев.
Композиция согласно изобретению может также содержать источник белка. Тип белка не считается существенным в контексте данного изобретения при условии, что удовлетворяются минимальные потребности в незаменимых аминокислотах и обеспечивается удовлетворительный рост ребенка. Можно использовать источники белка на основе молочной сыворотки, казеина и их смесей, а также источники белка на основе сои. Что касается белков молочной сыворотки, то источник белка может быть на основе кислой сыворотки либо сладкой сыворотки или их смесей; он может включать альфа-лактальбумин и бета-лактальбумин в любой желаемой пропорции. Наконец, белки могут быть частично гидролизованы, чтобы усилить оральную толерантность к аллергенам, особенно к пищевым аллергенам. В этом случае композиция согласно изобретению является гипоаллергенной.
Композиция согласно изобретению может также содержать источник углеводов помимо смеси олигосахаридов. Это особенно предпочтительно в том случае, когда композиция является смесью для питания грудных детей. Тогда можно использовать любой обычный для детских питательных смесей источник углеводов, например лактозу, сахарозу, мальтодекстрин, крахмал и их смеси, хотя предпочтительным источником углеводов является лактоза. В любом случае смесь олигосахаридов является единственным в композиции источником пребиотика.
Композиция согласно изобретению может также содержать источник липидов помимо длинноцепочечных полиненасыщенных жирных кислот. Это особенно уместно, если питательная композиция согласно изобретению является смесью для питания грудных детей. Тогда источником липидов может служить любой липид или жир, пригодный для использования в смеси для питания грудных детей. Предпочтительные источники жиров включают пальмовое масло, содержащее олеиновую кислоту, подсолнечное масло с высоким содержанием олеиновой кислоты и сафлоровое масло с высоким содержанием олеиновой кислоты. Можно также добавлять незаменимые жирные кислоты - линолевую и альфа-линоленовую. В композиции согласно изобретению в источнике жиров (включая такие длинноцепочечные полиненасыщенные жирные кислоты, как арахидоновая и/или докозагексаеновая) соотношение омега-6 (n-6)/омега-3 (n-3) жирных кислот составляет предпочтительно от около 1:2 до около 10:1, предпочтительно от около 3:1 до около 8:1.
Композиция согласно изобретению может также содержать все витамины и минеральные вещества, считающиеся обязательными в ежедневном рационе, в диетологически значимых количествах. Для некоторых витаминов и минеральных веществ установлены минимальные потребности. Примеры минеральных веществ, витаминов и других нутриентов, при необходимости присутствующих в композиции согласно изобретению, включают витамины A, B1, В2, В6, В12, Е, K, С, D, фолиевую кислоту, инозит, никотиновую кислоту, биотин, пантотеновую кислоту, холин, кальций, фосфор, йод, железо, магний, медь, цинк, марганец, хлор, калий, натрий, селен, хром, молибден, таурин и L-карнитин. Минеральные вещества обычно используют в виде солей. Наличие и количество конкретных минеральных веществ и витаминов может варьировать в зависимости от группы населения, для которой предназначена композиция.
При необходимости композиция согласно изобретению может содержать эмульгирующие и стабилизирующие агенты, например сою, лецитин, эфиры лимонной кислоты и моно- или диглицеридов и проч.
Композиция согласно изобретению может также содержать другие вещества благотворного действия, например лактоферрин, нуклеотиды, нуклеозиды, ганглиозиды, полиамины и проч.
Далее получение композиции согласно изобретению будет описано при помощи примеров.
Смесь для детского питания может быть получена любым пригодным для этого путем. Например, можно смешать вместе источник белка, источник углеводов (отличный от смеси олигосахаридов) и источник жиров, включая длинноцепочечные полиненасыщенные жирные кислоты в нужных пропорциях. На этом этапе в смесь включают эмульгирующие агенты, если они используются. На этом этапе могут быть добавлены также витамины и минеральные вещества, но обычно их добавляют позже, чтобы избежать тепловой деградации. Липофильные витамины, эмульгирующие агенты и подобные компоненты растворяют в источнике жиров до его смешивания с прочими источниками питательных веществ. Для получения жидкой смеси добавляют затем воду -предпочтительно предварительно подвергнутую обратному осмосу. При этом температура воды обычно составляет от около 50°С до около 80°С, чтобы ингредиенты распределились более равномерно. Для образования жидкой смеси можно использовать готовые имеющиеся в продаже разжижители. Если конечный продукты должен быть в жидкой форме, то на этом этапе добавляется олигосахаридная смесь. Если конечный продукт должен быть в форме порошка, то по желанию олигосахариды также можно добавить на этом этапе. Полученную жидкую смесь затем гомогенизируют, например в две стадии.
Полученную жидкую смесь можно затем подвергнуть тепловой обработке, чтобы снизить бактериальную нагрузку. Такая обработка состоит в быстром нагревании жидкой смеси до температуры от около 80°С до около 150°С в течение, например, от около 5 секунд до около 5 минут. Это осуществляется путем инжекции пара, с помощью автоклава или теплообменника, например пластинчатого теплообменника.
Затем жидкую смесь охлаждают до температуры от около 60°С до около 85°С, например путем мгновенного охлаждения, после этого жидкую смесь опять гомогенизируют, например в две стадии: под давлением от около 10 МПа до около 30 МПа на первой стадии и от около 2 МП до около 10 МПа на второй стадии. Гомогенизированную смесь подвергают дальнейшему охлаждению, чтобы добавить такие чувствительные к теплу компоненты, как витамины и минеральные вещества. На этом этапе подводят pH и содержание растворенных и нерастворенньгх компонентов до требующихся значений.
Гомогенизированную смесь переносят в подходящий сушильный аппарат, например для распылительной сушки или сублимационной сушки и превращают в порошок. Получаемый порошок должен содержать влаги менее чем около 5 масс.%. На этой стадии можно добавлять смесь олигосахаридов наряду с пробиотическими бактериальными штаммами путем сухого смешения или путем смешивания их в форме сиропа, или путем распылительной сушки, или путем сублимационной сушки.
Если предпочтительна жидкая композиция, то гомогенизированную смесь стерилизуют, потом в асептических условиях разливают в подходящие емкости; или же смесь сначала разливают по емкостям, а затем стерилизуют.
В другом воплощении данного изобретения предлагаемая композиция может быть питательной добавкой в количестве, достаточном для достижения желаемого эффекта у индивида. Такая форма введения композиции индивиду обычно больше подходит для грудных детей, родившихся раньше срока или с низкой массой тела, или испытывавших задержку внутриутробного развития, а для детей более старшего возраста и для взрослых.
Количества олигосахаридной смеси, длинноцепочечных полиненасыщенных кислот и пробиотических бактериальных штаммов, которые должны быть включены в состав питательной добавки согласно изобретению, выбирают соответственно способу введения этой питательной добавки индивиду.
Питательная добавка согласно изобретению может быть в форме, например, порошка, таблеток, капсул, пастилок или жидкости. Она также может содержать защитные гидроколлоидные компоненты (например, камеди, белки, модифицированный крахмал), связующие вещества, пленкообразующие агенты, агенты/вещества, формирующие капсулу; вещества, образующие стенку/оболочку; соединения, образующие матрикс; кроющие агенты, эмульгирующие агенты, поверхностно-активные агенты, солюбилизирующие агенты (масла, жиры, воска, лецитины и проч.), адсорбенты, носители, наполнители, комплексные соединения, диспергирующие агенты, увлажняющие агенты, вспомогательные компоненты (растворители); агенты, способствующие текучести; агенты, маскирующие вкус; утяжеляющие агенты, желирующие агенты и гелеобразующие агенты. Питательная добавка согласно изобретению может также содержать обычные в фармацевтической практике добавочные и вспомогательные компоненты, эксципиенты и разбавители, включая (но не ограничиваясь перечисленным здесь) воду, желатин любого происхождения, растительные камеди, лигносульфонат, тальк, сахара, крахмал, аравийскую камедь, растительные масла, полиалкиленгликоли, ароматизирующие агенты, консерванты, стабилизирующие агенты, эмульгирующие агенты, забуферивающие вещества и буферные растворы, агенты, улучшающие скольжение, красители, увлажняющие агенты, наполнители и прочее.
Питательная добавка согласно изобретению может быть добавлена в продукт, приемлемый для потребителя (человека или животного), например перевариваемый носитель или адъювант. Примерами таких носителей или адъювантов служат фармацевтические или пищевые композиции или композиции для кормления домашних питомцев. Примеры таких композиций, не ограничивающие объем изобретения: молоко, йогурт, творог, сыр, ферментированное молоко, молоко на основе ферментированных продуктов, ферментированные зерновые продукты, молочные порошки, женское молоко, смеси для питания недоношенных грудных детей, питательные добавки для перорального применения, смеси для питания через зонд.
Также питательная добавка согласно изобретению может содержать органическое или неорганическое вещество-носитель, пригодное для энтерального или парентерального введения индивиду, а также витамины, микроэлементы и другие вещества, необходимые организму в микроколичествах, согласно рекомендациям правительственных организаций, например Рекомендуемым нормам потребления США (USRDA)
Преимущества, сущность и различные другие признаки данного изобретения разъясняются подробно нижеследующим рассмотрением иллюстративного эксперимента и прилагаемых фигур.
Краткое описание фигур
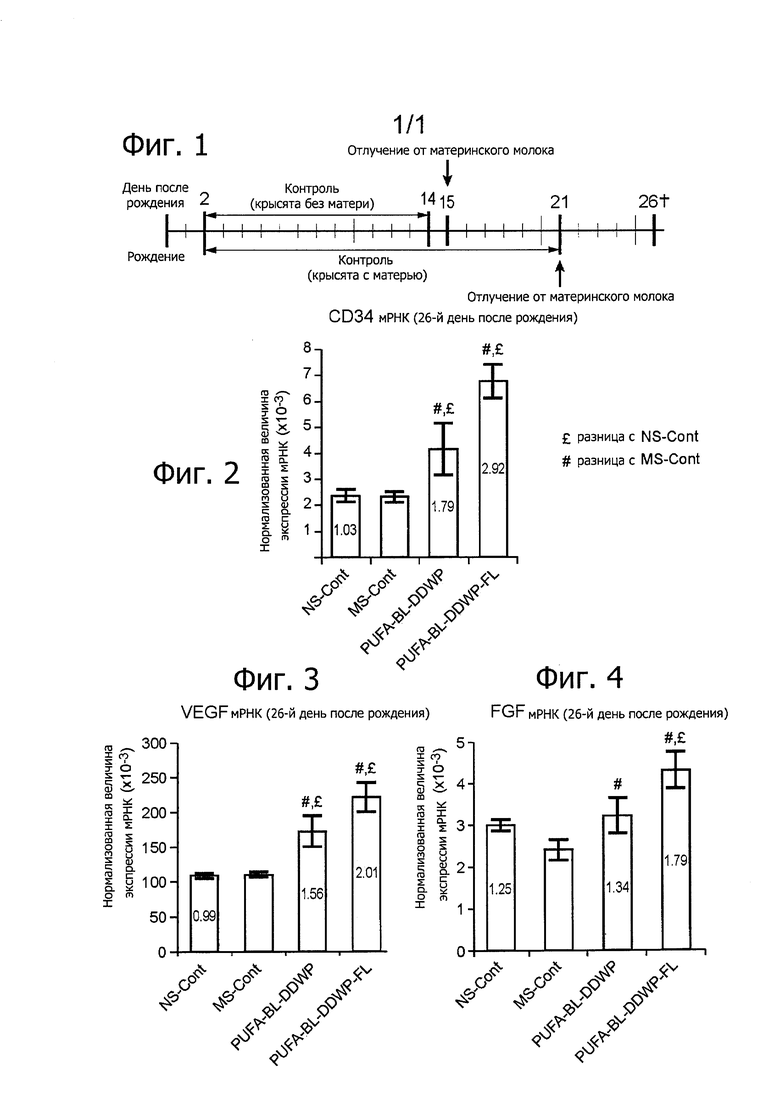
Фигура 1 - схема, иллюстрирующая протокол эксперимента.
Фигура 2 - столбчатая диаграмма, изображающая результаты опытов, представленные как нормализованная величина экспрессии мРНК (×10-3) CD34.
Фигура 3 - столбчатая диаграмма, изображающая результаты опытов, представленные как нормализованная величина экспрессии мРНК (×10-3) VEGF.
Фигура 4 - столбчатая диаграмма, изображающая результаты опытов, представленные как нормализованная величина экспрессии мРНК (×10-3) FGF.
Пример
Опыты проводились на детенышах крыс для изучения эффекта от добавки олигосахаридной смеси, представляющей собой смесь олигосахаридов коровьего молока (CMOS), обогащенную галактоолигосахаридами (деминерализованный безлактозный фильтрат молочной сыворотки - DDWP), длинноцепочечными полиненасыщенными жирными кислотами (LC-PUFA; арахидоновая кислота - ARA; докозагексаеновая - DHA) и Bifidobacterium lactis (BL), при необходимости содержащей 2'-фукозиллактозу (FL).
1. Методика
Протокол эксперимента
Опыты проводились в соответствии с Законом о защите животных Швейцарии (1-я степень) и с одобрения Кантонального ветеринарного бюро (Лозанна, Швейцария, постановления №2028 и 2028.1). Для опытов использовали самцов-производителей и девственных самок капюшонных крыс линии Лонга-Эванса (Long-Evans Hooded), предоставленных фирмой Janvier Labs. (Франция); животные поступали в виварий за две недели до спаривания.
Беременные самки получали корм (Kliba 3437) и воду без ограничений; животных держали при постоянных температуре и влажности; цикл чередования освещенности 12 часов свет: 12 часов темнота. Условия содержания не изменялись в течение всего эксперимента. На второй день после рождения детенышей (PND 2), их матерей забирали из клеток с потомством и определяли пол детенышей. Для дальнейшего выхаживания брали стандартизованные пометы из 8 детенышей-самцов, рандомизированных по массе тела. Крыс-матерей и их детенышей разделяли на две группы по следующим условиям: 1) группа лишения матери - в дни со 2-го по 12-й после рождения каждый день детенышей оставляли без матери на 180 минут (MS), 2) контрольная группа, в которой этого не делали (NS).
Детенышей из группы MS отлучали от материнского молока (W) на 15-й день после рождения (PND15). Их рандомизировали по массе тела и по материнской особи и распределяли на группы по 16 особей в каждой, которые вплоть до 26-го дня после рождения (PND26) получали контрольный рацион (модифицированный AIN 93 G, группа MS-Cont) или же сходный рацион, но содержащий LC-PUFA, Bifidobacterium lactis CNCM 1-3446 (BL) и олигосахариды (DDWP). Особей MS (группа MS-Cont) содержали группами по 8 животных до 21-го дня после рождения (PND21), чтобы ослабить стресс от преждевременного отлучения от материнского молока, а затем держали каждое животное отдельно вплоть до конца эксперимента. Особей из группы NS на 21-й день после рождения (PND21) переводили с материнского молока на контрольный рацион (группа NS-Cont) и содержали каждое животное отдельно вплоть до конца эксперимента.
Подопытных животных умерщвляли (+) на 26-й день после рождения путем кровопускания под наркозом (изофлуран). Брали образцы кишечника для определения экспрессии мРНК маркеров ангиогенгеза путем количественной полимеразной цепной реакции в реальном времени (qRT-PCR).
2. Воздействие и питание
Для экспериментального искусственного питания использовались следующие функциональные ингредиенты; композиция в рационе подопытных животных содержала DDWP (98,8% сухого вещества), состав олигосахаридной смеси подробно представлен в таблице 1 ниже.

DDWP получали, как правило, согласно описанию, приведенному в публикации WO 2007/101675 или WO 2007/090894; обычно эта смесь содержала 30 масс.% GalNAcα1,3Galβ1,4Glc и Galβ1,6GalNAcα1,3Galβ1,4Glc; 50 масс.% Galβ1,6Galβ1,4Glc и Galβ1,3Galβ1,4Glc; 20 масс.% NeuAcα2,3Galβ1,4Glc и NeuAcα2,6Galβ1,4Glc.
Подопытные животные от момента отлучения от материнского молока и до конца эксперимента получали адаптированный по питательной ценности полусинтетический рацион (модифицированный AIN 93 G), состав которого представлен в таблицах 2, 3 и 4.

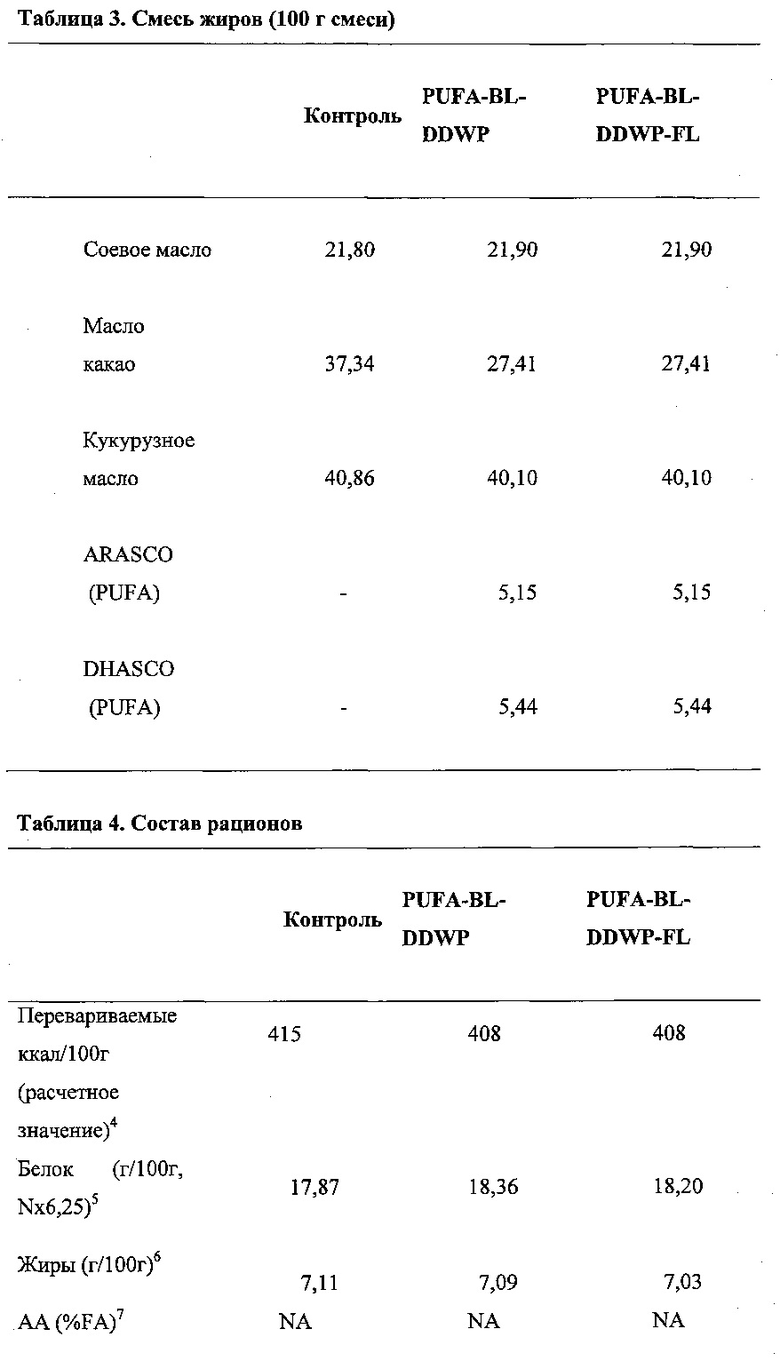

В трех указанных рационах был сбалансирован профиль жирных кислот, чтобы обеспечить сходное соотношение n-6/n-3 и сходную долю насыщенных, мононенасыщенных и полиненасыщенных жирных кислот. Таким образом, жирнокислотный состав этих трех рационов почти не различался в отношении профиля жирных кислот.
Подопытных животных умерщвляли на 26-й день после рождения (PND 26).
3. Показатели ангиогенеза
Определяли маркеры ангиогенеза, а именно белок CD34, уровень экспрессии которого в клетках эндотелия сосудов высокий, и ангиогенные факторы - фактор роста эндотелия сосудов (VEGF) фактор роста фибробластов (FGF).
Известно, что наличие в свободном виде CD34, VEGF и FGF указывает на более выраженную васкуляризацию в кишечнике.
Судя по результатам, представленным на фиг. 2, 3 и 4, в случае композиций PUFA-BL-DDWP и PUFA-BL-DDWP-FL согласно изобретению, по-видимому, наблюдается большая экспрессия ангиогенных факторов роста и маркера ангиогенеза, чем в случае двух контрольных композиций (NS-CONT и MS-CONT). В частности, нормализованная экспрессия мРНК CD34 и VEGF даже выше, чем в контроле (NS-CONT).
Таким образом, смеси согласно изобретению PUFA-BL-DDWP и PUFA-BL-DDWP-FL обеспечивали большую васкуляризацию, чем контрольные варианты (MS и NS). Этим демонстрируется действительное преимущество композиций согласно изобретению.
Известно, что при нарушении кровотока развитие кишечника задерживается и всасывание питательных веществ неадекватно, что, как считается, является причинным фактором патогенеза некротизирующего энтероколита. А смеси PUFA-BL-DDWP и PUFA-BL-DDWP-FL эффективно помогают индивидам, страдающим от ослабленного кровоснабжения слизистой кишечника.
Таким образом, питательные композиции согласно изобретению положительно влияют на ангиогенез в кишечнике, всасывание питательных веществ, переносимость энтерального питания и/или полезны при профилактике и/или лечении воспалительных поражений кишечника, например некротизирующего энтероколита; и/или при выздоровлении после повреждения и/или хирургического вмешательства в области кишечника.
Группа изобретений относится к композициям для грудных детей. Предложены: композиция, содержащая по меньшей мере одну длинноцепочечную полиненасыщенную жирную кислоту (LC-PUFA), по меньшей мере один пробиотик и смесь олигосахаридов, включающую по меньшей мере один N-ацетилированный олигосахарид, по меньшей мере один сиалированный олигосахарид и по меньшей мере один нейтральный олигосахарид, для стимуляции ангиогенеза в кишечнике и всасывания питательных веществ, переносимости энтерального питания грудных детей или подрастающих младенцев; её применение в качестве синтетического питательного агента по тому же назначению; композиция того же состава, применяемая при профилактике и/или лечении воспалительного поражения кишечника, представляющего собой некротизирующий энтероколит, и/или при выздоровлении после повреждения и/или хирургического вмешательства в области кишечника грудных детей или подрастающих младенцев, и её применение в качестве синтетического питательного агента по тому же назначению. Технический результат состоит в стимуляции ангиогенеза в кишечнике, что позволяет снизить риск некротизирующего энтероколита и способствует выздоровлению после повреждения и/или хирургического вмешательства в кишечнике грудных детей или подрастающих младенцев. 4 н. и 22 з.п. ф-лы, 4 ил., 4 табл.
1. Композиция, содержащая по меньшей мере одну длинноцепочечную полиненасыщенную жирную кислоту (LC-PUFA), по меньшей мере один пробиотик и смесь олигосахаридов, причем указанная смесь включает по меньшей мере один N-ацетилированный олигосахарид, по меньшей мере один сиалированный олигосахарид и по меньшей мере один нейтральный олигосахарид, применяемая для стимуляции ангиогенеза в кишечнике и всасывания питательных веществ, переносимости энтерального питания грудных детей или подрастающих младенцев.
2. Композиция, содержащая по меньшей мере одну длинноцепочечную полиненасыщенную жирную кислоту (LC-PUFA), по меньшей мере один пробиотик и смесь олигосахаридов, причем указанная смесь включает по меньшей мере один N-ацетилированный олигосахарид, по меньшей мере один сиалированный олигосахарид и по меньшей мере один нейтральный олигосахарид, применяемая при профилактике и/или лечении воспалительного поражения кишечника, представляющего собой некротизирующий энтероколит, и/или при выздоровлении после повреждения и/или хирургического вмешательства в области кишечника грудных детей или подрастающих младенцев.
3. Композиция по п. 1, в которой нейтральный олигосахарид выбран из фруктоолигосахаридов (FOS) и/или галактоолигосахаридов (GOS), предпочтительно галактоолигосахаридов.
4. Композиция по п. 2, в которой нейтральный олигосахарид выбран из фруктоолигосахаридов (FOS) и/или галактоолигосахаридов (GOS), предпочтительно галактоолигосахаридов.
5. Композиция по п. 1, в которой указанная смесь олигосахаридов содержит по меньшей мере один N-ацетилированный олигосахарид, выбранный из группы, включающей GalNAcα1,3Galβ1,4Glc (=3'GalNAc-lac = N-ацетилгалактозаминиллактозу), Ga1β1,6GalNAcα1,3Galβ1,4Glc (=6'Gal-3GalNAc-lac = галактозил-N-ацетилгалкатозаминиллактозу), Galb1,4GlcNAcb1,3Galb1,4Glc (лакто-N-неотетраозу, или LNnT) и Galb1,3GlcNAcb1,3Galb1,4Glc (лакто-N-тетраозу, или LNT); по меньшей мере один сиалированный олигосахарид, выбранный из группы, включающей NeuAcα2,3Galβ1,4Glc (= 3'-сиалиллактозу) и NeuAcα2,6Galβ1,4Glc (=6'-сиалиллактозу), и по меньшей мере один нейтральный олигосахарид, выбранный из группы, состоящей из Galβ1,6Gal (=β1,6-дигалактозида); Galβ1,6Galβ1,4Glc (=6'-Gal-lac); Galβ1,6Galβ1,6Glc; Galβ1,3Galβ1,3Glc; Galβ1,3Galβ1,4Glc (=3'Gal-lac); Galβ1,6Galβ1,6Galβ1,4Glc (=6',6-diGal-lac); Galβ1,6Galβ1,3Galβ1,4Glc (=6',3-diGal-lac); Galβ1,3Galβ1,6Galβ1,4Glc (=3',6-diGal-lac); Galβ1,3GaIβ1,3Galβ1,4Glc (=3',3-diGal-lac); Galβ1,4Galβ1,4Glc (=4'-Gal-lac) и Galβ1,4GaIβ1,4Galβ1,4Glc (=4',4-diGal-lac); и Fuca1,2Galb1,4Glc (=2'-фукозиллактозы, или FL).
6. Композиция по п. 2, в которой указанная смесь олигосахаридов содержит по меньшей мере один N-ацетилированный олигосахарид, выбранный из группы, включающей GalNAcα1,3Galβ1,4Glc (=3'GalNAc-lac = N-ацетилгалактозаминиллактозу), Galβ1,6GalNAcα1,3Galβ1,4Glc (=6'Gal-3GalNAc-lac = галактозил-N-ацетилгалкатозаминиллактозу), Galb1,4GlcNAcb1,3Galb1,4Glc (лакто-N-неотетраозу, или LNnT) и Galb1,3GlcNAcb1,3Galb1,4Glc (лакто-N-тетраозу, или LNT); по меньшей мере один сиалированный олигосахарид, выбранный из группы, включающей NeuAcα2,3Galβ1,4Glc (=3'-сиалиллактозу) и NeuAcα2,6Galβ1,4Glc (=6'-сиалиллактозу), и по меньшей мере один нейтральный олигосахарид, выбранный из группы, состоящей из Galβ1,6Gal (=β1,6-дигалактозида); Galβ1,6Galβ1,4Glc (=6'-Gal-lac); Galβ1,6Galβ1,6Glc; Galβ1,3Galβ1,3Glc; Galβ1,3Galβ1,4Glc (=3'Gal-lac); Galβ1,6Galβ1,6Galβ1,4Glc (=6',6-diGal-lac); Galβ1,6Galβ1,3Galβ1,4Glc (=6',3-diGal-lac); Galβ1,3Galβ1,6Galβ1,4Glc (=3',6-diGal-lac); Galβ1,3GaIβ1,3Galβ1,4Glc (=3',3-diGal-lac); Galβ1,4Galβ1,4Glc (=4'-Gal-lac) и Galβ1,4GaIβ1,4Galβ1,4Glc (=4',4-diGal-lac); и Fuca1,2Galb1,4Glc (=2'-фукозиллактозы, или FL).
7. Композиция по п. 1, в которой смесь олигосахаридов содержит:
• 0,25-20 мас.%, предпочтительно 0,3-10 мас.%, более предпочтительно 0,3-5 мас.% и еще более предпочтительно около 0,5 мас.% относительно общей массы смеси олигосахаридов и по меньшей мере один N-ацетилированный олигосахарид,
• 0,5-30 мас.%, предпочтительно 0,75-15 мас.%, более предпочтительно 0,75-10 мас.% и еще более предпочтительно около 1 мас.% относительно общей массы смеси олигосахаридов и по меньшей мере один сиалированный олигосахарид, и
• 50-99,3 мас.%, предпочтительно 20-80 мас.%, более предпочтительно 10-50 мас.% и еще более предпочтительно около 50 мас.% относительно общей массы смеси олигосахаридов и по меньшей мере один нейтральный олигосахарид.
8. Композиция по п. 2, в которой смесь олигосахаридов содержит:
• 0,25-20 мас.%, предпочтительно 0,3-10 мас.%, более предпочтительно 0,3-5 мас.% и еще более предпочтительно около 0,5 мас.% относительно общей массы смеси олигосахаридов и по меньшей мере один N-ацетилированный олигосахарид,
• 0,5-30 мас.%, предпочтительно 0,75-15 мас.%, более предпочтительно 0,75-10 мас.% и еще более предпочтительно около 1 мас.% относительно общей массы смеси олигосахаридов и по меньшей мере один сиалированный олигосахарид, и
• 50-99,3 мас.%, предпочтительно 20-80 мас.%, более предпочтительно 10-50 мас.% и еще более предпочтительно около 50 мас.% относительно общей массы смеси олигосахаридов и по меньшей мере один нейтральный олигосахарид.
9. Композиция по п. 1, в которой смесь олигосахаридов присутствует в количестве 0,5-70 мас.%, более предпочтительно 1-20 мас.%, еще более предпочтительно 2-5 мас.% относительно общей массы композиции.
10. Композиция по п. 2, в которой смесь олигосахаридов присутствует в количестве 0,5-70 мас.%, более предпочтительно 1-20 мас.%, еще более предпочтительно 2-5 мас.% относительно общей массы композиции.
11. Композиция по п. 1, в которой длинноцепочечная полиненасыщенная жирная кислота (LC-PUFA) выбрана из арахидоновой кислоты (ARA) и докозагексаеновой кислоты (DHA), предпочтительно LC-PUFA представляет собой смесь арахидоновой и докозагексаеновой кислот.
12. Композиция по п. 2, в которой длинноцепочечная полиненасыщенная жирная кислота (LC-PUFA) выбрана из арахидоновой кислоты (ARA) и докозагексаеновой кислоты (DHA), предпочтительно LC-PUFA представляет собой смесь арахидоновой и докозагексаеновой кислот.
13. Композиция по п. 1, в которой пробиотик выбран из пробиотических бактериальных штаммов, предпочтительно пробиотиком являются лактобациллы или бифидобактерии, более предпочтительно пробиотиком являются Lactobacillus rhamnosus, Bifidobacterium lactis и Lactobacillus reuteri.
14. Композиция по п. 2, в которой пробиотик выбран из пробиотических бактериальных штаммов, предпочтительно пробиотиком являются лактобациллы или бифидобактерии, более предпочтительно пробиотиком являются Lactobacillus rhamnosus, Bifidobacterium lactis и Lactobacillus reuteri.
15. Композиция по п. 1, в которой N-ацетилированный олигосахарид выбран из группы, включающей лакто-N-неотетраозу (LNnT) и лакто-N-тетраозу (LNT).
16. Композиция по п. 2, в которой N-ацетилированный олигосахарид выбран из группы, включающей лакто-N-неотетраозу (LNnT) и лакто-N-тетраозу (LNT).
17. Композиция по п. 1, в которой сиалированный олигосахарид выбран из группы, включающей 3'-сиалиллактозу и 6'-сиалиллактозу, и предпочтительно сиалированный олигосахарид включает как 3'-сиалиллактозу, так и 6'-сиалиллактозу, причем соотношение между 3'-сиалиллактозой и 6'-сиалиллактозой составляет предпочтительно от 5:1 до 1:2.
18. Композиция по п. 2, в которой сиалированный олигосахарид выбран из группы, включающей 3'-сиалиллактозу и 6'-сиалиллактозу, и предпочтительно сиалированный олигосахарид включает как 3'-сиалиллактозу, так и 6'-сиалиллактозу, причем соотношение между 3'-сиалиллактозой и 6'-сиалиллактозой составляет предпочтительно от 5:1 до 1:2.
19. Композиция по п. 1, в которой нейтральный олигосахарид является 2'-фукозиллактозой (FL).
20. Композиция по п. 2, в которой нейтральный олигосахарид является 2'-фукозиллактозой (FL).
21. Композиция по п. 1, которая является смесью для питания недоношенных грудных детей, обогатителем женского молока, смесью для питания грудных детей, смесью для подрастающих младенцев, смесью для детского питания, зерновой смесью для питания грудных детей, молочной смесью при прикорме, лечебным пищевым продуктом для клинического питания или питательной добавкой, и предпочтительно указанная композиция является смесью для питания недоношенных грудных детей, обогатителем женского молока или питательной добавкой.
22. Композиция по п. 2, которая является смесью для питания недоношенных грудных детей, обогатителем женского молока, смесью для питания грудных детей, смесью для подрастающих младенцев, смесью для детского питания, зерновой смесью для питания грудных детей, молочной смесью при прикорме, лечебным пищевым продуктом для клинического питания или питательной добавкой, и предпочтительно указанная композиция является смесью для питания недоношенных грудных детей, обогатителем женского молока или питательной добавкой.
23. Композиция по п. 1 для применения у грудных и маленьких детей, предпочтительно грудных, родившихся недоношенными, или с низкой массой тела, или с задержкой внутриутробного роста, и/или с недостаточностью внутриутробного питания, и/или с повреждением кишечника, и/или после хирургического вмешательства.
24. Композиция по п. 2 для применения у грудных и маленьких детей, предпочтительно грудных, родившихся недоношенными, или с низкой массой тела, или с задержкой внутриутробного роста, и/или с недостаточностью внутриутробного питания, и/или с повреждением кишечника, и/или после хирургического вмешательства.
25. Применение композиции, содержащей по меньшей мере одну длинноцепочечную полиненасыщенную жирную кислоту (LC-PUFA), по меньшей мере один пробиотик и смесь олигосахаридов, причем указанная смесь включает по меньшей мере один N-ацетилированный олигосахарид, по меньшей мере один сиалированный олигосахарид и по меньшей мере один нейтральный олигосахарид, в качестве синтетического питательного агента для стимуляции ангиогенеза в кишечнике и всасывания питательных веществ, переносимости энтерального питания грудных детей или подрастающих младенцев.
26. Применение композиции, содержащей по меньшей мере одну длинноцепочечную полиненасыщенную жирную кислоту (LC-PUFA), по меньшей мере один пробиотик и смесь олигосахаридов, причем указанная смесь включает по меньшей мере один N-ацетилированный олигосахарид, по меньшей мере один сиалированный олигосахарид и по меньшей мере один нейтральный олигосахарид, в качестве синтетического питательного агента при профилактике и/или лечении воспалительного поражения кишечника, представляющего собой некротизирующий энтероколит, и/или при выздоровлении после повреждения и/или хирургического вмешательства в области кишечника грудных детей или подрастающих младенцев.
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Колосоуборка | 1923 |
|
SU2009A1 |
| РЕГЕНЕРАТОР СМАЗОЧНОГО МАСЛА | 1993 |
|
RU2072052C1 |
| СПЛАВ НА ОСНОВЕ ЦИНКА | 2006 |
|
RU2308498C1 |
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ ИЛИ ПРЕДУПРЕЖДЕНИЯ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ | 1997 |
|
RU2242974C2 |
| ЧУБЕНКО В.А | |||
| и др | |||
| Адъювантная терапия злокачественных новообразований желудочно-кишечного тракта | |||
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
Авторы
Даты
2017-07-03—Публикация
2012-10-15—Подача