ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится, в общем, к композициям и способам лечения или предупреждения воспалительных заболеваний.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Воспалительные заболевания, хронической или острой природы, представляют существенную проблему в системе здравоохранения. Вкратце, хроническое воспаление рассматривается как воспаление долговременной продолжительности (недель или месяцев), в котором активное воспаление, деструкция тканей и попытки репарации происходят одновременно (Robbins Pathological Basis of Disease by R.S.Cotran, V.Kumar, and S.L.Robbins, W.B.Saunders Co., p.75, 1989). Хотя хроническое воспаление может наступать после острого воспалительного приступа, оно может также начинаться в виде постепенно развивающегося процесса, который прогрессирует со временем, например, как результат хронической инфекции (например, туберкулеза, сифилиса, грибковой инфекции), которая вызывает аллергическую реакцию замедленного типа, продолжительного экспонирования с эндогенными (например, повышенным содержанием липидов плазмы) или экзогенными (например, диоксидом кремния, асбестом, сигаретной смолой, хирургическим шовным материалом) токсинами, или аутоиммунных реакций против собственных тканей организма (например, ревматоидный артрит, системная красная волчанка, множественный склероз, псориаз). Таким образом, хронические воспалительные заболевания включают в себя многочисленные общие медицинские состояния, такие как ревматоидный артрит, рестеноз, псориаз, множественный склероз, хирургические спайки, туберкулез и хронические воспалительные болезни легких (например, астма, пневмокониоз, хроническая обструктивная болезнь легких, назальные полипы и фиброз легких).
Псориаз
Псориаз представляет собой общее хроническое кожное заболевание, характеризующееся выпуклыми, воспаленными, утолщенными и чешуйчатыми повреждениями, которые вызывают зуд, чувство жжения, острой боли и легко кровоточат. У приблизительно 10% пациентов псориаз сопровождается выраженными артропатическими симптомами, которые сходны с изменениями, наблюдаемыми при ревматоидном артрите. Приблизительно 2-3% населения США страдает от псориаза, причем ежегодно диагностируются 250000 новых случаев заболевания.
В настоящее время, причина псориаза не известна, хотя имеется достаточное доказательство, что он представляет собой полигенное аутоиммунное нарушение. Кроме того, в настоящее время не существует средства для излечения псориаза. Доступные воздействия включают в себя локальные способы терапии, такие как стероидные кремы и мази, угольная смола и антралин, и системное лечение, такое как лечение стероидами, ультрафиолетом В, PUVA (пероральное введение псоралена и последующее экспонирование на длинноволновом ультрафиолетовом свету УФ-А), метотрексатом и циклоспорином. Однако неудовлетворительные скорости ремиссии и/или потенциально серьезные побочные эффекты характеризуют большинство из способов терапии псориаза. Общая стоимость лечения псориаза в Соединенных Штатах оценивается суммой между 3 и 5 биллионами долларов в год, что делает псориаз основной проблемой здравоохранения.
Рассеянный склероз
Рассеянный склероз (PC), поражающий 350000 человек (отношение женщины:мужчины = 2:1) в Соединенных Штатах, с 8000 новыми случаями заболевания, сообщаемыми каждый год, является наиболее обычным хроническим воспалительным заболеванием, затрагивающим нервную систему. Обычно PC проявляется клинически в виде повторяющихся приступов неблагоприятных неврологических расстройств, имеющих место на протяжении периода нескольких лет. При грубой оценке половина случаев заболеваний PC прогрессируют в более хроническую фазу. Хотя это заболевание не приводит к ранней смерти или ухудшению функций познания, оно делает пациента инвалидом вследствие нарушения остроты зрения, стимуляции диплопии, нарушения двигательных функций, влияющего на ходьбу и использование рук, индуцирования недержания кишечника и мочевого пузыря, спастичности и нарушений чувствительности (чувствительности к прикосновению, болевой чувствительности и температурной чувствительности).
Причина PC не известна, хотя имеется значительное количество доказательств того, что он представляет собой аутоиммунное заболевание. В настоящее время нет средства излечения рассеянного склероза, и существующие терапевтические схемы лечения являются лишь частично успешными. Например, хотя химиотерапевтические агенты, такие как метотрексат, циклоспорин и азатиоприн, были испытаны для лечения пациентов с не поддающимся излечению прогрессирующим заболеванием, до настоящего времени были продемонстрированы минимальные долгосрочные благоприятные эффекты.
Другие терапевтические средства, которые были недавно одобрены, включают в себя интерферон-β для применения в случае амбулаторных пациентов с рецидивами/ремиссиями PC (Paty et al., Neurology 43: 662-667, 1993), в частности, бетасерон (рекомбинантный интерферон-β-1β; человеческий интерферон бета, замещенный в положении 17, Cys® Ser; Berlex/Chiron) или авонекс (рекомбинантный интерферон β-1α; гликозилированный человеческий интерферон бета, продуцируемый в клетках млекопитающего; Biogen). К сожалению, хотя бетасерон обеспечивает улучшенное качество жизни для пациентов с PC, прогрессирование заболевания, по-видимому, не улучшается значимо. Вредные побочные эффекты, связанные с терапией с использованием бетасерона, включают в себя: реакции в месте инъецирования (воспаление, боль, аллергию и некроз) и комплекс подобных гриппу симптомов (лихорадочное состояние, ознобы, беспокойство и спутанность сознания).
Ревматоидный артрит
Ревматоидный артрит (РА) представляет собой изнуряющее, хроническое воспалительное заболевание, поражающее 1-2% населения мира. Это состояние вызывает боль, распухание и разрушение многочисленных суставов тела и может также приводить к повреждению в других органах, таких как легкие и почки. Лица с прогрессирующим заболеванием имеют более высокий коэффициент смертности, чем некоторые формы рака, и вследствие этого лечебные схемы были смещены в сторону агрессивной ранней лекарственной терапии, предназначенной для уменьшения вероятности необратимого повреждения суставов. Недавние рекомендации Американского Колледжа Ревматологии (Arthritis and Rheumatism 39(5): 713-722, 1996) включают в себя раннюю инициацию модифицирующей болезнь терапии антиревматическим лекарственным средством (DMARD) для любого пациента с установленным диагнозом и соответствующими симптомами. Противораковые лекарственные средства стали первоочередной терапией для огромного большинства пациентов, причем 60-70% ревматологов предпочли химиотерапевтическое средство, метотрексат. Тяжесть заболевания часто оправдывает неограниченную еженедельную терапию этим лекарственным средством и, в случае пациентов, болезнь которых прогрессирует, несмотря на лечение метотрексатом (свыше 50% пациентов), часто используют химиотерапевтические лекарственные средства второй очереди, такие как циклоспорин и азатиоприн (отдельно или в сочетании).
Рестеноз
Рестеноз представляет собой форму сосудистого повреждения, приводящего к утолщению стенки сосуда и утрате тока крови к ткани, снабжаемой этим кровеносным сосудом. Это происходит в ответ на процедуры пластики сосудов, в том числе фактически любое манипулирование, которое направлено на ослабление закупорок сосудов, и является главным фактором, ограничивающим эффективность инвазивных способов лечения сосудистых заболеваний. Рестеноз был основным объектом внимания сердечно-сосудистых исследований на протяжении последних 15 лет. Согласно оценкам 1994 года (U.S.Heart and Stroke Foundation), свыше 60 миллионов американцев имеют одну или более форм сердечно-сосудистого заболевания. Эти заболевания, унесшие приблизительно 1 миллион жизней в том же году (41% всех смертей в Соединенных Штатах), считаются основной причиной смерти и нарушения трудоспособности в развитом обществе.
В настоящее время нет технически одобренных способов предупреждения рестеноза, эффективных для человека. Системные терапии, которые были исследованы, включают в себя агенты, направленные на снижение потери эндотелиальных клеток, антитромбоцитарные агенты (например, аспирин), сосудорасширяющие средства (например, блокаторы кальциевых каналов), антитромботические средства (например, гепарин), противовоспалительные средства (например, стероиды), средства, предотвращающие пролиферацию клеток гладких мышц сосудов (VSMC) (например, колхицин) и стимуляторы повторной эндотелиализации (например, фактор роста эндотелия сосудов). Местные обработки, которые были исследованы, включают в себя местную доставку лекарственных средств (например, гепарина) и бета- и гамма-излучение. Все они были неутешительными в применении к человеку, прежде всего потому, что они, по-видимому, действуют на ограниченную часть процесса рестеноза. Системные способы лечения встретились также с дополнительной проблемой достижения адекватного всасывания и удерживания лекарственного средства в месте этого нарушения для обеспечения продолжительного биологического эффекта, без индуцирования неблагоприятных системных осложнений и токсичности.
Воспалительная болезнь кишечника
Термин воспалительная болезнь кишечника (IBD) относится к хроническим расстройствам (первоначально называемым болезнью Крона и язвенным колитом), которые вызывают воспаление или изъязвление в тонкой и толстой кишках. Вкратце, приблизительно 2 миллиона людей в Соединенных Штатах страдают от IBD, причем мужчины и женщины поражаются в равной степени. Пик частоты заболеваний первично наблюдается между возрастом 15 и 30 лет, а второй сообщенный пик частоты заболеваний находится между возрастом 55 и 60 лет. Хотя документированы многие распределения уровня распространения заболевания, причина этого заболевания не известна.
IBD часто характеризуется чередующимися периодами ремиссии с последующими периодами непредсказуемого рецидива или внезапного обострения болезни. Приблизительно 50% пациентов пребывают в ремиссии в любое время, и большинство страдают, по меньшей мере, от одного рецидива в период 10 лет. Кроме того, имеется много системных осложнений, которые сопровождают это заболевание, причем наиболее обычным является артрит. Симптомы артрита имеют место у 1/4 всех людей с IBD. Воспаление суставов имеет место наиболее часто, когда в процесс вовлечена ободочная кишка, и внезапно обостряется, когда заболевание кишечника является наиболее активным. Эта форма воспалительного артрита не вызывает перманентного дефекта и часто является кратковременной. Другие осложнения этого заболевания включают в себя воспаление глаз (ирит, конъюнктивит и эписклерит), воспаление полости рта (мукозит), воспаление кожи (нодозная эритема и гангренозная пиодерма), мышечно-скелетные расстройства (анкилозирующий спондилит), почечные осложнения (почечные камни и свищи мочеиспускательного канала), желчные конкременты и другие заболевания печени (например, гепатит) и билиарной системы (склерозирующий холангит). К сожалению, во многих случаях долговременное (>10 лет) заболевание может приводить к более тяжелым осложнениям, таким как рак ободочной кишки и внекишечные карциномы.
В настоящее время IBD является неизлечимым. Многие существующие терапевтические агенты фокусируются на борьбе с симптомами этого заболевания посредством суппрессии воспаления, связанного с этим заболеванием. Основные лекарственные средства, используемые для лечения IBD, представляют собой аминосалицилаты и кортикостероиды, и для тех индивидуумов, которые не реагируют хорошо на эти агенты, могут быть также использованы антибиотики и иммуносуппрессивные лекарственные средства. Хотя лекарственное лечение является эффективным для 70-80% пациентов, для индивидуумов, имеющих более активное заболевание, часто требуется хирургия. Хронические симптомы и осложнения, связанные с активным заболеванием, такие как закупорка кишечника, прободение, абсцесс или кровотечение, могут быть ослаблены и корректированы инвазивной хирургией. Хотя хирургия не излечивает это заболевание перманентно и частота рецидивов является высокой, она действительно ослабляет активные симптомы.
Хирургические спайки
Хирургическое спайкообразование, сложный процесс, в котором ткани тела, которые в норме являются отдельными, срастаются вместе, наблюдается наиболее часто как результат хирургической травмы. Эти послеоперационные спайки имеют место у 60-90% пациентов, подвергающихся гинекологической хирургии, и являются одной из наиболее обычных причин закупорки сосудов в индустриализованном мире. Эти спайки являются главной причиной неудачного хирургического лечения и являются первоочередной причиной закупорки кишечника и бесплодия. Другие связанные со спайками осложнения включают в себя хроническую боль в области таза, закупорку мочеиспускательного канала и нарушение функции опорожнения (удаления каловых масс или мочевыделения). В настоящее время для ингибирования спайкообразования используют превентивные терапии, проводимые 4-5 дней после хирургии. Были испытаны различные способы предотвращения спайкообразования, в том числе (1) предупреждение отложения фибрина, (2) снижение локального воспаления тканей и (3) удаление отложений фибрина. Отложение фибрина предотвращается посредством применения физических барьеров, которые являются либо механическими, либо состоящими из вязких растворов. Хотя многие исследователи используют барьеры предупреждения спаек, существует целый ряд технических трудностей. Воспаление уменьшают введением лекарственных средств, таких как кортикостероиды и нестероидные противовоспалительные средства. Однако результаты использования этих лекарственных средств в моделях животных не были обнадеживающими вследствие степени воспалительного ответа и ограничения дозы из-за системных побочных эффектов. Наконец, удаление отложений фибрина исследовали с применением протеолитических и фибринолитических ферментов. Потенциальным осложнением для клинического применения этих ферментов является возможность избыточного кровотечения.
Воспалительные заболевания легких
Хронические воспалительных заболевания легких, в том числе, например, астма, пневмокониоз, хроническая обструктивная болезнь легких, назальные полипы и фиброз легких, поражают многих людей по всему свету. Обычно такие заболевания характеризуются инвазивным воспалительным процессом и утолщением пораженных тканей.
Например, назальные полипы характеризуются утолщенной тканью выстилки носа. Полипы могут встречаться в респираторных заболеваниях, таких как астма, муковисцидоэ, первичная цилиарная дискинезия и иммунодефициты. Считают, что назальные полипы развиваются как манифестация хронических воспалительных процессов, вовлекающих верхние дыхательные пути. Они были обнаружены в 36% пациентов с непереносимостью в отношении аспирина, 7% пациентов с астмой, 0,1% у детей и приблизительно 20% пациентов с муковисцидозом. Другими состояниями, связанными с назальными полипами, являются синдром Churg-Strauss, аллергический грибковый синусит и синдром цилиарной дискинезии и синдром Янга. Приблизительно 40% пациентов с хирургическими полипэктомиями имеют рецидивы (Settipane, Allergy Asthma Proc. 17(5): 231-236, 1996).
Основными симптомами назального полипоза являются носовые обструкции и нарушение обоняния. Целями лекарственного лечения назального полипоза являются (1) устранение назальных полипов и симптомов ринита, (2) восстановление дыхания через нос и обоняния и (3) предотвращение рецидива. Закупорка носового хода небольшим количеством больших полипов может лечиться простой полипэктомией, чтобы помочь пациенту дышать через нос. Целью хирургии является восстановление физиологических свойств носа путем освобождения этого дыхательного пути от полипов, насколько это возможно, и создания возможности дренирования инфицированных пазух. Однако рецидивирующий назальный полипоз является одной из наиболее обычных нерешенных проблем клинической ринологии. Дополняющая лекарственная обработка полипоза всегда является необходимой, так как хирургия не может излечить воспалительную составляющую этого заболевания слизистой оболочки. Местные кортикостероиды являются наиболее широко используемыми лекарственными средствами для уменьшения размера полипов и для предупреждения рецидива после хирургии. Стероиды уменьшают ринит, улучшают дыхание через нос, уменьшают размер полипов и уменьшают частоту рецидивов, но они оказывают незначительное действие на обоняние и на любую патологию пазух. Однако использование стероидов при полипозе связано с инфекционными осложнениями, которые требуют применения антибиотиков. Другие лекарственные средства для лечения назального полипоза включают в себя антагонисты H1-рецептора (например, азеластин-НСl) и антидиуретические (мочегонные) средства (например, фуросемид). Эти способы лечения не всегда являются эффективными и частота рецидивов все еще остается очень высокой. Современное лекарственное лечение назального полипоза использует кортикостероиды для ослабления симптомов этого заболевания, но оно не действует против лежащей в основе патологии этого заболевания. Кроме того, у пациентов с назальными полипами наблюдали рецидив заболевания или устойчивость к стероидной терапии.
Отторжение трансплантата
Отторжение трансплантата является сложным процессом, при помощи которого трансплантированная ткань узнается как чужеродная иммунной системой хозяина. На основе морфологии и основного механизма реакции подразделяются на три категории: сверхострые, острые и хронические. С устранением риска инфекции и раннего (острого) отторжения при помощи иммуносупрессивной терапии хроническое отторжение стало все более важной причиной дисфункции трансплантата и конечной неудачи при трансплантации. В настоящее время хроническое васкулярное отторжение является основной причиной смерти или неуспешной трансплантации в реципиентах трансплантируемого сердца по прошествии первого года.
Данное изобретение обеспечивает композиции и способы, пригодные для лечения или предупреждения воспалительных заболеваний. Эти композиции и способы направлены на решение проблем, связанных с существующими процедурами, предоставляют значительные преимущества при сравнении с существующими процедурами и обеспечивают дополнительно другие, связанные с ними преимущества.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Вкратце, данное изобретение обеспечивает способы лечения или предупреждения воспалительных заболеваний, включающие в себя доставку к месту воспаления антимикротрубочкового агента (агента, действующего на микротрубочки). Характерные примеры таких агентов включают в себя таксаны (например, паклитаксел и доцетаксел), кампотецин, элеутеробин, саркодиктины, эпотилоны А и В, дискодермолид, оксид дейтерия (D2O), гексиленгликоль (2-метил-2,4-пентандиол), туберцидин (7-деазааденозин), LY290181 (2-амино-4-(3-пиридил)-4Н-нафтол(1,2-b)пиран-3-карбонитрил), фторид алюминия, бис-(сукцинимидилсукцинат)этиленгликоля, этиловый эфир глицина, моноклональные антиидиотипические антитела, белок, стимулирующий сборку микротрубочек (таксолоподобный белок, TALP), набухание клеток, индуцированное гипотоническими (190 мосмоль/л) условиями, инсулином (100 нмоль/л) или глутамином (10 ммоль/л), связывание динеина, гибберелин, ХСНO1 (кинезиноподобный белок), лизофосфатидную кислоту, ион лития, компоненты клеточной стенки растений (например, поли-L-лизин и экстензин), буферы с глицерином, буфер с Тритоном Х-100, стабилизирующий микротрубочки, связанные с микротрубочками белки (например, МАР2, МАР4, тау, большой тау, энсконзин, фактор элонгации 1-α (EF-1α) и Е-МАР-115), клеточные частицы (например, гистон H1, миелиновый основной белок и кинетохоры), эндогенные микротрубочковые структуры (например, аксонемные структуры, макромолекулярные комплексы ферментов, формирующие поры в клеточной мембране и GTP-кэпы), стабильный трубочковый единственный полипептид (например, STOP145 и STOP220) и напряжение от митотических сил, а также любые аналоги и производные любого из вышеописанных агентов. В других вариантах антимикротрубочковый агент готовят таким образом, чтобы он дополнительно содержал полимер.
Характерные примеры воспалительных заболеваний, которые могут быть подвергнуты лечению, включают в себя множественный склероз, псориаз, артрит, стеноз, отторжение трансплантата, хирургические спайки, воспалительное заболевание кишечника и воспалительное заболевание легких.
В некоторых вариантах данного изобретения антимикротрубочковые агенты могут быть приготовлены вместе с другими соединениями или композициями, такими как, например, мазь, крем, лосьон, гель, спрей или т.п. В некоторых вариантах эти соединения или композиция могут функционировать в качестве носителя, который может быть полимерным или неполимерным. Характерные примеры полимерных носителей включают в себя поли(этиленвинилацетат), сополимеры молочной кислоты и гликолевой кислоты, поли(капролактон), поли( молочную кислоту), сополимеры поли(молочной кислоты) и поли(капролактона), желатин, гиалуроновую кислоту, коллагеновые матриксы и альбумин. Характерные примеры других подходящих носителей включают в себя, но не ограничиваются ими, этанол; смеси этанола и гликолей (например, этиленгликоля или пропиленгликоля); смеси этанола и изопропилмиристата или этанола, изопропилмиристата и воды (например, 55:5:40); смеси этанола и эйнеола или D-лимонена (с водой или без воды; гликоли (например, этиленгликоль или пропиленгликоль) и смеси гликолей, такие как пропиленгликоль и вода, фосфатидилглицерин, диолеоилфосфатидилглицерин, Транскутол®, или терпинолен; смеси изопропилмиристата и 1-гексил-2-пирролидона, N-додецил-2-пиперидинона или 1-гексил-2-пирролидона.
Еще в других аспектах, антимикротрубочковый агент может быть приготовлен таким образом, что он содержится в хирургическом или медицинском устройстве или имплантате или приспособлен к высвобождению таким устройством или имплантатом, таким как, например, стенты, шовные материалы, постоянные катетеры, протезы и т.п.
Эти и другие аспекты данного изобретения станут очевидными при ссылке на следующее подробное описание и прилагаемые рисунки. Кроме того, ниже изложены различные ссылки, которые описывают более детально определенные процедуры, устройства или композиции и, следовательно, включены ссылкой во всей полноте.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
Фиг.1А - график, показывающий реакцию хемилюминесценции нейтрофилов (5×106 клеток/мл) на опсонизированные плазмой кристаллы CPPD (50 мг/мл). Действие паклитаксела (также называемого "таксолом") при (o) без паклитаксела, (•) 4,5 мкМ, (Δ) 14 мкМ, (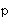 ) 28 мкМ,
) 28 мкМ,  46 мкМ; n=3.
46 мкМ; n=3.
Фиг.1В - график, показывающий концентрационную зависимость временного хода ингибирования паклитаксела индуцированной опсонизированными плазмой кристаллами CPPD хемилюминесценции.
Фиг.1С - график, показывающий действие фторида алюминия на индуцированную опсонизированным зимозаном активацию нейтрофилов, измеренное по хемилюминесценции.
Фиг.1D - график, показывающий действие этилового эфира глицина на индуцированную опсонизированным зимозаном активацию нейтрофилов, измеренное по хемилюминесценции.
Фиг.1E - график, показывающий действие LY290181 на индуцированную опсонизированным зимозаном активацию нейтрофилов, измеренное по хемилюминесценции.
Фиг.2 - график, показывающий высвобождение лизоцима из нейтрофилов (5×106 клеток/мл) в ответ на опсонизированные плазмой кристаллы CPPD (50 мг/мл). Действие паклитаксела при (o) без паклитаксела, (•) 28 мкМ, (Δ) контроль (только клетки), (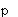 ) контроль (клетки и паклитаксел при 28 мкМ); n=3.
) контроль (клетки и паклитаксел при 28 мкМ); n=3.
Фиг.3А - график, показывающий образование супероксидного аниона нейтрофилами (5×106 клеток/мл) в ответ на опсонизированные плазмой кристаллы CPPD (50 мг/мл). Действие паклитаксела при (o) без паклитаксела, (•) 28 мкМ, (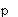 ) контроль (только клетки); n=3.
) контроль (только клетки); n=3.
Фиг.3В - график, показывающий концентрационную зависимость временного хода ингибирования паклитакселом индуцированного опсонизированными плазмой кристаллами CPPD образования супероксидного аниона нейтрофилами; n=3.
Фиг.3С - график, изображающий действие LY290181 на индуцированное кристаллами CPPD образование супероксидного аниона нейтрофилами.
Фиг.4А - график, показывающий реакцию хемилюминесценции нейтрофилов (5×106 клеток/мл) на опсонизированный плазмой зимозан (1 мг/мл). Действие паклитаксела при (o) без паклитаксела, (•) 28 мкМ; n=3.
Фиг.4В - график, показывающий индуцированное опсонизированным плазмой зимозаном образование супероксидного аниона. Действие паклитаксела при (o) без паклитаксела, (•) 28 мкМ, (Δ) контроль (только клетки); n=3.
Фиг.5А - график, показывающий высвобождение миелопероксидазы из нейтрофилов (5×106 клеток/мл) в ответ на опсонизированные плазмой кристаллы CPPD (50 мг/мл). Действие паклитаксела при (o) без паклитаксела, (•) 28 мкМ, (Δ) контроль (только клетки), ( ) контроль (клетки с паклитакселом при 28 мкМ); n=3.
) контроль (клетки с паклитакселом при 28 мкМ); n=3.
Фиг.5В - график, показывающий концентрационную зависимость ингибирования паклитакселом высвобождения миелопероксидазы из нейтрофилов в ответ на опсонизированные плазмой кристаллы CPPD; n=3.
Фиг.5С и 5D - графики, показывающие, что LY290181 уменьшает высвобождение как лизозима, так и миелопероксидазы в индуцированных кристаллами CPPD нейтрофилах.
Фиг.6 - график, показывающий пролиферацию синовиоцитов при различных концентрациях паклитаксела.
Фиг.7 - график, показывающий действия паклитаксела на кератиноциты in vitro.
Фиг.8А и 8В показывают действие паклитаксела на морфологию астроцитов. Электронно-микроскопические изображения выявили толстые, хорошо организованные нитевидные отростки в астроцитах трансгенных контрольных животных, тогда как трансгенные животные, обработанные паклитакселом, имели морфологически измененные астроциты. Паклитаксел индуцировал округление астроцита, утончал клеточные отростки и уменьшал цитоплазматические филаменты в сравнении с необработанными животными.
Фиг.9 - график, показывающий жизнеспособность клеток ЕОМА, обработанных концентрациями паклитаксела, большими, чем 10-8 М.
Фиг.10 - диаграмма, изображающая процент апоптотических клеток ЕОМА в культуре, обработанной увеличивающимися концентрациями паклитаксела.
Фиг.11А-11Е - графики, изображающие действие различных антитрубочковых агентов на синовиоциты после периода 24 часов.
Фиг.12А-12Н - блоты, показывающие действие различных антимикротрубочковых агентов в ингибировании экспрессии коллагеназы.
Фиг.13А-13Н - блоты, показывающие действие различных антимикротрубочковых агентов на экспрессию протеогликана.
Фиг.14А и 14В - две фотографии САМ, имеющей опухоль, обработанной контрольной (ненагруженной) термопастой. Вкратце, на Фиг.14А центральная белая масса является тканью опухоли. Обратите внимание на обилие кровеносных сосудов, входящих в опухоль из САМ во всех направлениях. Опухоль индуцирует врастание сосудистой сети хозяина путем образования "ангиогенных факторов". Опухоль расширяется дистально вдоль кровеносных сосудов, которые снабжают ее. Фиг.14В является видом снизу САМ, показанной на Фиг.15А. Вкратце, этот вид демонстрирует радиальный вид кровеносных сосудов, которые входят в опухоль подобно спицам колеса. Обратите внимание на то, что плотность кровеносных сосудов больше вблизи опухоли, чем в окружающей нормальной ткани САМ.
Фиг.14С и 14D - две фотографии САМ, имеющей опухоль, обработанной нагруженной 20% паклитакселом термопастой. Вкратце, на Фиг.14С центральная белая масса является тканью опухоли. Обратите внимание на малочисленность кровеносных сосудов вблизи ткани опухоли. Замедленное высвобождение антимикротрубочкового агента способно преодолевать ангиогенный стимул, продуцируемый опухолью. Сама опухоль слабо васкуляризована и прогрессивно уменьшается в размере.
Фиг.14D является видом снизу САМ, показанной на Фиг.14С, и демонстрирует нарушение кровотока в опухоль в сравнении с контрольной опухолевой тканью. Обратите внимание на то, что плотность кровеносных сосудов уменьшается вблизи опухоли и является более скудной, чем плотность нормальной окружающей ткани САМ.
Фиг.15А является фотографией, показывающей культуру яйца без оболочки на 6-й день.
Фиг.15В - дискретизованное компьютерное изображение, полученное при помощи стереомикроскопа, живых неокрашенных капилляров (1040×). Фиг.15С - фотография коррозионных заливок, показывающая капиллярную сеть хорионаллантоисной мембраны (САМ), которая снабжается более крупными, лежащими ниже сосудами (стрелки; 1300×).
Фиг.15D - фотография, изображающая пластиковый срез толщиной 0,5 мм, проходящий поперек САМ и регистрируемый на уровне светового микроскопа. Эта фотография показывает состав САМ, в том числе наружную двухслойную эктодерму (Ее), мезодерму (М), содержащую капилляры (стрелки) и рассеянные адвентициальные клетки и однослойную эндодерму (En) (400×).
Фиг.15Е - фотография на уровне электронного микроскопа (3500×), где представлена типичная капиллярная структура, показывающая тонкостенные эндотелиальные клетки (головки стрелок) и связанный с ними перицит (адвентициальную клетку).
Фиг.16А, 16В, 16С и 16D - серия дискретизованных изображений четырех различных неокрашенных САМ, полученных после 48-часовой экспозиции с 10 мкг паклитаксела на 10 мл метилцеллюлоэы. Прозрачный диск метилцеллюлозы (*), содержащей паклитаксел, присутствует на каждой САМ и расположен на отдельной бессосудистой зоне (А) с окружающими кровяными островками (Is). Эти лишенные сосудов зоны простираются за пределы диска и обычно имеют диаметр приблизительно 6 мм.
Фиг.16D иллюстрирует типичный эффект "локтевого загибания" (головки стрелок) как малых, так и больших сосудов, меняющих направление прочь от периферии бессосудистой зоны.
Фиг.17А - фотография (=400×), показывающая, что капилляры (головки стрелок), непосредственно периферические относительно бессосудистой зоны, обнаруживают многочисленные эндотелиальные клетки с задержанным митозом. Эктодерма (Еc); мезодерма (М); эндодерма (En).
Фиг.17В (=400×) показывает, что в бессосудистой зоне типичная капиллярная структура была ликвидирована и имеются многочисленные транссудированные клетки крови (головки стрелок). Фиг.17С (=400×) показывает, что в центральном участке бессосудистой зоны эритроциты диспергированы по мезодерме.
Фиг.18А (=2200×) показывает небольшой капилляр, лежащий рядом с эктодермальным слоем (Еc), имеющий три эндотелиальные клетки, задержанные в митозе (*). Несколько других типов клеток как в эктодерме, так и в мезодерме также задержаны в митозе.
Фиг.18В (=2800×) показывает раннюю лишенную сосудов фазу, которая содержит транссудированные клетки крови рядом с эктодермой; эти клетки крови смешаны с предположительными эндотелиальными клетками (*) и их отростками. Показаны деградированные клеточные вакуоли (головки стрелок). Фиг.18С (=2800х) показывает, что в ответ на паклитаксел поверхность раздела эктодермы-мезодермы становится заселенной клетками в различных стадиях деструкции, содержащих густо расположенные вакуоли и гранулы (головки стрелок).
Фиг.19А схематически изображает транскрипционную регуляцию металлопротеиназ матрикса.
Фиг.19В - блот, демонстрирующий, что IL-1 стимулирует транскрипционную активность АР-1.
Фиг.19С - диаграмма, показывающая, что индуцированная IL-1 связывающая активность уменьшалась в лизатах из хондроцитов, которые были предобработаны паклитакселом.
Фиг.20 - блот, показывающий, что индукция IL-1 увеличивает уровни РНК коллагеназы и стромелизина в хондроцитах и что эта индукция ингибируется предобработкой паклитакселом.
Фиг.21 - диаграмма, показывающая действие паклитаксела на жизнеспособность нормальных хондроцитов in vitro.
Фиг.22 - график, показывающий наблюдаемую кинетическую деструкцию псевдопервого порядка паклитаксела (20 мкг на мл-1 в растворах 10% HPβCD и 10% HPβCD при 37°С и рН 3,7 и 4,9 соответственно.
Фиг.23 - график, показывающий фазовую растворимость для циклодекстринов и паклитаксела в воде при 37°С.
Фиг.24 - график, показывающий графики второго порядка комплексообразования паклитаксела и γCD, HPβCD и HPγCD при 37°С.
Фиг.25 - таблица, показывающая температуру плавления, энтальпию, молекулярную массу, полидисперсность и характеристическую вязкость композиции PDLLA-PEG-PDLLA.
Фиг.26 - график, изображающий термограммы ДСК (дифференциальной сканирующей калориметрии) PDLLA-PEG-PDLLA и PEG. Скорость нагревания была 10°С/мин. См. Фиг.30 в отношении температур плавления и энтальпий.
Фиг.27 - график, показывающий кумулятивное высвобождение паклитаксела из нагруженных 20% паклитакселом цилиндров PDLLA-PEG-PDLLA в ЗФР-альбуминовый буфер при 37°С. Столбики ошибок обозначают стандартное отклонение 4 проб. Цилиндры из 40% ПЭГ прекращали исследовать при 4 днях из-за разрушения.
Фиг.28А, 28В и 28С - графики, показывающие изменение в размерах, длине (А), диаметре (В) и сыром весе (С) нагруженных 20% паклитакселом цилиндров PDLLA-PEG-PDLLA во время высвобождения паклитаксела in vitro при 37°С.
Фиг.29 - таблица, показывающая потерю массы и изменение полимерного состава цилиндров PDLLA-PEG-PDLLA (нагруженных 20% паклитакселом) во время высвобождения в ЗФР-альбуминовый буфер при 37°С.
Фиг.30 - график, показывающий гель-фильтрационные хроматограммы цилиндров PDLLA-PEG-PDLLA (20% ПЭГ, диаметр 1 мм), нагруженных 20% паклитакселом, во время высвобождения в ЗФР-альбуминовый буфер при 37°С.
Фиг.31А, 31В, 31С и 31D являются фотографиями растровой (сканирующей) электронной микроскопии (РЭМ) высушенных цилиндров PDLLA-PEG-PDLLA (нагруженных 20% паклитакселом, диаметр 1 мм) перед высвобождением паклитаксела и во время высвобождения паклитаксела. А: 20% ПЭГ, день 0; В: 30% ПЭГ, день 0; С: 20% ПЭГ, день 69; D: 30% ПЭГ, день 69.
Фиг.32 - график, показывающий кумулятивное высвобождение паклитаксела из нагруженных 20% паклитакселом смесей PDLLA-PCL и PCL в ЗФР-альбуминовый буфер при 37°С. Столбики ошибок обозначают стандартные отклонения 4 проб.
Фиг.33 - график, показывающий временной ход высвобождения паклитаксела из PCL-паст в ЗФР при 37°С. PCL-пасты содержат микрочастицы паклитаксела и различных добавок, приготовленные с применением меш №140. Столбики ошибок обозначают стандартное отклонение 3 проб.
Фиг.34 - график, показывающий временной ход высвобождения паклитаксела из паст паклитаксел-желатин-PCL в ЗФР при 37°С. Этот график показывает влияние концентрации желатина (меш №140) и размера паклитаксел-желатиновых (1:1) микрочастиц, приготовленных с применением меш №140 или меш №60. Столбики ошибок обозначают стандартное отклонение 3 проб.
Фиг.35А и 35В - графики, показывающие влияние добавок (17А; меш №140) и размера микрочастиц (17В; меш №140 или №60) и доли добавки (меш №140) на свойства набухания PCL-паст, содержащих 20% паклитаксел, после суспендирования в дистиллированной воде при 37°С. Измерения для пасты, приготовленной с микрочастицами 270 мкм в паклитаксел-желатине, и пасты, содержащей 30% желатин, прекращали после 4 часов из-за распада матрикса. Столбики ошибок обозначают стандартное отклонение 3 проб.
Фиг.36А, 36В, 36С и 36D представляют собой репрезентативные сканирующие электронные микрофотографии паст паклитаксел-желатин-PCL (20:20:60) до (36А) и после (36В) суспендирования в дистиллированной воде при 37°С в течение 6 часов. Микрофотографии 36С и 36D являются более высокими увеличениями 36В, показывающими тонкую связь паклитаксела (в форме палочек) и желатинового матрикса.
Фиг.37А и 37В представляют собой репрезентативные микрофотографии САМ, обработанных пастами желатин-PCL (37А) и паклитаксел-желатин-PCL (20:20:60; 37В), показывающие зоны, лишенные сосудов, в обработанных паклитакселом САМ.
Фиг.38 - график, показывающий фазовую растворимость для циклодекстринов и паклитаксела в воде при 37°С.
Фиг.39 - график, показывающий графики второго порядка комплексообразования паклитаксела и γCD, HPβCD или HPγCD при 37°С.
Фиг.40 - график, показывающий фазовую растворимость для паклитаксела при 37°С и гидроксипропил-β-циклодекстрина в растворах 50:50 вода:этанол.
Фиг.41 - график, показывающий профили скоростей растворения в 0,5, 10 или 20% растворах HPγCD при 37°С.
Фиг.42 - график, показывающий наблюдаемую кинетическую деструкцию псевдо-первого порядка паклитаксела (20 мкг/мл) в растворах 10% HPβCD и 10% HPγCD при 37°С и рН 3,7 и 4,9 соответственно.
Фиг.43А и 43В соответственно представляют собой две фотографии, показывающие высвобождение паклитаксела из пленок EVA и процент паклитаксела, остающегося в тех же пленках во времени.
Фиг.43С - график, показывающий набухание пленок EVA/F127 без паклитаксела во времени.
Фиг.43D - рафик, показывающий набухание пленок EVA/Span 80 без паклитаксела во времени.
Фиг.43Е - график, показывающий кривую зависимости напряжения от деформации (диаграмму напряжения) для различных смесей EVA/F127.
Фиг.44 - график, показывающий действие опсонизации плазмой полимерных микросфер на реакцию хемилюминесценции нейтрофилов (20 мг/мл микросфер в 0,5 мл клеток (конц. 5×106 клеток/мл)] на микросферы PCL.
Фиг.45 - график, показывающий влияние предварительного покрытия плазмой +/-2% плуроником F127 на реакцию хемилюминесценции нейтрофилов (5×106 клеток/мл) на микросферы PCL.
Фиг.46 - график, показывающий влияние предварительного покрытия плазмой +/-2% плуроником F127 на реакцию хемилюминесценции нейтрофилов (5×106 клеток/мл) на микросферы РММА.
Фиг.47 - график, показывающий влияние предварительного покрытия плазмой +/-2% плуроником F127 на реакцию хемилюминесценции нейтрофилов (5×106 клеток/мл) на микросферы PLA.
Фиг.48 - график, показывающий влияние предварительного покрытия плазмой +/-2% плуроником F127 на реакцию хемилюминесценции нейтрофилов (5×106 клеток/мл) на микросферы EVA:PLA.
Фиг.49 - график, показывающий влияние предварительного покрытия IgG (2 мг/мл) или 2% плуроником F127 и затем IgG (2 мг/мл) на реакцию хемилюминесценции нейтрофилов на микросферы PCL.
Фиг.50 - график, показывающий влияние предварительного покрытия IgG (2 мг/мл) или 2% плуроником F127 и затем IgG (2 мг/мл) на реакцию хемилюминесценции нейтрофилов на микросферы РММА.
Фиг.51 - график, показывающий влияние предварительного покрытия IgG (2 мг/мл) или 2% плуроником F127 и затем IgG (2 мг/мл) на реакцию хемилюминесценции нейтрофилов на микросферы PVA.
Фиг.52 - график, показывающий влияние предварительного покрытия IgG (2 мг/мл) или 2% плуроником F127 и затем IgG (2 мг/мл) на реакцию хемилюминесценции нейтрофилов на микросферы EVA:PLA.
Фиг.53А - график, показывающий профили скоростей высвобождения из поликапролактоновых микросфер, содержащих 1, 2, 5 или 10% паклитаксел, в забуференный фосфатом раствор при 37°С.
Фиг.53В - фотография, показывающая САМ, обработанную контрольными микросферами.
Фиг.53С - фотография, показывающая САМ, обработанную нагруженными 5% паклитакселом микросферами.
Фиг.54 - график, показывающий диапазон размеров частиц для контрольных микросфер (PLLA:GA-85:15).
Фиг.55 - график, показывающий диапазон размеров частиц для нагруженных 20% паклитакселом микросфер (PLLA:GA-5:15).
Фиг.56 - график, показывающий диапазон размеров частиц для контрольных микросфер (PLLA:GA - 85:15).
Фиг.57 - график, показывающий диапазон размеров частиц для нагруженных 20% паклитакселом микросфер (PLLA:GA - 85:15).
Фиг.58А, 58В и 58С - графики, показывающие зависимость профилей скоростей высвобождения паклитаксела из различных диапазонов размера микросфер и различных соотношений PLLA и GA.
Фиг.59А и 59В - графики, показывающие профили скоростей высвобождения паклитаксела из микросфер с различными соотношениями PLLA и GA.
Фиг.60А и 60В - графики, показывающие профили скоростей высвобождения паклитаксела из микросфер с различными соотношениями PLLA и GA.
Фиг.61А, 61В и 61С - графики, показывающие профили скоростей высвобождения паклитаксела из микросфер различного размера и с различными соотношениями PLLA и GA.
Фиг.62 - график, показывающий высвобождение паклитаксела из паклитаксел-найлоновых микрокапсул.
Фиг.63А и 63В - фотографии покрытых фибронектином PLLA-микросфер на ткани мочевого пузыря (63А) и поли-(L-лизиновых) микросфер на ткани мочевого пузыря.
Фиг.64 - график, показывающий, что мицеллярный паклитаксел улучшает ежедневные средние баллы артрита в крысиной модели индуцированного коллагеном артрита.
Фиг.65A-65D - ряд рентгенограмм, которые показывают действие мицеллярного паклитаксела в крысиной модели индуцированного коллагеном артрита.
Фиг.66А-66С - сканирующие электронные микрофотографии голеностопного сустава крысы.
Фиг.67 - увеличенный вид, показывающий гистопатологию в крысиной модели индуцированного коллагеном артрита.
Фиг.68А и 68В - увеличенные виды синовиальной сосудистой сети в крысиной модели индуцированного коллагеном артрита.
Фиг.69 - график, показывающий индукцию контактной аллергической реакции в мышиных ушах оксазолоном. Обработка 1% гелем паклитаксела или носителем во время антигенной стимуляции и после этого один раз в день. Воспаление кожи оценивали количественно измерением опухания ушей в сравнении с толщиной ушей перед антигенной стимуляцией. Результаты представляют собой средние величины +/- SD (стандартное отклонение) (n=5). **р<0,01; ***р<0,001.
Фиг.70 - график, показывающий индукцию контактной аллергической реакции в мышиных ушах оксазолоном. Первоначальная обработка 1% гелем паклитаксела или носителем при 24 часах после антигенной стимуляции и после этого один раз в день. Кожное воспаление определяли количественно измерениями опухания ушей в сравнении с толщиной ушей перед антигенной стимуляцией. Результаты представляют собой средние величины +/- SD (стандартное отклонение) (n=5). *р<0,05; **р<0,01.
Фиг.71 - график, показывающий индукцию кожного воспаления в мышиных ушах местным нанесением РМА. Первоначальная обработка 1% гелем паклитаксела или носителем при 1 часе после нанесения РМА и после этого один раз в день. Кожное воспаление определяли количественно измерениями опухания ушей в сравнении с толщиной ушей перед антигенной стимуляцией. Результаты представляют собой средние величины +/- SD (стандартное отклонение) (n=5). *р<0,05; **р<0,01.
Фиг.72 - график, показывающий индукцию кожного воспаления в мышиных ушах местным нанесением РМА. Первоначальная обработка 1% гелем паклитаксела или носителем при 24 часах после нанесения РМА и после этого один раз в день. Кожное воспаление определяли количественно измерениями опухания ушей в сравнении с толщиной ушей перед антигенной стимуляцией. Результаты представляют собой средние величины +/- SD (стандартное отклонение) (n=5). **р<0,01; ***р<0,001.
Фиг.73 иллюстрирует индукцию кожного воспаления в мышиных ушах местным нанесением РМА. Предобработка 1% гелем паклитаксела (правое ухо) или носителем (левое ухо). Изображения получали при 48 часах после нанесения РМА. Обратите внимание на красноту и расширенные кровеносные сосуды обработанных носителем левых ушей, в сравнении с обработанными паклитакселом правыми ушами. Одинаковые результаты получали в целом на 5 мышах.
Фиг.74 - график, показывающий влияние паклитаксела на вес тела трансгенных мышей DM20. Трансгенных мышей обрабатывали носителем или паклитакселом (2,0 мг/кг) три раза в неделю в течение 24 дней и затем умерщвляли на 27-й день. Результаты даны для двух животных, обработанных паклитакселом и одного необработанного животного. Обработанные паклитакселом животные показали минимальную потерю веса, тогда как контрольные животные показали 30% снижение веса тела, с 29 г до 22 г.
Фиг.75 - график, показывающий влияние терапии высокими дозами паклитаксела, предоставляемыми с интервалами, на прогрессирование клинических симптомов в трансгенных мышах. Трансгенных мышей обрабатывали 20 мг/кг паклитаксела один раз в неделю в течение 4 недель (неделя 0, 1, 2 и 3) и наблюдали в течение 10 недель, каждые два дня, с баллами, определенными для каждого симптома. Результаты представляют собой средний балл (кумулятивный для всех симптомов) для обработанных паклитакселом трансгенных мышей (n=5) и контрольных мышей (n=3). Обработка паклитакселом уменьшала ухудшение, вызываемое сверхэкспрессией DM20 в трансгенных мышах, тогда как контрольные мыши обнаруживали очень быстрое ухудшение, причем 2 из 3 мышей не выживали до конца экспериментального протокола (как показано).
Фиг.76А и 76В показывают пасту паклитаксела, нанесенную периваскулярно (на адвентициальную оболочку кровеносных сосудов) в крысиной модели сонной артерии. Адвентициальную поверхность левой общей сонной артерии обрабатывали 2,5 мг либо контрольной пасты (76А), либо нагруженной 20% паклитакселом пастой (76В). Контрольные артерии обнаружили увеличение толщины артериальной стенки вследствие гиперпролиферации клеток гладких мышц сосудов, тогда как артерия, обработанная нагруженной паклитакселом пастой, не обнаружила доказательства утолщения интимы.
Фиг.77А и 77В изображают влияние близости периваскулярной пасты паклитаксела в крысиной модели сонной артерии. Нагруженная паклитакселом паста, нанесенная непосредственно смежно с периваскулярным участком сосуда, предотвращала рестеноз; однако, когда паста не была непосредственно рядом со стенкой сосуда, была очевидной гиперплазия новообразующейся интимы.
Фиг.78А, 78В и 78С показывают влияние паклитаксела на GFAP-окрашивание астроцитов. Срезы мозга из нормальных животных и трансгенных животных (которые развили неврологическое заболевание, сходное со множественным склерозом), обработанные носителем или паклитакселом, окрашивали GFAP (маркером для активированных астроцитов) и исследовали гистологически. В контрольных трансгенных мышах было увеличение числа астроцитов и общих уровней GFAP в сравнении со срезами нормального мозга. Однако морфология этих клеток была одинаковой. Срезы мозга обработанных паклитакселом трансгенных мышей показали уменьшенные количества астроцитов и уровни GFAP в сравнении с необработанными трансгенными животными. Гистологически наблюдали округление клеток и утончение звездоподобных отростков в астроцитах.
Фиг.79А и 79В - графики, показывающие, что паклитаксел ингибирует стимуляцию Т-клеток в ответ на пептид миелинового основного белка (GP68-88) и КонА. 48-часовую культуру пролиферации Т-клеток RT-1 проводили с GP68-88 (А) или КонА (В) в качестве стимулагенов. Паклитаксел и его носитель (мицеллы) добавляли при градациях концентраций при начале антигенной стимуляции или спустя 24 часа. Паклитаксел ингибировал пролиферацию Т-клеток при таких низких концентрациях, как 0,02 мкМ, независимо от стимулагена.
Фиг.80А, 80В, 80С и 80D - графики, показывающие, что туберцидин и паклитаксел оба ингибируют как IL-1-, так и TNF-индуцированную активность NF-кВ.
Фиг.81А и 81В - графики, показывающие влияние увеличивающихся концентраций паклитаксела или камптотецина на рост раковых клеток предстательной железы человека (LNCaP) (2×103 клеток/мл), измеренный посредством окрашивания кристаллическим фиолетовым красителем (5%) и количественного определения по поглощению при 492 нм. Процентный рост выражен в виде % относительно контролей и дано среднее из 8 результатов.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Перед описанием изобретения может быть полезным для понимания его изложить определения некоторых терминов, которые будут использоваться далее.
Термин "воспалительное заболевание", в применении здесь, относится к любому из ряда заболеваний, которые характеризуются васкулярными изменениями: отеком и инфильтрацией нейтрофилов (например, острыми воспалительными реакциями); инфильтрацией тканей мононуклеарными клетками; разрушением ткани воспалительными клетками, клетками соединительной ткани и их клеточными продуктами; и попытками репарации посредством замены соединительной ткани (например, хроническими воспалительными реакциями). Характерные примеры таких заболеваний включают в себя многие общие медицинские состояния, такие как артрит, атеросклероз, псориаз, воспалительное заболевание кишечника, множественный склероз, хирургические спайки, рестеноз, туберкулез, отторжение трансплантата и хронические воспалительные респираторные заболевания (например, астма, пневмокониоз, хроническая обструктивная болезнь легких, назальные полипы и фиброз легких).
Термин "антимикротрубочковые агенты" включает в себя любой белок, пептид, химикат или другую молекулу, которая нарушает функцию микротрубочек, например, посредством предотвращения или стабилизации полимеризации. Большое разнообразие способов может быть использовано для определения антимикротрубочковой активности конкретного соединения, в том числе, например, тесты, описанные Smith et al., (Cancer Lett 79(2): 213-219) и Mooberry et al., (Cancer Lett. 96(2): 261-266, (1995).
Как отмечалось выше, данное изобретение обеспечивает способы лечения или предупреждения воспалительных заболеваний, включающие в себя стадию доставки к месту воспаления антимикротрубочкового агента. Вкратце, большое разнообразие агентов может быть доставлено к месту воспаления (или потенциальному месту воспаления) либо с носителем, либо без носителя (например, полимера или мази), для лечения или предупреждения воспалительного заболевания. Характерные примеры таких агентов включают в себя таксаны (например, паклитаксел (обсуждаемый более подробно ниже) и доцетаксел) (Schiff et al., Nature 277: 665-667, 1979; Long and Fair-child, Cancer Research 54: 4355-4361, 1994; Ringel and Horwitz, J. Natl. Cancer Inst. 83(4): 288-291, 1991; Pazdur et al., Cancer Treat. Rev. 19(4): 351-386, 1993), кампотецин, элеутеробин (например, U.S. Patent №5473057), саркодиктиины (в том числе саркодиктиин А), эпотилоны А и В (Bollag et al., Cancer Research 55: 2325-2333, 1995), дискодермолид (ter Haar et al., Biochemistry 35: 243-250, 1996), оксид дейтерия (D2O) (James and Lefebvre, Genetics 130(2): 305-314, 1992; Sollott et al., J. Clin. Invest. 95: 1869-1876, 1995), гексиленгликоль (2-метил-2,4-пентандиол) (Oka et al., Cell Struct. Funct. 16(2): 125-134, 1991), туберцидин (7-деазааденозин) (Mooberry et al., Cancer Lett. 96(2): 261-266, 1995), LY290181 (2-амино-4-(3-пиридил)-4Н-нафто(1,2-b)пиран-3-карбонитрил) (Panda et al., J. Biol. Chem. 272(12): 7681-7687, 1997; Wood et al., Mol. Pharmacol. 52(3): 437-444, 1997), фторид алюминия (Song et al., J. Cell. Sci. Suppl. 14: 147-150, 1991), бис(сукцинимидилсукцинат) этиленгликоля (Caplow and Shanks, J. Biol. Chem. 265(15): 8935-8941, 1990), этиловый эфир глицина (Mejillano et al., Biochembstry 31(13): 3478-3483, 1992), моноклональные антиидиотипические антитела (Leu et al., Proc. Natl. Acad. Sci. USA 91(22): 10690-10694, 1994), белок, стимулирующий сборку микротрубочек (таксолоподобный белок TALP) (Hwang et al., Biochem. Biophys. Res. Commun. 208(3): 1174-1180, 1995), клеточное набухание, индуцированное гипотоническими (190 мосмоль/л) условиями, инсулином (100 нмоль/л) или глутамином (10 ммоль/л) (Haussinger et al., Biochem. Cell. Biol. 72(1-2): 12-19, 1994), связывание динеина (Ohba et al., Biochem. Biophys. Acta 1158(3): 323-332, 1993), гибберелин (Mita and Shibaoka, Protoplasma 119(1/2): 100-109, 1984), XCHO1 (кинезинподобный белок) (Yonetani et al., Mol. Biol. Cell 7(suppl): 211A, 1996), лизофосфатидную кислоту (Cook et al., Mol. Biol. Cell 6(suppl): 260A, 1995, ион лития (Bhattacharyya and Wolff, Biochem. Biophys. Res. Commun. 73(2): 383-390, 1976), компоненты клеточной стенки растений (например, поли-L-лизин и экстенэин) (Akashi et al., Planta 182(3): 363-369, 1990), глицериновые буферы (Schilstra et al., Biochem. J. 277(Pt.3): 839-847, 1991; Farrell and Keates, Biochem. Cell. Biol. 68(11): 1256-1261, 1990; Lopez et al., J. Cell. Biochem. 43(3): 281-291, 1990), буфер с Тритоном Х-100, стабилизирующий микротрубочки (Brown et al., J. Cell Sci. 104(Pt.2): 339-352, 1993; Safiejko-Mroczka and Bell, J. Histochem. Cytochem. 44(6): 641-656, 1996), связанные с микротрубочками белки (например, МАР2, МАР4, тау, большой тау, энсконзин, фактор элонгации 1-альфа (EF-1α) и Е-МАР-115), (Burgess et al., Cell Motil. Cytoskeleton 20(4): 289-300, 1991; Saoudi et al., J. Cell. Sci. 108 (Pt.1): 357-367, 1995; Bulinski and Bossier, J. Cell. Sci. 107(Pt.10): 2839-2849, 1994; Ookata et al., J. Cell Biol. 128(5): 849-862, 1995; Boyne et al., J. Соmр. Neurol. 358(2): 279-293, 1995; Ferreira and Caceres, J. Neurosci. 11(2): 392-400, 1991; Thurston et al., Chromosoma 105(1): 20-30, 1996; Wang et al.. Brain Res. Mol. Brain Res. 38(2): 200-208, 1996; Moore and Cyr, Mol. Biol. Cell 7(suppl): 221-A, 1996; Masson and Kreis, J. Cell Biol. 123(2), 357-371, 1993), клеточные частицы (например, гистон H1, миелиновый основной белок и кинетохоры) (Saoudi et al., J. Cell. Sci. 108(Pt.1): 357-367, 1995; Simerly et al., J. Cell Biol. 111(4): 1491-1504, 1990), эндогенные микротрубочковые структуры (например, аксонемные структуры, макромолекулярные комплексы ферментов, формирующие поры в клеточной мембране и GTP-кэпы) (Dye et al., Cell Motil. Cytoskeleton 21(3): 171-186, 1992; Azhar and Murphy, Cell Motil. Cytoskeleton 15(3): 156-161, 1990; Walker et al., J. Cell Biol. 114(1): 73-81, 1991; Drechsel and Kirschner, Curr. Biol. 4(12); 1053-1061, 1994), стабильный трубочковый единственный полипептид (например, STOP145 и STOP220) (Pirollet et al., Biochem. Biophys. Acta 1160(1): 113-119, 1992; Pirollet et al.. Biochemistry 31(37): 8849-8855, 1992; Bosc et al. Proc. Natl. Acad. Sci. USA 93(5): 2125-2130, 1996; Margolis et al., EMBO J. 9(12): 4095-4102, 1990) и напряжение от митотических сил (Nicklas and Ward, J. Cell Biol. 126(5): 1241-1253, 1994), а также любые аналоги и производные любого из вышеописанных агентов. Такие соединения могут действовать либо путем деполимеризации микротрубочек (например, колхицин и винбластин), либо путем стабилизации образования микротрубочек (например, паклитаксел).
В одном предпочтительном варианте данного изобретения терапевтическим агентом является паклитаксел, соединение, которое нарушает образование микротрубочек посредством связывания с тубулином с образованием аномальных митотических веретен. Вкратце, паклитаксел представляет собой высокодериватизованный дитерпеноид (Wani et al., J. Am. Chem. Soc. 93: 2325, 1971), который был получен из собранной и высушенной коры Taxus brevifolia (тиса тихоокеанского) и Taxomyces Andreanae и эндофитного гриба (Endophytic Fungus) тиса тихоокеанского (Stierle et al., Science 60: 214-216, 1993). "Паклитаксел" (который, как должно быть понятно, включает в себя пролекарства, аналоги и производные, такие как, например, TAXOL®, TAXOTERE®, доцетаксел, 10-дезацетил-аналоги паклитаксела и 3’N-дезбензоил-3’N-трет-бутоксикарбонил-аналоги паклитаксела) может быть легко получен с применением способов, известных специалистам в данной области (см., например, Schiff et al., Nature 277: 665-667, 1979; Long and Fairchild, Cancer Research 54: 4355-4361, 1994; Ringel and Horwitz, J. Natl. Cancer Inst. 83(4): 288-291, 1991; Pazdur et al.. Cancer Treat. Rev. 19(4): 351-386, 1993; WO 94/07882, WO 94/07881; WO 94/07880; WO 94/07876; WO 93/23555; WO 93/10076; WO 94/00156; WO 93/24476; ЕР 590267; WO 94/20089; U.S. Patent Nos. 5294637; 5283253; 5279949; 5274137; 5202448; 5200534; 5229529; 5254580; 5412092; 5395850; 5380751; 5350866; 4857653; 5272171; 5411984; 5248796; 5248796; 5422364; 5300638; 5294637; 5362831; 5440056; 4814470; 5278324; 5352805; 5411984; 5059699; 4942184; Tetrahedron Letters 35(52): 9709-9712, 1994; J. Med. Chem. 35: 4230-4237, 1992; J. Med. Chem. 34: 992-998, 1991; J. Natural Prod. 57(10): 1404-1410, 1994; J. Natural Prod. 57(11): 1580-1583, 1994; J. Am. Chem. Soc. 110: 6558-6560, 1998) или получен из различных коммерческих источников, в том числе, например, (Sigma Chemical Co., St. Louis, Missouri (T7402 - из Taxus brevifolia).
Характерные примеры таких производных или аналогов паклитаксела включают в себя 7-деоксидоцетаксол, 7,8-циклопропатаксаны, N-замещенные 2-азетидоны, 6,7-эпоксипаклитакселы, 6,7-модифицированные паклитакселы, 10-дезацетокситаксол, 10-деацетилтаксол (из 10-деацетилбаккатина III), фосфоноокси- и карбонатные производные таксола, таксол-2,7-ди(натрий)-1,2-бензолдикарбоксилат, производные 10-дезацетокси-11,12-дигидротаксол-10,12(18)-диена, 10-дезацетокситаксол, протаксол (2’-и/или 7-O-эфирные производные), (2’-и/или 7-O-карбонатные производные), асимметричный синтез боковой цепи таксола, фтортаксолы, 9-деоксотаксан, (13-ацетил-9-деоксобаккатин III, 9-деоксотаксол, 7-деокси-9-деоксотаксол, 10-дезацетокси-7-деокси-9-деоксотаксол, производные, содержащие водород или ацетильную группу и гидрокси и трет-бутоксикарбониламино, производные сульфированного 2’-акрилоилтаксола и сульфированного 2’-O-ацилтаксола, сукцинилтаксол, 2’-Х-аминобутирилтаксолформиат, 2’-ацетилтаксол, 7-ацетилтаксол, 7-глицинкарбаматтаксол, 2’-ОН-7-ПЭГ(5000)-карбаматтаксол, 2’-бензоил- и 2’,7-дибензоилпроизводные таксола, другие пролекарства (2’-ацетилтаксол; 2’,7-диацетилтаксол; 2’-сукцинилтаксол; 2’-(бета-аланил)-таксол); формиат 2’-гамма-аминобутирилтаксола; содержащие этиленгликоль производные 2’-сукцинилтаксола; 2’-глутарилтаксол; 2’-(N,N-диметилглицил)таксол; 2’-(2-(N,N-диметиламино)пропионил)таксол; 2’-ортокарбоксибензоилтаксол; содержащие 2'-алифатические карбоновые кислоты производные таксола, пролекарства {2’-(N,N-диэтиламинопропионил)таксол, 2’-(N,N-диметилглицил)таксол, 7-(N,N-диметилглицил)таксол, 2’,7-ди(N,N-диметилглицил)таксол, 7-(N,N-диэтиламинопропионил)таксол, 2’,7-ди(N,N-диэтиламинопропионил)таксол, 2’-(L-глицил)таксол, 7-(L-глицил)таксол, 2’,7-ди(L-глицил)таксол, 2’-(L-аланил)таксол, 7-(L-аланил)таксол, 2’,7-ди(L-аланил)таксол, 2’-(L-лейцил)таксол, 7-(L-лейцил)таксол, 2’,7-ди(L-лейцил)таксол, 2’-(L-изолейцил)таксол, 7-(L-изолейцил)таксол, 2’,7-ди(L-изолейцил)таксол, 2’-(L-валил)таксол, 7-(L-валил)таксол, 2’,7-ди(L-валил)таксол, 2’-(L-фенилаланил)таксол, 7-(L-фенилаланил)таксол, 2’,7-ди(L-фенилаланил)таксол, 2’-(L-пролил)таксол, 7-(L-пролил)таксол, 2’,7-ди(L-пролил)таксол, 2’-(L-лизил)таксол, 7-(L-лизил)таксол, 2’,7-ди-(L-лизил)таксол, 2’-(L-глутамил)таксол, 7-(L-глутамил)-таксол, 2’,7-ди(L-глутамил)таксол, 2’-(L-аргинил)таксол, 7-(L-аргинил)таксол, 2’,7-ди-(L-аргинил)таксол}, аналоги таксола с модифицированными боковыми цепями фенилизосерина, таксотер, (N-дебензоил-N-трет-(бутоксикарбонил)-10-деацетилтаксол, и таксаны (например, баккатин III, цефаломаннин, 10-деацетил-баккатин III, бревифолиол, юнантаксузин и таксузин).
Характерные примеры агентов деполимеризации микротрубочек (или дестабилизации или разрушения) включают в себя нокодазол (Ding et al., J. Exp. Med. 171(3): 715-727, 1990; Dotti et al., J. Cell Sci. Suppl. 15:75-84, 1991; Oka et al., Cell Struct. Funct. 16(2): 125-134, 1991; Wiemer et al., J. Cell. Biol. 136(1): 71-80, 1997); цитохалазин В (Illinger et al., Biol. Cell 73 (2-3): 131-138, 1991); винбластин (Ding et al., J. Exp. Med. 171(3): 715-727, 1990; Dirk et al., Neurochem. Res.15 (11): 1135-1139, 1990; Illinger et al., Biol. Cell 73(2-3): 131-138, 1991; Wiemer et al., J. Cell. Biol. 136(1): 71-80, 1997); винкристин (Dirk et al., Neurochem. Res.15(11): 1135-1139, 1990; Ding et al., J. Exp. Med. 171(3):715-727, 1990); колхицин (Allen et al., Am. J. Physiol. 261(4 Pt.1): L315-L321, 1991; Ding et al., J. Exp. Med. 171(3): 715-727, 1990; Gonsales et al., Exp. Cell. Res.192(1): 10-15, 1991; Stargell et al., Mol. Cell. Biol. 12(4): 1443-1450, 1992); CI 980 (аналог колхицина) (Garcia et al., Anticancer Drugs 6(4): 533-544, 1995); колцемид (Barlow et al.. Cell. Motil. Cytoskeleton 19(1): 9-17, 1991; Meschini et al., J. Microsc. 176(Pt.3): 204-210, 1994; Oka et al., Cell Struct. Funct. 16(2): 125-134, 1991); подофиллотоксин (Ding et al., J. Exp. Med. 171(3): 715-727, 1990); беномил (Hardwick et al., J. Cell. Biol. 131 (3): 709-720, 1995; Shero et al., Genes Dev. 5(4): 549-560, 1991); оризалин (Stargell et al., Mol. Cell. Biol. 12(4): 1443-1450, 1992); маюскуламид С (Moore, J. Ind. Microbiol. 16(2): 134-143, 1996); демеколцин (Van Dolah and Ramsdell, J. Cell. Physiol. 166(1): 49-56, 1996; Wiemer et al., J. Cell. Biol. 136(1): 71-80, 1997); и метил-2-бенз-имидазолкарбамат (МВС) (Brown et al., J. Cell. Biol. 123(2): 387-403, 1993).
Готовые препаративные формы
Как отмечалось выше, терапевтические антимикротрубочковые агенты, описанные здесь, могут быть приготовлены различными способами и, следовательно, могут дополнительно содержать носитель. В этом отношении, может быть выбрано большое разнообразие носителей либо полимерного, либо неполимерного происхождения.
Например, в одном варианте данного изобретения могут быть использованы разнообразные полимерные носители, в которых могут содержаться и/или доставляться один или несколько обсуждаемых выше терапевтических агентов, в том числе, например, как биодеградируемые, так и не-биодеградируемые композиции. Характерные примеры биодеградируемых композиций включают в себя альбумин, коллаген, желатин, гиалуроновую кислоту, крахмал, целлюлозу (метилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, карбоксиметилцеллюлозу, ацетат-фталат целлюлозы, ацетат-сукцинат целлюлозы, фталат гидроксипропилметилцеллюлозы), казеин, декстраны, полисахариды, фибриноген, поли(D,L-лактид), сополимер поли(D,L-лактид-гликолид), поли(гликолид), поли(гидроксибутират), поли(алкилкарбонат) и поли(орто-эфиры), полиэфиры, поли(гидроксивалериановую кислоту), полидиоксанон, поли(этилен-терефталат), поли(яблочную кислоту), поли(тартроновую кислоту), полиангидриды, полифосфазены, поли(аминокислоты) и их сополимеры (см. в общем. Illum, L., Davids, S.S. (eds) "Polymers in Controlled Drug Delivery" Wright, Bristol, 1987; Arshady, J. Controlled Release 17: 1-22, 1991; Pitt, Int. J. Phar. 59: 173-196, 1990; Holland et al., J. Controlled Release 4: 155-0180, 1986). Характерные примеры недеградируемых полимеров включают в себя сополимеры поли(этиленвинилацетат) (EVA), силиконовый каучук, акриловые полимеры (полиакриловую кислоту, полиметилакриловую кислоту, полиметилметакрилат, полиалкилцианоакрилат), полиэтилен, полипропилен, полиамиды (найлон 6,6), полиуретан, поли(сложный эфир-уретаны), поли(простой эфир-уретаны), поли(эфир-мочевину), поли-простые эфиры (поли(этиленоксид), поли(пропиленоксид), плуроники и поли(тетраметиленгликоль)), силиконовые каучуки и виниловые полимеры (поливинилпирролидон, поли(виниловый спирт), поли(винилацетат-фталат). Могут быть получены также полимеры, которые являются либо анионными (например, альгинат, каррагенин, карбоксиметилцеллюлоза и поли(акриловая кислота), либо катионными (например, хитозан, поли-L-лизин, полиэтиленимин и поли(аллиламин)) (см. в общем Dunn et al., J. Applied Polymer Sci. 50: 353-365, 1993; Cascone et al., J. Materials Sci.: Materials in Medicine 5: 770-774, 1994; Shiraishi et al., Biol. Pharm. Bull. 16(11): 1164-1168, 1993; Thacharodi and Rao, Int’1 J. Pharm. 120: 115-118, 1995; Miyazaki et al., Int’1 J. Pharm. 118: 257-263, 1995). Особенно предпочтительные полимерные носители включают в себя поли(этиленвинилацетат), олигомеры и полимеры поли(D,L-молочной кислоты), олигомеры и полимеры поли (L-молочной кислоты), поли(гликолевую кислоту), сополимеры молочной кислоты и гликолевой кислоты, поли(капролактон), поли(валеролактон), полиангидриды, сополимеры поли(капролактона) или поли(молочной кислоты) с полиэтиленгликолем (например, Me PEG) и их смеси.
Полимерные носители могут быть приготовлены в разнообразных формах, с желательными характеристиками высвобождения и/или со специфическими желательными свойствами. Например, полимерные носители могут быть приготовлены таким образом, что они высвобождают терапевтический агент при экспонировании специфическому запускающему событию, например, рН (см, например. Heller et al., "Chemically Self-Regulated Drug Delivery Systems", in Polymers in Medicine III, Elsevier Science Publishers B.V., Amsterdam, 1988, pp.175-188; Kang et al., J.Applied Polymer Sci. 48: 343-354, 1993; Dong et al., J.Controlled Release 19: 171-178, 1992; Dong and Hoffman, J.Controlled Release 15: 141-152, 1991; Kirm et al., J. Controlled Release 28: 143-152, 1994; Cornejo-Bravo et al., J. Controlled Release 33: 223-229, 1995; Wu and Lee, Pharm. Res. 10(10): 1544-1547, 1993; Serres et al., Pharm Res. 13(2): 196-201, 1996; Peppas, "Fundamentals of pH- and Temperature-Sensitive Delivery Systems", in Gurny et al. (eds.), Pulsatile Drug Delivery, Wissenschaftliche Verlagsgesell-schaft mbH, Stuttgart, 1993, pp.41-55; Doelker, "Cellulose Derivatives", 1993, in Peppas and Langer (eds.), Biopolymers I, Springer-Verlag, Berlin). Характерные примеры рН-чувствительных полимеров включают в себя поли(акриловую кислоту) и ее производные (в том числе, например, гомополимеры, такие как поли(аминокарбоновая кислота); поли(акриловая кислота); поли(метилакриловая кислота), сополимеры таких гомополимеров и сополимеры поли(акриловой кислоты) и акрилмономеров, таких, как обсужденные выше. Другие рН-чувствительные полимеры включают в себя полисахариды, такие как ацетат-фталат целлюлозы; фталат гидроксипропилметилцеллюлозы; ацетат-сукцинат гидроксипропилметилцеллюлозы; ацетат-тримеллилат целлюлозы; и хитозан. Другие рН-чувствительные полимеры включают в себя любую смесь рН-чувствительного полимера и водорастворимого полимера.
Подобным образом могут быть изготовлены полимерные носители, которые являются чувствительными к температуре (см., например, Chen et al., "Novel Hydrogels of a Temperature-Sensitive Pluronic Grafted to a Bioadhesive Polyacrylic Acid Backbone for Vaginal Drug Delivery", in Proceed. Intern. Symp. Control. Rel. Bioact. Mater. 22: 167-168, Controlled Release Society, Inc., 1995; Okano, "Molecular Design of Stimuli-Responsive Hydrogels for Temporal Controlled Drug Delivery", in Proceed. Intern. Symp. Control. Rel. Bioact. Mater. 22: 111-112, Controlled Release Society, Inc., 1995; Johnston et al., Pharm. Res. 9(3): 425-433, 1992; Tung, Int’l J. Pharm. 107: 85-90, 1994; Harsh and Gehrke, J. Controlled Release 17: 175-186, 1991; Bae et al., Pharm. Res.8(4): 531-537, 1991; Dinarvand and D’Emanuele, J. Controlled Release 36: 221-227, 1995; Yu and Grainger, "Novel Thermosensitive Amphiphilic Gels: Poly N-isopropylacrylamid-co-sodium acrylate-co-n-N-alkylacrylamide Network Synthesis and Physicochemical Characterization", Dept of Chemical & Biological Sci., Oregon Graduate Institute of Science & Technology, Beaverton, OR, pp.820-821; Zhou and Smid, "Physical Hydrogels of Associative Star Polymers", Polymer Research Institute, Dept. of Chemistry, College of Environmental Science and Forestry, State Univ. of New York, Syracuse, NY, pp.822-823; Hoffman et al., "Characterizing Pore Sizes and Water ‘Structure’ in Stimuli-Responsive Hydrogels", Center for Bioengineering, Univ. of Washington, Seattle, WA, p.828; Yu and Grainger, "Thermosensitive Swelling Behavior in Crosslinked N-isopropylacrylamide Networks: Cationic, Anionic and Ampholytic Hydrogels", Dept. of Chemical & Biological Sci., Oregon Graduate Institute of Science & Technology, Beaverton, OR, pp.829-830; Kim et al., Pharm. Res.9(3): 283-290, 1992; Bae et al., Pharm. Res. 8(5): 624-628, 1991; Kono et al., J. Controlled Release 30: 69-75, 1994; Yoshida et al., J. Controlled Release 32: 97-102, 1994; Okano et al., J. Controlled Release 36:125-133, 1995; Chun and Kim, J. Controlled Release 38: 39-47, 1996; D’Emanuele and Dinarvand, Int’l J.Pharm. 118: 237-242, 1995; Katono et al., J. Controlled Release 16: 215-228, 1991; Hoffman, "Thermally Reversible Hydrogels Containing Biologically Active Species", in Migliaresi et al.(eds-). Polymers in Medicine III, Elsevier Science Publishers B.V., Amsterdam, 1988, pp.161-167; Hoffman, "Applications of Thermally Reversible Polymers and Hydrogels in Therapeutics and Diagnostics", in Third International Symposium on Recent Advances in Drug Delivery Systems, Salt Lake City, UT, Feb.24-27, 1987, pp.297-305; Gutowska et al., J.Controlled Release 22: 95-104, 1992, Palasis and Gehrke, J.Controlled Release 18: 1-12, 1992; Paavola et al., Pharm. Res. 12(12): 1997-2002, 1995).
Характерные примеры термогелирующихся полимеров и их температур гелеобразования (LCST (°С)) включают в себя гомополимеры, такие как поли(N-метил-N-н-пропилакриламид), 19,8; поли(N-н-пропилакриламид), 21,5; поли(N-метил-N-изопропилакриламид), 22,3; поли(N-н-пропилметакриламид), 28,0; поли(N-изопропилакриламид), 30,9; поли(N,N-н-диэтилакриламид), 32,0; поли(N-изопропилметакриламид), 44,0; поли(N-циклопропилакриламид), 45,5; поли(N-этилметакриламид), 50,0; поли(N-метил-N-этилакриламид), 56,0; поли(N-циклопропилметакриламид), 59,0; поли(N-этилакриламид), 72,0. Кроме того, термогелирующиеся полимеры могут быть получены приготовлением сополимеров между (среди) мономерами, описанными выше, или объединением таких гомополимеров с другими водорастворимыми полимерами, такими как акрилмономеры (например, акриловая кислота и ее производные, такие как метилакриловая кислота, акрилат и его производные, такие как бутилметакрилат, акриламид и N-н-бутилакриламид).
Другие характерные примеры термогелирующихся полимеров включают в себя содержащие являющиеся простыми эфирами производные целлюлозы, такие как гидроксипропилцеллюлоза, 41°С; метилцеллюлоза, 55°С; гидроксипропилметилцеллюлоза, 66°С, и этилгидроксиэтилцеллюлоза, и плуроник, такой как F-127, 10-15°С; L-122, 19°C; L-92, 26°C; L-81, 20°С и L-61, 24°С.
Большое разнообразие форм может быть приготовлено с применением полимерных носителей данного изобретения, в том числе устройства в форме палочек, шарики, пластинки или капсулы (см., например, Goodell et al.. Am. J. Hosp. Pharm. 43: 1454-1461, 1986; Langer et al., "Controlled release of macromolecules from polymers", in Biomedical Polymers, Polymeric Materials and Pharmaceuticals for Biomedical Use, Goldberg, E.P., Nakagim, A. (eds.) Academic Press, pp.113-137, 1980; Rhine et al., J. Pharm. Sci. 69: 265-270, 1980; Brown et al., J. Pharm. Sci. 72: 1181-1185, 1983; и Bawa et al., J. Controlled Release 1: 259-267, 1985). Терапевтические агенты могут быть связаны посредством окклюзии в матриксах полимера, связанные ковалентными связями, или инкапсулированы в микрокапсулах. В некоторых предпочтительных вариантах данного изобретения терапевтические композиции обеспечены в неинкапсулированных композициях, таких как микросферы (размером от нанометров до микрометров), пасты, нити разного размера, пленки и спреи.
Предпочтительно, терапевтические композиции данного изобретения готовят такими способами, которые пригодны для предлагаемого применения. В некоторых аспектах данного изобретения терапевтическая композиция должна быть биосовместимой и высвобождать один или несколько терапевтических агентов на протяжении периода от нескольких дней до месяцев. Например, обеспечены терапевтические композиции "быстрого высвобождения" или "выброса", которые высвобождают более 10, 20 или 25% (м/об) терапевтического агента (например, паклитаксела) на протяжении периода 7-10 дней. Такие композиции "быстрого высвобождения" должны быть, в некоторых вариантах, способны высвобождать химиотерапевтические уровни (где это применимо) желательного агента. В других вариантах обеспечены композиции "медленного высвобождения", которые высвобождают менее 1% (м/об) терапевтического агента на протяжении периода 7-10 дней. Кроме того, терапевтические композиции данного изобретения предпочтительно должны быть стабильными в течение нескольких месяцев и позволять их изготовление и сохранение при стерильных условиях.
В некоторых аспектах данного изобретения терапевтические композиции могут быть изготовлены в любом размере в пределах от 50 нм до 500 мкм, в зависимости от конкретного применения. Альтернативно, такие композиции могут быть также легко применены в виде "спрея", который отверждается в виде пленки или покрытия. Такие спреи могут быть приготовлены из микросфер широкого диапазона размеров, в том числе, например, от 0,1 мкм до 3 мкм, от 10 мкм до 30 мкм и от 30 мкм до 100 мкм.
Терапевтические композиции данного изобретения могут быть также приготовлены в разнообразных формах "паст" или гелей. Например, в одном варианте данного изобретения обеспечены терапевтические композиции, которые являются жидкими при одной температуре (например, при температуре, большей, чем 37°С, такой как 40, 45, 50, 55°С или 60°С) и твердыми или полутвердыми при другой температуре (например, при окружающей температуре тела или при любой температуре, меньшей, чем 37°С). Такие "термопасты" могут быть легко изготовлены на основании данного описания.
В еще одном варианте терапевтические композиции данного изобретения могут быть изготовлены в виде пленки. Предпочтительно, такие пленки имеют толщину менее 5, 4, 3, 2 или 1 мм, более предпочтительно менее 0,75 мм или 0,5 мм, и наиболее предпочтительно менее 500 мкм-100 мкм. Такие пленки являются предпочтительно упругими с хорошей прочностью на разрыв (например, большей, чем 50, предпочтительно большей, чем 100, и более предпочтительно большей, чем 150 или 200 Н/см2), обладают хорошими адгезивными свойствами (т.е. легко прикрепляются к влажным или сырым поверхностям) и имеют регулируемую проницаемость.
В дальнейших аспектах данного изобретения могут быть изготовлены терапевтические композиции для местного применения. Характерные примеры включают в себя: этанол; смеси этанола и гликолей (например, этиленгликоля или пропиленгликоля); смеси этанола и изопропилмиристата или этанола, изопропилмиристата и воды (например, 55:5:40); смеси этанола и эйнеола или D-лимонена (с водой или без воды); гликоли (например, этиленгликоль или пропиленгликоль) и смеси гликолей, таких как пропиленгликоль, и воды, фосфатидилглицерина, диолеоилфосфатидилглицерина, Транскутола® или тепинолена; смеси изопропилмиристата и 1-гексил-2-пирролидона, N-додецил-2-пиперидинона или 1-гексил-2-пирролидона. Другие наполнители могут быть добавлены к описанным выше, в том числе, например, кислоты, такие как олеиновая кислота и линолевая кислота, и мыла, такие как лаурилсульфат натрия. В отношении более подробного описания вышесказанного, см. Hoelgaard et al., J. Contr. Rel. 2:111, 1985; Liu et al., Pharm. Res. 8: 938, 1991; Roy et al., J. Pharm. Sci. 83: 126, 1991; Ogiso et al., J. Pharm. Sci. 84: 482, 1995; Sasaki et al., J. Pharm. Sci. 80: 533, 1991; Okabe et al., J. Contr. Rel. 32: 243, 1994; Yokomizo et al., J. Contr. Rel. 38: 267, 1996; Yokomizo et al., J. Contr. Rel. 42: 37, 1996; Mond. et al., J. Contr. Rel. 33: 72, 1994; Michniak et al., J. Contr. Rel. 32: 147, 1994; Sasaki et al., J. Pharm. Sci. 80: 533, 1991; Baker & Hadgraft, Pharm. Res. 12: 993, 1995; Jasti et al., AAPS Proceedings, 1996; Lee et al., AAPS Proceedings, 1996; Ritschel et al.. Skin Pharmacol. 4: 235, 1991; и McDaid & Deasy, Int. J. Pharm. 133: 71, 1996.
В некоторых вариантах данного изобретения терапевтические композиции могут также содержать дополнительные ингредиенты, такие как поверхностно-активные вещества (например, плуроники, такие как F-127, L-122, L-92, L-81 и L-61).
В дальнейших аспектах данного изобретения обеспечены полимерные носители, которые приспособлены для того, чтобы содержать и высвобождать гидрофобное соединение, причем этот носитель содержит это гидрофобное соединение в сочетании с углеводом, белком или полипептидом. В некоторых вариантах этот полимерный носитель содержит или включает в себя участки, включения или гранулы одного или нескольких гидрофобных соединений. Например, в одном варианте изобретения гидрофобные соединения могут быть включены в матрикс, который содержит это гидрофобное соединение, с последующим включением этого матрикса в полимерный носитель. Разнообразные матриксы могут быть использованы в этой связи, в том числе, например, углеводы и полисахариды, такие как крахмал, целлюлоза, декстран, метилцеллюлоза и гиалуроновая кислота, белки или полипептиды, такие как альбумин, коллаген и желатин. В альтернативных вариантах гидрофобные соединения могут содержаться в гидрофобной центральной части (коре), и эта центральная часть содержится в гидрофильной оболочке.
Другие носители, описанные здесь, которые также могут быть использованы для включения в них и доставки терапевтических агентов, включают в себя: гидроксипропил-β-циклодекстрин (Cserhati and Hollo, Int. J. Pharm. 108:69-75, 1994), липосомы (см., например, Sharma et al.. Cancer Res. 53: 5877-5881, 1993; Sharma and Straubinger, Pharm. Res. 11(60): 889-896, 1994; WO 93/18751; U.S. Patent №5242073), липосома/гель (WO 94/26254), нанокапсулы (Bartoli et al., J. Mi-croencapsulation 7(2): 191-197, 1990), мицеллы (Alkan-Onyuksel et al., Pharm. Res. 11(2): 206-212, 1994), имплантаты (Jampel et al., Invest. Ophthalm. Vis. Science 34(11): 3076-3083; Walter et al., Cancer Res. 54: 2201-2212, 1994), наночастицы (Violante and Lanzafame PAACR), модифицированные наночастицы (U.S. Patent №5145684), наночастицы (поверхностно модифицированные) (U.S. Patent №5399363), эмульсию/раствор таксола (U.S. Patent №5407683), мицеллу (поверхностно-активное вещество) (U.S. Patent №5403858), синтетические фосфолипидные соединения (U.S. Patent №4534899), несущую газ дисперсию (U.S. Patent №5301664), жидкие эмульсии, пену, спрей, гель, лосьон, крем, мазь, диспергированные везикулы, частицы или капельки твердых или жидких аэрозолей, микроэмульсии (U.S. Patent №5330756), полимерную оболочку (нано- и микрокапсулу) (U.S. Patent №5439686), композиции на основе таксоида в поверхностно-активном агенте (U.S. Patent №5438072), эмульсию (Tarr et al., Pharm. Res. 4: 62-165, 1987), наносферы (Hagan et al., Proc. Intern. Symp. Control Rel. Bioact. Mater. 22, 1995); Kwon et al., Pharm. Res. 12(2): 192-195; Kwon et al., Pharm. Res. 10(7): 970-974; Yokoyama et al., J. Contr. Rel. 32: 269-277, 1994; Gref et al., Science 263: 1600-1603, 1994; Bazile et al., J. Pharm. Sci. 84: 493-498, 1994) и имплантаты (U.S. Patent №4882168).
Как обсуждается более подробно ниже, терапевтические агенты данного изобретения, которые необязательно включены в один из описанных здесь носителей, могут быть приготовлены и применены для лечения или предупреждения большого разнообразия заболеваний.
Лечение или предупреждение воспалительных заболеваний
Как отмечалось выше, данное изобретение обеспечивает способы лечения или предупреждения большого разнообразия воспалительных заболеваний, включающие в себя стадию введения пациенту антимикротрубочкового агента. Характерные примеры воспалительных заболеваний, которые могут быть подвергнуты лечению, включают в себя, например, атрофический гастрит, воспалительную гемолитическую анемию, отторжение трансплантата, воспалительную нейтропению, буллезный пемфигоид, coeliac заболевание, демиелинизирующие невропатии, дерматомиозит, воспалительное заболевание кишечника (язвенный колит и болезнь Крона), рассеянный склероз, миокардит, миозит, назальные полипы, хронический синусит, пузырчатку вульгарную, первичный гломерулонефрит, псориаз, хирургические спайки, стеноз или рестеноз, склерит, склеродермию, экзему (в том числе атопический дерматит, раздражающий дерматит, аллергический дерматит) и диабет типа I.
Другие примеры воспалительных заболеваний включают в себя васкулит (например, гигантоклеточный артериит (темпоральный артериит, синдром Такаясу), нодозный полиартериит, аллергический ангиит и гранулематоз (болезнь Churg-Strauss), синдром перекрывания полиангиита, аллергический васкулит (пурпуру Геноха-Шёнляйна), сывороточную болезнь, индуцированный лекарственными средствами васкулит, инфекционный васкулит, неопластический васкулит, васкулит, связанный с нарушениями соединительных тканей, васкулит, связанный с врожденной недостаточностью системы комплемента, гранулематоз Вегенера, болезнь Кавасаки, васкулит центральной нервной системы, болезнь Бюргера и системный склероз); заболевания желудочно-кишечного тракта (например, панкреатит, болезнь Крона, язвенный колит, язвенный проктит, первичный склерозирующий холангит, доброкачественные стриктуры любого происхождения, в том числе идиопатические (например, стриктуры в желчных протоках, пищеводе, двенадцатиперстной кишке, тонкой кишке или ободочной кишке); заболевания дыхательных путей (например, астму, аллергический пневмонит, асбестоз, силикоз и другие формы пневмокониоза, хронический бронхит и хроническую обструктивную болезнь дыхательных путей); заболевания носослезного протока (например, стриктуры любого происхождения, в том числе идиопатические); и заболевания евстахиевых труб (например, стриктуры любого происхождения, в том числе идиопатические).
Для дальнейшего понимания таких заболеваний характерные воспалительные заболевания обсуждаются ниже более подробно.
1. Воспалительные кожные болезни (например, псориаз и экзема)
С использованием заявленных агентов, композиций и способов легко может лечиться или предупреждаться большое разнообразие воспалительных кожных болезней. Например, в одном варианте этого изобретения воспалительная кожная болезнь, такая как псориаз или экзема, может лечиться или предупреждаться путем доставки к месту воспаления (или к потенциальному месту воспаления) агента, ингибирующего функцию микротрубочек.
Вкратце, кожные клетки генетически запрограммированы для выполнения двух возможных программ - нормального роста или заживления ран. В случае нормальной картины роста кожные клетки создаются в базальном клеточном слое и затем перемещаются через эпидермис к поверхности кожи. Мертвые клетки сбрасываются со здоровой кожи с той же скоростью, с какой образуются новые клетки. Время оборота (т.е. время от рождения до смерти клетки) для нормальных кожных клеток равно приблизительно 28 дням. Во время заживления ран запускаются ускоренный рост и репарация, приводящие к быстрому обороту кожных клеток (для замены поврежденных клеток и репарации раны), увеличенному кровоснабжению (для удовлетворения увеличенных метаболических потребностей, связанных с ростом) и локализованному воспалению.
Во многих отношениях псориаз подобен преувеличенному процессу заживления ран. Кожные клетки (называемые "кератиноцитами") создаются и выталкиваются на поверхность кожи всего лишь за 2-4 дня. Поверхность кожи не может сбросить мертвые клетки достаточно быстро и избыточные кератиноциты наслаиваются с образованием повышенных, чешуйчатых поражений. Этот рост поддерживается новыми кровеносными сосудами в дерме (поддерживающей ткани под эпидермисом), развивающимися для обеспечения питательных элементов, необходимых для поддержания гиперпролиферирующих кератиноцитов. В то же самое время лимфоциты, нейтрофилы и макрофаги внедряются в ткань, создавая воспаление, опухание и болезненность и потенциально продуцируя факторы роста, которые усиливают быструю пролиферацию кератиноцитов. Все эти клетки (кератиноциты, эндотелиальные клетки сосудов и лейкоциты) продуцируют разрушающие ткань ферменты или протеиназы, которые способствуют прогрессированию этого заболевания и деструкции окружающей ткани.
С использованием обеспеченных выше композиций можно легко лечить воспалительные кожные повреждения. В частности, антимикротрубочковый агент вводят непосредственно в место воспаления (или в потенциальное место воспаления) для лечения или предупреждения заболевания. Подходящие антимикротрубочковые агенты обсуждаются подробно выше и включают в себя, например, таксаны (например, паклитаксел и доцетаксел), кампотецин, элеутеробин, саркодиктины, эпотилоны А и В, дискодермолид, оксид дейтерия (D2O), гексиленгликоль (2-метил-2,4-пентандиол), туберцидин (7-деазааденозин), LY290181 (2-амино-4-(3-пиридил)-4Н-нафто(1,2-b)пиран-3-карбонитрил), фторид алюминия, бис-(сукцинимидилсукцинат) этиленгликоля, этиловый эфир глицина, моноклональные антиидиотипические антитела, белок, стимулирующий сборку микротрубочек (таксол-подобный белок, TALP), набухание клеток, индуцированное гипотоническими (190 мосмоль/л) условиями, инсулином (100 нмоль/л) или глутамином (10 ммоль/л), связывание динеина, гибберелин, ХСНО1 (кинезин-подобный белок), лизофосфатидную кислоту, ион лития, компоненты клеточной стенки растений (например, поли-L-лизин и экстензин), буферы с глицерином, буфер с Тритоном Х-100, стабилизирующий микротрубочки, связанные с микротрубочками белки (например, МАР2, МАР4, тау, большой тау, энсконзин, фактор элонгации 1-α, (EF-1α) и Е-МАР-115), клеточные частицы (например, гистон H1, миелиновый основной белок и кинетохоры), эндогенные микротрубочковые структуры (например, аксонемные структуры, макромолекулярные комплексы ферментов, формирующие поры в клеточной мембране и GTP-кэпы), стабильный трубочковый единственный полипептид (например, STOP145 и STOP220) и напряжение от митотических сил, а также любые аналоги и производные любого из вышеописанных агентов. В некоторых вариантах антимикротрубочковый агент не является паклитакселом, кампотецином или эпотилоном. Такие агенты, в некоторых вариантах, могут доставляться в виде композиции вместе с полимерным носителем или в липосомной композиции, креме или мази, как обсуждается более подробно выше и ниже. В предпочтительных вариантах изобретения эти агенты или композиции доставляются либо локально, либо подкожным введением.
Эффективная антимикротрубочковая терапия для псориаза будет давать по меньшей мере один из следующих результатов: уменьшение количества и тяжести кожных поражений, уменьшение частоты возникновения или продолжительности активных обострений заболевания, увеличение времени, проводимого в ремиссии (т.е. периодов, когда пациент не имеет симптомов) и/или уменьшение тяжести или продолжительности сопутствующих болезни симптомов (например, боли и опухания суставов, боли в осевом скелете, кишечных симптомов).
Клинически это лечение будет приводить к уменьшению размера или количества кожных поражений, уменьшению кожных симптомов (боли, ощущения жжения и кровотечения пораженной кожи) и/или ослаблению сопутствующих симптомов (например, покраснения суставов, повышенной температуры тела, опухания, диареи, боли в кишечнике). Патологически антимикротрубочковый агент будет производить по меньшей мере один из следующих результатов: ингибирование пролиферации кератиноцитов, уменьшение кожного воспаления (например, воздействием на факторы аттрагирования и роста, презентацию антигенов, образование молекул реакционноспособного кислорода и металлопротеиназ матрикса) и ингибирование дермального ангиогенеза.
Антимикротрубочковый агент может быть введен любым способом для достижения вышеуказанных конечных результатов, но предпочтительные способы включают в себя местное (локальное) и системное введение. Пациентам с локализованным заболеванием можно вводить агент в виде содержащего паклитаксел крема, мази или мягчителя для местного нанесения, наносимых непосредственно на псориатические поражения. Например, крем для местного введения, содержащий 0,01-10% паклитаксела по весу, может быть введен в зависимости от тяжести заболевания и ответной реакции пациента на это лечение. В предпочтительном варианте препарат для местного применения, содержащий паклитаксел в концентрации 0,1-1% по весу, следует вводить на псориатические поражения. Альтернативно, для лечения отдельных повреждений можно использовать прямую внутрикожную инъекцию паклитаксела в подходящем фармацевтическом носителе.
В случае пациентов с широко распространенным заболеванием или внекожными симптомами (например, псориатическим артритом, синдромом Райтера, сопутствующим спондилитом, сопутствующим воспалительным заболеванием кишечника) паклитаксел может вводиться системно. Например, могут быть проведены интермиттирующие введения внутривенной композиции паклитаксела в дозе 10-75 мг/м2, в зависимости от терапевтического ответа и толерантности пациента; эквивалентный пероральный препарат был бы также пригоден для этого показания. Другие антимикротрубочковые агенты могли бы вводиться в "эквивалентных паклитакселу" дозах, скорректированных относительно активности и переносимости конкретного агента.
Другие состояния могут также получать пользу от антимикротрубочковых агентов, в том числе: экзематозное заболевание (атопический дерматит, контактный дерматит, экзема), иммунобуллезное заболевание, предраковые эпителиальные опухоли, базально-клеточный рак (базалиома), плоскоклеточный рак, кератокантома, злокачественная меланома и вирусные бородавки. Кремы, мази и мягчители для местного применения, содержащие 0,01-10% по весу паклитаксела, могут быть пригодны для лечения этих состояний.
2. Рассеянный склероз
В других аспектах изобретения антимикротрубочковые агенты могут быть использованы для лечения или предупреждения рассеянного склероза. Вкратце, рассеянный склероз (PC) представляет собой изнуряющее демиелинизирующее заболевание центральной нервной системы человека. Хотя его этиология и патогенез не известны, считают, что в нем играют роль генетические, иммунологические факторы и факторы окружающей среды. В ходе этого заболевания имеет место демиелинизация в мозгу пациентов с PC, приводящая к утрате двигательной функции. Хотя точные механизмы, участвующие в потере миелина, не выяснены, имеет место усиление пролиферации и накопления астроцитов в зонах деструкции миелина. В этих местах присутствует макрофаго-подобная активность и повышенная протеазная активность, которая по меньшей мере частично ответственна за деструкцию миелиновой оболочки.
Антимикротрубочковый агент может быть введен в место воспаления (или в потенциальное место воспаления) для лечения или предупреждения этого заболевания. Подходящие антимикротрубочковые агенты обсуждаются подробно выше и включают в себя, например, таксаны (например, паклитаксел и доцетаксел), кампотецин, элеутеробин, саркодиктины, эпотилоны А и В, дискодермолид, оксид дейтерия (D2O), гексиленгликоль (2-метил-2,4-пентандиол), туберцидин (7-деазааденозин), LY290181 (2-амино-4-(3-пиридил)-4Н-нафто(1,2-b)пиран-3-карбонитрил), фторид алюминия, бис-(сукцинимидилсукцинат) этиленгликоля, этиловый эфир глицина, моноклональные антиидиотипические антитела, белок, стимулирующий сборку микротрубочек (таксол-подобный белок, TALP), набухание клеток, индуцированное гипотоническими (190 мосмоль/л) условиями, инсулином (100 нмоль/л) или глутамином (10 ммоль/л), связывание динеина, гибберелин, ХСНО1 (кинезин-подобный белок), лизофосфатидную кислоту, ион лития, компоненты клеточной стенки растений (например, поли-L-лизин и экстензин), буферы с глицерином, буфер с Тритоном Х-100, стабилизирующий микротрубочки, связанные с микротрубочками белки (например, МАР2, МАР4, тау, большой тау, энсконзин, фактор элонгации 1-α (EF-1α) и Е-МАР-115), клеточные частицы (например, гистон H1, миелиновый основной белок и кинетохоры), эндогенные микротрубочковые структуры (например, аксонемные структуры, макромолекулярные комплексы ферментов, формирующие поры в клеточной мембране и GTP-кэпы), стабильный трубочковый единственный полипептид (например, STOP145 и STOP220) и напряжение от митотических сил, а также любые аналоги и производные любого из вышеописанных агентов. Такие агенты, в некоторых вариантах, могут доставляться в виде композиции вместе с полимерным носителем или в липосомной композиции, как обсуждается более подробно выше и ниже. В некоторых вариантах изобретения эти агенты или композиции могут вводиться перорально, внутривенно или прямым введением (предпочтительно при помощи ультразвукового, КТ, флуороскопического, MRI или эндоскопического контроля направления) в место патологии.
Эффективная антимикротрубочковая терапия для рассеянного склероза будет давать, по меньшей мере, один из следующих результатов: уменьшение тяжести симптомов; уменьшение продолжительности обострений заболевания; увеличение частоты появления и продолжительности периодов ремиссии/бессимптомных периодов; предупреждение стойкого ухудшения и потери трудоспособности; и/или предупреждение/ослабление хронического прогрессирования заболевания. Клинически это должно приводить к улучшению в зрительных симптомах (потери зрения, диплопии (двоения в глазах)), нарушении походки (слабости, осевой нестабильности, потери чувствительности, спастичности, гиперрефлексии, потери "праворукости"), дисфункции верхних конечностей (слабости, спастичности, потери чувствительности), дисфункции мочевого пузыря (утраты ощущения необходимости мочеиспускания, недержания, задержки мочи, неполного опорожнения), депрессии, эмоциональной лабильности и нарушения познавательной способности. Патологически это лечение уменьшает одно из следующих явлений: потерю миелина, разрушение гематоэнцефалического барьера, периваскулярную инфильтрацию мононуклеарных клеток, иммунологические расстройства, образование глиотических рубцов и пролиферацию астроцитов, образование металлопротеиназы и ухудшенную скорость проводимости нерва.
Антимикротрубочковый агент может быть введен любым способом для достижения вышеуказанных конечных результатов. Однако предпочтительные способы введения включают в себя внутривенное, пероральное введение или подкожную, внутримышечную или внутриоболочечную инъекцию. Антимикротрубочковый агент может вводиться в виде длительной терапии низкими дозами для предупреждения прогрессирования заболевания, пролонгирования ремиссии заболевания или уменьшения симптомов в случае активного заболевания. Альтернативно, терапевтический агент может вводиться в более высоких дозах в виде "импульсной" терапии для индукции ремиссии в остром активном заболевании. Минимальная доза, способная давать эти конечные результаты, может быть использована, и она может варьироваться в соответствии с конкретным пациентом, тяжестью заболевания, композицией вводимого агента и путем введения. Например, для паклитаксела, при системной длительной терапии низкими дозами можно вводить непрерывно 10-50 мг/м2 паклитаксела каждые 1-4 недели, в зависимости от терапевтического ответа: при системной "импульсной" терапии высокими дозами можно вводить 50-250 мг/м2 каждые 1-21 дня в течение 1-6 циклов. Другие антимикротрубочковые агенты могут вводиться в эквивалентных дозах, скорректированных относительно активности и переносимости конкретного агента.
3. Артрит
Воспалительный артрит представляет собой серьезную проблему для здоровья в развитых странах, в частности при условии увеличивающегося количества пожилых индивидуумов. Например, одной из форм воспалительного артрита, ревматоидного артрита (РА), является мультисистемное, хроническое, рецидивирующее воспалительное заболевание неизвестного происхождения. Хотя могут быть поражены многие органы, РА в основном является тяжелой формой хронического синовита, который иногда приводит к деструкции и анкилозу пораженных суставов (Robbins Pathological Basis of Disease, by R.S.Cotran, V.Kumar and S.L.Robbins, W.B.Saunders Co., 1989). Патологически это заболевание характеризуется заметным утолщением синовиальной мембраны, которая образует ворсинчатые выступы, простирающиеся в пространство сустава, образованием многочисленных слоев синовиоцитарной выстилки (пролиферацией синовиоцитов), инфильтрацией синовиальной мембраны лейкоцитами (макрофагами, лимфоцитами, плазматическими клетками и лимфоидными фолликулами: так называемым "воспалительным синовитом") и отложением фибрина с клеточным некрозом в синовии. Ткань, образованную в результате этого процесса, называют паннусом и постепенно этот паннус растет с заполнением суставного пространства. Паннус развивает обширную сеть новых кровеносных сосудов посредством процесса ангиогенеза, что является существенным для развития синовита. Высвобождение расщепляющих ферментов (металлопротеиназ матрикса (например, коллагеназы, стромелизина)) и других медиаторов воспалительного процесса (например, пероксида водорода, супероксидов, лизосомных ферментов и продуктов метаболизма арахидоновой кислоты) из клеток ткани паннуса приводит к прогрессирующей деструкции хрящевой ткани. Паннус внедряется в суставной хрящ, приводя к эрозиям и фрагментированию хрящевой ткани. Со временем имеет место эрозия находящейся под хрящом кости с волокнистым анкилозом и, в конце концов, костным анкилозом сустава.
Обычно считается, но это не доказано окончательно, что РА является аутоиммунным заболеванием и что многочисленные различные артрогенные стимулы активируют иммунный ответ в иммуногенетически восприимчивом хозяине. Как экзогенные инфекционные агенты (вирус Эпстайна-Барр, вирус коревой краснухи, цитомегаловирус, вирус герпеса, Т-клеточный лимфотропный вирус человека, Mycoplasma и другие), так и эндогенные белки (коллаген, протеогликаны, измененные иммуноглобулины) участвуют в качестве причинного агента, запускающего неподходящий иммунный ответ хозяина. Независимо от возбуждающего агента аутоиммунитет играет роль в прогрессировании этого заболевания. В частности, релевантный антиген поглощается антигенпрезентирующими клетками (макрофагами или дендритными клетками в синовиальной мембране), обрабатывается и предоставляется Т-лимфоцитам. Т-клетки инициируют клеточный иммунный ответ и стимулируют пролиферацию и дифференцировку В-лимфоцитов в плазматических клетках. Конечным результатом является генерирование избыточного несоответствующего иммунного ответа, направленного против тканей хозяина (например, антител, направленных против коллагена типа II, антител, направленных против Fc-части аутологичного IgG (называемых "ревматоидным фактором")). Это амплифицирует далее иммунный ответ и ускоряет деструкцию хрящевой ткани. Как только этот каскад инициируется, многочисленные медиаторы деструкции хряща являются ответственными за прогрессирование ревматоидного артрита.
Таким образом, в одном аспекте данного изобретения обеспечены способы лечения или предупреждения воспалительного артрита (например, ревматоидного артрита), включающие в себя стадию введения пациенту терапевтически эффективного количества антимикротрубочкового агента. Воспалительный артрит включает в себя различные состояния, в том числе (но не только) ревматоидный артрит, системную красную волчанку, системный склероз (склеродермию), смешанное заболевание соединительной ткани, синдром Шегрена, анкилозирующий спондилит, синдром Бехчета, саркоидоз и остеоартрит, - все из которых характеризуются воспаленными болезненными суставами в качестве ярко выраженного симптома. В предпочтительном варианте изобретения антимикротрубочковые агенты могут вводиться непосредственно в сустав внутрисуставной инъекцией, в виде хирургической пасты или другим путем, например, системно или перорально.
Подходящие антимикротрубочковые агенты обсуждаются подробно выше и включают в себя, например, таксаны (например, паклитаксел и доцетаксел), кампотецин, элеутеробин, саркодиктины, эпотилоны А и В, дискодермолид, оксид дейтерия (D2O), гексиленгликоль (2-метил-2,4-пентандиол), туберцидин (7-деазааденозин), LY290181 (2-амино-4-(3-пиридил)-4Н-нафто-(1,2-b)пиран-3-карбонитрил), фторид алюминия, бис-(сукцинимидилсукцинат) этиленгликоля, этиловый эфир глицина, моноклональные антиидиотипические антитела, белок, стимулирующий сборку микротрубочек (таксол-подобный белок, TALP), набухание клеток, индуцированное гипотоническими (190 мосмоль/л) условиями, инсулином (100 нмоль/л) или глутамином (10 ммоль/л), связывание динеина, гибберелин, ХСНO1 (кинезин-подобный белок), лизофосфатидную кислоту, ион лития, компоненты клеточной стенки растений (например, поли-L-лизин и экстензин), буферы с глицерином, буфер с Тритоном Х-100, стабилизирующий микротрубочки, связанные с микротрубочками белки (например, МАР2, МАР4, тау, большой тау, энсконзин, фактор элонгации 1-α (EF-1α) и Е-МАР-115), клеточные частицы (например, гистон H1, миелиновый основной белок и кинетохоры), эндогенные микротрубочковые структуры (например, аксонемные структуры, макромолекулярные комплексы ферментов, формирующие поры в клеточной мембране и GTP-кэпы), стабильный трубочковый единственный полипептид (например, STOP145 и STOP220) и напряжение от митотических сил, а также любые аналоги и производные любого из вышеописанных агентов. Такие агенты, в некоторых вариантах, могут доставляться в виде композиции вместе с полимерным носителем или в липосомной композиции, как обсуждается более подробно выше и ниже. В некоторых вариантах изобретения этот антимикротрубочковый агент является другим агентом, отличающимся от паклитаксела, кампотецина или эпотилона.
Эффективная антимикротрубочковая терапия для воспалительного артрита будет давать один или несколько из следующих результатов: (i) уменьшение тяжести симптомов (боли, опухания и болезненности пораженных суставов; утренней тугоподвижности суставов, слабости, усталости, анорексии, потери веса); (ii) уменьшение тяжести клинических признаков заболевания (утолщения суставной капсулы, синовиальной гипертрофии, суставного выпота, контрактур мягких тканей, уменьшенного диапазона движения, анкилоза и стойкой деформации суставов); (iii) уменьшение внесуставных проявлений этого заболевания (ревматических узелков, васкулита, легочных узелков, интерстициального фиброза, перикардита, эписклеротита, ирита, синдрома Фелти, остеопороза); (iv) увеличение частоты и продолжительности периодов ремиссии/бессимптомных периодов; (v) предупреждение стойкого нарушения и потери трудоспособности; и/или (vi) предотвращение/ослабление хронического прогрессирования заболевания. Патологически эффективная антимикротрубочковая терапия для воспалительного артрита будет производить, по меньшей мере, одно из следующих действий: (i) уменьшать воспалительную реакцию, (ii) нарушать активность воспалительных цитокинов (таких как IL-1, TNFα, FGF, VEGF), (iii) ингибировать пролиферацию синовиоцитов, (iv) блокировать активность металлопротеиназ матрикса и/или (v) ингибировать ангиогенез. Антимикротрубочковый агент должен вводиться системно (перорально, внутривенно или внутримышечной или подкожной инъекцией) в минимальной дозе для получения вышеупомянутых результатов. Для пациентов лишь с небольшим количеством пораженных суставов или с заболеванием, выраженным более заметно в ограниченном числе суставов, антимикротрубочковый агент может инъецироваться непосредственно (внутрисуставная инъекция) в пораженные суставы.
4. Имплантаты и хирургические или медицинские устройства, в том числе стенты и трансплантаты
Различные имплантаты, хирургические устройства или стенты могут быть покрыты любым из заявленных антимикротрубочковых агентов, или сконструированы иным образом так, чтобы содержать и/или высвобождать антимикротрубочковые агенты. Характерные примеры включают в себя сердечно-сосудистые устройства (например, имплантируемые венозные катетеры, венозные порты, туннельные венозные катетеры, линии или порты для продолжительной инфузии, в том числе катетеры для инфузии печеночной артерии, проволоки пейсмайкера, имплантируемые дифибрилляторы); неврологические/нейрохирургические устройства (например, перитонеальные шунты, желудочково-предсердные шунты, устройства для стимуляции нервов, дуральные пластыри и имплантаты для предотвращения эпидурального фиброза после ламинэктомии, устройства для непрерывных субарахноидных инфузий); желудочно-кишечные устройства (например, продолжительно действующие постоянные катетеры, питательные трубки, портосистемные шунты, шунты для асцитов, перитонеальные имплантаты для доставки лекарственных средств, катетеры для перитонеального диализа, имплантируемые сетки для грыж, суспензии или твердые имплантаты для предупреждения хирургических спаек, в том числе сетки); мочеполовые устройства (например, маточные имплантаты, в том числе внутриматочные противозачаточные средства (ВМС) и устройства для предупреждения гиперплазии эндометрия, имплантаты для фаллопиевых труб, в том числе обратимые стерилизующие устройства, стенты для фаллопиевых труб, искусственные сфинктеры и околомочеточниковые имплантаты для недержания мочи, мочеточниковые стенты, постоянные катетеры продолжительного действия, наращивания мочевого пузыря или обертки или шины для вазовазостомии); глазные имплантаты (например, мультиноимплантаты и другие имплантаты для неоваскулярной глаукомы, элюирующие лекарственное средство контактные линзы для птеригия, шины для неудачного вскрытия слезного мешка, элюирующие лекарственное средство контактные линзы для реваскуляризации роговицы, имплантаты для диабетической ретинопатии, элюирующие лекарственное средство контактные линзы для трансплантатов роговицы высокого риска); отоларингологические устройства (например, оссикулярные имплантаты (слуховой косточки), шины или стенты евстахиевых труб для экссудативного отита или хронического отита в качестве альтернативы транстемпанным дренажам); имплантаты для пластической хирургии (например, предупреждение контрактуры мышечных волокон в ответ на содержащие гель или солевой раствор имплантаты молочной железы в субпекторальных или субжелезистых подходах или после мастэктомии, или имплантатов подбородка) и ортопедические имплантаты (например, цементные ортопедические протезы).
Подходящие антимикротрубочковые агенты обсуждаются подробно выше и включают в себя, например, таксаны (например, паклитаксел и доцетаксел), кампотецин, элеутеробин, саркодиктины, эпотилоны А и В, дискодермолид, оксид дейтерия (D2O), гексиленгликоль (2-метил-2,4-пентандиол), туберцидин (7-деазааденозин), LY290181 (2-амино-4-(3-пиридил)-4Н-нафто-(1,2-b)пиран-3-карбонитрил), фторид алюминия, бис-(сукцинимидилсукцинат) этиленгликоля, этиловый эфир глицина, моноклональные антиидиотипические антитела, белок, стимулирующий сборку микротрубочек (таксол-подобный белок, TALP), набухание клеток, индуцированное гипотоническими (190 мосмоль/л) условиями, инсулином (100 нмоль/л) или глутамином (10 ммоль/л), связывание динеина, гибберелин, ХСНО1 (кинезин-подобный белок), лизофосфатидную кислоту, ион лития, компоненты клеточной стенки растений (например, поли-L-лизин и экстензин), буферы с глицерином, буфер с Тритоном Х-100, стабилизирующий микротрубочки, связанные с микротрубочками белки (например, МАР2, МД.Р4, тау, большой тау, энсконзин, фактор элонгации 1-α (EF-1α) и Е-МАР-115), клеточные частицы (например, гистон H1, миелиновый основной белок и кинетохоры), эндогенные микротрубочковые структуры (например, аксонемные структуры, макромолекулярные комплексы ферментов, формирующие поры в клеточной мембране и GTP-кэпы), стабильный трубочковый единственный полипептид (например, STOP145 и STOP220) и напряжение от митотических сил, а также любые аналоги и производные любого из вышеописанных агентов. Такие агенты, в некоторых вариантах, могут доставляться в виде композиции вместе с полимерным носителем или в липосомной композиции, как обсуждается более подробно выше и ниже. В некоторых вариантах изобретения (например, в случае стентов), антимикротрубочковый агент является агентом, отличающимся от паклитаксела, кампотецина или эпотилона.
Имплантаты и другие хирургические или медицинские устройства могут быть покрыты (или иным образом приспособлены для высвобождения) антимикротрубочковыми композициями или антимикротрубочковыми факторами данного изобретения различными способами, в том числе, например: (а) прямым прикреплением к имплантату или устройству антимикротрубочкового агента или композиции (например, напылением на имплантат или устройство пленки полимера/лекарственного средства или погружением имплантата или устройства в раствор полимера/лекарственного средства или другими ковалентными или нековалентными средствами); (b) покрытием имплантата или устройства веществом, таким как гидрогель, которое, в свою очередь, будет абсорбировать антимикротрубочковую композицию (или антимикротрубочковый фактор, описанный выше); (с) вплетением покрытой антимикротрубочковой композицией нити (или самого полимера, сформованного в нить) в имплантат или устройство; (d) вставлением имплантата или устройства в муфту или сетку, состоящую из антимикротрубочковой композиции или покрытую такой композицией; (е) конструированием имплантата или устройства с антимикротрубочковым агентом или композицией; или (f) приспосабливанием имплантата или устройства иным образом для высвобождения антимикротрубочкового агента. В предпочтительных вариантах изобретения композиции должны быть прочно прикреплены к имплантату или устройству во время хранения и во время вставления. Антимикротрубочковые агент или композиция предпочтительно не должны разрушаться во время хранения, перед вставлением или при нагревании до температуры тела после вставления внутрь тела (если это необходимо). Кроме того, они должны предпочтительно покрывать имплантат или устройство гладко и равномерно, с однородным распределением антимикротрубочкового агента, без изменения контура стента. В предпочтительном варианте изобретения антимикротрубочковые агент или композиция должны обеспечивать однородное, предсказуемое, пролонгированное высвобождение антимикротрубочкового фактора в ткань, окружающую имплантат или устройство, как только их вводят в действие. Для сосудистых стентов, кроме вышеуказанных свойств, композиция не должна делать стент тромбогенным (вызывать образование сгустков крови) или вызывать значительную турбулентность в кровотоке (более чем можно было бы ожидать при введении не имеющего покрытия стента).
В случае стентов может быть разработано большое разнообразие стентов для содержания в них и/или высвобождения антимикротрубочковых агентов, в том числе пищеводные стенты, желудочно-кишечные стенты, сосудистые стенты, билиарные стенты, стенты для ободочной кишки, стенты для поджелудочной железы, мочеточниковые и уретральные стенты, слезные стенты, стенты для Евстахиевых труб, стенты для фаллопиевых труб и трахеально/бронхиальные стенты. Стенты могут быть легко получены из коммерческих источников или сконструированы в соответствии с хорошо известными способами. Характерные примеры стентов включают в себя стенты, описанные в U.S. Patent №4768523, озаглавленном "Hydrogel Adhesive"; U.S. Patent №4776337, озаглавленном "Expandable Intraluminal Graft and Method and Apparatus for Implanting and Expandable Intraluminal Graft"; U.S. Patent №5041126, озаглавленном "Endovascular Stent and Delivery System"; U.S. Patent №5052998, озаглавленном "Indwelling Stent and Method of Use"; U.S. Patent №5064435, озаглавленном "Self-Expanding Prosthesis Having Stable Axial Length"; U.S. Patent №5089606, озаглавленном "Water-insoluble Polysaccharide Hydrogel Foam for Medical Applications"; U.S. Patent №5147370, озаглавленном "Nitinol Stent for Hollow Body Conduits"; U.S. Patent №5176626, озаглавленном "Indwelling Stent"; U.S. Patent №5213580, озаглавленном "Biodegradable Polymeric Endoluminal Sealing Process"; и U.S. Patent №5328471, озаглавленном "Method and Apparatus for Treatment of Focal Disease in Hollow Tubular Organs and Other Tissue Lumens".
В других аспектах данного изобретения обеспечены способы для расширения просвета прохода тела, включающие в себя вставление стента в этот проход, причем стент имеет обычно трубчатую структуру и поверхность этой структуры покрыта (или приспособлена иным способом для высвобождения) антимикротрубочковой композицией (или только антимикротрубочковым агентом), так чтобы проток расширился. Ниже описаны различные варианты, в которых просвет прохода тела расширяется для устранения билиарной, желудочно-кишечной, пищеводной, трахеально/бронхиальной, мочеточниковой или сосудистой обструкции.
Обычно стенты вставляют одинаковым образом независимо от места или заболевания, подлежащего лечению. Вкратце, перед вставлением обычно сначала проводят обследование, обычно при помощи процедуры диагностической томографии, эндоскопии или визуально во время хирургии для определения подходящего расположения для вставления стента. Затем через повреждение или предполагаемое место вставления продвигают направитель (направляющую проволоку) и по ней проходит катетер доставки, позволяющий вставить стент в его спавшемся виде. Обычно стенты могут быть сжаты, так что они могут быть вставлены через тонкие полости через маленькие катетеры и затем расширены до большего диаметра, как только они будут расположены в желаемом местоположении. После расширения стент физически раздвигает стенки протока и удерживает их открытыми. Как таковые они способны вставляться через небольшое отверстие и все же способны держать открытыми полость или проход большого диаметра. Стент может быть саморасширяющимся (например, Wallstent и стенты Gianturco), расширяемыми баллонами (например, стент Palmaz и стент Strecker) или имплантироваться при помощи изменения температуры (например, Nitinol стент).
Стенты обычно проводят маневрированием на место при радиологическом или прямом визуальном контроле, обращая особое внимание на помещение стента точно поперек сужения в подлежащем лечению органе. Затем доставляющий катетер удаляют, оставляя стент стоять самостоятельно в виде "лесов". Обследование после вставления, обычно при помощи рентгена, часто используется для подтверждения правильного помещения.
В предпочтительном варианте изобретения обеспечены способы устранения билиарных обструкций, предусматривающие вставление билиарного стента в желчный проток, причем этот стент имеет обычно трубчатую структуру и поверхность этой структуры покрыта (или иным образом приспособлена для высвобождения) агентом или композицией, описанной выше, так что билиарная обструкция устраняется. Вкратце, опухолевое разрастание обычного желчного протока приводит к прогрессирующей холестатической желтухе, которая несовместима с жизнью. Обычно билиарная система, которая дренирует желчь из печени в двенадцатиперстную кишку, наиболее часто закупоривается (1) опухолью, состоящей из клеток желчного протока (холангиокарциномой), (2) опухолью, которая внедряется в желчный проток (например, раком поджелудочной железы) или (3) опухолью, которая оказывает наружное давление и сжимает желчный проток (например, увеличенными лимфатическими узлами).
Как первичные билиарные опухоли, так и другие опухоли, которые вызывают сжатие билиарного дерева (совокупности всех протоков), могут лечиться с применением описанных здесь стентов. Одним из примеров первичных билиарных опухолей являются аденокарциномы (которые также называют опухолями Klatskin, когда они находятся в месте раздвоения общего печеночного протока). Эти опухоли называют также билиарными карциномами, холедохолангиокарциномами или аденокарциномами билиарной системы. Доброкачественные опухоли, которые поражают желчный проток (например, аденома билиарной системы), и, в редких случаях, плоскоклеточные карциномы желчного протока и аденокарциномы желчного пузыря, могут также вызывать сжатие билиарного дерева и, следовательно, приводить к билиарной обструкции.
Сжатие билиарного дерева наиболее часто обусловлено опухолями печени и поджелудочной железы, которые сжимают и, следовательно, закупоривают протоки. Большинство опухолей из поджелудочной железы возникают из клеток панкреатических протоков. Это высоколетальная форма рака (5% всех смертей от рака; 26000 новых случаев возникновения на один год в США) со средним временем выживания 6 месяцев и с выживанием в течение 1 года только в 10% случаев. Когда эти опухоли расположены в головной части поджелудочной железы, они часто вызывают билиарную обструкцию, и это значительно снижает качество жизни пациента. Хотя все типы панкреатических опухолей обычно называют "раком поджелудочной железы", имеются гистологические подтипы: аденокарцинома, аденоплоскоклеточная карцинома, цистаденокарцинома и ацинарноклеточная карцинома. Печеночные опухоли, как обсуждалось выше, могут также вызывать сжатие билиарного дерева и, следовательно, вызывать обструкцию желчных протоков.
В одном варианте изобретения билиарный стент сначала вставляют в билиарный проток одним из нескольких способов: с верхнего конца вставлением иглы через брюшную стенку и через печень (чрескожная чреспеченочная холангиограмма или "РТС"); с нижнего конца канюлированием желчного протока через эндоскоп, вставленный через рот, желудок и двенадцатиперстную кишку (эндоскопическая ретроградная холангиограмма или "ERCP"); или прямым рассечением во время хирургической процедуры. Перед вставлением обычно сначала проводят обследование, обычно при помощи процедуры РТС, ERCP или визуально во время хирургии для определения подходящего местоположения для вставления стента. Затем через повреждение и по нему продвигают катетер доставки, позволяющий вставить стент в его спавшемся виде. Если диагностическим исследованием является РТС, то направитель и катетер доставки вставляют через брюшную стенку, тогда как, если обследование проводят при помощи ERCP, то стент помещают на место через рот. Затем стент вводят на место под радиологическим, эндоскопическим или прямым визуальным контролем, обращая особое внимание на помещение его точно через сужение в желчном протоке. Доставляющий катетер затем удаляют, оставляя стент стоящим в виде "лесов", которые удерживают желчный проток в открытом состоянии. Последующая холангиограмма может быть получена для документирования того, что стент размещен надлежащим образом.
Еще в одном варианте изобретения обеспечены способы для устранения пищеводных обструкций, предусматривающие вставление пищеводного стента в пищевод, причем стент имеет обычно трубчатую структуру и поверхность этой структуры покрыта (или приспособлена иным способом для высвобождения) антимикротрубочковым агентом или композицией, как описано выше, так чтобы пищеводная обструкция была устранена. Вкратце, пищевод представляет собой полую трубку, которая транспортирует пищу и жидкости из полости рта в желудок. Рак пищевода или инвазия раком, возникающим в смежных органах (например, раком желудка или легкого), приводит к неспособности проглатывания пищи или слюны. В этом варианте, должно проводиться перед вставлением обследование, обычно проглатывание бария или эндоскопия для определения подходящего положения для вставления стента. Затем катетер или эндоскоп могут быть помещены через рот и направитель из проволоки продвигают через место закупорки. Катетер для доставки стента проходит по направителю под радиологическим или эндоскопическим контролем, и стент помещают точно через сужение в пищеводе. Обследование после вставления, обычно рентген проглоченного бария, может быть использовано для подтверждения подходящего помещения стента.
Еще в одном варианте изобретения обеспечены способы для устранения обструкций толстой кишки, предусматривающие вставление стента в толстую кишку, причем стент имеет обычно трубчатую структуру и поверхность этой структуры покрыта (или приспособлена иным способом для высвобождения) антимикротрубочковыми агентом или композицией, как описано выше, так чтобы устранить обструкцию толстой кишки. Вкратце, толстая кишка представляет собой полую трубку, которая транспортирует переваренную пищу и отходы переваривания из тонкой кишки к анусу. Рак прямой кишки и/или толстой кишки или инвазия раком, возникающим в соседних органах (например, раком матки, яичника, мочевого пузыря), приводит к неспособности выведения фекалий из кишечника. В этом варианте, должно обычно проводиться обследование перед вставлением, обычно при помощи клизмы с барием или колоноскопии, для определения подходящего местоположения для вставления стента. Затем катетер или эндоскоп может быть помещен через анус и проволочный направитель продвигают через место закупорки. Катетер доставки стента проходит по направителю под радиологическим или эндоскопическим контролем и стент помещают точно через сужение в толстой или прямой кишке. Обследование после вставления, обычно при помощи рентгена бариевой клизмы, может быть использовано для подтверждения правильного размещения стента.
В других вариантах изобретения обеспечены способы для устранения трахеально/бронхиальных обструкций, предусматривающие вставление трахеально/бронхиального стента в трахею или бронхи, причем стент имеет обычно трубчатую структуру и поверхность этой структуры покрыта (или приспособлена иным способом для высвобождения) антимикротрубочковыми агентом или композицией, так чтобы устранить трахеально/бронхиальную закупорку. Вкратце, трахея и бронхи представляют собой трубки, которые несут воздух изо рта и носа к легким. Закупорка трахеи раком, инвазия раком, возникающим в соседних органах (например, раком легких) или коллапс трахеи или бронхов, вызванный хондромаляцией (размягчением хрящевых колец), приводит к неспособности дышать. В этом варианте изобретения, должно обычно проводиться обследование перед вставлением, обычно эндоскопия, для определения подходящего местоположения для вставления стента. Затем катетер или эндоскоп помещают через рот и продвигают направитель через место закупорки. Затем катетер доставки стента проходит по направителю для вставления спавшегося стента. Стент помещают под радиологическим или эндоскопическим контролем для помещения его точно через сужение. Затем катетер доставки может быть удален с оставлением стента, стоящего самостоятельно в виде "лесов". Обследование после вставления, обычно бронхоскопия, может быть использовано для подтверждения подходящего помещения стента.
В другом варианте изобретения обеспечены способы для устранения уретральных закупорок, предусматривающие вставление уретрального стента в мочеиспускательный канал, причем стент имеет обычно трубчатую структуру и поверхность этой структуры покрыта (или приспособлена иным способом для высвобождения) антимикротрубочковыми агентом или композицией, так чтобы устранить непроходимость мочеиспускательного канала. Вкратце, мочеиспускательный канал представляет собой трубку, которая опустошает мочевой пузырь через половой член. Наружное сужение мочеиспускательного канала при его прохождении через предстательную железу, обусловленное гипертрофией предстательной железы, встречается фактически у каждого мужчины в возрасте более 60 лет и вызывает прогрессирующее затруднение мочеиспускания. В этом варианте, должно быть сначала проведено обследование перед вставлением, обычно эндоскопия или уретрограмма, для определения правильного местоположения для вставления стента, которое находится выше наружного сфинктера мочеиспускательного канала на его нижнем конце и близко к месту примыкания к шейке мочевого пузыря на верхнем конце. Затем эндоскоп или катетер помещают через отверстие полового члена и направитель продвигают в мочевой пузырь. Затем катетер доставки стента проходит по направителю для вставления стента. Затем катетер доставки удаляют и стент расширяется на место. Обследование после вставления, обычно эндоскопия или ретроградная уретрограмма, может быть использовано для подтверждения подходящего положения стента.
В другом варианте изобретения обеспечены способы для устранения сосудистых закупорок, предусматривающие вставление сосудистого стента в кровеносный сосуд, причем стент имеет обычно трубчатую структуру и поверхность этой структуры покрыта (или приспособлена иным способом для высвобождения) антимикротрубочковыми агентом или композицией, так чтобы устранить закупорку сосуда. Вкратце, стенты могут быть помещены в большую серию кровеносных сосудов, как артерий, так и вен, для предупреждения рецидивирующего стеноза в месте неудачной ангиопластики для обработки сужений, которые, по всей вероятности, не удастся устранить ангиопластикой, и для обработки сужений после хирургии (например, стеноз диализного трансплантата). Характерные примеры подходящих мест включают в себя артерии подвздошной железы, почечные и коронарные артерии, верхнюю полую вену и в диализных трансплантатах. В одном варианте сначала проводят ангиографию для определения места для помещения стента. Это обычно выполняют инъекцией радионепрозрачного контраста через катетер, вставленный в артерию или вену, при получении рентгенограммы. Затем катетер может быть вставлен чрескожно или хирургически в бедренную артерию, плечевую артерию, бедренную вену или плечевую вену и продвинут в подходящий кровеносный сосуд направлением его по сосудистой системе при помощи флуроскопии. Затем стент может быть помещен через сужение сосудов. Ангиограмма после вставления может быть использована для подтверждения правильного помещения стента.
Обычно используемой моделью животного для исследования рестеноза является крысиная модель сонной артерии, в которой общую сонную артерию освобождают от эндотелия посредством интралюминального прохождения баллонного катетера, введенного через наружную сонную артерию (Clowes et al., Lab. Invest. 49(2) 208-215, 1983). При 2 неделях сонная артерия является заметно суженной из-за сжатия клеток гладких мышц, но между 2 и 12 неделями интима удваивается по толщине, что приводит к уменьшению люминального размера.
5. Воспалительное заболевание кишечника
С применением описанных здесь агента, композиций и способов может быть достигнуто лечение или предупреждение большого разнообразия воспалительных заболеваний кишечника. Воспалительное заболевание кишечника (IBD) является термином для группы хронических воспалительных расстройств неизвестной этиологии, вовлекающих в себя желудочно-кишечный тракт. Хроническое IBD может быть подразделено на 2 группы: язвенный колит и болезнь Крона. В Западной Европе и в Соединенных Штатах язвенный колит имеет распространенность 6-8 случаев на 100000.
Хотя причина этого заболевания остается неизвестной, в качестве причинных факторов предполагались генетические, инфекционные, иммунологические и психологические факторы. В случае язвенного колита имеет место воспалительная реакция, охватывающая слизистую оболочку толстой кишки, приводящая к изъязвлениям поверхности. Обычной является инфильтрация нейтрофилов, и повторяющиеся воспалительные приступы приводят к фиброзу и укорочению толстой кишки. При длительном язвенном колите эпителий может стать дисплазированным и, в конце концов, злокачественным. Болезнь Крона характеризуется хроническим воспалением, простирающимся через все слои стенки кишечника. По мере прогрессирования этого заболевания кишечник становится утолщенным и имеет место стеноз просвета. Изъязвление слизистой оболочки имеет место, и эти изъязвления могут проникать в подслизистую оболочку и в мышечный слой с образованием свищей и фиссур.
Антимикротрубочковые агенты могут быть использованы для лечения воспалительного заболевания кишечника несколькими способами. В частности, антимикротрубочковый агент может быть введен в место воспаления (или потенциальное место воспаления) для лечения этого заболевания. Подходящие антимикротрубочковые агенты обсуждаются подробно выше и включают в себя, например, таксаны (например, паклитаксел и доцетаксел), кампотецин, элеутеробин, саркодиктины, эпотилоны А и В, дискодермолид, оксид дейтерия (D2O), гексиленгликоль (2-метил-2,4-пентандиол), туберцидин (7-деазааденоэин), LY290181 (2-амино-4-(3-пиридил)-4Н-нафто(1,2-b)пиран-3-карбонитрил), фторид алюминия, бис-(сукцинимидилсукцинат) этиленгликоля, этиловый эфир глицина, моноклональные антиидиотипические антитела, белок, стимулирующий сборку микротрубочек (таксол-подобный белок, TALP), набухание клеток, индуцированное гипотоническими (190 мосмоль/л) условиями, инсулином (100 нмоль/л) или глутамином (10 ммоль/л), связывание динеина, гибберелин, ХСНO1 (кинезин-подобный белок), лизофосфатидную кислоту, ион лития, компоненты клеточной стенки растений (например, поли-L-лизин и экстензин), буферы с глицерином, буфер с Тритоном Х-100, стабилизирующий микротрубочки, связанные с микротрубочками белки (например, МАР2, МАР4, тау, большой тау, энсконзин, фактор элонгации 1-α (EF-1α) и Е-МАР-115), клеточные частицы (например, гистон H1, миелиновый основной белок и кинетохоры), эндогенные микротрубочковые структуры (например, аксонемные структуры, макромолекулярные комплексы ферментов, формирующие поры в клеточной мембране и GTP-кэпы), стабильный трубочковый единственный полипептид (например, STOP145 и STOP220) и напряжение от митотических сил, а также любые аналоги и производные любого из вышеописанных агентов. Такие агенты, в некоторых вариантах, могут доставляться в виде композиции вместе с полимерным носителем или в липосомной композиции, как обсуждается более подробно выше и ниже.
Идеальная модель для исследования IBD должна быть встречающимся в природе или индуцируемым заболеванием животного, которое по существу идентично заболеванию человека. В настоящее время имеются только две встречающиеся в природе модели, обе в видах приматов, кишечного воспаления, в котором не был обнаружен причинный организм-возбудитель. Первая модель, тамарин (cotton-top tamarin), имеет высокую частоту случаев спонтанного колита, не ассоциированного с идентифицируемыми патогенами и, как и в случае людей, активность этого процесса заболевания спонтанно убывает и прибывает (Madara et al., Gastroenterology 88 : 13-19, 1985). Другой спонтанный хронический колит также встречается у ювенильных макак-резусов (Adier et al., Gastroenterology 98 : A436, 1990). Существует много моделей животных с экспериментально индуцированным колитом. В мышах, крысах, морских свинках и кроликах колит может быть индуцирован пероральным введением сульфатированных полисахаридов (сульфата амилопектина каррагенана, декстрансульфата) (Marcus and Watt, Lancet 2: 489-490, 1969), ректальным введением химических раздражителей (разбавленной уксусной кислоты) (MacPherson and Pfeiffer. Digestion 17 : 135-150, 1978) и аллергической реакцией замедленного типа на динитрохлорбензол (Glick and Falchuk., Gut 22 : 120-125, 1981) или на тринитробензолсульфоновую кислоту (Rabin and Rogers, Gastroenterology 75 : 29-33, 1978).
Поскольку нет патогеномоничных (характерных для данной болезни) признаков или специфических диагностических тестов для IBD, эффективность антимикротрубочкового агента в лечении этого заболевания определяют клинически. Эффективная антимикротрубочковая терапия для IBD будет достигаться по меньшей мере в виде следующих результатов: уменьшение частоты приступов, увеличение количества времени, проводимого в ремиссии (т.е. периодов, когда пациент не имеет симптомов заболевания) и/или уменьшение тяжести или продолжительности сопутствующих манифестаций (образования абсцессов, образования свищей, рака ободочной кишки, прободения кишечника, обструкции кишечника, токсического мегаколона, периферического артрита, анкилозирующего спондилита, холелитиаза, склерозирующего холангита, цирроза, нодозной эритемы, ирита, увеита, эписклеротита, венозного тромбоза). Специфические симптомы, такие как кровавая диарея, боль в области живота, пирексия, потеря веса, ректальное кровотечение, тенезмы и вздутие живота, будут уменьшены или ослаблены.
Антимикротрубочковый агент может быть введен любым способом для достижения вышеописанных конечных результатов, но предпочтительные способы включают в себя пероральное, ректальное или перитубулярное введение (предпочтительно при ультразвуковом, КТ (компьютерная томография), флуороскопическом, MRI или эндоскопическом контроле направления; введение может также выполняться прямым введением во время хирургии в брюшной полости). Для некоторых пациентов в лечении этого заболевания может быть также использована внутривенная, подкожная или внутримышечная инъекция. Для пациентов с широко распространившимися или внекишечными симптомами пригодно системное лечение (например, пероральное введение, внутривенная, подкожная, внутримышечная инъекция). В предпочтительном варианте, паклитаксел может быть введен перорально в дозе 10-75 мг/м2 каждые 1-4 недели в зависимости от терапевтического ответа и толерантности пациента. Для лечения тяжелых острых обострений более высокие дозы 50-250 мг/м2 паклитаксела, предоставляемые перорально (или внутривенно), могут вводиться в качестве "импульсной" терапии. В случае пациентов с локализованным ректальным заболеванием (прямая кишка поражается в 95% пациентов с язвенным колитом), паклитаксел может вводиться локально в виде ректального крема или суппозитория. Например, крем для местного применения, содержащий 0,01-10% паклитаксела по весу, может быть введен в зависимости от тяжести заболевания и реакции пациента на это введение. В предпочтительном варианте, препарат для местного введения, содержащий 0,1-1% паклитаксел по весу, мог бы вводиться в прямую кишку ежедневно при необходимости. Перитубулярный паклитаксел (т.е. введение лекарственного средства к наружной или мезентериальной поверхности кишечника) может вводиться в участки кишечника с активным заболеванием. В предпочтительном варианте, 0,5-20% паклитаксел по весу помещают в полимерный носитель (как описано в примерах) и наносят на мезентериальную поверхность в виде "пасты", "пленки" или "обертки", которая высвобождает лекарственное средство на протяжении некоторого периода времени. Во всех вариантах другие антимикротрубочковые агенты могли бы вводиться в эквивалентных дозах, скорректированных относительно активности и переносимости конкретного агента.
6. Хирургические процедуры
Как отмечалось выше, антимикротрубочковые агенты и композиции могут быть использованы в разнообразных хирургических процедурах. Например, в одном аспекте данного изобретения антимикротрубочковый агент или композиция (например, в форме спрея или пленки) могут быть использованы для покрытия или разбрызгивания на зону перед удалением опухоли, чтобы изолировать окружающие ткани от злокачественной ткани и/или предотвратить распространение заболевания на окружающие ткани. В других аспектах данного изобретения, антимикротрубочковые агенты или композиции (например, в форме спрея) могут быть доставлены посредством эндоскопических процедур для покрытия опухолей или ингибирования заболевания в желательном местоположении. Еще в других аспектах данного изобретения, хирургические сетки, которые были покрыты антимикротрубочковыми агентами или композициями или приспособлены для высвобождения антимикротрубочковых агентов или композиций данного изобретения, могут быть использованы в любой процедуре, в которой может быть использована хирургическая сетка. Например, в одном варианте изобретения, хирургическая сетка, загруженная антимикротрубочковой композицией, может быть использована во время иссекающей хирургии рака брюшной полости (например, после резекции ободочной кишки) для обеспечения поддержки для этой структуры и для высвобождения некоторого количества антимикротрубочкового агента.
В дальнейших аспектах данного изобретения обеспечены способы для лечения мест эксцизии (иссечения) опухолей, предусматривающие введение антимикротрубочковых агента или композиции, как описано выше, в края резекции опухоли после иссечения, так что локальный рецидив рака в этом месте ингибируется.
В одном варианте изобретения антимикротрубочковые композицию (композиции) (или только антимикротрубочковый фактор (факторы)) вводят непосредственно в место эксцизии опухоли (например, покрытием при помощи тампона или кисти краев (границ) резекции опухоли антимикротрубочковыми композициями или факторами)). Альтернативно, антимикротрубочковые композиции или факторы могут быть включены в известные хирургические пасты перед введением. В особенно предпочтительных вариантах изобретения, антимикротрубочковые композиции наносят после частичной мастэктомии при злокачественной опухоли и после нейрохирургических операций.
В одном аспекте данного изобретения, антимикротрубочковые агент или композиция могут быть введены в границу резекции большого разнообразия опухолей, в том числе, например, опухолей молочной железы, головы и шеи, опухолей ободочной кишки, мозга и печени. Например, в одном варианте изобретения, антимикротрубочковые агенты или композиции могут вводиться в место нейрологической опухоли после иссечения, так что ингибируется рецидив этой опухоли. Вкратце, мозг является высоколокализованным функционально; т.е. каждая специфическая анатомическая область специализирована для проведения специфической функции. Поэтому, часто более важным является местоположение мозговой патологии, чем ее тип. Относительно малое повреждение в решающей зоне может быть гораздо более губительным, чем гораздо большее повреждение в менее важной зоне. Подобным образом повреждение на поверхности мозга может быть легким для хирургического иссечения, тогда как та же самая опухоль, расположенная глубоко в мозгу, может не быть легкой для иссечения (нужно будет разрезать слишком много жизненно важных структур для доступа к ней). Также, даже доброкачественные опухоли могут быть опасными по нескольким причинам: они могут расти в жизненно важной области и вызывать значительное повреждение; даже если они могли бы быть удалены хирургическим иссечением, это может быть невозможным; и, наконец, если их оставить неконтролируемыми, они могут увеличивать внутричерепное давление. Череп является замкнутым пространством, неспособным к расширению. Поэтому, если что-то растет в одном его местоположении, что-то еще должно сжиматься в другом местоположении - результатом является увеличенное давление в черепе, или увеличенное внутричерепное давление. Если такое состояние оставить без лечения, жизненно важные структуры могут быть сдавленными, приводя к смерти. Заболеваемость злокачественными болезнями центральной нервной системы (ЦНС) составляет 8-16 на 100000. Прогноз первичной злокачественной опухоли мозга является мрачным, со средним выживанием менее одного года, даже после хирургического удаления. Эти опухоли, особенно глиомы, представляют собой преимущественно локальное заболевание, которое рецидивирует в 2 см от исходного очага болезни после хирургического удаления.
Характерные примеры опухолей мозга, которые могут лечиться с использованием описанных здесь агентов, композиций и способов, включают в себя глиальные опухоли (такие как анапластическая астроцитома, полиморфная глиобластома, волосяная астроцитома, олигодендроглиома, эпендимома, миксопапиллярная эпендимома, субэпендимома, папиллома сосудистого сплетения); нейронные опухоли (например, нейробластома, ганглионейробластома, ганглионеврома и медуллобластома); опухоли шишковидного тела (например, пинеобластома и пинеоцитома); менингеальные опухоли (например, менингиома, менингиальная гемангиоперицитома, менингиальная саркома); опухоли клеток периневрия (например, шваннома (неврилемома) и нейрофиброма); лимфомы (например, болезнь Ходжкина и лимфома не-Ходжкина (в том числе многочисленные подтипы, как первичные, так и вторичные); врожденные опухоли (например, краниофарингиома, эпидермоидная киста, дермоидная киста и коллоидная киста); и метастазирующие опухоли (которые могут быть образованы по существу из любой опухоли, наиболее часто из опухолей легких, молочной железы, меланомы, почек и желудочно-кишечного тракта).
Подходящие антимикротрубочковые агенты обсуждаются подробно выше и включают в себя, например, таксаны (например, паклитаксел и доцетаксел), кампотецин, элеутеробин, саркодиктины, эпотилоны А и В, дискодермолид, оксид дейтерия (D2O), гексиленгликоль (2-метил-2,4-пентандиол), туберцидин (7-деазааденозин), LY290181 (2-амино-4-(3-пиридил)-4Н-нафто-(1,2-b)пиран-3-карбонитрил), фторид алюминия, бис-(сукцинимидилсукцинат) этиленгликоля, этиловый эфир глицина, моно-клональные антиидиотипические антитела, белок, стимулирующий сборку микротрубочек (таксол-подобный белок, TALP), набухание клеток, индуцированное гипотоническими (190 мосмоль/л) условиями, инсулином (100 нмоль/л) или глутамином (10 ммоль/л), связывание динеина, гибберелин, ХСНО1 (кинезин-подобный белок), лизофосфатидную кислоту, ион лития, компоненты клеточной стенки растений (например, поли-L-лизин и экстензин), буферы с глицерином, буфер с Тритоном Х-100, стабилизирующий микротрубочки, связанные с микротрубочками белки (например, МАР2, МАР4, тау, большой тау, энсконзин, фактор элонгации 1-α, (EF-1α) и Е-МАР-115), клеточные частицы (например, гистон H1, миелиновый основной белок и кинетохоры), эндогенные микротрубочковые структуры (например, аксонемные структуры, макромолекулярные комплексы ферментов, формирующие поры в клеточной мембране и GTP-кэпы), стабильный трубочковый единственный полипептид (например, STOP145 и STOP220) и напряжение от митотических сил, а также любые аналоги и производные любого из вышеописанных агентов. Такие агенты, в некоторых вариантах, могут доставляться в виде композиции вместе с полимерным носителем или в липосомной композиции, как обсуждается более подробно выше и ниже. В некоторых вариантах изобретения, этот антимикротрубочковый агент является другим агентом, отличающимся от паклитаксела, кампотецина или эпотилона.
7. Хирургические спайки
В других аспектах изобретения обеспечены способы лечения и/или предупреждения хирургических спаек введением пациенту антимикротрубочкового агента. Вкратце, образование хирургических спаек представляет собой комплексный процесс, в котором ткани тела, которые в норме являются отдельными, срастаются вместе. Эти послеоперационные спайки имеют место в 60-90% пациентов, подвергнутых основной гинекологической хирургии. Хирургическая травма, как результат высыхания тканей, ишемии, термического повреждения, инфекции или присутствия чужеродного тела, давно признается как стимул образования спаек тканей. Эти спайки являются основной причиной неудачной хирургической терапии и являются ведущей причиной обструкции кишечника и бесплодия. Другие спаечные осложнения включают в себя хроническую боль в области таза, закупорку мочеиспускательного канала и дисфункцию опорожнения (удаления каловых масс и мочевыделения).
Обычно спайкообразование представляет собой воспалительную реакцию, в которой высвобождаются факторы, увеличивающие проницаемость сосудов и приводящие к притоку фибриногена и отложению фибрина. Это отложение образует матрикс, который соединяет мостом граничащие друг с другом ткани. Фибробласты накапливаются, присоединяются к этому матриксу, откладывают коллаген и индуцируют ангиогенез. Если этот каскад событий может быть предотвращен в течение 4-5 дней после хирургического вмешательства, то спайкообразование будет ингибироваться.
Таким образом, как отмечалось выше, данное изобретение обеспечивает способы лечения и/или предупреждения образования хирургических спаек. Большое разнообразие моделей животных может быть использовано для оценки конкретной терапевтической композиции или схемы лечения. Вкратце, перитонеальные спайки встречаются у животных как результат нанесенного серьезного повреждения, которое обычно охватывает две смежные поверхности. Повреждения могут быть механическими, вызванными ишемией, или быть результатом введения чужеродного материала. Механические повреждения включают в себя удары в области кишечника (Choate et al., Arch. Surg. 88 : 249-254, 1964) и обдирание или соскребание наружных слоев стенок кишечника (Gustavsson et al., Acta Chir. Scand. 109 : 327-333, 1955). Разъединение основных сосудов на петли кишечника индуцирует ишемию (James et al., J. Path. Bact. 90 : 279-287, 1965). Чужеродный материал, который может быть введен в эту область, включает в себя тальк (Green et al., Proc. Soc. Exp. Biol. Med. 133: 544-550, 1970), марлевые тампоны (Lehman and Boys, Ann. Surg. 111: 427-435, 1940), токсические химикаты (Chancy, Arch. Surg. 60 : 1151-1153, 1950), бактерии (Moin et al., Am. J. Sci. 250 : 675-679, 1965) и фекалии (Jackson, Surgery 44 : 507-518, 1958).
В настоящее время типичные модели предупреждения формирования спаек включают в себя кроличью модель маточного рога (кератомы), который характеризуется эрозией матки кролика (Linsky et al., J. Reprod. Med. 32(1) : 17-20, 1987), модифицированную деваскуляризацией кроличью модель маточного рога, которая характеризуется эрозией и нарушением кровоснабжения матки (Wiseman et al., J. Invest. Surg. 7: 527-532, 1994) и кроличью модель слепокишечной боковой стенки, включающую в себя вырезание лоскута париетальной брюшины и эрозию слепой кишки (Wiseman and Johns, Fertil. Steril. Suppi : 25S, 1993).
Характерные антимикротрубочковые агенты для лечения спаек обсуждаются подробно выше и включают в себя таксаны (например, паклитаксел и доцетаксел), кампотецин, элеутеробин, саркодиктины, эпотилоны А и В, дискодермолид, оксид дейтерия (D2O), гексиленгликоль (2-метил-2,4-пентандиол), туберцидин (7-деазааденозин), LY290181 (2-амино-4-(3-пиридил)-4Н-нафто(1,2-b)пиран-3-карбонитрил), фторид алюминия, бис-(сукцинимидилсукцинат)этиленгликоля, этиловый эфир глицина, моноклональные антиидиотипические антитела, белок, стимулирующий сборку микротрубочек (таксол-подобный белок, TALP), набухание клеток, индуцированное гипотоническими (190 мосмоль/л) условиями, инсулином (100 нмоль/л) или глутамином (10 ммоль/л), связывание динеина, гибберелин, ХСНO1 (кинезин-подобный белок), лизофосфатидную кислоту, ион лития, компоненты клеточной стенки растений (например, поли-L-лизин и экстензин), буферы с глицерином, буфер с Тритоном Х-100, стабилизирующий микротрубочки, связанные с микротрубочками белки (например, МАР2, МАР4, тау, большой тау, энсконзин, фактор элонгации 1-α (EF-1α) и Е-МАР-115), клеточные частицы (например, гистон H1, миелиновый основной белок и кинетохоры), эндогенные микротрубочковые структуры (например, аксонемные структуры, макромолекулярные комплексы ферментов, формирующие поры в клеточной мембране и GTP-кэпы), стабильный трубочковый единственный полипептид (например, STOP145 и STOP220) и напряжение от митотических сил, а также любые аналоги и производные любого из вышеописанных агентов. Такие агенты, в некоторых вариантах, могут доставляться в виде композиции вместе с полимерным носителем или в липосомной композиции, как обсуждается более подробно выше и ниже. В некоторых вариантах изобретения этот антимикротрубочковый агент является другим агентом, отличающимся от паклитаксела, кампотецина или эпотилона.
С использованием обеспеченных здесь агентов, композиций и способов может лечиться или предупреждаться большое разнообразие хирургических спайкообразований и осложнений. Спайкообразование или нежелательное накопление/инкапсулирование рубцовой ткани осложняет многие хирургические процедуры. Как описано выше, хирургические спайки осложняют фактически любую эндоскопическую хирургическую процедуру в брюшной или тазовой полости. Инкапсулирование хирургических имплантатов также является осложнением реконструктивной (пластической) хирургии, восстановительной хирургии суставов, восстановительной хирургии грыж, хирургии искусственных сосудистых трансплантатов и нейрохирургии. В каждом случае имплантат становится инкапсулированным капсулой из фиброзной соединительной ткани, которая ухудшает или нарушает функцию хирургического имплантата (например, имплантата молочной железы, искусственного сустава, хирургической сетки, сосудистого трансплантата, дурального пластыря). Хроническое воспаление и образование рубцов имеет место также во время хирургии по поводу коррекции хронического синусита или удаления других участков хронического воспаления (например, чужеродных тел, инфекций (грибковых, микобактериальных)).
Антимикротрубочковый агент может быть введен любым способом для достижения вышеуказанных конечных результатов, но предпочтительные способы включают в себя перитубулярное введение (либо прямым нанесением на место хирургии, либо с эндоскопическим, ультразвуковым, КТ, MRI или флуороскопическим контролем направления введения); "покрытие" хирургического имплантата; и помещение элюирующего лекарственное средство полимерного имплантата в место хирургии. В предпочтительном варианте, 0,5-20% паклитаксел по весу нагружают в полимерный носитель (как описано в следующих далее примерах) и наносят на перитубулярную (мезентериальную) поверхность в виде "пасты", "пленки" или "обертки", которая высвобождает лекарственное средство на протяжении некоторого периода времени, так что частота возникновения хирургических спаек снижается. Во время эндоскопических процедур препарат паклитаксел-полимер наносят в виде "спрея", через порты доставки в эндоскопе, на брыжейку органов брюшной и тазовой полости, с которыми манипулируют во время операции. В особенно предпочтительном варианте, перитубулярная композиция содержит 1-5% паклитаксел по весу. В другом предпочтительном варианте, полимерное покрытие, содержащее 0,1-20% паклитаксел, наносят на поверхность хирургического имплантата (например, имплантата молочной железы, искусственного сустава, сосудистого трансплантата) для предупреждения инкапсулирования/непригодного образования рубцов вблизи имплантата. Еще в одном предпочтительном варианте, полимерный имплантат, содержащий 0,1-20% паклитаксел по весу, наносят непосредственно на место хирургии (например, непосредственно в полость синуса, в полость грудной клетки, в брюшную полость или в место операции во время нейрохирургии), так что рецидив воспаления, спайкообразование или образование рубцов уменьшаются. Во всех этих вариантах, другие антимикротрубочковые агенты могли бы вводиться в эквивалентных дозах, скорректированных относительно активности и переносимости конкретного агента.
8. Хронические воспалительные заболевания дыхательных путей
В других аспектах изобретения антимикротрубочковые агенты (и композиции) могут быть использованы для лечения или предупреждения таких заболеваний, как хроническое воспалительное заболевание дыхательных путей. В частности, антимикротрубочковый агент может вводиться к месту воспаления (или потенциальному месту воспаления) для лечения этого заболевания. Подходящие антимикротрубочковые агенты для лечения спаек обсуждаются подробно выше и включают в себя таксаны (например, паклитаксел и доцетаксел), кампотецин, элеутеробин, саркодиктины, эпотилоны Д и В, дискодермолид, оксид дейтерия (D2O), гексиленгликоль (2-метил-2,4-пентандиол), туберцидин (7-деазааденозин), LY290181 (2-амино-4-(3-пиридил)-4Н-нафто(1,2-b)пиран-3-карбонитрил), фторид алюминия, бис-(сукцинимидилсукцинат)этиленгликоля, этиловый эфир глицина, моноклональные антиидиотипические антитела, белок, стимулирующий сборку микротрубочек (таксол-подобный белок, TALP), набухание клеток, индуцированное гипотоническими (190 мосмоль/л) условиями, инсулином (100 нмоль/л) или глутамином (10 ммоль/л), связывание динеина, гибберелин, ХСНО1 (кинезин-подобный белок), лизофосфатидную кислоту, ион лития, компоненты клеточной стенки растений (например, поли-L-лизин и экстензин), буферы с глицерином, буфер с Тритоном Х-100, стабилизирующий микротрубочки, связанные с микротрубочками белки (например, МАР2, МАР4, тау, большой тау, энсконзин, фактор элонгации 1-α (EF-1α) и Е-МАР-115), клеточные частицы (например, гистон H1, миелиновый основной белок и кинетохоры), эндогенные микротрубочковые структуры (например, аксонемные структуры, макромолекулярные комплексы ферментов, формирующие поры в клеточной мембране и GTP-кэпы), стабильный трубочковый единственный полипептид (например, STOP145 и STOP220) и напряжение от митотических сил, а также любые аналоги и производные любого из вышеописанных агентов. Такие агенты, в некоторых вариантах, могут доставляться в виде композиции вместе с полимерным носителем или в липосомной композиции, как обсуждается более подробно выше и ниже. В предпочтительных вариантах изобретения, эти агенты или композиции могут вводиться интраназально, системно, ингаляцией, местным введением (например, в случае полипов в носу) или в полости пазух.
Астма
В некоторых аспектах изобретения, антимикротрубочковые агенты могут быть использованы для лечения или предупреждения астмы. Вкратце, астма представляет собой состояние, характеризующееся рецидивирующими приступами обструкции дыхательных путей, которые могут наступать спонтанно или в ответ на лечение. Хотя точная этиология астмы не известна, это состояние представляет собой состояние чрезмерного сужения просвета бронхов и воспалительной реакции на стимулы, которое поражает 5% населения. Эффективная антимикротрубочковая терапия для астмы изменила бы один или несколько патологических признаков этого состояния, таких как уменьшение инфильтрации и активности воспалительных клеток (Т-клеток, мастоцитов, эозинофилов), уменьшение пролиферации и утолщения эпителия дыхательных путей, ингибирование пролиферации клеток гладких мышц и гипертрофии в стенке дыхательных путей, уменьшение секреции слизи в просвет дыхательных путей, блокирование активности воспалительных цитокинов (IL-3, IL-4, IL-5, GMSF), которые индуцируют и закрепляют воспаление и ингибируют гиперплазию и гипертрофию секретирующих желез дыхательных путей.
Клинически эффективная антимикротрубочковая терапия астмы могла бы производить одно из следующих действий: уменьшать тяжесть симптомов, уменьшать продолжительность обострений, увеличивать частоту и продолжительность периодов ремиссии, предотвращать стойкое ухудшение и потерю трудоспособности и предотвращать хроническое прогрессирование одышки, кашля и стридора (затрудненного шумного дыхания); при улучшении гипоксии, ОФВ (объема форсированного выдоха за одну секунду), противостоять потоку воздуха и гипокапническому/респираторному алкалозу и улучшать несоответствие V:Q (вентиляция:перфузия).
Антимикротрубочковый агент может вводиться любым путем для достижения вышеуказанных конечных результатов. Предпочтительные способы введения включают в себя ингаляционную терапию (например, при помощи ингалятора с отмеренными дозами, распылителя, через эндотрахеальную трубку, ингаляции микрочастиц) или системную терапию (внутривенную, подкожную или внутримышечную инъекцию или введение перорального препарата). Системная доза должна вводиться пациентам с тяжелыми обострениями или пациентам, для которых непригодна ингаляционная терапия. Должна использоваться минимальная доза, способная производить клиническое или патологическое улучшение.
Например, для паклитаксела продолжительная терапия низкими дозами может предусматривать введение 10-50 мг/м2 каждые 1-4 недели в зависимости от ответной реакции; "импульсная" терапия высокими дозами может предусматривать введение 50-250 мг/м2 для пациента с острым заболеванием. Для ингаляционной терапии 0,01-1% паклитаксел может вводиться непосредственно ингаляцией при помощи вышеупомянутых доставляющих носителей/композиций. Это приводило бы к доставке 1-50 мг/м2 паклитаксела непосредственно в дыхательные пути. Другие антимикротрубочковые агенты могут вводиться в эквивалентных дозах, скорректированных относительно активности и переносимости конкретного агента.
Хроническая обструктивная болезнь легких (ХОБЛ)
ХОБЛ включает в себя различные состояния (хронический бронхит, астматический бронхит, хронический обструктивный бронхит и эмфизему), которые приводят к хронической обструкции дыхательных путей. Эти состояния могут вызывать серьезную потерю трудоспособности и являются четвертой основной причиной смерти в Соединенных Штатах. Клинически все они характеризуются одышкой, кашлем, стридором и рецидивирующими инфекциями дыхательных путей. Признаки этого заболевания включают в себя пониженный ОФВ (объем форсированного выдоха за одну секунду), увеличенный остаточный объем, несоответствие V:Q и гипоксемию. Патологически, имеет место повышенное образование слизи, гиперплазия слизистых желез, повышенная активность протеаз (в основном эластазы), воспаление дыхательных путей и разрушение альвеолярных стенок. Несмотря на широкий диапазон этиологии (наиболее общей является курение), улучшение любого из вышеупомянутых симптомов, признаков или патологических процессов оказывало бы благоприятное воздействие на это состояние; следовательно, антимикротрубочковая терапия для ХОБЛ изменяет по меньшей мере один из вышеописанных симптомов. Терапия антимикротрубочковым агентом предусматривает такое же введение, какое описано выше для астмы: ингалируемый паклитаксел, предоставляемый при 1-50 мг/м2 по необходимости, в случае системной терапии 10-50 мг/м2, предоставляемые каждые 1-4 недели при продолжительном введении, или 50-250 мг/м2, предоставляемые в виде "импульса" пациентам с острым заболеванием. Другие антимикротрубочковые агенты могли бы вводиться в клинически эквивалентных дозах.
9. Стеноз, неопластические заболевания и обструкции
Как отмечалось выше, данное изобретение обеспечивает способы лечения или предупреждения большого разнообразия заболеваний, сопутствующих обструкции проходов тела, в том числе, например, сосудистых заболеваний, неопластических обструкций, воспалительных заболеваний и инфекционных болезней.
Например, в одном аспекте данного изобретения широкое разнообразие описанных здесь антимикротрубочковых агентов и композиций может быть использовано для лечения сосудистых заболеваний, которые вызывают непроходимость сосудистой системы. Характерные примеры таких заболеваний включают в себя атеросклероз всех сосудов (около любой артерии, вены или трансплантата, в том числе (но не только): коронарных артерий, аорты, подвздошных артерий, сонных артерий, общих бедренных артерий, поверхностных бедренных артерий и в месте анастомоза трансплантата; вазоспазмы (например, коронарные вазоспазмы и болезнь Рейно); рестеноз (закупорка сосуда в месте предшествующего вмешательства, такого как баллонная ангиопластика, вставление стента и вставление трансплантата); воспалительные и аутоиммунные состояния (например, височный артериит, васкулит).
Вкратце, в сосудистых заболеваниях, таких как атеросклероз, лейкоциты, в частности, моноциты и Т-лимфоциты прикрепляются к эндотелиальным клеткам, особенно в местах разветвления артерий. После прикрепления к эндотелию лейкоциты мигрируют через выстилку из эндотелиальных клеток в ответ на хемостатические стимулы и накапливаются в интиме артериальной стенки вместе с клетками гладких мышц. Это первоначальное повреждение развивающегося атеросклероза известно как "жировая полоска". Моноциты в этой жировой полоске дифференцируются в макрофаги, а макрофаги и клетки гладких мышц прогрессирующим образом поглощают липиды и липопротеин, становясь ксантомными (пенистыми) клетками.
По мере накопления макрофагов лежащий ниже эндотелий становится механически разрушенным и химически измененным окисленными липидами, произведенными из кислорода свободными радикалами и протеазами, выделяемыми макрофагами. Пенистые клетки прорываются через поверхность эндотелия, производя микроизъязвления стенки сосуда. Контактирование потенциально тромбогенных субэндотелиальных тканей (таких как коллаген и другие белки) с компонентами кровотока приводит к прикреплению тромбоцитов к участкам разрушенного эндотелия. Прикрепление тромбоцитов и другие события запускают освобождение и выделение факторов роста в эту среду, в том числе PDGF, фактора активации тромбоцитов (PAF), IL-1 и IL-6. Считается, что эти паракринные факторы стимулируют миграцию и пролиферацию клеток гладких мышц сосудов (VSMC).
В нормальной (непатологической) стенке кровеносного сосуда VSMC обладают сократительным фенотипом и низким митотическим индексом. Однако под влиянием цитокинов и факторов роста, высвобождаемых тромбоцитами, макрофагами и эндотелиальными клетками, VSMC подвергаются фенотипическому изменению от зрелых сократительных клеток до незрелых секреторных клеток. Преобразованные VSMC пролиферируют в среду стенки кровеносного сосуда, мигрируют в интиму, продолжают пролиферировать в интиме и генерируют большие количества внеклеточного матрикса. Это превращает развивающееся повреждение в волокнистую (фиброзную) бляшку. Внеклеточный матрикс, высвобождаемый секреторными VSMC, включает в себя коллаген, эластин, гликопротеин и гликозаминогликаны, причем коллаген является основным компонентом внеклеточного матрикса атеросклеротических бляшек. Эластин и гликозаминогликаны связывают липопротеины и также способствуют росту повреждений. Фиброзная бляшка состоит из волокнистой шапочки плотной соединительной ткани различной толщины, содержащей клетки гладких мышц и лежащие ниже макрофаги, Т-клетки и внеклеточный материал.
Кроме PDGF, IL-1 и IL-6, клетками продуцируются другие митогенные факторы, которые инфильтрируют стенку сосуда, в том числе: TGFβ, FGF, тромбоспондин, серотонин, тромбоксан a2, норэпинефрин и ангиотензин II. Это приводит к рекрутингу дополнительных клеток, высвобождению дополнительного внеклеточного матрикса и накоплению дополнительного липида. Это прогрессирующим образом увеличивает атеросклеротическое повреждение, пока оно не вторгается в просвет сосуда. Сначала, прегражденный кровоток через трубку сосуда вызывает ишемию тканей, дистальных относительно атеросклеротической бляшки, только при необходимости увеличения кровотока, а позже, по мере дальнейшего блокирования артерии повреждением, ишемия развивается в остальной части.
Макрофаги в увеличенной атеросклеротической бляшке высвобождают окисленные липиды, свободные радикалы, эластазы и коллагеназы, которые вызывают повреждение клеток и некроз соседних тканей. Повреждение развивает некротическую центральную часть и превращается в комплексную бляшку. Комплексные бляшки являются нестабильными повреждениями, которые могут отрываться, вызывая эмболизацию; местное кровотечение (вторичное относительно разрыва сосуда сосудов (vasa vasorum), снабжающего эту бляшку, что приводит к закупорке просвета, обусловленной быстрым распространением повреждения); или изъязвлению и образованию фиссур (это обнажает тромбогенную некротическую центральную часть для кровопотока, производя локальный тромбоз или дистальную эмболизацию). Даже если ни одно из этих последствий не имеет места, прикрепленный тромб может стать организованным и включенным в эту бляшку, ускоряя ее рост. Кроме того, по мере увеличения локальных концентраций фибриногена и тромбина пролиферация клеток гладких мышц сосудов в этой среде и в интиме стимулируется; процесс, который также приводит в конце концов к дополнительному сужению сосуда.
Интима и медия (средняя часть оболочки кровеносных сосудов) нормальных артерий являются оксигенированными и снабжаются питательными веществами из люмена аретрии или из сосудов сосудов (vasa vasorum) в адвентициальной оболочке. С развитием атеросклеротической бляшки микрососуды, возникающие из адвентициального сосуда сосудов, простираются в утолщенную интиму и в медию (среднюю часть оболочки). Эта сосудистая сеть становится более обширной по мере ухудшения бляшек и уменьшается с регрессией бляшек.
Кровотечение из этих микрососудов может ускорять неожиданное распространение и разрыв бляшки в связи с артериальным вскрытием, изъязвлением или тромбозом. Было также сообщено, что утечка плазматических белков из этих микрососудов может аттрагировать воспалительные инфильтраты в эту область и эти воспалительные клетки могут способствовать быстрому росту атеросклеротической бляшки и сопутствующим осложнениям (через местный отек и воспаление).
Для лечения заболеваний сосудов, таких как описанные здесь, антимикротрубочковый агент (с носителем или без носителя) может быть доставлен к наружной части прохода тела или к клеткам гладких мышц через адвентициальную оболочку прохода тела. Особенно предпочтительные в этом отношении антимикротрубочковые агенты включают в себя, например, таксаны (например, паклитаксел и доцетаксел), кампотецин, элеутеробин, саркодиктины, эпотилоны А и В, дискодермолид, оксид дейтерия (D2O), гексиленгликоль (2-метил-2,4-пентадиол), туберцидин (7-деазааденозин), LY290181 (2-амино-4-(3-пиридил)-4Н-нафто(1,2-b)пиран-3-карбонитрил), фторид алюминия, бис-(сукцинимидилсукцинат) этиленгликоля, этиловый эфир глицина, моноклональные антиидиотипические антитела, белок, стимулирующий сборку микротрубочек (таксол-подобный белок, TALP), набухание клеток, индуцированное гипотоническими (190 мосмоль/л) условиями, инсулином (100 нмоль/л) или глутамином (10 ммоль/л), связывание динеина, гибберелин, ХСНO1 (кинезин-подобный белок), лизофосфатидную кислоту, ион лития, компоненты клеточной стенки растений (например, поли-L-лизин и экстензин), буферы с глицерином, буфер с Тритоном Х-100, стабилизирующий микротрубочки, связанные с микротрубочками белки (например, МАР2, МАР4, тау, большой тау, энсконзин, фактор элонгации 1-α (EF-1α) и Е-МАР-115), клеточные частицы (например, гистон H1, миелиновый основной белок и кинетохоры), эндогенные микротрубочковые структуры (например, аксонемные структуры, макромолекулярные комплексы ферментов, формирующие поры в клеточной мембране и GTP-кэпы), стабильный трубочковый единственный полипептид (например, STOP145 и STOP220) и напряжение от митотических сил, а также любые аналоги и производные любого из вышеописанных агентов. В некоторых вариантах, антимикротрубочковый агент может быть агентом, отличающимся от паклитаксела, кампотецина или эпотилона. Такие агенты, в некоторых вариантах, могут доставляться в виде композиции вместе с полимерным носителем или в липосомной композиции, как обсуждается более подробно выше и ниже. В предпочтительных вариантах изобретения, эти агенты или композиции могут вводиться баллонным катетером, перорально, периваскулярно, при помощи стента и системно.
В других аспектах изобретения, описанные здесь антимикротрубочковые агент или композиции могут быть использованы для лечения неопластических обструкций. Вкратце, в применении здесь, термин "неопластическая обструкция" должен пониматься как неопластическая (доброкачественная или злокачественная) обструкция трубчатого прохода тела независимо от местоположения трубки или гистологического типа присутствующей злокачественности. Характерные примеры включают в себя желудочно-кишечные заболевания (например, орально-фарингеальная карцинома, аденокарцинома, рак пищевода (плоскоклеточный рак, аденокарцинома, лимфома, меланома), рак желудка (аденокарцинома, диффузный рак желудка (linitis plastica), лимфома, лейомиосаркома), опухоли тонкой кишки (аденомы, лейомиомы, липомы, аденокарциномы, лифомы, карциноидные опухоли), рак ободочной кишки (аденокарцинома) и аноректальный рак); заболевания желчных путей (например, неоплазмы, приводящие к билиарной обструкции, такие как рак поджелудочной железы (проточная аденокарцинома, опухоли островковых клеток, цистаденокарцинома), холангиокарцинома и гепатоцеллюлярная карцинома); легочные заболевания (например, рак легких и/или трахеально-бронхиальных проходов (мелкоклеточный рак легких, немелкоклеточный рак легких); заболевания женских репродуктивных органов (например, злокачественные опухоли фаллопиевых труб, рак матки, рак шейки матки, рак влагалища); заболевания мужских репродуктивных органов (например, рак яичка, рак придатка яичка, опухоли семявыносяшего протока, опухоль предстательной железы, доброкачественная гипертрофия предстательной железы); и заболевания мочевых путей (например, почечно-клеточный рак, опухоли почечных лоханок, опухоли системы сбора мочи, такие как переходно-клеточный рак, рак мочевого пузыря и обструкции мочеточников, вызванные доброкачественными стриктурами или злокачественными опухолями).
В качестве примера, доброкачественная гиперплазия предстательной железы (ВРН) представляет собой увеличение предстательной железы, в частности центральной части этой железы, которая окружает мочеиспускательный канал, которое имеет место в ответ на продолжительную андрогенную стимуляцию. Она поражает более 80% мужчин в возрасте более 50 лет. Это увеличение может приводить к сдавливанию части мочеиспускательного канала, проходящей через предстательную железу, что приводит к закупорке пути оттока мочевого пузыря, т.е. требуется патологически высокое давление мочевого пузыря для генерирования истекания мочи. В 1980 году в Соединенных Штатах было выполнено 367000 трансуретральных резекций предстательной железы в качестве лечения ВРН. Другие способы лечения включают в себя лекарственную терапию, трансуретральную сфинктеротомию, трансуретральный лазерный или микроволновой способ, трансуретральную гипертермию, трансуретральный ультразвуковой способ, трансректальный микроволновой способ, трансректальную гипертермию, трансректальный ультразвуковой способ и хирургическое удаление. Все они имеют недостатки, в том числе нарушение механизма сфинктера, приводящее к недержанию и образованию стриктур.
Для лечения неопластических заболеваний, таких как описанные выше, разнообразные терапевтические агенты (без полимерного носителя или с полимерным носителем) могут доставляться к наружной части прохода тела или к клеткам гладких мышц через адвентициальную оболочку этого прохода тела. Например, в одном предпочтительном варианте иглу или катетер направляют в предстательную железу рядом с мочеиспускательным каналом трансректальным путем (или, в альтернативном варианте, трансперитонеальным путем) при контроле введения с применением ультразвука и посредством такого введения доставляют терапевтический агент, предпочтительно в несколько квадрантов железы, особенно вокруг мочеиспускательного канала. Игла или катетер могут также помещаться при прямой пальпации или при эндоскопическом, КТ или MRI контроле направления и вводиться с интервалами. В качестве альтернативы, может выполняться помещение гранул через катетер или троакар. Описанные выше процедуры могут выполняться отдельно или в сочетании с помещением стента в мочеиспускательный канал предстательной железы. При избегании уретрального инструментирования или повреждения мочеиспускательного канала сфинктерный механизм может остаться интактным, что позволяет избежать недержания, и образование стриктур является маловероятным.
В других аспектах изобретения обеспечены способы предупреждения или лечения воспалительных заболеваний, которые поражают проходы тела или вызывают обструкцию проходов тела. Воспалительные заболевания включают в себя как острое, так и хроническое воспаление, приводящее к обструкции различных трубчатых проходов тела. Характерные примеры включают в себя васкулит (например, гигантоклеточный артериит (височный артериит, артериит Такаясу), нодозный полиартериит, аллергический ангиит и гранулематоз (болезнь Churg-Strauss), синдром перекрывания полиангиита, аллергический васкулит (пурпуру Геноха-Шёнляйна), сывороточную болезнь, индуцированный лекарственными средствами васкулит, инфекционный васкулит, неопластический васкулит, васкулит, ассоциированный с нарушениями соединительной ткани, васкулит, ассоциированный с врожденными недостаточностями системы комплемента), гранулематоз Вегенера, болезнь Кавасаки, васкулит центральной нервной системы, болезнь Бергера и системный склероз); болезни желудочно-кишечного тракта (например, панкреатит, болезнь Крона, язвенный колит, язвенный проктит, первичный склерозирующий холангит, доброкачественные стриктуры любого происхождения, в том числе идиопатические (например, стриктуры желчных путей, пищевода, двенадцатиперстной кишки, тонкого кишечника или толстой кишки)); заболевания дыхательных путей (например, астму, аллергический пневмонит, асбестоз, силикоз и другие формы пневмокониоза, хронический бронхит и хроническое обструктивное заболевание дыхательных путей); заболевания носослезных проходов (например, стриктуры любого происхождения, в том числе идиопатические); и заболевания евстахиевых труб (например, стриктуры любого происхождения, в том числе идиопатические).
Для лечения воспалительных заболеваний, таких как описанные выше, антимикротрубочковый агент (с носителем или без носителя) может доставляться к наружной части прохода тела или к клеткам гладких мышц через адветициальную оболочку этого прохода тела.
В других вариантах данного изобретения обеспечены способы лечения или предупреждения инфекционных заболеваний, которые связаны с обструкцией прохода тела или вызваны обструкцией прохода тела. Вкратце, инфекционные заболевания включают в себя некоторые острые или хронические инфекционные процессы, которые могут приводить к обструкции проходов тела, в том числе, например, обструкции мужских половых путей (например, стриктуры, вызываемые уретритом, эпидидимитом, простатитом); обструкции женских половых путей (например, вагинит, цервицит, воспаление тазовых органов (например, туберкулез, гонококк, хламидин, энтерококк и сифилис); обструкции мочевых путей (например, цистит, уретрит); обструкции дыхательных путей (например, хронический бронхит, туберкулез, другие микобактериальные инфекции (MAI и т.д.), анаэробные инфекции, грибковые инфекции и паразитарные инфекции); и сердечно-сосудистые обструкции (например, микотические аневризмы и инфекционный эндокардит).
Для лечения инфекционных заболеваний, таких как обсуждаемые выше, большое разнообразие терапевтических агентов (с носителем или без носителя) могут доставляться к наружной части прохода тела или к клеткам гладких мышц через адвентициальную оболочку этого прохода тела. Особенно предпочтительные агенты в этом отношении включают в себя обсуждаемые выше антимикротрубочковые агенты.
10. Отторжение трансплантата
Вышеописанные антимикротрубочковые агенты и композиции могут также использоваться для лечения или предупреждения отторжения трансплантата. Вкратце, двумя основными гистологическими манифестациями хронического отторжения трансплантата/органа являются воспаление и атеросклероз. Эта гиперплазия новообразующейся интимы наблюдалась в длительно выживающих почечных аллотрансплантатах (Hume et al., J. Clin. Invest. 34 : 327, 1955; Busch et al., Human Pathol. 2 : 253, 1971), а также трансплантатах сердца (Johnson et al., J. Heart Transplantation 8 : 349, 1989), печени (Demetris et al., Am. J. Pathol. 118 : 151, 1985) и легких (Burke et al., Lancet I : 517 : 1986). Сердечные трансплантаты чрезвычайно чувствительны к люминальному сужению вследствие зависимости миокарда от коронарного кровотока.
Многие модели животных использовали для исследования хронического отторжения сердечных трансплантатов. Модель пересадки сердца крыс Lewis-F344 дает сердечные аллотрансплантаты с хроническим отторжением, характеризующиеся образованием артериосклеротических повреждений. Эта модель применима, поскольку более 80% реципиентов выживают в течение более 3 недель, причем 90% из них обнаруживают повреждения интимы коронарных сосудов (Adams et al., Transplantation 53 : 1115-1119, 1992). Кроме обнаружения высокой частоты и тяжести повреждений, развитие воспалительной стадии повреждений легко распознается, так как эта система не требует иммуносупрессии. Хотя степень инфильтрации мононуклеарных клеток и некроз являются более тяжелыми, артериальные повреждения в этой модели очень сходны с клиническим артериосклерозом трансплантатов.
Эффективная антимикротрубочковая терапия для отторжения трансплантата могла бы выполняться, по меньшей мере, одним из следующих способов: (i) пролонгированием жизни трансплантата, (ii) уменьшением побочных эффектов, сопутствующих иммуносупрессивной терапии и, (iii) уменьшением ускоренного атеросклероза, сопутствующего трансплантатам.
Подходящие антимикротрубочковые агенты для лечения отторжения трансплантата включают в себя таксаны (например, паклитаксел и доцетаксел), кампотецин, элеутеробин, саркодиктины, эпотилоны А и В, дискодермолид, оксид дейтерия (D2O), гексиленгликоль (2-метил-2,4-пентандиол), туберцидин (7-деазааденозин), LY290181 (2-амино-4-(3-пиридил)-4Н-нафто-(1,2-b)пиран-3-карбонитрил), фторид алюминия, бис-(сукцинимидилсукцинат) этиленгликоля, этиловый эфир глицина, моноклональные антиидиотипические антитела, белок, стимулирующий сборку микротрубочек (таксол-подобный белок, TALP), набухание клеток, индуцированное гипотоническими (190 мосмоль/л) условиями, инсулином (100 нмоль/л) или глутамином (10 ммоль/л), связывание динеина, гибберелин, ХСНO1 (кинезин-подобный белок), лизофосфатидную кислоту, ион лития, компоненты клеточной стенки растений (например, поли-L-лизин и экстензин), буферы с глицерином, буфер с Тритоном Х-100, стабилизирующий микротрубочки, связанные с микротрубочками белки (например, МАР2, МАР4, тау, большой тау, энсконзин, фактор элонгации 1-α (EF-1α) и Е-МАР-115), клеточные частицы (например, гистон H1, миелиновый основной белок и кинетохоры), эндогенные микротрубочковые структуры (например, аксонемные структуры, макромолекулярные комплексы ферментов, формирующие поры в клеточной мембране и GTP-кэпы), стабильный трубочковый единственный полипептид (например, STOP145 и STOP220) и напряжение от митотических сил, а также любые аналоги и производные любого из вышеописанных агентов. Такие агенты, в некоторых вариантах, могут доставляться в виде композиции вместе с полимерным носителем или в липосомной композиции, как обсуждается более подробно выше и ниже.
Антимикротрубочковый агент может вводиться с трансплантатами любым способом для достижения описанных выше конечных результатов. Однако предпочтительные способы включают в себя пероральное введение или внутривенную, подкожную или внутримышечную инъекцию. Антимикротрубочковый агент может вводиться в виде долгосрочной терапии низкими дозами для предупреждения отторжения трансплантата или в высоких дозах для предупреждения острого отторжения трансплантата. Например, паклитаксел в случае системной долгосрочной терапии низкими дозами может вводиться при 10-50 мг/м2 каждые 1-4 недель в зависимости от терапевтической ответной реакции; при "импульсной" терапии высокими дозами он может вводиться при 50-250 мг/м2 каждые 1-21 день с повторениями до 6 раз, при необходимости. Другие антимикротрубочковые агенты могут вводиться в эквивалентных дозах, скорректированных относительно активности и переносимости конкретного агента.
11. Системная красная волчанка
Системная красная волчанка (SLE) представляет собой заболевание неизвестной этиологии, характеризующееся воспалением во многих различных системах органов, связанное с образованием антител, реактивных с ядерными, цитоплазматическими антигенами и антигенами клеточных мембран. SLE является довольно обычным заболеванием с частотой случаев 1 на 2500 в некоторых популяциях (Michet et al., Mayo Clini. Proc. 60 : 105, 1985). SLE является заболеванием преимущественно женщин, с частотой случаев 1 из 700 среди женщин в возрасте между 10 и 64 годами и отношение женщины:мужчины равно 9:1. Общая годичная частота заболеваний SLE равна приблизительно 6-35 новых случаев на популяцию 100000 человек в год, в зависимости от риска популяции.
SLE представляет собой, по-видимому, комплексное расстройство многофакторного происхождения, возникающее из взаимодействий среди генетических, гормональных факторов и факторов окружающей среды, действующих одновременно, для активации Т- и В-клеток, которая приводит к секреции нескольких типов антител. SLE часто классифицируется как аутоиммунное нарушение, характеризующееся увеличенным количеством аутоантител, направленных, в частности, против ядерных антигенов (антинуклеарных антител - AHA) и фосфолипидов. Антифосфолипидные антитела присутствуют в 20-40% пациентов с волчанкой и, как было обнаружено, реагируют с рядом анионных фосфолипидов.
Морфологические изменения в SLE являются чрезвычайно разнообразными, отражающими вариабельность клинических проявлений и течения болезни у отдельных пациентов. Наиболее характерные повреждения возникают из отложения иммунных комплексов и обнаруживаются в кровеносных сосудах, почках, соединительной ткани и коже. Острый некротирующий васкулит, охватывающий малые артерии и артериолы, может присутствовать в любой ткани, хотя наиболее часто поражаются кожа и мышцы. В органах, пораженных васкулитом малых сосудов, первые повреждения обычно характеризуются инфильтрацией гранулоцитов и околоартериолярным отеком. Фибриноидные отложения в стенках сосудов также характеризуют артериит. В хронических случаях сосуды подвергаются фиброзному утолщению с люминальным сужением. В селезенке эти сосудистые повреждения охватывают центральные артерии и характеризуются заметным околососудистым фиброзом, образуя так называемые "луковичные" (слоистые) повреждения.
Подходящие антимикротрубочковые агенты для лечения SLE включают в себя таксаны (например, паклитаксел и доцетаксел), кампотецин, элеутеробин, саркодиктины, эпотилоны А и В, дискодермолид, оксид дейтерия (D2O), гексиленгликоль (2-метил-2,4-пентандиол), туберцидин (7-деазааденозин), LY290181 (2-амино-4-(3-пиридил)-4Н-нафто(1,2-b)пиран-3-карбонитрил), фторид алюминия, бис-(сукцинимидилсукцинат) этиленгликоля, этиловый эфир глицина, моноклональные антиидиотипические антитела, белок, стимулирующий сборку микротрубочек (таксол-подобный белок, TALP), набухание клеток, индуцированное гипотоническими (190 мосмоль/л) условиями, инсулином (100 нмоль/л) или глутамином (10 ммоль/л), связывание динеина, гибберелин, ХСНО1 (кинезин-подобный белок), лизофосфатидную кислоту, ион лития, компоненты клеточной стенки растений (например, поли-L-лизин и экстензин), буферы с глицерином, буфер с Тритоном Х-100, стабилизирующий микротрубочки, связанные с микротрубочками белки (например, МАР2, МАР4, тау, большой тау, энсконзин, фактор элонгации 1-α, (EF-1α) и Е-МАР-115), клеточные частицы (например, гистон H1, миелиновый основной белок и кинетохоры), эндогенные микротрубочковые структуры (например, аксонемные структуры, макромолокулярные комплексы ферментов, формирующие поры в клеточной мембране и GTP-кэпы), стабильный трубочковый единственный полипептид (например, STOP145 и STOP220) и напряжение от митотических сил, а также любые аналоги и производные любого из вышеописанных агентов. Такие агенты, в некоторых вариантах, могут доставляться в виде композиции вместе с полимерным носителем или в липосомной композиции, как обсуждается более подробно выше и ниже. В предпочтительных вариантах изобретения агенты или композиции могут вводиться интраназально, системно, ингаляцией или местно (например, в случае полипов в носу).
ПРИГОТОВЛЕНИЕ ГОТОВЫХ ПРЕПАРАТИВНЫХ ФОРМ И ВВЕДЕНИЕ
Как отмечалось выше, антимикротрубочковые агенты данного изобретения могут быть приготовлены в различных формах (например, в виде микросфер, паст, пленок, спреев, мазей, кремов, гелей и т.п.). Кроме того, композиции данного изобретения могут быть приготовлены таким образом, что они содержат более одного антимикротрубочкового агента, содержат многие дополнительные соединения, имеют определенные физические свойства (например, эластичность, конкретную точку плавления или специфическую скорость выделения). В некоторых вариантах изобретения композиции могут быть комбинированными для достижения как быстрого, так и медленного или пролонгированного высвобождения одного или нескольких антимикротрубочковых агентов.
Антимикротрубочковые агенты могут вводиться либо отдельно, либо в сочетании с фармацевтически или физиологически приемлемым носителем, наполнителями или разбавителями. Обычно такие носители должны быть нетоксичными в отношении реципиентов в применяемых дозах и концентрациях. Обычно приготовление таких композиций предусматривает объединение терапевтического агента с буферами, антиоксидантами, такими как аскорбиновая кислота, низкомолекулярными (менее 10 остатков) полипептидами, белками, аминокислотами, углеводами, в том числе глюкозой, сахарозой или декстринами, хелатообразователями, такими как ЭДТА, глутатионом и другими стабилизаторами и наполнителями. Нейтральный забуференный солевой раствор или солевой раствор, смешанный с альбумином неспецифической сыворотки, являются подходящими примерами растворителей.
Как отмечалось выше, заявленные антимикротрубочковые агенты, композиции или фармацевтические композиции могут быть приготовлены для введения множеством различных путей, в том числе, например, местно в участок воспаления, перорально, ректально, интракраниально, внутриоболочечно, через нос, внутриглазно, внутривенно, подкожно, внутрибрюшинно, внутримышечно, подъязычно и внутрипузырно. Другие предпочтительные пути введения включают в себя прямое введение (предпочтительно при ультразвуковом, КТ, флуороскопическом, MRI или эндоскопическом контроле направления введения) к месту заболевания.
Терапевтические агенты, терапевтические композиции и фармацевтические композиции, описанные здесь, могут быть помещены в контейнеры вместе с упаковочным материалом, который обеспечивает инструкции относительно использования таких материалов. Обычно такие инструкции включают в себя описание концентрации реагентов, а также, в некоторых вариантах, относительные количества ингредиентов наполнителей или разбавителей (например, воды, солевого раствора или ЗФР), которые могут быть необходимы для воссоздания антимикротрубочкового агента, антимикротрубочковой композиции или фармацевтической композиции.
Следующие далее примеры представлены для иллюстрации, но не для ограничения.
ПРИМЕРЫ
Как обсуждается выше, хроническое воспаление представляет собой процесс, характеризующийся инфильтрацией ткани лейкоцитами (макрофагами, лимфоцитами, нейтрофилами и плазматическими клетками), разрушением ткани воспалительными клетками и клеточными продуктами (реакционноспособными молекулами кислорода, разрушающими ткань ферментами, такими как металлопротеиназы матрикса) и повторяющимися попытками репарации путем возмещения соединительной ткани (ангиогенеза и фиброза).
Для оценки антимикротрубочковых агентов на их способность действовать на хроническое воспаление используют следующие патологические/биологические конечные результаты: (1) ингибирование лейкоцитарного ответа (макрофагов, нейтрофилов и Т-клеток), который инициирует воспалительный каскад; (2) ингибирование пролиферации мезенхимных клеток (фибробластов, синовиоцитов и т.д.), которая приводит к развитию фиброза и утрате функции органа; (3) ингибирование продуцирования/активности металлопротеиназы матрикса, которая вызывает повреждение ткани; (4) нарушение ангиогенеза, который может усиливать воспалительную реакцию и обеспечивать метаболическую поддержку роста и развития фиброзной ткани; и (5) все это должно достигаться без существенной токсичности для нормальных паренхимных клеток или нарушения нормального синтеза компонентов матрикса (например, коллагена и протеогликанов).
Как описано более подробно ниже, активность агентов, стабилизирующих микротрубочки, таких как, например, паклитаксел, испытывали в нескольких тканях и воспалительных патологических состояниях. Эти агенты демонстрируют способность изменять приведенные выше показатели заболевания.
ПРИМЕР 1
ДЕЙСТВИЕ АНТИМИКРОТРУБОЧКОВЫХ АГЕНТОВ
НА АКТИВНОСТЬ НЕЙТРОФИЛОВ
Этот пример описывает влияние антимикротрубочковых агентов на реакцию нейтрофилов, стимулируемую опсонизированными кристаллами CPPD или опсонизированным зимозаном. Как показано экспериментами, изложенными ниже, антимикротрубочковые агенты являются сильными ингибиторами индуцируемой частицами активации нейтрофилов, как измерено по хемилюминесцении, продуцированию супероксидного аниона и дегрануляции в ответ на опсонизированные микрокристаллы или зимозан.
А. Материалы и способы
Во всем этом исследовании использовали сбалансированный солевой раствор Хенкса (ССРХ). Все химикаты были куплены в Sigma Chemical Co. (St. Louis, МО), если нет других указаний. Все эксперименты проводили при 37°С, если нет других указаний.
1. ПОЛУЧЕНИЕ И ХАРАКТЕРИСТИКА КРИСТАЛЛОВ
Получали кристаллы CPPD (триклинные). Распределение размеров этих кристаллов было: приблизительно 33% менее 10 мкм, 58% между 10 и 20 мкм и 9% более 20 мкм. Кристаллы, полученные при вышеописанных условиях, являются апирогенными, и кристаллы, полученные при стерильных, апирогенных условиях, дают такую же амплитуду реакции нейтрофилов, что и кристаллы, полученные при нормальных, нестерильных лабораторных условиях.
2. ОПСОНИЗАЦИЯ КРИСТАЛЛОВ И ЗИМОЗАНА
Все эксперименты, в которых исследовали реакции нейтрофилов на кристаллы или зимозан в присутствии паклитаксела, проводили с использованием опсонизированных плазмой CPPD или зимозана. Опсонизацию кристаллов или зимозана выполняли с 50% гепаринизованной плазмой при концентрации 75 мг CPPD или 12 мг зимоэана на мл 50% плазмы. Кристаллы или зимозан инкубировали с плазмой в течение 30 минут при 37°С и затем промывали избытком ССРХ.
3. ПОЛУЧЕНИЕ НЕЙТРОФИЛОВ
Нейтрофилы получали из свежесобранной обработанной цитратом цельной крови человека. Вкратце, 400 мл крови смешивали с 80 мл 4% декстрана Т500 (Pharmacia LKB, Biotechnology AB Uppsala, Sweden) в ССРХ и давали осаждаться в течение 1 часа. Плазму собирали непрерывно и 5 мл наносили на 5 мл Ficoll Paque (Pharmacia) в полипропиленовых пробирках на 15 мл (Coming, NY). После центрифугирования при 500 g в течение 30 минут осадки нейтрофилов промывали от эритроцитов 20 посредством 20-секундного гипотонического шока. Нейтрофилы ресуспендировали в ССРХ, выдерживали на льду и использовали для экспериментов в пределах 3 часов. Жизнеспособность и чистота нейтрофилов всегда была более 90%.
4. ИНКУБИРОВАНИЕ НЕЙТРОФИЛОВ С АНТИМИКРОТРУБОЧКОВЫМИ АГЕНТАМИ
(а) Паклитаксел
Исходный раствор паклитаксела при концентрации 12 мМ в диметилсульфоксиде (ДМСО) готовили в виде свежего раствора перед каждым экспериментом. Этот исходный раствор разбавляли в ДМСО с получением растворов паклитаксела в диапазоне концентраций 1-10 мМ. Равные объемы этих разбавленных растворов паклитаксела добавляли к нейтрофилам при концентрации 5000000 клеток на мл при мягком перемешивании вортексом с получением концентраций 0-50 мкМ с конечной концентрацией ДМСО 0,5%. Клетки инкубировали в течение 20 минут при 33°С, затем в течение 10 минут при 37°С перед добавлением кристаллов или зимозана.
(b) Фторид алюминия
Исходный раствор фторида алюминия (АlF3) при концентрации 1 М в ССРХ готовили в виде свежего раствора. Этот исходный раствор разбавляли в ССРХ с получением растворов АlF3 в диапазоне концентраций 5-100 мМ. Равные объемы (50 мкл) этих разбавленных растворов АlF3 добавляли к нейтрофилам при 5000000 клеток на мл и инкубировали в течение 15 минут при 37°С. Добавляли люминол (1 мкМ) и затем 20 мкл опсонизированного зимозана (конечная концентрация = 1 мг/мл) для активации клеток.
(c) Этиловый эфир глицина
Исходный раствор этилового эфира глицина готовили при концентрации 100 мМ в ССРХ в виде свежего раствора. Этот исходный раствор разбавляли в ССРХ с получением растворов этилового эфира глицина в диапазоне концентраций 0,5-10 мМ. Равные объемы (50 мкл) этих разбавленных растворов этилового эфира глицина добавляли к нейтрофилам при 5000000 клеток на мл и инкубировали в течение 15 минут при 37°С. Добавляли люминол (1 мкМ) и затем 20 мкл опсонизированного зимозана (конечная концентрация = 1 мг/мл) для активации клеток.
(d) LY290181
Исходный раствор LY290181 готовили при концентрации 100 мкМ в ССРХ в виде свежего раствора. Этот исходный раствор разбавляли в ССРХ с получением растворов LY290181 в диапазоне концентраций 0,5-50 мкМ. Равные объемы (50 мкл) этих разбавленных растворов LY290181 добавляли к нейтрофилам при 5000000 клеток на мл и инкубировали в течение 15 минут при 37°С. Добавляли люминол (1 мкМ) и затем 20 мкл опсонизированного зимозана (конечная концентрация = 1 мг/мл) для активации клеток.
5. ХЕМИЛЮМИНЕСЦЕНТНЫЙ ТЕСТ
Все исследования хемилюминесценции проводили при концентрации 5000000 клеток/мл в ССРХ с CPPD (50 мг/мл). Во всех экспериментах 0,5 мл клеток добавляли к 25 мг CPPD или 0,5 мг зимозана в пробирках Эппендорфа с крышками на 1,5 мл. 10 мкл люминола, растворенного в 25% ДМСО в ССРХ, добавляли до конечной концентрации 1 мкМ и пробы смешивали для инициации активации нейтрофилов кристаллами или зимозаном. Хемилюминесценцию наблюдали с использованием люменметра LKB Luminometer (Model 1250) при 37°С в течение 20 минут с встряхиванием непосредственно перед измерениями для ресуспендирования кристаллов или зимозана. Контрольные пробирки содержали клетки, лекарственные средства и люминол (кристаллы отсутствовали).
6. ГЕНЕРИРОВАНИЕ СУПЕРОКСИДНОГО АНИОНА
Концентрации супероксидного аниона измеряли с использованием теста ингибируемого супероксиддисмутазой восстановления цитохрома С. Вкратце, 25 мг кристаллов или 0,5 мг зимозана помещали в пробирку Эппедорфа с крышкой на 1,5 мл и нагревали до 37°С. Добавляли 0,5 мл клеток при 37°С вместе с феррицитохромом С (конечная концентрация 1,2 мг/мл) и клетки активировали встряхиванием закрытых крышками пробирок. В подходящие моменты времени пробирки центрифугировали при 10000 g в течение 10 секунд и супернатант собирали для измерения поглощения при 550 нм. Контрольные пробирки находились при тех же условиях с включением супероксиддисмутазы при 600 единицах на мл.
7. ТЕСТ ДЕГРАНУЛЯЦИИ НЕЙТРОФИЛОВ
Пробирки Эппендорфа на полтора миллилитра, содержащие либо 25 мг CPPD, либо 1 мг зимозана, предварительно нагревали до 37°С. 0,5 мл клеток при 37°С добавляли с последующим сильным встряхиванием для инициирования реакций. В подходящие моменты времени пробирки центрифугировали при 10000 g в течение 10 секунд и 0,4 мл супернатанта хранили при -20°С для последующего анализа.
Лизозим измеряли по уменьшению поглощения при 450 нм суспензии Micrococcus lysodeikticus. Вкратце, Micrococcus lysodeikticus суспендировали при 0,1 мг/мл в 65 мМ калий-фосфатном буфере, рН 6,2, и поглощение при 450 нм доводили до 0,7 единиц разбавлением. Кристалл (или зимозан) и клеточный супернатант (100 мкл) добавляли к 2,5 мл суспензии Micrococcus и наблюдали снижение поглощения. Готовили стандарты лизозима (белок куриного яйца) в диапазоне 0-2000 единиц/мл и получали калибровочную кривую концентрации лизозима в зависимости от скорости снижения поглощения при 450 нм.
Активность миелопероксидазы (МРО) измеряли по увеличению поглощения при 450 нм, которое сопровождает окисление дианизидина. 7,8 мг дианизидина растворяли в 100 мл 0,1 М цитратного буфера, рН 5,5, при 3,2 мМ с использованием обработки ультразвуком. В кювету на 1 мл добавляли 0,89 мл раствора дианизидина с последующим добавлением 50 мкл 1% Тритона Х-100, 10 мкл 0,05% раствора пероксида водорода в воде и 50 мкл супернатанта клеток с кристаллом. Активность МРО определяли на основании изменения поглощения (450 нм) в минуту, Дельта  450, с использованием следующего уравнения:
450, с использованием следующего уравнения:
Окисление дианизидина (нмоль/мин) = 50 × Дельта  450
450
8. ЖИЗНЕСПОСОБНОСТЬ НЕЙТРОФИЛОВ
Для определения влияния антимикротрубочковых агентов на жизнеспособность нейтрофилов измеряли высвобождение маркерного фермента цитоплазмы, лактатдегидрогеназы (LDH). Контрольные пробирки, содержащие клетки с лекарственным средством (без кристаллов) из экспериментов по дегрануляции, также анализировали на LDH.
В. Результаты
Во всех экспериментах статистическую значимость определяли с применением t-критерия Стьюдента, и значимость была при р<0,05. В тех случаях, когда показаны столбики ошибок, они описывают стандартное отклонение около средней величины для указанного числа n.
1. ЖИЗНЕСПОСОБНОСТЬ НЕЙТРОФИЛОВ
(a) Паклитаксел
Нейтрофилы, обработанные паклитакселом при 46 мкМ в течение одного часа при 37°С, не обнаружили какого-либо увеличенного уровня высвобождения LDH (всегда менее 5% от общего уровня) выше контролей, что указывает на то, что паклитаксел не вызывал гибели клеток.
(b) Фторид алюминия
Нейтрофилы, обработанные фторидом алюминия в диапазоне концентраций 5-100 мМ в течение 1 часа при 37°С, не обнаружили какого-либо увеличенного уровня высвобождения LDH выше контролей, что указывает на то, что фторид алюминия не вызывал гибели клеток.
(c) Этиловый эфир глицина
Нейтрофилы, обработанные этиловым эфиром глицина в диапазоне концентраций 0,5-20 мМ в течение 1 часа при 37°С, не обнаружили какого-либо увеличенного уровня высвобождения LDH выше контролей, что указывает на то, что этиловый эфир глицина не вызывал гибели клеток.
2. ХЕМИЛЮМИНЕСЦЕНЦИЯ
(a) Паклитаксел
Паклитаксел при 28 мкМ производил сильное ингибирование как индуцированной опсонизированным плазмой CPPD, так и индуцированной опсонизированным плазмой зимозаном хемилюминесценции нейтрофилов, как показано на фигурах 1А, 1В и 2А соответственно. Ингибирование максимальной реакции хемилюминесценции было 52% (+/-12%) и 45% (+/-11%) для CPPD и зимозана соответственно. Ингибирование паклитакселом при 28 мкМ как индуцированной опсонизированным плазмой CPPD, так и индуцированной опсонизированным плазмой зимозаном хемилюминесценции нейтрофилов было значимым во всех временных точках от 3 до 16 минут (фигуры 1 и 4А). Фигуры 1А и 1В показывают концентрационную зависимость ингибирования паклитакселом индуцированной опсонизированным плазмой CPPD хемилюминесценции нейтрофилов. Во всех экспериментах контрольные пробы никогда не давали величин хемилюминесценции более 5 мВ и добавление паклитаксела при всех концентрациях, использованных в этом исследовании, не оказывало влияния на величины хемилюминесценции контролей.
(b) Фторид алюминия
Фторид алюминия в концентрациях 5-100 мМ производил сильное ингибирование индуцированной опсонизированным плазмой зимозаном хемилюминесценции нейтрофилов, как показано на фигуре 1С. Эта фигура показывает концентрационную зависимость ингибирования АlF3 индуцированной опсонизированным плазмой зимозаном хемилюминесценции нейтрофилов. Добавление AlF3 при всех концентрациях, использованных в этом исследовании, не влияло на величины хемилюминесценции контролей.
(c) Этиловый эфир глицина
Этиловый эфир глицина в концентрациях 0,5-20 мМ производил сильное ингибирование индуцированной опсонизированным плазмой зимозаном хемилюминесценции нейтрофилов, как показано на фигуре 1D. Эта фигура показывает концентрационную зависимость ингибирования этиловым эфиром глицина индуцированной опсонизированным плазмой зимозаном хемилюминесценции нейтрофилов. Добавление этилового эфира глицина при всех концентрациях, использованных в этом исследовании, не влияло на величины хемилюминесценции контролей.
(d) LY290181
LY290181 в концентрациях 0,5-50 мкМ производил сильное ингибирование индуцированной опсонизированным плазмой зимозаном хемилюминесценции нейтрофилов, как показано на фигуре 1Е. Эта фигура показывает концентрационную зависимость ингибирования LY290181 индуцированной опсонизированным плазмой зимозаном хемилюминесценции нейтрофилов. Добавление LY290181 при всех концентрациях, использованных в этом исследовании, не влияло на величины хемилюминесценции контролей.
3. ГЕНЕРИРОВАНИЕ СУПЕРОКСИДА
Временной ход индуцированного опсонизированным кристаллом CPPD продуцирования супероксидного аниона, измеряемого ингибируемым супероксиддисмутазой (СОД) восстановлением цитохрома С, показан на фигуре 3. Обработка клеток паклитакселом при 28 мкМ производила уменьшение количества супероксида, генерируемого во всех временных точках. Это уменьшение было значимым во всех временных точках, показанных на фигуре 3А. Концентрационная зависимость этого ингибирования показана на фигуре 3В. Стимуляция продуцирования супероксидного аниона опсонизированным зимозаном (фигура 4В) показала одинаковый временной ход с индуцированной CPPD активацией. Ингибирование индуцированного зимозаном продуцирования супероксидного аниона паклитакселом при 28 мкМ было менее сильным, чем ингибирование активации CPPD, но было значимым во всех временных точках, показанных на фигуре 4В.
Обработка индуцированных кристаллом CPPD нейтрофилов LY290181 при 17 мкМ также производила уменьшение количества генерируемого супероксида (фигура 3С).
4. ДЕГРАНУЛЯЦИЯ НЕЙТРОФИЛОВ
Дегрануляцию нейтрофилов наблюдали по индуцированному опсониэированными плазмой кристаллами CPPD высвобождению миелопероксидазы и лизозима или по индуцированному опсонизированным плазмой зимозаном высвобождению миелопероксидазы. Было показано, что достаточные количества этих двух ферментов высвобождаются во внеклеточную среду, когда покрытые плазмой кристаллы CPPD используют для стимуляции нейтрофилов, без необходимости добавления цитохалазина В к клеткам. Фигуры 5 и 2 показывают временной ход высвобождения МРО и лизозима соответственно из нейтрофилов, стимулированных покрытыми плазмой кристаллами CPPD. Фигура 5А показывает, что паклитаксел ингибирует высвобождение миелопероксидазы из активированных опсонизированным CPPD нейтрофилов в первые 9 минут инкубирования кристалла-клетки. Паклитаксел значимо ингибировал CPPD-индуцированное высвобождение миелопероксидазы во всех временных точках, как показано на фигуре 5А. Фигура 5В показывает концентрационную зависимость ингибирования паклитакселом CPPD-индуцированного высвобождения миелопероксидазы.
Паклитаксел при 28 мкМ снижал высвобождение лизозима и это ингибирование дегрануляции было значимым во всех временных точках, как показано на фигуре 2.
Только небольшие количества МРО и лизозима высвобождались, когда нейтрофилы симулировались опсонизированным зимозаном. Несмотря на эти низкие уровни, можно было наблюдать 50% ингибирование высвобождения МРО после 9 минут инкубирования в присутствии паклитаксела в концентрации 28 мкМ, что было статистически значимым (р<0,05) (данные не показаны). Обработка индуцированных кристаллами CPPD нейтрофилов LY290181 в концентрации 17 мкМ снижала высвобождение как лизозима, так и миелопероксидазы из этих клеток (фигуры 5С и 5D).
С. Обсуждение
Эти эксперименты показывают, что паклитаксел и другие антимикротрубочковые агенты являются сильными ингибиторами индуцированной кристаллами активации нейтрофилов. Кроме того, вследствие обнаружения одинаковых уровней ингибирования реакций нейтрофилов на другую форму состоящего из частиц активатора, опсонизированный зимозан, очевидно, что ингибиторная активность паклитаксела и других антимикротрубочковых агентов не ограничивается реакциями нейтрофилов на кристаллы. Было показано, что паклитаксел, фторид алюминия, этиловый эфир глицина и LY290181 являются сильными ингибиторами индуцированной зимозаном активации нейтрофилов, не вызывающими гибели клеток. Было показано, что LY290181 уменьшает продуцирование супероксидного аниона и дегрануляцию индуцированных кристаллами CPPD нейтрофилов.
ПРИМЕР 2
Т-КЛЕТОЧНЫЙ ОТВЕТ НА АНТИГЕННЫЙ СТИМУЛ
Для определения, влияет ли паклитаксел на активацию Т-клеток в ответ на стимулагены, Т-клеточные клоны TR1 стимулировали либо пептидом миелинового основного белка, GP68-88, либо лектином, конА, в течение 48 часов в отсутствие или в присутствии увеличивающихся концентраций паклитаксела в мицеллярной композиции. Паклитаксел добавляли в начале эксперимента или спустя 24 часа после стимуляции клеток пептидом или конА. Включение тритированного тимидина определяли как меру пролиферации Т-клеток в ответ на стимуляцию пептидом или конА.
Результаты показали, что стимуляция Т-клеток увеличивалась в ответ на пептид GP68-88 и конА. В присутствии контрольных мицеллярных полимерных молекул стимуляция Т-клеток в ответ на оба агониста не изменялась. Однако обработка мицеллами паклитаксела либо в начале эксперимента, либо спустя 24 часа после стимуляции уменьшала Т-клеточный ответ зависимым от концентрации образом. В обоих условиях пролиферация Т-клеток полностью ингибировалась 0,02 мкМ паклитакселом (фигура 79).
Эти результаты показывают, что паклитаксел является сильным ингибитором пролиферации Т-клеток в ответ на индуцированную антигеном стимуляцию.
ПРИМЕР 3
ДЕЙСТВИЕ ПАКЛИТАКСЕЛА НА ПРОЛИФЕРАЦИЮ
СИНОВИОЦИТОВ in vitro
Два эксперимента проводили для оценки влияния различных концентраций паклитаксела на включение тритированного тимидина (измерение синтеза ДНК синовиоцитов) и пролиферацию клеток in vitro.
А. Материалы и способы
1. ВКЛЮЧЕНИЕ 3H-ТИМИДИНА В СИНОВИОЦИТЫ
Синовиоциты инкубировали с различными концентрациями паклитаксела (10-5 М, 10-6 М, 10-7 М и 10-8 М) непрерывно в течение 6 или 24 часов in vitro. В эти временные точки добавляли 1×10-6 имп/мин 3H-тимидина к клеточной культуре и инкубировали в течение 2 часов при 37°С. Клетки собирали при помощи харвестера клеток, промывали через фильтр, фильтры разрезали и определяли количество радиации, содержащейся в кусочках фильтра. После определения количества тимидина, включенного в клетки, это количество использовали для определения скорости пролиферации клеток. Этот эксперимент повторяли три раза и результаты сравнивали.
2. ПРОЛИФЕРАЦИЯ СИНОВИОЦИТОВ
Бычьи синовиальные фибробласты выращивали в присутствии и в отсутствие различных концентраций (10-5 М, 10-6 М, 10-7 М и 10-8 М) паклитаксела в течение 24 часов. В конце этого периода времени определяли визуально общее число жизнеспособных клеток синовиоцитов при помощи подсчета вытеснения красителя с использованием окрашивания трипановым синим. Этот эксперимент проводили 4 раза и результаты сравнивали.
В. Результаты
1. ВКЛЮЧЕНИЕ 3H-ТИМИДИНА В СИНОВИОЦИТЫ
Это исследование показало, что паклитаксел в низких концентрациях ингибирует включение 3H-тимидина (и в более широком смысле синтез ДНК) в синовиоцитах в таких низких концентрациях, как 10-8 М. При шести часах не было значимого различия между степенью ингибирования, производимой более высокими концентрациями, в сравнении с более низкими концентрациями паклитаксела (фигура 8). Однако при 24 часах некоторая часть эффекта терялась при более низких концентрациях лекарственного средства (10-8 М), но включение все еще оставалось более низким, чем наблюдаемое в контрольных животных.
2. ПРОЛИФЕРАЦИЯ СИНОВИОЦИТОВ
Это исследование показало, что паклитаксел был цитотоксичным в отношении пролиферации синовиальных фибробластов и его цитотоксичность зависела от концентрации. Паклитаксел в таких низких концентрациях, как 10-7 М, способен ингибировать пролиферацию синовиоцитов (фигура 9). При более высоких концентрациях паклитаксела (10-6 М и 10-5 М) это лекарственное средство было токсичным в отношении синовиальных фибробластов in vitro.
С. Обсуждение
Вышеописанное исследование показывает, что паклитаксел способен ингибировать пролиферацию фибробластов, полученных из синовия при относительно низких концентрациях in vitro. Таким образом, вследствие роли соединительной ткани в развитии хронического воспаления и его протекании во время патогенеза воспалительного заболевания блокирование клеточной пролиферации будет благоприятно влиять на исход заболевания in vivo.
ПРИМЕР 4
ХАРАКТЕРИСТИКА АКТИВНОСТИ ПАКЛИТАКСЕЛА НА ЭПИДЕРМАЛЬНЫХ
КЕРАТИНОЦИТАХ ЧЕЛОВЕКА in vitro
Исследовали зависимое от времени и дозы действие паклитаксела на активно пролиферирующие кератиноциты здорового человека и на кератиноциты НаСАТ (самопроизвольно иммортализованные эпидермальные кератиноциты человека).
А. Материалы и способы
Действие паклитаксела на кератиноциты оценивали путем определения числа клеток и включения 3H-тимидина этими клетками. Для включения тимидина кератиноциты, посеянные при низкой плотности (в DMEM, дополненной 10% ФТС, глутамином, антибиотиками), обрабатывали концентрациями паклитаксела от 0 до 10-4 М в течение 6 часов во время логарифмической фазы роста. К клеткам добавляли 3H-тимидин и инкубировали их еще в течение 6 часов. Клетки собирали и определяли радиоактивность. Для определения общего числа клеток кератиноциты высевали, как описано выше, и инкубировали в присутствии и в отсутствие паклитаксела в течение 4 дней. После инкубирования клетки собирали и считали при помощи теста вытесенения трипанового синего.
В. Результаты
Определяли число жизнеспособных клеток в процентах от необработанных контролей. При концентрации паклитаксела 10-9 М жизнеспособность клеток была более 100% от необработанных контролей, тогда как при 10-8 М жизнеспособность была менее 87% (фигура 7). Имело место значимое падение жизнеспособности клеток при концентрации паклитаксела 10-7 М или при более высокой концентрации.
С. Обсуждение
Паклитаксел был чрезвычайно цитотоксичным в отношении кератиноцитов человека при таких низких концентрациях, как 10-7 М. В случае псориаза кератиноциты являются атипично пролиферирующими клетками и поскольку паклитаксел стабилизирует микротрубочки, можно ожидать его влияния в этой митотически активной системе. В других исследованиях было обнаружено, что паклитаксел является цитотоксичным в отношении пролиферирующих синовиоцитов, но не влияет на непролиферирующие хондроциты. Таким образом, паклитаксел может действовать на гиперпролиферирующие клетки в повреждениях простаты, хотя он является нетоксичным в отношении нормальных эпидермальных клеток.
ПРИМЕР 5
ДЕЙСТВИЕ ПАКЛИТАКСЕЛА НА ПРОЛИФЕРАЦИЮ АСТРОЦИТОВ
Было установлено, что в повреждениях при PC (рассеянный склероз) имеет место увеличение фиброзных (волокнистых) астроцитов, которые, как считают, участвуют в деструкции миелина посредством продуцирования цитокинов и металлопротеиназ матрикса (Mastronardi et al., J. Neurosci. Res. 36: 315-324, 1993; Chandler et al., J. Neuroimmunol. 72: 155-161, 1997). Фиброзные астроциты имеют высокие уровни глиального фибриллярного кислого белка (GFAP), который служит в качестве биохимического маркера для пролиферации фиброзных астроцитов. Способность мицелл паклитаксела ингибировать пролиферацию астроцитов оценивали в модели демиелинирующего заболевания трансгенных мышей (Mastronardi et al., J. Neurosci. Res. 36: 315-324, 1993).
А. Материалы и способы
Непрерывную терапию с подкожным введением паклитаксела (2 мг/кг; 3× в неделю, всего 10 инъекций) начинали при клиническом возникновении заболевания (в возрасте приблизительно 4 месяца). Пять животных получали мицеллярный паклитаксел, двух мышей использовали в качестве контролей; одна мышь была необработанной обычной мышью и одна была необработанной однопометной трансгенной мышью. Только одну трансгенную мышь использовали в качестве контроля, так как ход заболевания был хорошо установлен в этой лаборатории. Четырехмесячных животных инъецировали мицеллярным паклитакселом после того, как были очевидными первоначальные признаки неврологической патологии PC.
Через три дня после десятой инъекции это экспериментальное исследование заканчивали и ткани мозга обрабатывали для гистологического анализа. Для световой микроскопии ткани фиксировали в формалине и заливали (заделывали) в парафин. Срезы окрашивали антителами против GFAP (DACO), промывали и затем давали им взаимодействовать с антителами, конъюгированными с НРР. Срезы окрашивали на НРР и вторично окрашивали гематоксилином. Для электронной микроскопии ткани фиксировали в 2,5% глутаровом альдегиде и забуференном фосфатом солевом растворе (рН 7,2) и после этого фиксировали 1% тетроксидом осмия. Готовили срезы и просматривали их в трансмиссионном электронном микроскопе ЕМ JEOL 1200 EX II.
В. Результаты
По мере прогрессирования неврологической патологии уровни GFAP повышаются в мозгу трансгенных мышей; это, как считают авторы, отражает увеличение числа присутствующих фиброзных астроцитов. В противоположность этому, трансгенные мыши, обработанные паклитакселом, имеют почти нормальные уровни GFAP (таблица 1). Эти результаты предполагают, что паклитаксел может ингибировать пролиферацию астроцитов in vivo, что может способствовать предупреждению демиелинизации PC.
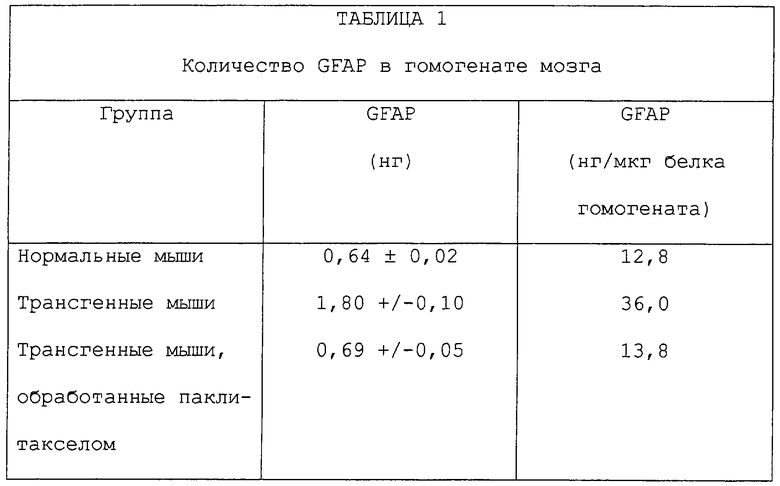
Дополнительно GFAP в ткани мозга оценивали гистологически. Фигура 78 иллюстрирует срезы мозга из нормальных мышей, контрольных трансгенных мышей, не обработанных паклитакселом, и трансгенных мышей, обработанных паклитакселом.
Хотя контрольные трансгенные мыши имеют более высокие числа фиброзных астроцитов, морфология этих астроцитов одинакова с морфологией, наблюдаемой в нормальных животных (толстые звездчатые отростки, выходящие из тела клетки). Однако в трансгенных мышах, обработанных паклитакселом, число фиброзных астроцитов значимо уменьшалось. Кроме того, наблюдали два морфологических изменения: клеточное тело фиброзных астроцитов кажется заметно округляющимся (что, как было показано, ведет к апоптозу в культуре) и клеточные отростки становятся очень тонкими вокруг клеточного тела.
Дополнительный анализ ультраструктуры при помощи электронного микроскопа показал, что астроциты трансгенных мышей характеризуются плотно окрашенными отростками астроцитов, выходящими из клеточного тела. Эти широкие отростки содержат хорошо организованный ряд филаментов (волокон), что свидетельствует о жизнеспособной, активированной клетке. Однако морфология астроцитов в трансгенных мышах, обработанных паклитакселом, характеризуется округлением клеток, тонкими волокнистыми отростками и внутриклеточным истощением и дезорганизацией белков филаментов.
С. Выводы
Эти результаты показывают, что паклитаксел вызывает изменения в фиброзных астроцитах in vivo, наиболее пролиферативном типе клеток в повреждениях PC. Возможно, что паклитаксел ингибирует также функцию отростков астроцитов и, следовательно, может изменять клеточные события, участвующие в деструкции миелина.
ПРИМЕР 6
ДЕЙСТВИЕ ПАКЛИТАКСЕЛА НА ПРОЛИФЕРАЦИЮ
ЭНДОТЕЛИАЛЬНЫХ КЛЕТОК
Для определения, ингибирует ли паклитаксел пролиферацию эндотелиальных клеток, клетки ЕОМА (линии эндотелиальных клеток) высевали при низкой плотности и инкубировали в отсутствие и в присутствии увеличивающихся концентраций паклитаксела в течение 48 часов. После инкубирования определяли число жизнеспособных клеток при помощи теста вытеснения трипанового синего. Результаты (представленные на фигуре 9) показывают, что паклитаксел в концентрациях 10-8 М ингибировал пролиферацию эндотелиальных клеток более чем на 50%, а концентрации 10-7 М или более полностью ингибировали пролиферацию клеток. Все тесты клеточной токсичности проводили три раза и каждое отдельное измерение выполняли в трех повторностях.
Для определения действия паклитаксела на оборот и апоптоз эндотелиальных клеток клетки ЕОМА инкубировали в отсутствие и в присутствии увеличивающихся концентраций паклитаксела в течение 24 часов. Клетки фиксировали 3,7% формальдегидом в забуференном фосфатом солевом растворе в течение 20 минут, окрашивали DAPI (4’-6-диаминидо-2-фенил-индолом), 1 мкг/мл, и исследовали с применением объектива 40× под эпифлюоресцентной оптикой. Апоптотические клетки оценивали путем подсчета клеток на фрагментированные ядра и конденсированный хроматин. Эти результаты показывают, что концентрации паклитаксела, большие, чем 10-8 М, индуцируют апоптоз эндотелиальных клеток (фигура 10).
ПРИМЕР 7
ПРОТОКОЛ ТЕСТА ПРОЛИФЕРАЦИИ (МТТ)
В первый день 5-10×104 синовиоцитов высевали на лунку (96-луночного планшета). Столбец №1 выдерживали свободным от клеток (слепой опыт). На второй день среду стряхивали щелчками и добавляли 200 мкл среды, содержащей различные концентрации лекарственного средства. Клетки экспонировали в течение 6 часов, 24 часов или 4 дней. Лекарственное средство не добавляли в столбцах №1 и №2 (слепой опыт и необработанный контроль, соответственно). Среду, содержащую лекарственное средство, выбрасывали и добавляли 200 мкл свежей полной среды. Затем клеткам давали расти еще в течение 3-4 дней. На пятый день добавляли 20 мкл бромидной соли диметилтиазолдифенилтетразолия (МТТ) (5 мг/мл ЗФР) и давали инкубироваться в течение 4 часов при 37°С. Среду декантировали и добавляли 200 мкл ДМСО. Планшет встряхивали в течение 30 минут и поглощение регистрировали при 562 нм.
Результаты
Результаты выражали в % выживания, которые получали делением числа клеток, оставшихся после обработки, на число клеток в необработанном контрольном столбце №2 (это число клеток получали из стандарта, приготовленного перед анализом). Концентрация IC50 лекарственного средства, которая убивает 50% популяции клеток, может быть интерполирована из фигур 11А-Е. В случае 24-часовой экспозиции было обнаружено, что соединение LY290181 является наиболее сильным антимикротрубочковым агентом в отношении снижения и ингибирования пролиферации клеток, с IC50 менее 5 нМ (фигура С). Паклитаксел, эпотилон В и туберцидин были несколько менее сильными, с IC50 около 30 нМ (фигура А), 45 нМ (фигура F) и 45 нМ (фигура В), соответственно. Наконец, IC50 для фторида алюминия (АlF3) и гексиленгликоля были значимо более высокими, с величинами около 32 мкМ (фигура Е) и 64 мМ (фигура D), соответственно.
ПРИМЕР 8
ДЕЙСТВИЕ ПАКЛИТАКСЕЛА И ДРУГИХ АНТИМИКРОТРУБОЧКОВЫХ АГЕНТОВ НА ПРОДУЦИРОВАНИЕ МЕТАЛЛОПРОТЕИНАЗ МАТРИКСА
А. Материалы и способы
1. СТИМУЛИРОВАННАЯ IL-1 ТРАНСКРИПЦИОННАЯ АКТИВНОСТЬ АР-1 ИНГИБИРУЕТСЯ ПАКЛИТАКСЕЛОМ
Хондроциты трансфицировали конструкциями, содержащими запускаемый АР-1 репортерный ген CAT (хлорамфениколацетил-трансферазы), и стимулировали IL-1, добавляли IL-1 (50 нг/мл) и инкубировали в течение 24 часов в отсутствие и в присутствии паклитаксела при различных концентрациях. Обработка паклитакселом уменьшала активность CAT зависимым от концентрации образом (среднее ± SD (стандартное отклонение)). Результаты, отмеченные звездочкой (*), имеют значимость, сравнимую с индуцированной IL-1 активностью CAT, согласно t-критерию, Р<0,05. Приведенные результаты представляют три независимых эксперимента.
2. ДЕЙСТВИЕ ПАКЛИТАКСЕЛА НА ИНДУЦИРОВАННУЮ IL-1 ДНК-СВЯЗЫВАЮЩУЮ АКТИВНОСТЬ АР-1, ДНК АР-1
Связывающую активность определяли с радиоактивно меченым зондом последовательности АР-1 человека и при помощи теста смещения подвижности в геле. Экстракты из хондроцитов, не обработанных или обработанных различными количествами паклитаксела (10-7-10-5 М), с последующим добавлением IL-1β (20 нг/мл) инкубировали с избытком зонда на льду в течение 30 минут с последующим неденатурирующим гель-электрофорезом. Дорожка "com" содержит избыток немеченого олигонуклеотида АР-1. Приведенные результаты представляют три независимых эксперимента.
3. ДЕЙСТВИЕ ПАКЛИТАКСЕЛА НА ИНДУЦИРОВАННУЮ IL-1 ЭКСПРЕССИЮ мРНК ММР-1 И ММР-3
Клетки обрабатывали паклитакселом в различных концентрациях (10-7-10-5 М) в течение 24 часов. Затем их обрабатывали IL-1β (20 нг/мл) еще в течение 18 часов в присутствии паклитаксела. Общую РНК выделяли и уровни мРНК ММР-1 определяли Нозерн-блот-анализом. Затем блоты "раздевали" и повторно зондировали 32Р-радиоактивно меченой кДНК крысиной GAPDH, которую использовали в качестве гена "домашнего хозяйства" (облигатного гена). Приведенные результаты представляют четыре независимых эксперимента. Определяли количество уровней экспрессии мРНК коллагеназы-1 и стромелизина. Уровни экспрессии ММР-1 и ММР-3 нормализовали с GAPDH.
4. ДЕЙСТВИЕ ДРУГИХ АНТИМИКРОТРУБОЧКОВЫХ АГЕНТОВ НА ЭКСПРЕССИЮ КОЛЛАГЕНАЗЫ
Первичные культуры хондроцитов выделяли из хряща теленка в виде свежих хондроцитов. Клетки высевали при 2,5×106 клеток на мл в культуральные планшеты 100×20 мм и инкубировали в среде Ham F12, содержащей 5% ФТС, в течение ночи при 37°С. Клетки голодали в бессывороточной среде в течение ночи и затем их обрабатывали антимикротрубочковыми агентами при различных концентрациях в течение 6 часов. Затем к каждому планшету добавляли IL-1 (20 мг/мл) и планшеты инкубировали еще в течение 18 часов. Общую РНК выделяли по способу с подкисленным гуанидинизотиоцианатом и подвергали электрофорезу на денатурирующем геле. Денатурированные пробы РНК (15 мкг) анализировали гель-электрофорезом в 1% денатурирующем геле, переносили на найлоновую мембрану и гибридизовали с 32Р-меченым кДНК-зондом коллагеназы. 32Р-меченую кДНК глицеральдегидфосфатдегидразы (GAPDH) использовали в качестве внутреннего стандарта для гарантии примерно одинаковой нагрузки. Экспонированные пленки сканировали и количественно анализировали при помощи ImageQuant.
В. Результаты
1. ПРОМОТОРЫ ДЛЯ СЕМЕЙСТВА МЕТАЛЛОПРОТЕИНАЗ МАТРИКСА
Фигура 19А показывает, что все металлопротеиназы матрикса содержали транскрипционные элементы АР-1 и РЕА-3, за исключением Гелатиназы В. Было хорошо установлено, что экспрессия металлопротеиназ матрикса, таких как коллагеназы и стромелизины, зависит от активации транскрипционных факторов АР-1. Таким образом, ингибиторы АР-1 должны ингибировать экспрессию металлопротеиназ матрикса.
2. ДЕЙСТВИЕ ПАКЛИТАКСЕЛА НА ТРАНСКРИПЦИОННУЮ АКТИВНОСТЬ АР-1
Как показано на фигуре 19В, IL-1 стимулировал транскрипционную активность АР-1 в 5 раз. Предобработка временно трансфицированных хондроцитов паклитакселом снижала индуцированную IL-1 активность репортерного гена CAT АР-1. Таким образом, индуцированная IL-1 активность АР-1 снижалась в хондроцитах паклитакселом зависимым от концентрации образом (10-7-10-5 М). Эти результаты показали, что паклитаксел является сильным ингибитором активности АР-1 в хондроцитах.
3. ДЕЙСТВИЕ ПАКЛИТАКСЕЛА НА ДНК-СВЯЗЫВАЮЩУЮ АКТИВНОСТЬ АР-1
Для подтверждения того, что ингибирование паклитакселом активности АР-1 не обусловлено неспецифическим действием, исследовали действие паклитаксела на индуцированное IL-1 связывание АР-1 с олигонуклеотидами с применением ядерных лизатов хондроцитов. Как показано на фигуре 19С, индуцированная IL-1 связывающая активность уменьшалась в лизатах из хондроцитов, которые были предобработаны паклитакселом в концентрации 10-7-10-5 М в течение 24 часов. Ингибирование паклитакселом транскрипционной активности АР-1 тесно коррелировало с уменьшением связывания АР-1 с ДНК.
4. ДЕЙСТВИЕ ПАКЛИТАКСЕЛА НА ЭКСПРЕССИЮ КОЛЛАГЕНАЗЫ И СТРОМЕЛИЗИНА
Поскольку паклитаксел был сильным ингибитором активности АР-1, исследовали действие паклитаксела на индуцированную IL-1 экспрессию коллагеназы и стромелизина. Вкратце, как показано на фигуре 20, IL-1 увеличивает уровни мРНК коллагеназы и стромелизина в хондроцитах. Предобработка хондроцитов паклитакселом в течение 24 часов значимо уменьшала уровни мРНК коллагеназы и стромелизина. При 10-5 М паклитакселе наблюдалось полное ингибирование. Эти результаты показывают, что паклитаксел полностью ингибировал экспрессию двух металлопротеиназ матрикса в концентрациях, одинаковых с концентрациями, ингибирующими активность АР-1.
5. ДЕЙСТВИЕ ДРУГИХ АНТИТРУБОЧКОВЫХ АГЕНТОВ НА ЭКСПРЕССИЮ КОЛЛАГЕНАЗЫ
Фигуры 12А-Н показывают, что антимикротрубочковые агенты ингибировали экспрессию коллагеназы. Экспрессия коллагеназы стимулировалась добавлением IL-1, являющегося провоспалительным цитокином. Предынкубация хондроцитов с различными антимикротрубочковыми агентами, в частности с LY290181, гексиленгликолем, оксидом дейтерия, этиловым эфиром глицина, AlF3, туберцидином, эпотилоном и бис-(сукцинимидилсукцинатом) этиленгликоля, предотвращала индуцированную IL-1 экспрессию коллагеназы в таких низких концентрациях, как 1×10-7 М.
С. Обсуждение
Паклитаксел был способен ингибировать экспрессию коллагеназы и стромелизина in vitro в концентрациях 10-6 M. Поскольку это ингибирование может объясняться ингибированием активности АР-1, необходимой стадии в индукции всех матричных металлопротеиназ за исключением гелатиназы В, ожидается, что паклитаксел должен ингибировать и другие металлопротеиназы матрикса, которые являются АР-1-зависимыми. Уровни этих металлопротеиназ матрикса являются повышенными во всех воспалительных заболеваниях и играют важную роль в деструкции матрикса, клеточной миграции и пролиферации и в ангиогенезе. Таким образом, ингибирование паклитакселом экспрессии металлопротеиназ матрикса, таких как коллагеназа и стромелизин, будет оказывать благоприятное действие в воспалительных заболеваниях.
ПРИМЕР 9
ДЕЙСТВИЕ АНТИМИКРОТРУБОЧКОВЫХ АГЕНТОВ НА ЭКСПРЕССИЮ ПРОТЕОГЛИКАНОВ
Первичные культуры хондроцитов выделяли из хряща теленка в виде свежих хондроцитов. Клетки высевали при 2,5×106 клеток на мл в культуральные планшеты 100×20 мм и инкубировали в среде Ham F12, содержащей 5% ФТС, в течение ночи при 37°С. Клетки голодали в бессывороточной среде в течение ночи и затем их обрабатывали антимикротрубочковыми агентами при различных концентрациях (10-7 М, 10-6 М, 10-5 М и 10-4 М) в течение 6 часов. Затем к каждому планшету добавляли IL-1 (20 мг/мл) и планшеты инкубировали еще в течение 18 часов. Общую РНК выделяли по способу с подкисленным гуанидинизотиоцианатом и подвергали электрофорезу на денатурирующем геле. Денатурированные пробы РНК (15 мкг) анализировали гель-электрофорезом в 1% денатурирующем геле, переносили на найлоновую мембрану и гибридизовали с 32Р-меченым кДНК-зондом протеогликана (аггрекана). 32Р-меченую кДНК глицеральдегидфосфатдегидразы (GAPDH) использовали в качестве внутреннего стандарта для гарантии примерно одинаковой нагрузки. Экспонированные пленки сканировали и количественно анализировали при помощи ImageQuant.
Результаты
Фигуры 13А-Н показывают, что антимикротрубочковые агенты, которые оказывали ингибирующее действие на экспрессию коллагеназы (пример 8), в частности LY290181, гексиленгликоль, оксид дейтерия, этиловый эфир глицина, АlF3, туберцидин, эпотилон и бис-(сукцинимидилсукцинат) этиленгликоля, не влияли на экспрессию аггрекана, основного компонента хрящевого матрикса, при всех испытанных концентрациях.
ПРИМЕР 10
ТЕСТ АКТИВНОСТИ NF-кВ (НА ОСНОВЕ КЛЕТОК)
IL-1 и TNF были идентифицированы как провоспалительные цитокины, которые активируют транскрипцию генов, запускаемых транскрипционным фактором, называемым NF-кВ, также участвующим в воспалительных процессах. Воспалительный эффект IL-1 и TNF может быть, следовательно, оценен косвенно при помощи теста на репортерный ген (NF-кВ), отвечающий на стимуляцию IL-1 и TNF.
В первый день 5×104 NIH-3T3 (мышиных фибробластов), стабильно трансфицированных репортерной конструкцией NF-кВ (Luciferase, Promega Corp.), высевали на лунку (24-луночного планшета). После достижения конфлюэнтности (на 3-4-й день) клетки голодали при замене полной среды 1 мл бессывороточной среды. После 24-часового голодания клетки обрабатывали различными концентрациями антимикротрубочковых агентов в течение 6 часов перед добавлением IL-1 (20 нг/мл) и TNF (20 нг/мл). Клетки экспонировали с IL-1 и TNF в течение 1 часа и 16 часов и активность NF-кВ измеряли спустя 24 часа. На пятый день среду выбрасывали и клетки промывали один раз ЗФР. Затем клетки экстрагировали в течение 15 минут 250 мкл лизисного буфера (Promega Corp., Wisconsin). Транскрипционную активность NF-кВ оценивали добавлением 25 мкл субстрата люциферазы в пробирку, содержащую 2,5 мкл клеточного экстракта. Пробирку сразу же вставляли в люминометр (Turner Designs) и эмиссию света измеряли в течение 10 секунд. Затем результаты люциферазного теста нормализовали в отношении концентрации белка.
Результаты
Результаты выражались в ингибировании антимикротрубочковыми агентами индукции NF-кВ (индукции в указанное число раз). Как показано на фигуре 80А, 80В, 80С и 80D, туберцидин и паклитаксел ингибировали активность NF-кВ, индуцированную как IL-1, так и TNF. Ингибирующее действие туберцидина и паклитаксела при 6-часовой и 24-часовой обработках были равны 10 мкМ и 2 мкМ, соответственно.
ПРИМЕР 11
ИНГИБИРОВАНИЕ АНГИОГЕНЕЗА ОПУХОЛЕЙ ПАКЛИТАКСЕЛОМ
Оплодотворенные зародыши домашней курицы инкубировали в течение 4 дней перед удалением их оболочек. Содержимое яиц выделяли удалением оболочки, расположенной вокруг воздушного пространства, и выходом содержимого яиц осторожным выскальзыванием из затупленного конца. Содержимое собирали в круглодонные стерилизованные стеклянные резервуары, покрывали крышками от чашек Петри и инкубировали при относительной влажности 90% и 3% диоксиде углерода.
Клетки MDAY-D2 (лимфоидной опухоли мышей) инъецировали в мышей и давали им расти в опухоли с весом 0,5-1,0 г. Мышей умерщвляли, места опухолей протирали спиртом, вырезали, помещали в стерильные среды для культуры тканей и нарезали кубиками 1 мм в ламинарном боксе. Перед помещением рассеченных опухолей на 9-дневных куриных зародышей поверхности САМ осторожно выскребали иглой 30 калибра (G) для гарантии имплантации опухолей. Затем опухоли помещали на САМ после 8 дней инкубирования (4 дня после снятия оболочки) и давали им расти на САМ в течение четырех дней для установления сосудистого снабжения. При помощи этого способа были получены четыре зародыша, причем каждый зародыш имел 3 опухоли. На 12-й день каждая из трех опухолей на зародышах получала либо нагруженную 20% паклитакселом термопасту, ненагруженную термопасту, либо не получала обработки (контроль). Эти обработки продолжали в течение двух дней перед регистрацией результатов.
Эксплантированные опухоли MDAY-D2 секретируют ангиогенные факторы, которые индуцируют врастание капилляров (происходящих из САМ) в массу опухоли и заставляют ее расти в размере. Поскольку все сосуды опухоли происходят из САМ, тогда как все опухолевые клетки происходят из эксплантата, можно оценить действие терапевтических вмешательств независимо на эти два процесса. Этот тест использовали для определения эффективности действия нагруженной паклитакселом термопасты на: (а) ингибирование васкуляризации опухоли и (b) ингибирование роста самих опухолевых клеток.
Прямая стереомикроскопическая оценка in vivo и гистологическое испытание фиксированных тканей из этого исследования показали следующее. В опухолях, обработанных нагруженной 20% паклитакселом термопастой, было уменьшение числа кровеносных сосудов, снабжающих опухоль (фигуры 14С и 14D), уменьшение числа кровеносных сосудов в опухоли и уменьшение числа кровеносных сосудов в периферии опухоли (в зоне, которая обычно наиболее васкуляризирована в твердых опухолях) по сравнению с контрольными опухолями (фигуры 14А и 14В). Опухоли начинали уменьшаться в размере и массе во время двух дней при проведении этого исследования. Кроме того, можно было видеть многочисленные эндотелиальные клетки с остановленным клеточным делением, указывающие на то, что было действие на пролиферацию эндотелиальных клеток. Наблюдали также часто опухолевые клетки с задержанным митозом. Все 4 зародыша обнаружили согласующуюся картину с подавлением васкуляризации опухоли нагруженной 20% паклитакселом термопастой, тогда как ненагруженная паклитакселом термопаста не оказывала такого действия.
В качестве сравнения, в САМ, обработанных ненагруженной термопастой, опухоли были хорошо васкуляризованы с увеличением числа и плотности сосудов в сравнении с васкуляризацией нормальной окружающей ткани и драматически большим количеством сосудов в сравнении с опухолями, обработанными нагруженной паклитакселом пастой. Новообразованные сосуды входили в опухоль из всех углов, появляясь в виде спиц, присоединенных к центру колеса (фигуры 14А и 14В). Контрольные опухоли продолжали увеличиваться в размере и массе в ходе этого исследования. Гистологически, многочисленные расширенные тонкостенные капилляры были видны в периферии опухоли и немногие эндотелиальные клетки находились в состоянии клеточного деления. Опухолевая ткань была хорошо васкуляризована и жизнеспособна на протяжении эксперимента.
В качестве примера, в двух опухолях одинакового размера (исходно, во время эксплантации), помещенных на одну и ту же САМ, были получены следующие результаты. Опухоль, обработанная нагруженной 20% паклитакселом термопастой, имела размер 330 мм × 597 мм; в непосредственной периферии эта опухоль имеет 14 кровеносных сосудов, тогда как опухолевая масса имеет только 3-4 небольших капилляра. Опухоль, обработанная ненагруженной термопастой, имела размер 623 мм × 678 мм; непосредственная периферия этой опухоли имеет 54 кровеносных сосуда, тогда как опухолевая масса имеет 12-14 малых кровеносных сосудов. Кроме того, сама окружающая САМ содержала больше кровеносных сосудов в сравнении с зоной, окружающей обработанную паклитакселом опухоль.
Это исследование демонстрирует, что термопаста высвобождает достаточные количества паклитаксела для ингибирования патологического ангиогенеза, который сопровождает рост и развитие опухолей. В этих условиях ангиогенез максимально стимулируется опухолевыми клетками, которые продуцируют ангиогенные факторы, способные индуцировать врастание капилляров из окружающей ткани в массу опухоли. Нагруженная 20% паклитакселом термопаста способна блокировать этот процесс и ограничивать способность опухолевой ткани поддерживать адекватное кровоснабжение. Это приводит в уменьшению массы опухоли как посредством цитотоксического действия лекарственного средства на сами опухолевые клетки, так и лишением этой ткани питательных элементов, необходимых для роста и растяжения.
ПРИМЕР 12
ИНГИБИРОВАНИЕ АНГИОГЕНЕЗА ПАКЛИТАКСЕЛОМ
А. Тесты с куриной хорионаллантоиновой мембраной ("САМ")
Оплодотворенные зародыши домашней курицы инкубировали в течение 3 дней перед их культивированием без скорлупы. В этом процессе содержимое яиц выделяли удалением оболочки, расположенной вокруг воздушного пространства. Затем внутреннюю мембрану скорлупы повреждали и противоположный конец скорлупы перфорировали, давая содержимому яйца осторожно выходить из затупленного конца. Содержимое яйца помещали в круглодонные стерилизованные стеклянные резервуары и покрывали крышками от чашек Петри. Затем их помещали в термостат при относительной влажности 90% и 3% СO2 и инкубировали в течение 3 дней.
Паклитаксел (Sigma, St. Louis, MI) смешивали при концентрациях 0,25, 0,5, 1, 5, 10, 30 мкг на аликвоту 10 мкл 0,5% водной метилцеллюлозы. Поскольку паклитаксел нерастворим в воде, для получения мелких частиц использовали стеклянные бусины. Аликвоты по 10 мкл этого раствора сушили на парафилме в течение 1 часа с образованием дисков с 2 мм в диаметре. Затем, высушенные диски, содержащие паклитаксел, осторожно помещали при растущем крае каждой САМ на 6-й день инкубирования. Контроли получали помещением не содержащих паклитаксела метилцеллюлозных дисков на САМ на протяжении того же самого временного хода. После 2-дневной экспозиции (8-й день инкубирования) сосудистую сеть обследовали при помощи стереомикроскопа. Липосин II, белый непрозрачный раствор, инъецировали в САМ для увеличения видимости деталей сосудов. Сосудистую сеть неокрашенных, живых зародышей наблюдали на изображениях стереомикроскопа Цейсса, который был сопряжен с видеокамерой (Dage-MTI Inc., Michigan City, IN). Эти видеосигналы затем отображали при увеличении 160х и их информацию собирали с применением системы анализа изображения (Vidas, Kontron; Etching, Germany). Затем изготовляли негативы изображений на графическом самописце (Model 3000; Matrix Instruments, Orangeburg, NY).
Мембраны 8-дневного не имеющего скорлупы зародыша заливали 2% глутаровым альдегидом в 0,1 М натрий-какодилатном буфере; дополнительное количество фиксатора инъецировали под САМ. После 10 минут in situ CAM удаляли и помещали в свежий фиксатор на 2 часа при комнатной температуре. Затем ткань промывали в течение ночи в какодилатном буфере, содержащем 6% сахарозу. Представляющие интерес зоны постфиксировали в 1% тетроксиде осмия в течение 1,5 часов при 4°С. Затем ткани дегидратировали в градиентных сериях спиртов, растворитель заменяли пропиленоксидом и заливали в смолу Spurr. Делали тонкие срезы алмазным микротомным ножом, помещали на медные сетки, окрашивали и обследовали в электронном микроскопе Joel 1200EX. Подобным образом делали срезы 0,5 мм и окрашивали толуоловым синим для светового микроскопа.
На 11-й день развития куриные зародыши использовали для коррозионного способа заливки. Смолу Mercox (Ted Pella, Inc., Redding, CA) инъецировали в сосудистую сеть САМ при помощи иглы 30 G для подкожных инъекций. Заливочный материал состоял из 2,5 граммов полимера Mercox CL-2B и 0,05 граммов катализатора (55% бензоилпероксида), имеющего время полимеризации 5 минут. После инъекции пластику давали находиться in situ в течение часа при комнатной температуре и затем в течение ночи в термостате при 65°С. Затем САМ помещали в 50% раствор гидроксида натрия для расщепления всех органических компонентов. Пластиковые заливки промывали обильно в дистиллированной воде, сушили на воздухе, покрывали золотом/палладием и просматривали при помощи сканирующего электронного микроскопа Philips 501B.
Результаты вышеописанных экспериментов показаны на фигурах 15-18. Вкратце, общие черты нормальной культуры куриного, лишенного скорлупы, зародыша показаны на фигуре 15А. На 6-й день инкубации зародыш расположен центрально относительно расходящейся радиально сети кровеносных сосудов; САМ развивается рядом с зародышем. Эти растущие сосуды лежат вблизи поверхности и легко видимы, что делает эту систему идеализированной моделью для исследования ангиогенеза. Живая неокрашенная капиллярная сеть САМ может быть отображена неинвазивно при помощи стереомикроскопа. Фигура 15В иллюстрирует такую васкулярную зону, в которой клеточные компоненты крови в капиллярах регистрируются при помощи видеокомпьютерного интерфейса. Трехмерная архитектоника таких капиллярных сетей САМ показана при помощи способа коррозионной заливки и наблюдается в сканирующем электронном микроскопе (фигура 15С). Эти заливки выявили лежащие ниже сосуды, которые выступают в направлении поверхности САМ, где они образуют один слой анастомозных капилляров.
Поперечные срезы через САМ показывают наружную эктодерму, состоящую из двойного клеточного слоя, более широкого мезодермального слоя, содержащего капилляры, которые лежат смежно с эктодермой, адвентициальные клетки и внутренний эндодермальный слой клеток (фигура 15D). На уровне электронного микроскопа показаны типичные структурные детали капилляров САМ. Обычно эти сосуды лежат в тесной близости с внутренним клеточным слоем эктодермы (фигура 15Е).
После 48 часов экспозиции с паклитакселом в концентрациях 0,25, 0,5, 1, 5, 10 или 30 мкг каждую САМ испытывали в условиях ее жизнеспособности при помощи стереомикроскопа, снабженного видеокомпьютерным интерфейсом, для оценки действия на ангиогенез. Эту дающую изображение установку использовали при увеличении 160×, что разрешало прямую визуализацию клеток крови в капиллярах; вследствие этого кровоток в представляющих интерес зонах можно было легко оценивать и регистрировать. Для этого исследования ингибирование ангиогенеза определено как зона САМ (имеющая 2-6 мм в диаметре), не имеющая капиллярной сети и сосудистого кровотока. Во всех экспериментах бессосудистые зоны оценивали на 4-точечном аваскулярном градиенте (таблица 2). Эта шкала представляет степень общего ингибирования с максимальным ингибированием, представленным в виде числа 3 шкалы аваскулярного градиента. Паклитаксел был очень стойким и индуцировал максимальную бессосудистую зону (6 мм в диаметре или 3 согласно шкале аваскулярного градиента) в пределах 48 часов в зависимости от его концентрации.

Зависимые от дозы экспериментальные данные эффектов различных терапевтических агентов при различных концентрациях показаны в таблице 3.
Показаны также типичные обработанные паклитакселом САМ с прозрачным диском метилцеллюлозы, расположенным центрально на бессосудистой зоне, имеющим 6 мм в диаметре. При слегка более высоком увеличении периферия таких бессосудистых зон является четко различимой (фигура 16С); окружающие функциональные сосуды часто были направлены прочь от источника паклитаксела (фигуры 16С и 16D). Такие изменения под углом направления кровотока никогда не наблюдались при нормальных условиях. Другим признаком действия паклитаксела было образование кровяных островков в бессосудистой зоне, представляющих собой агрегацию клеток крови.
Сопутствующие морфологические изменения обработанных паклитакселом САМ явно различимы как на урове светого, так и на уровне электронного микроскопа. Для удобства представления показаны три различные фазы основного перехода от нормального к бессосудистому состоянию. Вблизи периферии бессосудистой зоны САМ отличается обилием митотических клеток во всех трех зародышевых слоях (фигуры 17А и 18А). Это усиленное митотическое деление также стойко наблюдалось для капиллярных эндотелиальных клеток. С дальнейшей деструкцией САМ отличается распадом и растворением капилляров (фигуры 17В и 18В). Предполагаемые эндотелиальные клетки, обычно задержанные в митозе, все еще сохраняют тесную пространственную взаимосвязь с клетками крови и лежат вблизи эктодермы; однако эти клетки не соединены сочленением. Наиболее центральная часть бессосудистой зоны характеризовалась утолщенным эктодермальным и эндодермальным слоем (фигуры 17С и 18С). Хотя эти слои были утолщены, клеточные сочленения оставались интактными и слои сохраняли их структурные характеристики. В мезодерме были обильные рассеянные клетки с задержанным митозом; эти клетки не обнаруживали поляризации эндотелиальных клеток, наблюдаемой в первой фазе. Также, в этой бессосудистой зоне дегенерирующие клетки были обычными, что можно заметить по электронно-плотным вакуолям и клеточному дебрису (фигура 18С).
В целом, данное изобретение показало, что спустя 48 часов после нанесения паклитаксела на САМ ангиогенез ингибировался. Ингибирование кровеносных сосудов, образованных в бессосудистой зоне, было представлено тремя переходными фазами действия паклитаксела. Центральная наиболее пораженная зона бессосудистой зоны содержала разрушенные капилляры с транссудированными эритроцитами; это указывало на то, что межклеточные сочленения между эндотелиальными клетками отсутствуют. Клетки эндодермы и эктодермы сохраняли их межклеточные сочленения и, следовательно, эти зародышевые слои оставались интактными; однако они были слегка утолщенными. По мере приближения к нормальной васкулярной зоне кровеносные сосуды удерживали их сочленяющие комплексы и, следовательно, также оставались интактными. На периферии обработанной паклитакселом зоны дополнительный рост кровеносных сосудов ингибировался, что было видно из типичного изменения направления или эффекта "локтевого" сгибания кровеносных сосудов (фигура 16D).
Обработанные паклитакселом бессосудистые зоны обнаружили также обилие клеток, задержанных в митозе, во всех трех зародышевых слоях САМ; это было уникальным для паклитаксела, так как ни одно прежнее исследование не продемонстрировало такого события. Задержанные в митозе эндотелиальные клетки не могли подвергаться их нормальным метаболическим функциям, участвующим в ангиогенезе. В качестве сравнения, бессосудистая зона, образуемая сурамином и ацетатом кортизона, не продуцирует митотически задержанных клеток в САМ; они только предотвращают дополнительный рост кровеносных сосудов в обработанную зону. Таким образом, даже хотя эти агенты являются антиангиогенными, имеется много точек, в которых процесс ангиогенеза может быть поражен.
Также наблюдали действие паклитаксела на протяжении 48 часов. Во время этого периода наблюдения было отмечено, что ингибирование ангиогенеза наступает так рано, как 9 часов после нанесения. Гистологические срезы выявили одинаковую морфологию с морфологией, наблюдаемой в первой переходной фазе бессосудистой зоны при 48 часах, иллюстрированной в фигурах 17А и 18А. Также наблюдали процесс реваскуляризации в бессосудистую зону, наблюдаемый ранее. Было обнаружено, что бессосудистая зона, образуемая гепарином и ангиостатическими стероидами, становилась реваскуляризованной через 60 часов после нанесения. В одном исследовании обработанные паклитакселом бессосудистые зоны не были реваскуляризованными в течение, по меньшей мере, 7 дней после нанесения, что предполагает более сильное долгосрочное действие.
ПРИМЕР 13
ДЕЙСТВИЕ ПАКЛИТАКСЕЛА И КАМПОТЕЦИНА НА ПРОЛИФЕРАЦИЮ
КЛЕТОК LNCaP
Материалы и способы
Клетки LNCaP высевали при концентрациях 2×103 и 1×103 клеток/лунку, соответственно, в 96-луночные планшеты. После 48 часов в каждую культуральную лунку добавляли различные концентрации паклитаксела или камптотецина (25 мкл) и планшеты инкубировали при 37°С в течение 5 дней. После инкубирования клетки фиксировали 1% раствором глутарового альдегида и окрашивали в течение 5 минут 0,5% кристаллическим фиолетовым красителем. Краситель последовательно элюировали 100 мкл буферного раствора и поглощение регистрировали на микропланшет-ридере Titertek Multiskan при длине волны 492 нм. Рост клеток выражали в процентах относительно контрольных лунок, не содержащих испытуемого соединения (принятых за 100%).
Результаты
Паклитаксел ингибировал рост клеток LNCaP с EC50 приблизительно 0,09 нМ. Эксперименты по апоптозу проводили на клетках в лунках после обработки паклитакселом с применением тестов фрагментации ДНК. Наблюдали сильный апоптоз клеток, указывающий на то, что паклитаксел был цитотоксичным в соответствии с механизмом апоптоза.
Кампотецин был очень сильным в его цитотоксическом действии против клеток LNCaP. Такие низкие концентрации, как 0,001 нМ, были токсичными для более 60% клеток. Таким образом, EC50 для этого лекарственного средства против клеток LNCaP должна лежать в диапазоне фемтомолярных концентраций (табл.4, 5).
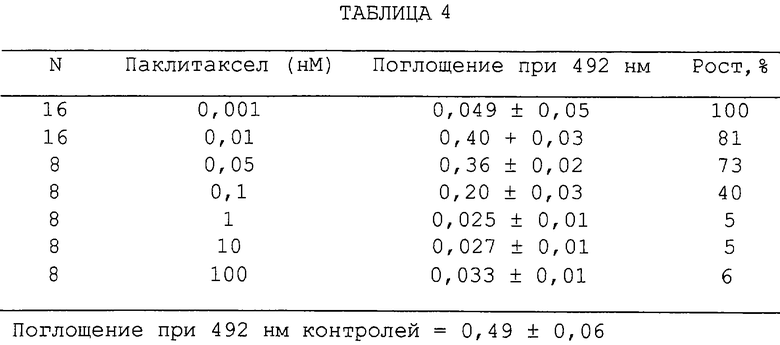
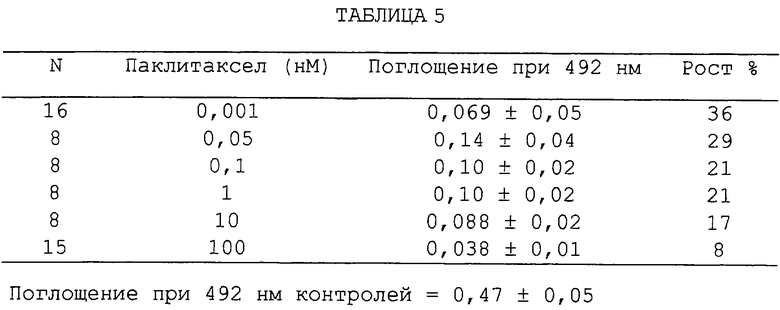
ПРИМЕР 14
АНТИАНГИОГЕННАЯ АКТИВНОСТЬ ДРУГИХ АНТИМИКРОТРУБОЧКОВЫХ АГЕНТОВ
Кроме паклитаксела, другие антимикротрубочковые агенты могут быть также включены в полимерные носители. Характерные примеры, которые приведены ниже, включают в себя кампотецин и винка-алкалоиды, такие как винбластин и винкристин, и стабилизирующие микротрубочки агенты, такие как туберцидин, фторид алюминия и LY290181.
А. Включение агентов в PCL
Агенты растирали пестиком в ступке для уменьшения размеров частиц до менее 5 микронов. Затем этот порошок смешивали в виде сухого порошка с поликапролактоном (PCL) (молекулярная масса 18000 Birmingham Polymers, AL USA). Смесь нагревали до 65°С в течение 5 минут и смесь расплавленного полимера/агента перемешивали в гладкую пасту в течение 5 минут. Затем расплавленную массу набирали в шприц на 1 мл и выдавливали с получением гранул 3 мг. Эти гранулы помещали затем на САМ на 6-й день гестации для оценки их антиангиогенных свойств.
В. Действие нагруженной кампотецином пасты PCL на САМ
Нагруженная кампотецином термопаста была эффективной в ингибировании ангиогенеза в сравнении с контрольными гранулами PCL. При 5% нагрузке лекарственного средства 4/5 испытанных САМ обнаружили сильное ингибирование ангиогенеза. Кроме того, при нагрузке 1% и 0,25% 2/3 и 3/4 САМ, соответственно, обнаружили ингибирование ангиогенеза. Таким образом, из этих данных очевидно, что кампотецин в достаточной степени высвобождался из термопасты PCL и что он имеет терапевтическую антиангиогенную эффективность.
С. Действие нагруженной винбластином и винкристином пасты
PCL на САМ
При тестировании этих композиций на САМ было видно, что эти агенты высвобождались из гранул PCL в достаточных количествах для индукции биологического эффекта. Как винбластин, так и винкристин индуцировали антиангиогенные эффекты в САМ-тесте в сравнении с контрольными гранулами термопасты PCL.
При концентрациях 0,5% и 0,1% нагрузке лекарственного средства винкристин индуцировал ингибирование ангиогенеза во всех испытанных САМ. При испытании концентраций, превышающих 2%, достигались токсичные уровни лекарственного средства и имела место неожиданная смерть зародыша.
Винбластин был также эффективным в ингибировании ангиогенеза на САМ при концентрациях 0,25%, 0,5% и 1%. Однако при концентрациях, превышающих 2%, винбластин был токсичным в отношении зародыша.
D. Действие нагруженной туберцидином пасты PCL на САМ
Нагруженная туберцидином термопаста была эффективной в ингибировании ангиогенеза в сравнении с контрольными гранулами PCL. При нагрузке 1% туберцидин индуцировал ингибирование ангиогенеза в 1/3 испытанных САМ. Однако при более высоких концентрациях лекарственного средства 5% нагрузки туберцидин сильно ингибировал ангиогенез в 2/3 САМ. Таким образом, из этих результатов было очевидно, что туберцидин в достаточной степени высвобождался из пасты PCL и что он имеет сильную антиангиогенную активность.
Е. Действие нагруженной фторидом алюминия пасты PCL на САМ Нагруженные фторидом алюминия (АlF3) пасты PCL были эффективными в ингибировании ангиогенеза при 20% нагрузке лекарственного средства в сравнении с контрольными гранулами. При 20% нагрузке лекарственного средства 2/4 САМ обнаружили ингибирование ангиогенеза, как очевидно из образования бессосудистой зоны с диаметром 2-6 мм. Однако при более низкой нагрузке лекарственного средства, 1% и 5%, ингибирование ангиогенеза не было заметным (0/6 и 0/5 САМ, соответственно). Таким образом, фторид алюминия был эффективным в индукции ингибирования ангиогенеза только при более высоких концентрациях лекарственного средства.
F. Действие нагруженной LY290181 пасты PCL на САМ
Оценка пасты PCL, нагруженной 5% LY290181, на САМ выявила, что LY290181 индуцировал ингибирование ангиогенеза в 1/3 испытанных САМ. Однако при нагрузке лекарственного средства 1% LY290181 не индуцировал антиангиогенную реакцию (n=2).
ПРИМЕР 15
ДЕЙСТВИЕ ПАКЛИТАКСЕЛА НА ЖИЗНЕСПОСОБНОСТЬ НЕПРОЛИФЕРИРУЮЩИХ КЛЕТОК
Хотя важно, что модифицирующий заболевание агент является способным сильно ингибировать различные неуместные клеточные активности (пролиферацию, воспаление, продуцирование протеолитических ферментов), которые имеют место в избытке во время развития хронического воспаления, он не должен быть токсичным для нормальных тканей. Особенно критическим является то, что нормальные клетки не должны повреждаться, так как это привело бы к прогрессированию заболевания. В этом примере исследовали действие паклитаксела на жизнеспособность нормальных неделящихся клеток in vitro с использованием культивируемых хондроцитов, выращенных до конфлюэнтности.
Вкратце, хондроциты инкубировали в присутствии (10-5 М, 10-7 М и 10-9 М) или в отсутствие (контроль) паклитаксела в течение 72 часов. В конце этого периода времени общее число жизнеспособных клеток определяли визуально при помощи вытеснения красителя трипанового синего. Этот эксперимент проводили 4 раза и результаты сравнивали.
Результаты этого эксперимента показаны на фигуре 21. Вкратце, как видно из фигуры 21, паклитаксел не влияет на жизнеспособность нормальных непролиферирующих клеток in vitro даже при высоких (10-5 М) концентрациях паклитаксела. Более конкретно, даже при концентрациях лекарственного средства, достаточных для блокирования патологических процессов, описанных в предшествующих примерах, отсутствует цитотоксичность в отношении нормальных хондроцитов.
ПРИМЕР 16
ВЫБОР УСИЛИТЕЛЯ ПРОНИКНОВЕНИЯ ДЛЯ КОМПОЗИЦИЙ
ПАКЛИТАКСЕЛА ДЛЯ МЕСТНОГО НАНЕСЕНИЯ
А. Растворимость паклитаксела в различных усилителях
Испытывали следующие усилители проникновения: Транскутол®, этанол, пропиленгликоль, изопропилмиристат, олеиновую кислоту и смесь Транскутол:изопропилмиристат (9:1 об./об.). Один миллилитр каждого усилителя в стеклянных флаконах предварительно нагревали до 37°С и добавляли избыток паклитаксела. Пробу 0,5 мл жидкости из каждого сосуда центрифугировали при 37°С и 13000 об/мин, в течение 2 минут. Аликвоты (0,1 мл) супернатанта из центрифужных пробирок переносили в мерные колбы и разводили метанолом. Содержание паклитаксела оценивали при помощи жидкостной хроматографии высокого давления (ЖХВД=ВЖХ).
В. Коэффициент распределения
Определенное количество паклитаксела растворяли в объеме усилителя, нагретого до 37°С. Аликвоты (1 мл) этого раствора добавляли к 1 мл октанола в стеклянном флаконе на 4 мл. Затем добавляли забуференный фосфатом солевой раствор (1 мл) (рН 7,4) и сосуды встряхивали вортексом с получением эмульсии. Флаконы помещали в термостат на 37°С на 16 часов, после чего из каждого флакона брали 0,1 мл октанола и разбавляли 9,9 мл метанола. Для водных фаз пробы 0,5 мл брали из флаконов с олеиновой кислотой и изопропилмиристатом и пробы 0,5 мл брали из флаконов с пропиленгликолем и разбавляли 0,5 мл метанола. Из флаконов с Транскутолом брали пробы 0,1 мл и разбавляли 9,9 мл смеси 50:50 Транскутол:ЗФР и из флаконов с этанолом брали пробы 0,1 мл и разбавляли смесью 50:50 этанол:ЗФР. Содержание паклитаксела определяли при помощи ВЖХ. Каждое определение выполняли в трех повторностях.
С. Результаты
Растворимость паклитаксела в каждом усилителе при 37°С показана в таблице 6.
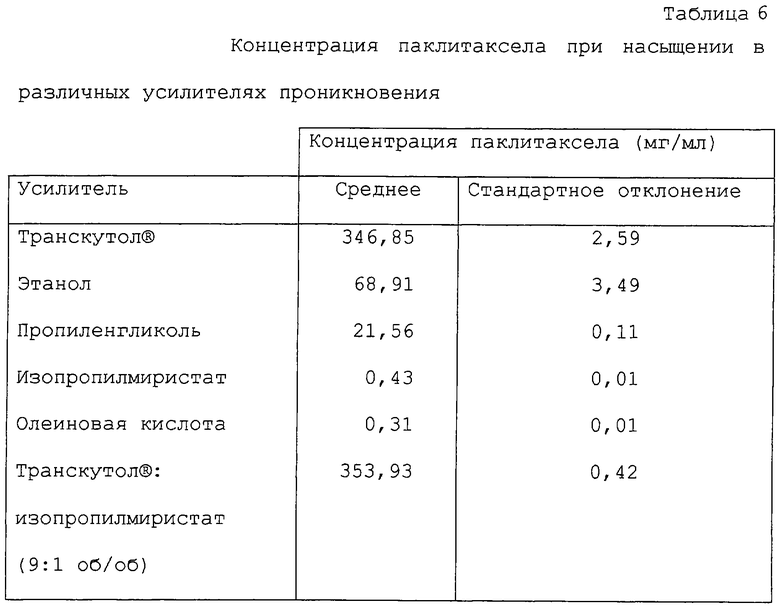
Коэффициенты распределения октанол/вода, Ко/в, показаны в таблице 7.
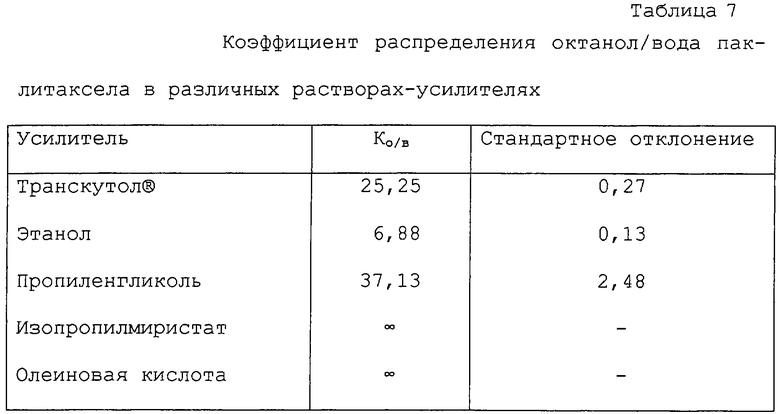
Для эффективного действия паклитаксел должен проникать в кожу до более низкого слоя жизнеспособного эпидермиса. Было установлено, что лекарственные средства, чтобы проникать в жизнеспособный эпидермис, должны иметь коэффициент распределения октанол/вода, близкий к 100 (Hadgraft J.H. and Walters К., Drug absorption enhancements, A.G. de Boers Ed., Harwood Publishers, 1994). На основании результатов в таблицах 1 и 2, видно, что пропиленгликоль и Транскутол обнаруживают наилучшую комбинацию солюбилизации паклитаксела и усиления его распределения из масляной фазы в водную фазу.
Однако Ко/в, производимый как Транскутолом, так и пропиленгликолем, может быть несколько низким, поэтому их комбинировали с изопропилмиристатом, который имеет бесконечный Ко/в, в попытке увеличения растворимости паклитаксела в фазе октанола. Изопропилмиристат и Транскутол смешивали в отношении объемов 1:9. Изопропилмиристат растворялся легко при комнатной температуре в Транскутоле. Для образования гомогенной фазы пропиленгликоль и изопропилмиристат смешивали также с этанолом в соотношении 4:3,5:0,5 пропиленгликоль:этанол:изопропилмиристат. Полученные Ко/в показаны в таблице 8.

Добавление изопропилмиристата к Транскутолу приводило к значимому увеличению коэффициента распределения. Однако раствор пропиленгликоль:этанол:изопропилмиристат не приводил к значимому улучшению коэффициента распределения в сравнении с одним пропиленгликолем. Этот последний результат и факт, что этанол, как было обнаружено, обостряет псориатическое состояние, категорически исключал эту комбинацию усилителей из дальнейшего рассмотрения. Кроме того, добавление изопропилмиристата фактически увеличивало растворимость паклитаксела относительно его растворимости в одном Транскутоле. Растворимость паклитаксела в Транскутоле была 346,9 мг/мл, тогда как в комбинации Транскутол:изопропилмиристат растворимость увеличивалась до 353,9 мг/мл. Таким образом, эта комбинация усилителей была выбрана в исследованиях кожных заболеваний.
ПРИМЕР 17
ПРИГОТОВЛЕНИЕ И АНАЛИЗ КОМПОЗИЦИЙ ПАКЛИТАКСЕЛА
ДЛЯ МЕСТНОГО ПРИМЕНЕНИЯ
А. Приготовление мази А паклитаксела
Транскутол (3,2 г), изопропилмиристат (0,3 г), лабразол (2,5 г), паклитаксел (0,01 г) и 0,5 мКи/мл 3H-паклитаксела (0,3 мл) объединяли в сцинтилляционном флаконе на 20 мл. В отдельном сцинтилляционном флаконе объединяли лабрафил (2,5 г), арлацел 165 (1,2 г) и компритол (0,3 г) и нагревали до 70°С до полного расплавления. Содержимое первого сцинтилляционного флакона добавляли к расплаву, встряхивали на вортексе до гомогенности и давали остыть.
В. Приготовление мази В паклитаксела
Транскутол (2,5 г), изопропилмиристат (1,0 г), лабразол (2,5 г), паклитаксел (0,01 г) и 0,5 мКи/мл 3H-паклитаксела (0,3 мл) объединяли в сцинтилляционном флаконе на 20 мл. В отдельном сцинтилляционном флаконе объединяли лабрафил (2,5 г), арлацел 165 (1,2 г) и компритол (0,3 г) и нагревали до 70°С до полного расплавления. Содержимое первого сцинтилляционного флакона добавляли к расплаву, встряхивали на вортексе до гомогенности и давали остыть.
С. Приготовление кожи и исследование проникновения
Замороженную кожу мини-свиньи Yucatan (миниатюрной свиньи для медицинских опытов) хранили при -70°С до использования. Пробы кожи готовили с применением пробочного сверда №10 для выбивания дисков из замороженной кожи. Пробы промывали раствором стрептомицина-пенициллина и помещали в мешочки для морозильника и хранили при -70°С.
Срезы кожи помещали на диффузионные ячейки Франца вверх ороговевшим слоем (stratum corneum). Нижним рецепторным раствором был 0,05% раствор амоксициллина в R.O. воде. Донорную ячейку прикрепляли на каждой поверхности кожи. Мазь паклитаксела нагревали до расплавления (40-50°С) и набирали в шприц. Все еще в расплавленном виде 0,1 мл выдавливали на каждую поверхность кожи. Донорные клетки покрывали стеклянным диском и весь ансамбль оставляли на 24 часа.
После 24 часов ячейки разбирали, избыток мази удаляли и хранили в сцинтилляционном флаконе. Кожную поверхность быстро промывали 3 мл дихлорметана (ДХМ) и сушили. Промывной ДХМ хранили в том же самом флаконе, в котором был избыток мази. Срезы кожи и рецепторные растворы помещали в отдельные сцинтилляционные флаконы. Кожу криотомировали при -30°С на срезы 30 мкм и собирали в отдельные сцинтилляционные флаконы. Пробы срезов кожи растворяли добавлением 0,5 мл солюбилизатора ткани в каждый флакон. Пробы оставляли на ночь для растворения при комнатной температуре. На следующий день во флаконы добавляли 3 мл сцинтилляционной смеси. В случае промывных ДХМ-растворов 100 мкл переносили в 1 мл ацетонитрила и затем добавляли 3 мл сцинтилляционной смеси. Радиоактивность всех растворов измеряли при помощи бета-счетчика.
Пробы кожи помещали на диффузионные ячейки Франца и разделяли на три группы. Каждую пробу обрабатывали соответственно (без обработки или мазь В с паклитакселом или без паклитаксела). После 24 часов пробы удаляли и обрабатывали с применением стандартных гистологических способов.
D. Результаты
На основании исследования гистологических срезов было обнаружено, что необработанная кожа имеет толщину 50-120 мкм, тогда как жизнеспособный эпидермис имел толщину 400-700 мкм. В случае мази, содержащей 3% м/м изопропилмиристат (мазь А), концентрация паклитаксела в коже была по существу постоянной при 1 мкг/мл (1,2×10-6 М) в stratum соrneum и по всему жизнеспособному эпидермису. В случае мази, содержащей 10% м/м изопропилмиристат (мазь В), концентрация паклитаксела была постоянной в stratum corneum и жизнеспособном эпидермисе, но более высокими в stratum corneum (6 мкг/мл против 2 мкг/мл). При исследовании каждой мази не было радиоактивности в рецепторном растворе, что свидетельствует о том, что паклитаксел совершенно не проходил через срез кожи.
Не наблюдали больших различий при нанесении мази, содержащей паклитаксел.
ПРИМЕР 18
РАЗРАБОТКА СИСТЕМНЫХ КОМПОЗИЦИЙ ПАКЛИТАКСЕЛА ДЛЯ ЛЕЧЕНИЯ ПСОРИАЗА
В тяжелых случаях псориаза считаются приемлемыми более агрессивные способы лечения и, следовательно, могут быть приемлемыми токсичности, связанные с системным лечением паклитакселом.
Системная композиция для паклитаксела состоит из амфифильных диблок-сополимеров, которые в водных растворах образуют мицеллы, состоящие из гидрофобной центральной части и гидрофильной оболочки в воде. Диблок-сополимеры поли(DL-лактид)-блок-метоксиполиэтиленгликоль (PDLLA-MePEG), поликапролактон-блок-метоксиполиэтиленгликоль (PCL-MePEG) и поли (DL-лактид-со-капролактон)-блок-метоксиполиэтиленгликоль (PDLLACL-MePEG) могут быть синтезированы с применением процедуры полимеризации расплава в массе или сходных способов. Вкратце, определенные количества мономеров DL-лактида, капролактона и метоксиполиэтиленгликолей с различными молекулярными массами нагревали (130°С) для расплавления при барботировании азота и перемешивали. К расплавленным мономерам добавляли катализатор октоат олова (0,2% м/м). Полимеризацию проводили в течение 4 часов. Молекулярные массы, критические мицеллярные концентрации и максимальные нагрузки паклитаксела измеряли при помощи ГПХ, флуоресценции и тестирования солюбилизации, соответственно (фигура 22). Были получены высокие несущие емкости для паклитаксела. Способность солюбилизации паклитаксела зависит от составов и концентраций этих сополимеров (фигуры 22 и 23). PDLLA-MePEG дал наиболее стабильно солюбилизированный паклитаксел (фигуры 23 и 24).
Сильная связь во внутренней центральной части (ядре) полимерных мицелл предоставляет среду высокой емкости для несения гидрофобных лекарственных средств, таких как паклитаксел. Лекарственные средства могут быть ковалентно связаны с блок-сополимерами с образованием мицеллярной структуры или они могут быть физически включены в гидрофобные ядра этих мицелл. Механизмы высвобождения лекарственных средств из мицелл включают в себя диффузию из ядра и обмен между отдельными цепями полимеров и мицеллами. Небольшой размер мицелл (обычно менее 100 нм) будет устранять трудности, связанные с инъецированием более крупных частиц.
ПРИМЕР 19
ПРОЦЕДУРА ПРИГОТОВЛЕНИЯ ТЕРМОПАСТЫ
Взвешивали пять граммов поликапролактона с мол. массой 10000 - 20000 (Polysciences, Warrington Penn. USA) в стеклянный сцинтилляционный флакон на 20 мл, который помещали в химический стакан на 600 мл, содержащий 50 мл воды. Химический стакан медленно нагревали до 65°С и выдерживали при этой температуре в течение 20 минут до расплавления полимера. Известную навеску паклитаксела или другого ингибитора ангиогенеза основательно смешивали в расплавленный полимер при 65°С. Расплавленный полимер выливали в предварительно нагретую (термостат при 60°С) форму и давали остывать до отверждения полимера. Полимер нарезали на небольшие кусочки (размером приблизительно 2 мм на 2 мм) и помещали в 1 мл-овый стеклянный шприц.
Стеклянный шприц помещали затем вертикально (закрытым крышкой кончиком вниз) в стеклянный химический стакан на 500 мл), содержащий дистиллированную воду при 65°С (горячая пластина Корнинга), до полного расплавления полимера. Затем вставляли поршень в шприц для сжатия расплавленного полимера в липкую массу при кончике цилиндра шприца. Шприц закрывали крышкой и давали ему остыть при комнатной температуре.
Для применения этот шприц повторно нагревали до 60°С и вводили в виде жидкости, которая отверждалась при охлаждении до температуры тела.
ПРИМЕР 20
МОДИФИКАЦИЯ ВЫСВОБОЖДЕНИЯ ПАКЛИТАКСЕЛА ИЗ ТЕРМОПАСТЫ С ИСПОЛЬЗОВАНИЕМ PDLLA-PEG-PDLLA И НИЗКОМОЛЕКУЛЯРНОЙ
ПОЛИ(D,L-МОЛОЧНОЙ КИСЛОТЫ)
А. Приготовление PDLLA-PEG-PDLLA и низкомолекулярной PDLLA
DL-лактид покупали у Aldrich. Полиэтиленгликоль (PEG) с молекулярной массой 8000, октоат олова и DL-молочную кислоту получали из Sigma. Поли-ε-капролактон (PCL) с молекулярной массой 20000 получали из Birmingham Polymers (Birmingham, AL). Паклитаксел получали из Hauser Chemicals (Boulder, CO).
Стандарты полистирола с узкими распределениями молекулярных масс получали из Polysciences (Warrington, PA). Ацетонитрил и метиленхорид имели ВЖХ-чистоту (Fisher Scientific).
Триблок-сополимер PDLLA-PEG-PDLLA синтезировали полимеризацией с раскрытием кольца. Мономеры DL-лактида и PEG в различных соотношениях смешивали и добавляли 0,5 мас.% октоат олова. Полимеризацию проводили при 150°С в течение 3,5 часов. Низкомолекулярную PDLLA синтезировали поликонденсацией DL-молочной кислоты. Реакцию проводили в стеклянной колбе в условиях медленного продувания азотом, механического перемешивания и нагревания при 180°С в течение 1,5 часов. Молекулярная масса PDLLA была примерно 800 согласно измерению при помощи титрования концевых карбоксильных групп.
В. Приготовление композиций в виде паст
Паклитаксел при нагрузках 20% или 30% тщательно смешивали с сополимерами PDLLA-PEG-PDLLA или смесями PDLLA-PCL 90:10, 80:20 и 70:30, расплавленными при около 60°С. Пасты, нагруженные паклитакселом, взвешивали в шприцы на 1 мл и хранили при 4°С.
С. Характеристика PDLLA-PEG-PDLLA и пастообразных смесей
Молекулярные веса и распределения сополимеров PDLLA-PEG-PDLLA определяли при температуре окружающей среды при помощи ГПХ с использованием насоса Shimadzu LC-10AD HPLC и детектора показателя преломления Shimadzu RID-6A (Kyoto, Japan), соединенного с гель-колонкой 104 - Hewlett Packard PI. Подвижной фазой был хлороформ со скоростью тока 1 мл/мин. Инъекционный объем пробы был 20 мкл при концентрации полимера 0,2% (м/об). Молекулярные массы полимеров определяли относительно стандартов полистирола. Характеристическую вязкость PDLLA-PEG-PDLLA в СНСl3 при 25°С измеряли при помощи вискозиметра Cannon-Fenske.
Hewlett Packard PI. Подвижной фазой был хлороформ со скоростью тока 1 мл/мин. Инъекционный объем пробы был 20 мкл при концентрации полимера 0,2% (м/об). Молекулярные массы полимеров определяли относительно стандартов полистирола. Характеристическую вязкость PDLLA-PEG-PDLLA в СНСl3 при 25°С измеряли при помощи вискозиметра Cannon-Fenske.
Термический анализ сополимеров проводили дифференциальной сканирующей калориметрией (ДСК) с применением контроллера ТА Instruments 2000 и ДСК DuPont 910S (Newcastle, Delaware). Скорость нагревания была 10°С/мин, и пробы матрикса сополимера и матрикса паклитаксел/сополимер взвешивали (3-5 мг) в загнутые открытые алюминиевые лоточки для проб.
1H-ядерный магнитный резонанс (ЯМР) использовали для определения химического состава полимера. Спектры 1H-ЯМР нагруженного паклитакселом PDLLA-PEG-PDLLA получали в CDCl3 с применением ЯМР-прибора (Bruker, AC-200E) при 200 МГц. Концентрация полимера была 1-2%.
Морфологию пасты паклитаксел/PDLLA-PEG-PDLLA исследовали с применением сканирующей электронной микроскопии (СЭМ) (Hitachi F-2300). Пробу покрывали 60% Au и 40% Pd (толщина 10-15 нм) при помощи прибора Хаммера (Technics, USA).
D. Высвобождение паклитаксела in vitro
Небольшую гранулу нагруженной 20% паклитакселом пасты PDLLA:PCL (примерно 2 мг) или цилиндр (приготовленный выдавливанием расплавленной пасты через шприц) нагруженной 20% паклитакселом пасты PDLLA-PEG-PDLLA помещали в закрытые крышками стеклянные пробирки на 14 мл, содержащие 10 мл забуференного фосфатом солевого раствора (рН 7,4) с 0,4 г/л альбумина. Пробирку инкубировали при 37°С с медленным ротационным перемешиванием. Супернатант брали периодически для анализа паклитаксела и заменяли свежим буфером ЗФР/альбумин. Супернатант (10 мл) экстрагировали 1 мл метиленхлорида. Водную фазу декантировали и фазу метиленхлорида сушили под током азота при 60°С. Высушенный остаток воссоздавали в смеси 40:60 вода:ацетонитрил и центрифугировали при 10000 g в течение примерно 1 минуты. Затем количество паклитаксела в супернатанте анализировали при помощи ВЖХ. Анализ ВЖХ выполняли с использованием насоса 110А и колонки ультрасфер С-8 (Beckman) и УФ-детекторной установки SPD-6A при 232 нм, автоинжектора SIL-9A и интегратора C-R3A (Shimadzu). Инъекционный объем 20 мкл и скорость тока 1 мл/мин. Подвижная фаза состояла из 58% ацетонитрила, 5% метанола и 37% дистиллированной воды.
Е. Результаты и обсуждение
Молекулярную массу и распределение молекулярных масс PDLLA-PEG-PDLLA относительно стандартов полистирола измеряли при помощи ГПХ (фигура 30). Характеристическую вязкость сополимера в СНСl3 при 25°С определяли при помощи вискозиметра Canon-Fenske. Молекулярная масса и характеристическая вязкость уменьшались с увеличением содержания PEG. Полидисперсности PDLLA-PEG-PDLLA с содержанием PEG 10-40% были 2,4-3,5. Однако сополимер с 70% PEG имел узкое молекулярно-массовое распределение с полидисперсностью 1,21. Это может быть обусловлено высоким содержанием PEG, уменьшающим шанс побочных реакций, таких как переэтерификация, которая приводит к широкому распределению молекулярных масс полимера. Альтернативно, спиральная структура гидрофобных-гидрофильных блок-сополимеров может приводить к искусственно низкой величине полидисперсности.
Сканы ДСК чистого PEG и сополимеров PDLLA-PEG-PDLLA представлены в фигурах 25 и 26. PEG и PDLLA-PEG-PDLLA с содержанием PEG 70% и 40% показали эндотермические пики с уменьшающейся энтальпией и температурой по мере уменьшения содержания PEG сополимера. Эндотермические пики в сополимерах с 40% и 70% PEG, вероятно, обусловлены расплавлением участка PEG, что указывает на появление разделения фаз. В то время как PEG имел острый пик расплавления, сополимеры как с 70%, так и с 40% PEG обнаруживали широкие пики с заметным плечом в случае 70% PEG. Широкие пики расплавления могли быть результатом интерференции PDLLA с кристаллизацией PEG. Это плечо в случае 70% PEG может представлять собой переход из высокоэластического состояния в стеклообразное участка PDLLA. Не наблюдали термических изменений в сополимерах с содержанием PEG 10%, 20% и 30% в пределах температур 10-250°С, что свидетельствует о том, что не происходила значимая кристаллизация (следовательно, может быть разделение фаз).
ДСК-термограммы смесей PDLLA:PCL (70:30, 80:20, 90:10) без паклитаксела или с 20% паклитакселом обнаружили эндотермический пик при около 60°С, возникающий из плавления PCL.
Вследствие аморфной природы PDLLA и его малой молекулярной массы (800) плавление и переходы в стеклообразное состояние PDLLA не наблюдались. Не наблюдали термических изменений из-за перекристаллизации или плавления паклитаксела.
Сополимеры PDLLA-PEG-PDLLA с содержанием PEG 20% и 30% были выбраны в качестве оптимальных композиционных материалов для пасты в силу следующих причин: PDLLA-PEG-PDLLA с 10% PEG не могли плавиться при температуре примерно 60°С; сополимеры 40% и 70% PEG легко плавились при 60°С и сополимер 20% и 30% PEG становился вязкой жидкостью между 50°С и 60°С; и набухание 40% и 70% сополимеров PEG в воде было очень высоким, приводя к быстрому диспергированию паст в воде.
Профили высвобождения паклитаксела in vitro из цилиндров PDLLA-PEG-PDLLA показаны на фигуре 27. Эксперимент, измеряющий высвобождение из 40% цилиндров PEG, прекращали, так как эти цилиндры имели очень высокую степень набухания (приблизительно 200% поглощения воды в пределах одного дня) и разрушались за несколько дней. Высвобождающаяся фракция паклитаксела из цилиндров 30% PEG постепенно увеличивалась на протяжении 70 дней. Высвобождающаяся фракция паклитаксела из цилиндров 20% PEG медленно увеличивалась до 30 дней и затем резко увеличивалась с последующим другим периодом постепенного увеличения. Существовало значимое различие в степени, с которой индивидуальный цилиндр (содержание PEG 20%) обнаруживал резкое изменение в высвобождении паклитаксела. Перед резким увеличением высвобождающаяся фракция паклитаксела была более низкой для полимеров с более низким содержанием PEG при одинаковом диаметре цилиндра (1 мм). 40% и 30% цилиндры PEG обнаружили гораздо более высокие скорости высвобождения паклитаксела, чем цилиндры 20% PEG. Например, цилиндр 30% PEG высвобождал 17% паклитаксел за 30 дней, по сравнению с 2% высвобождением из цилиндра 20% PEG. Цилиндры с меньшими диаметрами приводили к более высоким скоростям высвобождения (например, за 30 дней цилиндры 30% PEG с диаметрами 0,65 мм и 1 мм высвобождали 26% и 17% паклитаксела, соответственно (фигура 27)).
Приведенные выше наблюдения могут быть объяснены механизмами высвобождения паклитаксела из цилиндров. Паклитаксел диспергирован в полимере в виде кристаллов, как наблюдали при помощи оптической микроскопии. Эти кристаллы начинают растворяться в матриксе сополимера при 170°С и полностью растворяются при 180°С, как наблюдали на термограммах микроскопии ДСК с нагреваемым столиком нагруженной 20% паклитакселом пасты PDLLA-PEG-PDLLA (30% PEG), выявивших небольшую экзотерму перекристаллизации (16 Дж/г, 190°С) и эндотерму плавления (6 Дж/г, 212°С) для паклитаксела (фигура 25), указывающих на перекристаллизацию паклитаксела из расплава сополимера после 180°С. В этом типе матрикса лекарственное средство/полимер паклитаксел мог бы высвобождаться посредством диффузии и/или эрозии полимера.
В регулируемом диффузией случае лекарственное средство может высвобождаться молекулярной диффузией в полимере и/или через открытые каналы, образованные связанными частицами лекарственного средства. Следовательно, при 20% нагрузке некоторые частицы паклитаксела выделялись и паклитаксел мог высвобождаться путем растворения в сополимере с последующей диффузией. Другие частицы паклитаксела могли образовывать кластеры, соединяющиеся с поверхностью, и высвобождаться через канальную диффузию. В обоих случаях цилиндры малого размера давали более быстрое высвобождение лекарственного средства вследствие более короткого пути диффузии (фигура 27).
Во время высвобождения регистрировали изменения размера и поглощение воды цилиндров (фигура 28). Изменения длины, диаметра и сырого веса цилиндров 30% PEG увеличивались быстро до максимума в пределах 2 дней, оставались неизменными в течение приблизительно 15 дней, затем постепенно уменьшались. Исходный диаметр цилиндра не влиял на характеристику набухания. Для цилиндра 20% PEG длина уменьшалась на 10% за один день и выравнивалась, тогда как диаметр и поглощение воды постепенно увеличивались со временем. Поскольку большее количество PEG в сополимере поглощало больше воды для облегчения диффузии паклитаксела, наблюдали более быстрое высвобождение (фигура 27).
Деструкцию молекулярной массы сополимера пасты PDLLA-PEG-PDLLA наблюдали при помощи ГПХ. Для цилиндра 20% PEG объем элюции в положении пика увеличивался со временем, свидетельствуя об уменьшенной молекулярной массе полимера в ходе эксперимента по высвобождению (фигура 30). Двухфазное молекулярно-массовое распределение наблюдали на 69-й день. Молекулярная масса полимера уменьшалась также для цилиндров 30% PEG (1 мм и 0,65 мм). Однако двухфазное распределение не наблюдалось.
Спектры ЯМР выявили пик PEG при 3,6 м.д. и пики PDLLA при 1,65 м.д. и 5,1 м.д. Площадь пика PEG относительно PDLLA в сополимере уменьшалась значимо после 69 дней (фигура 29), свидетельствуя о растворении PEG после его диссоциации от PDLLA. Потерю сухой массы цилиндров также регистрировали (фигура 29), и она показывает уменьшение скорости деструкции в последовательности 30% PEG-0,65 мм>30% PEG-1 мм>20% PEG-1 мм.
Морфологические изменения высушенных цилиндров до и во время высвобождения паклитаксела наблюдали при помощи СЭМ (фигура 31). Вкратце, твердые кристаллы паклитаксела и непористые полимерные матриксы наблюдали перед высвобождением (фигуры 31А и 31В). После 69 дней высвобождения не наблюдали кристаллов паклитаксела и матриксы содержали много пор из-за деструкции полимера и поглощения воды (фигуры 31С и 31D).
Цилиндры 30% PEG обнаруживали сильное набухание после всего лишь двух дней в воде (фигура 28) и, следовательно, торможение диффузии отсоединившегося водорастворимого блока PEG и деградированного PDLLA (т.е. олигомеров DL-молочной кислоты) уменьшалось. Поскольку потеря массы и деструкция цилиндров 30% PEG были непрерывными, вклад эрозионного высвобождения постепенно увеличивался, приводя к замедленному высвобождению паклитаксела без какого-либо резкого изменения (фигура 27). Для цилиндров 20% PEG набухание было исходно низким (фигура 28), приводя к медленной диффузии продуктов деструкции. Таким образом, продукты деструкции на внутреннем участке первоначально удерживались, тогда как меньше продуктов деструкции было в наружном участке вследствие короткого пути диффузии. Эти продукты деструкции ускоряли скорость деструкции, так как концевые карбоксильные группы этих олигомеров катализировали гидролитическую деструкцию. Это приводило к более высокомолекулярной оболочке и к низкомолекулярной внутренней части, как показано двухфазным молекулярно-массовым распределением сополимера (фигура 30, 69-й день). Поскольку разрыв оболочки зависел от таких факторов, как прочность, толщина и дефекты этой оболочки и продуктов деструкции внутренней части, возникновение и степень потери продуктов деструкции внутренней части были очень изменчивыми. Поскольку разрыв оболочки не был стойким и лекарственное средство в этом полимере не было микроскопически гомогенным, временная точка для высвобождения в виде выброса и степень этого выброса были различными для 4 тестированных проб (фигура 27).
Высвобождение паклитаксела из смесей PDLLA и PCL и чистого PCL показаны на фигуре 32. Вкратце, высвобождаемая фракция увеличивалась с увеличением содержания PDLLA в этой смеси. Например, в пределах 10 дней высвобожденный паклитаксел из смесей 80:20, 70:30 и 0:100 PDLLA:PCL составлял 17%, 11% и 6%, соответственно. После первоначального выброса в первый день было получено приблизительно постоянное высвобождение из пасты 80:20 PDLLA:PCL. He наблюдали значимой степени набухания во время высвобождения. Для смесей PDLLA:PCL, поскольку PDLLA имеет очень низкую молекулярную массу примерно 800, он гидролизовался быстро до водорастворимых продуктов без длительной задержки в потере массы. PCL служил в качестве "удерживающего" материала, предохраняя эту пасту от быстрого разрушения. Следовательно, скорость высвобождения увеличивалась с увеличением содержания PDLLA в этой смеси вследствие усиленной деструкции. Непрерывная эрозия PDLLA регулировала высвобождение паклитаксела и приводила к постоянному высвобождению. Высвобождение паклитаксела из чистого PCL, возможно, регулировалось диффузией вследствие низкой скорости деструкции (1-2 года) PCL.
Трудности были обнаружены в исследовании высвобождения для нагруженной 20% паклитакселом пасты 90:10 PDLLA:PCL вследствие разрушения шарика пасты за 24 часа инкубирования. Вкратце, во время первых 12 часов инкубирования брали пробы каждый час для гарантии условий оседания для высвобождения паклитаксела. Высвобожденный паклитаксел из пасты 90:10 составлял 25-35% в пределах 10 часов.
Паста 90:10 PDLLA: PCL, содержащая 30% паклитаксел, высвобождала больше паклитаксела, чем паста 90:10 PDLLA:PCL, содержащая 20% паклитаксел. Таким образом, модулирование скорости высвобождения паклитаксела, которая регулируется свойствами полимера и химиотерапевтическими агентами, а также местом введения, было важным в разработке местной терапии.
ПРИМЕР 21
ПОЛУЧЕНИЕ ПОЛИМЕРНЫХ КОМПОЗИЦИЙ, СОДЕРЖАЩИХ
ВОДОРАСТВОРИМЫЕ ДОБАВКИ И ПАКЛИТАКСЕЛ
А. Приготовление полимерных композиций
Получали микрочастицы сопреципитатов паклитаксела/добавки и затем добавляли к PCL с получением паст. Вкратце, паклитаксел (100 мг) растворяли в 0,5 мл этанола (95%) и смешивали с добавкой (100 мг), предварительно растворенной или диспергированной в 1,0 мл дистиллированной воды. Смесь растирали до получения гладкой пасты. Эту пасту распределяли на чашке Петри и сушили на воздухе в течение ночи при 37°С. Высушенную массу измельчали в порошок при помощи ступки и пестика и пропускали через сито с меш №140 (106 мкм) (Endecotts Test Sieves Ltd, London, England). Затем эти микрочастицы (40%) включали в расплавленный PCL (60%) при 65°С, что соответствует 20% нагрузке паклитаксела. Добавками, использованными в этом исследовании, были желатин (Типа В, 100 bloom. Fisher Scientific), метилцеллюлоза (British Drug Houses), декстран, Т500 (Pharmacia, Sweden), альбумин (Fisher Scientific) и хлорид натрия (Fisher Scientific). Микрочастицы паклитаксела и желатина или альбумина готовили, как описано выше, но их пропускали через сито с меш №60 (270 мкм) (Endecotts Test Sieves Ltd, London, England) для оценки влияния размера частиц на высвобождение паклитаксела из пасты. Также готовили пасты, содержащие 10, 20 или 30% желатин и 20% паклитаксел в PCL для исследования влияния доли добавки на высвобождение лекарственного средства. Если нет иных указаний, пасты, содержащие 20% паклитаксел, диспергированный в PCL, готовили для использования в качестве контролей для исследований скорости высвобождения.
В. Исследования высвобождения лекарственного средства
Гранулу приблизительно 2,5 мг нагруженной паклитакселом пасты суспендировали в 50 мл 10 мМ ЗФР (рН 7,4) в закрытых завинчивающихся крышками пробирках. Пробирки переворачивали от конца к концу при 37°С и при определенных интервалах времени 49,5 мл супернатант удаляли, фильтровали через мембранный фильтр 0,45 мкм и сохраняли для анализа паклитаксела. Равный объем ЗФР добавляли в каждую пробирку для поддержания условий оседания во всем исследовании. Для анализа фильтраты экстрагировали 3×1 мл дихлорметана (ДХМ), экстракты ДХМ выпаривали досуха под током азота и повторно растворяли в 1 мл ацетонитрила. Анализ проводили при помощи ВЖХ с использованием в качестве подвижной фазы смеси вода:метанол:ацетонитрил (37:5:58) при скорости тока 1 мл/мин. (Beckman Isocratic Pump), обращенно-фазовой колонки С18 (Beckman) и УФ-детектирования (Shimadzu SPD А) при 232 нм.
С. Исследования набухания
Пасты паклитаксел/добавка/PCL, приготовленные с применением микрочастиц паклитаксел/добавка с размером меш №140 (и №60 только для желатина), экструдировали с образованием цилиндров, нарезали кусочками, взвешивали и диаметр и длину каждого кусочка измеряли при помощи микрометра (Mitutoyo Digimatic). Кусочки суспендировали в дистиллированной воде (10 мл) при 37°С и при заданных интервалах воду удаляли и диаметр и длину цилиндрических кусочков измеряли и пробы взвешивали. Морфологию проб (до и после суспендирования в воде) исследовали при помощи сканирующей электронной микроскопии (СЭМ) (Hitachi F-2300). Пробы покрывали 60% Au и 40% Pd (толщина 10-15 нм) при помощи прибора Хаммера (Technics, USA).
D. Исследования с использованием хориоаллантоисной мембраны куриного зародыша (САМ)
Оплодотворенные зародыши домашних кур инкубировали в течение 4 дней перед культивированием без скорлупы. Содержимое яйца инкубировали при 90% относительной влажности и 3% СO2 и на 6-й день инкубации кусочки нагруженной паклитакселом пасты весом 1 мг (содержащей 6% паклитаксел, 24% желатин и 70% PCL) или контрольные пасты (30% желатин в PCL) помещали непосредственно на поверхность САМ. После 2-дневного экспонирования сосудистую сеть исследовали при помощи стереомикроскопа, соединенного с видеокамерой; затем видеосигналы отображали на компьютер и видеосигналы изображения регистрировали с использованием системы анализа изображения.
Е. Результаты и обсуждение
Микрочастицы соосажденных паклитаксела и желатина или альбумина были твердыми и хрупкими и легко включались в PCL, тогда как другие добавки производили мягкие частицы, которые проявляли тенденцию распадаться во время приготовления пасты.
Фигура 33 показывает временной ход высвобождения паклитаксела из паст, содержащих 20% паклитаксел в PCL или 20% паклитаксел, 20% добавку и 60% PCL. Высвобождение паклитаксела из PCL с добавками или без добавок имело двухфазную картину высвобождения; сначала была более быстрая скорость высвобождения с последующим более медленным высвобождением лекарственного средства. Авторы предполагают, что первоначальный период более быстрой скорости высвобождения из этих паст обусловлен растворением паклитаксела, локализованного на поверхности, или диффузией паклитаксела из поверхностных областей пасты. Последующая более медленная фаза профилей высвобождения может быть связана с уменьшением эффективной площади поверхности частиц лекарственного средства в контакте с буфером, медленным вхождением буфера в полимерный матрикс или увеличением средних путей диффузии лекарственного средства через полимерный матрикс.
Обе фазы профилей высвобождения паклитаксела из PCL увеличивались в присутствии гидрофильных добавок, причем желатин, альбумин и метилцеллюлоза производили самое сильное увеличение скоростей высвобождения лекарственного средства (фигура 33). Дополнительные увеличения в скорости высвобождения паклитаксела из полимерного матрикса были в том случае, когда более крупные частицы паклитаксел-добавка (270 мкм) использовали для приготовления пасты, в сравнении со случаями, когда использовали меньшие частицы паклитаксел-добавка (106 мкм) (фигура 34). Увеличения в количестве добавки (например, желатина) производили соответствующее увеличение в высвобождении лекарственного средства (фигура 34). Фигура 35А показывает характеристику набухания паст, содержащих 20% паклитаксел, 20% добавку и 60% PCL. Скорость набухания следовала следующему порядку: желатин > альбумин > метилцеллюлоза > декстран > хлорид натрия. Кроме того, скорость набухания увеличивалась, когда более высокую долю водорастворимого полимера добавляли к пасте (фигура 35В). Пасты, содержащие желатин или альбумин, набухали быстро в пределах первых 8-10 часов и затем скорость набухания уменьшалась, когда изменение объема пробы было более 40%. Паста, приготовленная с использованием более крупных (270 мкм) частиц паклитаксел-желатин, набухала при более высокой скорости, чем пасты, приготовленные с меньшими (106 мкм) частицами паклитаксел-желатин. Все пасты распадались, когда объем увеличивался больше, чем на 50%. Исследования с применением СЭМ показали, что набухание паст сопровождалось растрескиванием матрикса (фигура 36). При высоких увеличениях (фигуры 36С и 36D) были видны кристаллы паклитаксела в форме игл или палочек на поверхности пасты и в тесной связи с желатином после набухания (фигуры 36С и 36D).
Осмотические или набухаемые гидрофильные агенты, погруженные в виде дискретных частиц в гидрофобный полимер, приводили к высвобождению лекарственного средства сочетанием эрозии матрикса, диффузии лекарственного средства через полимерный матрикс и/или диффузии и/или конвекционного потока через поры, образованные в матриксе растворением водорастворимых добавок. Осмотические агенты или набухаемые полимеры, диспергированные в гидрофобном полимере, будут впитывать воду (действуя в качестве капиллярных агентов), растворяться или набухать и оказывать тургорное давление, которое могло бы разрывать перегородку (полимерный слой) между соседними частицами, создавая микроканалы и, следовательно, облегчая выход молекул лекарственного средства в окружающую среду посредством диффузии или конвекционного тока. Набухание и растрескивание матрикса пасты (фигура 36), вероятно, приводило к образованию микроканалов через внутреннюю часть матрикса. Различные скорости и степень набухания полимеров (фигура 35) могут быть причиной различий в наблюдаемых скоростях высвобождения паклитаксела (фигуры 33 и 34).
Фигура 37 показывает САМ, обработанные контрольной пастой желатин-PCL (фигура 37А) и пастой 20% паклитаксел-желатин-PCL (фигура 37В). Паста на поверхности САМ показана стрелками на фигурах. САМ с контрольной пастой показывает нормальную архитектуру капиллярной сети. САМ, обработанные пастой паклитаксел-PCL, стойко показывали регресс сосудистой сети и зоны, не имеющие капиллярной сосудистой сети. Включение добавок в пасту заметно увеличивало диаметр бессосудистой зоны (фигура 37).
Это исследование показало, что высвобождение in vitro паклитаксела из PCL могло быть увеличено включением микрочастиц, состоящих из паклитаксела/гидрофильного полимера, в матрикс PCL. Исследования in vivo, оценивающие эффективность композиции в лечении подкожных опухолей у мышей, также показали, что паста паклитаксел/желатин/PCL значимо уменьшала массу опухолей. Было показано, что такие факторы как водорастворимый агент, размер микрочастиц и доля добавок влияют на характеристики высвобождения лекарственного средства.
ПРИМЕР 22
ПРОЦЕДУРА ПРИГОТОВЛЕНИЯ НАНОПАСТЫ
Нанопаста представляет собой суспензию микросфер в гидрофильном геле. В одном аспекте данного изобретения гель или паста могут быть намазаны на ткань как способ помещения нагруженных лекарственным средством микросфер вблизи ткани-мишени. Имея в своей основе воду, паста быстро становится растворенной в жидкостях тела, вызывая уменьшение липкости пасты и тенденцию микросфер располагаться на ближайшей ткани. Пул инкапсулированного в микросферах лекарственного средства в результате помещается вблизи ткани-мишени.
Реагенты и оборудование, которое использовали в этих экспериментах, включают в себя стеклянные химические стаканы, Carbopol 925 (фармацевтической чистоты, Goodyear Chemical Co.), дистиллированную воду, гидроксид натрия (1 М) в виде водного раствора, раствор гидроксида натрия (5 М) в виде водного раствора, микросферы в диапазоне размеров 0,1-3 лм, суспендированные в воде при 20% м/об (см. выше).
1. ПРИГОТОВЛЕНИЕ 5% м/об ГЕЛЯ КАРБОПОЛА
Достаточное количество карбопола добавляли к 1 М гидроксиду натрия с получением 5% м/об раствора. Для растворения карбопола в 1 М гидроксиде натрия смеси давали стоять в течение приблизительно одного часа. Во время этого периода времени смесь перемешивали и после одного часа рН доводили до 7,4 при помощи 5 М гидроксида натрия до полного растворения карбопола. По достижении рН 7,4 гель накрывали и давали ему стоять в течение 2-3 часов.
2. ПРОЦЕДУРА ПРИГОТОВЛЕНИЯ НАНОПАСТЫ
Достаточное количество микросфер 0,1-3 мкм добавляли к воде с получением 20% суспензии микросфер. Гель карбопола (8 мл 5% м/об) помещали в стеклянный химический стакан и добавляли 2 мл 20% суспензии микросфер. Смесь перемешивали для основательного диспергирования микросфер по гелю. Эту смесь хранили при 4°С.
ПРИМЕР 23
КОМПЛЕКСООБРАЗОВАНИЕ ПАКЛИТАКСЕЛА С ЦИКЛОДЕКСТРИНАМИ
А. Материалы
Паклитаксел получали из Hauser Chemicals Inc. (Boulder Drug Colorado). Динатрийфосфат (Fisher), лимонную кислоту (British Drug Houses), гидроксипропил-β-циклодекстрин (HPβCD), γ-циклодекстрин (γ-CD) и гидроксипропил-γ-циклодекстрин (HPγCD) получали из American Maize-Products Company (Hammond, Indiana) и использовали в том виде, в каком они были получены.
В. Способы
1. ИССЛЕДОВАНИЯ РАСТВОРИМОСТИ
Избыточные количества паклитаксела (5 мг) добавляли к водным растворам, содержащим различные концентрации γ-CD, HPγ-CD или HPβ-CD и переворачивали медленно в течение приблизительно 24 часов при 37°С. После уравновешивания аликвоты суспензии фильтровали через мембранный фильтр 0,45 мкм (Millipore), подходящим образом разбавляли и анализировали с применением ВЖХ. Подвижная фаза состояла из ацетонитрила, метанола и воды (58:5:37) при скорости тока 1,0 мл/мин. Растворимость паклитаксела в растворителе, состоящем из 50:50 воды и этанола (95%), содержащем различные концентрации, до 10%, HPβ-CD, также исследовали. Кроме того, профили скоростей растворения паклитаксела исследовали добавлением 2 мг паклитаксела (в таком виде, в каком его получали) к 0, 5, 10 или 20% растворам HPγ-CD или 2 мг предварительно гидратированного паклитаксела (суспендированием в воде в течение 7 дней) к чистой воде и переворачиванием медленно при 37°С. В различные интервалы времени брали аликвоты и анализировали на паклитаксел.
2. ИССЛЕДОВАНИЯ СТАБИЛЬНОСТИ
Растворы, содержащие 20% HPβCD или HPγCD, имели величины рН 3,9 и 5,2, соответственно. Стабильность паклитаксела в растворах циклодекстринов исследовали анализом паклитаксела в растворах (20 мкг/мл), содержащих 10 или 20% HPγ-CD или HPβ-CD, либо в воде, либо в смеси 50:50 вода-этанол при 37°С или 55°С при различных временных интервалах. Кроме того, определяли стабильность паклитаксела в растворах (1 мкг/мл), содержащих 1%, 2% или 5% HPβCD, при 55°С.
С. Результаты
1. ИССЛЕДОВАНИЯ РАСТВОРИМОСТИ
Растворимость паклитаксела увеличивалась на всем исследованном диапазоне концентраций CD; при этом HPβ-CD давал наибольшее увеличение растворимости паклитаксела (фигура 38). Форма кривых растворимости предполагает, что стехиометрии были более высокого порядка, чем комплекс 1:1. Паклитаксел образовал кривые типа Ар как с HPβ-CD, так и с HPγ-CD и кривые типа ANСγ-CD. Растворимость паклитаксела в 50% растворе HPβCD в воде была 3,2 мг/мл при 37°С, что представляло собой примерно 2000-кратное увеличение относительно растворимости паклитаксела в воде. Оцененные константы устойчивости (из фигуры 39) для комплексов первого порядка паклитаксел-циклодекстрины были 3,1, 5,8 и 7,2 М-1 для γCD, HPγCD и HPβCD и константы устойчивости для комплексов второго порядка были 0,785×103, 1,886×103 и 7,965×103 М-1 для γCD, HPγCD и HPβCD, соответственно. Величины наблюдаемой стабильности предполагают, что комплексы включения, образованные паклитакселом с циклодекстринами, были преимущественно комплексами второго порядка.
Растворимость паклитаксела в смеси 50:50 вода-этанол увеличивалась с увеличением концентрации циклодекстринов (фигура 40) при наблюдении комплексообразования в чистой воде. Видимая константа устойчивости для комплексообразования паклитаксела и HPβ-CD в присутствии 50% этанола (26,57 М-1) была значительно более низкой (приблизительно в 300 раз), чем константа устойчивости в отсутствие этанола. Более низкая константа устойчивости может быть отнесена к изменению диэлектрической проницаемости или полярности растворителя в присутствии этанола.
Профили диффузии паклитаксела в 0, 5, 10 и 20% растворах γ-cd (фигура 41) иллюстрируют образование метастабильного раствора паклитаксела в чистой воде или в растворах циклодекстринов; количество паклитаксела в растворе постепенно увеличивалось, достигало максимума и затем уменьшалось. Исследования растворения с применением проб паклитаксела, которые были предварительно гидратированы суспендированием в воде в течение 48 часов, не показали образования метастабильного раствора. Кроме того, ДСК-анализ гидратированного паклитаксела (высушенного в вакуумном термостате при комнатной температуре) показал два широких эндотермических пика между 60 и 110°С. Эти пики сопровождались примерно 4,5% потерей веса (определенной термогравиметрическим анализом), что указывает на присутствие гидрата (гидратов). Потеря веса примерно 2,1% предполагала бы образование моногидрата паклитаксела. Таким образом, появление пиков ДСК между 60°С и 110°С и потеря веса примерно 4,5% предполагают присутствие дигидрата. Для проб паклитаксела в таком виде, в каком он был получен, не было эндотермического пика (пиков) между 60°С и 110°С (результаты ДСК) или потери веса (результаты ТГА). Таким образом, паклитаксел (в том виде, в каком он был получен) был безводным и при суспендировании в воде растворялся с образованием перенасыщенного раствора, который перекристаллизовывался в виде гидрата с более низкой растворимостью (фигура 41).
2. ИССЛЕДОВАНИЯ СТАБИЛЬНОСТИ
Деструкция паклитаксела зависела от концентрации циклодекстрина и имела кинетику деструкции псевдопервого порядка (например, фигура 42). Скорость деструкции паклитаксела в растворах (1 мкг/мл паклитаксел), содержащих 1% HPβ-CD, при 55°С выше (k=3,38×10-3 ч-1), чем при более высоких концентрациях циклодекстрина. Константы скорости деструкции 1,78×10-3 ч-1 и 0,96×10-3 ч-1 наблюдали для паклитаксела в 10% HPβ-CD и HPγ-CD, соответственно. Растворы паклитаксела (1 мкг/мл), содержащие 2, 4, 6 или 8% HPβ-CD, не показали какого-либо значимого различия в скорости деструкции в сравнении с полученными с растворами 10 или 20% HPβ-CD (20 мкг/мл). Присутствие этанола не оказывало вредного действия на устойчивость паклитаксела в растворах циклодекстринов.
D. Вывод
Это исследование показало, что растворимость паклитаксела может быть увеличена комплексообразованием с циклодекстринами. Эти циклодекстриновые композиции на основе воды могут быть использованы в лечении различных воспалительных заболеваний.
ПРИМЕР 24
ПОЛИМЕРНЫЕ КОМПОЗИЦИИ С УВЕЛИЧЕННЫМИ КОНЦЕНТРАЦИЯМИ
ПАКЛИТАКСЕЛА
PDLLA-MePEG и PDLLA-PEG-PDLLA являются блок-сополимерами с гидрофобной (PDLLA) и гидрофильными (PEG или Me PEG) областями. При подходящих молекулярных массах и химическом составе они могут образовывать очень маленькие агрегаты гидрофобного ядра PDLLA и гидрофильной оболочки MePEG. Паклитаксел может быть загружен в гидрофобное ядро, что обеспечивает паклитаксел с увеличенной "растворимостью".
А. Материалы
D, L-лактид покупали у Aldrich, октоат олова, поли(этиленгликоль) (мол. масса 8000), MePEG (мол. масса 2000 и 5000) были из Sigma. MePEG (мол. масса 750) получали из Union Carbide. Сополимеры синтезировали процедурой полимеризации с раскрытием кольца с использованием октоата олова в качестве катализатора (Deng et al., J. Polym. Sci., Polym, Lett. 28: 411-416, 1990; Cohn et al., J. Biomed, Mater. Res. 22: 993-1009, 1988).
Для синтеза PDLLA-MePEG смесь DL-лактид/МеРЕG/октоат олова добавляли в стеклянную ампулу на 10 миллилитров. Ампулу подсоединяли к вакууму и запаивали на пламени. Полимеризации проводили инкубированием ампулы в масляной бане на 150°С в течение 3 часов. Для синтеза PDLLA-PEG-PDLLA смесь D, L-лактид/РЕG/октоат олова переносили в стеклянную колбу, герметизировали резиновой пробкой и нагревали в течение 3 часов в термостате на 150°С. Исходные составы сополимеров даны в таблицах 1 и 2. Во всех случаях количество октоата олова было 0,5-0,7%.
В. Способы
Полимеры растворяли в ацетонитриле и центрифугировали при 10000 g в течение 5 минут для удаления нерастворимых примесей. Затем раствор паклитаксела в ацетонитриле добавляли к каждому раствору полимера с получением 10 мас.% раствора паклитаксела (паклитаксел + полимер). Затем растворитель ацетонитрил удаляли с получением прозрачного матрикса паклитаксел/ PDLLA-MePEG в токе азота и при нагревании при 60°С. Добавляли дистиллированную воду, 0,9% солевой раствор NaCl или 5% декстрозу при весе, в 4 раза превышающем вес матрикса. Наконец, этот матрикс "растворяли" смешиванием при помощи вортекса и периодического нагревания при 60°С. Во всех случаях получали прозрачные растворы. Размеры частиц были ниже 50 нм, как определено в классификаторе субмикронных частиц (NICOMP Model 270). Составы представлены в таблице 9.
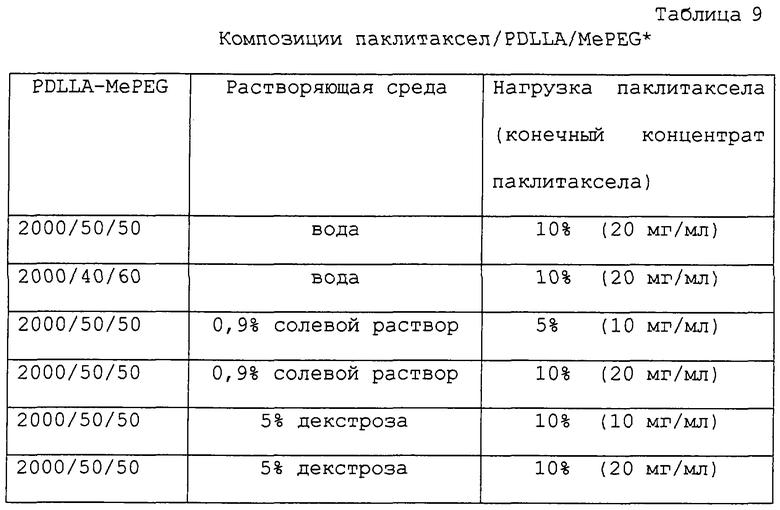
В случае PDLLA-PEG-PDLLA (таблица 10), поскольку сополимеры не могут растворяться в воде, паклитаксел и полимер совместно растворяли в ацетоне. Воду или смесь вода/ацетон постепенно добавляли к этому раствору паклитаксел-полимер для индуцирования образования сфер паклитаксел/полимер.

С. Результаты
Многие композиции PDLLA-MePEG образуют прозрачные растворы в воде, 0,9% солевом растворе или 5% декстрозе, что указывает на образование крошечных агрегатов в диапазоне манометров. Паклитаксел успешно загружали в мицеллы PDLLA-MePEG. Например, при % нагрузке (это означает 10 мг паклитаксела в 1 мл пaклитaкceл/PDLLA-MePEG/вoднaя система) получали прозрачный раствор из 2000-50/50 и 2000-40/60. Размер частиц был примерно 60 нм.
ПРИМЕР 25
ПРОЦЕДУРА ДЛЯ ПРИГОТОВЛЕНИЯ ПЛЕНКИ
Термин пленка относится к полимеру, образованному в виде одной из многих геометрических форм. Пленка может быть тонким эластичным листом полимера или диском полимера толщиной 2 мм, каждый из которых может быть нанесен на поверхность ткани для предотвращения последующего образования рубцов или спайкообразования. Эта пленка может быть изготовлена для помещения на обнаженную ткань таким образом, чтобы инкапсулированное лекарственное средство могло высвобождаться из полимера в течение продолжительного периода времени в этом участке ткани. Пленки могут быть изготовлены различными способами, в том числе, например, отливкой или распылением.
В способе отливки полимер либо расплавляли, либо выливали в форму или растворяли в дихлорметане и выливали в форму. Затем полимер либо отверждали при охлаждении, либо отверждали выпариванием растворителя, соответственно. В способе распыления полимер растворяли в растворителе и напыляли на стекло и при выпаривании растворителя полимер отверждался на стекле. Повторяемое напыление позволяло получить полимер в виде пленки, которую можно было снять со стекла.
Реагенты и оборудование, которые использовали в этих экспериментах, включают в себя небольшой химический стакан, смеситель с горячей пластиной Корнинга, формы для заливки (например, крышки центрифужных пробирок на 50 мл) и устройство для держания форм, стеклянный сцинтилляционный флакон на 20 мл с крышкой (Plastic insert type), TCX-распылитель, резервуар с газообразным азотом, поликапролактон ("PCL" - молекулярная масса 10000-20000; Polysciences), паклитаксел (Sigma 95% чистоты), этанол, "промытый" (см. выше) этиленвинилацетат ("EVA"), поли(DL)молочную кислоту ("PLA" - молекулярная масса 15000-25000; Polysciences), ДХМ (ВЖХ-чистоты; Fisher Scientific).
1. ПРОЦЕДУРА ИЗГОТОВЛЕНИЯ ПЛЕНОК - ЛИТЬЕ РАСПЛАВА
Небольшой стеклянный химический стакан с известной навеской PCL помещали в больший химический стакан, содержащий воду (действующий в качестве водяной бани), и помещали на горячую пластину при 70°С и выдерживали на ней до полного расплавления полимера. К расплавленному полимеру добавляли известную навеску лекарственного средства и смесь основательно перемешивали. Расплавленный полимер выливали в форму и давали ему остыть.
2. ПРОЦЕДУРА ИЗГОТОВЛЕНИЯ ПЛЕНОК - ЛИТЬЕ РАСТВОРИТЕЛЯ
Известную навеску PCL взвешивали непосредственно в стеклянный сцинтилляционный флакон на 20 мл и добавляли достаточное количество ДХМ для получения 10% м/об раствора. Раствор перемешивали с последующим добавлением достаточного количества паклитаксела для получения желаемой конечной концентрации паклитаксела. Раствор перемешивали вортексом для растворения паклитаксела, давая ему стоять в течение одного часа (для уменьшения присутствия воздушных пузырьков), и затем медленно выливали в форму. Форму помещали в вытяжной шкаф на ночь для испарения ДХМ.
3. ПРОЦЕДУРА ИЗГОТОВЛЕНИЯ ПЛЕНОК – НАПЫЛЕНИЕ
Достаточное количество полимера взвешивали непосредственно в стеклянный сцинтилляционный флакон на 20 мл и добавляли достаточное количество ДХМ для получения 2% м/об раствора. Раствор перемешивали для растворения полимера. С применением автоматической пипетки подходящий объем (минимально 5 мл) 2% раствора полимера переносили в другой стеклянный сцинтилляционный флакон на 20 мл. К раствору добавляли достаточное количество паклитаксела и растворяли встряхиванием закрытого крышкой флакона. Для подготовки к распылению крышку флакона удаляли и цилиндр ТСХ-распылителя погружали в раствор полимера.
Резервуар с азотом подсоединяли к входному отверстию для газа распылителя и давление постепенно увеличивали до тех пор, пока не начинались атомизация и распыление. Формы напыляли с использованием 5-секундных осцилляционных напылений с временем сушки 15 секунд между напылениями. Напыление продолжали, пока на форме не создавалась подходящая толщина полимера.
ПРИМЕР 26
НАГРУЖЕННЫЕ ТЕРАПЕВТИЧЕСКИМ АГЕНТОМ ПОЛИМЕРНЫЕ ПЛЕНКИ, СОСТОЯЩИЕ ИЗ ЭТИЛЕНВИНИЛАЦЕТАТА И ПОВЕРХНОСТНО-АКТИВНОГО ВЕЩЕСТВА
В этом примере исследовали два типа пленок: пленки чистого EVA, нагруженные паклитакселом, и пленки из смесей EVA/поверхностно-активное вещество, нагруженные паклитакселом.
Испытанными поверхностно-активными веществами были два гидрофобных поверхностно-активных вещества (Span 80 и плуроник L101) и одно гидрофильное поверхностно-активное вещество (плуроник F127). Поверхностно-активные вещества типа плуроника сами являются полимерами, что было привлекательным, поскольку они могут смешиваться с EVA для оптимизации свойств доставки различных лекарственных средств. Span 80 является меньшей молекулой, которая диспергируется в полимерном матриксе и не образует смеси.
Поверхностно-активные вещества применимы в модулировании скоростей высвобождения паклитаксела из пленок и оптимизации некоторых физических параметров пленок. Один аспект смешанных с поверхностно-активным веществом пленок, указывающий на то, что скорости высвобождения лекарственного средства могут регулироваться, состоял в способности изменять скорость и степень, с которой соединение набухало в воде. Диффузия воды в матрикс полимер-лекарственное средство было критическим для высвобождения лекарственного средства из носителя. Фигуры 43С и 43D показывают степень набухания этих пленок, когда уровень поверхностно-активного вещества в смеси изменяли. Чистые EVA-пленки не набухали до какой-либо значимой степени на протяжении 2 месяцев. Однако посредством увеличения уровня поверхностно-активного вещества, добавленного к EVA, можно было увеличить степень набухания соединения и в результате увеличения гидрофильности набухание увеличивалось.
Результаты экспериментов с этими пленками приведены ниже в фигурах 43А-Е. Вкратце, фигура 43А показывает высвобождение паклитаксела (в мг) на протяжении времени из чистых EVA-пленок. Фигура 43В показывает процент лекарственного средства, остающегося в тех же самых пленках. Как можно видеть из этих двух фигур, при увеличении нагрузки паклитаксела (т.е. увеличения процента паклитаксела по весу) скорости высвобождения паклитаксела увеличивались, показывая ожидаемую концентрационную зависимость. При увеличении нагрузки паклитаксела процент паклитаксела, остающегося в пленке, также увеличивался, свидетельствуя о том, что более высокая нагрузка может быть более благоприятной для композиций для долгосрочного высвобождения.
Физическую прочность и эластичность пленок оценивали, и они представлены в фигуре 43Е. Вкратце, фигура 43Е показывает кривые зависимости напряжения от деформации (диаграммы напряжения) для пленок из чистого EVA и пленок из смесей EVA/поверхностно-активное вещество. Эта грубая оценка напряжения показала, что эластичность пленок увеличивается с добавлением плуроника F127 и что прочность на разрыв (напряжение при разрыве) увеличивается зависимым от концентрации образом при добавлении плуроника F127. Эластичность и прочность являются важными соображениями в конструировании пленки, которая должна применяться для конкретных клинических приложений без вызывания перманентной деформации соединения.
Приведенные выше результаты демонстрируют способность некоторых добавок в виде поверхностно-активных веществ регулировать скорости высвобождения лекарственных средств и изменять физические характеристики носителя.
ПРИМЕР 27
ПРОЦЕДУРА ПРИГОТОВЛЕНИЯ НАНОСПРЕЯ
Наноспрей представляет собой суспензию небольших микросфер в солевом растворе. Если микросферы являются очень маленькими (т.е. менее 1 мкм в диаметре), они образуют коллоид, так что суспензия не будет осаждаться под действием гравитационных сил. Как описано более подробно ниже, суспензия микрочастиц 0,1-1 мкм может быть сделана пригодной для аэрозольного помещения непосредственно на ткань во время хирургии (например, по поводу сосудистых спаек) посредством лапроскопического введения или посредством нагнетаемого мануально аэрозоля (например, для местной доставки). Оборудование и материалы, которые использовали для получения наноспрея, включают в себя стакан с водяной рубашкой на 200 мл (Kimax or Pyrex), циркулирующую водяную баню Хааке, вставляемый сверху смеситель и регулятор с диаметром 2 дюйма (мешалка пропеллерного типа из нержавеющей стали с 4 лопастями, Fisher brand), стеклянный стакан на 500 мл, смеситель с горячей пластиной (Corning brand), 4×50 мл полипропиленовые центрифужные пробирки (Nalgene), стеклянные сцинтилляционные флаконы с пластиковыми вставляющимися крышками, настольную центрифугу (Beckman), высокоскоростную центрифугу - напольную модель (JS 21 Beckman), аналитические весы Меттлера (AJ 100, 0,1 мг), цифровые весы с верхней нагрузкой Меттлера (АЕ 163, 0,01 мг), автоматическую пипетку (Gilson), стерильные кончики для пипетки, аэрозоль, подаваемый насосом (Pfeiffer pharmaceuticals) на 20 мл, ламинарный бокс, PCL (молекулярная масса 10000-20000; Polysciences, Warrington, Pennsylvania USA), "промытый" (см. выше) EVA, PLA (молекулярная масса 15000-25000; Polysciences), поливиниловый спирт ("PVA" - молекулярная масса 124000-186000; гидролизованный на 99%; Aldrich Chemical Co., Milwaukee, WI, USA), ДХМ или "метиленхорид"; ВЖХ-чистоты, Fisher Scientific), дистиллированную воду, стерильный солевой раствор (Becton and Dickenson или равноценный).
1. ПРИГОТОВЛЕНИЕ 5% (м/об) РАСТВОРОВ ПОЛИМЕРОВ
В зависимости от приготовляемого раствора полимера взвешивали непосредственно в стеклянный сцинтилляционный флакон на 20 мл: 1,00 г PCL или PLA или 0,50 г каждого из PLA и промытого EVA. При помощи мерного цилиндра добавляли 20 мл ДХМ и флакон прочно закрывали крышкой. Флакону давали стоять при комнатной температуре (25°С) до полного растворения полимера.
2. ПРИГОТОВЛЕНИЕ 3,5% (м/об) ИСХОДНОГО РАСТВОРА PVA
Раствор готовили согласно приведенной ниже процедуре или разбавлением 5% (м/об) исходного раствора PVA, приготовленного для изготовления микросфер (см. пример 28). Вкратце, 17,5 г PVA взвешивали непосредственно в стеклянный химический стакан на 600 мл и добавляли 500 мл дистиллированной воды. Стакан закрывали и помещали в стеклянный стакан на 2000 мл, содержащий 300 мл воды. PVA перемешивали при 300 об/мин, при 85°С до полного растворения.
3. ПРОЦЕДУРА ПОЛУЧЕНИЯ НАНОСПРЕЯ
Вкратце, 100 мл 3,5% раствора PVA помещали в стакан с водяной рубашкой на 200 мл с подсоединенной водяной баней Хааке. Содержимое стакана перемешивали при 3000 об/мин, и 10 мл раствора полимера (использовали раствор полимера на основе типа приготавливаемого наноспрея) погружали в перемешиваемый PVA на 2 минуты при помощи автоматической пипетки на 5 мл. После 3 минут скорость перемешивания доводили до 2500 об/мин (+/- 200 об/мин) и перемешивали в течение 2,5 часов. После 2,5 часов перемешивающие лопасти удаляли из препарата наноспрея и ополаскивали 10 мл дистиллированной воды, давая промывному раствору стекать в препарат наноспрея.
Препарат микросфер выливали в химический стакан на 500 мл. Баню с водяной рубашкой промывали 70 мл дистиллированной воды, давая 70 мл промывного раствора стекать в препарат микросфер. 180 мл препарата микросфер перемешивали стеклянной палочкой и выливали поровну в четыре полипропиленовые центрифужные пробирки на 50 мл, которые центрифугировали при 10000 g (+/- 1000 g) в течение 10 минут. Раствор PVA оттягивали от каждого осадка микросфер и выбрасывали. В каждую центрифужную пробирку добавляли дистиллированную воду (5 мл) и перемешивали вортексом. Четыре суспензии микросфер объединяли в одной центрифужной пробирке при помощи 20 мл дистиллированной воды и центрифугировали в течение 10 минут при 10000 g (+/- 1000 g). Супернатант оттягивали от осадка микросфер и добавляли 40 мл дистиллированной воды и препарат микросфер перемешивали вортексом (этот процесс повторяли 3х). Затем препарат микросфер переносили в предварительно взвешенный стеклянный сцинтилляционный флакон.
Флакону давали стоять в течение 1 часа при комнатной температуре (25°С), чтобы дать микросферам с диаметром 2 мкм и 3 мкм осадиться под действием силы тяжести. После 1 часа верхние 9 мл суспензии оттягивали, помещали в стерильную центрифужную пробирку на 50 мл с крышкой и центрифугировали при 10000 g (+/- 1000 g) в течение 10 минут. Супернатант выбрасывали, а осадок ресуспендировали в 20 мл стерильного солевого раствора центрифугированием суспензии при 10000 g (+/- 1000 g) в течение 10 минут. Супернатант выбрасывали и осадок ресуспендировали в стерильном солевом растворе. Количество солевого раствора зависело от требующейся конечной концентрации (обычно 10% м/об). Эту суспензию наноспрея добавляли в аэрозоль.
ПРИМЕР 28
ПРИГОТОВЛЕНИЕ МИКРОСФЕР
Оборудование, используемое для приготовления микросфер, включает в себя: стакан с водяной рубашкой на 200 мл (Kimax or Pyrex), циркулирующую водяную баню Хааке, вставляемый сверху смеситель и регулятор с диаметром 2 дюйма (мешалка пропеллерного типа из нержавеющей стали с 4 лопастями, Fisher brand), стеклянный стакан на 500 мл, смеситель с горячей пластиной (Corning brand), 4×50 мл полипропиленовые центрифужные пробирки (Nalgene), стеклянные сцинтилляционные флаконы с пластиковыми вставляющимися крышками, настольную центрифугу (GPR Beckman), высокоскоростную центрифугу - напольную модель (JS 21 Beckman), аналитические весы Меттлера (AJ 100, 0,1 мг), цифровые весы с верхней нагрузкой Меттлера (АЕ 163, 0,01 мг), автоматическую пипетку (Gilson). Реагенты включают в себя PCL (молекулярная масса 10000-20000; Polysciences, Warrington, Pennsylvania USA), "промытый" (см. способ промывания ниже) EVA, PLA (молекулярная масса 15000-25000; Polysciences), поливиниловый спирт ("PVA" - молекулярная масса 124000-186000; гидролизованный на 99%; Aldrich Chemical Co., Milwaukee, WI, USA), ДХМ или "метиленхорид"; ВЖХ-чистоты, Fisher Scientific) и дистиллированную воду.
А. Приготовление 5% (м/об) растворов полимеров
DCL (1,00 г) или PLA или 0,50 г каждого из PLA и промытого EVA взвешивали непосредственно в стеклянный сцинтилляционный флакон на 20 мл. Затем добавляли двадцать миллилитров ДХМ. Флакон закрывали крышкой и хранили при комнатной температуре (25°С) в течение одного часа (может быть применено периодическое встряхивание) или до полного растворения всего полимера. Раствор может храниться при комнатной температуре в течение, по меньшей мере, двух недель.
В. Приготовление 5% (м/об) исходного раствора PVA
Двадцать пять граммов PVA взвешивали непосредственно в стеклянный химический стакан на 600 мл и добавляли 500 мл дистиллированной воды, вместе с покрытым тефлоном стержнем для перемешивания размером 3 дюйма. Стакан закрывали стеклом и помещали в стеклянный стакан на 2000 мл, содержащий 300 мл воды. PVA перемешивали при 300 об/мин, при 85°С (смеситель с горячей пластиной Корнинга) в течение 2 часов или до полного растворения. Растворение PVA определяли визуальным контролем; раствор должен быть прозрачным. Затем раствор переносили в стеклянный контейнер для хранения с завинчивающейся крышкой и хранили при 4°С максимально в течение двух месяцев. Однако раствор должен быть нагрет до комнатной температуры перед использованием или разбавлением.
С. Процедура приготовления микросфер
На основании размера приготовляемых микросфер (см. таблицу 1) 100 мл раствора PVA (концентрации приведены в таблице 1) помещали в химический стакан с водяной рубашкой на 200 мл. Циркулирующую водяную баню Хааке подсоединяли к этому химическому стакану и содержимому давали уравновеситься при 27°С (+/-1°С) в течение 10 минут. На основании размера приготовляемых микросфер (см. таблицу 1) устанавливали исходную скорость верхней мешалки и лопасти верхней мешалки помещали в середине раствора PVA. Затем мешалку запускали и 10 мл раствора полимера (использовали раствор полимера на основании типа приготовляемых микросфер) погружали в перемешиваемый раствор PVA на 2 минуты при помощи автоматической пипетки на 5 мл. После 3 минут скорость перемешивания корректировали (см. таблицу 1) и раствор перемешивали еще в течение 2,5 часов. Затем перемешивающий лопастной нож удаляли из препарата микросфер и промывали 10 мл дистиллированной воды, давая промывному раствору стекать в препарат микросфер. Затем препарат микросфер выливали в химический стакан на 500 мл и баню с водяной рубашкой промывали 70 мл дистиллированной воды, давая промывному раствору также стекать в препарат микросфер. Затем 180 мл препарата микросфер перемешивали стеклянной палочкой и выливали поровну в четыре полипропиленовые центрифужные пробирки на 50 мл. Затем пробирки центрифугировали в течение 10 минут (центробежная сила приведена в таблице 11). Сорок пять миллилитров раствора PVA оттягивали от каждого осадка микросфер.
Затем в каждую центрифужную пробирку добавляли пять миллилитров дистиллированной воды и перемешивали вортексом для ресуспендирования микросфер. Затем четыре суспензии микросфер объединяли в одной центрифужной пробирке вместе с 20 мл дистиллированной воды и центрифугировали еще в течение 10 минут (центробежная сила дана в таблице 1). Этот процесс повторяли еще два раза с получением всего трех промывок. Затем микросферы центрифугировали последний раз и ресуспендировали в 10 мл дистиллированной воды. После конечной промывки препарат микросфер переносили в предварительно взвешенный стеклянный сцинтилляционный флакон. Флакон закрывали крышкой и оставляли на ночь при комнатной температуре (25°С), чтобы дать микросферам осадиться под действием силы тяжести. Так как микросферы, которые попадают в диапазон размеров 0,1-3 мкм, не осаждаются под действием силы тяжести, они оставались в 10 мл суспензии.
D. Сушка микросфер с диаметром 10-30 мкм или 30-100 мкм
После стояния микросфер при комнатной температуре в течение ночи супернатант оттягивали от осажденных микросфер. Микросферам давали высыхать в незакрытом крышкой флаконе с тягой в течение периода одной недели или до их полного высыхания (до постоянного веса флакона). Более быстрое высушивание может быть достигнуто оставлением незакрытого флакона под медленным током азота (ток приблизительно 10 мл/мин) в вытяжном шкафу. После полного высушивания (до постоянного веса флакона) флакон взвешивают и закрывают крышкой. Закрытый подписанный флакон хранят при комнатной температуре в тяге. Микросферы обычно хранят не более 3 месяцев.
Е. Определение концентрации суспензии микросфер с диаметром 0,1-3 мкм
Микросферы этого диапазона размеров не осаждаются, так что они остаются в суспензии при 4°С максимально в течение четырех недель. Для определения концентрации микросфер в 10 мл суспензии пробу 200 мкл этой суспензии помещают пипеткой в предварительно взвешенную микрофужную пробирку на 1,5 мл. Затем пробирку центрифугируют при 10000 g (в настольной центрифуге Эппендорфа), супернатант удаляют и пробирке дают высыхать при 50°С в течение ночи. Затем пробирку повторно взвешивают для определения веса высушенных микросфер в пробирке.
F. Приготовление нагруженных паклитакселом микросфер
Для приготовления содержащих паклитаксел микросфер подходящее количество взвешенного паклитаксела (на основании процента паклитаксела, который должен быть инкапсулирован) помещали непосредственно в стеклянный сцинтилляционный флакон на 20 мл. Затем во флакон, содержащий паклитаксел, добавляли 10 мл раствора подходящего полимера и затем перемешивали вортексом до растворения паклитаксела.
Затем микросферы, содержащие паклитаксел, могут быть приготовлены, как описано в стадиях (С)-(Е).
ПРИМЕР 29
МИКРОСФЕРЫ, ПОКРЫТЫЕ ПОВЕРХНОСТНО-АКТИВНЫМ ВЕЩЕСТВОМ
А. Материалы и способы
Микросферы готовили из поли(DL)молочной кислоты (PLA), полиметилметакрилата (РММА), поликапролактона (PCL) и 50:50 этиленвинилацетат (EVA):PLA по существу, как описано выше.
Кровь человека получали из здоровых волонтеров. Нейтрофилы (лейкоциты) отделяли из крови способами седиментации декстраном и центрифугирования в Ficoll Hypaque. Нейтрофилы центрифугировали при 5 миллионах клеток на мл в ССРХ.
Уровни активации нейтрофилов определяли посредством генерирования молекул реакционноспособного кислорода, определяемого по хемилюминесценции. В частности, хемилюминесценцию определяли при помощи люминометра LKB с 1 мкМ люминола в качестве усилителя. Предварительное покрытие (или опсонизацию) плазмой микросфер проводили суспендированием 10 мг микросфер в 0,5 мл плазмы и переворачиванием при 37°С в течение 30 минут.
Затем микросферы промывали в 1 мл ССРХ и центрифугированный осадок микросфер добавляли к суспензии нейтрофилов при 37°С при времени t=0. Поверхности микросфер модифицировали с применением поверхностно-активного вещества плуроника F127 (BASF) суспендированием 10 мг микросфер в 0,5 мл 2% м/м раствора F127 в ССРХ в течение 30 минут при 37°С. Затем микросферы промывали дважды в 1 мл ССРХ перед добавлением к нейтрофилам или к плазме для дальнейшего предварительного покрытия.
В. Результаты
Фигура 44 показывает, что необработанные микросферы дают величины хемилюминесценции менее 50 мВ. Эти величины представляют низкие уровни активации нейтрофилов. В качестве сравнения, воспалительные микрокристаллы могут давать величины, близкие к 1000 мВ, растворимые химические активаторы могут давать величины, близкие к 5000 мВ. Однако когда микросферы предварительно покрыты плазмой, все величины хемилюминесценции увеличиваются до диапазона 100-300 мВ (фигура 44). Эти уровни реакции нейтрофилов или активации могут рассматриваться как средневоспалительные. РММА давал наивысшую реакцию и мог бы рассматриваться как наиболее воспалительный. PLA и PCL, оба, становились в 3-4 раза более сильными в активации нейтрофилов после предобработки плазмой (или опсонизации), но было небольшое различие между этими двумя полимерами в этом отношении. EVA:PLA, по-видимому, не может использоваться в композициях для ангиогенеза, так как эти микросферы трудно сушить и ресуспендировать в водном буфере. Это действие плазмы называется опсонизацией, и оно приводит к адсорбции антител или молекул комплемента на поверхности. Эти адсорбированные молекулы взаимодействуют с рецепторами лейкоцитов и вызывают усиленную активацию клеток.
Фигуры 45-48 описывают действие предварительного покрытия плазмой PCL, РММА, PLA и EVA:PLA, соответственно, а также показывают действие покрытия плуроником F127 перед предварительным покрытием микросфер плазмой. Все эти фигуры показывают одно и то же действие: (1) предварительное покрытие плазмой усиливает реакцию; (2) предварительное покрытие плуроником F127 не влияет само по себе; (3) усиленная реакция нейтрофилов, вызываемая предварительным покрытием плазмой, может сильно ингибироваться предварительной обработкой поверхности микросфер 2% плуроником F127.
Природу адсорбированных белковых молекул из плазмы исследовали также при помощи электрофореза. С применением этого способа было показано, что предобработка полимерной поверхности плуроником F127 ингибировала адсорбцию антител на полимерной поверхности.
Фигуры 49-52 также показывают действие предварительного покрытия микросфер PCL, РММА, PLA или EVA:PLA (соответственно) либо IgG (2 мг/мл), либо 2% плуроником F127 и затем IgG (2 мг/мл). Как можно видеть из этих фигур, усиленная реакция, вызываемая предварительным покрытием микросфер IgG, могла быть ингибирована обработкой плуроником F127.
Этот результат показывает, что посредством предобработки полимерной последовательности всех четырех типов микросфер плуроником F127 "воспалительная" реакция нейтрофилов на микросферы может быть ингибирована.
ПРИМЕР 30
ИНКАПСУЛИРОВАНИЕ ТЕРАПЕВТИЧЕСКОГО АГЕНТА В МИКРОСФЕРАХ
ПОЛИ(ε-КАПРОЛАКТОНА). ИНГИБИРОВАНИЕ АНГИОГЕНЕЗА В САМ-ТЕСТЕ НАГРУЖЕННЫМИ
ПАКЛИТАКСЕЛОМ МИКРОСФЕРАМИ
Этот пример оценивает профили скоростей высвобождения in vitro паклитаксела из биодеградируемых микросфер поли(ε-капролактона) (PCL) и демонстрирует in vivo антиангиогенную активность паклитаксела, высвобожденного из этих микросфер, при помещении на САМ.
Реагенты, которые использовали в этих экспериментах, включают в себя: PCL (молекулярная масса 35000-45000; купленный в Polusciences (Warrington, PA)), ДХМ из Fisher Scientific Co. Canada; поливиниловый спирт ("PVP" - молекулярная масса 12000-18000, гидролизованный на 99%) из Aldrich Chemical Co. (Milwaukee, Wis.) и паклитаксел из Sigma Chemical Co. (St. Louis, МО). Если нет других указаний, все химикаты и реагенты использовали в том виде, в каком они были поставлены. Во всех случаях использовали дистиллированную воду.
А. Приготовление микросфер
Микросферы готовили по существу, как описано в примере 28, с использованием способа выпаривания растворителя. Вкратце, нагруженные 5% м/м паклитакселом микросферы готовили растворением 10 мг паклитаксела и 190 мг PCL в 2 мл ДХМ с добавлением к 100 мл 1% водного раствора PVP и перемешиванием при 1000 об/мин, при 25°С в течение 2 часов. Суспензии микросфер центрифугировали при 1000×g в течение 10 минут (Beckman GPR), супернатант удаляли и микросферы промывали трижды водой. Промытые микросферы сушили на воздухе в течение ночи и хранили при комнатной температуре. Контрольные микросферы (без паклитаксела) готовили, как описано выше. Также готовили микросферы, содержащие 1% и 2% паклитаксел. Размер микросфер определяли с применением оптического микроскопа с микрометром на столике.
В. Эффективность инкапсулирования
Известную навеску нагруженных лекарственным средством микросфер (примерно 5 мг) растворяли в 8 мл ацетонитрила и добавляли 2 мл дистиллированной воды для осаждения полимера. Смесь центрифугировали при 1000 g в течение 10 минут и количество инкапсулированного паклитаксела рассчитывали из поглощения супернатанта, измеренного в УФ-спектрофотометре (Hewlett-Packard 8452A Diode Array Spectrophotometer) при 232 нм.
С. Исследования высвобождения лекарственного средства
Приблизительно 10 мг нагруженных паклитакселом микросфер суспендировали в 20 мл 10 мМ ЗФР (рН 7,4) в пробирках с завинчивающимися крышками. Пробирки переворачивали от конца к концу при 37°С и при определенных интервалах времени удаляли 19,5 мл супернатанта (после выдерживания микросфер для осаждения на дне), фильтровали через мембранный фильтр 0,45 мкм и сохраняли для анализа на паклитаксел. Равный объем ЗФР добавляли в каждую пробирку для сохранения условий оседания во всем исследовании. Фильтраты экстрагировали 3×1 мл ДХМ, экстракты ДХМ выпаривали досуха под током азота, перерастворяли в 1 мл ацетонитрила и анализировали при помощи ВЖХ с использованием в качестве подвижной фазы смеси вода:метанол:ацетонитрил (37:5:58) при скорости тока 1 мл/мин (Beckman Isocratic pump), обращенно-фазовой колонки С8 (Beckman) и УФ-детектирования (Shimadzu SPD А) при 232 нм.
D. Исследования с применением САМ
Оплодотворенные зародыши домашних кур инкубировали в течение 4 дней перед культивированием без скорлупы. На 6-й день инкубирования аликвоты 1 мг нагруженных 5% паклитакселом или контрольных (не содержащих паклитаксела) микросфер помещали непосредственно на поверхность САМ. После 2-дневной экспозиции сосудистую сеть исследовали при помощи стереомикроскопа с подключенной видеокамерой; затем видеосигналы отображались на компьютере и их информацию собирали с применением системы анализа изображения.
Е. Сканирующая электронная микроскопия
Микросферы помещали на держатели для проб, покрытые напылением золотом, и затем помещали в СЭМ Phillips 501B, работающий при 15 кВ.
F. Результаты
Диапазон размеров проб микросфер был между 30 и 100 мкм, хотя во всех нагруженных паклитакселом или контрольных сериях микросфер некоторые микросферы находились за пределами этого диапазона. Эффективность нагрузки микросфер PCL паклитакселом была всегда выше 95% для всех исследованных нагрузок лекарственного средства. Сканирующая электронная микроскопия показала, что все микросферы были сферическими и многие обнаружили шероховатую или покрытую ямками морфологию поверхности. По-видимому, не было доказательства наличия твердого лекарственного средства на поверхности микросфер.
Временной ход высвобождения паклитаксела из нагруженных 1%, 2% и 5% паклитакселом микросфер PCL представлен на фигуре 53А. Профили скоростей высвобождения были двухфазными. Наблюдалось исходное быстрое высвобождение паклитаксела или "фаза выброса" при всех нагрузках лекарственного средства. Фаза выброса имела место на протяжении 1-2 дней при 1% и 2% нагрузках паклитаксела и на протяжении 3-4 дней для нагруженных 5% паклитакселом микросфер. За начальной фазой быстрого высвобождения следовала фаза значительно более медленного высвобождения лекарственного средства. Для микросфер, содержащих 1% или 2% паклитаксел, не было дополнительного высвобождения лекарственного средства после 21 дня. При 5% нагрузке паклитаксела микросферы высвобождали примерно 20% всего содержания лекарственного средства после 21 дня.
Фигура 53В показывает САМ, обработанные контрольными микросферами PCL, и фигура 53С показывает обработку нагруженными 5% паклитакселом микросферами. САМ с контрольными микросферами обнаружила нормальную архитектуру капиллярной сети. САМ, обработанная микросферами паклитаксел-PCL, показала заметный регресс сосудов и зоны, которые не имели капиллярной сосудистой сети.
G. Обсуждение
Способ выпаривания растворителя при приготовлении нагруженных паклитакселом микросфер давал очень высокие эффективности инкапсулирования 95-100%. Это было обусловлено слабой водорастворимостыо паклитаксела и его гидрофобной природой, благоприятствующими распределению в фазе органического растворителя, содержащей полимер.
Двухфазный профиль высвобождения для паклитаксела был типичной картиной высвобождения для многих лекарственных средств из биодеградируемых полимерных матриксов. Поли(ε-капролактон) является алифатическим полиэфиром, который может разрушаться гидролизом при физиологических условиях, и он является нетоксичным и тканесовместимым. Деструкция PCL является значительно более медленной, чем деструкция хорошо исследованных полимеров и сополимеров молочной и гликолевой кислот, и, следовательно, он является пригодным для конструирования долгосрочных систем доставки лекарственных средств. Считается, что начальная быстрая фаза высвобождения или фаза выброса паклитаксела обусловлена диффузионным высвобождением лекарственного средства из поверхностной области микросфер (близкой к поверхности микросфер). Высвобождение паклитаксела во второй (более медленной) фазе профилей высвобождения не было, по-видимому, обусловлено деструкцией или эрозией PCL, так как исследования показали, что в условиях in vitro в воде не было значимой потери веса или эрозии поверхности PCL на протяжении 7, 5-недельного периода. Более медленная фаза высвобождения паклитаксела была, возможно, обусловлена растворением лекарственного средства в заполненных жидкостью порах в полимерном матриксе и диффузией через эти поры. Более высокая скорость высвобождения при более высокой нагрузке паклитаксела была, возможно, результатом более обильной сети пор в полимерном матриксе.
Было показано, что микросферы паклитаксела с 5% нагрузкой высвобождают достаточное количество лекарственного средства для индуцирования сильного ингибирования ангиогенеза при помещении на САМ. Ингибирование роста кровеносных сосудов приводило к образованию бессосудистой зоны, как показано на фигуре 53С.
ПРИМЕР 31
ПРИГОТОВЛЕНИЕ МИКРОСФЕР PLGA
Микросферы готовили из сополимеров молочной кислоты - гликолевой кислоты (PLGA).
А. Способ
Микросферы готовили в диапазонах размеров 0,5-10 мкм, 10-20 мкм и 30-100 мкм с применением стандартных способов (полимер растворяли в дихлорметане и эмульгировали в растворе поливинилового спирта при перемешивании, как описано ранее в способах приготовления микросфер PCL или PDLLA). Различные соотношения PLLA к GA использовали в качестве полимеров с различными молекулярными массами (представленные в виде характеристической вязкости (I.V.)).
В. Результат
Микросферы были успешно приготовлены из следующих исходных полимеров:

Паклитаксел при 10% или 20% нагрузках успешно включался во все эти микросферы. Примеры распределений размеров для одного исходного полимера (85:15, I.V.=0,56) даны на фигурах 54-57. Эксперименты по высвобождению паклитаксела проводили с применением микросфер различного размера и различных составов. Скорости высвобождения показаны на фигурах 58-61.
ПРИМЕР 32
ИНКАПСУЛИРОВАНИЕ ПАКЛИТАКСЕЛА В НАЙЛОНОВЫХ
МИКРОКАПСУЛАХ
Терапевтические агенты могут быть также инкапсулированы в большом разнообразии носителей, которые могут быть образованы в виде выбранной формы или устройства. Например, как описано более подробно ниже, паклитаксел может быть включен в найлоновые микрокапсулы, которые могут быть приготовлены в виде искусственных клапанов сердца, сосудистых трансплантатов, хирургических сеток или шовного материала.
А. Приготовление нагруженных паклитакселом микрокапсул
Паклитаксел инкапсулировали в найлоновые микрокапсулы с применением способов межфазной полимеризации (полимеризации на границе фаз). Вкратце, 100 мг паклитаксела и 100 мг плуроника F-127 растворяли в 1 мл ДХМ и добавляли 0,4 мл (примерно 500 мг) адипоилхлорида (ADC). Этот раствор гомогенизировали в 2% раствор PVA при помощи гомогенизатора Polytron (установка 1) в течение 15 секунд. При гомогенизации добавляли по каплям раствор 1,6-гександиамина (HMD) в 5 мл дистиллированной воды. Смесь гомогенизировали еще в течение 10 секунд после добавления раствора HMD. Смесь переносили в химический стакан и перемешивали с магнитной мешалкой в течение 3 часов. Смесь центрифугировали, собирали и ресуспендировали в 1 мл дистиллированной воды.
В. Эффективность инкапсулирования/нагрузка паклитаксела
Приблизительно 0,5 мл суспензии фильтровали и микросферы сушили. Приблизительно 2,5 мг микрокапсул взвешивали и суспендировали в 10 мл ацетонитрила в течение 24 часов. Супернатант анализировали на паклитаксел и результат выражали в виде процента паклитаксела. Предварительные исследования показали, что паклитаксел мог быть инкапсулирован в найлоновых микрокапсулах при высокой нагрузке (до 60%) и высокой эффективности инкапсулирования (более 80%).
С. Исследования высвобождения паклитаксела
Приблизительно 2,5 мг микросфер паклитаксел-найлон суспендировали в 50 мл воды, содержащей 1 М хлорид натрия и 1 М мочевину, и периодически анализировали. Высвобождение паклитаксела из этих микрокапсул было быстрым, с 95% лекарственного средства, высвобожденного после 72 часов (фигура 62).
ПРИМЕР 33
БИОАДГЕЗИВНЫЕ МИКРОСФЕРЫ
А. Приготовление биоадгезивных микросфер
Микросферы готовили из 100 кг/моль PLLA с диапазоном диаметров частиц 10-60 мкм. Эти микросферы инкубировали в растворе гидроксида натрия с получением карбоксильных групп на поверхности гидролизом этого полиэфира. Реакцию характеризовали в отношении концентрации гидроксида натрия и времени инкубирования измерением поверхностного заряда. Реакция завершалась после 45 минут инкубирования в 0,1 М гидроксиде натрия. После обработки щелочью микросферы покрывали диметиламинопропилкарбодиимидом (DEC), сшивающим агентом, путем суспендирования микросфер в спиртовом растворе DEC и высушивания этой смеси до диспергируемого порошка. Весовое отношение микросфер к DEC было 9:1. После высушивания микросфер их диспергировали при перемешивании в 2% м/об растворе поли(акриловой кислоты) (РАА) и давали DEC реагировать с РАА с образованием нерастворимой в воде сети сшитой РАА на поверхности микросфер. Сканирующую электронную микроскопию использовали для подтверждения присутствия РАА на поверхности микросфер.
Дифференциальная сканирующая калориметрия этих микросфер до и после обработки щелочью обнаружила, что не наблюдалось изменений в общих термических свойствах (Тс, плавлении и степени кристалличности) при исследовании с СЭМ.
В. Скорости высвобождения паклитаксела in vitro
Готовили нагруженные паклитакселом микросферы (10% и 30% м/м нагрузки) с одним и тем же диапазоном размеров диаметров и определяли профили высвобождения in vitro для 10-дневного высвобождения в ЗФР. Высвобождение было пропорционально нагрузке лекарственного средства, с 400 мкг высвобожденного паклитаксела из 5 мг нагруженных 30% паклитакселом микросфер за 10 дней и 150 мкг высвобожденного паклитаксела из нагруженных 10% паклитакселом микросфер за тот же самый период времени. Эффективность инкапсулирования была примерно 80%. Нагруженные паклитакселом микросферы инкубировали в 0,1 М гидроксиде натрия в течение 45 минут и измеряли дзета-потенциал до и после инкубирования в гидроксиде натрия. Поверхностный заряд нагруженных паклитакселом микросфер был ниже, чем микросфер без паклитаксела, как до, так и после обработки щелочью.
С. Приготовление и оценка in vitro PLLA, покрытого полилизином или фибронектином
Готовили микросферы PLLA, содержащие 1% судан черный (для окрашивания микросфер). Эти сферы суспендировали в 2% (м/об) растворе полилизина (Sigma Chemicals - Hydrobromell form) или фибронектина (Sigma) в течение 10 минут. Микросферы промывали один раз в буфере и помещали на внутреннюю поверхность свежепрепарированных мочевых пузырей из крыс. Мочевые пузыри оставляли на 10 минут и затем промывали три раза в буфере. Остаточные (связанные) микросферы присутствовали на стенке мочевого пузыря после этого процесса, что указывало, следовательно, на наличие биоадгезии (фигуры 63А и 63В) как для покрытых фибронектином, так и для покрытых поли-L-лизином микросфер.
ПРИМЕР 34
ПРЕДУПРЕЖДЕНИЕ ПРИСТУПА АРТРИТА ПАКЛИТАКСЕЛОМ
В КРЫСИНОЙ МОДЕЛИ ClA
А. Материалы и способы
Сингенных самок крыс Louvain весом 120-150 граммов инъецировали внутрикожно 0,5 мг нативного куриного коллагена II (Genzyme, Boston, MA), растворенного в 0,1 М уксусной кислоте и эмульгированного в FIA (Difco, Detroit, MI). Примерно через 9 дней после иммунизации животные обнаружили полиартрит с гистологическими изменениями в виде образования паннуса и костных/хрящевых эрозий. Использовали всего 45 крыс в 4 протоколах: контрольная группа (n=17), которая получала только носитель, и 3 группы обработки паклитакселом, состоящие из группы с превентивным протоколом и 2 групп с супрессивными протоколами. Для оценки действия паклитаксела паклитаксел (солюбилизированный в разведении 1:1 этанол:Сrеmорhоr E.L.® (Sigma) и добавленный к солевому раствору для конечной концентрации 4,8 мг/мл паклитаксела в 5% м/об этаноле и Сrеmophor E.L.) вводили внутрибрюшинно (i.p.), начиная с дня 2 после иммунизации (превентивный протокол) или при возникновении артрита в день 9 (супрессивный протокол). Для превентивного протокола (n=8) паклитаксел предоставляли в концентрации 1 мг/кг веса тела, начиная в день 2 с 5 последующими дозами в дни 5, 7, 9, 12 и 14. Для супрессивного протокола с высокими дозами (n=10) паклитаксел (1 мг/кг веса тела) вводили при 1 мг/кг веса тела в дни 9, 11 и 13 и затем 75% этого уровня дозы (0,75 мг/кг веса тела) через день до дня 21. Контрольных и экспериментальных животных оценивали относительно тяжести заболевания как клинически, так и рентгенографически лицами, которые не знали постановки эксперимента (обработанных групп).
Тяжесть воспаления для каждой конечности оценивали ежедневно и давали оценку в баллах на основании стандартизованных уровней опухания и околосуставной эритемы (0 для нормальных и 4 для тяжелых). Животных оценивали рентгенографически на 28-й день эксперимента. Рентгенограммы обеих задних конечностей располагали по степеням опухания мягких тканей, сужения суставного пространства, деструкции костей и надкостничного новообразования костной ткани. Для количественной оценки каждой конечности использовали шкалу 0-3 (0 = нормальная, 1 = опухание мягких тканей, 2 = ранние эрозии кости, 3 = тяжелая деструкция костей и/или анкилоз). Гистологическую оценку суставов выполняли в конце эксперимента.
Аллергическую реакцию замедленного типа (DTH) на коллаген II (СII) определяли радиометрическим ушным тестом, выполняемым на 28-й день. Радиометрические показатели ушного теста ≥1,4 обозначают значимую реакцию на СII. Присутствие антител IgG против СII определяли иммуноферментным твердофазным анализом (ELISA). Пробы сывороток, полученные на 26-й день, разводили 1:2560 и результаты выражали в виде средней величины оптической плотности при 490 нм, в четырех повторностях. Уровни фона в сыворотке нормальных крыс при этом разведении равны 0 и легко отличимы от сыворотки иммунизированных коллагеном крыс.
В. Результаты
В этой модели обработка паклитакселом, предпринятая до возникновения артрита, полностью предотвращала развитие этого заболевания у всех обработанных крыс (даже после прерывания обработки паклитакселом) в сравнении с контрольной группой, получавшей носитель.
В контрольных животных было прогрессивное увеличение клинических симптомов заболевания до тех пор, пока не происходили деформация и утрата функционирования суставов. Животные, получавшие как низкие дозы, так и высокие дозы паклитаксела после возникновения артрита, показали значимое клиническое улучшение. В среднем, клинические баллы были эквивалентны баллам, наблюдаемым в начале обработки, что свидетельствует о способности паклитаксела предотвращать прогрессирование этого заболевания.
Животные, получавшие паклитаксел, были способны выдерживать свой вес и передвигаться и обнаружили малотоксичных эффектов (или вообще никаких токсичных эффектов) лечения. У обработанных животных наблюдали заживление ран и повторный рост шерсти в месте вакцинации. Обработанные паклитакселом животные прибавляли в весе относительно контролей.
Ни одна из крыс в превентивном протоколе (с действием паклитаксела на предупреждение артрита) не обнаружила каких-либо рентгенографических изменений или клинического артрита. Обе группы, с высокими и низкими дозами паклитаксела, имели значимо меньшее рентгенографическое заболевание по сравнению с контрольной группой. Последующая гистологическая оценка выявила, что крысы контрольной группы продемонстрировали заметный паннус, с костными и хрящевыми эрозиями, однако обработанные паклитакселом крысы имели минимальный паннус (или никакого паннуса) с сохранением суставного хряща.
При применении теста ELISA, антитела IgG к коллагену II были значимо ниже в обработанных паклитакселом крысах по сравнению с контрольной группой; крысы в превентивном протоколе имели значимо меньше антител IgG по сравнению с крысами в супрессивных протоколах с высокими и низкими дозами паклитаксела.
С. Обсуждение
Паклитаксел представляет собой жизнеспособное средство лечения для артрита и потенциально для других типов аутоиммунного заболевания, так как он блокирует процесс заболевания при введении после иммунизации, но до возникновения артрита. Эти результаты показывают, что паклитаксел мог полностью подавлять возникновение артрита при начале его введения через 2 дня после иммунизации СII. При лечении паклитакселом в супрессивном протоколе тяжесть артрита снижалась при продолжении введения паклитаксела, но начинала увеличиваться в пределах 4 дней после прекращения лечения в обоих супрессивных протоколах. Однако раннее введение паклитаксела, по-видимому, снижает необходимость непрерывной терапии.
ПРИМЕР 35
РЕГРЕСС ИНДУЦИРОВАННОГО КОЛЛАГЕНОМ АРТРИТА
ПАКЛИТАКСЕЛОМ
Паклитаксел показал модифицирующие заболевание эффекты в модели CIA при системном введении в виде мицеллярной композиции. Для оценки потенциального модифицирующего заболевание действия паклитаксела мицеллярный (без Cremophor) паклитаксел вводили внутрибрюшинно (i.p.) каждые четыре дня (q.o.d.) при 5 мг/кг (группа 1) или 10 мг/кг (группа 2) иммунизированным животным при возникновении клинически детектируемого артрита (день 9). Паклитаксел вводили на протяжении периода оценки. Для сравнения со стандартной терапией, третья группа получала метотрексат при 0,3 мг/кг i.p. (эквивалентная доза для человека) в дни 0, 5 и 10 после возникновения артрита. Четвертая группа получала комбинаторную терапию с предоставлением метотрексата (0,3 мг/кг) и мицеллярного паклитаксела (10 мг/кг). Контрольную группу (группу 5) и экспериментальных животных оценивали в отношении тяжести заболевания как клинически, так и рентгенографически лицами, не знакомыми с группами обработки.
Тяжесть воспаления для каждой конечности определяли ежедневно и оценивали в баллах на основании стандартизованных уровней опухания и околосуставной эритемы (0 для нормальных и 4 для тяжелых). Животных оценивали рентгенографически на 28-й день эксперимента. Рентгенограммы обеих задних конечностей располагали по степеням опухания мягких тканей, сужения суставного пространства, деструкции костей и надкостничного нового костеобразования. Для количественной оценки каждой конечности использовали шкалу 0-3 (0 = нормальная, 1 = опухание мягких тканей, 2 = ранние эрозии кости, 3 = тяжелая деструкция костей и/или анкилоз) (Brahn et al.. Arthritis Rheum. 37: 839-845, 1994; Oliver et al., Cell. Immunol., 157:291-299, 1994). Гистологическую оценку суставов выполняли в конце эксперимента.
В этой модели обработка мицеллярным паклитакселом, предпринятая до возникновения артрита, полностью предотвращала развитие этого заболевания даже после прерывания обработки паклитакселом. У контрольных животных было прогрессивное увеличение клинических симптомов заболевания (фигура 64), пока не возникали деформация и потеря функционирования суставов. Животные, получающие терапию метотрексатом, статистически не были в улучшенном состоянии в сравнении с контролями (фигура 64 и таблица 12). Животные, которые получали низкую дозу мицеллярного паклитаксела (5 мг/кг) после наступления артрита, показали некоторое улучшение, но животные, которые получали дозы мицеллярного паклитаксела 10 мг/кг, продемонстрировали высокозначимое (р=0,0002) клиническое улучшение (фигура 64). В среднем, клинические баллы были эквивалентны баллам, наблюдаемым в начале лечения, что свидетельствует о способности мицеллярного паклитаксела предотвращать клиническое прогрессирование этого заболевания (таблица 12).
Животные, получающие мицеллярный паклитаксел, были способны удерживать вес и передвигаться и не обнаруживали каких-либо токсичных эффектов обработки. У обработанных животных наблюдали заживление ран и возобновление роста волос в месте вакцинации. Обработанные мицеллярным паклитакселом животные прибавляли в весе относительно необработанных контролей. Животные, получающие как мицеллярный паклитаксел, так и метотрексат, хорошо переносили эту терапию и показали впечатляющее клиническое улучшение (р≤0,0001) в сравнении с контролями (фигура 64). При использовании твердофазного иммуноферментного анализа (ELISA) уровни антител IgG к коллагену типа II были ниже в обработанных паклитакселом и комбинацией МТХ/паклитаксел крысах в сравнении с контролями.
Рентгенографические исследования также показали значимое улучшение в случае терапии паклитакселом. В то время как контрольные и обработанные метотрексатом животные обнаружили рентгенографическое доказательство опухания мягких тканей, сужение пространства суставов, деструкцию костей и периостеальное новообразование костной ткани, обработанные паклитакселом животные имели почти нормальные признаки суставов при рентгенографии (фигура 65).
Фактически, только небольшой процент (17-18%) животных, получавших только мицеллярный паклитаксел (10 мг/кг) или паклитаксел в комбинации с метотрексатом, развили хрящевые эрозии. Хрящевые эрозии, важный индикатор прогрессирования/исхода заболевания, встречаются в 4 раза более часто у контрольных животных (72%) или у животных, получавших только метотрексат, чем у животных, получавших терапию мицеллярным паклитакселом (таблица 13).
Микрофотографии сканирующего электронного микроскопа иллюстрируют хондрозащитные эффекты терапии паклитакселом in vivo. Нормальная поверхность сустава характеризуется интактным хрящевым матриксом, окруженным тонкой синовиальной выстилкой (фигура 66А). В ClA хрящевая поверхность изъязвлена ММР, продуцируемой тканью паннуса и воспаленным синовием (фигура 66В). Поверхностный хрящевой матрикс расщепляется, обнажая хондроциты или пустые лакуны, которые они когда-то занимали (вставка фигуры 66В). У животных с ClA, получавших обработку паклитакселом после возникновения клинического артрита, поверхность суставов остается интактной (фигура 66С) и хрящевой матрикс кажется в значительной степени нормальным, даже при большом увеличении (вставка фигуры 66С).
Образование ткани паннуса и синовиальную гипертрофию не наблюдали в обработанных паклитакселом группах.
Гистологически CIA характеризуется заметной синовиальной гипертрофией, инфильтрацией воспалительных клеток в синовии и деструкцией хряща (фигура 67А). В обработанных паклитакселом животных синовий кажется нормальным, имеющим только 1-2 слоя синовиоцитов и не имеющим инфильтрата воспалительных клеток (фигура 67В).
Коррозионные отливки оценивали также для определения, способен ли паклитаксел блокировать ангиогенез в синовии животных с ClA. Полимер Мегсох вводили вливанием в бедренную артерию умерщвленных животных при давлении 100 мм рт. ст., давая ему отверждаться in situ, и затем ткани расщепляли с получением отливки сосудистой сети нижней конечности. Микрофотографии сканирующего электронного микроскопа отливок синовиальной сосудистой сети в животных с CIA выявили слепозаканчивающиеся капиллярные отростки, выступающие внутрь суставного пространства (фигура 68А). Эти сосуды кажутся морфологически сходными с растущими ангиогенными сосудами, описанными для твердых опухолей и других ангиогенных состояний (вставка фигуры 68А). В противоположность этому, синовиальные сосуды обработанных паклитакселом животных размещены в виде капиллярных петель (фигура 68В) без появления неоваскулярных отростков.
Наблюдали обратное развитие пролиферации сосудов и морфологических сосудистых структур в реципиентах паклитаксела/МТХ, похожее на эту картину, обнаруженную в не обработанных ничем контролях. Эти исследования предполагают, что терапия с использованием мицеллярного паклитаксела и комбинации паклитаксел/метотрексат может приводить к обратному развитию (регрессу) неоваскуляризации, ингибировать воспалительные процессы, вызывать обратное развитие установившегося синовита и предотвращать деструкцию суставов.
Было продемонстрировано, что системное введение паклитаксела является жизнеспособной терапией для артрита. Природный ход заболевания внезапно обостряется и обнаруживает ремиссии, причем каждое внезапное обострение приводит к дополнительному повреждению, что, в конце концов, приводит к деструкции сустава. Существует потенциал для краткосрочной терапии, терапии с высокими дозами, системной терапии, которая должна быть использована для индукции ремиссии этого заболевания, или длительной терапии с низкими дозами для поддержания контроля заболевания. Альтернативные способы доставки паклитаксела включают в себя прямую внутрисуставную инъекцию лекарственного средства в пораженные суставы пациентов с преобладающим заболеванием 1 или 2 суставов.
ПРИМЕР 36
ОЦЕНКА КОМПОЗИЦИЙ ПАКЛИТАКСЕЛА В ЖИВОТНЫХ
МОДЕЛЯХ ПСОРИАЗА
А. Модель кожного ангиогенеза
Новую модель животного используют для исследования специфического для кожи ангиогенеза. Иммунодефицитных мышей SCID используют в качестве реципиентов для поверхностных трансплантатов линий кератиноцитов человека, трансфицированных фактором роста сосудистого эндотелия (VEGF) в смысловой и антисмысловой ориентации. Кератиноциты трансплантируют путем применения модифицированного теста с силиконовой камерой для трансплантации на кожу мыши-реципиента. Кератиноцитам дают дифференцироваться и индуцировать кожный ангиогенез. Затем вводят паклитаксел либо системно, либо местно (крем, мазь, лосьон, гель) и выполняют морфометрические измерения числа и размеров сосудов в необработанных и обработанных группах.
В. Мышиная модель для кожных аллергических реакций замедленного типа
Мышиную модель для кожных аллергических реакций замедленного типа использовали для исследования действий паклитаксела на индуцированное воспаление кожи. Вкратце, мышей сенсибилизировали оксазолоном местным нанесением этого соединения на кожу. Спустя пять дней мышей провоцировали оксазолоном путем местного нанесения на кожу уха (левое ухо: оксазолон, правое ухо: один носитель), что приводило к кожному воспалению, "аллергической реакции замедленного типа". Степень воспаления определяли количественно измерениями полученного опухания уха на протяжении периода 48 часов (см. фигуры 69 и 70). Залитые в Ероn, окрашенные Giesma, срезы тканей 1 мкм оценивали на присутствие воспалительных клеток, на присутствие мастоцитов в ткани и их состояние активации и на степень эпидермальной гиперплазии. Паклитаксел предоставляли системно или местно для количественной оценки действия на кожную воспалительную реакцию в этой модели in vivo.
С. Результаты
Эти исследования показали, что местное введение 1% паклитаксела в сравнении с одним носителем в лечении экспериментально индуцированного кожного воспаления у мышей выявило, что паклитаксел проявляет ингибирующее действие на кожное воспаление. В экспериментально индуцированных аллергических реакциях замедленного типа было значимое уменьшение опухания ушей, обработанных местно 1% паклитакселом, в сравнении с одним носителем. Местное нанесение композиции 1% паклитаксела значимо ингибировало опухание ушей и кожную эритему (красноту), индуцированные местным нанесением РМА (форбол-12-миристол-13-ацетата) (см. фигуры 71 и 72). Как показано на фигуре 73, обработанное паклитакселом ухо (правое ухо) было нормальным по виду в сравнении с контролями (левое ухо). Сходные результаты получали в целом для 5 мышей.
Для оценки раздражения кожи 1% паклитакселом в сравнении с одним носителем две эти композиции наносили ежедневно при 20 мкл на каждую сторону ушей в течение 8 дней. После 8 дней не было обнаружено раздражения кожи после нанесения одного носителя или композиции 1% паклитаксела на нормальную или воспаленную кожу ушей мыши.
ПРИМЕР 37
ОЦЕНКА ХРОНИЧЕСКОГО ОТТОРЖЕНИЯ ТРАНСПЛАНТАТА В МОДЕЛИ ЖИВОТНОГО
Ускоренная форма атеросклероза развивается в большинстве реципиентов сердечных трансплантатов и лимитирует долгосрочное выживание трансплантата. Модель хронического отторжения гетеротопического сердечного трансплантата крыс Lewis-F344 является ценной экспериментальной моделью, поскольку она продуцирует атеросклеротические повреждения постадийно, в средних и долгосрочно выживающих аллотрансплантатах. Преимущества модели Lewis-F344 заключаются в следующем: (i) встречаемость и тяжесть атеросклеротических повреждений в долговыживающих трансплантатах является вполне высокой; и (ii) воспалительная стадия развития повреждений легко распознается, так как эта система не требует иммуносупрессии.
Взрослые самцы крыс Lewis служат в качестве доноров, а крысы F-344 - в качестве реципиентов. Двадцать гетеротопических абдоминальных сердечных аллотрансплантатов трансплантируют, делая длинный абдоминальный разрез по средней линии у анестезированных реципиентов для обнажения аорты и нижней полой вены. Эти два сосуда отделяют друг от друга и от окружающей соединительной ткани и малые зажимы помещают на эти сосуды. Продольные разрезы (2-3 мм) производят в каждом сосуде в месте анастомоза.
Живот анестезированной донорной крысы открывают для инъекции 300 единиц водного гепарина в нижнюю полую вену. Грудную стенку открывают для обнажения сердца. Полые вены лигируют с последующей перерезкой восходящей аорты и главной легочной артерии, так что начала сосудов 2-3 мм длиной остаются присоединенными к сердцу. Полые вены дистально относительно лигатур разделяют и помещают лигатуру вокруг массы левого предсердия и легочных вен. Сосуды на легочной стороне лигатур отделяют и сердце удаляют.
Донорное сердце помещают в брюшную полость реципиента и аорты сшивают вместе в месте разреза на сосуде реципиента. Подобным образом легочную артерию соединяют с местом разреза на нижней полой вене таким же образом. Зажимы для сосудов освобождают (проксимальная полая вена, дистальная полая вена и аорта и проксимальная аорта) для минимизации кровотечения из отверстий игл.
После трансплантации паклитаксел (33%) в пасте поликапролактона (PCL) (n=10) или только пасту PCL (n=10) инъецируют через эпикард на протяжении длины наружной поверхности коронарной артерии в 10 крысах, так чтобы зона артерии, погруженная в миокард, оставалась необработанной.
Все реципиенты получают одну внутримышечную инъекцию пенициллина G (100000 единиц) во время трансплантации. Трансплантаты обследуют ежедневной пальпацией и их функцию оценивают по шкале 1-4, с 4 баллами, представляющими нормальное сердечное сокращение, и 0, представляющим отсутствие механической активности. Пять крыс из каждой группы умерщвляют при 14 днях и остальные пять - при 28 днях. У крыс наблюдали потерю веса и другие признаки системной болезни. После 14 или 28 дней животных анестезируют и сердце обнажают, как в начале эксперимента. Покрытые и непокрытые коронарные артерии выделяют, фиксируют в 10% забуференном формальдегиде и исследуют гистологически.
Исходный эксперимент может быть модифицирован для применения пленки паклитаксел/EVA или покрытых стентов в коронарных артериях после трансплантации. Пленку EVA наносят на экстралюминальную поверхность коронарной артерии подобно тому, как описано выше, тогда как стент с покрытием помещают интралюминально.
Кроме того, эти исследования могут быть дополнительно расширены таким образом, чтобы они включали в себя трансплантаты других органов, а также трансплантаты тканей (например, вены, кожи).
ПРИМЕР 38
ДЕЙСТВИЕ ПАКЛИТАКСЕЛА В МОДЕЛИ PC (РАССЕЯННОГО СКЛЕРОЗА)
ЖИВОТНОГО
Исследовали способность мицелл паклитаксела ингибировать прогрессирование симптомов рассеянного склероза и патогенез в демиелинирующей модели трансгенной мыши (Mastronardi et al., J. Neurosci. Res. 36: 315-324, 1993). Эти трансгенные мыши содержат 70 копий трансгенного DM20, протеолипида миелина. Клинически, животные кажутся нормальными до 3-месячного возраста. После 3 месяцев появляются и прогрессивно увеличиваются по их тяжести признаки неврологической патологии, такие как припадки, дрожь, подвижность задних конечностей, неустойчивость походки, вялый хвост, шатающаяся походка и снижение степени активности, пока эти животные не умирают в возрасте между 6 и 8 месяцами. Клинические признаки коррелируют гистологически с демиелинированием и увеличенной пролиферацией фиброзных астроцитов в мозгу (Mastronardi et al., J. Neurosci. Res. 36: 315-324, 1993).
А. Материалы и способы
Два исследования на животных проводили с применением подкожного введения либо согласно протоколу непрерывной терапии паклитакселом в низких дозах (2,0 мг/кг; 3× в неделю, всего 10 инъекций), либо согласно протоколу "импульсной" терапии паклитакселом в высоких дозах (20 мг/кг; четыре раза, один раз в неделю), начинаемого при клиническом появлении заболевания (приблизительно в возрасте 4 месяцев). Для протокола с низкими дозами 5 животных получали мицеллярный паклитаксел, двух мышей использовали в качестве контролей; одна мышь была необработанной нормальной мышью и одна мышь была необработанной трансгенной однопометной мышью. Только одну трансгенную мышь использовали в качестве контроля, так как ход этой болезни был хорошо установлен в этой лаборатории. Четырехмесячных животных инъецировали мицеллярным паклитакселом после того, как первоначальные признаки PC достигали показателя 1+ для категорий симптомов, описанных выше. Обработку проводили в течение 24 дней (2,0 мг/кг паклитаксела, 3× в неделю, ×10 доз). Вес тела и клинические признаки определяли в каждый день инъекции.
В. Результаты
5 животных, получавших паклитаксел, не обнаружили значимой потери веса. Однако, необработанная трансгенная мышь обнаружила 30% уменьшение веса тела, с 29 г до 22 г (фигура 74), как это в норме связано с прогрессированием этого заболевания.
Клинические индикаторы PC, такие как дрожь, подвижность задних конечностей, припадки, тремор головы, неустойчивость походки, вялый хвост и снижение степени активности, наблюдали ежедневно. При начале лечения животные имели показатель 1+ в основных категориях симптомов. Необработанные животные прогрессировали от балла 1+ до балла 4+ на протяжении следующих 27 дней по ряду симптомов; показатель 3+ характеризовался слабым равновесием, одним из главных признаков этого заболевания. В обработанной паклитакселом группе все пять животных оставались при оценке 1+ на протяжении того же периода во всех наблюдаемых симптомах (таблица 14).
Для протокола с высокими дозами мышей обрабатывали 20 мг/кг паклитаксела один раз в неделю в течение 4-х недель для имитации импульсной терапии с интервалами (предоставляемой один раз в месяц для рака молочной железы и рака яичников), используемой для онкологических пациентов. Животных наблюдали в течение 10 недель, в каждые два дня и баллы определяли для каждого симптома. У трех необработанных животных неврологические симптомы прогрессировали быстро и два животных умерли (на 5-й неделе и на 9-й неделе) в ходе эксперимента; третье выжившее животное имело тяжелые клинические симптомы. У 5 трансгенных животных, получающих обработку паклитакселом, начатую после первой недели наблюдения, было снижение баллов PC (рассеянного склероза) относительно контролей после первой недели наблюдения и после этого неврологического ухудшения не наблюдали. У этих животных прогрессирования болезни не наблюдали, и животные оставались клинически в ремиссии как во время терапии (недели 0-3), так и после прекращения лекарственной обработки (недели 4-10) (фигура 75).
С. Выводы
Паклитаксел предотвращал быстрое прогрессирование неврологических симптомов, наблюдаемых в этой модели PC животного как при низких дозах, так и при высоких дозах. Эти результаты предполагают, что паклитаксел может быть потенциальным терапевтическим агентом демиелинизирующего заболевания.
ПРИМЕР 39
ОЦЕНКА ПАКЛИТАКСЕЛА И ДРУГИХ СТАБИЛИЗИРУЮЩИХ МИКРОТРУБОЧКИ АГЕНТОВ ДЛЯ ЛЕЧЕНИЯ НАЗАЛЬНЫХ ПОЛИПОВ
Культуры эпителиальных клеток и/или культуры ткани назального полипа использовали для оценки эффективности композиций, содержащих паклитаксел или другие агенты, в лечении назальных полипов. Этот подход основан на предпосылке, что эпителиальные клетки высвобождают цитокины и способствуют хроническому воспалению, обнаруживаемому при назальном полипозе, а также при рините и астме, и что лечение лекарственными средствами с пролонгированным действием будет предотвращать эозинофилию и ингибировать экспрессию генов цитокинов.
Композиции паклитаксела, в том числе растворы (применение циклодекстринов) или суспензии, содержащие паклитаксел, инкапсулированный в мукоадгезивных полимерах для применения в виде назальных спреев, и/или микроинкапсулированный паклитаксел в мукоадгезивных полимерах используют в виде инсуффляций. Эти композиции использовали в исследованиях, подробно описанных ниже.
А. Действие паклитаксела in vitro
Манипулирование с тканями - Нормальные образцы слизистой оболочки носа (НМ) получают из пациентов без клинических признаков ринита и с отрицательным тестом кожного укола во время пластической хирургии носа. Образцы назального полипа (НП) получают из пациентов с позитивным и негативным тестом кожного укола, подвергнутых назальной полипэктомии. Назальные образцы помещают в среду Ham F12, дополненную 100 ME/мл пенициллина, 100 мкг/мл стрептомицина и 2 мкг/мл амфотерицина В, и сразу же транспортируют в лабораторию.
Культура эпителиальных клеток - назальные эпителиальные клетки из НМ и НП выделяют протеазным расщеплением следующим образом. Образцы ткани промывают 2-3 раза средой Ham F12, дополненной 100 МЕ/мл пенициллина, 100 мкг/мл стрептомицина и 2 мкг/мл амфотерицина В, и затем инкубируют в 0,1% протеазе типа XIV в Ham F12 при 4°С в течение ночи. После инкубации добавляют 10% ФТС для нейтрализации протеазной активности и эпителиальные клетки отделяют медленным встряхиванием. Суспензии клеток фильтруют через сито для диссоциации клеток с меш 60 и центрифугируют при 500 g в течение 10 минут при комнатной температуре. Затем осадок клеток ресуспендируют в гормонально определенной культуральной среде Ham F12 (Ham HD), содержащей следующие реагенты: 100 МЕ/мл пенициллина, 100 мкг/мл стрептомицина, 2 мкг/мл амфотерицина В, 150 мкг/мл глутамина, 5 мкг трансферина, 5 мкг/мл инсулина, 25 нг/мл эпидермального фактора роста, 15 мкг/мл ростовой добавки эндотелиальных клеток, 200 пМ трийодтрионин и 100 нМ гидрокортизон. Затем клеточные суспензии (105 клеток/лунку) высевают на покрытые коллагеном лунки в 2 мл НАМ HD и культивируют в увлажненной атмосфере 5% СO2 при 37°С. Культуральную среду заменяют днем и затем каждый последующий день. Монослой конфлюэнтных клеток достигается после 6-10 дней культуры.
Генерирование кондиционированной эпителиальными клетками человека среды (НЕСМ) - Когда культуры эпителиальных клеток достигали конфлюэнтности, среду Ham HD заменяют средой RPMI 1640 (Irvin, Scotland), дополненной 100 МЕ/мл пенициллина, 100 мкг/мл стрептомицина, 2 мкг/мл амфотерицина В, 150 мкг/мл глутамина и 25 мМ Hepes-буфером (RPMI 10%). НЕСМ, которая генерируется после 48 часов инкубации с RPMI (10%), собирают из культур, центрифугируют при 400 g в течение 10 минут при комнатной температуре (КТ), стерилизуют фильтрованием через фильтры 0,22 мкм и хранят при -70°С до использования.
Выживание эозинофилов и действие паклитаксела - Эозинофилы выделяют из периферической крови и действие НЕСМ из НМ и НП на выживание эозинофилов определяют двумя различными путями: анализом временного хода и анализом дозы-ответа. В экспериментах с временным ходом эозинофилы в концентрации приблизительно 250000/мл инкубируют в шестилуночных культурах ткани с 50% НЕСМ или без 50% НЕСМ (негативный контроль) и индекс выживания оценивают в дни 2, 4, 6 и 8. Другие эксперименты проводят с 1-50% НЕСМ. В экспериментах, в которых испытывают действие лекарственных средств (например, паклитаксела) на индуцированное НЕСМ выживание эозинофилов, лекарственное средство (паклитаксел) от 0,1 нМ до 10 мкМ инкубируют с эозинофилами при 37°С на протяжении 1 часа перед добавлением НЕСМ. В каждом эксперименте всегда оценивают негативный контроль (только культуральная среда) и позитивный контроль (культуральная среда с НЕСМ). Для исследования, обладают ли эти лекарственные средства каким-либо токсическим действием, жизнеспособность эозинофилов, инкубированных с лекарственным средством (различными концентрациями), сравнивают с эозинофилами, культивируемыми только с RPMI (10%), на протяжении периода 24 часов.
В. Действие паклитаксела на экспрессию генов цитокинов и высвобождение из эпителиальных клеток
Эпителиальные клетки, полученные из назальных полипов и нормальной слизистой оболочки носа, культивируют до конфлюэнтности, генерируют кондиционированные эпителиальными клетками человека среды с паклитакселом и без паклитаксела (или других агентов) и супернатанты измеряют при помощи ELISA. Экспрессию генов цитокинов исследуют при помощи полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР), как описано Mullol et al., Clinical and Experimental Allergy 25: 607-615, 1995.
Результаты показывают, модулирует ли паклитаксел экспрессию генов цитокинов как средство ингибирования выживания эозинофилов. Основным недостатком использования первичных культур клеток является то, что требуется 10 дней для достижения клетками конфлюэнтности, диссоциации клеточных функций от локальной среды, а также системных эффектов, которые могли бы привести в первую очередь к этому заболеванию. Однако они представляют собой превосходную модель in vitro/ex vivo для исследования факторов роста, регулирующих функцию и пролиферацию структурных клеток (например, эпителиальных клеток), и тем самым выяснения некоторых аспектов воспаления слизистой оболочки.
С. Иммунологическое высвобождение химических модуляторов из назальных полипов человека
Опосредование паклитакселом и другими агентами - Полипы получают во время резекции и промывают 5 раз буфером Тироде и фрагментируют маленькими ножницами на реплики с сырым весом примерно 200 мг. Реплики суспендируют в 3 мл буфера, содержащего различные концентрации паклитаксела, при 37°С и провоцируют (спустя 5 минут) 0,2 мкг/мл антигена Е. После 15 минут инкубации с антигеном диффузаты удаляют и ткани кипятят в свежем буфере в течение 10 минут для экстракции остаточного гистамина. Высвобождаемые гистамин и SRS-A анализируют при помощи ВЖХ.
ПРИМЕР 40
ОКОЛОСОСУДИСТОЕ ВВЕДЕНИЕ АГЕНТОВ, КОТОРЫЕ НАРУШАЮТ
ФУНКЦИЮ МИКРОТРУБОЧЕК
Были проведены исследования для оценки эффективности нагруженной паклитакселом/камптотецином хирургической пасты (PCL) и/или пленки EVA при околососудистом введении в лечении по поводу рестеноза.
А. Материалы и способы
Крыс Wistar весом 250-300 г анестезировали внутримышечной инъекцией Инновара (0,33 мл/кг). После получения седативного эффекта их помещали под галотановую анестезию. После установления общей анестезии шерсть в области шеи выбривали, кожу фиксировали и протирали тампоном с бетадином. Делали вертикальный надрез над левой сонной артерией и обнажали наружную сонную аретрию. Две лигатуры помещали вокруг наружной сонной артерии и проводили поперечную артериотомию. Затем в сонную артерию вводили французский катетер-баллон Фогарти номер 2 и пропускали его в левую общую сонную артерию и баллон наполняли солевым раствором. Эндотелий обнажали проведением наполненного баллона вверх и вниз по сонной артерии три раза. Затем катетер удаляли и лигатуру на левой наружной сонной артерии отвязывали.
Крыс рандомизировали в группы из 10 для получения вариантов: без обработки, один полимер (пленка EVA или паста PCL) или полимер плюс 20% паклитаксел. Полимерную смесь (2,5 мг) помещали периферическим образом вокруг сонной артерии. Затем рану закрывали. Пять крыс каждой группы умерщвляли при 14 днях и остальных пять - при 28 днях. В промежутке крыс наблюдали относительно потери веса или других признаков системной болезни. После 14 или 28 дней животных анестезировали и левую сонную артерию выделяли, фиксировали 10% забуференным формальдегидом и исследовали гистологически.
В качестве предварительного исследования двух крыс обрабатывали нагруженной 10% камптотецином пленкой EVA в течение 14 дней для оценки эффективности камптотецина в этой модели заболевания.
В. Результаты
Результаты из этих исследований обнаружили, что нагруженные паклитакселом (20%) полимеры полностью предотвращают рестеноз, тогда как контрольные животные и животные, получающие только полимер, развивали 28% и 55% люминальное нарушение при 14 днях и 28 днях после баллонного повреждения (фигуры 76А и 76В).
Наблюдали абсолютное ингибирование гиперплазии интимы в тех местах, где паклитаксел находился в контакте со стенкой сосуда. Однако этот эффект был очень локальным, о чем свидетельствовал неравный эффект паклитаксела в тех местах, где не было возможности удержать лекарственное средство смежно со стенкой сосуда (фигуры 77А и 77В).
Предварительные результаты показали, что нагруженная камптотецином пленка EVA была эффективной в предупреждении реакции рестеноза в этой модели заболевания животного. Камптотецин полностью ингибировал гиперплазию интимы в двух испытанных животных.
ПРИМЕР 41
ДЕЙСТВИЕ ПАКЛИТАКСЕЛА В МОДЕЛИ ХИРУРГИЧЕСКИХ СПАЕК ЖИВОТНОГО
Применение нагруженной паклитакселом пленки EVA для уменьшения спайкообразования испытывают в кроличьей модели маточного рога (кератомы).
Самок Ново-Зеландских белых кроликов анестезировали и выполняли лапаротомию через надрез по средней линии. Маточные кератомы обнажали и сегмент длиной 5 см каждой из них выскабливали при помощи лезвия скальпеля. Это выскабливание является достаточным для удаления серозной оболочки, приводящего к точечному кровотечению. Кроликов произвольно распределяли на контрольные или обрабатываемые паклитакселом группы и на послеоперационные периоды оценки с длительностью две, четыре и восемь недель. В обрабатываемой паклитакселом группе каждую маточную кератому полностью обертывают нагруженной паклитакселом пленкой EVA после соскабливания. Мышечно-перитонеальный слой закрывают швами, а кожный слой - кожными скрепками.
Животных оценивают в отношении спайкообразования через две, четыре или восемь недель после хирургии. Животных эвтанизируют гуманно и проводят аутопсии. Маточные кератомы исследуют в целом виде и гистологически при помощи стандартных микроскопических способов. В целом виде спайки располагают по степеням при помощи стандартной балльной системы, которая основана на том факте, что травмированы 5 см маточного рога; следовательно, степень спайкообразования определяют измерением длины зоны, содержащей спайки. Используют следующую систему распределения по степеням: 0 = нет спаек, 1 = спайка на 25% этой зоны, 2 = спайки на 50% этой зоны и 3 = полное вовлечение в спайку. Тяжесть спаек измеряют следующим образом: 0 = нет резистентности к разделению, 0,5 = некоторая резистентность (требуется умеренная сила) и 1 = требуется резкое расслоение. Общая степень является аддитивной (суммарной), причем диапазон баллов спаек 0-4, который представляет как степень, так и тяжесть спайкообразования.
ПРИМЕР 42
МИЦЕЛЛЯРНЫЙ ПАКЛИТАКСЕЛ В ЛЕЧЕНИИ ВОСПАЛИТЕЛЬНОГО
ЗАБОЛЕВАНИЯ КИШЕЧНИКА (IBD)
Воспалительное заболевание кишечника (IBD), а именно болезнь Крона и язвенный колит, характеризуется периодами рецидива и ремиссии. Наилучшую доступную модель IBD получают в крысах инъекцией в ободочную кишку 2,4,6-тринитробензолсульфоновой кислоты (TNB), растворенной в этаноле и солевом растворе (Morris et al., Gastroenterology, 96: 795-803, 1989). Одно введение инициирует острое и хроническое воспаление, которое сохраняется в течение нескольких недель. Однако было показано фармакологически, что кроличья ободочная кишка больше подобна ободочной кишке человека, чем крысиная ободочная кишка (Gastroenterology, 99: 13424-13432, 1990).
Во всех экспериментах используют самок Ново-Зеландских белых кроликов. Животных анестезируют внутривенно (i.v.) пентобарбитолом. Питательную трубку для зондового питания младенцев вставляют ректально, так что кончик находится на 20 см проксимально к анусу, для введения TNB (0,6 мл; 40 мг в 25% этаноле в солевом растворе). Через одну неделю после введения TNB кроликов рандомизируют на 3 группы обработки. В это время животные либо не получают обработки, либо получают только мицеллы (i.v.), либо получают мицеллярный паклитаксел (i.v.). Это повторяют каждые 4 дня, всего 4 обработки.
В ходе этого исследования кроликов испытывают каждую неделю при помощи эндоскопии с применением педиатрического бронхоскопа под общей анестезией, выполняемой, как описано выше. Повреждение оцениваются в баллах эндоскопистом (который не знает вариантов эксперимента) в соответствии со следующей шкалой: 0 - нет нарушений; 1 - воспаление, но не изъязвление; 2 - воспаление и изъязвление в 1 месте (<1 см); 3 - два или более мест воспаления и изъязвления или один основной очаг воспаления и изъязвления (>1 см) по всей длине ободочной кишки.
После последней обработки кроликов умерщвляют Эутанолом при 24 часах и 1, 2, 4 и 6 неделях. Всю ободочную кишку выделяют, иссекают и открывают по антимезентериальной границе, промывают солевым раствором и помещают в сбалансированный солевой раствор Хенкса, содержащий антитела. Ободочную кишку исследуют при помощи стереомикроскопа и оценивают в баллах в соответствии с теми же самыми критериями, что и при эндоскопии. Также выбирают образцы ободочной кишки при аутопсии, как из явно воспаленных и изъязвленных областей, так и из нормальной ободочной кишки по всей длине от ануса до восходящей ободочной кишки. Ткани фиксируют в 10% формальдегиде и обрабатывают для заливки в парафин; делают срезы и окрашивают гемотоксилином и эозином. Микроскопические препараты обследуют на присутствие или отсутствие гистопатологии IBD.
Исходный эксперимент может быть модифицирован для применения перорального паклитаксела после индукции колита у кроликов введением TNB через ободочную кишку. Животных рандомизируют на 3 группы: не получающие обработки, получающие только носитель или приготовленный для перорального введения паклитаксел.
ПРИМЕР 43
ДЕЙСТВИЕ ПАКЛИТАКСЕЛА В МОДЕЛИ СИСТЕМНОЙ
КРАСНОЙ ВОЛЧАНКИ ЖИВОТНОГО
Эффективность паклитаксела при системной красной волчанке определяют лечением (обработкой) самок мышей NZB/NZW F1 (B/W) мицеллярным паклитакселом. Этот штамм мышей развивает заболевание, похожее на SLE (системную красную волчанку) человека. В возрасте одного месяца эти мыши имеют повышенный уровень В-клеток селезенки, самопроизвольно секретирующих иммуноглобулин, в сравнении с нормальными мышами. Высокие уровни антител против одноцепочечной ДНК наблюдаются при возрасте 2 месяца. При возрасте 5 месяцев иммуноглобулин накапливается вдоль гломерулярных капиллярных стенок. Развивается тяжелый гломерулонефрит и при возрасте 9 месяцев 50% мышей B/W умирают.
А. Материалы и способы
Самок мышей B/W получают из Jackson Laboratory (Bar Harbor, ME, USA). Пятимесячных самок мышей B/W произвольно распределяют на группу обработки и контрольную группу. Группы обработки получают либо непрерывную обработку низкими дозами мицеллярного паклитаксела (2,0 мг/кг; 3 раза в неделю, всего 10 инъекций), либо "импульсную" обработку высокими дозами мицеллярного паклитаксела (20 мг/кг; четыре раза, один раз в неделю). Контрольная группа получает контрольные мицеллы.
При заданных интервалах времени обработанных паклитакселом и необработанных контрольных мышей B/W сравнимого возраста умерщвляют, их селезенки удаляют асептически и суспензии отдельных клеток готовят для счета лимфоцитов. Для идентификации субпопуляций лимфоцитов селезенки проводят флуоресцентный анализ. Число клеток на миллион В-клеток селезенки, самопроизвольно секретирующих иммуноглобулин (IgG, IgM, общий иммуноглобулин) или антитела против одноцепочечной ДНК, определяют при помощи ELISA.
Из предшествующего описания должно быть понятно, что, хотя здесь описаны характерные варианты данного изобретения для целей иллюстрации, могут быть сделаны различные модификации без отхода от идеи и объема изобретения. Таким образом, данное изобретение не ограничивается ничем, за исключением прилагаемой формулы изобретения.
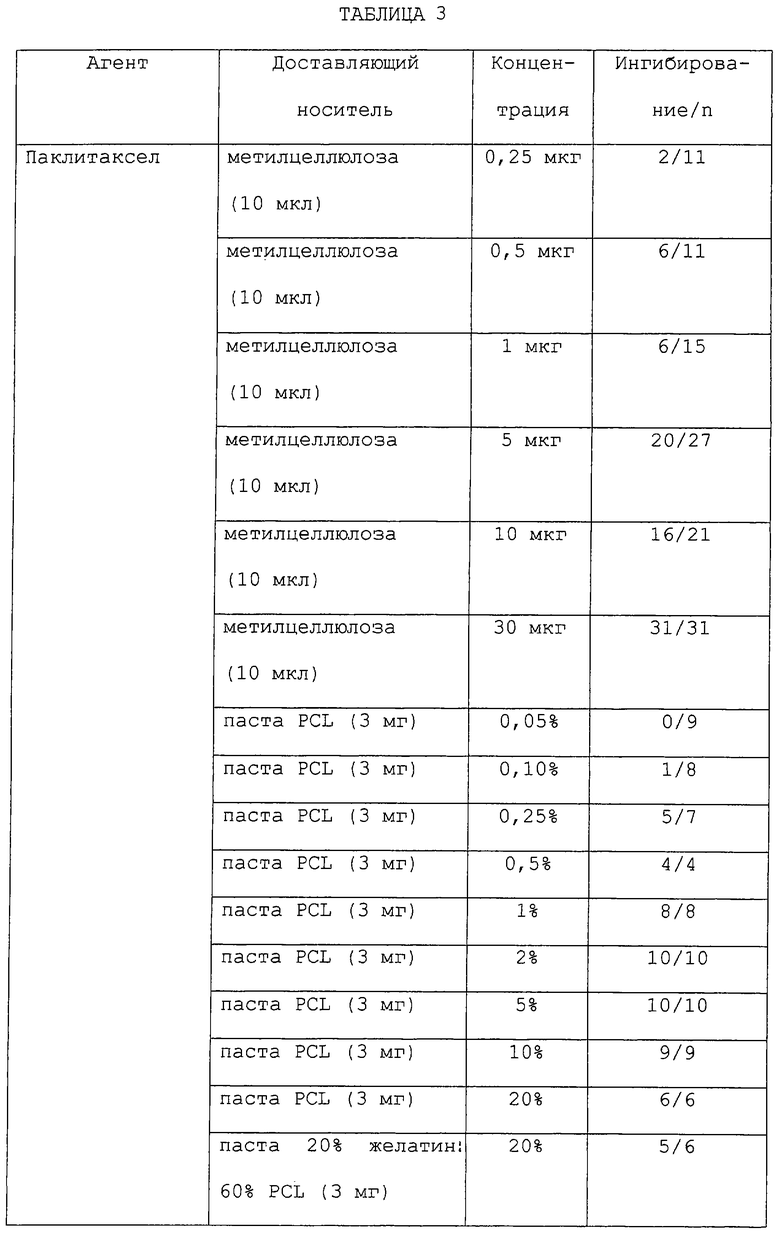
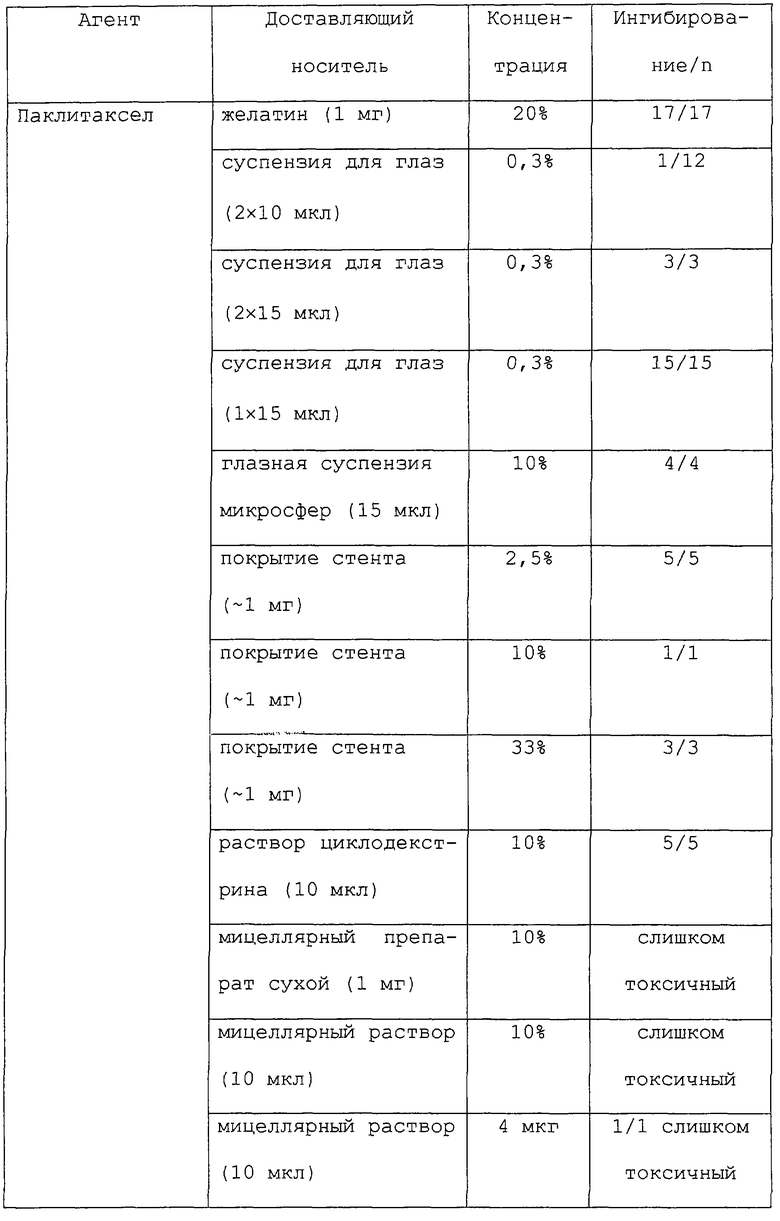
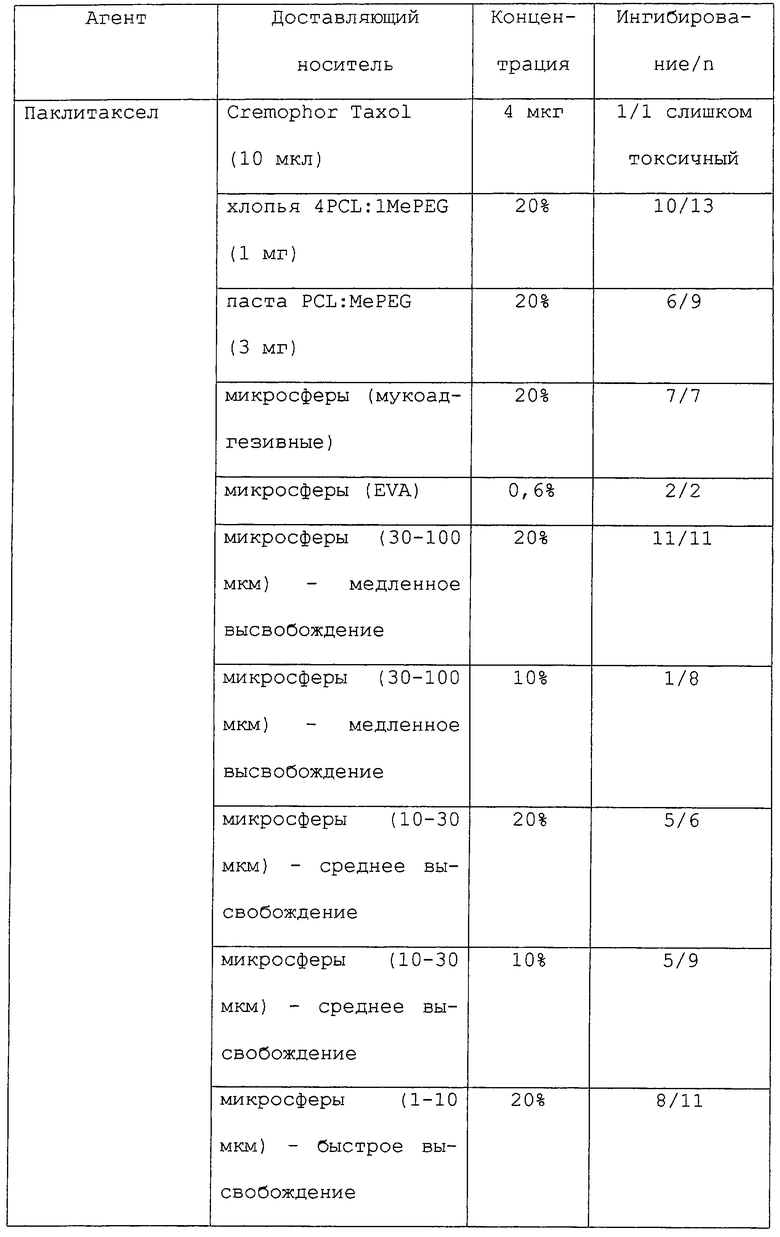
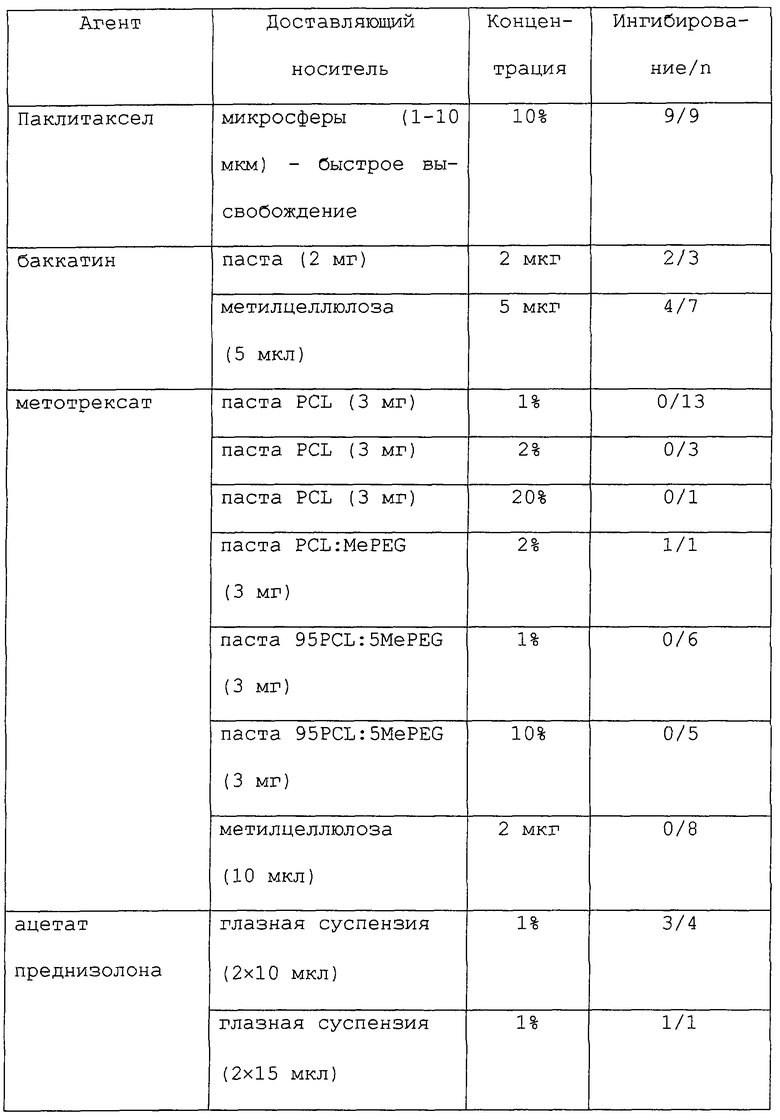
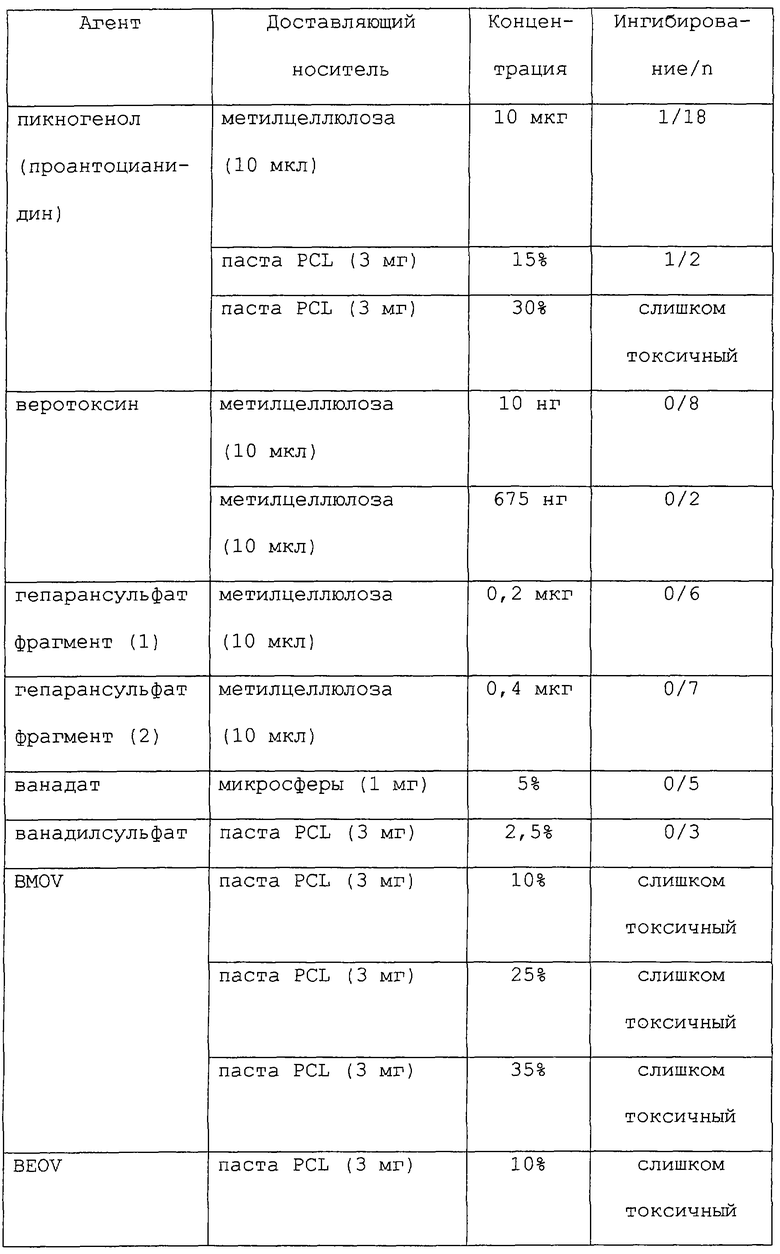
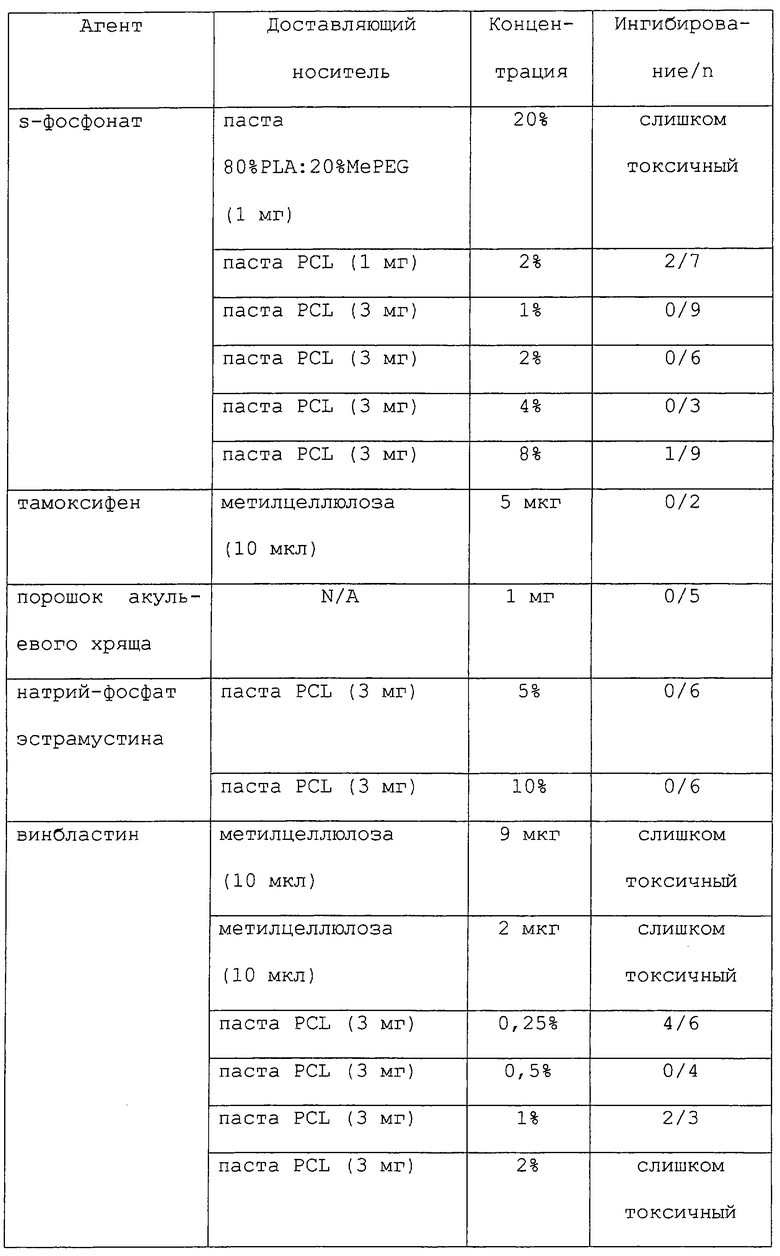
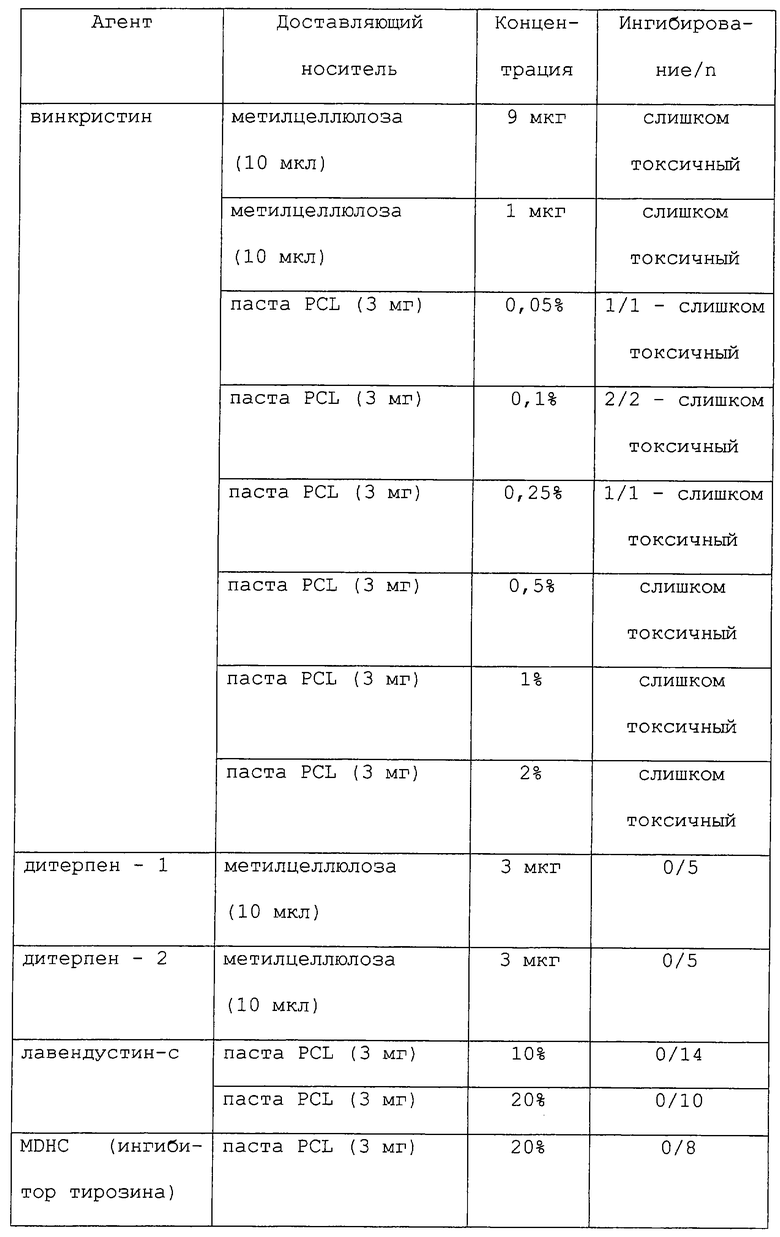
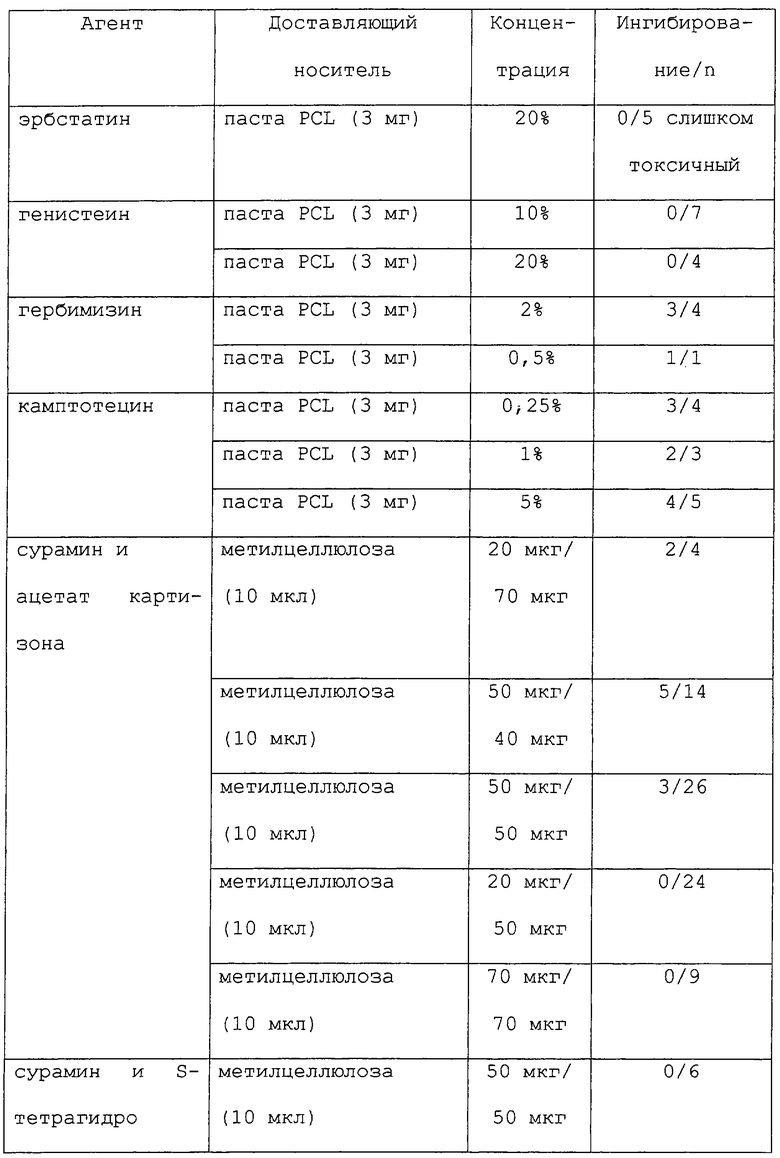
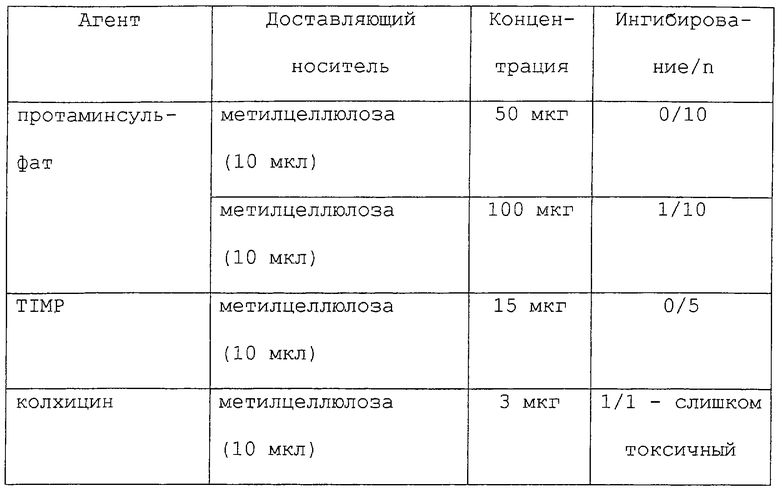
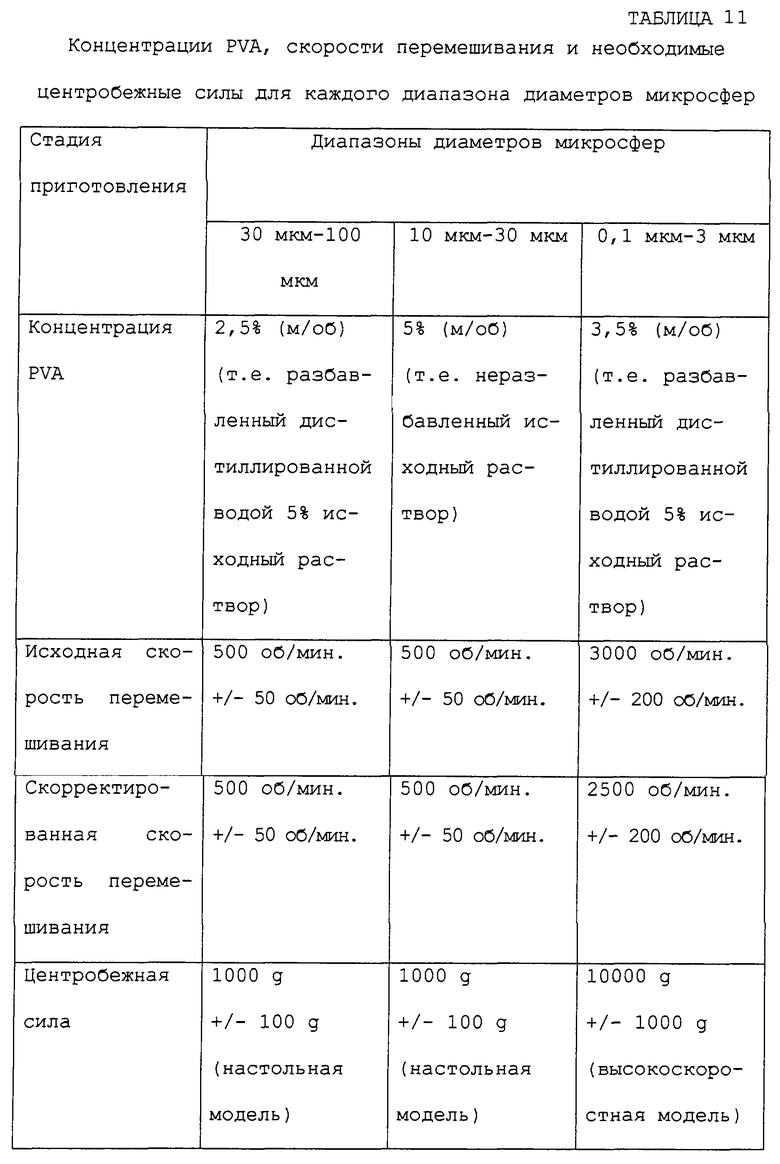
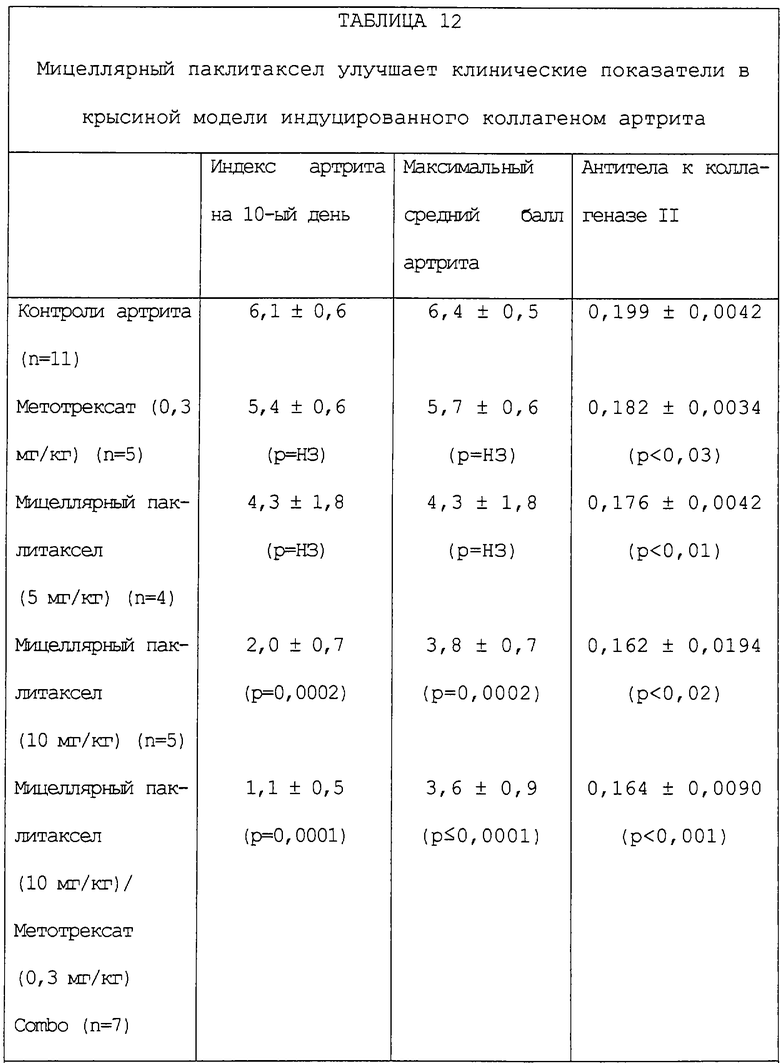

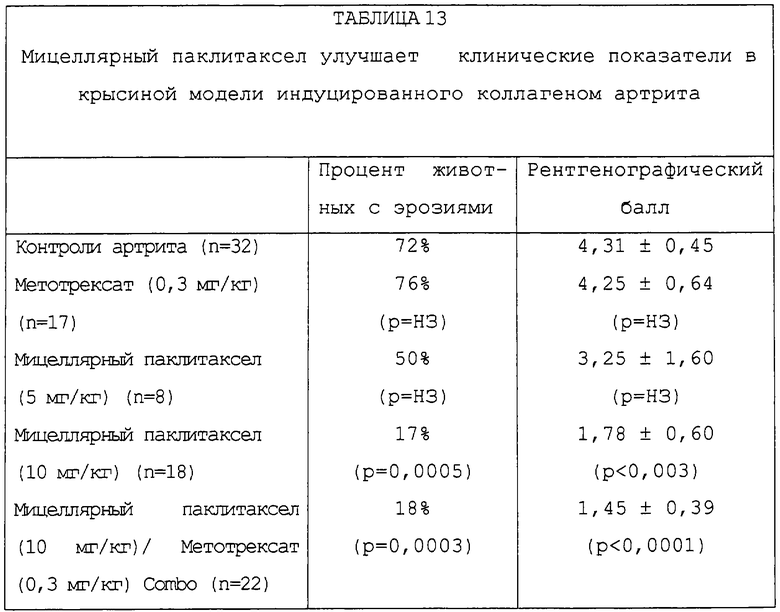

| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ, ПОДАВЛЯЮЩИЕ РАЗВИТИЕ КРОВЕНОСНЫХ СОСУДОВ, И СПОСОБЫ ИХ ИСПОЛЬЗОВАНИЯ | 2001 |
|
RU2304433C2 |
| СТЕНТ ДЛЯ РАСШИРЕНИЯ ПРОСВЕТА, РАСПОЛОЖЕННОГО ВНУТРИ ТЕЛА КАНАЛА | 1994 |
|
RU2180844C2 |
| ТАКСАНЫ, КОВАЛЕНТНО СВЯЗАННЫЕ С ГИАЛУРОНОВОЙ КИСЛОТОЙ ИЛИ ПРОИЗВОДНЫМИ ГИАЛУРОНОВОЙ КИСЛОТЫ | 2003 |
|
RU2384593C2 |
| УСТРОЙСТВО ДЛЯ ЛОКАЛЬНОЙ И/ИЛИ РЕГИОНАРНОЙ ДОСТАВКИ С ПРИМЕНЕНИЕМ ЖИДКИХ СОСТАВОВ ТЕРАПЕВТИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ | 2009 |
|
RU2596092C2 |
| УСТРОЙСТВО ДЛЯ ЛОКАЛЬНОЙ И/ИЛИ РЕГИОНАРНОЙ ДОСТАВКИ С ПРИМЕНЕНИЕМ ЖИДКИХ СОСТАВОВ ТЕРАПЕВТИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ | 2009 |
|
RU2513153C2 |
| КОНЪЮГАТЫ ПОЛИГЛУТАМАТ-АМИНОКИСЛОТА И СПОСОБЫ | 2006 |
|
RU2472812C2 |
| Белок, фармацевтическая композиция, лекарственное средство, устройство, набор | 2019 |
|
RU2815577C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДОСТАВКИ ФАРМАКОЛОГИЧЕСКИХ АГЕНТОВ | 2009 |
|
RU2522977C2 |
| КОМПОЗИЦИИ ПОЛИМЕРНЫХ МИЦЕЛЛ | 2001 |
|
RU2308943C2 |
| БИОЛОГИЧЕСКИЕ МАТЕРИАЛЫ И ИХ ПРИМЕНЕНИЕ | 2009 |
|
RU2508296C2 |
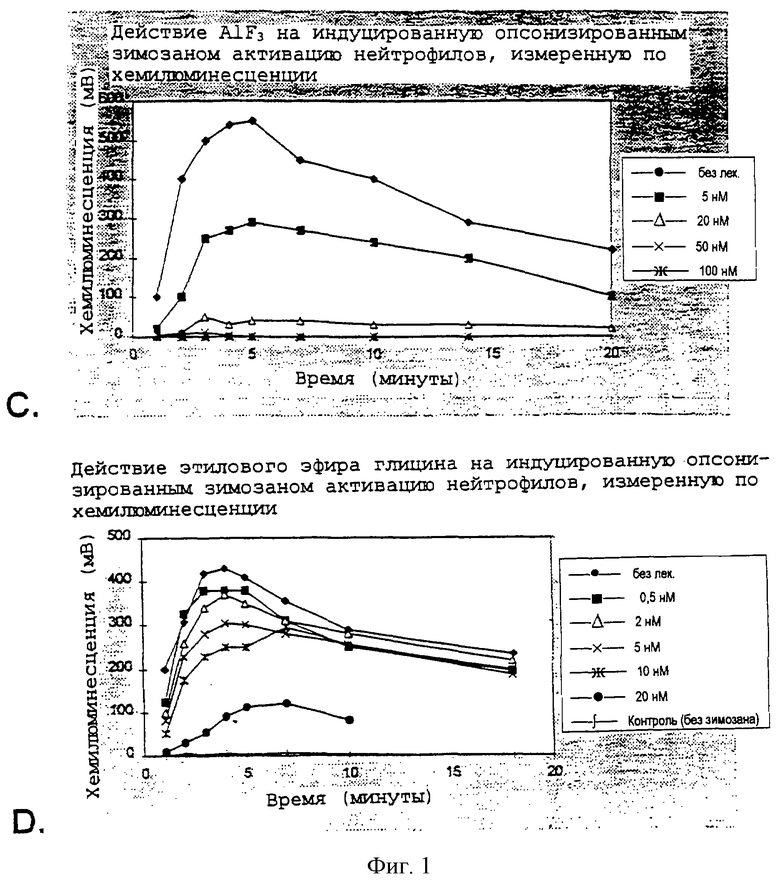
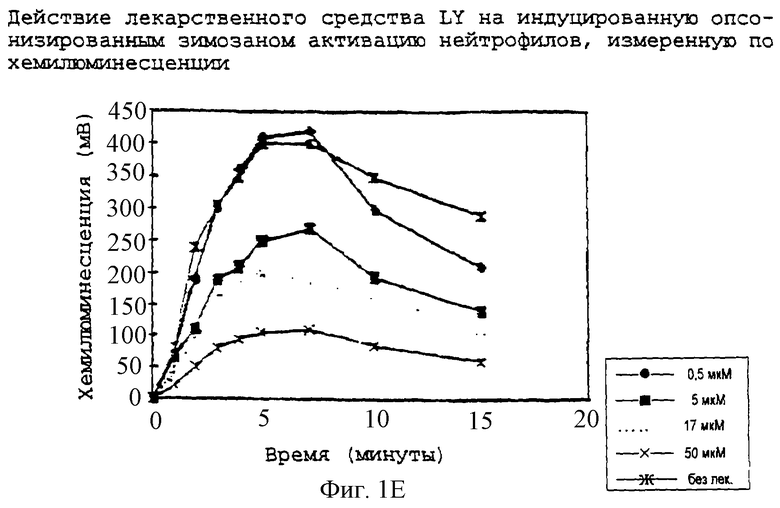
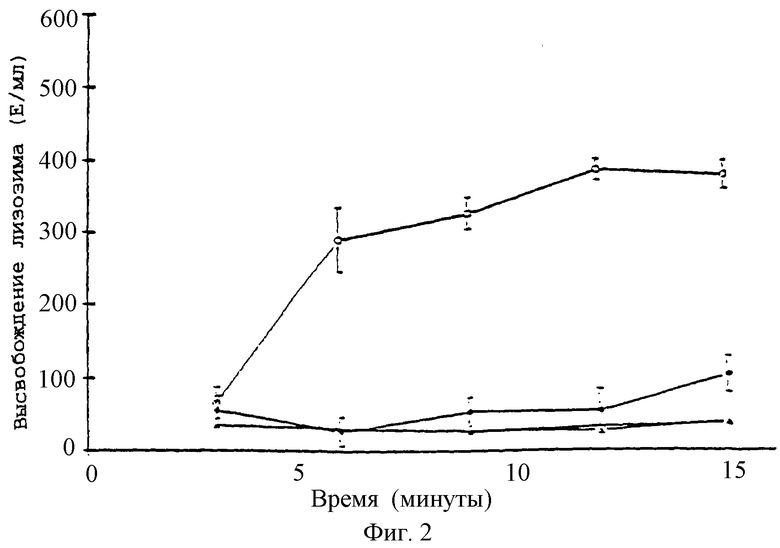
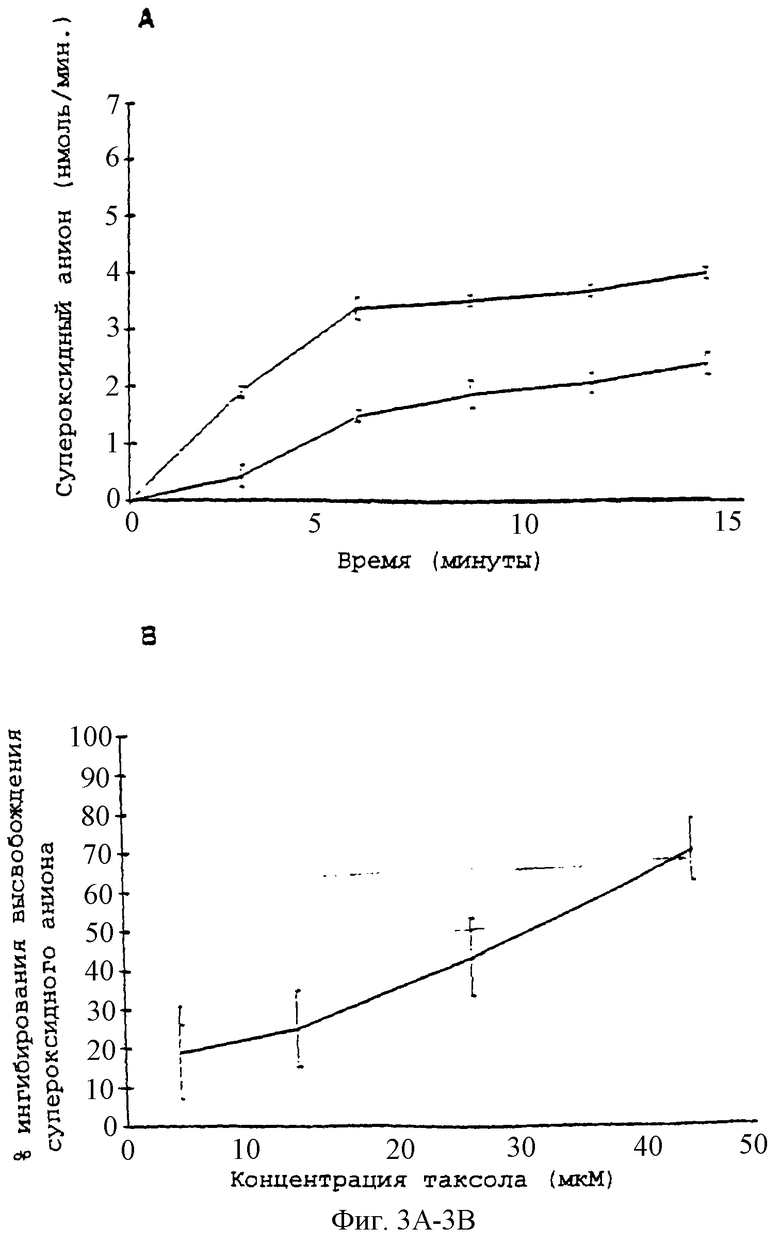

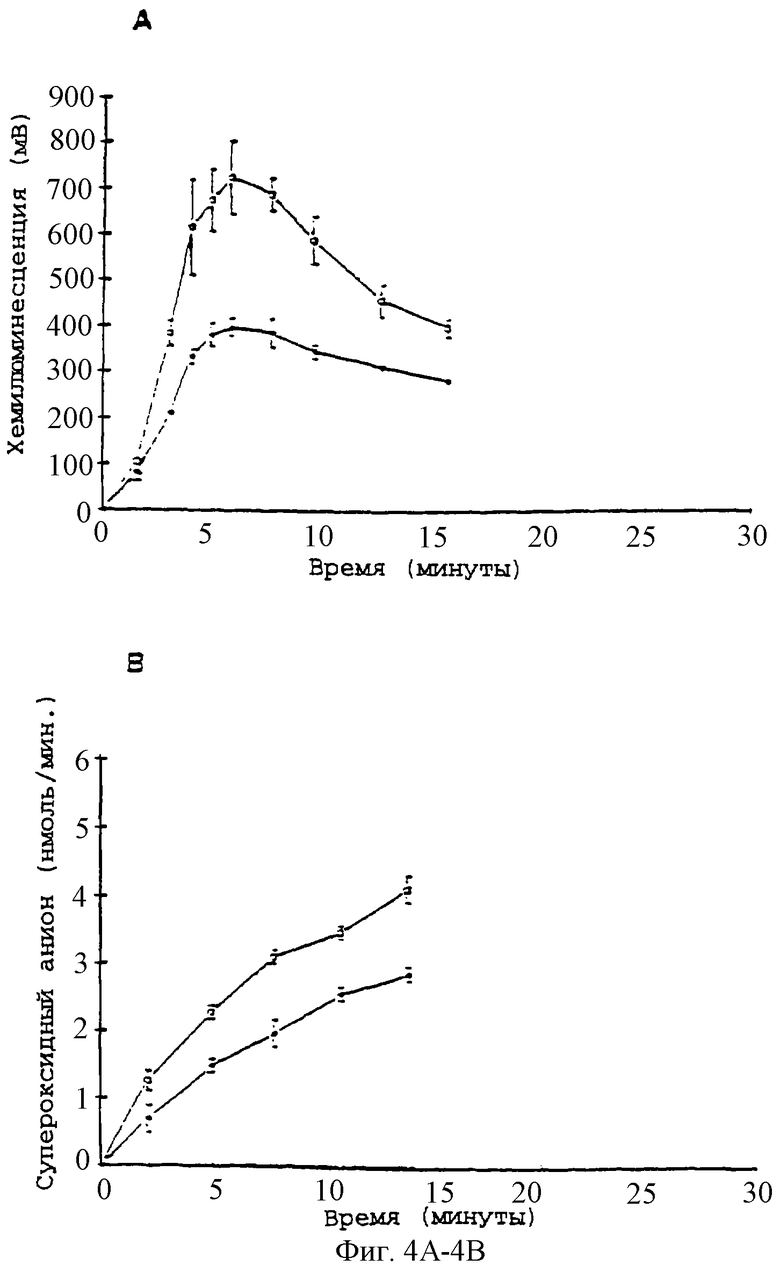
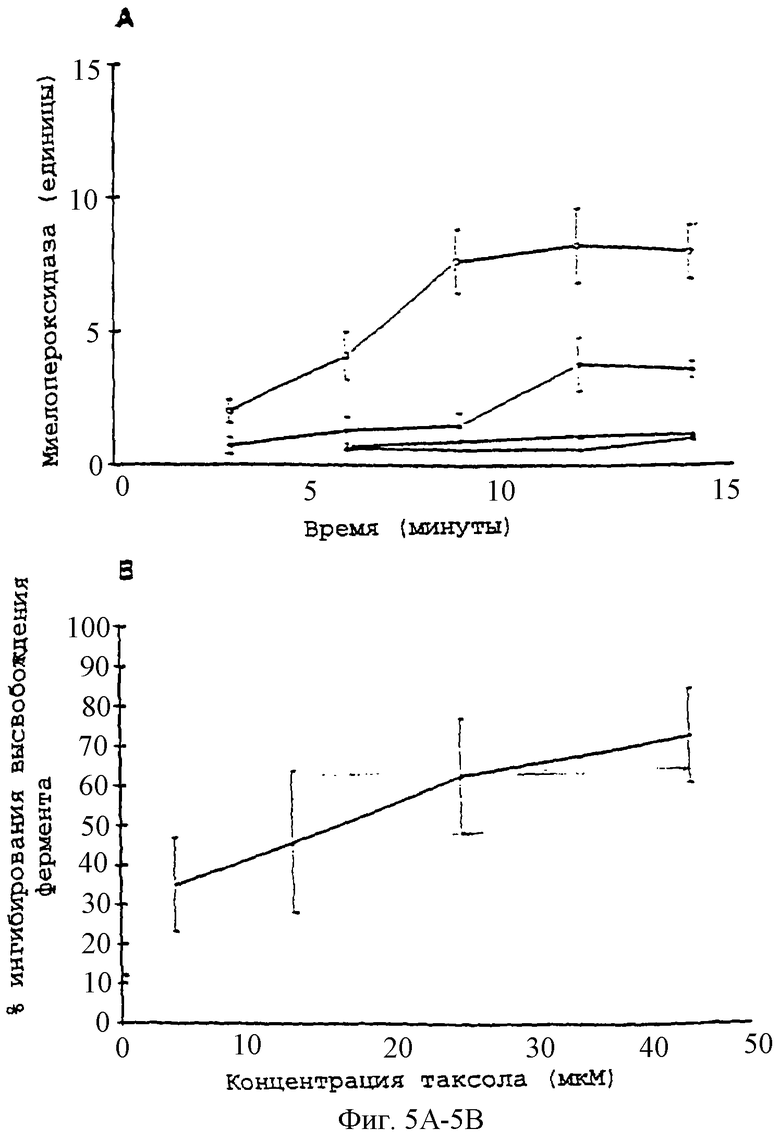
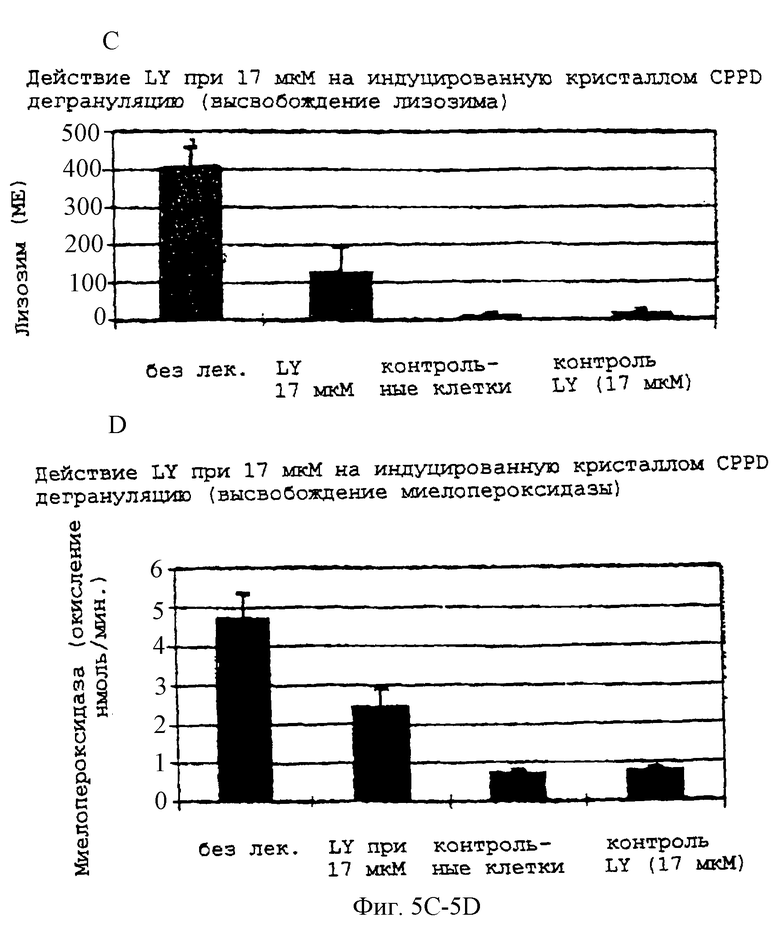
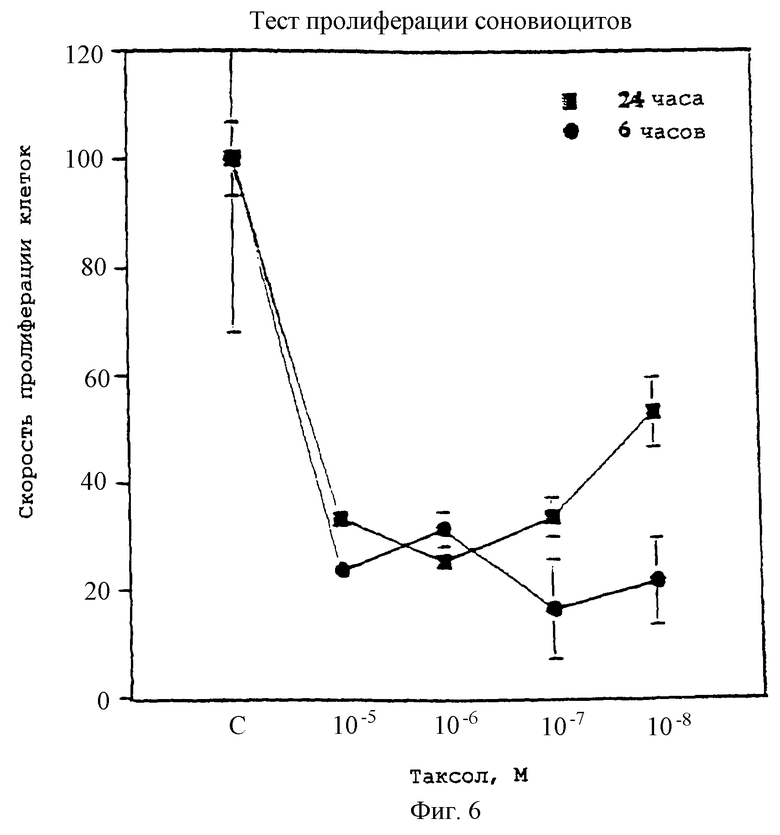
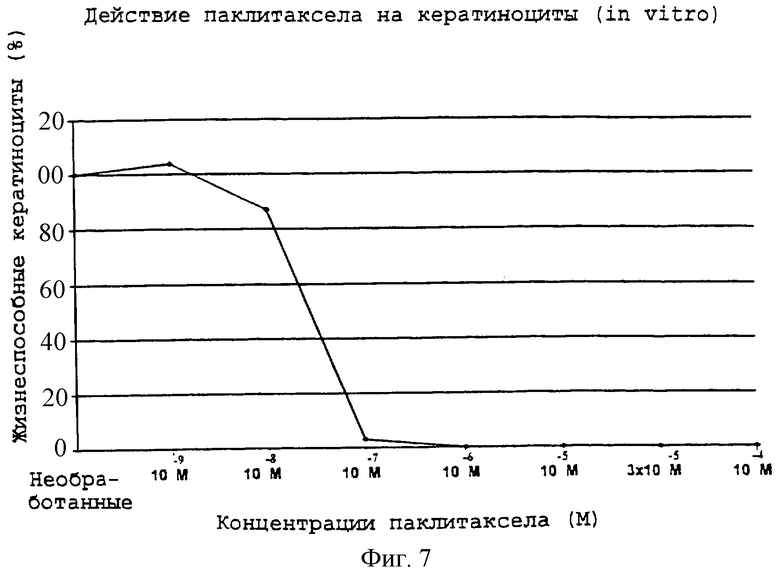

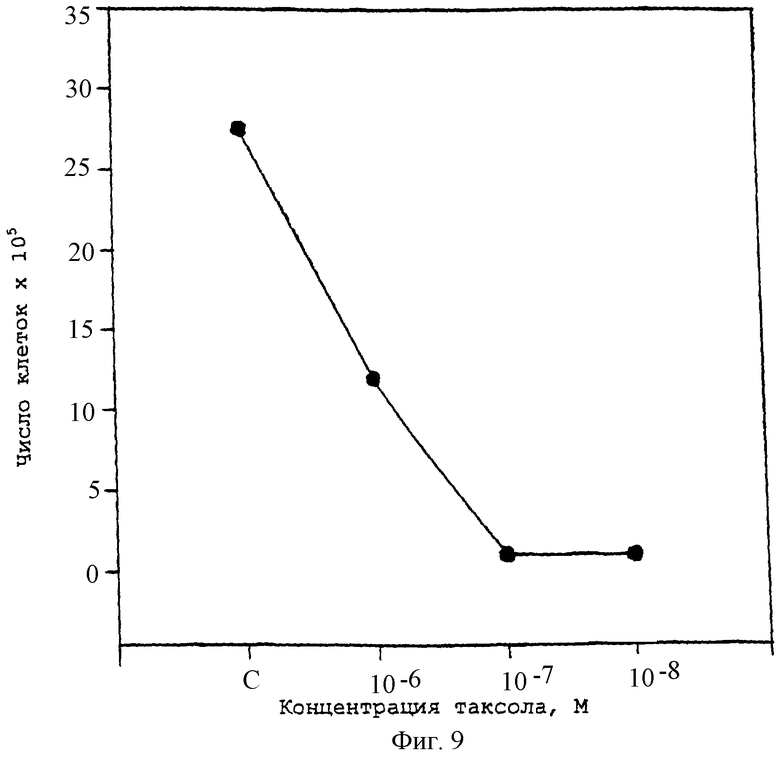
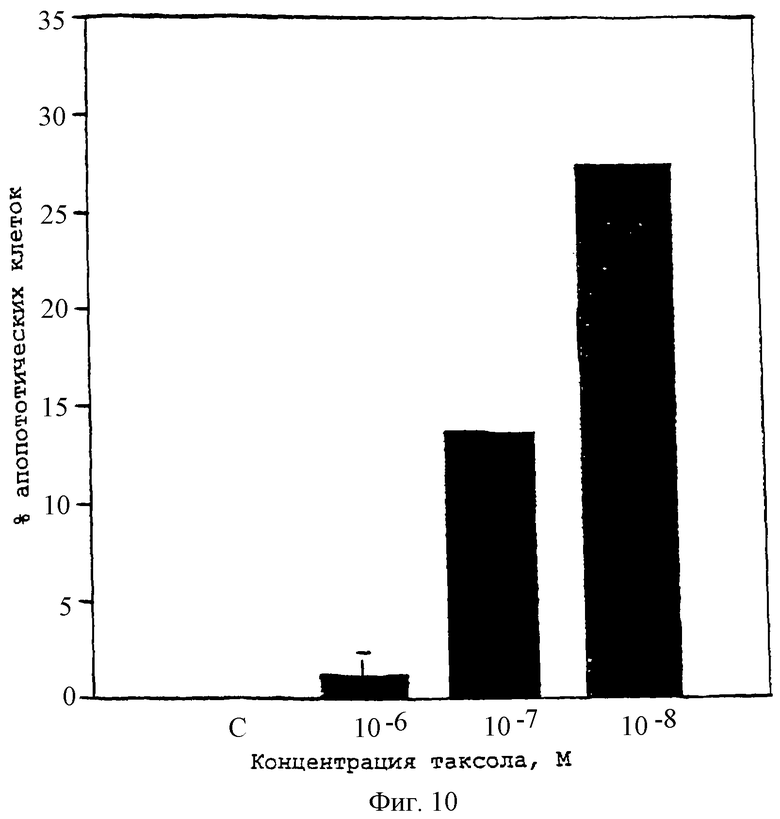
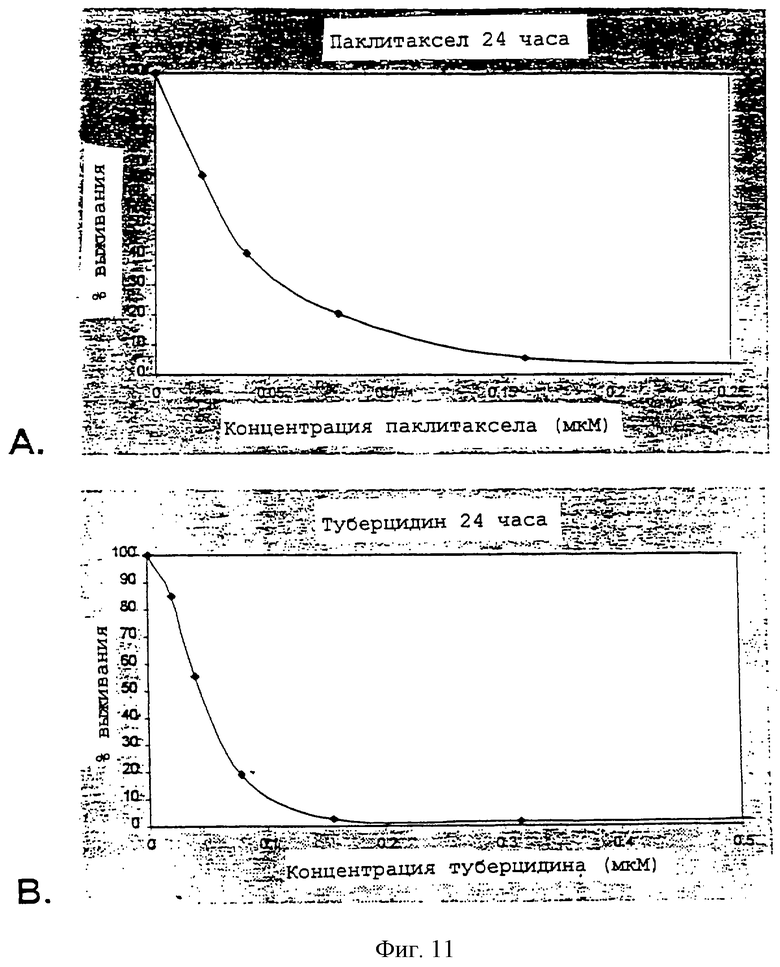
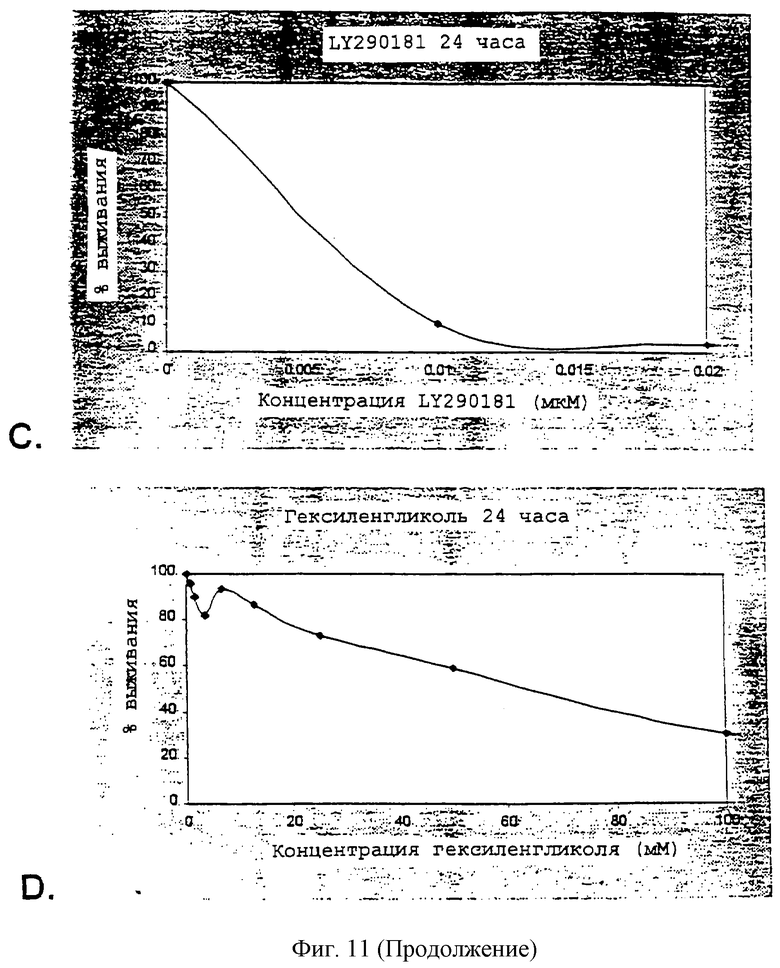
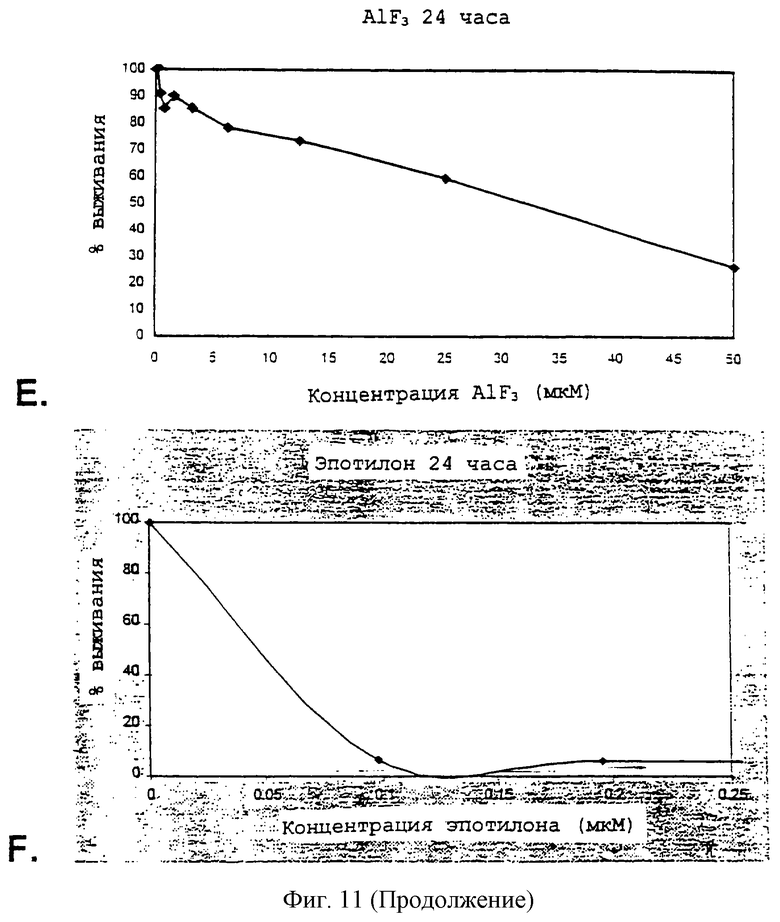
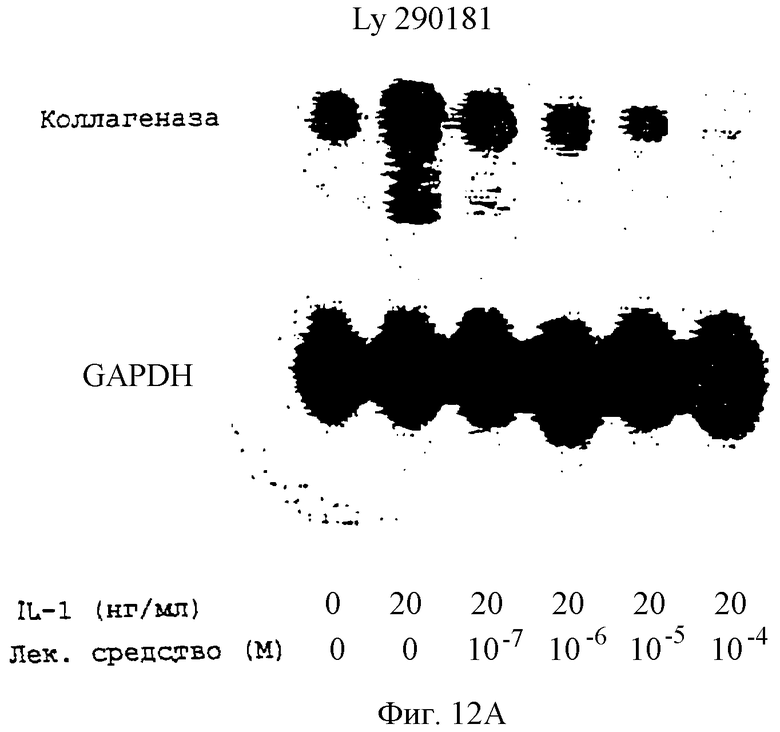

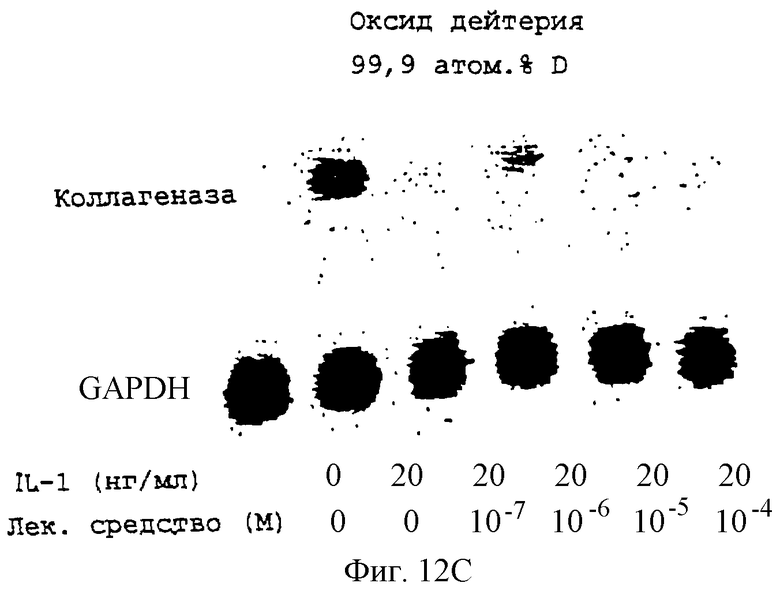

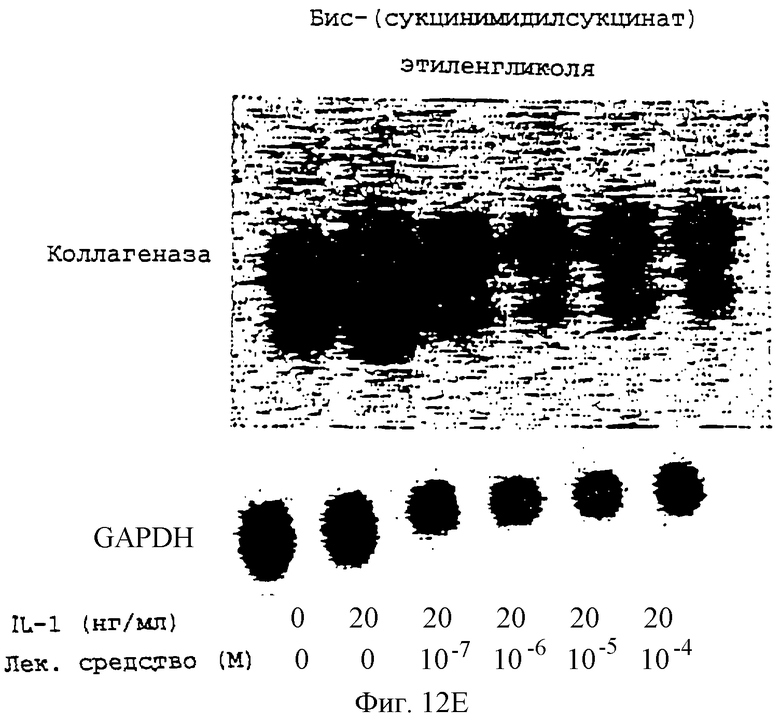
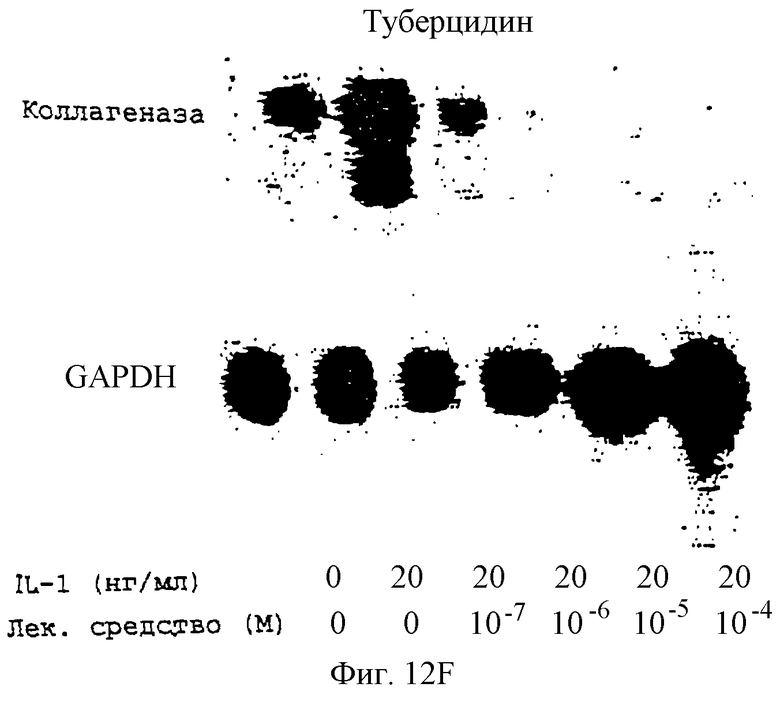

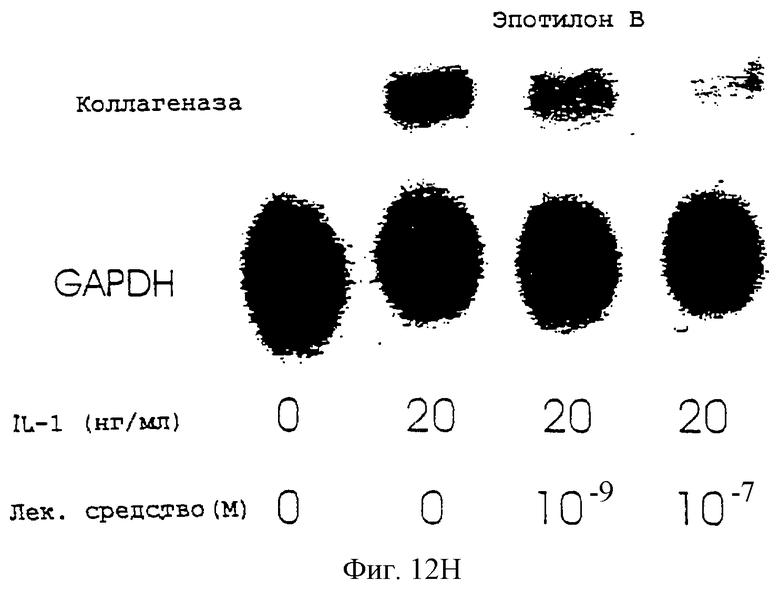
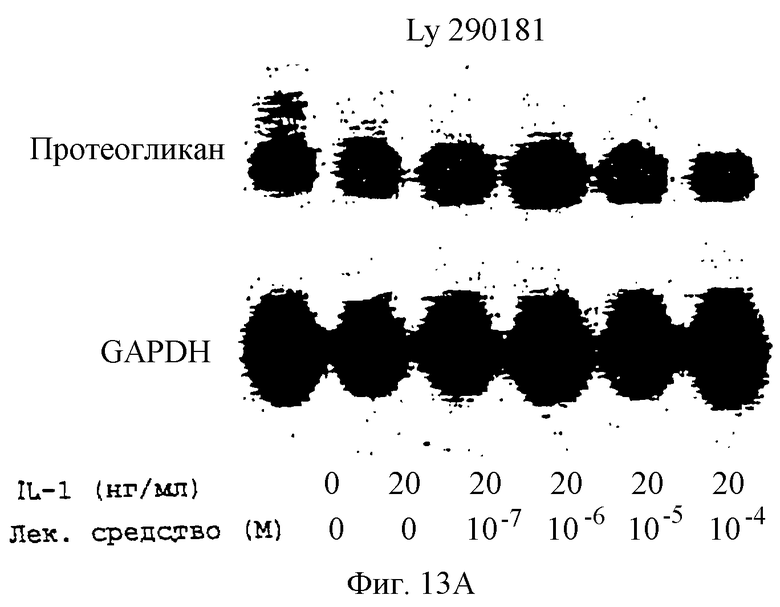
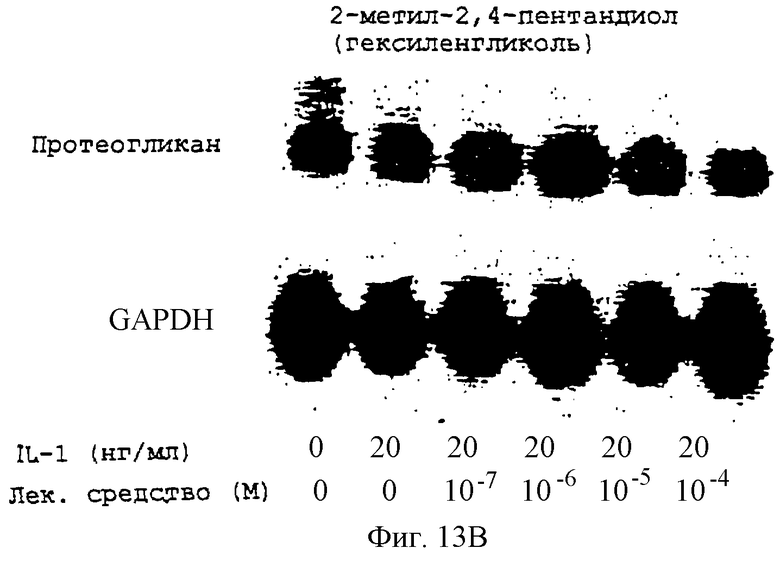
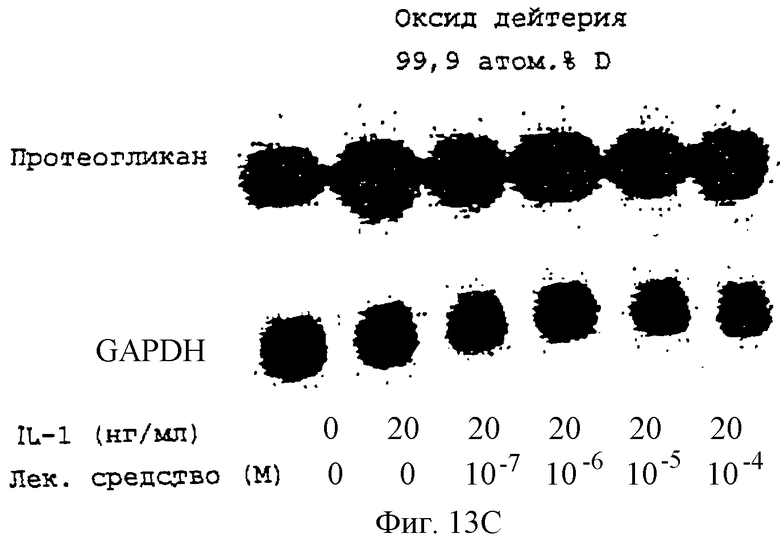
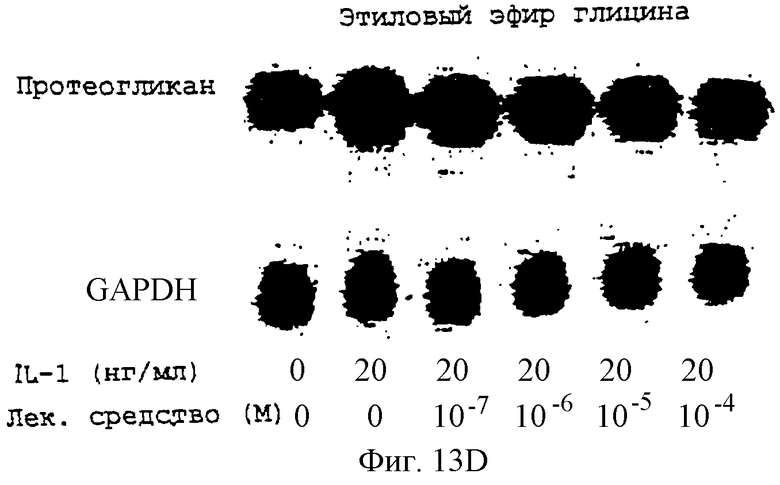
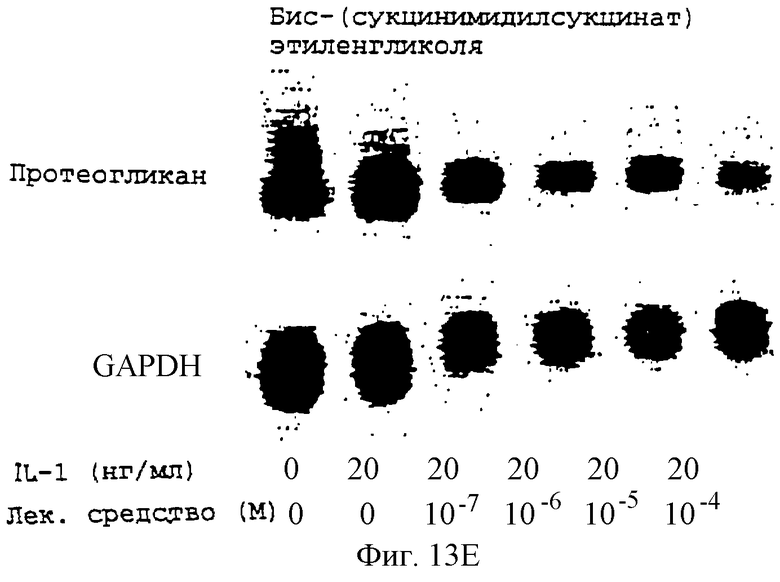
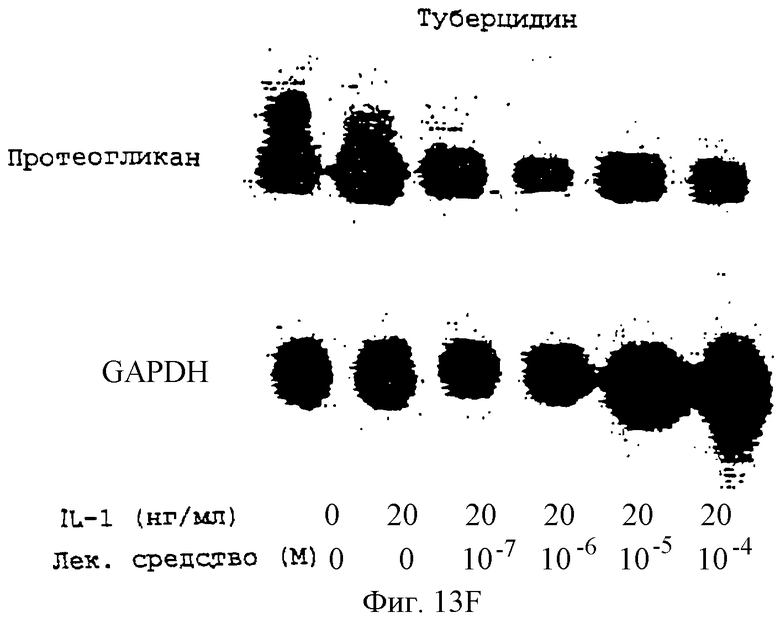
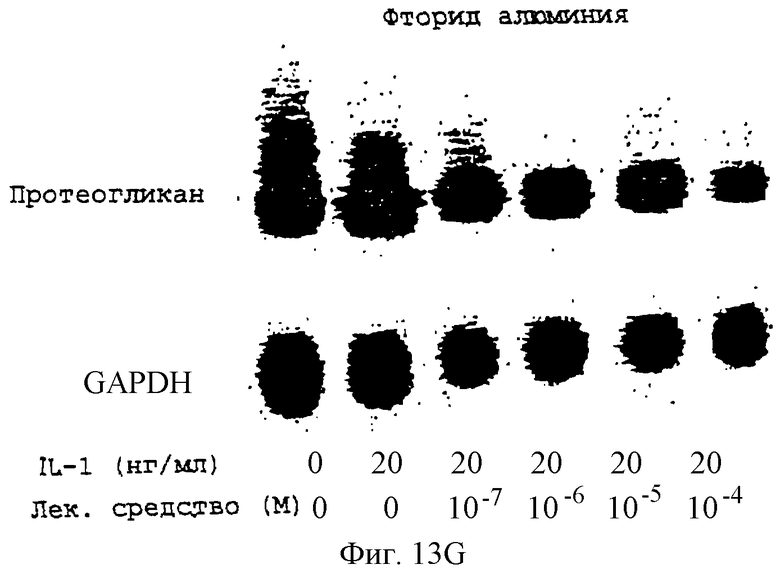
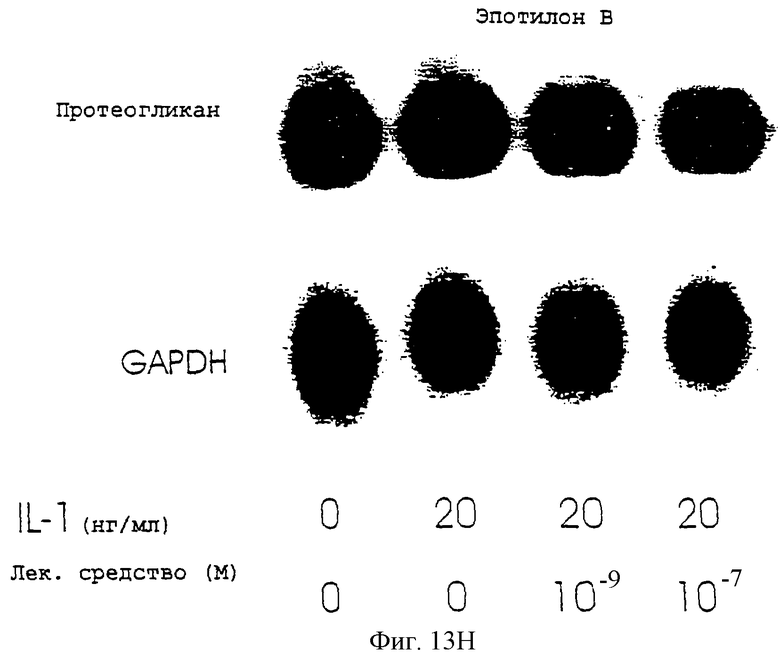
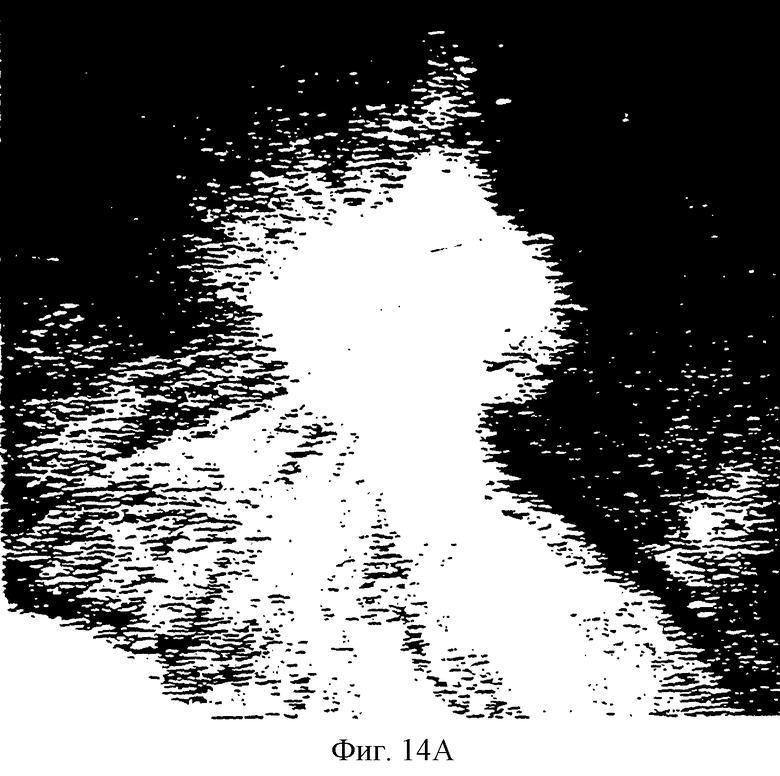

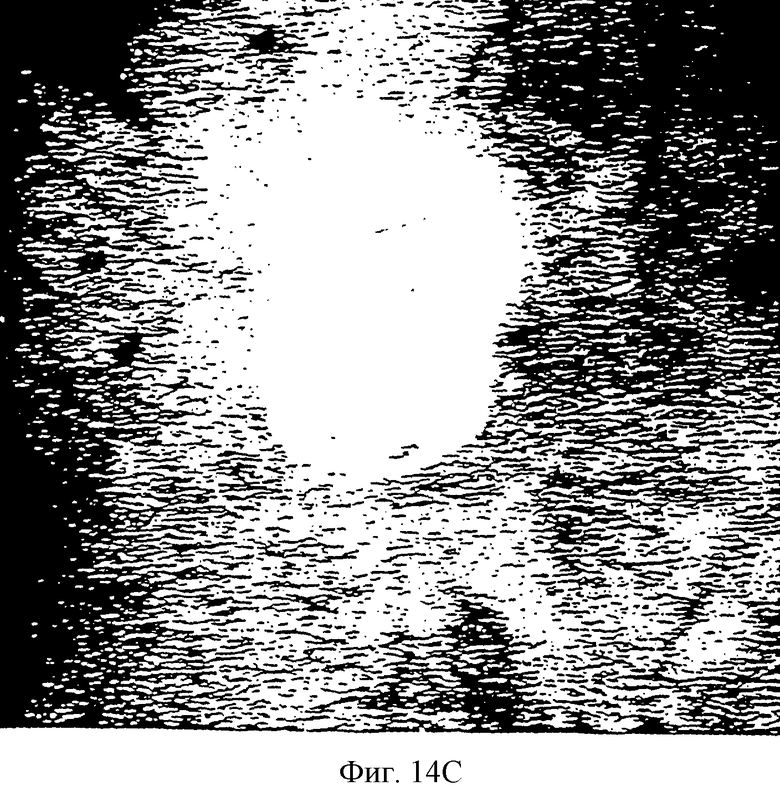
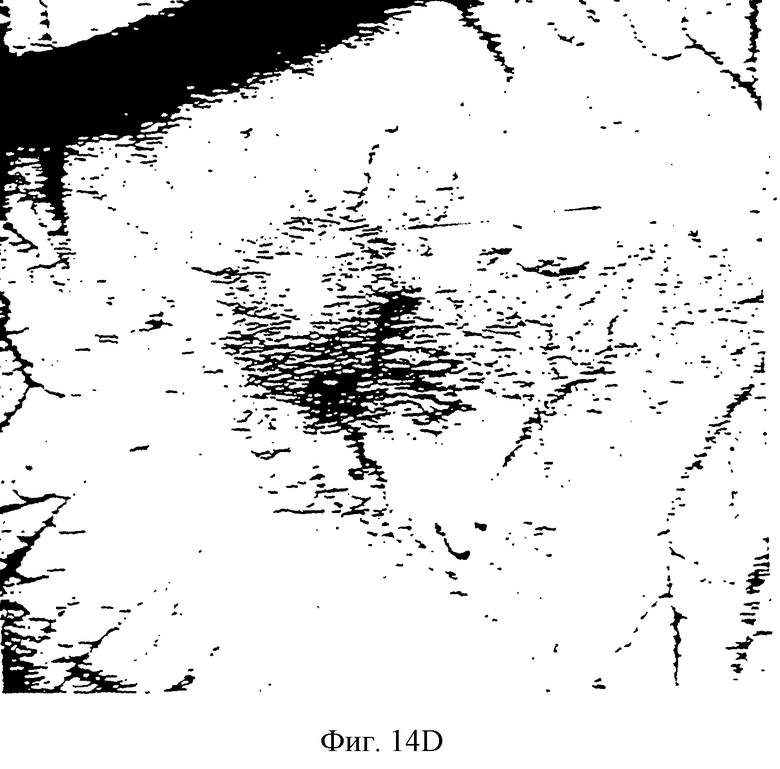
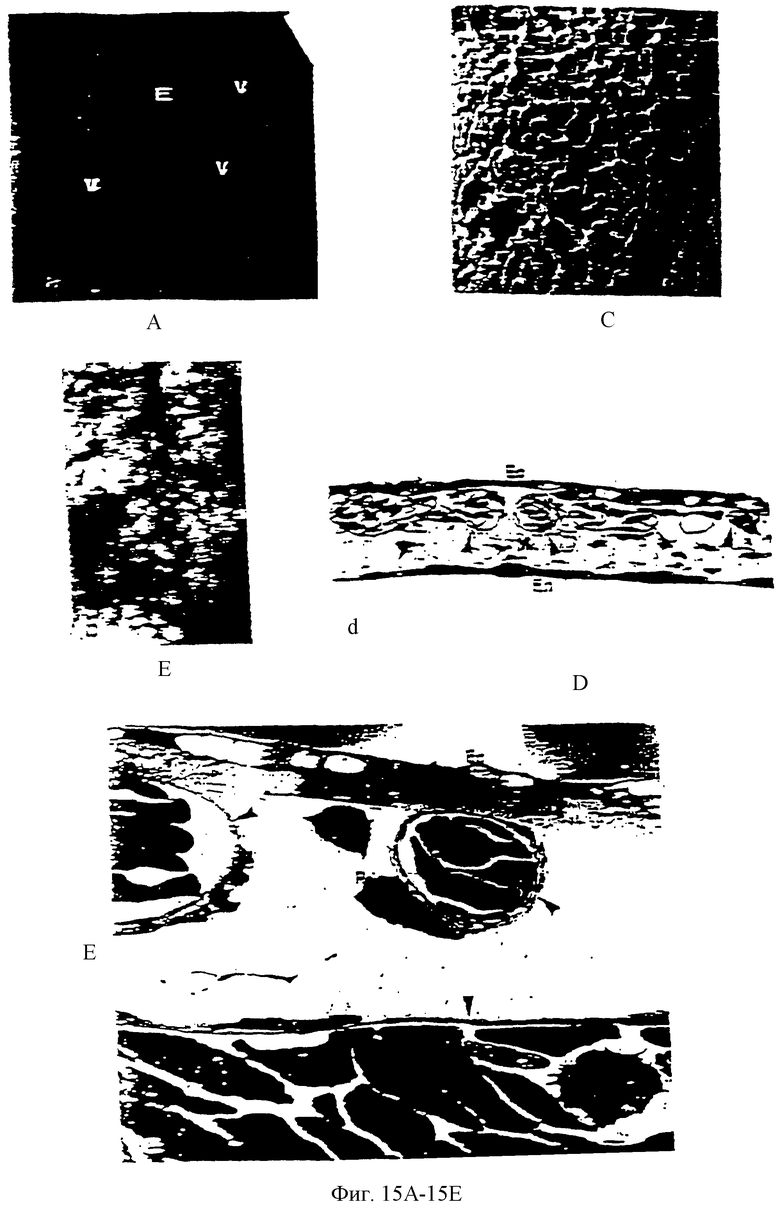
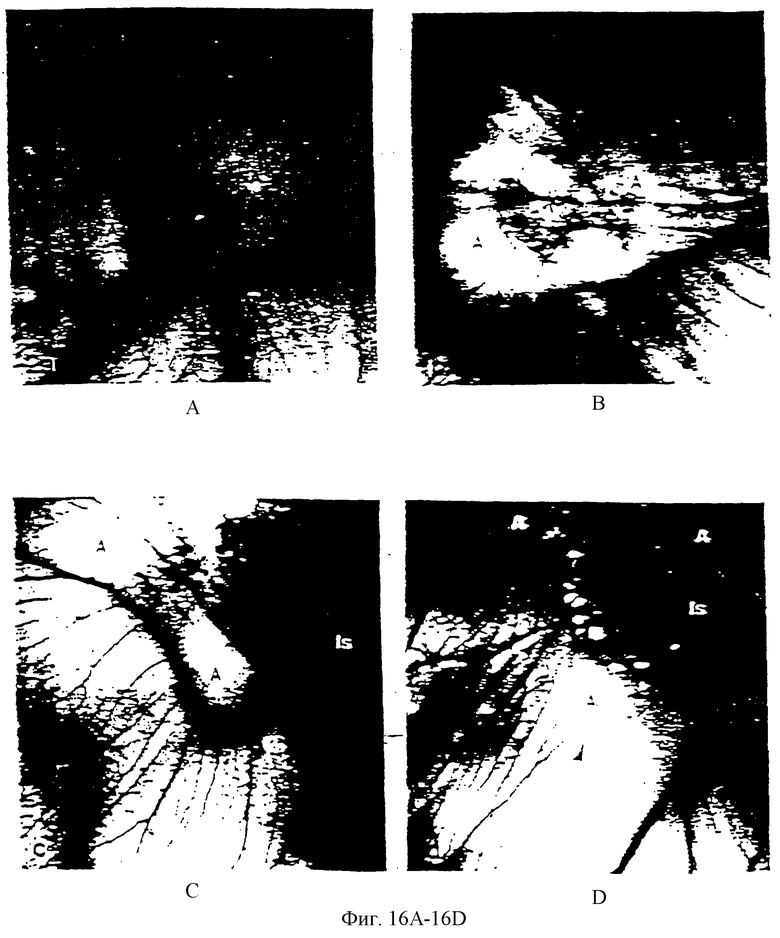
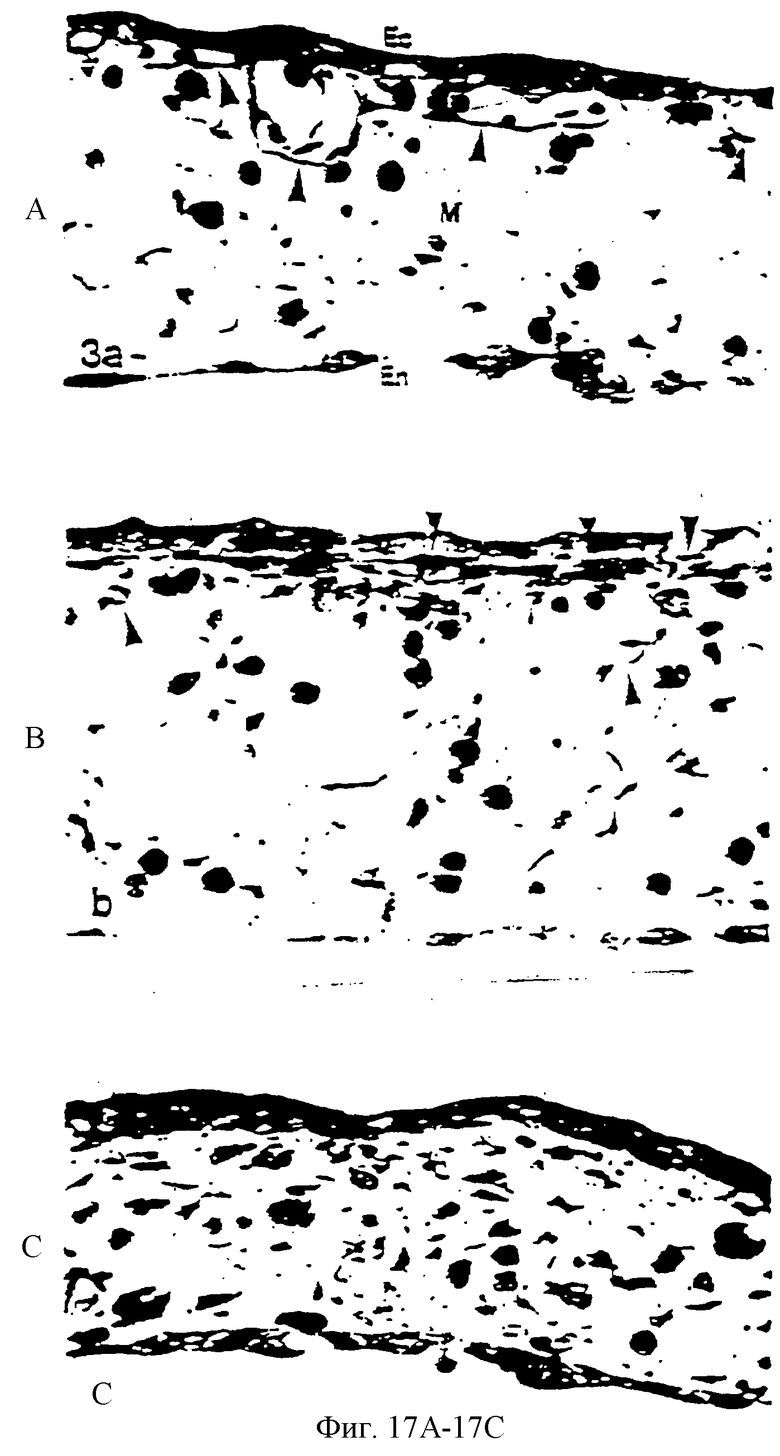
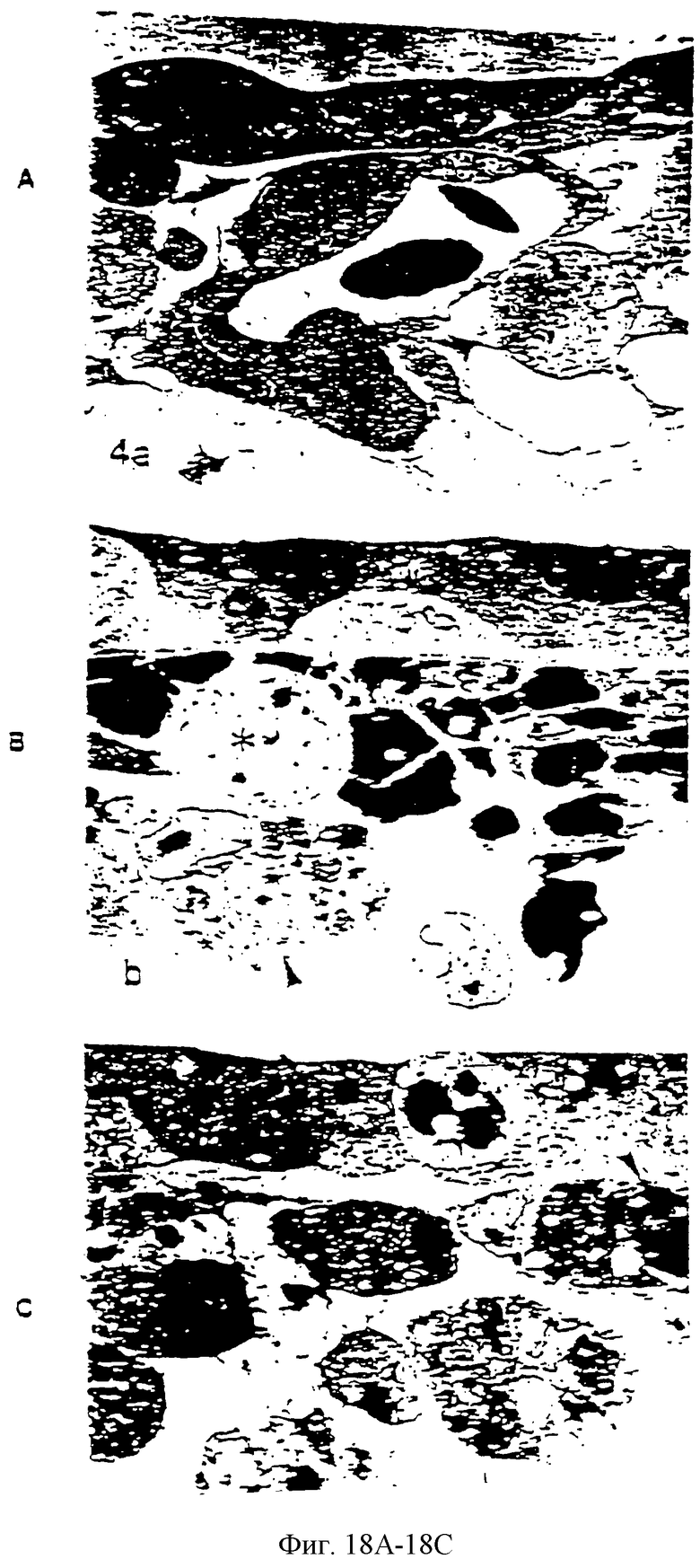
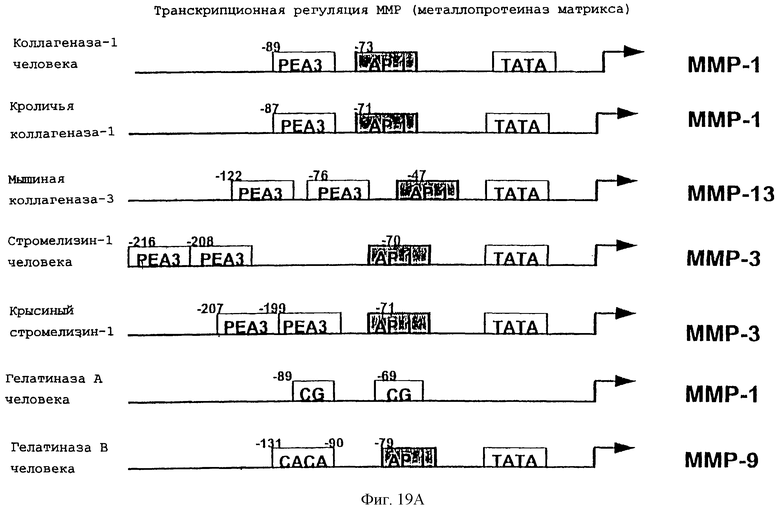
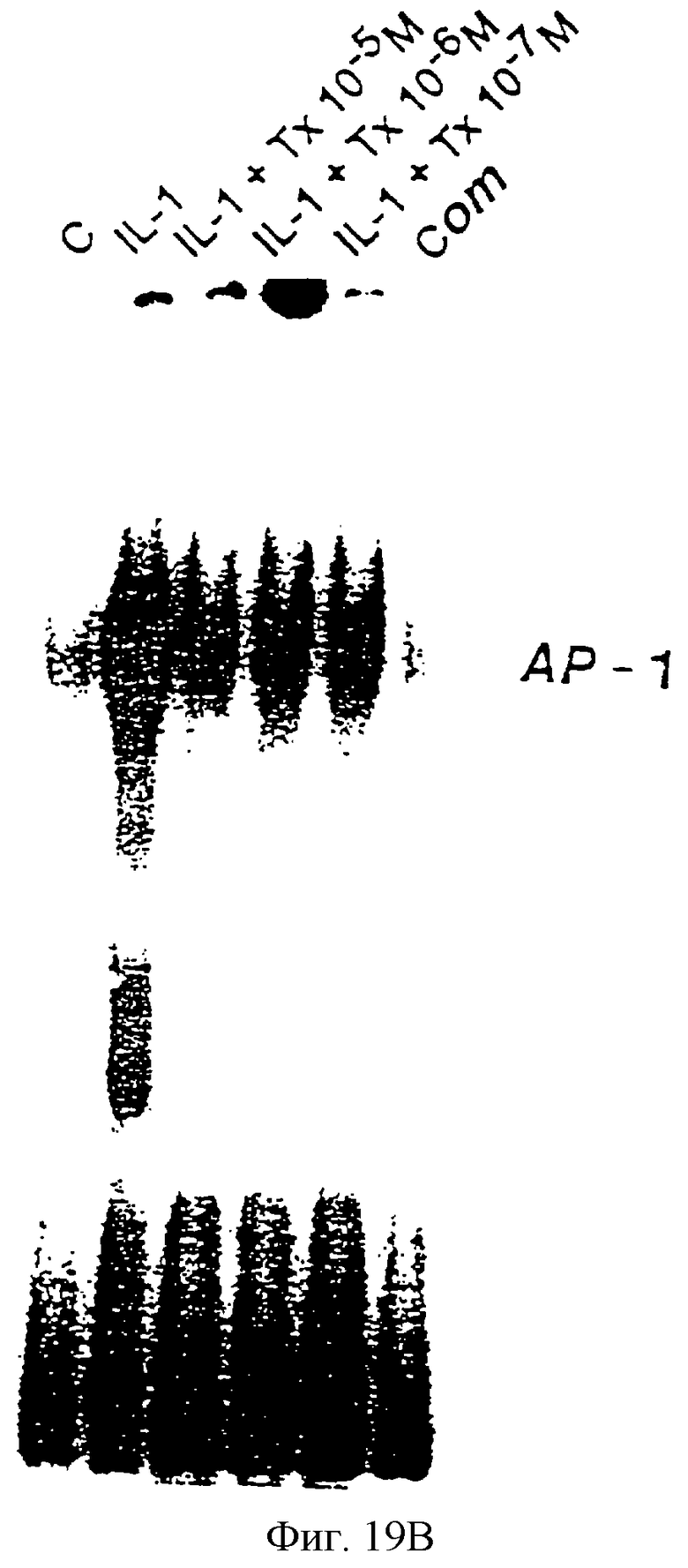
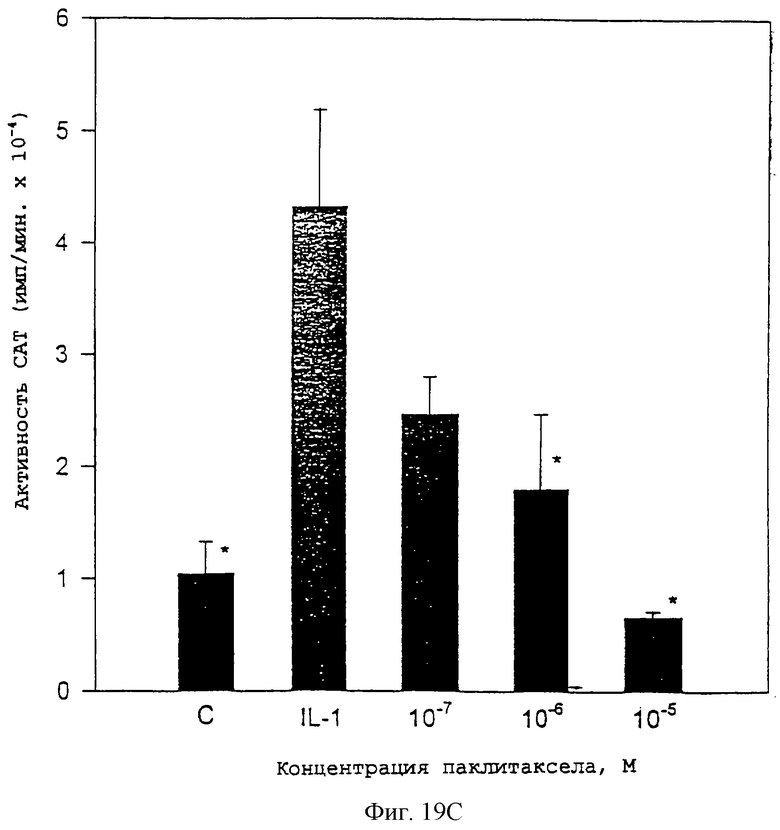
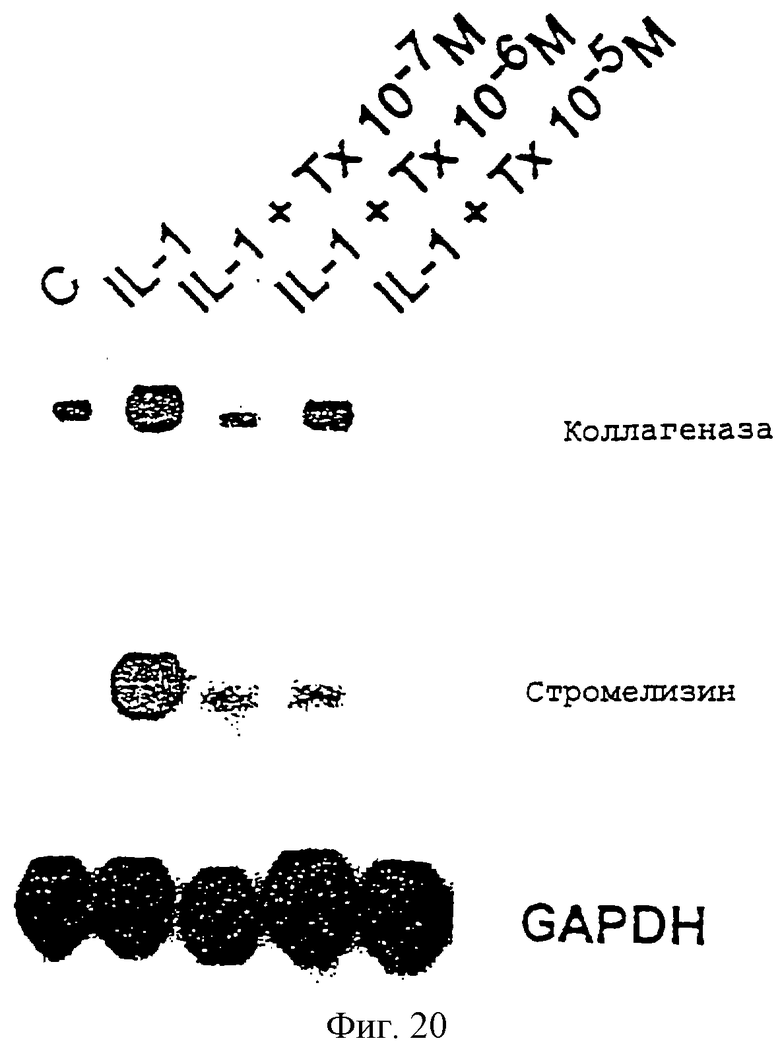
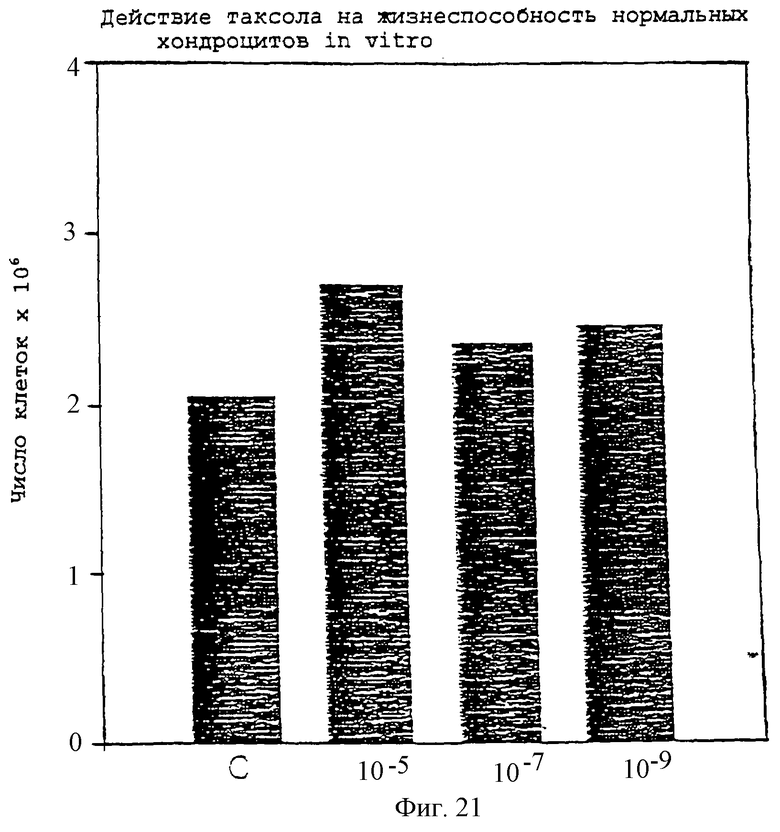

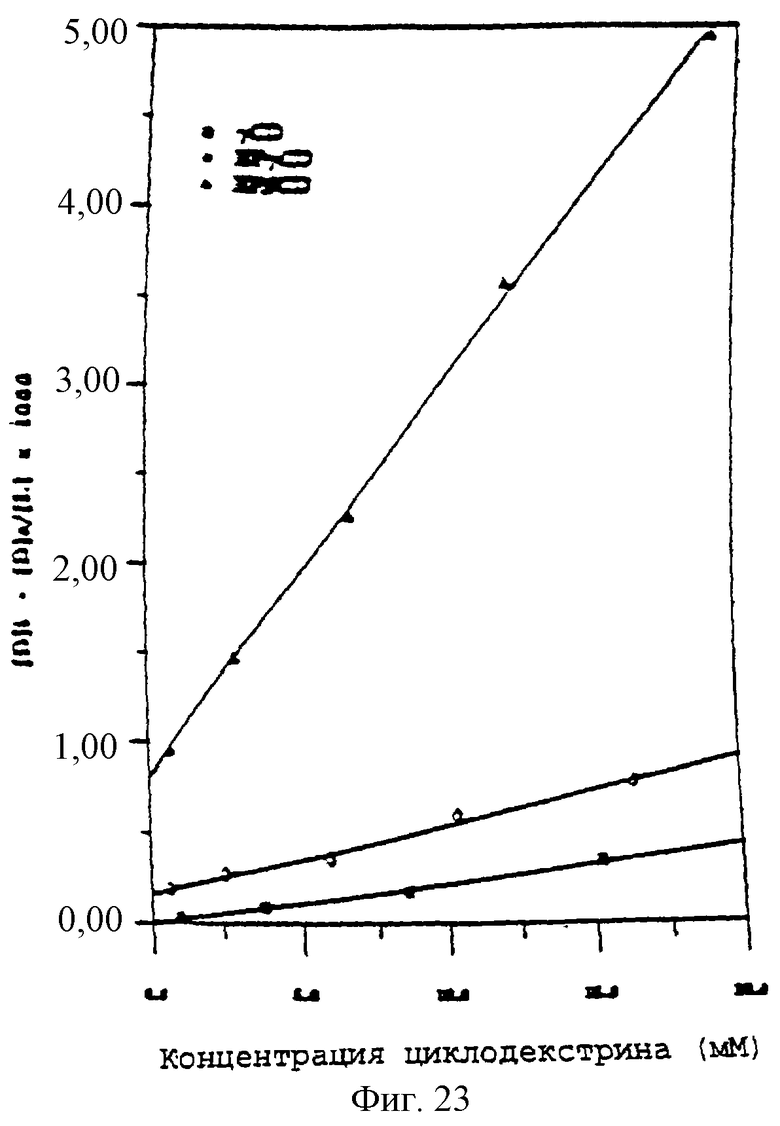
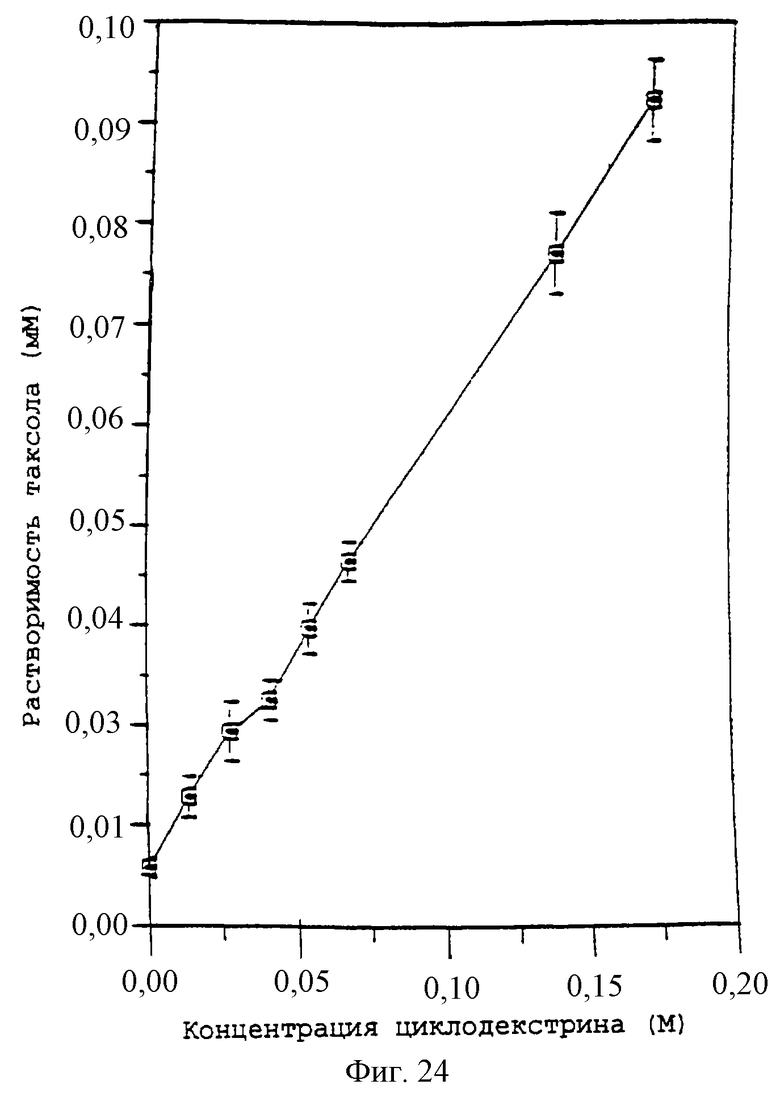
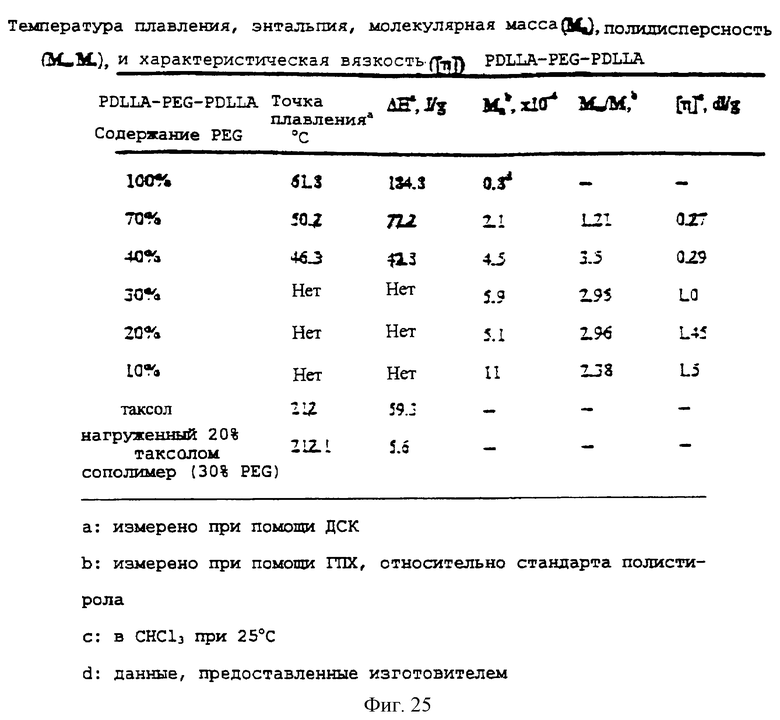
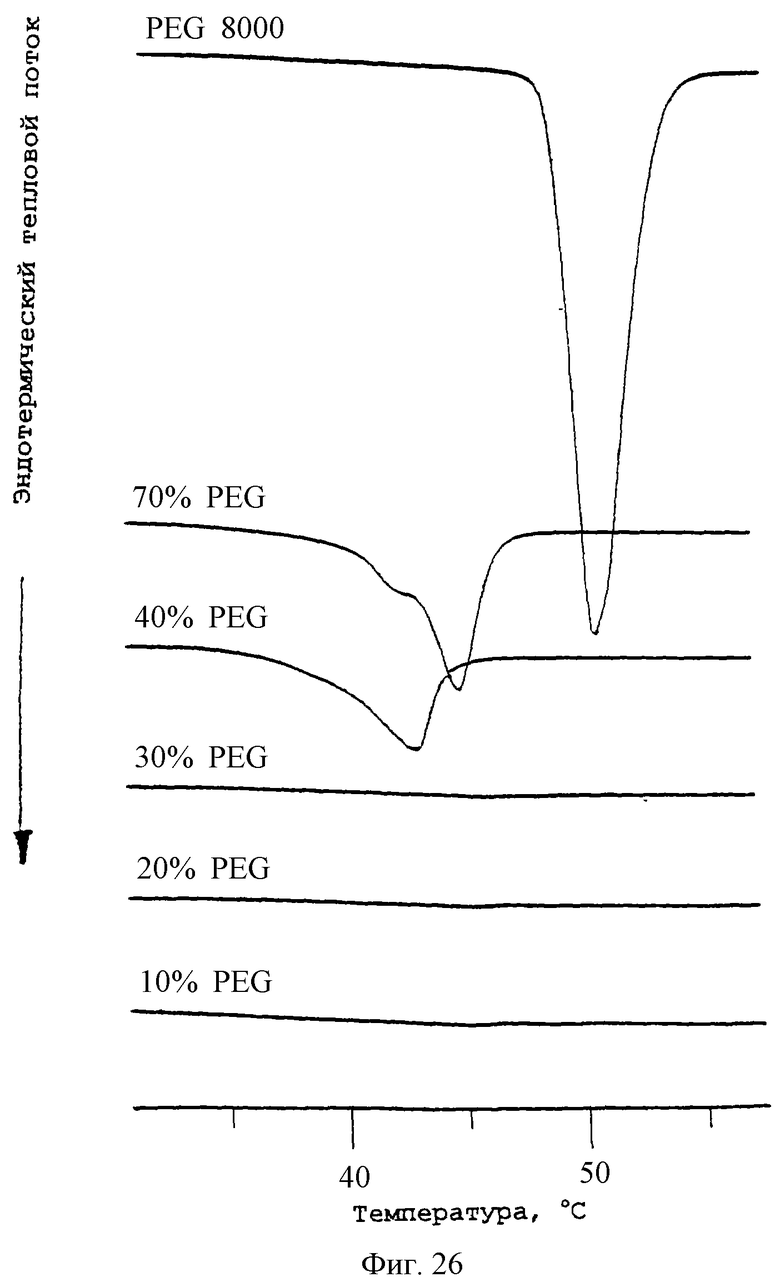
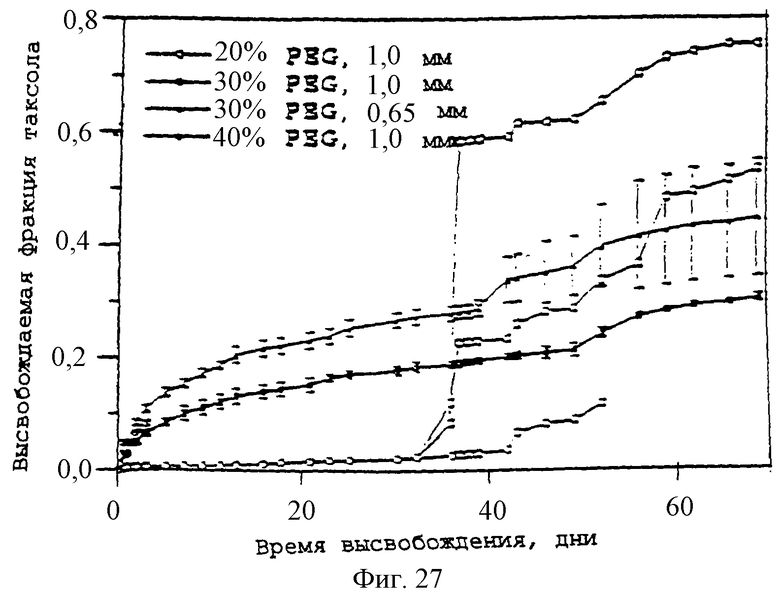
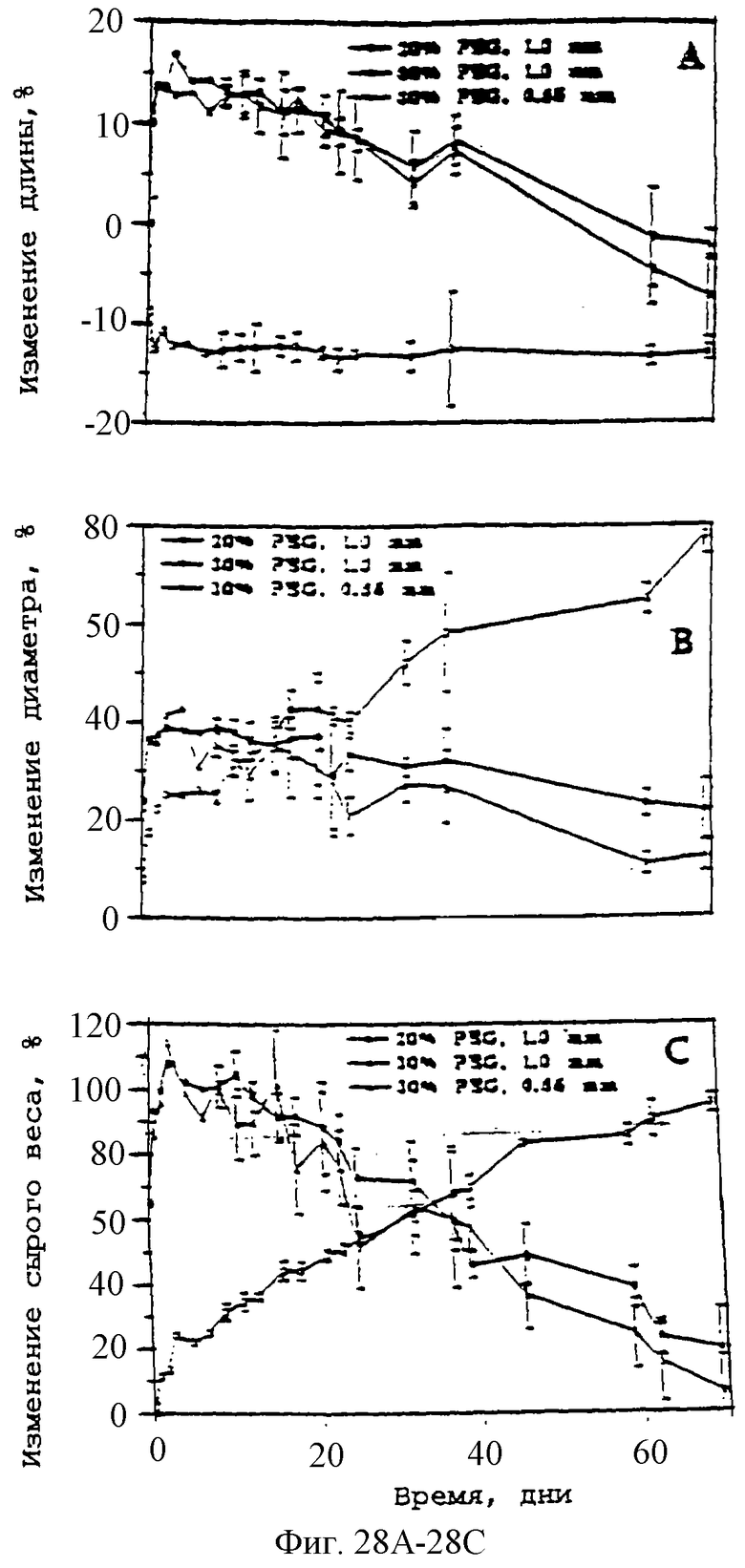
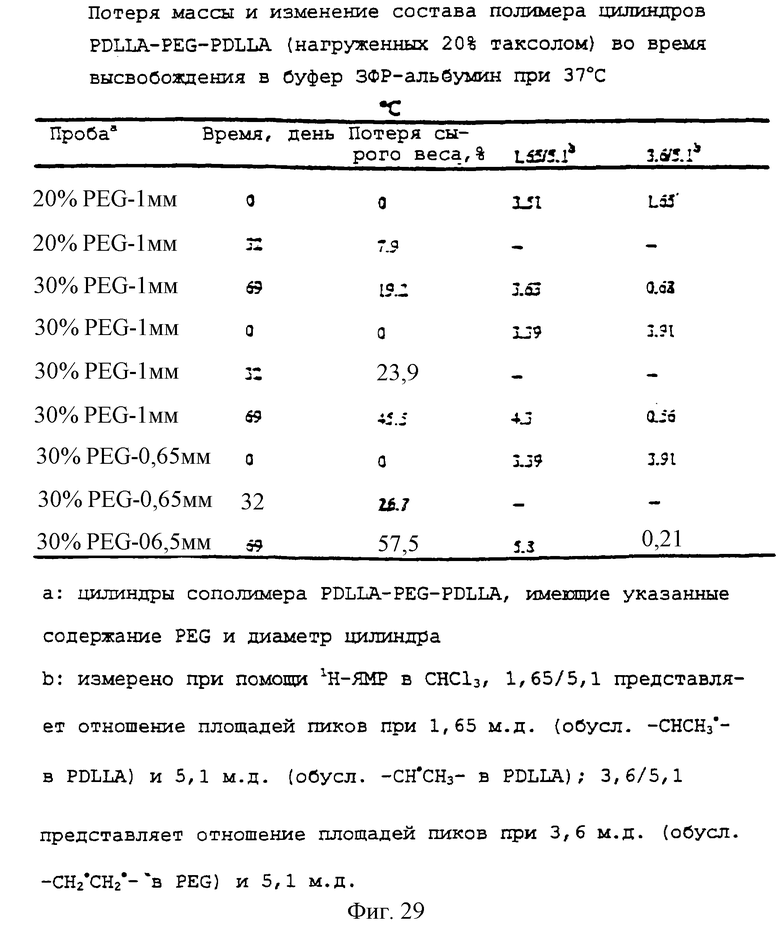
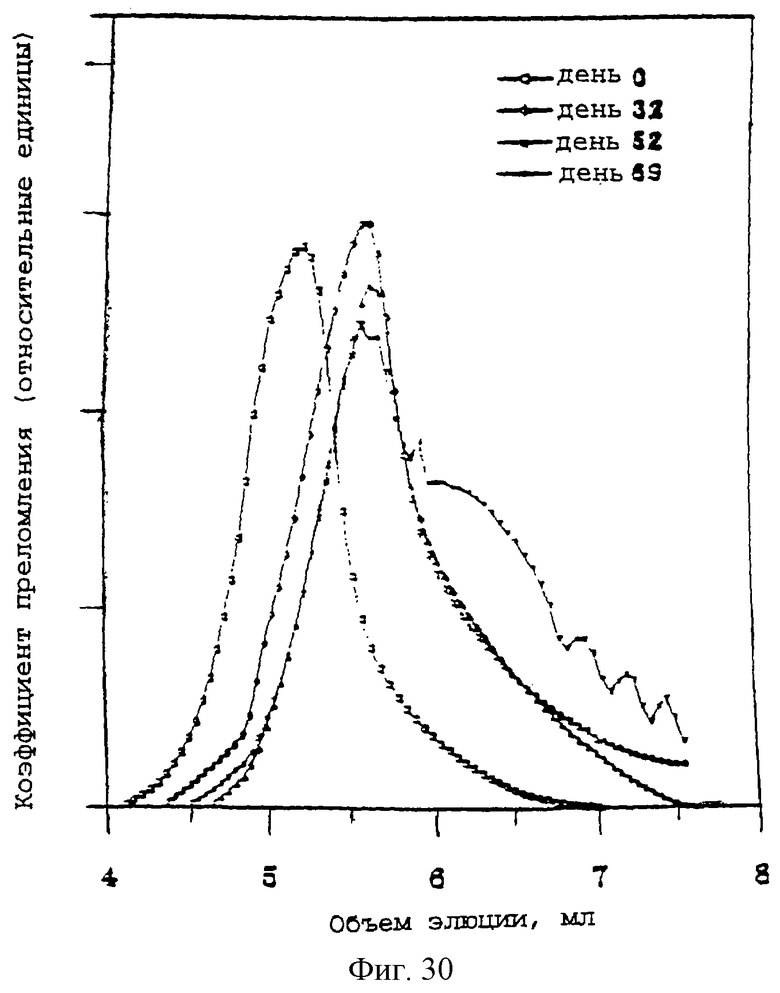
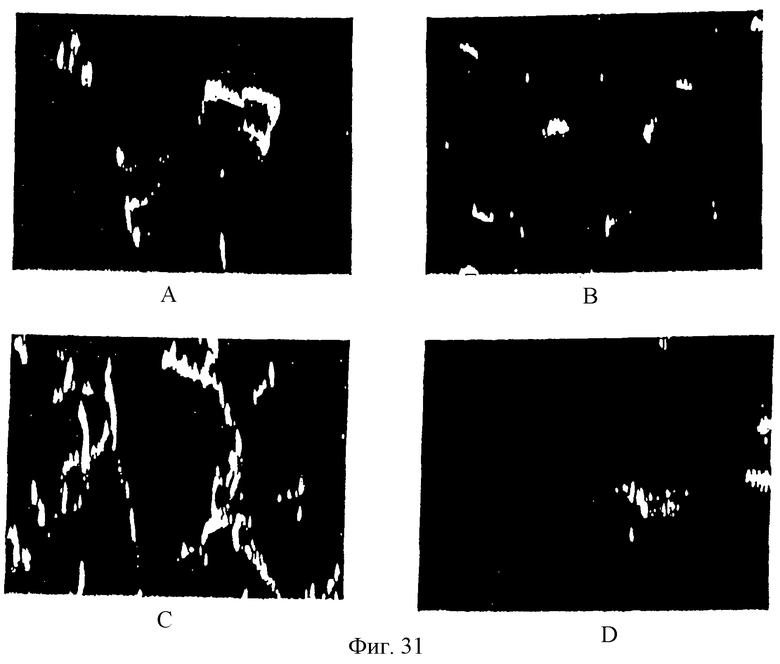
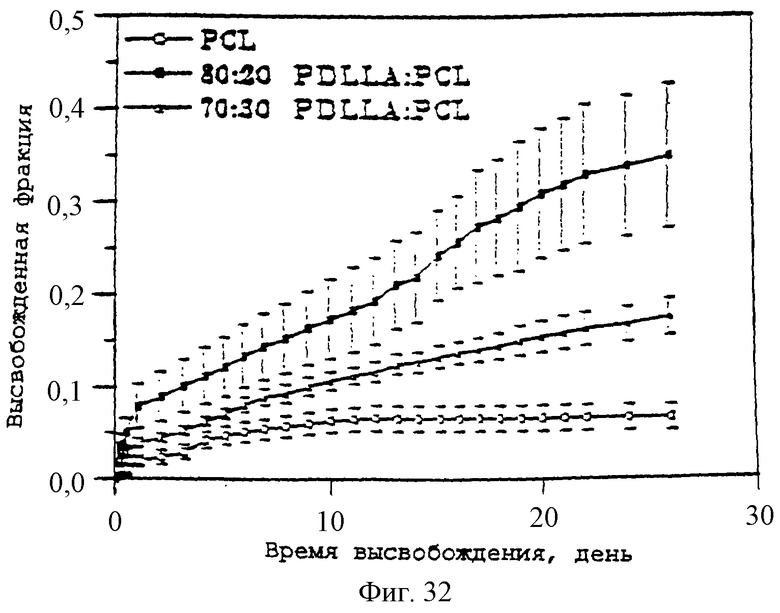
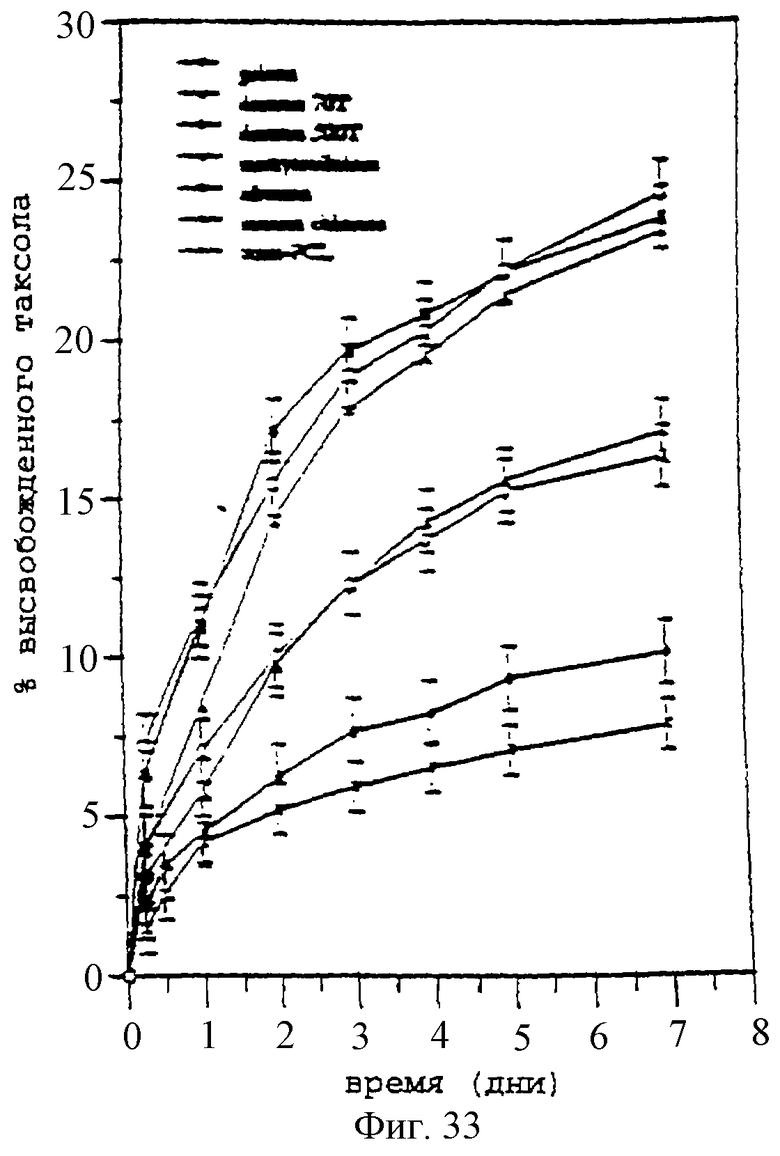
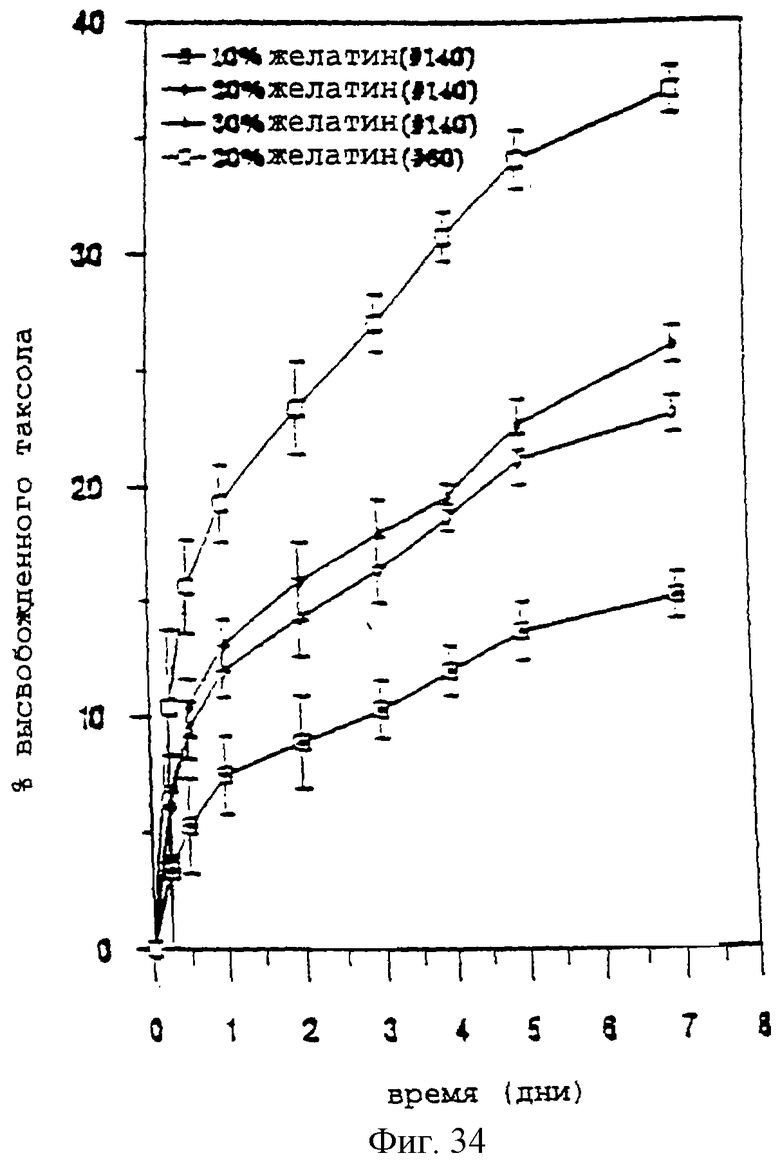
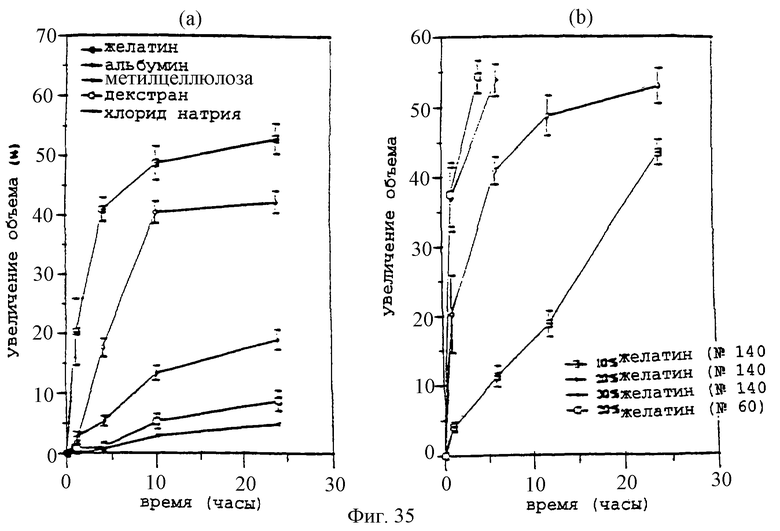

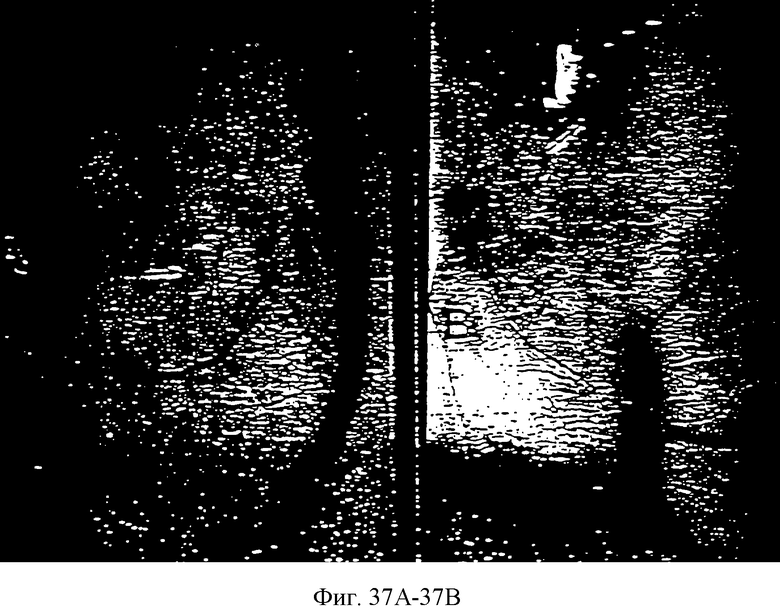
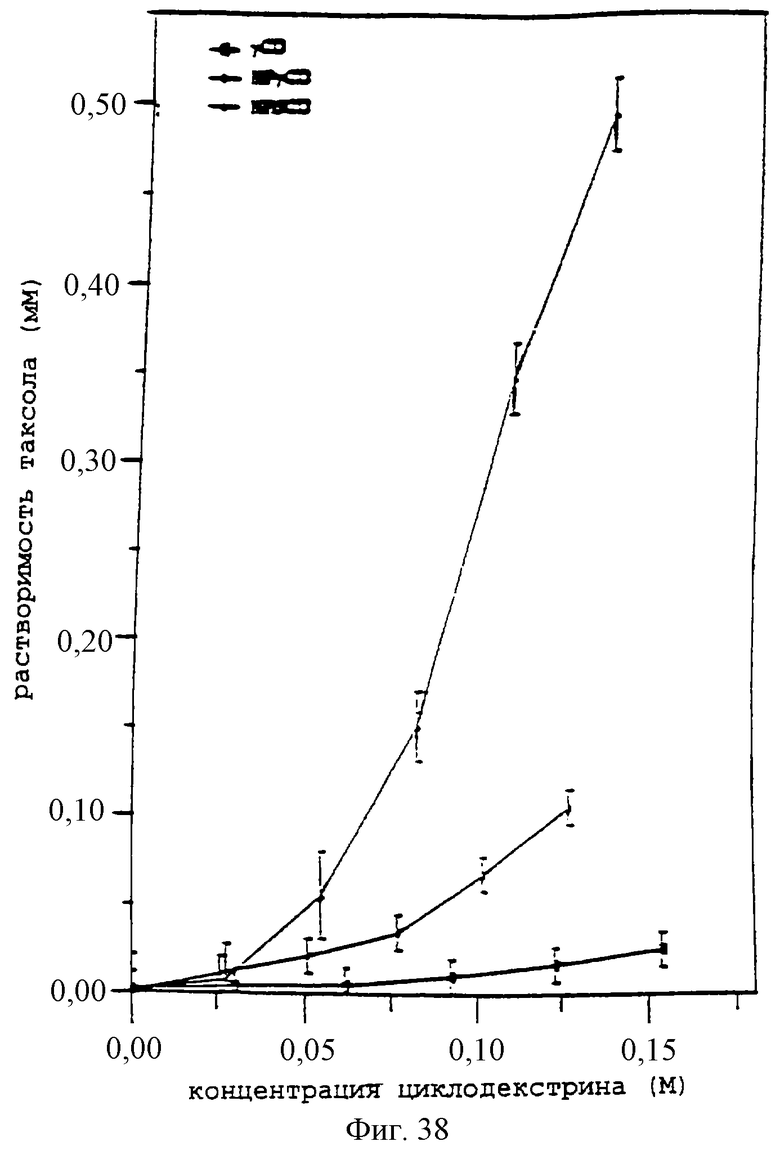
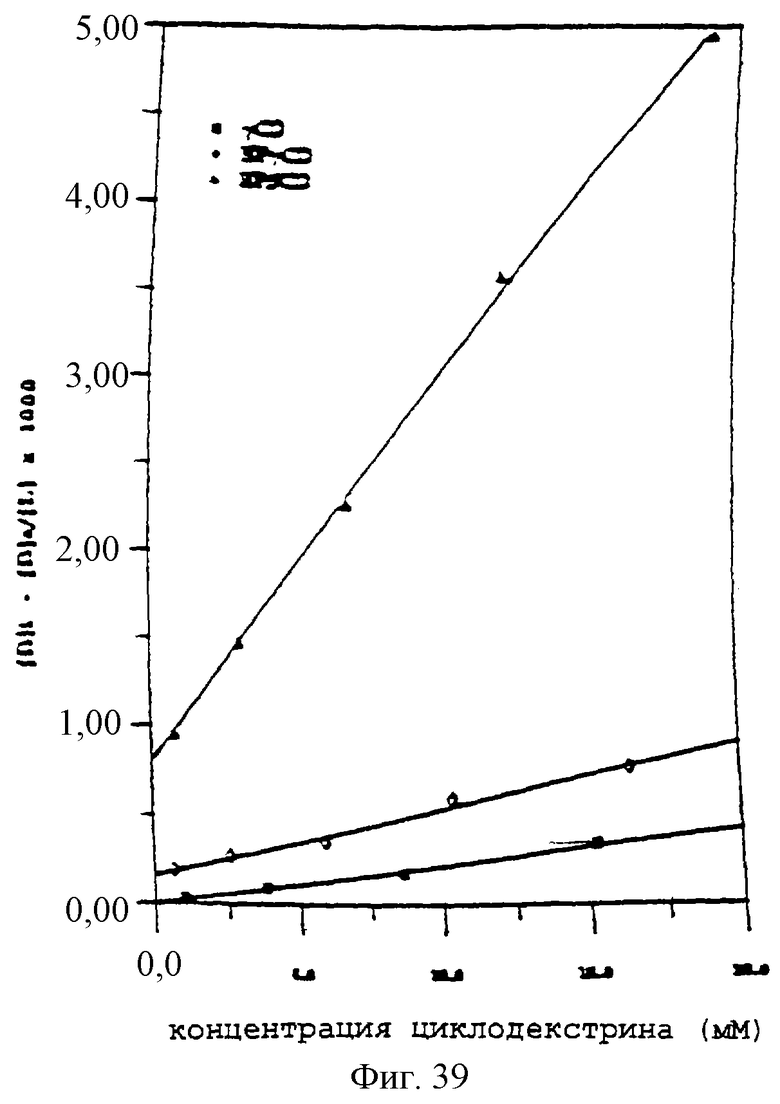
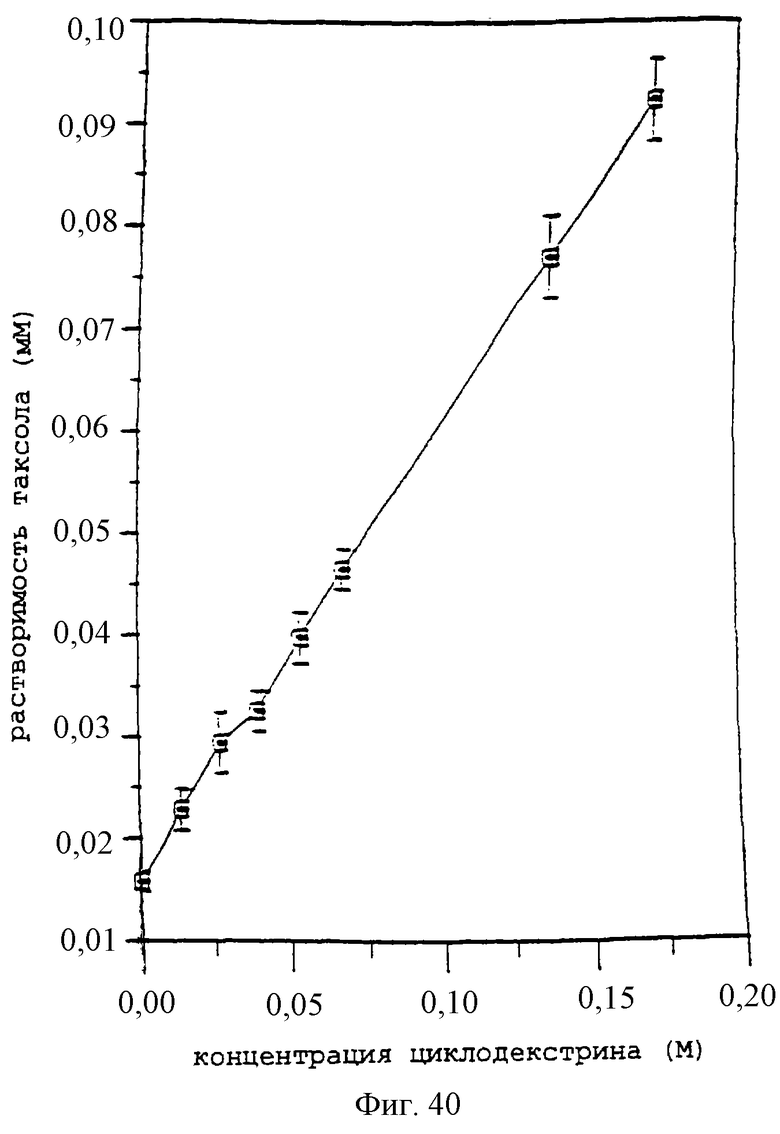

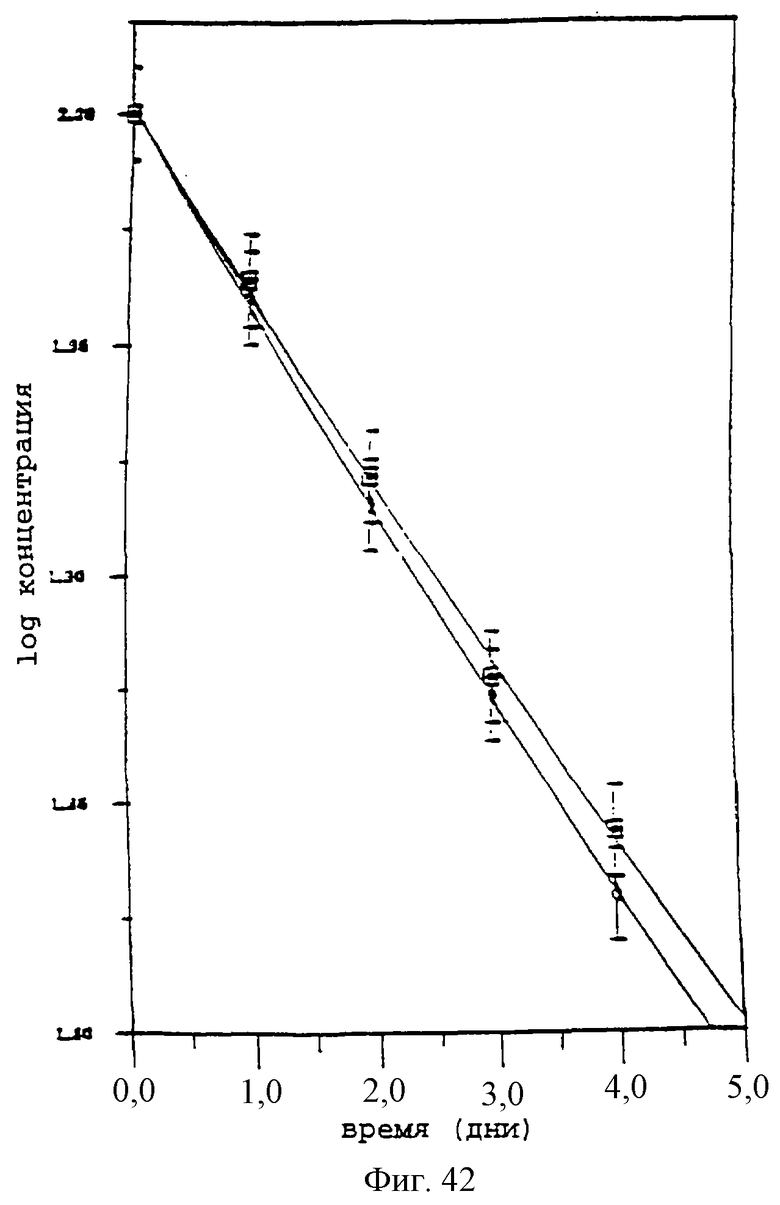
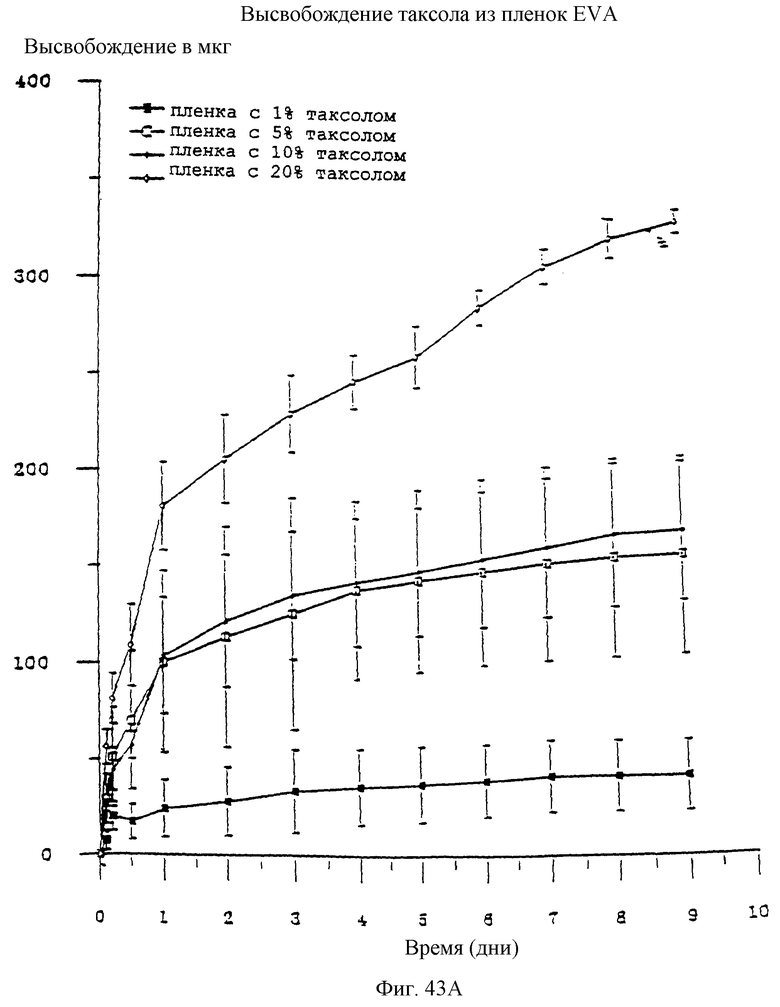
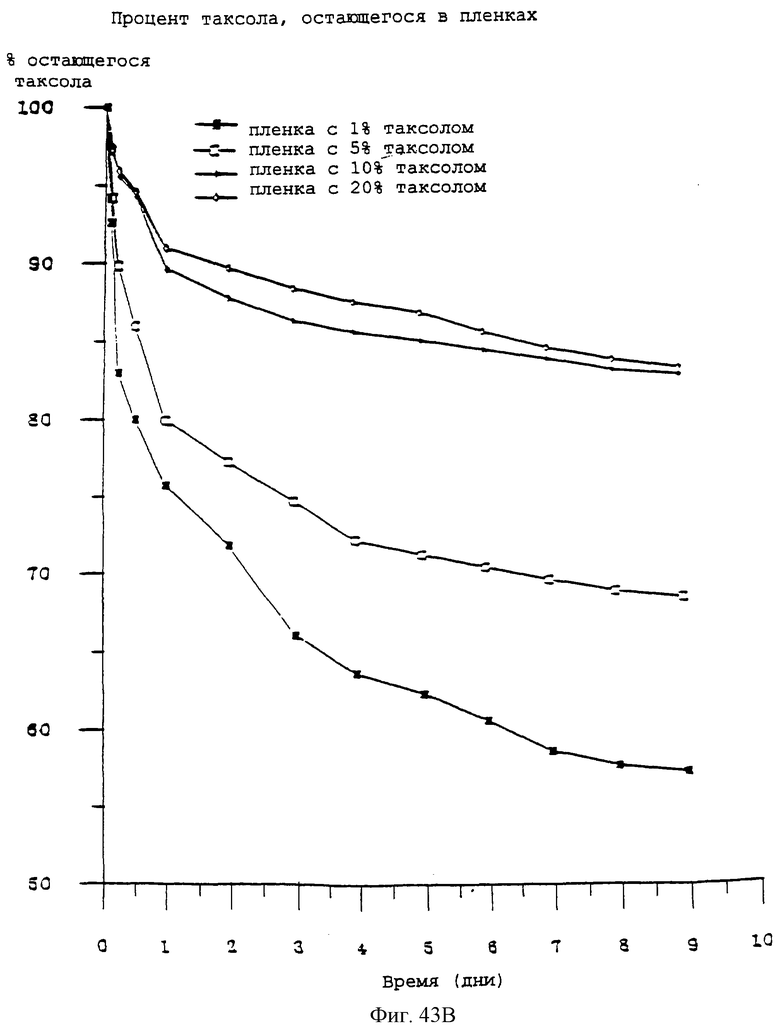
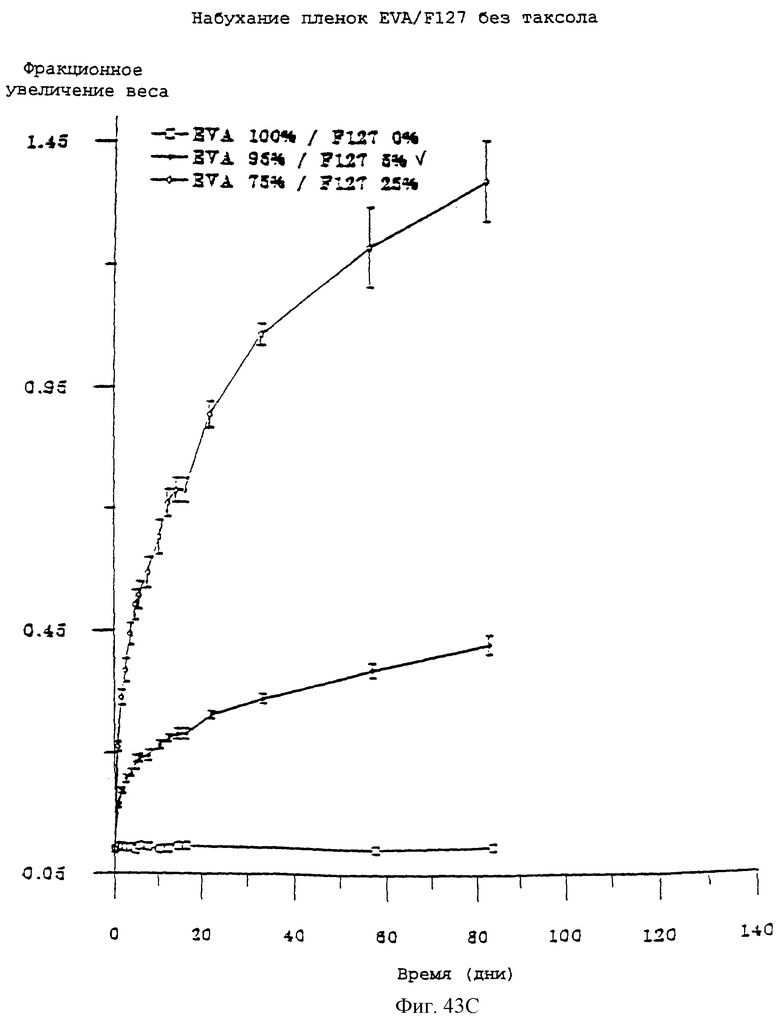
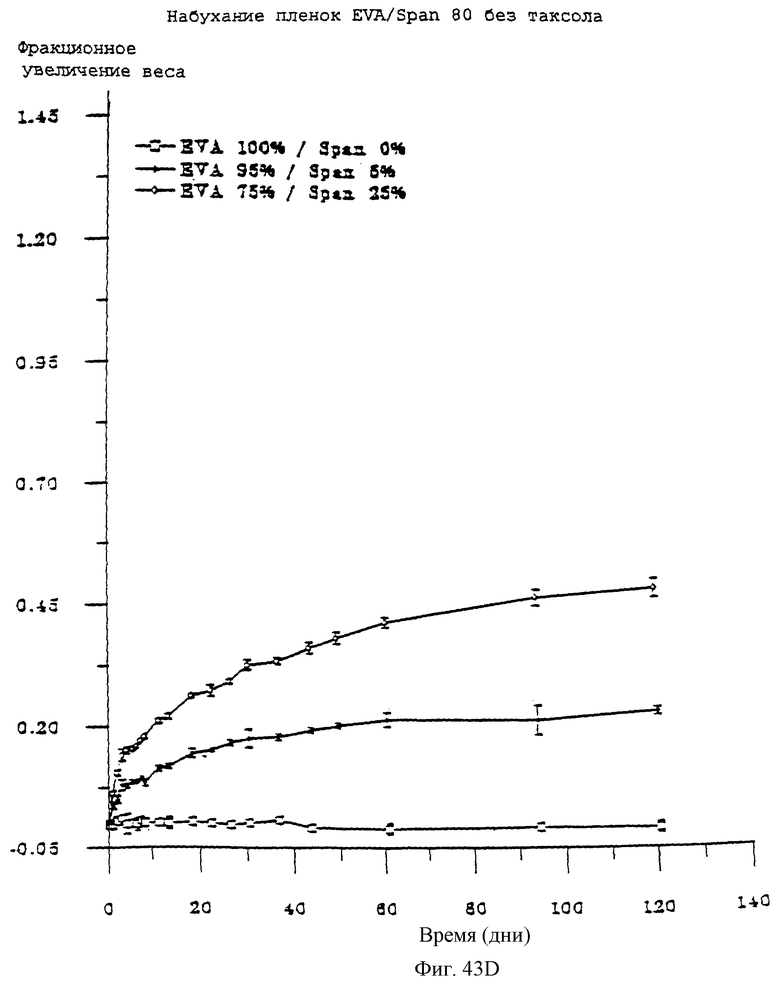
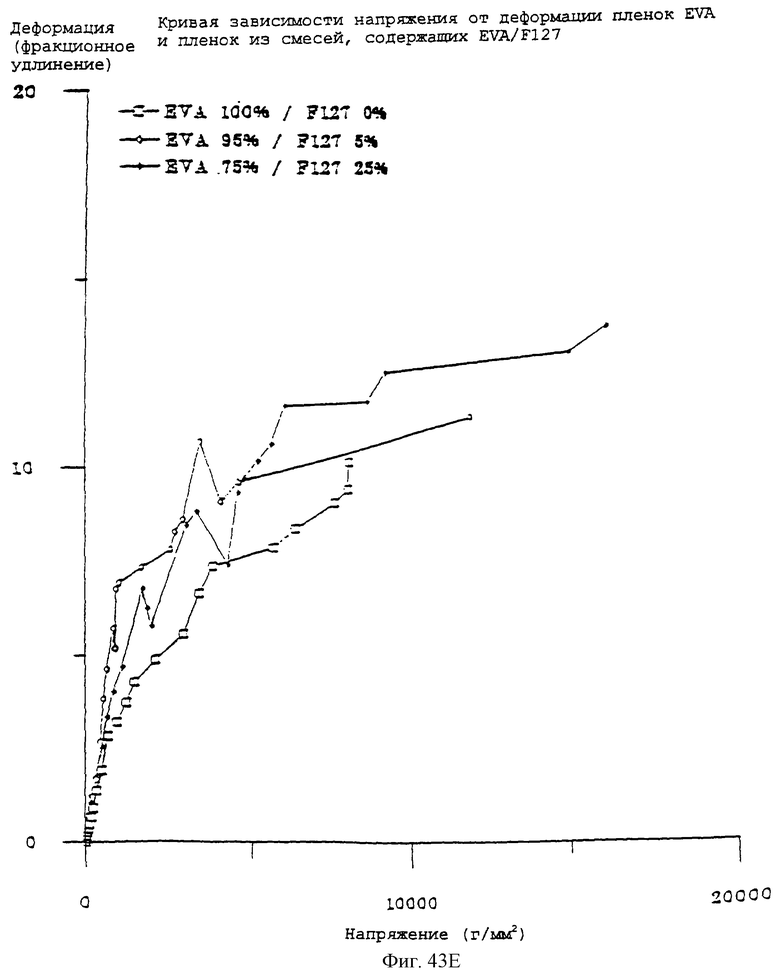
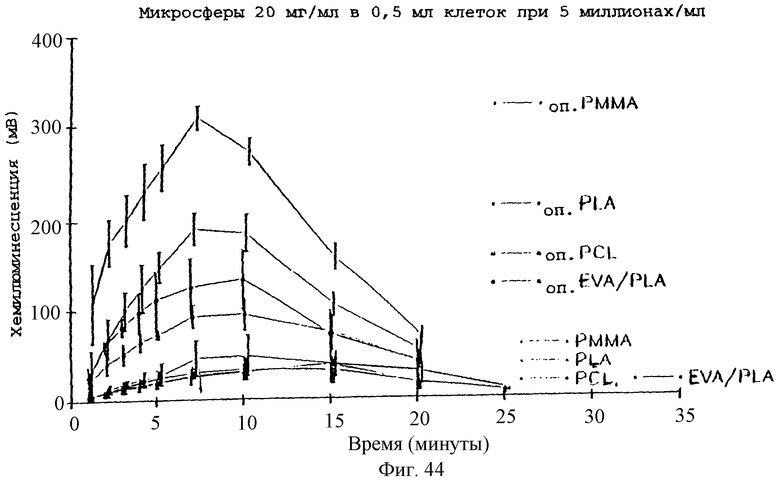
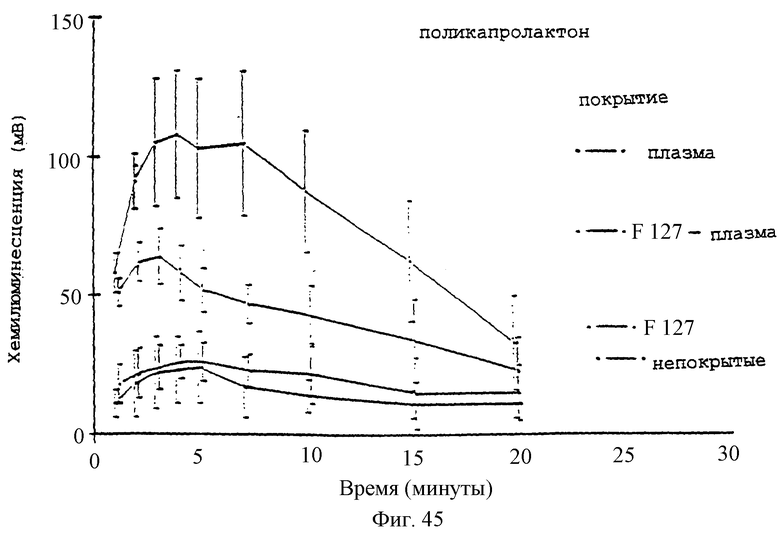
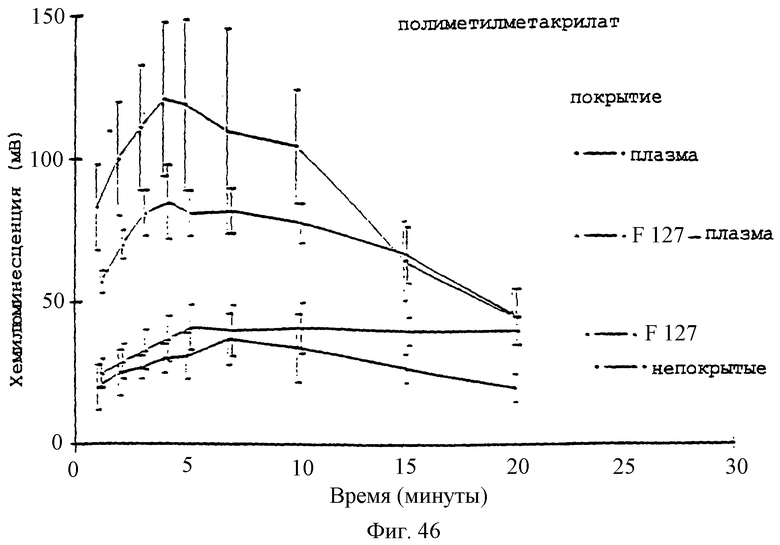
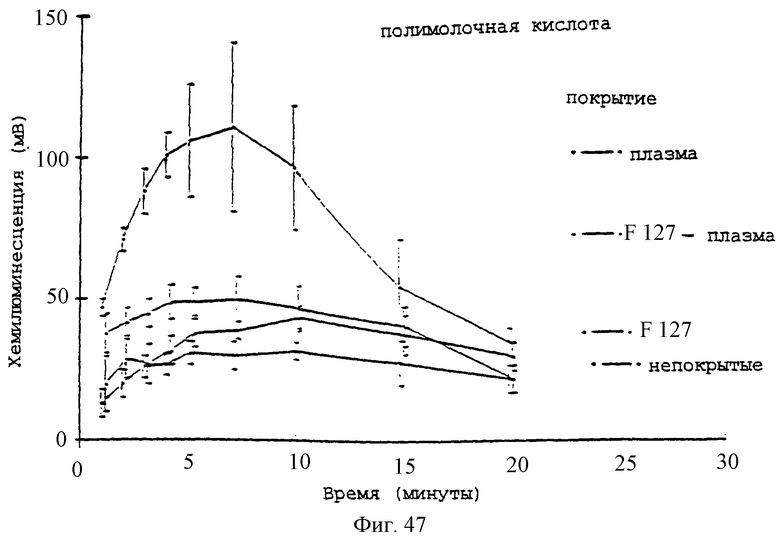
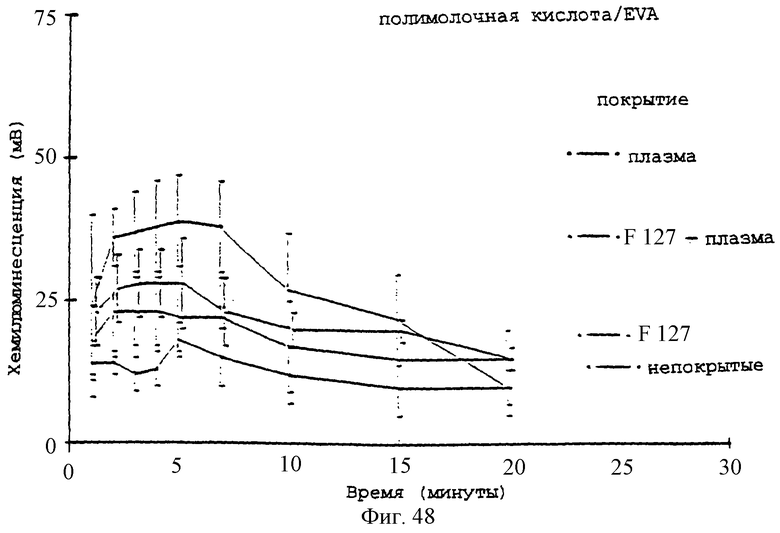

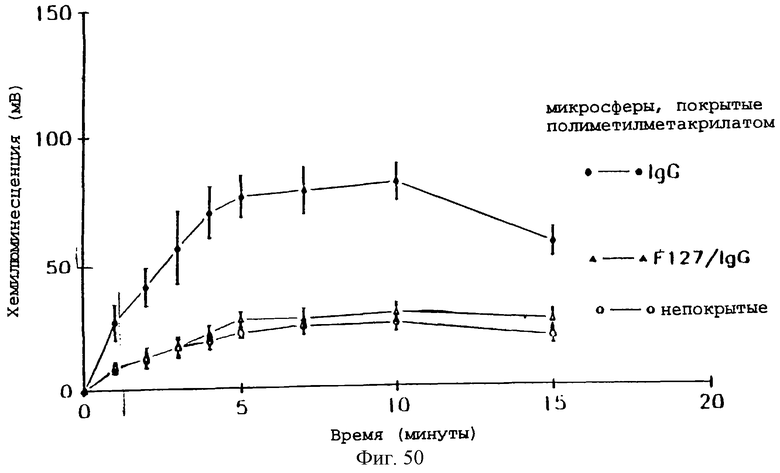
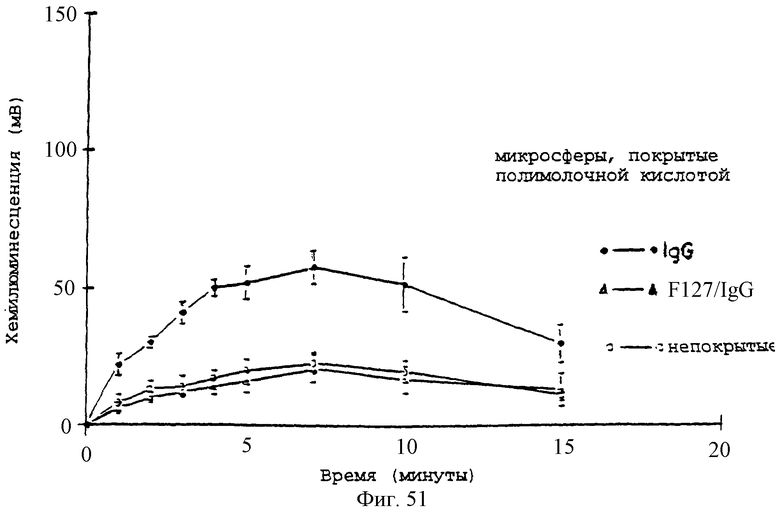
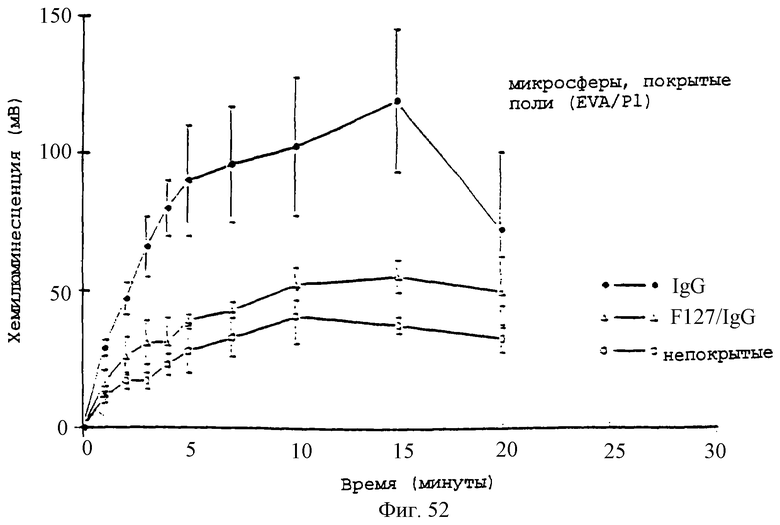
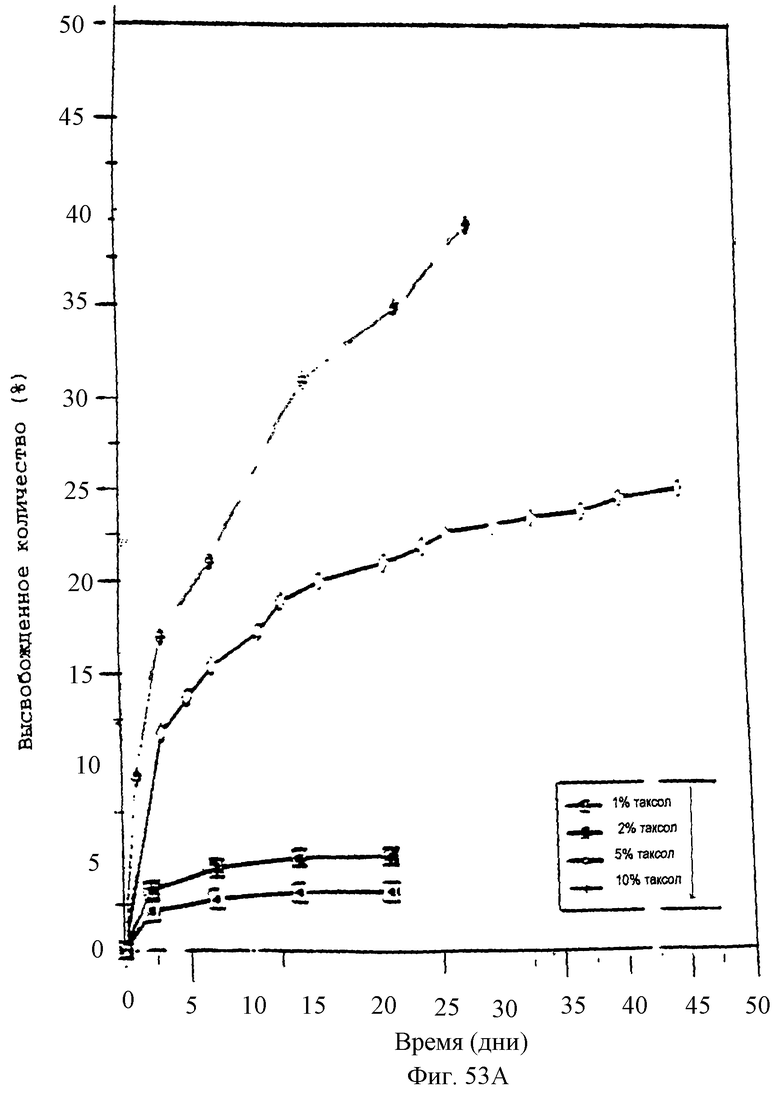

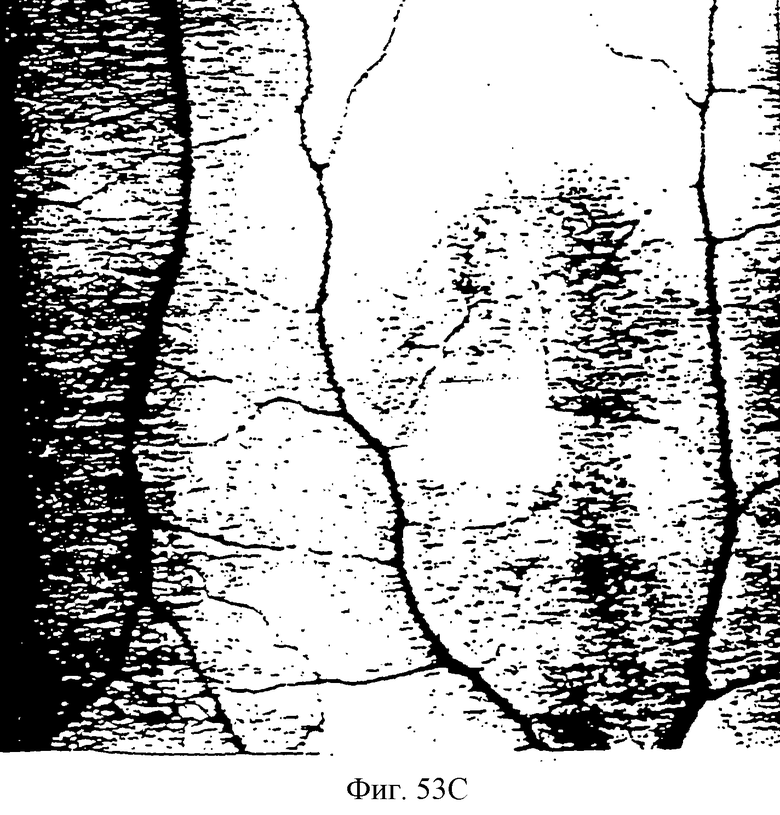
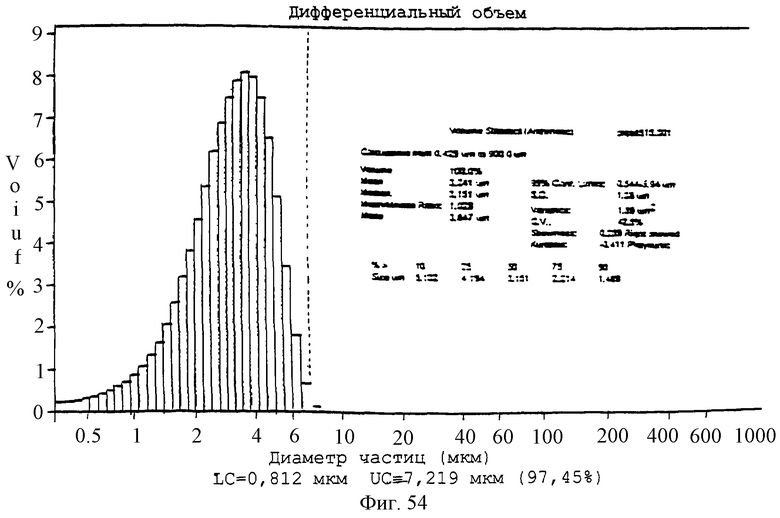
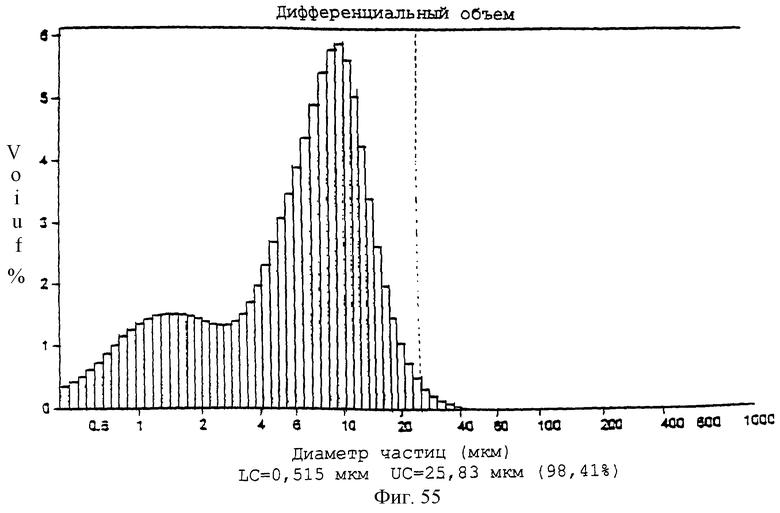
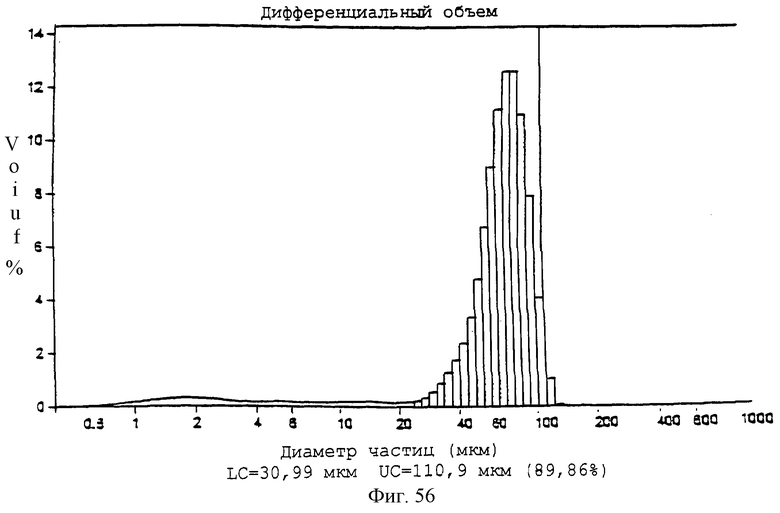
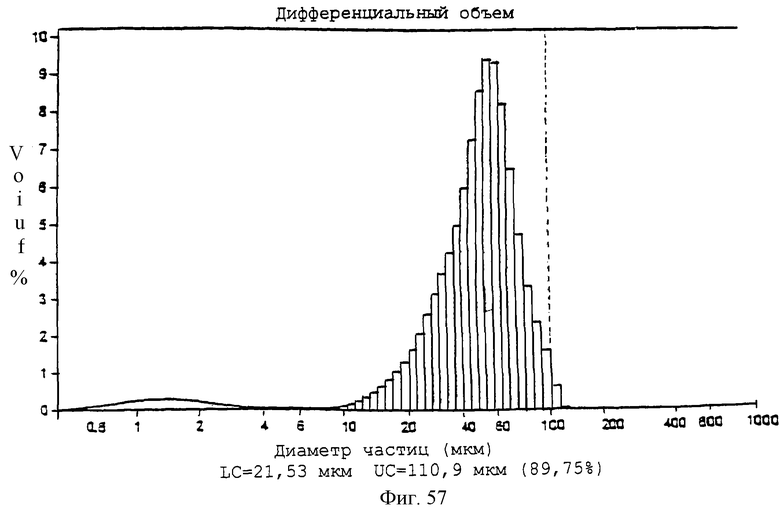
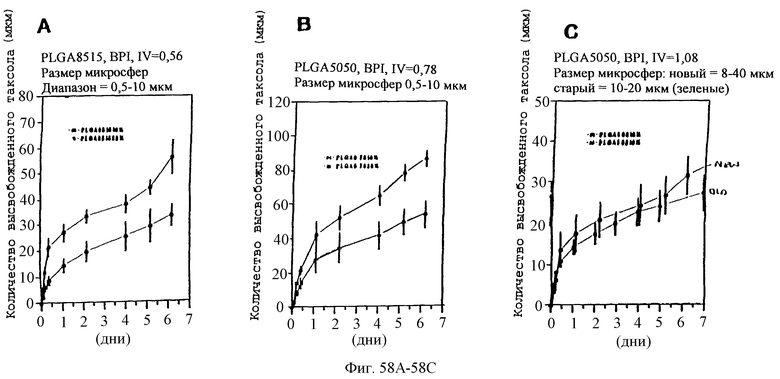
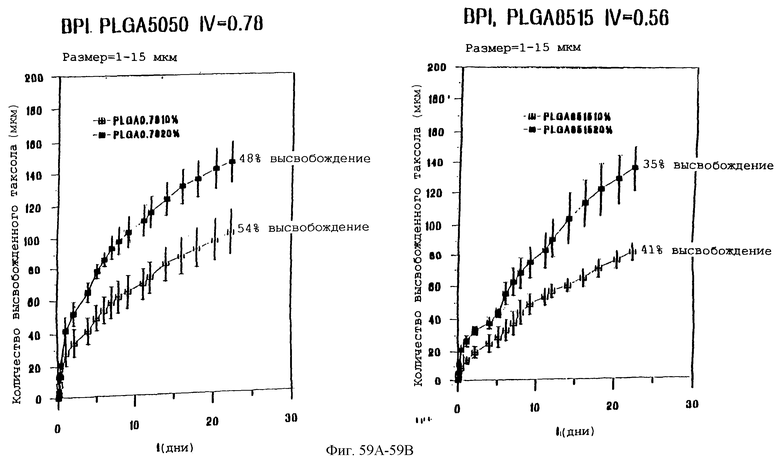
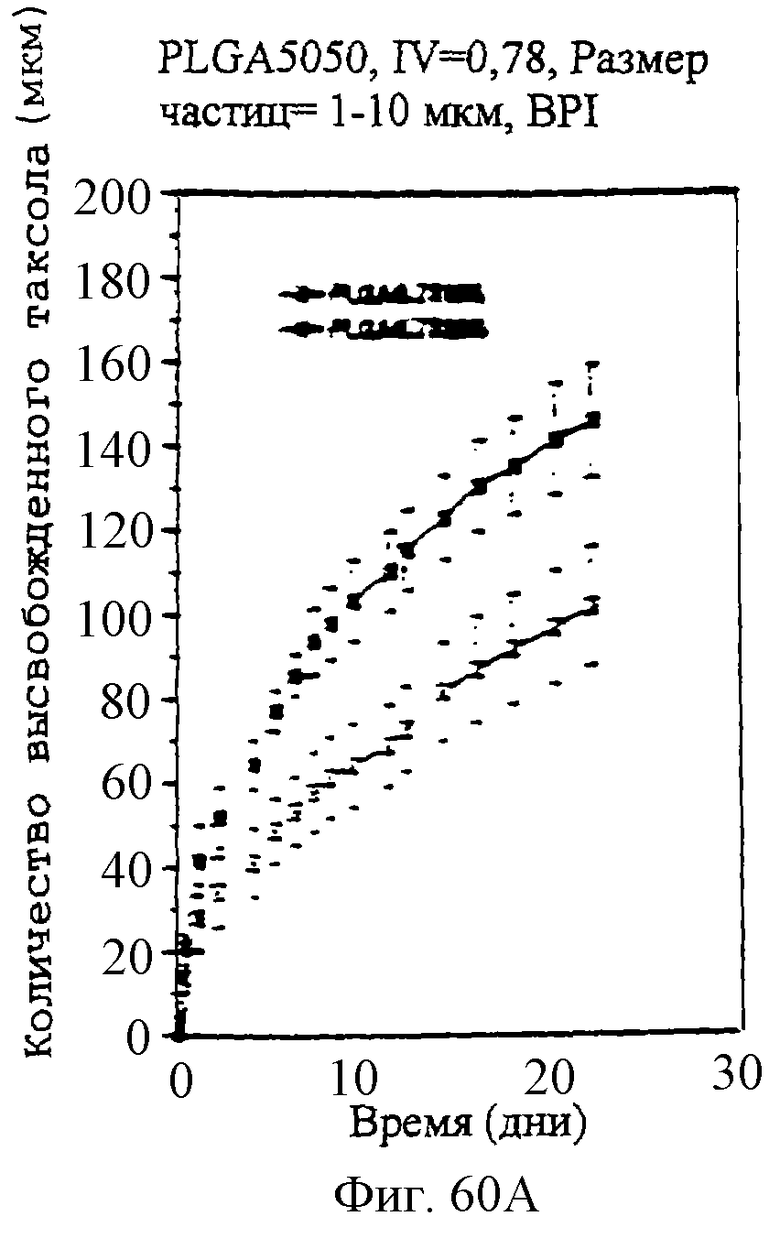
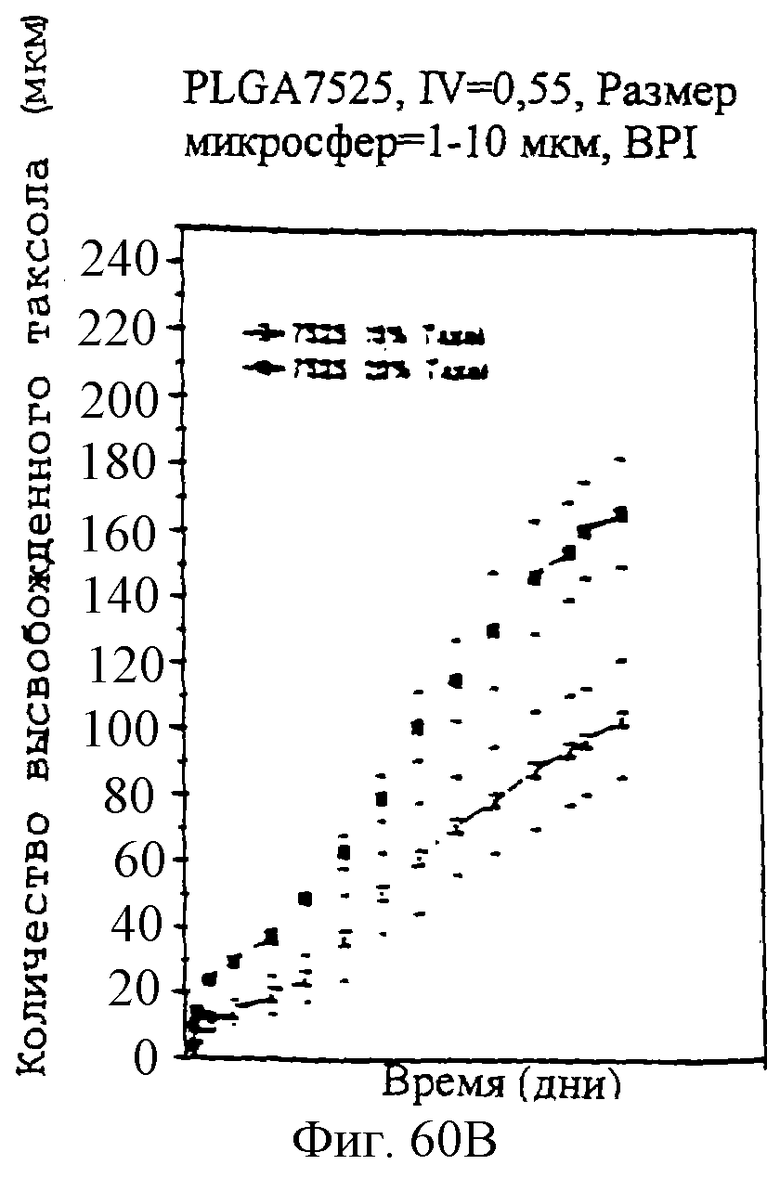
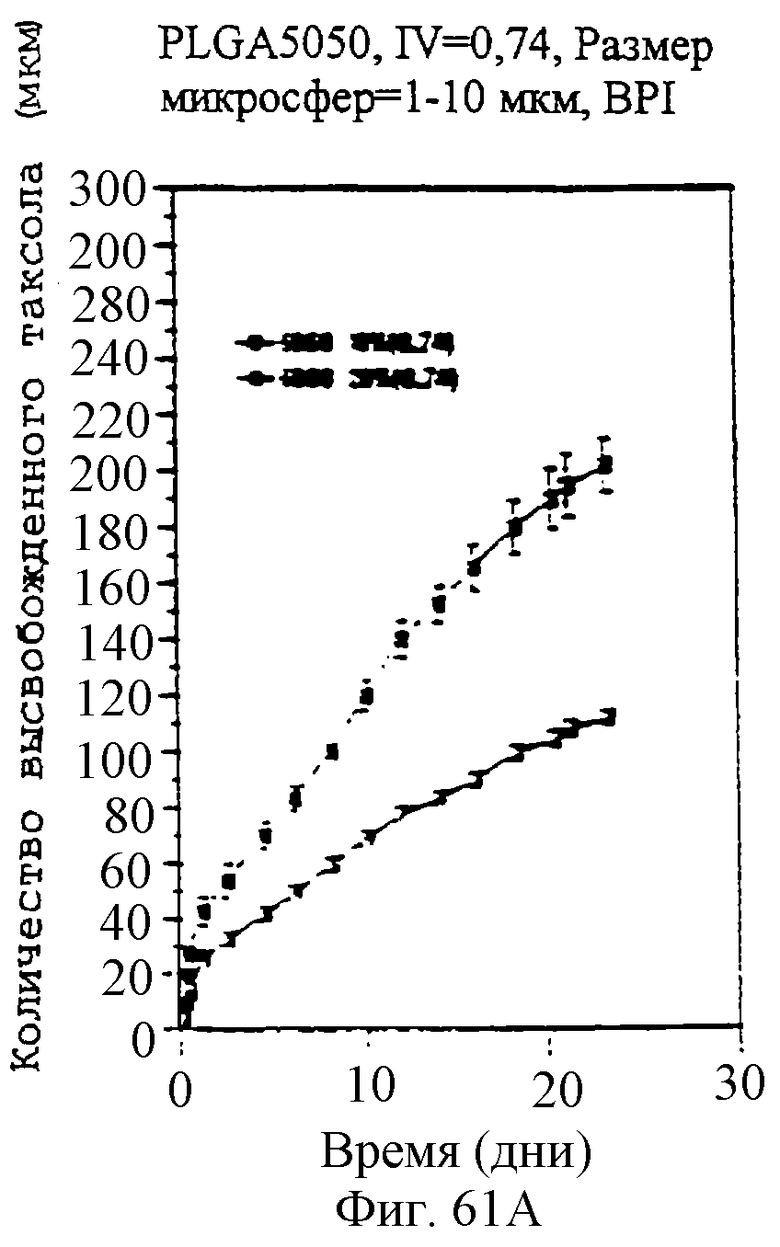
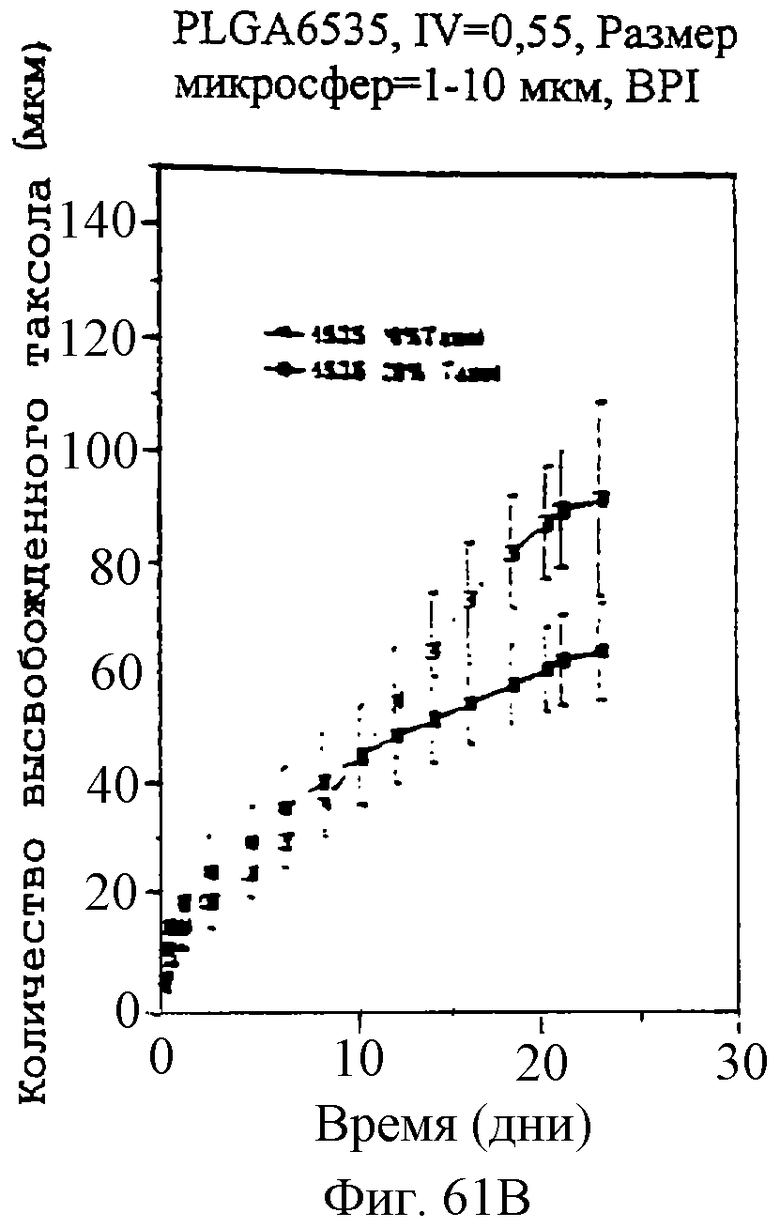
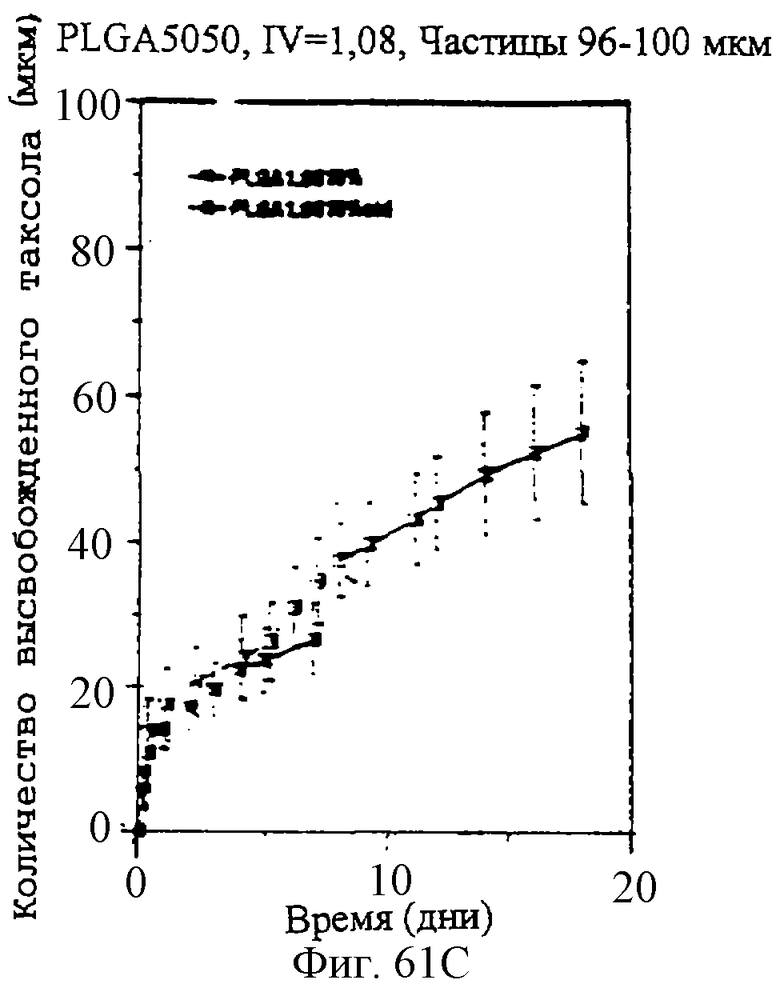
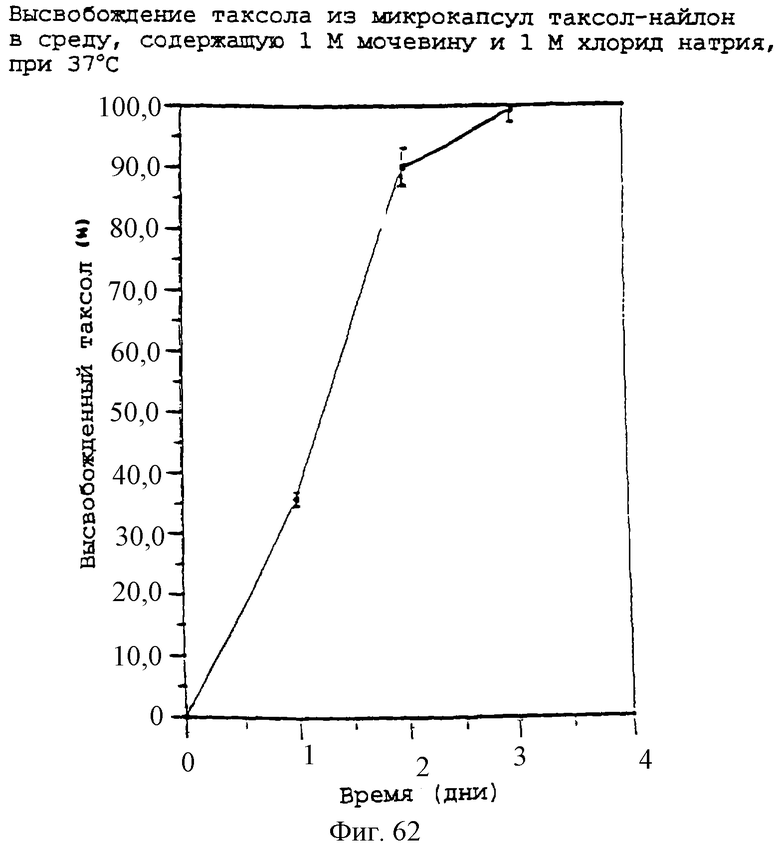
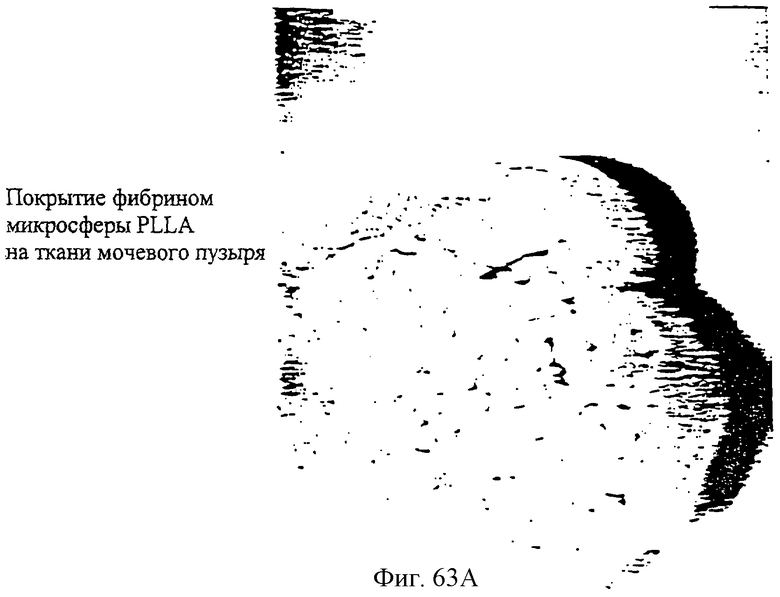

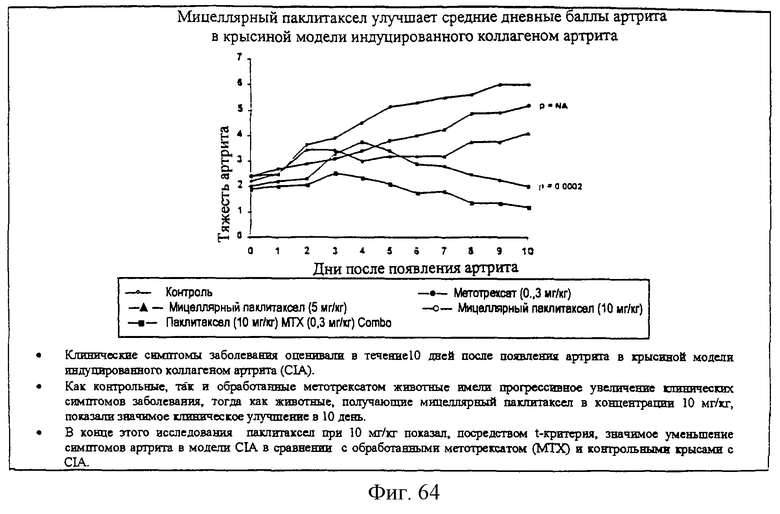

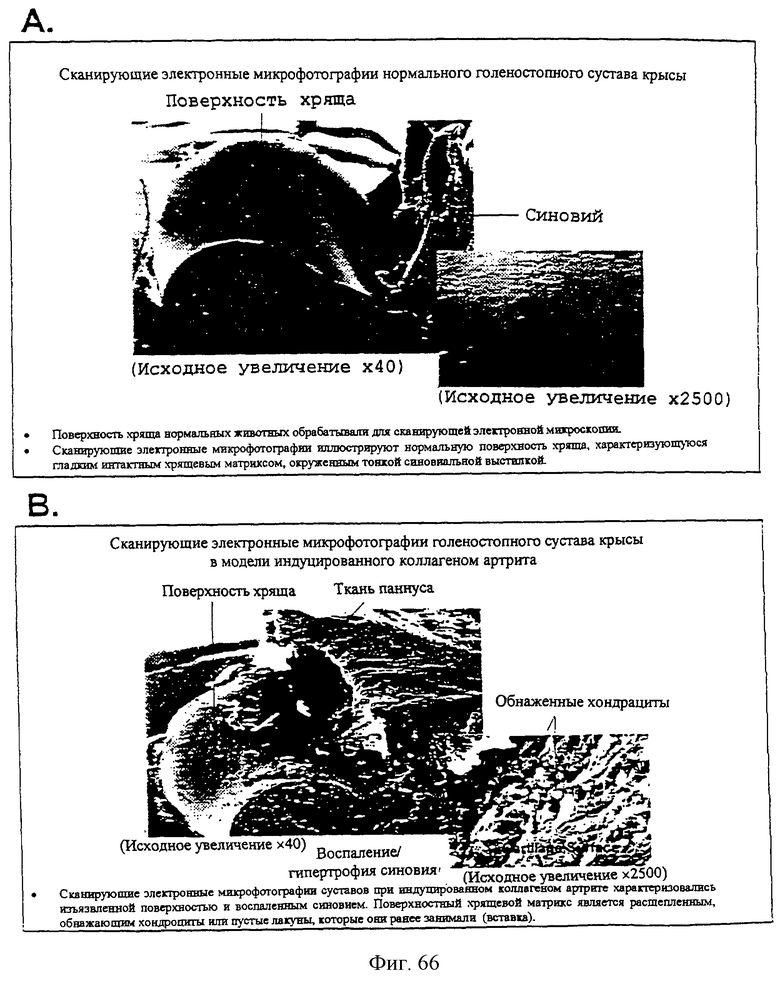



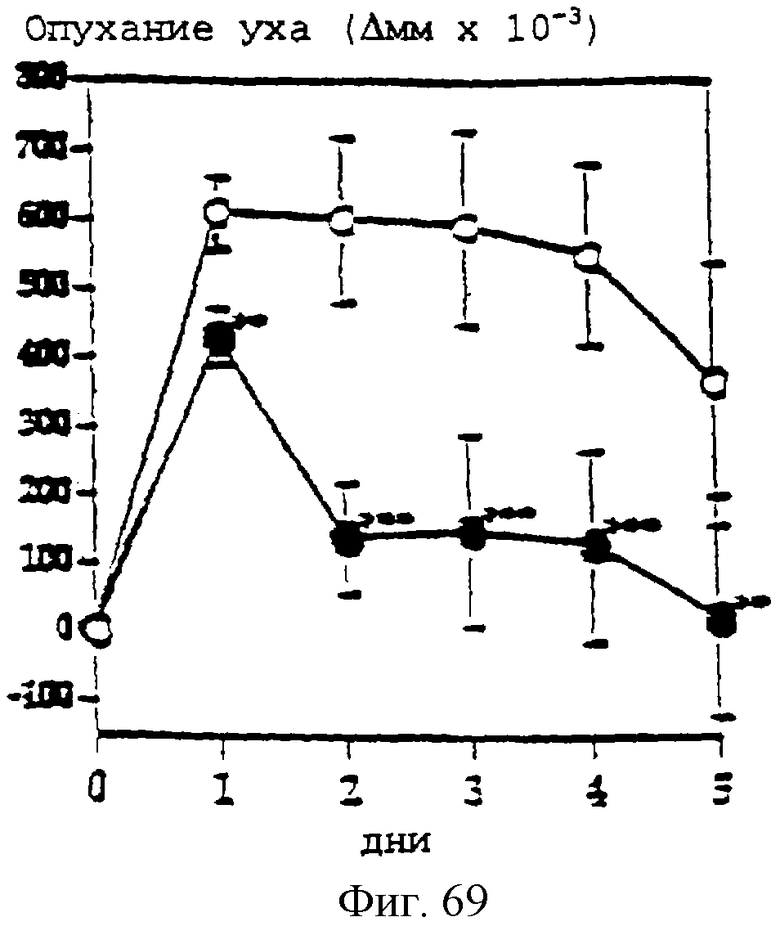
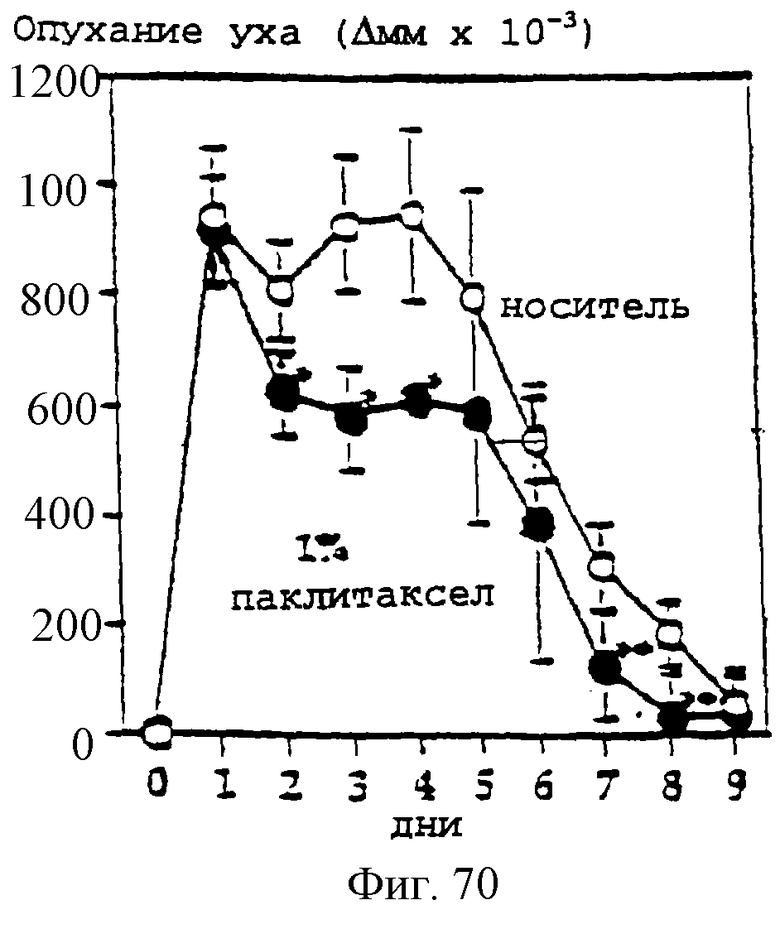
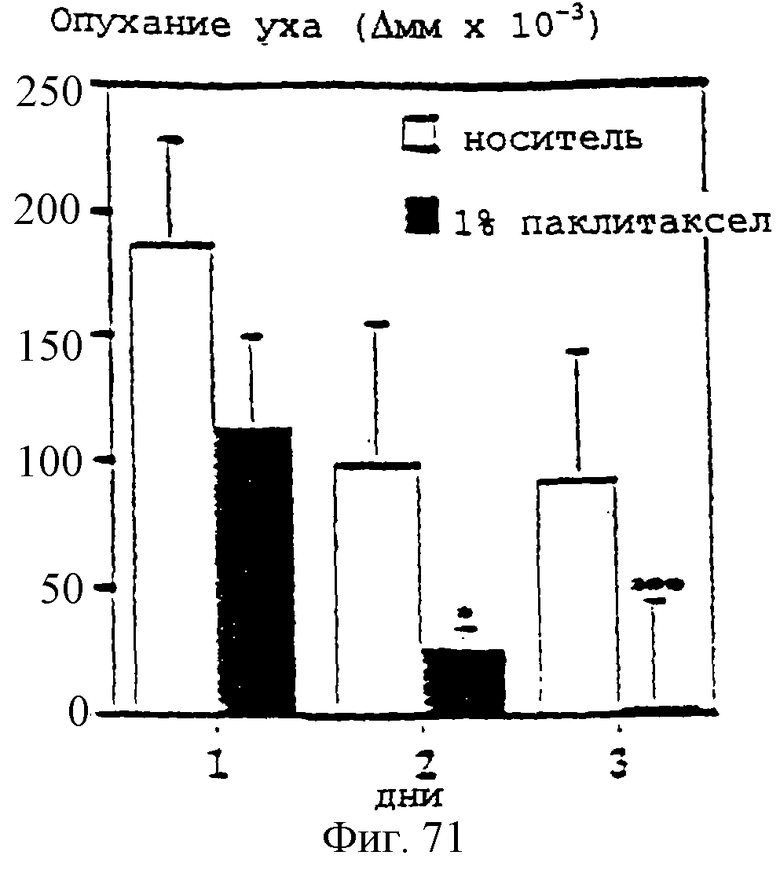
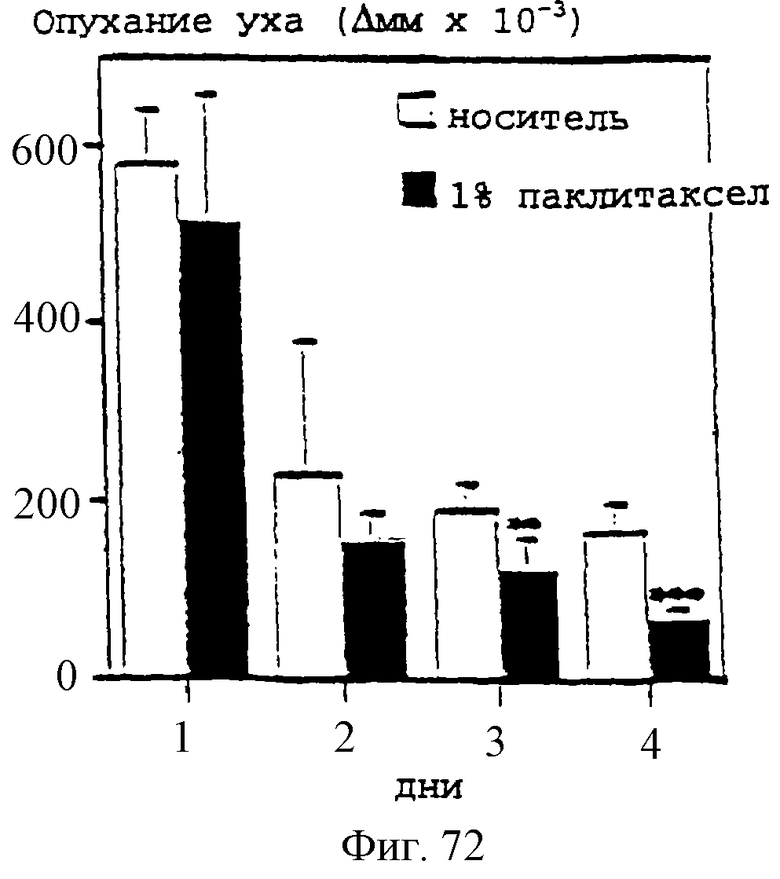
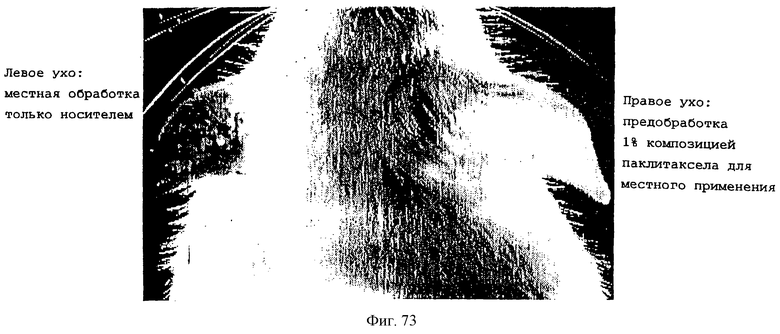
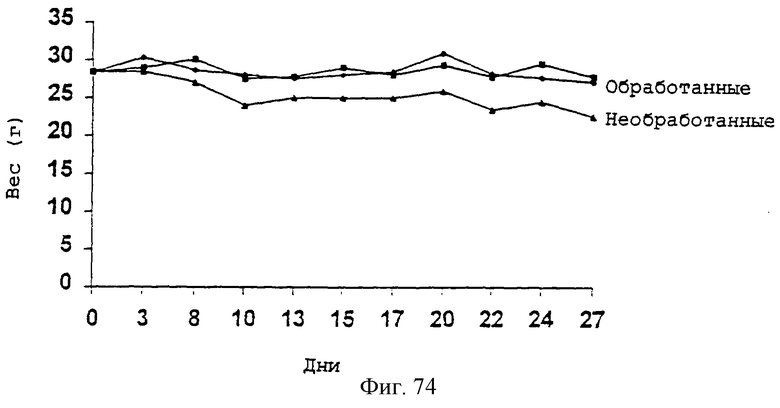
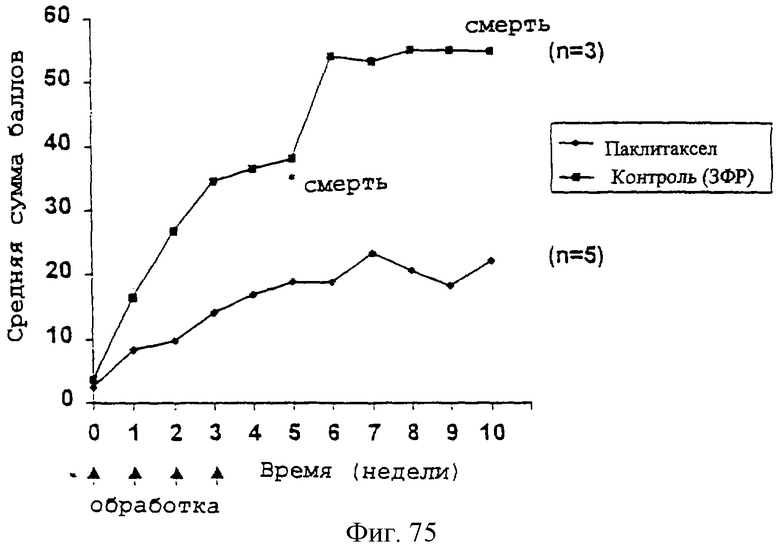




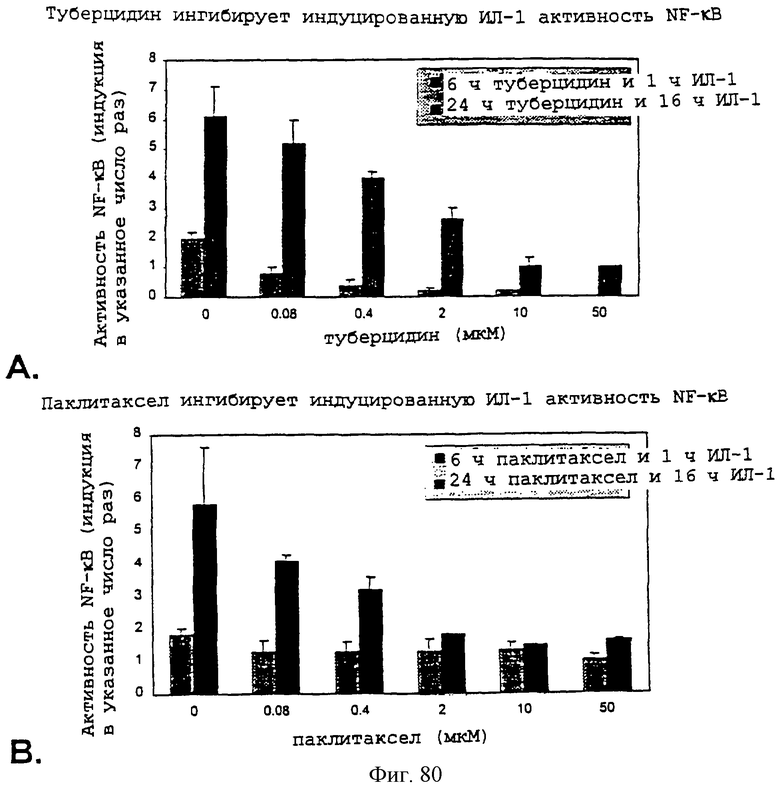
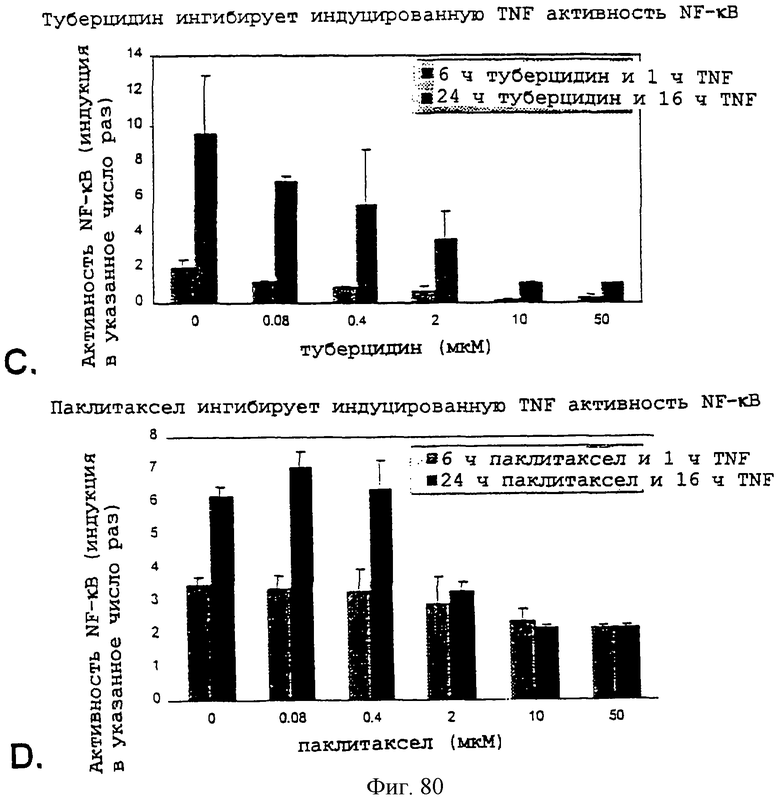
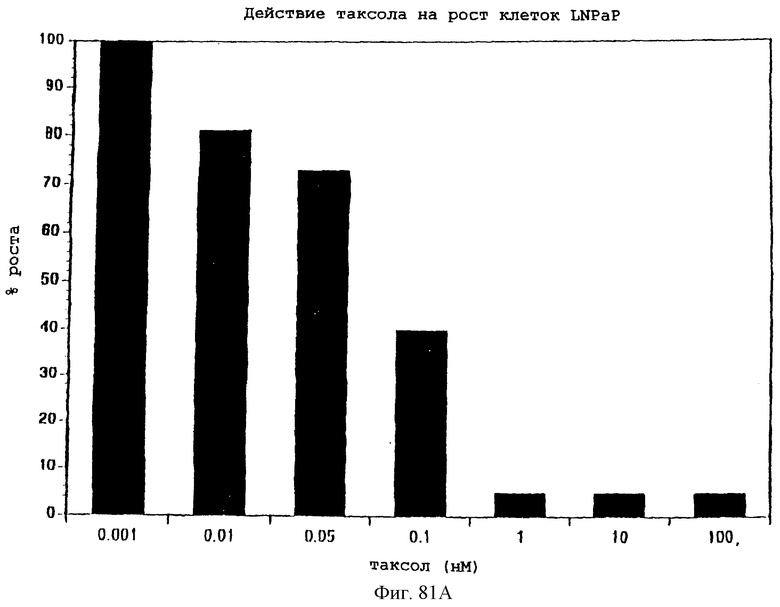
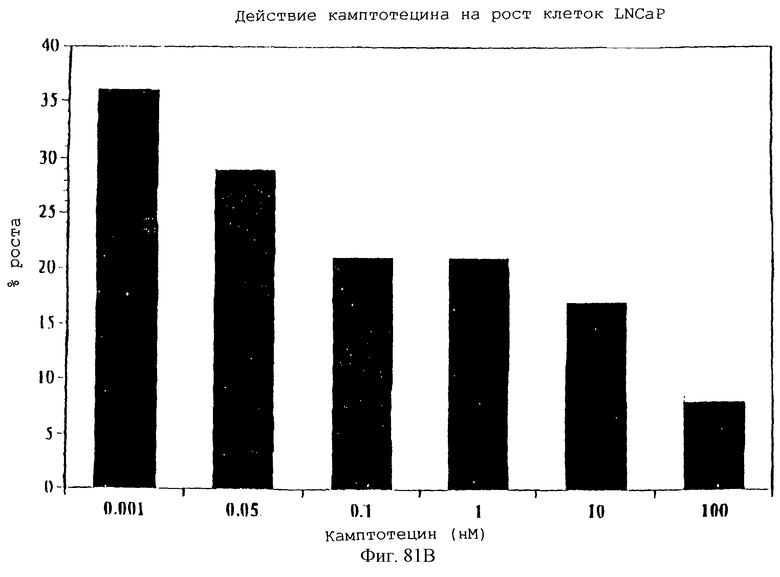
Изобретение относится к композициям и способам лечения и предупреждения таких заболеваний и состояний, как отторжение трансплантата, хирургические спайки, воспалительные заболевания кишечника, назальные полипы, и предусматривает доставку к месту воспаления антимикротрубочкового агента, которым является паклитаксел, или его аналог или производное. Изобретение обеспечивает указанное лечение и предупреждение за счет нарушения функции микротрубочек путем деполимеризации или стабилизации их образования, что прерывает патогенез указанных заболеваний. 4 н. и 42 з.п. ф-лы, 14 табл., 81 ил.
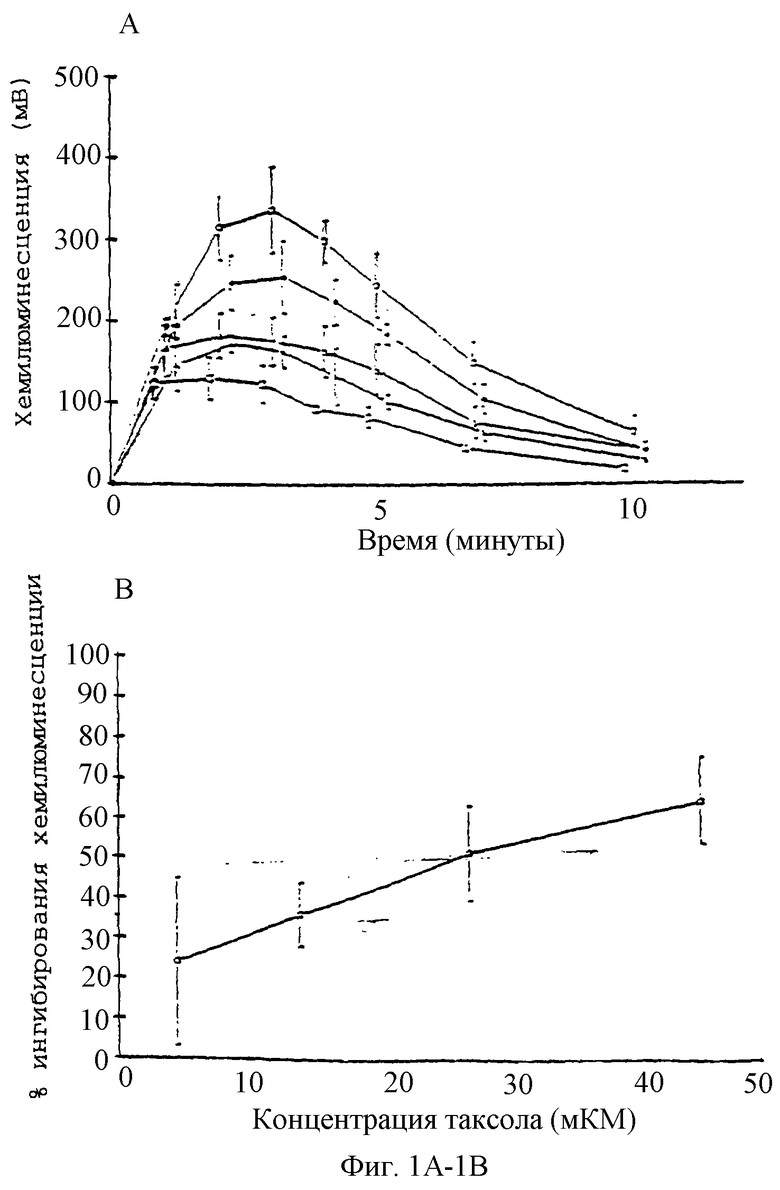
Приоритет по пунктам:
| US 5565478, 15.10.1996 | |||
| US 5616608, 01.04.1996 | |||
| BELOTTI D | |||
| et al | |||
| The microtubule - affecting drug paclitaxel has antiangiogenic activity // Clin Cancer Res | |||
| Предохранительное устройство для паровых котлов, работающих на нефти | 1922 |
|
SU1996A1 |
| PubMed | |||
| GUILHOU J.J | |||
| Psoriasis: physiopathology and therapeutic targets // Rev Prat | |||
| Циркуль-угломер | 1920 |
|
SU1991A1 |
| PubMed. | |||
Авторы
Даты
2004-12-27—Публикация
1997-12-02—Подача