ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Сердечно-сосудистые заболевания являются одной из основных причин смертности в Соединенных Штатах Америки и большинстве стран Европы. Рассчитано, что только в Соединенных Штатах Америки более 70 миллионов человек страдают от сердечно-сосудистых заболеваний или нарушений, включая в качестве неограничивающих примеров высокое артериальное давление, ишемическую болезнь сердца, дислипидемию, застойную сердечную недостаточность и инсульт.
СУЩНОСТЬ
В одном из вариантов осуществления настоящее изобретение относится к фармацевтической композиции, содержащей EPA и необязательно одно или несколько дополнительных сердечно-сосудистых средств. В другом варианте осуществления EPA включает этиловый эфир эйкозапентаеновой кислоты. В другом варианте осуществления композиция по существу не содержит никакого количества докозагексаеновой кислоты или ее производного (например, этил-DHA), если вообще содержит.
В других вариантах осуществления настоящее изобретение относится к способам лечения и/или предотвращения связанного с сердечно-сосудистой системой заболевания, включающим введение нуждающемуся в этом индивидууму фармацевтической композиции или композиции(й), содержащей(их) EPA и необязательно одно или несколько дополнительных сердечно-сосудистых средств.
В любом из указанных выше вариантах осуществления EPA и дополнительное сердечно-сосудистое средство(а) можно комбинировать в виде одной единицы дозирования или можно формулировать в виде от двух до множества единиц дозирования для согласованного, комбинированного или одновременного введения.
Ниже в настоящем документе более подробно описаны эти и другие варианты осуществления настоящего изобретения.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
На фиг. 1 представлено действие EPA, DHA и комбинированного лечения на перекисное окисление липидов мембран при соотношении холестерина к фосфолипидам 1,0.
На фиг. 2 представлено действие EPA, DHA и комбинированного лечения на перекисное окисление липидов мембран при соотношении холестерина к фосфолипидам 0,5.
На фиг. 3 представлено зависимое от холестерина действие EPA, DHA и комбинированного лечения на перекисное окисление липидов мембран.
На фиг. 4 представлено действие EPA, DHA или EPA/DHA с аторвастатином (молярное отношение 10:1) на уровни пероксидов липидов в обогащенных холестерином мембранах (соотношение холестерина к фосфолипидам 1:1).
ПОДРОБНОЕ ОПИСАНИЕ
Хотя настоящее изобретение можно осуществлять в различных формах, предоставленное ниже описание нескольких вариантов осуществления сделано с пониманием, что настоящее описание следует рассматривать как пример изобретения, и оно не предназначено для ограничения изобретения конкретными проиллюстрированными вариантами изобретения. Заголовки предоставлены исключительно для удобства, и их не следует рассматривать, как каким-либо образом ограничивающие изобретение. Варианты осуществления, проиллюстрированные под любым заголовком, можно комбинировать с вариантами осуществления, проиллюстрированными под любым другим заголовком.
При использовании числовых значений в различных количественных величинах, указанных в настоящей заявке, если не конкретно не указано иначе, они указаны как приближения, как если бы минимальному и максимальному значениям в указанных диапазонах предшествовало бы слово "приблизительно". Таким образом, для достижения по существу тех же результатов, как указанная величина, можно использовать небольшие отклонения от указанного значения. Также описание диапазонов приведено как непрерывный диапазон, включающий каждое значение между приведенными минимальным и максимальным значениями, а также любые диапазоны, которые можно образовать из таких значений. Также в настоящем документе описаны любые и все соотношения (и диапазоны любых из таких соотношений), которые можно образовывать, деля приведенное числовое значение на любое другое приведенное числовое значение. Таким образом, специалист поймет, что из числовых значений, предоставленных в настоящем документе, можно однозначно получить многие такие соотношения, диапазоны и диапазоны соотношений, и во всех случаях таких соотношений, диапазонов и диапазонов соотношений предоставлены различные варианты осуществления настоящего изобретения.
Эйкозапентаеновая кислота
В одном из вариантов осуществления композиции по изобретению в качестве активного ингредиента содержат EPA. Как применяют в настоящем документе, термин "EPA" относится к эйкозапентаеновой кислоте (например, эйкоза-5,8,11,14,17-пентаеновая кислота) и/или ее фармацевтически приемлемому сложному эфиру, производному, конъюгату или соли или смеси любого из указанного выше. Термин "фармацевтически приемлемый" в настоящем контексте означает, что рассматриваемое вещество не вызывает неприемлемой токсичности для индивидуума или взаимодействия с другими компонентами композиции.
В одном из вариантов осуществления EPA содержит полностью цис-эйкоза-5,8,11,14,17-пентаеновую кислоту. В другом варианте осуществления EPA находится в форме сложного эфира эйкозапентаеновой кислоты (также обозначаемого в настоящем документе как E-EPA или этил-EPA). В другом варианте осуществления EPA содержит C1-C5-алкиловый эфир EPA. В другом варианте осуществления EPA содержит, метиловый эфир эйкозапентаеновой кислоты, пропиловый эфир эйкозапентаеновой кислоты или бутиловый эфир эйкозапентаеновой кислоты. В другом варианте осуществления EPA содержит этиловый эфир полностью цис-эйкоза-5,8,11,14,17-пентаеновой кислоты.
В другом варианте осуществления EPA содержит литиевую соль EPA, моно-, ди- или триглицерид EPA или любой другой сложный эфир или соль EPA или форму свободной кислоты EPA. Также EPA может находиться в форме 2-замещенного производного или другого производного, которое замедляет скорость ее окисления, но в другом отношении не изменяет ее биологическое действие в какой-либо значимой степени.
В одном из вариантов осуществления EPA, присутствующая в композиции по изобретению, содержит ультрачистую EPA. Как применяют в настоящем документе, термин "ультрачистая" в отношении EPA относится к композиции, содержащей по меньшей мере 96% по массе EPA (как термин "EPA" определена и проиллюстрирована в настоящем документе). Ультрачистая EPA может содержать даже более чистую EPA, например, по меньшей мере 97% по массе EPA или по меньшей мере 98% по массе EPA, где EPA представляет собой любую форму EPA, как указано в настоящем документе. Ультрачистую EPA можно дополнительно определять (например, составом примесей) посредством любого из определений EPA, предоставленных в настоящем документе.
В другом варианте осуществления EPA содержит конъюгат EPA-жирная кислота, где EPA конъюгирована с другой молекулой EPA или с другой жирной кислотой. В одном из вариантов осуществления конъюгат EPA-жирная кислота содержит сложный диэфир, образованный EPA и EPA или EPA и второй жирной кислотой, как показано в структурах (I) и (II). В одном из вариантов осуществления R1 представляет собой ацильную группу жирной кислоты, происходящую из EPA, а R2 выбран из H, ацила жирной кислоты с количеством атомов углерода от 12 до 30 с двумя или более цис- или транс-двойными связями и групп жирных спиртов с количеством атомов углерода от 12 до 30, таких же, как R1, или отличных от него. R1 и R2 могут происходить из EPA (EPA-EPA) или один может происходить из EPA, а второй из другой жирной кислоты (EPA-жирная кислота), например, гамма-линоленовой кислоты, дигомо-гамма-линоленовой кислоты, арахидоновой кислоты, адреновой кислоты, стеаридоновой кислоты, докозапентаеновой кислоты n-3 и т.д.). R3 в основном представляет собой водород, полностью углеводород или содержит гетероатомы, а в одном из вариантов осуществления представляет собой C1-C4-алкильную группу.


Синтез конъюгата сложного диэфира можно проводить хорошо известными в данной области способами, включая, например, использование в качестве катализаторов металлов, хлоридов металлов или органических кислот; использование хлоридов жирных кислот, таких как хлорид EPA, хлорид γ-линоленовой кислоты (хлорид GLA), хлорид дигомо-γ-линоленовой кислоты (хлорид DGLA), хлорид линолевой кислоты (хлорид LA), хлорид арахидоновой кислоты (хлорид AA), хлорид конъюгированной линолевой кислоты (хлорид cLA), хлорид ALA, хлорид STA, хлорид ETA, хлорид DPA и т.д.; и использование в качестве катализаторов иммобилизованных ферментов.
В другом варианте осуществления композиция по настоящему изобретению содержит смеси сложных диэфиров EPA-жирная кислота. В связанном варианте осуществления композиции по настоящему изобретению содержит менее 20% конъюгата EPA-DHA, менее 15% конъюгата EPA-DHA, менее 10% конъюгата EPA-DHA, менее 9% конъюгата EPA-DHA, менее 8% конъюгата EPA-DHA, менее 7% конъюгата EPA-DHA, менее 6% конъюгата EPA-DHA, менее 5% конъюгата EPA-DHA, менее 4% конъюгата EPA-DHA, менее 3% конъюгата EPA-DHA, менее 2% конъюгата EPA-DHA, менее 1% конъюгата EPA-DHA, менее 0,5% конъюгата EPA-DHA или менее 0,1% по массе конъюгата EPA-DHA.
В другом варианте осуществления композиция по настоящему изобретению содержит по меньшей мере 96% конъюгата EPA-жирная кислота (например, EPA-EPA), по меньшей мере 97% конъюгата EPA-жирная кислота, по меньшей мере 98% конъюгата EPA-жирная кислота или по меньшей мере 99% конъюгата EPA-жирная кислота. В другом варианте осуществления композиция по настоящему изобретению содержит не более 10%, не более 9%, не более 8%, не более 7%, не более 6%, не более 5%, не более 4%, не более 3%, не более 2%, не более 1% или не более 0,6%, не более 0,5%, не более 0,4%, не более 0,3%, не более 0,2 или не более 0,1% любого конъюгата EPA-жирная кислота, отличного от сложного диэфира EPA-EPA.
В другом варианте осуществления EPA присутствует в композиции по изобретению в количестве приблизительно от 50 мг до приблизительно 5000 мг, приблизительно от 75 мг до приблизительно 2500 мг или приблизительно от 100 мг до приблизительно 1000 мг, например, приблизительно 75 мг, приблизительно 100 мг, приблизительно 125 мг, приблизительно 150 мг, приблизительно 175 мг, приблизительно 200 мг, приблизительно 225 мг, приблизительно 250 мг, приблизительно 275 мг, приблизительно 300 мг, приблизительно 325 мг, приблизительно 350 мг, приблизительно 375 мг, приблизительно 400 мг, приблизительно 425 мг, приблизительно 450 мг, приблизительно 475 мг, приблизительно 500 мг, приблизительно 525 мг, приблизительно 550 мг, приблизительно 575 мг, приблизительно 600 мг, приблизительно 625 мг, приблизительно 650 мг, приблизительно 675 мг, приблизительно 700 мг, приблизительно 725 мг, приблизительно 750 мг, приблизительно 775 мг, приблизительно 800 мг, приблизительно 825 мг, приблизительно 850 мг, приблизительно 875 мг, приблизительно 900 мг, приблизительно 925 мг, приблизительно 950 мг, приблизительно 975 мг, приблизительно 1000 мг, приблизительно 1025 мг, приблизительно 1050 мг, приблизительно 1075 мг, приблизительно 1100 мг, приблизительно 1025 мг, приблизительно 1050 мг, приблизительно 1075 мг, приблизительно 1200 мг, приблизительно 1225 мг, приблизительно 1250 мг, приблизительно 1275 мг, приблизительно 1300 мг, приблизительно 1325 мг, приблизительно 1350 мг, приблизительно 1375 мг, приблизительно 1400 мг, приблизительно 1425 мг, приблизительно 1450 мг, приблизительно 1475 мг, приблизительно 1500 мг, приблизительно 1525 мг, приблизительно 1550 мг, приблизительно 1575 мг, приблизительно 1600 мг, приблизительно 1625 мг, приблизительно 1650 мг, приблизительно 1675 мг, приблизительно 1700 мг, приблизительно 1725 мг, приблизительно 1750 мг, приблизительно 1775 мг, приблизительно 1800 мг, приблизительно 1825 мг, приблизительно 1850 мг, приблизительно 1875 мг, приблизительно 1900 мг, приблизительно 1925 мг, приблизительно 1950 мг, приблизительно 1975 мг, приблизительно 2000 мг, приблизительно 2025 мг, приблизительно 2050 мг, приблизительно 2075 мг, приблизительно 2100 мг, приблизительно 2125 мг, приблизительно 2150 мг, приблизительно 2175 мг, приблизительно 2200 мг, приблизительно 2225 мг, приблизительно 2250 мг, приблизительно 2275 мг, приблизительно 2300 мг, приблизительно 2325 мг, приблизительно 2350 мг, приблизительно 2375 мг, приблизительно 2400 мг, приблизительно 2425 мг, приблизительно 2450 мг, приблизительно 2475 мг или приблизительно 2500 мг.
В одном из вариантов осуществления композиция по изобретению содержит не более чем приблизительно 10%, не более чем приблизительно 9%, не более чем приблизительно 8%, не более чем приблизительно 7%, не более чем приблизительно 6%, не более чем приблизительно 5%, не более чем приблизительно 4%, не более чем приблизительно 3%, не более чем приблизительно 2%, не более чем приблизительно 1% или не более чем приблизительно 0,5% по массе докозагексаеновой кислоты или ее производного, такого как этил-DHA (E-DHA) от всех жирных кислот, если вообще содержит. В другом варианте осуществления композиция по изобретению по существу не содержит докозагексаеновой кислоты или ее производного, такого как E-DHA. В другом варианте осуществления композиция по изобретению не содержит докозагексаеновой кислоты или E-DHA.
В другом варианте осуществления EPA составляет по меньшей мере приблизительно 60%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98%, по меньшей мере приблизительно 99% или 100% по массе от всех жирных кислот, присутствующих в композиции по изобретению.
В другом варианте осуществления композиция по изобретению содержит менее 30%, менее 20%, менее 10%, менее 9%, менее 8%, менее 7%, менее 6%, менее 5%, менее 4%, менее 3%, менее 2%, менее 1%, менее 0,5% или менее 0,25% любой жирной кислоты, отличной от EPA или ее производного, по массе от общей композиции или по массе от содержания всех жирных кислот. Иллюстративные примеры "жирной кислоты, отличной от EPA" включают линоленовую кислоту (LA) или ее производное, такое как этиллиноленовая кислота, арахидоновую кислоту (AA) или ее производное, такое как этил-AA, докозагексаеновую кислоту (DHA) или ее производное, такое как этил-DHA, альфа-линоленовую кислоту (ALA) или ее производное, такое как этил-ALA, стеаридоновую кислоту (STA) или ее производное, такое как этил-SA, эйкозатриеновую кислоту (ETA) или ее производное, такое как этил-ETA, и/или докозапентаеновую кислоту (DPA) или ее производное, такое как этил-DPA.
В другом варианте осуществления композиция по изобретению обладает одной или несколькими из следующих характеристик: (a) этиловый эфир эйкозапентаеновой кислоты составляет по меньшей мере 96%, по меньшей мере 97% или по меньшей мере 98% по массе от всех жирных кислот, присутствующих в композиции; (b) композиция содержит не более 4%, не более 3% или не более 2% по массе от всех жирных кислот, отличных от этилового эфира эйкозапентаеновой кислоты; (c) композиция содержит не более 0,6%, 0,5% или 0,4% каждой отдельной жирной кислоты, отличной от этилового эфира эйкозапентаеновой кислоты; (d) показатель преломления композиции составляет (20°C) приблизительно от 1 до приблизительно 2, приблизительно от 1,2 до приблизительно 1,8 или приблизительно от 1,4 до приблизительно 1,5; (e) удельная плотность композиции составляет (20°C) приблизительно от 0,8 до приблизительно 1,0, приблизительно от 0,85 до приблизительно 0,95 или приблизительно от 0,9 до приблизительно 0,92; (f) композиция содержит не более 20 ч./млн, 15 ч./млн или 10 ч./млн тяжелых металлов, (g) композиция содержит не более 5 ч./млн, 4 ч./млн, 3 ч./млн или 2 ч./млн мышьяка и/или (h) перекисное число композиции составляет не более 5, 4, 3 или 2 мг-экв./кг.
В другом варианте осуществления композиция, пригодная по изобретению, содержит по меньшей мере, по существу состоит по меньшей мере из или состоит по меньшей мере из 95% этилэйкозапентаеноата (EPA-E), приблизительно от 0,2% до приблизительно 0,5% этилоктадекатетраеноата (ODTA-E), приблизительно от 0,05% до приблизительно 0,25% этилнонаэкапентаеноата (NDPA-E), приблизительно от 0,2% до приблизительно 0,45% этиларахидоната (AA-E), приблизительно от 0,3% до приблизительно 0,5% этилэйкозатетраеноата (ETA-E) и приблизительно от 0,05% до приблизительно 0,32% этилгенэйкозапентаеноата (HPA-E), каждого по массе от всех жирных кислот, присутствующих в композиции. В другом варианте осуществления композиция находится в капсульной оболочке. В другом варианте осуществления капсульная оболочка не содержит химически модифицированного желатина.
В другом варианте осуществления композиции, пригодные по изобретению, содержат по меньшей мере, по существу состоят по меньшей мере из или состоят по меньшей мере из 95%, 96% или 97% этилэйкозапентаеноата, приблизительно от 0,2% до приблизительно 0,5% этилоктадекатетраеноата, приблизительно от 0,05% до приблизительно 0,25% этилнонаэкапентаеноата, приблизительно от 0,2% до приблизительно 0,45% этиларахидоната, приблизительно от 0,3% до приблизительно 0,5% этилэйкозатетраеноата и приблизительно от 0,05% до приблизительно 0,32% этилгенэйкозапентаеноат, каждый по массе от всех жирных кислот, присутствующих в композиции. Необязательно, композиция содержит не более чем приблизительно 0,06%, приблизительно 0,05% или приблизительно 0,04% по массе DHA или ее производного, такого как этил-DHA, от всех присутствующих жирных кислот. В одном из вариантов осуществления композиция по существу не содержит или не содержит никакого количества DHA или ее производного, такого как этил-DHA. Кроме того, композиция необязательно содержит один или несколько антиоксидантов (например, токоферол) в количестве не более чем приблизительно 0,5% или не более 0,05%. В другом варианте осуществления композиция содержит приблизительно от 0,05% до приблизительно 0,4%, например, приблизительно 0,2% по массе токоферола. В другом варианте осуществления приблизительно от 500 мг до приблизительно 1 г композиции предоставлено в капсульной оболочке. В другом варианте осуществления капсульная оболочка не содержит химически модифицированного желатина.
В другом варианте осуществления композиции, пригодные по изобретению, содержат по меньшей мере, по существу состоят по меньшей мере из или состоят по меньшей мере из 96% этилэйкозапентаеноата, приблизительно от 0,22% до приблизительно 0,4% этилоктадекатетраеноата, приблизительно от 0,075% до приблизительно 0,20% этилнонаэкапентаеноата, приблизительно от 0,25% до приблизительно 0,40% этиларахидоната, приблизительно от 0,3% до приблизительно 0,4% этилэйкозатетраеноата и приблизительно от 0,075% до приблизительно 0,25% этилгенэйкозапентаеноата, каждый по массе от всех жирных кислот, присутствующих в композиции. Необязательно, композиция содержит не более чем приблизительно 0,06%, приблизительно 0,05% или приблизительно 0,04% по массе DHA или ее производного, такого как этил-DHA, от всех присутствующих жирных кислот. В одном из вариантов осуществления композиция по существу не содержит или не содержит никакого количества DHA или ее производного, такого как этил-DHA. Кроме того, композиция необязательно содержит один или несколько антиоксидантов (например, токоферол) в количестве не более чем приблизительно 0,5% или не более 0,05%. В другом варианте осуществления композиция содержит приблизительно от 0,05% до приблизительно 0,4%, например, приблизительно 0,2% по массе токоферола. В другом варианте осуществления изобретение относится к лекарственной форме, содержащей приблизительно от 500 мг до приблизительно 1 г указанной выше композиции в капсульной оболочке. В одном из вариантов осуществления лекарственная форма представляет собой содержащую гель или жидкость капсулу, и ее упаковывают в блистерные упаковки с количеством капсул на пластину приблизительно от 1 до приблизительно 20.
В другом варианте осуществления композиции, пригодные по изобретению, содержат по меньшей мере, по существу состоят по меньшей мере из или состоят по меньшей мере из 96%, 97% или 98% по массе этилэйкозапентаеноата, приблизительно от 0,25% до приблизительно 0,38% по массе этилоктадекатетраеноата, приблизительно от 0,10% до приблизительно 0,15% по массе этилнонаэкапентаеноата, приблизительно от 0,25% до приблизительно 0,35% по массе этиларахидоната, приблизительно от 0,31% до приблизительно 0,38% по массе этилэйкозатетраеноата и приблизительно от 0,08% до приблизительно 0,20% этилгенэйкозапентаеноата, каждый по массе от всех жирных кислот, присутствующих в композиции. Необязательно, композиция содержит не более чем приблизительно 0,06%, приблизительно 0,05% или приблизительно 0,04% по массе DHA или ее производного, такого как этил-DHA, от всех присутствующих жирных кислот. В одном из вариантов осуществления композиция по существу не содержит или не содержит никакого количества DHA или ее производного, такого как этил-DHA. Кроме того, композиция необязательно содержит один или несколько антиоксидантов (например, токоферол) в количестве не более чем приблизительно 0,5% или не более 0,05%. В другом варианте осуществления композиция содержит приблизительно от 0,05% до приблизительно 0,4%, например, приблизительно 0,2% по массе токоферола. В другом варианте осуществления изобретение относится к лекарственной форме, содержащей приблизительно от 500 мг до приблизительно 1 г указанной выше композиции в капсульной оболочке. В другом варианте осуществления капсульная оболочка не содержит химически модифицированного желатина.
Сердечно-сосудистые средства
В одном из вариантов осуществления композиция (или схема лечения с совместным введением) по изобретению включает одно или несколько дополнительных сердечно-сосудистых средств. Одно или несколько дополнительных сердечно-сосудистых средств можно комбинировать с EPA или можно совместно вводить с EPA. Взаимозаменяемые термины "сердечно-сосудистое средство" или "сердечно-сосудистое лекарственное средство" в настоящем документе относятся к лекарственному средству или средству, которое способно к лечению, предотвращению или снижению риска развития сердечно-сосудистого заболевания или нарушения или его факторов риска или симптомов у индивидуума. Сердечно-сосудистые средства в настоящем документе в качестве неограничивающих примеров могут включать средства, модулирующие холестерин и триглицерид, средства, лечащие ишемическую болезнь сердца, средства, лечащие гипертензию или легочную артериальную гипертензию, средства, лечащие фибрилляцию предсердий или аритмию, средства, лечащие инсульт, средства, лечащие ишемию миокарда, и/или средства, лечащие тромбоз.
Неограничивающие примеры классов, из которых можно выбирать сердечно-сосудистые средства, пригодные для использования по настоящему изобретению, включают: ингибиторы ацил-коэнзим A:холестеринацилтрансферазы (ACAT), включая селективные ингибиторы ACAT-1, ACAT-2, а также двойные ингибиторы ACAT-1 и ACAT-2, лекарственные средства, блокирующие альфа-адренэргические рецепторы (альфа-блокаторы), альфа/бета-блокаторы, ингибиторы ангиотензин-превращающего фермента (ACE), антагонисты альдостерона, антагонисты рецепторов ангиотензина II, антиаритмические средства, антикоагулянты, антитромбоцитарные средства, миметики аполипопротеина A-1 (apoA-1), бета-блокаторы, усилители экскреции желчных кислот, блокаторы кальциевых каналов, ингибиторы белка-переносчика сложных эфиров холестерина с ApoB (CETP), ингибиторы всасывания холестерина, диуретики, средства против дислипидемии, антагонисты рецепторов эндотелина, фибраты, ингибиторы редуктазы 3-гидрокси-3-метилглутарил-коэнзима A (HMG-CoA), активаторы LCAT, индукторы рецепторов LDL, ингибиторы липазы, ингибиторы липопротеин-ассоциированной фосфолипазы A2 (Lp-PLA2), ингибиторы микросомального белка-переносчика триглицеридов (MTP), ингибиторы агрегации тромбоцитов, агонисты PPAR и активаторы, включающие агонисты PPARγ, PPARα агонисты и двойные агонисты PPAR α/γ, антисмысловую РНК или РНКи PCSK9, ингибиторы скваленэпоксидазы, ингибиторы скваленсинтетазы, тромболитики и активаторы тиреоидных рецепторов бета.
Ингибиторы ACAT
Ацил-CoA:холестринацилтрансфераза ("ACAT") представляет собой ацилтрансферазный фермент. В биосинтезе желчных кислот ACAT катализирует внутриклеточное образование сложных эфиров холестерина из холестерина. ACAT способствует накоплению сложных эфиров холестерина в тканях сосудов. Таким образом, средства, ингибирующие ACAT, пригодны для предотвращения или лечения атеросклероза. Неограничивающие примеры подходящих ингибиторов ACAT включают CI-1011 (авазимиб (Avasimibe), Pfizer), CS-505 (сульфат пактимиба (Pactimibe), Sankyo Pharma) или их сочетания.
При желании один или несколько ингибиторов ACAT, как правило, присутствуют в композиции по изобретению (или их совместно вводят с EPA в соответствии с другими вариантами осуществления изобретения) в количестве приблизительно от 1 мг до приблизительно 1000 мг, например, приблизительно 1 мг, приблизительно 5 мг, приблизительно 10 мг, приблизительно 20 мг, приблизительно 30 мг, приблизительно 40 мг, приблизительно 50 мг, приблизительно 60 мг, приблизительно 70 мг, приблизительно 80 мг, приблизительно 90 мг, приблизительно 100 мг, приблизительно 125 мг, приблизительно 150 мг, приблизительно 175 мг, приблизительно 200 мг, приблизительно 225 мг, приблизительно 250 мг, приблизительно 266 мг, приблизительно 275 мг, приблизительно 300 мг, приблизительно 324 мг, приблизительно 325 мг, приблизительно 330 мг, приблизительно 350 мг, приблизительно 375 мг, приблизительно 400 мг, приблизительно 425 мг, приблизительно 450 мг, приблизительно 475 мг, приблизительно 500 мг, приблизительно 525 мг, приблизительно 550 мг, приблизительно 575 мг, приблизительно 600 мг, приблизительно 625 мг, приблизительно 650 мг, приблизительно 675 мг, приблизительно 700 мг, приблизительно 725 мг, приблизительно 750 мг, приблизительно 775 мг, приблизительно 800 мг, приблизительно 825 мг, приблизительно 850 мг, приблизительно 875 мг, приблизительно 900 мг, приблизительно 925 мг, приблизительно 950 мг, приблизительно 975 мг, приблизительно 1000 мг.
Ингибиторы ACE
Ангиотензин-I-превращающий фермент ("ACE") преобразует ангиотензин I в ангиотензин II и ингибирует брадикинин. Вследствие того, что увеличенные уровни ангиотензина II и сниженные уровни брадикинина способствуют ряду сердечно-сосудистых заболеваний и нарушений, средства, ингибирующие ACE, пригодны для предотвращения или лечения связанных с сердечно-сосудистой системой заболеваний, таких как гипертензия, сердечная недостаточность, диабетическая нейропатия и диабет 2 типа. Неограничивающие примеры подходящих ингибиторов ACE включают каптоприл, эналаприл, эналаприлат, трандолаприл, моэксиприл, рамиприл, хинаприл, периндоприл, лизиноприл, беназеприл, фозиноприл или их сочетания.
При желании один или несколько ингибиторов ACE, как правило, присутствуют в композиции по изобретению (или их совместно вводят с EPA в соответствии с другими вариантами осуществления изобретения) в количестве приблизительно от 0,5 мг до приблизительно 50 мг, например, приблизительно 0,5 мг, приблизительно 0,75 мг, приблизительно 1 мг, приблизительно 1,25 мг, приблизительно 2 мг, приблизительно 2,5 мг, приблизительно 3 мг, приблизительно 4 мг, приблизительно 5 мг, приблизительно 6 мг, приблизительно 7 мг, приблизительно 7,5 мг, приблизительно 8 мг, приблизительно 9 мг, приблизительно 10 мг, приблизительно 11 мг, приблизительно 12 мг, приблизительно 13 мг, приблизительно 14 мг, приблизительно 15 мг, приблизительно 16 мг, приблизительно 17 мг, приблизительно 18 мг, приблизительно 19 мг, приблизительно 20 мг, приблизительно 21 мг, приблизительно 22 мг, приблизительно 23 мг, приблизительно 24 мг, приблизительно 25 мг, приблизительно 26 мг, приблизительно 27 мг, приблизительно 28 мг, приблизительно 29 мг, приблизительно 30 мг, приблизительно 31 мг, приблизительно 32 мг, приблизительно 33 мг, приблизительно 34 мг, приблизительно 35 мг, приблизительно 36 мг, приблизительно 37 мг, приблизительно 38 мг, приблизительно 39 мг, приблизительно 40 мг, приблизительно 41 мг, приблизительно 42 мг, приблизительно 43 мг, приблизительно 44 мг, приблизительно 45 мг, приблизительно 46 мг, приблизительно 47 мг, приблизительно 48 мг, приблизительно 49 мг или приблизительно 50 мг.
Антагонисты альдостерона
Альдостерон представляет собой стероидный гормон, способствующий гипертензии посредством ингибирования функции почек. Таким образом, средства, конкурирующие с альдостероном за рецепторы к минералокортикоидам, пригодны для предотвращения или лечения гипертензии. Неограничивающие примеры подходящих средств против альдостерона включают эплеренон и альдактон или их сочетания.
При желании антагонисты альдостерона, как правило, присутствуют в композиции по изобретению (или их совместно вводят с EPA в соответствии с другими вариантами осуществления изобретения) в количестве приблизительно от 5 мг до приблизительно 100 мг, например, приблизительно 5 мг, приблизительно 10 мг, приблизительно 12 мг, приблизительно 15 мг, приблизительно 20 мг, приблизительно 25 мг, приблизительно 30 мг, приблизительно 35 мг, приблизительно 40 мг, приблизительно 45 мг, приблизительно 50 мг, приблизительно 55 мг, приблизительно 60 мг, приблизительно 65 мг, приблизительно 70 мг, приблизительно 75 мг, приблизительно 80 мг, приблизительно 85 мг, приблизительно 90 мг, приблизительно 95 или приблизительно 100 мг.
Альфа-блокаторы
Альфа-блокаторы, также называемые антагонисты альфа-адренергических рецепторов, конкурируют с адреналином за связывание с α-адренорецепторами. Связывание адреналина с такими рецепторами приводит к вазоконстрикции и, таким образом, гипертензии. Таким образом, средства, конкурирующие с адреналином или блокирующие α-адренорецепторы, пригодны для предотвращения или лечения гипертензии. Неограничивающие примеры подходящих альфа-блокаторов включают доксазозин, метилдофу, клонидин, празозин, теразозин или их сочетания.
При желании альфа-блокаторы, как правило, присутствуют в композиции по изобретению (или их совместно вводят с EPA в соответствии с другими вариантами осуществления изобретения) в количестве приблизительно от 0,02 мг до приблизительно 0,5 мг, например, приблизительно 0,02 мг, приблизительно 0,03 мг, приблизительно 0,04 мг, приблизительно 0,05 мг, приблизительно 0,06 мг, приблизительно 0,07 мг, приблизительно 0,08 мг, приблизительно 0,09 мг, приблизительно 0,1 мг, приблизительно 0,2 мг, приблизительно 2,5 мг, приблизительно 0,3 мг, приблизительно 3,5 мг, приблизительно 0,4 мг, приблизительно 4,5 мг или приблизительно 0,5 мг; в количестве приблизительно от 0,5 мг до приблизительно 15 мг, например, приблизительно 0,5 мг, приблизительно 0,75 мг, приблизительно 1 мг, приблизительно 2 мг, приблизительно 3 мг, приблизительно 4 мг, приблизительно 5 мг, приблизительно 6 мг, приблизительно 7 мг, приблизительно 8 мг, приблизительно 9 мг, приблизительно 10 мг, приблизительно 11 мг, приблизительно 12 мг, приблизительно 13 мг, приблизительно 14 мг или приблизительно 15 мг или в количестве приблизительно от 100 мг до приблизительно 500 мг, например, приблизительно 100 мг, приблизительно 125 мг, приблизительно 150 мг, приблизительно 175 мг, приблизительно 200 мг, приблизительно 225 мг, приблизительно 250 мг, приблизительно 275 мг, приблизительно 300 мг, приблизительно 325 мг, приблизительно 350 мг, приблизительно 375 мг, приблизительно 400 мг, приблизительно 425 мг, приблизительно 450 мг, приблизительно 475 мг или приблизительно 500 мг.
Альфа/бета-блокаторы
При желании один или несколько альфа/бета-блокаторов, как правило, присутствуют в композиции по изобретению (или их совместно вводят с EPA в соответствии с другими вариантами осуществления изобретения) в количестве приблизительно от 1 мг до приблизительно 25 мг, например, приблизительно 1 мг, приблизительно 2 мг, приблизительно 3 мг, приблизительно 3,125 мг, приблизительно 4 мг, приблизительно 5 мг, приблизительно 6 мг, приблизительно 6,25 мг, приблизительно 7 мг, приблизительно 8 мг, приблизительно 9 мг, приблизительно 10 мг, приблизительно 11 мг, приблизительно 12 мг, приблизительно 13 мг, приблизительно 14 мг, приблизительно 15 мг, приблизительно 16 мг, приблизительно 17 мг, приблизительно 18 мг, приблизительно 19 мг, приблизительно 20 мг, приблизительно 21 мг, приблизительно 22 мг, приблизительно 23 мг, приблизительно 24 или приблизительно 25 мг. Неограничивающий пример альфа/бета-блокатора представляет собой карведилол.
Антагонисты рецепторов ангиотензина II
Антагонисты рецепторов ангиотензина II, иначе называемые блокаторы рецепторов ангиотензина, ARB, антагонисты AT1-рецепторов или сартаны, пригодны для лечения гипертензии, застойной сердечной недостаточности и различных других заболеваний и нарушений. Неограничивающие примеры антагонистов рецепторов ангиотензина II включают кандесартан, ирбесартан, олмесартан, лозартан, валсартан, телмисартан, эпросартан или их сочетания.
При желании один или несколько антагонистов рецепторов ангиотензина II, как правило, присутствуют в композиции по изобретению (или их совместно вводят с EPA в соответствии с другими вариантами осуществления изобретения) в количестве приблизительно от 1 мг до приблизительно 100 мг, например, приблизительно 1 мг, приблизительно 2 мг, приблизительно 3 мг, приблизительно 4 мг, приблизительно 5 мг, приблизительно 6 мг, приблизительно 7 мг, приблизительно 8 мг, приблизительно 9 мг, приблизительно 10 мг, приблизительно 12 мг, приблизительно 15 мг, приблизительно 16 мг, приблизительно 20 мг, приблизительно 24 мг, приблизительно 25 мг, приблизительно 28 мг, приблизительно 30 мг, приблизительно 32 мг, приблизительно 35 мг, приблизительно 40 мг, приблизительно 45 мг, приблизительно 50 мг, приблизительно 55 мг, приблизительно 60 мг, приблизительно 65 мг, приблизительно 70 мг, приблизительно 75 мг, приблизительно 80 мг, приблизительно 85 мг, приблизительно 90 мг, приблизительно 95 мг, приблизительно 100 мг; в количестве приблизительно от 40 мг до приблизительно 320 мг, например, приблизительно 40 мг, приблизительно 60 мг, приблизительно 80 мг, приблизительно 100 мг, приблизительно 120 мг, приблизительно 140 мг, приблизительно 160 мг, приблизительно 180 мг, приблизительно 200 мг, приблизительно 220 мг, приблизительно 240 мг, приблизительно 260 мг, приблизительно 280 мг, приблизительно 300 мг, приблизительно 320 мг; в количестве приблизительно от 200 мг до приблизительно 800 мг, например, приблизительно 200 мг, приблизительно 250 мг, приблизительно 300 мг, приблизительно 350 мг, приблизительно 400 мг, приблизительно 450 мг, приблизительно 500 мг, приблизительно 550 мг, приблизительно 600 мг, приблизительно 650 мг, приблизительно 700 мг, приблизительно 750 мг или приблизительно 800 мг.
Антиаритмические средства
Антиаритмические лекарственные средства действуют, корректируя нерегулярные сердечные сокращения и/или замедляя сердце со слишком высокой частотой сердечных сокращений. Неограничивающие примеры подходящих антиаритмические средства включают аденозин, амиодарон, дигоксин, дизопирамид, флекаинид, лидокаин, мексилетин, прокаинамид, глюконат хинидина, гидрохлорид пропафенона, токайнид или их сочетания.
При желании одно или несколько антиаритмических средств, как правило, присутствуют в композиции по изобретению (или их совместно вводят с EPA в соответствии с другими вариантами осуществления изобретения) в количестве приблизительно от 0,1 мг до приблизительно 1500 мг, приблизительно от 1 мг до приблизительно 1200 мг или приблизительно от 5 мг до приблизительно 1000 мг, например, приблизительно 0,1 мг, приблизительно 0,5 мг, приблизительно 0,75 мг, приблизительно 1 мг, приблизительно 5 мг, приблизительно 6 мг, приблизительно 10 мг, приблизительно 20 мг, приблизительно 30 мг, приблизительно 40 мг, приблизительно 50 мг, приблизительно 60 мг, приблизительно 70 мг, приблизительно 80 мг, приблизительно 90 мг, приблизительно 100 мг, приблизительно 125 мг, приблизительно 150 мг, приблизительно 175 мг, приблизительно 200 мг, приблизительно 225 мг, приблизительно 250 мг, приблизительно 266 мг, приблизительно 275 мг, приблизительно 300 мг, приблизительно 324 мг, приблизительно 325 мг, приблизительно 330 мг, приблизительно 350 мг, приблизительно 375 мг, приблизительно 400 мг, приблизительно 425 мг, приблизительно 450 мг, приблизительно 475 мг, приблизительно 500 мг, приблизительно 525 мг, приблизительно 550 мг, приблизительно 575 мг, приблизительно 600 мг, приблизительно 625 мг, приблизительно 650 мг, приблизительно 675 мг, приблизительно 700 мг, приблизительно 725 мг, приблизительно 750 мг, приблизительно 775 мг, приблизительно 800 мг, приблизительно 825 мг, приблизительно 850 мг, приблизительно 875 мг, приблизительно 900 мг, приблизительно 925 мг, приблизительно 950 мг, приблизительно 975 мг, приблизительно 1000 мг, приблизительно 1025 мг, приблизительно 1050 мг, приблизительно 1075 мг, приблизительно 1100 мг, приблизительно 1025 мг, приблизительно 1050 мг, приблизительно 1075 мг или приблизительно 1200 мг, приблизительно 1225 мг, приблизительно 1250 мг, приблизительно 1275 мг, приблизительно 1300 мг, приблизительно 1325 мг, приблизительно 1350 мг, приблизительно 1375 мг, приблизительно 1400 мг, приблизительно 1425 мг, приблизительно 1450 мг, приблизительно 1475 мг или приблизительно 1500 мг.
В другом варианте осуществления одно или несколько антиаритмических средств могут присутствовать в количестве приблизительно от 1 мг на мл до приблизительно 500 мг на мл, например, приблизительно 1 мг на мл, приблизительно 2 мг на мл, приблизительно 3 мг на мл, приблизительно 4 мг на мл, приблизительно 5 мг на мл, приблизительно 6 мг на мл, приблизительно 10 мг на мл, приблизительно 25 мг на мл, приблизительно 50 мг на мл, приблизительно 75 мг на мл, приблизительно 80 мг на мл, приблизительно 100 мг на мл, приблизительно 125 мг на мл, приблизительно 150 мг на мл, приблизительно 175 мг на мл, приблизительно 200 мг на мл, приблизительно 225 мг на мл, приблизительно 250 мг на мл, приблизительно 275 мг на мл, приблизительно 300 мг на мл, приблизительно 325 мг на мл, приблизительно 350 мг на мл, приблизительно 375 мг на мл, приблизительно 400 мг на мл, приблизительно 425 мг на мл, приблизительно 450 мг на мл, приблизительно 475 мг на мл или приблизительно 500 мг на мл.
В другом варианте осуществления антиаритмические средства присутствуют в количестве приблизительно от 0,01% до приблизительно 5%, например, приблизительно 0,01%, приблизительно 0,02%, приблизительно 0,03%, приблизительно 0,04%, приблизительно 0,05%, приблизительно 0,06%, приблизительно 0,07%, приблизительно 0,08%, приблизительно 0,09%, приблизительно 0,1%, приблизительно 0,2%, приблизительно 0,3%, приблизительно 0,4%, приблизительно 0,5%, приблизительно 0,6%, приблизительно 0,7%, приблизительно 0,8%, приблизительно 0,9%, приблизительно 1%, приблизительно 1,1%, приблизительно 1,2%, приблизительно 1,3%, приблизительно 1,4%, приблизительно 1,5%, приблизительно 1,6%, приблизительно 1,7%, приблизительно 1,8%, приблизительно 1,9%, приблизительно 2%, приблизительно 2,1%, приблизительно 2,2%, приблизительно 2,3%, приблизительно 2,4%, приблизительно 2,5%, приблизительно 2,6%, приблизительно 2,7%, приблизительно 2,8%, приблизительно 2,9%, приблизительно 3%, приблизительно 3,1%, приблизительно 3,2%, приблизительно 3,3%, приблизительно 3,4%, приблизительно 3,5%, приблизительно 3,6%, приблизительно 3,7%, приблизительно 3,8%, приблизительно 3,9%, приблизительно 4%, приблизительно 4,1%, приблизительно 4,2%, приблизительно 4,3%, приблизительно 4,4%, приблизительно 4,5%, приблизительно 4,6%, приблизительно 4,7%, приблизительно 4,8%, приблизительно 4,9% или приблизительно 5% по массе от общей композиции.
Антитромбоцитарные средства
Антитромбоцитарные средства ингибируют агрегацию тромбоцитов и таким образом противостоят развитию тромбов. Неограничивающие примеры антитромбоцитарных средств включают адепарин, аспирин, клопидогрель, данапароид, дельтапарин, денапароид, тиклопидин, цилостазол, абциксимаб, эптифибатид, тирофибан, дефибротид, эноксапарин, дипиридамол, тинзапарин или их сочетания.
При желании одно или несколько антитромбоцитарных средств, как правило, присутствуют в композиции по изобретению (или их совместно вводят с EPA в соответствии с другими вариантами осуществления изобретения) в количестве приблизительно от 10 мг до приблизительно 100 мг, например, приблизительно 10 мг, приблизительно 12,5 мг, приблизительно 15 мг, приблизительно 20 мг, приблизительно 25 мг, приблизительно 30 мг, приблизительно 35 мг, приблизительно 40 мг, приблизительно 45 мг, приблизительно 50 мг, приблизительно 55 мг, приблизительно 60 мг, приблизительно 65 мг, приблизительно 70 мг, приблизительно 75 мг, приблизительно 80 мг, приблизительно 85 мг, приблизительно 90 мг, приблизительно 95 мг или приблизительно 100 мг; в количестве приблизительно от 50 мг до приблизительно 300 мг, например, приблизительно 50 мг, приблизительно 75 мг, приблизительно 100 мг, приблизительно 125 мг, приблизительно 150 мг, приблизительно 175 мг, приблизительно 200 мг, приблизительно 225 мг, приблизительно 250 мг, приблизительно 275 мг или приблизительно 300 мг.
В другом варианте осуществления одно или несколько антитромбоцитарных средств присутствуют в количестве приблизительно от 25 мкг на мл до приблизительно 50 мкг на мл, например, приблизительно 25 мкг на мл, приблизительно 30 мкг на мл, приблизительно 35 мкг на мл, приблизительно 40 мкг на мл, приблизительно 45 мкг на мл или приблизительно 50 мкг на мл; или в количестве приблизительно от 1 мг на мл до приблизительно 2 мг на мл, например, приблизительно 1 мг на мл, приблизительно 1,25 мг на мл, приблизительно 1,50 мг на мл, приблизительно 1,75 или приблизительно 2 мг на мл.
Миметики apoA-1
Аполипопротеин A-1 ("apoA-1") представляет собой первичный белковый компонент сывороточных HDL с холестерином. Неограничивающие примеры миметиков apoA-1 включают ETC-216, ETC-588-липосома, ETC-642, тримерный apoA-1, CSL-111, APP018, обратный D-4F или их сочетания.
При желании один или несколько миметиков apoA-1, как правило, присутствуют в композиции по изобретению (или их совместно вводят с EPA в соответствии с другими вариантами осуществления изобретения) в количестве приблизительно от 0,1 мг до приблизительно 1500 мг, приблизительно от 1 мг до приблизительно 1200 мг или приблизительно от 5 мг до приблизительно 1000 мг, например, приблизительно 0,1 мг, приблизительно 0,5 мг, приблизительно 0,75 мг, приблизительно 1 мг, приблизительно 5 мг, приблизительно 6 мг, приблизительно 10 мг, приблизительно 20 мг, приблизительно 30 мг, приблизительно 40 мг, приблизительно 50 мг, приблизительно 60 мг, приблизительно 70 мг, приблизительно 80 мг, приблизительно 90 мг, приблизительно 100 мг, приблизительно 125 мг, приблизительно 150 мг, приблизительно 175 мг, приблизительно 200 мг, приблизительно 225 мг, приблизительно 250 мг, приблизительно 266 мг, приблизительно 275 мг, приблизительно 300 мг, приблизительно 324 мг, приблизительно 325 мг, приблизительно 330 мг, приблизительно 350 мг, приблизительно 375 мг, приблизительно 400 мг, приблизительно 425 мг, приблизительно 450 мг, приблизительно 475 мг, приблизительно 500 мг, приблизительно 525 мг, приблизительно 550 мг, приблизительно 575 мг, приблизительно 600 мг, приблизительно 625 мг, приблизительно 650 мг, приблизительно 675 мг, приблизительно 700 мг, приблизительно 725 мг, приблизительно 750 мг, приблизительно 775 мг, приблизительно 800 мг, приблизительно 825 мг, приблизительно 850 мг, приблизительно 875 мг, приблизительно 900 мг, приблизительно 925 мг, приблизительно 950 мг, приблизительно 975 мг, приблизительно 1000 мг, приблизительно 1025 мг, приблизительно 1050 мг, приблизительно 1075 мг, приблизительно 1100 мг, приблизительно 1125 мг, приблизительно 1150 мг, приблизительно 1175 мг или приблизительно 1200 мг, приблизительно 1225 мг, приблизительно 1250 мг, приблизительно 1275 мг, приблизительно 1300 мг, приблизительно 1325 мг, приблизительно 1350 мг, приблизительно 1375 мг, приблизительно 1400 мг, приблизительно 1425 мг, приблизительно 1450 мг, приблизительно 1475 мг или приблизительно 1500 мг.
Бета-блокаторы
Бета-блокаторы блокируют ответ на бета-адренорецепторы нервов, что приводит к замедлению частоты сердечных сокращения и снижению артериального давления. Неограничивающие примеры подходящих бета-блокаторов включают ацебутолол, атенолол, метопролол, надолол, небиволол, пиндолол, пропранолол или их сочетания.
При желании один или несколько бета-блокаторы, как правило, присутствуют в композиции по изобретению (или их совместно вводят с EPA в соответствии с другими вариантами осуществления изобретения) в количестве приблизительно от 1 мг до приблизительно 1000 мг, приблизительно от 1 мг до приблизительно 750 мг или приблизительно от 1 мг до приблизительно 500 мг, например, приблизительно 1 мг, приблизительно 2 мг, приблизительно 2,5 мг, приблизительно 3 мг, приблизительно 4 мг, приблизительно 5 мг, приблизительно 10 мг, приблизительно 20 мг, приблизительно 25 мг, приблизительно 30 мг, приблизительно 40 мг, приблизительно 50 мг, приблизительно 60 мг, приблизительно 70 мг, приблизительно 80 мг, приблизительно 90 мг, приблизительно 100 мг, приблизительно 120 мг, приблизительно 125 мг, приблизительно 150 мг, приблизительно 175 мг, приблизительно 200 мг, приблизительно 225 мг, приблизительно 250 мг, приблизительно 275 мг, приблизительно 300 мг, приблизительно 325 мг, приблизительно 350 мг, приблизительно 375 мг, приблизительно 400 мг, приблизительно 425 мг, приблизительно 450 мг, приблизительно 475 мг или приблизительно 500 мг.
Усилители экскреции желчных кислот
Усилители экскреции желчных кислот прерывают кишечно-печеночную циркуляцию желчных кислот, связывая компоненты желчных кислот в желудочно-кишечном тракте, делая их после этого невсасываемыми. Таким образом, усилители экскреции желчных кислот кроме других заболеваний и нарушений пригодны для предотвращения или лечения гиперлипидемии. Неограничивающие примеры усилителей экскреции желчных кислот включают колесевелам HCl, колестипол, лохолест и холестирамин или их сочетания.
При желании один или несколько усилителей экскреции желчных кислот, как правило, присутствуют в композиции по изобретению (или их совместно вводят с EPA в соответствии с другими вариантами осуществления изобретения) в количестве приблизительно от 4 мг до приблизительно 32 мг, например, приблизительно 4 мг, приблизительно 8 мг, приблизительно 12 мг, приблизительно 16 мг, приблизительно 24 мг, приблизительно 32 мг или в количестве приблизительно от 300 мг до приблизительно 4000 мг, например, приблизительно 300 мг, приблизительно 325 мг, приблизительно 350 мг, приблизительно 400 мг, приблизительно 450 мг, приблизительно 500 мг, приблизительно 550 мг, приблизительно 600 мг, приблизительно 625 мг, приблизительно 650 мг, приблизительно 700 мг, приблизительно 750 мг, приблизительно 800 мг, приблизительно 900 мг, приблизительно 1000 мг, приблизительно 1250 мг, приблизительно 1500 мг, приблизительно 1750 мг, приблизительно 2000 мг, приблизительно 2250 мг, приблизительно 2500 мг, приблизительно 2750 мг, приблизительно 3000 мг, приблизительно 3250 мг, приблизительно 3500 мг, приблизительно 3750 или приблизительно 4000 мг.
Блокаторы кальциевых каналов
Блокаторы кальциевых каналов вследствие их сосудорасширяющего действия пригодны для предотвращения или лечения гипертензии. Неограничивающие примеры блокаторов кальциевых каналов включают никардипин, дилтиазем, бутират клевидипина, исрадипин, нимодипин, нисолдипин, верапамил, и безилат амлодипина или их сочетания. Неограничивающие примеры комбинированных блокаторов кальциевых каналов включают амлодипин, олмесартан, валсартан или их сочетания.
При желании один или несколько блокаторов кальциевых каналов, как правило, присутствуют в композиции по изобретению (или их совместно вводят с EPA в соответствии с другими вариантами осуществления изобретения) в количестве приблизительно от 1 мг до приблизительно 10 мг, например, приблизительно 1 мг, приблизительно 2 мг, приблизительно 2,5 мг, приблизительно 3 мг, приблизительно 4 мг, приблизительно 5 мг, приблизительно 6 мг, приблизительно 7 мг, приблизительно 8 мг, приблизительно 9 мг или приблизительно 10 мг; в количестве приблизительно от 5 мг до приблизительно 34 мг, например, приблизительно 5 мг, приблизительно 6 мг, приблизительно 7 мг, приблизительно 8 мг, приблизительно 8,5 мг, приблизительно 9 мг, приблизительно 10 мг, приблизительно 15 мг, приблизительно 17,5 мг, приблизительно 20 мг, приблизительно 22,5 мг, приблизительно 25 мг, приблизительно 25,5 мг, приблизительно 27,5 мг, приблизительно 30 мг, приблизительно 32,5 или приблизительно 34 мг; в количестве приблизительно от 10 мг до приблизительно 60 мг, например, приблизительно 10 мг, приблизительно 15 мг, приблизительно 20 мг, приблизительно 25 мг, приблизительно 30 мг, приблизительно 35 мг, приблизительно 40 мг, приблизительно 45 мг, приблизительно 50 мг, приблизительно 55 мг или приблизительно 60 мг; в количестве приблизительно от 20 мг до приблизительно 120 мг, например, приблизительно 20 мг, приблизительно 30 мг, приблизительно 40 мг, приблизительно 50 мг, приблизительно 60 мг, приблизительно 70 мг, приблизительно 80 мг, приблизительно 90 мг, приблизительно 100 мг, приблизительно 110 или приблизительно 120 мг; в количестве приблизительно от 60 мг до приблизительно 420 мг, например, приблизительно 60 мг, приблизительно 70 мг, приблизительно 80 мг, приблизительно 90 мг, приблизительно 100 мг, приблизительно 110 мг, приблизительно 120 мг, приблизительно 140 мг, приблизительно 160 мг, приблизительно 180 мг, приблизительно 200 мг, приблизительно 220 мг, приблизительно 240 мг, приблизительно 260 мг, приблизительно 280 мг, приблизительно 300 мг, приблизительно 320 мг, приблизительно 340 мг, приблизительно 360 мг, приблизительно 380 мг, приблизительно 400 или приблизительно 420 мг.
В другом варианте осуществления один или несколько блокаторов кальциевых каналов присутствуют в количестве приблизительно от 0,05 мг на мл до приблизительно 2,5 мг на мл, например, приблизительно 0,05 мг на мл, приблизительно 0,1 мг на мл, приблизительно 0,2 мг на мл, приблизительно 0,3 мг на мл, приблизительно 0,4 мг на мл, приблизительно 0,5 мг на мл, приблизительно 0,6 мг на мл, приблизительно 0,7 мг на мл, приблизительно 0,8 мг на мл, приблизительно 0,9 мг на мл, приблизительно 1,0 мг на мл, приблизительно 1,25 мг на мл, приблизительно 1,5 мг на мл, приблизительно 1,75 мг на мл, приблизительно 2,0 мг на мл, приблизительно 2,25 мг на мл или приблизительно 2,5 мг на мл.
Ингибиторы CETP
Белок-переносчик сложных эфиров холестерина ("CETP") играет важную роль в переносе сложных эфиров холестерина и триглицеридов. Таким образом, ингибирование CETP также называемого белок-переносчик плазматических липидов, пригодно для предотвращения или лечения атеросклероза и других сердечно-сосудистых заболеваний и нарушений. Неограничивающие примеры ингибиторов CETP включают торцетрапиб, анацетрапиб, JTT-705, BAY-60-5521, PF-3185043 и CP-800569 или их сочетания.
Один или несколько ингибиторов CETP, при желании, присутствуют в композиции по изобретению (или их совместно вводят с EPA в соответствии с другими вариантами осуществления изобретения) в количестве, достаточном для обеспечения индивидууму дозы приблизительно 25 мг на кг массы тела ("мг на кг") до приблизительно 100 мг на кг, например, приблизительно 25 мг на кг, приблизительно 30 мг на кг, приблизительно 35 мг на кг, приблизительно 40 мг на кг, приблизительно 45 мг на кг, приблизительно 50 мг на кг, приблизительно 55 мг на кг, приблизительно 60 мг на кг, приблизительно 65 мг на кг, приблизительно 70 мг на кг, приблизительно 75 мг на кг, приблизительно 80 мг на кг, приблизительно 85 мг на кг, приблизительно 90 мг на кг, приблизительно 95 мг на кг или приблизительно 100 мг на кг.
В другом варианте осуществления, при желании, один или несколько ингибиторов CETP присутствуют в композиции по изобретению (или их совместно вводят с EPA в соответствии с другими вариантами осуществления изобретения) в количестве приблизительно от 100 мг до приблизительно 10 г, приблизительно от 500 мг до приблизительно 9 г или приблизительно от 750 мг до приблизительно 5 г.
Ингибиторы всасывания холестерина
Ингибиторы всасывания холестерина снижают содержание холестерина хиломикрон и остатков хиломикрон, предотвращая захват мицелллярного холестерина из тонкого кишечника. В результате в печень доставляется меньшее количество холестерина и, таким образом, снижаются LDL. Неограничивающие примеры ингибиторов всасывания холестерина включают эзетимиб и симвастатин или их сочетания.
При желании один или несколько ингибиторов всасывания холестерина, как правило, присутствуют в композиции по изобретению (или их совместно вводят с EPA в соответствии с другими вариантами осуществления изобретения) в количестве приблизительно от 1 мг до приблизительно 10 мг, например, приблизительно 1 мг, приблизительно 2 мг, приблизительно 3 мг, приблизительно 4 мг, приблизительно 5 мг, приблизительно 6 мг, приблизительно 7 мг, приблизительно 8 мг, приблизительно 9 мг или приблизительно 10 мг или в количестве приблизительно от 10 до приблизительно 80 мг, например, приблизительно 10 мг, приблизительно 15 мг, приблизительно 20 мг, приблизительно 25 мг, приблизительно 30 мг, приблизительно 35 мг, приблизительно 40 мг, приблизительно 45 мг, приблизительно 50 мг, приблизительно 55 мг, приблизительно 60 мг, приблизительно 65 мг, приблизительно 70 мг, приблизительно 75 мг или приблизительно 80 мг.
Диуретики
Диуретики увеличивают частоту мочеиспускания, форсируя диурез. Некоторые диуретики также обеспечивают антигипертензивное действие. Неограничивающие примеры диуретиков включают гидрохлоротиазид, торсемид, этакриновую кислоту, фуросемид, триамтерен, индапамид, хлортиазид натрия, алискирен или их сочетания.
При желании один или несколько диуретиков, как правило, присутствуют в композиции по изобретению (или их совместно вводят с EPA в соответствии с другими вариантами осуществления изобретения) в количестве: (a) приблизительно от 0,25 мг до приблизительно 2,5 мг, например, приблизительно 0,25 мг, приблизительно 0,5 мг, приблизительно 0,75 мг, приблизительно 1 мг, приблизительно 1,25 мг, приблизительно 1,5 мг, приблизительно 1,75 мг, приблизительно 2 мг, приблизительно 2,25 мг или приблизительно 2,5 мг; (b) в количестве приблизительно от 5 мг до приблизительно 25 мг, например, приблизительно 5 мг, приблизительно 10 мг, приблизительно 12,5 мг, приблизительно 15 мг, приблизительно 17,5 мг, приблизительно 20 мг, приблизительно 22,5 мг или приблизительно 25 мг; (c) в количестве приблизительно от 2 мг до приблизительно 100 мг, например, приблизительно 2 мг, приблизительно 3 мг, приблизительно 4 мг, приблизительно 5 мг, приблизительно 7,5 мг, приблизительно 10 мг, приблизительно 12,5 мг, приблизительно 15 мг, приблизительно 17,5 мг, приблизительно 20 мг, приблизительно 25 мг, приблизительно 30 мг, приблизительно 35 мг, приблизительно 40 мг, приблизительно 45 мг, приблизительно 50 мг, приблизительно 55 мг, приблизительно 60 мг, приблизительно 65 мг, приблизительно 70 мг, приблизительно 75 мг, приблизительно 80 мг, приблизительно 85 мг, приблизительно 90 мг, приблизительно 95 мг или приблизительно 100 мг; (d) приблизительно от 10 мг до приблизительно 50 мг, например, приблизительно 10 мг, приблизительно 12,5 мг, приблизительно 15 мг, приблизительно 17,5 мг, приблизительно 20 мг, приблизительно 22,5 мг, приблизительно 25 мг, приблизительно 30 мг, приблизительно 35 мг, приблизительно 40 мг, приблизительно 45 мг или приблизительно 50 мг; в количестве приблизительно от 5 мг до приблизительно 60 мг, например, приблизительно 5 мг, приблизительно 10 мг, приблизительно 15 мг, приблизительно 20 мг, приблизительно 25 мг, приблизительно 30 мг, приблизительно 35 мг, приблизительно 40 мг, приблизительно 45 мг, приблизительно 50 мг, приблизительно 55 мг или приблизительно 60 мг; (e) в количестве приблизительно от 25 мг до приблизительно 100 мг, например, приблизительно 25 мг, приблизительно 30 мг, приблизительно 35 мг, приблизительно 40 мг, приблизительно 45 мг, приблизительно 50 мг, приблизительно 60 мг, приблизительно 70 мг, приблизительно 80 мг, приблизительно 90 мг или приблизительно 100 мг; в количестве приблизительно от 75 мг до приблизительно 300 мг, например, приблизительно 75 мг, приблизительно 100 мг, приблизительно 125 мг, приблизительно 150 мг, приблизительно 175 мг, приблизительно 200 мг, приблизительно 225 мг, приблизительно 250 мг, приблизительно 275 мг или приблизительно 300 мг; (f) приблизительно от 0,1 г до приблизительно 0,5 г, например, приблизительно 0,1 г, приблизительно 0,2 г, приблизительно 0,3 г, приблизительно 0,4 г или приблизительно 0,5 г; или (g) в количестве приблизительно от 1 мг на мл до приблизительно 10 мг на мл, например, приблизительно 1 мг на мл, приблизительно 2 мг на мл, приблизительно 3 мг на мл, приблизительно 4 мг на мл, приблизительно 5 мг на мл, приблизительно 6 мг на мл, приблизительно 7 мг на мл, приблизительно 8 мг на мл, приблизительно 9 мг на мл или приблизительно 10 мг на мл.
Средства против дислипидемии
Дислипидемия представляет собой класс заболеваний, включающий гиперлипидемию. Дислипидемия Фредриксона типа I (иногда, обозначаемая как синдром Бюргера-Грютца, первичная гиперлипопротеинемия или семейная гиперхиломикронемия) характеризуется повышенными уровнями холестерина, у индивидуумов с дислипидемией Фредриксона типа IIa (также известной как семейная гиперхолестеринемия) наблюдают повышенные уровни LDL. У индивидуумов с дислипидемией Фредриксона типа IIb (семейная комбинированная гиперлипопротеинемия (FCH) или вторичная комбинированная гиперлипопротеинемия) наблюдают повышенные уровни LDL и VLDL. Дислипидемия Фредриксона типа III (иногда называемая бета-болезнь или дисбеталипопротеинемия) характеризуется повышенными уровнями липопротеинов средней плотности ("IDL"), тогда как у индивидуумов с дислипидемией Фредриксона типа IV (иногда называемой "чистая гипертриглицеридемия") наблюдают повышенные уровни VLDL. У индивидуумов с дислипидемией Фредриксона типа V наблюдают повышенные уровни VLDL и хиломикрон.
Неограничивающие примеры средств против дислипидемии включают антитело Angpt14, APA-01 (Phosphagenics), CRD-5 (ImaSight), NCX6560 (NicOx), РНКи PCSK9 (Alnylam), рекомбинантный apoA-1 (SemBioSys Genetics), антитело к oxLDL (Genentech), APL180 (Novartis), APP018 (D4F) (Novartis), CER-002 (Cerenis Therapeutics), CP-800569 (Pfizer), GSK-256073 (GlaxoSmithKline), MB07811 (Metabasis), PF-3185043 (Pfizer), R7232 (Roche), рилапладиб (GlaxoSmithKline), RVX-208 (Resverlogix), зобетиром (Sobetirome) (QRX-431 (QuatRx)), анацетрапиб (Merk), CSL111 (CSL Limited), дарапладиб (GlaxoSmithKline), эпротиром (Karo Bio), GFT505 (Genfit), MAHDL01 (Marzal Plant Pharma), MBX-8025 (Metabolex), PLX204 (Wyeth/Plexxikon), алеглитезар (Roche), далцетрапиб (Roche), SLx4090 (Surface Logix), вареспладиб (Anthera Pharmaceuticals), AEGR-733 (Aegerion), ABT-335 (Abbott Laboratories), AVE5530 (Sanofi-Aventis), LCP-AtorFen (LifeCycle Pharma), TRIA-662 (Cortria), фенофибрат, холинфенофибрат, эзетимиб, колесевелам, ларопипрант или комбинации любого из указанных выше.
При желании один или несколько средств против дислипидемии, как правило, присутствуют в композиции по изобретению (или их совместно вводят с EPA в соответствии с другими вариантами осуществления изобретения) в количестве приблизительно от 1 мг до приблизительно 1000 мг, например, приблизительно 1 мг, приблизительно 2 мг, приблизительно 3 мг, приблизительно 4 мг, приблизительно 5 мг, приблизительно 6 мг, приблизительно 7 мг, приблизительно 8 мг, приблизительно 9 мг, приблизительно 10 мг, приблизительно 15 мг, приблизительно 20 мг, приблизительно 25 мг, приблизительно 30 мг, приблизительно 35 мг, приблизительно 40 мг, приблизительно 43 мг, приблизительно 45 мг, приблизительно 48 мг, приблизительно 50 мг, приблизительно 54 мг, приблизительно 55 мг, приблизительно 60 мг, приблизительно 65 мг, приблизительно 67 мг, приблизительно 70 мг, приблизительно 75 мг, приблизительно 80 мг, приблизительно 85 мг, приблизительно 87 мг, приблизительно 90 мг, приблизительно 95 мг, приблизительно 100 мг, приблизительно 105 мг, приблизительно 107 мг, приблизительно 110 мг, приблизительно 115 мг, приблизительно 120 мг, приблизительно 125 мг, приблизительно 130 мг, приблизительно 134 мг, приблизительно 135 мг, приблизительно 140 мг, приблизительно 145 мг, приблизительно 150 мг, приблизительно 155 мг, приблизительно 160 мг, приблизительно 165 мг, приблизительно 170 мг, приблизительно 175 мг, приблизительно 180 мг, приблизительно 185 мг, приблизительно 190 мг, приблизительно 195 мг, приблизительно 200 мг, приблизительно 250 мг, приблизительно 275 мг, приблизительно 300 мг, приблизительно 325 мг, приблизительно 350 мг, приблизительно 375 мг, приблизительно 400 мг, приблизительно 425 мг, приблизительно 450 мг, приблизительно 500 мг, приблизительно 550 мг, приблизительно 575 мг, приблизительно 600 мг, приблизительно 625 мг, приблизительно 650 мг, приблизительно 675 мг, приблизительно 700 мг, приблизительно 725 мг, приблизительно 750 мг, приблизительно 775 мг, приблизительно 800 мг, приблизительно 825 мг, приблизительно 850 мг, приблизительно 875 мг, приблизительно 900 мг, приблизительно 925 мг, приблизительно 950 мг, приблизительно 975 мг или приблизительно 1000 мг.
Антагонисты рецепторов эндотелина
Связывание эндотелина-1 с рецепторами эндотелина A (ETA) или рецепторами эндотелина B (ETB) вызывает вазоконстрикцию в легких. Антагонисты рецепторов эндотелина конкурируют за связывание с эндотелином-1, таким образом, ослабляя вазоконстрикцию в легких. Таким образом, антагонисты рецепторов эндотелина пригодны для лечения легочной гипертензии. Неограничивающие примеры антагонистов рецепторов эндотелина включают амбрисентан, бозентан, волибрис, телин или их сочетания.
При желании один или несколько антагонистов рецепторов эндотелина, как правило, присутствуют в композиции по изобретению (или их совместно вводят с EPA в соответствии с другими вариантами осуществления изобретения) в количестве приблизительно от 1 мг до приблизительно 10 мг, например, приблизительно 1 мг, приблизительно 2 мг, приблизительно 3 мг, приблизительно 4 мг, приблизительно 5 мг, приблизительно 6 мг, приблизительно 7 мг, приблизительно 8 мг, приблизительно 9 мг или приблизительно 10 мг; в количестве приблизительно от 50 мг до приблизительно 250 мг, например, приблизительно 50 мг, приблизительно 75 мг, приблизительно 100 мг, приблизительно 125 мг, приблизительно 150 мг, приблизительно 175 мг, приблизительно 200 мг, приблизительно 225 мг или приблизительно 250 мг.
Ингибиторы редуктазы HMG-CoA
Редуктаза HMG-CoA (также известная как HMGR) в метаболическом каскаде продукции холестерина преобразует HMG-CoA (3-гидрокси-3-метилглутарил-коэнзим A) в мевалоновую кислоту (3,5-дигидрокси-3-метилпентановую кислоту). Ингибиторы редуктазы HMG-CoA, также называемые статинами, ингибируют редуктазу HMG-CoA и, таким образом, снижают продукцию холестерина. В результате ингибиторы редуктазы HMG-CoA пригодны для лечения ряда сердечно-сосудистых заболеваний и нарушений, включая, например, гиперхолестеринемию, гиперлипидемию, смешанную дислипидемию, гипертриглицеридемию, атеросклероз. Неограничивающие примеры ингибиторов редуктазы HMG-CoA среди прочих включают ловастатин, ловастатин + ниацин, мевастатин, питавастатин, правастатин, розувастатин, флувастатин, аторвастатин, аторвастатин + безилат амлодипина, симвастатин, симвистатин + ниацин, эзетимиб и правастатин.
При желании один или несколько ингибиторов редуктазы HMG-CoA, как правило, присутствуют в композиции по изобретению (или их совместно вводят с EPA в соответствии с другими вариантами осуществления изобретения) в количестве приблизительно от 1 мг до приблизительно 1000 мг, например, приблизительно 1 мг, приблизительно 2 мг, приблизительно 3 мг, приблизительно 4 мг, приблизительно 5 мг, приблизительно 6 мг, приблизительно 7 мг, приблизительно 8 мг, приблизительно 9 мг или приблизительно 10 мг; приблизительно 15 мг, приблизительно 20 мг, приблизительно 25 мг, приблизительно 30 мг, приблизительно 35 мг, приблизительно 40 мг, приблизительно 45 мг, приблизительно 50 мг, приблизительно 55 мг, приблизительно 60 мг, приблизительно 65 мг, приблизительно 70 мг, приблизительно 75 мг, приблизительно 80 мг, приблизительно 90 мг, приблизительно 100 мг, приблизительно 125 мг, приблизительно 150 мг, приблизительно 175 мг, приблизительно 200 мг, приблизительно 225 мг, приблизительно 250 мг, приблизительно 275 мг, приблизительно 300 мг, приблизительно 325 мг, приблизительно 350 мг, приблизительно 375 мг, приблизительно 400 мг, приблизительно 425 мг, приблизительно 450 мг, приблизительно 475 мг, приблизительно 500 мг, приблизительно 525 мг, приблизительно 550 мг, приблизительно 575 мг, приблизительно 600 мг, приблизительно 625 мг, приблизительно 650 мг, приблизительно 675 мг, приблизительно 700 мг, приблизительно 725 мг, приблизительно 750 мг, приблизительно 775 мг, приблизительно 800 мг, приблизительно 825 мг, приблизительно 850 мг, приблизительно 875 мг, приблизительно 900 мг, приблизительно 925 мг, приблизительно 950 мг, приблизительно 975 мг или приблизительно 1000 мг.
Активаторы LCAT
Лецитин-холестеринацилтрансфераза ("LCAT") преобразует холестерин в сложный эфир холестерина. У индивидуумов с недостаточными уровнями LCAT в тканях организма накапливается неэтерифицированный холестерин. Это может приводить к повышенным уровням HDL в сыворотке и с течением времени к атеросклерозу. Таким образом, активаторы LCAT пригодны для снижения уровней HDL в сыворотке и для лечения или предотвращения атеросклероза. Неограничивающие примеры активаторов LCAT включают фермент LCAT, рекомбинантный LCAT, генотерапевтические средства, которые содержат последовательность нуклеиновой кислоты, кодирующую последовательность для экспрессии LCAT, эстрогены, аналоги эстрогенов и их сочетания, например, как описано в патенте США № 6635614, полностью включенном в настоящий документ в качестве ссылки.
При желании один или несколько активаторы LCAT, как правило, присутствуют в композиции по изобретению (или их совместно вводят с EPA в соответствии с другими вариантами осуществления изобретения) в количестве, достаточном для повышения уровня LCAT в сыворотке индивидуума до желаемого уровня. Индивидуумам с аномально низкими уровнями LCAT в сыворотке можно вводить количество композиции по изобретению, содержащей EPA и фермент LCAT, эстроген, аналоги эстрогенов или их сочетания, достаточной для повышения уровня LCAT в сыворотке субъекта до нормальных уровней, как правило, приблизительно 5 мкг на мл или более. В другом варианте осуществления индивидуумов с приблизительно нормальными уровнями LCAT в сыворотке можно лечить композицией по изобретению, содержащей EPA и фермент LCAT, эстроген, аналоги эстрогенов или их сочетания в количестве, достаточном для повышения уровня LCAT в сыворотке приблизительно до 6 мкг на мл или более, приблизительно 7 мкг на мл или более, приблизительно 8 мкг на мл или более, приблизительно 9 мкг на мл или более или приблизительно 10 мкг на мл или более.
Индукторы рецепторов LDL
Рецепторы LDL представляют собой белки на клеточной поверхности. Совместно с адаптином рецепторы LDL связывают свободный холестерин LDL с образованием покрытых клатрином везикул, снижая уровни LDL в сыворотке. Таким образом, средства, индуцирующие рецепторы LDL дополнительно снижают уровни LDL в сыворотке и пригодны для предотвращения или лечения атеросклероза. Неограничивающим примером рецептора LDL является лактацистин.
При желании один или несколько индукторов рецепторов LDL, как правило, присутствуют в композиции по изобретению (или их совместно вводят с EPA в соответствии с другими вариантами осуществления изобретения) в количестве приблизительно от 1 мг до приблизительно 1000 мг, например, приблизительно 1 мг, приблизительно 2 мг, приблизительно 3 мг, приблизительно 4 мг, приблизительно 5 мг, приблизительно 6 мг, приблизительно 7 мг, приблизительно 8 мг, приблизительно 9 мг или приблизительно 10 мг приблизительно 15 мг, приблизительно 20 мг, приблизительно 25 мг, приблизительно 30 мг, приблизительно 35 мг, приблизительно 40 мг, приблизительно 45 мг, приблизительно 50 мг, приблизительно 55 мг, приблизительно 60 мг, приблизительно 65 мг, приблизительно 70 мг, приблизительно 75 мг, приблизительно 80 мг, приблизительно 90 мг, приблизительно 100 мг, приблизительно 125 мг, приблизительно 150 мг, приблизительно 175 мг, приблизительно 200 мг, приблизительно 225 мг, приблизительно 250 мг, приблизительно 275 мг, приблизительно 300 мг, приблизительно 325 мг, приблизительно 350 мг, приблизительно 375 мг, приблизительно 400 мг, приблизительно 425 мг, приблизительно 450 мг, приблизительно 475 мг, приблизительно 500 мг, приблизительно 525 мг, приблизительно 550 мг, приблизительно 575 мг, приблизительно 600 мг, приблизительно 625 мг, приблизительно 650 мг, приблизительно 675 мг, приблизительно 700 мг, приблизительно 725 мг, приблизительно 750 мг, приблизительно 775 мг, приблизительно 800 мг, приблизительно 825 мг, приблизительно 850 мг, приблизительно 875 мг, приблизительно 900 мг, приблизительно 925 мг, приблизительно 950 мг, приблизительно 975 мг или приблизительно 1000 мг.
Ингибиторы Lp-PLA2
Композиции по изобретению могут содержать один или несколько ингибиторов липопротеин-ассоциированной фосфолипазы A2 (Lp-PLA2). Lp-PLA2 гидролизует окисленные фосфолипиды в LDL с холестерином. Полагают, что высокие уровни Lp-PLA2 запускают каскад воспалительных процессов при атеросклерозе и приводят к повышенному риску инсульта. Таким образом, ингибиторы Lp-PLA2 пригодны для замедления или предотвращения развития атеросклероза. Неограничивающие примеры ингибиторов Lp-PLA2 включают рилапладиб, дарапладиб и их сочетания.
При желании один или несколько ингибиторов Lp-PLA2, как правило, присутствуют в композиции по изобретению (или их совместно вводят с EPA в соответствии с другими вариантами осуществления изобретения) в количестве приблизительно от 1 мг до приблизительно 1000 мг, например, приблизительно 1 мг, приблизительно 2 мг, приблизительно 3 мг, приблизительно 4 мг, приблизительно 5 мг, приблизительно 6 мг, приблизительно 7 мг, приблизительно 8 мг, приблизительно 9 мг или приблизительно 10 мг; приблизительно 15 мг, приблизительно 20 мг, приблизительно 25 мг, приблизительно 30 мг, приблизительно 35 мг, приблизительно 40 мг, приблизительно 45 мг, приблизительно 50 мг, приблизительно 55 мг, приблизительно 60 мг, приблизительно 65 мг, приблизительно 70 мг, приблизительно 75 мг, приблизительно 80 мг, приблизительно 90 мг, приблизительно 100 мг, приблизительно 125 мг, приблизительно 150 мг, приблизительно 175 мг, приблизительно 200 мг, приблизительно 225 мг, приблизительно 250 мг, приблизительно 275 мг, приблизительно 300 мг, приблизительно 325 мг, приблизительно 350 мг, приблизительно 375 мг, приблизительно 400 мг, приблизительно 425 мг, приблизительно 450 мг, приблизительно 475 мг, приблизительно 500 мг, приблизительно 525 мг, приблизительно 550 мг, приблизительно 575 мг, приблизительно 600 мг, приблизительно 625 мг, приблизительно 650 мг, приблизительно 675 мг, приблизительно 700 мг, приблизительно 725 мг, приблизительно 750 мг, приблизительно 775 мг, приблизительно 800 мг, приблизительно 825 мг, приблизительно 850 мг, приблизительно 875 мг, приблизительно 900 мг, приблизительно 925 мг, приблизительно 950 мг, приблизительно 975 мг или приблизительно 1000 мг.
Ингибиторы 5-липоксигеназы
Ингибиторы 5-липоксигеназы пригодны в соответствии с различными вариантами осуществления изобретения. Неограничивающие примеры ингибиторов 5-липоксигеназы включают VIA-2291, MK-886, CMI 977, ABT-761, ZD2138, лонапален, зилеутон, ингибитор 5-LO 6, L-739010, CGS 22745, SC 45662 и их сочетания.
Дополнительные ингибиторы 5-липоксигеназы, пригодные для использования в соответствии с вариантами осуществления настоящего изобретения, описаны в приведенных ниже патентах и патентных заявках США, каждый из которых, таким образом, полностью включен в настоящий документ в качестве ссылки: U.S. 20050101659, U.S. 7026344, U.S. 7329682, U.S. 20040198768, U.S. 20090054519, U.S. 5112848, U.S. 5086052, U.S. 482828, U.S. 5208364, U.S. 4970210, U.S. 4794114, U.S. 4686231, U.S. 5134150, U.S. 5639782, U.S. 6239170, U.S. 20060106014, U.S. 5229386, U.S. 4673684, U.S. 6136839, U.S. 6090547, U.S. 6355434, U.S. 20090042849, U.S. 4731382, U.S. 4877881, U.S. 5130485, U.S. 5665752, U.S. 5723481, U.S. 5102897, U.S. 5234939, U.S. 5143928, U.S. 5217971, U.S. 4889941, U.S. 5234937, U.S. 5283361, U.S. 5232939, U.S. 5086064, U.S. 5208251, U.S. 5290800, U.S. 5006549, U.S. 5494927, U.S. 20040198800, U.S. 4719218, U.S. 4847270, U.S. 6121323, U.S. 20080226758, U.S. 20070218146, U.S. 4728656, U.S. 4835189, U.S. 5763673, U.S. 4835190, U.S. 5162365, U.S. 5985937, U.S. 6455541, U.S. 5534524, U.S. 20070134341, U.S. 20050267145, U.S. 4694018, U.S. 5260294, U.S. 5792776, U.S. 5530141, U.S. 5780503, U.S. 5093356, U.S. 5348957, U.S. 5384318, U.S. 568822, U.S. 20010009918, U.S. 20070219206, U.S. 20070225285, U.S. 20050267211, U.S. 20030162193, U.S. 20070173508, U.S. 20070066577, U.S. 5036067, U.S. 20030082108, U.S. 20090018170, U.S. 20070105866, U.S. 20070237848, U.S. 20070244185, U.S. 20080227807, U.S. 4728735, U.S. 4803279, U.S. 4962119, U.S. 5314898, U.S. 20070123522, U.S. 20070123522, U.S. 20070244128, U.S. 20070093524, U.S. 4602023, U.S. 4943587, U.S. 6025384, U.S. 20090118373, U.S. 5112868, U.S. 5254553, U.S. 5312821, U.S. 5635514, U.S. 7405302, U.S. 4624964, U.S. 4786755, U.S. 4933351, U.S. 5059609, U.S. 5442111, U.S. 5066668, U.S. 5292900, U.S. 5998451, U.S. 4851586, U.S. 5314900, U.S. 5447943, U.S. 6221880, U.S. 6262077, U.S. 6376528, U.S. 6569895, U.S. 4663347, U.S. 4975457, U.S. 4978679, U.S. 5703093, U.S. 5811432, U.S. 4822803, U.S. 5356921, U.S. 5750565, U.S. 4751310, U.S. 4816486, U.S. 5288751, U.S. 5298512, U.S. 5909734, U.S. 4745127, U.S. 5215986, U.S. 5270319, U.S. 5476944, U.S. 4939169, U.S. 6166031, U.S. 6696477, U.S. 6756399, U.S. 4931444, U.S. 5066658, U.S. 5248685, U.S. 5240929, U.S. 4861798, U.S. 4933329, U.S. 5008390, U.S. 5814648, U.S. 6939674, U.S. 5696141, U.S. 5434151, U.S. 20030216481, U.S. 20030232763, U.S. 20060177528, U.S. 20030235620, U.S. 20020177723, U.S. 5036105, U.S. 5504097, U.S. 5741809, U.S. 5459154, U.S. 5463083, U.S. 6420392, U.S. 5358938, U.S. 5326907, U.S. 6294574, U.S. 5648486, U.S. 5856323, U.S. 7387797, U.S. 4801611, U.S. 5530114, U.S. 7514469, U.S. 20010025040, U.S. 20020143033, U.S. 5665749, U.S. 20010009917, U.S. 20070049621, U.S. 20080280826, U.S. 5393923, U.S. 5114958, U.S. 5376670, U.S. 6217875, U.S. 5155122, U.S. 5288896, U.S. 6436924, U.S. 5256680, U.S. 7132441, U.S. 5145860, U.S. 5354768, U.S. 5698576, U.S. 7371874, U.S. 5068251, U.S. 5130483, U.S. 6177415, U.S. 5541218, U.S. 20070264361, U.S. 5284949, U.S. 4672075, U.S. 5212189, U.S. 5302597, U.S. 20080107757, U.S. 6620813, U.S. 5250565, U.S. 624012, U.S. 4732901, U.S. 5196431, U.S. 5340815, U.S. 5504108, U.S. 5220025, U.S. 5252562, U.S. 5420131, U.S. 5037837, U.S. 5081126, U.S. 5105020, U.S. 5187175, U.S. 5342838, U.S. 4755525, U.S. 5248682, U.S. 4963576, U.S. 5514703, U.S. 6194585, U.S. 6194585, U.S. 6291534, U.S. 4695586, U.S. 4971979, U.S. 6653311, U.S. 4755524, U.S. 5147893, U.S. 4711903, U.S. 20040077691, U.S. 4695585, U.S. 2005009084, U.S. 5516789, U.S. 5512594, U.S. 20070202206, U.S. 6261607, U.S. 5350754, U.S. 6344563, U.S. 20040235807, U.S. 5064851, U.S. 5254581, U.S. 5288742, U.S. 5403859, U.S. 5407945, U.S. 20030008914, U.S. 5254731, U.S. 5318970, U.S. 5519022, U.S. 6174883, U.S. 6262073, U.S. 20040170974, U.S. 20070231345, U.S. 4985435, U.S. 5126365, U.S. 5234950, U.S. 5321025, U.S. 5484805, U.S. 5221677, U.S. 5280047, U.S. 5300655 и U.S. 5359063.
При желании один или несколько ингибиторов 5-липоксигеназы, как правило, присутствуют в композиции по изобретению (или их совместно вводят с EPA в соответствии с другими вариантами осуществления изобретения) в количестве приблизительно от 0,01 мг до приблизительно 2500 мг, приблизительно от 0,1 мг до приблизительно 1500 мг, приблизительно от 1 мг до приблизительно 1200 мг или приблизительно от 5 мг до приблизительно 1000 мг, например, приблизительно 0,1 мг, приблизительно 0,5, приблизительно 0,75 мг, приблизительно 1 мг, приблизительно 5 мг, приблизительно 10 мг, приблизительно 20 мг, приблизительно 30 мг, приблизительно 40 мг, приблизительно 50 мг, приблизительно 60 мг, приблизительно 70 мг, приблизительно 80 мг, приблизительно 90 мг, приблизительно 100 мг, приблизительно 125 мг, приблизительно 150 мг, приблизительно 175 мг, приблизительно 200 мг, приблизительно 225 мг, приблизительно 250 мг, приблизительно 275 мг, приблизительно 300 мг, приблизительно 325 мг, приблизительно 350 мг, приблизительно 375 мг, приблизительно 400 мг, приблизительно 425 мг, приблизительно 450 мг, приблизительно 475 мг, приблизительно 500 мг, приблизительно 525 мг, приблизительно 550 мг, приблизительно 575 мг, приблизительно 600 мг, приблизительно 625 мг, приблизительно 650 мг, приблизительно 675 мг, приблизительно 700 мг, приблизительно 725 мг, приблизительно 750 мг, приблизительно 775 мг, приблизительно 800 мг, приблизительно 825 мг, приблизительно 850 мг, приблизительно 875 мг, приблизительно 900 мг, приблизительно 925 мг, приблизительно 950 мг, приблизительно 975 мг, приблизительно 1000 мг, приблизительно 1025 мг, приблизительно 1050 мг, приблизительно 1075 мг, приблизительно 1100 мг, приблизительно 1125 мг, приблизительно 1150 мг, приблизительно 1175 мг или приблизительно 1200 мг, приблизительно 1225 мг, приблизительно 1250 мг, приблизительно 1275 мг, приблизительно 1300 мг, приблизительно 1325 мг, приблизительно 1350 мг, приблизительно 1375 мг, приблизительно 1400 мг, приблизительно 1425 мг, приблизительно 1450 мг, приблизительно 1475 мг, приблизительно 1500 мг, приблизительно 1525 мг, приблизительно 1550 мг, приблизительно 1575 мг, приблизительно 1600 мг, приблизительно 1625 мг, приблизительно 1650 мг, приблизительно 1675 мг, приблизительно 1700 мг, приблизительно 1725 мг, приблизительно 1750 мг, приблизительно 1775 мг, приблизительно 1800 мг, приблизительно 1825 мг, приблизительно 1850 мг, приблизительно 1875 мг, приблизительно 1900 мг, приблизительно 1925 мг, приблизительно 1950 мг, приблизительно 1975 мг, приблизительно 2000 мг, приблизительно 2025 мг, приблизительно 2050 мг, приблизительно 2075 мг, приблизительно 2100 мг, приблизительно 2125 мг, приблизительно 2150 мг, приблизительно 2175 мг, приблизительно 2200 мг, приблизительно 2225 мг, приблизительно 2250 мг, приблизительно 2275 мг, приблизительно 2300 мг, приблизительно 2325 мг, приблизительно 2350 мг, приблизительно 2375 мг, приблизительно 2400 мг, приблизительно 2425 мг, приблизительно 2450 мг, приблизительно 2475 мг или приблизительно 2500 мг.
Ингибиторы микросомального белка-переносчика триглицеридов
Микросомальный белок-переносчик триглицеридов ("MTTP" или "MTP") представляет собой гетеродимерный белок, участвующий в сборке липопротеинов. Таким образом, ингибиторы MTP пригодны для замедления или предотвращения продукции липопротеинов и, таким образом, сердечно-сосудистых заболеваний и нарушений. Неограничивающие примеры ингибиторов MTP включают SLx-4090, AEGR-733, имплитапид, BMS-200150, CP-346086, JTT-130, дирлотапид и их сочетания.
Дополнительные ингибиторы MTP, пригодные для использования в соответствии с вариантами осуществления настоящего изобретения, описаны в приведенных ниже патентах и патентных заявках США, каждый из которых, таким образом, полностью включен в настоящий документ в качестве ссылки: U.S. 20030166590, U.S. 6492365, U.S. 20040132779, U.S. 20040132745, U.S. 20050181376, U.S. 20030086912, U.S. 6767739, U.S. 20080249130, U.S. 20020028943, U.S. 5883099, U.S. 5739135, U.S. 5712279, U.S. 6034098, U.S. 5827875, U.S. 6066650, U.S. 5885983, U.S. 20060166999, U.S. 20070027183, U.S. 20020045271, U.S. 6288234, U.S. 20030109700, U.S. 20040014748, 6878707, 6218524, 5595872, U.S. 20080253985, U.S. 20080103122, U.S. 20050234073, U.S. 20050090426, U.S. 20040044008, U.S. 20090042835, U.S. 20040058908, U.S. 20060270655, U.S. 6369075, U.S. 20080241869, U.S. 20070093468, U.S. 20090054393, U.S. 20020132806, U.S. 20070088089, U.S. 20040033506, U.S. 20080161279, U.S. 20020161233, U.S. 20020042516, U.S. 20070093527, U.S. 6713489, U.S. 20060211020, U.S. 6617325, U.S. 6147214 и U.S. 20020032238.
В одном из вариантов осуществления, при желании, один или несколько ингибиторов MTP, как правило, присутствуют в композиции по изобретению (или их совместно вводят с EPA в соответствии с другими вариантами осуществления изобретения) в количестве, достаточном для обеспечения индивидууму дозы приблизительно 1 мкг на кг массы тела (мкг на кг) до приблизительно 100 мкг на кг, например, приблизительно 25 мкг на кг, приблизительно 30 мкг на кг, приблизительно 35 мкг на кг, приблизительно 40 мкг на кг, приблизительно 45 мкг на кг, приблизительно 50 мкг на кг, приблизительно 55 мкг на кг, приблизительно 60 мкг на кг, приблизительно 65 мкг на кг, приблизительно 70 мкг на кг, приблизительно 75 мкг на кг, приблизительно 80 мкг на кг, приблизительно 85 мкг на кг, приблизительно 90 мкг на кг, приблизительно 95 мкг на кг или приблизительно 100 мкг на кг. В другом варианте осуществления, при желании, один или несколько ингибиторов MTP присутствуют в композиции по изобретению (или их совместно вводят с EPA в соответствии с другими вариантами осуществления изобретения) в количестве приблизительно от 30 мкг до приблизительно 20 мг, приблизительно от 50 мкг до приблизительно 15 мг или приблизительно от 70 мкг до приблизительно 10 мг.
В другом варианте осуществления, при желании, один или несколько ингибиторов MTP присутствуют в композиции по изобретению (или их совместно вводят с EPA в соответствии с другими вариантами осуществления изобретения) в количестве приблизительно от 0,01 мг до приблизительно 2500 мг, приблизительно от 0,1 мг до приблизительно 1500 мг, приблизительно от 1 мг до приблизительно 1200 мг или приблизительно от 5 мг до приблизительно 1000 мг, например, приблизительно 0,1 мг, приблизительно 0,5, приблизительно 0,75 мг, приблизительно 1 мг, приблизительно 5 мг, приблизительно 10 мг, приблизительно 20 мг, приблизительно 30 мг, приблизительно 40 мг, приблизительно 50 мг, приблизительно 60 мг, приблизительно 70 мг, приблизительно 80 мг, приблизительно 90 мг, приблизительно 100 мг, приблизительно 125 мг, приблизительно 150 мг, приблизительно 175 мг, приблизительно 200 мг, приблизительно 225 мг, приблизительно 250 мг, приблизительно 275 мг, приблизительно 300 мг, приблизительно 325 мг, приблизительно 350 мг, приблизительно 375 мг, приблизительно 400 мг, приблизительно 425 мг, приблизительно 450 мг, приблизительно 475 мг, приблизительно 500 мг, приблизительно 525 мг, приблизительно 550 мг, приблизительно 575 мг, приблизительно 600 мг, приблизительно 625 мг, приблизительно 650 мг, приблизительно 675 мг, приблизительно 700 мг, приблизительно 725 мг, приблизительно 750 мг, приблизительно 775 мг, приблизительно 800 мг, приблизительно 825 мг, приблизительно 850 мг, приблизительно 875 мг, приблизительно 900 мг, приблизительно 925 мг, приблизительно 950 мг, приблизительно 975 мг, приблизительно 1000 мг, приблизительно 1025 мг, приблизительно 1050 мг, приблизительно 1075 мг, приблизительно 1100 мг, приблизительно 1125 мг, приблизительно 1150 мг, приблизительно 1175 мг или приблизительно 1200 мг, приблизительно 1225 мг, приблизительно 1250 мг, приблизительно 1275 мг, приблизительно 1300 мг, приблизительно 1325 мг, приблизительно 1350 мг, приблизительно 1375 мг, приблизительно 1400 мг, приблизительно 1425 мг, приблизительно 1450 мг, приблизительно 1475 мг, приблизительно 1500 мг, приблизительно 1525 мг, приблизительно 1550 мг, приблизительно 1575 мг, приблизительно 1600 мг, приблизительно 1625 мг, приблизительно 1650 мг, приблизительно 1675 мг, приблизительно 1700 мг, приблизительно 1725 мг, приблизительно 1750 мг, приблизительно 1775 мг, приблизительно 1800 мг, приблизительно 1825 мг, приблизительно 1850 мг, приблизительно 1875 мг, приблизительно 1900 мг, приблизительно 1925 мг, приблизительно 1950 мг, приблизительно 1975 мг, приблизительно 2000 мг, приблизительно 2025 мг, приблизительно 2050 мг, приблизительно 2075 мг, приблизительно 2100 мг, приблизительно 2125 мг, приблизительно 2150 мг, приблизительно 2175 мг, приблизительно 2200 мг, приблизительно 2225 мг, приблизительно 2250 мг, приблизительно 2275 мг, приблизительно 2300 мг, приблизительно 2325 мг, приблизительно 2350 мг, приблизительно 2375 мг, приблизительно 2400 мг, приблизительно 2425 мг, приблизительно 2450 мг, приблизительно 2475 мг или приблизительно 2500 мг.
Агонисты и активаторы PPAR
Активируемые пролифератором пероксисом рецепторы ("PPAR") представляют собой ядерные рецепторные белки, регулирующие экспрессию генов, действуя в качестве факторов транскрипции в комбинации с ретиноидным рецептором X ("RXR"). Таким образом, средства, ингибирующие или активирующие PPAR, пригодны для модификации экспрессии определенных генов, включая, например, гены, ассоциированные с нарушениями обмена веществ, такими как гиперхолестеринемия. Неограничивающие примеры агонистов и активаторов PPAR включают фенофибрат, безафибрат, ципрофибрат, клофибрат, гемфиброзил, CER-002, росиглитазон, GW501516, RWJ 800025, KD-3010 и их сочетания.
При желании один или несколько агонистов и/или активаторов PPAR, как правило, присутствуют в композиции по изобретению (или их совместно вводят с EPA в соответствии с другими вариантами осуществления изобретения) в количестве приблизительно от 0,5 мг до приблизительно 4 мг, например, приблизительно 0,5 мг, приблизительно 0,75 мг, приблизительно 1 мг, приблизительно 1,25 мг, приблизительно 1,5 мг, приблизительно 1,75 мг, приблизительно 2 мг, приблизительно 2,25 мг, приблизительно 2,5 мг, приблизительно 2,75 мг, приблизительно 3 мг, приблизительно 3,25 мг, приблизительно 3,5 мг, приблизительно 3,75 мг или приблизительно 4 мг; или в количестве приблизительно от 20 мг до приблизительно 120 мг, например, приблизительно 20 мг, приблизительно 30 мг, приблизительно 40 мг, приблизительно 50 мг, приблизительно 60 мг, приблизительно 70 мг, приблизительно 80 мг, приблизительно 90 мг, приблизительно 100 мг, приблизительно 110 мг или приблизительно 120 мг.
Ингибиторы sPLA2
Ингибиторы sPLA2 пригодны для использования в соответствии с различными вариантами осуществления настоящего изобретения. Неограничивающие примеры ингибиторов sPLA2 включают LY 333013, вареспладиб, WA8242A, WA8242A2, WA8242B, A-0001, A-0002 и их сочетания.
Дополнительные ингибиторы sPLA2, пригодные для использования в соответствии с вариантами осуществления настоящего изобретения, описаны в приведенных ниже патентах и патентных заявках США, каждый из которых, таким образом, полностью включен в настоящий документ в качестве ссылки: U.S.6974831, U.S.6916840, U.S.6992100, U.S.6872743, U.S.20040063967, U.S.20040063941, U.S.20040092543, U.S.20040077704, U.S.6433001, U.S.20030153770, U.S.20030191175, U.S.6706752, U.S.6730694, U.S.20040059130, U.S.7026348, U.S.6608099, U.S.6340699, U.S.6252084, U.S.6635670, U.S.6939890, U.S.6930123, U.S.6713505, U.S.6274578, U.S.6451839, U.S.20040029948, U.S.20090062369, U.S.20030236232, U.S.7160909, U.S.6384041, U.S.6175021, U.S.6214876, U.S.20090131396, U.S.6353128, U.S.6407104, U.S.6274616, U.S.20030087944, U.S.5916922, U.S.20040198801, U.S.20080249027, U.S.7026318, U.S.6933313, U.S.20040087796, U.S.6391908, U.S.20030181454, U.S.6831095, U.S.6177426, U.S.20060116379, U.S.6472389, U.S.6797708, U.S.20090118503, U.S.20070249008, U.S.7087637, U.S.5919810, U.S.6828344, U.S.6916841, U.S.5654326, U.S.5641800, U.S.5733923, U.S.6534535, U.S.20050026988, U.S.6166062, U.S.5684034, U.S.7253194, U.S.20080045444, U.S.20040033995, U.S.20060235009, U.S.20090088427, U.S.7196103, U.S.20080317809, U.S.20090092595, U.S.20070037253, U.S.7098237, U.S.6140327, U.S.5972972, U.S.20040248898, U.S.6967200, U.S.20030092767, U.S.20040106669, U.S.20040077651, U.S.20050158401, U.S.6514984, U.S.20040102442, U.S.6610728, U.S.20030119860, U.S.6436983, U.S.6703385, U.S.6576654, U.S.7101875, U.S.6635771, U.S.6756376, U.S.6984735, U.S.6448284, U.S.6787545, U.S.6265591, U.S.6713645, U.S.6673781, U.S.6214855, U.S.6008231, U.S.6344467, U.S.6177440, U.S.6426344, U.S.7105514, U.S.6214991, U.S.20020169108, U.S.20060025348, U.S.20030008816, U.S.20090029917, U.S.6900208, U.S.6380397, U.S.7205329, U.S.5919943, U.S.7126010, U.S.7109231, U.S.6555568, U.S.6872557, U.S.7030112, U.S.7041695, U.S.7220756, U.S.7396838, U.S.6407261, U.S.6028116, U.S.5965619, U.S.6063818, U.S.5998477, U.S.6121321, U.S.6958348, U.S.7528112, U.S.6903104, U.S.6745133, U.S.6861436, U.S.5650374, U.S.6569539, U.S.6432987, U.S.5762413, U.S.7176281, U.S.7317009, U.S.7153854, U.S.20020110523, U.S.6776986, U.S.5948779, U.S.7449615, U.S.7531568, U.S.7476746, U.S.7491831, U.S.6231189, U.S.6987105, U.S.7300932, U.S.6962784, U.S.6248553, U.S.6255063, U.S.20070053912, U.S.6974831, U.S.20040063941, U.S.20040077704, U.S.20040248898, U.S.20040063967, U.S.6992100, U.S.20040092543, U.S.6916840, U.S.6433001, U.S.20070249008, U.S.20090092595, U.S.6872743, U.S.20070037253.
При желании один или несколько ингибиторов sPLA2, как правило, присутствуют в композиции по изобретению (или их совместно вводят с EPA в соответствии с другими вариантами осуществления изобретения) в количестве приблизительно от 0,01 мг до приблизительно 2500 мг, приблизительно от 0,1 мг до приблизительно 1500 мг, приблизительно от 1 мг до приблизительно 1200 мг или приблизительно от 5 мг до приблизительно 1000 мг, например, приблизительно 0,1 мг, приблизительно 0,5, приблизительно 0,75 мг, приблизительно 1 мг, приблизительно 5 мг, приблизительно 10 мг, приблизительно 20 мг, приблизительно 30 мг, приблизительно 40 мг, приблизительно 50 мг, приблизительно 60 мг, приблизительно 70 мг, приблизительно 80 мг, приблизительно 90 мг, приблизительно 100 мг, приблизительно 125 мг, приблизительно 150 мг, приблизительно 175 мг, приблизительно 200 мг, приблизительно 225 мг, приблизительно 250 мг, приблизительно 275 мг, приблизительно 300 мг, приблизительно 325 мг, приблизительно 350 мг, приблизительно 375 мг, приблизительно 400 мг, приблизительно 425 мг, приблизительно 450 мг, приблизительно 475 мг, приблизительно 500 мг, приблизительно 525 мг, приблизительно 550 мг, приблизительно 575 мг, приблизительно 600 мг, приблизительно 625 мг, приблизительно 650 мг, приблизительно 675 мг, приблизительно 700 мг, приблизительно 725 мг, приблизительно 750 мг, приблизительно 775 мг, приблизительно 800 мг, приблизительно 825 мг, приблизительно 850 мг, приблизительно 875 мг, приблизительно 900 мг, приблизительно 925 мг, приблизительно 950 мг, приблизительно 975 мг, приблизительно 1000 мг, приблизительно 1025 мг, приблизительно 1050 мг, приблизительно 1075 мг, приблизительно 1100 мг, приблизительно 1125 мг, приблизительно 1150 мг, приблизительно 1175 мг или приблизительно 1200 мг, приблизительно 1225 мг, приблизительно 1250 мг, приблизительно 1275 мг, приблизительно 1300 мг, приблизительно 1325 мг, приблизительно 1350 мг, приблизительно 1375 мг, приблизительно 1400 мг, приблизительно 1425 мг, приблизительно 1450 мг, приблизительно 1475 мг, приблизительно 1500 мг, приблизительно 1525 мг, приблизительно 1550 мг, приблизительно 1575 мг, приблизительно 1600 мг, приблизительно 1625 мг, приблизительно 1650 мг, приблизительно 1675 мг, приблизительно 1700 мг, приблизительно 1725 мг, приблизительно 1750 мг, приблизительно 1775 мг, приблизительно 1800 мг, приблизительно 1825 мг, приблизительно 1850 мг, приблизительно 1875 мг, приблизительно 1900 мг, приблизительно 1925 мг, приблизительно 1950 мг, приблизительно 1975 мг, приблизительно 2000 мг, приблизительно 2025 мг, приблизительно 2050 мг, приблизительно 2075 мг, приблизительно 2100 мг, приблизительно 2125 мг, приблизительно 2150 мг, приблизительно 2175 мг, приблизительно 2200 мг, приблизительно 2225 мг, приблизительно 2250 мг, приблизительно 2275 мг, приблизительно 2300 мг, приблизительно 2325 мг, приблизительно 2350 мг, приблизительно 2375 мг, приблизительно 2400 мг, приблизительно 2425 мг, приблизительно 2450 мг, приблизительно 2475 мг или приблизительно 2500 мг.
Ингибиторы скваленэпоксидазы
Скваленэпоксидаза, также называемая скваленмонооксигеназой, катализирует окисление сквалена в каскаде биосинтеза холестерина. Таким образом, средства, ингибирующие скваленэпоксидазу, пригодны для предотвращения или замедления продукции холестерина. Неограничивающие примеры ингибиторов скваленэпоксидазы включают тербинафин, нафтифин, аморолфин, бутенафин, FR194738, NB-598, ресвератрол (транс-3,4',5-тригидроксистильбен), эпигаллокатехин-3-O-галлат, S-аллилцистеин, селеноцистеин, аллиин, диаллилтрисульфид, диаллилдисульфид и их сочетания.
При желании один или несколько ингибиторов скваленэпоксидазы, как правило, присутствуют в композиции по изобретению (или их совместно вводят с EPA в соответствии с другими вариантами осуществления изобретения) в количестве приблизительно от 100 мг до 250 мг, например, приблизительно 100 мг, приблизительно 125 мг, приблизительно 150 мг, приблизительно 175 мг, приблизительно 200 мг, приблизительно 225 мг или приблизительно 250 мг; или в количестве приблизительно от 0,5% до приблизительно 5% по массе композиции, например, приблизительно 0,5%, приблизительно 0,75%, приблизительно 1%, приблизительно 1,25%, приблизительно 1,5%, приблизительно 1,75%, приблизительно 2%, приблизительно 2,25%, приблизительно 2,5%, приблизительно 2,75%, приблизительно 3%, приблизительно 3,25%, приблизительно 3,5%, приблизительно 3,75%, приблизительно 4%, приблизительно 4,25%, приблизительно 4,5%, приблизительно 4,75% или приблизительно 5% по массе.
Тромболитики
Тромболитики растворяют сгустки крови. Таким образом, тромболитики пригодны для лечения сердечно-сосудистых заболеваний и нарушений, включая среди прочего, например, тромбоз глубоких вен, эмболию сосудов легких, ишемические осложнения, нестабильную стенокардию, инфаркт миокарда и венозную тромбоэмболию. Неограничивающие примеры тромболитиков включают фондапаринукс, далтепарин, эноксапарин, апиксабан, PD-348292 и их сочетания.
При желании один или несколько тромболитиков, как правило, присутствуют в композиции по изобретению (или их совместно вводят с EPA в соответствии с другими вариантами осуществления изобретения) в количестве, достаточном для обеспечения дозы приблизительно 0,5 мг на кг массы тела ("мг на кг") до приблизительно 40 мг на кг, например, приблизительно 0,5 мг на кг, приблизительно 1 мг на кг, приблизительно 2 мг на кг, приблизительно 3 мг на кг, приблизительно 4 мг на кг, приблизительно 5 мг на кг, приблизительно 6 мг на кг, приблизительно 7 мг на кг, приблизительно 8 мг на кг, приблизительно 9 мг на кг, приблизительно 10 мг на кг, приблизительно 11 мг на кг, приблизительно 12 мг на кг, приблизительно 13 мг на кг, приблизительно 14 мг на кг, приблизительно 15 мг на кг, приблизительно 16 мг на кг, приблизительно 17 мг на кг, приблизительно 18 мг на кг, приблизительно 19 мг на кг, приблизительно 20 мг на кг, приблизительно 21 мг на кг, приблизительно 22 мг на кг, приблизительно 23 мг на кг, приблизительно 24 мг на кг, приблизительно 25 мг на кг, приблизительно 26 мг на кг, приблизительно 27 мг на кг, приблизительно 28 мг на кг, приблизительно 29 мг на кг, приблизительно 30 мг на кг, приблизительно 31 мг на кг, приблизительно 32 мг на кг, приблизительно 33 мг на кг, приблизительно 34 мг на кг, приблизительно 35 мг на кг, приблизительно 36 мг на кг, приблизительно 37 мг на кг, приблизительно 38 мг на кг, приблизительно 39 мг на кг или приблизительно 40 мг на кг или в общем количестве приблизительно от 30 мг до приблизительно 3,5 г.
В другом варианте осуществления один или несколько тромболитиков присутствуют в композиции по изобретению (или их совместно вводят с EPA в соответствии с другими вариантами осуществления изобретения) в количестве приблизительно от 0,5 мг до приблизительно 2,5 мг, например, 0,5 мг, приблизительно 0,75 мг, приблизительно 1 мг, приблизительно 1,25 мг, приблизительно 1,5 мг, приблизительно 1,75 мг, приблизительно 2 мг, приблизительно 2,25 мг или приблизительно 2,5 мг; или в количестве, достаточном для обеспечения приблизительно 60 международных единиц на кг массы тела ("IU на кг") до приблизительно 240 IU на кг, например, 60 IU на кг, приблизительно 70 IU на кг, приблизительно 80 IU на кг, приблизительно 90 IU на кг, приблизительно 100 IU на кг, приблизительно 110 IU на кг, приблизительно 120 IU на кг, приблизительно 130 IU на кг, приблизительно 140 IU на кг, приблизительно 150 IU на кг, приблизительно 160 IU на кг, приблизительно 170 IU на кг, приблизительно 180 IU на кг, приблизительно 190 IU на кг, приблизительно 200 IU на кг, приблизительно 210 IU на кг, приблизительно 220 IU на кг, приблизительно 230 IU на кг или приблизительно 240 IU на кг.
Другие сердечно-сосудистые средства
Для предотвращения, ингибирования или лечения сердечно-сосудистых заболеваний или нарушений также пригодны другие сердечно-сосудистые средства. Неограничивающие примеры других сердечно-сосудистых средств включают гемфиброзил, ниаспан, орлистат, GFT14, AZD-2479, ETC-1001 и их сочетания.
При желании, одно или несколько из этих других сердечно-сосудистых средств могут присутствовать в композиции по изобретению (или их можно совместно вводить с EPA в соответствии с другими вариантами осуществления изобретения) в количестве, соответствующем рекомендуемой или предлагаемой дозе для конкретных сердечно-сосудистых средств(а). В связанном варианте осуществления сердечно-сосудистое средство(а) может присутствовать в композиции по изобретению (или его можно совместно вводить с EPA в соответствии с другими вариантами осуществления изобретения) в количестве, меньшем рекомендуемой или предлагаемой дозы для конкретных сердечно-сосудистых средств(а). Например, композиция по изобретению может содержать EPA и одно или несколько из этих других сердечно-сосудистых средств в количестве приблизительно от 5 мг до приблизительно 1500 мг, например, приблизительно 10 мг, приблизительно 20 мг, приблизительно 30 мг, приблизительно 40 мг, приблизительно 50 мг, приблизительно 60 мг, приблизительно 70 мг, приблизительно 80 мг, приблизительно 90 мг, приблизительно 100 мг, приблизительно 125 мг, приблизительно 150 мг, приблизительно 175 мг, приблизительно 200 мг, приблизительно 225 мг, приблизительно 250 мг, приблизительно 266 мг, приблизительно 275 мг, приблизительно 300 мг, приблизительно 324 мг, приблизительно 325 мг, приблизительно 330 мг, приблизительно 350 мг, приблизительно 375 мг, приблизительно 400 мг, приблизительно 425 мг, приблизительно 450 мг, приблизительно 475 мг, приблизительно 500 мг, приблизительно 525 мг, приблизительно 550 мг, приблизительно 575 мг, приблизительно 600 мг, приблизительно 625 мг, приблизительно 650 мг, приблизительно 675 мг, приблизительно 700 мг, приблизительно 725 мг, приблизительно 750 мг, приблизительно 775 мг, приблизительно 800 мг, приблизительно 825 мг, приблизительно 850 мг, приблизительно 875 мг, приблизительно 900 мг, приблизительно 925 мг, приблизительно 950 мг, приблизительно 975 мг, приблизительно 1000 мг, приблизительно 1025 мг, приблизительно 1050 мг, приблизительно 1075 мг, приблизительно 1100 мг, приблизительно 1125 мг, приблизительно 1150 мг, приблизительно 1175 мг или приблизительно 1200 мг, приблизительно 1225 мг, приблизительно 1250 мг, приблизительно 1275 мг, приблизительно 1300 мг, приблизительно 1325 мг, приблизительно 1350 мг, приблизительно 1375 мг, приблизительно 1400 мг, приблизительно 1425 мг, приблизительно 1450 мг, приблизительно 1475 мг или приблизительно 1500 мг.
Заголовки, используемые для описания сердечно-сосудистых средств в настоящем документе не следует рассматривать, как ограничивающие каким-либо образом. Многие сердечно-сосудистые средства могут обладать несколькими механизмами действия и их можно описывать под одним или несколькими заголовками.
Соли и другие производные
По изобретению можно использовать соли, гидраты, сольваты, сложные эфиры, амиды, энантиомеры, изомеры, таутомеры, полиморфные формы, пролекарственные средства и производные любого из указанных выше лекарственных средств, и их можно получать стандартными способами, известными специалистам в области синтетической органической химии. См., например, March, Advanced Organic Chemistry: Reactions, Mechanisms and Structure, 4th Ed. (New York: Wiley-Interscience, 1992); Leonard et al., Advanced Practical Organic Chemistry (1992); Howarth et al., Core Organic Chemistry (1998) и Weisermel et al., Industrial Organic Chemistry (2002).
"Фармацевтически приемлемые соли" или "соли" включают соль лекарственного средства, получаемую из муравьиной, уксусной, пропионовой, янтарной, гликолевой, глюконовой, молочной, яблочной, винной, лимонной, аскорбиновой, глюкуроновой, малеиновой, фумаровой, пировиноградной, аспарагиновой, глутаминовой, бензойной, антраниловой, мезиловой, стеариновой, салициловой, п-гидроксибензойной, фенилуксусной, миндальной, эмбоновой, метансульфоновой, этансульфоновой, бензолсульфоновой, пантотеновой, толуолсульфоновой, 2-гидроксиэтансульфоновой, сульфаниловой, циклогексиламиносульфоновой, альгиновой, бета-гидроксимасляной, галактаровой и галактуроновой кислот.
В одном из вариантов осуществления соли присоединения кислот получают из форм свободного основания общепринятыми способами, включающими реакцию свободного основания с подходящей кислотой. Подходящие кислоты для получения солей присоединения кислот включают органические кислоты, например, уксусную кислоту, пропионовую кислоту, гликолевую кислоту, пировиноградную кислоту, щавелевую кислоту, яблочную кислоту, малоновую кислоту, янтарную кислоту, малеиновую кислоту, фумаровую кислоту, винную кислоту, лимонную кислоту, бензойную кислоту, коричную кислоту, миндальную кислоту, метансульфоновую кислоту, этансульфоновую кислоту, п-толуолсульфоновую кислоту, салициловую кислоту и т.п., а также неорганические кислоты, например, соляную кислоту, бромистоводородную кислоту, серную кислоту, азотную кислоту, фосфорную кислоту и т.п.
В другом варианте осуществления соли присоединения оснований получают из форм свободных кислот общепринятыми способами, включающими реакцию свободной кислоты с подходящим основанием.
В других вариантах осуществления соль присоединения кислоты снова преобразуют в свободное основание посредством обработки подходящим основанием. В дополнительном варианте осуществления соли присоединения кислот представляют собой галогеновые соли, которые получают с использованием соляной или бромистоводородной кислот. В других вариантах осуществления основные соли представляют собой соли щелочных металлов, например, натриевую соль. В других вариантах осуществления соль присоединения основания обратно преобразуют в свободное основание посредством обработки подходящей кислотой.
В одном из вариантов осуществления EPA и одно или несколько сердечно-сосудистых средств присутствуют в композиции по изобретению или их совместно вводят в массовом отношении EPA:сердечно-сосудистое средство приблизительно от 1:1000 до приблизительно 1000:1, приблизительно от 1:500 до приблизительно 500:1, приблизительно от 1:100 до приблизительно 100:1, приблизительно от 1:50 до приблизительно 50:1, приблизительно от 1:25 до приблизительно 25:1, приблизительно от 1:10 до приблизительно 10:1, приблизительно от 1:5 до приблизительно 5:1, приблизительно от 1:4 до приблизительно 4:1 приблизительно от 1:3 до приблизительно 3:1, приблизительно от 1:2 до приблизительно 2:1 или приблизительно 1:1.
Антиретровирусная терапия
В одном из вариантов осуществления настоящее изобретение относится к способу лечения связанного с сердечно-сосудистой системой заболевания, как определено в настоящем документе, например, дислипидемии или гиперлипидемии, у ВИЧ-положительного индивидуума. В другом варианте осуществления способ включает совместное введение или одновременное введение композиции или композиций, как описано в настоящем документе, с одним или несколькими ингибиторами протеазы ВИЧ-1. Неограничивающие примеры ингибиторов протеазы ВИЧ-1 включают ампренавир, фосампренавир, индинавир, лопинавир, нелфинавир, ритонавир и саквинавир.
При желании один или несколько ингибиторов протеазы ВИЧ-1, как правило, присутствуют в композиции по изобретению (или их совместно вводят с EPA в соответствии с другими вариантами осуществления изобретения) в количестве приблизительно от 100 мг до приблизительно 2500 мг, например, приблизительно 125 мг, приблизительно 150 мг, приблизительно 175 мг, приблизительно 200 мг, приблизительно 225 мг, приблизительно 250 мг, приблизительно 300 мг, приблизительно 350 мг, приблизительно 400 мг, приблизительно 450 мг, приблизительно 500 мг, приблизительно 550 мг, приблизительно 600 мг, приблизительно 625 мг, приблизительно 650 мг, приблизительно 700 мг, приблизительно 800 мг, приблизительно 900 мг, приблизительно 1000 мг, приблизительно 1100 мг, приблизительно 1200 мг, приблизительно 1250 мг, приблизительно 1300 мг, приблизительно 1400 мг, приблизительно 1500 мг, приблизительно 1600 мг, приблизительно 1700 мг, приблизительно 1800 мг, приблизительно 1825 мг, приблизительно 1900 мг, приблизительно 2000 мг, приблизительно 2100 мг, приблизительно 2200 мг, приблизительно 2300 мг, приблизительно 2400 мг или приблизительно 2500 мг; в количестве приблизительно от 200 мг до приблизительно 1000 мг, например, приблизительно 200 мг, приблизительно 300 мг, приблизительно 400 мг, приблизительно 500 мг, приблизительно 600 мг, приблизительно 700 мг, приблизительно 800 мг, приблизительно 900 мг или приблизительно 1000 мг; в количестве приблизительно от 50 мг до приблизительно 400 мг, например, приблизительно 50 мг, приблизительно 100 мг, приблизительно 150 мг, приблизительно 200 мг, приблизительно 250 мг, приблизительно 300 мг, приблизительно 350 мг или приблизительно 400 мг; в количестве приблизительно от 200 мг до приблизительно 1066 мг, например, приблизительно 200 мг, приблизительно 250 мг, приблизительно 300 мг, приблизительно 350 мг, приблизительно 400 мг, приблизительно 450 мг, приблизительно 500 мг, приблизительно 533 мг, приблизительно 550 мг, приблизительно 600 мг, приблизительно 650 мг, приблизительно 700 мг, приблизительно 750 мг, приблизительно 800 мг, приблизительно 850 мг, приблизительно 900 мг, приблизительно 950 мг, приблизительно 1000 мг или приблизительно 1066 мг; в количестве приблизительно от 50 мг до приблизительно 1200 мг, например, приблизительно 50 мг, приблизительно 100 мг, приблизительно 150 мг, приблизительно 200 мг, приблизительно 250 мг, приблизительно 300 мг, приблизительно 350 мг, приблизительно 400 мг, приблизительно 450 мг, приблизительно 500 мг, приблизительно 550 мг, приблизительно 600 мг, приблизительно 650 мг, приблизительно 700 мг, приблизительно 750 мг, приблизительно 800 мг, приблизительно 850 мг, приблизительно 900 мг, приблизительно 950 мг, приблизительно 1000 мг, приблизительно 1050 мг, приблизительно 1100 мг, приблизительно 1150 мг или приблизительно 1200 мг; или в количестве приблизительно от 15 мг на кг массы тела до приблизительно 40 мг на кг массы тела, например, приблизительно 15 мг на кг, приблизительно 20 мг на кг, приблизительно 25 мг на кг, приблизительно 30 мг на кг, приблизительно 35 мг на кг или приблизительно 40 мг на кг.
Лекарственные формы
В одном из вариантов осуществления композиции по изобретению являются доставляемыми перорально. Термины "доставляемые перорально" или "пероральное введение" в настоящем документе включают любую форму доставки терапевтического средства или его композиции индивидууму, где средство или композицию помещают в ротовую полость индивидуума, вне зависимости от того, проглатывают ли средство или композицию или нет. Таким образом "пероральное введение" включает буккальное и сублингвальное, а также пищеводное введение.
В некоторых вариантах осуществления композиции по изобретению находятся в форме твердых лекарственных форм. Неограничивающие примеры подходящих твердых лекарственных форм включают таблетки (например, суспендируемые таблетки, раскусываемые суспендируемые таблетки, быстродиспергируемые таблетки, жевательные таблетки, расплавляющиеся таблетки, шипучие таблетки, двуслойные таблетки и т.д.), каплеты, капсулы (например, мягкие или твердые желатиновые капсулы, заполненные твердым веществом и/или жидкостью), порошок (например, упакованный порошок, дозируемый порошок или шипучий порошок), таблетки-леденцы, саше, крахмальные капсулы, пастилки, пилюли, гранулы, микрогранулы, инкапсулированные микрогранулы, порошковые аэрозольные составы или любую другую твердую лекарственную форму, подходящим образом адаптированную для перорального введения.
EPA и/или любое другое желаемое сердечно-сосудистое средство(а) можно комбинировать в одну и ту же единицу дозирования или их можно формулировать индивидуально в отдельные единицы дозирования. Термины "лекарственная форма" и "единица дозирования" в настоящем документе относятся к части фармацевтической композиции, содержащей количество терапевтического средства, подходящее для однократного введения с обеспечением терапевтического эффекта. Такие единицы дозирования можно вводить от одного до нескольких (т.е. от 1 до приблизительно 10, от 1 до 8, от 1 до 6, от 1 до 4 или от 1 до 2) раз в сутки или так много раз, как необходимо для получения терапевтического ответа.
В одном из вариантов осуществления композиция по изобретению содержит одно или несколько сердечно-сосудистых средств, диспергированных или суспендированных в EPA, где дисперсия или суспензия находится в капсуле (например, желатиновая или HPMC капсула), саше или другой лекарственной форме или носителе, как описано в настоящем документе. В другом варианте осуществления дисперсия или суспензия по существу являются однородными. В другом варианте осуществления, когда желательно совместное введение двух или более единиц дозирования, EPA находится в первой единице дозирования, например, в суспензии в капсуле, а сердечно-сосудистое средство находится во второй единице дозирования, например, таблетке. Необязательно, в третьей композиции может присутствовать любое желаемое дополнительное сердечно-сосудистое средство.
В другом варианте осуществления композиция(и) по изобретению могут находиться в форме жидких лекарственных форм или лекарственных форм для непосредственного всасывания, и их до приема внутрь можно смешивать с пищей или напитком. Неограничивающие примеры подходящих жидких лекарственных форм включают растворы, суспензию, эликсиры, сиропы, жидкие аэрозольные составы и т.д.
В одном из вариантов осуществления композиции по изобретению после хранения в закрытом контейнере, сохраняемом при комнатной температуре, температуре охлаждения (например, приблизительно от 5 до приблизительно 5 -10°C) или замороженным в течение периода приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 месяцев, демонстрирует по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 97,5% или по меньшей мере приблизительно 99% активного ингредиента(ов), исходно присутствующего в ней.
В другом варианте осуществления изобретение относится к фармацевтической композиции, содержащей EPA и сердечно-сосудистое средство (наполнитель), инкапсулированные в капсульной оболочке, где исходное перекисное число наполнителя составляет не более чем приблизительно 10 мг-экв./кг, приблизительно 9 мг-экв./кг, приблизительно 8 мг-экв./кг, приблизительно 7 мг-экв./кг, приблизительно 6 мг-экв./кг, приблизительно 5 мг-экв./кг, приблизительно 4 мг-экв./кг, приблизительно 3 мг-экв./кг или приблизительно 2 мг-экв./кг, где после хранения композиции при 23°C и 50% RH в течение периода приблизительно 1, приблизительно 2, приблизительно 3, приблизительно 4, приблизительно 5, приблизительно 6, приблизительно 7, приблизительно 8, приблизительно 9, приблизительно 10, приблизительно 11, приблизительно 12, приблизительно 13, приблизительно 14, приблизительно 15, приблизительно 16, приблизительно 17, приблизительно 18, приблизительно 19, приблизительно 20, приблизительно 21, приблизительно 22, приблизительно 23 или приблизительно 24 месяцев второе перекисное число ультрачистой EPA составляет не более чем приблизительно 25 мг-экв./кг, приблизительно 24 мг-экв./кг, приблизительно 23 мг-экв./кг, приблизительно 22 мг-экв./кг, приблизительно 21 мг-экв./кг, приблизительно 20 мг-экв./кг, приблизительно 19 мг-экв./кг, приблизительно 18 мг-экв./кг, приблизительно 17 мг-экв./кг, приблизительно 16 мг-экв./кг, приблизительно 15 мг-экв./кг, приблизительно 14 мг-экв./кг, приблизительно 13 мг-экв./кг, приблизительно 12 мг-экв./кг, приблизительно 11 мг-экв./кг, приблизительно 10 мг-экв./кг, приблизительно 9 мг-экв./кг, приблизительно 8 мг-экв./кг, приблизительно 7 мг-экв./кг, приблизительно 6 мг-экв./кг, приблизительно 5 мг-экв./кг, приблизительно 4 мг-экв./кг, приблизительно 3 мг-экв./кг или приблизительно 2 мг-экв./кг.
При хранении некоторые фармацевтические композиции с течением времени разрушаются. Продукты разрушения могут изменять эффективность композиции, например, вследствие доставки индивидууму меньшего количества активного ингредиента, чем рекомендовано. О продуктах разрушения новых лекарственных средств выше определенных порогов следует сообщать в Food & Drug Administration (FDA) в соответствии с текущими руководящими документами. Продукты разрушения выше определенного порогового количества следует идентифицировать. Продукт разрушения является "идентифицированным", когда получена его структурная характеристика. Для продуктов разрушения выше определенного количества необходимо определять соответствие установленным требованиям. Для продукта разрушения "определено соответствие установленным требованиям", когда выявлена и оценена его биологическая безопасность.
В одном из вариантов осуществления композиции по изобретению с максимальной суточной дозой менее или равной 1 грамму после хранения в условиях освещенности, нагревания, влажности, кислого/основного гидролиза и/или в окислительных условиях содержат менее чем приблизительно 0,1% любого продукта разрушения, не описанного для Food and Drug Administration (FDA). В другом варианте осуществления композиции по изобретению с максимальной суточной дозой более 1 грамма после хранения в условиях освещенности, нагревания, влажности, кислого/основного гидролиза и/или в окислительных условиях содержат менее чем приблизительно 0,05% любого продукта разрушения, не описанного для FDA.
В одном из вариантов осуществления композиции по изобретению с максимальной суточной дозой менее 1 мг после хранения в условиях освещенности, нагревания, влажности, кислого/основного гидролиза и/или в окислительных условиях содержат менее чем приблизительно 1% любого неидентифицированного продукта разрушения. В другом варианте осуществления композиции по изобретению с максимальной суточной дозой менее 1 мг после хранения в условиях освещенности, нагревания, влажности, кислого/основного гидролиза и/или в окислительных условиях содержат менее чем приблизительно 5 мкг любого неидентифицированного продукта разрушения.
В одном из вариантов осуществления композиции по изобретению с максимальной суточной дозой от 1 мг до 10 мг после хранения в условиях освещенности, нагревания, влажности, кислого/основного гидролиза и/или в окислительных условиях содержат менее чем приблизительно 0,5% любого неидентифицированного продукта разрушения. В другом варианте осуществления композиции по изобретению с максимальной суточной дозой от 1 мг до 10 мг после хранения в условиях освещенности, нагревания, влажности, кислого/основного гидролиза и/или в окислительных условиях содержат менее чем приблизительно 20 мкг любого неидентифицированного продукта разрушения.
В одном из вариантов осуществления композиции по изобретению с максимальной суточной дозой от 10 мг до 2 г после хранения в условиях освещенности, нагревания, влажности, кислого/основного гидролиза и/или в окислительных условиях содержат менее чем приблизительно 0,2% любого неидентифицированного продукта разрушения. В другом варианте осуществления композиции по изобретению с максимальной суточной дозой от 10 мг до 2 г после хранения в условиях освещенности, нагревания, влажности, кислого/основного гидролиза и/или в окислительных условиях содержат менее чем приблизительно 2 мг любого неидентифицированного продукта разрушения.
В одном из вариантов осуществления композиции по изобретению с максимальной суточной дозой более 2 г после хранения в условиях освещенности, нагревания, влажности, кислого/основного гидролиза и/или в окислительных условиях содержат менее чем приблизительно 0,1% любого неидентифицированного продукта разрушения.
В одном из вариантов осуществления композиции по изобретению с максимальной суточной дозой менее 10 мг после хранения в условиях освещенности, нагревания, влажности, кислого/основного гидролиза и/или в окислительных условиях содержат менее чем приблизительно 1% любого продукта разрушения с неопределенным соответствием установленным требованиям. В другом варианте осуществления композиции по изобретению с максимальной суточной дозой менее 10 мг после хранения в условиях освещенности, нагревания, влажности, кислого/основного гидролиза и/или в окислительных условиях содержат менее чем приблизительно 50 мкг любого продукта разрушения с неопределенным соответствием установленным требованиям.
В одном из вариантов осуществления композиции по изобретению с максимальной суточной дозой от 10 мг до 100 мг после хранения в условиях освещенности, нагревания, влажности, кислого/основного гидролиза и/или в окислительных условиях содержат менее чем приблизительно 0,5% любого продукта разрушения с неопределенным соответствием установленным требованиям. В другом варианте осуществления композиции по изобретению с максимальной суточной дозой от 10 мг до 100 мг после хранения в условиях освещенности, нагревания, влажности, кислого/основного гидролиза и/или в окислительных условиях содержат менее чем приблизительно 200 мкг любого продукта разрушения с неопределенным соответствием установленным требованиям.
В одном из вариантов осуществления композиции по изобретению с максимальной суточной дозой от 100 мг до 2 г после хранения в условиях освещенности, нагревания, влажности, кислого/основного гидролиза и/или в окислительных условиях содержат менее чем приблизительно 0,2% любого продукта разрушения с неопределенным соответствием установленным требованиям. В другом варианте осуществления композиции по изобретению с максимальной суточной дозой от 100 мг до 2 г после хранения в условиях освещенности, нагревания, влажности, кислого/основного гидролиза и/или в окислительных условиях содержат менее чем приблизительно 3 мг любого продукта разрушения с неопределенным соответствием установленным требованиям.
В одном из вариантов осуществления композиции по изобретению с максимальной суточной дозой более 2 г после хранения в условиях освещенности, нагревания, влажности, кислого/основного гидролиза и/или в окислительных условиях содержат менее чем приблизительно 0,15% любого продукта разрушения с неопределенным соответствием установленным требованиям.
В некоторых вариантах осуществления композиции по изобретению содержат стабилизирующее средство, которое подавляет, предотвращает, препятствует или другим образом уменьшает разрушение активного ингредиента(ов) при хранении. Например, окислительное разрушение EPA в композициях по изобретению можно предотвращать или уменьшать посредством наличия антиоксидантов. Неограничивающие примеры подходящих антиоксидантов включают токоферол, лецитин, лимонную кислоту и/или аскорбиновую кислоту. При желании один или несколько антиоксидантов, как правило, присутствуют в композиции в количестве приблизительно от 0,01% до приблизительно 0,1% по массе или приблизительно от 0,025% до приблизительно 0,05% по массе.
Эксципиенты
Композиции по изобретению необязательно содержат один или несколько фармацевтически приемлемых эксципиентов. Термин "фармацевтически приемлемый эксципиент" в настоящем документе означает любое вещество, само не являющееся терапевтическим средством, используемое в качестве носителя или транспортера для доставки терапевтического средства индивидууму или добавляемое в фармацевтическую композицию для улучшения ее технологических свойств или стабильности при хранении или для обеспечения или облегчения формирования стандартной дозы композиции, и которое не вызывает неприемлемой токсичности или взаимодействия с другими компонентами в композиции.
Композиции по изобретению в качестве эксципиентов необязательно содержат один или несколько фармацевтически приемлемых разбавителей. Подходящие разбавители иллюстративно, по отдельности или в комбинации, включают лактозу, включая безводную лактозу и моногидрат лактозы; крахмалы, включая непосредственно прессуемый крахмал и гидролизованные крахмалы (например, целютаб (Celutab™) и эмдекс (Emdex™)); маннит; сорбит; ксилит; декстрозу (например, церелозу (Cerelose™) 2000) и моногидрат декстрозы; дигидрат двухосновного фосфата кальция; основанные на сахарозе разбавители; кондитерский сахар; моногидрат моноосновного сульфата кальция; дигидрат сульфата кальция; тригидрат гранулярного лактата кальция; декстраты; инозитол; твердые вещества гидролизованных злаков; амилозу; различные виды целлюлозы, включая микрокристаллическую целлюлозу, пищевые источники α- и аморфной целлюлозы (например, рексель (Rexcel™)) и порошковую целлюлозу; карбонат кальция; глицин; бентонит; поливинилпирролидон и т.п. Такие разбавители, если присутствуют, всего составляют приблизительно от 5% до приблизительно 99%, приблизительно от 10% до приблизительно 85% или приблизительно от 20% до приблизительно 80% от общей массы композиции.
Композиции по изобретению в качестве эксципиентов необязательно содержат один или несколько фармацевтически приемлемых дезинтегрантов. Подходящие дезинтегранты, по отдельности или в комбинации, включают крахмалы, включая крахмалгликолят натрия (например, эксплотаб (Explotab™) от PenWest) и прежелатинизированные кукурузные крахмалы (например, национал (National™) 1551, национал (National™) 1550 и колокорн (Colocorn™) 1500), глины (например, вигум (Veegum™) HV), различные виды целлюлозы, такие как очищенная целлюлоза, микрокристаллическая целлюлоза, метилцеллюлоза, карбоксиметилцеллюлоза и карбоксиметилцеллюлоза натрия, кроскармеллоза натрия (например, Ac-Di-Sol™ из FMC), альгинаты, кросповидон и камеди, такие как агаровые, гуаровые, ксантановые камеди, камедь рожкового дерева, камедь карайи, пектиновые и трагакантовые камеди. Такие дезинтегранты, если присутствуют, как правило, всего составляют приблизительно от 0,2% до приблизительно 30%, приблизительно от 0,2% до приблизительно 10% или приблизительно от 0,2% до приблизительно 5% от общей массы композиции.
Композиции по изобретению необязательно содержат один или несколько антиоксидантов. Иллюстративные антиоксиданты включают аскорбат натрия и витамин E (токоферол). Один или несколько антиоксидантов, если присутствуют, как правило, присутствуют в композиции по изобретению в количестве приблизительно от 0,001% до приблизительно 5%, приблизительно от 0,005% до приблизительно 2,5% или приблизительно от 0,01% до приблизительно 1% по массе.
Композиции по изобретению в качестве эксципиентов необязательно содержат одно или несколько фармацевтически приемлемых связывающих средств или адгезивов. Такие связывающие средства и адгезивы могут придавать достаточную связность таблетируемому порошку для обеспечения нормального процесса обработки, такого как определение размеров, смазка, прессование и упаковка, но все еще могут позволять таблетке дезинтегрировать и всасываться композиции после приема внутрь. Подходящие связывающие средства и адгезивы, по отдельности или в комбинации, включают гуммиарабик; трагакант; сахарозу; желатин; глюкозу; крахмалы, в качестве неограничивающих примеров, такие как пептизированные крахмалы (например, национал (National™) 1511 и национал (National™) 1500); различные виды целлюлозы, в качестве неограничивающих примеров, такие как метилцеллюлоза и кармеллоза натрия (например, тайлоза (Tylose™)); альгиновую кислоту и соли альгиновой кислоты; магний силикат алюминия; PEG; гуаровая камедь; полисахаридные кислоты; бентониты; повидон, например, повидон K-15, K-30 и K-29/32; полиметакрилаты; HPMC; гидроксипропилцеллюлозу (например, клуцел (Klucel™)) и этилцеллюлозу (например, этоцел (Ethocel™)). Такие связывающие средства и/или адгезивы, если присутствуют, всего составляют приблизительно от 0,5% до приблизительно 25%, приблизительно от 0,75% до приблизительно 15% или приблизительно от 1% до приблизительно 10% от общей массы композиции.
Композиции по изобретению в качестве эксципиентов необязательно содержат один или несколько фармацевтически приемлемых увлажнителей. Неограничивающие примеры поверхностно-активных веществ, которые можно использовать в качестве увлажнителей в композициях по изобретению, включают соединения четвертичного аммония, например, хлорид бензалкония, хлорид бензетония и хлорид цетилпиридиния, диоктилнатрийсульфосукцинат, простые алкилфениловые эфиры полиоксиэтилена, например, ноноксинол 9, ноноксинол 10 и октоксинол 9, полоксамеры (блок-сополимеры полиоксиэтилена и полиоксипропилена), глицериды и масла полиоксиэтилена и жирных кислот, например, полиоксиэтиленовые (8) каприловые/каприновые моно- и диглицериды (например, лабразол (Labrasol™ от Gattefossé), полиоксиэтиленовое (35) касторовое масло и полиоксиэтиленовое (40) гидрогенизированное касторовое масло; простые эфиры полиоксиэтилена и алкилов, например, простой эфир полиоксиэтилена (20) и цетостеарила, сложные эфиры полиоксиэтилена и жирных кислот, например, полиоксиэтилен(40)стеарат, сложные эфиры полиоксиэтилена и сорбитанов, например, полисорбат 20 и полисорбат 80 (например, Tween™ 80 из ICI), сложные эфиры пропиленгликоля и жирных кислот, например, пропиленгликольлаурат (например, лабразол (Labrasol™) от Gattefossé), лаурилсульфат натрия, жирные кислоты и их соли, например, олеиновая кислота, олеат натрия и триэтаноламинолеат, сложные глицериловые эфиры жирных кислот, например, глицерилмоностеарат, сложные сорбитановые эфиры, например, сорбитанмонолаурат, сорбитанмоноолеат, сорбитанмонопальмитат и сорбитанмоностеарат, тилоксапол и их смеси. Такие увлажнители, если присутствуют, всего составляют приблизительно от 0,25% до приблизительно 15%, приблизительно от 0,4% до приблизительно 10% или приблизительно от 0,5% до приблизительно 5% от общей массы композиции.
Композиции по изобретению в качестве эксципиентов необязательно содержат одно или несколько фармацевтически приемлемых смазочных средств (включая антиадгезивы и/или способствующие скольжению средства). Подходящие смазочные средства, по отдельности или в комбинации, включают глицерилбегенат (например, Compritol™ 888); стеариновую кислоту и ее соли, включая стеараты магния (стеарат магния), кальция и натрия; гидрогенизированные растительные масла (например, стеротекс (Sterotex™)); коллоидный диоксид кремния; тальк; воска; борную кислоту; бензоат натрия; ацетат натрия; фумарат натрия; хлорид натрия; DL-лейцин; PEG (например, карбовакс (Carbowax™) 4000 и карбовакс (Carbowax™) 6000); олеат натрия; лаурилсульфат натрия и лаурилсульфат магния. Такие смазочные средства, если присутствуют, всего составляют приблизительно от 0,1% до приблизительно 10%, приблизительно от 0,2% до приблизительно 8% или приблизительно от 0,25% до приблизительно 5% от общей массы композиции.
Подходящие антиадгезивы включают тальк, кукурузный крахмал, DL-лейцин, лаурилсульфат натрия и стеараты металлов. Тальк представляет собой антиадгезив или способствующее скольжению средство, используемое, например, для уменьшения прилипания состава к поверхностям оборудования, а также для уменьшения помех при смешивании. Тальк, если присутствует, составляет приблизительно от 0,1% до приблизительно 10%, приблизительно от 0,25% до приблизительно 5% или приблизительно от 0,5% до приблизительно 2% от общей массы композиции. Способствующие скольжению средства можно использовать для обеспечения текучести порошка в твердых составах. Подходящие способствующие скольжению средства включают коллоидный диоксид кремния, крахмал, тальк, трехосновный фосфат кальция, порошковую целлюлозу и трисиликат магния.
Композиции по настоящему изобретению необязательно содержат один или несколько ароматизаторов, подсластителей и/или красителей. Ароматизаторы, пригодные по настоящему изобретению в качестве неограничивающих примеров включают сироп гуммиарабика, алитам, анис, яблоко, аспартам, банан, желе со взбитыми сливками, ягоду, черную смородину, масло, масло пекан, ирис, цитрат кальция, камфару, карамель, вишню, вишневый крем, шоколад, корицу, цитрусовые, цитрусовый пунш, цитрусовый крем, какао, кофе, колу, замороженную вишню, замороженный цитрус, цикламат, циламат, декстрозу, эвкалипт, эвгенол, фруктозу, фруктовый пунш, имбирь, глицерретинат, сироп солодки (лакрицы), виноград, грейпфрут, мед, изомальт, лимон, лайм, лимонный крем, магнасвит (MagnaSweet®), мальтол, маннит, клен, ментол, мяту, мятный крем, ягодную смесь, орех, апельсин, арахисовое масло, грушу, перечную мяту, крем из перечной мяты, порошок просвит (Prosweet®), малину, корневое пиво, ром, сахарин, сафрол, сорбит, колосовую мяту, крем из колосовой мяты, клубнику, клубничный крем, стевию, сукралозу, сахарозу, швейцарский крем, тагатозу, мандарин, тауматин, засахаренные фрукты, ваниль, грецкий орех, арбуз, черешню, винтергрен, ксилит и их сочетания, например, анис-ментол, вишню-анис, корицу-апельсин, вишню-корицу, шоколад-мяту, мед-лимон, лимон-лайм, лимон-мяту, ментол-эвкалипт, апельсин-крем, ваниль-мяту и т.д.
Подсластители, которые можно использовать по настоящему изобретению, включают, например, ацесульфам калия (ацесульфам K), алитам, аспартам, цикламат, циламат, декстрозу, изомальт, магнасвит (MagnaSweet®), мальтит, маннит, неогесперидин DC, неотам, порошок просвит (Prosweet®), сахарин, сорбит, стевию, сукралозу, сахарозу, тагатозу, тауматин, ксилит и т.п.
Ароматизаторы, подсластители и/или красители могут присутствовать в композициях по изобретению в любом подходящем количестве, например, приблизительно от 0,01% до приблизительно 10%, приблизительно от 0,1% до приблизительно 8% или приблизительно от 1% до приблизительно 5% по массе.
Композиции по изобретению необязательно содержат суспендирующее средство. Неограничивающие иллюстративные примеры подходящих суспендирующих средств включают диоксид кремния, бентонит, гидратированный силикат алюминия (например, каолин) и их смеси. Один или несколько суспендирующих средств необязательно присутствуют в композициях по изобретению в общем количестве приблизительно от 0,01% до приблизительно 3,0%, приблизительно от 0,1% до приблизительно 2,0% или приблизительно от 0,25% до приблизительно 1,0% по массе.
Как известно в данной области, указанные выше эксципиенты могут иметь несколько ролей. Например, крахмал может служить как наполнитель, а также как дезинтегрант. Приведенную выше классификацию эксципиентов никоим образом не следует рассматривать как ограничивающую. Как легко поймет специалист в данной области, эксципиенты, любым образом отнесенные к категориям, также могут функционировать в других различных категориях эксципиентов.
Терапевтические способы
В различных вариантах осуществления композиции по изобретению пригодны для лечения и/или предотвращения связанного с сердечно-сосудистой системой заболевания. Термин "связанное с сердечно-сосудистой системой заболевание" в настоящем документе относится к любому заболеванию или нарушению сердца или кровеносных сосудов (т.е. артерий и вен) или любому их симптому или любому заболеванию или состоянию, которые вызывают или вносят вклад в сердечно-сосудистое заболевание. Неограничивающие примеры связанных с сердечно-сосудистой системой заболеваний и нарушений включают острые ишемические нарушения сердца, острый инфаркт миокарда, стенокардию, грудную жабу, аритмию, фибрилляцию предсердий, атеросклероз, фибрилляцию предсердий, сердечную недостаточность, сердечно-сосудистое заболевание, хроническую сердечную недостаточность, хроническую стабильную стенокардию, застойную сердечную недостаточность, ишемическую болезнь сердца, атеросклеротическую болезнь сердца, тромбоз глубоких вен, диабет, сахарный диабет, диабетическую нейропатию, диастолическую дисфункцию у индивидуумов с сахарным диабетом, отек, первичную артериальную гипертензию, потенциальную эмболию сосудов легких, жировую болезнь печени, сердечное заболевание, сердечную недостаточность, гомозиготную семейную гиперхолестеринемию (HoFH), гомозиготную семейную ситостеролемию, гиперхолестеринемию, гиперлипидемию, гиперлипидемию у ВИЧ-положительных индивидуумов, гипертензию, гипертриглицеридемию, ишемические осложнения при нестабильной стенокардии и инфаркте миокарда, низкое артериальное давление, метаболический синдром, смешанную дислипидемию, сердечную недостаточность от умеренной до мягкой, инфаркт миокарда, контроль ожирения, пароксизмальные фибрилляцию/трепетание предсердий, пароксизмальные наджелудочковые тахикардии (PSVT), очень тяжелый отек или отек с быстрым началом, агрегацию тромбоцитов, первичную гиперхолестеринемию, первичную гиперлипидемию, легочную артериальную гипертензию, легочную гипертензию, пароксизмальную гемодинамически нестабильную желудочковую тахикардию (VT), пароксизмальные желудочковые аритмии, пароксизмальные фибрилляции желудочков (VF), разорвавшуюся аневризму, ситостеролемию, инсульт, наджелудочковую тахикардию, симптоматическую фибрилляцию/трепетание предсердий, тахикардию, диабет II типа, сосудистое заболевание, венозную тромбоэмболию, желудочковые аритмии и другие сердечно-сосудистые нарушения.
Термин "лечение" в отношении данных заболевания или нарушения в качестве неограничивающих примеров включает сдерживание заболевания или нарушения, например, прекращение развития заболевания или нарушения; облегчение заболевания или нарушения, например, обуславливая регресс заболевания или нарушения; или облегчение состояния, вызываемого или являющегося результатом заболевания или нарушения, например, облегчение, предотвращение или лечение симптомов заболевания или нарушения. Термин "предотвращение" в отношении данного заболевания или нарушения означает предотвращение начала развития заболевания, если оно не произошло, предотвращение возникновения заболевания или нарушения у индивидуума, который может быть предрасположен к нарушению или заболеванию, но у которого еще не диагностировано наличие нарушения или заболевания, и/или предотвращение дальнейшего развития заболевания/нарушения, если оно уже присутствует.
В некоторых вариантах осуществления композиции по настоящему изобретению можно вводить совместно или вводить одновременно с одним или несколькими дополнительными сердечно-сосудистыми средствами. Термины "вводимые совместно", "одновременное введение" и "вводимые одновременно" используют в настоящем документе взаимозаменяемо и каждый относится, например, к введению двух или более средств (например, EPA или ее производного и сердечно-сосудистого средства) в одно и то же время, в одной и той же единице дозирования, одно непосредственно после другого, в пределах пяти минут друг от друга, в пределах десяти минут друг от друга, в пределах пятнадцати минут друг от друга, в пределах тридцати минут друг от друга, в пределах одного часа друг от друга, в пределах двух часов друг от друга, в пределах четырех часов друг от друга, в пределах шести часов друг от друга, в пределах двенадцати часов друг от друга, в пределах одних суток друг от друга, в пределах одной недели друг от друга, в пределах двух недель друг от друга, в пределах одного месяца друг от друга, в пределах двух месяцев друг от друга, в пределах шести месяцы друг от друга, в пределах одного года друг от друга и т.д.
В одном из вариантов осуществления настоящее изобретение относится к способу лечения связанного с сердечно-сосудистой системой заболевания, включающему введение нуждающемуся в этом индивидуума композиции или композиций, содержащих EPA и одно или несколько дополнительных сердечно-сосудистых средств (в виде одной единицы дозирования или в виде нескольких единиц дозирования), где улучшаются один или несколько параметров липидов по сравнению с параметрами липидов, достигаемыми посредством аддитивных эффектов лечения по отдельности.
В связанном варианте осуществления после лечения по настоящему изобретению, например, в течение периода приблизительно от 1 до приблизительно 200 недель, приблизительно от 1 до приблизительно 100 недель, приблизительно от 1 до приблизительно 80 недель, приблизительно от 1 до приблизительно 50 недель, приблизительно от 1 до приблизительно 40 недель, приблизительно от 1 до приблизительно 20 недель, приблизительно от 1 до приблизительно 15 недель, приблизительно от 1 до приблизительно 12 недель, приблизительно от 1 до приблизительно 10 недель, приблизительно от 1 до приблизительно 5 недель, приблизительно от 1 до приблизительно 2 недель или приблизительно 1 недели, индивидуум или группа индивидуумов демонстрируют один или несколько из следующих исходов:
(a) сниженные уровни триглицеридов по сравнению с исходным уровнем или группой, получавшей плацебо;
(b) сниженные уровни Apo B по сравнению с исходным уровнем или группой, получавшей плацебо;
(c) увеличенные уровни HDL-C по сравнению с исходным уровнем или группой, получавшей плацебо;
(d) отсутствие увеличения уровней LDL-C по сравнению с исходным уровнем или группой, получавшей плацебо;
(e) снижение уровней LDL-C по сравнению с исходным уровнем или группой, получавшей плацебо;
(f) снижение уровней не HDL-C по сравнению с исходным уровнем или группой, получавшей плацебо;
(g) снижение уровней vLDL по сравнению с исходным уровнем или группой, получавшей плацебо;
(h) увеличение уровней apo A-I по сравнению с исходным уровнем или группой, получавшей плацебо;
(i) увеличение соотношения apo A-I/apo B по сравнению с исходным уровнем или группой, получавшей плацебо;
(j) снижение уровней липопротеина A по сравнению с исходным уровнем или группой, получавшей плацебо;
(k) увеличения числа частиц LDL по сравнению с исходным уровнем или группой, получавшей плацебо;
(l) снижения размера LDL по сравнению с исходным уровнем или группой, получавшей плацебо;
(m) снижение холестерина в остаточных частицах по сравнению с исходным уровнем или группой, получавшей плацебо;
(n) снижение окисленных LDL по сравнению с исходным уровнем или группой, получавшей плацебо;
(o) отсутствие изменения или снижение глюкозы в плазме натощак (FPG) по сравнению с исходным уровнем или группой, получавшей плацебо;
(p) снижение гемоглобина A1c (HbA1c) по сравнению с исходным уровнем или группой, получавшей плацебо;
(q) уменьшение резистентности к инсулину в модели гомеостаза по сравнению с исходным уровнем или группой, получавшей плацебо;
(r) снижение липопротеин-ассоциированной фосфолипазы A2 по сравнению с исходным уровнем или группой, получавшей плацебо;
(s) снижение внутриклеточной молекулы адгезии-1 по сравнению с исходным уровнем или группой, получавшей плацебо;
(t) снижение интерлейкина-6 по сравнению с исходным уровнем или группой, получавшей плацебо;
(u) снижение ингибитора активатора плазминогена-1 по сравнению с исходным уровнем или группой, получавшей плацебо;
(v) снижение высокочувствительного C-реактивного белка (hsCRP) по сравнению с исходным уровнем или группой, получавшей плацебо;
(w) увеличение EPA в сывороточных фосфолипидах по сравнению с исходным уровнем или группой, получавшей плацебо;
(x) увеличение EPA в мембранах эритроцитов по сравнению с исходным уровнем или группой, получавшей плацебо; и/или
(y) снижение или увеличение одного или нескольких из содержания в сывороточных фосфолипидах и/или в эритроцитах докозагексаеновой кислоты (DHA), докозапентаеновой кислоты (DPA), арахидоновой кислоты (AA), пальмитиновой кислоты (PA), стеаридоновой кислоты (SA) или олеиновой кислоты (OA) по сравнению с исходным уровнем или группой, получавшей плацебо.
В одном из вариантов осуществления способы по настоящему изобретению включают измерение до дозирования индивидууму или группе индивидуумов исходных уровней одного или нескольких маркеров, указанных в (a)-(y) выше. В другом варианте осуществления способы включают введение индивидууму композиции, как описано в настоящем документе, после определения исходных уровней одного или нескольких маркеров, указанных в (a)-(y), а затем проведение дополнительного измерения указанных одного или нескольких маркеров.
В другом варианте осуществления после лечения композицией по настоящему изобретению, например, в течение периода приблизительно от 1 до приблизительно 200 недель, приблизительно от 1 до приблизительно 100 недель, приблизительно от 1 до приблизительно 80 недель, приблизительно от 1 до приблизительно 50 недель, приблизительно от 1 до приблизительно 40 недель, приблизительно от 1 до приблизительно 20 недель, приблизительно от 1 до приблизительно 15 недель, приблизительно от 1 до приблизительно 12 недель, приблизительно от 1 до приблизительно 10 недель, приблизительно от 1 до приблизительно 5 недель, приблизительно от 1 до приблизительно 2 недель или приблизительно 1 недели индивидуум или группа индивидуумов демонстрируют любые 2 или более, любые 3 или более, любые 4 или более, любые 5 или более, любые 6 или более, любые 7 или более, любые 8 или более, любые 9 или более, любые 10 или более, любые 11 или более, любые 12 или более, любые 13 или более, любые 14 или более, любые 15 или более, любые 16 или более, любые 17 или более, любые 18 или более, любые 19 или более, любые 20 или более, любые 21 или более, любые 22 или более, любые 23 или более, любые 24 или более или все 25 из результатов (a)-(y), описанных непосредственно выше.
В другом варианте осуществления после лечения композицией по настоящему изобретению, например, в течение периода приблизительно от 1 до приблизительно 200 недель, приблизительно от 1 до приблизительно 100 недель, приблизительно от 1 до приблизительно 80 недель, приблизительно от 1 до приблизительно 50 недель, приблизительно от 1 до приблизительно 40 недель, приблизительно от 1 до приблизительно 20 недель, приблизительно от 1 до приблизительно 15 недель, приблизительно от 1 до приблизительно 10 недель, приблизительно от 1 до приблизительно 5 недель, приблизительно от 1 до приблизительно 2 недель или приблизительно 1 неделю индивидуум или группа индивидуумов демонстрирует один или несколько из следующих исходов:
(a) снижение уровня триглицеридов по меньшей мере приблизительно на 5%, по меньшей мере приблизительно на 10%, по меньшей мере приблизительно на 15%, по меньшей мере приблизительно на 20%, по меньшей мере приблизительно на 25%, по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 35%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 45%, по меньшей мере приблизительно на 50%, по меньшей мере приблизительно на 55% или по меньшей мере приблизительно на 75% (изменение в абсолютных % или изменение в средних %) по сравнению с исходным уровнем или группой, получавшей плацебо;
(b) увеличение менее 30%, увеличение менее 20%, увеличение менее 10%, увеличение менее 5% или отсутствие увеличения уровней не HDL-C или снижение уровней не HDL-C по меньшей мере приблизительно на 1%, по меньшей мере приблизительно на 3%, по меньшей мере приблизительно на 5%, по меньшей мере приблизительно на 10%, по меньшей мере приблизительно на 15%, по меньшей мере приблизительно на 20%, по меньшей мере приблизительно на 25%, по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 35%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 45%, по меньшей мере приблизительно на 50%, по меньшей мере приблизительно на 55% или по меньшей мере приблизительно на 75% (изменение в абсолютных % или изменение в средних %) по сравнению с исходным уровнем или группой, получавшей плацебо;
(c) по существу отсутствие изменений, отсутствие изменений или увеличение уровней HDL-C по меньшей мере приблизительно на 5%, по меньшей мере приблизительно на 10%, по меньшей мере приблизительно на 15%, по меньшей мере приблизительно на 20%, по меньшей мере приблизительно на 25%, по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 35%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 45%, по меньшей мере приблизительно на 50%, по меньшей мере приблизительно на 55% или по меньшей мере приблизительно на 75% (изменение в абсолютных % или изменение в средних %) по сравнению с исходным уровнем или группой, получавшей плацебо;
(d) увеличение менее 60%, увеличение менее 50%, увеличение менее 40%, увеличение менее 30%, увеличение менее 20%, увеличение менее 15% или отсутствие увеличения уровней LDL-C или снижение уровней LDL-C по меньшей мере приблизительно на 5%, по меньшей мере приблизительно на 10%, по меньшей мере приблизительно на 15%, по меньшей мере приблизительно на 20%, по меньшей мере приблизительно на 25%, по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 35%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 45%, по меньшей мере приблизительно на 50%, по меньшей мере приблизительно на 55%, по меньшей мере приблизительно на 55% или по меньшей мере приблизительно на 75% (изменение в абсолютных % или изменение в средних %) по сравнению с исходным уровнем или группой, получавшей плацебо;
(e) снижение уровней Apo B по меньшей мере приблизительно на 5%, по меньшей мере приблизительно на 10%, по меньшей мере приблизительно на 15%, по меньшей мере приблизительно на 20%, по меньшей мере приблизительно на 25%, по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 35%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 45%, по меньшей мере приблизительно на 50%, по меньшей мере приблизительно на 55% или по меньшей мере приблизительно на 75% (изменение в абсолютных % или изменение в средних %) по сравнению с исходным уровнем или группой, получавшей плацебо;
(f) снижение уровней vLDL по меньшей мере приблизительно на 5%, по меньшей мере приблизительно на 10%, по меньшей мере приблизительно на 15%, по меньшей мере приблизительно на 20%, по меньшей мере приблизительно на 25%, по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 35%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 45%, по меньшей мере приблизительно на 50% или по меньшей мере приблизительно на 100% (изменение в абсолютных % или изменение в средних %) по сравнению с исходным уровнем или группой, получавшей плацебо;
(g) увеличение уровней apo A-I по меньшей мере приблизительно на 5%, по меньшей мере приблизительно на 10%, по меньшей мере приблизительно на 15%, по меньшей мере приблизительно на 20%, по меньшей мере приблизительно на 25%, по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 35%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 45%, по меньшей мере приблизительно на 50% или по меньшей мере приблизительно на 100% (изменение в абсолютных % или изменение в средних %) по сравнению с исходным уровнем или группой, получавшей плацебо;
(h) увеличение отношения apo A-I/apo B по меньшей мере приблизительно на 5%, по меньшей мере приблизительно на 10%, по меньшей мере приблизительно на 15%, по меньшей мере приблизительно на 20%, по меньшей мере приблизительно на 25%, по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 35%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 45%, по меньшей мере приблизительно на 50% или по меньшей мере приблизительно на 100% (изменение в абсолютных % или изменение в средних %) по сравнению с исходным уровнем или группой, получавшей плацебо;
(i) снижение уровней липопротеина (a) по меньшей мере приблизительно на 5%, по меньшей мере приблизительно на 10%, по меньшей мере приблизительно на 15%, по меньшей мере приблизительно на 20%, по меньшей мере приблизительно на 25%, по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 35%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 45%, по меньшей мере приблизительно на 50% или по меньшей мере приблизительно на 100% (изменение в абсолютных % или изменение в средних %) по сравнению с исходным уровнем или группой, получавшей плацебо;
(j) снижение среднего количества частиц LDL по меньшей мере приблизительно на 5%, по меньшей мере приблизительно на 10%, по меньшей мере приблизительно на 15%, по меньшей мере приблизительно на 20%, по меньшей мере приблизительно на 25%, по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 35%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 45%, по меньшей мере приблизительно на 50% или по меньшей мере приблизительно на 100% (изменение в абсолютных % или изменение в средних %) по сравнению с исходным уровнем или группой, получавшей плацебо;
(k) увеличение среднего размера частиц LDL по меньшей мере приблизительно на 5%, по меньшей мере приблизительно на 10%, по меньшей мере приблизительно на 15%, по меньшей мере приблизительно на 20%, по меньшей мере приблизительно на 25%, по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 35%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 45%, по меньшей мере приблизительно на 50% или по меньшей мере приблизительно на 100% (изменение в абсолютных % или изменение в средних %) по сравнению с исходным уровнем или группой, получавшей плацебо;
(l) снижение холестерина в остаточных частицах по меньшей мере приблизительно на 5%, по меньшей мере приблизительно на 10%, по меньшей мере приблизительно на 15%, по меньшей мере приблизительно на 20%, по меньшей мере приблизительно на 25%, по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 35%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 45%, по меньшей мере приблизительно на 50% или по меньшей мере приблизительно на 100% (изменение в абсолютных % или изменение в средних %) по сравнению с исходным уровнем или группой, получавшей плацебо;
(m) снижение окисленных LDL по меньшей мере приблизительно на 5%, по меньшей мере приблизительно на 10%, по меньшей мере приблизительно на 15%, по меньшей мере приблизительно на 20%, по меньшей мере приблизительно на 25%, по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 35%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 45%, по меньшей мере приблизительно на 50% или по меньшей мере приблизительно на 100% (изменение в абсолютных % или изменение в средних %) по сравнению с исходным уровнем или группой, получавшей плацебо;
(n) по существу отсутствие изменений, отсутствие изменений или снижение уровня глюкозы в плазме натощак (FPG) по меньшей мере приблизительно на 5%, по меньшей мере приблизительно на 10%, по меньшей мере приблизительно на 15%, по меньшей мере приблизительно на 20%, по меньшей мере приблизительно на 25%, по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 35%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 45%, по меньшей мере приблизительно на 50% или по меньшей мере приблизительно на 100% (изменение в абсолютных % или изменение в средних %) по сравнению с исходным уровнем или группой, получавшей плацебо;
(o) по существу отсутствие изменений, отсутствие изменений или снижение гемоглобина A1c (HbA1c) по меньшей мере приблизительно на 5%, по меньшей мере приблизительно на 10%, по меньшей мере приблизительно на 15%, по меньшей мере приблизительно на 20%, по меньшей мере приблизительно на 25%, по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 35%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 45% или по меньшей мере приблизительно на 50% (изменение в абсолютных % или изменение в средних %) по сравнению с исходным уровнем или группой, получавшей плацебо;
(p) уменьшение индекса резистентности к инсулину в модели гомеостаза по меньшей мере приблизительно на 5%, по меньшей мере приблизительно на 10%, по меньшей мере приблизительно на 15%, по меньшей мере приблизительно на 20%, по меньшей мере приблизительно на 25%, по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 35%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 45%, по меньшей мере приблизительно на 50% или по меньшей мере приблизительно на 100% (изменение в абсолютных % или изменение в средних %) по сравнению с исходным уровнем или группой, получавшей плацебо;
(q) снижение липопротеин-ассоциированной фосфолипазы A2 по меньшей мере приблизительно на 5%, по меньшей мере приблизительно на 10%, по меньшей мере приблизительно на 15%, по меньшей мере приблизительно на 20%, по меньшей мере приблизительно на 25%, по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 35%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 45%, по меньшей мере приблизительно на 50% или по меньшей мере приблизительно на 100% (изменение в абсолютных % или изменение в средних %) по сравнению с исходным уровнем или группой, получавшей плацебо;
(r) снижение внутриклеточной молекулы адгезии-1 по меньшей мере приблизительно на 5%, по меньшей мере приблизительно на 10%, по меньшей мере приблизительно на 15%, по меньшей мере приблизительно на 20%, по меньшей мере приблизительно на 25%, по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 35%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 45%, по меньшей мере приблизительно на 50% или по меньшей мере приблизительно на 100% (изменение в абсолютных % или изменение в средних %) по сравнению с исходным уровнем или группой, получавшей плацебо;
(s) снижение интерлейкина-6 по меньшей мере приблизительно на 5%, по меньшей мере приблизительно на 10%, по меньшей мере приблизительно на 15%, по меньшей мере приблизительно на 20%, по меньшей мере приблизительно на 25%, по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 35%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 45%, по меньшей мере приблизительно на 50% или по меньшей мере приблизительно на 100% (изменение в абсолютных % или изменение в средних %) по сравнению с исходным уровнем или группой, получавшей плацебо;
(t) снижения ингибитора активатора плазминогена-1 по меньшей мере приблизительно на 5%, по меньшей мере приблизительно на 10%, по меньшей мере приблизительно на 15%, по меньшей мере приблизительно на 20%, по меньшей мере приблизительно на 25%, по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 35%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 45%, по меньшей мере приблизительно на 50% или по меньшей мере приблизительно на 100% (изменение в абсолютных % или изменение в средних %) по сравнению с исходным уровнем или группой, получавшей плацебо;
(u) снижение высокочувствительного C-реактивного белка (hsCRP) по меньшей мере приблизительно на 5%, по меньшей мере приблизительно на 10%, по меньшей мере приблизительно на 15%, по меньшей мере приблизительно на 20%, по меньшей мере приблизительно на 25%, по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 35%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 45%, по меньшей мере приблизительно на 50% или по меньшей мере приблизительно на 100% (изменение в абсолютных % или изменение в средних %) по сравнению с исходным уровнем или группой, получавшей плацебо;
(v) увеличение EPA в сыворотке плазмы и/или RBC по меньшей мере приблизительно на 5%, по меньшей мере приблизительно на 10%, по меньшей мере приблизительно на 15%, по меньшей мере приблизительно на 20%, по меньшей мере приблизительно на 25%, по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 35%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 45%, по меньшей мере приблизительно на 50%, по меньшей мере приблизительно на 100%, по меньшей мере приблизительно на 200% или по меньшей мере приблизительно на 400% (изменение в абсолютных % или изменение в средних %) по сравнению с исходным уровнем или группой, получавшей плацебо;
(w) увеличение EPA в сывороточных фосфолипидах и/или мембранах эритроцитов по меньшей мере приблизительно на 5%, по меньшей мере приблизительно на 10%, по меньшей мере приблизительно на 15%, по меньшей мере приблизительно на 20%, по меньшей мере приблизительно на 25%, по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 35%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 45%, по меньшей мере приблизительно на 50%, по меньшей мере приблизительно на 100%, по меньшей мере приблизительно на 200% или по меньшей мере приблизительно на 400% (изменение в абсолютных % или изменение в средних %) по сравнению с исходным уровнем или группой, получавшей плацебо;
(x) снижение или увеличение одного или нескольких из DHA, DPA, AA, PA и/или OA в сывороточных фосфолипидах и/или в эритроцитах по меньшей мере приблизительно на 5%, по меньшей мере приблизительно на 10%, по меньшей мере приблизительно на 15%, по меньшей мере приблизительно на 20%, по меньшей мере приблизительно на 25%, по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 35%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 45%, по меньшей мере приблизительно на 50%, по меньшей мере приблизительно на 55% или по меньшей мере приблизительно на 75% (изменение в абсолютных % или изменение в средних %) по сравнению с исходным уровнем или группой, получавшей плацебо; и/или
(y) снижение общего холестерина по меньшей мере приблизительно на 5%, по меньшей мере приблизительно на 10%, по меньшей мере приблизительно на 15%, по меньшей мере приблизительно на 20%, по меньшей мере приблизительно на 25%, по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 35%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 45%, по меньшей мере приблизительно на 50%, по меньшей мере приблизительно на 55% или по меньшей мере приблизительно на 75% (изменение в абсолютных % или изменение в средних %) по сравнению с исходным уровнем или группой, получавшей плацебо.
В одном из вариантов осуществления способы по настоящему изобретению включают до дозирования индивидууму или группе индивидуумов измерение исходных уровней одного или нескольких маркеров, указанных в (a)-(y). В другом варианте осуществления способы включают введение композиции, как описано в настоящем документе, индивидууму после определения исходных уровней одного или нескольких маркеров, указанных в (a)-(y), а затем проведение дополнительного измерения одного или нескольких маркеров, которые измеряют на исходном уровне, для сравнения с ним.
В другом варианте осуществления после лечения композицией по настоящему изобретению, например, в течение периода приблизительно от 1 до приблизительно 200 недель, приблизительно от 1 до приблизительно 100 недель, приблизительно от 1 до приблизительно 80 недель, приблизительно от 1 до приблизительно 50 недель, приблизительно от 1 до приблизительно 40 недель, приблизительно от 1 до приблизительно 20 недель, приблизительно от 1 до приблизительно 15 недель, приблизительно от 1 до приблизительно 12 недель, приблизительно от 1 до приблизительно 10 недель, приблизительно от 1 до приблизительно 5 недель, приблизительно от 1 до приблизительно 2 недель или приблизительно 1 неделя, индивидуум или группа индивидуумов демонстрирует любые 2 или более, любые 3 или более, любые 4 или более, любые 5 или более, любые 6 или более, любые 7 или более, любые 8 или более, любые 9 или более, любые 10 или более, любые 11 или более, любые 12 или более, любые 13 или более, любые 14 или более, любые 15 или более, любые 16 или более, любые 17 или более, любые 18 или более, любые 19 или более, любые 20 или более, любые 21 или более, любые 22 или более, любые 23 или более, любые 24 или более или все 25 из исходов (a)-(y), описанных непосредственно выше.
Параметры (a)-(y) можно измерять в соответствии с любой клинически приемлемой методологией. Например, триглицериды, общий холестерин, HDL-C и сахар в крови натощак могут представлять собой образец из сыворотки, и их можно анализировать стандартными способами фотометрии. VLDL-TG, LDL-C и VLDL-C можно рассчитывать и определять с применением фракционирования сывороточных липопротеинов посредством препаративного ультрацентрифугирования и последующего количественного анализа посредством рефрактометрии или посредством способов аналитического ультрацентрифугирования. Apo A1, Apo B и hsCRP можно определять в сыворотке стандартными способами нефелометрии. Липопротеин (a) можно определять в сыворотке стандартными способами турбидиметрического иммунологического анализа. Количество частиц LDL и размер частиц можно определять с применением спектрометрии ядерного магнитного резонанса (ЯМР). Остаточные липопротеины и LDL-фосфолипазу A2 можно определять в плазме или сыворотке с ЭДТА и сыворотке, соответственно, способами ферментативного иммунофракционирования. Уровни окисленных LDL, молекулы межклеточной адгезии-1 и интерлейкина-2 можно определять в сыворотке стандартными способами иммуноферментного анализа. Эти способы подробно описаны в стандартных руководствах, например, Tietz Fundamentals of Clinical Chemistry, 6th Ed. (Burtis, Ashwood and Borter Eds.), WB Saunders Company.
В связанном варианте осуществления снижение или увеличение параметров (a)-(y), указанных выше, является статистически значимым.
В другом варианте осуществления настоящее изобретение относится к способу лечения липидов крови, включающему введение нуждающемуся в этом индивидууму от 1 до множества единиц дозирования, содержащих композицию или композиции, как описано в настоящем документе. В другом варианте осуществления исходный уровень триглицеридов у индивидуума, подвергаемого лечению, до лечения композицией по настоящему изобретению является большим или равным приблизительно 150 мг/дл, большим или равным приблизительно 175 мг/дл, большим или равным приблизительно 250 мг/дл или большим или равным приблизительно 500 мг/дл, например, приблизительно от 200 мг/дл до приблизительно 2000 мг/дл, приблизительно от 300 до приблизительно 1800 мг/дл или приблизительно от 500 мг/дл до приблизительно 1500 мг/дл.
В одном из вариантов осуществления способы по настоящему изобретению включают до дозирования индивидууму или группе индивидуумов измерение исходных уровней одного или нескольких маркеров, указанных в (a)-(y). В другом варианте осуществления способы включают введение индивидууму композиции, как описано в настоящем документе, после определения исходных уровней одного или нескольких маркеров, указанных в (a)-(y), а затем проведение дополнительного измерения одного или нескольких маркеров, которые измеряют на исходном уровне, для сравнения с ним.
В одном из вариантов осуществления настоящее изобретение относится к способу лечения или предотвращения первичной гиперхолестеринемии и/или смешанной дислипидемии (Фредриксона типов IIa и IIb) у нуждающегося в этом индивидуума, включающему введение индивидууму композиции или композиций, содержащих EPA и одно или несколько дополнительных сердечно-сосудистых средств (или в виде одной единицы дозирования, или в виде нескольких единиц дозирования), как описано в настоящем документе. В связанном варианте осуществления настоящее изобретение относится к способу снижения уровней триглицеридов у индивидуума или индивидуумов, когда лечение монотерапией статином или ниацином пролонгированного действия полагают недостаточным (гиперлипидемия Фредриксона типа IV). Монотерапию статином или ниацином пролонгированного действия полагают недостаточной, когда, например, уровень не HDL-C индивидуума не снижается или не снижается до желаемой степени, уровень LDL-C индивидуума не улучшается или не улучшается до желаемой степени, уровень HDL-C индивидуума не улучшается или не улучшается до желаемой степени и/или уровень триглицеридов индивидуума не улучшается или не улучшается до желаемой степени.
В другом варианте осуществления настоящее изобретение относится к способу лечения или предотвращения несмертельного инфаркта миокарда, включающему введение индивидууму композиции или композиций, содержащих EPA и одно или несколько дополнительных сердечно-сосудистых средств (или в виде одной единицы дозирования, или в виде нескольких единиц дозирования), как описано в настоящем документе.
В другом варианте осуществления настоящее изобретение относится к способу лечения или предотвращения риска рецидивирующего несмертельного инфаркта миокарда у индивидуума с инфарктом миокарда в истории болезни, включающему введение индивидууму композиции или композиций, содержащих EPA и одно или несколько дополнительных сердечно-сосудистых средств (или в виде одной единицы дозирования, или в виде нескольких единиц дозирования), как описано в настоящем документе.
В другом варианте осуществления настоящее изобретение относится к способу замедления развития или стимуляции регресса атеросклеротического заболевания у нуждающегося в этом индивидуума, включающему введение индивидууму композиции или композиций, содержащих EPA и одно или несколько дополнительных сердечно-сосудистых средств (или в виде одной единицы дозирования, или в виде нескольких единиц дозирования), как описано в настоящем документе.
В другом варианте осуществления настоящее изобретение относится к способу лечения ожирения у нуждающегося в этом индивидуума, включающему введение нуждающемуся в этом индивидууму композиции или композиций, содержащих EPA и одно или несколько дополнительных сердечно-сосудистых средств (или в виде одной единицы дозирования, или в виде нескольких единиц дозирования), как описано в настоящем документе.
В другом варианте осуществления настоящее изобретение относится к способу лечения или предотвращения очень высоких уровней триглицеридов в сыворотке (например, гиперлипидемии типа IV и V) у нуждающегося в этом индивидуума, включающему введение индивидууму композиции или композиций, содержащих EPA и одно или несколько дополнительных сердечно-сосудистых средств (или в виде одной единицы дозирования, или в виде нескольких единиц дозирования), как описано в настоящем документе.
В другом варианте осуществления настоящее изобретение относится к способу лечения индивидуумов с очень высокими уровнями триглицеридов в сыворотке (например, более 1000 мг/дл или более 2000 мг/дл) и с риском развития панкреатита, включающему введение индивидууму композиции или композиций, содержащих EPA и одно или несколько дополнительных сердечно-сосудистых средств (или в виде одной единицы дозирования, или в виде нескольких единиц дозирования), как описано в настоящем документе.
В другом варианте осуществления настоящее изобретение относится к способу предотвращения рецидива инсульта, включающему введение индивидууму с инсультом в истории болезни композиции или композиций, содержащих EPA и одно или несколько дополнительных сердечно-сосудистых средств (или в виде одной единицы дозирования, или в виде нескольких единиц дозирования), как описано в настоящем документе.
В другом варианте осуществления настоящее изобретение относится к способу предотвращения начала и/или рецидива сердечно-сосудистого нарушения у индивидуума, вышедшему из периода нестабильности после сердечно-сосудистой ангиопластики, включающему введение индивидууму композиции или композиций, содержащих EPA и одно или несколько дополнительных сердечно-сосудистых средств (или в виде одной единицы дозирования, или в виде нескольких единиц дозирования), как описано в настоящем документе.
В другом варианте осуществления настоящее изобретение относится к способу снижения уровней Apo-B и не HDL-холестерина у группы индивидуумов с исходным уровнем LDL-холестерина по меньшей мере 100 мг/дл, исходным уровнем не HDL-холестерина по меньшей мере 130 мг/дл и исходным уровнем триглицеридов по меньшей мере 200 мг/дл и снижения уровней Apo-B и не HDL-холестерина у группы индивидуумов посредством введения композиции или композиций, содержащих EPA и одно или несколько дополнительных сердечно-сосудистых средств (или в виде одной единицы дозирования, или в виде нескольких единиц дозирования), как описано в настоящем документе, членам группы индивидуумов.
В другом варианте осуществления изобретение относится к способу снижения уровней Apo-B у группы индивидуумов, включающему измерение уровней LDL-холестерина, не HDL-холестерина и триглицеридов у индивидуумов, получая группу индивидуумов с исходным уровнем LDL-холестерина по меньшей мере 100 мг/дл, исходным уровнем не HDL-холестерина по меньшей мере 130 мг/дл и исходным уровнем триглицеридов по меньшей мере 200 мг/дл, и снижение уровней Apo-B у группы индивидуумов посредством введения членам группы индивидуумов композиции или композиций, содержащих EPA и одно или несколько дополнительных сердечно-сосудистых средств (или в виде одной единицы дозирования, или в виде нескольких единиц дозирования), как описано в настоящем документе, в количестве, эффективном для снижения уровней Apo-B у группы индивидуумов в статистически значимой степени по сравнению с контрольным лечением, где избегается увеличение или статистически значимое увеличение уровня LDL-холестерина.
В другом варианте осуществления изобретение относится к способу снижения уровней Apo-B у группы индивидуумов, включающему получение группы индивидуумов с исходным уровнем LDL-холестерина по меньшей мере 100 мг/дл, исходным уровнем не HDL-холестерина по меньшей мере 130 мг/дл и исходным уровнем триглицеридов по меньшей мере 200 мг/дл, снижение уровней Apo-B у группы индивидуумов посредством введения членам группы индивидуумов композиции или композиций, содержащих EPA и одно или несколько дополнительных сердечно-сосудистых средств (или в виде одной единицы дозирования, или в виде нескольких единиц дозирования), как описано в настоящем документе, в количестве, эффективном для снижения уровней Apo-B у группы индивидуумов в статистически значимой степени по сравнению с контрольным лечением, и определение снижения уровней Apo-B у группы индивидуумов.
В одном из вариантов осуществления композицию по изобретению вводят индивидууму в количестве, достаточном для обеспечения суточной дозы EPA приблизительно от 1 мг до приблизительно 10000 мг, приблизительно от 25 до приблизительно 5000 мг, приблизительно от 50 до приблизительно 3000 мг, приблизительно от 75 мг до приблизительно 2500 мг или приблизительно от 100 мг до приблизительно 1000 мг, например, приблизительно 75 мг, приблизительно 100 мг, приблизительно 125 мг, приблизительно 150 мг, приблизительно 175 мг, приблизительно 200 мг, приблизительно 225 мг, приблизительно 250 мг, приблизительно 275 мг, приблизительно 300 мг, приблизительно 325 мг, приблизительно 350 мг, приблизительно 375 мг, приблизительно 400 мг, приблизительно 425 мг, приблизительно 450 мг, приблизительно 475 мг, приблизительно 500 мг, приблизительно 525 мг, приблизительно 550 мг, приблизительно 575 мг, приблизительно 600 мг, приблизительно 625 мг, приблизительно 650 мг, приблизительно 675 мг, приблизительно 700 мг, приблизительно 725 мг, приблизительно 750 мг, приблизительно 775 мг, приблизительно 800 мг, приблизительно 825 мг, приблизительно 850 мг, приблизительно 875 мг, приблизительно 900 мг, приблизительно 925 мг, приблизительно 950 мг, приблизительно 975 мг, приблизительно 1000 мг, приблизительно 1025 мг, приблизительно 1050 мг, приблизительно 1075 мг, приблизительно 1100 мг, приблизительно 1125 мг, приблизительно 1150 мг, приблизительно 1175 мг, приблизительно 1200 мг, приблизительно 1225 мг, приблизительно 1250 мг, приблизительно 1275 мг, приблизительно 1300 мг, приблизительно 1325 мг, приблизительно 1350 мг, приблизительно 1375 мг, приблизительно 1400 мг, приблизительно 1425 мг, приблизительно 1450 мг, приблизительно 1475 мг, приблизительно 1500 мг, приблизительно 1525 мг, приблизительно 1550 мг, приблизительно 1575 мг, приблизительно 1600 мг, приблизительно 1625 мг, приблизительно 1650 мг, приблизительно 1675 мг, приблизительно 1700 мг, приблизительно 1725 мг, приблизительно 1750 мг, приблизительно 1775 мг, приблизительно 1800 мг, приблизительно 1825 мг, приблизительно 1850 мг, приблизительно 1875 мг, приблизительно 1900 мг, приблизительно 1925 мг, приблизительно 1950 мг, приблизительно 1975 мг, приблизительно 2000 мг, приблизительно 2025 мг, приблизительно 2050 мг, приблизительно 2075 мг, приблизительно 2100 мг, приблизительно 2125 мг, приблизительно 2150 мг, приблизительно 2175 мг, приблизительно 2200 мг, приблизительно 2225 мг, приблизительно 2250 мг, приблизительно 2275 мг, приблизительно 2300 мг, приблизительно 2325 мг, приблизительно 2350 мг, приблизительно 2375 мг, приблизительно 2400 мг, приблизительно 2425 мг, приблизительно 2450 мг, приблизительно 2475 мг или приблизительно 2500 мг.
В различных вариантах осуществления изобретения, описываемого в настоящем документе, EPA и необязательные одно или несколько дополнительных сердечно-сосудистых средств можно вводить в виде совместно формулируемой одной единицы дозирования или в виде отдельных единиц дозирования. Когда EPA и необязательные одно или несколько дополнительных сердечно-сосудистых средств вводят совместно в виде отдельных единиц дозирования, каждую единицу дозирования можно вводить индивидууму по существу в одно и тоже время или по существу в различные моменты времени. В одном из вариантов осуществления, когда две или более отдельных единиц дозирования необходимо вводить ежедневно, каждую единицу дозирования можно вводить индивидууму в пределах периода приблизительно 24 часов, 18 часов, 12 часов, 10 часов, 8 часов, 6 часов, 4 часов, 2 часов, 1 часа или 0,5 часа.
В другом варианте осуществления EPA и одно или несколько необязательных сердечно-сосудистых средств можно вводить последовательно. Например, EPA можно вводить индивидууму в виде одного средства в течение периода дозирования EPA. Период дозирования может представлять собой, например, 1 сутки, 2 суток, 4 суток, 6 суток, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 7 недель, 8 недель, 9 недель или 10 недель. После любого такого периода дозирования вместе с текущим введением EPA или вместо лечения EPA можно начинать введение одного или нескольких дополнительных сердечно-сосудистых средств.
В другом варианте осуществления EPA вводят индивидууму утром, например, приблизительно от 4 часов утра до приблизительно 10 часов утра, приблизительно от 5 часов утра до приблизительно 9 часов утра или приблизительно от 6 часов утра до приблизительно 8 часов утра, а необязательные одно или несколько сердечно-сосудистых средств вводят индивидууму после полудня или вечером, например, приблизительно от 13 часов до приблизительно 23, приблизительно от 14 часов до приблизительно 22 часов или приблизительно от 15 часов до приблизительно 21 часа, или наоборот.
В другом варианте осуществления изобретение относится к применению EPA и одного или нескольких сердечно-сосудистых средств в получении лекарственного средства для лечения или предотвращения связанного с сердечно-сосудистой системой заболевания, такого как гипертриглицеридемия, гиперхолестеринемия, смешанная дислипидемия, ишемическая болезнь сердца, сосудистое заболевание, инсульт, атеросклероз, аритмия, гипертензия, инфаркт миокарда и другие сердечно-сосудистые нарушения. В одном из вариантов осуществления композиция содержит не более 10% DHA, если вообще содержит. В другом варианте осуществления композиция по существу не содержит или не содержит DHA.
В другом варианте осуществления изобретение относится к фармацевтической композиции, содержащей EPA и одно или несколько сердечно-сосудистых средств для лечения и/или предотвращения связанного с сердечно-сосудистой системой заболевания, где композиция содержит не более 10% DHA, если вообще содержит. В связанном варианте осуществления композиция по существу не содержит DHA или не содержит DHA.
В одном из вариантов осуществления индивидуум, подвергаемый лечению композицией или посредством схемы лечения, указанными в настоящем документе, является индивидуумом с диабетом или предиабетом.
В одном из вариантов осуществления любой из способов, описываемых в настоящем документе, применяют для лечения или предотвращения у индивидуума или индивидуумов, находящихся на традиционной западной диете. В одном из вариантов осуществления способы по изобретению включают этап определения индивидуума как находящегося на западной диете или находящегося на разумной диете, а затем лечение индивидуума, если индивидуума признают потребляющим западную диету. Термин "западная диета" в настоящем документе в основном означает типичную диету, в процентах от общих калорий, состоящую из приблизительно от 45% до приблизительно 50% углеводов, приблизительно от 35 до приблизительно 40% жира и приблизительно от 10% до приблизительно 15% белка. Западную диету можно дополнительно охарактеризовать относительно высоким потреблением сырого и обработанного мяса, сладкого, продуктов из очищенных зерновых и десертов, например, когда половина или более или 70% или более калорий происходят из этих источников.
Следует понимать, что специалистам в данной области очевиден и предусмотрен широкий диапазон изменений и модификаций вариантов осуществления, описанных выше. Таким образом, полагают, что указанное выше подробное описание следует рассматривать как иллюстративное, а не как лимитирующее, и что следует понимать, что для определения сущности и объема изобретения существует приведенная ниже формула изобретения, включая все эквиваленты.
Следует понимать, что специалистам в данной области очевидны различные изменения и модификации предпочтительных вариантов осуществления настоящего изобретения, описываемых в настоящем документе. Такие изменения и модификации можно осуществлять без отклонения от сущности и объема объекта настоящего изобретения и без уменьшения его подразумеваемых преимуществ. Таким образом, полагают, что такие изменения и модификации предусмотрены в прилагаемой формуле изобретения.
ПРИМЕРЫ
Приведенные ниже неограничивающие примеры приведены только для иллюстративных целей, и их не следует рассматривать как каким-либо образом ограничивающие изобретение.
Пример 1
Эксперимент проводили для тестирования EPA, DHA, EPA + DHA с аторвастатином и без в модели мембран, обогащенных PUFA и холестерином на уровнях, воспроизводящих заболевание или условия высокого CV-риска (т.е. гипохолестеринемии). Как показано ниже, EPA демонстрирует мощный антиоксидантный эффект в обогащенных холестерином мембранах, который превосходил антиоксидантный эффект, наблюдаемый при применении DHA. Кроме того, комбинация EPA и аторвастатина обеспечивала даже больший антиоксидантный эффект при сравнении с одной EPA.
EPA и DHA тестировали отдельно при фиксированной концентрации 10,0 мкМ или в комбинации при 5,65 мкМ и 4,35 мкМ (EPA и DHA, соответственно), которая представляет собой молярное соотношение 1,3:1. Отдельное и комбинированное действие этих средств на образование пероксидов липидов (LOOH) исследовали при молярных отношениях холестерина к фосфолипидам (C/P) 0,5:1, 1,0:1 и 1,5:1. Уровни гидропероксидов липидов также измеряли для EPA, DPH и EPA/DPH в обогащенных холестерином мембранах, получаемых в отсутствие и в присутствии аторвастатина.
1,2-дилинолеоил-3-sn-фосфатидилхолин (DLPC) получали от Avanti Polar Lipids (Alabaster, AL) и до использования хранили в хлороформе (25 мг/мл) при -80°C. Холестерин получали и хранили в хлороформе (10 мг/мл) при -20°C. Цветной реагент CHOD-йодид (исходный раствор), состоящий из 0,2 M K2HPO4, 0,12 M KI, 0,15 мМ NaN3, 10 мкМ молибдата аммония и 0,1 г/л хлорида бензалкония, получали модифицированным способом на основе El-Saadani et al. (El-Saadani M, Esterbauer H, El-Sayed M, Goher M, Nassar AY, Jurgens G. A spectrophotometric assay for lipid peroxides in serum lipoproteins using commercially available reagent. J Lipid Res 1989; 30:627-30). Перед использованием в эксперименте реагент CHOD активировали, добавляя 24 мкМ этилендиаминтетрауксусную кислоту (ЭДТА), 20 мкМ бутилированный гидрокситолуол (BHT) и 0,2% Triton X-100. Аторвастатин получали в этаноле непосредственно перед использованием в эксперименте и добавляли вместе с составляющими липидами, содержащими фиксированные количества эквимолярных уровней EPA, DPH или EPA/DPH. Соединения и липиды добавляли в комбинации в течение получения образца мембраны для обеспечения полной инкорпорации в липидные бислои.
Образцы мембран, состоящие из DLPC ± холестерин, с молярными отношениями холестерина к фосфолипидам (C/P) в диапазоне от 0,5 до 1,5, получали как указано далее. Составляющие липиды (в хлороформе) переносили в тестовые пробирки 13×100 мм и сушили в кожухе в постоянном потоке газообразного азота при перемешивании на центрифуге типа "вортекс". Липид совместно высушивали с EPA, DPH или EPA/DPH, полученными в отсутствие или в присутствии эквимолярных уровней аторвастатина.
Остаточный растворитель удаляли посредством высушивания в течение минимум 3 часов в вакууме. После высушивания каждый образец мембраны ресуспендировали в дифракционном буфере (0,5 мМ HEPES, 154 мМ NaCl, pH 7,3) с получением конечной концентрации фосфолипидов 1,0 мг/мл. Получали многослойные везикулы (MLV) посредством перемешивания на центрифуге типа "вортекс" в течение 3 минут при температуре окружающей среды. Bangham AD, Standish MM, Watkins JC. Diffusion of univalent ions across the lamellae of swollen phospholipids. J. Mol. Biol. 1965; 13:238-52. Непосредственно после исходного получения MLV отбирали аликвоты каждого образца мембраны для анализа исходного перекисного окисления (0 час).
Все образцы липидных мембран подвергали самоокислению различной длительности посредством инкубации при 37°C в незакрытой водяной бане с перемешиванием. Отбирали небольшие аликвоты каждого образца с интервалами 24 часа и комбинировали с 1,0 мл активного красителя CHOD-йодид. Для обеспечения считывания спектрофотометрических данных в оптимуме диапазона оптической плотности, объемы образцов, взятые для измерения формирования пероксидов липидов, регулировали по длительности перекисного окисления и диапазону от 100 до 10 мкл. Тестируемые образцы сразу же покрывали фольгой и инкубировали при комнатной температуре в течение >4 часов в отсутствие света. Поглощение измеряли по отношению к контролю CHOD при 365 нм с применением спектрофотометра Beckman DU-640.
Колориметрический анализ CHOD основан на окислении йодида (I-) гидропероксидами липидов (LOOH) и проходит в соответствии со следующей схемой реакции:
LOOH + 2H+ + 3I- → LOH + H2O + I3-
Количество аниона трийодида (I3-), высвобождаемого в этой реакции, прямо пропорционально количеству гидропероксидов липидов, присутствующих в образце мембран. Молярный коэффициент поглощения (ε) I3- при 365 нм составляет 2,46×104 М-1⋅см-1.
Результаты представлены на фигурах 1-4.

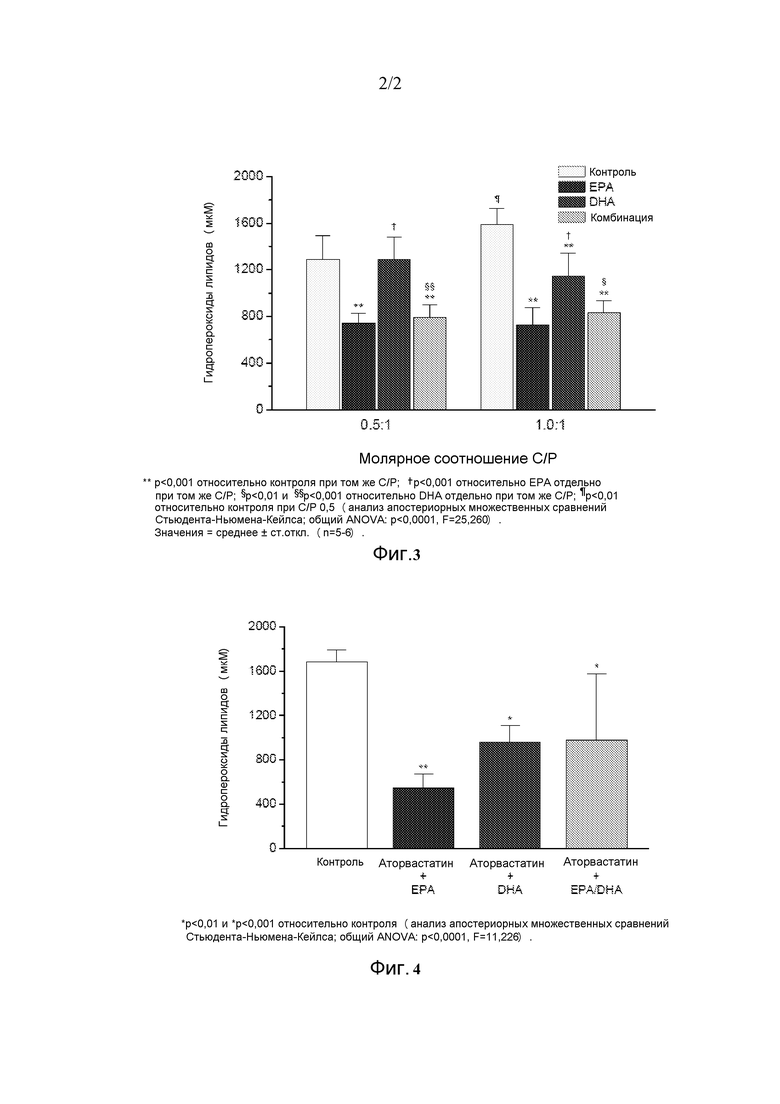
Изобретение относится к фармацевтической промышленности и медицине и представляет собой способ лечения смешанной дислипидемии у субъекта, получающего лечение статинами, причем указанный способ включает введение субъекту 4 капсул в день, где каждая капсула содержит 900 мг, 925 мг, 950 мг, 975 мг или 1 г этил-ЕРА для снижения уровня триглицеридов натощак и LDL-C у субъекта относительно субъектов, имеющих смешанную дислипидемию, которые получают статины без этил-ЕРА. Изобретение обеспечивает снижение уровней триглицеридов и уровней LDL-C у субъектов с различной степенью выраженности дислипидемии. 4 н. и 9 з.п. ф-лы, 1 пр., 4 ил.
1. Способ лечения смешанной дислипидемии у субъекта, получающего лечение статинами, причем указанный способ включает введение субъекту 4 капсул в день, где каждая капсула содержит 900 мг, 925 мг, 950 мг, 975 мг или 1 г этил-ЕРА для снижения уровня триглицеридов натощак и LDL-C у субъекта относительно субъектов, имеющих смешанную дислипидемию, которые получают статины без этил-ЕРА.
2. Способ по п. 1, где стадия введения снижает уровень триглицеридов натощак по меньшей мере на 10% по отношению к субъектам со смешанной дислипидемией, которые получают статины без указанного этил-ЕРА.
3. Способ по п. 1, где стадия введения снижает уровень триглицеридов натощак по меньшей мере на 15% по отношению к субъектам со смешанной дислипидемией, которые получают статины без указанного этил-ЕРА.
4. Способ по п. 1, где стадия введения снижает уровень триглицеридов натощак по меньшей мере на 20% по отношению к субъектам со смешанной дислипидемией, которые получают статины без указанного этил-ЕРА.
5. Способ по п. 1, где стадия введения снижает уровень триглицеридов натощак по меньшей мере на 25% и LDL-C по меньшей мере на 5% по отношению к субъектам со смешанной дислипидемией, которые получают статины без указанного этил-ЕРА.
6. Способ по п. 1, где стадия введения снижает уровень аполипопротеина В натощак по отношению к субъектам со смешанной дислипидемией, которые получают статины без указанного этил-ЕРА.
7. Способ по п. 1, где стадия введения снижает уровень аполипопротеина В натощак по меньшей мере на 5% по отношению к субъектам со смешанной дислипидемией, которые получают статины без указанного этил-ЕРА.
8. Способ по п. 1, где стадия введения снижает уровень VLDL-C натощак по отношению к субъектам со смешанной дислипидемией, которые получают статины без указанного этил-ЕРА.
9. Способ по п. 1, где стадия введения снижает уровень VLDL-C натощак по меньшей мере на 15% по отношению к субъектам со смешанной дислипидемией, которые получают статины без указанного этил-ЕРА.
10. Способ по п. 1, где статин выбирают из ловастатина, мевастатина, питавастатина, правастатина, розувастатина, флувастатина, аторвастатина и симвастатина.
11. Способ лечения смешанной дислипидемии у субъекта, получающего лечение статинами, включающий введение субъекту 4 капсул, каждая из которых содержит 900 мг этил-ЕРА ежедневно, что эффективно для снижения уровня триглицеридов натощак и LDL-C по отношению к субъектам, имеющим смешанную дислипидемию, которые получают статины без указанного этил-ЕРА.
12. Способ лечения смешанной дислипидемии у субъекта, получающего лечение статинами, включающий введение субъекту 4 капсул, каждая из которых содержит 925 мг или 950 мг этил-ЕРА ежедневно, что эффективно для снижения уровня триглицеридов натощак и LDL-C по отношению к субъектам, имеющим смешанную дислипидемию, которые получают статины без указанного этил-ЕРА.
13. Способ лечения смешанной дислипидемии у субъекта, получающего лечение статинами, включающий введение субъекту 4 капсул, каждая из которых содержит 975 мг этил-ЕРА ежедневно, что эффективно для снижения уровня триглицеридов натощак и LDL-C по отношению к субъектам, имеющим смешанную дислипидемию, которые получают статины без указанного этил-ЕРА.
| US 2008306154 A1, 11.12.2008US 2007060532 A1, 15.03.2007US 2007191467 A1, 16.08.2007US 7022713 A1, 25.03.2005EP 1982710 A1, 22.11.2008Miles JM et | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Электрическое сопротивление для нагревательных приборов и нагревательный элемент для этих приборов | 1922 |
|
SU1997A1 |
| Aberg " Dyslipidemiain HIV patients", Cleveland Clinic Journal of Medicine, v.72, N 12,December 2005, найдено в Интернет на сайте:http://www.ccjm.org/content/72/12/1113.full.pdfЭнциклопедический словарьмедицинских терминов, под редакцией академика РАМН В.И.Покровского, издание 2-е, Москва "Медицина", 2001, стр.648БЕЛИКОВ В.Г | |||
| Фармацевтическая химия, М., Высшая школа, 1993, с | |||
| Зубчатое колесо со сменным зубчатым ободом | 1922 |
|
SU43A1 |
Авторы
Даты
2017-07-04—Публикация
2010-04-29—Подача