ПЕРЕКРЕСТНАЯ ССЫЛКА НА РАНЕЕ ПОДАННУЮ ЗАЯВКУ
По данной заявке испрашивается приоритет в соответствии с предварительной заявкой на выдачу патента США №61/639274, поданной 27 апреля 2012 года, полное содержание которой включено в настоящий документ посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее раскрытие относится к способам получения молекул, которые применимы в качестве пестицидов (например, акарицидов, инсектицидов, моллюскоцидов и нематоцидов), к таким молекулам и к способам применения таких молекул для контроля вредителей.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Каждый год вредители служат причиной смерти миллионов людей во всем мире. Кроме того, существует более десяти тысяч видов вредителей, которые служат причиной убытков в сельском хозяйстве. Каждый год убытки в сельском хозяйстве составляют во всем мире миллиарды долларов США.
Термиты наносят ущерб всем видам частных и общественных сооружений. Каждый год убытки в результате вызванного термитами ущерба составляют во всем мире миллиарды долларов США.
Вредители запасов продовольствия поедают и ухудшают качество запасов продовольствия. Каждый год убытки запасов продовольствия составляют во всем мире миллиарды долларов США, но, что более важно, лишают людей необходимой пищи.
Существует острая потребность в новых пестицидах. У некоторых вредителей развивается резистентность к пестицидам, используемым в настоящее время. Сотни видов вредителей являются резистентными к одному или нескольким пестицидам. Хорошо известно развитие резистентности к некоторым из более ранних пестицидов, таким как DDT, карбаматы и органофосфаты. Но резистентность уже выработалась к некоторым из новых пестицидов.
Таким образом, по многим причинам, включая приведенные выше причины, существует потребность в новых пестицидах.
ОПРЕДЕЛЕНИЯ
Примеры, представленные в определениях, как правило, не являются исчерпывающими и не должны истолковываться как ограничивающие изобретение, раскрытое в настоящем документе. Следует понимать, что заместитель должен соответствовать правилам химического связывания и стерическим ограничениям на совместимость в отношении конкретной молекулы, к которой он присоединен.
«Алкенил» означает ациклический ненасыщенный (по меньшей мере, одна двойная углерод-углеродная связь) разветвленный или неразветвленный заместитель, состоящий из углерода и водорода, например, винил, аллил, бутенил, пентенил и гексенил.
«Алкенилокси» означает алкенил, дополнительно содержащий простую углерод-кислородную связь, например, аллилокси, бутенилокси, пентенилокси, гексенилокси.
«Алкокси» означает алкил, дополнительно содержащий простую углерод-кислородную связь, например, метокси, этокси, пропокси, изопропокси, бутокси, изобутокси и трет-бутокси.
«Алкил» означает ациклический насыщенный разветвленный или неразветвленный заместитель, состоящий из углерода и водорода, например, метил, этил, (C3)алкил, который представляет собой н-пропил и изопропил, (C4)алкил, который представляет собой н-бутил, втор-бутил, изобутил и трет-бутил.
«Алкинил» означает ациклический ненасыщенный (по меньшей мере, одна тройная углерод-углеродная связь) разветвленный или неразветвленный заместитель, состоящий из углерода и водорода, например, этинил, пропаргил, бутинил и пентинил.
«Алкинилокси» означает алкинил, дополнительно содержащий простую углерод-кислородную связь, например, пентинилокси, гексинилокси, гептинилокси и октинилокси.
«Арил» означает циклический ароматический заместитель, состоящий из водорода и углерода, например, фенил, нафтил и бифенил.
«(Cx-Cy)», где подстрочные индексы «x» и «y» представляют собой целые числа, такие как 1, 2 или 3, означает диапазон атомов углерода для каждого отдельного заместителя, например, (C1-C4)алкил означает метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил и трет-бутил.
«Циклоалкенил» означает моноциклический или полициклический ненасыщенный (по меньшей мере, одна двойная углерод-углеродная связь) заместитель, состоящий из углерода и водорода, например, циклобутенил, циклопентенил, циклогексенил, норборненил, бицикло[2.2.2]октенил, тетрагидронафтил, гексагидронафтил и октагидронафтил.
«Циклоалкенилокси» означает циклоалкенил, дополнительно содержащий простую углерод-кислородную связь, например, циклобутенилокси, циклопентенилокси, норборненилокси и бицикло[2.2.2]октенилокси.
«Циклоалкил» означает моноциклический или полициклический насыщенный заместитель, состоящий из углерода и водорода, например, циклопропил, циклобутил, циклопентил, норборнил, бицикло[2.2.2]октил и декагидронафтил.
«Циклоалкокси» означает циклоалкил, дополнительно содержащий простую углерод-кислородную связь, например, циклопропилокси, циклобутилокси, циклопентилокси, норборнилокси и бицикло[2.2.2]октилокси.
«Галоген» означает фтор, хлор, бром и йод.
«Галогеналкокси» означает алкокси, дополнительно содержащий от одного до максимально возможного числа одинаковых или различных атомов галогена, например, фторметокси, трифторметокси, 2,2-дифторпропокси, хлорметокси, трихлорметокси, 1,1,2,2-тетрафторэтокси и пентафторэтокси.
«Галогеналкил» означает алкил, дополнительно содержащий от одного до максимально возможного числа одинаковых или различных атомов галогена, например, фторметил, трифторметил, 2,2-дифторпропил, хлорметил, трихлорметил и 1,1,2,2-тетрафторэтил.
«Гетероциклил» означает циклический заместитель, который может быть полностью насыщенным, частично ненасыщенным или полностью ненасыщенным, где циклическая структура содержит, по меньшей мере, один атом углерода и, по меньшей мере, один гетероатом, причем указанный гетероатом представляет собой азот, серу или кислород. В случае серы этот атом может быть в других степенях окисления, таких как сульфоксид и сульфон. Примеры ароматических гетероциклилов включают без ограничения бензофуранил, бензоизотиазолил, бензоизоксазолил, бензоксазолил, бензотиенил, бензотиазолил, циннолинил, фуранил, имидазолил, индазолил, индолил, изоиндолил, изохинолинил, изотиазолил, изоксазолил, оксадиазолил, оксазолинил, оксазолил, фталазинил, пиразинил, пиразолинил, пиразолил, пиридазинил, пиридил, пиримидинил, пирролил, хиназолинил, хинолинил, хиноксалинил, тетразолил, тиазолинил, тиазолил, тиенил, триазинил и триазолил. Примеры полностью насыщенных гетероциклилов включают без ограничения пиперазинил, пиперидинил, морфолинил, пирролидинил, оксетанил, тетрагидрофуранил, тетрагидротиенил и тетрагидропиранил. Примеры частично ненасыщенных гетероциклилов включают без ограничения 1,2,3,4-тетрагидрохинолинил, 4,5-дигидрооксазолил, 4,5-дигидро-1H-пиразолил, 4,5-дигидроизоксазолил и 2,3-дигидро-[1,3,4]-оксадиазолил. Дополнительные примеры включают следующие:
ПОДРОБНОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
В настоящем документе раскрыты молекулы следующей формулы («формула 1»):
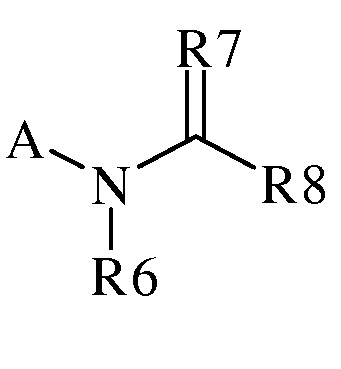 ,
,
где:
(a) A представляет собой либо
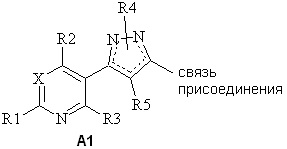 ,
,
либо
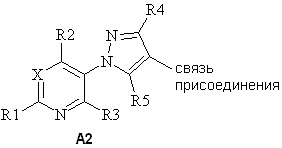 ;
;
(b) R1 представляет собой H, F, Cl, Br, I, CN, NO2, замещенный или незамещенный C1-C6алкил, замещенный или незамещенный C2-C6алкенил, замещенный или незамещенный C1-C6алкокси, замещенный или незамещенный C2-C6алкенилокси, замещенный или незамещенный C3-C10циклоалкил, замещенный или незамещенный C3-C10циклоалкенил, замещенный или незамещенный C6-C20арил, замещенный или незамещенный C1-C20гетероциклил, OR9, C(=X1)R9, C(=X1)OR9, C(=X1)N(R9)2, N(R9)2, N(R9)C(=X1)R9, S(O)nR9, S(O)nOR9, S(O)nN(R9)2 или R9S(O)nR9,
где каждый упомянутый R1, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-C6алкила, C2-C6алкенила, C1-C6галогеналкила, C2-C6галогеналкенила, C1-C6галогеналкилокси, C2-C6галогеналкенилокси, C3-C10циклоалкила, C3-C10циклоалкенила, C3-C10галогенциклоалкила, C3-C10галогенциклоалкенила, OR9, S(O)nOR9, C6-C20арила или C1-C20гетероциклила (каждый из которых, возможный к замещению, может быть необязательно замещен R9);
(c) R2 представляет собой H, F, Cl, Br, I, CN, NO2, замещенный или незамещенный C1-C6алкил, замещенный или незамещенный C2-C6алкенил, замещенный или незамещенный C1-C6алкокси, замещенный или незамещенный C2-C6алкенилокси, замещенный или незамещенный C3-C10циклоалкил, замещенный или незамещенный C3-C10циклоалкенил, замещенный или незамещенный C6-C20арил, замещенный или незамещенный C1-C20гетероциклил, OR9, C(=X1)R9, C(=X1)OR9, C(=X1)N(R9)2, N(R9)2, N(R9)C(=X1)R9, SR9, S(O)nOR9 или R9S(O)nR9,
где каждый упомянутый R2, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-C6алкила, C2-C6алкенила, C1-C6галогеналкила, C2-C6галогеналкенила, C1-C6галогеналкилокси, C2-C6галогеналкенилокси, C3-C10циклоалкила, C3-C10циклоалкенила, C3-C10галогенциклоалкила, C3-C10галогенциклоалкенила, OR9, S(O)nOR9, C6-C20арила или C1-C20гетероциклила (каждый из которых, возможный к замещению, может быть необязательно замещен R9);
(d) R3 представляет собой H, F, Cl, Br, I, CN, NO2, замещенный или незамещенный C1-C6алкил, замещенный или незамещенный C2-C6алкенил, замещенный или незамещенный C1-C6алкокси, замещенный или незамещенный C2-C6алкенилокси, замещенный или незамещенный C3-C10циклоалкил, замещенный или незамещенный C3-C10циклоалкенил, замещенный или незамещенный C6-C20арил, замещенный или незамещенный C1-C20гетероциклил, OR9, C(=X1)R9, C(=X1)OR9, C(=X1)N(R9)2, N(R9)2, N(R9)C(=X1)R9, SR9, S(O)nOR9 или R9S(O)nR9,
где каждый упомянутый R3, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-C6алкила, C2-C6алкенила, C1-C6галогеналкила, C2-C6галогеналкенила, C1-C6галогеналкилокси, C2-C6галогеналкенилокси, C3-C10циклоалкила, C3-C10циклоалкенила, C3-C10галогенциклоалкила, C3-C10галогенциклоалкенила, OR9, S(O)nOR9, C6-C20арила или C1-C20гетероциклила (каждый из которых, возможный к замещению, может быть необязательно замещен R9);
(e) если A представляет собой
(1) A1, то A1 представляет собой либо
(a) A11
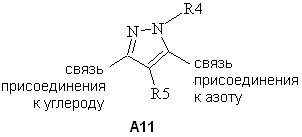 ,
,
где R4 представляет собой H, NO2, замещенный или незамещенный C1-C6алкил, замещенный или незамещенный C2-C6алкенил, замещенный или незамещенный C1-C6алкокси, замещенный или незамещенный C3-C10циклоалкил, замещенный или незамещенный C3-C10циклоалкенил, замещенный или незамещенный C6-C20арил, замещенный или незамещенный C1-C20гетероциклил, C(=X1)R9, C(=X1)OR9, C(=X1)N(R9)2, N(R9)2, N(R9)C(=X1)R9, S(O)nOR9 или R9S(O)nR9,
где каждый упомянутый R4, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-C6алкила, C2-C6алкенила, C1-C6галогеналкила, C2-C6галогеналкенила, C1-C6галогеналкилокси, C2-C6галогеналкенилокси, C3-C10циклоалкила, C3-C10циклоалкенила, C3-C10галогенциклоалкила, C3-C10галогенциклоалкенила, OR9, S(O)nOR9, C6-C20арила или C1-C20гетероциклила (каждый из которых, возможный к замещению, может быть необязательно замещен R9), либо
(b) A12
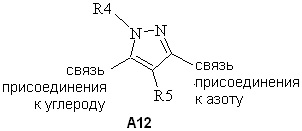 ,
,
где R4 представляет собой C1-C6алкил,
(2) A2, то R4 представляет собой H, F, Cl, Br, I, CN, NO2, замещенный или незамещенный C1-C6алкил, замещенный или незамещенный C2-C6алкенил, замещенный или незамещенный C1-C6алкокси, замещенный или незамещенный C2-C6алкенилокси, замещенный или незамещенный C3-C10циклоалкил, замещенный или незамещенный C3-C10циклоалкенил, замещенный или незамещенный C6-C20арил, замещенный или незамещенный C1-C20гетероциклил, OR9, C(=X1)R9, C(=X1)OR9, C(=X1)N(R9)2, N(R9)2, N(R9)C(=X1)R9, SR9, S(O)nOR9 или R9S(O)nR9,
где каждый упомянутый R4, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-C6алкила, C2-C6алкенила, C1-C6галогеналкила, C2-C6галогеналкенила, C1-C6галогеналкилокси, C2-C6галогеналкенилокси, C3-C10циклоалкила, C3-C10циклоалкенила, C3-C10галогенциклоалкила, C3-C10галогенциклоалкенила, OR9, S(O)nOR9, C6-C20арила или C1-C20гетероциклила (каждый из которых, возможный к замещению, может быть необязательно замещен R9);
(f) R5 представляет собой H, F, Cl, Br, I, CN, NO2, замещенный или незамещенный C1-C6алкил, замещенный или незамещенный C2-C6алкенил, замещенный или незамещенный C1-C6алкокси, замещенный или незамещенный C2-C6алкенилокси, замещенный или незамещенный C3-C10циклоалкил, замещенный или незамещенный C3-C10циклоалкенил, замещенный или незамещенный C6-C20арил, OR9, C(=X1)R9, C(=X1)OR9, C(=X1)N(R9)2, N(R9)2, N(R9)C(=X1)R9, SR9, S(O)nOR9 или R9S(O)nR9,
где каждый упомянутый R5, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-C6алкила, C2-C6алкенила, C1-C6галогеналкила, C2-C6галогеналкенила, C1-C6галогеналкилокси, C2-C6галогеналкенилокси, C3-C10циклоалкила, C3-C10циклоалкенила, C3-C10галогенциклоалкила, C3-C10галогенциклоалкенила, OR9, S(O)nOR9 или C6-C20арила (каждый из которых, возможный к замещению, может быть необязательно замещен R9);
(g)
(1) если A представляет собой A1, то R6 представляет собой R11, замещенный или незамещенный C1-C6алкил, замещенный или незамещенный C2-C6алкенил, замещенный или незамещенный C1-C6алкокси, замещенный или незамещенный C2-C6алкенилокси, замещенный или незамещенный C3-C10циклоалкил, замещенный или незамещенный C3-C10циклоалкенил, замещенный или незамещенный C6-C20арил, замещенный или незамещенный C1-C20гетероциклил, OR9, C(=X1)R9, C(=X1)OR9, C(=X1)N(R9)2, N(R9)2, N(R9)C(=X1)R9, SR9, S(O)nOR9, R9S(O)nR9, C1-C6алкилC6-C20арил (где алкил и арил могут быть независимо замещенными или незамещенными), C(=X2)R9, C(=X1)X2R9, R9X2C(=X1)R9, R9X2R9, C(=O)(C1-C6алкил)S(O)n(C1-C6алкил), C(=O)(C1-C6алкил)C(=O)O(C1-C6алкил), (C1-C6алкил)OC(=O)(C6-C20арил), (C1-C6алкил)OC(=O)(C1-C6алкил), C1-C6алкил-(C3-C10циклогалогеналкил) или (C1-C6алкенил)C(=O)O(C1-C6алкил) или R9X2C(=X1)X2R9,
где каждый упомянутый R6 (за исключением R11), который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-C6алкила, C2-C6алкенила, C1-C6галогеналкила, C2-C6галогеналкенила, C1-C6галогеналкилокси, C2-C6галогеналкенилокси, C3-C10циклоалкила, C3-C10циклоалкенила, C3-C10галогенциклоалкила, C3-C10галогенциклоалкенила, OR9, S(O)nOR9, C6-C20арила или C1-C20гетероциклила, R9арила (каждый из которых, возможный к замещению, может быть необязательно замещен R9),
R6 (за исключением R11) и R8 могут быть необязательно соединены в циклическом расположении, причем такое расположение может необязательно содержать в циклической структуре один или несколько гетероатомов, выбранных из O, S или N, соединяющих R6 и R8, и
(2) если A представляет собой A2, то R6 представляет собой R11, H, замещенный или незамещенный C1-C6алкил, замещенный или незамещенный C2-C6алкенил, замещенный или незамещенный C1-C6алкокси, замещенный или незамещенный C2-C6алкенилокси, замещенный или незамещенный C3-C10циклоалкил, замещенный или незамещенный C3-C10циклоалкенил, замещенный или незамещенный C6-C20арил, замещенный или незамещенный C1-C20гетероциклил, OR9, C(=X1)R9, C(=X1)OR9, C(=X1)N(R9)2, N(R9)2, N(R9)C(=X1)R9, SR9, S(O)nOR9, R9S(O)nR9, C1-C6алкилC6-C20арил (где алкил и арил могут быть независимо замещенными или незамещенными), C(=X2)R9, C(=X1)X2R9, R9X2C(=X1)R9, R9X2R9, C(=O)(C1-C6алкил)S(O)n(C1-C6алкил), C(=O)(C1-C6алкил)C(=O)O(C1-C6алкил), (C1-C6алкил)OC(=O)(C6-C20арил), (C1-C6алкил)OC(=O)(C1-C6алкил), C1-C6алкил-(C3-C10циклогалогеналкил) или (C1-C6алкенил)C(=O)O(C1-C6алкил) или R9X2C(=X1)X2R9,
где каждый упомянутый R6 (за исключением R11), который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-C6алкила, C2-C6алкенила, C1-C6галогеналкила, C2-C6галогеналкенила, C1-C6галогеналкилокси, C2-C6галогеналкенилокси, C3-C10циклоалкила, C3-C10циклоалкенила, C3-C10галогенциклоалкила, C3-C10галогенциклоалкенила, OR9, S(O)nOR9, C6-C20арила или C1-C20гетероциклила, R9арила (каждый из которых, возможный к замещению, может быть необязательно замещен R9),
R6 (за исключением R11) и R8 могут быть необязательно соединены в циклическом расположении, причем такое расположение может необязательно содержать в циклической структуре один или несколько гетероатомов, выбранных из O, S или N, соединяющих R6 и R8;
(h) R7 представляет собой O, S, NR9 или NOR9;
(i) R8 представляет собой замещенный или незамещенный C1-C6алкил, замещенный или незамещенный C2-C6алкенил, замещенный или незамещенный C1-C6алкокси, замещенный или незамещенный C2-C6алкенилокси, замещенный или незамещенный C3-C10циклоалкил, замещенный или незамещенный C3-C10циклоалкенил, замещенный или незамещенный C6-C20арил, замещенный или незамещенный C1-C20гетероциклил, OR9, OR9S(O)nR9, C(=X1)R9, C(=X1)OR9, R9C(=X1)OR9, R9X2C(=X1)R9X2R9, C(=X1)N(R9)2, N(R9)2, N(R9)(R9S(O)nR9), N(R9)C(=X1)R9, SR9, S(O)nOR9, R9S(O)nR9 или R9S(O)n(NZ)R9,
где каждый упомянутый R8, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-C6алкила, C2-C6алкенила, C1-C6галогеналкила, C2-C6галогеналкенила, C1-C6галогеналкилокси, C2-C6галогеналкенилокси, C3-C10циклоалкила, C3-C10циклоалкенила, C3-C10галогенциклоалкила, C3-C10галогенциклоалкенила, N(R9)S(O)nR9, оксо, OR9, S(O)nOR9, R9S(O)nR9, S(O)nR9, C6-C20арила или C1-C20гетероциклила (каждый из которых, возможный к замещению, может быть необязательно замещен R9),
в качестве альтернативы, R8 представляет собой R13-S(O)n-R13, где каждый R13 независимо выбирают из замещенного или незамещенного C1-C6алкила, замещенного или незамещенного C2-C6алкенила, замещенного или незамещенного C1-C6алкокси, замещенного или незамещенного C2-C6алкенилокси, замещенного или незамещенного C3-C10циклоалкила, замещенного или незамещенного C3-C10циклоалкенила, замещенного или незамещенного C6-C20арила, замещенного или незамещенного C1-C20гетероциклила, замещенного или незамещенного S(O)nC1-C6алкила, замещенного или незамещенного N(C1-C6алкил)2, где каждый упомянутый замещенный алкил, замещенный алкенил, замещенный алкокси, замещенный алкенилокси, замещенный циклоалкил, замещенный циклоалкенил, замещенный арил, замещенный гетероциклил содержит один или несколько заместителей, независимо выбранных из F, Cl, Br, I, CN, NO2, C1-C6алкила, C2-C6алкенила, C1-C6галогеналкила, C2-C6галогеналкенила, C1-C6галогеналкилокси, C2-C6галогеналкенилокси, C3-C10циклоалкила, C3-C10циклоалкенила, C3-C10галогенциклоалкила, C3-C10галогенциклоалкенила, OC1-C6алкила, OC1-C6галогеналкила, S(O)nC1-C6алкила, S(O)nOC1-C6алкила, C6-C20арила или C1-C20гетероциклила, C2-C6алкинила, C1-C6алкокси, N(R9)S(O)nR9, OR9, N(R9)2, R9OR9, R9N(R9)2, R9C(=X1)R9, R9C(=X1)N(R9)2, N(R9)C(=X1)R9, R9N(R9)C(=X1)R9, S(O)nOR9, R9C(=X1)OR9, R9OC(=X1)R9, R9S(O)nR9, S(O)nR9, оксо (каждый из которых, возможный к замещению, может быть необязательно замещен R9);
(j) R9 (каждый независимо) представляет собой H, CN, замещенный или незамещенный C1-C6алкил, замещенный или незамещенный C2-C6алкенил, замещенный или незамещенный C1-C6алкокси, замещенный или незамещенный C2-C6алкенилокси, замещенный или незамещенный C3-C10циклоалкил, замещенный или незамещенный C3-C10циклоалкенил, замещенный или незамещенный C6-C20арил, замещенный или незамещенный C1-C20гетероциклил, замещенный или незамещенный S(O)nC1-C6алкил, замещенный или незамещенный N(C1-C6алкил)2,
где каждый упомянутый R9, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-C6алкила, C2-C6алкенила, C1-C6галогеналкила, C2-C6галогеналкенила, C1-C6галогеналкилокси, C2-C6галогеналкенилокси, C3-C10циклоалкила, C3-C10циклоалкенила, C3-C10галогенциклоалкила, C3-C10галогенциклоалкенила, OC1-C6алкила, OC1-C6галогеналкила, S(O)nC1-C6алкила, S(O)nOC1-C6алкила, C6-C20арила или C1-C20гетероциклила;
(k) n равно 0, 1 или 2;
(l) X представляет собой N или CRn1, где Rn1 представляет собой H, F, Cl, Br, I, CN, NO2, замещенный или незамещенный C1-C6алкил, замещенный или незамещенный C2-C6алкенил, замещенный или незамещенный C1-C6алкокси, замещенный или незамещенный C2-C6алкенилокси, замещенный или незамещенный C3-C10циклоалкил, замещенный или незамещенный C3-C10циклоалкенил, замещенный или незамещенный C6-C20арил, замещенный или незамещенный C1-C20гетероциклил, OR9, C(=X1)R9, C(=X1)OR9, C(=X1)N(R9)2, N(R9)2, N(R9)C(=X1)R9, SR9, S(O)nR9, S(O)nOR9 или R9S(O)nR9,
где каждый упомянутый Rn1, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-C6алкила, C2-C6алкенила, C1-C6галогеналкила, C2-C6галогеналкенила, C1-C6галогеналкилокси, C2-C6галогеналкенилокси, C3-C10циклоалкила, C3-C10циклоалкенила, C3-C10галогенциклоалкила, C3-C10галогенциклоалкенила, OR9, S(O)nOR9, C6-C20арила или C1-C20гетероциклила (каждый из которых, возможный к замещению, может быть необязательно замещен R9);
(m) X1 (каждый независимо) представляет собой O или S;
(n) X2 (каждый независимо) представляет собой O, S, =NR9 или =NOR9;
(o) Z представляет собой CN, NO2, C1-C6алкил(R9), C(=X1)N(R9)2;
(p) R11 представляет собой Q1(C≡C)R12, где Q1 представляет собой связь, замещенный или незамещенный C1-C6алкил, замещенный или незамещенный C2-C6алкенил, замещенный или незамещенный C2-C6алкинил, замещенный или незамещенный C3-C10циклоалкил, замещенный или незамещенный C2-C10циклоалкокси, замещенный или незамещенный C1-C6алкилOR9, замещенный или незамещенный C1-C6алкилS(O)nR9, замещенный или незамещенный C1-C6алкилS(O)n(=NR9), замещенный или незамещенный C1-C6алкилN(R9) (где (C≡C) присоединен связью непосредственно к N), замещенный или незамещенный C1-C6алкилN(R9)2, замещенный или незамещенный C2-C6алкенилокси, замещенный или незамещенный C3-C10циклоалкенил, замещенный или незамещенный C0-C6алкилC(=R7)C0-C6алкилR9, замещенный или незамещенный C0-C6алкилC(=R7)OR9, замещенный или незамещенный C1-C6алкилOC0-C6алкилC(=R7)R9, замещенный или незамещенный C1-C6алкилN(R9)(C(=R7)R9), замещенный или незамещенный C1-C6алкилN(R9)(C(=R7)OR9), замещенный или незамещенный C0-C6алкилC(=R7)C0-C6алкилN(R9) (где (C≡C) присоединен связью непосредственно к N), замещенный или незамещенный C0-C6алкилC(=R7)C0-C6алкилN(R9)2, OR9, S(O)nR9, N(R9)R9, замещенный или незамещенный C6-C20арил, замещенный или незамещенный C1-C20гетероциклил,
где каждый упомянутый Q1, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-C6алкила, C2-C6алкенила, C2-C6алкинила, C1-C6галогеналкила, C2-C6галогеналкенила, C1-C6галогеналкилокси, C2-C6галогеналкенилокси, C3-C10циклоалкила, C3-C10циклоалкенила, C3-C10галогенциклоалкила, C3-C10галогенциклоалкенила, OR9, SR9, S(O)nR9, S(O)nOR9, C6-C20арила или C1-C20гетероциклила, R9арила, C1-C6алкилOR9, C1-C6алкилS(O)nR9 (каждый из которых, возможный к замещению, может быть необязательно замещен R9),
Q1 и R8 могут быть необязательно соединены в циклическом расположении, причем такое расположение может необязательно содержать в циклической структуре один или несколько гетероатомов, выбранных из O, S или N, соединяющих Q1 и R8;
(q) R12 представляет собой Q1 (за исключением случая, когда Q1 представляет собой связь), F, Cl, Br, I, Si(R9)3 (где каждый R9 выбирают независимо) или R9; и
(r) при следующих условиях:
(1) что R6 и R8 оба не могут представлять собой C(=O)CH3,
(2) что если A1 представляет собой A11, то R6 и R8 вместе не образуют конденсированные кольцевые системы,
(3) что R6 и R8 не связаны в циклическом расположении только с -CH2-,
(4) что если A представляет собой A2, то R5 не представляет собой C(=O)OH,
(5) что если A представляет собой A2 и R6 представляет собой H, то R8 не представляет собой -(C1-C6алкил)-O-(замещенный арил), и
(6) что если A представляет собой A2, то R6 не представляет собой -(C1алкил)(замещенный арил).
Согласно другому варианту осуществления настоящего изобретения, A представляет собой A1.
Согласно другому варианту осуществления настоящего изобретения, A представляет собой A2.
Согласно другому варианту осуществления настоящего изобретения, R1 представляет собой H.
Согласно другому варианту осуществления настоящего изобретения, R2 представляет собой H.
Согласно другому варианту осуществления настоящего изобретения, R3 выбирают из H или замещенного или незамещенного C1-C6алкила.
Согласно другому варианту осуществления настоящего изобретения, R3 выбирают из H или CH3.
Согласно другому варианту осуществления настоящего изобретения, если A представляет собой A1, то A1 представляет собой A11.
Согласно другому варианту осуществления настоящего изобретения, если A представляет собой A1 и A1 представляет собой A11, то R4 выбирают из H или замещенного или незамещенного C1-C6алкила, или замещенного или незамещенного C6-C20арила.
Согласно другому варианту осуществления настоящего изобретения, если A представляет собой A1 и A1 представляет собой A11, то R4 выбирают из CH3, CH(CH3)2 или фенила.
Согласно другому варианту осуществления настоящего изобретения, если A представляет собой A1 и A1 представляет собой A12, то R4 представляет собой CH3.
Согласно другому варианту осуществления настоящего изобретения, если A представляет собой A2, то R4 выбирают из H или замещенного или незамещенного C1-C6алкила, замещенного или незамещенного C2-C6алкенила, замещенного или незамещенного C3-C10циклоалкила, замещенного или незамещенного C6-C20арила, где каждый упомянутый R4, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br или I.
Согласно другому варианту осуществления настоящего изобретения, если A представляет собой A2, то R4 представляет собой H или C1-C6алкил.
Согласно другому варианту осуществления настоящего изобретения, если A представляет собой A2, то R4 представляет собой H, CH3, CH2CH3, CH=CH2, циклопропил, CH2Cl, CF3 или фенил.
Согласно другому варианту осуществления настоящего изобретения, если A представляет собой A2, то R4 представляет собой Br или Cl.
Согласно другому варианту осуществления настоящего изобретения, R5 представляет собой H, F, Cl, Br, I или замещенный или незамещенный C1-C6алкил, замещенный или незамещенный C1-C6алкокси.
Согласно другому варианту осуществления настоящего изобретения, R5 представляет собой H, OCH2CH3, F, Cl, Br или CH3.
Согласно другому варианту осуществления настоящего изобретения, если A представляет собой A1, то R6 представляет собой замещенный или незамещенный C1-C6алкил.
Согласно другому варианту осуществления настоящего изобретения, если A представляет собой A2, то R6 выбирают из замещенного или незамещенного C1-C6алкила, замещенного или незамещенного C2-C6алкенила, замещенного или незамещенного C3-C10циклоалкила, C(=X1)R9, C(=X1)X2R9, R9X2R9, C(=O)(C1-C6алкил)S(O)n(C1-C6алкил), (C1-C6алкил)OC(=O)(C6-C20арил), (C1-C6алкил)OC(=O)(C1-C6алкил) или R9X2C(=X1)X2R9.
Согласно другому варианту осуществления настоящего изобретения, если A представляет собой A2, то R6 и R8 соединены в циклическом расположении, причем такое расположение может необязательно содержать в циклической структуре один или несколько гетероатомов, выбранных из O, S или N, соединяющих R6 и R8.
Согласно другому варианту осуществления настоящего изобретения, R6 представляет собой C1-C6алкил или C1-C6алкил-фенил.
Согласно другому варианту осуществления настоящего изобретения, R6 представляет собой H, CH3, CH2CH3, CH2CH2CH3, CH(CH3)2, CH2фенил, CH2CH(CH3)2, CH2циклопропил, C(=O)CH2CH2SCH3, C(=O)OC(CH3)3, CH2CH=CH2, C(=O)OCH2CH3, C(=O)CH(CH3)CH2SCH3, циклопропил, CD3, CH2OC(=O)фенил, C(=O)CH3, C(=O)CH(CH3)2, CH2OC(=O)CH(CH3)2, CH2OC(=O)CH3, C(=O)фенил, CH2OCH3, CH2OC(=O)CH2OCH2CH3, CH2CH2OCH3, CH2OC(=O)OCH(CH3)2, CH2CH2OCH2OCH3, CH2CH2OCH3, CH2CH2OC(=O)CH3, CH2CN.
Согласно другому варианту осуществления настоящего изобретения, R6 представляет собой метил или этил.
Согласно другому варианту осуществления настоящего изобретения, R7 представляет собой O или S.
Согласно другому варианту осуществления настоящего изобретения, R8 выбирают из замещенного или незамещенного C1-C6алкила, замещенного или незамещенного C2-C6алкенила, замещенного или незамещенного C3-C10циклоалкила, замещенного или незамещенного C6-C20арила, замещенного или незамещенного C1-C20гетероциклила, R9C(=X1)OR9, SR9, S(O)nOR9, R9S(O)nR9 или R9S(O)n(NZ)R9.
Согласно другому варианту осуществления настоящего изобретения, R8 представляет собой CH(CH3)CH2SCH3, CH(CH3)2, C(CH3)2CH2SCH3, CH2CH2SCH3, CH2CF3, CH2CH2C(=O)OCH3, N(H)(CH2CH2SCH3), OCH2CH2SCH3, CH(CH2SCH3)(CH2фенил), тиазолил, оксазолил, изотиазолил, замещенный фуранил, CH3, C(CH3)3, фенил, CH2CH2OCH3, пиридил, CH2CH(CH3)SCH3, OC(CH3)3, C(CH3)2CH2SCH3, CH(CH3)CH(CH3)SCH3, CH(CH3)CF3, CH2CH2-тиенил, CH(CH3)SCF3,CH2CH2Cl, CH2CH2CH2CF3, CH2CH2S(=O)CH3, CH(CH3)CH2S(=O)CH3, CH2CH2S(=O)2CH3, CH(CH3)CH2S(=O)2CH3, NCH2CH3, N(H)(CH2CH2CH3), C(CH3)=C(H)(CH3), N(H)(CH2CH=CH2), CH2CH(CF3)SCH3, CH(CF3)CH2SCH3, тиэтанил, CH2CH(CF3)2, CH2CH2CF(OCF3)CF3, CH2CH2CF(CF3)CF3, CF(CH3)2, CH(CH3)фенил-Cl, CH(CH3)фенил-F, CH(CH3)фенил-OCF3, CH2N(CH3)(S(=O)2N(CH3)2, CH(CH3)OCH2CH2SCH3, CH(CH3)OCH2CH2OCH3, OCH3, CH(CH3)SCH3, CH2SCH3, N(H)CH3, CH(Br)CH2Br или CH(CH3)CH2SCD3.
Согласно другому, более предпочтительному, варианту осуществления настоящего изобретения, R8 предпочтительно представляет собой R13-S(O)n-R13, где каждый R13 независимо выбирают из замещенного или незамещенного C1-C6алкила, замещенного или незамещенного C2-C6алкенила, замещенного или незамещенного C1-C6алкокси, замещенного или незамещенного C2-C6алкенилокси, замещенного или незамещенного C3-C10циклоалкила, замещенного или незамещенного C3-C10циклоалкенила, замещенного или незамещенного C6-C20арила, замещенного или незамещенного C1-C20гетероциклила, замещенного или незамещенного S(O)nC1-C6алкила, замещенного или незамещенного N(C1-C6алкил)2, где каждый упомянутый замещенный алкил, замещенный алкенил, замещенный алкокси, замещенный алкенилокси, замещенный циклоалкил, замещенный циклоалкенил, замещенный арил, замещенный гетероциклил содержит один или несколько заместителей, независимо выбранных из F, Cl, Br, I, CN, NO2, C1-C6алкила, C2-C6алкенила, C1-C6галогеналкила, C2-C6галогеналкенила, C1-C6галогеналкилокси, C2-C6галогеналкенилокси, C3-C10циклоалкила, C3-C10циклоалкенила, C3-C10галогенциклоалкила, C3-C10галогенциклоалкенила, OC1-C6алкила, OC1-C6галогеналкила, S(O)nC1-C6алкила, S(O)nOC1-C6алкила, C6-C20арила или C1-C20гетероциклила, C2-C6алкинила, C1-C6алкокси, N(R9)S(O)nR9, OR9, N(R9)2, R9OR9, R9N(R9)2, R9C(=X1)R9, R9C(=X1)N(R9)2, N(R9)C(=X1)R9, R9N(R9)C(=X1)R9, S(O)nOR9, R9C(=X1)OR9, R9OC(=X1)R9, R9S(O)nR9, S(O)nR9, оксо (каждый из которых, возможный к замещению, может быть необязательно замещен R9).
Согласно другому варианту осуществления настоящего изобретения, R8 представляет собой (замещенный или незамещенный C1-C6алкил)-S(O)n-(замещенный или незамещенный C1-C6алкил), где упомянутые заместители на упомянутых замещенных алкилах независимо выбирают из F, Cl, Br, I, CN, NO2, C1-C6алкила, C2-C6алкенила, C1-C6галогеналкила, C2-C6галогеналкенила, C1-C6галогеналкилокси, C2-C6галогеналкенилокси, C3-C10циклоалкила, C3-C10циклоалкенила, C3-C10галогенциклоалкила, C3-C10галогенциклоалкенила, OC1-C6алкила, OC1-C6галогеналкила, S(O)nC1-C6алкила, S(O)nOC1-C6алкила, C6-C20арила или C1-C20гетероциклила, C2-C6алкинила, C1-C6алкокси, N(R9)S(O)nR9, OR9, N(R9)2, R9OR9, R9N(R9)2, R9C(=X1)R9, R9C(=X1)N(R9)2, N(R9)C(=X1)R9, R9N(R9)C(=X1)R9, S(O)nOR9, R9C(=X1)OR9, R9OC(=X1)R9, R9S(O)nR9, S(O)nR9, оксо (каждый из которых, возможный к замещению, может быть необязательно замещен R9).
Согласно другому варианту осуществления настоящего изобретения, R8 выбирают из CH(CH3)SCH2CF3, CH2CH2SCH2CF3, CH2SCH2CF3, CH2SCHClCF3, CH(CH2CH3)SCH2CF3, CH(CH3)SCH2CHF2, CH(CH3)SCH2CH2F, CH2CH2SCH2CH2F, CH(CH3)S(=O)2CH2CF3, CH(CH3)S(=O)CH2CF3, CH(CH3)CH2SCF3, CH(CH3)CH2SCF3,CH(CH3)SCH2CH2CF3 и CH2CH2SCH2CH2CF3.
Согласно другому варианту осуществления настоящего изобретения, R8 представляет собой (замещенный или незамещенный C1-C6алкил)-S(O)n-(замещенный или незамещенный C1-C6алкил)-(замещенный или незамещенный C3-C10циклоалкил), где упомянутые заместители на упомянутых замещенных алкилах и упомянутых замещенных циклоалкилах независимо выбирают из F, Cl, Br, I, CN, NO2, C1-C6алкила, C2-C6алкенила, C1-C6галогеналкила, C2-C6галогеналкенила, C1-C6галогеналкилокси, C2-C6галогеналкенилокси, C3-C10циклоалкила, C3-C10циклоалкенила, C3-C10галогенциклоалкила, C3-C10галогенциклоалкенила, OC1-C6алкила, OC1-C6галогеналкила, S(O)nC1-C6алкила, S(O)nOC1-C6алкила, C6-C20арила или C1-C20гетероциклила, C2-C6алкинила, C1-C6алкокси, N(R9)S(O)nR9, OR9, N(R9)2, R9OR9, R9N(R9)2, R9C(=X1)R9, R9C(=X1)N(R9)2, N(R9)C(=X1)R9, R9N(R9)C(=X1)R9, S(O)nOR9, R9C(=X1)OR9, R9OC(=X1)R9, R9S(O)nR9, S(O)nR9, оксо (каждый из которых, возможный к замещению, может быть необязательно замещен R9).
Согласно другому варианту осуществления настоящего изобретения, R8 выбирают из CH(CH3)CH2SCH2(2,2-дифторциклопропил), CH2CH2SCH2(2,2-дифторциклопропил), CH2CH2S(=O)CH2(2,2-дифторциклопропил), CH2CH2S(=O)2CH2CH2(2,2-дифторциклопропил) и CH2CH(CF3)SCH2(2,2-дифторциклопропил).
Согласно другому варианту осуществления настоящего изобретения, R8 представляет собой (замещенный или незамещенный C1-C6алкил)-S(O)n-(замещенный или незамещенный C2-C6алкенил), где упомянутые заместители на упомянутых замещенных алкилах и упомянутых замещенных алкенилах независимо выбирают из F, Cl, Br, I, CN, NO2, C1-C6алкила, C2-C6алкенила, C1-C6галогеналкила, C2-C6галогеналкенила, C1-C6галогеналкилокси, C2-C6галогеналкенилокси, C3-C10циклоалкила, C3-C10циклоалкенила, C3-C10галогенциклоалкила, C3-C10галогенциклоалкенила, OC1-C6алкила, OC1-C6галогеналкила, S(O)nC1-C6алкила, S(O)nOC1-C6алкила, C6-C20арила или C1-C20гетероциклила, C2-C6алкинила, C1-C6алкокси, N(R9)S(O)nR9, OR9, N(R9)2, R9OR9, R9N(R9)2, R9C(=X1)R9, R9C(=X1)N(R9)2, N(R9)C(=X1)R9, R9N(R9)C(=X1)R9, S(O)nOR9, R9C(=X1)OR9, R9OC(=X1)R9, R9S(O)nR9, S(O)nR9, оксо (каждый из которых, возможный к замещению, может быть необязательно замещен R9).
Согласно другому варианту осуществления настоящего изобретения, R8 выбирают из CH2CH2SCH2CH=CCl2, CH2SCH2CH=CCl2, CH(CH3)SCH2CH=CCl2, CH(CH3)SCH=CHF, CH2CH2S(=O)CH2CH2CF3 и CH2CH2S(=O)2CH2CH2CF3.
Согласно другому варианту осуществления настоящего изобретения, X представляет собой CRn1, где Rn1 представляет собой H или галоген.
Согласно другому варианту осуществления настоящего изобретения, X представляет собой CRn1, где Rn1 представляет собой H или F.
Согласно другому варианту осуществления настоящего изобретения, X1 представляет собой O.
Согласно другому варианту осуществления настоящего изобретения, X2 представляет собой O.
Согласно другому варианту осуществления настоящего изобретения, R11 представляет собой замещенный или незамещенный C1-C6алкилC≡CR12.
Согласно другому варианту осуществления настоящего изобретения, R11 представляет собой CH2C≡CH.
Молекулы формулы 1, как правило, будут характеризоваться молекулярной массой от приблизительно 100 дальтон до приблизительно 1200 дальтон. Однако, как правило, предпочтительно, если молекулярная масса составляет от приблизительно 120 дальтон до приблизительно 900 дальтон, и, как правило, еще более предпочтительно, если молекулярная масса составляет от приблизительно 140 дальтон до приблизительно 600 дальтон.
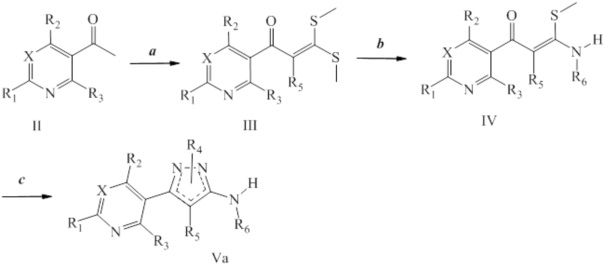
На последующих схемах проиллюстрированы подходы к получению аминопиразолов. На стадии a схемы I путем обработки 3-ацетопиридина или 5-ацетопиримидина формулы II, где значения R1, R2, R3 и X определены выше, сернистым углеродом и йодметаном в присутствии основания, такого как гидрид натрия, и в растворителе, таком как диметилсульфоксид, получают соединение формулы III. На стадии b схемы I соединение формулы III может быть обработано амином или амингидрохлоридом в присутствии основания, такого как триэтиламин, в растворителе, таком как этиловый спирт, с получением соединения формулы IV, где значения R1, R2, R3, R6 и X определены выше. Соединение формулы IV может быть преобразовано в аминопиразол формулы Va, где R5=H, как представлено на стадии c схемы I и в Peruncheralathan, S. et al. J. Org. Chem. 2005, 70, 9644-9647, путем осуществления взаимодействия с гидразином, таким как метилгидразин, в полярном протонном растворителе, таком как этиловый спирт.
Схема I
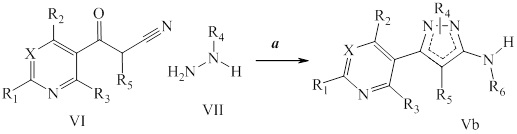
Другой подход к получению аминопиразолов проиллюстрирован на схеме II. На стадии a нитрил формулы VI, где значения X, R1, R2 и R3 определены выше и R5 представляет собой водород, конденсируют, как представлено в Dhananjay, B. Kendre et al. J. Het Chem 2008, 45, (5), 1281-86, с гидразином формулы VII, таким как метилгидразин, с получением смеси аминопиразолов формулы Vb, где R5 и R6=H, причем оба этих компонента выделяют.
Схема II
Получение аминопиразолов, например, формулы XIIa, представлено на схеме III. Соединение формулы X, представленное на стадии a и в Cristau, Henri-Jean et al. Eur. J. Org. Chem. 2004, 695-709, может быть получено путем N-арилирования пиразола формулы IX подходящим арилгалогенидом формулы VIIIa, где Q представляет собой бром, в присутствии основания, такого как карбонат цезия, медного катализатора, такого как оксид меди(II), и лиганда, такого как салицилальдоксим, в полярном апротонном растворителе, таком как ацетонитрил. Соединения формулы IX, представленные на схеме III, где R4=Cl и R5=H, могут быть получены, как представлено в Pelcman, B. et al, WO2007/045868 A1. Путем нитрования пиридилпиразола формулы X, представленного на стадии b схемы III и в Khan, Misbanul Ain et al. J. Heterocyclic Chem. 1981, 18, 9-14, путем осуществления взаимодействия с азотной кислотой и серной кислотой получают соединения формулы XIa. Путем восстановления функциональной нитрогруппы соединений формулы XIa в присутствии водорода с катализатором, таким как 5% Pd/C, в полярном апротонном растворителе, таком как тетрагидрофуран, получают амин формулы XIIa, как представлено на стадии c схемы III. Путем восстановления функциональной нитрогруппы соединений формулы XIa, где значения R1, R2, R3, R4 и X определены выше и R5=H, в присутствии водорода с катализатором, таким как 10% Pd/C, в полярном протонном растворителе, таком как этанол, получают амин формулы XIIa, где R5=H, а также амин формулы XIIa, где R5=OEt, как представлено на стадии d схемы III. Соединения формулы XIa, где значения R1, R2, R3, R5 и X определены выше и R4=Cl, могут быть восстановлены в присутствии восстановителя, такого как железо, в смеси полярных растворителей, таких как уксусная кислота, вода и этанол, с получением аминов формулы XIIa, где значения R1, R2, R3, R5 и X определены выше и R4=Cl, как представлено на стадии e схемы III. Соединения формулы XIa, где значения R1, R2, R3, R5 и X определены выше и R4=Cl, могут быть оставлены для осуществления взаимодействия в условиях сочетания по Судзуки с бороновой кислотой, такой как фенилбороновая кислота, в присутствии катализатора, такого как тетракиспалладий, основания, такого как 2M водный карбонат калия, и в системе смеси растворителей, таких как этанол и толуол, с получением пиразолов с перекрестными связями формулы XIb, как представлено на стадии f схемы III.
Схема III
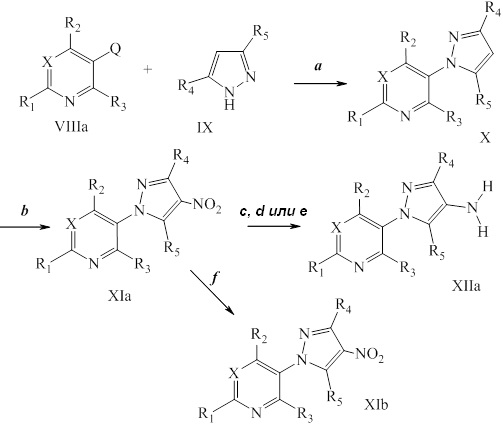
На стадии a схемы IV соединения формулы XIIb могут быть обработаны триэтилортоформиатом и кислотой, такой как трифторуксусная кислота. Путем последовательного добавления восстановителя, такого как боргидрид натрия, в полярном протонном растворителе, таком как этанол, получают соединение формулы XIIIa, где R6=метил.
На стадии b схемы IV соединение формулы XIIb может быть обработано ацетоном в растворителе, таком как изопропилацетат, кислотой, такой как трифторуксусная кислота, и триацетоксиборгидридом натрия с получением соединений формулы XIIIa, где R6=изопропил.
На стадии c схемы IV соединения формулы XIIb могут быть ацилированы хлорангидридом, таким как ацетилхлорид, в полярном апротонном растворителе, таком как дихлорметан, в условиях, описанных на схеме V. Путем восстановления амида восстановителем, таким как алюмогидрид лития, в полярном апротонном растворителе, таком как тетрагидрофуран, получают соединения формулы XIIIa, где R6=этил.
В качестве альтернативы, на стадии d схемы IV соединения формулы XIIb могут быть обработаны бензотриазолом и альдегидом в этаноле с последующим восстановлением с применением, например, боргидрида натрия, с получением соединений формулы XIIIa. На стадии e схемы IV соединения формулы XIIb могут быть обработаны альдегидом, таким как пропиональдегид, и триацетоксиборгидридом натрия в полярном апротонном растворителе, таком как дихлорметан, с получением соединений формулы XIIIa, где R6=пропил. Как представлено на стадии f, путем ацилирования соединений формулы XIIIa, представленных на схеме IV, в условиях, описанных на схеме IX, получают соединения формулы Ia, где значения R1, R2, R3, R4, R5, R6, R8 и X определены выше.
Схема IV
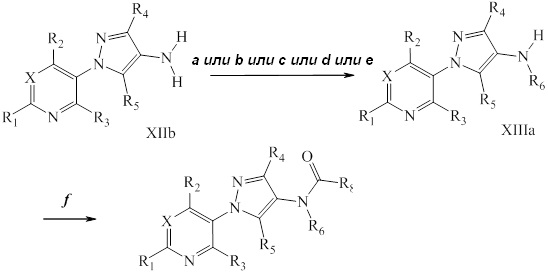
На стадии a схемы V соединения формулы Vc, где значения R1, R2, R3, R4, R5 и R6 и X определены выше, могут быть обработаны хлорангидридом формулы XIV в присутствии основания, такого как триэтиламин или N,N-диметиламинопиридин, в полярном апротонном растворителе, таком как дихлорэтан (DCE), с получением соединений формулы Ib, где значение R8 определено выше. Дополнительно, если R6=H, то 2-амид может быть последовательно алкилирован на стадии b схемы V алкилгалогенидом, таким как йодэтан, в присутствии основания, такого как гидрид натрия, и полярного апротонного растворителя, такого как N,N-диметилформамид (DMF), с получением желаемых соединений формулы Ib. Используемые в представленных реакциях ацилирования хлорангидриды являются или коммерчески доступными, или могут быть синтезированы специалистами в данной области техники.
Схема V
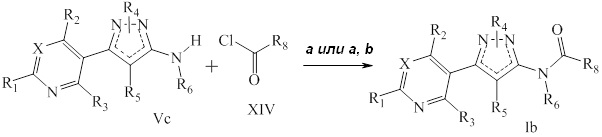
Как представлено на стадии a схемы VI и в Sammelson et al. Bioorg. Med. Chem. 2004, 12, 3345-3355, аминопиразолы формулы Vd, где значения R1, R2, R3, R4, R6 и X определены выше и R5=H, могут быть галогенированы источником галогена, таким как N-хлорсукцинимид или N-бромсукцинимид, в полярном апротонном растворителе, таком как ацетонитрил, с получением R5-замещенного пиразола. На стадии b путем ацилирования такого соединения в описанных на схеме V условиях получают соединение формулы Ic, где значения R1, R2, R3, R4, R5, R6, R8 и X определены выше.
Схема VI
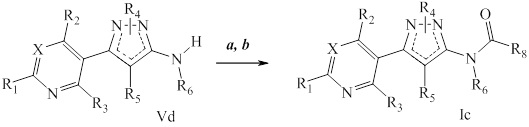
На стадии a схемы VII мочевины и карбаматы получают из аминопиразолов формулы Ve. Соединения формулы Ve, где значения X, R1, R2, R3, R4, R5 и R6 определены выше, оставляют для осуществления взаимодействия с фосгеном с получением промежуточного карбамоилхлорида, который затем обрабатывают амином, как представлено на стадии b, или спиртом, как представлено на стадии c, соответственно, с образованием мочевины формулы Id или карбамата формулы Ie, соответственно, где значение R9 определено выше.
Схема VII
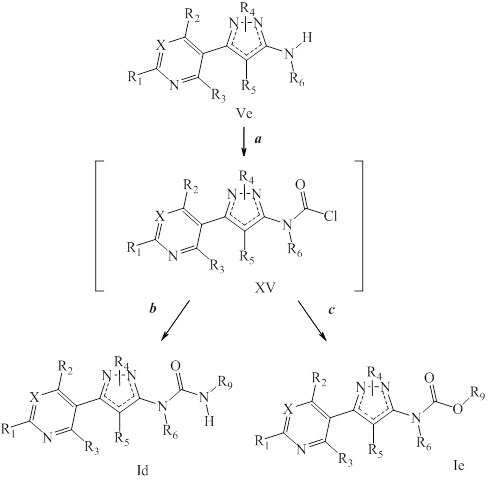
На стадии a схемы VIII соединения формулы XIIc, где значения X, R1, R2, R3, R4 и R5 определены выше, могут быть обработаны ди-трет-бутилдикарбонатом (Boc2O) и основанием, таким как триэтиламин, в полярном апротонном растворителе, таком как дихлорметан (DCM), с получением соединений формулы XVIa. Путем обработки карбаматной функциональной группы алкилгалогенидом, таким как йодметан или Boc-ангидрид, в присутствии основания, такого как гидрид натрия, и в полярном апротонном растворителе, таком как DMF, получают карбаматы формулы XVII, как представлено на стадии b схемы VIII, где значение R6 определено выше, за исключением случая, когда R6 представляет собой водород. Boc-группа может быть удалена в условиях, хорошо известных из уровня техники, например, в кислых условиях, таких как трифторуксусная кислота (TFA), в полярном апротонном растворителе, таком как дихлорметан, с получением соединений формулы XIIIb, как представлено на стадии c.
Схема VIII
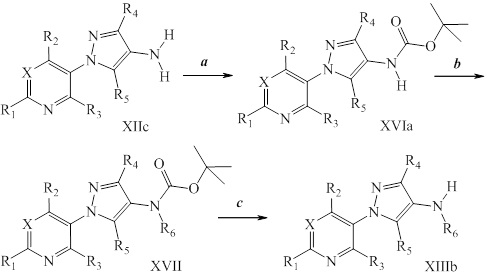
На стадиях a, b и c схемы IX соединения формулы XIIIc, где значения X, R1, R2, R3, R4, R5 и R6 определены выше, могут быть обработаны соединением формулы XVIII, где значения R8 определены выше, и R10 представляет собой или OH, OR9 или O(C=O)OR9, с получением соединений формулы Id. Если R10=OH, то соединения формулы XIIIc могут быть преобразованы в соединения формулы Id в присутствии агента сочетания, такого как 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид (EDC·HCl), и основания, такого как N,N-диметиламинопиридин (DMAP), в полярном апротонном растворителе, таком как дихлорэтан (DCE), как представлено на стадии a. Если R10=OR9, то соединения формулы XIIIc могут быть преобразованы в соединения формулы Id в присутствии 2,3,4,6,7,8-гексагидро-1H-пиримидо[1,2-a]пиримидина в полярном апротонном растворителе, таком как 1,4-диоксан, при повышенной температуре, как представлено на стадии b. Если R10=O(C=O)OR9, то соединения формулы XIIIc могут быть преобразованы в соединения формулы Id в полярном апротонном растворителе, таком как дихлорметан (DCM), как представлено на стадии c. Путем ацилирования амидов формулы Id, если R6=H, хлорангидридом в присутствии основания, такого как диизопропилэтиламин, в полярном апротонном растворителе, таком как дихлорэтан (DCE), получают имиды формулы Ie, как представлено на стадии d. Кроме того, путем алкилирования амидов формулы Id, если R6=H, алкилгалогенидом или алкилсульфонатом в присутствии основания, такого как гидрид натрия, в полярном апротонном растворителе, таком как N,N-диметилформамид (DMF), получают алкилированные амиды формулы Ie, как представлено на стадии e. Путем галогенирования соединений формулы Id, где значения R1, R2, R3, R4, R6, R8 и X определены выше и R5=H, источником галогена, таким как N-бромсукцинимид, в полярном апротонном растворителе, таком как DCE, или источником галогена, таким как N-хлорсукцинимид, в полярном апротонном растворителе, таком как DCE или ацетонитрил, или источником галогена, таким как Selectfluor®, в смеси полярных апротонных растворителей, таких как ацетонитрил и DMF, получают галогенированные пиразолы формулы Ie, где R5=галоген, как представлено на стадии f схемы IX. Амиды формулы Id могут быть преобразованы в тиоамиды формулы If в присутствии тионирующего агента, такого как реагент Лавессона, в полярном апротонном растворителе, таком как дихлорэтан (DCE), как представлено на стадии g.
Схема IX
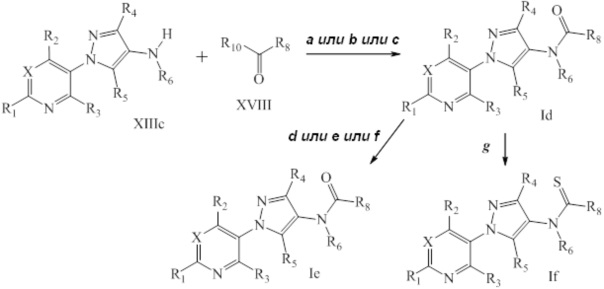
На стадии a схемы X соединения формулы XIIId, где значения X, R1, R2, R3, R4, R5 и R6 определены выше, могут быть обработаны соединениями формулы XIX, где значение R8 определено выше, в полярном апротонном растворителе, таком как дихлорэтан (DCE), с получением соединений формулы XX. Дополнительно, если R6=H и R8 содержит галоген, то соединения формулы XX могут быть обработаны основанием, таким как гидрид натрия, в полярном апротонном растворителе, таком как THF, с получением соединений формулы XXI, где m представляет собой целое число, выбранное из 1, 2, 3, 4, 5 или 6, как представлено на стадии b схемы X.
Схема X
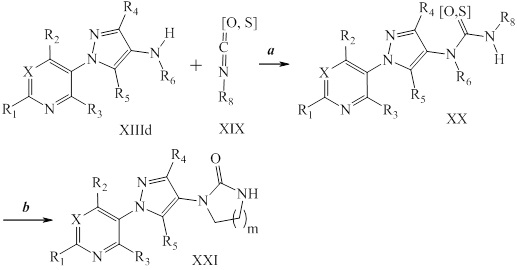
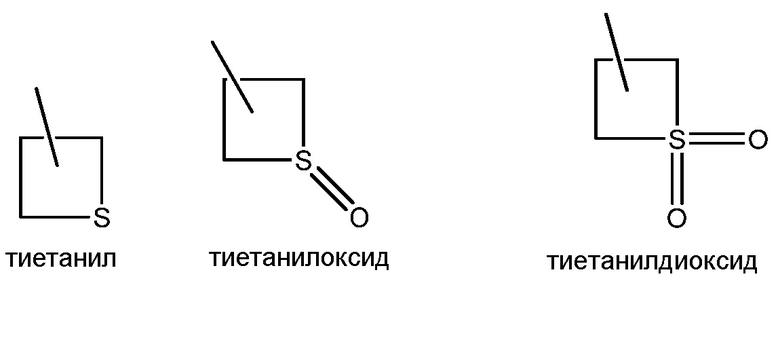
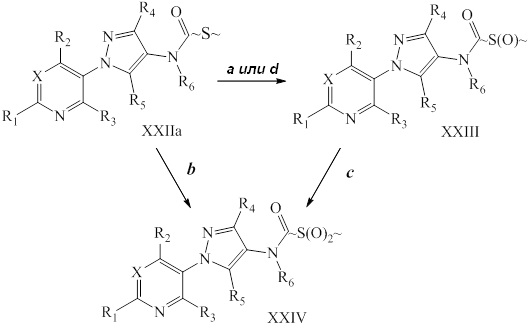
Окисление сульфида до сульфоксида или сульфона проводят, как представлено на схеме XI, где (~S~) может быть определенным выше сульфидом в пределах объема R8 согласно настоящему изобретению. Сульфид формулы XXIIa, где значения X, R1, R2, R3, R4, R5 и R6 определены выше, обрабатывают окислителем, таким как тетрагидрат пербората натрия, в полярном протонном растворителе, таком как ледяная уксусная кислота, с получением сульфоксида формулы XXIII, как представлено на стадии a схемы XI. В качестве альтернативы, сульфид формулы XXIIa может быть окислен окислителем, таким как пероксид водорода, в полярном протонном растворителе, таком как гексафторизопропанол, с получением сульфоксида формулы XXIII, как представлено на стадии d схемы XI. Сульфоксид формулы XXIII может быть дополнительно окислен до сульфона формулы XXIV тетрагидратом пербората натрия в полярном протонном растворителе, таком как ледяная уксусная кислота, как представлено на стадии c схемы XI. В качестве альтернативы, сульфон формулы XXIV может быть получен в одностадийной процедуре из сульфида формулы XXIIa с применением вышеупомянутых условий более чем с 2 эквивалентами тетрагидрата пербората натрия, как представлено на стадии b схемы XI.
Схема XI
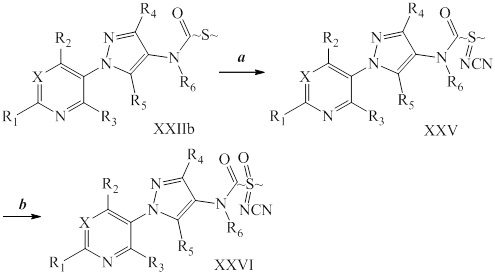
Окисление сульфида до сульфоксимина проводили, как представлено на схеме XII, где (~S~) может быть любым определенным выше сульфидом в пределах объема R8 согласно настоящему изобретению. Сульфид формулы XXIIb, где значения X, R1, R2, R3, R4, R5 и R6 определены выше, окисляли, как представлено на стадии a, йодбензолдиацетатом в присутствии цианамида в полярном апротонном растворителе, таком как метиленхлорид (DCM), с получением сульфилимина формулы XXV. Сульфилимин формулы XXV может быть дополнительно окислен до сульфоксимина формулы XXVI окислителем, таким как мета-хлорпероксибензойная кислота («mCPBA»), в присутствии основания, такого как карбонат калия, в протонном полярном растворителе, таком как этанол и вода, как представлено на стадии b схемы XII.
Схема XII
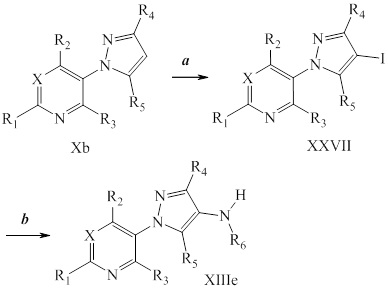
Йодирование пиразола формулы Xb, как представлено на стадии a схемы XIII и в Potapov, A. et al. Russ. J. Org. Chem. 2006, 42, 1368-1373, проводят путем осуществления взаимодействия с йодирующим агентом, таким как йод, в присутствии кислот, таких как йодноватая кислота и серная кислота, в полярном протонном растворителе, таком как уксусная кислота, с получением соединения формулы XXVII. Как представлено на стадии b схемы XIII и в Wang, D. et al. Adv. Synth. Catal. 2009, 351, 1722-1726, аминопиразолы формулы XIIIe могут быть получены из йодпиразолов формулы XXVII посредством реакций кросс-сочетания с соответствующим амином в присутствии основания, такого как карбонат цезия, медного катализатора, такого как бромид меди(I), и лиганда, такого как 1-(5,6,7,8-тетрагидрохинолин-8-ил)этанон, в полярном апротонном растворителе, таком как ДМСО.
Схема XIII
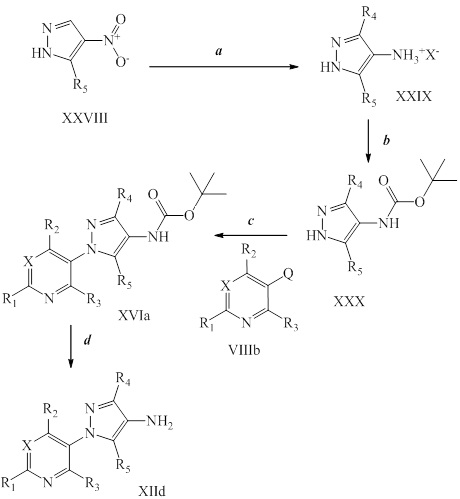
На стадии a схемы XIV соединения формулы XXIX, где R4 представляет собой Cl, R5 представляет собой H и X- представляет собой Cl-, могут быть получены способами, описанными в Acta. Pharm. Suec. 22, 147-156 (1985) Tolf, Bo-Ragnar and Dahlbom, R. По аналогии, соединения формулы XXIX, где R4 представляет собой Br, X- представляет собой Br- и значение R5 определено выше, могут быть получены путем обработки соединений формулы XXVIII газообразным водородом в присутствии металла-катализатора, такого как 5% Pd на оксиде алюминия, и раствора 50% водной HBr в растворителе, таком как этанол. В качестве альтернативы, на стадии a схемы XIV соединения формулы XXIX, где R4 представляет собой Cl или Br, X- представляет собой Cl- или Br- и значение R5 определено выше, могут быть получены путем обработки соединений формулы XXVIII, где значение R5 определено выше, гидросиланом, таким как триэтилсилан, в присутствии металла-катализатора, такого как 5% Pd на оксиде алюминия, и кислоты, такой как HCl или HBr, соответственно, в растворителе, таком как этанол.
На стадии b схемы XIV соединения формулы XXX, где R4 представляет собой Cl или Br и значение R5 определено выше, могут быть получены путем обработки соединений формулы XXIX, где R4 представляет собой Cl или Br, X- представляет собой Cl- или Br- и значение R5 определено выше, ди-трет-бутилдикарбонатом (Boc2O) в присутствии смеси растворителей, таких как THF и вода, и основания, такого как бикарбонат натрия.
На стадии c схемы XIV соединения формулы XVIa, где значения X, R1, R2, R3 и R5 определены выше и R4 представляет собой Cl или Br, предпочтительно Cl, могут быть получены путем обработки соединений формулы XXX, где R4 представляет собой Cl или Br и значение R5 определено выше, предпочтительно H, соединениями формулы VIIIb, где значения X, R1, R2 и R3 определены выше и Q представляет собой йод, в присутствии каталитического количества соли меди, такой как CuCl2, лиганда, такого как производное этан-1,2-диамина, например, N1,N2-диметилэтан-1,2-диамин, и основания, такого как K3PO4, в полярном апротонном растворителе, таком как ацетонитрил, при подходящей температуре.
На стадии c пиразолы формулы XXX сочетают с соединениями формулы VIIIb, предпочтительно с 3-йодпиридином, в присутствии металла-катализатора, такого как CuCl2, и диаминового лиганда, такого как N1,N2-диметилэтан-1,2-диамин, и неорганического основания, такого как K3PO4. Реакцию проводят в полярном апротонном растворителе, таком как ацетонитрил. Реакцию проводят при температуре от приблизительно 60°C до приблизительно 82°C и предпочтительно от приблизительно 75°C до 82°C. Приблизительно, пиразолы формулы XXX и гетероциклильные йодиды формулы VIIIb может использоваться в молярном соотношении 1/1,2, однако, также могут быть использованы молярные соотношения от приблизительно 5/1 до приблизительно 1/5. Реакцию проводят приблизительно при атмосферном давлении, однако, может быть использовано более высокое или более низкое давление.
Boc-группа соединений формулы XVIa может быть удалена в условиях, хорошо известных из области техники, например, в кислых условиях, таких как TFA, в полярном апротонном растворителе, таком как дихлорметан, с получением соединений формулы XIId, как представлено на стадии d схемы XIV.
Схема XIV
Бромпиразолы формулы XXXI, где значения R1, R2, R3, R5, R8 и X определены выше, могут взаимодействовать в условиях сочетания по Судзуки со сложным эфиром бороновой кислоты, таким как сложный пинаколиновый эфир винилбороновой кислоты или сложный пинаколиновый эфир циклопропилбороновой кислоты, в присутствии катализатора, такого как тетракиспалладий, основания, такого как 2M водный карбонат калия, и в смеси растворителей, таких как этанол и толуол, с получением соединений формулы XXXII, как представлено на стадии a схемы XV.
Схема XV
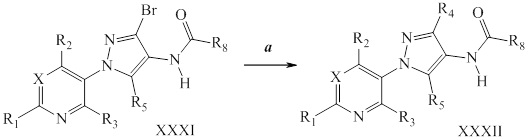
Винильная группа соединений формулы XXXIII, где значения R1, R2, R3, R5, R6, R8 и X определены выше, может быть восстановлена в присутствии водорода с катализатором, таким как 10% Pd/C, в полярном протонном растворителе, таком как метанол, с получением соединений формулы XXXIV, как представлено на стадии a схемы XVI. Путем окисления винильной группы соединений формулы XXXIII с применением окислителя, такого как тетраоксид осмия, в присутствии перйодата натрия в смеси полярного протонного растворителя, такого как вода, и полярного апротонного растворителя, такого как THF, получают соединения формулы XXXV, как представлено на стадии b схемы XVI. Путем восстановления альдегидной группы соединений формулы XXXV, как представлено на стадии c схемы XVI, восстановителем, таким как боргидрид натрия, в полярном протонном растворителе, таком как метанол, получают соответствующий спирт формулы XXXVI. Путем обработки соединений формулы XXXVI хлорирующим агентом, таким как тионилхлорид, в полярном апротонном растворителе, таком как дихлорметан, получают соединения формулы XXXVII, как представлено на стадии d схемы XVI.
Схема XVI
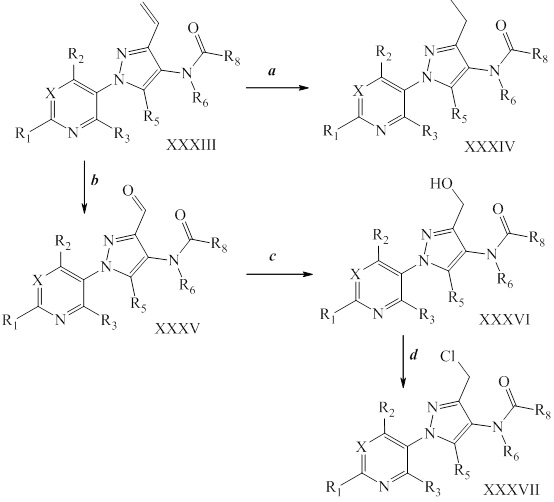
На стадии a схемы XVII α,β-ненасыщенная кислота XXXVIII может быть обработана нуклеофилом, таким как тиометоксид натрия, в полярном протонном растворителе, таком как метанол, с получением кислоты XXXIX.
Схема XVII
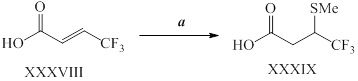
На стадии a схемы XVIII путем обработки соединений формулы Ig, где A представляет собой A2, R7 представляет собой O и R8 представляет собой трет-бутокси, реагентом, таким как пропаргилбромид, в присутствии основания, такого как гидрид натрия, и в полярном апротонном растворителе, таком как DMF, получают соединения формулы Ih, где R6=R11.
Схема XVIII
На стадии a схемы XIX соединения формулы XL, где значения X, R1, R2, R3, R4, R5 и R6 определены выше, могут быть обработаны кислотой формулы XLI, где значение R8 определено выше, в присутствии агента сочетания, такого как 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид (EDC·HCl), и основания, такого как N,N-диметиламинопиридин (DMAP), в полярном апротонном растворителе, таком как дихлорметан (DCM), с получением соединений формулы XLII. На стадии b соединения формулы XLII могут быть обработаны основанием, таким как метоксид натрия, в полярном растворителе, таком как THF, а затем алкилгалогенидом R9-Hal с получением соединений формулы XLIII.
Схема XIX
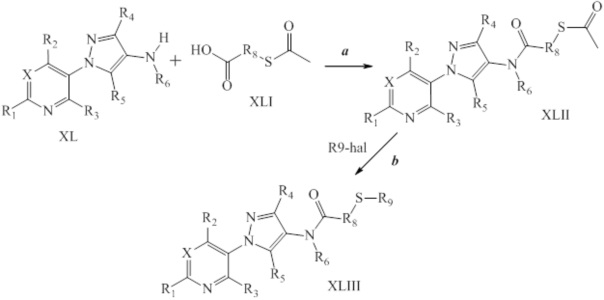
В качестве альтернативы, на стадии a схемы XX соединения формулы XL или соответствующая соль HCl, где значения X, R1, R2, R3, R4, R5 и R6 определены выше, могут быть сочетаны с кислотами формулы XLIV, где значение R8 определено выше, в присутствии агента сочетания, такого как 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид (EDC·HCl), и основания, такого как N,N-диметиламинопиридин, в полярном апротонном растворителе, таком как дихлорметан, с получением соединений формулы XLV, где значения X, R1, R2, R3, R4, R5, R6 и R8 определены выше. На стадии b схемы XX соединения формулы XLV, где значения X, R1, R2, R3, R4, R5, R6 и R8 определены выше и Tr представляет собой тритил (трифенилметил), могут быть обработаны кислотой, такой как 2,2,2-трифторуксусная кислота, в присутствии триалкилсилана, такого как триэтилсилан, в полярном апротонном растворителе, таком как метиленхлорид, с удалением тритильной группы и получением тиолов формулы XLVI, где значения X, R1, R2, R3, R4, R5, R6 и R8 определены выше. На стадии c схемы XX тиолы формулы XLVI, где значения X, R1, R2, R3, R4, R5, R6 и R8 определены выше, могут быть обработаны основанием, таким как гидрид натрия, в полярном апротонном растворителе, таком как тетрагидрофуран, или карбонатом цезия в ацетонитриле, или DBU в диметилформамиде, и электрофилом (R9-Hal), таким как 2-(бромметил)-1,1-дифторциклопропан, в тетрагидрофуране с получением соединений формулы XLVII. В качестве альтернативы, для преобразования XLVI в XLVII могут быть использованы модифицированные условия, описанные Pustovit и сотр. (Synthesis 2010, 7, 1159-1165).
Схема XX
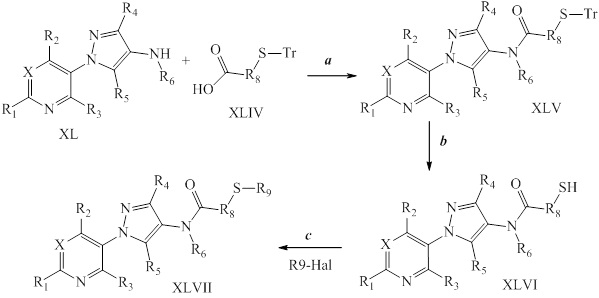
В качестве альтернативы, на стадии a схемы XXI соединения формулы XL или соответствующая соль HCl, где значения X, R1, R2, R3, R4, R5 и R6 определены выше, могут быть сочетаны с кислотами формулы XLVIII, где значение R9 определено выше, в присутствии агента сочетания, такого как EDC·HCl, и основания, такого как DMAP, в полярном апротонном растворителе, таком как DMF, с получением соединений формулы XLIX, где значения X, R1, R2, R3, R4, R5, R6 и R9 определены выше. На стадии b схемы XXI соединения формулы XLIX, где значения X, R1, R2, R3, R4, R5, R6 и R9 определены выше, могут быть обработаны солью тиокислоты, такой как тиоацетат калия, при повышенной температуре (приблизительно 50°C) в растворителе, таком как ДМСО, с получением соединений формулы L, где значения X, R1, R2, R3, R4, R5, R6 и R9 определены выше. На стадии c схемы XXI соединения формулы L, где значения X, R1, R2, R3, R4, R5, R6 и R9 определены выше, могут быть обработаны эквимолярным количеством основания, такого как метоксид натрия, полученного при смешивании гидрида натрия и метанола, а затем электрофилом (R9-галоген), таким как 2-(бромметил)-1,1-дифторциклопропан, в растворителе, таком как тетрагидрофуран, с получением соединений формулы LI.
Схема XXI
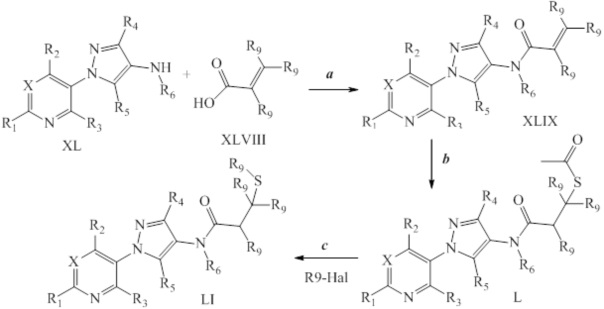
На стадии a схемы XXII соединения формулы XL, где значения X, R1, R2, R3, R4, R5, R6 и галогена определены выше, могут быть обработаны хлорангидридом формулы LII в присутствии основания, такого как триэтиламин или диизопропилэтиламин, в полярном апротонном растворителе, таком как DCE, с получением соединений формулы LIII, где R8 представляет собой замещенную или незамещенную алкильную цепь. На стадии b соединения формулы LIII могут быть обработаны тиоацетатом калия с получением соединений формулы LIV после нагревания (приблизительно 60°C) в полярном апротонном растворителе, таком как ацетон. Как представлено на стадии c, одностадийный метанолизис/алкилирование могут выполняться путем обработки соединений формулы LIV одним эквивалентом основания, такого как метоксид натрия (NaOMe), в полярном апротонном растворителе, таком как тетрагидрофуран (THF). Затем к реакционной смеси может быть добавлен алкилсульфонат или алкилгалогенид, например, 2-йод-1,1,1-трифторэтан, с получением соединений формулы LV, где значение R9 определено выше. На стадии d соединения формулы LV могут быть получены из соединений формулы LIII путем обработки алкилтиолом, таким как 2,2,2-трифторэтантиол, при повышенных температурах (приблизительно 50°C) в полярном апротонном растворителе, таком как THF, в присутствии йодида натрия и основания, такого как диизопропилэтиламин. В качестве альтернативы, на стадии f путем обработки соединений формулы LIII алкилтионом, таким как метантиолят натрия, в полярном апротонном растворителе, таком как ДМСО, при повышенных температурах (приблизительно 50°C) получают соединения формулы LV. Как представлено на стадии e, если соединения формулы LIV обрабатывают двумя или несколькими эквивалентами основания, такого как NaOMe, а затем 1,2,2-тригалогеналкильным соединением, таким как 2-бром-1,1-дифторэтан, то получают соединения формулы LVI.
Схема XXII
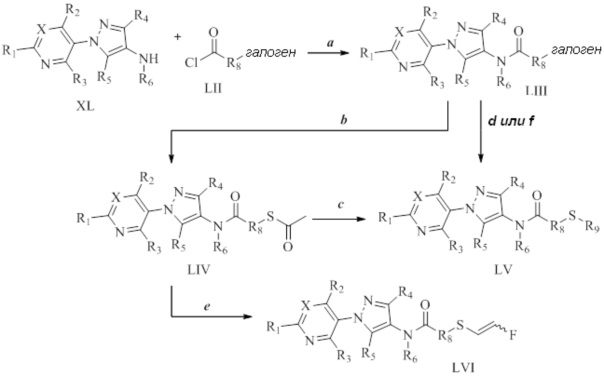
На стадии a схемы 23 соединения формулы 23.1, где значения X, R1, R2, R3, R4, R5, R6 и R8 определены выше, могут быть обработаны основанием, таким как водный 2M гидроксид лития, в полярном протонном растворителе, таком как метанол, с получением соединений формулы 23.2. Затем на стадии b соединения формулы 23.2 могут быть обработаны основанием, таким как гидрид натрия, в полярном апротонном растворителе, таком как тетрагидрофуран, а затем электрофилом, таким как алкилгалогенид или сульфонилгалогенид, с получением соединений формулы 23.3.
Схема 23
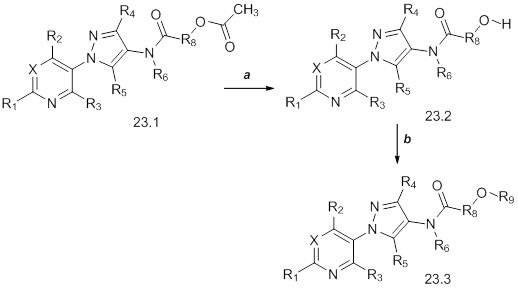
На стадии a схемы 24 соединения формулы 24.1, где значения X, R1, R2, R3, R4, R5, R8 и галогена определены выше и R6=H, могут быть обработаны основанием, таким как гидрид натрия, в полярном апротонном растворителе, таком как тетрагидрофуран (THF), с получением соединений формулы 24.2, где m представляет собой целое число, выбранное из 0, 1, 2, 3, 4, 5 или 6. На стадии b схемы 24 соединения формулы 24.2 могут быть обработаны основанием, таким как триэтиламин, и силилирующими агентами, такими как триметилсилилтрифторметансульфонат и йодид диметилметилиденаммония (соль Эшенмозера), в полярном апротонном растворителе, таком как дихлорметан (DCM), с получением соединений формулы 24.3. На стадии c схемы 24 соединения формулы 24.3 могут быть обработаны основанием, таким как гидроксид калия, и нуклеофилом, таким как S,S-диметилкарбонодитионат, в воде или полярном апротонном растворителе, таком как тетрагидрофуран (THF), с получением соединений формулы 24.4, где значения X, R1, R2, R3, R4, R5, R9 и m определены выше.
Схема 24
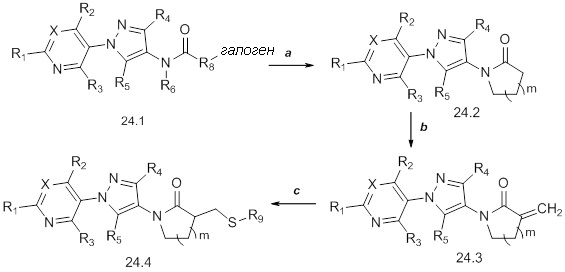
Подход к получению соединений формулы 25.2 описан на схеме 25. Как представлено на стадии a, если соединения формулы 25.1, где значения X, R1, R2, R3, R4, R5, R6 и R8 определены выше, обрабатывают двумя или несколькими эквивалентами основания, такого как метоксид натрия, а затем 1,2-дигалогеналкильным соединением, таким как 1-фтор-2-йодэтан, в растворителе, таком как тетрагидрофуран (THF), то получают соединения формулы 25.2, где значение R9 определено выше.
Схема 25
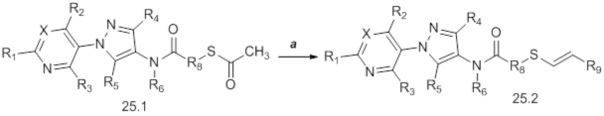
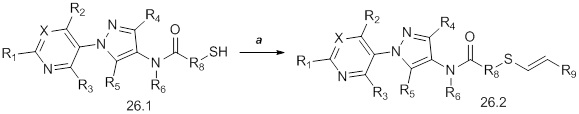
Альтернативный подход к получению винилсульфидов описан на стадии a схемы 26. В этом подходе используют условия, раскрытые Kao and Lee (Org. Lett. 2011, 13, 5204-5207), в которых тиолы формулы 26.1, где значения X, R1, R2, R3, R4, R5, R6 и R8 определены выше, сочетают с винилгалогенидом, таким как (E)-1-бром-3,3,3-трифторпроп-1-ен, в присутствии катализатора, такого как оксид меди(I), основания, такого как гидроксид калия, и растворителя, такого как диоксан, при повышенных температурах с получением продуктов формулы 26.2, где значение R9 определено выше.
Схема 26
На стадии a схемы 27 осуществляют взаимодействие акриламида формулы 27.1, где значения X, R1, R2, R3, R4, R5 и R6 определены выше, с сульфонамидом формулы 27.2, где значение R9 определено выше, в присутствии основания, такого как карбонат калия, при повышенных температурах в полярном апротонном растворителе, таком как диметилформамид (DMF), с получением соединений формулы 27.3. Затем этот продукт обрабатывают основанием, таким как гидрид натрия, и алкилгалогенидом, таким как 2-бромацетонитрил, в полярном апротонном растворителе, таком как тетрагидрофуран (THF), с получением соединений формулы 27.4, как представлено на стадии b.
Схема 27
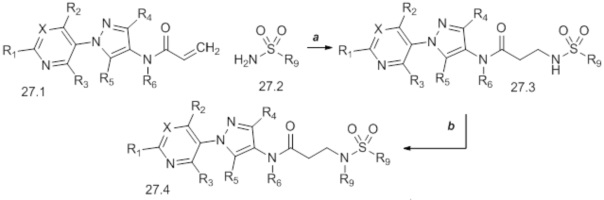
Если соединения формулы 28.1, где значения X, R1, R2, R3, R4, R5, R6, R8 и галогена определены выше, обрабатывают аминами формулы 28.2, где значение R9 определено выше, при повышенных температурах в полярном протонном растворителе, таком как метанол, то могут быть получены соединения формулы 28.3, как представлено на стадии a схемы 28. Соединения формулы 28.3 могут быть обработаны сульфонилхлоридом, таким как метансульфонилхлорид, в присутствии основания, такого как диизопропилэтиламин, и полярного апротонного растворителя, такого как дихлорметан (DCM), с получением продуктов формулы 28.4, как представлено на стадии b. Как представлено на стадии c, если соединения формулы 28.3 обрабатывают алкилгалогенидом, таким как 3-бром-1,1,1-трифторпропан, при повышенных температурах и в присутствии основания, такого как карбонат калия, и полярного апротонного растворителя, такого как диметилформамид (DMF), то могут быть получены соединения формулы 28.5. В качестве альтернативы, соединения формулы 28.3 могут быть получены двухстадийным способом, как описано на стадиях d и e схемы 28. Соединения формулы 28.6 могут быть преобразованы в соединения формулы 28.8 при обработке соединениями формулы 28.7 в присутствии агента сочетания, такого как 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид (EDC·HCl), и основания, такого как N,N-диметиламинопиридин (DMAP), в полярном апротонном растворителе, таком как дихлорэтан (DCE), как представлено на стадии d. Boc-группа может быть удалена в условиях, хорошо известных из области техники, например, в кислых условиях, таких как трифторуксусная кислота (TFA), в полярном апротонном растворителе, таком как дихлорметан, с получением соединений формулы 28.3, как представлено на стадии e.
Схема 28
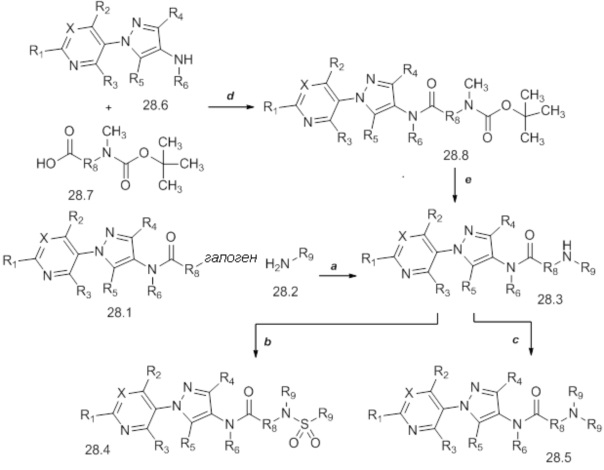
На стадии a схемы 29 соединения формулы 29.1, где значения X, R1, R2, R3, R4, R5, R6 и R8 определены выше, могут взаимодействовать или с циклическим, или с ациклическим еноном, таким как бут-3-ен-2-он, в условиях, описанных Chakraborti (Org. Lett. 2006, 8, 2433-2436), с получением соединений формулы 29.2, где значение R9 определено выше. Затем эти продукты могут быть подвергнуты действию фторирующего реагента, такого как Deoxo-Fluor®, и инициатора, такого как этанол, в полярном апротонном растворителе, таком как дихлорметан (DCM), с получением соединений формулы 29.3, как описано на стадии b.
Схема 29
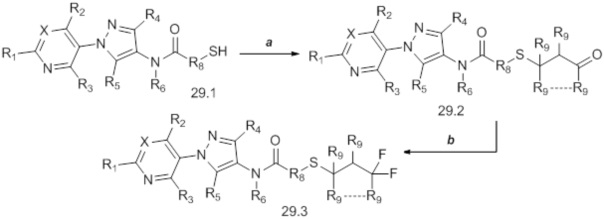
На стадии a схемы 30 представлен гидролиз соединений формулы 30.1, где значения X, R1, R2, R3, R4, R5, R6, R8 и R9 определены выше, путем обработки кислотой, такой как водная соляная кислота, в растворителе, таком как THF, с получением промежуточного альдегида формулы 30.2. Соединения формулы 30.2 могут сразу же взаимодействовать с фторирующим реагентом, таким как Deoxo-Fluor®, в присутствии инициатора, такого как этанол, и растворителя, такого как тетрагидрофуран (THF), с получением продуктов формулы 30.3.
Схема 30
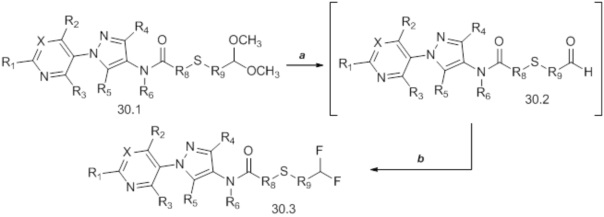
На схеме 31 соединения формулы 31.1, где значение R9 определено выше, преобразуют в соединения формулы 31.2 согласно процедуре, описанной Dmowski (J. Fluor. Chem., 2007, 128, 997-1006), как представлено на стадии a. Затем соединения формулы 31.2 могут быть подвергнуты условиям, описанным на стадии b, на которой в результате взаимодействия с солью тиокислоты в растворителе, таком как диметилформамид (DMF), получают соединения формулы 31.3, где W представляет собой арил или алкил. Как представлено на стадии c, одностадийное снятие защитных групп/алкилирование могут проводиться путем обработки соединений формулы 31.3 одним эквивалентом основания, такого как метоксид натрия (NaOMe), в полярном апротонном растворителе, таком как тетрагидрофуран (THF). Соединение формулы 31.4, где значения X, R1, R2, R3, R4, R5, R6, R8 и галогена определены выше, может быть впоследствии добавлено к реакционной смеси с получением соединений формулы 31.5.
Схема 31
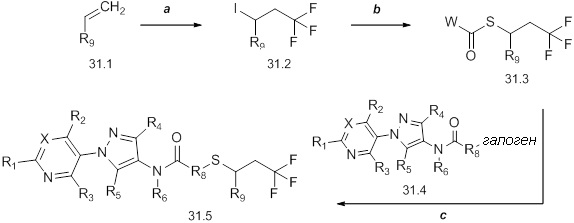
На схеме 32 неразбавленная смесь олефина формулы 32.1, где n представляет собой целое число, выбранное из 0, 1, 2, 3, 4 или 5, и триметилсилил-2,2-дифтор-2-(фторсульфонил)ацетата может быть нагрета в присутствии фторида натрия с получением замещенного дифторциклопропана формулы 32.2, как представлено на стадии a. На стадии b этот продукт обрабатывают фторидом тетрабутиламмония (TBAF) в тетрагидрофуране (THF) с получением промежуточного гомоаллильного спирта формулы 32.3. Этот спирт не выделяют, а немедленно обрабатывают пара-толуолсульфонилхлоридом в присутствии пиридина и дихлорметана с получением тозилата формулы 32.4, как представлено на стадии c.
Схема 32
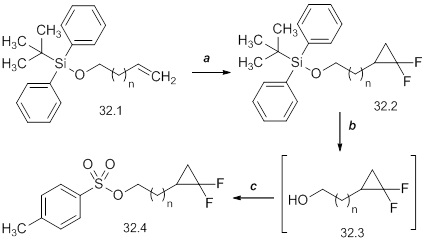
Соединения формулы 33.1, где значения X, R1, R2, R3, R4, R5 и R6 определены выше, где X предпочтительно представляет собой углерод, R1, R2, R3 и R5 представляют собой водород и R4 представляет собой хлор, могут быть сочетаны с хлорангидридом формулы 33.2, где значение R8 определено выше, в присутствии основания, такого как пиридин, диизопропилэтиламин или N,N-диметиламинопиридин (DMAP), и растворителя, такого как 1,2-дихлорэтан или метиленхлорид, с получением продуктов формулы 33.3, как представлено на стадии a схемы 33.
На стадии a схемы 33 амины формулы 33.1 сочетают с хлорангидридами формулы 33.2 в присутствии основания или комбинации оснований, таких как пиридин, N,N-диметиламинопиридин или диизопропилэтиламин. Реакцию проводят в галогенированном растворителе, таком как 1,2-дихлорэтан или метиленхлорид. Реакцию проводят при температуре от 0°C до 80°C, и предпочтительно от 0°C до 23°C. Приблизительно, амин формулы 33.1 и хлорангидрид формулы 33.2 могут быть использованы в молярном соотношении 1/1, однако, также могут быть использованы молярные соотношения от приблизительно 5/1 до приблизительно 1/5. Реакцию проводят приблизительно при атмосферном давлении, однако, может быть использовано более высокое или более низкое давление.
Схема 33
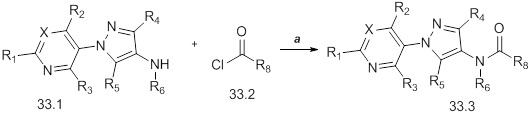
На стадии a схемы 34 соединения формулы 34.1, где значения R1, R2, R3, R4, R5 и R6 и X определены выше, могут быть обработаны кислотой формулы 34.2, где значение R8 определено выше, в присутствии N,N′-дициклогексилкарбодиимида (DCC), и основанием, таким как N,N-диметиламинопиридин (DMAP), в растворителе, таком как диэтиловый эфир (Et2O), с получением соединений формулы 34.3.
Схема 34
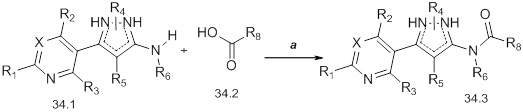
На стадии a схемы 35 аминопиразолы формулы 35.1, где значения X, R1, R2, R3, R4, R5 и R6 определены выше, могут быть обработаны фосгеном и N,N-диметиламинопиридином (DMAP) приблизительно при 80ºC в полярном апротонном растворителе, таком как дихлорэтан (DCE). Далее, путем обработки амином, как представлено на стадии b, или спиртом, как представлено на стадии c, или тиолом, как представлено на стадии d, получают мочевину формулы 35.2, карбамат формулы 35.3 или карбамотиоат формулы 35.4, соответственно, где значение R9 определено выше.
Схема 35
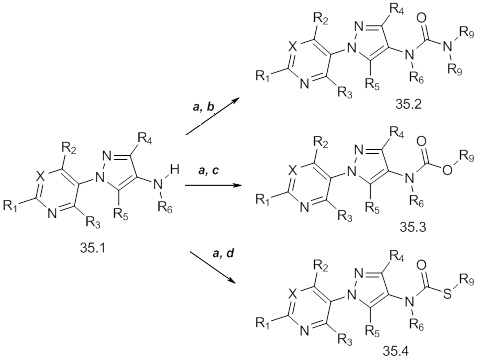
На стадии a схемы 36 соединения формулы 36.1, где значения X, R1, R2 и R3 определены выше, могут быть обработаны основанием, таким как триэтиламин, сероуглеродом и сульфохлоридом, таким как 4-метилбензол-1-сульфохлорид, в полярном апротонном растворителе, таком как тетрагидрофуран (THF), с получением соединений формулы 36.2. На стадии b схемы 36 оксазолидин-2-он может быть обработан эквимолярным количеством основания, такого как гидрид натрия, а затем соединениями формулы 36.2, в полярном апротонном растворителе, таком как диметилформамид (DMF), с получением соединений формулы 36.3. Дополнительно, продукт стадии b (до обработки) может быть обработан электрофилом, таким как йодметан, с получением соединений формулы 36.4, как представлено на стадии c схемы 36.
Схема 36
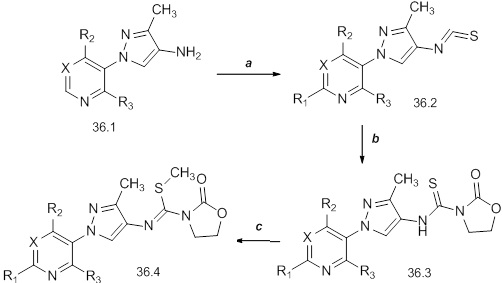
На стадии a схемы 37 мочевины формулы 37.1, где значения R1, R2, R3, R4, R5, R6, R8 и X определены выше, могут взаимодействовать с основанием, таким как бис(триметилсилил)амид лития, в полярном апротонном растворителе, таком как THF, а затем с ацилхлоридом, таким как пивалоилхлорид, с получением ацилированных мочевин формулы 37.2, где значения R1, R2, R3, R4, R5, R6, R8 и X определены выше. На стадии b схемы 37 мочевины формулы 37.1, где значения R1, R2, R3, R4, R5, R6, R8 и X определены выше, могут взаимодействовать с основанием, таким как бис(триметилсилил)амид лития, в полярном апротонном растворителе, таком как THF, а затем с алкилгалогенидом, таким как (хлорметил)(метил)сульфан, с получением алкилированных мочевин формулы 37.2, где значения R1, R2, R3, R4, R5, R6, R8 и X определены выше. На стадии c схемы 37 мочевины формулы 37.1, где значения R1, R2, R3, R4, R5, R6, R8 и X определены выше, могут взаимодействовать с основанием, таким как бис(триметилсилил)амид лития, в полярном апротонном растворителе, таком как THF, а затем с сульфонилхлоридом, таким как метансульфонилхлорид, с получением сульфонилированных мочевин формулы 37.3, где значения R1, R2, R3, R4, R5, R6, R8 и X определены выше.
Схема 37
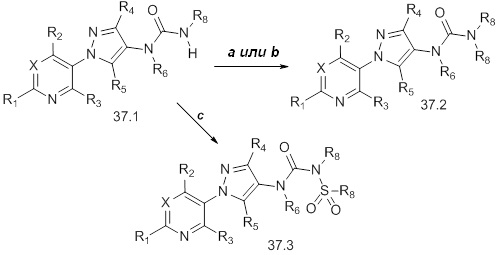
На стадии a схемы 38 амины формулы 38.1, где R6 представляет собой H или Me, могут взаимодействовать с электрофилом формулы 38.2, где значения R8 и R9 определены выше, таким как нафталин-2-илметил-3-(метилтио)пропанимидотиоата гидробромид, в полярном протонном растворителе, таком как этанол, с последующим воздействием основания, такого как MP-карбонат, в полярном протонном растворителе, таком как метанол, с получением амидинов формулы 38.3, где R6 представляет собой H или Me и значения R8 и R9 определены выше.
Схема 38
На стадии a схемы 39 соединения формулы 39.1, где значения X, R1, R2, R3, R4, R5, R6 и R8 определены выше, могут быть обработаны спиртами формулы 39.2, где значение R9 определено выше, в присутствии основания, такого как гидрид натрия или трет-бутоксид калия, в полярном апротонном растворителе, таком как THF, при подходящих температурах с получением соответствующих эфиров формулы 39.3. В качестве альтернативы, на стадии b схемы 39 тиоэфиры формулы 39.5 могут быть получены путем обработки соединений формулы 39.1, где значения X, R1, R2, R3, R4, R5, R6 и R8 определены выше, тиолами формулы 39.4, где значение R9 определено выше, в присутствии основания, такого как гидрид натрия, в апротонном растворителе, таком как THF.
Схема 39
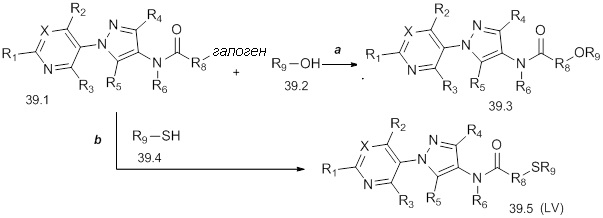
На схеме 40 соединения формулы 40.1, где значения X, R1, R2, R3, R4, R5, R6 и R8 определены выше, могут быть обработаны в условиях по Estrada et. al. (Synlett, 2011, 2387-2891), с получением соответствующих сульфонамидов формулы 40.2, где значение R9 определено выше, при условии, что, по меньшей мере, один из R9 не представляет собой H.
Схема 40
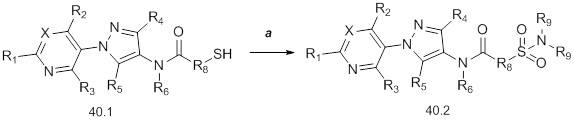
На стадии a схемы 41 соединения формулы 41.1, где значения X, R1, R2, R3, R4, R5 и R6 определены выше, могут быть сочетаны с кислотами формулы 41.2, где значения R8 и R9 определены выше, в присутствии агента сочетания, такого как EDC·HCl, и основания, такого как DMAP, в апротонном растворителе, таком как дихлорметан, с получением фосфонатов формулы 41.3. На стадии b схемы 41 фосфонаты формулы 41.3, где значения X, R1, R2, R3, R4, R5, R6, R8 и R9 определены выше, могут быть обработаны карбонильными соединениями формулы 41.4, где значение R9 определено выше, в присутствии основания, такого как гидрид натрия, в апротонном растворителе, таком как THF, с получением соответствующих алкенов формулы 41.5.
Схема 41
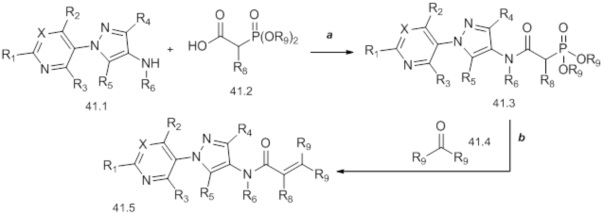
На стадии a схемы 42 соединения формулы 42.1, где значения X, R1, R2, R3, R4 и R5 определены выше, могут быть обработаны трифторуксусным ангидридом в присутствии основания, такого как триэтиламин, в апротонном растворителе, таком как дихлорметан, с получением амидов формулы 42.2, где значения X, R1, R2, R3, R4 и R5 определены выше. На стадии b схемы 42 амиды формулы 42.2, где значения X, R1, R2, R3, R4 и R5 определены выше, могут быть обработаны алкилирующим агентом, таким как йодметан, в присутствии основания, такого как трет-бутоксид калия, в растворителе, таком как THF, с получением соединений формулы 42.3. На стадии c схемы 42 амиды формулы 42.3, где значения X, R1, R2, R3, R4 и R5 определены выше, могут быть обработаны в основных условиях, таких как карбонат калия и метанол, с получением соответствующих аминов формулы 42.4.
Схема 42
ПРИМЕРЫ
Примеры представлены с иллюстративными целями и не должны истолковываться как ограничивающие изобретение, раскрытое в настоящем документе лишь вариантами осуществления, раскрытыми в указанных примерах.
Исходные вещества, реагенты и растворители, которые были получены из коммерческих источников, использовали без дополнительной очистки. Безводные растворители приобретали в виде Sure/Seal™ производства Aldrich и использовали как есть. Значения точки плавления получали на приборе для определения точки плавления капиллярным способом Thomas Hoover Unimelt или на автоматизированной системе для определения точки плавления OptiMelt производства Stanford Research Systems и не корректировали. Молекулам присваивали их известные названия, полученные в соответствии с программами присвоения имен в составе ISIS Draw, ChemDraw или ACD Name Pro. Если такие программы были не способны присвоить название, то молекулу именовали с использованием общепринятых правил наименования. Если не указано иное, то все ЯМР-сдвиги представлены в м.д. (δ) и регистрировали при 300, 400 или 600 МГц. Примеры с использованием «комнатной температуры» проводили в кондиционируемых лабораториях при температурах, варьирующих от приблизительно 20°C до приблизительно 24°C.
Пример 1, стадия 1: Получение 3,3-бис-метилсульфанил-1-пиридин-3-илпропенона
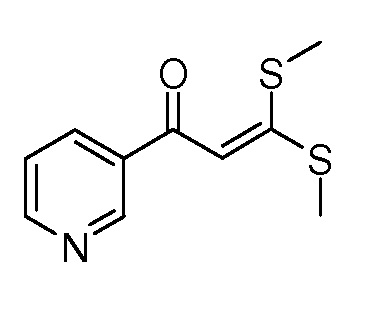
К находящейся при комнатной температуре суспензии гидрида натрия (NaH, 60% суспензия в минеральном масле; 4,13 г, 86 ммоль) в безводном диметилсульфоксиде (ДМСО, 60 мл) в атмосфере азота (N2) добавляли 3-ацетилпиридин (5,00 г, 41,3 ммоль) по каплям в течение 30 минут (мин). Смесь перемешивали дополнительно в течение 30 минут при той же температуре. При энергичном перемешивании по каплям добавляли сероуглерод (CS2; 3,27 г, 43 ммоль), а затем по каплям в течение 45 мин добавляли йодметан (12,21 г, 86 ммоль). Перемешивание продолжали дополнительно в течение 18 часов (ч) в атмосфере N2. Реакционную смесь гасили добавлением холодной воды (H2O, 50 мл). Темное твердое вещество фильтровали и промывали ледяным этиловым спиртом (EtOH) до обесцвечивания смывов. Не совсем белый твердый продукт сушили в условиях вакуума при 60°C с получением 3,3-бис-метилсульфанил-1-пиридин-3-илпропенона в виде коричневого твердого вещества (4,8 г, 51%):
1H ЯМР (300 МГц, CDCl3) δ 9,13 (д, J=1,8 Гц, 1H), 8,72 (дд, J=4,8, 1,6 Гц, 1H), 8,23 (ддд, J=7,9, 2,2 Гц, 1H), 7,40 (дд, J=7,9, 4,8 Гц, 1H), 6,73 (с, 1H), 2,58 (д, J=9,4 Гц, 6H); MS (m/z) 226,2 [M+1].
1-(5-Фторпиридин-3-ил)-3,3-бис(метилтио)проп-2-ен-1-он получали, как описано в примере 1, стадия 1: т.пл. 150-152°C;
1H ЯМР (400 МГц, CDCl3) δ 8,93 (т, J=1,6 Гц, 1H), 8,58 (д, J=2,8 Гц, 1H), 7,94 (ддд, J=8,9, 2,8, 1,7 Гц, 1H), 6,69 (с, 1H), 2,60 (с, 3H), 2,57 (с, 3H).
Пример 1, стадия 2: Получение (Z)-3-метиламино-3-метилсульфанил-1-пиридин-3-илпропенона
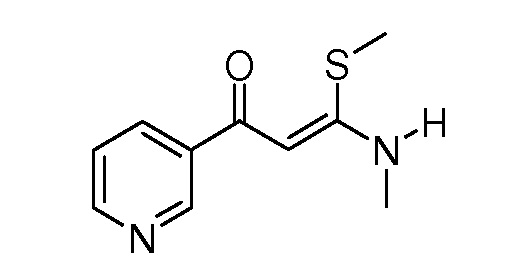
Раствор 3,3-бис-метилсульфанил-1-пиридин-3-илпропенона (18,6 г, 82,5 ммоль) в абсолютном спирте (400 мл) в атмосфере N2 обрабатывали гидрохлоридом метиламина (27,86 г, 412 ммоль), а затем триэтиламином (Et3N; 58,5 мл, 412 ммоль). Смесь нагревали с обратным холодильником в течение 3 ч, охлаждали до комнатной температуры и концентрировали в условиях пониженного давления. Твердый остаток растворяли в этилацетате (EtOAc; 150 мл). Раствор промывали H2O (2×50 мл) и солевым раствором (50 мл), сушили над Na2SO4, концентрировали в условиях пониженного давления и очищали методом хроматографии на силикагеле, элюируя 10% EtOAc в петролейном эфире, с получением (Z)-3-метиламино-3-метилсульфанил-1-пиридин-3-илпропенона в виде бледно-желтого твердого вещества (8,6 г, 50%):
1H ЯМР (300 МГц, CDCl3) δ 11,8 (уш. с, 1H), 9,06 (с, 1H); 8,67 (д, J=3,9 Гц, 1H), 8,26 (д, J=8,0 Гц, 1H), 7,46 (дд, J=7,6, 4,9 Гц 1H), 5,62 (с, 1H), 3,10 (д, J=5,2 Гц, 3H), 2,52 (с, 3H); MS (m/z) 209,2 [M+1].
(Z)-3-(этиламино)-3(метилтио)-1-(пиридин-3-ил)проп-2-ен-1-он получали, как описано в примере 1, стадия 2:
1H ЯМР (400 МГц, CDCl3) δ 11,81 (уш. с, 1H), 9,04 (дд, J=2,2, 0,7 Гц, 1H), 8,64 (дд, J=4,8, 1,7 Гц, 1H), 8,29-7,98 (м, 1H), 7,35 (ддд, J=7,9, 4,8, 0,9 Гц, 1H), 3,45 (кв., J=7,2, 5,6 Гц, 2H), 2,50 (с, 3H), 1,35 (т, J=7,2 Гц, 3H).
(Z)-3-(циклопропилметил)амино-3(метилтио)-1-(пиридин-3-ил)проп-2-ен-1-он получали, как описано в примере 1, стадия 2:
1H ЯМР (400 МГц, CDCl3) δ 9,00 (с, 1H), 9,05 (дд, J=2,2, 0,7 Гц, 1H), 8,64 (дд, J=4,8, 1,7 Гц, 1H), 8,16 (дт, J=7,9, 2,0 Гц, 1H), 7,35 (ддд, J=7,9, 4,8, 0,8 Гц, 1H), 5,62 (с, 1H), 3,27 (дд, J=7,0, 5,5 Гц, 2H), 2,50 (с, 3H), 1,20-1,07 (м, 1H), 0,73-0,49 (м, 2H), 0,41-0,17 (м, 2H).
Пример 1, стадия 3: Получение метил(2-метил-5-пиридин-3-пиразол-3-ил)амина
Раствор (Z)-3-метиламино-3-метилсульфанил-1-пиридин-3-илпропенона (3,00 г, 14 ммоль) и метилгидразина (729 мг, 15,4 ммоль) в абсолютном EtOH (64 мл) перемешивали при нагревании с обратным холодильником в течение 18 ч в атмосфере N2, охлаждали до комнатной температуры и упаривали в условиях пониженного давления. Остаток растворяли в EtOAc (50 мл), органический слой промывали H2O (2×30 мл) и солевым раствором (30 мл), сушили над Na2SO4, концентрировали в условиях пониженного давления и очищали методом хроматографии на силикагеле, элюируя градиентом 0-1% EtOH в EtOAc, с получением двух региоизомеров в соотношении 1/2, с основным региоизомером в виде коричневого твердого вещества (1,0 г, 27%):
1H ЯМР (300 МГц, CDCl3) δ 8,97 (д, J=1,3 Гц, 1H), 8,51 (дд, J=3,6, 1,0 Гц, 1H), 8,07 (ддд, J=5,9, 1,4, 1,4 Гц, 1H), 7,30 (дд, J=5,9, 3,6 Гц, 1H), 5,82 (с, 1H), 3,69 (с, 3H), 2,93 (с, 3H); MS (m/z) 188,6 [M+1].
1-Этил-N-метил-3-(пиридин-3-ил)-1H-пиразол-5-амин получали, как описано в примере 1, стадия 3: ESIMS m/z 204 ([M+2H]).
N-Этил-1-метил-3-(пиридин-3-ил)-1H-пиразол-5-амин получали, как описано в примере 1, стадия 3: ESIMS m/z 203 ([M+H]).
N-Метил-1-фенил-3-(пиридин-3-ил)-1H-пиразол-5-амин получали, как описано в примере 1, стадия 3: ESIMS m/z 252 ([M+2H]).
N-(Циклопропилметил)-1-метил-3-(пиридин-3-ил)-1H-пиразол-5-амин получали, как описано в примере 1, стадия 3: ESIMS m/z 230 ([M+2H]).
1-Изопропил-N-метил-3-пиридин-3-ил)-1H-пиразол-5-амин получали, как описано в примере 1, стадия 3: 1H ЯМР (300 МГц, CDCl3) δ 8,53 (с, 1H), 8,06-7,90 (м, J=7,2 Гц, 2H), 7,13 (дд, J=7,9, 5,6 Гц, 1H), 5,33 (с, 1H), 3,70 (уш. с, 1H), 3,65 (дт, J=13,2, 6,6 Гц, 1H), 2,31 (с, 3H), 0,88 (д, J=6,6 Гц, 6H); ESIMS m/z 217 ([M+H]).
3-(5-Фторпиридин-3-ил)-N,1-диметил-1H-пиразол-5-амин получали, как описано в примере 1, стадия 3: 1H ЯМР (300 МГц, CDCl3) δ 8,28 (с, 1H), 7,87 (т, J=1,3 Гц, 1H), 7,60 (м, 1H), 6,66 (с, 1H), 5,28 (уш. с, 2H), 3,12 (с, 3H), 2,34 (с, 3H); ESIMS m/z 206 ([M+H]).
Пример 2: Получение (4-хлор-2-метил-5-пиридин-3-ил-2H-пиразол-3-ил)метиламина
Смесь метил(2-метил-5-пиридин-3-ил-2H-пиразол-3-ил)амина (0,35 г, 1,8 ммоль) и N-хлорсукцинимида (0,273 г, 2 ммоль) объединяли в ацетонитриле (3 мл), перемешивали при комнатной температуре в течение 30 минут, концентрировали в условиях пониженного давления и очищали методом хроматографии на силикагеле, элюируя градиентом EtOAc в гексанах, с получением указанного в заголовке соединения в виде желтого масла (0,096 г, 23%): ИК (тонкая пленка) 1581,6 см-1; 1H ЯМР (400 МГц, CDCl3) δ 9,12 (д, J=1,5 Гц, 1H), 8,57 (дд, J=4,8, 1,3 Гц, 1H), 8,15 (ддд, J=7,8, 2,0, 2,0 Гц, 1H), 7,33 (дд, J=8,1, 5,1 Гц, 1H), 3,80 (с, 3H), 2,91 (д, J=5,8 Гц, 3H); ESIMS (m/z) 225,6 [M+2].
В реакции также получали 4-хлор-2-метил-5-пиридин-3-ил-2H-пиразол-3-иламин в виде зеленого клейкого вещества (0,046 г, 13%): ИК (тонкая пленка) 1720,5 см-1; 1H ЯМР (CDCl3, 400 МГц) δ 9,13 (уш. с, 1H), 8,57 (уш. с, 1H), 8,16 (дт, J=8,0, 2,0 Гц, 1H), 7,33 (дд, J=7,8, 4,8 Гц, 1H), 3,76 (с, 3H); ESIMS (m/z) 207,0 [M-1].
Пример 3: Получение 2,N-диметил-N-(2-метил-5-пиридин-3-ил-2H-пиразол-3-ил)-3-метилсульфанилпропионамида (соединение 1)
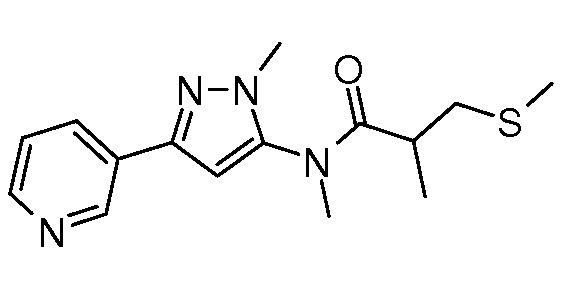
К раствору метил(2-метил-5-пиридин-3-ил-2H-пиразол-3-ил)амина (150 мг, 0,8 ммоль) в атмосфере N2 в ледяном дихлорэтане (DCE; 2 мл) по каплям пипеткой добавляли раствор 2-метил-3-метилсульфанилпропионилхлорида (146 мг, 0,9 ммоль) в DCE (1,5 мл). После перемешивания в течение 10 минут (мин), по каплям добавляли раствор 4-N,N-диметиламинопиридина (DMAP; 107 мг, 0,9 ммоль) в DCE (2 мл). Баню со льдом удаляли спустя 30 мин, смесь перемешивали при комнатной температуре в течение 90 мин, а затем при нагревании с обратным холодильником в течение 14 ч. Смесь концентрировали в условиях пониженного давления и очищали методом хроматографии на силикагеле, элюируя градиентом EtOAc в гексане. Продукт, 2,N-диметил-N-(2-метил-5-пиридин-3-ил-2H-пиразол-3-ил)-3-метилсульфанилпропионамид, выделяли в виде желтого полутвердого вещества (44 мг, 24%): 1H ЯМР (400 МГц, CDCl3) δ 9,00 (с, 1H), 8,58 (с, 1H), 8,08 (уш. д, J=7,0 Гц, 1H), 7,35 (уш. дд, J=7,3, 4,8 Гц, 1H), 6,58 (уш. с, 0,5H), 6,49 (уш. с, 0,5H), 3,89-3,79 (м, 3H), 3,25 (с, 3H), 2,96-2,80 (м, 1H), 2,42-2,40 (м, 1H), 2,02-1,99 (м, 3H), 2,62 (м, 1H), 1,15 (д, J=6,0 Гц, 3H); MS (m/z) 305,0 [M+1].
Соединения 2-6, 9, 10, 12, 18-21, 24-33, 477, 487, 509, 520, 556, 557, 562-568 получали из соответствующих аминов в соответствии с методиками, раскрытыми в примере 3.
Пример 4: Получение 1-метил-1-(2-метил-5-пиридин-3-ил-2H-пиразол-3-ил)-3-(2-метилсульфанилэтил)мочевины (соединение 7)
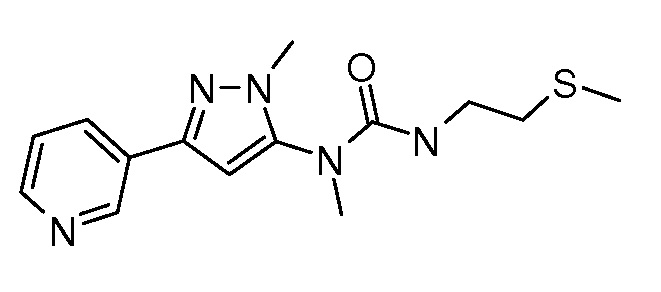
К раствору метил(2-метил-5-пиридин-3-ил-2H-пиразол-3-ил)амина (150 мг, 0,8 ммоль) в ледяном DCE (2 мл) в атмосфере N2 добавляли раствор фосгена в толуоле (20%, 0,43 мл, 0,88 ммоль). Баню со льдом удаляли спустя 30 мин, смесь перемешивали при комнатной температуре в течение 1 ч и при нагревании с обратным холодильником в течение 2 ч. Смесь охлаждали до комнатной температуры, а затем дополнительно добавляли фосген (0,86 мл, 1,76 ммоль). Смесь перемешивали при нагревании с обратным холодильником в течение 90 мин, а затем охлаждали на бане со льдом. К смеси добавляли раствор 2-метилтиоэтиламина (80 мг, 0,88 ммоль) в DCE (2 мл). Баню со льдом удаляли спустя 10 мин, реакционную смесь перемешивали при нагревании с обратным холодильником в течение 14 ч, охлаждали и разбавляли DCE (30 мл). Разбавленную реакционную смесь промывали насыщенным NaHCO3 (20 мл), сушили над MgSO4, адсорбировали на силикагеле и очищали методом хроматографии на силикагеле, элюируя градиентом метанола в дихлорметане, с получением 1-метил-1-(2-метил-5-пиридин-3-ил-2H-пиразол-3-ил)-3-(2-метилсульфанилэтил)мочевины в виде желтого клейкого вещества (14 мг, 6%): 1H ЯМР (400 МГц, CDCl3) δ 8,99 (д, J=1,5 Гц, 1H), 8,57 (дд, J=4,8, 1,5 Гц, 1H), 8,08 (ддд, J=8,1, 2,1, 2,1 Гц, 1H), 7,34 (дд, J=7,9, 4,8 Гц, 1H), 6,52 (с, 1H), 4,88 (уш. т, J=5,5 Гц, 1H), 3,80 (с, 3H), 3,41 (кв., J=6,3 Гц, 2H), 3,24 (с, 3H), 2,61 (т, J=6,3, 2H), 2,06 (с, 3H); ESIMS (m/z) 292,2 [M+2].
Соединение 8 получали в соответствии с методиками, раскрытыми в примере 4, с использованием 2-(метилтио)этанола вместо 2-метилтиоэтиламина.
Пример 5: Получение 1-метил-5-(пиридин-3-ил)-1H-пиразол-3-амина и 1-метил-3-(пиридин-3-ил)-1H-пиразол-5-амина
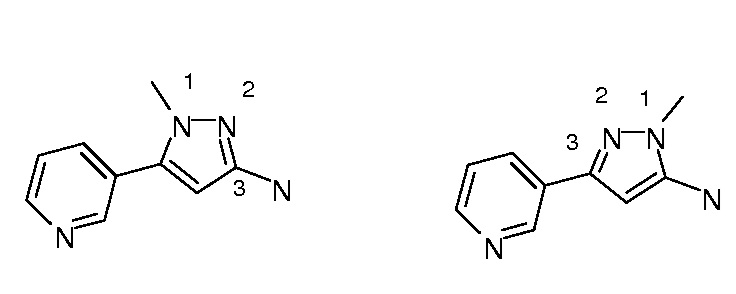
К этанолу (8,53 мл) добавляли 3-оксо-3-(пиридин-3-ил)пропаннитрил (0,82 г, 5,61 ммоль) и метилгидразин (0,25 г, 5,61 ммоль) и перемешивали при нагревании с обратным холодильником в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и концентрировали досуха. Неочищенное вещество очищали методом хроматографии на силикагеле, элюируя 0-20% MeOH в дихлорметане, с получением двух продуктов - 1-метил-5-(пиридин-3-ил)-1H-пиразол-3-амина (0,060 г, 6,14%): 1H ЯМР (300 МГц, CDCl3) δ 8,72 (с, 1H), 8,53 (д, 1H), 7,76-7,63 (м, 1H), 7,43-7,33 (м, 1H), 5,75 (с, 1H), 3,76-3,57 (м, 5H); и 1-метил-3-(пиридин-3-ил)-1H-пиразол-5-амина (0,150 г, 15,35%): 1H ЯМР (300 МГц, CDCl3) δ 8,88 (с, 1H), 8,48 (д, 1H), 7,99 (д, 1H), 7,38-7,07 (м, 1H), 585 (с, 1H), 3,80-3,59 (м, 5H).
Пример 6, стадия 1: Получение 3-пиразол-1-илпиридина
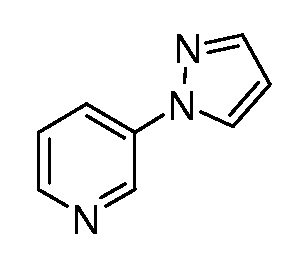
К раствору 3-бромпиридина (5 г, 0,031 моль) в 50 мл ацетонитрила в атмосфере N2 добавляли пиразол (2,6 г, 0,038 моль), Cs2CO3 (16,5 г, 0,050 моль), Cu2O (0,226 г, 0,0016 моль) и салицилальдоксим (0,867 г, 0,006 моль). Реакционную массу нагревали с обратным холодильником в течение 24 ч при 80°C. Реакционную массу концентрировали и очищали неочищенное вещество методом колоночной хроматографии с использованием этилацетата и гексана (1/1) с получением пиразолилпиридина в виде темно-коричневой жидкости (2 г, 43%): 1H ЯМР (400 МГц, CDCl3) δ 8,99 (д, J=2,8 Гц, 1H), 8,48 (дд, J=4,8, 1,2 Гц, 1H), 8,11-8,08 (м, 1H), 7,99 (д, J=1,2 Гц, 1H), 7,78 (д, J=1,2 Гц, 1H), 7,38-7,35 (м, 1H), 6,53 (т, J=1,2 Гц, 1H); MS (m/z) 146 [M+1].
3-(3-Хлор-1H-пиразол-1-ил)пиридин получали, как описано в примере 6, стадия 1: т.пл. 98-106°C; 1H ЯМР (400 МГц, CDCl3) δ 8,93 (д, J=2,6 Гц, 1H), 8,57 (дд, J=4,8, 1,4 Гц, 1H), 8,03 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,90 (д, J=2,5 Гц, 1H), 7,42 (ддд, J=8,3, 4,8, 0,7 Гц, 1H), 6,46 (д, J=2,5 Гц, 1H); 13C (ДМСО-d6) 148, 142, 140, 136, 131, 126, 125, 108.
2-Метил-3-(3-метил-1H-пиразол-1-ил)пиридин получали, как описано в примере 6, стадия 1: 1H ЯМР (400 МГц, CDCl3) δ 8,53 (д, J=4,7 Гц, 1H), 7,67 (д, J=7,9 Гц, 1H), 7,54 (т, J=8,0 Гц, 1H), 7,27-7,19 (м, 1H), 6,27 (д, J=1,4 Гц, 1H), 2,53 (с, 3H), 2,38 (с, 3H).
3-(3-(Трифторметил)-1H-пиразол-1-ил)пиридин получали из соответствующих исходных веществ, как описано в примере 6, стадия 1: т.пл. 59,0-61,0°C; 1H ЯМР (400 МГц, CDCl3) δ 9,00 (с, 1H), 8,70-8,59 (м, 1H), 8,11 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 8,05-7,98 (м, 1H), 7,46 (дд, J=8,3, 4,8 Гц, 1H), 6,79 (д, J=2,4 Гц, 1H); EIMS m/z 213.
3-Фтор-5-(3-метил-1H-пиразол-1-ил)пиридин получали из соответствующих исходных веществ, как описано в примере 6, стадия 1: т.пл. 70,0-72,0°C; 1H ЯМР (400 МГц, CDCl3) δ 8,76-8,73 (м, 1H), 8,37-8,33 (м, 1H), 7,88-7,85 (м, 1H), 7,84-7,79 (м, 1H), 6,34-6,29 (м, 1H), 2,37 (с, 3H); EIMS m/z 177.
3-(3-Хлор-1H-пиразол-1-ил)-5-фторпиридин получали из соответствующих исходных веществ, как описано в примере 6, стадия 1: т.пл. 77,0-82,0°C; 1H ЯМР (400 МГц, CDCl3) δ 8,75 (д, J=1,8 Гц, 1H), 8,43 (д, J=2,3 Гц, 1H), 7,92 (д, J=2,6 Гц, 1H), 7,84 (дт, J=9,3, 2,4 Гц, 1H), 6,48 (д, J=2,6 Гц, 1H); EIMS m/z 198.
3-(3-Метил-1H-пиразол-1-ил)пиридин получали, как описано в примере 6, стадия 1: 1H ЯМР (400 МГц, CDCl3) δ 8,94 (уш. с, 1H), 8,51 (д, J=3,9 Гц, 1H), 8,02 (ддд, J=8,3, 2,6, 1,5 Гц, 1H), 7,90-7,79 (м, 1H), 7,39 (дд, J=8,2, 5,1 Гц, 1H), 6,30 (д, J=2,4 Гц, 1H), 2,39 (с, 3H).
3-(5-Метил-1H-пиразол-1-ил)пиридин получали, как описано в примере 6, стадия 1: 1H ЯМР (400 МГц, CDCl3) δ 8,77 (д, J=2,5 Гц, 1H), 8,65 (дд, J=4,8, 1,5 Гц, 1H), 7,84 (ддд, J=8,2, 2,5, 1,5 Гц, 1H), 7,63 (д, J=1,6 Гц, 1H), 7,44 (ддд, J=8,2, 4,8, 0,7 Гц, 1H), 6,225 (дд, J=1,6, 0,7 Гц, 1H), 2,40 (с, 3H).
Пример 6, стадия 2: Получение 3-(4-нитропиразол-1-ил)пиридина
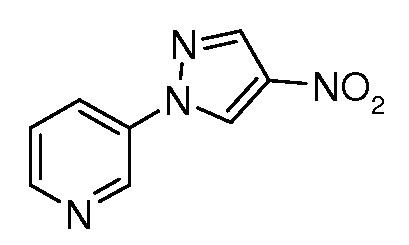
3-Пиразол-1-илпиридин (2 г, 0,032 моль) растворяли в концентрированной H2SO4 (32 мл, 0,598 ммоль) и охлаждали при -5°C с использованием бани со льдом. К реакционной массе по каплям в течение 30 мин добавляли смесь (1/1) концентрированной HNO3 (30 мл, 0,673 ммоль) и концентрированной H2SO4 (30 мл, 15 об.). Охлаждение прекращали и перемешивали реакционную смесь при комнатной температуре в течение ночи. После завершения реакции смесь выливали в колотый лед, нейтрализовывали добавлением насыщенного NaHCO3, фильтровали, промывали водой и сушили с получением нитропиразола в виде бледно-желтого твердого вещества (1,8 г, 68%): 1H ЯМР (400 МГц, ДМСО-d6) δ 9,03 (д, J=2,8 Гц, 1H), 8,70 (дд, J=4,8, 1,6 Гц, 1H), 8,69 (с, 1H), 8,33 (с, 1H), 8,11-8,08 (м, 1H), 7,51 (дд, J=8,4, 4,8 Гц, 1H); MS (m/z) 191 [M+1].
3-(3-Хлор-4-нитро-1H-пиразол-1-ил)пиридин получали, как описано в примере 6, стадия 2: т.пл. 139-142°C, 1H ЯМР (400 МГц, CDCl3) δ 9,01 (д, J=2,0 Гц, 1H), 8,73 (д, J=4,9 Гц, 2H), 8,08 (ддд, J=8,3, 2,5, 1,3 Гц, 1H), 7,52 (дд, J=8,3, 4,8 Гц, 1H), EIMS m/z 224.
3-(5-Метил-4-нитро-1H-пиразол-1-ил)пиридин получали, как описано в примере 6, стадия 2: 1H ЯМР (400 МГц, CDCl3) δ 8,81-8,71 (м, 2H), 8,32 (с, 1H), 7,83 (ддд, J=8,2, 2,5, 1,6 Гц, 1H), 7,54 (дд, J=8,2, 4,8 Гц, 1H), 2,72 (с, 3H).
2-Метил-3-(3-метил-4-нитро-1H-пиразол-1-ил)пиридин получали, как описано в примере 6, стадия 2: 1H ЯМР (400 МГц, d6-ДМСО) δ 14,01 (с, 1H), 9,37 (д, J=4,0 Гц, 1H), 8,69 (т, J=17,3 Гц, 1H), 8,21 (дд, J=7,7, 4,8 Гц, 1H), 2,29 (с, 3H), 2,20 (с, 3H); 13C 154, 150, 146, 135, 134,9, 134,8, 134,3, 122, 21, 14; EIMS m/z 218.
3-(3-Метил-4-нитро-1H-пиразол-1-ил)пиридин получали, как описано в примере 6, стадия 2: т.пл. 122-124°C; 1H ЯМР (400 МГц, CDCl3) δ 9,01 (д, J=2,5 Гц, 1H), 8,77-8,56 (м, 2H), 8,07 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,56-7,37 (м, 1H), 2,66 (с, 3H); EIMS m/z 208.
3-Фтор-5-(3-метил-4-нитро-1H-пиразол-1-ил)пиридин получали из соответствующего исходного вещества, как описано в примере 6, стадия 2: т.пл. 90,0-92,0°C; 1H ЯМР (400 МГц, CDCl3) δ 8,82 (д, J=2,0 Гц, 1H), 8,69 (с, 1H), 8,54 (д, J=2,5 Гц, 1H), 7,89 (дт, J=8,9, 2,4 Гц, 1H), 2,66 (с, 3H); EIMS m/z 222.
3-(4-Нитро-3-(трифторметил)-1H-пиразол-1-ил)пиридин получали из соответствующего исходного вещества, как описано в примере 6, стадия 2: т.пл. 121,0-123,0°C; 1H ЯМР (400 МГц, CDCl3) δ 9,04 (д, J=2,5 Гц, 1H), 8,79 (с, 1H), 8,77 (д, J=0,9 Гц, 1H), 8,13 (ддд, J=8,3, 2,7, 1,4 Гц, 1H), 7,55 (дт, J=10,8, 5,4 Гц, 1H); EIMS m/z 258.
3-(3-Хлор-4-нитро-1H-пиразол-1-ил)-5-фторпиридин получали из соответствующего исходного вещества, как описано в примере 6, стадия 2: т.пл. 109,5-111,0°C; 1H ЯМР (400 МГц, CDCl3) δ 8,83 (д, J=2,1 Гц, 1H), 8,75 (с, 1H), 8,60 (д, J=2,4 Гц, 1H), 7,89 (дт, J=8,6, 2,4 Гц, 1H); EIMS m/z 242.
3-(3-Бром-4-нитро-1H-пиразол-1-ил)пиридин получали из соответствующего исходного вещества, как описано в примере 6, стадия 2: т.пл. 139,0-141,0°C; 1H ЯМР (400 МГц, CDCl3) δ 9,01 (д, J=2,5 Гц, 1H), 8,73 (дд, J=4,7, 1,1 Гц, 1H), 8,71 (с, 1H), 8,15-8,00 (м, 1H), 7,52 (дд, J=8,3, 4,8 Гц, 1H); ESIMS m/z 271 ([M+2]+).
Пример 6, стадия 3: Получение 1-пиридин-3-ил-1H-пиразол-4-иламина
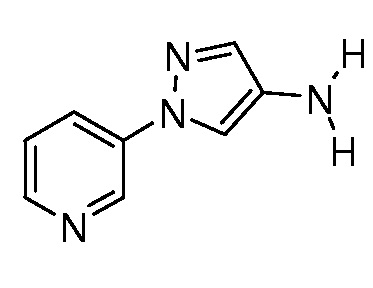
К раствору 3-(4-нитропиразол-1-ил)пиридина (1,8 г, 0,009 моль) в безводном THF (18 мл) в атмосфере азота добавляли 5% Pd/C (180 мг). Затем смесь перемешивали в атмосфере водорода до завершения реакции. Реакционную смесь фильтровали через слой целита и концентрировали досуха с получением содержащего примеси темно-коричневого твердого вещества (1,76 г): 1H ЯМР (400 МГц, ДМСО-d6) δ 8,89 (дд, J=2,8, 0,4 Гц, 1H); 8,48 (дд, J=4,8, 1,2 Гц, 1H), 7,99-7,96 (м, 1H), 7,54 (д, J=1,2 Гц, 1H), 7,45 (д, J=0,4 Гц, 1H), 7,38-7,35 (м, 1H), 4,81 (уш. с, 1H); ESIMS (m/z) 161 [M+1].
5-Метил-1-(пиридин-3-ил)-1H-пиразол-4-амин получали, как описано в примере 6, стадия 3: 1H ЯМР (400 МГц, CDCl3) δ 8,74 (д, J=2,3 Гц, 1H), 8,63-8,50 (м, 1H), 7,81 (ддд, J=8,2, 2,5, 1,5 Гц, 1H), 7,46-7,33 (м, 2H), 2,64 (уш. с, 1H), 2,29 (с, 3H); 13C (ДМСО-d6) 147, 144, 137, 133, 130, 129, 124, 123, 10; EIMS m/z 174.
3-Метил-1-(пиримидин-5-ил)-1H-пиразол-4-амин получали, как описано в примере 6, стадия 3: т.пл. 211-215°C; 1H ЯМР (400 МГц, CDCl3) δ 9,10-8,87 (м, 3H), 7,51 (с, 1H), 3,24 (уш. с, 2H), 2,29 (с, 3H); ESIMS m/z 176 ([M+H]).
3-Хлор-1-(пиримидин-5-ил)-1H-пиразол-4-амин получали, как описано в примере 6, стадия 3: т.пл. 146-148°C; 1H ЯМР (400 МГц, CDCl3) δ 9,07 (с, 1H), 9,02 (с, 2H), 7,52 (с, 1H), 3,45 (с, 2H); ESIMS m/z 196 ([M+H]).
Пример 7: Получение метил(1-пиридин-3-ил-1H-пиразол-4-ил)амина
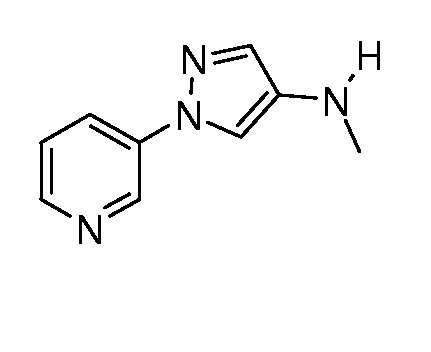
Способ A:
В круглодонную колбу объемом 25 мл, содержащую 1-пиридин-3-ил-1H-пиразол-4-иламин (1,76 г, 0,011 моль) в этаноле (26,4 мл) добавляли бензотриазол (1,31 г, 0,011 моль). Реакционную смесь охлаждали при 0°C-10°C, медленно добавляли формальдегид (0,36 мл, 0,0121 моль) и поддерживали смесь в течение 30 мин при этой температуре. Реакционную смесь фильтровали и концентрировали досуха. Неочищенное вещество (2,56 г, 0,009 моль) растворяли в безводном тетрагидрофуране (25,6 мл), охлаждали до 0°C, и в течение 15 мин добавляли боргидрид натрия (0,326 г, 0,00882 моль). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 2 часов. Реакционную смесь вливали в воду и экстрагировали с использованием дихлорметана, органический слой сушили над безводным Na2SO4 и концентрировали досуха. Путем очистки неочищенного вещества методом хроматографии на силикагеле, элюируя 20% метанолом в хлороформе, получали целевой продукт в виде коричневого твердого вещества (0,610 г, 32%): 1H ЯМР (400 МГц, d6-ДМСО) δ 8,92 (д, J=2,4 Гц, 1H), 8,47 (дд, J=4,8, 1,6 Гц, 1H), 8,01-7,98 (м, 1H), 7,45 (с, 1H), 7,30 (с, 1H), 7,37 (дд, J=8,0, 4,4 Гц, 1H), 2,84 (с, 3H); ESIMS m/z 175 ([M+1]).
Способ B:
1-Пиридин-3-ил-1H-пиразол-4-иламин (1,0 г, 6,2 ммоль) растворяли в триэтилортоформиате (5 мл, 30 ммоль) и добавляли к нему трифторуксусную кислоту (3-4 капли). Реакционную смесь нагревали с обратным холодильником при 120°C в течение 3 часов, а затем концентрировали. Неочищенное вещество растворяли в этаноле (5 мл), охлаждали до 0°C и обрабатывали боргидридом натрия (0,6 г, 15,7 ммоль). После нагрева до комнатной температуры, смесь нагревали с обратным холодильником в течение 3 часов. Смесь концентрировали, и распределяли остаток между водой и диэтиловым эфиром. Эфирный слой разделяли и концентрировали досуха. Неочищенное вещество очищали методом хроматографии на силикагеле, элюируя 5% метанолом в хлороформе, с получением целевого продукта в виде бледно-желтого твердого вещества (0,3 г, 27%): т.пл. 65-67°C; 1H ЯМР (300 МГц, CDCl3) δ 8,91 (уш. с, 1H), 8,46 (д, J=4,5 Гц, 1H), 7,99 (д, J=8,3 Гц, 1H), 7,43 (с, 1H), 7,41 (с, 1H), 7,36 (дд, J=8,3, 4,7 Гц, 1H), 2,86 (д, J=12,4 Гц, 3H); ESIMS m/z 175 ([M+1]).
Пример 8: Получение этил(1-пиридин-3-ил-1H-пиразол-4-ил)амина
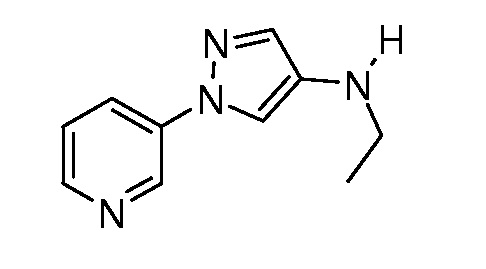
Способ A:
К 1-пиридин-3-ил-1H-пиразол-4-иламину (0,5 г, 3,12 ммоль) в дихлорметане (5 мл) добавляли ацетилхлорид (0,28 г, 3,75 ммоль), а затем DMAP (0,57 г, 4,68 ммоль), и перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали и очищали методом колоночной хроматографии на силикагеле. Полученное вещество растворяли в тетрагидрофуране (5 мл), добавляли алюмогидрид лития (0,23 г, 6,25 ммоль) и перемешивали при комнатной температуре в течение 12 часов. Реакционную смесь гасили добавлением насыщенного Na2SO4 и фильтровали через целит. Фильтрат собирали и концентрировали досуха. Неочищенное вещество очищали методом колоночной хроматографии на силикагеле, элюируя 0-5% метанолом в хлороформе, и снова подвергали хроматографии на силикагеле, элюируя 0-100% этилацетатом в гексанах, с получением целевого продукта (0,080 г, 14%): 1H ЯМР (400 МГц, CDCl3) δ 8,90 (д, J=2,7 Гц, 1H), 8,46 (дд, J=4,7, 1,3 Гц, 1H), 7,98 (ддд, J=8,3, 2,6, 1,5 Гц, 1H), 7,41 (дт, J=13,3, 6,6 Гц, 2H), 7,36 (ддд, J=8,3, 4,7, 0,7 Гц, 1H), 3,10 (кв., J=7,1 Гц, 2H), 1,27 (т, 3H).
Способ B:
К раствору трет-бутилэтил(1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамата (3,4 г, 11,79 ммоль) в дихлорметане (4,54 мл) добавляли трифторуксусную кислоту (9 мл) и перемешивали реакционную смесь в течение 1 часа при комнатной температуре. Добавляли толуол и концентрировали реакционную смесь почти досуха. Реакционную смесь вливали в делительную воронку, осторожно гасили добавлением насыщенного водного NaHCO3 и экстрагировали дихлорэтаном. Органический слой сушили (MgSO4), фильтровали и концентрировали досуха. Неочищенный продукт очищали методом хроматографии на силикагеле (0-10% MeOH в дихлорметане) с получением целевого продукта в виде бледно-желтого масла (2,10 г, 95%): 1H ЯМР (400 МГц, CDCl3) δ 8,90 (дд, J=1,8, 0,8 Гц, 1H), 8,51-8,39 (м, 1H), 7,97 (ддт, J=8,3, 2,7, 1,3 Гц, 1H), 7,41 (д, J=0,8 Гц, 2H), 7,38-7,30 (м, 1H), 3,21-2,93 (м, 2H), 1,34-1,19 (м, 3H).
3-Хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амин получали, как описано в примере 8, способ B: 1H ЯМР (400 МГц, CDCl3) δ 8,87 (д, J=2,5 Гц, 1H), 8,47 (дд, J=4,7, 1,2 Гц, 1H), 7,96 (ддд, J=8,4, 2,6, 1,4 Гц, 1H), 7,38-7,32 (м, 2H), 3,11 (кв., J=7,1 Гц, 2H), 2,97 (уш. с, 1H), 1,31 (т, J=7,1 Гц, 3H).
3-Хлор-N-метил-1-(пиридин-3-ил)-1H-пиразол-4-амин получали, как описано в примере 8, способ B: т.пл. 108-118 C; 1H ЯМР (400 МГц, CDCl3) δ 8,88 (д, J=2,4 Гц, 1H), 8,48 (дд, J=4,7, 1,4 Гц, 1H), 7,96 (ддд, J=8,3, 2,7, 1,4 Гц, 1H), 7,41-7,29 (м, 2H), 2,87 (с, 3H); EIMS m/z 208.
N,3-диметил-1-(пиридин-3-ил)-1H-пиразол-4-амин получали, как описано в примере 8, способ B: 1H ЯМР (400 МГц, CDCl3) δ 9,03-8,73 (м, 1H), 8,41 (дд, J=4,7, 1,4 Гц, 1H), 7,95 (ддд, J=8,4, 2,7, 1,4 Гц, 1H), 7,42-7,27 (м, 2H), 2,85 (с, 4H), 2,25 (с, 3H); EIMS m/z 189.
3-Хлор-N-(циклопропилметил)-1-(пиридин-3-ил)-1H-пиразол-4-амин получали, как описано в примере 8, способ B: 1H ЯМР (400 МГц, CDCl3) δ 8,86 (д, J=2,5 Гц, 1H), 8,47 (дд, J=4,7, 1,4 Гц, 1H), 8,03-7,89 (м, 1H), 7,40-7,29 (м, 2H), 3,21 (с, 1H), 2,91 (д, J=4,4 Гц, 2H), 1,18-1,02 (м, 1H), 0,65-0,45 (м, 2H), 0,41-0,12 (м, 2H).
3-Хлор-N-пропил-1-(пиридин-3-ил)-1H-пиразол-4-амин получали, как описано в примере 8, способ B: 1H ЯМР (400 МГц, CDCl3) δ 8,86 (д, J=2,6 Гц, 1H), 8,47 (дд, J=4,7, 1,4 Гц, 1H), 8,01-7,89 (м, 1H), 7,42-7,27 (м, 2H), 3,23-2,84 (м, 3H), 1,77-1,59 (м, 2H), 1,03 (т, J=7,4 Гц, 3H).
1-(5-Фторпиридин-3-ил)-N,3-диметил-1H-пиразол-4-амин получали из соответствующего Boc-амина, как описано в примере 8, способ B: т.пл. 142,0-143,5°C; 1H ЯМР (400 МГц, CDCl3) δ 8,67 (с, 1H), 8,26 (д, J=2,3 Гц, 1H), 7,73 (дт, J=10,0, 2,4 Гц, 1H), 7,27 (с, 1H), 2,92-2,81 (м, 4H), 2,24 (с, 3H); ESIMS m/z 207 ([M+H]+).
N-Этил-1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-амин получали из соответствующего Boc-амина, как описано в примере 8, способ B: т.пл. 85,0-86,0°C; 1H ЯМР (400 МГц, CDCl3) δ 8,66 (с, 1H), 8,25 (д, J=2,5 Гц, 1H), 7,72 (дт, J=10,0, 2,3 Гц, 1H), 7,27 (с, 1H), 3,07 (кв., J=7,1 Гц, 2H), 2,71 (с, 1H), 2,25 (с, 3H), 1,30 (т, J=7,1 Гц, 3H); ESIMS m/z 221 ([M+H]+).
3-Метил-N-пропил-1-(пиридин-3-ил)-1H-пиразол-4-амин получали из соответствующего Boc-амина, как описано в примере 8, способ B: т.пл. 65,0-67,0°C; 1H ЯМР (400 МГц, CDCl3) δ 8,86 (д, J=2,4 Гц, 1H), 8,40 (дд, J=4,7, 1,4 Гц, 1H), 7,94 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,35-7,28 (м, 2H), 3,00 (т, J=7,1 Гц, 2H), 2,26 (с, 3H), 1,76-1,58 (м, 2H), 1,03 (т, J=7,4 Гц, 3H); ESIMS m/z 217 ([M+H]+).
N-(Циклопропилметил)-3-метил-1-(пиридин-3-ил)-1H-пиразол-4-амин получали из соответствующего Boc-амина, как описано в примере 8, способ B: т.пл. 73,0-75,0°C; 1H ЯМР (400 МГц, CDCl3) δ 8,86 (д, J=2,4 Гц, 1H), 8,40 (дд, J=4,7, 1,3 Гц, 1H), 7,94 (ддд, J=8,3, 2,6, 1,5 Гц, 1H), 7,35-7,28 (м, 2H), 2,87 (д, J=6,9 Гц, 2H), 2,75 (с, 1H), 2,28 (с, 3H), 1,22-1,05 (м, 1H), 0,63-0,56 (м, 2H), 0,26 (кв., J=4,7 Гц, 2H); ESIMS m/z 229 ([M+H]+).
N-Изопропил-3-метил-1-(пиридин-3-ил)-1H-пиразол-4-амин получали из соответствующего Boc-амина, как описано в примере 8, способ B: ИК (тонкая пленка) 3303 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,86 (д, J=2,3 Гц, 1H), 8,41 (дд, J=4,7, 1,4 Гц, 1H), 7,94 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,36-7,28 (м, 2H), 3,30 (гепт, J=6,3 Гц, 1H), 2,25 (с, 3H), 1,24 (д, J=6,3 Гц, 6H); EIMS m/z 216.
5-Этокси-1-(5-фторпиридин-3-ил)-N,3-диметил-1H-пиразол-4-амин получали из соответствующего Boc-амина, как описано в примере 8, способ B: ИК (тонкая пленка) 3340 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,91 (с, 1H), 8,31 (д, J=2,5 Гц, 1H), 7,88-7,80 (м, 1H), 4,24 (кв., J=7,1 Гц, 2H), 2,79 (с, 3H), 2,24 (с, 3H), 1,36 (т, J=7,1 Гц, 3H); EIMS m/z 250.
5-Бром-N-метил-1-(пиридин-3-ил)-1H-пиразол-4-амин получали из соответствующего Boc-амина, как описано в примере 8, способ B: т.пл. 77,0-79,0°C; 1H ЯМР (400 МГц, CDCl3) δ 8,90 (д, J=2,0 Гц, 1H), 8,63 (д, J=3,9 Гц, 1H), 7,93 (ддд, J=8,2, 2,4, 1,5 Гц, 1H), 7,51 (с, 1H), 7,43 (дд, J=8,2, 4,8 Гц, 1H), 4,49 (с, 1H), 2,91 (с, 3H); ESIMS m/z 255 ([M+2]+).
5-Фтор-N,3-диметил-1-(пиридин-3-ил)-1H-пиразол-4-амин получали из соответствующего Boc-амина, как описано в примере 8, способ B: 1H ЯМР (400 МГц, CDCl3) δ 8,91 (т, J=2,1 Гц, 1H), 8,50 (дд, J=4,8, 1,5 Гц, 1H), 7,93 (ддт, J=8,3, 2,8, 1,5 Гц, 1H), 7,37 (ддд, J=8,3, 4,8, 0,7 Гц, 1H), 2,86 (д, J=1,6 Гц, 3H), 2,43 (с, 2H), 2,24 (с, 3H); EIMS m/z 206.
5-Бром-N,3-диметил-1-(пиридин-3-ил)-1H-пиразол-4-амин получали из соответствующего Boc-амина, как описано в примере 8, способ B: 1H ЯМР (400 МГц, CDCl3) δ 8,86 (дд, J=2,5, 0,5 Гц, 1H), 8,59 (дд, J=4,8, 1,5 Гц, 1H), 7,88 (ддд, J=8,2, 2,6, 1,5 Гц, 1H), 7,40 (ддд, J=8,2, 4,8, 0,7 Гц, 1H), 2,85 (с, 3H), 2,69 (с, 1H), 2,35 (с, 3H); ESIMS m/z 268 ([M+H]+).
5-Хлор-N,3-диметил-1-(пиридин-3-ил)-1H-пиразол-4-амин получали из соответствующего Boc-амина, как описано в примере 8, способ B: 1H ЯМР (400 МГц, CDCl3) δ 8,87 (д, J=2,3 Гц, 1H), 8,59 (дд, J=4,8, 1,3 Гц, 1H), 7,90 (ддд, J=8,2, 2,6, 1,5 Гц, 1H), 7,40 (ддд, J=8,2, 4,8, 0,6 Гц, 1H), 2,87 (с, 3H), 2,45-2,19 (м, 4H); EIMS m/z 223.
3-Хлор-1-(5-фторпиридин-3-ил)-N-метил-1H-пиразол-4-амин получали из соответствующего Boc-амина, как описано в примере 8, способ B: т.пл. 117,5-119,0°C; 1H ЯМР (400 МГц, CDCl3) δ 8,68 (д, J=1,1 Гц, 1H), 8,33 (д, J=2,5 Гц, 1H), 7,75 (дт, J=9,6, 2,4 Гц, 1H), 7,31 (с, 1H), 3,14 (с, 1H), 2,87 (с, 3H); ESIMS m/z 227 ([M]+).
3-Хлор-N-этил-1-(5-фторпиридин-3-ил)-1H-пиразол-4-амин получали из соответствующего Boc-амина, как описано в примере 8, способ B: 1H ЯМР (400 МГц, CDCl3) δ 8,70-8,63 (м, 1H), 8,32 (д, J=2,4 Гц, 1H), 7,74 (дт, J=9,7, 2,4 Гц, 1H), 7,31 (с, 1H), 3,11 (кв., J=7,2 Гц, 2H), 1,31 (т, J=7,1 Гц, 3H).
1-(5-Фторпиридин-3-ил)-N-метил-3-винил-1H-пиразол-4-амин получали из соответствующего Boc-амина, как описано в примере 8, способ B: 105,0-107,0°C; 1H ЯМР (400 МГц, CDCl3) δ 8,72 (с, 1H), 8,31 (д, J=2,5 Гц, 1H), 7,81 (дт, J=9,8, 2,4 Гц, 1H), 7,33 (с, 1H), 6,75 (дд, J=18,0, 11,6 Гц, 1H), 5,83 (дд, J=18,0, 1,1 Гц, 1H), 5,46 (дд, J=11,6, 1,1 Гц, 1H), 2,86 (с, 3H); ESIMS m/z 219 ([M+H]+).
3-Циклопропил-1-(5-фторпиридин-3-ил)-N-метил-1H-пиразол-4-амин получали из соответствующего Boc-амина, как описано в примере 8, способ B: т.пл. 118,0-119,5°C; 1H ЯМР (400 МГц, CDCl3) δ 8,66-8,58 (м, 1H), 8,23 (д, J=2,5 Гц, 1H), 7,75-7,68 (м, 1H), 7,25 (с, 1H), 3,09 (с, 1H), 2,86 (с, 3H), 1,78-1,63 (м, 1H), 0,99-0,90 (м, 4H); ESIMS m/z 233 ([M+H]+).
3-Хлор-1-(пиридин-3-ил)-1H-пиразол-4-амин получали из соответствующего Boc-амина, как описано в примере 8, способ B: т.пл. 137,9-139,9; 1H ЯМР (400 МГц, CDCl3) δ 8,84 (д, J=2,4 Гц, 1H), 8,50 (дд, J=4,7, 1,4 Гц, 1H), 7,95 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,52 (с, 1H), 7,37 (ддд, J=8,4, 4,7, 0,7 Гц, 1H), 3,18 (с, 2H); ESIMS m/z 196 ([M+H]+).
2-((3-Хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)амино)ацетонитрил получали из трет-бутил(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(цианометил)карбамата, как описано в примере 8, способ B: т.пл. 141-143°C; 1H ЯМР (300 МГц, CDCl3) δ 8,91 (д, J=2,7 Гц, 1H), 8,54 (дд, J=5,1, 1,8 Гц, 1H), 7,97 (м, 1H), 7,62 (с, 1H), 7,38 (дд, J=12,0, 7,5 Гц, 1H), 4,97 (д, J=6,9 Гц, 2H), 3,52 (м, 1H); EIMS m/z 235 ([M+1]+).
N-3-диметил-1-(пиримидин-5-ил)-1H-пиразол-4-амин получали, как описано в примере 8, способ B: т.пл. 139-143°C; 1H ЯМР (400 МГц, CDCl3) δ 9,02 (с, 2H), 9,00 (с, 1H), 7,30 (с, 1H), 2,87 (д, J=11,5 Гц, 3H), 2,27 (с, 3H); ESIMS m/z 190 ([M+H]).
3-Хлор-N-метил-1-(пиримидин-5-ил)1-1H-пиразол-4-амин получали, как описано в примере 8, способ B: т.пл. 111-114°C; 1H ЯМР (400 МГц, CDCl3) δ 9,09-9,04 (м, 1H), 9,02 (с, 2H), 7,30 (с, 1H), 3,14 (уш. с, 1H), 2,88 (с, 3H); ESIMS m/z 196 ([M+H]).
1-(5-Фтор-3-пиридил)-3-метил-N-(тридейтерометил)пиразол-4-амин получали из соединения 380 с использованием методики, описанной в примере 8, способ B: т.пл. 146-148°C; ИК (тонкая пленка) 1599 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,67 (с, 1H), 8,25 (д, J=2,5 Гц, 1H), 7,73 (дт, J=10,0, 2,3 Гц, 1H), 7,27 (с, 1H), 2,87 (с, 1H), 2,24 (с, 3H); ESIMS m/z 210 ([M+H]+).
3-Хлор-1-(3-пиридил)-N-(тридейтерометил)пиразол-4-амин получали из соединения 381 с использованием методики, описанной в примере 8, способ B: т.пл. 104-106°C; ИК (тонкая пленка) 1579 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,87 (д, J=1,9 Гц, 1H), 8,47 (д, J=4,7 Гц, 1H), 8,00-7,90 (м, 1H), 7,40-7,30 (м, 2H), 3,10 (с, 1H); ESIMS m/z 212 ([M+H]+).
3-Хлор-N-(циклопропилметил)-1-(пиридин-3-ил)-1H-пиразол-4-амин получали из соединения 361 с использованием методики, описанной в примере 8, способ B: т.пл. 82-83°C; 1H ЯМР (400 МГц, CDCl3) δ 8,86 (д, J=2,5 Гц, 1H), 8,47 (дд, J=4,7, 1,3 Гц, 1H), 7,95 (ддд, J=8,4, 2,7, 1,5 Гц, 1H), 7,38-7,32 (м, 2H), 3,22 (с, 1H), 2,90 (д, J=6,9 Гц, 2H), 1,23-1,06 (м, 1H), 0,65-0,53 (м, 2H), 0,31-0,19 (м, 2H),; ESIMS m/z 249 ([M+H]+).
3-Хлор-N-пропил-1-(пиридин-3-ил)-1H-пиразол-4-амин получали из соединения 360 с использованием методики, описанной в примере 8, способ B: т.пл. 92-94°C; 1H ЯМР (400 МГц, CDCl3) δ 8,86 (д, J=2,6 Гц, 1H), 8,47 (дд, J=4,7, 1,4 Гц, 1H), 7,95 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,35 (ддд, J=8,4, 4,7, 0,6 Гц, 1H), 7,33 (с, 1H), 3,22-2,94 (м, 3H), 1,75-1,52 (м, 2H), 1,02 (т, J=7,4 Гц, 3H); ESIMS m/z 237 ([M+H]+).
3-Хлор-1-(пиридин-3-ил)-N-(4,4,4-трифторбутил)-1H-пиразол-4-амин получали из соответствующего Boc-амина, как описано в примере 8, способ B: ИК (тонкая пленка) 3416, 3089 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,86 (д, J=2,5 Гц, 1H), 8,48 (дд, J=4,7, 1,3 Гц, 1H), 7,95 (ддд, J=8,3, 2,7, 1,4 Гц, 1H), 7,42-7,31 (множественные пики, 2H), 3,16 (дд, J=13,0, 6,5 Гц, 2H), 3,08 (д, J=5,6 Гц, 1H), 2,35-2,18 (м, 2H), 2,00-1,86 (м, 2H); ESIMS m/z 307 ([M+2H]+).
3-Хлор-1-(пиридин-3-ил)-N-(5,5,5-трифторпентил)-1H-пиразол-4-амин получали из соответствующего Boc-амина, как описано в примере 8, способ B: ИК (тонкая пленка) 3087 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,86 (д, J=2,5 Гц, 1H), 8,48 (дд, J=4,7, 1,4 Гц, 1H), 7,96 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,36 (ддд, J=8,3, 4,8, 0,6 Гц, 1H), 7,34 (с, 1H), 3,10 (с, 2H), 3,04 (с, 1H), 2,30-1,98 (м, 2H), 1,84-1,69 (множественные пики, 4H); 19F ЯМР (376 МГц, CDCl3) δ -66,28; ESIMS m/z 320 ([M+2H]+).
3-Хлор-N-(4-фторбутил)-1-(пиридин-3-ил)-1H-пиразол-4-амин получали из соответствующего Boc-амина, как описано в примере 8, способ B: т.пл. 82-83°C; ИК (тонкая пленка) 3348, 3086 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,86 (д, J=2,5 Гц, 1H), 8,47 (дд, J=4,7, 1,4 Гц, 1H), 7,95 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,38-7,33 (множественные пики, 2H), 4,58 (т, J=5,7 Гц, 1H), 4,50-4,42 (м, 1H), 3,11 (множественные пики, 3H), 1,90-1,76 (множественные пики, 4H); ESIMS m/z 269 ([M+H]+).
3-Хлор-N-изопропил-1-(пиридин-3-ил)-1H-пиразол-4-амин получали из соответствующего Boc-амина, как описано в примере 8, способ B: ИК (тонкая пленка) 3318, 1583 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,86 (д, J=2,7 Гц, 1H), 8,47 (дд, J=4,7, 1,4 Гц, 1H), 7,96 (ддд, J=8,4, 2,7, 1,5 Гц, 1H), 7,36 (ддд, J=8,3, 4,8, 0,7 Гц, 1H), 7,31 (с, 1H), 2,87 (д, J=6,8 Гц, 2H), 1,92 (дкв., J=13,4, 6,7 Гц, 1H), 1,02 (д, J=6,7 Гц, 6H); ESIMS m/z 251 ([M+H]+).
3-Хлор-N-(2-метоксиэтил)-1-(пиридин-3-ил)-1H-пиразол-4-амин получали из соответствующего Boc-амина, как описано в примере 8, способ B: ИК (тонкая пленка) 3364, 1485 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,86 (дд, J=2,7, 0,7 Гц, 1H), 8,48 (дд, J=4,7, 1,5 Гц, 1H), 7,96 (ддд, J=8,4, 2,7, 1,5 Гц, 1H), 7,38 (с, 1H), 7,38-7,34 (м, 1H), 3,68-3,59 (м, 2H), 3,49 (с, 1H), 3,42 (с, 3H), 3,24 (д, J=7,3 Гц, 2H); ESIMS m/z 253 ([M+H]+).
3-Хлор-N-((2,2-дифторциклопропил)метил)-1-(пиридин-3-ил)-1H-пиразол-4-амин получали из соответствующего Boc-амина, как описано в примере 8, способ B: 1H ЯМР (400 МГц, CDCl3) δ 8,87 (д, J=2,6 Гц, 1H), 8,49 (дд, J=4,7, 1,5 Гц, 1H), 7,96 (ддд, J=8,4, 2,7, 1,4 Гц, 1H), 7,41 (с, 1H), 7,37 (ддд, J=8,3, 4,7, 0,7 Гц, 1H), 3,19 (тд, J=15,5, 13,0, 6,8 Гц, 2H), 2,00-1,84 (м, 1H), 1,55 (м, 1H), 1,26 (с, 1H), 1,23-1,11 (м, 1H); 19F ЯМР (376 МГц, CDCl3) δ -128,61 (д, J=159,5 Гц), -143,58 (д, J=160,0 Гц); ESIMS m/z 285 ([M+H]+).
3-Хлор-N-(3-фторпропил)-1-(пиридин-3-ил)-1H-пиразол-4-амин получали из соответствующего Boc-амина, как описано в примере 8, способ B: ИК (тонкая пленка) 3359 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,87 (д, J=2,7 Гц, 1H), 8,48 (дд, J=4,7, 1,4 Гц, 1H), 7,95 (ддд, J=8,3, 2,6, 1,4 Гц, 1H), 7,39-7,34 (множественные пики, 2H), 4,63 (дт, J=47,2, 5,6 Гц, 2H), 3,25 (т, J=6,7 Гц, 2H), 3,18 (уш. с, 1H), 2,17-1,92 (м, 2H); ESIMS m/z 255 ([M+H]+).
N-аллил-3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-амин получали из соответствующего Boc-амина, как описано в примере 8, способ B: ИК (тонкая пленка) 3291 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,85 (д, J=2,6 Гц, 1H), 8,48 (дд, J=4,8, 1,5 Гц, 1H), 7,95 (ддд, J=8,3, 2,7, 1,4 Гц, 1H), 7,38-7,35 (м, 1H), 7,34 (с, 1H), 5,97 (ддт, J=17,3, 10,6, 5,5 Гц, 1H), 5,34 (дкв., J=17,2, 1,6 Гц, 1H), 5,23 (дкв., J=10,3, 1,5 Гц, 1H), 3,73 (дт, J=5,5, 1,6 Гц, 2H), 3,25 (с, 1H); ESIMS m/z 235 ([M+H]+).
2-((3-Хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)амино)этилацетат получали из соответствующего Boc-амина, как описано в примере 8, способ B: ИК (тонкая пленка) 3361, 1733 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,87 (с, 1H), 8,49 (д, J=4,7 Гц, 1H), 7,96 (ддд, J=8,3, 2,7, 1,4 Гц, 1H), 7,43 (с, 1H), 7,37 (дд, J=8,4, 4,7 Гц, 1H), 4,30 (дд, J=5,9, 4,8 Гц, 2H), 3,34 (т, J=5,5 Гц, 2H), 2,12 (с, 3H), 1,59 (с, 1H); ESIMS m/z 281 ([M+H]+).
3-Хлор-N-(2-фторэтил)-1-(пиридин-3-ил)-1H-пиразол-4-амин получали из соответствующего Boc-амина, как описано в примере 8, способ B: ИК (тонкая пленка) 3369 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,86 (д, J=2,7 Гц, 1H), 8,49 (дд, J=4,7, 1,4 Гц, 1H), 7,96 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,40 (с, 1H), 7,37 (дд, J=8,3, 4,7 Гц, 1H), 4,82-4,53 (м, 2H), 3,54-3,27 (множественные пики, 3H); ESIMS m/z 241 ([M+H]+).
3-Хлор-1-(пиридин-3-ил)-N-(2-(пирролидин-1-ил)этил)-1H-пиразол-4-амин получали из соответствующего Boc-амина, как описано в примере 8, способ B: ESIMS m/z 292 ([M+H]+).
3-Хлор-N-(2,2-дифторэтил)-1-(пиридин-3-ил)-1H-пиразол-4-амин получали из соответствующего Boc-амина, как описано в примере 8, способ B: ИК (тонкая пленка) 3295 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,87 (дд, J=2,8, 0,7 Гц, 1H), 8,51 (дд, J=4,7, 1,4 Гц, 1H), 7,95 (ддд, J=8,4, 2,7, 1,5 Гц, 1H), 7,45 (с, 1H), 7,37 (ддд, J=8,5, 4,7, 0,8 Гц, 1H), 5,96 (тт, J=55,9, 4,1 Гц, 1H), 3,69-3,26 (множественные пики, 3H); 19F ЯМР (376 МГц, CDCl3) δ -122,15; ESIMS m/z 259 ([M+H]+).
3-Хлор-1-(пиридин-3-ил)-N-(2,2,2-трифторэтил)-1H-пиразол-4-амин получали из соответствующего Boc-амина, как описано в примере 8, способ B: ИК (тонкая пленка) 3309 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,92-8,85 (м, 1H), 8,52 (дд, J=4,8, 1,4 Гц, 1H), 7,98 (ддд, J=8,4, 2,7, 1,5 Гц, 1H), 7,47 (с, 1H), 7,40 (ддд, J=8,4, 4,8, 0,7 Гц, 1H), 3,68 (кв., J=8,9 Гц, 2H), 3,49 (с, 1H); 19F ЯМР (376 МГц, CDCl3) δ -72,29; ESIMS m/z 277 ([M+H]+).
3-Хлор-N-(2-хлорэтил)-1-(пиридин-3-ил)-1H-пиразол-4-амин получали из соответствующего Boc-амина, как описано в примере 8, способ B: ИК (тонкая пленка) 3354 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,86 (дд, J=2,7, 0,7 Гц, 1H), 8,50 (дд, J=4,8, 1,5 Гц, 1H), 7,96 (ддд, J=8,3, 2,7, 1,4 Гц, 1H), 7,40 (с, 1H), 7,37 (ддд, J=8,5, 4,8, 0,8 Гц, 1H), 3,76 (дд, J=6,0, 5,4 Гц, 2H), 3,54 (с, 1H), 3,43 (т, J=5,7 Гц, 2H); ESIMS m/z 257 ([M+H]+).
3-Хлор-1-(пиридин-3-ил)-N-(3,3,3-трифторпропил)-1H-пиразол-4-амин получали из соответствующего Boc-амина, как описано в примере 8, способ B: ИК (тонкая пленка) 3366, 3081 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,87 (дд, J=2,6, 0,7 Гц, 1H), 8,50 (дд, J=4,7, 1,4 Гц, 1H), 7,96 (ддд, J=8,3, 2,7, 1,4 Гц, 1H), 7,40-7,35 (множественные пики, 2H), 3,38 (кв., J=6,8 Гц, 2H), 3,22 (т, J=6,7 Гц, 1H), 2,48 (кв. т, J=10,7, 7,0 Гц, 2H); 19F ЯМР (376 МГц, CDCl3) δ -64,99; ESIMS m/z 291 ([M+H]+).
N-(Бут-2-ин-1-ил)-3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-амин получали из соответствующего Boc-амина, как описано в примере 8, способ B: ИК (тонкая пленка) 3249, 3122 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,89 (дд, J=2,7, 0,7 Гц, 1H), 8,49 (дд, J=4,8, 1,5 Гц, 1H), 7,98 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,50 (с, 1H), 7,37 (ддд, J=8,4, 4,8, 0,8 Гц, 1H), 3,93-3,68 (м, 2H), 3,33 (с, 1H), 1,83 (т, J=2,4 Гц, 3H); ESIMS m/z 247 ([M+H]+).
3-Хлор-N-изобутил-1-(пиридин-3-ил)-1H-пиразол-4-амин получали, как описано в примере 8, способ B: 1H ЯМР (400 МГц, CDCl3) δ 8,86 (д, J=2,5 Гц, 1H), 8,47 (дд, J=4,7, 1,3 Гц, 1H), 7,95 (ддд, J=8,4, 2,7, 1,5 Гц, 1H), 7,35 (ддд, J=8,3, 4,7, 0,6 Гц, 1H), 7,31 (с, 1H), 3,11 (уш. с, 1H), 2,87 (т, J=6,5 Гц, 2H), 1,93 (дп, J=13,4, 6,7 Гц, 1H), 1,01 (д, J=6,7 Гц, 6H).
Пример 9: Получение изопропил(1-пиридин-3-ил-1H-пиразол-4-ил)амина
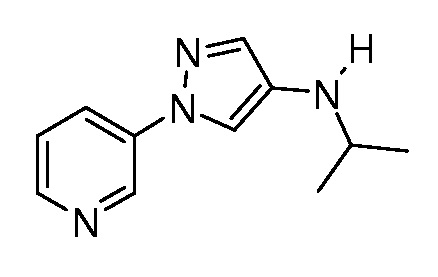
1-Пиридин-3-ил-1H-пиразол-4-иламин (0,6 г, 3,7 ммоль) растворяли в изопропилацетате (8,5 мл). К смеси добавляли ацетон (0,261 г, 4,5 ммоль), трифторуксусную кислоту (0,855 г, 7,5 ммоль) и триацетоксиборгидрид натрия (0,945 г, 4,5 ммоль). Реакционную смесь перемешивали в атмосфере азота при комнатной температуре в течение 4,5 часов, а затем гасили добавлением 10% раствора гидроксида натрия до достижение pH ~9. Слои разделяли, и экстрагировали водную фазу этилацетатом. Органические экстракты объединяли, сушили над сульфатом натрия и концентрировали досуха. Неочищенное вещество очищали методом хроматографии на силикагеле (5% метанол в дихлорметане) с получением указанного в заголовке соединения в виде не совсем белого твердого вещества (0,35 г, 46%): т.пл. 105-107°C; 1H ЯМР (300 МГц, CDCl3) δ 8,82 (д, J=2,2 Гц, 1H), 8,63 (дд, J=4,8, 1,5 Гц, 1H), 8,13 (д, J=1,8 Гц, 1H), 8,03 (д, J=2,7 Гц, 1H), 7,94-7,77 (м, 1H), 7,38 (дт, J=15,2, 7,6 Гц, 1H), 6,99 (т, 1H), 3,72 (м, 1H), 1,30 (т, J=10,0 Гц, 6H), ESIMS 214 m/z (M+1).
Пример 10: Получение пропил(1-пиридин-3-ил-1H-пиразол-4-иламина
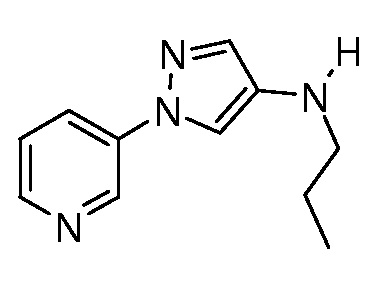
К 1-пиридин-3-ил-1H-пиразол-4-иламину (0,5 г, 3,12 ммоль) в дихлорметане (5 мл) добавляли пропиональдегид (0,18 г, 3,12 ммоль) и триацетоксиборгидрид натрия (0,99 г, 4,68 ммоль) и перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь поглощали дихлорметаном и промывали водой и солевым раствором. Органический слой сушили (MgSO4), фильтровали и концентрировали досуха. Неочищенное вещество очищали методом хроматографии на силикагеле, элюируя 0-5% MeOH в дихлорметане, а затем 0-100% этилацетатом в гексанах, с получением указанного в заголовке соединения в виде темного масла (0,05 г, 7%): 1H ЯМР (300 МГц, CDCl3) δ 8,92 (д, J=2,6 Гц, 1H), 8,48 (дд, J=4,7, 1,4 Гц, 1H), 8,00 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,47-7,40 (м, 2H), 7,37 (дд, J=8,3, 4,7 Гц, 1H), 3,04 (т, J=7,1 Гц, 3H), 1,92-1,46 (м, 2H), 1,03 (т, J=7,4 Гц, 3H).
Пример 11: Получение N-метил-N-(1-пиридин-3-ил-1H-пиразол-4-ил)изобутирамида (соединение 42)
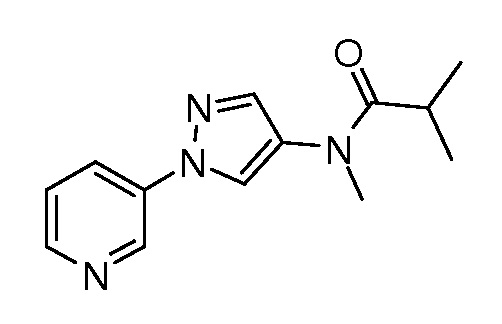
Раствор изобутирилхлорида (0,138 г, 1,3 ммоль) в дихлорэтане (1 мл) пипеткой по каплям добавляли к ледяной суспензии метил(1-пиридин-3-ил-1H-пиразол-4-ил)амина (0,15 г, 0,86 ммоль) в дихлорэтане (5 мл), перемешивали в течение 10 минут, а затем по каплям обрабатывали раствором 4-N,N-диметиламинопиридина (0,11 г, 0,9 ммоль) в дихлорэтане (1,5 мл). Охлаждающую баню удаляли спустя 30 минут, перемешивали в атмосфере азота при комнатной температуре в течение 14 часов, разбавляли дихлорэтаном (40 мл), промывали водой (30 мл), солевым раствором (10 мл), сушили над MgSO4 и очищали методом колоночной хроматографии с обращенной фазой с получением желтоватого клейкого вещества (0,114 г, 54%). 1H ЯМР (300 МГц, CDCl3) δ 9,01-8,93 (м, 1H), 8,67 (с, 0,4H), 8,61 (д, J=4,2 Гц, 0,6H), 8,54 (д, 0,4H), 8,08-8,02 (м, 1H), 7,96 (с, 0,6H), 7,80 (с, 0,4H), 7,70 (с, 0,6H), 7,47-7,37 (м, 1H), 3,49 (с, 1,2H), 3,26 (с, 2,8H), 3,06-2,98 (м, 0,4H), 2,86-2,70 (м, 0,6H), 1,25 (д, J=6,1 Гц, 2,4H), 1,09 (д, J=6,6 Гц, 3,6H), ESIMS m/z 245 ([M+1]).
Соединения 32-41, 43-52, 54-56, 59-61, 66, 73-75, 77-79, 82-85, 93-100, 113, 117-129, 131-134, 139, 140, 142-144, 148, 160, 163, 173-175, 184-186, 197, 198, 202, 208, 215-217, 252, 253, 277, 282-285, 287-290, 314-316, 347, 350, 351, 353-355, 365-367, 370, 388, 395, 399-403, 407, 409, 415-418, 444-449, 452-454, 462, 463, 465, 467-469, 496-498, 506, 507, 512, 525-527, 569, 577, 581, 591 и 592 получали из соответствующих аминов в соответствии с методиками, раскрытыми в примере 11.
Пример 12: Получение 4,4,4-трифтор-2-метил-N-(1-(пиридин-3-ил)-1H-пиразол-4-ил)бутанамида (соединение 65)
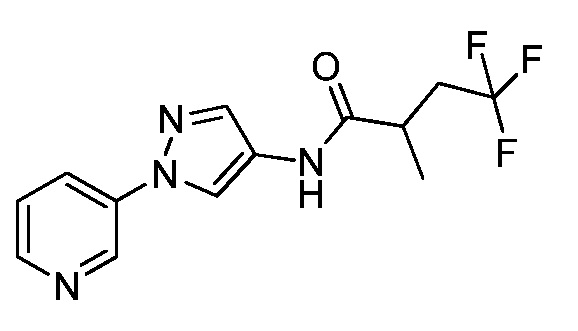
К раствору 1-(пиридин-3-ил)-1H-пиразол-4-амина (0,150 г, 0,93 ммоль) в дихлорэтане (1,8 мл) добавляли 4,4,4-трифтор-2-метилбутановую кислоту (0,14 г, 0,93 ммоль) и 4-N,N-диметиламинопиридин (0,23 г, 1,87 ммоль), а затем гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (0,36 г, 1,87 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали и очищали неочищенный продукт методом хроматографии на силикагеле, элюируя 0-5% MeOH в дихлорметане, с получением белого твердого вещества (0,15 г, 55%); т.пл. 140-145°C; 1H ЯМР (400 МГц, CDCl3) δ 9,00 (д, J=2,4 Гц, 1H), 8,62-8,47 (м, 2H), 8,01 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,68 (с, 1H), 7,53 (уш. с, 1H), 7,40 (ддд, J=8,3, 4,8, 0,6 Гц, 1H), 2,92-2,61 (м, 2H), 2,32-2,05 (м, 1H), 1,38 (д, J=6,6 Гц, 3H); ESIMS m/z 300 ([M+2]).
Соединения 53, 58, 62, 63, 72, 76, 80, 81, 107, 108, 136-138, 147, 151-159, 164-168, 176-179, 187-196, 201, 203-207, 209-214, 220, 224-249, 251, 259-275, 286, 292-296, 303-313, 323-326, 341-344, 356-359, 371, 378, 379, 382, 384, 419-426, 439-443, 455, 458-461, 464, 466, 476, 486, 490-493, 505, 508, 517, 528, 529, 536, 537, 539-541, 544, 545, 549-554, 572-577, 578, 579 и 580 получали из соответствующих аминов в соответствии с методиками, раскрытыми в примере 12.
Пример 13: Получение трет-бутил-1-(пиридин-3-ил)-1H-пиразол-4-илкарбамата (соединение 57)
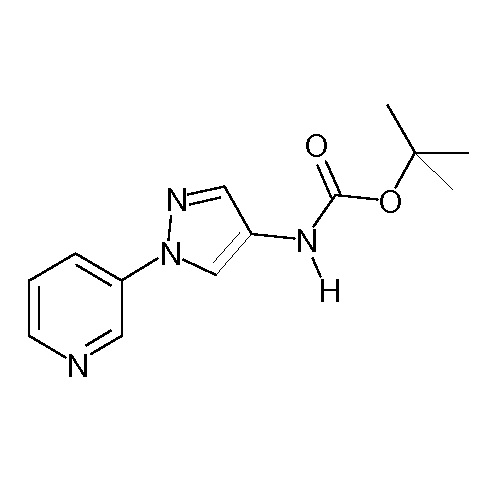
Способ A:
К раствору 1-(пиридин-3-ил)-1H-пиразол-4-амина (3 г, 18,73 ммоль) в дихлорметане (33,4 мл) добавляли триэтиламин (3,13 мл, 7,68 ммоль) и BOC-ангидрид (4,5 г, 20,60 ммоль). Полученный раствор перемешивали при комнатной температуре в течение ночи. Реакционную смесь распределяли между этилацетатом и водой. Органическую фазу сушили (MgSO4), фильтровали и концентрировали досуха. Неочищенный продукт очищали методом хроматографии на силикагеле, элюируя 0-100% этилацетатом в гексанах, с получением белого твердого вещества (2,0 г, 41%); т.пл. 108-112°C; 1H ЯМР (400 МГц, CDCl3) δ 9,02 (д, J=2,2 Гц, 1H), 8,51 (т, J=8,7 Гц, 1H), 8,37 (с, 1H), 8,30 (с, 1H), 7,98 (ддд, J=8,3, 2,4, 1,3 Гц, 1H), 7,68 (с, 1H), 7,36 (дд, J=8,2, 4,8 Гц, 1H), 1,52 (с, 9H); ESIMS m/z 261 ([M+1]).
Соединения 64 и 130 получали в соответствии с методиками, раскрытыми в примере 13, способ A.
Способ B:
К раствору 1-(пиридин-3-ил)-1H-пиразол-4-амина (0,1 г, 0,624 ммоль) и ди-трет-бутилдикарбоната (0,161 мл, 0,693 ммоль) в тетрагидрофуране (1,890 мл) и воде (0,568 мл) по каплям добавляли насыщенный водный бикарбонат натрия (0,572 мл, 0,687 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли водой и экстрагировали этилацетатом. Объединенные органические фазы концентрировали с получением трет-бутил-1-(пиридин-3-ил)-1H-пиразол-4-илкарбамата (135 мг, 0,519 ммоль, 83%), аналитические данные для которого соответствовали данным, представлены в примере 13, способ A.
Соединения 150, 172, 223 и 317 получали в соответствии с методиками, раскрытыми в примере 13, способ B. Соединения 172 и 317 также получали в соответствии с методиками, раскрытыми в примере 17. Указанные соединения, а также определенные другие соединения, получали альтернативными способами, дополнительно иллюстрирующими определенные варианты осуществления.
Пример 14: Получение трет-бутил-метил(1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамата (соединение 67)
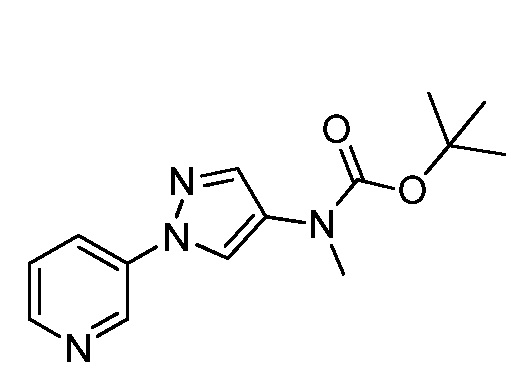
К раствору трет-бутил-1-(пиридин-3-ил)-1H-пиразол-4-илкарбамата (1,6 г, 6,15 ммоль) в DMF (30,7 мл) при 0°C одной порцией добавляли гидрид натрия (0,34 г, 8,61 ммоль, 60% дисперсия в минеральном масле), и перемешивали суспензию в течение 30 минут. Баню со льдом удаляли и перемешивали дополнительно в течение 30 минут. Одной порцией добавляли йодметан (0,46 мл, 7,38 ммоль) и перемешивали в течение ночи при комнатной температуре. Добавляли воду и этилацетат и разделяли полученную двухфазную смесь. Водный слой однократно экстрагировали этилацетатом. Объединенные органические экстракты промывали солевым раствором, сушили (MgSO4), фильтровали и концентрировали досуха. Неочищенный продукт очищали методом хроматографии на силикагеле, элюируя 0-35% этилацетатом в гексанах, с получением светло-желтого полутвердого вещества (0,85 г, 50%): ИК (KBr) 1703 см-1; 1H ЯМР(400 МГц, CDCl3) δ 8,98 (с, 1H), 8,52 (д, J=3,8 Гц, 1H), 8,32 (с, 0,5H), 8,13-7,97 (м, 1H), 7,84 (с, 0,5H), 7,74 (с, 1H), 7,39 (дд, J=8,0, 4,8 Гц, 1H), 3,30 (с, 3H), 1,56 (с, 9H); ESIMS m/z 275 ([M+H]).
Соединения 68, 86-92, 105, 106, 114-116, 141, 149, 161, 162, 199, 200, 254, 258, 291, 332, 352, 360, 361, 380, 381, 414, 430, 431, 450, 457, 474, 475, 485, 488, 510, 511, 515, 523 и 590 получали из соответствующих амидов в соответствии с методиками, раскрытыми в примере 14.
трет-Бутил-метил(3-метил-1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамат получали, как описано в примере 14: 1H ЯМР (400 МГц, CDCl3) δ 8,91 (д, J=2,5 Гц, 1H), 8,51 (дд, J=4,7, 1,3 Гц, 1H), 8,00 (ддд, J=8,3, 2,4, 1,4 Гц, 1H), 7,83 (с, 1H), 7,38 (дд, J=8,3, 4,7 Гц, 1H), 3,20 (с, 3H), 2,22 (с, 3H), 1,60-1,30 (м, 9H).
Пример 15: Получение N-этил-N-(1-метил-3-(пиридин-3-ил)-1H-пиразол-5-ил)изобутирамида (соединение 23)
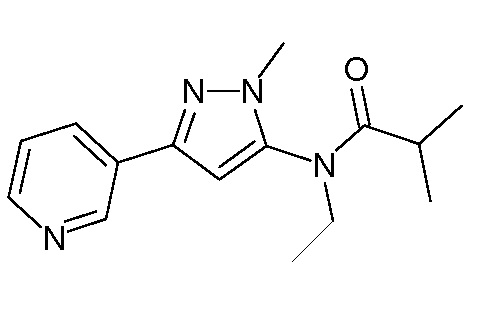
К раствору N-(1-метил-3-(пиридин-3-ил)-1H-пиразол-5-ил)изобутирамида (0,08 г, 0,33 ммоль) в DMF (0,66 мл) при 0°C одной порцией добавляли гидрид натрия (0,016 г, 0,39 ммоль, 60% дисперсия в минеральном масле) и перемешивали суспензию в течение 30 минут. Баню со льдом удаляли и перемешивали дополнительно в течение 30 минут. Одной порцией добавляли йодэтан (0,06 г, 0,39 ммоль) и перемешивали в течение ночи при комнатной температуре. Добавляли воду и этилацетат и разделяли полученную двухфазную смесь. Водный слой однократно экстрагировали этилацетатом. Объединенные органические экстракты промывали солевым раствором, сушили (MgSO4), фильтровали и концентрировали досуха. Неочищенный продукт очищали методом хроматографии на силикагеле с получением указанного в заголовке соединения в виде прозрачного масла (27,5 мг, 30%): 1H ЯМР (300 МГц, CDCl3) δ 9,00 (уш. с, 1H), 8,57 (с, 1H), 8,09 (дд, J=7,9 Гц, 1H), 7,34 (дд, 1H), 6,48 (с, 1H), 4,00 (м, 1H), 3,76 (с, 3H), 3,36 (м, 1H), 2,33 (м, 1H), 1,17 (т, J=7,1 Гц, 3H), 1,08 (т, J=6,7 Гц, 6H); ESIMS m/z 273 (M+H).
Соединение 22 получали в соответствии с методиками, раскрытыми в примере 15.
Пример 16: Получение гидробромида 5-бром-1H-пиразол-4-амина
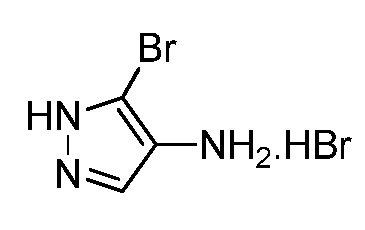
Смесь 4-нитро-1H-пиразола (10 г, 88 ммоль) и 5% палладия на Al2O3 (1 г) в смеси этанола (150 мл) и 50% водного HBr (50 мл) перемешивали встряхиванием в аппарате Парра в атмосфере водорода (давление 10 фунт./кв.дюйм) в течение 36 ч. Смесь фильтровали, и промывали катализатор этанолом. Фильтрат концентрировали в условиях вакуума с получением белого твердого вещества. Это твердое вещество суспендировали в 10 мл этанола. После формирования завихрения в колбе в течение 5 мин, добавляли диэтиловый эфир для завершения кристаллизации. Твердое вещество фильтровали, промывали эфиром и сушили в условиях высокого вакуума с получением 5-бром-1H-пиразол-4-амина гидробромида (18,1 г, выход 84%) в виде белого твердого вещества: т.пл. 248°C; 1H ЯМР (400 МГц, ДМСО-d6) δ 11,47 (с, 1H), 10,00 (с, 1H), 7,79 (с, 1H).
Пример 17: Получение трет-бутил(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамата (соединение 172)
Пример 17, стадия 1: Получение гидрохлорида 3-хлор-1H-пиразол-4-амина
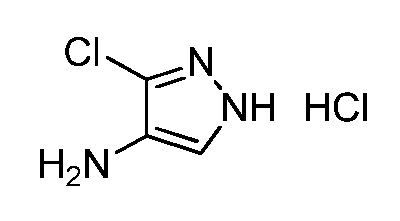
В трехгорлую круглодонную колбу объемом 2 л, оснащенную верхнеприводной мешалкой, датчиком температуры, капельной воронкой и впуском азота, добавляли этанол (600 мл) и 4-нитро-1H-пиразол (50,6 г, 447 ммоль). К этому раствору одной порцией добавляли конц. HCl (368 мл) (внимание: быстрое повышение температуры от 15°C до 39°C), и продували полученную смесь азотом в течение 5 минут. К смеси добавляли палладий на окиси алюминия (5% масс./масс.) (2,6 г, Alfa, черное твердое вещество) и перемешивали при комнатной температуре, добавляя по каплям триэтилсилан (208 г, 1789 ммоль) в течение 4 ч. Реакционную смесь, которая начинала медленно нагреваться от 35°C до 55°C в течение 2,0 ч, перемешивали всего в течение 16 ч и проводили вакуумное фильтрование через слой Celite® с получением двухфазной смеси. Смесь переносили в делительную воронку, нижний водный слой собирали и упаривали досуха на роторном испарителе (60°C, 50 мм рт.ст.) с добавлением ацетонитрила (3×350 мл). Полученное желтое твердое вещество суспендировали в ацетонитриле (150 мл) и оставляли отстаиваться в течение 2 ч при комнатной температуре, а затем на 1 ч при 0°C (в холодильнике). Твердые вещества фильтровали и промывали ацетонитрилом (100 мл) с получением указанного в заголовке соединения, гидрохлорида 3-хлор-1H-пиразол-4-амина (84 г, выход 97%, чистота 80%), в виде белого твердого вещества: т.пл. 190-193°C; 1H ЯМР (400 МГц, ДМСО-d6) δ 10,46-10,24 (уш. с, 2H), 8,03 (с, 0,54H), 7,75 (с, 0,46H), 5,95 (уш. с, 1H); 13C-ЯМР (101 МГц, ДМСО) δ 128,24, 125,97, 116,71.
Пример 17, стадия 2: Получение трет-бутил(3-хлор-1H-пиразол-4-ил)карбамата
В круглодонную колбу объемом 2 л добавляли гидрохлорид 3-хлор-1H-пиразол-4-амина (100 г, 649 ммоль) и THF (500 мл). К этой смеси добавляли ди-трет-бутилдикарбонат (156 г, 714 ммоль), а затем бикарбонат натрия (120 г, 1429 ммоль) и воду (50,0 мл). Смесь перемешивали в течение 16 ч, разбавляли водой (500 мл) и этилацетатом (500 мл) и переносили в делительную воронку. Получали три слоя: нижний - белый желатиноподобный осадок, средний - светло-желтая водная фаза, верхний - красновато-коричневая органическая фаза. Фазы разделяли, собирая вместе желатиноподобный осадок и водную фазу. Водную фазу экстрагировали этилацетатом (2×200 мл), этилацетатные экстракты объединяли, промывали солевым раствором (200 мл), сушили над безводным сульфатом натрия, фильтровали и упаривали на роторном испарителе с получением красновато-коричневого плотного масла (160 г). Плотное масло суспендировали в гексане (1000 мл) и перемешивали при 55°C в течение 2 ч. Получали светло-коричневую суспензию. Смесь охлаждали до 0°C, твердое вещество собирали путем вакуумного фильтрования и промывали гексаном (2×10 мл). Образец сушили на воздухе до постоянной массы с получением (3-хлор-1H-пиразол-4-ил)карбамата (102,97 г, выход 72%, чистота 80%) в виде светло-коричневого твердого вещества: т.пл. 137-138°C; 1H ЯМР (400 МГц, CDCl3) δ 10,69 (с, 1H), 7,91 (с, 1H), 1,52 (с, 9H).
Пример 17, стадия 3: Получение трет-бутил(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамата (соединение 172)
В сухую круглодонную колбу объемом 2 л, оснащенную механической мешалкой, впуском азота, термометром и обратным холодильником, загружали 3-йодпиридин (113,0 г, 551 ммоль), (3-хлор-1H-пиразол-4-ил)карбамат (100 г, 459 ммоль), фосфат калия (измельченный пестиком в ступке) (195 г, 919 ммоль) и хлорид меди (3,09, 22,97 ммоль). Добавляли ацетонитрил (1 л), а затем N1,N2-диметилэтан-1,2-диамин (101 г, 1149 ммоль) и нагревали смесь до 81°C в течение 4 часов. Смесь охлаждали до комнатной температуры и фильтровали через слой Celite®. Фильтрат переносили в колбу Эрленмейера объемом 4 л, оснащенную механической мешалкой, и разбавляли водой до общего объема, приблизительно равного 4 л. Смесь перемешивали в течение 30 минут при комнатной температуре, и собирали полученное твердое вещество путем вакуумного фильтрования. Твердое вещество промывали водой и сушили в печи в течение нескольких суток в условиях вакуума при 40°C до постоянной массы с получением трет-бутил(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамата (117,8 г, 87% выход, чистота 80%) в виде рыжеватого твердого вещества: т.пл. 140-143°C; 1H ЯМР (400 МГц, CDCl3) δ 8,96 (с, 1H), 8,53 (дд, J=4,7, 1,2 Гц, 1H), 8,36 (с, 1H), 7,98 (ддд, J=8,3, 2,7, 1,4 Гц, 1H), 7,38 (дд, J=8,3, 4,8 Гц, 1H), 6,37 (с, 1H), 1,54 (с, 9H); ESIMS (m/z) 338 ([M-t-Bu]+), 220 ([M-O-t-Bu]-).
Соединение 172 также получали в соответствии с методиками, раскрытыми в примере 13. Соединение 317 получали в соответствии с методиками, раскрытыми в примере 17, из трет-бутил(3-бром-1H-пиразол-4-ил)карбамата, а также в соответствии с методиками, раскрытыми в примере 13.
Пример 18: Получение 3-(3-метил-1H-пиразол-1-ил)пиридина и 3-(5-метил-1H-пиразол-1-ил)пиридина
К раствору 3-метил-1H-пиразола (10,99 г, 134 ммоль) в N,N-диметилформамиде (100 мл) при 0°C добавляли гидрид натрия (3,71 г, 154 ммоль, 60% дисперсия). Реакционную смесь перемешивали при 0°C в течение 2 часов. Добавляли 3-фторпиридин (10,0 г, 103 ммоль) и перемешивали реакционную смесь при 100°C в течение ночи. Реакционную смесь охлаждали до комнатной температуры и медленно добавляли воду. Смесь экстрагировали дихлорметаном, объединенные органические фазы промывали солевым раствором, концентрировали и подвергали хроматографии (0-100% этилацетат в гексанах) с получением 3-(3-метил-1H-пиразол-1-ил)пиридина (8,4 г, 52,77 ммоль, 51,2%) и 3-(5-метил-1H-пиразол-1-ил)пиридин (1,0 г, 6%). Аналитические данные обоих продуктов соответствовали таковым, приведенным для стадии 1 примера 6.
3-(3-Бром-1H-пиразол-1-ил)пиридин получали из 3-фторпиридина и 3-бромпиразола, полученного в соответствии с WO2008130021, как описано в примере 18: т.пл. 89,5-92,5°C; 1H ЯМР (400 МГц, CDCl3) δ 8,94 (д, J=2,4 Гц, 1H), 8,62-8,49 (м, 1H), 8,03 (ддд, J=8,3, 2,7, 1,4 Гц, 1H), 7,87 (д, J=2,5 Гц, 1H), 7,42 (дд, J=8,2, 4,7 Гц, 1H), 6,54 (д, J=2,5 Гц, 1H); ESIMS m/z 224 ([M]+).
Пример 19: Получение 3-хлор-1-(5-фторпиридин-3-ил)-1H-пиразол-4-амина
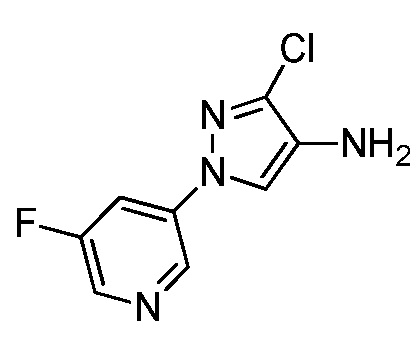
К перемешанному раствору гидрохлорида 5-хлор-1H-пиразол-4-амина (2 г, 12,99 ммоль) и карбоната цезия (8,89 г, 27,3 ммоль) в DMF (13 мл) добавляли 3,5-дифторпиридин (1,794 г, 15,58 ммоль) и нагревали смесь при 70°C в течение 12 ч. Смесь охлаждали до комнатной температуры и фильтровали. Твердые вещества промывали большим количеством этилацетата. Фильтраты промывали солевым раствором, сушили над безводным MgSO4 и концентрировали в условиях вакуума с получением коричневого твердого вещества. Это твердое вещество растворяли в этилацетате, полученный раствор насыщали гексанами с выпадением в осадок 3-хлор-1-(5-фторпиридин-3-ил)-1H-пиразол-4-амина (2,31 г, 10,32 ммоль, выход 79%) в виде коричневого твердого вещества: 1H ЯМР (400 МГц, ДМСО-d6) δ 8,89-8,82 (м, 1H), 8,45 (д, J=2,5 Гц, 1H), 8,07 (д, J=10,4 Гц, 1H), 7,94 (с, 1H), 4,51 (с, 2H); EIMS (m/z) 213 ([M+1]+).
3-Бром-1-(5-фторпиридин-3-ил)-1H-пиразол-4-амин получали из соответствующего пиразола, как описано в примере 19: т.пл. 164-165°C; 1H ЯМР (400 МГц, CDCl3) δ 8,65 (д, J=1,7 Гц, 1H), 8,36 (д, J=2,5 Гц, 1H), 7,76 (дд, J=5,9, 3,6 Гц, 1H), 7,48 (с, 1H), 3,22 (с, 2H), 13C ЯМР (101 МГц, CDCl3) δ 160,87, 158,30, 135,36, 135,13, 134,39, 134,35, 131,16, 123,31, 114,02, 112,77, 112,54; EIMS (m/z) 258 ([M+1]+).
Пример 20: Получение 1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-амина
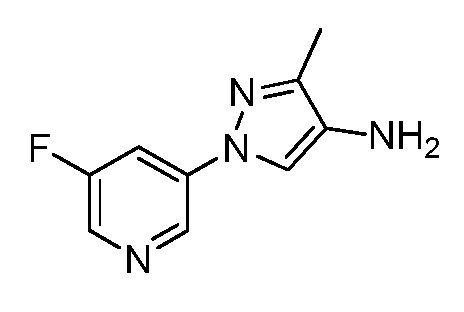
К раствору 3-фтор-5-(3-метил-4-нитро-1H-пиразол-1-ил)пиридина (3,133 г, 14,10 ммоль) в этаноле (28,2 мл) добавляли этилацетат до перехода всего исходного вещества в раствор. Раствор дегазировали, добавляли 10% палладированный уголь (0,750 г, 0,705 ммоль) и перемешивали реакционную смесь в аппарате Парра при 40 фунт./кв.дюйм в течение 3 часов. Раствор фильтровали через целит с этилацетатом и концентрировали с получением 1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-амина (2,000 г, 10,41 ммоль, 73,8%) в виде коричневого твердого вещества: т.пл. 136,0-138,0°C; 1H ЯМР (400 МГц, CDCl3) δ 8,67-8,59 (м, 1H), 8,27 (д, J=2,5 Гц, 1H), 7,73 (дт, J=9,9, 2,3 Гц, 1H), 7,45 (с, 1H), 3,01 (с, 2H), 2,28 (с, 3H); EIMS m/z 192.
1-(Пиридин-3-ил)-3-(трифторметил)-1H-пиразол-4-амин получали из соответствующего нитропиразола, как описано в примере 20: т.пл. 112,5-115,0°C; 1H ЯМР (400 МГц, CDCl3) δ 8,89 (д, J=2,4 Гц, 1H), 8,57 (дд, J=4,7, 1,4 Гц, 1H), 8,03 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,56 (д, J=0,7 Гц, 1H), 7,41 (ддд, J=8,3, 4,8, 0,7 Гц, 1H), 3,47-3,31 (м, 2H); EIMS m/z 228.
Пример 21: Получение 3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-амина
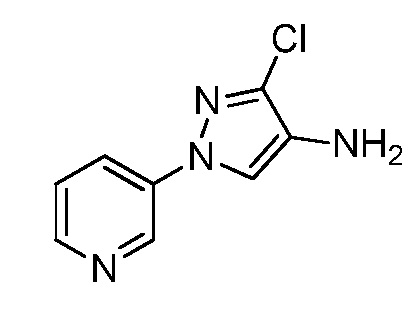
К 3-(3-хлор-4-нитро-1H-пиразол-1-ил)пиридину (0,95 г, 4,23 ммоль) в уксусной кислоте (8,46 мл), этаноле (8,46 мл) и воде (4,23 мл) добавляли железный порошок (1,18 г, 21,15 ммоль), и перемешивали реакционную смесь при комнатной температуре в течение 30 минут. К этой смеси осторожно добавляли 2M KOH и экстрагировали этилацетатом. Этилацетатные слои объединяли, сушили (MgSO4), фильтровали и концентрировали досуха. Неочищенное вещество очищали методом хроматографии на силикагеле (0-10% метанол в дихлорметане) с получением целевого продукта в виде белого твердого вещества (0,66 г, 80%): 1H ЯМР (400 МГц, CDCl3) δ 8,84 (д, J=2,6 Гц, 1H), 8,49 (дд, J=4,7, 1,4 Гц, 1H), 7,95 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,53 (с, 1H), 7,37 (ддд, J=8,4, 4,7, 0,6 Гц, 1H), 3,17 (уш. с, 2H).
3-Метил-1-(2-метилпиридин-3-ил)-1H-пиразол-4-амин получали, как описано в примере 21: 1H ЯМР (400 МГц, CDCl3) δ 8,48 (дд, J=4,8, 1,6 Гц, 1H), 7,62 (дд, J=8,0, 1,6 Гц, 1H), 7,23-7,18 (м, 2H), 2,91 (уш. с, 2H), 2,55 (с, 3H), 2,28 (с, 3H); EIMS m/z 188.
3-Фенил-1-(пиридин-3-ил)-1H-пиразол-4-амин получали из соответствующего нитропиразола, как описано в примере 21: ИК (тонкая пленка) 3324 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,94 (д, J=2,2 Гц, 1H), 8,47 (дд, J=4,7, 1,4 Гц, 1H), 8,07 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,87-7,80 (м, 2H), 7,60 (с, 1H), 7,50-7,44 (м, 2H), 7,40-7,34 (м, 2H), 3,86 (с, 2H); EIMS m/z 236.
3-Хлор-1-(5-фторпиридин-3-ил)-1H-пиразол-4-амин получали из соответствующего нитропиразола, как описано в примере 21: т.пл. 149,0-151,0°C; 1H ЯМР (400 МГц, CDCl3) δ 8,65 (д, J=1,6 Гц, 1H), 8,35 (д, J=2,4 Гц, 1H), 7,75 (дт, J=9,5, 2,4 Гц, 1H), 7,51 (с, 1H), 3,21 (с, 2H); ESIMS m/z 213 ([M]+).
3-Бром-1-(пиридин-3-ил)-1H-пиразол-4-амин получали из соответствующего нитропиразола, как описано в примере 21: т.пл. 143,0-146,0°C; 1H ЯМР (400 МГц, CDCl3) δ 8,85 (д, J=2,4 Гц, 1H), 8,50 (дд, J=4,7, 1,4 Гц, 1H), 7,96 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,49 (с, 1H), 7,37 (ддд, J=8,4, 4,7, 0,7 Гц, 1H), 3,21 (с, 2H); ESIMS m/z 241 ([M+2]+).
Пример 22: Получение трет-бутил(5-метил-1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамата (соединение 281)
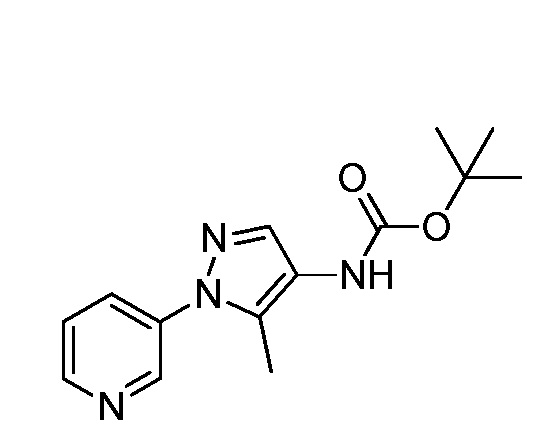
К раствору (E)-трет-бутил-1-(диметиламино)-3-оксобут-1-ен-2-илкарбамата (0,59 г, 2,58 ммоль) в этаноле (2,5 мл) добавляли дигидрохлорид 3-гидразинилпиридина (0,470 г, 2,58 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 16 часов. Реакционную смесь концентрировали и очищали методом хроматографии на силикагеле (0-100% этилацетат в гексанах) с получением указанного в заголовке соединения в виде оранжевой пены (0,235 г, 30%): ИК (тонкая пленка) 3268, 2978 и 1698 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,75 (дд, J=2,5, 0,5 Гц, 1H), 8,62 (дд, J=4,8, 1,5 Гц, 1H), 7,82 (ддд, J=8,2, 2,6, 1,5 Гц, 1H), 7,78 (с, 1H), 7,43 (ддд, J=8,1, 4,8, 0,6 Гц, 1H), 6,04 (с, 1H), 2,29 (с, 3H), 1,52 (с, 9H); ESIMS m/z 275 ([M+H]+), 273 ([M-H]-).
Пример 23: Получение трет-бутил-1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-илкарбамата (соединение 111) и трет-бутил-5-этокси-1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-илкарбамата (соединение 112)
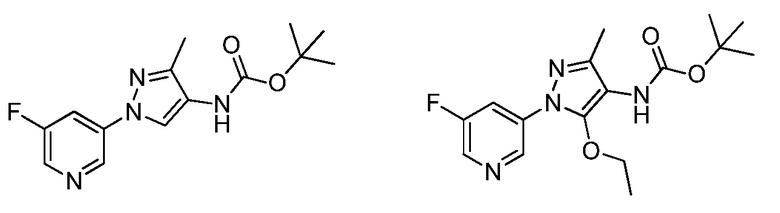
К раствору 3-фтор-5-(3-метил-4-нитро-1H-пиразол-1-ил)пиридина (3,133 г, 14,10 ммоль) в этаноле (28,2 мл) добавляли этилацетат до перехода всего исходного вещества в раствор. Раствор дегазировали, добавляли 10% палладированный уголь (0,750 г, 0,705 ммоль) и перемешивали реакционную смесь в аппарате Парра при давлении 40 фунт./кв.дюйм в течение 3 часов. Раствор фильтровали через целит с этилацетатом, и удаляли растворитель в условиях пониженного давления. Остаток растворяли в тетрагидрофуране (32,0 мл) и воде (9,61 мл). Добавляли ди-трет-бутилдикарбонат (2,52 г, 11,55 ммоль), а затем насыщенный водный бикарбонат натрия (9,54 мл, 11,45 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, разбавляли водой и экстрагировали этилацетатом. Объединенные органические фазы концентрировали и подвергали хроматографии (0-100% этилацетат в гексанах) с получением трет-бутил-1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-илкарбамата (1,673 г, 5,72 ммоль, 41,0%) в виде желтого твердого вещества и трет-бутил-5-этокси-1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-илкарбамата (0,250 г, 0,74 ммоль, 5,2%) в виде коричневого масла:
трет-Бутил-1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-илкарбамат (соединение 111): т.пл. 131,5-133,0°C; 1H ЯМР (400 МГц, CDCl3) δ 8,75 (с, 1H), 8,32 (д, J=2,5 Гц, 1H), 8,28 (с, 1H), 7,77 (дт, J=9,7, 2,4 Гц, 1H), 6,15 (с, 1H), 2,29 (с, 3H), 1,54 (с, 9H); ESIMS m/z 293 ([M+H]+);
трет-Бутил-5-этокси-1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-илкарбамат (соединение 112): ИК (тонкая пленка) 1698 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,88 (с, 1H), 8,34 (д, J=2,5 Гц, 1H), 7,83 (д, J=9,9 Гц, 1H), 5,99 (с, 1H), 4,37 (кв., J=7,0 Гц, 2H), 2,17 (с, 3H), 1,50 (с, 9H), 1,37 (т, J=7,1 Гц, 3H); ESIMS m/z 337 ([M+H]+).
Пример 24: Получение бис-трет-бутил(1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамата (соединение 595)
К раствору трет-бутил(1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамата (2,00 г, 7,68 ммоль) в безводном THF (21,95 мл) при 0°C одной порцией добавляли 60% гидрид натрия (0,33 г, 8,45 ммоль) и перемешивали при этой температуре в течение 30 минут. Затем к этой смеси одной порцией добавляли Boc-ангидрид (1,84 г, 8,45 ммоль) и перемешивали в течение 5 минут при 0°C. Водную баню удаляли, реакционную смесь нагревали до комнатной температуры и перемешивали еще в течение 30 минут. Реакционную смесь гасили добавлением воды и экстрагировали этилацетатом. Этилацетатные слои объединяли, сушили (MgSO4), фильтровали и концентрировали досуха. Неочищенное вещество очищали методом хроматографии на силикагеле (0-100% этилацетат в гексанах) с получением целевого продукта в виде белого твердого вещества (2,0 г, 72%): 1H ЯМР (400 МГц, CDCl3) δ 9,12-8,86 (м, 1H), 8,55 (дд, J=4,7, 1,4 Гц, 1H), 8,04 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 8,01 (д, J=0,5 Гц, 1H), 7,84-7,65 (м, 1H), 7,41 (ддд, J=8,3, 4,8, 0,7 Гц, 1H), 1,51 (с, 18H).
Пример 25: Получение 3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-амина (соединение 516)
К трет-бутил(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамату (2 г, 6,79 ммоль) в дихлорметане (6,79 мл) добавляли трифторуксусную кислоту (6,79 мл), и оставляли смесь перемешиваться при комнатной температуре в течение 2 часов. Добавляли толуол (12 мл) и концентрировали реакционную смесь почти досуха. Смесь вливали в делительную воронку, содержащую насыщенный водный бикарбонат натрия, и экстрагировали дихлорметаном. Объединенные органические слои концентрировали с получением 3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-амина (0,954 г, 4,90 ммоль, 72,2%) в виде белого твердого вещества: т.пл. 137,9-139,9°C; 1H ЯМР (400 МГц, CDCl3) δ 8,84 (д, J=2,4 Гц, 1H), 8,50 (дд, J=4,7, 1,4 Гц, 1H), 7,95 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,52 (с, 1H), 7,37 (ддд, J=8,4, 4,7, 0,7 Гц, 1H), 3,18 (с, 2H); ESIMS m/z 196 ([M+H]+).
Пример 26: Получение гидрохлорида N-аллил-1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-амина
К раствору трет-бутил-аллил(1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-ил)карбамата (908 мг, 2,73 ммоль) в диоксане (5 мл) добавляли HCl (1M в эфире) (13,65 мл, 13,65 ммоль) и перемешивали смесь при комнатной температуре в течение 48 ч. Полученное белое твердое вещество фильтровали, промывали эфиром и сушили в условиях вакуума с получением гидрохлорида N-аллил-1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-амина (688 мг, выход 94%) в виде белого твердого вещества: т.пл. 189-190°C; 1H ЯМР (400 МГц, CDCl3) δ 8,79-8,68 (м, 1H), 8,32-8,26 (м, 1H), 8,23 (с, 1H), 7,98-7,86 (м, 1H), 5,86-5,68 (м, 1H), 5,28-5,17 (м, 1H), 5,17-5,03 (м, 1H), 3,59 (д, J=6,2 Гц, 2H), 2,11 (с, 3H); EIMS (m/z) 233 ([M+1]+).
Гидрохлорид N-аллил-3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-амина получали, как описано в примере 26, из трет-бутил-аллил(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамата: т.пл. 172-174°C; 1H ЯМР (400 МГц, CDCl3) δ 9,20 (д, J=2,5 Гц, 1H), 8,65 (дд, J=5,3, 1,1 Гц, 1H), 8,61 (ддд, J=8,6, 2,5, 1,1 Гц, 1H), 8,24 (с, 1H), 7,93 (дд, J=8,6, 5,3 Гц, 1H), 3,66 (дт, J=5,5, 1,3 Гц, 2H); EIMS (m/z) 235 ([M+1]+).
Гидрохлорид N-аллил-3-метил-1-(пиридин-3-ил)-1H-пиразол-4-амина получали, как описано в примере 26, из трет-бутил-аллил(3-метил-1-(пиридин-3-ил)-1H-пиразол-4-ил): т.пл. 195-197°C; 1H ЯМР (400 МГц, ДМСО-d6) δ 9,12 (д, J=2,4 Гц, 1H), 8,58 (дд, J=5,0, 1,2 Гц, 1H), 8,48 (с, 1H), 8,43 (д, J=9,7 Гц, 1H), 7,77 (дд, J=8,4, 5,0 Гц, 1H), 6,04-5,92 (м, 1H), 5,44 (дд, J=17,2, 1,4 Гц, 1H), 5,32 (д, J=9,4 Гц, 1H), 3,81 (д, J=6,2 Гц, 2H); EIMS (m/z) 249 ([M-1]+).
Гидрохлорид 3-бром-1-(5-фторпиридин-3-ил)-N-метил-1H-пиразол-4-амина получали, как описано в примере 26, из трет-бутил-3-бром-1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил(метил)карбамата: т.пл. 167-168°C; 1H ЯМР (400 МГц, CDCl3) δ 8,93 (с, 1H), 8,50 (д, J=2,5 Гц, 1H), 8,23 (с, 1H), 8,14 (дт, J=10,4, 2,3 Гц, 1H), 2,73 (с, 3H).
Гидрохлорид 3-бром-N-метил-1-(пиридин-3-ил)-1H-пиразол-4-амина получали, как описано в примере 26, из трет-бутил(3-бром-1-(пиридин-3-ил)-1H-пиразол-4-ил)(метил)карбамата (160 мг, 0,45 ммоль) в диоксане (1 мл) с добавлением 4M HCl: т.пл. 226-228°C; 1H ЯМР (400 МГц, ДМСО-d6) δ 9,26-9,06 (д, J=2,6 Гц, 1H), 8,69-8,54 (м, 1H), 8,54-8,39 (д, J=8,0 Гц, 1H), 8,33-8,14 (с, 1H), 7,90-7,72 (м, 1H), 2,82-2,67 (с, 3H); EIMS (m/z) 253 ([M+1]+), 255 ([M+2H]+).
Гидрохлорид 3-бром-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амина получали, как описано в примере 26, из гидрохлорида 3-бром-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амина: т.пл. 216-217°C; 1H ЯМР (400 МГц, ДМСО-d6) δ 10,66-10,05 (с, 3H), 9,28-9,20 (д, J=2,5 Гц, 1H), 8,74-8,67 (м, 1H), 8,67-8,56 (м, 3H), 7,96-7,84 (м, 1H), 3,21-3,14 (м, 2H), 1,29-1,22 (м, 3H); EIMS (m/z) 267 ([M+1]+).
Гидрохлорид 3-хлор-N-(2-метоксиэтил)-1-(пиридин-3-ил)-1H-пиразол-4-амина получали, как описано в примере 26, из гидрохлорида трет-бутил(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(2-метоксиэтил)карбамата: т.пл. 157-158°C; 1H ЯМР (400 МГц, ДМСО) δ 9,22-9,14 (д, J=2,5 Гц, 1H), 8,70-8,65 (с, 1H), 8,65-8,59 (м, 1H), 8,38-8,33 (м, 1H), 8,00-7,89 (м, 1H), 3,59-3,50 (т, J=5,8 Гц, 2H), 3,32-3,27 (с, 3H), 3,22-3,14 (м, 2H); EIMS (m/z) 253 ([M+1]+).
Пример 27: Получение гидрохлорида 3-хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амина
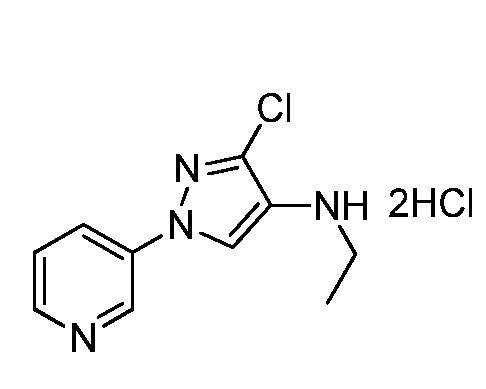
В трехгорлую круглодонную колбу объемом 500 мл, оснащенную магнитной мешалкой, добавляли раствор трет-бутил(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)карбамата (21 г, 65,1 ммоль) в 1,4-диоксане (35 мл). Полученный бледно-желтый раствор помещали на баню со льдом и охлаждали до 1°C. Одной порцией добавляли 4M раствор HCl в диоксане (65 мл, 260 ммоль). После перемешивания в течение 20 минут баню со льдом удаляли, и перемешивали суспензию еще в течение 16 часов при температуре окружающей среды. Реакционную смесь разбавляли 200 мл этилового эфира, твердое вещество фильтровали и промывали эфиром и помещали в вакуумную печь при 40°C на 18 часов. Указанное в заголовке соединение выделяли в виде бледно-желтого твердого вещества (18,2 г, 95%): 1H ЯМР (400 МГц, MeOD) δ 9,52 (д, J=2,5 Гц, 1H), 9,17 (с, 1H), 9,14 (ддд, J=8,7, 2,5, 1,1 Гц, 1H), 8,93 (ддд, J=5,7, 1,1, 0,6 Гц, 1H), 8,31 (ддд, J=8,7, 5,7, 0,5 Гц, 1H), 3,58 (кв., J=7,3 Гц, 2H), 1,48 (т, J=7,3 Гц, 3H); ESIMS m/z 223 ([M+H]+).
Дигидрохлорид 3-хлор-N-метил-1-(пиридин-3-ил)-1H-пиразол-4-амина получали, как описано в примере 27: 1H ЯМР (400 МГц, MeOD) δ 9,28 (д, J=2,5 Гц, 1H), 8,86 (ддд, J=8,7, 2,5, 1,2 Гц, 1H), 8,79-8,75 (м, 1H), 8,62 (с, 1H), 8,19 (ддд, J=8,7, 5,6, 0,5 Гц, 1H), 3,06 (с, 3H); 13C ЯМР (101 МГц, MeOD) δ 141,42, 139,58, 137,76, 134,58, 134,11, 129,33, 127,55, 122,14, 35,62; ESIMS m/z 209 ([M+H]+).
Пример 28: Получение 3-(4-нитро-3-фенил-1H-пиразол-1-ил)пиридина
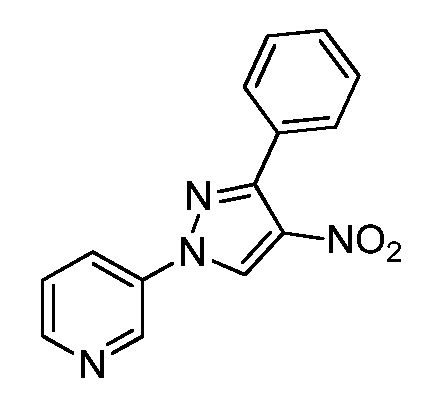
К суспензии фенилбороновой кислоты (0,546 г, 4,47 ммоль) в толуоле (6,63 мл) добавляли 3-(3-хлор-4-нитро-1H-пиразол-1-ил)пиридин (0,335 г, 1,492 ммоль), а затем этанол (3,31 мл) и 2M водный карбонат калия (1,492 мл, 2,98 ммоль). Раствор дегазировали с использованием вакуума, а затем продували азотом (трижды). К реакционной смеси добавляли тетракис(трифенилфосфин)палладий (0,086 г, 0,075 ммоль), и нагревали колбу в течение 16 часов при 110°C в атмосфере азота. Водный слой удаляли, и концентрировали органический слой. Неочищенный продукт очищали методом хроматографии на силикагеле (0-100% этилацетат в гексанах) с получением 3-(4-нитро-3-фенил-1H-пиразол-1-ил)пиридина (499 мг, 1,874 ммоль, 80%) в виде желтого твердого вещества: т.пл. 144,0-146,0°C; 1H ЯМР (400 МГц, CDCl3) δ 9,09 (д, J=2,3 Гц, 1H), 8,82 (с, 1H), 8,71 (дд, J=4,8, 1,4 Гц, 1H), 8,16 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,82-7,74 (м, 2H), 7,55-7,48 (м, 4H); EIMS m/z 266.
Пример 29: Получение 5-бром-1-(пиридин-3-ил)-1H-пиразол-4-ил(метил)карбамата (соединение 110)
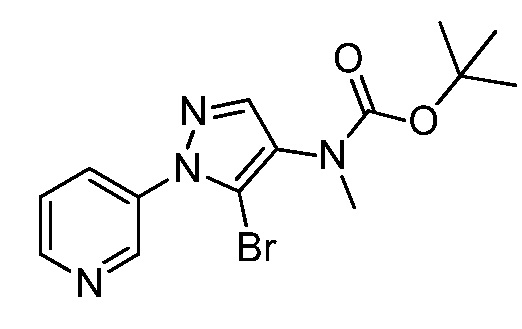
К трет-бутил-метил(1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамату (0,200 г, 0,729 ммоль) в дихлорэтане (3,65 мл) добавляли 1-бромпирролидин-2,5-дион (0,260 г, 1,458 ммоль) и перемешивали реакционную смесь в течение ночи при 50°C. Реакционную смесь концентрировали, разбавляли дихлорметаном и промывали водой и насыщенным водным тиосульфатом натрия. Органическую фазу концентрировали с получением трет-бутил-5-бром-1-(пиридин-3-ил)-1H-пиразол-4-ил(метил)карбамата (256 мг, 0,725 ммоль, 99%) в виде коричневого масла: ИК (тонкая пленка) 1697 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,89 (с, 1H), 8,68 (д, J=4,1 Гц, 1H), 7,93 (ддд, J=8,2, 2,5, 1,5 Гц, 1H), 7,69 (с, 1H), 7,46 (дд, J=8,1, 4,8 Гц, 1H), 3,22 (с, 3H), 1,44 (с, 9H); ESIMS m/z 352 ([M-H]-).
Пример 30: Получение бис-трет-бутил(5-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамата (соединение 109)
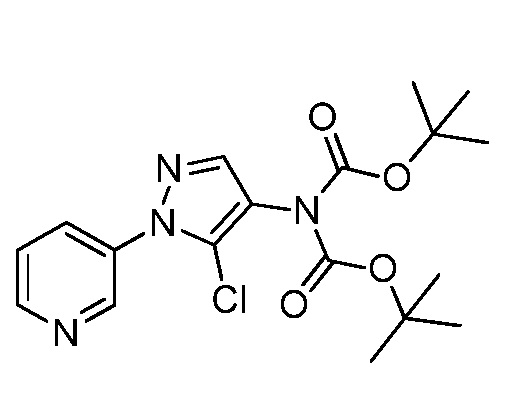
К бис-трет-бутил(1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамату (1,30 г, 3,61 ммоль) в ацетонитриле (21,22 мл) добавляли N-хлорсукцинимид (0,96 г, 7,21 ммоль) и перемешивали реакционную смесь при 45°C в течение 48 часов. Реакционную смесь охлаждали до комнатной температуры, выливали в воду и экстрагировали дихлорметаном. Дихлорметановые слои объединяли, пропускали через фазовый сепаратор для удаления воды и концентрировали досуха. Неочищенное вещество очищали методом хроматографии на силикагеле (0-60% этилацетат в гексанах) с получением целевого продукта в виде желтого твердого вещества (0,90 г, 63%): т.пл. 109-115°C; 1H ЯМР (400 МГц, CDCl3) δ 8,90 (д, J=2,3 Гц, 1H), 8,68 (дд, J=4,8, 1,5 Гц, 1H), 7,94 (ддд, J=8,2, 2,5, 1,5 Гц, 1H), 7,70 (с, 1H), 7,47 (дтд, J=11,0, 5,6, 5,5, 4,8 Гц, 1H), 1,49 (с, 18H); ESIMS m/z 395 ([M+H]+).
трет-Бутил(5-хлор-3-метил-1-(пиридин-3-ил)-1H-пиразол-4-ил)(метил)карбамат получали из соответствующего пиразола в дихлорэтане в качестве растворителя, как описано в примере 30: ESIMS m/z 324 ([M+H]+).
Соединения 110 (см. также методику, описанную в примере 29) и 146 получали из соответствующих пиразолов с использованием N-бромсукцинимида в соответствии с методиками, раскрытыми в примере 30.
трет-Бутил-5-бром-3-метил-1-(пиридин-3-ил)-1H-пиразол-4-ил(метил)карбамат получали из соответствующего пиразола в дихлорэтане, как описано в примере 30: 1H ЯМР (400 МГц, CDCl3) δ 8,88 (д, J=2,3 Гц, 1H), 8,69-8,60 (м, 1H), 7,96-7,86 (м, 1H), 7,48-7,39 (м, 1H), 3,18 (с, 3H), 2,26 (с, 3H), 1,60-1,36 (м, 9H); ESIMS m/z 368 ([M+H]+).
Пример 31: Получение бис-трет-бутил(5-фтор-1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамата (соединение 135)
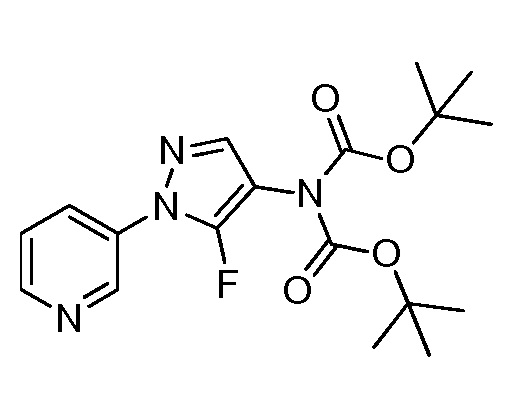
К раствору бис-трет-бутил(1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамата (0,075 г, 0,208 ммоль) в DMF (0,416 мл) и ацетонитриле (0,416 мл) добавляли Selecfluor® (0,184 г, 0,520 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение одной недели. Реакционную смесь концентрировали, добавляли насыщенный водный хлорид натрия и смесь экстрагировали этилацетатом. Объединенные органические фазы концентрировали и подвергали хроматографии (0-100% этилацетат в гексанах) с получением бис-трет-бутил(5-фтор-1-(пиридин-3-ил)-1H-пиразол-4-ил)карбамата (16 мг, 0,042 ммоль, 20,32%) в виде не совсем белого твердого вещества: 1H ЯМР (400 МГц, CDCl3) δ 8,97 (т, J=2,0 Гц, 1H), 8,61 (дд, J=4,8, 1,4 Гц, 1H), 7,99 (ддт, J=8,3, 2,6, 1,3 Гц, 1H), 7,57 (д, J=2,5 Гц, 1H), 7,44 (ддд, J=8,3, 4,8, 0,6 Гц, 1H), 1,50 (с, 18H); ESIMS m/z 379 ([M+H]+).
Трет-Бутил(5-фтор-3-метил-1-(пиридин-3-ил)-1H-пиразол-4-ил)(метил)карбамат получали, как описано в примере 31: 1H ЯМР (400 МГц, CDCl3) δ 8,94 (с, 1H), 8,57 (д, J=4,2 Гц, 1H), 7,96 (д, J=7,7 Гц, 1H), 7,41 (дд, J=7,9, 4,7 Гц, 1H), 3,17 (с, 3H), 2,23 (с, 3H), 1,58-1,40 (м, 9H); ESIMS m/z 307 ([M+H]+).
Пример 32: Получение N-циклопропил-3-метил-1-(пиридин-3-ил)-1H-пиразол-4-амина
Пример 32, стадия 1: Получение 3-(4-йод-3-метил-1H-пиразол-1-ил)пиридина
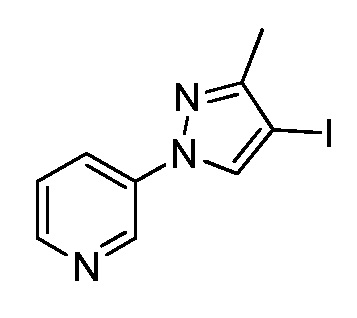
К смеси 3-(3-метил-1H-пиразол-1-ил)пиридина (6,7 г, 42,1 ммоль), йодноватой кислоты (2,96 г, 16,84 ммоль) и дийода (8,55 г, 33,7 ммоль) в уксусной кислоте (60,1 мл) добавляли концентрированную серную кислоту (3,74 мл, 21,04 ммоль). Реакционную смесь нагревали до 70°C в течение 30 минут. Реакционную смесь выливали на лед с тиосульфатом натрия и экстрагировали диэтиловым эфиром. Объединенные органические фазы промывали насыщенным водным бикарбонатом натрия. Затем органические фазы сушили с сульфатом магния, фильтровали и концентрировали в условиях вакуума. Твердый остаток растворяли в дихлорметане, наносили на колонку с 80 г силикагеля и элюировали 0-80% ацетона в гексанах с получением 3-(4-йод-3-метил-1H-пиразол-1-ил)пиридина (11,3 г, 35,7 ммоль, 85%) в виде белого твердого вещества: т.пл. 131°C; 1H ЯМР (400 МГц, CDCl3) δ 8,95-8,85 (м, 1H), 8,52 (дд, J=4,8, 1,4 Гц, 1H), 8,00-7,94 (м, 1H), 7,91 (с, 1H), 7,38 (ддд, J=8,3, 4,8, 0,7 Гц, 1H), 2,34 (с, 3H); EIMS m/z 285.
Пример 32, стадия 2: Получение N-циклопропил-3-метил-1-(пиридин-3-ил)-1H-пиразол-4-амина
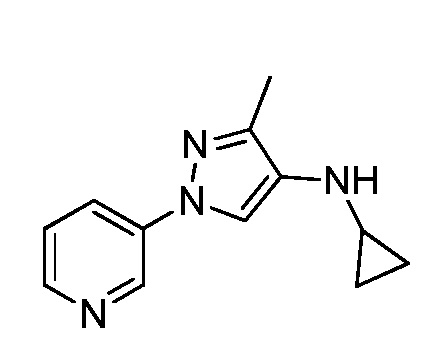
К раствору 3-(4-йод-3-метил-1H-пиразол-1-ил)пиридина (2,0 г, 7,02 ммоль) в диметилсульфоксиде (7,02 мл) добавляли 1-(5,6,7,8-тетрагидрохинолин-8-ил)этанон (0,246 г, 1,403 ммоль), циклопропанамин (0,486 мл, 7,02 ммоль), карбонат цезия (6,86 г, 21,05 ммоль) и бромид меди(I) (0,101 г, 0,702 ммоль). Реакционную смесь перемешивали при 35°C в течение 2 суток. Реакционную смесь разбавляли водой и экстрагировали дихлорметаном. Объединенные органические фазы промывали солевым раствором, концентрировали и подвергали хроматографии (0-100% этилацетат в гексанах) с получением N-циклопропил-3-метил-1-(пиридин-3-ил)-1H-пиразол-4-амина (269 мг, 1,255 ммоль, 17,90%) в виде желтого твердого вещества: т.пл. 104,0-107,0°C; 1H ЯМР (400 МГц, CDCl3) δ 8,89 (дд, J=2,7, 0,5 Гц, 1H), 8,41 (дд, J=4,7, 1,4 Гц, 1H), 7,96 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,51 (с, 1H), 7,33 (ддд, J=8,3, 4,7, 0,7 Гц, 1H), 3,42 (с, 1H), 2,53-2,42 (м, 1H), 2,22 (с, 3H), 0,72-0,65 (м, 2H), 0,60-0,53 (м, 2H); ESIMS m/z 215 ([M+H]+).
3-Метил-N-(3-(метилтио)пропил)-1-(пиридин-3-ил)-1H-пиразол-4-амин получали, как описано в примере 32: ИК (тонкая пленка) 3298 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,87 (д, J=2,3 Гц, 1H), 8,40 (дд, J=4,7, 1,4 Гц, 1H), 7,93 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,35 (с, 1H), 7,34-7,29 (м, 1H), 3,16 (т, J=6,8 Гц, 2H), 2,89 (с, 1H), 2,64 (т, J=7,0 Гц, 2H), 2,25 (с, 3H), 2,13 (с, 3H), 1,95 (п, J=6,9 Гц, 2H); ESIMS m/z 263 ([M+H]+).
3-Метил-N-(2-метил-3-(метилтио)пропил)-1-(пиридин-3-ил)-1H-пиразол-4-амин получали, как описано в примере 32: ИК (тонкая пленка) 3325 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,86 (д, J=2,5 Гц, 1H), 8,40 (дд, J=4,7, 1,2 Гц, 1H), 7,93 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,35 (с, 1H), 7,32 (ддд, J=8,3, 4,7, 0,5 Гц, 1H), 3,12 (дд, J=11,5, 6,1 Гц, 1H), 2,94 (дд, J=11,9, 6,6 Гц, 1H), 2,62 (дд, J=12,9, 6,9 Гц, 1H), 2,52 (дд, J=12,9, 6,2 Гц, 1H), 2,26 (с, 3H), 2,14 (с, 3H), 2,12-2,02 (м, 1H), 1,11 (д, J=6,8 Гц, 3H); EIMS m/z 276.
Пример 33: Получение трет-бутил(3-циклопропил-1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)карбамата (соединение 434) и трет-бутил(1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)карбамата (соединение 489)
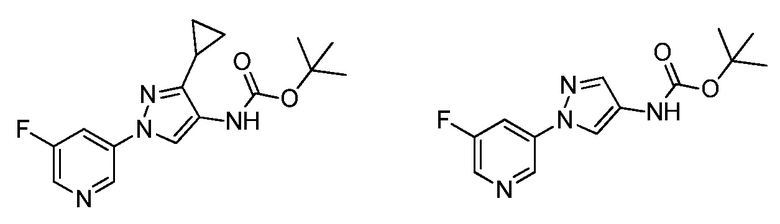
К суспензии 2-циклопропил-4,4,5,5-тетраметил-1,3,2-диоксаборолана (1,087 г, 6,47 ммоль) в толуоле (13,69 мл) добавляли трет-бутил(3-бром-1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)карбамат (1,1 г, 3,08 ммоль), а затем этанол (6,84 мл) и 2M водный карбонат калия (3,08 мл, 6,16 ммоль). Раствор дегазировали с использованием вакуума, а затем продували азотом (трижды). К реакционной смеси добавляли тетракис(трифенилфосфин)палладий (0,178 г, 0,154 ммоль), и нагревали колбу в течение 36 часов при 100°C в атмосфере азота. Добавляли воду (5 мл) и экстрагировали смесь этилацетатом. Объединенные органические фазы концентрировали и подвергали хроматографии (0-100% этилацетат в гексанах) с получением трет-бутил(3-циклопропил-1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)карбамата (705 мг, 2,215 ммоль, выход 71,9%) в виде желтого твердого вещества и трет-бутил(1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)карбамата (242 мг, 0,870 ммоль, выход 28,2%) в виде желтого твердого вещества.
трет-Бутил(3-циклопропил-1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)карбамат: т.пл. 156,5-158,0°C; 1H ЯМР (400 МГц, CDCl3) δ 8,73 (с, 1H), 8,30 (д, J=2,5 Гц, 1H), 8,27 (с, 1H), 7,76 (дт, J=9,8, 2,4 Гц, 1H), 6,43 (с, 1H), 1,55 (с, 9H), 1,01-0,91 (м, 4H); ESIMS m/z 319 ([M+H]+).
(1-(5-Фторпиридин-3-ил)-1H-пиразол-4-ил)карбамат: т.пл. 121,0-123,0°C; 1H ЯМР (300 МГц, CDCl3) δ 8,78 (с, 1H), 8,37 (с, 1H), 8,28 (с, 1H), 7,81 (д, J=9,6 Гц, 1H), 7,59 (с, 1H), 6,44 (с, 1H), 1,53 (с, 9H), ESIMS m/z 278 ([M]+).
Соединения 340 и 404 получали, как описано в примере 33.
Пример 34: Получение трет-бутил(3-этил-1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)(метил)карбамата (соединение 408)
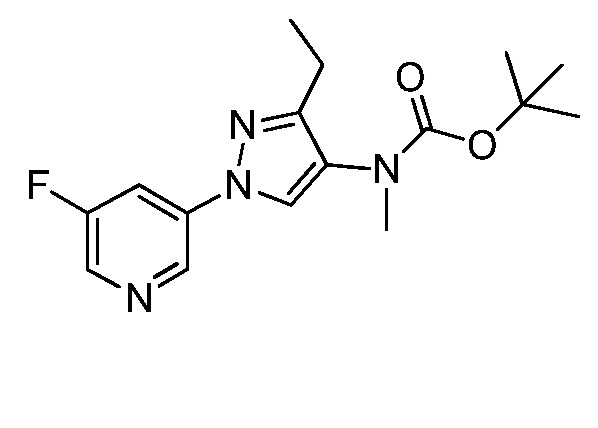
В продутый N2 раствор трет-бутил(1-(5-фторпиридин-3-ил)-3-винил-1H-пиразол-4-ил)(метил)карбамата (0,730 г, 2,293 ммоль) в метаноле (15,29 мл) добавляли 10% палладированный уголь (0,036 г, 0,339 ммоль). Реакционную смесь продували водородом, и проводили реакцию под давлением 80 фунт./кв.дюйм водорода при комнатной температуре в течение 60 часов. В реакции получали менее чем 20% преобразование. Реакционную смесь фильтровали через целит, концентрировали, повторно растворяли в этилацетате (4 мл) и переносили в автоклав. Реакционную смесь нагревали при 50°C при давлении 600 фунт./кв.дюйм водорода в течение 20 часов. Получали 50% завершение реакции. Добавляли метанол (1 мл) и 10% палладированный уголь (36 мг) и нагревали реакционную смесь при 80°C при давлении 650 фунт./кв. дюйм водорода в течение 20 часов. Реакционную смесь фильтровали через целит и концентрировали с получением трет-бутил(3-этил-1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)(метил)карбамата (616 мг, 1,923 ммоль, выход 84%) в виде желтого масла: ИК (тонкая пленка) 1692 см-1; 1H ЯМР (300 МГц, CDCl3) δ 8,71 (т, J=1,4 Гц, 1H), 8,35 (д, J=2,6 Гц, 1H), 7,83 (дт, J=9,5, 2,3 Гц, 2H), 3,18 (с, 3H), 2,65 (кв., J=7,5 Гц, 2H), 1,44 (с, 9H), 1,25 (т, J=7,1 Гц, 3H); EIMS m/z 320.
Пример 35: Получение N-(1-(5-фторпиридин-3-ил)-3-формил-1H-пиразол-4-ил)изобутирамида (соединение 560)
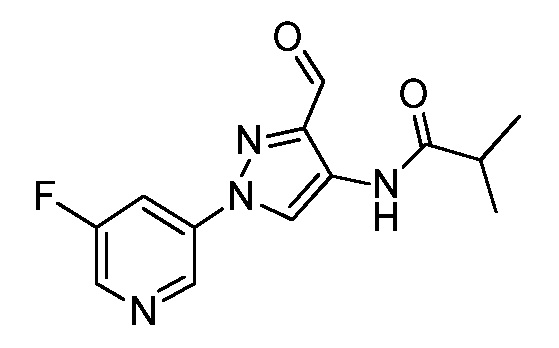
К раствору N-(1-(5-фторпиридин-3-ил)-3-винил-1H-пиразол-4-ил)изобутирамида (0,706 г, 2,57 ммоль) в тетрагидрофуране (12,87 мл) и воде (12,87 мл) добавляли тетроксид осмия (0,164 мл, 0,026 ммоль). Спустя 10 минут при комнатной температуре, порциями в течение 3 минут добавляли перйодат натрия (1,101 г, 5,15 ммоль) и перемешивали полученный раствор при комнатной температуре. Спустя 18 часов раствор вливали в 10 мл воды и экстрагировали дихлорметаном (3×10 мл). Объединенные органические слои сушили, концентрировали и подвергали хроматографии (0-100% этилацетат в гексанах) с получением N-(1-(5-фторпиридин-3-ил)-3-формил-1H-пиразол-4-ил)изобутирамида (626 мг, 2,266 ммоль, 88% выход) в виде желтого твердого вещества: т.пл. 140,0-142,0°C; 1H ЯМР (300 МГц, CDCl3) δ 10,12 (с, 1H), 9,14 (с, 1H), 8,90 (д, J=2,0 Гц, 1H), 8,82 (с, 1H), 8,51 (д, J=2,5 Гц, 1H), 7,92 (дт, J=9,2, 2,4 Гц, 1H), 2,65 (дт, J=13,8, 6,9 Гц, 1H), 1,31 (д, J=6,9 Гц, 6H); ESIMS m/z 277 ([M+H]+).
Соединение 369 получали в соответствии с методиками, раскрытыми в примере 35.
Пример 36: Получение N-(1-(5-фторпиридин-3-ил)-3-(гидроксиметил)-1H-пиразол-4-ил)изобутирамида (соединение 435) и N-(1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)изобутирамида (соединение 436)
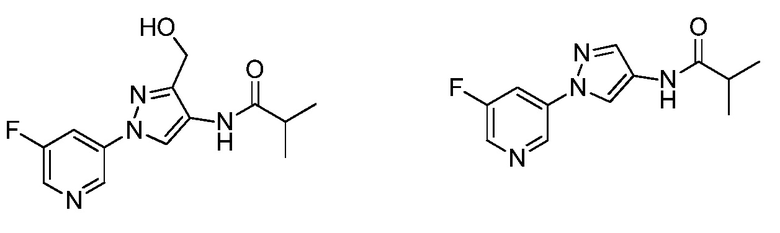
К раствору N-(1-(5-фторпиридин-3-ил)-3-формил-1H-пиразол-4-ил)изобутирамида (0,315 г, 1,140 ммоль) в метаноле (5,70 мл) при 0°C добавляли боргидрид натрия (0,086 г, 2,280 ммоль). Реакционную смесь перемешивали при 0°C в течение 2 часов и при комнатной температуре в течение 20 часов. Добавляли 0,5M HCl, реакционную смесь нейтрализовали насыщенным водным бикарбонатом натрия, и экстрагировали смесь дихлорметаном. Органические фазы концентрировали и подвергали хроматографии (0-100% этилацетат в гексанах) с получением N-(1-(5-фторпиридин-3-ил)-3-(гидроксиметил)-1H-пиразол-4-ил)изобутирамида (180 мг, 0,647 ммоль, 56,7%) в виде белого твердого вещества и N-(1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)изобутирамида (9 мг, 0,036 ммоль, 3,18%) в виде белого твердого вещества.
N-(1-(5-фторпиридин-3-ил)-3-(гидроксиметил)-1H-пиразол-4-ил)изобутирамид: т.пл. 144,0-146,0°C; 1H ЯМР (400 МГц, CDCl3) δ 8,74 (д, J=1,1 Гц, 1H), 8,64 (с, 1H), 8,37-8,29 (м, 2H), 7,74 (дт, J=9,5, 2,3 Гц, 1H), 4,95 (д, J=3,0 Гц, 2H), 3,21-3,06 (м, 1H), 2,63-2,48 (м, 1H), 1,26 (д, J=6,9 Гц, 6H); ESIMS m/z 279 ([M+H]+).
N-(1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)изобутирамид: ИК (тонкая пленка) 1659 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,79 (д, J=1,2 Гц, 1H), 8,60 (с, 1H), 8,38 (д, J=2,5 Гц, 1H), 7,81 (дт, J=9,5, 2,3 Гц, 1H), 7,68 (с, 1H), 7,54 (с, 1H), 2,63-2,51 (м, 1H), 1,28 (д, J=6,9 Гц, 6H); ESIMS m/z 249 ([M+H]+).
Пример 37: Получение N-(3-(хлорметил)-1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)изобутирамида (соединение 561)
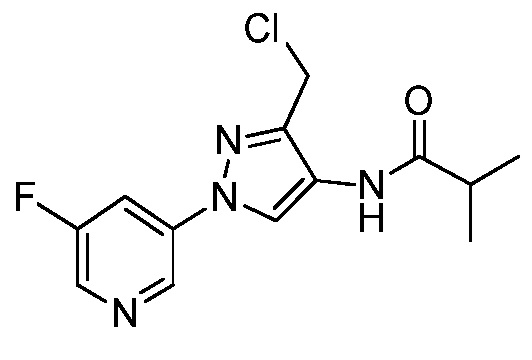
К раствору N-(1-(5-фторпиридин-3-ил)-3-(гидроксиметил)-1H-пиразол-4-ил)изобутирамида (0,100 г, 0,359 ммоль) в дихлорметане (3,59 мл) добавляли тионилхлорид (0,157 мл, 2,151 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 часов. Добавляли насыщенный водный бикарбонат натрия и экстрагировали смесь дихлорметаном. Объединенные органические фазы промывали солевым раствором и концентрировали с получением N-(3-(хлорметил)-1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)изобутирамида (100 мг, 0,337 ммоль, выход 94%) в виде белого твердого вещества: т.пл. 172,0-177,0°C; 1H ЯМР (400 МГц, CDCl3) δ 8,79 (с, 1H), 8,67 (с, 1H), 8,40 (с, 1H), 7,80 (дт, J=9,4, 2,3 Гц, 1H), 7,42 (с, 1H), 4,77 (с, 2H), 2,63 (гепт, J=6,9 Гц, 1H), 1,30 (д, J=6,9 Гц, 6H); ESIMS m/z 298 ([M+H]+).
Пример 38: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-метоксиацетамида (соединение 512) (см. также пример 11)
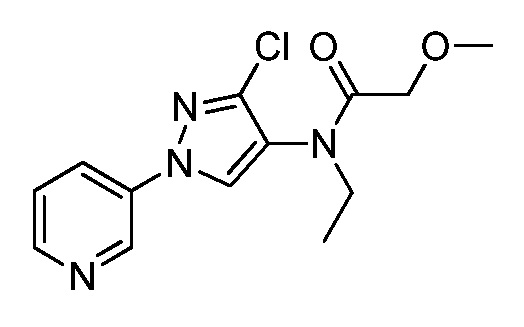
К раствору дигидрохлорида 3-хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амина (0,130 г, 0,502 ммоль) в DCM (2,508 мл) добавляли N-этил-N-изопропилпропан-2-амин (0,257 мл, 1,505 ммоль), а затем 2-метоксиацетилхлорид (0,109 г, 1,003 ммоль), и перемешивали реакционную смесь при температуре окружающей среды в течение 16 часов. Реакционную смесь гасили добавлением насыщенного бикарбоната натрия. Органический слой экстрагировали DCM. Органический слой сушили над сульфатом натрия, фильтровали, концентрировали и очищали методом хроматографии на силикагеле (0-100% этилацетат в гексанах) с получением указанного в заголовке соединения в виде бледно-желтого масла (0,12 г, 77%): ИК (тонкая пленка) 3514, 3091, 2978, 1676 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,96 (д, J=2,4 Гц, 1H), 8,63 (д, J=3,8 Гц, 1H), 8,09-8,03 (м, 1H), 7,99 (с, 1H), 7,47 (дд, J=8,3, 4,8 Гц, 1H), 3,88 (с, 2H), 3,77-3,65 (м, 2H), 3,40 (с, 3H), 1,18 (т, J=7,2 Гц, 3H); ESIMS m/z 295 ([M+H]+).
Соединения 71, 478, 481, 483-484 и 543 получали в соответствии с методиками, раскрытыми в примере 38.
Пример 39: Получение N-(3-хлор-1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-метил-3-(метилтио)бутанамида (соединение 182) и (Z)-N-(3-хлор-1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-метилбут-2-енамида (соединение 183)
К раствору 2-метил-3-(метилтио)бутановой кислоты (0,154 г, 1,039 ммоль) в дихлорметане (1 мл) при комнатной температуре добавляли 1 каплю диметилформамида. По каплям добавляли оксалилдихлорид (0,178 мл, 2,078 ммоль) и перемешивали реакционную смесь при комнатной температуре в течение ночи. Растворитель удаляли в условиях пониженного давления. Остаток повторно растворяли в дихлорметане (1 мл), и удаляли растворитель в условиях пониженного давления. Остаток повторно растворяли в дихлорметане (0,5 мл), добавляли раствор к раствору 3-хлор-N-этил-1-(5-фторпиридин-3-ил)-1H-пиразол-4-амина (0,100 г, 0,416 ммоль) и 4-диметиламинопиридина (0,254 г, 2,078 ммоль) в дихлорметане (1,5 мл) и перемешивали при комнатной температуре в течение ночи. Растворитель удаляли в условиях пониженного давления, и очищали остаток методом хроматографии (0-100% этилацетат в гексанах) с получением N-(3-хлор-1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-метил-3-(метилтио)бутанамида (34 мг, 0,092 ммоль, 22,06%) в виде тусклого желтого масла и (Z)-N-(3-хлор-1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-метилбут-2-енамида (38 мг, 0,118 ммоль, 28,3% выход) в виде желтого масла.
N-(3-хлор-1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-метил-3-(метилтио)бутанамид: ИК (тонкая пленка) 1633 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,79 (д, J=2,0 Гц, 0,66H), 8,77 (д, J=2,0 Гц, 0,33H), 8,50 (д, J=2,6 Гц, 0,33H), 8,49 (д, J=2,5 Гц, 0,66H), 8,08 (с, 0,66H), 7,95 (с, 0,33H), 7,92-7,81 (м, 1H), 4,03-3,46 (м, 2H), 3,03-2,78 (м, 1H), 2,59-2,33 (м, 1H), 2,04 (с, 2H), 2,02 (с, 1H), 1,32 (д, J=6,7 Гц, 1H), 1,27 (д, J=6,2 Гц, 1H), 1,23 (д, J=6,9 Гц, 2H), 1,18-1,12 (м, 5H); ESIMS m/z 371 ([M]+).
(Z)-N-(3-хлор-1-(5-фторпиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-метилбут-2-енамид: 1H ЯМР (400 МГц, CDCl3) δ 8,73 (д, J=2,0 Гц, 1H), 8,46 (д, J=2,4 Гц, 1H), 7,87 (д, J=4,9 Гц, 1H), 7,84 (дт, J=9,2, 2,4 Гц, 1H), 5,93-5,76 (м, 1H), 3,73 (кв., J=7,1 Гц, 2H), 1,72 (с, 3H), 1,58 (дд, J=6,9, 0,9 Гц, 3H), 1,17 (т, J=7,1 Гц, 3H); ESIMS m/z 323 ([M]+).
Соединения 70, 180, 181, 389-392, 397, 398, 405, 406, 427-429, 432, 456, 482, 521, 522, 532-534, 555 и 589 получали из соответствующих интермедиатов и исходных веществ в соответствии с методиками, раскрытыми в примере 39.
Пример 40: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-метил-2-(метилтио)ацетамида (соединение 337)
К ледяному раствору 2-(метилтио)уксусной кислоты (0,092 г, 0,863 ммоль) в DCM (2 мл) добавляли N-этил-N-изопропилпропан-2-амин (0,111 г, 0,863 ммоль), а затем изобутилхлороформиат (0,099 мл, 0,767 ммоль). Продолжали перемешивание в течение 10 минут. Затем к раствору 3-хлор-N-метил-1-(пиридин-3-ил)-1H-пиразол-4-амина (0,08 г, 0,383 ммоль) в DCM (0,66 мл) добавляли смешанный ангидрид и перемешивали реакционную смесь при температуре окружающей среды в течение 2 часов. Реакционную смесь концентрировали и очищали методом хроматографии с использованием C-18 колонки с обращенной фазой (0-100% CH3CN в H2O) с получением указанного в заголовке соединения в виде бледно-желтого масла (0,075 г, 66%): 1H ЯМР (400 МГц, CDCl3) δ 8,95 (д, J=2,5 Гц, 1H), 8,62 (дд, J=4,8, 1,4 Гц, 1H), 8,13 (с, 1H), 8,04 (ддд, J=8,3, 2,7, 1,4 Гц, 1H), 7,50-7,43 (м, 1H), 3,26 (с, 3H), 3,12 (с, 2H), 2,24 (с, 3H); 13C ЯМР (101 МГц, CDCl3) δ 170,00, 148,61, 140,15, 140,03, 135,68, 126,56, 126,42, 125,33, 124,15, 37,16, 34,94, 16,22; ESIMS m/z 297 ([M+H]+).
Соединения 335, 336 и 542 получали в соответствии с методиками, раскрытыми в примере 40.
Пример 41: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-метил-3-оксобутанамида (соединение 499)

К раствору гидрохлорида 3-хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амина (259 мг, 1 ммоль) и этил-2-метил-3-оксобутаноата (144 мг, 1,000 ммоль) в диоксане (1 мл) добавляли 2,3,4,6,7,8-гексагидро-1H-пиримидо[1,2-a]пиримидин (181 мг, 1,30 ммоль), и смесь нагревали в микроволновой печи (CEM Discover) при 150°C в течение 1,5 ч с внешним ИК-датчиком для мониторинга температуры со дна сосуда. Методом LCMS (ELSD) обнаруживали 40% преобразование до целевого продукта. Смесь разбавляли этилацетатом (50 мл) и насыщенным водным NH4Cl (15 мл), и разделяли органическую фазу. Водную фазу экстрагировали этилацетатом (20 мл), объединенную органическую фазу промывали солевым раствором, сушили над MgSO4 и концентрировали в условиях вакуума с получением маслянистого остатка. Этот остаток очищали на силикагеле, элюируя смесью этилацетата и гексанов, с получением N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-метил-3-оксобутанамида (37 мг, выход 11%, чистота 96%) в виде бесцветного масла: 1H ЯМР (400 МГц, CDCl3) δ 9,02-8,92 (дд, J=2,6, 0,8 Гц, 1H), 8,68-8,60 (дд, J=4,8, 1,5 Гц, 1H), 8,09-7,98 (м, 1H), 7,96-7,87 (с, 1H), 3,87-3,58 (д, J=3,0 Гц, 2H), 3,49-3,38 (м, 1H), 2,16-2,08 (с, 3H), 1,39-1,32 (д, J=7,0 Гц, 3H), 1,22-1,13 (м, 3H); EIMS (m/z) 321 ([M+1]+), 319 ([M-1]-).
Пример 42: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этилциклопропанкарбоксамида (соединение 538)

К раствору моногидрохлорида 3-хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амина (0,10 г, 0,0,38 ммоль) в дихлорэтане (0,75 мл) добавляли циклопропанкарбоновую кислоту (0,03 г, 0,38 ммоль) и 4-N,N-диметиламинопиридин (0,14 г, 1,15 ммоль), а затем гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (0,14 г, 0,77 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали досуха, и очищали неочищенный продукт методом обращенно-фазовой колоночной хроматографии на силикагеле, элюируя 0-50% ацетонитрилом в воде, с получением белого твердого вещества (0,03 г, 25%); т.пл. 111-119°C; 1H ЯМР (400 МГц, CDCl3) δ 8,96 (д, J=2,5 Гц, 1H), 8,63-8,59 (м, 1H), 8,06 (ддд, J=8,3, 2,6, 1,4 Гц, 1H), 8,01 (с, 1H), 7,46 (дд, J=8,3, 4,7 Гц, 1H), 3,73 (кв., J=7,2 Гц, 2H), 1,46 (ддд, J=12,6, 8,1, 4,7 Гц, 1H), 1,16 (т, J=7,2 Гц, 3H), 1,04 (т, J=3,7 Гц, 2H), 0,71 (дд, J=7,7, 3,0 Гц, 2H); ESIMS m/z 291 ([M+H]).
Соединения 69, 516, 524, 546, 558, 559, 582-588, 593 и 594 получали из соответствующих кислот в соответствии с методиками, раскрытыми в примере 42.
Пример 43: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-2-метил-3-(метилтио)-N-(3-(метилтио)пропаноил)пропанамид (соединение 407)
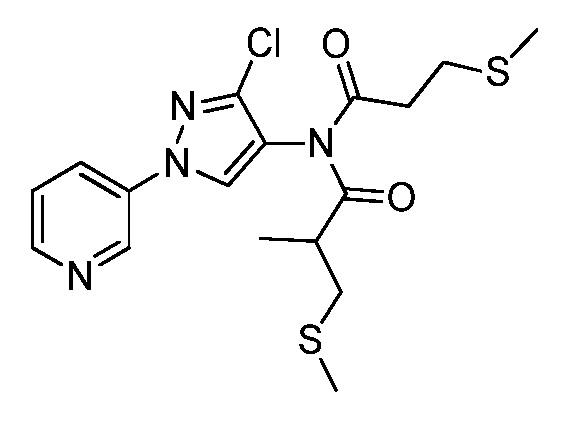
В сосуде объемом 10 мл к раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-(метилтио)пропанамида (0,216 г, 0,728 ммоль) в DCE (2,91 мл) добавляли 2-метил-3-(метилтио)пропаноилхлорид (0,244 г, 1,601 ммоль). Сосуд закрывали крышкой и помещали на 3 часа при 100°C в микроволновой реактор Biotage Initiator с внешним ИК-датчиком для мониторинга температуры с боковой стенки сосуда. Неочищенную смесь концентрировали и очищали с использованием обращенно-фазовой хроматографии на C-18 колонке (0-100% ацетонитрил в воде) с получением указанного в заголовке соединения в виде бледно-желтого масла (67 мг, 22%): ИК (тонкая пленка) 2916 и 1714 см-1; 1H ЯМР (300 МГц, CDCl3) δ 8,96-8,92 (д, J=2,7 Гц, 1H), 8,64-8,59 (дд, J=4,9, 1,4 Гц, 1H), 8,07-7,99 (м, 2H), 7,50-7,40 (дд, J=8,4, 4,8 Гц, 1H), 3,39-3,28 (м, 1H), 3,10-2,99 (тд, J=7,2, 3,9 Гц, 2H), 2,96-2,86 (дд, J=13,2, 8,7 Гц, 1H), 2,86-2,79 (т, J=7,3 Гц, 2H), 2,58-2,48 (дд, J=13,1, 5,8 Гц, 1H), 2,14-2,12 (с, 3H), 2,09-2,06 (с, 3H), 1,30-1,26 (д, J=6,9 Гц, 3H); ESIMS m/z 413 ([M+H]+).
Соединения 383, 410, 433, 437, 451, 470, 530 и 531 получали в соответствии с методиками, раскрытыми в примере 43.
Пример 44: Получение N-[3-хлор-1-(3-пиридил)пиразол-4-ил]-2,2-дидейтеро-N-этил-3-метилсульфанилпропанамида (соединение 393)
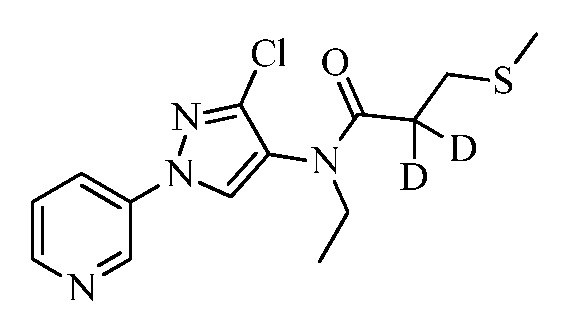
В сосуд объемом 7 мл добавляли 3-хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амин (111 мг, 0,5 ммоль), 2,2-дидейтеро-3-метилсульфанилпропановую кислоту (58,0 мг, 0,475 ммоль), а затем DCM (объем: 2 мл). Раствор перемешивали при 0°C. Затем добавляли раствор DCC (0,500 мл, 0,500 ммоль, 1,0M в DCM). Раствор оставляли медленно нагреваться до 25°C и перемешивали при 25°C в течение ночи. В процессе реакции образовывался белый осадок. Неочищенную реакционную смесь фильтровали через слой ваты и очищали методом хроматографии на силикагеле (0-100% EtOAc в гексане) с получением N-[3-хлор-1-(3-пиридил)пиразол-4-ил]-2,2-дидейтеро-N-этил-3-метилсульфанил-пропанамида (97 мг, 0,297 ммоль, 59,4% выход) в виде бесцветного масла: 1H ЯМР (400 МГц, CDCl3) δ 8,96 (д, J=2,4 Гц, 1H), 8,63 (дд, J=4,6, 0,9 Гц, 1H), 8,06 (ддд, J=8,4, 2,7, 1,4 Гц, 1H), 7,98 (с, 1H), 7,52-7,40 (м, 1H), 3,72 (кв., J=7,2 Гц, 2H), 2,78 (с, 2H), 2,06 (с, 3H), 1,17 (т, J=7,2 Гц, 3H); ESIMS m/z 327 ([M+H]+); ИК (тонкая пленка) 1652 см-1.
Соединения 394, 396 и 471-473 получали из соответствующих интермедиатов и исходных веществ в соответствии с методиками, раскрытыми в примере 44.
Пример 45: Получение 1-этил-3-(3-метил-1-(пиридин-3-ил)-1H-пиразол-4-ил)мочевины (соединение 145)
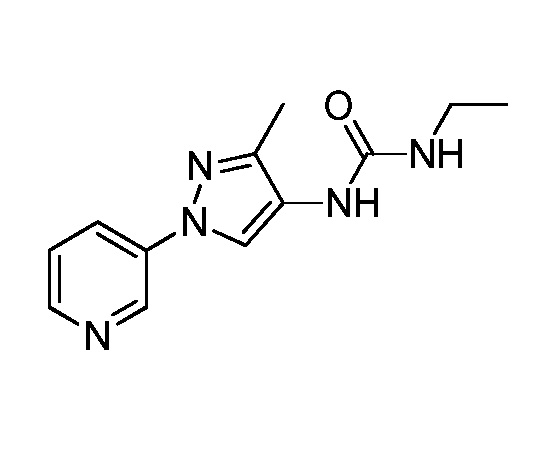
К раствору 3-метил-1-(пиридин-3-ил)-1H-пиразол-4-амина (0,1 г, 0,574 ммоль) в DCM (5,74 мл) добавляли этилизоцианат (0,041 г, 0,574 ммоль) и перемешивали реакционную смесь при температуре окружающей среды в течение 40 минут. Реакционная смесь превращалась из прозрачного раствора в суспензию белого твердого вещества. Реакционную смесь концентрировали и очищали методом хроматографии на силикагеле (0-20% MeOH в DCM) с получением указанного в заголовке соединения в виде белого твердого вещества (0,135 г, 95%): т.пл. 197-200ºC; 1H ЯМР (400 МГц, CDCl3) δ 8,94 (д, J=2,3 Гц, 1H), 8,48-8,37 (м, 1H), 8,32 (с, 1H), 7,94 (д, J=8,3 Гц, 1H), 7,52 (уш. с, 1H), 7,41-7,25 (м, 1H), 5,79 (уш. с, 1H), 3,33-3,23 (м, 2H), 2,29 (д, J=2,9 Гц, 3H), 1,16 (дд, J=8,7, 5,7 Гц, 3H); ESIMS m/z 246 ([M+H]+), 244 ([M-H]-).
Соединения 169-171, 221, 222, 255-257, 278-280, 297-302, 318-322, 334, 345, 348, 375-377, 385-387 и 411-413 получали в соответствии с методиками, раскрытыми в примере 45.
1-(3-Хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-этил-1-метилтиомочевину (соединение Y2048) получали в соответствии с методикой, раскрытой в примере 45, с использованием DMAP в качестве основания, диоксана в качестве растворителя и нагревания реакционной смеси при 120°C в течение 2 часов в микроволновом реакторе (CEM Discover®) с внешним ИК-датчиком для мониторинга температуры со дна сосуда: белое твердое вещество; т.пл. 160,0-162,0°C; 1H ЯМР (300 МГц, CDCl3) δ 8,94 (д, J=2,6 Гц, 1H), 8,62 (дд, J=4,8, 1,4 Гц, 1H), 8,05-7,98 (м, 2H), 7,46 (дд, J=8,3, 4,7 Гц, 1H), 5,66 (с, 1H), 3,72-3,59 (м, 5H), 1,17 (т, J=7,2 Гц, 3H); ESIMS m/z 297 ([M+H]+).
Пример 46: Получение 3-бутил-1-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-1-этилмочевины (соединение 500)
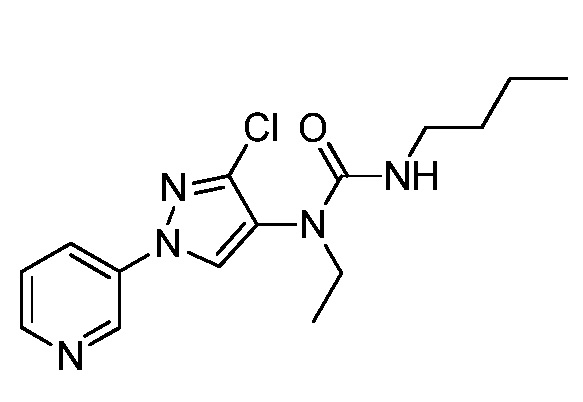
К раствору дигидрохлорида 3-хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амина (0,130 г, 0,502 ммоль) в DCE (1,25 мл) добавляли N-этил-N-изопропилпропан-2-амин (0,21 мл, 1,255 ммоль), а затем 1-изоцианатобутан (0,109 г, 1,104 ммоль), и перемешивали реакционную смесь при температуре окружающей среды в течение 16 часов. Реакционную смесь концентрировали и очищали методом хроматографии на силикагеле (0-20% MeOH в DCM) с получением указанного в заголовке соединения в виде бежевого твердого вещества (0,131 г, 77%): ИК (тонкая пленка) 3326, 2959, 2931, 1648 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,95 (с, 1H), 8,62 (д, J=4,0 Гц, 1H), 8,08-8,01 (м, 1H), 7,97 (с, 1H), 7,46 (дд, J=8,3, 4,7 Гц, 1H), 4,42-4,32 (м, 1H), 3,74-3,61 (м, 2H), 3,27-3,15 (м, 2H), 1,49-1,37 (м, 2H), 1,37-1,22 (м, 2H), 1,19-1,12 (м, 3H), 0,94-0,84 (м, 3H); ESIMS m/z 322 ([M+H]+).
Соединения 479, 480, 501-504, 513, 518 и 519 получали в соответствии с примером 46.
Пример 47: Получение 1-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)имидазолидин-2-он (соединение 374)
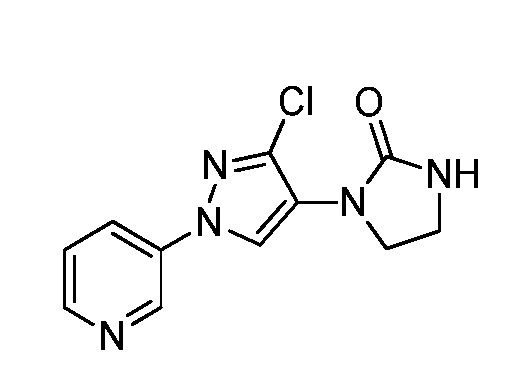
К раствору 1-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-(2-хлорэтил)мочевины (0,1 г, 0,333 ммоль) в THF (6,66 мл) добавляли гидрид натрия (8,00 мг, 0,333 ммоль) и перемешивали реакционную смесь при температуре окружающей среды в течение 30 минут. Реакционную смесь гасили добавлением насыщенного раствора хлорида аммония, и экстрагировали продукт этилацетатом (2×). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали. Продукт представлял собой бежевое твердое вещество, которое было чистым и не требовало дополнительной очистки (63 мг, 72%): т.пл. 167-170ºC; 1H ЯМР (400 МГц, CDCl3) δ 8,96 (д, J=2,2 Гц, 1H), 8,56 (дд, J=4,7, 1,4 Гц, 1H), 8,33 (с, 1H), 7,99 (ддд, J=8,3, 2,7, 1,4 Гц, 1H), 7,40 (ддд, J=8,3, 4,8, 0,7 Гц, 1H), 5,00 (с, 1H), 4,14-4,07 (м, 2H), 3,68-3,58 (м, 2H); ESIMS m/z 264 ([M+H]+).
Соединение 349 получали в соответствии с методиками, раскрытыми в примере 47.
Пример 48: Получение S-трет-бутил(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)карбамотиоата (соединение 514)
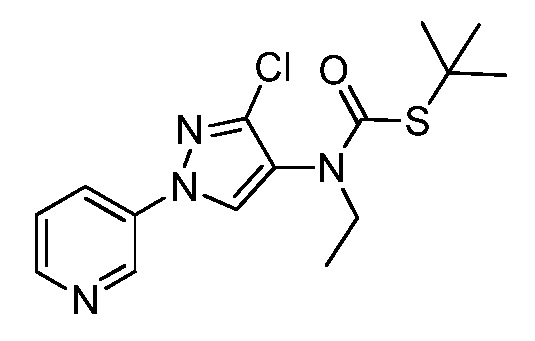
К раствору дигидрохлорида 3-хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амина (0,13 г, 0,502 ммоль) в DCM (2,508 мл) добавляли N-этил-N-изопропилпропан-2-амин (0,257 мл, 1,505 ммоль), а затем S-трет-бутилкарбонохлоридотиоат (0,153 г, 1,003 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 16 часов. Реакционную смесь гасили добавлением водного бикарбоната натрия. Органический слой экстрагировали DCM. Органический слой сушили над сульфатом натрия, фильтровали, концентрировали и очищали методом колоночной хроматографии на силикагеле (0-100% этилацетат в гексанах) с получением указанного в заголовке соединения в виде белого твердого вещества (132 мг, 78%): т.пл. 91-93ºC; 1H ЯМР (400 МГц, CDCl3) δ 8,96 (д, J=2,5 Гц, 1H), 8,60 (дд, J=4,7, 1,4 Гц, 1H), 8,08-8,03 (м, 1H), 7,97 (с, 1H), 7,47-7,41 (м, 1H), 3,69 (кв., J=7,2 Гц, 2H), 1,47 (с, 9H), 1,21-1,13 (м, 3H); ESIMS m/z 339 ([M+H]+).
Соединения 333, 338, 339, 346, 368 и 373 получали в соответствии с методиками, раскрытыми в примере 48.
Пример 49: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-метил-3-(метилтио)пропантиоамида (соединение 364)
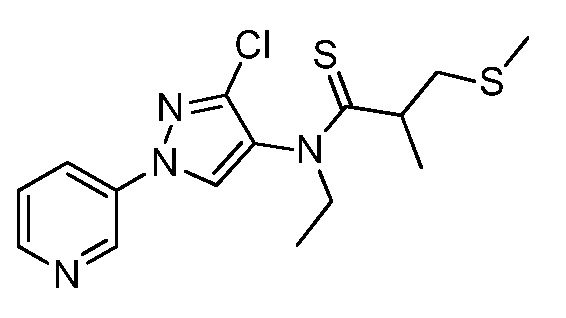
В сосуд для обработки микроволнами добавляли N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-метил-3-(метилтио)пропанамид (0,07 г, 0,22 ммоль) в дихлорэтане (1,87 мл) и реагент Лавессона (0,05 г, 0,12 ммоль). Сосуд закрывали крышкой и нагревали в течение 15 минут при 130°C в микроволновом реакторе Biotage Initiator с внешним ИК-датчиком для мониторинга температуры с боковой стенки сосуда. Реакционную смесь концентрировали досуха, и очищали неочищенное вещество методом хроматографии на силикагеле (0-80% ацетонитрил в воде) с получением целевого продукта в виде желтого масла (0,33 г, 44%): ИК (тонкая пленка) 1436 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,97 (д, J=2,5 Гц, 1H), 8,77-8,52 (м, 1H), 8,11-7,89 (м, 2H), 7,60-7,38 (м, 1H), 4,62 (уш. с, 1H), 4,02 (уш. с, 1H), 3,21-2,46 (м, 3H), 2,01 (с, 3H), 1,35-1,15 (м, 6H); ESIMS m/z 355 ([M+H]+).
Соединения 372, 438 и 548 получали в соответствии с методиками, раскрытыми в примере 49.
N-Метил-3-(метилтио)пропантиоамид получали в соответствии с методикой, раскрытой в примере 49, и выделяли в виде прозрачного масла; 1H ЯМР (400 МГц, CDCl3) δ 7,69 (с, 1H), 3,20 (д, J=4,8 Гц, 3H), 2,99-2,88 (м, 4H), 2,15 (с, 3H); ESIMS m/z 150 ([M+H]+).
Пример 50: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-4,4,4-трифтор-3-(метилсульфинил)бутанамида (соединение 570)
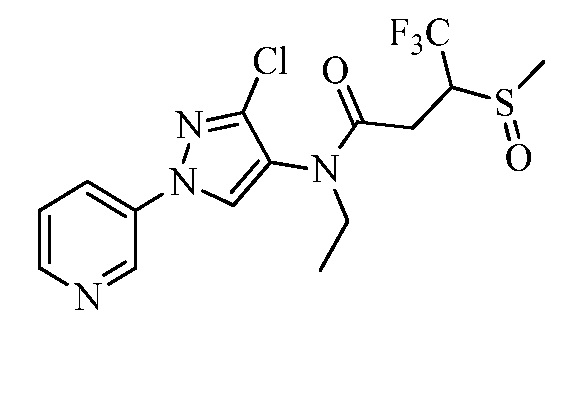
В сосуд объемом 20 мл добавляли N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-4,4,4-трифтор-3-(метилтио)бутанамид (82 мг, 0,209 ммоль) и гексафторизопропанол (1,5 мл). Одной порцией добавляли пероксид водорода (0,054 мл, 0,626 ммоль, 35% раствор в воде) и перемешивали раствор при комнатной температуре. Спустя 3 часа реакционную смесь гасили добавлением насыщенного раствора сульфита натрия и экстрагировали EtOAc (3×20 мл). Объединенные органические слои сушили над сульфатом натрия, концентрировали и очищали методом хроматографии (0-10% MeOH в DCM) с получением N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-4,4,4-трифтор-3-(метилсульфинил)бутанамида (76 мг, 0,186 ммоль, выход 89%) в виде белого полутвердого вещества: ИК (тонкая пленка) 1652 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,98 (д, J=2,3 Гц, 1H), 8,63 (тд, J=4,8, 2,4 Гц, 1H), 8,14-8,01 (м, 2H), 7,46 (ддд, J=8,3, 4,8, 0,7 Гц, 1H), 4,26 (дд, J=17,2, 8,4 Гц, 1H), 3,89-3,61 (м, 2H), 3,01 (дд, J=17,6, 8,2 Гц, 1H), 2,77 (с, 2H), 2,48 (дд, J=17,7, 3,3 Гц, 1H), 1,19 (т, J=7,2 Гц, 3H) (показан только один изомер); ESIMS m/z 409 ([M+H]+).
Соединение 571 получали из соответствующих интермедиатов и исходных веществ в соответствии с методиками, раскрытыми в примере 50.
Пример 51: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-(метилсульфинил)пропанамида (соединение 362)
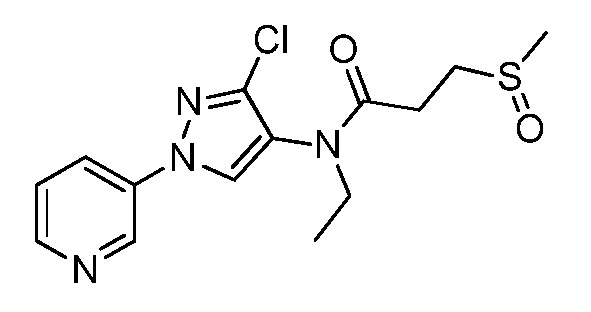
К N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-(метилтио)пропанамиду (0,08 г, 0,24 ммоль) в ледяной уксусной кислоте (0,82 мл) добавляли тетрагидрат пербората натрия (0,05 г, 0,25 ммоль) и нагревали смесь при 60°C в течение 1 часа. Реакционную смесь осторожно выливали в делительную воронку с насыщенным водным NaHCO3, что приводило к выделению газа. После завершения выделения газа добавляли этилацетат, и разделяли слои. Водный слой дважды экстрагировали этилацетатом, все органические слои объединяли, сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления. Неочищенное вещество очищали методом хроматографии на силикагеле (0-10% метанол в дихлорметане) с получением целевого продукта в виде прозрачного масла (0,03 г, 40%): ИК (тонкая пленка) 1655 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,95 (т, J=9,2 Гц, 1H), 8,63 (дд, J=4,7, 1,4 Гц, 1H), 8,20-7,86 (м, 2H), 7,59-7,33 (м, 1H), 3,73 (ддт, J=20,5, 13,4, 6,8 Гц, 2H), 3,23-3,06 (м, 1H), 2,94-2,81 (м, 1H), 2,74-2,62 (м, 2H), 2,59 (с, 3H), 1,25-1,07 (м, 3H); ESIMS m/z 341 ([M+H]+).
Соединения 101, 102, 218, 328, 330 и 494 получали из соответствующих сульфидов в соответствии с методиками, раскрытыми в примере 51.
Пример 52: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-(метилсульфонил)пропанамида (соединение 363)
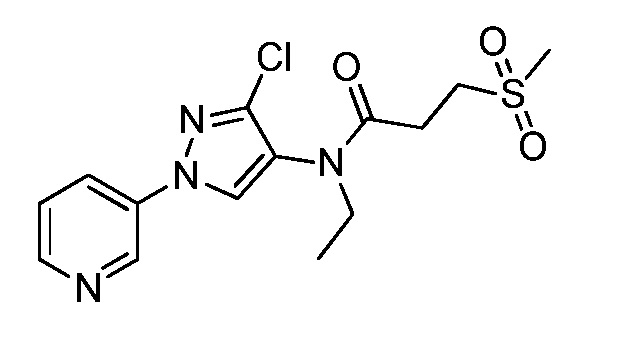
К N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-(метилтио)пропанамиду (0,08 г, 0,25 ммоль) в ледяной уксусной кислоте (0,85 мл) добавляли тетрагидрат пербората натрия (0,11 г, 0,52 ммоль) и нагревали смесь при 60°C в течение 1 часа. Реакционную смесь осторожно выливали в делительную воронку с насыщенным водным NaHCO3, что приводило к выделению газа. После завершения выделения газа добавляли этилацетат, и разделяли слои. Водный слой дважды экстрагировали этилацетатом, все органические слои объединяли, сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления. Неочищенный продукт очищали методом хроматографии на силикагеле (0-10% метанол в дихлорметане) с получением целевого продукта в виде прозрачного масла (0,04, 47%): ИК (тонкая пленка) 1661 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,95 (т, J=11,5 Гц, 1H), 8,64 (дд, J=4,8, 1,4 Гц, 1H), 8,17-7,96 (м, 2H), 7,59-7,39 (м, 1H), 3,73 (д, J=7,0 Гц, 2H), 3,44 (дд, J=22,5, 15,7 Гц, 2H), 2,96 (с, 3H), 2,71 (т, J=6,9 Гц, 2H), 1,18 (дд, J=8,8, 5,5 Гц, 3H); ESIMS m/z 357 ([M+H]+).
Соединения 103, 104, 219, 329, 331 и 495 получали из соответствующих сульфидов в соответствии с методиками, раскрытыми в примере 52.
Пример 53: Получение N-(3-метил-1-(3-фторпиридин-5-ил)-1H-пиразол-4-ил)N-этил-2-метил(3-оксидо-λ4-сульфанилиденцианамид)(метил)пропанамида (соединение 250)
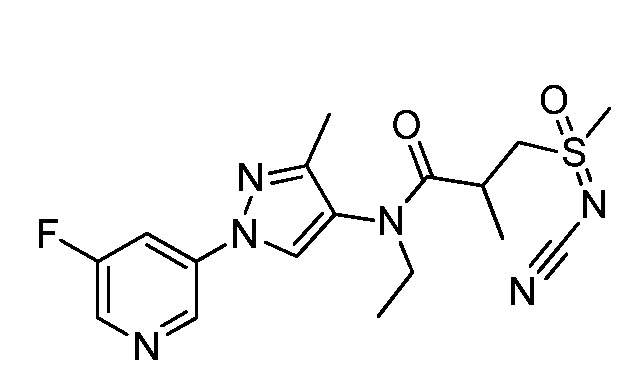
К раствору N-этил-N-(1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-ил)-2-метил-3-(метилтио)пропанамида (0,30 г, 0,89 ммоль) в дихлорметане (3,57 мл) при 0°C добавляли цианамид (0,07 г, 1,78 ммоль) и йодбензолдиацетат (0,31 г, 0,98 ммоль), а затем перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали досуха, и очищали неочищенное вещество методом хроматографии на силикагеле (10% метанол в этилацетате) с получением целевого сульфиламина в виде светло-желтого твердого вещества (0,28 г, 85%). К раствору 70% mCPBA (0,25 г, 1,13 ммоль) в этаноле (4,19 мл) при 0°C добавляли раствор карбоната калия (0,31 г, 2,26 ммоль) в воде (4,19 мл), перемешивали в течение 20 минут, после чего одной порцией добавляли раствор сульфиламина (0,28 г, 0,75 ммоль) в этаноле (4,19 мл). Реакционную смесь перемешивали в течение 1 часа при 0°C. Избыток mCPBA гасили добавлением 10% тиосульфита натрия, и концентрировали реакционную смесь досуха. Остаток очищали методом хроматографии на силикагеле (0-10% метанол в дихлорметане) с получением целевого продукта в виде прозрачного масла (0,16 г, 56%): ИК (тонкая пленка) 1649 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,80 (дд, J=43,8, 10,1 Гц, 1H), 8,51-8,36 (м, 1H), 8,11 (д, J=38,7 Гц, 1H), 7,96-7,77 (м, 1H), 4,32-3,92 (м, 2H), 3,49-3,11 (м, 6H), 2,32 (с, 3H), 1,27-1,05 (м, 6H); ESIMS m/z 393 ([M+H]+).
Пример 54: Получение N-этил-4,4,4-трифтор-3-метокси-N-(3-метил-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-(трифторметил)бутанамида (соединение 276)
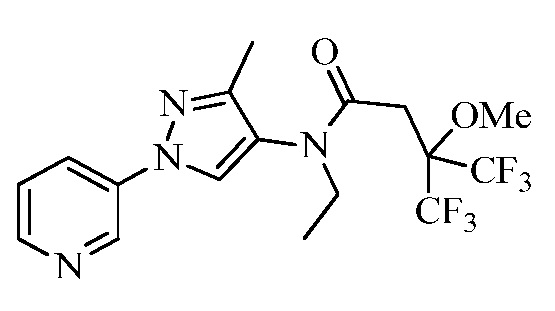
К раствору N-этил-4,4,4-трифтор-3-гидрокси-N-(3-метил-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-(трифторметил)бутанамида (184 мг, 0,448 ммоль) в DMF (3 мл) при перемешивании при 0°C добавляли гидрид натрия (26,9 мг, 0,673 ммоль). Раствор перемешивали при 0°C в течение 0,5 часа. Затем добавляли йодметан (0,034 мл, 0,538 ммоль), удаляли баню со льдом, и перемешивали смесь при 25°C в течение ночи. Из реакционной смеси выделяли продукт реакции путем медленного добавления воды, дополнительно разбавляли 20 мл воды, а затем экстрагировали 4×20 мл EtOAc. Объединенные органические слои промывали водой, сушили над Na2SO4 и концентрировали. Методом хроматографии на силикагеле (0-100% EtOAc в гексане) получали N-этил-4,4,4-трифтор-3-метокси-N-(3-метил-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-(трифторметил)бутанамид (52 мг, 0,123 ммоль, 27,3% выход) в виде белого твердого вещества: т.пл.=83-86°C; ИК (тонкая пленка) 1664 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,94 (д, J=2,5 Гц, 1H), 8,59 (дд, J=4,7, 1,3 Гц, 1H), 8,01 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,85 (с, 1H), 7,44 (ддд, J=8,3, 4,8, 0,6 Гц, 1H), 4,00 (уш. с, 1H), 3,73 (с, 3H), 3,39 (уш. с, 1H), 2,86 (с, 2H), 2,26 (с, 3H), 1,16 (т, J=7,1 Гц, 3H); ESIMS m/z 425 ([M+H]+).
Соединение 327 получали из соответствующих интермедиатов и исходных веществ в соответствии с методиками, раскрытыми в примере 54.
Пример 55, стадия 1: Получение N-(2-((трет-бутилдиметилсилил)окси)этил)-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-2-метил-3-(метилтио)пропанамида
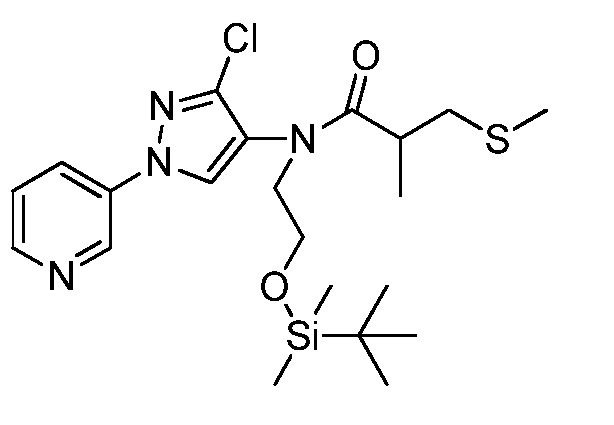
Раствор N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-2-метил-3-(метилтио)пропанамида (0,150 г, 0,483 ммоль) в N,N-диметилформамиде (2,413 мл) охлаждали до 0°C. Добавляли гидрид натрия (0,039 г, 0,965 ммоль, 60% дисперсия) и перемешивали реакционную смесь при 0°C в течение 30 минут. Добавляли (2-бромэтокси)(трет-бутил)диметилсилан (0,231 г, 0,965 ммоль), удаляли баню со льдом, и перемешивали реакционную смесь при комнатной температуре в течение 2 часов. Реакционную смесь нагревали при 65°C в течение 1,5 часов, а затем охлаждали до комнатной температуры. Добавляли солевой раствор и экстрагировали смесь дихлорметаном. Объединенные органические фазы концентрировали и подвергали хроматографии (0-100% этилацетат в гексанах) с получением N-(2-((трет-бутилдиметилсилил)окси)этил)-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-2-метил-3-(метилтио)пропанамида (0,120 г, 0,243 ммоль, 50,4%) в виде оранжевого масла: ИК (тонкая пленка) 1669 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,88 (д, J=2,5 Гц, 1H), 8,55 (дд, J=4,7, 1,4 Гц, 1H), 8,05 (с, 1H), 7,98 (ддд, J=8,3, 2,6, 1,4 Гц, 1H), 7,41 (ддд, J=8,4, 4,8, 0,5 Гц, 1H), 4,35-3,06 (м, 4H), 2,86-2,73 (м, 1H), 2,73-2,59 (м, 1H), 2,41 (дд, J=12,8, 5,7 Гц, 1H), 1,94 (с, 3H), 1,11 (д, J=6,7 Гц, 3H), 0,80 (с, 9H), 0,00 (с, 3H), -0,01 (с, 3H); ESIMS m/z 470 ([M+H]+).
Пример 55, стадия 2: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-(2-гидроксиэтил)-2-метил-3-(метилтио)пропанамида (соединение 535)
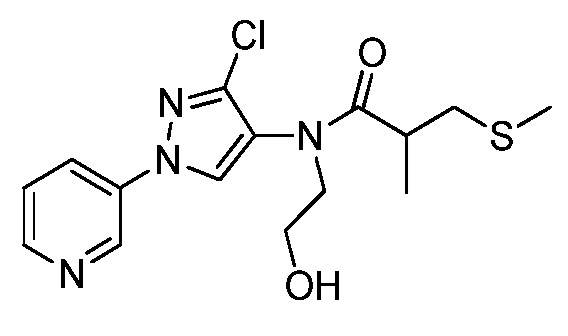
К раствору N-(2-((трет-бутилдиметилсилил)окси)этил)-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-2-метил-3-(метилтио)пропанамида (0,180 г, 0,384 ммоль) в тетрагидрофуране (1,54 мл) добавляли фторид тетрабутиламмония (0,201 г, 0,767 ммоль) и перемешивали реакционную смесь при комнатной температуре в течение 2 часов. Добавляли солевой раствор и экстрагировали смесь этилацетатом. Объединенные органические фазы концентрировали и подвергали хроматографии (0-100% вода в ацетонитриле) с получением N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-(2-гидроксиэтил)-2-метил-3-(метилтио)пропанамида в виде белого масла (0,081 г, 0,217 ммоль, 56,5%): ИК (тонкая пленка) 3423, 1654 см-1; 1H ЯМР (400 МГц, CDCl3) δ 9,00 (д, J=2,5 Гц, 1H), 8,62 (дд, J=4,7, 1,2 Гц, 1H), 8,25 (с, 1H), 8,07 (ддд, J=8,3, 2,4, 1,3 Гц, 1H), 7,47 (дд, J=8,3, 4,7 Гц, 1H), 4,47-3,70 (м, 3H), 3,65-3,09 (м, 2H), 2,91-2,68 (м, 2H), 2,48 (дд, J=12,4, 5,0 Гц, 1H), 2,01 (с, 3H), 1,18 (д, J=6,5 Гц, 3H); ESIMS m/z 356 ([M+H]+).
Пример 56: Получение 2-(N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-2-метил-3-(метилтио)пропанамидо)этилацетата (соединение 547)
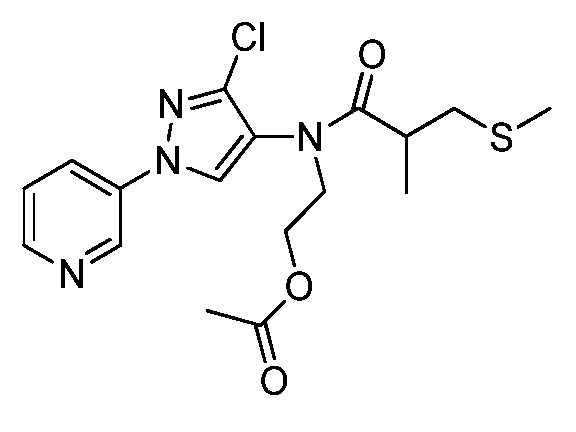
К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-(2-гидроксиэтил)-2-метил-3-(метилтио)пропанамида (0,045 г, 0,127 ммоль) в дихлорметане (1,27 мл) добавляли N,N-диметилпиридин-4-амин (0,023 г, 0,190 ммоль) и триэтиламин (0,019 г, 0,190 ммоль), а затем ацетилхлорид (0,015 г, 0,190 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Добавляли воду и экстрагировали смесь дихлорметаном. Объединенные органические фазы концентрировали и подвергали хроматографии (0-100% этилацетат в гексанах) с получением 2-(N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-2-метил-3-(метилтио)пропанамидо)этилацетата в виде желтого масла (0,015 г, 0,034 ммоль, 26,8%): ИК (тонкая пленка) 1739, 1669 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,97 (д, J=2,3 Гц, 1H), 8,64 (дд, J=4,7, 1,4 Гц, 1H), 8,15 (с, 1H), 8,04 (ддд, J=8,3, 2,7, 1,4 Гц, 1H), 7,47 (ддд, J=8,3, 4,8, 0,7 Гц, 1H), 4,50-3,40 (м, 4H), 2,84 (дд, J=12,7, 8,9 Гц, 1H), 2,78-2,63 (м, 1H), 2,46 (дд, J=12,7, 5,4 Гц, 1H), 2,03 (с, 3H), 2,01 (с, 3H), 1,16 (д, J=6,6 Гц, 3H); ESIMS m/z 398 ([M+H]+).
Пример 57: Получение 2,2-дидейтеро-3-метилсульфанилпропановой кислоты
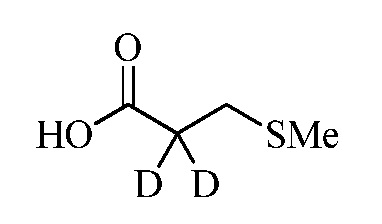
В круглодонную колбу объемом 100 мл добавляли 3-(метилтио)пропановую кислоту (3 г, 24,96 ммоль), затем D2O (23 мл) и KOD (8,53 мл, 100 ммоль) (40 масс.% раствор в D2O), и нагревали раствор до температуры возгонки в течение ночи. Методом ЯМР обнаруживали ~95% D в α-положении. Реакционную смесь охлаждали и гасили добавлением концентрированной HCl до pH<2. При подкислении в водном слое появлялся белый осадок. Реакционную смесь экстрагировали EtOAc (3×50 мл), объединенные органические слои сушили над Na2SO4, и почти досуха концентрировали в условиях вакуума. Добавляли 100 мл гексана, и снова концентрировали раствор с получением 2,2-дидейтеро-3-метилсульфанилпропановой кислоты в виде бесцветного масла (2,539 г, 20,78 ммоль, 83%): ИК (тонкая пленка) 3430, 1704 см-1; 1H ЯМР (400 МГц, CDCl3) δ 2,76 (с, 2H), 2,14 (с, 3H); 13C ЯМР (101 МГц, CDCl3) δ 178,28, 38,14-28,55 (м), 28,55, 15,51; EIMS m/z 122.
2-Дейтеро-2-метил-3-метилсульфанилпропановую кислоту получали, как описано в примере 57, с получением бесцветного масла (3,62 г, 26,8 ммоль, 60,9%): ИК (тонкая пленка) 2975, 1701 см-1; 1H ЯМР (400 МГц, CDCl3) δ 11,39-10,41 (уш. с, 1H), 2,88-2,79 (д, J=13,3 Гц, 1H), 2,61-2,53 (д, J=13,3 Гц, 1H), 2,16-2,09 (с, 3H), 1,32-1,25 (с, 3H); 13C ЯМР (101 МГц, CDCl3) δ 181,74, 39,74-39,02 (м), 37,16, 16,50, 16,03; EIMS m/z 135.
Пример 58: Получение 2-метил-3-(тридейтерометилсульфанил)пропановой кислоты
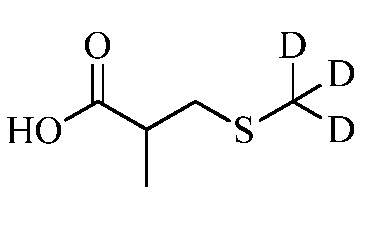
В круглодонную колбу объемом 50 мл добавляли 3-меркапто-2-метилпропановую кислоту (5 г, 41,6 ммоль), а затем MeOH (15 мл), и перемешивали раствор при 25°C. Медленно добавляли гидроксид калия (5,14 г, 92 ммоль), поскольку реакция является экзотермической. Медленно добавляли йодметан-d3 (6,63 г, 45,8 ммоль), а затем нагревали реакционную смесь при 65°C в течение ночи. Из реакционной смеси выбивали продукт путем добавления 2н HCl до тех пор, пока смесь не становилась кислой. Затем смесь экстрагировали EtOAc (4×50 мл), объединенные органические слои сушили над Na2SO4, концентрировали и очищали методом флэш-хроматографии, элюируя 0-80% EtOAc в гексане, с получением 2-метил-3-(тридейтерометилсульфанил)пропановой кислоты (4,534 г, 33,0 ммоль, 79%) в виде бесцветного масла: ИК (тонкая пленка) 3446, 1704 см-1; 1H ЯМР (400 МГц, CDCl3) δ 2,84 (дд, J=13,0, 7,1 Гц, 1H), 2,80-2,66 (м, 1H), 2,57 (дд, J=13,0, 6,6 Гц, 1H), 1,30 (д, J=7,0 Гц, 3H); EIMS m/z 137.
Пример 59: Получение 2-гидрокси-3-(метилтио)пропановой кислоты
К раствору 3-хлор-2-гидроксипропановой кислоты (2 г, 16,06 ммоль) в MeOH (120 мл) при 25°C добавляли метантиолат натрия (4,50 г, 64,2 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 8 часов, а затем охлаждали до 25°C. Осадок удаляли путем фильтрования, и упаривали фильтрат. Остаток подкисляли до pH 2 добавлением 2н HCl, экстрагировали EtOAc (3×30 мл), объединенные органические слои сушили с Na2SO4 и концентрировали с получением 2-гидрокси-3-(метилтио)пропановой кислоты в виде белого твердого вещества (1,898 г, 13,94 ммоль, выход 87%): т.пл. 55-59°C; ИК (тонкая пленка) 2927, 1698 см-1; 1H ЯМР (400 МГц, CDCl3) δ 6,33 (с, 3H), 4,48 (дд, J=6,3, 4,2 Гц, 1H), 3,02 (дд, J=14,2, 4,2 Гц, 1H), 2,90 (дд, J=14,2, 6,3 Гц, 1H), 2,20 (с, 3H); EIMS m/z 136.
Пример 60: Получение 2-метокси-3-(метилтио)пропановой кислоты
К перемешанному раствору гидрида натрия (0,176 г, 4,41 ммоль) в DMF (5 мл) при 25°C добавляли раствор 2-гидрокси-3-(метилтио)пропановой кислоты (0,25 г, 1,836 ммоль) в 1 мл DMF и перемешивали в течение 10 мин. При добавлении NaH наблюдали энергичное образование пузырей. Затем добавляли йодметан (0,126 мл, 2,020 ммоль) и перемешивали раствор при 25°C в течение ночи. Реакционную смесь гасили добавлением 2н HCl, экстрагировали EtOAc (3×10 мл), объединенные органические слои промывали водой (2×20 мл), концентрировали и очищали методом колоночной хроматографии, элюируя 0-100% EtOAc в гексане, с получением 2-метокси-3-(метилтио)пропановой кислоты (126 мг, 0,839 ммоль, выход 45,7%) в виде бесцветного масла: 1H ЯМР (400 МГц, CDCl3) δ 9,10 (с, 1H), 4,03 (дд, J=6,9, 4,4 Гц, 1H), 3,51 (с, 3H), 2,98-2,93 (м, 1H), 2,86 (дд, J=14,1, 6,9 Гц, 1H), 2,21 (с, 3H); EIMS m/z 150.
Пример 61: Получение 2-(ацетилтиометил)-3,3,3-трифторпропановой кислоты
В круглодонную колбу объемом 50 мл добавляли 2-(трифторметил)акриловую кислоту (6 г, 42,8 ммоль), а затем тиоуксусную кислоту (4,59 мл, 64,3 ммоль). Реакция была слегка экзотермической. Затем смесь перемешивали при 25°C в течение ночи. Методом ЯМР обнаруживали некоторое количество исходного вещества (~30%). Добавляли еще один эквивалент тиоуксусной кислоты, смесь нагревали при 95°C в течение 1 часа, а затем оставляли охлаждаться до комнатной температуры. Смесь очищали методом вакуумной перегонки при 2,1-2,5 мм рт.ст.; при этом фракция, перегоняемая при 80-85°C, главным образом представляла собой тиоуксусную кислоту, фракция, перегоняемая при 100-110°C, представляла собой чистый продукт с неполярными примесями (согласно методу TLC). Смесь снова очищали методом флэш-хроматографии (0-20% MeOH в DCM) с получением 2-(ацетилтиометил)-3,3,3-трифторпропановой кислоты (7,78 г, 36,0 ммоль, выход 84%) в виде бесцветного масла, которое отверждалось в условиях высокого вакуума с получением белого твердого вещества: т.пл. 28-30°C; 1H ЯМР (400 МГц, CDCl3) δ 7,52 (уш. с, 1H), 3,44 (дт, J=7,5, 3,5 Гц, 2H), 3,20 (дд, J=14,9, 11,1 Гц, 1H), 2,38 (с, 3H); 13C ЯМР (101 МГц, CDCl3) δ 194,79, 171,14, 123,44 (кв., J=281,6 Гц), 50,47 (кв., J=27,9 Гц), 30,44, 24,69 (кв., J=2,6 Гц); 19F ЯМР (376 МГц, CDCl3) δ -67,82.
Пример 62: Получение 3,3,3-трифтор-2-(метилтиометил)пропановой кислоты
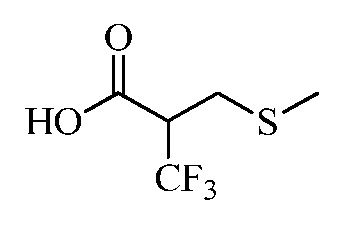
К раствору 2-(ацетилтиометил)-3,3,3-трифторпропановой кислоты (649 мг, 3 ммоль) в MeOH (5 мл), перемешиваемому при 25°C, четырьмя порциями в течение 5 минут добавляли гранулы гидроксида калия (421 мг, 7,50 ммоль). Реакция была экзотермической. Затем однократно добавляли MeI, реакционную смесь нагревали при 65°C в течение 18 часов. Затем реакционную смесь охлаждали и гасили добавлением 2н HCl до получения кислой смеси, и экстрагировали водный слой хлороформом (4×20 мл). Объединенный органический слой сушили, концентрировали в условиях вакуума и очищали методом флэш-хроматографии (0-20% MeOH в DCM) с получением 3,3,3-трифтор-2-(метилтиометил)пропановой кислоты (410 мг, 2,179 ммоль, выход 72,6%) в виде светло-желтого масла: 1H ЯМР (400 МГц, CDCl3) δ 10,95 (с, 1H), 3,49-3,37 (м, 1H), 3,02 (дд, J=13,8, 10,8 Гц, 1H), 2,90 (дд, J=13,8, 4,0 Гц, 1H), 2,18 (с, 3H); 13C ЯМР (101 МГц, CDCl3) δ 172,04 (кв., J=2,8 Гц), 123,55 (кв., J=281,2 Гц), 50,89 (кв., J=27,5 Гц), 29,62 (кв., J=2,3 Гц), 15,85; 19F ЯМР (376 МГц, CDCl3) δ -67,98.
Пример 63: Получение 3-(метилтио)пентановой кислоты
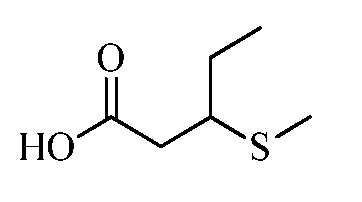
К раствору (E)-пент-2-еновой кислоты (2,002 г, 20 ммоль) в 30% растворе KOH (полученном из гидроксида калия (3,87 г, 69 ммоль) и воды (10 мл)) при энергичном перемешивании добавляли S,S-диметилкарбонодитиоат (1,467 г, 12,00 ммоль). Реакционную смесь медленно нагревали до 90°C в течение 20-30 мин. Нагревание продолжали в течение 3 часов, после чего реакционную смесь охлаждали до 25°C и медленно гасили добавлением HCl. Затем смесь экстрагировали DCM (3×30 мл), объединенный органический слой сушили и концентрировали с получением 3-(метилтио)пентановой кислоты (2,7 г, 18,22 ммоль, выход 91%) в виде светло-оранжевого масла: ИК (тонкая пленка) 2975, 1701 см-1; 1H ЯМР (400 МГц, CDCl3) δ 2,92 (кв. д, J=7,3, 5,6 Гц, 1H), 2,63 (д, J=7,2 Гц, 2H), 2,08 (с, 3H), 1,75-1,51 (м, 2H), 1,03 (т, J=7,4 Гц, 3H); 13C ЯМР (101 МГц, CDCl3) δ 178,14, 43,95, 39,78, 27,04, 12,95, 11,29; EIMS m/z 148.
4-Метил-3-(метилтио)пентановую кислоту получали, как описано в примере 63, и выделяли в виде бесцветного масла: ИК (тонкая пленка) 2960, 1704 см-1; 1H ЯМР (400 МГц, CDCl3) δ 2,88 (ддд, J=9,1, 5,4, 4,7 Гц, 1H), 2,68 (дд, J=16,0, 5,5 Гц, 1H), 2,55 (дд, J=16,0, 9,1 Гц, 1H), 2,13 (с, 3H), 2,01-1,90 (м, 1H), 1,03 (д, J=6,8 Гц, 3H), 0,99 (д, J=6,8 Гц, 3H); EIMS m/z 162.
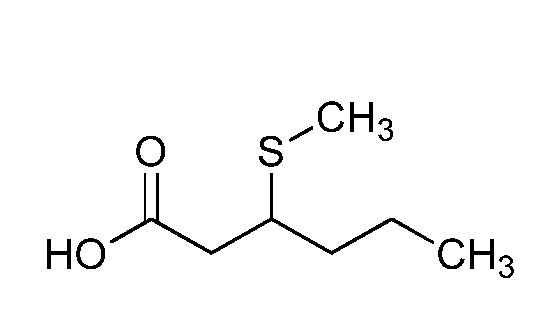
3-(Метилтио)гексановую кислоту получали в соответствии с методикой, описанной в примере 63, и выделяли в виде бесцветного масла: ИК (тонкая пленка) 2921, 1705 см-1; 1H ЯМР (400 МГц, CDCl3) δ 10,72 (с, 1H), 3,06-2,92 (м, 1H), 2,63 (дд, J=7,2, 2,6 Гц, 2H), 2,08 (с, 3H), 1,66-1,37 (м, 4H), 0,94 (т, J=7,2 Гц, 3H); 13C ЯМР (101 МГц, CDCl3) δ 178,19, 42,00, 40,20, 36,33, 20,05, 13,80, 12,86.
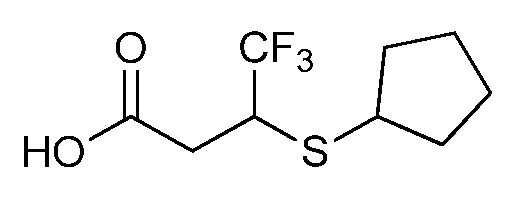
3-(Циклопентилтио)-4,4,4-трифторбутановую кислоту получали в соответствии с методикой, описанной в примере 63, и выделяли в виде бесцветного масла: ИК (тонкая пленка) 2959, 1714 см-1; 1H ЯМР (400 МГц, CDCl3) δ 9,27 (с, 1H), 3,74-3,53 (м, 1H), 3,36 (п, J=6,9 Гц, 1H), 2,96 (дд, J=16,9, 3,9 Гц, 1H), 2,61 (дд, J=16,9, 10,6 Гц, 1H), 2,15-1,92 (м, 2H), 1,84-1,68 (м, 2H), 1,68-1,54 (м, 3H), 1,53-1,43 (м, 1H); EIMS m/z 242.
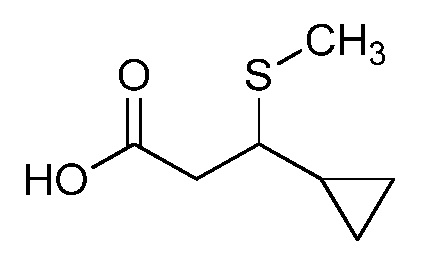
3-Циклопропил-3-(метилтио)пропановую кислоту получали в соответствии с методикой, описанной в примере 63, и выделяли в виде бесцветного масла: ИК (тонкая пленка) 3002, 1703 см-1; 1H ЯМР (400 МГц, CDCl3) δ 2,73 (дд, J=7,1, 2,2 Гц, 2H), 2,39 (дт, J=9,7, 7,1 Гц, 1H), 2,17 (с, 3H), 0,97 (дддд, J=14,6, 13,0, 6,5, 3,6 Гц, 1H), 0,74-0,52 (м, 2H), 0,43-0,35 (м, 1H), 0,35-0,26 (м, 1H); 13C ЯМР (101 МГц, CDCl3) δ 177,60, 47,18, 40,66, 16,34, 13,61, 5,30, 4,91.
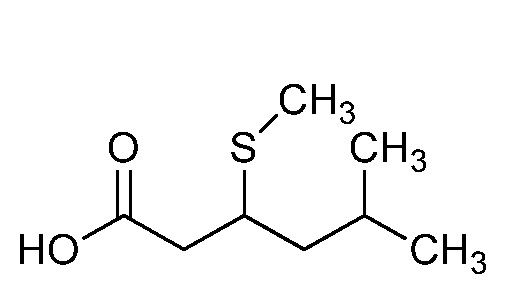
5-Метил-3-(метилтио)гексановую кислоту получали в соответствии с методикой, описанной в примере 63, и выделяли в виде светло-оранжевого масла: ИК (тонкая пленка) 2955, 1705 см-1; 1H ЯМР (400 МГц, CDCl3) δ 3,12-2,96 (м, 1H), 2,70-2,53 (м, 2H), 2,07 (с, 3H), 1,91-1,78 (м, 1H), 1,49 (ддд, J=14,6, 9,1, 5,6 Гц, 1H), 1,38 (ддд, J=14,1, 8,4, 5,9 Гц, 1H), 0,93 (д, J=2,4 Гц, 3H), 0,92 (д, J=2,3 Гц, 3H); 13C ЯМР (101 МГц, CDCl3) δ 178,07, 43,35, 40,53, 39,99, 25,45, 22,91, 21,83, 12,38.
2-(1-(Метилтио)циклобутил)уксусную кислоту получали в соответствии с методикой, описанной в примере 63, и выделяли в виде белого кристаллического твердого вещества: т.пл. 43-46°C; ИК (тонкая пленка) 2955, 1691 см-1; 1H ЯМР (400 МГц, CDCl3) δ 2,77 (с, 2H), 2,30 (тдд, J=5,4, 3,9, 2,2 Гц, 2H), 2,23-2,13 (м, 3H), 2,04 (с, 3H), 2,00-1,89 (м, 1H); 13C ЯМР (101 МГц, CDCl3) δ 176,84, 47,08, 44,08, 33,27, 16,00, 11,72.
3-(Метилтио)-3-фенилпропановую кислоту получали в соответствии с методикой, описанной в примере 63, и выделяли в виде белого твердого вещества: т.пл. 75-77°C; ИК (тонкая пленка) 2915, 1704 см-1; 1H ЯМР (400 МГц, CDCl3) δ 7,35-7,29 (м, 4H), 7,29-7,20 (м, 1H), 4,17 (т, J=7,6 Гц, 1H), 2,93 (дд, J=7,6, 3,2 Гц, 2H), 1,91 (с, 3H); 13C ЯМР (101 МГц, CDCl3) δ 176,98, 140,60, 128,61, 127,64, 127,56, 46,19, 40,70, 14,33.
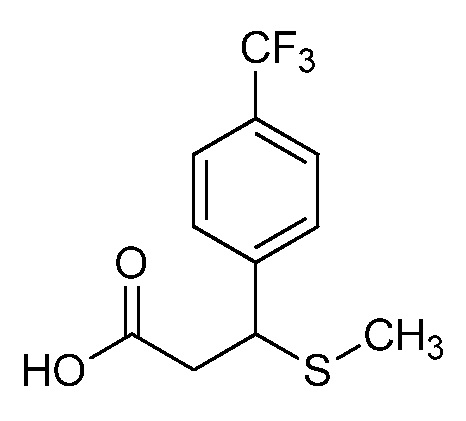
3-(Метилтио)-3-(4-(трифторметил)фенил)пропановую кислоту получали в соответствии с методикой, описанной в примере 63, и выделяли в виде белого твердого вещества: т.пл. 106-108°C; ИК (тонкая пленка) 2924, 1708 см-1; 1H ЯМР (400 МГц, CDCl3) δ 7,59 (д, J=8,1 Гц, 2H), 7,45 (д, J=8,1 Гц, 2H), 4,21 (т, J=7,6 Гц, 1H), 2,95 (кв. д, J=16,3, 7,7 Гц, 2H), 1,92 (с, 3H); EIMS m/z (M-1) 263.
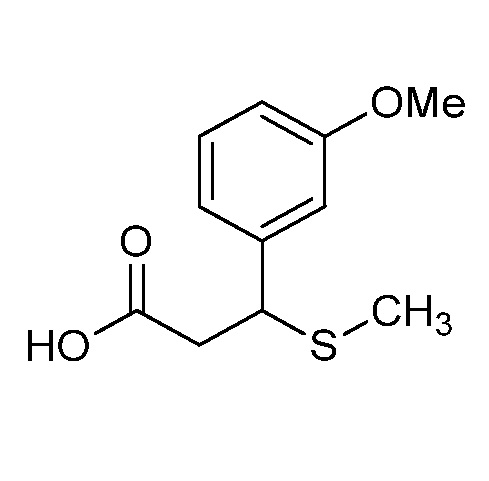
3-(3-Метоксифенил)-3-(метилтио)пропановую кислоту получали в соответствии с методикой, описанной в примере 63, и выделяли в виде белого твердого вещества: т.пл. 61-63°C; ИК (тонкая пленка) 2921, 1699 см-1; 1H ЯМР (400 МГц, CDCl3) δ 7,28-7,17 (м, 1H), 6,94-6,86 (м, 2H), 6,79 (ддд, J=8,3, 2,5, 0,9 Гц, 1H), 4,14 (т, J=7,6 Гц, 1H), 3,80 (с, 3H), 2,92 (д, J=8,0 Гц, 2H), 1,92 (с, 3H); EIMS m/z 225.
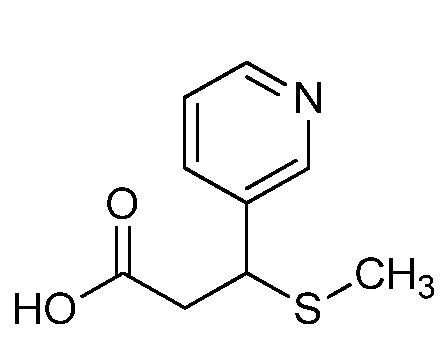
3-(Метилтио)-3-(пиридин-3-ил)пропановой кислоты получали в соответствии с методикой, описанной в примере 63, и выделяли в виде белого полутвердого вещества: ИК (тонкая пленка) 3349, 1547 см-1; 1H ЯМР (400 МГц, CD3OD) δ 8,54 (дд, J=2,3, 0,8 Гц, 1H), 8,39 (дд, J=4,9, 1,6 Гц, 1H), 7,90 (дт, J=7,9, 2,0 Гц, 1H), 7,41 (ддд, J=8,0, 4,9, 0,8 Гц, 1H), 4,26 (дд, J=9,2, 6,5 Гц, 1H), 2,81 (дд, J=14,7, 6,5 Гц, 1H), 2,71 (дд, J=14,8, 9,2 Гц, 1H), 1,94 (с, 3H); EIMS m/z 198.
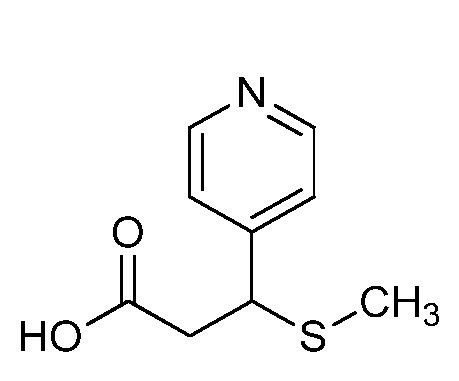
3-(Метилтио)-3-(пиридин-4-ил)пропановую кислоту получали в соответствии с методикой, описанной в примере 63, и выделяли в виде белого твердого вещества: т.пл. 187-189°C; ИК (тонкая пленка) 1692 см-1; 1H ЯМР (400 МГц, CD3OD) δ 8,57-8,38 (м, 2H), 7,55-7,37 (м, 2H), 4,19 (дд, J=8,2, 7,3 Гц, 1H), 2,93 (дд, J=7,7, 2,8 Гц, 2H), 1,94 (с, 3H); EIMS m/z 198.
Пример 64: Получение этил-1-(гидроксиметил)циклопропанкарбоксилата
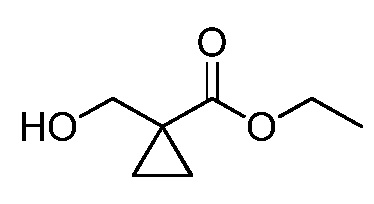
К перемешанному раствору диэтилциклопропан-1,1’-дикарбоксилата (6 г, 32,20 ммоль) в тетрагидрофуране (129 мл) при 23°C добавляли 1M раствор три-трет-бутоксиалюмогидрида лития в тетрагидрофуране (70,90 мл, 70,90 ммоль). Полученный раствор нагревали до 65°C и перемешивали в течение 24 ч. Охлажденную реакционную смесь разбавляли 10% раствором бисульфата натрия (275 мл) и экстрагировали этилацетатом. Объединенные органические слои сушили (MgSO4), фильтровали и концентрировали досуха с получением целевого продукта в виде бледно-желтого масла (4,60 г, 91%): 1H ЯМР (300 МГц, CDCl3) δ 4,16 (кв., J=7 Гц, 2H), 3,62 (с, 2H), 2,60 (уш. с, 1H), 1,22-1,30 (м, 5H), 0,87 (дд, J=7, 4 Гц, 2H).
Пример 65: Получение этил-1-((метилсульфонилокси)метил)циклопропанкарбоксилата
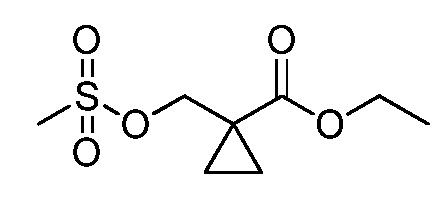
К перемешанному раствору 1-(гидроксиметил)циклопропанкарбоксилата (4,80 г, 33,30 ммоль) в дихлорметане (83 мл) при 23°C последовательно добавляли триэтиламин (5,57 мл, 40,00 ммоль) и метансульфонилхлорид (2,85 мл, 36,60 ммоль). Полученный ярко-желтый раствор перемешивали при 23°C в течение 20 ч. Реакционную смесь разбавляли водой и экстрагировали дихлорметаном. Объединенные органические слои сушили (MgSO4), фильтровали и концентрировали досуха с получением целевого продукта в виде коричневого масла (6,92 г, 94%): 1H ЯМР (300 МГц, CDCl3) δ 4,33 (с, 2H), 4,16 (кв., J=7 Гц, 2H), 3,08 (с, 3H), 1,43 (дд, J=7, 4 Гц, 2H), 1,26 (т, J=7 Гц, 3H), 1,04 (дд, J=7, 4 Гц, 2H).
Пример 66: Получение этил-1-(метилтиометил)циклопропанкарбоксилата
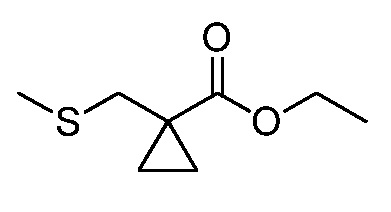
К перемешанному раствору этил-1-((метилсульфонилокси)метил)циклопропанкарбоксилата (6,92 г, 31,10 ммоль) в N,N-диметилформамиде (62,30 мл) при 23°C добавляли метантиолат натрия (4,36 г, 62,30 ммоль). Полученную коричневую суспензию перемешивали при 23°C в течение 18 ч. Реакционную смесь разбавляли водой и экстрагировали диэтиловым эфиром. Объединенные органические слои сушили (MgSO4), фильтровали и концентрировали на роторном испарителе с получением указанного в заголовке соединения в виде коричневого масла (5,43 г, 100%): 1H ЯМР (300 МГц, CDCl3) δ 4,14 (кв., J=7 Гц, 2H), 2,83 (с, 2H), 2,16 (с, 3H), 1,31 (дд, J=7, 4 Гц, 2H), 1,25 (т, J=7 Гц, 3H), 0,89 (дд, J=7, 4 Гц, 2H).
Пример 67: Получение 1-(метилтиометил)циклопропанкарбоновой кислоты
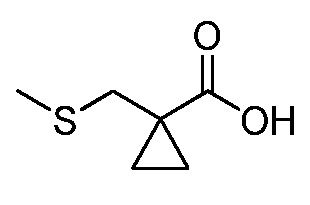
К перемешанному раствору этил-1-(метилтиометил)циклопропанкарбоксилата (5,43 г, 31,20 ммоль) в абсолютном этаноле (62,30 мл) при 23°C добавляли 50% раствор гидроксида натрия (12,63 мл, 243 ммоль). Полученный раствор перемешивали при 23°C в течение 20 ч. Реакционную смесь разбавляли 0,5M раствором гидроксида натрия и промывали дихлорметаном. Водный слой подкисляли до pH~1 добавлением концентрированной соляной кислоты и экстрагировали дихлорметаном. Объединенные органические слои сушили (Na2SO4), фильтровали и концентрировали досуха с получением целевого продукта в виде светло-коричневого масла (2,10 г, 46%): 1H ЯМР (300 МГц, CDCl3) δ 2,82 (с, 2H), 2,17 (с, 3H), 1,41 (дд, J=7, 4 Гц, 2H), 0,99 (дд, J=7, 4 Гц, 2H).
Пример 68: Получение 2,2-диметил-3-(метилтио)пропановой кислоты
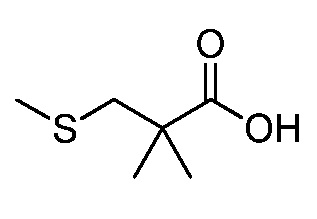
2,2-Диметил-3-(метилтио)пропановая кислота может быть получена, как представлено в литературе (см. Musker, W. K.; et al. J. Org. Chem. 1996, 51, 1026-1029). К перемешанному раствору 3-хлор-2,2-диметилпропановой кислоты (1,0 г, 7,2 ммоль, 1,0 эквив.) в N,N-диметилформамиде(3,7 мл) при 0°C добавляли метантиолат натрия (1,0 г, 14 ммоль, 2,0 эквив.). Полученную коричневую суспензию оставляли нагреваться до 23°C и перемешивали в течение 24 ч. Реакционную смесь разбавляли насыщенным раствором бикарбоната натрия (300 мл) и промывали диэтиловым эфиром (3×75 мл). Водный слой подкисляли до pH≈1 добавлением концентрированной соляной кислоты и экстрагировали диэтиловым эфиром (3×75 мл). Объединенные органические слои сушили (сульфат натрия), подвергали гравитационному фильтрованию и концентрировали с получением бесцветного масла (1,2 г, выход неочищенного вещества 99%). 1H ЯМР (300 МГц, CDCl3) δ 2,76 (с, 2H), 2,16 (с, 3H), 1,30 (с, 6H).
Пример 69: Получение 4,4,4-трифтор-3-(метилтио)бутановой кислоты
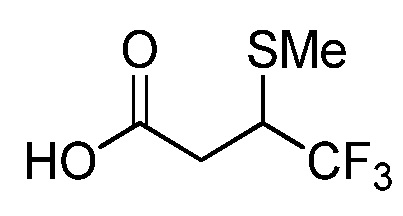
В круглодонную колбу объемом 100 мл добавляли (E)-4,4,4-трифторбут-2-еновую кислоту (8 г, 57,1 ммоль) и метанол (24 мл), раствор перемешивали на водяной бане, а затем тремя порциями добавляли метантиолат натрия (10,01 г, 143 ммоль). Наблюдали энергичное образование пузырей, перемешивали смесь при 25°C в течение ночи, и методом ЯМР более не обнаруживали исходное вещество. К реакционной смеси добавляли 2н HCl до получения кислой смеси. Смесь экстрагировали хлороформом (5×50 мл), объединенный органический слой сушили над Na2SO4, концентрировали в условиях вакуума и затем очищали в условиях высокого вакуума до отсутствия потери веса с получением 4,4,4-трифтор-3-(метилтио)бутановой кислоты (10,68 г, 56,8 ммоль, выход 99%) в виде бесцветного масла: 1H ЯМР (400 МГц, CDCl3) δ 10,88 (с, 1H), 3,53 (дкв. д, J=10,5, 8,3, 4,0 Гц, 1H), 2,96 (дд, J=16,9, 4,0 Гц, 1H), 2,65 (дд, J=16,9, 10,4 Гц, 1H), 2,29 (с, 3H); 13C ЯМР (101 МГц, CDCl3) δ 175,78 (с), 126,61 (кв., JC-F=278,8 Гц), 44,99 (кв., JC-F=30,3Гц), 34,12 (д, JC-F=1,7 Гц), 15,95 (с); EIMS m/z 162.
Пример 70: Получение 3-метил-3-метилсульфанилмасляной кислоты
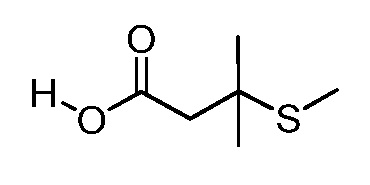
3-Метил-3-метилсульфанилмасляную кислоту получали с использованием методик, раскрытых в J. Chem Soc Perkin 1, 1992, 10, 1215-21.
Пример 71: Получение 3-метилсульфанилмасляной кислоты
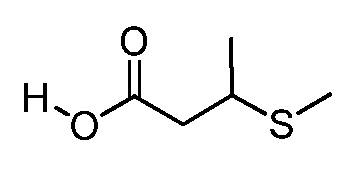
3-Метилсульфанилмасляную кислоту получали с использованием методик, раскрытых в Synthetic Comm., 1985, 15(7), 623-32.
Пример 72: Получение тетрагидротиофен-3-карбоновой кислоты
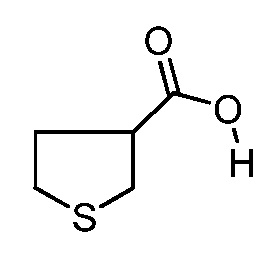
Тетрагидротиофен-3-карбоновую кислоту получали с использованием методик, раскрытых в Heterocycles, 2007, 74, 397-409.
Пример 73: Получение 2-метил-3-метилсульфанилмасляной кислоты
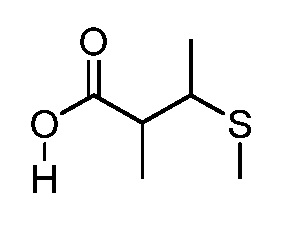
2-Метил-3-метилсульфанилмасляную кислоту получали, как описано в J. Chem Soc Perkin 1, 1992, 10, 1215-21.
Пример 74: Получение (1S,2S)-2-(метилтио)циклопропанкарбоновой кислоты
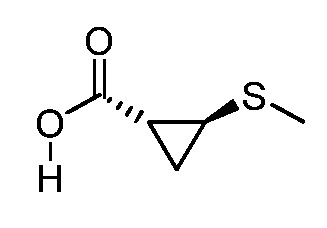
(1S,2S)-2-(метилтио)циклопропанкарбоновую кислоту получали с использованием методик, раскрытых в Synthetic Comm., 2003, 33(5); 801-807.
Пример 75: Получение 2-(2-(метилтио)этокси)пропановой кислоты
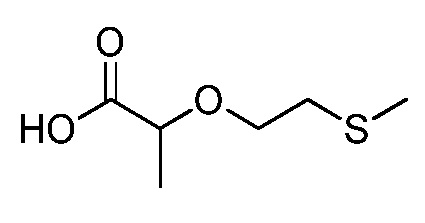
2-(2-(Метилтио)этокси)пропановую кислоту получали, как описано в WO2007/064316A1.
Пример 76: Получение 2-((тетрагидрофуран-3-ил)окси)пропановой кислоты
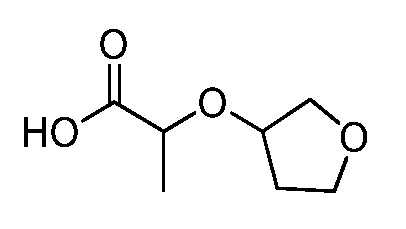
2-((Тетрагидрофуран-3-ил)окси)пропановую кислоту получали, как описано в WO2007/064316A1.
Пример 77: Получение трет-бутил-1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-ил(проп-2-инил)карбамата (соединение 601)
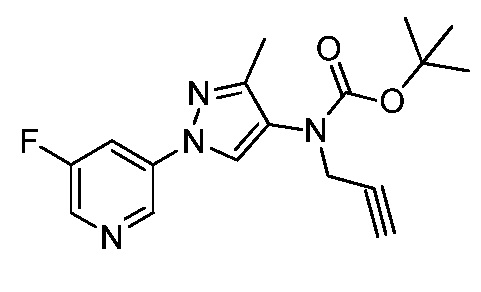
К ледяному раствору трет-бутил-1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-илкарбамата (1200 мг, 4,11 ммоль) в безводном DMF (4 мл) в атмосфере азота добавляли 60 масс.% гидрида натрия (197 мг, 4,93 ммоль) и перемешивали смесь в течение 10 мин. Затем добавляли 3-бромпроп-1-ин (733 мг, 6,16 ммоль) и дополнительно перемешивали смесь в течение 0,5 ч при 0-5°C. Смесь оставляли нагреваться до температуры окружающей среды, а затем дополнительно перемешивали в течение 3 ч при комнатной температуре. Коричневую реакционную смесь вливали в насыщенный водный NH4Cl (20 мл) и разбавляли этилацетатом (50 мл). Органическую фазу разделяли, и экстрагировали водную фазу этилацетатом (20 мл). Объединенную органическую фазу промывали солевым раствором, сушили над безводным MgSO4, фильтровали и концентрировали в условиях вакуума с получением коричневого масла. Это масло очищали на силикагеле, элюируя смесью гексанов и этилацетата, с получением указанного в заголовке соединения в виде светло-желтого твердого вещества (1103 мг, 81%); т.пл. 81-82°C; 1H ЯМР (400 МГц, CDCl3) δ 8,73 (с, 1H), 8,37 (д, J=2,5 Гц, 1H), 7,99 (с, 1H), 7,83 (дт, J=9,5, 2,2 Гц, 1H), 4,31 (с, 2H), 2,29 (т, J=2,4 Гц, 1H), 2,27 (с, 3H), 1,45 (с, 8H); ESIMS m/z 229,84 ([M]+).
Соединения 596 и 606 получали в соответствии с методикой, раскрытой в примере 77, из соответствующего амина.
Пример 78: Получение гидрохлорида 1-(5-фторпиридин-3-ил)-3-метил-N-(проп-2-инил)-1H-пиразол-4-амина
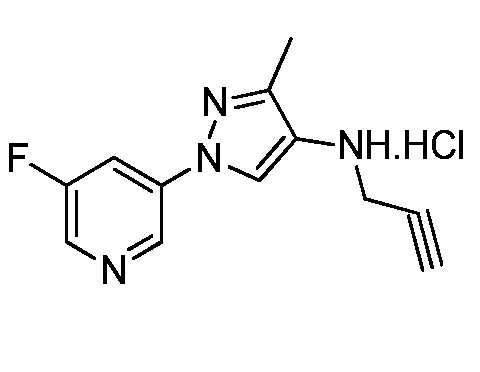
К раствору трет-бутил-1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-ил(проп-2-инил)карбамата (1,03 г, 3,11 ммоль) в диоксане (5 мл) добавляли 4M HCl (3,9 мл, 15,5 ммоль) в диоксане. Смесь перемешивали при комнатной температуре в течение 48 ч, полученное белое твердое вещество фильтровали, промывали эфиром и сушили в условиях вакуума с получением с получением указанного в заголовке соединения в виде белого твердого вещества (741 мг, 89%): т.пл. 167-168°C; 1H ЯМР (400 МГц, ДМСО d6) δ 8,92-8,85 (м, 1H), 8,42 (д, J=2,5 Гц, 1H), 8,15 (с, 1H), 8,12-8,02 (м, 1H), 3,85 (д, J=2,5 Гц, 2H), 3,27-3,19 (м, 1H), 2,22 (с, 3H); ESIMS m/z 230,4 ([M]+).
3-Хлор-N-(проп-2-ин-1-ил)-1-(пиридин-3-ил)-1H-пиразол-4-амина гидрохлорид получали в соответствии с методикой, раскрытой в примере 78, из соединения 606: т.пл. 180-182°C; 1H ЯМР (400 МГц, CDCl3) δ 9,22 (д, J=2,5 Гц, 1H), 8,67 (дд, J=5,3, 1,0 Гц, 1H), 8,64 (ддд, J=8,6, 2,6, 1,2 Гц, 1H), 8,32 (с, 1H), 7,96 (дд, J=8,6, 5,3 Гц, 1H), 3,81 (д, J=2,4 Гц, 2H), 3,15 (т, J=2,4 Гц, 1H); ESIMS m/z 234 ([M+2]+).
3-Метил-N-(проп-2-ин-1-ил)-1-(пиридин-3-ил)-1H-пиразол-4-амина гидрохлорид получали в соответствии с методикой, раскрытой в примере 78 из соединения 596: т.пл. 161-163°C; 1H ЯМР (400 МГц, ДМСО-d6) δ 8,46 (с, 1H), 8,05 (с, 0H), 7,83 (д, J=5,9 Гц, 1H), 7,57 (с, 1H), 7,29 (дд, J=8,8, 5,6 Гц, 1H), 3,27 (д, J=2,5 Гц, 2H), 1,52 (с, 3H); EIMS m/z 213,1 ([M]+).
Пример 79: Получение N-(1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-ил)-3-(метилтио)-N-(проп-2-инил)пропанамида (соединение 605)
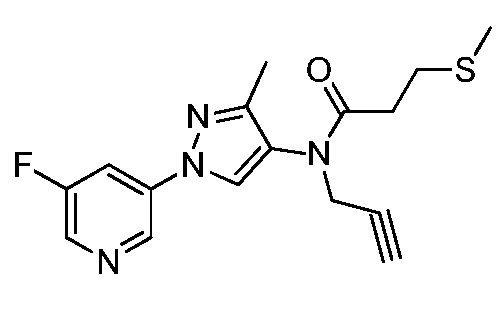
К перемешанному раствору гидрохлорида 1-(5-фторпиридин-3-ил)-3-метил-N-(проп-2-ин-1-ил)-1H-пиразол-4-амина (100 мг, 0,38 ммоль) и N,N-диметилпиридин-4-амина (115 мг, 0,94 ммоль) в CH2Cl2 (2 мл) добавляли 2-метил-3-(метилтио)пропаноилхлорид (69 мг, 0,45 ммоль), и перемешивали смесь при комнатной температуре в течение 24 ч. Смесь концентрировали в условиях вакуума с получением коричневого масла, которое очищали на силикагеле, элюируя смесью этилацетата и гексанов, с получением указанного в заголовке соединения в виде бесцветного масла (80 мг, 61%): 1H ЯМР (400 МГц, CDCl3) δ 8,77 (д, J=1,7 Гц, 1H), 8,43 (д, J=2,5 Гц, 1H), 8,05 (с, 1H), 7,86 (дт, J=9,4, 2,3 Гц, 1H), 4,49 (с, 1H), 2,88 (дд, J=12,8, 9,4 Гц, 1H), 2,74 (с, 1H), 2,45 (дд, J=12,9, 5,0 Гц,1H), 2,34 (с, 3H), 2,24 (т, J=2,5 Гц, 1H), 2,02 (с, 3H), 1,14 (д, J=6,8 Гц, 3H); ESIMS m/z 347,5 ([M+H]+).
Соединения 598, 599, 600, 602, 603, 607, 608 и 610 получали в соответствии с методикой, раскрытой в примере 79, из соответствующих аминов.
Пример 80: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-4,4,4-трифтор-3-(метилтио)-N-(проп-2-ин-1-ил)бутанамида (соединение 613)
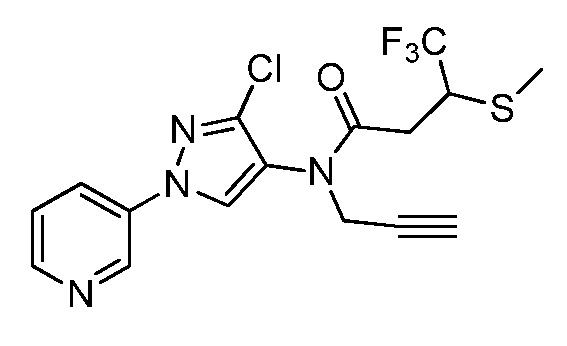
В сосуд емкостью 7 мл добавляли 3-хлор-N-(проп-2-ин-1-ил)-1-(пиридин-3-ил)-1H-пиразол-4-амин (140 мг, 0,6 ммоль), N,N-диметилпиридин-4-амин (249 мг, 2,040 ммоль), гидрохлорид N1-((этилимино)метилен)-N3,N3-диметилпропан-1,3-диамина (276 мг, 1,440 ммоль), а затем 4,4,4-трифтор-3-(метилтио)бутановую кислоту (158 мг, 0,840 ммоль) и DCE (1,2 мл). Раствор перемешивали при 25ºC в течение 18 часов, неочищенную реакционную смесь концентрировали и очищали методом хроматографии на силикагеле (0-100% EtOAc в гексане) с получением указанного в заголовке соединения в виде коричневого масла (237 мг, 0,588 ммоль, 98%): ИК (тонкая пленка) 1674 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,97 (д, J=2,6 Гц, 1H), 8,64 (дд, J=4,7, 1,3 Гц, 1H), 8,13 (с, 1H), 8,07 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,48 (ддд, J=8,3, 4,8, 0,5 Гц, 1H), 4,39 (с, 2H), 3,76 (дкв. д, J=17,2, 8,6, 3,6 Гц, 1H), 2,67 (дд, J=16,6, 3,6 Гц, 1H), 2,46 (дд, J=16,5, 9,9 Гц, 1H), 2,29 (д, J=2,5 Гц, 4H); ESIMS m/z 403 ([M+H]+).
Соединения 597, 604, 609, 614-616 получали в соответствии с методикой, раскрытой в примере 80.
Пример 81: Получение 3-хлор-N-(проп-2-инил)-1-(пиридин-3-ил)-1H-пиразол-4-амина
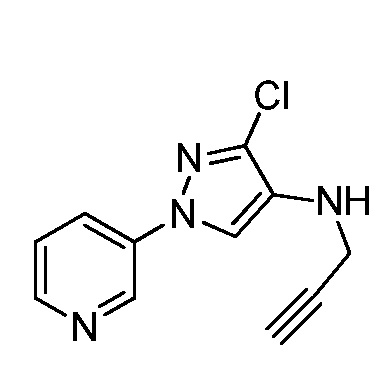
К раствору трет-бутил(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(проп-2-ин-1-ил)карбамата (2,2 г, 6,61 ммоль) в дихлорметане (8,3 мл) добавляли 2,2,2-трифторуксусную кислоту (12,06 г, 106 ммоль) и перемешивали реакционную смесь при температуре окружающей среды в течение 1 часа. Реакционную смесь гасили добавлением насыщенного бикарбоната натрия. Органический слой экстрагировали дихлорметаном (2×20 мл). Органические слои объединяли и сушили над сульфатом натрия, фильтровали и концентрировали без дополнительной очистки с получением указанного в заголовке соединения в виде бежевого твердого вещества (1,5 г, 6,12 ммоль, 93%): 1H ЯМР (400 МГц, CDCl3) δ 8,89 (д, J=2,3 Гц, 1H), 8,50 (дд, J=4,7, 1,4 Гц, 1H), 8,01-7,93 (м, 1H), 7,54 (с, 1H), 7,37 (ддд, J=8,3, 4,8, 0,7 Гц, 1H), 3,90 (с, 2H), 3,38 (с, 1H), 2,44-2,09 (м, 1H); ESIMS m/z 233 ([M+H]+).
Пример 82: Получение N-(3-Хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-2-(метилтио)-N-(проп-2-ин-1-ил)пропанамида (соединение 611)
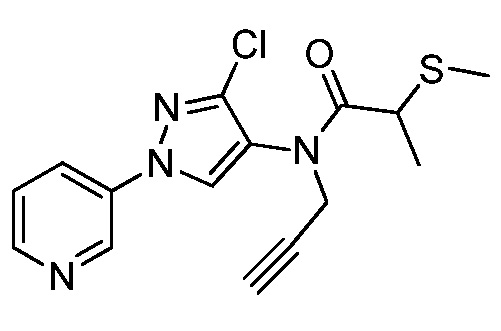
К раствору 2-(метилтио)пропановой кислоты (0,36 г, 3,00 ммоль) в дихлорметане (3 мл) добавляли оксалилдихлорид (0,29 мл, 3,31 ммоль), а затем одну каплю N,N-диметилформамида. Реакционную смесь перемешивали в течение 30 минут, после чего выпаривали весь растворитель. Полученный остаток растворяли в дихлорметане (2 мл) и добавляли его к предварительно перемешанному раствору 3-хлор-N-(проп-2-ин-1-ил)-1-(пиридин-3-ил)-1H-пиразол-4-амина (0,35 г, 1,50 ммоль) и N-этил-N-изопропилпропан-2-амина (0,57 мл, 3,31 ммоль) в дихлорметане (5,5 мл). Реакционную смесь перемешивали при температуре окружающей среды в течение 16 часов. Реакционную смесь концентрировали, и очищали остаток методом хроматографии на силикагеле (0-100% этилацетат в гексанах) с получением указанного в заголовке соединения в виде желтого масла (432 мг, 1,23 ммоль, 85%): 1H ЯМР (400 МГц, CDCl3) δ 8,97 (д, J=2,5 Гц, 1H), 8,66-8,60 (м, 1H), 8,25 (с, 1H), 8,08-8,01 (м, 1H), 7,49-7,42 (м, 1H), 4,86 (с, 1H), 4,29-3,97 (м, 1H), 3,31 (д, J=6,5 Гц, 1H), 2,30-2,24 (м, 1H), 2,09 (с, 3H), 1,46 (д, J=6,9 Гц, 3H); 13C ЯМР (101 МГц, CDCl3) δ 171,30, 148,66, 140,71, 140,18, 135,71, 127,87, 126,35, 124,11, 122,12, 78,53, 72,92, 53,39, 37,97, 16,42, 11,07; ESIMS m/z 335 ([M+H]+).
Соединение 612 получали в соответствии с методикой, раскрытой в примере 82.
Пример 83: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-2-(метилсульфинил)-N-(проп-2-ин-1-ил)пропанамида (соединение 617)
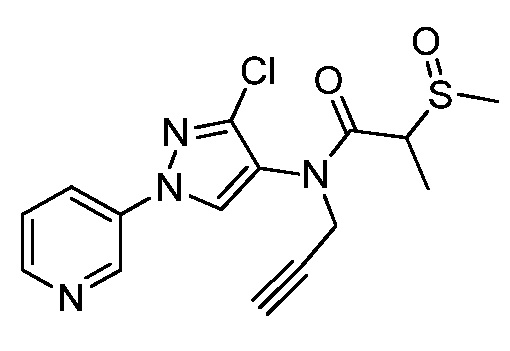
К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-2-(метилтио)-N-(проп-2-ин-1-ил)пропанамида (0,1 г, 0,30 ммоль) в гексафторизопропаноле (2,0 мл) добавляли пероксид водорода (35 масс.%, 0,08 мл, 0,90 ммоль) и энергично перемешивали реакционную смесь при температуре окружающей среды. Реакция завершалась спустя 1 час. Реакционную смесь гасили добавлением насыщенного раствора сульфита натрия, и экстрагировали органический слой этилацетатом (3×20 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали. Остаток очищали методом хроматографии на силикагеле (0-20% метанол в дихлорметане) с получением указанного в заголовке соединения в виде не совсем белой пены (82 мг, 0,21 ммоль, 78%): 1H ЯМР (400 МГц, CDCl3) δ 8,98 (с, 1H), 8,65 (д, J=4,6 Гц, 1H), 8,23 (с, 1H), 8,11-7,97 (м, 1H), 7,51-7,41 (м, 1H), 4,88 (уш. с, 1H), 4,14 (уш. с, 1H), 2,64 (с, 1,2H), 2,55 (с, 1,8H), 2,33-2,27 (м, 1H), 1,47 (д, J=6,8 Гц, 3H); 13C ЯМР (101 МГц, CDCl3) δ 168,11, 148,95, 148,78, 140,45, 140,33, 140,20, 135,56, 126,54, 124,10, 121,68, 121,58, 121,48, 77,69, 73,49, 38,60; ESIMS m/z 351 ([M+H]+).
Пример 84: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-2-(метилсульфонил)-N-(проп-2-ин-1-ил)пропанамида (соединение 618)
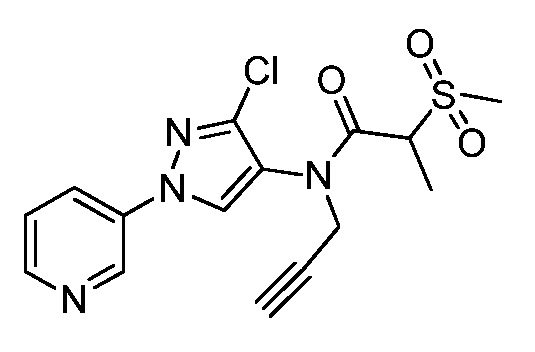
К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-2-(метилтио)-N-(проп-2-ин-1-ил)пропанамида (0,10 г, 0,30 ммоль) и уксусной кислоты (2,0 мл) добавляли тетрагидрат пербората натрия (0,11 г, 0,74 ммоль), и нагревали сосуд до 65°C в течение 2 часов. Реакционную смесь охлаждали до температуры окружающей среды и нейтрализовывали насыщенным бикарбонатом натрия. Органический слой экстрагировали этилацетатом (3×). Органические слои объединяли, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток очищали методом хроматографии на силикагеле (0-20% метанол в дихлорметане) с получением указанного в заголовке соединения в виде желтой пены (84 мг, 0,21 ммоль, 73%): 1H ЯМР (400 МГц, CDCl3) δ 9,00 (с, 1H), 8,65 (с, 1H), 8,29 (с, 1H), 8,03 (д, J=8,0 Гц, 1H), 7,54-7,39 (м, 1H), 4,89 (д, J=16,9 Гц, 1H), 4,20-4,08 (м, 1H), 4,07-3,92 (м, 1H), 3,01 (с, 3H), 2,34-2,29 (м, 1H), 1,67 (д, J=7,0 Гц, 3H); 13C ЯМР (101 МГц, CDCl3) δ 166,97, 166,90, 148,77, 140,43, 140,24, 135,58, 129,36, 126,64, 124,14, 121,34, 73,80, 60,91, 38,78, 36,29, 13,97; ESIMS m/z 367 ([M+H]+).
Пример 85: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-метил-3-(тритилтио)пропанамида
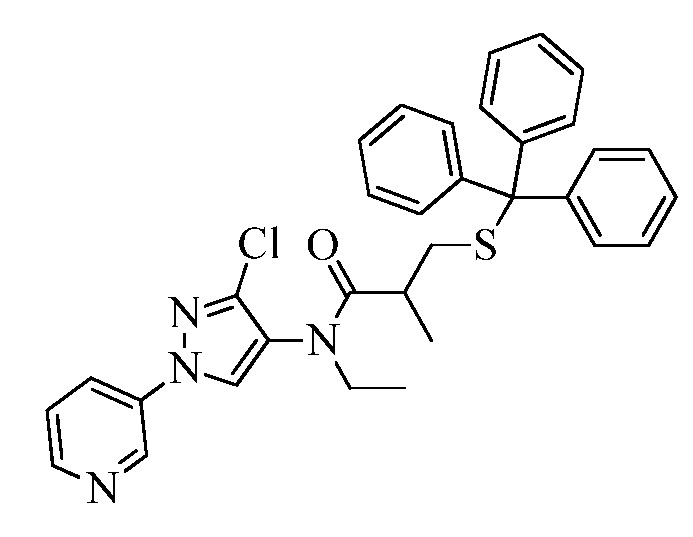
К раствору N,N-диметилпиридин-4-амина (2,60 г, 21,31 ммоль), 2-метил-3-(тритилтио)пропановой кислоты (4,41 г, 12,18 ммоль) (полученной в соответствии с Ondetti, Miguel Angel et. al. DE2703828) и гидрохлорида N1-((этилимино)метилен)-N3,N3-диметилпропан-1,3-диамина (2,36 г, 15,22 ммоль) в CH2Cl2 (20 мл) добавляли дигидрохлорид 3-хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амина (3,0 г, 10 ммоль). Смесь перемешивали при 0°C в течение 2 часов, а затем при комнатной температуре в течение дополнительных 48 часов. Смесь разбавляли этилацетатом (100 мл) и насыщенным водным NH4Cl. Органическую фазу разделяли, промывали солевым раствором, сушили над MgSO4 и концентрировали в условиях вакуума с получением светло-коричневого клейкого вещества. Это клейкое вещество очищали на силикагеле, элюируя смесью этилацетата и гексанов, с получением указанного в заголовке соединения в виде розового твердого вещества (2,97 г, 51%): т.пл. 64-66°C; 1H ЯМР (400 МГц, CDCl3) δ 8,89 (д, J=2,7 Гц, 1H), 8,62 (дд, J=4,7, 1,4 Гц, 1H), 7,93-7,86 (м, 1H), 7,82 (с, 1H), 7,41 (дд, J=8,3, 4,7 Гц, 1H), 7,33-7,14 (м, 15H), 3,68 (д, J=47,9 Гц, 2H), 2,72 (дд, J=12,0, 8,8 Гц, 1H), 2,37-2,24 (м, 1H), 2,01 (дд, J=12,0, 5,2 Гц, 1H), 1,14 (т, J=7,2 Гц, 3H), 0,95 (д, J=6,7 Гц, 3H); ESIMS m/z 568 ([M+H]+).
Пример 86: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-метил-3-(тритилтио)пропанамида
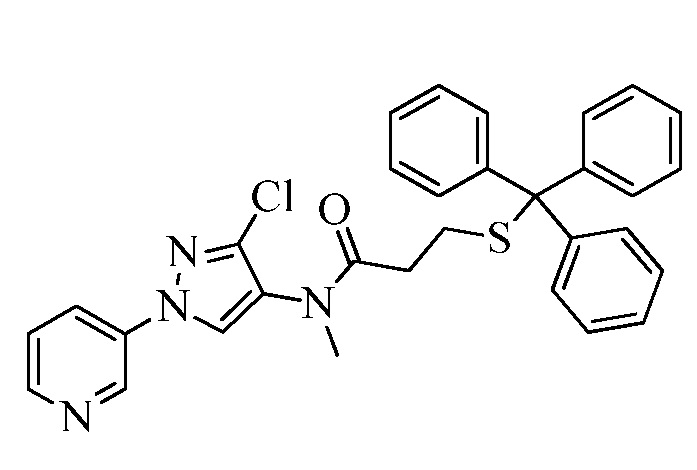
К раствору гидрохлорида 3-хлор-N-метил-1-(пиридин-3-ил)-1H-пиразол-4-амина (1,5 г, 6,12 ммоль) в CH2Cl2 (10 мл) добавляли 3-(тритилтио)пропановую кислоту (2,35 г, 6,73 ммоль) (полученную в соответствии с Ondetti, Miguel Angel et.al. DE2703828), N,N-диметилпиридин-4-амин (0,82 г, 6,73 ммоль) и гидрохлорид N1-((этилимино)метилен)-N3,N3-диметилпропан-1,3-диамина (1,76 г, 9,18 ммоль), и перемешивали смесь при комнатной температуре в течение 16 ч. Смесь разбавляли CH2Cl2 (100 мл) и водой (50 мл) и разделяли органическую фазу. Водную фазу экстрагировали этилацетатом, объединенную органическую фазу промывали солевым раствором, сушили над MgSO4 и концентрировали в условиях вакуума с получением указанного в заголовке соединения в виде белого порошка (1,95 г, 59%): т.пл. 62-64°C; 1H ЯМР (400 МГц, CDCl3) δ 8,91 (д, J=2,7 Гц, 1H), 8,67-8,61 (м, 1H), 8,06-7,96 (м, 1H), 7,81 (с, 1H), 7,49-7,46 (м, 1H), 7,25-7,45 (м, 15H), 3,17 (с, 3H), 2,56-2,46 (м, 2H), 2,09-1,97 (м, 2H); ESIMS m/z 540 ([M+H]+).
Пример 87: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-меркапто-N-метилпропанамида
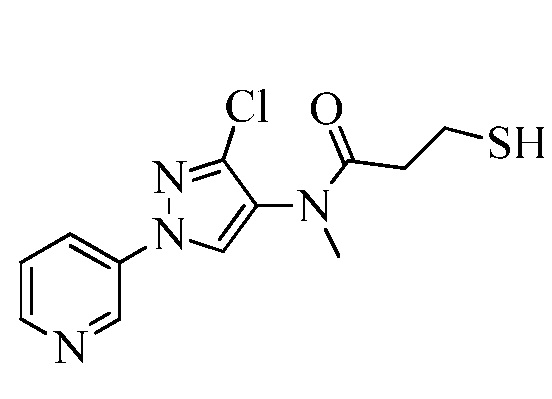
К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-метил-3-(тритилтио)пропанамида (1,300 г, 2,411 ммоль) в CH2Cl2 (6,14 г, 72,3 ммоль) при комнатной температуре добавляли триэтилсилан (1,402 г, 12,06 ммоль), а затем 2,2,2-трифторуксусную кислоту (2,75 г, 24,11 ммоль). Смесь перемешивали в течение 1 часа и гасили добавлением насыщенного водного NaHCO3. Смесь разбавляли CH2Cl2, и разделяли органическую фазу. Водную фазу экстрагировали CH2Cl2, органические фазы объединяли, промывали солевым раствором, сушили над безводным MgSO4 и концентрировали в условиях вакуума с получением светло-желтого масла. Это масло очищали на силикагеле, элюируя этилацетатом и гексанами, с получением указанного в заголовке соединения в виде бесцветного масла (701 мг, 93%): ИК (тонкая пленка) 3094, 2980, 1657, 1582 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,95 (д, J=2,6 Гц, 1H), 8,63 (с, 1H), 8,06 (с, 1H), 8,04-7,96 (м, 1H), 7,52-7,42 (м, 1H), 3,26 (с, 3H), 2,85-2,73 (м, 2H), 2,56-2,48 (м, 2H).
Следующие соединения получали в соответствии с методиками, раскрытыми в примере 87:
N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-меркаптопропанамид
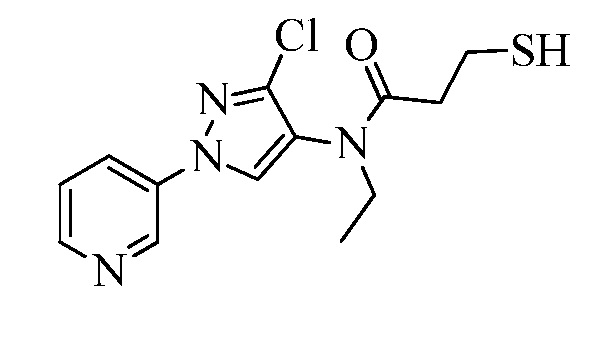
Указанное в заголовке соединение выделяли в виде светло-коричневого клейкого вещества (902 мг, 64%): ИК (тонкая пленка) 3086, 2980, 2936, 2548, 1657 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,96 (дд, J=2,7, 0,7 Гц, 1H), 8,63 (дд, J=4,8, 1,5 Гц, 1H), 8,06 (ддд, J=8,3, 2,7, 1,4 Гц, 1H), 7,97 (с, 1H), 7,47 (ддд, J=8,4, 4,7, 0,8 Гц, 1H), 3,72 (кв., J=7,1 Гц, 2H), 2,79 (дт, J=8,5, 6,8 Гц, 2H), 2,49 (т, J=6,7 Гц, 2H), 1,67 (т, J=8,4 Гц, 1H), 1,17 (т, J=7,2 Гц, 3H); ESIMS m/z 311 ([M+H]+), 309 ([M-H]-).
N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-меркапто-2-метилпропанамид
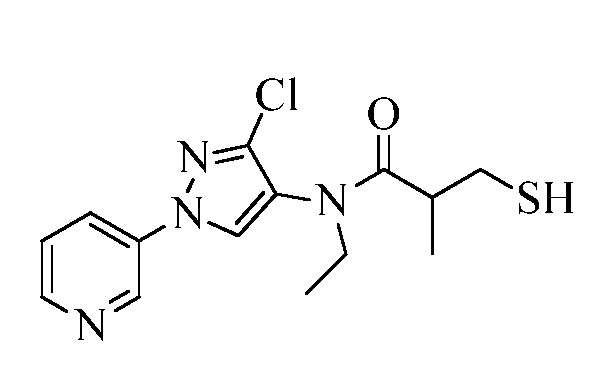
Указанное в заголовке соединение выделяли в виде бесцветного масла, которое отверждалось при отстаивании: т.пл. 94-96°C; 1H ЯМР (400 МГц, CDCl3) δ 8,97 (дд, J=2,7, 0,7 Гц, 1H), 8,63 (дд, J=4,8, 1,5 Гц, 1H), 8,05 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 8,02 (с, 1H), 7,47 (ддд, J=8,3, 4,8, 0,8 Гц, 1H), 3,85 (м, 1H), 3,60 (м, 1H), 2,91 (ддд, J=13,2, 9,4, 8,1 Гц, 1H), 2,41 (ддд, J=13,2, 9,2, 4,9 Гц, 1H), 1,49 (дд, J=9,2, 8,2 Гц, 1H), 1,18 (т, J=7,2 Гц, 3H), 1,14 (д, J=6,7 Гц, 3H); ESIMS m/z 325 ([M+H]+).
Пример 88: Получение 3-(((2,2-дифторциклопропил)метил)тио)пропановой кислоты
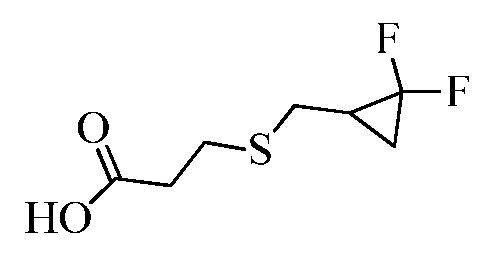
К перемешанному раствору 3-меркаптопропановой кислоты (400 мг, 3,77 ммоль) в метаноле (2 мл) при комнатной температуре последовательно добавляли измельченный гидроксид калия (423 мг, 7,54 ммоль) и 2-(бромметил)-1,1-дифторциклопропан (657 мг, 3,84 ммоль). Полученную белую суспензию перемешивали при 65°C в течение 3 ч и гасили добавлением 1н водного HCl, и разбавляли этилацетатом. Органическую фазу разделяли, и экстрагировали водную фазу этилацетатом (2×50 мл). Объединенные органические экстракты сушили над MgSO4, фильтровали и концентрировали в условиях вакуума с получением указанного в заголовке соединения в виде бесцветного масла (652 мг, 84%): ИК (KBr тонкая пленка) 3025, 2927, 2665, 2569, 1696 см-1; 1H ЯМР (400 МГц, CDCl3) δ 2,85 (т, J=7,0 Гц, 2H), 2,82-2,56 (м, 4H), 1,88-1,72 (м, 1H), 1,53 (дддд, J=12,3, 11,2, 7,8, 4,5 Гц, 1H), 1,09 (дтд, J=13,1, 7,6, 3,7 Гц, 1H); ESIMS m/z 195,1 ([M-H]-).
Следующие соединения получали в соответствии с методиками, раскрытыми в примере 88:
4-(((2,2-Дифторциклопропил)метил)тио)бутановая кислота: 1H ЯМР (400 МГц, CDCl3) δ 11,31 (с, 1H), 2,71-2,54 (м, 4H), 2,51 (т, J=7,2 Гц, 2H), 2,01-1,86 (м, 2H), 1,85-1,70 (м, 1H), 1,51 (дддд, J=12,3, 11,2, 7,8, 4,5 Гц, 1H), 1,07 (дтд, J=13,2, 7,6, 3,7 Гц, 1H); 13C ЯМР (101 МГц, CDCl3) δ 179,6, 113,7 (дд, J=286,4, 283,4 Гц), 32,7, 30,7, 28,7 (д, J=4,6 Гц), 24,2, 22,8 (т, J=11,2 Гц), 16,6 (т, J=10,8 Гц); 19F ЯМР (376 МГц, CDCl3) δ -128,12 (д, J=156,8 Гц), -142,77 (д, J=156,7 Гц).
4-((2,2,2-Трифторэтил)тио)бутановая кислота: 1H ЯМР (400 МГц, ДМСО-d6) δ 3,47 (кв., J=10,8 Гц, 2H), 2,72 (дд, J=7,8, 6,6 Гц, 2H), 2,32 (тд, J=7,3, 4,5 Гц, 2H), 1,96-1,81 (м, 2H).
Пример 89: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-(((2,2-дифторциклопропил)метил)тио)-N-этилпропанамида (соединение 626)
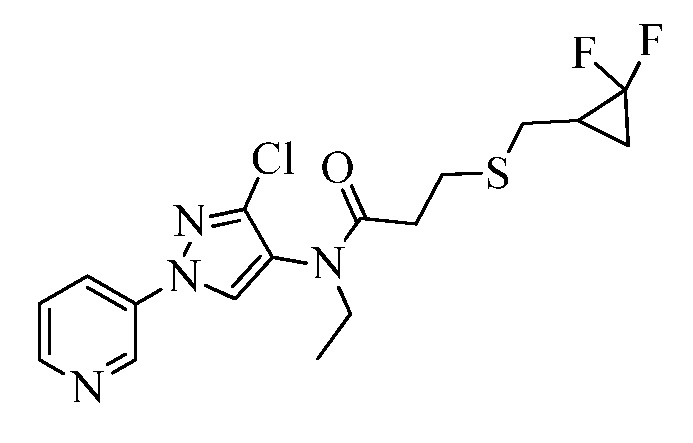
К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-меркаптопропанамида (100 мг, 0,322 ммоль) в THF (1 мл) добавляли гидрид натрия (60% дисперсия в масле, 13,5 мг, 0,34 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 10 мин, а затем добавляли 2-(бромметил)-1,1-дифторциклопропан (60 мг, 0,35 ммоль). Смесь перемешивали при комнатной температуре в течение 24 ч и разбавляли насыщенным водным хлоридом аммония и этилацетатом. Органическую фазу разделяли, и экстрагировали водную фазу этилацетатом (2×50 мл). Объединенные органические экстракты сушили над MgSO4, фильтровали и концентрировали в условиях вакуума с получением бесцветного масла. Это масло очищали методом хроматографии, элюируя смесью этилацетата и гексанов, с получением указанного в заголовке соединения в виде бесцветного клейкого вещества (101 мг, 78%): ИК (тонкая пленка) 3092, 2975, 2931, 1659, 1584 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,99-8,90 (м, 1H), 8,63 (дд, J=4,8, 1,5 Гц, 1H), 8,05 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,96 (с, 1H), 7,47 (ддд, J=8,3, 4,7, 0,7 Гц, 1H), 3,72 (кв., J=7,2 Гц, 2H), 2,87 (т, J=7,3 Гц, 2H), 2,63-2,55 (м, 2H), 2,46 (т, J=7,3 Гц, 2H), 1,76 (ддкв., J=13,2, 11,4, 7,5 Гц, 1H), 1,48 (дддд, J=12,3, 11,2, 7,8, 4,5 Гц, 1H), 1,17 (т, J=7,2 Гц, 3H), 1,04 (дтд, J=13,2, 7,6, 3,7 Гц, 1H); ESIMS m/z 400 ([M+H]+).
Соединения 624, 625, 629, 633, 643, 653, представленные в таблице 1, получали в соответствии с методиками, раскрытыми в примере 89.
Пример 90: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-(((2,2-дифторциклопропил)метил)сульфинил)-N-этилпропанамида (соединение 627)
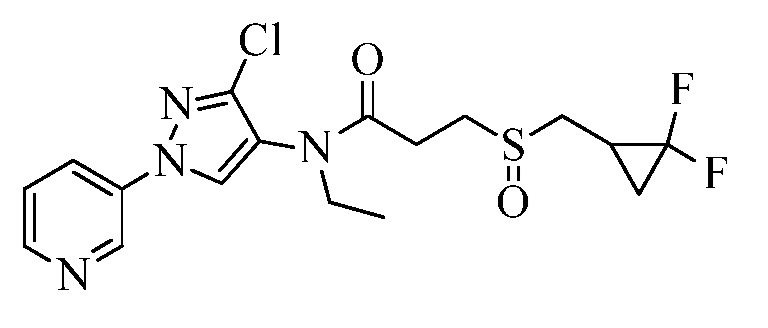
К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-(((2,2-дифторциклопропил)метил)тио)-N-этилпропанамида (100 мг, 0,25 ммоль) в уксусной кислоте (5 мл, 0,25 ммоль) добавляли тетрагидрат пербората натрия (38,4 мг, 0,25 ммоль), и перемешивали смесь при 50ºC в течение 1 часа. Смесь охлаждали до комнатной температуры, гасили добавлением насыщенного водного бикарбоната натрия, а затем разбавляли этилацетатом. Органическую фазу разделяли, и экстрагировали водную фазу этилацетатом. Объединенную органическую фазу промывали солевым раствором, сушили над MgSO4 и концентрировали в условиях вакуума с получением бесцветного масла. Это масло очищали на силикагеле, элюируя метанолом и CH2Cl2 (0-10% градиент), с получением указанного в заголовке соединения в виде бесцветного клейкого вещества (91 мг, 88%): ИК (тонкая пленка) 3448, 3092, 2976, 2933, 1659, 1585, 1440, 1012 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,97 (д, J=2,6 Гц, 1H), 8,63 (дд, J=4,8, 1,5 Гц, 1H), 8,04 (м, 2H), 7,46 (ддд, J=8,3, 4,8, 0,7 Гц, 1H), 3,72 (дкв., J=13,8, 7,0 Гц, 2H), 3,16 (ддд, J=20,3, 13,9, 6,8 Гц, 1H), 3,00-2,79 (м, 3H), 2,69 (м, 2H), 2,13-1,85 (м, 1H), 1,77-1,62 (м, 1H), 1,41-1,21 (м, 1H), 1,18 (т, J=7,2 Гц, 3H); ESIMS m/z 417 ([M+H]+).
Соединения 622, 630, 645, представленные в таблице 1, получали в соответствии с методиками, раскрытыми в примере 90.
Пример 91: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-(((2,2-дифторциклопропил)метил)сульфонил)-N-этилпропанамида (соединение 628)
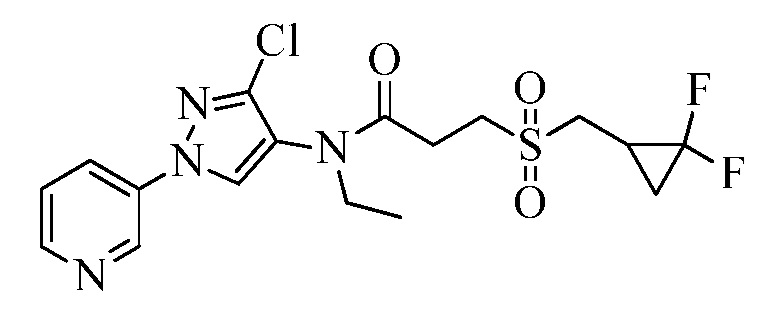
К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-(((2,2-дифторциклопропил)метил)тио)-N-этилпропанамида (100 мг, 0,25 ммоль) в уксусной кислоте (5 мл, 0,25 ммоль) добавляли тетрагидрат пербората натрия (77 мг, 0,499 ммоль) и перемешивали смесь при 50°C в течение 1 часа. Смесь охлаждали до комнатной температуры, гасили добавлением насыщенного водного бикарбоната натрия, а затем разбавляли этилацетатом. Органическую фазу разделяли, и экстрагировали водную фазу этилацетатом. Объединенную органическую фазу промывали солевым раствором, сушили над MgSO4 и концентрировали в условиях вакуума с получением коричневого масла. Это масло очищали на силикагеле, элюируя смесью этилацетата и гексанов, с получением указанного в заголовке соединения в виде бесцветного клейкого вещества (90 мг, 83%): ИК (тонкая пленка) 3104, 2980, 2934, 1662, 1486, 1460 см-1; 1H ЯМР (400 МГц, CDCl3) δ 9,00-8,90 (м, 1H), 8,64 (дд, J=4,7, 1,4 Гц, 1H), 8,09-8,00 (м, 2H), 7,47 (ддд, J=8,4, 4,8, 0,7 Гц, 1H), 3,72 (д, J=7,1 Гц, 2H), 3,43 (с, 2H), 3,30 (дд, J=14,7, 6,8 Гц, 1H), 3,11-3,00 (м, 1H), 2,72 (т, J=6,9 Гц, 2H), 2,13-1,96 (м, 1H), 1,73 (тдд, J=11,5, 8,3, 5,4 Гц, 1H), 1,45 (ддт, J=16,1, 8,0, 3,8 Гц, 1H), 1,18 (т, J=7,2 Гц, 3H); ESIMS m/z 433 ([M+H]+).
Соединения 623, 631, 644, представленные в таблице 1, получали в соответствии с методиками, раскрытыми в примере 91.
Пример 92: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-(циклопропилметил)-3-(((2,2-дифторциклопропил)метил)тио)пропанамида (соединение 632)
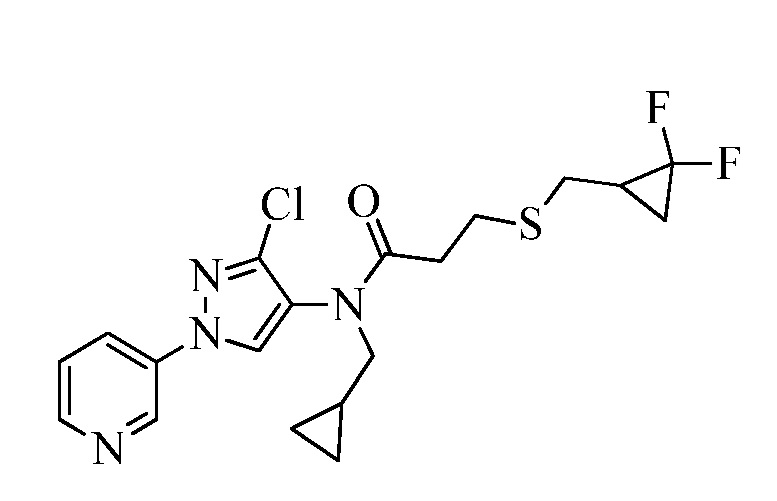
К раствору 3-хлор-N-(циклопропилметил)-1-(пиридин-3-ил)-1H-пиразол-4-амина (108 мг, 0,43 ммоль), N,N-диметилпиридин-4-амина (53 мг, 0,43 ммоль) и 3-(((2,2-дифторциклопропил)метил)тио)-пропановой кислоты (85 мг, 0,43 ммоль) в DMF (5 мл) добавляли гидрохлорид N1-((этилимино)метилен)-N3,N3-диметилпропан-1,3-диамина (101 мг, 0,65 ммоль). Полученную коричнево-желтую смесь перемешивали при температуре окружающей среды в течение 2 ч. Смесь разбавляли насыщенным водным хлоридом аммония и этилацетатом. Органическую фазу разделяли и экстрагировали водную фазу этилацетатом (2×50 мл). Объединенные органические экстракты сушили над MgSO4, фильтровали и концентрировали в условиях вакуума с получением указанного в заголовке соединения в виде бесцветного масла (120 мг, 61%): ИК (тонкая пленка) 3089, 3005, 2923, 1660 1584 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,95 (д, J=2,6 Гц, 1H), 8,63 (дд, J=4,8, 1,5 Гц, 1H), 8,05 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,99 (с, 1H), 7,47 (ддд, J=8,3, 4,7, 0,7 Гц, 1H), 3,54 (с, 2H), 2,88 (т, J=7,3 Гц, 2H), 2,69-2,54 (м, 2H), 2,48 (т, J=7,3 Гц, 2H), 1,76 (ддт, J=18,7, 13,3, 7,4 Гц, 1H), 1,53-1,42 (м, 1H), 1,12-0,90 (м, 2H), 0,54-0,44 (м, 2H), 0,20 (дт, J=6,1, 4,6 Гц, 2H); ESIMS m/z 427 ([M+H]+).
Соединение 646, представленное в таблице 1, получали в соответствии с методиками, раскрытыми в примере 92.
Пример 93: Получение (E)-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-4,4,4-трифторбут-2-енамида
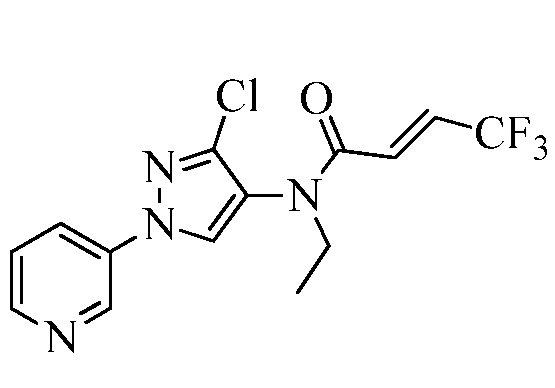
К раствору дигидрохлорида 3-хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амина (1,0 г, 3,38 ммоль), N,N-диметилпиридин-4-амина (827 мг, 6,77 ммоль) и (E)-4,4,4-трифторбут-2-еновой кислоты (474 мг, 3,38 ммоль) в DMF (3 мл) добавляли N1-((этилимино)метилен)-N3,N3-диметилпропан-1,3-диамина гидрохлорид (973 мг, 5,07 ммоль). Полученную коричнево-желтую смесь перемешивали при температуре окружающей среды в течение 2 часов. Смесь разбавляли насыщенным водным NH4Cl и этилацетатом и насыщали NaCl. Органическую фазу разделяли, и экстрагировали водную фазу этилацетатом (2×50 мл). Объединенную органическую фазу сушили над MgSO4, фильтровали и концентрировали в условиях вакуума с получением указанного в заголовке соединения в виде светло-коричневого клейкого вещества (901 мг, 73%): ИК (тонкая пленка) 3093, 2978, 2937, 1681, 1649, 1585, 1114 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,97 (д, J=2,7 Гц, 1H), 8,65 (дд, J=4,9, 1,4 Гц, 1H), 8,07 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,99 (с, 1H), 7,48 (дд, J=8,3, 4,8 Гц, 1H), 6,84 (дкв., J=15,4, 6,8 Гц, 1H), 6,60-6,44 (м, 1H), 3,80 (кв., J=7,2 Гц, 2H), 1,22 (т, J=7,2 Гц, 3H); ESIMS m/z 345 ([M+H]+).
Пример 94: Получение S-(4-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)амино)-1,1,1-трифтор-4-оксобутан-2-ил)этантиоата
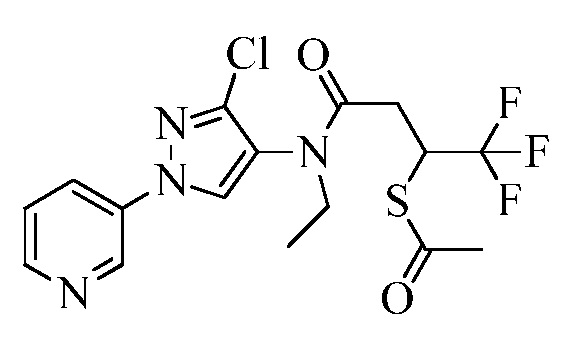
К раствору (E)-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-4,4,4-трифторбут-2-енамида (465 мг, 1,349 ммоль) в безводном ДМСО (5 мл) добавляли этантиоацетат калия (616 мг, 5,40 ммоль). Смесь перемешивали при 50°C в течение 96 часов в атмосфере азота. Смесь гасили добавлением насыщенного хлорида аммония и дважды экстрагировали этилацетатом. Объединенную органическую фазу промывали солевым раствором, сушили над MgSO4, фильтровали и концентрировали в условиях вакуума с получением коричневого клейкого вещества. Путем очистки этого клейкого вещества на силикагеле, элюируя смесью гексана и этилацетата, получали указанное в заголовке соединение в виде коричневого клейкого вещества (265 мг, 44%): ИК (тонкая пленка) 3099, 2976, 2936, 1708, 1666, 1585, 1102 см-1; 1H ЯМР (400 МГц, CDCl3) δ 9,03-8,93 (м, 1H), 8,64 (дд, J=4,7, 1,5 Гц, 1H), 8,12-8,04 (м, 1H), 7,98 (с, 1H), 7,53-7,42 (м, 1H), 4,78 (дд, J=9,0, 4,4 Гц, 1H), 3,90-3,54 (м, 2H), 2,76 (дд, J=16,6, 4,4 Гц, 1H), 2,53 (дд, J=16,6, 9,4 Гц, 1H), 2,41 (с, 3H), 1,16 (т, J=7,2 Гц, 3H); ESIMS m/z 421 ([M+H]+).
Пример 95: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-(((2,2-дифторциклопропил)метил)тио)-N-этил-4,4,4-трифторбутанамида (соединение 634)
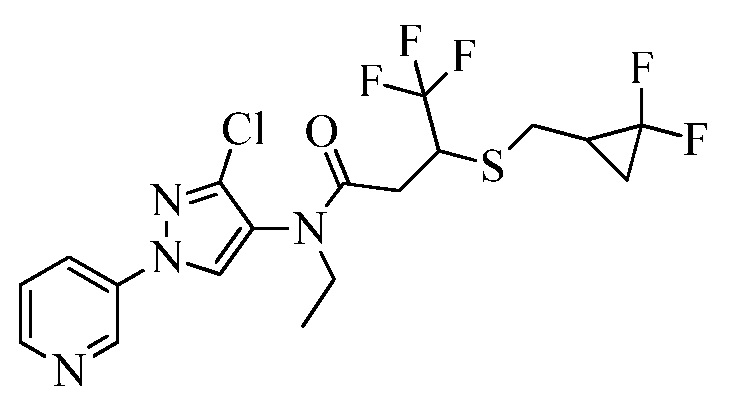
К раствору метанола (21,1 мг, 0,66 ммоль) в THF (1 мл) добавляли гидрид натрия (26,5 мг, 0,66 ммоль, 60% суспензия в масле). Полученную смесь перемешивали в течение 10 минут при комнатной температуре и добавляли S-(4-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)амино)-1,1,1-трифтор-4-оксобутан-2-ил)этантиоат (266 мг, 0,63 ммоль) в THF (1 мл). После перемешивания в течение 30 минут добавляли 2-(бромметил)-1,1-дифторциклопропан (130 мг, 0,76 ммоль). Смесь дополнительно перемешивали при комнатной температуре в течение 4 часов и разбавляли насыщенным водным хлоридом аммония и этилацетатом. Органическую фазу разделяли, и экстрагировали водную фазу этилацетатом (2×50 мл). Объединенные этилацетатные экстракты сушили над MgSO4, фильтровали и концентрировали в условиях вакуума с получением бесцветного масла. Путем очистки на силикагеле, элюируя этилацетатом и гексанами, получали указанное в заголовке соединение в виде коричневого масла (89 мг, выход 30%): ИК (тонкая пленка) 3097, 2978, 2937, 1664, 1440 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,96 (д, J=2,7 Гц, 1H), 8,64 (дд, J=4,8, 1,4 Гц, 1H), 8,06 (ддд, J=8,4, 2,8, 1,4 Гц, 1H), 7,98 (д, J=2,1 Гц, 1H), 7,47 (дд, J=8,3, 4,8 Гц,1H), 3,94-3,84 (м, 1H), 3,75 (с, 2H), 2,97 (дд, J=13,4, 7,5 Гц, 0,55H), 2,85 (с, 1H), 2,79-2,65 (м, 0,45H), 2,60 (м, 1H), 2,43 (дт, J=16,3, 10,0 Гц, 1H), 1,89 (тт, J=12,2, 7,5 Гц, 1H), 1,63-1,49 (м, 1H), 1,23-1,13 (м, 4H); ESIMS m/z 469 ([M+H]+).
Пример 96: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-2-((циклопропилметил)тио)-N-этилпропанамида (соединение 621)
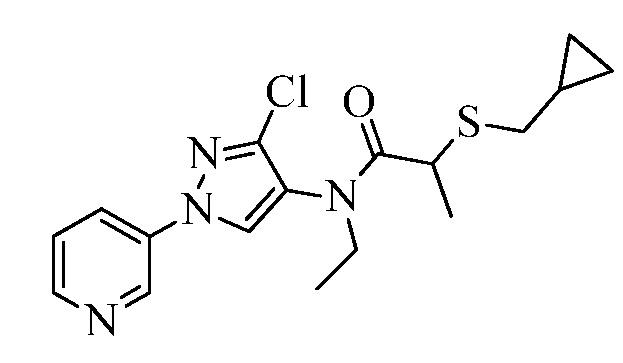
К раствору метанола (9,99 мг, 0,312 ммоль) в THF (1 мл) добавляли гидрид натрия (12,4 мг, 0,31 ммоль, 60% суспензия в масле). Смесь перемешивали при комнатной температуре в течение 10 минут и добавляли S-(1-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)амино)-1-оксопропан-2-ил)этантиоат (100 мг, 0,28 ммоль). После перемешивания смеси в течение 30 мин добавляли (бромметил)циклопропан (38 мг, 0,28 ммоль), и дополнительно перемешивали смесь в течение 14 часов. Смесь разбавляли насыщенным водным хлоридом аммония (5 мл) и этилацетатом (15 мл), и разделяли органическую фазу. Водную фазу экстрагировали этилацетатом (5 мл), объединенную органическую фазу промывали солевым раствором, сушили над MgSO4 и концентрировали в условиях вакуума с получением маслянистого остатка. Этот остаток очищали на силикагеле, элюируя смесью этилацетата и гексанов, с получением указанного в заголовке соединения в виде бесцветного клейкого вещества (31 мг, 30%): ИК (тонкая пленка) 3081, 2972, 2930, 2871, 1655, 1438 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,96 (д, J=2,8 Гц, 1H), 8,63 (дд, J=4,8, 1,4 Гц, 1H), 8,13 (с, 1H), 8,04 (ддт, J=8,3, 3,2, 1,6 Гц, 1H), 7,50-7,40 (м, 1H), 3,81 (уш. с, 1H), 3,59 (уш. с, 1H), 3,33 (д, J=7,4 Гц, 1H), 2,58-2,41 (м, 2H), 1,47 (д, J=6,9 Гц, 3H), 1,17 (тд, J=7,1, 1,8 Гц, 3H), 0,84 (дт, J=10,3, 7,4, 3,7 Гц, 1H), 0,56-0,38 (м, 2H), 0,25-0,07 (м, 2H); ESIMS m/z 365 ([M+H]+).
Соединение 651, представленное в таблице 1, получали в соответствии с методиками, раскрытыми в примере 96.
Пример 97: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-((циклопропилметил)тио)-N-этилпропанамида (соединение 619)
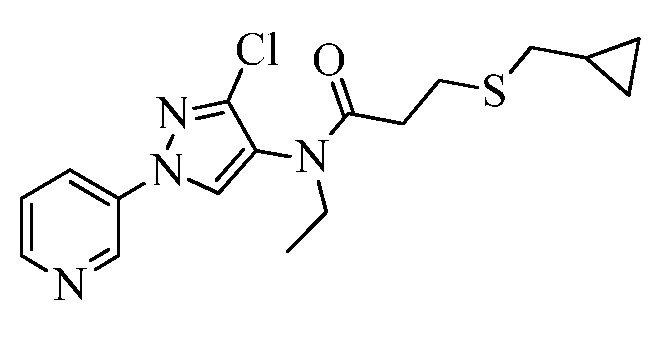
К раствору метанола (9,99 мг, 0,31 ммоль) в ДМСО (1 мл) добавляли гидрид натрия (12,4 мг, 0,31 ммоль). Смесь перемешивали при комнатной температуре в течение 10 минут и добавляли раствор S-(3-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)амино)-3-оксопропил)этантиоата (100 мг, 0,28 ммоль). После перемешивания смеси в течение 30 мин, добавляли (бромметил)циклопропан (38 мг, 0,28 ммоль) и дополнительно перемешивали смесь в течение 30 минут. Смесь разбавляли насыщенным водным NH4Cl и этилацетатом, и разделяли органическую фазу. Водную фазу экстрагировали этилацетатом, объединенную органическую фазу промывали солевым раствором, сушили над MgSO4 и концентрировали в условиях вакуума с получением светло-коричневого масла. Это масло очищали на силикагеле, элюируя смесью гексанов и этилацетата, с получением указанного в заголовке соединения в виде бесцветного клейкого вещества (33 мг, 31%): ИК (тонкая пленка) 3080, 2978, 2930, 1660, 1584 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,95 (д, J=2,8 Гц, 1H), 8,63 (дд, J=4,7, 1,5 Гц, 1H), 8,12-8,01 (м, 1H), 7,98-7,92 (м, 1H), 7,53-7,40 (м, 1H), 3,78-3,62 (м, 2H), 2,95-2,84 (м, 2H), 2,51-2,38 (м, 4H), 1,20-1,11 (м, 3H), 0,94 (с, 1H), 0,60-0,34 (м, 2H), 0,24-0,09 (м, 2H); ESIMS m/z 365 ([M+H]+).
Пример 98: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-2-((циклопропилметил)тио)-N-этилацетамида (соединение 620)
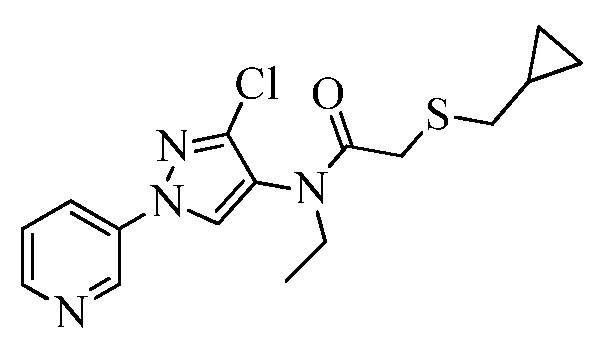
К раствору метанола (10,4 мг, 0,32 ммоль) в ДМСО (1 мл) добавляли гидрид натрия (13 мг, 0,32 ммоль). Смесь перемешивали при комнатной температуре в течение 10 минут, охлаждали до 0-5°C и добавляли раствор S-(2-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)амино)-2-оксоэтил)этантиоата (100 мг, 0,29 ммоль). После перемешивания смеси в течение 30 мин добавляли (бромметил)циклопропан (39 мг, 0,29 ммоль) и дополнительно перемешивали смесь в течение 2 часов. Смесь разбавляли насыщенным водным хлоридом аммония (5 мл) и этилацетатом (15 мл), и разделяли органическую фазу. Водную фазу экстрагировали этилацетатом (5 мл), объединенную органическую фазу промывали солевым раствором, сушили над MgSO4 и концентрировали в условиях вакуума с получением маслянистого остатка. Этот остаток очищали на силикагеле, элюируя этилацетатом и гексанами, с получением указанного в заголовке соединения в виде бесцветного клейкого вещества (38 мг, 37%): ИК (тонкая пленка) 3080, 2975, 2931, 1657, 1584 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,96 (дд, J=2,7, 0,7 Гц, 1H), 8,63 (дд, J=4,8, 1,4 Гц, 1H), 8,08 (с, 1H), 8,04 (ддд, J=8,4, 2,8, 1,5 Гц, 1H), 7,46 (ддд, J=8,4, 4,7, 0,8 Гц, 1H), 3,6 (уш. с, 1H), 3,17 (с, 1H), 2,61 (д, J=7,1 Гц, 2H), 1,17 (т, J=7,2 Гц, 2H), 1,05-0,91 (м, 1H), 0,55 (дд, J=7,9, 1,5 Гц, 2H), 1,21-1,10 (м, 3H), 0,24 (дд, J=4,8, 1,4 Гц, 2H); ESIMS m/z 351 ([M+H]+).
Соединение 650, представленное в таблице 1, получали в соответствии с методиками, раскрытыми в примере 98.
Пример 99: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-((3,3-дихлораллил)тио)-N-метилпропанамида (соединение 649)
К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-меркапто-N-метилпропанамида (100 мг, 0,34 ммоль) в ДМСО (1 мл) добавляли гидрид натрия (14,8 мг, 0,37 ммоль). Смесь перемешивали при комнатной температуре в течение 10 мин и охлаждали до 0-5°C. Добавляли 1,1,3-трихлорпроп-1-ен (49,0 мг, 0,34 ммоль) и дополнительно перемешивали смесь в течение 45 минут. Смесь разбавляли насыщенным водным NH4Cl и этилацетатом, и разделяли органическую фазу. Водную фазу экстрагировали этилацетатом, объединенную органическую фазу промывали солевым раствором, сушили над MgSO4 и концентрировали в условиях вакуума с получением светло-коричневого масла. Это масло очищали на силикагеле, элюируя смесь гексанов, с получением указанного в заголовке соединения в виде бесцветного клейкого вещества (60 мг, 43,9%): ИК (тонкая пленка) 3078, 2926, 1659, 1583, 1458, 1437, 803 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,94 (дд, J=2,7, 0,7 Гц, 1H), 8,63 (дд, J=4,8, 1,5 Гц, 1H), 8,04 (ддд, J=8,3, 2,7, 1,4 Гц, 1H), 7,98 (с, 1H), 7,47 (ддд, J=8,3, 4,7, 0,7 Гц, 1H), 5,30 (с, 1H), 3,51 (с, 2H), 3,25 (с, 3H), 2,87 (т, J=7,3 Гц, 2H), 2,52 (т, J=7,3 Гц, 2H); ESIMS m/z 406 ([M+2]+), 403,7 ([M-1]-).
Пример 100: Получение 2-хлор-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этилпропанамида
К раствору 3-хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амина (1,0 г, 4,49 ммоль) в 1,2-дихлорэтане (44,9 мл) при 0°C последовательно добавляли диизопропилэтиламин (0,941 мл, 5,39 ммоль) и 2-хлорпропаноилхлорид (0,436 мл, 4,49 ммоль). Реакционную смесь оставляли нагреваться до температуры окружающей среды и перемешивали в течение 1,5 ч. Реакционную смесь гасили добавлением водного NaHCO3, и быстро разделяли слои. Водный слой экстрагировали CH2Cl2 (3×50 мл), объединенные органические фазы сушили над Na2SO4, фильтровали и концентрировали в условиях вакуума. Неочищенный остаток очищали методом флэш-хроматографии (30-100% EtOAc в гексанах) с получением указанного в заголовке соединения в виде белого твердого вещества (1,301 г, 93%): т.пл. 94-105°C; 1H ЯМР (400 МГц, CDCl3) δ 8,97 (д, J=2,7 Гц, 1H), 8,64 (дд, J=4,8, 1,5 Гц, 1H), 8,09 (с, 1H), 8,04 (ддд, J=8,4, 2,7, 1,5 Гц, 1H), 7,47 (дд, J=8,3, 4,8 Гц, 1H), 4,27 (кв., J=6,5 Гц, 1H), 3,83 (с, 1H), 3,63 (с, 1H), 1,64 (д, J=6,5 Гц, 3H), 1,19 (т, J=7,2 Гц, 3H); ESIMS m/z 313 ([M+H]+).
Следующие соединения получали в соответствии с методиками, раскрытыми в примере 100:
2-Хлор-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этилбутанамид
т.пл. 95-103°C; 1H ЯМР (400 МГц, CDCl3) δ 8,98 (д, J=2,6 Гц, 1H), 8,64 (дд, J=4,8, 1,4 Гц, 1H), 8,08 (с, 1H), 8,05 (ддд, J=8,4, 2,7, 1,4 Гц, 1H), 7,47 (дд, J=8,3, 4,7 Гц, 1H), 3,99 (м, 1H), 3,86 (уш. с, 1H), 3,60 (уш. с, 1H), 2,13 (дт, J=14,6, 7,3 Гц, 1H), 1,91 (дт, J=14,5, 7,3 Гц, 1H), 1,19 (т, J=7,2 Гц, 3H), 0,97 (т, J=7,3 Гц, 3H); ESIMS m/z 327 ([M+H]+).
2-Хлор-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этилацетамид (соединение Y2007)
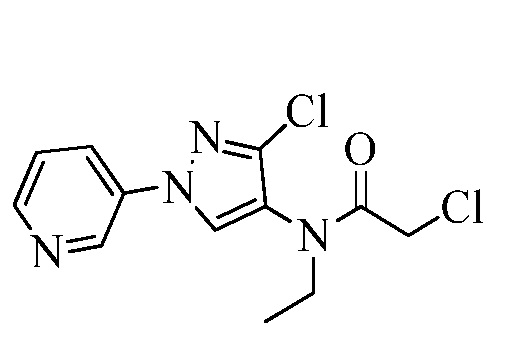
Вследствие декомпозиции, наблюдаемой при оставлении при температуре окружающей среды в течение ночи, указанное в заголовке соединение сразу использовали в последующих реакциях: 1H ЯМР (400 МГц, CDCl3) δ 8,96 (д, J=2,6 Гц, 1H), 8,65 (дд, J=4,7, 1,3 Гц, 1H), 8,07-8,01 (м, 2H), 7,47 (дд, J=8,3, 4,7 Гц, 1H), 3,93 (с, 2H), 3,79-3,68 (уш. с, 2H), 1,19 (т, J=7,2 Гц, 3H).
N-(3-Хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-2-((1-хлор-2,2,2-трифторэтил)тио)-N-этилацетамид (соединение 638)
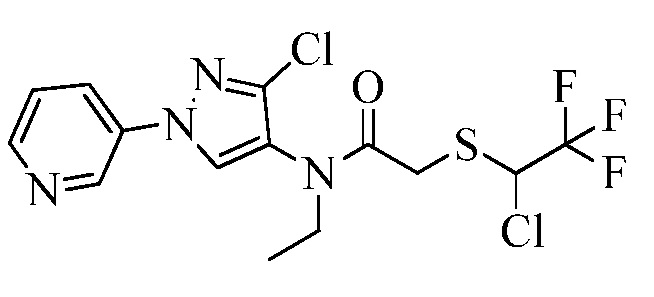
Вспомогательные аналитические данные для указанного в заголовке соединения могут быть найдены в таблице 2.
Пример 101: Получение S-(1-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)амино)-1-оксопропан-2-ил)этантиоата (соединение 685)
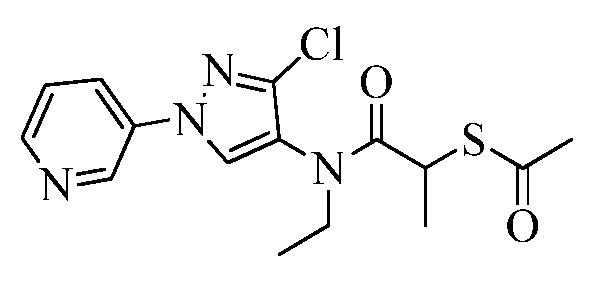
К раствору 2-хлор-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этилпропанамида (1,0 г, 3,19 ммоль) в ацетоне (6,39 мл) добавляли этантиоат калия (0,438 г, 3,83 ммоль). Реакционный сосуд закрывали крышкой и нагревали до 60°C в течение 1,5 ч. Реакционную смесь охлаждали и вливали в делительную воронку, содержащую воду (20 мл) и EtOAc (20 мл). Слои разделяли, и экстрагировали водный слой EtOAc (3×20 мл). Объединенный органический экстракт сушили над безводным Na2SO4, фильтровали и концентрировали в условиях вакуума. Неочищенный остаток очищали (флэш-хроматография, 20-100% EtOAc в гексане) с получением указанного в заголовке соединения в виде коричневого очень вязкого масла (1,07 г, 90%).
Следующие соединения получали в соответствии с методиками, раскрытыми в примере 101:
S-(1-((3-Хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)амино)-1-оксобутан-2-ил)этантиоат
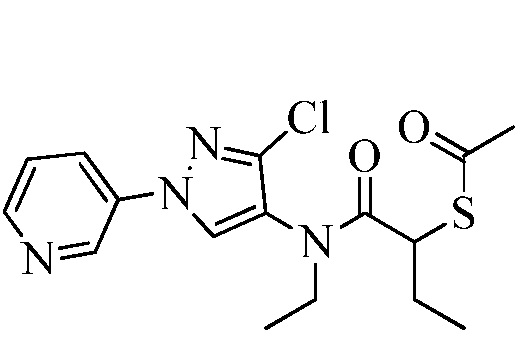
т.пл. 116-122°C; 1H ЯМР (400 МГц, CDCl3) δ 8,97 (д, J=2,6 Гц, 1H), 8,63 (дд, J=4,8, 1,5 Гц, 1H), 8,13-7,99 (м, 2H), 7,46 (дд, J=8,3, 4,7 Гц, 1H), 4,14 (т, J=7,3 Гц, 1H), 3,85 (уш. с, 1H), 3,57 (уш. с, 1H), 2,27 (с, 3H), 1,98 (дт, J=14,2, 7,1 Гц, 1H), 1,74-1,62 (м, 1H), 1,16 (т, J=7,2 Гц, 3H), 0,92 (т, J=7,4 Гц, 3H); ESIMS m/z 367 ([M+H]+).
S-(2-((3-Хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)амино)-2-оксоэтил)этантиоат (соединение 694)
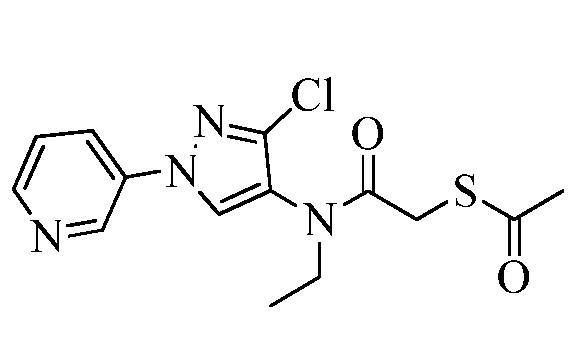
т.пл. 117-124°C; 1H ЯМР (400 МГц, CDCl3) δ 8,98 (дд, J=2,7, 0,7 Гц, 1H), 8,64 (дд, J=4,8, 1,5 Гц, 1H), 8,09 (с, 1H), 8,06 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,47 (ддд, J=8,3, 4,8, 0,7 Гц, 1H), 3,84-3,65 (м, 2H), 3,61 (с, 2H), 2,33 (с, 3H), 1,17 (т, J=7,2 Гц, 3H); ESIMS m/z 339 ([M+H]+).
Пример 102: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-((2,2,2-трифторэтил)тио)пропанамида (соединение 635)
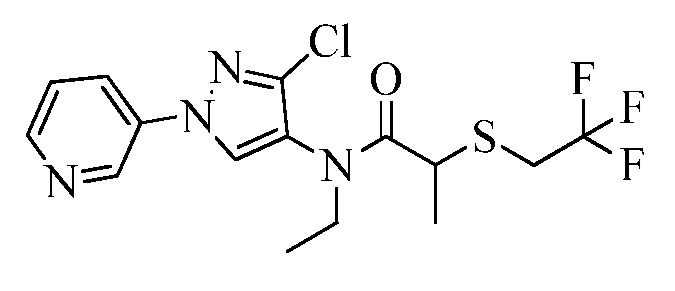
В сухую круглодонную колбу в атмосфере N2 добавляли гидрид натрия (0,018 г, 0,446 ммоль) и THF (2,1 мл), а затем метанол (0,018 мл, 0,446 ммоль). Реакционную смесь оставляли перемешиваться при температуре окружающей среды до завершения наблюдаемого выделения водорода (~45 мин). Затем реакционную смесь охлаждали при 0°C и добавляли S-(1-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)амино)-1-оксопропан-2-ил)этантиоат (0,150 г, 0,425 ммоль) в THF (2,1 мл). Реакционную смесь нагревали до температуры окружающей среды и перемешивали в течение 30 мин. Реакционную смесь снова охлаждали при 0°C и добавляли 1,1,1-трифтор-2-йодэтан (0,063 мл, 0,638 ммоль) в THF (2,1 мл). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение ночи. Реакционную смесь разбавляли EtOAc (20 мл) и гасили добавлением H2O (5 мл). Слои разделяли, и экстрагировали водный слой EtOAc (3×10 мл). Объединенные органические экстракты сушили над Na2SO4, фильтровали и концентрировали в условиях вакуума с получением желтого масла. Неочищенный продукт очищали методом флэш-хроматографии (0-75% CH2Cl2 в EtOAc) с получением указанного в заголовке соединения в виде матового вязкого масла (43 мг, 25%): ИК (тонкая пленка) 1657 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,96 (д, J=2,6 Гц, 1H), 8,64 (дд, J=4,8, 1,4 Гц, 1H), 8,14-7,96 (м, 2H), 7,47 (дд, J=8,3, 4,8 Гц, 1H), 3,82 (с, 1H), 3,59 (с, 1H), 3,44 (с, 1H), 3,25 (кв. д, J=10,2, 3,8 Гц, 2H), 1,48 (д, J=6,8 Гц, 3H), 1,17 (т, J=7,2 Гц, 3H); 19F ЯМР (376 МГц, CDCl3) δ -66,16; ESIMS m/z 393 ([M+H]+).
Соединения 637, 639-642 и 652, представленные в таблице 1, получали в соответствии с методиками, раскрытыми в примере 102.
Пример 103: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-((2-фторвинил)тио)пропанамида (соединение 654)
В сухую круглодонную колбу в атмосфере N2 добавляли 60% дисперсию NaH в минеральном масле (0,043 г, 1,063 ммоль) и THF (2,1 мл), а затем метанол (0,086 мл, 2,126 ммоль). Реакционную смесь оставляли перемешиваться при температуре окружающей среды до завершения наблюдаемого выделения водорода (~45 мин). Затем реакционную смесь охлаждали при 0°C и добавляли S-(1-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)амино)-1-оксопропан-2-ил)этантиоат (0,150 г, 0,425 ммоль) в THF (2,1 мл). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 30 мин. Реакционную смесь снова охлаждали при 0°C и добавляли 2-бром-1,1-дифторэтан (0,101 мл, 1,275 ммоль) в THF (2,1 мл). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение ночи. Методом LC-MS обнаруживали присутствие двух продуктов, причем главный продукт соответствовал целевому продукту элиминирования, а минорный продукт соответствовал продукту начального алкилирования. Поэтому реакционную смесь охлаждали до 0°C и переносили пробирку, содержащую дополнительное количество NaOMe (свежеприготовленного путем смешивания NaH (5,86 мг, 0,147 ммоль) и MeOH (5,93 мкл, 0,147 ммоль) в THF (0,73 мл) при 0°C. После дополнительного перемешивания в течение 18 ч, реакционную смесь разбавляли EtOAc (5 мл) и гасили добавлением H2O (5 мл). Водный слой экстрагировали EtOAc (3×10 мл), объединенные органические экстракты сушили над Na2SO4, фильтровали и концентрировали в условиях вакуума с получением желтого масла. Неочищенный остаток очищали методом флэш-хроматографии (25-80% EtOAc в гексане) с получением неразделимой смеси олефиновых изомеров (~3/2, E/Z) в виде матового вязкого масла (15 мг, 10%): ИК (тонкая пленка) 3091, 1656 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,97 (м, 1H), 8,64 (дд, J=4,7, 1,4 Гц, 1H), 8,13 (с, 0,4H), 8,04 (м, 1,6H), 7,54-7,41 (м, 1H), 6,79 (дд, J=83,3, 11,0 Гц, 0,6H), 6,75 (дд, J=82,7, 4,3 Гц, 0,4H), 5,97 (дд, J=12,7, 11,0 Гц, 0,6H), 5,68 (дд, J=39,8, 4,3 Гц, 0,4H), 3,82 (уш. с, 1H), 3,72-3,47 (м, 1H), 3,47-3,20 (м, 1H), 1,50 (д, J=6,9 Гц, 1,2H), 1,42 (д, J=6,8 Гц, 1,8H), 1,17 (м, 3H); ESIMS m/z 355 ([M+H]+).
Пример 104: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-((2,2,2-трифторэтил)тио)пропанамида (соединение 636)
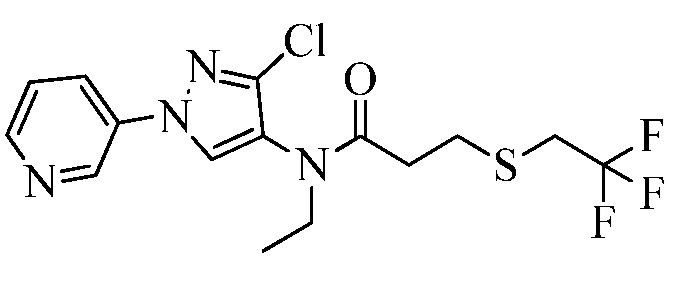
К раствору 3-хлор-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этилпропанамида (100 мг, 0,32 ммоль) в THF (0,3 мл) добавляли йодид натрия (4,7 мг, 0,032 ммоль), 2,2,2-трифторэтантиол (148 мг, 1,3 ммоль) и N,N-ди-изопропилэтиламин (222 мкл, 1,277 ммоль). Реакционную смесь нагревали в течение ночи при 50°C, разбавляли DCM и промывали 5% раствором KOH. Фазы разделяли, концентрировали и очищали методом хроматографии на силикагеле, элюируя 0-40% ацетоном в гексанах, с получением указанного в заголовке соединения в виде бесцветного масла (109 мг, 83%): 1H ЯМР (400 МГц, CDCl3) δ 8,95 (д, J=2,4 Гц, 1H), 8,63 (дд, J=4,7, 1,4 Гц, 1H), 8,05 (ддд, J=8,3, 2,7, 1,4 Гц, 1H), 7,96 (д, J=7,1 Гц, 1H), 7,46 (ддд, J=8,3, 4,8, 0,6 Гц, 1H), 3,72 (кв., J=7,1 Гц, 2H), 3,10 (кв., J=10,0 Гц, 2H), 2,96 (т, J=7,0 Гц, 2H), 2,47 (т, J=7,0 Гц, 2H), 1,17 (т, J=7,2 Гц, 3H); 19F ЯМР (376 МГц, CDCl3) δ -66,56 (с); ESIMS m/z 393 ([M+H]+).
Пример 105: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N,2-диметил-3-((трифторметил)тио)пропанамида (соединение 647)
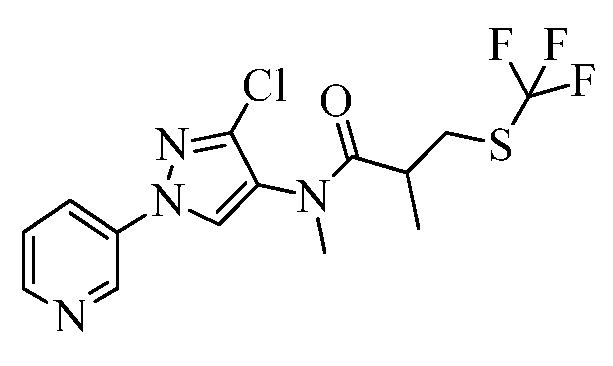
К раствору 2-метил-3-((трифторметил)тио)пропановой кислоты (0,200 г, 1,065 ммоль) в DCM (1,0 мл) добавляли оксалилдихлорид (0,093 мл, 1,065 ммоль) и 1 каплю DMF и перемешивали при температуре окружающей среды в течение 1 часа (наблюдали выделение газа). Реакционную смесь концентрировали, неочищенный хлорангидрид растворяли в DCM (0,3 мл), затем добавляли к предварительно перемешанному раствору дигидрохлорида 3-хлор-N-метил-1-(пиридин-3-ил)-1H-пиразол-4-амина (0,100 г, 0,355 ммоль) и N,N-диметилпиридин-4-амина (0,130 г, 1,065 ммоль) в DCM (1,0 мл), и перемешивали в течение ночи при комнатной температуре. Реакционную смесь разбавляли насыщенным NaHCO3 и экстрагировали DCM. Органический слой сушили над Na2SO4, фильтровали и концентрировали. Неочищенное вещество очищали методом флэш-хроматографии, элюируя 0-100% EtOAc в гексанах, с получением указанного в заголовке соединения в виде желтого масла (93 мг, 65,7%): ИК (тонкая пленка) 1654 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,96 (д, J=2,6 Гц, 1H), 8,64 (дд, J=4,7, 1,3 Гц, 1H), 8,08-8,00 (м, 1H), 7,98 (д, J=8,3 Гц, 1H), 7,51-7,44 (м, 1H), 4,07-3,36 (м, 2H), 3,25-3,11 (м, 1H), 2,94-2,77 (м, 2H), 1,22-1,15 (м, 6H); ESIMS m/z 394 ([M+H])+).
Соединение 648, представленное в таблице 1, получали в соответствии с методиками, раскрытыми в примере 105.
Пример 106: Получение N-метил-N-(1-метил-3-(пиридин-3-ил)-1H-пиразол-5-ил)-3-((3,3,3-трифторпропил)тио)пропанамида (соединение 1011)
Раствор 3-((3,3,3-трифторпропил)тио)пропановой кислоты (75 мг, 0,372 ммоль), DMAP (110 мг, 0,903 ммоль) и N,1-диметил-3-(пиридин-3-ил)-1H-пиразол-5-амина (50 мг, 0,266 ммоль) в безводном диэтиловом эфире (886 мкл) охлаждали до 0°C в атмосфере N2. Добавляли N,N'-дициклогексилкарбодиимид (DCC) (132 мг, 0,638 ммоль), реакционную смесь нагревали до комнатной температуры в атмосфере N2, а затем перемешивали при комнатной температуре в течение ночи. Реакционную смесь фильтровали с использованием дополнительного количества диэтилового эфира (0,5 мл) для удаления солей и концентрировали в условиях пониженного давления. Путем очистки методом хроматографии на силикагеле, элюируя 0-90% гексанами в EtOAc, получали указанное в заголовке соединение в виде прозрачного масла (64 мг, 61%).
Пример 107: Получение трет-бутил(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(2-гидроксиэтил)карбамата (соединение Y2151)
К раствору 2-((трет-бутоксикарбонил)(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)амино)этилацетата (841 мг, 2,21 ммоль) в MeOH (7,3 мл) добавляли карбонат калия (305 мг, 2,21 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли водой (10 мл) и экстрагировали EtOAc (2×10 мл). Органический слой промывали насыщенным водным NaHCO3 (10 мл), сушили над MgSO4 и концентрировали. Добавляли Et2O, и собирали полученный осадок путем фильтрования с получением указанного в заголовке соединения в виде белого твердого вещества (249 мг, 32%).
Пример 108: Получение 2-((трет-бутоксикарбонил)(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)амино)этилметансульфоната
К раствору трет-бутил(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(2-гидроксиэтил)карбамата (574 мг, 1,69 ммоль) в безводном CH2Cl2 (4,0 мл) в атмосфере N2 добавляли триэтиламин (260 мкл, 1,86 ммоль). По каплям добавляли метансульфонилхлорид (145 мкл, 1,864 ммоль) и перемешивали реакционную смесь при комнатной температуре в течение 4 ч. После того, как согласно методу LCMS реакция считалась завершенной, реакционную смесь разбавляли CH2Cl2 (10 мл) и промывали водой (2×10 мл) и солевым раствором (10 мл). Органический слой сушили и концентрировали в условиях пониженного давления. Путем очистки методом хроматографии на силикагеле, элюируя 10-100% гексанами в EtOAc, получали указанное в заголовке соединение в виде бесцветной жидкости (330 мг, 44%): 1H ЯМР (400 МГц, CDCl3) δ 9,00 (с, 1H), 8,59 (дд, J=4,9, 1,5 Гц, 1H), 8,12 (с, 1H), 8,06 (ддд, J=8,4, 2,8, 1,3 Гц, 1H), 7,46 (дд, J=8,4, 4,7 Гц, 1H), 4,52-4,31 (м, 2H), 3,89 (т, J=5,1 Гц, 2H), 3,04 (с, 3H), 2,19 (с, 3H), 1,68-1,32 (м, 6H); ESIMS m/z 417 ([M+H]+).
Пример 109: Получение трет-бутил(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(2-(пирролидин-1-ил)этил)карбамата (соединение Y2152)
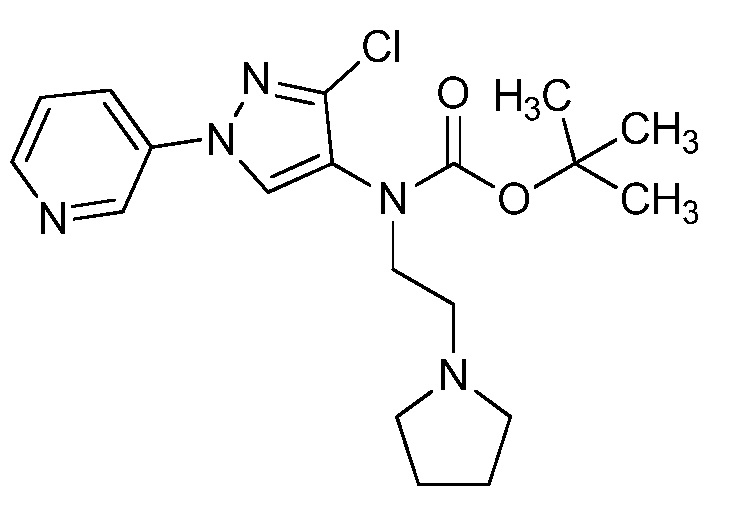
К раствору 2-((трет-бутоксикарбонил)(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)амино)этилметансульфоната (129 мг, 0,309 ммоль) в безводном DMF (884 мкл) в атмосфере N2 добавляли триэтиламин (51,8 мкл, 0,371 ммоль) и пирролидин (37,5 мкл, 0,449 ммоль). Затем реакционную смесь нагревали при 80°C в атмосфере N2 в течение ночи. После завершения реакции согласно анализу методом LCMS, реакционную смесь разбавляли водой (10 мл) и насыщенным водным NaHCO3 (5 мл), а затем экстрагировали EtOAc (3×10 мл). Органический слой сушили над MgSO4 и концентрировали в условиях пониженного давления. Путем очистки методом хроматографии на силикагеле, элюируя 0-50% CH2Cl2 в MeOH, получали указанное в заголовке соединение в виде не совсем белого твердого вещества (65 мг, 51%).
Пример 110: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-(оксиран-2-илметил)-3-((3,3,3-трифторпропил)тио)пропанамида (соединение 928)
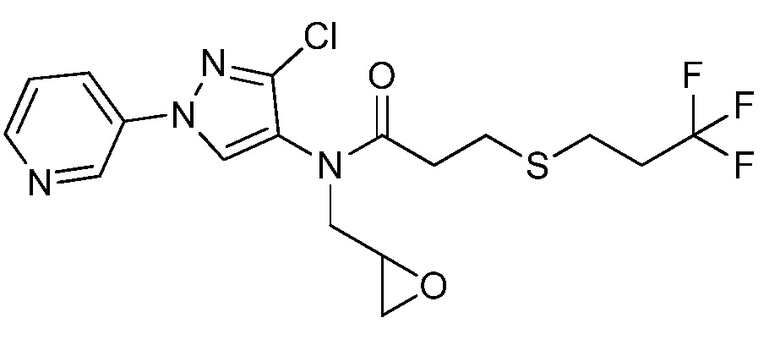
Раствор N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-((3,3,3-трифторпропил)тио)пропанамида (109 мг, 0,288 ммоль) в безводном DMF (882 мкл) охлаждали до 0°C на бане со льдом в атмосфере N2. Осторожно добавляли гидрид натрия (16,11 мг, 0,403 ммоль, 60% дисперсия в минеральном масле) и перемешивали реакционную смесь при 0°C в течение 30 мин. Затем добавляли 2-(бромметил)оксиран (47,6 мкл, 0,576 ммоль) и перемешивали в течение 30 мин при 0°C. Реакционную смесь медленно нагревали до комнатной температуры и перемешивали в течение ночи в атмосфере N2. Реакционную смесь гасили добавлением воды (15 мл) и экстрагировали EtOAc (3×10 мл). Органический слой сушили над MgSO4 и концентрировали в условиях пониженного давления. Путем очистки методом хроматографии на силикагеле, элюируя 0-90% гексаном в EtOAc, получали указанное в заголовке соединение в виде желтого масла (28 мг, 21%).
Пример 111: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-(этилкарбамоил)-3-((3,3,3-трифторпропил)тио)пропанамида (соединение 988)
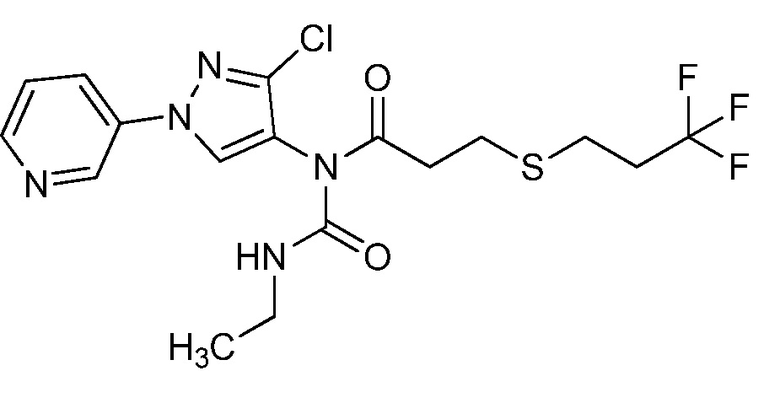
К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-((3,3,3-трифторпропил)тио)пропанамида (106 мг, 0,280 ммоль) в безводном CH2Cl2 (1,8 мл) добавляли изоцианатоэтан (44,3 мкл, 0,560 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, а затем нагревали с обратным холодильником в течение 2 ч. Растворитель заменяли на THF, добавляли другую порцию изоцианатоэтана (44,3 мкл, 0,560 ммоль) и дополнительно нагревали с обратным холодильником в течение 2 ч. Добавляли толуол (1,9 мл) еще с одной порцией изоцианатоэтана (44,3 мкл, 0,560 ммоль) и нагревали реакционную смесь с обратным холодильником в течение ночи. Методом LCMS наблюдали образование небольшого количества продукта. Реакционную смесь вливали в толстостенную пробирку емкостью 5 мл с дополнительным количеством толуола (0,5 мл), и добавляли ацетонитрил (0,5 мл) еще с одной порцией изоцианатоэтана (44,3 мкл, 0,560 ммоль). Реакционную смесь закрывали крышкой и помещали в микроволновой реактор Biotage® Initiator всего на 9 ч при 120°C, а затем на 8 ч при 125°C, с внешним ИК-датчиком для мониторинга температуры с боковой стенки сосуда. Реакционную смесь концентрировали в условиях пониженного давления. Путем очистки методом хроматографии на силикагеле, элюируя 0-10% CH2Cl2 в MeOH, а затем 0-100% водой в ацетонитриле, получали указанное в заголовке соединение в виде белого твердого вещества (36 мг, 27%). Ссылка: J. Org. Chem., 1951, 16, 1879-1890.
Пример 112: Получение 4-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)амино)-4-оксобутановой кислоты (соединение Y2187)
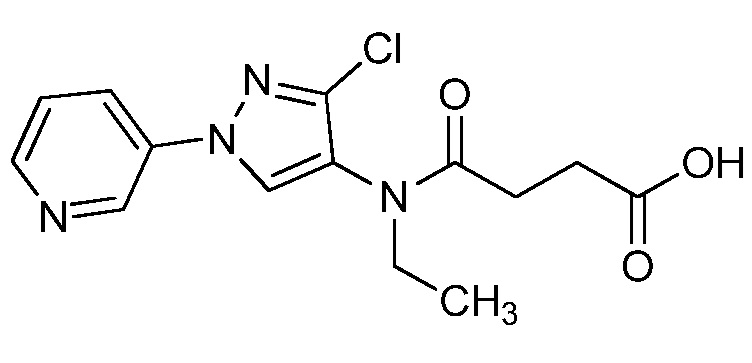
В круглодонную колбу (RBF) емкостью 100 мл добавляли 3-хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амин (500 мг, 2,25 ммоль), DMAP (27,4 мг, 0,225 ммоль), триэтиламин (0,469 мл, 3,37 ммоль) и дигидрофуран-2,5-дион (449 мг, 4,49 ммоль) в дихлорэтане (22,5 мл). Реакционную смесь нагревали при 60°C в атмосфере N2 в течение ночи. Реакционную смесь концентрировали и очищали методом хроматографии на силикагеле, элюируя 0-15% CH2Cl2 в MeOH, с получением указанного в заголовке соединения в виде не совсем белого твердого вещества (635 мг, 86%).
Пример 113: Получение S-(3,3,3-трифторпропил) 4-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)амино)-4-оксобутантиоата (соединение 979)
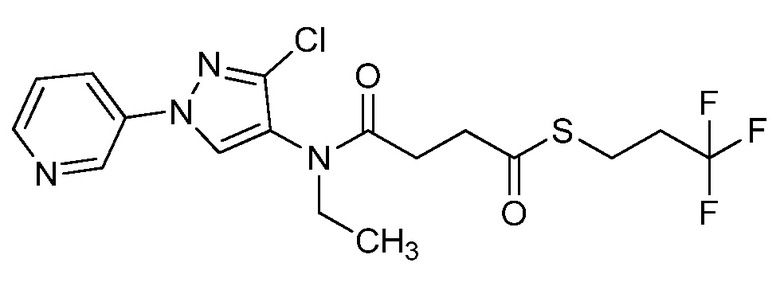
Раствор 4-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)амино)-4-оксобутановой кислоты (100 мг, 0,310 ммоль), 3,3,3-трифторпропан-1-тиола (42,0 мкл, 0,387 ммоль) и DMAP (3,79 мг, 0,031 ммоль) в безводном CH2Cl2 (620 мкл) охлаждали до 0°C. Добавляли DCC (63,9 мг, 0,310 ммоль), реакционную смесь нагревали до комнатной температуры в атмосфере N2, а затем перемешивали в течение ночи. Реакционную смесь фильтровали с использованием дополнительного количества CH2Cl2 (1 мл) для удаления солей и концентрировали в условиях пониженного давления. Путем очистки методом флэш-хроматографии на силикагеле, элюируя 10-90% гексанами в EtOAc, получали указанное в заголовке соединение в виде слегка желтого прозрачного вязкого полутвердого вещества (83 мг, 60%). Ссылка: J. Am. Chem. Soc., 2009, 131, 14604-14605.
Пример 114: Получение 3,3,3-трифторпропил 4-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)амино)-4-оксобутаноата (соединение Y2154)
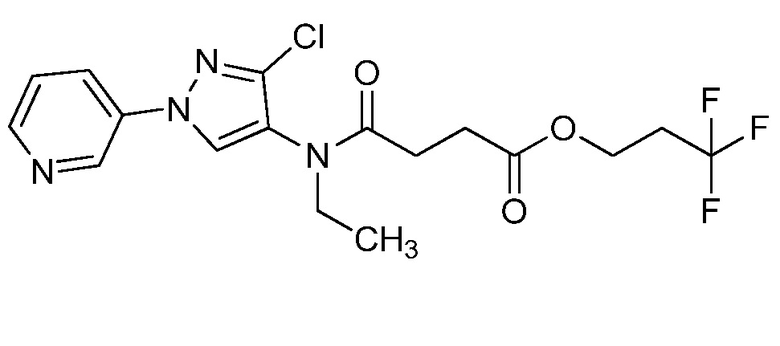
Раствор 4-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)амино)-4-оксобутановой кислоты (101 мг, 0,313 ммоль), бикарбоната натрия (526 мг, 6,26 ммоль) и 3-бром-1,1,1-трифторпропана (66,6 мкл, 0,626 ммоль) в DMF (1565 мкл) перемешивали при комнатной температуре в атмосфере N2 в течение ночи. Реакционную смесь гасили добавлением воды (15 мл) и экстрагировали CH2Cl2 (3×10 мл). Органический слой сушили и концентрировали в условиях пониженного давления. Путем очистки методом хроматографии на силикагеле, элюируя 0-100% гексанами в EtOAc, получали указанное в заголовке соединение в виде прозрачного масла (36 мг, 26%). Ссылка: Syn. Commun., 2008, 38, 54-71.
Пример 115: Получение 2-((2,2,2-трифторэтил)тио)этил(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)карбамата (соединение 970)
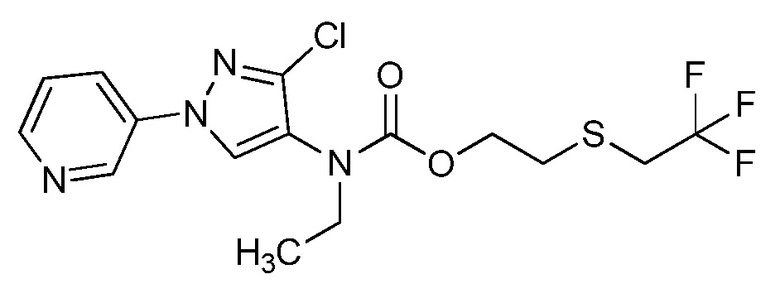
Раствор 3-хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амина (170 мг, 0,763 ммоль) в дихлорэтане (2 мл) охлаждали до 0°C. В атмосфере N2 добавляли фосген (708 мкл, 0,992 ммоль, 15 масс.% в толуоле), и спустя 5 минут одной порцией добавляли N,N-диметилпиридин-4-амин (196 мг, 1,603 ммоль). Баню со льдом удаляли, и перемешивали смесь при комнатной температуре в течение 5 минут и при 80°C в течение 50 мин. Смесь охлаждали до комнатной температуры, затем добавляли 2-((2,2,2-трифторэтил)тио)этанол (251 мг, 1,57 ммоль) с CH2Cl2 (0,5 мл), а затем еще одну порцию N,N-диметилпиридин-4-амина (196 мг, 1,60 ммоль). Реакционную смесь нагревали в атмосфере N2 при 80°C в течение 2 ч. Реакционную смесь разбавляли CH2Cl2 (10 мл) и насыщенным водным NH4Cl (10 мл). Органический слой разделяли, сушили и концентрировали. Путем очистки методом хроматографии на силикагеле, элюируя 0-100% гексанами в EtOAc, а затем 0-100% водой в ацетонитриле, получали указанное в заголовке соединение в виде мутного белого масла (33 мг, 10%).
Пример 116: Получение 1-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-1-этил-3-(((3,3,3-трифторпропил)тио)метил)мочевины (соединение 990)
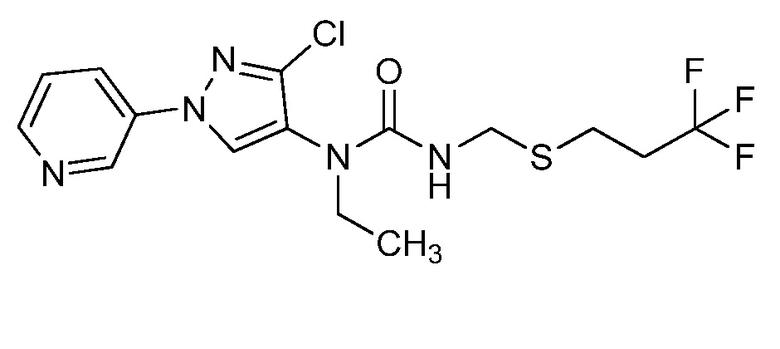
К раствору 2-((3,3,3-трифторпропил)тио)уксусной кислоты (696 мг, 3,70 ммоль) в CH2Cl2 (7,40 мл) при комнатной температуре добавляли оксалилхлорид (1,619 мл, 18,49 ммоль) вместе с каплей DMF. После добавления DMF наблюдали выделение газа, и продолжали в течение приблизительно 30 мин. Реакционную смесь перемешивали при комнатной температуре всего в течение 1 ч, а затем удаляли растворитель в условиях пониженного давления. К концентрированному веществу добавляли ацетон (18,50 мл), и охлаждали реакционную смесь до 0°C на бане со льдом. К смеси по каплям добавляли раствор азида натрия (265 мг, 4,07 ммоль) в воде (1 мл). Реакционную смесь перемешивали при 0°C в течение 1 ч. Реакционную смесь разбавляли водой (15 мл) и перемешивали при комнатной температуре в течение 5 мин. Добавляли дихлорметан (10 мл), органический слой разделяли, сушили и концентрировали в условиях пониженного давления с получением 2-((3,3,3-трифторпропил)тио)ацетилазида в виде темного коричнево-зеленого масла. К неочищенному азиду добавляли безводный CH2Cl2 (4193 мкл) и нагревали с обратным холодильником в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры и добавляли 3-хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амин (140 мг, 0,629 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь концентрировали в условиях пониженного давления и очищали методом хроматографии на силикагеле, элюируя 0-10% CH2Cl2 в MeOH, с получением указанного в заголовке соединения в виде светло-коричневого твердого вещества (179 мг, 68%). Ссылка: J. Org. Chem., 2003, 68, 9453-9455.
Пример 117: Получение 3-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-5-(гидроксиметил)оксазолидин-2-она (соединение Y2148)
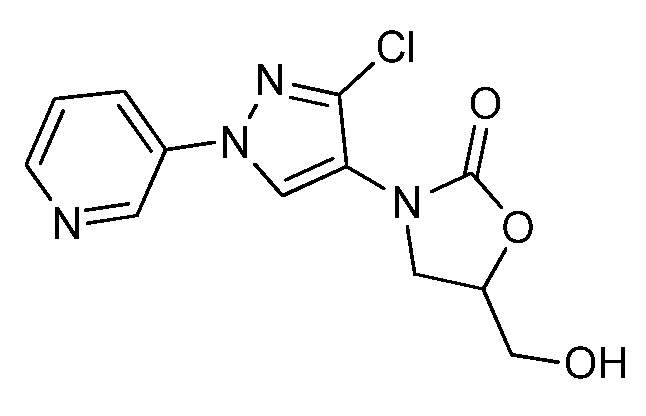
К раствору трет-бутил(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(оксиран-2-илметил)карбамата (321 мг, 0,915 ммоль) в безводном CH2Cl2 (915 мкл) в атмосфере N2 добавляли трифторуксусную кислоту (915 мкл). Реакционную смесь перемешивали при комнатной температуре в течение 90 мин в атмосфере N2. Реакционную смесь разбавляли толуолом (10 мл) и концентрировали в условиях пониженного давления почти досуха. Добавляли EtOAc (5 мл) и гасили реакционную смесь добавлением насыщенного водного NaHCO3 (10 мл). Органический слой разделяли, затем водный слой экстрагировали EtOAc (3×5 мл), сушили над MgSO4 и концентрировали в условиях пониженного давления с получением указанного в заголовке соединения в виде белой пены (134 мг, 47%).
Пример 118: Получение N-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)карбамоил)-4-метоксибензамида (соединение Y2189)
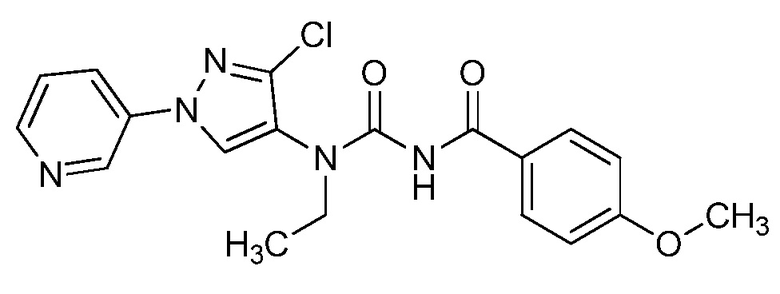
Раствор 4-метоксибензамида (61,1 мг, 0,404 ммоль) и оксалилхлорида (44,2 мкл, 0,505 ммоль) в DCE (1684 мкл) нагревали с обратным холодильником в течение 15 ч в атмосфере N2. Реакционную смесь охлаждали до комнатной температуры, добавляли 3-хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амин (75 мг, 0,337 ммоль) и перемешивали в течение ночи при комнатной температуре. Реакционную смесь разбавляли насыщенным водным NaHCO3 (5 мл) и CH2Cl2 (3 мл). Фазы разделяли, и промывали водный слой CH2Cl2 (2×3 мл). Объединенный органический слой сушили и концентрировали. Путем очистки методом хроматографии на силикагеле, элюируя 15-100% гексанами в EtOAc, получали указанное в заголовке соединение в виде белого твердого вещества (107 мг, 78%). Ссылка: J. Org. Chem., 1963, 73, 1805.
Пример 119: Получение 1-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-1-этилмочевины (соединение Y2186)
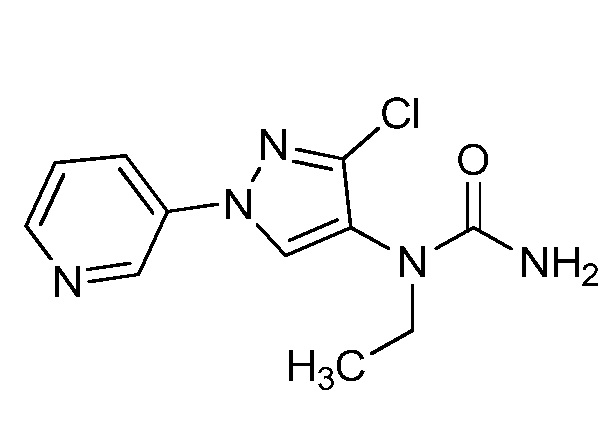
Раствор N-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)карбамоил)бензамида (300 мг, 0,811 ммоль) в безводном MeOH (2028 мкл) и 2н водном NaOH (811 мкл, 1,62 ммоль) нагревали при 65°C в течение 3 ч. Реакционную смесь охлаждали до комнатной температуры, нейтрализовывали добавлением 2н водного HCl и концентрировали в условиях пониженного давления, в результате чего образовывался желтый осадок. Осадок собирали путем фильтрования, промывали гексанами (3 мл) и сушили в условиях вакуума с получением указанного в заголовке соединения (109 мг, 48%).
Пример 120: Получение N-этил-N-(3-метил-1-(пиридин-3-ил)-1H-пиразол-4-ил)-4-оксобутанамида (соединение Y2185)
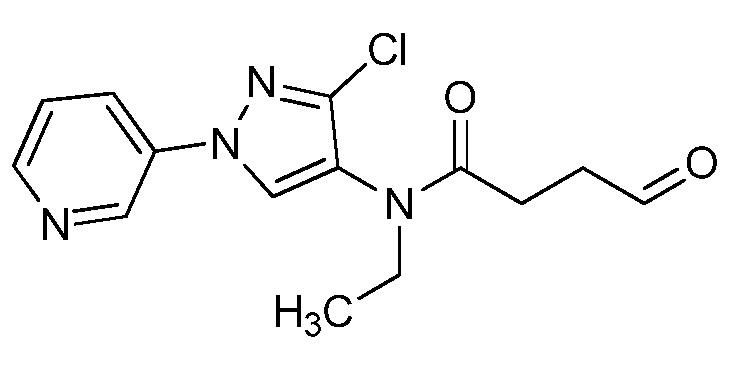
Раствор N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-4-гидроксибутанамида (41 мг, 0,133 ммоль) в безводном CH2Cl2 (1328 мкл) охлаждали до 0°C на бане со льдом в атмосфере N2. Добавляли бикарбонат натрия (112 мг, 1,328 ммоль) и перйодинан Десс-Мартина (64,8 мг, 0,153 ммоль), реакционную смесь нагревали до комнатной температуры и перемешивали в течение 5 ч. Методом LCMS обнаруживали отсутствие образования продукта, поэтому добавляли еще одну порцию перйодинана Десс-Мартина (64,8 мг, 0,153 ммоль), и перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли насыщенным водным NaHCO3 (5 мл) и экстрагировали CH2Cl2 (3×5 мл). Органический слой сушили, концентрировали и очищали методом хроматографии на силикагеле, элюируя 0-50% CH2Cl2 в MeOH, с получением указанного в заголовке соединения в виде прозрачного масла (21 мг, 46%).
Пример 121: Получение 1,1,1-трифтор-7,7-диметоксигептан-4-ола
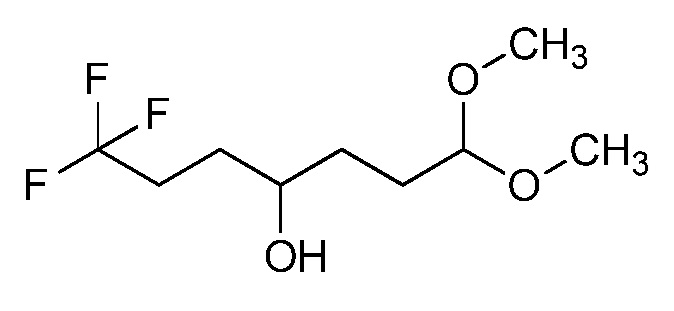
В высушенную в печи пробирку с мешалкой добавляли магний (77 мг, 3,17 ммоль), и продували свободное пространство над ним N2. Добавляли безводный THF (4957 мкл) с кристаллическим I2 и нагревали при помощи тепловой пушки до появления пузырьков из Mg. Медленно добавляли 3-бром-1,1-диметоксипропан (395 мкл, 2,97 ммоль) и продолжали нагревание тепловой пушкой до пузырения Mg и исчезновения окрашивания йодом. Реакционную смесь нагревали с обратным холодильником в течение 1 ч в атмосфере N2 с получением мутного бесцветного раствора. В отдельной печи высушивали круглодонную колбу, добавляли 4,4,4-трифторбутаналь (208 мкл, 1,983 ммоль) с безводным THF (10 мл, 0,2M) и охлаждали до 0°C. По каплям в течение 8 мин при комнатной температуре добавляли реактив Гриньяра и перемешивали при 0°C в течение 30 мин. Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 1,5 ч. Реакционную смесь гасили добавлением насыщенного водного NH4Cl (15 мл) и экстрагировали CH2Cl2 (3×15 мл). Органический слой сушили, концентрировали и очищали методом хроматографии на силикагеле, элюируя 0-10% CH2Cl2 в MeOH, с получением указанного в заголовке продукта в виде прозрачного полутвердого вещества с чистотой 85% (372 мг, 69%): ИК (тонкая пленка) 3442 см-1; 1H ЯМР (400 МГц, CDCl3) δ 4,39 (т, J=5,2 Гц, 1H), 3,65 (ткв., J=8,2, 3,9 Гц, 1H), 3,35 (д, J=0,7 Гц, 6H), 2,40 (дд, J=4,6, 0,7 Гц, 1H), 2,39-2,24 (м, 1H), 2,24-2,06 (м, 1H), 1,80-1,72 (м, 2H), 1,72-1,59 (множественные пики, 3H), 1,52 (ддт, J=15,7, 14,2, 7,0 Гц, 1H); 19F ЯМР (376 МГц, CDCl3) δ -66,37; HRMS-FAB (m/z) [M+Na]+ рассч. для C9H17F3NaO3 253,1022; обнаружено 253,1025.
Пример 122: Получение 7,7,7-трифтор-4-оксогептановой кислоты
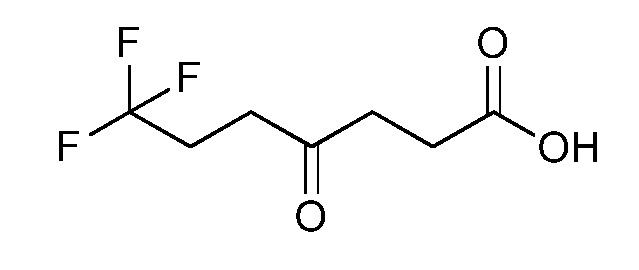
К раствору 1,1,1-трифтор-7,7-диметоксигептан-4-ола (372 мг, 1,616 ммоль) в безводном THF (10,8 мл) при комнатной температуре добавляли 1н водный HCl (8079 мкл, 8,08 ммоль). Реакционную смесь перемешивали в течение 1 ч, а затем разбавляли водой (10 мл) и Et2O (10 мл). Органический слой разделяли, и промывали водный слой Et2O (2×10 мл). Объединенный органический слой промывали насыщенным водным NaHCO3 (10 мл), сушили над MgSO4 и концентрировали. Концентрированное неочищенное вещество растворяли в ацетоне (5 мл) и ледяной уксусной кислоте (0,5 мл). Затем к раствору при перемешивании по каплям добавляли KMnO4 (766 мг, 4,85 ммоль), растворенный в воде (10 мл), и перемешивали при комнатной температуре в течение 2,5 ч. Методом GCMS обнаруживали неполное преобразование, поэтому дополнительно добавляли KMnO4 (510 мг), и оставляли реакционную смесь перемешиваться в течение ночи при комнатной температуре. Реакционную смесь разбавляли AcOH (15 мл; 2 мл ледяной AcOH в 13 мл воды) и CH2Cl2 (10 мл). Органический слой разделяли, и экстрагировали водный слой CH2Cl2 (2×10 мл). Объединенный органический слой промывали водой (15 мл), сушили и концентрировали. Путем очистки методом хроматографии на силикагеле, элюируя 0-10% CH2Cl2 в MeOH, получали указанное в заголовке соединение в виде белого твердого вещества (66 мг, 15%): ИК (тонкая пленка) 1715 см-1; 1H ЯМР (400 МГц, CDCl3) δ 2,81-2,72 (множественные пики, 4H), 2,69 (ддд, J=6,8, 5,5, 1,2 Гц, 2H), 2,50-2,35 (м, 2H), 1,59 (уш. с, 1H); 19F ЯМР (376 МГц, CDCl3) δ -66,66.
Пример 123: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-7,7,7-трифтор-4-оксогептанамида (соединение Y2188)
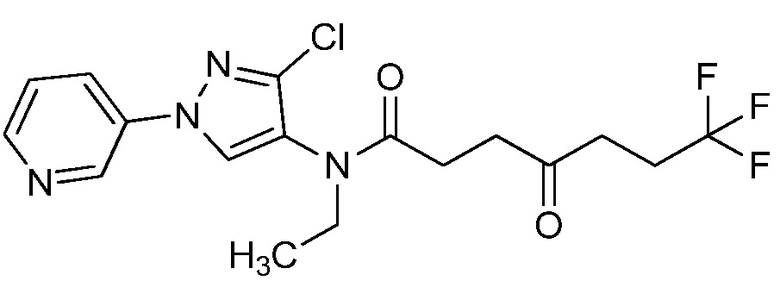
Раствор 3-хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амина (62 мг, 0,278 ммоль), 7,7,7-трифтор-4-оксогептановой кислоты (66,2 мг, 0,334 ммоль) и DMAP (51,0 мг, 0,418 ммоль) в безводном Et2O (928 мкл) охлаждали до 0°C на бане со льдом в атмосфере N2. Добавляли DCC (138 мг, 0,668 ммоль) и медленно нагревали реакционную смесь до комнатной температуры. Реакционную смесь перемешивали в атмосфере N2 в течение ночи при комнатной температуре. Белый осадок отфильтровали с Et2O (1 мл), и концентрировали фильтрат. Путем очистки методом хроматографии на силикагеле, элюируя 0-75% гексанами в EtOAc, получали указанный в заголовке продукт в виде коричневого вязкого масла (59 мг, 50%).
Пример 124: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-гидроксипропанамида
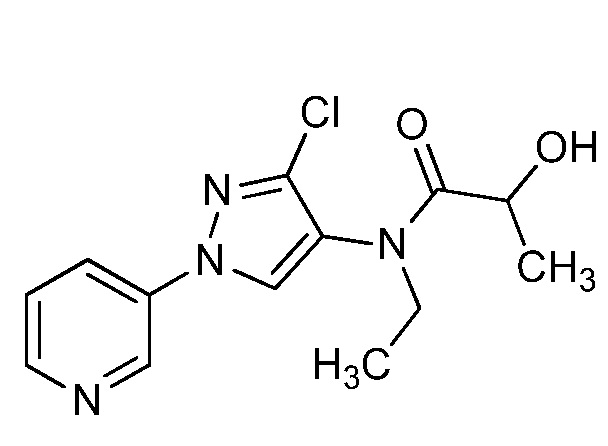
К раствору 1-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)амино)-1-оксопропан-2-илацетата (2,4 г, 7,1 ммоль) в метаноле (8,9 мл) и тетрагидрофуране (8,9 мл) добавляли 2M гидроксид лития (7,1 мл, 14,2 ммоль). Реакционную смесь перемешивали в течение 2 часов при 25°C. Значение pH реакционной смеси делали нейтральным добавлением 2M HCl. Смесь экстрагировали этилацетатом, органические фазы объединяли, сушили над MgSO4, фильтровали и концентрировали в условиях вакуума с получением указанного в заголовке соединения в виде белого твердого вещества (1,85 г, 88%): т.пл. 137-138°C; 1H ЯМР (400 МГц, ДМСО) δ 9,08 (д, J=2,5 Гц, 1H), 8,98 (с, 1H), 8,58 (дд, J=4,7, 1,1 Гц, 1H), 8,23 (ддд, J=8,4, 2,6, 1,3 Гц, 1H), 7,59 (дд, J=8,3, 4,7 Гц, 1H), 4,97 (д, J=7,6 Гц, 1H), 4,08 (м, 1H), 3,57 (д, J=50,6 Гц, 2H), 1,10 (д, J=6,5 Гц, 3H), 1,07 (т, J=7,1 Гц, 3H); ESIMS m/z 295,6 ([M+H]+).
Пример 125: 1-((3-Хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)амино)-1-оксопропан-2-илметансульфонат (соединение Y2008)
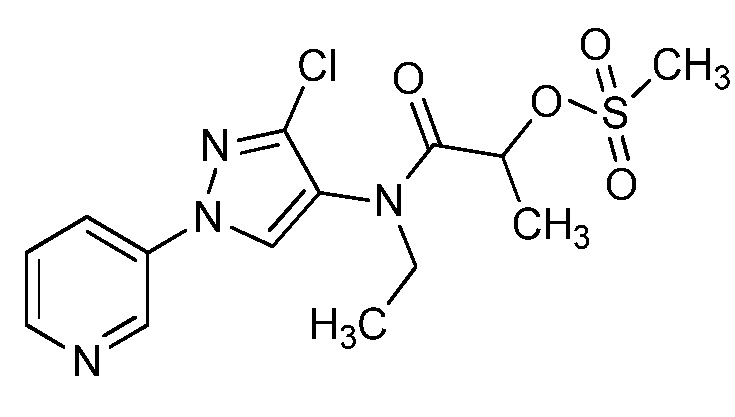
К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-гидроксипропанамида (100 мг, 0,34 ммоль) в тетрагидрофуране (1,1 мл) добавляли гидрид натрия (14,9 мг, 0,34 ммоль). Смесь перемешивали в течение 15 мин, а затем добавляли метансульфонилхлорид (58,3 мг, 0,51 ммоль). Реакционную смесь перемешивали в течение 16 часов, разбавляли CH2Cl2 и промывали водой. Фазы разделяли, сушили, концентрировали в условиях вакуума и очищали методом хроматографии на силикагеле, элюируя 0-70% ацетоном в гексанах, с получением указанного в заголовке соединения в виде светло-желтого масла (88 мг, 70%): ИК (тонкая пленка) 2980, 2936, 1676 см-1; 1H ЯМР (400 МГц, CDCl3) δ 9,00 (д, J=2,5 Гц, 1H), 8,64 (дд, J=4,8, 1,4 Гц, 1H), 8,12 (с, 1H), 8,02 (ддд, J=8,3, 2,7, 1,4 Гц, 1H), 7,46 (ддд, J=8,3, 4,8, 0,6 Гц, 1H), 5,17 (кв., J=6,7 Гц, 1H), 3,71 (м, 2H), 3,13 (с, 3H), 1,50 (д, J=6,7 Гц, 3H), 1,19 (т, J=7,2 Гц, 3H); ESIMS m/z 373,6 ([M+H]+).
Пример 126: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-((3,3-дифторциклобутил)тио)-N-этилпропанамида (соединение 910)
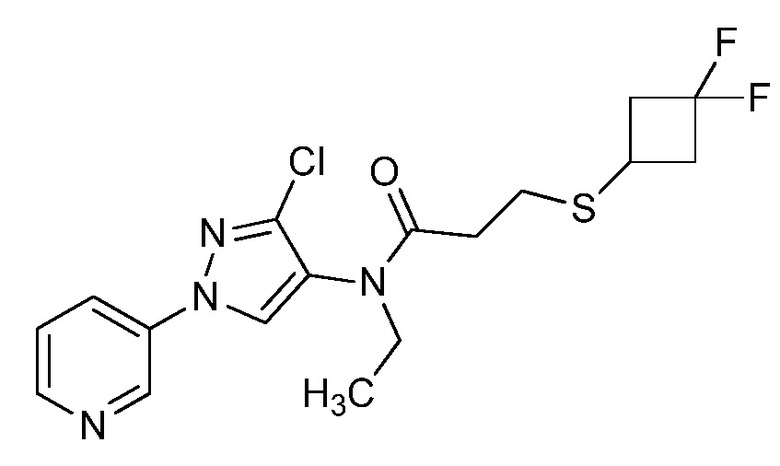
N-(3-Хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-((3-оксоциклобутил)тио)пропанамид (100 мг, 0,264 ммоль) растворяли в CH2Cl2 (2 мл) и перемешивали при 0°C. К раствору при 0°C добавляли Deoxofluor® (0,083 мл, 0,449 ммоль) и EtOH (2,312 мкл, 0,040 ммоль). Полученный раствор медленно нагревали до 25°C и перемешивали при 25°C. Спустя 4 часа добавляли еще 1 эквивалент Deoxofluor® (50 мкл) и еще 2,5 мкл EtOH. Реакционную смесь обрабатывали путем медленного добавления раствора NaHCO3 и перемешивали в течение 30 мин при 25°C. Смесь разбавляли водой (20 мл) и экстрагировали CH2Cl2 (3×20 мл). Объединенный органический слой промывали 0,01M HCl, сушили над Na2SO4 и очищали методом хроматографии на силикагеле (0-100% EtOAc в гексане) с получением указанного в заголовке соединения в виде светло-желтого масла (19 мг, 18%).
Пример 127: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-(винилсульфинил)пропанамида (соединение 1004)
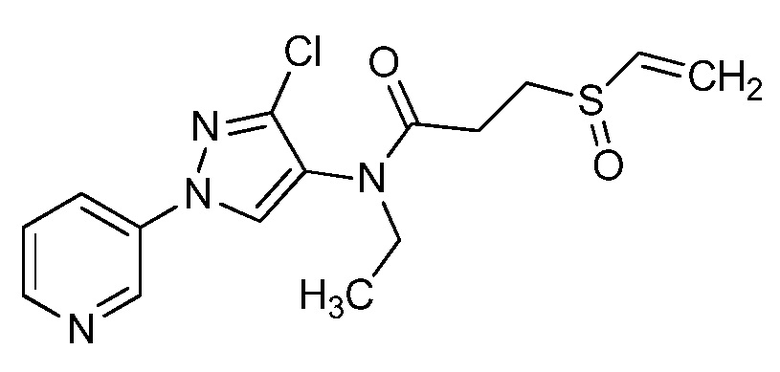
В пробирку емкостью 7 мл добавляли N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-меркаптопропанамид (0,050 г, 0,161 ммоль), 1,2-дибромэтан (0,907 г, 4,83 ммоль), а затем 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU) (0,024 г, 0,161 ммоль). Раствор перемешивали при 25°C в течение ночи, затем его концентрировали и повторно растворяли в гексафторизопропаноле (1 мл). Добавляли пероксид водорода (0,055 г, 0,483 ммоль), раствор перемешивали при 25°C в течение 2 часов, затем обрабатывали раствором сульфита натрия и экстрагировали CH2Cl2. Неочищенную реакционную смесь очищали методом хроматографии на силикагеле (0-10% MeOH в CH2Cl2) с получением указанного в заголовке соединения в виде коричневого масла (33 мг, 58%).
Пример 128: Получение 3-(N-карбамоил-S-метилсульфонимидоил)-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этилпропанамида (соединение Y2099)
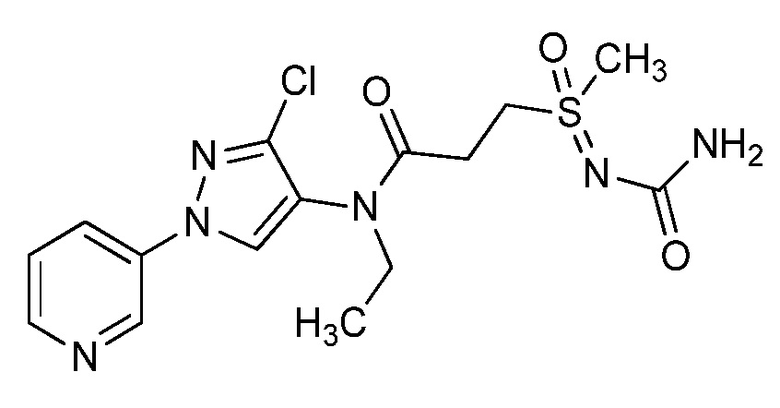
N-[3-Хлор-1-(3-пиридил)пиразол-4-ил]-3-(N-циан-S-метилсульфонимидоил)-N-этилпропанамид (320 мг, 0,840 ммоль) растворяли в конц. серной кислоте (4 мл, 75 ммоль) и перемешивали при 25°C в течение 16 ч. Раствор вливали в колбу со льдом, и медленно добавляли твердый NaHCO3, пока водный слой не становился нейтральным. Водный слой экстрагировали CH2Cl2, объединенные органические слои сушили над Na2SO4 и концентрировали. Неочищенную реакционную смесь очищали методом хроматографии на силикагеле (0-10% MeOH в CH2Cl2) с получением указанного в заголовке соединения в виде белого твердого вещества (135 мг, 40%).
Пример 129: Получение 4-хлор-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)бутанамида (соединение Y2166)
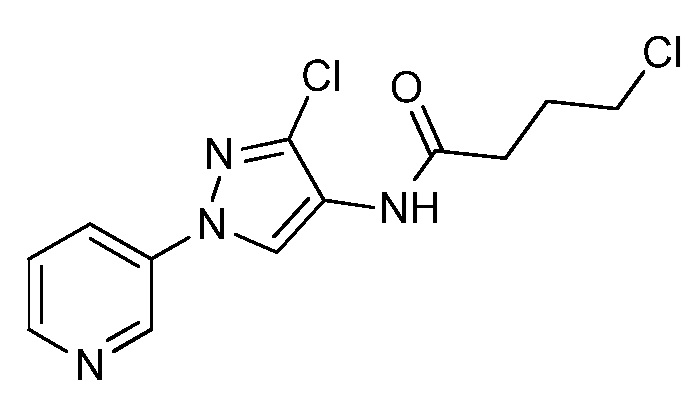
К охлажденному до 0°C раствору 3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-амина (1,34 г, 6,89 ммоль) в CH2Cl2 (11 мл) добавляли триэтиламин (1,439 мл, 10,33 ммоль) и 4-хлорбутаноилхлорид (0,971 г, 6,89 ммоль). Раствор оставляли медленно нагреваться до 25°C и перемешивали в течение 1 ч. Реакционную смесь разбавляли водой (20 мл) и экстрагировали CH2Cl2 (3×20 мл). Объединенные органические слои сушили, концентрировали и очищали методом хроматографии (0-100% EtOAc в гексане) с получением указанного в заголовке соединения в виде белого твердого вещества (1,87 г, 91%).
Пример 130: Получение 1-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)пирролидин-2-она (соединение Y2167)
Раствор 4-хлор-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)бутанамида (1,82 г, 6,08 ммоль) в THF (50 мл) охлаждали до 0°C. Добавляли NaH (0,280 г, 7,00 ммоль), смесь медленно нагревали до 25°C и перемешивали в течение 2 ч. Смесь разбавляли водой и экстрагировали CH2Cl2 (3×20 мл). Объединенные органические слои сушили, концентрировали и очищали методом хроматографии на силикагеле (0-10% MeOH в CH2Cl2) с получением указанного в заголовке соединения в виде желтого твердого вещества (1,70 г, 96%).
Пример 131: Получение 1-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-метиленпирролидин-2-она (соединение Y2168)
Раствор 1-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)пирролидин-2-она (1600 мг, 6,09 ммоль) в CH2Cl2 (15 мл) охлаждали до 0°C. Добавляли триэтиламин (1,273 мл, 9,14 ммоль) и триметилсилилтрифторметансульфонат (1,431 мл, 7,92 ммоль) и перемешивали полученный темно-красный раствор при 0°C в течение 45 мин. Затем добавляли соль Эшенмозера (йодид диметилметилиденаммония)(1465 мг, 7,92 ммоль), и оставляли раствор нагреваться до 25°C и перемешиваться в течение ночи. Раствор разбавляли CH2Cl2 (30 мл), добавляли 1н HCl (30 мл) и перемешивали смесь в течение 10 мин, после чего ее подщелачивали до pH=12 добавлением раствора NaOH. Смесь экстрагировали CH2Cl2, объединенные органические слои сушили, концентрировали и очищали методом хроматографии на силикагеле (0-10% MeOH в CH2Cl2) с получением указанного в заголовке соединения в виде светло-желтого твердого вещества (866 мг, 52%).
Пример 132: Получение 1-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-((метилтио)метил)пирролидин-2-она (соединение 955)
1-(3-Хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-метиленпирролидин-2-он (400 мг, 1,46 ммоль) растворяли в THF (6 мл). К смеси добавляли гидроксид калия (384 мг, 5,82 ммоль), растворенный в воде (1 мл), а затем S,S-диметилкарбонодитиоат (125 мг, 1,019 ммоль). Смесь нагревали с обратным холодильником в течение 3 часов, а затем ее разбавляли водой (20 мл) и экстрагировали CH2Cl2 (3×20 мл). Объединенные органические слои сушили и концентрировали, и очищали неочищенную смесь методом хроматографии на силикагеле (0-10% MeOH в CH2Cl2) с получением указанного в заголовке соединения в виде белого твердого вещества (385 мг, 82%).
Пример 133: Получение метил-2-циклобутилиденацетата
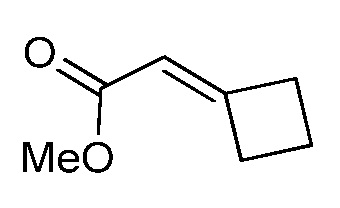
В круглодонную колбу емкостью 250 мл добавляли метил-2-(трифенилфосфоранилиден)ацетат (12,04 г, 36 ммоль) и бензол (90 мл). Добавляли циклобутанон (5,05 г, 72,0 ммоль) и нагревали раствор с обратным холодильником в течение 2 суток. Реакционную смесь охлаждали и добавляли гексан (70 мл). Белый осадок отфильтровывали, раствор концентрировали и очищали методом хроматографии на силикагеле с получением указанного в заголовке соединения в виде бесцветного масла (3,22 г, 71%): ИК (тонкая пленка) 1714 см-1; 1H ЯМР (400 МГц, CDCl3) δ 5,60 (т, J=2,3 Гц, 1H), 3,68 (с, 3H), 3,13 (дддд, J=9,0, 4,5, 2,2, 1,1 Гц, 2H), 2,90-2,76 (м, 2H), 2,09 (тт, J=11,4, 5,8 Гц, 2H); 13C ЯМР (101 МГц, CDCl3) δ 167,92, 166,95, 111,93, 50,79, 33,71, 32,32, 17,62.
Пример 134: Получение 2-циклобутилиденуксусной кислоты
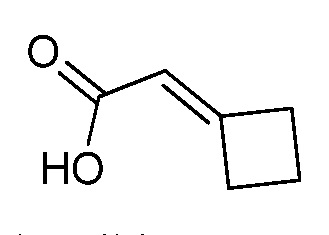
К раствору метил-2-циклобутилиденацетата (100 мг, 0,793 ммоль) в MeOH (1,00 мл) при перемешивании при к.т. добавляли 2н раствор LiOH (полученный из гидрата гидроксида лития (100 мг, 2,378 ммоль) и воды (1 мл)). Смесь перемешивали при 25°C в течение ночи, а затем ее обрабатывали добавлением 2н HCl и экстрагировали CH2Cl2. Объединенный органический слой сушили с получением белого твердого вещества, которое очищали методом хроматографии на силикагеле (0-70% EtOAcв гексане), с получением указанного в заголовке соединения в виде белого твердого вещества (20 мг, 23%): ИК (тонкая пленка) 2923, 1647 см-1; 1H ЯМР (400 МГц, CDCl3) δ 10,89 (с, 1H), 5,60 (дд, J=4,3, 2,1 Гц, 1H), 3,38-3,02 (м, 2H), 2,97-2,71 (м, 2H), 2,10 (дкв., J=15,9, 8,0 Гц, 2H); 13C ЯМР (101 МГц, CDCl3) δ 172,35, 171,33, 112,13, 34,10, 32,58, 17,56.
Пример 135: Получение 3-((3,3,3-трифторпропил)тио)пропановой кислоты

3-Меркаптопропановую кислоту (3,2 г, 30,1 ммоль) растворяли в MeOH (20 мл) и перемешивали при к.т. К раствору добавляли измельченный в порошок гидроксид калия (3,72 г, 66,3 ммоль), а затем 3-бром-1,1,1-трифторпропан (6,14 г, 34,7 ммоль). Раствор перемешивали при 65°C в течение 3 ч, а затем реакционную смесь гасили добавлением 1н HCl до кислых значений pH раствора. Смесь экстрагировали CH2Cl2 (3×30 мл), объединенные органические фазы сушили, концентрировали и очищали методом хроматографии на силикагеле (0-50% EtOAc в гексане) с получением указанного в заголовке соединения в виде бесцветного масла, смешанного с некоторым количеством белой суспензии (5,5 г, 90%): ИК (тонкая пленка) 2936, 1708 см-1; 1H ЯМР (300 МГц, CDCl3) δ 2,86-2,78 (м, 2H), 2,78-2,58 (м, 4H), 2,52-2,25 (м, 2H); EIMS m/z 202.
Пример 136: Получение N-[3-хлор-1-(3-пиридил)пиразол-4-ил]-3-[3-[[3-хлор-1-(3-пиридил)пиразол-4-ил]-метил-амино]-3-оксо-пропил]сульфанил-N-этил-2-метилпропанамида (соединение 790)
К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-метил-3-меркаптопропанамида (100 мг, 0,308 ммоль) и 3-хлор-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4yl)-N-метилпропанамида (100 мг, 0,334 ммоль) в DMF (1 мл) добавляли гидрид натрия (60% дисперсия в масле, 15 мг, 0,375 ммоль). Смесь перемешивали при комнатной температуре в течение 18 ч и разбавляли водой и CH2Cl2. Органическую фазу разделяли, сушили над Na2SO4, фильтровали и концентрировали в условиях вакуума с получением оранжевого масла. Это масло очищали методом хроматографии, элюируя смесью метанола и хлористого метилена, с получением указанного в заголовке соединения в виде желтого масла (120 мг, 66%).
Пример 137: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-((2-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(метил)амино)-2-оксоэтил)тио)-N-этилпропанамида (соединение 789)
К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-меркаптопропанамида (100 мг, 0,322 ммоль) в ДМСО (1 мл) добавляли гидрид натрия (60% дисперсия в масле, 15 мг, 0,375 ммоль). Добавляли свежеприготовленный 2-хлор-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-метилацетамид (150 мг, 0,526 ммоль) и оставляли смесь отстаиваться в течение 1 часа с периодическими встряхиваниями. Реакционную смесь разбавляли насыщенным бикарбонатом натрия и Et2O. К органической фазе добавляли аммиак в MeOH (7M, 1 мл, 1 ммоль), а затем Na2SO4. После отстаивания в течение 10 минут смесь фильтровали и концентрировали в условиях вакуума с получением оранжевого масла. Масло очищали методом хроматографии на силикагеле, элюируя смесью метанола и CH2Cl2, с получением указанного в заголовке соединения в виде оранжевого масла (120 мг, 66%).
Пример 138: Получение трет-бутил((1R,4S)-4-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(метил)карбамоил)циклопент-2-ен-1-ил)карбамата
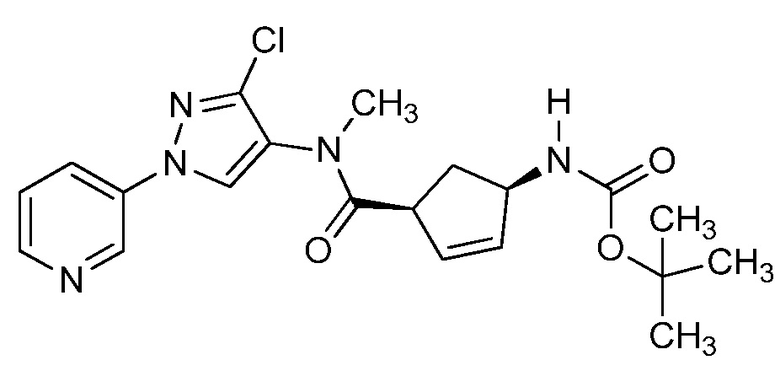
Раствор 3-хлор-N-метил-1-(пиридин-3-ил)-1H-пиразол-4-амина (200 мг, 0,96 ммоль) в THF (10 мл) охлаждали до -78°C. Добавляли бис(триметилсилил)амид лития (1 мл, 1,00 ммоль, 1M раствор в гексане) и перемешивали раствор при -78°C в течение 15 минут. К раствору при -78°C одной порцией добавляли раствор (1R,4S)-трет-бутил-3-оксо-2-азабицикло[2.2.1]гепт-5-ен-2-карбоксилата (201 мг, 0,96 ммоль), растворенного в THF (3 мл). После перемешивания в течение 1 часа при -78°C охлаждающую баню удаляли, и нагревали реакционную смесь до 20°C. После дополнительного перемешивания в течение 5 минут к раствору добавляли уксусную кислоту (0,1 мл). Реакционную смесь концентрировали и очищали методом хроматографии на силикагеле, используя гексаны и этилацетат в качестве подвижной фазы, с получением указанного в заголовке соединения в виде белого твердого вещества (250 мг, 59%): 1H ЯМР (400 МГц, CDCl3) δ 9,01-8,93 (д, J=2,8 Гц, 1H), 8,66-8,60 (м, 1H), 8,11-8,02 (м, 2H), 7,52-7,42 (м, 1H), 5,93-5,85 (м, 1H), 5,72-5,66 (м, 1H), 5,53-5,44 (д, J=9,5 Гц, 1H), 4,80-4,67 (м, 1H), 3,58-3,47 (м, 1H), 3,30-3,21 (с, 3H), 2,35-2,22 (м, 1H), 1,90-1,80 (м, 1H), 1,51-1,34 (с, 9H); 13C ЯМР (101 МГц, CDCl3) δ 175,26, 155,23, 148,70, 140,31, 140,00, 135,61, 135,18, 130,99, 126,34, 125,92, 125,78, 124,12, 79,04, 55,69, 47,33, 37,49, 35,55, 28,45; ESIMS m/z 418 [M+H]+, 416 ([M-H]-).
Пример 139: Получение (1S,4R)-4-амино-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-метилциклопент-2-енкарбоксамид-2,2,2-трифторацетата
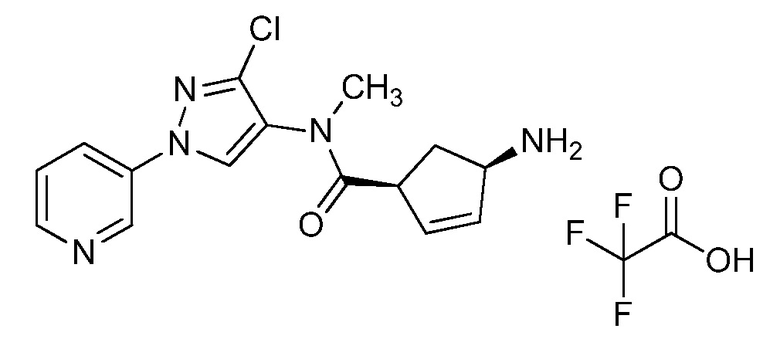
К раствору трет-бутил((1R,4S)-4-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(метил)карбамоил)циклопент-2-ен-1-ил)карбамата (130 мг, 0,31 ммоль) в CH2Cl2 (4 мл) добавляли трифторуксусную кислоту (4 мл). Реакционную смесь оставляли отстаиваться в течение 20 минут с периодическими встряхиваниями. Реакционную смесь концентрировали в условиях вакуума при 40°C, что приводило к выделению указанного в заголовке соединения в виде прозрачного масла (130 мг, 94%): 1H ЯМР (400 МГц, CD3OD) δ 9,02 (дд, J=2,7, 0,7 Гц, 1H), 8,70 (с, 1H), 8,54 (дд, J=5,0, 1,4 Гц, 1H), 8,30 (ддд, J=8,4, 2,7, 1,4 Гц, 1H), 7,63 (ддд, J=8,4, 5,0, 0,7 Гц, 1H), 6,09 (ддд, J=5,6, 2,7, 1,0 Гц, 1H), 5,92 (дт, J=5,6, 2,1 Гц, 1H), 4,16 (д, J=7,7 Гц, 1H), 3,80-3,72 (м, 1H), 2,98 (с, 3H), 2,29 (дт, J=14,3, 7,9 Гц, 1H), 2,01 (дт, J=14,3, 2,5 Гц, 1H); 13C ЯМР (101 МГц, CDCl3) δ 179,16, 163,52 (кв., J=19 Гц) , 145,04, 142,05, 141,15, 137,81, 136,71, 134,11, 134,06, 132,73, 131,26, 129,77, 119,49 (кв., J=289 Гц) 59,80, 51,85, 40,50, 36,87; ESIMS m/z 318 ([M+H]+).
Пример 140: Получение (1S,4R)-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-метил-4-(метилсульфонамидо)циклопент-2-енкарбоксамида (соединение Y2054)
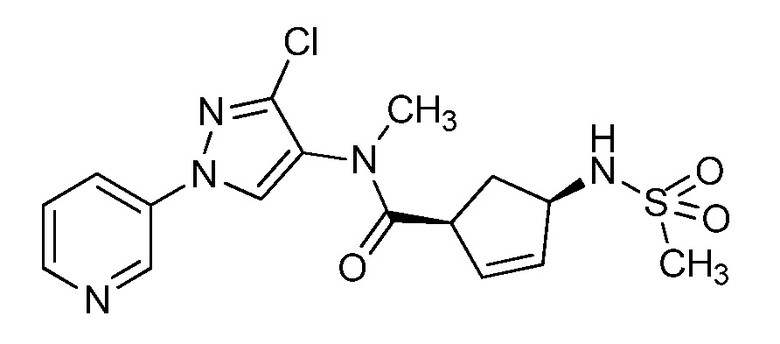
К раствору (1S,4R)-4-амино-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-метилциклопент-2-енкарбоксамид-2,2,2-трифторацетата (541 мг, 1,25 ммоль), растворенного в CH2Cl2 (15 мл), добавляли триэтиламин (0,380 мг, 3,76 ммоль), а затем метансульфонилхлорид (215 мг, 1,88 ммоль). После перемешивания в течение 24 часов реакционную смесь разбавляли насыщенным водным бикарбонатом натрия (15 мл), и разделяли фазы. Органический слой сушили с безводным сульфатом натрия, фильтровали и концентрировали. Полученный остаток очищали методом хроматографии на силикагеле с использованием метанола и CH2Cl2, что приводило к выделению указанного в заголовке соединения в виде белой пены (319 мг, 64%).
Пример 141: Получение (1S,3R)-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-метил-3-(метилсульфонамидо)циклопентанкарбоксамида (соединение Y2092)
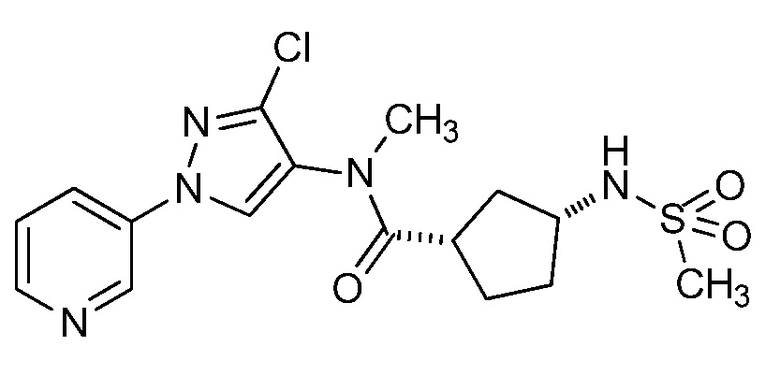
Раствор (1R,4S)-4-амино-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-метилциклопент-2-енкарбоксамид-2,2,2-трифторацетата (60 мг, 0,15 ммоль) в метаноле (1,5 мл) пропускали через гидрогенизатор с непрерывным потоком H-Cube®, оснащенный картриджем с 10% Pd/C (H2, 25°C, скорость потока 1 мл/мин). Полученный раствор концентрировали и очищали методом хроматографии на силикагеле, используя метанол и CH2Cl2 в качестве подвижной фазы, с получением указанного в заголовке соединения в виде белого твердого вещества (16 мг, 24%).
Пример 142: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-(1H-тетразол-5-ил)-N-этилпропанамида (соединение Y2178)
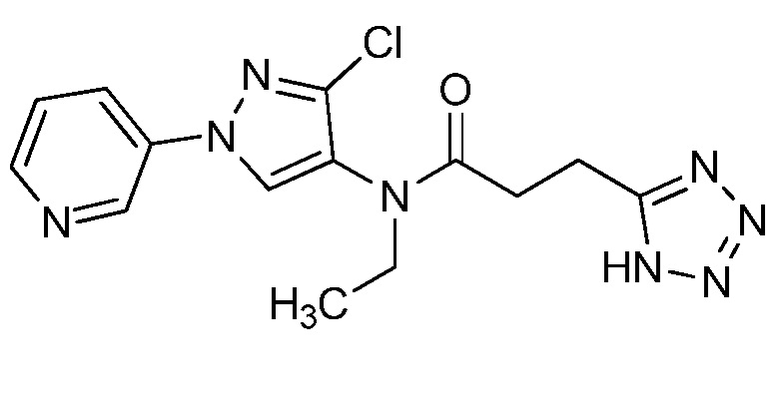
К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-циан-N-этилпропанамида (0,176 г, 0,579 ммоль) в толуоле (5,79 мл) при температуре окружающей среды в атмосфере N2 добавляли азидотриметилсилан (0,154 мл, 1,159 ммоль) и дибутилстаннон (0,014 г, 0,058 ммоль). Реакционный сосуд оснащали конденсером и нагревали до 110°C. Реакционную смесь оставляли перемешиваться при той же температуре в течение 24 ч, после чего методом UPLC-MS обнаруживали почти полное преобразование до продукта с целевой массой. Реакционную смесь охлаждали, разбавляли (медленно) MeOH (20 мл) и концентрировали в условиях вакуума с получением темно-коричневого масла. Остаток адсорбировали на целите и очищали методом флэш-хроматографии с обращенной фазой (0-100% CH3CN в H2O) с получением целевого продукта в виде бледно-коричневого стекловидного твердого вещества (49 мг, 24%).
Пример 143: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-((3,3,3-трифтор-2-метилпропил)тио)пропанамида (соединение 919)
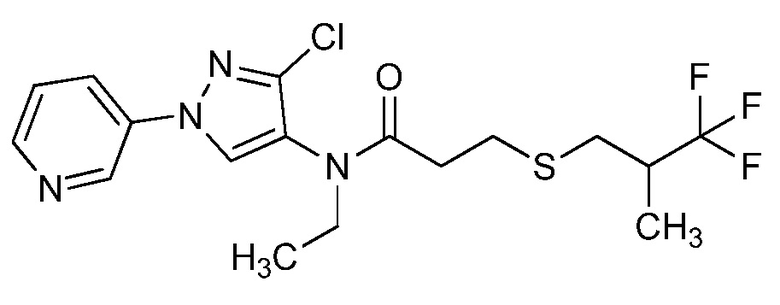
К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-((2-(трифторметил)аллил)тио)пропанамида (0,056 г, 0,134 ммоль) в DME (2,5 мл) и воде (0,5 мл) добавляли 4-метилбензолсульфонгидразид (0,249 г, 1,337 ммоль) и ацетат натрия (0,110 г, 1,337 ммоль). Реакционную смесь нагревали до 90°C и перемешивали в течение 1,5 ч. Методом UPLC-MS обнаруживали ~30% преобразование до продукта с целевой массой. Реакционную смесь дополнительно перемешивали при 90°C в течение 1,5 ч, после чего методом UPLC-MS обнаруживали ~75% преобразование до продукта с целевой массой. Реакционную смесь охлаждали, и дополнительно добавляли по 5 эквивалентов гидразида и ацетата натрия. Реакционную смесь снова нагревали до 90°C и дополнительно перемешивали в течение 2 ч. Методом UPLC-MS обнаруживали лишь незначительное остаточное количество исходного вещества. Поэтому дополнительно добавляли по 5 эквивалентов гидразида и ацетата натрия. Реакционную смесь дополнительно перемешивали при 90°C в течение 3 ч. Реакционную смесь охлаждали, разбавляли EtOAc (10 мл) и промывали водой (2×5 мл) и солевым раствором (1×5 мл). Органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях вакуума с получением желтого масла. Неочищенный остаток очищали прямофазной флэш-хроматографией (0-100% EtOAc в CH2Cl2) с получением целевого продукта в виде бледно-желтого масла (46 мг, 79%).
Пример 144: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-(винилтио)пропанамида (соединение 787)
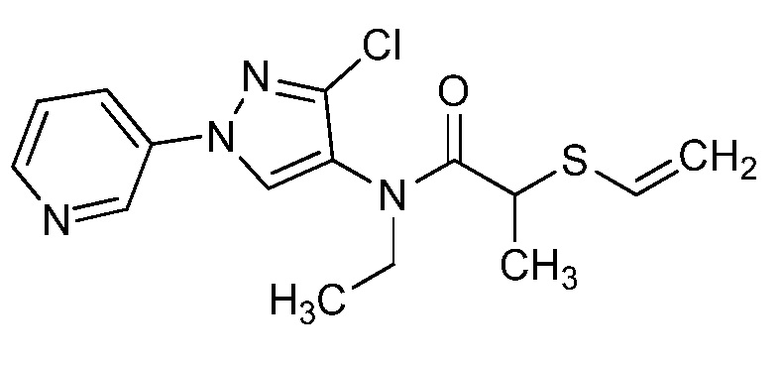
В сухую круглодонную колбу в атмосфере N2 добавляли гидрид натрия (0,043 г, 1,063 ммоль, 60% дисперсия в минеральном масле) и THF (2,126 мл), а затем метанол (0,086 мл, 2,126 ммоль). Реакционную смесь оставляли перемешиваться при температуре окружающей среды до завершения наблюдаемого выделения газа (~45 мин). Затем реакционную смесь охлаждали до 0°C, и добавляли S-(1-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)амино)-1-оксопропан-2-ил)этантиоат (0,150 г, 0,425 ммоль) в THF (2,126 мл). Реакционную смесь нагревали до температуры окружающей среды и перемешивали в течение 30 мин. Реакционную смесь снова охлаждали до 0°C и добавляли 1-фтор-2-йодэтан (0,104 мл, 1,275 ммоль) в THF (2,126 мл). Реакционную смесь нагревали до температуры окружающей среды и перемешивали в течение ночи. Реакционную смесь разбавляли EtOAc (5 мл) и гасили добавлением H2O (1 мл). Слои разделяли, и экстрагировали водный слой EtOAc (3×10 мл). Объединенные органические экстракты сушили над Na2SO4, фильтровали и концентрировали в условиях вакуума с получением коричневого масла. Неочищенный остаток очищали методом флэш-хроматографии (25-80% EtOAc в гексанах) с получением целевого продукта в виде тусклого масла (29 мг, 20%).
Пример 145: Получение (E)-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-((3,3,3-трифторпроп-1-ен-1-ил)тио)пропанамида (соединение 890)
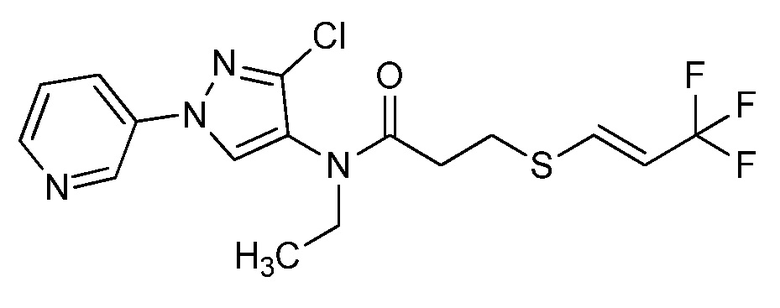
В высушенную в печи толстостенную пробирку в атмосфере N2 последовательно добавляли диоксан (0,241 мл), Cu2O (3,45 мг, 0,024 ммоль), KOH (0,0l54 г, 0,965 ммоль), (E)-1-бром-3,3,3-трифторпроп-1-ен (0,563 мл, 4,83 ммоль) и N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-меркаптопропанамид (0,150 г, 0,483 ммоль). Реакционную смесь закрывали крышкой и помещали на 3 ч при 110°C в микроволновой реактор Biotage® Initiator с внешним ИК-датчиком для мониторинга температуры с боковой стенки сосуда. В процессе этого реакционная смесь преобразовывалась из густой желтой смеси в черную смесь. Гетерогенную смесь охлаждали до комнатной температуры и разбавляли EtOAc (20 мл). Смесь фильтровали через слой целита (промывка EtOAc), и концентрировали фильтрат в условиях вакуума с получением темно-коричневого масла. Неочищенный остаток очищали методом прямофазной флэш-хроматографии (0-100% EtOAc в CH2Cl2) с получением целевого продукта в виде бледно-желтого масла (71 мг, 35%). Ссылка: Kao, H.-L.; Lee, C.-F. Org. Lett. 2011, 13, 5204-5207.
Пример 146: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-(метилсульфонамидо)пропанамида (соединение Y2145)
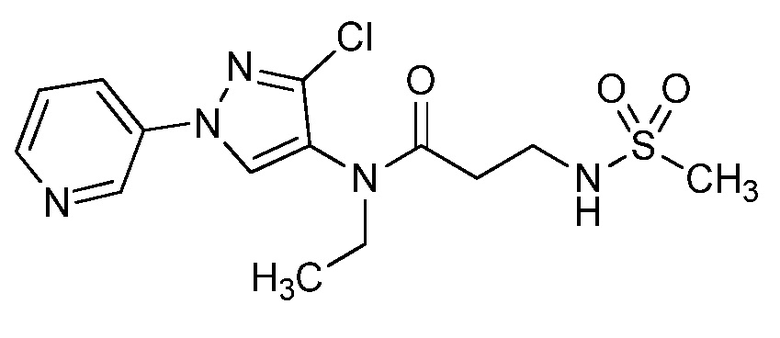
К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этилакриламида (0,538 г, 1,944 ммоль) в DMF (19,44 мл) при температуре окружающей среды добавляли K2CO3 (0,672 г, 4,86 ммоль) и метансульфонамид (0,277 г, 2,92 ммоль). Реакционную смесь оснащали обратным холодильником и нагревали до 80°C. После перемешивания в течение 1 ч, реакционную смесь охлаждали до температуры окружающей среды и разбавляли EtOAc (50 мл) и водой (50 мл). Слои энергично смешивали в течение 2 мин, а затем разделяли. Водную фазу экстрагировали EtOAc (3×50 мл), объединенные органические экстракты промывали солевым раствором (3×100 мл), сушили над Na2SO4, фильтровали и концентрировали в условиях вакуума с получением прозрачного масла. Неочищенный остаток очищали методом прямофазной флэш-хроматографии (0-30% MeOH в EtOAc) с получением целевого продукта в виде прозрачного полутвердого вещества (524 мг, 69%).
Пример 147: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-(N-(цианметил)метилсульфонамидо)-N-метилпропанамида (соединение 803)
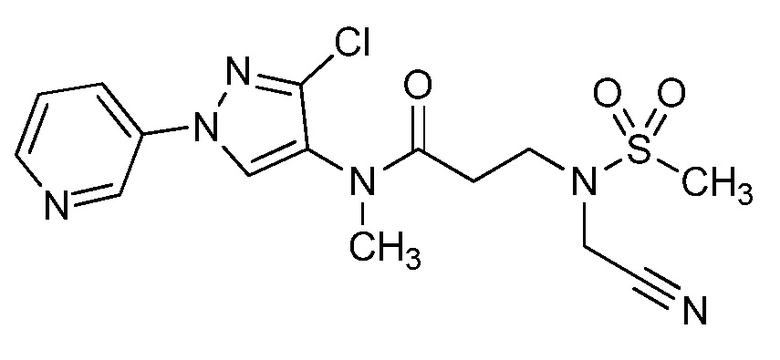
К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-метил-3-(метилсульфонамидо)пропанамида (0,085 г, 0,238 ммоль) в THF (2,376 мл) при 0°C добавляли NaH (9,98 мг, 0,249 ммоль, 60% дисперсия в минеральном масле). Реакционную смесь оставляли перемешиваться в течение 10 мин, после чего добавляли 2-бромацетонитрил (0,025 мл, 0,356 ммоль). Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 1 ч. Реакционную смесь гасили добавлением воды (5 мл) и разбавляли EtOAc (10 мл). Слои разделяли, и экстрагировали водный слой EtOAc (3×10 мл). Объединенные органические экстракты сушили над Na2SO4, фильтровали и концентрировали в условиях вакуума. Неочищенный остаток очищали методом флэш-хроматографии (0-10% MeOH в CH2Cl2) с получением целевого продукта в виде бледно-желтой пены (86 мг, 87%).
Пример 148: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-((3,3,3-трифторпропил)амино)пропанамида
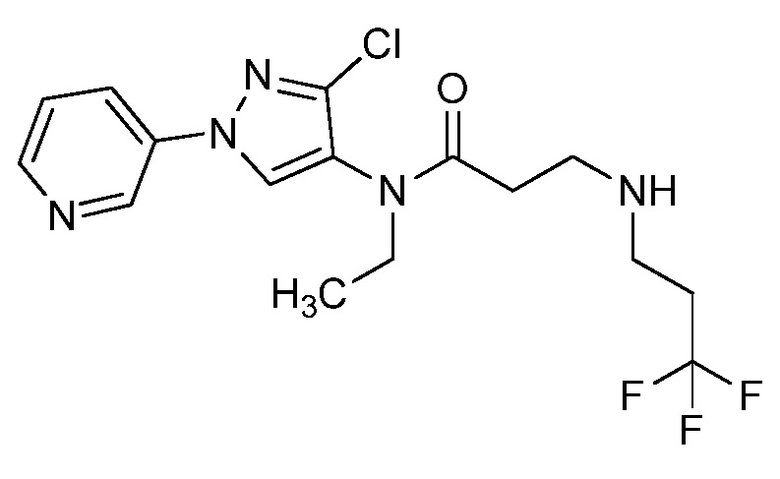
В толстостенную пробирку последовательно добавляли MeOH (2,0 мл), 3,3,3-трифторпропан-1-амин (0,386 г, 3,42 ммоль) и 3-хлор-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этилпропанамид (0,107 г, 0,342 ммоль). Реакционную смесь закрывали крышкой и помещали на 3 ч при 100°C в микроволновой реактор Biotage® Initiator с внешним ИК-датчиком для мониторинга температуры с боковой стенки сосуда. После охлаждения реакционную смесь концентрировали в условиях вакуума и очищали методом прямофазной флэш-хроматографии (0-15% MeOH в EtOAc) с получением целевого продукта в виде матового вязкого масла (127 мг, 94%): 1H ЯМР (400 МГц, CDCl3) δ 8,94 (дд, J=2,8, 0,7 Гц, 1H), 8,63 (дд, J=4,7, 1,5 Гц, 1H), 8,04 (ддд, J=8,3, 2,7, 1,4 Гц, 1H), 7,95 (с, 1H), 7,46 (ддд, J=8,4, 4,8, 0,8 Гц, 1H), 3,71 (кв., J=7,2 Гц, 2H), 2,93-2,80 (м, 4H), 2,35 (т, J=6,2 Гц, 2H), 2,28 (ддт, J=14,6, 7,3, 3,6 Гц, 2H), 1,16 (т, J=7,2 Гц, 3H); 19F ЯМР (376 МГц, CDCl3) δ -65,13; ESIMS m/z 390 ([M+H]+).
N-(3-Хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-(метиламино)пропанамид получали, как описано в примере 148: 1H ЯМР (400 МГц, CDCl3) δ 9,01 (д, J=2,6 Гц, 1H), 8,61 (дд, J=4,8, 1,4 Гц, 1H), 8,23 (с, 1H), 8,06 (ддд, J=8,3, 2,7, 1,4 Гц, 1H), 7,45 (дд, J=8,3, 4,8 Гц, 1H), 7,24 (с, 1H), 3,68 (кв., J=7,2 Гц, 2H), 3,14 (т, J=6,1 Гц, 2H), 2,71-2,56 (м, 5H), 1,14 (т, J=7,2 Гц, 3H); 13C ЯМР (101 МГц, CDCl3) δ 172,1, 148,6, 140,8, 140,1, 135,6, 126,6, 126,3, 124,1, 123,8, 47,1, 43,8, 36,1, 33,5, 13,1; ESIMS m/z 308 ([M+H]+).
N-(3-Хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-((4,4,4-трифторбутил)амино)пропанамид получали, как описано в примере 148: 1H ЯМР (400 МГц, CDCl3) δ 9,04 (д, J=2,7 Гц, 1H), 8,61 (дд, J=4,7, 1,5 Гц, 1H), 8,36 (с, 1H), 8,08 (ддд, J=8,4, 2,8, 1,5 Гц, 1H), 7,45 (ддд, J=8,4, 4,8, 0,7 Гц, 1H), 3,69 (кв., J=7,2 Гц, 2H), 3,18 (т, J=6,0 Гц, 2H), 3,02 (т, J=7,7 Гц, 3H), 2,75 (т, J=6,0 Гц, 2H), 2,25 (тдт, J=16,1, 10,6, 5,5 Гц, 2H), 2,14-1,98 (м, 2H), 1,16 (т, J=7,2 Гц, 3H); 19F ЯМР (376 МГц, CDCl3) δ -66,03; ESIMS m/z 404 ([M+H]+).
N-(3-Хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-(этиламино)пропанамид получали, как описано в примере 148: 1H ЯМР (400 МГц, CDCl3) δ 9,05 (с, 1H), 8,61 (с, 1H), 8,41 (дд, J=7,6, 2,1 Гц, 1H), 8,09 (дд, J=8,3, 1,4 Гц, 1H), 7,44 (дд, J=8,4, 4,8 Гц, 1H), 3,83-3,59 (м, 2H), 3,21 (т, J=6,0 Гц, 2H), 3,14-2,97 (м, 2H), 2,86 (с, 2H), 1,52-1,32 (м, 3H), 1,23-1,06 (м, 3H); 13C ЯМР (101 МГц, CDCl3) δ 170,7, 148,5, 140,5, 140,0, 135,6, 128,1, 126,4, 124,0, 122,4, 44,0, 43,3, 43,3, 30,1, 12,8, 11,4; ESIMS m/z 322 ([M+H]+).
N-(3-Хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-(фениламино)пропанамид получали, как описано в примере 148: 1H ЯМР (400 МГц, CDCl3) δ 8,81 (д, J=2,7 Гц, 1H), 8,60 (дд, J=4,8, 1,4 Гц, 1H), 7,89 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,54 (с, 1H), 7,42 (ддд, J=8,3, 4,8, 0,8 Гц, 1H), 7,17-7,05 (м, 2H), 6,64 (тт, J=7,3, 1,1 Гц, 1H), 6,59-6,49 (м, 2H), 4,22 (с, 1H), 3,70 (дт, J=14,8, 7,4 Гц, 2H), 3,48 (т, J=6,0 Гц, 2H), 2,45 (т, J=6,2 Гц, 2H), 1,14 (т, J=7,1 Гц, 3H); ESIMS m/z 370 ([M+H]+).
Пример 149: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-(N-(3,3,3-трифторпропил)метилсульфонамидо)пропанамида (соединение 978)
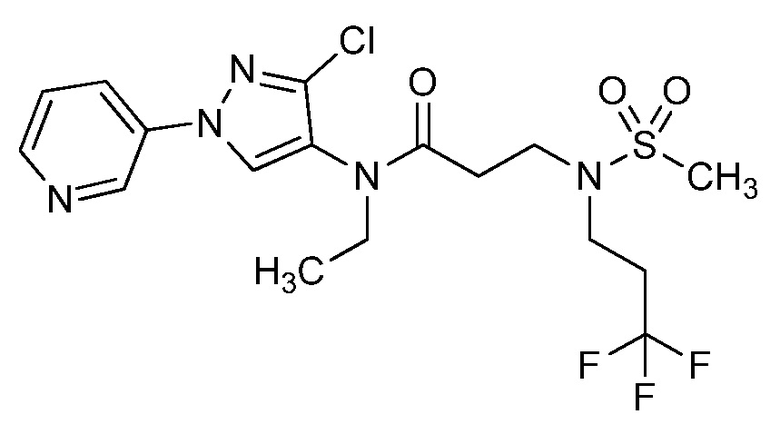
К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-((3,3,3-трифторпропил)амино)пропанамида (0,085 г, 0,218 ммоль) в CH2Cl2 (2,181 мл) при температуре окружающей среды в атмосфере N2 добавляли диизопропилэтиламин (0,152 мл, 0,872 ммоль) и метансульфонилхлорид (0,025 мл, 0,327 ммоль). Реакционную смесь оставляли перемешиваться в течение ночи, после чего реакционную смесь разбавляли CH2Cl2 (5 мл) и водой (3 мл). Фазы смешивали, а затем разделяли на фазовом сепараторе. Органический слой концентрировали в условиях вакуума с получением темно-оранжевого масла. Неочищенный продукт очищали методом прямофазной флэш-хроматографии (0-100% EtOAc в CH2Cl2) с получением целевого продукта в виде бледно-желтого вязкого масла (78 мг, 73%).
Пример 150: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-(метил(3,3,3-трифторпропил)амино)пропанамида (соединение Y2146)
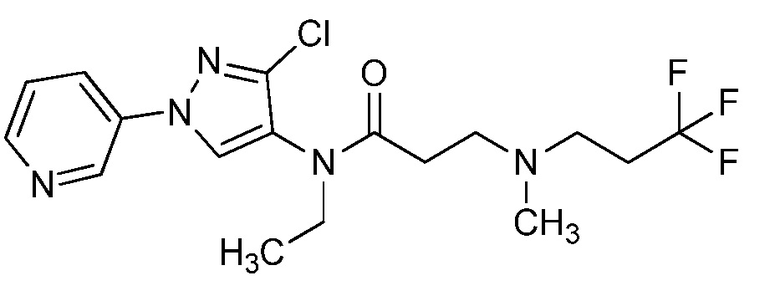
К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-(метиламино)пропанамида (0,139 г, 0,452 ммоль) в DMF (4,52 мл) при температуре окружающей среды добавляли K2CO3 (0,125 г, 0,903 ммоль) и 3-бром-1,1,1-трифторпропан (0,060 мл, 0,565 ммоль). Реакционную смесь оснащали конденсером, нагревали до 70°C и перемешивали в течение ночи. Методом UPLC-MS обнаруживали наличие непрореагировавшего исходного вещества. Поэтому дополнительно добавляли 3 эквивалента 3-бром-1,1,1-трифторпропана и оставляли реакционную смесь перемешиваться при 70°C в течение 3 ч. Методом UPLC-MS обнаруживали полное расходование исходного материала и преобразование до продукта с целевого массой. Реакционную смесь охлаждали, разбавляли EtOAc (20 мл) и фильтровали через слой целита. Затем фильтрат промывали полунасыщенным солевым раствором (3×20 мл), сушили над Na2SO4, фильтровали и концентрировали в условиях вакуума. Неочищенный остаток очищали методом прямофазной флэш-хроматографии (0-15% MeOH в CH2Cl2) с получением целевого продукта в виде прозрачного масла (84 мг, 44%).
Пример 151: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-((3-оксобутил)тио)пропанамида (соединение 877)
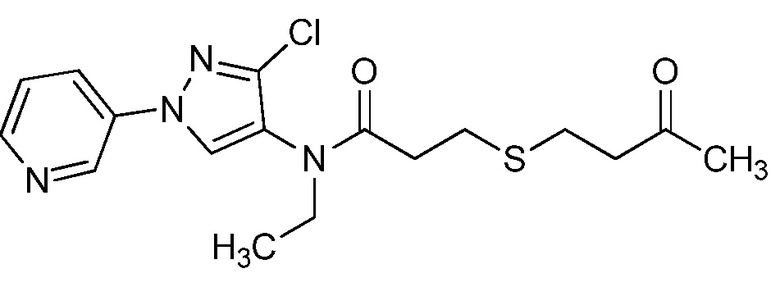
К раствору бут-3-ен-2-она (0,040 мл, 0,444 ммоль) в воде (0,370 мл) и диоксане (0,370 мл) при температуре окружающей среды добавляли N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-меркаптопропанамид (0,115 г, 0,370 ммоль). Реакционную смесь оставляли перемешиваться в течение 1 ч, после чего реакционную смесь разбавляли CH2Cl2, и энергично перемешивали смесь в течение 1 ч. Затем смесь пропускали через фазовый сепаратор, и промывали оставшуюся водную фазу CH2Cl2 (3×5 мл). Объединенные органические экстракты концентрировали в условиях вакуума с получением целевого продукта в виде оранжевого масла, которое было аналитически чистым согласно методам 1H NMR и UPLC-MS (140 мг, 94%). Ссылка: Khatik, G. L.; Kumar, R.; Chakraborti, A. K. Org. Lett. 2006, 8, 2433-2436.
Пример 152: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-((3,3-дифторбутил)тио)-N-этилпропанамида (соединение 889)
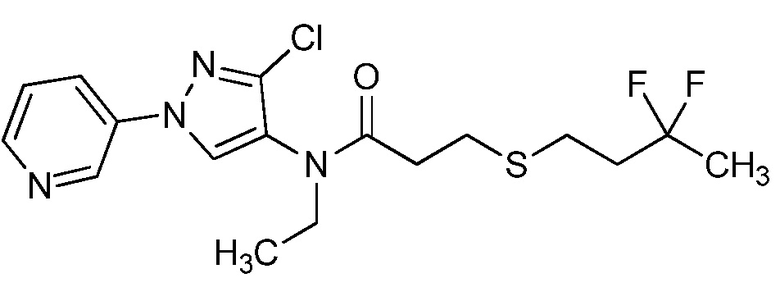
К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-((3-оксобутил)тио)пропанамида (0,184 г, 0,483 ммоль) в CH2Cl2 (4,83 мл) при 0°C добавляли Deoxo-Fluor® (0,534 мл, 2,90 ммоль), а затем EtOH (0,017 мл, 0,290 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 48 ч, в процессе чего раствор преобразовывался из бледно-желтого в темно-коричневый. Реакционную смесь разбавляли CH2Cl2 (10 мл) и гасили осторожным добавлением водн. NaHCO3 (5 мл). Слои разделяли, и экстрагировали водную фазу CH2Cl2 (3×10 мл). Объединенные органические экстракты сушили над Na2SO4, фильтровали и концентрировали в условиях вакуума. Неочищенный остаток очищали методом прямофазной флэш-хроматографии (0-100% EtOAc в CH2Cl2) с получением целевого продукта в виде бледно-желтого масла (43 мг, 21%).
Пример 153: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-((3,3-дифторпропил)тио)-N-этилпропанамида (соединение 927)
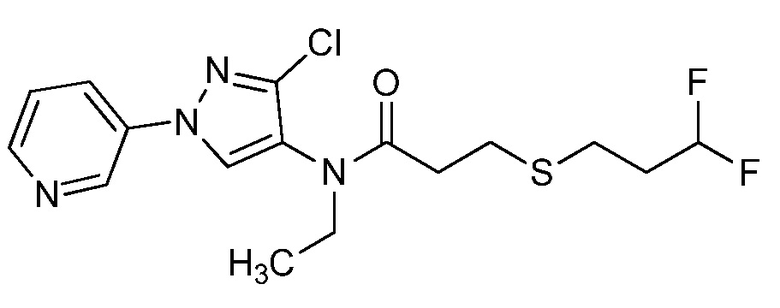
К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-((3,3-диметоксипропил)тио)-N-этилпропанамида (0,307 г, 0,743 ммоль) в THF (7,43 мл) добавляли 1,0M водный раствор HCl (7,43 мл, 7,43 ммоль). Реакционную смесь оставляли перемешиваться при температуре окружающей среды в течение 1 ч, после чего методом TLC/UPLC-MS обнаруживали полный гидролиз до целевого альдегида. Смесь разбавляли EtOAc (20 мл) и водой (10 мл). Слои смешивали, разделяли и экстрагировали водный слой EtOAc (3×20 мл). Объединенные органические экстракты промывали NaHCO3 (1×25 мл), водой (1×25 мл) и солевым раствором (1×25 мл), а затем сушили над Na2SO4, фильтровали и концентрировали в условиях вакуума. Неочищенный продукт сушили методом азеотропной перегонки из толуола (3×10 мл), а затем помещали в атмосферу N2. В колбу добавляли CH2Cl2 (7,44 мл) и охлаждали раствор до 0°C. Добавляли Deoxo-Fluor® (0,686 мл, 3,72 ммоль) и EtOH (4,34 мкл, 0,074 ммоль) и нагревали реакционную смесь до температуры окружающей среды. Спустя 18 ч реакционную смесь разбавляли CH2Cl2 (10 мл) и гасили осторожным добавлением водн. NaHCO3 (5 мл). Слои разделяли, и экстрагировали водную фазу CH2Cl2 (3×10 мл). Объединенные органические экстракты сушили над Na2SO4, фильтровали и концентрировали в условиях вакуума. Неочищенное вещество очищали методом прямофазной флэш-хроматографии (0-100% EtOAc в CH2Cl2) с получением целевого продукта в виде бледно-желтого масла (151 мг, 50%).
Пример 154: Получение 1,1,1-трифтор-3-йод-5-метилгексана
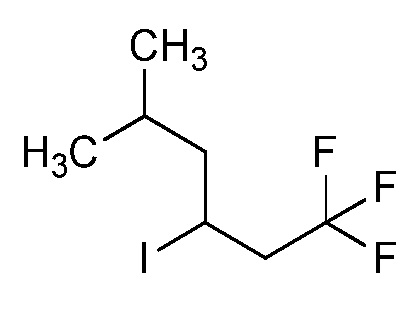
В толстостенную пробирку с магнитной мешалкой добавляли воду (5,94 мл), ацетонитрил (5,94 мл), дитионит натрия (0,569 г, 3,27 ммоль), бикарбонат натрия (0,499 г, 5,94 ммоль) и 4-метилпент-1-ен (0,379 мл, 2,97 ммоль). Сосуд герметизировали при помощи обжимной крышки, охлаждали до -78°C и выкачивали воздух в условиях вакуума. Затем в реакционном сосуде конденсировали трифторйодметан (0,873 г, 4,46 ммоль) (приблизительно). После нагрева до температуры окружающей среды реакционную смесь перемешивали в течение 2,5 ч. Перед удалением крышки, из реакционной смеси иглой удаляли газы, и наблюдали при этом выделение газа. Затем реакционную смесь разбавляли водой (5 мл), экстрагировали смесь Et2O (3×20 мл), объединенные экстракты сушили над MgSO4, фильтровали и концентрировали в условиях вакуума с получением прозрачного масла (740 мг, 80%). Методом 1H-ЯМР анализа неочищенного образца обнаруживали, что указанный целевой продукт характеризуется чистотой ~90%. Поэтому продукт использовали в последующих реакциях без дополнительной очистки: 1H ЯМР (400 МГц, CDCl3) δ 4,25-4,06 (м, 1H), 2,94 (дкв. д, J=15,5, 10,6, 6,1 Гц, 1H), 2,77 (дкв. д, J=15,5, 10,0, 7,5 Гц, 1H), 1,92-1,74 (м, 2H), 1,45-1,28 (м, 1H), 0,98 (д, J=6,5 Гц, 3H), 0,87 (д, J=6,5 Гц, 3H); 19F ЯМР (376 МГц, CDCl3) δ -63,63.
Ссылка: Ignatowska, J.; Dmowski, W. J. Fluor. Chem., 2007, 128, 997-1006.
(4,4,4-Трифтор-2-йодбутил)бензол получали, как описано в примере 154: 1H ЯМР (400 МГц, CDCl3) δ 7,41-7,27 (м, 3H), 7,23-7,16 (м, 2H), 4,33 (дкв., J=8,2, 6,7 Гц, 1H), 3,31-3,15 (м, 2H), 2,96-2,72 (м, 2H); 19F ЯМР (376 МГц, CDCl3) δ -63,63; EIMS m/z 314.
1-(4,4,4-Трифтор-2-йодбутил)-1H-имидазол получали, как описано в примере 154: 1H ЯМР (400 МГц, CDCl3) δ 7,61 (т, J=1,1 Гц, 1H), 7,12 (т, J=1,1 Гц, 1H), 7,00 (т, J=1,4 Гц, 1H), 4,46-4,31 (м, 3H), 2,88-2,66 (м, 2H); 19F ЯМР (376 МГц, CDCl3) δ -63,57; EIMS m/z 304.
1,1,1-Трифтор-3-йодпентан получали, как описано в примере 154: 1H ЯМР (400 МГц, CDCl3) δ 4,20 (тдд, J=7,9, 6,2, 4,4 Гц, 1H), 3,01-2,84 (м, 1H), 2,84-2,69 (м, 1H), 1,84-1,74 (м, 2H), 1,06 (т, J=7,1 Гц, 3H); 19F ЯМР (376 МГц, CDCl3) δ -64,06; EIMS m/z 252.
Пример 155: Получение S-(1,1,1-трифтор-5-метилгексан-3-ил)бензотиоат
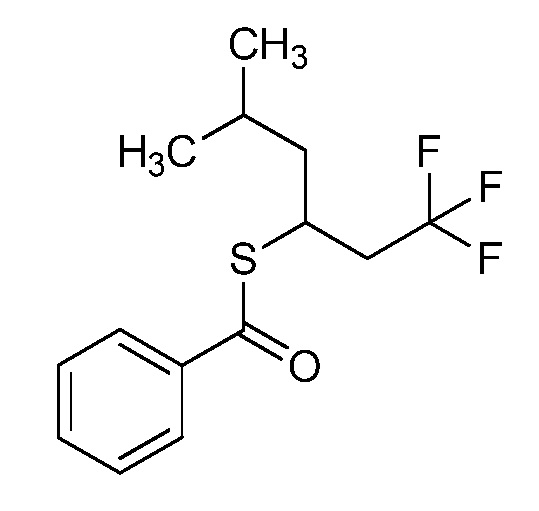
К раствору 1,1,1-трифтор-3-йод-5-метилгексана (0,047 г, 0,168 ммоль) в DMF (1,678 мл) при температуре окружающей среды добавляли бензотиоат калия (0,035 г, 0,201 ммоль). Реакционную смесь оставляли перемешиваться в течение 18 ч, после чего реакционную смесь разбавляли водой (3 мл) и EtOAc (5 мл). Слои смешивали, а затем разделяли. Водный слой экстрагировали EtOAc (3×5 мл), объединенные органические экстракты промывали водой (1×10 мл) и полунасыщенным солевым раствором (2×10 мл), сушили над Na2SO4, фильтровали и концентрировали в условиях вакуума. Остаток очищали методом флэш-хроматографии (0-30% EtOAc в гексанах) с получением целевого продукта в виде прозрачного масла (37 мг, 68%): 1H ЯМР (400 МГц, CDCl3) δ 7,99-7,92 (м, 2H), 7,62-7,55 (м, 1H), 7,50-7,41 (м, 2H), 4,10-3,95 (м, 1H), 2,73-2,56 (м, 1H), 2,56-2,40 (м, 1H), 1,94-1,73 (м, 1H), 1,73-1,61 (м, 2H), 0,97 (д, J=6,6 Гц, 3H), 0,94 (д, J=6,5 Гц, 3H); 19F ЯМР (376 МГц, CDCl3) δ -62,89.
S-(4,4,4-Трифтор-1-фенилбутан-2-ил)бензотиоат получали, как описано в примере 155: 1H ЯМР (400 МГц, CDCl3) δ 7,97-7,89 (м, 2H), 7,58 (ддт, J=7,9, 6,9, 1,3 Гц, 1H), 7,49-7,41 (м, 2H), 7,39-7,26 (м, 5H), 4,29-4,15 (м, 1H), 3,11 (д, J=7,2 Гц, 2H), 2,54 (кв. д, J=10,6, 6,6 Гц, 2H); 19F ЯМР (376 МГц, CDCl3) δ -62,86; EIMS m/z 324.
S-(4,4,4-Трифтор-1-(1H-имидазол-1-ил)бутан-2-ил)бензотиоат получали, как описано в примере 155: 1H ЯМР (400 МГц, CDCl3) δ 7,98-7,89 (м, 2H), 7,68-7,60 (м, 1H), 7,56 (т, J=1,1 Гц, 1H), 7,53-7,45 (м, 2H), 7,11 (т, J=1,1 Гц, 1H), 7,05 (т, J=1,3 Гц, 1H), 4,42-4,18 (м, 3H), 2,64-2,39 (м, 2H); 19F ЯМР (376 МГц, CDCl3) δ -62,98; EIMS m/z 314.
S-(1,1,1-Трифторпентан-3-ил)бензотиоат получали, как описано в примере 155: 1H ЯМР (400 МГц, CDCl3) δ 8,02-7,91 (м, 2H), 7,64-7,55 (м, 1H), 7,51-7,40 (м, 2H), 4,06-3,90 (м, 1H), 2,70-2,41 (м, 2H), 2,02-1,86 (м, 1H), 1,86-1,71 (м, 1H), 1,05 (т, J=7,3 Гц, 3H); 19F ЯМР (376 МГц, CDCl3) δ -63,32; EIMS m/z 262.
Пример 156: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-((1,1,1-трифтор-5-метилгексан-3-ил)тио)пропанамида (соединение 1053)
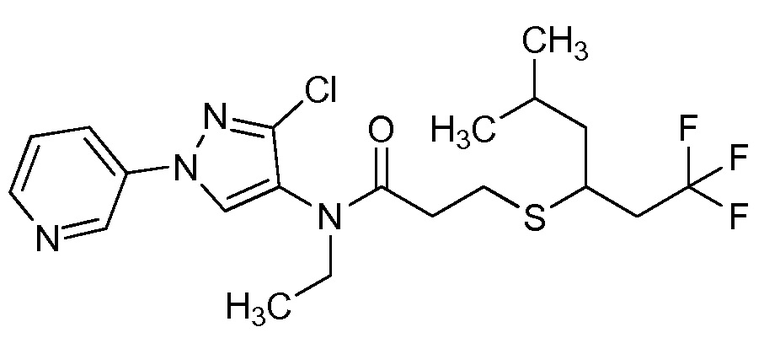
К суспензии NaH (60% в минеральном масле, 0,012 г, 0,300 ммоль) в THF (2,86 мл) при температуре окружающей среды в атмосфере N2 добавляли MeOH (0,058 мл, 1,429 ммоль). Реакционная смесь становилась гомогенной, и наблюдалось выделение газа. После перемешивания в течение 30 мин реакционную смесь охлаждали до 0°C, и медленно добавляли раствор S-(1,1,1-трифтор-5-метилгексан-3-ил)бензотиоата (0,083 г, 0,286 ммоль) в THF (2 мл). Реакционную смесь нагревали до температуры окружающей среды, перемешивали в течение 45 мин, а затем обратно охлаждали до 0°C. К реакционной смеси добавляли раствор 3-хлор-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этилпропанамида (0,090 г, 0,286 ммоль) в THF (2 мл). Реакционную смесь нагревали до температуры окружающей среды и перемешивали в течение 18 ч. Реакционную смесь разбавляли EtOAc (20 мл) и водой (10 мл). Слои смешивали, а затем разделяли. Водный слой экстрагировали EtOAc (3×20 мл), объединенные органические экстракты сушили над Na2SO4, фильтровали и концентрировали в условиях вакуума. Неочищенный остаток очищали методом прямофазной флэш-хроматографии (0-100% EtOAc в CH2Cl2) с получением целевого продукта в виде бледно-желтого масла (63 мг, 45%).
Пример 157: Получение трет-бутил(2-(2,2-дифторциклопропил)этокси)дифенилсилана
В высушенную в печи 3-горлую круглодонную колбу, оснащенную обратным холодильником и делительной воронкой, в атмосфере N2 добавляли (бут-3-ен-1-илокси)(трет-бутил)дифенилсилан (3,6 г, 11,59 ммоль) и фторид натрия (7,30 мг, 0,174 ммоль) (для приготовления исходного олефина см. Waser, J.; Gaspar, B.; Nambu, H.; Carreira, E. M. J. Am. Chem. Soc. 2006, 128, 11693-11712). В закрытую делительную воронку добавляли триметилсилил-2,2-дифтор-2-(фторсульфонил)ацетат (4,57 мл, 23,19 ммоль). Реакционный сосуд и его содержимое нагревали до 120°C, затем делительную воронку открывали и добавляли сульфонилфторид в течение 1 ч. После завершения добавления реакционную смесь оставляли перемешиваться при 120°C в течение 30 мин. Реакционную смесь охлаждали до температуры окружающей среды, разбавляли CH2Cl2 (50 мл) и промывали водн. NaHCO3 (2×50 мл). Органическую фазу разделяли, сушили над Na2SO4, фильтровали и концентрировали в условиях вакуума с получением коричневого масла. Неочищенный остаток очищали методом прямофазной флэш-хроматографии (0-15% CH2Cl2в гексанах) с получением целевого продукта в виде прозрачного масла (3,07 г, 73%): 1H ЯМР (400 МГц, CDCl3) δ 7,72-7,63 (м, 4H), 7,49-7,34 (м, 6H), 3,73 (т, J=6,0 Гц, 2H), 1,88-1,73 (м, 1H), 1,73-1,55 (м, 2H), 1,42-1,27 (м, 1H), 1,06 (с, 9H), 0,94-0,81 (м, 1H); 19F ЯМР (376 МГц, CDCl3) δ -128,54 (д, J=156,2 Гц), -143,96 (д, J=155,5 Гц); 13C ЯМР (101 МГц, CDCl3) δ 135,5, 133,7 (д, J=3,7 Гц), 129,6, 127,7, 114,5, 62,8, 30,0 (д, J=3,5 Гц), 26,8, 19,9 (т, J=10,9 Гц), 19,2, 15,9 (т, J=11,0 Гц).
Пример 158: Получение 2-(2,2-дифторциклопропил)этил-4-метилбензолсульфоната
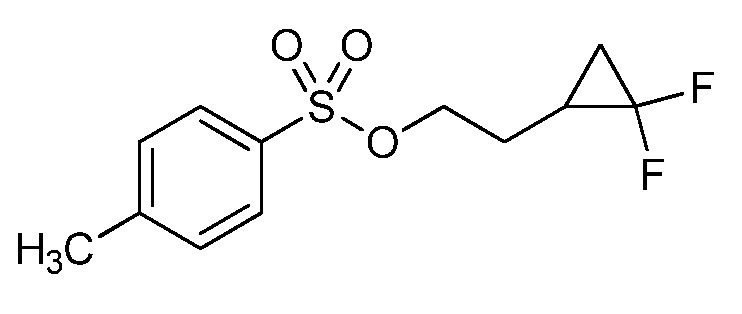
К раствору трет-бутил(2-(2,2-дифторциклопропил)этокси)дифенилсилана (0,386 г, 1,071 ммоль) в THF (10,71 мл) при 0°C добавляли 1,0M раствор TBAF (3,21 мл, 3,21 ммоль) в THF. Реакционную смесь нагревали до температуры окружающей среды и перемешивали в течение 3 ч. Реакционную смесь гасили добавлением водн. NH4Cl (1 мл), и распределяли смесь между водой (15 мл) и EtOAc (15 мл). Слои тщательно смешивали, а затем разделяли. Водный слой экстрагировали EtOAc (3×20 мл), объединенные органические экстракты сушили над Na2SO4, фильтровали и концентрировали в условиях вакуума. Затем неочищенный остаток поглощали CH2Cl2 (7,15 мл). Затем к раствору добавляли пиридин (0,434 мл, 5,36 ммоль) и пара-толуолсульфонилхлорид (0,614 г, 3,22 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 48 ч, после чего реакционную смесь распределяли между CH2Cl2 (50 мл) и водой (25 мл). Слои разделяли, и промывали органический слой 1н водн. HCl (20 мл), водой (20 мл) и солевым раствором (20 мл). Затем, органический слой сушили над Na2SO4, фильтровали и концентрировали в условиях вакуума. Неочищенный остаток очищали методом прямофазной флэш-хроматографии (0-50% EtOAc в гексанах) с получением целевого продукта в виде прозрачного масла (142 мг, 46%, в 2 этапа): 1H ЯМР (400 МГц, CDCl3) δ 7,89-7,71 (м, 2H), 7,42-7,29 (м, 2H), 4,20-3,96 (м, 2H), 2,46 (с, 3H), 1,92-1,81 (м, 1H), 1,81-1,69 (м, 1H), 1,63-1,48 (м, 1H), 1,39 (дддд, J=12,2, 11,2, 7,7, 4,3 Гц, 1H), 0,93 (дтд, J=13,0, 7,6, 3,5 Гц, 1H); 13C ЯМР (101 МГц, CDCl3) δ 145,0, 132,9, 129,9, 127,9, 113,5 (т, J=282,4 Гц), 69,0 (д, J=2,2 Гц), 26,6 (д, J=4,3 Гц), 21,7, 18,9 (т, J=11,1 Гц), 15,9 (т, J=11,0 Гц); 19F ЯМР (376 МГц, CDCl3) δ -129,09 (д, J=157,8 Гц), -144,18 (д, J=158,1 Гц).
Пример 159: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-метилакриламида (соединение Y2098)
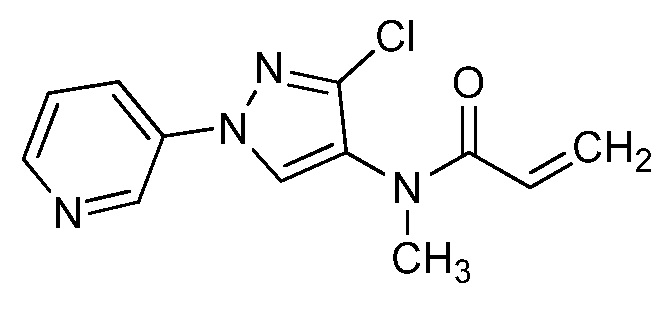
К раствору 3-хлор-N-метил-1-(пиридин-3-ил)-1H-пиразол-4-амина (0,526 г, 2,52 ммоль) в 1,2-дихлорэтане (25,2 мл) при 0°C добавляли диизопропилэтиламин (0,484 мл, 2,77 ммоль) и акрилоилхлорид (0,205 мл, 2,52 ммоль). Реакционную смесь оставляли нагреваться до температуры окружающей среды и перемешивали в течение 1 ч. Реакционную смесь гасили добавлением водн. NaHCO3 и разбавляли CH2Cl2. Слои разделяли, и экстрагировали водный слой CH2Cl2. Объединенные органические экстракты сушили над Na2SO4, фильтровали и концентрировали в условиях вакуума. Неочищенный продукт очищали методом флэш-хроматографии (0-10% MeOH в CH2Cl2) с получением целевого продукта в виде оранжевого твердого вещества (634 мг, 91%).
Пример 160: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-((3,3,3-трифторпропил)тио)пропанамида (соединение 653)
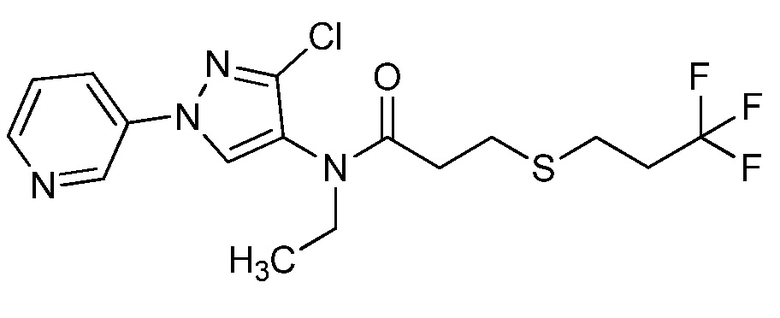
К раствору 3-хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амина (10 г, 44,9 ммоль) в CH2Cl2 (100 мл) при 0°C в атмосфере N2 последовательно добавляли пиридин (5,45 мл, 67,4 ммоль), 4-диметиламинопиридин (DMAP) (2,74 г, 22,45 ммоль) и 3-((3,3,3-трифторпропил)тио)пропаноилхлорид (9,91 г, 44,9 ммоль). Реакционную смесь нагревали до температуры окружающей среды и перемешивали в течение 1 ч. Реакционную смесь вливали в воду (100 мл), и перемешивали полученную смесь в течение 5 мин. Смесь переносили в делительную воронку, и разделяли слои. Водную фазу экстрагировали CH2Cl2 (3×50 мл), объединенные органические экстракты сушили над Na2SO4, фильтровали и концентрировали в условиях вакуума. Неочищенный продукт очищали методом прямофазной флэш-хроматографии (0-100% EtOAc в CH2Cl2) с получением целевого продукта в виде бледно-желтого твердого вещества (17,21 г, 89%).
Пример 161: Получение N-(1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-ил)-2-оксооксазолидин-3-карботиоамида (соединение Y2032)
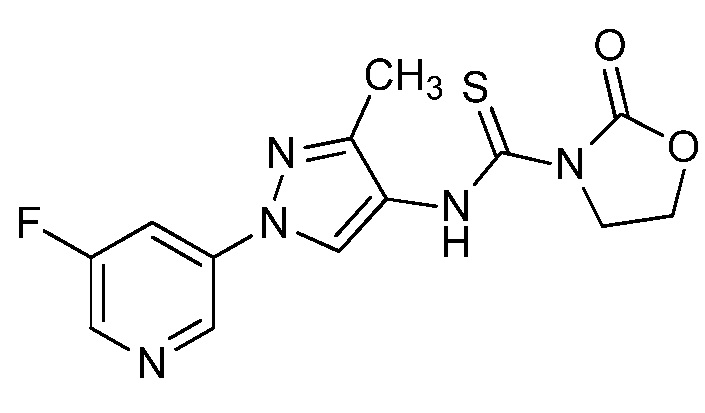
К раствору 1-(5-фторпиридин-3-ил)-3-метил-1H-пиразол-4-амина (0,10 г, 0,52 ммоль) и триэтиламина (0,24 мл, 1,71 ммоль) в безводном THF (0,52 мл) шприцем в течение 15 минут добавляли сероуглерод (0,03 мл, 0,52 ммоль). После перемешивания в течение 1 часа, смесь охлаждали на бане со льдом, одной порцией добавляли 4-метилбензол-1-сульфонилхлорид (0,11 г, 0,57 ммоль), перемешивали в течение 5 минут при 0°C, а затем нагревали до 25°C и перемешивали в течение 1 часа. Реакционную смесь гасили добавлением 1н HCl и экстрагировали диэтиловым эфиром. Эфирные слои объединяли, промывали водой и полунасыщенным водным бикарбонатом натрия, сушили (MgSO4), фильтровали и концентрировали досуха с получением целевого изотиоцианата (0,12 г, 98%). К раствору оксазолидин-2-она (0,05 г, 0,61 ммоль), растворенного в безводном DMF (2,05 мл), одной порцией добавляли гидрид натрия (0,03 г, 0,61 ммоль, 60% дисперсия в минеральном масле) и перемешивали суспензию в течение 20 минут. Реакционную смесь охлаждали до 0°C, одной порцией добавляли 3-фтор-5-(4-изотиоцианато-3-метил-1H-пиразол-1-ил)пиридин (0,12 г, 0,51 ммоль) в минимальном количестве безводного DMF и перемешивали в течение 20 минут. Добавляли воду и этилацетат, полученную двухфазную смесь разделяли, и однократно экстрагировали водный слой этилацетатом. Объединенные органические экстракты промывали гексанами/водой (1/1), сушили (MgSO4), фильтровали и концентрировали досуха. Неочищенный продукт очищали методом хроматографии на силикагеле, элюируя 0-75% этилацетатом в гексанах, с получением целевого продукта в виде белого твердого вещества (0,03 г, 18%).
Пример 162: Получение 3-(4-изотиоцианато-3-метил-1H-пиразол-1-ил)пиридина
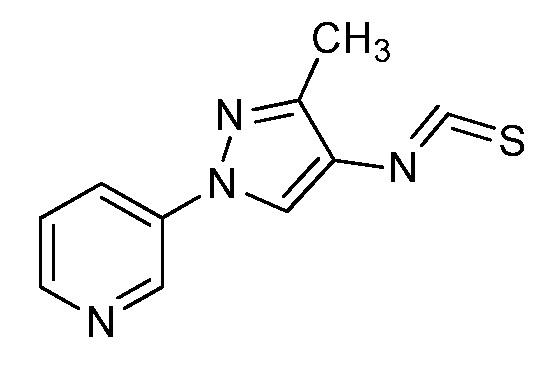
К раствору 3-метил-1-(пиридин-3-ил)-1H-пиразол-4-амина (0,50 г, 2,87 ммоль) и триэтиламина (1,3 мл, 1,71 ммоль) в безводном THF (2,8 мл) шприцем в течение 15 минут добавляли сероуглерод (0,17 мл, 2,87 ммоль). После перемешивания в течение 1 часа, смесь охлаждали на бане со льдом, одной порцией добавляли 4-метилбензол-1-сульфонилхлорид (0,60 г, 0,3,16 ммоль), перемешивали в течение 5 минут при 0°C, а затем нагревали до 25°C, и перемешивали в течение 1 часа. Реакционную смесь гасили добавлением 1н HCl и экстрагировали диэтиловым эфиром. Эфирные слои объединяли, промывали водой и полунасыщенным водным NaHCO3, сушили (MgSO4), фильтровали и концентрировали досуха. Неочищенное вещество очищали методом хроматографии на силикагеле, элюируя 0-100% этилацетатом в гексанах, с получением целевого продукта в виде светло-желтого твердого вещества (0,48 г, 78%): 1H ЯМР (400 МГц, CDCl3) δ 8,89 (д, J=2,6 Гц, 1H), 8,56 (дд, J=4,7, 1,4 Гц, 1H), 7,96 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,89 (с, 1H), 7,40 (ддд, J=8,3, 4,8, 0,7 Гц, 1H), 2,40 (с, 3H); ESIMS m/z 218 ([M+H]+).
Пример 163: Получение N-(3-метил-1-(пиридин-2-ил)-1H-пиразол-4-ил)-2-оксооксазолидин-3-карботиоамида (соединение Y2034)
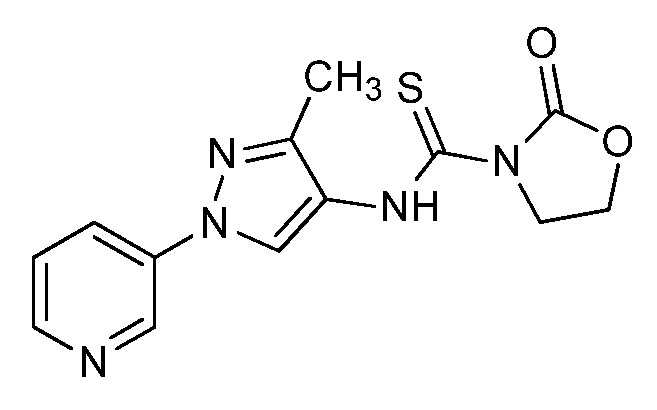
К раствору оксазолидин-2-она (0,06 г, 0,66 ммоль), растворенного в безводном DMF (2,2 мл), одной порцией добавляли гидрид натрия (0,03 г, 0,67 ммоль, 60% дисперсия в минеральном масле) и перемешивали суспензию в течение 20 минут. Реакционную смесь охлаждали до 0°C, одной порцией добавляли 3-(4-изотиоцианато-3-метил-1H-пиразол-1-ил)пиридин (0,12 г, 0,56 ммоль) в минимальном количестве безводного DMF и перемешивали в течение 20 минут. Добавляли воду и этилацетат, полученную двухфазную смесь разделяли, и однократно экстрагировали водный слой этилацетатом. Объединенные органические экстракты промывали гексанами/водой (1/1), сушили (MgSO4), фильтровали и концентрировали досуха. Неочищенный продукт очищали методом хроматографии на силикагеле, элюируя 0-75% этилацетатом в гексанах, с получением целевого продукта в виде белого твердого вещества (0,07 г, 41%).
Пример 164: Получение метил-N-(3-метил-1-(пиридин-3-ил)-1H-пиразол-4-ил)-2-оксооксазолидин-3-карбимидотиоата (соединение Y2035)
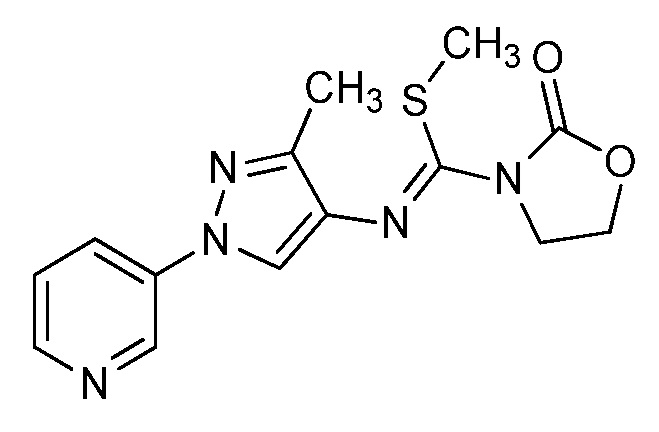
К раствору оксазолидин-2-она (0,05 г, 0,66 ммоль), растворенного в безводном DMF (2,22 мл), одной порцией добавляли гидрид натрия (0,03 г, 0,66 ммоль, 60% дисперсия в минеральном масле) и перемешивали суспензию в течение 20 минут. Реакционную смесь охлаждали до 0°C, одной порцией добавляли 3-(4-изотиоцианато-3-метил-1H-пиразол-1-ил)пиридин (0,12 г, 0,55 ммоль) в минимальном количестве безводного DMF и перемешивали в течение 20 минут. Добавляли йодметан (0,04 мл, 0,66 ммоль), и отслеживали прохождение реакции методом TLC. Добавляли водный хлорид аммония и 50% этилацетат в гексанах, полученную двухфазную смесь разделяли, органический экстракт промывали водой и насыщенным водным бикарбонатом натрия и концентрировали досуха. Неочищенный продукт очищали методом хроматографии на силикагеле, элюируя 0-10% метанолом в CH2Cl2, с получением целевого продукта в виде светло-желтого твердого вещества (0,14 г, 82%).
Пример 165: Получение N-ацетил-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)циклопропанкарбоксамида (соединение Y2060)
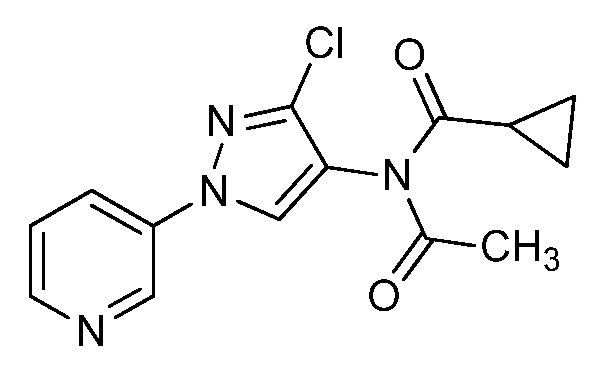
К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)циклопропанкарбоксамида (0,15 г, 0,57 ммоль) в дихлорэтане (2,5 мл) добавляли диизопропилэтиламин (0,12 мл, 0,68 ммоль), а затем ацетилхлорид (0,54 г, 0,68 ммоль) и перемешивали реакционную смесь при комнатной температуре в течение ночи. Добавляли насыщенный водный NaHCO3 и экстрагировали смесь CH2Cl2. Объединенные органические фазы концентрировали досуха и очищали методом хроматографии на силикагеле, элюируя 0-100% этилацетатом в гексанах, с получением целевого продукта в виде белого твердого вещества (10 мг, 6%).
Пример 166: Получение S-метил-(3-хлор-5-(метилтио)-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)карбамотиоата (соединение Y2076)
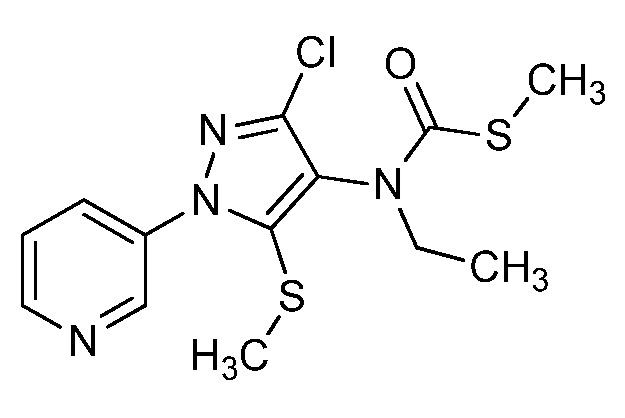
К раствору THF (1,35 мл) и диизопропилэтиламина (0,07 мл, 0,40 ммоль) добавляли 2,5M н-бутиллитий (0,16 мл, 0,40 ммоль) и перемешивали реакционную смесь в течение 30 минут. Реакционную смесь дополнительно охлаждали до -78°C, к ней по каплям добавляли S-метил-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)карбамотиоат (0,10 г, 0,33 ммоль) в минимальном количестве безводного THF и перемешивали в течение 45 минут. Затем к смеси добавляли 1,2-диметилдисульфан (0,04 г, 0,37 ммоль), и дополнительно реакционную смесь перемешивали в течение 20 минут. Реакционную смесь вливали в воду и экстрагировали этилацетатом. Этилацетатные слои объединяли, сушили (MgSO4), фильтровали и концентрировали досуха. Неочищенный продукт очищали методом хроматографии на силикагеле, элюируя 0-100% этилацетатом в гексанах, с получением целевого продукта в виде прозрачного масла (53 мг, 46%).
Пример 167: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-(3,3,3-трифторпропил)тио)пропанамида (соединение 653)
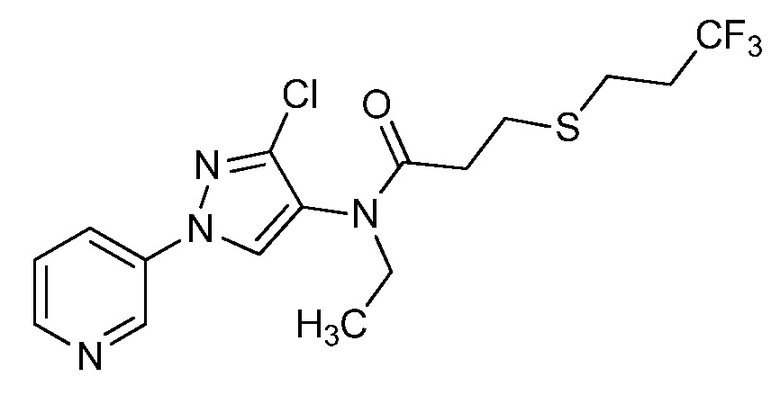
К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-меркаптопропанамида (0,10 г, 0,32 ммоль), растворенного в безводном THF (1,07 мл) и охлажденного на бане со льдом, одной порцией добавляли гидрид натрия (0,02 г, 0,34 ммоль, 60% дисперсия в минеральном масле) и перемешивали реакционную смесь в течение 10 минут. К смеси одной порцией добавляли 3-бром-1,1,1-трифторпропан (0,06 г, 0,35 ммоль) в минимальном количестве безводного DMF, и перемешивали реакционную смесь при комнатной температуре в течение 2 часов. Реакционную смесь вливали в воду и экстрагировали этилацетатом. Этилацетатные слои объединяли и концентрировали досуха. Неочищенный продукт очищали методом хроматографии на силикагеле, элюируя 0-75% этилацетатом в гексанах, с получением целевого продукта в виде прозрачного масла (83 мг, 63%).
Пример 168: Получение трет-бутил(2-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)амино)-2-оксоэтил)(метил)карбамата
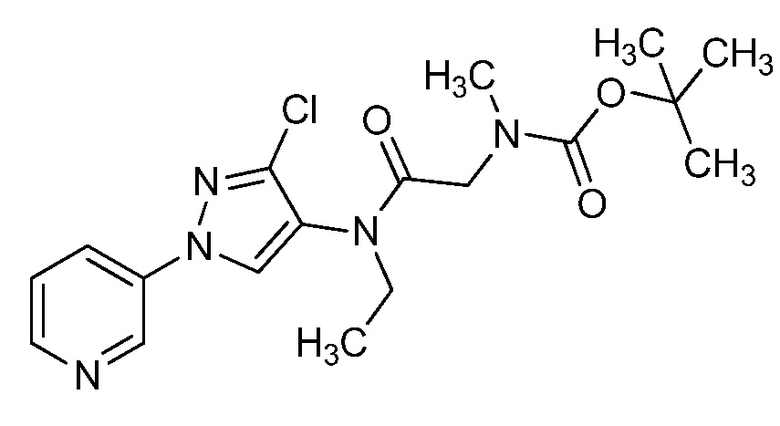
К раствору 3-хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амина (0,40 г, 1,79 ммоль) в дихлорэтане (3,59 мл) добавляли 2-((трет-бутоксикарбонил)(метил)амино)уксусную кислоту (0,37 г, 1,97 ммоль), 4-N,N-диметиламинопиридин (0,24 г, 1,97 ммоль) и гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (0,51 г, 2,69 ммоль) и перемешивали реакционную смесь в течение ночи при комнатной температуре. Реакционную смесь концентрировали досуха, и очищали неочищенный продукт методом хроматографии на силикагеле, элюируя 0-100% этилацетатом в гексанах, с получением целевого продукта в виде белого полутвердого вещества (0,61 г, 87%): ИК (тонкая пленка) 1673 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,96 (д, J=2,4 Гц, 1H), 8,63 (дд, J=5,3 Гц, 1H), 8,11-7,86 (м, 2H), 7,51-7,36 (м, 1H), 3,92-3,57 (м, 4H), 2,96-2,81 (м, 3H), 1,50-1,37 (с, 9H), 1,20-1,11 (м, 3H); ESIMS m/z 394 ([M+H]+).
Следующие соединения получали в соответствии с методиками, раскрытыми в примере 168:
трет-Бутил(2-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(метил)амино)-2-оксоэтил)(метил)карбамат: 1H ЯМР (400 МГц, CDCl3) δ 8,95 (д, J=2,5 Гц, 1H), 8,62 (д, J=4,8 Гц, 1H), 8,14-7,84 (м, 2H), 7,59-7,35 (м, 1H), 3,85 (д, J=25,9 Гц, 2H), 3,31-3,15 (м, 3H), 2,99-2,81 (м, 3H), 1,53-1,31 (с, 9H).
трет-Бутил(2-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(циклопропилметил)амино)-2-оксоэтил)(метил)карбамат: ИК (тонкая пленка) 1675 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,95 (уш. с, 1H), 8,63 (дд, J=5,1 Гц, 1H), 8,17-7,88 (м, 2H), 7,54-7,36 (м, 1H), 3,99-3,41 (м, 4H), 2,97-2,82 (м, 3H), 1,44 (с, 9H), 1,12-0,83 (м, 1H), 0,59-0,39 (м, 2H), 0,28-0,08 (м, 2H); ESIMS m/z 420 ([M+H]+).
Пример 169: Получение N-(3-хлор-1-пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-(метиламино)ацетамида
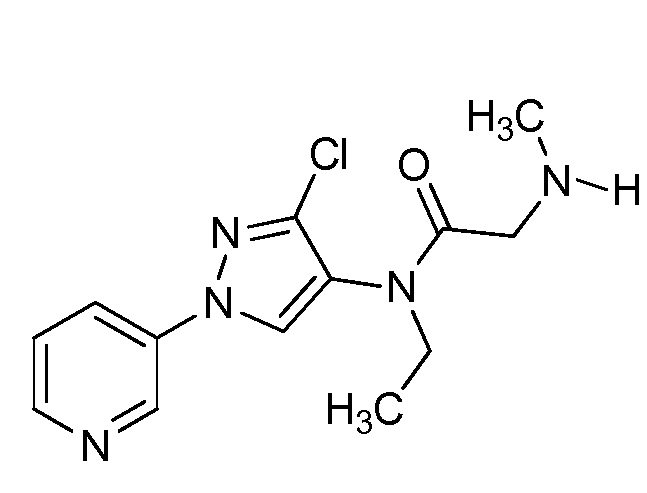
К раствору трет-бутил(2-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)амино)-2-оксоэтил)(метил)карбамата (0,57 г, 1,44 ммоль) в CH2Cl2 (1,44 мл) добавляли трифторуксусную кислоту (1,44 мл) и перемешивали реакционную смесь при комнатной температуре в течение 1 часа. Добавляли толуол и концентрировали реакционную смесь почти досуха. Смесь вливали в делительную воронку с насыщенным водным NaHCO3 и экстрагировали CH2Cl2. CH2Cl2 слои объединяли и концентрировали досуха. Неочищенный продукт очищали методом хроматографии на силикагеле, элюируя 0-15% метанолом в CH2Cl2, с получением целевого продукта в виде желтого масла (0,31 г, 73%): ИК (тонкая пленка) 1666 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,98 (д, J=2,6 Гц, 1H), 8,63 (дд, J=4,7, 1,3 Гц, 1H), 8,06 (м, 2H), 7,47 (дд, J=8,3, 4,8 Гц, 1H), 3,72 (кв., J=7,1 Гц, 2H), 3,30 (с, 2H), 2,48 (с, 3H), 1,17 (т, J=7,2 Гц, 3H); ESIMS m/z 294 ([M+H]+).
Следующие соединения получали в соответствии с методиками, раскрытыми в примере 169:
N-(3-Хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-метил-2-(метиламино)ацетамид: ИК (тонкая пленка) 1666 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,96 (д, J=2,6 Гц, 1H), 8,64 (дд, J=4,8, 1,3 Гц, 1H), 8,11-7,94 (м, 2H), 7,47 (дд, J=8,4, 4,4 Гц, 1H), 3,30 (с, 2H), 3,27 (с, 3H), 2,47(с, 3H); ESIMS m/z 280 ([M+H]+).
N-(3-Хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-(циклопропилметил)-2-(метиламино)ацетамид: ИК (тонкая пленка) 1667 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,98 (д, J=2,6 Гц, 1H), 8,63 (дд, J=4,7, 1,3 Гц, 1H), 8,11 (с, 1H), 8,06 (ддд, J=8,3, 2,7, 1,4 Гц, 1H), 7,47 (дд, J=8,3, 4,8 Гц, 1H), 3,53 (уш. с, 2H), 3,27 (уш. с, 2H), 2,49 (с, 3H), 1,02-0,91 (м, 1H), 0,55-0,44 (м, 2H), 0,22-0,15 (м, 2H); ESIMS m/z 320 ([M+H]+).
Пример 170: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-(N-метилметилсульфонамидо)ацетамида (соединение 800)
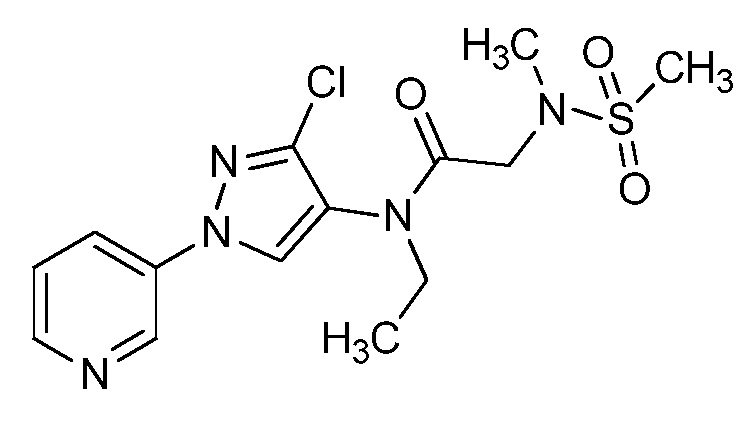
К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-(метиламино)ацетамида (0,10 г, 0,34 ммоль) в CH2Cl2 (0,68 мл) добавляли метансульфонилхлорид (0,06 г, 0,51 ммоль), а затем диизопропилэтиламин (0,12 мл, 0,68 ммоль), и перемешивали реакционную смесь в течение ночи при комнатной температуре. Реакционную смесь вливали в насыщенный водный NaHCO3 и экстрагировали CH2Cl2. CH2Cl2 слои объединяли и концентрировали досуха. Неочищенный продукт очищали методом хроматографии на силикагеле, элюируя 50-100% этилацетатом в гексанах, с получением целевого продукта в виде белого полутвердого вещества (81 мг, 64%).
Пример 171: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-((3,3,3-трифторпропил)сульфинил)пропанамида (соединение 861)
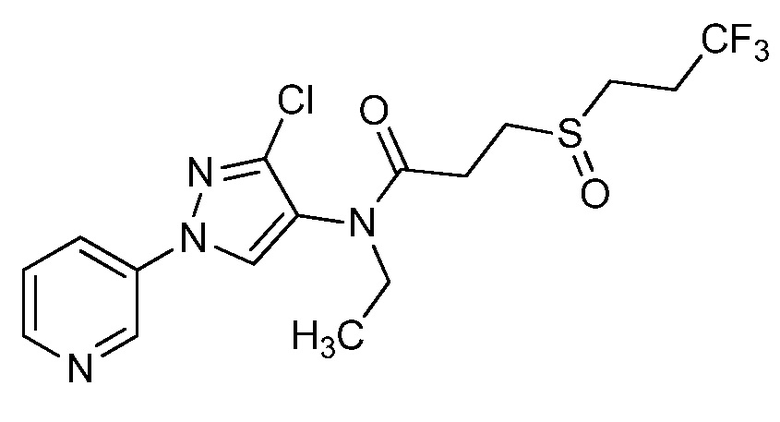
Способ A: К N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-((3,3,3-трифторпропил)тио)пропанамиду (0,17 г, 0,43 ммоль) в ледяной уксусной кислоте (4,35 мл) добавляли тетрагидрат пербората натрия (0,07 г, 0,45 ммоль) и нагревали смесь при 55°C в течение 1 часа. Реакционную смесь осторожно вливали в делительную воронку с насыщенным водным NaHCO3, что приводило к выделению газа. После завершения выделения газа добавляли этилацетат, и разделяли слои. Водный слой дважды экстрагировали этилацетатом, органические слои объединяли, сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления. Неочищенное вещество очищали методом хроматографии на силикагеле, элюируя 0-5% метанолом в CH2Cl2, с получением целевого продукта в виде темного масла (60 мг, 33%).
Способ B: К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-((3,3,3-трифторпропил)тио)пропанамида (500 мг, 1,229 ммоль) в гексафторизопропаноле (5 мл) при перемешивании при комнатной температуре добавляли 30% пероксид водорода (523 мг, 4,92 ммоль). Раствор перемешивали при комнатной температуре в течение 15 мин. Смесь гасили добавлением насыщенного раствора сульфита натрия и экстрагировали CH2Cl2. Методом хроматографии на силикагеле (0-10% MeOH в CH2Cl2) получали указанное в заголовке соединение в виде белого полутвердого вещества (495 мг, 95%).
Пример 172: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-(метиламино)пропанамида
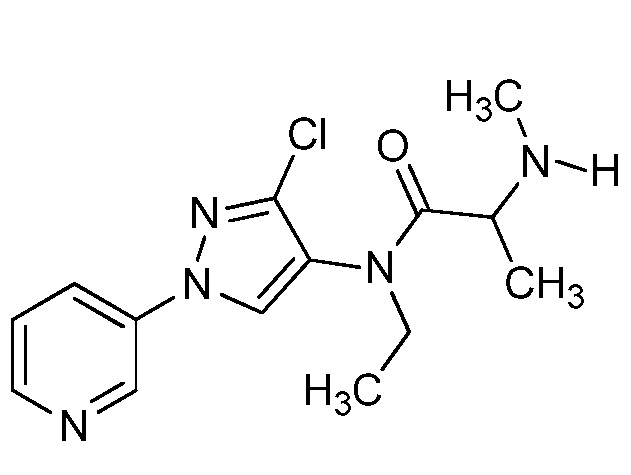
2-Хлор-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этилпропанамид (0,51 г, 1,62 ммоль) и метиламин (4,05 мл, 32,6 ммоль, 33% в этаноле) помещали на 45 минут при 100°C в пробирке емкостью 25 мл в микроволновой реактор Biotage® Initiator с внешним ИК-датчиком для мониторинга температуры с боковой стенки сосуда. Реакционную смесь концентрировали досуха и очищали методом хроматографии на силикагеле (0-10% метанол в CH2Cl2) с получением целевого продукта в виде желтого твердого вещества (0,21 г, 43%): 1H ЯМР (400 МГц, CDCl3) δ 8,96 (д, J=2,6 Гц, 1H), 8,64 (дд, J=4,7, 1,3 Гц, 1H), 8,06 (ддд, J=8,3, 2,7, 1,4 Гц, 1H), 7,98 (с, 1H), 7,47 (дд, J=8,3, 4,8 Гц, 1H), 3,93-3,57 (м, 2H), 3,25-3,11 (м, 1H), 2,34 (с, 3H), 1,21-1,17 (м, 6H).
Следующее соединение получали в соответствии с методиками, раскрытыми в примере 172:
N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-(метиламино)пропанамид
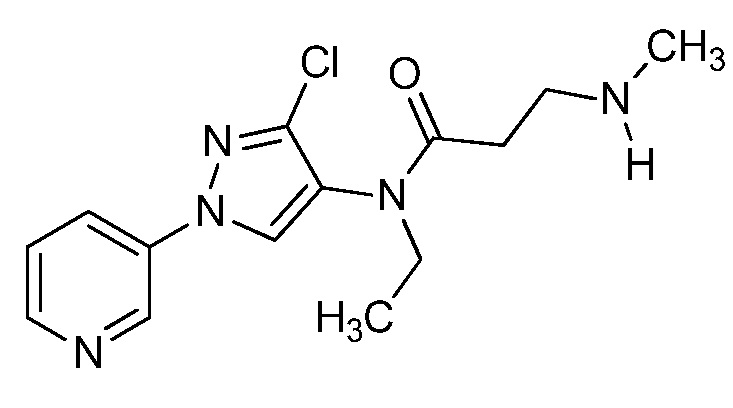
1H ЯМР (400 МГц, Ацетон) δ 9,12 (дд, J=6,7, 2,6 Гц, 1H), 8,90 (с, 1H), 8,58 (дд, J=4,7, 1,4 Гц, 1H), 8,25 (м, 1H), 7,56 (м, 1H), 3,67 (кв., J=7,1 Гц, 2H), 3,01 (т, J=6,5 Гц, 2H), 2,66 (т, J=6,4 Гц, 2H), 2,50 (с, 3H), 1,12 (т, J=7,2 Гц, 3H); LC/MS (ESI) m/z 308,4 ([M+H]+); ИК (KBr тонкая пленка) 3055, 2971, 2773, 1656 см-1.
Пример 173: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-(2-метоксиэтокси)ацетамид (соединение Y2195)
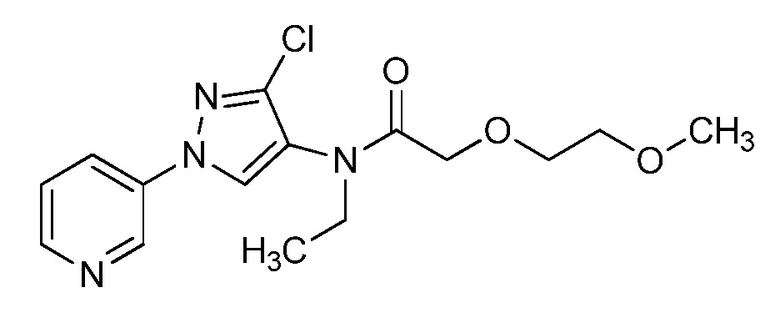
К перемешанному раствору 2-метоксиэтанола (0,07 мл, 0,87 ммоль) в THF (4 мл) при 0°C добавляли гидрид натрия (0,032 г, 0,80 ммоль, 60% дисперсия в масле). После перемешивания в течение 10 мин одной порцией добавляли 2-хлор-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этилацетамид (0,2 г, 0,7 ммоль). Реакционную смесь перемешивали в течение 20 минут, затем реакционный сосуд удаляли с бани со льдом, оставляли нагреваться до комнатной температуры и перемешивали в течение ночи (~16 ч), после чего реакция считалась завершенной согласно методу TLC. Реакционную смесь разбавляли водой и этилацетатом, и разделяли слои. Водный слой однократно экстрагировали этилацетатом. Объединенные органические слои сушили над MgSO4, концентрировали в условиях пониженного давления, и очищали методом флэш-хроматографии (SiO2, 100-200 меш; элюирование 0-20% метанолом в CH2Cl2) с получением указанного в заголовке соединения в виде рыжеватого твердого вещества (0,045 г, 20%).
Пример 174: Получение N-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(метил)карбамоил)-N-этилпиваламид (соединение Y2082)
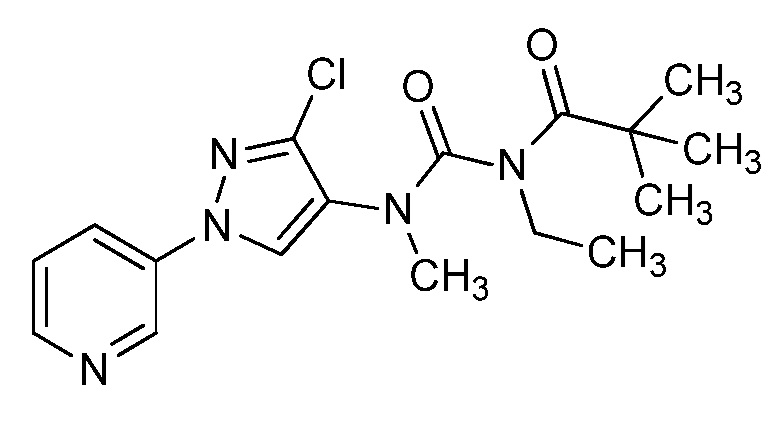
К раствору 1-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-этил-1-метилмочевины (0,075 г, 0,268 ммоль) в THF (2,68 мл) при -78°C добавляли 1M бис(триметилсилил)амид лития (LiHMDS) (0,282 мл, 0,282 ммоль) в толуоле. Реакционную смесь перемешивали при -78°C в течение 15 мин, добавляли пивалоилхлорид (0,036 мл, 0,295 ммоль) и перемешивали реакционную смесь при -78°C в течение 10 мин и при комнатной температуре в течение 30 мин. Добавляли солевой раствор и экстрагировали реакционную смесь EtOAc. Объединенные органические фазы концентрировали и очищали методом флэш-хроматографии (0-15% MeOH в CH2Cl2) с получением указанного в заголовке соединения в виде желтого масла (54 мг, 55%): ИК (тонкая пленка) 2969, 1681 см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,93 (д, J=2,5 Гц, 1H), 8,61 (дд, J=4,7, 1,3 Гц, 1H), 8,06 (с, 1H), 8,00 (ддд, J=8,3, 2,6, 1,4 Гц, 1H), 7,44 (дд, J=8,3, 4,7 Гц, 1H), 3,58 (кв., J=7,0 Гц, 2H), 3,35 (с, 3H), 1,25-1,13 (м, 12H); ESIMS m/z 365 ([M+H]+).
Пример 175: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-(метилтио)пропанимидамид (соединение 706)
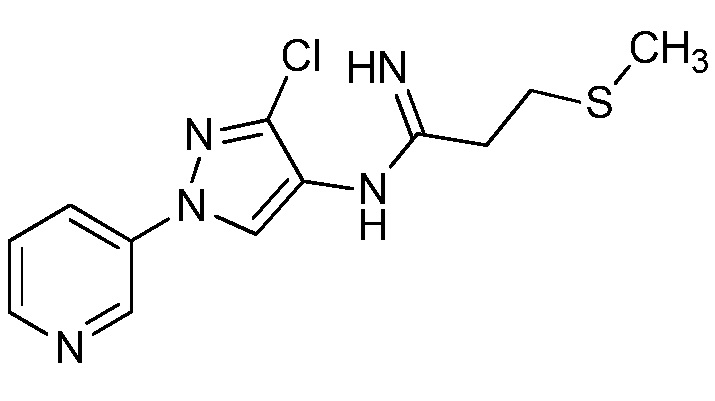
К раствору 3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-амина (0,058 г, 0,297 ммоль) в EtOH (0,992 мл) добавляли гидробромид нафталин-2-илметил-3-(метилтио)пропанимидотиоата (0,106 г, 0,297 ммоль). Реакционную смесь перемешивали при 0°C в течение 1 часа. Растворитель удаляли в условиях пониженного давления, и добавляли воду и Et2O. Фазы разделяли, и концентрировали водную фазу с получением неочищенной смеси. Остаток растворяли в MeOH (1 мл), и добавляли MP-карбонат (0,281 г, 0,892 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь фильтровали, концентрировали и очищали методом флэш-хроматографии (0-15% MeOH в гексанах) с получением указанного в заголовке соединения в виде светло-коричневого твердого вещества (32 мг, 31%): т.пл. 137°C; 1H ЯМР (300 МГц, CDCl3) δ 8,86 (д, J=2,6 Гц, 1H), 8,49 (дд, J=4,8, 1,2 Гц, 1H), 7,95 (ддд, J=8,3, 2,5, 1,3 Гц, 1H), 7,68 (с, 1H), 7,37 (дд, J=8,3, 4,8 Гц, 1H), 5,29 (уш. с, 2H), 3,02-2,73 (м, 2H), 2,64 (т, J=7,1 Гц, 2H), 2,18 (с, 3H); ESIMS m/z 297 ([M+H]+).
Пример 176: Получение гидробромида нафталин-2-илметил-3-(метилтио)пропанимидотиоата
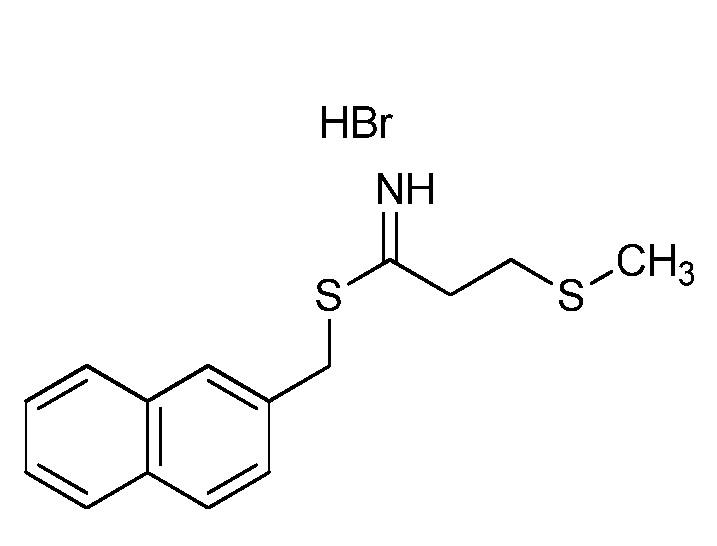
К раствору 3-(метилтио)пропантиоамида (0,062 г, 0,458 ммоль) в CHCl3 (1,146 мл) добавляли 2-(бромметил)нафталин (0,101 г, 0,458 ммоль). Смесь нагревали с обратным холодильником в течение 1,5 часов. Реакционную смесь охлаждали до комнатной температуры, добавляли Et2O, и образовывался осадок. Растворитель удаляли в условиях пониженного давления. Et2O добавляли, а затем декантировали. Оставшееся твердое вещество сушили в условиях пониженного давления с получением указанного в заголовке соединения в виде тускло-желтого твердого вещества (109 мг, 67%): 1H ЯМР (300 МГц, ДМСО-d6) δ 11,78 (уш. с, 1H), 8,00 (с, 1H), 7,98-7,85 (м, 3H), 7,59-7,49 (м, 3H), 4,74 (с, 2H), 3,10 (т, J=7,1 Гц, 2H), 2,84 (т, J=7,2 Гц, 2H), 2,08 (с, 3H). Ссылка: Shearer, B. G. et al. Tetrahedron Letters 1997, 38, 179-182.
Гидробромид нафталин-2-илметил-N-метил-3-(метилтио)пропанимидотиоата получали в соответствии с методикой, раскрытой в примере 176, и выделяли в виде не совсем белого полутвердого вещества; 1H ЯМР (400 МГц, ДМСО-d6) δ 8,08 (с, 1H), 8,02-7,93 (м, 3H), 7,63-7,56 (м, 3H), 5,02 (с, 2H), 3,40-3,32 (м, 2H), 3,21 (с, 3H), 2,89-2,83 (м, 2H), 2,13 (с, 3H); ESIMS m/z 290 ([M+H]+).
Гидробромид нафталин-2-илметил-N-метилэтанимидотиоата получали в соответствии с методикой, раскрытой в примере 176, и выделяли в виде белого твердого вещества; 1H ЯМР (400 МГц, ДМСО-d6) δ 8,02 (с, 1H), 8,01-7,92 (м, 3H), 7,61-7,53 (м, 3H), 4,93 (с, 2H), 3,15 (д, J=1,1 Гц, 3H), 2,81 (д, J=1,1 Гц, 3H); ESIMS m/z 230 ([M+H]+).
Гидробромид нафталин-2-илметилэтанимидотиоата получали, как описано в Shearer, B. G. et al. Tetrahedron Letters 1997, 38, 179-182.
Гидробромид нафталин-2-илметил-циклопропанкарбимидотиоата получали в соответствии с методикой, раскрытой в примере 176, и выделяли в виде желтого твердого вещества; 1H ЯМР (400 МГц, ДМСО-d6) δ 11,58 (с, 1H), 8,01 (с, 1H), 7,99-7,88 (м, 3H), 7,59-7,51 (м, 3H), 4,77 (с, 2H), 2,42-2,29 (м, 1H), 1,46-1,37 (м, 2H), 1,36-1,29 (м, 2H); ESIMS m/z 242 ([M+H]+).
Пример 177: Получение этил-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N'-этил-N-метилкарбамимидотиоата (соединение Y2049)
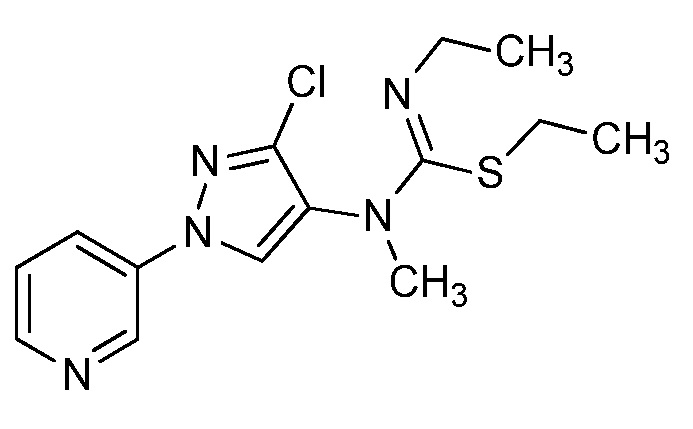
К раствору 1-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-этил-1-метилтиомочевины (0,085 г, 0,287 ммоль) в этаноле (1,916 мл) в толстостенной пробирке добавляли йодэтан (0,028 мл, 0,345 ммоль). Реакционную смесь нагревали при 80°C в течение 6 часов с микроволновом реакторе (CEM Discover®) с внешним ИК-датчиком для мониторинга температуры со дна сосуда. Реакционную смесь концентрировали и очищали методом флэш-хроматографии (0-100% EtOAc в гексанах) с получением указанного в заголовке соединения в виде желтого масла (56 мг, 57%): ИК (тонкая пленка) 3050, 2931, 1583 см-1; 1H ЯМР (300 МГц, CDCl3) δ 9,05 (д, J=2,6 Гц, 1H), 8,91 (с, 1H), 8,59-8,48 (м, 1H), 8,13-8,04 (м, 1H), 7,40 (дд, J=8,4, 4,8 Гц, 1H), 3,81 (кв., J=7,2 Гц, 2H), 3,73 (с, 3H), 2,95 (кв., J=14,1, 7,0 Гц, 2H), 1,44-1,28 (м, 6H); ESIMS m/z 325 ([M+H]+).
Пример 178: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-(N-метил-N-(3,3,3-трифторпропил)сульфамоил)пропанамида (соединение 965)
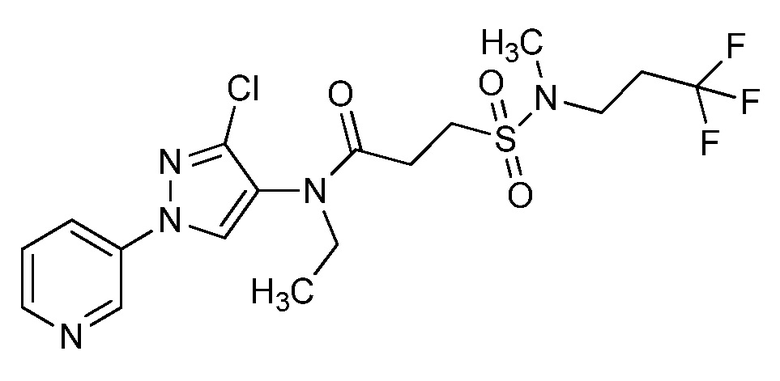
К перемешанному раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-меркаптопропанамида (200 мг, 0,64 ммоль), хлорида тетрабутиламмония (715 мг, 2,57 ммоль) и воды (29 мг, 1,61 ммоль) в ацетонитриле (30 мл) при 0°C порциями в течение 3 мин добавляли 1-хлорпирролидин-2,5-дион (258 мг, 1,93 ммоль). После перемешивания в течение 1 часа добавляли 3,3,3-трифтор-N-метилпропан-1-амин (82 мг, 0,64 ммоль), и дополнительно перемешивали реакционную смесь в течение 14 часов при комнатной температуре. Смесь фильтровали и концентрировали в условиях вакуума с получением коричневого остатка. Путем очистки этого остатка на силикагеле, элюируя CH2Cl2 и метанолом, получали указанное в заголовке соединение в виде не совсем белого клейкого вещества (71 мг, 22%).
Пример 179: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-((1-хлор-2,2,2-трифторэтил)тио)-N-этилпропанамида (соединение 859)
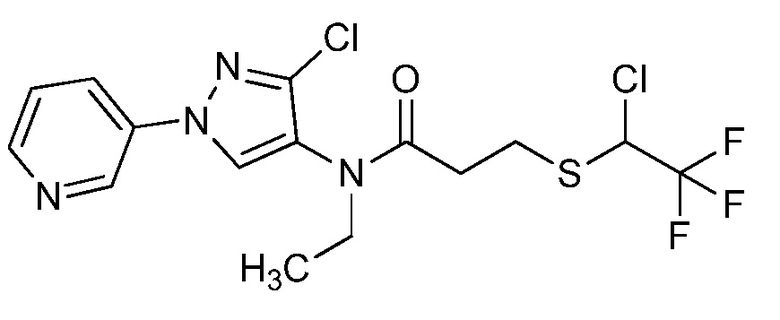
К суспензии N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-меркаптопропанамида (0,100 г, 0,322 ммоль), дитионита натрия (0,070 г, 0,338 ммоль) и бикарбоната натрия (0,028 г, 0,338 ммоль) в ДМСО (3,22 мл) при 40°C по каплям добавляли 2-бром-2-хлор-1,1,1-трифторэтан (0,079 г, 0,402 ммоль). Реакционную смесь перемешивали при той же температуре в течение 3 ч, после чего реакционную смесь охлаждали, вливали в воду (10 мл) и экстрагировали EtOAc (3×20 мл). Объединенные органические экстракты промывали водой (2×50 мл) и полунасыщенным солевым раствором (3×50 мл), а затем сушили над Na2SO4, фильтровали и концентрировали в условиях вакуума. Неочищенный остаток очищали методом прямофазной флэш-хроматографии (0-100% EtOAc в CH2Cl2) с получением целевого продукта в виде прозрачного вязкого масла (111 мг, 77%). Ссылка: Pustovit, et al., Synthesis, 2010, 7, 1159-1165.
Пример 180: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-((3-(мезитиламино)-3-оксопропил)тио)пропанамида (соединение 1024)
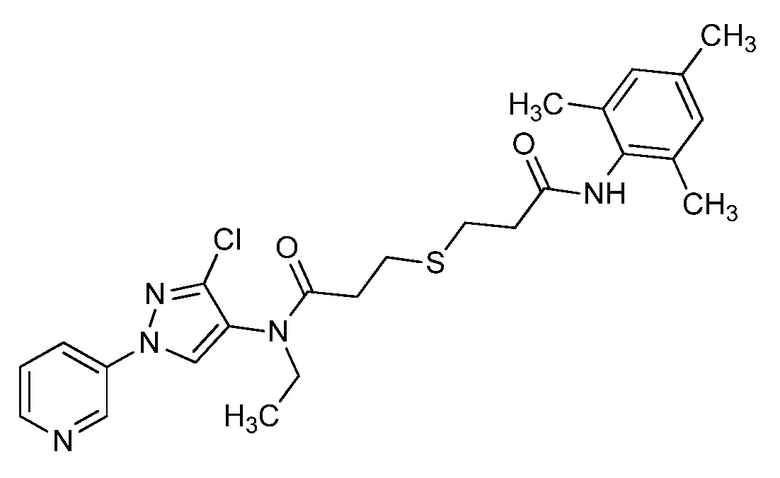
К перемешанному раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-меркаптопропанамида (0,20 г, 0,64 ммоль) в ацетонитриле (2,1 мл) добавляли 3-бром-N-мезитилпропанамид (0,17 г, 0,64 ммоль) и карбонат цезия (0,23 г, 0,70 ммоль), и перемешивали реакционную смесь в течение ночи при комнатной температуре. Реакционную смесь наносили непосредственно на целит и помещали в вакуумную печь на ночь при 25°C. Неочищенный продукт очищали методом хроматографии на силикагеле, элюируя 0-75% этилацетатом в гексанах, с получением целевого продукта в виде белого полутвердого вещества (226 мг, 53%).
Пример 181: Получение двух энантиомеров N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-3-((3,3,3-трифторпропил)сульфинил)пропанамида (соединения 1028 и 1029)
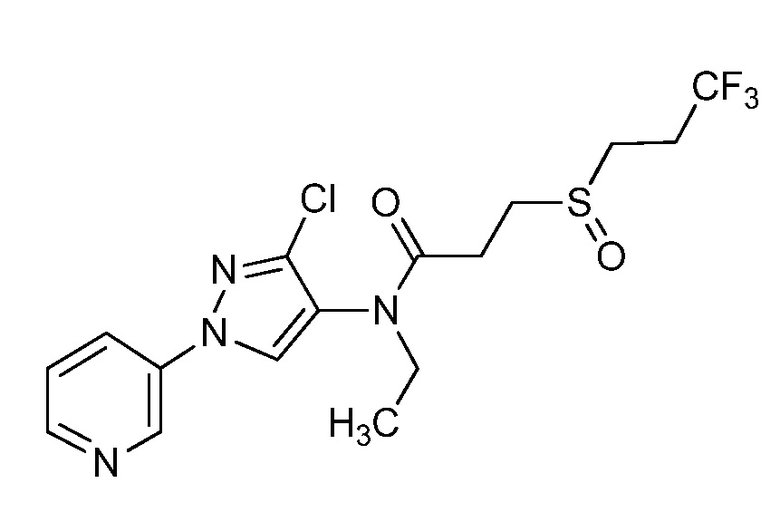
Два энантиомера указанного в заголовке соединения разделяли методом хиральной HPLC с использованием полупрепаративной колонки RegisCell™ (25 см×10,0 мм, 5 мкм) с использованием 0,1% TFA в гексане и изопропанола в качестве подвижной фазы (15-30% градиент IPA в гексане в течение 15 минут, затем поддержание до 20 минут) со скоростью потока 15 мл/мин при температуре окружающей среды. В указанных условиях соединение 1028 собирали со временем удерживания 6,0 мин и оптическим вращением [α]D30=+25,9 (c 0,27% в CDCl3). Соединение 1029 собирали со временем удерживания 7,5 мин и оптическим вращением [α]D30=-27,4 (c 0,27% в CDCl3). Данные охарактеризации указанных соединений представлены в таблице 2.
Пример 182: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-4,4,4-трифтор-N-метил-3-(метилсульфонил)бутанамида (соединение 714)
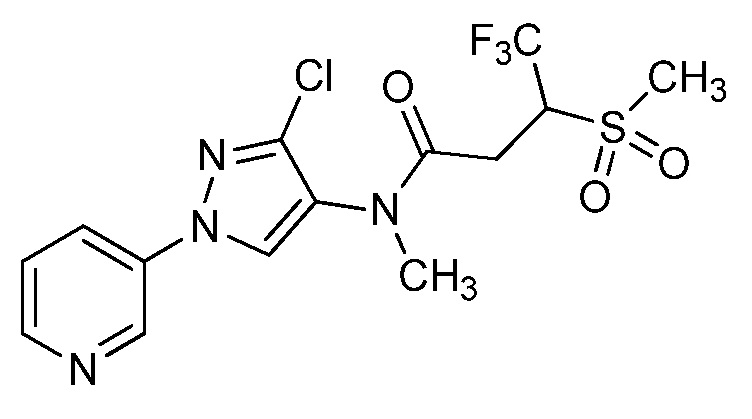
В пробирку емкостью 20 мл добавляли N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-4,4,4-трифтор-N-метил-3-(метилсульфинил)бутанамид (130 мг, 0,329 ммоль) и DCM (3 мл). Добавляли m-CPBA (83 мг, 0,362 ммоль) и перемешивали раствор при комнатной температуре в течение 3 часов. Реакционную смесь гасили добавлением раствора сульфита натрия, экстрагировали DCM и концентрировали. Путем очистки методом хроматографии на силикагеле (0-100% EtOAc в гексане) получали N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-4,4,4-трифтор-N-метил-3-(метилсульфонил)бутанамид в виде белого твердого вещества (25 мг, 18%).
Пример 183: Получение энантиомеров N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-метил-3-(метилсульфинил)пропанамида (соединения 804-807)
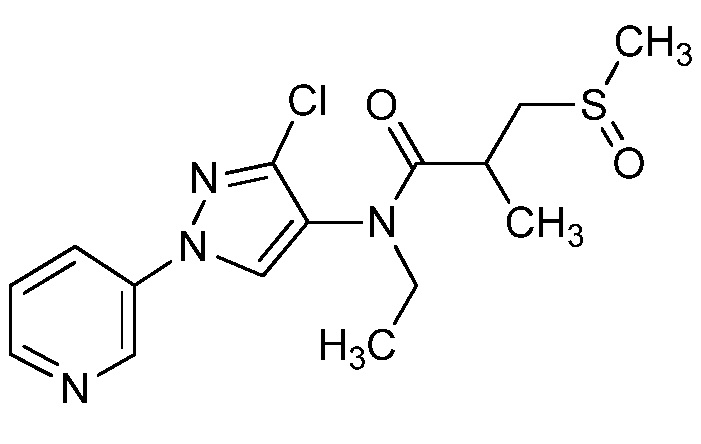
Четыре стереоизомера указанного в заголовке соединения разделяли методом хиральной HPLC с использованием колонки Chiralpak IC (30×250 мм) с использованием 0,2% TFA и 0,2% изопропиламина в гексане и изопропаноле в качестве подвижной фазы (25% IPA в гексане) при температуре окружающей среды. В указанных условиях соединение 804 собирали со временем удерживания 8,4 мин и оптическим вращением [α]D30=-43,8 (c 0,5% в CDCl3). Соединение 805 собирали со временем удерживания 11,9 минут и оптическим вращением [α]D30=+48,2 (c 0,5% в CDCl3). Соединение 806 собирали со временем удерживания 16,4 минут и оптическим вращением [α]D30=+113,4 (c 0,5% в CDCl3). Соединение 807 собирали со временем удерживания 20,6 минут и оптическим вращением [α]D30=-93,0 (c 0,5% в CDCl3). Данные охарактеризации указанных соединений представлены в таблице 2.
Пример 184: Получение 3-((3,3,3-трифторпропил)тио)пропаноилхлорида
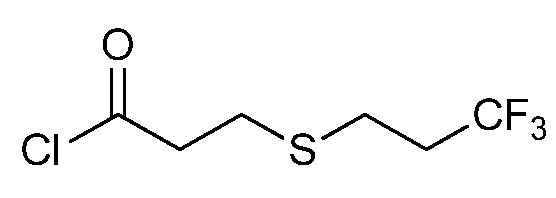
В сухую круглодонную колбу емкостью 5 л, оснащенную магнитной мешалкой, впуском азота, обратным холодильником и термометром, загружали 3-((3,3,3-трифторпропил)тио)пропановую кислоту (188 г, 883 ммоль) в дихлорметане (3 л). Затем по каплям в течение 50 минут добавляли тионилхлорид (525 г, 321 мл, 4,42 моль). Реакционную смесь нагревали с обратным холодильником (36°C) в течение 2 часов, а затем охлаждали до температуры окружающей среды. Путем концентрирования в условиях вакуума на роторном испарителе, а затем перегонки (40 торр, продукт собирали при 123-127°C), получали указанное в заголовке соединение в виде прозрачной бесцветной жидкости (177,3 г, 86%): 1H ЯМР (400 МГц, CDCl3) δ 3,20 (т, J=7,1 Гц, 2H), 2,86 (т, J=7,1 Гц, 2H), 2,78-2,67 (м, 2H), 2,48-2,31 (м, 2H); 19F ЯМР (376 МГц, CDCl3) δ -66,42, -66,43, -66,44, -66,44.
Пример 185: Получение 3-хлор-1-(5-хлорпиридин-3-ил)-1H-пиразол-4-амина
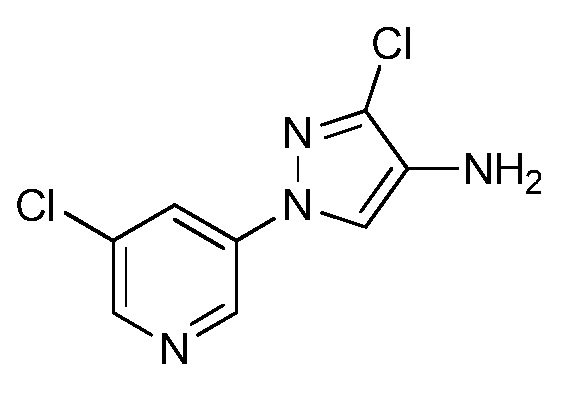
К раствору трет-бутил(3-хлор-1H-пиразол-4-ил)карбамата (5 г, 22,97 ммоль) в смеси DMF-H2O (9:1) (40 мл) добавляли йодид меди (0,13 г, 0,69 ммоль, 0,03 экв.), карбонат цезия (14,97 г, 45,9 ммоль), 8-гидроксихинолин (0,33 г, 2,30 ммоль) и 3-бром-5-хлорпиридин (5,29 г, 27,5 ммоль). Смесь нагревали при 140°C в атмосфере азота в течение 11 часов. Реакционную смесь охлаждали до комнатной температуры, гасили добавлением гидроксида аммония (15 мл), фильтровали через целит, и экстрагировали фильтрат этилацетатом (3×50 мл). Объединенный органический слой промывали солевым раствором (1×50 мл), сушили над безводным Na2SO4, фильтровали и упаривали досуха в условиях пониженного давления. Неочищенный продукт очищали на силикагеле с использованием 0-100% этилацетата в гексане в качестве элюента с получением указанного в заголовке соединения в виде темно-коричневого аморфного твердого вещества (1,35 г, 26%): 1H ЯМР (400 МГц, ДМСО-d6) δ 8,93 (д, J=2,24 Гц, 1H), 8,48 (д, J=2,00 Гц, 1H), 8,25 (т, J=2,16 Гц, 1H), 7,96 (с, 1H), 4,52 (уш. с, 2H); ESIMS m/z 231 ([M+2H]+).
Следующие соединения получали в соответствии с методиками, раскрытыми в примере 185:
1-(5-Бромпиридин-3-ил)-3-хлор-1H-пиразол-4-амин: ESIMS m/z 274 ([M+H]+).
3-Хлор-1-(5-метоксипиридин-3-ил)-1H-пиразол-4-амин: ESIMS m/z 225 ([M+H]+).
3-Хлор-1-(5-метилпиридин-3-ил)-1H-пиразол-4-амин: 1H ЯМР (400 МГц, ДМСО-d6, D2O): δ 8,68 (с, 1H), 8,27 (с, 1H), 7,86 (д, J=5,64 Гц, 2H), 2,34 (с, 3H); ESIMS m/z 209 ([M+H]+).
Пример 186: Получение трет-бутил(3-хлор-1-(5-хлорпиридин-3-ил)-1H-пиразол-4-ил)карбамата
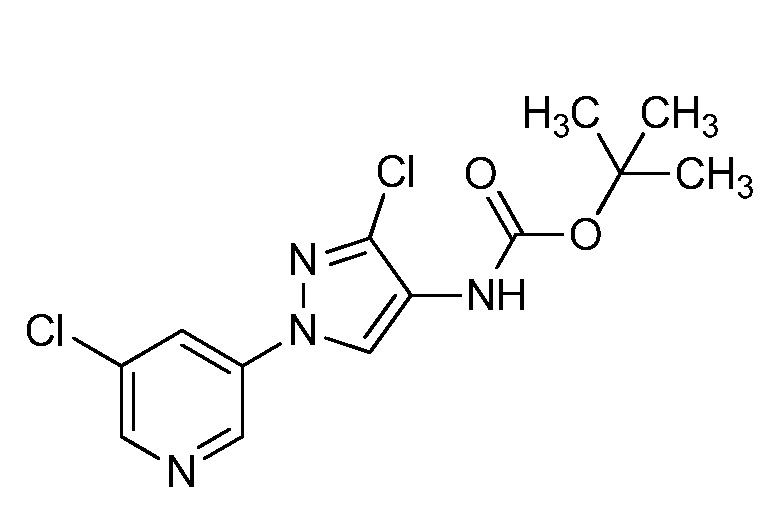
К раствору 3-хлор-1-(5-хлорпиридин-3-ил)-1H-пиразол-4-амина (1,00 г, 4,4 ммоль) и триэтиламина (666 мг, 6,6 ммоль) в безводном THF (10 мл) в течение 30 минут добавляли ди-трет-бутилдикарбоновый ангидрид (960 мг, 4,62 ммоль), и оставляли реакционную смесь перемешиваться при комнатной температуре в течение 18 часов. Реакционную смесь разбавляли водой (10 мл) и экстрагировали этилацетатом (50 мл×2). Органическую фазу промывали солевым раствором (10 мл), сушили над Na2SO4 и концентрировали в условиях пониженного давления. Путем очистки методом колоночной хроматографии на силикагеле с использованием гексанов в качестве элюента получали указанное в заголовке соединение (651 мг, 46%): ESIMS m/z 330 ([M+H]+).
Следующие соединения получали в соответствии с методиками, раскрытыми в примере 186:
трет-Бутил(1-(5-бромпиридин-3-ил)-3-хлор-1H-пиразол-4-ил)карбамат: ESIMS m/z 372 ([M+H]+).
трет-Бутил(3-хлор-1-(5-метилпиридин-3-ил)-1H-пиразол-4-ил)карбамат: ESIMS m/z 309 ([M+H]+).
Пример 187: Получение трет-бутил(3-хлор-1-(5-хлорпиридин-3-ил)-1H-пиразол-4-ил)(метил)карбамата
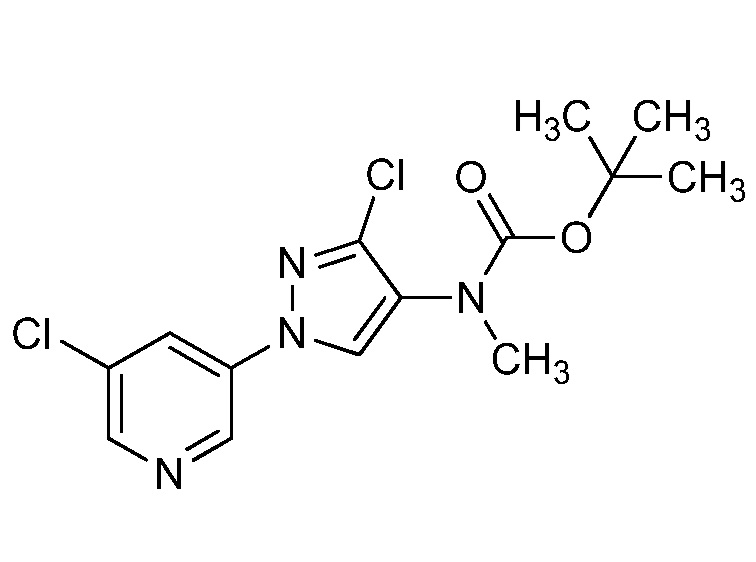
К раствору трет-бутил(3-хлор-1-(5-хлорпиридин-3-ил)-1H-пиразол-4-ил)карбамата (501 мг, 1,5 ммоль) в безводном THF (10 мл) добавляли трет-бутоксид калия (1,5 мл, 1M раствор в THF) и перемешивали реакционную смесь в течение 30 мин. При 0°C медленно добавляли метилйодид (317 мг, 2,25 ммоль) и дополнительно перемешивали в течение 18 часов при комнатной температуре. Смесь гасили добавлением насыщенного водного хлорида аммония и экстрагировали этилацетатом (2×20 мл). Объединенный органический экстракт промывали солевым раствором (1×20 мл), сушили над Na2SO4 и упаривали досуха в условиях пониженного давления. Неочищенный продукт очищали на силикагеле с использованием гексанов и этилацетата в качестве элюента (0-10%) с получением указанного в заголовке соединения (220 мг, 42%): ESIMS m/z 345 ([M+H]+).
Следующие соединения получали в соответствии с методиками, раскрытыми в примере 187:
трет-Бутил(1-(5-бромпиридин-3-ил)-3-хлор-1H-пиразол-4-ил)(метил)карбамат: ESIMS m/z 387 ([M+H]+).
трет-Бутил(3-хлор-1-(5-метилпиридин-3-ил)-1H-пиразол-4-ил)(метил)карбамат: ESIMS m/z 265 ([M-t-Bu]+).
Пример 188: Получение 3-хлор-1-(5-хлорпиридин-3-ил)-N-метил-1H-пиразол-4-амина
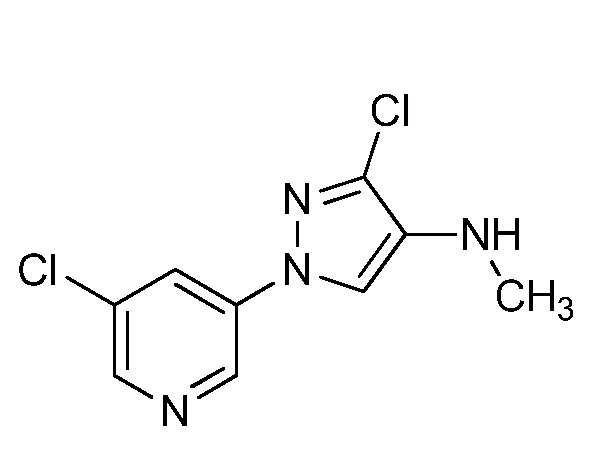
трет-Бутил(3-хлор-1-(5-хлорпиридин-3-ил)-1H-пиразол-4-ил)(метил)карбамат (343 мг, 1 ммоль, 1,0 экв.) растворяли в 1,4-диоксане (10 мл) и охлаждали раствор до 0°C. По каплям добавляли раствор HCl в диоксане (5 мл, 4M), смесь перемешивали в течение 2 часов, а затем концентрировали в условиях пониженного давления. Остаток разбавляли CH2Cl2 (50 мл), раствор промывали водным бикарбонатом натрия, водой (10 мл) и солевым раствором (10 мл). Органический слой сушили над Na2SO4 и концентрировали в условиях пониженного давления с получением указанного в заголовке соединения (148 мг, 61%): ESMS m/z 244 ([M+H]+).
Следующее соединение получали в соответствии с методиками, раскрытыми в примере 188:
1-(5-Бромпиридин-3-ил)-3-хлор-N-метил-1H-пиразол-4-амин: ESMS m/z 289 ([M+H]+).
Пример 189: Получение N-(3-хлор-1-(5-метоксипиридин-3-ил)-1H-пиразол-4-ил)-2,2,2-трифторацетамида
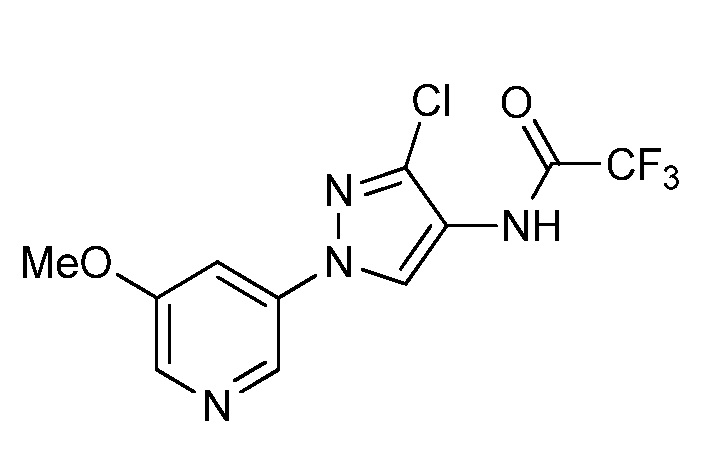
К раствору 3-хлор-1-(5-метоксипиридин-3-ил)-1H-пиразол-4-амина (1,0 г, 4,46 ммоль) и пиридина (530 мг, 6,69 ммоль) в безводном дихлорметане (10 мл) при 0°C по каплям добавляли трифторуксусный ангидрид (1,0 экв.). Реакционную смесь медленно нагревали до комнатной температуры и перемешивали в течение 4 часов. Реакционную смесь разбавляли водой (10 мл) и экстрагировали этилацетатом (2×50 мл). Органическую фазу промывали солевым раствором (10 мл), сушили над Na2SO4 и концентрировали в условиях пониженного давления. Неочищенный продукт очищали на силикагеле, элюируя гексанами и этилацетатом, с получением указанного в заголовке соединения (700 мг, 49%): ESIMS m/z 321 ([M+H]+).
Пример 190: Получение N-(3-хлор-1-(5-метоксипиридин-3-ил)-1H-пиразол-4-ил)-2,2,2-трифтор-N-метилацетамида
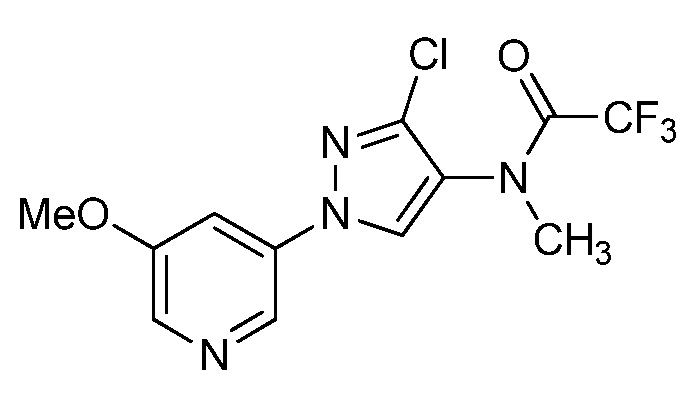
К раствору N-(3-хлор-1-(5-метоксипиридин-3-ил)-1H-пиразол-4-ил)-2,2,2-трифторацетамида (700 мг, 2,18 ммоль) в безводном THF (10 мл) при 0°C добавляли трет-бутоксид калия (1M раствор в THF, 0,32 мл, 3,2 ммоль) и перемешивали реакционную смесь в течение 30 мин. При 0°C медленно добавляли метилйодид (466 мг, 3,28 ммоль) и дополнительно перемешивали реакционную смесь в течение 18 часов при комнатной температуре. Реакционную смесь гасили добавлением насыщенного раствора хлорида аммония и экстрагировали этилацетатом (2×20 мл). Объединенный органический экстракт промывали солевым раствором (1×20 мл), сушили над Na2SO4 и упаривали досуха в условиях пониженного давления. Неочищенный продукт очищали на силикагеле, элюируя гексанами и этилацетатом (0-30%), с получением указанного в заголовке соединения (426 мг, выход 58%): ESIMS m/z 335 ([M+H]+).
Пример 191: Получение 3-хлор-1-(5-метоксипиридин-3-ил)-N-метил-1H-пиразол-4-амина
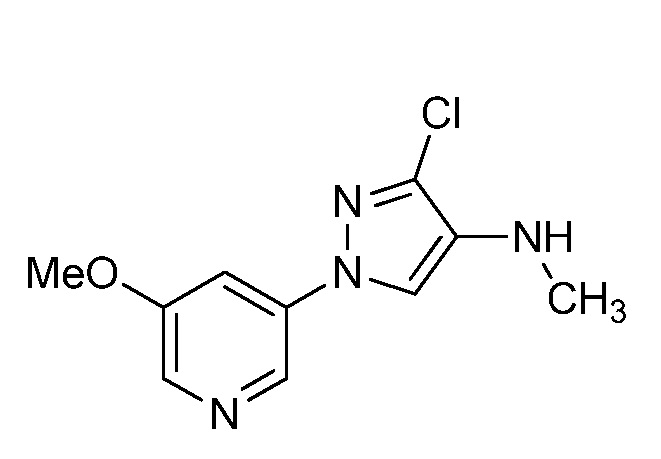
К суспензии N-(3-хлор-1-(5-метоксипиридин-3-ил)-1H-пиразол-4-ил)-2,2,2-трифтор-N-метилацетамида (410 мг, 1,23 ммоль) в метаноле (10 мл) добавляли K2CO3 (254 мг, 1,8 ммоль) и перемешивали смесь при комнатной температуре в течение 4 часов. Реакционную смесь концентрировали в условиях пониженного давления, остаток суспендировали в дихлорметане (50 мл) и промывали водой (10 мл) и солевым раствором (10 мл). Органический слой сушили над Na2SO4 и концентрировали в условиях пониженного давления с получением указанного в заголовке соединения (206 мг, 71%): ESIMS m/z 239 ([M+H]+).
Пример 192: Получение диэтил(2-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)амино)-2-оксоэтил)фосфоната
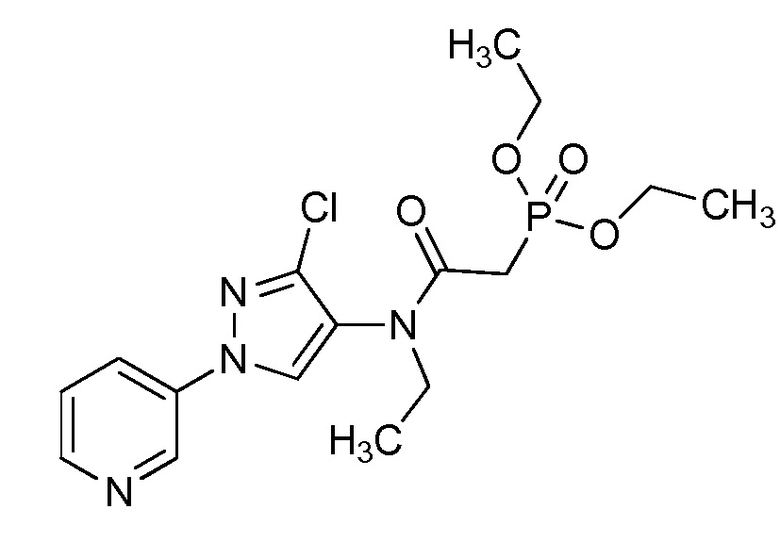
К раствору 3-хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амина (2,00 г, 8,98 ммоль), 2-(диэтоксифосфорил)уксусной кислоты (1,94 мг, 9,88 ммоль) и N,N-диметилпиридин-4-амина (2,20 г, 17,96 ммоль) в безводном DMF (10 мл) добавляли гидрохлорид N1-((этилимино)метилен)-N3,N3-диметилпропан-1,3-диамина (2,58 г, 13,47 ммоль), и перемешивали смесь при 0°C в течение 2 часов. Смесь разбавляли водой и экстрагировали этилацетатом (75 мл×2). Объединенный органический экстракт промывали насыщенным водным NH4Cl, нас. водным NaHCO3 и солевым раствором, сушили над MgSO4, фильтровали и концентрировали в условиях вакуума с получением коричневого осадка. Этот остаток очищали на силикагеле, элюируя CH2Cl2 и метанолом, с получением указанного в заголовке соединения в виде коричневого твердого вещества (2,62 г, 69%): т.пл. 46-48°C; 1H ЯМР (400 МГц, CDCl3) δ 9,00 (дд, J=2,7, 0,7 Гц, 1H), 8,62 (дд, J=4,7, 1,4 Гц, 1H), 8,35 (с, 1H), 8,03 (ддд, J=8,3, 2,7, 1,5 Гц, 1H), 7,44 (ддд, J=8,3, 4,8, 0,8 Гц, 1H), 4,28-4,02 (м, 4H), 3,79 (м, 2H), 2,89 (д, J=22,0 Гц, 2H), 1,40-1,22 (м, 6H), 1,17 (т, J=7,2 Гц, 3H); ESIMS m/z 401 [(M+H)+] 399 [(M-H)-].
Пример 193: Получение (E)-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-5,5,5-трифторпент-2-енамида (соединение Y2177)
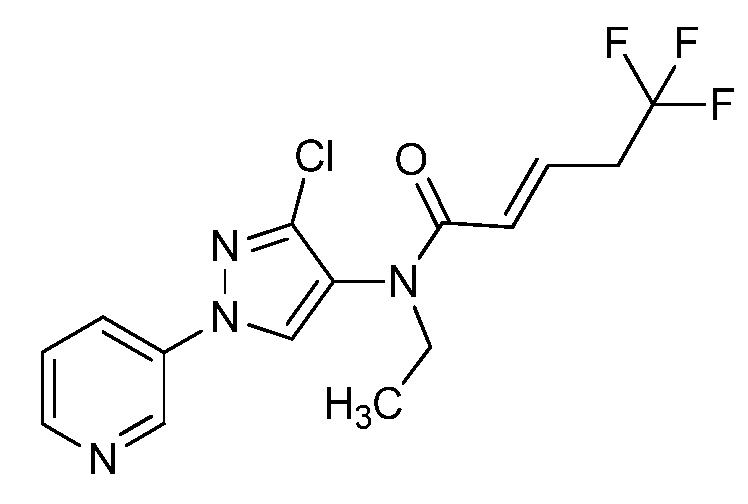
К раствору диэтил(2-((3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)(этил)амино)-2-оксоэтил)фосфоната (500 мг, 1,25 ммоль) в THF (4 мл) добавляли гидрид натрия (55 мг, 1,37 ммоль, 60% суспензия в масле) и перемешивали смесь при 0°C в течение 20 мин. Смесь охлаждали до -78°C, добавляли 3,3,3-трифторпропаналь (210 мг, 1,87 ммоль) и перемешивали реакционную смесь в течение 1 часа. Затем смесь нагревали до комнатной температуры и перемешивали при комнатной температуре в течение 2 часов. Дополнительно добавляли NaH (30 мг, 0,75 ммоль, 60% суспензия в масле) и перемешивали смесь при комнатной температуре в течение 0,5 ч. Смесь разбавляли водой и этилацетатом, органическую фазу разделяли, промывали солевым раствором, сушили над MgSO4 и концентрировали в условиях вакуума с получением коричневого маслянистого остатка. Этот остаток очищали на силикагеле, элюируя CH2Cl2 и метанолом, с получением указанного в заголовке соединения в виде светло-желтого клейкого вещества (230 мг, 51%).
Пример 194: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-((3,3-дифтораллил)тио)-N-этилпропанамида (соединение 918)
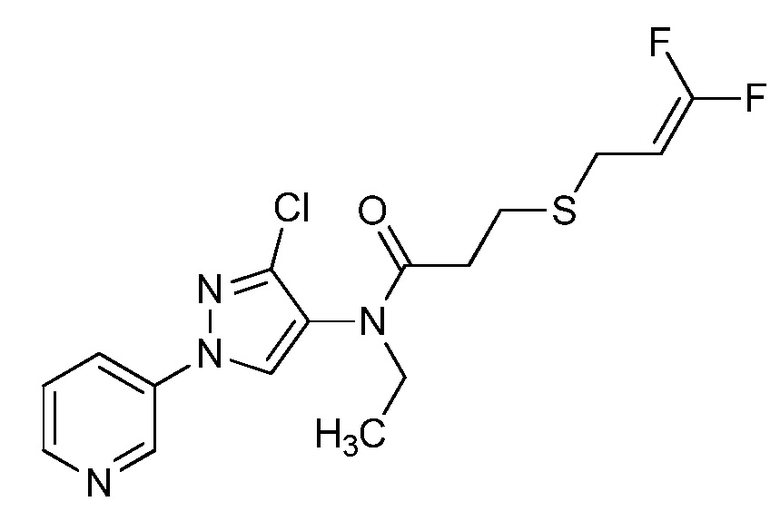
К раствору 3-((3-бром-3,3-дифторпропил)тио)-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этилпропанамида (100 мг, 0,21 ммоль) в диоксане (1 мл) добавляли 2,3,4,6,7,8,9,10-октагидропиримидо[1,2-a]азепин (32 мг, 0,21 ммоль), и перемешивали смесь при 120°C в течение 30 мин в микроволновом реакторе Biotage® Initiator с внешним ИК-датчиком для мониторинга температуры с боковой стенки сосуда. Смесь разбавляли этилацетатом, а затем промывали насыщенным водным хлоридом аммония и солевым раствором, сушили над MgSO4 и концентрировали в условиях вакуума с получением коричневого клейкого вещества. Это клейкое вещество очищали на силикагеле, элюируя хлористым метиленом и метанолом, с получением указанного в заголовке соединения в виде светло-желтого масла (76 мг, 92%).
Пример 195: Получение 1-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-3-этил-1,3-диметилмочевины (соединение Y2012)
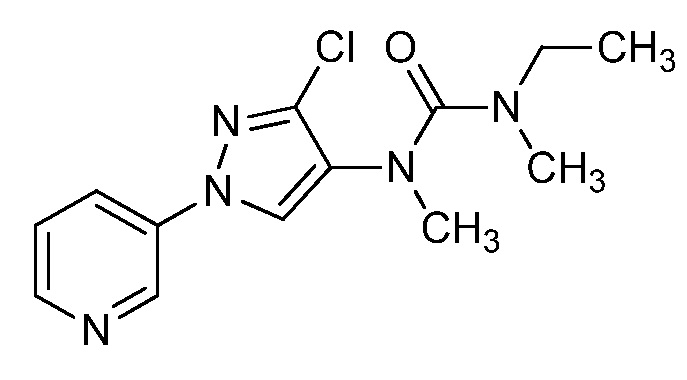
К раствору 3-хлор-N-метил-1-(пиридин-3-ил)-1H-пиразол-4-амина (0,100 г, 0,48 ммоль) в CH2Cl2 (1,9 мл) добавляли N-этил-N-изопропилпропан-2-амин (0,21 мл, 1,20 ммоль), а затем этил(метил)карбамилхлорид (0,117 г, 0,959 ммоль), и перемешивали реакционную смесь при температуре окружающей среды в течение 2 часов. Реакционную смесь гасили добавлением насыщенного бикарбоната натрия. Водный слой экстрагировали CH2Cl2. Объединенные органические слои сушили над сульфатом натрия, фильтровали, концентрировали в условиях вакуума и очищали методом колоночной хроматографии на силикагеле (0-100% этилацетат в гексанах) с получением указанного в заголовке соединения в виде желтого масла (57 мг, 36%).
Пример 196: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-(2,2,2-трифторэтокси)пропанамида (соединение Y2001)
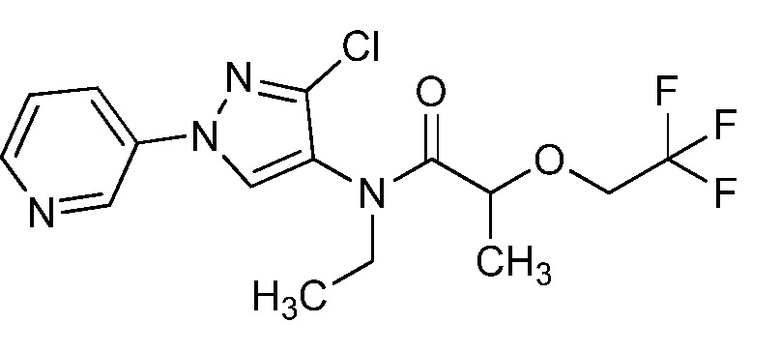
К раствору 2,2,2-трифторэтанола (128 мг, 1,3 ммоль) в DMF (1,3 мл) добавляли гидрид натрия (51,1 мг, 1,3 ммоль). Реакционную смесь перемешивали в течение 30 мин до момента, когда смесь становилась прозрачной и не наблюдалось выделение H2. К этому раствору добавляли 2-хлор-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этилпропанамид (200 мг, 0,64 ммоль) и перемешивали реакционную смесь при 50°C в течение ночи. Реакционную смесь разбавляли CH2Cl2 и промывали водой, фазы разделяли на сепараторе Biotage® Phase, а затем концентрировали. Остаток очищали методом хроматографии на силикагеле, элюируя 0-50% ацетоном в гексанах, с получением указанного в заголовке соединения в виде белого твердого вещества (156 мг, 64%).
Пример 197: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-((метилтио)метокси)пропанамида (соединение Y2199)

К раствору N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-N-этил-2-гидроксипропанамида (100 мг, 0,34 ммоль) в THF (1,1 мл) добавляли гидрид натрия (60% в минеральном масле, 33,9 мг, 0,85 ммоль). Смесь перемешивали в течение 15 мин, а затем добавляли (хлорметил)(метил)сульфан (33,6 мкл, 0,41 ммоль). После перемешивания при температуре окружающей среды в течение ночи реакционную смесь разбавляли CH2Cl2 и промывали водой. Фазы разделяли, сушили на Biotage® Phases Separator© и концентрировали в условиях вакуума. Остаток очищали методом хроматографии на силикагеле, элюируя 0-70% ацетоном в гексанах, с получением указанного в заголовке соединения в виде не совсем белого твердого вещества (73 мг, 63%).
Пример 198: Получение N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-2,2-дифтор-N-метил-2-(метилтио)ацетамида (соединение Y2021)
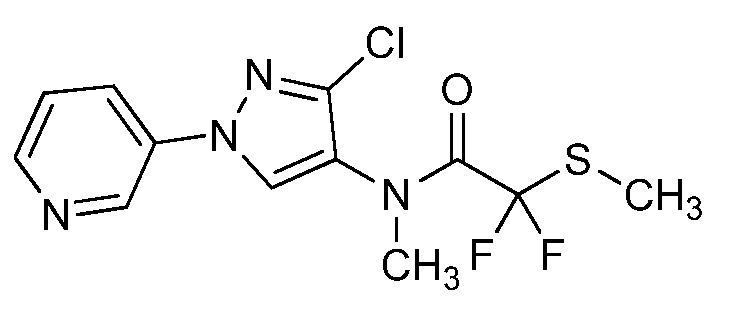
К раствору 2-бром-N-(3-хлор-1-(пиридин-3-ил)-1H-пиразол-4-ил)-2,2-дифтор-N-метилацетамида (250 мг, 0,684 ммоль) в ДМСО (2,3 мл) добавляли метантиолят натрия (96 мг, 1,37 ммоль). Реакционную смесь нагревали до 50°C в течение 3 ч, а затем разбавляли водой и экстрагировали CH2Cl2. Органические фазы сушили с MgSO4, фильтровали и концентрировали в условиях вакуума. Остаток очищали методом хроматографии на силикагеле, элюируя 0-80% ацетоном в гексанах, с получением указанного в заголовке соединения в виде красного масла (188 мг, 83%).
Пример 199: Получение 3-хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амина
В круглодонную колбу емкостью 100 мл загружали бисгидрохлорид 3-хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амина (2 г, 6,77 ммоль), добавляли DCM (20 мл) и перемешивали суспензию при комнатной температуре. К этой суспензии медленно добавляли насыщенный раствор NaHCO3 до момента, когда выделение газа останавливалось, а водный слой становился щелочным. Смесь наносили на делительную воронку, органический слой разделяли, и экстрагировали водный слой DCM (2×10 мл). Объединенные DCM слои сушили и концентрировали с получением указанного в заголовке соединения в виде не совсем белого твердого вещества (1,41 г, 94%). Аналитические данные для 3-хлор-N-этил-1-(пиридин-3-ил)-1H-пиразол-4-амина могут быть найдены в примере 8.
Пример A: Биотестирование на тле персиковой зеленой (GPA) (Myzus persicae) (MYZUPE)
GPA является наиболее серьезным тлевым вредителем персиковых деревьев, вызывающим снижение роста, увядание листьев и отмирание различных тканей. Она также опасна, поскольку действует как вектор для переноса вирусов растений, таких как Y-вирус картофеля и вирус скручивания листьев картофеля, членам семейства пасленовых/картофельных Solanaceae, а также различных вирусов мозаики многим другим продовольственным культурам. Наряду с другими растениями, GPA нападает на такие растения, как брокколи, репейник, капуста, морковь, цветная капуста, дайкон, баклажан, овощная фасоль, латук, макадамия, папайя, перцы, бататы, томаты, кресс водяной и цукини. GPA также нападает на многие декоративные культуры, такие как гвоздика, хризантема, цветковая белокочанная капуста, пуансеттия и розы. У GPA выработалась устойчивость ко многим пестицидам.
Некоторые молекулы, раскрытые в настоящем документе, тестировали против GPA с использованием методик, описанных в следующем примере. Для представления результатов использовали «Таблицу 3: Оценочная таблица GPA (MYZUPE) и гусеницы белокрылки бататовой (BEMITA)» (см. раздел «Таблицы»).
В качестве экспериментального субстрата использовали выращиваемые в 3-дюймовых горшках проростки капусты с 2-3 небольшими (3-5 см) настоящими листьями. Проростки заражали 20-50 GPA (бескрылой взрослой и личиночной стадиями) за один день до применения химических соединений. Для каждой обработки использовали четыре горшка с отдельными проростками. Тестируемые соединения (2 мг) растворяли в 2 мл ацетона/метанола (1/1), получая исходные растворы, содержащие 1000 м.д. тестируемого соединения. Исходные растворы разбавляли в 5 раз 0,025% Tween 20 в H2O с получением раствора, содержащего 200 м.д. тестируемого соединения. Использовали ручной опрыскиватель аспирационного типа для распыления раствора на обеих сторонах листьев капусты до стекания. Контрольные растения (контроль с растворителем) опрыскивали только растворителем, содержащим 20 об.% ацетона/метанола (1/1). До выставления оценки обработанные растения содержали в помещении для временного содержания в течение трех суток приблизительно при 25°C и относительной влажности (RH) окружающей среды. Оценку проводили с помощью подсчета числа живых тлей на растение под микроскопом. Контроль (%) измеряли с использованием следующей поправочной формулы Эббота (W.S. Abbott, “A Method of Computing the Effectiveness of an Insecticide” J. Econ. Entomol. 18 (1925), pp. 265-267) следующим образом:
исправленный контроль (%)=100 * (X-Y)/X,
где X=число живых тлей на контрольных обработанных растворителем растениях, и Y=число живых тлей на обработанных растениях.
Результаты представлены в таблице под названием «Таблица 4. Биологические данные для GPA (MYZUPE) и гусеницы белокрылки бататовой (BEMITA)» (см. раздел «Таблицы»).
Пример B: Инсектицидный тест для гусеницы белокрылки бататовой (Bemisia tabaci) (BEMITA) в анализе с опрыскиванием листьев
В качестве экспериментального субстрата использовали выращиваемые в 3-дюймовых горшках растения хлопчатника с 1 небольшим (3-5 см) настоящим листком. Растения помещали в помещение с взрослыми белокрылками. Взрослым особям позволяли откладывать яйца в течение 2-3 суток. После 2-3-суточного периода яйцекладки растения забирали из помещения с взрослыми белокрылками. Взрослых особей сдували с листьев с использованием ручного опрыскивателя Devilbiss (23 фунта на квадратный дюйм). Зараженные яйцами растения (100-300 яиц на растение) помещали в помещение для временного содержания на 5-6 дней при 82°F и 50% RH для выведения из яиц и развития стадии гусеницы. Для каждой обработки использовали четыре растения хлопчатника. Соединения (2 мг) растворяли в 1 мл ацетона, получая маточные растворы, содержащие 2000 м.д. соединения. Маточные растворы разбавляли в 10 раз 0,025% Tween 20 в H2O с получением тестового раствора, содержащего 200 м.д. соединения. Использовали ручной опрыскиватель Devilbiss для распыления раствора на обеих сторонах листка хлопчатника до стекания. Контрольные растения (контроль с растворителем) опрыскивали только растворителем. До выставления оценки обработанные растения содержали в помещении для временного содержания в течение 8-9 суток приблизительно при 82°F и 50% RH. Оценку проводили с помощью подсчета числа живых личинок на растение под микроскопом. Инсектицидную активность измеряли с использованием поправочной формулы Эббота и представляли в «Таблице 4. Биологические данные для GPA (MYZUPE) и гусеницы белокрылки бататовой (BEMITA)» (см. колонку «BEMITA»):
исправленный контроль (%)=100 * (X-Y)/X,
где X=число живых личинок на контрольных обработанных растворителем растениях, Y=число живых личинок на обработанных растениях.
ПЕСТИЦИДНО ПРИЕМЛЕМЫЕ КИСЛОТНО-АДДИТИВНЫЕ СОЛИ, ПРОИЗВОДНЫЕ СОЛЕЙ, СОЛЬВАТЫ, СЛОЖНОЭФИРНЫЕ ПРОИЗВОДНЫЕ, ПОЛИМОРФЫ, ИЗОТОПЫ И РАДИОНУКЛИДЫ
Молекулы формулы 1 могут быть представлены в виде приемлемых для пестицидов кислотно-аддитивных солей. В качестве неограничивающего примера функциональная аминогруппа может образовывать соли соляной, бромистоводородной, серной, фосфорной, уксусной, бензойной, лимонной, малоновой, салициловой, яблочной, фумаровой, щавелевой, янтарной, винной, молочной, глюконовой, аскорбиновой, малеиновой, аспарагиновой, бензолсульфоновой, метансульфоновой, этансульфоновой, гидроксиметансульфоновой и гидроксиэтансульфоновой кислот. Дополнительно, в качестве неограничивающего примера, кислотная функциональная группа может образовывать соли, включая соли щелочных или щелочноземельных металлов, и соли аммония и аминов. Примеры предпочтительных катионов включают натрий, калий и магний.
Молекулы формулы 1 могут быть преобразованы в производные солей. В качестве неограничивающего примера, производные солей могут быть получены путем приведения свободного основания в контакт с достаточным количеством нужной кислоты с получением соли. Свободное основание может быть восстановлено путем обработки соли подходящим разбавленным водным раствором основания, таким как разбавленный водный гидроксид натрия (NaOH), карбонат калия, аммиак и бикарбонат натрия. В качестве примера, во многих случаях пестицид, такой как 2,4-D, делают более растворимым в воде путем его преобразования до его соли диметиламина.
Молекулы формулы 1 могут быть преобразованы в стабильные комплексы с растворителем, так что комплекс остается интактным после удаления растворителя, не входящего в состав комплекса. Такие комплексы часто называют «сольватами». Однако особенно желательно образование стабильных гидратов с водой в качестве растворителя.
Молекулы формулы 1 могут быть преобразованы в сложноэфирные производные. Такие сложноэфирные производные могут затем использоваться тем же образом, что и раскрытые в настоящем документе соединения.
Молекулы формулы 1 могут быть преобразованы в различные кристаллические полиморфы. Полиморфизм важен для разработки агрохимикатов, поскольку различные кристаллические полиморфы или структуры одной и той же молекулы могут обладать совершенно различными физическими свойствами и биологическими эффектами.
Могут быть получены молекулы формулы 1 с содержанием различных изотопов. Особую важность представляют собой молекулы, содержащие 2H (также известный как дейтерий) вместо 1H.
Могут быть получены молекулы формулы 1 с содержанием различных радионуклидов. Особую важность представляют собой молекулы, содержащие 13C или 14C.
СТЕРЕОИЗОМЕРЫ
Молекулы формулы 1 могут существовать в виде одного или нескольких стереоизомеров. Таким образом, некоторые молекулы могут быть получены в виде рацемических смесей. Специалистам в данной области техники следует понимать, что один стереоизомер может быть более активным, чем другие стереоизомеры. Отдельные стереоизомеры могут быть получены посредством традиционных селективных методик синтеза, традиционных методик синтеза с использованием расщепленных исходных веществ или посредством общепринятых методик расщепления. Некоторые раскрытые в настоящем документе молекулы могут существовать в виде двух или нескольких изомеров. Различные изомеры включают геометрические изомеры, диастереоизомеры и энантиомеры. Таким образом, раскрытые в настоящем документе молекулы включают геометрические изомеры, рацемические смеси, отдельные стереоизомеры и оптически активные смеси. Специалистам в данной области техники следует понимать, что один изомер может быть более активным, чем другие. Структуры, раскрытые в настоящем описании, представлены для ясности лишь в одной геометрической форме, но предназначены для представления всех геометрических форм молекулы.
КОМБИНАЦИИ
Молекулы формулы 1 также могут быть использованы в комбинации (например, в композиционной смеси или при одновременном или последовательном применении) с одним или несколькими соединениями, обладающими акарицидными, альгицидными, авицидными, бактерицидными, фунгицидными, гербицидными, инсектицидными, моллюскоцидными, нематоцидными, родентицидными или вируцидными свойствами. Кроме того, молекулы формулы 1 также могут быть использованы в комбинации (например, в композиционной смеси или при одновременном или последовательном применении) с соединениями, которые являются антифидингами, средствами отпугивания птиц, химическими стерилизаторами, гербицидными антидотами, аттрактантами для насекомых, средствами отпугивания насекомых, средствами отпугивания млекопитающих, средствами нарушения спаривания, активаторами растений, регуляторами роста растений или синергистами. Примерами таких соединений в вышеупомянутых группах, которые могут быть использованы с молекулами формулы 1, являются бромид (3-этоксипропил)ртути, 1,2-дихлорпропан, 1,3-дихлорпропен, 1-метилциклопропен, 1-нафтол, 2-(октилтио)этанол, 2,3,5-три-йодбензойная кислота, 2,3,6-TBA, 2,3,6-TBA-диметиламмоний, 2,3,6-TBA-литий, 2,3,6-TBA-калий, 2,3,6-TBA-натрий, 2,4,5-T, 2,4,5-T-2-бутоксипропил, 2,4,5-T-2-этилгексил, 2,4,5-T-3-бутоксипропил, 2,4,5-TB, 2,4,5-T-бутометил, 2,4,5-T-бутотил, 2,4,5-T-бутил, 2,4,5-T-изобутил, 2,4,5-T-изооктил, 2,4,5-T-изопропил, 2,4,5-T-метил, 2,4,5-T-пентил, 2,4,5-T-натрий, 2,4,5-T-триэтиламмоний, 2,4,5-T-троламин, 2,4-D, 2,4-D-2-бутоксипропил, 2,4-D-2-этилгексил, 2,4-D-3-бутоксипропил, 2,4-D-аммоний, 2,4-DB, 2,4-DB-бутил, 2,4-DB-диметиламмоний, 2,4-DB-изооктил, 2,4-DB-калий, 2,4-DB-натрий, 2,4-D-бутотил, 2,4-D-бутил, 2,4-D-диэтиламмоний, 2,4-D-диметиламмоний, 2,4-D-диоламин, 2,4-D-додециламмоний, 2,4-DEB, 2,4-DEP, 2,4-D-этил, 2,4-D-гептиламмоний, 2,4-D-изобутил, 2,4-D-изооктил, 2,4-D-изопропил, 2,4-D-изопропиламмоний, 2,4-D-литий, 2,4-D-мептил, 2,4-D-метил, 2,4-D-октил, 2,4-D-пентил, 2,4-D-калий, 2,4-D-пропил, 2,4-D-натрий, 2,4-D-тефурил, 2,4-D-тетрадециламмоний, 2,4-D-триэтиламмоний, 2,4-D-трис(2-гидроксипропил)аммоний, 2,4-D-троламин, 2iP, 2-метоксиэтилртути хлорид, 2-фенилфенол, 3,4-DA, 3,4-DB, 3,4-DP, 4-аминопиридин, 4-CPA, 4-CPA-калий, 4-CPA-натрий, 4-CPB, 4-CPP, 4-гидроксифенетиловый спирт, сульфат 8-гидроксихинолина, 8-фенилртутьоксихинолин, абамектин, абсцизовая кислота, ACC, ацефат, ацехиноцил, ацетамиприд, ацетион, ацетохлор, ацетофос, ацетопрол, ацибензолар, ацибензолар-S-метил, ацифлуорфен, ацифлуорфен-метил, ацифлуорфен-натрий, аклонифен, акреп, акринатрин, акролеин, акрилонитрил, аципетакс, аципетакс-медь, аципетакс-цинк, алахлор, аланикарб, албендазол, альдикарб, алдиморф, алдоксикарб, алдрин, аллетрин, аллицин, аллидохлор, аллозамидин, аллоксидим, аллоксидим-натрий, аллиловый спирт, алликсикарб, алорак, альфа-циперметрин, альфа-эндосульфан, аметоктрадин, аметридион, аметрин, амибузин, амикарбазон, амикартиазол, амидитион, амидофлумет, амидосульфурон, аминокарб, аминоциклопирахлор, аминоциклопирахлор-метил, аминоциклопирахлор-калий, аминопиралид, аминопиралид-калий, аминопиралид-трис(2-гидроксипропил)аммоний, амипрофос-метил, амипрофос, амисулбром, амитон, амитон оксалат, амитраз, амитрол, сульфамат аммония, α-нафталинацетат аммония, амобам, ампропилфос, анабазин, анцимидол, анилазин, анилофос, анизурон, антрахинон, анту, афолат, арамит, оксид мышьяка, азомат, аспирин, асулам, асулам-калий, асулам-натрий, атидатион, атратон, атразин, ауреофунгин, авиглицин, гидрохлорид авиглицина, азаконазол, азадирахтин, азафенидин, азаметифос, азимсульфурон, азинфос-этил, азинфос-метил, азипротрин, азитирам, азобензол, азоциклотин, азотоат, азоксистробин, bachmedesh, барбан, гексафторсиликат бария, полисульфид бария, бартрин, BCPC, бефлубутамид, беналаксил, беналаксил-M, беназолин, беназолин-диметиламмоний, беназолин-этил, беназолин-калий, бенкарбазон, бенклотиаз, бендиокарб, бенфлуралин, бенфуракарб, бенфурезат, беноданил, беномил, беноксакор, беноксафос, бенквинокс, бенсульфурон, бенсульфурон-метил, бенсулид, бенсултап, бенталурон, бентазон, бентазон-натрий, бентиаваликарб, бентиаваликарб-изопропил, бентиазол, бентранил, бензадокс, бензадокс-аммоний, бензалкония хлорид, бензамакрил, бензамакрил-изобутил, бензаморф, бензфендизон, бензипрам, бензобициклон, бензофенап, бензофлуор, бензогидроксамовая кислота, бензоксимат, бензоилпроп, бензоилпроп-этил, бензтиазурон, бензилбензоат, бензиладенин, берберин, хлорид берберина, бета-цифлутрин, бета-циперметрин, бетоксазин, бициклопирон, бифеназат, бифенокс, бифентрин, bifujunzhi, биланафос, биланафос-натрий, бинапакрил, bingqingxiao, биоаллетрин, биоэтанометрин, биоперметрин, биоресметрин, бифенил, бисазир, бисмертиазол, биспирибак, биспирибак-натрий, бистрифлурон, битертанол, битионол, биксафен, бластицидин-S, боракс, бордосская смесь, борная кислота, боскалид, брассинолид, брассинолид-этил, бревикомин, бродифакум, брофенвалерат, брофлутринат, бромацил, бромацил-литий, бромацил-натрий, бромaдиолон, брометалин, брометрин, бромфенвинфос, бромоацетамид, бромобонил, бромобутид, бромоциклен, бром-DDT, бромофеноксим, бромофос, бромофос-этил, бромопропилат, бромоталонил, бромоксинил, бромоксинил бутират, бромоксинил гептаноат, бромоксинил октаноат, бромоксинил-калий, бромпиразон, бромуконазол, бронопол, букарполат, буфенкарб, буминафос, бупиримат, бупрофезин, бургундская смесь, бусульфан, бутакарб, бутахлор, бутафенацил, бутамифос, бутатиофос, бутенахлор, бутетрин, бутидазол, бутиобат, бутиурон, бутокарбоксим, бутонат, бутопироноксил, бутоксикарбоксим, бутралин, бутроксидим, бутурон, бутиламин, бутилат, какодиловая кислота, кадусафос, кафенстрол, арсенат кальция, хлорат кальция, цианамид кальция, полисульфид кальция, калвинфос, камбендихлор, камфехлор, камфора, каптафол, каптан, карбаморф, карбанолат, карбарил, карбасулам, карбендазим, карбендазим бензолсульфонат, карбендазим сульфит, карбетамид, карбофуран, углерода дисульфид, углерода тетрахлорид, карбофенотион, карбосульфан, карбоксазол, карбоксид, карбоксин, карфентразон, карфентразон-этил, карпропамид, картап, картапа гидрохлорид, карвакрол, карвон, CDEA, целлоцидин, CEPC, цералур, смесь Cheshunt, хинометионат, хитозан, хлобентиазон, хлометоксифен, хлоралоза, хлорамбен, хлорамбен-аммоний, хлорамбен-диоламин, хлорамбен-метил, хлорамбен-метиламмоний, хлорамбен-натрий, хлорамин фосфор, хлорамфеникол, хлораниформетан, хлоранил, хлоранокрил, хлорантранилипрол, хлоразифоп, хлоразифоп-пропаргил, хлоразин, хлорбензид, хлорбензурон, хлорбициклен, хлорбромурон, хлорбуфам, хлордан, хлордекон, хлордимеформ, хлордимеформа гидрохлорид, хлоремпентрин, хлорэтоксифос, хлоретурон, хлорфенак, хлорфенак-аммоний, хлорфенак-натрий, хлорфенапир, хлорфеназол, хлорфенетол, хлорфенпроп, хлорфенсон, хлорфенсульфид, хлорфенвинфос, хлорфлуазурон, хлорфлуразол, хлорфлурен, хлорфлурен-метил, хлорфлуренол, хлорфлуренол-метил, хлоридазон, хлоримурон, хлоримурон-этил, хлормефос, хлормекват, хлормекват хлорид, хлорнидин, хлорнитрофен, хлорбензилат, хлородинитронафталины, хлороформ, хлоромебуформ, хлорометиурон, хлоронеб, хлорофацинон, хлорофацинон-натрий, хлоропикрин, хлоропон, хлоропропилат, хлороталонил, хлоротолурон, хлороксурон, хлороксинил, хлорфониум, хлорфониум хлорид, хлорфоксим, хлорпарзофос, хлорпрокарб, хлорпрофам, хлорпирифос, хлорпирифос-метил, хлорквинокс, хлорсульфурон, хлортал, хлортал-диметил, хлортал-монометил, хлортиамид, хлортиофос, хлозолинат, холина хлорид, хромафенозид, цинерин I, цинерин II, цинерины, цинидон-этил, цинметилин, циносульфурон, циобутид, цисанилид, цисметрин, клетодим, климбазол, клиодинат, клодинафоп, клодинафоп-пропаргил, клоетокарб, клофенцет, клофенцет-калий, клофентезин, клофибриновая кислота, клофоп, клофоп-изобутил, кломазон, кломепроп, клопроп, клопроксидим, клопиралид, клопиралид-метил, клопиралид-оламин, клопиралид-калий, клопиралид-трис(2-гидроксипропил)аммоний, клоквинтоцет, клоквинтоцет-мексил, клорансулам, клорансулам-метил, клосентел, клотианидин, клотримазол, клоксифонак, клоксифонак-натрий, CMA, кодлелур, колофонат, ацетат меди, ацетоарсенит меди, арсенат меди, карбонат меди, медь углекислая основная, гидроксид меди, нафтенат меди, олеат меди, оксихлорид меди, силикат меди, сульфат меди, хромат меди и цинка, кумахлор, кумафурил, кумафос, куматетралил, кумитоат, кумоксистробин, CPMC, CPMF, CPPC, кредазин, крезол, кримидин, кротамитон, кротоксифос, круфомат, криолит, cue-lure, куфранеб, кумилурон, купробам, оксид меди, куркуменол, цианамид, цианатрин, цианазин, цианофенфос, цианофос, циантоат, циантранилипрол, циазофамид, цибутрин, циклафурамид, цикланилид, циклетрин, циклоат, циклогексимид, циклопрат, циклопротрин, циклосульфамурон, циклоксидим, циклурон, циенопирафен, цифлуфенамид, цифлуметофен, цифлутрин, цигалофоп, цигалофоп-бутил, цигалотрин, цигексатин, цимиазол, цимиазола гидрохлорид, цимоксанил, циометринил, ципендазол, циперметрин, циперкват, циперкват хлорид, цифенотрин, ципразин, ципразол, ципроконазол, ципродинил, ципрофурам, ципромид, ципросульфамид, циромазин, цитиоат, даимурон, далапон, далапон-кальций, далапон-магний, далапон-натрий, даминозид, dayoutong, дазомет, дазомет-натрий, DBCP, d-камфора, DCIP, DCPTA, DDT, дебакарб, декафентин, декарбофуран, дегидроуксусная кислота, делахлор, дельтаметрин, демефион, демефион-O, демефион-S, деметон, деметон-метил, деметон-O, деметон-O-метил, деметон-S, деметон-S-метил, деметон-S-метилсульфон, десмедифам, десметрин, d-fanshiluquebingjuzhi, диафентиурон, диалифос, диаллат, диамидафос, диатомовая земля, диазинон, дибутилфталат, дибутилсукцинат, дикамба, дикамба-дигликольамин, дикамба-диметиламмоний, дикамба-диоламин, дикамба-изопропиламмоний, дикамба-метил, дикамба-оламин, дикамба-калий, дикамба-натрий, дикамба-троламин, дикаптон, дихлобенил, дихлофентион, дихлофлуанид, дихлон, дихлоральмочевина, дихлорбензурон, дихлорфлуренол, дихлорфлуренол-метил, дихлормат, дихлормид, дихлорофен, дихлорпроп, дихлорпроп-2-этилгексил, дихлорпроп-бутотил, дихлорпроп-диметиламмоний, дихлорпроп-этиламмоний, дихлорпроп-изооктил, дихлорпроп-метил, дихлорпроп-P, дихлорпроп-P-2-этилгексил, дихлорпроп-P-диметиламмоний, дихлорпроп-калий, дихлорпроп-натрий, дихлорвос, дихлозолин, диклобутразол, диклоцимет, диклофоп, диклофоп-метил, дикломезин, дикломезин-натрий, диклоран, диклосулам, дикофол, дикумарол, дикрезил, дикротофос, дицикланил, дициклонон, диелдрин, диенохлор, диетамкват, диетамкват дихлорид, диетатил, диетатил-этил, диэтофенкарб, диетолат, диэтилпирокарбонат, диэтилтолуамид, дифенакум, дифеноконазол, дифенопентен, дифенопентен-этил, дифеноксурон, дифензокват, дифензокват метилсульфат, дифетиалон, дифловидазин, дифлубензурон, дифлуфеникан, дифлуфензопир, дифлуфензопир-натрий, дифлуметорим, дикегулак, дикегулак-натрий, дилор, диматиф, димефлутрин, димефокс, димефурон, димепиперат, диметахлон, диметан, диметакарб, диметахлор, диметаметрин, диметенамид, диметенамид-P, диметипин, диметиримол, диметоат, диметоморф, диметрин, диметилкарбат, диметилфталат, диметилвинфос, диметилан, димексано, димидазон, димоксистробин, динекс, динекс-диклексин, dingjunezuo, диниконазол, диниконазол-M, динитрамин, динобутон, динокап, динокап-4, динокап-6, диноктон, динофенат, динопентон, динопроп, диносам, диносеб, диносеб ацетат, диносеб-аммоний, диносеб-диоламин, диносеб-натрий, диносеб-троламин, диносульфон, динотефуран, динотерб, динотерб ацетат, динотербон, диофенолан, диоксабензофос, диоксакарб, диоксатион, дифацинон, дифацинон-натрий, дифенамид, дифенил сульфон, дифениламин, дипропалин, дипропетрин, дипиритион, дикват, дикват дибромид, диспарлур, дисул, дисулфирам, дисулфотон, дисул-натрий, диталимфос, дитианон, дитикрофос, дитиоэфир, дитиопир, диурон, d-лимонен, DMPA, DNOC, DNOC-аммоний, DNOC-калий, DNOC-натрий, додеморф, додеморф ацетат, додеморф бензоат, додицин, додицин гидрохлорид, додицин-натрий, додин, дофенапин, доминикалур, дорамектин, дразоксолон, DSMA, дуфулин, EBEP, EBP, экдистерон, эдифенфос, эглиназин, эглиназин-этил, эмамектин, эмамектин бензоат, EMPC, эмпентрин, эндосульфан, эндотал, эндотал-диаммоний, эндотал-дикалий, эндотал-динатрий, эндотион, эндрин, энестробурин, EPN, эпохолеон, эпофенонан, эпоксиконазол, эприномектин, эпроназ, EPTC, эрбон, эргокальциферол, erlujixiancaoan, эсдепаллетрин, эсфенвалерат, эспрокарб, этацелазил, этаконазол, этафос, этем, этабоксам, этахлор, эталфлуралин, этаметсульфурон, этаметсульфурон-метил, этапрохлор, этефон, этидимурон, этиофенкарб, этиолат, этион, этиозин, этипрол, этиримол, этоат-метил, этофумезат, этогексадиол, этопрофос, этоксифен, этоксифен-этил, этоксиквин, этоксисульфурон, этихлозат, этилформиат, этил-α-нафталинацетат, этил-DDD, этилен, этилен дибромид, этилен дихлорид, этиленоксид, этилицин, этилртути 2,3-дигидроксипропил меркаптид, этилмеркурацетат, этилмеркурбромид, этилмеркурхлорид, этилмеркурфосфат, этинофен, этнипромид, этобензанид, этофенпрокс, этоксазол, этридиазол, этримфос, эвгенол, EXD, фамоксадон, фамфур, фенамидон, фенаминосульф, фенамифос, фенапанил, фенаримол, фенасулам, феназафлор, феназаквин, фенбуконазол, фенбутатин оксид, фенхлоразол, фенхлоразол-этил, фенхлорфос, фенклорим, фенетакарб, фенфлутрин, фенфурам, фенгексамид, фенитропан, фенитротион, fenjuntong, фенобукарб, фенопроп, фенопроп-3-бутоксипропил, фенопроп-бутометил, фенопроп-бутотил, фенопроп-бутил, фенопроп-изооктил, фенопроп-метил, фенопроп-калий, фенотиокарб, феноксакрим, феноксанил, феноксапроп, феноксапроп-этил, феноксапроп-P, феноксапроп-P-этил, феноксасульфон, феноксикарб, фенпиклонил, фенпиритрин, фенпропатрин, фенпропидин, фенпропиморф, фенпиразамин, фенпироксимат, фенридазон, фенридазон-калий, фенридазон-пропил, фензон, фенсульфотион, фентеракол, фентиапроп, фентиапроп-этил, фентион, фентион-этил, фентин, фентин ацетат, фентин хлорид, фентин гидроксид, фентразамид, фентрифанил, фенурон, фенурон TCA, фенвалерат, фербам, феримзон, сульфат железа, фипронил, флампроп, флампроп-изопропил, флампроп-M, флампроп-метил, флампроп-M-изопропил, флампроп-M-метил, флазасульфурон, флокумафен, флометоквин, флоникамид, флорасулам, флуакрипирим, флуазифоп, флуазифоп-бутил, флуазифоп-метил, флуазифоп-P, флуазифоп-P-бутил, флуазинам, флуазолат, флуазурон, флубендиамид, флубензимин, флукарбазон, флукарбазон-натрий, флуцетосульфурон, флухлоралин, флукофурон, флуциклоксурон, флуцитринат, флудиоксонил, флуенетил, флуенсульфон, флуфенацет, флуфенерим, флуфеникан, флуфеноксурон, флуфенпрокс, флуфенпир, флуфенпир-этил, флуфипрол, флуметрин, флуметовер, флуметралин, флуметсулам, флумезин, флумиклорак, флумиклорак-пентил, флумиоксазин, флумипропин, флуморф, флуометурон, флуопиколид, флуопирам, флуорбензид, флуоридамид, фторацетамид, флуородифен, флуорогликофен, флуорогликофен-этил, фторимид, флуоромидин, флуоронитрофен, флуотиурон, флуотримазол, флуоксастробин, флупоксам, флупропацил, флупропадин, флупропанат, флупропанат-натрий, флупирадифурон, флупирсульфурон, флупирсульфурон-метил, флупирсульфурон-метил-натрий, флуквинконазол, флуразол, флуренол, флуренол-бутил, флуренол-метил, флуридон, флурохлоридон, флуроксипир, флуроксипир-бутометил, флуроксипир-мептил, флурпримидол, флурсуламид, флуртамон, флусилазол, флусульфамид, флутиацет, флутиацет-метил, флутианил, флутоланил, флутриафол, флувалинат, флуксапироксад, флуксофеним, фолпет, фомесафен, фомесафен-натрий, фонофос, форамсульфурон, форхлорфенурон, формальдегид, форметанат, форметаната гидрохлорид, формотион, формпаранат, формпараната гидрохлорид, фосамин, фосамин-аммоний, фосетил, фосетил-алюминий, фосметилан, фоспират, фостиазат, фостиетан, фронталин, фуберидазол, fucaojing, fucaomi, funaihecaoling, фуфентиомочевина, фуралан, фуралаксил, фураметрин, фураметпир, фуратиокарб, фуркарбанил, фурконазол, фурконазол-цис, фуретрин, фурфурал, фурилазол, фурмециклокс, фурофанат, фурилоксифен, гамма-цигалотрин, гамма-HCH, генит, гиббереллиновая кислота, гиббереллины, глифтор, глуфосинат, глуфосинат-аммоний, глуфосинат-P, глуфосинат-P-аммоний, глуфосинат-P-натрий, глиодин, глиоксим, глифосат, глифосат-диаммоний, глифосат-диметиламмоний, глифосат-изопропиламмоний, глифосат-моноаммоний, глифосат-калий, глифосат-сесквинатрий, глифосат-тримезиум, глифосин, госсиплур, грандлур, гризеофульвин, квазатин, квазатин ацетаты, галакринат, галфенпрокс, галофенозид, галосафен, галосульфурон, галосульфурон-метил, галоксидин, галоксифоп, галоксифоп-этотил, галоксифоп-метил, галоксифоп-P, галоксифоп-P-этотил, галоксифоп-P-метил, галоксифоп-натрий, HCH, хемел, хемпа, HEOD, гептахлор, гептенофос, гептопаргил, гетерофос, гексахлорацетон, гексахлорбензол, гексахлорбутадиен, гексахлорфен, гексаконазол, гексафлумурон, гексафлурат, гексалур, гексамид, гексазинон, гексилтиофос, гекситиазокс, HHDN, голосулф, huancaiwo, huangcaoling, huanjunzuo, гидраметилнон, гидраргафен, гашеная известь, цианистый водород, гидропрен, гимексазол, хиквинкарб, IAA, IBA, икаридин, имазалил, имазалил нитрат, имазалил сульфат, имазаметабенз, имазаметабенз-метил, имазамокс, имазамокс-аммоний, имазапик, имазапик-аммоний, имазапир, имазапир-изопропиламмоний, имазаквин, имазаквин-аммоний, имазаквин-метил, имазаквин-натрий, имазетапир, имазаквин-аммоний, имазосульфурон, имибенконазол, имициафос, имидаклоприд, имидаклотиз, иминоктадин, иминоктадин триацетат, иминоктадин триалбезилат, имипротрин, инабенфид, инданофан, индазифлам, индоксакарб, инезин, йодобонил, йодокарб, йодометан, йодосульфурон, йодосульфурон-метил, йодосульфурон-метил-натрий, иофенсульфурон, иофенсульфурон-натрий, иоксинил, иоксинил октаноат, иоксинил-литий, иоксинил-натрий, ипазин, ипконазол, ипфенкарбазон, ипробенфос, ипродион, ипроваликарб, ипримидам, ипсдиенол, ипсенол, IPSP, изамидофос, исазофос, изобензан, изокарбамид, изокарбофос, изоцил, изодрин, изофенфос, изофенфос-метил, изолан, изометиозин, изонорунон, изополинат, изопрокарб, изопропалин, изопротиолан, изопротурон, изопиразам, изопиримол, изотиоат, изотианил, изоурон, изовалидион, изоксабен, изоксахлортол, изоксадифен, изоксадифен-этил, изоксафлутол, изоксапирифоп, изоксатион, ивермектин, изопамфос, японилур, жапотрины, жасмолин I, жасмолин II, жасмоновая кислота, jiahuangchongzong, jiajizengxiaolin, jiaxianjunzhi, jiecaowan, jiecaoxi, йодофенфос, ювенильный гормон I, ювенильный гормон II, ювенильный гормон III, кадетрин, карбутилат, каретазан, каретазан-калий, касугамицин, касугамицина гидрохлорид, kejunlin, келеван, кетоспирадокс, кетоспирадокс-калий, кинетин, кинопрен, крезоксим-метил, kuicaoxi, лактофен, лямбда-цигалотрин, латилур, арсенат свинца, ленацил, лепимектин, лепрофос, линдан, линеатин, линурон, лиримфос, литлур, луплур, луфенурон, ludingjunzhi, luxiancaolin, литидатион, MAA, малатион, гидразид малеиновой кислоты, малонобен, мальтодекстрин, MAMA, манкоппер, манкозеб, мандипропамид, манеб, матрин, мазидокс, MCPA, MCPA-2-этилгексил, MCPA-бутотил, MCPA-бутил, MCPA-диметиламмоний, MCPA-диоламин, MCPA-этил, MCPA-изобутил, MCPA-изооктил, MCPA-изопропил, MCPA-метил, MCPA-оламин, MCPA-калий, MCPA-натрий, MCPA-тиоэтил, MCPA-троламин, MCPB, MCPB-этил, MCPB-метил, MCPB-натрий, мебенил, мекарбам, мекарбинзид, мекарфон, мекопроп, мекопроп-2-этилгексил, мекопроп-диметиламмоний, мекопроп-диоламин, мекопроп-этадил, мекопроп-изооктил, мекопроп-метил, мекопроп-P, мекопроп-P-2-этилгексил, мекопроп-P-диметиламмоний, мекопроп-P-изобутил, мекопроп-калий, мекопроп-P-калий, мекопроп-натрий, мекопроп-троламин, медимеформ, мединотерб, мединотерб ацетат, медлур, мефенацет, мефенпир, мефенпир-диэтил, мефлуидид, мефлуидид-диоламин, мефлуидид-калий, тетрадекадиеновая кислота, меназон, мепанипирим, меперфлутрин, мефенат, мефосфолан, мепикват, мепикват хлорид, мепикват пентаборат, мепронил, мептилдинокам, хлорид ртути, оксид ртути, хлористая ртуть, мерфос, мезопразин, мезосульфурон, мезосульфурон-метил, мезотрион, месульфен, месульфенфос, метафлумизон, металаксил, металаксил-M, метальдегид, метам, метам-аммоний, метамифоп, метамитрон, метам-калий, метам-натрий, метазахлор, метазосульфурон, метазоксолон, метконазол, метепа, метфлуразон, метабензтиазурон, метакрифос, металпропалин, метамидофос, метасульфокарб, метазол, метфуроксам, метидатион, метиобенкарб, метиокарб, метиопирисульфурон, метиотепа, метиозолин, метиурон, метокротофос, метометон, метомил, метопрен, метопротрин, метоквин-бутил, метотрин, метоксихлор, метоксифенозид, метоксифенон, метил афолат, метилбромид, метилэвгенол, метилйодид, метил изотиоцианат, метилацетофос, метилхлороформ, метилдимрон, метилен хлористый, метилртути бензоат, метилртути дициандиамид, метилртути пентахлорфеноксид, метилнеодеканамид, метирам, метобензурон, метобромурон, метофлутрин, метолахлор, метолкарб, метоминостробин, метосулам, метоксадиазон, метоксурон, метрафенон, метрибузин, метсульфовакс, метсульфурон, метсульфурон-метил, мевинфос, мексакарбат, mieshuan, милбемектин, милбемицин оксим, милнеб, мипафокс, мирекс, MNAF, могучун, молинат, молосултап, моналид, монисоурон, монохлоруксусная кислота, монокротофос, монолинурон, моносульфурон, моносульфурон-сложный эфир, монурон, монурон TCA, морфамкват, морфамкват дихлорид, мороксидин, мороксидина гидрохлорид, морфотион, морзид, моксидектин, MSMA, мускалур, миклобутанил, миклозолин, N-(этилртуть)-пара-толуолсульфонанилид, набам, нафталофос, налед, нафталин, нафталинацетамид, ангидрид нафтойной кислоты, нафтоксиуксусные кислоты, напроанилид, напропамид, напталам, напталам-натрий, натамицин, небурон, никлозамид, никлозамид-оламин, никосульфурон, никотин, нифлуридид, нипираклофен, нитенпирам, нитиазин, нитралин, нитрапирин, нитрилакарб, нитрофен, нитрофлуорфен, нитростирин, нитротал-изопропил, норбормид, норфлуразон, норникотин, норурон, новалурон, новифлумурон, нуаримол, OCH, октахлордипропиловый эфир, октилинон, офурас, ометоат, орбенкарб, орфралур, орто-дихлорбензол, ортосульфамурон, орикталур, орисастробин, оризалин, остол, острамон, оксабетринил, оксадиаргил, оксадиазон, оксадиксил, оксамат, оксамил, оксапиразон, оксапиразон-димоламин, оксапиразон-натрий, оксасульфурон, оксазикломефон, оксиновая медь, оксолиновая кислота, окспоконазол, окспоконазол фумарат, оксикарбоксин, оксидеметон-метил, оксидепрофос, оксидисульфотон, оксифлуорфен, оксиматрин, окситетрациклин, гидрохлорид окситетрациклина, паклобутразол, paichongding, пара-дихлорбензол, парафлурон, паракват, паракват дихлорид, паракват диметилсульфат, паратион, паратион-метил, паринол, пебулат, пефуразоат, пеларгоновая кислота, пенконазол, пенцикурон, пендиметалин, пенфлуфен, пенфлурон, пенокссулам, пентахлорфенол, пентанохлор, пентиопирад, пентметрин, пентоксазон, перфлуидон, перметрин, петоксамид, фенамакрил, феназин оксид, фенизофам, фенкаптон, фенмедифам, фенмедифам-этил, фенобензурон, фенотрин, фенпроксид, фентоат, фенилмеркуромочевина, фенилмеркурацетат, фенилмеркурхлорид, фенилмеркурпроизводное пирокатехола, фенилмеркурнитрат, фенилмеркурсалицилат, форат, фосацетим, фосалон, фосдифен, фосфолан, фосфолан-метил, фосглицин, фосмет, фоснихлор, фосфамидон, фосфин, фосфокарб, фосфор, фостин, фоксим, фоксим-метил, фталид, пиклорам, пиклорам-2-этилгексил, пиклорам-изооктил, пиклорам-метил, пиклорам-оламин, пиклорам-калий, пиклорам-триэтиламмоний, пиклорам-трис(2-гидроксипропил)аммоний, пиколинафен, пикоксистробин, пиндон, пиндон-натрий, пиноксаден, пипералин, пиперонил бутоксид, пиперонил циклонен, пиперофос, пипроктанил, пипроктанил бромид, пипротал, пириметафос, пиримикарб, пиримиоксифос, пиримифос-этил, пиримифос-метил, плифенат, поликарбамат, полиоксины, полиоксорим, полиоксорим-цинк, политиалан, арсенат калия, азид калия, цианат калия, гиббереллат калия, нафтенат калия, полисульфид калия, тиоцианат калия, α-нафталинацетат калия, pp'-DDT, праллетрин, прекоцен I, прекоцен II, прекоцен III, претилахлор, примидофос, примисульфурон, примисульфурон-метил, пробеназол, прохлораз, прохлораз-марганец, проклонол, проциазин, процимидон, продиамин, профенофос, профлуазол, профлуралин, профлутрин, профоксидим, проглиназин, проглиназин-этил, прогексадион, прогексадион-кальция, прогидрожасмон, промацил, промекарб, прометон, прометрин, промурит, пропахлор, пропамидин, пропамидин дигидрохлорид, пропамокарб, пропамокарба гидрохлорид, пропанил, пропафос, пропаквизафоп, пропаргит, пропартрин, пропазин, пропетамфос, профам, пропиконазол, пропинеб, пропизохлор, пропоксур, пропоксикарбазон, пропоксикарбазон-натрий, пропилизом, пропирисульфурон, пропизамид, проквиназид, просулер, просульфалин, просульфокарб, просульфурон, протидатион, протиокарб, протиокарб гидрохлорид, протиоконазол, протиофос, протоат, протрифенбут, проксан, проксан-натрий, принахлор, пиданон, пиметрозин, пиракарболид, пираклофос, пираклонил, пираклостробин, пирафлуфен, пирафлуфен-этил, пирафлупрол, пирамат, пираметостробин, пираоксистробин, пирасульфотол, пиразолинат, пиразофос, пиразосульфурон, пиразосульфурон-этил, пиразотион, пиразоксифен, пиресметрин, пиретрин I, пиретрин II, пиретрины, пирибамбенз-изопропил, пирибамбенз-пропил, пирибенкарб, пирибензоксим, пирибутикарб, пириклор, пиридабен, пиридафол, пиридалил, пиридафентион, пиридат, пиридинитрил, пирифенокс, пирифлуквиназон, пирифталид, пириметанил, пиримидифен, пириминобак, пириминобак-метил, пиримисульфан, пиримитат, пиринурон, пириофенон, пирипрол, пирипропанол, пирипроксифен, пиритиобак, пириминобак-натрий, пиролан, пироквилон, пироксасульфон, пирокссулам, пироксихлор, пироксифур, квассия, квинацетол, квинацетол сульфат, квиналфос, квиналфос-метил, квиназамид, квинклорак, квинконазол, квинмерак, квинокламин, квинонамид, квинотион, квиноксифен, квинтиофос, квинтозен, квизалофоп, квизалофоп-этил, квизалофоп-P, квизалофоп-P-этил, квизалофоп-P-тефурил, quwenzhi, quyingding, рабензазол, рафоксанид, ребемид, ресметрин, родетанил, родожапонин-III, рибавирин, римсульфурон, ротенон, риания, сафлуфенацил, saijunmao, saisentong, салициланилид, сангвинарин, сантонин, шрадан, сциллирозид, себутилазин, секбуметон, седаксан, селамектин, семиамитраз, семиамитраз хлорид, сезамекс, сезамолин, сетоксидим, shuangjiaancaolin, сидурон, сиглур, силафлуофен, силатран, силикагель, силтиофам, симазин, симеконазол, симетон, симетрин, синтофен, SMA, C-метолахлор, арсенит натрия, азид натрия, хлорат натрия, фторид натрия, фторацетат натрия, гексафторсиликат натрия, нафтенат натрия, ортофенилфеноксид натрия, пентахлорфеноксид натрия, полисульфид натрия, тиоцианат натрия, α-нафталинацетат натрия, софамид, спинеторам, спиносад, спиродиклофен, спиромезифен, спиротетрамат, спироксамин, стрептомицин, стрептомицин сесквисульфат, стрихнин, сулкатол, сулкофурон, сулкофурон-натрий, сулкотрион, сульфаллат, сульфентразон, сульфирам, сульфлурамид, сульфометурон, сульфометурон-метил, сульфосульфурон, сульфотеп, сульфоксафлор, сульфоксид, сульфоксим, сера, серная кислота, сульфурил фторид, сулгликапин, сулпрофос, султропен, свеп, тау-флювалинат, таврон, тазимкарб, TCA, TCA-аммоний, TCA-кальция, TCA-этадил, TCA-магний, TCA-натрий, TDE, тебуконазол, тебуфенозид, тебуфенпирад, тебуфлоквин, тебупиримфос, тебутам, тебутиурон, теклофталам, фекназен, текорам, тефлубензурон, тефлутрин, тефурилтрион, темботрион, темефос, тепа, TEPP, тепралоксидим, тераллетрин, тербацил, тербукарб, тербухлор, тербуфос, тербуметон, тербутилазин, тербутрин, тетсикласис, тетрахлорэтан, тетрахлорвинфос, тетраконазол, тетрадифон, тетрафлурон, тетраметрин, тетраметилфлутрин, тетрамин, тетранактин, тетрасул, таллия сульфат, тенилхлор, тета-циперметрин, тиабендазол, тиаклоприд, тиадифлуор, тиаметоксам, тиапронил, тиазафлурон, тиазопир, тикрофос, тициофен, тиадиазимин, тиадиазурон, тиенкарбазон, тиенкарбазон-метил, тифенсульфурон, тифенсульфурон-метил, тифлузамид, тиобенкарб, тиокарбоксим, тиохлорфенпим, тиоциклам, тиоциклама гидрохлорид, тиоциклам оксалат, тиодиазол-меди, тиодикарб, тиофанокс, тиофлуоксимат, тиохемпа, тиомерсал, тиометон, тионазин, тиофанат, тиофанат-метил, тиоквинокс, тиосемикарбазид, тиосултап, тиосултап-димаммоний, тиосултап-динатрий, тиосултап-мононатрий, тиотепа, тирам, thuringiensin, тиадинил, tiaojiean, тиокарбазил, тиоклорим, тиоксимид, тирпат, толклофос-метил, толфенпирад, толилфлуанид, толилмеркурацетат, топрамезон, тралкосидим, тралоцитрин, тралометрин, тралопирил, трансфлутрин, трансперметрин, третамин, триаконтанол, триадимефон, триадименол, триафамон, триаллат, триамифос, триапентенол, триаратен, триаримол, триасульфурон, триазамат, триазбутил, триазифлам, триазофос, триазоксид, трибенурон, трибенурон-метил, трибуфос, трибутилолова оксид, трикамба, трихламид, трихлорфон, трихлорметафос-3, трихлоронат, триклопир, триклопир-бутотил, триклопир-этил, триклопир-триэтиламмоний, трициклазол, тридеморф, тридифан, триэтазин, трифенморф, трифенофос, трифлоксистробин, трифлоксисульфурон, трифлоксисульфурон-натрий, трифлумизол, трифлумурон, трифлуралин, трифлусульфурон, трифлусульфурон-метил, трифоп, трифоп-метил, трифопсим, трифорин, тригидрокситриазин, тримедлур, триметакарб, триметурон, тринексапак, тринексапак-этил, трипрен, трипропиндан, трипролид, тритак, тритиконазол, тритосульфурон, трунк-кол, униконазол, униконазол-P, урбацид, уредепа, валерат, валидамицин, валифеналат, валон, вамидотион, вангард, ванилипрол, вернолат, винклозолин, варфарин, варфарин-калий, варфарин-натрий, xiaochongliulin, xinjunan, xiwojunan, XMC, ксилахлор, ксиленолы, ксилилкарб, yishijing, зариламид, зеатин, zengxiaoan, зета-циперметрин, цинка нафтенат, цинка фосфид, цинка тиазол, зинеб, зирам, золапрофос, зоксамид, zuomihuanglong, α-хлоргидрин, α-экдизон, α-мултистриатин и α-нафтилуксусная кислота. Для более подробной информации см. “Compendium of Pesticide Common Names”, размещенный на http://www.alanwood.net/pesticides/index.html. Также см. “The Pesticide Manual” 14th Edition, edited by C D S Tomlin, copyright 2006 by British Crop Production Council, или более ранние, или более поздние его издания.
БИОПЕСТИЦИДЫ
Молекулы формулы 1 также могут быть использованы в комбинации (такой как в композиционной смеси или при одновременном или последовательном применении) с одним или несколькими биопестицидами. Термин «биопестицид» используется для средств контроля микробиологических вредителей, которые применяются способом, подобным способу применения химических пестицидов. Обычно они являются бактериальными, но также имеются примеры грибковых средств контроля, включающие Trichoderma spp. и Ampelomyces quisqualis (средство контроля мучнистой росы винограда). Bacillus subtilis используется для контроля растительных патогенов. Сорняки и грызуны также контролируются микробными средствами. Одним хорошо известным примером инсектицида является Bacillus thuringiensis, вызывающая бактериальное заболевание у Lepidoptera, Coleoptera и Diptera. Поскольку она оказывает незначительный эффект на другие организмы, то считается более экологически безопасной, чем синтетические пестициды. Биологические инсектициды предусматривают продукты на основе:
1) энтомопатогенных грибов (например, Metarhizium anisopliae),
2) энтомопатогенных нематод (например, Steinernema feltiae) и
3) энтомопатогенных вирусов (например, вирус гранулеза Cydia pomonella).
Другие примеры энтомопатогенных организмов включают без ограничения бакуловирусы, бактерии и другие прокариотические организмы, грибы, простейших и Microsproridia. Инсектициды биологического происхождения включают без ограничения ротенон, вератридин, а также микробные токсины; выносливые или устойчивые к насекомым сорта растений и организмы, модифицированные технологией рекомбинантной ДНК либо для продуцирования инсектицидов, либо для обеспечения свойства устойчивости к насекомым у генномодифицированного организма. Согласно одному варианту осуществления, молекулы формулы 1 могут быть использованы с одним или несколькими биопестицидами для обработки семян и улучшения почвы. В The Manual of Biocontrol Agents приводится обзор доступных биологических инсектицидных продуктов (и других средств контроля на основе биологического материала) (Copping L.G. (ed.) (2004), The Manual of Biocontrol Agents (ранее The Biopesticide Manual) 3rd Edition. British Crop Production Council (BCPC), Farnham, Surrey UK).
ДРУГИЕ АКТИВНЫЕ СОЕДИНЕНИЯ
Молекулы формулы (I) могут также использоваться в сочетании (например, в составной смеси или при одновременном или последовательном применении) с одним или несколькими из:
1. 3-(4-хлор-2,6-диметилфенил)-4-гидрокси-8-окса-1-азаспиро[4,5]дец-3-ен-2-она;
2. 3-(4’-хлор-2,4-диметил[1,1’-бифенил]-3-ил)-4-гидрокси-8-окса-1-азаспиро[4,5]дец-3-ен-2-она;
3. 4-[[(6-хлор-3-пиридинил)метил]метиламино]-2(5H)-фуранона;
4. 4-[[(6-хлор-3-пиридинил)метил]циклопропиламино]-2(5H)-фуранона;
5. 3-хлор-N2-[(1S)-1-метил-2-(метилсульфонил)этил]-N1-[2-метил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]-1,2-бензолдикарбоксамида;
6. 2-циано-N-этил-4-фтор-3-метоксибензолсульфонамида;
7. 2-циано-N-этил-3-метоксибензолсульфонамида;
8. 2-циано-3-дифторметокси-N-этил-4-фторбензолсульфонамида;
9. 2-циано-3-фторметокси-N-этилбензолсульфонамида;
10. 2-циано-6-фтор-3-метокси-N,N-диметилбензолсульфонамида;
11. 2-циано-N-этил-6-фтор-3-метокси-N-метилбензолсульфонамида;
12. 2-циано-3-дифторметокси-N,N-диметилбензолсульфонамида;
13. 3-(дифторметил)-N-[2-(3,3-диметилбутил)фенил]-1-метил-1H-пиразол-4-карбоксамида;
14. N-этил-2,2-диметилпропионамид-2-(2,6-дихлор-α,α,α-трифтор-пара-толил)гидразона;
15. N-этил-2,2-дихлор-1-метилциклопропанкарбоксамид-2-(2,6-дихлор-α,α,α-трифтор-пара-толил)гидразонникотина;
16. O-{(E-)-[2-(4-хлорфенил)-2-циано-1-(2-трифторметилфенил)винил]}-S-метилтиокарбоната;
17. (E)-N1-[(2-хлор-1,3-тиазол-5-илметил)]-N2-циано-N1-метилацетамидина;
18. 1-(6-хлорпиридин-3-илметил)-7-метил-8-нитро-1,2,3,5,6,7-гексагидроимидазо[1,2-a]пиридин-5-ола;
19. 4-[4-хлорфенил-(2-бутилидингидразоно)метил)]-фенилмезилата; и
20. N-этил-2,2-дихлор-1-метилциклопропанкарбоксамид-2-(2,6-дихлор-α,α,α-трифтор-пара-толил)гидразона.
СИНЕРГИЧНЫЕ СМЕСИ
Молекулы формулы 1 могут использоваться вместе с некоторыми активными соединениями для образования синергичных смесей, в которых механизм действия таких соединений является таким же, сходным или различным по сравнению с механизмом действия молекул формулы 1. Примеры механизмов действия включают без ограничения: ингибитор ацетилхолинэстеразы; модулятор натриевых каналов; ингибитор биосинтеза хинина; антагонист канала-переносчика ионов хлора, регулируемого глутаматом и GABA; агонист канала-переносчика ионов хлора, регулируемого глутаматом и GABA; агонист рецептора ацетилхолина; антагонист рецептора ацетилхолина; ингибитор MET I; ингибитор Mg-стимулируемой АТФазы; никотиновый ацетилхолиновый рецептор; мембранный разобщитель средней зоны кишечника; разобщитель окислительного фосфорилирования и рецептор рианодина (RyRs). Как правило, в синергичной смеси весовые соотношения молекул формулы 1 и другого соединения составляют от приблизительно 10/1 до приблизительно 1/10, согласно другому варианту осуществления от приблизительно 5/1 до приблизительно 1/5, и согласно другому варианту осуществления приблизительно 3/1, и согласно другому варианту осуществления приблизительно 1/1.
СОСТАВЫ
Пестициды редко подходят для использования в чистой форме. Обычно необходимо добавление других веществ, так чтобы пестицид мог быть использован в необходимой концентрации и в подходящей форме, обеспечивая простоту нанесения, обращения, транспортировки, хранения и максимальную пестицидную активность. Таким образом, пестициды включают в состав, например, приманок, концентрированных эмульсий, порошковидных препаратов, эмульгируемых концентратов, фумигантов, гелей, гранул, микроинкапсулированных препаратов, протравок для семян, концентратов суспензий, суспоэмульсий, таблеток, растворимых в воде жидкостей, диспергируемых в воде гранул или сухих сыпучих препаратов, смачивающихся порошков и ультрамалообъемных растворов. Для дополнительной информации о типах составов см. “Catalogue of Pesticide Formulation Types and International Coding System” Technical Monograph n°2, 5th Edition by CropLife International (2002).
Пестициды чаще всего применяют в виде водных суспензий или эмульсий, приготовленных из концентрированных составов таких пестицидов. Такие растворимые в воде, суспендируемые в воде или эмульгируемые составы представляют собой либо твердые вещества, обычно известные как смачивающиеся порошки или диспергируемые в воде гранулы, либо жидкости, обычно известные как эмульгируемые концентраты или водные суспензии. Смачивающиеся порошки, которые могут быть спрессованы с получением диспергируемых в воде гранул, содержат однородную смесь пестицида, носителя и поверхностно-активных веществ. Концентрация пестицида обычно составляет от приблизительно 10% до приблизительно 90% по массе. Носитель обычно выбирают из аттапульгитовых глин, монтмориллонитовых глин, диатомовых земель или очищенных силикатов. Эффективные поверхностно-активные вещества, составляющие от приблизительно 0,5% до приблизительно 10% от массы смачивающегося порошка, находят среди сульфонированных лигнинов, конденсированных нафталинсульфонатов, нафталинсульфонатов, алкилбензолсульфонатов, алкилсульфатов и неионогенных поверхностно-активных веществ, таких как этиленоксидные аддукты алкилфенолов.
Эмульгируемые концентраты пестицидов содержат подходящую концентрацию пестицида, такую как от приблизительно 50 до приблизительно 500 г на литр жидкости, растворенного в носителе, который представляет собой либо смешиваемый с водой растворитель, либо смесь не смешиваемого с водой органического растворителя и эмульгаторов. Применимые органические растворители включают ароматические вещества, особенно ксилолы и нефтяные фракции, особенно высококипящие нафталиновые и олефиновые нефтяные фракции, такие как обогащенный ароматикой тяжелый лигроин. Также могут быть использованы другие органические растворители, такие как терпеновые растворители, включая производные канифоли, алифатические кетоны, такие как циклогексанон, и сложные спирты, такие как 2-этоксиэтанол. Подходящие эмульгаторы для эмульгируемых концентратов выбирают из общепринятых анионогенных и неионогенных поверхностно-активных веществ.
Водные суспензии содержат суспензии нерастворимых в воде пестицидов, диспергированных в водном носителе в концентрации от приблизительно 5% до приблизительно 50% по массе. Суспензии приготавливают путем тонкого измельчения пестицида и энергичного вмешивания его в носитель, состоящий из воды и поверхностно-активных веществ. Для увеличения плотности и вязкости водного носителя также могут быть добавлены такие ингредиенты, как неорганические соли и синтетические или природные камеди. Часто наиболее эффективным является измельчение и перемешивание пестицида одновременно с приготовлением водной смеси и ее гомогенизация в устройстве, таком как песчаная мельница, шаровая мельница или гомогенизатор поршневого типа.
Пестициды также могут использоваться в виде гранулированных композиций, которые являются особенно применимыми для нанесения на почву. Гранулированные композиции обычно содержат от приблизительно 0,5% до приблизительно 10% по массе пестицида, диспергированного в носителе, который содержит глину или похожее вещество. Такие композиции обычно приготавливают путем растворения пестицида в подходящем растворителе и нанесения его на гранулированный носитель, который был предварительно отформован в частицы подходящего размера в диапазоне от приблизительно 0,5 до приблизительно 3 мм. Такие композиции также могут быть составлены путем приготовления густой массы или пасты из носителя и соединения, и измельчения и высушивания с получением гранулированных частиц желаемого размера.
Содержащие пестицид порошковидные препараты приготавливают путем тщательного перемешивания пестицида в порошковой форме с подходящим порошкообразным сельскохозяйственным носителем, таким как каолиновая глина, грунт вулканической породы и т.п. Порошковидные препараты могут надлежащим образом содержать от приблизительно 1% до приблизительно 10% пестицида. Они могут быть использованы в виде протравки для семян или в виде внекорневой подкормки с использованием опыливателя.
В равной степени практичным является применение пестицида в форме раствора в подходящем органическом растворителе, обычно в нефтяном масле, таком как аэрозольные масла, которые широко используются в сельскохозяйственной химии.
Пестициды также могут быть использованы в форме аэрозольной композиции. В таких композициях пестицид растворяют или диспергируют в носителе, который представляет собой создающую давление смесь пропеллентов. Аэрозольную композицию упаковывают в контейнер, из которого смесь распыляется через распыляющий клапан.
Пестицидные приманки получают при смешении пестицида с пищей или аттрактантом или с обоими. Когда вредители съедают приманку, они также поглощают пестицид. Приманки могут иметь форму гранул, гелей, сыпучих порошков, жидкостей или твердых препаратов. Они могут быть использованы в местах скопления вредителей.
Фумиганты представляют собой пестициды, которые обладают сравнительно высоким давлением паров, и, следовательно, могут существовать в виде газа в концентрациях, достаточных для гибели вредителей в почве или замкнутых пространствах. Токсичность фумиганта пропорциональна его концентрации и длительности воздействия. Они характеризуются хорошей диффузионной способностью и действуют посредством проникновения в дыхательную систему вредителя или всасывания через кутикулу вредителя. Фумиганты применяют для контроля вредителей запасов продовольствия под газонепроницаемыми листами, в герметизированных комнатах или сооружениях или в специальных камерах.
Пестициды могут быть микроинкапсулированы путем суспендирования частиц или капель пестицида в пластиковых полимерах различных типов. Путем изменения химического состава полимера или условий переработки могут быть получены микрокапсулы с различными размерами, значениями растворимости, толщиной стенок и степенями проницаемости. Эти факторы определяют скорость, с которой высвобождается активный ингредиент, что в свою очередь влияет на остаточное действие, скорость действия и запах продукта.
Концентраты масляных растворов приготавливают путем растворения пестицида в растворителе, который будет удерживать пестицид в растворе. Масляные растворы пестицида обычно обеспечивают более быстрый нокдаун-эффект и гибель вредителей, чем другие составы, в связи с тем, что растворители сами по себе обладают пестицидным действием, а растворение воскового покрытия наружного покрова увеличивает скорость всасывания пестицида. Другие преимущества масляных растворов включают улучшенную стабильность при хранении, улучшенное проникновение в трещины и улучшенную адгезию к сальным поверхностям.
Другой вариант осуществления представляет собой эмульсию типа «масло в воде», причем эмульсия содержит масляные капли, каждая из которых снабжена ламеллярным жидкокристаллическим покрытием, и которые диспергированы в водной фазе, причем каждая масляная капля содержит, по меньшей мере, одно соединение, которое является эффективным в сельском хозяйстве, и отдельно покрыта моноламеллярным или олиголамеллярным слоем, содержащим: (1) по меньшей мере, одно неионогенное липофильное поверхностно-активное средство, (2) по меньшей мере, одно неионогенное гидрофильное поверхностно-активное средство, и (3) по меньшей мере, одно неионогенное поверхностно-активное средство, причем капли имеют средний диаметр частиц менее 800 нм. Дополнительная информация об этом варианте осуществления раскрыта в публикации патента США 20070027034, опубликованной 1 февраля 2007 года, с патентной заявкой №11/495228. Для удобства использования этот вариант осуществления будет обозначаться как «OIWE».
Для дополнительной информации см. “Insect Pest Management” 2nd Edition by D. Dent, copyright CAB International (2000). Кроме того, для более детальной информации см. “Handbook of Pest Control - The Behavior, Life History, and Control of Household Pests” by Arnold Mallis, 9th Edition, copyright 2004 by GIE Media Inc.
ДРУГИЕ КОМПОНЕНТЫ СОСТАВА
Как правило, если молекулы, раскрытые в формуле 1, используют в каком-либо составе, то такой состав также может содержать другие компоненты. Эти компоненты включают без ограничения (это неисчерпывающий и невзаимоисключающий список) смачивающие средства, растекатели, клейкие вещества, пенетранты, буферы, секвестранты, средства, снижающие вымывание, агенты совместимости, противовспениватели, очищающие средства и эмульгаторы. Несколько компонентов описаны далее.
Смачивающее средство представляет собой вещество, которое при добавлении к жидкости улучшает растекание или проникающую способность жидкости путем уменьшения поверхностного натяжения между жидкостью и поверхностью, по которой она растекается. Смачивающие средства выполняют в агрохимических составах две основные функции: увеличивают скорость смачивания порошков в воде для приготовления концентратов для растворимых жидкостей или концентратов суспензий в процессе технологической обработки и производства; и снижают время смачивания смачивающихся порошков и улучшают проницаемость воды в диспергируемые в ней гранулы в процессе смешивания продукта с водой в резервуаре опрыскивателя. Примерами смачивающих средств, используемых в составах со смачивающимися порошками, концентратами суспензий и диспергируемыми в воде гранулами, являются: лаурилсульфат натрия; диоктилсульфосукцинат натрия; алкилфенолэтоксилаты; и этоксилаты алифатических спиртов.
Диспергирующее средство представляет собой вещество, которое адсорбируется на поверхности частиц, помогает сохранить частицы в состоянии дисперсии и предохраняет их от повторной агрегации. Диспергирующие средства добавляют в агрохимические составы для облегчения диспергирования и суспендирования в процессе производства, и для обеспечения повторного диспергирования частиц в воде в резервуаре опрыскивателя. Они широко используются в смачивающихся порошках, концентратах суспензий и диспергируемых в воде гранулах. Поверхностно-активные вещества, которые используются в качестве диспергирующих средств, обладают способностью прочно адсорбироваться на поверхности частицы и обеспечивают электростатический или стерический барьер для повторной агрегации частиц. Наиболее широко используемыми поверхностно-активными веществами являются анионогенные, неионогенные или смеси указанных двух типов. Для составов в виде смачивающегося порошка самыми распространенными диспергирующими средствами являются лигносульфонаты натрия. Для концентратов суспензий очень хорошей адсорбции и стабилизации достигают с использованием полиэлектролитов, таких как конденсаты нафталинсульфоната натрия и формальдегида. Также используют тристирилфенолэтоксилат фосфатные эфиры. В качестве диспергирующих средств для концентратов суспензий неионогенные поверхностно-активные вещества, такие как конденсаты алкиларилэтиленоксида и EO-PO блок-сополимеры, иногда сочетают с анионогенными. В последние годы были разработаны новые типы полимерных поверхностно-активных веществ с очень высоким молекулярным весом в качестве диспергирующих средств. Эти вещества имеют очень длинные гидрофобные «остовы» и большое число этиленоксидных цепей, образующих «зубцы» на «гребенке» поверхностно-активного вещества. Эти высокомолекулярные полимеры могут придавать концентратам суспензий очень хорошую долговременную стабильность, так как гидрофобные остовы имеют много точек закрепления на поверхности частиц. Примерами диспергирующих средств, используемых в агрохимических составах, являются: конденсаты нафталинсульфоната натрия и формальдегида; тристирилфенолэтоксилат фосфатные эфиры; этоксилаты алифатических спиртов; алкилэтоксилаты; EO-PO блок-сополимеры; и привитые сополимеры.
Эмульгатор представляет собой вещество, которое стабилизирует суспензию капель одной жидкой фазы в другой жидкой фазе. Без эмульгатора две жидкости будут разделяться на две несмешивающиеся жидкие фазы. Наиболее широко используемые эмульгируемые смеси содержат алкилфенол или алифатический спирт с двенадцатью или более субъединицами этиленоксида и растворимую в масле кальциевую соль додецилбензолсульфоновой кислоты. Диапазон значений гидрофильно-липофильного баланса (HLB) от 8 до 18 будет стандартно обеспечивать хорошие стабильные эмульсии. Стабильность эмульсий иногда можно улучшить путем добавления небольшого количества EO-PO блок-сополимерного поверхностно-активного вещества.
Солюбилизатор представляет собой поверхностно-активное вещество, которое будет образовывать мицеллы в воде при концентрациях выше критической концентрации мицеллообразования. Мицеллы затем способны растворять или солюбилизировать нерастворимые в воде вещества внутри гидрофобной части мицеллы. Типы поверхностно-активных веществ, обычно используемых для солюбилизации, представляют собой неионогенные поверхностно-активные вещества, моноолеаты сорбитана, этоксилаты моноолеатов сорбитана и сложные метилолеатные эфиры.
Поверхностно-активные вещества иногда используют, либо отдельно, либо с другими добавками, такими как минеральные или растительные масла, в качестве адъювантов смесей для опрыскивателя, для улучшения биологического эффекта пестицида на мишень. Типы поверхностно-активных веществ, используемых для биоусиления, как правило, зависят от природы и механизма действия пестицида. Однако часто - это неионогенные поверхностно-активные вещества, такие как алкилэтоксилаты; этоксилаты линейных алифатических спиртов; этоксилаты алифатических аминов.
Носитель или разбавитель в сельскохозяйственном составе представляет собой вещество, добавляемое к пестициду для придания продукту необходимой концентрации. Носители чаще всего представляют собой вещества с высокой абсорбирующей способностью, тогда как разбавители представляют собой вещества с низкой абсорбирующей способностью. Носители и разбавители используют при составлении порошковидных препаратов, смачивающихся порошков, гранул и диспергируемых в воде гранул.
Органические растворители в основном используют при составлении эмульгируемых концентратов, эмульсий типа «масло в воде», суспоэмульсий и ультрамикрообъемных составов, и в меньшей степени в гранулированных составах. Иногда используют смеси растворителей. Первая основная группа растворителей представляет собой алифатические парафиновые масла, такие как керосин или очищенные парафины. Вторая основная группа (и наиболее часто используемая) включает ароматические растворители, такие как ксилол и фракции C9 и C10 ароматических растворителей с более высокой молекулярной массой. Хлорированные углеводороды применимы в качестве сорастворителей для предотвращения кристаллизации пестицидов, когда состав эмульгируют в воде. В качестве сорастворителей иногда используют спирты для увеличения растворяющей способности. Другие растворители могут включать растительные масла, масла из семян и сложные эфиры растительных масел и масел из семян.
Загустители и желирующие средства используют в основном при составлении концентратов суспензий, эмульсий и суспоэмульсий для изменения реологии или свойств текучести жидкости и для предотвращения разделения и осаждения диспергированных частиц или капель. Загустители, желирующие средства и противоосаждающие средства обычно подразделяют на две категории, а именно на нерастворимые в воде твердые частицы и растворимые в воде полимеры. Существует возможность получения концентратов суспензий с использованием глин и кремнеземов. Примеры указанных типов веществ включают без ограничения монтмориллонит, бентонит, алюмосиликат магния и аттапульгит. В течение многих лет в качестве загустителей/желирующих средств использовали растворимые в воде полисахариды. Наиболее широко используемыми типами полисахаридов являются натуральные экстракты семян и морских водорослей или синтетические производные целлюлозы. Примеры указанных типов веществ включают без ограничения гуаровую камедь; камедь бобов рожкового дерева; каррагинан; альгинаты; метилцеллюлозу; карбоксиметилцеллюлозу натрия (SCMC); гидроксиэтилцеллюлозу (HEC). Другие типы противоосаждающих средств основаны на модифицированных крахмалах, полиакрилатах, поливиниловом спирте и полиэтиленоксиде. Другим хорошим противоосаждающим средством является ксантановая камедь.
Микроорганизмы могут служить причиной порчи полученных составов. Поэтому, для устранения или снижения их эффекта, используют консерванты. Примеры таких средств включают без ограничения: пропионовую кислоту и ее натриевую соль; сорбиновую кислоту и ее натриевую и калиевую соли; бензойную кислоту и ее натриевую соль; натриевую соль пара-гидроксибензойной кислоты; метил-пара-гидроксибензоат; и 1,2-бензизотиазолин-3-он (BIT).
Присутствие поверхностно-активных веществ часто вызывает образование пены в составах на водной основе в процессе перемешивания при получении и при использовании с помощью распылителя. С целью снижения тенденции к пенообразованию часто добавляют противовспениватели, как на стадии получения, так и перед заполнением флаконов. Как правило, существует два типа противовспенивателей, а именно силиконы и несиликоны. Силиконы обычно представляют собой водные эмульсии диметилполисилоксана, тогда как несиликоновые противовспениватели представляют собой водорастворимые масла, такие как октанол и нонанол, или диоксид кремния. В обоих случаях функцией противовспенивателя является вытеснение поверхностно-активного вещества с границы раздела воздух-вода.
«Зеленые» средства (например, адъюванты, поверхностно-активные вещества, растворители) могут снижать общий масштаб воздействия защитных сельскохозяйственных составов на окружающую среду. Зеленые средства являются биоразлагаемыми и, как правило, производятся из натуральных и/или неистощимых источников, например, из растительных и животных источников. Конкретными примерами являются: растительные масла, масла из семян и их сложные эфиры, а также алкоксилированные алкилполигликозиды.
Для дальнейшей информации см. “Chemistry and Technology of Agrochemical Formulations” edited by D.A. Knowles, copyright 1998 by Kluwer Academic Publishers. Также см. “Insecticides in Agriculture and Environment - Retrospects and Prospects” by A.S. Perry, I. Yamamoto, I. Ishaaya, and R. Perry, copyright 1998 by Springer-Verlag.
ВРЕДИТЕЛИ
В целом, молекулы формулы 1 могут быть использованы для контроля вредителей, например, жуков, уховерток, тараканов, мух, тлей, щитовок, белокрылок, цикадок, муравьев, ос, термитов, мотыльков, бабочек, вшей, кузнечиковых, саранчевых, сверчков, блох, трипсов, щетинохвосток, клещей, иксодовых клещей, нематод и многоножек.
Согласно другому варианту осуществления, молекулы формулы 1 могут быть использованы для контроля вредителей из типа Nematoda и/или Arthropoda.
Согласно другому варианту осуществления, молекулы формулы 1 могут быть использованы для контроля вредителей из подтипа Chelicerata, Myriapoda и/или Hexapoda.
Согласно другому варианту осуществления, молекулы формулы 1 могут быть использованы для контроля вредителей из классов Arachnida, Symphyla и/или Insecta.
Согласно другому варианту осуществления, молекулы формулы 1 могут быть использованы для контроля вредителей из отряда Anoplura. Неисчерпывающий перечень конкретных родов включает без ограничения Haematopinus spp., Hoplopleura spp., Linognathus spp., Pediculus spp. и Polyplax spp. Неисчерпывающий перечень конкретных видов включает без ограничения Haematopinus asini, Haematopinus suis, Linognathus setosus, Linognathus ovillus, Pediculus humanus capitis, Pediculus humanus humanus и Pthirus pubis.
Согласно другому варианту осуществления, молекулы формулы 1 могут быть использованы для контроля вредителей из отряда Coleoptera. Неисчерпывающий перечень конкретных родов включает без ограничения Acanthoscelides spp., Agriotes spp., Anthonomus spp., Apion spp., Apogonia spp., Aulacophora spp., Bruchus spp., Cerosterna spp., Cerotoma spp., Ceutorhynchus spp., Chaetocnema spp., Colaspis spp., Ctenicera spp., Curculio spp., Cyclocephala spp., Diabrotica spp., Hypera spp., Ips spp., Lyctus spp., Megascelis spp., Meligethes spp., Otiorhynchus spp., Pantomorus spp., Phyllophaga spp., Phyllotreta spp., Rhizotrogus spp., Rhynchites spp., Rhynchophorus spp., Scolytus spp., Sphenophorus spp., Sitophilus spp. и Tribolium spp. Неисчерпывающий перечень конкретных видов включает без ограничения Acanthoscelides obtectus, Agrilus planipennis, Anoplophora glabripennis, Anthonomus grandis, Ataenius spretulus, Atomaria linearis, Bothynoderes punctiventris, Bruchus pisorum, Callosobruchus maculatus, Carpophilus hemipterus, Cassida vittata, Cerotoma trifurcata, Ceutorhynchus assimilis, Ceutorhynchus napi, Conoderus scalaris, Conoderus stigmosus, Conotrachelus nenuphar, Cotinis nitida, Crioceris asparagi, Cryptolestes ferrugineus, Cryptolestes pusillus, Cryptolestes turcicus, Cylindrocopturus adspersus, Deporaus marginatus, Dermestes lardarius, Dermestes maculatus, Epilachna varivestis, Faustinus cubae, Hylobius pales, Hypera postica, Hypothenemus hampei, Lasioderma serricorne, Leptinotarsa decemlineata, Liogenys fuscus, Liogenys suturalis, Lissorhoptrus oryzophilus, Maecolaspis joliveti, Melanotus communis, Meligethes aeneus, Melolontha melolontha, Oberea brevis, Oberea linearis, Oryctes rhinoceros, Oryzaephilus mercator, Oryzaephilus surinamensis, Oulema melanopus, Oulema oryzae, Phyllophaga cuyabana, Popillia japonica, Prostephanus truncatus, Rhyzopertha dominica, Sitona lineatus, Sitophilus granarius, Sitophilus oryzae, Sitophilus zeamais, Stegobium paniceum, Tribolium castaneum, Tribolium confusum, Trogoderma variabile и Zabrus tenebrioides.
Согласно другому варианту осуществления, молекулы формулы 1 могут быть использованы для контроля вредителей отряда Dermaptera.
Согласно другому варианту осуществления, молекулы формулы 1 могут быть использованы для контроля вредителей отряда Blattaria. Неисчерпывающий перечень конкретных видов включает без ограничения Blattella germanica, Blatta orientalis, Parcoblatta pennsylvanica, Periplaneta americana, Periplaneta australasiae, Periplaneta brunnea, Periplaneta fuliginosa, Pycnoscelus surinamensis и Supella longipalpa.
Согласно другому варианту осуществления, молекулы формулы 1 могут быть использованы для контроля вредителей отряда Diptera. Неисчерпывающий перечень конкретных родов включает без ограничения Aedes spp., Agromyza spp., Anastrepha spp., Anopheles spp., Bactrocera spp., Ceratitis spp., Chrysops spp., Cochliomyia spp., Contarinia spp., Culex spp., Dasineura spp., Delia spp., Drosophila spp., Fannia spp., Hylemyia spp., Liriomyza spp., Musca spp., Phorbia spp., Tabanus spp. и Tipula spp. Неисчерпывающий перечень конкретных видов включает без ограничения Agromyza frontella, Anastrepha suspensa, Anastrepha ludens, Anastrepha obliqa, Bactrocera cucurbitae, Bactrocera dorsalis, Bactrocera invadens, Bactrocera zonata, Ceratitis capitata, Dasineura brassicae, Delia platura, Fannia canicularis, Fannia scalaris, Gasterophilus intestinalis, Gracillia perseae, Haematobia irritans, Hypoderma lineatum, Liriomyza brassicae, Melophagus ovinus, Musca autumnalis, Musca domestica, Oestrus ovis, Oscinella frit, Pegomya betae, Psila rosae, Rhagoletis cerasi, Rhagoletis pomonella, Rhagoletis mendax, Sitodiplosis mosellana и Stomoxys calcitrans.
Согласно другому варианту осуществления, молекулы формулы 1 могут быть использованы для контроля вредителей отряда Hemiptera. Неисчерпывающий перечень конкретных родов включает без ограничения Adelges spp., Aulacaspis spp., Aphrophora spp., Aphis spp., Bemisia spp., Ceroplastes spp., Chionaspis spp., Chrysomphalus spp., Coccus spp., Empoasca spp., Lepidosaphes spp., Lagynotomus spp., Lygus spp., Macrosiphum spp., Nephotettix spp., Nezara spp., Philaenus spp., Phytocoris spp., Piezodorus spp., Planococcus spp., Pseudococcus spp., Rhopalosiphum spp., Saissetia spp., Therioaphis spp., Toumeyella spp., Toxoptera spp., Trialeurodes spp., Triatoma spp. и Unaspis spp. Неисчерпывающий перечень конкретных видов включает без ограничения Acrosternum hilare, Acyrthosiphon pisum, Aleyrodes proletella, Aleurodicus dispersus, Aleurothrixus floccosus, Amrasca biguttula biguttula, Aonidiella aurantii, Aphis gossypii, Aphis glycines, Aphis pomi, Aulacorthum solani, Bemisia argentifolii, Bemisia tabaci, Blissus leucopterus, Brachycorynella asparagi, Brevennia rehi, Brevicoryne brassicae, Calocoris norvegicus, Ceroplastes rubens, Cimex hemipterus, Cimex lectularius, Dagbertus fasciatus, Dichelops furcatus, Diuraphis noxia, Diaphorina citri, Dysaphis plantaginea, Dysdercus suturellus, Edessa meditabunda, Eriosoma lanigerum, Eurygaster maura, Euschistus heros, Euschistus servus, Helopeltis antonii, Helopeltis theivora, Icerya purchasi, Idioscopus nitidulus, Laodelphax striatellus, Leptocorisa oratorius, Leptocorisa varicornis, Lygus hesperus, Maconellicoccus hirsutus, Macrosiphum euphorbiae, Macrosiphum granarium, Macrosiphum rosae, Macrosteles quadrilineatus, Mahanarva frimbiolata, Metopolophium dirhodum, Mictis longicornis, Myzus persicae, Nephotettix cinctipes, Neurocolpus longirostris, Nezara viridula, Nilaparvata lugens, Parlatoria pergandii, Parlatoria ziziphi, Peregrinus maidis, Phylloxera vitifoliae, Physokermes piceae, Phytocoris californicus, Phytocoris relativus, Piezodorus guildinii, Poecilocapsus lineatus, Psallus vaccinicola, Pseudacysta perseae, Pseudococcus brevipes, Quadraspidiotus perniciosus, Rhopalosiphum maidis, Rhopalosiphum padi, Saissetia oleae, Scaptocoris castanea, Schizaphis graminum, Sitobion avenae, Sogatella furcifera, Trialeurodes vaporariorum, Trialeurodes abutiloneus, Unaspis yanonensis и Zulia entrerriana.
Согласно другому варианту осуществления, молекулы формулы 1 могут быть использованы для контроля вредителей отряда Hymenoptera. Неисчерпывающий перечень конкретных родов включает без ограничения Acromyrmex spp., Atta spp., Camponotus spp., Diprion spp., Formica spp., Monomorium spp., Neodiprion spp., Pogonomyrmex spp., Polistes spp., Solenopsis spp., Vespula spp. и Xylocopa spp. Неисчерпывающий перечень конкретных видов включает без ограничения Athalia rosae, Atta texana, Iridomyrmex humilis, Monomorium minimum, Monomorium pharaonis, Solenopsis invicta, Solenopsis geminata, Solenopsis molesta, Solenopsis richtery, Solenopsis xyloni и Tapinoma sessile.
Согласно другому варианту осуществления, молекулы формулы 1 могут быть использованы для контроля вредителей отряда Isoptera. Неисчерпывающий перечень конкретных родов включает без ограничения Coptotermes spp., Cornitermes spp., Cryptotermes spp., Heterotermes spp., Kalotermes spp., Incisitermes spp., Macrotermes spp., Marginitermes spp., Microcerotermes spp., Procornitermes spp., Reticulitermes spp., Schedorhinotermes spp. и Zootermopsis spp. Неисчерпывающий перечень конкретных видов включает без ограничения Coptotermes curvignathus, Coptotermes frenchi, Coptotermes formosanus, Heterotermes aureus, Microtermes obesi, Reticulitermes banyulensis, Reticulitermes grassei, Reticulitermes flavipes, Reticulitermes hageni, Reticulitermes hesperus, Reticulitermes santonensis, Reticulitermes speratus, Reticulitermes tibialis и Reticulitermes virginicus.
Согласно другому варианту осуществления, молекулы формулы 1 могут быть использованы для контроля вредителей отряда Lepidoptera. Неисчерпывающий перечень конкретных родов включает без ограничения Adoxophyes spp., Agrotis spp., Argyrotaenia spp., Cacoecia spp., Caloptilia spp., Chilo spp., Chrysodeixis spp., Colias spp., Crambus spp., Diaphania spp., Diatraea spp., Earias spp., Ephestia spp., Epimecis spp., Feltia spp., Gortyna spp., Helicoverpa spp., Heliothis spp., Indarbela spp., Lithocolletis spp., Loxagrotis spp., Malacosoma spp., Peridroma spp., Phyllonorycter spp., Pseudaletia spp., Sesamia spp., Spodoptera spp., Synanthedon spp. и Yponomeuta spp. Неисчерпывающий перечень конкретных видов включает без ограничения Achaea janata, Adoxophyes orana, Agrotis ipsilon, Alabama argillacea, Amorbia cuneana, Amyelois transitella, Anacamptodes defectaria, Anarsia lineatella, Anomis sabulifera, Anticarsia gemmatalis, Archips argyrospila, Archips rosana, Argyrotaenia citrana, Autographa gamma, Bonagota cranaodes, Borbo cinnara, Bucculatrix thurberiella, Capua reticulana, Carposina niponensis, Chlumetia transversa, Choristoneura rosaceana, Cnaphalocrocis medinalis, Conopomorpha cramerella, Cossus cossus, Cydia caryana, Cydia funebrana, Cydia molesta, Cydia nigricana, Cydia pomonella, Darna diducta, Diatraea saccharalis, Diatraea grandiosella, Earias insulana, Earias vittella, Ecdytolopha aurantianum, Elasmopalpus lignosellus, Ephestia cautella, Ephestia elutella, Ephestia kuehniella, Epinotia aporema, Epiphyas postvittana, Erionota thrax, Eupoecilia ambiguella, Euxoa auxiliaris, Grapholita molesta, Hedylepta indicata, Helicoverpa armigera, Helicoverpa zea, Heliothis virescens, Hellula undalis, Keiferia lycopersicella, Leucinodes orbonalis, Leucoptera coffeella, Leucoptera malifoliella, Lobesia botrana, Loxagrotis albicosta, Lymantria dispar, Lyonetia clerkella, Mahasena corbetti, Mamestra brassicae, Maruca testulalis, Metisa plana, Mythimna unipuncta, Neoleucinodes elegantalis, Nymphula depunctalis, Operophtera brumata, Ostrinia nubilalis, Oxydia vesulia, Pandemis cerasana, Pandemis heparana, Papilio demodocus, Pectinophora gossypiella, Peridroma saucia, Perileucoptera coffeella, Phthorimaea operculella, Phyllocnistis citrella, Pieris rapae, Plathypena scabra, Plodia interpunctella, Plutella xylostella, Polychrosis viteana, Prays endocarpa, Prays oleae, Pseudaletia unipuncta, Pseudoplusia includens, Rachiplusia nu, Scirpophaga incertulas, Sesamia inferens, Sesamia nonagrioides, Setora nitens, Sitotroga cerealella, Sparganothis pilleriana, Spodoptera exigua, Spodoptera frugiperda, Spodoptera eridania, Thecla basilides, Tineola bisselliella, Trichoplusia ni, Tuta absoluta, Zeuzera coffeae и Zeuzera pyrina.
Согласно другому варианту осуществления, молекулы формулы 1 могут быть использованы для контроля вредителей отряда Mallophaga. Неисчерпывающий перечень конкретных родов включает без ограничения Anaticola spp., Bovicola spp., Chelopistes spp., Goniodes spp., Menacanthus spp. и Trichodectes spp. Неисчерпывающий перечень конкретных видов включает без ограничения Bovicola bovis, Bovicola caprae, Bovicola ovis, Chelopistes meleagridis, Goniodes dissimilis, Goniodes gigas, Menacanthus stramineus, Menopon gallinae и Trichodectes canis.
Согласно другому варианту осуществления, молекулы формулы 1 могут быть использованы для контроля вредителей отряда Orthoptera. Неисчерпывающий перечень конкретных родов включает без ограничения Melanoplus spp. и Pterophylla spp. Неисчерпывающий перечень конкретных видов включает без ограничения Anabrus simplex, Gryllotalpa africana, Gryllotalpa australis, Gryllotalpa brachyptera, Gryllotalpa hexadactyla, Locusta migratoria, Microcentrum retinerve, Schistocerca gregaria и Scudderia furcata.
Согласно другому варианту осуществления, молекулы формулы 1 могут быть использованы для контроля вредителей отряда Siphonaptera. Неисчерпывающий перечень конкретных видов включает без ограничения Ceratophyllus gallinae, Ceratophyllus niger, Ctenocephalides canis, Ctenocephalides felis и Pulex irritans.
Согласно другому варианту осуществления, молекулы формулы 1 могут быть использованы для контроля вредителей отряда Thysanoptera. Неисчерпывающий перечень конкретных родов включает без ограничения Caliothrips spp., Frankliniella spp., Scirtothrips spp. и Thrips spp. Неисчерпывающий перечень конкретных видов включает без ограничения Frankliniella fusca, Frankliniella occidentalis, Frankliniella schultzei, Frankliniella williamsi, Heliothrips haemorrhoidalis, Rhipiphorothrips cruentatus, Scirtothrips citri, Scirtothrips dorsalis и Taeniothrips rhopalantennalis, Thrips hawaiiensis, Thrips nigropilosus, Thrips orientalis, Thrips tabaci.
Согласно другому варианту осуществления, молекулы формулы 1 могут быть использованы для контроля вредителей отряда Thysanura. Неисчерпывающий перечень конкретных родов включает без ограничения Lepisma spp. и Thermobia spp.
Согласно другому варианту осуществления, молекулы формулы 1 могут быть использованы для контроля вредителей отряда Acarina. Неисчерпывающий перечень конкретных родов включает без ограничения Acarus spp., Aculops spp., Boophilus spp., Demodex spp., Dermacentor spp., Epitrimerus spp., Eriophyes spp., Ixodes spp., Oligonychus spp., Panonychus spp., Rhizoglyphus spp. и Tetranychus spp. Неисчерпывающий перечень конкретных видов включает без ограничения Acarapis woodi, Acarus siro, Aceria mangiferae, Aculops lycopersici, Aculus pelekassi, Aculus schlechtendali, Amblyomma americanum, Brevipalpus obovatus, Brevipalpus phoenicis, Dermacentor variabilis, Dermatophagoides pteronyssinus, Eotetranychus carpini, Notoedres cati, Oligonychus coffeae, Oligonychus ilicis, Panonychus citri, Panonychus ulmi, Phyllocoptruta oleivora, Polyphagotarsonemus latus, Rhipicephalus sanguineus, Sarcoptes scabiei, Tegolophus perseaflorae, Tetranychus urticae и Varroa destructor.
Согласно другому варианту осуществления, молекулы формулы 1 могут быть использованы для контроля вредителя отряда Symphyla. Неисчерпывающий перечень конкретных видов включает без ограничения Scutigerella immaculata.
Согласно другому варианту осуществления, молекулы формулы 1 могут быть использованы для контроля вредителей типа Nematoda. Неисчерпывающий перечень конкретных родов включает без ограничения Aphelenchoides spp., Belonolaimus spp., Criconemella spp., Ditylenchus spp., Heterodera spp., Hirschmanniella spp., Hoplolaimus spp., Meloidogyne spp., Pratylenchus spp. и Radopholus spp. Неисчерпывающий перечень конкретных видов включает без ограничения Dirofilaria immitis, Heterodera zeae, Meloidogyne incognita, Meloidogyne javanica, Onchocerca volvulus, Radopholus similis и Rotylenchulus reniformis.
Для дополнительной информации см. “Handbook of Pest Control - The Behavior, Life History, and Control of Household Pests” by Arnold Mallis, 9th Edition, copyright 2004 by GIE Media Inc.
ВНЕСЕНИЯ
Для обеспечения контроля молекулы формулы 1, как правило, применяют в количествах от приблизительно 0,01 г на гектар до приблизительно 5000 г на гектар. Обычно предпочтительными являются количества от приблизительно 0,1 г на гектар до приблизительно 500 г на гектар, а более предпочтительными являются количества от приблизительно 1 г на гектар до приблизительно 50 г на гектар.
Площадью, на которую наносится молекула формулы 1, может служить любая площадь, заселенная (или предположительно заселенная или пересекаемая) вредителем, например: на которой выращиваются сельскохозяйственные культуры, деревья, фруктовые культуры, зерновые культуры, виды кормовых растений, сорта винограда, газонные и декоративные растения; на которой живут одомашненные животные; внутренние или внешние поверхности зданий (таких как помещения для хранения зерна), материалы конструкций, применяемые в строительстве (такие как пропитанная древесина), и почва вокруг зданий. Конкретные возделываемые посевные площади, на которых применяется молекула формулы 1, предусматривают площади, на которых будут высажены яблони, кукуруза, подсолнечник, хлопчатник, соя, канола, пшеница, рис, сорго, ячмень, овес, картофель, апельсины, люцерна, латук, земляника, томаты, перец, крестоцветные, груши, табак, миндаль, сахарная свекла, фасоль и другие ценные культурные растения или их семена. Также выгодно при выращивании различных растений с молекулой формулы 1 применять сульфат аммония.
Контроль вредителей в общих чертах означает, что на площади снижаются популяции насекомых, активность вредителей или оба показателя. Это может происходить в таких случаях: популяции насекомых отпугиваются от площади; вредители являются неспособными к размножению на площади или вокруг нее; или вредители уничтожаются, полностью или частично, на площади или вокруг нее. Разумеется, может наблюдаться комбинация этих результатов. Как правило, популяции вредителей, активность или оба показателя желательно снижать более чем на пятьдесят процентов, предпочтительно более чем на 90 процентов. Как правило, площадь не является площадью внутри организма человека или на его поверхности; следовательно, участком обычно является отличная от человеческого организма площадь.
Молекулы формулы 1 могут быть использованы в смесях, наноситься одновременно или последовательно, отдельно или с другими соединениями для усиления мощности растения (например, для роста лучшей корневой системы, для лучшего противостояния стрессовым условиям выращивания). Такими другими соединениями являются, например, соединения, которые модулируют этиленовые рецепторы растений, особенно 1-метилциклопропен (также известный как 1-MCP). Кроме того, такие молекулы могут быть использованы в периоды, когда активность вредителей низкая, например, до того, как выращиваемые растения начинают давать ценное сельскохозяйственное сырье. Такие периоды включают ранний сезон посадки, когда нагрузка вредителей обычно низкая.
Молекулы формулы 1 для контроля вредителей могут быть нанесены на листву и плодоносящие участки растений. Либо молекулы будут вступать в непосредственный контакт с вредителем, либо вредитель будет поглощать пестицид, поедая листву, плодовую массу или выделяющийся сок, который содержит пестицид. Молекулы формулы 1 также могут быть внесены в почву, и при внесении таким способом можно контролировать поедающих корень и стебель вредителей. Корни могут всасывать молекулу и передавать ее в листовые участки растения, при этом будут контролироваться наземные грызущие и питающиеся соком вредители.
Что касается приманок, то они, как правило, размещаются на почве, где, например, термиты могут вступать в контакт с приманкой и/или могут быть привлечены ею. Приманки также могут быть нанесены на поверхность здания (горизонтальную, вертикальную или наклонную поверхность), где, например, муравьи, термиты, тараканы и мухи могут вступать в контакт с приманкой и/или могут быть привлечены ею. Приманки могут содержать молекулу формулы 1.
Молекулы формулы 1 могут быть заключены внутрь или помещены на поверхность капсулы. Размер капсул может варьировать от нанометрового размера (приблизительно 100-900 нм в диаметре) до микрометрового размера (приблизительно 10-900 мкм в диаметре).
Из-за уникальной способности яиц некоторых вредителей быть устойчивыми к некоторым пестицидам, для контроля заново появившихся личинок могут понадобиться повторные внесения молекул формулы 1.
Системное перемещение пестицидов в растениях могут быть использованы для контроля вредителей на одной части растения путем нанесения (например, с помощью опрыскивания площади) молекул формулы 1 на другую часть растения. Например, контроль питающихся листьями насекомых может быть достигнут путем капельного орошения или внесения в борозды, путем обработки почвы, например, допосевным или послепосевным пропитыванием почвы, или путем обработки семян растения перед посевом.
Обработка семян может быть применена для всех типов семян, в том числе семян, из которых прорастут растения, генномодифицированные для экспрессии специальных признаков. Типичные примеры включают семена, экспрессирующие белки, токсичные для беспозвоночных вредителей, например, токсин Bacillus thuringiensis или другие инсектицидные токсины, семена, проявляющие устойчивость к гербицидам, например, устойчивые к гербициду раундап семена, или семена с «упакованными» чужеродными генами, экспрессирующие инсектицидные токсины, устойчивость к гербицидам, усиление усвоения питательных веществ, засухоустойчивость или какие-либо другие полезные признаки. Кроме того, такие обработки семян молекулами формулы 1 дополнительно могут улучшать способность растения к лучшему противостоянию стрессовым условиям выращивания. Это обеспечивает жизнеспособное, более сильное растение, которое в период сбора урожая может дать более высокие урожаи. Как правило, считается, что количества от приблизительно 1 г молекул формулы 1 до приблизительно 500 г на 100000 семян обеспечивают хороший эффект, считается, что количества от приблизительно 10 г до приблизительно 100 г на 100000 семян обеспечивают больший эффект, и считается, что количества от приблизительно 25 г до приблизительно 75 г на 100000 семян обеспечат еще больший эффект.
Должно быть совершенно очевидно, что молекулы формулы 1 могут быть использованы на растениях, в растениях или вокруг растений, генномодифицированных для экспрессии специальных признаков, например, токсинов Bacillus thuringiensis или других инсектицидных токсинов, или растений, экспрессирующих устойчивость к гербицидам, или растений с «упакованными» чужеродными генами, экспрессирующих инсектицидные токсины, устойчивость к гербицидам, усиление усвоения питательных веществ, засухоустойчивость или какие-либо другие полезные признаки.
Молекулы формулы 1 могут быть использованы для контроля эндопаразитов и эктопаразитов в области ветеринарной медицины или в области содержания отличных от человека животных. Молекулы формулы 1 применяют, например, путем перорального введения, например, в форме таблеток, капсул, напитков, гранул, накожных аппликаций, например, в форме погружения, распыления, наливания, точечного нанесения и опудривания, а также путем парентерального введения, например, в форме инъекции.
Молекулы формулы 1 также могут успешно использоваться при содержании сельскохозяйственных животных, например, крупного рогатого скота, овец, свиней, кур и гусей. Они также могут успешно использоваться для домашних животных, таких как, лошади, собаки и кошки. Особенно подлежат контролю блохи и иксодовые клещи, которые докучают таким животным. Приемлемые составы вводят животным перорально с питьевой водой или кормом. Дозировки и составы, которые являются приемлемыми, зависят от видов.
Молекулы формулы 1 также могут быть использованы для контроля у вышеперечисленных животных паразитических червей, особенно в кишечнике.
Молекулы формулы 1 также могут применяться в терапевтических методах оказания медицинской помощи человеку. Такие методы предусматривают без ограничения пероральное введение, например, в форме таблеток, капсул, напитков, гранул, а также накожных аппликаций.
По всему миру вредители мигрируют в новую (для такого вредителя) окружающую среду и становятся после этого новыми инвазивными видами в этой новой окружающей среде. Молекулы формулы 1 также могут быть использованы на таких новых инвазивных видах для их контроля в этой новой окружающей среде.
Молекулы формулы 1 также могут быть использованы на площади, на которой выращиваются растения, такие как культурные растения, (например, до посева, в период посева, до сбора урожая), и на которой наблюдаются низкие уровни (даже без фактического присутствия) вредителей, которые могут наносить таким растениям коммерческий ущерб. Применение этих молекул на такой площади приносит пользу растениям, выращиваемым на площади. Такая польза может включать без ограничения улучшение жизнеспособности растения, увеличение урожая с растения (например, повышенная биомасса и/или повышенное содержание ценных ингредиентов), улучшение мощности растения (например, улучшенный рост растения и/или более зеленая листва), улучшение качества растения (например, улучшенное содержание или композиция определенных ингредиентов) и улучшение выносливости растения к абиотическому и/или биотическому стрессу.
До того как пестицид может быть использован или продан в коммерческом масштабе, такой пестицид подлежит длительным процессам оценки различными государственными органами (местными, региональными, государственными, национальными и международнями). Многочисленные требования к данным определяются контролирующими органами и должны учитываться при получении и предоставлении данных регистрантом продукта или третьей стороной, действующей от имени регистранта продукта, часто с использованием компьютера с подключением к Всемирной паутине. Затем эти государственные органы рассматривают такие данные и, если имеется заключение о безопасности, предоставляют подтверждение регистрации продукта потенциальному потребителю или продавцу. После этого такой потребитель или продавец может использовать этот пестицид в той местности, где регистрация продукта разрешается и предоставляется.
Молекула формулы 1 может быть протестирована для определения ее эффективности против вредителей. Кроме того, для определения, обладает ли указанная молекула механизмом действия, отличным от такового у других пестицидов, могут быть проведены исследования механизма действия. Затем эти полученные данные могут быть предоставлены третьим сторонам, например, с помощью Интернета.
Заголовки в настоящем документе предоставляются исключительно для удобства, и не должны использоваться для интерпретации какой-либо части настоящего документа.
Разел «ТАБЛИЦЫ» представлен в графической части после Формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПЕСТИЦИДНЫЕ КОМПОЗИЦИИ И ОТНОСЯЩИЕСЯ К НИМ СПОСОБЫ | 2013 |
|
RU2623233C2 |
| ПЕСТИЦИДНЫЕ КОМПОЗИЦИИ И ОТНОСЯЩИЕСЯ К НИМ СПОСОБЫ | 2013 |
|
RU2651369C1 |
| ПЕСТИЦИДНАЯ КОМПОЗИЦИЯ, СПОСОБ КОНТРОЛЯ ВРЕДИТЕЛЕЙ, СПОСОБ КОНТРОЛЯ ЭНДОПАРАЗИТОВ, ЭКТОПАРАЗИТОВ ИЛИ ОБОИХ И СПОСОБ УСИЛЕНИЯ ЖИЗНЕСТОЙКОСТИ РАСТЕНИЙ | 2011 |
|
RU2576316C2 |
| ПЕСТИЦИДНЫЕ КОМПОЗИЦИИ И СПОСОБЫ, ОТНОСЯЩИЕСЯ К НИМ | 2012 |
|
RU2605537C2 |
| ПЕСТИЦИДНЫЕ КОМПОЗИЦИИ И СООТВЕТСТВУЮЩИЕ СПОСОБЫ | 2014 |
|
RU2656894C2 |
| ПЕСТИЦИДНЫЕ КОМПОЗИЦИИ | 2010 |
|
RU2550352C2 |
| 1Н-ПИРАЗОЛО[3,4-B]ПИРИДИНЫ И ИХ ТЕРАПЕВТИЧЕСКИЕ ПРИМЕНЕНИЯ | 2013 |
|
RU2689141C2 |
| ПЕСТИЦИДНЫЕ КОМПОЗИЦИИ | 2011 |
|
RU2606641C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛОПИРИДИНА В КАЧЕСТВЕ БЛОКАТОРОВ TTX-S | 2013 |
|
RU2652117C2 |
| ПЕСТИЦИДНАЯ КОМПОЗИЦИЯ | 2011 |
|
RU2571076C2 |

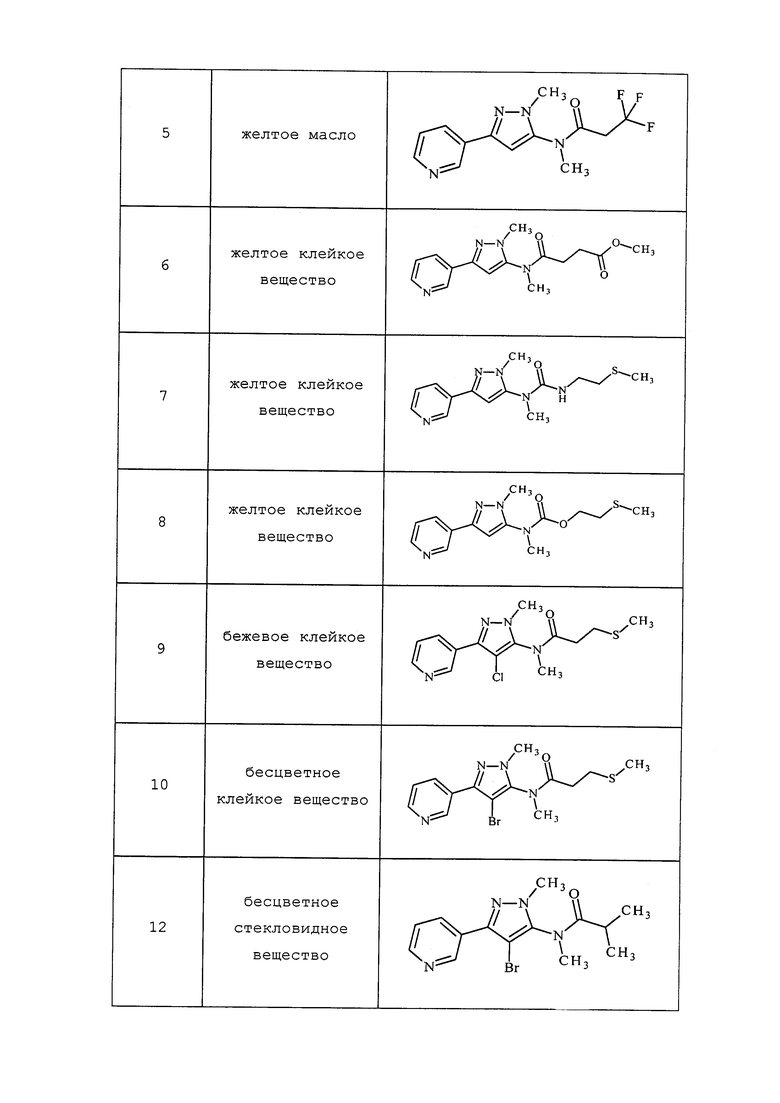
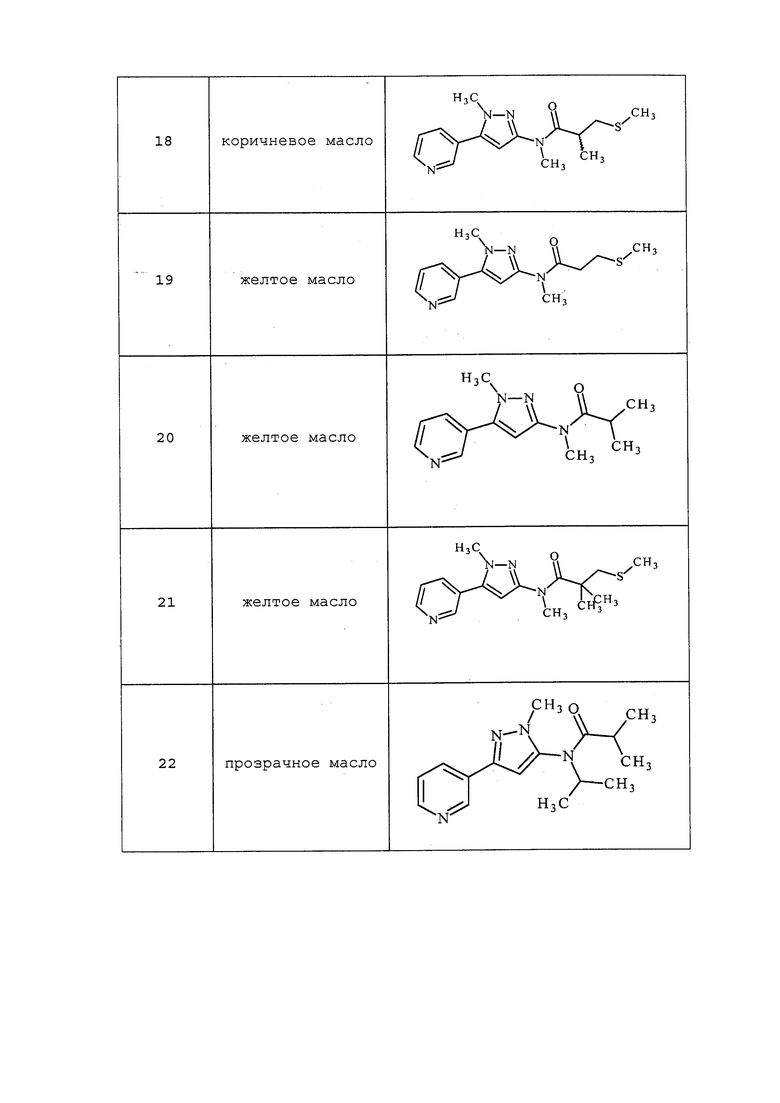
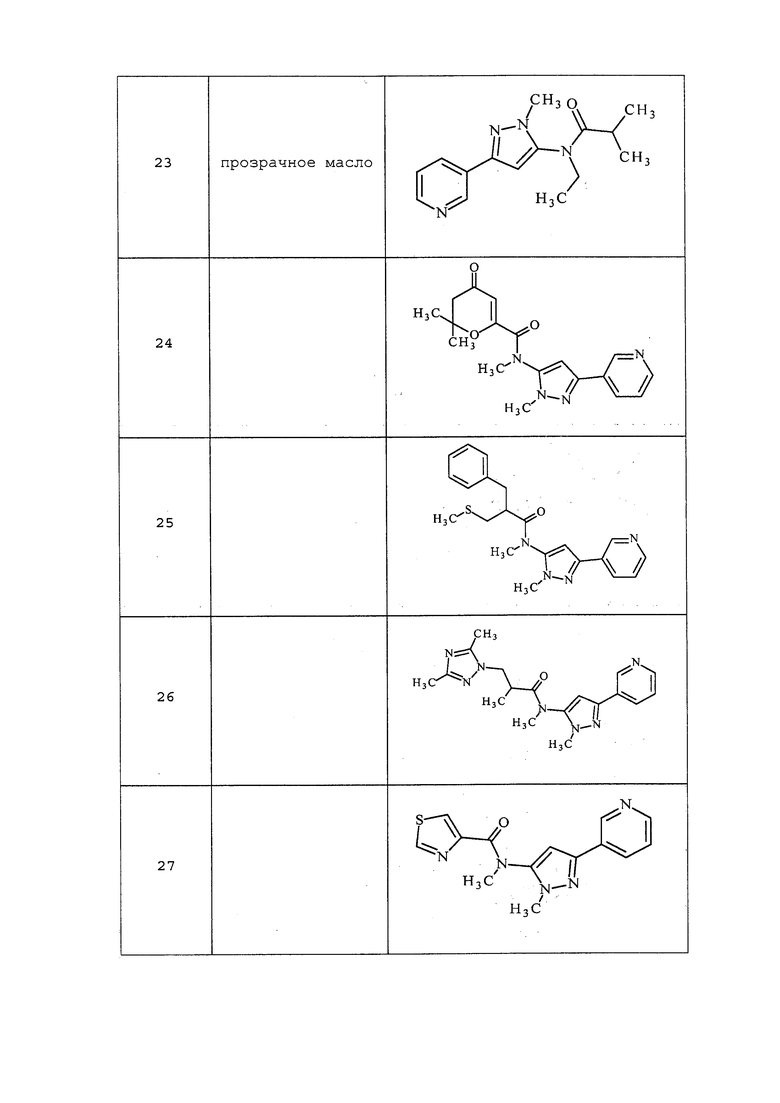
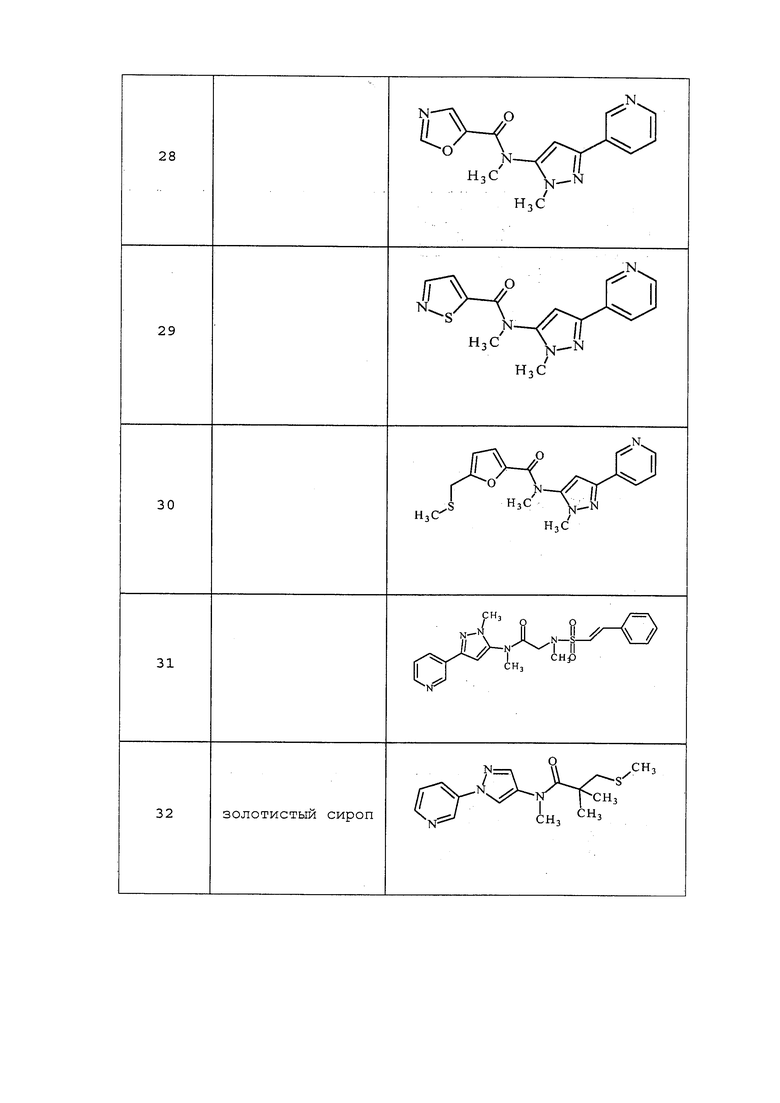
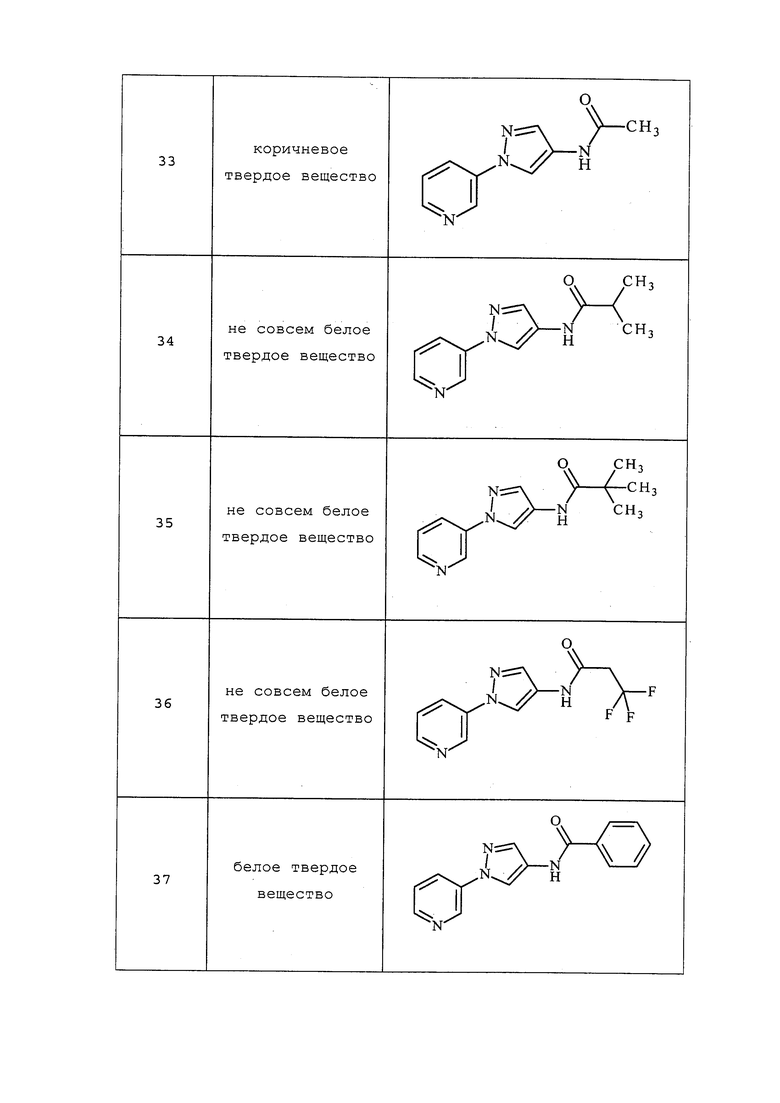
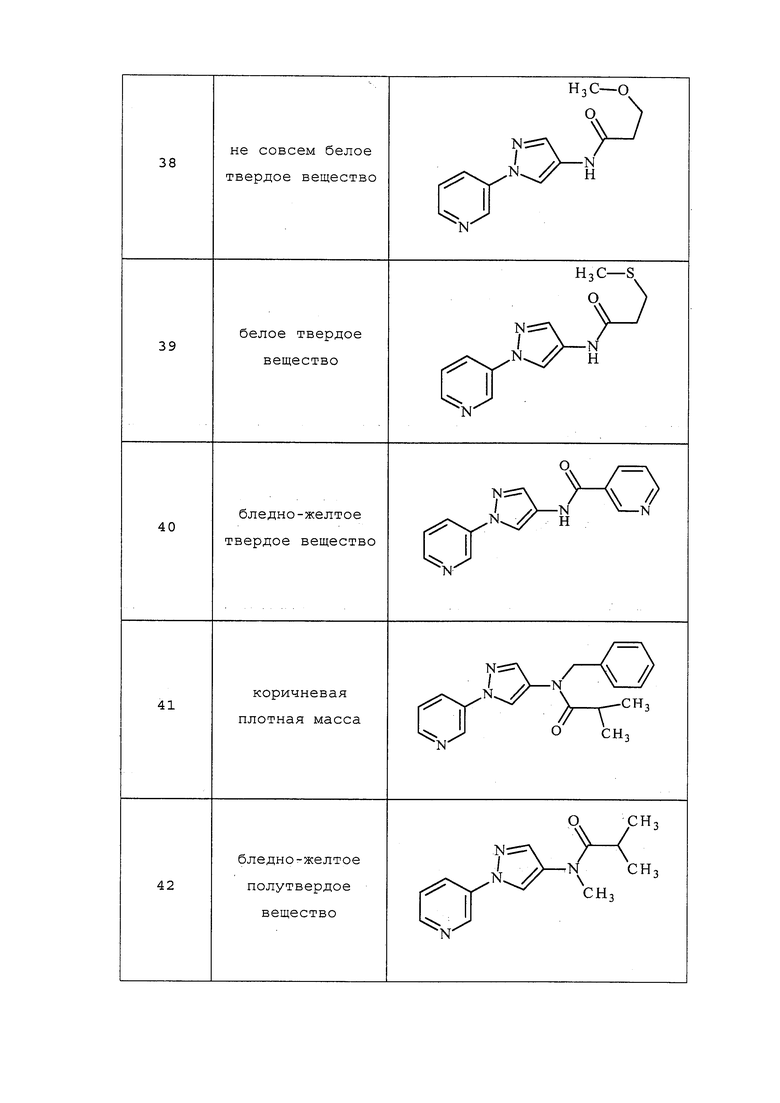
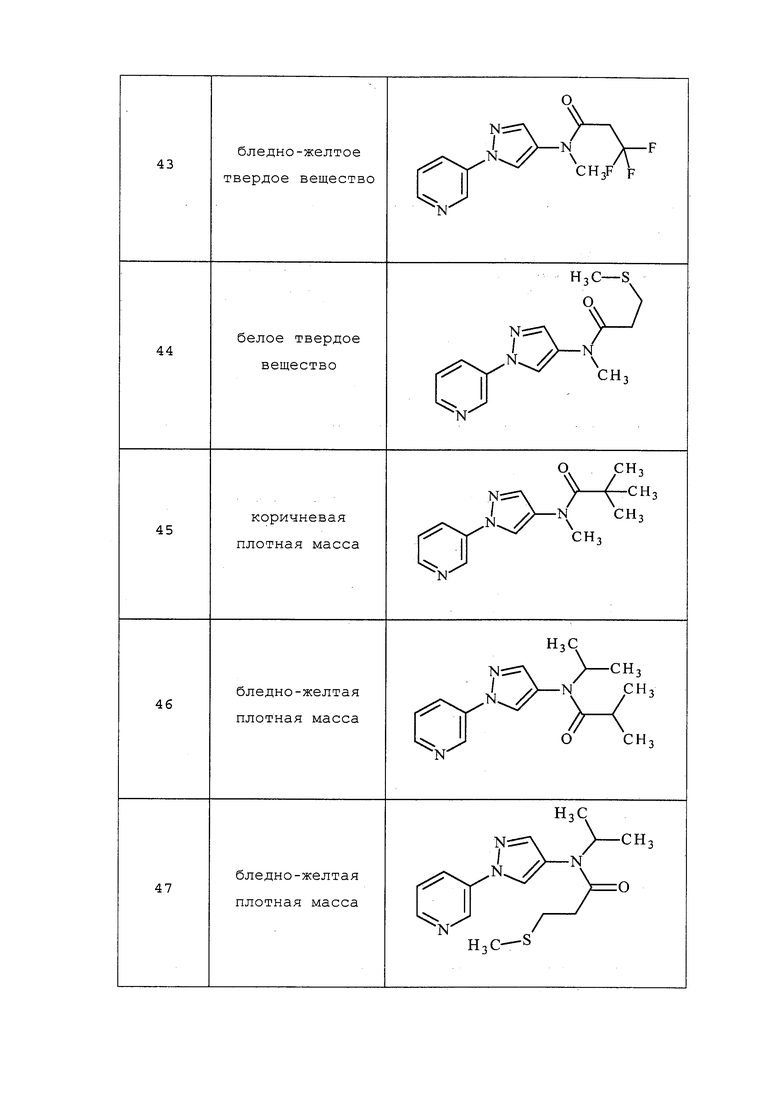
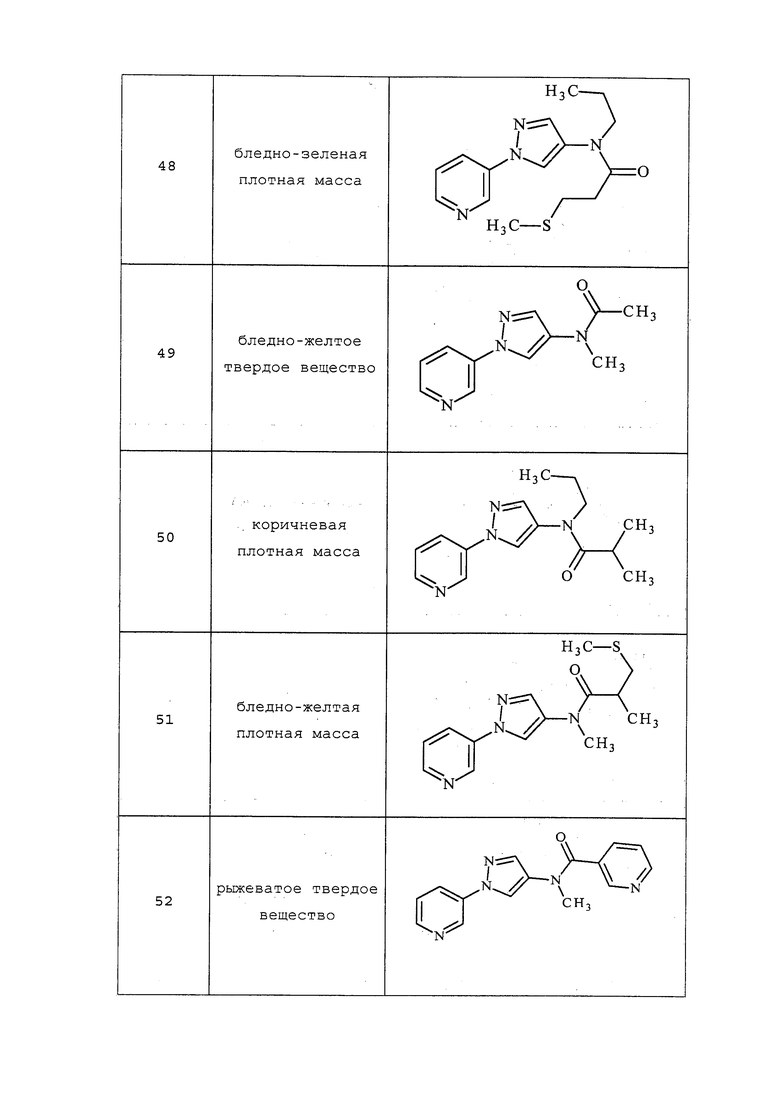
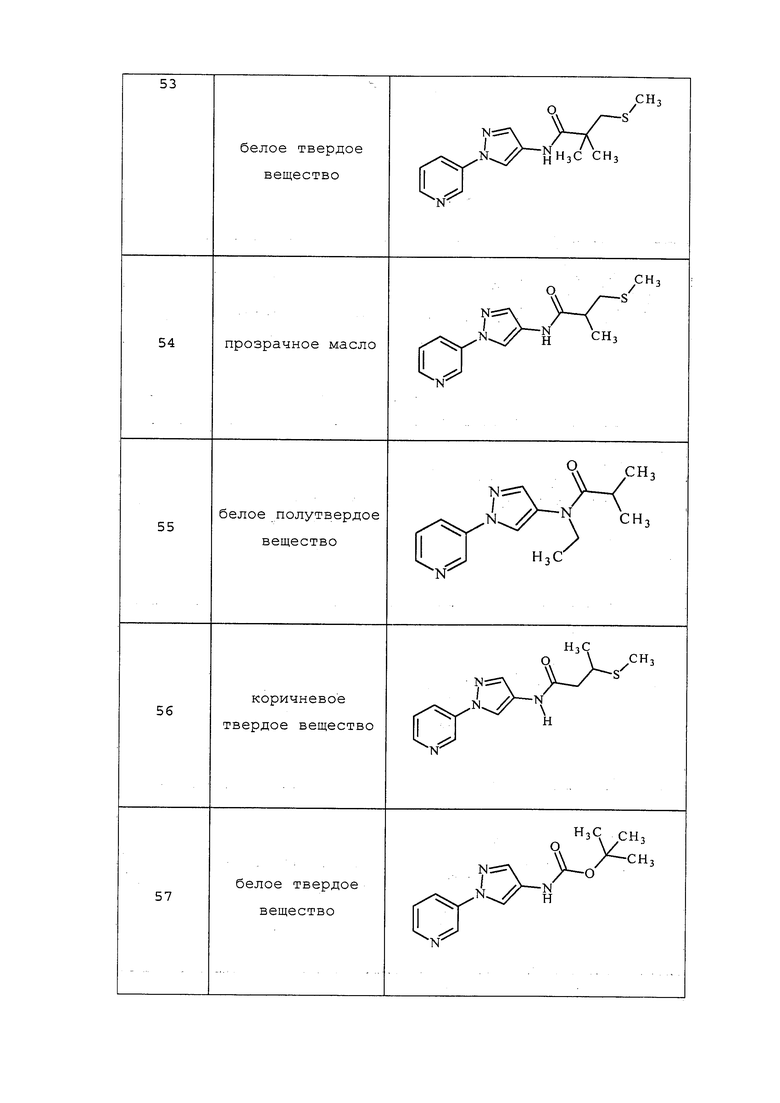
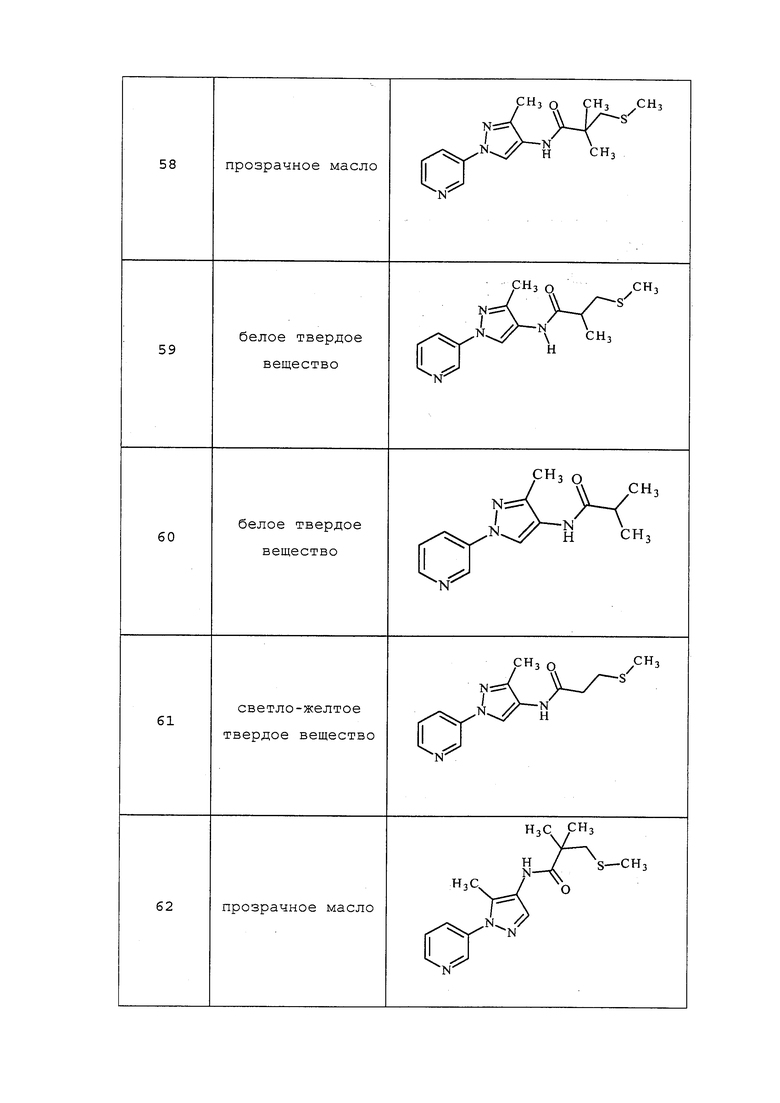
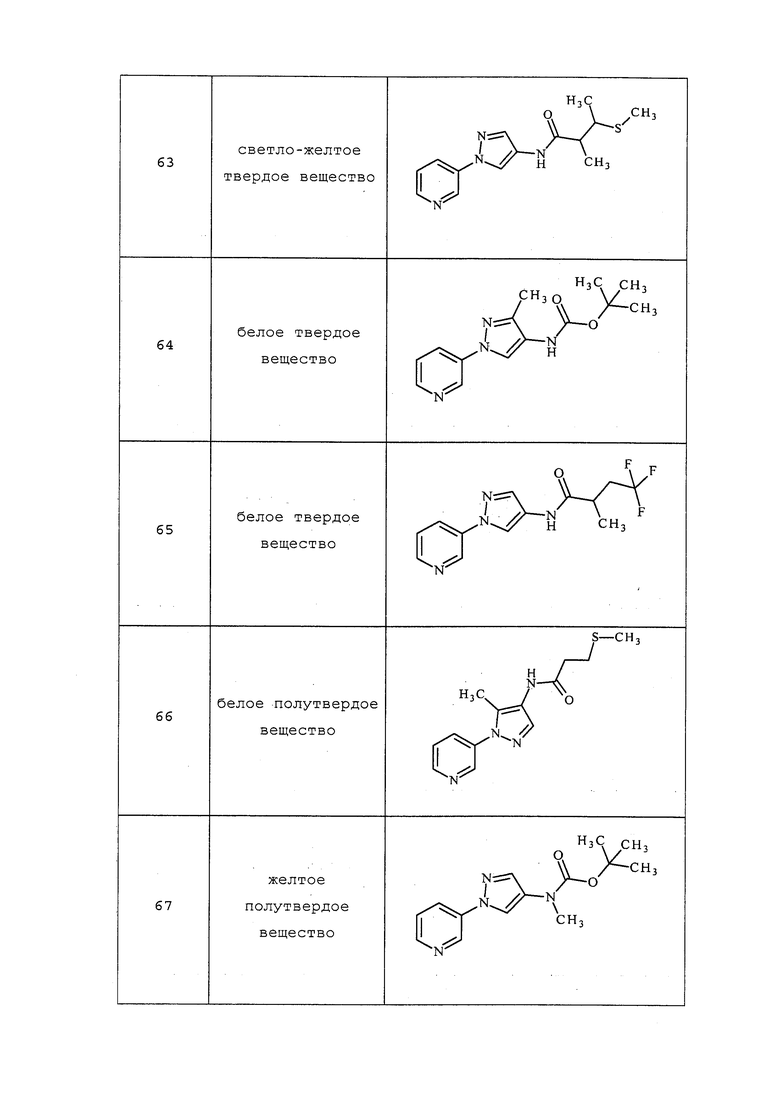
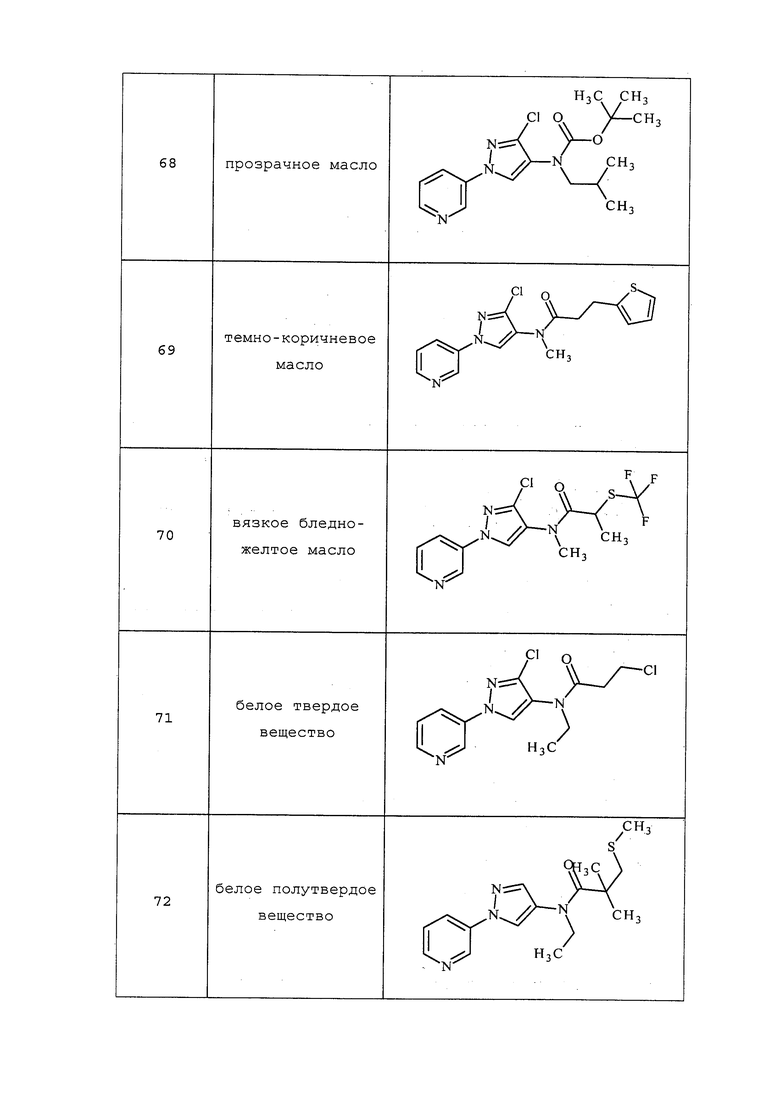
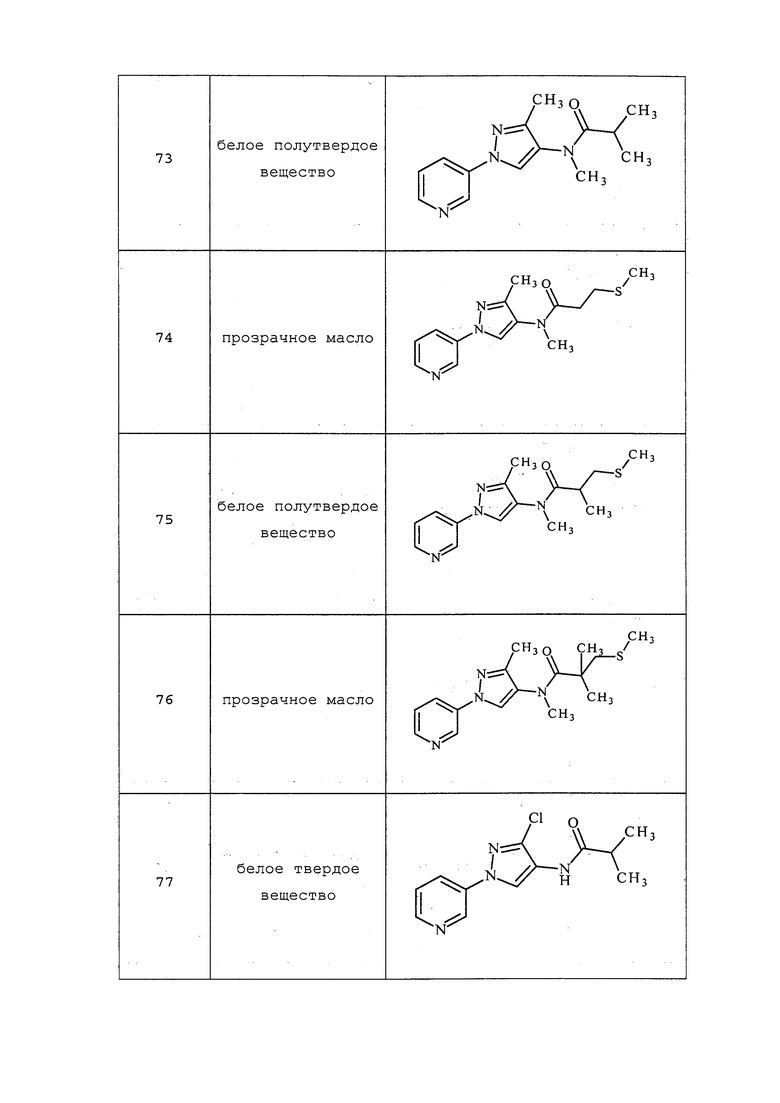
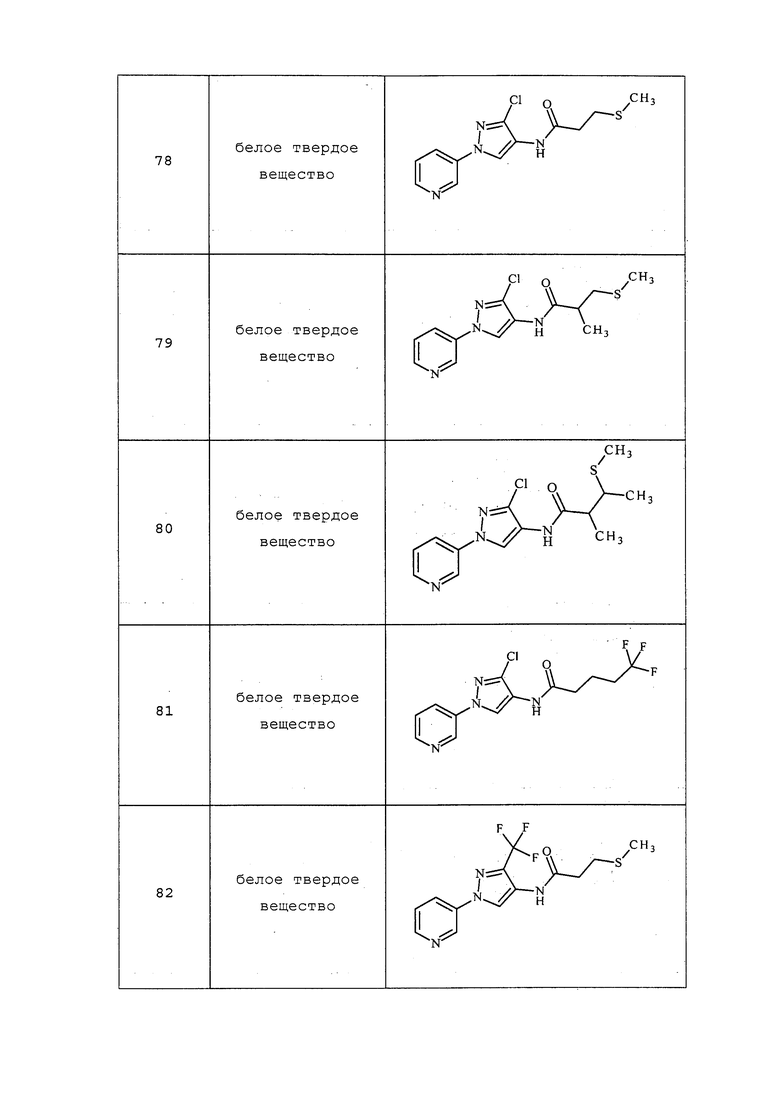
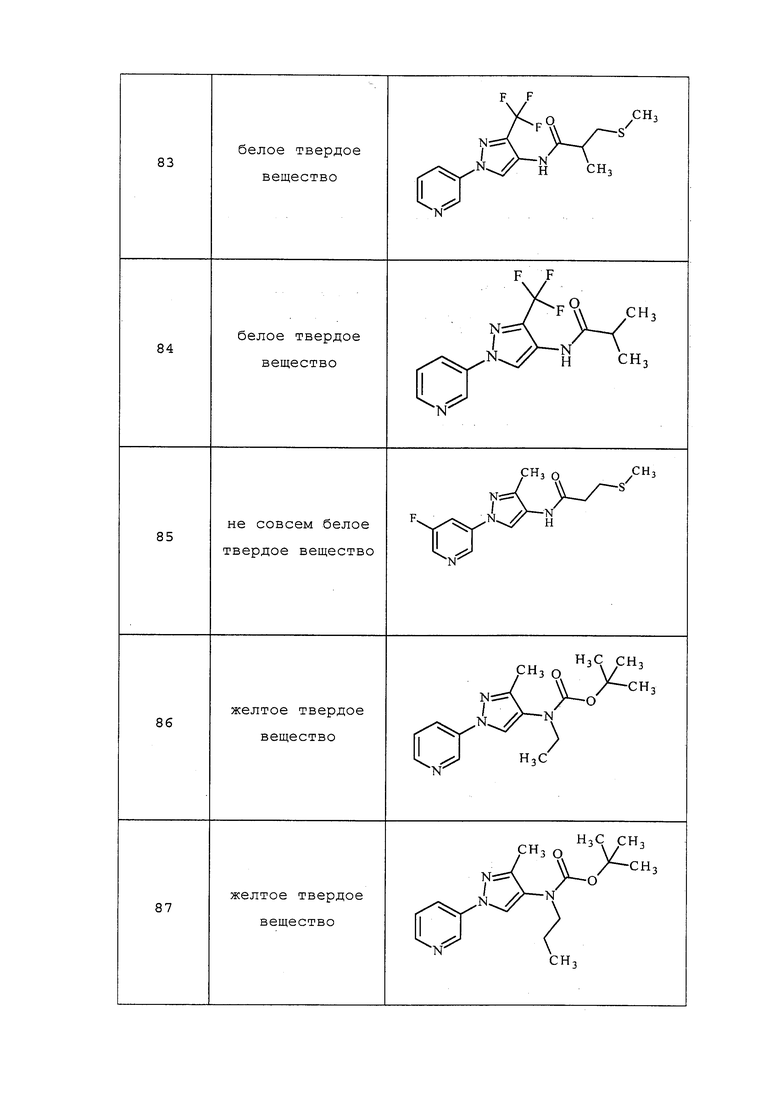
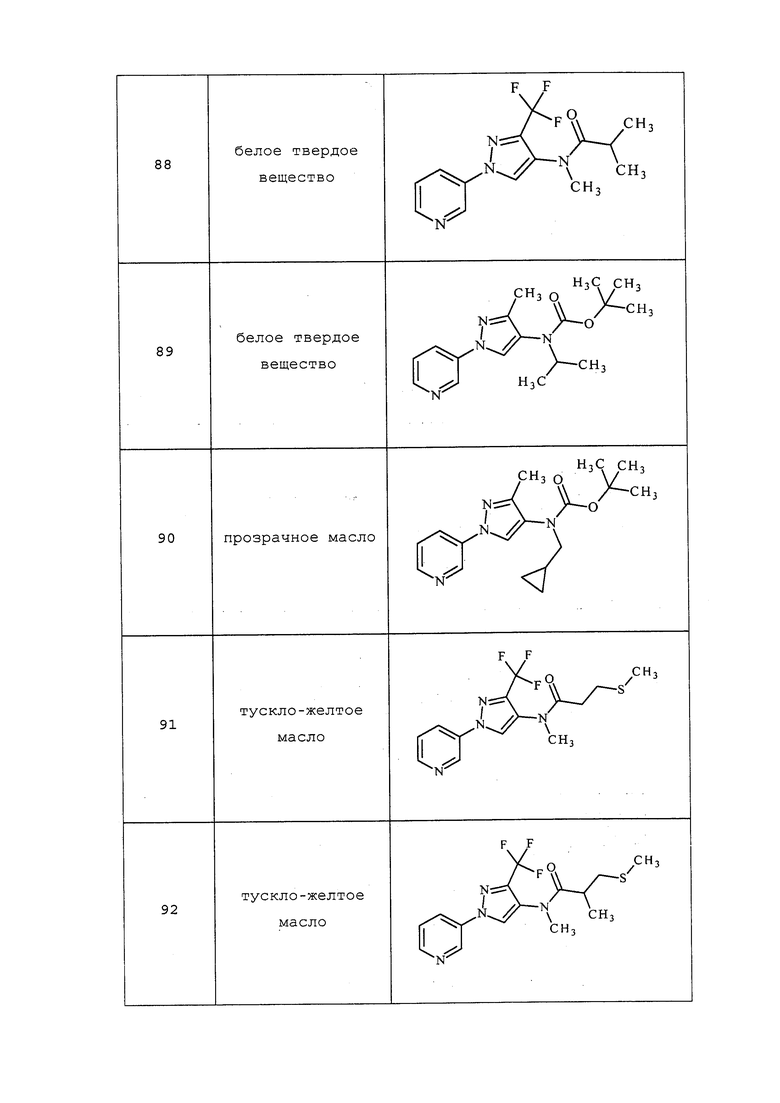
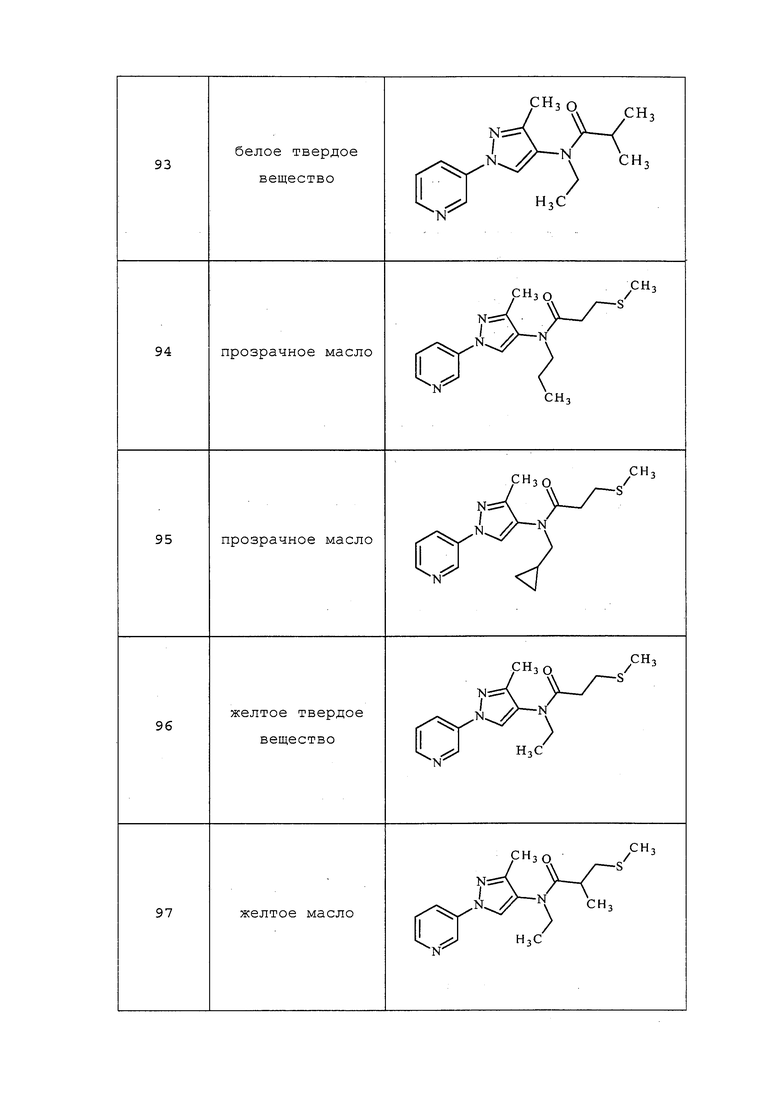
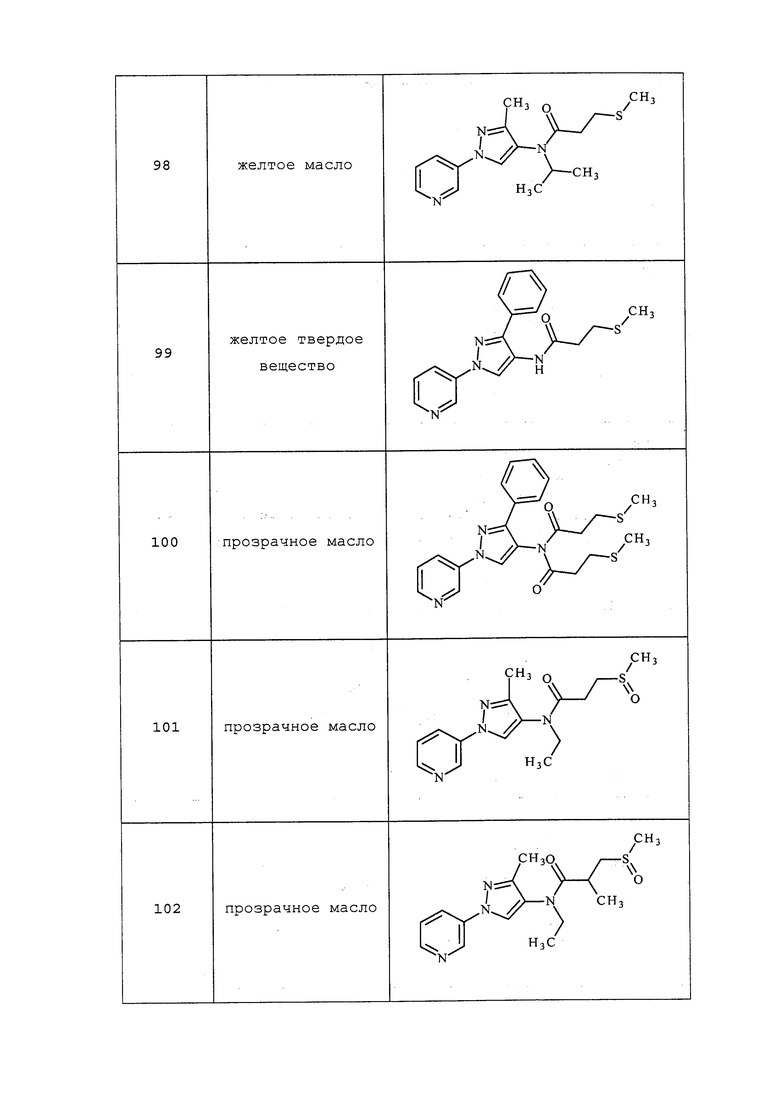

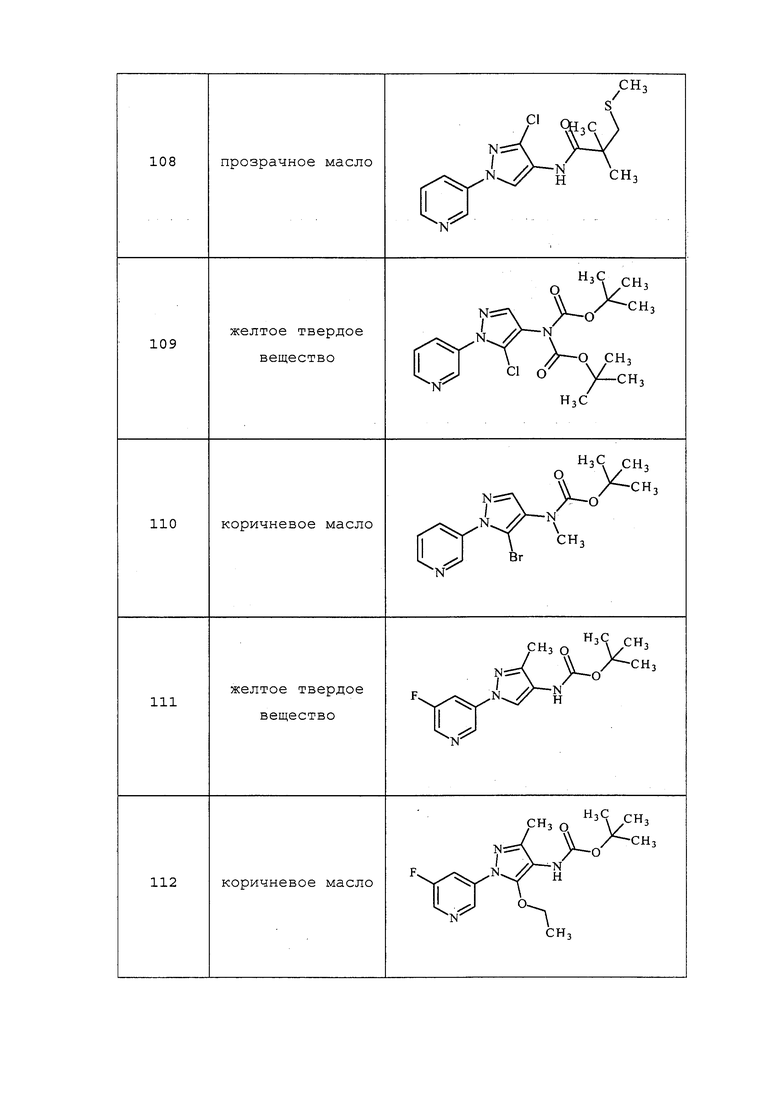
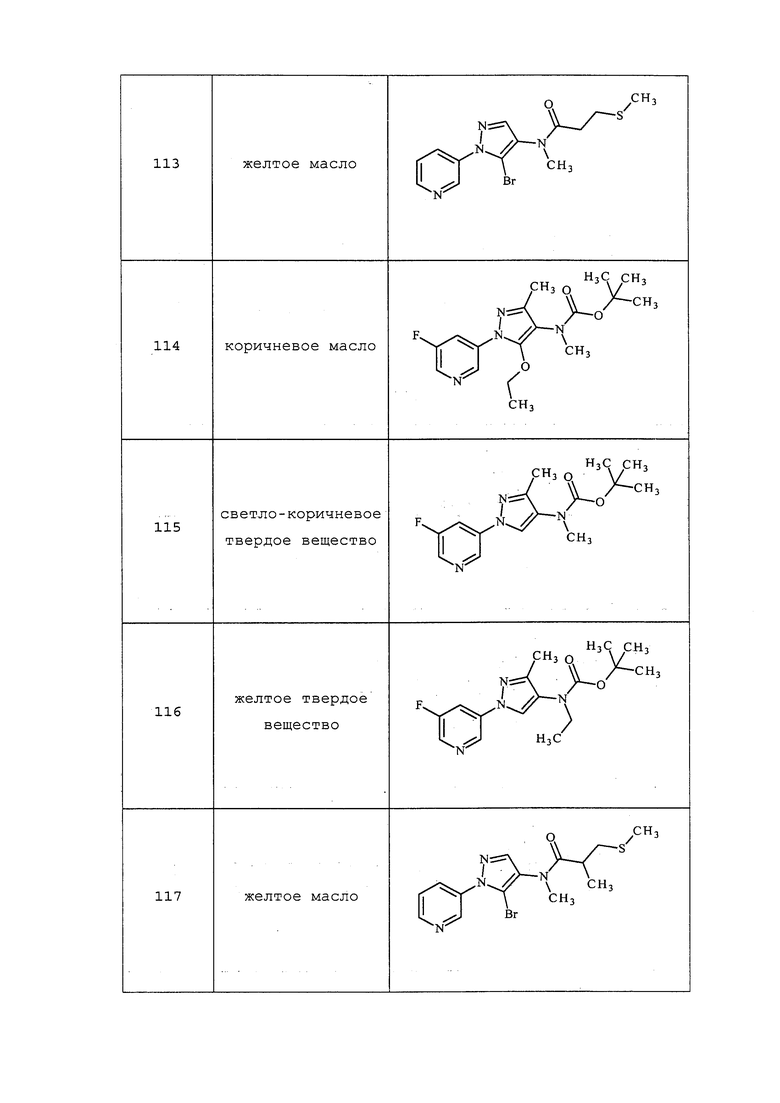
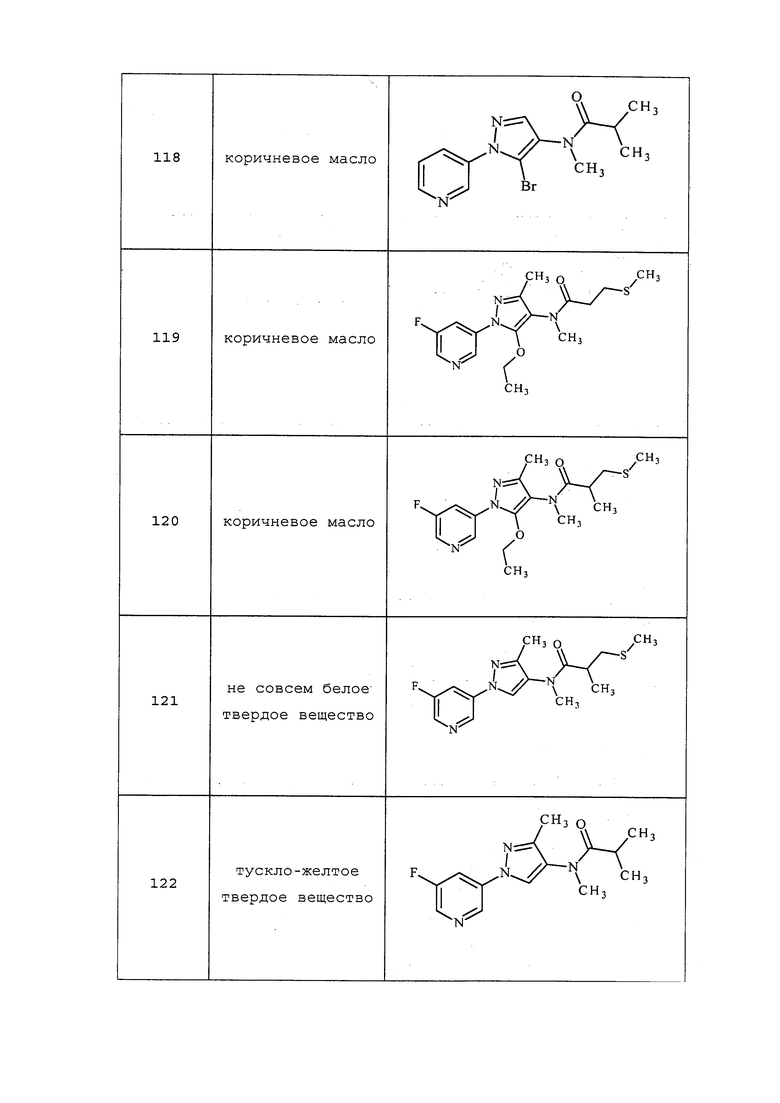
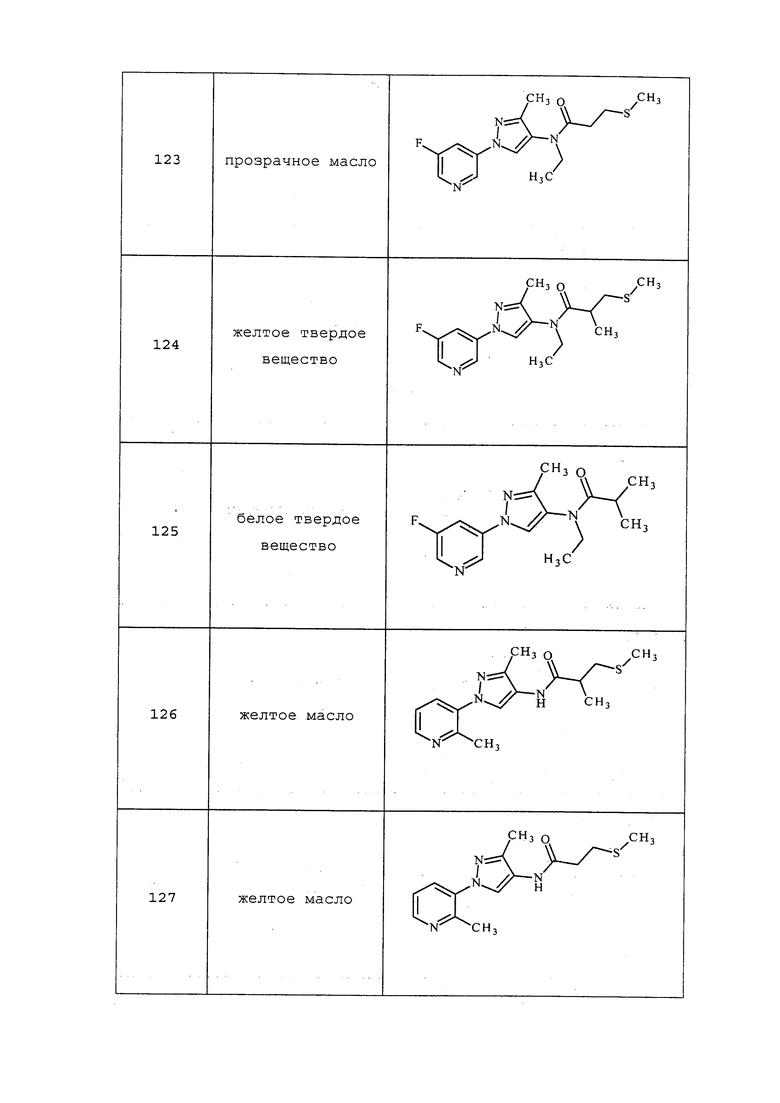
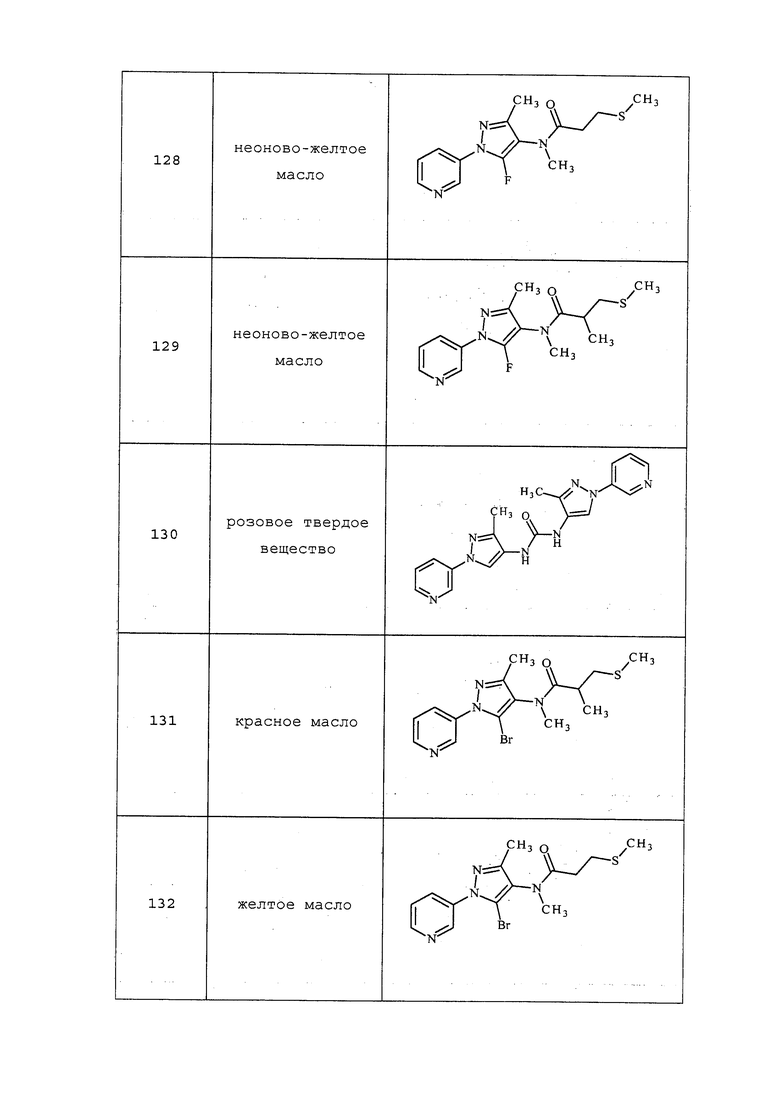
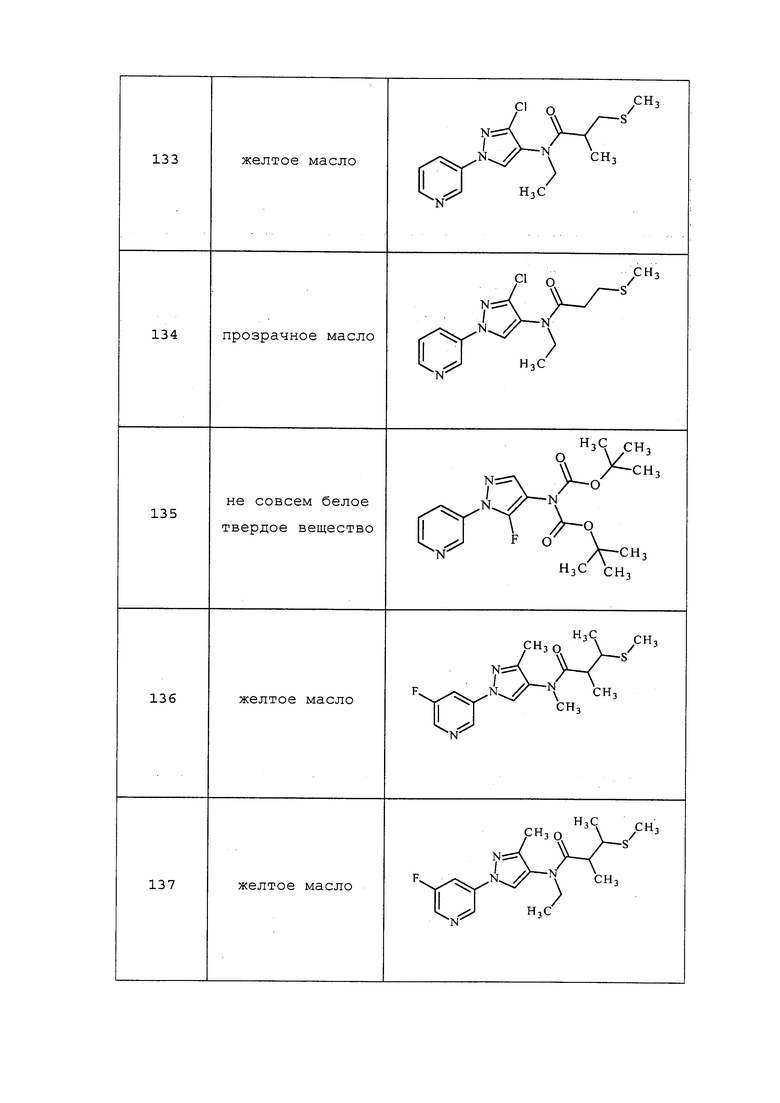
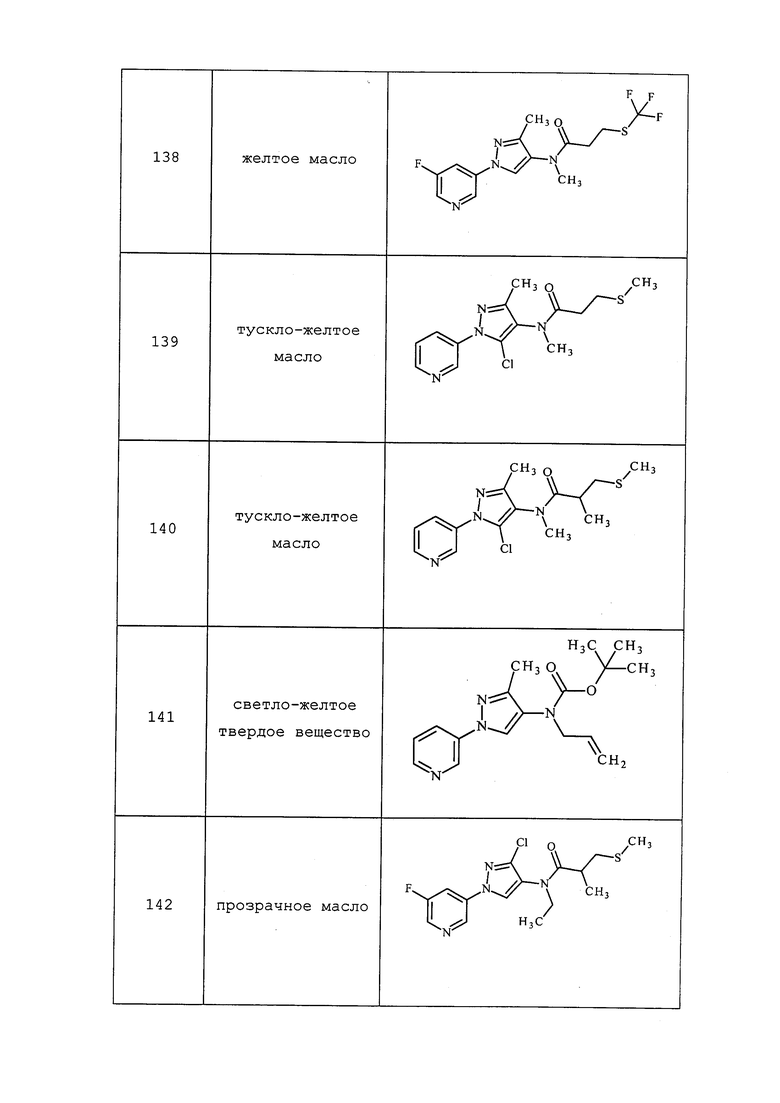
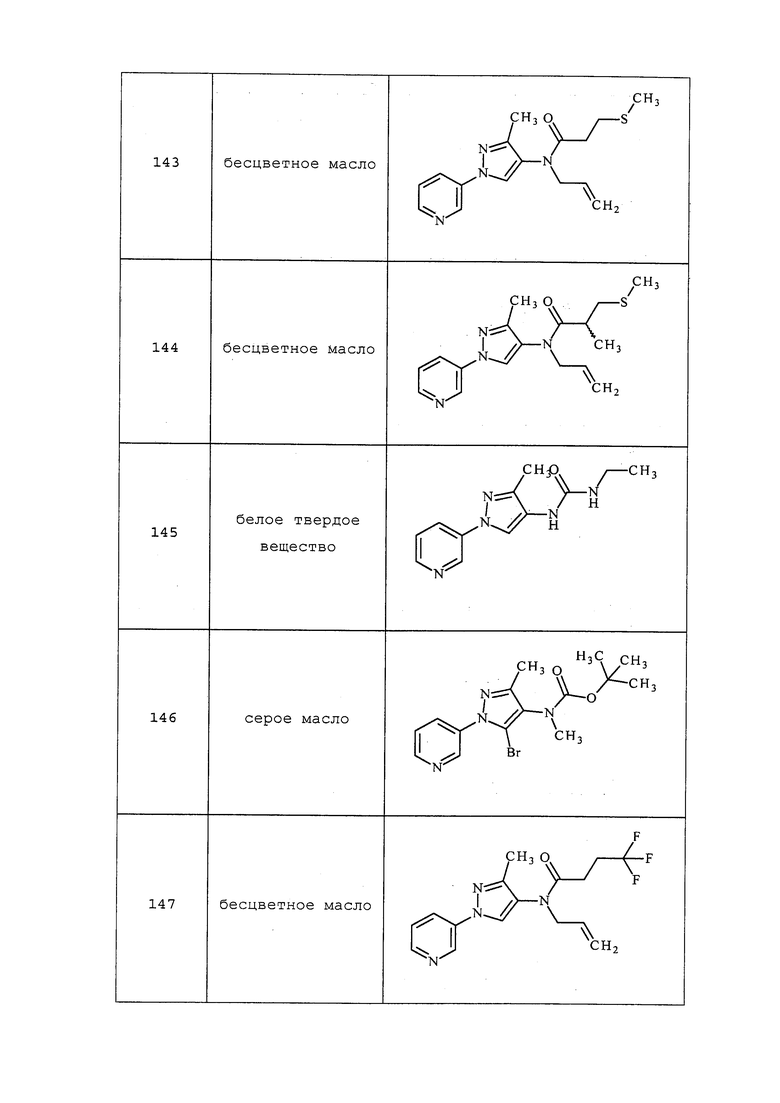
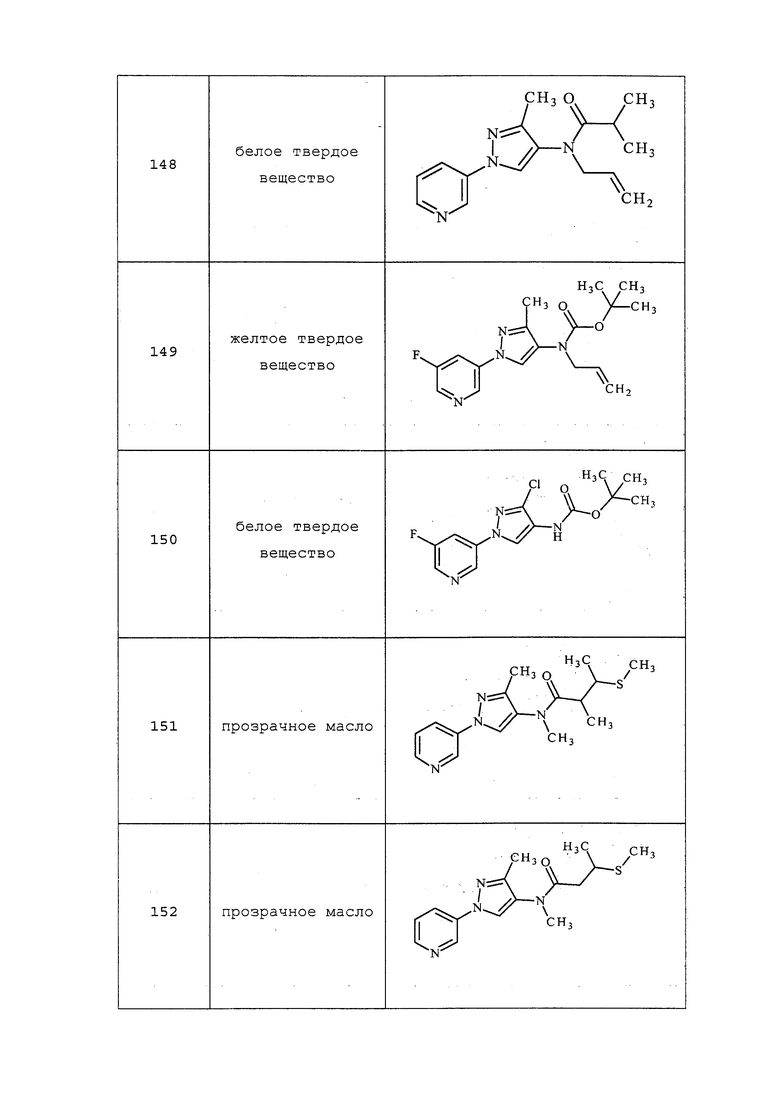
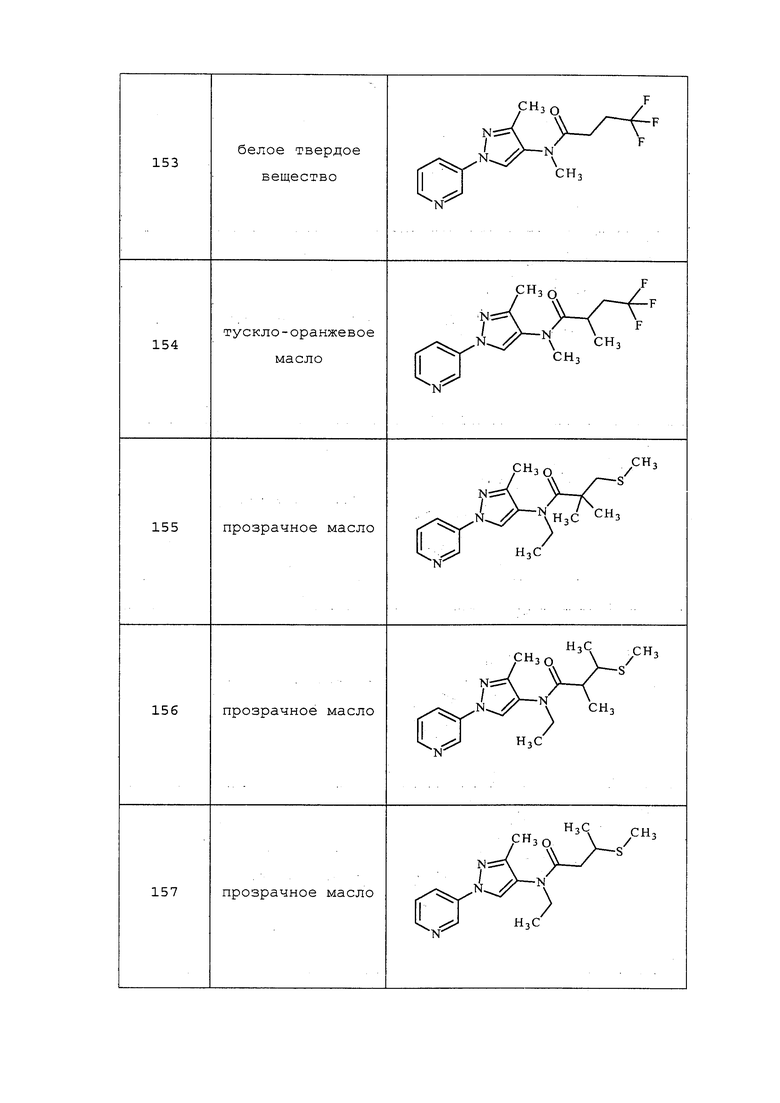
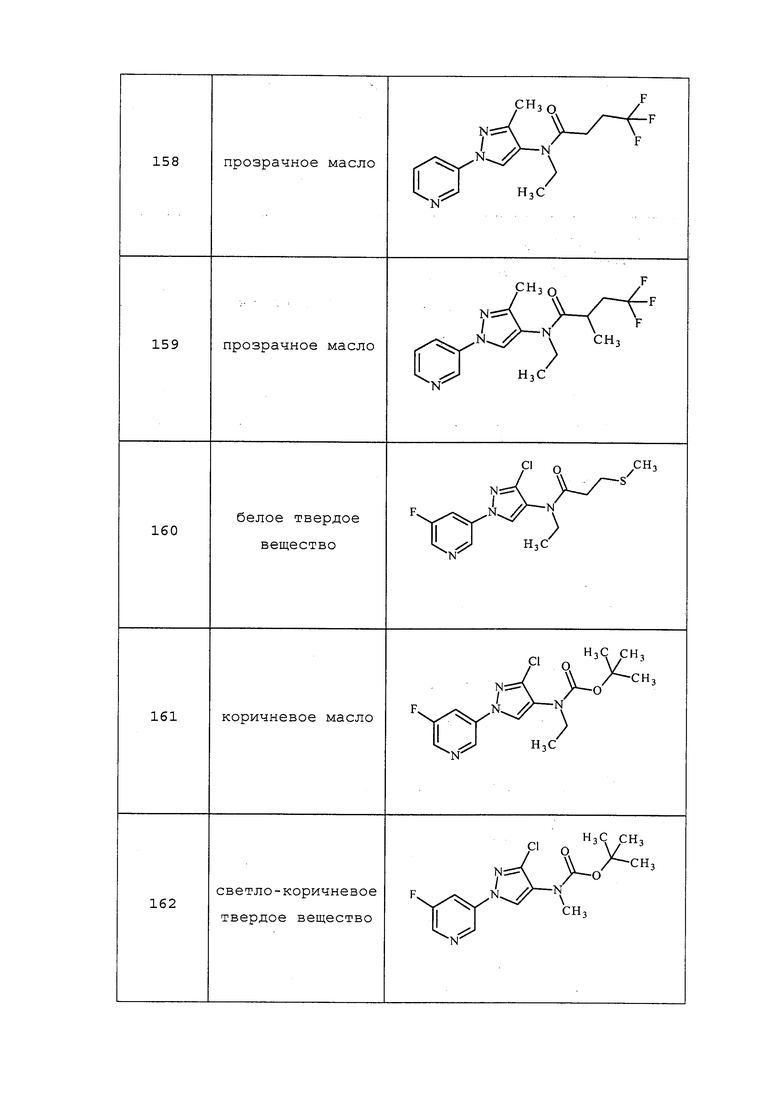
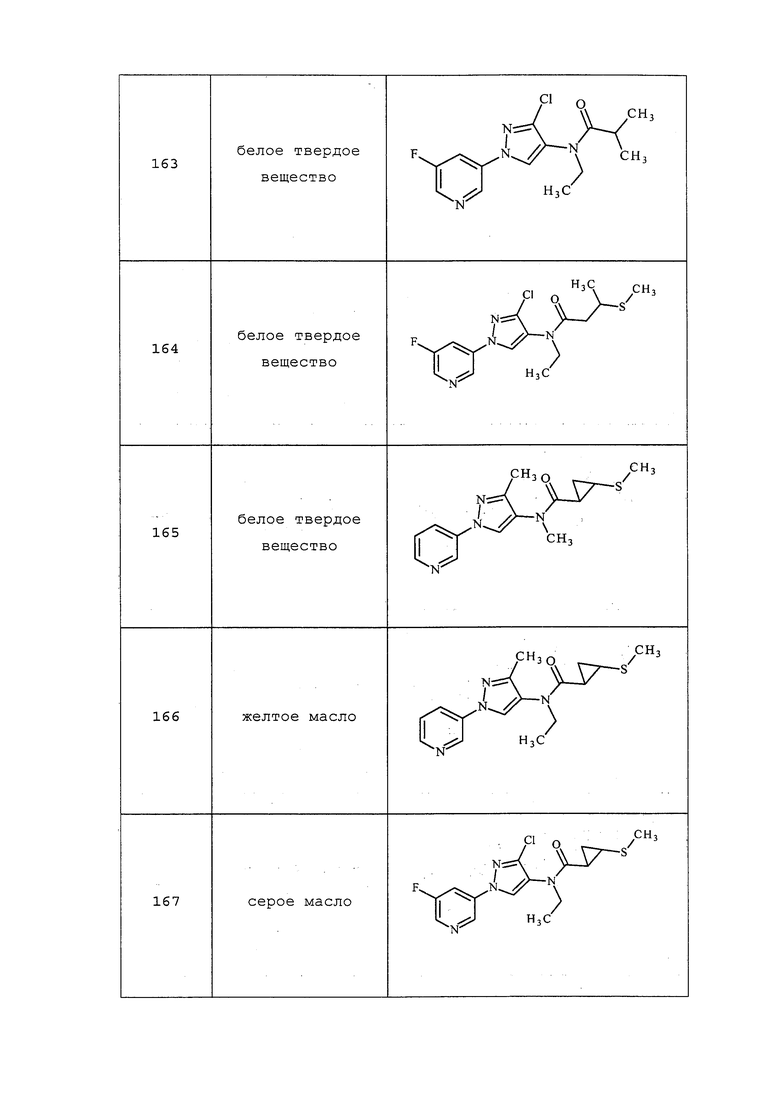
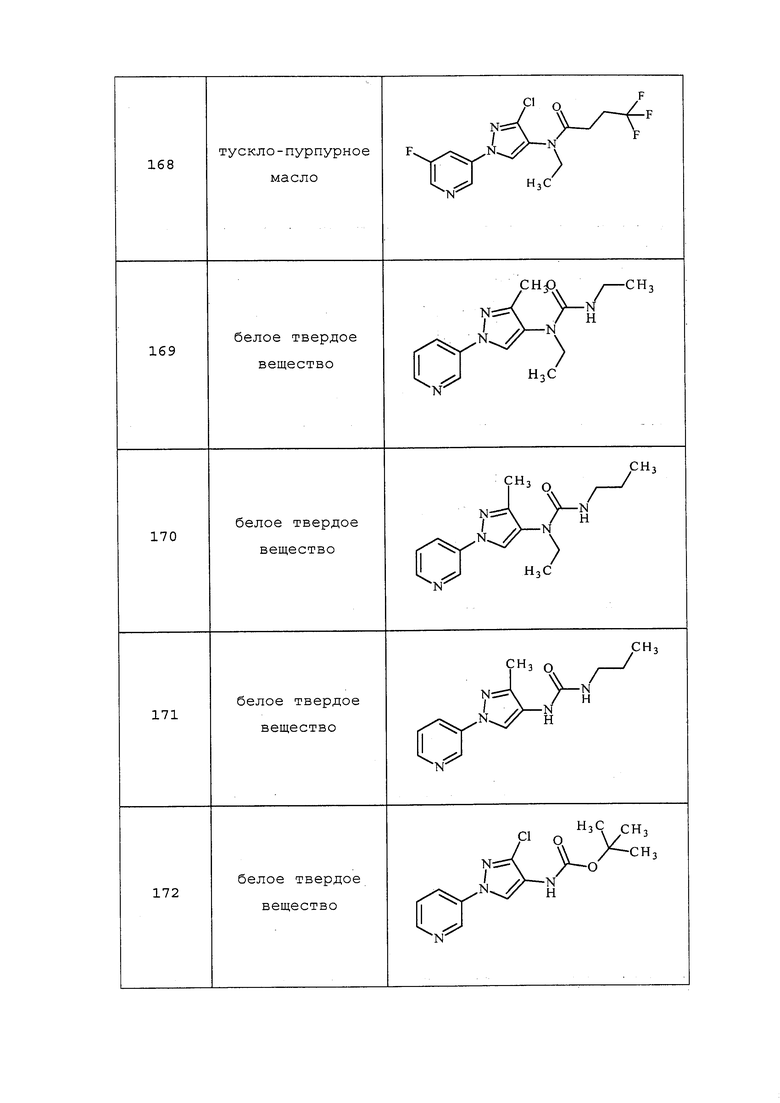
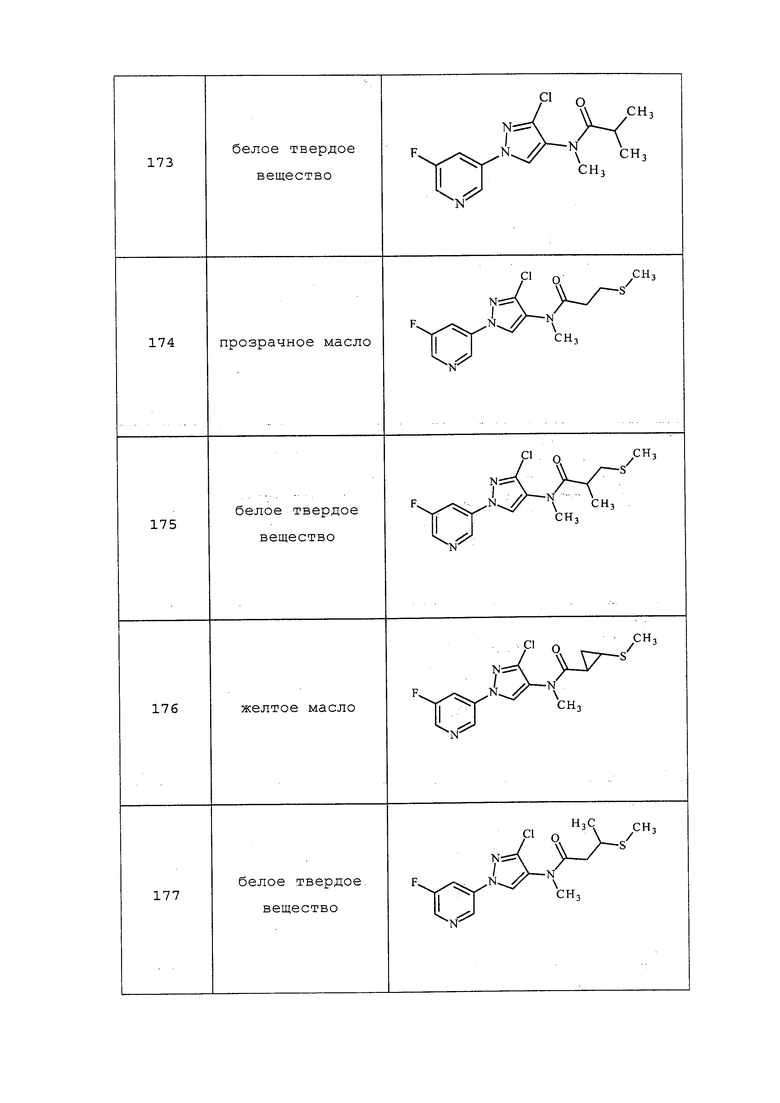
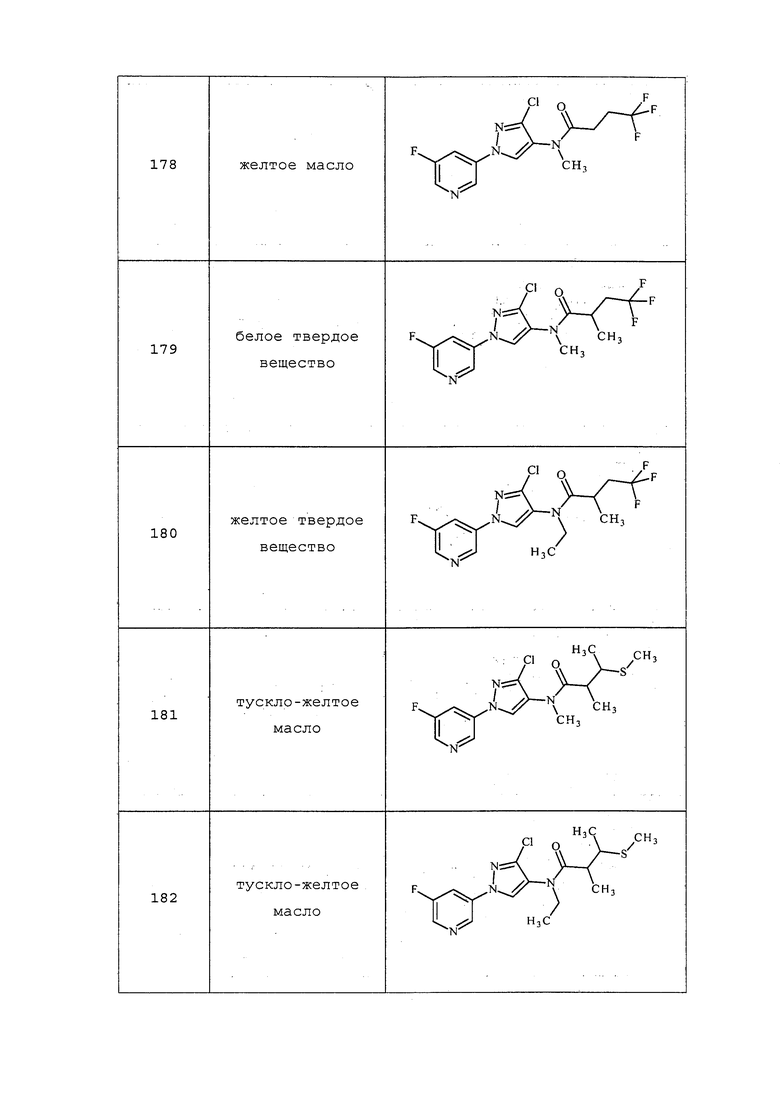
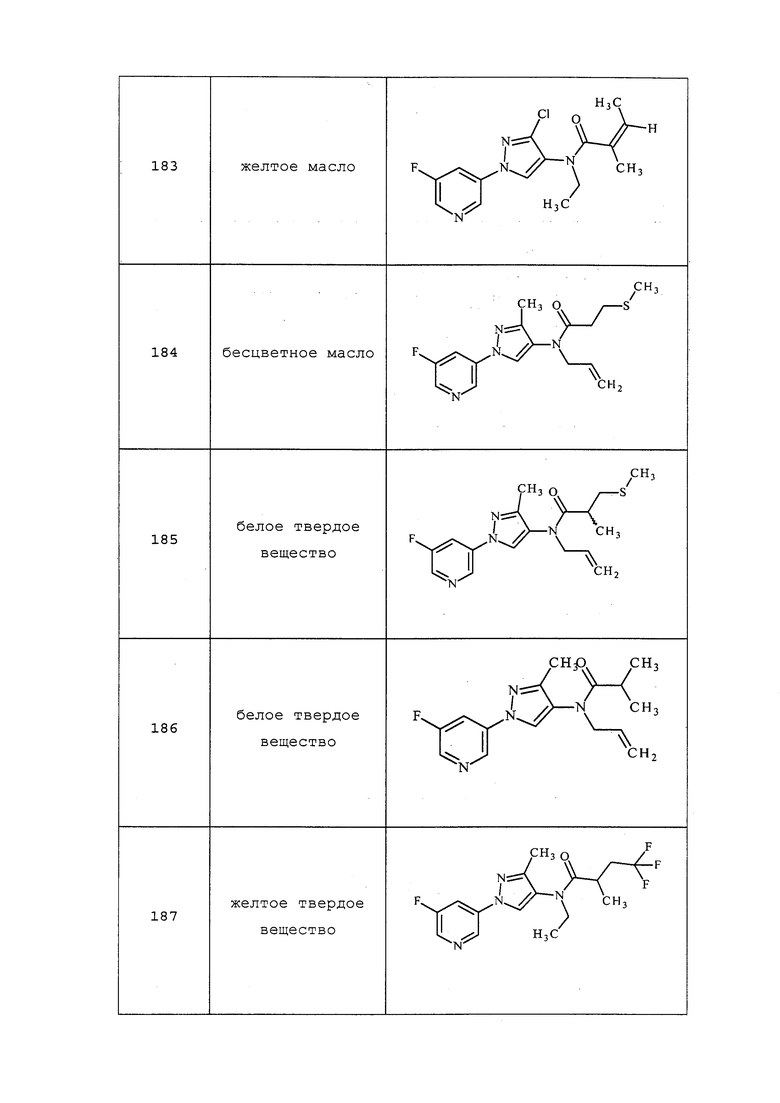
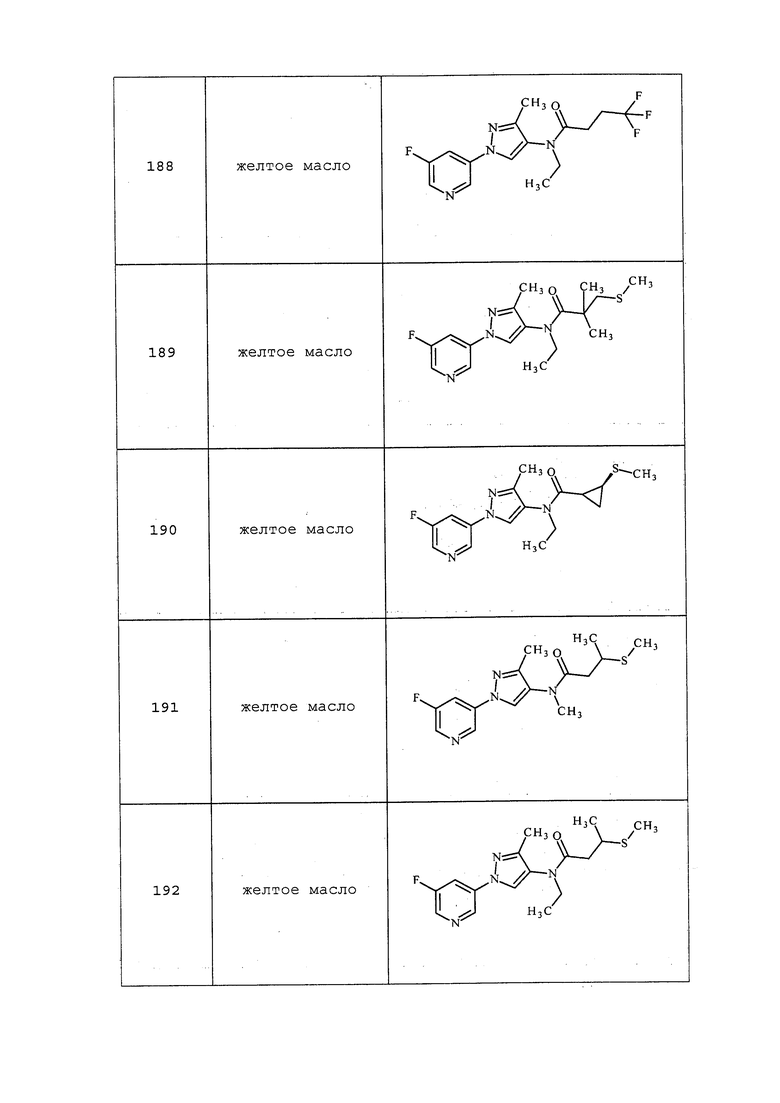
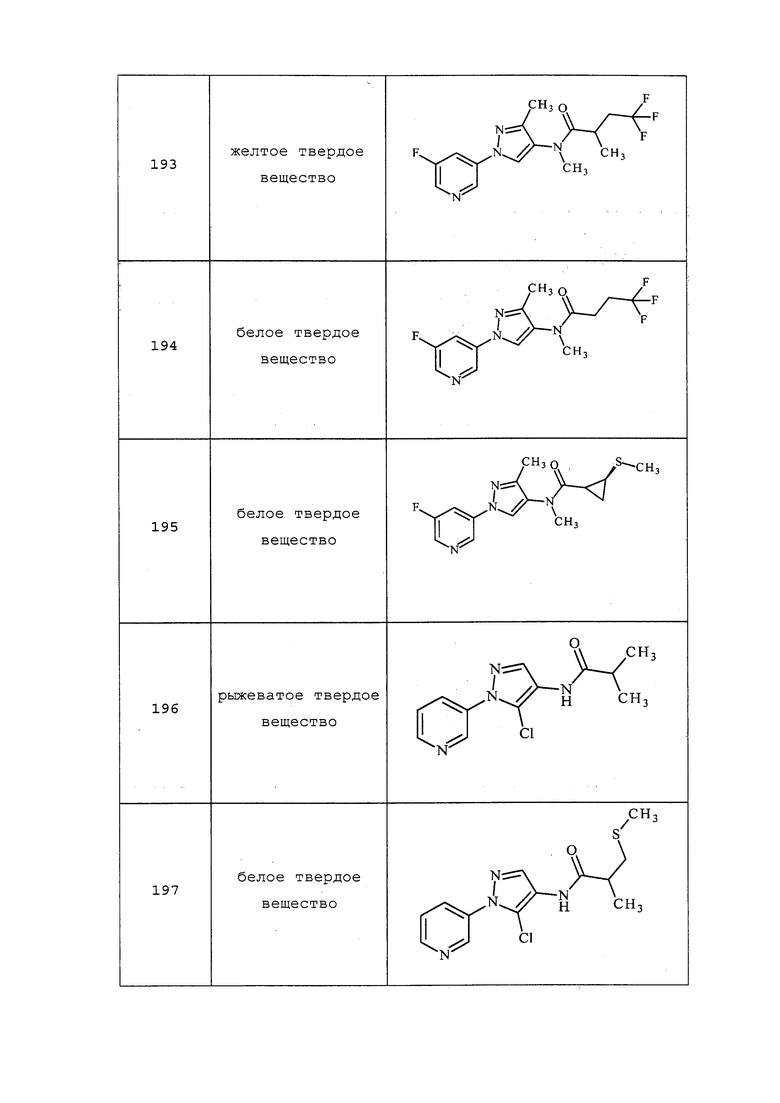
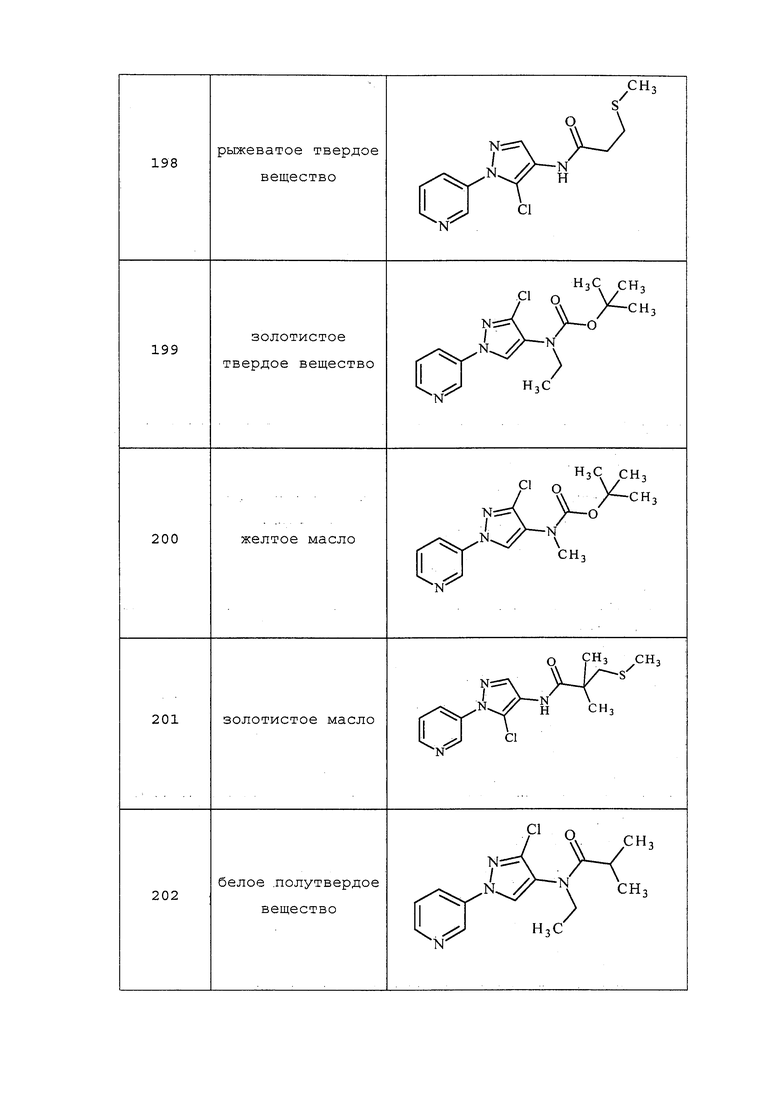

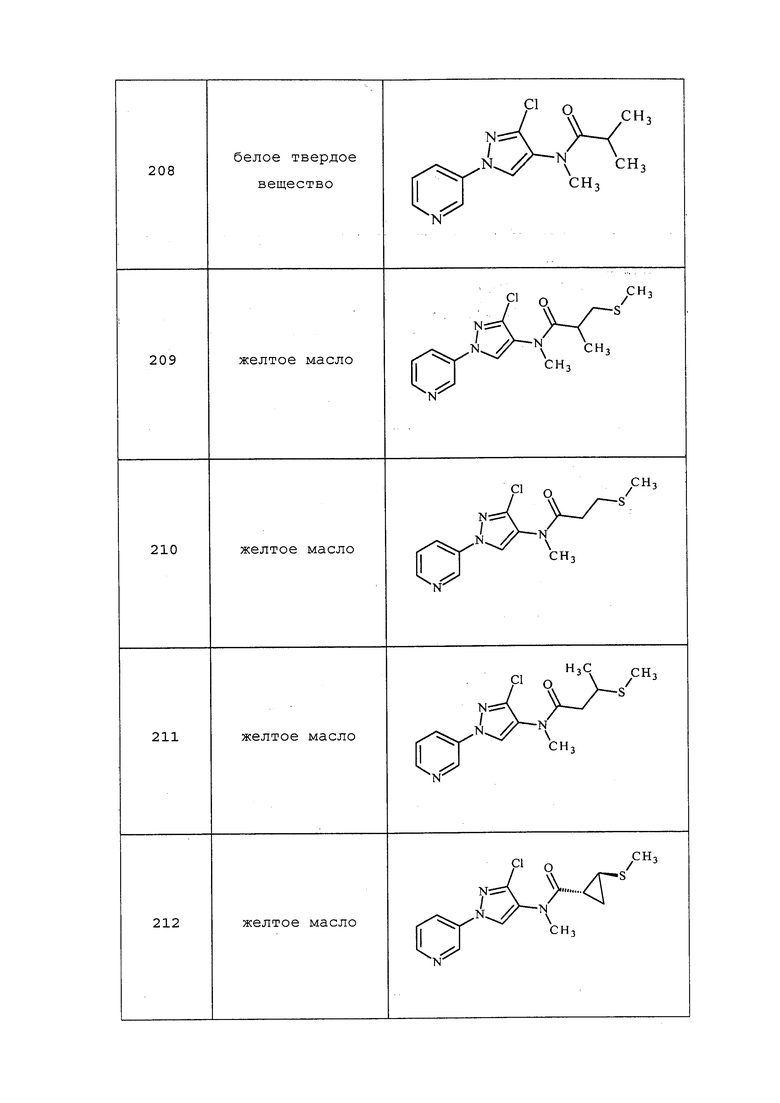
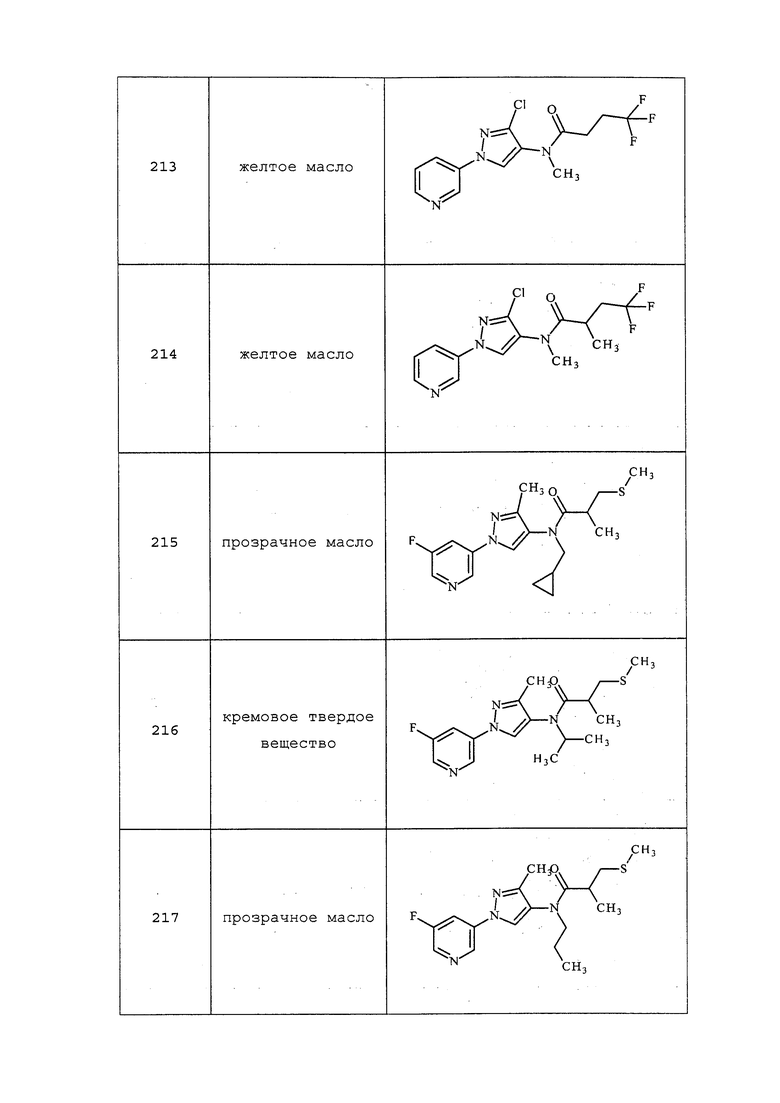
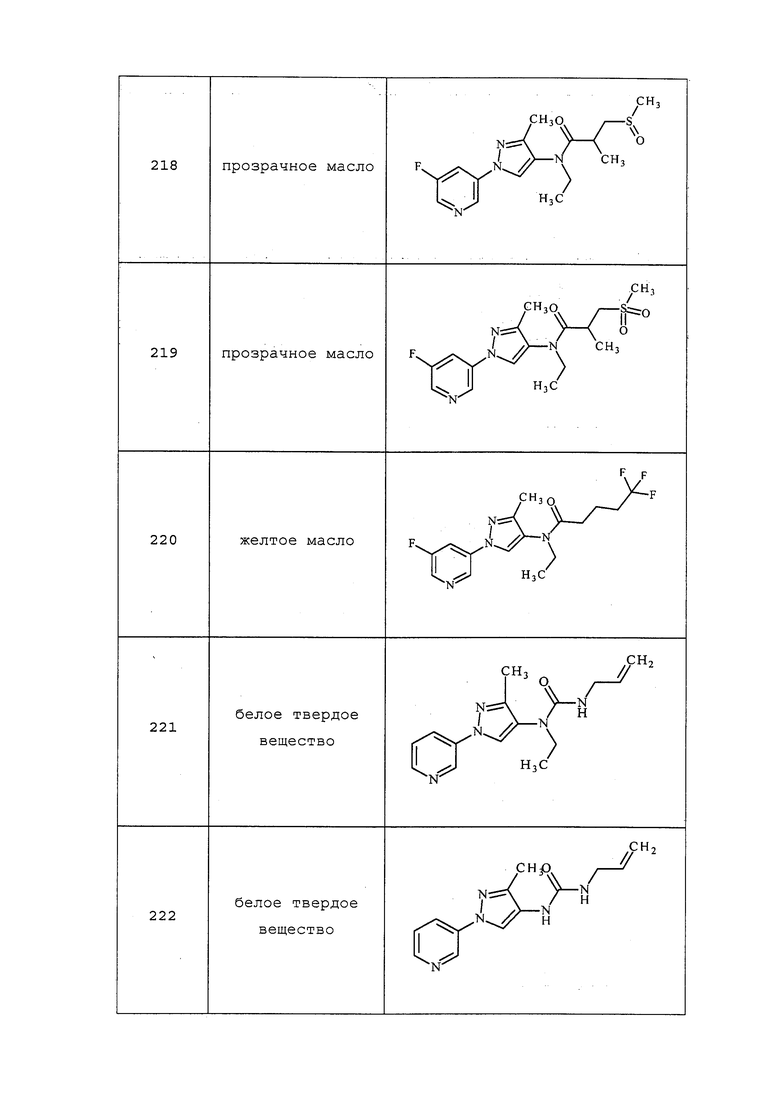
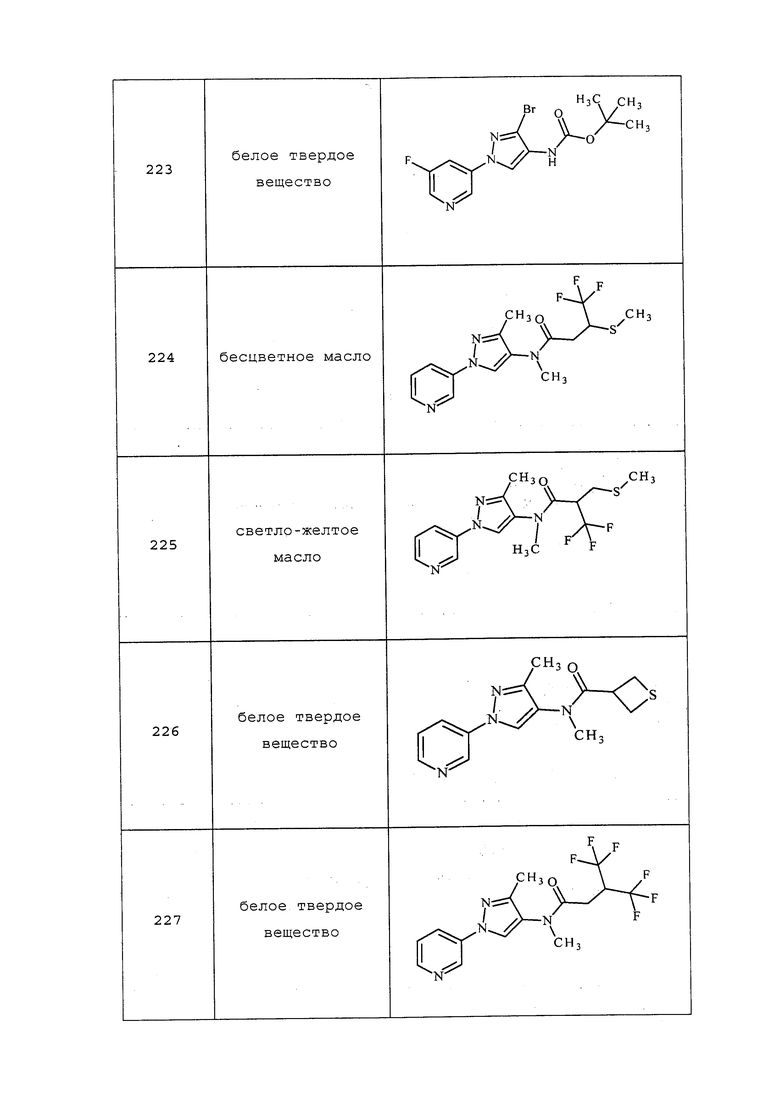
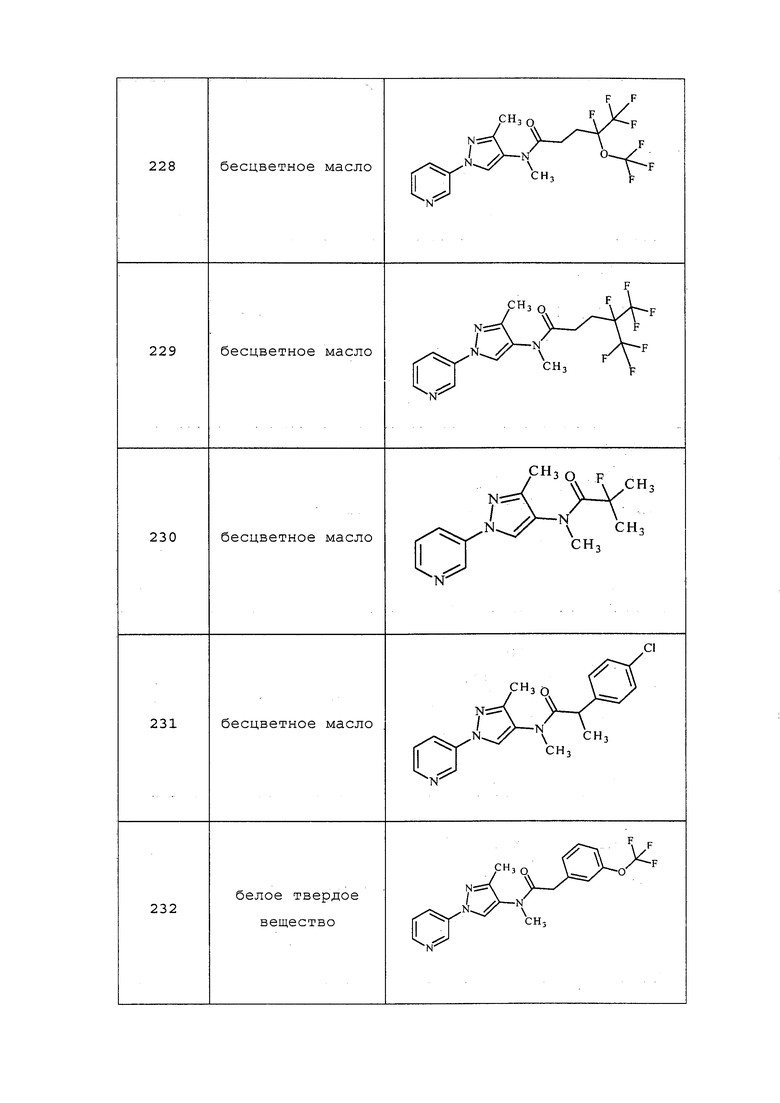
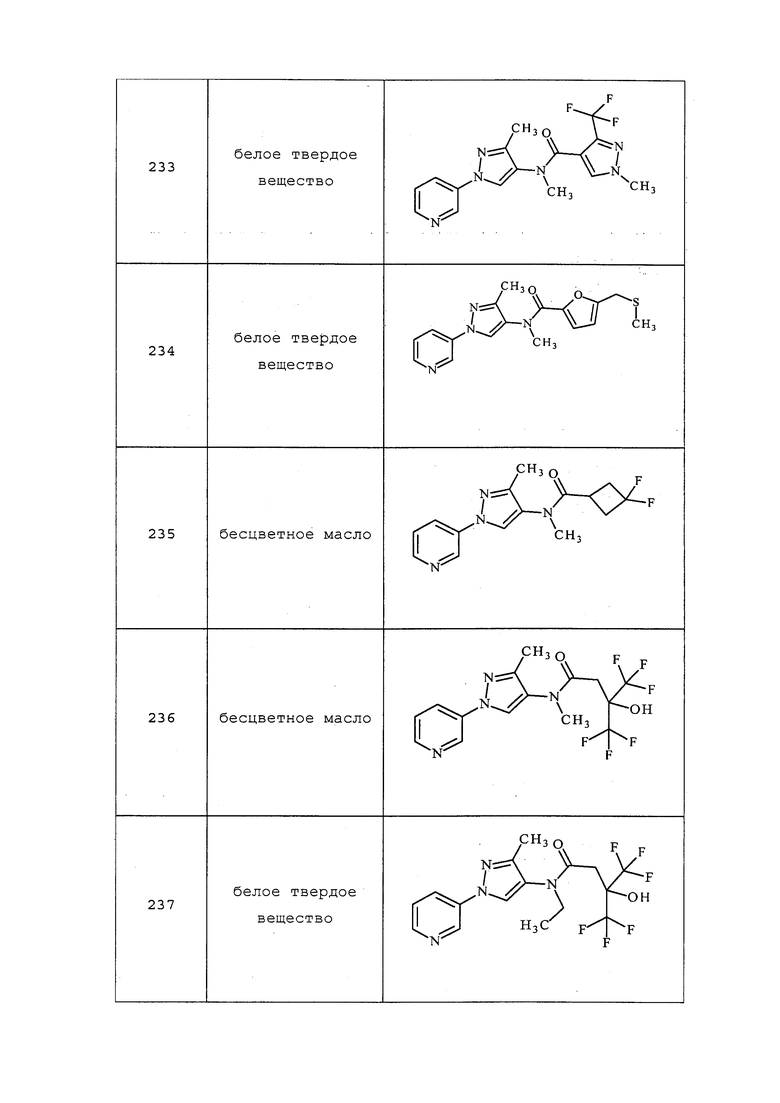
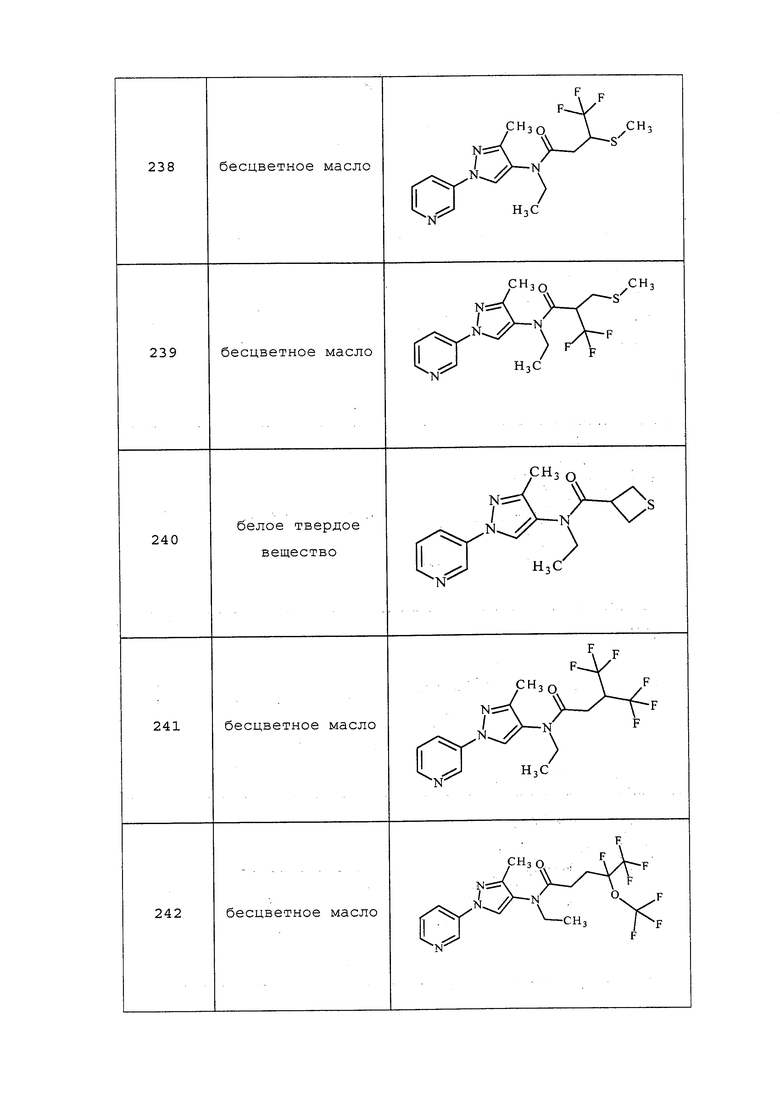
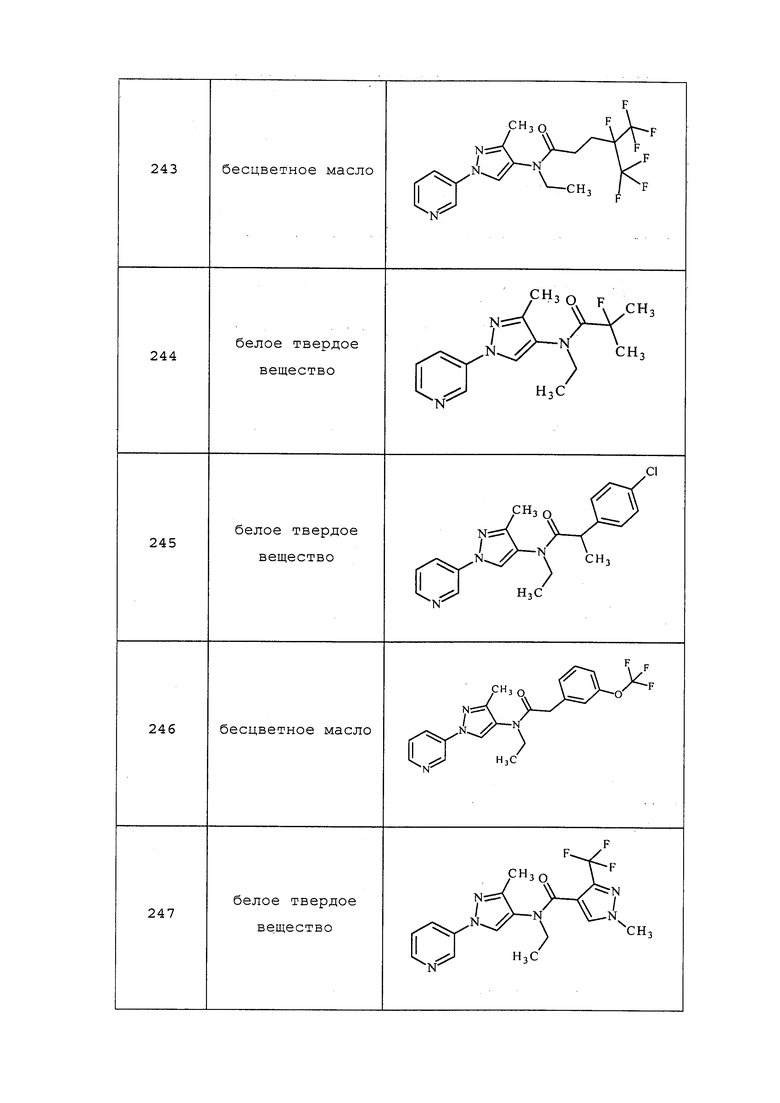
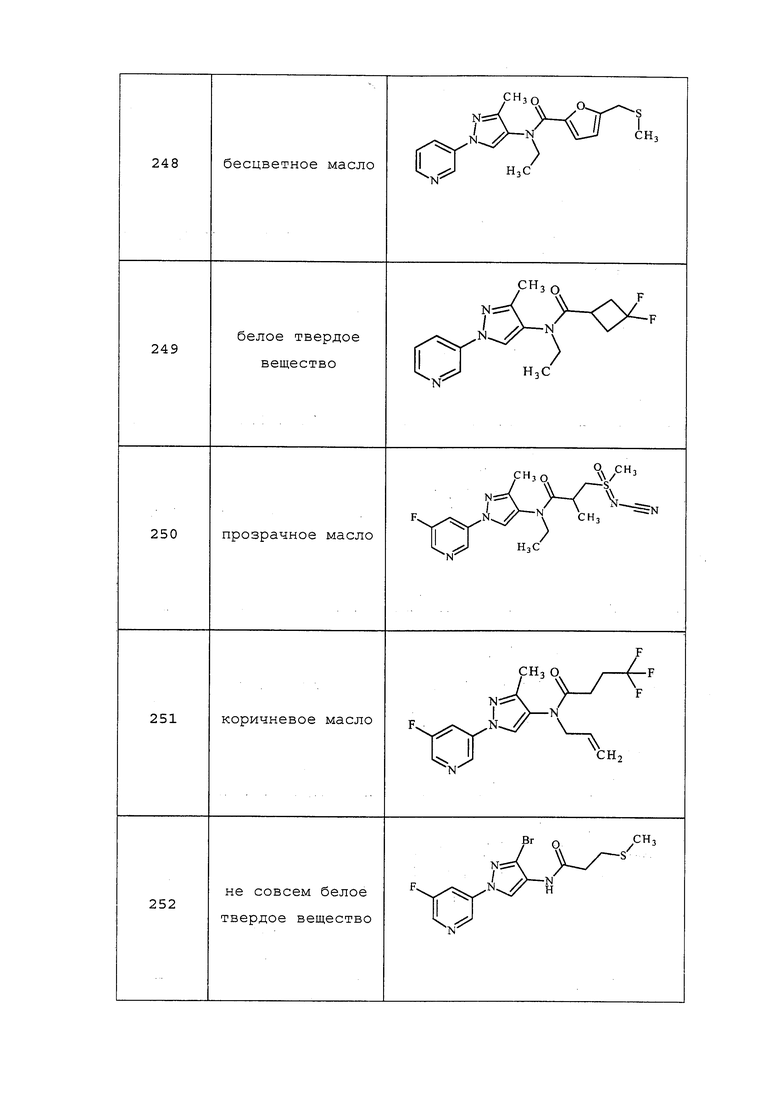
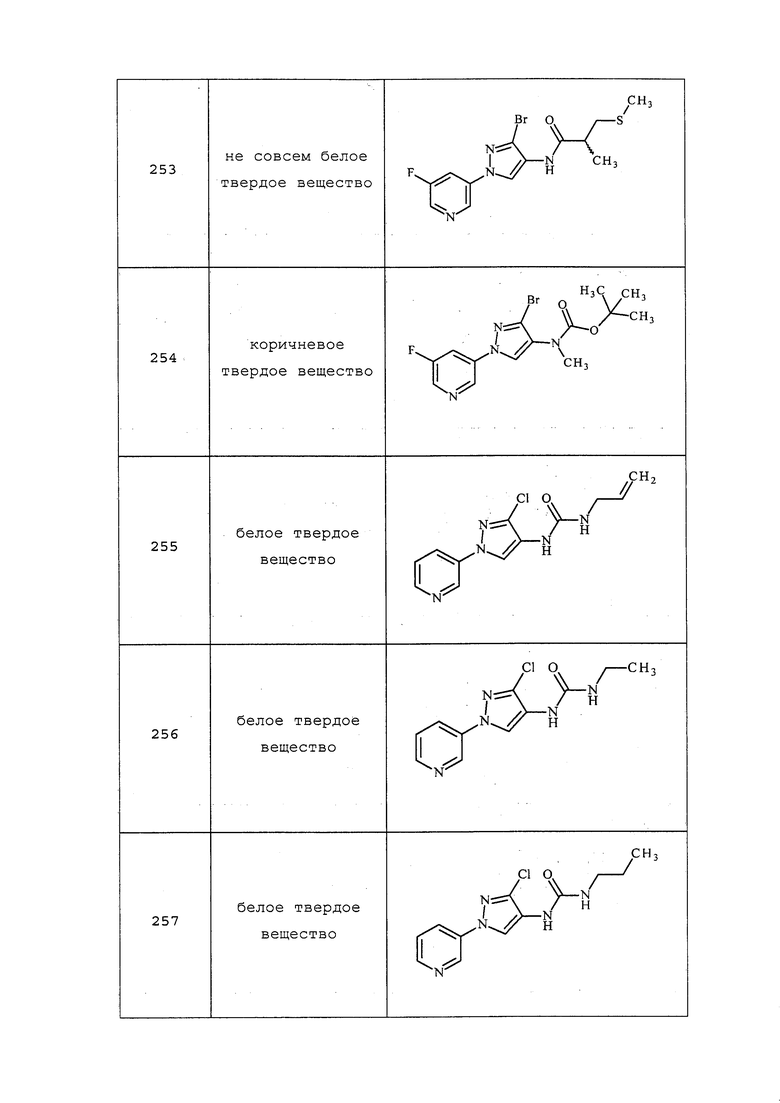
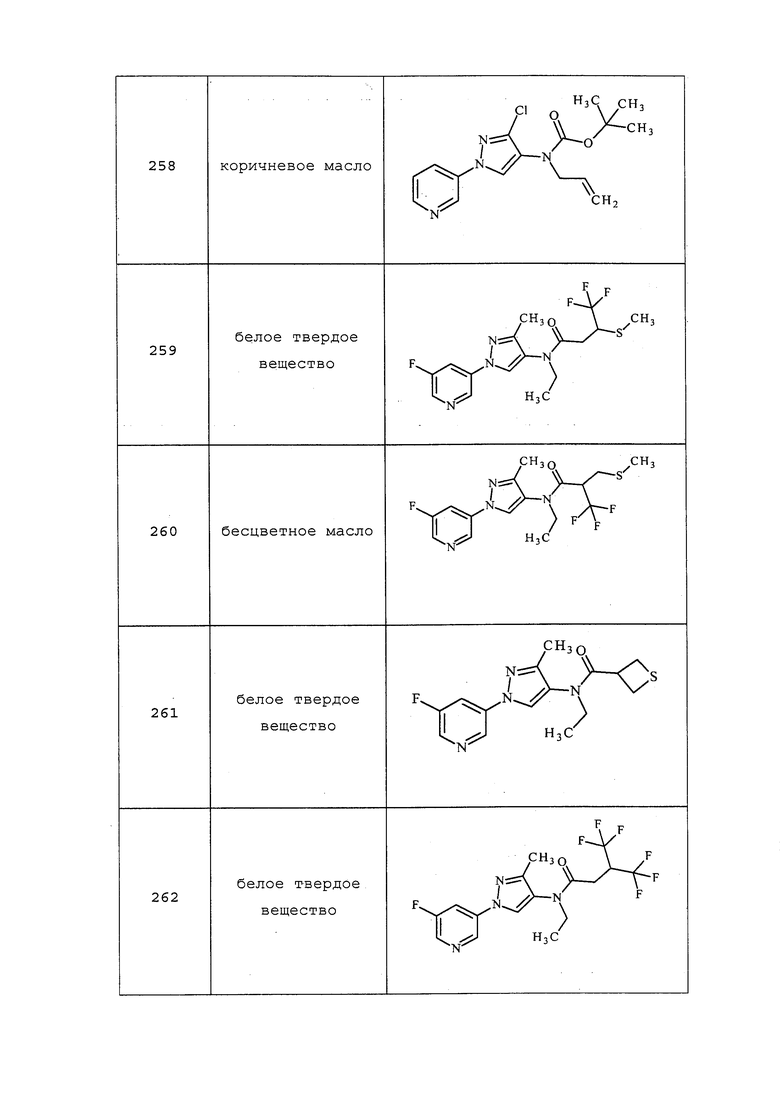
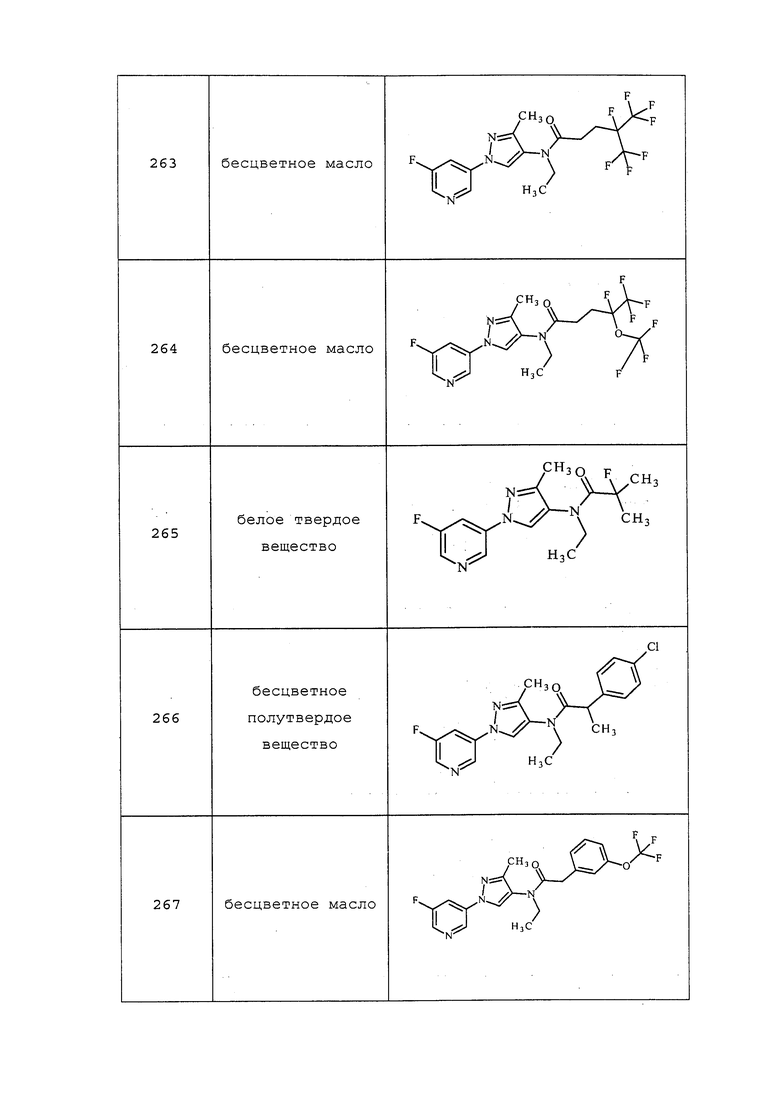
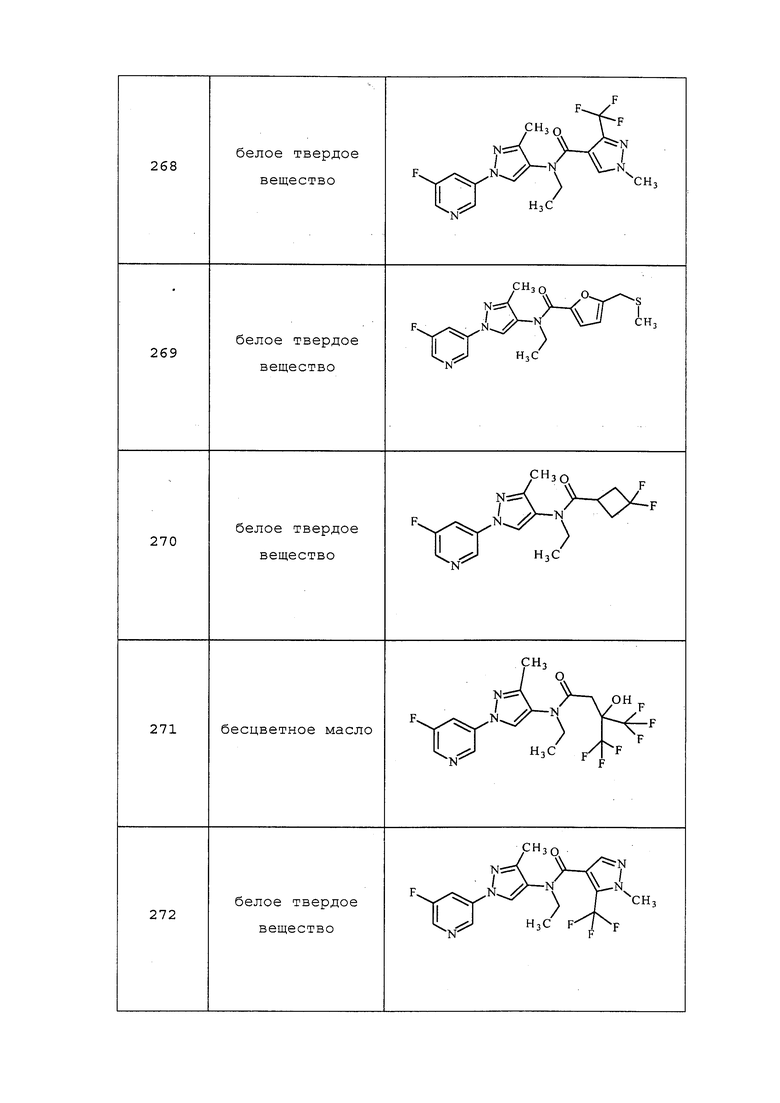
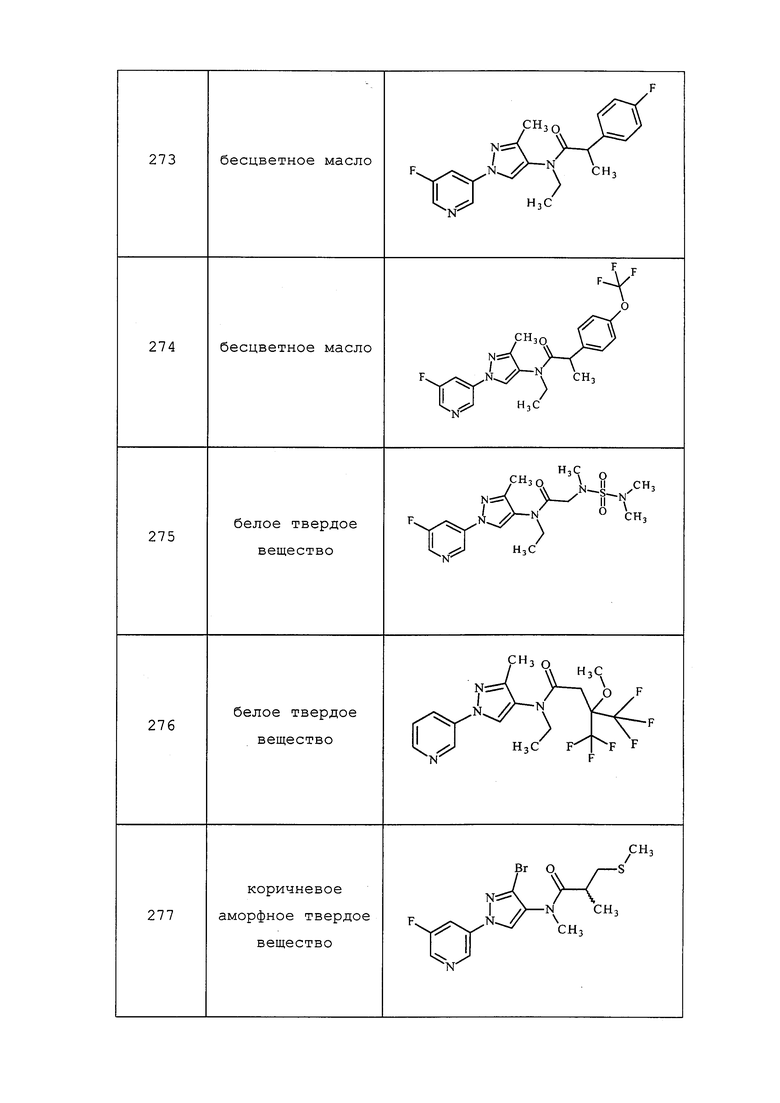
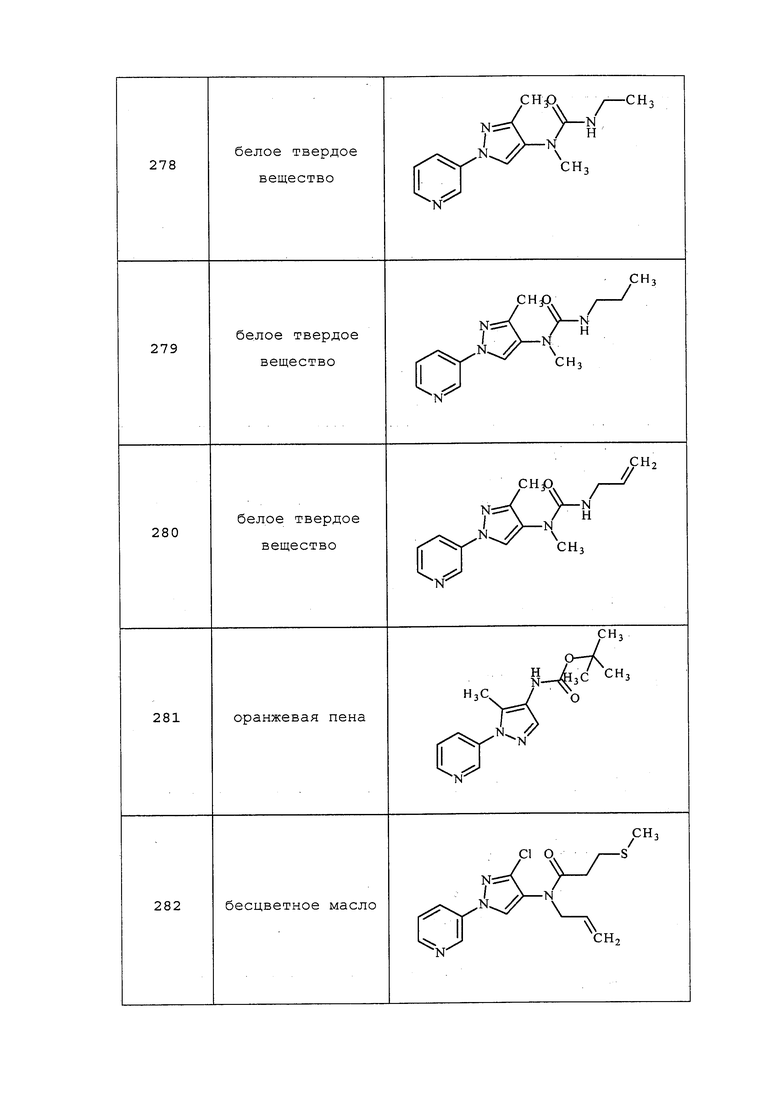
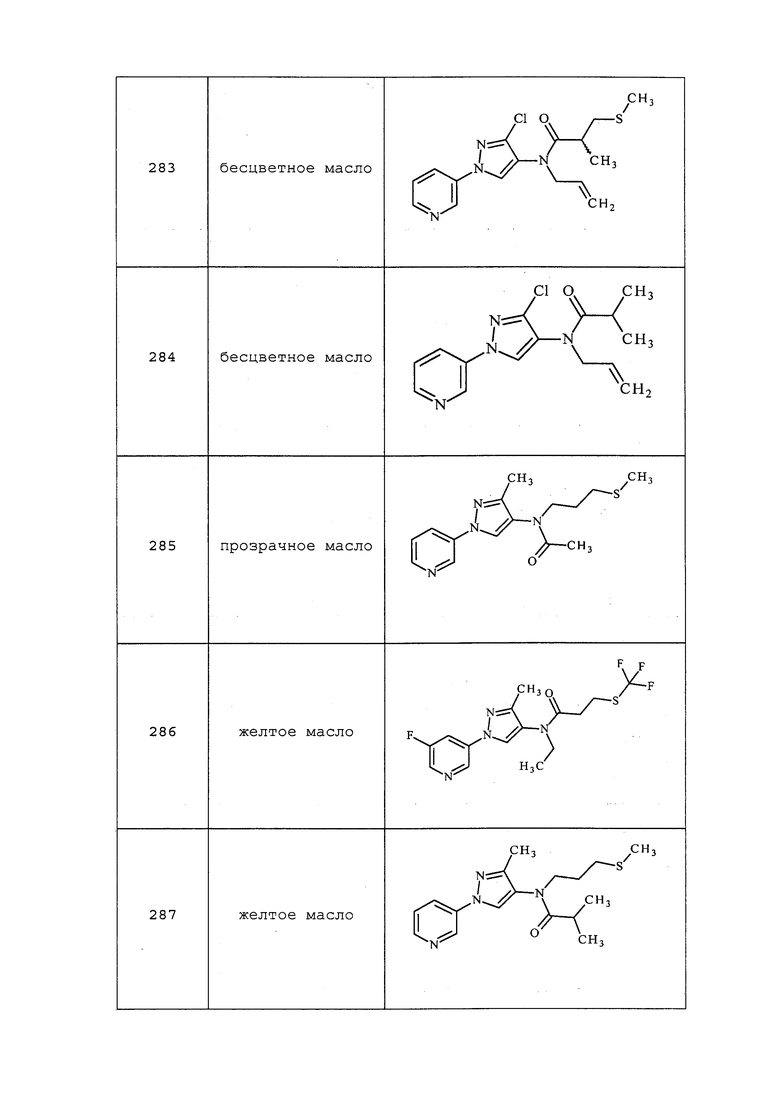
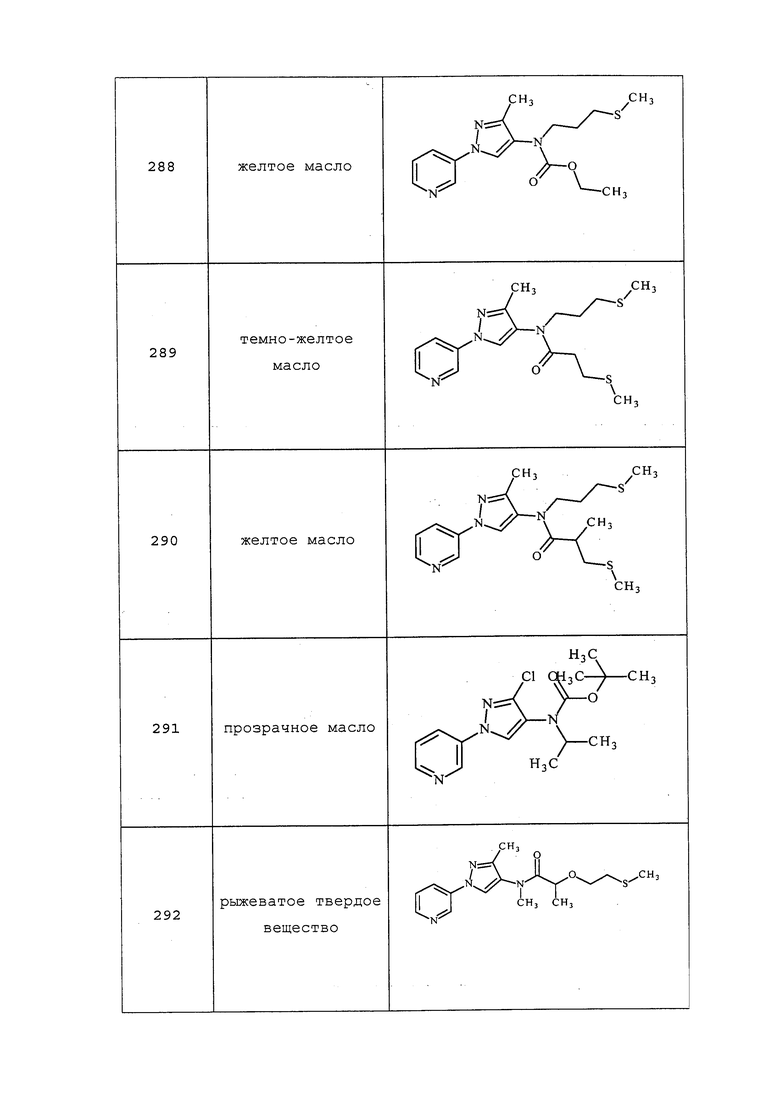
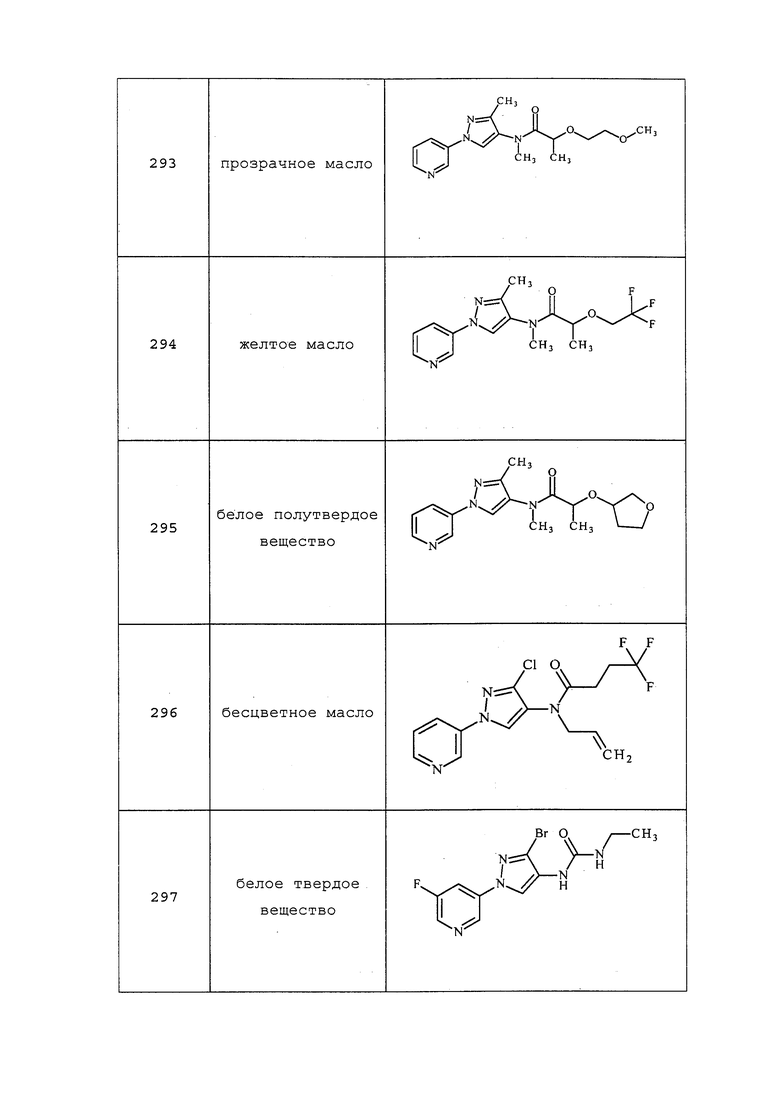
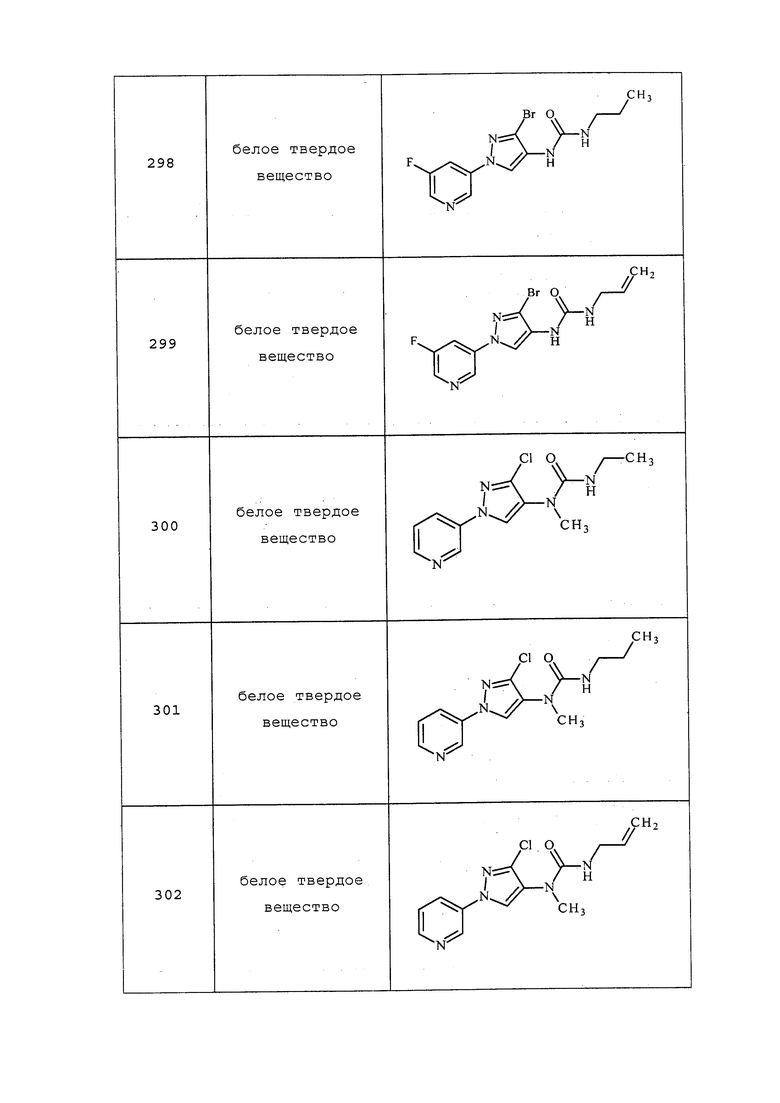
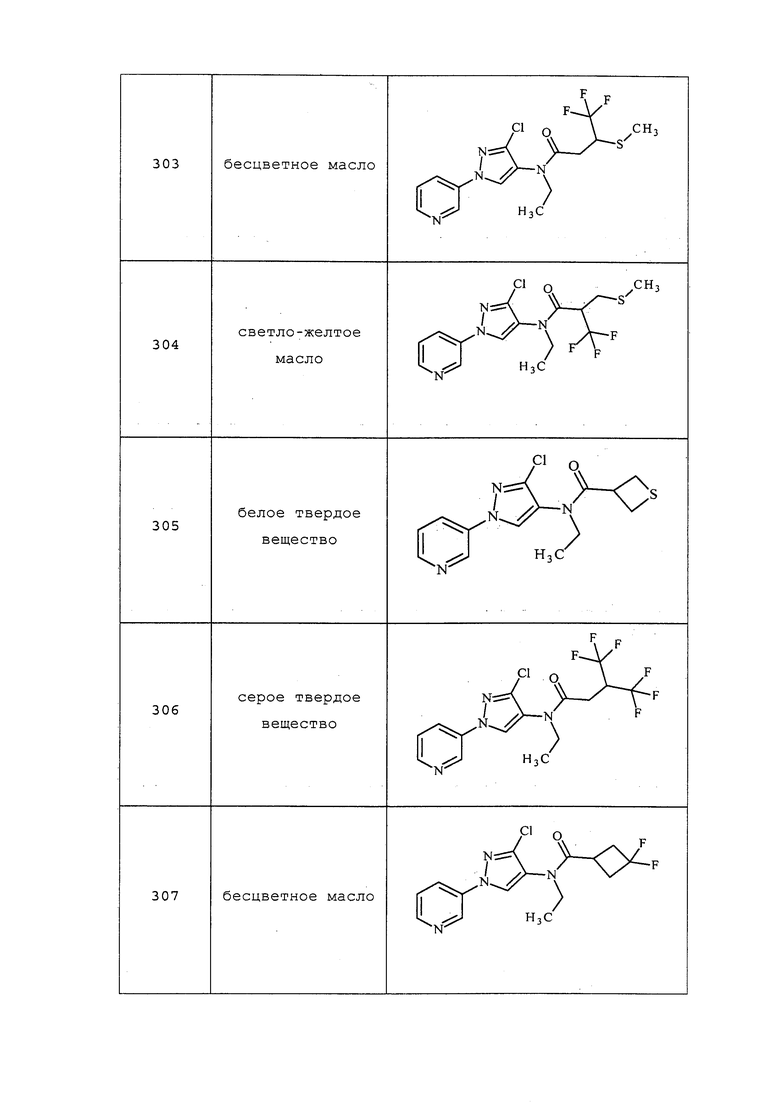
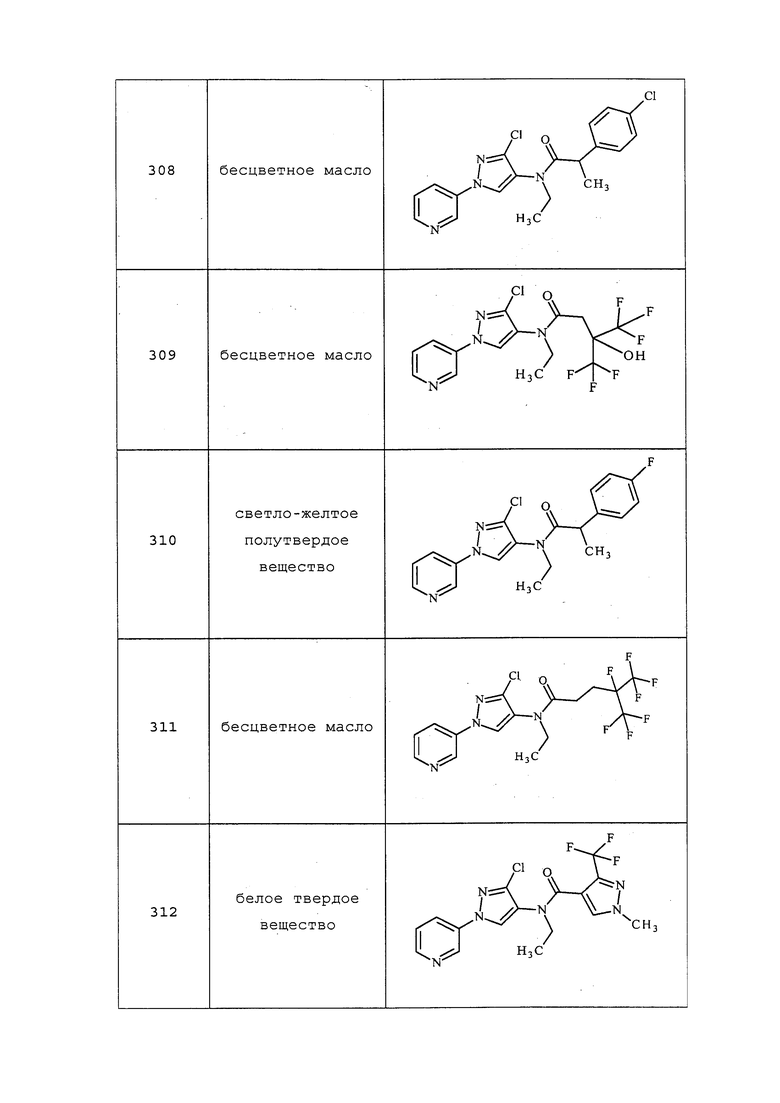
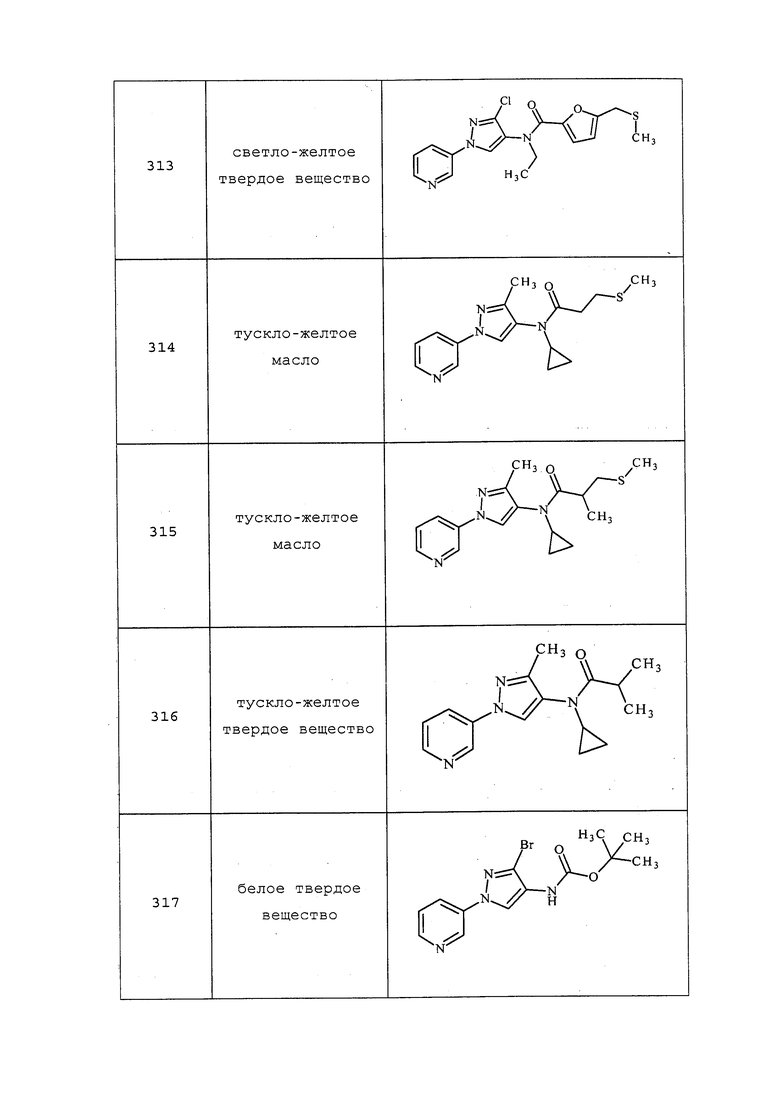
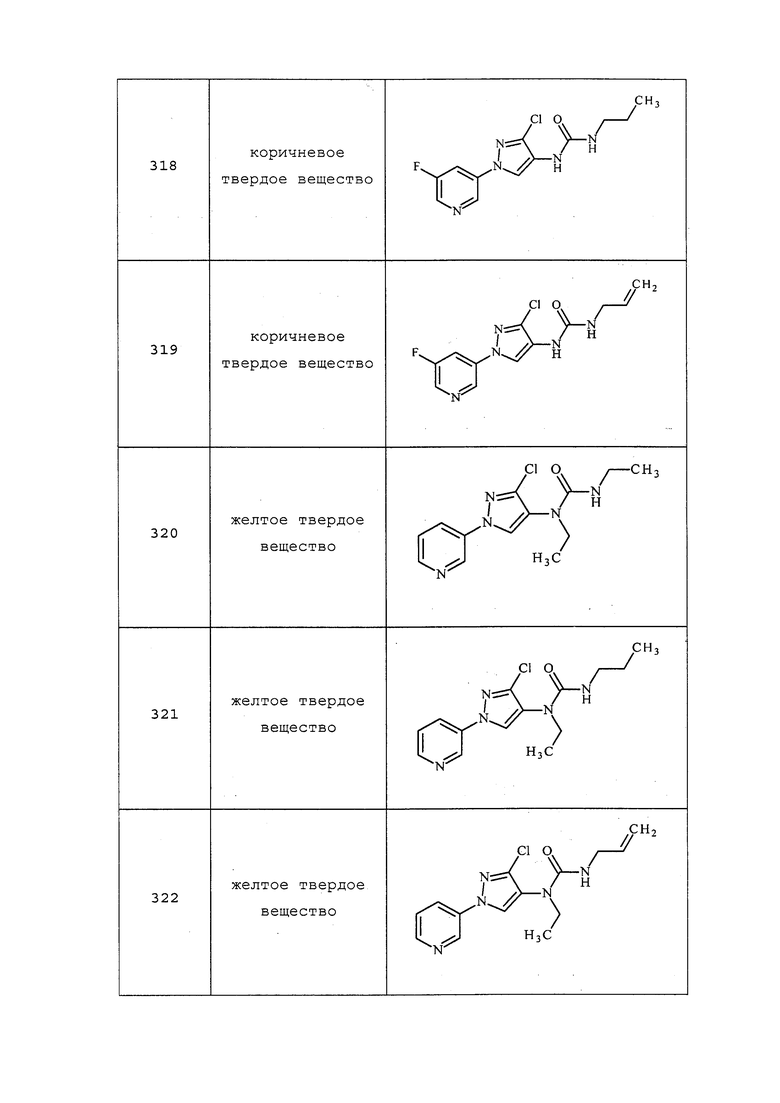
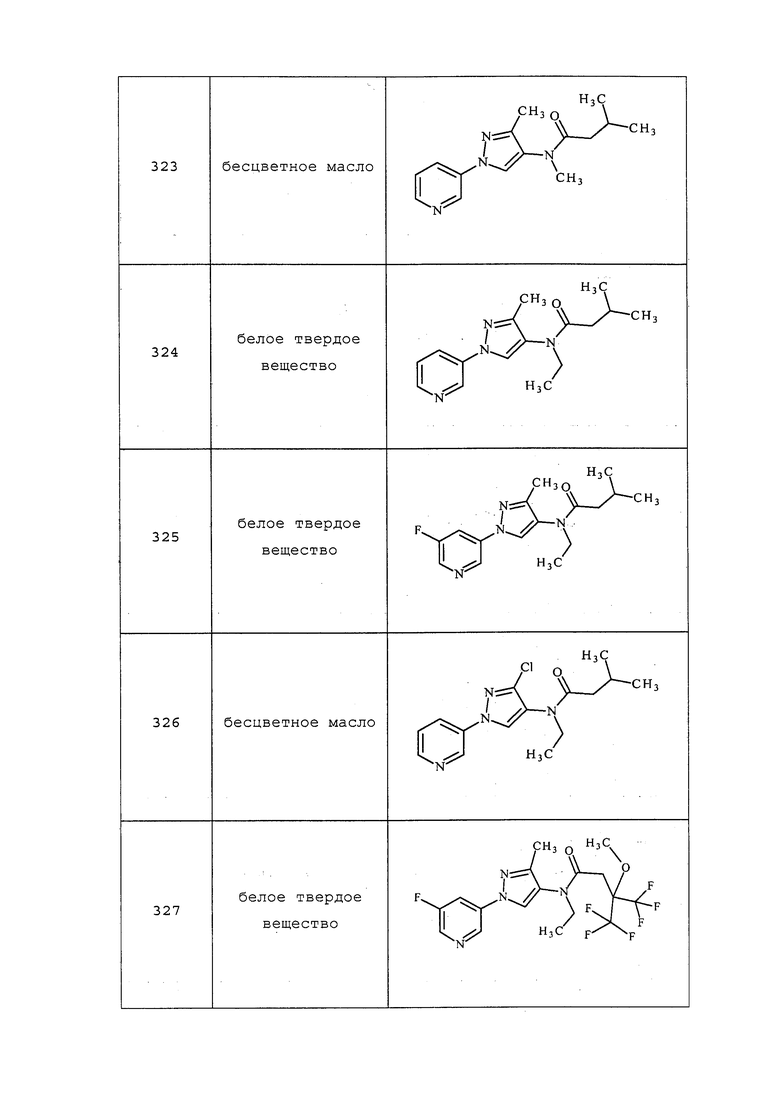
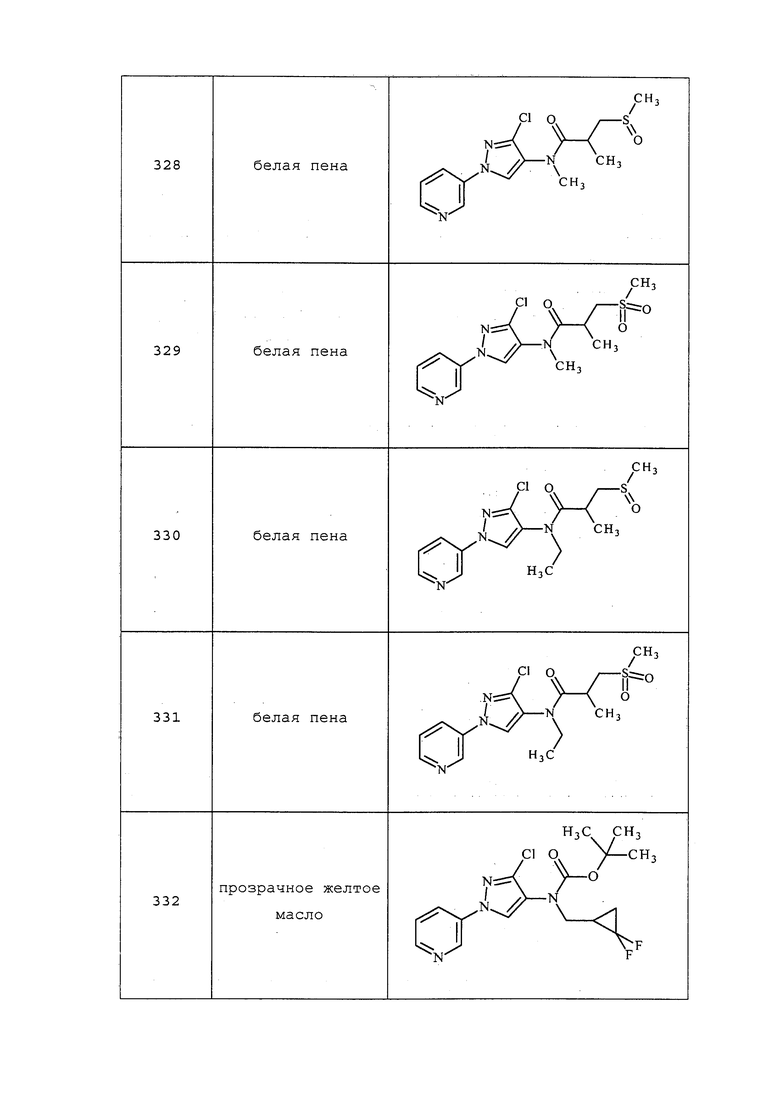
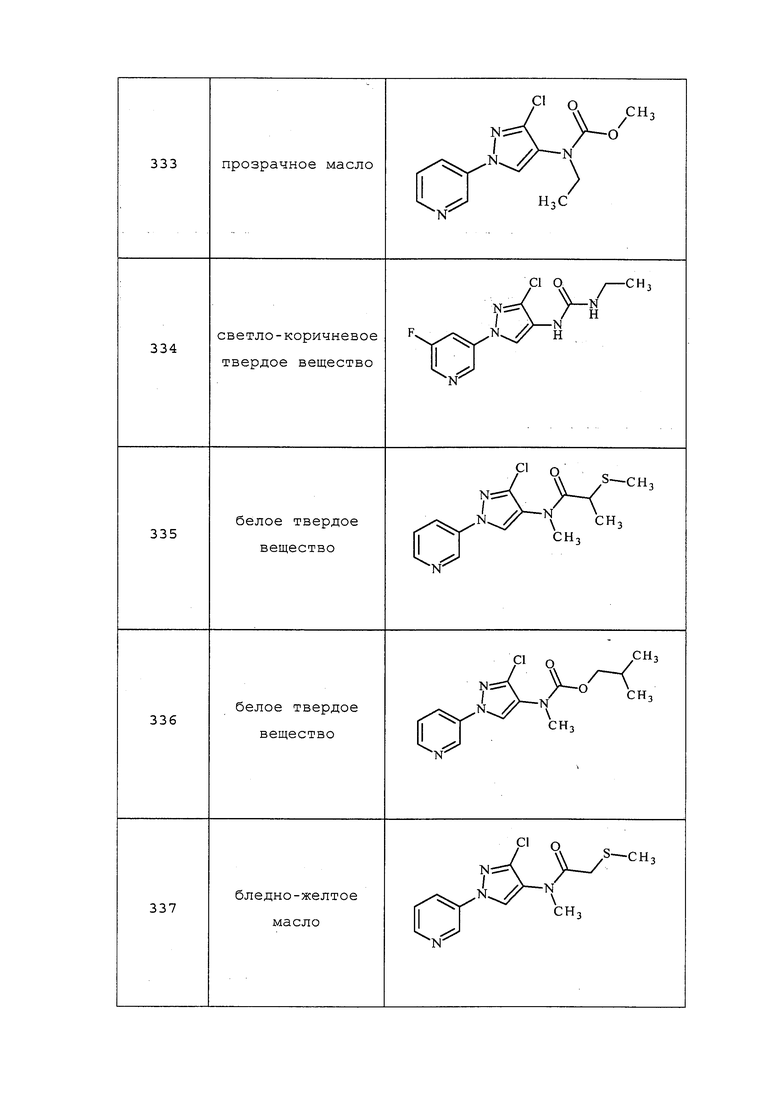
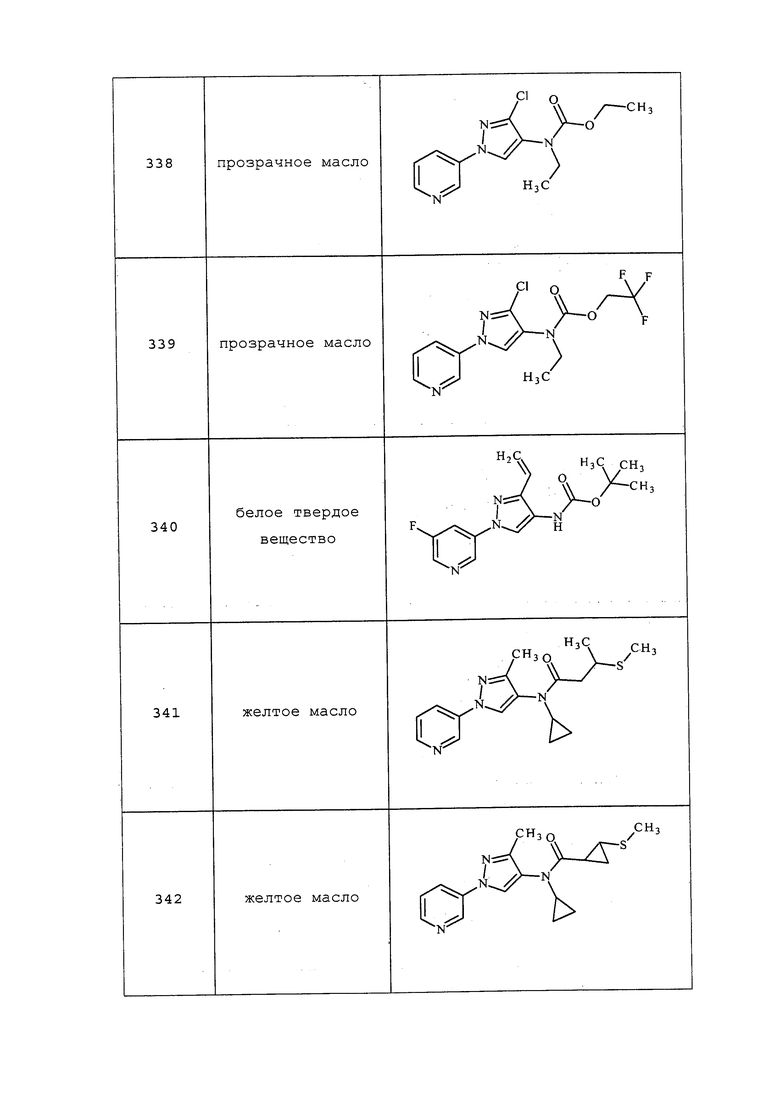
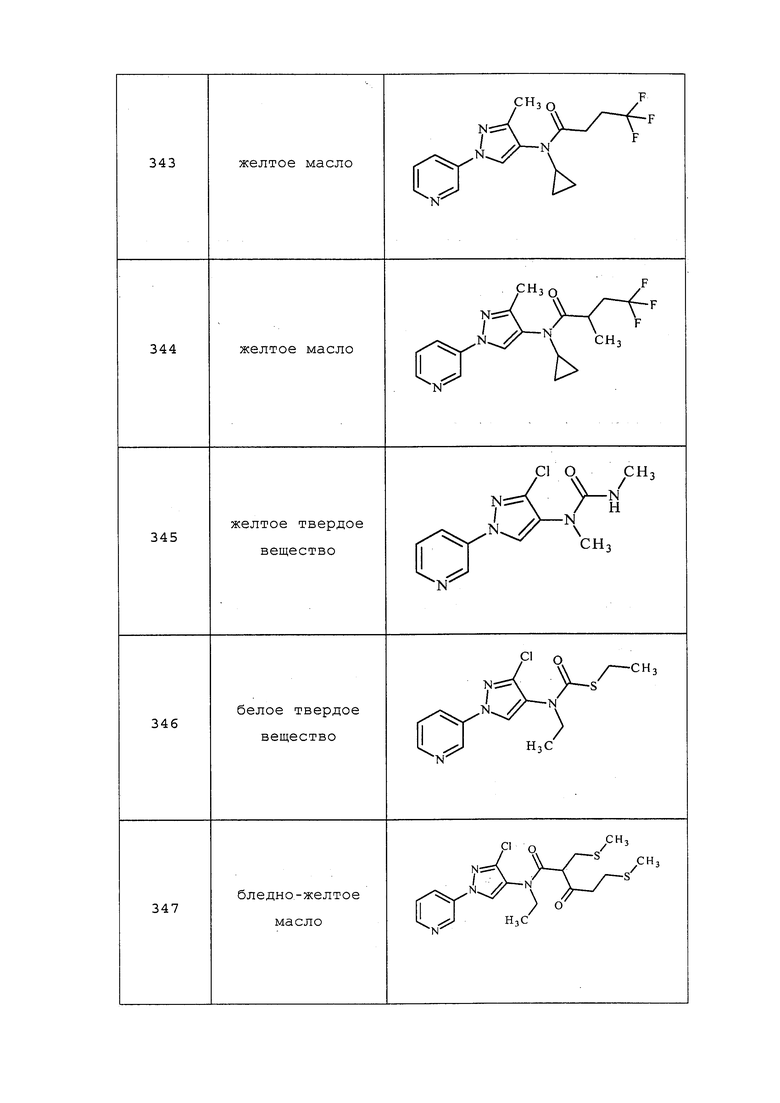
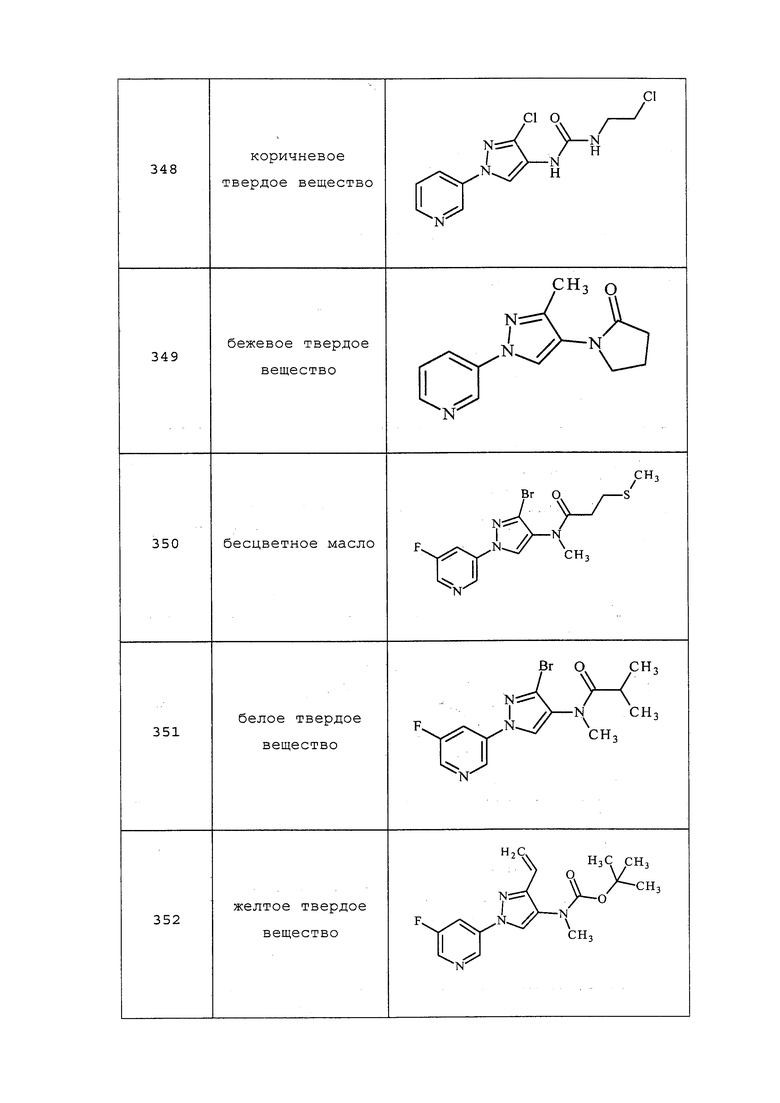
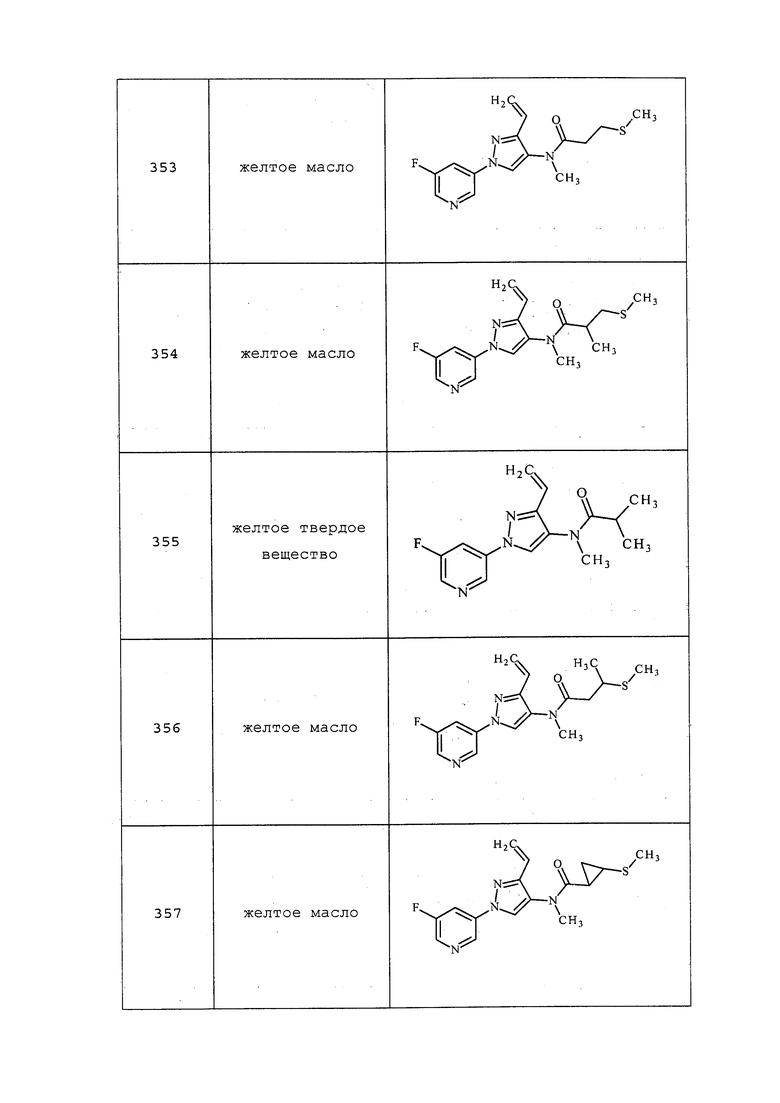
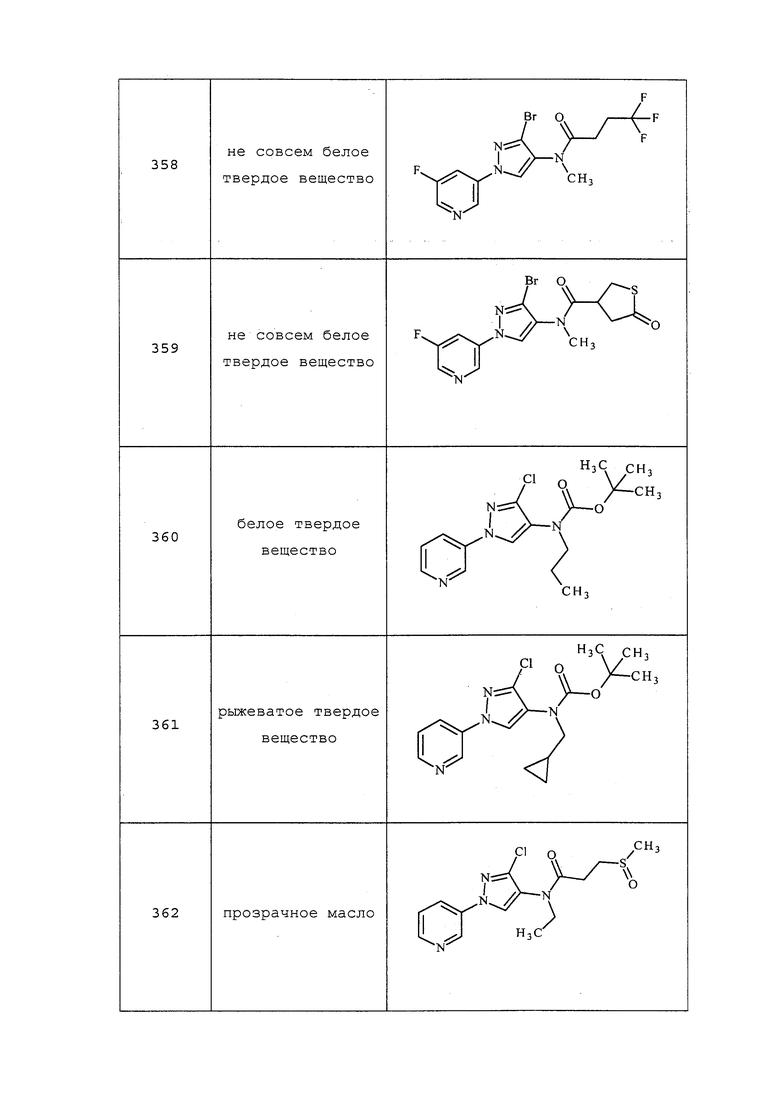
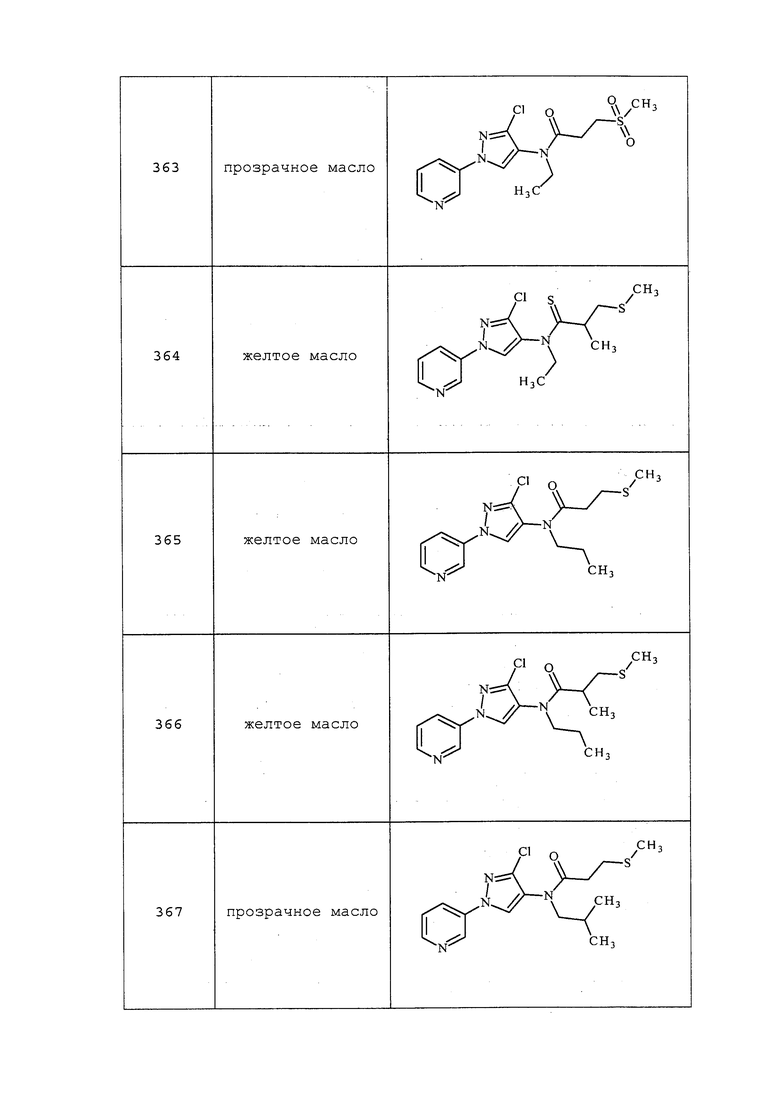
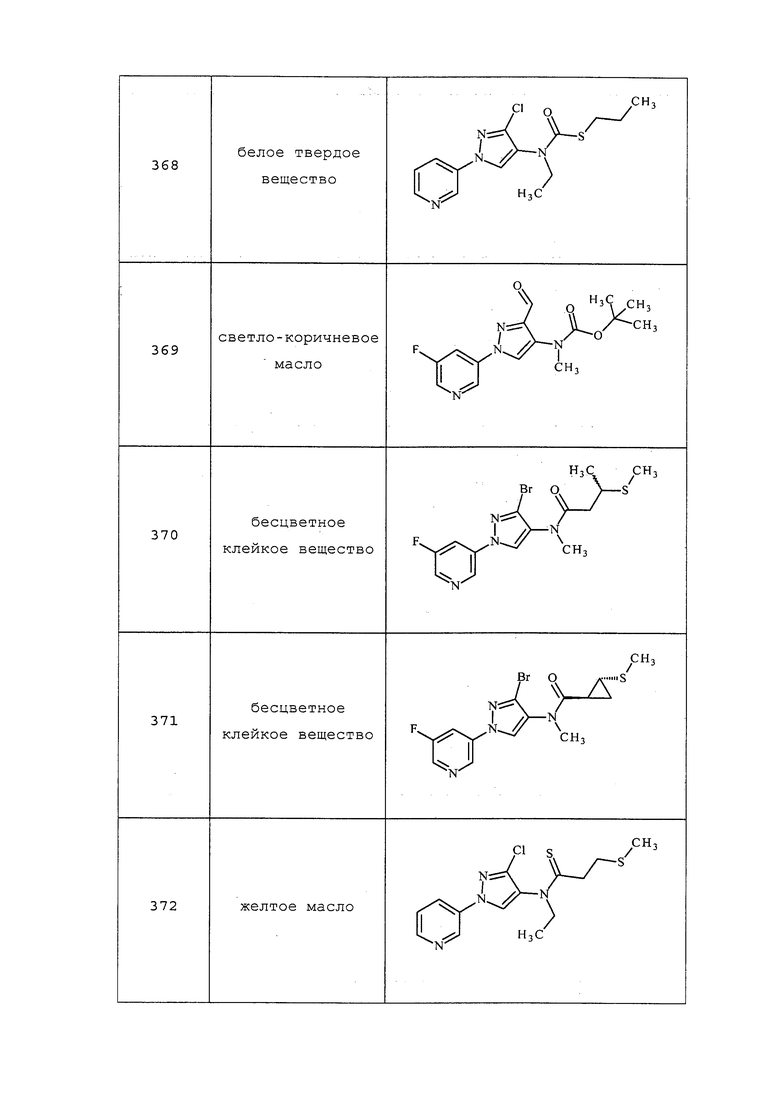
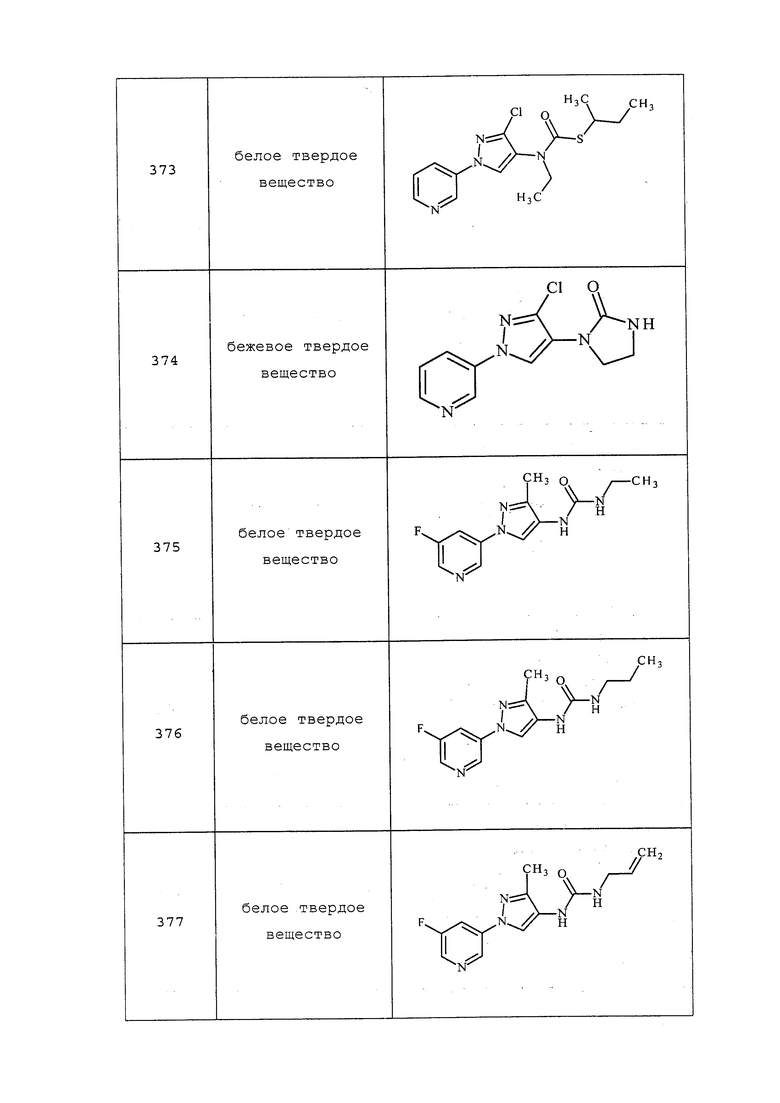
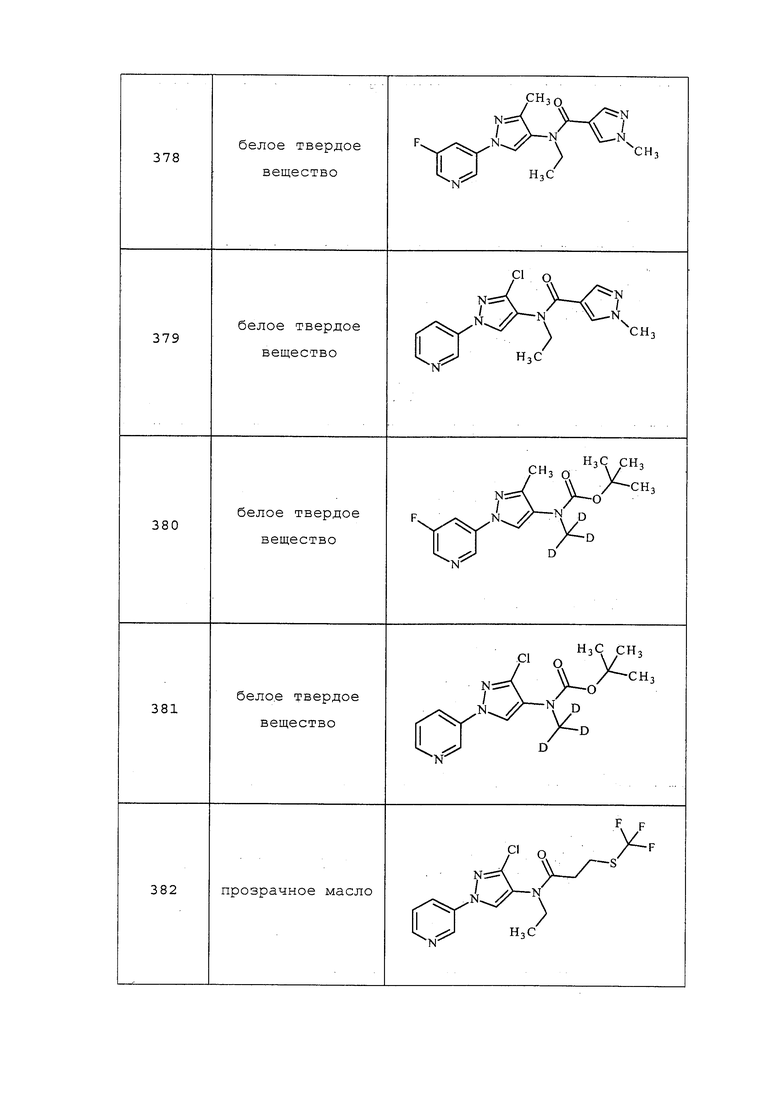
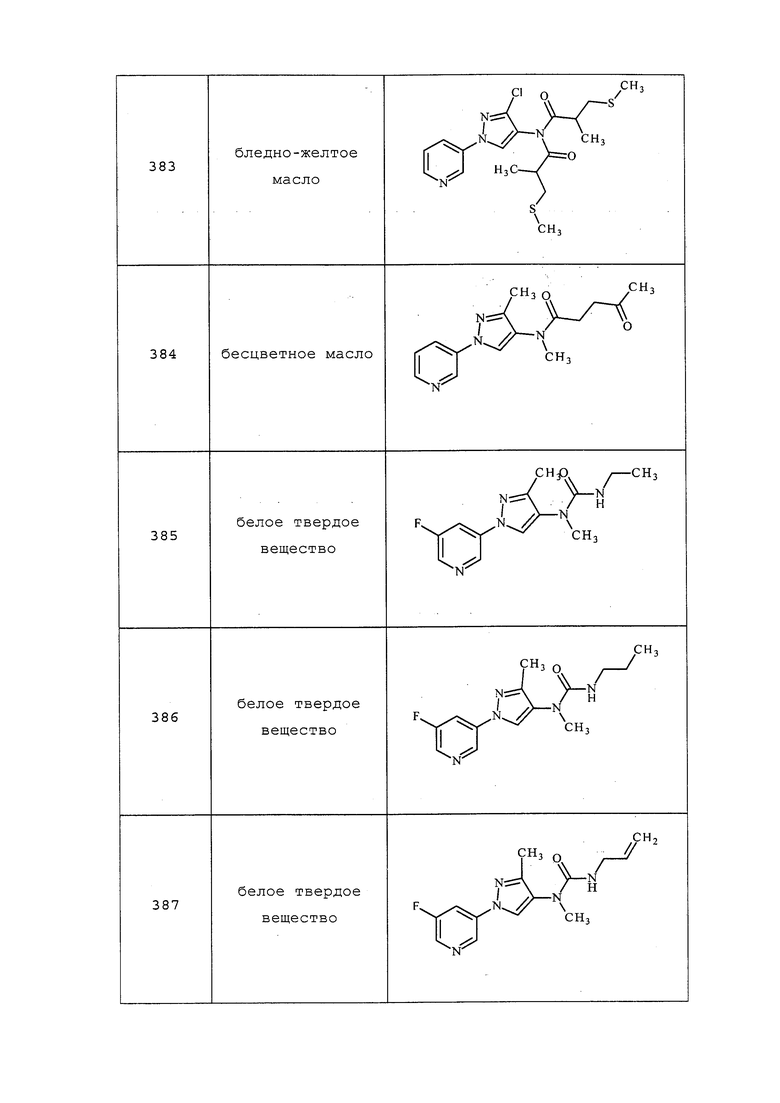
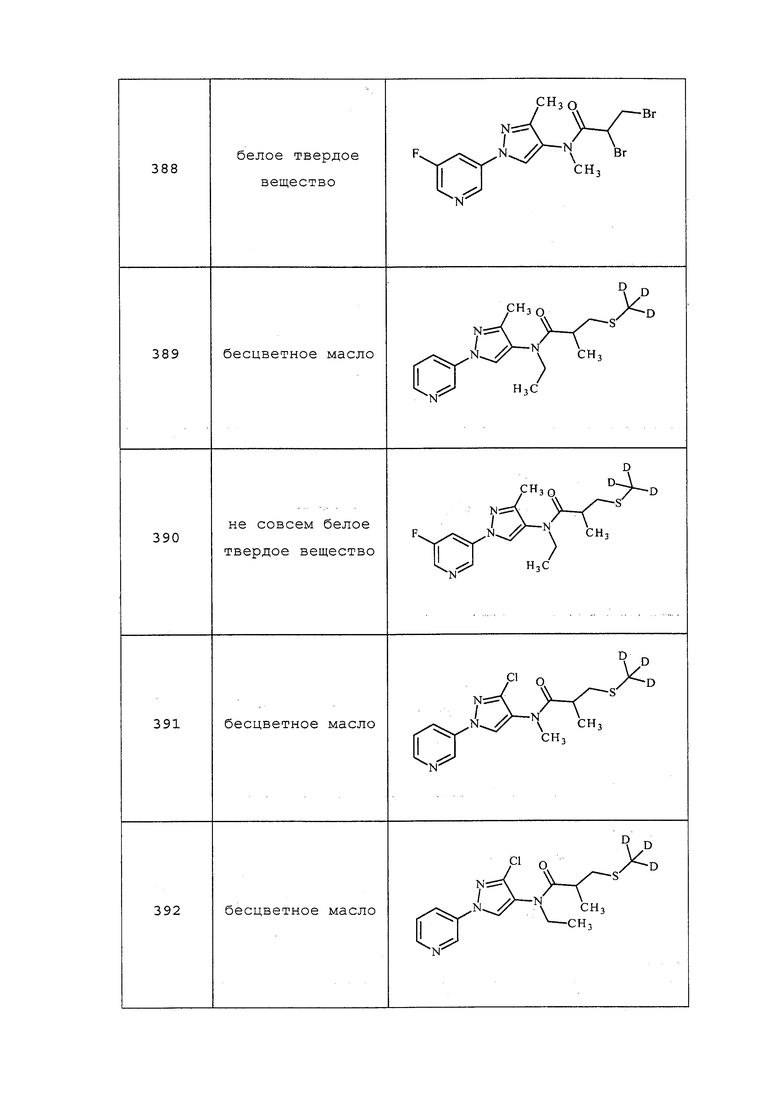
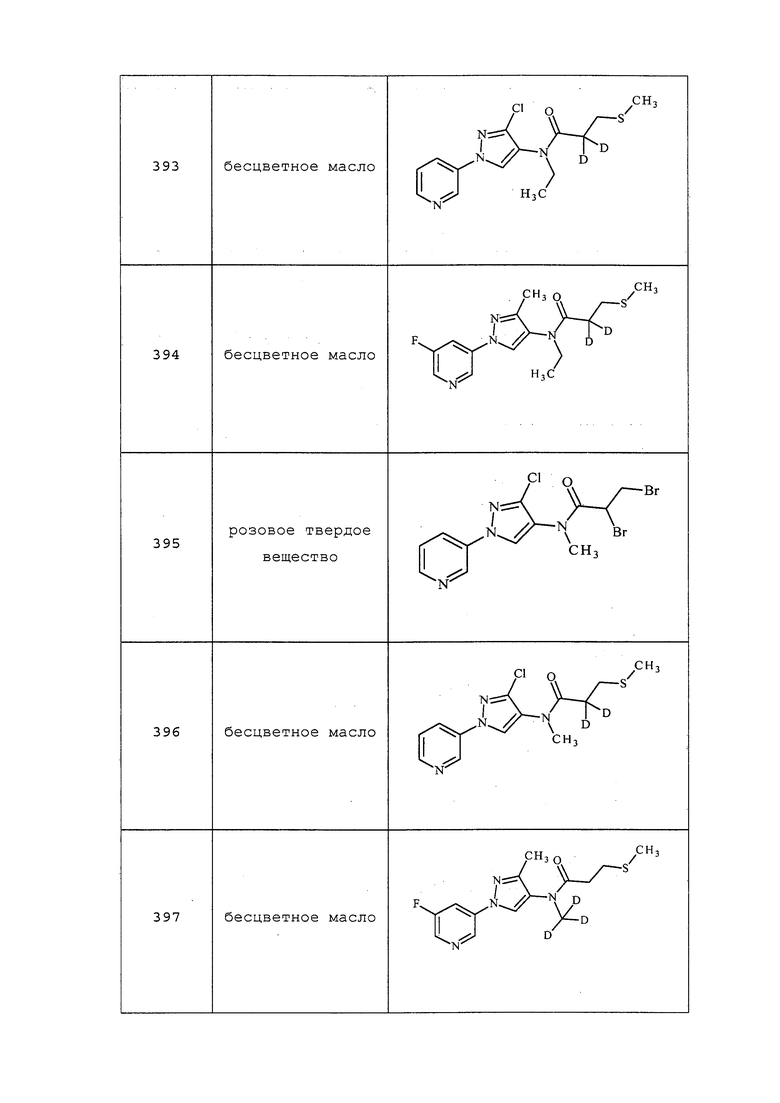
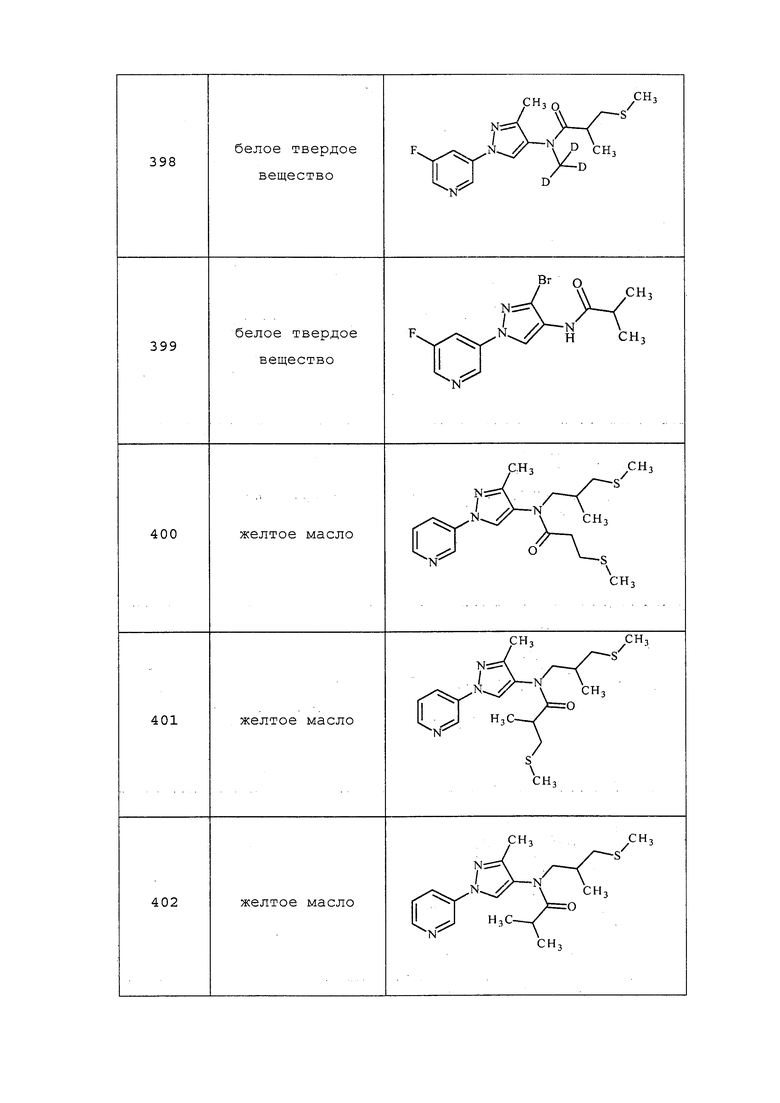
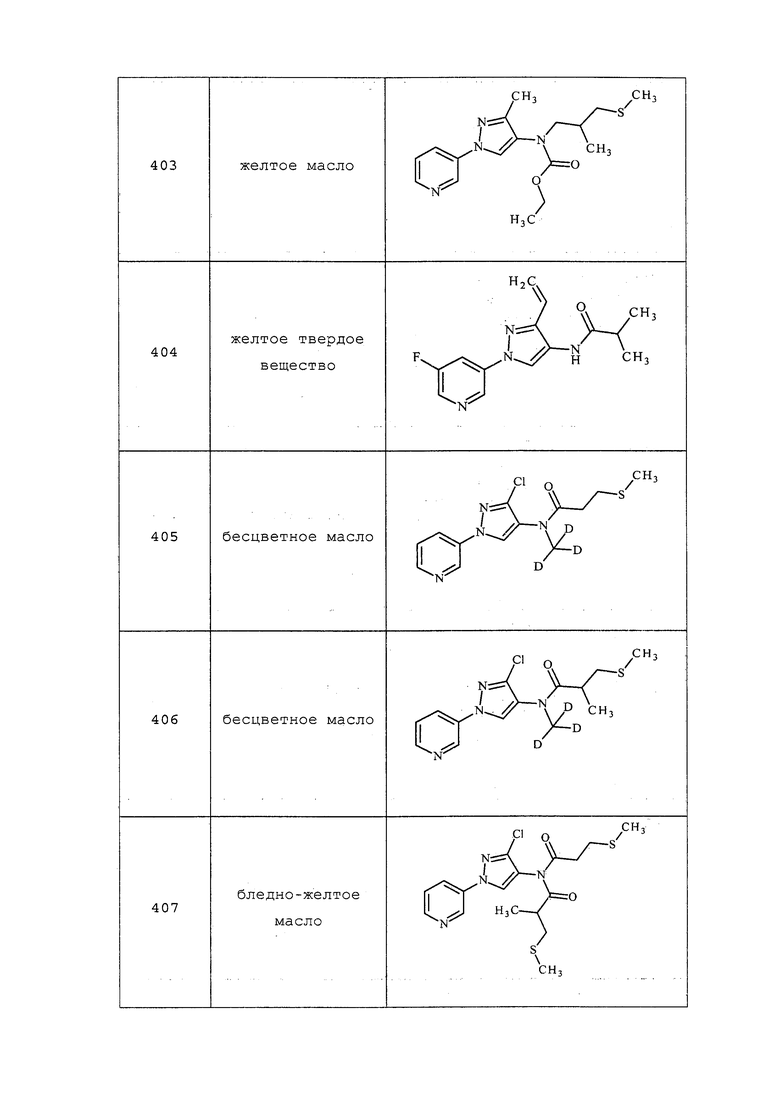
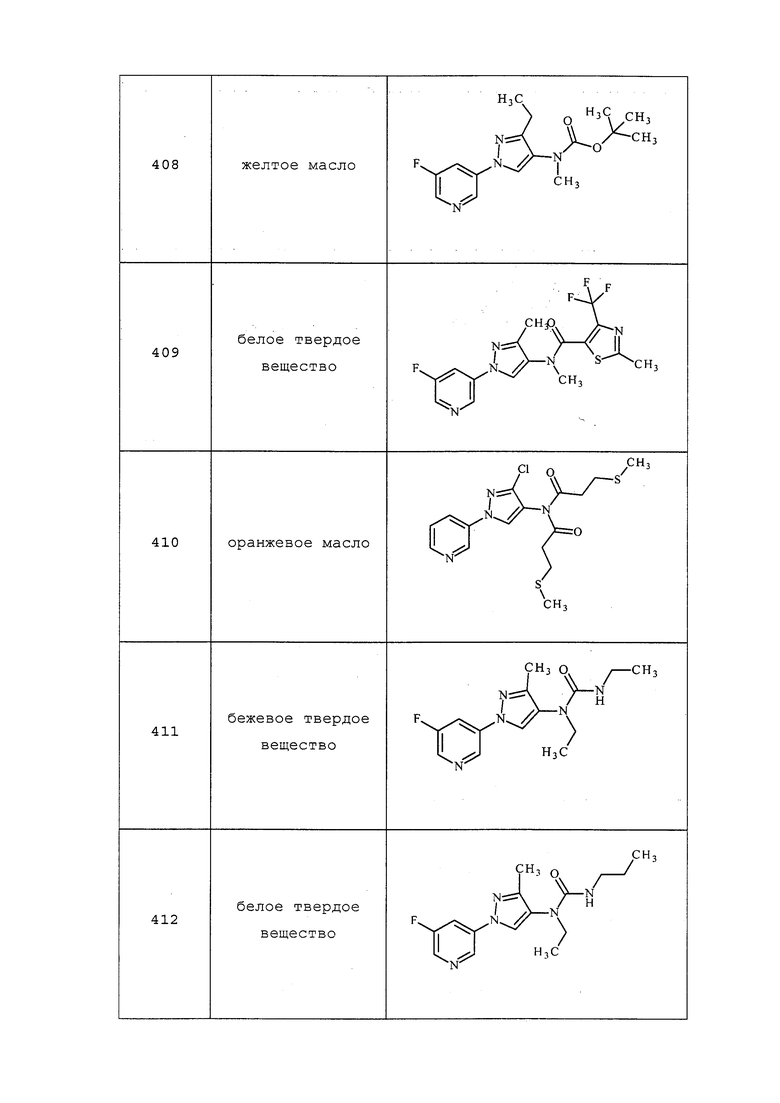
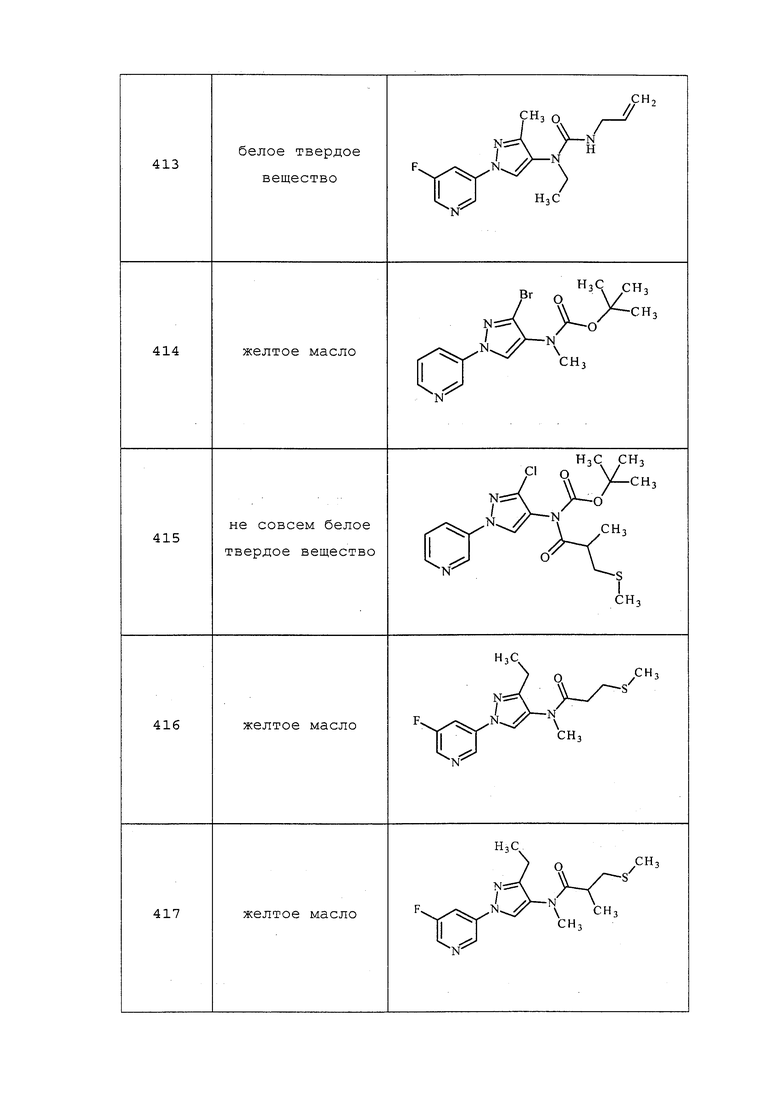
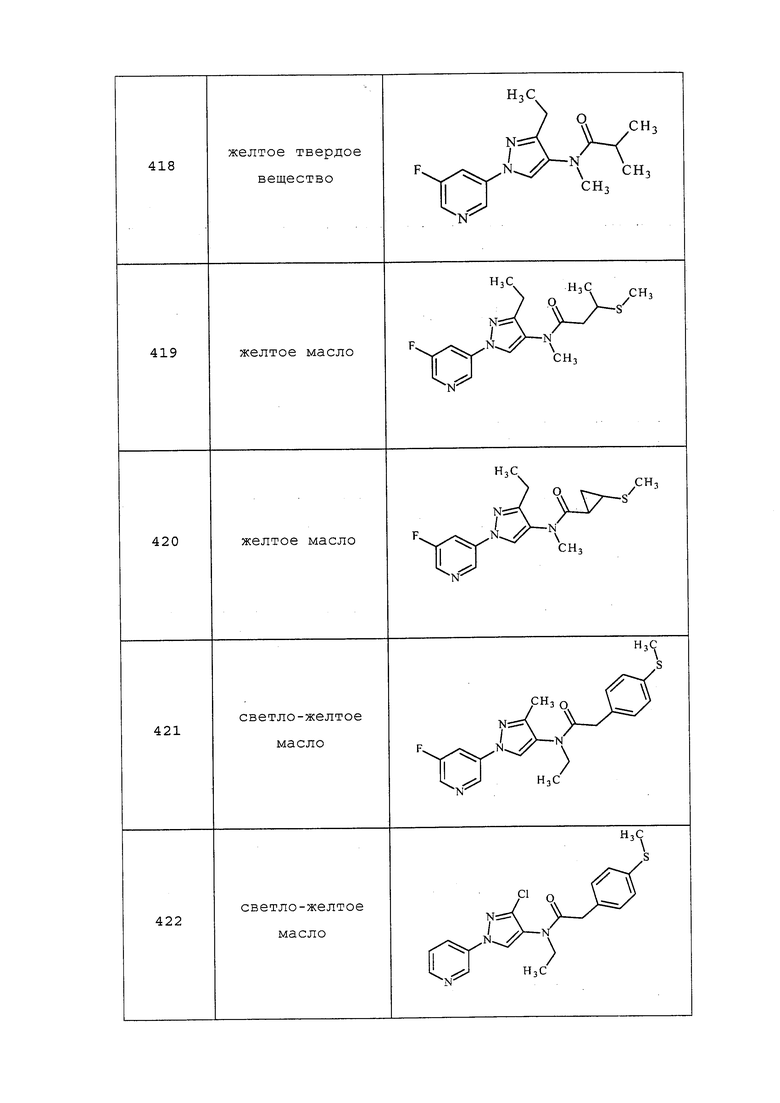
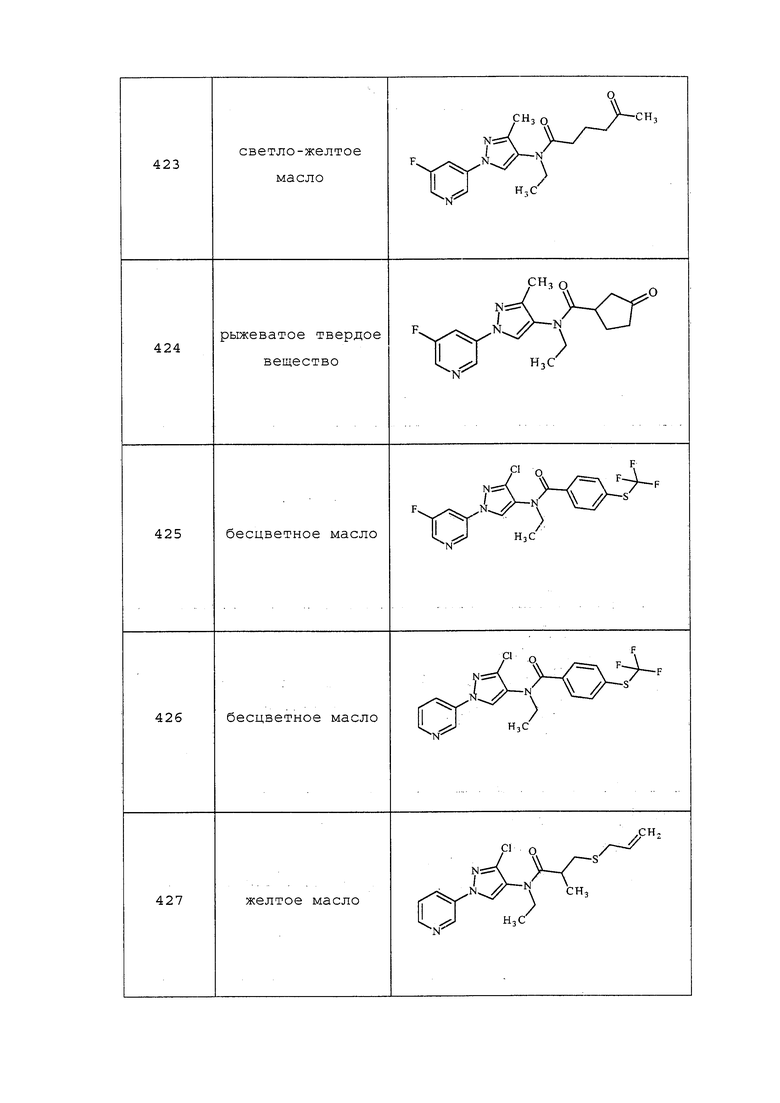
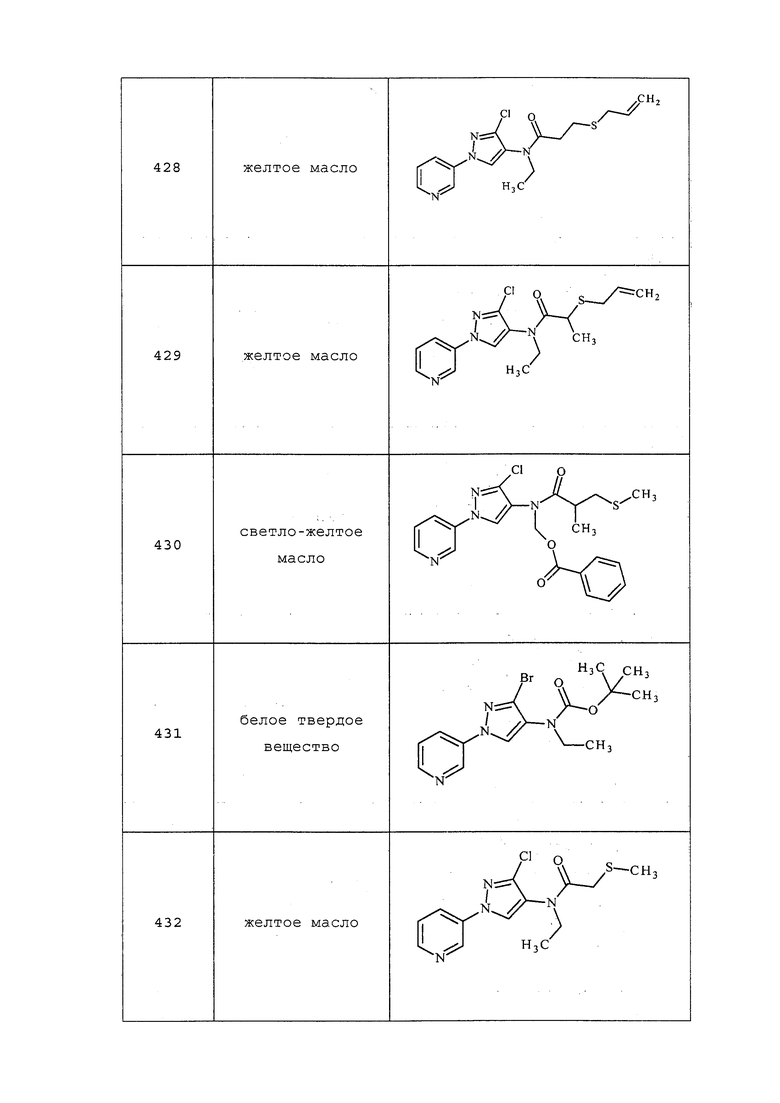
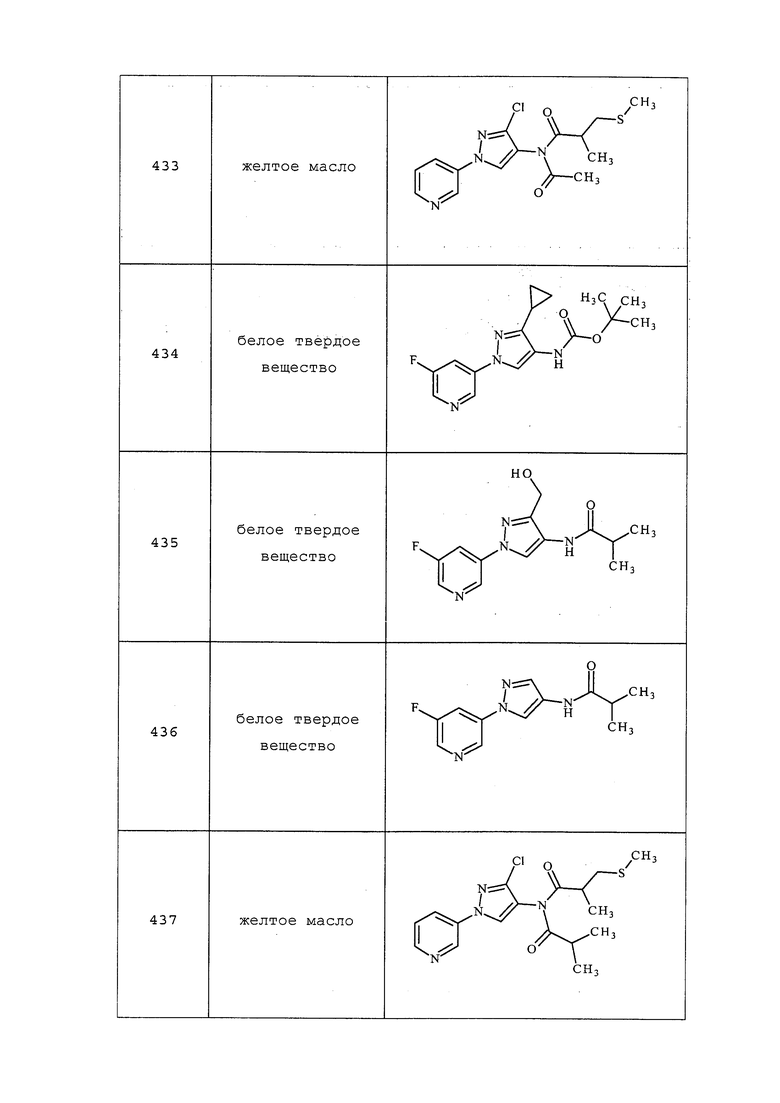
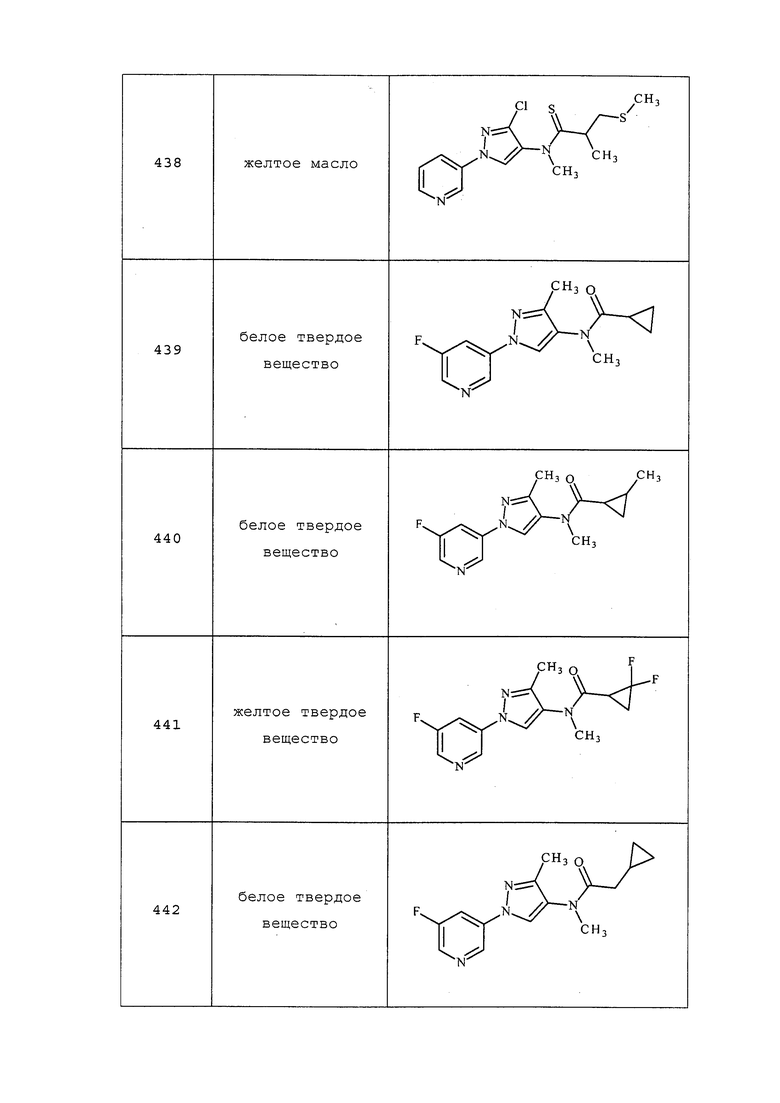

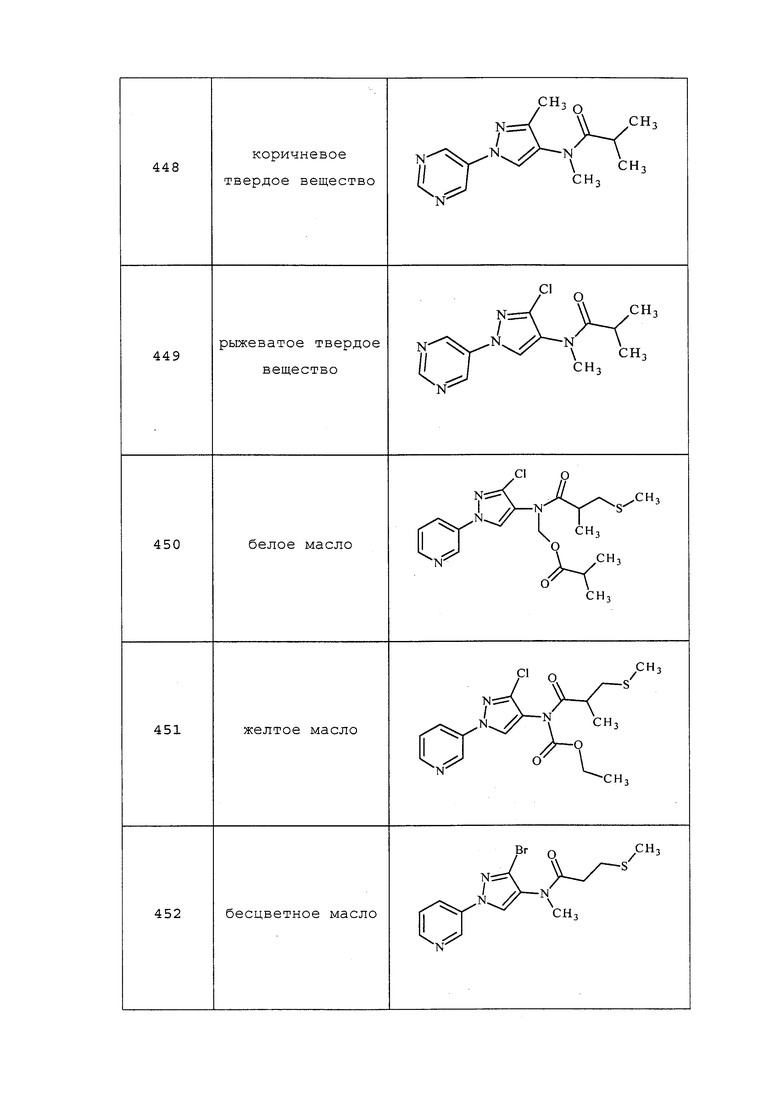
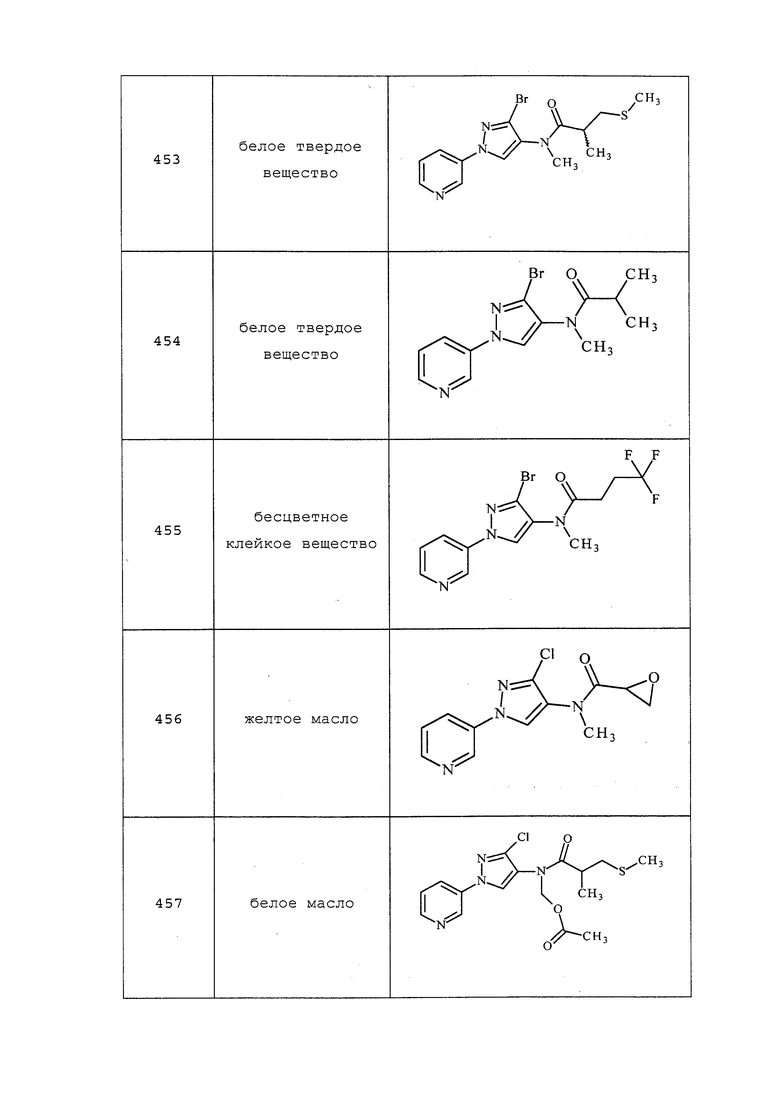
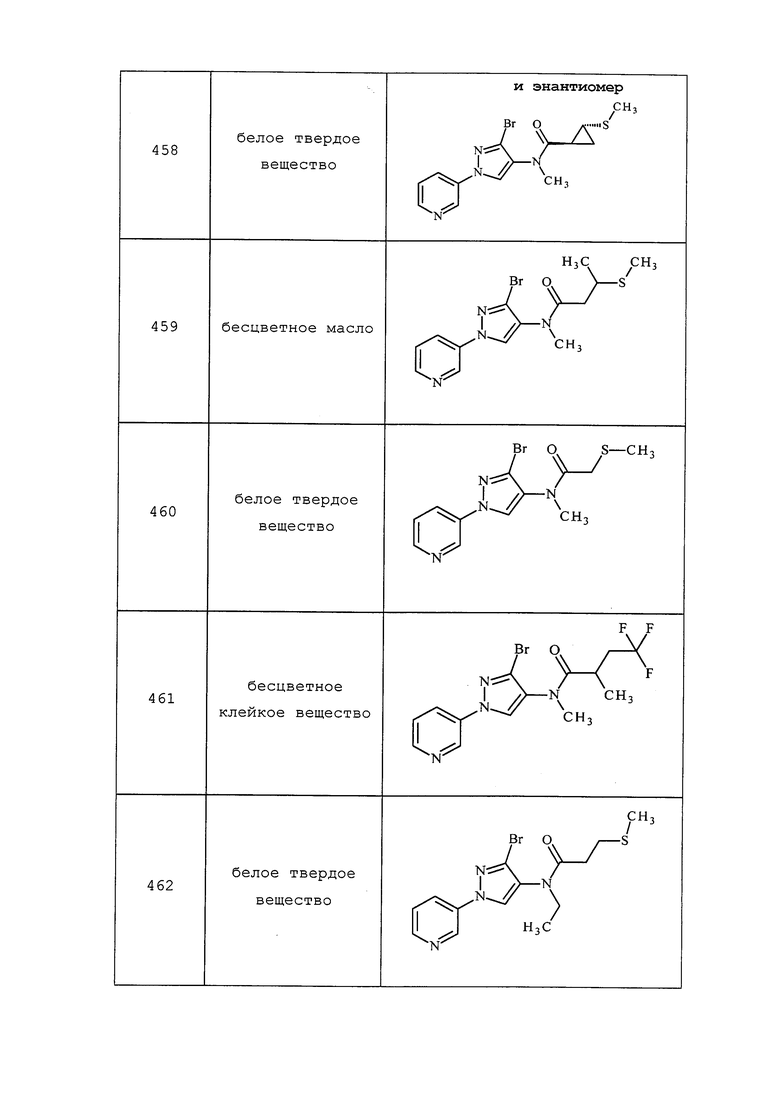
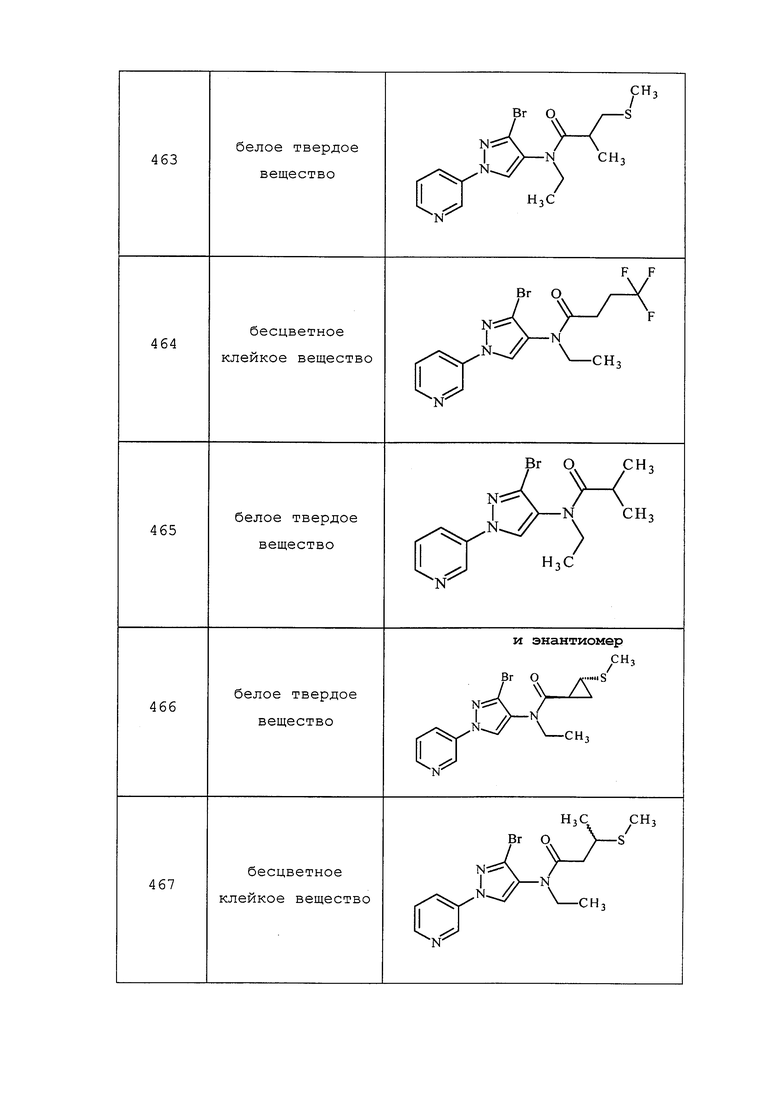
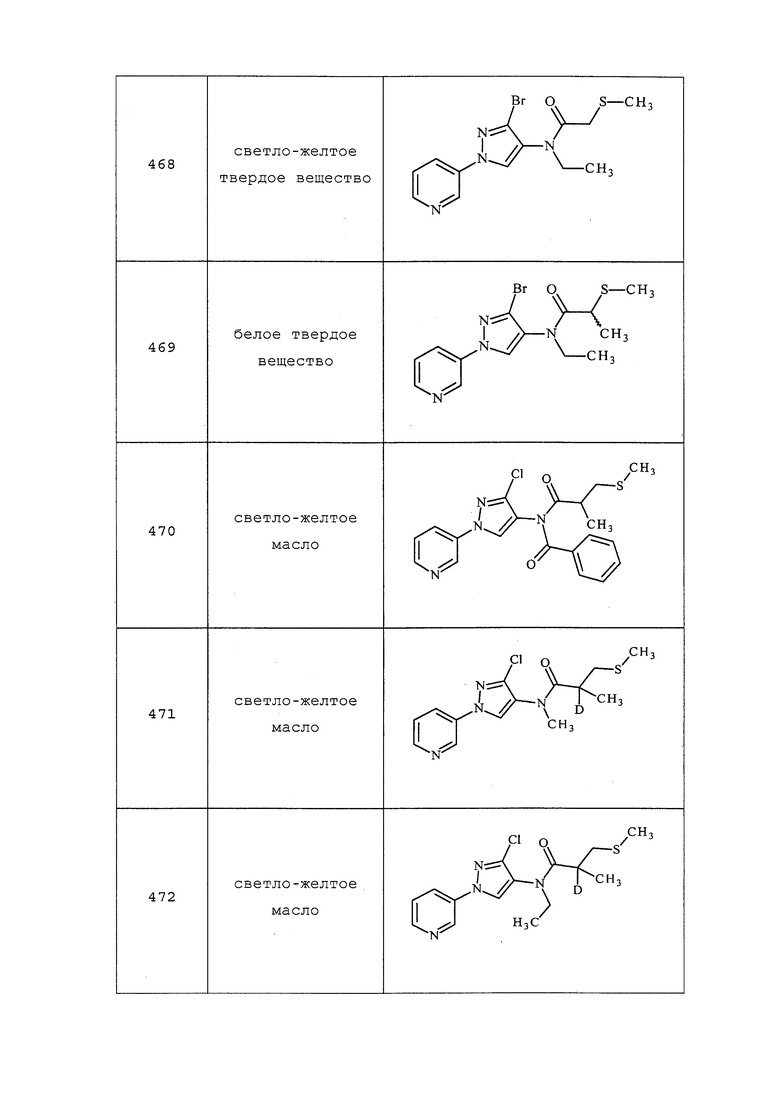
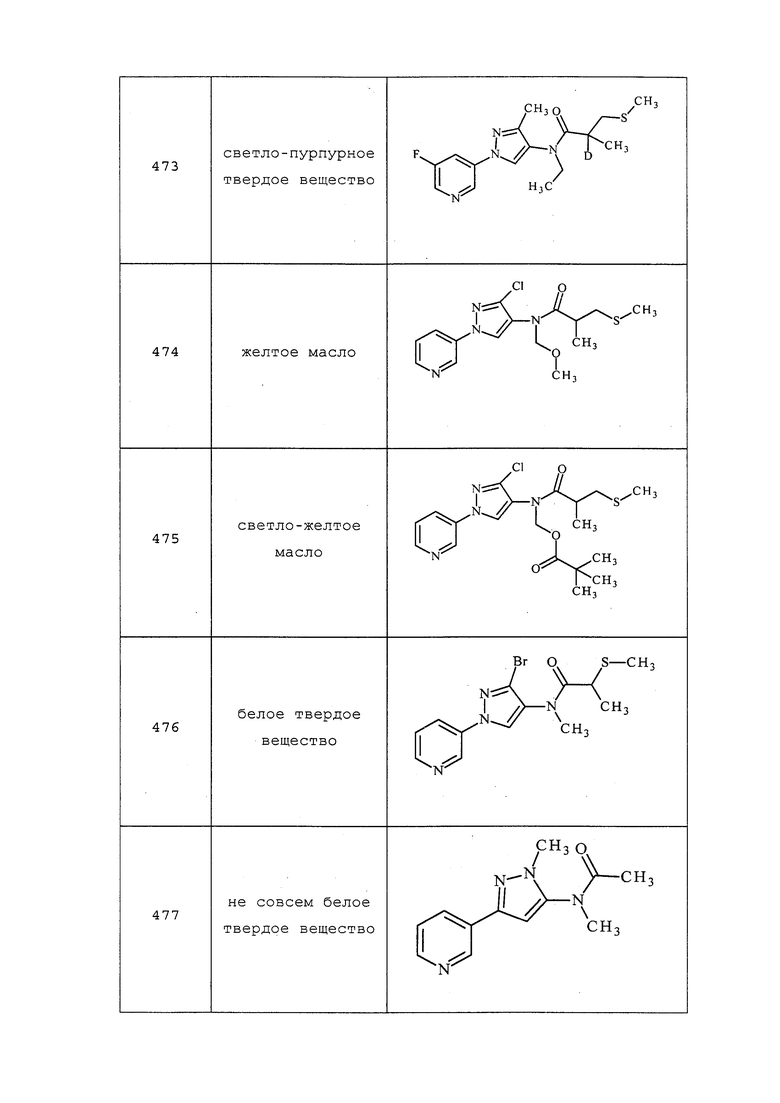
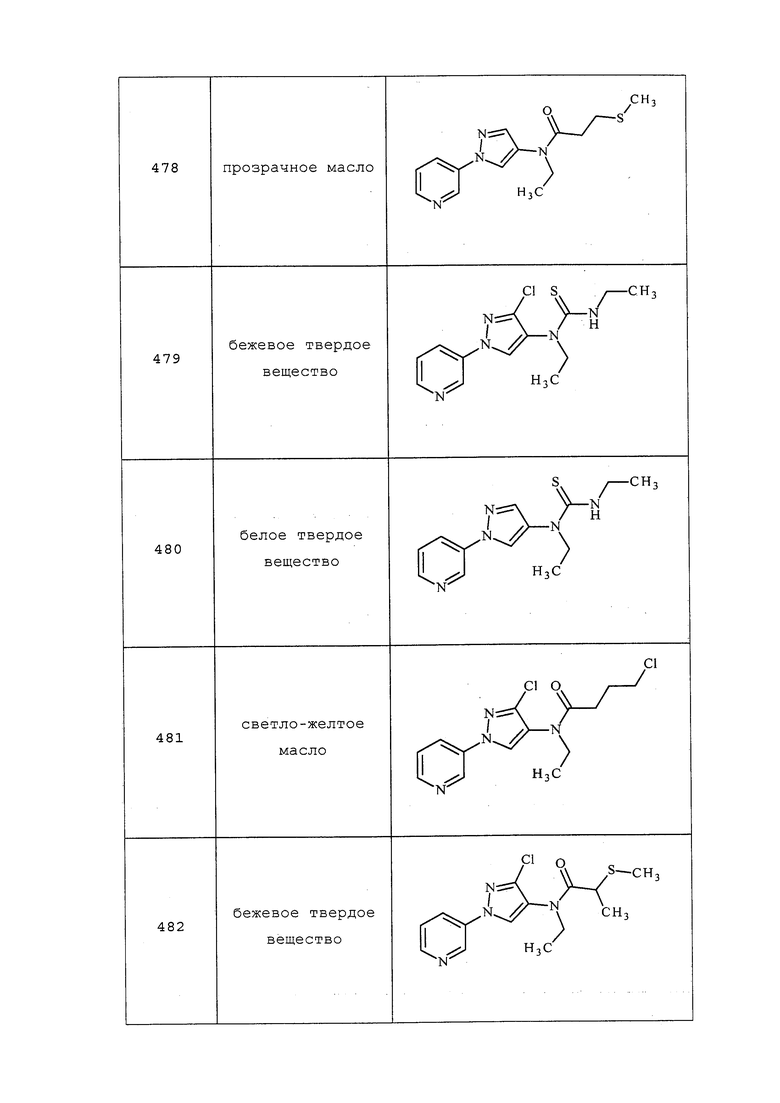
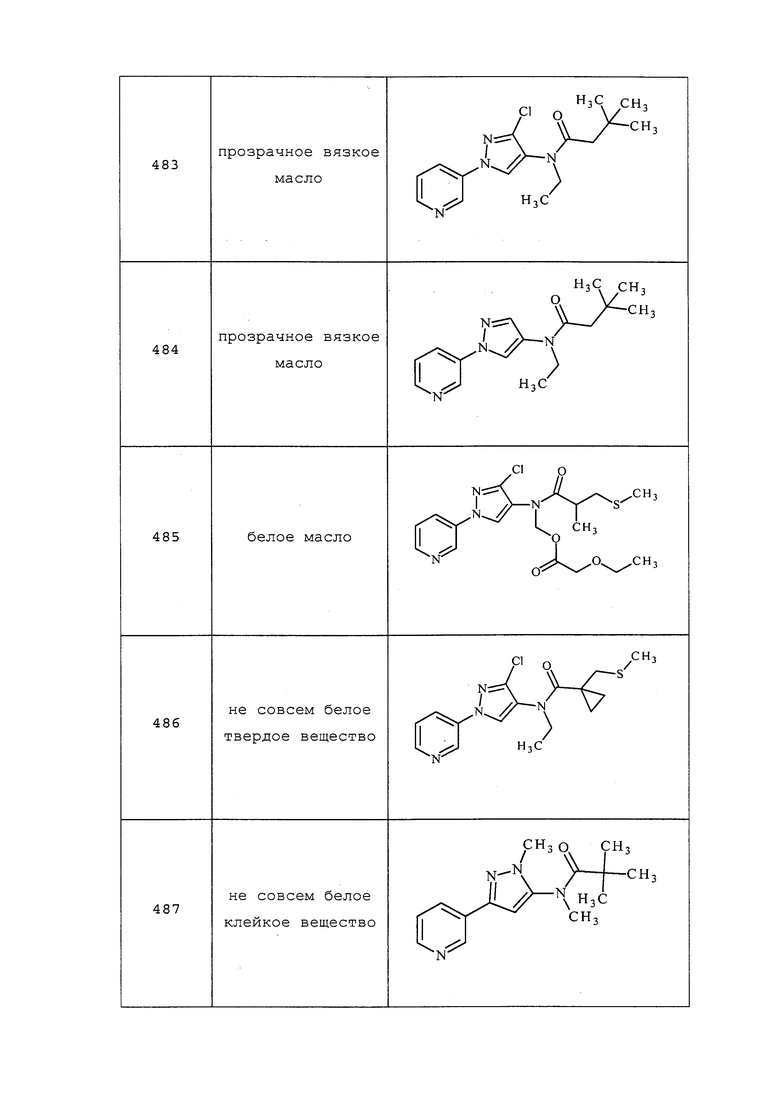
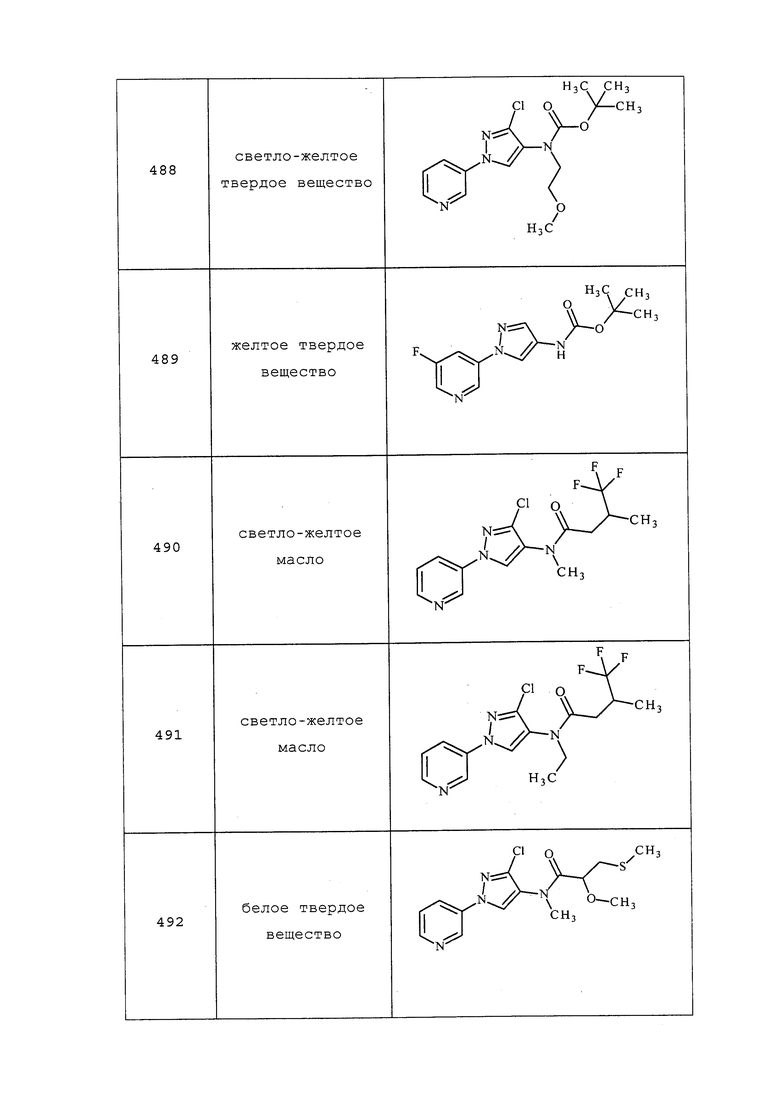
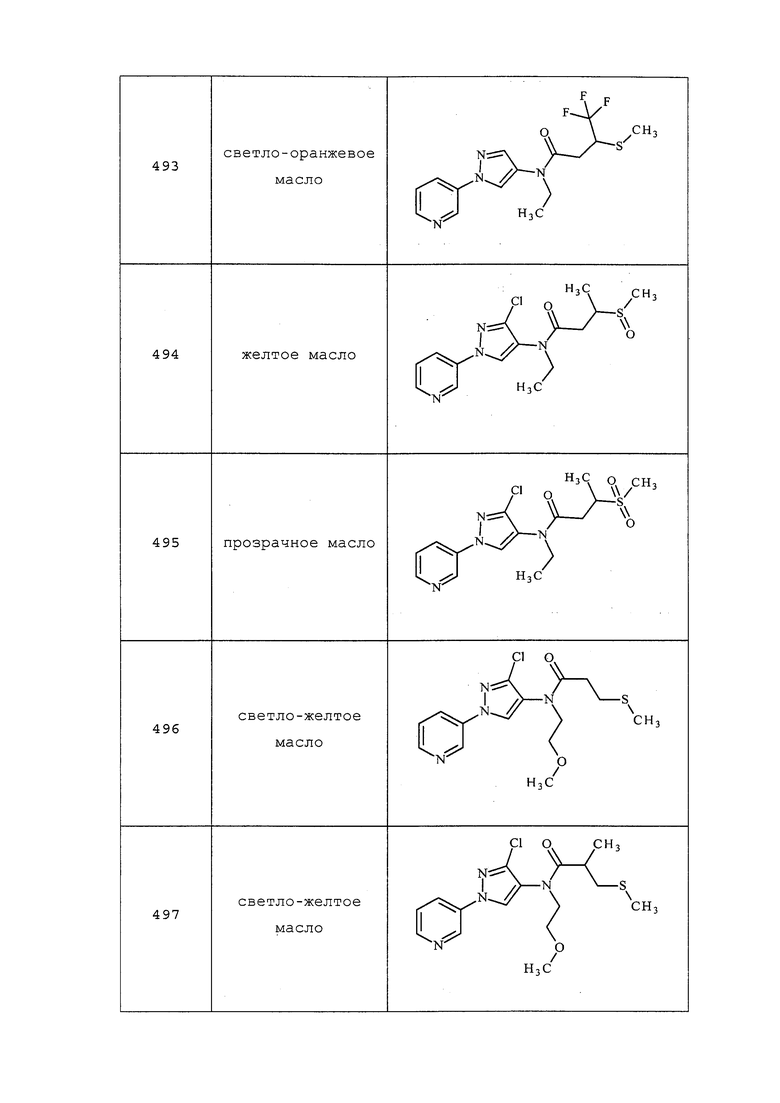
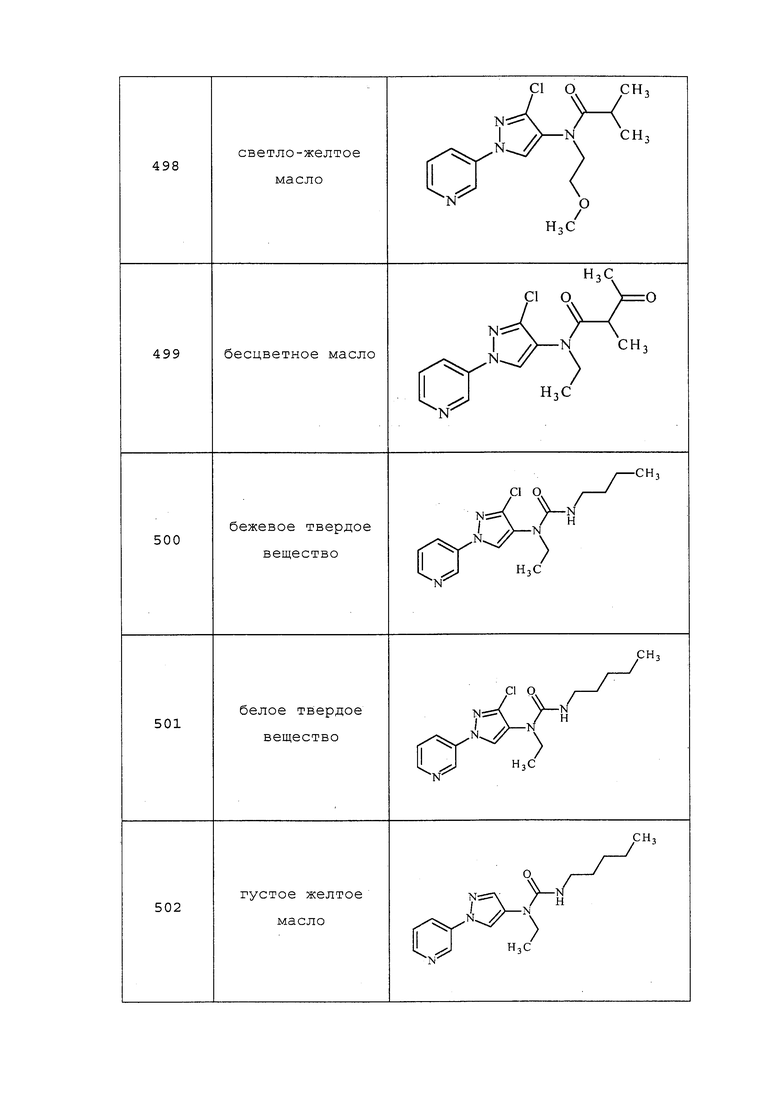
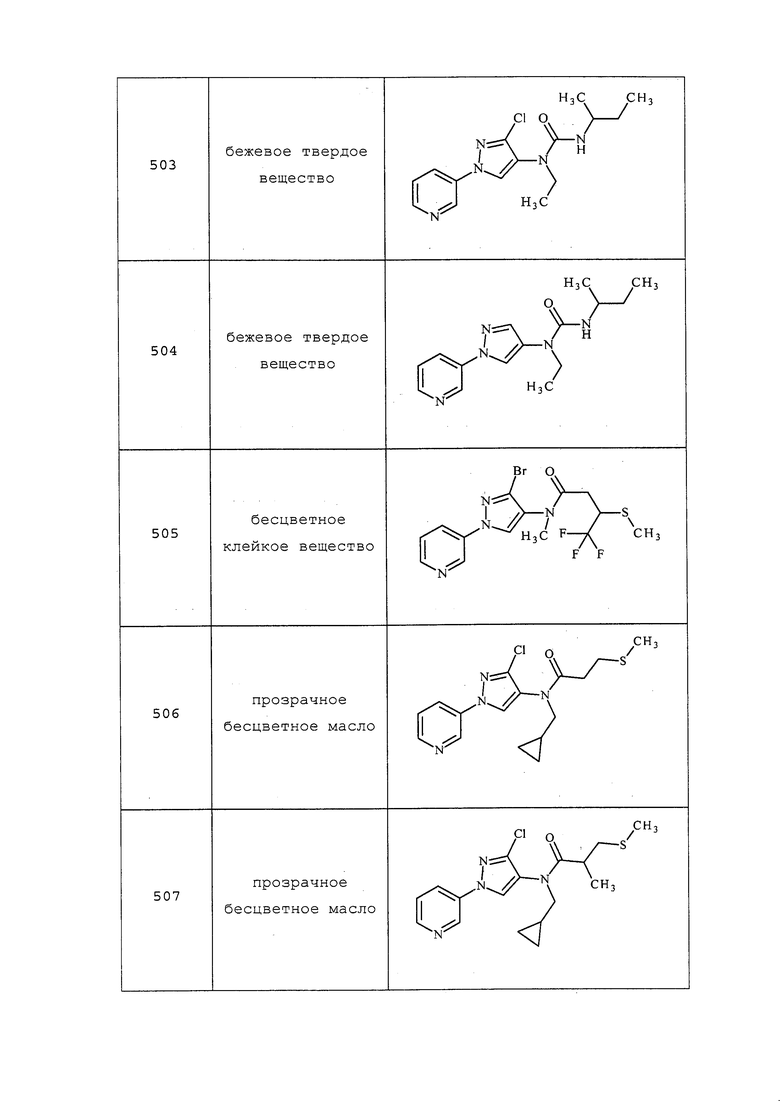
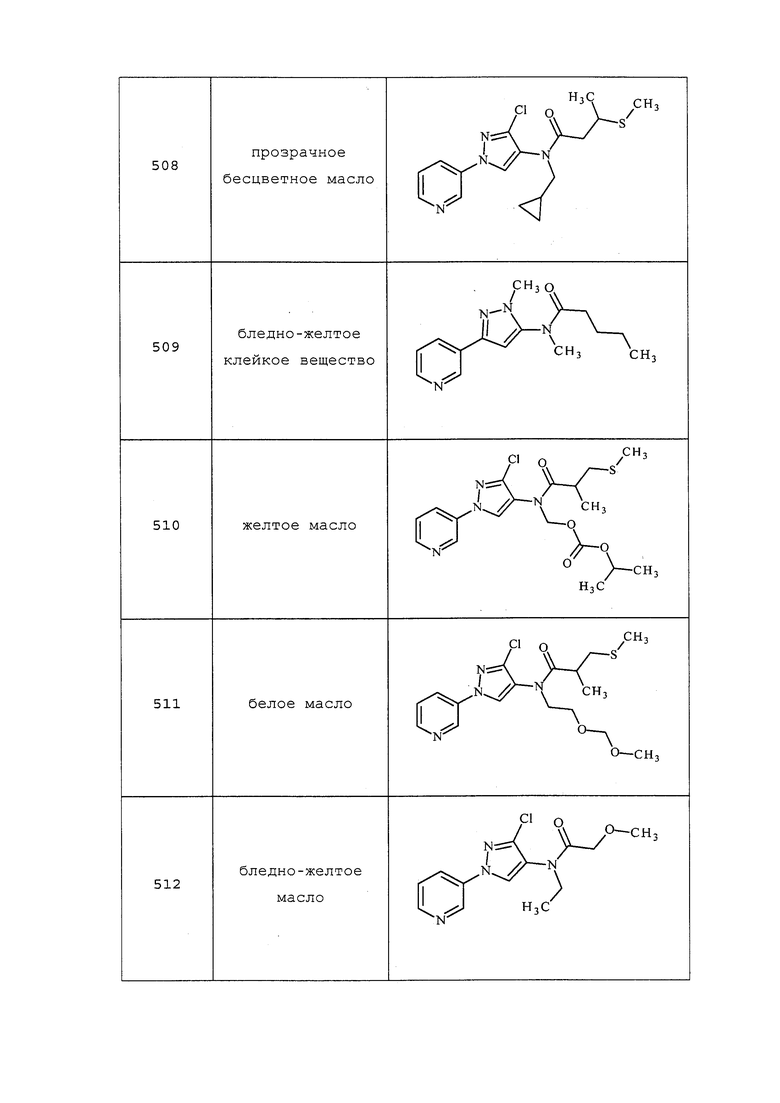
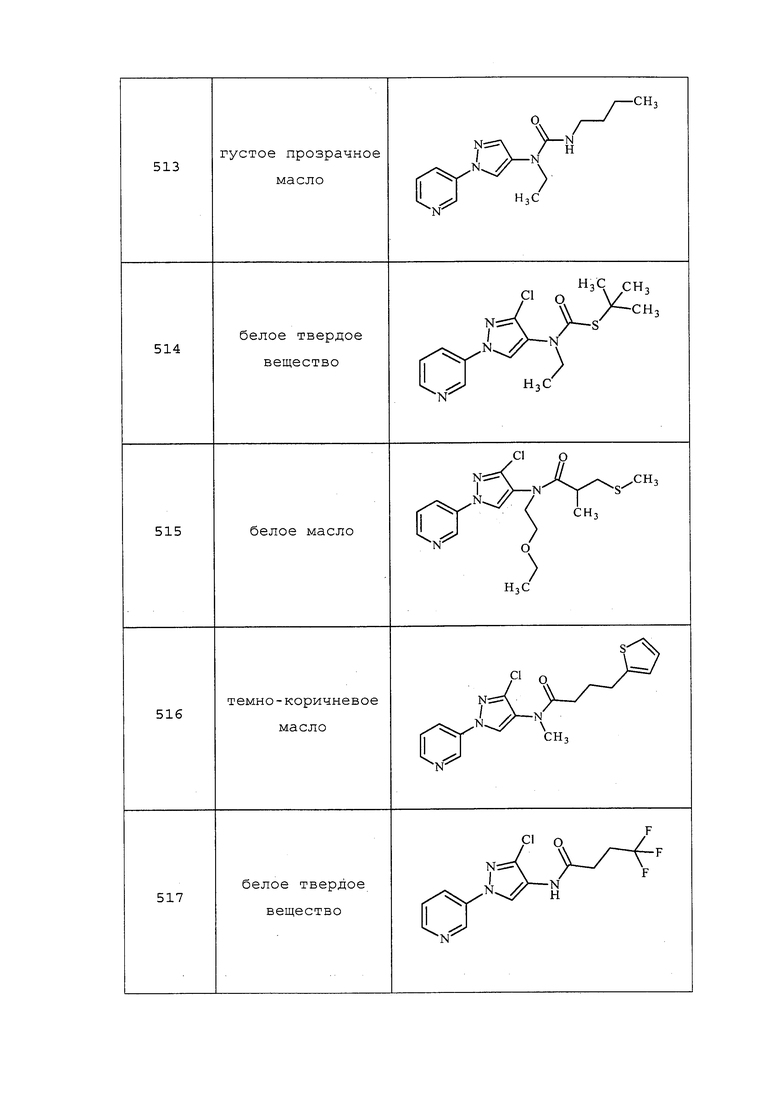
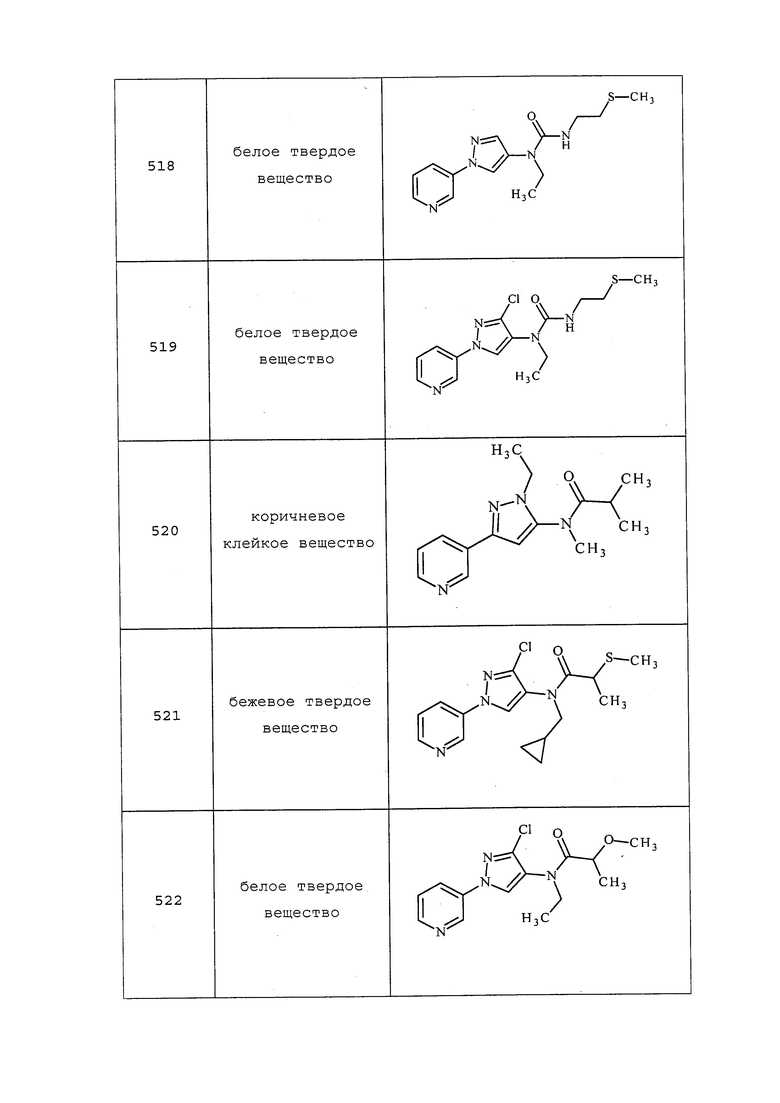
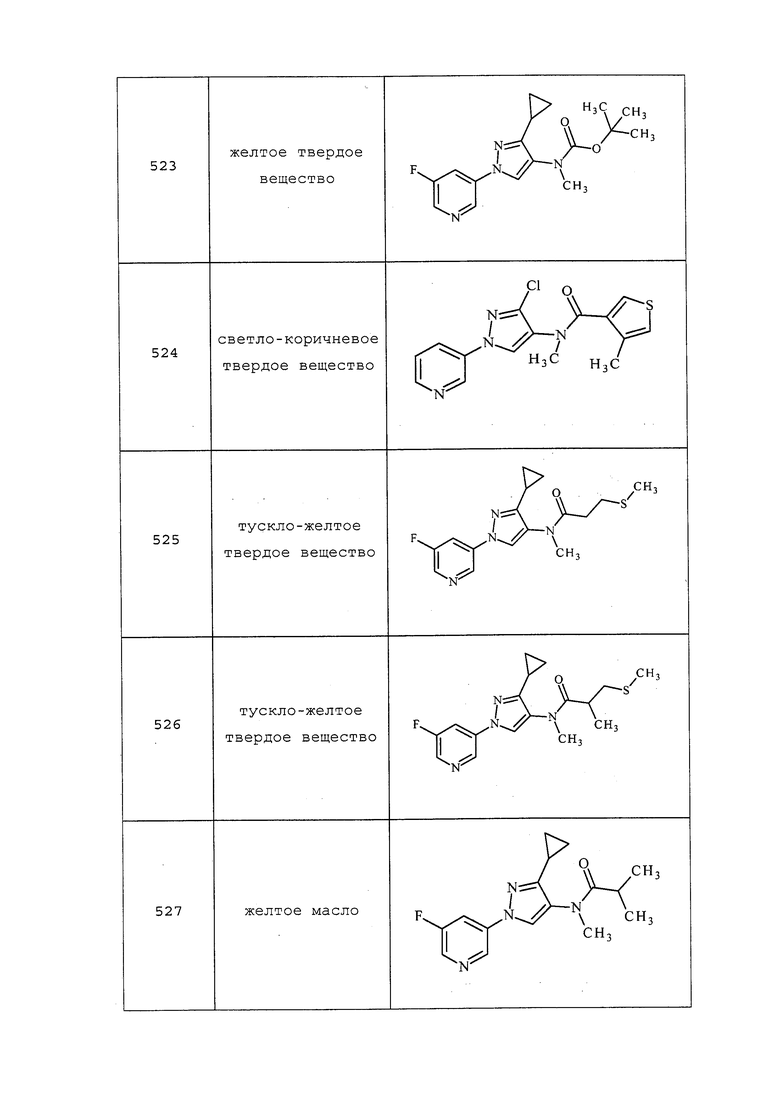
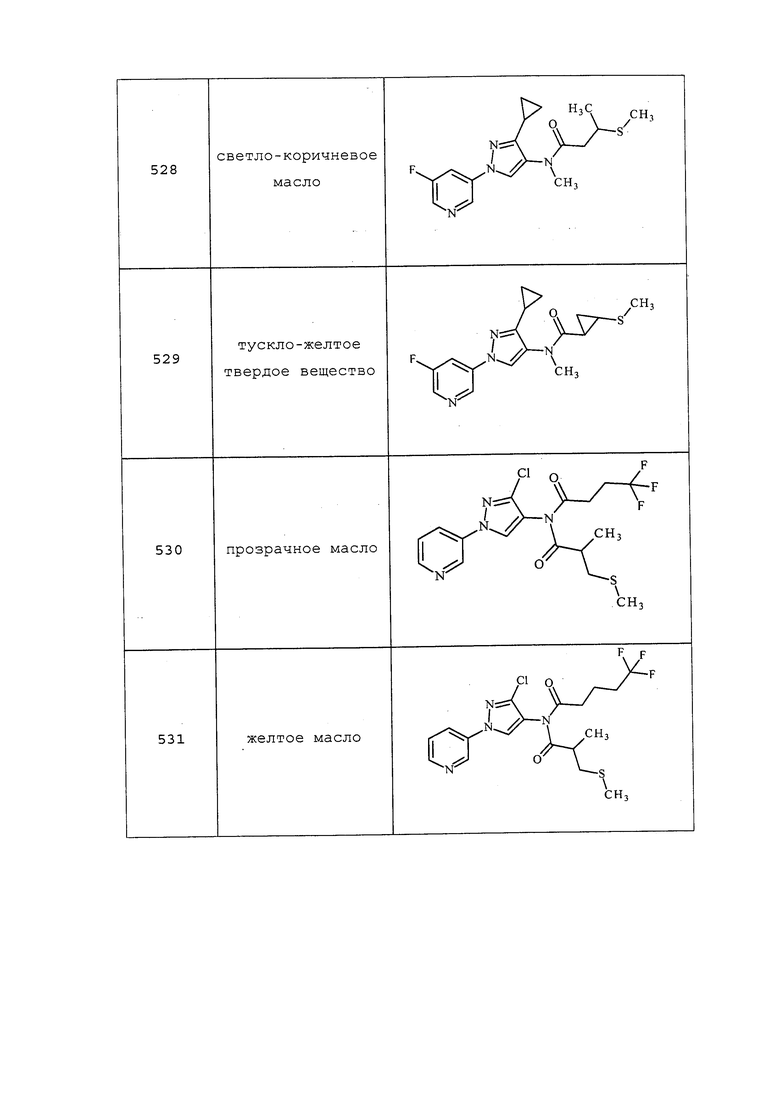
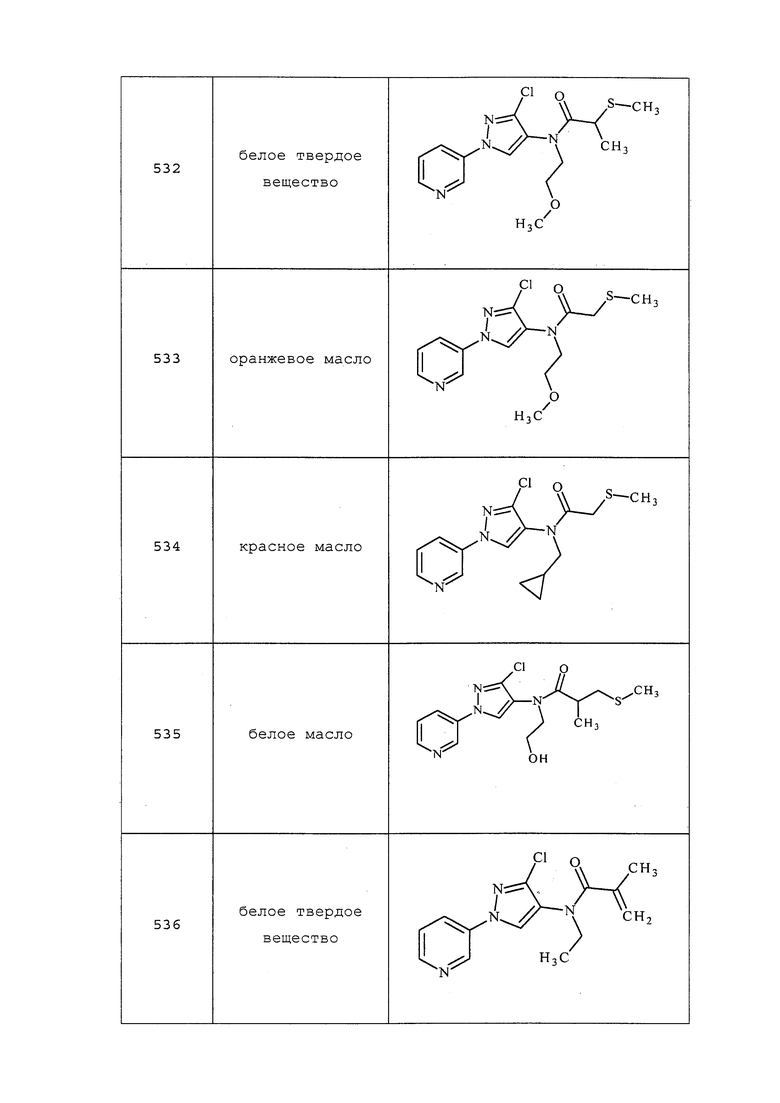
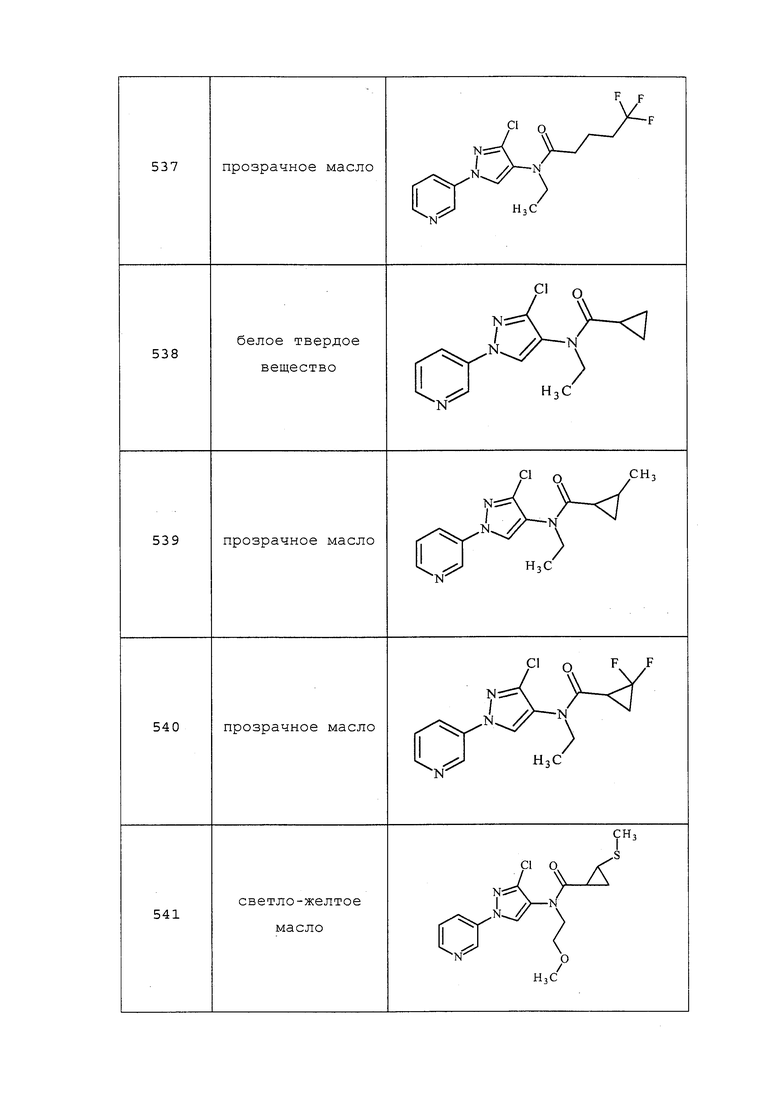
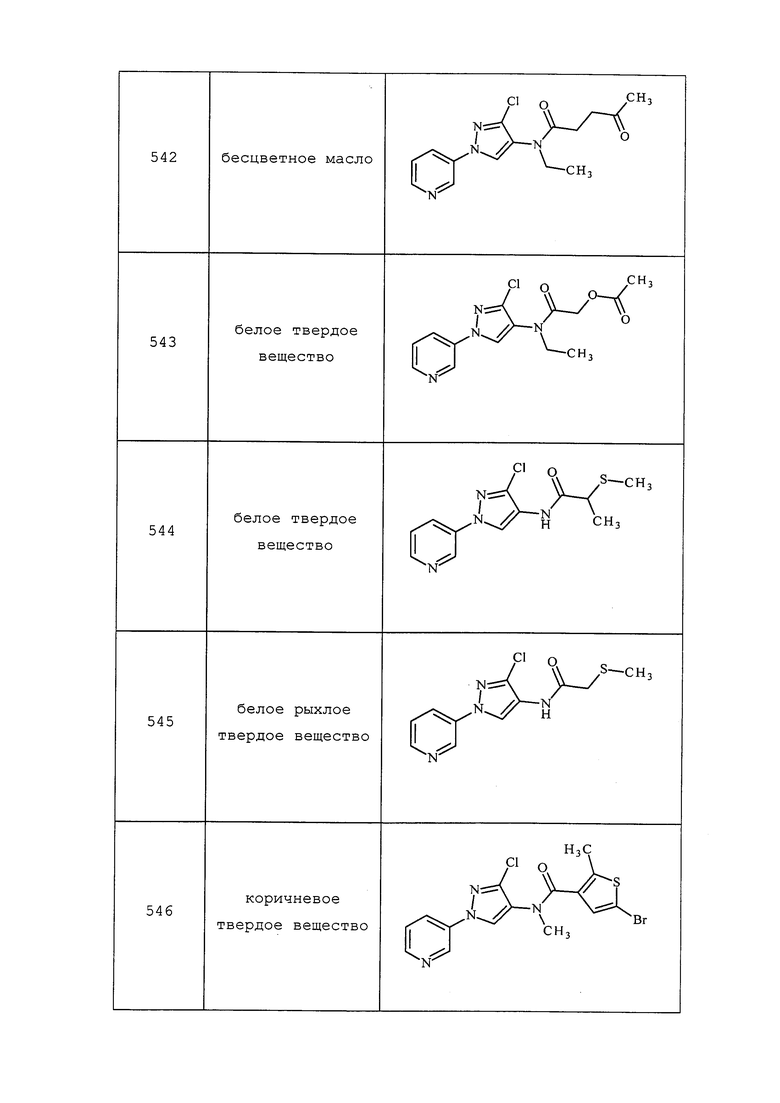
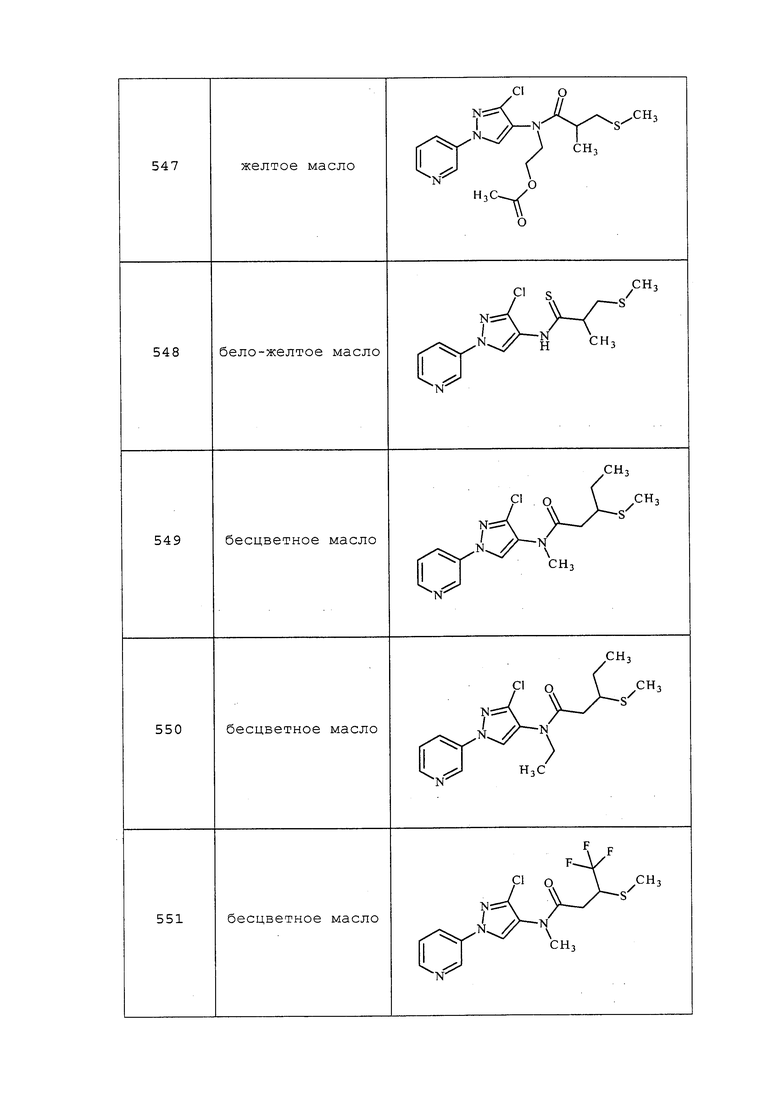
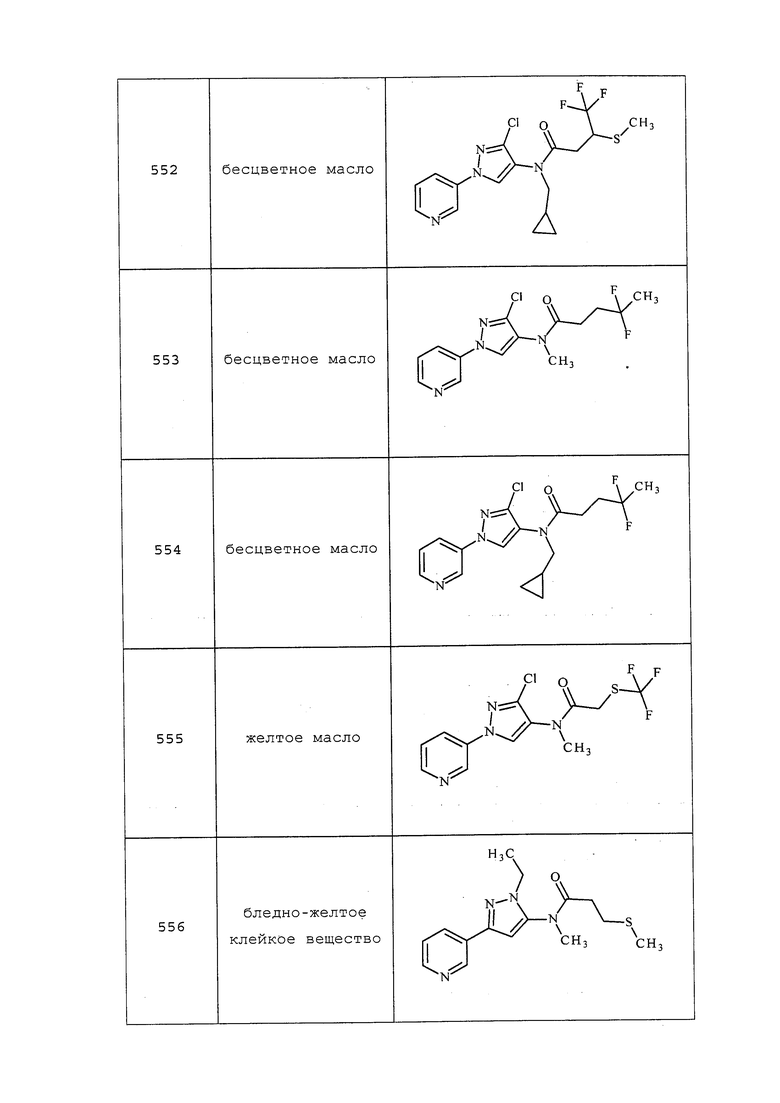
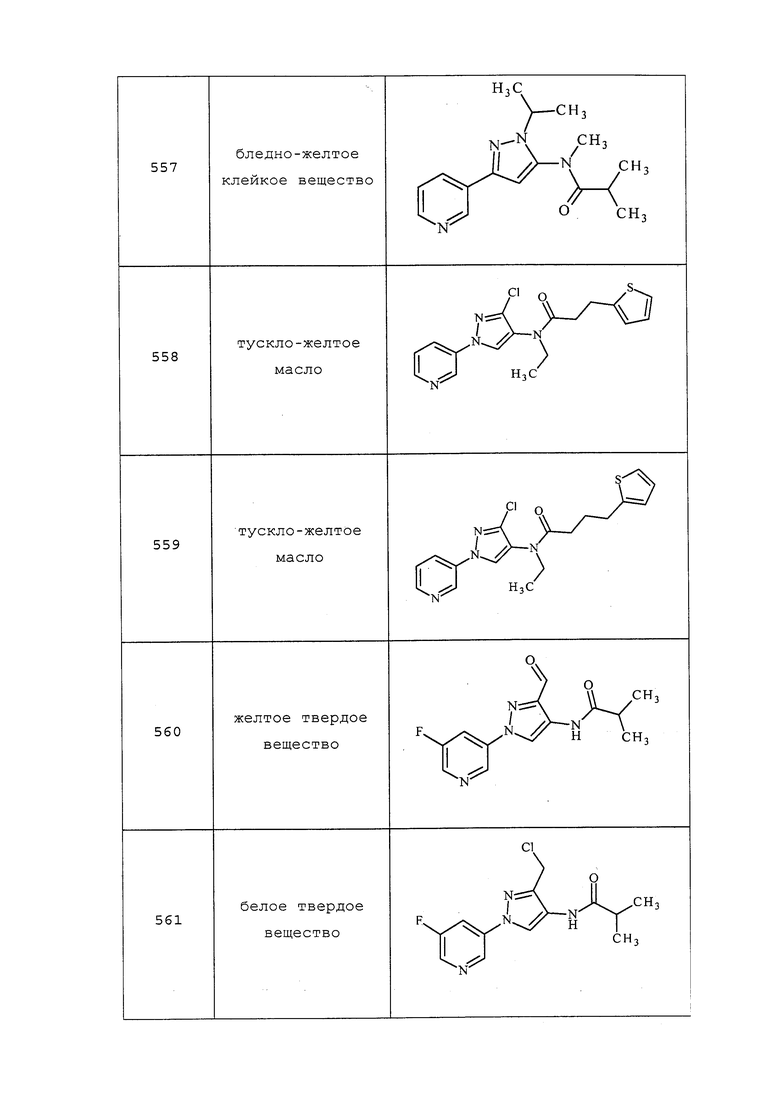
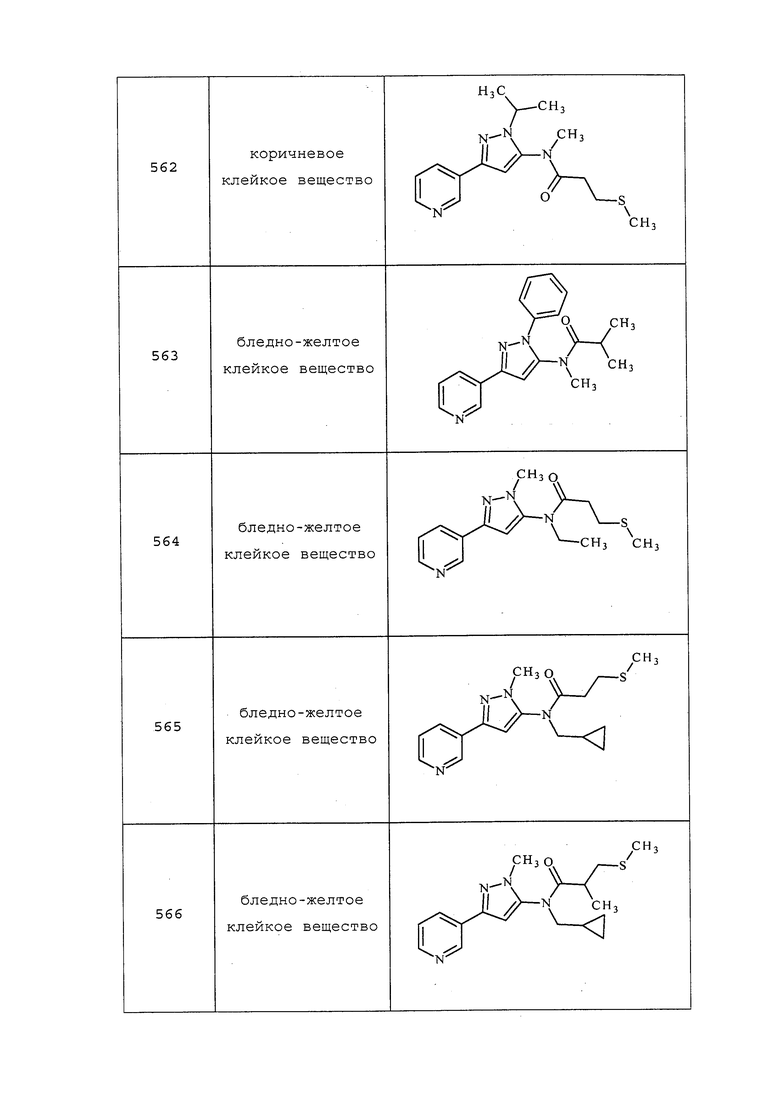
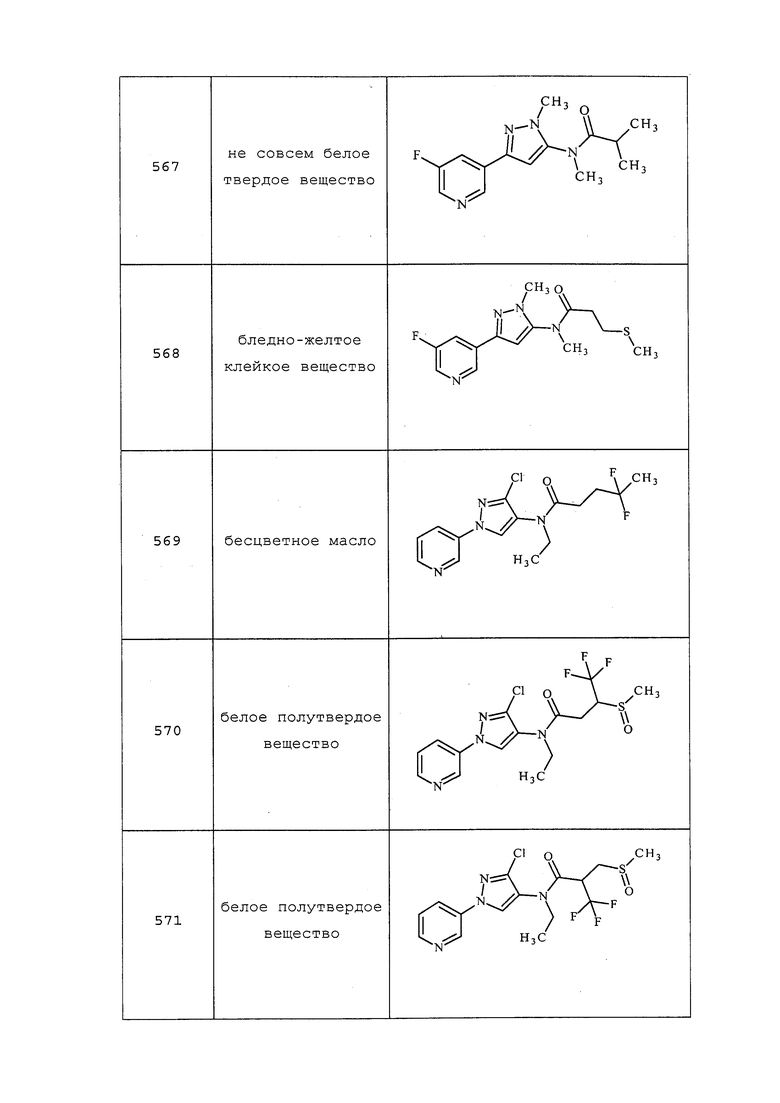
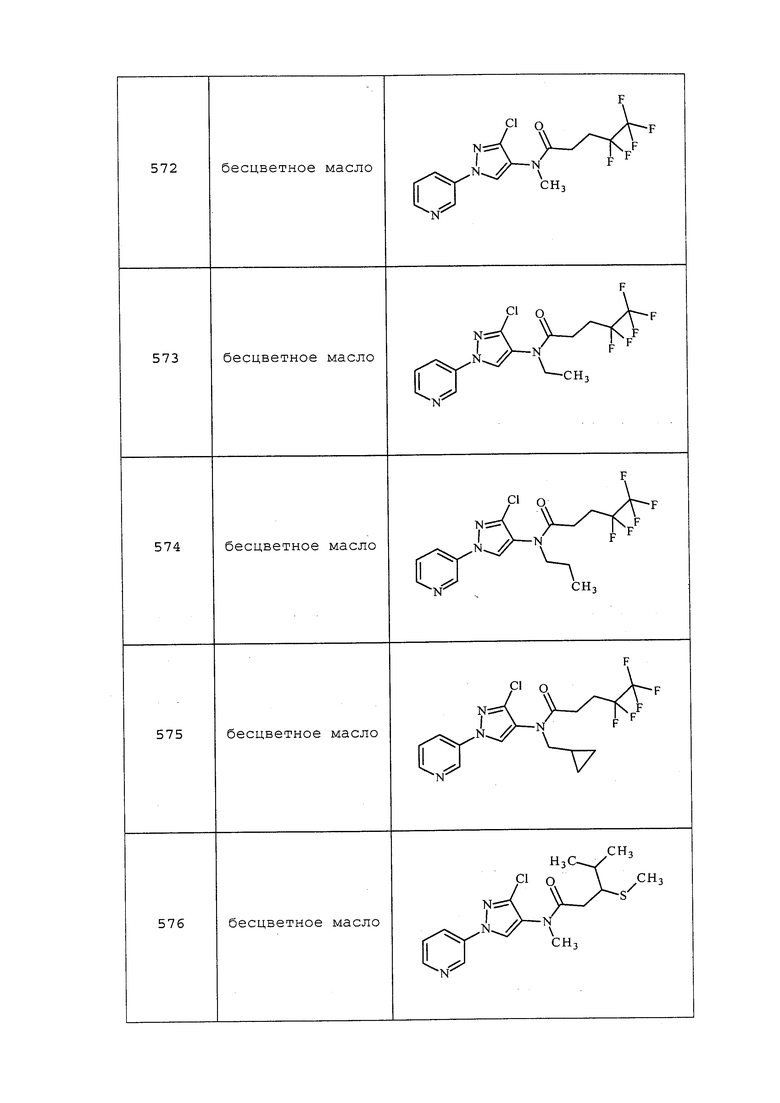
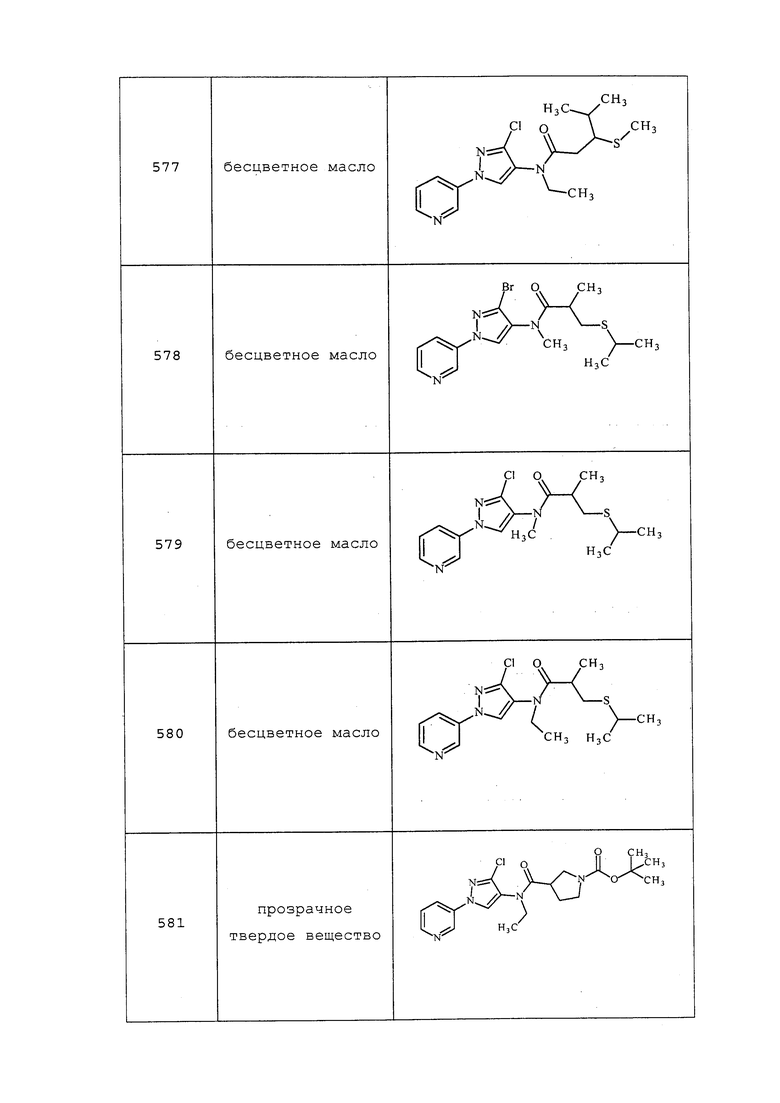
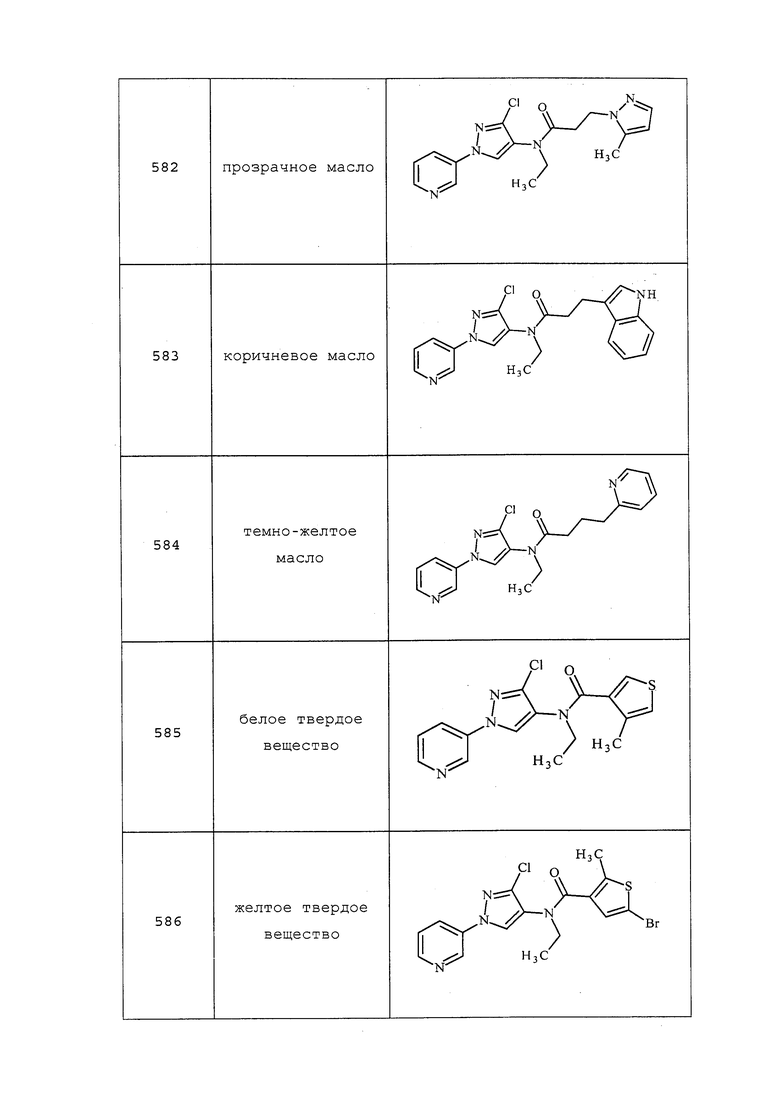
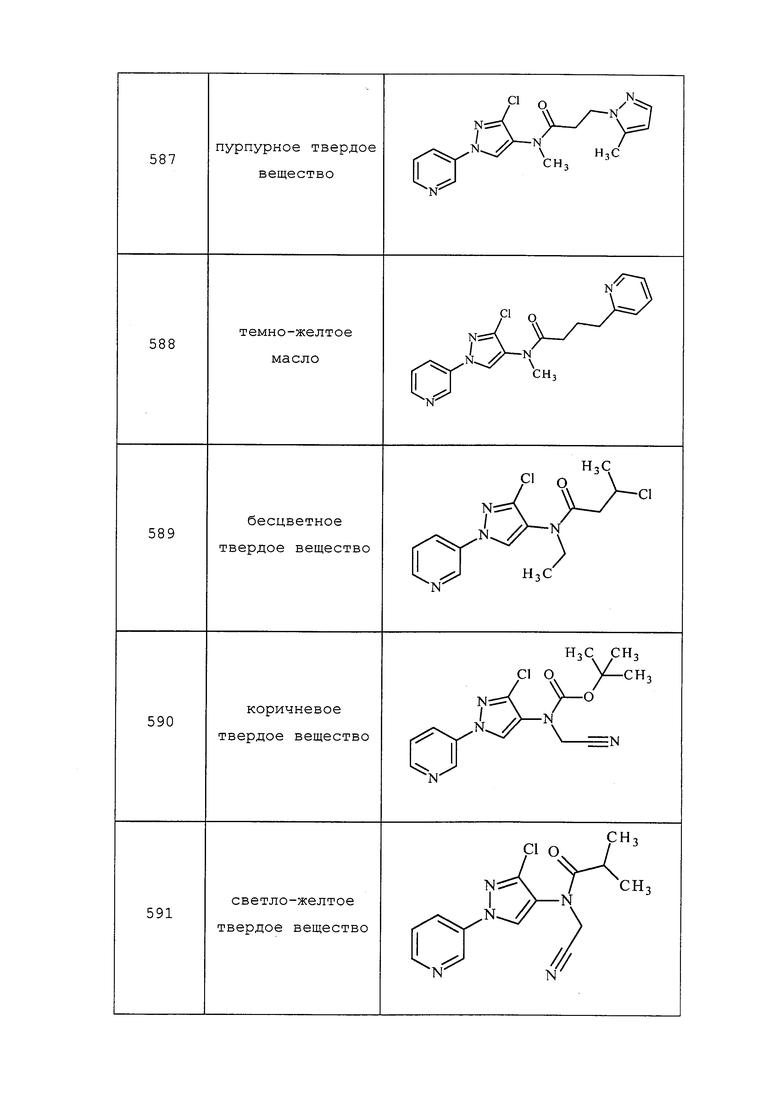
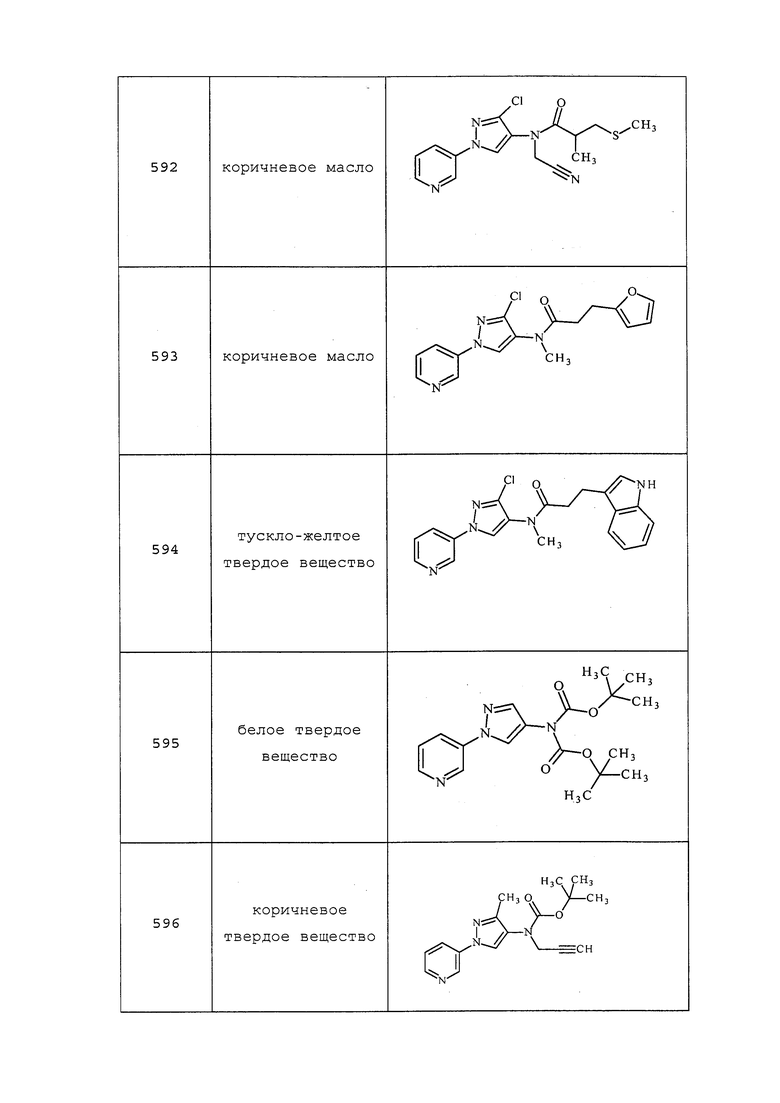
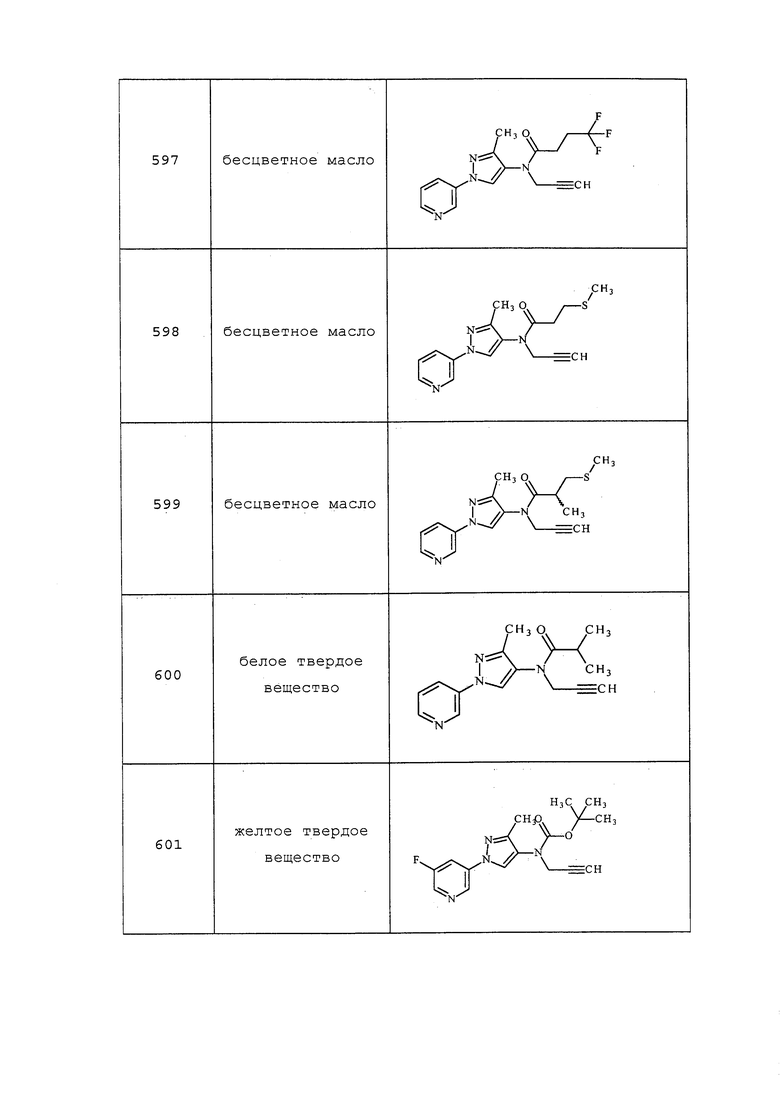
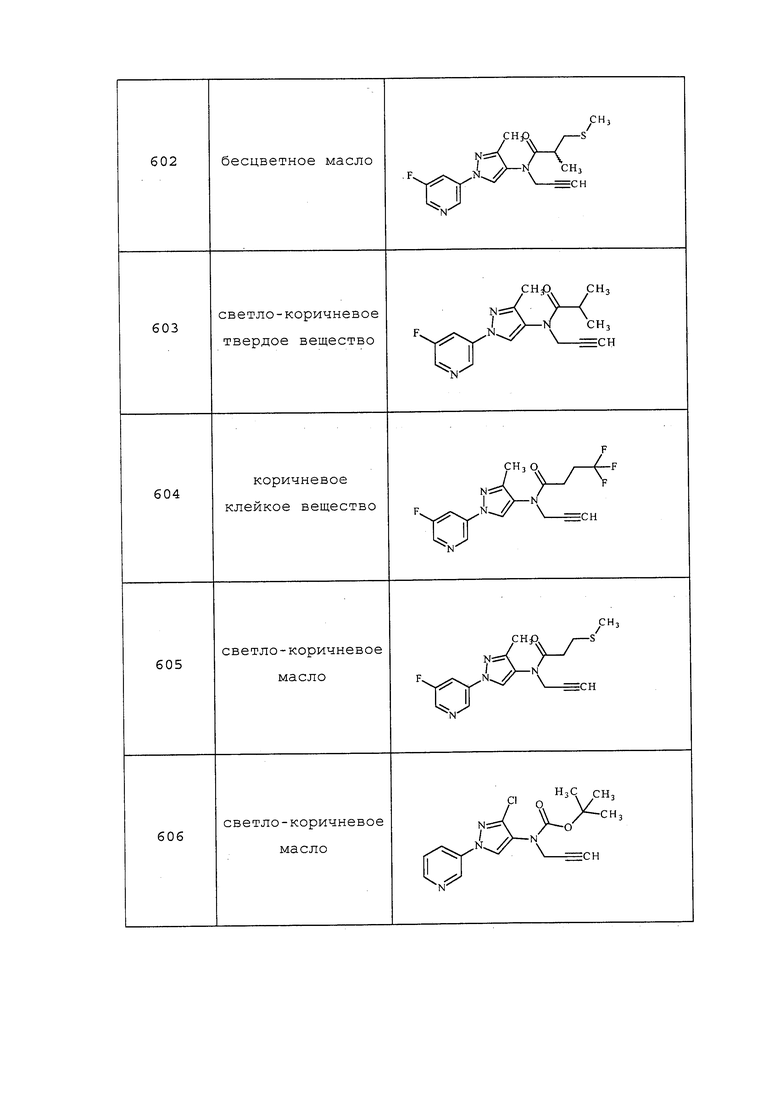
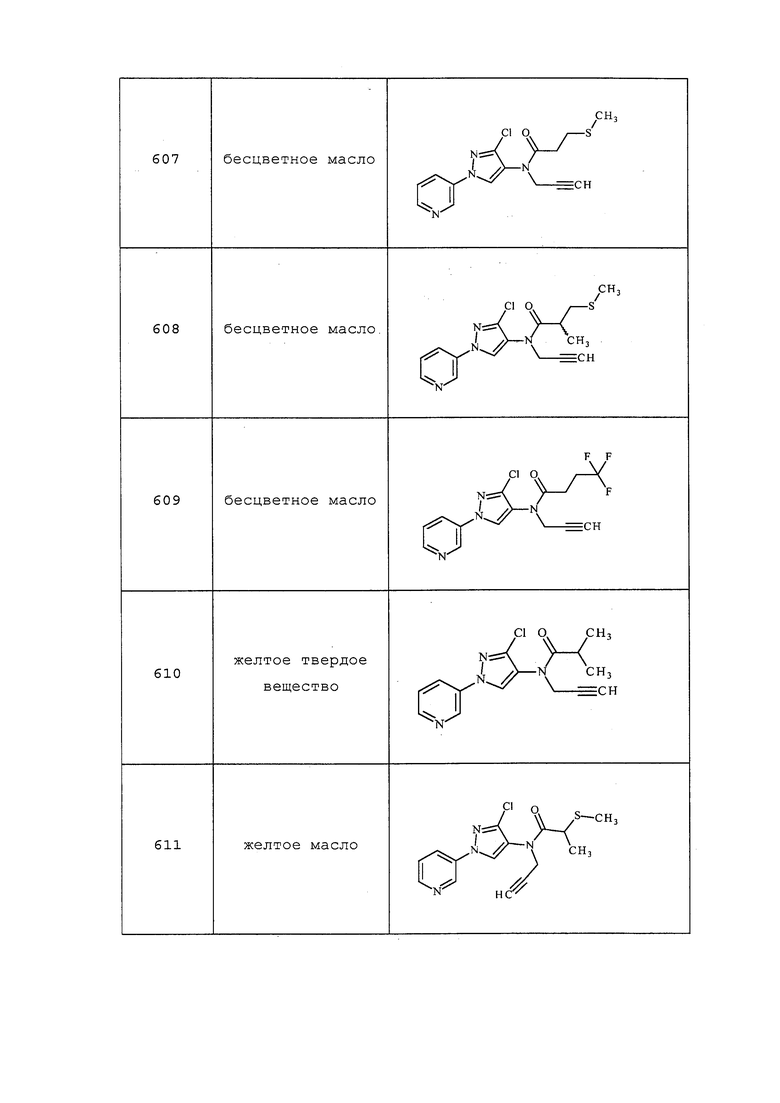
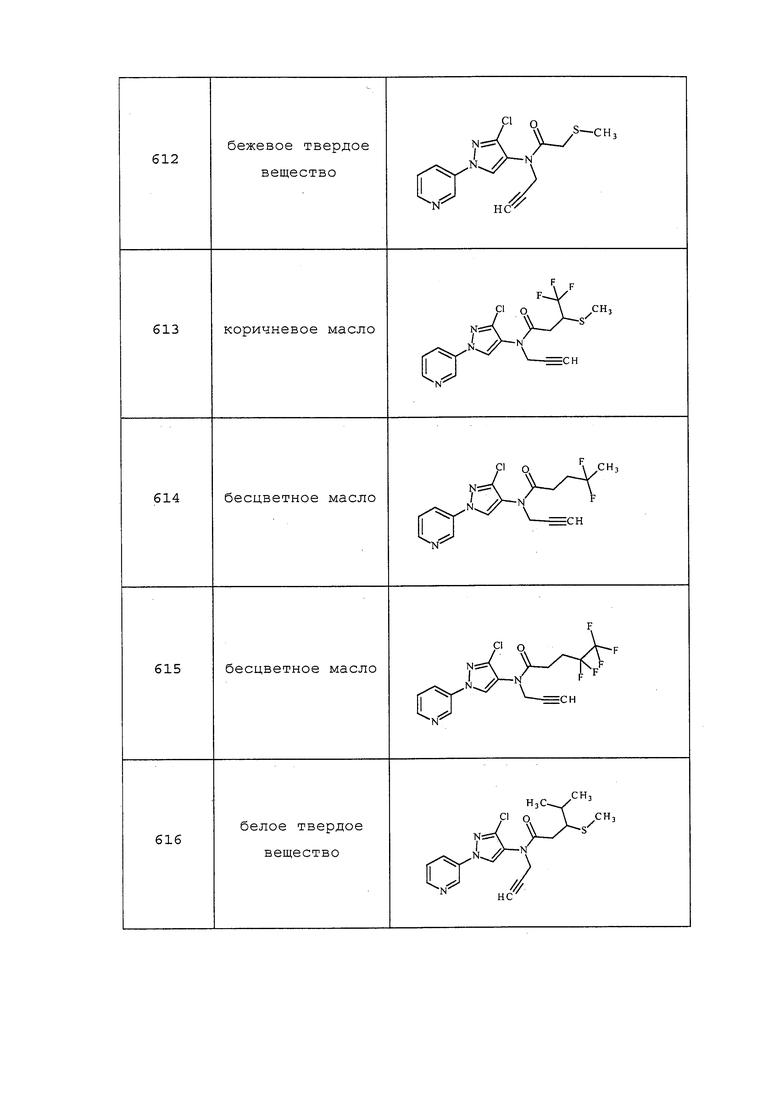
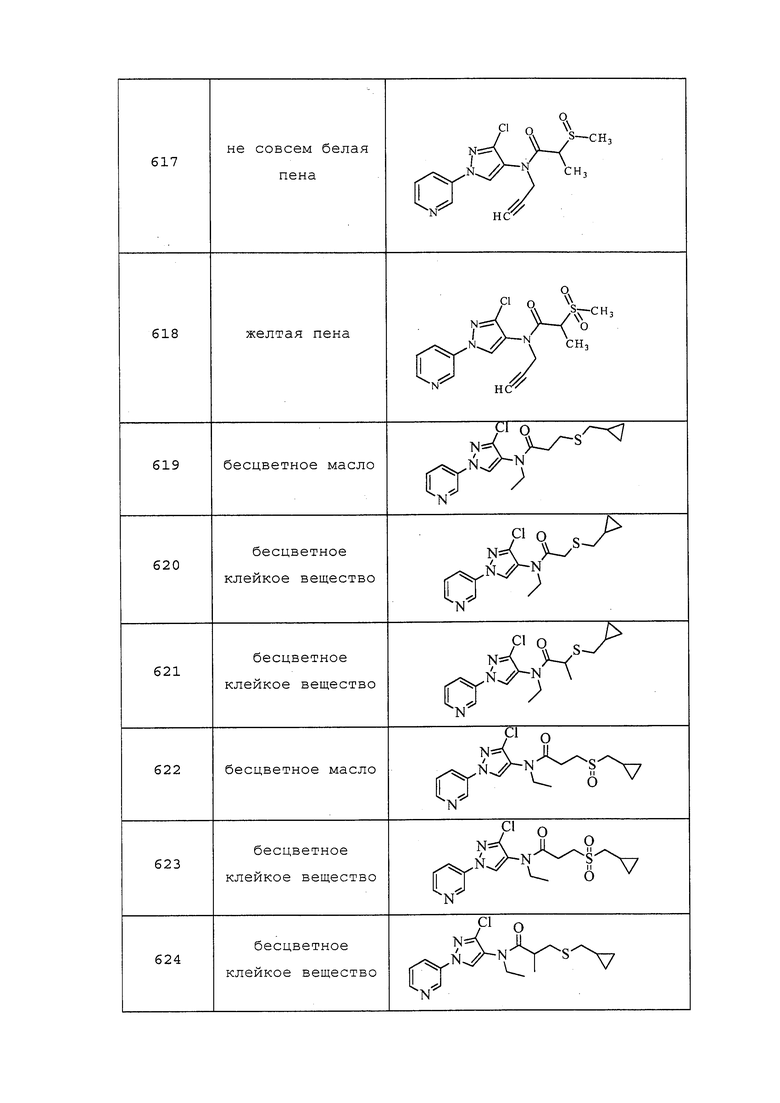
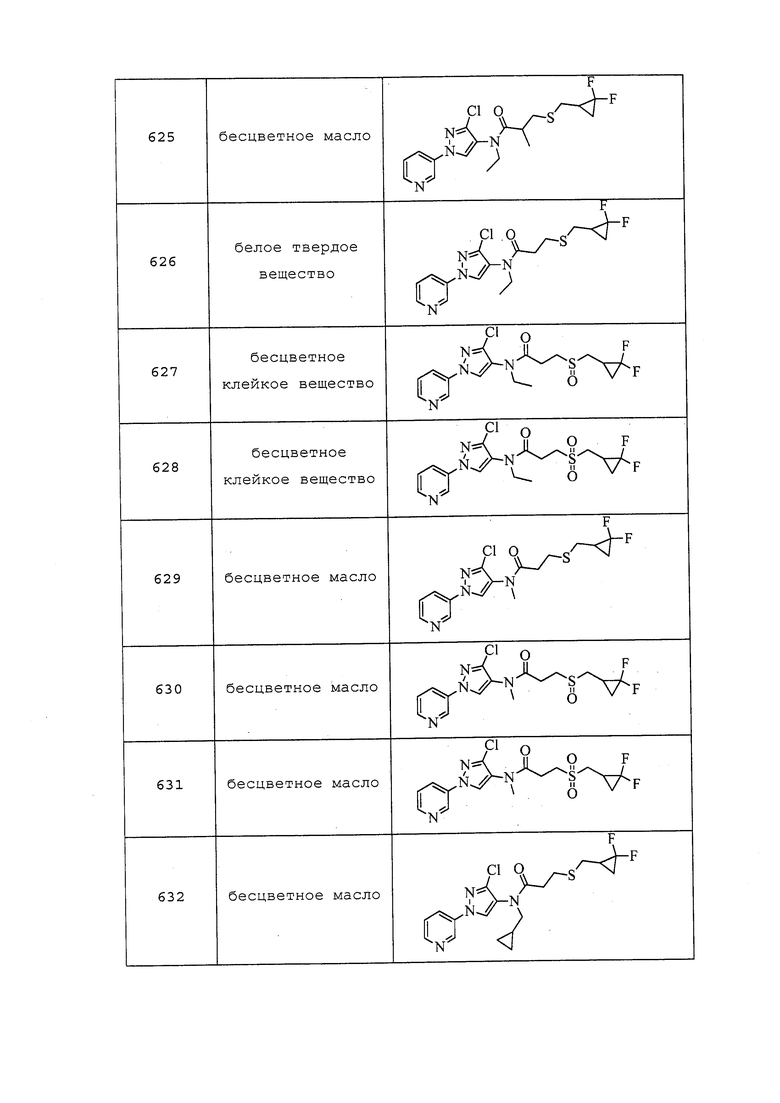
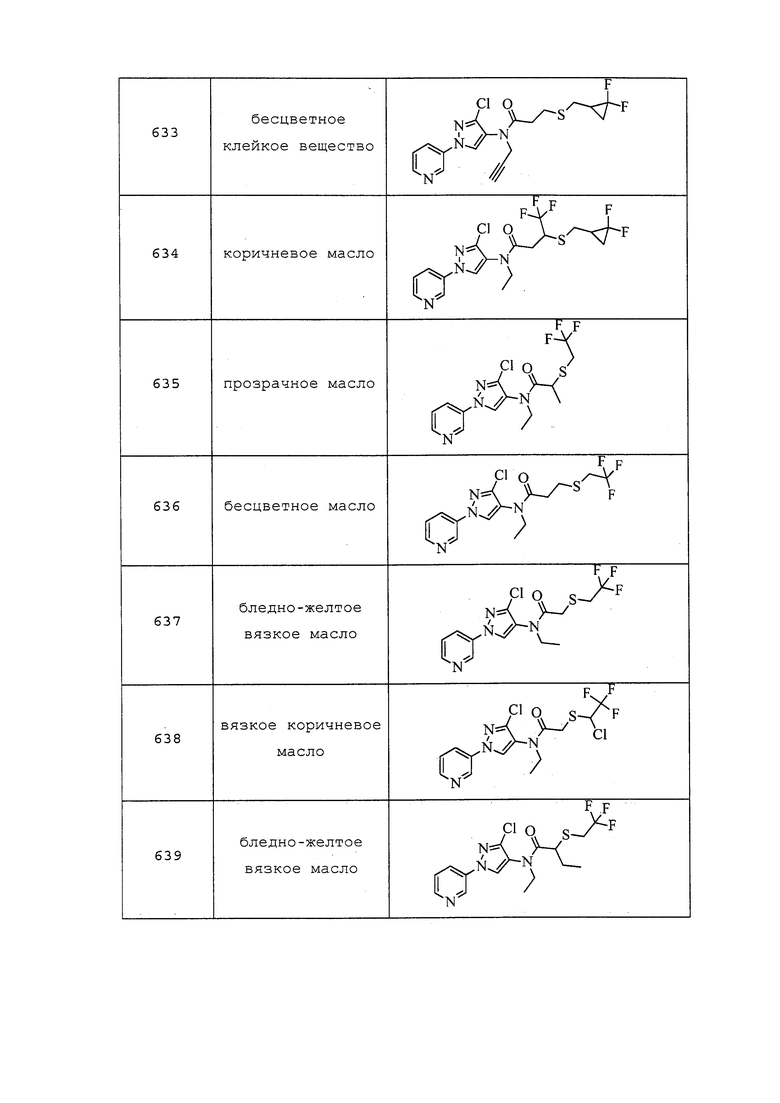
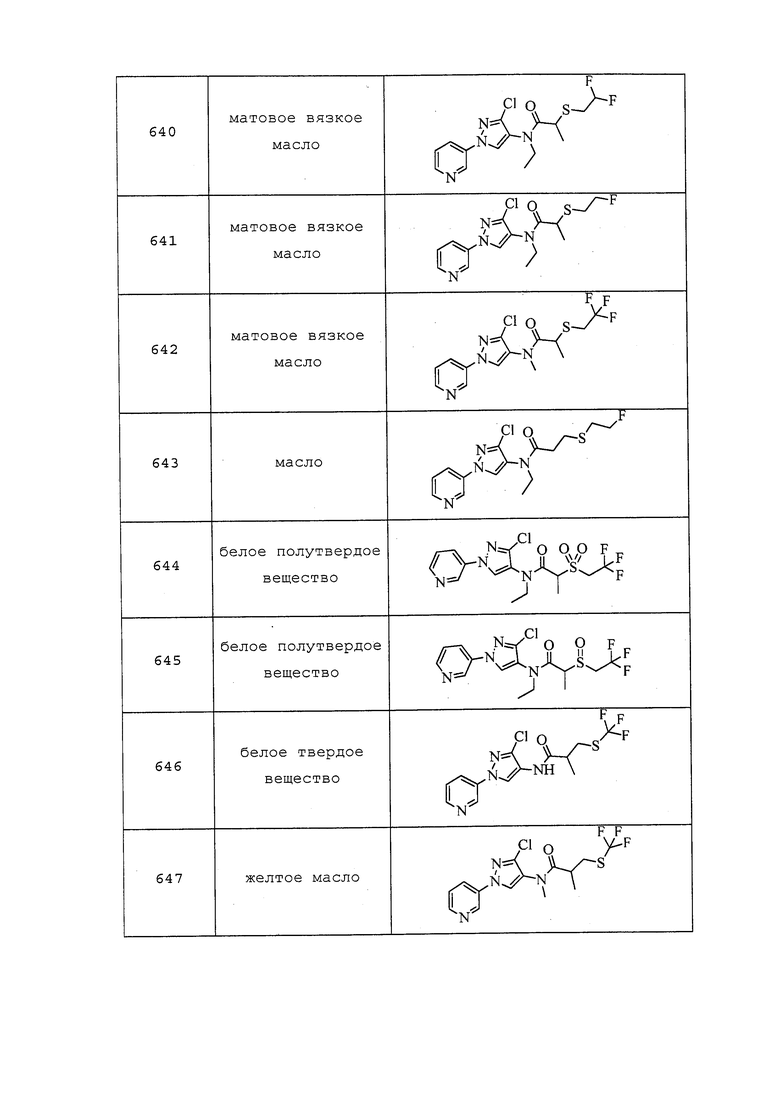
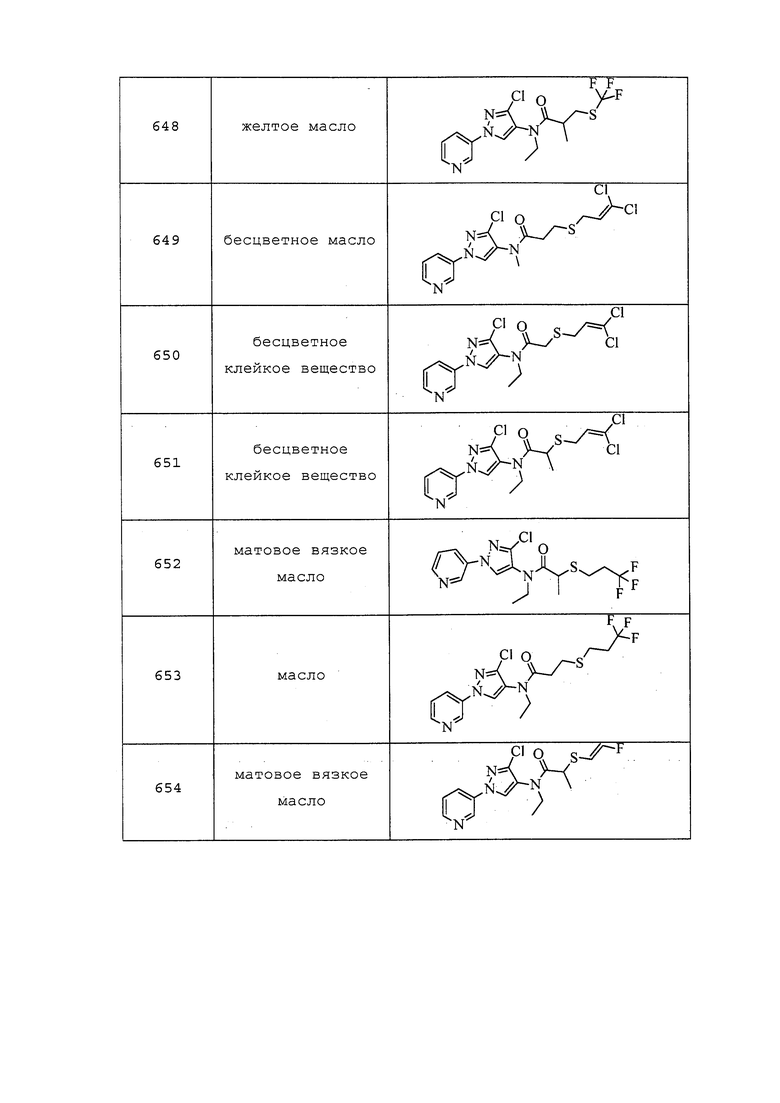
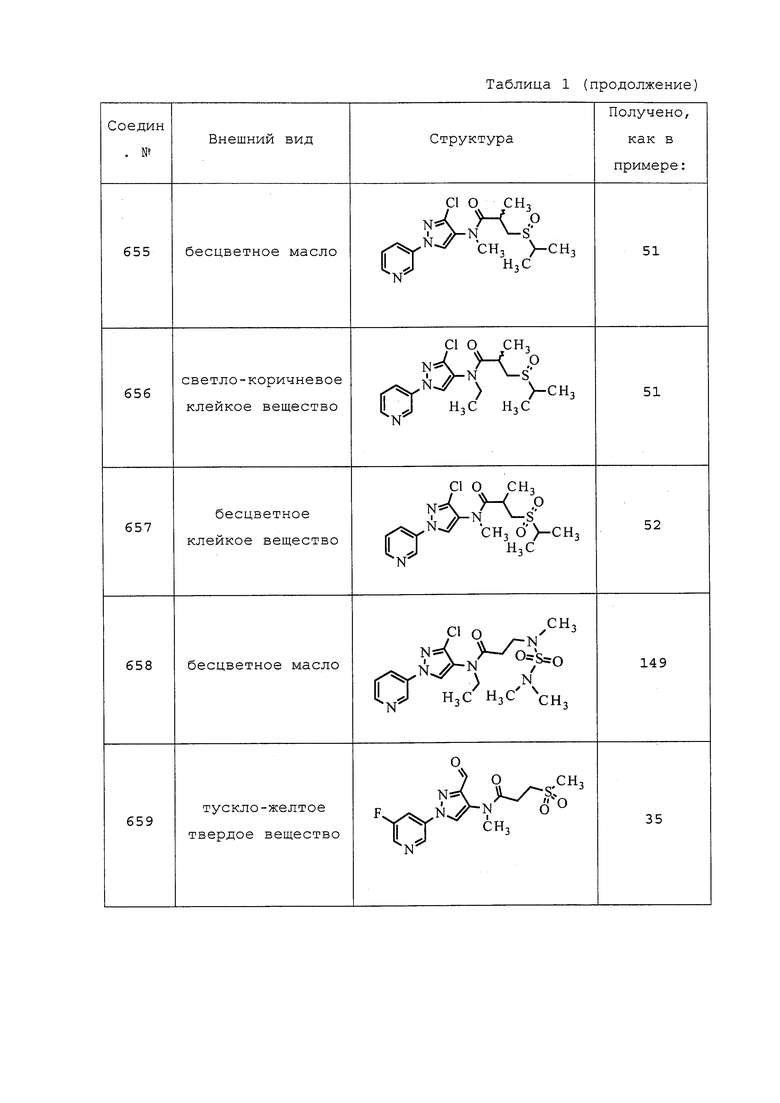
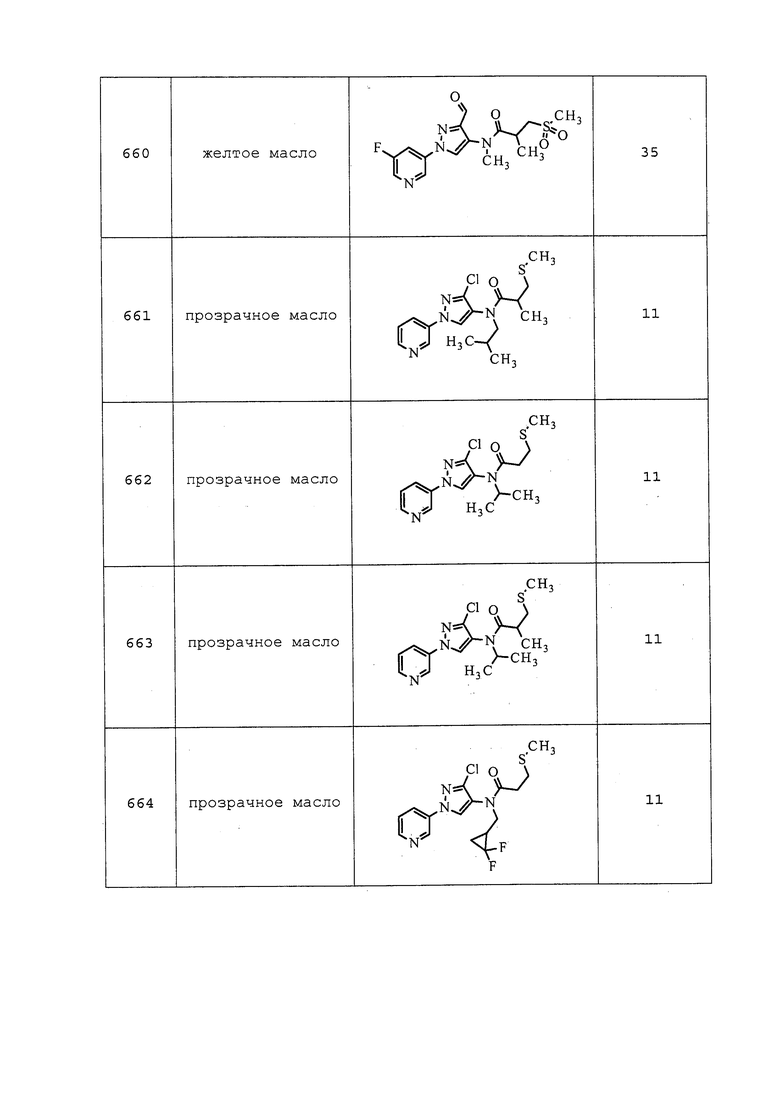
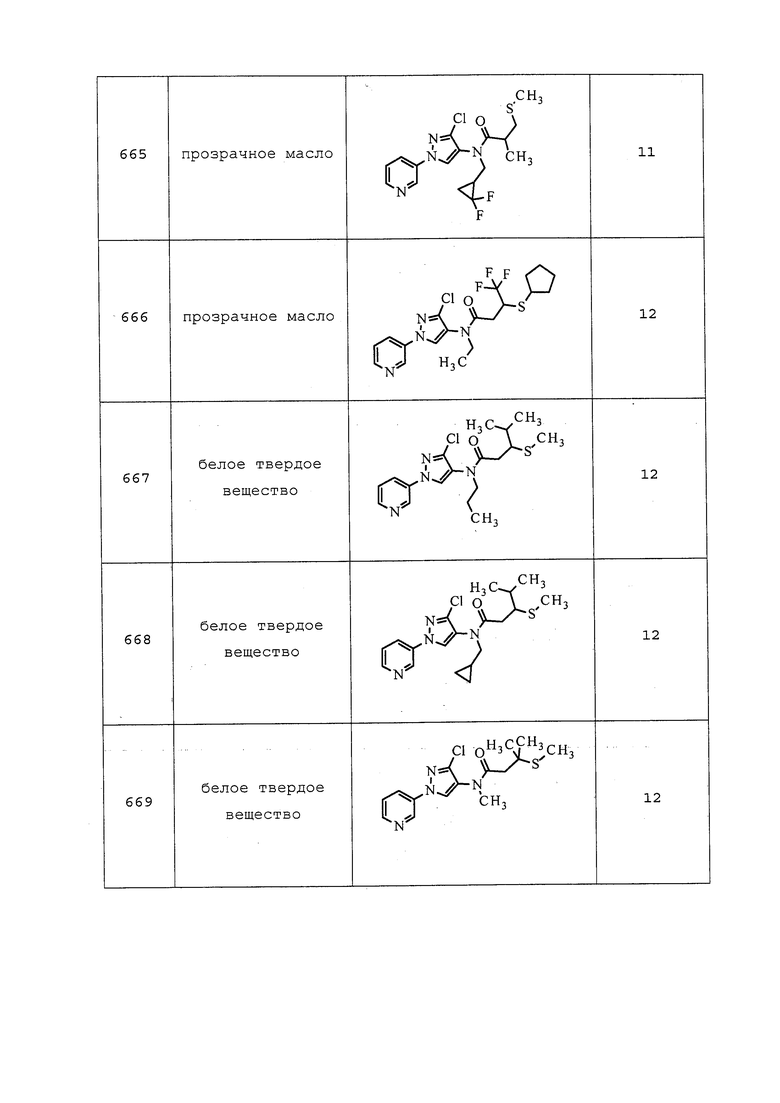
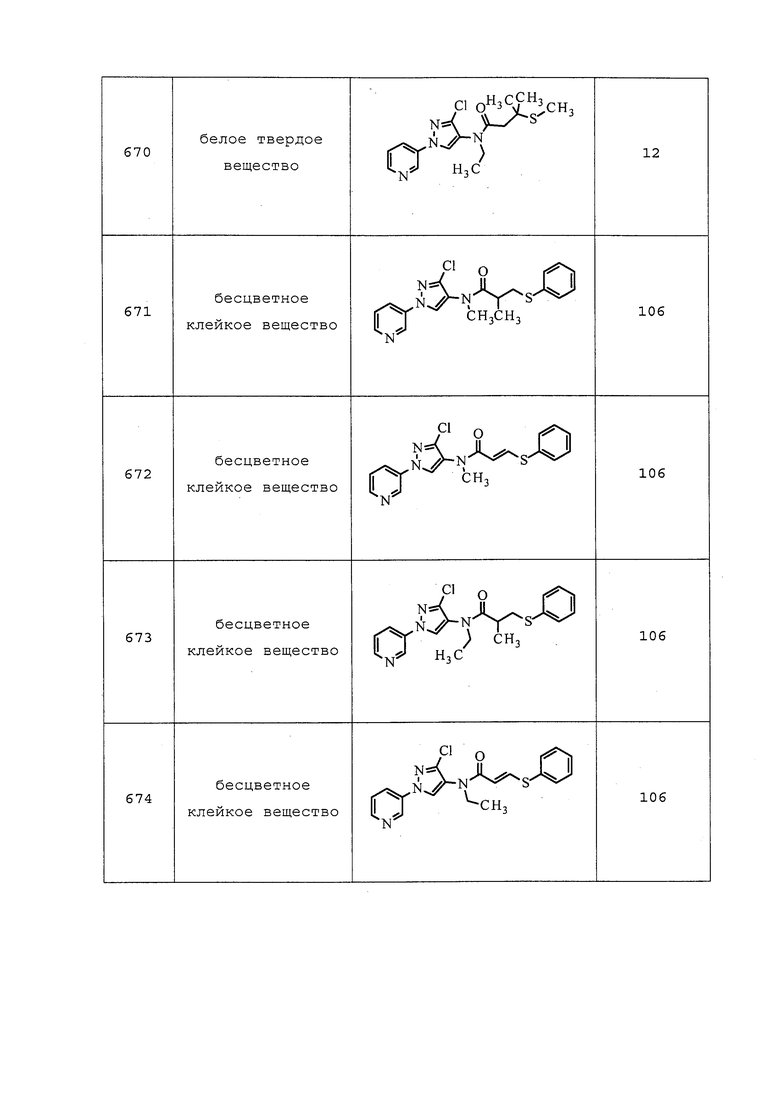
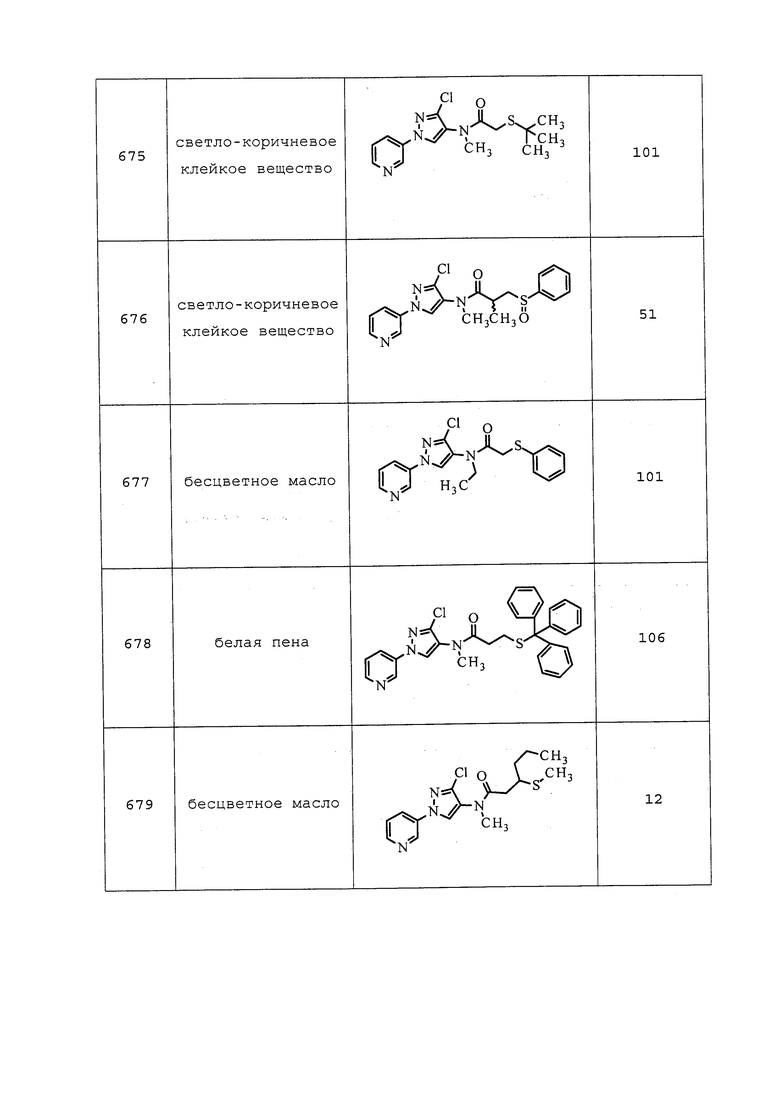
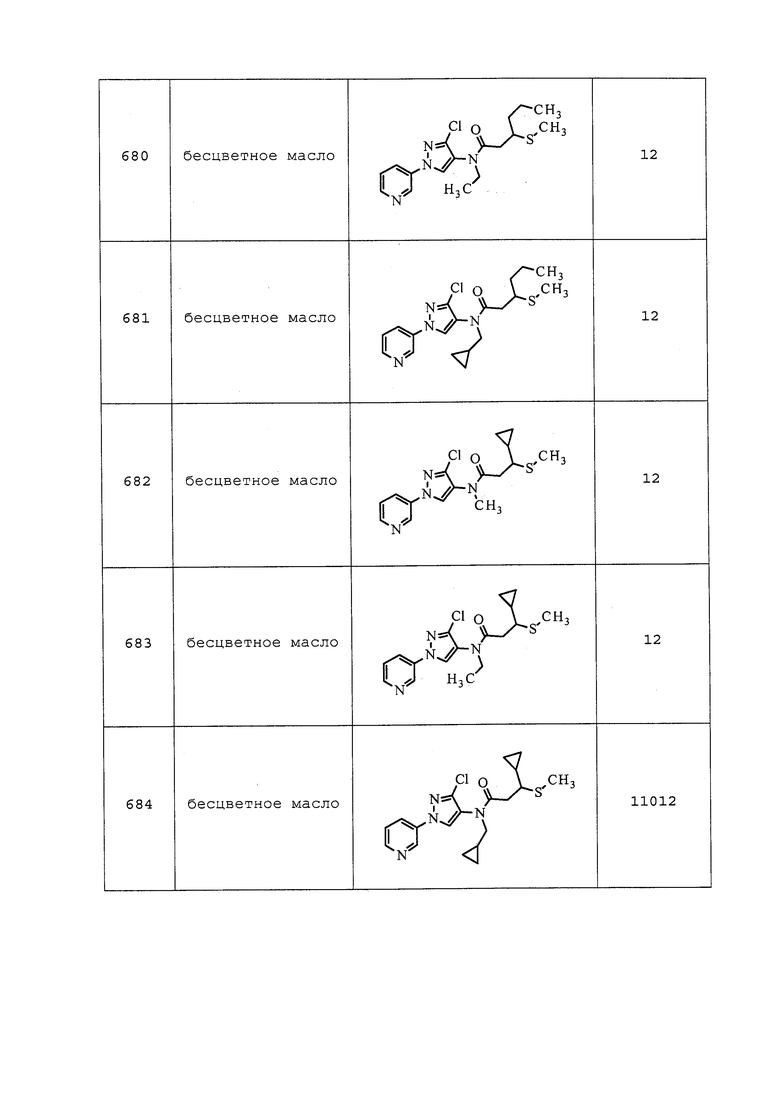
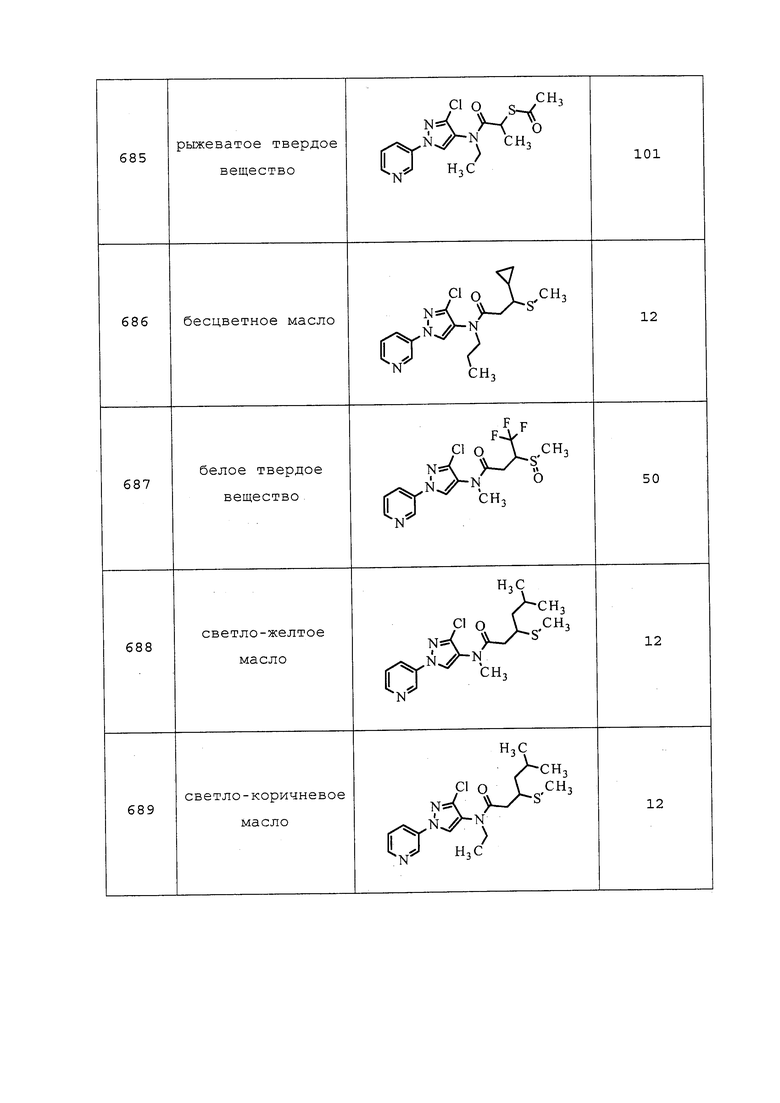
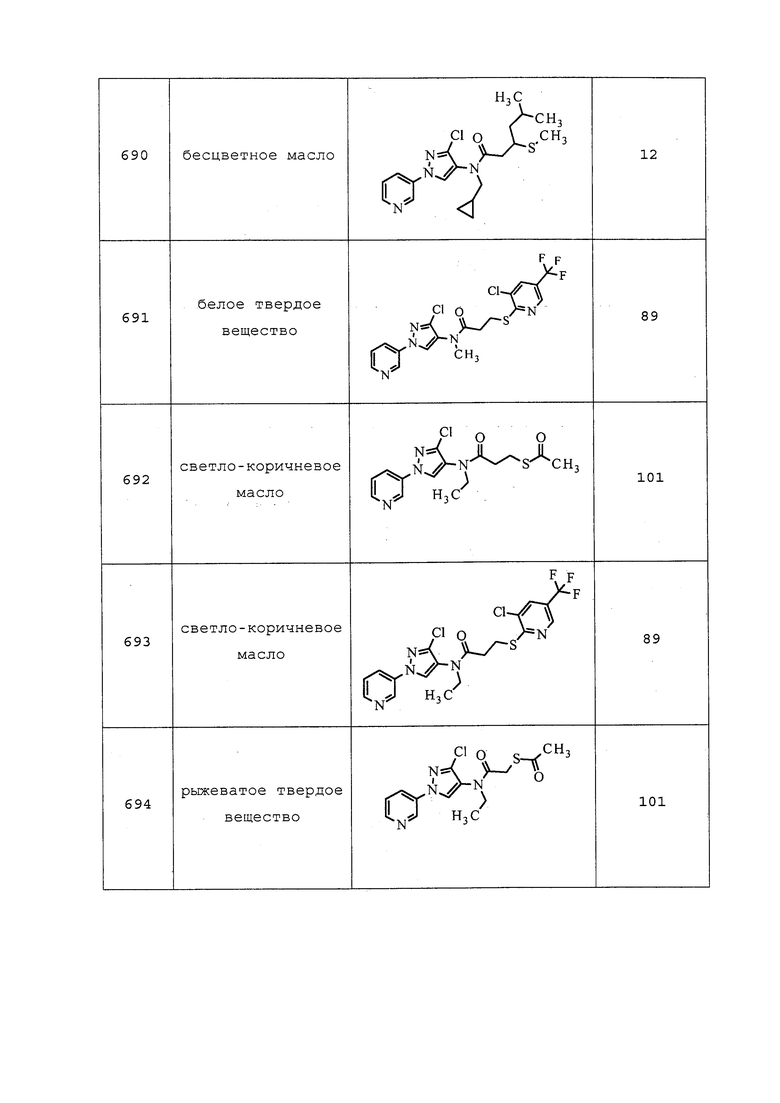
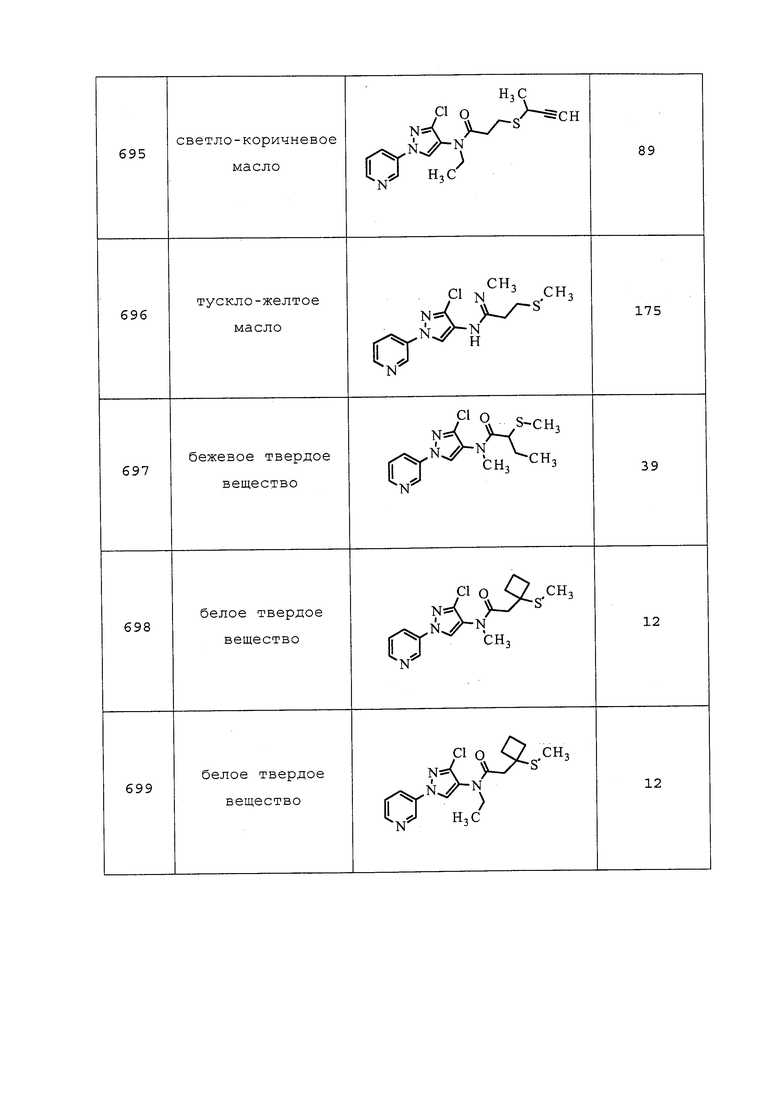
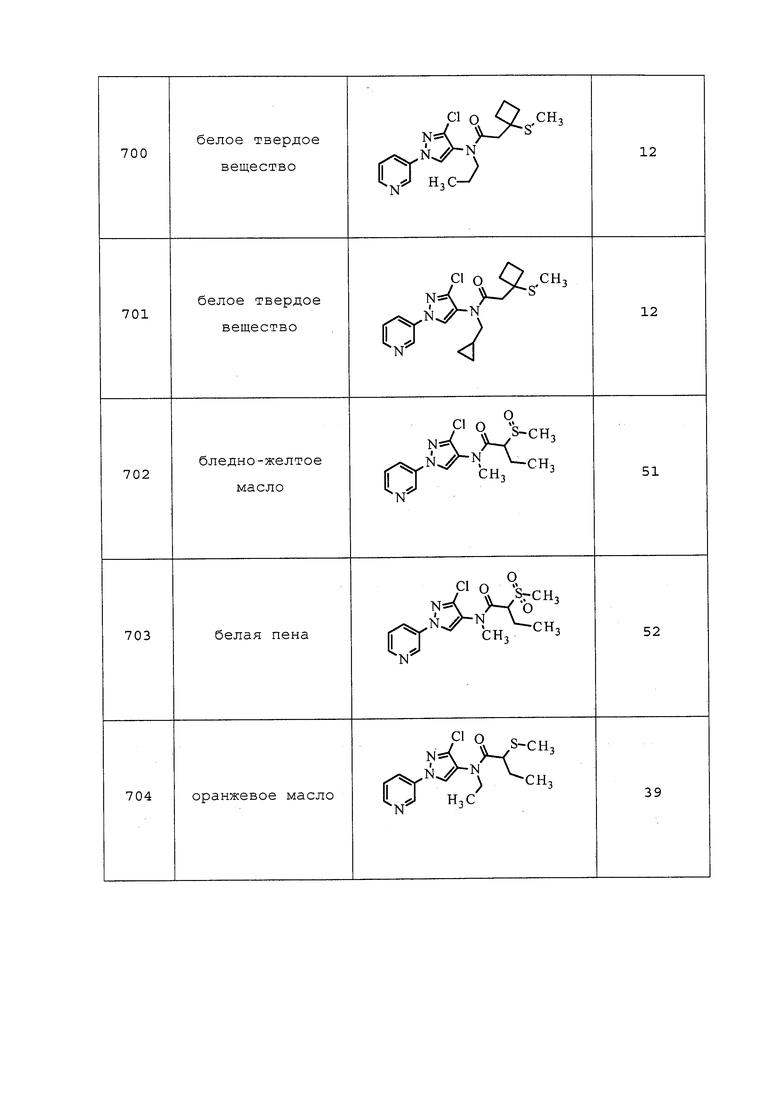
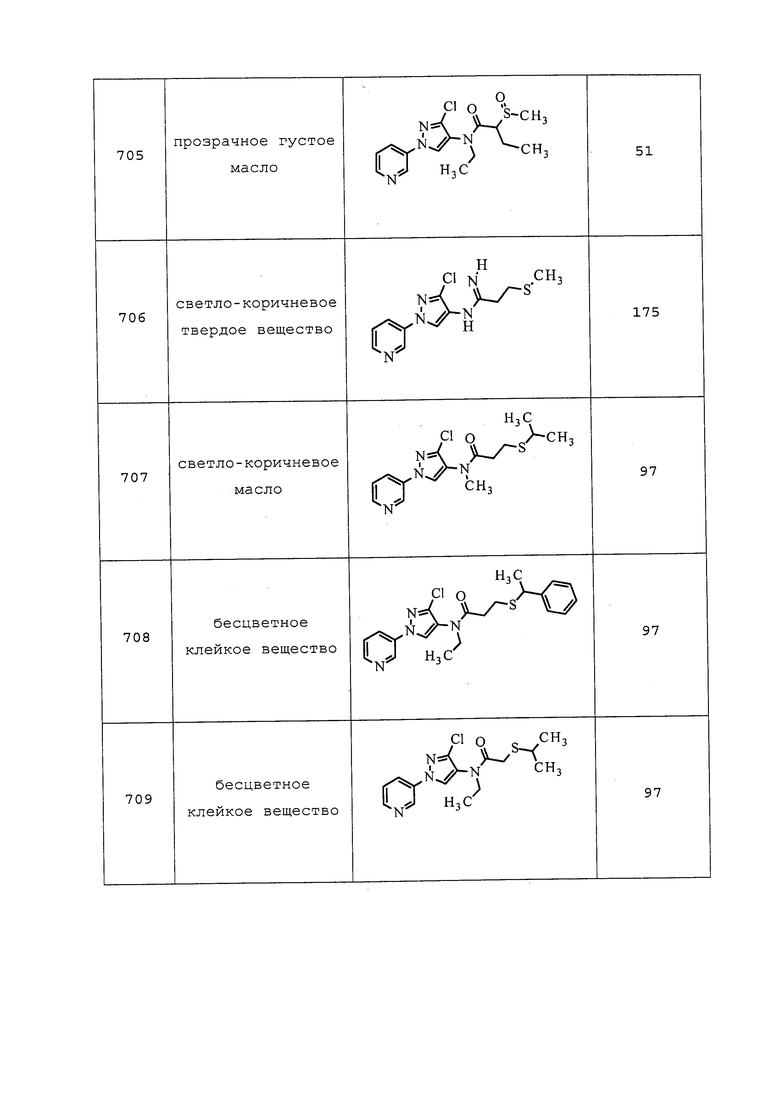
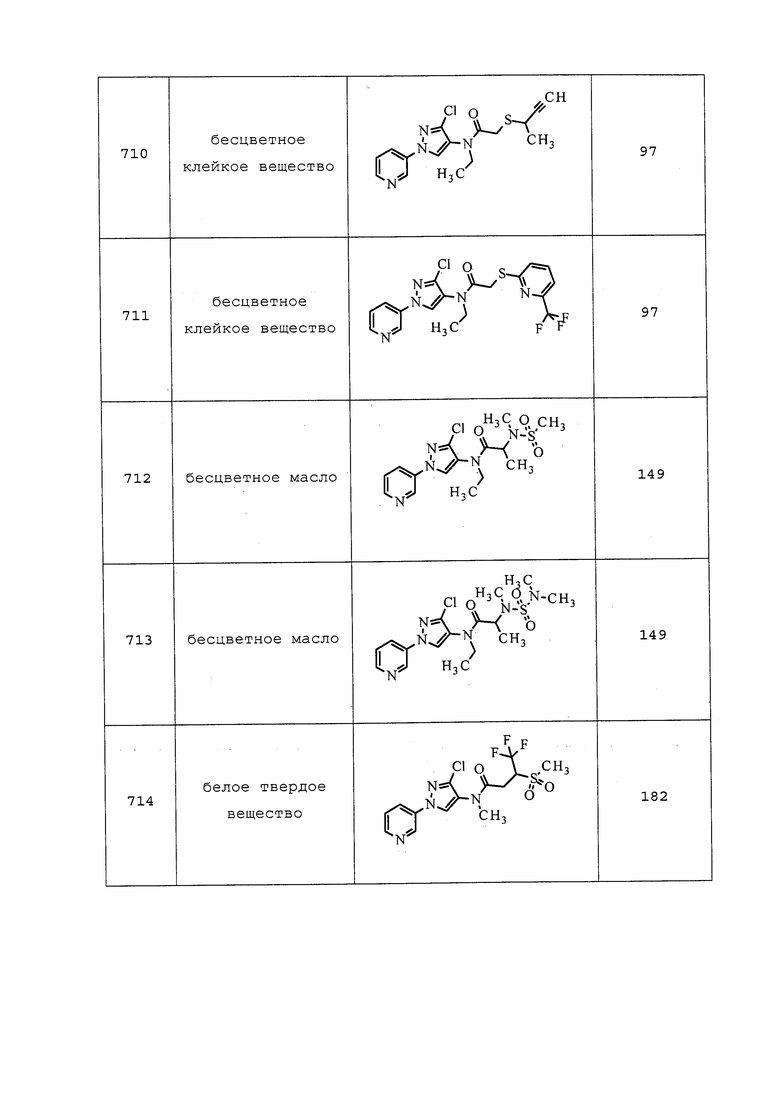
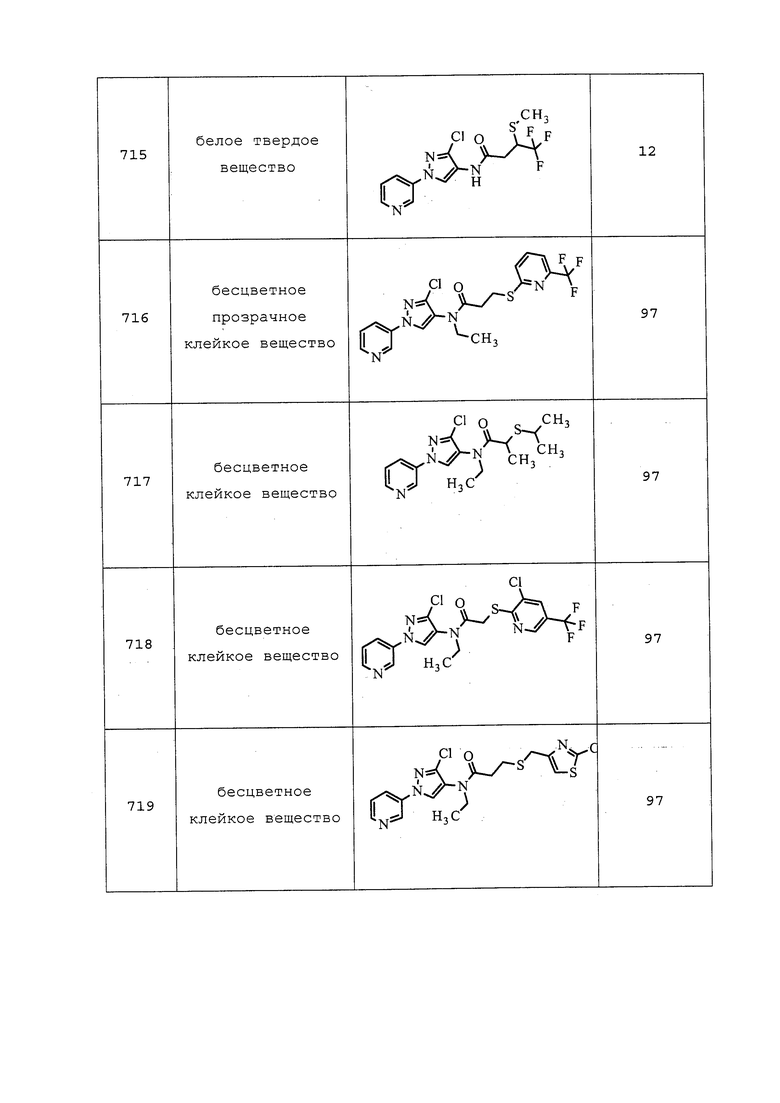
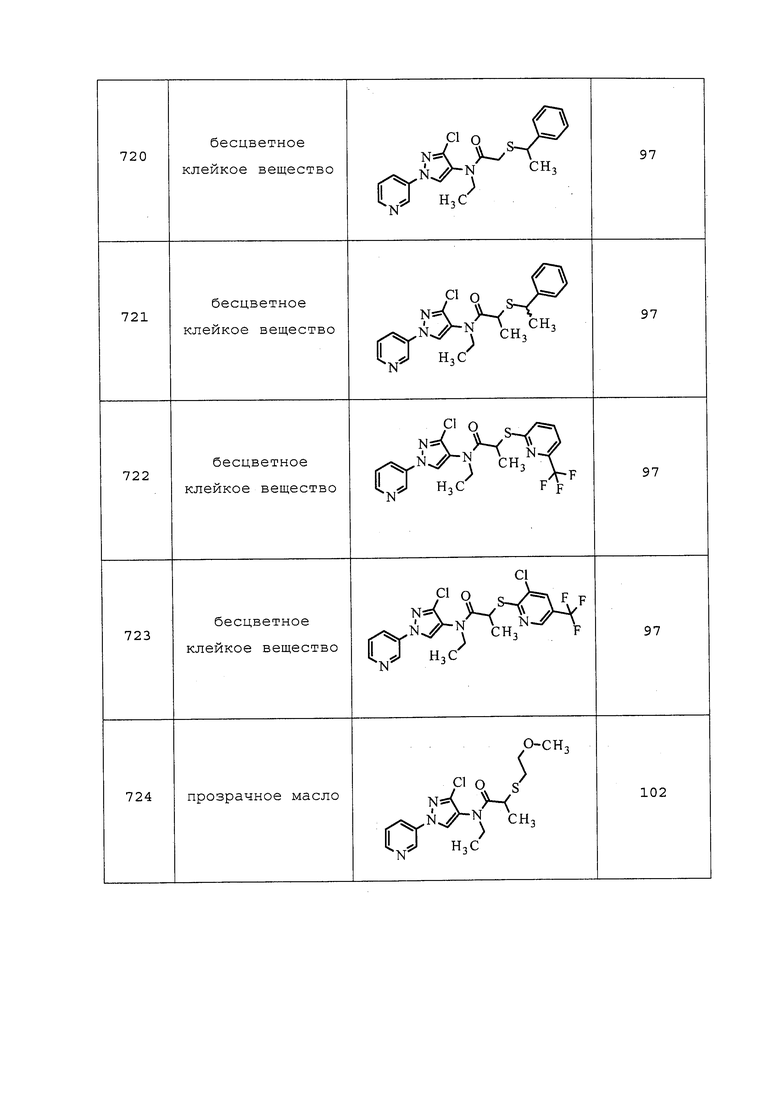
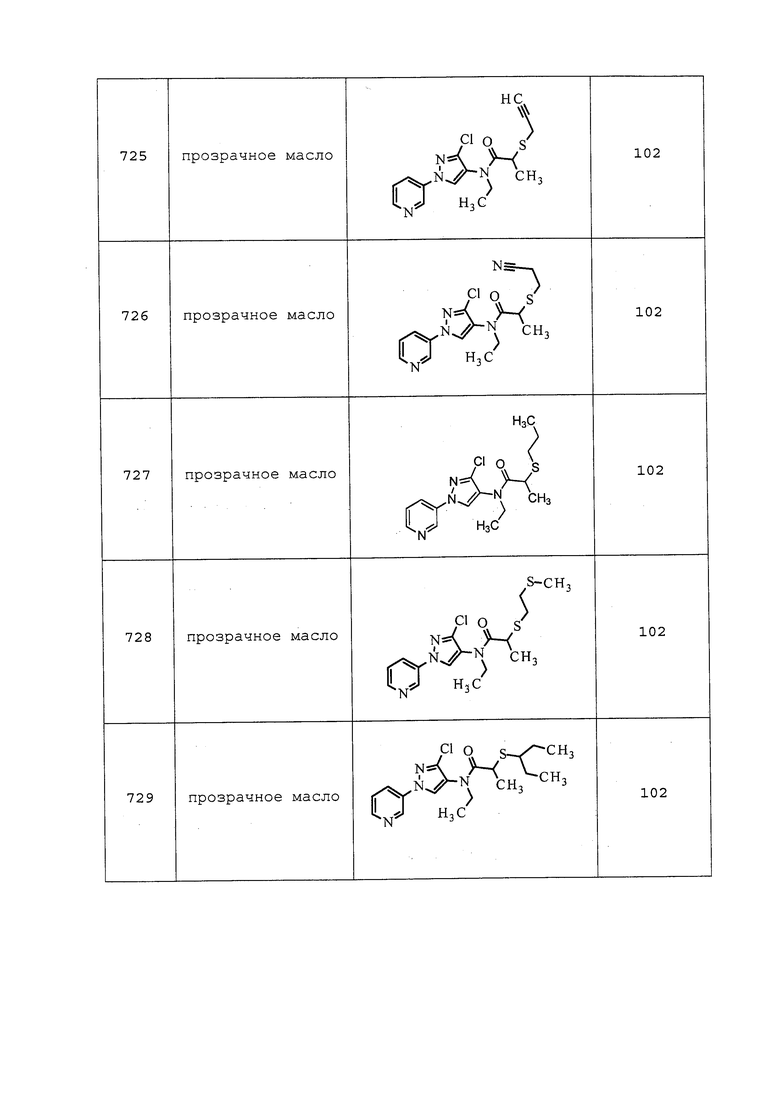
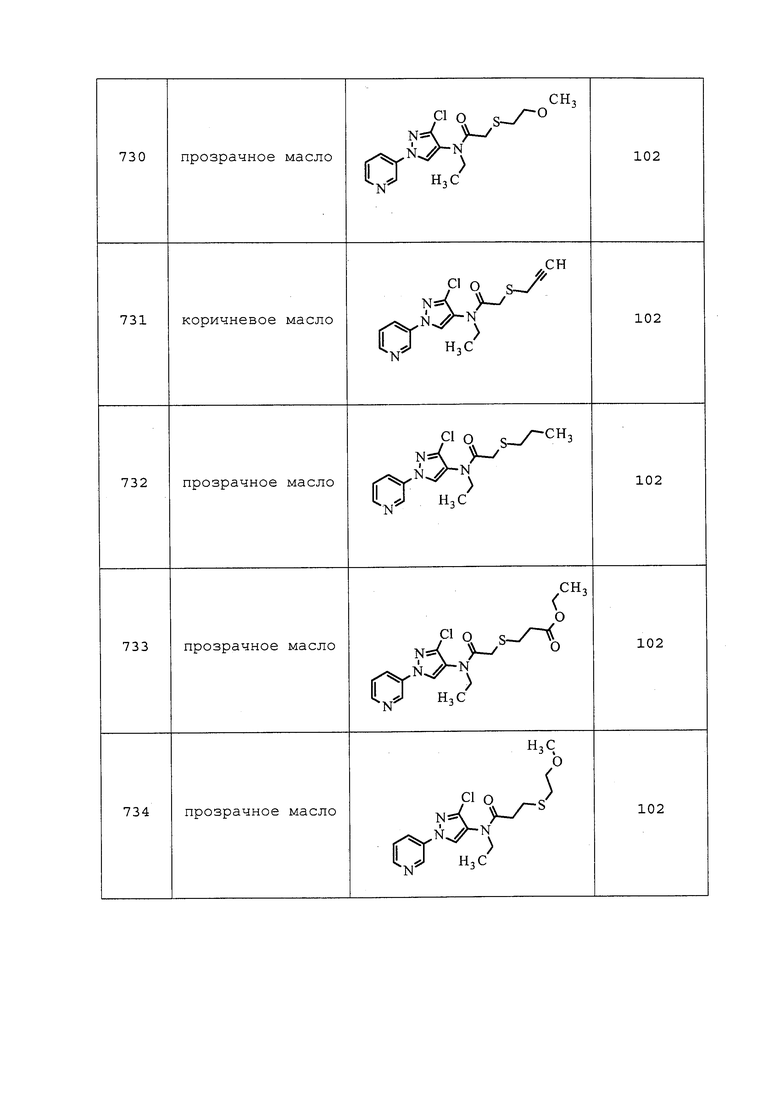
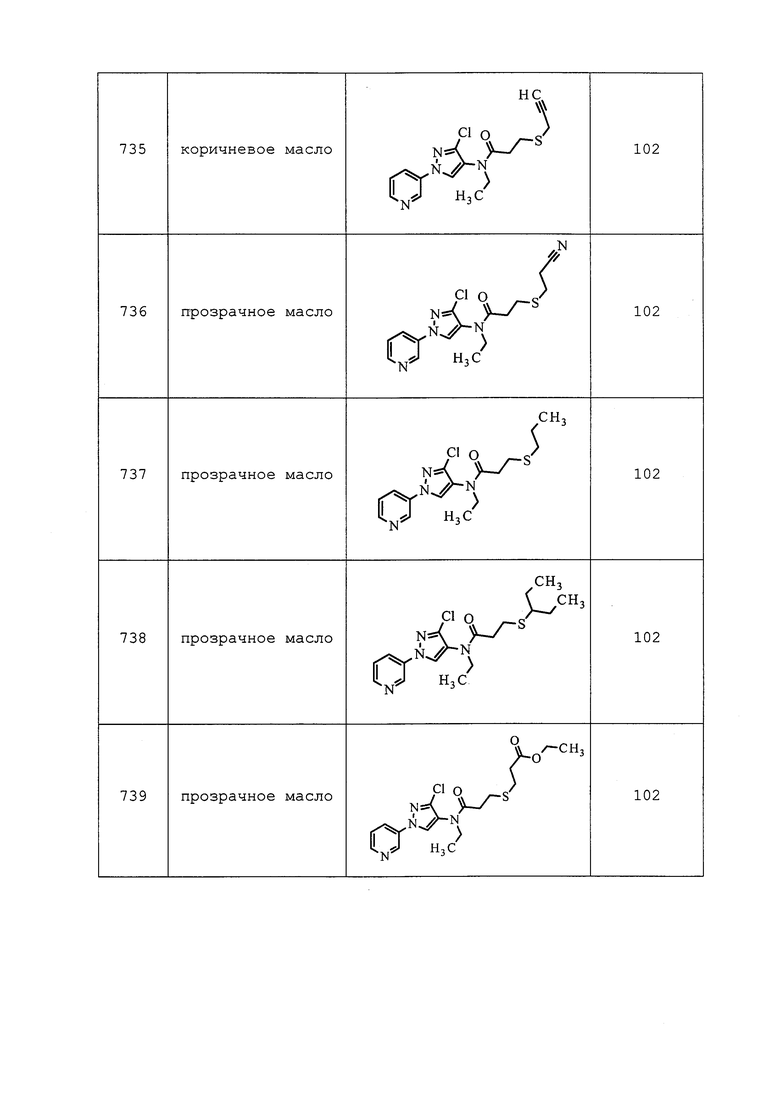
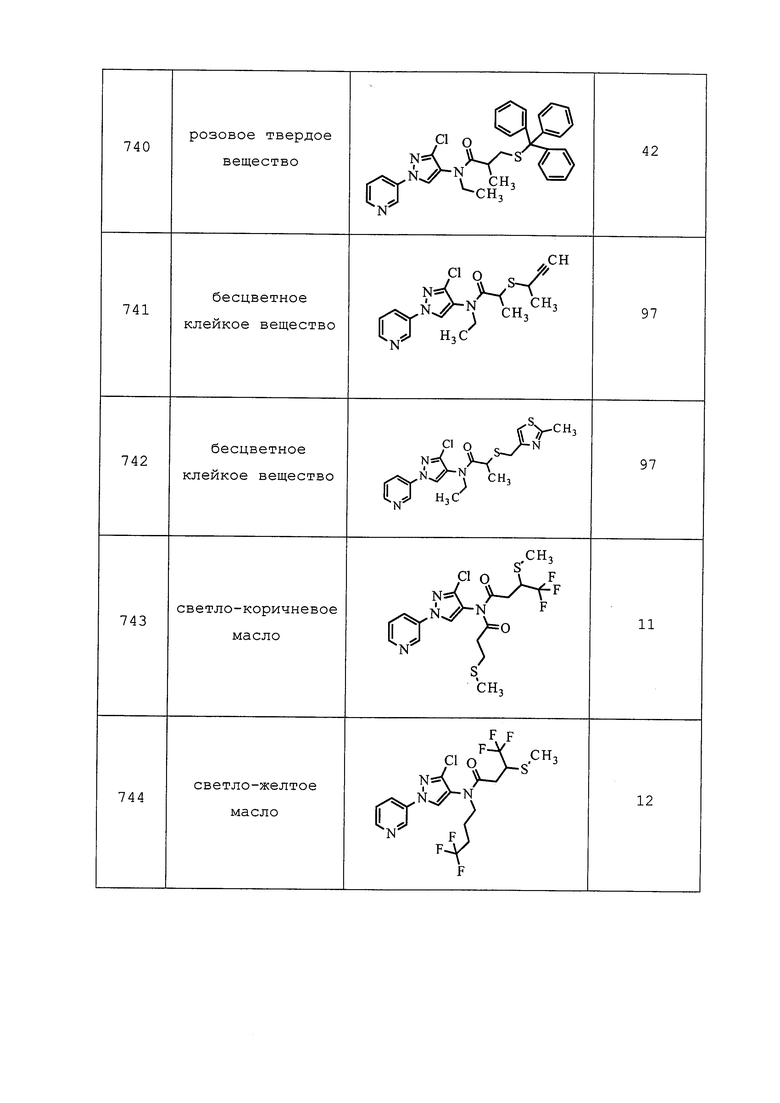
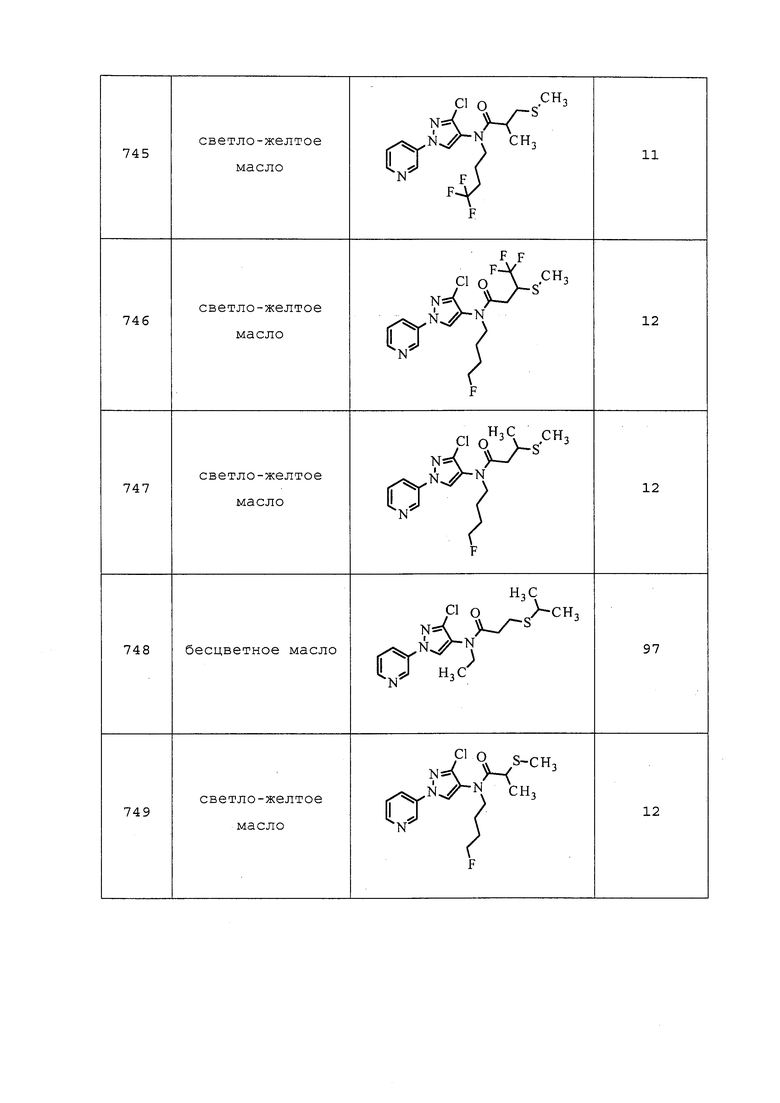
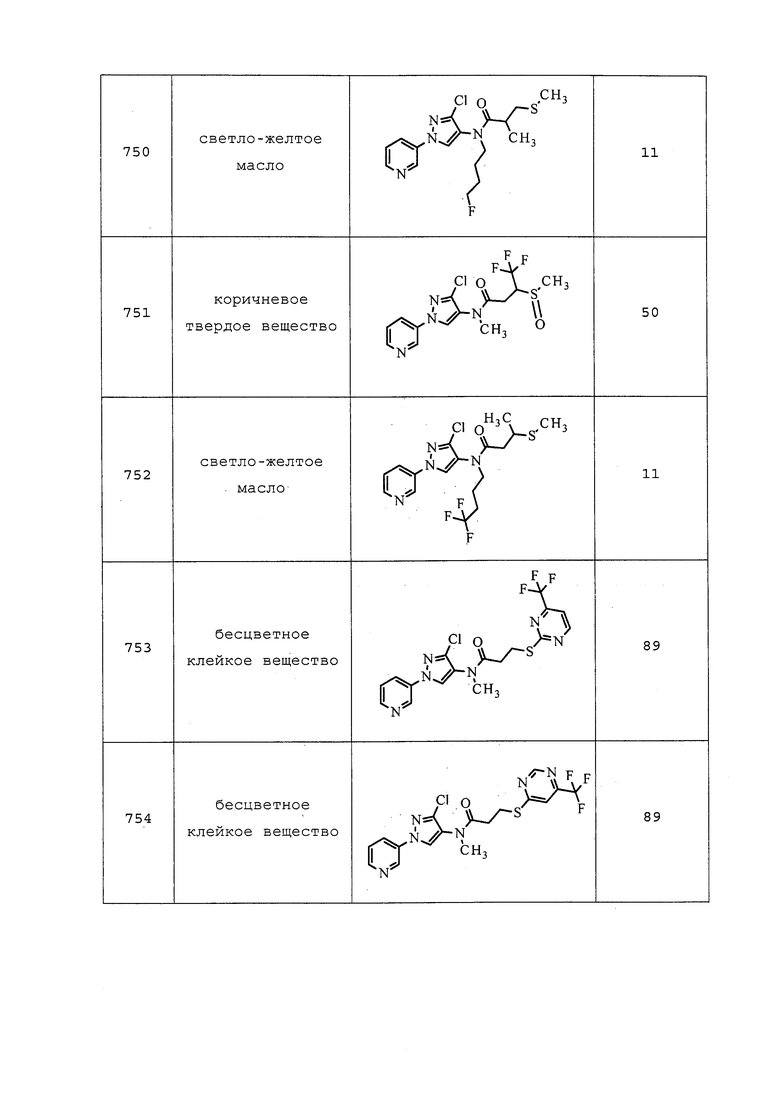
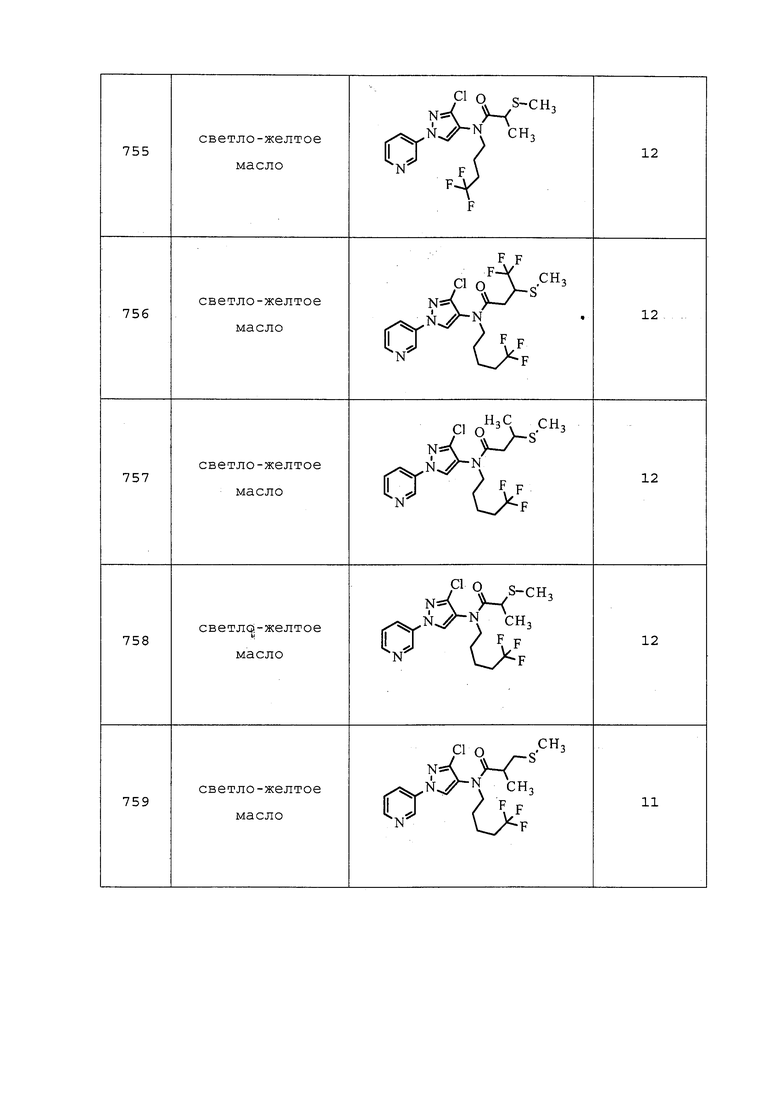
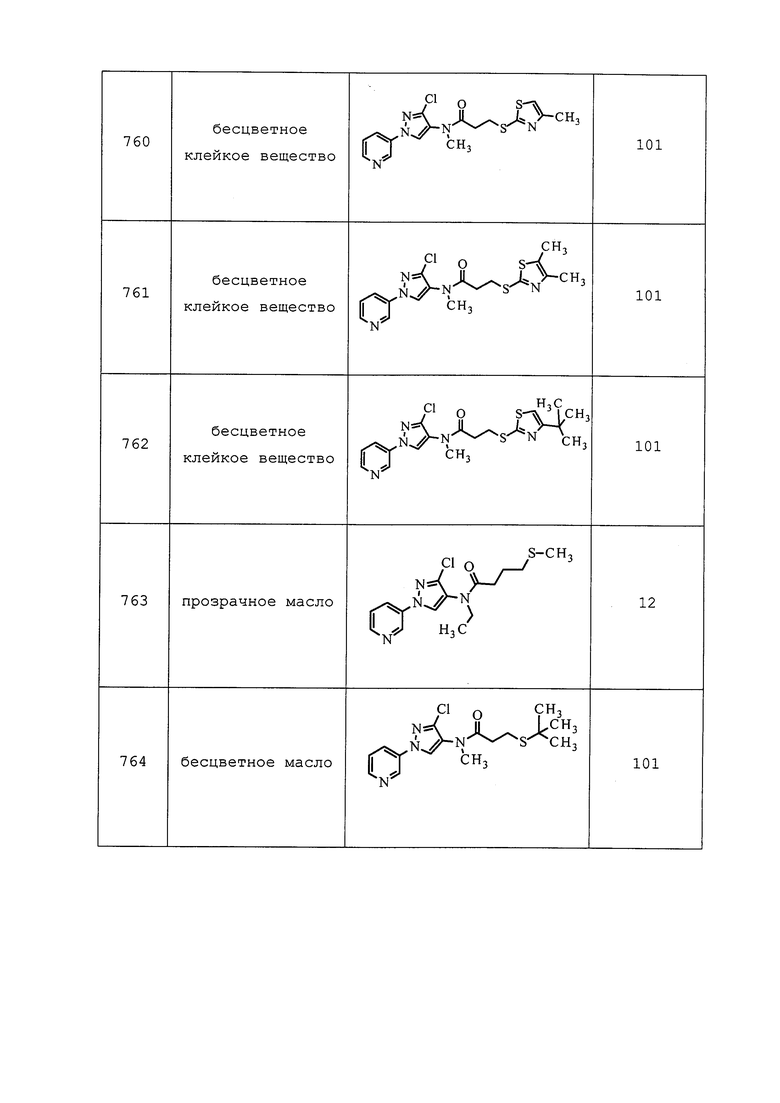
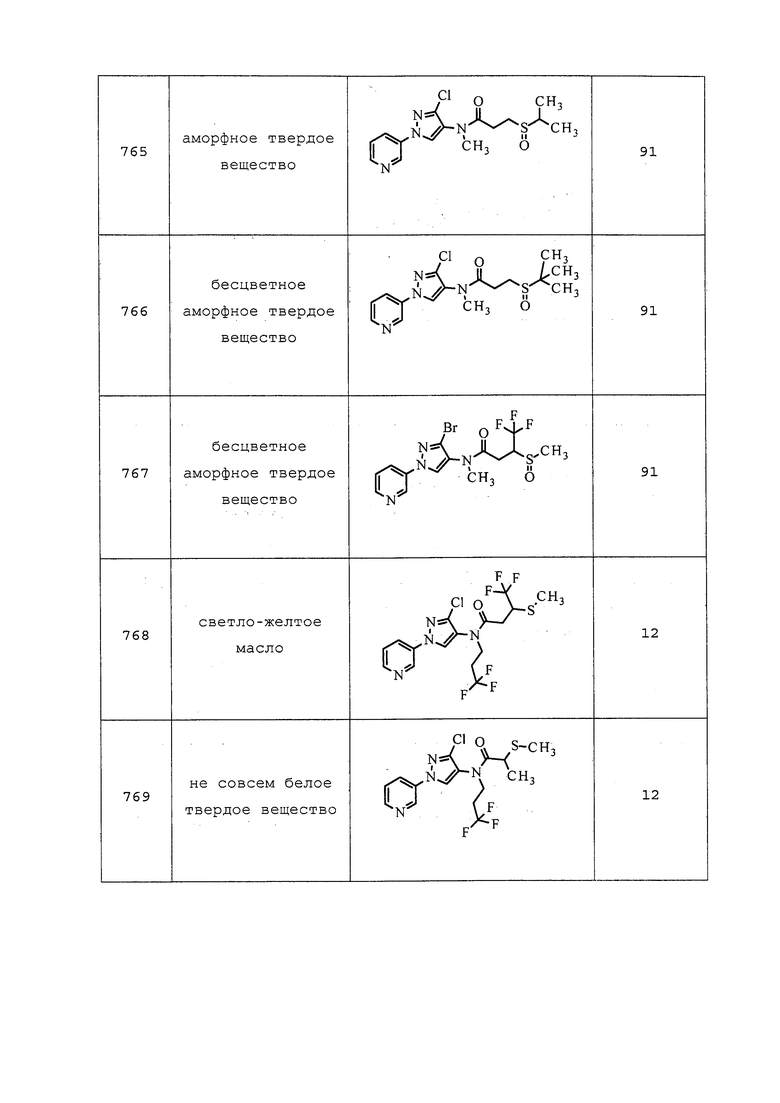
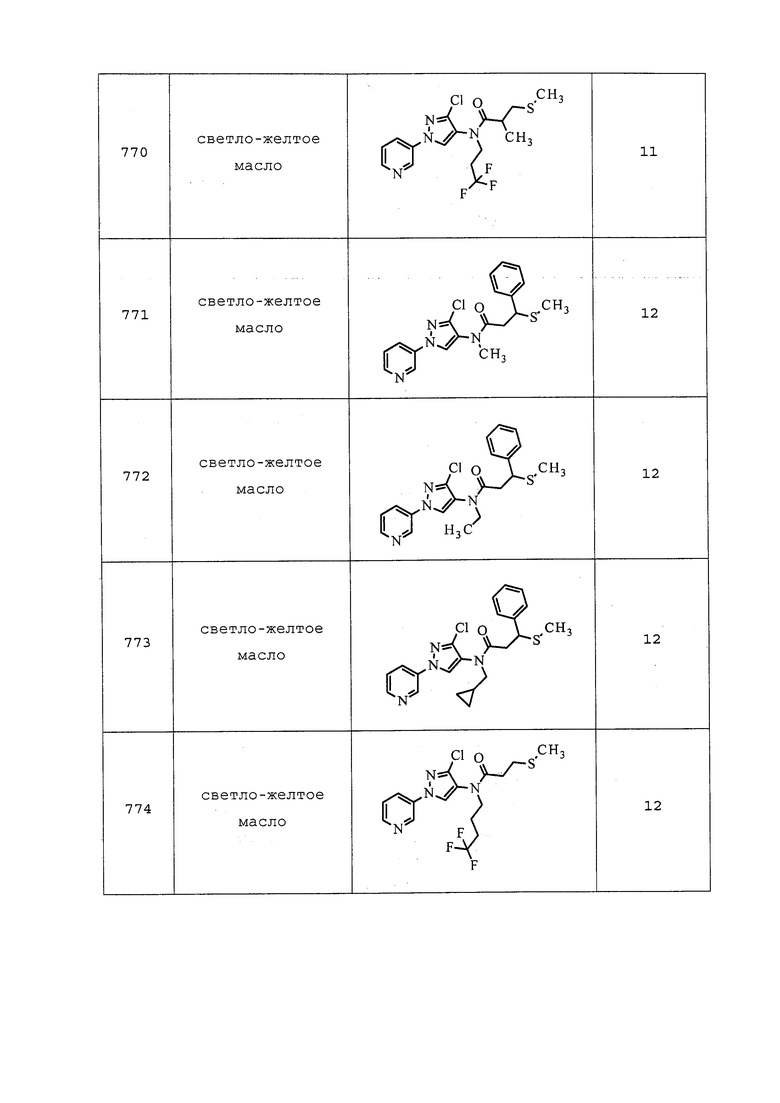
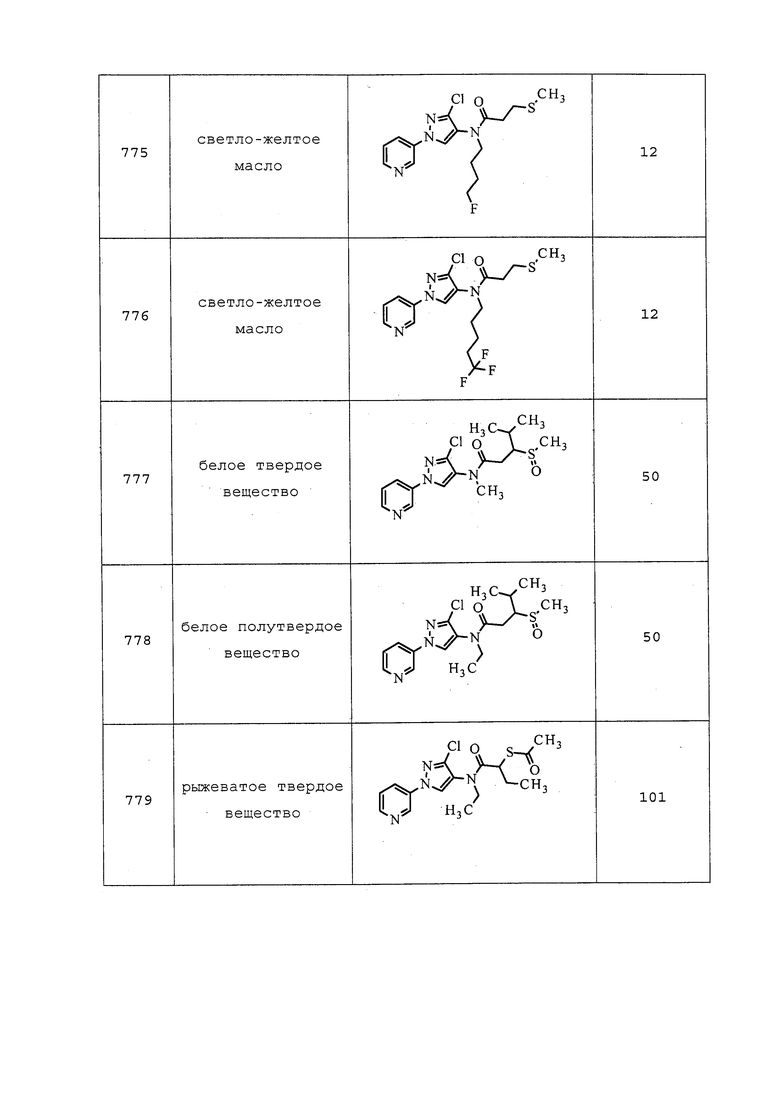
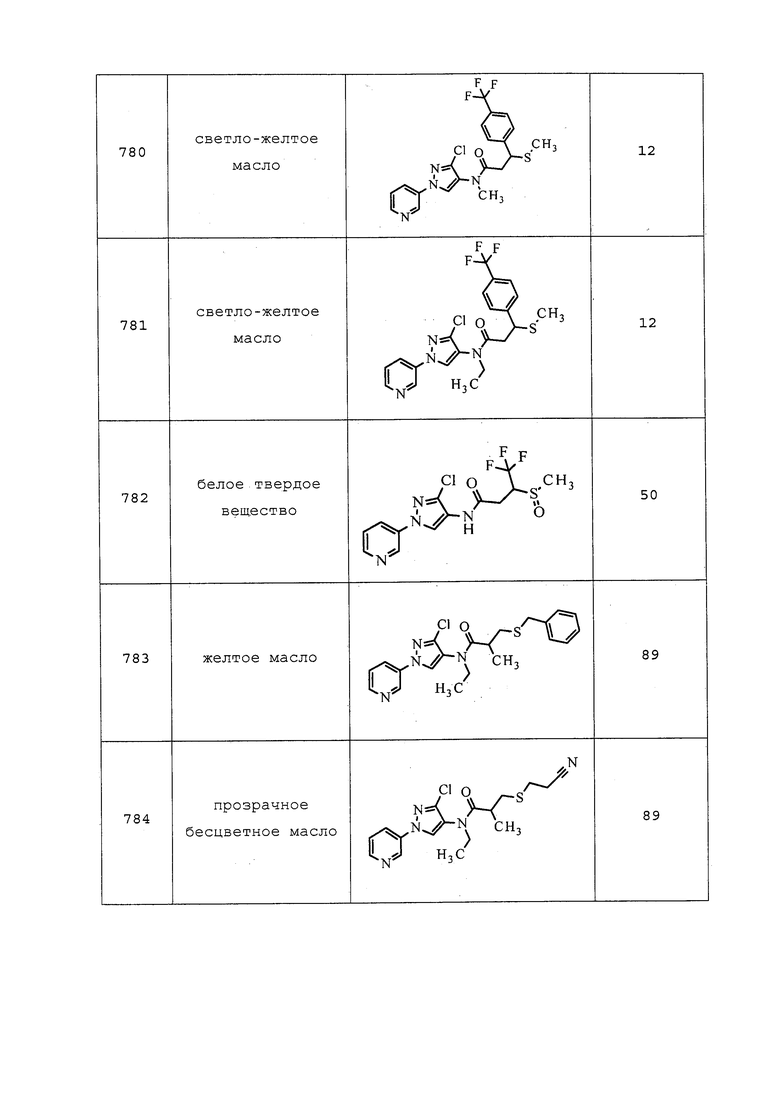
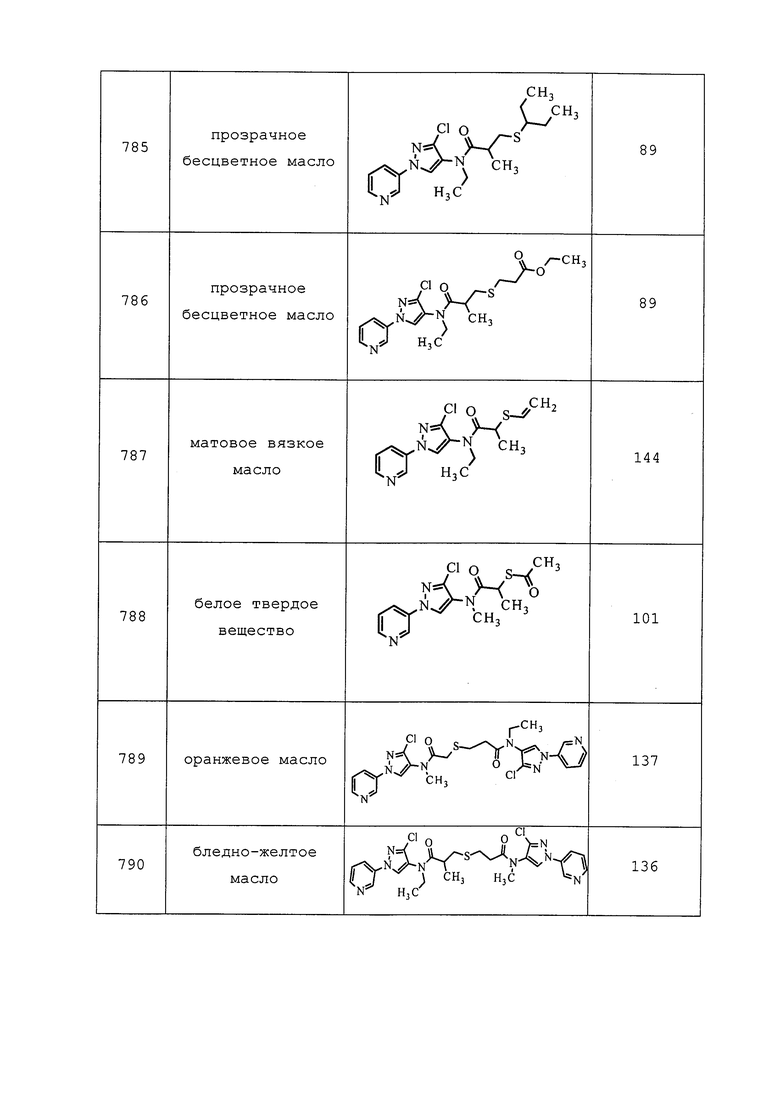
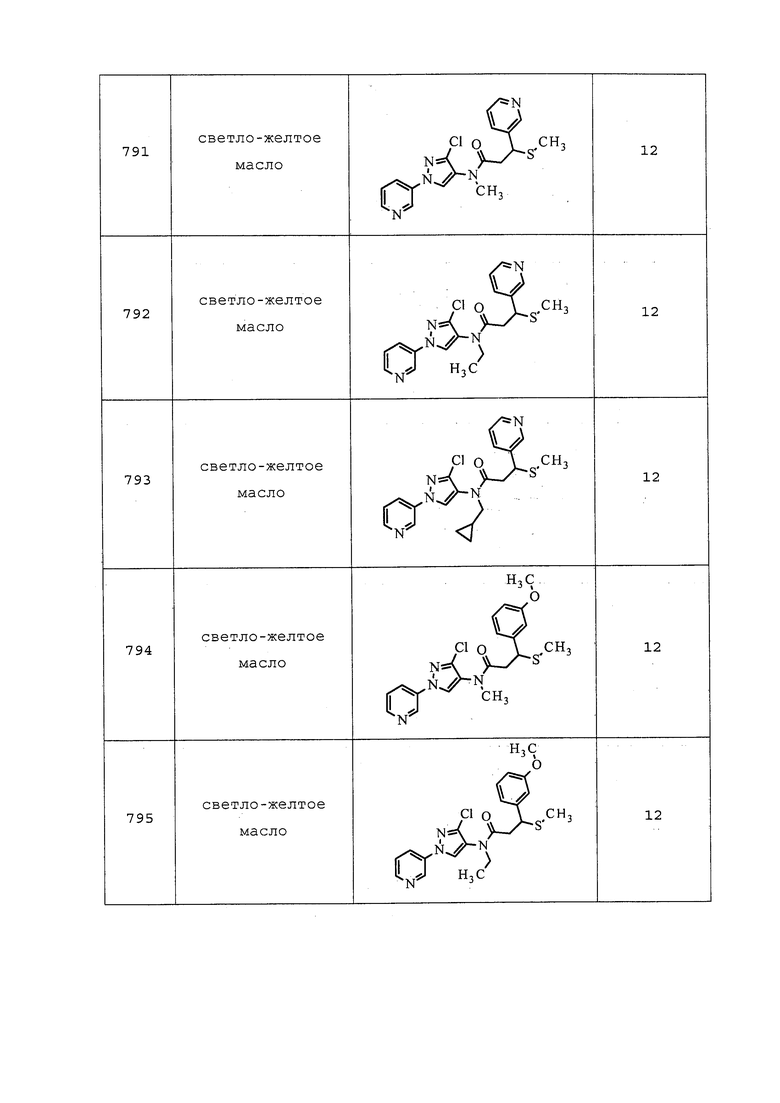
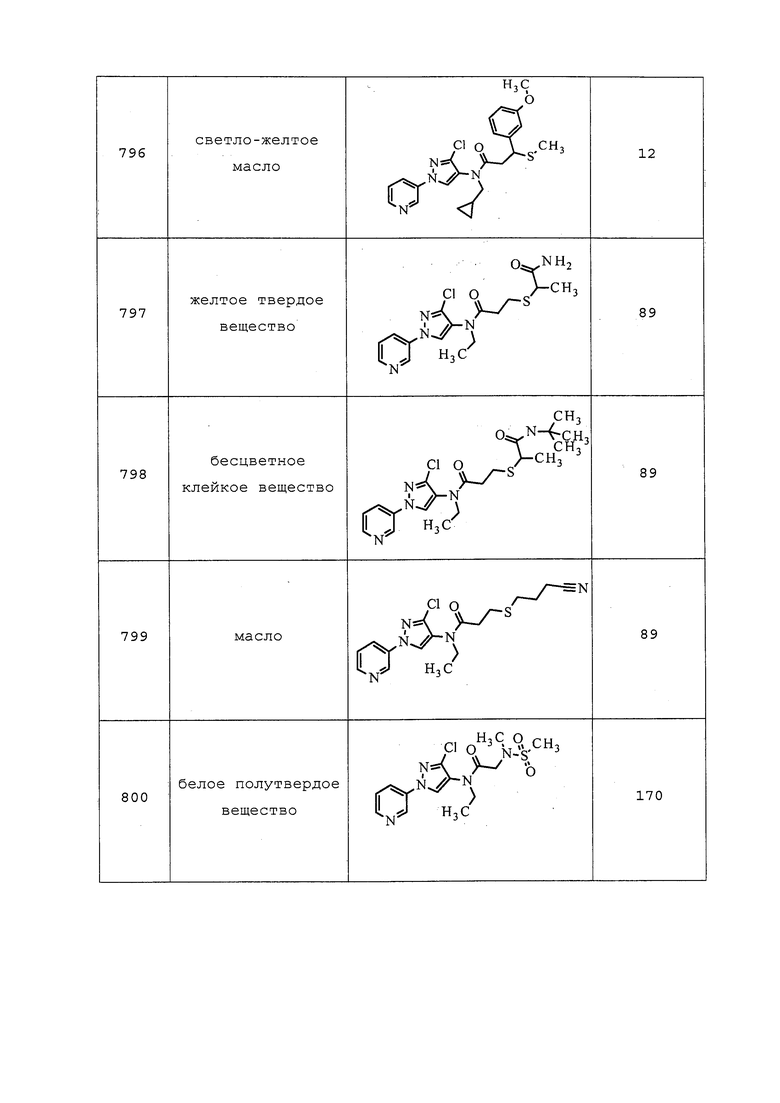
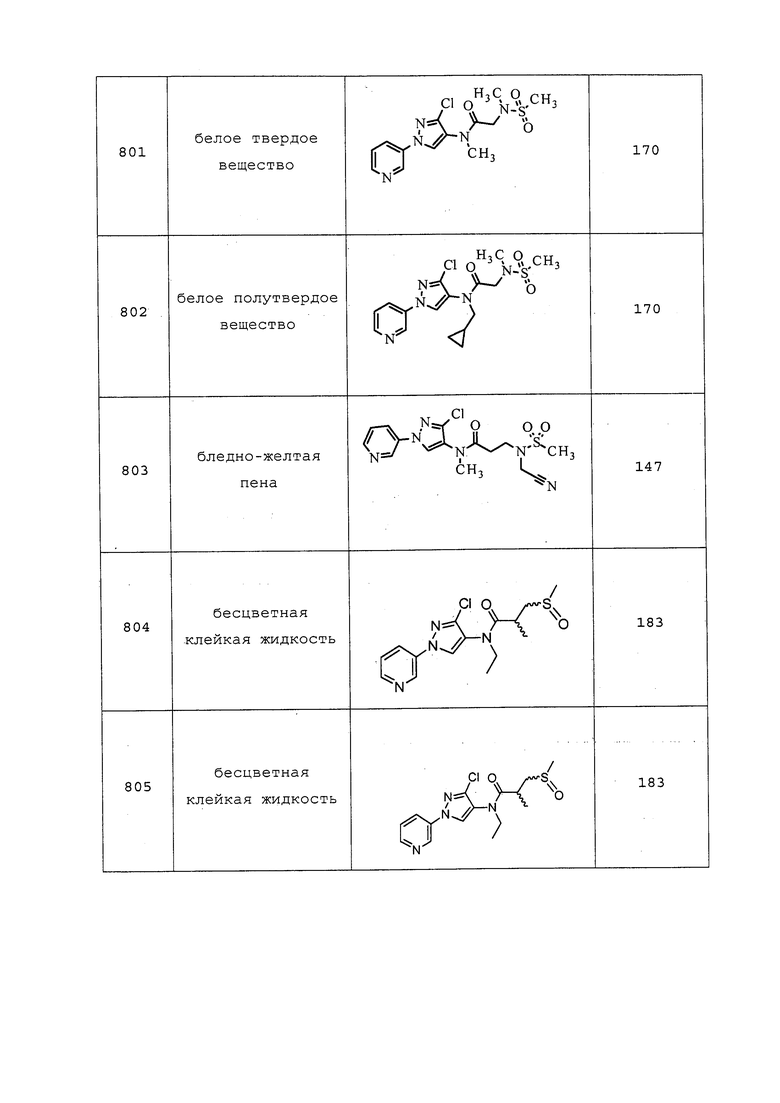
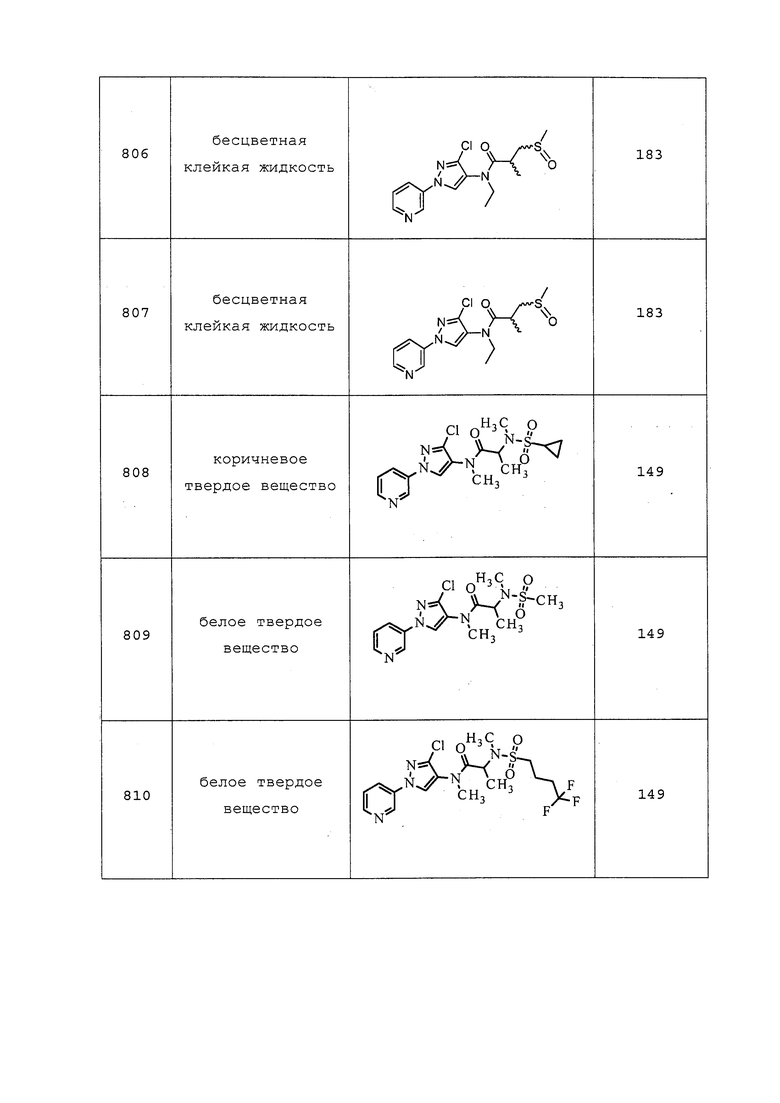
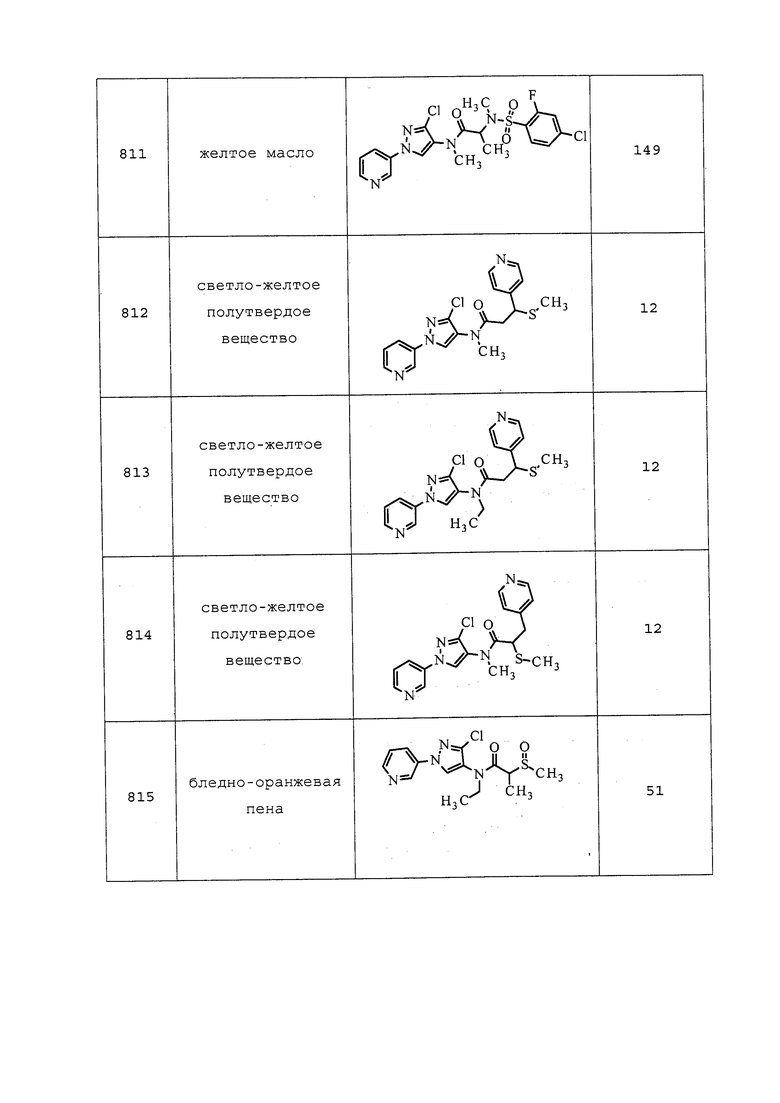
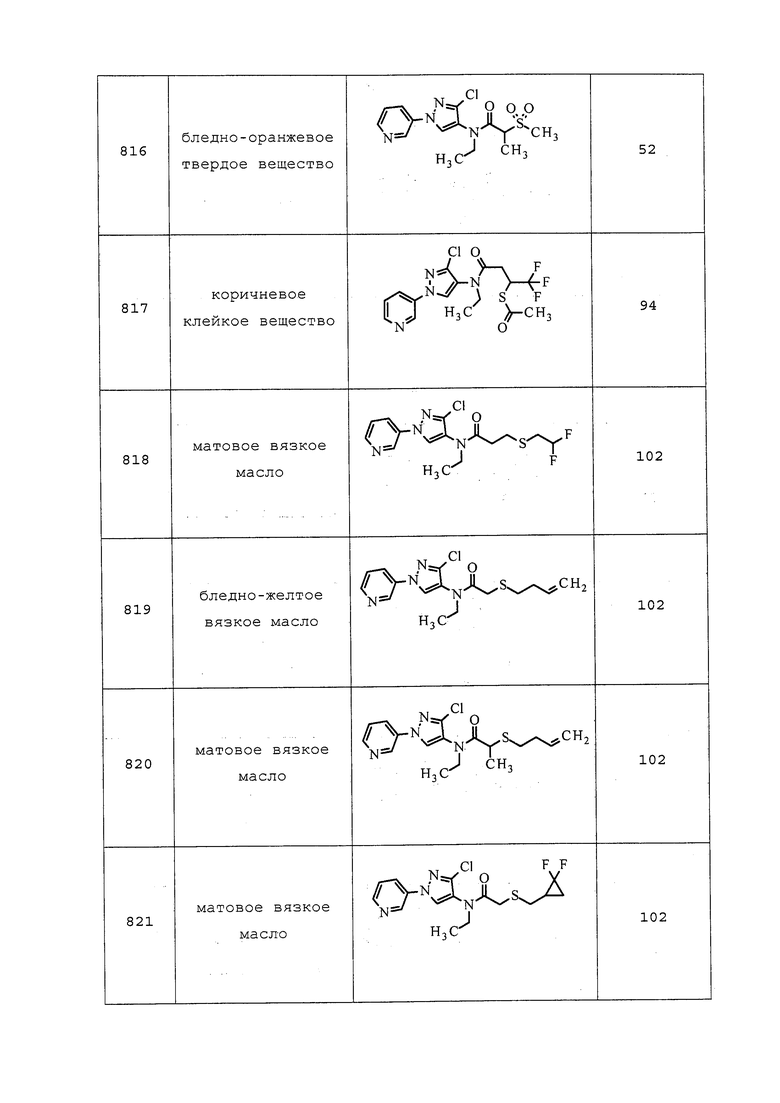
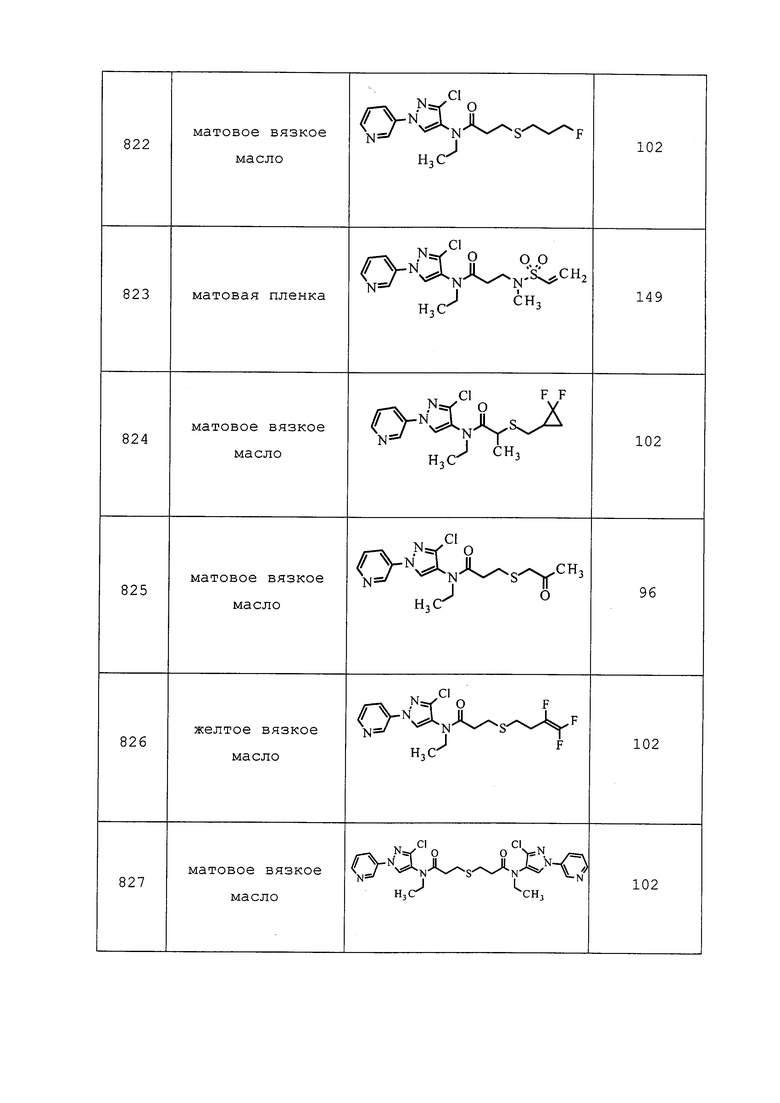
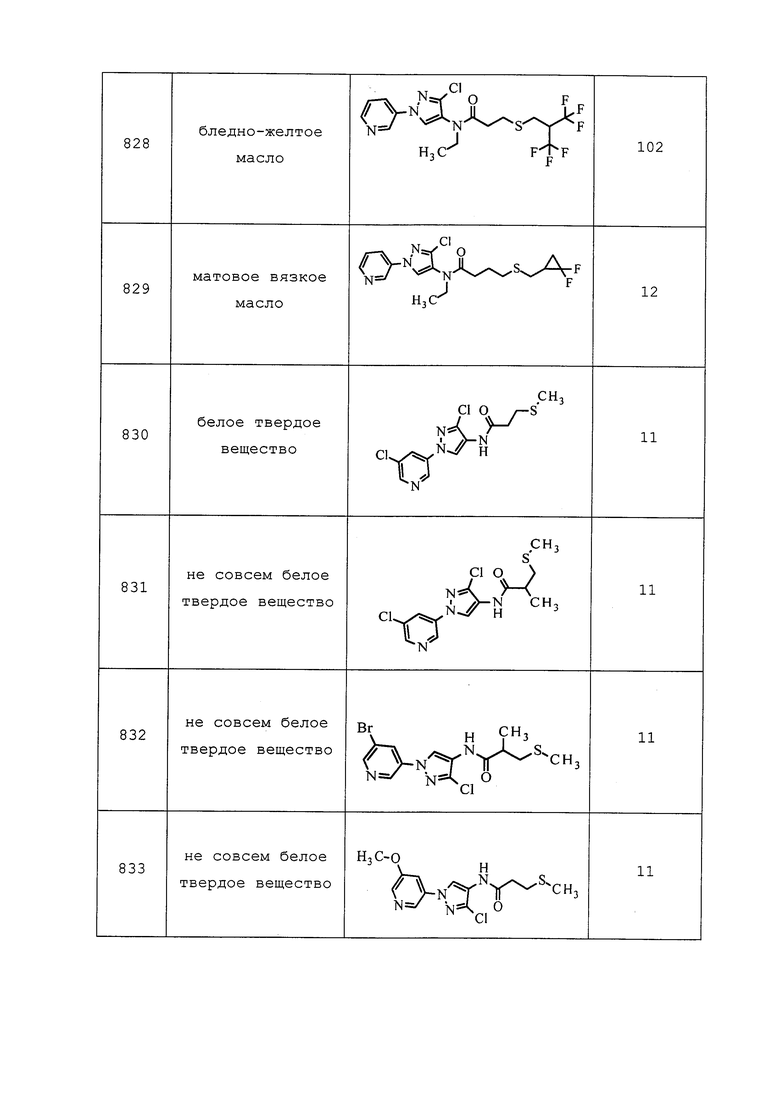
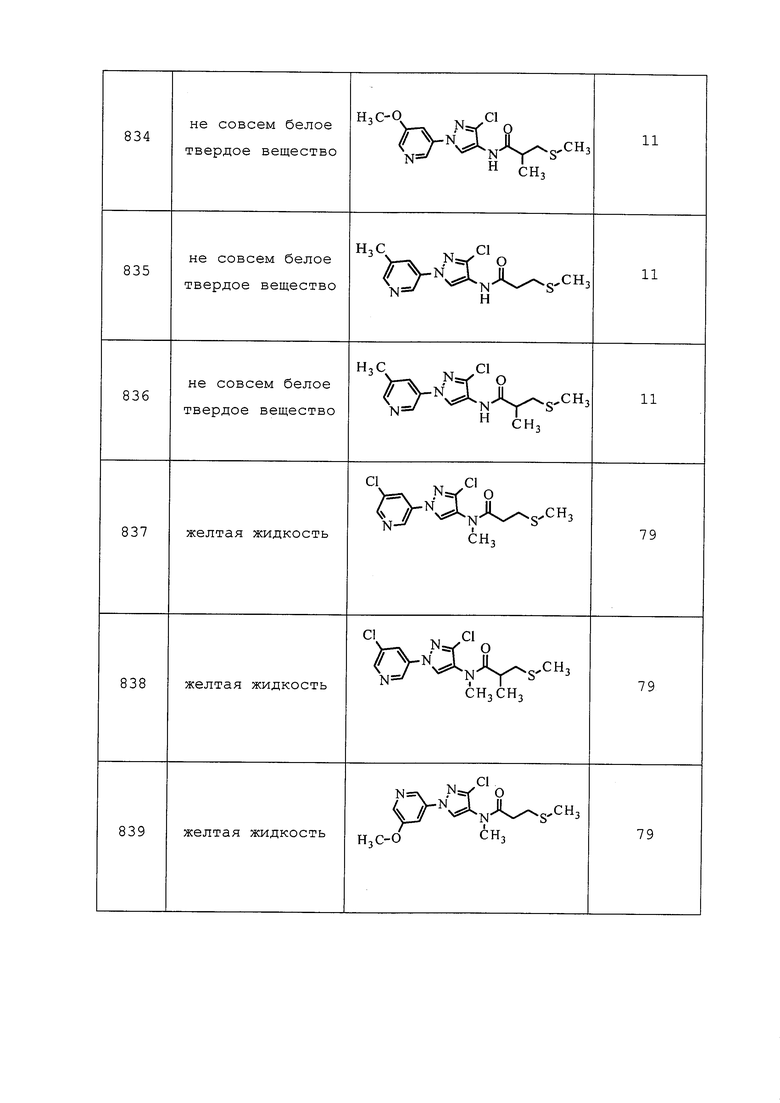
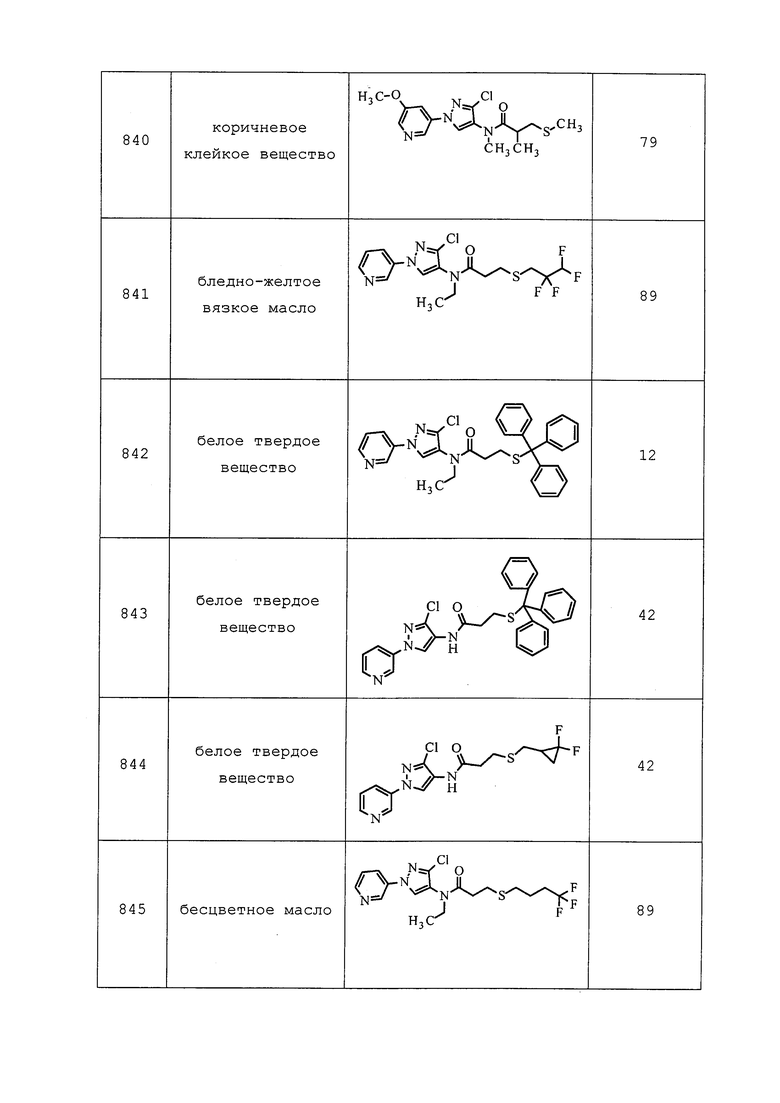
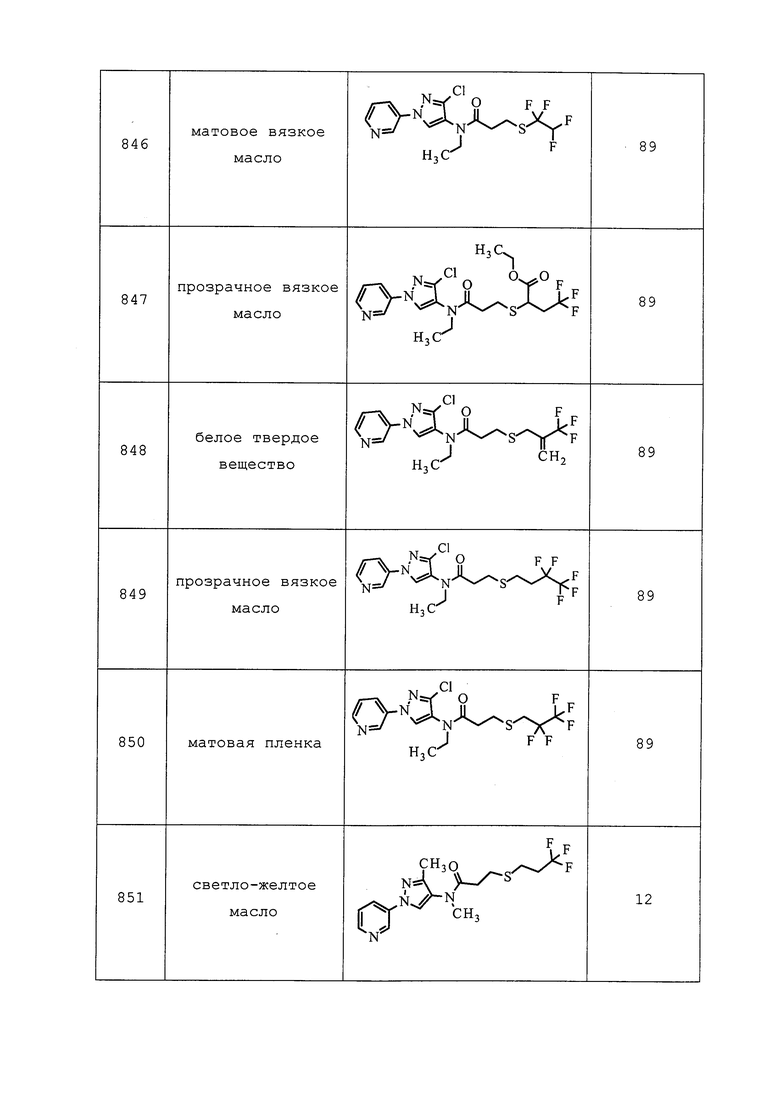
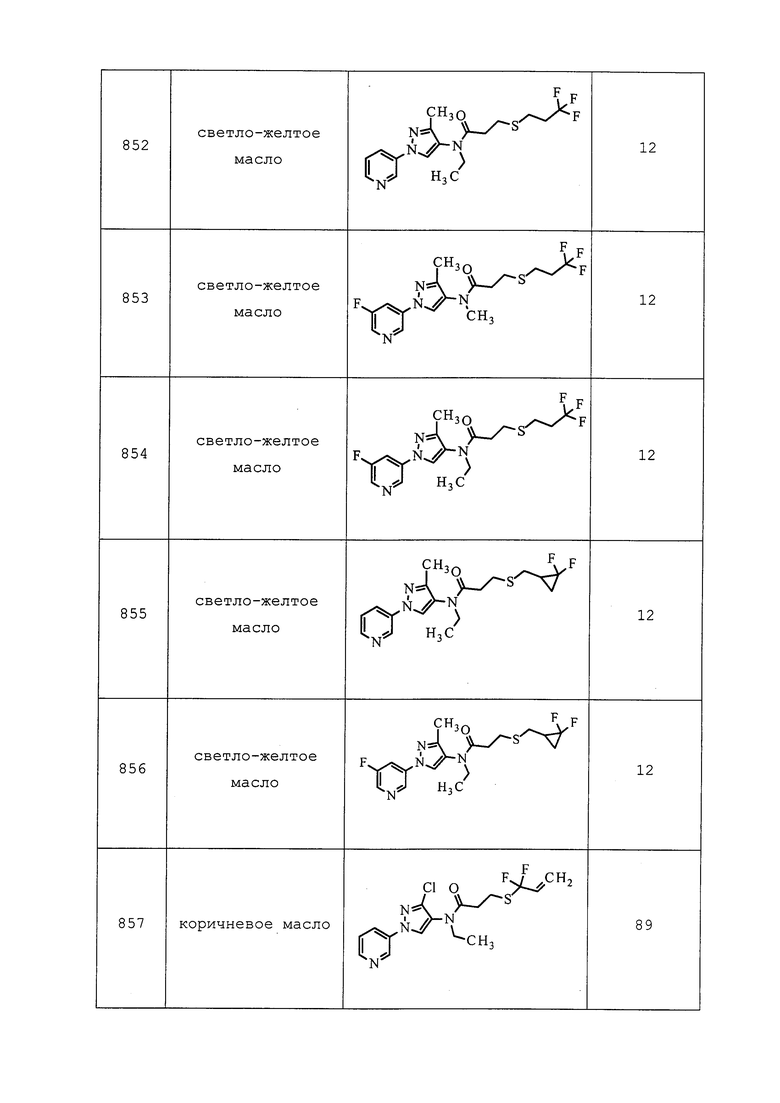
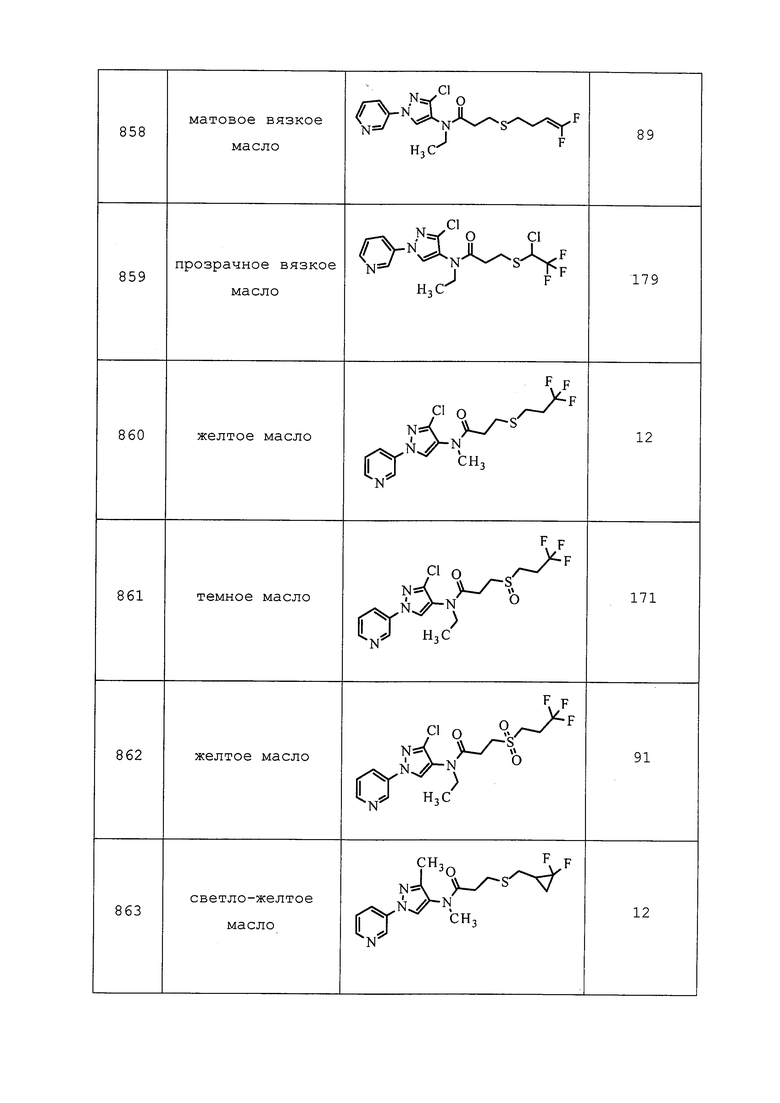
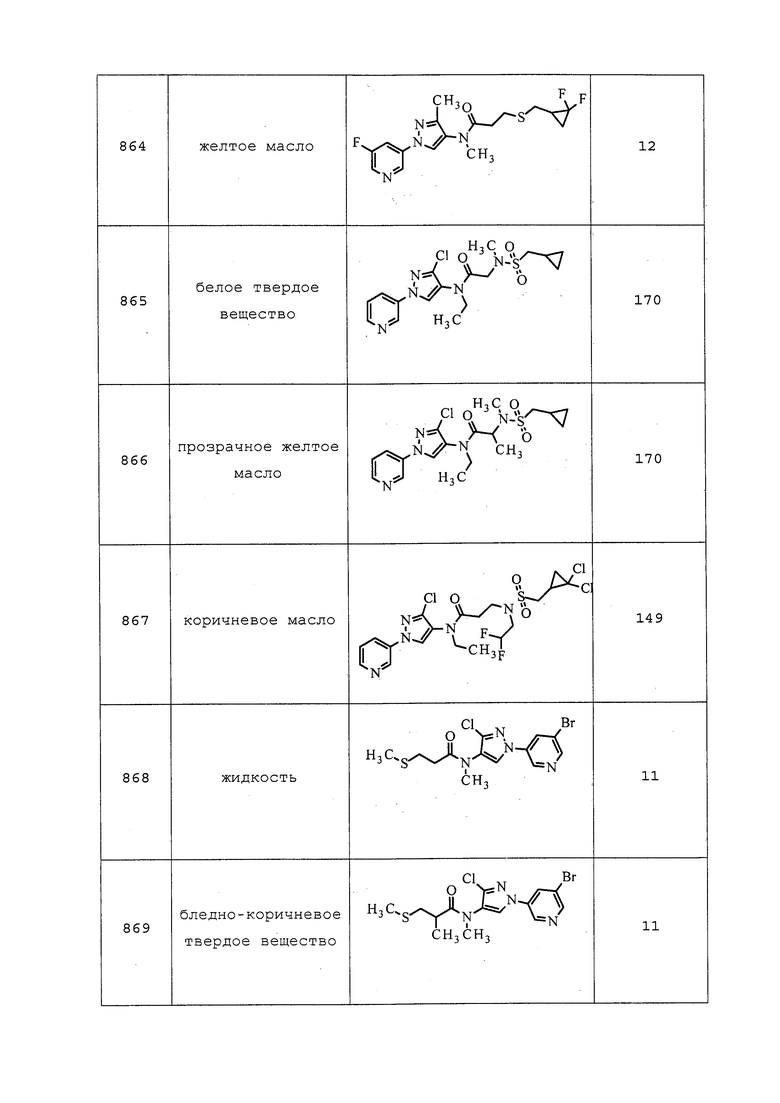
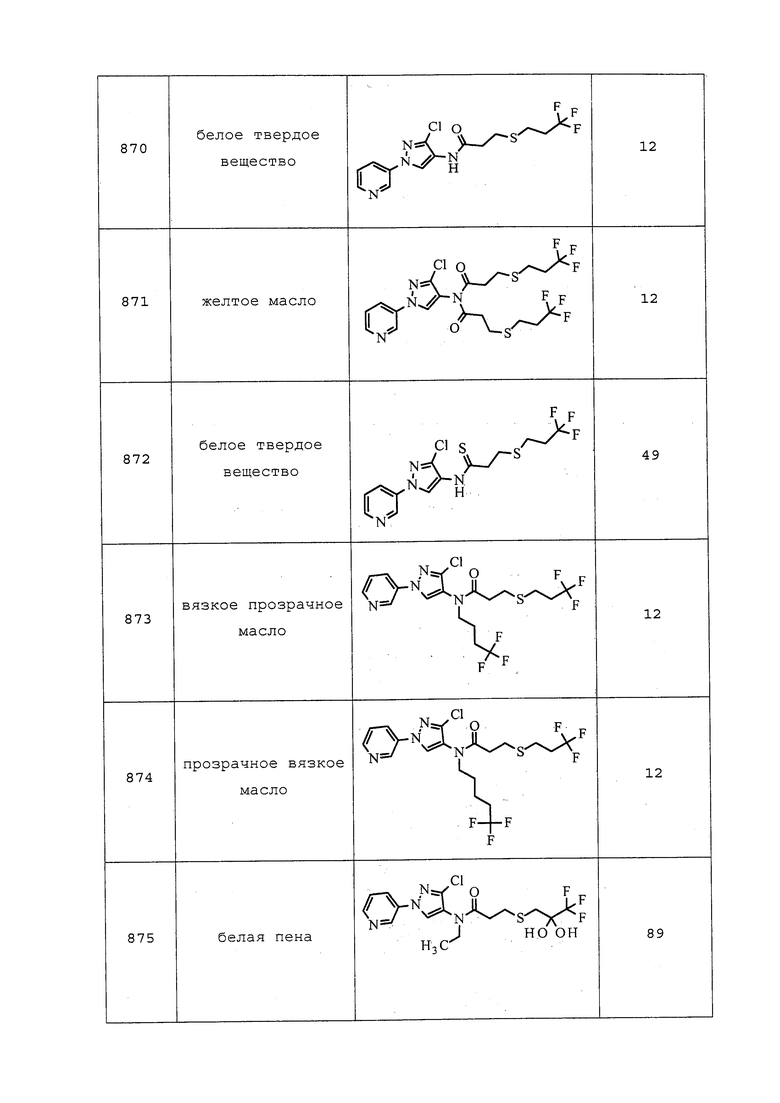
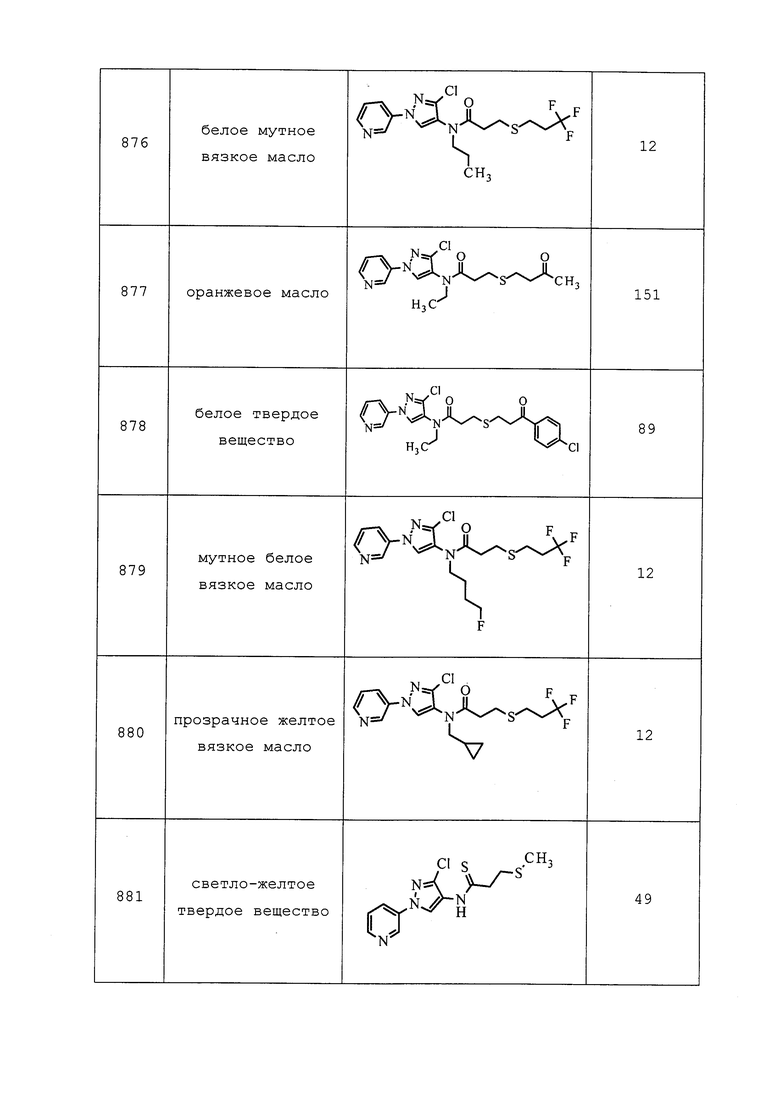
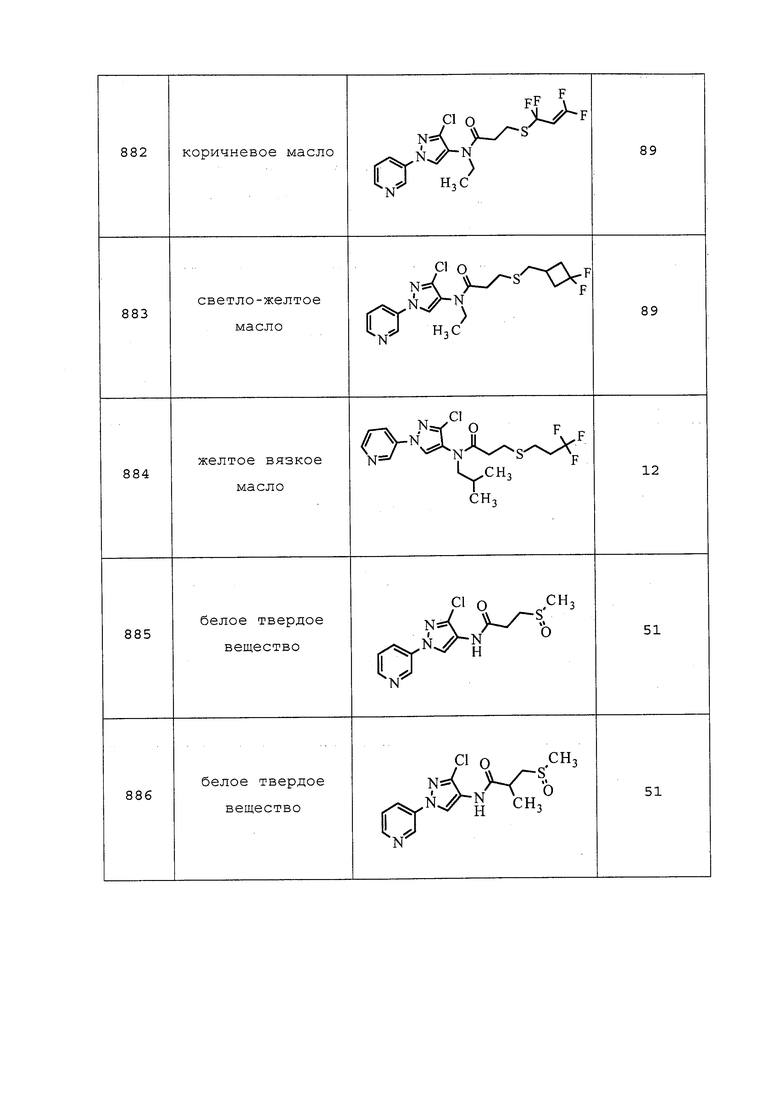
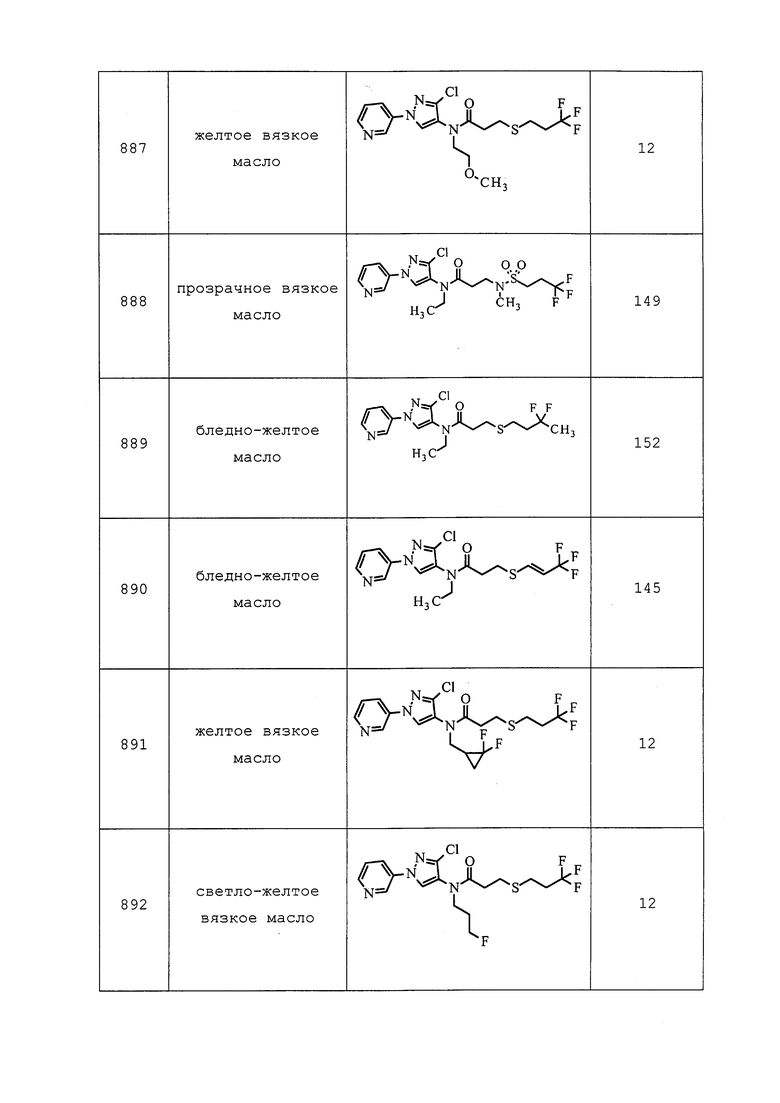
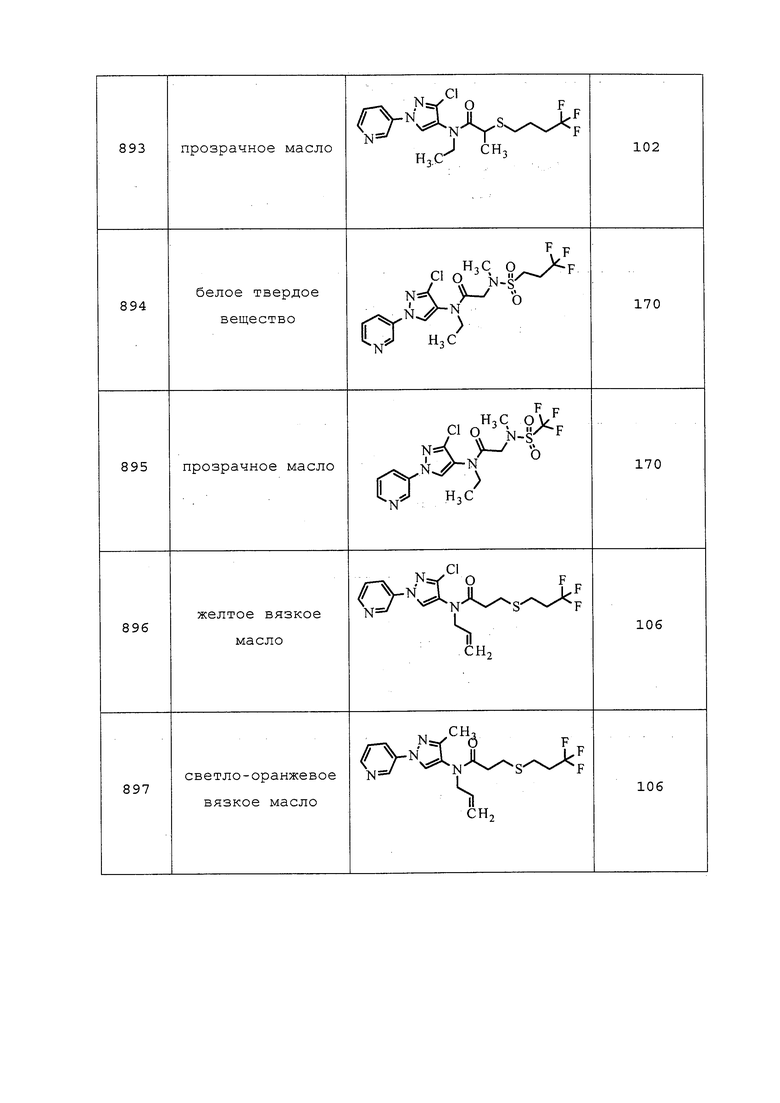
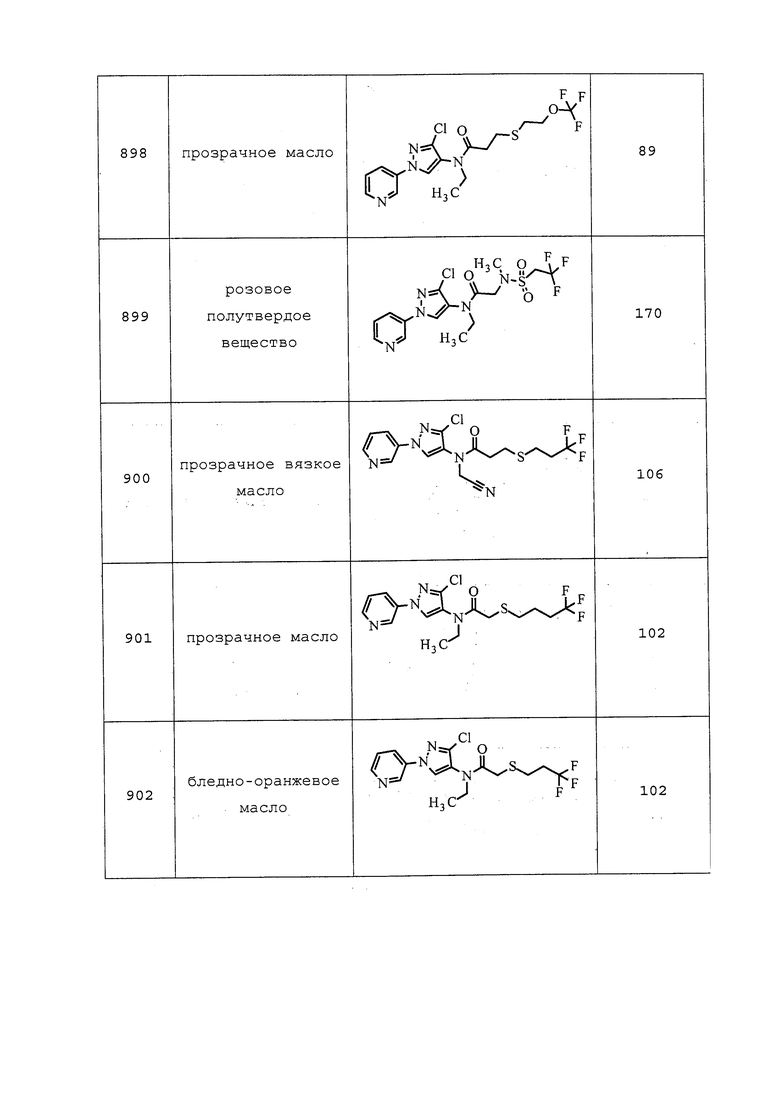
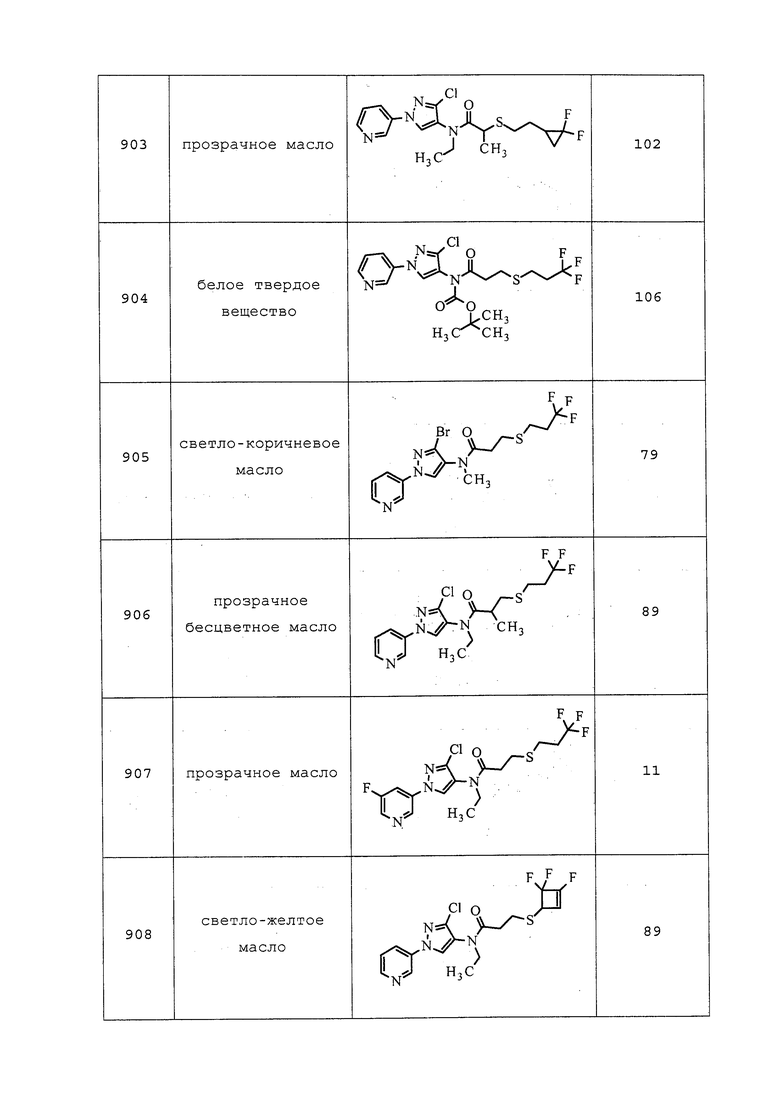
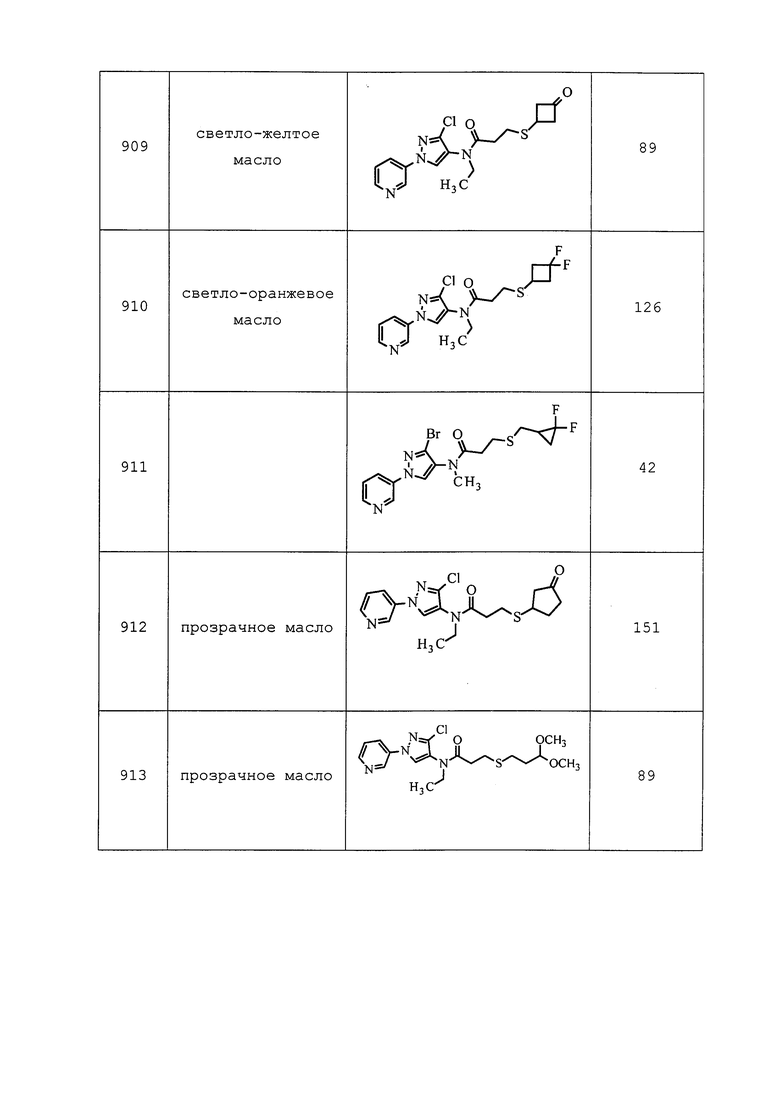
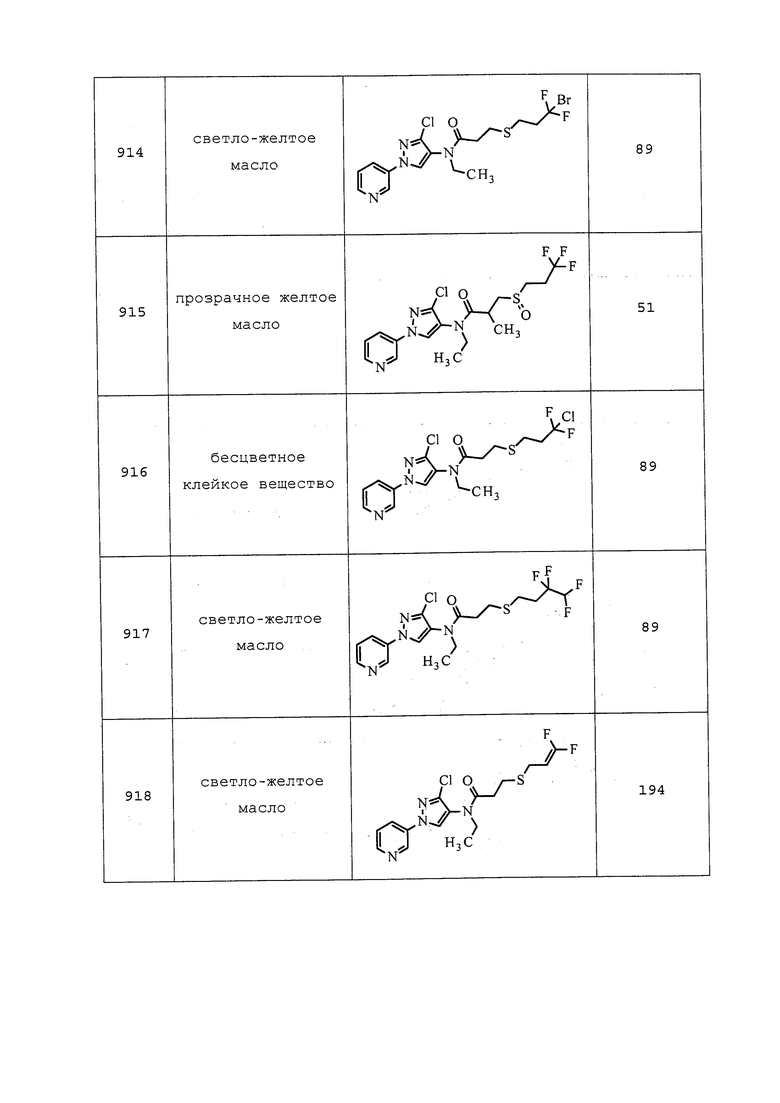
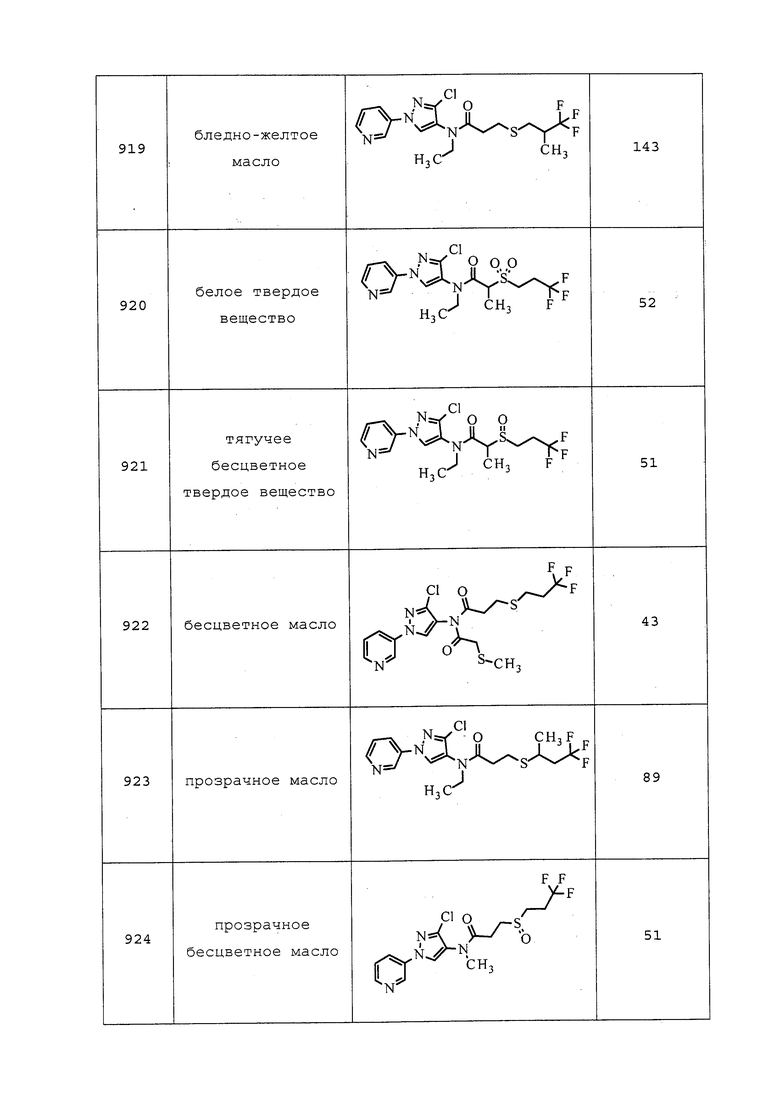
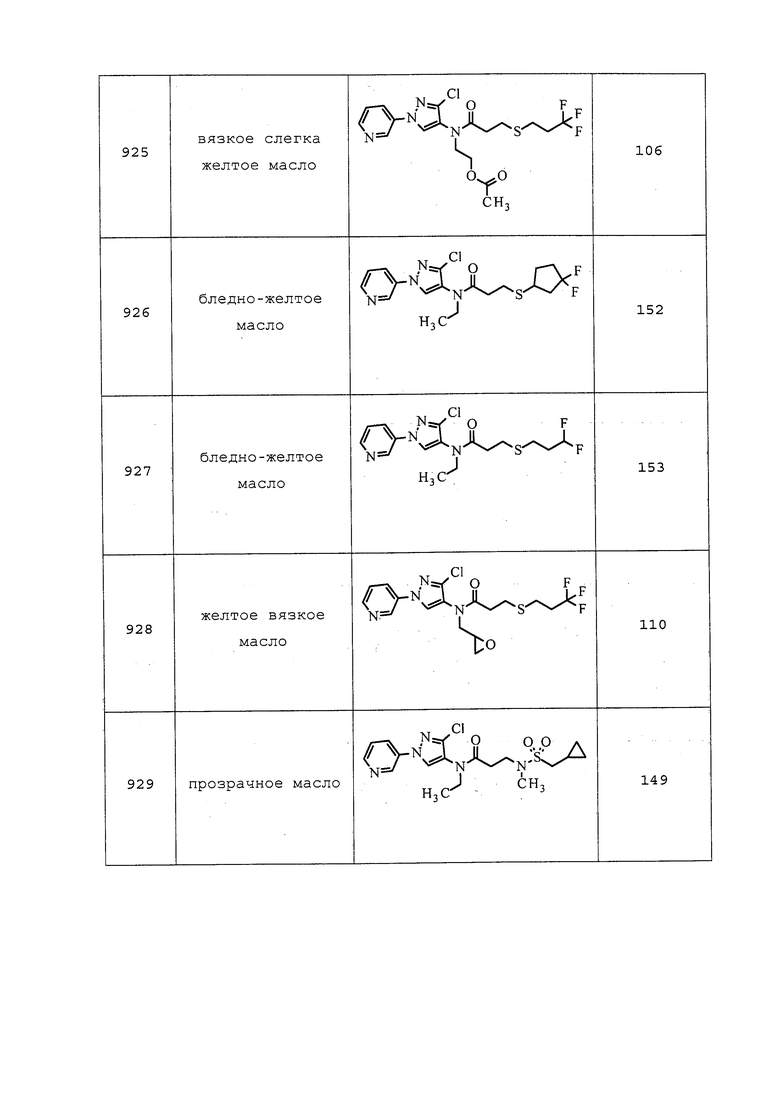
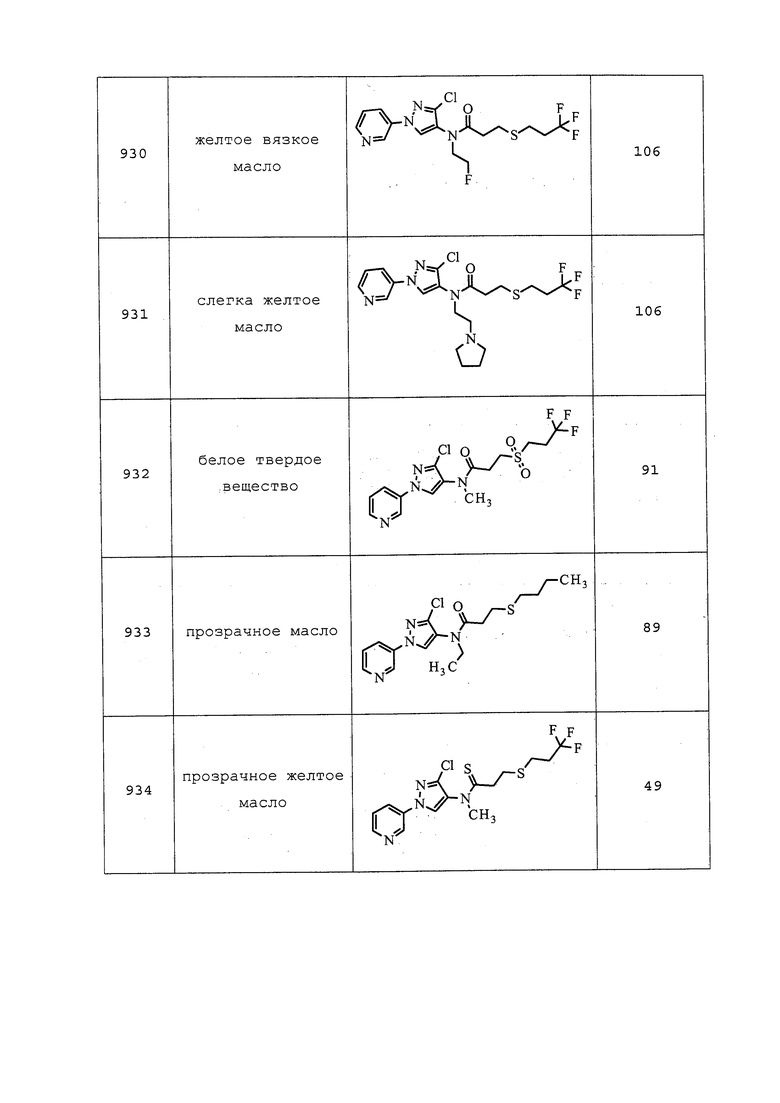
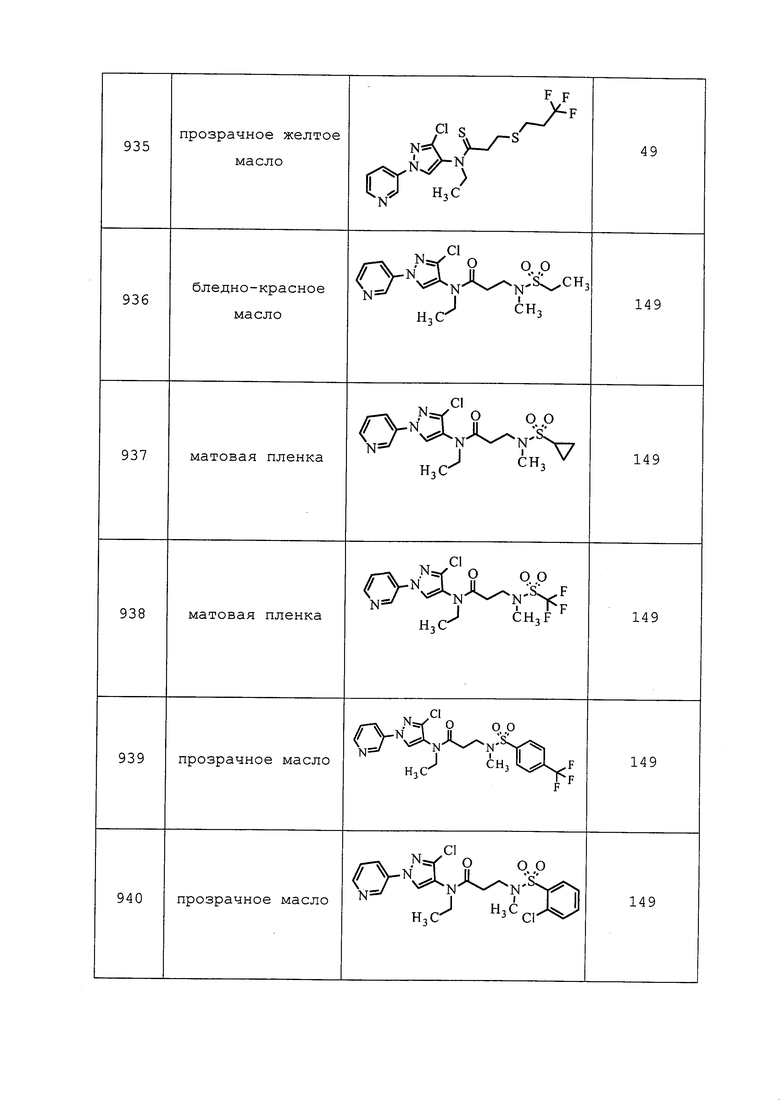
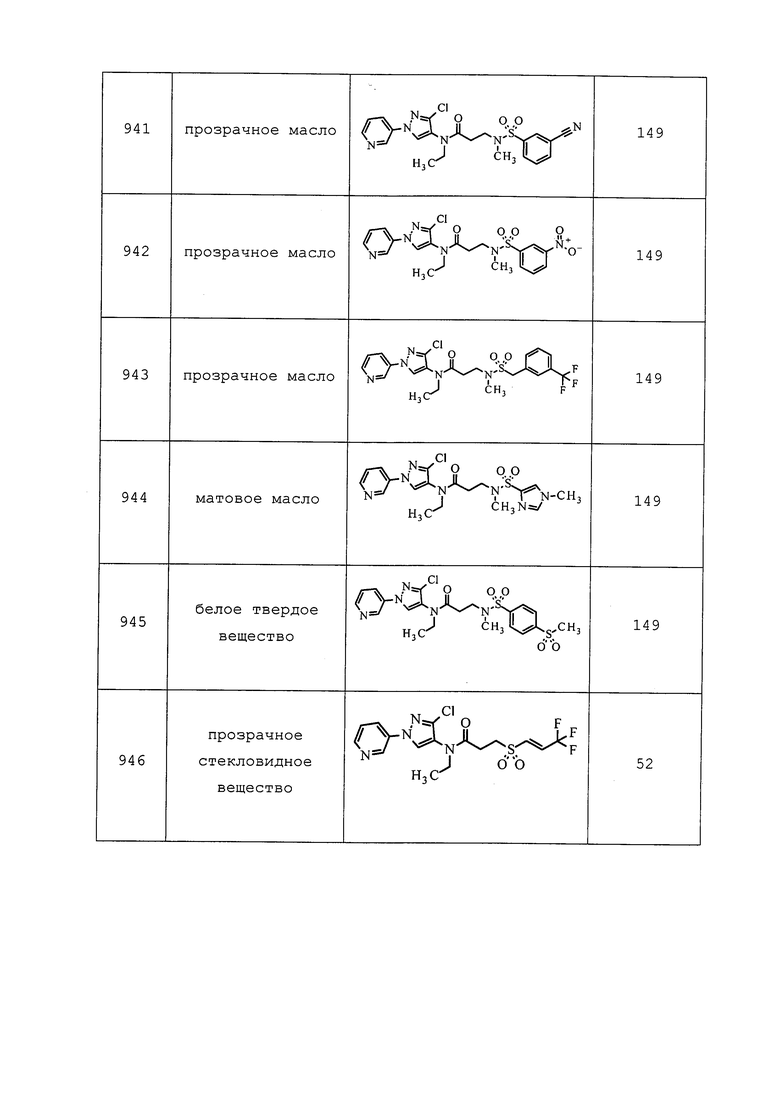
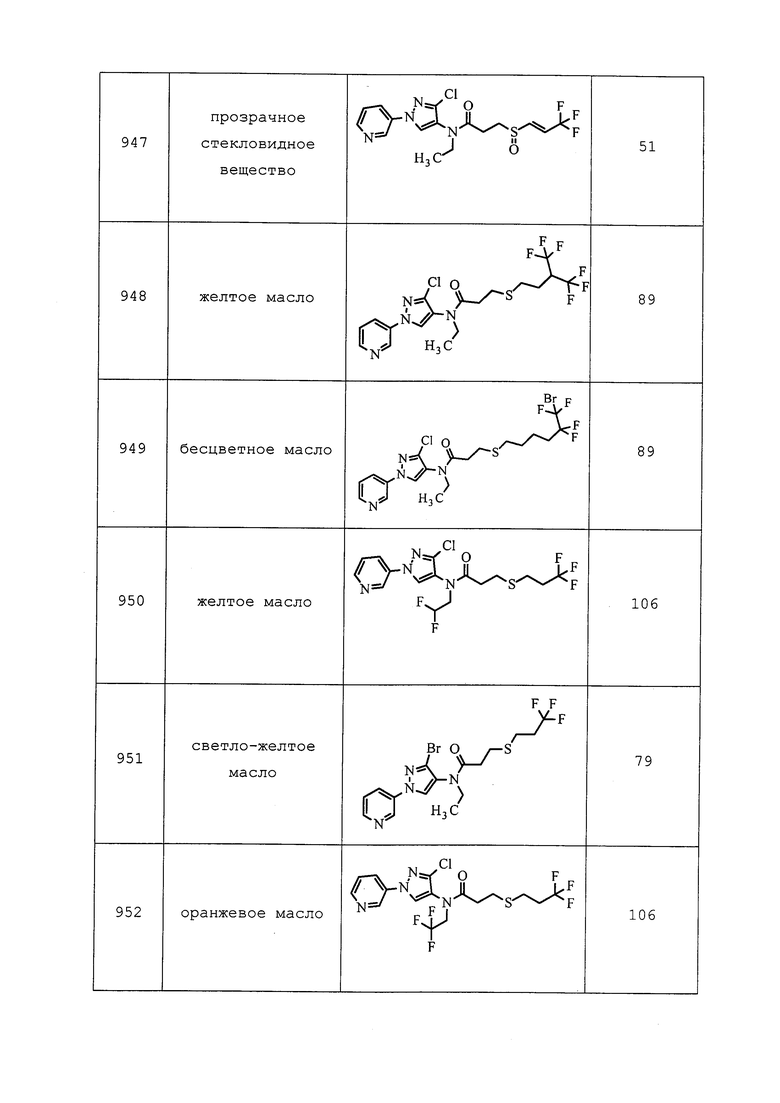
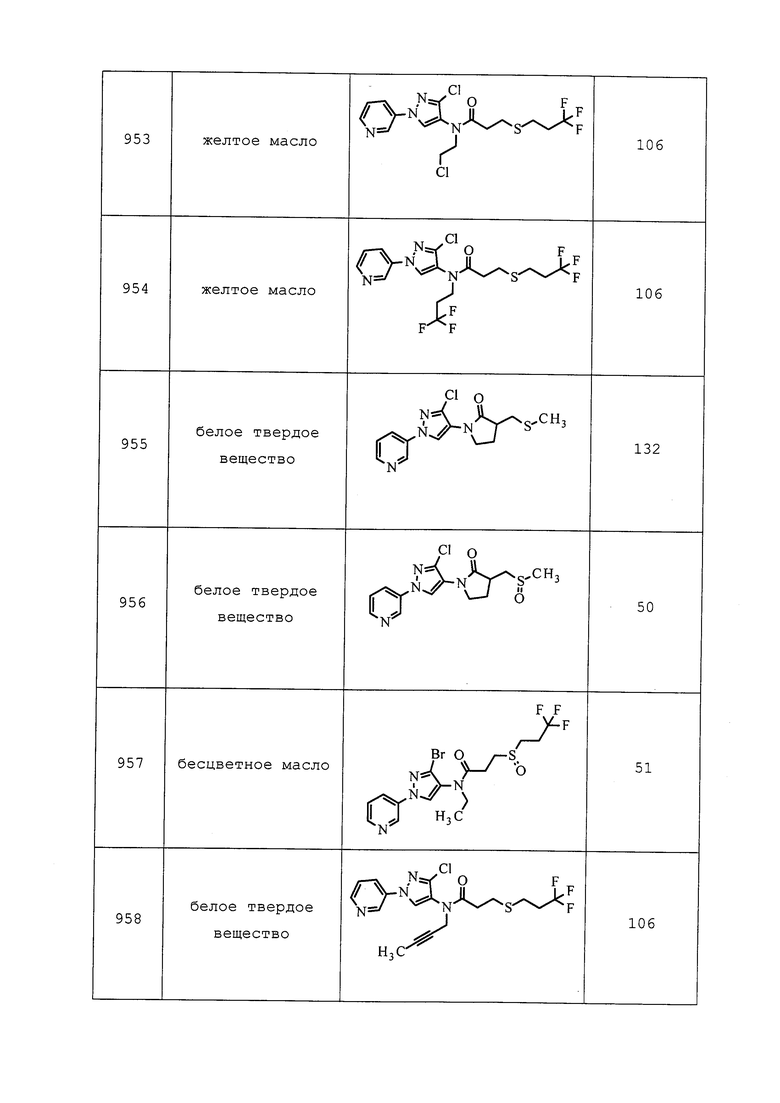
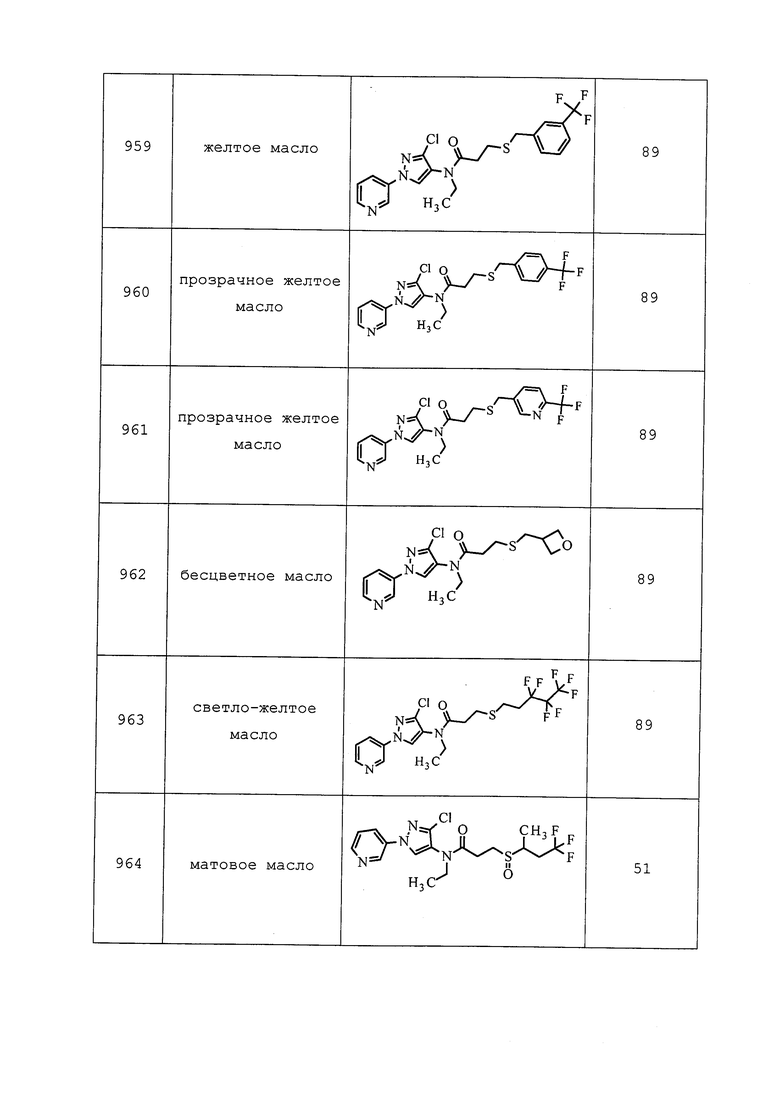
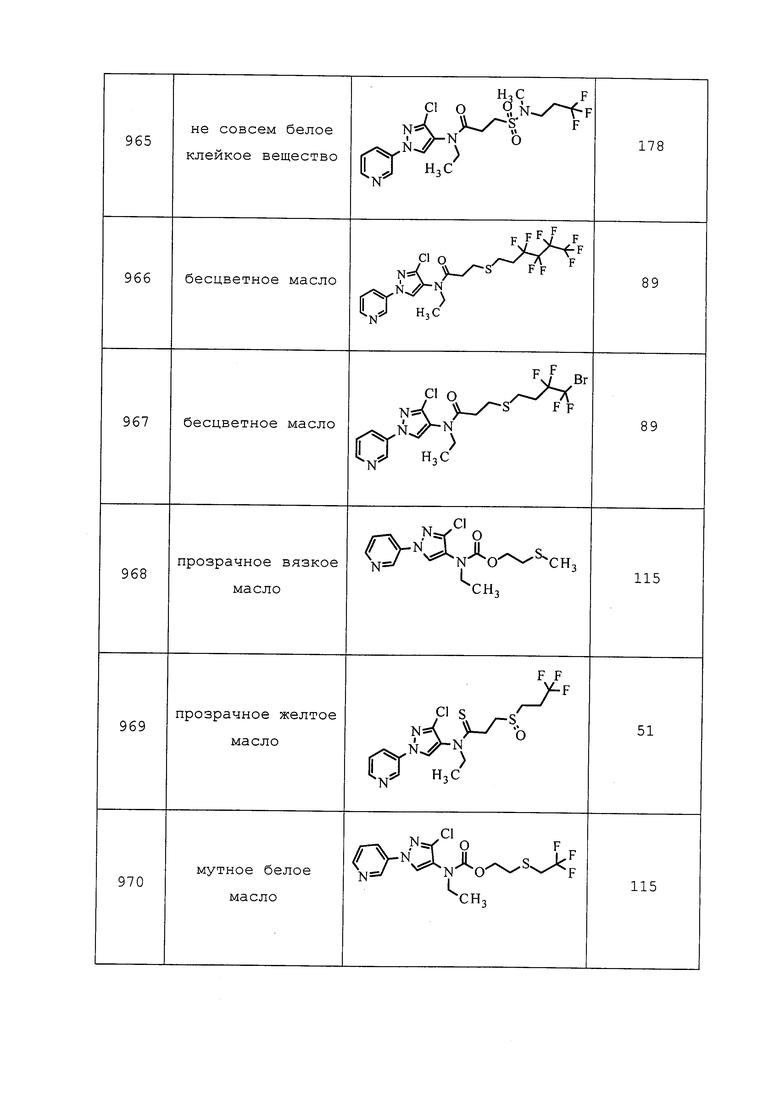
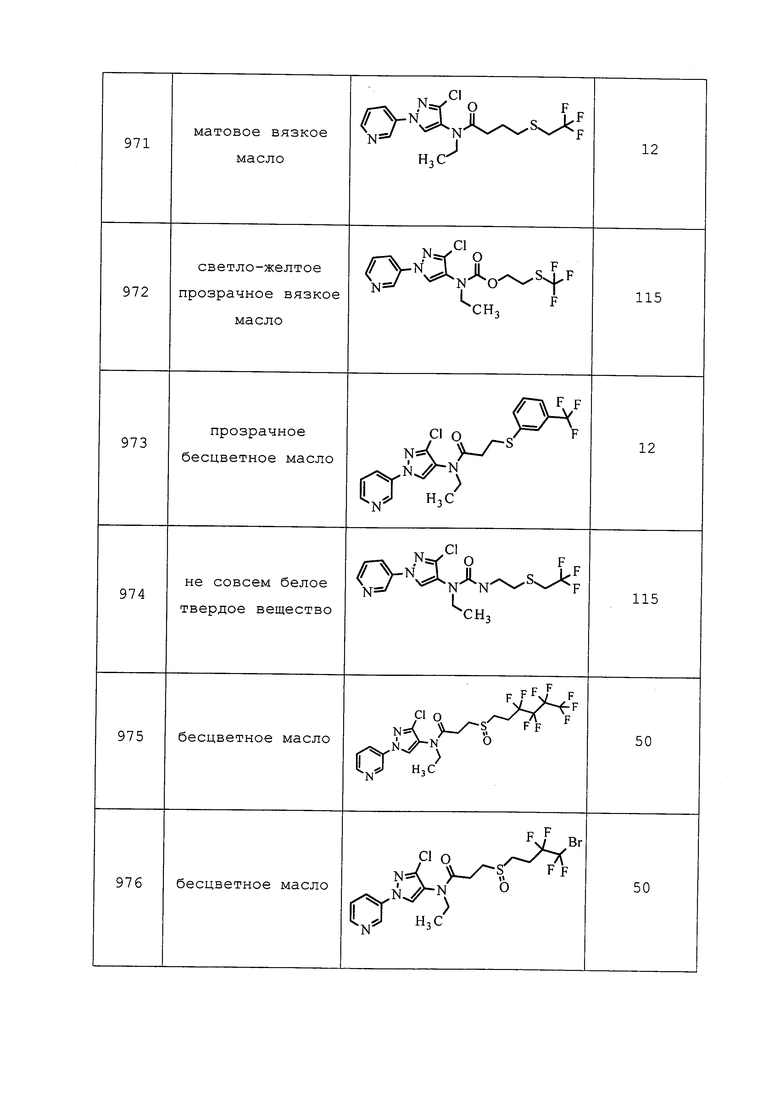
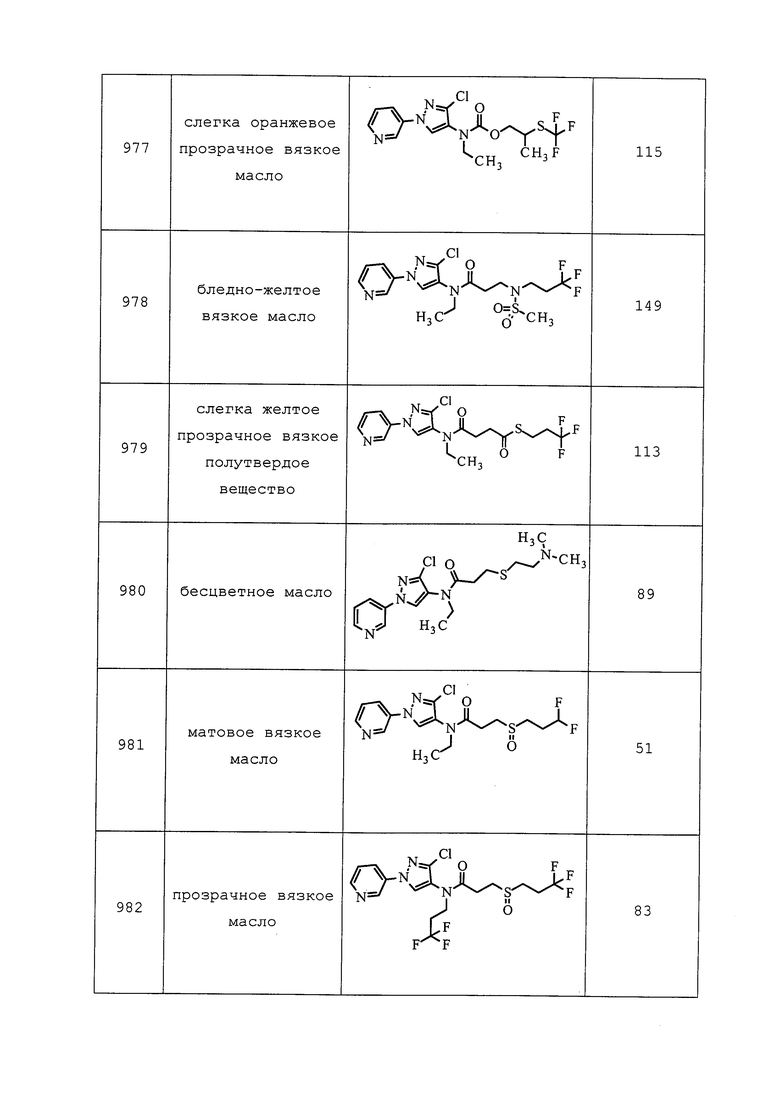
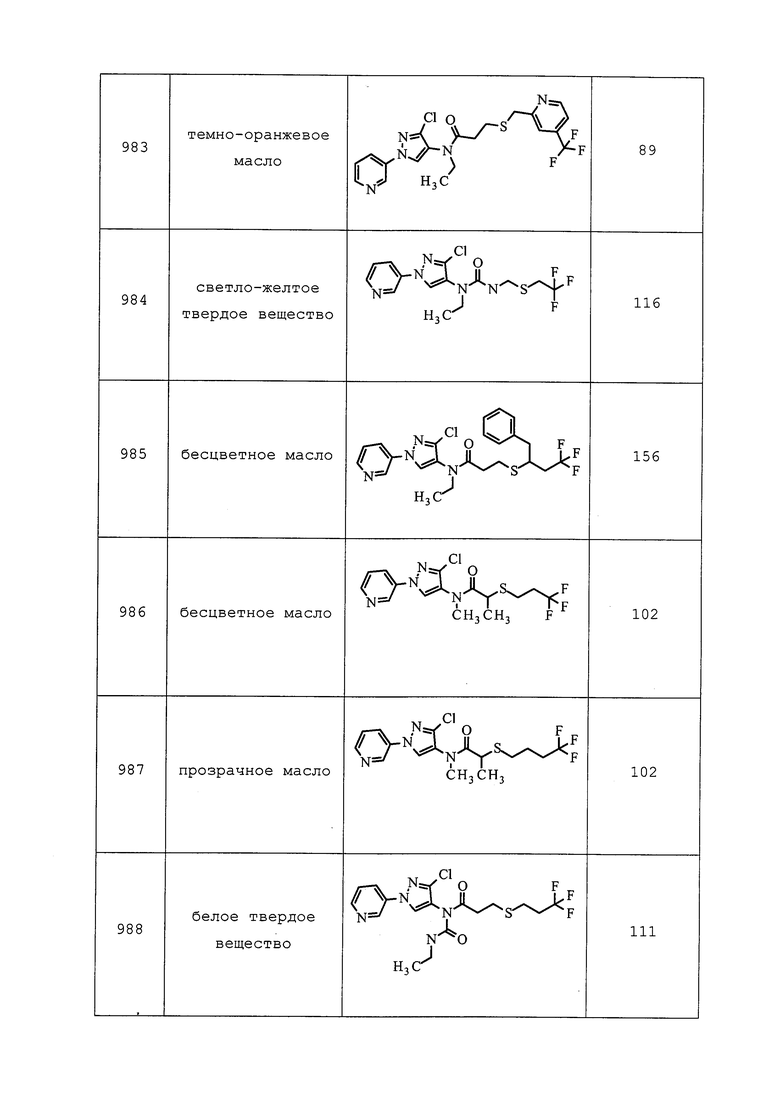
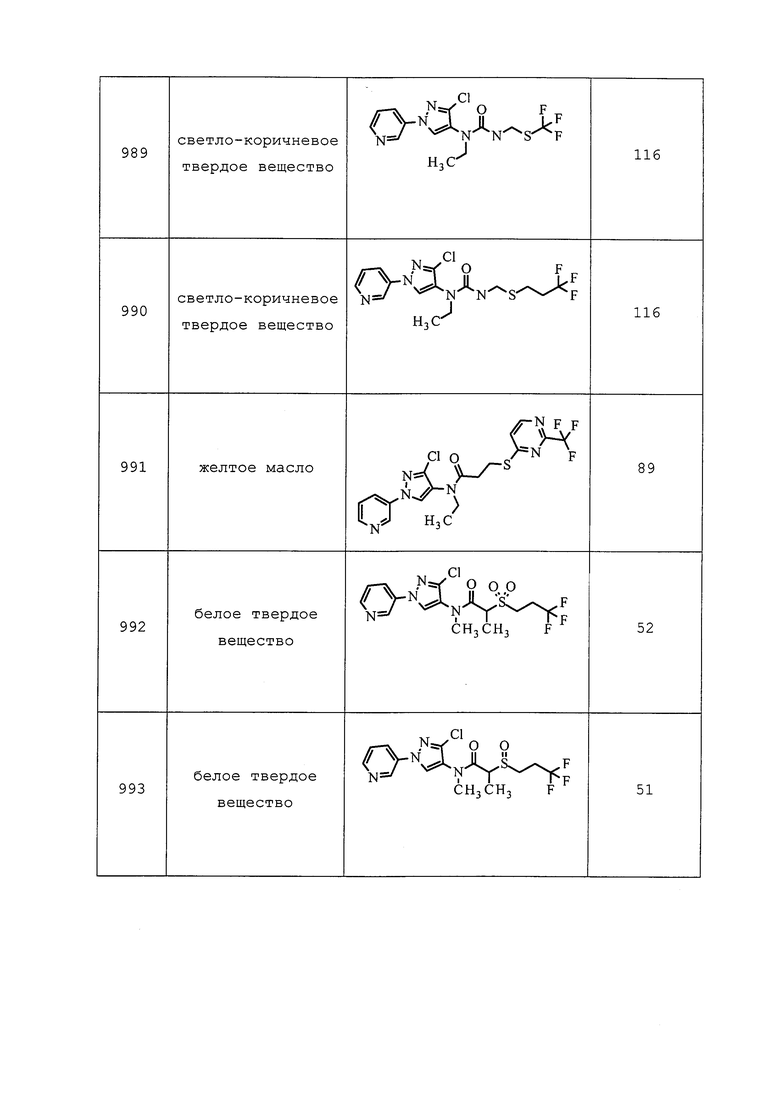
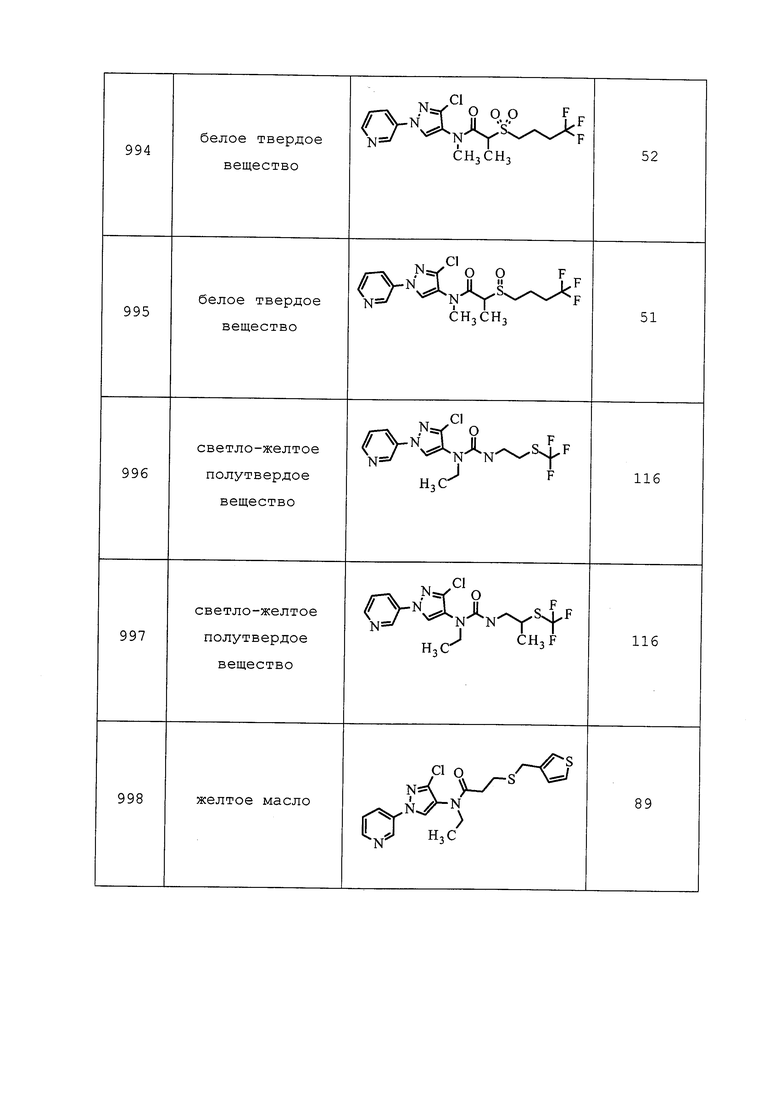
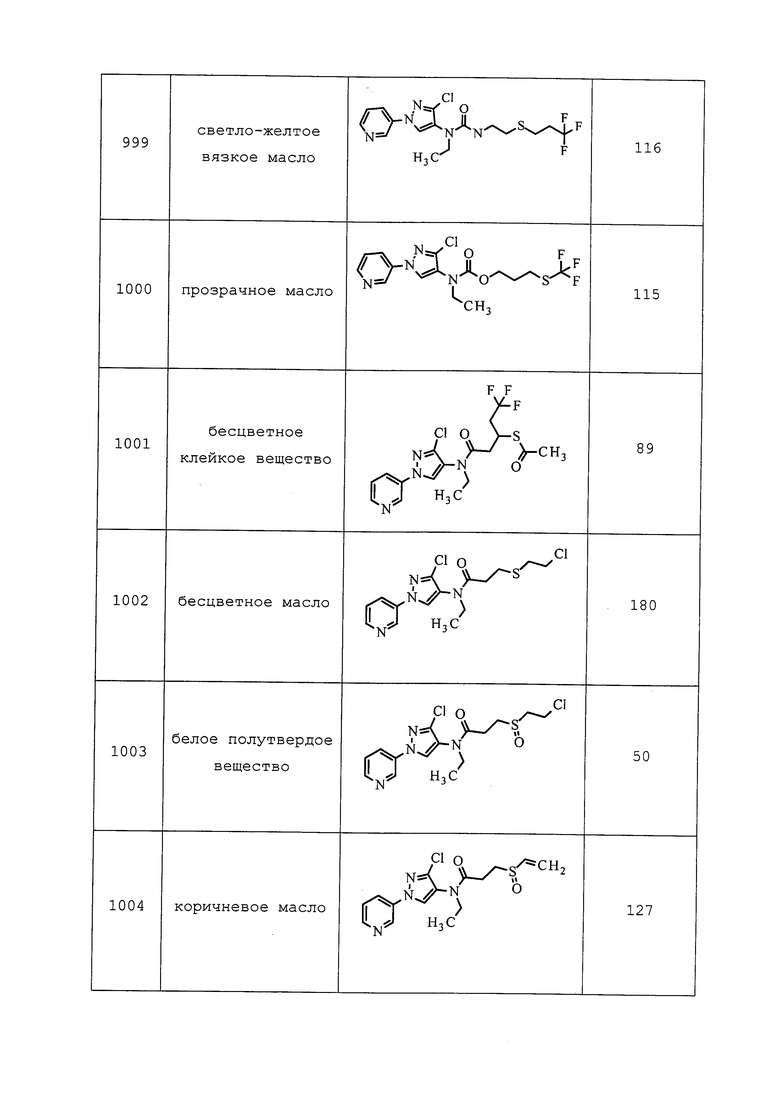
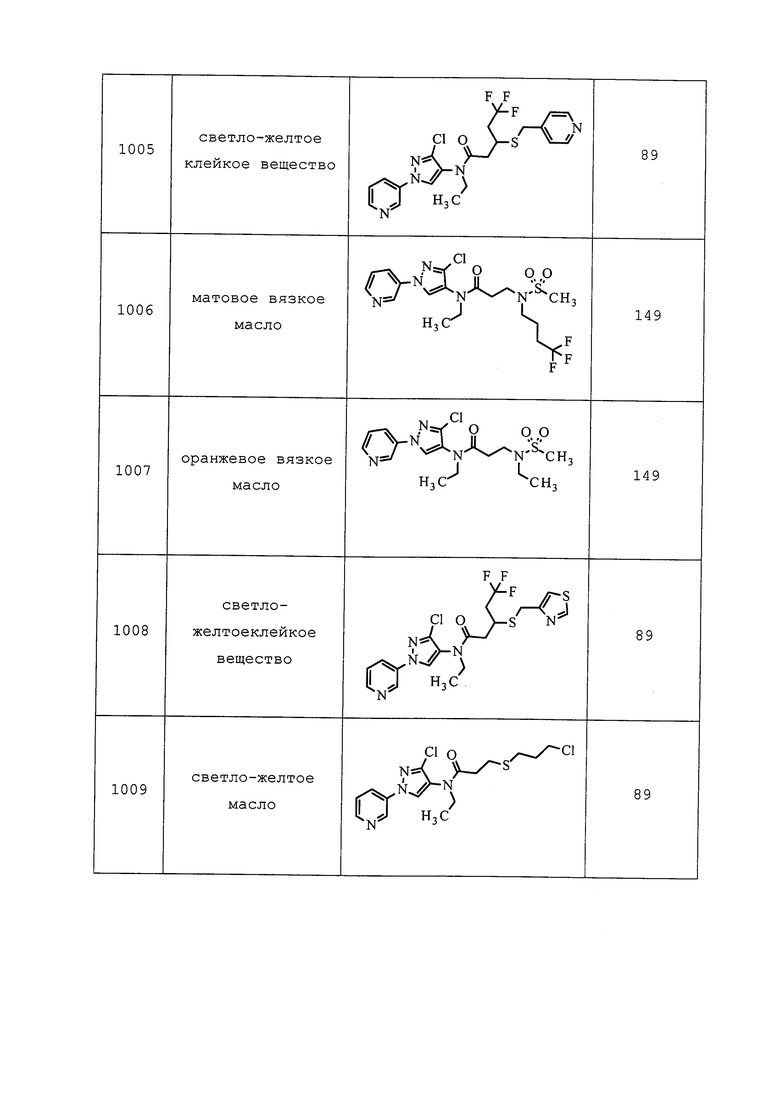
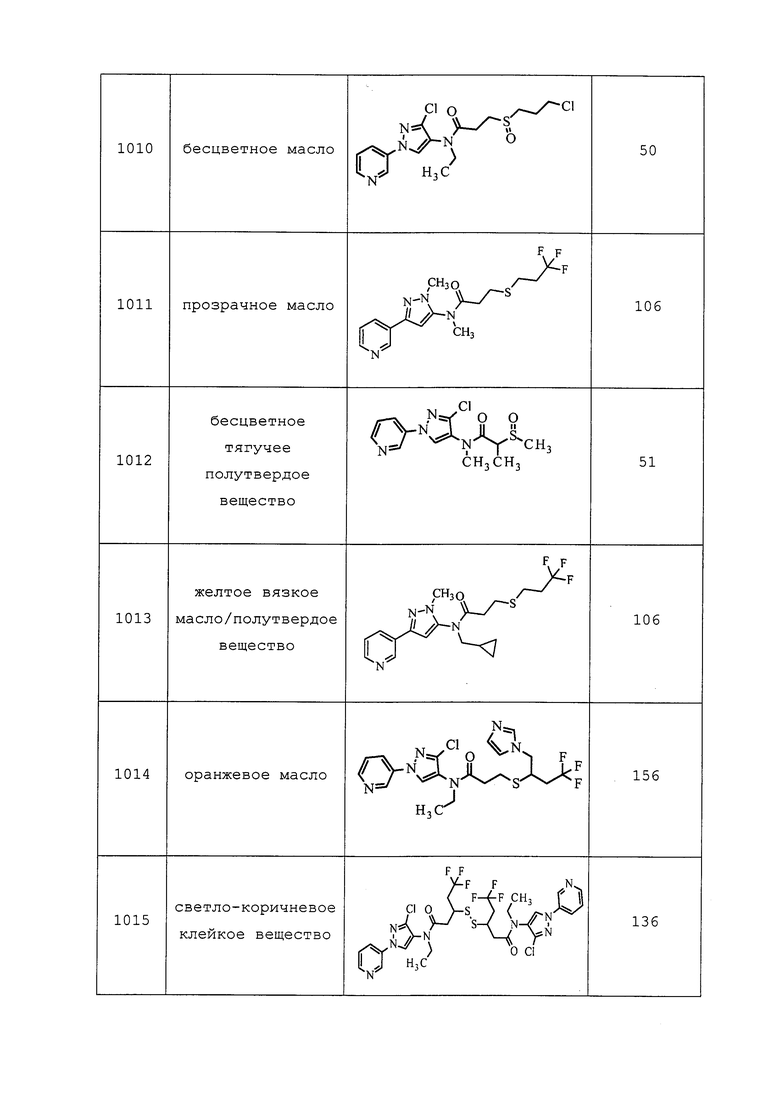
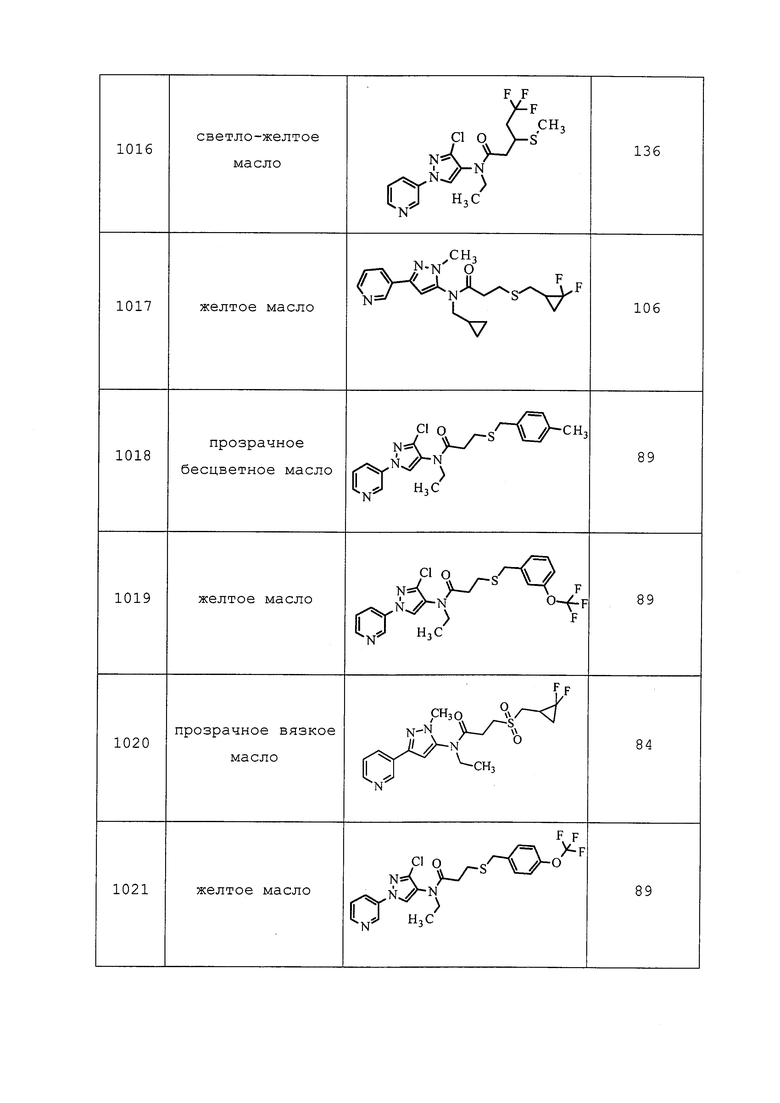
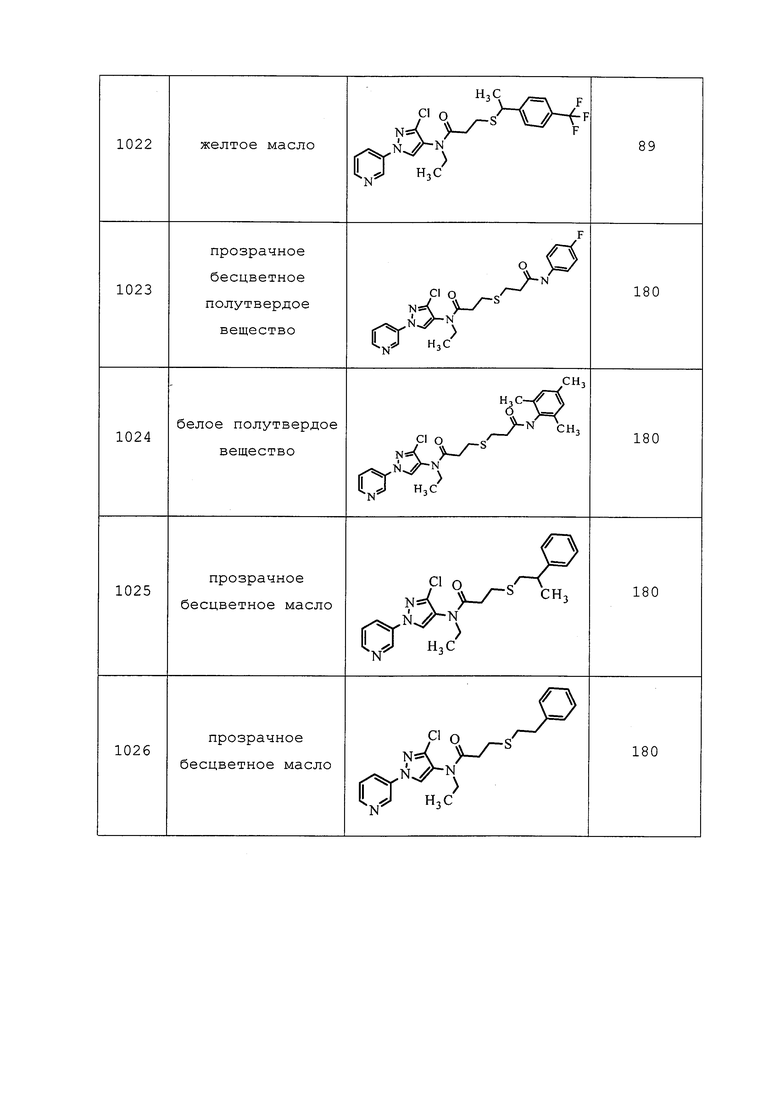
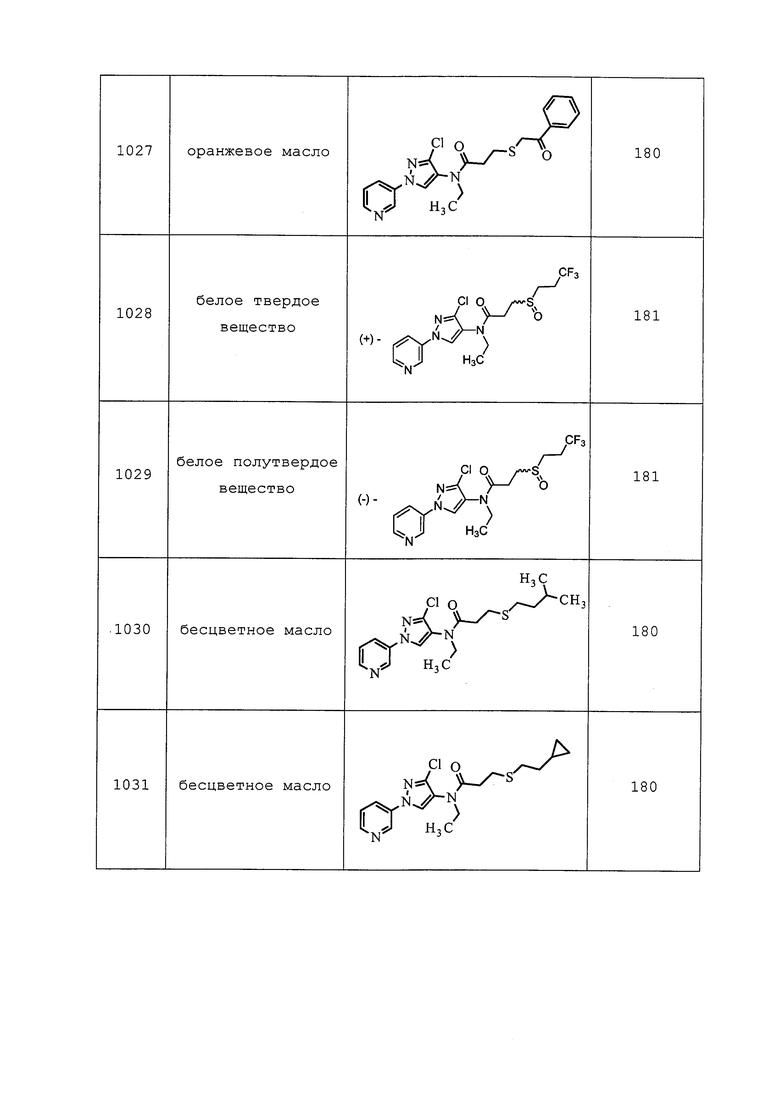
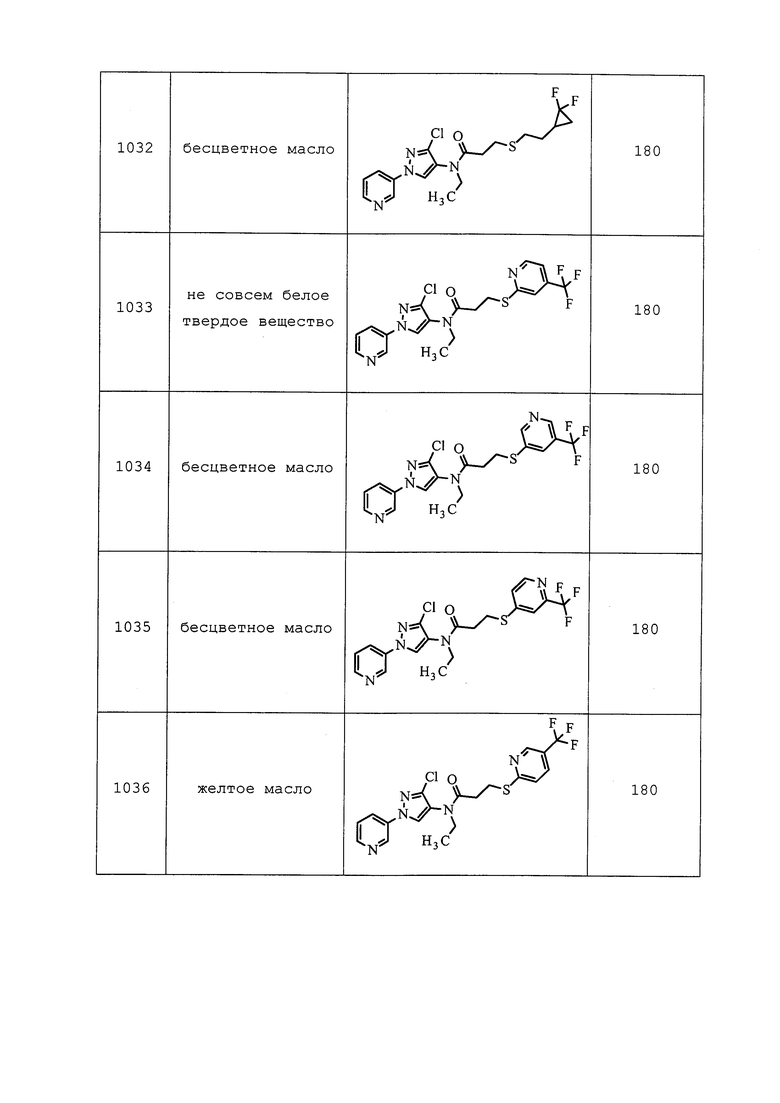
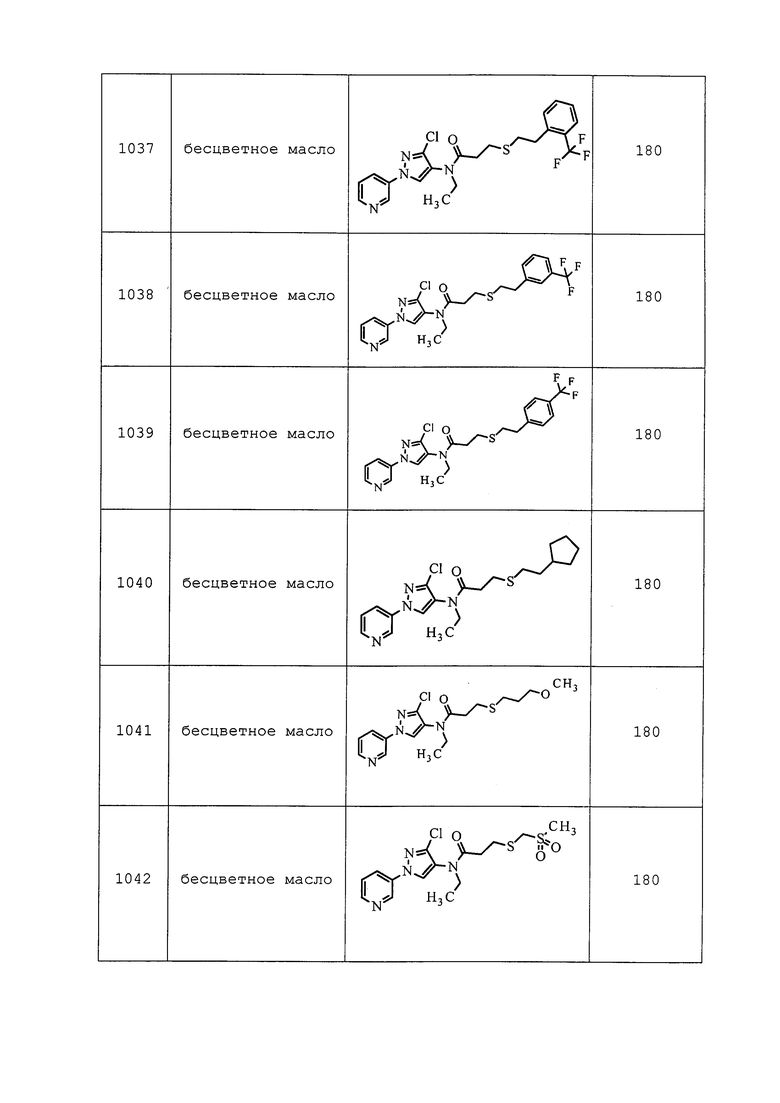
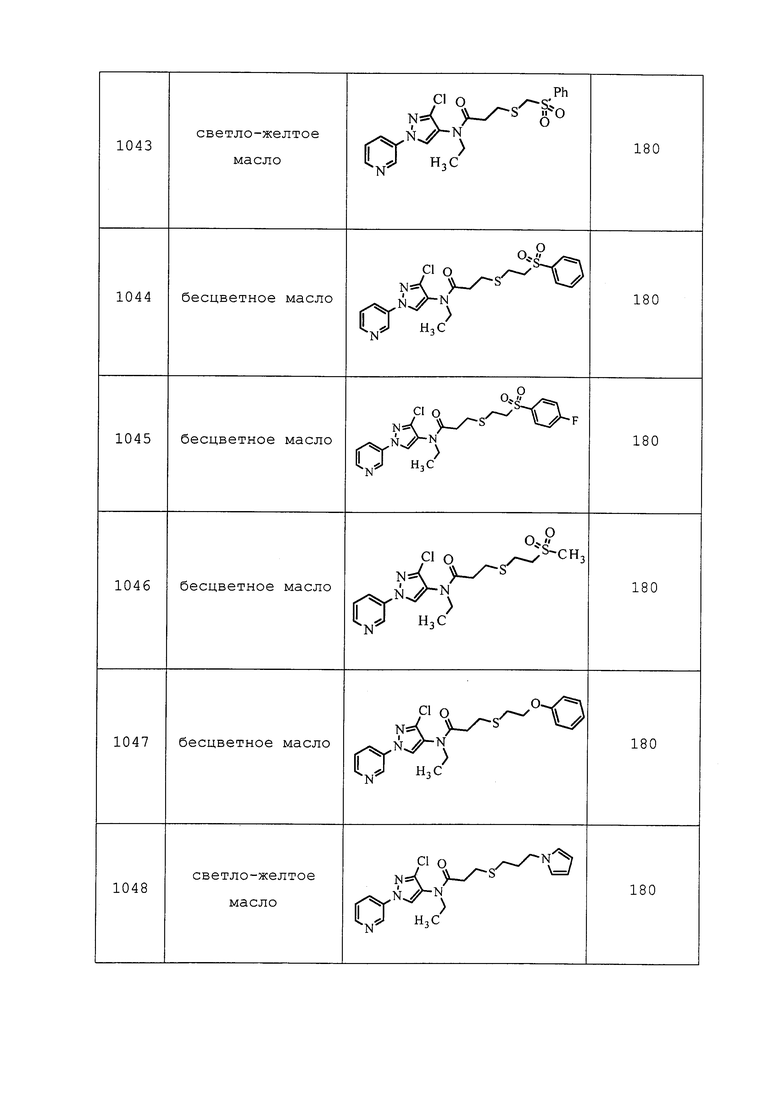
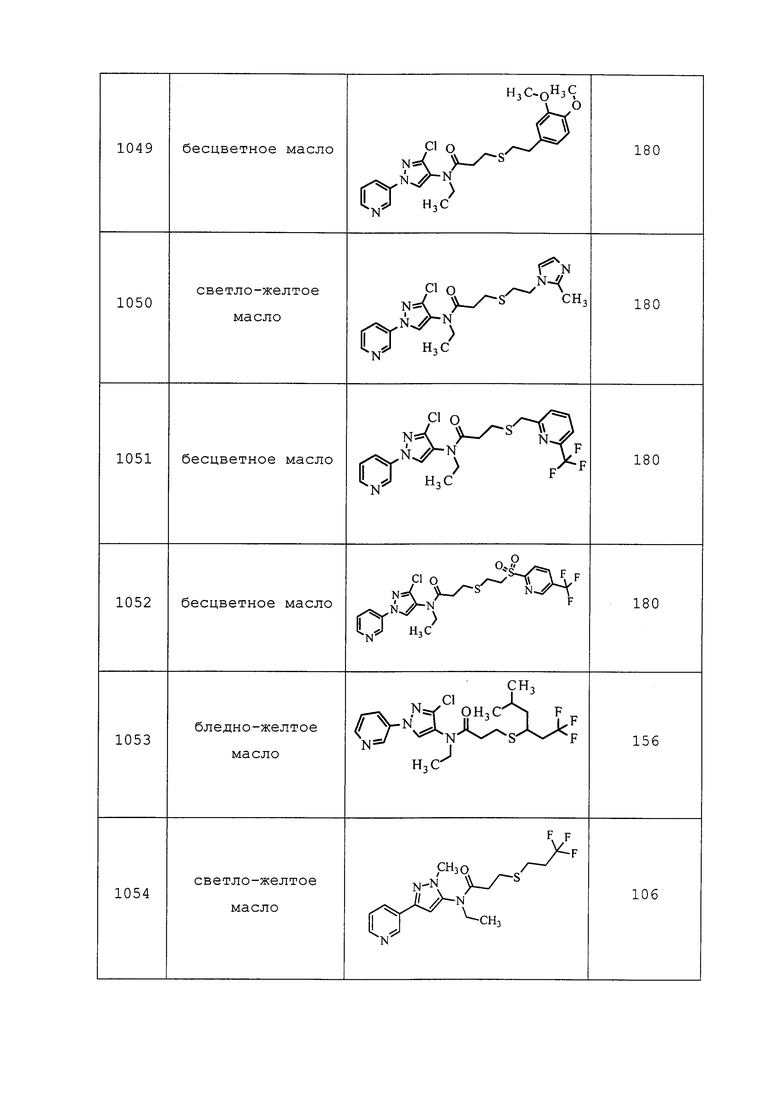
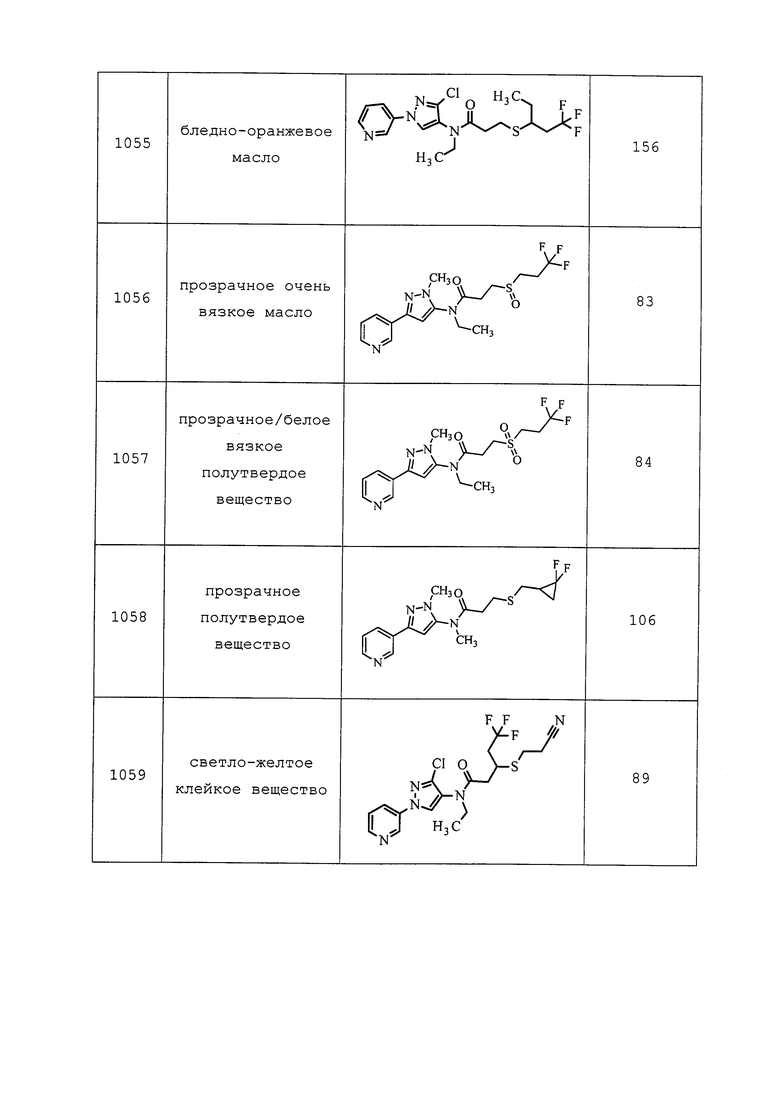
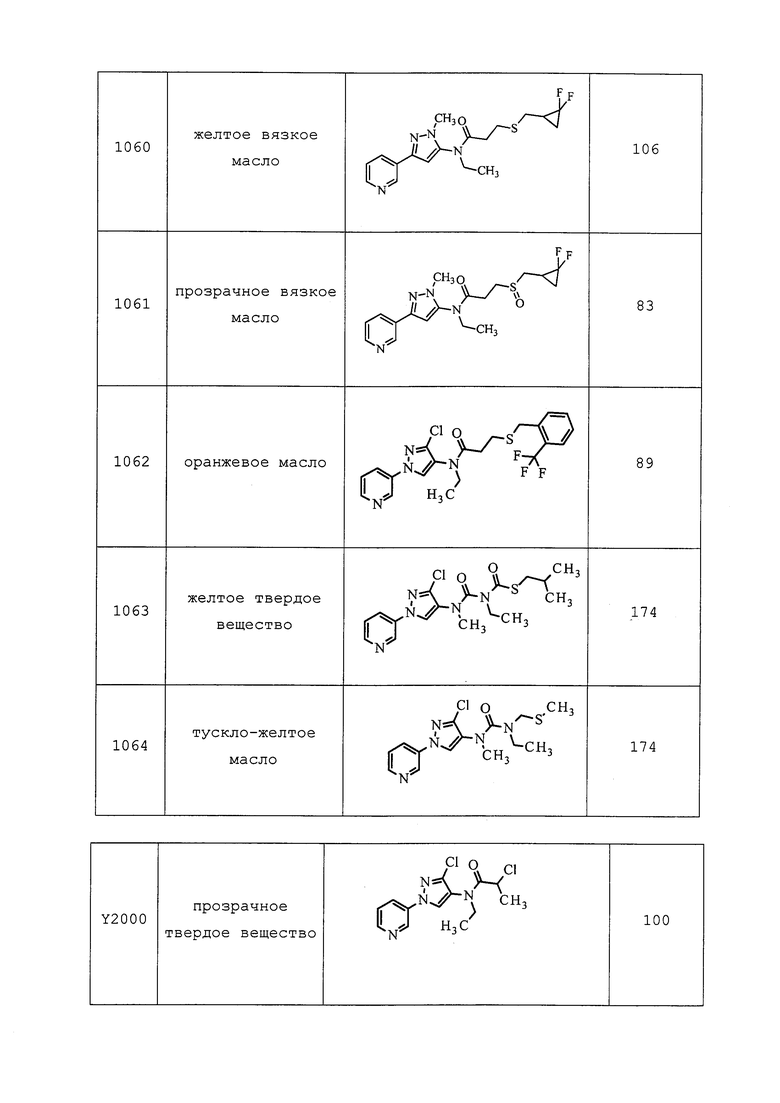
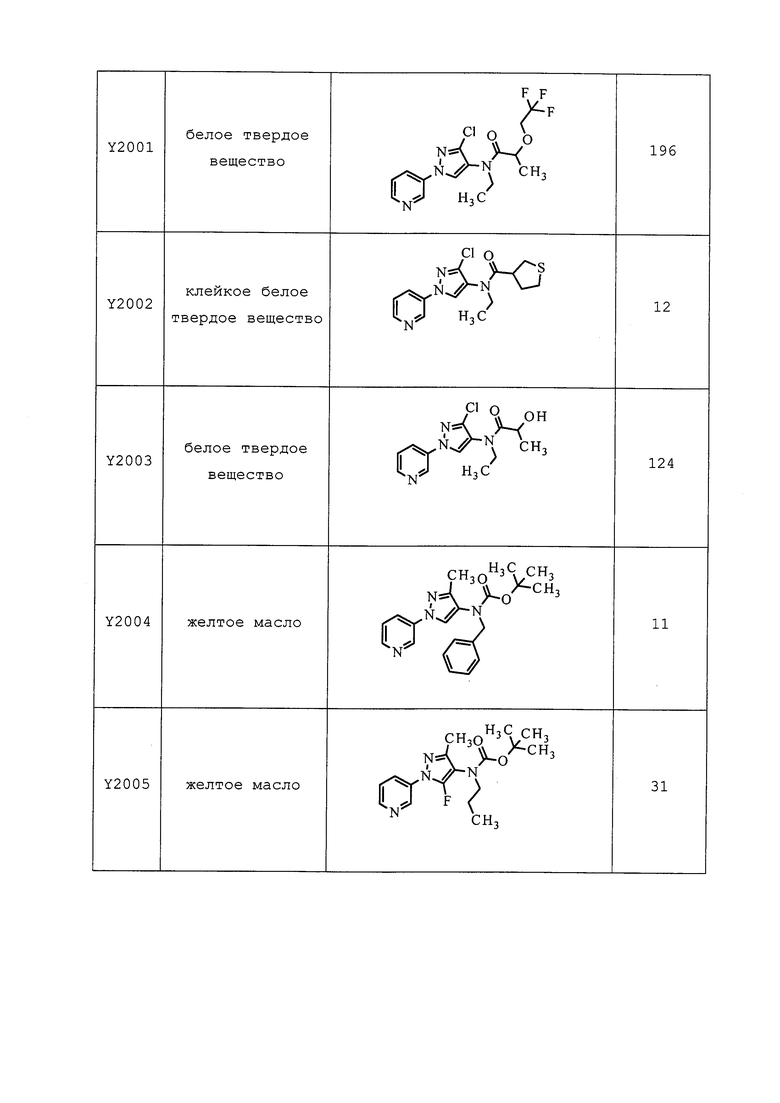
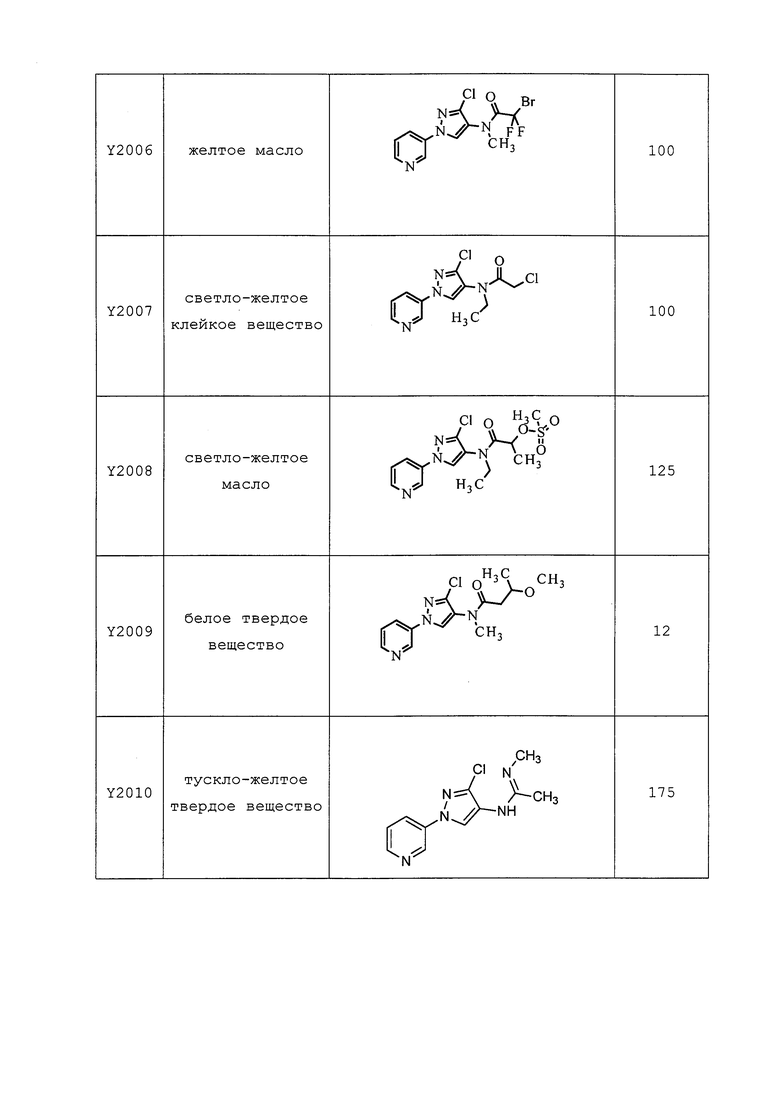
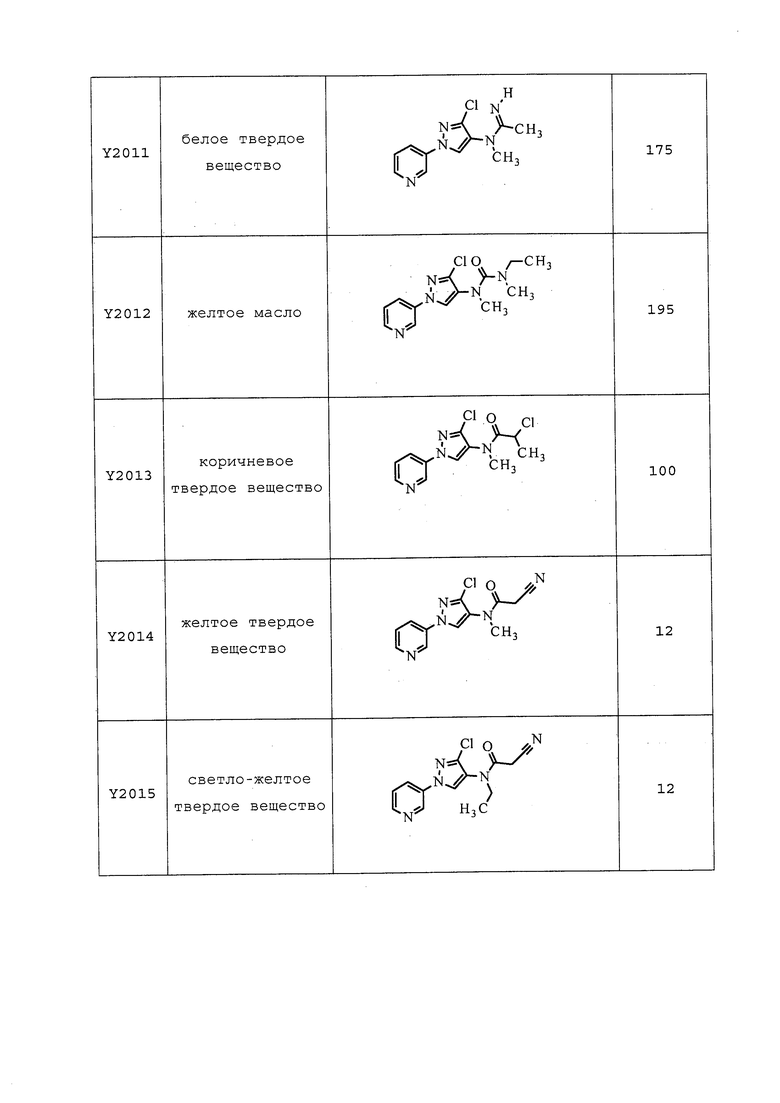
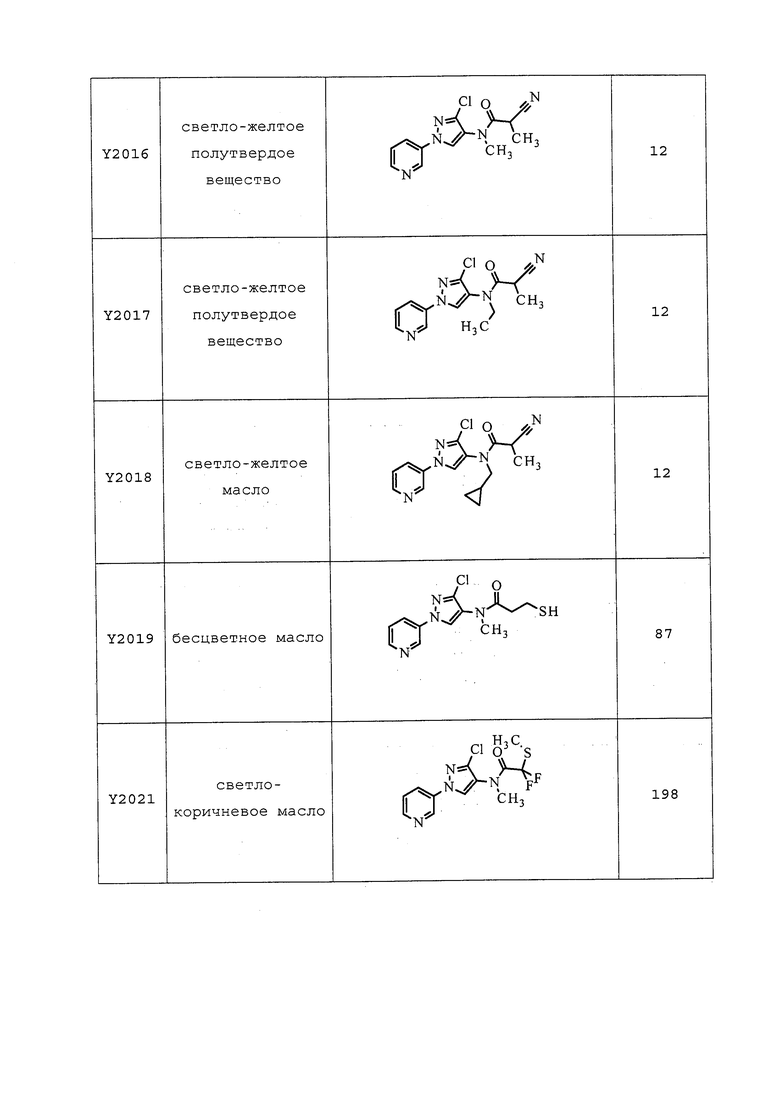
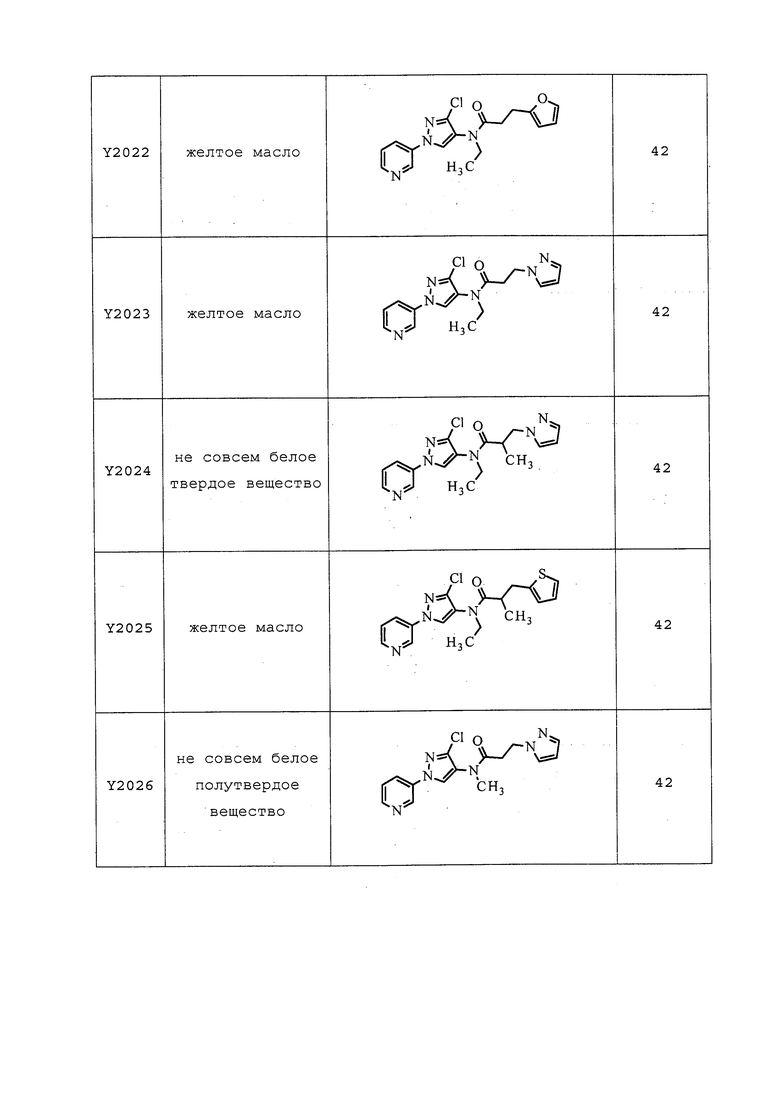
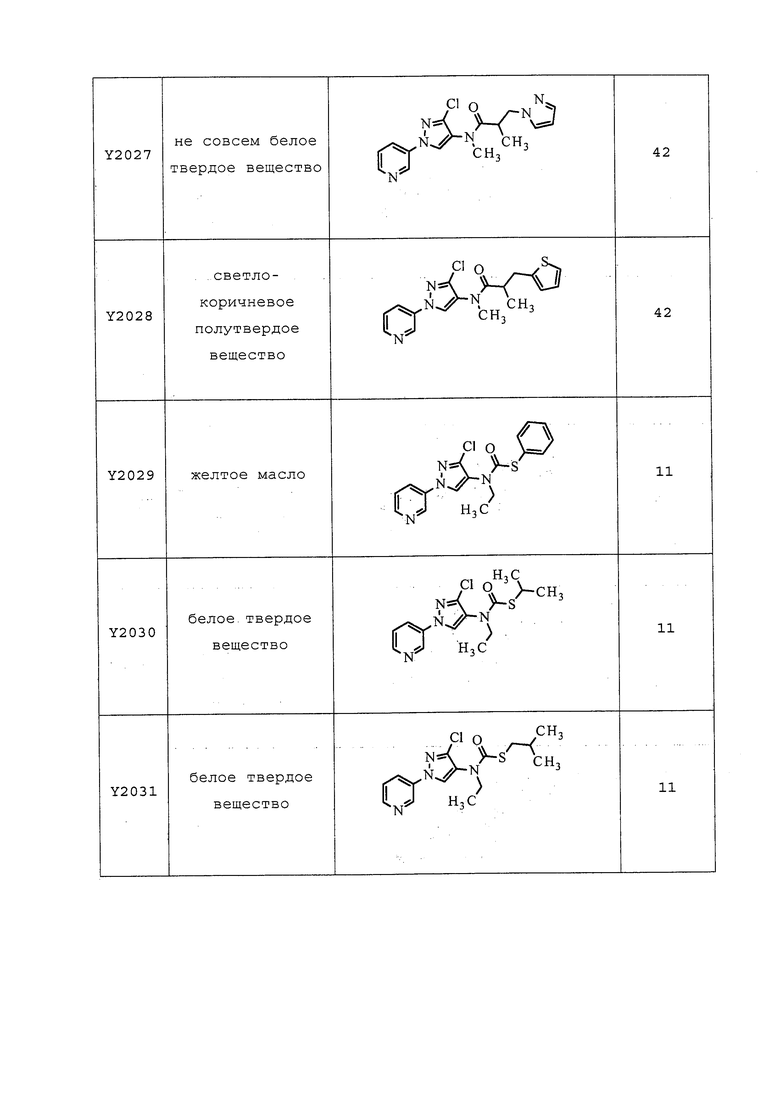
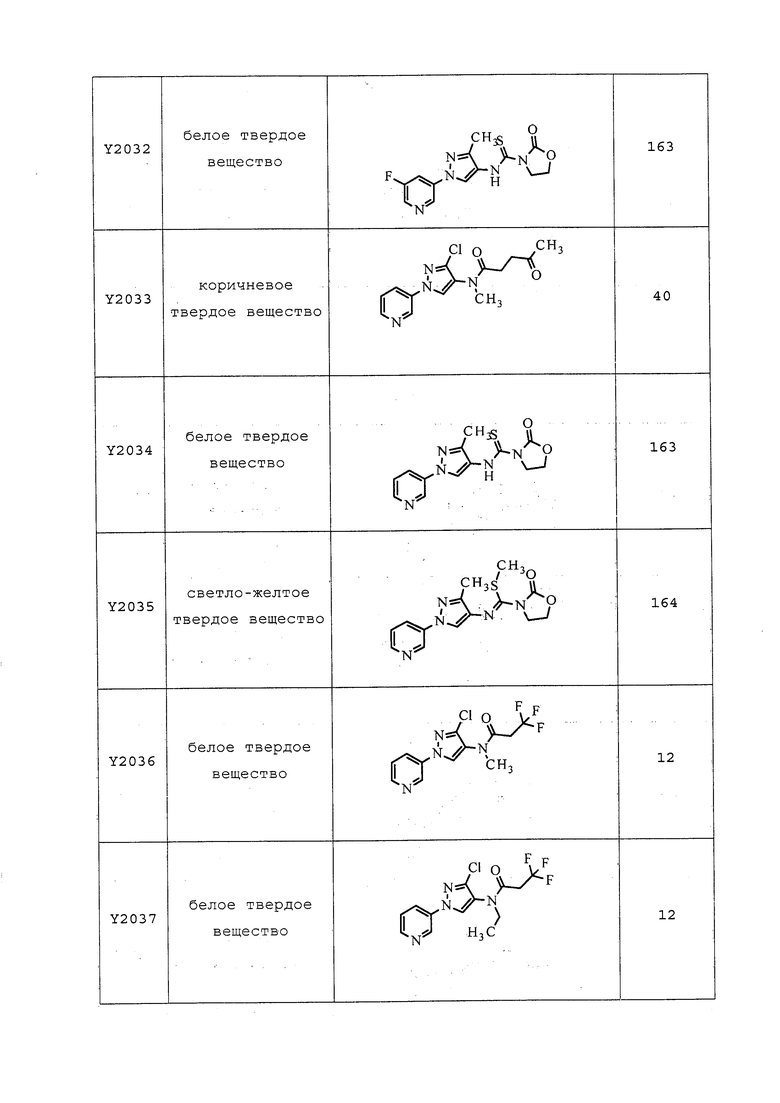
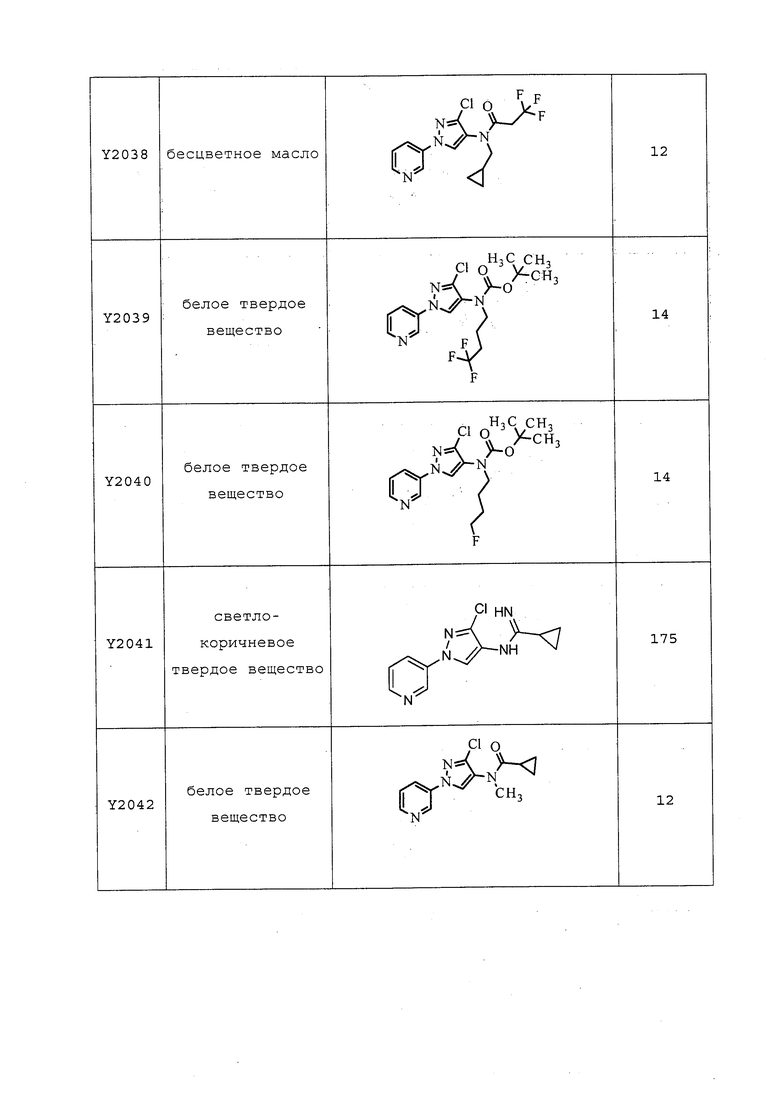
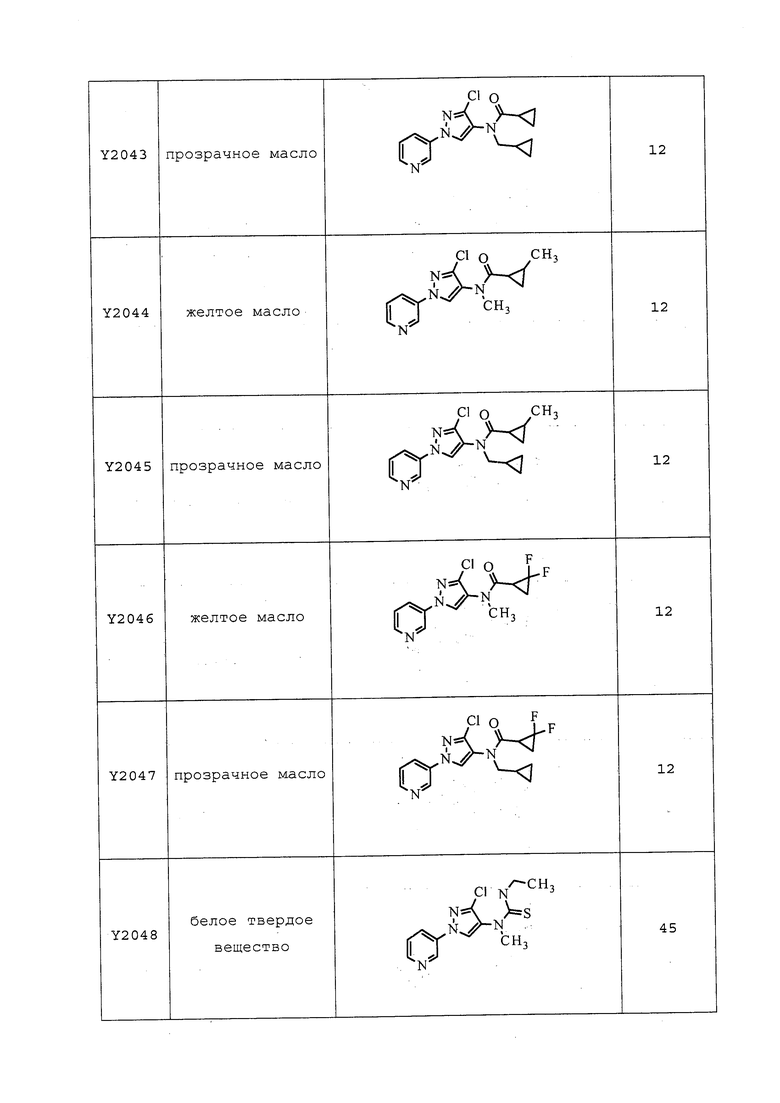
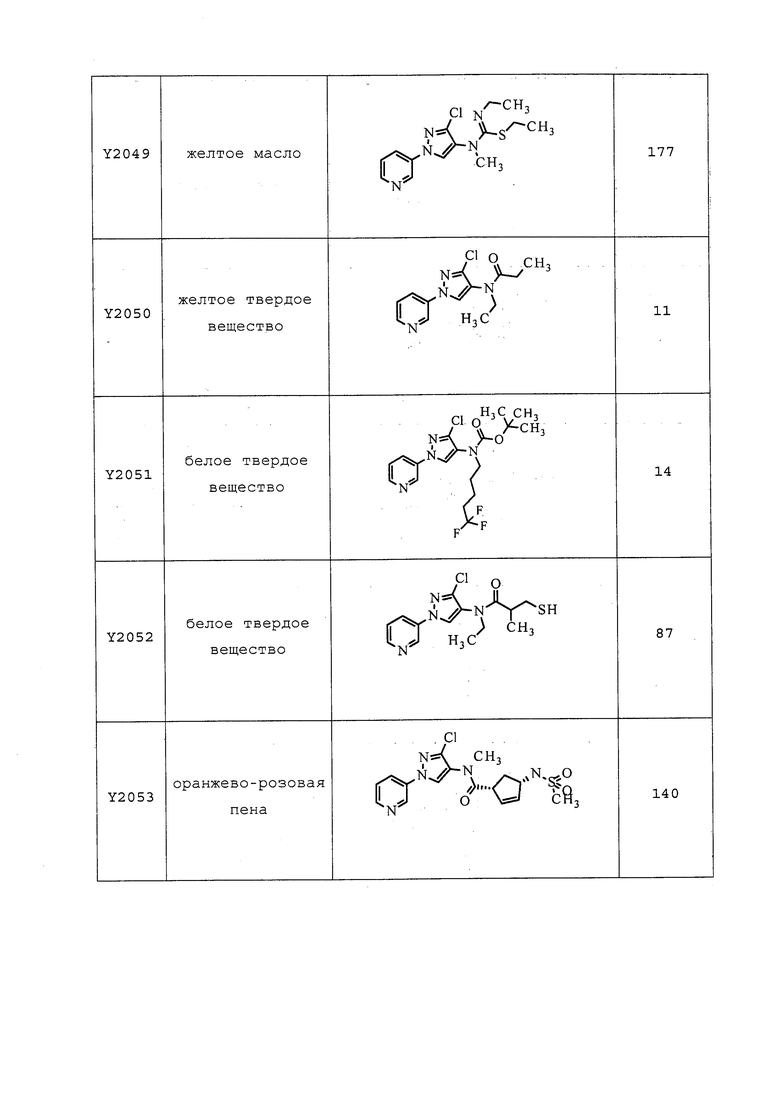
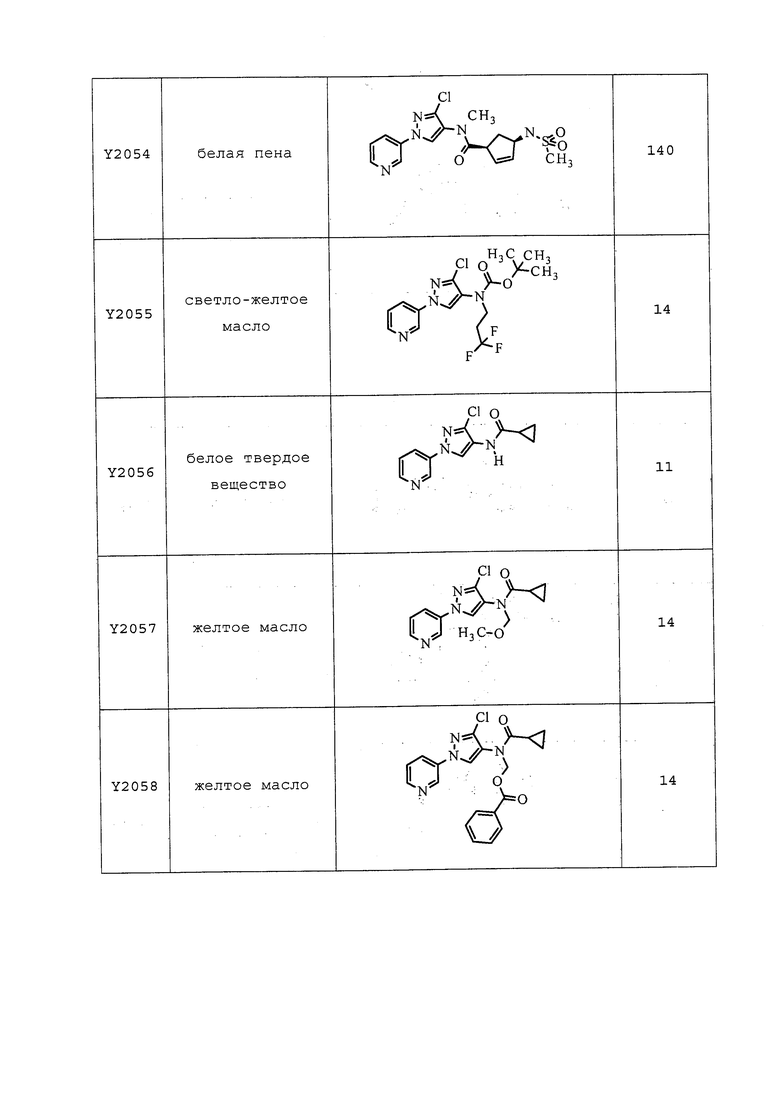
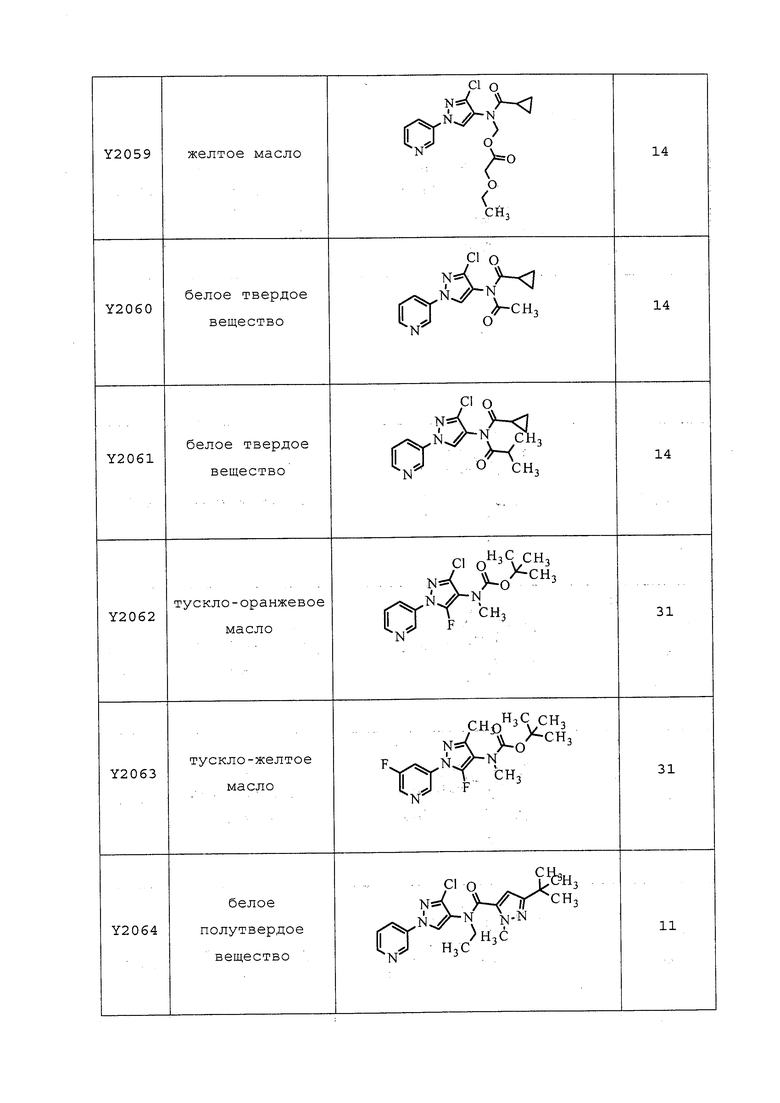
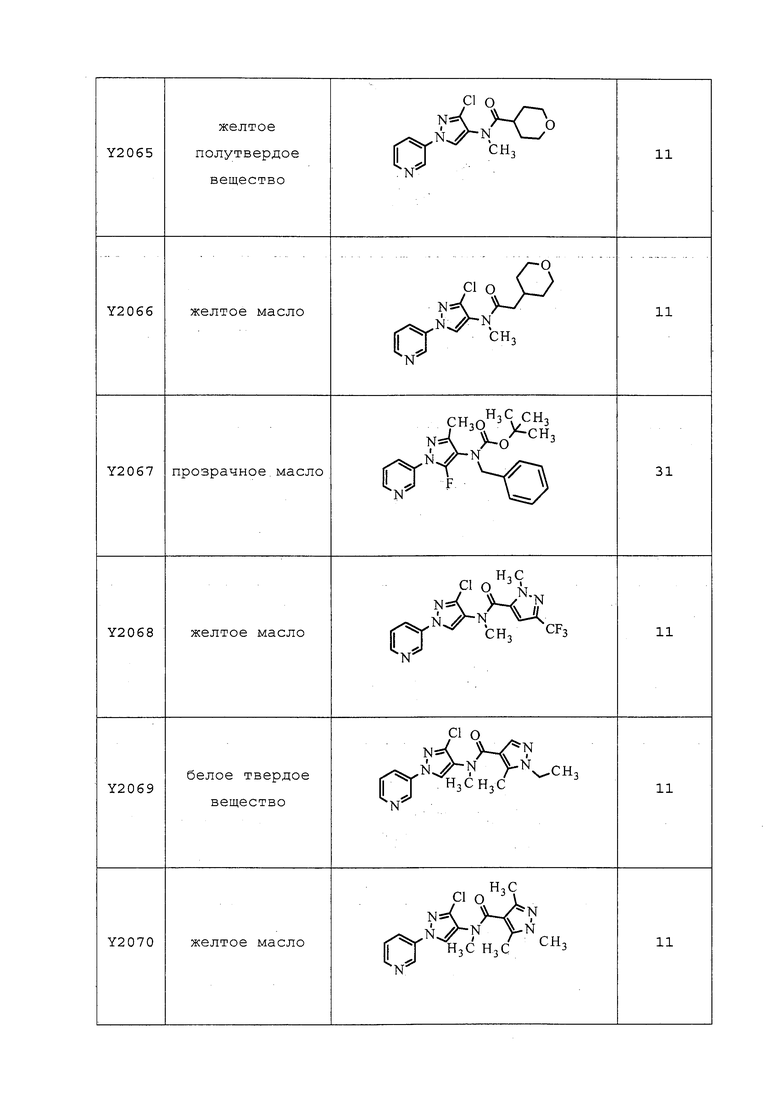
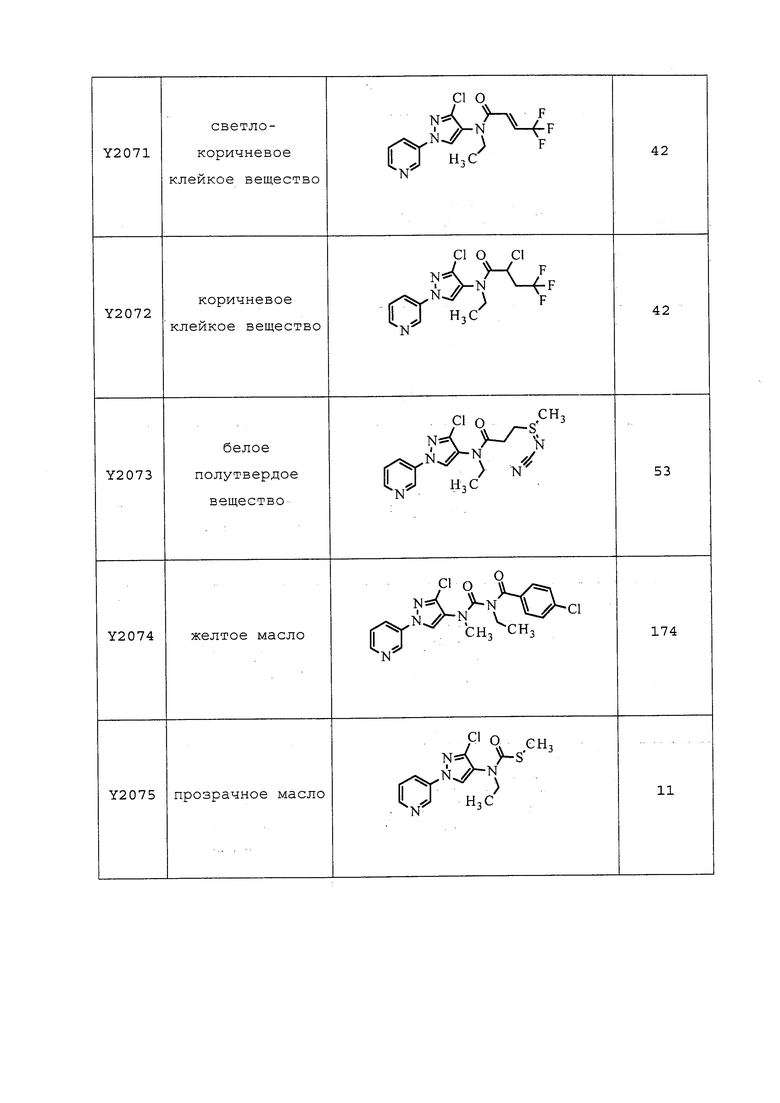
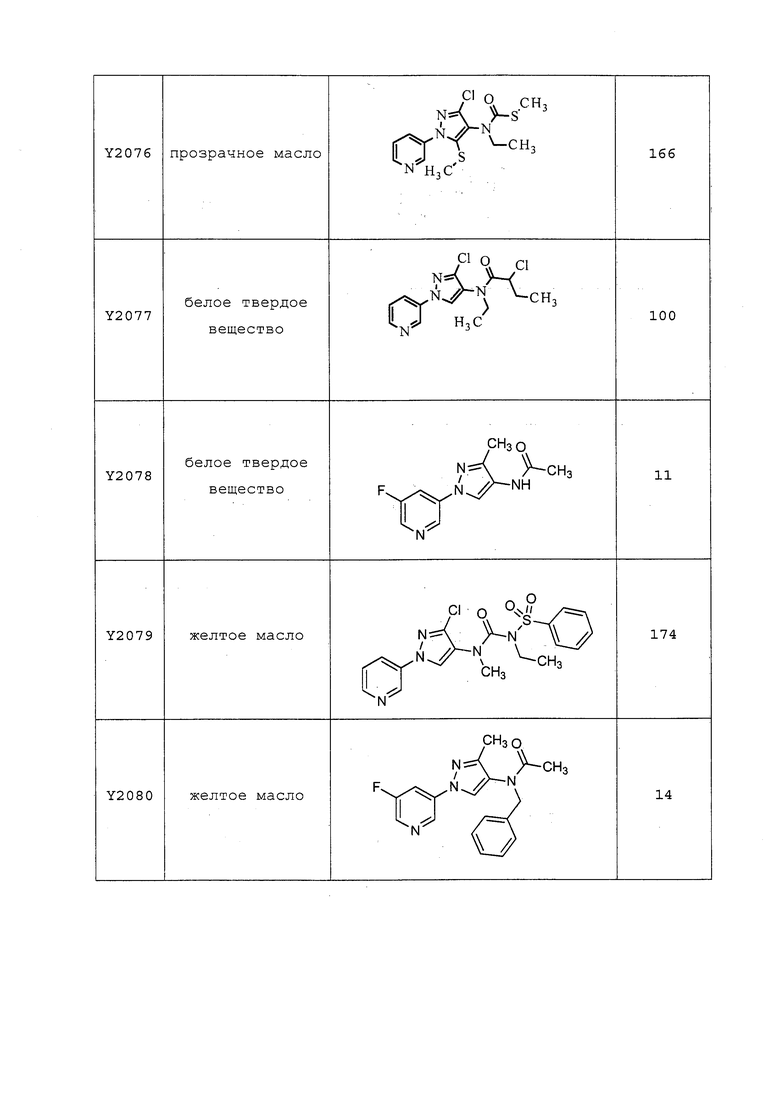
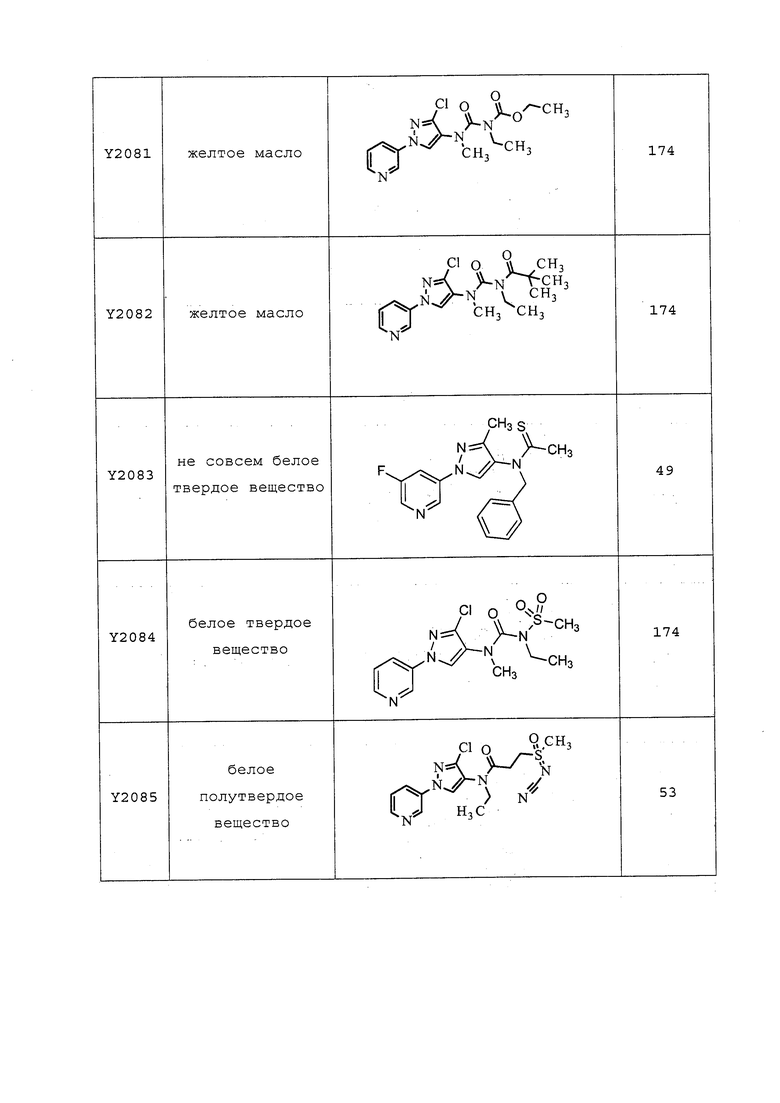
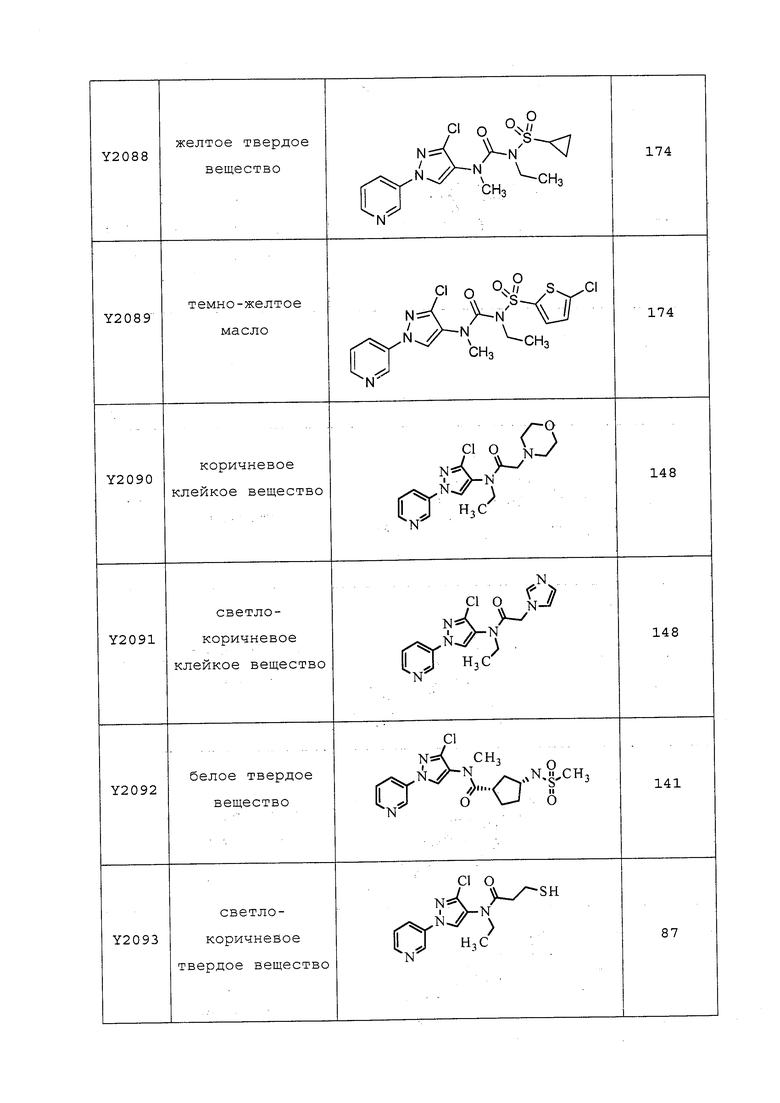
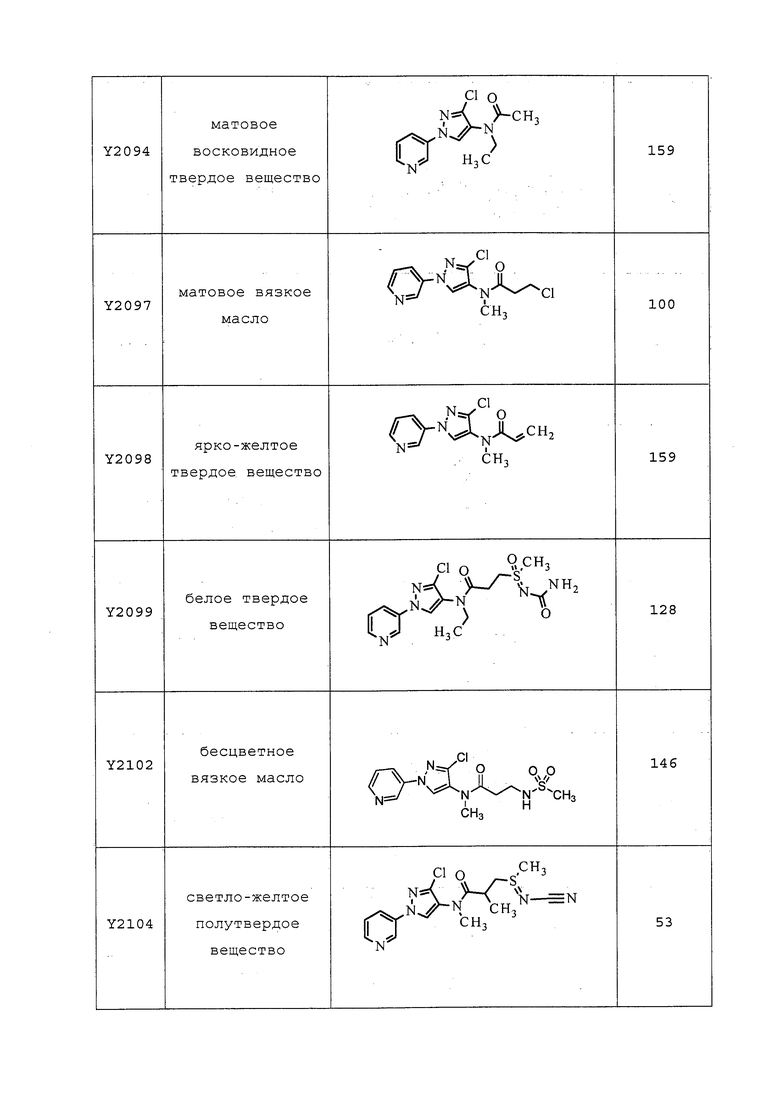
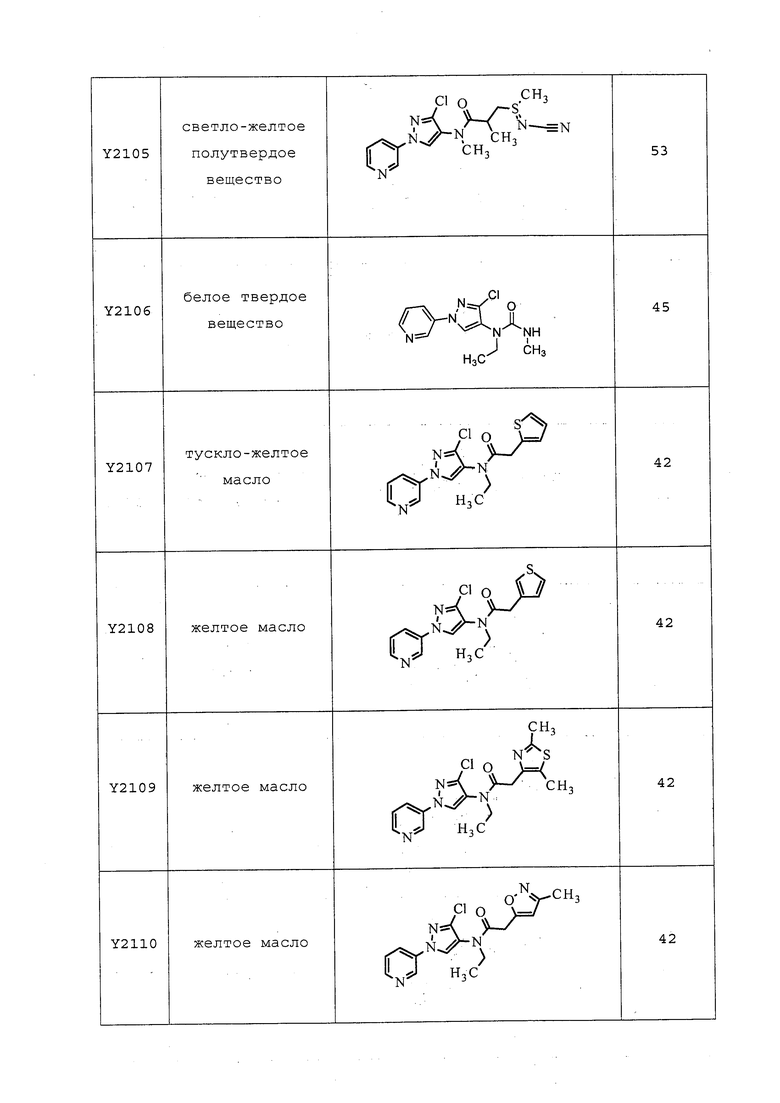
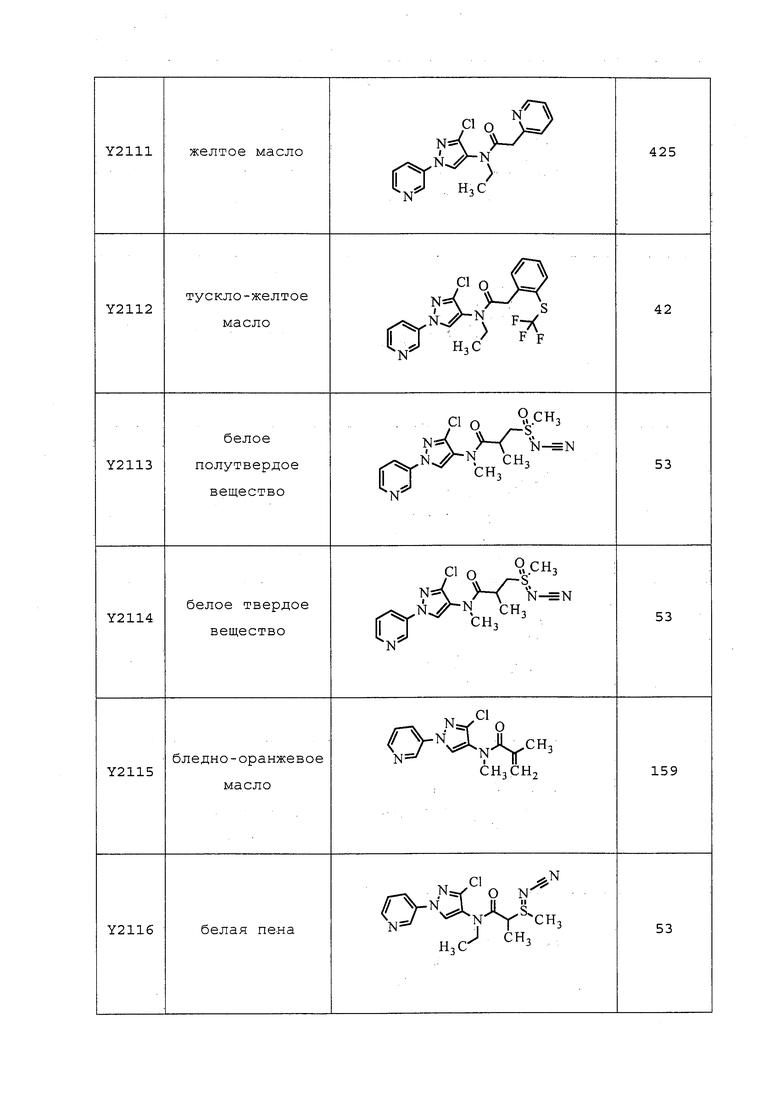
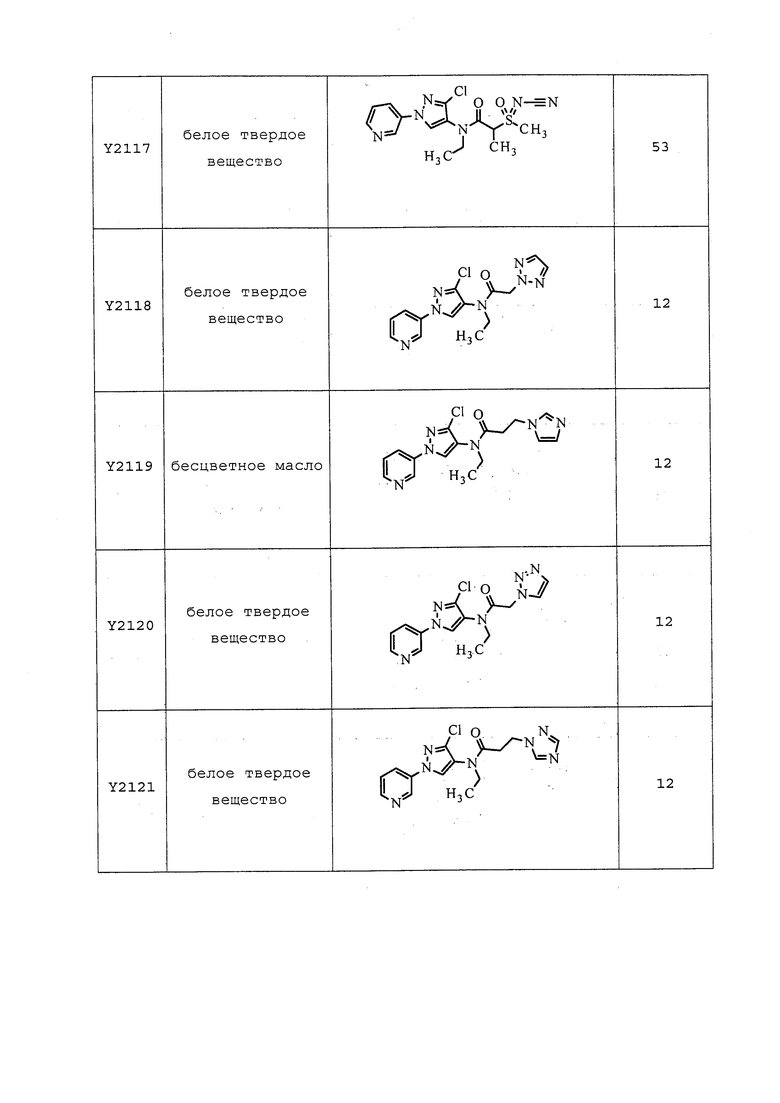
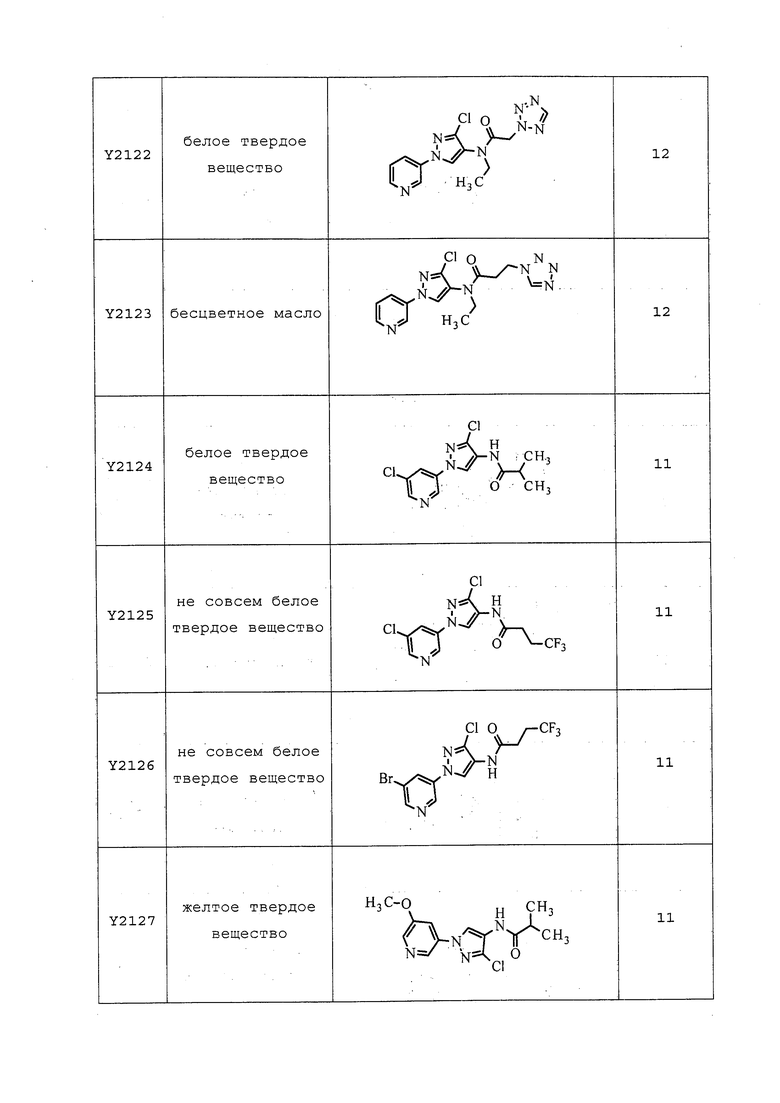
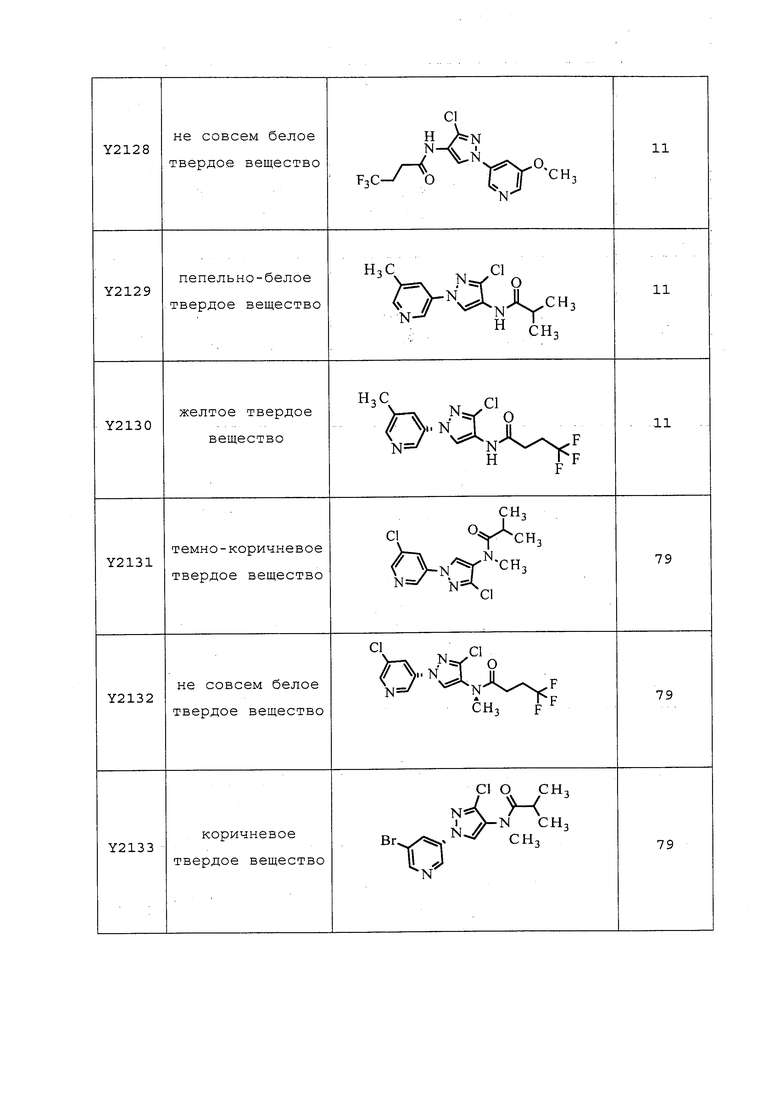
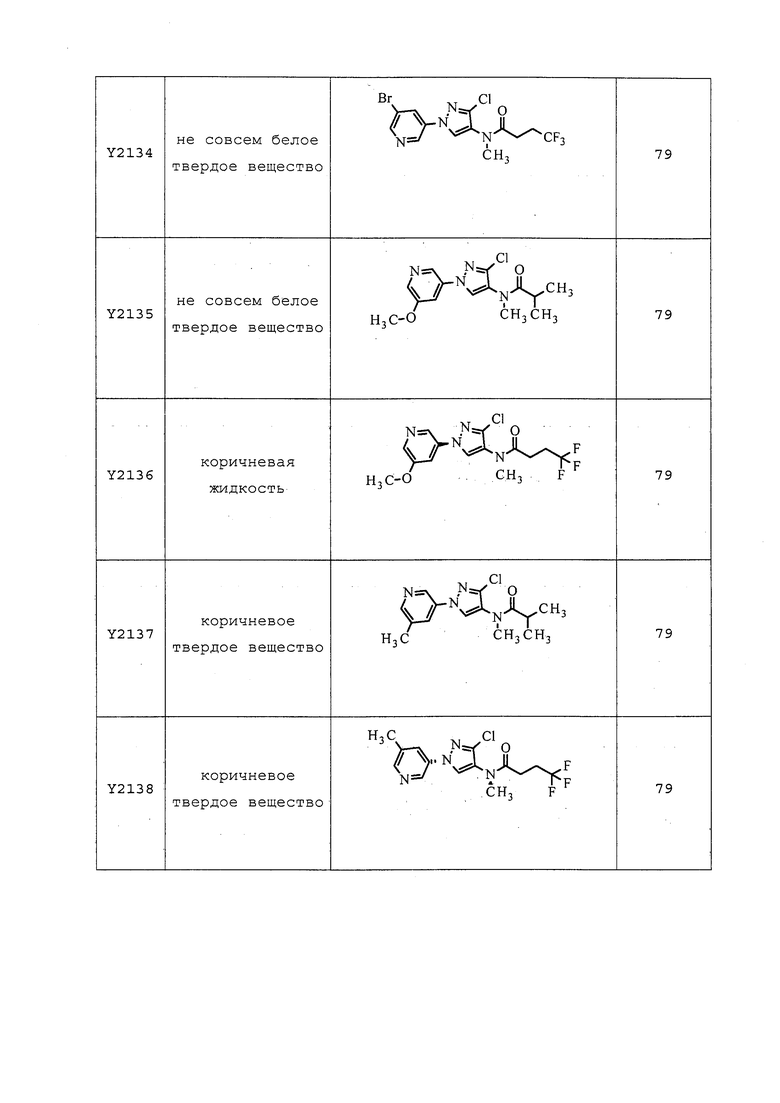
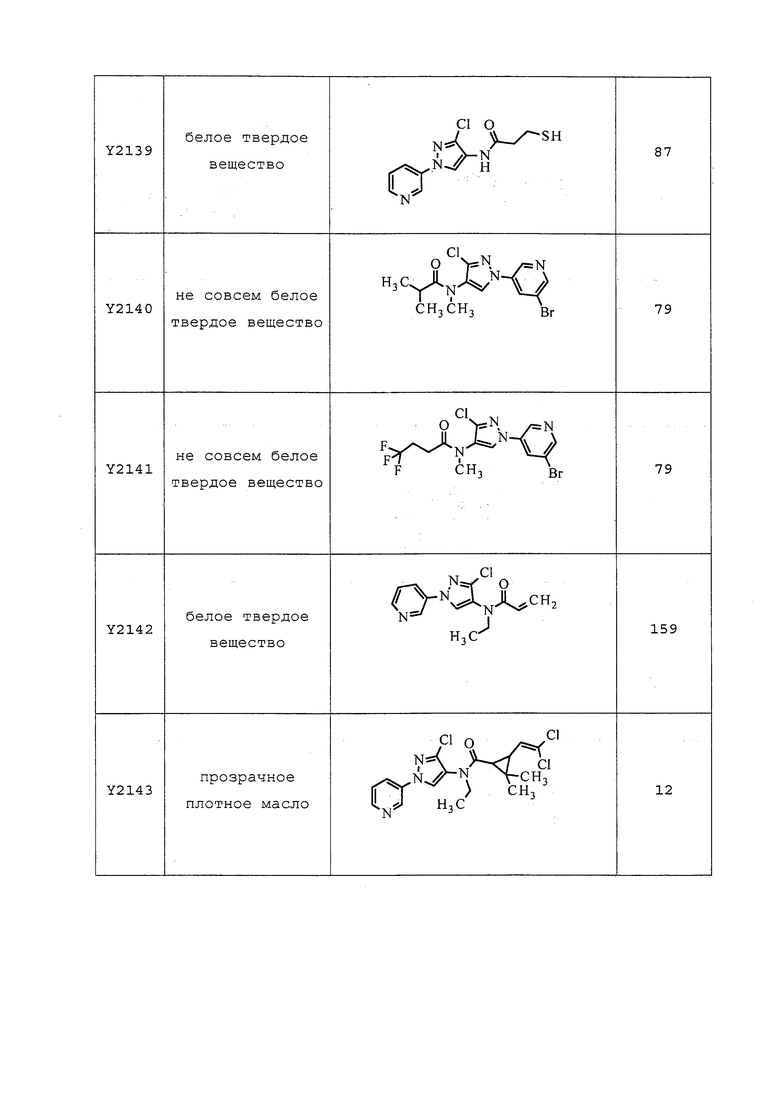
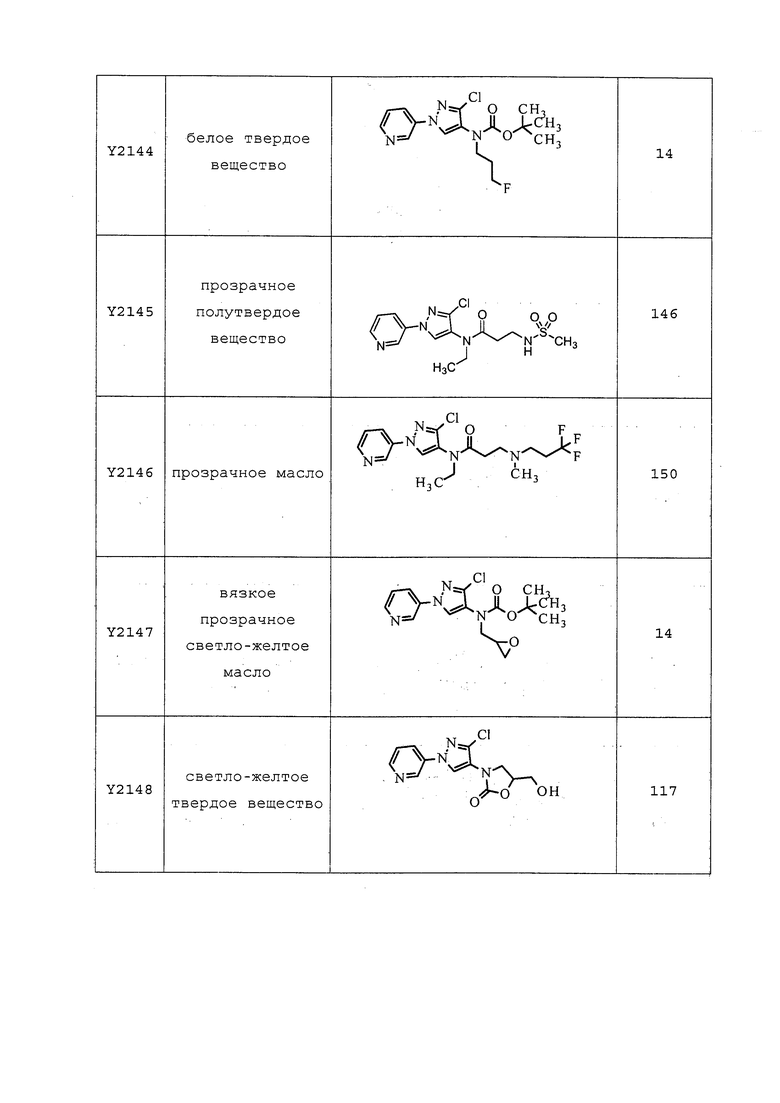
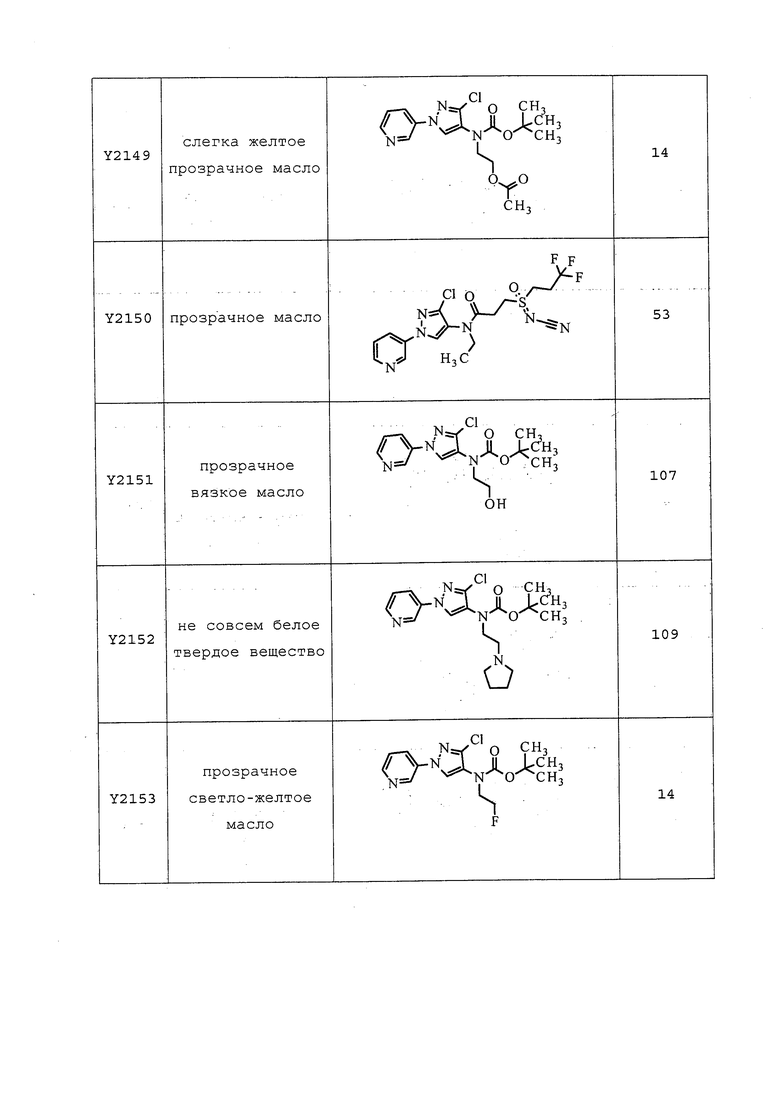
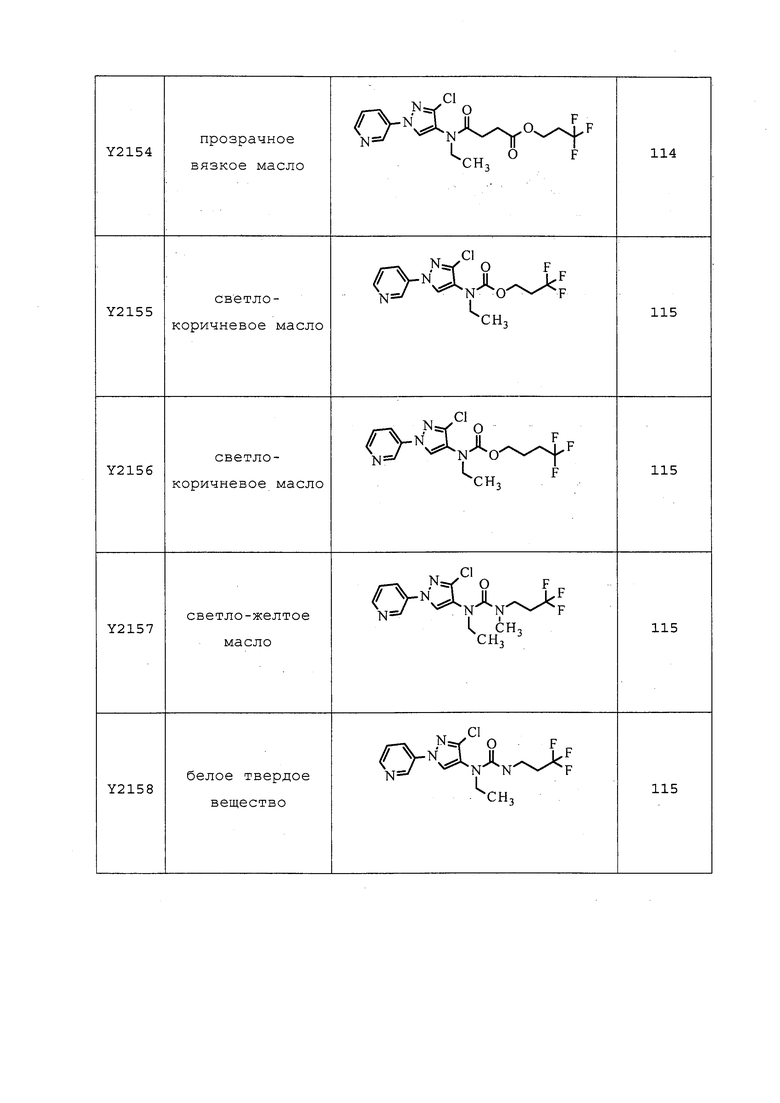
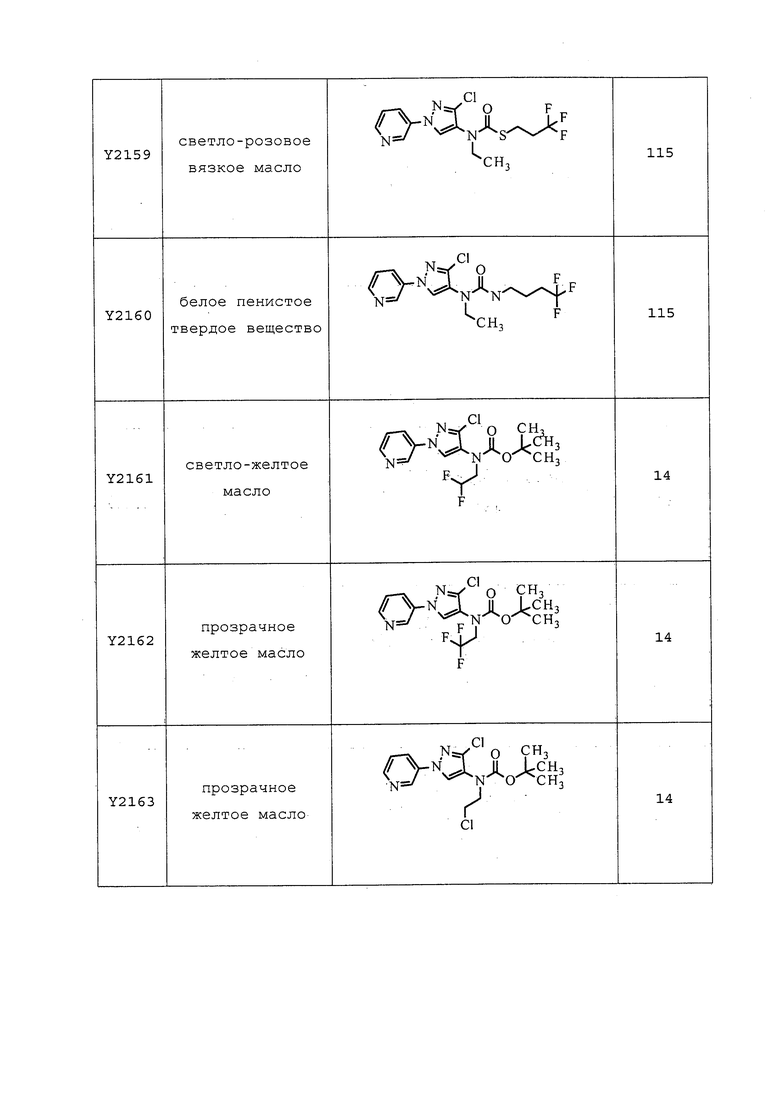
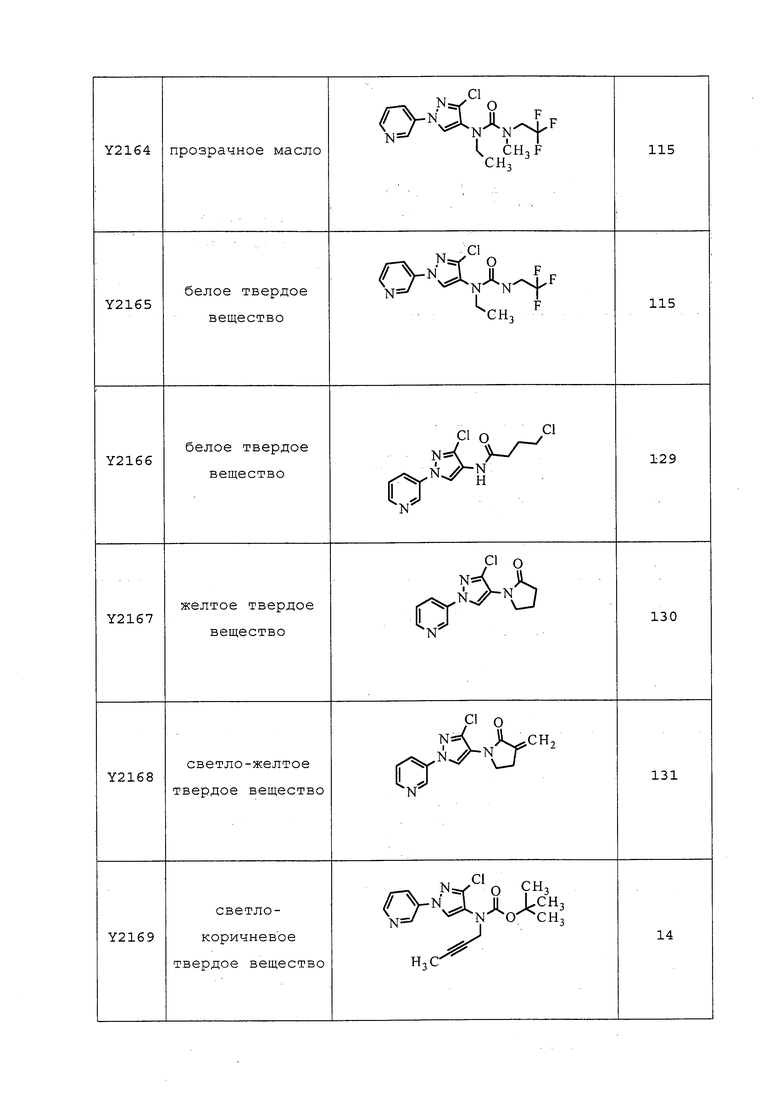
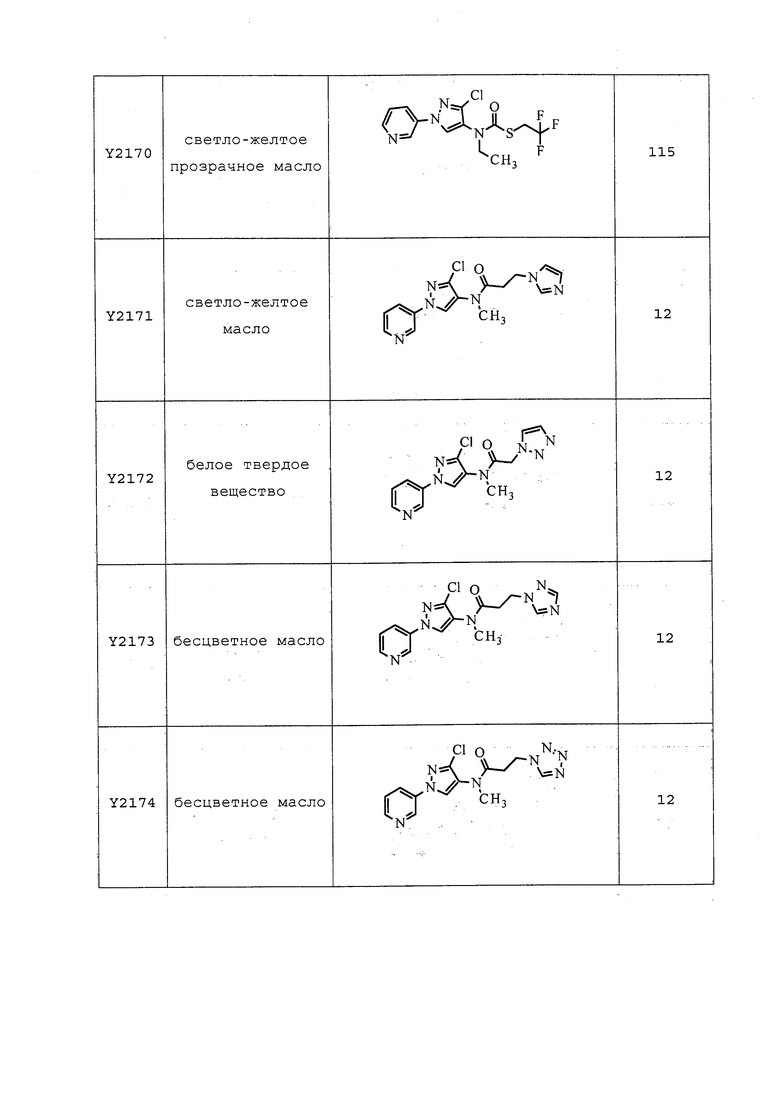
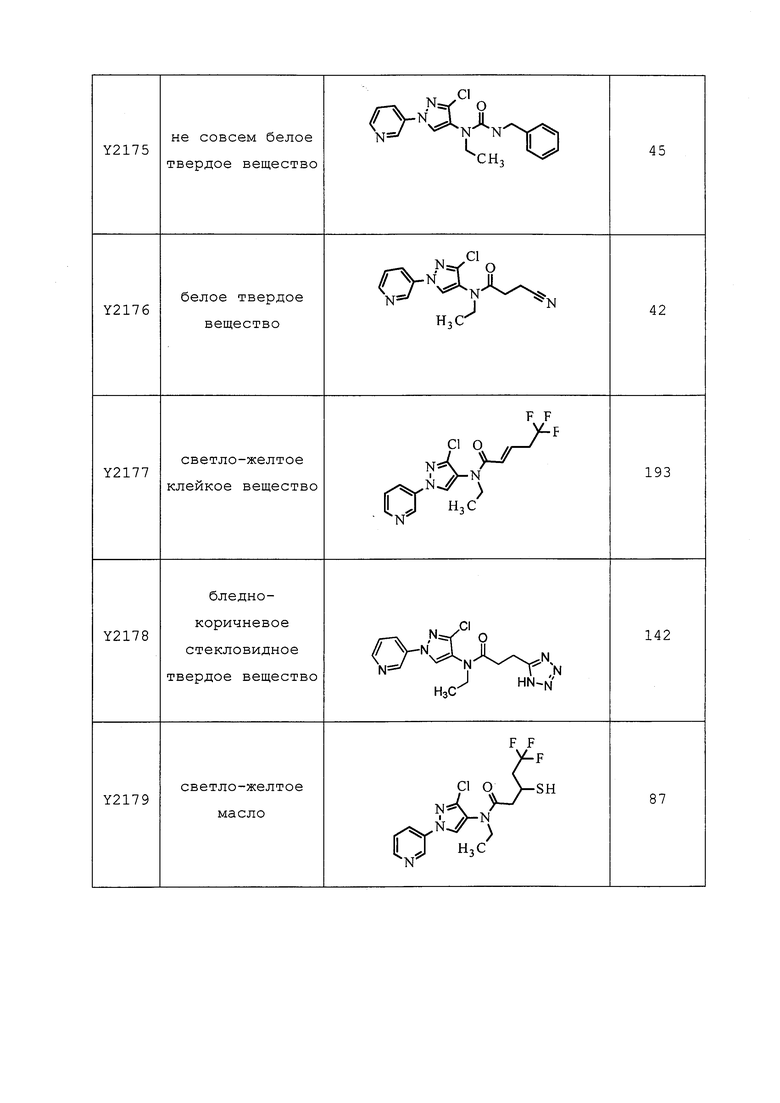
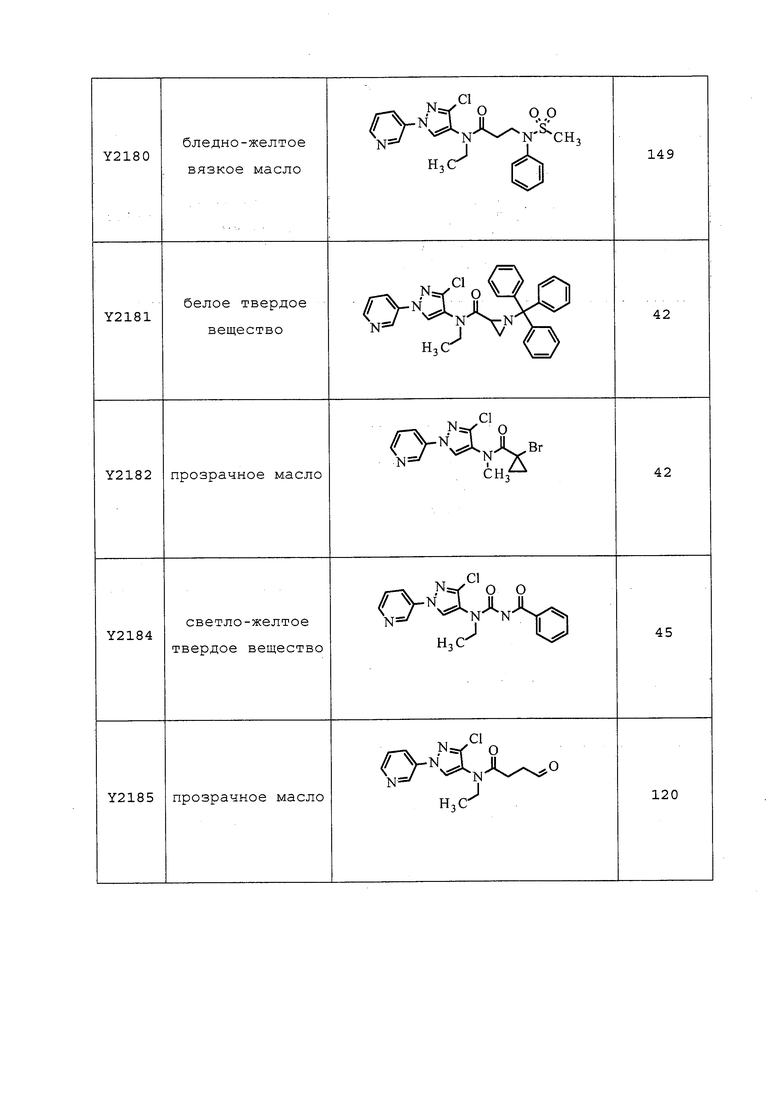
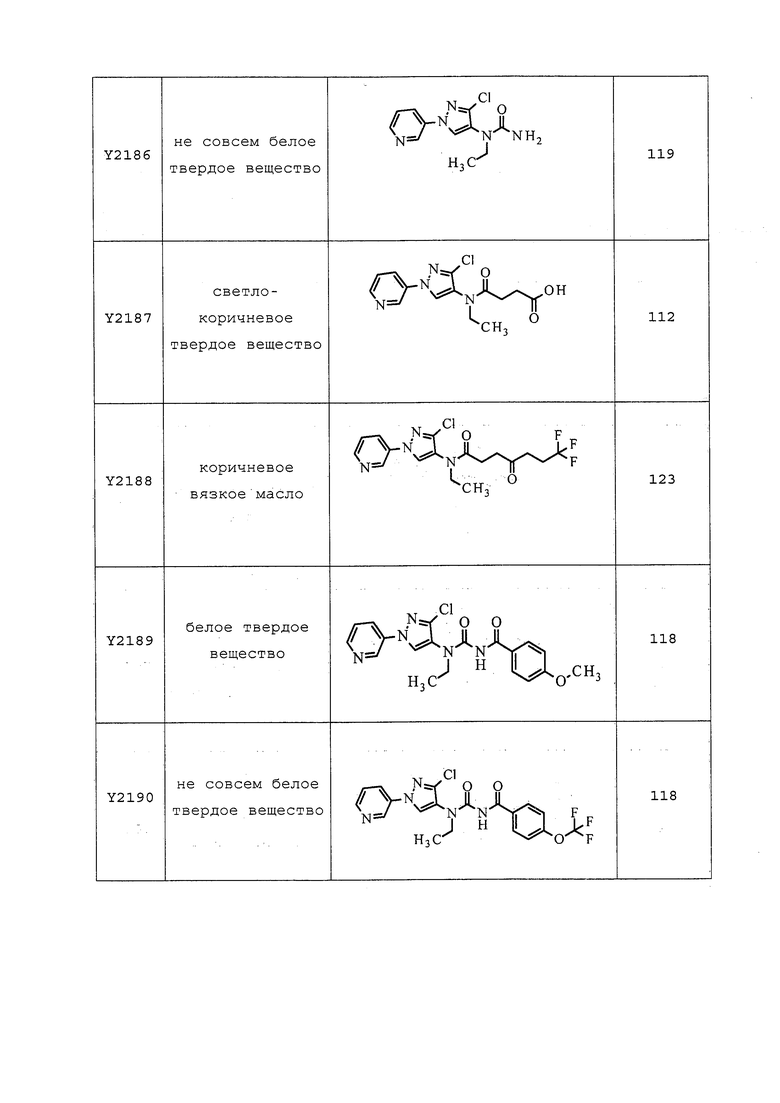
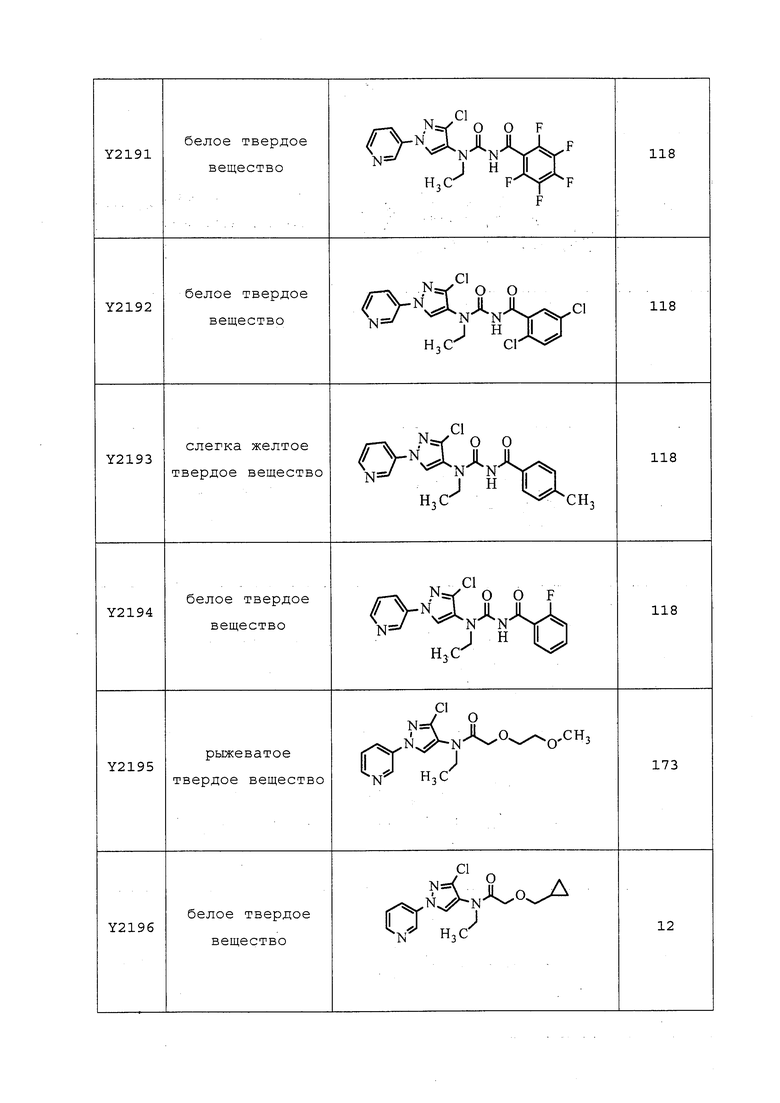
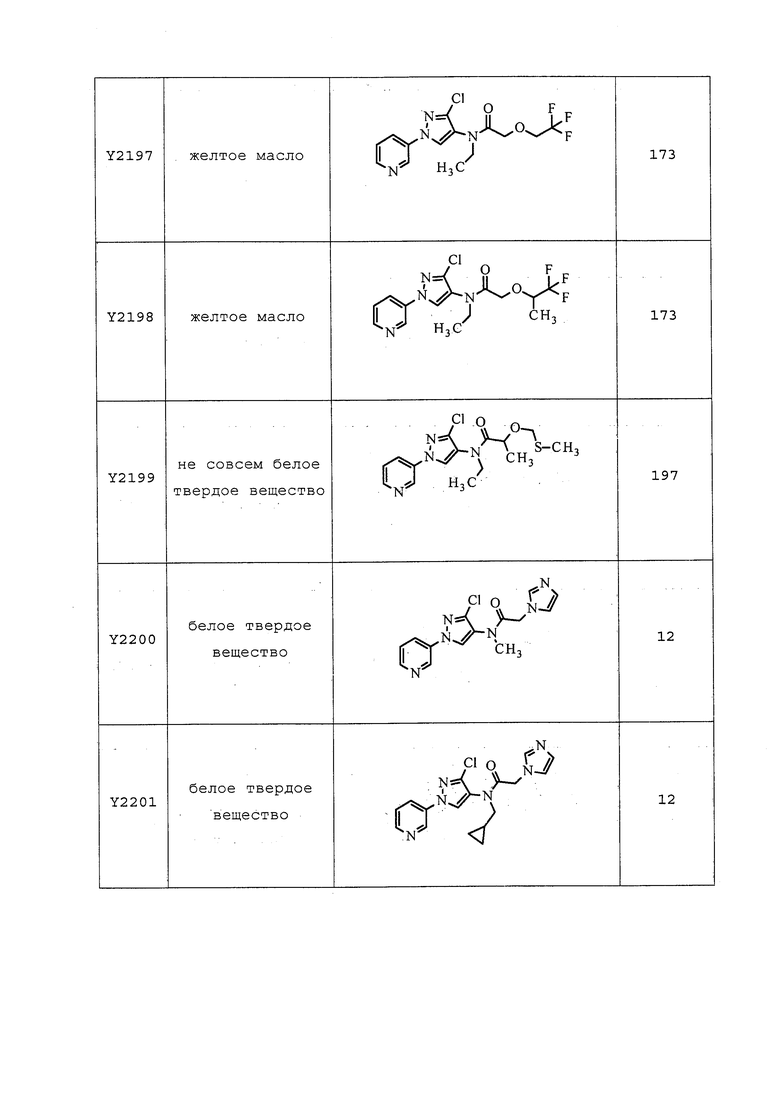
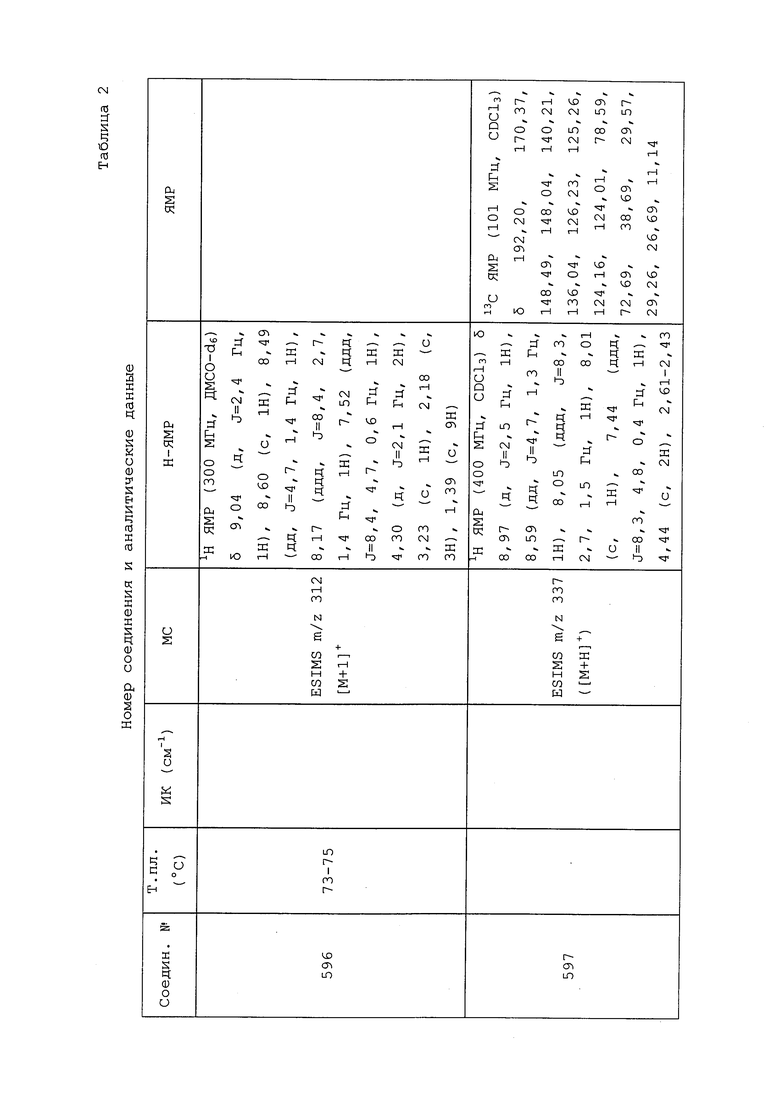
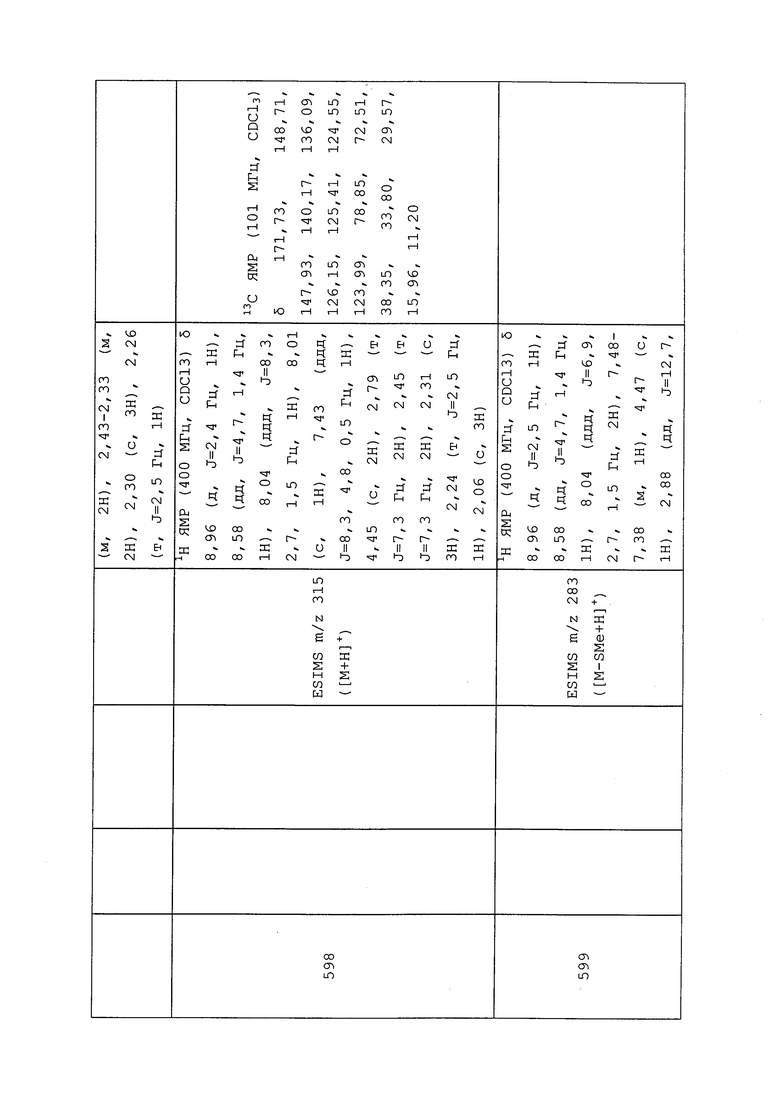
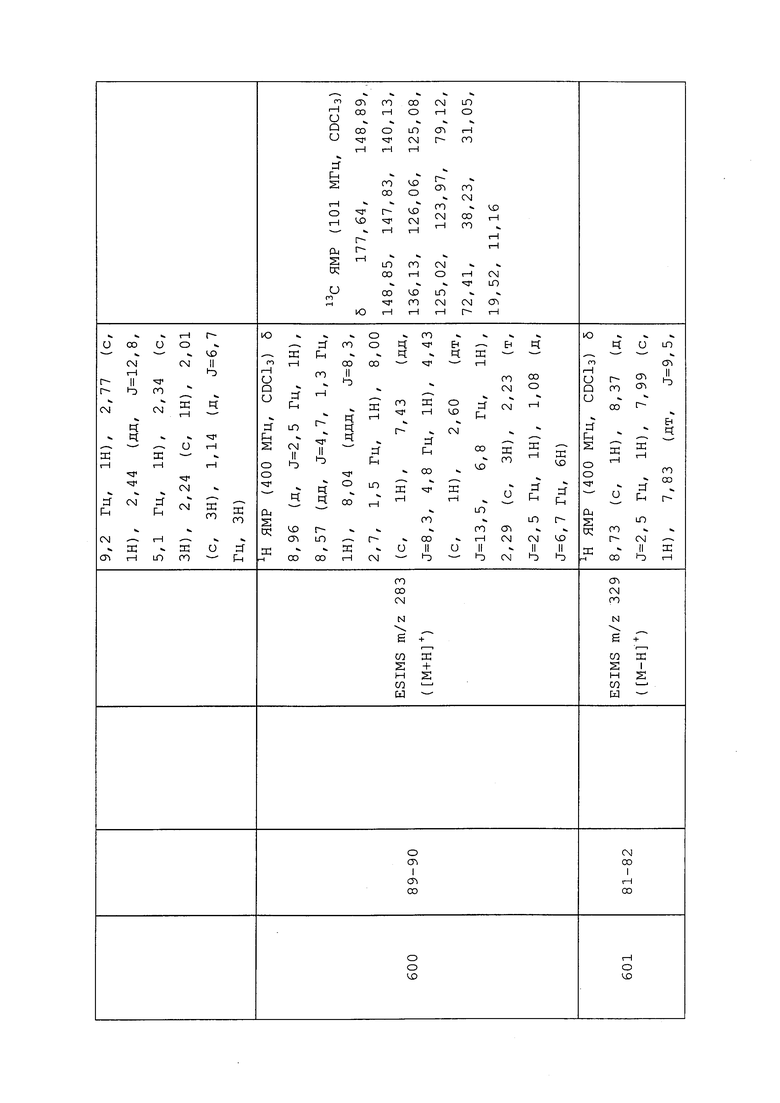
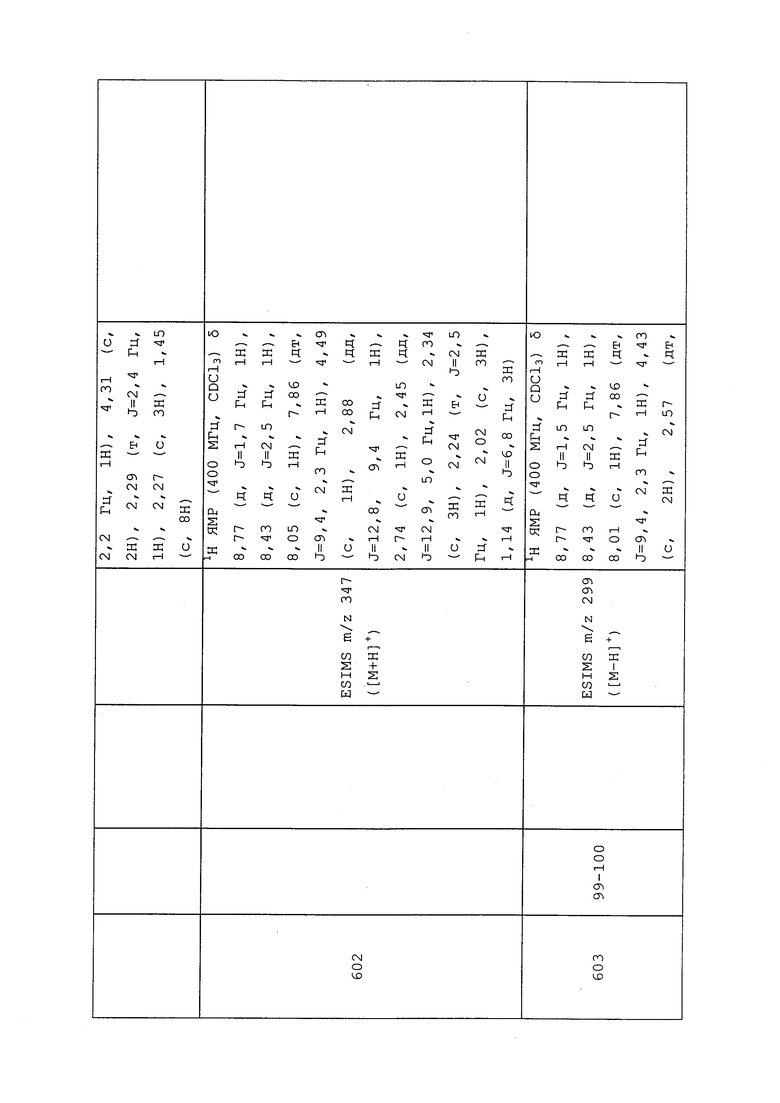
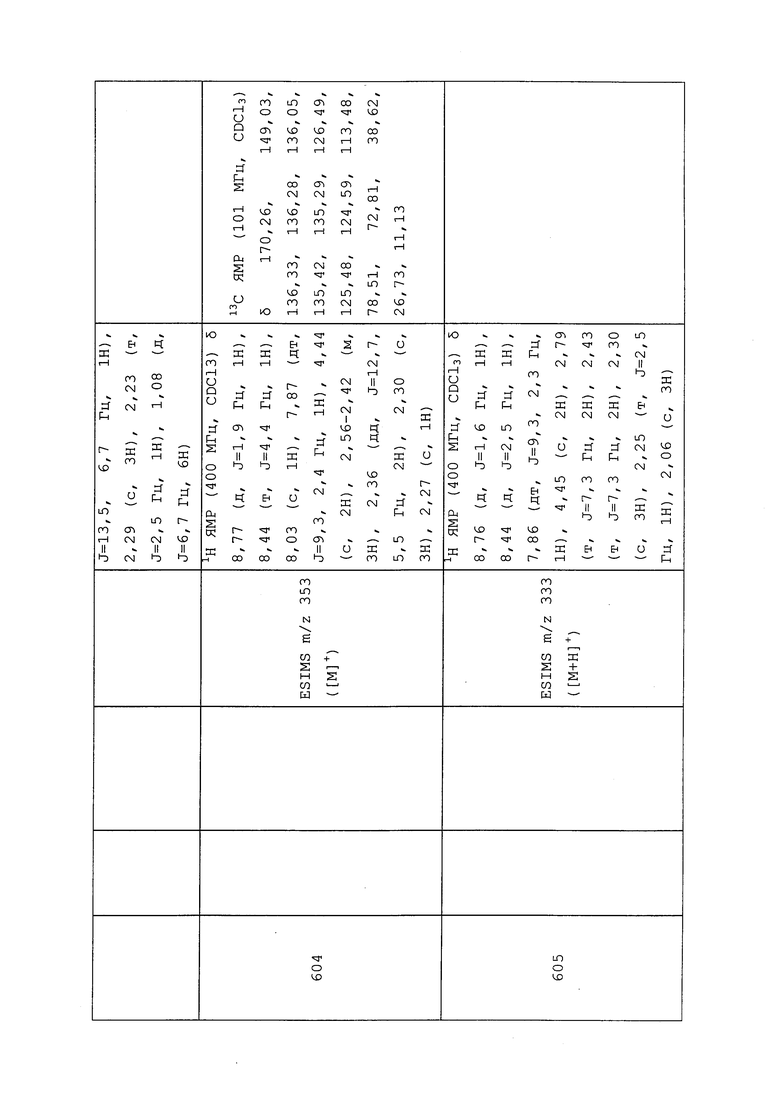
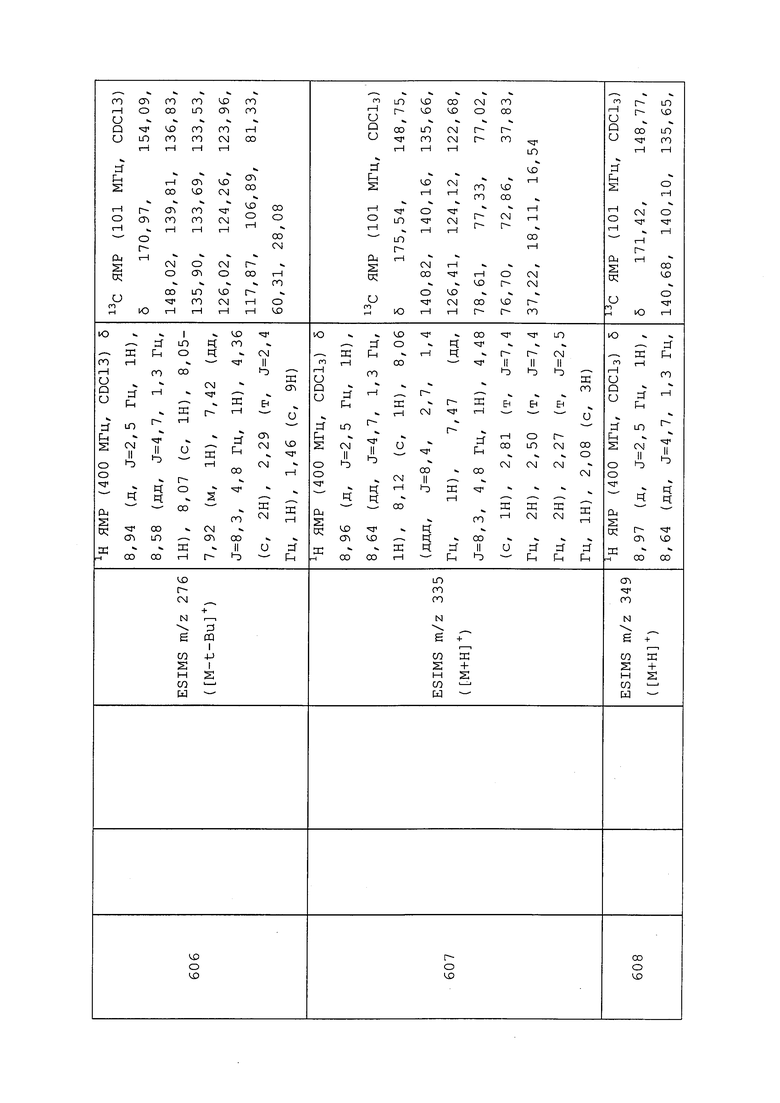
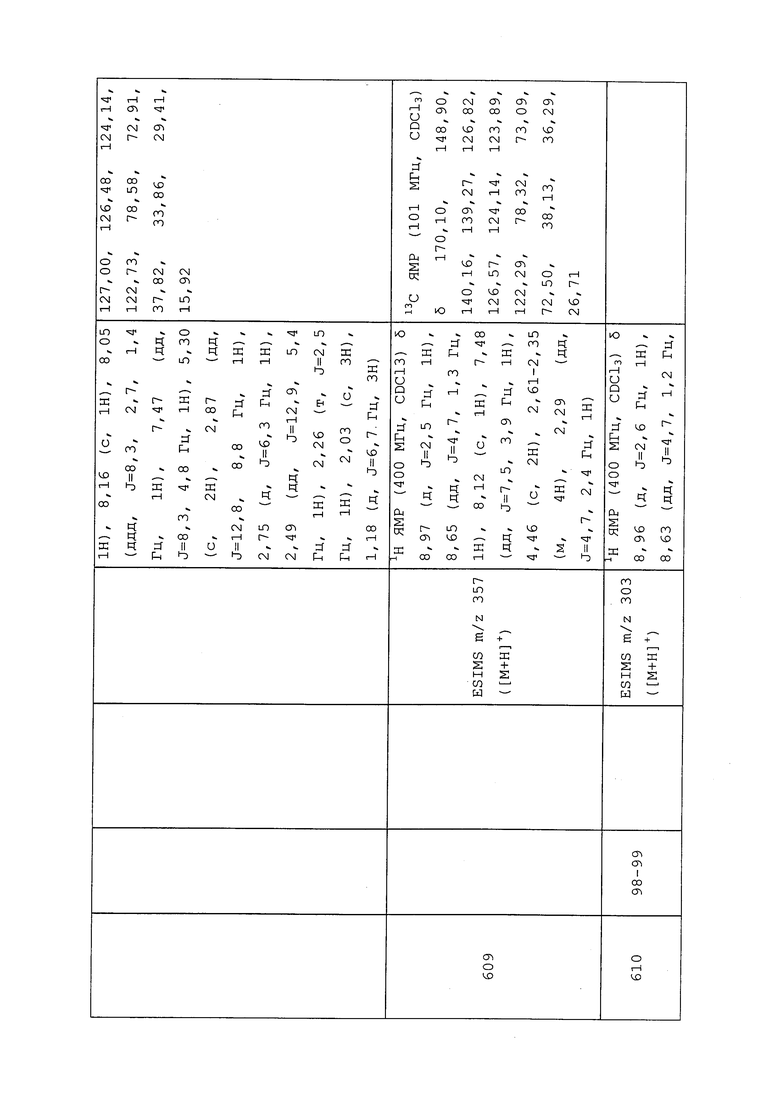
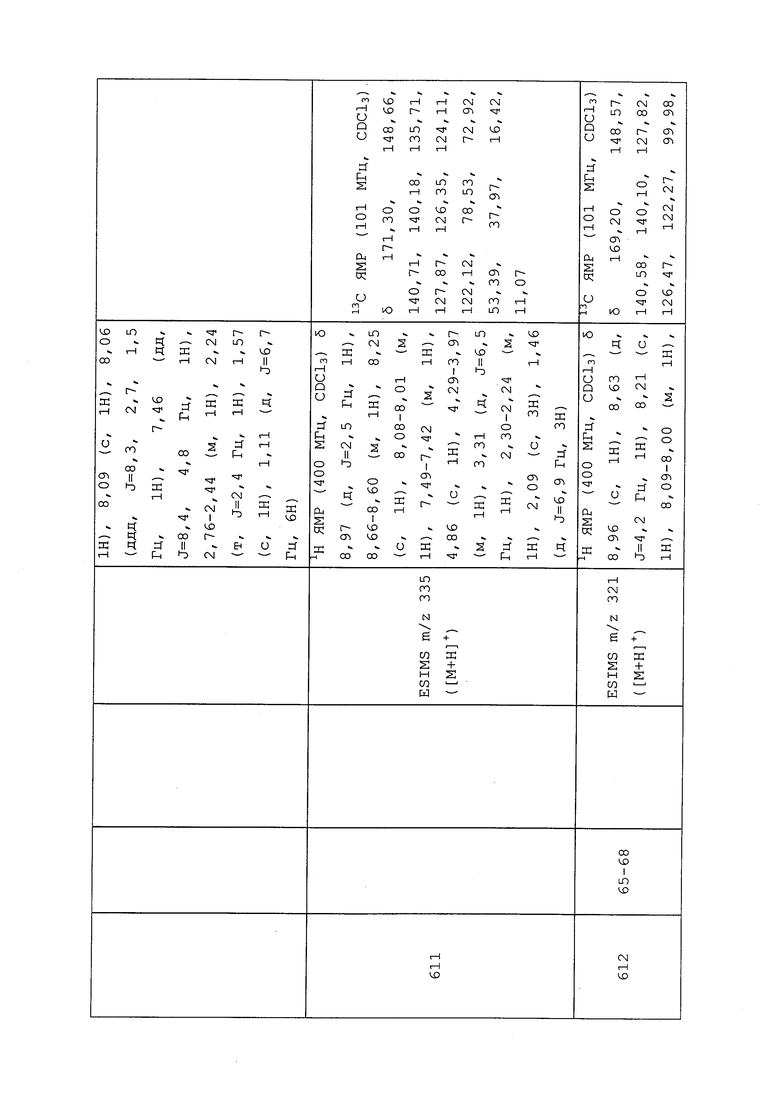
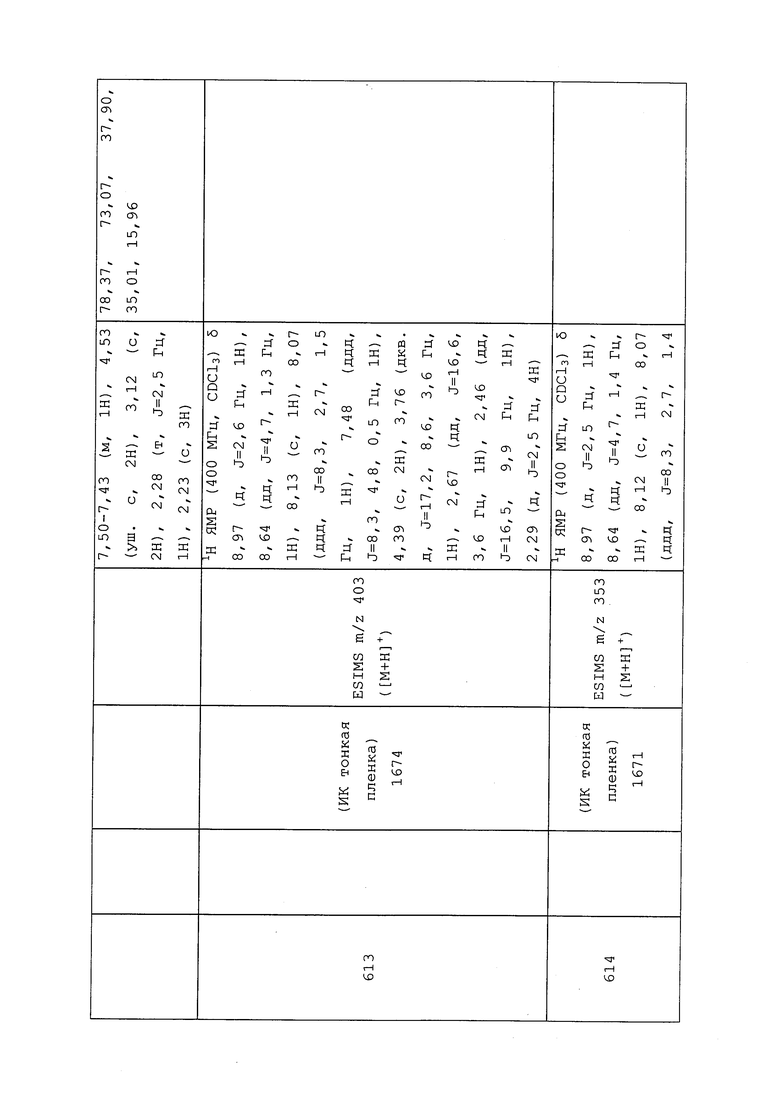
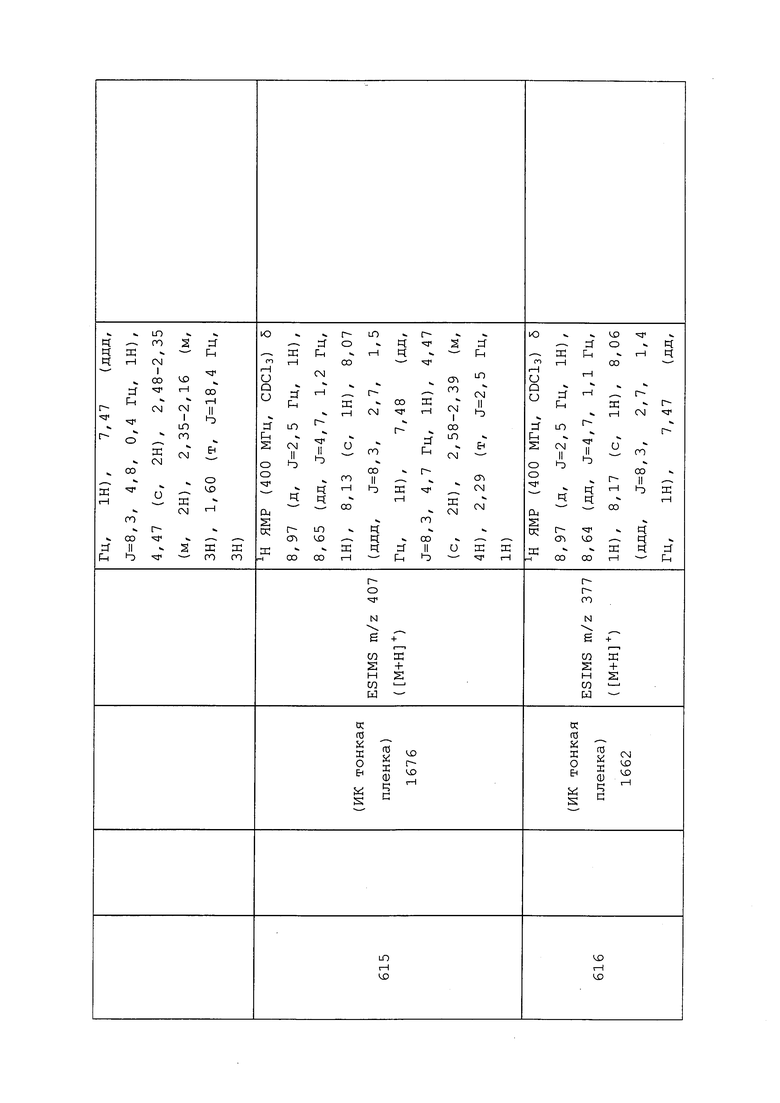
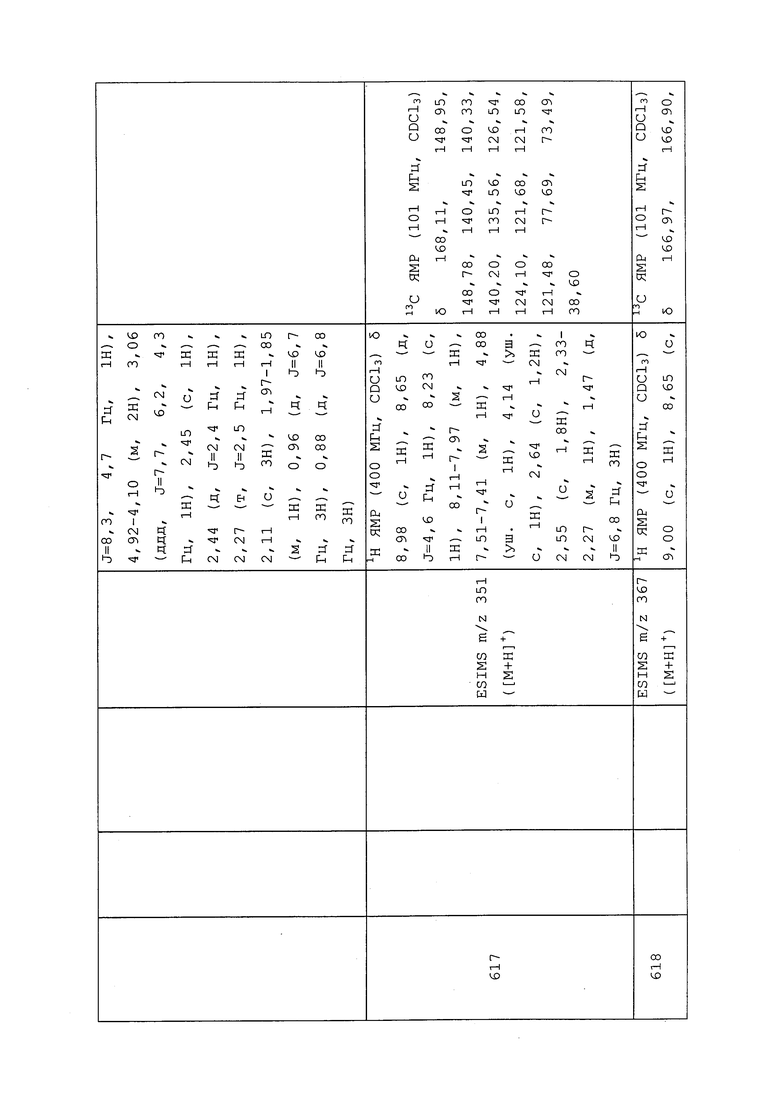
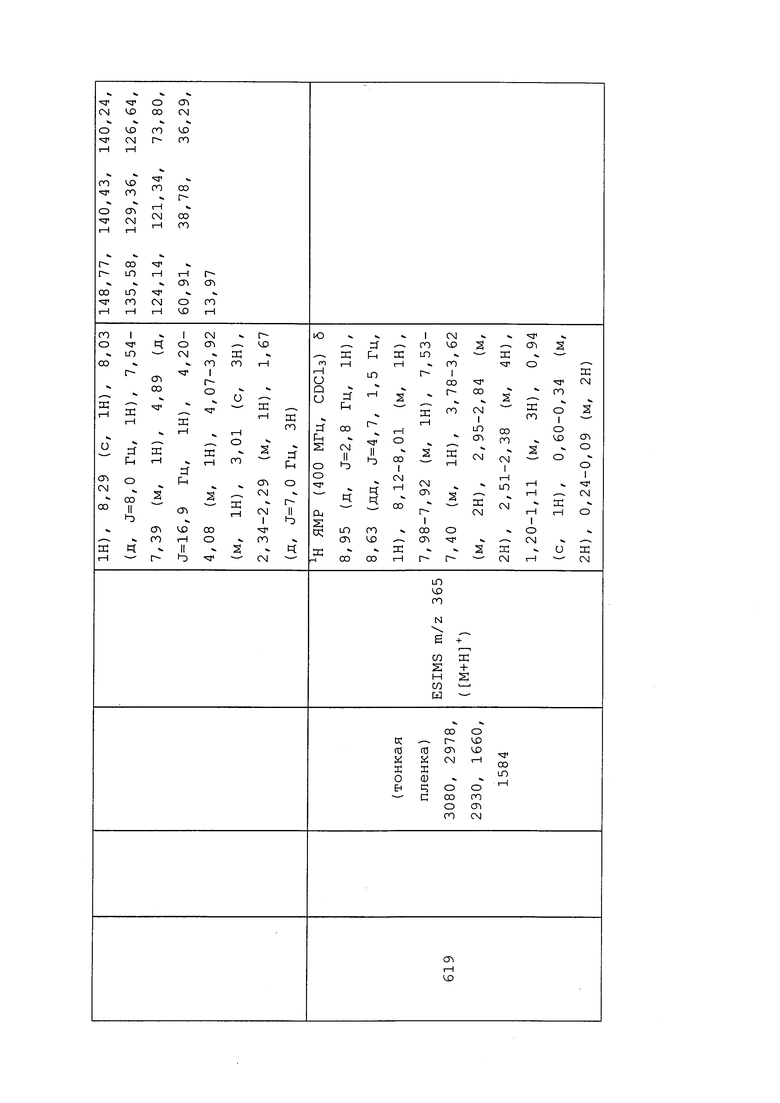
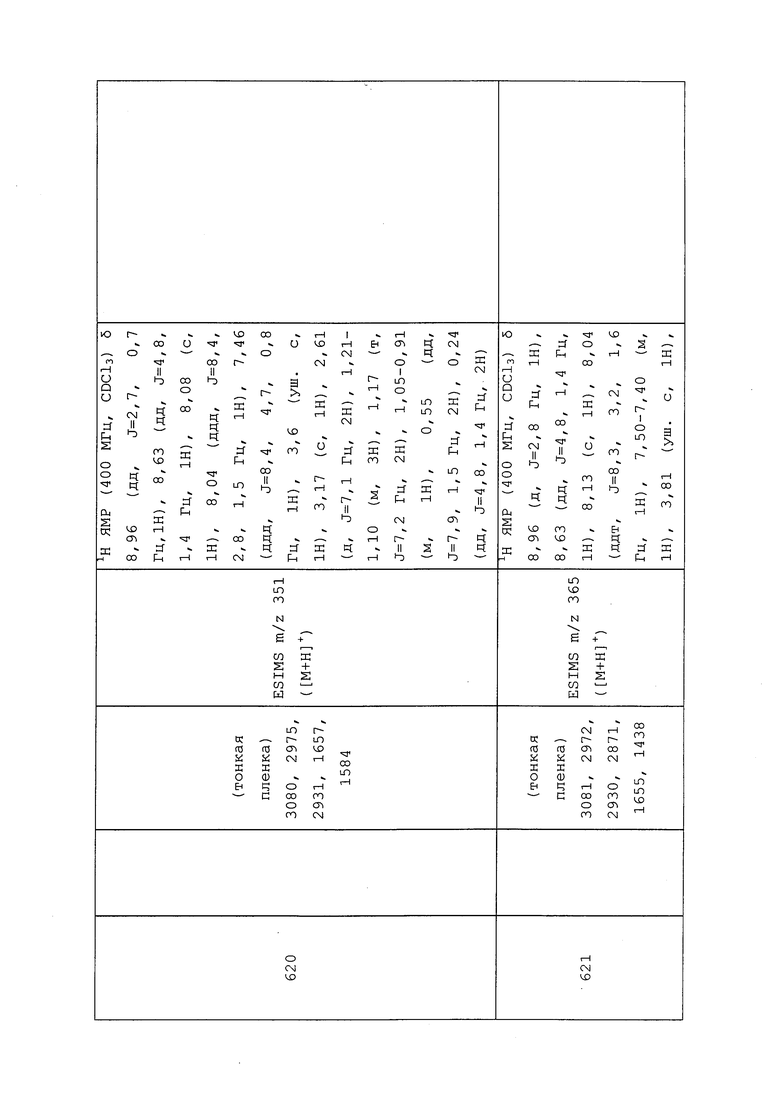
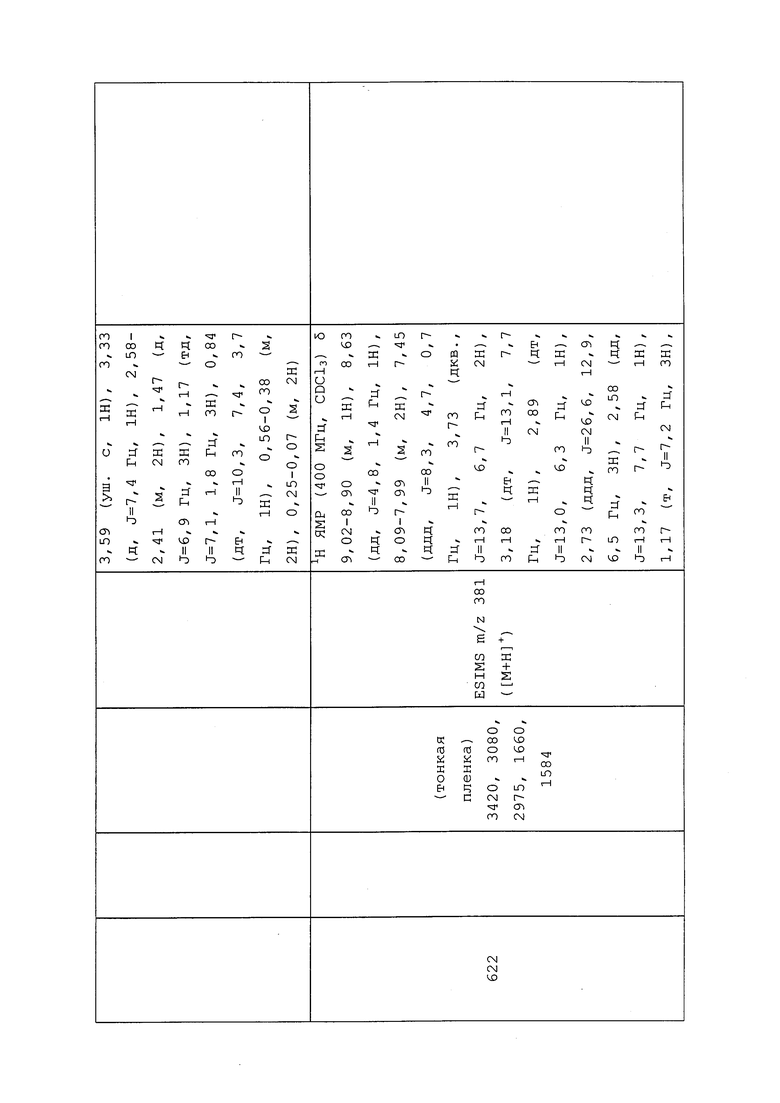
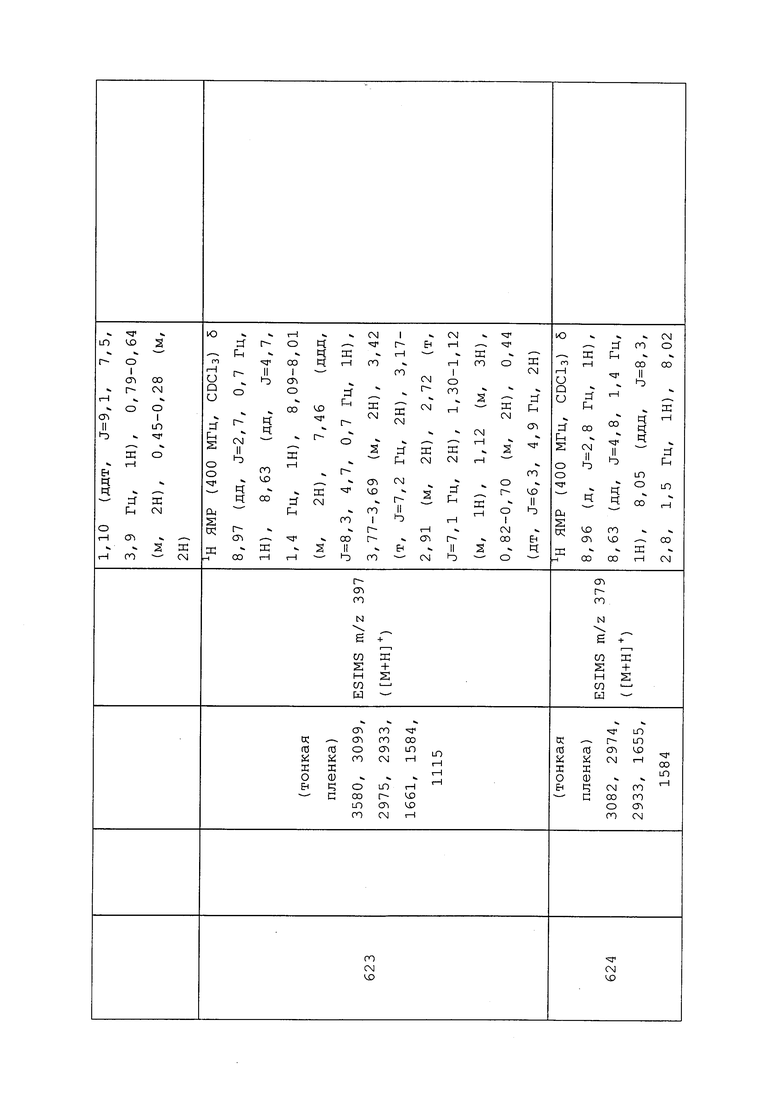
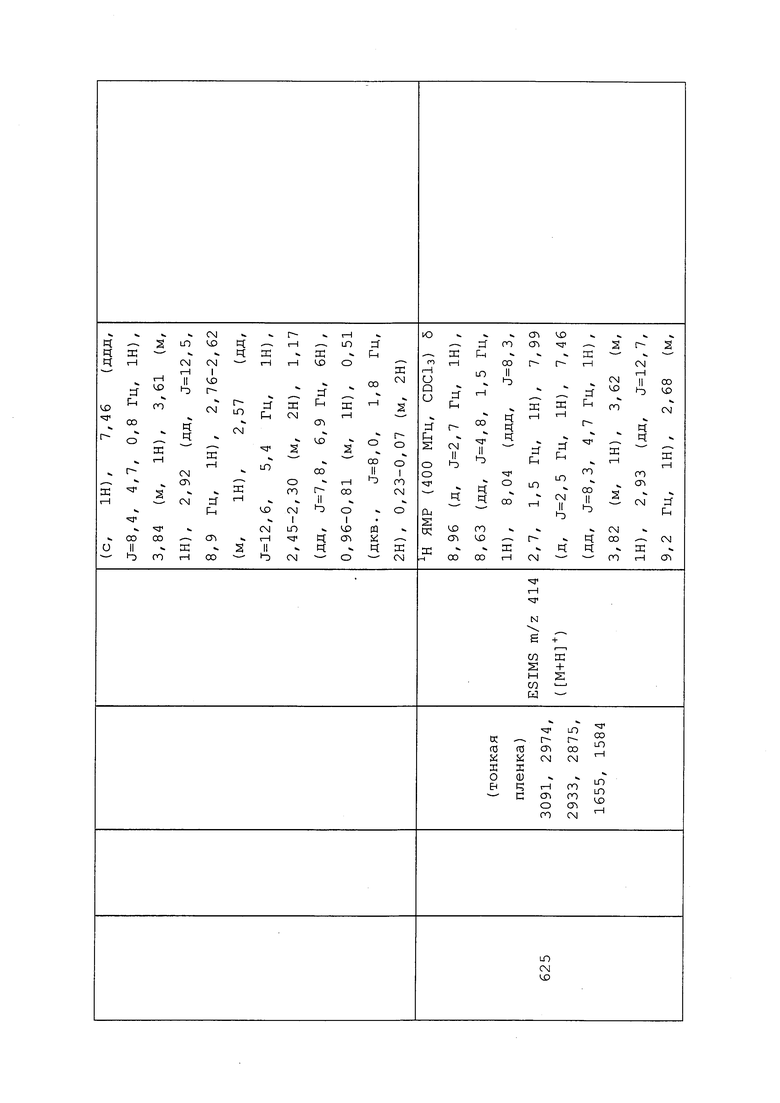
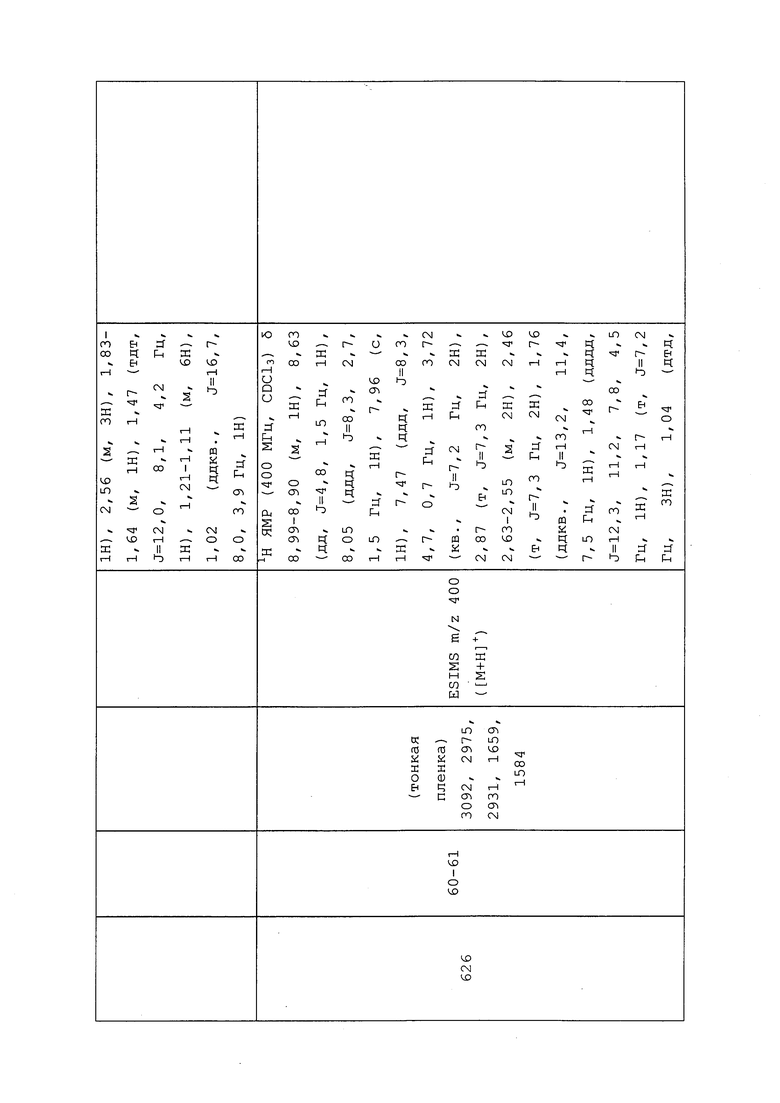
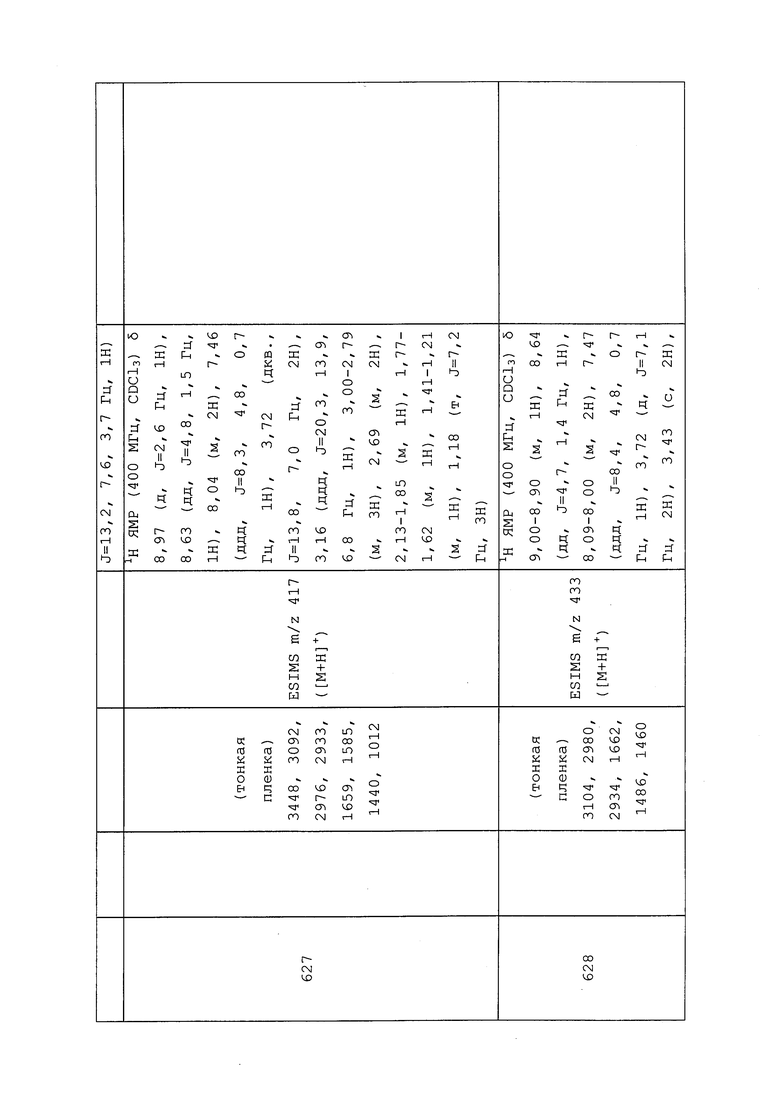
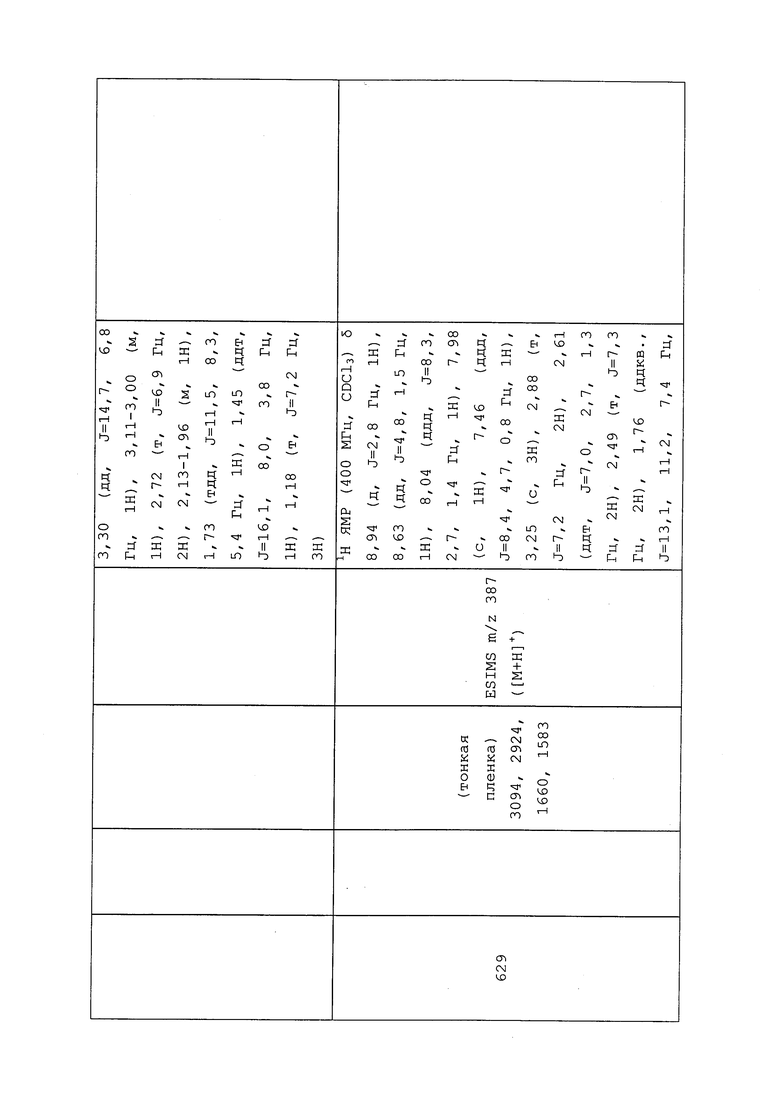
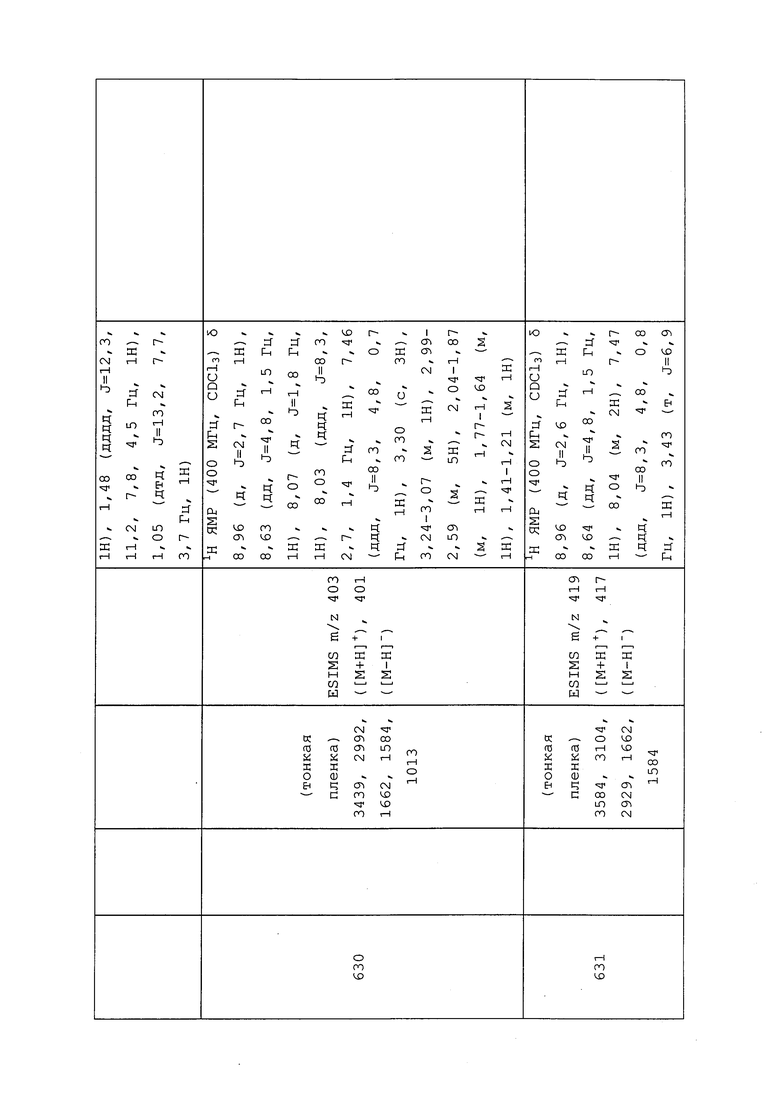
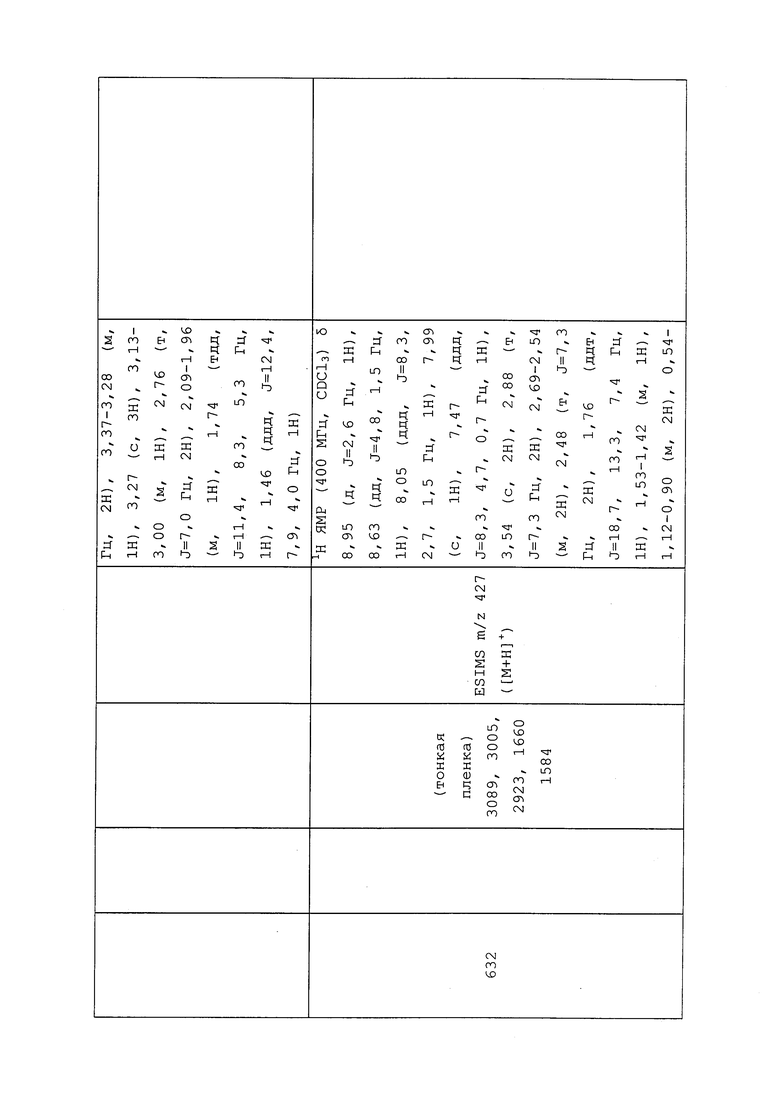
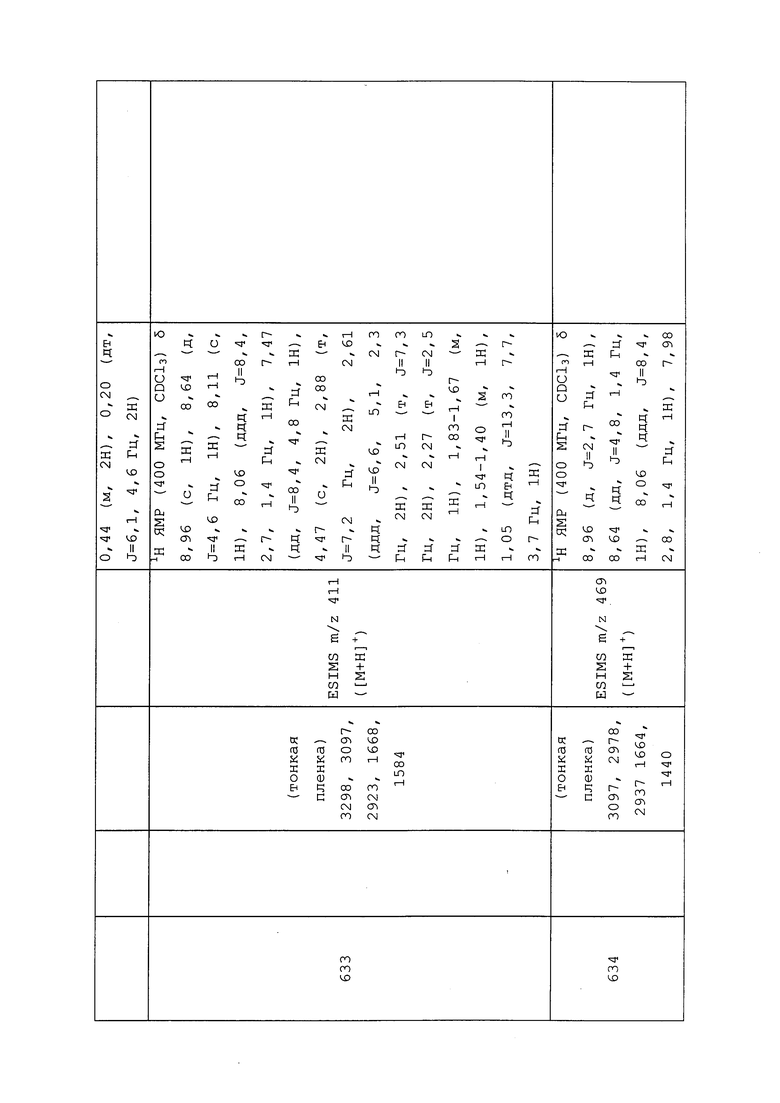
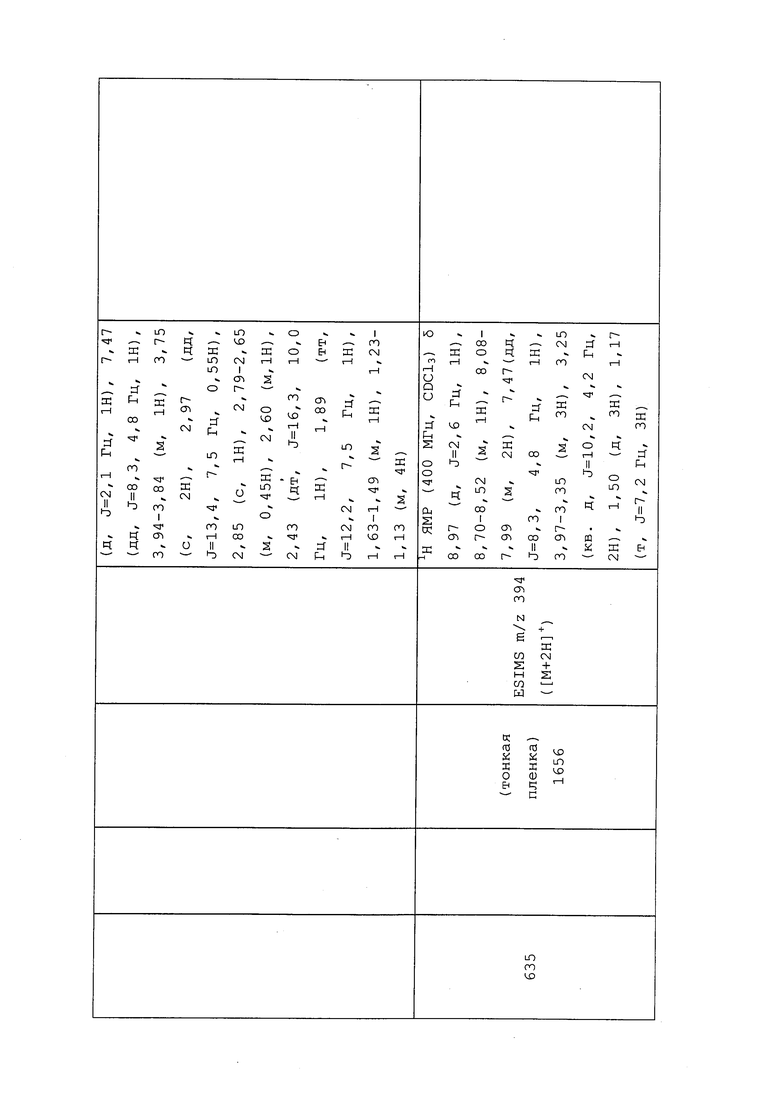
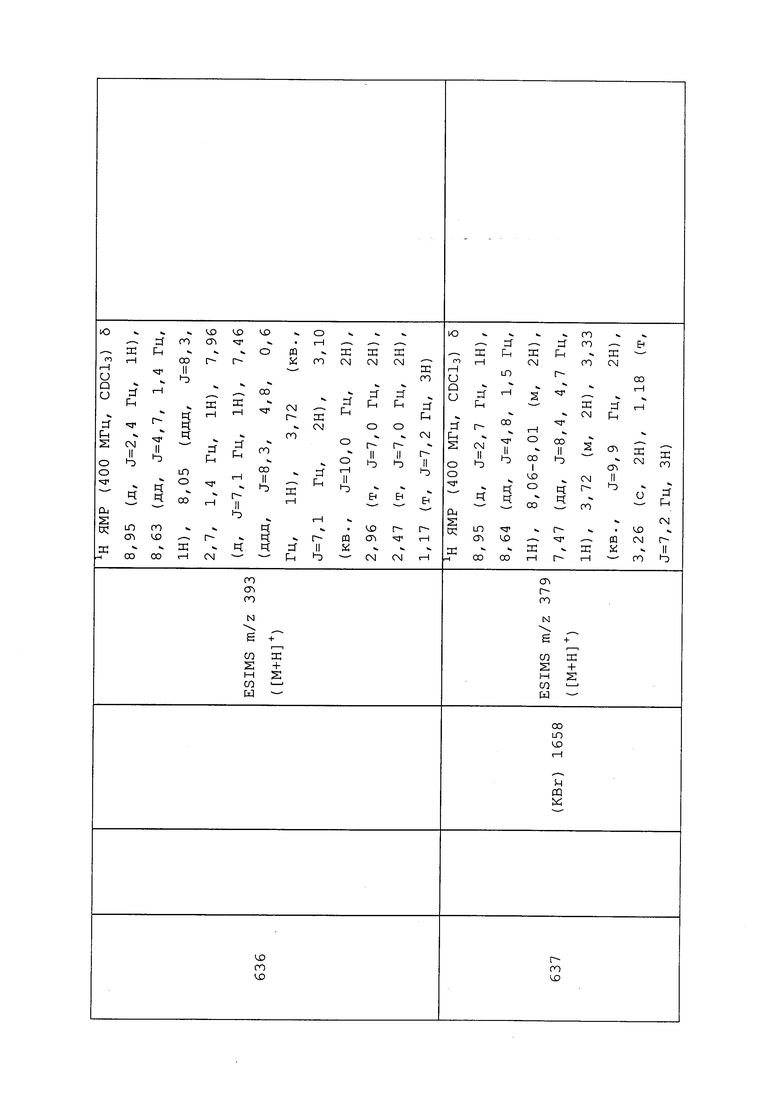
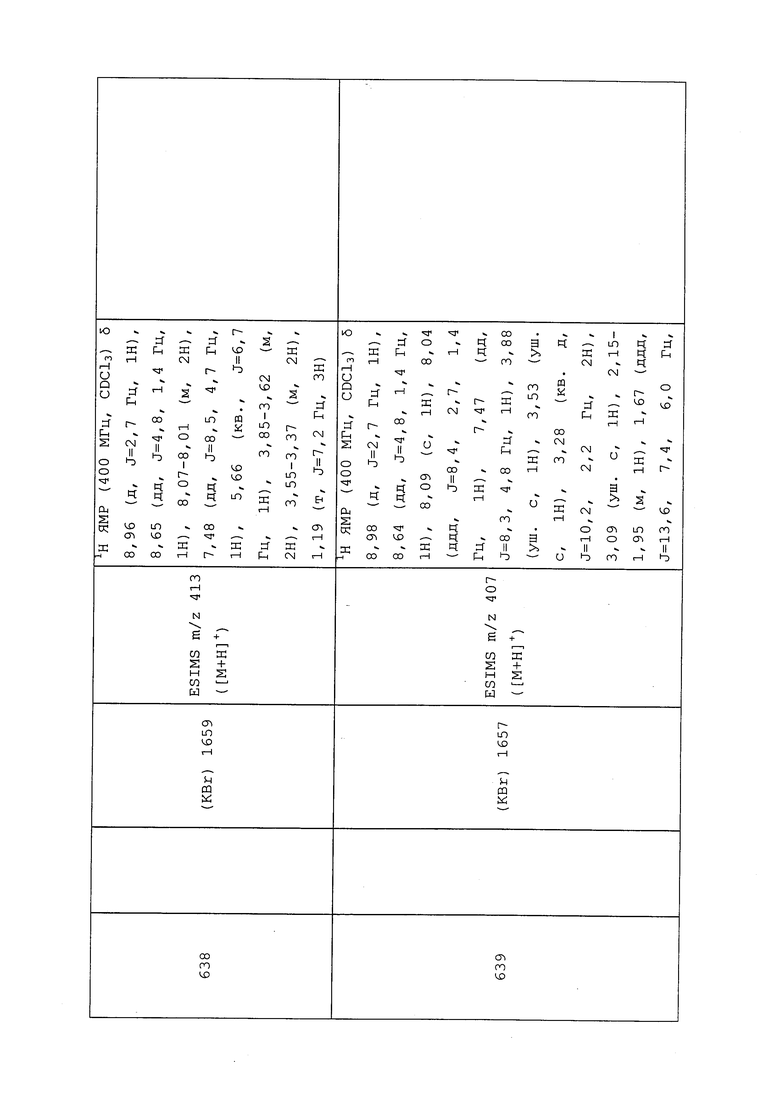
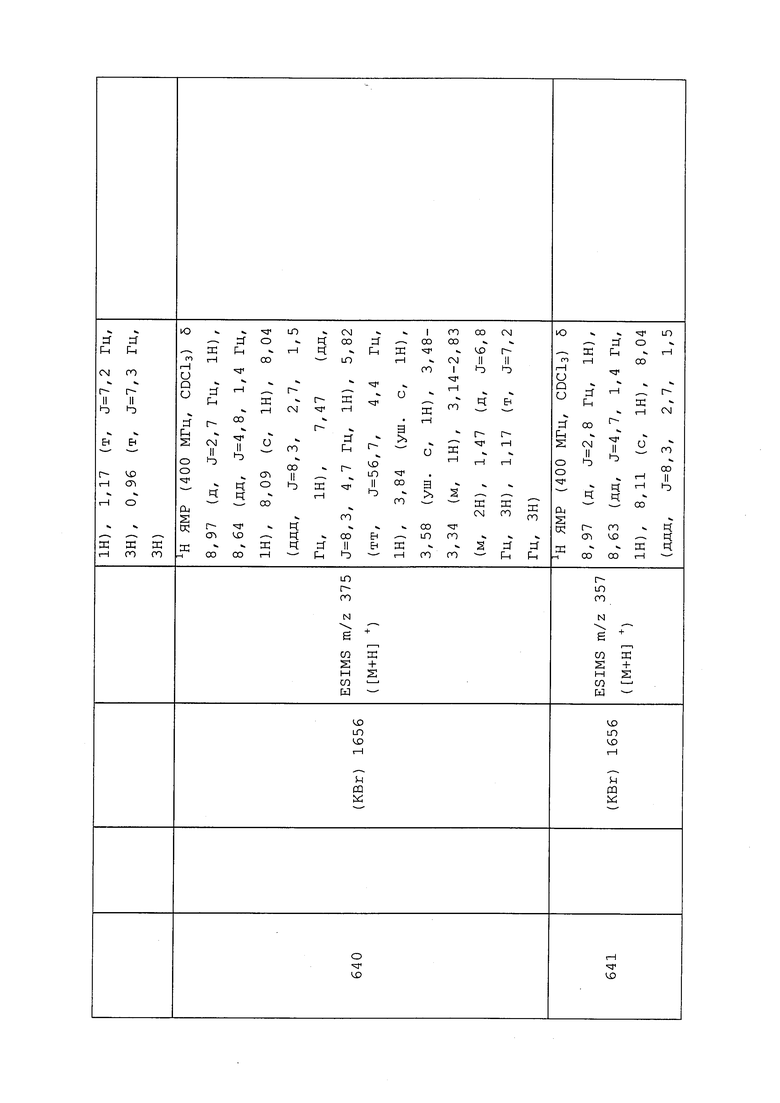
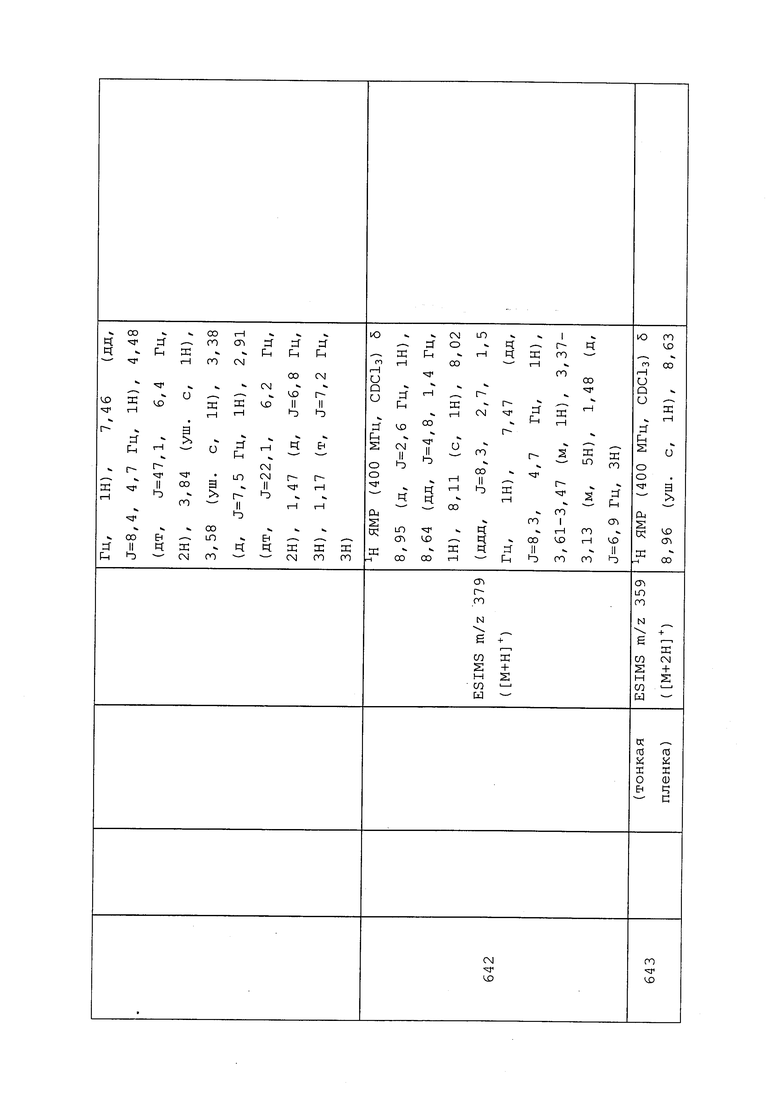
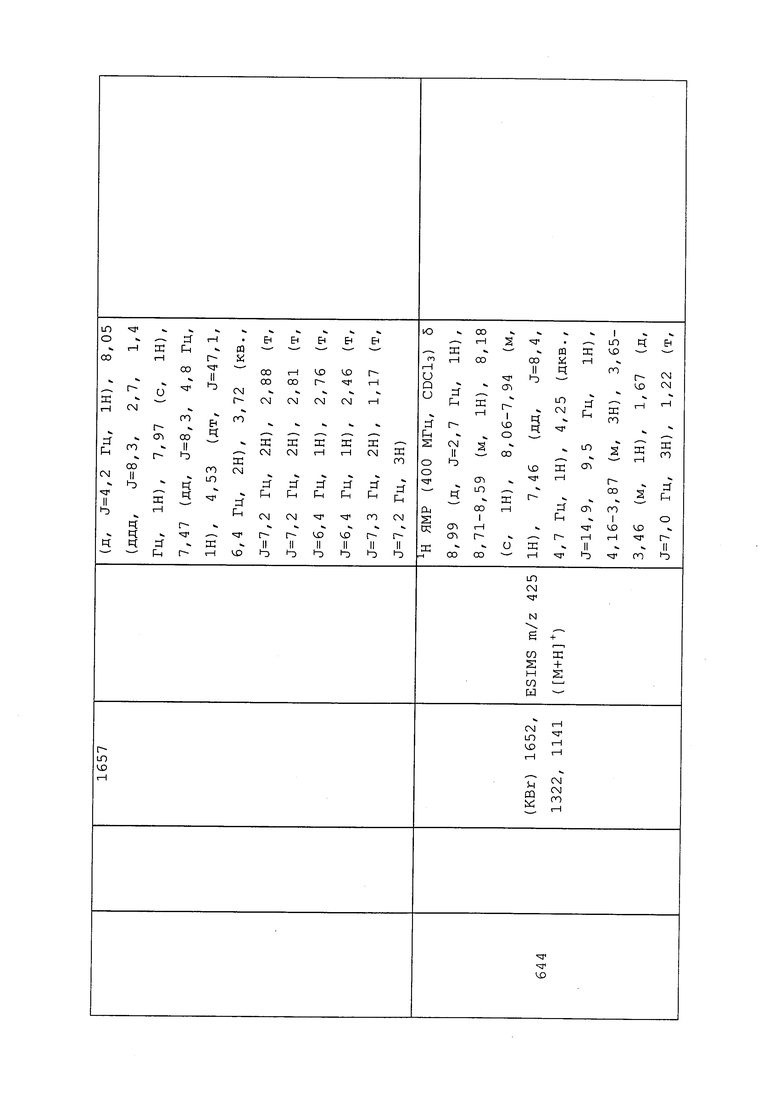
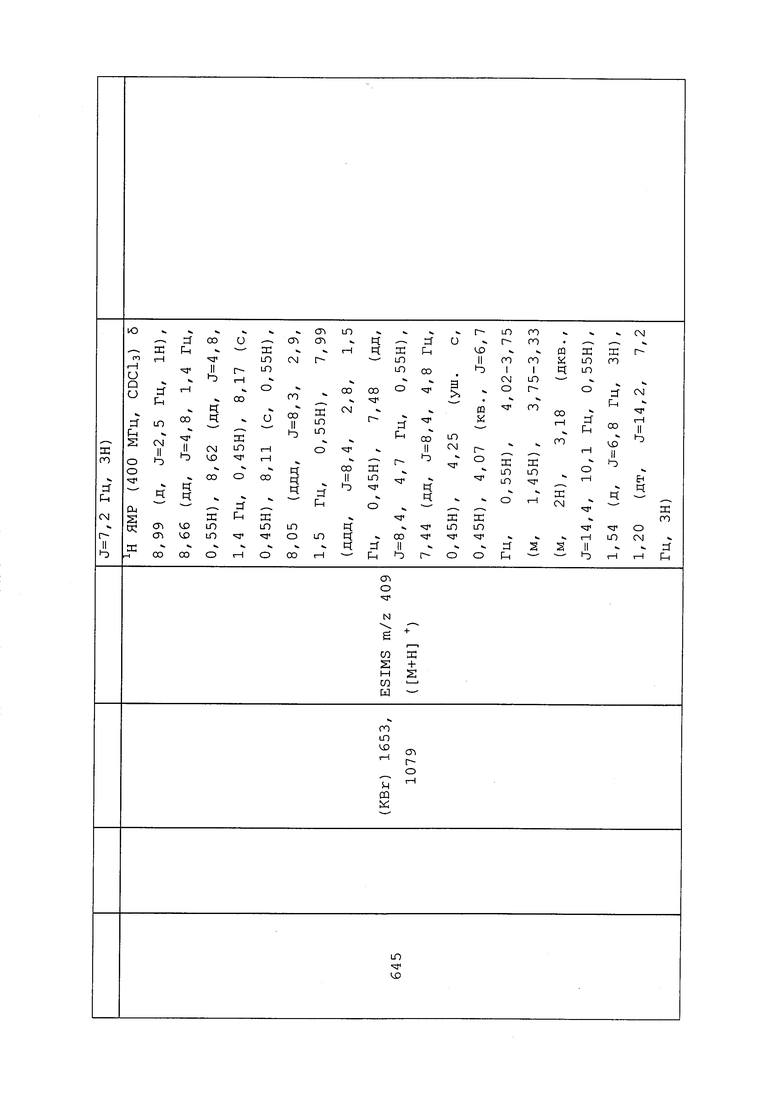
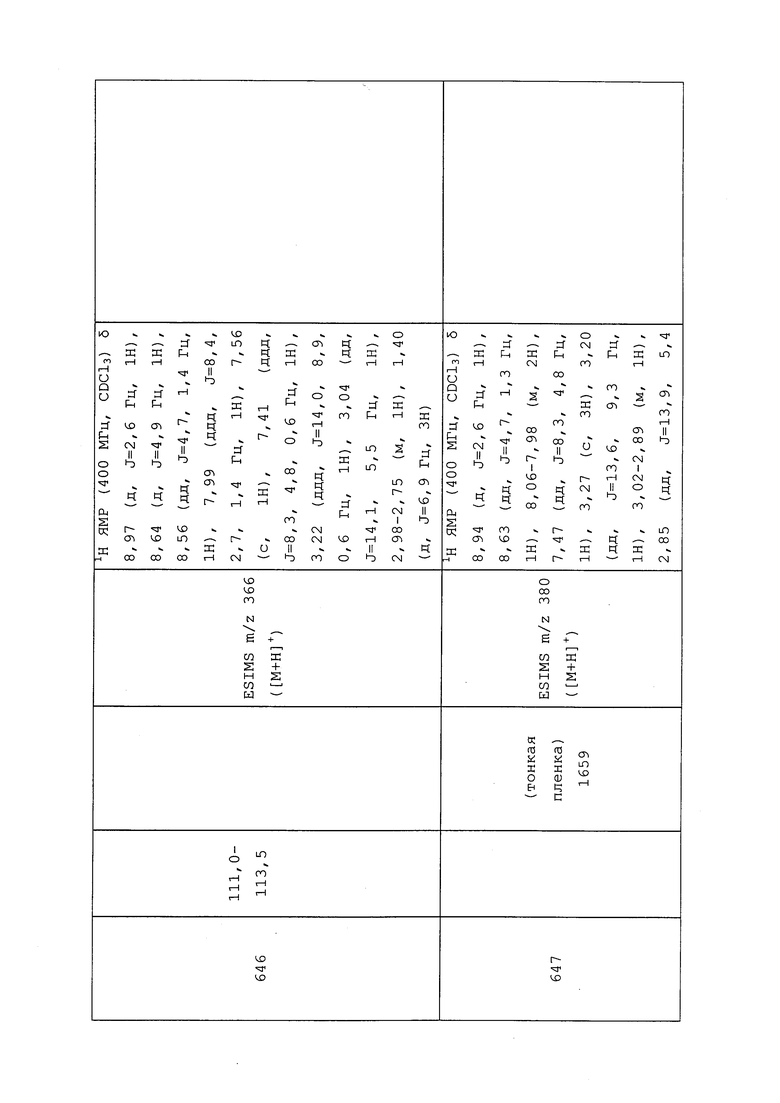
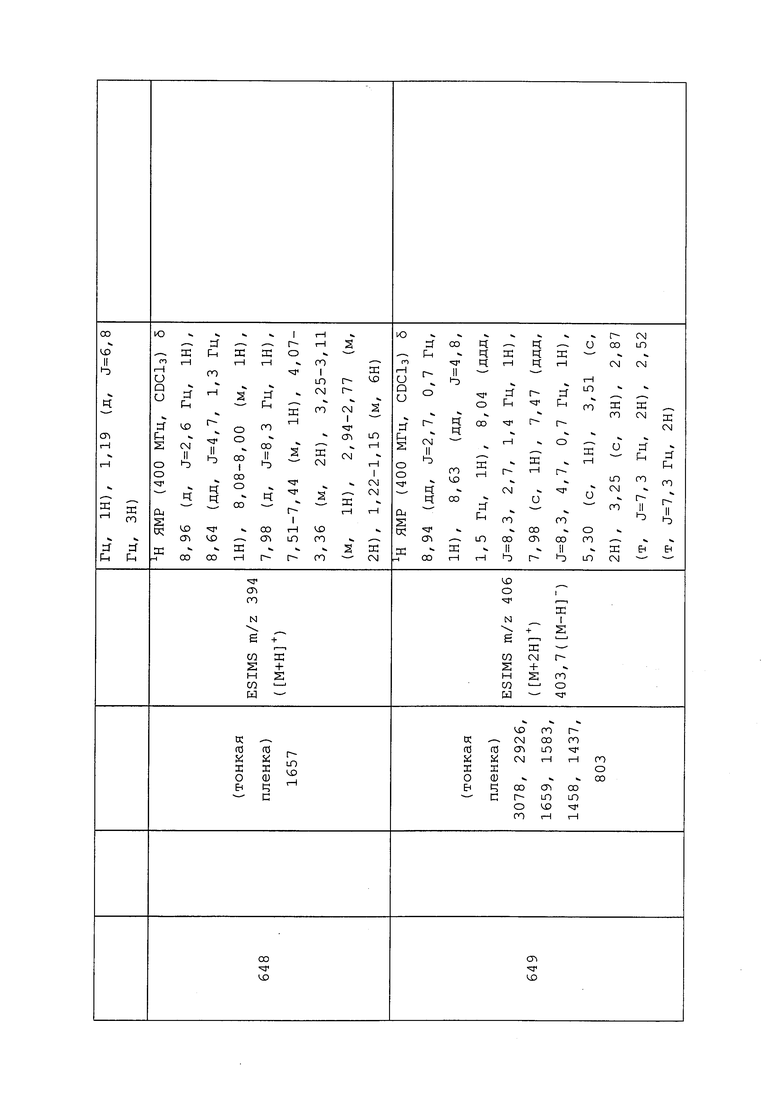
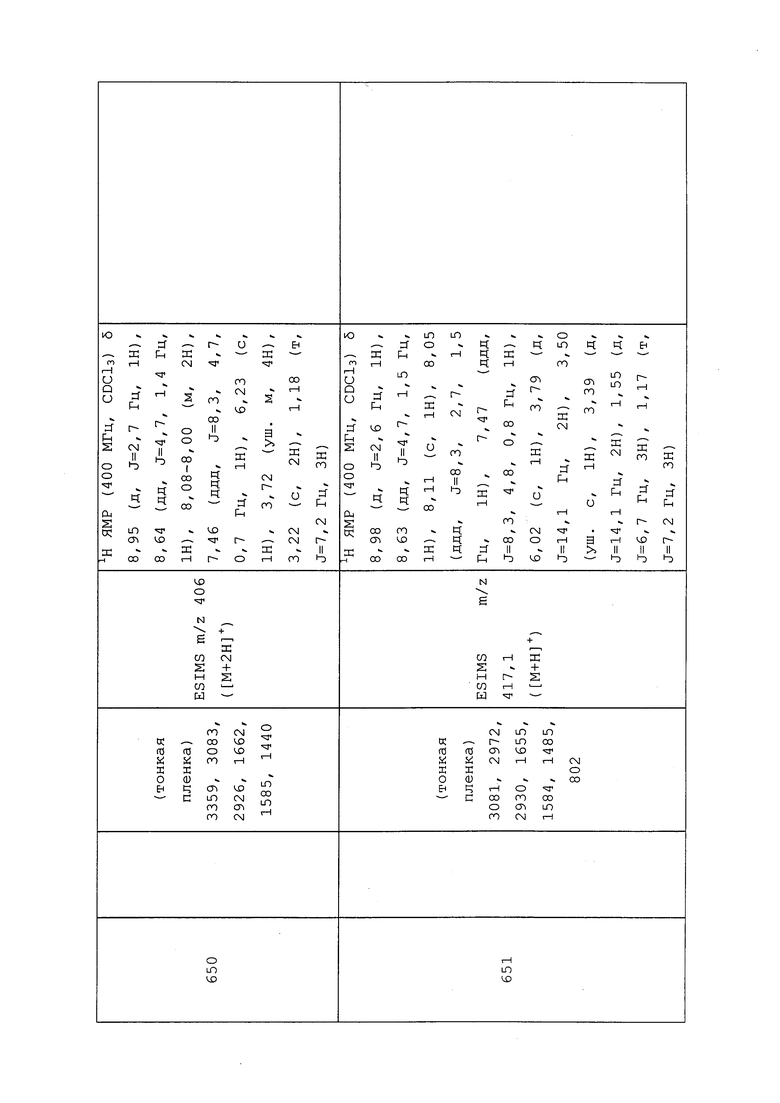
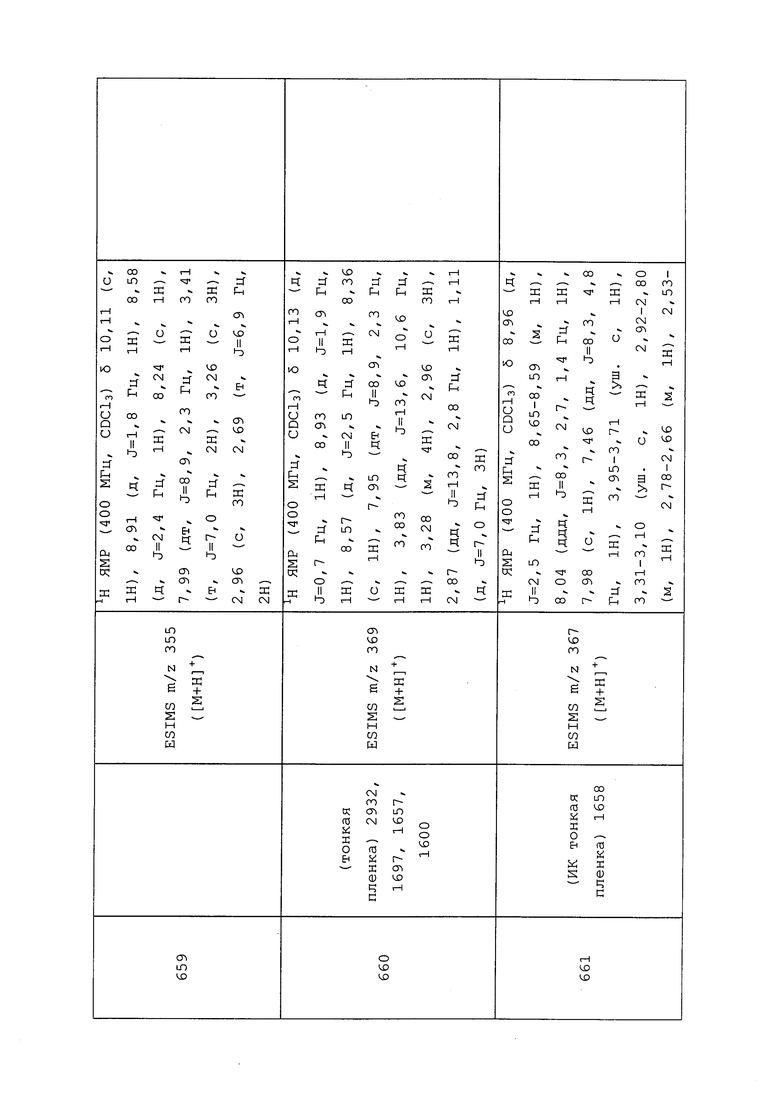
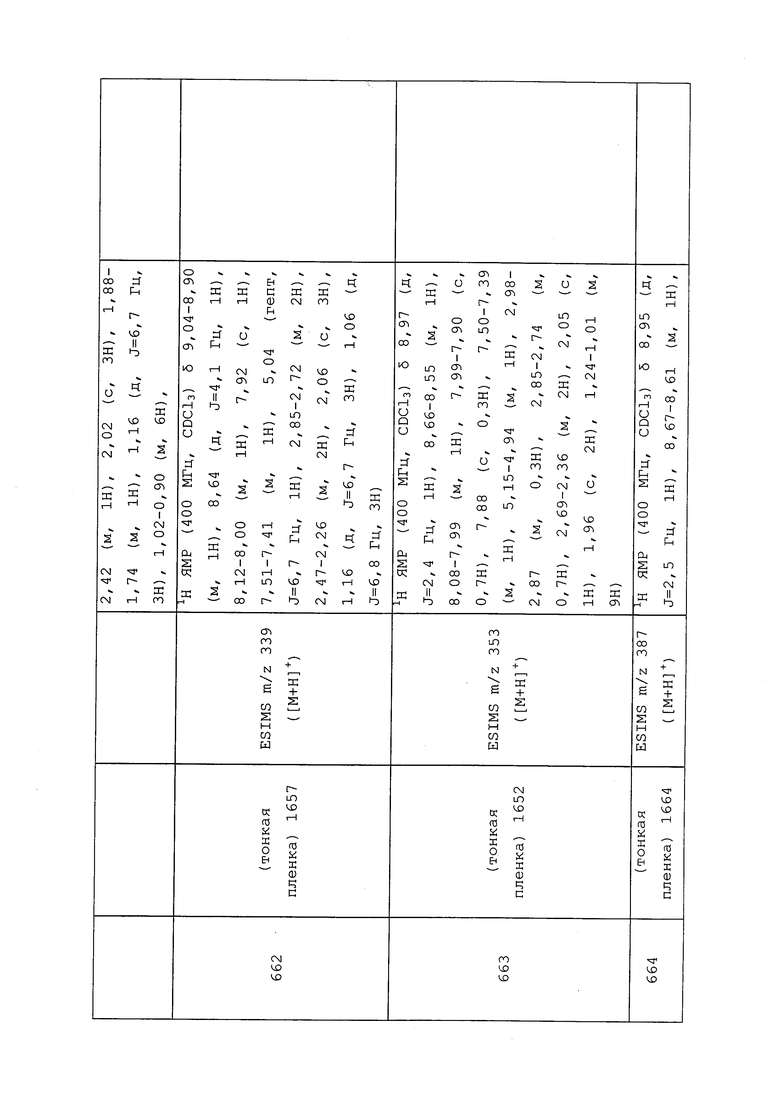
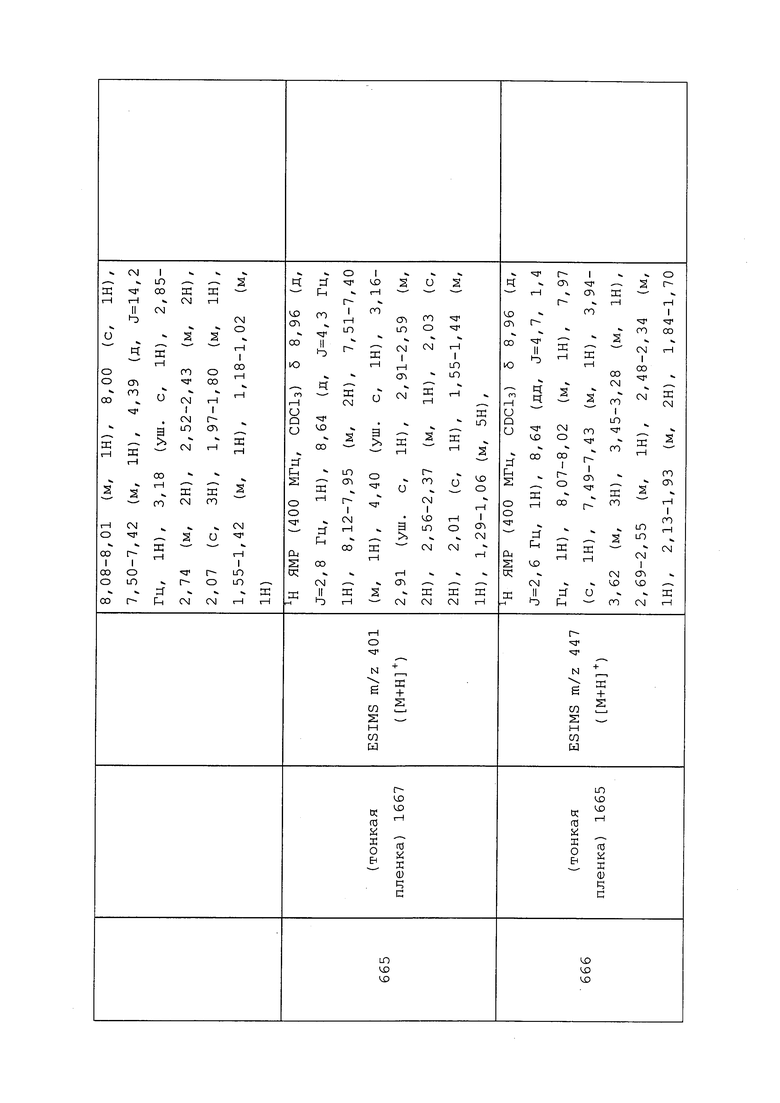
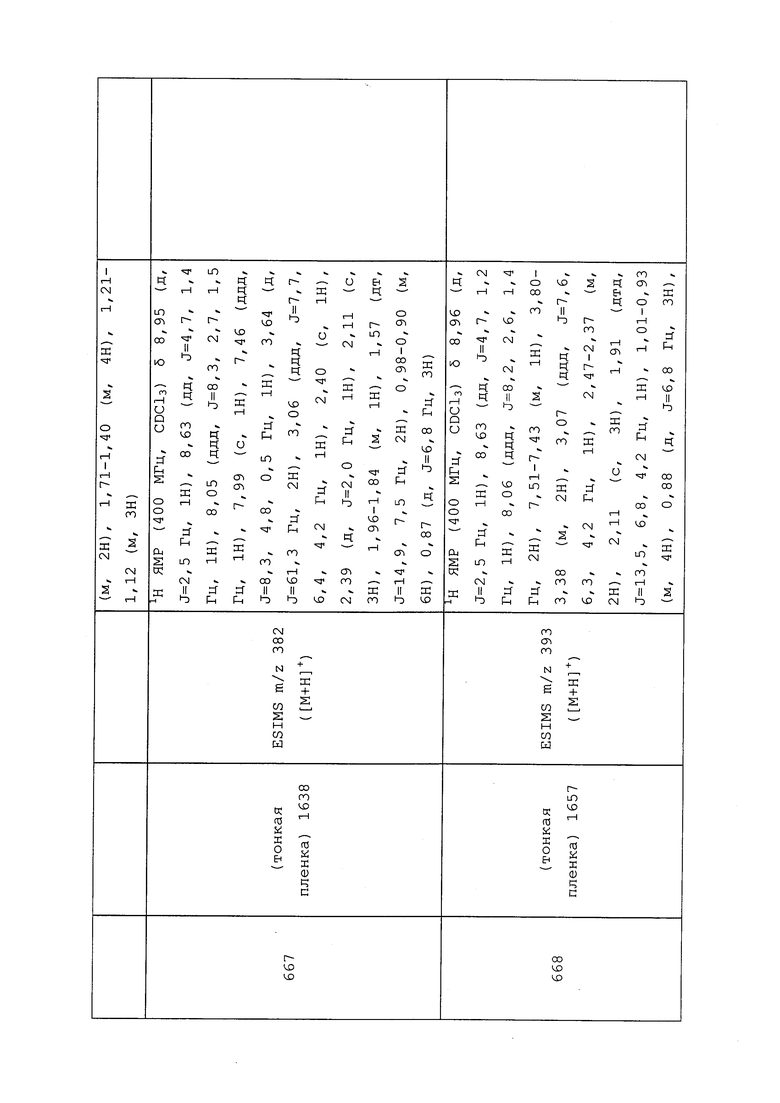
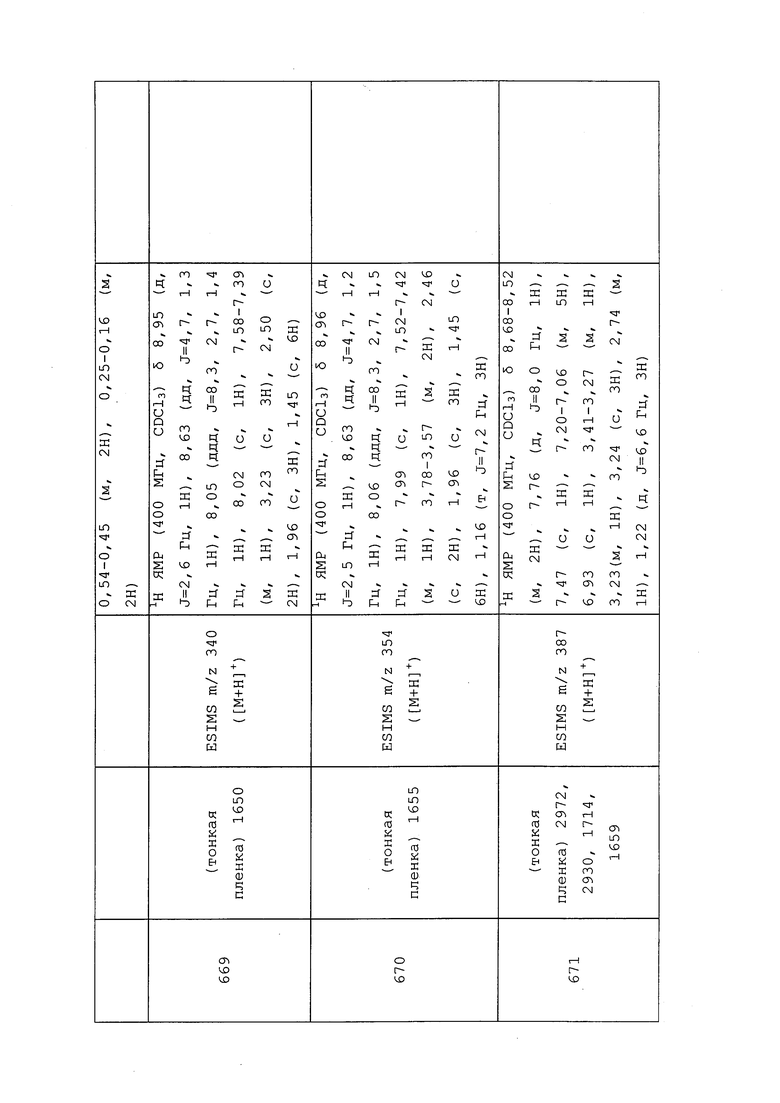
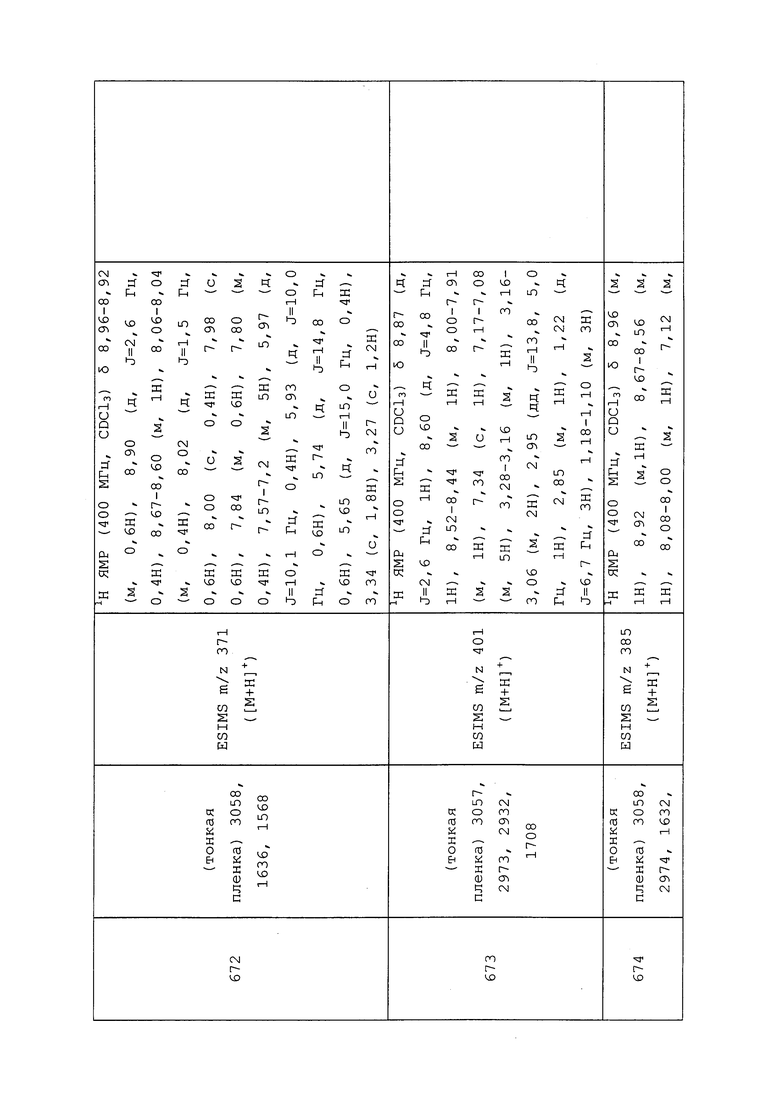
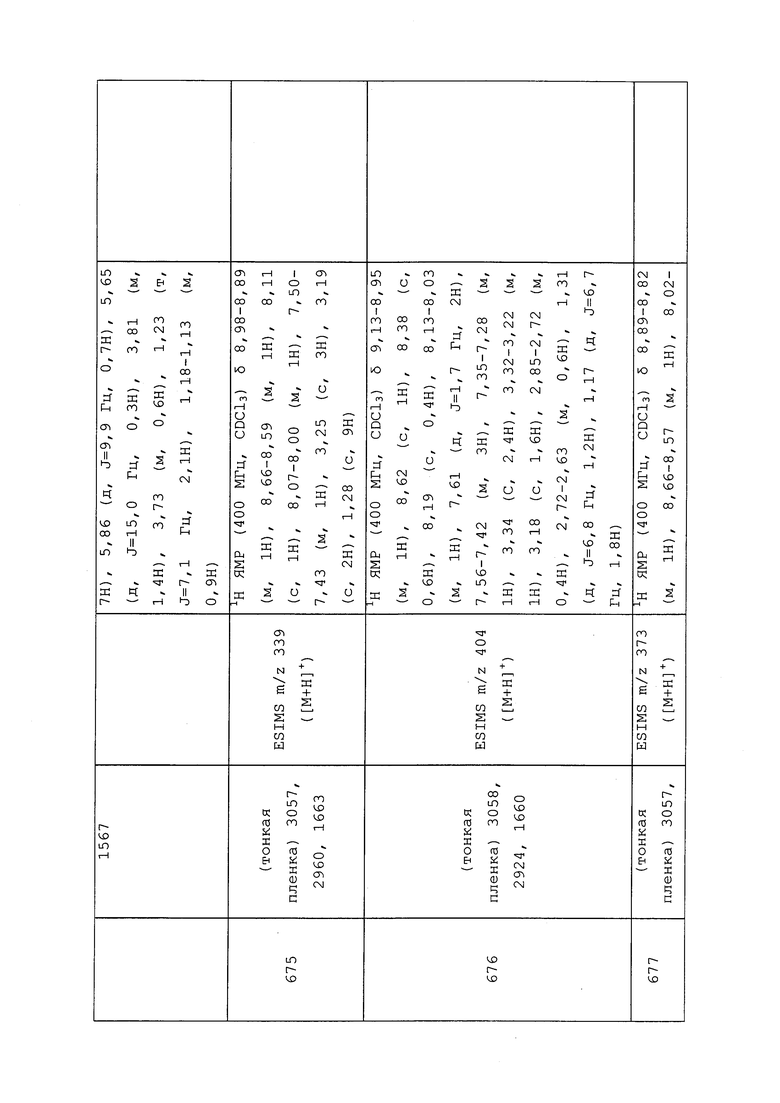
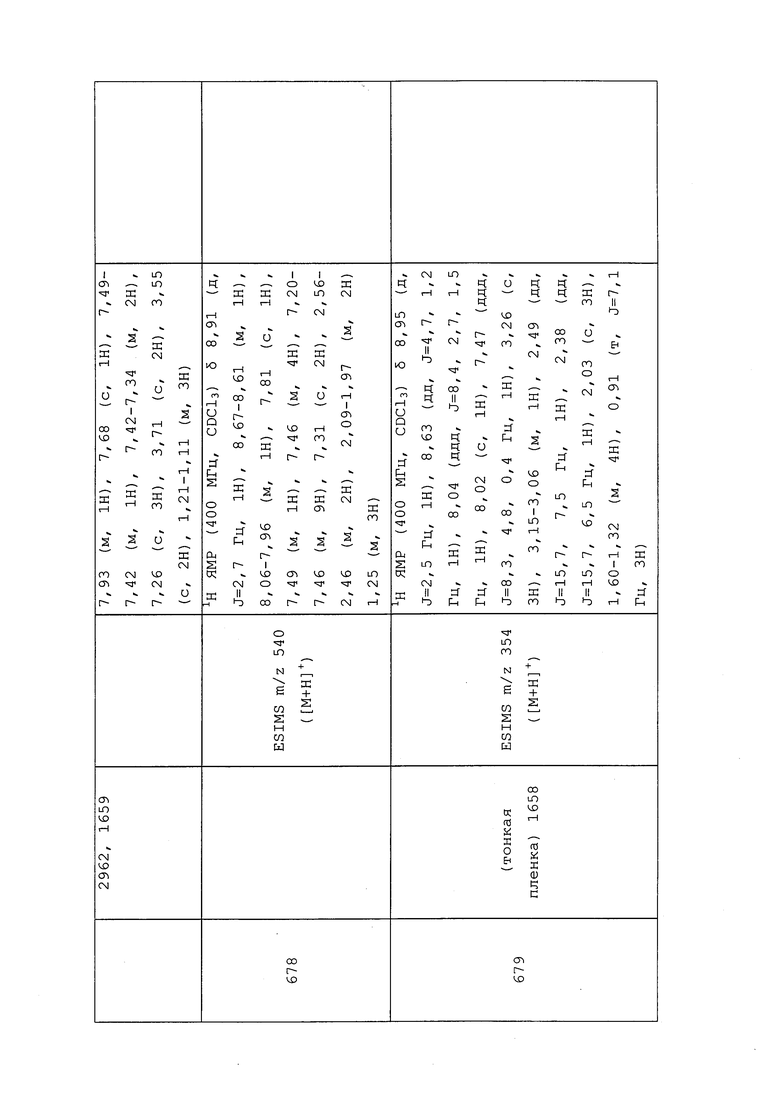
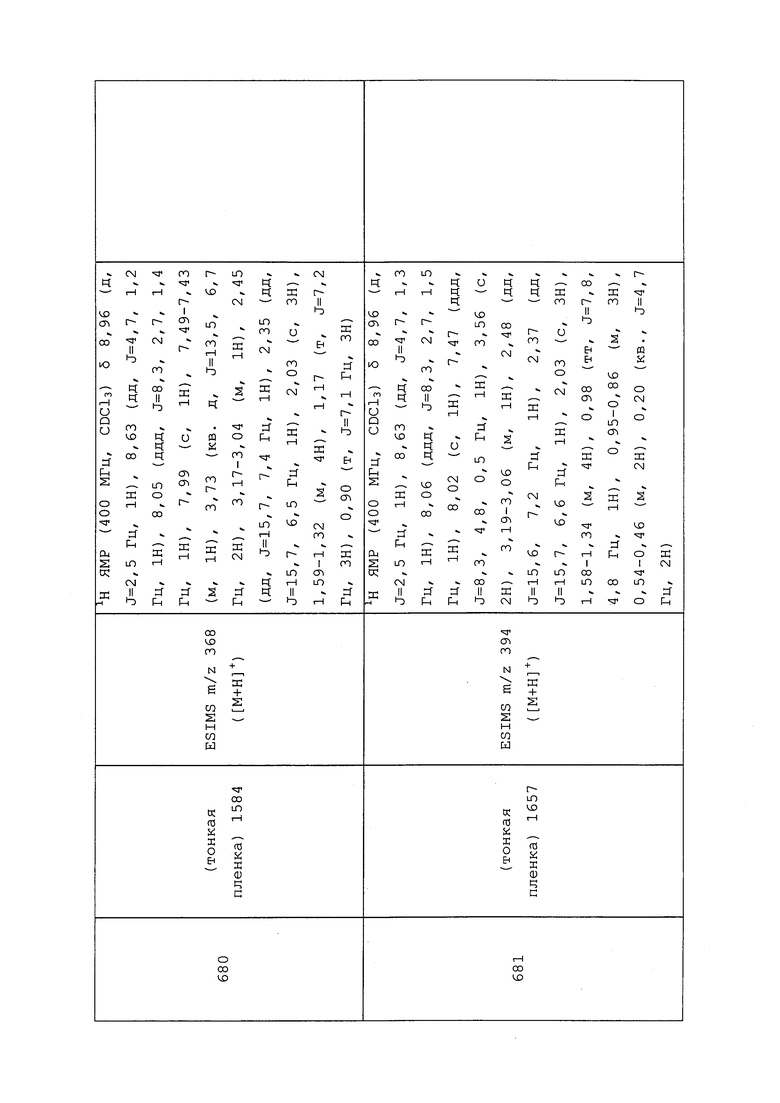
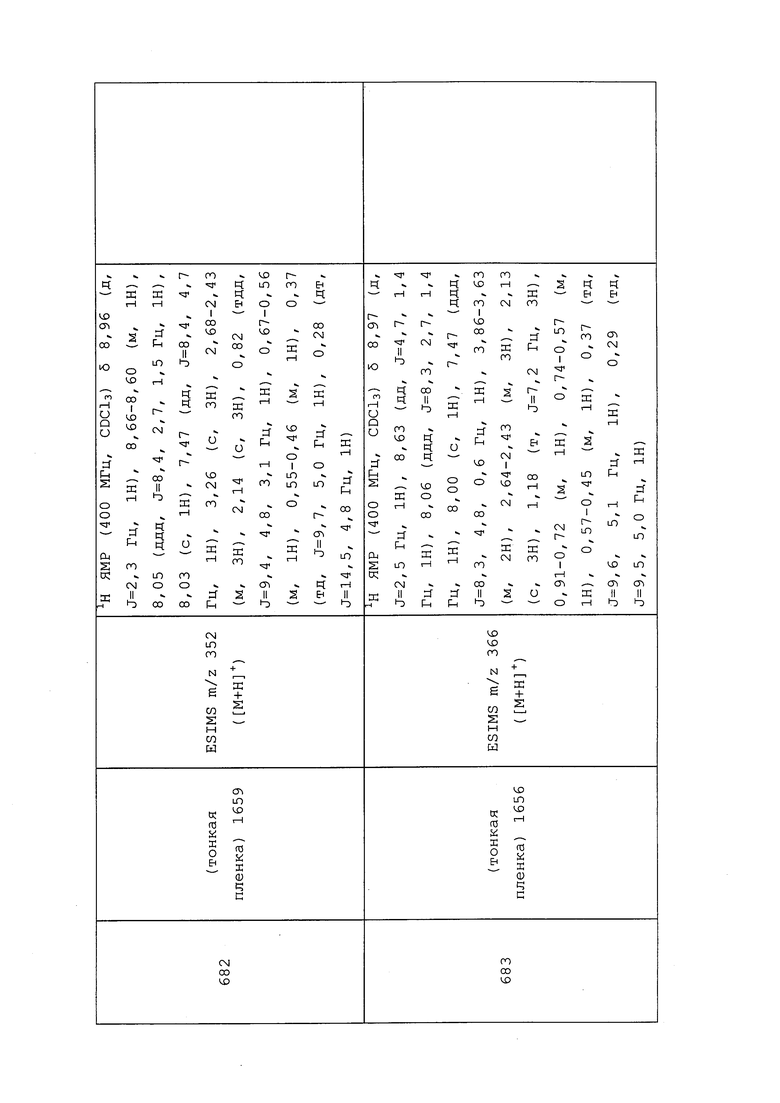
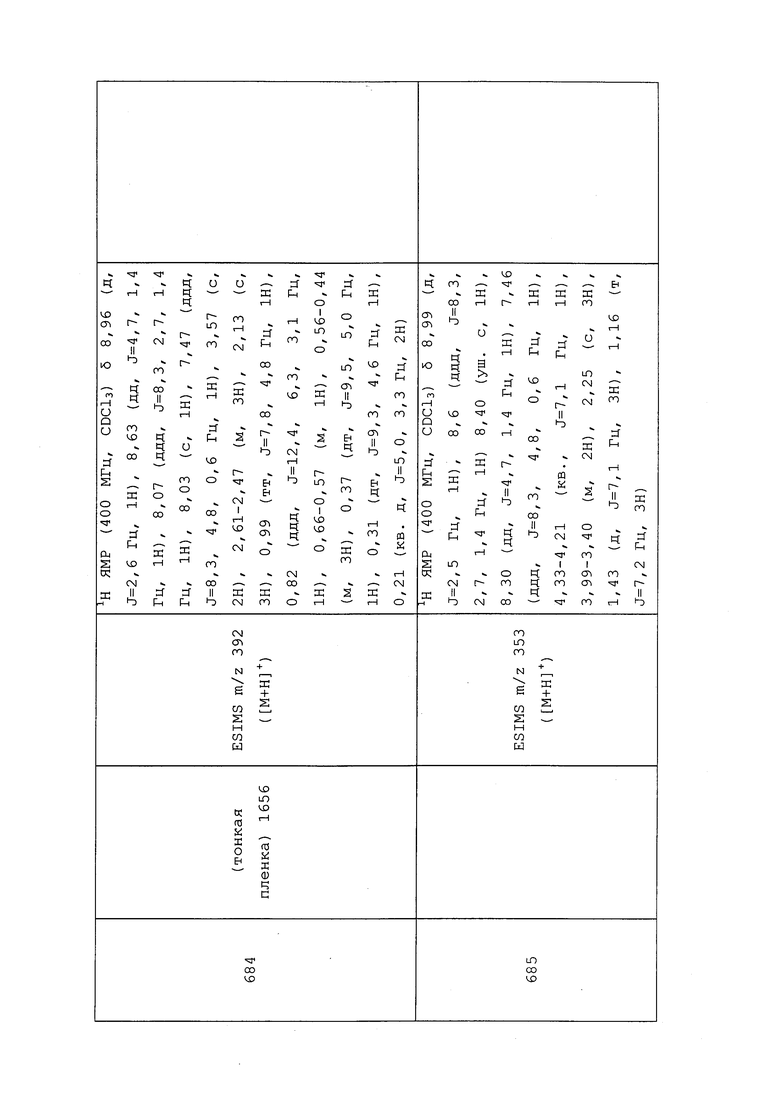
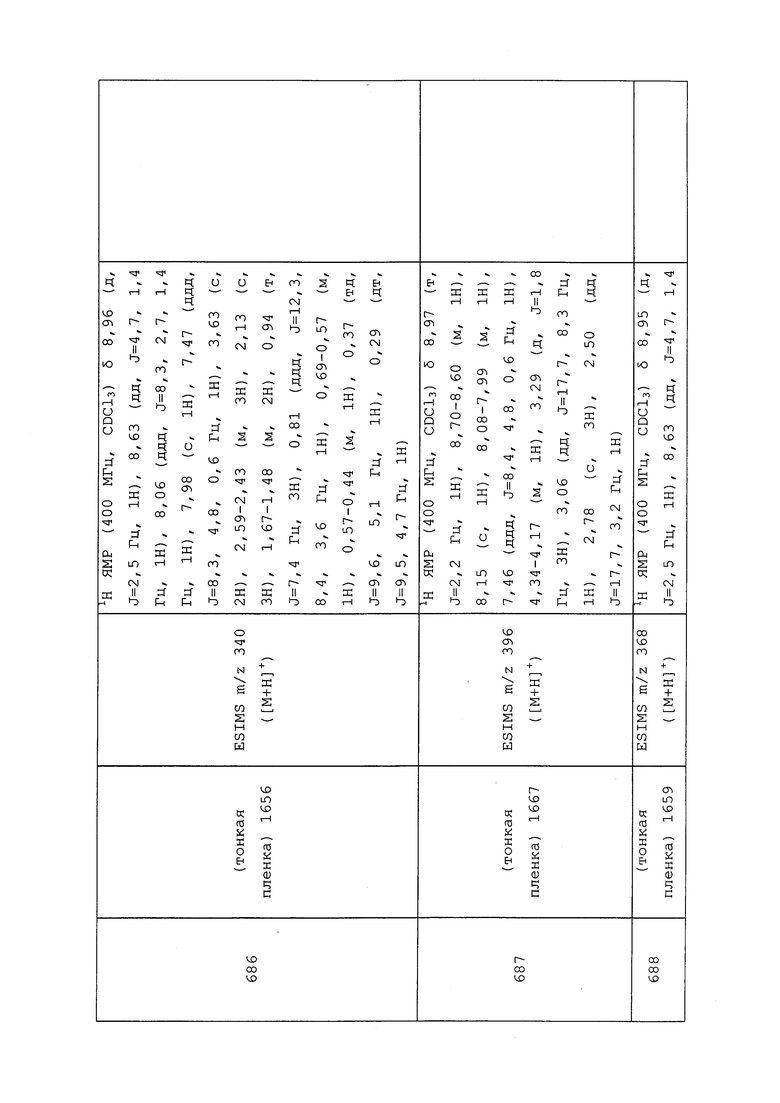
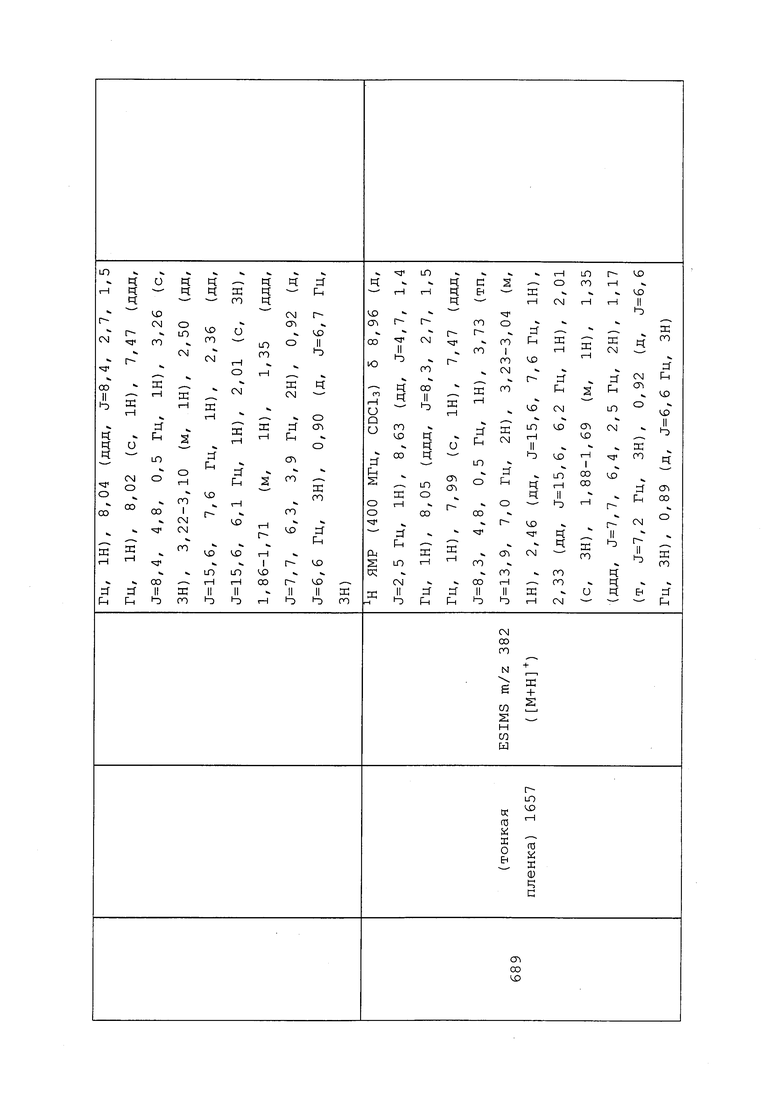
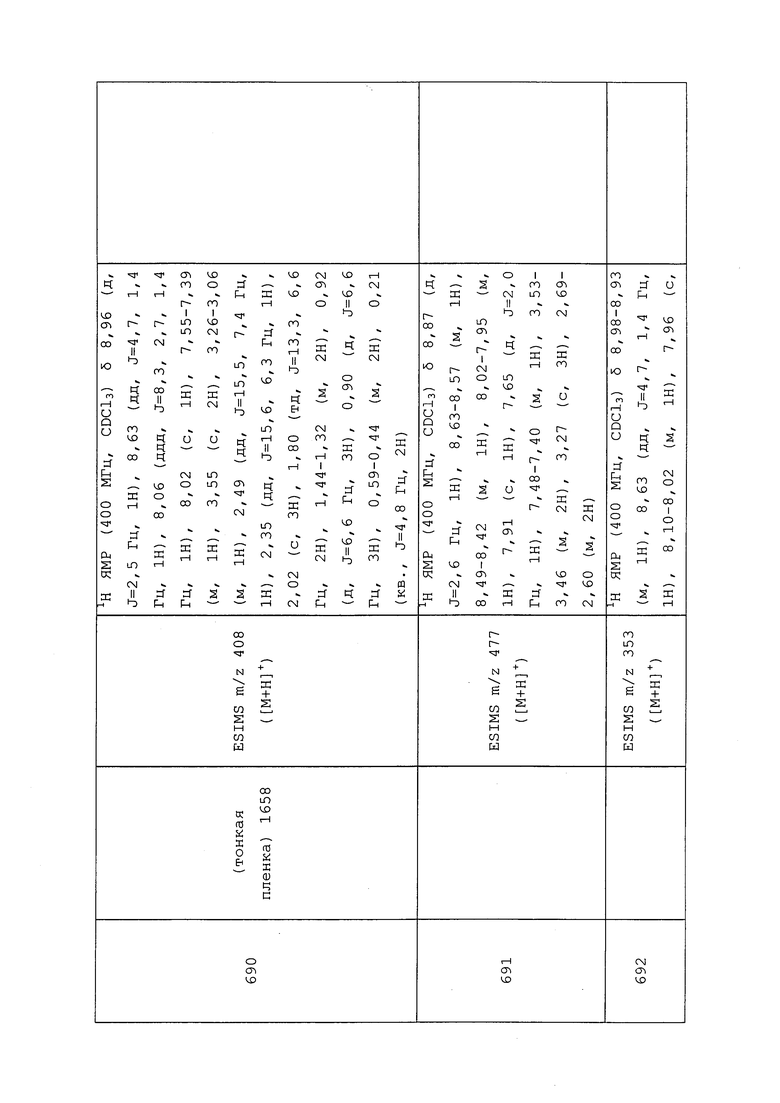
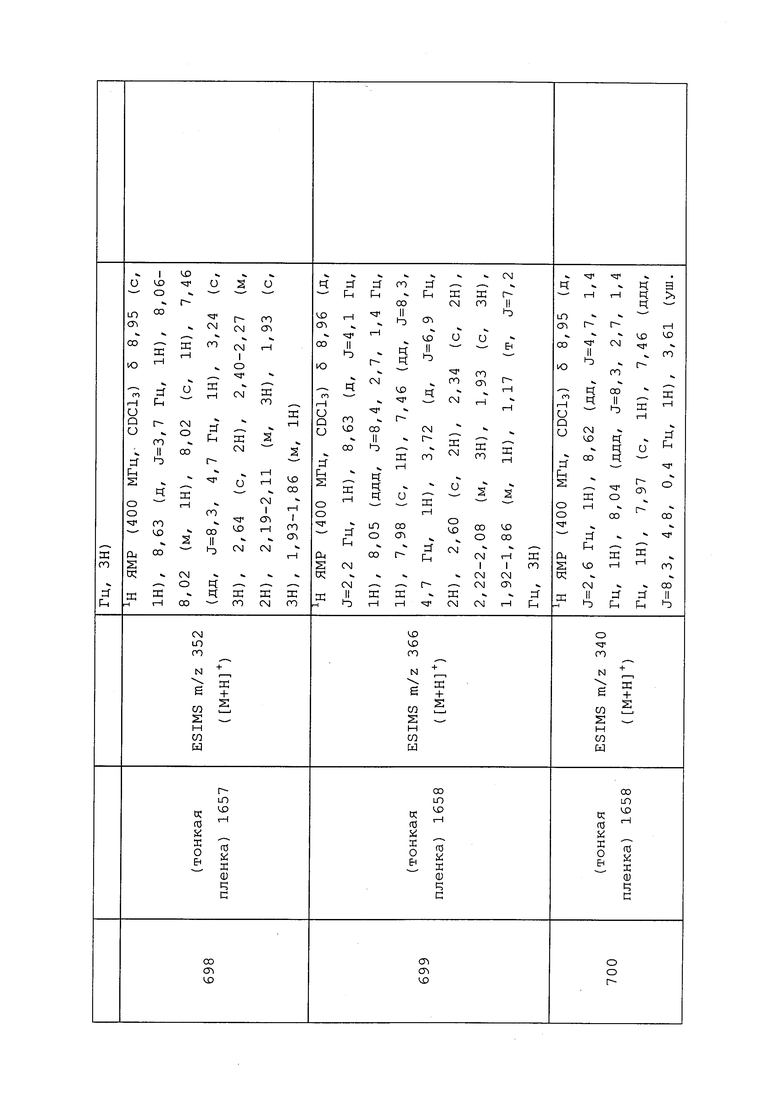
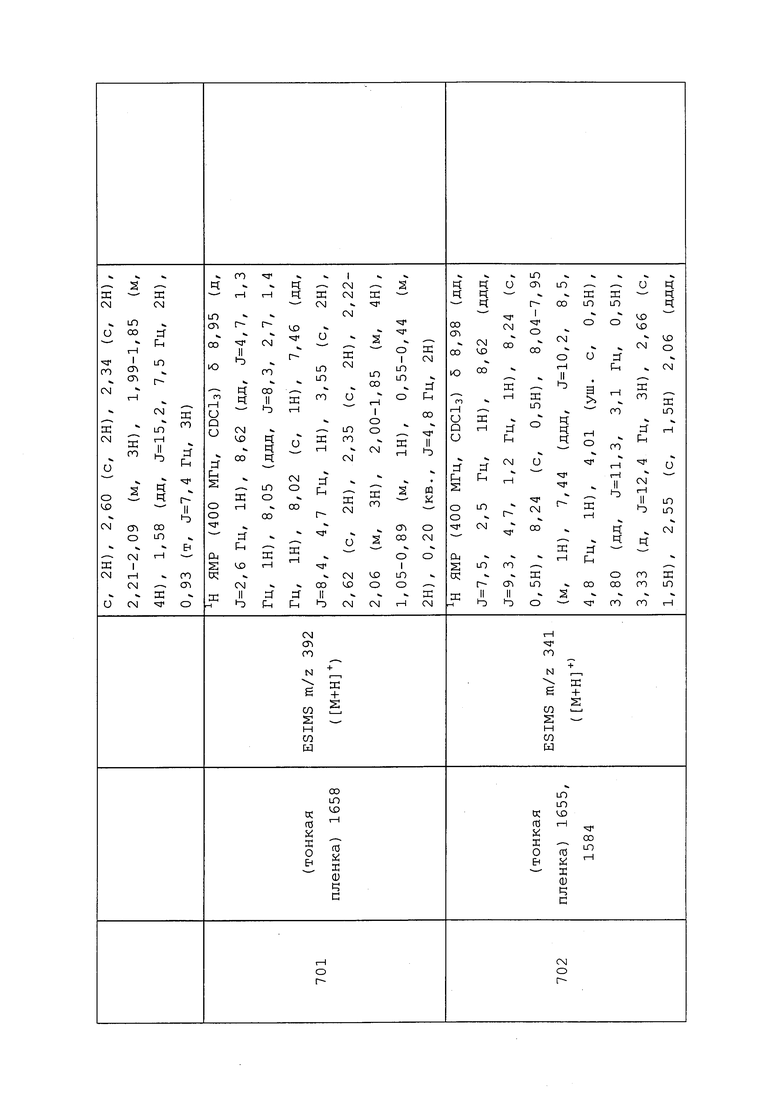
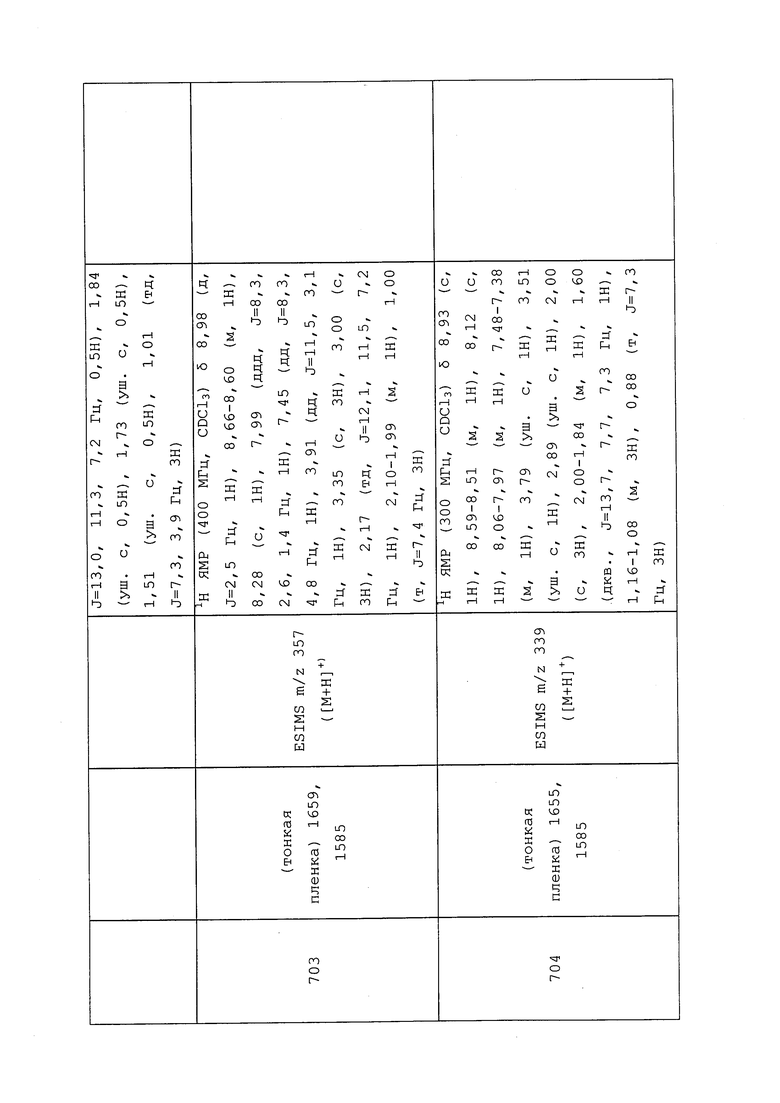
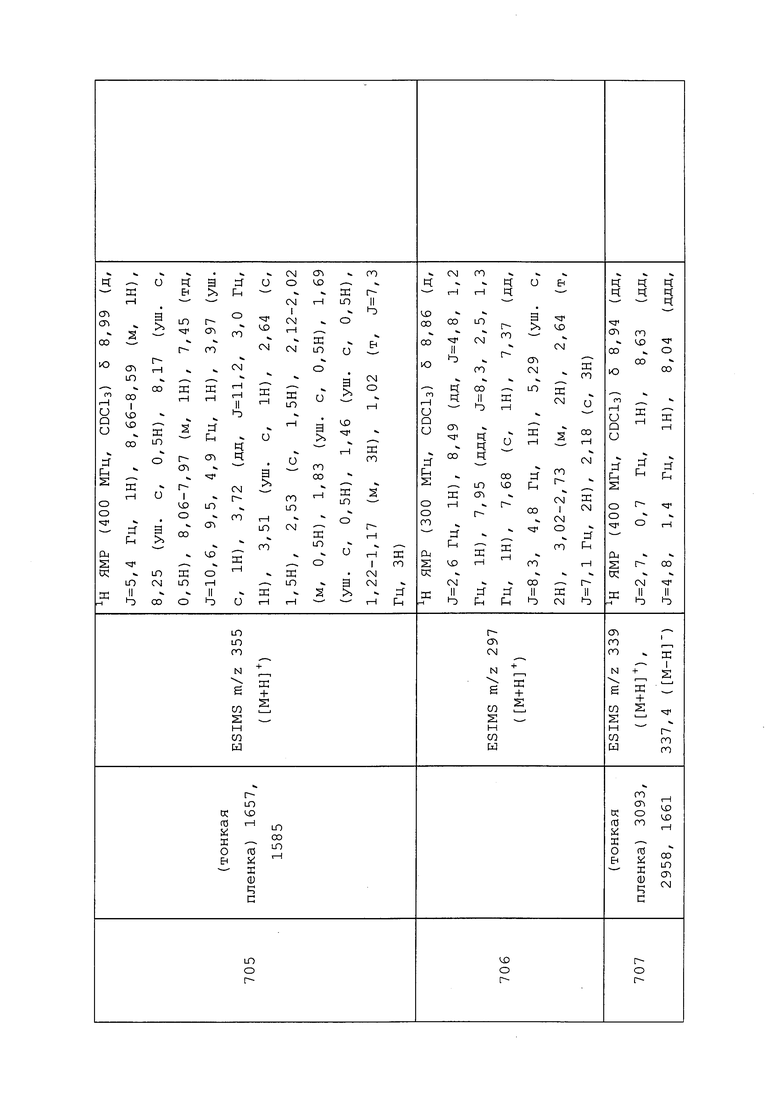
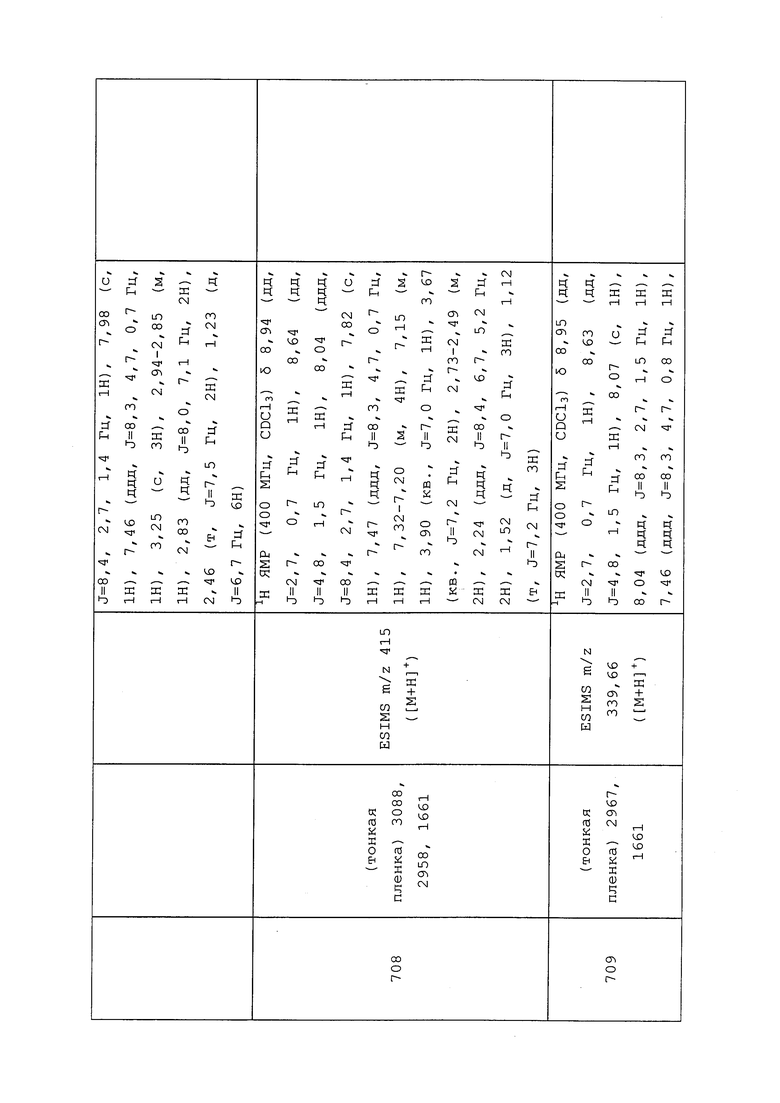
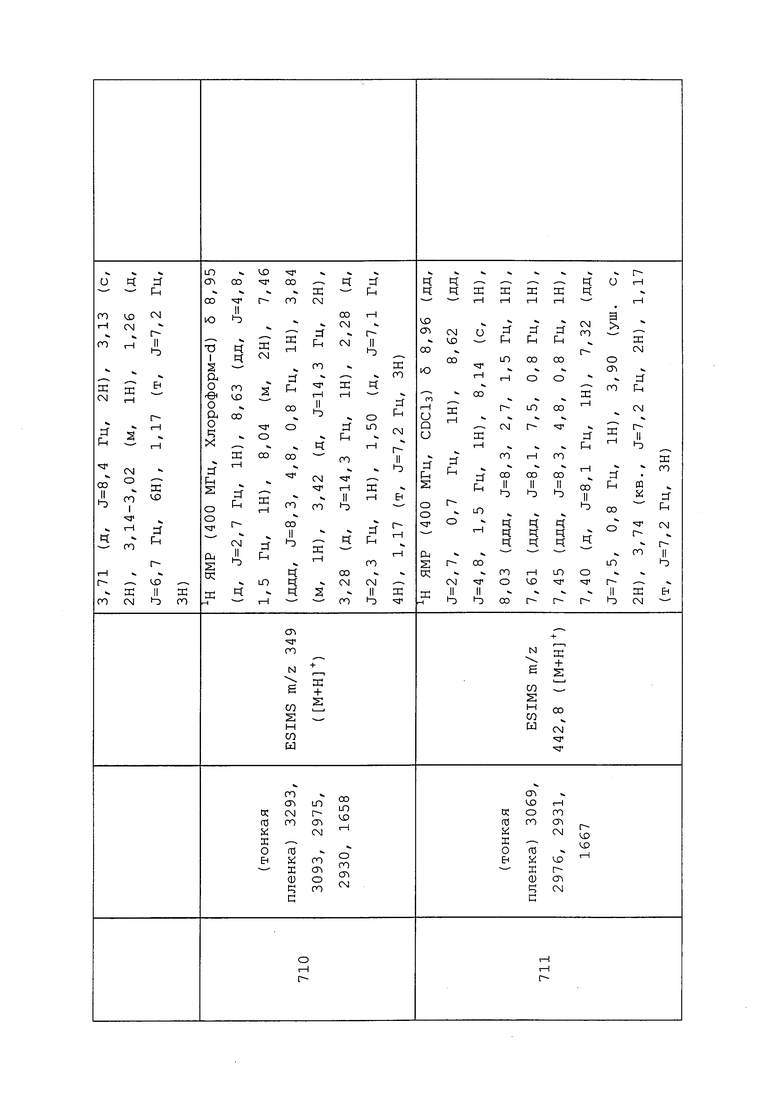
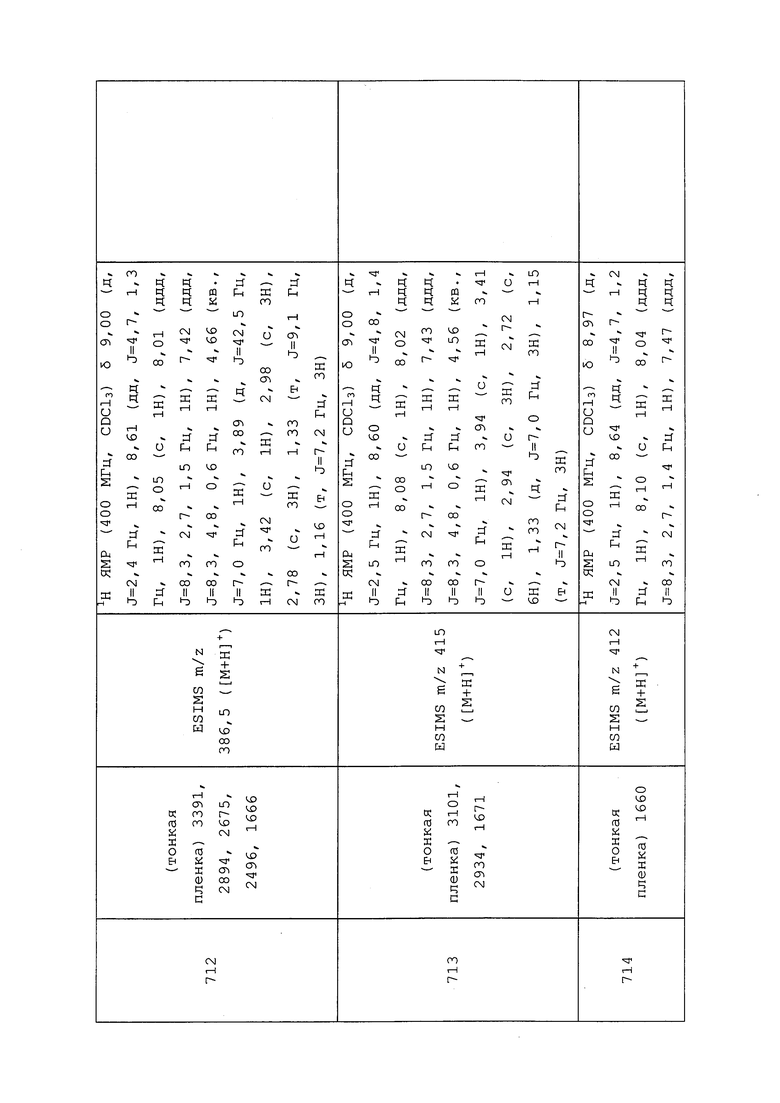
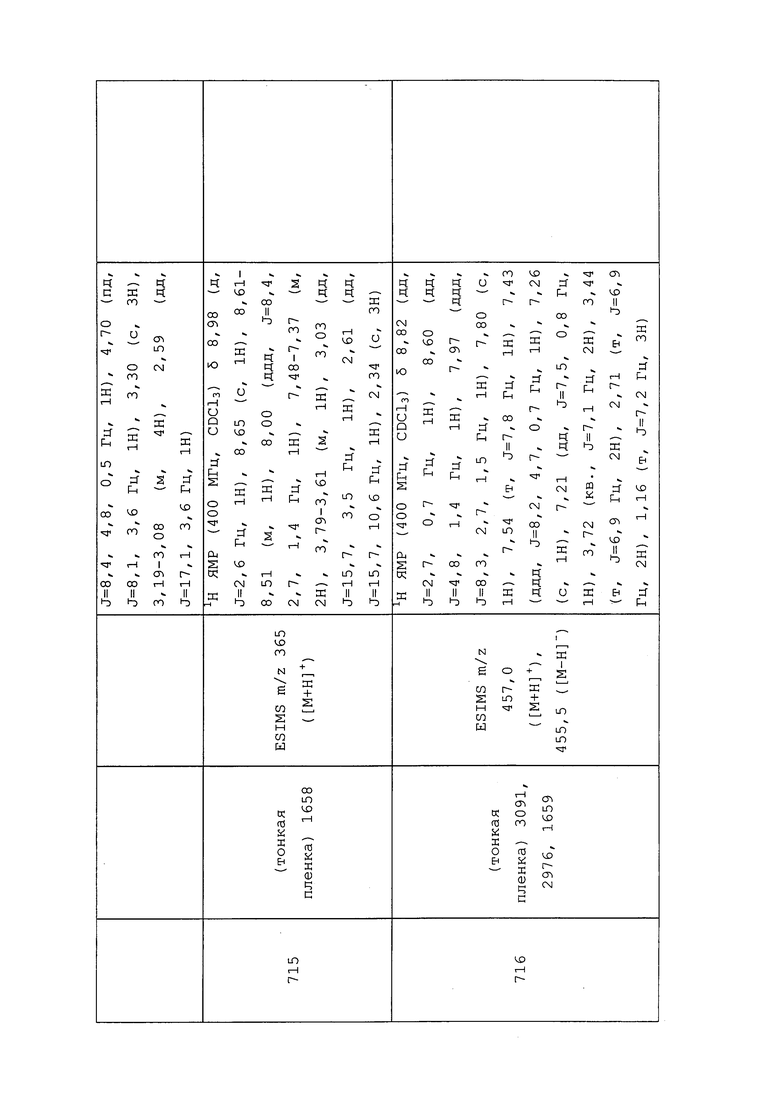
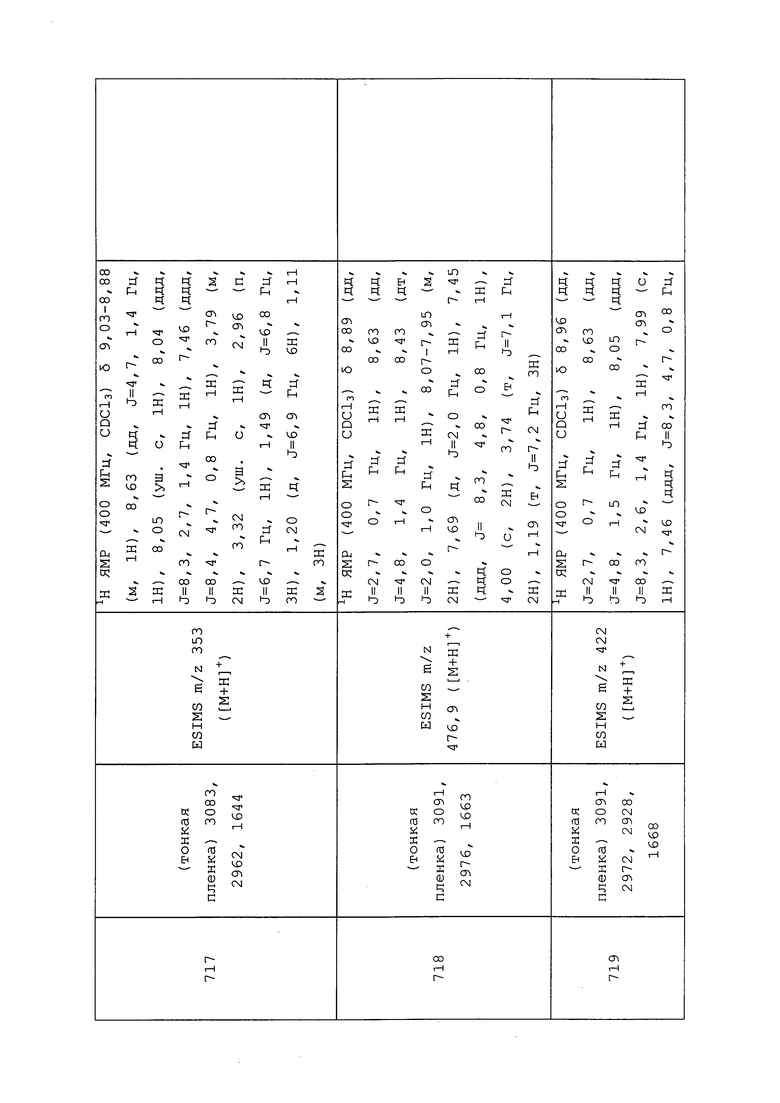
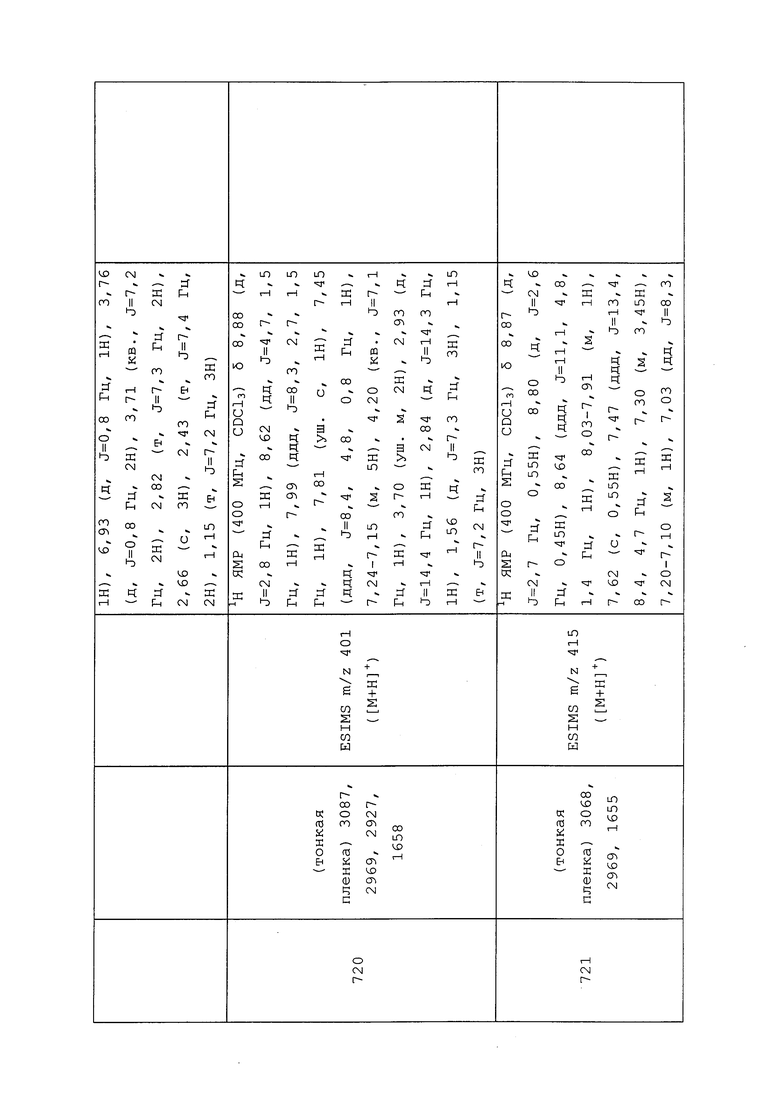
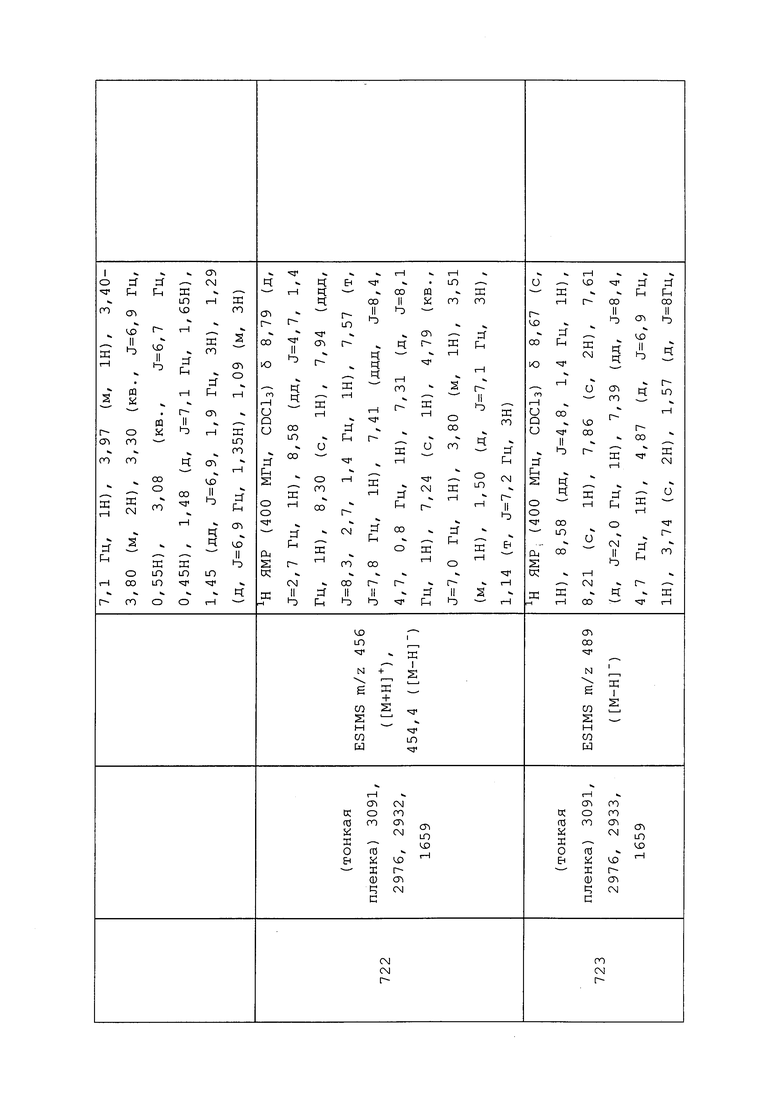
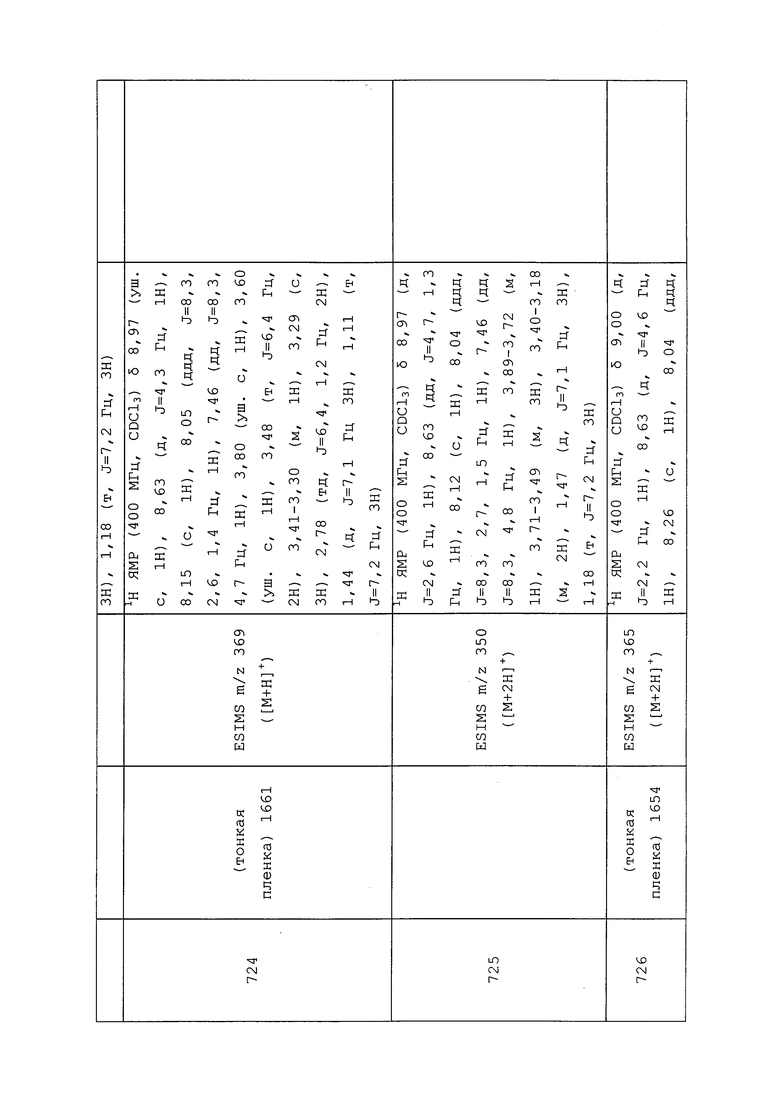
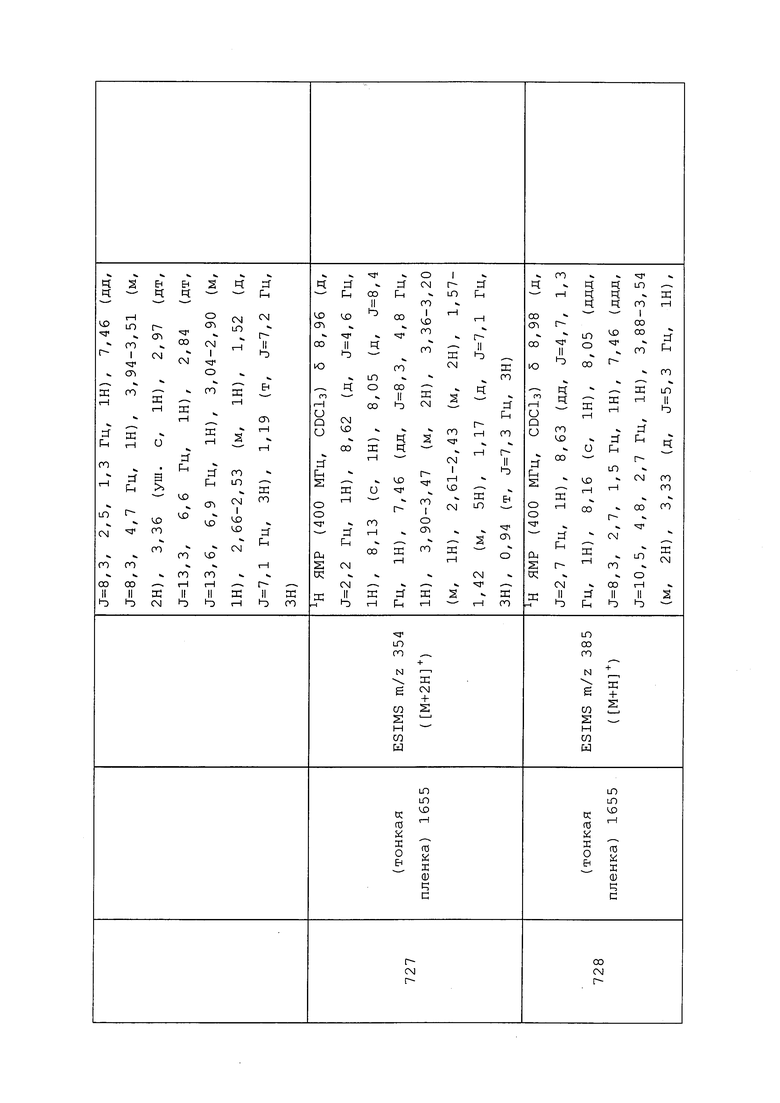
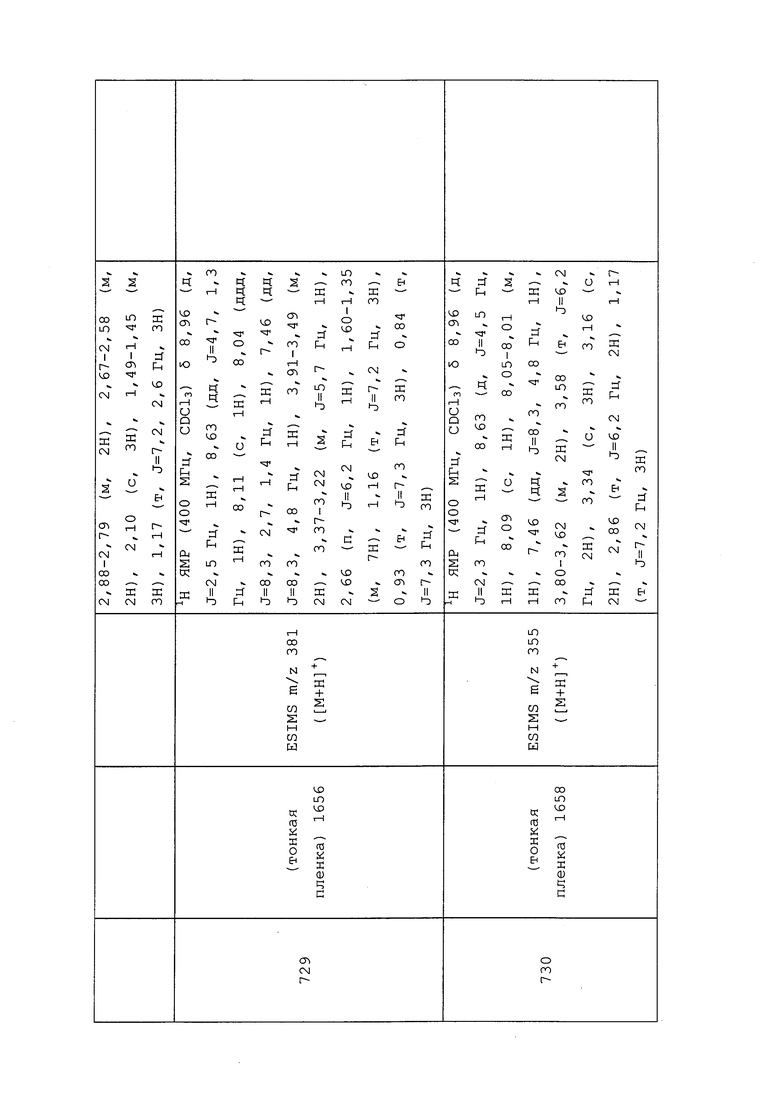
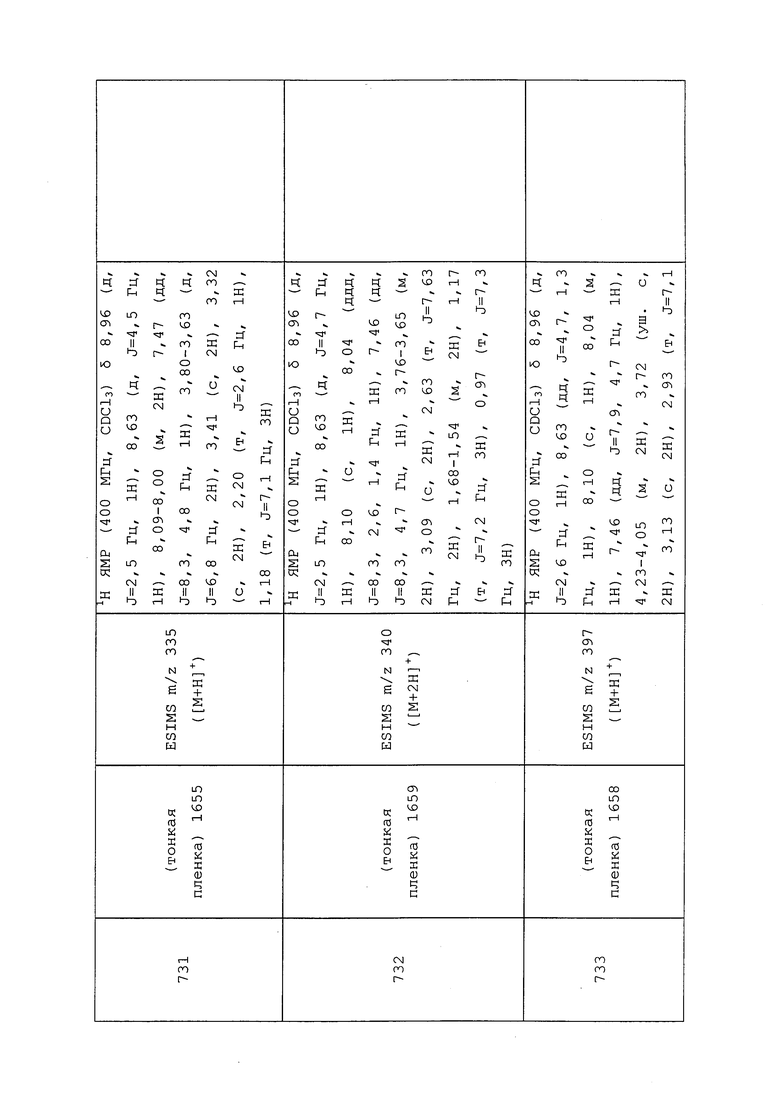
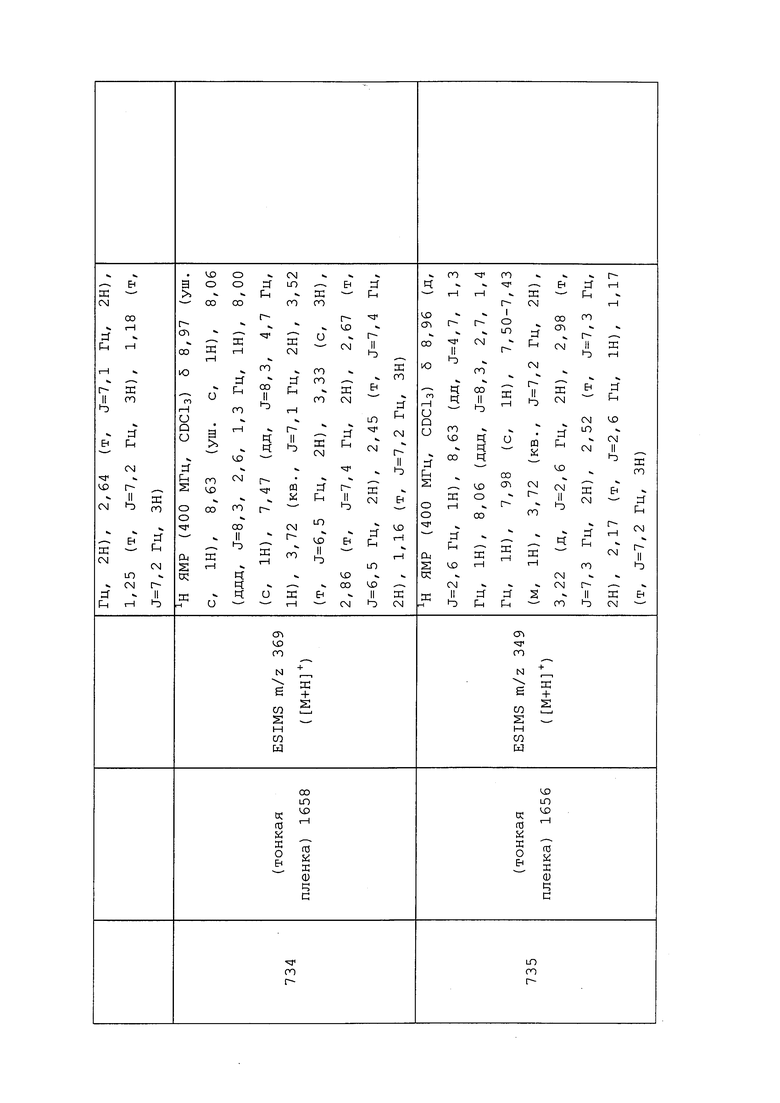
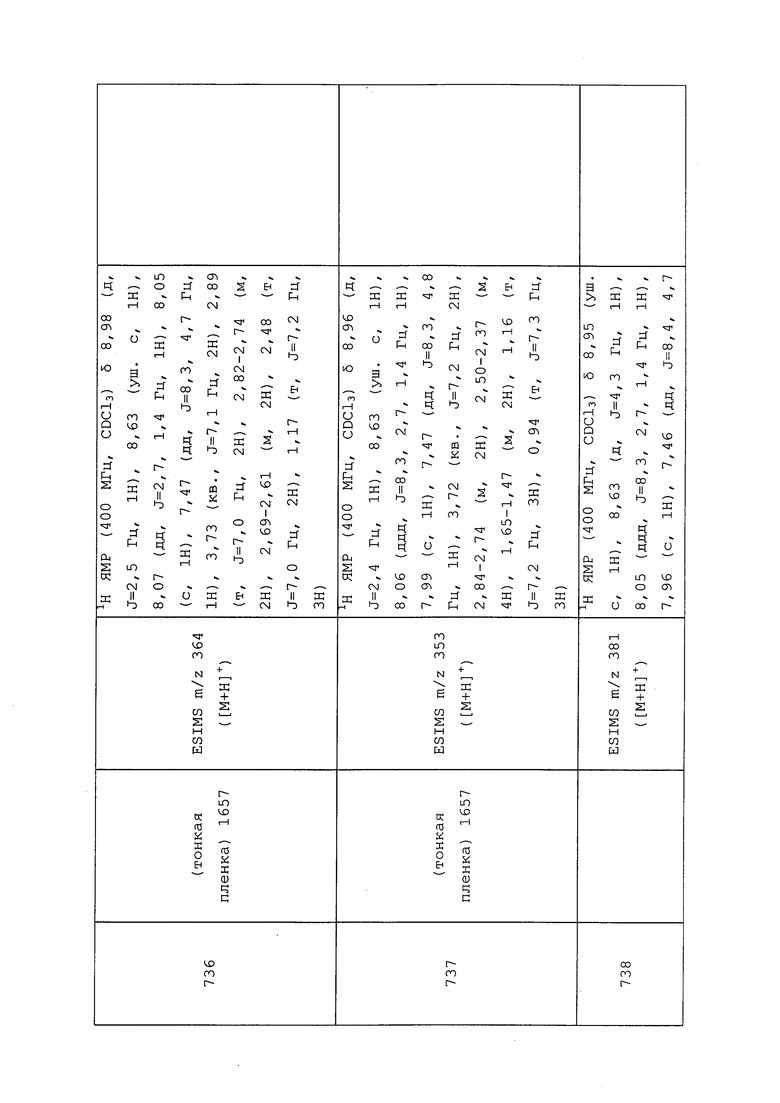
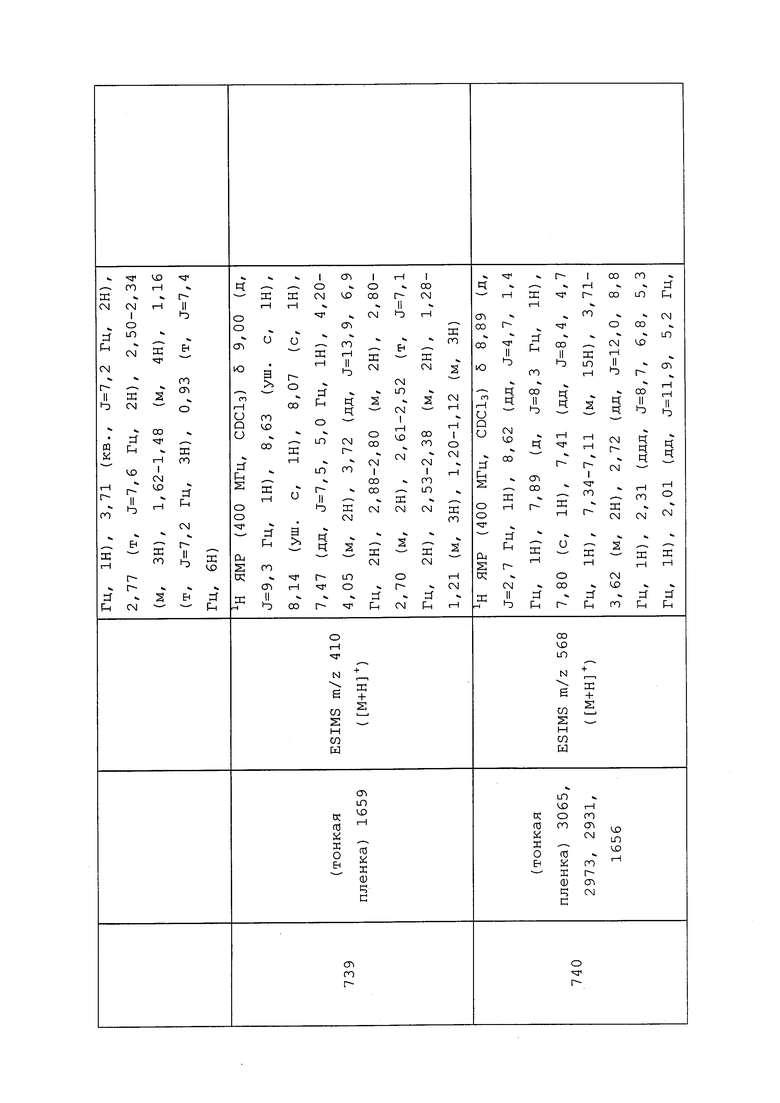
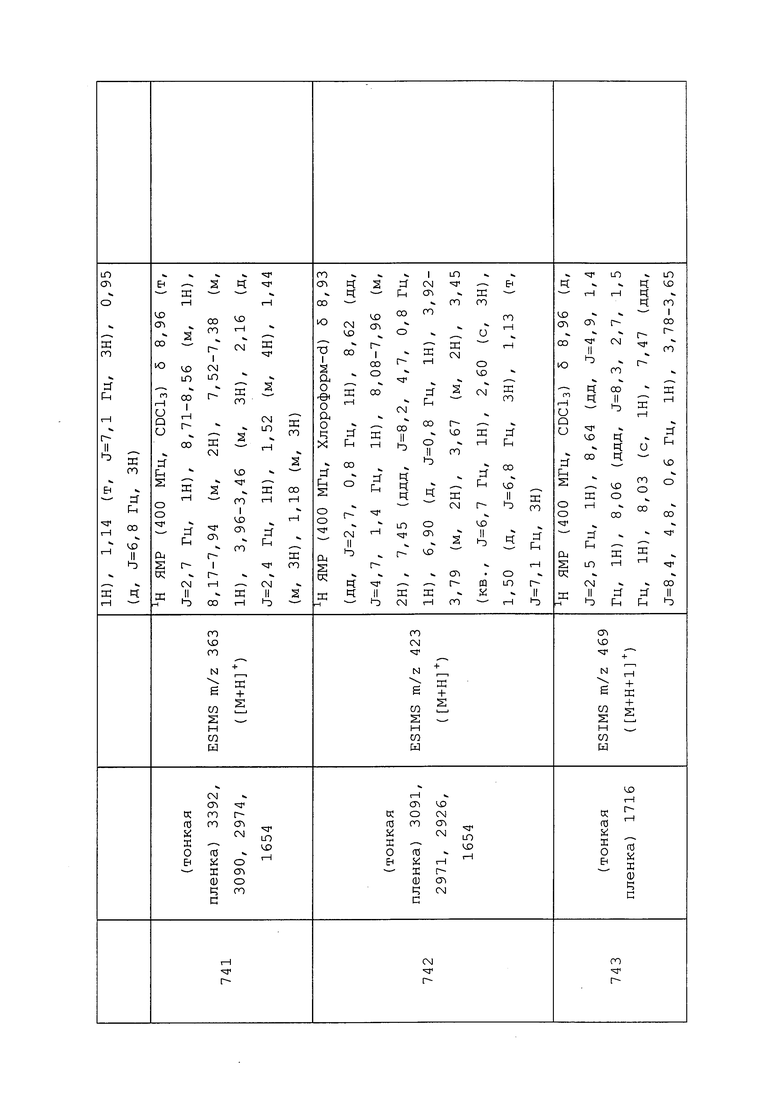
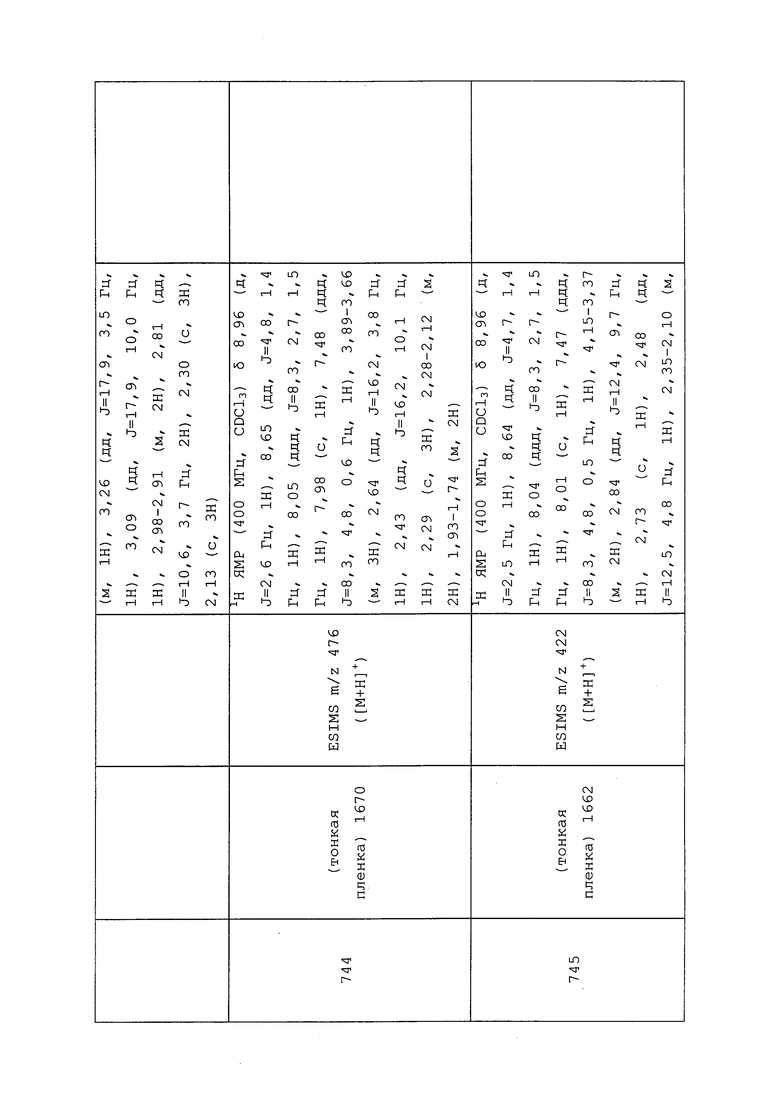
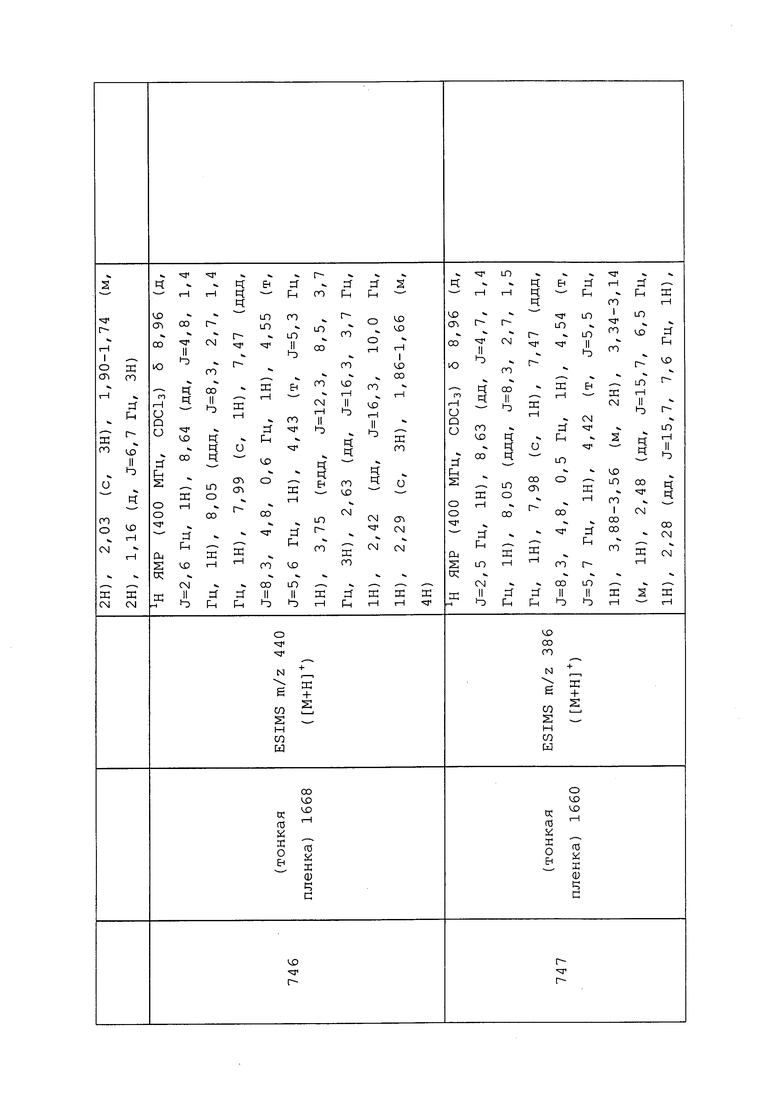
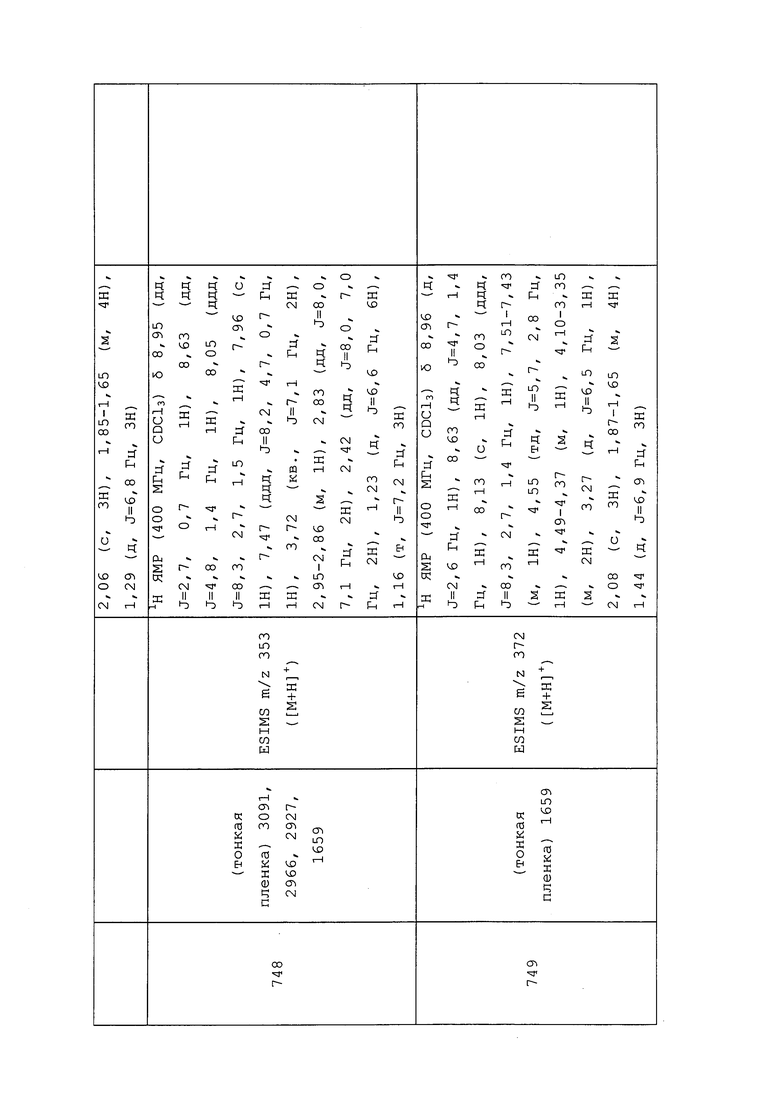
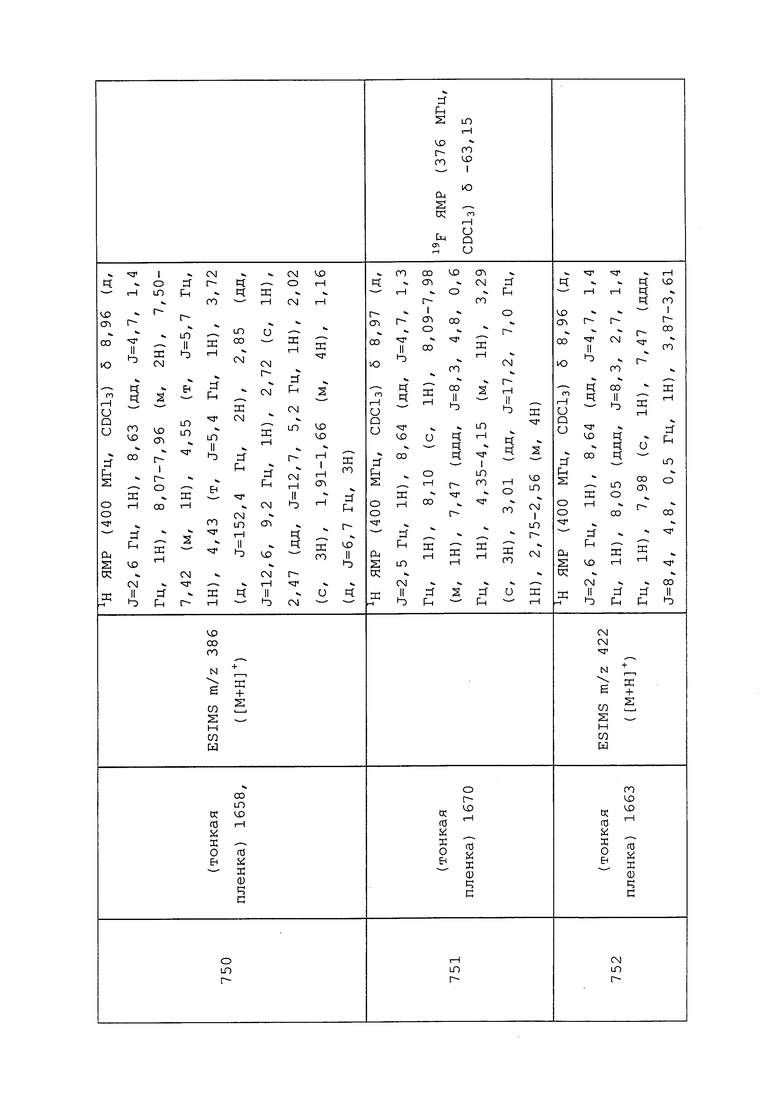
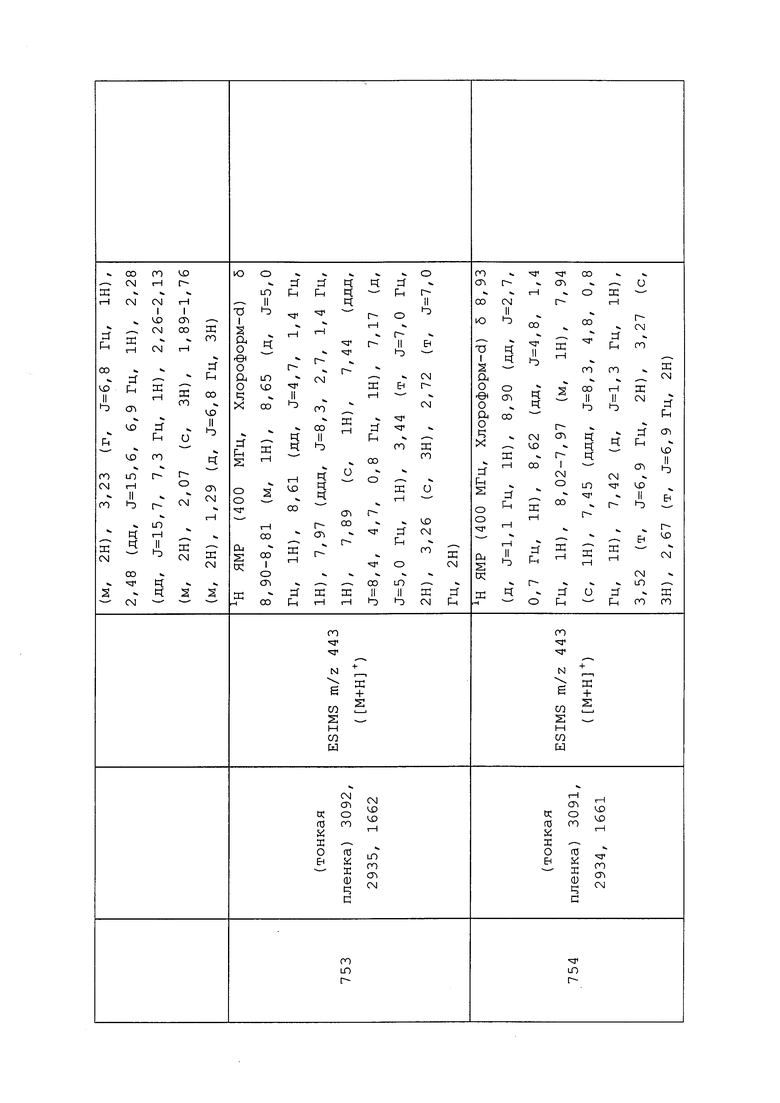
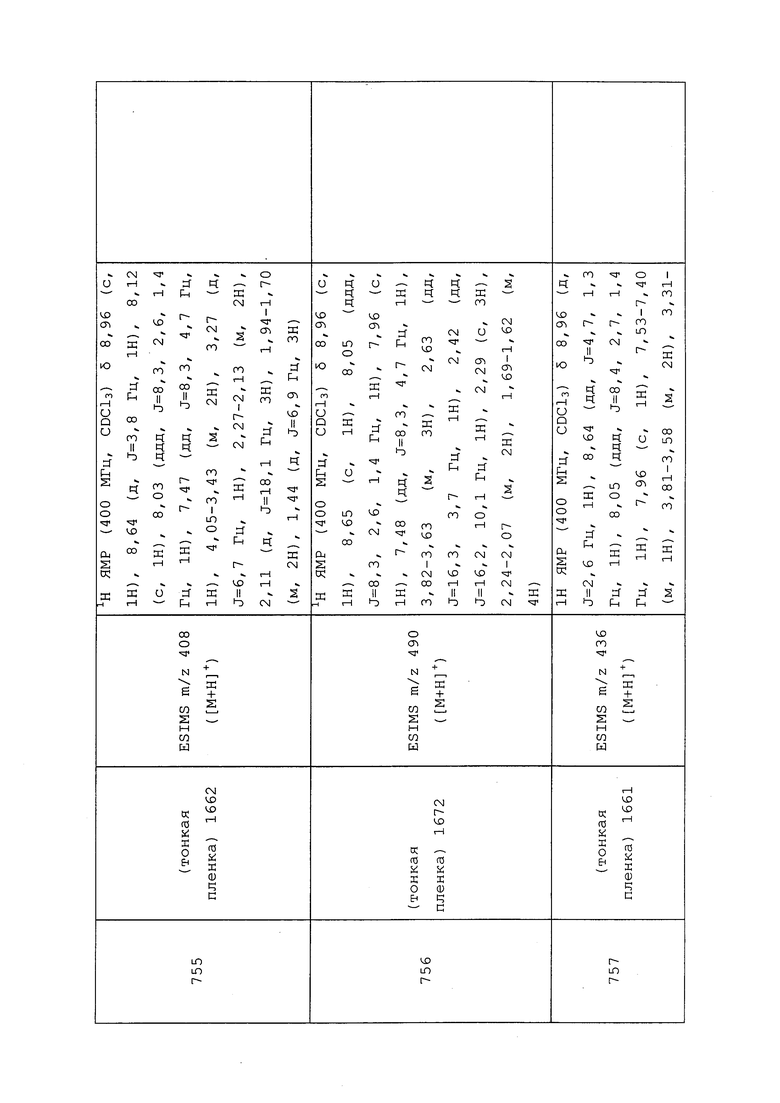
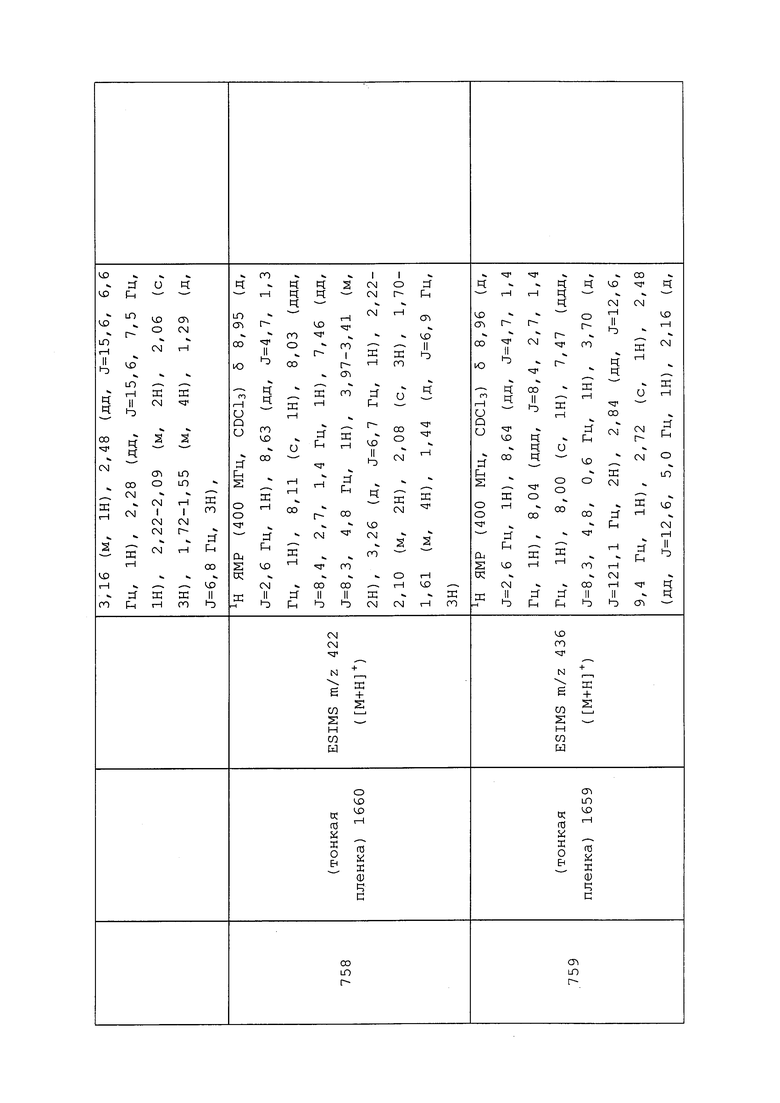
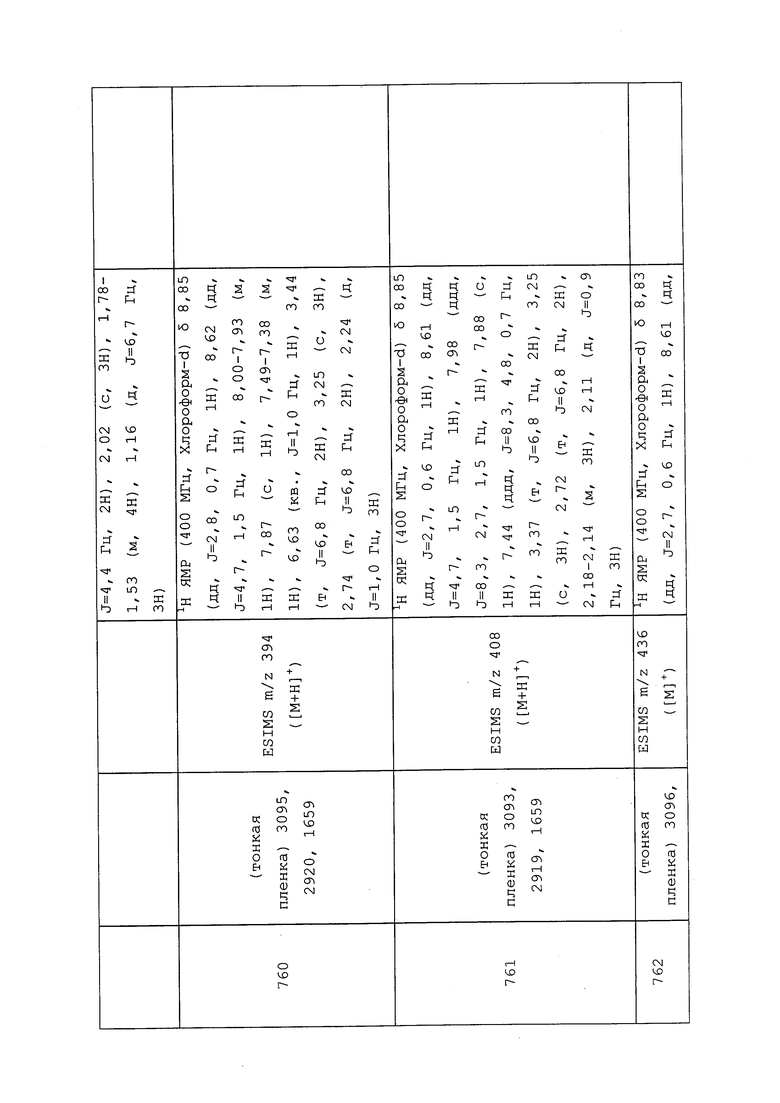
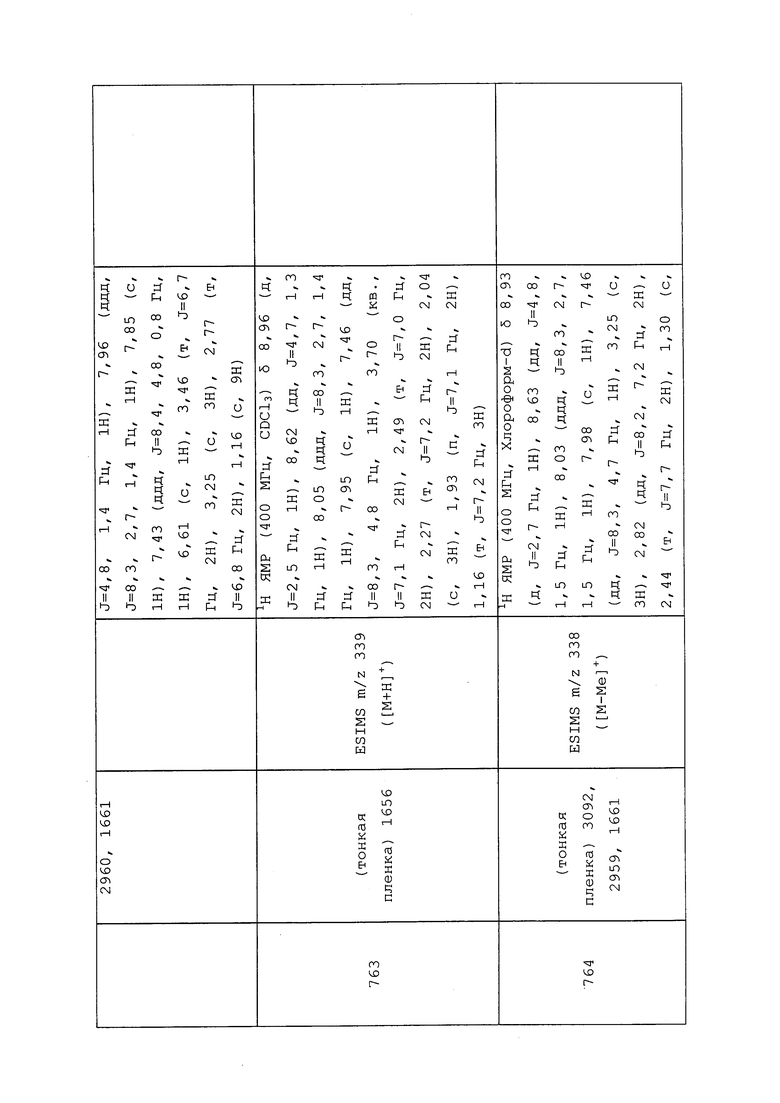
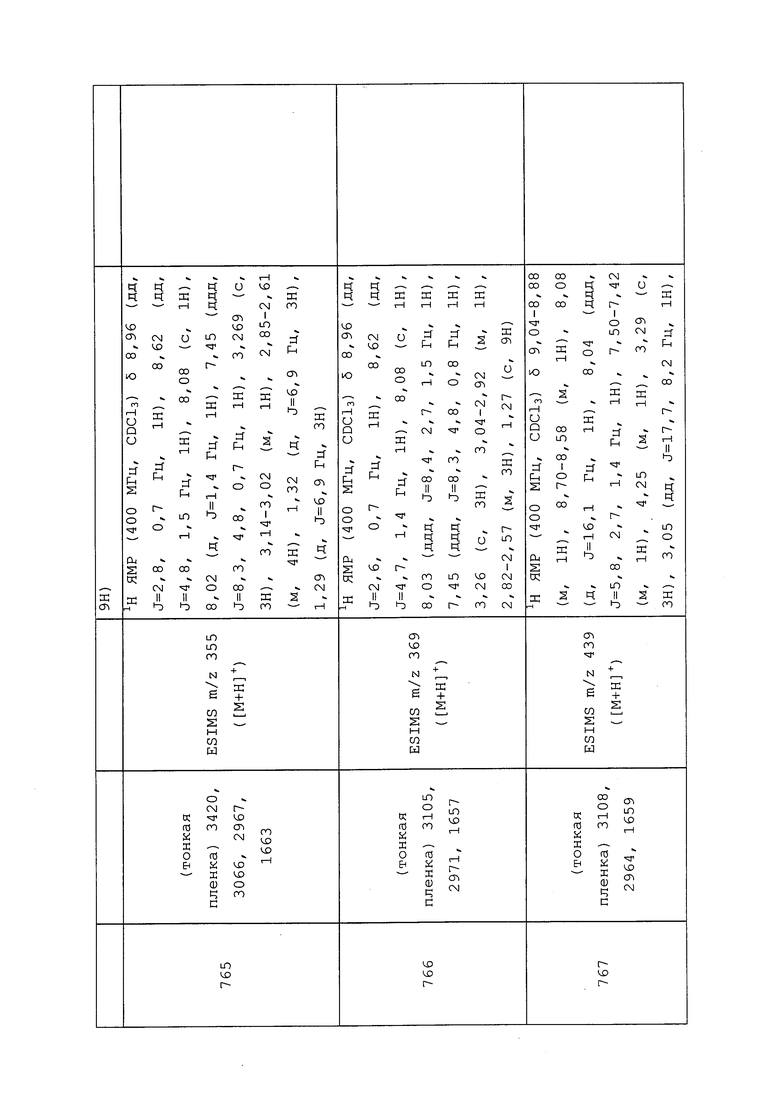
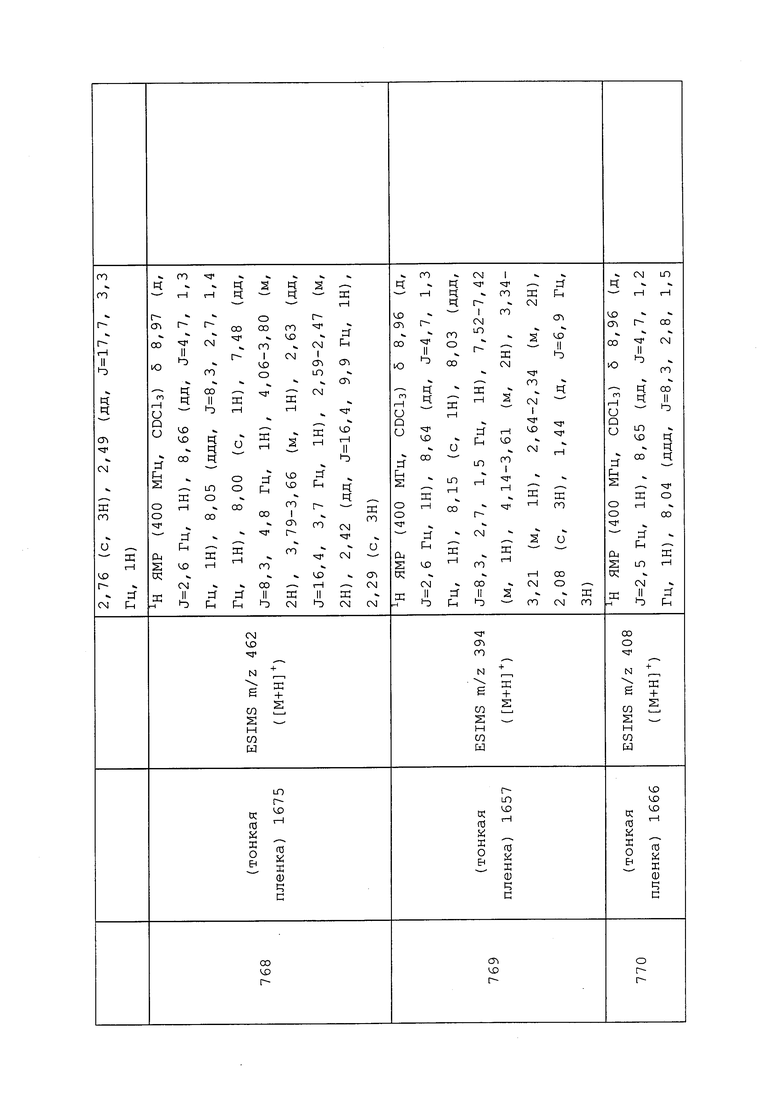
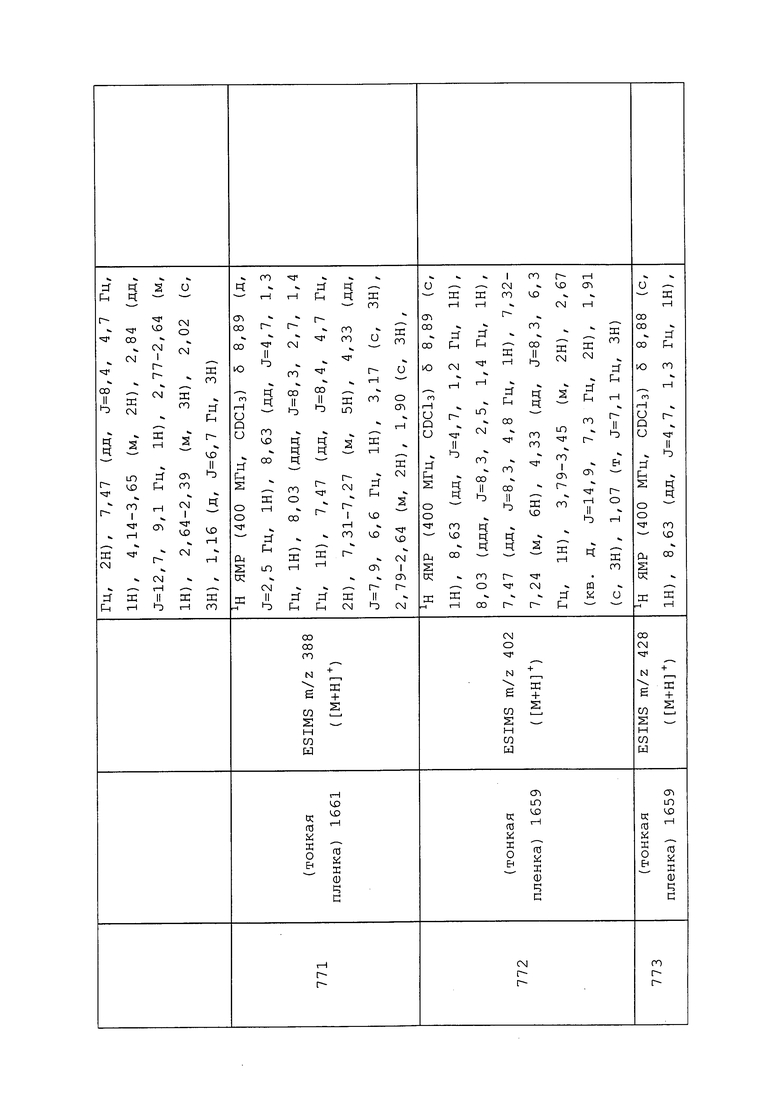
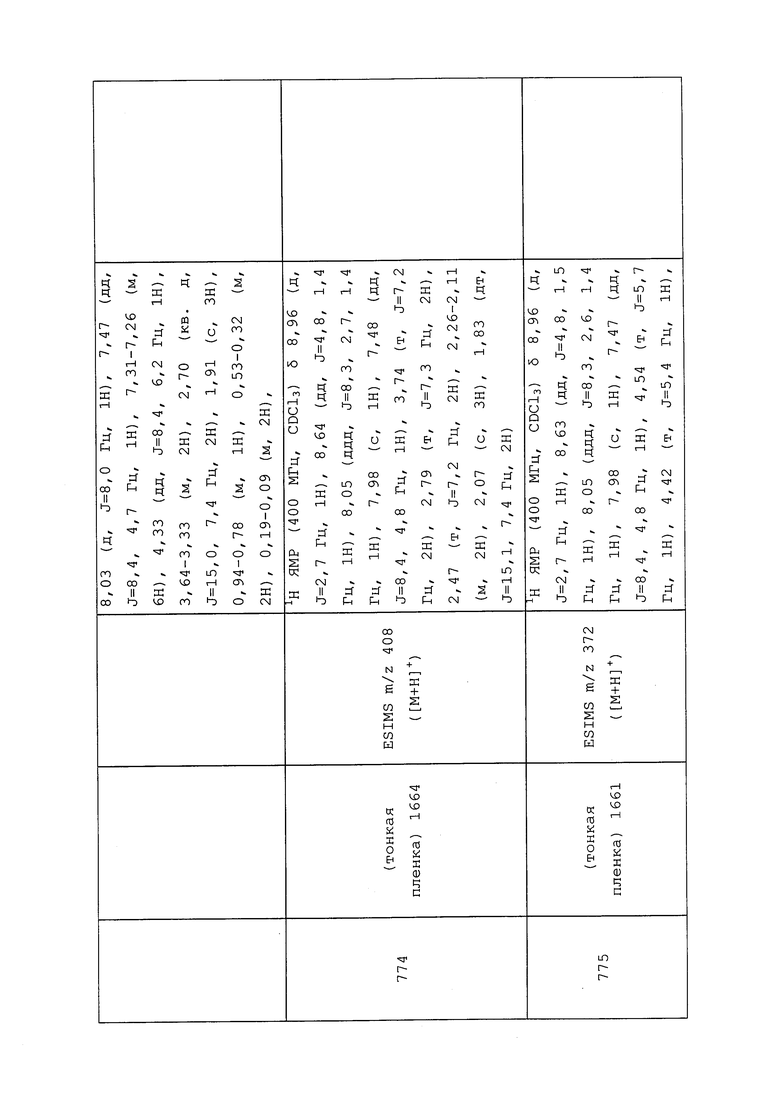
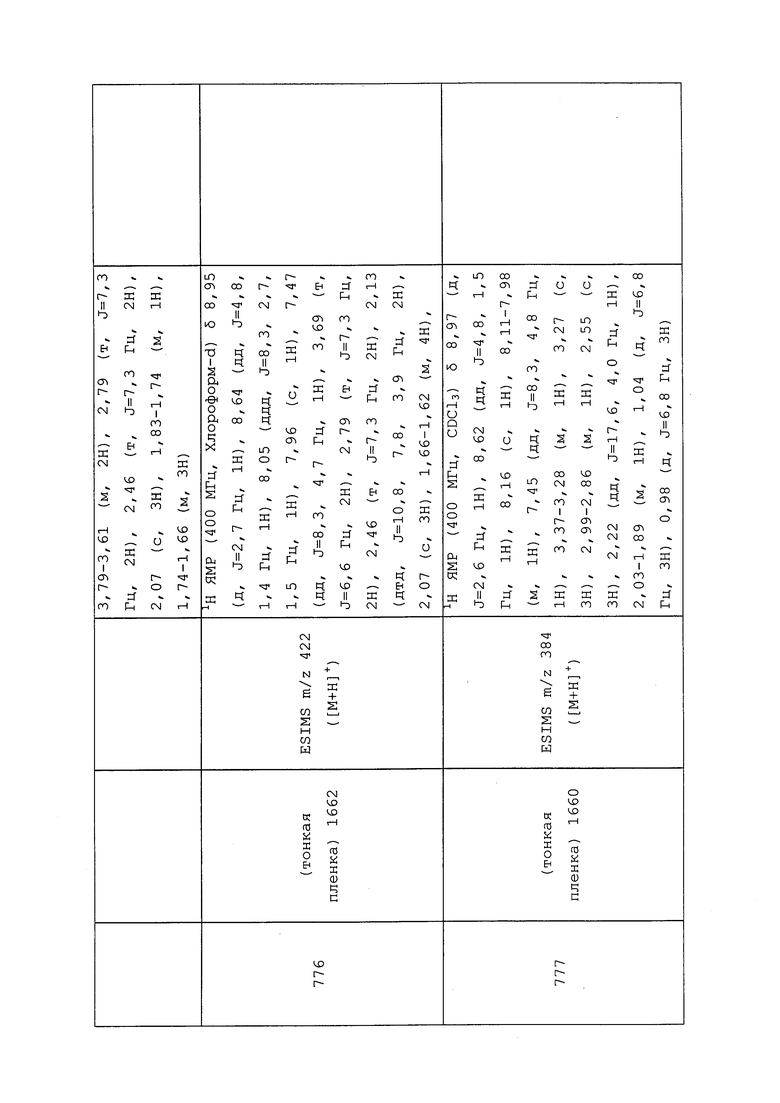
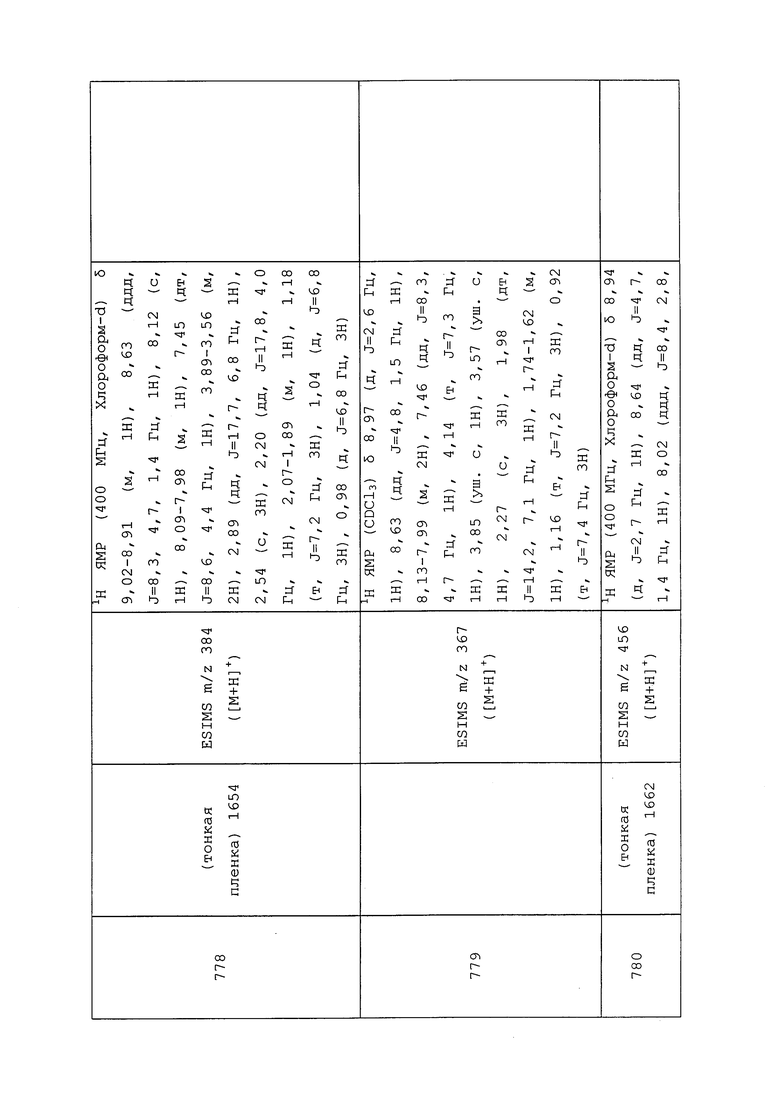
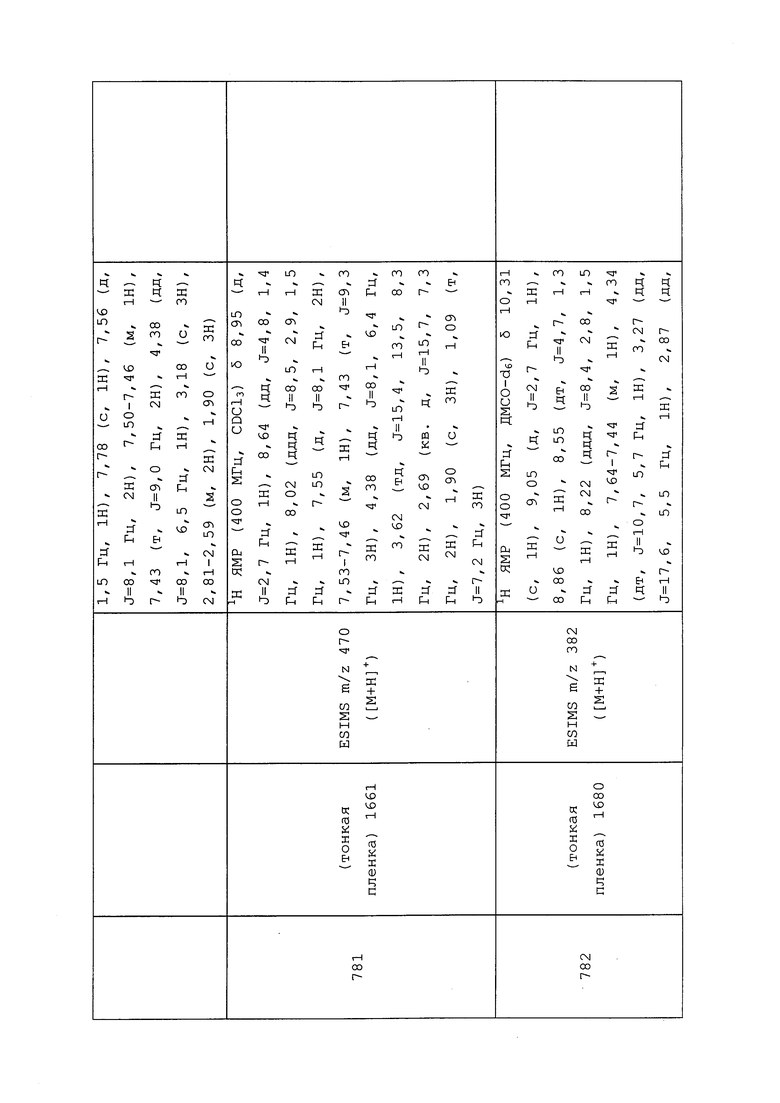
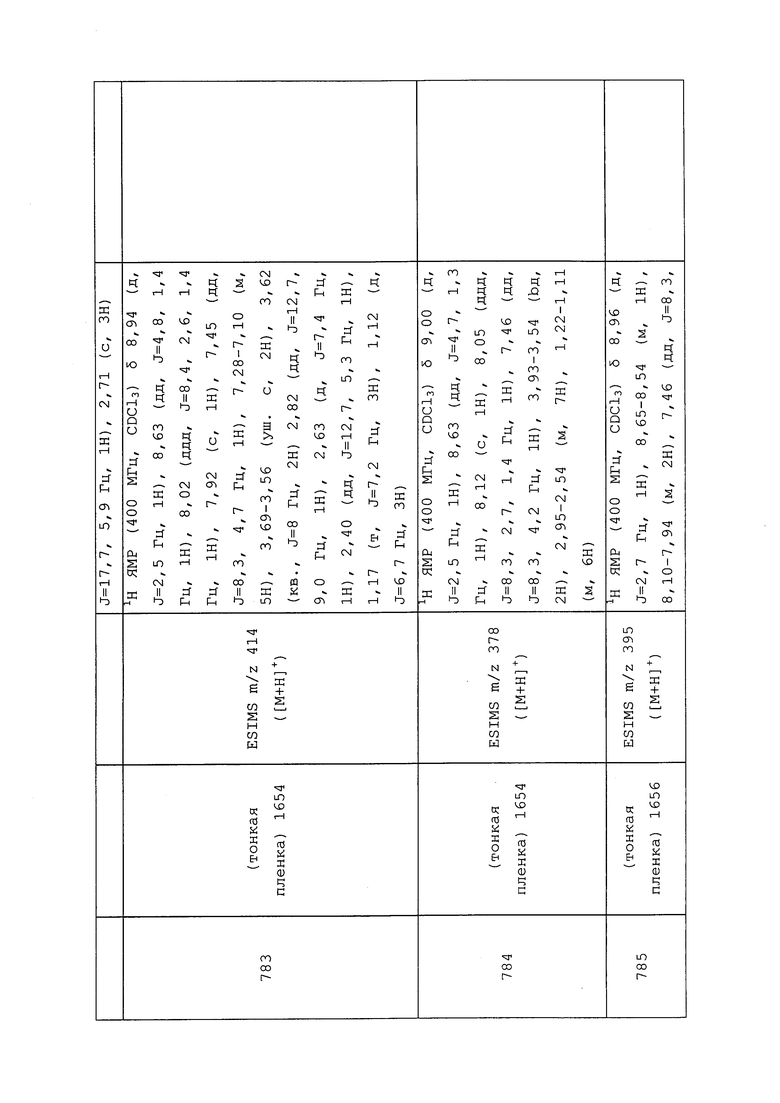
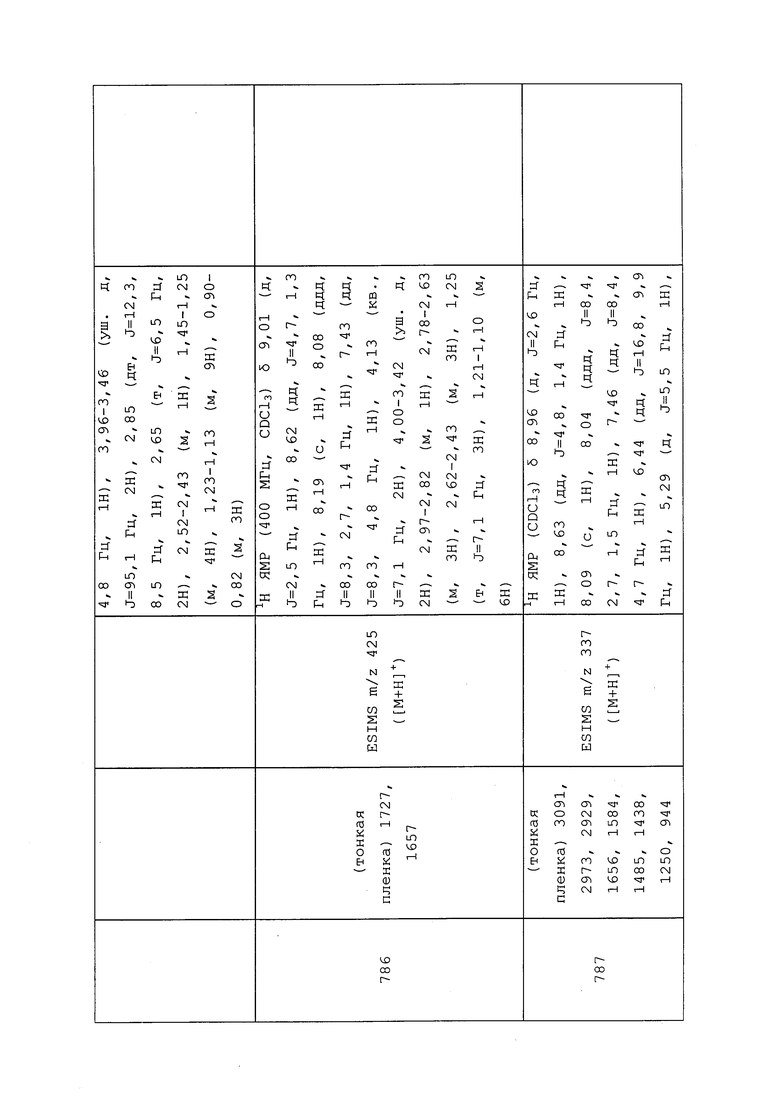
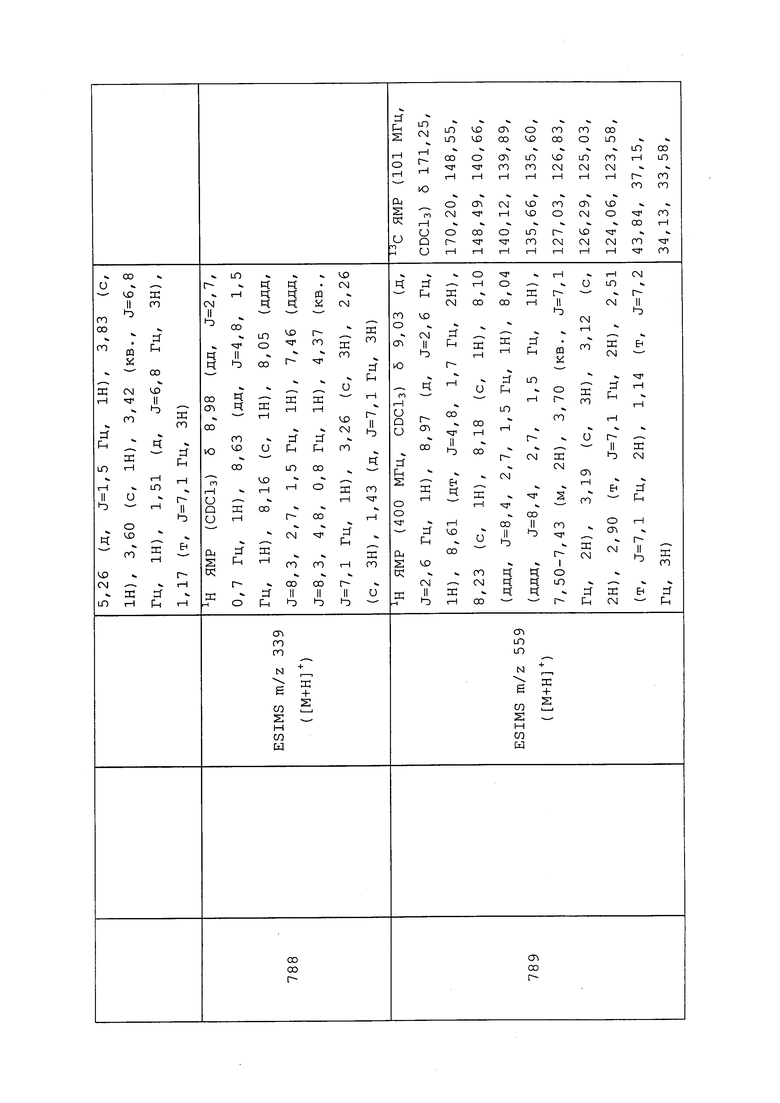
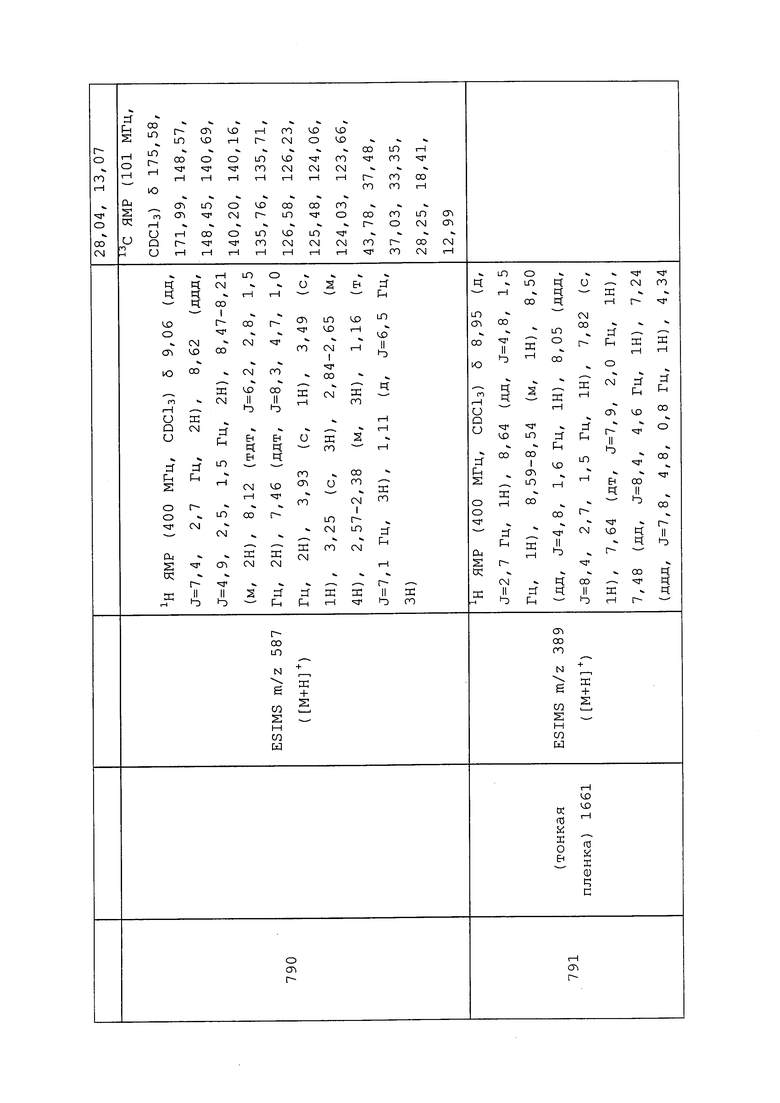
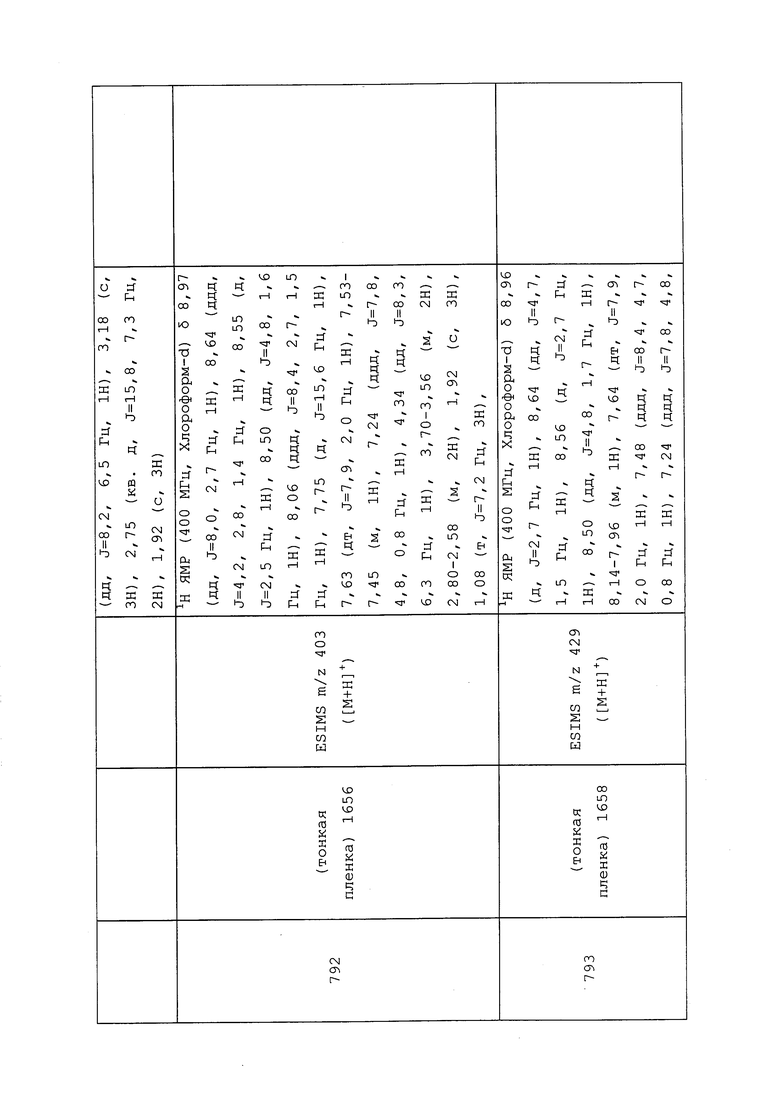
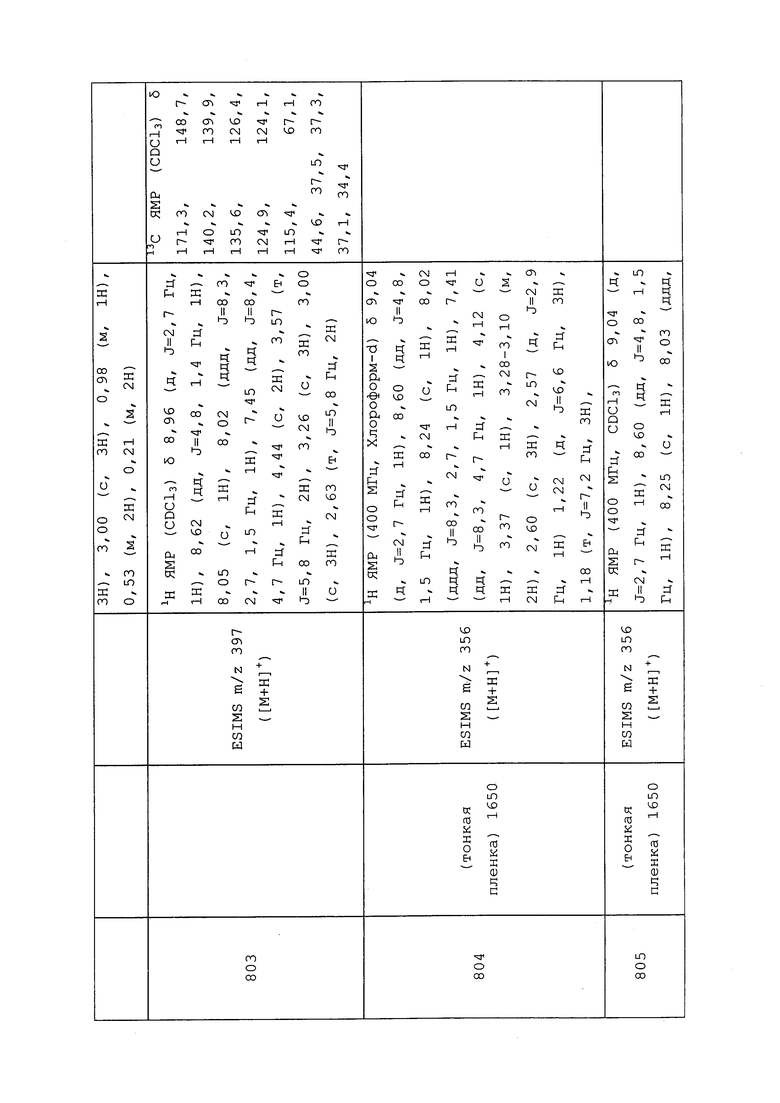
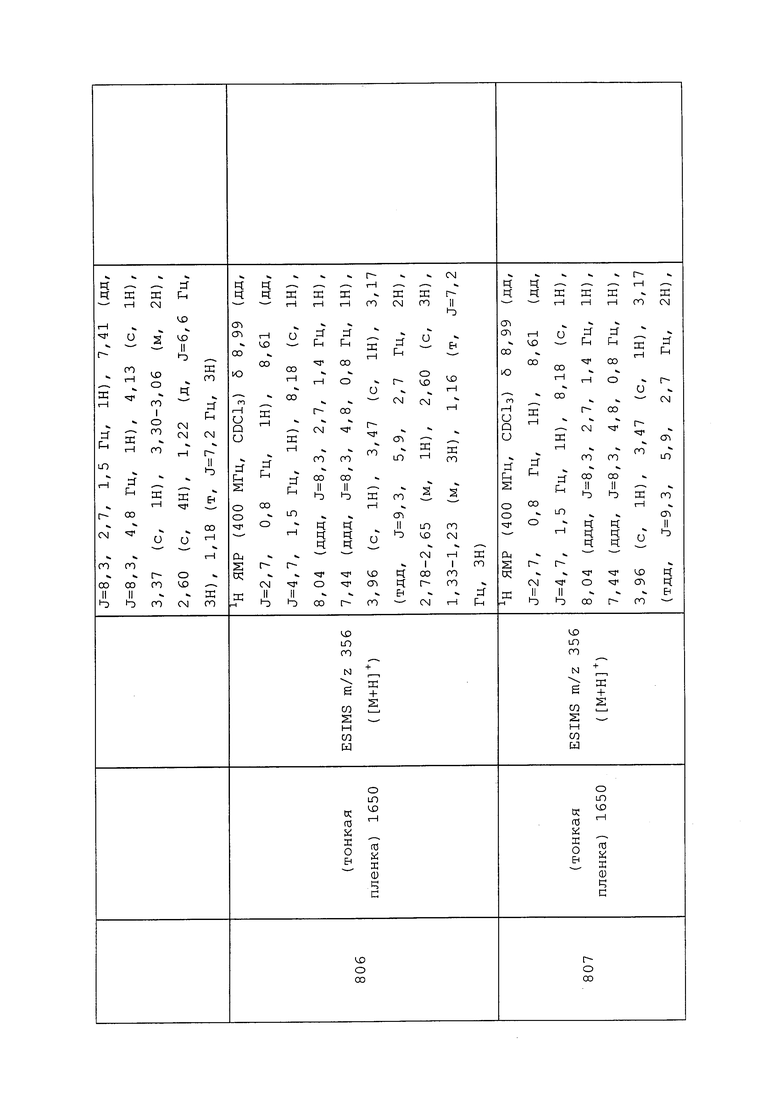
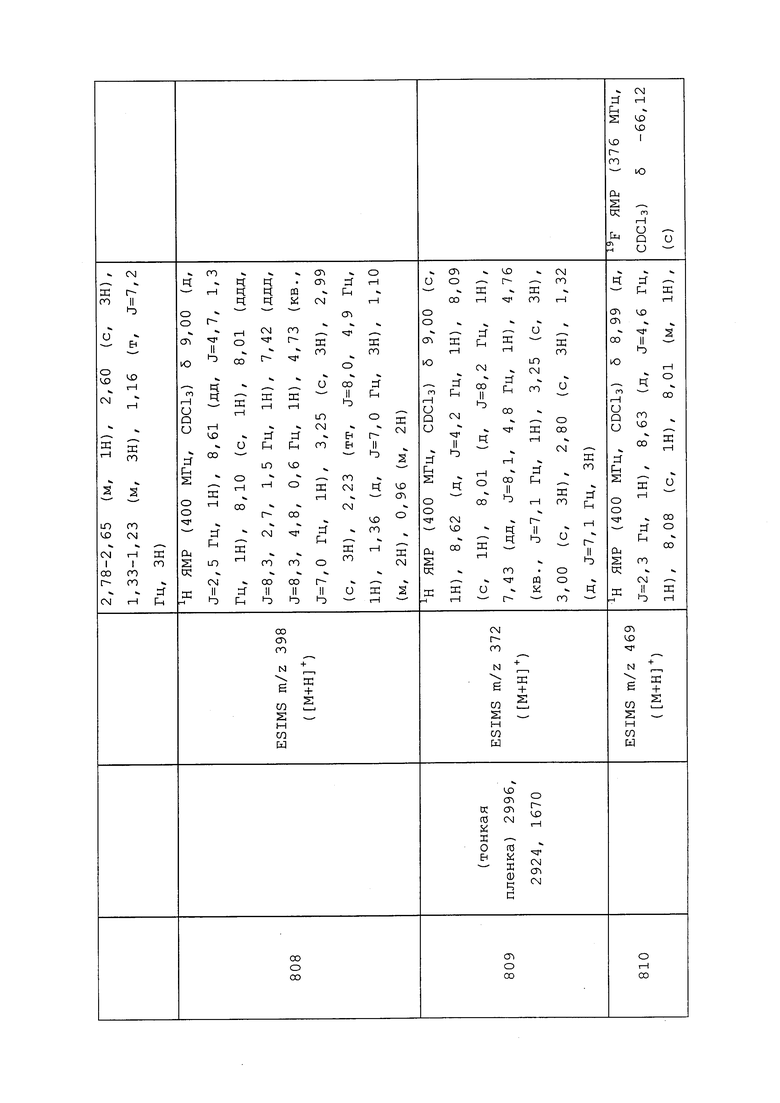
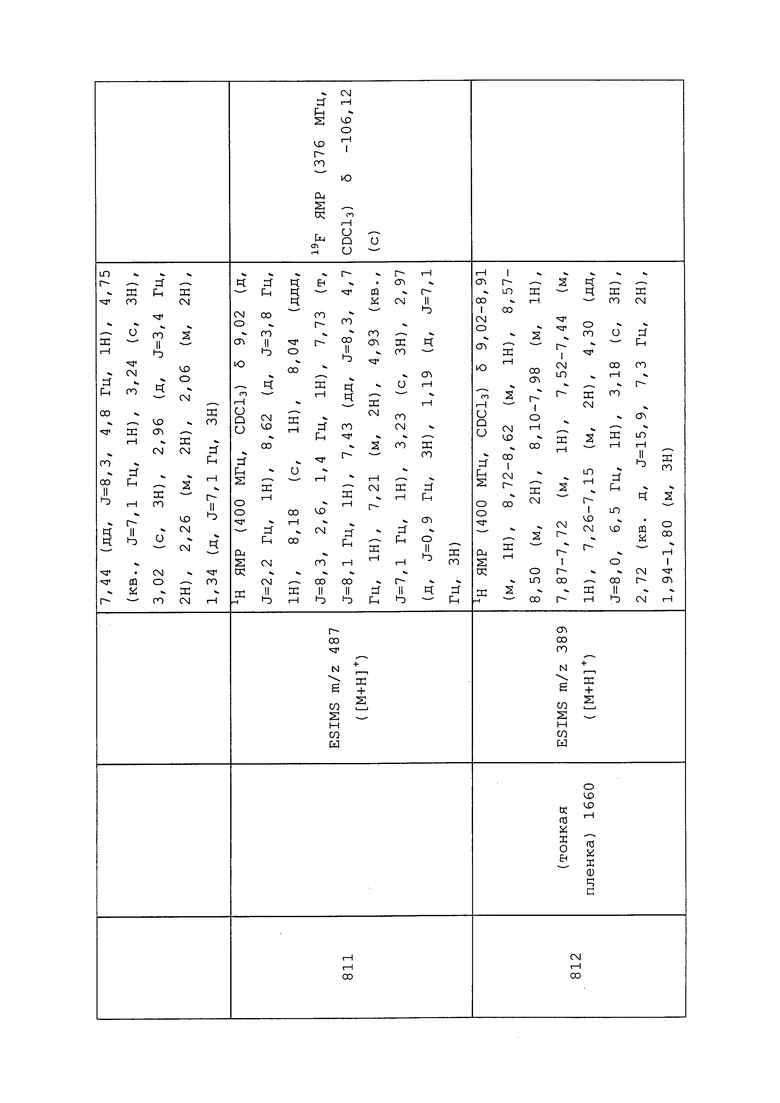
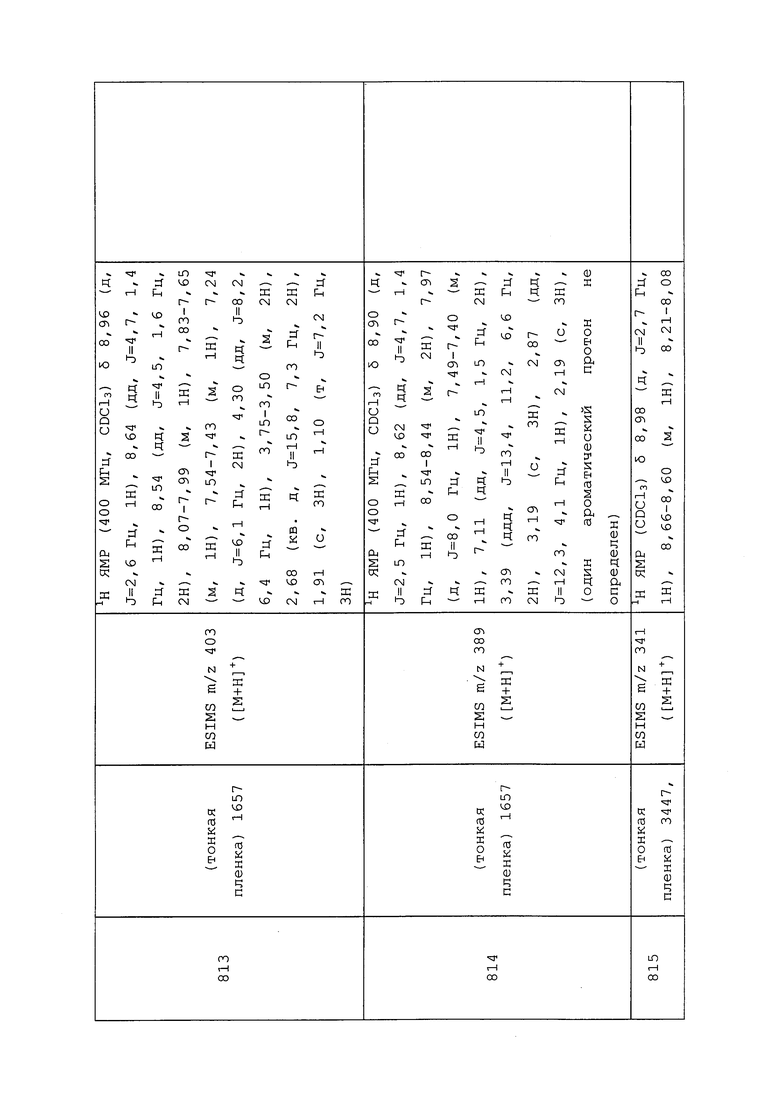
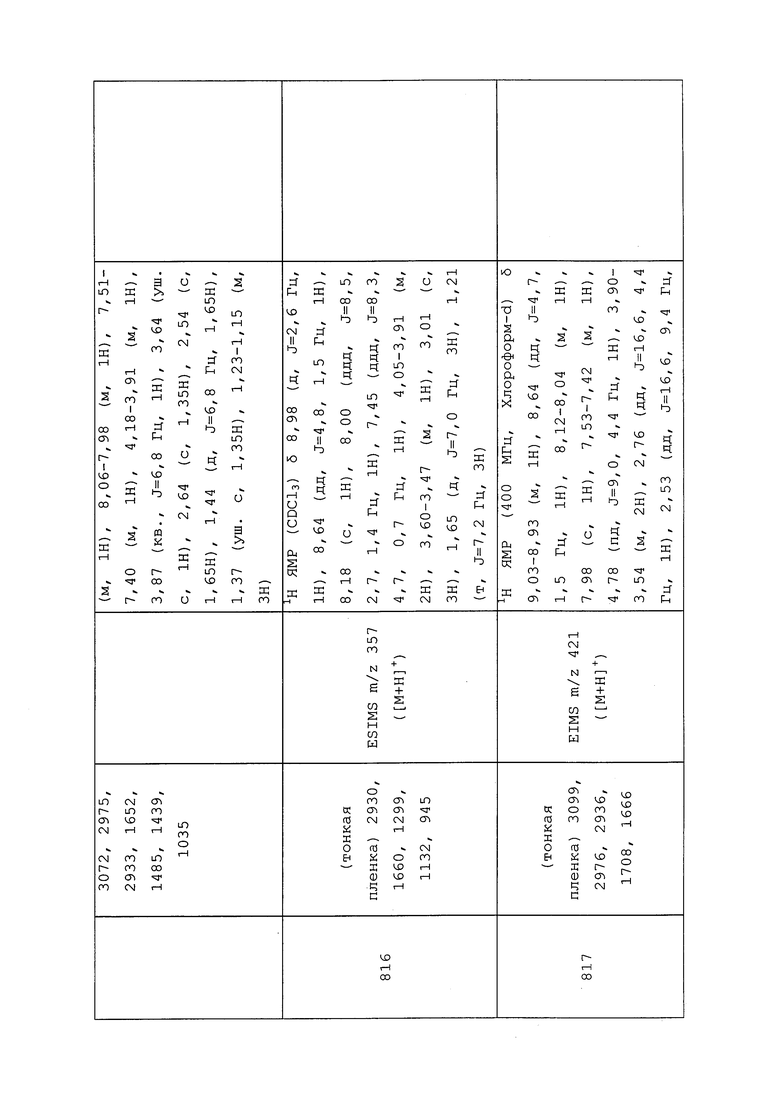
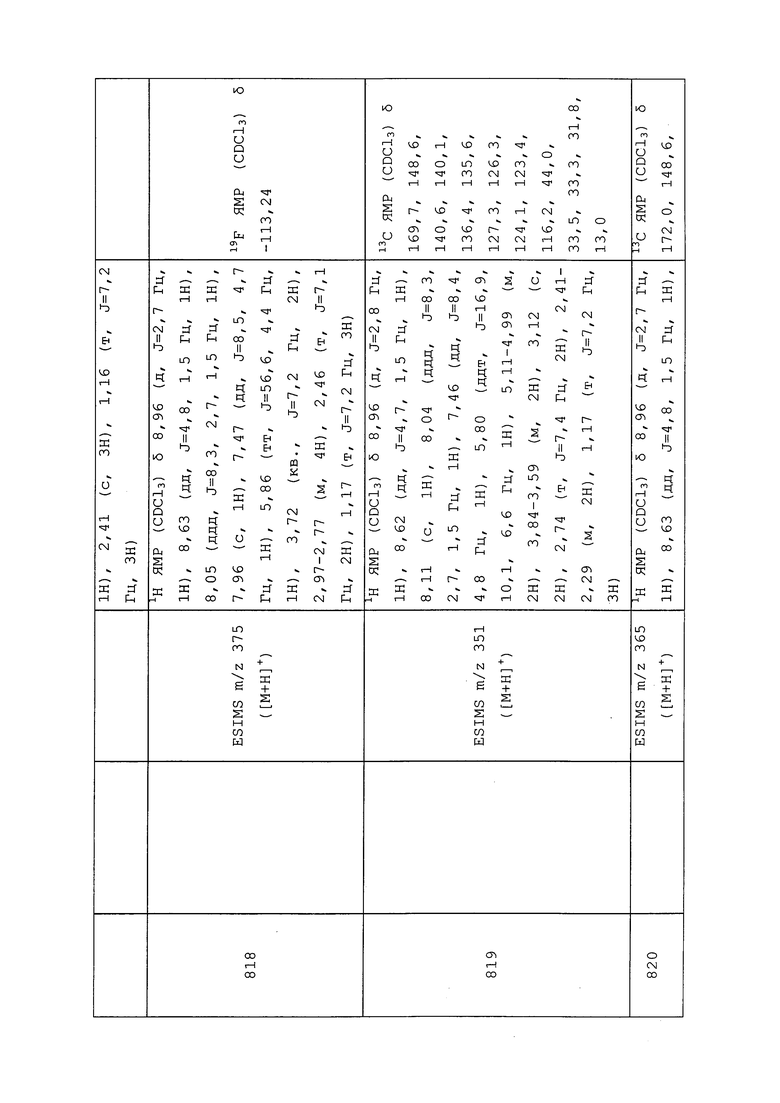
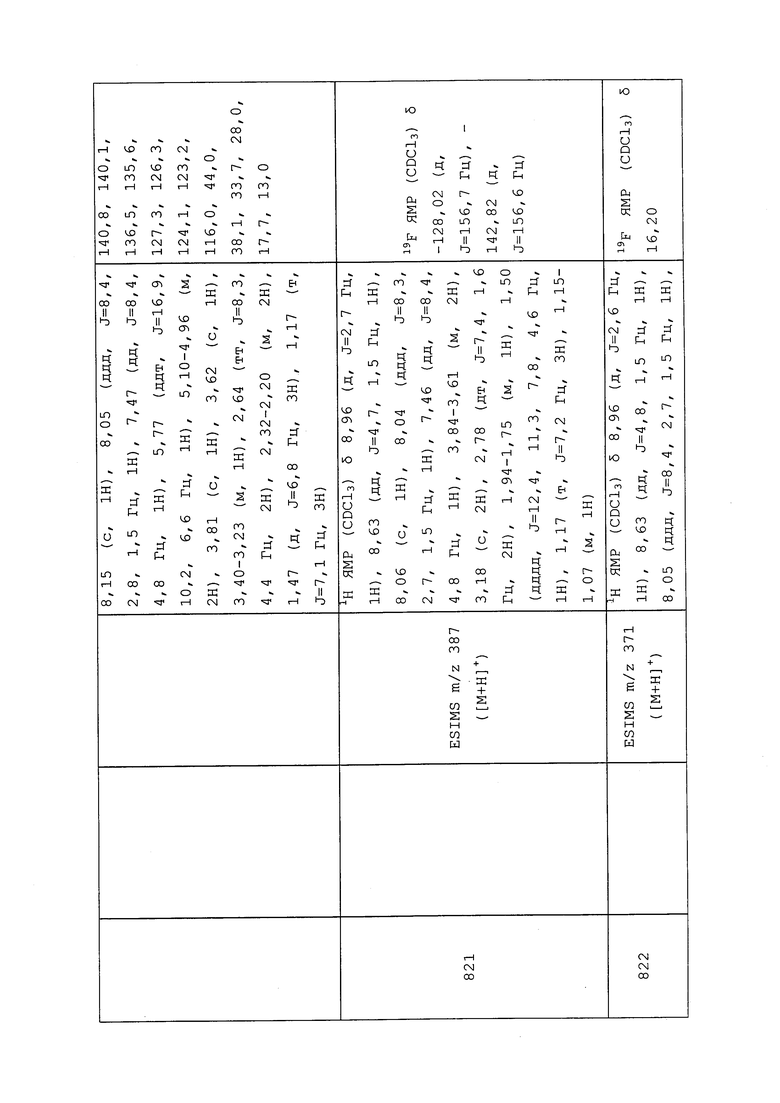
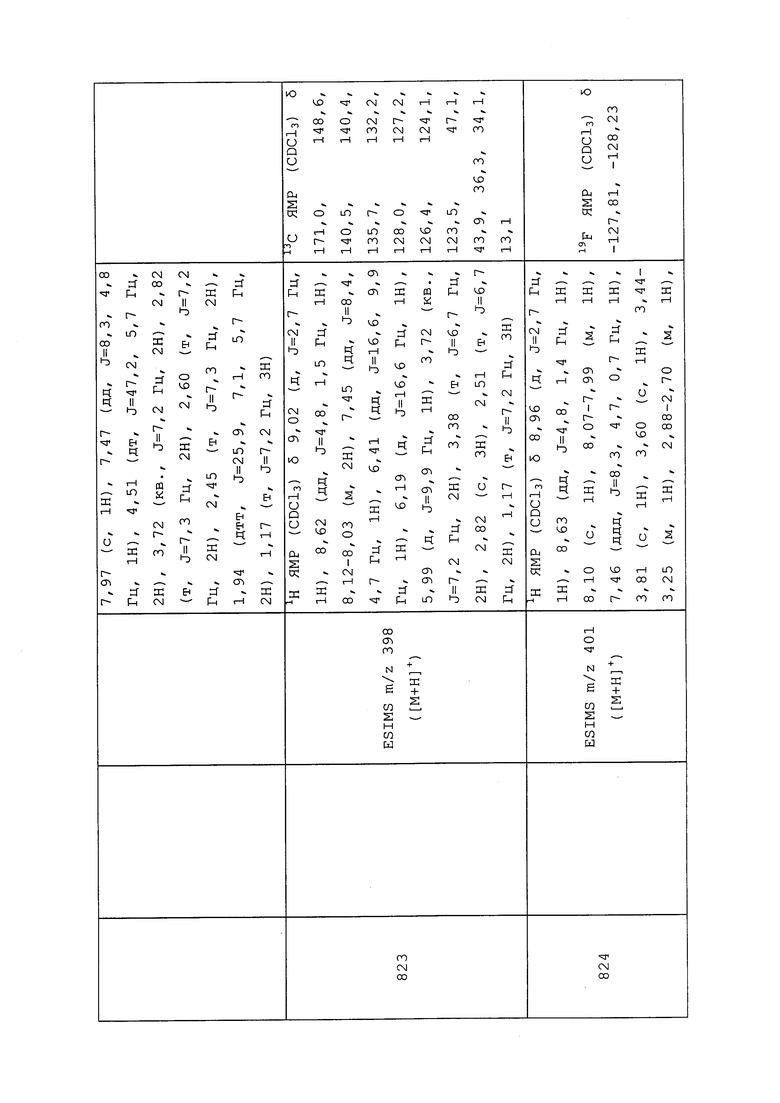
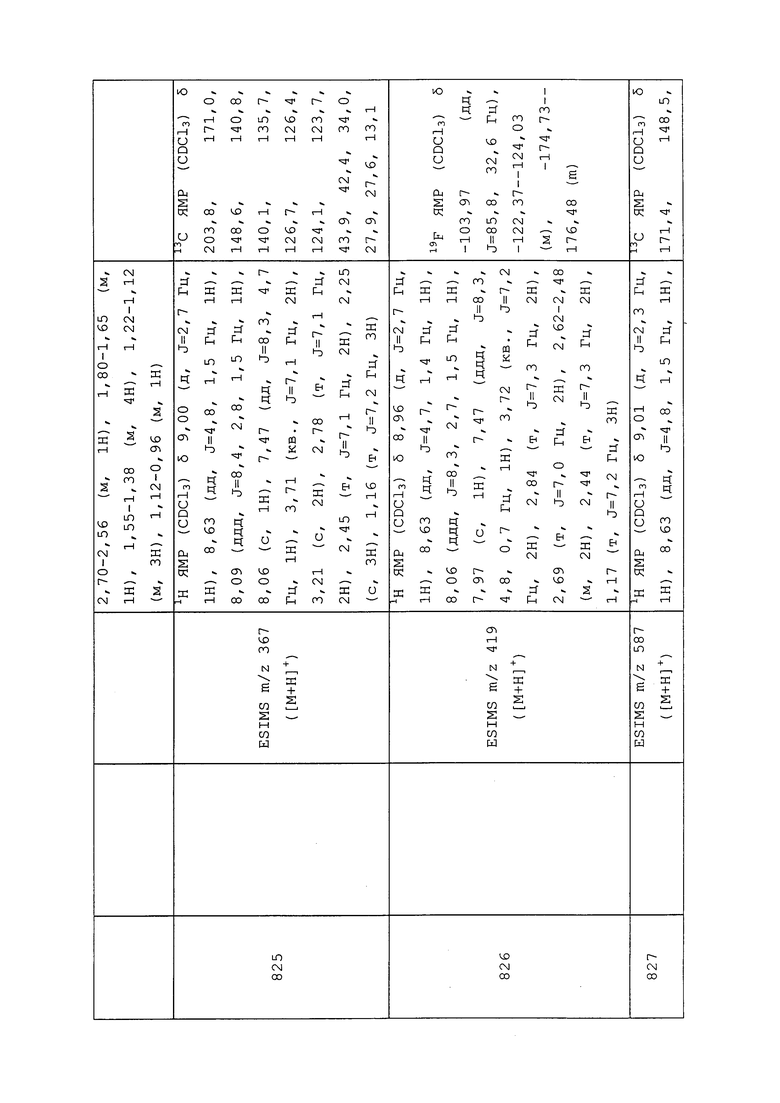
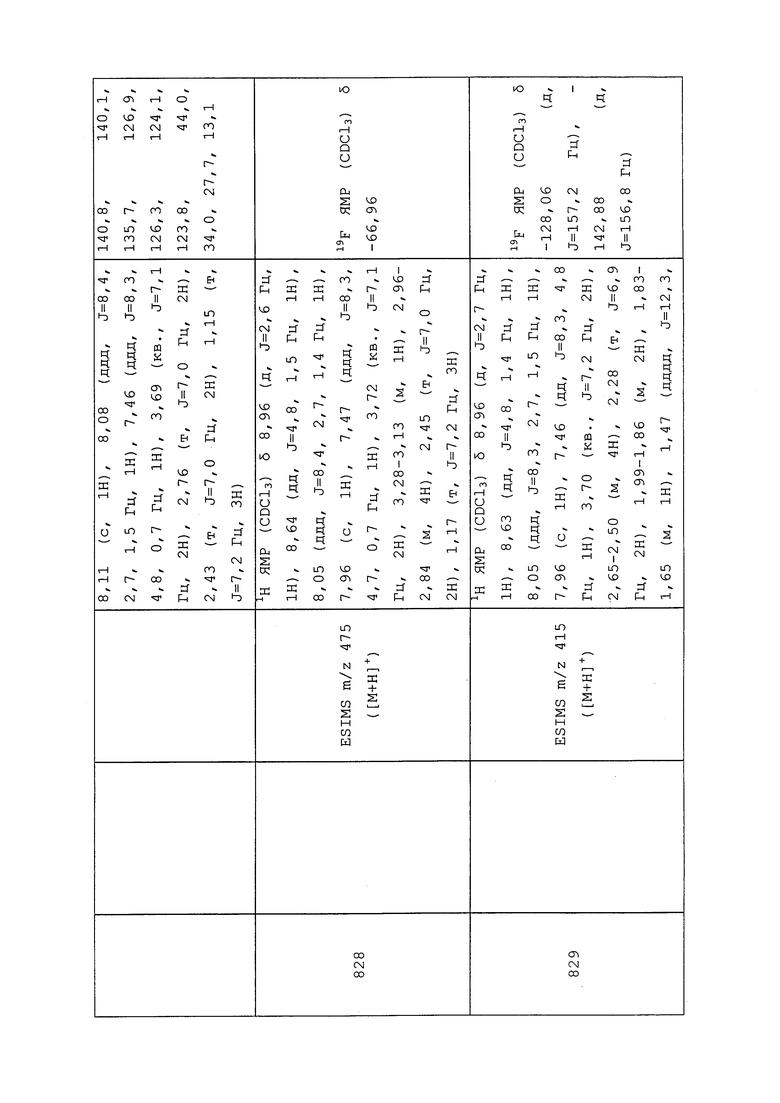
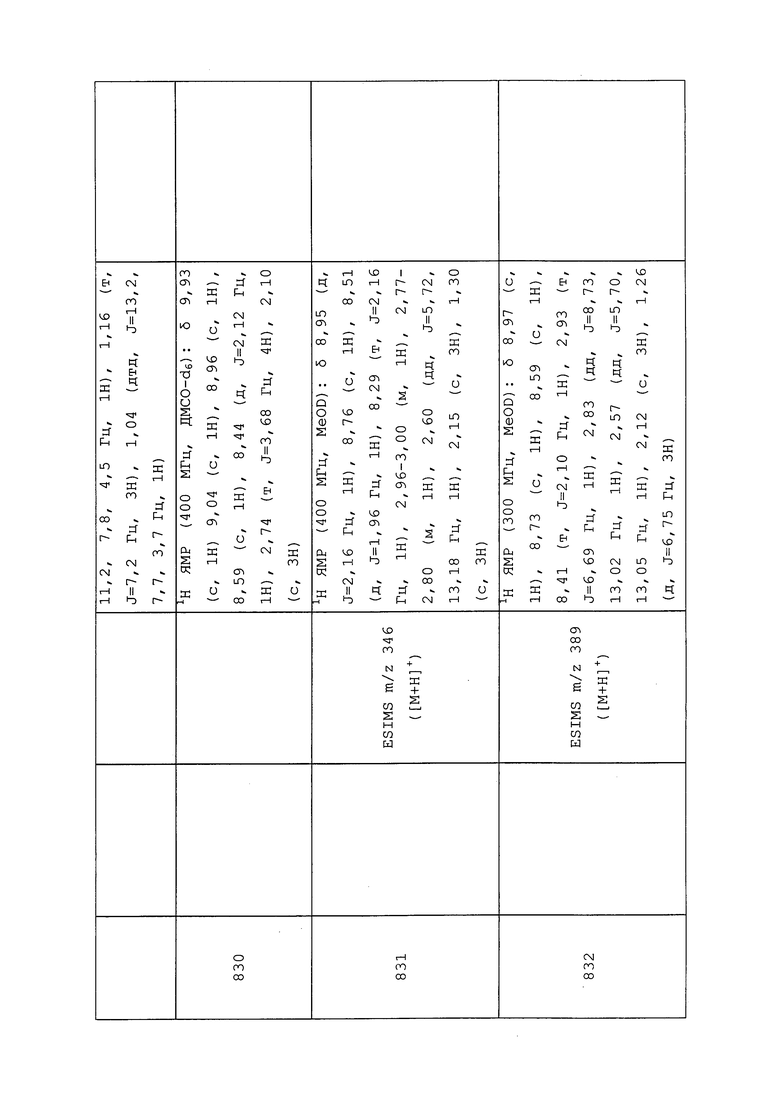
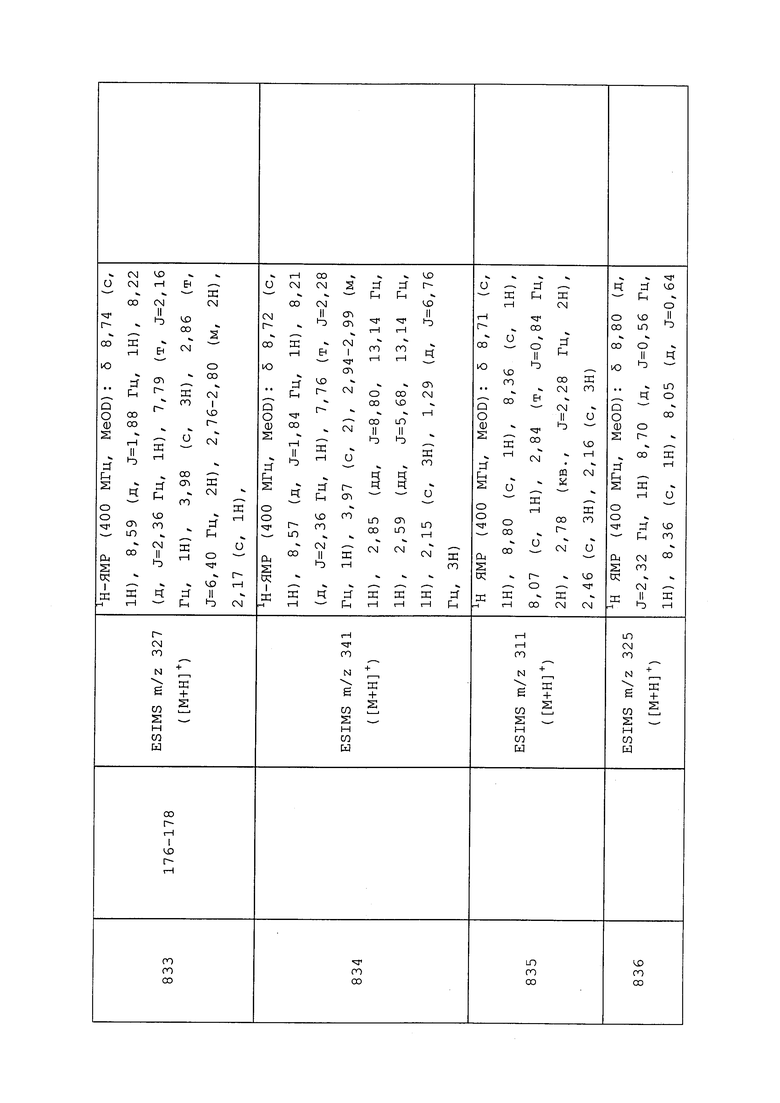
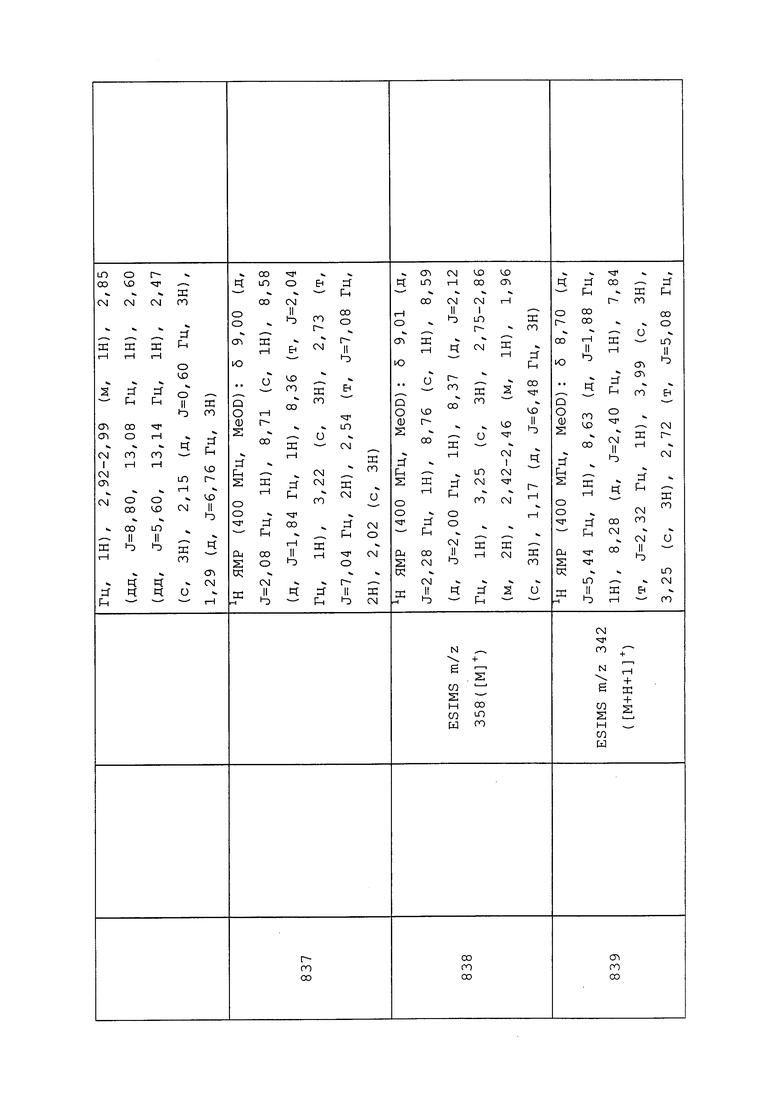
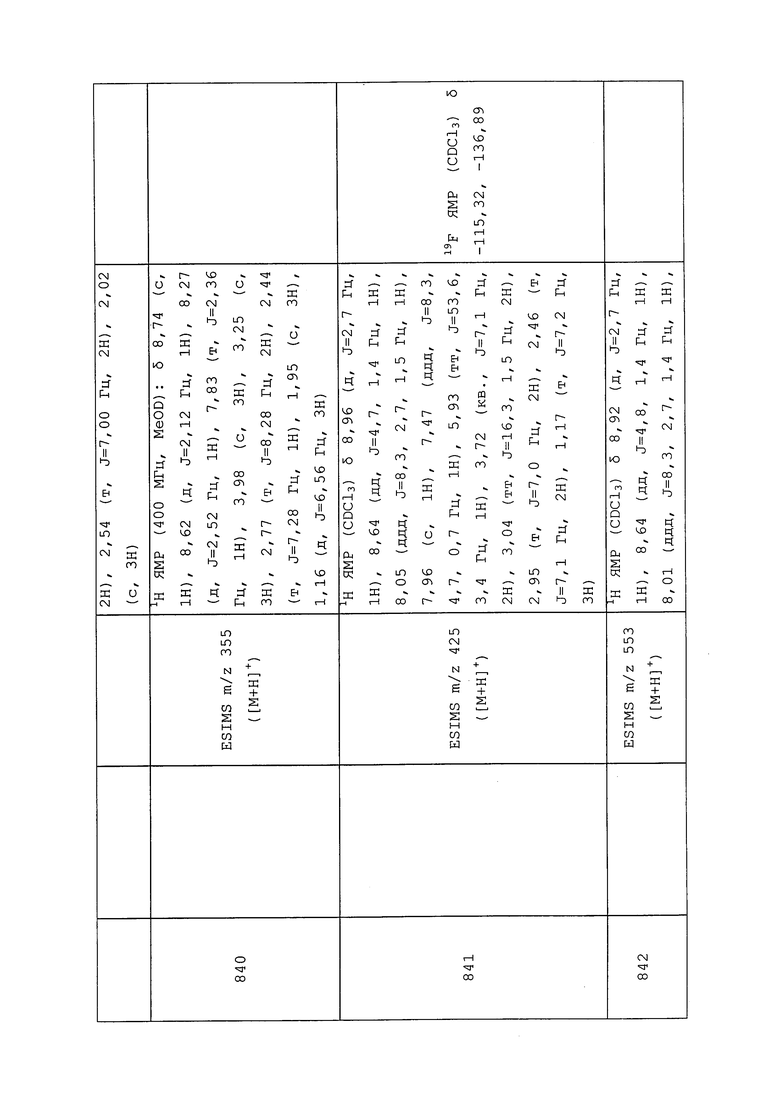
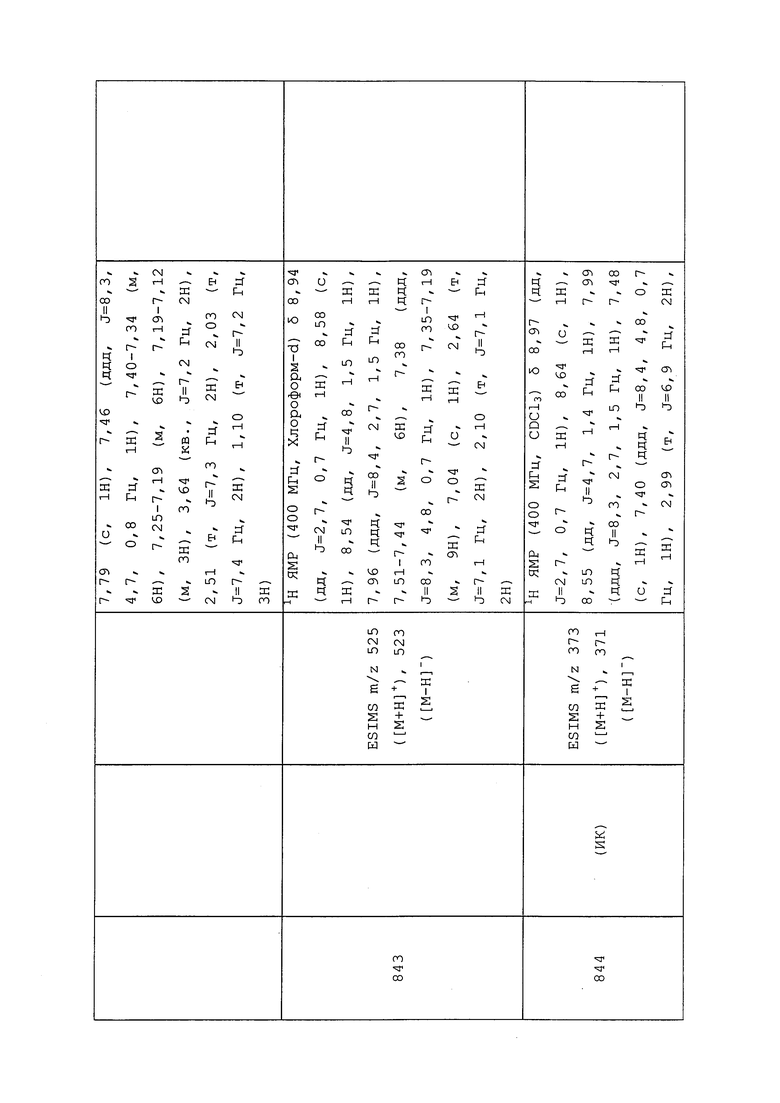
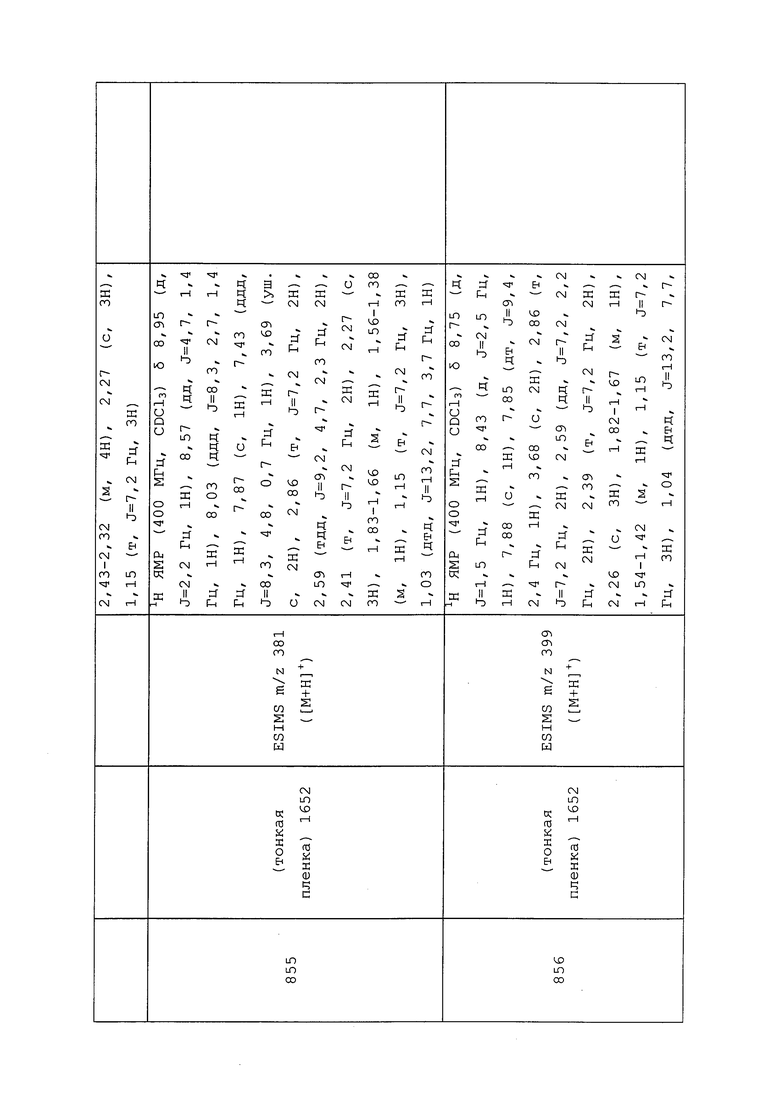
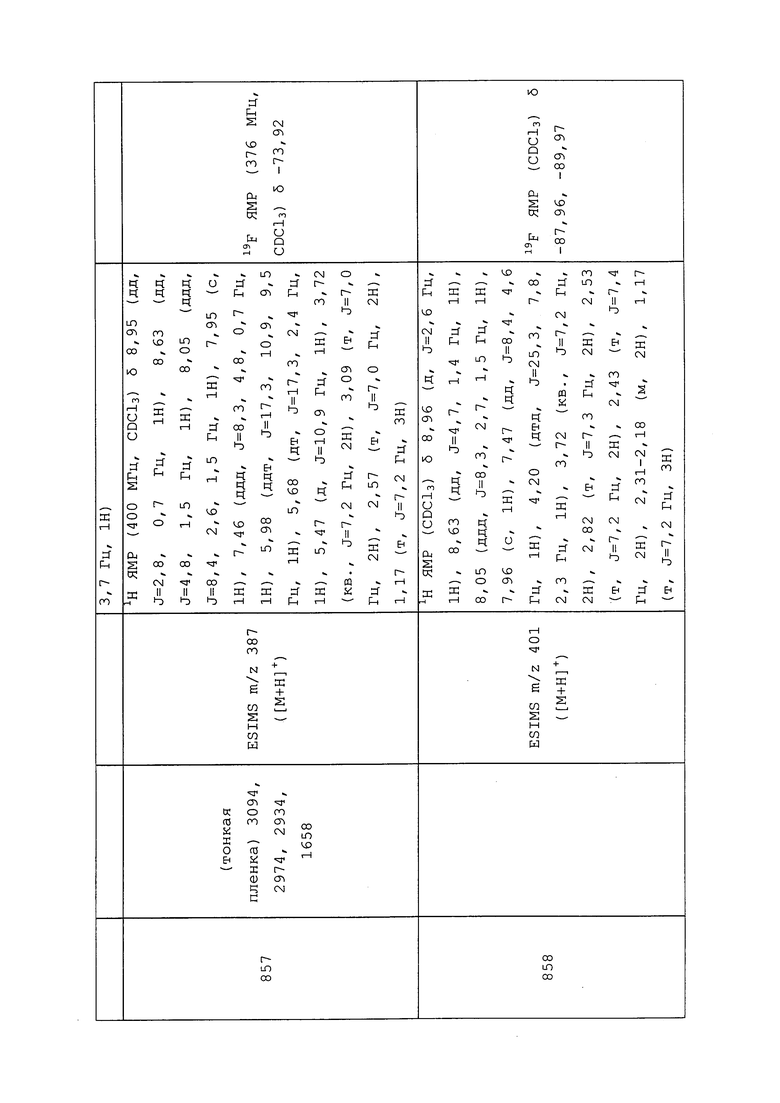
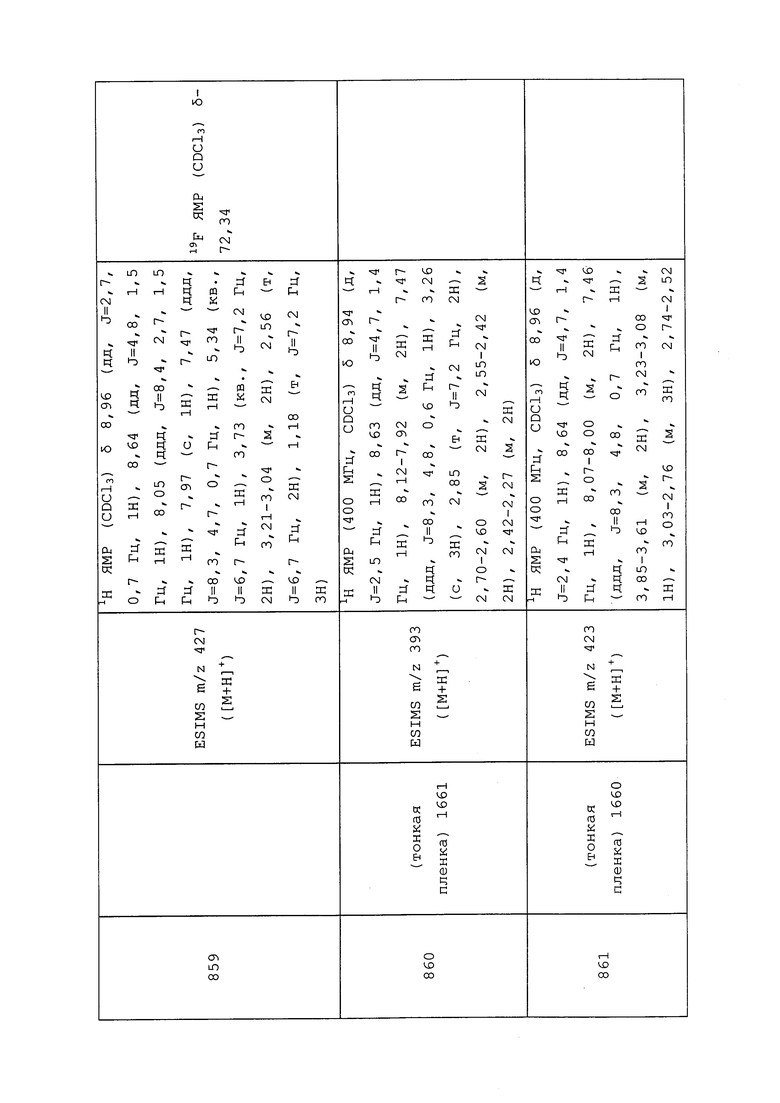
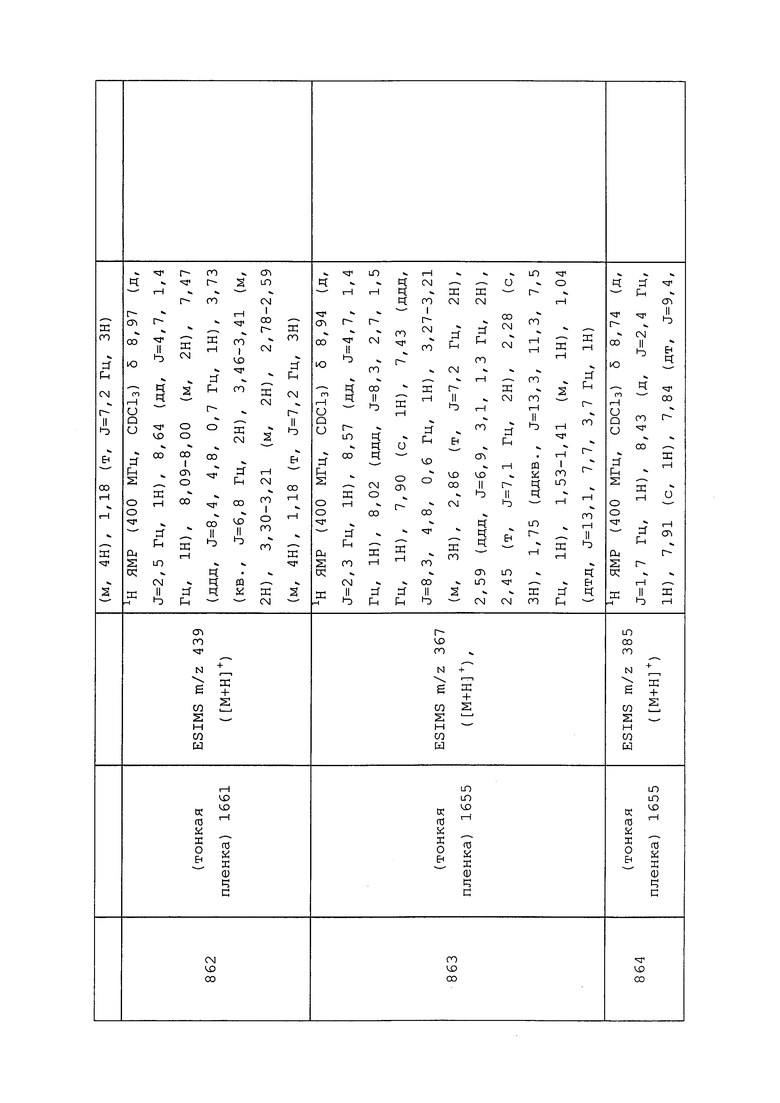
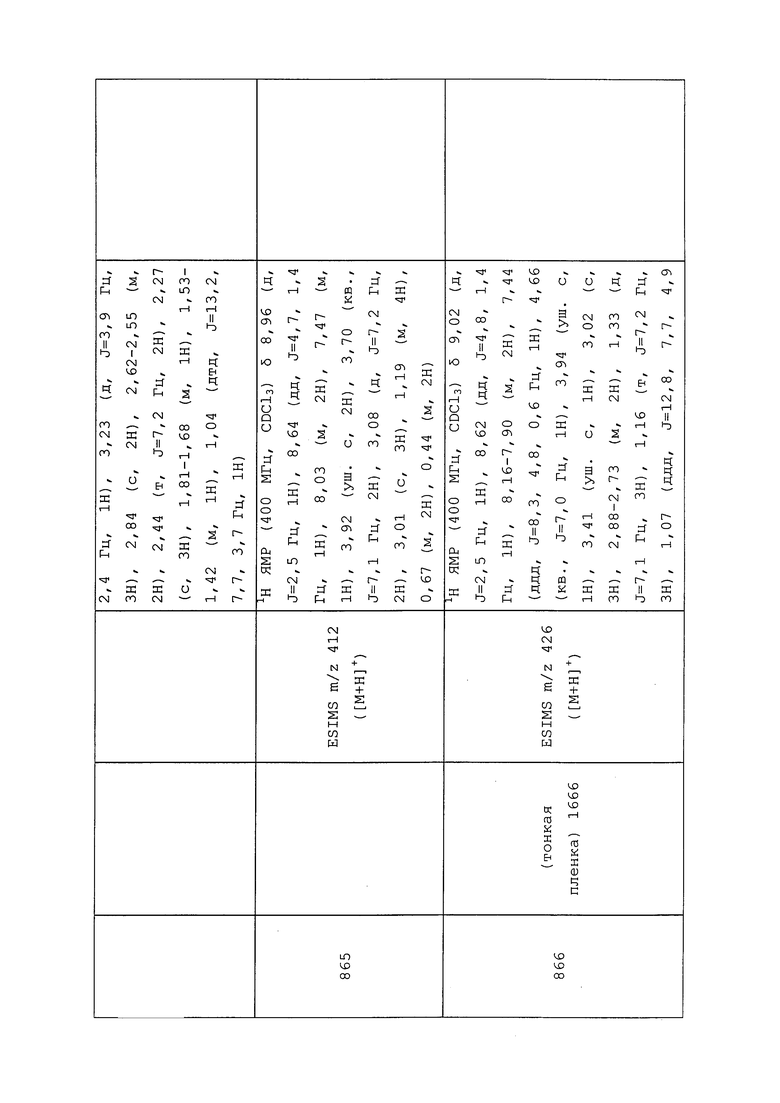
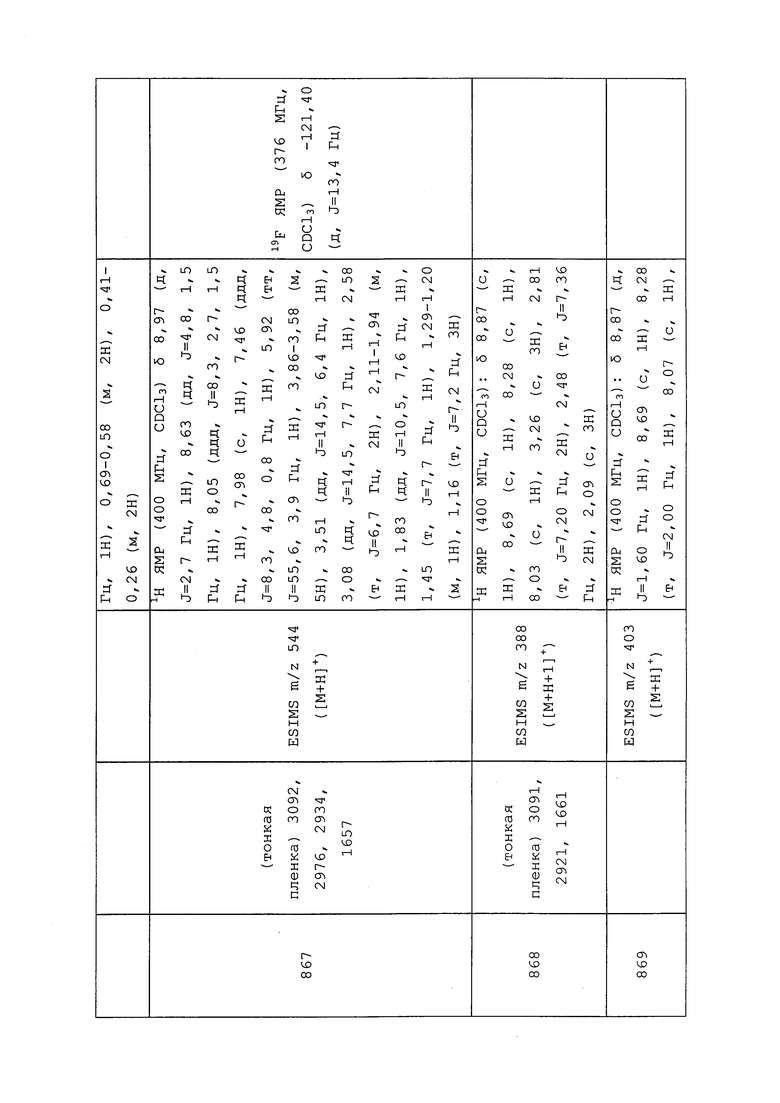
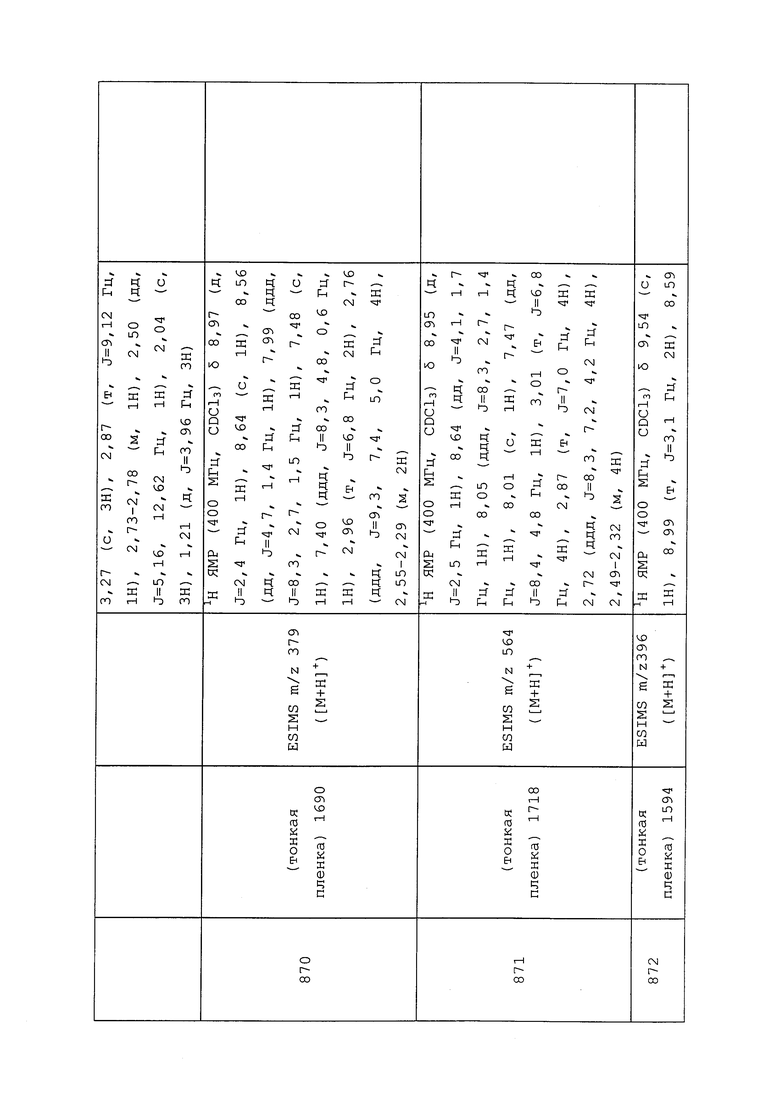
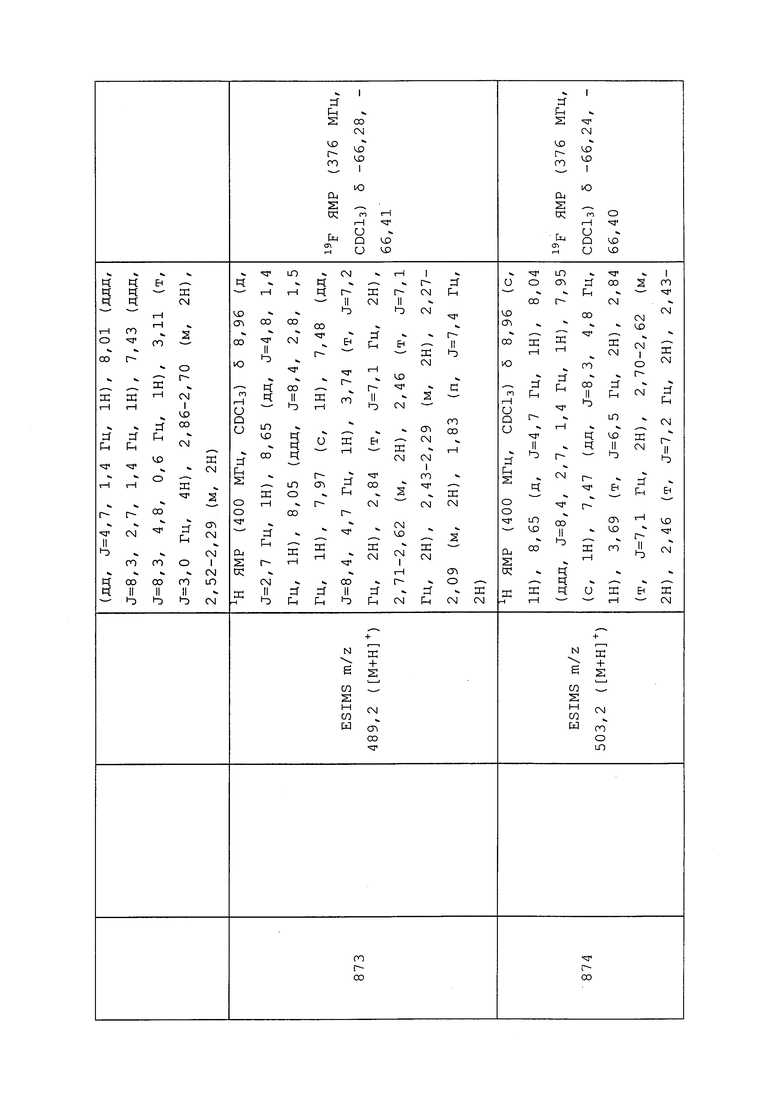
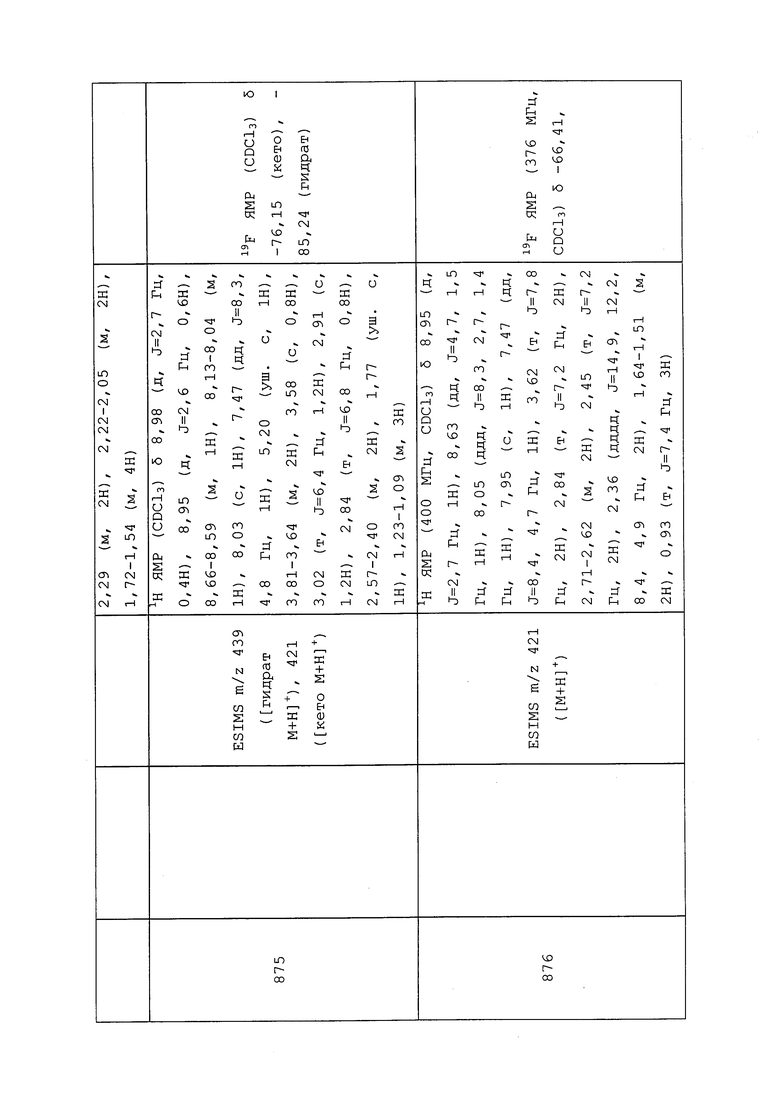
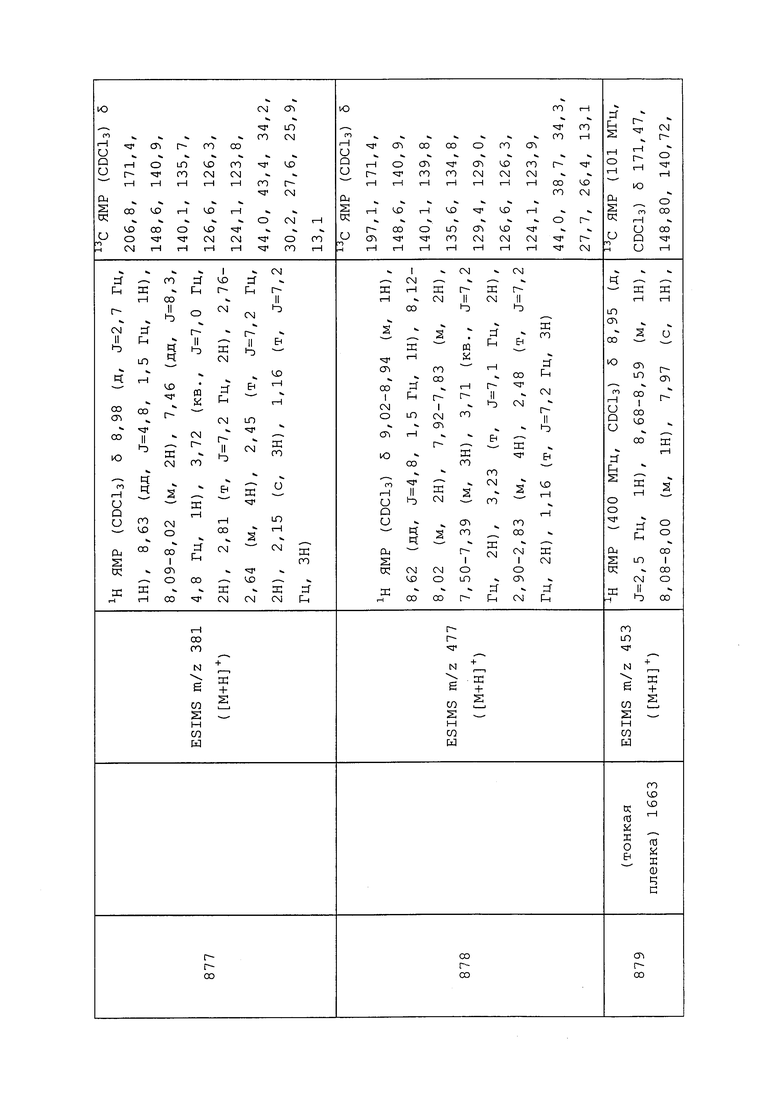
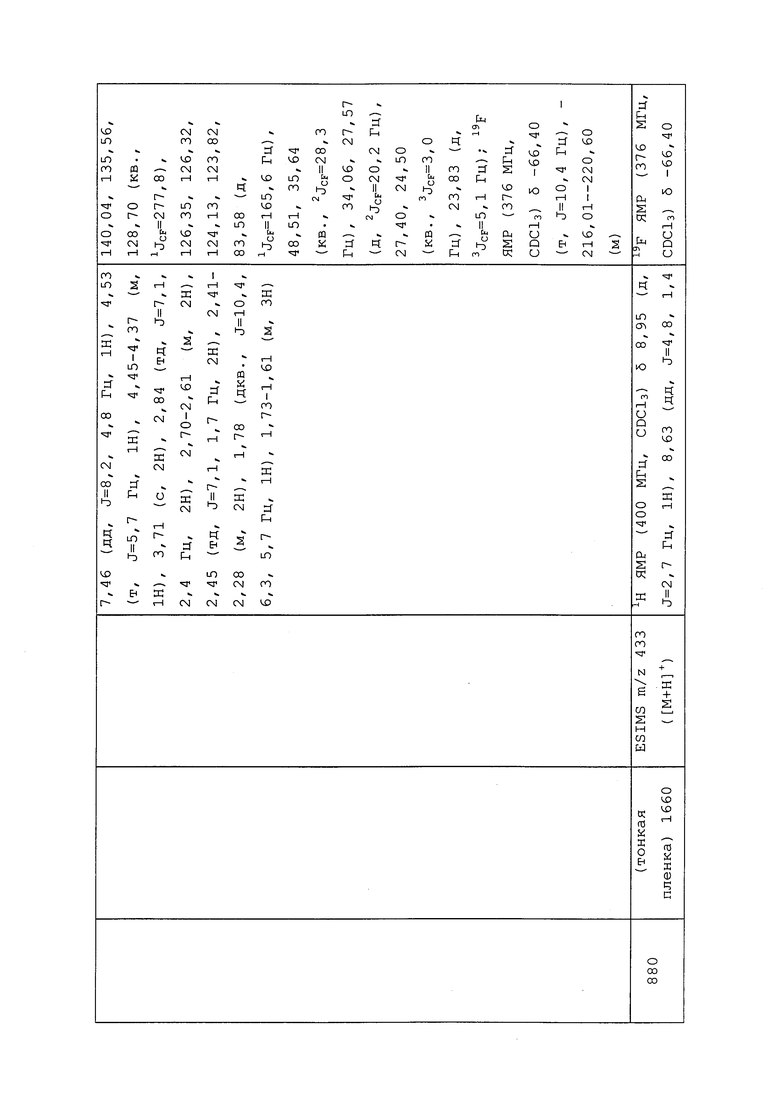
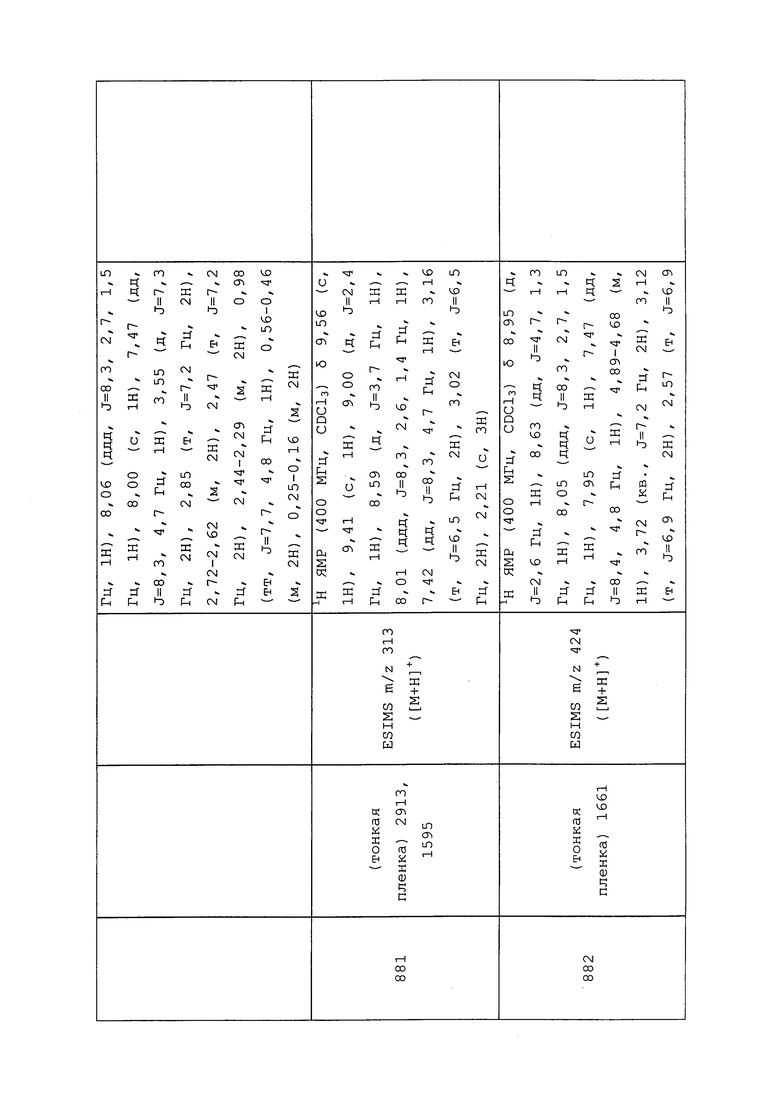
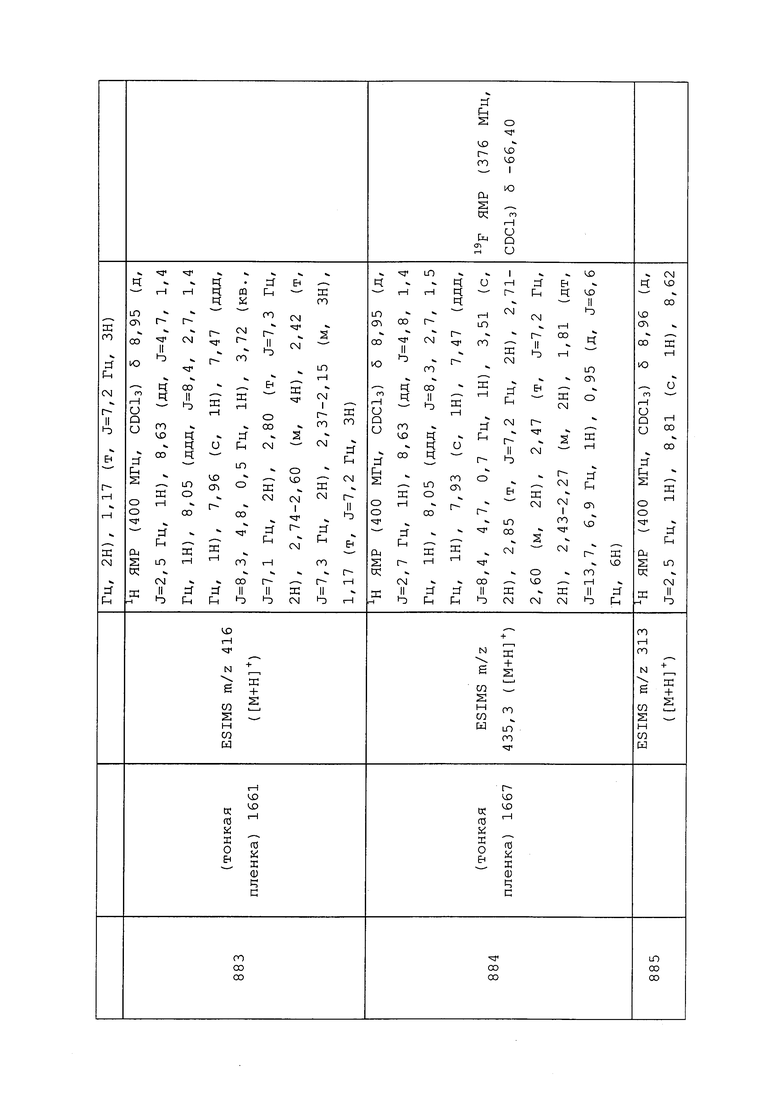
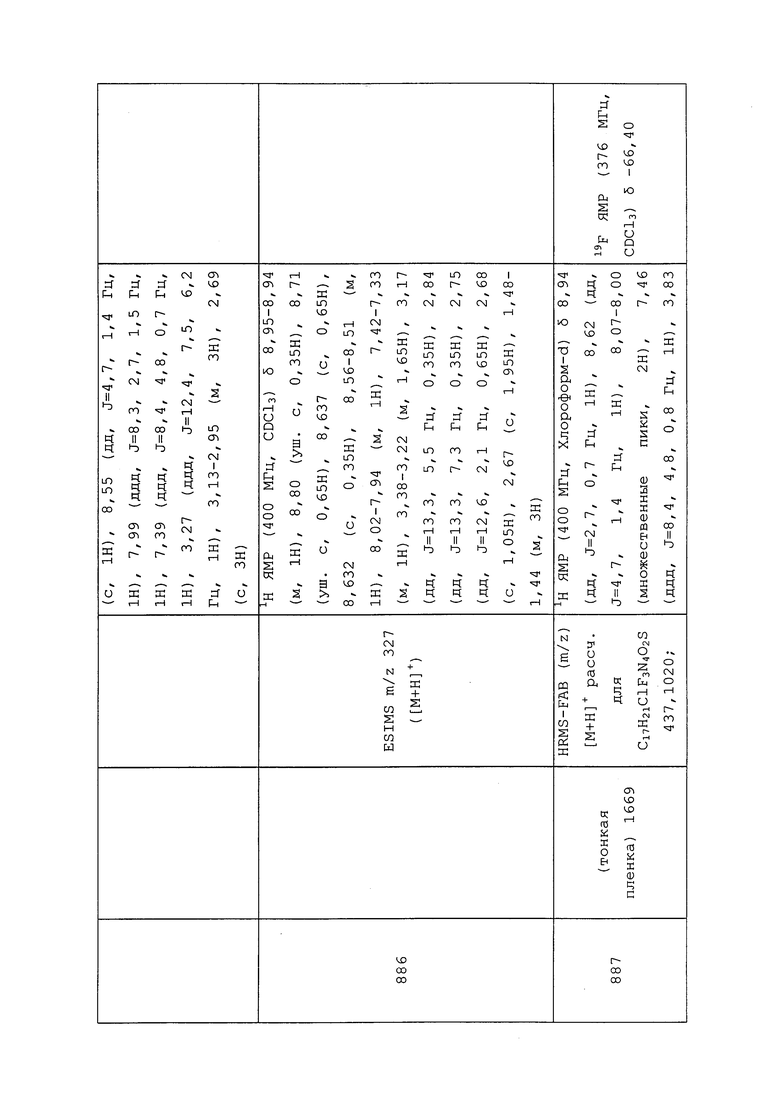
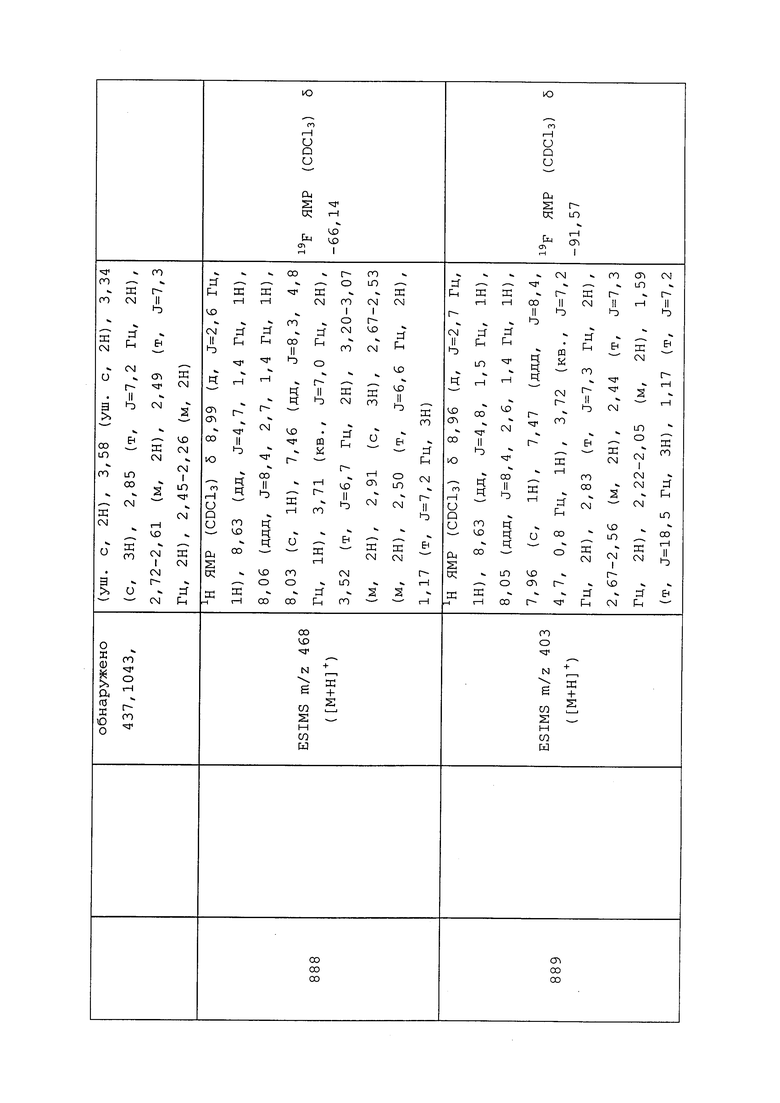
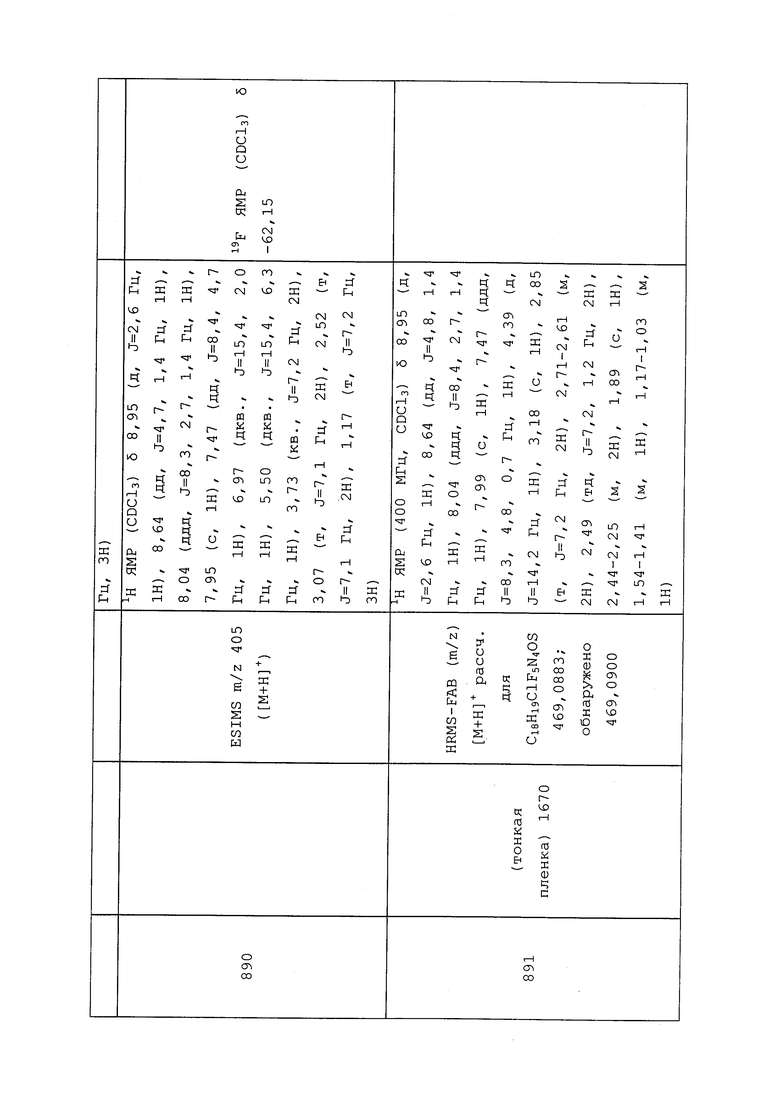
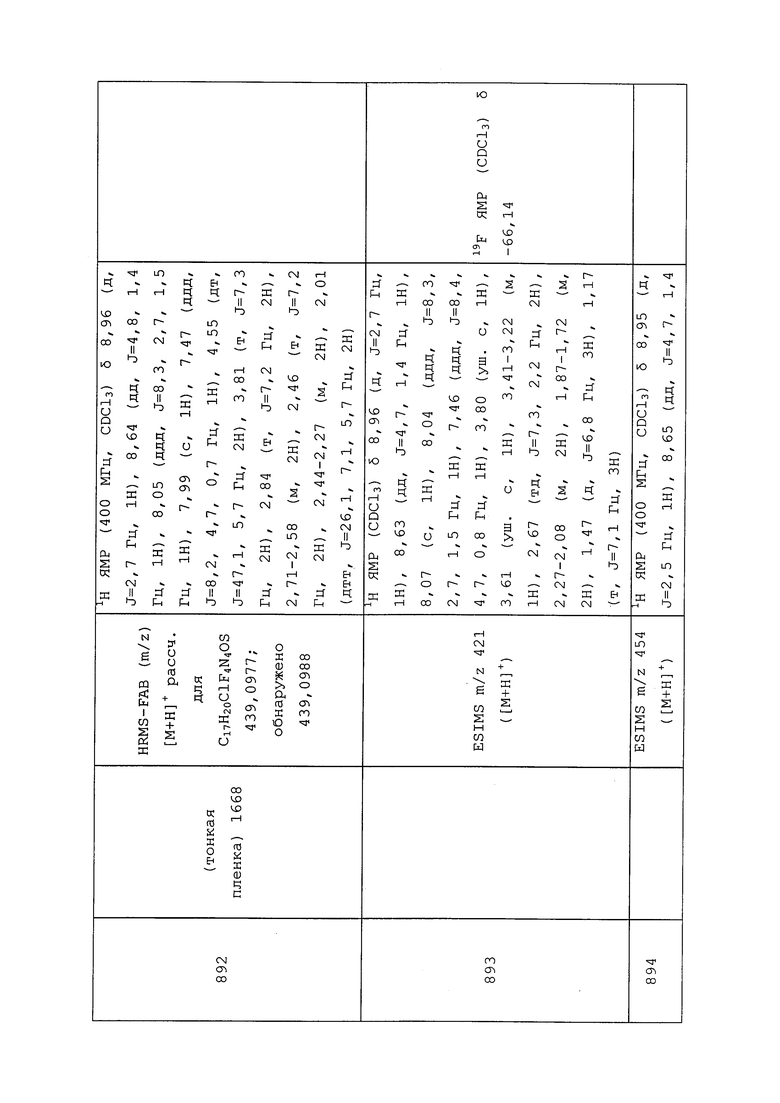
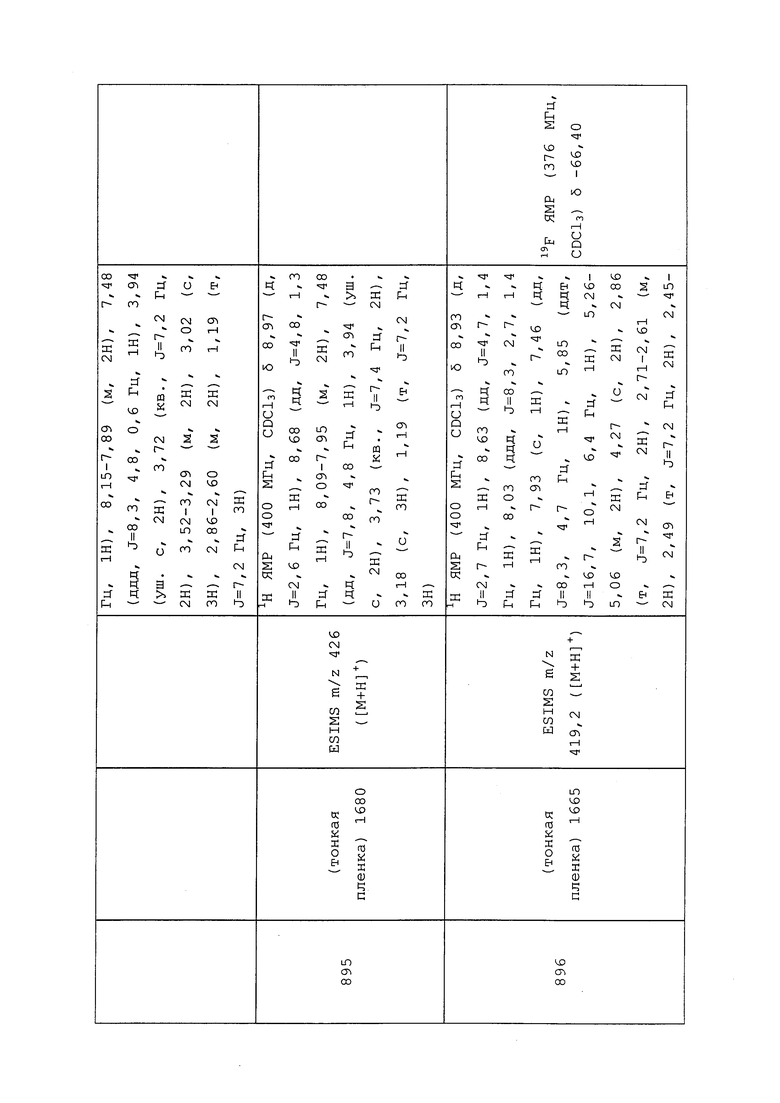
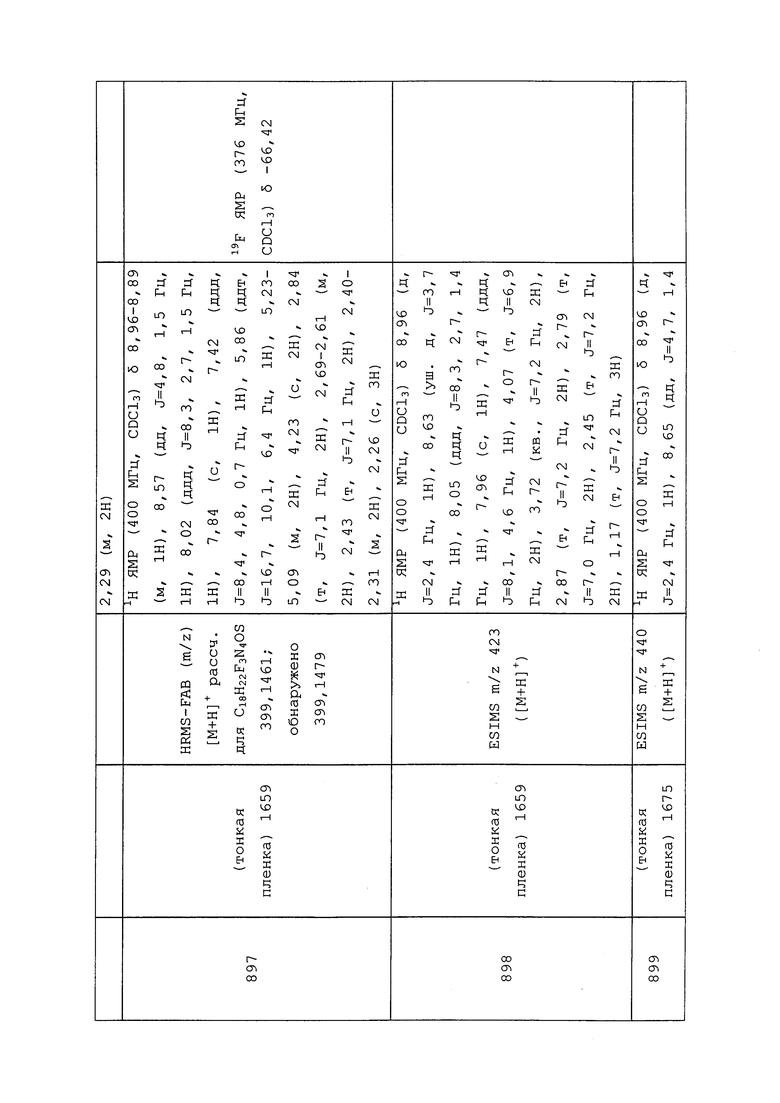
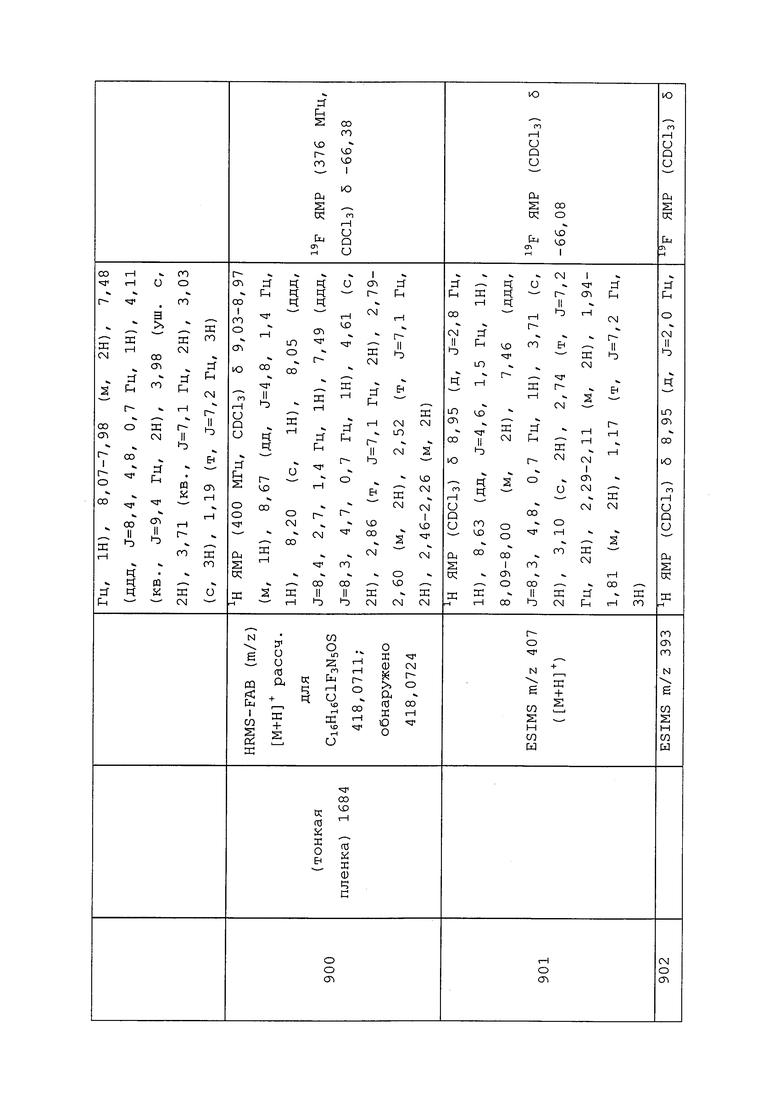
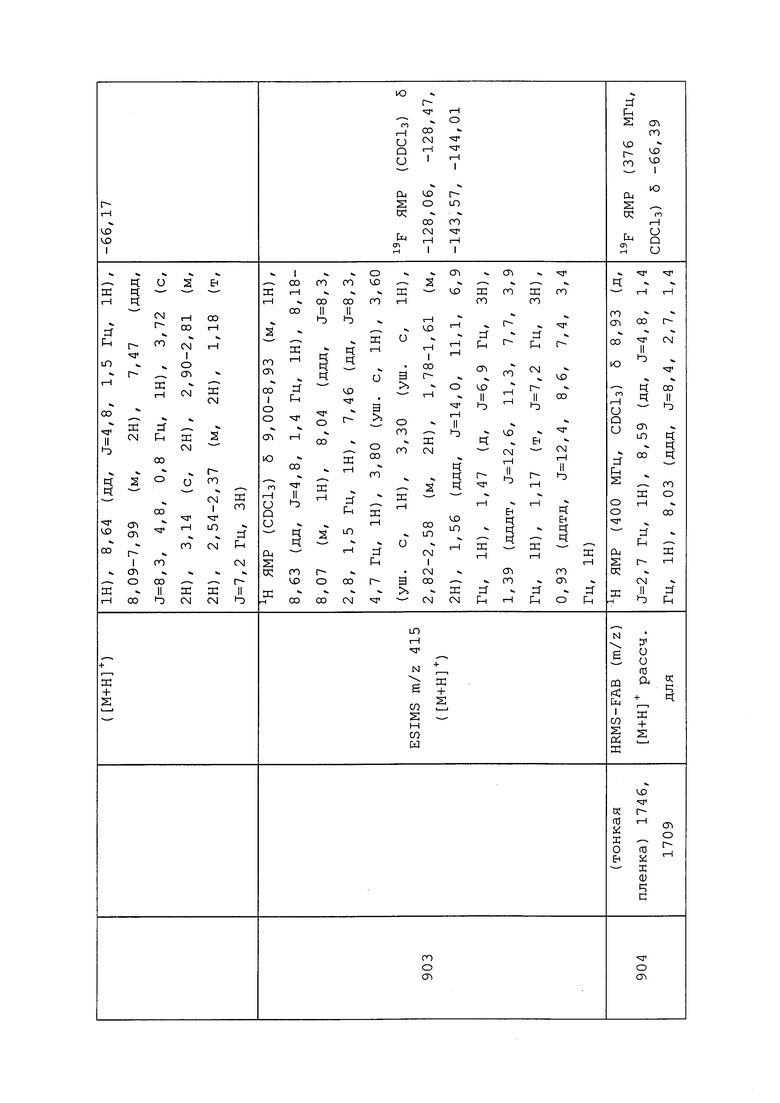
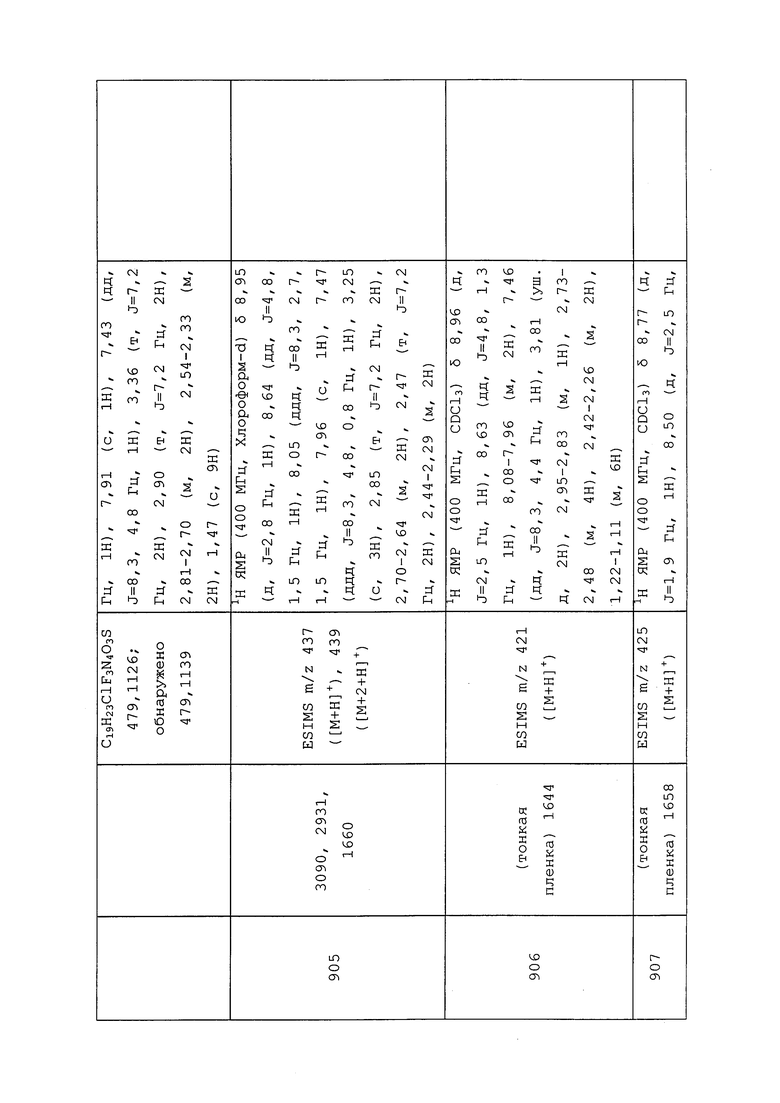
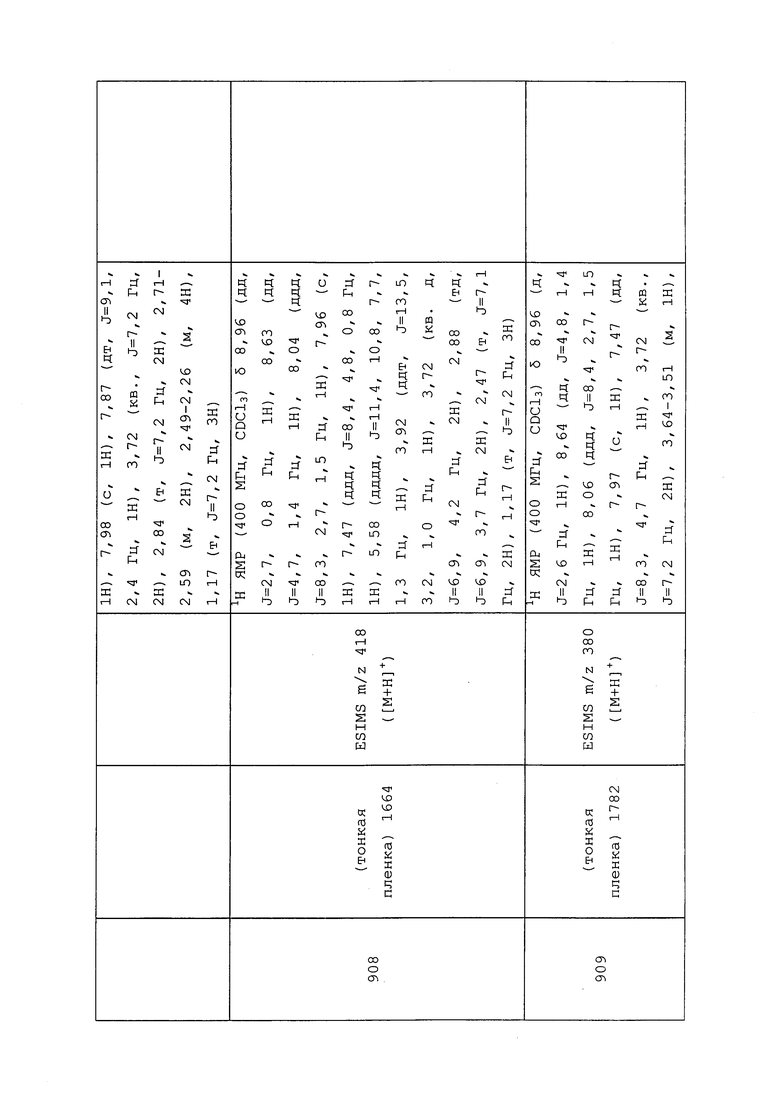
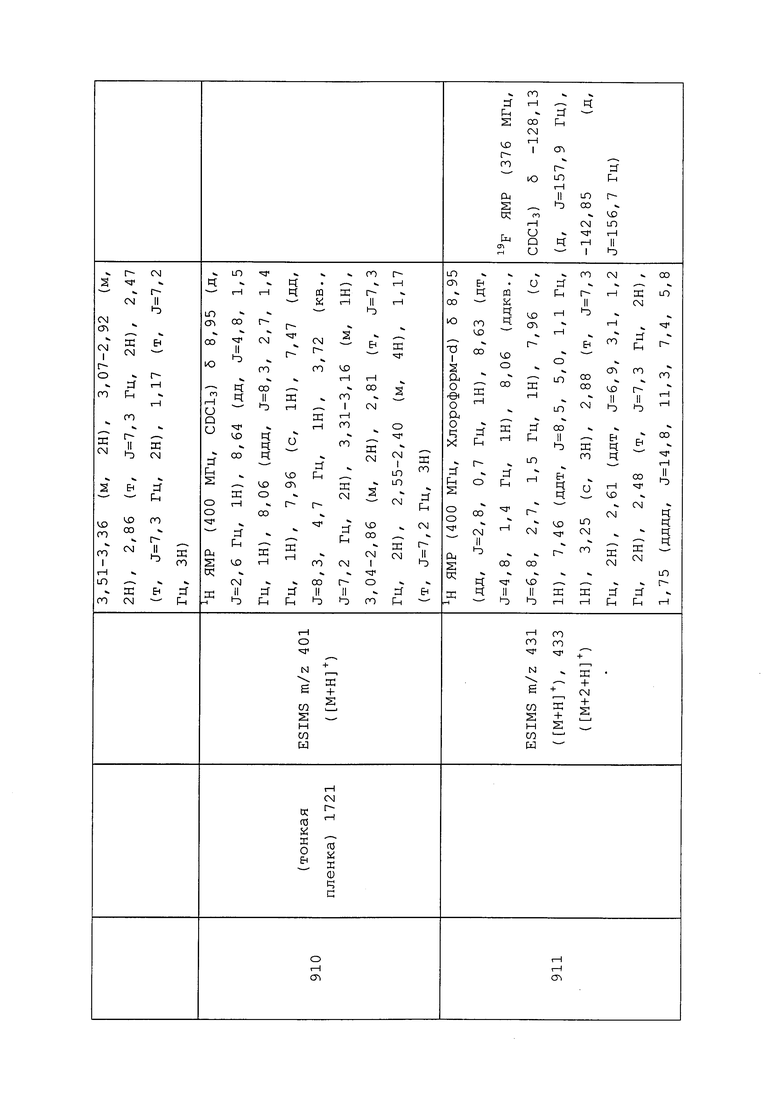
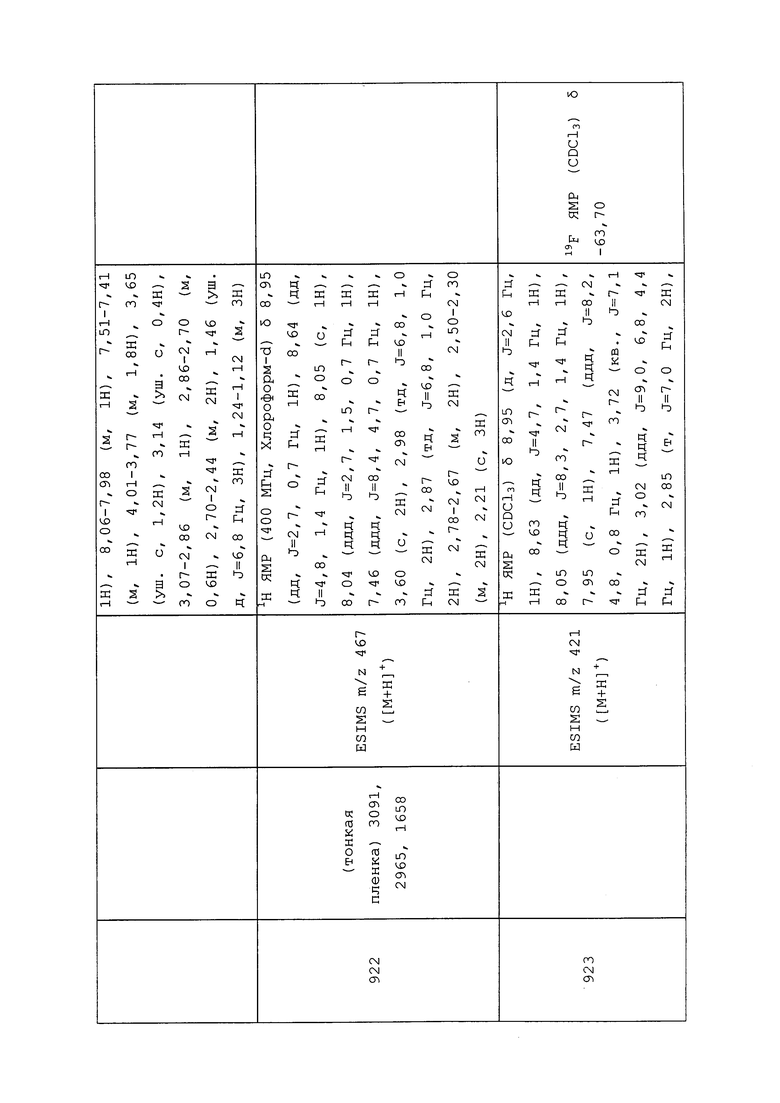
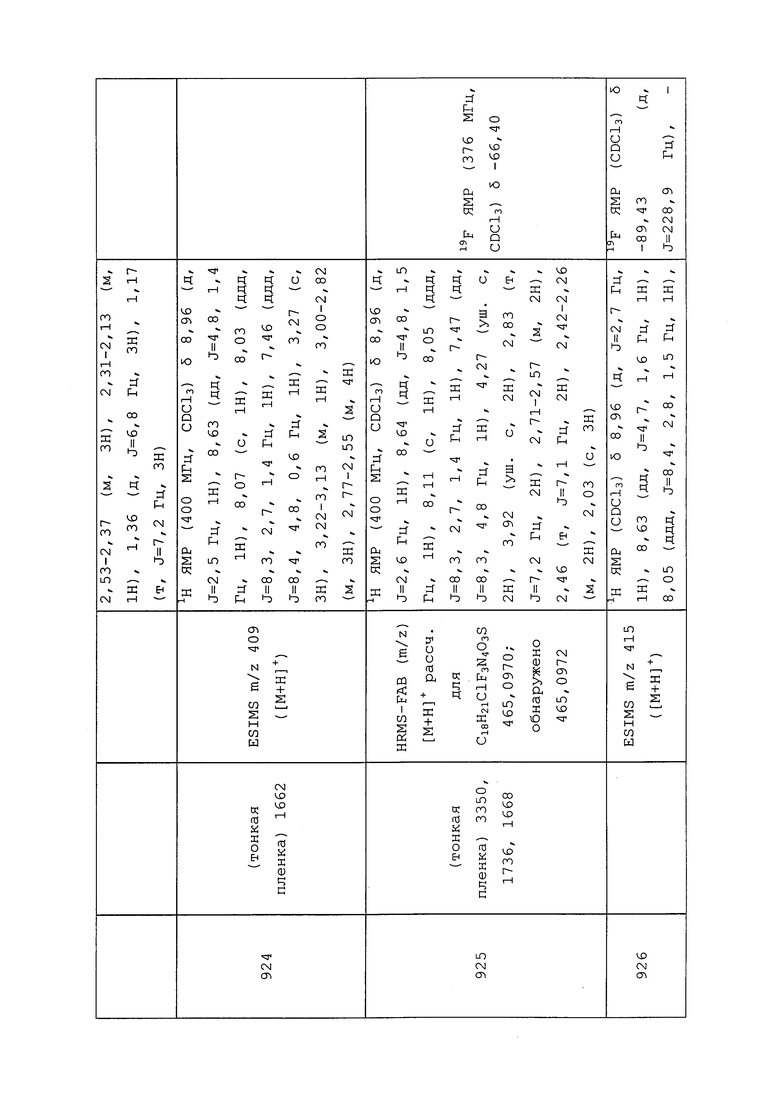
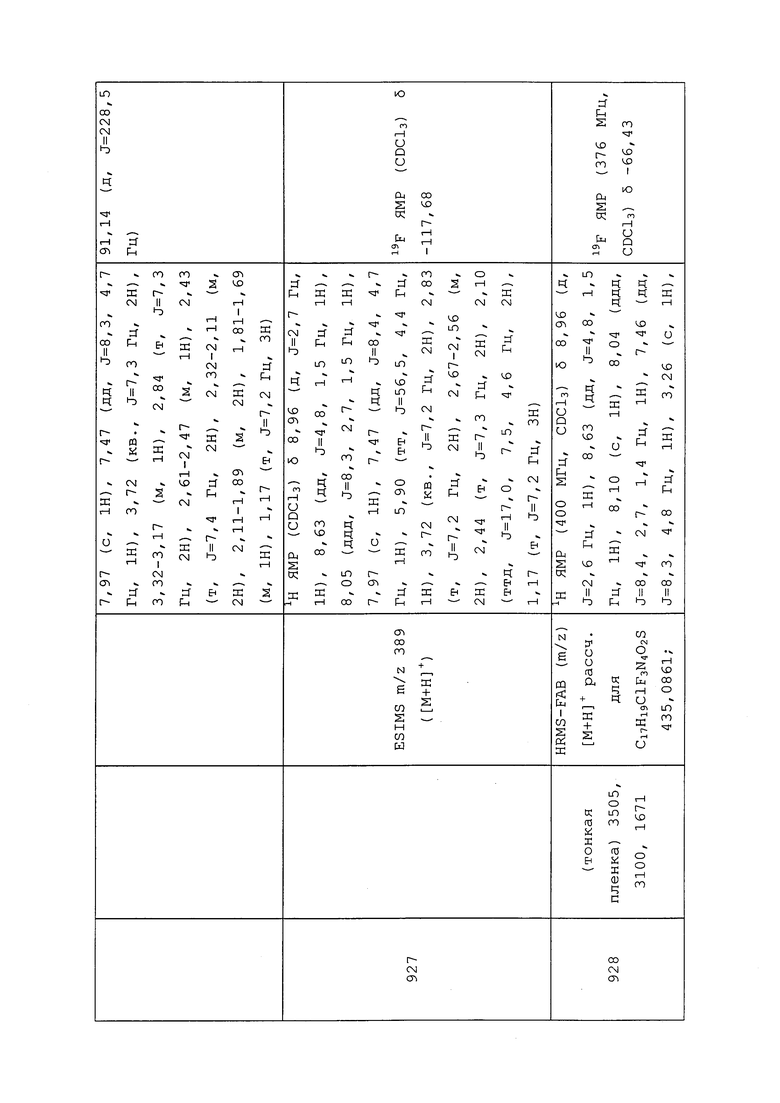
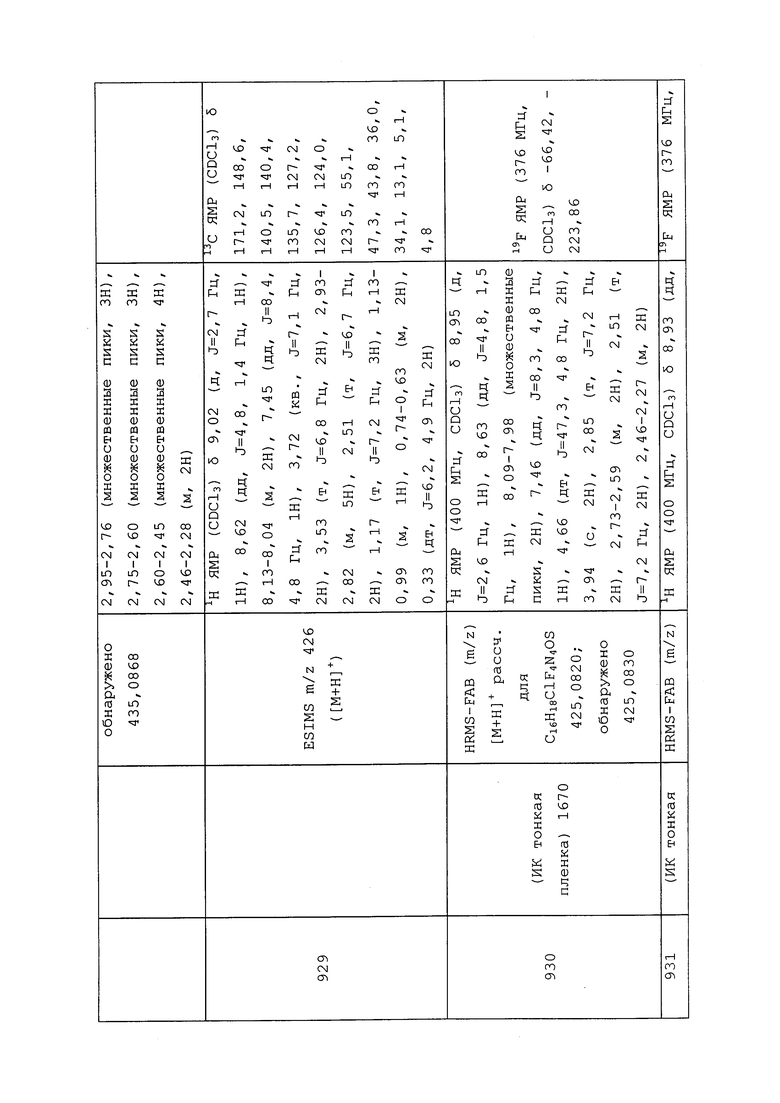
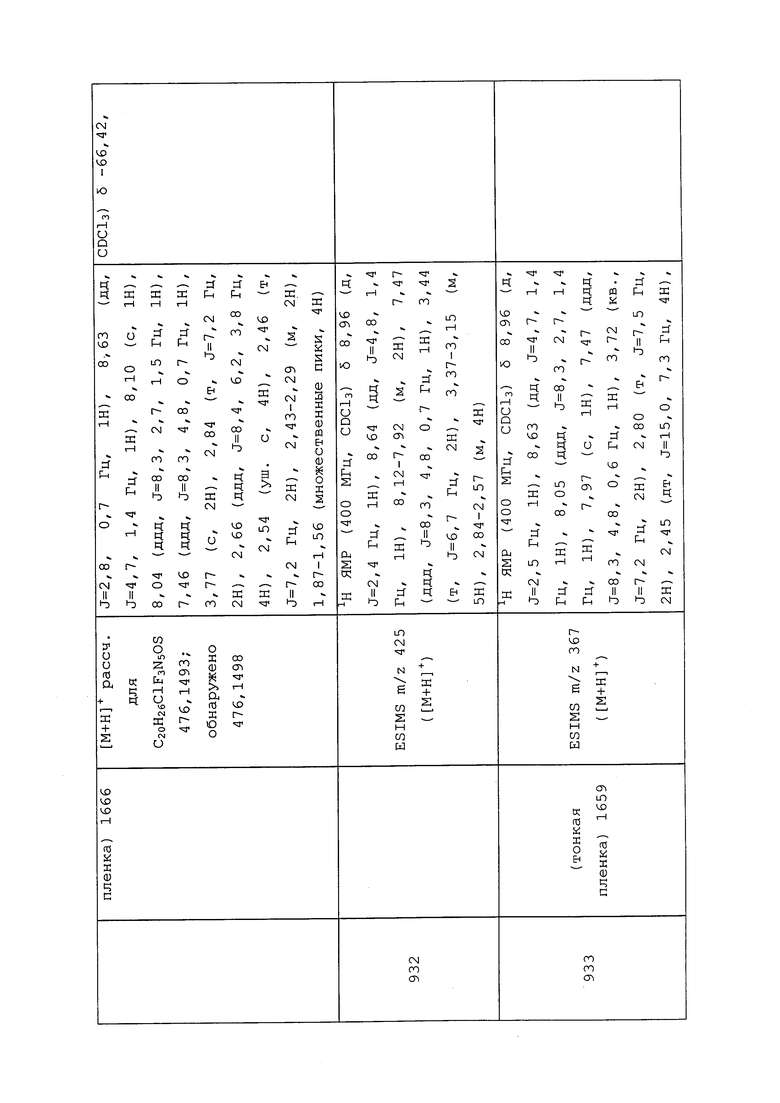
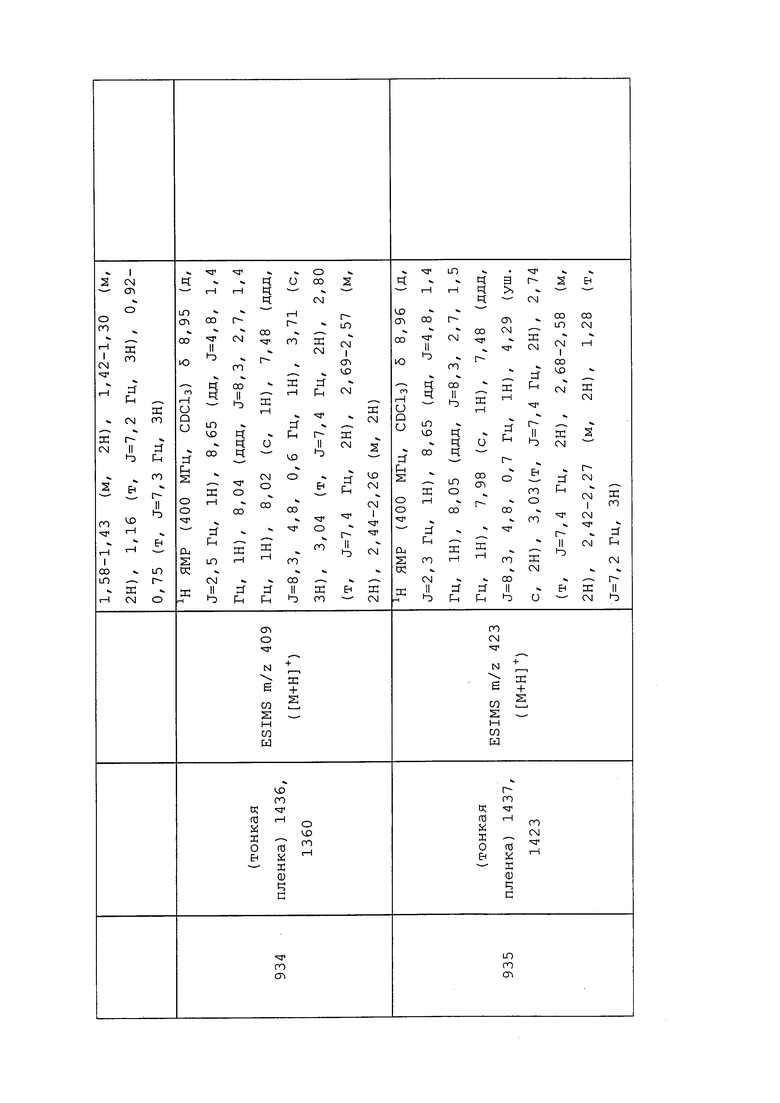
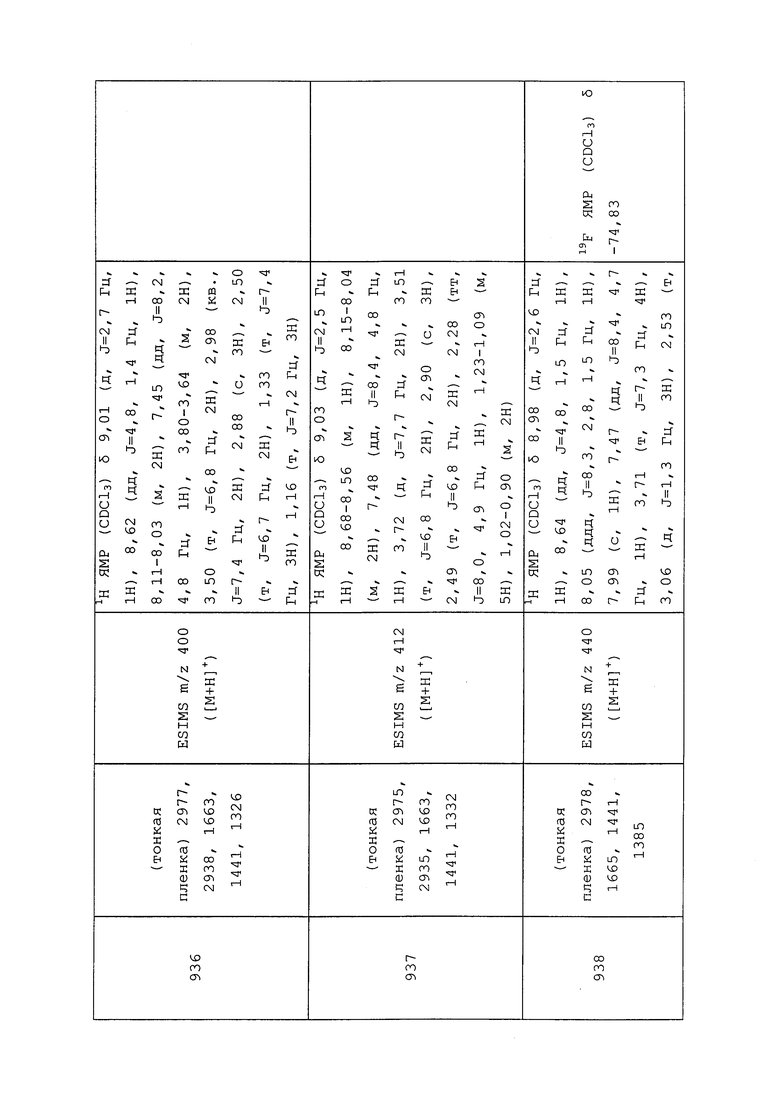
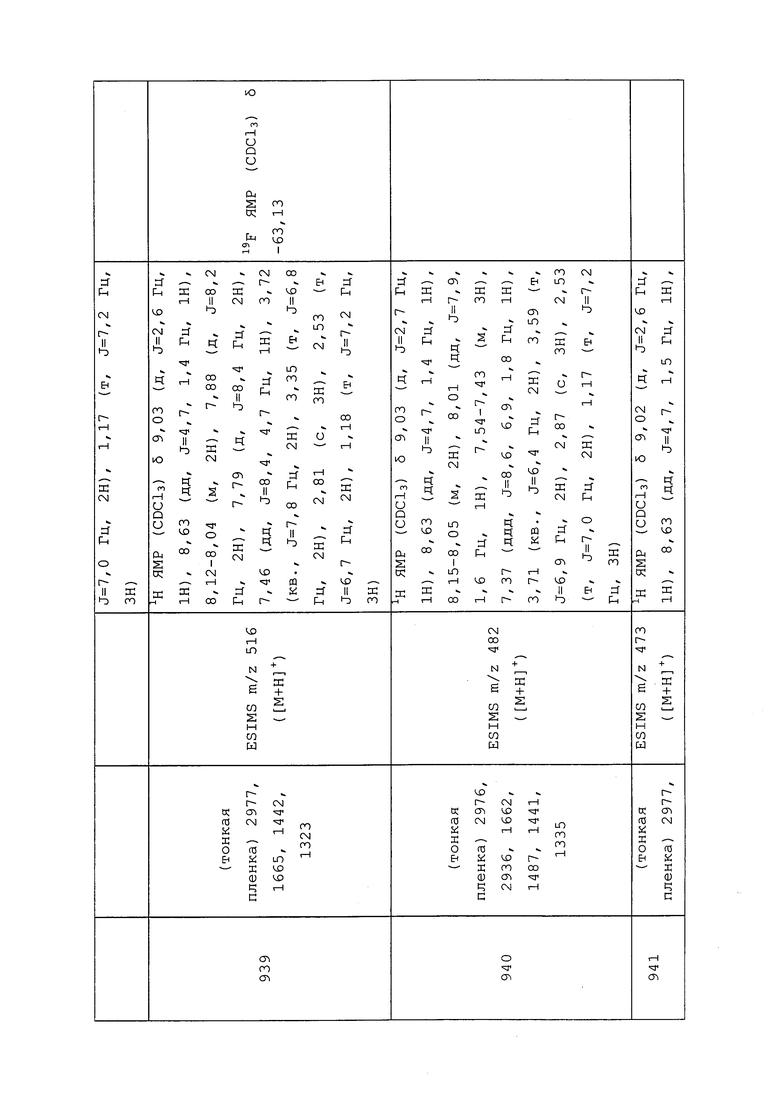
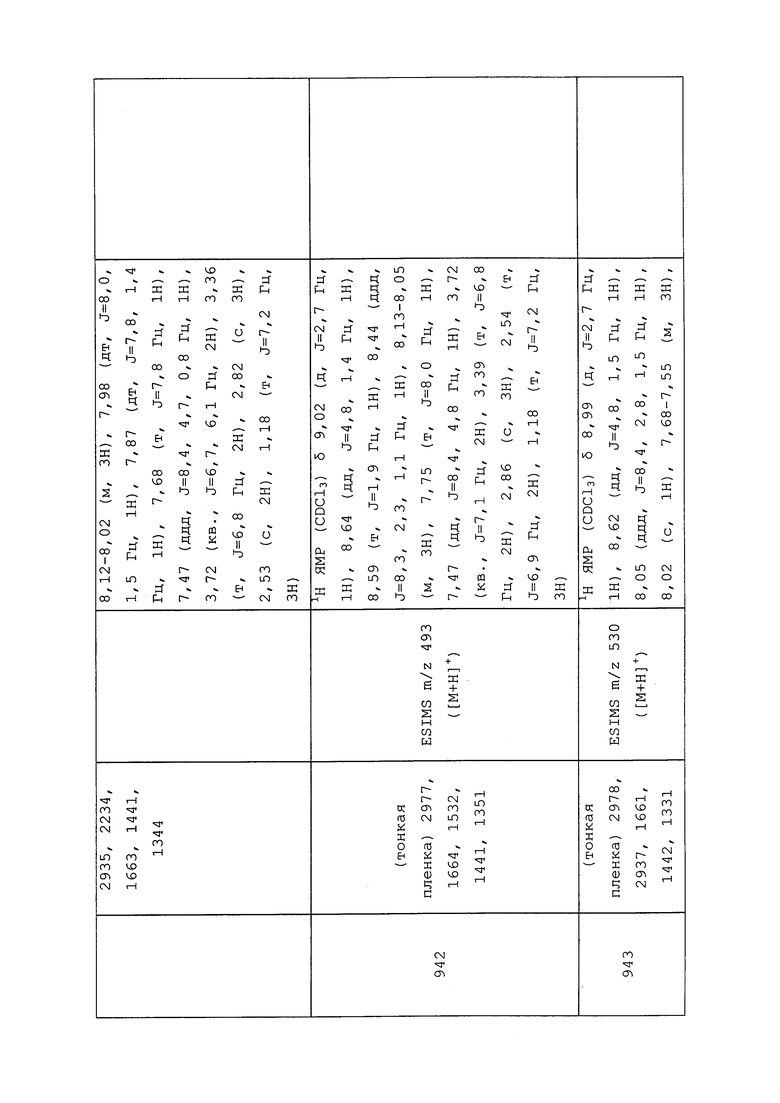
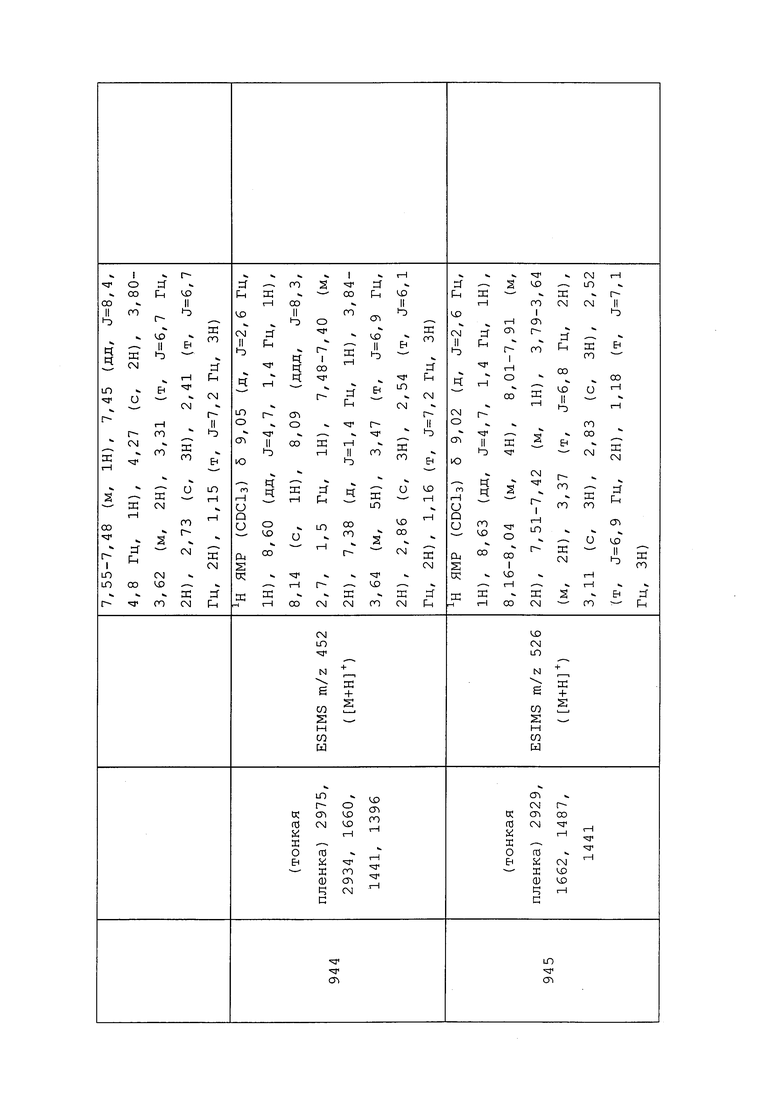
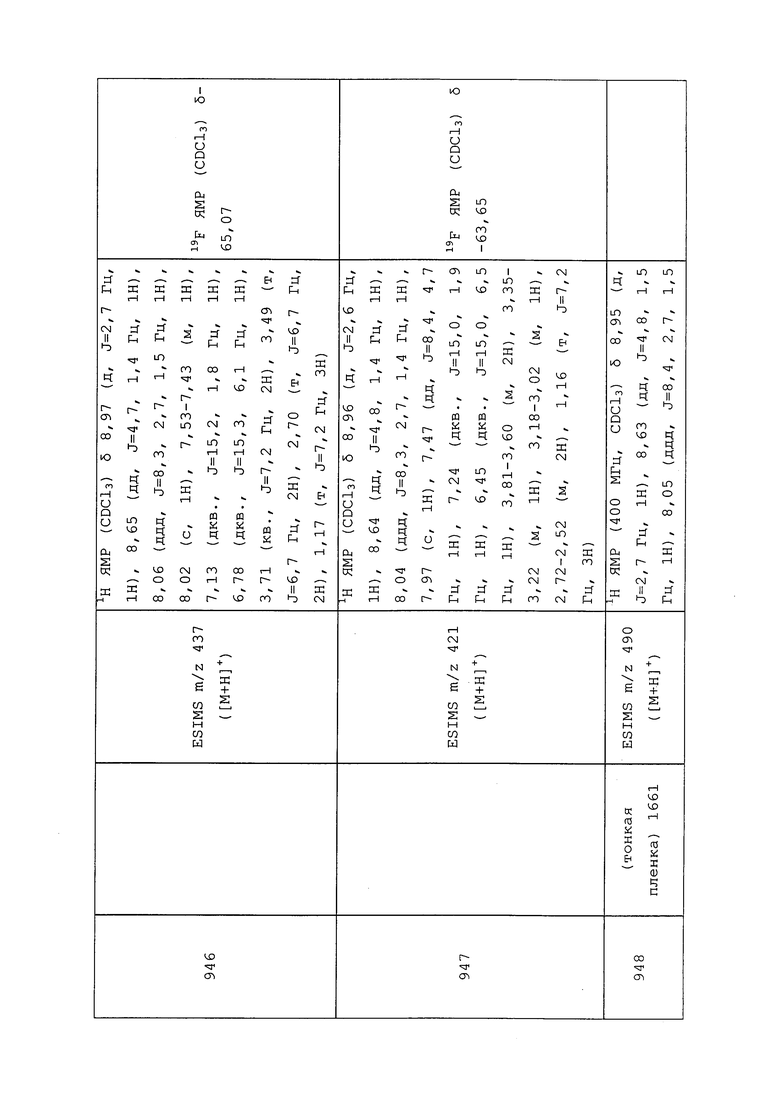
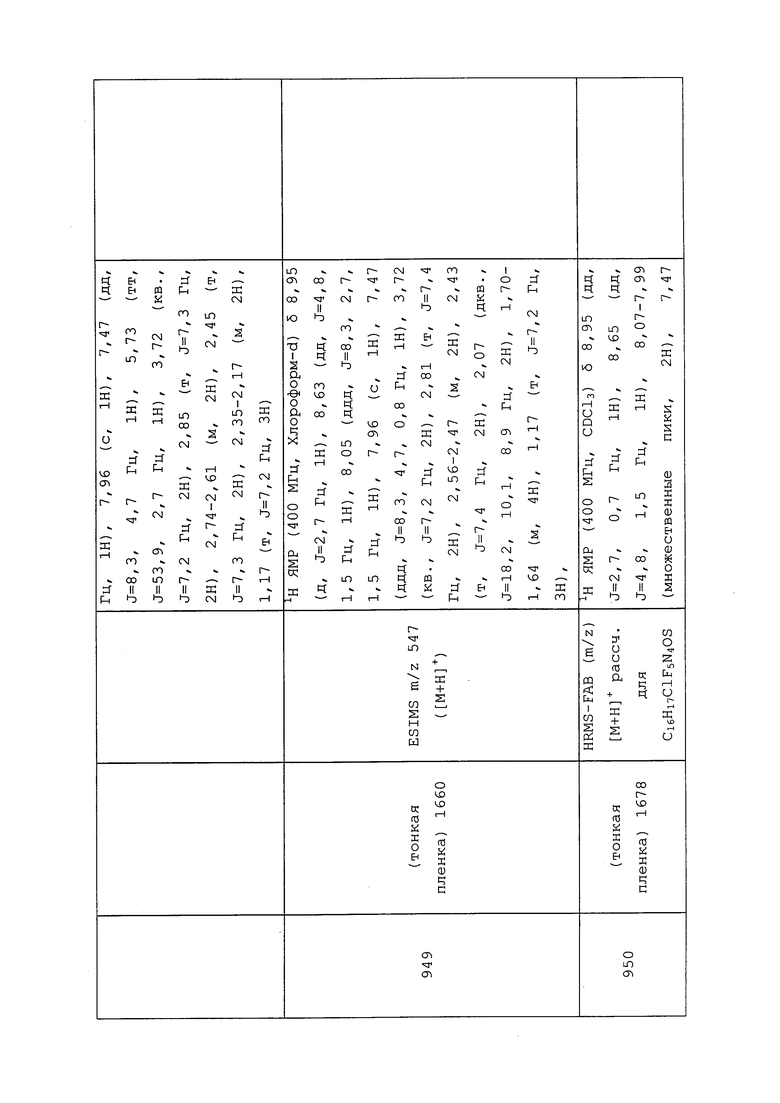
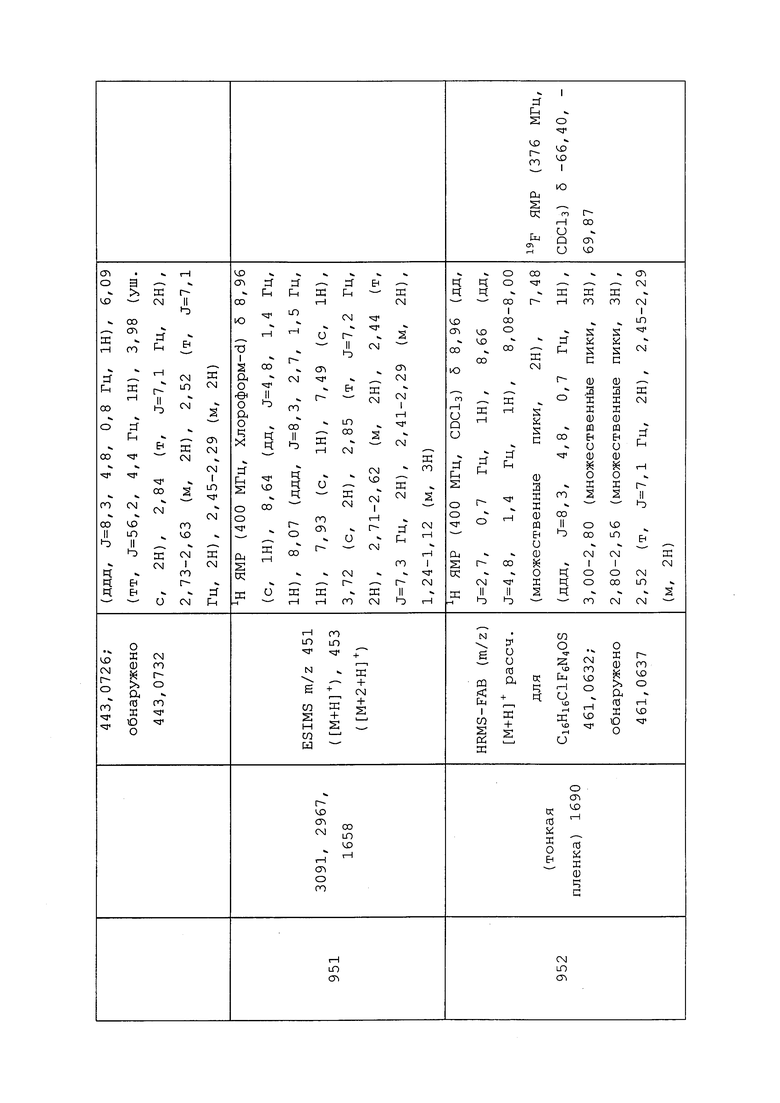
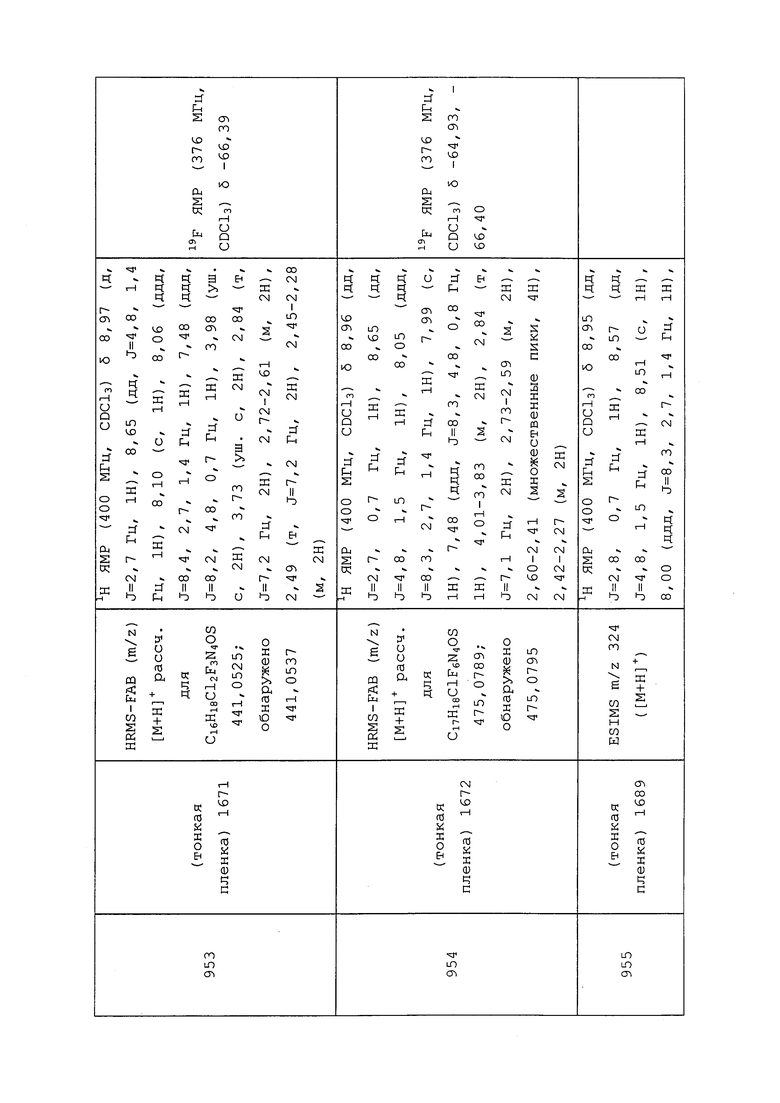
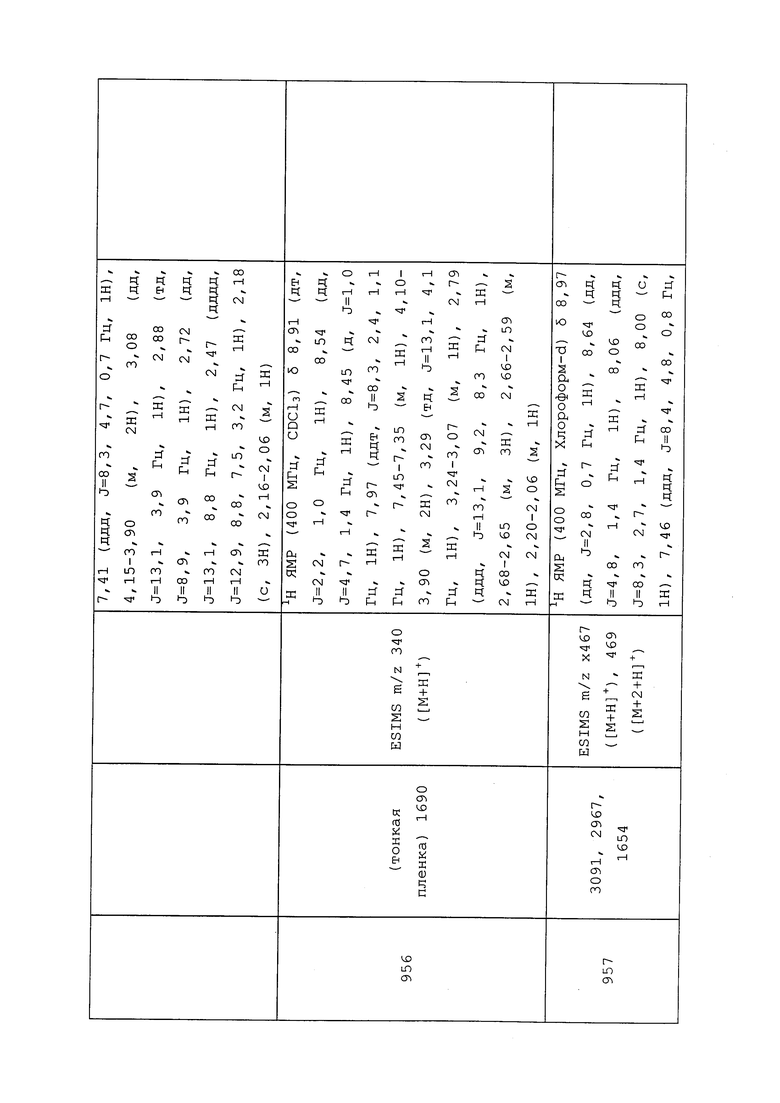
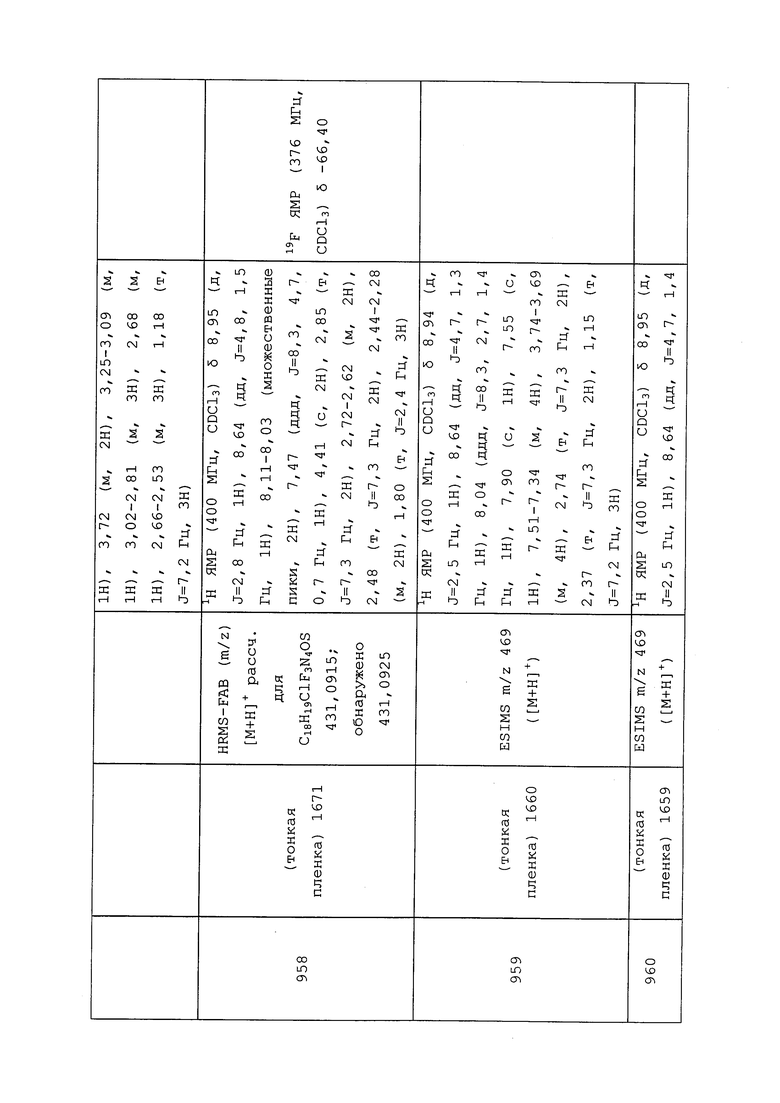
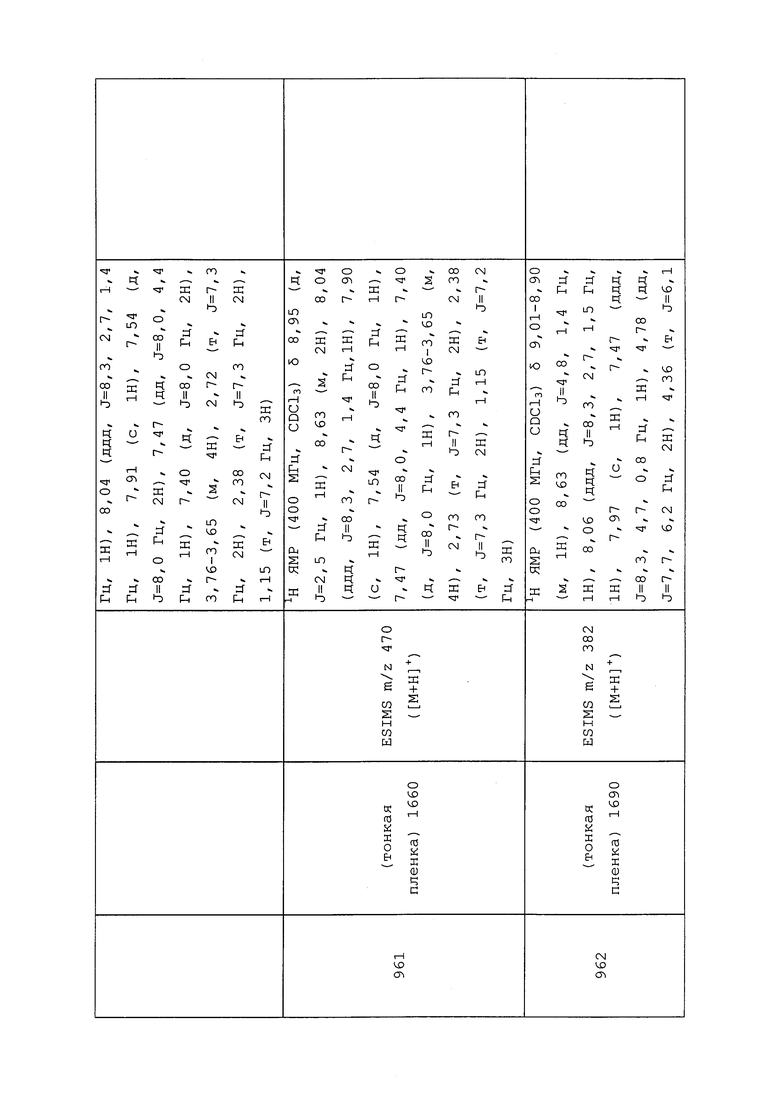
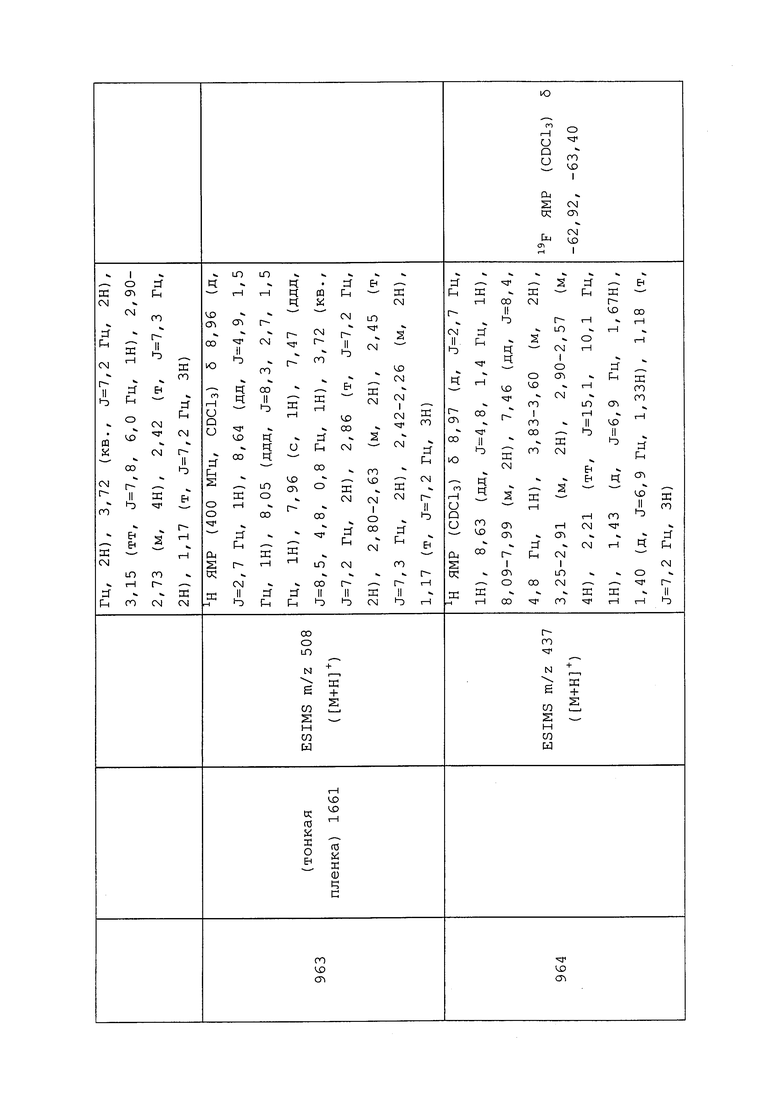
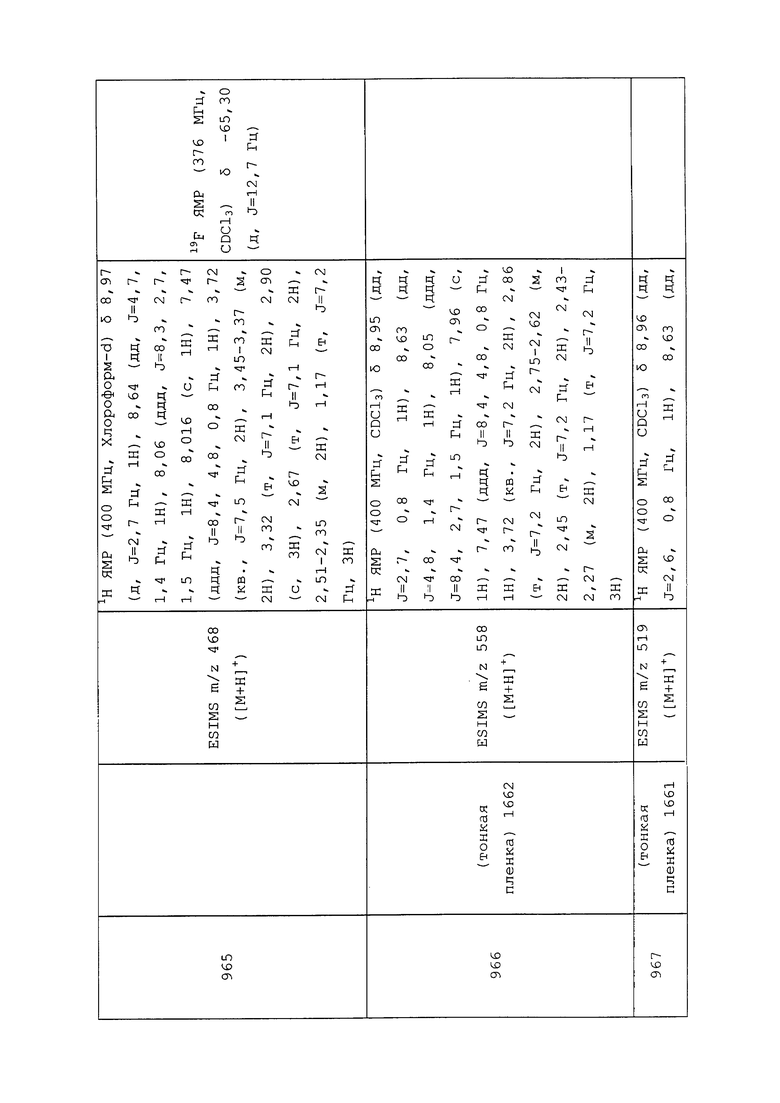
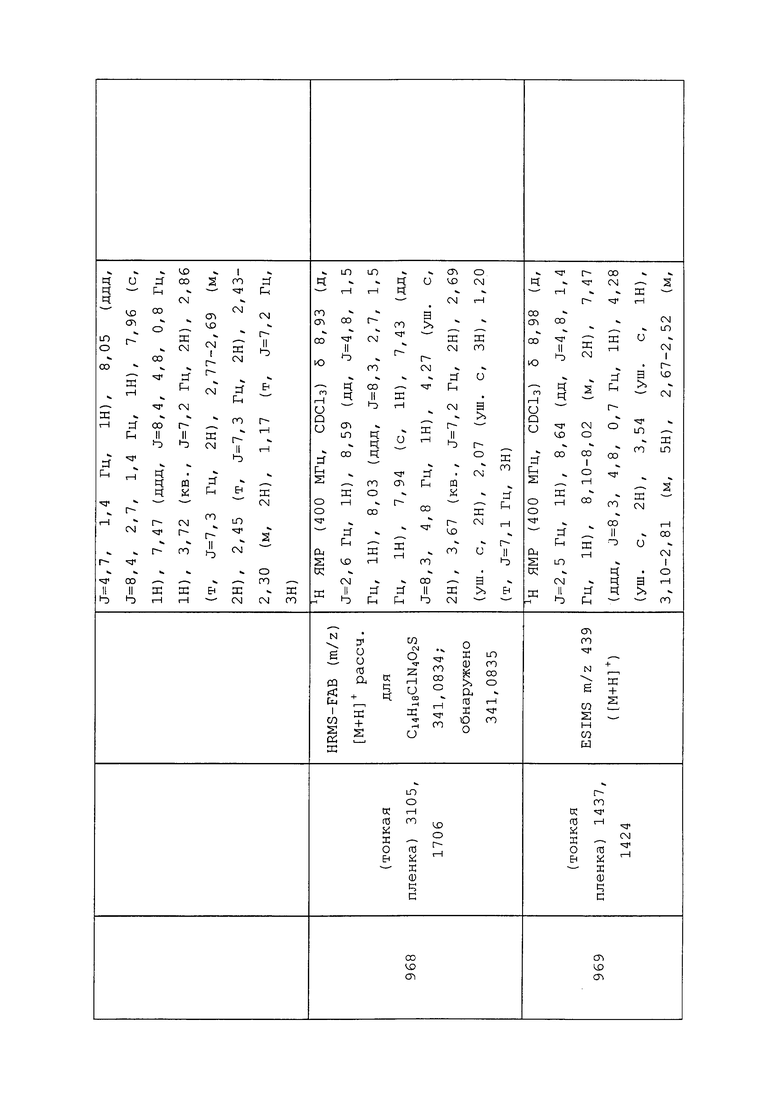
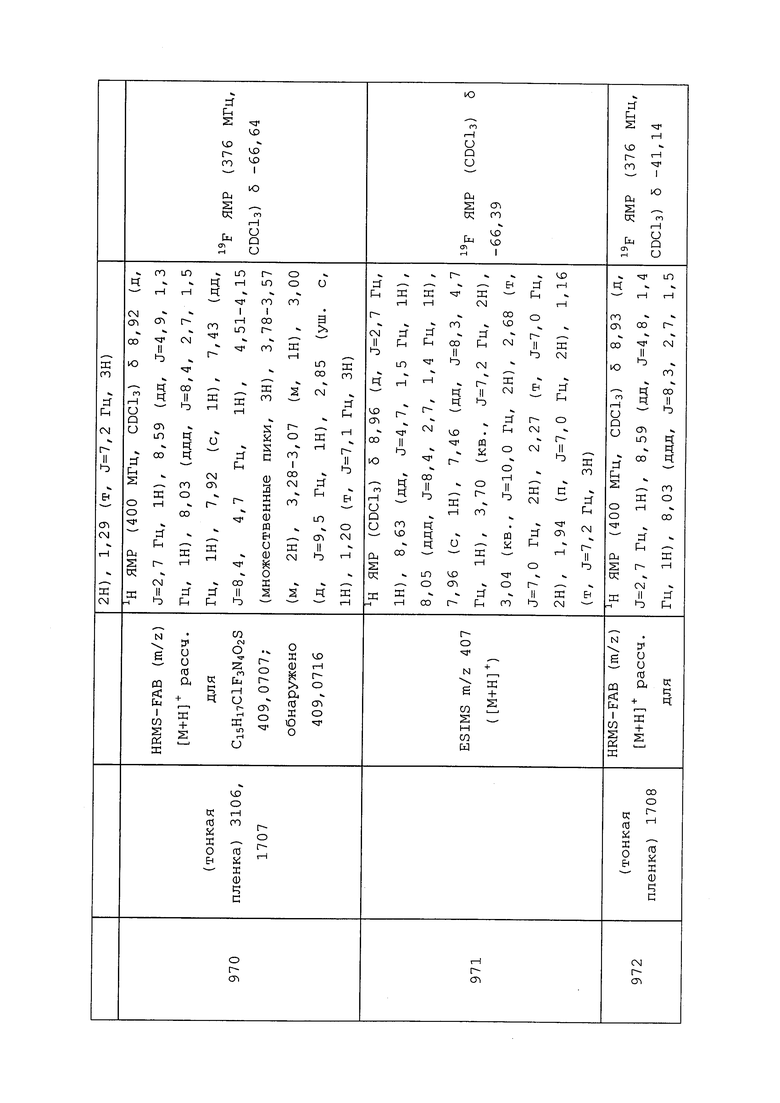
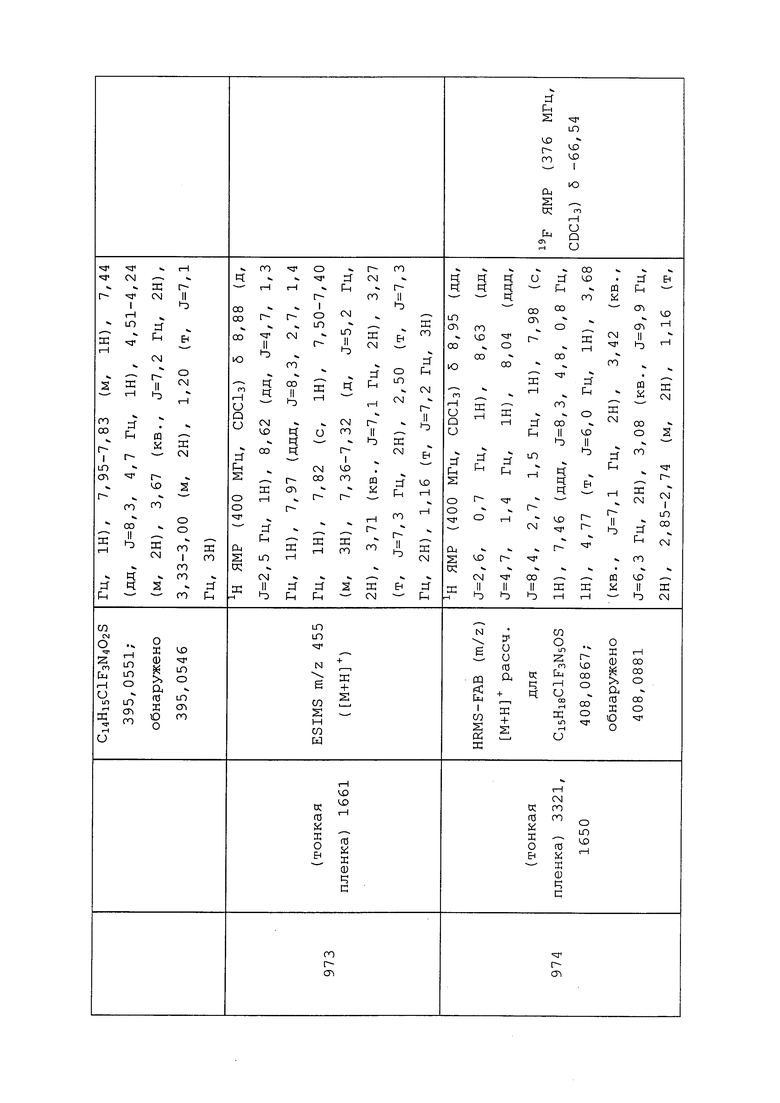
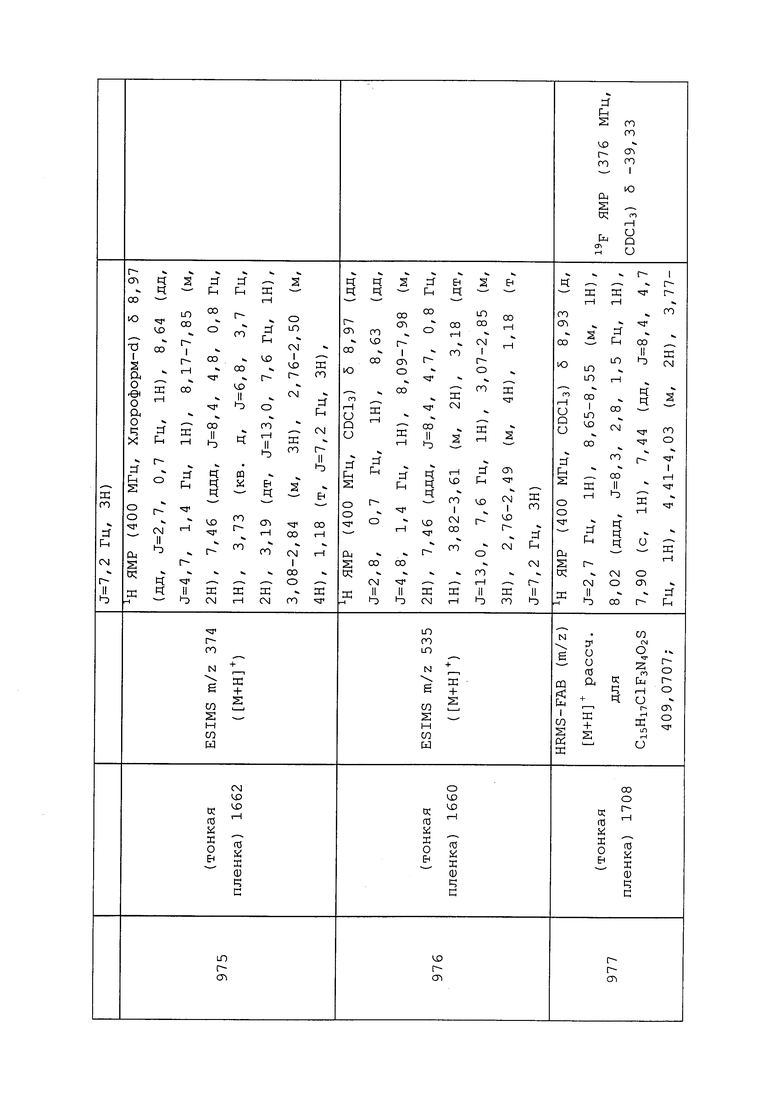
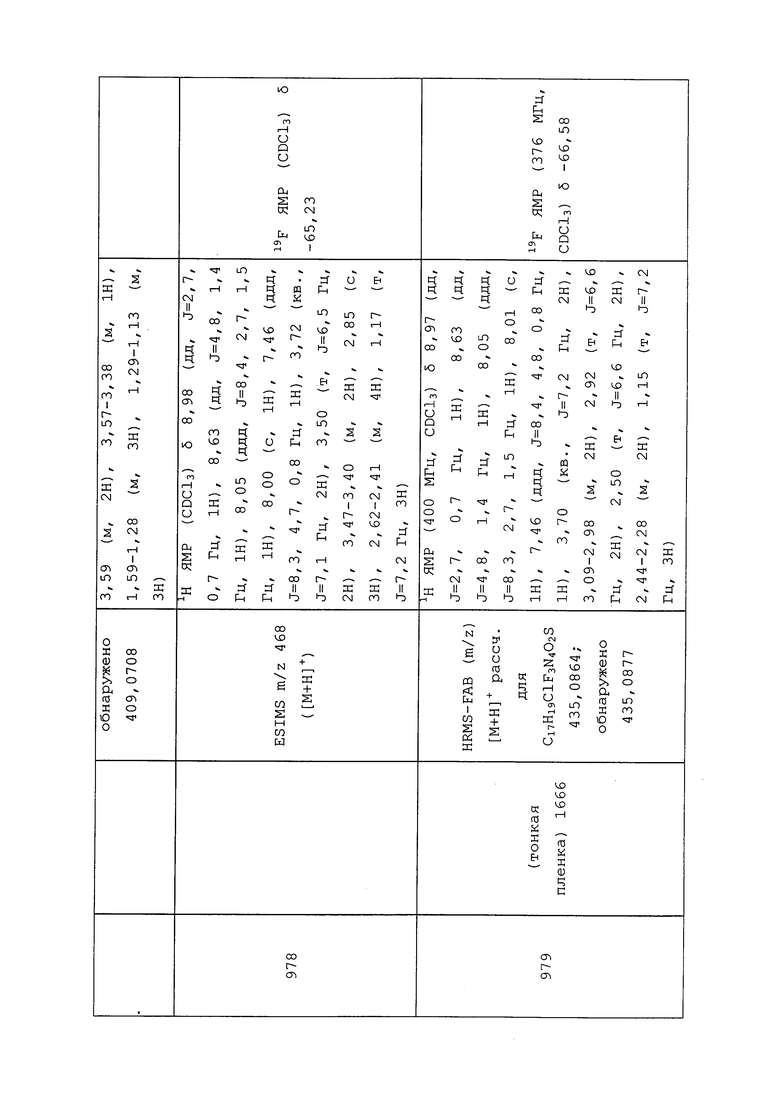
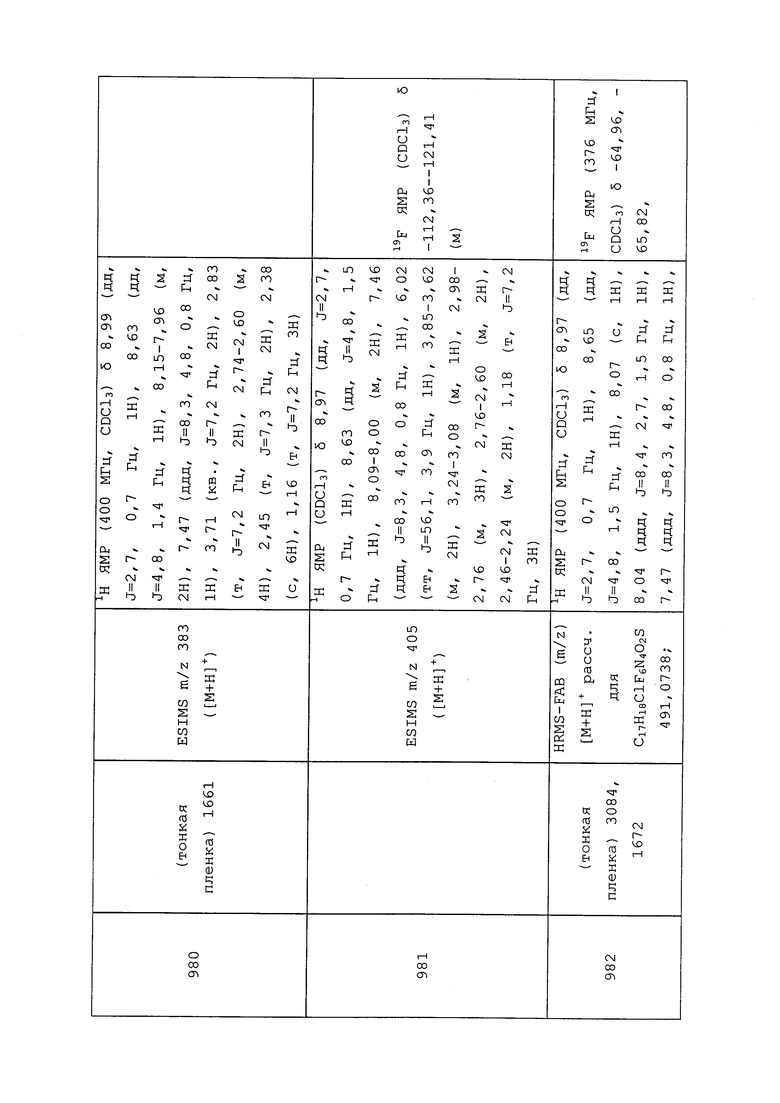
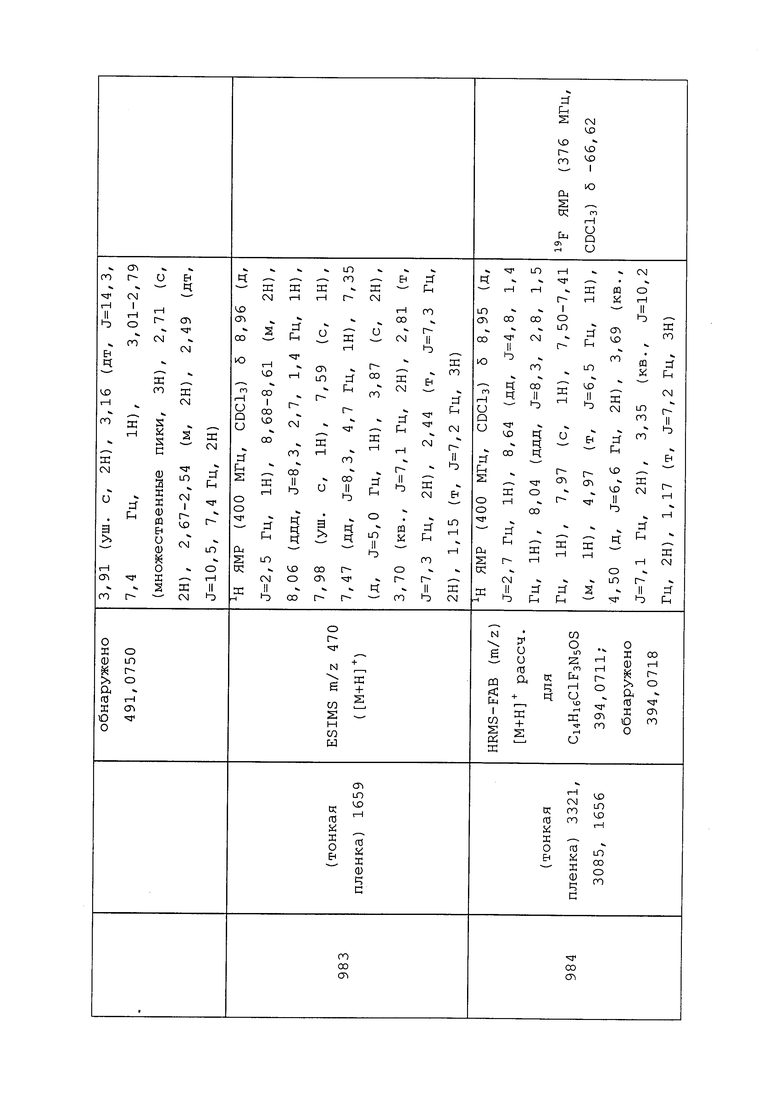
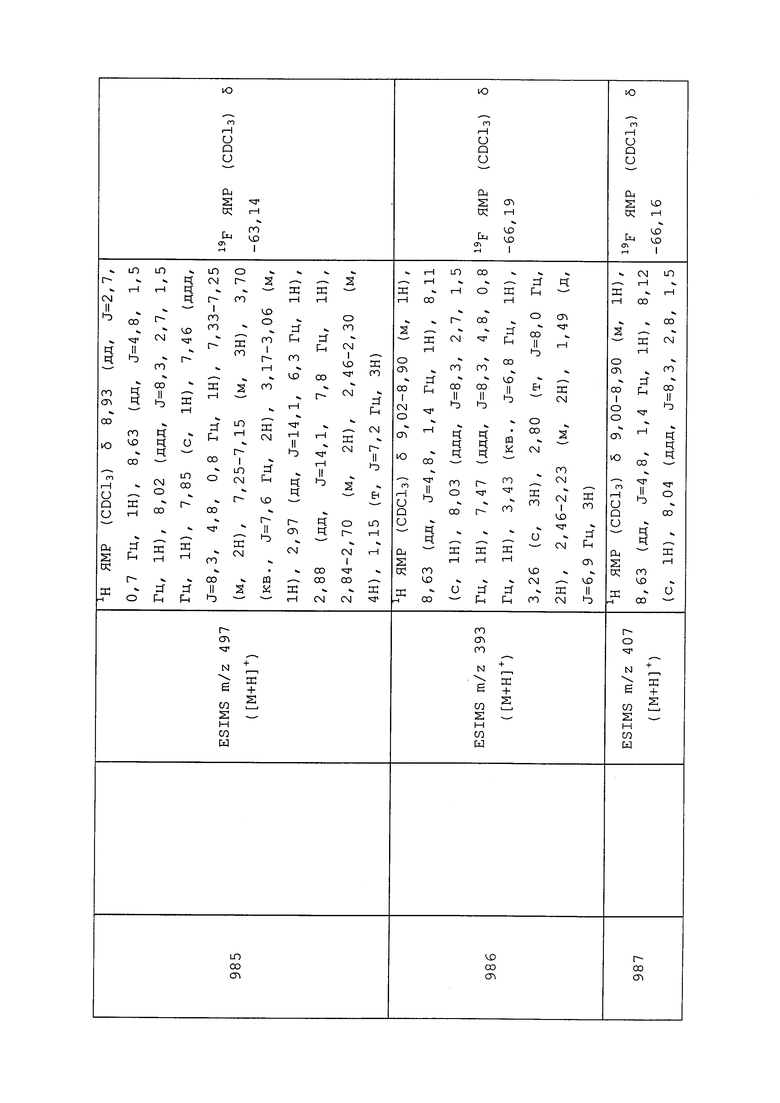
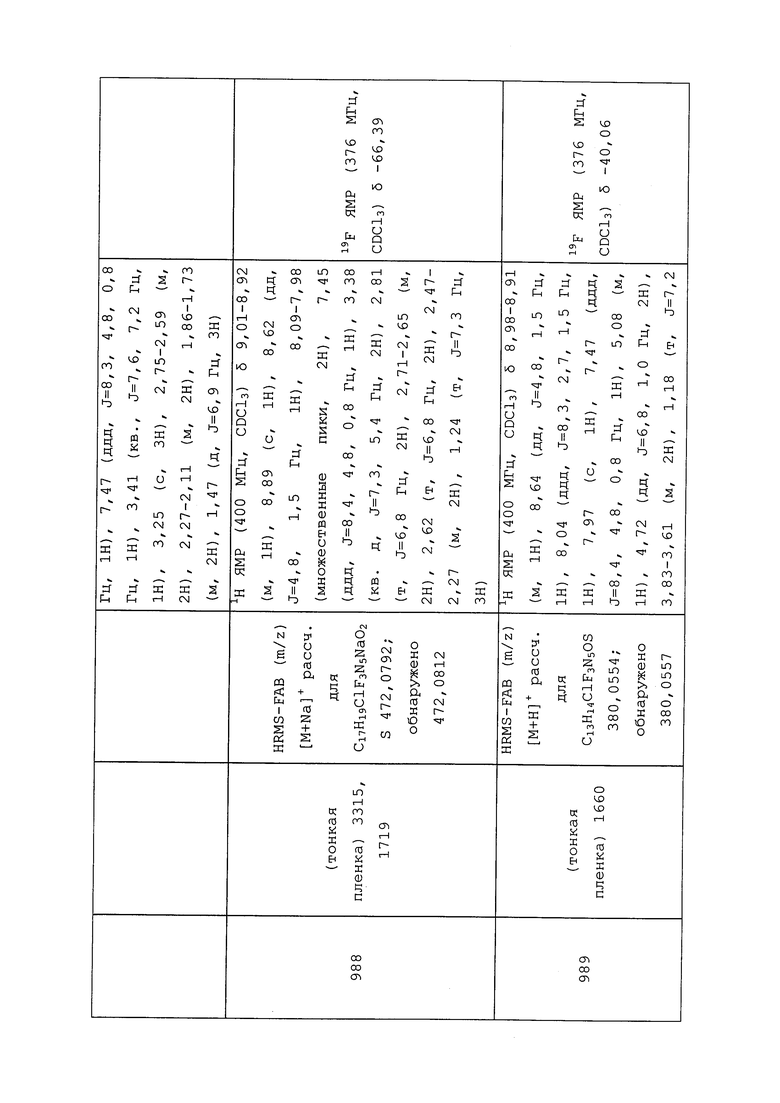
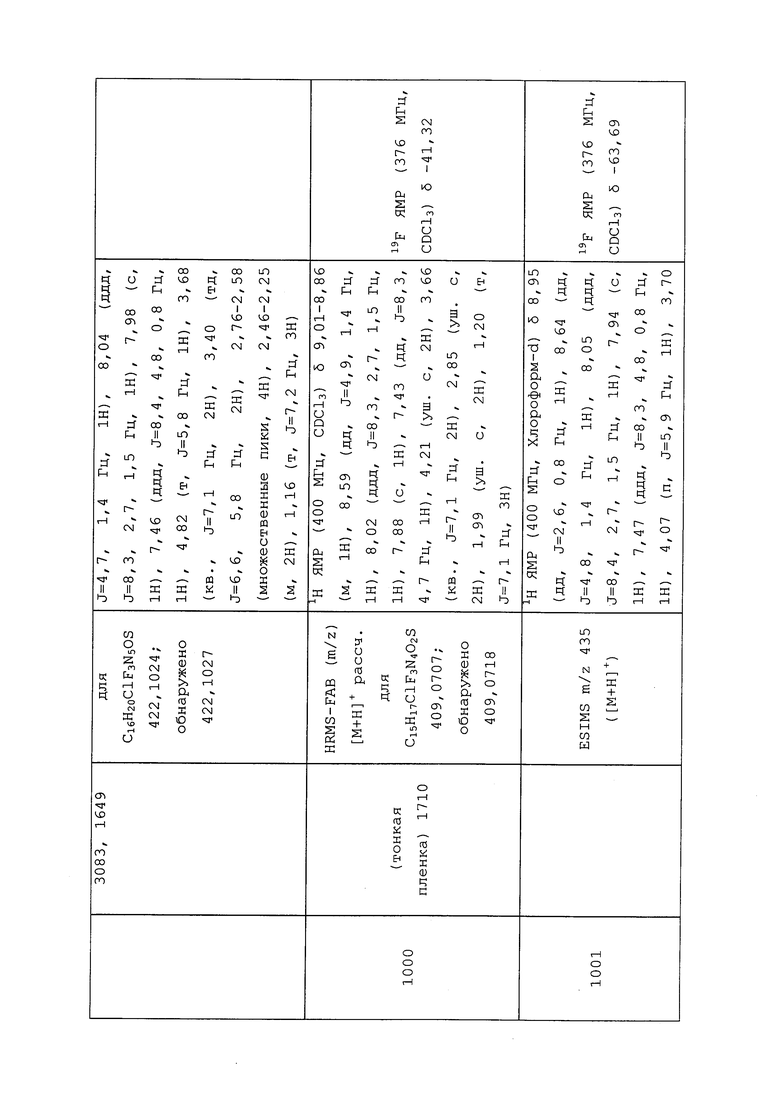
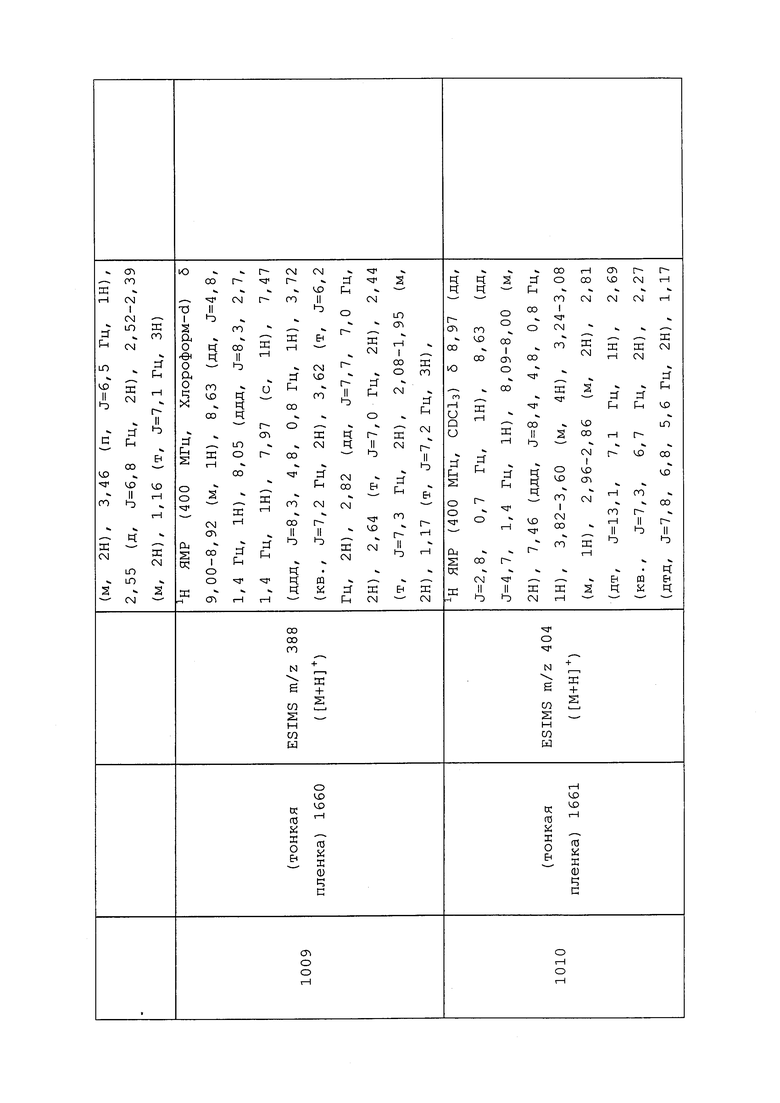
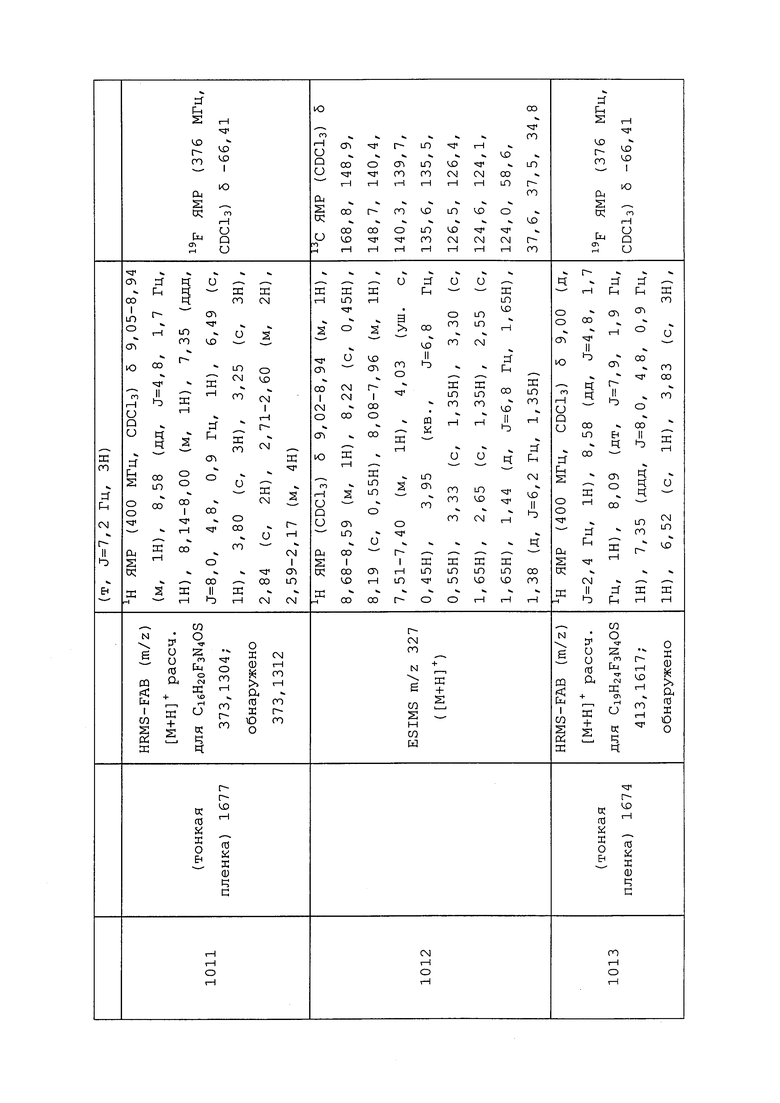
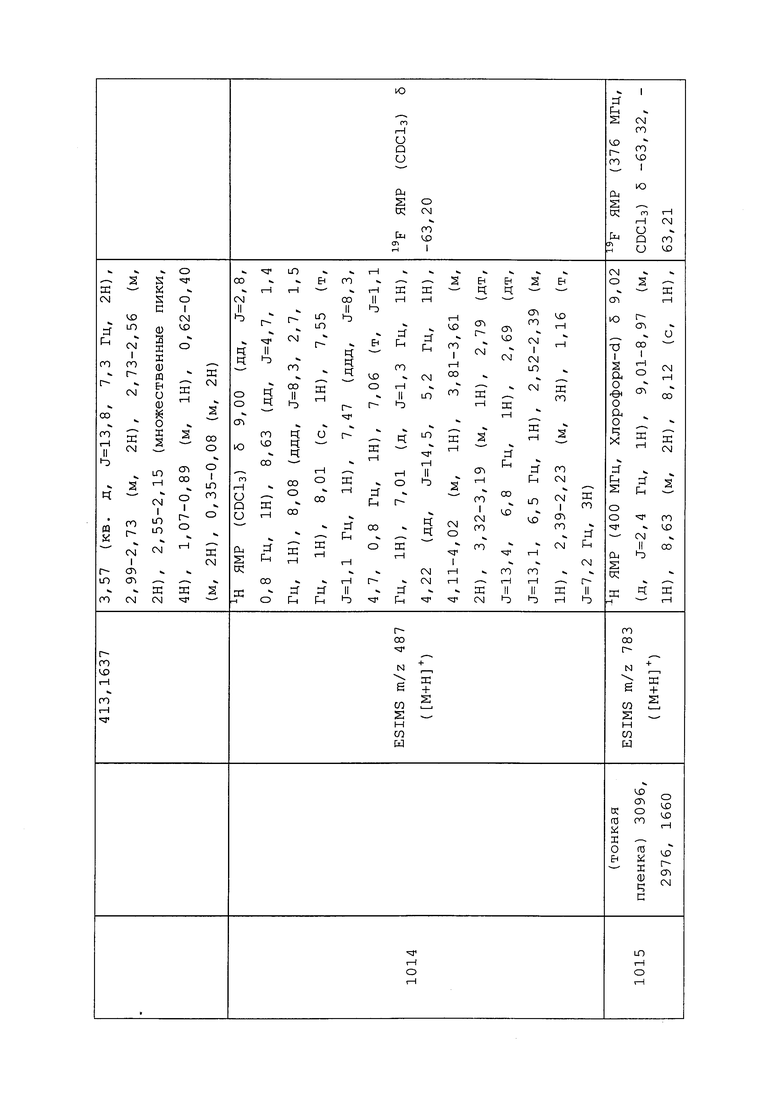
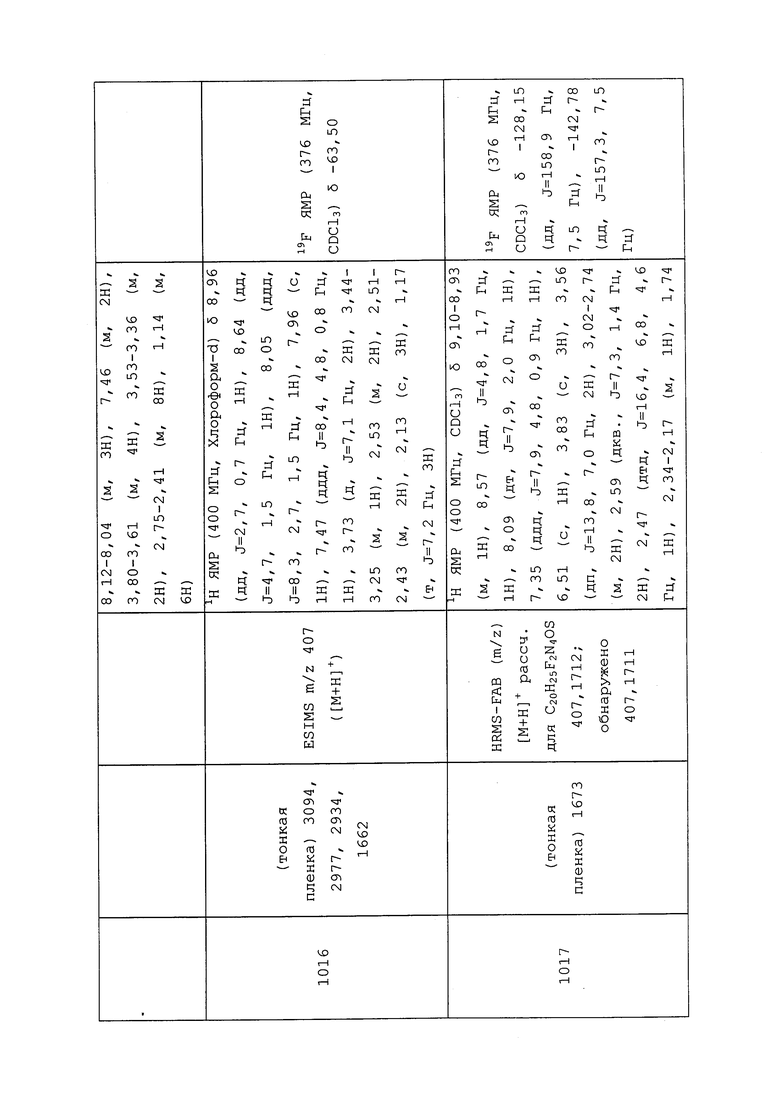
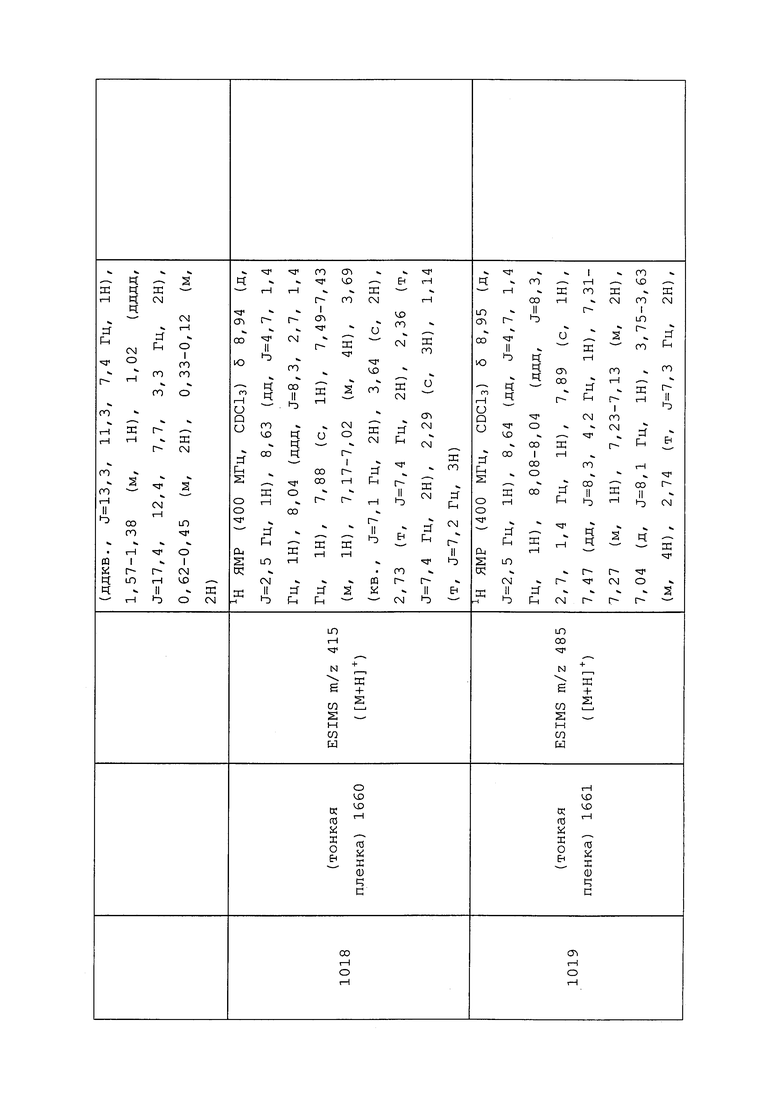
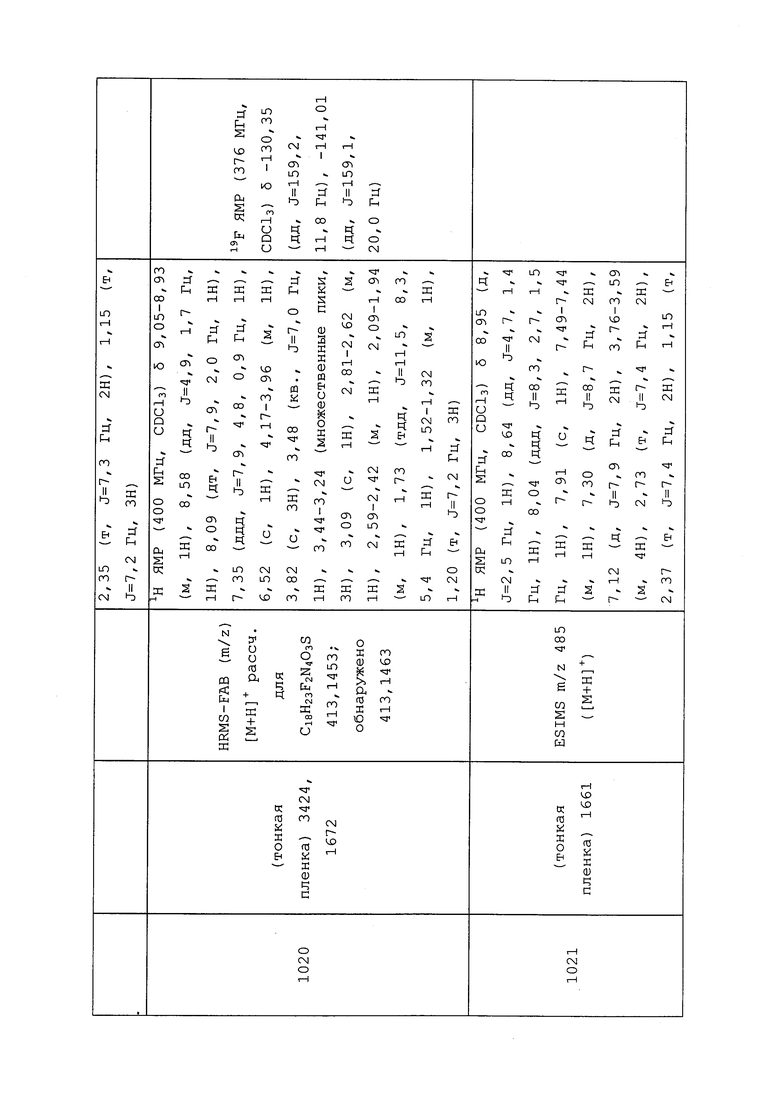
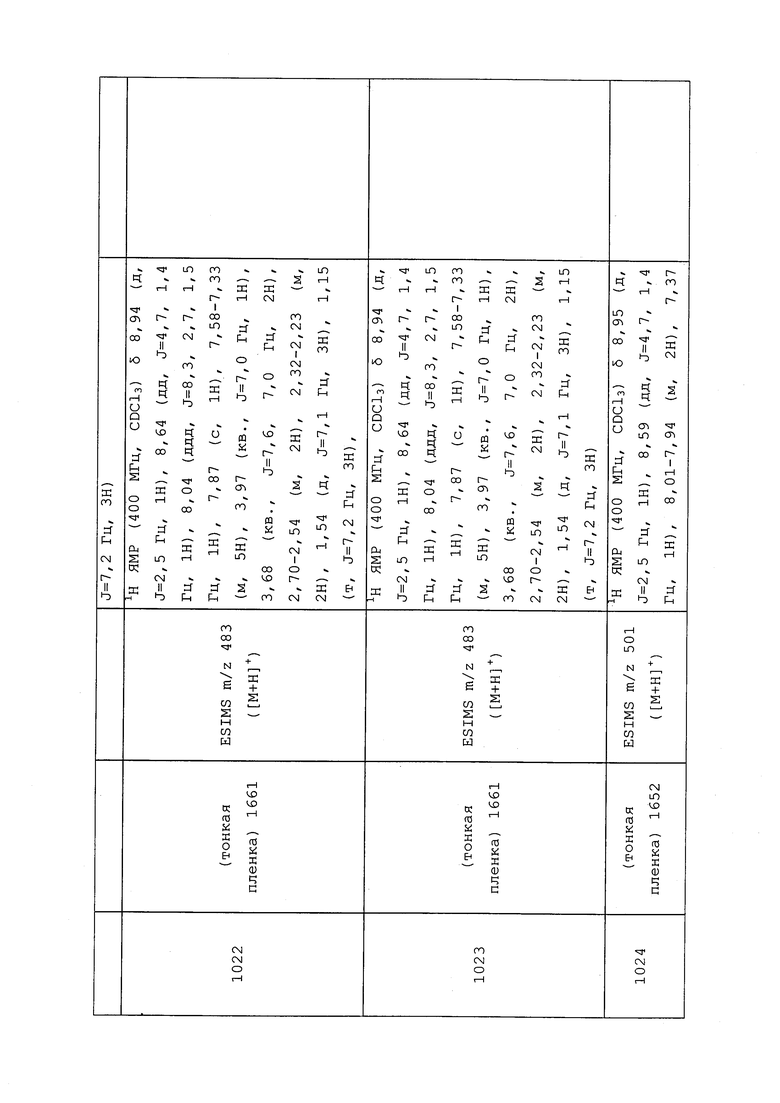
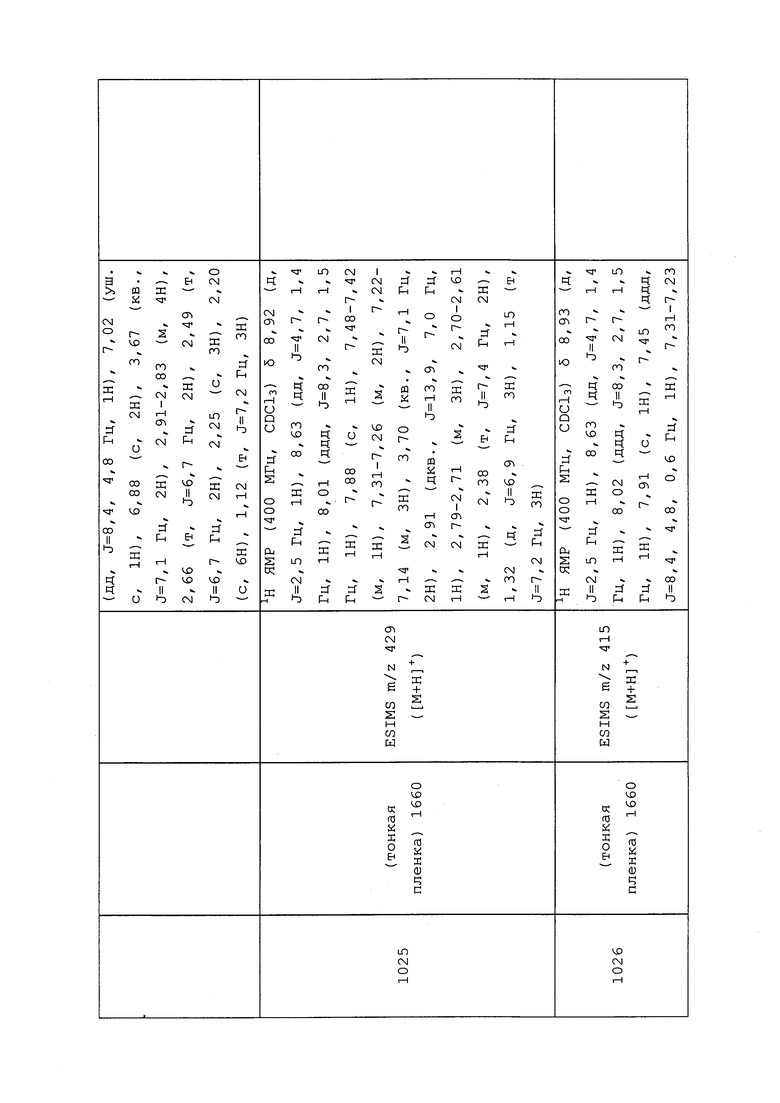
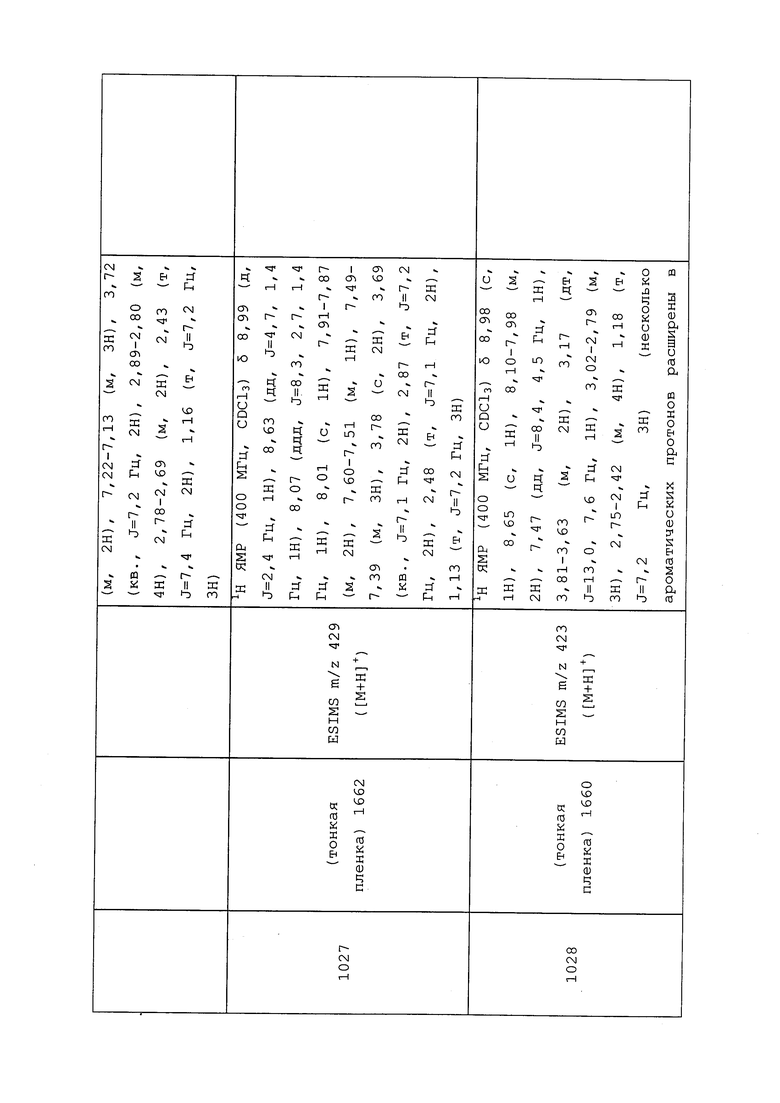
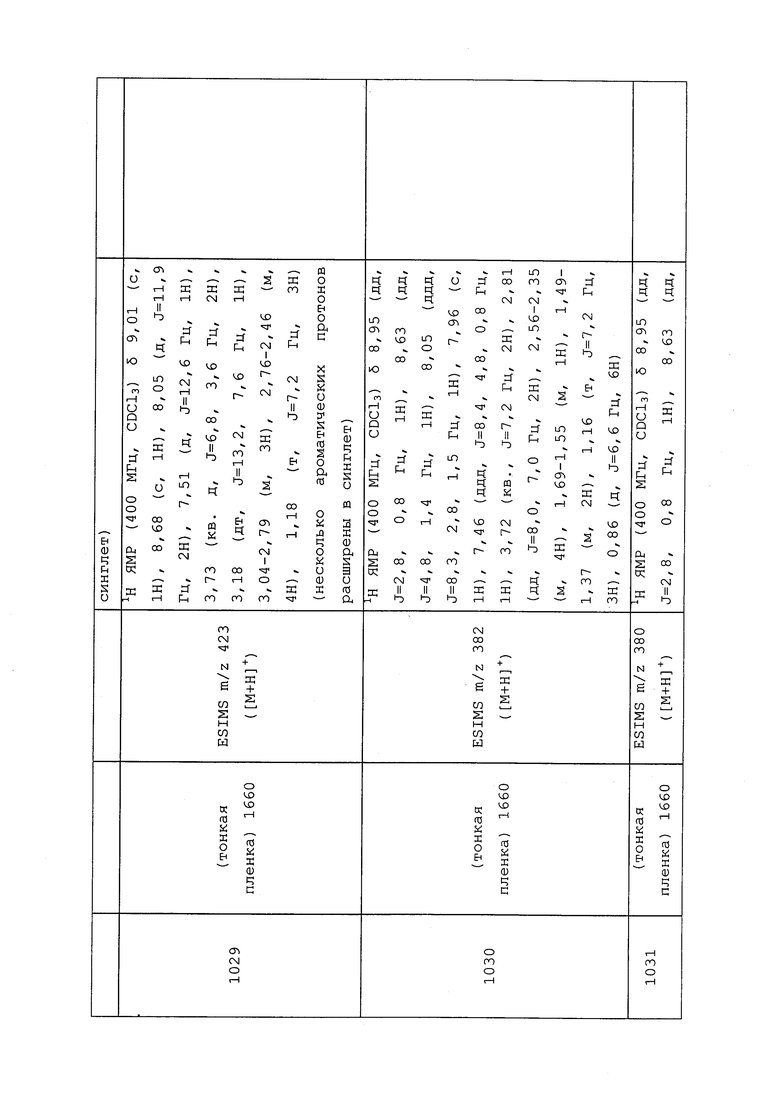
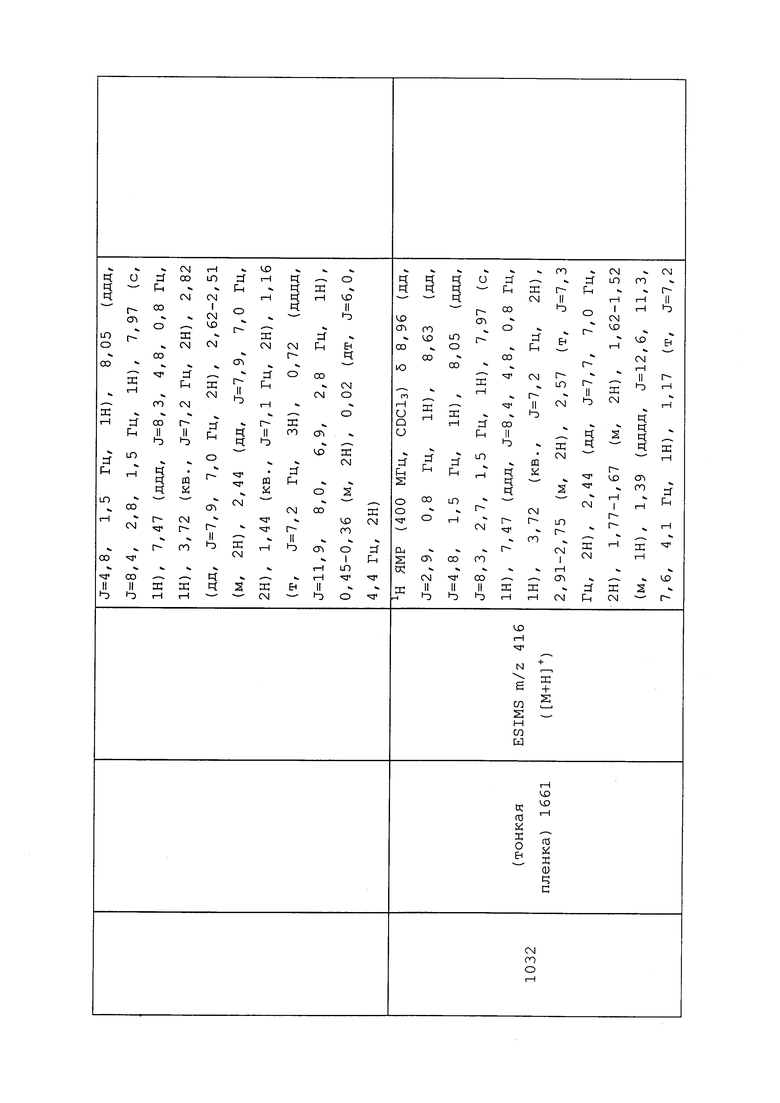
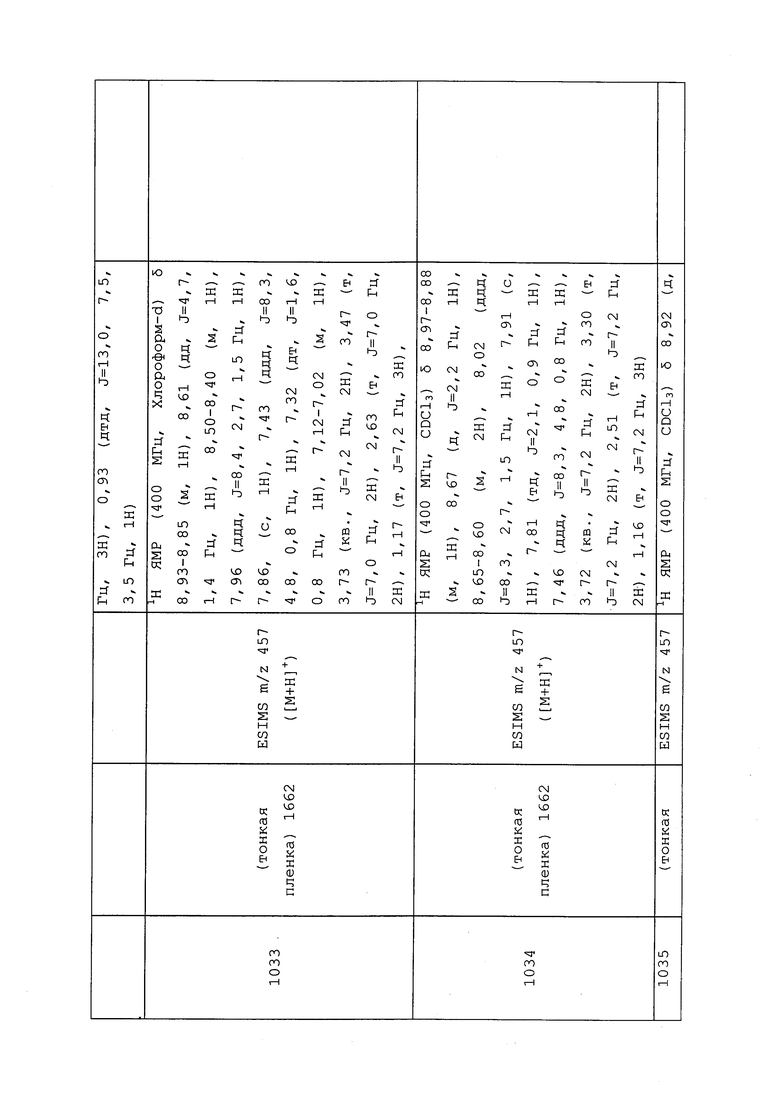
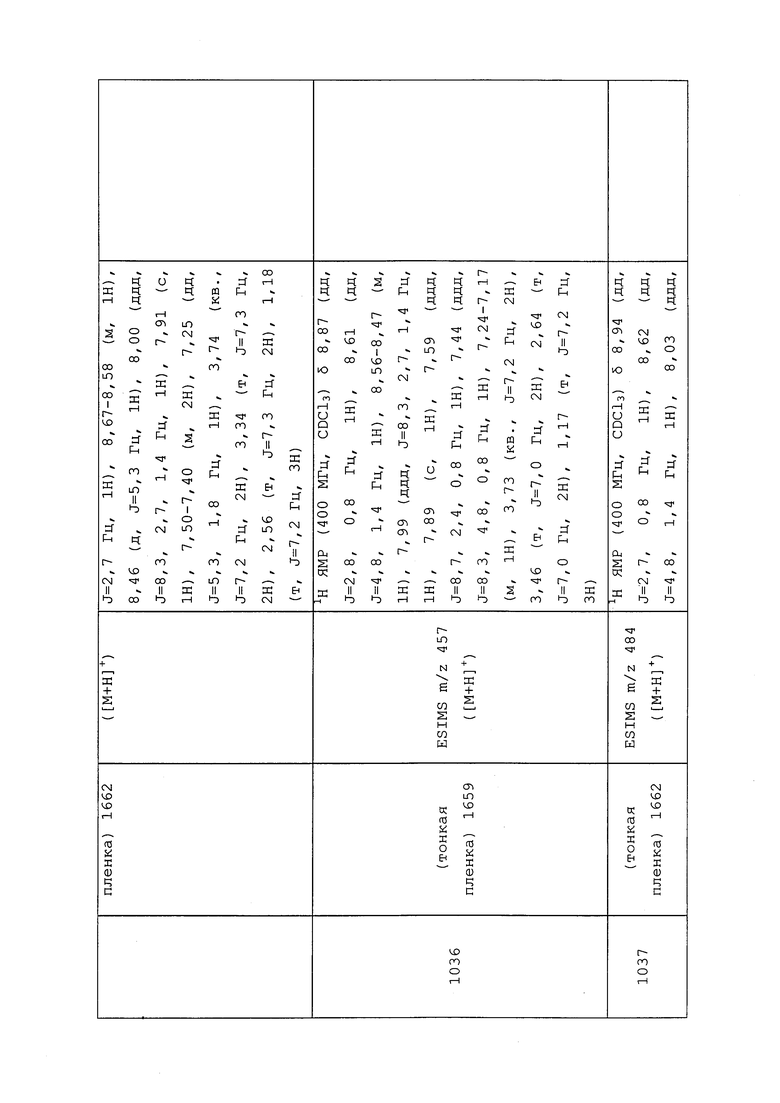
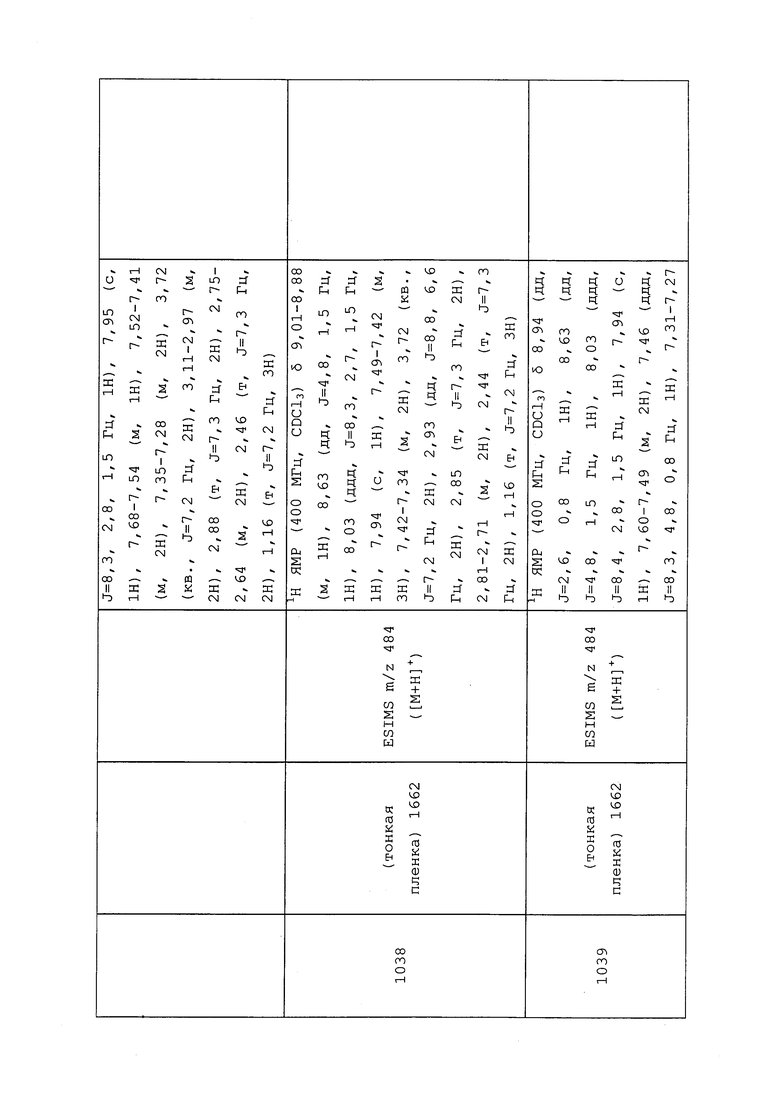
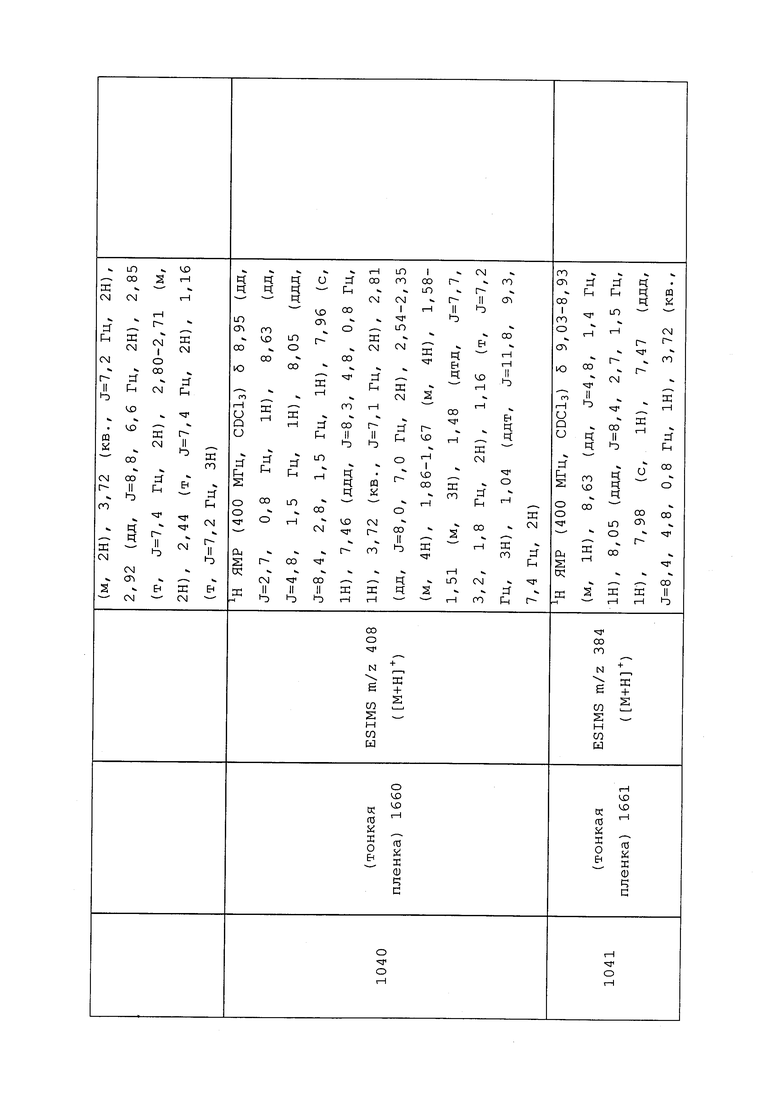
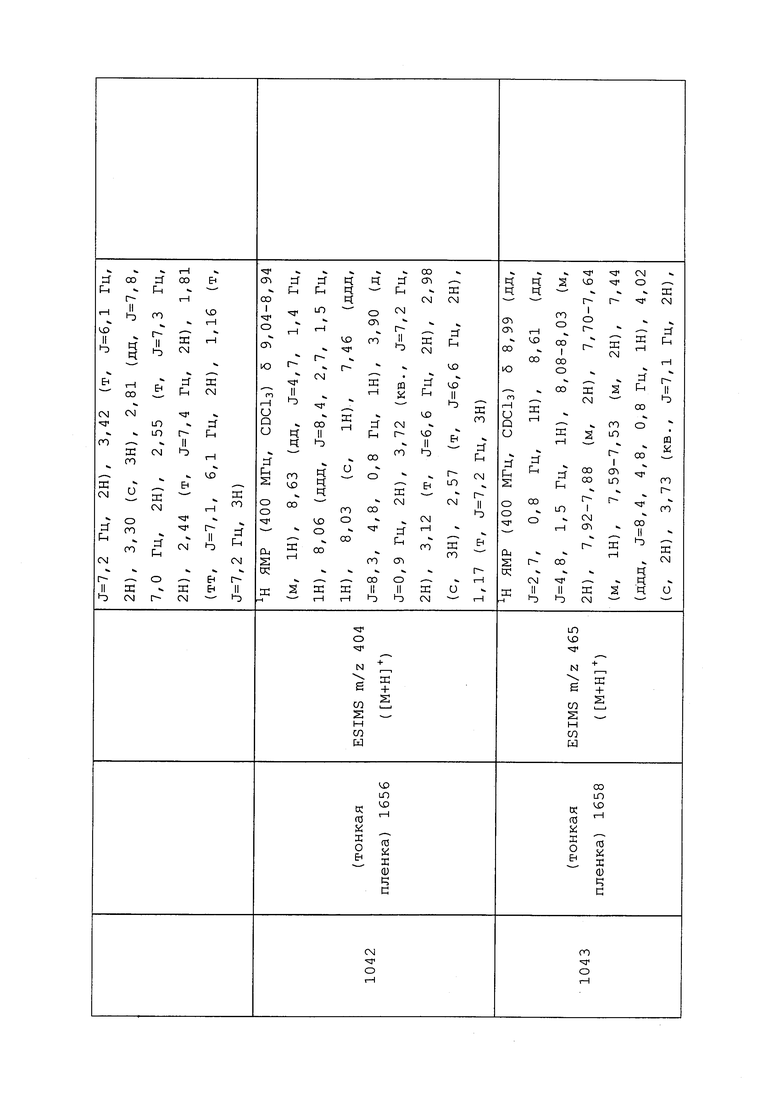
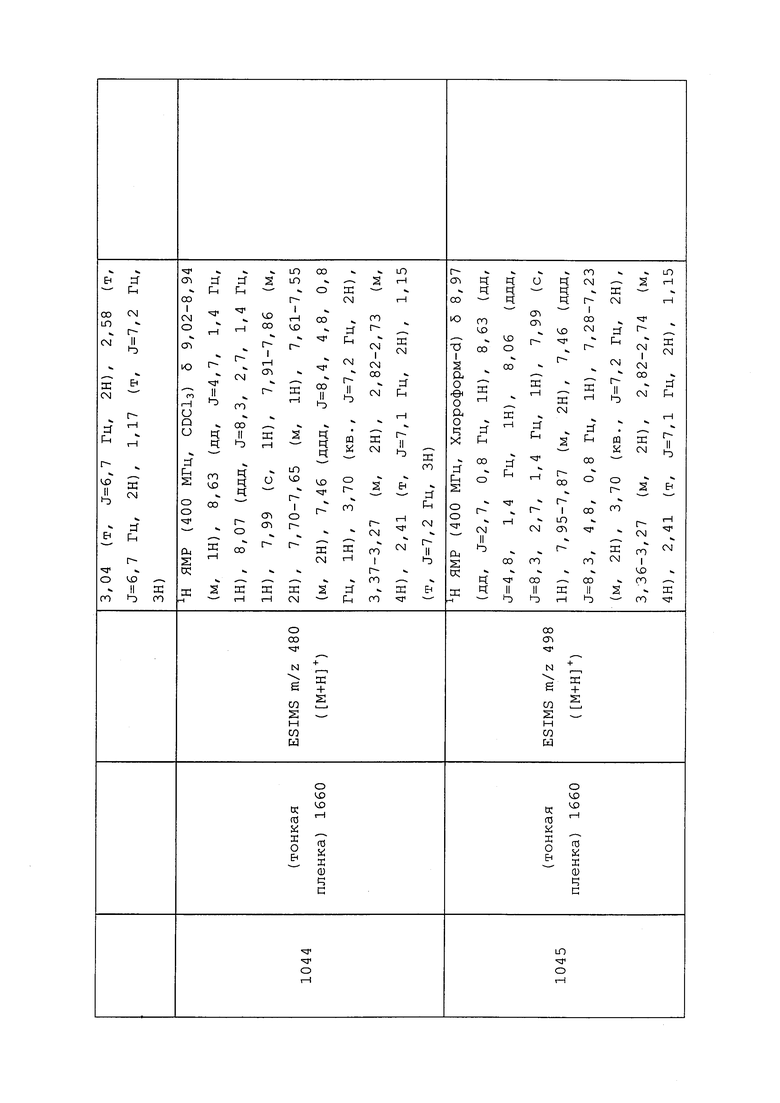
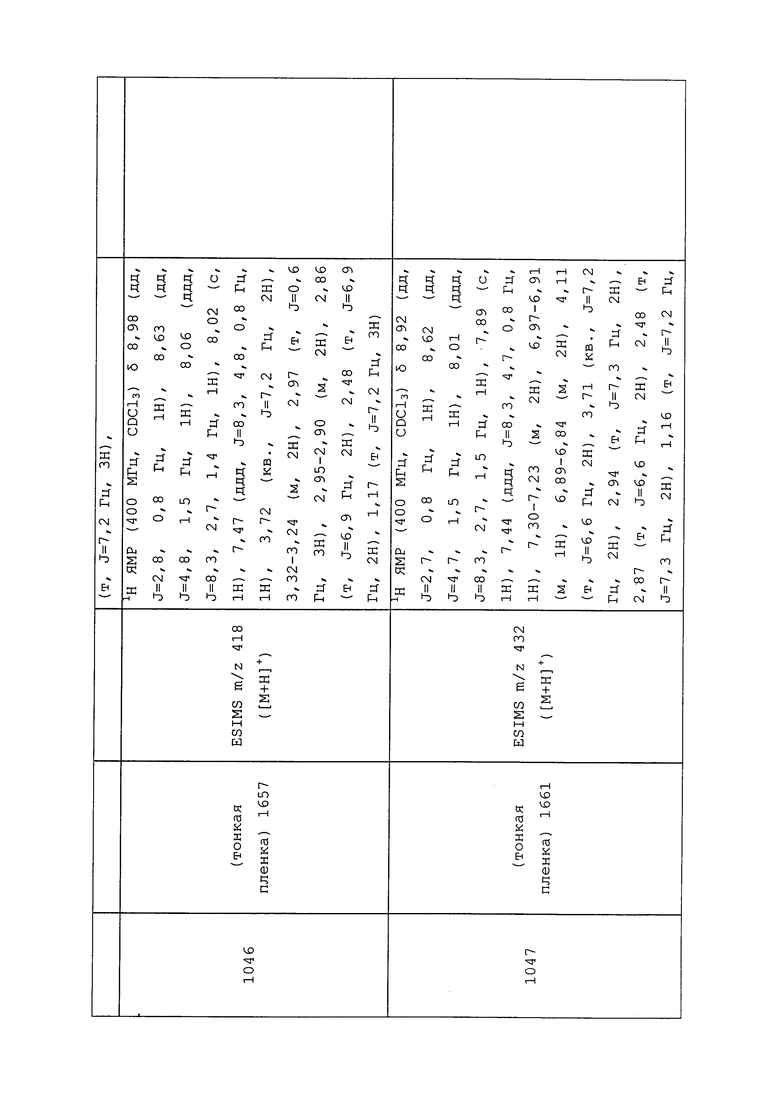
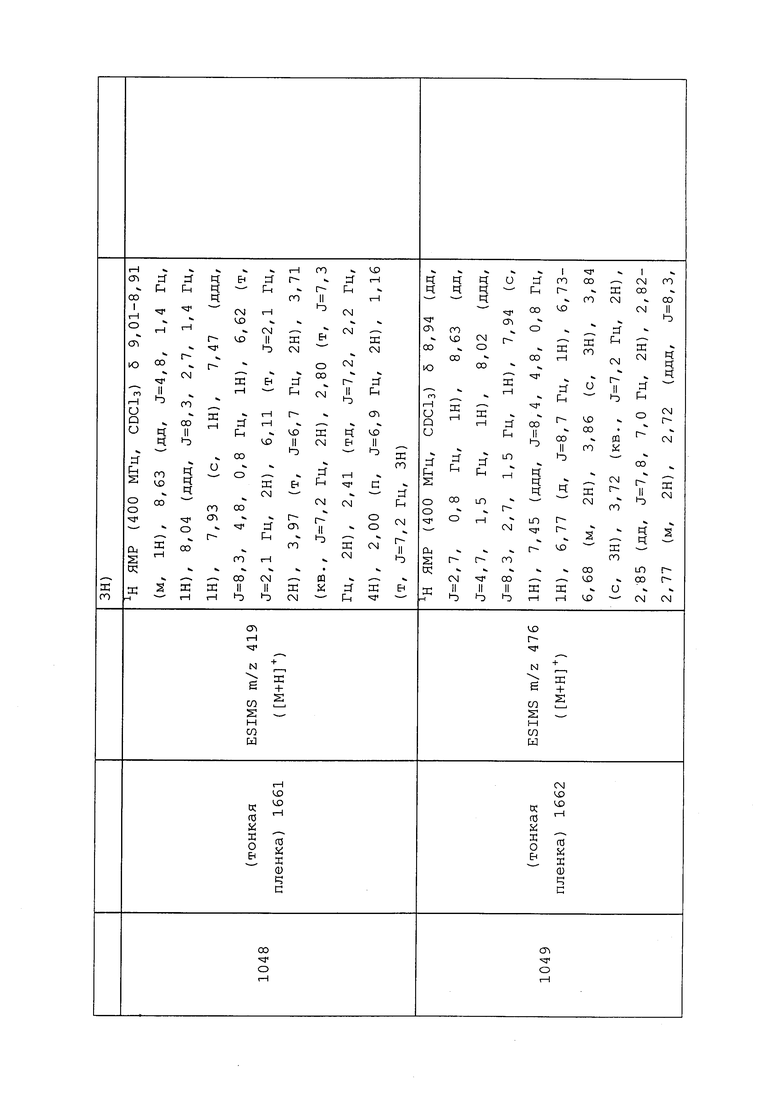
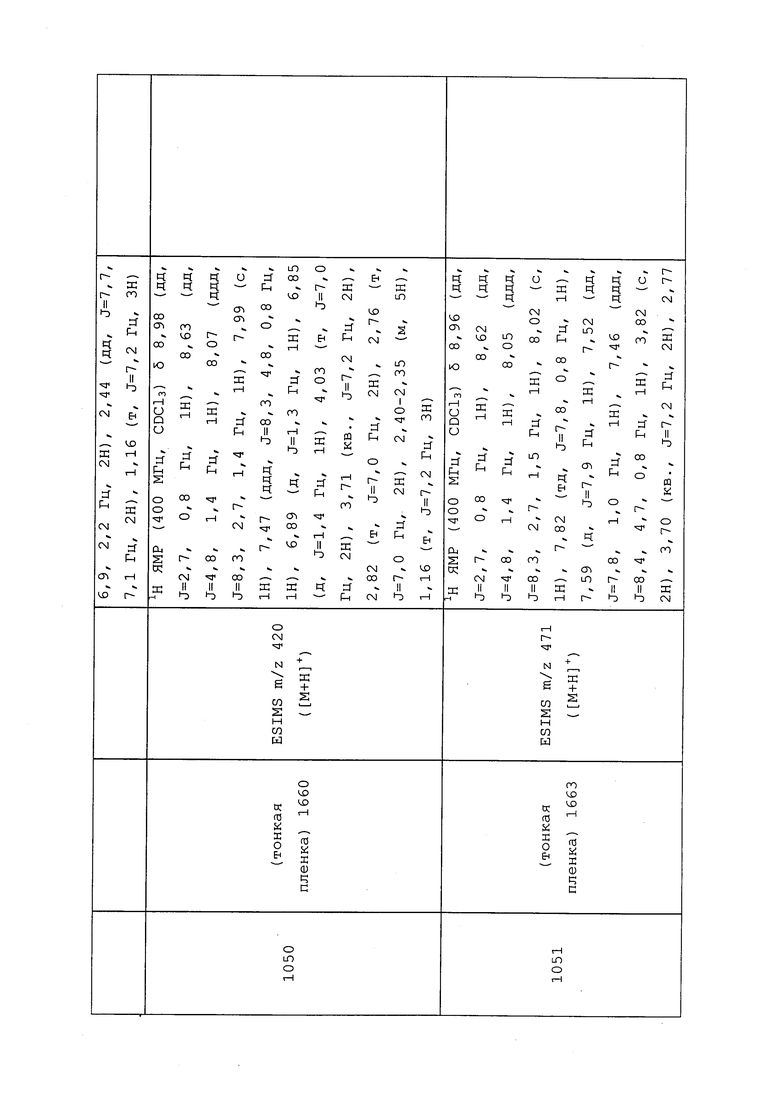
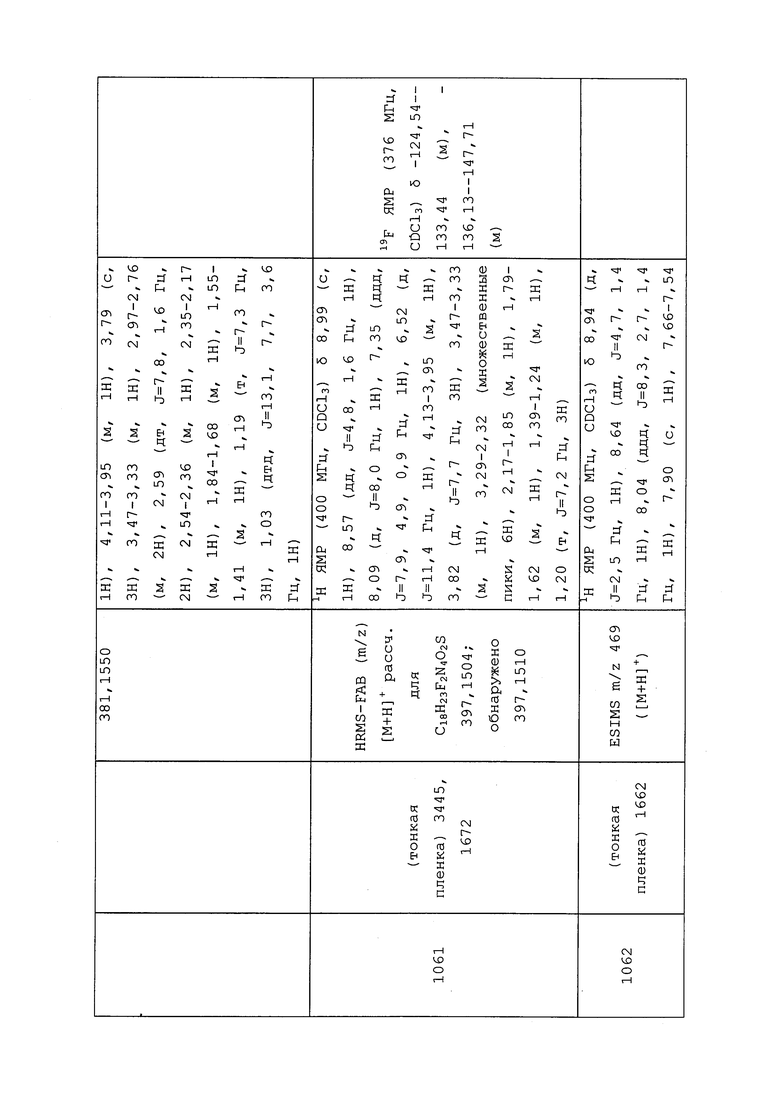

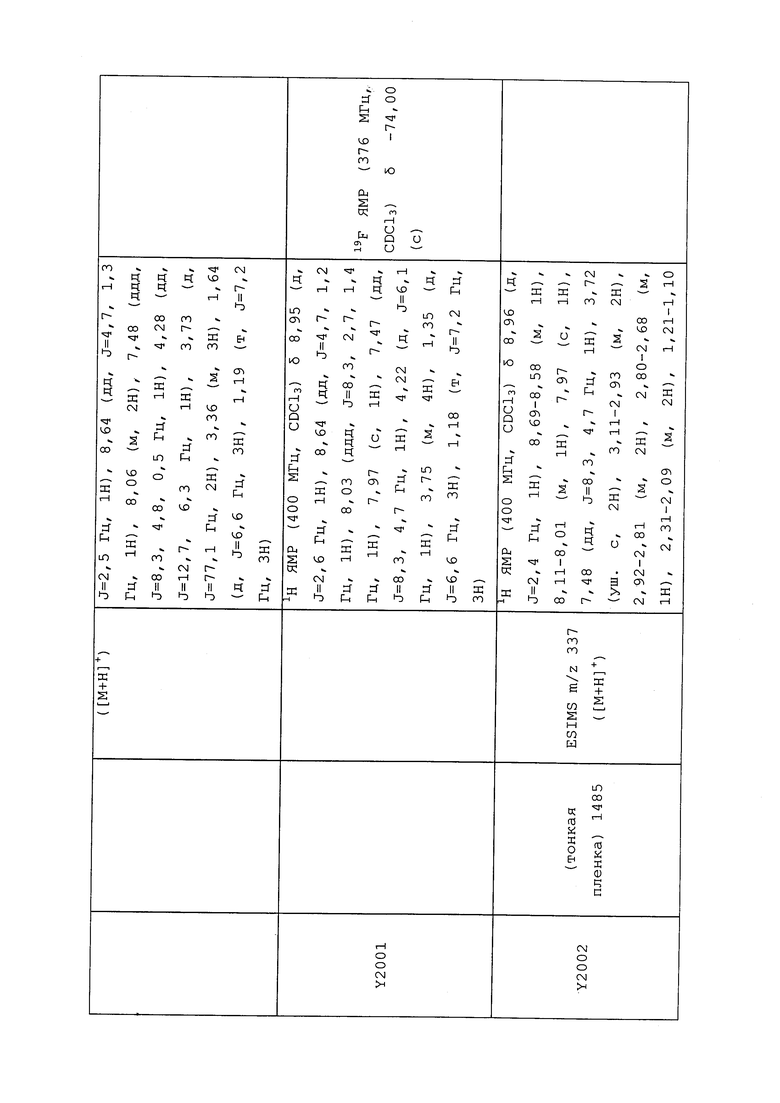
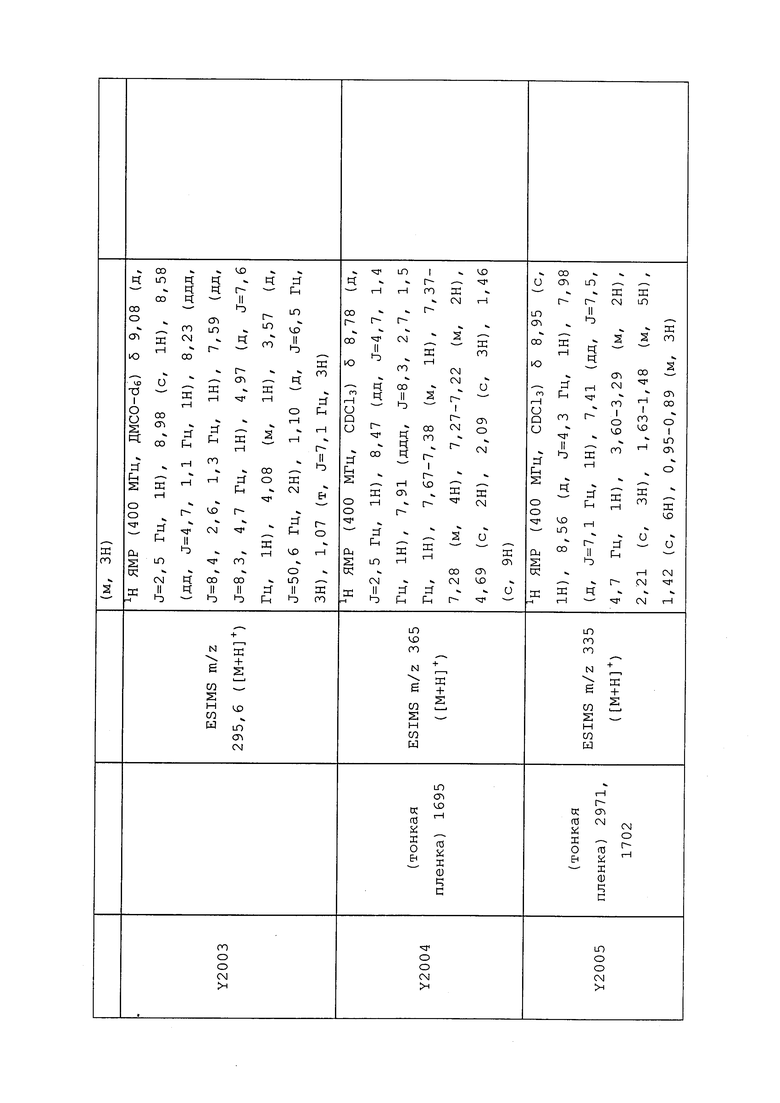
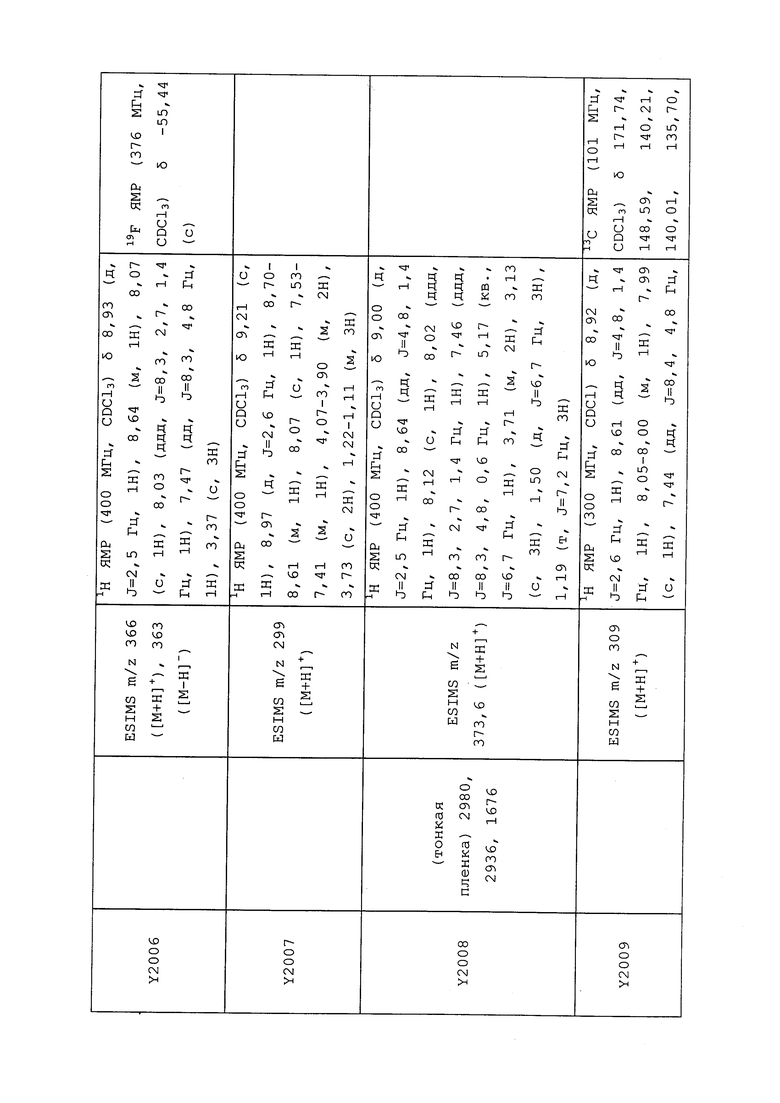
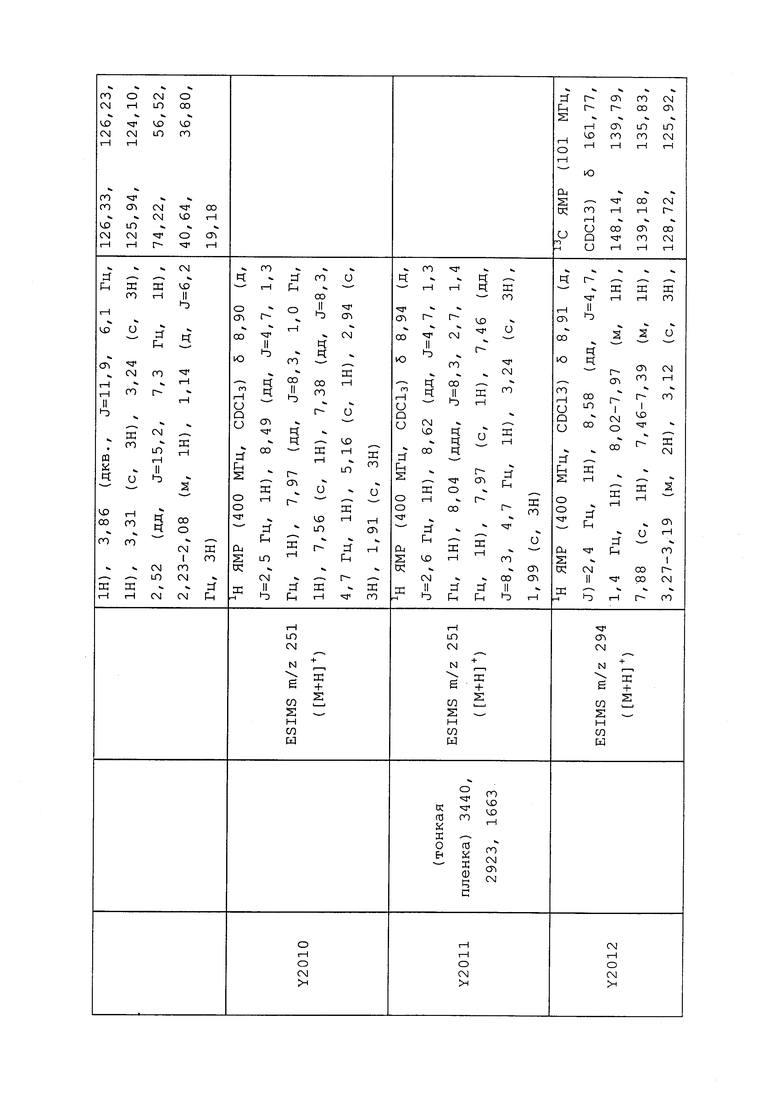
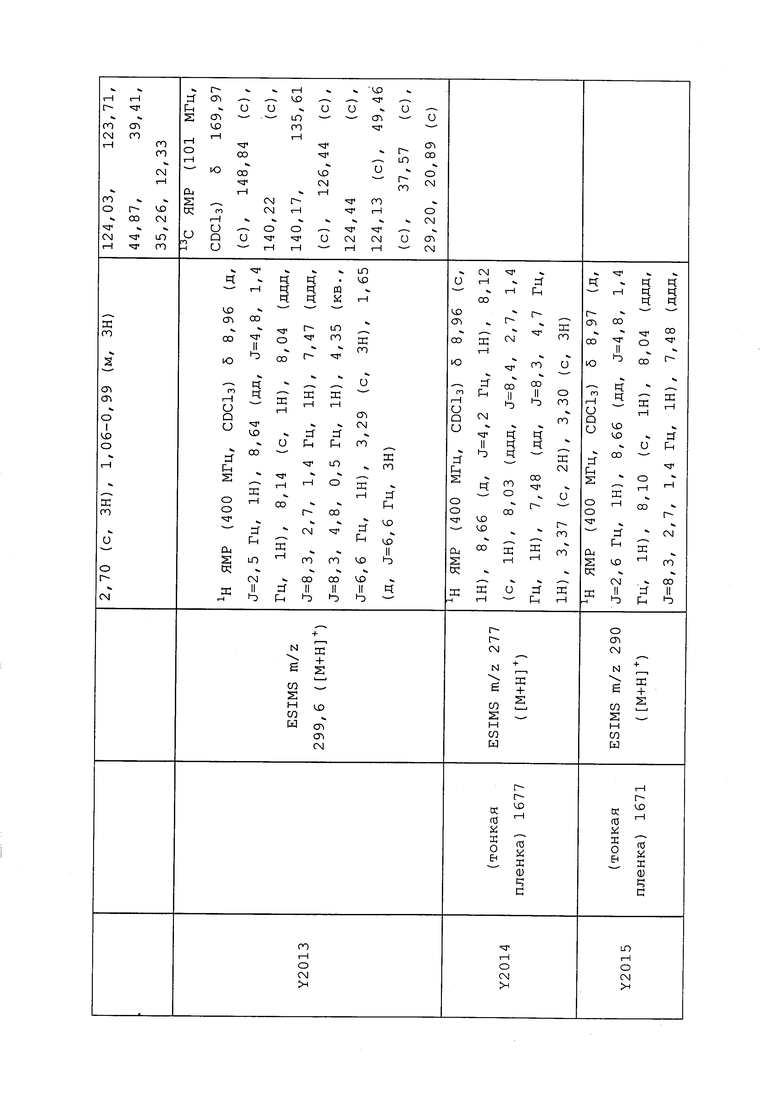
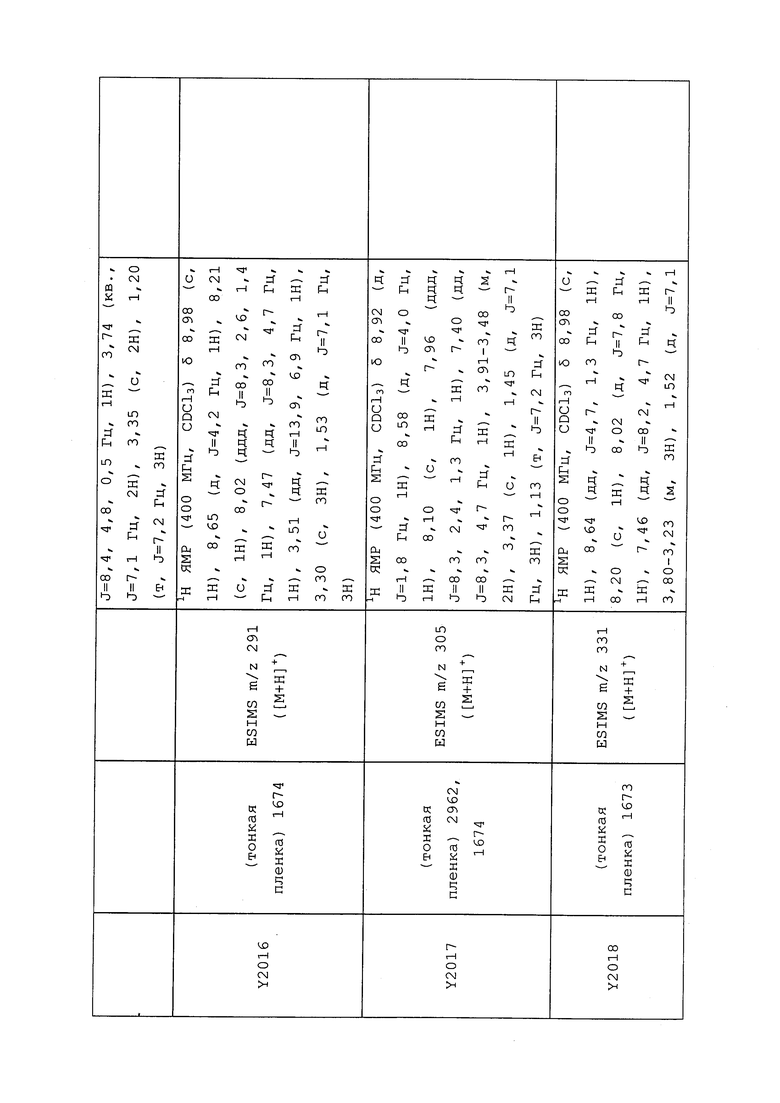
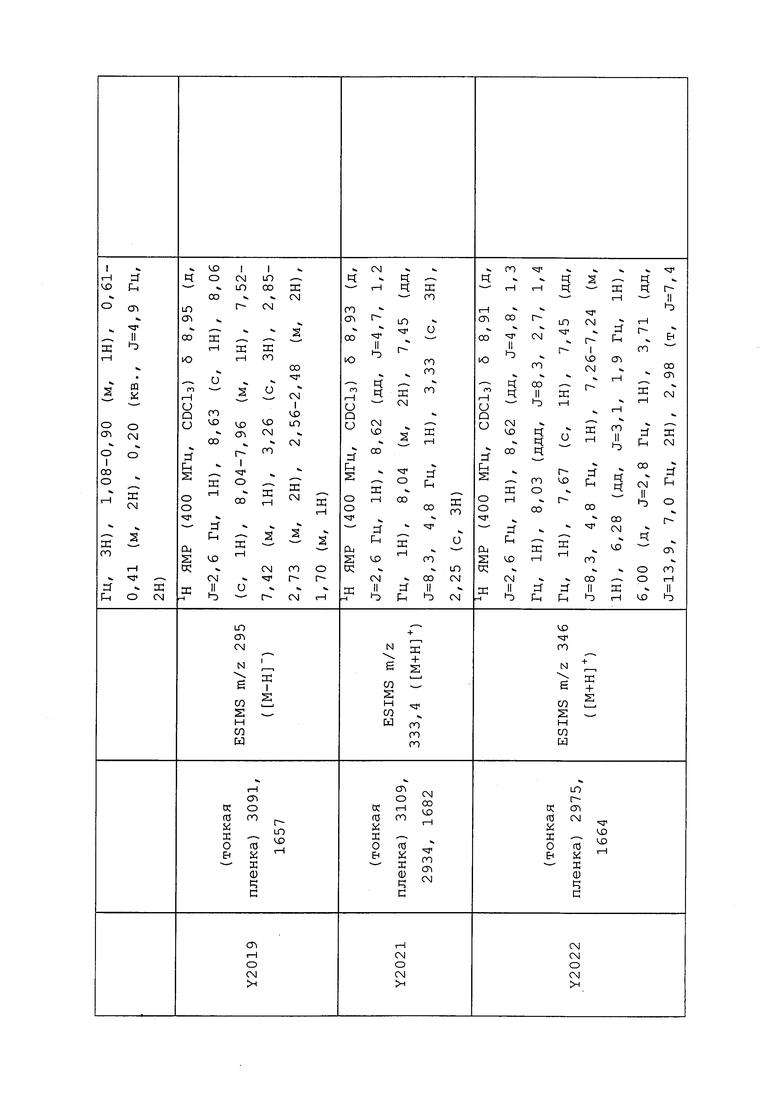
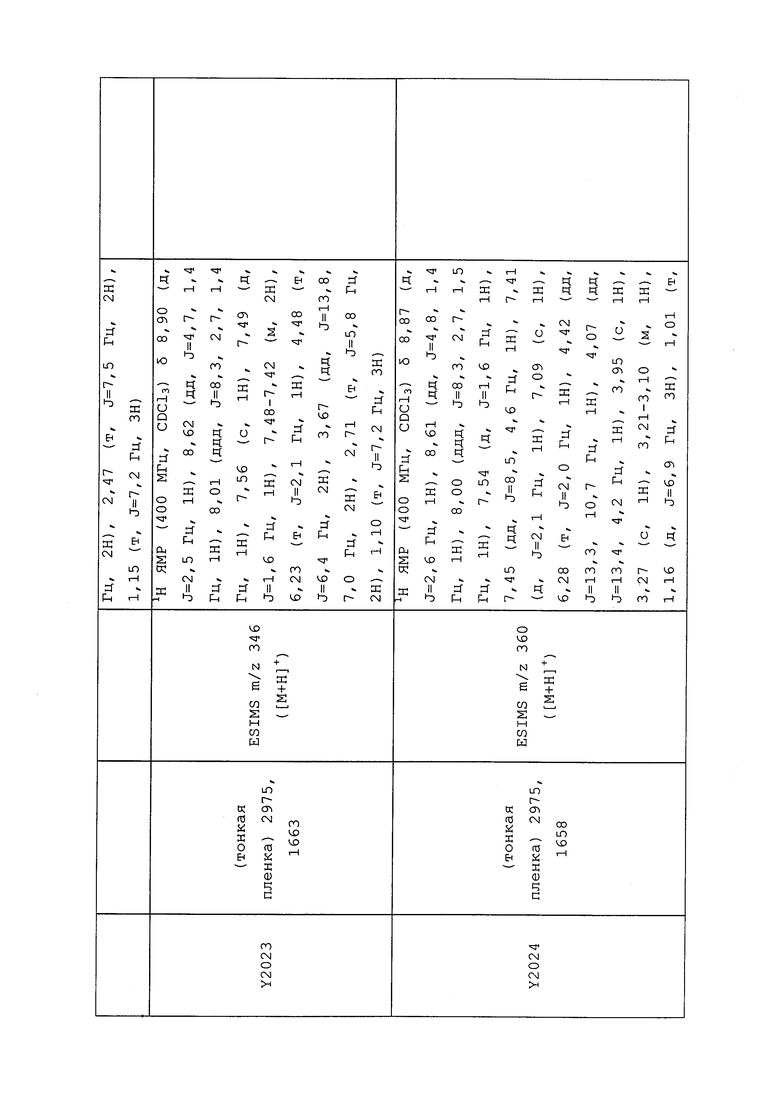
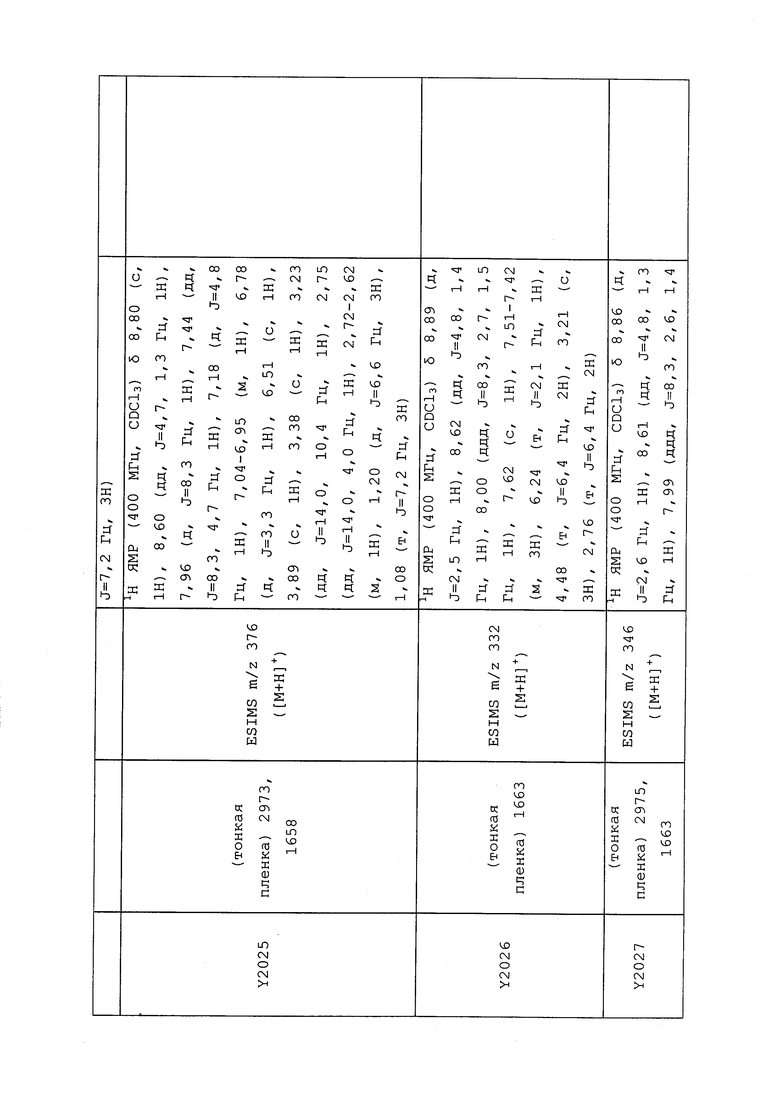
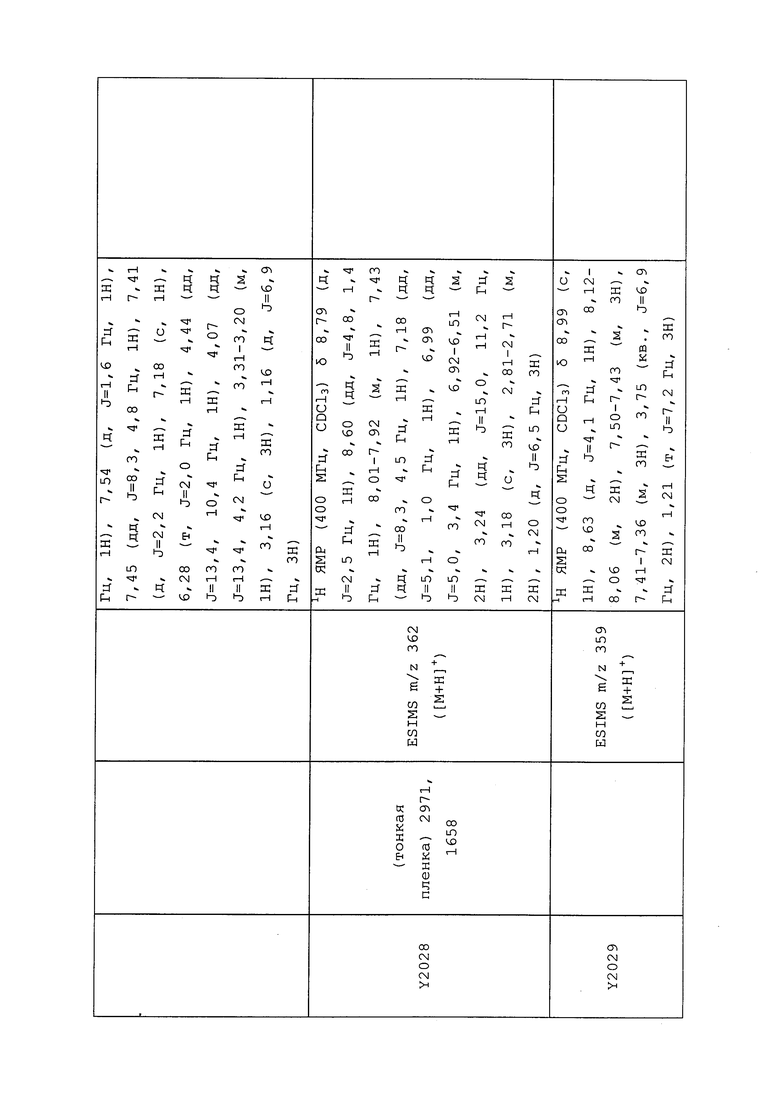
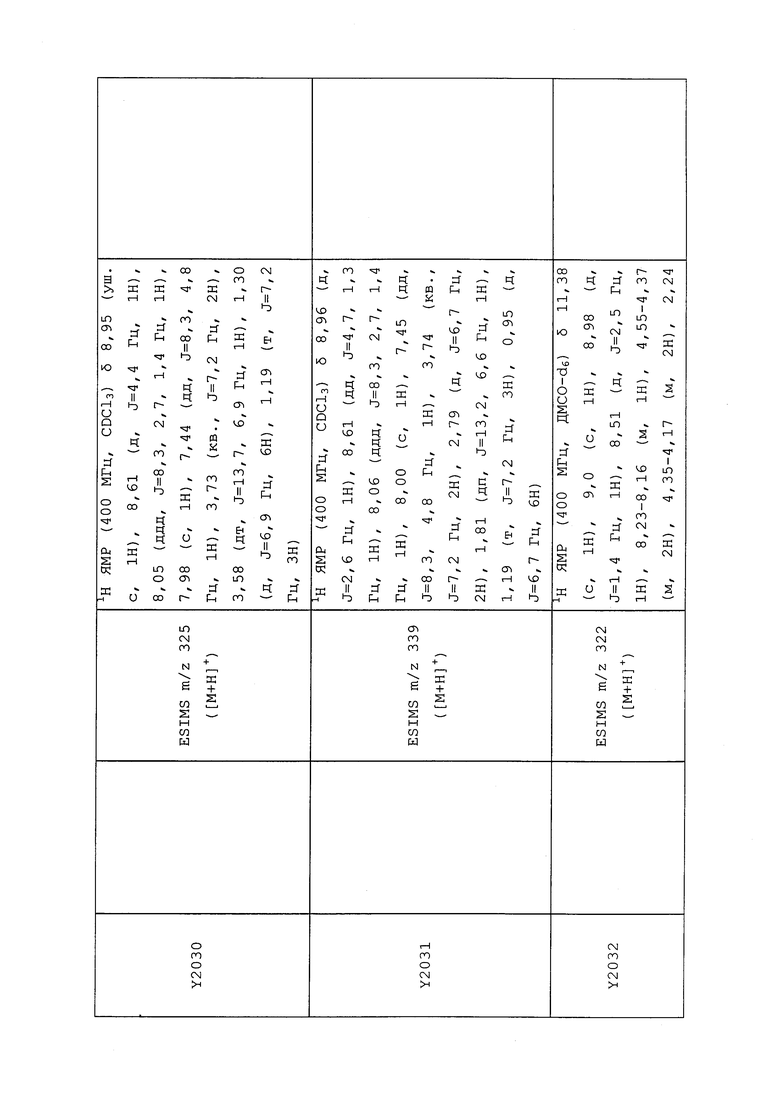
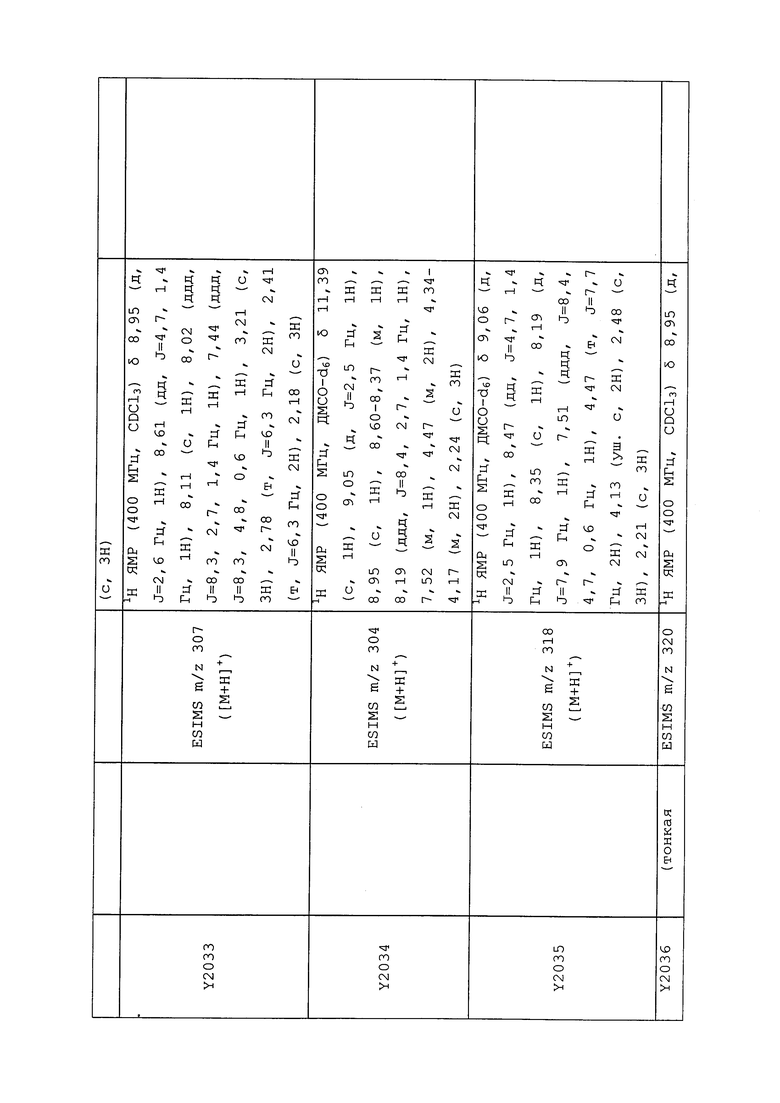
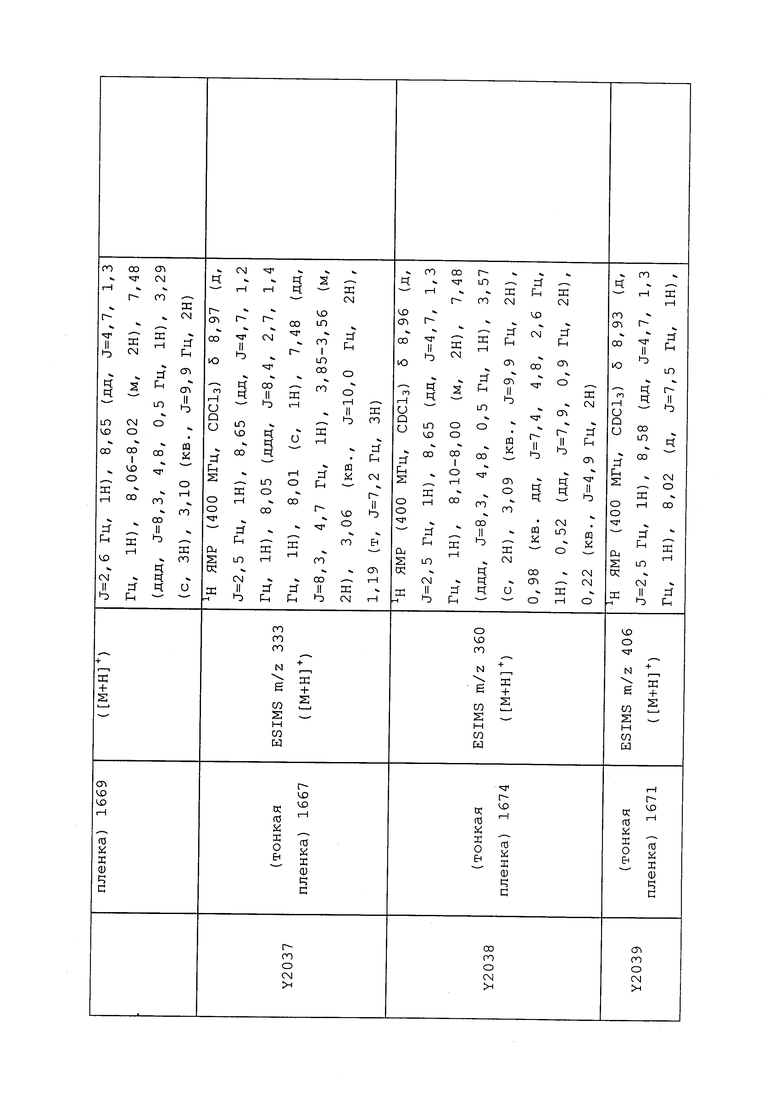
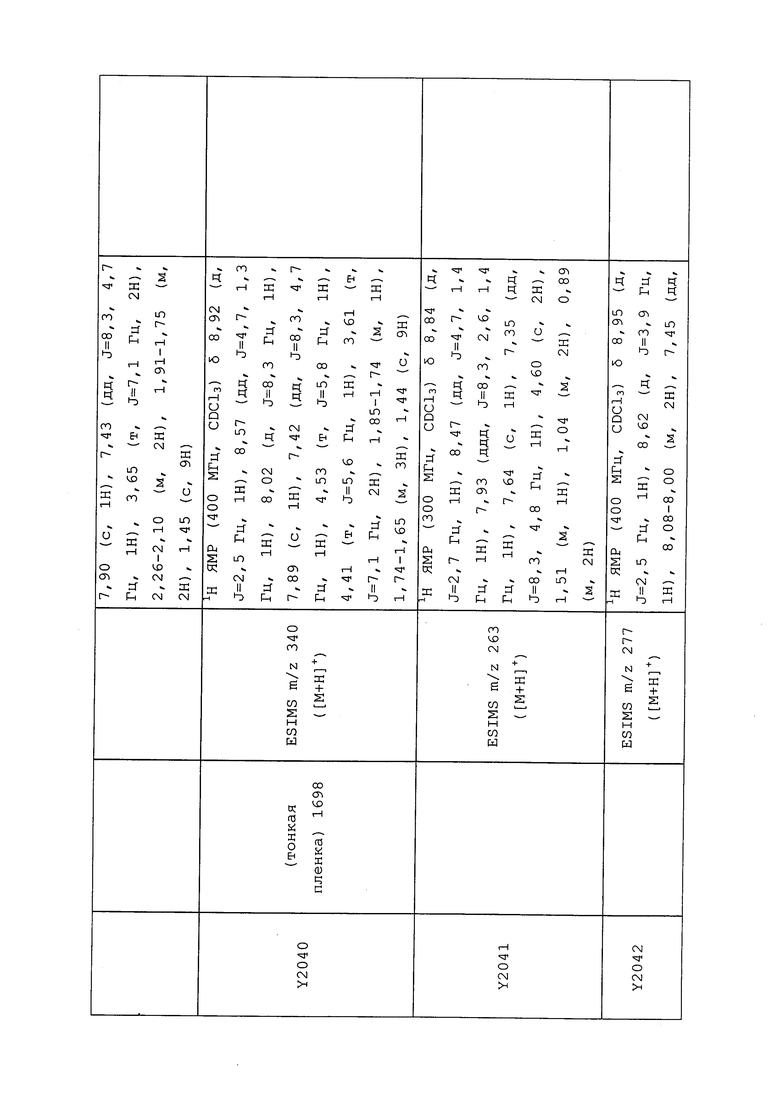
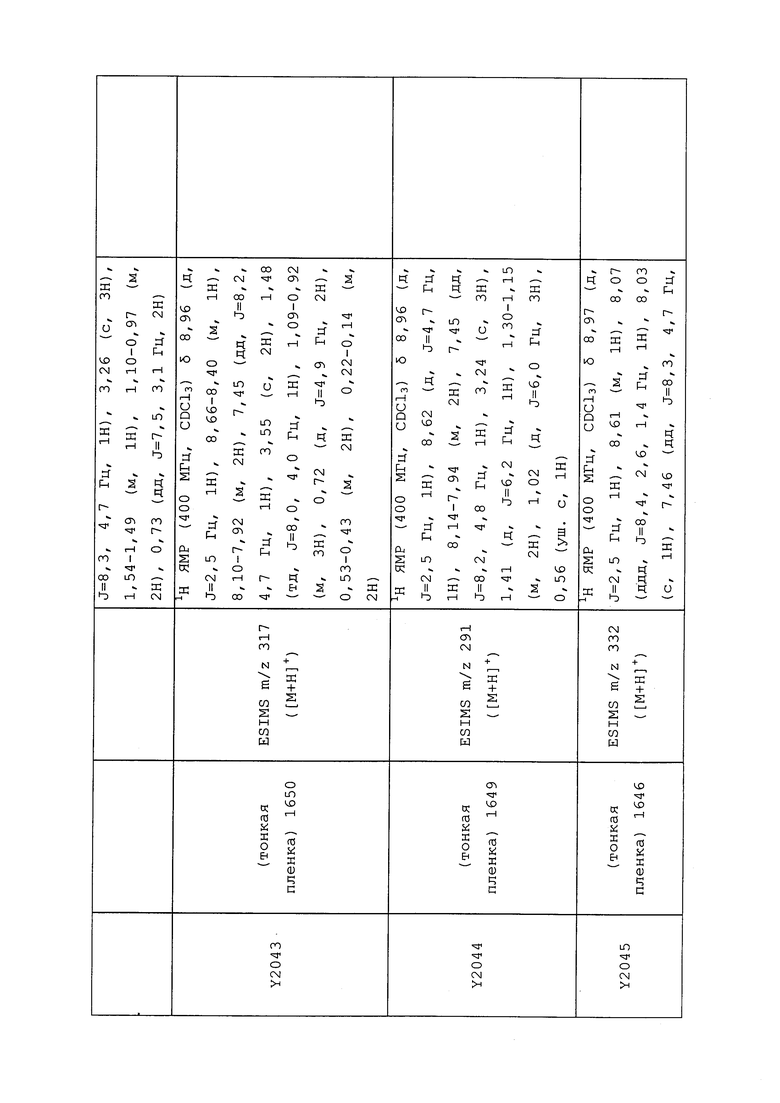
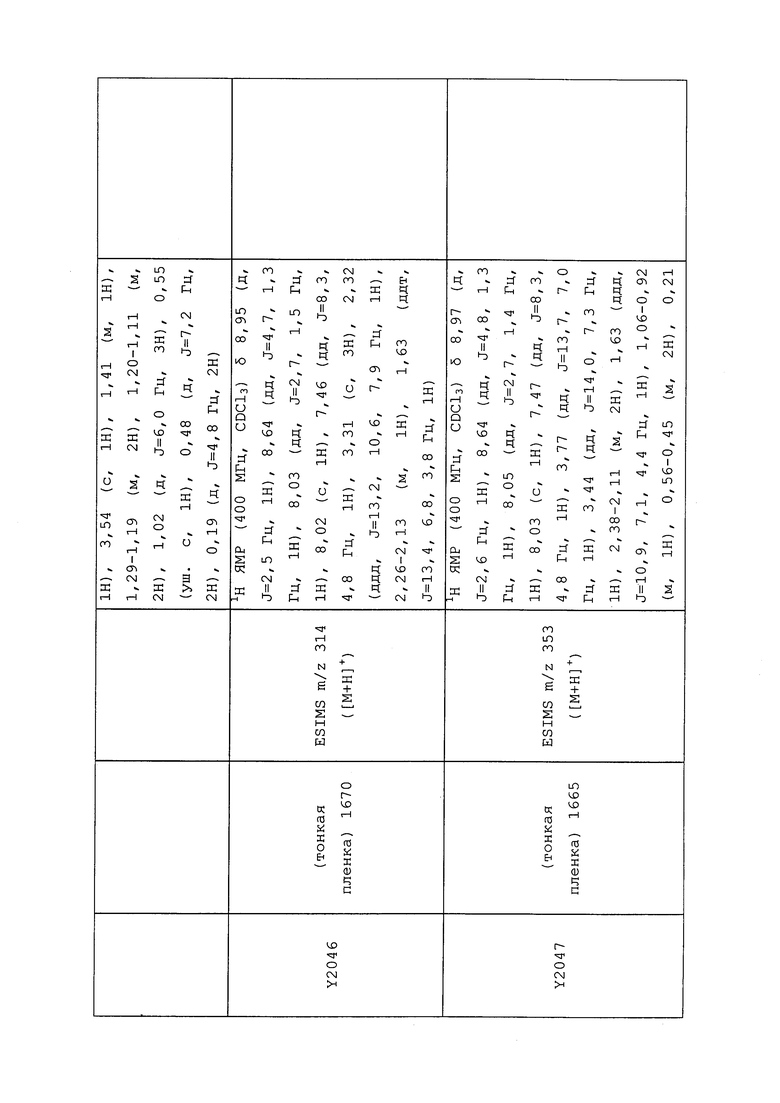
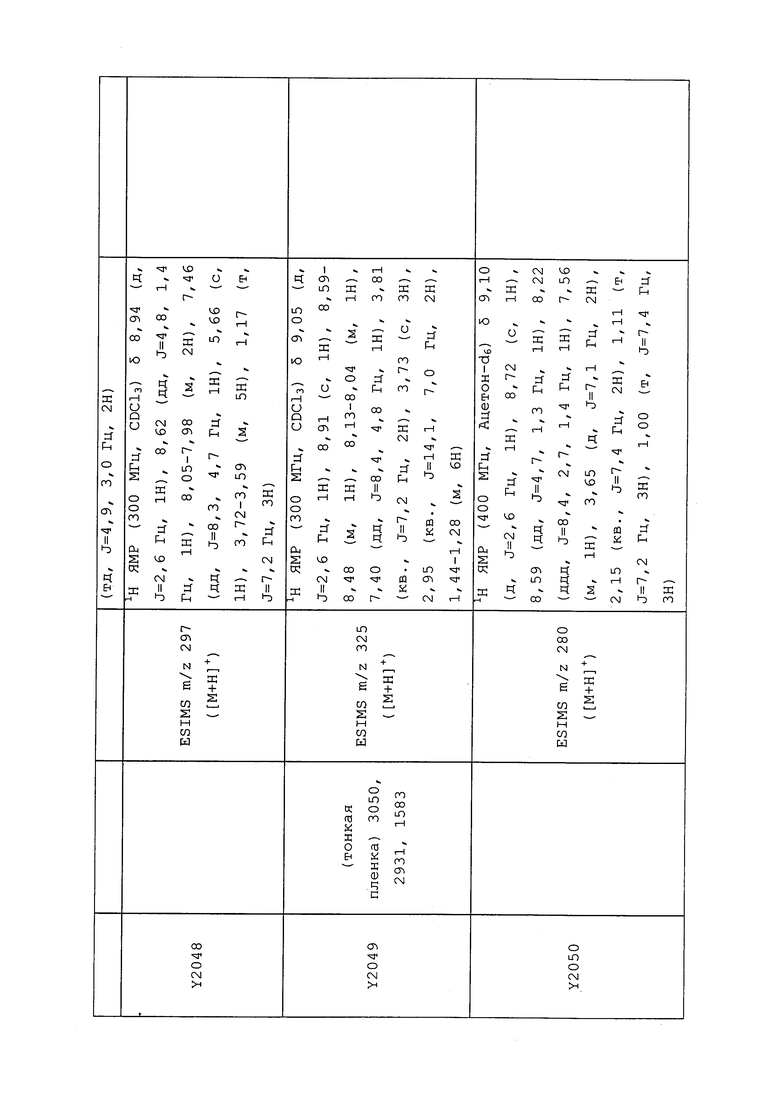
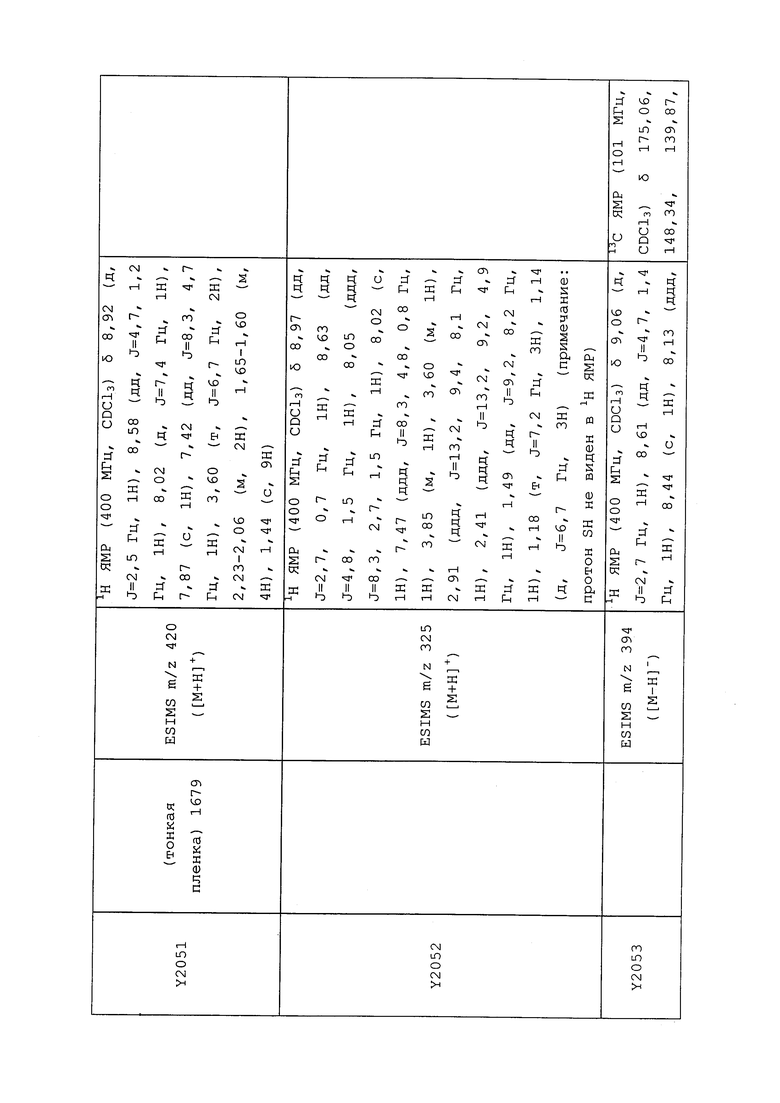
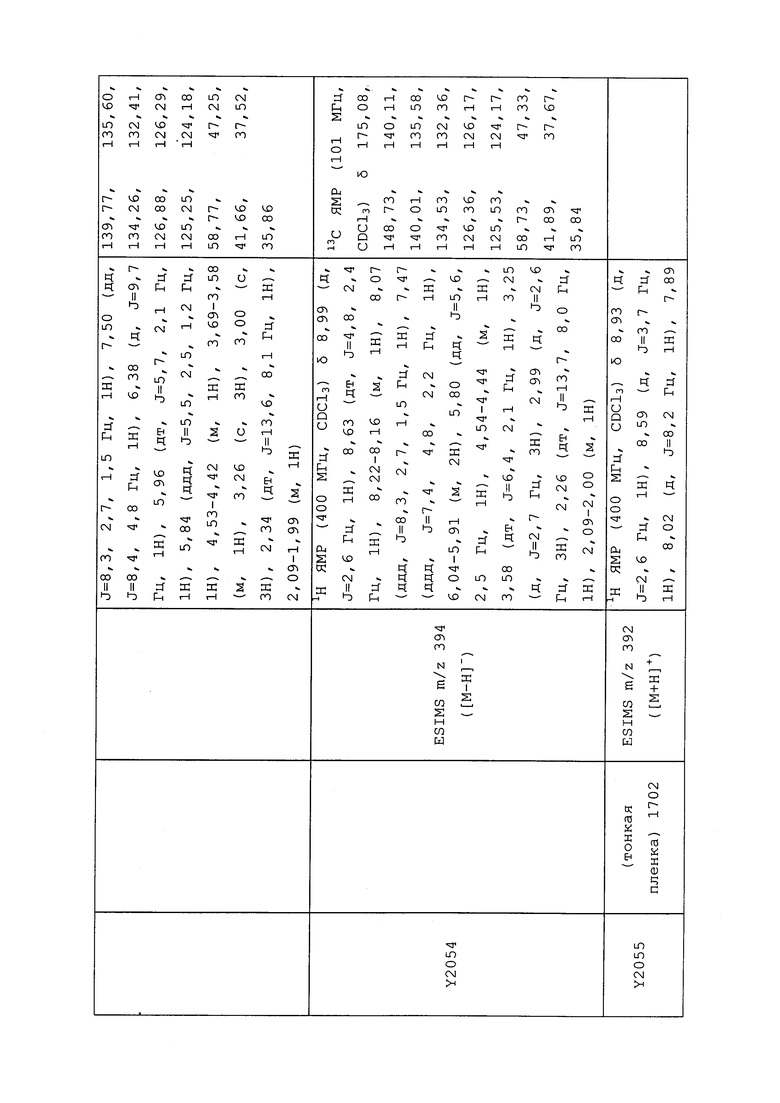
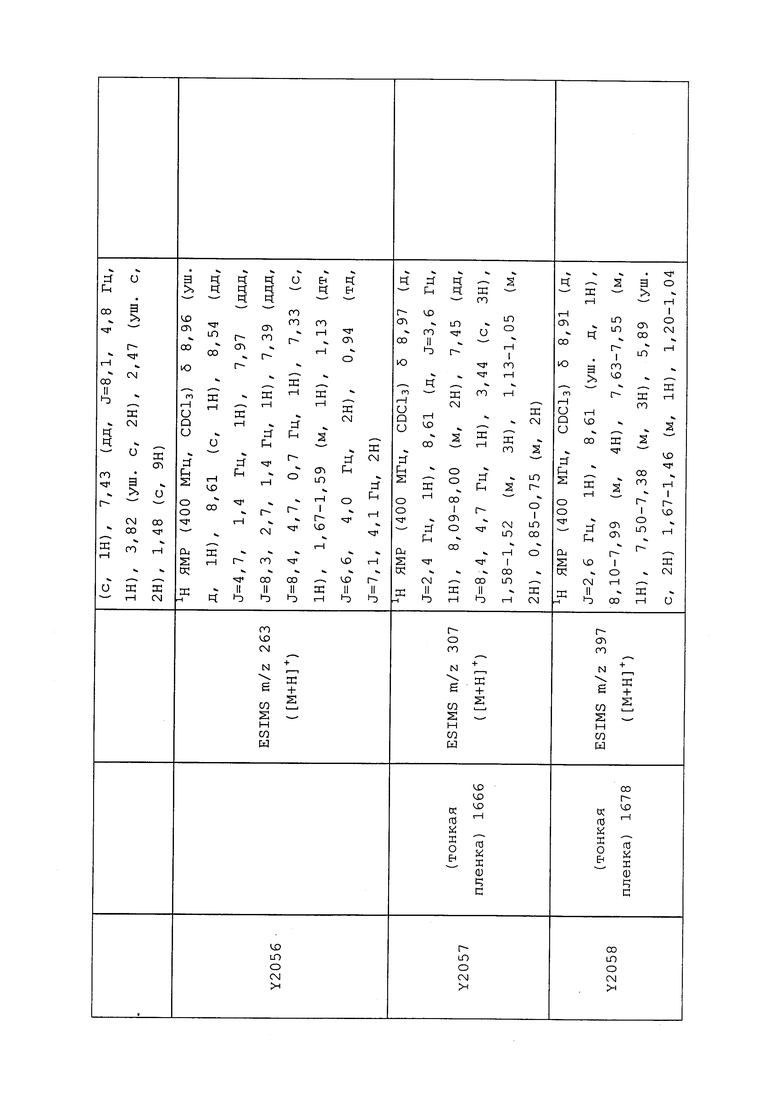

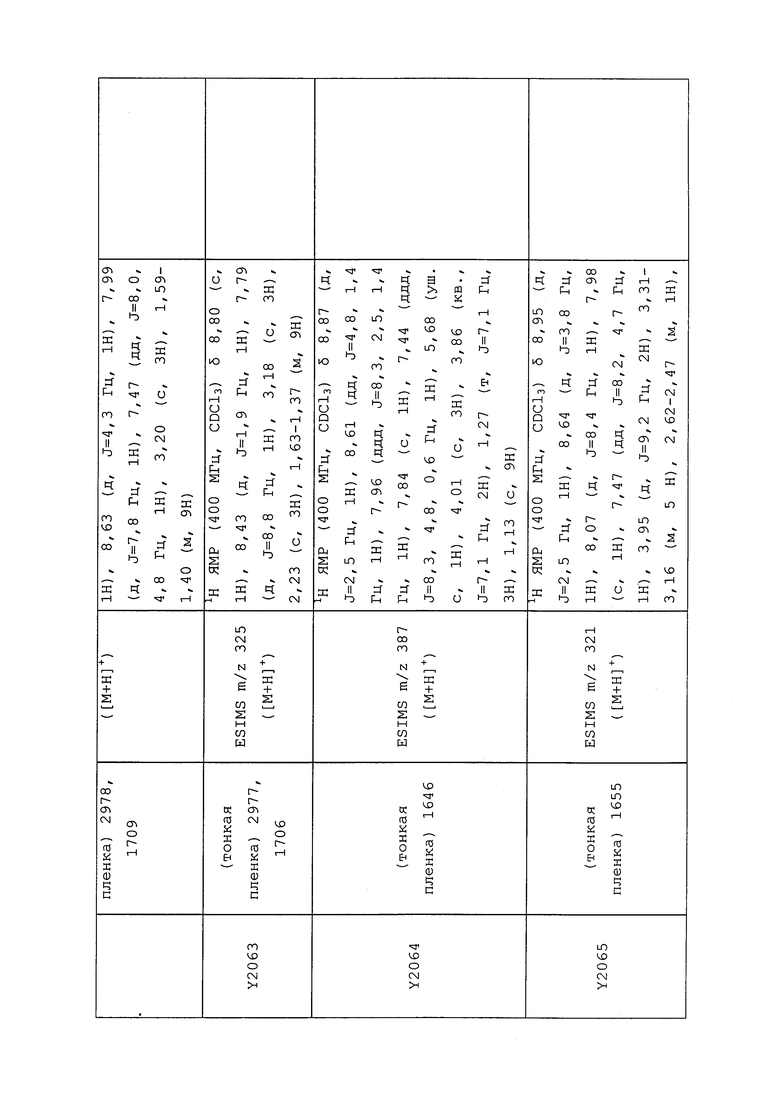
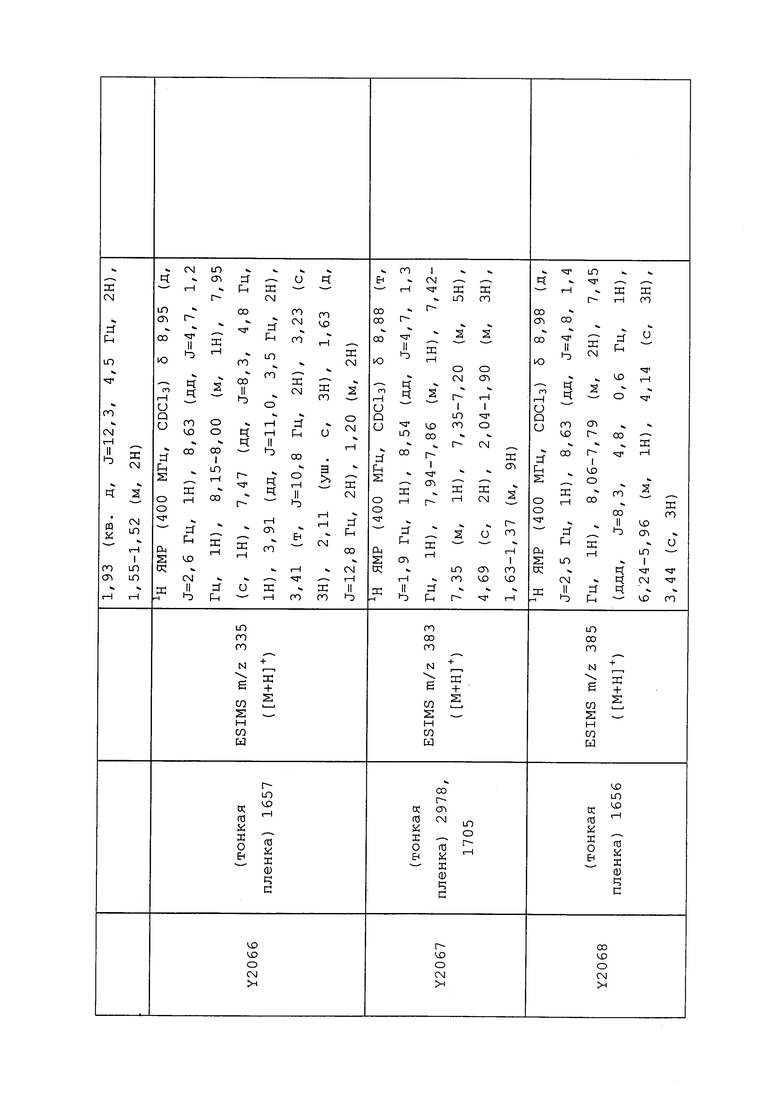
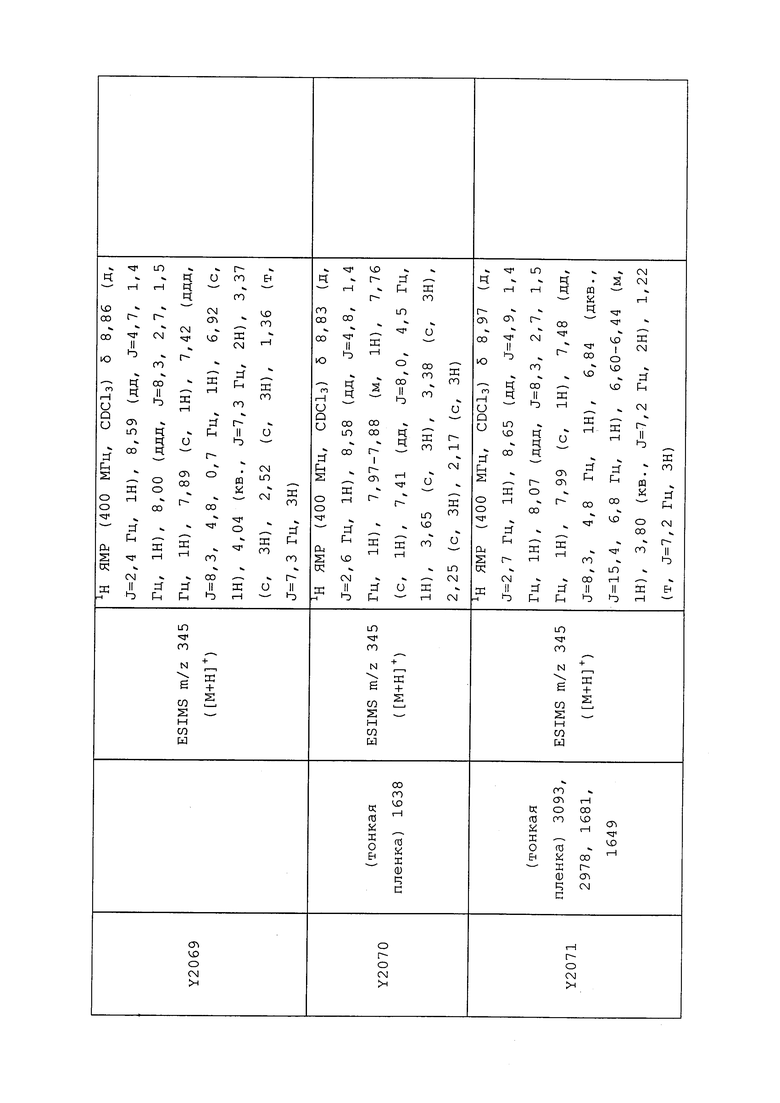
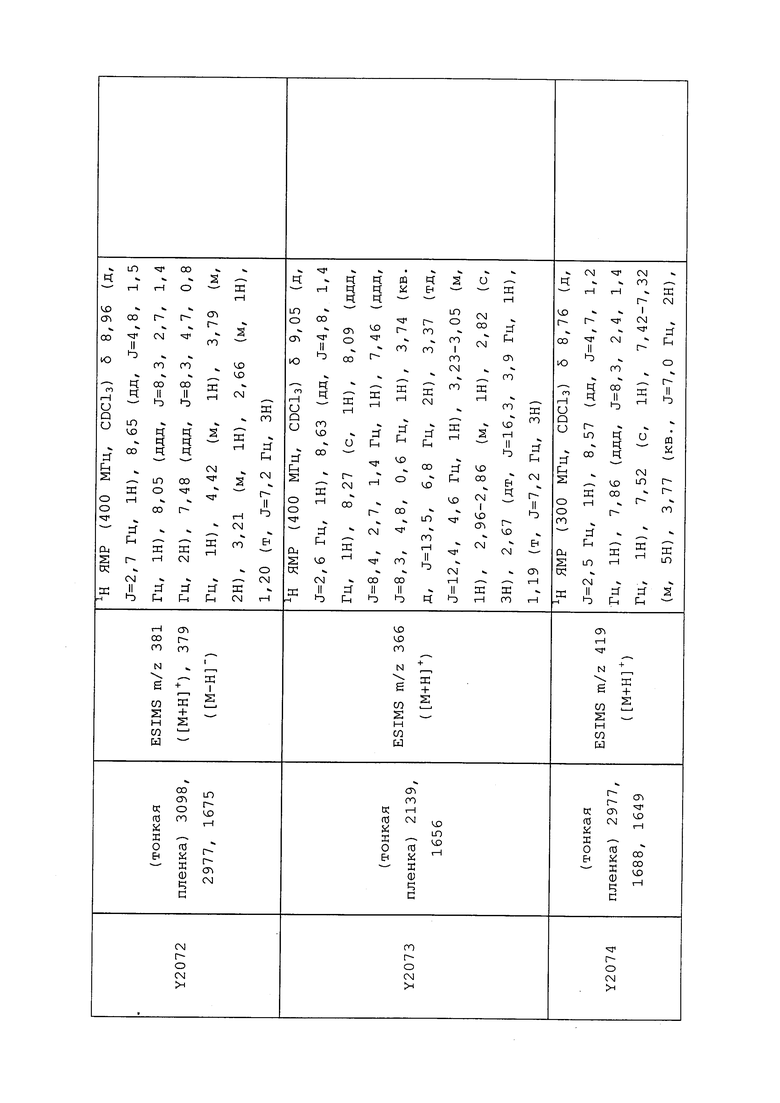
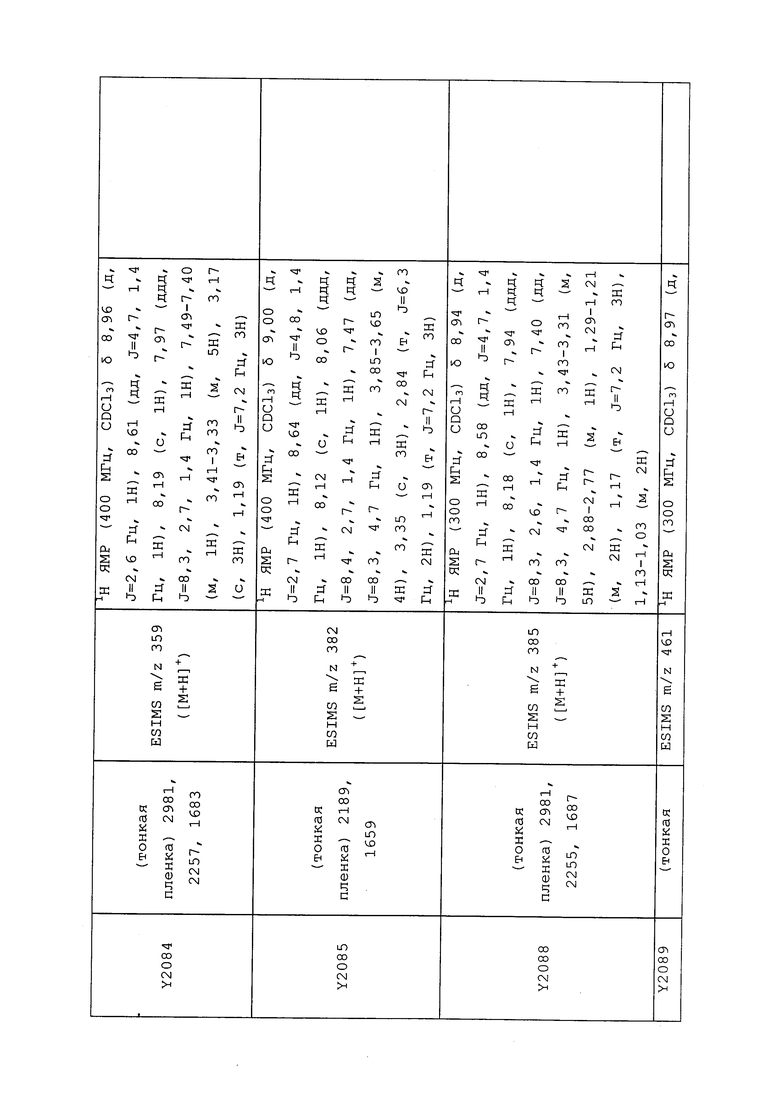
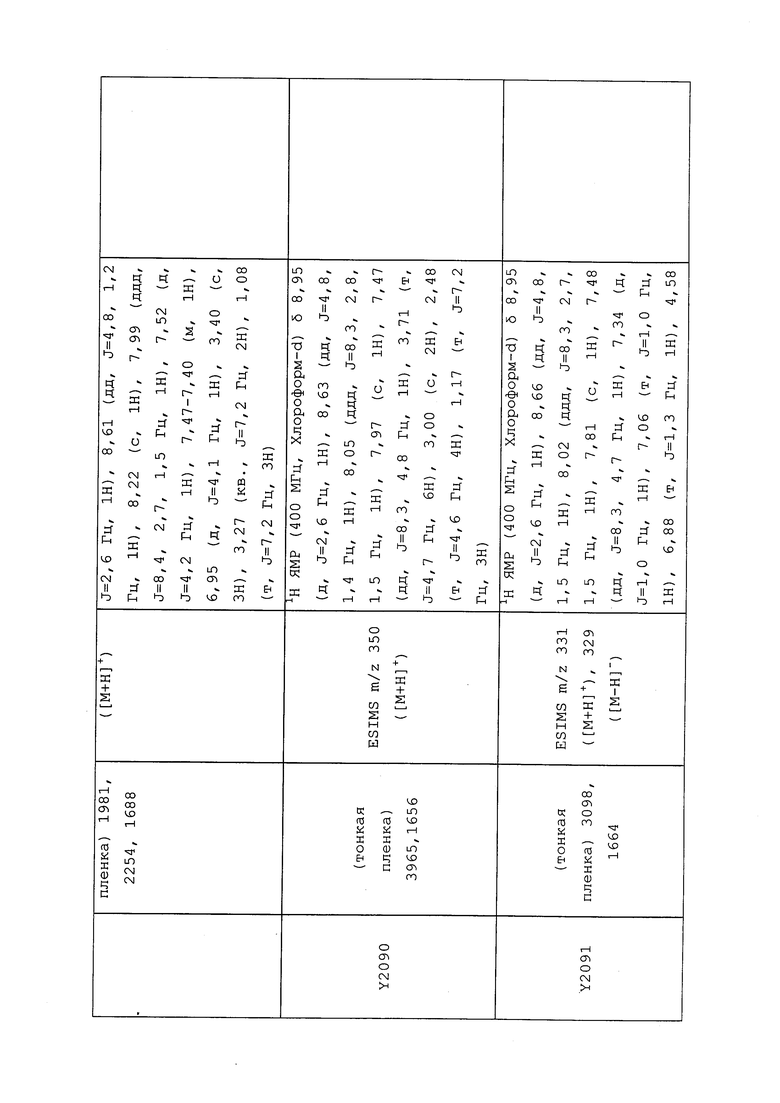
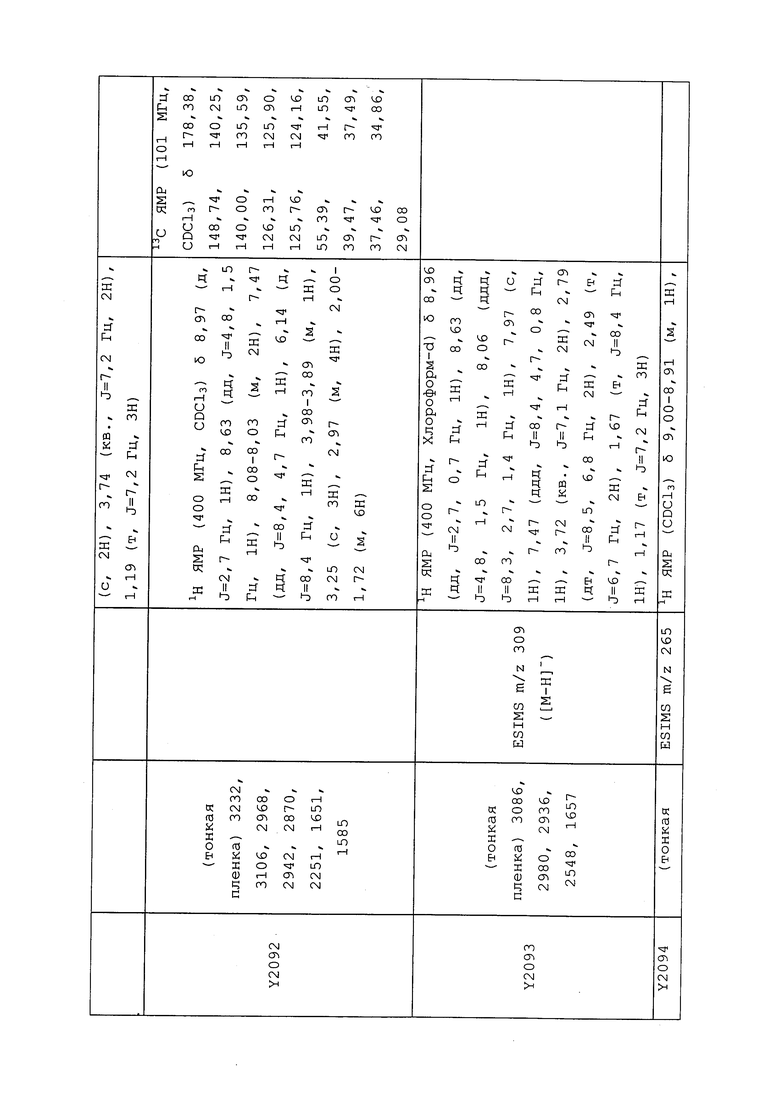
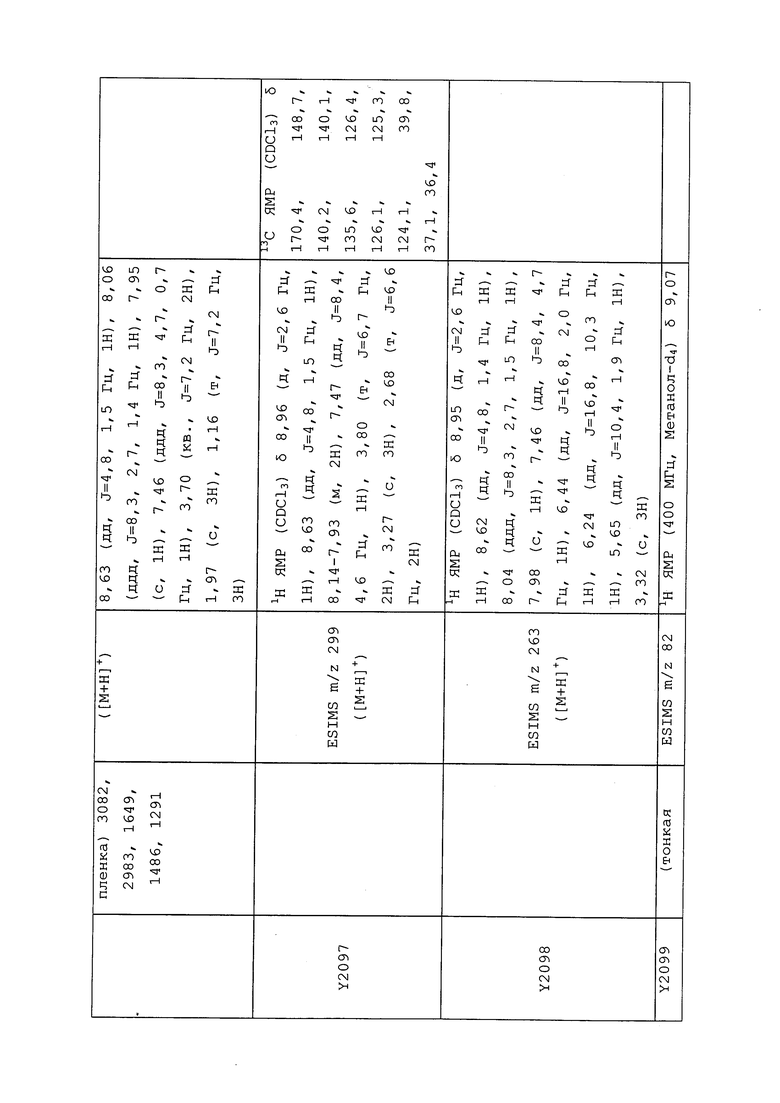
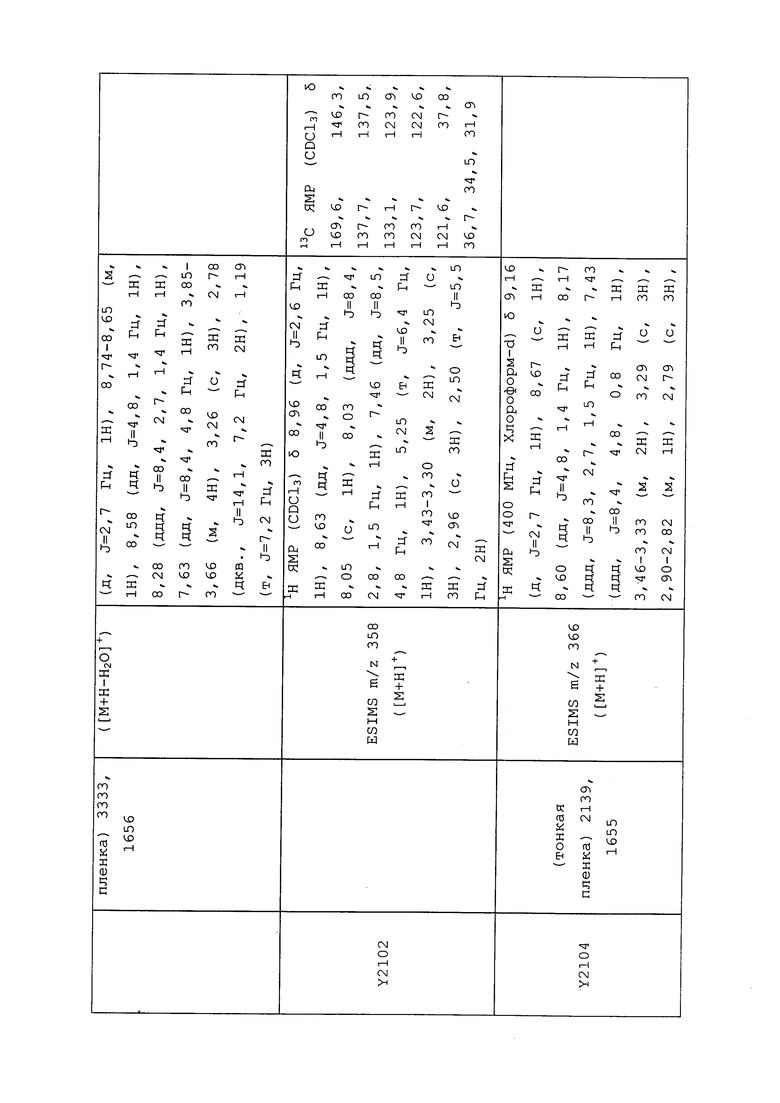
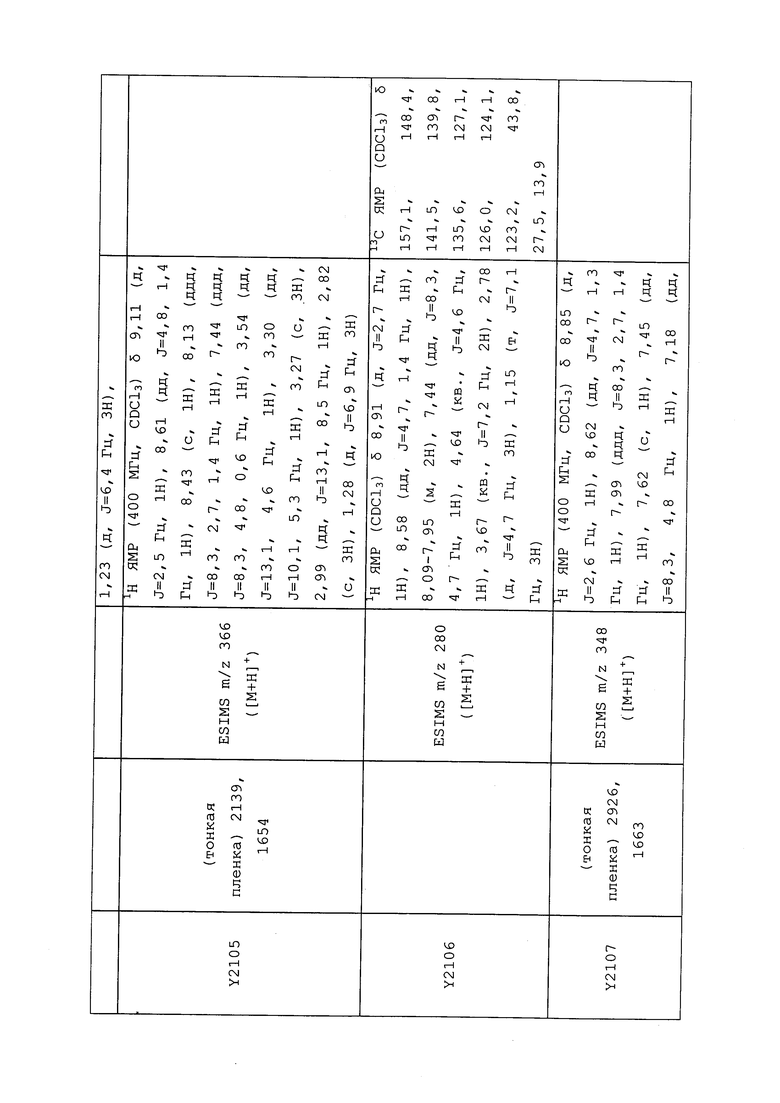
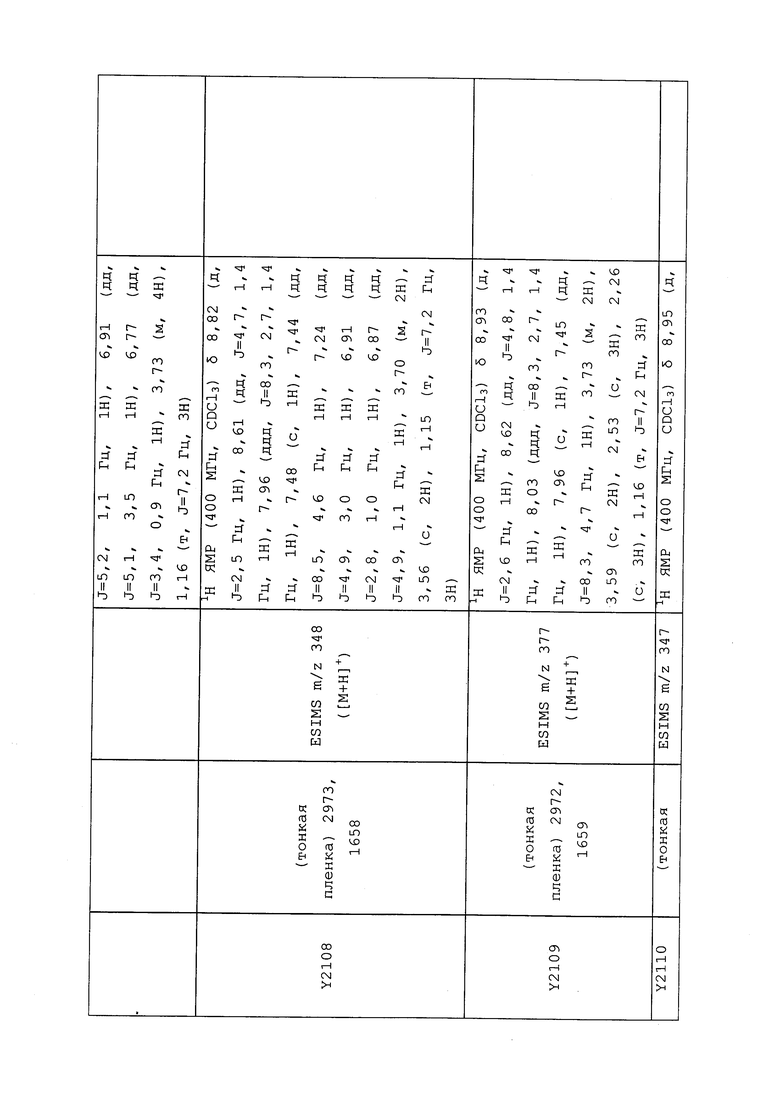
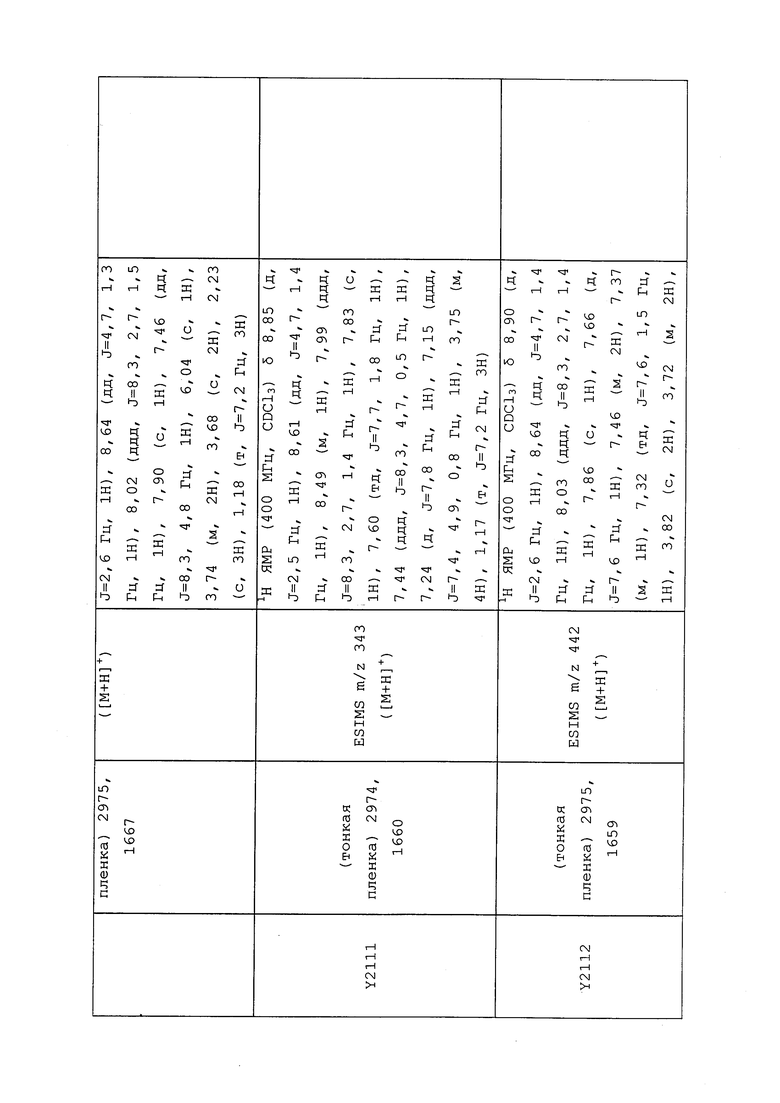
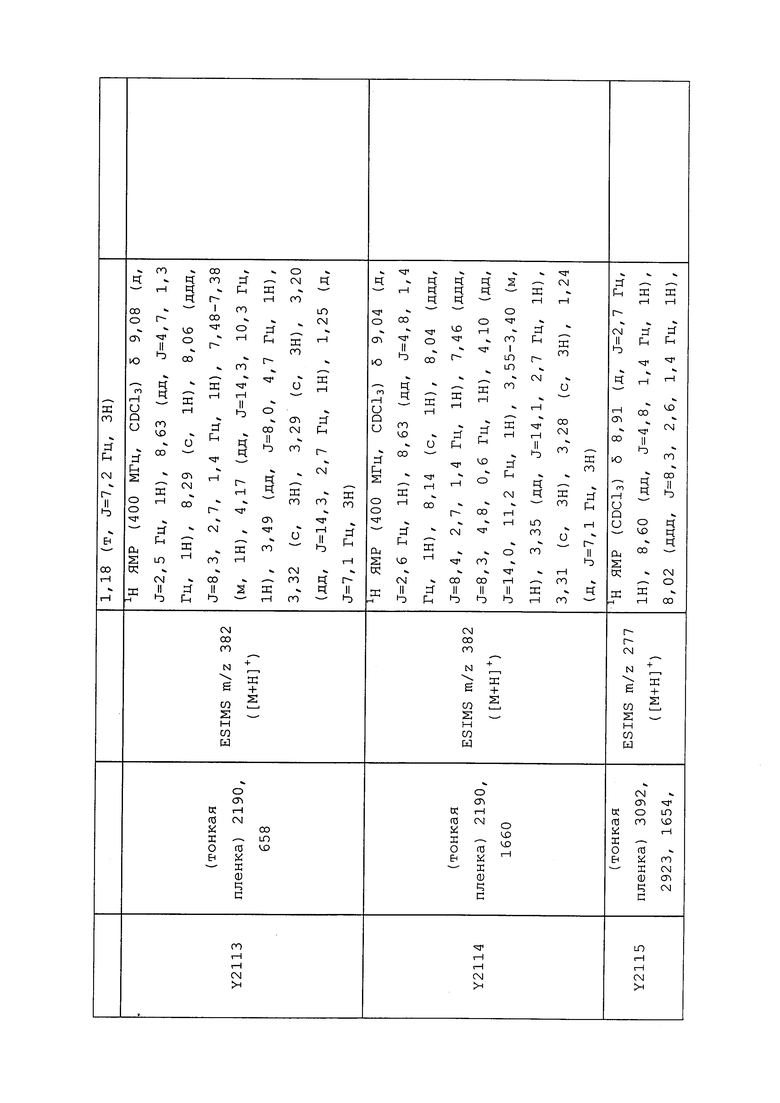
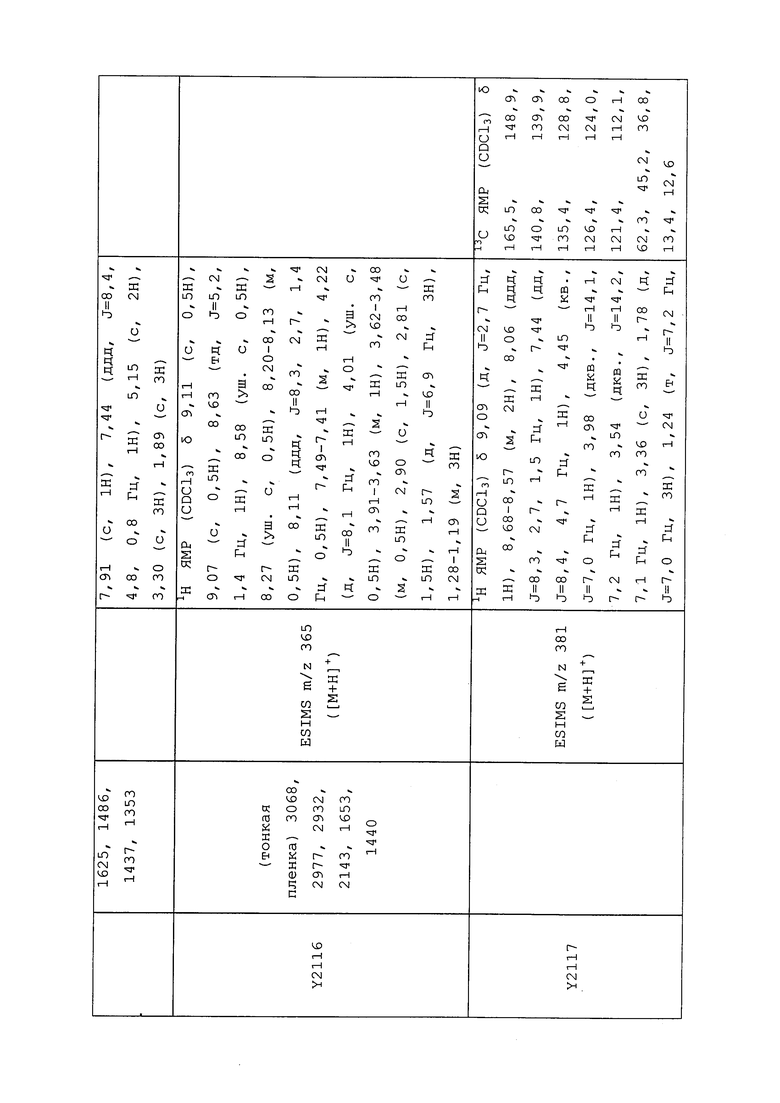
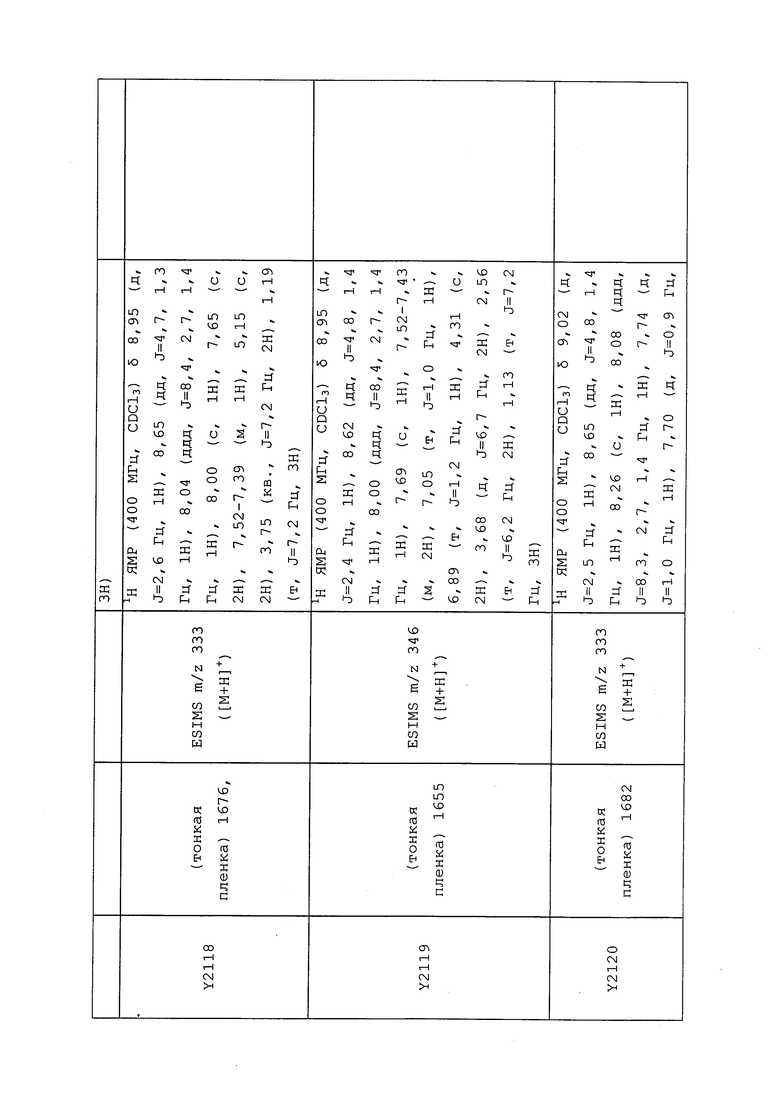
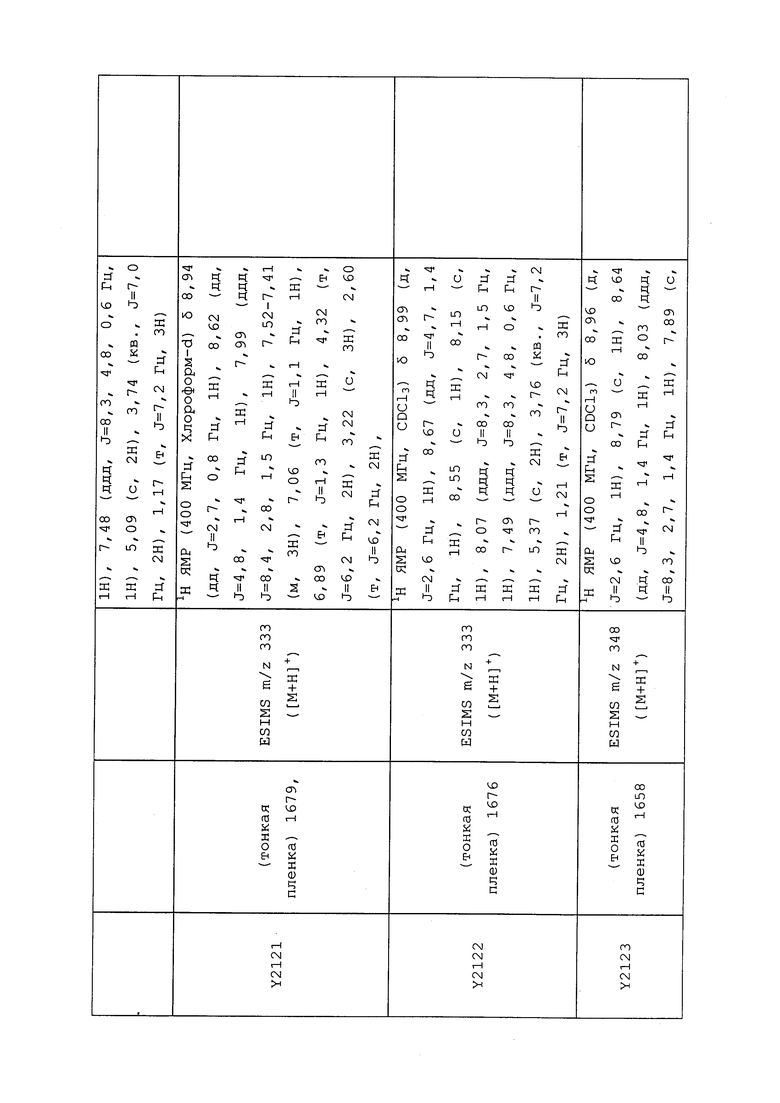
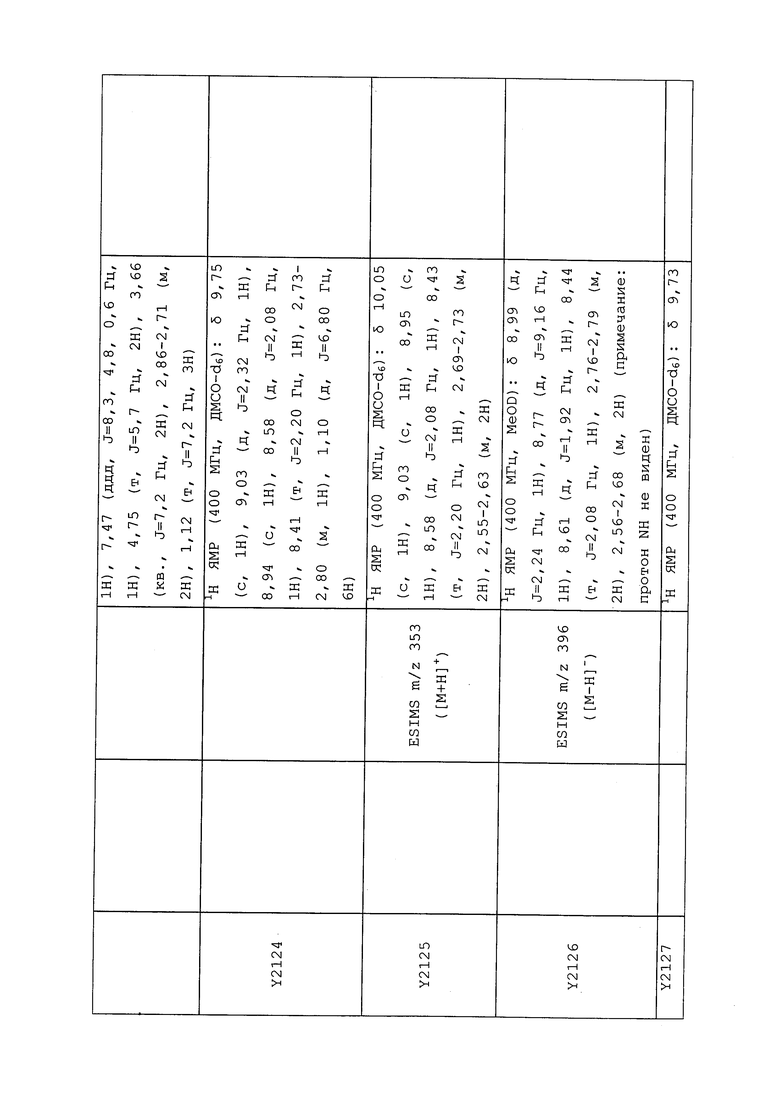
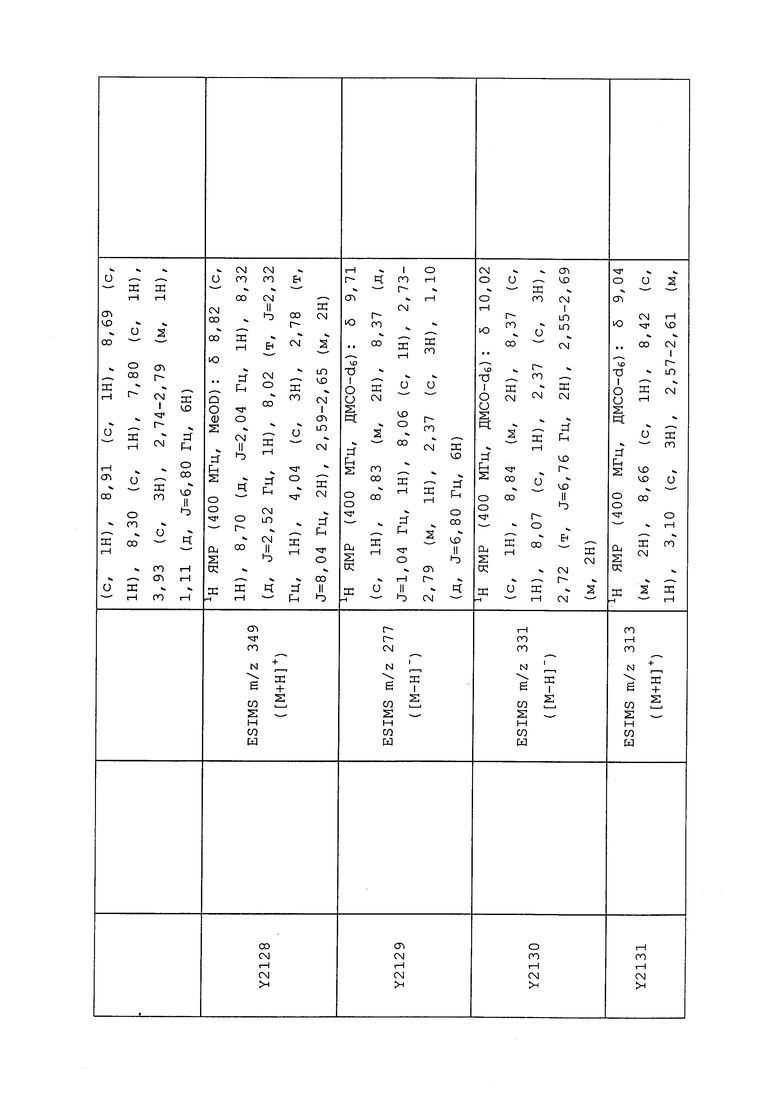
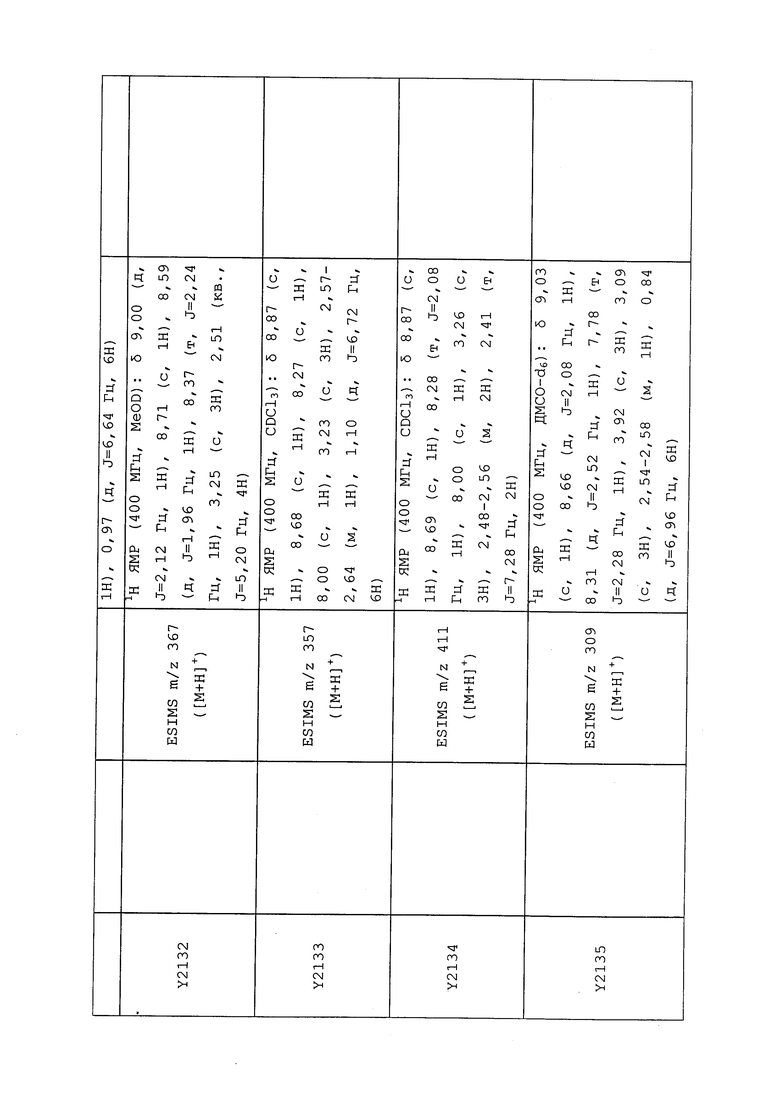
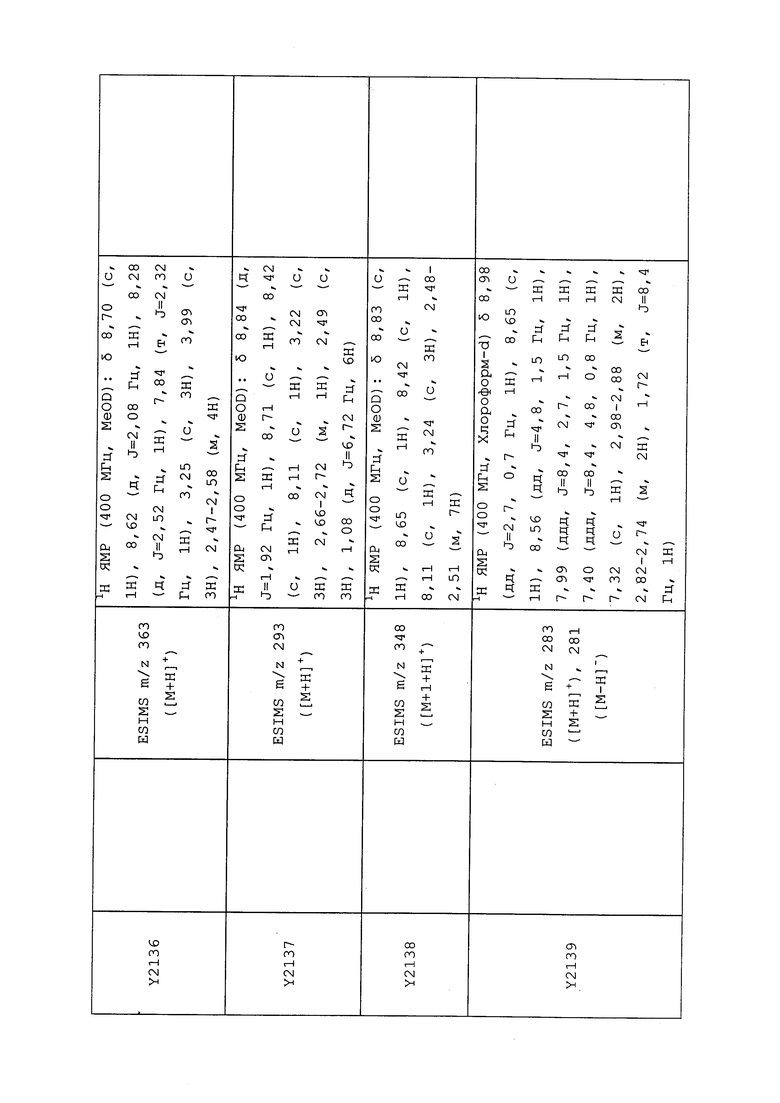
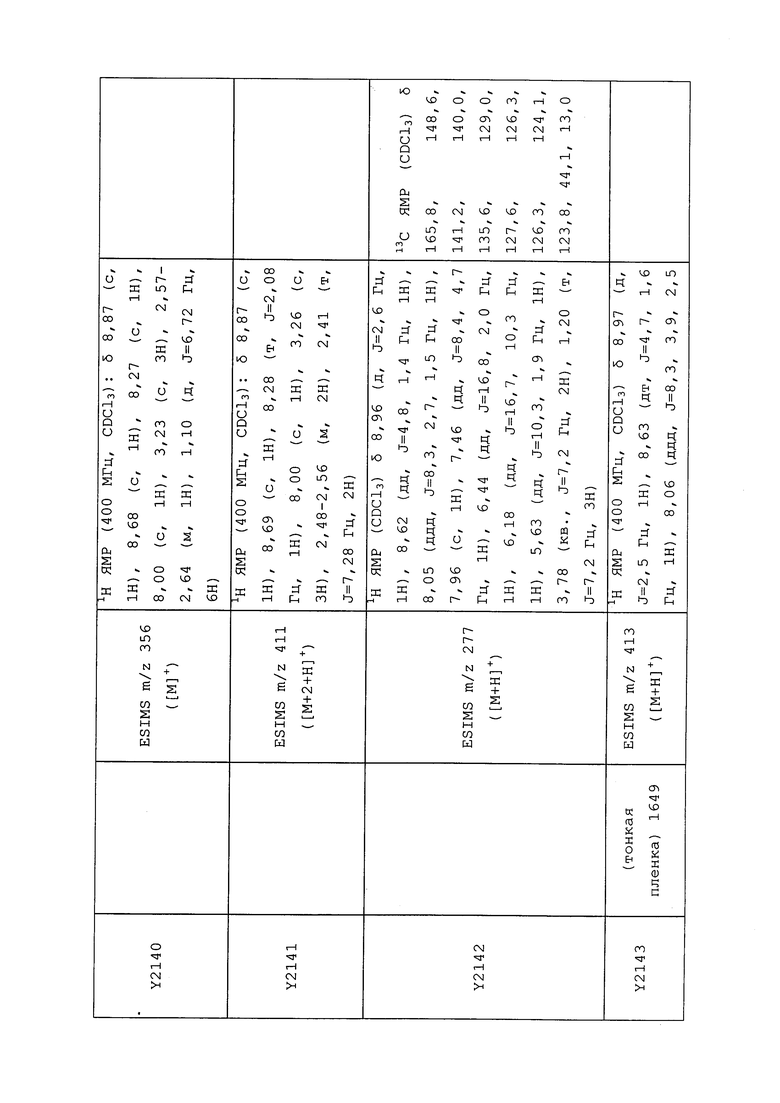
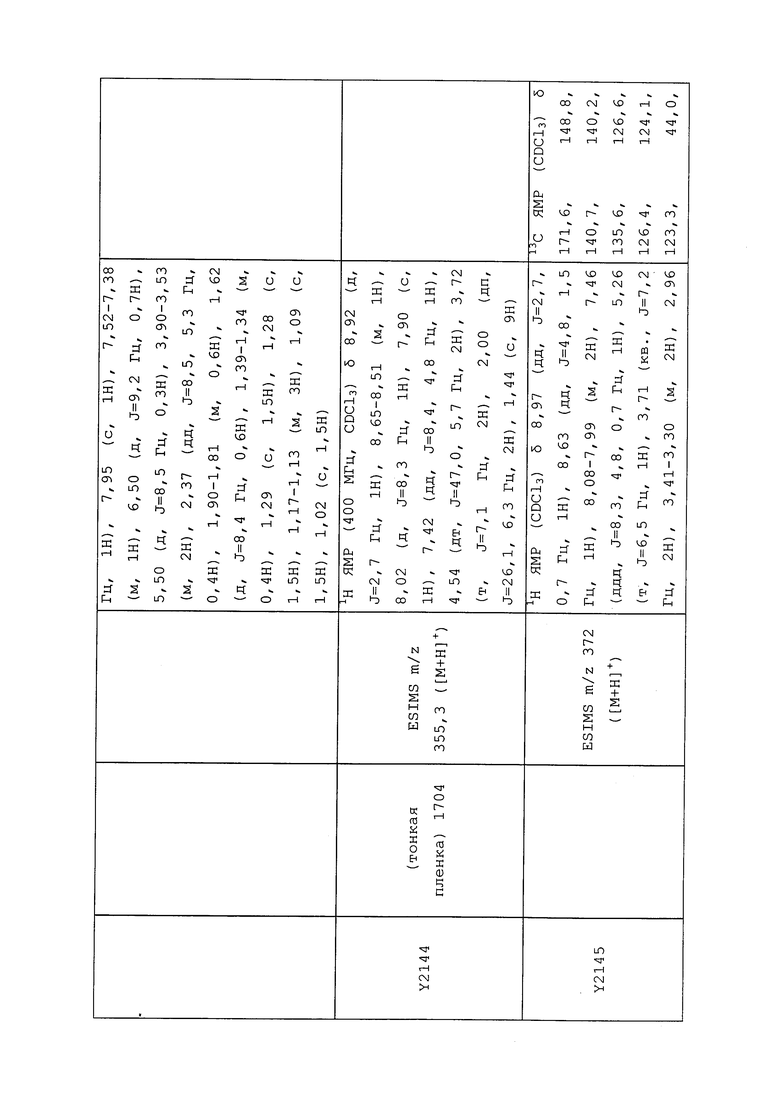
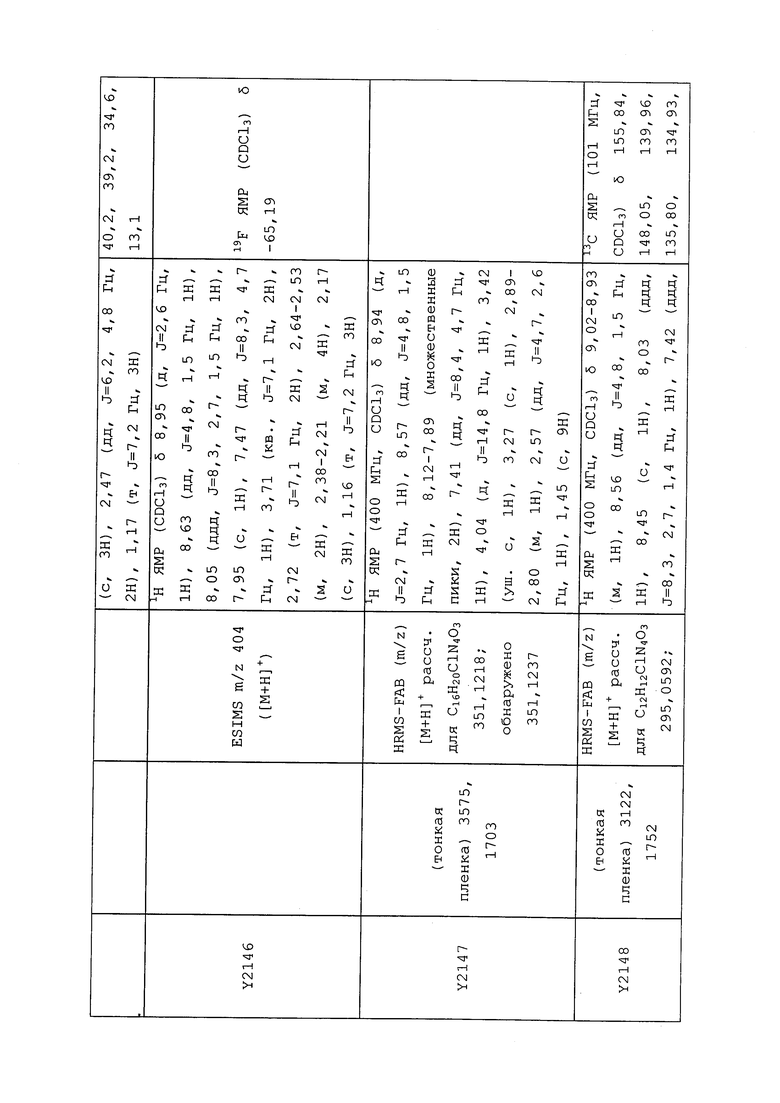
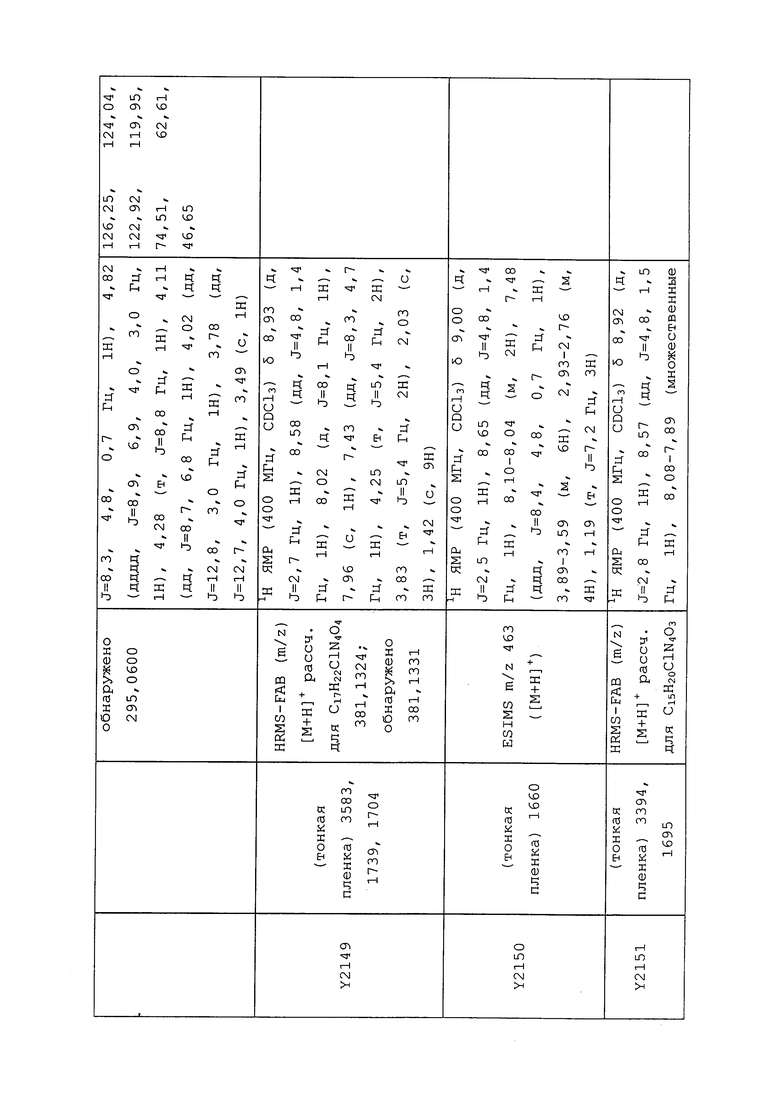
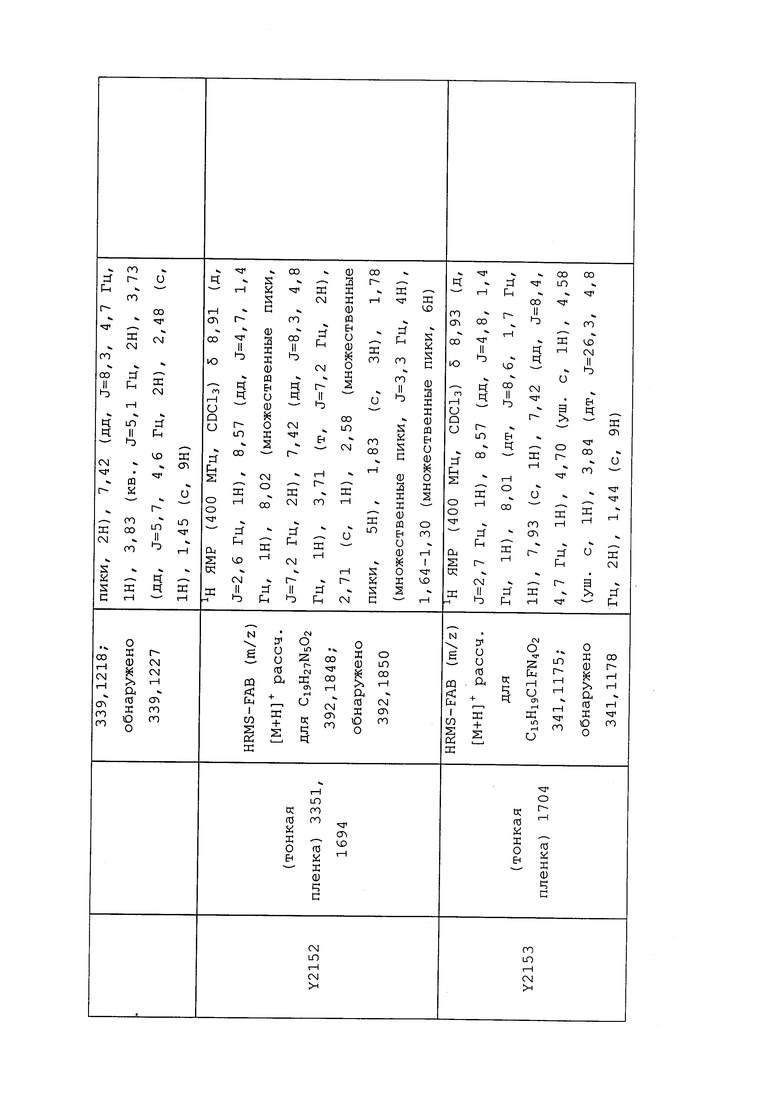
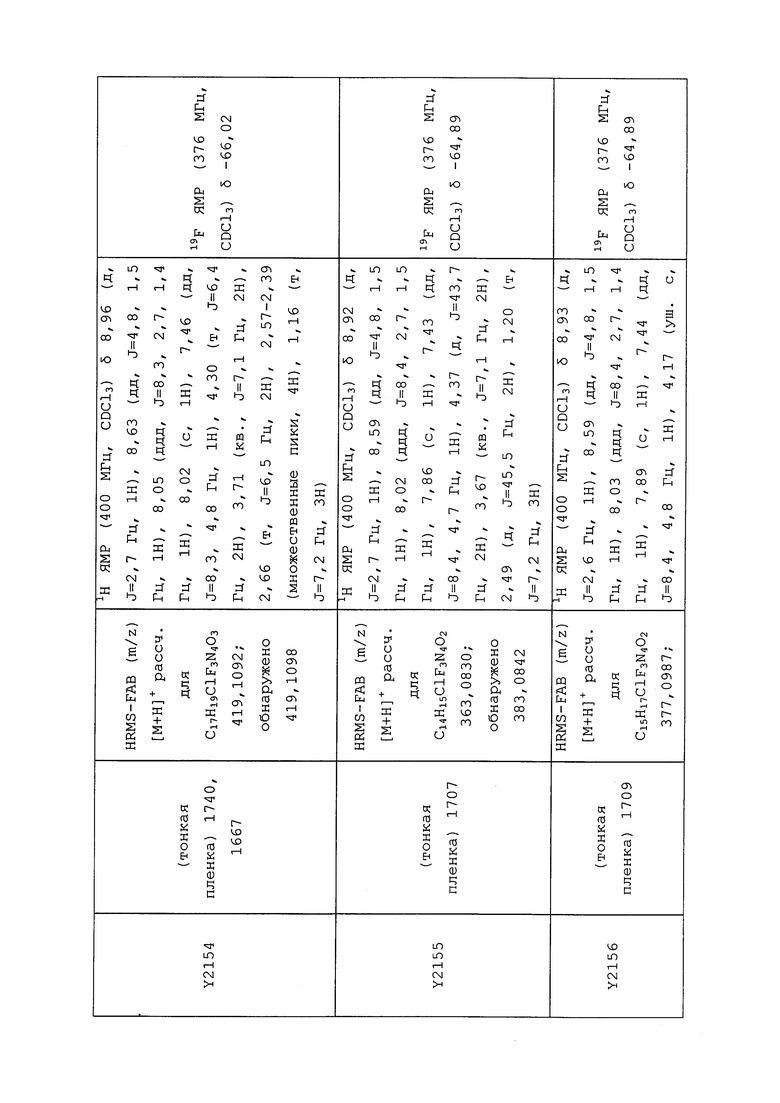
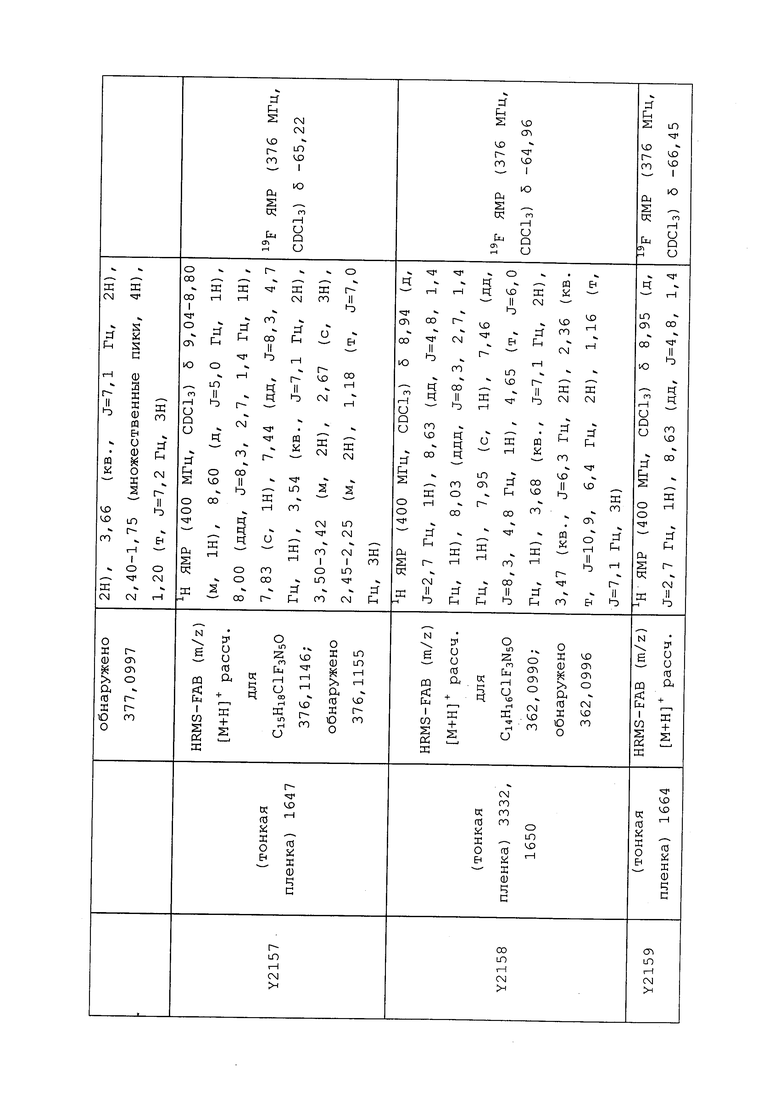
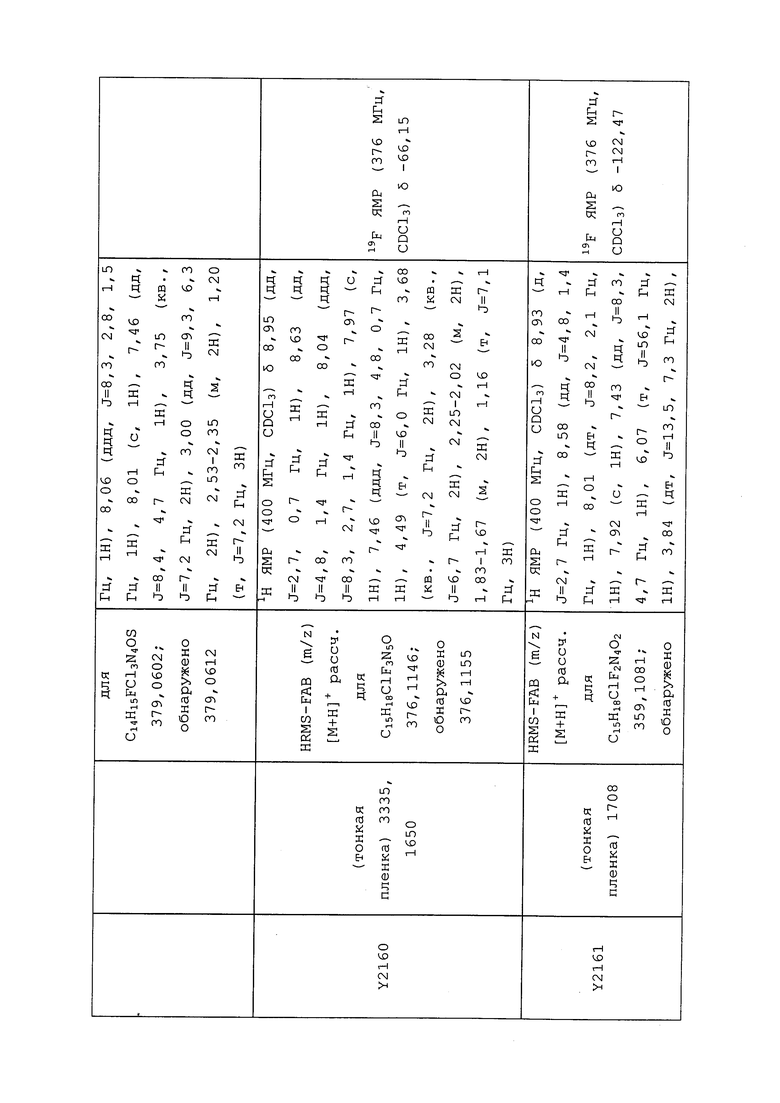
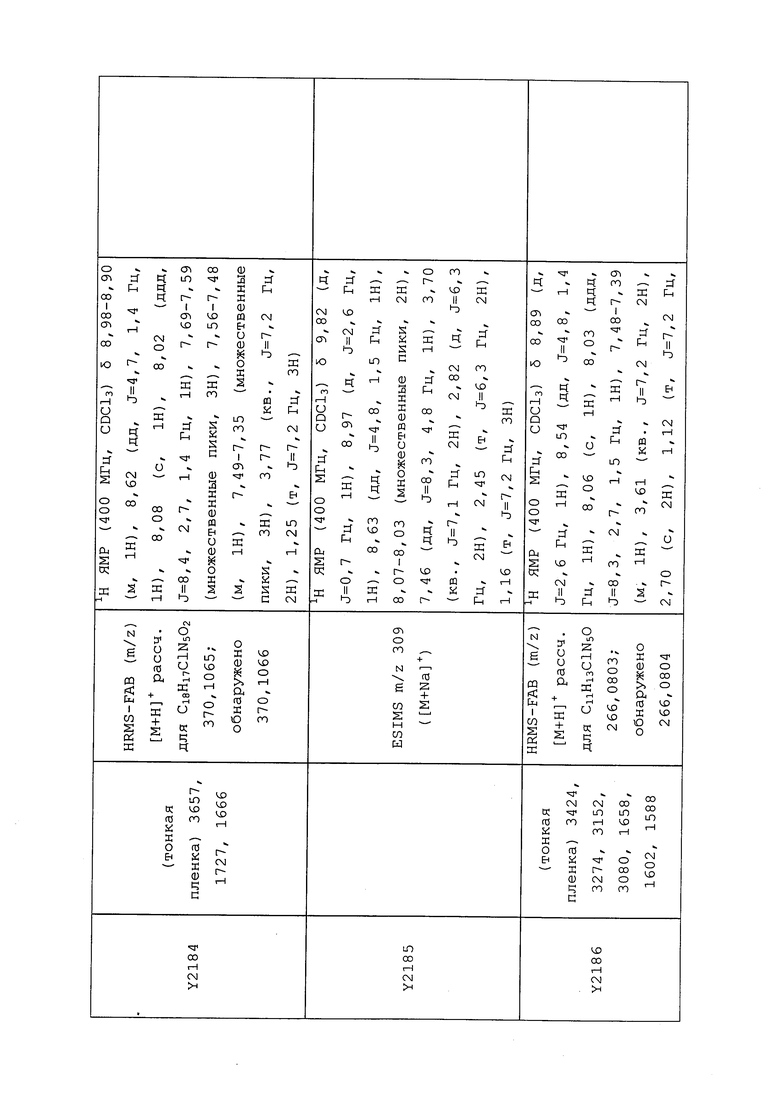
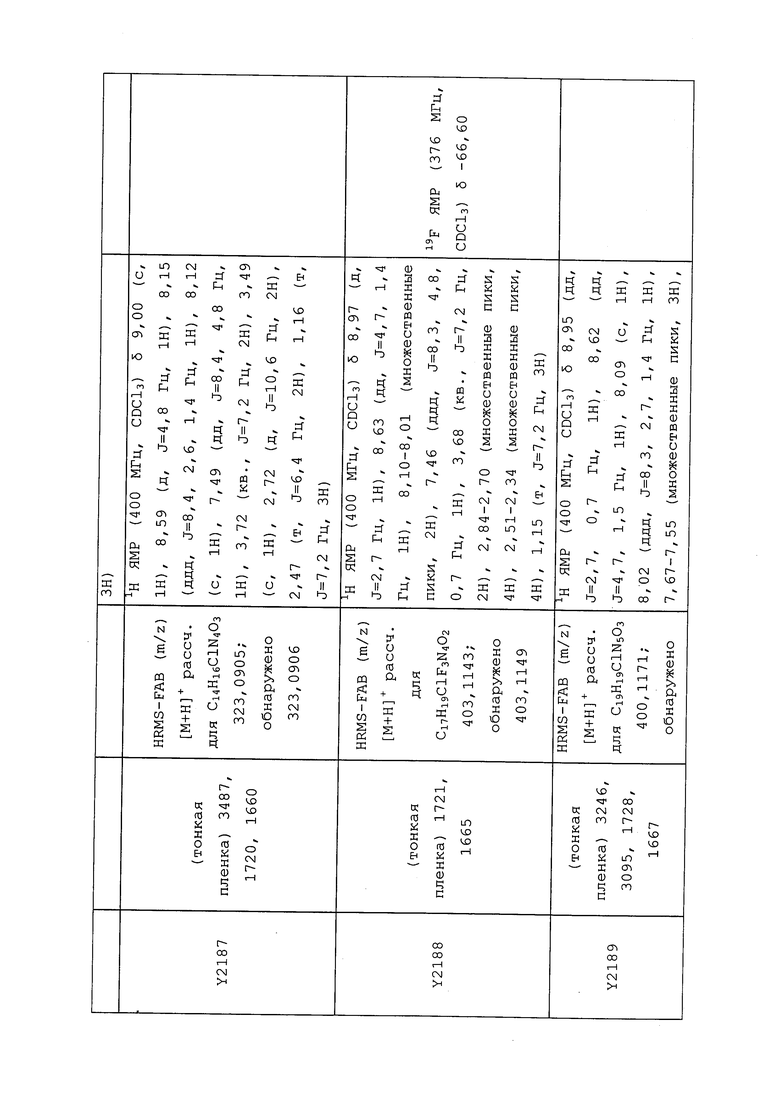
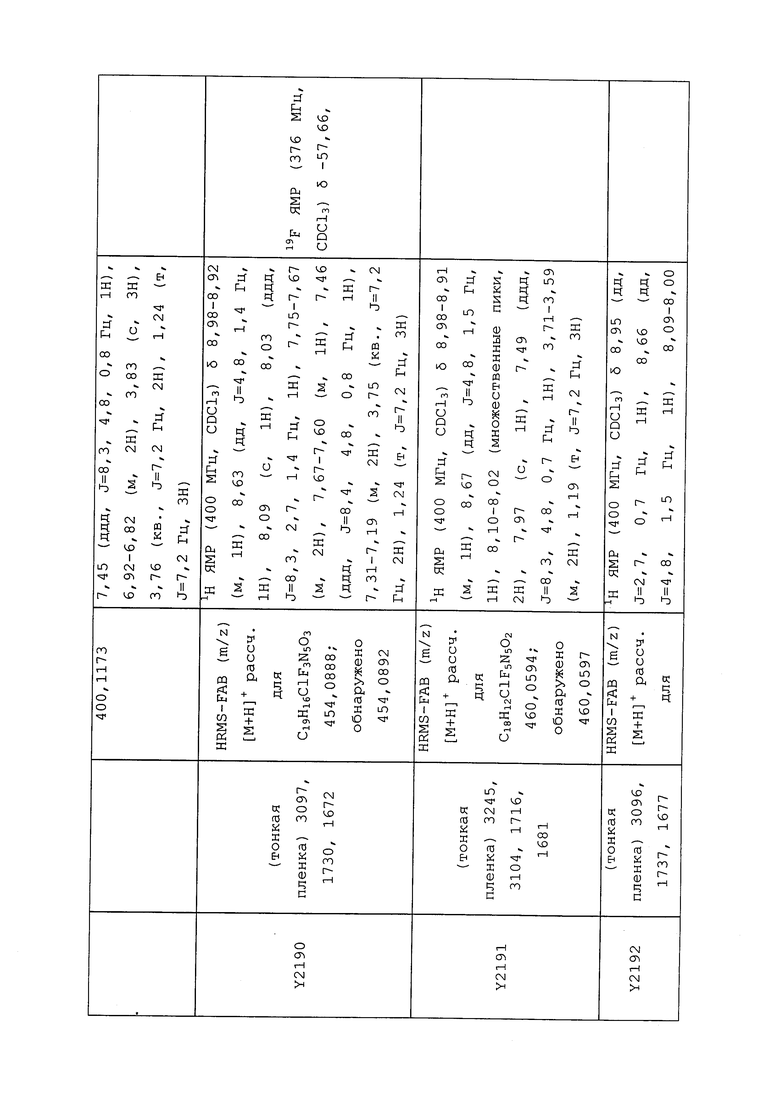
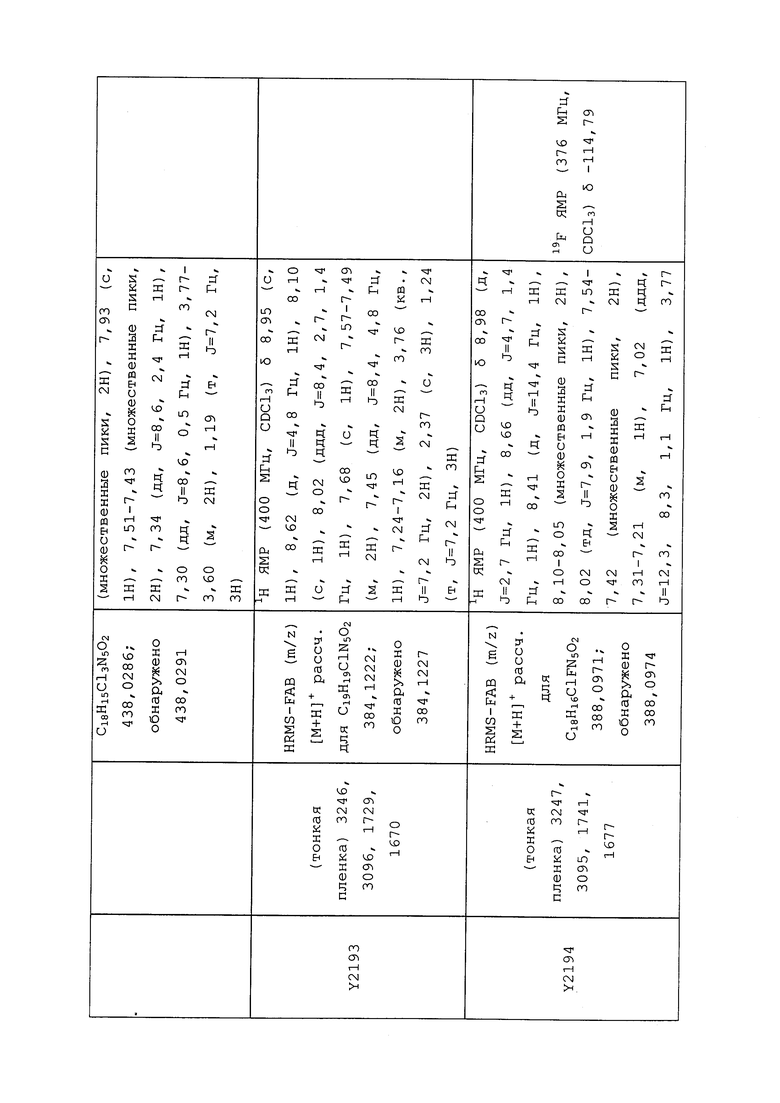
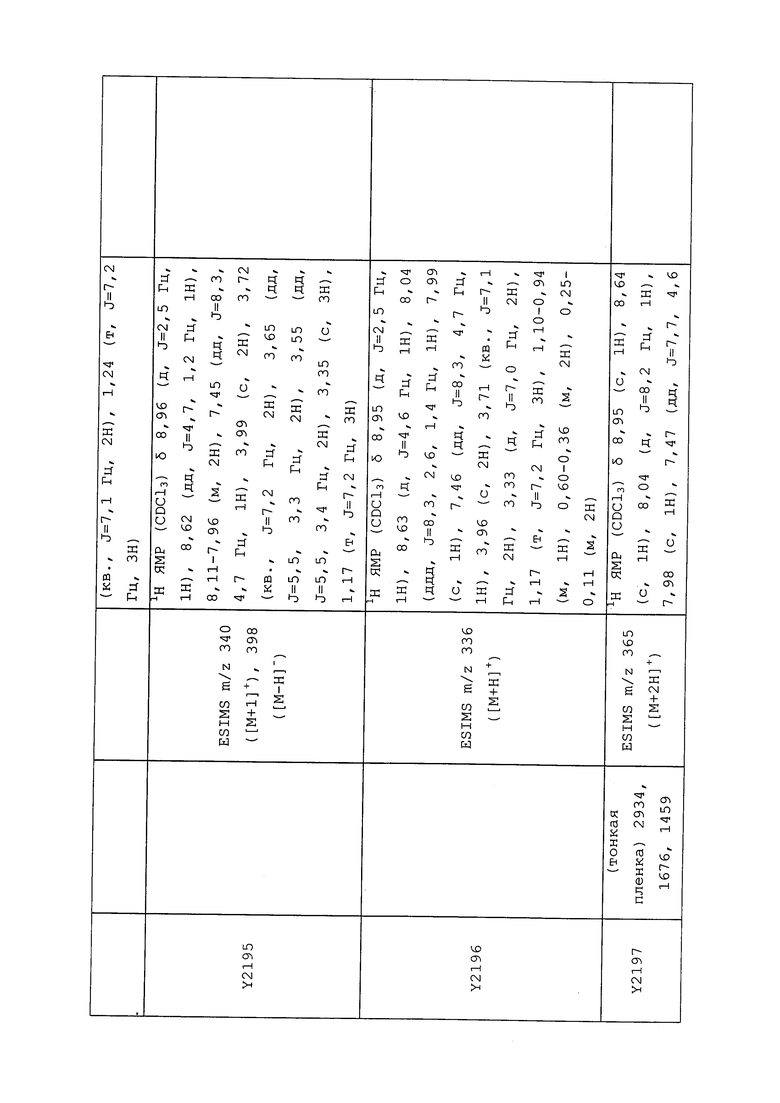
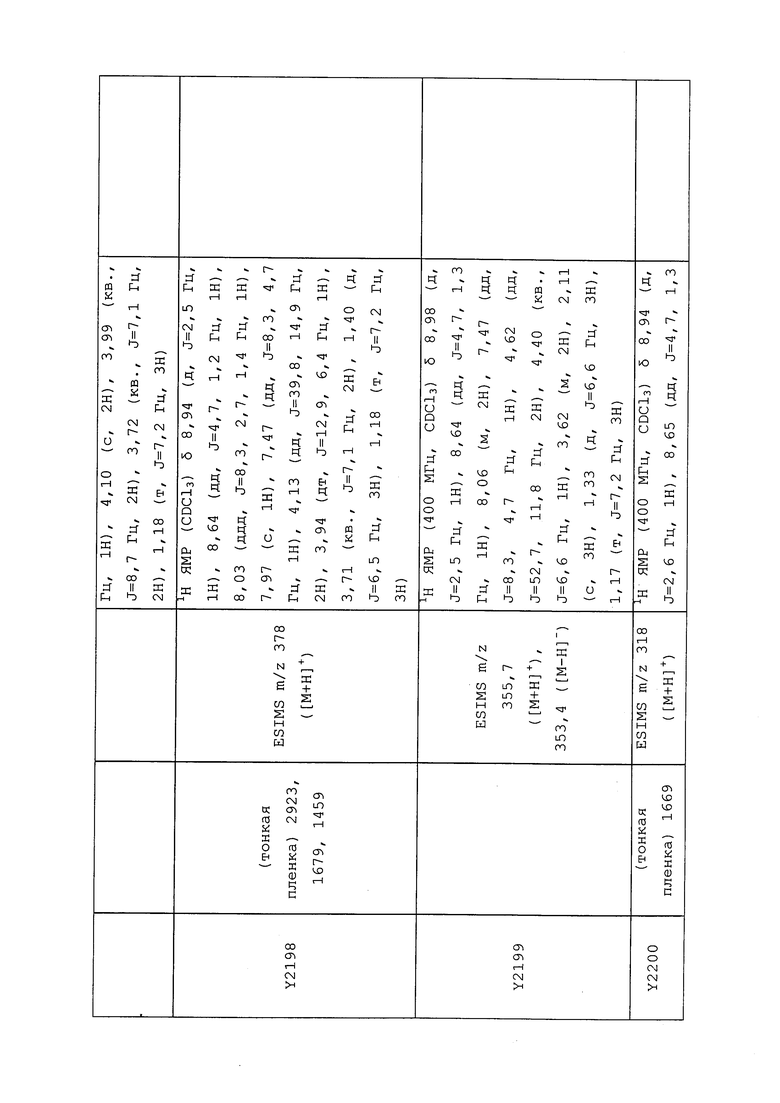
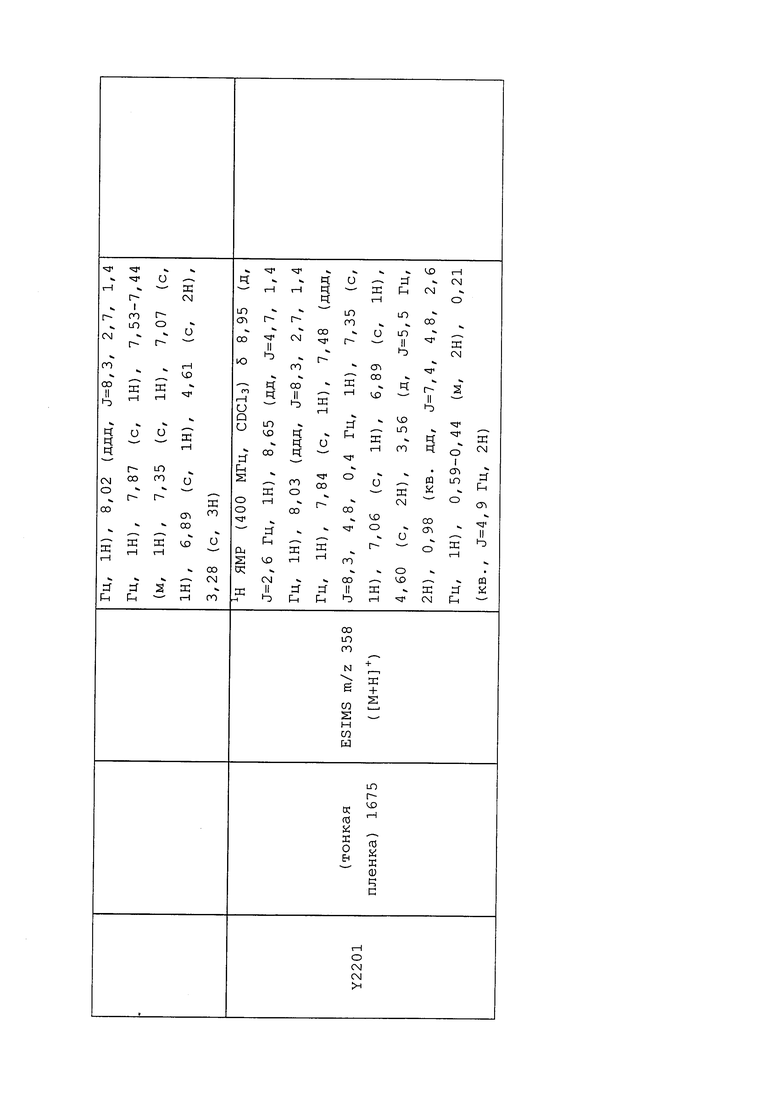
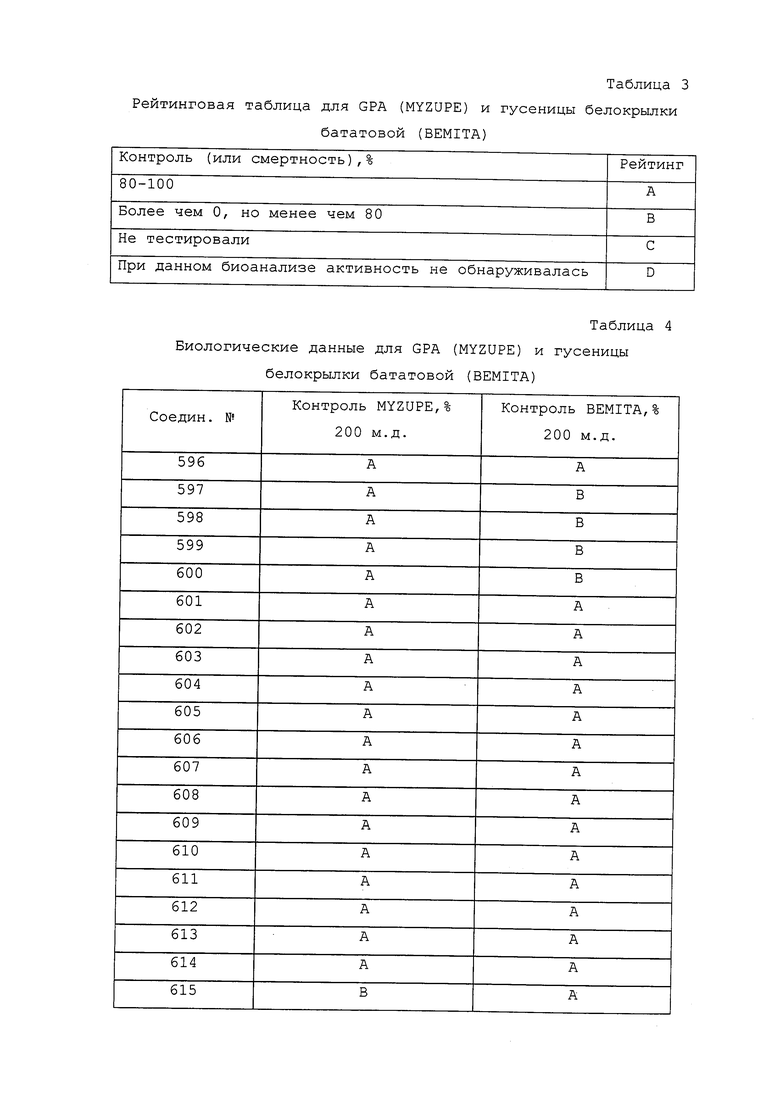
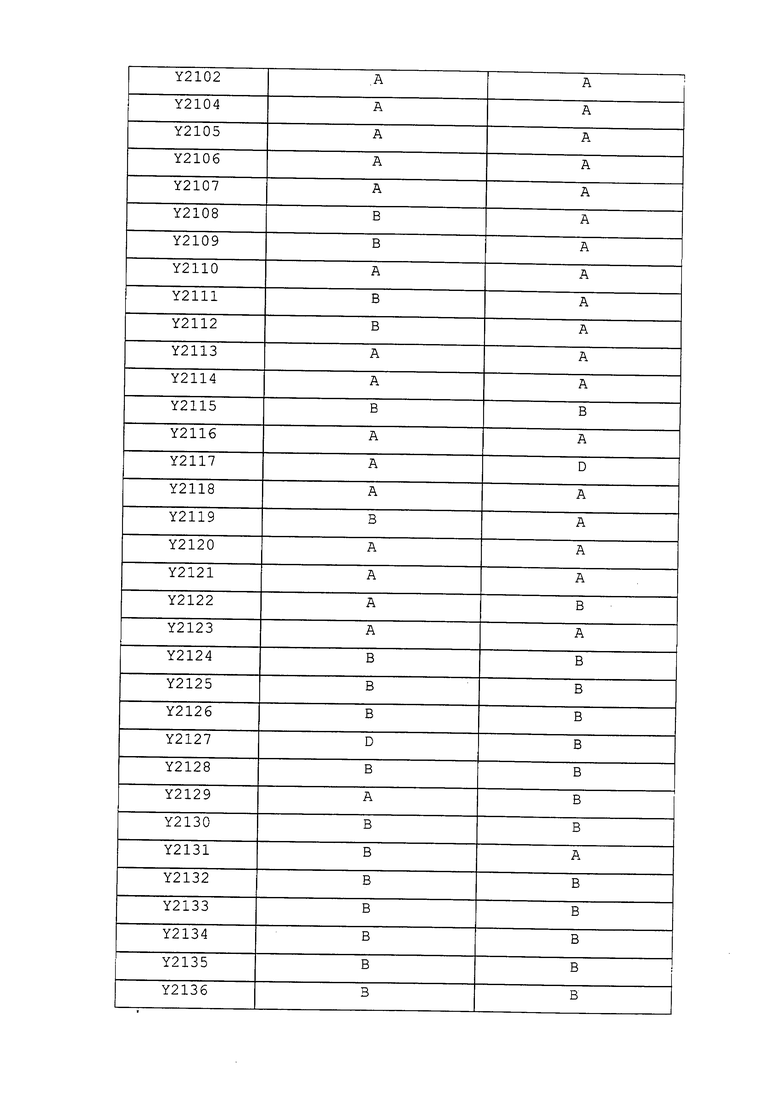
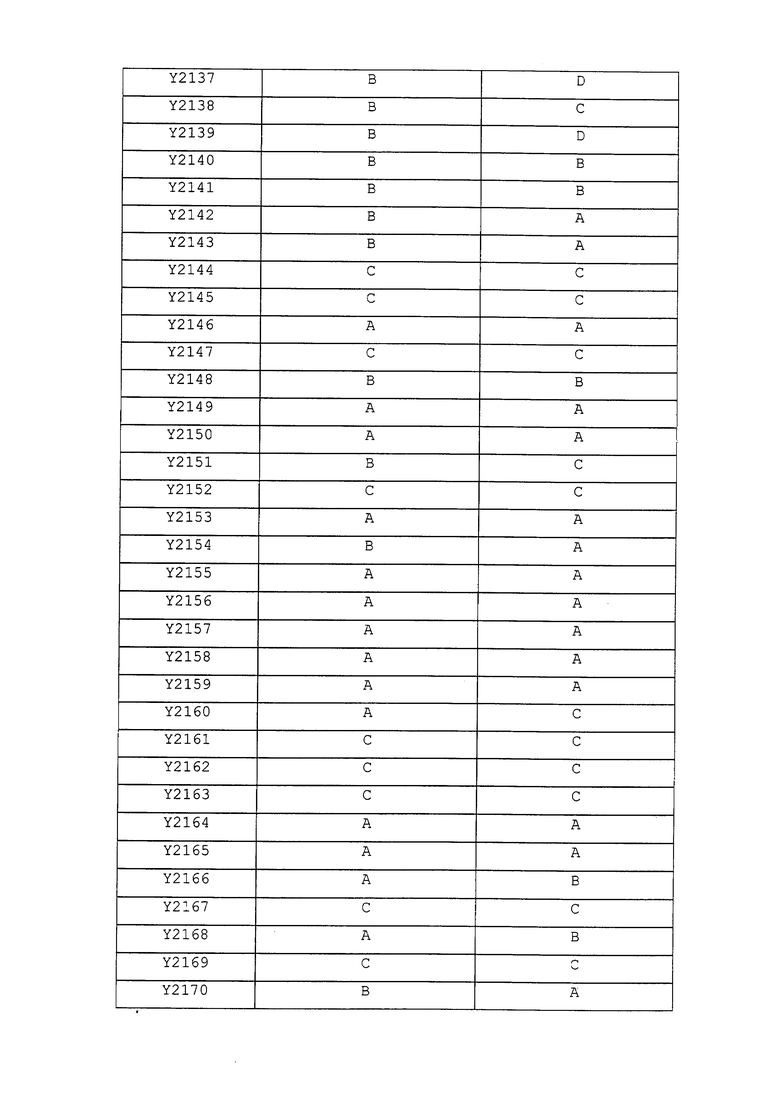
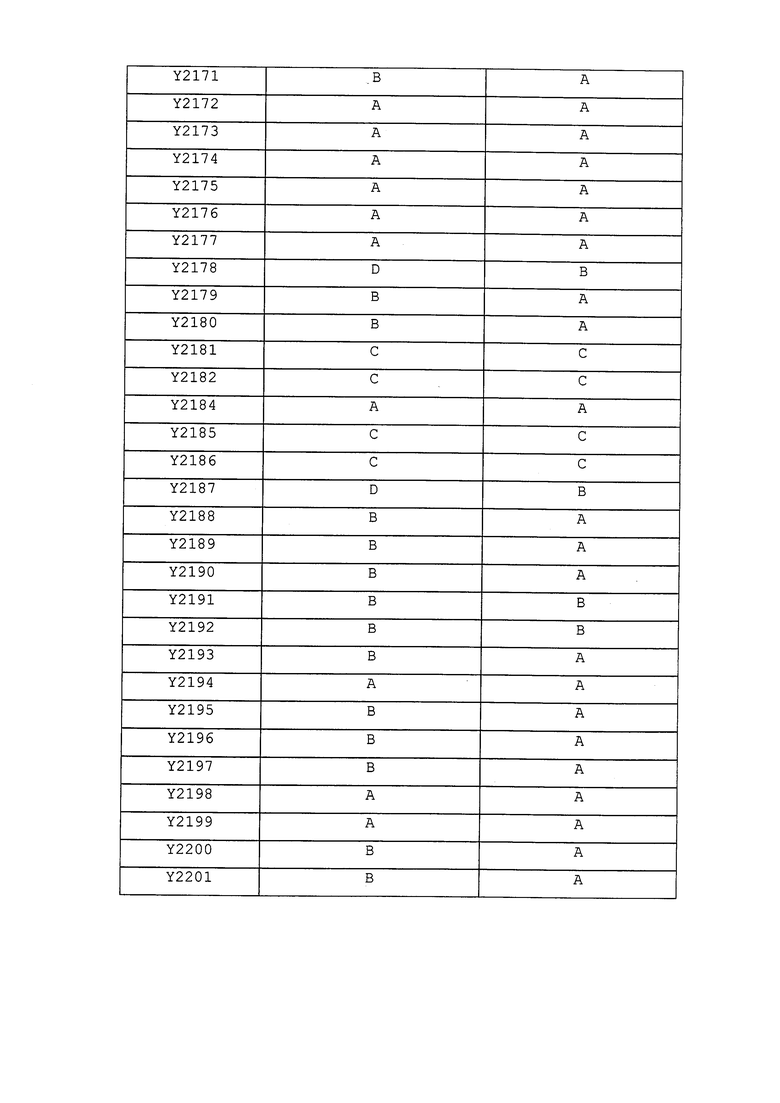
Изобретение относится к сельскому хозяйству. Композиция содержит молекулу, характеризующуюся следующей формулой:
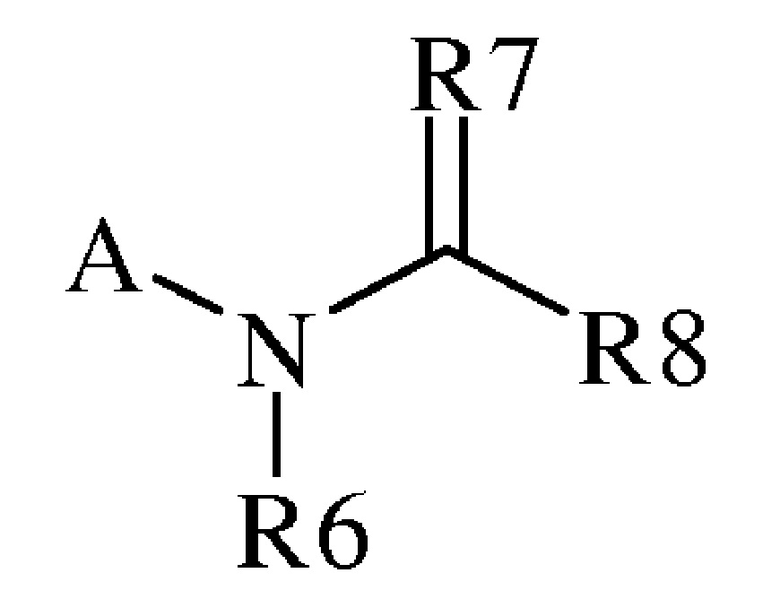 ,
,
Изобретение позволяет повысить эффективность защиты от вредителей. 6 н. и 53 з.п. ф-лы, 4 табл., 199 пр.
1. Молекула в соответствии с формулой 1
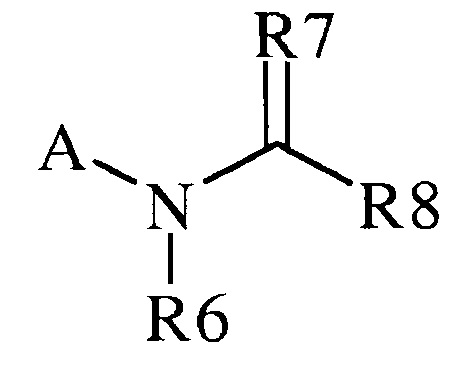 ,
,
где
(a) А представляет собой
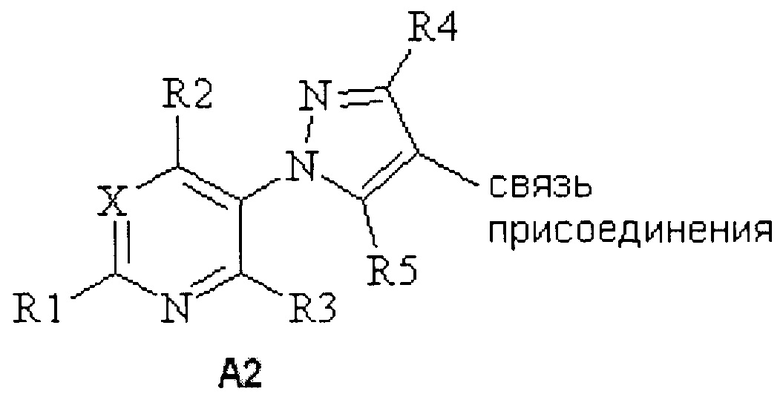 ;
;
(b) R1 представляет собой Н, F, Cl, Br, I, CN, NO2, замещенный или незамещенный С1-С6алкил, замещенный или незамещенный С2-С6алкенил, замещенный или незамещенный C1-С6алкокси, замещенный или незамещенный С2-С6алкенилокси, замещенный или незамещенный С3-С10циклоалкил, замещенный или незамещенный С3-С10циклоалкенил, замещенный или незамещенный С6-С20арил, замещенный или незамещенный С1-С20гетероциклил, OR9, C(=X1)R9, C(=X1)OR9, C(=X1)N(R9)2, N(R9)2, N(R9)С(=X1)R9, S(O)nR9, S(O)nOR9, S(O)nN(R9)2 или R9S(O)nR9,
где каждый упомянутый R1, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-С6алкила, С2-С6алкенила, C1-С6галогеналкила, С2-С6галогеналкенила, C1-С6галогеналкилокси, С2-С6галогеналкенилокси, С3-С10циклоалкила, С3-С10циклоалкенила, С3-С10галогенциклоалкила, С3-С10галогенциклоалкенила, OR9, S(O)nOR9, С6-С20арила или C1-С20гетероциклила (каждый из которых, возможный к замещению, может быть необязательно замещен R9);
(c) R2 представляет собой Н, F, Cl, Br, I, CN, NO2, замещенный или незамещенный С1-С6алкил, замещенный или незамещенный С2-С6алкенил, замещенный или незамещенный C1-С6алкокси, замещенный или незамещенный С2-С6алкенилокси, замещенный или незамещенный С3-С10циклоалкил, замещенный или незамещенный С3-С10циклоалкенил, замещенный или незамещенный С6-С20арил, замещенный или незамещенный С1-С20гетероциклил, OR9, C(=X1)R9, C(=X1)OR9, С(=Х1)N(R9)2, N(R9)2, N(R9)С(=Х1)R9, SR9, S(O)nOR9 или R9S(O)nR9,
где каждый упомянутый R2, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-С6алкила, С2-С6алкенила, C1-С6галогеналкила, С2-С6галогеналкенила, C1-С6галогеналкилокси, С2-С6галогеналкенилокси, С3-С10циклоалкила, С3-С10циклоалкенила, С3-С10галогенциклоалкила, С3-С10галогенциклоалкенила, OR9, S(O)nOR9, С6-С20арила или C1-С20гетероциклила (каждый из которых, возможный к замещению, может быть необязательно замещен R9);
(d) R3 представляет собой Н, F, Cl, Br, I, CN, NO2, замещенный или незамещенный C1-С6алкил, замещенный или незамещенный С1-С6алкенил, замещенный или незамещенный C1-С6алкокси, замещенный или незамещенный С2-С6алкенилокси, замещенный или незамещенный С3-С10циклоалкил, замещенный или незамещенный С3-С10циклоалкенил, замещенный или незамещенный С6-С20арил, замещенный или незамещенный С1-С20гетероциклил, OR9, C(=X1)R9, C(=X1)OR9, C(=X1)N(R9)2, N(R9)2, N(R9)С(=X1)R9, SR9, S(O)nOR9 или R9S(O)nR9,
где каждый упомянутый R3, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-С6алкила, С2-С6алкенила, C1-С6галогеналкила, С2-С6галогеналкенила, C1-С6галогеналкилокси, С2-С6галогеналкенилокси, С3-С10циклоалкила, С3-С10циклоалкенила, С3-С10галогенциклоалкила, С3-С10галогенциклоалкенила, OR9, S(O)nOR9, С6-С20арила или C1-С20гетероциклила (каждый из которых, возможный к замещению, может быть необязательно замещен R9);
(f) R5 представляет собой Н, F, Cl, Br, I, CN, NO2, замещенный или незамещенный С1-С6алкил, замещенный или незамещенный С2-С6алкенил, замещенный или незамещенный C1-С6алкокси, замещенный или незамещенный С2-С6алкенилокси, замещенный или незамещенный С3-С10циклоалкил, замещенный или незамещенный С3-С10циклоалкенил, замещенный или незамещенный С6-С20арил, OR9, C(=X1)R9, C(=X1)OR9, С(=Х1)N(R9)2, N(R9)2, N(R9)C(=X1)R9, SR9, S(O)nOR9 или R9S(O)nR9,
где каждый упомянутый R5, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-С6алкила, С2-С6алкенила, C1-С6галогеналкила, С2-С6галогеналкенила, C1-С6галогеналкилокси, С2-С6галогеналкенилокси, С3-С10циклоалкила, С3-С10циклоалкенила, С3-С10галогенциклоалкила, С3-С10галогенциклоалкенила, OR9, S(O)nOR9 или С6-С20арила (каждый из которых, возможный к замещению, может быть необязательно замещен R9);
(g) R6 представляет собой R11, Н, замещенный или незамещенный C1-С6алкил, замещенный или незамещенный С2-С6алкенил, замещенный или незамещенный C1-С6алкокси, замещенный или незамещенный С2-С6алкенилокси, замещенный или незамещенный С3-С10циклоалкил, замещенный или незамещенный С3-С10циклоалкенил, замещенный или незамещенный С6-С20арил, замещенный или незамещенный C1-С20гетероциклил, OR9, C(=X1)R9, C(=X1)OR9, C(=X1)N(R9)2, N(R9)2, N(R9)С(=X1)R9, SR9, S(O)nOR9, R9S(O)nR9, C1-С6алкилС6-С20арил (где алкил и арил могут быть независимо замещенными или незамещенными), C(=X2)R9, C(=X1)X2R9, R9X2C(=Х1)R9, R9X2R9, С(=O)(C1-С6алкил)S(О)n(C1-С6алкил), С(=O)(C1-С6алкил)С(=O)О(C1-С6алкил), (C1-С6алкил)ОС(=O)(С6-С20арил), (C1-С6алкил)ОС(=O)(C1-С6алкил), C1-С6алкил-(С3-С10циклогалогеналкил) или (C1-С6алкенил)С(=O)О(C1-С6алкил) или R9X2C(=X1)X2R9,
где каждый упомянутый R6 (за исключением R11), который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-С6алкила, С2-С6алкенила, C1-С6галогеналкила, С2-С6галогеналкенила, C1-С6галогеналкилокси, С2-С6галогеналкенилокси, С3-С10циклоалкила, С3-С10циклоалкенила, С3-С10галогенциклоалкила, С3-С10галогенциклоалкенила, OR9, S(O)nOR9, С6-С20арила или C1-С20гетероциклила, R9apилa (каждый из которых, возможный к замещению, может быть необязательно замещен R9),
R6 (за исключением R11) и R8 могут быть необязательно соединены в циклическом расположении, причем такое расположение может необязательно содержать в циклической структуре один или несколько гетероатомов, выбранных из О, S или N, соединяющих R6 и R8;
(h) R7 представляет собой О, S, NR9 или NOR9;
(i) R8 представляет собой R13-S(О)n-R13, где каждый R13 независимо выбирают из замещенного или незамещенного C1-С6алкила, замещенного или незамещенного С2-С6алкенила, замещенного или незамещенного C1-С6алкокси, замещенного или незамещенного С2-С6алкенилокси, замещенного или незамещенного С3-С10циклоалкила, замещенного или незамещенного С3-С10циклоалкенила, замещенного или незамещенного С6-С20арила, замещенного или незамещенного C1-С20гетероциклила, замещенного или незамещенного S(О)nC1-С6алкила, замещенного или незамещенного N(C1-С6алкил)2, где каждый упомянутый замещенный алкил, замещенный алкенил, замещенный алкокси, замещенный алкенилокси, замещенный циклоалкил, замещенный циклоалкенил, замещенный арил, замещенный гетероциклил содержит один или несколько заместителей, независимо выбранных из F, Cl, Br, I, CN, NO2, C1-С6алкила, С2-С6алкенила, C1-С6галогеналкила, С2-С6галогеналкенила, C1-С6галогеналкилокси, С2-С6галогеналкенилокси, С3-С10циклоалкила, С3-С10циклоалкенила, С3-С10галогенциклоалкила, С3-С10галогенциклоалкенила, OC1-С6алкила, OC1-С6галогеналкила, S(О)nC1-С6алкила, S(О)nOC1-С6алкила, С6-С20арила или C1-С20гетероциклила, С2-С6алкинила, C1-С6алкокси, N(R9)S(О)nR9, OR9, N(R9)2, R9OR9, R9N(R9)2, R9C(=X1)R9, R9C(=X1)N(R9)2, N(R9)C(=X1)R9, R9N(R9)C(=X1)R9, S(O)nOR9, R9C(=X1)OR9, R9OC(=X1)R9, R9S(O)nR9, S(O)nR9, оксо (каждый из которых, возможный к замещению, может быть необязательно замещен R9);
(j) R9 (каждый независимо) представляет собой Н, CN, замещенный или незамещенный C1-С6алкил, замещенный или незамещенный С2-С6алкенил, замещенный или незамещенный C1-С6алкокси, замещенный или незамещенный С2-С6алкенилокси, замещенный или незамещенный С3-С10циклоалкил, замещенный или незамещенный С3-С10циклоалкенил, замещенный или незамещенный С6-С20арил, замещенный или незамещенный С1-С20гетероциклил, замещенный или незамещенный S(О)nC1-С6алкил, замещенный или незамещенный N(C1-С6алкил)2,
где каждый упомянутый R9, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-С6алкила, С2-С6алкенила, C1-С6галогеналкила, С2-С6галогеналкенила, C1-С6галогеналкилокси, С2-С6галогеналкенилокси, С3-С10циклоалкила, С3-С10циклоалкенила, С3-С10галогенциклоалкила, С3-С10галогенциклоалкенила, OC1-С6алкила, OC1-С6галогеналкила, S(О)nC1-С6алкила, S(О)nOC1-С6алкила, С6-С20арила или C1-С20гетероциклила;
(k) n равно 0, 1 или 2;
(l) X представляет собой N или CRn1, где Rn1 представляет собой Н, F, Cl, Br, I, CN, NO2, замещенный или незамещенный C1-С6алкил, замещенный или незамещенный С2-С6алкенил, замещенный или незамещенный C1-С6алкокси, замещенный или незамещенный С2-С6алкенилокси, замещенный или незамещенный С3-С10циклоалкил, замещенный или незамещенный С3-С10циклоалкенил, замещенный или незамещенный С6-С20арил, замещенный или незамещенный C1-С20гетероциклил, OR9, C(=X1)R9, C(=X1)OR9, С(=Х1)N(R9)2, N(R9)2, N(R9)C(=X1)R9, SR9, S(O)nR9, S(O)nOR9 или R9S(O)nR9,
где каждый упомянутый Rn1, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-С6алкила, С2-С6алкенила, C1-С6галогеналкила, С2-С6галогеналкенила, C1-С6галогеналкилокси, С2-С6галогеналкенилокси, С3-С10циклоалкила, С3-С10циклоалкенила, С3-С10галогенциклоалкила, С3-С10галогенциклоалкенила, OR9, S(O)nOR9, С6-С20арила или C1-С20гетероциклила (каждый из которых, возможный к замещению, может быть необязательно замещен R9);
(m) X1 (каждый независимо) представляет собой О или S;
(n) Х2 (каждый независимо) представляет собой О, S, =NR9 или =NOR9;
(о) Z представляет собой CN, NO2, C1-С6алкил(R9), C(=X1)N(R9)2;
(р) R11 представляет собой Q1(C≡C)R12, где Q1 представляет собой связь, замещенный или незамещенный C1-С6алкил, замещенный или незамещенный С2-С6алкенил, замещенный или незамещенный С2-С6алкинил, замещенный или незамещенный С3-С10циклоалкил, замещенный или незамещенный С2-С10циклоалкокси, замещенный или незамещенный С1-С6алкилOR9, замещенный или незамещенный C1-С6алкилS(О)nR9, замещенный или незамещенный C1-С6алкилS(О)n(=NR9), замещенный или незамещенный С1-С6алкилN(R9) (где (С≡С) присоединен связью непосредственно к N), замещенный или незамещенный С1-С6алкилN(R9)2, замещенный или незамещенный С2-С6алкенилокси, замещенный или незамещенный С3-С10циклоалкенил, замещенный или незамещенный С0-С6алкилС(=R7)C0-C6aлкилR9, замещенный или незамещенный С0-С6алкилС(=R7)OR9, замещенный или незамещенный C1-С6алкилОС0-С6алкилС(=R7)R9, замещенный или незамещенный С1-С6алкилN(R9)(C(=R7)R9), замещенный или незамещенный С1-С6алкилN(R9)(C(=R7)OR9), замещенный или незамещенный С0-С6алкилС(=R7)С0-С6алкилN(R9) (где (С≡С) присоединен связью непосредственно к N), замещенный или незамещенный С0-С6алкилС(=R7)С0-С6алкилN(R9)2, OR9, S(O)nR9, N(R9)R9, замещенный или незамещенный С6-С20арил, замещенный или незамещенный C1-С20гетероциклил,
где каждый упомянутый Q1, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-С6алкила, С2-С6алкенила, С2-С6алкинила, C1-С6галогеналкила, С2-С6галогеналкенила, C1-С6галогеналкилокси, С2-С6галогеналкенилокси, С3-С10циклоалкила, С3-С10циклоалкенила, С3-С10галогенциклоалкила, С3-С10галогенциклоалкенила, OR9, SR9, S(O)nR9, S(O)nOR9, С6-С20арила или C1-С20гетероциклила, R9apилa, C1-C6aлкилOR9, C1-С6алкилS(О)nR9 (каждый из которых, возможный к замещению, может быть необязательно замещен R9),
Q1 и R8 могут быть необязательно соединены в циклическом расположении, причем такое расположение может необязательно содержать в циклической структуре один или несколько гетероатомов, выбранных из О, S или N, соединяющих Q1 и R8;
(q) R12 представляет собой Q1 (за исключением случая, когда Q1 представляет собой связь), F, Cl, Br, I, Si(R9)3 (где каждый R9 выбирают независимо) или R9.
2. Молекула по п. 1, где R1 представляет собой Н.
3. Молекула по п. 1, где R2 представляет собой Н.
4. Молекула по п. 1, где R3 выбирают из Н или замещенного или незамещенного C1-С6алкила.
5. Молекула по п. 1, где R3 выбирают из Н или СН3.
6. Молекула по п. 1, где R4 выбирают из Н, замещенного или незамещенного C1-С6алкила, замещенного или незамещенного С2-С6алкенила, замещенного или незамещенного С3-С10циклоалкила, замещенного или незамещенного С6-С20арила, где каждый упомянутый R4, который является замещенным, содержит один или несколько заместителей, выбранных из F, Cl, Br или I.
7. Молекула по п. 1, где R4 представляет собой Н или C1-С6алкил.
8. Молекула по п. 1, где R4 представляет собой Н, СН3, СН2СН3, СН=СН2, циклопропил, CH2Cl, CF3 или фенил.
9. Молекула по п. 1, где R4 представляет собой Br или Cl.
10. Молекула по п. 1, где R5 выбирают из Н, F, Cl, Br, I, замещенного или незамещенного C1-С6алкила, замещенного или незамещенного C1-С6алкокси.
11. Молекула по п. 1, где R5 выбирают из Н, ОСН2СН3, F, Cl, Br или СН3.
12. Молекула по п. 1, где R11 представляет собой замещенный или незамещенный C1-C6aлкилC≡CR12.
13. Молекула по п. 1, где R11 представляет собой замещенный или незамещенный С1-С6алкилС≡СН.
14. Молекула по п. 1, где R11 представляет собой замещенный или незамещенный С1-С4алкилС≡СН.
15. Молекула по п. 1, где R11 представляет собой замещенный или незамещенный С1-С2алкилС≡СН.
16. Молекула по п. 1, где R11 представляет собой замещенный или незамещенный СН2С≡СН.
17. Молекула по п. 1, где R7 представляет собой О или S.
18. Молекула по п. 1, где R8 выбирают из СН(СН3)SCH2CF3, CH2CH2SCH2CF3, CH2SCH2CF3, CH2SCHClCF3, СН(СН2СН3)SCH2CF3, СН(СН3)SCH2CHF2, СН(СН3)SCH2CH2F, CH2CH2SCH2CH2F, CH(CH3)S(=O)2CH2CF3, CH(CH3)S(=O)CH2CF3, CH2CH2S(=O)CH2CH2CF3, CH2CH2S(=O)2CH2CH2CF3, СН(СН3)CH2SCF3, СН(СН3)SCH2CH2CF3 и CH2CH2SCH2CH2CF3.
19. Молекула по п. 1, где R8 выбирают из СН(СН3)CH2SCH2(2,2-дифторциклопропил), CH2CH2SCH2(2,2-дифторциклопропил), CH2CH2S(=O)СН2(2,2-дифторциклопропил), CH2CH2S(=O)2СН2(2,2-дифторциклопропил) и СН2СН(CF3)SCH2(2,2-дифторциклопропил).
20. Молекула по п. 1, где R8 выбирают из CH2CH2SCH2CH=CCl2, CH2SCH2CH=CCl2, СН(СН3)SCH2CH=CCl2 и СН(СН3)SCH=CHF, CH2CH2SCH2CH2CF3, CH2CH2S(=O)CH2CH2CF3 и CH2CH2S(=O)2CH2CH2CF3.
21. Молекула по п. 1, где R8 выбирают из (замещенный или незамещенный C1-С6алкил)-S(О)n-(замещенный или незамещенный C1-С6алкил), где упомянутые заместители на упомянутых замещенных алкилах выбирают из F, Cl, Br, I, CN, NO2, N(R9)S(О)nR9, OR9, S(O)nOR9, R9S(O)nR9, S(O)nR9, С6-С20арила или C1-С20гетероциклила (каждый из которых, возможных к замещению, может быть необязательно замещен R9).
22. Молекула по п. 1, где X представляет собой CRn1, где Rn1 представляет собой Н или галоген.
23. Молекула по п. 1, где X представляет собой CRn1, где Rn1 представляет собой Н или F.
24. Молекула по п. 1, где X1 или Х2, или оба, представляют собой О.
25. Молекула по п. 1, где упомянутая молекула характеризуется одной из следующих структур
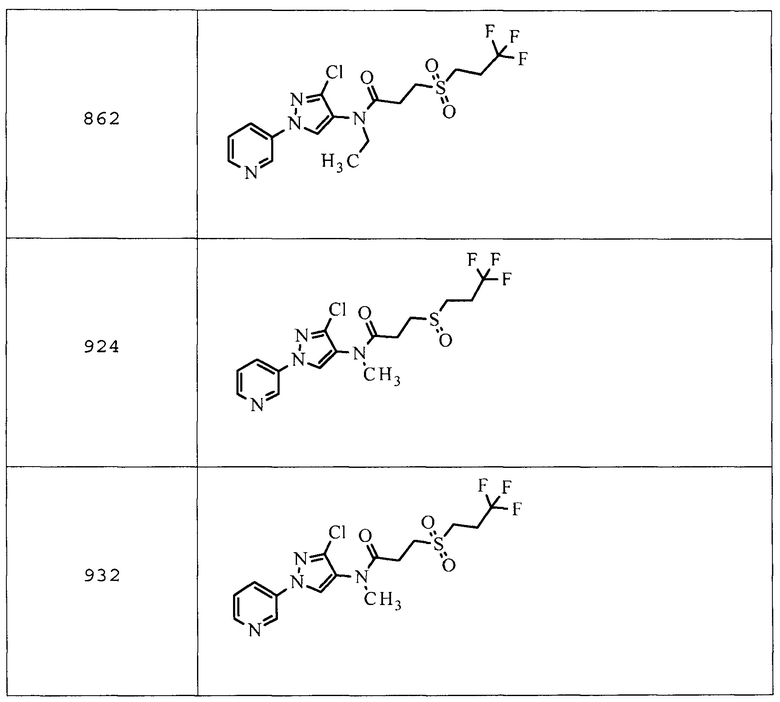
26. Пестицидная композиция, содержащая молекулу по любому из пп. 1-25 и носитель или разбавитель.
27. Композиция по п. 26, дополнительно содержащая:
(a) одно или несколько соединений, обладающих акарицидными, альгицидными, авицидными, бактерицидными, фунгицидными, гербицидными, инсектицидными, моллюскоцидными, нематоцидными, родентицидными или вируцидными свойствами; или
(b) одно или несколько соединений, которые являются антифидингами, средствами отпугивания птиц, химическими стерилизаторами, гербицидными антидотами, аттрактантами для насекомых, средствами отпугивания насекомых, средствами отпугивания млекопитающих, средствами нарушения спаривания, активаторами растений, регуляторами роста растений или синергистами; или
(c) и (а) и (b).
28. Композиция по п. 26, дополнительно содержащая одно или несколько соединений, выбранных из следующей группы: бромид (3-этоксипропил)ртути, 1,2-дихлорпропан, 1,3-дихлорпропен, 1-метилциклопропен, 1-нафтол, 2-(октилтио)этанол, 2,3,5-три-йодбензойная кислота, 2,3,6-ТВА, 2,3,6-ТВА-диметиламмоний, 2,3,6-ТВА-литий, 2,3,6-ТВА-калий, 2,3,6-ТВА-натрий, 2,4,5-Т, 2,4,5-Т-2-бутоксипропил, 2,4,5-Т-2-этилгексил, 2,4,5-Т-3-бутоксипропил, 2,4,5-ТВ, 2,4,5-Т-бутометил, 2,4,5-Т-бутотил, 2,4,5-Т-бутил, 2,4,5-Т-изобутил, 2,4,5-Т-изооктил, 2,4,5-Т-изопропил, 2,4,5-Т-метил, 2,4,5-Т-пентил, 2,4,5-Т-натрий, 2,4,5-Т-триэтиламмоний, 2,4,5-Т-троламин, 2,4-D, 2,4-D-2-бутоксипропил, 2,4-D-2-этилгексил, 2,4-D-3-бутоксипропил, 2,4-D-аммоний, 2,4-DB, 2,4-DB-бутил, 2,4-DB-диметиламмоний, 2,4-DB-изооктил, 2,4-DB-калий, 2,4-DB-натрий, 2,4-D-бутотил, 2,4-D-бутил, 2,4-D-диэтиламмоний, 2,4-D-диметиламмоний, 2,4-D-диоламин, 2,4-D-додециламмоний, 2,4-DEB, 2,4-DEP, 2,4-D-этил, 2,4-D-гептиламмоний, 2,4-D-изобутил, 2,4-D-изооктил, 2,4-D-изопропил, 2,4-D-изопропиламмоний, 2,4-D-литий, 2,4-D-мептил, 2,4-D-метил, 2,4-D-октил, 2,4-D-пентил, 2,4-D-калий, 2,4-D-пропил, 2,4-D-натрий, 2,4-D-тефурил, 2,4-D-тетрадециламмоний, 2,4-D-триэтиламмоний, 2,4-D-трис(2-гидроксипропил)аммоний, 2,4-D-троламин, 2iP, 2-метоксиэтилртути хлорид, 2-фенилфенол, 3,4-DA, 3,4-DB, 3,4-DP, 4-аминопиридин, 4-CPA, 4-CPA-калий, 4-CPA-натрий, 4-СРВ, 4-СРР, 4-гидроксифенетиловый спирт, сульфат 8-гидроксихинолина, 8-фенилртутьоксихинолин, абамектин, абсцизовая кислота, АСС, ацефат, ацехиноцил, ацетамиприд, ацетион, ацетохлор, ацетофос, ацетопрол, ацибензолар, ацибензолар-S-метил, ацифлуорфен, ацифлуорфен-метил, ацифлуорфен-натрий, аклонифен, акреп, акринатрин, акролеин, акрилонитрил, аципетакс, аципетакс-медь, аципетакс-цинк, алахлор, аланикарб, албендазол, альдикарб, алдиморф, алдоксикарб, алдрин, аллетрин, аллицин, аллидохлор, аллозамидин, аллоксидим, аллоксидим-натрий, аллиловый спирт, алликсикарб, алорак, альфа-циперметрин, алъфа-эндосульфан, аметоктрадин, аметридион, аметрин, амибузин, амикарбазон, амикартиазол, амидитион, амидофлумет, амидосульфурон, аминокарб, аминоциклопирахлор, аминоциклопирахлор-метил, аминоциклопирахлор-калий, аминопиралид, аминопиралид-калий, аминопиралид-трис(2-гидроксипропил)аммоний, амипрофос-метил, амипрофос, амисулбром, амитон, амитон оксалат, амитраз, амитрол, сульфамат аммония, α-нафталинацетат аммония, амобам, ампропилфос, анабазин, анцимидол, анилазин, анилофос, анизурон, антрахинон, анту, афолат, арамит, оксид мышьяка, азомат, аспирин, асулам, асулам-калий, асулам-натрий, атидатион, атратон, атразин, ауреофунгин, авиглицин, гидрохлорид авиглицина, азаконазол, азадирахтин, азафенидин, азаметифос, азимсульфурон, азинфос-этил, азинфос-метил, азипротрин, азитирам, азобензол, азоциклотин, азотоат, азоксистробин, bachmedesh, барбан, гексафторсиликат бария, полисульфид бария, бартрин, ВСРС, бефлубутамид, беналаксил, беналаксил-М, беназолин, беназолин-диметиламмоний, беназолин-этил, беназолин-калий, бенкарбазон, бенклотиаз, бендиокарб, бенфлуралин, бенфуракарб, бенфурезат, беноданил, беномил, беноксакор, беноксафос, бенквинокс, бенсульфурон, бенсульфурон-метил, бенсулид, бенсултап, бенталурон, бентазон, бентазон-натрий, бентиаваликарб, бентиаваликарб-изопропил, бентиазол, бентранил, бензадокс, бензадокс-аммоний, бензалкония хлорид, бензамакрил, бензамакрил-изобутил, бензаморф, бензфендизон, бензипрам, бензобициклон, бензофенап, бензофлуор, бензогидроксамовая кислота, бензоксимат, бензоилпроп, бензоилпроп-этил, бензтиазурон, бензилбензоат, бензиладенин, берберин, хлорид берберина, бета-цифлутрин, бета-циперметрин, бетоксазин, бициклопирон, бифеназат, бифенокс, бифентрин, bifujunzhi, биланафос, биланафос-натрий, бинапакрил, bingqingxiao, биоаллетрин, биоэтанометрин, биоперметрин, биоресметрин, бифенил, бисазир, бисмертиазол, биспирибак, биспирибак-натрий, бистрифлурон, битертанол, битионол, биксафен, бластицидин-S, боракс, бордосская смесь, борная кислота, боскалид, брассинолид, брассинолид-этил, бревикомин, бродифакум, брофенвалерат, брофлутринат, бромацил, бромацил-литий, бромацил-натрий, бромадиолон, брометалин, брометрин, бромфенвинфос, бромоацетамид, бромобонил, бромобутид, бромоциклен, бром-DDT, бромофеноксим, бромофос, бромофос-этил, бромопропилат, бромоталонил, бромоксинил, бромоксинил бутират, бромоксинил гептаноат, бромоксинил октаноат, бромоксинил-калий, бромпиразон, бромуконазол, бронопол, букарполат, буфенкарб, буминафос, бупиримат, бупрофезин, бургундская смесь, бусульфан, бутакарб, бутахлор, бутафенацил, бутамифос, бутатиофос, бутенахлор, бутетрин, бутидазол, бутиобат, бутиурон, бутокарбоксим, бутонат, бутопироноксил, бутоксикарбоксим, бутралин, бутроксидим, бутурон, бутиламин, бутилат, какодиловая кислота, кадусафос, кафенстрол, арсенат кальция, хлорат кальция, цианамид кальция, полисульфид кальция, калвинфос, камбендихлор, камфехлор, камфора, каптафол, каптан, карбаморф, карбанолат, карбарил, карбасулам, карбендазим, карбендазим бензолсульфонат, карбендазим сульфит, карбетамид, карбофуран, углерода дисульфид, углерода тетрахлорид, карбофенотион, карбосульфан, карбоксазол, карбоксид, карбоксин, карфентразон, карфентразон-этил, карпропамид, картап, картапа гидрохлорид, карвакрол, карвон, CDEA, целлоцидин, СЕРС, цералур, смесь Cheshunt, хинометионат, хитозан, хлобентиазон, хлометоксифен, хлоралоза, хлорамбен, хлорамбен-аммоний, хлорамбен-диоламин, хлорамбен-метил, хлорамбен-метиламмоний, хлорамбен-натрий, хлорамин фосфор, хлорамфеникол, хлораниформетан, хлоранил, хлоранокрил, хлорантранилипрол, хлоразифоп, хлоразифоп-пропаргил, хлоразин, хлорбензид, хлорбензурон, хлорбициклен, хлорбромурон, хлорбуфам, хлордан, хлордекон, хлордимеформ, хлордимеформа гидрохлорид, хлоремпентрин, хлорэтоксифос, хлоретурон, хлорфенак, хлорфенак-аммоний, хлорфенак-натрий, хлорфенапир, хлорфеназол, хлорфенетол, хлорфенпроп, хлорфенсон, хлорфенсульфид, хлорфенвинфос, хлорфлуазурон, хлорфлуразол, хлорфлурен, хлорфлурен-метил, хлорфлуренол, хлорфлуренол-метил, хлоридазон, хлоримурон, хлоримурон-этил, хлормефос, хлормекват, хлормекват хлорид, хлорнидин, хлорнитрофен, хлорбензилат, хлородинитронафталины, хлороформ, хлоромебуформ, хлорометиурон, хлоронеб, хлорофацинон, хлорофацинон-натрий, хлоропикрин, хлоропон, хлоропропилат, хлороталонил, хлоротолурон, хлороксурон, хлороксинил, хлорфониум, хлорфониум хлорид, хлорфоксим, хлорпарзофос, хлорпрокарб, хлорпрофам, хлорпирифос, хлорпирифос-метил, хлорквинокс, хлорсульфурон, хлортал, хлортал-диметил, хлортал-монометил, хлортиамид, хлортиофос, хлозолинат, холина хлорид, хромафенозид, цинерин I, цинерин II, цинерины, цинидон-этил, цинметилин, циносульфурон, циобутид, цисанилид, цисметрин, клетодим, климбазол, клиодинат, клодинафоп, клодинафоп-пропаргил, клоетокарб, клофенцет, клофенцет-калий, клофентезин, клофибриновая кислота, клофоп, клофоп-изобутил, кломазон, кломепроп, клопроп, клопроксидим, клопиралид, клопиралид-метил, клопиралид-оламин, клопиралид-калий, клопиралид-трис(2-гидроксипропил)аммоний, клоквинтоцет, клоквинтоцет-мексил, клорансулам, клорансулам-метил, клосентел, клотианидин, клотримазол, клоксифонак, клоксифонак-натрий, СМА, кодлелур, колофонат, ацетат меди, ацетоарсенит меди, арсенат меди, карбонат меди, медь углекислая основная, гидроксид меди, нафтенат меди, олеат меди, оксихлорид меди, силикат меди, сульфат меди, хромат меди и цинка, кумахлор, кумафурил, кумафос, куматетралил, кумитоат, кумоксистробин, СРМС, CPMF, СРРС, кредазин, крезол, кримидин, кротамитон, кротоксифос, круфомат, криолит, cue-lure, куфранеб, кумилурон, купробам, оксид меди, куркуменол, цианамид, цианатрин, цианазин, цианофенфос, цианофос, циантоат, циантранилипрол, циазофамид, цибутрин, циклафурамид, цикланилид, циклетрин, циклоат, циклогексимид, циклопрат, циклопротрин, циклосульфамурон, циклоксидим, циклурон, циенопирафен, цифлуфенамид, цифлуметофен, цифлутрин, цигалофоп, цигалофоп-бутил, цигалотрин, цигексатин, цимиазол, цимиазола гидрохлорид, цимоксанил, циометринил, ципендазол, циперметрин, циперкват, циперкват хлорид, цифенотрин, ципразин, ципразол, ципроконазол, ципродинил, ципрофурам, ципромид, ципросульфамид, циромазин, цитиоат, даимурон, далапон, далапон-кальций, далапон-магний, далапон-натрий, даминозид, dayoutong, дазомет, дазомет-натрий, DBCP, d-камфора, DCIP, DCPTA, DDT, дебакарб, декафентин, декарбофуран, дегидроуксусная кислота, делахлор, дельтаметрин, демефион, демефион-О, демефион-S, деметон, деметон-метил, деметон-О, деметон-О-метил, деметон-S, деметон-S-метил, деметон-S-метилсульфон, десмедифам, десметрин, d-fanshiluquebingjuzhi, диафентиурон, диалифос, диаллат, диамидафос, диатомовая земля, диазинон, дибутилфталат, дибутилсукцинат, дикамба, дикамба-дигликольамин, дикамба-диметиламмоний, дикамба-диоламин, дикамба-изопропиламмоний, дикамба-метил, дикамба-оламин, дикамба-калий, дикамба-натрий, дикамба-троламин, дикаптон, дихлобенил, дихлофентион, дихлофлуанид, дихлон, дихлоральмочевина, дихлорбензурон, дихлорфлуренол, дихлорфлуренол-метил, дихлормат, дихлормид, дихлорофен, дихлорпроп, дихлорпроп-2-этилгексил, дихлорпроп-бутотил, дихлорпроп-диметиламмоний, дихлорпроп-этиламмоний, дихлорпроп-изооктил, дихлорпроп-метил, дихлорпроп-Р, дихлорпроп-P-2-этилгексил, дихлорпроп-Р-диметиламмоний, дихлорпроп-калий, дихлорпроп-натрий, дихлорвос, дихлозолин, диклобутразол, диклоцимет, диклофоп, диклофоп-метил, дикломезин, дикломезин-натрий, диклоран, диклосулам, дикофол, дикумарол, дикрезил, дикротофос, дицикланил, дициклонон, диелдрин, диенохлор, диетамкват, диетамкват дихлорид, диетатил, диетатил-этил, диэтофенкарб, диетолат, диэтилпирокарбонат, диэтилтолуамид, дифенакум, дифеноконазол, дифенопентен, дифенопентен-этил, дифеноксурон, дифензокват, дифензокват метилсульфат, дифетиалон, дифловидазин, дифлубензурон, дифлуфеникан, дифлуфензопир, дифлуфензопир-натрий, дифлуметорим, дикегулак, дикегулак-натрий, дилор, диматиф, димефлутрин, димефокс, димефурон, димепиперат, диметахлон, диметан, диметакарб, диметахлор, диметаметрин, диметенамид, диметенамид-Р, диметипин, диметиримол, диметоат, диметоморф, диметрин, диметилкарбат, диметилфталат, диметилвинфос, диметилан, димексано, димидазон, димоксистробин, динекс, динекс-диклексин, dingjunezuo, диниконазол, диниконазол-М, динитрамин, динобутон, динокап, динокап-4, динокап-6, диноктон, динофенат, динопентон, динопроп, диносам, диносеб, диносеб ацетат, диносеб-аммоний, диносеб-диоламин, диносеб-натрий, диносеб-троламин, диносульфон, динотефуран, динотерб, динотерб ацетат, динотербон, диофенолан, диоксабензофос, диоксакарб, диоксатион, дифацинон, дифацинон-натрий, дифенамид, дифенил сульфон, дифениламин, дипропалин, дипропетрин, дипиритион, дикват, дикват дибромид, диспарлур, дисул, дисулфирам, дисулфотон, дисул-натрий, диталимфос, дитианон, дитикрофос, дитиоэфир, дитиопир, диурон, d-лимонен, DMPA, DNOC, DNOC-аммоний, DNOC-калий, DNOC-натрий, додеморф, додеморф ацетат, додеморф бензоат, додицин, додицин гидрохлорид, додицин-натрий, додин, дофенапин, доминикалур, дорамектин, дразоксолон, DSMA, дуфулин, ЕВЕР, ЕВР, экдистерон, эдифенфос, эглиназин, эглиназин-этил, эмамектин, эмамектин бензоат, ЕМРС, эмпентрин, эндосульфан, эндотал, эндотал-диаммоний, эндотал-дикалий, эндотал-динатрий, эндотион, эндрин, энестробурин, EPN, эпохолеон, эпофенонан, эпоксиконазол, эприномектин, эпроназ, ЕРТС, эрбон, эргокальциферол, erlujixiancaoan, эсдепаллетрин, эсфенвалерат, эспрокарб, этацелазил, этаконазол, этафос, этем, этабоксам, этахлор, эталфлуралин, этаметсульфурон, этаметсульфурон-метил, этапрохлор, этефон, этидимурон, этиофенкарб, этиолат, этион, этиозин, этипрол, этиримол, этоат-метил, этофумезат, этогексадиол, этопрофос, этоксифен, этоксифен-этил, этоксиквин, этоксисульфурон, этихлозат, этилформиат, этил-а-нафталинацетат, этил-DDD, этилен, этилен дибромид, этилен дихлорид, этиленоксид, этилицин, этилртути 2,3-дигидроксипропил меркаптид, этилмеркурацетат, этилмеркурбромид, этилмеркурхлорид, этилмеркурфосфат, этинофен, этнипромид, этобензанид, этофенпрокс, этоксазол, этридиазол, этримфос, эвгенол, EXD, фамоксадон, фамфур, фенамидон, фенаминосульф, фенамифос, фенапанил, фенаримол, фенасулам, феназафлор, феназаквин, фенбуконазол, фенбутатин оксид, фенхлоразол, фенхлоразол-этил, фенхлорфос, фенклорим, фенетакарб, фенфлутрин, фенфурам, фенгексамид, фенитропан, фенитротион, fenjuntong, фенобукарб, фенопроп, фенопроп-3-бутоксипропил, фенопроп-бутометил, фенопроп-бутотил, фенопроп-бутил, фенопроп-изооктил, фенопроп-метил, фенопроп-калий, фенотиокарб, феноксакрим, феноксанил, феноксапроп, феноксапроп-этил, феноксапроп-Р, феноксапроп-Р-этил, феноксасульфон, феноксикарб, фенпиклонил, фенпиритрин, фенпропатрин, фенпропидин, фенпропиморф, фенпиразамин, фенпироксимат, фенридазон, фенридазон-калий, фенридазон-пропил, фензон, фенсульфотион, фентеракол, фентиапроп, фентиапроп-этил, фентион, фентион-этил, фентин, фентин ацетат, фентин хлорид, фентин гидроксид, фентразамид, фентрифанил, фенурон, фенурон ТСА, фенвалерат, фербам, феримзон, сульфат железа, фипронил, флампроп, флампроп-изопропил, флампроп-М, флампроп-метил, флампроп-М-изопропил, флампроп-М-метил, флазасульфурон, флокумафен, флометоквин, флоникамид, флорасулам, флуакрипирим, флуазифоп, флуазифоп-бутил, флуазифоп-метил, флуазифоп-Р, флуазифоп-Р-бутил, флуазинам, флуазолат, флуазурон, флубендиамид, флубензимин, флукарбазон, флукарбазон-натрий, флуцетосульфурон, флухлоралин, флукофурон, флуциклоксурон, флуцитринат, флудиоксонил, флуенетил, флуенсульфон, флуфенацет, флуфенерим, флуфеникан, флуфеноксурон, флуфенпрокс, флуфенпир, флуфенпир-этил, флуфипрол, флуметрин, флуметовер, флуметралин, флуметсулам, флумезин, флумиклорак, флумиклорак-пентил, флумиоксазин, флумипропин, флуморф, флуометурон, флуопиколид, флуопирам, флуорбензид, флуоридамид, фторацетамид, флуородифен, флуорогликофен, флуорогликофен-этил, фторимид, флуоромидин, флуоронитрофен, флуотиурон, флуотримазол, флуоксастробин, флупоксам, флупропацил, флупропадин, флупропанат, флупропанат-натрий, флупирадифурон, флупирсульфурон, флупирсульфурон-метил, флупирсульфурон-метил-натрий, флуквинконазол, флуразол, флуренол, флуренол-бутил, флуренол-метил, флуридон, флурохлоридон, флуроксипир, флуроксипир-бутометил, флуроксипир-мептил, флурпримидол, флурсуламид, флуртамон, флусилазол, флусульфамид, флутиацет, флутиацет-метил, флутианил, флутоланил, флутриафол, флувалинат, флуксапироксад, флуксофеним, фолпет, фомесафен, фомесафен-натрий, фонофос, форамсульфурон, форхлорфенурон, формальдегид, форметанат, форметаната гидрохлорид, формотион, формпаранат, формпараната гидрохлорид, фосамин, фосамин-аммоний, фосетил, фосетил-алюминий, фосметилан, фоспират, фостиазат, фостиетан, фронталин, фуберидазол, fucaojing, fucaomi, funaihecaoling, фуфентиомочевина, фуралан, фуралаксил, фураметрин, фураметпир, фуратиокарб, фуркарбанил, фурконазол, фурконазол-цис, фуретрин, фурфурал, фурилазол, фурмециклокс, фурофанат, фурилоксифен, гамма-цигалотрин, гамма-HCH, генит, гиббереллиновая кислота, гиббереллины, глифтор, глуфосинат, глуфосинат-аммоний, глуфосинат-Р, глуфосинат-Р-аммоний, глуфосинат-Р-натрий, глиодин, глиоксим, глифосат, глифосат-диаммоний, глифосат-диметиламмоний, глифосат-изопропиламмоний, глифосат-моноаммоний, глифосат-калий, глифосат-сесквинатрий, глифосат-тримезиум, глифосин, госсиплур, грандлур, гризеофульвин, квазатин, квазатин ацетаты, галакринат, галфенпрокс, галофенозид, галосафен, галосульфурон, галосульфурон-метил, галоксидин, галоксифоп, галоксифоп-этотил, галоксифоп-метил, галоксифоп-Р, галоксифоп-Р-этотил, галоксифоп-Р-метил, галоксифоп-натрий, НСН, хемел, хемпа, HEOD, гептахлор, гептенофос, гептопаргил, гетерофос, гексахлорацетон, гексахлорбензол, гексахлорбутадиен, гексахлорфен, гексаконазол, гексафлумурон, гексафлурат, гексалур, гексамид, гексазинон, гексилтиофос, гекситиазокс, HHDN, голосулф, huancaiwo, huangcaoling, huanjunzuo, гидраметилнон, гидраргафен, гашеная известь, цианистый водород, гидропрен, гимексазол, хиквинкарб, IAA, IBA, икаридин, имазалил, имазалил нитрат, имазалил сульфат, имазаметабенз, имазаметабенз-метил, имазамокс, имазамокс-аммоний, имазапик, имазапик-аммоний, имазапир, имазапир-изопропиламмоний, имазаквин, имазаквин-аммоний, имазаквин-метил, имазаквин-натрий, имазетапир, имазаквин-аммоний, имазосульфурон, имибенконазол, имициафос, имидаклоприд, имидаклотиз, иминоктадин, иминоктадин триацетат, иминоктадин триалбезилат, имипротрин, инабенфид, инданофан, индазифлам, индоксакарб, инезин, йодобонил, йодокарб, йодометан, йодосульфурон, йодосульфурон-метил, йодосульфурон-метил-натрий, иофенсульфурон, иофенсульфурон-натрий, иоксинил, иоксинил октаноат, иоксинил-литий, иоксинил-натрий, ипазин, ипконазол, ипфенкарбазон, ипробенфос, ипродион, ипроваликарб, ипримидам, ипсдиенол, ипсенол, IPSP, изамидофос, исазофос, изобензан, изокарбамид, изокарбофос, изоцил, изодрин, изофенфос, изофенфос-метил, изолан, изометиозин, изонорунон, изополинат, изопрокарб, изопропалин, изопротиолан, изопротурон, изопиразам, изопиримол, изотиоат, изотианил, изоурон, изовалидион, изоксабен, изоксахлортол, изоксадифен, изоксадифен-этил, изоксафлутол, изоксапирифоп, изоксатион, ивермектин, изопамфос, японилур, жапотрины, жасмолин I, жасмолин II, жасмоновая кислота, jiahuangchongzong, jiajizengxiaolin, jiaxianjunzhi, jiecaowan, jiecaoxi, йодофенфос, ювенильный гормон I, ювенильный гормон II, ювенильный гормон III, кадетрин, карбутилат, каретазан, каретазан-калий, касугамицин, касугамицина гидрохлорид, kejunlin, келеван, кетоспирадокс, кетоспирадокс-калий, кинетин, кинопрен, крезоксим-метил, kuicaoxi, лактофен, лямбда-цигалотрин, латилур, арсенат свинца, ленацил, лепимектин, лепрофос, линдан, линеатин, линурон, лиримфос, литлур, луплур, луфенурон, ludingjunzhi, luxiancaolin, литидатион, МАА, малатион, гидразид малеиновой кислоты, малонобен, мальтодекстрин, МАМА, манкоппер, манкозеб, мандипропамид, манеб, матрин, мазидокс, МСРА, MCPA-2-этилгексил, МСРА-бутотил, МСРА-бутил, МСРА-диметиламмоний, МСРА-диоламин, МСРА-этил, МСРА-изобутил, МСРА-изооктил, МСРА-изопропил, МСРА-метил, МСРА-оламин, МСРА-калий, МСРА-натрий, МСРА-тиоэтил, МСРА-троламин, МСРВ, МСРВ-этил, МСРВ-метил, МСРВ-натрий, мебенил, мекарбам, мекарбинзид, мекарфон, мекопроп, мекопроп-2-этилгексил, мекопроп-диметиламмоний, мекопроп-диоламин, мекопроп-этадил, мекопроп-изооктил, мекопроп-метил, мекопроп-Р, мекопроп-Р-2-этилгексил, мекопроп-Р-диметиламмоний, мекопроп-Р-изобутил, мекопроп-калий, мекопроп-Р-калий, мекопроп-натрий, мекопроп-троламин, медимеформ, мединотерб, мединотерб ацетат, медлур, мефенацет, мефенпир, мефенпир-диэтил, мефлуидид, мефлуидид-диоламин, мефлуидид-калий, тетрадекадиеновая кислота, меназон, мепанипирим, меперфлутрин, мефенат, мефосфолан, мепикват, мепикват хлорид, мепикват пентаборат, мепронил, мептилдинокам, хлорид ртути, оксид ртути, хлористая ртуть, мерфос, мезопразин, мезосульфурон, мезосульфурон-метил, мезотрион, месульфен, месульфенфос, метафлумизон, металаксил, металаксил-М, метальдегид, метам, метам-аммоний, метамифоп, метамитрон, метам-калий, метам-натрий, метазахлор, метазосульфурон, метазоксолон, метконазол, метепа, метфлуразон, метабензтиазурон, метакрифос, металпропалин, метамидофос, метасульфокарб, метазол, метфуроксам, метидатион, метиобенкарб, метиокарб, метиопирисульфурон, метиотепа, метиозолин, метиурон, метокротофос, метометон, метомил, метопрен, метопротрин, метоквин-бутил, метотрин, метоксихлор, метоксифенозид, метоксифенон, метил афолат, метилбромид, метилэвгенол, метилйодид, метил изотиоцианат, метилацетофос, метилхлороформ, метилдимрон, метилен хлористый, метилртути бензоат, метилртути дициандиамид, метилртути пентахлорфеноксид, метилнеодеканамид, метирам, метобензурон, метобромурон, метофлутрин, метолахлор, метолкарб, метоминостробин, метосулам, метоксадиазон, метоксурон, метрафенон, метрибузин, метсульфовакс, метсульфурон, метсульфурон-метил, мевинфос, мексакарбат, mieshuan, милбемектин, милбемицин оксим, милнеб, мипафокс, мирекс, MNAF, могучун, молинат, молосултап, моналид, монисоурон, монохлоруксусная кислота, монокротофос, монолинурон, моносульфурон, моносульфурон-сложный эфир, монурон, монурон ТСА, морфамкват, морфамкват дихлорид, мороксидин, мороксидина гидрохлорид, морфотион, морзид, моксидектин, MSMA, мускалур, миклобутанил, миклозолин, N-(этилртуть)-пара-толуолсульфонанилид, набам, нафталофос, налед, нафталин, нафталинацетамид, ангидрид нафтойной кислоты, нафтоксиуксусные кислоты, напроанилид, напропамид, напталам, напталам-натрий, натамицин, небурон, никлозамид, никлозамид-оламин, никосульфурон, никотин, нифлуридид, нипираклофен, нитенпирам, нитиазин, нитралин, нитрапирин, нитрилакарб, нитрофен, нитрофлуорфен, нитростирин, нитротал-изопропил, норбормид, норфлуразон, норникотин, норурон, новалурон, новифлумурон, нуаримол, ОСН, октахлордипропиловый эфир, октилинон, офурас, ометоат, орбенкарб, орфралур, орто-дихлорбензол, ортосульфамурон, орикталур, орисастробин, оризалин, остол, острамон, оксабетринил, оксадиаргил, оксадиазон, оксадиксил, оксамат, оксамил, оксапиразон, оксапиразон-димоламин, оксапиразон-натрий, оксасульфурон, оксазикломефон, оксиновая медь, оксолиновая кислота, окспоконазол, окспоконазол фумарат, оксикарбоксин, оксидеметон-метил, оксидепрофос, оксидисульфотон, оксифлуорфен, оксиматрин, окситетрациклин, гидрохлорид окситетрациклина, паклобутразол, paichongding, пара-дихлорбензол, парафлурон, паракват, паракват дихлорид, паракват диметилсульфат, паратион, паратион-метил, паринол, пебулат, пефуразоат, пеларгоновая кислота, пенконазол, пенцикурон, пендиметалин, пенфлуфен, пенфлурон, пенокссулам, пентахлорфенол, пентанохлор, пентиопирад, пентметрин, пентоксазон, перфлуидон, перметрин, петоксамид, фенамакрил, феназин оксид, фенизофам, фенкаптон, фенмедифам, фенмедифам-этил, фенобензурон, фенотрин, фенпроксид, фентоат, фенилмеркуромочевина, фенилмеркурацетат, фенилмеркурхлорид, фенилмеркурпроизводное пирокатехола, фенилмеркурнитрат, фенилмеркурсалицилат, форат, фосацетим, фосалон, фосдифен, фосфолан, фосфолан-метил, фосглицин, фосмет, фоснихлор, фосфамидон, фосфин, фосфокарб, фосфор, фостин, фоксим, фоксим-метил, фталид, пиклорам, пиклорам-2-этилгексил, пиклорам-изооктил, пиклорам-метил, пиклорам-оламин, пиклорам-калий, пиклорам-триэтиламмоний, пиклорам-трис(2-гидроксипропил)аммоний, пиколинафен, пикоксистробин, пиндон, пиндон-натрий, пиноксаден, пипералин, пиперонил бутоксид, пиперонил циклонен, пиперофос, пипроктанил, пипроктанил бромид, пипротал, пириметафос, пиримикарб, пиримиоксифос, пиримифос-этил, пиримифос-метил, плифенат, поликарбамат, полиоксины, полиоксорим, полиоксорим-цинк, политиалан, арсенат калия, азид калия, цианат калия, гиббереллат калия, нафтенат калия, полисульфид калия, тиоцианат калия, α-нафталинацетат калия, рр'-DDT, праллетрин, прекоцен I, прекоцен II, прекоцен III, претилахлор, примидофос, примисульфурон, примисульфурон-метил, пробеназол, прохлораз, прохлораз-марганец, проклонол, проциазин, процимидон, продиамин, профенофос, профлуазол, профлуралин, профлутрин, профоксидим, проглиназин, проглиназин-этил, прогексадион, прогексадион-кальция, прогидрожасмон, промацил, промекарб, прометон, прометрин, промурит, пропахлор, пропамидин, пропамидин дигидрохлорид, пропамокарб, пропамокарба гидрохлорид, пропанил, пропафос, пропаквизафоп, пропаргит, пропартрин, пропазин, пропетамфос, профам, пропиконазол, пропинеб, пропизохлор, пропоксур, пропоксикарбазон, пропоксикарбазон-натрий, пропилизом, пропирисульфурон, пропизамид, проквиназид, просулер, просульфалин, просульфокарб, просульфурон, протидатион, протиокарб, протиокарб гидрохлорид, протиоконазол, протиофос, протоат, протрифенбут, проксан, проксан-натрий, принахлор, пиданон, пиметрозин, пиракарболид, пираклофос, пираклонил, пираклостробин, пирафлуфен, пирафлуфен-этил, пирафлупрол, пирамат, пираметостробин, пираоксистробин, пирасульфотол, пиразолинат, пиразофос, пиразосульфурон, пиразосульфурон-этил, пиразотион, пиразоксифен, пиресметрин, пиретрин I, пиретрин II, пиретрины, пирибамбенз-изопропил, пирибамбенз-пропил, пирибенкарб, пирибензоксим, пирибутикарб, пириклор, пиридабен, пиридафол, пиридалил, пиридафентион, пиридат, пиридинитрил, пирифенокс, пирифлуквиназон, пирифталид, пириметанил, пиримидифен, пириминобак, пириминобак-метил, пиримисульфан, пиримитат, пиринурон, пириофенон, пирипрол, пирипропанол, пирипроксифен, пиритиобак, пириминобак-натрий, пиролан, пироквилон, пироксасульфон, пирокссулам, пироксихлор, пироксифур, квассия, квинацетол, квинацетол сульфат, квиналфос, квиналфос-метил, квиназамид, квинклорак, квинконазол, квинмерак, квинокламин, квинонамид, квинотион, квиноксифен, квинтиофос, квинтозен, квизалофоп, квизалофоп-этил, квизалофоп-Р, квизалофоп-Р-этил, квизалофоп-Р-тефурил, quwenzhi, quyingding, рабензазол, рафоксанид, ребемид, ресметрин, родетанил, родожапонин-III, рибавирин, римсульфурон, ротенон, риания, сафлуфенацил, saijunmao, saisentong, салициланилид, сангвинарин, сантонин, шрадан, сциллирозид, себутилазин, секбуметон, седаксан, селамектин, семиамитраз, семиамитраз хлорид, сезамекс, сезамолин, сетоксидим, shuangjiaancaolin, сидурон, сиглур, силафлуофен, силатран, силикагель, силтиофам, симазин, симеконазол, симетон, симетрин, синтофен, SMA, С-метолахлор, арсенит натрия, азид натрия, хлорат натрия, фторид натрия, фторацетат натрия, гексафторсиликат натрия, нафтенат натрия, ортофенилфеноксид натрия, пентахлорфеноксид натрия, полисульфид натрия, тиоцианат натрия, α-нафталинацетат натрия, софамид, спинеторам, спиносад, спиродиклофен, спиромезифен, спиротетрамат, спироксамин, стрептомицин, стрептомицин сесквисульфат, стрихнин, сулкатол, сулкофурон, сулкофурон-натрий, сулкотрион, сульфаллат, сульфентразон, сульфирам, сульфлурамид, сульфометурон, сульфометурон-метил, сульфосульфурон, сульфотеп, сульфоксафлор, сульфоксид, сульфоксим, сера, серная кислота, сульфурил фторид, сулгликапин, сулпрофос, султропен, свел, тау-флювалинат, таврон, тазимкарб, ТСА, ТСА-аммоний, ТСА-кальция, ТСА-этадил, ТСА-магний, ТСА-натрий, TDE, тебуконазол, тебуфенозид, тебуфенпирад, тебуфлоквин, тебупиримфос, тебутам, тебутиурон, теклофталам, фекназен, текорам, тефлубензурон, тефлутрин, тефурилтрион, темботрион, темефос, тепа, ТЕРР, тепралоксидим, тераллетрин, тербацил, тербукарб, тербухлор, тербуфос, тербуметон, тербутилазин, тербутрин, тетсикласис, тетрахлорэтан, тетрахлорвинфос, тетраконазол, тетрадифон, тетрафлурон, тетраметрин, тетраметилфлутрин, тетрамин, тетранактин, тетрасул, таллия сульфат, тенилхлор, тета-циперметрин, тиабендазол, тиаклоприд, тиадифлуор, тиаметоксам, тиапронил, тиазафлурон, тиазопир, тикрофос, тициофен, тиадиазимин, тиадиазурон, тиенкарбазон, тиенкарбазон-метил, тифенсульфурон, тифенсульфурон-метил, тифлузамид, тиобенкарб, тиокарбоксим, тиохлорфенпим, тиоциклам, тиоциклама гидрохлорид, тиоциклам оксалат, тиодиазол-меди, тиодикарб, тиофанокс, тиофлуоксимат, тиохемпа, тиомерсал, тиометон, тионазин, тиофанат, тиофанат-метил, тиоквинокс, тиосемикарбазид, тиосултап, тиосултап-димаммоний, тиосултап-динатрий, тиосултап-мононатрий, тиотепа, тирам, thuringiensin, тиадинил, tiaojiean, тиокарбазил, тиоклорим, тиоксимид, тирпат, толклофос-метил, толфенпирад, толилфлуанид, толилмеркурацетат, топрамезон, тралкосидим, тралоцитрин, тралометрин, тралопирил, трансфлутрин, трансперметрин, третамин, триаконтанол, триадимефон, триадименол, триафамон, триаллат, триамифос, триапентенол, триаратен, триаримол, триасульфурон, триазамат, триазбутил, триазифлам, триазофос, триазоксид, трибенурон, трибенурон-метил, трибуфос, трибутилолова оксид, трикамба, трихламид, трихлорфон, трихлорметафос-3, трихлоронат, триклопир, триклопир-бутотил, триклопир-этил, триклопир-триэтиламмоний, трициклазол, тридеморф, тридифан, триэтазин, трифенморф, трифенофос, трифлоксистробин, трифлоксисульфурон, трифлоксисульфурон-натрий, трифлумизол, трифлумурон, трифлуралин, трифлусульфурон, трифлусульфурон-метил, трифоп, трифоп-метил, трифопсим, трифорин, тригидрокситриазин, тримедлур, триметакарб, триметурон, тринексапак, тринексапак-этил, трипрен, трипропиндан, трипролид, тритак, тритиконазол, тритосульфурон, трунк-кол, униконазол, униконазол-Р, урбацид, уредепа, валерат, валидамицин, валифеналат, валон, вамидотион, вангард, ванилипрол, вернолат, винклозолин, варфарин, варфарин-калий, варфарин-натрий, xiaochongliulin, xinjunan, xiwojunan, ХМС, ксилахлор, ксиленолы, ксилилкарб, yishijing, зариламид, зеатин, zengxiaoan, зета-циперметрин, цинка нафтенат, цинка фосфид, цинка тиазол, зинеб, зирам, золапрофос, зоксамид, zuomihuanglong, α-хлоргидрин, α-экдизон, α-мултистриатин и α-нафтилуксусная кислота.
29. Композиция по п. 26, содержащая приемлемый в сельском хозяйстве носитель.
30. Композиция по п. 26, где упомянутая молекула находится в форме приемлемой для пестицидов кислотно-аддитивной соли.
31. Композиция по п. 26, где упомянутая молекула находится в форме производного соли.
32. Композиция по п. 26, где упомянутая молекула находится в форме гидрата.
33. Композиция по п. 26, где упомянутая молекула представляет собой отделенный стереоизомер.
34. Композиция по п. 26, где упомянутая молекула находится в форме кристаллического полиморфа.
35. Композиция по п. 26, где упомянутая молекула содержит 2Н вместо 1Н.
36. Композиция по п. 26, где упомянутая молекула содержит 13С вместо 12С.
37. Композиция по п. 26, дополнительно содержащая биопестицид.
38. Композиция по п. 26, дополнительно содержащая одно или несколько из следующих соединений:
(a) 3-(4-хлор-2,6-диметилфенил)-4-гидрокси-8-окса-1-азаспиро[4,5]дец-3-ен-2-он;
(b) 3-(4'-хлор-2,4-диметил[1,1'-бифенил]-3-ил)-4-гидрокси-8-окса-1-азаспиро[4,5]дец-3-ен-2-он;
(c) 4-[[(6-хлор-3-пиридинил)метил]метиламино]-2(5Н)-фуранон;
(d) 4-[[(6-хлор-3-пиридинил)метил]циклопропиламино]-2(5Н)-фуранон;
(e) 3-хлор-N2-[(1S)-1-метил-2-(метилсульфонил)этил]-N1-[2-метил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]-1,2-бензолдикарбоксамид;
(f) 2-циано-N-этил-4-фтор-3-метоксибензолсульфонамид;
(g) 2-циано-N-этил-3-метоксибензолсульфонамид;
(h) 2-циано-3-дифторметокси-N-этил-4-фторбензолсульфонамид;
(i) 2-циано-3-фторметокси-N-этилбензолсульфонамид;
(j) 2-циано-6-фтор-3-метокси-N,N-диметилбензолсульфонамид;
(k) 2-циано-N-этил-6-фтор-3-метокси-N-метилбензолсульфонамид;
(l) 2-циано-3-дифторметокси-N,N-диметилбензолсульфонамид;
(m) 3-(дифторметил)-N-[2-(3,3-диметилбутил)фенил]-1-метил-1Н-пиразол-4-карбоксамид;
(n) N-этил-2,2-диметилпропионамид-2-(2,6-дихлор-α,α,α-трифтор-пара-толил)гидразон;
(о) N-этил-2,2-дихлор-1-метилциклопропанкарбоксамид-2-(2,6-дихлор-α,α,α-трифтор-пара-толил)гидразонникотин;
(р) O-{(Е-)-[2-(4-хлорфенил)-2-циано-1-(2-трифторметилфенил)винил]}-S-метилтиокарбонат;
(q) (Е)-N1-[(2-хлор-1,3-тиазол-5-илметил)]-N2-циано-N1-метилацетамидин;
(r) 1-(6-хлорпиридин-3-илметил)-7-метил-8-нитро-1,2,3,5,6,7-гексагидроимидазо[1,2-а]пиридин-5-ол;
(s) 4-[4-хлорфенил-(2-бутилидингидразоно)метил)]-фенилмезилат; и
(t) N-этил-2,2-дихлор-1-метилциклопропанкарбоксамид-2-(2,6-дихлор-α,α,α-трифтор-пара-толил)гидразон.
39. Композиция по п. 26, дополнительно содержащая соединение, характеризующееся одним или несколькими видами действия: ингибитор ацетилхолинэстеразы; модулятор натриевых каналов; ингибитор биосинтеза хинина; антагонист канала-переносчика ионов хлора, регулируемого глутаматом и GABA; агонист канала-переносчика ионов хлора, регулируемого глутаматом и GABA; агонист рецептора ацетилхолина; антагонист рецептора ацетилхолина; ингибитор MET I; ингибитор Mg-стимулируемой АТФазы; никотиновый ацетилхолиновый рецептор; мембранный разобщитель средней зоны кишечника; разобщитель окислительного фосфорилирования и рецептор рианодина (RyRs).
40. Композиция по п. 26, дополнительно содержащая семя.
41. Композиция по п. 26, дополнительно содержащая семя, которое было генетически модифицировано для экспрессии одной или нескольких определенных черт.
42. Композиция по п. 26, где упомянутая композиция заключена в капсулу или помещена на поверхность капсулы.
43. Композиция по п. 26, где упомянутая композиция заключена в капсулу или помещена на поверхность капсулы, причем диаметр упомянутой капсулы составляет приблизительно 100-900 нм или приблизительно 10-900 мкм.
44. Способ контроля вредителя, включающий внесение композиции по п. 26 на площадь в количестве, достаточном для контроля такого вредителя.
45. Способ по п. 44, где упомянутого вредителя выбирают из жуков, уховерток, тараканов, мух, тлей, щитовок, белокрылок, цикадок, муравьев, ос, термитов, мотыльков, бабочек, вшей, кузнечиковых, саранчевых, сверчков, блох, трипсов, щетинохвосток, клещей, иксодовых клещей, нематод и многоножек.
46. Способ по п. 44, где упомянутый вредитель принадлежит типу Nematoda и/или Arthropoda.
47. Способ по п. 44, где упомянутый вредитель принадлежит подтипу Chelicerata, Myriapoda и/или Hexapoda.
48. Способ по п. 44, где упомянутый вредитель принадлежит классу Arachnida, Symphyla и/или Insecta.
49. Способ по п. 44, где упомянутый вредитель принадлежит отряду Anoplura, отряду Coleoptera, отряду Dermaptera, отряду Blattaria, отряду Diptera, отряду Hemiptera, отряду Hymenoptera, отряду Isoptera, отряду Lepidoptera, отряду Mallophaga, отряду Orthoptera, отряду Siphonaptera, отряду Thysanoptera, отряду Thysanura, отряду Acarina или отряду Symphyla.
50. Способ по п. 44, где упомянутый вредитель представляет собой MYZUPE или BEMITA.
51. Способ по п. 44, где упомянутое количество составляет от 0,01 до 5000 г/га.
52. Способ по п. 44, где упомянутое количество составляет от 0,1 до 500 г/га.
53. Способ по п. 44, где упомянутое количество составляет от 1 до 50 г/га.
54. Способ по п. 44, где упомянутая площадь представляет собой площадь, на которой произрастают яблони, кукуруза, подсолнечник, хлопчатник, соя, канола, пшеница, рис, сорго, ячмень, овес, картофель, апельсины, люцерна, латук, земляника, томаты, перец, крестоцветные, груши, табак, миндаль, сахарная свекла или фасоль или будут высажены их семена.
55. Способ по п. 44, дополнительно включающий нанесение упомянутой композиции на генетически модифицированное растение, которое было генетически модифицировано для экспрессии одной или нескольких определенных черт.
56. Способ по п. 44, где упомянутая композиция дополнительно содержит сульфат аммония.
57. Способ контроля эндопаразитов, эктопаразитов или обоих, включающий пероральное введение или местное введение композиции по п. 26 отличному от человека животному.
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| Соединительная гайка для рукавов | 1925 |
|
SU3186A1 |
Авторы
Даты
2017-08-09—Публикация
2013-03-07—Подача