Изобретение относится к области биоорганической химии, более конкретно к способу получения новых, ранее неописанных аналогов рибавирина - замещенных по оксадиазольному кольцу 1-β-D-рибофуранозил-3-(1,2,4-оксадиазол-3-ил)-1,2,4-триазолов, обладающих противовирусной активностью.
В медицине для лечения различных вирусных инфекций, таких как вирус гепатита С, вирус гриппа типов А и В, вирус простого герпеса, респираторно-синцитиальной вирусной инфекции и других, используется препарат рибавирин (1-β-D-рибофуранозил-1,2,4-триазол-3-карбоксамид) [Таm R.C. et al. Mechanisms of action of ribavirin in antiviral therapies / Antiviral Chemistry and Chemotherapy, 2001, Vol. 12, P. 261-272; Crotty S. et al. The broad-spectrum antiviral ribonucleoside ribavirin is an RNA virus mutagen / Nature Medicine, 2000, Vol. 6, P. 1375-1379; Girish S. et al. Pharmacological profile of ribavirin and monitoring of its plasma concentration in chronic hepatitis С infection / Journal of Clinical and Experimental Hepatology, 2012, Vol. 2, Iss. 1, P. 42-54; Yung-Hung Luo et al. Inhaled ribavirin therapy in adult respiratory syncytial virus-induced acute respiratory distress syndrome / Archivos De Bronconeumologia, 2011, Vol. 47, Iss. 6, P. 315-317].
Основным недостатком рибавирина является ряд побочных эффектов, наблюдаемых у пациентов. Самым серьезным побочным эффектом является дозозависимая гемолитическая анемия. В настоящее время ведется поиск новых аналогов рибавирина, имеющих менее выраженные побочные действия.
Аналоги рибавирина с противовирусным действием могут быть найдены в ряду 1-β-D-рибофуранозил-3-замещенных-1,2,4-триазолов. Это связано с механизмом действия рибавирина: 1,2,4-триазол-3-карбоксамид (гетероциклическое основание рибавирина) стерически подобен гетероциклическим основаниям природных пуриновых нуклеотидов и встраивается в вирусную цепь РНК вместо гуанозина, тем самым делая ее дефектной и нефункциональной [Helen S. et al. Mechanism of action of ribavirin in the treatment of chronic hepatitis С / Gastroenterology and Hepatology, 2007, Vol. 3, Iss. 3, P. 218-225].
Описано множество способов синтеза аналогов рибавирина, модифицированных по третьему положению 1,2,4-триазольного кольца, например, химический синтез 1-β-D-рибофуранозил-3-(5-Н(ОН)-1,4,5,6-тетрагидропиримидинил)-1,2,4-триазолов [Gabrielsen В. et al. Synthesis and antiviral evaluation of N-carboxamidine-substituted analogues of 1-beta-D-ribofuranosyl-1,2,4-triazole-3-carboxamidine hydrochloride / Journal of Medicinal Chemistry, 1992, Vol. 35, Iss. 17, P. 3231-3238] или 1-β-D-рибофуранозил-3-(3-гидроксипропионамид-3-ил)-1,2,4-триазола [заявка на патент WO 2008067002 А2, опубл. 05.06.2008].
Одним из известных аналогов рибавирина является ETAR (1-β-D-рибофуранозил-3-этинил-1,2,4-триазол), который рассматривали в качестве эффективного кандидата для лечения хантавирусных инфекций [Dong-Hoon Chunga et al. Synthesis of 1-β-D-ribofuranosyl-3-ethynyl-[1,2,4]triazole and its in vitro and in vivo efficacy against Hantavirus / Antiviral Research, 2008, Vol. 79, Iss. 1, P. 19-27].
Наиболее близким аналогом настоящего изобретения является документ [Tatyana Sharonova et al. Synthesis of new 1,2,4-triazoles containing oxadiazole moiety: potential intermediates for preparation of ribavirin analogues / International Research Journal of Pure & Applied Chemistry, 2016, Vol. 10, Iss. 3, P. 1-5], в котором описаны 3-(1,2,4-триазол-3-ил)-5-алкил(метил, изопропил и циклопропил)-1,2,4-оксадиазолы и способ их получения.
Однако указанные соединения не обладают противовирусной активностью, так как они являются гетероциклическими основаниями, а не нуклеозидными аналогами, а для получения аналогов нуклеозидов необходимо применить химический или биотехнологический подход.
Изобретение решает задачу получения 1-β-D-рибофуранозил-3-(5-замещенных-1,2,4-оксадиазол-3-ил)-1,2,4-триазолов - потенциальных противовирусных агентов, и разработки эффективного способа их получения.
Технический результат настоящего изобретения заключается в расширении числа аналогов рибавирина, потенциально обладающих противовирусным действием.
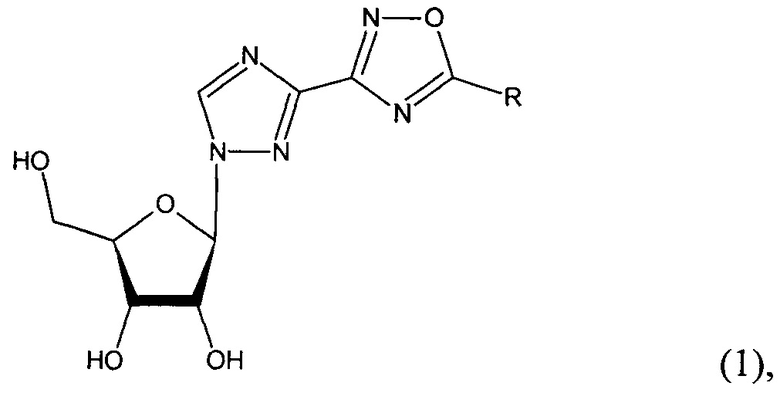
Технический результат достигается новыми соединениями - 1-β-D-рибофуранозил-3-(5-замещенные-1,2,4-оксадиазол-3-ил)-1,2,4-триазолы общей структурной формулы (1):
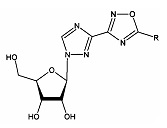 , где R=-Н (1а), -СH3 (1б), -СH(СH3)2 (1в), -Ph (1г) - (фиг. 1).
, где R=-Н (1а), -СH3 (1б), -СH(СH3)2 (1в), -Ph (1г) - (фиг. 1).
Технический результат достигается также способом получения указанных соединений формулы (1), включающим введение изопропилиденовой и трифенилметильной защитных групп в гликозидную часть молекулы рибавирина, дегидратацию карбоксамидной группы в амидоксим, получение О-ацилированного производного по амидоксимовой группировке с последующей внутримолекулярной циклизацией с получением защищенного по гликозидной части аналога рибавирина, имеющего 5-замещенный-1,2,4-оксадиазольный фрагмент в 3-ем положении 1,2,4-триазола, и последующим удалением изопропилиденовой и триметилфенильной защитных групп.
Предлагаемые в настоящем изобретении новые соединения формулы (1) могут применяться в качестве агентов, обладающих противовирусной активностью по отношению к вирусу простого герпеса 1 типа, вирусу гриппа А и вирусу гепатита С, что подтверждается примером 12, приведенным ниже.
Более конкретно способ получения 1-β-D-рибофуранозил-3-(5-замещенных-1,2,4-оксадиазол-3-ил)-1,2,4-триазолов характеризуется следующими этапами:
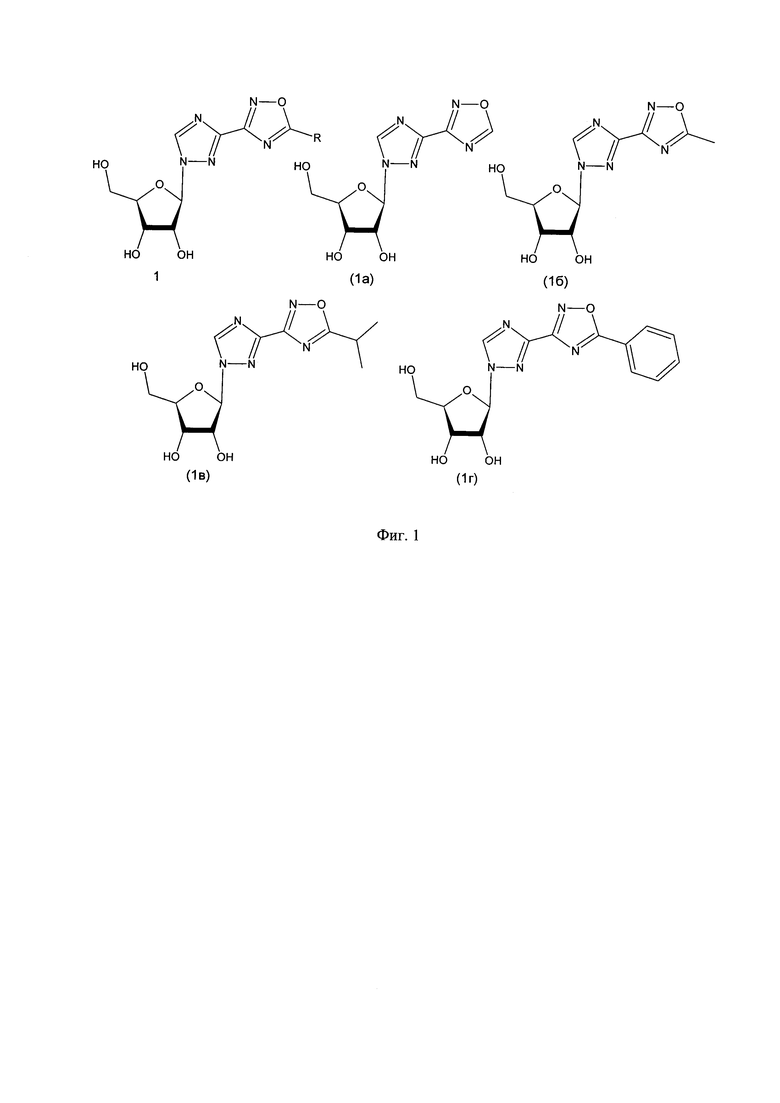
1. Синтез целевых соединений проводили из рибавирина, в качестве защитных групп для гидроксилов гликозидной части использовали изопропилиденовую и трифенилметильную защитную группы (фиг. 2);
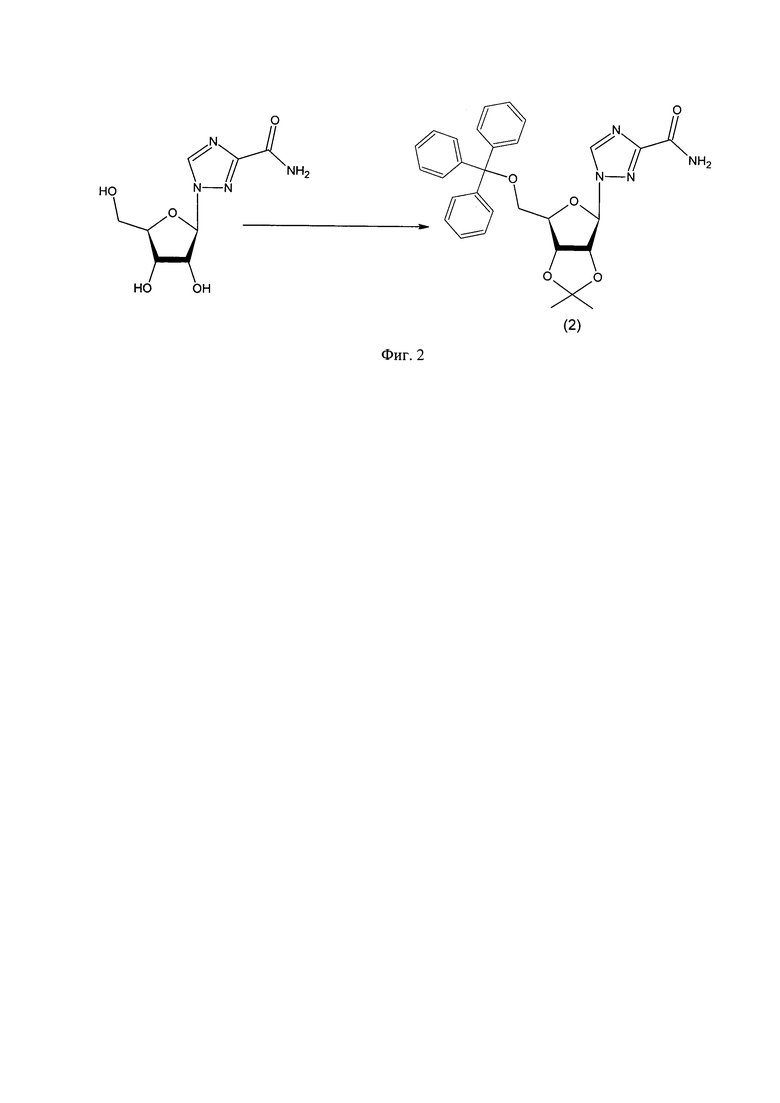
2. Дегидратацию карбоксамидной группы осуществляли оксихлоридом фосфора в присутствии триэтиламина (фиг. 3);
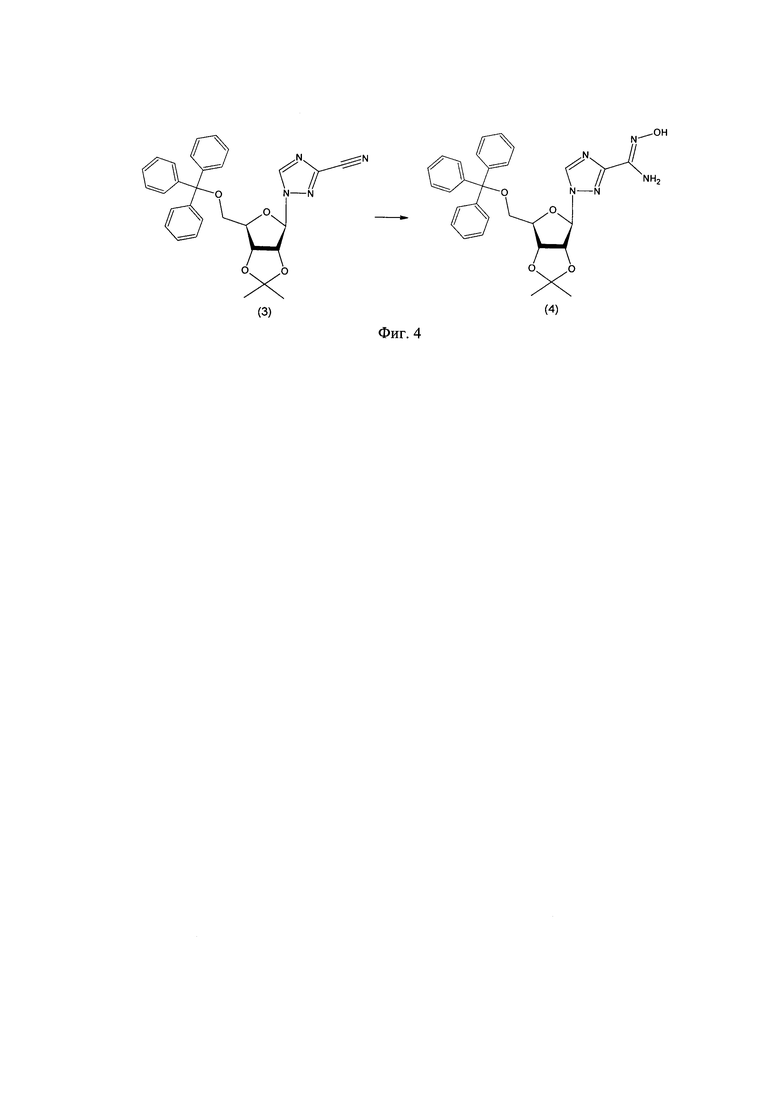
3. Амидоксим (4) получали обработкой нитрила (3) водным гидроксиламином (фиг. 4);
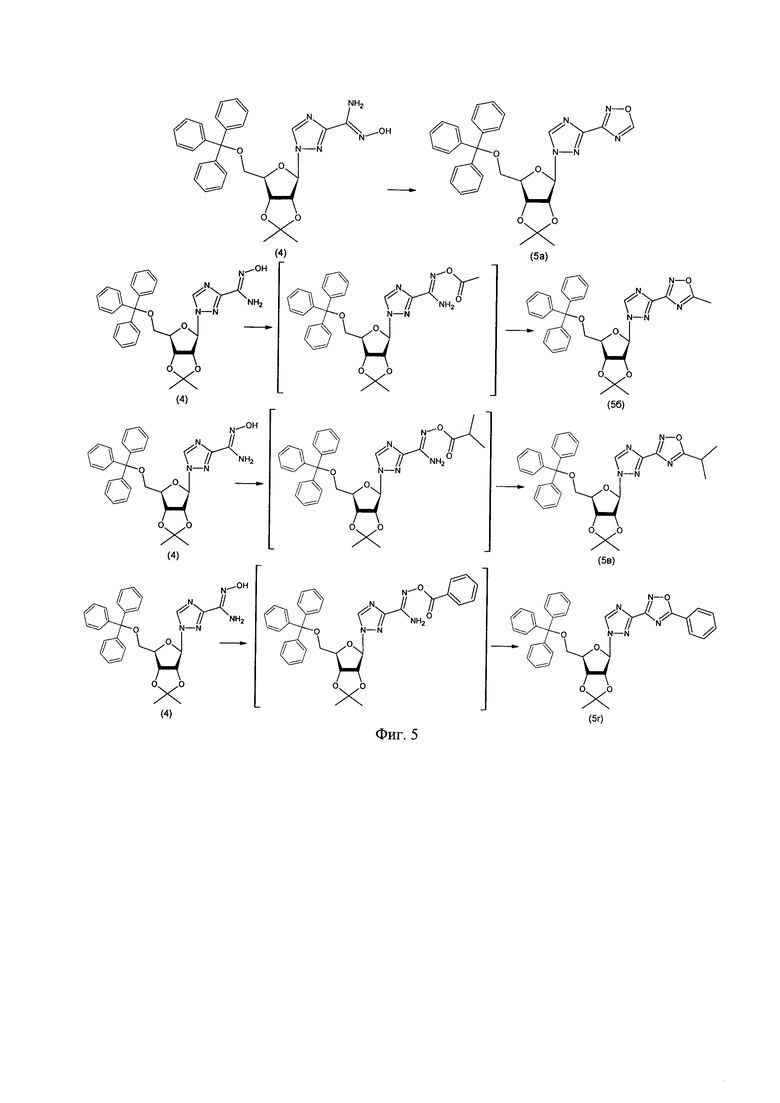
4. Кипячением в триэтилортоформиате получали замещенный оксадиазол (5а). Замещенные оксадиазолы (5б, 5в, 5г) получали ацилированием амидоксима (4) соответствующими хлорангидридами с последующей циклизацией (фиг. 5);
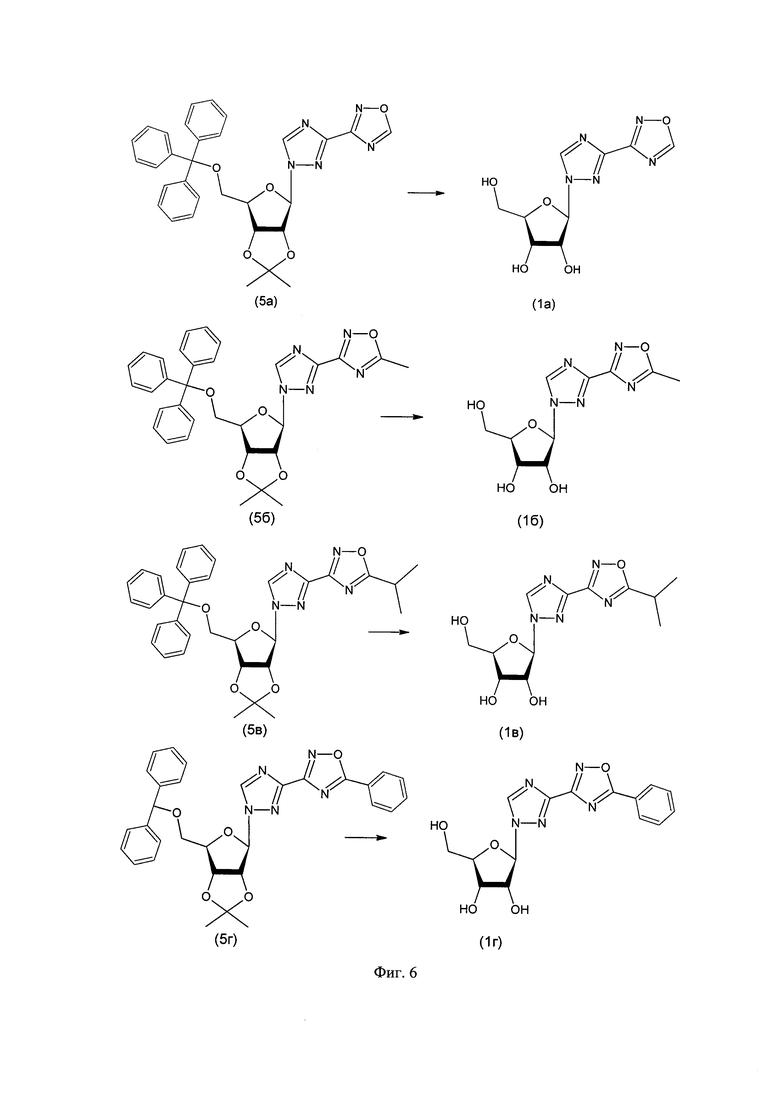
5. Удалением защитных групп водным раствором трифторуксусной кислоты получали целевые соединения 1а, 1б, 1в, 1г (фиг. 6).
Сущность изобретения иллюстрируется следующими графическими изображениями:
Фиг. 1: Структура 1-β-D-рибофуранозил-3-(5-замещенных-1,2,4-оксадиазол-3-ил)-1,2,4-триазолов.
Фиг. 2: Схема синтеза 1-(2,3-O-изопропилиден-5-O-трифенилметил-β-D-рибофуранозил)-1,2,4-триазол-3-карбоксамида.
Фиг. 3: Схема синтеза 1-(2,3-O-изопропилиден-5-O-трифенилметил-β-D-рибофуранозил)-1,2,4-триазол-3-карбонитрила.
Фиг. 4: Схема синтеза 1-(2,3-O-изопропилиден-5-O-трифенилметил-β-D-рибофуранозил)-1,2,4-триазол-3-карбоамидоксима.
Фиг. 5: Схема синтеза 1-(2,3-O-изопропилиден-5-O-трифенилметил-β-D-рибофуранозил)-3-(1,2,4-оксадиазол-3-ил)-1,2,4-триазола, 1-(2,3-O-изопропилиден-5-O-трифенилметил-β-D-рибофуранозил)-3-(5-метил-1,2,4-оксадиазол-3-ил)-1,2,4-триазола, 1-(2,3-O-изопропилиден-5-O-трифенилметил-β-D-рибофуранозил)-3-(5-изопропил-1,2,4-оксадиазол-3-ил)-1,2,4-триазола и 1-(2,3-O-изопропилиден-5-O-трифенилметил-β-D-рибофуранозил)-3-(5-фенил-1,2,4-оксадиазол-3-ил)-1,2,4-триазола.
Фиг. 6: Схема синтеза 1-β-D-рибофуранозил-3-(1,2,4-оксадиазол-3-ил)-1,2,4-триазола, 1-β-D-рибофуранозил-3-(5-метил-1,2,4-оксадиазол-3-ил)-1,2,4-триазола, 1-β-D-рибофуранозил-3-(5-изопропил-1,2,4-оксадиазол-3-ил)-1,2,4-триазола и 1-β-D-рибофуранозил-3-(5-фенил-1,2,4-оксадиазол-3-ил)-1,2,4-триазола.
Настоящее изобретение иллюстрируется следующими примерами.
Пример 1. Синтез 1-(2,3-O-изопропилиден-5-O-трифенилметил-β-D-рибофуранозил)-1,2,4-триазол-3-карбоксамида (2).
Раствор 5 г (20,5 ммоль) 1-β-D-рибофуранозил-1,2,4-триазол-3-карбоксамида, 10,6 г (102,0 ммоль) 2,2-диметоксипропана и 1 г (6,0 ммоль) n-толуолсульфокислоты в диметилформамиде перемешивали в течение 2 ч при 100°С до практически полного растворения осадка. К охлажденному раствору добавляли триэтиламин (10 мл) и через 15 мин удаляли низкокипящие растворители в вакууме водоструйного насоса при 40°С. К полученному раствору добавляли пиридин 3,3 мл (41,0 ммоль) и медленно по каплям при перемешивании и охлаждении на водяной бане 6,3 г (23,0 ммоль) трифенилметилхлорида. Контроль реакции осуществляли методом ТСХ: хлороформ, Rf конечного продукта ≈0,45. По окончании реакции смесь разбавили этилацетатом и промыли несколько раз 5%-ным раствором лимонной кислоты и несколько раз дистиллированной водой. Растворитель удалили на вакуумном роторном испарителе. Продукт очищали колоночной хроматографией на силикагеле, элюент: хлороформ.
Выход: 64% (6,1 г).
1H ЯМP (CDCl3, σ, м.д.): 1,34 (3Н, с, -СH3), 1,57 (3Н, с, -СH3), 3,10-3,21 (2Н, м, С5'Н2), 4,55-4,59 (1H, м, С4'Н), 4,79 (1Н, дд, J1=2,1 Гц, J2=6,1 Гц, С3'Н), 5,35 (1Н, дд, J1=1,3 Гц, J2=6,1 Гц, С2'Н), 6,02 (1H, д, J=1,2 Гц, C1'H), 6,52 (2Н, д, J=191,0 Гц, -CONH2), 7,20-7,34 (15Н, м, (С6Н5)3С-), 8,23 (1Н, с, СНтр).
13С ЯМР (CDCl3, σ, м.д.): 25,06 (-СН3), 26,78 (-СН3), 63,86 (С5'), 81,76 (С4'), 84,54 (С3'), 86,94 ((С6Н5)3С-), 87,80 (С2'), 93,87 (С1'), 113,71 ((СН3)2С-), 127,16 (С6Н5-), 127,84 (С6Н5-), 128,40 (С6Н5-), 143,22 (С6Н5-), 144,17 (C5тр), 156,94 (С3тр), 160,64 (CONH2).
Пример 2. Синтез 1-(2,3-O-изопропилиден-5-O-трифенилметил-β-D-рибофуранозил)-1,2,4-триазол-3-карбонитрила (3).
К раствору 4 г (7,6 ммоль) 1-(2,3-O-Изопропилиден-5-трифенилметил-β-D-рибофуранозил)-1,2,4-триазол-3-карбоксамида и 6,1 мл (76,0 ммоль) пиридина в безводном хлористом метилене при перемешивании и охлаждении на ледяной бане медленно по каплям добавляли 5,2 мл (38,0 ммоль) трифторуксусного ангидрида. Реакционную массу перемешивали ночь. Контроль реакции осуществляли методом ТСХ: хлороформ, Rf конечного продукта ≈0,90. По окончании реакции смесь несколько раз промыли 5%-ным раствором лимонной кислоты, органический растворитель удалили на вакуумном роторном испарителе. Целевой продукт выделяли флеш-хроматографией на силикагеле, элюент: хлороформ.
Выход: 70% (2,7 г).
1Н ЯМР (CDCl3, σ, м.д.): 1,36 (3Н, с, -СН3), 1,58 (3Н, с, -СН3), 3,10-3,21 (2Н, м, С5'Н2), 4,60-4,64 (1H, м, С4'Н), 4,77 (1Н, дд, J1=1,8 Гц, J2=6,0 Гц, С3'Н), 5,20 (1Н, дд, Гц, J2=6,0 Гц, С2'Н), 5,98 (1H, д, J=1,2 Гц, С1'H), 7,24-7,32 (15Н, м, (С6Н5)3С-), 8,23 (1H, с, СНтр).
13С ЯМР (CDCl3, σ, м.д.): 25,12 (-СН3), 26,83 (-СН3), 63,59 (С5'), 81,93 (С4'), 84,83 (С3'), 87,13 ((С6Н5)3С-), 88,09 (С2'), 94,69 (С1'), 111,48 (-CN), 114,00 ((СН3)2C-), 127,24 (С6Н5-), 127,94 (С6Н5-), 128,38 (С6Н5-), 139,96 (С3тр), 143,05 (С6Н5-), 144,43 (C5тр).
Пример 3. Синтез амидоксима 1-(2,3-O-изопропилиден-5-O-трифенилметил-β-D-рибофуранозил)-1,2,4-триазол-3-карбоновой кислоты (4).
К раствору 1,35 г (2,65 ммоль) 1-(2,3-O-Изопропилиден-5-трифенилметил-β-D-рибофуранозил)-1,2,4-триазол-3-карбонитрила в метиловом спирте добавляли 0,35 г (5,30 ммоль) водного гидроксиламина (50% по массе). Реакционную массу перемешивали при комнатной температуре одну ночь. Контроль реакции осуществляли методом ТСХ: 5% метанола в хлороформе, Rf конечного продуктам ≈0,15. Метиловый спирт упарили на вакуумном роторном испарителе, выпавший осадок отфильтровали и промыли минимальным количеством дистиллированной воды. Осадок сушили в вакуумируемом эксикаторе над гидроксидом натрия в течение 20 часов.
Выход: 96% (1,38 г).
1Н ЯМР (CDCl3, σ, м.д.): 1,32 (3Н, с, -СН3), 1,55 (3Н, с, -СН3), 3,12-3,23 (2Н, м, С5'Н2), 4,47-4,52 (1Н, м, С4'Н), 4,76 (1Н, дд, J1=l,5 Гц, J2=5,7 Гц, С3'Н), 5,14 (1H, д, J=5,7 Гц, С2'Н), 5,87 (1H, с, С1'Н), 7,17-7,33 (15Н, м, (С6Н5)3С-), 8,08 (1Н, уш. с., СНтр).
13C ЯМР (CDCl3, σ, м.д.): 25,24 (-CH3), 26,93 (-CH3), 63,88 (C5'), 81,18 (C4'), 84,48 (C3'), 86,91 ((C6H5)3C-), 87,38 (C2'), 93,14 (С1'), 113,63 ((СН3)2C-), 127,19 (C6H5-), 127,86 (C6H5-), 128,46 (C6H5-), 143,39 (C6H5-), 144,26 (C5тр), 157,96 (C3тр).
Пример 4. Синтез 1-(2,3-O-изопропилиден-5-O-трифенилметил-β-D-рибофуранозил)-3-(1,2,4-оксадиазол-3-ил)-1,2,4-триазола (5а).
Амидоксим 1-(2,3-О-изопропилиден-5-трифенилметил-β-D-рибофуранозил)-1,2,4-триазол-3-карбоновой кислоты 500 мг (0,92 ммоль) и 16 мг (0,09 ммоль) n-толуолсульфокислоты растворили в триэтилортоформиате. Реакционную массу при перемешивании нагревали до кипения в течение 3-х часов. Контроль реакции осуществляли методом ТСХ: хлороформ, Rf конечного продукта ≈0,65. По окончании реакции растворитель удалили в вакууме водоструйного насоса. Продукт выделяли колоночной хроматографией на силикагеле (элюент: хлороформ).
Выход: 96% (490 мг).
1Н ЯМР (DMSO-d6, σ, м.д.): 1,36 (3Н, с, -СН3), 1,59 (3Н, с, -СН3), 3,26-3,32 (2Н, м, С5'Н2), 4,57-4,62 (1Н, м, С4'Н), 4,80 (1Н, дд, J1=2,0 Гц, J2=6,0 Гц, С3'Н), 5,35 (1H, д, J=5,7 Гц, С2'Н), 6,10 (1Н, уш. с., С1'Н), 7,14-7,34 (15Н, м, (С6Н5)3С-), 8,39 (1Н, с, СНокс), 8,85 (1Н, с, СНтр).
Пример 5. Синтез 1-(2,3-O-изопропилиден-5-O-трифенилметил-β-D-рибофуранозил)-3-(5-метил-1,2,4-оксадиазол-3-ил)-1,2,4-триазола (5б).
К раствору 110 мг (0,20 ммоль) амидоксима 1-(2,3-O-изопропилиден-5-трифенилметил-β-D-рибофуранозил)-1,2,4-триазол-3-карбоновой кислоты и 37 мкл (0,26 ммоль) триэтиламина в безводном хлористом метилене добавили 16 мкл (0,22 ммоль) ацетилхлорида. Реакционную массу перемешивали при комнатной температуре 1,5 часа. Контроль реакции осуществляли методом ТСХ: хлороформ, Rf конечного продукта ≈0,65. По окончании реакции смесь промыли 5%-ным раствором лимонной кислоты, органическую фазу высушили над сульфатом натрия и растворитель удалили в вакууме водоструйного насоса. Продукт выделяли колоночной хроматографией на силикагеле (элюент: хлороформ).
Выход: 85% (98 мг).
1Н ЯМР (DMSO-d6, σ, м.д.): 1,29 (3Н, с, -СН3), 1,50 (3Н, с, -СН3), 2,68 (3Н, с, -СН3окс), 3,25-3,31 (2Н, м, С5'Н2), 4,36-4,41 (1H, м, С4'Н), 4,79 (1Н, дд, J1=2,2 Гц, J2=6,0 Гц, С3'Н), 5,35 (1H, дд, J1=0,8 Гц, J2=6,0 Гц, С2'Н), 6,35 (1Н, д, J=0,8 Гц, С1'Н), 7,15-7,29 (15Н, м, (С6Н5)3С-), 8,90 (1Н, с, СНтр).
Пример 6. Синтез 1-(2,3-O-изопропилиден-5-O-трифенилметил-β-D-рибофуранозил)-3-(5-изопропил-1,2,4-оксадиазол-3-ил)-1,2,4-триазола (5в).
К раствору 310 мг (0,57 ммоль) амидоксима 1-(2,3-O-изопропилиден-5-трифенилметил-β-D-рибофуранозил)-1,2,4-триазол-3-карбоновой кислоты и 110 мкл (0,79 ммоль) триэтиламина в безводном хлористом метилене добавили 66 мкл (0,63 ммоль) хлорангидрида изомасляной кислоты. Реакционную массу перемешивали при комнатной температуре 1,5 часа. Контроль реакции осуществляли методом ТСХ: хлороформ, Rf конечного продукта ≈0,62. По окончании реакции смесь промыли 5%-ным раствором лимонной кислоты, органическую фазу высушили над сульфатом натрия и растворитель удалили в вакууме водоструйного насоса. Продукт выделяли колоночной хроматографией на силикагеле (элюент: хлороформ).
Выход: 73,5% (250 мг).
1Н-ЯМР (DMSO-d6, σ, м.д.): 1,33 (3Н, с, -СН3), 1,46-1,52 (6Н, м, -CH(CH3)2), 1,57 (3Н, с, -СН3), 3,09-3,40 (2Н, м, С5'Н2, -СН(СН3)2), 4,53-4,60 (1Н, м, С4'Н), 4,75 (1H, дд, J1=2,2 Гц, J2=6,0 Гц, С3'Н), 5,35 (1H, дд, J1=1,3 Гц, J2=6,0 Гц, С2'Н), 6,07 (1H, д, J=1,1 Гц, С1'Н), 7,11-7,35 (15Н, м, (С6Н5)3С-), 8,35 (1H, с, СНтр).
Пример 7. Синтез 1-(2,3-O-изопропилиден-5-O-трифенилметил-β-D-рибофуранозил)-3-(5-фенил-1,2,4-оксадиазол-3-ил)-1,2,4-триазола (5г).
К раствору 310 мг (0,57 ммоль) амидоксима 1-(2,3-O-изопропилиден-5-трифенилметил-β-D-рибофуранозил)-1,2,4-триазол-3-карбоновой кислоты и 110 мкл (0,79 ммоль) триэтиламина в безводном хлористом метилене добавили 73 мкл (0,63 ммоль) бензоилхлорида. Реакционную массу перемешивали при комнатной температуре 1,5 часа. Контроль реакции осуществляли методом ТСХ: хлороформ, Rf конечного продукта ≈0,63. По окончании реакции смесь промыли 5%-ным раствором лимонной кислоты, органическую фазу высушили над сульфатом натрия и растворитель удалили в вакууме водоструйного насоса. Продукт выделяли колоночной хроматографией на силикагеле (элюент: хлороформ).
Выход: 89% (319 мг).
1Н-ЯМР (PMSO-d6, σ, м.д.): 1,35 (3Н, с, -СН3), 1,58 (3Н, с, -СН3), 3,13-3,32 (2Н, м, С5'Н2), 4,55-4,62 (1Н, м, С4'Н), 4,79 (1Н, дд, J1=2,0 Гц, J2=6,0 Гц, С3'Н), 5,35 (1H, дд, J1=1,0 Гц, J2=6,0 Гц, С2'Н), 6,09 (1Н, уш. с., J=1,1 Гц, C1'H), 7,11-7,35 (15Н, м, (С6Н5)3С-), 7,51-7,68 (3Н, м, -С6Н5), 8,25-8,31 (2Н, м, -С6Н5), 8,38 (1H, с, CHтр).
Пример 8. Синтез 1-β-D-рибофуранозил-3-(1,2,4-оксадиазол-3-ил)-1,2,4-триазола (1a).
1-(2,3-O-Изопропилиден-5-трифенилметил-β-D-рибофуранозил)-3-(1,2,4-оксадиазол-3-ил)-1,2,4-триазол (470 мг) в 5 мл трифторуксуной кислоты (90% водный раствор) перемешивали при комнатной температуре 40 мин. Контроль реакции осуществляли методом ТСХ: 5% метанола в этилацетате, Rf конечного продукта ≈0,55. По окончании реакции смесь упарили на вакуумном роторном испарителе. Продукт выделяли колоночной хроматографией на силикагеле (элюент: 3% метанола в этилацетате).
Выход: 48% (110 мг).
1Н ЯМР (DMSO-d6, σ, м.д.): 3,48-3,68 (2Н, м, С5'Н2), 3,98 (1Н, кв, J=4,7 Гц, С4'Н), 4,15 (1Н, кв, J=5,1 Гц, С3'Н), 4,37-4,42 (1Н, м, С2'Н), 4,89 (1Н, тр, J=5,4 Гц, С2'ОН), 5,17 (1Н, д, J=5,5 Гц, С3'ОН), 5,56 (1Н, д, J=5,6 Гц, С5'ОН), 5,88 (1Н, д, J=3,9 Гц, С1'Н), 9,02 (1Н, с, СНтр), 9,77 (1H, с, СНокс).
13С ЯМР (DMSO-d6, σ, м.д.): 61,18 (С5'), 69,84 (С3'), 74,15 (С2'), 85,49 (С4'), 91,92 (С1'), 145,77 (С5тр), 152,12 (С3окс), 161,86 (С3тр), 184,48 (С5окс).
Пример 9. Синтез 1-β-D-рибофуранозил-3-(5-метил-1,2,4-оксадиазол-3-ил)-1,2,4-триазола (1б).
1-(2,3-O-Изопропилиден-5-трифенилметил-β-D-рибофуранозил)-3-(1,2,4-оксадиазол-3-ил)-1,2,4-триазол (470 мг) в 5 мл трифторуксуной кислоты (90% водный раствор) перемешивали при комнатной температуре 40 мин. Контроль реакции осуществляли методом ТСХ: 5% метанола в этилацетате, Rf конечного продукта ≈0,55. По окончании реакции смесь упарили на вакуумном роторном испарителе. Продукт выделяли колоночной хроматографией на силикагеле (элюент: 3% метанола в этилацетате).
1H ЯМР (DMSO-d6, σ, м.д.): 2,61 (3Н, с, -СН3), 3,50-3,69 (2Н, м, С5'Н2), 3,99 (1H, кв, J=4,5 Гц, С4'Н), 4,15 (1Н, кв, J=4,9 Гц, С3'Н), 4,38-4,45 (1Н, м, С2'Н), 4,89 (1H, уш. с., С2'ОН), 5,14 (1Н, уш. с., С3'ОН), 5,57 (1H, уш. с., С5'ОН), 5,88 (1Н, д, J=3,9 Гц, С1'Н), 9,00 (1H, с, СНтр).
13С ЯМР (DMSO-d6, σ, м.д.): 11,86 (-СН3), 61,16 (С5'), 69,84 (С3'), 74,24 (С2'), 85,50 (С4'), 91,92 (С1'), 145,77 (C5тр), 152,12 (С3окс), 161,86 (С3тр), 184,48 (С5окс).
Пример 10. Синтез 1-β-D-рибофуранозил-3-(5-изопропил-1,2,4-оксадиазол-3-ил)-1,2,4-триазола (5в).
1-(2,3-O-Изопропилиден-5-трифенилметил-β-D-рибофуранозил)-3-(5-изопропил-1,2,4-оксадиазол-3-ил)-1,2,4-триазол (230 мг) в 5 мл трифторуксуной кислоты (90% водный раствор) перемешивали при комнатной температуре 40 мин. Контроль реакции осуществляли методом ТСХ: 5% метанола в этилацетате, Rf конечного продукта ≈0,56. По окончании реакции смесь упарили на вакуумном роторном испарителе. Продукт выделяли колоночной хроматографией на силикагеле (элюент: 3% метанола в этилацетате).
Выход: 71% (86 мг).
1Н ЯМР (DMSO-d6, σ, м.д.): 1,37 (6Н, д, J=7,0 Гц, -СН(СН3)2), 3,36 (1Н, септет, J=7,0 Гц, -СН(СН3)2), 3,49-3,67 (2Н, м, С5'Н2), 3,98 (1Н, кв, J=4,5 Гц, С4'Н), 4,15 (1H, тр, J=4,8 Гц, С3'Н), 4,39 (1Н, тр, J=3,7 Гц, С2'Н), 4,89 (1Н, уш. с., С2'ОН), 5,11 (1Н, уш. с., С3'ОН), 5,54 (1Н, уш. с., С5'ОН), 5,88 (1Н, д, J=3,9 Гц, С1'Н), 9,00 (1Н, с, СНтр).
13С ЯМР (DMSO-d6, σ, м.д.): 19,72 (-СН(СН3)2), 26,75 (-СН(СН3)2), 61,13 (С5'), 69,84 (С3'), 74,51 (С2'), 85,49 (С4'), 91,92 (С1'), 145,77 (C5тр), 152,12 (С3окс), 161,86 (С3тр), 184,48 (С5окс).
Пример 11. Синтез 1-β-D-рибофуранозил-3-(5-фенил-1,2,4-оксадиазол-3-ил)-1,2,4-триазола (5г).
1-(2,3-O-Изопропилиден-5-O-трифенилметил-β-D-рибофуранозил)-3-(5-фенил-1,2,4-оксадиазол-3-ил)-1,2,4-триазол (300 мг) в 5 мл трифторуксуной кислоты (90% водный раствор) перемешивали при комнатной температуре 40 мин. Контроль реакции осуществляли методом ТСХ: 5% метанола в этилацетате, Rf конечного продукта ≈0,55. По окончании реакции смесь упарили на вакуумном роторном испарителе. Продукт выделяли колоночной хроматографией на силикагеле (элюент: 3% метанола в этилацетате).
Выход: 70% (115 мг).
1Н ЯМР (DMSO-d6, σ, м.д.): 3,51-3,72 (2Н, м, С5'Н2), 3,99 (1Н, 9В, J=4,2 Гц, С4'Н), 4,15 (1Н, 9 В, J=4,8 Гц, С3'Н), 4,39 (1H, 9В, J=4,2 Гц, С2'Н), 4,99 (1Н, тр., J=5,2 Гц, С2'ОН), 5,25 (1Н, д, J=5,4 Гц, С3'ОН), 5,66 (1H, д, J=5,5 Гц, С5'ОН), 5,91 (1H, д, J=3,7 Гц, С1'Н), 7,64-7,74 (3Н, м, С6Н5-), 8,18-8,20 (2Н, м, С6Н5-), 9,07 (1Н, с, C5тр).
13С ЯМР (DMSO-d6, σ, м.д.): 61,15 (С5'), 69,87 (С3'), 74,58 (С2'), 85,56 (С4'), 92,04 (С1'), 145,90 (C5тр), 123,10 (С6Н5-), 128,01 (С6Н5-), 129,61 (С6Н5-), 133,55 (С6Н5-), 152,00 (С3окс), 162,69 (С3тр), 175,81 (С5окс).
Пример 12. Исследование противовирусной активности соединений 1а, 1б, 1в. 1г.
Изучение цитотоксических свойств и противовирусной активности соединений проводили микрометодом в Институте вирусологии им. Д.И. Ивановского ФГБУ «ФНИЦЭМ им. Н.Ф. Гамалеи» Минздрава России. Использовали 96-луночные пластиковые планшеты со сформировавшимся монослоем перевиваемой линии клеток почек зеленой мартышки Vero-Е6, либо перевиваемой линии клеток почки эмбриона свиньи (СПЭВ).
Противовирусную активность аналогов рибавирина исследовали на экспериментальных моделях инфекций in vitro, вызванных высоко вирулентным штаммом вируса гриппа А птиц (H5N1), выделенного во время эпизоотии среди домашних птиц в июле 2005 года в Новосибирской области - A/duck/Novosibirsk/56/05, цитопатогенным вариантом вируса гепатита С (ВГС), а также эталонным штаммом вируса герпеса простого 1 типа штамма L2 (ВПГ-1). Противовирусный эффект аналогов рибавирина определяли по влиянию разных концентраций соединений на сохранение жизнеспособности клеток, если монослой клеток обрабатывали рибавирином и его аналогами за 12 часов до заражения, в момент заражения клеток или через 12 часов после заражения клеток. Через 4-5 дней инкубации монослой клеток обрабатывали метиленовым синим (в случае вируса гриппа А и ВГС) или трипановым синим (в случае ВПГ-1) и подсчитывали % клеток, сохранивших жизнеспособность. Рассчитывали величину ИД50, (ингибирующую дозу 50) т.е. концентрацию веществ, которая обеспечивала жизнеспособность 50% клеток монослоя, инфицированных вирусом.
Цитотоксичность соединений определяли количественно, для чего разные концентрации соединений по 25 мкл вносили в лунки на монослой клеток, затем доводили до объема 200 мкл питательной средой 199 и инкубировали в течение 72 часов при 37°С. Затем монослой клеток окрашивали трипановым синим (в случае ВПГ-1) или метиленовым синим (в случае вируса гриппа А и ВГС). За величину ЦД50 (50% цитотоксической дозы/концентрации) принимали такую концентрацию соединения, при которой выживаемость клеток составляла 50% через 72 ч контакта клеточной культуры с изучаемыми соединениями.
Соединения данного класса обладают низкой цитотоксической активностью в концентрациях до 300 мкг/мл (рибавирин 75 мкг/мл) для клеток СПЭВ, и в концентрациях до 1000 мкг/мл (рибавирин >1000 мкг/мл) для клеток Vero-E6.
В экспериментах in vitro соединения 1a и 1г (ИД50=260 мкг/мл) проявляют достоверную противогерпетическую активность и по своей активности приближаются к активности рибавирина (ИД50=250 мкг/мл), для соединения 1в ИД50=500 мкг/мл, а для соединения 1б ИД50>500 мкг/мл.
Соединение 1в характеризуется выраженными противовирусными свойствами в отношении инфекции, вызванной вирусом гриппа А (ИД50=18,75 мкг/мл), что всего в 2 раза ниже противовирусной активности рибавирина (ИД50=8,25 мкг/мл), для соединений 1а и 1г ИД50>300 мкг/мл.
Соединение 1 г обладает выраженными противовирусными свойствами в отношении инфекции, вызванной вирусом гепатита С: ИД50<75,0 мкг/мл при обработке клеток за 24 часа до заражения вирусом и 8,8 мкг/мл - при обработке монослоя клеток в момент инфицирования вирусом (для рибавирина 8,8 и 6,25 мкг/мл соответственно), ИД50 при обработке клеток за 24 часа до заражения вирусом для соединений 1а и 1в составляет 160 мкг/мл, а в момент инфицирования - 140 и 80 мкг/мл, соответственно.
| название | год | авторы | номер документа |
|---|---|---|---|
| Амид 5-(тетрагидрофуран-2-ил)-1,2,4-триазол-3-карбоновой кислоты, обладающий противовирусной активностью, и способ его получения | 2016 |
|
RU2624018C2 |
| СПОСОБ ПОЛУЧЕНИЯ 5-ЗАМЕЩЁННЫХ 1,2,4-ТРИАЗОЛ-3-КАРБОНОВЫХ КИСЛОТ И ИХ ПРОИЗВОДНЫХ ИЗ УНИВЕРСАЛЬНОГО ПРЕДШЕСТВЕННИКА | 2015 |
|
RU2605414C1 |
| МОНОЦИКЛИЧЕСКИЕ L-НУКЛЕОЗИДЫ, ИХ АНАЛОГИ И ПРИМЕНЕНИЯ | 1997 |
|
RU2188828C2 |
| [1,2,4]Триазоло[3,4-b][1,3,4]тиадиазины, проявляющие активность против вируса гриппа А, и способ их получения | 2022 |
|
RU2824814C2 |
| 3-Бутилтио-1-(бета-D-2-дезоксирибофуранозил)-5-фенил-(4Н)-1,2,4-триазол, синтез, противогерпесвирусное действие | 2023 |
|
RU2815137C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-β-D-РИБОФУРАНОЗИЛ-1,2,4-ТРИАЗОЛ-3-КАРБОКСАМИДА | 2011 |
|
RU2480218C1 |
| Адамантилсодержащие производные 1,2,4-триазола и 1,3,4-тиадиазола, имеющие монотерпеноидные фрагменты, используемые в качестве ингибиторов фермента тирозил-ДНК-фосфодиэстеразы 1 | 2020 |
|
RU2761880C1 |
| 16-(1,2,4-ОКСАДИАЗОЛ-3-ИЛ)-15,16-ЭПОКСИЛАБДАНОИДЫ, ОБЛАДАЮЩИЕ ЦИТОТОКСИЧЕСКОЙ АКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К ОПУХОЛЕВЫМ КЛЕТКАМ ЧЕЛОВЕКА | 2011 |
|
RU2473550C1 |
| 4-((Z)-4'-ГИДРОКСИБУТЕН-2'-ИЛ)-2-R-6-ФЕНИЛ-1,2,4-ТРИАЗОЛО[5,1-c][1,2,4]ТРИАЗИН-7-ОНЫ | 2008 |
|
RU2376307C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЛКИЛЗАМЕЩЕННЫХ 2-ДЕЗОКСИ-2-ФТОР-D-РИБОФУРАНОЗИЛ-ПИРИМИДИНОВ И ПУРИНОВ И ИХ ПРОИЗВОДНЫХ | 2005 |
|
RU2407747C2 |
Изобретение относится к новым антивирусным производным общей формулы:
где R выбран из Н, СH3, СH(СH3)2, Ph, а также к способу их получения, который может быть использован в фармацевтической промышленности. Предложенный способ получения включает введение изопропилиденовой и трифенилметильной защитных групп в гликозидную часть рибавирина, дегидратацию карбоксамидной группы в амидоксим, получение О-ацилированного производного по амидоксимовой группировке с последующей внутримолекулярной циклизацией с получением защищенного по гликозидной части аналога рибавирина, имеющего 5-замещенный-1,2,4-оксадиазольный фрагмент в 3-м положении 1,2,4-триазола, и последующее удаление изопропилиденовой и триметилфенильной защитных групп. Предложены новые соединения, эффективные в отношении вируса простого герпеса 1 типа, вируса гриппа А и вируса гепатита С, а также эффективный способ их получения. 3 н.п. ф-лы, 12 пр., 6 ил.
1. 1-β-D-Рибофуранозил-3-(5-замещенные-1,2,4-оксадиазол-3-ил)-1,2,4-триазолы общей структурной формулы (1):
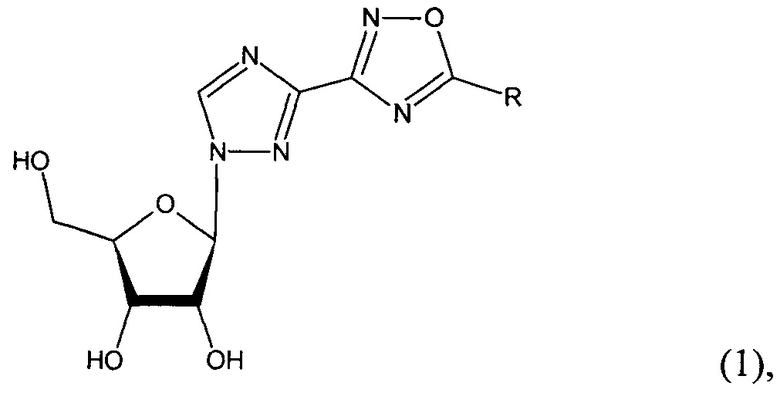
где R=-Н (1а), -СН3 (1б), -СН(СН3)2 (1в), -Ph (1г).
2. Способ получения 1-β-D-рибофуранозил-3-(5-замещенных-1,2,4-оксадиазол-3-ил)-1,2,4-триазолов по п. 1, включающий введение изопропилиденовой и трифенилметильной защитных групп в гликозидную часть молекулы рибавирина, дегидратацию карбоксамидной группы в амидоксим, получение О-ацилированного производного по амидоксимовой группировке с последующей внутримолекулярной циклизацией с получением защищенного по гликозидной части аналога рибавирина, имеющего 5-замещенный-1,2,4-оксадиазольный фрагмент в 3-м положении 1,2,4-триазола, и последующее удаление изопропилиденовой и триметилфенильной защитных групп.
3. Применение 1-β-D-рибофуранозил-3-(5-замещенных-1,2,4-оксадиазол-3-ил)-1,2,4-триазолов по п. 1 в качестве агентов, обладающих противовирусной активностью по отношению к вирусу простого герпеса 1 типа, вирусу гриппа А и вирусу гепатита С.
| Tatyana Sharonova et al, International Research Journal of Pure & Applied Chemistry", 2016, vol | |||
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| RU 2005118418 A, 10.02.2006 | |||
| Dong-Hoon Chunga et al, Antiviral Research, 2008, Vol | |||
| Цилиндрический сушильный шкаф с двойными стенками | 0 |
|
SU79A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2017-08-29—Публикация
2016-12-08—Подача