Изобретение относится к области аналитической химии, в частности к анализу минеральных вод для определения гидрокарбонатной щелочности в объектах исследования.
В аналитической химии известен проточно-инжекционный кондуктометрический способ определения гидрокарбонат-ионов в бутилированных питьевых водах различного солевого состава [1].
Недостатком этого метода является использование достаточно дорогостоящей установки, требующей опытных операторов. Метод также требует для проведения анализа достаточно больших объемов исследуемых образцов, что влияет на расход реактивов, и продолжительности эксперимента.
Известен способ получения экспериментальных данных для определения гидрокарбонат-ионов методами кондуктометрического и кислотно-основного титрования [2].
Однако известный способ имеет следующие недостатки. Использование одновременно кислотно-основного и кондуктометрического титрования для получения экспериментальных данных и определения содержания гидрокарбонат-ионов в питьевых минеральных водах не отменяет необходимости применения третьего (арбитражного) метода в случае возникающих разногласий, а это влияет на продолжительность эксперимента и требует дополнительного расхода как реактивов, так и исследуемых образцов.
Известен способ получения экспериментальных данных для определения гидрокарбонат-ионов титриметрическим методом [3] с помощью индикаторов. Титриметрический метод (pH-метрия) основан на нейтрализации гидрокарбонат-ионов соляной кислотой в присутствии индикатора метилового оранжевого.
Недостатком этого метода является расход больших объемов исследуемых образцов для проведения анализа.
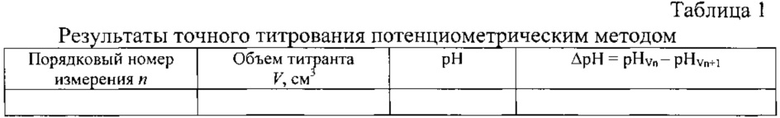
Наиболее близким техническим решением по способу определения гидрокарбонат-ионов, выбранным в качестве прототипа, является способ потенциометрического определения гидрокарбонатов в водах минеральных питьевых лечебных, лечебно-столовых и природных столовых (ГОСТ 23268.3.0-78) [3]. В выбранном прототипе для определения гидрокарбонат-ионов в минеральных водах предложен способ потенциометрического наибольшему изменению величины рН, фиксируемому с помощью стеклянного электрода. Способ реализуют с помощью установки, включающей прибор для измерения величины рН типа рН-метр-милливольтметр (рН-340, рН-121) или иономер ЭВ-74, электрохимическую ячейку (химический стакан, вместимостью 150 см3), электроды стеклянный и хлорсеребряный, магнитную мешалку, бюретку на 25 см3. Для проведения анализа в электрохимическую ячейку (химический стакан, вместимостью 150 см3), отмеривают от 1 до 100 мл минеральной воды с таким расчетом, чтобы в ней содержалось от 5 до 120 мг гидрокарбонат-ионов, доливают дистиллированной водой до 100 см (если отмеренная проба составляла менее 100 см3). В раствор погружают стеклянный и хлорсеребряный электроды. Титрование ведут 0,1н или 0,02н (при содержании в пробе менее 10 мг гидрокарбонат-ионов) раствором HCl из обычной бюретки с ценой деления не более 0,1 см3, перемешивая титруемый раствор магнитной мешалкой. Вначале проводят ориентировочное титрование с целью определения примерного положения эквивалентной точки. Для этого раствор титранта прибавляют порциями по 0,5-1,0 см3 и после прибавления каждой порции снимают показания прибора (величину рН). Вначале величина рН изменяется незначительно, но вблизи эквивалентной точки наблюдается резкий скачок рН. После скачка рН прибавляют еще 2-3 порции титранта и ориентировочное титрование заканчивают. Замечают объемы титранта (V2) и (V3), при которых наблюдалось максимальное изменение рН 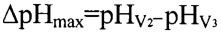 ). Последующее, точное титрование проводят вблизи эквивалентной точки, но, начиная с объема V2, титрант прибавляют по каплям и снова по максимальному скачку рН определяют объем титранта. Результаты оформляют в виде табл. 1
). Последующее, точное титрование проводят вблизи эквивалентной точки, но, начиная с объема V2, титрант прибавляют по каплям и снова по максимальному скачку рН определяют объем титранта. Результаты оформляют в виде табл. 1
Массовую концентрацию гидрокарбонат-ионов (X), мг/дм3, вычисляют по формуле
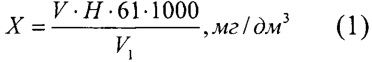
где V - объем раствора соляной кислоты, израсходованный на титрование;
Н - нормальность раствора соляной кислоты;
61 - грамм-эквивалент гидрокарбонат-ионов;
V1 - объем воды, взятый на анализ, см3.
Однако известный способ имеет следующие недостатки.
Недостатком этого метода является расход больших объемов исследуемых образцов для проведения анализа (до 100 см3 на анализ одной пробы воды), что влияет на расход реактивов. Для подтверждения правильности определения гидрокарбонат-ионов pH-потенциометрический метод (ГОСТ), используемый как химический метод, должен также сравниваться с данными, полученными другим методом, для которого также нужна своя установка, свои реактивы и растворы, приготовленные из них, пробы минеральной воды, что дополнительно приводит к удорожанию общего анализа и увеличению времени его проведения. В выбранном прототипе нет указаний о том, что контроль качества измерений и установление их метрологических характеристик проводится автоматизированным способом.
Изобретение направлено на повышение экспрессности, удешевления, ускорения и упрощения анализа.
Это достигается тем, что в способе получения экспериментальных данных для определения содержания гидрокарбонат-ионов методами потенциометрического и кислотно-основного титрования, включающем титрование пробы минеральной воды кислотным титрантом и измерение pH в растворе потенциометрической ячейки при добавлении каждой порции титранта (до 20 замеров), причем в качестве титранта при определении гидрокарбонат-ионов в минеральной воде используют раствор хлористоводородной кислоты (HCl); для этого 10 см3 минеральной воды вносят в электрохимическую ячейку с двумя электродами (стеклянным и хлорсеребряным), затем добавляют одну каплю 0,1%-ного раствора индикатора метилового оранжевого и магнитик для перемешивания раствора в ячейке на магнитной мешалке; электрохимическую ячейку подключают к рН-метру-милливольтметру (рН-150); бюретку для титрования заполняют раствором HCl, причем при определении содержания гидрокарбонат-ионов в питьевых минеральных водах предварительно устанавливают точную концентрацию титранта HCl по буре (натрий тетраборнокислый - Na2B4O7⋅10H2O); экспериментальные данные при титровании получают одновременно двумя методами - методом кислотно-основного титрования, основанным на нейтрализации гидрокарбонат-ионов HCl в присутствии индикатора метилового оранжевого, и потенциометрическим титрованием; для этого после прибавления каждой порции титранта фиксируют значение pH анализируемого раствора, что соответствует потенциометрическому титрованию, а после изменения цвета раствора в присутствии индикатора, а именно перехода розового цвета раствора в желтый, измеряют общий объем титранта (VТЭ) (метод кислотно-основного титрования); массовую концентрацию гидрокарбонат-ионов, X мг/л, рассчитывают по формуле:
X=VТЭ×Нт×61×1000/VВ,
где 61 - грамм-эквивалент гидрокарбонат-ионов, VТЭ - объем титранта, соответствующий конечной точке титрования в потенциометрическом методе или ТЭ в кислотно-основном титровании пробы минеральной воды, см3; VB - объем воды, взятый на анализ, см3; аналогично описанному выше анализируют еще 3 пробы воды с проведением статистической обработки полученных результатов.
Таким образом, реализовано назначение предлагаемого способа: получены экспериментальные данные (рН; VТЭ) для определения содержания гидрокарбонат-ионов в минеральных водах.
В развитии предлагаемого способа достигается дополнительно повышение экспрессности, уменьшение трудоемкости и повышение экономичности последующего определения содержания гидрокарбонат-ионов тем, что по экспериментальным данным, полученным одновременно обоими указанными методами, и оформленными в виде табл. 2,

(результаты определений и расчетов в потенциометрическом титровании проведены аналогично [4, стр. 456] с учетом наличия в растворе гидрокарбонат-ионов, обладающих щелочной реакцией) рассчитывают с последующим проведением статистической обработки содержание гидрокарбонат-ионов в анализируемой минеральной воде одновременно по известным математическим соотношениям метода кислотно-основного титрования (ГОСТ), связывающим содержание гидрокарбонат-ионов с измеренным после изменения цвета раствора общим объемом титранта, и по известным математическим соотношениям метода потенциометрического титрования (ГОСТ), связывающим содержание гидрокарбонат-ионов с совокупностью измеренных значений рН анализируемого раствора и соответствующих им объемов титранта.
Указанный расчет содержания гидрокарбонат-ионов в анализируемой минеральной воде по экспериментальным данным объема титранта в точке эквивалентности (ТЭ), полученным одновременно обоими методами, предпочтительно ведут с помощью технических средств вычисления, например, с помощью компьютера и компьютерной программы [5]. Компьютерная программа как таковая не является предметом предполагаемого изобретения. Однако использование автоматизированной программы для ЭВМ позволяет облегчить труд аналитика, заменив многие ручные, трудоемкие операции автоматическими, снизить погрешности отдельных операций, увеличить скорость проведения анализа, снизить его стоимость. Указанный расчет характеризуется тем, что использует, в частности, нижеприведенные известные соотношения 2-4 [6, гл. 1, § 10] для расчета объема титранта в точке эквивалентности по измеренным значениям рН.
Как было сказано выше, в потенциометрическом титровании конечную точку титрования (КТТ) находят по резкому скачку рН измерительного электрода, отвечающему моменту завершения реакции [3]. Для более четкого выявления особенностей процесса титрования и в прикладных целях чаще всего строят дифференциальные кривые титрования, откладывая по оси абсцисс объем прибавляемого титранта VT, а по оси ординат - первую производную от логарифма концентрации прибавляемого титранта dlgc(x)/dV(x). Такие кривые титрования обычно широко используются в физико-химических методах анализа, например, при потенциометрическом титровании. На дифференциальных кривых титрования положение точки эквивалентности (ТЭ) соответствует максимуму кривой и поэтому определяется достаточно надежно [4, стр. 69-70]; [7, стр. 62-63].
В предлагаемой заявке конечная точка титрования (КТТ) определяется графическим способом, связанным с построением по полученным экспериментальным данным дифференциальной кривой титрования по первой производной (см. табл. 2)
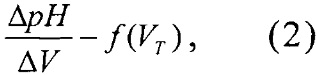
где положению ТЭ соответствует точка пересечения экстраполированных ветвей кривых [4, стр. 70, рис. 3,1-в; стр. 456, рис. 10, 1-6]; [7, стр. 63, рис. 3/2]. По построенной кривой титрования определяют объем титранта V(ТЭ) в ТЭ [4, стр. 455-456].
Использование дифференциальной кривой для определения ТЭ позволяет более точно определить объем титранта, соответствующий этому моменту, кроме того, надо отметить, такой способ определения ТЭ и объема титранта, соответствующего ей, является еще и очень наглядным.
Из найденного значения объема титранта получают точную нормальность титранта HCl для каждого метода, используя формулу:
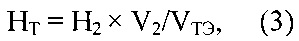
где HT - точная нормальность титранта (НСl); VТЭ - объем раствора титранта, соответствующий конечной точке титрования в потенциометрическом методе или ТЭ в кислотно-основном титровании, см3; Н2 - нормальность раствора буры; V2 - объем аликвоты буры в ячейке, см3.
Из найденного значения Нт точной нормальности титранта получают массовую концентрацию X гидрокарбонат-ионов, мг/л, по соотношению:
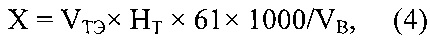
где 61 - грамм-эквивалент гидрокарбонат-ионов;
VТЭ - объем титранта, соответствующий конечной точке титрования в потенциометрическом методе или ТЭ в кислотно-основном титровании пробы минеральной воды, см3;
VB - объем воды, взятый на анализ, см3 (см. указанное соотношение 4 в [3, стр. 3]; [6, гл. 1, § 10]; [8, гл. 6.3.1.]).
Это обусловлено тем, что при потенциометрическом и кислотно-основном титровании в растворе протекает одна и та же кислотно-основная реакция взаимодействия гидрокарбонат-ионов с титрантом НСl, при этом титрование гидрокарбонат-ионов HCO3- (среда щелочная, рН 8,34) идет до Н2СО3 (среда кислая, рН раствора равен 4,25). Введение в такой раствор кислотно-основного индикатора метилового оранжевого, меняющего свою окраску при переходе из щелочной среды в кислую (розовая→желтая) и позволяющего тем самым фиксировать точку эквивалентности (ТЭ), а также замерять соответствующий ей (VТЭ) - объем титранта (кислотно-основное титрование), создает условия для одновременного получения экспериментальных данных в одной анализируемой пробе как потенциометрическим методом анализа, так и методом кислотно-основного титрования. Изменение окраски анализируемого раствора не сказывается на получении экспериментальных данных методом потенциометрического титрования, так как этот метод можно использовать для проведения анализа в мутных и цветных растворах. Получение экспериментальных данных одновременно двумя методами в присутствии индикатора в пробе минеральной воды обеспечивает достижение основной части технического результата - ускорение и упрощение анализа, повышение экспрессности, уменьшение трудоемкости и удешевлении анализа.
В развитии предложенного способа одновременный расчет содержания гидрокарбонат-ионов с их статистической обработкой по полученным экспериментальным данным обоими методами с помощью
автоматизированной программы для ЭВМ [5] обеспечивает дополнительное повышение экспрессности, уменьшение трудоемкости, упрощение и удешевление анализа.
Исследования, проведенные по источникам патентной и научно-технической информации показали, что заявляемый способ одновременного получения экспериментальных данных и определения гидрокарбонат-ионов методами потенциометрического и кислотно-основного титрования неизвестен в заявляемой совокупности признаков.
На фиг. 1 изображена установка, реализующая предлагаемый способ.
Она включает рН-метр-милливольтметр (рН-150) (измерительный блок) (1) с ручками управления (2) измерительным блоком (1); электрохимическую (потенциометрическую) ячейку (3) с двумя электродами (4) - стеклянным и хлорсеребряным; магнитик (5); бюретку вместимостью 25 см (6); штатив для бюретки (7); магнитную мешалку (8) и компьютер (9).
В качестве компьютерной программы может быть использована не только [5], но и любая известная программа математической обработки данных химического эксперимента, настроенная на работу в соответствии с обработкой этих экспериментальных данных согласно табл. 2 и известными из уровня техники соотношениями (2-4).
Способ осуществляется следующим образом.
Для определения содержания гидрокарбонат-ионов в минеральных водах заполняют бюретку (6) титрантом HCl с точно установленной предварительно концентрацией по буре. В ячейку (3) с двумя электродами (стеклянным и хлорсеребряным) вносят 10 см3 выбранной для анализа минеральной воды и 1 каплю 0,1%-ного раствора индикатора метилового оранжевого. На дно ячейки опускают магнитик (5), включают мешалку (8) и прибор рН-метр-милливольтметр (рН-150) (1), затем на передней панели прибора включают кнопку для снятия показаний рН (2), шкала в этом случае оказывается проградуированной в единицах рН, а на световом табло прибора (1) появится измеренное значение рН для исходного анализируемого раствора (минеральная вода). Раствор перемешивают до установления постоянного показания значения рН на табло прибора. Полученное значение рН записывают в таблицу и приступают к титрованию. Для этого к анализируемой пробе добавляют из бюретки (6) порциями титрант (от 0,05 до 1,0 см3) в зависимости от концентрации гидрокарбонат-ионов, указанной в сертификате качества торговой продукции и определяют после каждой добавленной порции рН раствора в ячейке (3). После добавления каждой порции титранта HCl раствор в ячейке перемешивают, замеряют рН, и все полученные экспериментальные данные записывают в таблицу. Титрование продолжают до тех пор, пока (в присутствие индикатора) раствор в ячейке не изменит свою окраску из розовой в желтую. В этот момент измеряют общий объем VТЭ по бюретке (6), соответствующий ТЭ при смене окраски индикатора (кислотно-основное титрование), и записывают его также в таблицу. После смены окраски раствора в ячейке (3) делают еще 5-7 замеров рН при титровании, записывая их каждый раз в таблицу. Таким образом, результаты всех измерений - рН и соответствующие им объемы (V) титранта и объем по бюретке при смене окраски раствора в ячейке VТЭ - записывают в таблицу. Окончив измерения, отключают прибор рН-метр-милливольтметр (1) и магнитную мешалку (8). Содержимое ячейки (3) выливают, а затем ополаскивают ее дистиллированной водой (не потеряв магнитик (5) из ячейки (3)). Затем экспериментальные данные, полученные одновременно с помощью двух методов, обрабатывают в соответствии с табл.2 и соотношениями (2-4) с помощью ПК (9), используя программу для ЭВМ [5], и таким образом определяют содержание гидрокарбонат-ионов в минеральной воде одновременно двумя методами - кислотно-основным (ГОСТ) и потенциометрическим (ГОСТ) титрованием. Далее проводят статистическую обработку с помощью этой же программы [5], подвергнув анализу предварительно 3-4 пробы взятой минеральной воды.
Способ иллюстрируется следующими примерами:
- установление точной концентрации титранта HCl с помощью натрия тетраборнокислого (буры);
- установление точной концентрации титранта HCl с помощью натрия тетраборнокислого (буры);
- анализ лечебно-столовой природной минеральной воды «Ессентуки 4» средней минерализации (7,0-10,0 г/дм3); (3400-4800 HCO3-);
- анализ лечебно-столовой природной минеральной воды «Рычал-Су» маломинерализованной (4,0-5,0 г/дм3); (2500-3000 HCO3-);
- анализ лечебно-столовой природной минеральной воды «Нарзан» маломинерализованной (до 3,0-4 г/дм3); (1000-1500 HCO3-);
- анализ лечебно-столовой природной минеральной воды «Evian» слабоминерализованной (0,3-0,75 г/дм3); (300-360 HCO3-);
- анализ питьевой артезианской природной воды «Аква-баланс» с низкой минерализацией (0,3-0,5 г/дм3). (200-300 HCO3-).
Пример 1
Установление точной концентрации титранта HCl с помощью натрия тетраборнокислого (буры).
Для этого 10 см3 0,1М (молярная концентрация эквивалента) раствора буры вносят в электрохимическую ячейку (3). Затем в электрохимическую ячейку (3) добавляют одну каплю 0,1%-ного раствора индикатора метилового оранжевого, туда же помещают два электрода - стеклянный (измерительный) и хлорсеребряный (вспомогательный). Бюретку для титрования (6) заполняют раствором с приблизительной 0,1М раствором хлористоводородной кислоты. В электрохимическую (потенциометрическую) ячейку (3) опускают магнитик (5) и включают магнитную мешалку (8) для перемешивания раствора в электрохимической ячейке (3). Включают прибор (1), затем тумблером (2) - световое табло на передней панели прибора (1). При титровании получают экспериментальные данные одновременно двумя методами - методом кислотно-основного титрования (нейтрализация) и потенциометрическим титрованием. После прибавления каждой порции титранта фиксируют по прибору (1) значение рН анализируемого раствора (потенциометрическое титрование), а после изменения цвета раствора в ячейке в присутствии индикатора (розовый цвет раствора переходит в желтый), измеряют объем титранта (VТЭ) по бюретке (6) (метод кислотно-основного титрования). После смены окраски раствора в ячейке (3) делают еще 5-7 замеров рН при титровании, записывая их каждый раз в таблицу. По экспериментальным данным, полученным одновременно обоими методами, рассчитывают с помощью ПК и автоматизированной программы для ЭВМ [5] точную концентрацию титранта HCl одновременно для каждого метода, используя формулу (2):
НT=Н2×V2/VТЭ
где HT - точная нормальность титранта (HCl); VТЭ - объем титранта, соответствующий конечной точке титрования в потенциометрическом методе или ТЭ в кислотно-основном титровании, см3; Н2 - нормальность буры; V2 - объем аликвоты буры в ячейке, см.
Концентрацию исходного ~0,1 моль/л раствора HCl уточняют еженедельно. Далее этот раствор HCl с установленной точной концентрацией по буре используют в анализе минеральных вод разной степени минерализации в качестве титранта.
Пример 2
В качестве объекта исследования выбрана лечебно-столовая природная минеральная вода «Ессентуки 4» средней минерализации (7-10 г/дм3) со следующим составом:
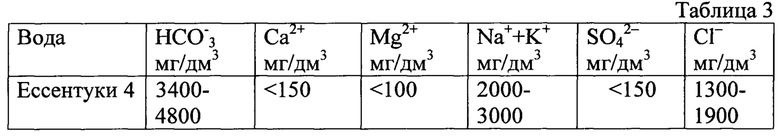
Работу выполняют на установке (фиг. 1). В качестве титранта при определении гидрокарбонат-ионов в минеральной воде «Ессентуки 4» используют раствор хлористоводородной кислоты (HCl), точную концентрацию которой устанавливают по буре (пример 1). Для этого 10 см3 минеральной воды «Ессентуки 4» вносят в электрохимическую ячейку (3). Затем в электрохимическую ячейку (3) добавляют одну каплю 0,1%-ного раствора индикатора метилового оранжевого, туда же помещают два электрода - стеклянный (измерительный) и хлорсеребряный (вспомогательный). Бюретку для титрования (6) заполняют раствором хлористоводородной кислоты. В электрохимическую ячейку (3) опускают магнитик (5) и включают магнитную мешалку (8) для перемешивания раствора в электрохимической ячейке (3), включают прибор (1), затем тумблером (2) - световое табло на передней панели прибора (1). При титровании получают экспериментальные данные одновременно двумя методами - методом кислотно-основного титрования (нейтрализация) и потенциометрическим титрованием. После прибавления каждой порции титранта фиксируют по прибору (1) значение рН анализируемого раствора (потенциометрическое титрование), а после изменения цвета раствора в присутствии индикатора (розовый цвет раствора переходит в желтый), измеряют общий объем титранта (VТЭ) по бюретке (6) (метод кислотно-основного титрования). После смены окраски раствора в ячейке (3) делают еще 5-7 замеров рН при титровании, записывая их каждый раз в таблицу. По экспериментальным данным, полученным одновременно обоими методами, рассчитывают содержание гидрокарбонат-ионов в анализируемой воде «Ессентуки 4» одновременно кислотно-основным методом (ГОСТ) и потенциометрическим титрованием (ГОСТ), используя для этих целей ПК и Далее аналогично описанному выше подвергают анализу еще 3 пробы воды «Ессентуки 4» каждая объемом 10 см3 (всего 4 пробы каждая объемом 10 см3). После получения экспериментальных данных их вводят в ПК в программу для ЭВМ [5], обрабатывают и далее с помощью этой же программы проводят их статистическую обработку.
В табл. 4 представлены данные определения содержания гидрокарбонат-ионов в минеральной воде «Ессентуки 4», полученные предложенным способом и обработанные на ПК с помощью специальной программы [5], действующей в соответствии с табл. 2 и с известными из уровня техники соотношениями (2-4).

Расчет показывает, что содержание гидрокарбонат-ионов в минеральной воде «Ессентуки 4» в обоих методах не превышают значений, заявленных в сертификате, а погрешность определения находится в пределах 3,2-4,6%. Статистическая обработка данных обоих методов показывает одинаковую воспроизводимость методов, незначимость систематической погрешности и возможность объединения обоих выборок двух методов в одну общую совокупность, причем относительная погрешность измерения в этом случае составляет 5,5%.
Пример 3
В качестве объекта исследования выбрана лечебно-столовая природная минеральная вода «Рычал-Су» средней минерализации (до 4,0-5,0 г/ мг/дм3) со следующим составом:

Подготовку, измерения и расчет проводили как в примере 2, для анализа брали 4 пробы воды «Рычал-Су», каждая объемом по 10 см3.
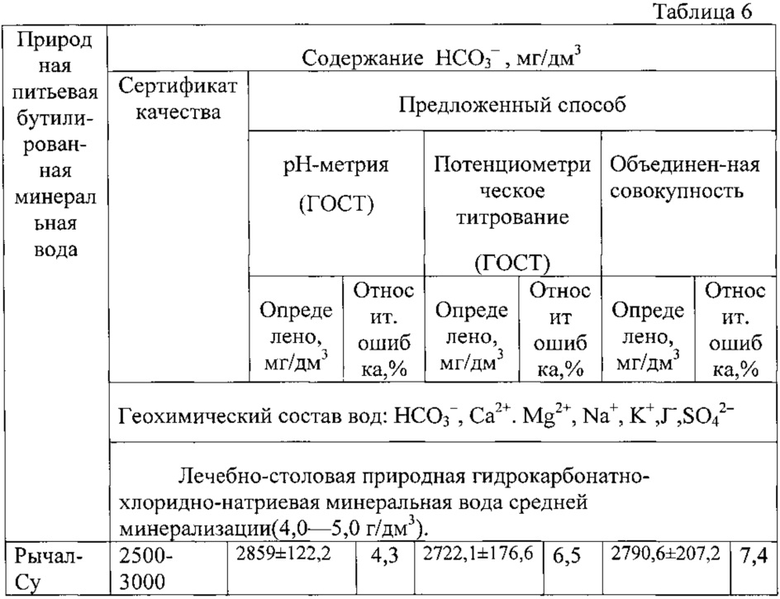
Расчет показывает, что содержание гидрокарбонат-ионов в минеральной воде «Рычал-Су» в обоих методах не превышают значений, заявленных в сертификате, а погрешность определения находится в пределах 4,3-6,5%. Статистическая обработка данных обоих методов показала одинаковую воспроизводимость методов, незначимость систематической погрешности и возможность объединения обоих выборок двух методов в одну общую совокупность, причем относительная погрешность измерения в этом случае составляет 7,4%.
Пример 4
В качестве объекта исследования выбрана лечебно-столовая природная маломинерализованная (до 3,0-4,0 г/ мг/дм3) минеральная вода «Нарзан» со следующим составом:
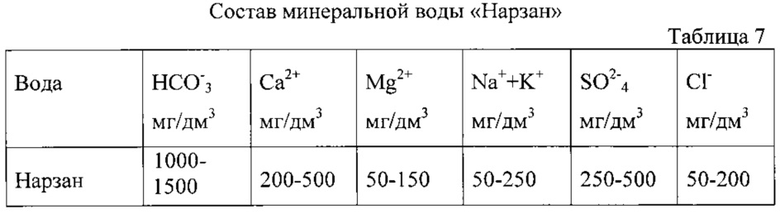
Подготовку, измерения и расчет проводили как в примере 2, только для анализа брали 4 пробы воды «Нарзан» - одну пробу воды объемом 10 см3 и 3 пробы воды объемами по 12 см3.
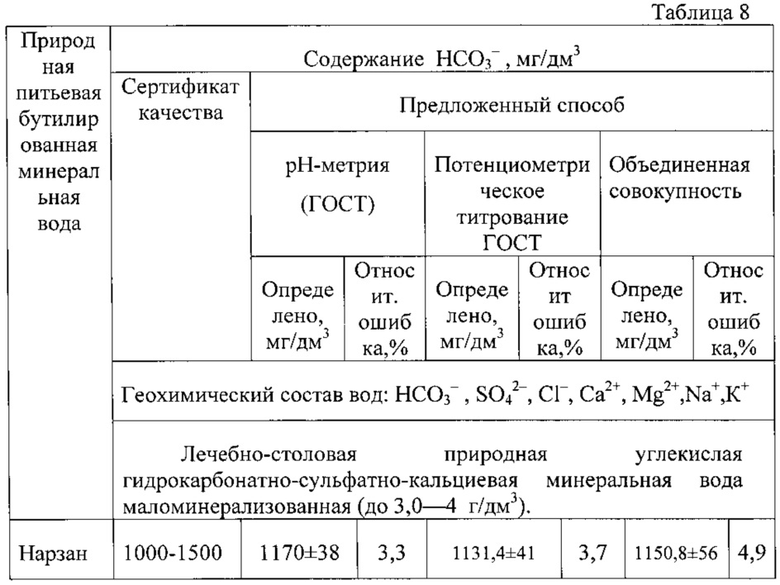
Расчет показывает, что содержание гидрокарбонат-ионов в минеральной воде «Нарзан» в обоих методах не превышают значений, заявленных в сертификате, а погрешность определения находится в пределах 3,3-3,7%. Статистическая обработка данных обоих методов показала одинаковую воспроизводимость методов, незначимость систематической погрешности и возможность объединения обоих выборок двух методов в одну общую совокупность, причем относительная погрешность измерения в этом случае составляет 4,9%.
Пример 5
В качестве объекта исследования выбрана лечебно-столовая природная слабоминерализованная (до 2,0-2,6 г/ мг/дм) минеральная вода «Evian» со следующим составом:

Подготовку, измерения и расчет проводили как в примере 2, только для анализа брали 4 пробы воды «Evian» - две пробы объемом по 10 см3 и две пробы объемами 12 и 14 см3 соответственно.
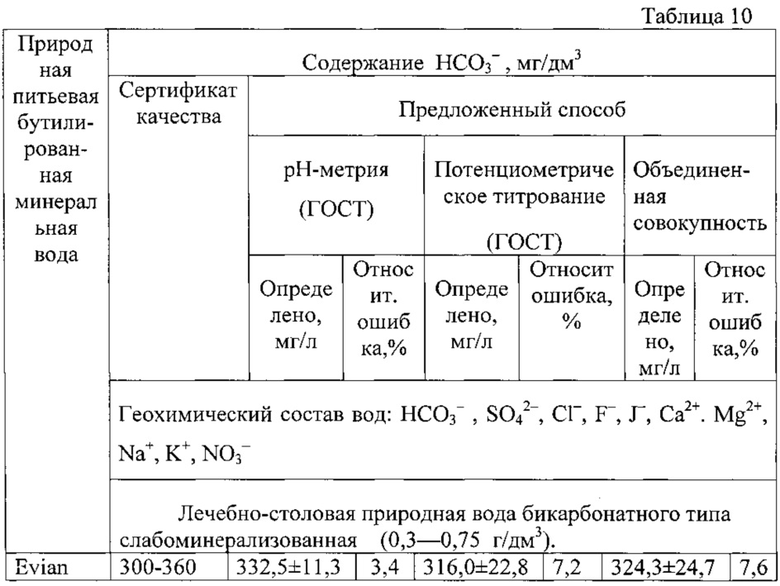
Расчет показывает, что содержание гидрокарбонат-ионов в минеральной воде «Evian» в обоих методах не превышают значений, заявленных в сертификате, а погрешность определения находится в пределах 3,4-7,2%). Статистическая обработка данных обоих методов показала одинаковую воспроизводимость методов, незначимость систематической погрешности и возможность объединения обоих выборок двух методов в одну общую совокупность, причем относительная погрешность измерения в этом случае составляет 7,6%.
Пример 6
В качестве объекта исследования выбрана питьевая артезианская природная вода «Аква-баланс» с низкой минерализацией (0,3-0,5 г/л) со следующим составом:

Подготовку, измерения и расчет проводили как в примере 2, только для анализа брали 4 пробы воды «Аква-баланс» две пробы объемами по 15 см3 и две пробы объемами 10 и 12 см3 соответственно.
В табл. 12 представлены данные определения содержания гидрокарбонат-ионов в минеральной воде «Аква-баланс», полученные предложенным способом и обработанные на ПК с помощью специальной программы [4].
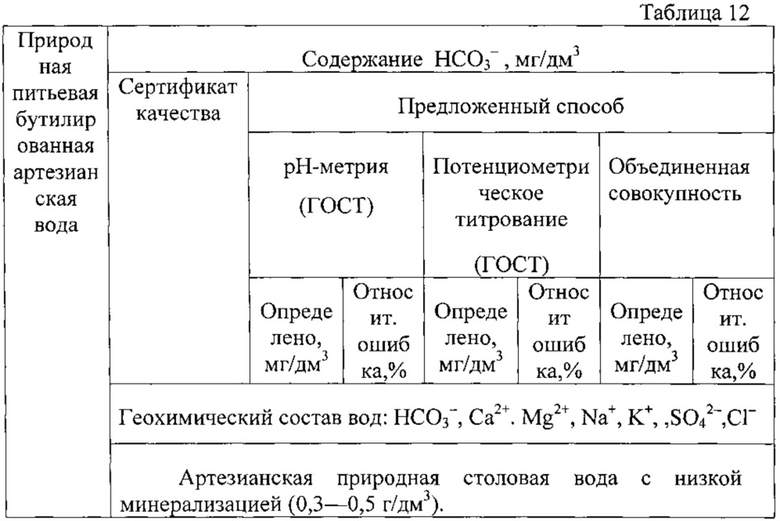

Расчет показывает, что содержание гидрокарбонат-ионов в артезианской питьевой воде «Аква-баланс» в обоих методах не превышают значений, заявленных в сертификате, а погрешность определения находится в пределах 3,1-7,1%. Проверка правильности заявленного способа проводилась путем сопоставления полученных данных метода нейтрализации (кислотно-основное титрование) и потенциометрического титрования. Сравнение результатов показывает одинаковую воспроизводимость методов, незначимость систематической погрешности и возможность объединения обоих выборок двух методов в одну общую совокупность, т.е. полученные данные обоих методов принадлежат к одной генеральной совокупности, причем относительная погрешность измерения составляет 7,0%.
В качестве компьютерной программы может быть использована не только [5], но и любая известная программа математической обработки данных химического эксперимента, настроенная на работу в соответствии с обработкой этих данных согласно табл. 2 и известными соотношениями (2-4). Авторы же изобретения использовали программу собственной разработки [5], действующую в соответствии с табл. 2 и известными из уровня техники соотношениями (2-4).
Использование предлагаемого способа получения экспериментальных данных одновременно двумя методами для определения содержания гидрокарбонат-ионов в минеральных водах с последующим одновременным расчетом их содержания с помощью специальной программы для ЭВМ [5] на ПК позволяет значительно экономить время, затрачиваемое на общий анализ, повышает экспрессность, уменьшает трудоемкость, упрощает и удешевляет анализ в отличие от прототипа, где для используемого потенциометрического анализа (который в этом случае используется как химический метод) необходим для проверки и сравнения полученных данных другой независимый метод, причем оба метода обычно проводятся раздельно; облегчить труд оператора, заменив многие ручные, трудоемкие операции автоматическими, снизить погрешности отдельных операций, увеличить скорость проведения анализа, снизить его стоимость; уменьшить количество пробы воды на один анализ со 100 мл (прототип) до 10-15 мл, использовать в работе на предлагаемой простой установке, например, менее квалифицированных сотрудников (лаборантов, студентов). В развитии предлагаемого способа процесс построения графиков в потенциометрическом титровании с последующим определением по ним конечной точки титрования (КТТ) и определения соответствующего ей объема титранта, а также определения содержания гидрокарбонат-ионов в минеральных водах одновременно обоими методами, в отличие от прототипа, полностью автоматизирован. В отличие от прототипа, в предлагаемом способе дальнейшая обработка результатов анализа с применением математической статистики осуществляется с помощью той же специальной программы [5] на ПК, которая позволяет проводить не только одновременную автоматизированную обработку результатов эксперимента каждого метода с учетом погрешности результата, но и проводить оценку достоверности результата по двум выборкам с использованием объединенной совокупности, что отсутствует в прототипе. Проведение всех расчетов с помощью специальной программы на ПК позволяет повысить эффективность работы пользователя, увеличить скорость расчета и обработки информации, сократить время ручного труда, минимизировать ошибки при проведении расчетов, обусловленные часто недостаточной квалификацией сотрудников. Таким образом, предлагаемый способ получения экспериментальных данных для определения содержания гидрокарбонат-ионов по сравнению с прототипом позволяет получать экспериментальные данные одновременно двумя методами (потенциометрическим (ГОСТ) и кислотно-основным титрованием (ГОСТ).
Источники информации
1. Елипашева Е.В., Куликов П.Н., Сергеева В.П., Сергеев Г.М. Проточно-инжекционный анализ питьевых вод. Кондуктометрическое определение минерализации и гидрокарбонатов. Ж. «Аналитика и контроль». Т. 15, №2, 2011 г., стр. 187-193.
2. Чернышева А.В., Стожко Н.Ю., Подшивалова Е.М., Татауров В.П. Патент на изобретение №2562546 С2, МПК G01N 31/16, G01N 27/26 Российская Федерация. Зарегистрировано 12 августа 2015 г. Способ получения экспериментальных данных для определения гидрокарбонат-ионов методами кондуктометрического и кислотно-основного титрования. Заявитель и патентообладатель ФГБОУ ВПО «Уральский государственный экономический университет». - №2013136626/15; заявл. 05.08.2013; опубл.: Бюл. №25. 10.09.2015.
3. ГОСТ 23268.3-78 Воды минеральные питьевые, лечебные, лечебно-столовые и природные столовые. Методы определения гидрокарбонат-ионов (с Изменением №1) // Государственный контроль качества минеральной воды и напитков: Сб. М.: Изд-во стандартов, 2003. С. 369-372 (прототип).
4. Харитонов Ю.Я. Аналитическая химия. Аналитика 2. Количественный анализ. Физико-химические (инструментальные) методы анализа. М.: «Высшая школа», 2001 г., с. 69-70, с. 454-456.
5. Подшивалова Е.М., Чернышева А.В., Стожко Н.Ю., Бортник Б.И. Программа одновременного автоматизированного определения содержания вещества или смеси веществ в объектах анализа методами кислотно-основного и потенциометрического титрования (Пара-Метод). Свидетельство о государственной регистрации программы для ЭВМ №2015617710. Зарегистрирована в Реестре программ для ЭВМ 21.07.2015 г. Бюл. №8, 2015 г.
6. Крешков А.П. Основы аналитической химии. Теоретические основы. Количественный анализ, книга 2. М.: «Химия», 1971, гл. 1, § 10.
7. Крешков А.П. Основы аналитической химии. Физико-химические и инструментальные методы анализа, книга 3. М.: «Химия», 1970, с. 62-63.
8. Муравьев А.Г. Руководство по определению показателей качества воды полевыми методами, гл. 6.3.1. Карбонаты, гидрокарбонаты, карбонатная жесткость и щелочность. Изд-е 3-е, - СПб: Крисмас +, 2004.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения экспериментальных данных для определения гидрокарбонат-ионов в минеральных водах методами кондуктометрического и потенциометрического титрования | 2018 |
|
RU2689404C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭКСПЕРИМЕНТАЛЬНЫХ ДАННЫХ ДЛЯ ОПРЕДЕЛЕНИЯ ГИДРОКАРБОНАТ-ИОНОВ МЕТОДАМИ КОНДУКТОМЕТРИЧЕСКОГО И КИСЛОТНО-ОСНОВНОГО ТИТРОВАНИЯ | 2013 |
|
RU2562546C2 |
| Способ количественного определения фосфатов, карбонатов и гидроксида натрия | 1989 |
|
SU1793369A1 |
| Способ определения борной кислоты | 1990 |
|
SU1725110A1 |
| СПОСОБ ИДЕНТИФИКАЦИИ ПОДЛИННОСТИ ВИНА | 2008 |
|
RU2384841C1 |
| Способ оперативной оценки качества винодельческой продукции | 2016 |
|
RU2631489C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ НЕИНОГЕННЫХ ПАВ В ИХ СУЛЬФАТИРОВАННЫХ ПРОИЗВОДНЫХ | 2007 |
|
RU2329497C1 |
| МЕТОД ОПРЕДЕЛЕНИЯ ЩЕЛОЧНОСТИ ПИЩЕВЫХ И НЕПИЩЕВЫХ ВЕЩЕСТВ | 2003 |
|
RU2234698C1 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ СОДЕРЖАНИЯ КАЛЬЦИЯ В ЖИДКИХ ЭКСТРАКТАХ ИЗ ЛЕКАРСТВЕННОГО РАСТИТЕЛЬНОГО СЫРЬЯ | 2012 |
|
RU2488818C1 |
| Способ определения состава реагентного аммиачно-карбонатного раствора | 1991 |
|
SU1784910A1 |

Изобретение относится к аналитической химии и может быть использовано для определения гидрокарбонат-ионов при анализе минеральных вод методом потенциометрического титрования, включающего титрование пробы минеральной воды кислотным титрантом и измерение рН в растворе потенциометрической ячейки при добавлении каждой порции титранта. В качестве титранта используют раствор хлористоводородной кислоты (НС1), точную концентрацию которого устанавливают по буре (натрий тетраборнокислый - Na2B4O7⋅10Н2О). Для этого10 см3 минеральной воды вносят в электрохимическую ячейку с двумя электродами - стеклянным (измерительным) и хлорсеребряным (вспомогательным), подключенными к рН-метру-милливольтметру (рН-150), затем добавляют одну каплю 0,1%-ного раствора индикатора метилового оранжевого. Раствор НСl добавляют из бюретки при перемешивании реакционной смеси на магнитной мешалке. При титровании экспериментальные данные получают одновременно двумя методами - методом кислотно-основного титрования (нейтрализация) и потенциометрическим титрованием, после прибавления каждой порции титранта раствор перемешивают до установления постоянного показания рН на табло прибора, затем фиксируют по прибору значение рН анализируемого раствора (потенциометрическое титрование), а после изменения цвета раствора в присутствии индикатора измеряют общий объем титранта (VТЭ) по бюретке (метод кислотно-основного титрования). Каждый анализ повторяют 3 раза. Полученные результаты вводят в программу компьютера, которая осуществляет расчет с проведением статистической обработки. Изобретение обеспечивает снижение стоимости, сложности и проведение экспресс-анализа минеральных вод. 1 ил., 12 табл.
Способ получения экспериментальных данных для определения содержания гидрокарбонат-ионов в минеральных водах методами потенциометрического и кислотно-основного титрования, включающий титрование пробы минеральной воды кислотным титрантом и измерение рН в растворе потенциометрической ячейки при добавлении каждой порции титранта, всего до 20 замеров, отличающийся тем, что в качестве титранта при определении гидрокарбонат-ионов в минеральной воде используют раствор хлористоводородной кислоты (HCl); для этого 10 см3 минеральной воды вносят в электрохимическую ячейку с двумя электродами (стеклянным и хлорсеребряным), затем добавляют одну каплю 0,1%-ного раствора индикатора метилового оранжевого и магнитик для перемешивания раствора в ячейке на магнитной мешалке; электрохимическую ячейку подключают к рН-метру-милливольтметру (рН-150); бюретку для титрования заполняют раствором HCl, причем при определении содержания гидрокарбонат-ионов в питьевых минеральных водах предварительно устанавливают точную концентрацию титранта HCl по буре (натрий тетраборнокислый - Na2B4O7⋅10H2O); экспериментальные данные при титровании получают одновременно двумя методами - методом кислотно-основного титрования, основанным на нейтрализации гидрокарбонат-ионов HCl в присутствии индикатора метилового оранжевого, и потенциометрическим титрованием; для этого после прибавления каждой порции титранта фиксируют значение рН анализируемого раствора, что соответствует потенциометрическому титрованию, а после изменения цвета раствора в присутствии индикатора, а именно перехода розового цвета раствора в желтый, измеряют общий объем титранта (VТЭ) (метод кислотно-основного титрования); массовую концентрацию гидрокарбонат-ионов, X мг/л, рассчитывают по формуле:
X=VТЭ×Нт×61x1000/VB,
где 61 - грамм-эквивалент гидрокарбонат-ионов; VТЭ - объем титранта, соответствующий конечной точке титрования в потенциометрическом методе или ТЭ в кислотно-основном титровании пробы минеральной воды, см3; VB - объем воды, взятый на анализ, см3; аналогично описанному выше анализируют еще 3 пробы воды с проведением статистической обработки полученных результатов.
| RU 22562546 C2, 10.02.2015 | |||
| Способ изготовления цветов из овощей | 1930 |
|
SU23268A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Стандартов, 01.01.1980, найдено 16.05.2017 в Интернете [on-line] на сайте http://docs.cntd.ru/document/1200022308 | |||
| ШПЕЙЗЕР Г.М | |||
| и др., Методическое пособие Руководство по химическому анализу вод, ГОУ ВПО ИГУ, Иркутск, 2006, стр | |||
| Способ использования делительного аппарата ровничных (чесальных) машин, предназначенных для мериносовой шерсти, с целью переработки на них грубых шерстей | 1921 |
|
SU18A1 |
| КРЕШКОВ А.П., Основы аналитической химии | |||
| Теоретические основы | |||
| Количественный анализ, М., 1971, стр.126-127, 416-418, найдено 16.05.2017 в Интернете [on-line] на сайте http://alnam.ru/book_a_chem2.php?id=48 | |||
| Деревянный коленчатый рычаг | 1919 |
|
SU150A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2017-09-25—Публикация
2016-05-31—Подача