Изобретение относится к химической промышленности, а именно к получению нового лиганда коррола, в частности 10-(5-иодванилил)-5,15-бис(пентафторфенил)коррола, который может быть использован для создания на его основе фотосенсибилизатора для фотодинамической терапии инфекционных и онкологических заболеваний.
Корролы - тетрапиррольные макрогетероциклические соединения, занимающие по структуре промежуточное положение между порфиринами и корринами [Erben, Ch. Metallocorroles: molecular structure, spectroscopy and electronic states. / Ch. Erben, S. Will, K.M. Kadish // In: The porphyrin handbook. - Ed. by Kadish K.M., Smith K.M., Guilard R. - Academic Press. - New York. - 2000. - V. 2. - P. 235-300]. Описанные в литературе синтетические методики [Gryko, D.T. Refined methods for the synthesis of meso-substituted A3- and trans-A2B-corroles. / D.T. Gryko, B. Koszarna // Org. Biomol. Chem. - 2003. -V. l. - P. 350-357] позволяют получать мезо-замещенные корролы различного строения - как с одинаковыми (А3-типа), так и с разными (А2В-типов) мезо-заместителями, в том числе различной электронной природы. "Несимметричные" корролы А2B-типа и их расширенные аналоги могут демонстрировать высокие квантовые выходы флуоресценции и выступать в качестве эффективных генераторов синглетного кислорода [Flamigni, L. Photoactive corrole-based arrays. / L. Flamigni, D.T. Gryko // Chem. Soc. Rev. - 2009. - V. 38. - P. 1635-1646; Shi, L. The heavy atom effect on photocleavage of DNA by mono-hydroxyl halogenated corroles. / L. Shi, H.Y. Liu, L.P. Si, K.M. Peng, L.L. You, H. Wang, L. Zhang, L.N. Ji, C.K. Chang, H.F. Jiang // Chinese Chem. Lett. - 2010. - V. 21. - P. 373-375], что позволяет рассматривать их в качестве потенциальных средств для фотодинамической терапии инфекционных и онкологических заболеваний.
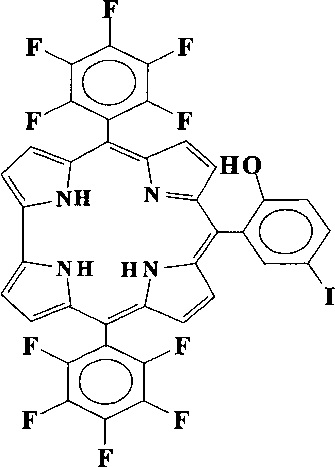
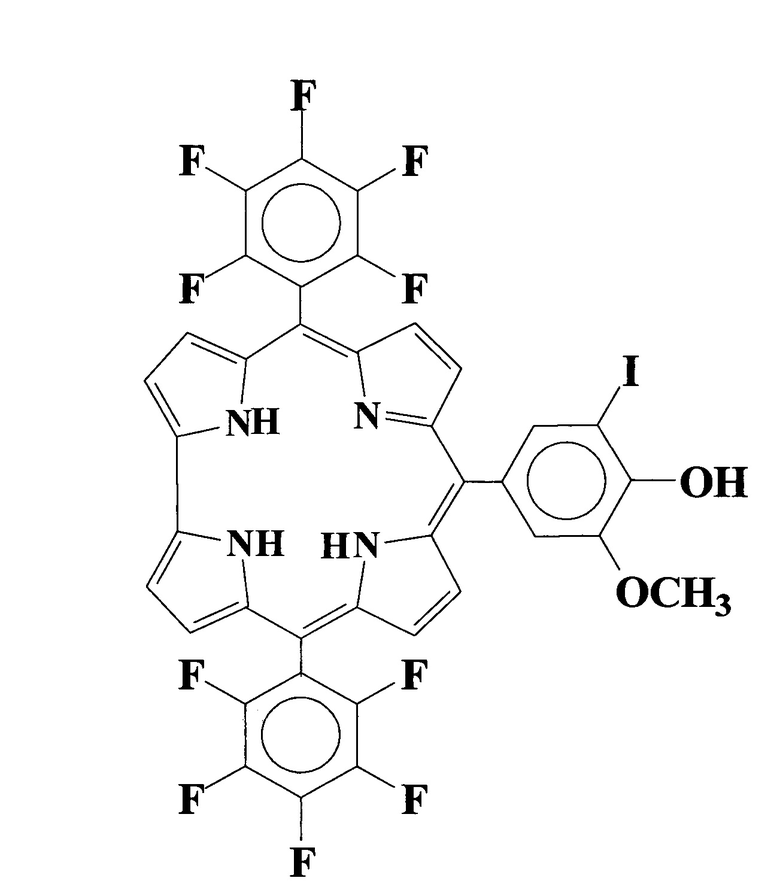
Наиболее близким структурным аналогом заявляемого соединения является 10-(2-гидрокси-5-иодфенил)-5,15-бис(пентафторфенил)коррол [You, L.L. Photophysical properties of the corrole photosensitizers. / L.L. You, H. Shen, L. Shi, G.L. Zhang, H.Y. Liu, H. Wang, L.N. Ji // Sci. China Phys. Mech. Astron. - 2010. - V. 53. -N. 8 - P. 1491-1496], приведенный выше. Данное соединение обладает выраженной способностью к генерации синглетного кислорода в неводных средах за счет снижения квантового выхода флуоресценции, что позволяет рассматривать его в качестве потенциального эффективного средства для ФДТ.
Основным недостатком данного соединения является высокая стоимость 2-гидрокси-5-иодбензальдегида и его малая стабильность, что значительно усложняет и удорожает получение коррола.
Технический результат предлагаемого изобретения заключается в создании нового коррола из стабильных при комнатной температуре веществ, имеющего один из самых высоких квантовых выходов синглетного кислорода в неводной среде, при низкой стоимости получаемого препарата и возможностью варьирования его амфифильности путем дальнейшей химической модификации.
Технический результат достигается путем синтеза 10-(5-иодванилил)-5,15-бис(пентафторфенил)коррола формулы:
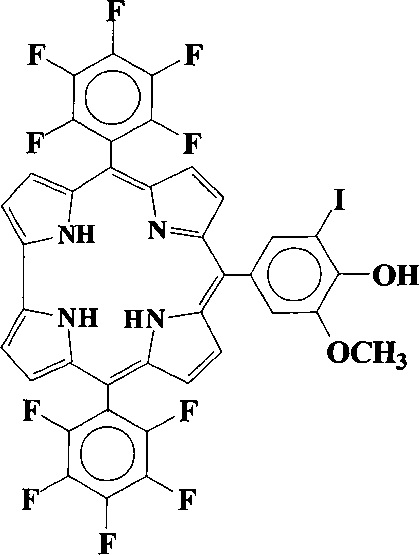 ,
,
проявляющий свойства потенциального сенсибилизатора для фотодинамической терапии антибактериальных инфекций и онкологических заболеваний.
Структура заявленного соединения доказана методами электронной спектроскопии, 1Н-ЯМР и масс-спектрометрии MALDI.
ЭСП: λmах (СНСl3) (lgε)/nm 412 (5.18),426 (пл), 526 (пл), 565 (4.38), 613 (4.17), 655 (пл); λmax (DMF) (lgε)/nm 425 (5.19), 441 (5.16), 589 (4.24), 628 (4.67).
ЯМР 1Ή (CDCl3, 500 МГц), δ, м.д. (J, Гц). 9.15 д (2Н, Н2, Н18, J 4.2), 8.76 д.д (4Н, Н7-8, Н12-13, J 17.2 и 7.7), 8.60 д (2Н, Н3, Н17, J 4.3), 8.16 и 7.69 оба с (1Н, 10-мезо-Ph), 4.04 с (3Н, 10-мезо-Рh-ОСН3), 1.28 с (1Н, 10-мезо-Ph-OH).
Масс-спектр, m/z: 877.92 (100%) [М]+, 878.93 (56%) [МН]+.
Данное изобретение позволяет получить следующие преимущества:
- использовать исходные вещества с высокой доступностью и стабильностью;
- варьировать амфифильность за счет модификации как гидрокси-, так и метоксигруппы, которая может быть переведена в гидроксигруппу в остатке 5-иодванилина;
- достигнуть более низкой стоимости получаемого препарата.
Для реализации способа используются следующие вещества:
1. Хлороформ ТУ 2631-001-29483781-04 изм. №1, 2
2. Метанол ГОСТ 6995-77
3. Дихлорметан ТУ 6-09-2662-77 изм. №1, 2, 3
4. Петролейный эфир ТУ 2631-074-44493179-01
5. Пиррол CAS 109-97-7
6. Соляная кислота (конц.) ГОСТ 3118-77 (СТ СЭВ 4276-83)
7. n-Хлоранил CAS 118-75-2
8. Пентафторбензальдегид CAS 653-37-2
9. Ванилин CAS 121-33-5
10. Иод ГОСТ 4159-79
11. Иодид калия ГОСТ 4232-74
12. Гидрокарбонат натрия ГОСТ 2156-76
13. Карбонат натрия ГОСТ 83-79
14. Трифторуксусная кислота ТУ 6-09-3877-80
15. Силикагель для колоночной хроматографии СAS 7631-86-9 или Cat №1.07734.9999.
Изобретение поясняется чертежами, где:
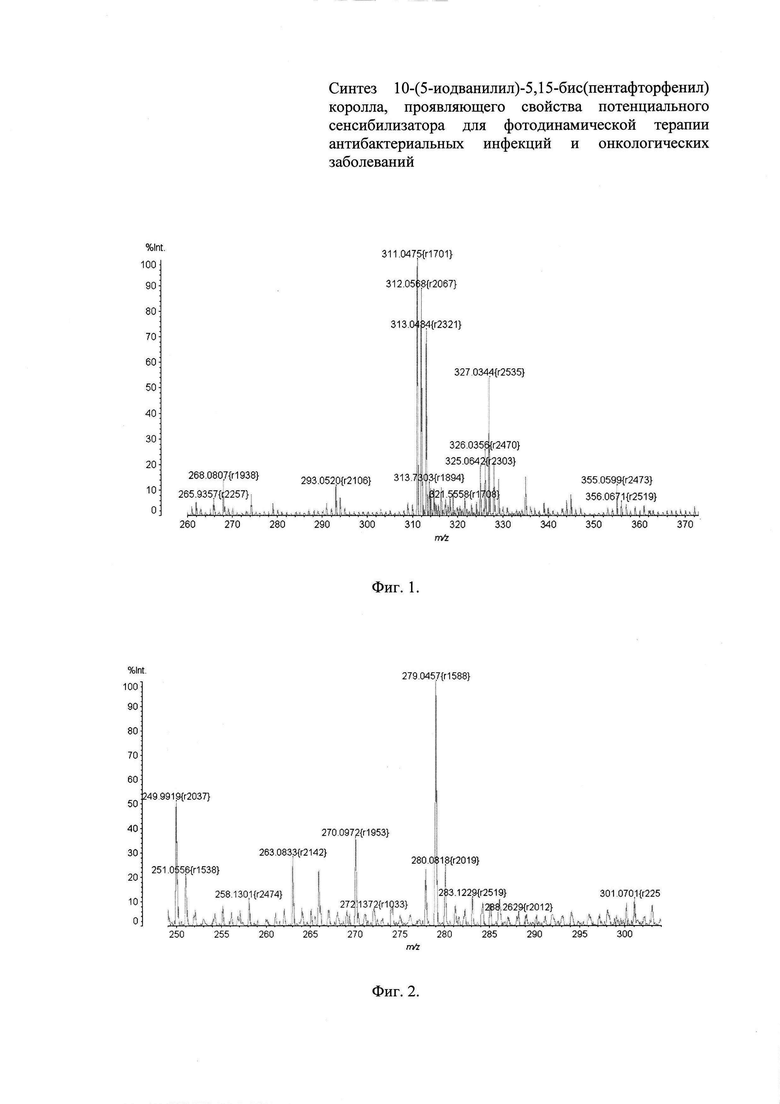
Фиг. 1 - Масс-спектр 5-(пентафторфенил)-дипирролилметана,
Фиг. 2 - Масс-спектр 5-иодванилина,
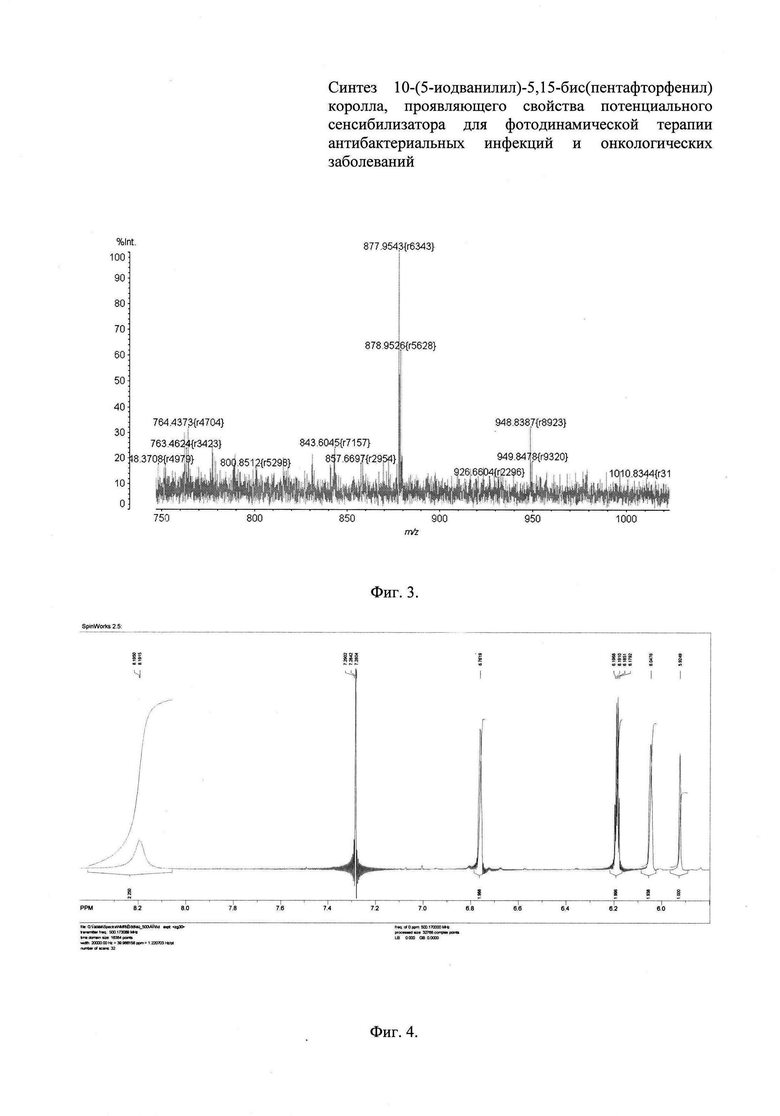
Фиг. 3 - Масс-спектр 10-(5-иодванилил)-5,15-
бис(пентафторфенил) коррола,
Фиг. 4 - 1Н ЯМР-спектр 5-(пентафторфенил)-дипирролилметана,
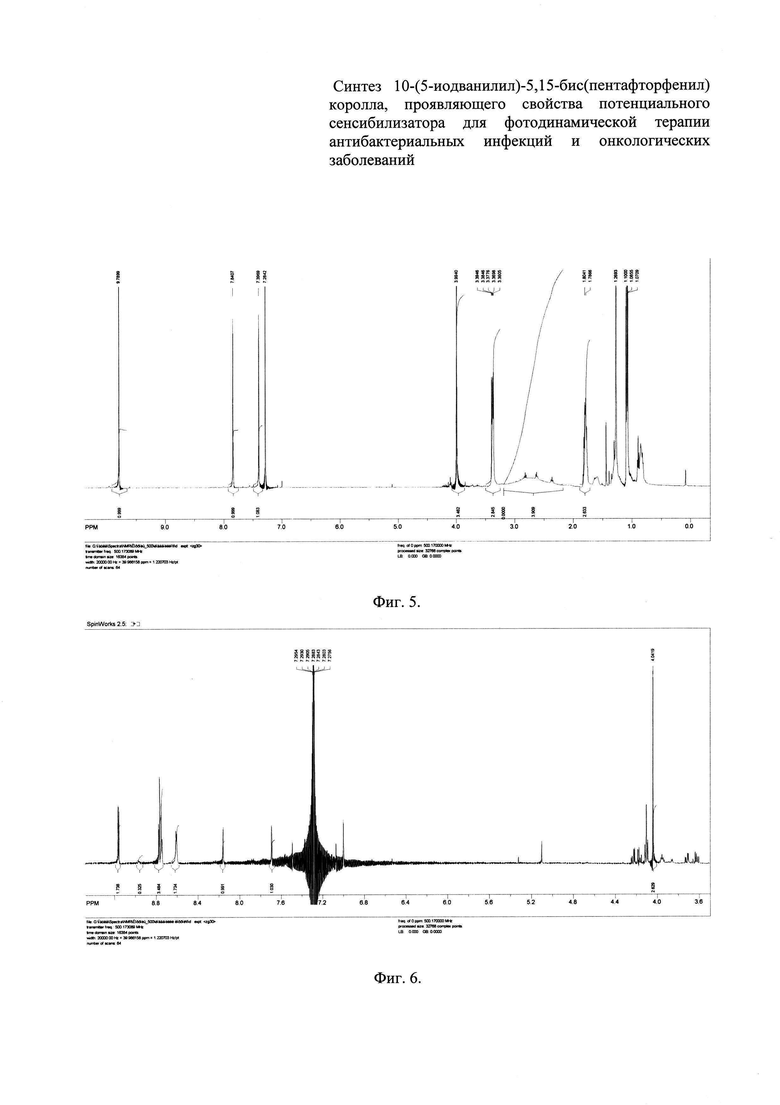
Фиг. 5 - 1HЯМР-спектр 5-иодванилина,
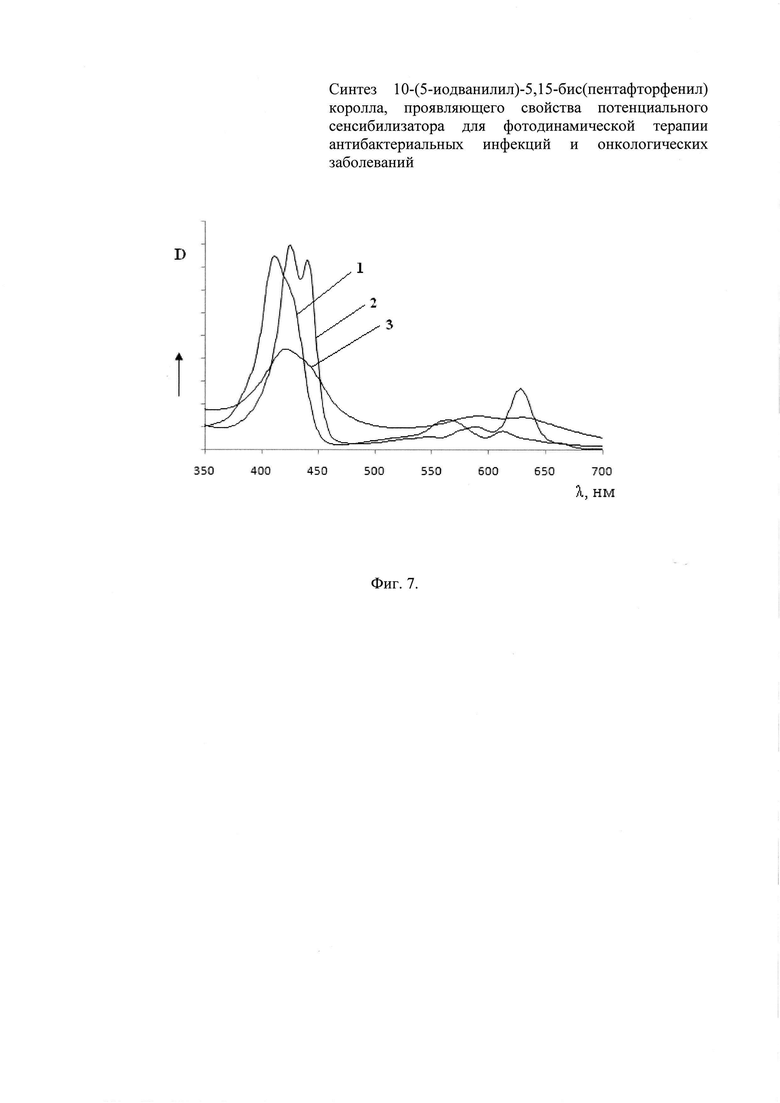
Фиг. 6 - 1Н ЯМР-спектр 10-(5-иодванилил)-5,15-бис(пентафторфенил) коррола,
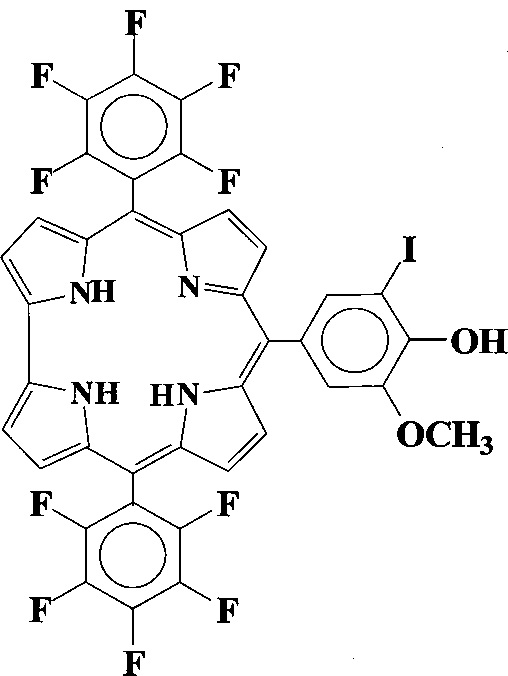
Фиг. 7 - Электронный спектр поглощения 10-(5-иодванилил)-5,15-бис(пентафторфенил) коррола в 1 - хлороформ, 2 - ДМФА, 3-10% водн. этанол с добавкой 1% ПАВ.
Заявленное соединение получают следующим образом.
Стадия 1. Синтез 5-(пентафторфенил)-дипирролилметана.
2 мл (16,2 ммоль) пентафторбензальдегида растворяют в 50 мл свежеперегнанного пиррола. К смеси добавляют 0,12 мл (1,62 ммоль) трифторуксусной кислоты. Реакционную массу перемешивают в течение 0,5 ч при комнатной температуре, после чего разбавляют 150 мл хлороформа и промывают на делительной воронке водой, водным раствором карбоната натрия (5,72 г Na2CO3⋅10Н2О в 400 мл воды) и еще четырехкратно - водой, для получения рН~7. Органический слой отделяют. Перегонкой на ротационном испарителе частично отгоняют хлороформ; при последующей отгонке растворителя под вакуумом отгоняют смесь хлороформа и пиррола, а в реакционной колбе оставляют коричневую смолу. Смолу растворяют в 120 мл метанола, и при последующем добавлении воды наблюдают образование беловатого осадка дипирролилметана, который отфильтровывают и высушивают. С целью дополнительной очистки раствор переосажденного продукта в метаноле обрабатывают активированным углем при комнатной температуре в течение 5-10 мин, после чего уголь отфильтровывают и проводят повторное переосаждение добавлением воды. Очищенный таким образом продукт образует бледно-розовые игольчатые кристаллы.
Выход: 2,01 г (40%). Спектр ЯМР lH (CDCl3, 500 МГц), δ, м.д. 8.19 уш.с (2Н, NHl, NH11), 6.76 с (2Н, Η2, Н10), 6.20-6.18 м (2Н, Н3, Н9), 6.05 уш.с (2Н, Η4, Н8). Масс-спектр, m/z: 311.05 (100%) [М1]+, 312.06 (90%) [М2]+, 313.05 (74%) [М3]+(изотопный эффект).
Стадия 2. Синтез 5-иодванилина.
10 г иодида калия и 5 г гидрокарбоната натрия растворяют в 200 мл воды. К полученному раствору при перемешивании добавляют 7,51 г (0,05 моль) ванилина. Далее к образованной взвеси медленно небольшими порциями добавляют 12,66 г (0,05 моль) кристаллического иода. Общее время синтеза составляет 2 ч. При этом уже к середине реакции наблюдают образование осадка 5-иодванилина, а раствор окрашен в интенсивный коричневый цвет за счет избытка иода. Осадок 5-иодванилина кремового цвета отделяют от раствора с помощью фильтра Шотта, пятикратно промывают водой и высушивают в сушильном шкафу при 50°С до постоянной массы.
Выход: 10,17 г (74%). Спектр ЯМР 1Ή (CDC13, 500 МГц), δ, м.д. 9.79 с (1Н, 3-СОН), 7.84 и 7.40 оба с (1Н, Η2, Н4), 3.99 с (3Н, 1-ОСН3), 3.20 - 2.20 под м (1Н, 6-ОН). Масс-спектр, m/z: 279.05 (100%) [МН]+.
Стадия 3. Синтез 10-(5-иодванилил)-5,15-бис(пентафторфенил)коррола.
153,1 мг (0,48 ммоль) 5-(пентафторфенил)-дипирролилметана и 68,2 мг (0,24 ммоль) 5-иодванилина растворяют в 24 мл метанола, затем к реакционной смеси добавляют раствор 1,2 мл концентрированной соляной кислоты в 24 мл воды. При этом наблюдают образование розового осадка. Реакционную массу перемешивают в течение 1 ч при комнатной температуре, после чего проводят экстракцию 20 мл хлороформа, отделение органического слоя и трехкратную промывку его водой. Полученный раствор в СНСl3 разбавляют 100 мл хлороформа. Затем к раствору добавляют 177,4 мг (0,72 ммоль) n-хлоранила (2,3,5,6-тетрахлор-1,4-бензохинона) и реакционную смесь подвергают кипячению в течение 1 ч. После этого реакционную смесь упаривают и подвергают колоночной хроматографии на силикагеле с использованием хлороформа в качестве элюента. Большая часть коррола при этом остается в первой фракции, однако для выделения чистого продукта подвергают повторной хроматографии. Повторную хроматографию проводят на силикагеле с использованием в качестве элюента смеси дихлорметан - петролейный эфир (1:1 об., затем 3:1 об.). Зона фиолетового цвета, идущая сразу после самой первой желтой зоны, представляет собой 10-(5-иодванилил)-5,15-бис(пентафторфенил)коррол. Раствор этой зоны собирают и упаривают; продукт переосаждают из дихлорметана с помощью петролейного эфира.
Выход: 56 мг (26%). ЭСП: λmax (СНСl3) (lgε)/nm 412 (5.18),426 (пл), 526 (пл), 565 (4.38), 613 (4.17), 655 (пл); λmax (DMF) (lgε)/nm 425 (5.19), 441 (5.16), 589 (4.24), 628 (4.67). Спектр ЯМР 1Н (CDCl3, 500 МГц), δ, м.д. (J, Гц). 9.15 д (2Н, Н2, Н18, J 4.2), 8.76 д.д (4Н, Н7-8, Н12-13, J 17.2 и 7.7), 8.60 д (2Н, Н3, Н17, J 4.3), 8.16 и 7.69 оба с (1H, 10-мезо-Ph), 4.04 с (3Н, 10-мезо-Рh-ОСН3), 1.28 с (1Н, 10-мезо-Рh-ОН)·Масс-спектр, m/z: 877.92 (100%) [М]+, 878.93 (56%) [МН]+.
Возможность использования заявленного соединения в качестве потенциального фотосенсибилизатора иллюстрируют фотофизическим показателем - временем жизни синглетного кислорода (Δτ) и его квантового выхода (ϕΔ). Определение фотофизической характеристики 10-(5-иодванилил)-5,15-бис(пентафторфенил)коррола в бензоле осуществлялось путем совместного фотоокисления тетрацена и коррола в бензоле в присутствии молекулярного кислорода при инициировании процесса светом от осветителя ОВС-1 с галогенной лампой КГМ 9-70. Облучение растворов проводилось в прямоугольной кювете из кварцевого стекла (1×1 см) при помощи комбинации стеклянного фильтра КС - 10 с коротковолновой границей пропускания при 610 нм и линзового конденсора. В соответствии с условиями эксперимента возбуждающий свет поглощался в области длинноволнового максимума коррола. При этом максимальная оптическая плотность в наиболее батохромных полосах видимого спектра поглощения тетрацена и коррола составляла около 1. Окисление контролировалось по уменьшению интенсивности их поглощения. Электронные спектры поглощения и кинетику фотоокисления измеряли на спектрофотометре «SPECORD-M40» (Carl Zeiss, ГДР).
Квантовый выход 1O2 (ϕΔ) определялся относительным методом. При использовании в качестве эталона сравнения диметиловый эфир Pd-мезопорфирина -IX (ϕΔэт=1) обнаружено, что при возбуждении раствора 10-(5-иодванилил)-5,15-бис(пентафторфенил)коррола в области его УФ-поглощения (337.1 нм) величина ϕΔ составляет 0.75 в бензоле. Значение квантового выхода 1O2 полученного коррола почти такое же, как у прототипа, однако, значительно выше, чем для фотосенсибилизаторов, применяемых в настоящее время в медицинских целях, для которых величина ϕΔ колеблется в пределах 0,4-0,6 [Bonnett R. Chemical aspects of photodynamic therapy. VHC Publ.: London, 2000. 285 p.].
| название | год | авторы | номер документа |
|---|---|---|---|
| 13(1)-N-(4'-N'N'-ДИМЕТИЛПИПЕРАЗИНИЛ ИОДИД) АМИД, 15(2), 17(3)-ДИМЕТИЛОВЫЙ ЭФИР ХЛОРИНА Е6 | 2022 |
|
RU2794092C1 |
| НИЗКОМОЛЕКУЛЯРНЫЕ ПРОИЗВОДНЫЕ КАРБОКСАМИДНЫХ ГАЛОГЕНИРОВАННЫХ ПОРФИРИНОВ, А ИМЕННО ХЛОРИНОВ И БАКТЕРИОХЛОРИНОВ, И ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2718923C2 |
| 5,15-ДИАМИНОТЕТРАБЕНЗОПОРФИРИНАТ ЦИНКА | 2011 |
|
RU2454417C1 |
| КОМПОЗИЦИЯ ДЛЯ ПРИМЕНЕНИЯ В ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ РАКА | 2016 |
|
RU2626600C1 |
| Периленилэтинилфенолы: новые противовирусные фотосенсибилизаторы | 2023 |
|
RU2835709C1 |
| КОВАЛЕНТНЫЕ КОНЪЮГАТЫ НА ОСНОВЕ ФТАЛОЦИАНИНОВ И МЕТИЛФЕОФОРБИДА а, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ИСПОЛЬЗОВАНИЯ В МЕДИЦИНЕ | 2019 |
|
RU2722309C1 |
| КАРБОРАНОВЫЕ ПРОИЗВОДНЫЕ 4,4-ДИФТОР-4-БОРА-3а,4а-ДИАЗА-s-ИНДАЦЕНА, ПРОЯВЛЯЮЩИЕ ПРОТИВООПУХОЛЕВУЮ АКТИВНОСТЬ | 2022 |
|
RU2789401C1 |
| СЕНСИБИЛИЗАТОР ДЛЯ ФОТОДИНАМИЧЕСКОГО РАЗРУШЕНИЯ КЛЕТОК ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ С ЕГО ИСПОЛЬЗОВАНИЕМ | 2004 |
|
RU2259200C1 |
| КВАТЕРНИЗОВАННЫЕ ФТАЛОЦИАНИНЫ И СПОСОБ ФОТООБЕЗЗАРАЖИВАНИЯ ВОДЫ | 2005 |
|
RU2281953C1 |
| ВОДОРАСТВОРИМОЕ ПРОИЗВОДНОЕ ХЛОРОФИЛЛА α, МОДИФИЦИРОВАННОЕ ФРАГМЕНТОМ МИРИСТИНОВОЙ КИСЛОТЫ | 2017 |
|
RU2680523C1 |
Изобретение относится к химической промышленности, а именно к получению нового коррола, в частности 10-(5-иодванилил)-5,15-бис(пентафторфенил)коррола, который может быть использован в качестве сенсибилизатора для фотодинамической терапии инфекционных и онкологических заболеваний. 7 ил., 1 пр.
10-(5-иодванилил)-5,15-бис(пентафторфенил)коррол формулы:
| WO 2015043533 A1, 02.04.2015 | |||
| LiLi You et al,"Photophysical properties of the Corrole photosensitizers", Science China Physics, Mechanics and Astronomy,August 2010, Volume 53, Issue 8, pp 1491-1496 | |||
| Каримов Дмитрий Рустамович "Синтез, спектральные характеристики и реакционная способность корролов с различным типом функционального замещения", Aвтореферат диссертации на соискание ученой степени кандидата химических наук, Иваново, 2011. |
Авторы
Даты
2017-10-12—Публикация
2016-07-20—Подача