Изобретение относится к химической промышленности, а именно, к новым биологически активным соединениям хлоринового ряда, обладающим антибактериальным действием, конкретно, к водорастворимому производному хлорофилла а, модифицированному фрагментом миристиновой кислоты с катионными группами формулы I.
Заявляемое соединение представляет интерес в качестве антимикробного препарата и может быть использовано в медицине.
В литературе описаны различные производные хлорофила a [Dmitri V. Belykh, Irina S. Tarabukina, Ivan V. Gruzdev and Aleksandr V. Kutchin. //Mendeleev Communications. 2007. №6. P. 340-342.; Белых, Д.В., Тарабукина, И.С., Груздев, И.В., Кучин, А.В. // Журнал органической химии. 2009. Т. 45. Вып. 1. С. 1-9.; Белых Д.В., Копылов Е.А., Груздев И.В., Кучин А.В. // Журнал органической химии. 2010. Т. 46. №4. С. 584-592; Белых Д.В., Тарабукина И.С., Матвеев Ю.С., Кучин А.В. // Патент РФ №2310658. Опубл. 20.11.2007, и др.].
Известно, что порфирины, содержащие катионные группы могут быть использованы в качестве противоопухолевых фотосенсибилизаторов (ФС) [Gyulkhandanyan G., Ghambaryan S., Amelyan G., Ghazaryan R., Arsenyan F., Gyulkhandanyan A. //Proc. of SPIE. - 2006. - Vol. 6139. - P. 613911-1 - 613911-7; Tovmasyan A., Ghazaryan R., Sahakyan L., Gasparyan G., Babayan N., Gyulkhandanyan G. // J. Of Biomolecular Structure and Dynamics. - 2007. - Vol. 24(6). - P. 682-683; Ковалева О.А. - Автореферат канд. физ.-мат. наук специальность 03.01.02. - биофизика Москва 2014]. Наличие катионных групп способствует направленному поражению митохондрий, что повышает эффективность действия ФС, вызывая апоптоз раковых клеток.
Ранее синтезированы катионные производные хлорина е6 с различным расположением заряженных групп [Gushchina O.I., Larkina Е.А., Mironov A.F. // Macroheterocycles. 2014. V. 7. N 4. P. 414-416; DOI: 10.6060/mhc140931g; Tarabukina I.S., Startseva O.M., Patov S.A., Belykh D.V. // Macroheterocycles. 2015. V. 8. N 2. P. 168-176; DOI: 10.6060/mhc150456b].
Формирование катионных заместителей на периферии хлоринового макроцикла осуществляли алкилированием предварительно внедренных диметиламино-групп действием метилйодида путем аминометилирования винильной группы (действие бис(N,N-диметиламино)метана и реагента Эшенмозера), а так же размыканием экзоцикла метилфеофорбида а действием N,N-диметилэтилендиамина Комбинация этих реакций была использована для синтеза производных хлорина е6 с различным количеством катионных групп и их расположением в макроцикле.
Анализ литературы по исследованию антибактериальной активности катионных производных [Кустов А.В., Гарасько Е.В., Белых Д.В., Худяева И.С., Старцева О.М., Макаров В.В., Стрельников А.И., Березин Д.Б. // Успехи современного естествознания. 2016. №12 (часть 2) С. 263-268 DOI: 10.17513/use.36297] свидетельствует о том, что их антибактериальное действие можно усилить путем введения в молекулу фрагментов, повышающих их мембранотропность, в частности, фрагмента миристиновой кислоты.
Ближайшими структурными аналогами заявляемого соединения являются 3(1),3(2)-бис(N,N,N-триметиламиноиодид)хлорин е6 13(1)-N-метиламид-15(2),17(3)-диметиловый эфир II и его производные III-VII, а также 3(1),3(2)-бис(N,N,N-триметиламиноиодид)хлорин е6 13(1)-N-2-метиламид-15(2)-диэтиленгликоль-17(3)-метиловый эфир и его производные общей формулы VIII, описанные в литературе [Tarabukina I.S., Startseva О.М., Patov S.A., Belykh D.V. //Macroheterocycles. 2015. V. 8. N 2. P. 168-176; DOI: 10.6060/mhc150456b].
Авторами /Tarabukina I.S., Startseva O.M., Patov S.A., Belykh D.V. // Macroheterocycles. 2015. V. 8. N 2. P. 168-176; DOI: 10.6060/mhc150456b/ показано, что некоторые из полученных дикатионных хлоринов могут образовывать истинные растворы в воде, однако внедрение в амидную группу гидрофобных заместителей (начиная с двух метальных или одной этильной группы) приводит к потере растворимости. Катионные производные с полиэфирными фрагментами на периферии макроцикла VIII нерастворимы в воде, несмотря на наличие гидрофильных фрагментов.
Изобретательской задачей является получение катионных водорастворимых антибактериальных производных хлорина е6 на основе метилфеофорбида а с усиленным антибактериальным действием, повышенной мембранотропностью и способностью к направленному поражению митохондрий, что повысит эффективность действия ФС, вызывая апоптоз раковых клеток.
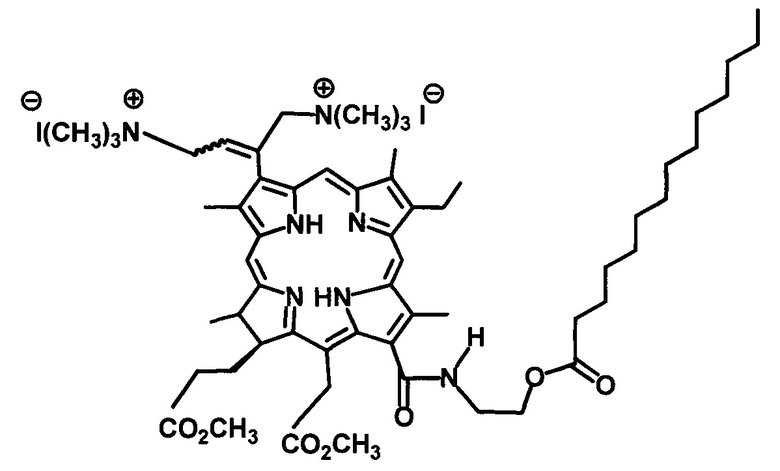
Поставленная задача решена синтезом водорастворимого производного хлорофилла a, модифицированного фрагментом миристиновой кислоты с катионными группами, синтезированного согласно схемы, которое может быть использовано в качестве потенциального фотосенсибилизатора для антибактериальной ФДТ.
Схема
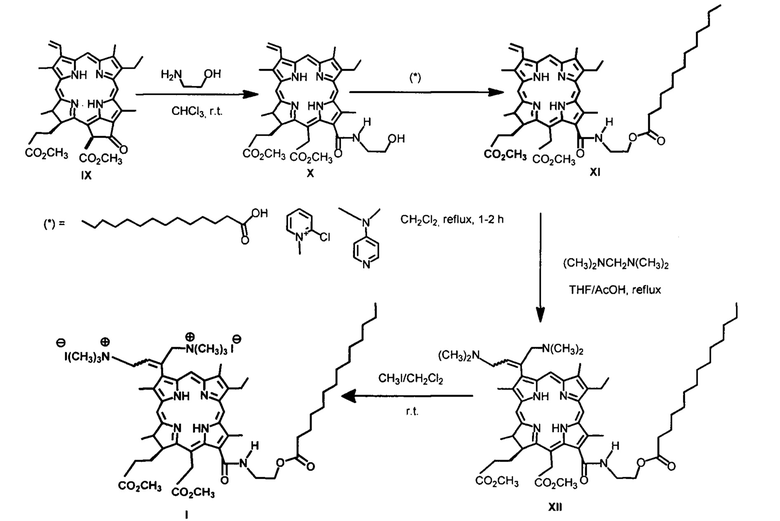
Дикатионное производное хлорина (I) - 3(l),3(2)-бис-(N,N,N-триметиламинометилиодид)хлорин е6 13(1)-N-(2-миристоксиэтил)15(2),17(3) диметиловый эфир - было получено при аминометилировании непосредственно - 13(1)-N-(2-миристоксиэтил)-амид-15(2),17(3)диметилового эфира хлорина е6 (XI) действием бис(N,N-диметиламино)метана в присутствии кислоты. Как и во всех аналогичных реакциях, образуется дважды аминометилированное производное в виде смеси цис- и транс-изомеров [Белых Д.В., Тарабукина И.С., Кучин А.В. // Патент №2337103. Опубл. 27.10.2008. Бюл. №32]. Кватеринизация диметиламинометильного производного (XII) - 3(1),3(2)-бис-(N,N-диметиламинометил) хлорин е6 - 13(1)-N-(2-миристоксиэтил)-амид 15(2),17(3) диметилового эфира была проведена действием йодметана в хлористом метилене при комнатной температуре. Выход дикатионного хлорина - 3(1),3(2)-бис-(N,N,N-триметиламинометилиодид)хлорин е6 13(1)-N-(2-миристоксиэтил)15(2),17(3) диметилового эфира (I) на этой стадии количественный.
Таким образом, синтезировано новое катионное производное хлорина е6 с фрагментом миристиновой кислоты в молекуле.
Строение полученных соединений доказано при помощи ЯМР, электронной и ИК-спектроскопии, а также масс-спектрометрии.
В масс-спектрах всех полученных соединений наблюдаются пики, соответствующие молекулярному иону исследованных соединений. Хлориновый хромофор проявляется в электронных спектрах поглощения всех соединений. Наличие фрагмента миристиновой кислоты проявляется в спектре ЯМР 1Н, соотношение интенсивностей мультиплетов протонов соответствует количеству фрагментов миристиновой кислоты в молекуле.
Таким образом, полученное водорастворимое производное хлорофилла а, модифицированное фрагментом миристиновой кислоты и катионными группами позволяет синтезировать потенциальные фотосенсибилизаторы для антибактериальной фотодинамической терапии. Изобретение позволяет получить следующие преимущества:
1). Наличие катионных групп способствует направленному поражению митохондрий, что повышает эффективность действия ФС, вызывая апоптоз раковых клеток; повышает растворимость, снижает тенденцию гидрофобной ассоциации (стекингу); повышает сродство к ядерной ДНК.
2). Антибактериальное действие катионных производных усилено путем внедрения в молекулу фрагментов, повышающих их мембранотропность (фрагмента миристиновой кислоты), что повышает их эффективность в качестве фотосенсибилизаторов за счет фотоповреждения мембранных структур клеток-мишеней.
Краткое описание чертежей:
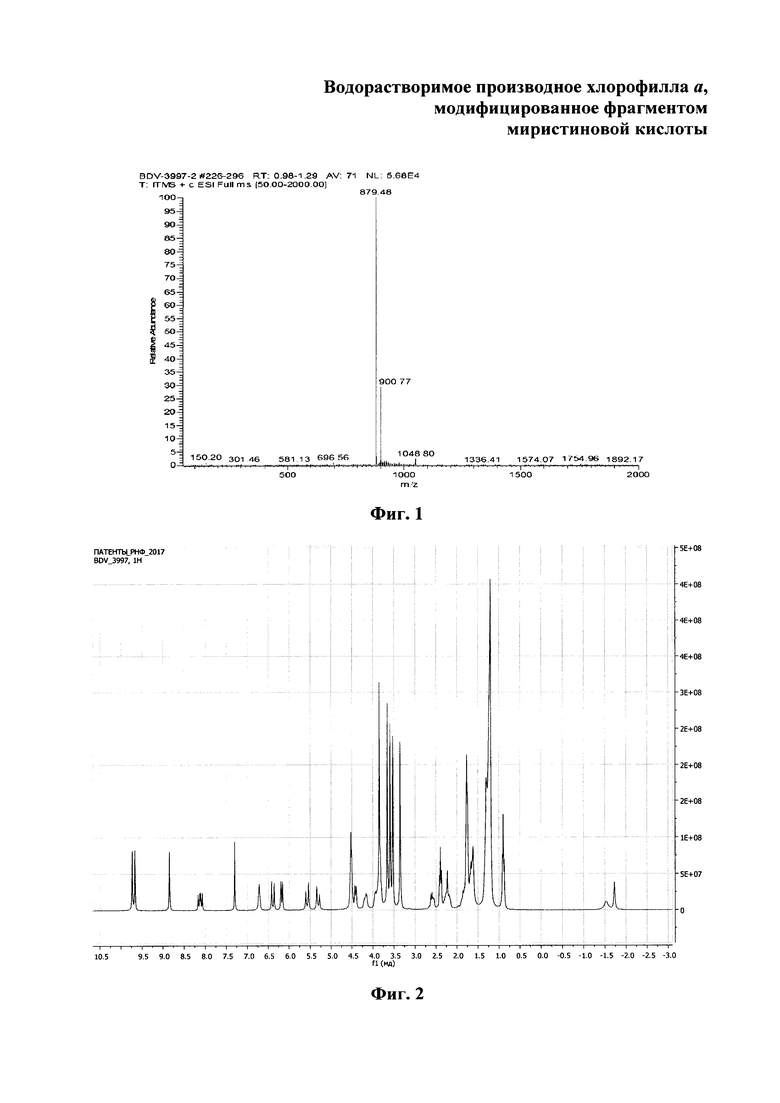
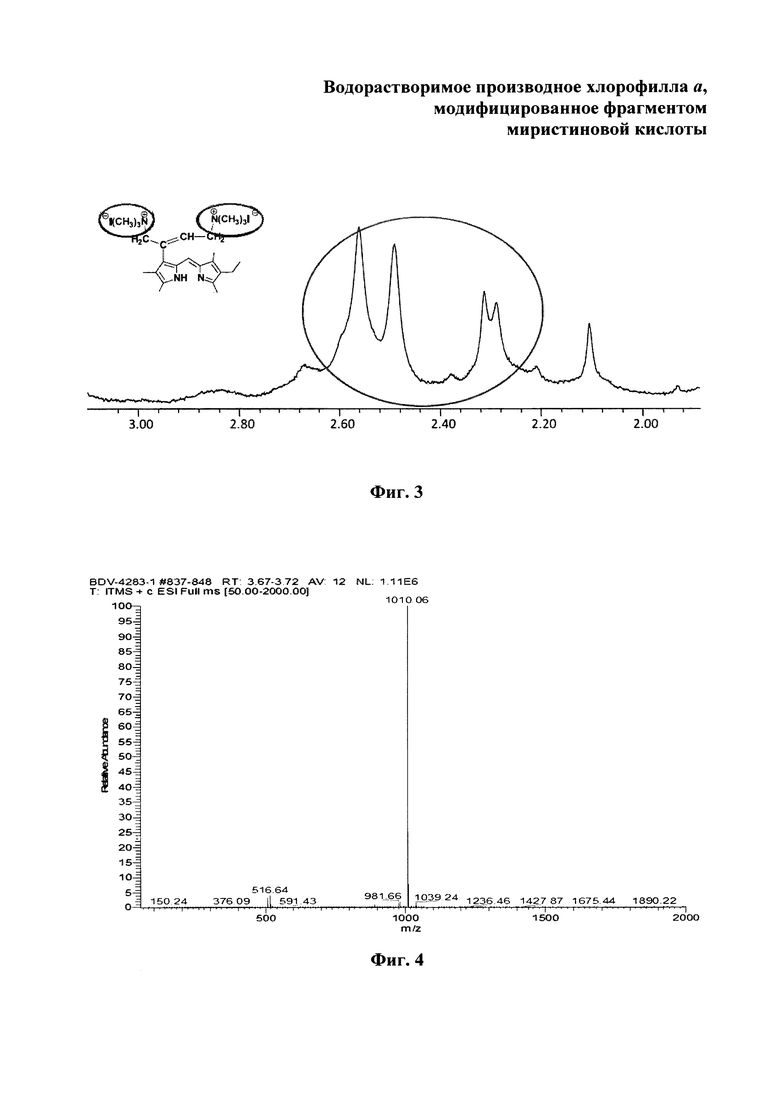
На фиг. 1 изображен масс-спектр (ESI) 13(1)-N-(2-миристоксиэтил)-амид-15(2),17(3)диметилового эфира хлорина е6 (XI); на фиг. 2 - 1Н ЯМР соединения (XI) - 13(1)-N-(2-миристоксиэтил)-амид-15(2),17(3)диметилового эфира хлорина е6; на фиг. 3 - фрагмент 1Н ЯМР 3(1),3(2)-бис-(N,N,N-триметиламинометилиодид) хлорин е6 13(1)-N-(2-миристоксиэтил) 15(2),17(3) диметилового эфира (I) в области 3.2-1.8 ppm в CDCl3, 300 МГц; на фиг. 4 - масс-спектр (ESI) 3(1),3(2)-бис-(N,N,N-триметиламинометилиодид) хлорин е6 13(1)-N-(2-миристоксиэтил)15(2),17(3) диметилового эфира (I).
Для синтеза заявляемого соединения используют следующие вещества:
- метилфеофорбид а (соединение IX, схема), полученный по известной методике [Патент РФ №2490273 от 20.08.2013 Б.И. №23];
- 4-диметиламинопиридин (DMAP) - 4-(Dimethylamino)pyridine ≥99% CAS Number 1122-58-3 SIGMA-ALDRICH, 522805 ALDRICH PubChem Substance ID 24874122;
- хлористый метилен - ГОСТ 9968-86;
- 2-хлор-N-метилпиридиний йодида - 2-Chloro-1-methylpyridinium iodide, 97% А12820 CAS 14338-32-0 Alfa Aesar;
- миристиновая кислота - ООО Вектон-М CAS №544-63-8;
- четыреххлористый углерод - тетрахлорметан, CCl4, СAS №56-23-5 ГОСТ 20288-74 CCl4;
- ацетон - ЗАО «ЭКОС-1» (ХЧ) ТУ 2633-018-44493179-98 с изм. №1, 2;
- метиловый спирт - ГОСТ 2222-95;
- соляная кислота- кислота соляная ХЧ ГОСТ 3118-77 «Аквахим»;
- безводный сульфат натрия - натрий сернокислый безводный, ГОСТ 4166-76, CAS No: 7757-82-6, ООО "ХПК-ГРУПП";
- бис(N,N-диметиламино)метан - Bis(dimethylamino)methane, CAS номер: 51-80-9, Sigma-Aldrich;
- 4-диметиламинопиридин (DMAP) - N,N-Dimethylpyridin-4-amine, CAS Number 1122-58-3, Sigma-Aldrich;
- тетрагидрофуран (ТГФ), 99,9% - Tetrahydrofuran, ООО "Кемикал Лайн";
- йодметан - Iodomethane CAS 74-88-4 I8504 SIGMA, Sigma-Aldrich;
- хлороформ - трихлорметан (стабилизированный 0,6-1,0% масс. этанола) чистый для анализа (ЧДА), ЗАО «ЭКОС-1», СAS: 67-66-3, ТУ 2631-066-44493179-01.
Заявляемое соединение может быть получено следующим образом.
Пример 1. Синтез 13(1)-N-(2-миристоксиэтил)-амид 15(2),17(3) диметилового эфира хлорина е6 (XI). К раствору 50 мг производного X в 20 мл хлористого метилена добавляют 25 мг 4-диметиламинопиридина (DMAP), 25 мг 2-хлор-N-метилпиридиний йодида и 12.5 мг миристиновой кислоты и кипятят в колбе с обратным холодильником в течение 60 минут (контроль ТСХ, элюент CCl4 : ацетон = 4:1). Реакционную смесь переносят в делительную воронку и отмывают от избытка DMAP и продуктов превращения 2-хлор-N-метилпиридинйодида 7% соляной кислотой, затем кислоту отмывают дистиллированной водой до нейтральной реакции промывных вод. Полученный раствор сушат над безводным сульфатом натрия и упаривают при пониженном давлении при температуре 45°С. Остаток после упаривания хроматографируют на силикагеле (элюирование смесью CCl4 : ацетон в соотношениях от 40:1 до 1:1). Элюат, содержащий основное вещество, упаривают при пониженном давлении.
Выход: 27.0 мг (44%)
Масс-спектр (ESI) m/z = 879.4 [М+Н]+ (C52H71N5O7) рассчитано 878.1; (MALDI-TOF) m/z = 878.7 [М]+, 879.7 [М+Н]+ (C52H71N5O7) рассчитано 878.1. (Фиг. 1)
Спектр ЯМР 1Н (CDCl3, 300 МГц), δ, м.д.: 9.73 с (1Н, 10-Н), 9.67 с (1Н, 5-Н), 8.85 с (1Н, 20-Н), 8.12 дд (1H, J 18.3 и 11.9 Гц, 3-СН=СН2), 6.72 уш.т (1Н, J 6.4 Гц, 13-CONHCH2CH2OC(O)C13H27), 6.39 д (1Н, J 18.3, 3-СН=СНН(транс)), 6.18 д (1Н, J 11.9, 3-СН=СНН(цис)), 15-СН2CO2CH3: 5.57 д (1Н, J 19.2) и 5.31 д (1Н, J 19.2); 4.57-4.47 м (3Н, 18-Н, 13-CONHCH2CH2OC(O)C13H27), 4.41 уш.д (1Н, J 8.2, 17-Н), 13-CONHCH2CH2OC(O)C13H27: 4.25-4.11 м (1Н) и 3.99-3.90 м (1Н), 3.89-3.78 м (2Н, 8-СН2СН3), 3.85 с (3Н, 15-СН2СO2СН3), 3.66 с (3Н, 17-СН2СН2СO2СН3), 3.59 с (3Н, 12-СН3), 3.53 с (3Н, 7-СН3), 3.36 с (3Н, 2-СН3), 17-СН2СН2СО2СН3: 2.67 м (1Н) и 2.37-2.13 м (3Н); 2.39 т (2Н, J 7.3 Гц, 13-CONH(CH2)2OC(O)CH2C12H25), 13-CONH(CH2)2OC(O)CH2(CH2)11CH3): 1.91-1.56 м (6Н) и 1.39-1.14 м (16Н); 1.76 т (3Н, J 6.4 Гц, 8-СН2СН3), 1.76 д (3Н, J 7.3 Гц, 18-СН3), 0.90 т (3Н,, J 7.3 Гц, 13-CONH(CH2)2OC(O)(CH2)12CH3), -1.53 уш.с (1Н, III-NH), -1.72 уш.с (1Н, I-NH).
Пример 2. Аминометилирование бис(N,NN-диметиламино)метаном:
синтез 3(1),3(2)-бис-(N,N-диметиламинометил) хлорин е6 - 13(1)-N-(2-миристоксиэтил)-амид 15(2),17(3) диметилового эфир (XII).
2.0 мл бис(N,N-диметиламино)метана прибавляют к раствору 109.0 мг 13(1)-N-(2-миристоксиэтил)-амида 15(2),17(3) диметилового эфира хлорина е6 (XI) в смеси 10 мл тетрагидрофурана и 10 мл ледяной уксусной кислоты. Полученный раствор кипятят в течение 20 мин, охлажденную реакционную смесь разбавляют хлороформом (50 мл), промывают водой, сушат безводным сульфатом натрия и полученный раствор упаривают досуха при пониженном давлении. Остаток после упаривания хроматографируют на силикагеле (элюент : CCl4-ацетон, 50:1 - 1:1, затем CHCl3-C2H5OH, 30:1 - 1:1) собирают фракции, содержащие основной продукт реакции, упаривают и переосаждают из смеси хлороформа с пентаном.
Выход продукта (40) 83.2 мг (67%). ЭСП (CHCl3; λ, нм): 658.0 (30%), 603.5 (4%), 547.0 (3%), 498.0 (11%), 398.5 (100%). Масс-спектр (ESI) m/z: для (М+4Н)Н+ (C58H89N7O7) рассчитано 995.7, найдено 996.2. Спектр ЯМР 1Н (CDCl3, 300 МГц), δ, м.д.: 9.86 с (1Н, 10-Н), 9.76 с (1Н, 5-Н), 8.84 с (1Н, 20-Н), 7.36/7.32 оба т (1H, J 7.3 Гц, 3-C(CH2N(CH3)2)=CHCH2N(CH3)2), 6.74 уш.т (1H, J 5.5 Гц, 13-CONHCH2CH2OC(O)C13H27), 15-СН2СО2СН3: 5.57 д (1Н, J 19.2) и 5.31 д (1Н, J 19.2); 4.54 т (2Н, J 4.6 Гц, 13-CONHCH2CH2ОC(О)C13H27), 4.50 к (1Н, J 7.3 Гц, 18-Н), 4.41 уш.д (1Н, J 10.1 Гц, 17-Н), 13-CONHCH2CH2OC(O)C13H27: 4.26-4.13 м (1Н) и 4.02-3.92 м (1Н), 3.86 (2Н, 8-CH2CH3, J 8.2 Гц), 3.84 с (3Н, 15-СН2СО2СН3), 3.65 с (3Н, 17-СН2СН2СО2СН3), 3.61 с (3Н, 12-СН3), 3.57 с (3Н, 7-СН3), 3.39 с (3Н, 2-СН3), 17-СН2СН2СО2СН3 и 3-C(CH2N(CH3)2)=CHCH2N(CH3)2: 3.04-2.91 м (1Н), 2.87-2.74 м (1Н), 2.70-2.07 м (4Н) и 1.93-1.82 м (2Н); 2.39 т (2Н, J 8.2 Гц, 13-CONH(CH2)2OC(O)CH2C12H25), 3-C(CH2N(CH3)2)=CHCH2N(CH3)2: 2.33 с (6Н), 2.28 с (3Н) и 2.24 с (3Н); 1.81-1.70 м (6Н, 8-СН2СН3, 18-СН3), 13-CONH(CH2)2OC(O)CH2(CH2)11CH3: 1.68-1.61 м (2Н), 1.42-1.03 м (20Н); 0.89 т (3Н, J 7.3 Гц, 13-CONH(CH2)2OC(O)(CH2)12CH3), -1.65 уш.с (1Н, III-NH), -1.86 уш.с (1H, I-NH).
Пример 3. Синтез 3(1),3(2)-бис-(N,N,N-триметиламинометилиодид)хлорин е6 13(1)-N-(2-миристоксиэтил)15(2),17(3) диметилового эфира (I). К раствору 83.2 мг аминометилированного производного в 15 мл хлористого метилена прибавляют 1 мл йодметана. Полученную смесь выдерживают 1 час при комнатной температуре, затем при пониженном давлении упаривают хлористый метилен и йодметан. Продукт алкилирования получают с количественным выходом.
Масс-спектр (ESI), m/z (Chl I2): 1010.06 (Chl2++Н2-СН2+)+. ЭСП (CHCl3; λ, нм): 661.5 (33%), 605.5 (3%), 554.5 (2%), 524.0 (3%), 498.5 (10%), 398.5 (100%). Спектр ЯМР 1Н (CDCl3, 300 МГц), δ, м.д.: 9.68/9.63 с (1H, 10-Н), 9.68 с (1Н, 5-Н), 8.86 с (1Н, 20-Н), 7.16-7.05 м (1Н, 3-С(СН2N+(СН3)3I-)=СНСН2N+(СН3)3I-), 6.91 уш.т (1Н, J 5.5 Гц, 13-CONHCH2CH2OC(O)C13H27), 15-СН2СO2СН3: 5.56 д (1Н, J 18.3) и 5.31 д (1H, J 18.3); 4.59-4.45 м (3Н, 13-CONHCH2CH2OC(O)C13H27 и 18-Н), 4.40 уш.д (1Н, J 9.2 Гц, 17-Н), 13-CONHCH2CH2OC(O)C13H27: 4.22-4.07 м (1Н) и 4.01-3.89 м (1Н), 3.98-3.79 м (2Н, 8-СН2СН3), 3.83 с (3Н, 15-СН2СО2СН3), 3.79-3.65 м (4Н, 3-C(CH2N+(CH3)3I-)=CHCH2N+(CH3)3I-), 3.63/3.62 с (3Н, 17-СН2СН2СО2СН3), 3.55 с (3Н, 12-СН3), 3.55/3.53 с (3Н, 7-СН3), 3.33/3.32 с (3Н, 2-СН3), 2.91-2.50 м (4Н, 17-СН2СН2СО2СН3), 3-C(CH2N+(CH3)3I-)=CHCH2N+(CH3)3I-: 2.60/2.59 с (12Н), 2.32/2.28 с (3Н) и 1.70/1.68 с (3Н), 2.40 т (2Н, J 7.3 Гц, 13-CONH(CH2)2OC(O)CH2C12H25), 1.74-1.63 м (6Н, 8-СН2СН3, 18-СН3), 13-CONH(CH2)2OC(O)CH2(CH2)11CH3: 1.85-1.57 м (2Н), 1.42-1.14 м (20Н); 0.88 т (3Н, J 7.3 Гц, 13-CONH(CH2)2OC(O)(CH2)12CH3), -1.77 уш.с (1Н, III-NH), -2.01 уш.с (1Н, I-NH).
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ХЛОРОФИЛЛА α, МОДИФИЦИРОВАННЫЕ ФРАГМЕНТАМИ МИРИСТИНОВОЙ КИСЛОТЫ | 2018 |
|
RU2673888C1 |
| 13(1)-N-(4'-N'N'-ДИМЕТИЛПИПЕРАЗИНИЛ ИОДИД) АМИД, 15(2), 17(3)-ДИМЕТИЛОВЫЙ ЭФИР ХЛОРИНА Е6 | 2022 |
|
RU2794092C1 |
| Новые производные хлорина е, содержащие фрагменты галактозы | 2019 |
|
RU2706698C1 |
| ПРОИЗВОДНЫЕ 13(1)-N-{2-[N-(КЛОЗО-МОНОКАРБАДОДЕКАБОРАН-1-ИЛ)-МЕТИЛ]АМИНОЭТИЛ}АМИД-15(2),17(3)-ДИМЕТИЛОВОГО ЭФИРА ХЛОРИНА e, ПРОЯВЛЯЮЩИЕ СВОЙСТВА ФОТОСЕНСИБИЛИЗАТОРА | 2009 |
|
RU2406726C1 |
| СПОСОБ СИНТЕЗА ДИ- И ТРИАМИНОХЛОРИНОВ | 2006 |
|
RU2304583C1 |
| ПРОИЗВОДНЫЕ 4-АРИЛКУМАРИНОВ И ПРОТИВООПУХОЛЕВОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ИХ ОСНОВЕ | 2010 |
|
RU2440998C1 |
| ПОЛУЧЕНИЕ НОВОГО КЛАССА ЖИДКОКРИСТАЛЛИЧЕСКИХ СОЕДИНЕНИЙ, СОДЕРЖАЩИХ ЧЕТЫРЕХАТОМНЫЙ ФТОРСОДЕРЖАЩИЙ ФРАГМЕНТ МОСТИКОГО ТИПА | 2012 |
|
RU2511009C2 |
| НОВЫЕ N-МОДИФИЦИРОВАННЫЕ 5-МЕТИЛ-2'-ДЕЗОКСИЦИТИДИНЫ, ПРОЯВЛЯЮЩИЕ АНТИМИКОЗНУЮ АКТИВНОСТЬ | 2021 |
|
RU2766333C1 |
| СЕНСИБИЛИЗАТОР ДЛЯ ФОТОДИНАМИЧЕСКОГО РАЗРУШЕНИЯ КЛЕТОК ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ С ЕГО ИСПОЛЬЗОВАНИЕМ | 2004 |
|
RU2259200C1 |
| ПРОИЗВОДНЫЕ 4Н-БИС[1,2,5]ОКСАДИАЗОЛО[3,4-b:3',4'-f]АЗЕПИН-8,9-ДИАМИНА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2012 |
|
RU2499799C2 |
Изобретение относится к водорастворимому производному хлорофилла а, модифицированному фрагментом миристиновой кислоты. Технический результат: получено новое биологически активное соединение хлоринового ряда, обладающее антибактериальным действием, которое может быть использовано в качестве потенциального фотосенсибилизатора (ФС) для антибактериальной ФДТ. 4 ил., 3 пр.
Водорастворимое производное хлорофилла а, модифицированное фрагментом миристиновой кислоты формулы
| Березин Д.Б | |||
| и др | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| И.С | |||
| Тарабукина и др | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| СПОСОБ СИНТЕЗА ПРОИЗВОДНЫХ ХЛОРОФИЛЛА С ДВУМЯ N, N-ДИМЕТИЛАМИНОМЕТИЛЬНЫМИ ГРУППАМИ | 2007 |
|
RU2337103C9 |
| АМИНОАМИДЫ В РЯДУ БАКТЕРИОХЛОРОФИЛЛА A, ОБЛАДАЮЩИЕ ФОТОДИНАМИЧЕСКОЙ АКТИВНОСТЬЮ, И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2013 |
|
RU2548675C9 |
| WO 9316692 A1, 02.09.1993. | |||
Авторы
Даты
2019-02-22—Публикация
2017-12-01—Подача