ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Neisseria meningitidis (менингококк) является грамотрицательным патогенным микроорганизмом человека. Он колонизирует глотку, вызывая менингит и изредка сепсис при отсутствии менингита. Он тесно связан с гонококками [N. Gonorrhoeae], хотя есть одна особенность, которая четко отличает менингококк, - это наличие полисахаридной капсулы, присутствующей во всех патогенных менингококках. На основании капсулярного полисахарида организма идентифицировано двенадцать серологических групп N. meningitidis (А, В, С, Н, I, K, L, 29Е, W135, X, Y и Z).
Серогруппа А ('MenA') является наиболее частой причиной эпидемических заболеваний в Африке к югу от пустыни Сахара. Серогруппы В & С отвечают за большинство случаев в развитых странах, остальные случаи вызваны серогруппами W135 и Y.
Вакцина, в которой используется полисахарид (ПС) в чистом виде, имеет относительно низкую иммуногенность. Чтобы преодолеть относительно низкую иммуногенность полисахарида, вакцины с ПС конъюгируют с белками-носителями для повышения иммуногенности и обеспечения долгосрочной защиты у маленьких детей. Многие менингококковые конъюгатные вакцины уже утверждены и продаются по всему миру. Примерами таких вакцин, известных как «Конъюгаты Neisseria meningitidis», являются моновалентный менингококковый конъюгат серогруппы A (MenAfriVac), моновалентный менингококковый конъюгат серогруппы С (Meningitec) и четырехвалентные менингококковые конъюгаты серогрупп А С Y W (Menveo & Menactra).
Помимо использования для классификации капсулярный полисахарид используется также и для вакцинации. Инъекционная четырехвалентная вакцина капсулярных полисахаридов из серогрупп А, С, Y и W135 известна в течение многих лет и имеет лицензию на использование на людях. Несмотря на эффективность у подростков и взрослых она индуцирует слабый иммунный ответ и короткую продолжительность защиты и не может быть использована для грудных детей. Mencevax ACWY™ и Menomune™ содержат 50 мкг каждого очищенного полисахарида после восстановления из своих лиофилизированных форм. Капсулярные сахариды серогрупп А, С, W135 и Y также были объединены в виде конъюгатов с получением четырехвалентных вакцин, например неадъювантный продукт Menactra™. Также для использования на людях утвержден конъюгированный полисахарид серогруппы А как MenAfriVac™, олигосахариды серогруппы С утверждены для использования на людях как Menjugate™, Meningitec™ и NeisVac-C™.
Штаммы N.meningitidis серогруппы X впервые были описаны в 1960-е годы и были выделены из нескольких случаев инвазивных менингококковых заболеваний в Северной Америке, Европе, Австралии и Китае. Вспышки штаммов N.meningitidis серогруппы X были зарегистрированы в Нигере, западной Кении, а также северной части Ганы. Штаммы N.meningitidis серогруппы X, как сообщалось, очень эффективны в колонизации среди призывников в Соединенном Королевстве. Ссылка: Abdullah Kilic et al; Neisseria meningitidis Serogroup X Sequence Type 767 in Turkey; Journal Of Clinical Microbiology, Nov. 2010, p. 4340-4341; Vol. 48, No. 11.
Сообщалось, что повторная массовая вакцинация во многих африканских странах, возможно, способствовала колонизации штаммами серогруппы X и менингококковым заболеваниям, вызванных штаммами серогруппы X, и могла привести к изменению профиля менингококкового заболевания. Ссылка: Gagneux, S. Р et al; Prospective study of a serogroup X Neisseria meningitidis outbreak in northern Ghana J. Infect. Dis. 185: 618-626; 2002.
Капсулярные полисахариды менингококков серогрупп В, С, Y и W135 состоят из производных сиаловой кислоты. Менингококки серогруппы В и С экспрессируют (α 2-8)- и (α 2-9 239)-связанную полисиаловую кислоту соответственно, в то время как чередующиеся последовательности D-глюкозы или D-галактозы и сиаловой кислоты экспрессируются N.meningitidis серогруппы Y и W135. Напротив, капсула менингококков серогруппы А состоит из (α 1-6)-связанного N-ацетилманнозамин 6-фосфата, тогда как N.meningitidis серогруппа X синтезирует капсулярные полимеры (α 1-4)-связанного N-ацетилглюкозамин 1-фосфата. Ссылка: Yih-Ling Tzeng et al; Genetic Basis for Biosynthesis of the (134)-Linked N-Acetyl-D-Glucosamine 1-Phosphate Capsule of Neisseria meningitidis Serogroup X; Infection And Immunity, Dec. 2003, p. 6712-6720; Vol. 71, No. 12.
Существующие менингококковые конъюгатные вакцины основаны на полисахаридах А С Y W135. Увеличение случаев заболеваемости, вызванной заболеванием MenX, в африканском поясе менингита за последние 5 лет [1, 4] оправдывает разработку и внедрение MenX полисахаридной конъюгатной вакцины в отдельных районах региона с целью предотвращения и контроля эпидемий в будущем. Хотя ранее сообщалось, что несмотря на доступность подробных данных по серопревалентности и структурных данных в отношении менингококкового X, коммерчески жизнеспособная конъюгатная вакцина, содержащая полисахарид серогруппы X, еще находится в разработке в связи с крайне ограниченными достижениями в аспектах очищения, конъюгации и стабильности состава для нее. Это создает дополнительную проблему для успешного решения и контроля различных параметров, особенно при использовании масштабируемого способа конъюгации для серийного производства конъюгатов Neisseria meningitidis, содержащих полисахарид Neisseria meningitides серогруппы X.
Настоящее изобретение появилось как результат неожиданного открытия, заключающегося в том, что есть возможность приготовить одновалентную или поливалентную иммуногенную композицию на основе конъюгатов менингококкового полисахарида из серогруппы X с помощью масштабируемого и эффективного способа конъюгации.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к конъюгатам сахарид N.meningitidis серогруппы X-белок-носитель, полученным с помощью реакции конъюгации, состоящей из i) сортировки по размеру полисахарида; ii) активации на основе СРРТ отсортированного по размеру полисахарида, имеющего среднюю молекулярную массу от 100 до 150 кДа, при рН от 9 до 9,5 iii) добавления ADH [адиуретин-АДГ] по истечении периода времени примерно 2-5 минут с последующим инкубационным периодом 4-20 часов и iv) реакции ADH-активированного полисахарида с очищенным неактивированным белком-носителем в соотношении от 0,75 до 1,5 в присутствии MES буфера и EDAC с последующим инкубационным периодом 3-4 часа, характеризующейся тем, что реакция конъюгации осуществляется при температуре 2-8°С с получением в результате выхода конъюгата от 20% до примерно 30% и при соотношении сахарида к белку от 0,2 до примерно 0,6 в конечном конъюгате.
Альтернативно конъюгаты сахарид N.meningitidis серогруппы X - белок-носитель можно также получить с помощью реакции конъюгации, состоящей из i) сортировки по размеру полисахарида, ii) активации на основе СРРТ отсортированного по размеру полисахарида, имеющего среднюю молекулярную массу от 100 до 150 кДа, при рН от 9 до 9,5 iii) добавления ADH-активированного белка-носителя в соотношении сахарид:белок от 0,5 до 2 через 2-3 минуты с последующим инкубационным периодом от 2 до 20 часов, характеризующейся тем, что реакция конъюгации осуществляется при 22°С до 25°С, с получением в результате выхода конъюгата от 5% до примерно 10%.
Соответственно, настоящее изобретение относится к поливалентной композиции менингококкового полисахарид-белкового конъюгата, содержащей капсулярный сахарид из серогрупп X и по меньшей мере один капсулярный сахарид из серогрупп А, С, W135 и Y, отличающейся тем, что i) полисахариды серогрупп А С W135 X сортируются по размеру механически, тогда как полисахарид серогруппы Y сортируется по размеру химически, ii) все сахариды конъюгируются с белком-носителем через линкер с помощью химии конъюгации цианилированием, iii) все соотношения сахарида с белком в конечных конъюгатах составляют от 0,2-0,6 и iv) используются по меньшей мере два различных белка-носителя, выбранных из группы, состоящей из столбнячного анатоксина (ТТ), дифтерийного анатоксина (DT) и нетоксичного рекомбинантного варианта дифтерийного токсина CRM197.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1. Накладываемое изображение [оверлей] реакции конъюгации, когда Men X Ps (215 кДа) конъюгируется с гидразин дериватизированным ТТ
Фигура 2. Очищенный конъюгат, когда Men X Ps (215 кДа) конъюгируется с производным от гидразин дериватизированным ТТ
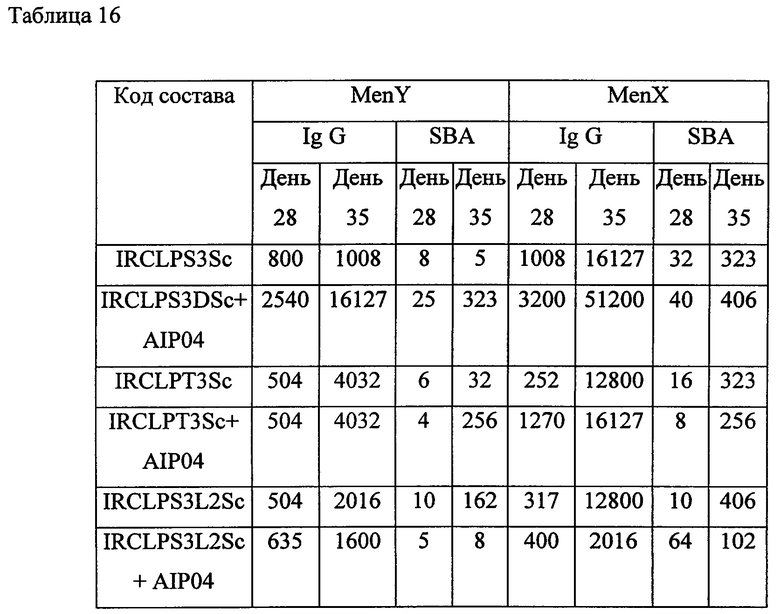
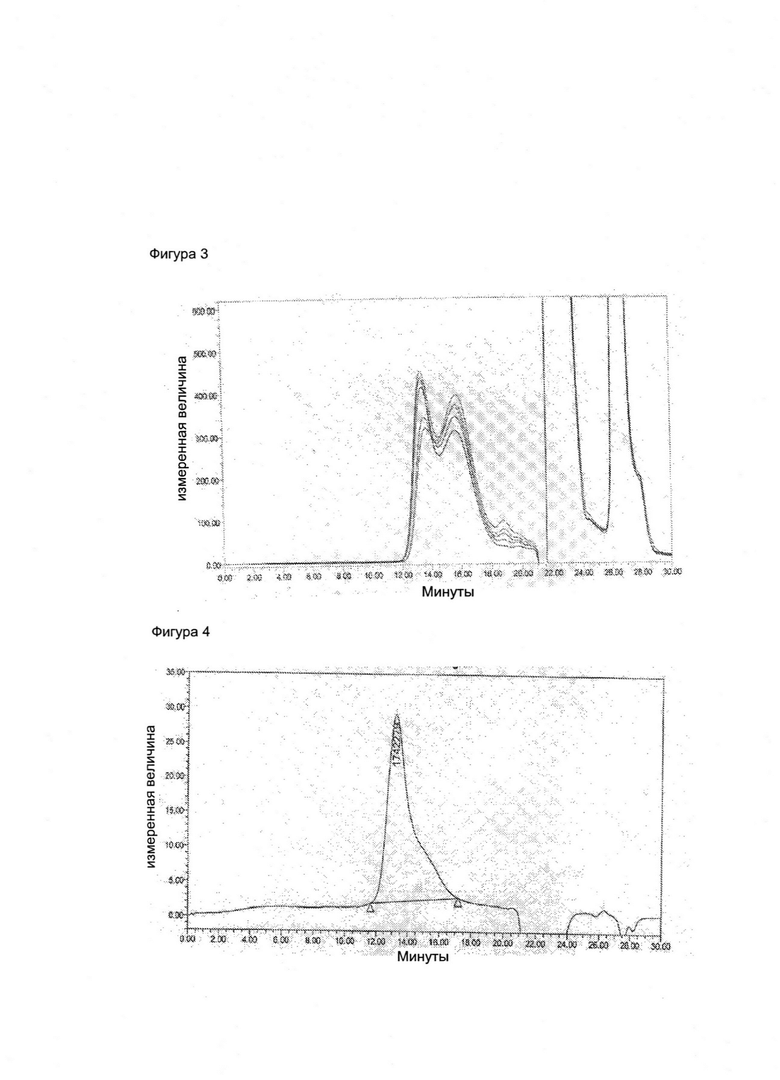
Фигура 3. Оверлей реакции конъюгации, когда Men X Ps (326 кДа) конъюгируется с ADH дериватизированным ТТ
Фигура 4. Очищенный конъюгат, когда Men X Ps (326 кДа) конъюгируется с ADH дериватизированным ТТ
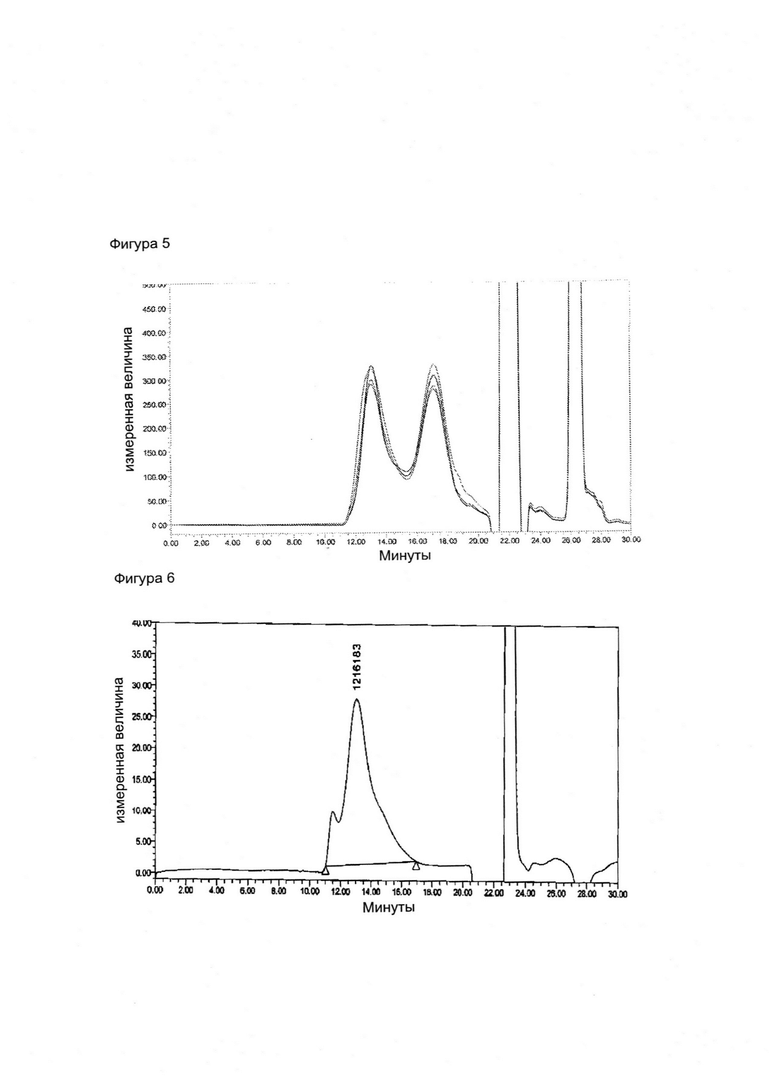
Фигура 5. Оверлей реакции конъюгации, когда Men X Ps (120 кДа) конъюгируется с ADH дериватизированным ТТ
Фигура 6. Очищенный конъюгат, когда Men X Ps (120 кДа) конъюгируется с ADH дериватизированным ТТ
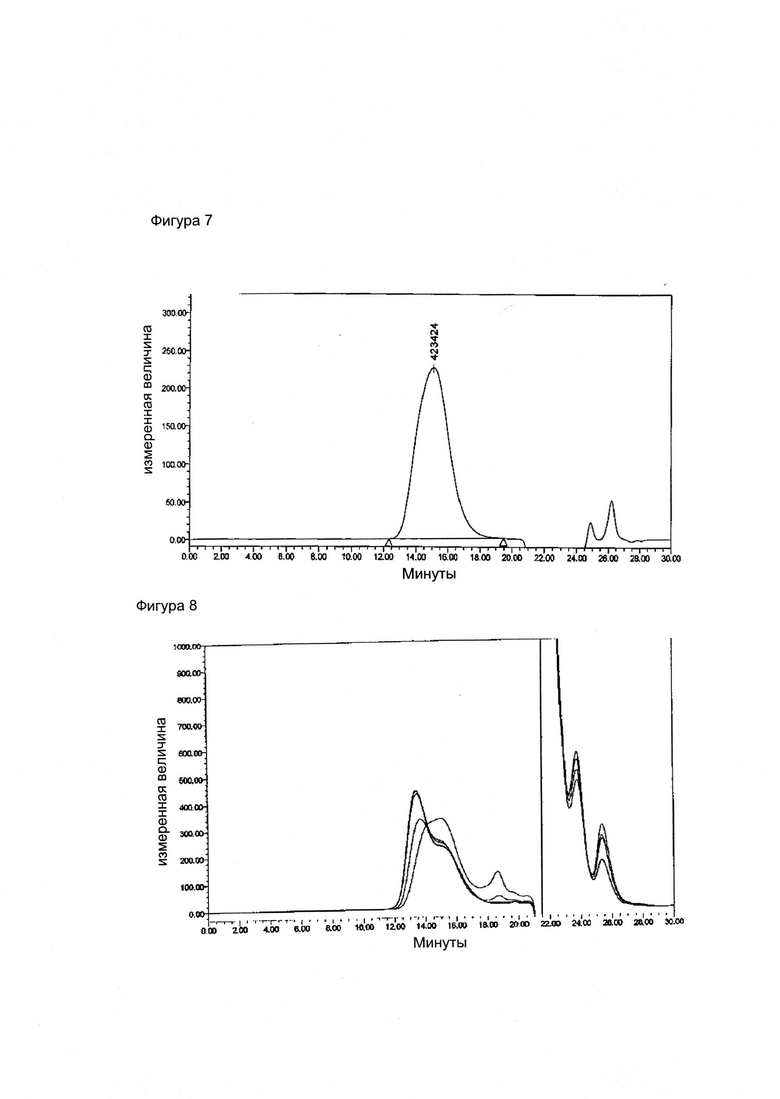
Фигура 7. Хроматограмма нативного менингококкового полисахарида серогруппы X.
Фигура 8. Оверлей реакции конъюгации, когда Men X Ps (510 кДа) активируется ADH и конъюгируется с очищенным ТТ
Фигура 9. Очищенный конъюгат, когда Men X Ps (510 кДа) активируется ADH и конъюгируется с очищенным ТТ
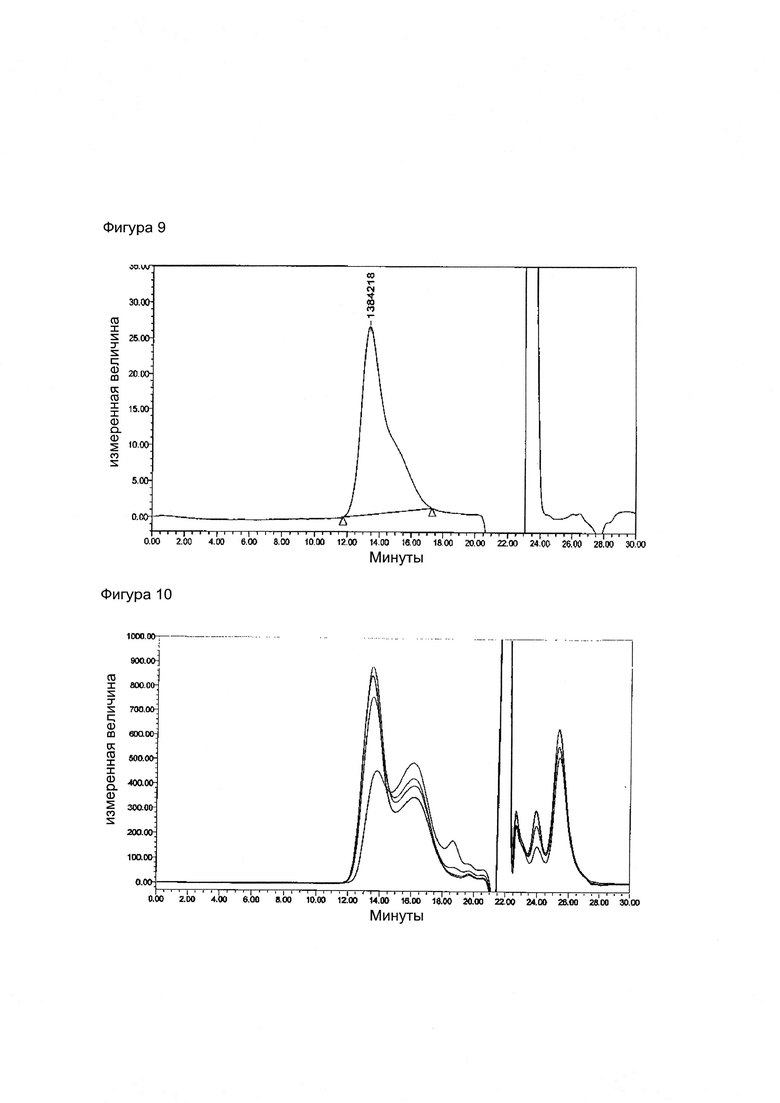
Фигура 10. Оверлей реакции конъюгации, когда Men X Ps (250 кДа) активируется ADH и конъюгируется с очищенным ТТ
Фигура 11. Очищенный конъюгат, когда Men X Ps (250 кДа) активируется ADH и конъюгируется с очищенным ТТ
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
«Поливалентные иммуногенные композиции» относятся к следующим композициям.
Композиция I содержит: (а) конъюгат (i) капсулярного сахарида N meningitidis серогруппы А и (ii) столбнячного анатоксина; (b) конъюгат (i) капсулярного сахарида N meningitidis серогруппы С и (ii) столбнячного анатоксина; (с) конъюгат (i) капсулярного сахарида N.meningitidis серогруппы Y и (ii) дифтерийного анатоксина; (d) конъюгат (i) капсулярного сахарида N.meningitidis серогруппы W135 и (ii) столбнячного анатоксина; и (d) конъюгат (i) капсулярногоо сахарида N meningitidis серогруппы X и (ii) столбнячного анатоксина.
Композиция II содержит (а) конъюгат (i) капсулярного сахарида N meningitidis серогруппы А и (ii) столбнячного анатоксина; (b) конъюгат (i) капсулярного сахарида N meningitidis серогруппы С и (ii) CRM197; (с) конъюгат (i) капсулярного сахарида N.meningitidis серогруппы Y и (ii) столбнячного анатоксина; (d) конъюгат (i) капсулярного сахарида N.meningitidis серогруппы W135 и (ii) CRM 197; и (d) конъюгат (i) капсулярного сахарида N meningitidis серогруппы X и (ii) CRM 197.
Композиция III содержит (а) конъюгат (i) капсулярного сахарида N meningitidis серогруппы А и (ii) CRM 197; (b) конъюгат (i) капсулярного сахарида N meningitidis серогруппы С и (ii) CRM197; (с) конъюгат (i) капсулярного сахарида N meningitidis серогруппы Y и (ii) столбнячного анатоксина; (d) конъюгат (i) капсулярного сахарида N.meningitidis серогруппы W135 и (ii) CRM197; и (d) конъюгат (i) капсулярного сахарида N meningitidis серогруппы X и (ii) столбнячного анатоксина, характеризующаяся тем, что конъюгаты, содержащие столбнячный анатоксин в качестве белка-носителя, как было установлено, повышают иммуногенность конъюгатов, содержащих CRM 197 в качестве белка-носителя.
Композиция IV содержит (а) конъюгат (i) капсулярного сахарида N meningitidis серогруппы А и (ii) столбнячного анатоксина; (b) конъюгат (i) капсулярного сахарида N meningitidis серогруппы С и (ii) CRM 197; (с) конъюгат (i) капсулярного сахарида N.meningitidis серогруппы Y и (ii) CRM 197; (d) конъюгат (i) капсулярного сахарида N.meningitidis серогруппы W135 и (ii) CRM197; и (d) конъюгат (i) капсулярного сахарида N.meningitidis серогруппы X и (ii) столбнячного анатоксина.
Композиция V содержит (а) конъюгат (i) капсулярного сахарида N meningitidis серогруппы А и (ii) CRM 197; (b) конъюгат (i) капсулярного сахарида N meningitidis серогруппы С и (ii) CRM197; (с) конъюгат (i) капсулярного сахарида N.meningitidis серогруппы Y и (ii) CRM 197; (d) конъюгат (I) капсулярного сахарида N.meningitidis серогруппы W135 и (ii) CRM197; и (d) конъюгат (i) капсулярного сахарида N meningitidis серогруппы X и (ii) столбнячного анатоксина.
Соответственно, в первом варианте осуществления композиция может содержать сахарид серогрупп А, С, Y, W135 и X в количестве 0,5-10 мкг, 0,5-5 мкг или 0,5-2 мкг на 0,5 мл дозу.
Другим аспектом первого варианта осуществления является то, что указанная композиция может содержать 10 мкг сахарида серогруппы А, 5 мкг сахарида серогруппы С, 5 мкг сахарида серогруппы W135, 5 мкг сахарида серогруппы Y и 5 мкг сахарида серогруппы X.
Альтернативно, указанная поливалентная иммуногенная композиция может содержать 5 мкг сахарида серогруппы А, 5 мкг сахарида серогруппы С, 5 мкг сахарида серогруппы W135, 5 мкг сахарида серогруппы Y и 5 мкг сахарида серогруппы X.
Соответственно, во втором варианте осуществления указанные один или несколько конъюгатов сахарида N.meningitidis могут дополнительно адсорбироваться на гидроксид алюминия, фосфат алюминия или их смесь или не адсорбироваться на адъювант.
Одним аспектом второго варианта осуществления является то, что адъювант соли алюминия может добавляться в количестве 20-300 мкг, 20-200 мкг, 25-150 мкг Al+++ на 0,5 мл дозу.
Другим аспектом второго варианта осуществления является то, что адъювант соли алюминия может добавляться в количестве 25-125 мкг Al+++ на 0,5 мл.
Третий вариант осуществления настоящего изобретения состоит в том, что указанная композиция может содержать консервант, выбранный из тиомерсала и 2-феноксиэтанола.
Одним аспектом третьего варианта осуществления является то, что указанная композиция может дополнительно содержать фосфат натрия, хлорид натрия или их комбинацию.
Четвертым вариантом осуществления настоящего изобретения является то, что указанная поливалентная иммуногенная композиция может быть в буферной жидкой форме или в лиофилизированной форме.
Одним аспектом четвертого варианта осуществления является то, что указанная лиофилизированная иммуногенная композиция может содержать комбинацию стабилизатора, выбранную из: а) от 2 до 5% (вес/объем) трегалозы, от 0,25 до 0,75% цитрата натрия, b) от 2 до 5% (вес/объем) сахарозы и от 0,25 до 0,75% цитрата натрия; с) от 2 до 5% (вес/объем) сахарозы, от 2 до 5% (вес/объем) лактозы и от 0,25 до 0,75% цитрата натрия и d) от 2 до 5% (вес/объем) трегалозы, от 2 до 5% (вес/объем) лактозы и от 0,25 до 0,75% цитрата натрия.
Другим аспектом четвертого варианта осуществления является то, что указанная лиофилизированная иммуногенная композиция может дополнительно содержать буфер, выбранный из Трис и фосфата.
Соответственно, в пятом варианте осуществления изобретения указанные полисахариды серогрупп А С W и X могут сортироваться по размеру механически с получением средней молекулярной массы в пределах 100-600 кДа, 100-400 кДа, предпочтительно 100-200 кДа, наиболее предпочтительно 100-150 кДа. Предпочтительны методы механической сортировки по размеру, такие как гомогенизация, микрофлюидизация и разрушение клетки высоким давлением.
В другом аспекте пятого варианта осуществления указанный полисахарид серогруппы Y может сортироваться по размеру с получением средней молекулярной массы в пределах 90-110 кДа с помощью метода, выбранного из следующих: кислотный гидролиз, щелочная деградация, окисление периодатом, озонолиз, ферментативный гидролиз, обработка ультразвуком, фрагментация электронным пучком. Предпочтительна химическая сортировка по размеру с использованием ацетата натрия при температуре от 60 до 80°С.
В шестом варианте осуществления каждый из сахаридов N.meningitidis конъюгируется с белком-носителем через гетеро или гомо-бифункциональный линкер с помощью химии конъюгации цианилированием.
В одном аспекте шестого варианта осуществления указанный отсортированный по размеру полисахарид активируется с помощью реагента цианилирования, выбранного из, но не ограничиваясь этим, 1-циано-4-(диметиламино)-пиридиний тетрафторбората ('CDAP'), р-нитрофенилцианата и N-цианотриэтиламмоний тетрафторбората ('СТЕА'). В предпочтительном способе конъюгации цианилирующий реагент любой, за исключением CD АР, и может быть выбран из группы: 1-циано-4-пирролидинопиридиний тетрафторборат (СРРТ), 1-циано-имидазол (1-CI), 1-цианобензотриазол (1-СВТ) или 2-цианпиридазин-3(2Н)он (2-СРО) или их функциональное производное или модификация.
В другом аспекте шестого варианта осуществления указанный активированный полисахарид или белок-носитель, в частности полисахарид, вступает в реакцию с гидразином, карбогидразидой, гидразин хлоридом, дигидразидом, их смесью, предпочтительно с дигидразидом адипиновой кислоты.
Гидразидные группы могут вводиться в белки через карбоксильные группы остатков аспарагиновой кислоты и глутаминовой кислоты на белке при применении карбодиимидной реакции, например, с помощью реакции с гидразином, карбогидразидом, сукцинил дигидразидом, дигидразидом адипиновой кислоты, хлоридом гидразина (например, дигидрохлорид гидразина), или любых других дигидразидов в присутствии EDC. EDC используется в качестве катализатора для активации и модификации белкового реактанта гидразином или дигидразидом. В качестве катализатора может использоваться любой водорастворимый карбодиимид, включая EDC. EDC-катализированные белки обычно имеют склонность к полимеризации и осаждению. См. Schneerson et al., Infect. Immun. 1986, 52: 519-528; Shafer et al., Vaccine 2000; 18(13): 1273-1281; and Inman et al., Biochemistry 1969; 8: 4074-4082.
В седьмом варианте осуществления указанная поливалентная композиция менингококкового полисахарид-белкового конъюгата содержит полисахариды из серогрупп А, В, С, Н, I, K, L, 29Е, W135, Y и Z, конъюгированные отдельно с двумя или более различными типами белков-носителей. Капсулярные сахариды выбирают из менингококковых серогрупп А, С, W135 Y и X, так что композиции включают сахариды из 1, 2, 3, 4 или 5 из этих пяти серогрупп. Конкретные композиции содержат сахариды из следующих серогрупп: серогруппы А & X; серогруппы X & W135; серогруппы X & Y; серогруппы С & X; серогруппы A Y & X; серогруппы С, X & W135; серогруппы X, Y & W135; серогруппы А, С & X; серогруппы Y, C & X; серогруппы A, W & X; серогруппы Y & W135 & С & X; серогруппы Y & W135 & А & X; серогруппы С & W135 & А & X; серогруппы Y & С & А & X; серогруппы А & С & Y & W135 & X. Композиции, включающие по меньшей мере серогруппу X, являются предпочтительными, а композиции, включающие сахариды из всех пяти серогрупп, являются наиболее предпочтительными.
В одном аспекте седьмого варианта осуществления указанный белок-носитель может быть выбран из группы, но не ограничиваясь этим, содержащей CRM 197, дифтерийный анатоксин, столбнячный анатоксин, коклюшный анатоксин, Е. коли LT, Е:коли ST и экзотоксин А из синегнойной палочки, комплекс наружной мембраны с (ОМРС), порины, трансферрин-связывающие белки, пневмолизин, пневмококковый поверхностный белок A (PspA), пневмококковый адгезии белок (PsaA), пневмококковые поверхностные белки BVH-3 и BVH-11, защитный антиген (РА) бациллы сибирской язвы и детоксифицированный фактор, вызьшающий отек (EF), и фактор летальности (LF) бациллы сибирской язвы, овальбумин, гемоцианин лимфы улитки (KLH), человеческий сывороточный альбумин, бычий сывороточный альбумин (BSA) и очищенное белковое производное туберкулина (PPD). Предпочтительно комбинации используемых белков-носителей включают столбнячный анатоксин & дифтерийный анатоксин, CRM 197 & столбнячный анатоксин.
В другом аспекте третьего варианта осуществления в реакции конъюгации используются линкеры, выбранные из группы, состоящей из дигидразида адипиновой кислоты, ε-аминогексановой кислоты, хлоргексанол диметилацетала, D-глюкуронолактона, цистамина и р-нитрофенилэтил амина.
После конъюгации конъюгаты могут быть очищены от непрореагировавшего белка и полисахарида с помощью любых стандартных методик, включая, среди прочего, гель-хроматографию, центрифугирование в градиенте плотности, ультрафильтрацию, гидрофобную хроматографию или фракционирование сульфатом аммония. См., например, P.W. Anderson, et. al. (1986). J. Immunol. 137: 1181-1186. См. также H.J. Jennings and C. Lugowski (1981) J. Immunol. 127: 1011-1018.
В восьмом варианте осуществления указанная иммуногенная композиция по настоящему изобретению может, кроме того, содержать дополнительный неменингококковый полисахарид-белковый конъюгат, отличающийся тем, что полисахариды и олигосахариды для использования могут быть выбраны из, но не ограничиваясь этим, пневмококковых полисахаридов из серогрупп 1, 2, 3, 4, 5, 6А, 6В, 7F, 8, 9N, 9V, 10А, 11A, 12F, 14, 15В, 17F, 18С, 19F, 19А, 20, 22F, 23F и 33F; полисахарид-полирибозилрибитолфосфата гемофильной инфекции типа Ь, стрептококковых полисахаридов группы В серотипов III и V и полисахарида сальмонеллы брюшного тифа Vi. Другие полисахариды пневмококковых серотипов и стрептококковых серотипов группы В также подходят для использования здесь, как и другие Т-независимые полисахаридные и олигосахаридные антигены, например полисахариды или олигосахариды, полученные из стрептококка группы А, стафилококков, энтерококков, клебсиеллы пневмонии, Е. коли, синегнойной палочки и бациллы сибирской язвы. Хотя о собо предпочтительными являются бактериальные полисахариды и олигосахариды, грамм (-) бактериальные липополисахариды и липоолигосахариды и их полисахаридные и олигосахаридные производные, а также вирусные полисахариды и олигосахариды также могут использоваться.
Композиции по изобретению могут быть представлены и упакованы различными способами. Композиции могут быть в ампулах или могут быть в заполненных, готовых к использованию шприцах. Шприцы могут поставляться с иглами или без игл. Шприц будет содержать разовую дозу композиции, в то время как ампула может содержать разовую дозу или несколько доз. Инъекционные композиции, как правило, будут в виде жидких растворов или суспензий. Альтернативно они могут быть представлены в твердой форме (например, лиофилизированной) для растворения или суспендирования в жидких носителях перед инъекцией.
Примеры
Пример 1
Получение менингококкового полисахарида серогруппы X
а) Ферментация и очистка менингококкового полисахарида серогруппы X
Менингококковые полисахариды серогруппы X получают из штаммов N.meningitidis (8210 & 9601), используя подходящую ферментационную среду, методом непрерывной ферментации с подпиткой в оптимальном режиме ферментера. Кроме того, менингококковые капсулярные полисахариды серогруппы X обычно получают способом, включающем следующие стадии: осаждение на основе СТАВ [ЦТАБ], обработка этанолом (96%) с последующей глубинной фильтрацией, фильтрацией через слой активированного угля, осаждением с помощью CaCl2, обработкой этанолом (96%) и ультрафильтрацией.
b) Сортировка по размеру менингококкового полисахарида серогруппы X
Очищенные менингококковые полисахариды серогруппы X подвергали 1-2 проходам механической сортировки по размеру (клеточный дезинтегратор систем с постоянными параметрами) в инъекционной воде (WFI) при давлении примерно 30-40 kpsi [килофунт на квадратный дюйм].
Пример 2
Конъюгация менингококкового полисахарида серогруппы X с белком-носителем.
а) Менингококковый полисахарид серогруппы X с разной средней молекулярной массой, конъюгированный с производным гидразин дериватизированным столбнячным анатоксином (ТТ)
Во-первых, (30 мг/мл) 45 мг гомогенизированного полисахарида серогруппы X (штамм 9601), средняя молекулярная масса 215 кДа на основании эксклюзионной ВЭЖХ [SEC HPLC], активировали с помощью 90 мг CD АР (растворили 100 мг/мл в ацетонитриле), рН смеси довели до 9,5 с помощью 1 М NaOH. Затем через 3 мин к реакционной смеси добавили гидразин-активированный ТТ (30 мг/мл в 1М NaCl) 67,5. Контроль реакции проводили по ВЭЖХ, реакция продолжалась в течение 18 часов. Через 18 ч реакцию погасили добавлением глицина и сырой конъюгат очистили диафильтрацией на 300 кД TFF мембране, в Трис 10 мМ, рН=7,2. Последовательно использовали колонки shodex SB-804 HQ и СО-805 HQ с PBS в качестве подвижной фазы при расходе 1 мл/мин. Концентрацию полисахарида и концентрацию белка определяли путем анализа на содержание фосфора и модифицированного анализа Лоури соответственно.
Во-вторых, (24 мг/мл в 2 М NaCl) 60 мг полисахарида серогруппы X (штамм 8210), средняя молекулярная масса 326 кДа на основании ВЭЖХ, активировали с помощью 150 мг СРРТ (растворили 114 мг/мл в ацетонитриле) и рН смеси довели до 9,5 с помощью 2,5М NaOH. Затем через 3 мин к реакционной смеси добавили (37 мг/мл в 2М NaCl) 37,5 мг ADH-активированного ТТ и контроль реакции проводили на основании ВЭЖХ, реакция продолжалась в течение 5 часов. Через 5 часов реакцию погасили добавлением глицина и сырой конъюгат очистили диафильтрацией на 500 кД TFF мембране в 10 мМ PBS, далее в Трис 10 мМ при рН=7,2.
Далее (20 мг/мл в 1М NaCl) 200 мг полисахарида X (штамм 8210), имеющего среднюю молекулярную массу 120 кДа на основании эксклюзионной ВЭЖХ, активировали с помощью 400 мг CPIP (растворили 114 мг/мл в ацетонитриле) и рН смеси довели до 9,5 с помощью 1 М NaOH. Затем через 3 мин к реакционной смеси добавили (30 мг/мл) 150 мг ADH-активированного ТТ. Контроль реакции проводили на основании ВЭЖХ, и реакция продолжалась в течение 4 часов. Через 4 ч реакцию погасили, добавив глицин, и сырой конъюгат очистили диафильтрацией с помощью 300 кД TFF мембраны в 10 мМ PBS, далее в Трис 10 мМ при рН=7,2.
b) Менингококковый полисахарид серогруппы X с разной средней молекулярной массой, активированный ADH и конъюгированный с очищенным неактивированным столбнячным анатоксином (ТТ)
Во-первых, (27 мг/мл в 2М NaCl) 200 мг полисахарида серогруппы X (штамм 8210), имеющего среднюю молекулярную массу 510 кДа на основании эксклюзионной ВЭЖХ, активировали с помощью 400 мг СРРТ (растворили 114 мг/мл в ацетонитриле), рН смеси довели до 9,5 с помощью 2,5 М NaOH. Затем через 3 мин добавили 1,5 г (100 мг/мл в карбонатном буфере) ADH и реакцию продолжили в течение 4 часов. Через 4 часа добавили глицин и реакционную смесь подвергли диафильтрации на 8 кД TFF мембране. Далее полисахарид ADH-Men X концентрировали. К 44 мг полученного продукта (7,5 мг/мл) добавили очищенный ТТ (37,5 мг / мл в 0,9% NaCl) и MES буфер, рН=6,0, в результате получили конечную буферную концентрацию MES, равную 100 мМ, затем добавили 37,5 мг EDAC (растворенного в 100 мМ MES, рН=6,0). Реакция продолжалась в течение 4 часов, контроль реакции проводили по ВЭЖХ. Несвязанный полисахарид удалили с помощью гель-фильтрационной хроматографии при использовании Toyopearl HW65 смолы в хроматографической системе Акта [Akta Chromatography System]. (GE Amersham). Фракции собрали и объединили на основании пикового профиля и соотношения сахарид-белок.
Во-вторых, полисахарид серогруппы X (штамм 8210), имеющий среднюю молекулярную массу 250 кДа на основании эксклюзионной ВЭЖХ, концентрировали до 18 мг/мл в 2М NaCl. Количество 200 мг активировали с помощью 296 мг СРРТ (растворили 114 мг/мл в ацетонитриле) и рН смеси довели до 9,5 с помощью 2,5М NaOH. Затем через 3 мин добавили 1,12 г (100 мг/мл в карбонатном буфере) ADH, реакция продолжалась в течение 4 часов. Через 4 часа добавили глицин и реакционную смесь подвергли диафильтрации на 8 кД TFF мембране. После этого полисахарид ADH-Men X концентрировали. Далее к 200 мг полученного продукта (7,5 мг/мл) добавили очищенный ТТ (36,7 мг/мл в 0,9% NaCl) и MES буфер, рН=6,0, в результате получили конечную буферную концентрацию MES, равную 100 мМ, затем добавили 200 мг EDAC (растворенного в 100 мМ MES, рН=6,0). Реакция продолжалась в течение 4 часов, контроль реакции проводили по ВЭЖХ. Неочищенный конъюгат очистили диафильтрацией на 500 кД TFF мембране в 10 мМ PBS, далее в Трис 10 мМ при рН=7,2.
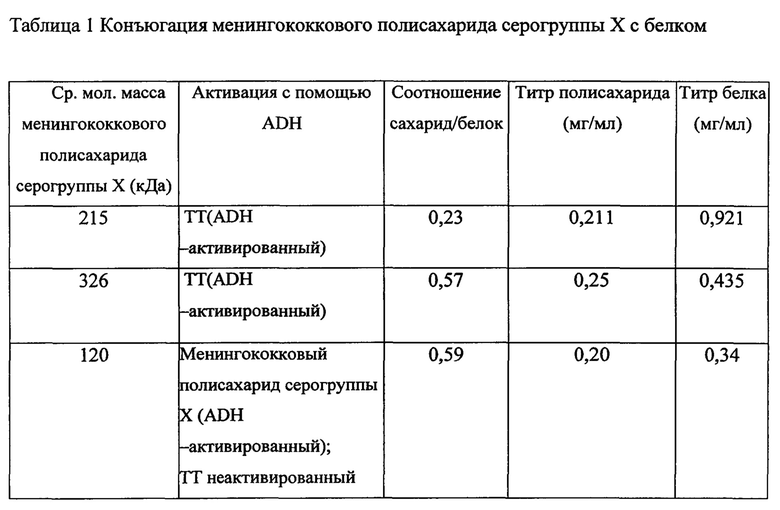
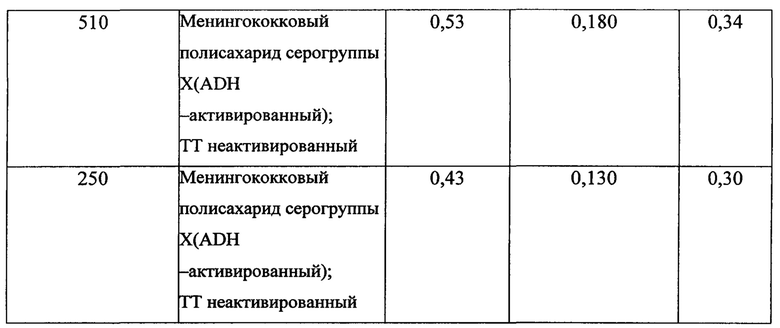
Приведенные выше данные показывают, что можно получить выход конечного конъюгата примерно 20 до 30% при использовании i) менингококкового полисахарида серогруппы X со средней молекулярной массой примерно 100-200 кД, ii) ADH-активированного менингококкового полисахарида серогруппы X, iii) неактивированного ТТ, iv) соотношения сахарид:белок от 0,5 до 2 за время реакции конъюгации, v) СРРТ в качестве реагента цианилирования, vi) инкубации реакции конъюгации при 2-8°С, vi) соотношения сахарид:белок от 0,2 до 0,6 в конечном конъюгате.
Пример 3
Конъюгация менингококкового полисахарида серогрупп А, С, Y, W135 с белком-носителем CRM197.
Очищенные менингококковые полисахариды серогрупп А С Y W135, имеющие среднюю молекулярную массу от 100 до 200, конъюгировали с CRM 197 при соотношении сахарид:белок меньше единицы с использованием подходящего реагента цианилирования (CDAP или СРРТ). Конъюгаты дополнительно очистили диафильтрацией на 300 кД TFF с помощью 50 объемов 10 мМ PBS и 50 объемов 10 мМ Трис.
Пример 4
Лиофилизация & состав конъюгата Men А С Y W135 & X, содержащего два разных белка-носителя. Были получены лиофилизированные составы, содержащие конъюгаты N.meningitidis, цитрат натрия и трис-буфер в различных комбинациях с трегалозой, сахарозой и лактозой, в которых содержание свободного полисахарида было в определенных пределах, а содержание влаги было меньше 2%. Указанная комбинация стабилизатора была выбрана из а) от 2 до 5% (вес/объем) трегалозы, от 0,25 до 0,75% цитрата натрия; b) от 2 до 5% (вес/объем) сахарозы и от 0,25 до 0,75% цитрата натрия; с) от 2 до 5% (вес/объем) сахарозы, от 2 до 5% (вес/объем) лактозы и от 0,25 до 0,75% цитрата натрия и d) от 2 до 5% (вес/объем) трегалозы, от 2 до 5% (вес/объем) лактозы и от 0,25 до 0,75% цитрата натрия.
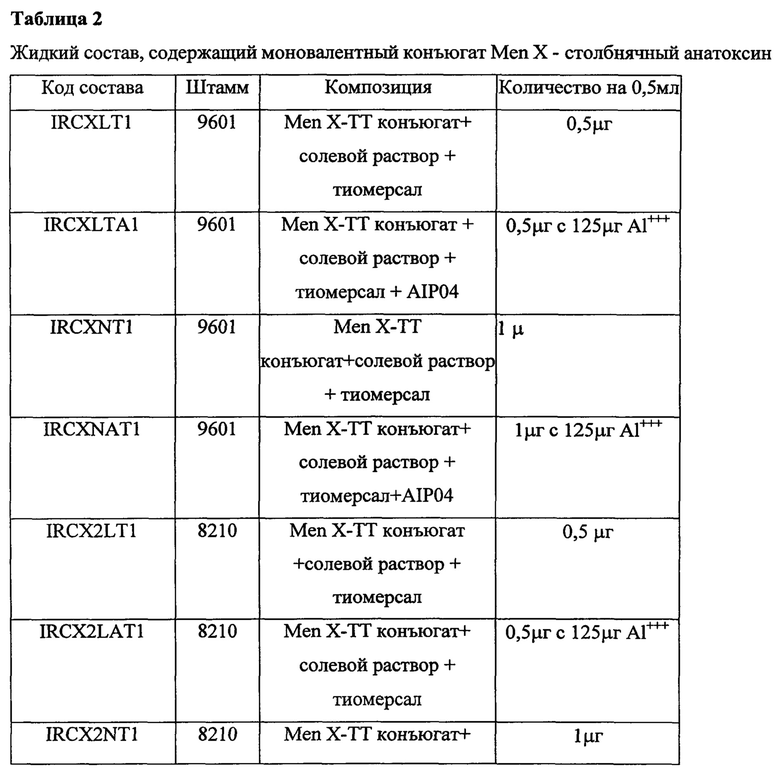

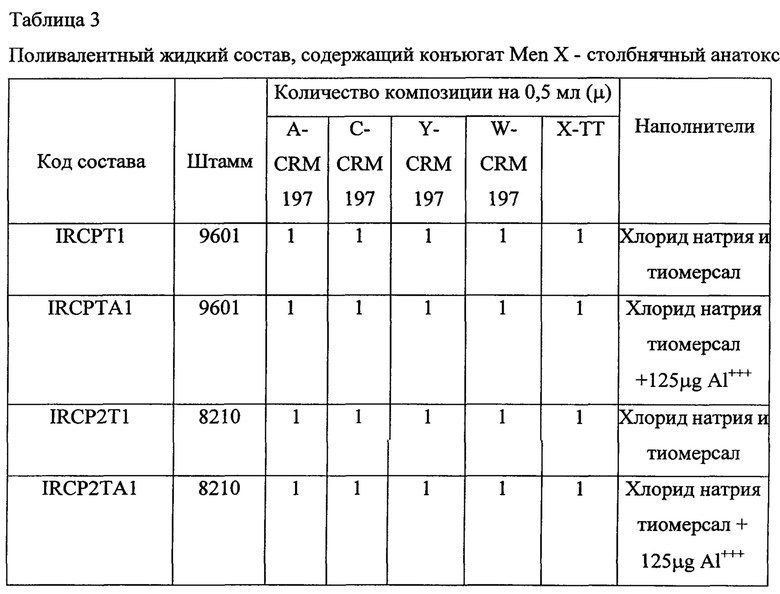
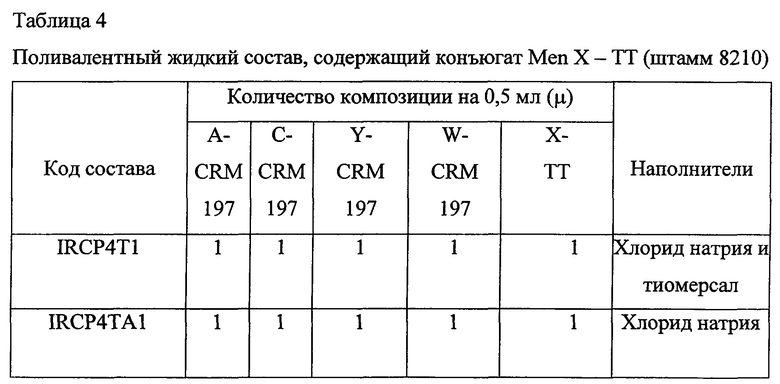
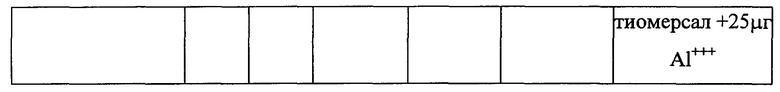
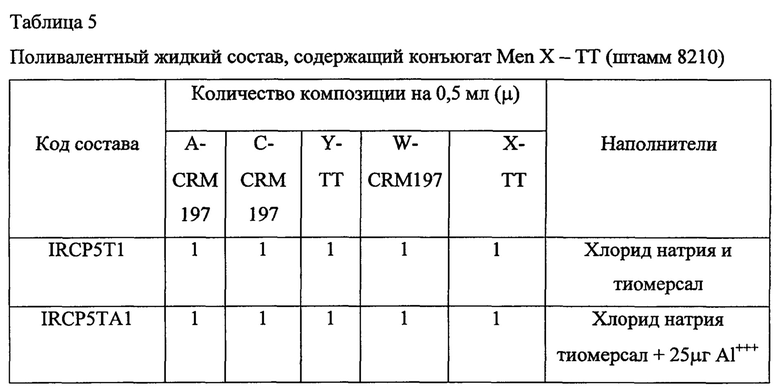
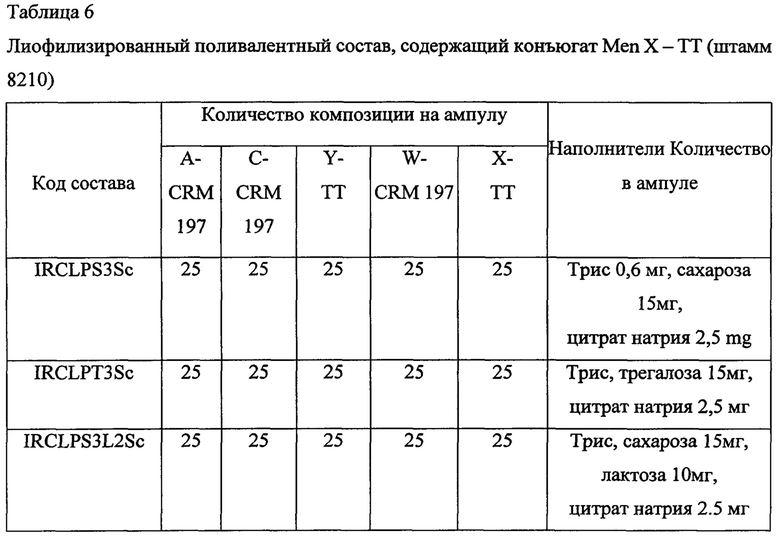
Пример 5
Биологическая активность менингококковой моновалентной и поливалентной конъюгатной композиции, содержащей Men X сахаридный конъюгат
Каждый состав иммунизировали шести женским особям швейцарских белых мышей с массой тела 16-20 г.Мышей иммунизировали подкожно в День 0, 14 и 28. Всех мышей обескровили через 1 & 2 недели после второй иммунизации (День 21 и День 35).
Титрация антитела была выполнена с помощью анализа на основе гранул и SBA [сывороточный бактерицидный тест]. Образцы сыворотки предварительной иммунизации от всех шести мышей смешали, получили одну смешанную сыворотку по каждому составу из исследования 4 далее и также послеиммунизационный образец сыворотки от шести мышей, которые все принадлежали к швейцарской белой породе, по каждому составу смешали и получили смеси 1, 2 & 3, используя сыворотку от мыши 1+2, 3+4 и 5+6 соответственно. Каждую из смесей проанализировали на титры общего иммуноглобулина G [IgG] (мультиплексированный анализ на основе гранул) и на функциональные титры антител (SBA).

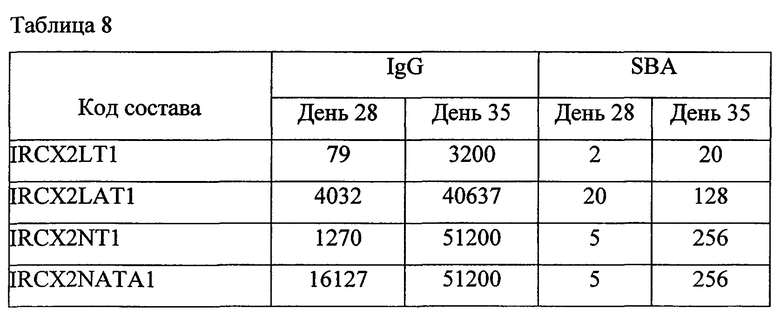
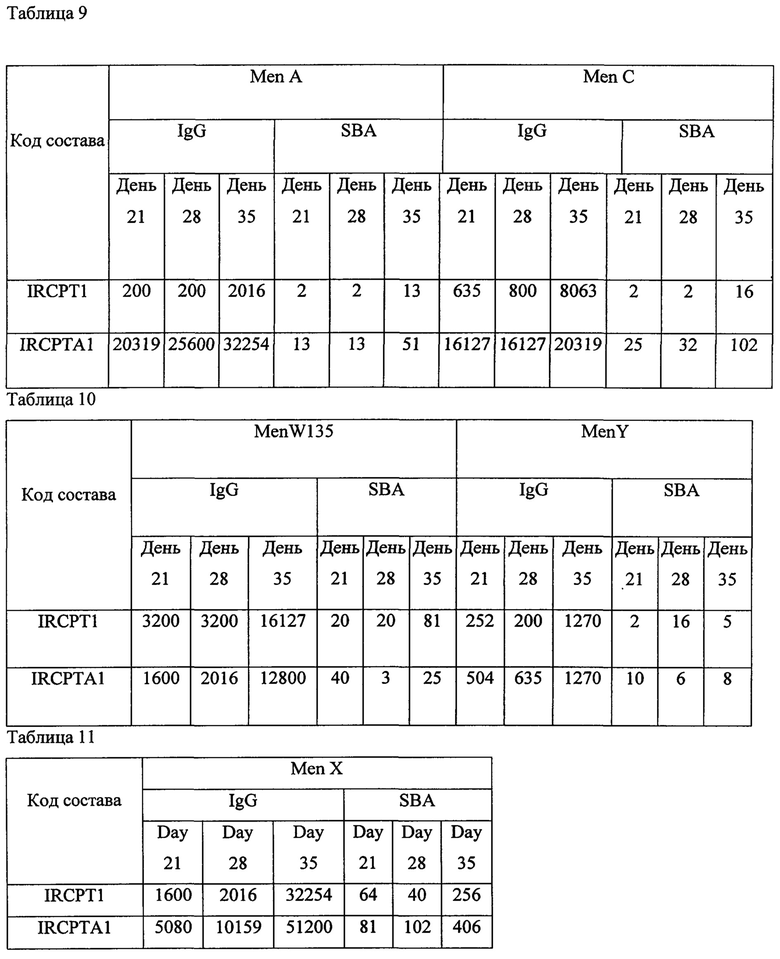

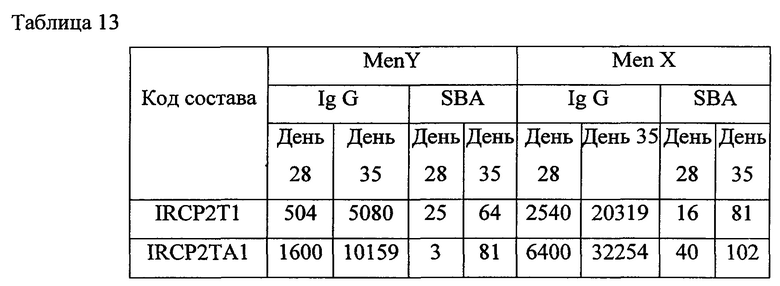
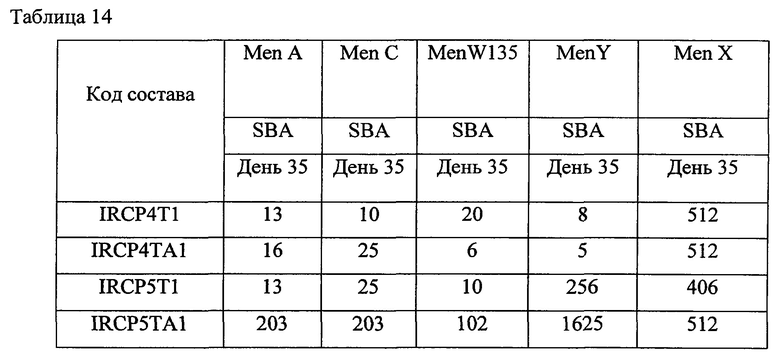
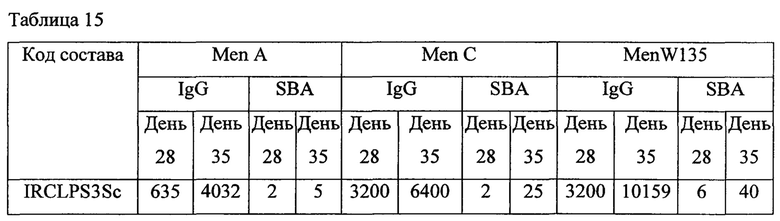
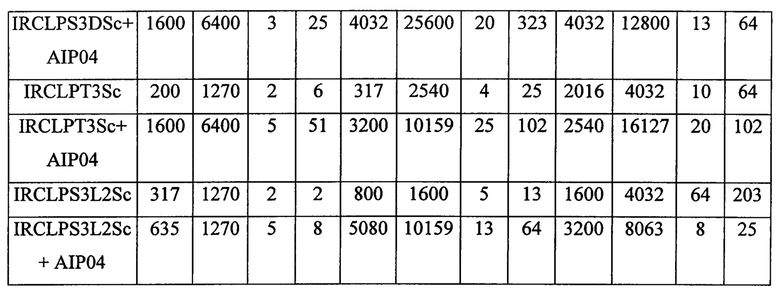
Приведенные выше данные по иммуногенности мышей показывают, что жидкие и лиофилизированные композиции одновалентного конъюгата Х-столбнячный анатоксин и поливалентных конъюгатов, содержащих конъюгат Х-столбнячный анатоксин, признаны иммуногенными. Кроме того, моновалентная жидкая композиция, содержащая 1 мкг конъюгата Х-столбнячный анатоксин, хлорид натрия, тиомерсал и 125 мкг Al+++, дает оптимальный иммуногенный ответ. Также жидкая поливалентная композиция в объеме 0,5 мл, содержащая конъюгаты A-CRM197, C-CRM197, Y-столбнячный анатоксин, W-CRM197 и Х-столбнячный анатоксин при 1 мкг каждого из всех 5 сахаридов, хлорида натрия, тиомерсала и 25 мкг Al+++, дает оптимальный иммуногенный ответ. Таким образом, в этой пятивалентной конъюгатной композиции конъюгаты, содержащие столбнячный анатоксин в качестве белка-носителя, признаны повышающими иммуногенность конъюгатов, содержащих CRM 197 в качестве белка-носителя.
Ввиду наличия многих возможных вариантов осуществления, к которым могут быть применены принципы раскрытого изобретения, следует понимать, что проиллюстрированные варианты осуществления являются только предпочтительными примерами изобретения и не должны рассматриваться как ограничивающие объем изобретения. Точнее, объем изобретения определяется прилагаемой патентной формулой. Авторы, следовательно, претендуют на все, что подпадает под действие сущности и объема данной патентной формулы.


Изобретения касаются иммуногенной композиции (варианты) и способа получения композиции (варианты). Представленные композиции содержат конъюгаты капсулярных сахаридов Neisseria meningitides серогрупп А, С, Y, W135 и X со столбнячными анатоксинами или CRM197. Причем каждый из сахаридов N.meningitidis имеет белок-носитель, с которым он конъюгируется через гетеро- или гомо-бифункциональный линкер с помощью 1-циано-4-пирролидинопиридиния тетрафторбората (СРРТ), применяемого в качестве реагента цианилирования. Изобретения могут быть использованы для защиты человеческого организма-хозяина от заболевании, вызванного инфекцией Neisseria meningitidis. 7 н. и 15 з.п. ф-лы, 11 ил., 16 табл., 5 пр.
1. Иммуногенная композиция для защиты человеческого организма-хозяина от заболевания, вызванного инфекцией Neisseria meningitidis, содержащая:
(a) эффективное количество конъюгата (i) капсулярного сахарида N. meningitidis серогруппы А и (ii) столбнячного анатоксина;
(b) эффективное количество конъюгата (i) капсулярного сахарида N. meningitidis серогруппы С и (ii) CRM197;
(c) эффективное количество конъюгата (i) капсулярного сахарида N. meningitidis серогруппы Y и (ii) CRM197;
(d) эффективное количество конъюгата (i) капсулярного сахарида N. meningitidis серогруппы W135 и (ii) CRM197; и
(e) эффективное количество конъюгата (i) капсулярного сахарида N. meningitidis серогруппы X и (ii) столбнячного анатоксина,
отличающаяся тем, что указанный конъюгат белка и сахарида N. meningitidis серогруппы X получен из N. meningitidis серогруппы X штамма 8210,
причем каждый из сахаридов N. meningitidis имеет белок-носитель, с которым он конъюгируется через гетеро- или гомо-бифункциональный линкер с помощью химии конъюгации цианилированием с помощью 1-циано-4-пирролидинопиридиния тетрафторбората (СРРТ) в качестве реагента цианилирования.
2. Иммуногенная композиция по п. 1, отличающаяся тем, что каждый капсулярный полисахарид имеет средний размер от 100 до 200 кДа.
3. Иммуногенная композиция по п. 1, отличающаяся тем, что по меньшей мере 3 полисахарида N. meningitidis из серогрупп А, С, W135 и X после сортировки по размеру имеют средний размер от 100 до 150 кДа.
4. Иммуногенная композиция по п. 3, отличающаяся тем, что сортировка по размеру выполняется путем использования системы разрушения клеток под высоким давлением.
5. Иммуногенная композиция по п. 1, отличающаяся тем, что полисахарид N. meningitidis из серогруппы Y после химической сортировки по размеру имеет средний размер от 90 до 110 кДа.
6. Иммуногенная композиция по п. 5, отличающаяся тем, что химическая сортировка по размеру выполняется путем использования ацетата натрия при температуре от 60 до 80°С.
7. Иммуногенная композиция по п. 1, отличающаяся тем, что гетеро- или гомо-бифункциональным линкером является ADH.
8. Иммуногенная композиция для защиты человеческого организма-хозяина от заболевания, вызванного инфекцией Neisseria meningitidis, содержащая:
эффективное количество конъюгата белка и полисахарида из N. meningitidis серогруппы X штамма 8210; и
эффективное количество по меньшей мере одного дополнительного сахаридного конъюгата из капсулярного сахарида N. meningitidis пятивалентной композиции конъюгата ACWYX,
причем каждый из полисахаридов N. meningitidis имеет белок-носитель, с которым он конъюгируется через гетеро- или гомо-бифункциональный линкер с помощью химии конъюгации цианилированием с помощью 1-циано-4-пирролидинопиридиния тетрафторбората (СРРТ) в качестве реагента цианилирования.
9. Иммуногенная композиция по п. 8, отличающаяся тем, что композиция содержит капсулярный полисахарид N. meningitidis серогрупп А, С, W-135, Y и X путем использования по меньшей мере 2 различных белков-носителей для конъюгации всех 5 полисахаридов.
10. Иммуногенная композиция по п. 8, отличающаяся тем, что каждый полисахарид N. meningitidis конъюгируется с белком-носителем, выбранным из группы, состоящей из ТТ, DT, CRM197, фрагмента С столбнячного анатоксина, белка D, ОМРС и пневмолизина.
11. Иммуногенная композиция по п. 9, отличающаяся тем, что композиция содержит:
(a) конъюгат (i) капсулярного сахарида N. meningitidis серогруппы А и (ii) столбнячного анатоксина;
(b) конъюгат (i) капсулярного сахарида N. meningitidis серогруппы С и (ii) CRM197;
(c) конъюгат (i) капсулярного сахарида N. meningitidis серогруппы Y и (ii) столбнячного анатоксина;
(d) конъюгат (i) капсулярного сахарида N. meningitidis серогруппы W135 и (ii) CRM197; и
(e) конъюгат (i) капсулярного сахарида N. meningitidis серогруппы X и (ii) CRM197.
12. Иммуногенная композиция по п. 8, отличающаяся тем, что каждый капсулярный полисахарид имеет средний размер от 100 до 200 кДа.
13. Иммуногенная композиция по п. 9, отличающаяся тем, что по меньшей мере 3 полисахарида N. meningitidis из серогрупп А, С, W135 и X после сортировки по размеру имеют средний размер от 100 до 150 кДа.
14. Иммуногенная композиция по п. 12, отличающаяся тем, что сортировка по размеру выполняется путем использования системы разрушения клеток под высоким давлением.
15. Иммуногенная композиция по п. 9, отличающаяся тем, что полисахарид N. meningitidis из серогруппы Y после химической сортировки по размеру имеет средний размер от 90 до 110 кДа.
16. Иммуногенная композиция по п. 14, отличающаяся тем, что химическая сортировка по размеру выполняется путем использования ацетата натрия при температуре от 60 до 80°С.
17. Иммуногенная композиция по п. 8, отличающаяся тем, что гетеро- или гомо-бифункциональным линкером является ADH.
18. Способ получения иммуногенной композиции, имеющей конъюгат белка и полисахарида из N. meningitidis серогруппы X штамма 8210, содержащей
конъюгат (i) капсулярного сахарида N. meningitidis серогруппы X и (ii) столбнячного анатоксина,
причем каждый из сахаридов N. meningitidis конъюгирован с белком-носителем через гетеро- или гомо-бифункциональный линкер с помощью химии конъюгации цианилированием, и
отличающийся тем, что конъюгаты сахарида N. meningitidis серогруппы X и столбнячного анатоксина получают с помощью реакции конъюгации, состоящей из
i) сортировки по размеру полисахарида;
ii) активации на основе СРРТ отсортированного по размеру полисахарида, имеющего среднюю молекулярную массу от 100 до 150 кДа, при рН от 9 до 9,5;
ii) добавления ADH примерно через 2-3 минуты с последующим периодом инкубации 4-20 часов,
iv) диафильтрации для удаления непрореагировавшего ADH и
v) взаимодействия ADH-активированного полисахарида с очищенным неактивированным белком-носителем в соотношении 0,75-1,5 в присутствии MES буфера и EDAC с последующим периодом инкубации 3-4 часа,
причем реакция конъюгации осуществляется при температуре от 2 до 8°С и соотношение сахарида к белку в конечном конъюгате составляет от 0,2 до 0,6.
19. Способ получения иммуногенной композиции, имеющей конъюгат белка и полисахарида из N. meningitidis серогруппы X штамма 8210, содержащей:
конъюгат (i) капсулярного сахарида N. meningitidis серогруппы X и (ii) столбнячного анатоксина,
причем каждый из сахаридов N. meningitidis конъюгирован с белком-носителем через гетеро- или гомо-бифункциональный линкер с помощью химии конъюгации цианилированием, и
отличающийся тем, что конъюгаты полисахарид N. meningitidis серогруппы X-столбнячный анатоксин получают с помощью реакции конъюгации, состоящей из
i) сортировки по размеру полисахарида;
ii) активации на основе СРРТ отсортированного по размеру полисахарида, имеющего среднюю молекулярную массу от 100 до 150 кДа, при рН от 9 до 9,5;
iii) добавления ADH-активированного белка-носителя в соотношении сахарид:белок от 0,5 до 2 через 2-3 минуты с последующим периодом инкубации от 2 до 20 часов, причем реакция конъюгации осуществляется при температуре от 22°С до примерно 25°С и соотношение сахарида к белку в конечном конъюгате составляет от 0,2 до 0,6.
20. Способ получения иммуногенной композиции, имеющей конъюгат белка и полисахарида из N. meningitidis серогруппы X штамма 8210, и
по меньшей мере один дополнительный сахаридный конъюгат(ы) из капсулярного сахарида N. meningitidis серогрупп А, В, С, W135 и Y, причем композиция содержит капсулярный полисахарид N. meningitidis серогрупп А, С, W-135, Y и X путем использования по меньшей мере 2 различных белков-носителей для конъюгации всех 5 полисахаридов
причем каждый из сахаридов N. meningitidis конъюгирован с белком-носителем через гетеро- или гомо-бифункциональный линкер с помощью химии конъюгации цианилированием,и
отличающийся тем, что конъюгаты полисахарида N. meningitidis серогруппы X и белка-носителя получают с помощью реакции конъюгации, состоящей из
i) сортировки по размеру полисахарида;
ii) активации на основе СРРТ отсортированного по размеру полисахарида, имеющего среднюю молекулярную массу от 100 до 150 кДа, при рН от 9 до 9,5;
iii) добавления ADH примерно через 2-3 минуты с последующим периодом инкубации 4-20 часов,
iv) диафильтрации для удаления непрореагировавшего ADH и
v) взаимодействия ADH-активированного полисахарида с очищенным неактивированным белком-носителем в соотношении 0,75-1,5 в присутствии MES буфера и EDAC с последующим периодом инкубации 3-4 часа,
причем реакция конъюгации осуществляется при температуре от 2 до 8°С и соотношение сахарида к белку в конечном конъюгате составляет от 0,2 до 0,6.
21. Способ получения иммуногенной композиции, имеющей конъюгат белка и полисахарида из N. meningitidis серогруппы X штамма 8210 и
по меньшей мере один дополнительный сахаридный конъюгат из капсулярного
сахарида N. meningitidis серогрупп А, В, С, W135 и Y,
причем композиция содержит капсулярный полисахарид N. meningitidis серогрупп А, С, W-135, Y и X путем использования по меньшей мере 2 различных белков-носителей для конъюгации всех 5 полисахаридов
причем каждый из сахаридов N. meningitidis конъюгирован с белком-носителем через гетеро- или гомо-бифункциональный линкер с помощью химии конъюгации цианилированием,и
отличающийся тем, что конъюгаты полисахарид N. meningitidis серогруппы Х-белок-носитель получают с помощью реакции конъюгации, состоящей из
i) сортировки по размеру полисахарида;
ii) активации на основе СРРТ отсортированного по размеру полисахарида, имеющего среднюю молекулярную массу от 100 до 150 кДа, при рН от 9 до 9,5;
iii) добавления ADH-активированного белка-носителя в соотношении сахарид: белок от 0,5 до 2 через 2-3 минуты с последующим периодом инкубации от 2 до 20 часов, причем реакция конъюгации осуществляется при температуре от 22°С до примерно 25°С и соотношение сахарида к белку в конечном конъюгате составляет от 0,2 до 0,6.
22. Способ иммунизации человеческого организма-хозяина от заболевания, вызванного инфекцией Neisseria meningitidis, включающий введение хозяину иммунозащитной дозы иммуногенной композиции по пп. 1-17.
| WO 2008102173 A1, 28.08.2008 | |||
| US 20080193476 A1, 14.08.2008 | |||
| EP 1741442 B1, 21.07.2010 | |||
| ЖИДКИЕ ВАКЦИНЫ ДЛЯ МНОЖЕСТВЕННЫХ СЕРОГРУПП МЕНИНГОКОККОВ | 2004 |
|
RU2378010C2 |
Авторы
Даты
2017-10-26—Публикация
2013-01-29—Подача