Родственные заявки
Настоящая заявка притязает на приоритет согласно 35 USC 119(e) на основании предварительной заявки на выдачу патента № 61/121092, поданной 9 декабря 2008, описание которой включено в настоящее описание путем ссылки в полном объеме.
Область техники, к которой относится изобретение
Настоящее изобретение, в общем, относится к иммунной функции и к усилению функции T-клеток, включая повышенную регуляцию опосредованных клетками иммунных ответов, и к лечению T-клеточных дисфункциональных расстройств.
Уровень техники
Костимуляция или предоставление двух отдельных сигналов T-клеткам является широко распространенной моделью активации покоящихся T-лимфоцитов антигенпрезентирующими клетками (APC, АПК). Lafferty et al., Aust. J. Exp. Biol. Med. Sci. 53: 27-42 (1975). Такая модель дополнительно предусматривает способность отличать свое от чужого и иммунную толерантность. Bretscher et al., Science 169: 1042-1049 (1970); Bretscher, P.A., P.N.A.S. USA 96: 185-190 (1999); Jenkins et al., J. Exp. Med. 165: 302-319 (1987). Трансдукция первого сигнала или специфичного для антигена сигнала осуществляется через T-клеточный рецептор (TCR) после распознавания чужеродного антигенного пептида, презентируемого в контексте главного комплекса гистосовместимости (MHC). Второй или костимулирующий сигнал доставляется к T-клеткам костимулирующими молекулами, экспрессируемыми на антигенпрезентирующих клетках (АПК), и индуцирует T-клетки, стимулируя клональную экспансию, секрецию цитокинов и эффекторную функцию. Lenschow et al., Ann. Rev. Immunol. 14: 233 (1996). В отсутствие костимуляции T-клетки могут становиться невосприимчивыми к антигенной стимуляции, не обеспечивают формирование эффективного иммунного ответа и, кроме того, могут приводить к истощению или толерантности к чужеродным антигенам.
Простая основанная на двух сигналах модель может быть чрезмерным упрощением, поскольку интенсивность сигнала TCR в действительности оказывает количественное влияние на активацию и дифференцировку T-клеток. Viola et al., Science 273: 104-106 (1996); Sloan-Lancaster, Nature 363: 156-159 (1993). Кроме того, активация T-клеток может происходить даже в отсутствие костимулирующего сигнала, если интенсивность сигнала TCR высока. Более важно то, что T-клетки получают как позитивные, так и негативные вторичные костимулирующие сигналы. Регулирование таких позитивных и негативных сигналов является важным для максимизации защитных иммунных ответов хозяина при сохранении иммунной толерантности и недопущении аутоиммунитета. Негативные вторичные сигналы, по-видимому, необходимы для индукции T-клеточной толерантности, тогда как позитивные сигналы стимулируют активацию T-клеток. Хотя простая основанная на двух сигналах модель все же дает правильное объяснение в случае «необученных» лимфоцитов, иммунный ответ хозяина является динамическим процессом, и подвергаемые воздействию антигена T-клетки также могут получать костимулирующие сигналы.
Механизм костимуляции представляет терапевтический интерес, так как показано, что управление костимулирующими сигналами обеспечивает средство либо для усиления, либо для прекращения основанного на клетках иммунного ответа. Недавно было обнаружено, что нарушение функции T-клеток или анергия возникает одновременно с индуцированной и длительной экспрессией ингибирующего рецептора, полипептида запрограммированной гибели 1 (PD-1). В результате целенаправленное терапевтическое воздействие, направленное на PD-1 и другие молекулы, которые передают сигнал посредством взаимодействий с PD-1, такие как лиганд пептида запрограммированной гибели 1 (PD-L1) и лиганд пептида запрограммированной гибели 2 (PD-L2), относится к области повышенного интереса. Ингибирование передачи сигнала PD-L1 было предложено в качестве средства усиления T-клеточного иммунитета для лечения злокачественной опухоли (например, опухолевого иммунитета) и инфекции, включая как острую, так и хроническую (например, персистирующую) инфекцию. Однако поскольку оптимальное терапевтическое средство, направленное к мишени в таком пути, должно быть все-таки поставлено на коммерческую основу, в области медицины существует значительная неудовлетворенная потребность в таких средствах.
Сущность изобретения
Настоящее изобретение относится к антителам к PD-L1, включая кодирующую их нуклеиновую кислоту и композиции, содержащие такие антитела, и к их применению с целью усиления функции T-клеток для осуществления повышающей регуляции опосредованных клетками иммунных ответов, и для лечения T-клеточных дисфункциональных расстройств, включая инфекцию (например, острую и хроническую) и опухолевый иммунитет.
В одном варианте изобретение относится к выделенному полипептиду вариабельной области тяжелой цепи, содержащему последовательность HVR-H1, HVR-H2 и HVR-H3, где:
(a) последовательность HVR-H1 представляет собой последовательность GFTFSX1SWIH (SEQ ID NO:1);
(b) последовательность HVR-H2 представляет собой последовательность AWIX2PYGGSX3YYADSVKG (SEQ ID NO:2);
(c) последовательность HVR-H3 представляет собой последовательность RHWPGGFDY (SEQ ID NO:3);
и где: X1 означает D или G; X2 означает S или L; X3 означает T или S.
В одном конкретном аспекте X1 означает D; X2 означает S, и X3 означает T. В другом аспекте полипептид дополнительно содержит последовательности каркаса вариабельной области тяжелой цепи, расположенные между HVR согласно формуле: (HC-FR1)-(HVR-H1)-(HC-FR2)-(HVR-H2)-(HC-FR3)-(HVR-H3)-(HC-FR4). В еще одном аспекте каркасные последовательности получены из консенсусных каркасных последовательностей человека. В следующем аспекте каркасные последовательности представляют собой консенсусный каркас VH подгруппы III. В еще одном аспекте, по меньшей мере, одна из каркасных последовательностей представляет собой следующую последовательность:
HC-FR1 представляет собой EVQLVESGGGLVQPGGSLRLSCAAS (SEQ ID NO:4)
HC-FR2 представляет собой WVRQAPGKGLEWV (SEQ ID NO:5)
HC-FR3 представляет собой RFTISADTSKNTAYLQMNSLRAEDTAVYYCAR (SEQ ID NO:6)
HC-FR4 представляет собой WGQGTLVTVSA (SEQ ID NO:7).
В еще одном аспекте полипептид тяжелой цепи дополнительно объединен с вариабельной областью легкой цепи, содержащей HVR-L1, HVR-L2 и HVR-L3, где:
(a) последовательность HVR-L1 представляет собой RASQX4X5X6TX7X8A (SEQ ID NO:8);
(b) последовательность HVR-L2 представляет собой SASX9LX10S, (SEQ ID NO:9);
(c) последовательность HVR-L3 представляет собой QQX11X12X13X14PX15T (SEQ ID NO:10);
и где: X4 означает D или V; X5 означает V или I; X6 означает S или N; X7 означает A или F; X8 означает V или L; X9 означает F или T; X10 означает Y или A; X11 означает Y, G, F или S; X12 означает L, Y, F или W; X13 означает Y, N, A, T, G, F или I; X14 означает H, V, P, T или I; X15 означает A, W, R, P или T.
В еще одном аспекте X4 означает D; X5 означает V; X6 означает S; X7 означает A; X8 означает V; X9 означает F; X10 означает Y; X11 означает Y; X12 означает L; X13 означает Y; X14 означает H; X15 означает A. В еще одном аспекте легкая цепь дополнительно содержит каркасные последовательности вариабельной области легкой цепи, расположенные между HVR согласно формуле: (LC-FR1)-(HVR-L1)-(LC-FR2)-(HVR-L2)-(LC-FR3)-(HVR-L3)-(LC-FR4). В еще одном аспекте каркасные последовательности получены из консенсусных каркасных последовательностей человека. В еще одном аспекте каркасные последовательности представляют собой консенсусный каркас VL каппа I. В еще одном аспекте, по меньшей мере, одна из каркасных последовательностей представляет собой следующую последовательность:
LC-FR1 представляет собой DIQMTQSPSSLSASVGDRVTITC (SEQ ID NO:11)
LC-FR2 представляет собой WYQQKPGKAPKLLIY (SEQ ID NO:12)
LC-FR3 представляет собой GVPSRFSGSGSGTDFTLTISSLQPEDFATYYC (SEQ ID NO:13)
LC-FR4 представляет собой FGQGTKVEIKR (SEQ ID NO:14).
В другом варианте изобретение относится к выделенному антителу к PD-L1 или антигенсвязывающему фрагменту, содержащему последовательность вариабельной области тяжелой цепи и легкой цепи, где:
(a) тяжелая цепь содержит HVR-H1, HVR-H2 и HVR-H3, и где:
(i) последовательность HVR-H1 представляет собой GFTFSX1SWIH; (SEQ ID NO:1)
(ii) последовательность HVR-H2 представляет собой AWIX2PYGGSX3YYADSVKG (SEQ ID NO:2)
(iii) последовательность HVR-H3 представляет собой RHWPGGFDY и (SEQ ID NO:3),
(b) легкая цепь содержит HVR-L1, HVR-L2 и HVR-L3, и где:
(i) последовательность HVR-L1 представляет собой RASQX4X5X6TX7X8A (SEQ ID NO:8)
(ii) последовательность HVR-L2 представляет собой SASX9LX10S; и (SEQ ID NO:9)
(iii) последовательность HVR-L3 представляет собой QQX11X12X13X14PX15T; (SEQ ID NO:10)
и где: X1 означает D или G; X2 означает S или L; X3 означает T или S; X4 означает D или V; X5 означает V или I; X6 означает S или N; X7 означает A или F; X8 означает V или L; X9 означает F или T; X10 означает Y или A; X11 означает Y, G, F или S; X12 означает L, Y, F или W; X13 означает Y, N, A, T, G, F или I; X14 означает H, V, P, T или I; X15 означает A, W, R, P или T.
В конкретном аспекте X1 означает D; X2 означает S и X3 означает T. В другом аспекте X4 означает D; X5 означает V; X6 означает S; X7 означает A; X8 означает V; X9 означает F; X10 означает Y; X11 означает Y; X12 означает L; X13 означает Y; X14 означает H; X15 означает A. В еще одном аспекте X1 означает D; X2 означает S и X3 означает T, X4 означает D; X5 означает V; X6 означает S; X7 означает A; X8 означает V; X9 означает F; X10 означает Y; X11 означает Y; X12 означает L; X13 означает Y; X14 означает H и X15 означает A.
В следующем аспекте вариабельная область тяжелой цепи содержит одну или более каркасных последовательностей, расположенных между HVR следующим образом: (HC-FR1)-(HVR-H1)-(HC-FR2)-(HVR-H2)-(HC-FR3)-(HVR-H3)-(HC-FR4), и вариабельная область легкой цепи содержит одну или более каркасных последовательностей, расположенных между HVR следующим образом: (LC-FR1)-(HVR-L1)-(LC-FR2)-(HVR-L2)-(LC-FR3)-(HVR-L3)-(LC-FR4). В еще одном аспекте каркасные последовательности получены из консенсусных каркасных последовательностей человека. В еще одном аспекте каркасные последовательности тяжелой цепи получены из последовательности подгруппы I, II или III по Кабату. В еще одном аспекте каркасная последовательность тяжелой цепи представляет собой консенсусный каркас подгруппы III VH. В еще одном аспекте одна или более каркасных последовательностей тяжелой цепи представляют собой следующие последовательности:

В еще одном аспекте каркасные последовательности легкой цепи получены из последовательности подгруппы каппа I, II, II или IV по Кабату. В еще одном аспекте каркасные последовательности легкой цепи представляют собой консенсусный каркас VL каппа I. В еще одном аспекте одна или более каркасных последовательностей легкой цепи представляют собой следующие последовательности:

В еще одном конкретном аспекте антитело дополнительно содержит константную область человека или мыши. В еще одном аспекте константная область человека выбрана из группы, состоящей из IgG1, IgG2, IgG2, IgG3, IgG4. В еще одном конкретном аспекте константная область человека получена из IgG1. В еще одном аспекте константная область мыши выбрана из группы, состоящей из IgG1, IgG2A, IgG2B, IgG3. В еще одном аспекте константная область мыши получена из IgG2A. В еще одном дополнительном конкретном аспекте антитело обладает пониженной или минимальной эффекторной функцией. В еще одном конкретном аспекте минимальная эффекторная функция является результатом «Fc-мутации с утратой эффекторной функции» или отсутствия гликозилирования. В еще одном варианте изобретения Fc-мутация с утратой эффекторной функции представляет собой замену N297A или D265A/N297A в константной области.
В еще одном варианте изобретения предлагается антитело к PD-L1, содержащее последовательность вариабельной области тяжелой цепи и легкой цепи, где:
(a) тяжелая цепь дополнительно содержит последовательность HVR-H1, HVR-H2 и HVR-H3, имеющую, по меньшей мере, 85% идентичность последовательности с последовательностью GFTFSDSWIH (SEQ ID NO:15), AWISPYGGSTYYADSVKG (SEQ ID NO:16) и RHWPGGFDY (SEQ ID NO:3), соответственно, или
(b) легкая цепь дополнительно содержит последовательность HVR-L1, HVR-L2 и HVR-L3, имеющую, по меньшей мере, 85% идентичность последовательности с последовательностью RASQDVSTAVA (SEQ ID NO:17), SASFLYS (SEQ ID NO:18) и QQYLYHPAT (SEQ ID NO:19), соответственно.
В конкретном аспекте идентичность последовательности составляет 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%. В другом аспекте вариабельная область тяжелой цепи содержит одну или более каркасных последовательностей, расположенных между HVR следующим образом: (HC-FR1)-(HVR-H1)-(HC-FR2)-(HVR-H2)-(HC-FR3)-(HVR-H3)-(HC-FR4), и вариабельные области легкой цепи содержат одну или более каркасных последовательностей, расположенных между HVR следующим образом: (LC-FR1)-(HVR-L1)-(LC-FR2)-(HVR-L2)-(LC-FR3)-(HVR-L3)-(LC-FR4). В еще одном аспекте каркасные последовательности получены из консенсусных каркасных последовательностей человека. В еще одном аспекте каркасные последовательности тяжелой цепи получены из последовательности подгруппы I, II или III по Кабату. В еще одном аспекте каркасная последовательность тяжелой цепи представляет собой консенсусный каркас VH подгруппы III. В еще одном аспекте одна или более каркасных последовательностей тяжелой цепи представляют собой следующие последовательности:

В еще одном аспекте каркасные последовательности легкой цепи получены из последовательности каппа подгруппы I, II, II или IV по Кабату. В еще одном аспекте каркасные последовательности легкой цепи представляют собой консенсусный каркас VL каппа I. В еще одном аспекте одна или более каркасных последовательностей легкой цепи представляют собой следующие последовательности:

В еще одном конкретном аспекте антитело дополнительно содержит константную область человека или мыши. В еще одном аспекте константная область человека выбрана из группы, состоящей из IgG1, IgG2, IgG2, IgG3, IgG4. В еще одном конкретном аспекте константная область человека получена из IgG1. В еще одном аспекте константная область мыши выбрана из группы, состоящей из IgG1, IgG2A, IgG2B, IgG3. В еще одном аспекте константная область мыши получена из IgG2A. В еще одном дополнительном конкретном аспекте антитело обладает пониженной или минимальной эффекторной функцией. В еще одном конкретном аспекте минимальная эффекторная функция является результатом «Fc-мутации с утратой эффекторной функции» или отсутствия гликозилирования. В еще одном варианте изобретения Fc-мутация с утратой эффекторной функции представляет собой замену N297A или D265A/N297A в константной области.
В еще одном варианте изобретения предлагается выделенное антитело к PD-L1, содержащее последовательность вариабельной области тяжелой цепи и легкой цепи, где:
(a) последовательность тяжелой цепи имеет, по меньшей мере, 85% идентичность последовательности с последовательностью тяжелой цепи:

или
(b) последовательность легкой цепи имеет, по меньшей мере, 85% идентичность последовательности с последовательностью легкой цепи:
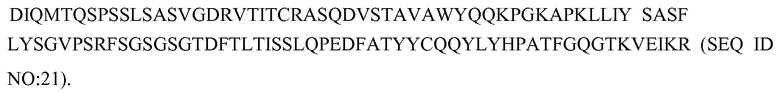
В конкретном аспекте идентичность последовательности составляет 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%. В другом аспекте вариабельная область тяжелой цепи содержит одну или более каркасных последовательностей, расположенных между HVR следующим образом: (HC-FR1)-(HVR-H1)-(HC-FR2)-(HVR-H2)-(HC-FR3)-(HVR-H3)-(HC-FR4), и вариабельные области легкой цепи содержат одну или более каркасных последовательностей, расположенных между HVR следующим образом: (LC-FR1)-(HVR-L1)-(LC-FR2)-(HVR-L2)-(LC-FR3)-(HVR-L3)-(LC-FR4). В еще одном аспекте каркасные последовательности получены из консенсусных каркасных последовательностей человека. В следующем аспекте каркасные последовательности тяжелой цепи получены из последовательности подгруппы I, II или III по Кабату. В еще одном аспекте каркасная последовательность тяжелой цепи представляет собой консенсусный каркас VH подгруппы III. В еще одном аспекте одна или более каркасных последовательностей тяжелой цепи представляют собой следующие последовательности:

В еще одном аспекте каркасные последовательности легкой цепи получены из последовательности каппа подгруппы I, II, II или IV по Кабату. В еще одном аспекте каркасные последовательности легкой цепи представляют собой консенсусный каркас VL каппа I. В еще одном аспекте одна или более каркасных последовательностей легкой цепи представляют собой следующие последовательности:

В еще одном конкретном аспекте антитело дополнительно содержит константную область человека или мыши. В еще одном аспекте константная область человека выбрана из группы, состоящей из IgG1, IgG2, IgG2, IgG3, IgG4. В еще одном конкретном аспекте константная область человека получена из IgG1. В еще одном аспекте константная область мыши выбрана из группы, состоящей из IgG1, IgG2A, IgG2B, IgG3. В еще одном аспекте константная область мыши получена из IgG2A. В еще одном дополнительном конкретном аспекте антитело обладает пониженной или минимальной эффекторной функцией. В еще одном конкретном аспекте минимальная эффекторная функция является результатом продуцирования в прокариотических клетках. В еще одном конкретном аспекте минимальная эффекторная функция является результатом «Fc-мутации с утратой эффекторной функции» или отсутствия гликозилирования. В еще одном варианте изобретения Fc-мутация с утратой эффекторной функции представляет собой замену N297A или D265A/N297A в константной области.
В еще одном варианте изобретение относится к композициям, содержащим любое из описанных выше антител к PD-L1 в сочетании, по меньшей мере, с одним фармацевтически приемлемым носителем.
В еще одном варианте изобретение относится к выделенной нуклеиновой кислоте, кодирующей последовательность вариабельной области легкой цепи или тяжелой цепи антитела к PD-L1, где:
(a) тяжелая цепь дополнительно содержит последовательность HVR-H1, HVR-H2 и HVR-H3, имеющую, по меньшей мере, 85% идентичность последовательности с последовательностью GFTFSDSWIH (SEQ ID NO:15), AWISPYGGSTYYADSVKG (SEQ ID NO:16) и RHWPGGFDY (SEQ ID NO:3), соответственно, и
(b) легкая цепь дополнительно содержит последовательность HVR-L1, HVR-L2 и HVR-L3, имеющую, по меньшей мере, 85% идентичность последовательности с последовательностью RASQDVSTAVA (SEQ ID NO:17), SASFLYS (SEQ ID NO:18) и QQYLYHPAT (SEQ ID NO:19), соответственно.
В конкретном аспекте идентичность последовательности составляет 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%. В одном аспекте вариабельная область тяжелой цепи содержит одну или более каркасных последовательностей, расположенных между HVR следующим образом: (HC-FR1)-(HVR-H1)-(HC-FR2)-(HVR-H2)-(HC-FR3)-(HVR-H3)-(HC-FR4), и вариабельные области легкой цепи содержат одну или более каркасных последовательностей, расположенных между HVR следующим образом: (LC-FR1)-(HVR-L1)-(LC-FR2)-(HVR-L2)-(LC-FR3)-(HVR-L3)-(LC-FR4). В еще одном аспекте каркасные последовательности получены из консенсусных каркасных последовательностей человека. В следующем аспекте каркасные последовательности тяжелой цепи получены из последовательности подгруппы I, II или III по Кабату. В еще одном аспекте каркасная последовательность тяжелой цепи представляет собой консенсусный каркас VH подгруппы III. В еще одном аспекте одна или более каркасных последовательностей тяжелой цепи представляют собой следующие последовательности:

В еще одном аспекте каркасные последовательности легкой цепи получены из последовательности каппа подгруппы I, II, II или IV по Кабату. В еще одном аспекте каркасные последовательности легкой цепи представляют собой консенсусный каркас VL каппа I. В еще одном аспекте одна или более каркасных последовательностей легкой цепи представляют собой следующие последовательности:

В еще одном конкретном аспекте антитело дополнительно содержит константную область человека или мыши. В еще одном аспекте константная область человека выбрана из группы, состоящей из IgG1, IgG2, IgG2, IgG3, IgG4. В еще одном конкретном аспекте константная область человека получена из IgG1. В еще одном аспекте константная область мыши выбрана из группы, состоящей из IgG1, IgG2A, IgG2B, IgG3. В еще одном аспекте константная область мыши получена из IgG2A. В еще одном дополнительном конкретном аспекте антитело обладает пониженной или минимальной эффекторной функцией. В еще одном конкретном аспекте минимальная эффекторная функция является результатом продуцирования в прокариотических клетках. В еще одном конкретном аспекте минимальная эффекторная функция является результатом «Fc-мутации с утратой эффекторной функции» или отсутствия гликозилирования. В еще одном варианте Fc-мутация с утратой эффекторной функции представляет собой замену N297A или D265A/N297A в константной области.
В еще одном аспекте нуклеиновая кислота дополнительно содержится в векторе, подходящем для экспрессии нуклеиновой кислоты, кодирующей любое из ранее описанных антител к PD-L1. В еще одном конкретном аспекте вектор дополнительно содержится в клетке-хозяине, подходящей для экспрессии нуклеиновой кислоты. В еще одном конкретном аспекте клеткой-хозяином является эукариотическая клетка или прокариотическая клетка. В еще одном конкретном аспекте эукариотической клеткой является клетка млекопитающего, такая как клетка яичника китайского хомячка (CHO).
В еще одном варианте изобретение относится к способу получения антитела к PD-L1 или его антигенсвязывающего фрагмента, включающему культивирование клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую ранее описанные антитела к PD-L1 или антигенсвязывающий фрагмент, в форме, подходящей для экспрессии, в условиях, подходящих для продуцирования такого антитела или фрагмента, и извлечение антитела или фрагмента.
В еще одном варианте изобретение относится к композиции, содержащей антитело к PD-L1 или его антигенсвязывающий фрагмент, предлагаемые в изобретении, и, по меньшей мере, один фармацевтически приемлемый носитель.
В еще одном варианте изобретение относится к изделию производства, включающему емкость, содержащую терапевтически эффективное количество композиции, описанной в настоящей публикации, и вкладыш в упаковку, в котором указано применение для лечения T-клеточного дисфункционального расстройства.
В еще одном варианте изобретение относится к изделию производства, содержащему любую из описанных выше композиций анти-PD-L1 в сочетании, по меньшей мере, с одной молекулой BNCA. В одном аспекте молекулы BNCA представляют собой антитело, антигенсвязывающий фрагмент антитела, олигопептид BNCA, РНК-и BNCA или малую молекулу BNCA. В другом аспекте негативная костимулирующая молекула B7 выбрана из группы, состоящей из: CTLA-4, PD-1, PD-L1, PD-L2, B7.1, B7-H3 и B7-H4.
В еще одном варианте изделие производства содержит любую из описанных выше анти-PD-L1-композиций в сочетании с химиотерапевтическим средством. В одном аспекте химиотерапевтическим средством является гемцитабин.
В еще одном варианте изобретения предлагается изделие производства, содержащее любое из описанных выше антител к PD-L1 в сочетании с одним или более агонистами позитивной костимулирующей молекулы. В одном аспекте позитивная костимулирующая молекула представляет собой костимулирующую молекулу семейства B7. В другом аспекте позитивная костимулирующая молекула выбрана из группы, состоящей из: CD28, CD80, CD86, ICOS/ICOSL. В еще одном аспекте позитивная костимулирующая молекула представляет собой костимулирующую молекулу семейства TNFR. В следующем аспекте костимулирующая молекула TNFR выбрана из группы, состоящей из: OX40/OX40L, 4-1BB/4-1BBL, CD27/CD27L, CD30/CD30L и HVEM/LIGHT, и их растворимых фрагментов, конструкций и агонистических антител.
В еще одном варианте изобретения предлагается изделие производства, содержащее любое из описанных выше антител к PD-L1 в сочетании с одним или более антибиотиками. В одном аспекте антибиотик выбран из группы, состоящей из противовирусного средства, антибактериального средства, противогрибкового средства, противопротозойного средства.
В другом аспекте противовирусное средство выбрано из группы, состоящей из ингибиторов обратной транскриптазы, ингибиторов протеазы, ингибиторов интегразы, ингибиторов проникновения или слияния, ингибиторов созревания, ингибиторов высвобождения вирусов, усилителей иммунного ответа, противовирусных синергетических усилителей, вакцин, печеночных агонистов и терапевтических средств из растительного сырья. В еще одном аспекте сочетание включает одну или более категорий противовирусных средств.
В еще одном варианте изобретения предлагается изделие производства, содержащее любое из описанных выше антител к PD-L1 в сочетании с одной или более вакцинами.
В еще одном варианте изобретение относится к способу усиления T-клеточной функции, включающему введение эффективного количества любого из описанных выше антител к PD-L1 или композиций. В одном аспекте антитело к PD-L1 или композиция делает дисфункциональные T-клетки недисфункциональными.
В еще одном варианте изобретение относится к способу лечения T-клеточного дисфункционального расстройства, включающему введение терапевтически эффективного количества любого из описанных выше антител к PD-L1 или композиций. В одном конкретном аспекте T-клеточным дисфункциональным расстройством является инфекция или опухолевый иммунитет. В другом аспекте инфекция является острой или хронической. В другом аспекте хроническая инфекция является персистирующей, латентной или медленно текущей. В еще одном аспекте хроническая инфекция является результатом действия патогена, выбранного из группы, состоящей из бактерий, вирусов, грибов и простейших. В следующем аспекте уровень патогена в организме хозяина снижают. В еще одном аспекте способ дополнительно включает лечение вакциной. В еще одном аспекте способ дополнительно включает лечение антибиотиком. В еще одном аспекте патогеном являются бактерии, и способ дополнительно включает введение антибактериального средства. В еще одном аспекте бактерии выбраны из группы, состоящей из: Mycobacterium spp., Salmonella spp., Listeria spp., Streptococcus spp., Haemophilus spp., Neisseria spp., Klebsiella spp., Borrelia spp., Bacterioides fragillis, Treponema spp. и Helicobacter pylori. В еще одном аспекте патогеном является вирус, и способ дополнительно включает введение противовирусного средства. В еще одном аспекте вирус выбран из группы, состоящей из: вируса гепатита-B, -C, вируса простого герпеса-I, -II, вируса иммунодефицита человека -I, -II, цитомегаловируса, вируса Эпштейн-Барр, вируса папилломы человека, T-клеточных лимфотрофических вирусов человека -I, -II, вируса ветряной оспы. В еще одном аспекте патогеном является гриб, и способ дополнительно включает введение противогрибкового средства. В еще одном аспекте расстройство выбрано из группы, состоящей из: аспергиллеза, бластомикоза, кандидоза (Candida albicans), кокцидиоидомикоза (Coccidioides immitis), гистоплазмоза, паракокцидиоидомикоза, микроспоридиоза. В еще одном аспекте патогеном является простейшее, и способ дополнительно включает введение противопротозойного средства. В еще одном аспекте расстройство выбрано из группы, состоящей из: лейшманиоза, плазмодиоза (т.е. малярии), криптоспоридиоза, токсоплазмоза, трипаносомоза и гельминтовых инфекций, включая инфекции, вызванные трематодами (например, шистосомоз), ленточными червями (например, эхинококкоз) и нематодами (например, трихиноз, аскаридоз, филариоз и стронгилоидоз).
В еще одном аспекте T-клеточным дисфункциональным расстройством является опухолевый иммунитет. В еще одном аспекте антитело к PD-L1 или композицию сочетают в схеме лечения, дополнительно включающей традиционную терапию, выбранную из группы, состоящей из: лучевой терапии, химиотерапии, целенаправленной терапии, иммунотерапии, гормональной терапии, ингибирования ангиогенеза и паллиативного лечения. В еще одном конкретном аспекте химиотерапевтическое лечение выбрано из группы, состоящей из: гемцитабина, циклофосфамида, доксорубицина, паклитаксела, цисплатина. В еще одном конкретном аспекте опухолевый иммунитет возникает в результате наличия злокачественной опухоли, выбранной из группы, состоящей из: рака молочной железы, легкого, ободочной кишки, яичника, меланомы, рака мочевого пузыря, почки, печени, слюнных желез, желудка, глиом, рака щитовидной железы, вилочковой железы, эпителиального рака, рака головы и шеи, рака ЖКТ и поджелудочной железы.
Краткое описание чертежей
Фигура 1 является графической иллюстрацией, изображающей костимуляцию T-клеток молекулами клеточной поверхности семейства B7.
Фигура 2 является схематичным изображением дизайна эксперимента для анализа стимуляции T-клеток PMEL/B16.
Фигура 3 представляет собой гистограмму, показывающую влияние антитела к PD-L1 на антиген-специфичную функцию T-клеток на основании повышенной продукции IFN-γ в T-клетках CD8+ PMEL в ответ на пептид меланоцитов gp100. Как процентное содержание IFN-γ-продуцирующих T-клеток CD8+, так и уровни продукции ими IFN-γ повышены при стимуляции в присутствии антитела к PD-L1.
Фигура 4 представляет собой гистограмму, показывающую влияние антитела к PD-L1 на антиген-специфичную функцию T-клеток на основании повышения пролиферации овальбумин-специфичных T-клеток CD4+ антителом к PD-L1 YW243.55.S1 при вторичной стимуляции с использованием импульсно обработанных овальбумином B-клеток A20/АПК mPD-L1.
Фигура 5 представляет собой серию графиков FACS, показывающих усиление пролиферации T-клеток CD8 человека антителом к PD-L1 YW243.55S1 в реакции смешанных лимфоцитов. Также указан процент пролиферирующих клеток, измеренный при разбавлении в единицах интенсивности CFSE.
Фигура 6 является схемой дизайна эксперимента по лечению хронической инфекции LCMV химерной формой антитела к PD-L1 YW243.55S70. Стрелками обозначены временные точки для 6 доз анти-PD-L1, начиная с 14 дня после инфекции с использованием 2×106 БОЕ LCMV клона 13.
Фигуры 7A и 7B представляют собой графики, показывающие усиленную эффекторную функцию CD8 в клетках ex vivo после лечения in vivo хронической инфекции LCMV антителом к PD-L1 YW243.55.S70. Блокада PD-L1 антителом YW243.55.S70 увеличивала дегрануляцию T-клеток CD8+ (которую измеряли по увеличению поверхностного CD107A) (фиг.7A) и увеличивала % IFN-гамма-продуцирующих клеток в ответ на пептид gp33 LCMV (фиг.7B). Частоту встречаемости gp33-специфичных клеток выявляли окрашиванием H2-Db-gp33-пентамерами.
На фигурах 8A и 8B показано снижение титров LCMV в крови и ткани при хронической инфекции LCMV после лечения in vivo антителом к PD-L1. На фигуре 8A: титр вирусов в различных указанных тканях анализировали на 21 и 28 день, через одну и две недели после лечения антителом, соответственно. На фигуре 8B: титры вирусов в сыворотке анализировали в дни 0, 7, 14, 21 и 28, при этом инокуляцию LCMV осуществляли в 0 день и лечение начинали на 14 день.
На фигуре 9A показано значимое снижение роста опухоли карциномы ободочной кишки MC38.Ova в результате применения антитела к PD-L1 после терапевтического лечения верифицированных опухолей (лечение начинали на 14 день, когда опухоль имела размер 250 мм3). Фигура 9B представляет собой гистограмму, показывающую поверхностные уровни экспрессии PD-L1 на клетках MC38.Ova в культуре ткани, которые измеряли проточной цитометрией. PD-L2 не экспрессируется клетками MC38.Ova.
Фигура 10 является графиком, показывающим влияние лечения, блокирующего PD-L1, отдельно и в сочетании либо с анти-VEGF, либо с гемцитабином, на рост опухолей MC38.Ova у мышей C57BL/6.
На фигурах 11A-B показаны последовательности вариабельных областей тяжелой и легкой цепи, соответственно, 11 антител к PD-L1, идентифицированных с помощью фагового дисплея. Заштрихованные столбики показывают CDR с разными определениями, тогда как заключенные в прямоугольники области показывают протяженность HVR.
Подробное описание предпочтительных вариантов осуществления
Все публикации, указанные в настоящем описании, специально включены путем ссылки.
Общие способы
При практическом осуществлении настоящего изобретения, если не оговорено особо, будут использованы обычные методики молекулярной биологии (включая методику рекомбинантов), микробиологии, клеточной биологии, биохимии и иммунологии, которые известны специалистам в данной области. Такие методики полностью объяснены в литературе, например, Molecular Cloning: A Laboratory Manual, second edition (Sambrook et al., 1989); Oligonecleotide Synthesis (M.J. Gait, ed., 1984); Animal Cell Culture (R.I. Freshney, ed., 1987); Methods in Enzymology (Academic Press, Inc.); Current Protocols in Molecular Biology (F.M. Ausubel et al., eds 1987, and periodic updates), PCR: The Polymerase Chain Reaction, (Mullis et al., ed., 1994); A Practical Guide to Molecular Cloning (Perbal Bernard V., 1988); Phage Display: A Laboratory Manual (Barbas et al., 2001).
I. Иммунитет хозяина
A. Развитие и активация лимфоцитов
У человека два основных типа лимфоцитов: T (происходящие из тимуса) и B (происходящие из костного мозга). Такие клетки происходят из гематопоэтических стволовых клеток в костном мозге и печени плода, которые были коммитированы к лимфоидному пути развития. Потомство таких стволовых клеток следует по дивергентным путям, созревая либо до B-, либо до T-лимфоцитов. Развитие B-лимфоцитов человека происходит полностью в костном мозге. С другой стороны, T-клетки развиваются из незрелых предшественников, которые покидают костный мозг и перемещаются по кровяному руслу в тимус, где они пролиферируют и дифференцируются в зрелые T-лимфоциты.
Зрелые лимфоциты, которые происходят из тимуса или костного мозга, находятся в молчащем или «покоящемся» состоянии, т.е. они являются митотически неактивными. При распределении в кровообращении такие «нативные» или «необученные» лимфоциты перемещаются в различные вторичные или периферические лимфоидные органы, такие как селезенка, лимфатические узлы или миндалины. Большинство необученных лимфоцитов по своей природе имеют короткую продолжительность жизни и погибают в течение нескольких дней после того, как они покидают костный мозг или тимус. Однако если такая клетка получает сигналы, которые свидетельствуют о присутствии антигена, они могут активироваться и подвергаться последовательным раундам клеточного деления. Затем некоторые из образовавшихся клеток потомства возвращаются к покоящемуся состоянию, становясь лимфоцитами памяти - B- и T-клетками, которые по существу примированы для следующей встречи со стимулирующим аллергеном. Другим потомством активированных необученных лимфоцитов являются эффекторные клетки, которые живут только в течение нескольких дней, но осуществляют специфичные защитные активности.
Активация лимфоцитов относится к серии упорядоченных событий, которые проходит покоящийся лимфоцит, когда он стимулирован к делению и образованию клеток-потомков, некоторые из которых становятся эффекторными клетками. Полный ответ включает как индукцию клеточной пролиферации (митогенез), так и экспрессию иммунологических функций. Лимфоциты становятся активированными, когда специфичные лиганды связываются с рецепторами на их поверхности. Лиганды для T-клеток и B-клеток отличаются, но итоговые внутриклеточные физиологические механизмы сходны.
Некоторые чужеродные антигены могут индуцировать активацию лимфоцитов сами по себе, особенно крупные полимерные антигены, которые поперечно сшивают поверхностные иммуноглобулины на B-клетках или другие гликопротеины на T-клетках. Однако большинство антигенов не являются полимерами, и даже прямое связывание с B-клетками больших количеств не может привести к активации. Такие более распространенные антигены активируют B-клетки в случае костимуляции соседними активированными хелперными T-лимфоцитами. Такая стимуляция может осуществляться лимфокинами, секретируемыми T-клеткой, но наиболее эффективно может происходить при прямом контакте B-клетки с поверхностными белками T-клетки, которые взаимодействуют с некоторыми рецепторами на поверхности B-клеток, генерируя вторичный сигнал.
B. T-клетки
T-лимфоциты не экспрессируют иммуноглобулины, но вместо этого выявляют наличие чужеродных веществ с помощью поверхностных белков, называемых T-клеточными рецепторами (TCR). Такие рецепторы узнают антигены либо в результате прямого контакта, либо под влиянием активности других иммунных клеток. Вместе с макрофагами T-клетки относятся к основному типу клеток, вовлеченных в опосредованный клетками иммунитет.
В отличие от B-клеток, T-клетки могут выявлять чужеродные вещества только в конкретных ситуациях. В частности, T-лимфоциты будут узнавать чужеродный белок, только если он сначала расщепляется на небольшие пептиды, которые затем представляются на поверхности второй клетки хозяина, называемой антигенпрезентирующей клеткой (АПК). Многие типы клеток хозяина могут презентировать антигены в определенных условиях, но некоторые типы более специфично приспособлены для такой цели и являются особенно важными для регуляции активности T-клеток, включая макрофаги и другие B-клетки. Презентация антигенов отчасти зависит от конкретных белков, называемых белками главного комплекса гистосовместимости (MHC), на поверхности презентирующих клеток. Таким образом, чтобы стимулировать опосредованный клетками иммунитет, чужеродные пептиды должны быть презентированы T-клеткам в сочетании с пептидами MHC, и такое сочетание должно узнаваться T-клеточным рецептором.
Существуют две важные подгруппы T-клеток: цитотоксические T-лимфоциты (TC-клетки или CTL) и хелперные T-клетки (TH), которые могут быть приближенно идентифицированы на основе экспрессии на клеточной поверхности маркеров CD8 и CD4. Tc-клетки важны для защиты от вирусов и могут непосредственно убивать вирусы в результате узнавания некоторых экспрессируемых на клеточной поверхности вирусных пептидов. TH-клетки стимулируют пролиферацию, созревание и иммунологическую функцию других клеточных типов, например, секрецию лимфокинов для контроля активностей B-клеток, макрофагов и цитотоксических T-клеток. Как необученные T-лимфоциты, так и T-лимфоциты памяти обычно остаются в покоящемся состоянии, и в таком состоянии они не проявляют значимой хелперной или цитотоксической активности. При активации такие клетки подвергаются нескольким раундам митотического деления, продуцируя дочерние клетки. Некоторые из таких дочерних клеток возвращаются к покоящемуся состоянию в виде клеток памяти, а другие становятся эффекторными клетками, которые активно проявляют хелперную или цитотоксическую активность. Такие дочерние клетки сходны со своими родителями: клетки CD4+ могут давать только потомство CD4+, тогда как клетки CD8+ дают только потомство CD8+. Эффекторные T-клетки экспрессируют маркеры клеточной поверхности, которые не экспрессируются на покоящихся T-клетках, таких как CD25, CD28, CD29, CD40L, рецепторы трансферрина и белки MHC класса II. Когда активирующие стимулы отменяются, цитотоксическая или хелперная активность постепенно снижается в течение периода времени, составляющего несколько дней, так как эффекторные клетки либо погибают, либо возвращаются в покоящееся состояние.
Подобно активации B-клеток ответы T-лимфоцитов на большинство антигенов также требуют двух типов одновременных стимулов. Первым является антиген, который в том случае, если он соответствующим образом представлен белками MHC на антигенпрезентирующей клетке, может быть узнан и связан T-клеточными рецепторами. Хотя такой комплекс антиген-MHC посылает сигнал внутрь клетки, обычно он недостаточен для того, чтобы привести к активации T-клетки. Полная активация, такая, которая происходит с участием хелперных T-клеток, требует костимуляции другими специфичными лигандами, называемыми костимуляторами, которые экспрессируются на поверхности антигенпрезентирующей клетки. С другой стороны, активация цитотоксической T-клетки обычно требует IL-2, цитокина, секретируемого активированными хелперными T-клетками.
C. Иммунный ответ
Три основных функциональных свойства иммунной системы млекопитающих, отличающих ее от других средств защиты организма, включают: (1) специфичность - способность узнавать и отвечать или не отвечать по отдельности на огромное множество молекул-мишеней, (2) распознавание - способность отличать свое от чужого так, чтобы мирно сосуществовать со всеми многочисленными белками и другим органическим веществом, и все же энергично отвечать против чужеродного вещества, которое введено в организм, и (3) память - способность действовать по шаблону на основании опыта, так что последующие встречи с конкретным чужеродным патогеном будут стимулировать более быстрый и энергичный ответ, чем ответ, который имеет место при начальной встрече. Когда одна или более таких функций нарушены, возникает патологическое состояние.
Необученные лимфоциты непрерывно высвобождаются из первичных лимфоидных органов в периферию, причем каждый несет поверхностные рецепторы, которые способны к связыванию антигена. Связывание антигенов в B-клетках опосредовано поверхностно-связанными иммуноглобулинами, тогда как в T-клетках связывание опосредовано T-клеточными рецепторами. Когда необученные лимфоциты активируются, они пролиферируют, давая дочерние клетки, которые затем могут подвергаться следующим циклам активации и пролиферации. Скорость и интенсивность ответа на данный антиген в значительной степени определяются клональной селекцией: чем больше популяция дочерних клеток или клонов, специфичных для конкретного антигена, тем больше количество клеток, которые могут распознавать и принимать участие в иммунном ответе. Каждый иммунный ответ представляет собой сложную и сложно регулируемую последовательность событий, в которые вовлечено несколько типов клеток. Она запускается, когда иммуноген проникает в организм и встречается со специализированным классом клеток, называемых антигенпрезентирующими клетками (АПК). Такие АПК захватывают небольшое количество иммуногена и презентируют его в форме, которую могут узнавать антиген-специфичные хелперные T-лимфоциты. Затем хелперные T-клетки становятся активированными и, в свою очередь, стимулируют активацию других классов лимфоцитов, таких как B-клетки или цитотоксические T-клетки. Затем активированные лимфоциты пролиферируют и осуществляют свои специфичные эффекторные функции. На каждой стадии указанного процесса лимфоциты и АПК взаимодействуют друг с другом посредством прямого контакта или посредством секреции регуляторных цитокинов.
Экзогенные антигены, которые улавливаются АПК, подвергаются серии изменений, называемых процессингом антигенов. Такой процессинг, особенно белковых иммуногенов, заключается в денатурации и частичных протеолитических расщеплениях, так что иммуноген расщепляется на короткие пептиды. Ограниченное количество полученных в результате пептидов затем нековалентно ассоциируют с белками MHC класса II и транспортируются к поверхности АПК, такой процесс известен как презентация антигена. Хелперный T-лимфоцит CD4+, который вступает в прямой контакт с АПК, может активироваться, но это произойдет, если только он экспрессирует белок T-клеточного рецептора, который может узнавать и связывать комплекс конкретного пептида-MHC, презентированный АПК.
Хелперные T-клетки (TH-клетки) являются главными организаторами иммунного ответа, поскольку они необходимы для активации двух других лимфатических эффекторных клеток: цитотоксических T-клеток (Tc) и секретирующих антитела плазматических клеток. Активация TH происходит в начале иммунного ответа и требует, по меньшей мере, двух сигналов. Один сигнал обусловлен связыванием T-клеточного рецептора антигена с комплексом антигенный пептид-MHC на поверхности АПК, и такой сигнал передается через комплекс белка CD3, тогда как второй костимулирующий сигнал через АПК, как предполагают, является результатом связывания отдельного передающего сигнал белка на поверхности T-клетки со специфичным лигандом на АПК. Одним известным взаимодействием такого типа является взаимодействие T-клеточного белка CD28 и семейства поверхностных белков АПК, известного как B7. Другие пары поверхностных белков также могут опосредовать костимуляцию. Процесс костимуляции описан более подробно далее. Полагают, что антитела к PD-L1 согласно настоящему изобретению усиливают костимуляцию посредством антагонизма негативного костимулирующего сигнала, обусловленного передачей сигнала через PD-L1.
Два сигнала вместе заставляют хелперную T-клетку начать секрецию цитокина интерлейкина-2 (IL-2), а также начать экспрессию специфичных высоко аффинных рецепторов IL-2 на ее поверхности. IL-2 является высоко активным митогенным фактором для T-лимфоцитов и не является необходимым для пролиферативного ответа активированных T-клеток. Влияние IL-2 на клетку, из которой он секретируется - явление, известное как аутокринный эффект. Кроме того, было показано, что даже если T-клетка получила оба сигнала, она не будет пролиферировать, если ее собственные поверхностные рецепторы IL-2 блокированы. IL-2 также может действовать на клетки, находящиеся в непосредственной близости, оказывая так называемый паракринный эффект. Такой эффект особенно важен для активации Tc-клеток, которые обычно не продуцируют достаточного количества IL-2, чтобы стимулировать их собственную пролиферацию. Кроме IL-2 активированные TH-клетки секретируют другие цитокины и стимулируют рост, дифференцировку и функции B-клеток, макрофагов и других клеточных типов.
Контакт между АПК и антиген-специфичной TH-клеткой также оказывает влияние на АПК - одним из наиболее важных эффектов которого является высвобождение IL-1. Считается, что такой цитокин действует аутокринным путем, увеличивая поверхностную экспрессию белков MHC класса II и различных молекул адгезии, тем самым усиливая связывание TH-клетки и усиливая презентацию антигена. Одновременно IL-1 функционирует паракринным путем, действуя на TH-клетку, стимулируя секрецию IL-2 и экспрессию рецептора IL-2.
В ходе активации TH-клеток описанным выше образом некоторые B-клетки также могут захватывать иммуноген своими рецепторами антигенов, которые представляют собой связанные с мембраной формы антител, которые они будут позднее секретировать. В отличие от T-клеток, B-клетки узнают иммуноген в его свободной, непроцессированной форме. Специфичное связывание антигена обеспечивает один тип сигнала, который может приводить к активации B-клеток. Второй тип обеспечивается активированными TH-клетками, экспрессирующими белки, которые помогают активировать B-клетку путем связывания с неиммуноглобулиновыми рецепторами на ее поверхности. Такие полученные от TH сигналы, которые действуют на любую B-клетку, независимо от ее антигенной специфичности, известны как хелперные факторы. Такие хелперные факторы включают IL-2, IL-4 и IL-6. Однако помощь более эффективно достигается посредством контакта клетки с клеткой, который обеспечивает возможность белкам на поверхности T-клетки непосредственно контактировать с белками на B-клетке. Наиболее эффективная форма опосредованной контактом помощи имеет место в том случае, когда белок, называемый лигандом CD40 (CD40L), который экспрессируется на TH-клетках только после того, как они станут активированными, связывается с белком, называемым CD40, на B-клетках. В процессе, известном как активация свидетелей, контакт с активированной B-клеткой уже может быть достаточным для того, чтобы активировать покоящиеся B-клетки, даже если их поверхностные иммуноглобулины не были заняты антигеном.
Tc-лимфоциты функционируют, истребляя клетки, которые экспрессируют чужеродные антигены на своей поверхности, такие как инфицированные вирусом клетки хозяина. Большинство Tc-клеток экспрессирует CD8, а не CD4, и поэтому узнают антигены в ассоциации с белками MHC класса I, а не класса II. Когда соматическая клетка инфицирована вирусом, некоторые иммуногенные вирусные белки могут подвергаться процессингу в клетке, и затем полученные пептиды могут появляться в виде поверхностных комплексов с молекулами MHC класса I. Затем такие комплексы пептид-MHC могут распознаваться T-клеточным рецептором антиген-специфичного клона, генерируя один из двух сигналов, необходимых для активации Tc-клеток. Такой первый сигнал отдельно индуцирует высоко аффинные IL-2-рецепторы на Tc-клетке. Второй сигнал обеспечивается IL-2, секретируемым из соседнего активированного TH-лимфоцита. При получении обоих сигналов активированная Tc-клетка приобретает цитотоксическую активность, позволяющую ей убивать клетку, с которой она связана, а также любые другие клетки, несущие такие же комплексы пептид-MHC класса I. В некоторых случаях гибель имеет место в связи с тем, что Tc высвобождает специфичные токсины в клетку-мишень; в других случаях Tc заставляет клетку-мишень совершить суицид посредством апоптоза. Активированная Tc-клетка также пролиферирует, давая начало дополнительным Tc-клеткам с такой же антигенной специфичностью.
D. Костимуляция надсемейством иммуноглобулинов:
1. B7.1/B7.2-CD28/CTLA-4
Пожалуй, наиболее хорошо охарактеризованным путем костимуляции T-клеток является путь, который передает сигналы через B7.1(CD80)/B7.2(CD86)-CD28/CTLA-4(CD152). Такой путь передачи сигналов необходим для активации и толерантности T-клеток. Karandikar et al., J. Neuroimmunol. 89: 10-18 (1988); Oosterwegal et al., Curr. Opin Immunol. 11: 294-300 (1999); Salomon et al., Annu. Rev. Immunol. 19: 225-252 (2001); Sansom, D.M., Immunol. 101: 169-177 (2000); Chambers et al., Annu. Rev. Immunol. 19: 565-592 (2001).
B7.1 [Freeman et al., J. Exp. Med. 174: 625-631 (1991); Freedman et al., J. Immunol. 137: 3260-3267 (1987); Yokochi et al., J. Immunol. 128: 823-827 (1982)] и B7.2 [Freeman et al., Science 262: 909-911 (1993); Freeman et al., J. Exp. Med. 178: 2185-2192 (1993); Azuma et al., Nature 366: 76-79 (1993)] обладают двойной специфичностью по отношению к двум стимулирующим рецепторам CD-28 и CTLA-4. Aruffo et al., Proc. Natl. Acad. Sci USA 84: 8573-8577 (1987); Gross et al., J. Immunol. 144: 3201-3210 (1990). CD28 конститутивно экспрессируется на поверхности T-клеток [Gross et al, J. Immunol. 149: 380-388 (1992)], тогда как CTLA-4, рецептор с более высокой аффинностью, имеет экспрессию, которая подвергается быстрой повышающей регуляции после активации T-клеток. Peach et al., J. Exp. Med. 180: 2049-2058 (1994); Linsley et al., J. Exp. Med. 176: 1595-1604 (1992); Kinsley et al., Immunity 1: 793-801 (1994); Linsley et al., Immunity 4: 535-543 (1996). Большинство популяций АПК экспрессируют B7.2 конститутивно на низком уровне, который подвергается быстрой повышающей регуляции, тогда как B7.1 индуцируемым образом экспрессируется позже после активации. Freeman et al., Science 262: 909-911 (1993); Hathcock et al., J. Exp. Med. 180: 631-640 (1994). Заблаговременная экспрессия B7.2 и данные о нокауте у мышей свидетельствуют о том, что B7.2 является более важной костимулирующей молекулой для инициации иммунных ответов, но во всем остальном две молекулы имеют в значительной степени перекрывающиеся функции. McAdam et al., Immuno. Rev. 165: 631-640 (1994).
CD28 взаимодействует с B7.1 и B7.2, передавая сигнал, который действует синергетически с TCR-сигналом, стимулируя активацию T-клеток. Lenschow et al., Annu. Rev. Immunol 165: 233-258 (1996); Lanzavecchia et al., Cell 96: 1-4 (1999). В отсутствие TCR-сигнала передача сигнала CD28 не имеет физиологического значения. Передача сигнала CD28 регулирует порог активации T-клеток и значительно снижает количество занятых TCR, необходимых для активации T-клеток. Viola et al, Science 273: 104-106 (1996). Активация CD28 поддерживает T-клеточные ответы, стимулируя жизнеспособность T-клеток, тем самым обеспечивая возможность инициации цитокинами клональной экспансии и дифференцировки T-клеток. Thompson et al., Proc. Natl. Acad. Sci. USA 86: 1333-1337 (1989); Lucas et al., J. Immunol. 154: 5757-5768 (1995); Shahinian et al., Science 261: 609-612 (1993); Sperling et al., J. Immunol. 157: 3909-3917 (1996); Boise et al., Immunity 3: 87-98 (1995). CD28 также оптимизирует ответы ранее активированных T-клеток, стимулируя продукцию интерлейкина 2 (IL-2) и жизнеспособность T-клеток. Хотя некоторые ответы не зависят от CD28, еще не ясно, является ли такая независимость от костимуляции результатом сильных антигенных стимулов или результатом зависимости от других неизвестных костимулирующих путей.
Активация CTLA-4 вызывает негативный сигнал, который ингибирует TCR- и CD-28-опосредованную сигнальную трансдукцию. Привлечение CTLA-4 приводит к ингибированию синтеза IL-2 и прохождения клеточного цикла и терминации T-клеточных ответов. Walunas et al., Immunity 1: 405-413 (1994); Walunas et al., J. Exp. Med. 183: 2541-2550 (1996); Krummel et al., J. Exp. Med. 182: 459-466 (1995); Brunner et al., J. Immunol. 162: 5813-5820 (1999); Greenwald et al., Immunity 14: 145-155 (2001). CTLA-4 играет важную роль в регуляции T-клеточных ответов, включая периферическую T-клеточную толерантность. Хотя не ясно, как координируется передача сигнала через CTLA-4 и CD28, некоторые возможные варианты включают вытеснение CD28 из конкуренции за связывание с B7, индукцию иммуносупрессивных цитокинов, прямой антагонизм передачи сигналов CD28 и/или TCR-опосредованную передачу сигналов.
В результате антагонизм CTLA-4 (например, антагонистические антитела к CTLA) и/или агонизм B7.1/B7.2/CD28 могут быть применимы для усиления иммунных ответов при лечении инфекции (например, острой и хронической) и опухолевого иммунитета.
2. Передача сигнала ICOS/ICOSL:
Другой путь взаимодействия между АПК и T-клетками осуществляется через ICOS (CD278) и ICOSL (B7-H2, CD275). Передача сигнала ICOS/ICOSL стимулирует дифференцировку и эффекторную функцию T-хелперных клеток и особенно важна для продукции интерлейкина-10 (IL-10), но играет более скромную роль в регуляции экспансии T-клеток и продукции IL-2, включая регуляторные T-клетки, T-клеточную толерантность и аутоиммунитет.
В отличие от CD28, ICOS не экспрессируется конститутивно на нативных T-клетках, но быстро индуцируется на T-клетках после вовлечения TCR. Hutloff et al., Nature 397: 263-266 (1999); Yoshinaga et al., Nature 402: 827-832 (1999); Beier et al., Eur. J. Immunol. 30: 3707-3717 (2000); Coyle et al., Immunity 13: 95-105 (2000); Mages et al., Eur. J. Immunol. 30: 1040-1047 (2000); McAdam et al., J. Immunol. 165: 5035-5040 (2000). Это свидетельствует о том, что ICOS предоставляет костимулирующий сигнал активированным T-клеткам. Хотя костимуляция CD28 усиливает экспрессию ICOS, и экспрессия ICOS снижается в отсутствие B7.1 и B7.2, ICOS не полностью зависит от сигналов CD28. McAdam et al., J. Immunol. 165: 5035-5040 (2000); Aicher et al., J. Immunol. 164: 4689-4696 (2000); Kopf et al, J. Exp. Med. 192: 53-61 (2000). ICOS подвергается повышающей регуляции на T-хелперных клетках обоих типов 1 и 2 (TH1 и TH2) во время начальной фазы дифференцировки, но уровни остаются высокими на TH2-клетках и снижаются на TH1-клетках. Картина экспрессии ICOS на T-клетках в зародышевых центрах (Beier et al., Eur. J. Immunol. 30: 3707-3717 (2000); Mages et al., Eur. J. Immunol. 30: 1040-1047 (2000)) свидетельствует о роли ICOS в T-клеточной помощи B-клеткам. Функциональные исследования это подтвердили, и даже была подтверждена экспрессия ICOS на B-клетках крыс, хотя и не на других видах. Tezuka et al., Biochem. Biophys. Res. Commun. 276: 335-345 (2000); McAdam et al., Nature 409: 102-105 (2001); Dong et al., Nature 409: 97-101 (2001); Dong et al., J. Immunol. 166: 3659-3662 (2001); Tafuri et al., Nature 409: 105-109 (2001).
Одной из ролей передачи сигнала ICOS/ICOSL, по-видимому, является регуляция продукции цитокинов (например, IL-4, IL-13) недавно активированными, а также эффекторными T-клетками. Hutloff et al., Nature 397: 263-266 (1999); Coyle et al., Immunity 13: 95-105 (2000); Dong et al., Nature 409: 97-101 (2001). В исследованиях аллергического заболевания дыхательных путей эффекторная функция TH2, но не дифференцировка TH2 обеспечивается блокадой ICOS. Tesciuba et al., J. Immunol. 167: 1996-2003 (2001). На основании свидетельств о том, что ICOS также может регулировать эффекторную функцию TH1, продуцирование цитокинов как TH1, так и TH2, может быть подавлено слитым белком ICOS-Ig при реактивации in vitro. Kopf et al., J. Exp. Med. 192: 53-61 (2000).
Другая возможная роль ICOS относится к поддержанию ответов TH1. В экспериментальной модели аутоиммунного энцефаломиелита (EAE) для исследования рассеянного склероза, заболевания TH1, опосредованного миелин-специфичными T-клетками CD4+, показано, что результат блокады ICOS может отличаться в случае костимуляции во время примирования T-клеток от результата в случае костимуляции во время эффекторной фазы EAE. Dong et al., Nature 409: 97-101 (2001); Rottman et al., Nature Immunol. 2: 605-611 (2001); Sporici et al., Clin. Immunol. 100: 277-288 (2001). EAE, индуцированный миелиновым гликопротеином олигодендроцитов (MOG), в значительной степени обостряется у нокаутированных мышей ICOS-/- с повышенной продукцией IFN-γ по сравнению с диким типом. Аналогично, блокада ICOS во время индукции EAE обостряла заболевание, также приводя к повышенной продукции IFN-γ. Следовательно, блокада ICOS во время примирования приводит к TH1-поляризации ответа. Интересно, что примирование миелин-специфичных трансгенных по TCR T-клеток in vitro в присутствии ICOS-Ig ингибировало их способность индуцировать EAE, что абсолютно противоположно результатам блокады ICOS-Ig, наблюдаемой in vivo. Sporici et al., см. выше. Различие, связанное с противоположными результатами in vitro и in vivo, еще не ясно, но может отражать роль ICOS для IL-10-продуцирующих регуляторных T-клеток, а также эффекторных T-клеток во время блокады ICOS in vivo. Костимуляция посредством IL-10 очень эффективна в отношении повышения продукции IL-10 и более эффективна, чем костимуляция посредством CD28. Hutloff et al., см. выше. Регуляторная петля IL-10, IL-12 необходима для регуляции EAE, так как у мышей IL-10 -/-, но не у мышей IL4 -/- развивается более глубокая форма EAE. Segal et al., J. Exp. Med. 187: 537-546 (1998).
Еще одной возможной ролью ICOS является усиление зависимых от T-клеток гуморальных ответов B-клеток. У мышей ICOS-/- и ICOSL-/- показано, что ICOS требуется для зависимых от T-клеток B-клеточных ответов. Hutloff et al., Nature 397:263-66 (1999); Chapoval et al., Nat. Immunol. 2:269-74 (2001); Coyle et al., Immunity 13: 95-105 (2000); McAdam et al., Nature 409: 102-5 (2001); Tafuri et al., Nature 409: 105-9 (2001); Suh et al., Nat. Immunol. 4:899-906 (2003). У мышей ICOS-/- также показаны уменьшенные зародышевые центры в ответ на первичную иммунизацию, глубокие дефекты в образовании зародышевых центров в ответ на вторичную стимуляцию и дефекты в переключении классов IgG. Роль ICOS во взаимодействии T:B-клеток дополнительно подтвердили в результате идентификации гомозиготной утраты ICOS в T-клетках у пациентов с общим вариабельным иммунодефицитным заболеванием взрослых. Grimbacher et al., Nat. Immunol. 4: 261-68 (2003).
В результате агонизм ICOS/ICOSL (например, агонистические антитела к ICOS, растворимый лиганд ICOS/ICOSL) может быть применим для усиления иммунного ответа при лечении инфекции (например, острой и хронической) и/или опухолевого иммунитета.
3. Путь PD-1:
Важный негативный костимулирующий сигнал, регулирующий активацию T-клеток, дает рецептор запрограммированной гибели - 1 (PD-1)(CD279) и связывающиеся с ним партнеры-лиганды PD-L1 (B7-H1, CD274) и PD-L2 (B7-DC, CD273). Негативная регуляторная роль PD-1 была выявлена с помощью нокаутов по PD-1 ( Pdcd1 -/-), в случае которых существует склонность к аутоиммунитету. Nishimura et al ., Immunity 11: 141-51 (1999); Nishimura et al ., Science 291: 319-22 (2001). PD-1 является родственным CD28 и CTLA-4, но не имеет проксимального к мембране цистеина, который обеспечивает возможность гомодимеризации. Цитоплазматический домен PD-1 содержит основанный на тирозине мотив ингибирования иммунорецептора (ITIM, V/IxYxxL/V). PD-1 связывается только с PD-L1 и PD-L2. Freeman et al ., J. Exp. Med. 192: 1-9 (2000); Dong et al ., Nature Med. 5: 1365-1369 (1999); Latchman et al ., Nature Immunol. 2: 261-268 (2001); Tseng et al ., J. Exp. Med. 193: 839-846 (2001).
PD-1 может быть экспрессирован на T-клетках, B-клетках, природных T-клетках-киллерах, активированных моноцитах и дендритных клетках (DC, ДК). PD-1 экспрессируется активированными, но не экспрессируется нестимулированными T-клетками CD4+ и CD8+, B-клетками и миелоидными клетками человека. Это контрастирует с более ограниченной экспрессией CD28 и CTLA-4. Nishimura et al., Int. Immunol. 8: 773-80 (1996); Boettler et al., J. Virol. 80: 3532-40 (2006). Существует, по меньшей мере, 4 варианта PD-1, которые были клонированы из активированных T-клеток человека, включая транскрипты, в которых отсутствует (i) экзон 2, (ii) экзон 3, (iii) экзоны 2 и 3 или (iv) экзоны 2-4. Nielsen et al., Cell. Immunol. 235: 109-16 (2005). За исключением PD-1Δex3, все варианты экспрессируются на сходных уровнях в виде полноразмерного PD-1 в покоящихся мононуклеарных клетках периферической крови (PBMC). Экспрессия всех вариантов в значительной степени индуцируется при активации T-клеток человека с помощью анти-CD3 и анти-CD28. Вариант PD-1Δex3 не имеет трансмембранного домена и похож на растворимый CTLA-4, который играет важную роль в аутоиммунитете. Ueda et al., Nature 423: 506-11 (2003). Указанным вариантом обогащена синовиальная жидкость и сыворотка пациентов с ревматоидным артритом. Wan et al., J. Immunol. 177: 8844-50 (2006).
Два лиганда PD-1 отличаются по своим картинам экспрессии. PD-L1 конститутивно экспрессируется на мышиных T- и B-клетках, ДК, макрофагах, мезенхимальных стволовых клетках и полученных из костного мозга тучных клетках. Yamazaki et al., J. Immunol. 169: 5538-45 (2002). PD-L1 экспрессируется на широком круге негематопоэтических клеток (например, клетках роговицы, легкого, сосудистого эпителия, непаренхимных клетках печени, мезенхимальных стволовых клетках, клетках панкреатических островков, синцитиотрофобластах плаценты, кератиноцитах и т.д.) [Keir et al., Annu. Rev. Immunol. 26: 677-704 (2008)] и подвергается повышающей регуляции в ряде клеточных типов после активации. Оба типа интерферонов (IFN) I и II являются повышающими регуляторами PD-L1. Eppihimer et al., Microcirculation 9: 133-45 (2002); Schreiner et al., J. Neuroimmunol. 155: 172-82 (2004). Экспрессия PD-L1 в клеточных линиях снижается при ингибировании MyD88, TRAF6 и MEK. Liu et al., Blood 110: 296-304 (2007). JAK2 также вовлечен в индукцию PD-L1. Lee et al., FEBS Lett. 580: 755-62 (2006); Liu et al., Blood 110: 296-304 (2007). Утрата или ингибирование фосфатазы и гомолога тензина (PTEN), клеточной фосфатазы, которая модифицирует фосфатидилинозитол-3-киназу (PI3K) и передачу сигнала Akt, повышали посттранскрипционную экспрессию PD-L1 в злокачественных опухолях. Parsa et al., Nat. Med. 13: 84-88 (2007).
Экспрессия PD-L2 более ограничена, чем PD-L1. PD-L2 индуцируемым образом экспрессируется на ДК, макрофагах и полученных из костного мозга тучных клетках. PD-L2 также экспрессируется примерно на половине-двух третьих покоящихся перитониальных B1-клеток, но не экспрессируется на обычных B-клетках B2. Zhong et al., Eur. J. Immunol. 37: 2405-10 (2007). Клетки B1 PD-L2+ связывают фосфатидилхолин и могут быть важными для врожденных иммунных ответов против бактериальных антигенов. Индукция PD-L2 интерфероном-γ, в частности, зависит от NF-KB. Liang et al., Eur. J. Immunol. 33: 2706-16 (2003). PD-L2 также может быть индуцирован на моноцитах и макрофагах под действием GM-CF, IL-4 и IFN-γ. Yamazaki et al., J. Immunol. 169: 5538-45 (2002); Loke et al., PNAS 100: 5336-41 (2003).
Передача сигнала PD-1 обычно оказывает больший эффект на продукцию цитокинов, чем на пролиферацию клеток, при этом значительное влияние оказывает на продукцию IFN-γ, TNF-α и IL-2. Опосредованная PD-1 передача ингибирующего сигнала также зависит от интенсивности передачи сигнала TCR, при этом более сильное ингибирование происходит при более низких уровнях стимуляции TCR. Такое снижение может быть преодолено костимуляцией посредством CD28 [Freeman et al., J. Exp. Med. 192: 1027-34 (2000)] или в присутствии IL-2 [Carter et al., Eur. J. Immunol. 32: 634-43 (2002)].
Получены доказательства того, что передача сигнала через PD-L1 и PD-L2 может быть двунаправленной. То есть, в дополнение к модификации передачи сигналов TCR или BCR, сигнал также может быть доставлен назад в клетки, экспрессирующие PD-L1 и PD-L2. Хотя не обнаружено, что обработка дендритных клеток природным антителом к PD-L2 человека, выделенным из организма пациента с макроглобулинемией Вальденстрема, приводит к повышающей регуляции MHC II или костимулирующих молекул B7, такие клетки продуцировали большее количество провоспалительных цитокинов, особенно TNF-α и IL-6, и стимулировали пролиферацию T-клеток. Nguyen et al., J. Exp. Med. 196: 1393-98 (2002). Обработка мышей таким антителом также (1) повышала резистентность к трансплантируемой меланоме b16 и быстро индуцировала специфичные для опухоли CTL. Radhakrishnan et al., J. Immunol. 170: 1830-38 (2003); Radhakrishnan et al., Cancer Res. 64: 4965-72 (2004); Heckman et al., Eur. J. Immunol. 37: 1827-35 (2007); (2) блокировала развитие воспалительного заболевания дыхательных путей в мышиной модели аллергической астмы. Radhakrishnan et al., J. Immunol. 173: 1360-65 (2004); Radhakrishnan et al, J. Allergy Clin. Immunol. 116: 668-74 (2005).
Дополнительным доказательством обратной передачи сигнала в дендритные клетки («ДК») является результат исследований ДК, полученных из костного мозга, культивируемых с растворимым PD-1 (домен EC PD-1, слитый с константной областью Ig - «s-PD-1»). Kuipers et al., Eur. J. Immunol. 36: 2472-82 (2006). Такой sPD-1 ингибировал активацию ДК и увеличивал продукцию IL-10, и такое действие было обратимо благодаря введению анти-PD-1.
Кроме того, в нескольких исследованиях показан рецептор для PD-L1 или PD-L2, который не зависит от PD-1. B7.1 уже идентифицирован как связывающий партнер для PD-L1. Butte et al., Immunity 27: 111-22 (2007). Исследования химического перекрестного сшивания свидетельствуют о том, что PD-L1 и B7.1 могут взаимодействовать посредством их IgV-подобных доменов. Взаимодействия B7.1:PD-L1 могут индуцировать ингибирующий сигнал для T-клеток. Лигирование PD-L1 на T-клетках CD4+ посредством B7.1 или лигирование B7.1 на T-клетках CD4+ посредством PD-L1 генерирует ингибирующий сигнал. В случае T-клеток, не имеющих CD28 и CTLA-4, обнаружена сниженная пролиферация и сниженная продукция цитокинов при стимуляции шариками, покрытыми анти-CD3 плюс B7.1. В T-клетках, у которых отсутствуют все рецепторы для B7.1 (т.е. CD28, CTLA-4 и PD-L1), пролиферация T-клеток и продукция цитокинов больше не ингибировалась шариками, покрытыми анти-CD3 плюс B7.1. Полученные данные свидетельствуют о том, что B7.1 действует специфично через PD-L1 на T-клетке в отсутствие CD28 и CTLA-4. Подобным образом, в T-клетках, не имеющих PD-1, обнаружены сниженная пролиферация и продукция цитокинов при стимуляции в присутствии шариков, покрытых анти-CD3 плюс PD-L1, что свидетельствует об ингибирующем действии лигирования PD-L1 с B7.1 на T-клетках. В случае T-клеток, у которых отсутствуют все известные рецепторы для PD-L1 (т.е. нет PD-1 и B7.1), пролиферация T-клеток больше на нарушалась шариками, покрытыми анти-CD3 плюс PD-L1. Таким образом, PD-L1 может оказывать ингибирующее влияние на T-клетки либо через B7.1, либо через PD-1.
Прямое взаимодействие между B7.1 и PD-L1 свидетельствует о том, что современные представления о костимуляции являются неполными, и подчеркивает важность экспрессии таких молекул на T-клетках. Исследования T-клеток PD-L1-/- показывают, что PD-L1 на T-клетках может приводить к понижающей регуляции продукции T-клеточных цитокинов. Latchman et al., Proc. Natl. Acad. Sci. USA 101: 10691-96 (2004). Поскольку и PD-L1 и B7.1 экспрессируются на T-клетках, B-клетках, ДК и макрофагах, существует возможность для направленных взаимодействий между B7.1 и PD-L1 на таких типах клеток. Кроме того, PD-L1 на негематопоэтических клетках может взаимодействовать с B7.1, а также PD-1 на T-клетках, вызывая вопрос о том, вовлечен ли PD-L1 в их регуляцию. Одним возможным объяснением ингибирующего влияния взаимодействия B7.1:PD-L1 является то, что PD-L1 T-клеток может улавливать или выделять B7.1 АПК из взаимодействия с CD28.
В результате, антагонизм передачи сигнала через PD-L1, включая блокирование PD-L1, препятствующее взаимодействию с PD-1, B7.1 или обеими молекулами, тем самым предотвращающее передачу PD-L1 негативного костимулирующего сигнала к T-клеткам и другим антигенпрезентирующим клеткам, вероятно, усиливает иммунитет в ответ на инфекцию (например, острую и хроническую) и опухолевый иммунитет. Кроме того, антитела к PD-L1 согласно настоящему изобретению можно сочетать с антагонистами других компонентов передачи сигнала PD-1:PD-L1, например, антагонистическими антителами к PD-1 и к PD-L2.
4. B7-H3
Костимулирующие сигналы также передаются через B7-H3 (B7RP-2, CD276, PRO352), который широко экспрессируется в лимфоидных и нелимфоидных тканях. Chapoval et al., Nat. Immunol. 2: 269-74 (2001). У человека B7-H3 имеет два варианта 41g и 21g, причем форма 41g является преобладающей, тогда как вариант 21g преобладает у мыши. Sun et al., J. Immunol. 168: 6294-97 (2002); Steinberger et al., J. Immunol. 172: 2352-59 (2004); Ling et al, Genomics 82: 365-77 (2003).
Недавние исследования показали, что B7-H3 является и стимулятором и ингибитором T-клеточных ответов. Доказательством стимулирующей активации являются следующие факты: (1) в сочетании с анти-CD3 слияния B7-H3/Ig костимулировали пролиферацию T-клеток CD4+ и CD8+ и стимулировали IFN-γ и CD8-литическую активность (Chapoval et al., Nat. Immunol. 2: 269-74 (2001)); и (2) инъекция экспрессирующей B7-H3 плазмиды в опухоли модели лимфомы EL-4 приводила к полной регрессии 50% опухолей, которая зависела от T-клеток CD8+ и NK-клеток. Однако в нескольких недавних исследованиях показана ингибирующая роль такой молекулы. Нокауты АПК B7-H3-/- показывают двукратное увеличение пролиферации аллореактивных T-клеток в реакции MLR. Активация T-клеток CD4 антителами к CD3 и к CD28 была ингибирована в HLA-DR2, трансфицированных любой формой B7-H3. Ling et al., Genomics 82: 365-77 (2003). Результатом была пониженная пролиферация и сниженная продукция IFN-γ, TNF-α, IL-10 и GM-CSF. Согласование противоречивых результатов таких исследований может быть основано на существовании двух рецепторов для B7-H3 с противоположными функциями, подобно тому, как CD28 и CTLA-4 регулируют передачу сигнала через B7.1 и B7.2.
В результате, блокада передачи сигнала B7-H3 может вносить вклад в усиление иммунного ответа на инфекцию и опухолевый иммунитет в сочетании с антителами к PD-L1 согласно изобретению.
5. B7-H4
Самым последним дополнением к семейству B7 является B7-H4 (B7x, B7-S1, B7-H.5, VTCN1, PRO1291), который является негативным регулятором T-клеточных ответов. Zang et al., Proc. Natl. Acad. Sci. U.S.A. 100 (18), 10388-10392 (2003); Watanabe et al., Nat. Immunol. 4(7), 670-679 (2003); Prasad, et al., Immunity 18(6), 863-873 (2003); Sica et al., Immunity 18(6), 849-861 (2003). B7-H4 человека и мыши широко экспрессируются как в лимфоидных (селезенка и тимус), так и нелимфоидных органах (включая легкое, печень, семенник, яичник, плаценту, скелетную мышцу, поджелудочную железу и тонкий кишечник). B7-H4 не выявлен в нормальных тканях человека при IHC (ИГХ) и не выявлена регуляция B7-H4 на уровне трансляции. ИГХ показывает, что B7-H4 в высокой степени экспрессируется в опухолях легкого и яичника, и анализ полимеразной цепной реакции (ПЦР) в режиме реального времени показывает, что мышиный B7-H4 также в высокой степени экспрессируется в линиях клеток карциномы простаты, легкого и ободочной кишки. B7-H4 связывает еще неизвестный рецептор на активированных, но не на нативных T-клетках, который отличается от CTLA-4, ICOS, PD-I и рецептора для B7-H3. Хотя сначала сообщали, что BTLA является лигандом B7-H4, описанное связывание слияний B7-H4/Ig с клетками дикого типа, но не с клетками BTLA-/- заставляет сделать вывод о том, что HVEM, а не BTLA, является уникальным лигандом B7-H4. Sedy et al., Nat. Immunol. 6: 90-98 (2004).
Исследования трансфектантов B7-H4 и иммобилизованных слияний B7-H4/Ig показывают, что B7-H4 доставляет сигнал, который ингибирует TCR-опосредованную пролиферацию T-клеток CD4+ и CD8+, прохождение клеточного цикла в фазе G0/G1 и продукцию IL-2. Sica et al., Immunity 18: 849-61 (2003); Zang et al., PNAS 100: 10388-92 (2003); Prasad et al., Immunity 18: 863-73 (2003). Костимуляция B7.1 не может преодолеть B7-H4/Ig-индуцированное ингибирование. Блокирующее антитело к B7-H4 усиливало T-клеточную пролиферацию и продукцию IL-2 in vitro. Введение in vivo антитела к B7-H4 соизмеримо с введением гемоцианина морского блюдечка «замочная скважина» (KLH) в полном адъюванте Фрейнда (CFA) приводило к небольшому увеличению продукции IgM-антитела против KLH и двух-трехкратному увеличению T-клеточной пролиферации и продукции IL-2 при повторной стимуляции in vitro с использованием KLH, что свидетельствует о более высоком примировании T-клеток in vivo в присутствии анти-B7-H4. Блокирующее антитело к B7-H4 заметно ускоряло появление и увеличивало тяжесть EAE с повышением количества T-клеток CD4+ и CD8+ и макрофагов CD11b+ в головном мозге у обработанных анти-B7-H4 мышей в модели аутоиммунного заболевания. Объединенные имеющиеся экспериментальные данные о B7-H4 свидетельствуют о том, что он может осуществлять понижающую регуляцию иммунных ответов в периферических тканях и играет роль в регуляции T-клеточной толерантности. Экспрессия B7-H4 также может играть роль в ускользании опухолевого иммунитета от иммунных реакций хозяина. Choi et al., J. Immunol. 171: 4650-54 (2003). В результате, антагонизм B7-H4 может быть применим для усиления иммунного ответа на инфекцию и опухолевый иммунитет при сочетании с антителами к PD-L1 согласно изобретению.
6. BTLA:
Представитель B7-семейства BTLA (CD272, BTLA-1) функционально сходен с PD-1 и CTLA. Исходно идентифицированный как селектируемый маркер Th1-клеток BTLA экспрессируется только на лимфоцитах. Подобно CTLA-4, ICOS и PD-1, BTLA индуцируется на T-клетках во время активации. Однако в отличие от ICOS, который остается повышенным на Th2-клетках, но подвергается понижающей регуляции в Th1-клетках, BTLA продолжает экспрессироваться на Th1-клетках, но не на Th2-клетках. Подобно PD-1, BTLA также экспрессируется на B-клетках. Gavrieli et al., Biochem. Biophys. Res. Commun. 312: 1236-43 (2003). Однако BTLA экспрессируется как на покоящихся, так и на активированных B-клетках, тогда как PD-1 подвергается повышающей регуляции на активированных B-клетках. BTLA имеет два мотива ITIM.
BTLA оказывает ингибирующее влияние и на B- и на T-лимфоциты. Watanabe et al., Nat. Immunol. 4: 670-79 (2003). B-клетки BTLA-/- умеренно реагируют на анти-IgM, но проявляют повышенную реакцию на анти-CD3 in vitro. В поляризованных Th1-клетках BTLA-/- наблюдается двукратное увеличение ответа на воздействие антигена in vitro. In vivo у мышей BTLA-/- наблюдается трехкратное увеличение гаптен-специфичных гуморальных ответов и повышенная чувствительность к EAE. Фенотип мышей BTLA-/- похож на фенотип мышей PD-1-/-, проявляя повышенную чувствительность к аутоиммунитету, но такие фенотипы являются более слабо выраженными, чем у мышей CTLA-4-/-. Однако, с учетом роли BTLA в качестве негативного регулятора, его блокада может быть полезной для усиления иммунного ответа на инфекцию и противоопухолевого иммунитета в сочетании с антителами к PD-L1 согласно изобретению.
Интересно, как недавно было показано, что представитель надсемейства Ig BTLA также взаимодействует с представителем TNFR-семейства HVEM. Sedy et al., Nat. Immunol. 6: 90-98 (2005); Gonzalez et al., Proc. Natl. Acad. Sci. USA 102: 1116-1121 (2005). Обзор данных относительно HVEM приведен ниже в разделе «Костимуляторы семейства TNFR».
E. Костимуляторы семейства TNFR
1. OX40/OX40L (CD134)
Мыши с недостаточностью OX40 (CD 134, TXPG1L, TNFRSF4) и OX40L (CD134L, CD252, GP34, TNFSF4, TXGP1) имеют сниженные первичные ответы T-клеток CD4+ как на вирусные, так и на общие белковые антигены в реакциях контактной чувствительности. Chen et al., Immunity 11: 689-698 (1999); Kopf et al., Immunity 11: 699-708 (1999); Murata et al., J. Exp. Med. 191: 365-374 (2000); Gramaglia et al., J. Immunol. 165: 3043-3050 (2000). Более низкая частота антиген-специфичных эффекторных T-клеток создается в конце первичной реакции и развивается меньше T-клеток памяти. Gramaglia et al., см. выше. В отличие от T-клеток с недостаточностью CD27, ранняя пролиферация не нарушена в популяциях нативных T-клеток CD4+, которые имеют недостаточность OX40. Однако пониженная пролиферация и заметная апоптозная гибель клеток происходит через 4-5 дней после активации, что приводит к тому, что остается мало длительно живущих T-клеток. Rogers et al., Immunity 15: 445-455 (2001). В случае OX40-дефицитных T-клеток CD8+, начальное клеточное деление не затрагивается, но накопление первичных эффекторных клеток заметно снижено через 3-6 дней после встречи с антигеном. Croft et al., Nat. Immunol. 3: 609-620 (2003).
Трансгенная экспрессия OX40L дендритными клетками или T-клетками повышала количество отвечающих на антиген T-клеток CD4+ и вызывала аутоиммунно-подобные симптомы, которые ассоциированы с аномальной активацией T-клеток. Brocker et al., Eur. J. Immunol. 29: 1610-1616 (1999); Murata et al., J. Immunol. 169: 4628-4636 (2002). После иммунизации инъекция агонистических антител к OX40 приводит к накоплению большего количества антиген-реактивных T-клеток CD4+ в точке максимума первичного ответа и сопутствующему увеличению количества образуемых T-клеток памяти. Gramaglia et al., см. выше, Bansai-Pakala et al., Nature Med. 7: 907-912 (2001), Maxwell et al., J. Immunol. 164: 107-112 (2000); Weatherill et al., Cell. Immunol. 209: 63-75 (2001). Усиленное накопление первичных эффекторных CTL происходит, когда примированных антигеном мышей обрабатывают агонистическим антителом, специфичным для OX40. De Smedt et al., J. Immunol. 168: 661-670 (2002).
Полагают, что OX40 дает поздно действующий сигнал, который обеспечивает жизнеспособность новообразованных эффекторных клеток в точке максимума первичного иммунного ответа. Также имеются хорошие доказательства того, что OX40 функционирует ниже CD28 - в дополнение к повышенной экспрессии OX40, опосредованной сигналами CD28, функциональные анализы недостаточности CD28 по сравнению с недостаточностью OX40 показали, что ранние первичные T-клеточные ответы заметно нарушены в отсутствие сигналов CD28, но в отсутствие сигналов OX40 нарушены только поздние ответы. Rogers et al., Immunity 15: 445-455 (2001); Bertram et al., J. Immunol. 168: 3777-3785 (2002).
В результате, вероятным является то, что активация OX40/OX40L, например, посредством применения агонистических антител, может быть полезной в сочетании с антителами к PD-L1 согласно изобретению для лечения T-клеточных дисфункциональных расстройств.
2. 4-1BB (CD137)/4-1BBL
Подобно случаю с OX40/OX40L, в случае T-клеток, которые имеют недостаточность по 4-1BB (CD 137, TNFRSF9) и 4-1BBL (TNFSF9), наблюдают меньшее накопление антиген-реактивных T-клеток CD8+ при первичных ответах, когда 4-1BBL отсутствует, и развитие меньшего количества T-клеток памяти. DeBenedette et al., J. Immunol. 163: 4833-4841 (1999); Tan et al., J. Immunol. 163: 4859-4868 (1999); Tan et al., J. Immunol. 164: 2320-2325 (2000). Также блокирование 4-1BBL не изменяет начальный пролиферативный ответ T-клеток CD8+, но подавляет накопление эффекторных CTL в точке максимума первичного ответа через 3-6 дней, принуждая к апоптозу клетки, которые поделились несколько раз. Cooper et al., Eur. J. Immunol. 32: 521-529 (2002). Агонистические антитела к 4-1BB и анти-4-1BBL-трансфицированные АПК также давали сходные результаты: ответы CTL и T-клеток CD4+ заметно возрастают in vivo. Melero et al., Nature Med. 3: 682-685 (1997); Melero et al., Eur. J. Immunol. 28: 1116-1121 (1998); Takahashi et al., J. Immunol. 162: 5037-5040 (1999); Guinn et al., J. Immunol. 162: 5003-5010 (1999); Halstead et al., Nature Immunol. 3: 536-541 (2002); Takahashi et al., Immunol. Lett. 76: 183-191 (2001); Bansal-Pakala et al., J. Immunol. 169: 5005-5009 (2002). 4-1BB-специфичное антитело не изменяет начальный пролиферативный ответ, что подтверждает выводы экспериментов по блокированию 4-1BBL и подчеркивает наличие поздней активности 4-1BB в обеспечении сигналом жизнеспособности клеток.
Подобно OX40, как считают, 4-IBB дает поздно действующий сигнал, который обеспечивает жизнеспособность новообразованных эффекторных клеток в точке максимума первичного иммунного ответа. Также получены хорошие доказательства того, что 4-1BB функционирует позже, чем CD28 - в дополнение к повышенной экспрессии OX40 и 4-1BB, опосредованных сигналами CD28, функциональный анализ недостаточности CD28 по сравнению с недостаточностью 4-1BB показал, что ранние первичные ответы T-клеток заметно нарушены в отсутствие сигналов CD28, но в отсутствие сигналов OX40 нарушены только поздние ответы. Rogers et al., Immunity 15: 445-455 (2001); Bertram et al., J. Immunol. 168: 3777-3785 (2002).
Агонистическое антитело к CD137 может индуцировать регрессию опухолей в случае злокачественной опухоли, в которой CTL CD8+ играют центральную роль. Melero et al., Nat. Med. 3: 682-5 (1997); Hirano et al, Cancer Res. 65(3): 1089-96 (2005). Конститутивная и индуцируемая экспрессия PD-L1 придает резистентность таким опухолям, которая обратима при блокаде PD-L1. Hirano et al.
В результате, вероятным является то, что активация 4-1BB/4-BBL, например, посредством применения агонистических антител, особенно в сочетании с антагонистами PD-L1 (например, антителом к PD-L1) может быть полезной для лечения T-клеточных дисфункциональных расстройств.
3. CD27/CD27L (CD70)
Важность передачи сигнала CD27 (TNFRSF7, S152) и CD27L (CD70, TNFSF7) для начальных стадий T-клеточного ответа показана в исследованиях блокирования in vitro, при котором нарушали взаимодействия CD27/CD70. Oshima et al., Int. Immunol. 10: 517-526 (1998); Agematsu et al., J. Immunol. 153: 1421-1429 (1994); Hintzen et al., J. Immunol. 154: 2612-2623 (1995). T-клетки, в которых отсутствует CD27, сначала делятся нормально, но затем пролиферируют слабо через 3 или больше дней после активации. Hendriks et al., Nature Immunol. 1: 433-440 (2000). Полученные данные свидетельствуют о том, что CD27 принимает участие в стимуляции начальной экспансии популяции нативных T-клеток, либо благодаря ранней супрессии гибели T-клеток, либо благодаря действию на клеточный цикл, обеспечивая поддержание деления через 2-3 дня после активации. Это подтверждено исследованиями in vivo CD27-дефицитных мышей, у которых меньше количество антиген-специфичных ответов (дни 4-8) и развивается меньше T-клеток памяти на протяжении 3 или более недель. Hendriks et al., см. выше. Экспрессия CD27 рано подвергается повышающей регуляции после активации T-клеток, свидетельствуя о том, что он, главным образом, доставляет сигналы, которые поддерживают раннюю пролиферацию до максимальной точки эффекторного ответа.
В результате, вероятным является то, что активация CD27/CD27L, включая активацию посредством применения агонистических антител, особенно в сочетании с антителами к PD-L1, описанными в настоящей публикации, может быть полезной при лечении T-клеточных дисфункциональных расстройств.
4. CD30/CD30L (CD153)
Передача сигнала CD30 (TNFRSF8, Ki-1) и CD30L (CD153, TNFSF8) является костимулирующей для нескольких T-клеточных функций in vitro. Del Prete et al., J. Exp. Med. 182: 1655-1661 (1995), Bowen et al., J. Immunol. 156: 442-449 (1995). Блокирующие CD30L реагенты подавляли развитие Th2-клеток и усиливали развитие Th1-клеток in vitro. Такая активность соответствует данным, показывающим, что CD30 предпочтительно экспрессируется Th2-клетками и цитотоксическими клетками типа 2 Tc2. Del Prete et al., см. выше, Nakamura et al., J. Immunol. 158: 2090-2098 (1996). CD30 экспрессируется через 3-4 дня после активации нативных T-клеток при неполяризованных первичных ответах (Nakamura et al., см. выше), свидетельствуя о том, что его роль не ограничена подавляемыми цитокином типа 2 ответами.
Хотя точные механизмы передачи сигнала CD30/CD30L не выяснены, предполагалось, что он может быть сходен с OX40 и 4-1BB. Когда адоптивно переносимые антиген-специфичные T-клетки CD8+ переносят CD30L-дефицитным мышам, они не накапливаются в больших количествах в максимальной точке первичного ответа, и развивается меньше T-клеток памяти. В результате, CD30 также может предоставлять сигналы пролиферации и/или жизнеспособности, обеспечивая возможность образования больших количеств антиген-специфичных T-клеток в максимальной точке первичных ответов.
В результате, вероятным является то, что активация CD27/CD27L, включая активацию посредством применения агонистических антител, особенно в сочетании с антителами к PD-L1, описанными в настоящей публикации, может быть полезной для лечения T-клеточных дисфункциональных расстройств.
5. HVEM/LIGHT
Влияние HVEM (HVEA, ATAR, LIGHTR, TNFRSF14, PRO509) и LIGHT (CD258, HVEML, TR2, TNFSF14, PRO726) на костимуляцию T-клеток является сложным из-за 1) способности LIGHT также связывать рецептор лимфотоксина-β (LTβR) и 2) способности HVEM связывать растворимый LTα3. Таким образом, в любом исследовании эффекта HVEM/LIGHT следует также учитывать влияние других связывающих партнеров в случае такой системы передачи сигналов. Блокирование LIGHT может рано ингибировать пролиферацию T-клеток и секрецию цитокинов в реакциях смешанных аллогенных лимфоцитов (MLR). Tamada et al., J. Immunol. 164: 4105-4110 (200), Kwon et al., J. Biol. Chem. 272: 14272-14276 (1997); Harrop et al., J. Immunol. 161: 1786-1794 (1988); Tamada et al., Nature Med. 6: 283-289 (200). Продуцирование провоспалительных цитокинов подавляется, когда LIGHT блокирован в аллотрансплантатах сердца, не совпадающих по MHC. Ye et al., J. Exp. Med. 195: 795-800 (2002). Кроме того, аллогенные трансплантаты кожи отторгаются с замедленной кинетикой у реципиентов, имеющих недостаточность как LIGHT, так и CD28. Scheu et al., J. Exp. Med. 195: 1613-1624 (2002). Предполагают, что замедленное отторжение трансплантата может указывать на раннее подавление клональной экспансии T-клеток или продукции цитокинов. Такой вывод подтверждается (i) исследованиями in vitro, показывающими, что LIGHT-дефицитные спленоциты, отвечающие на аллоантиген, имели сниженную продукцию как TH1-, так и TH2-цитокинов и слабое формирование активности цитотоксических T-лимфоцитов (CTL) [Sheu et al., см. выше], и (ii) исследованиями in vivo, показывающими, что блокирование LIGHT снижает образование аллореактивных CTL. Tamada et al., Nature Med. 6: 283-289 (2000).
В результате, воздействие на HVEM/LIGHT, например, посредством применения агонистических антител, особенно в сочетании с антителами к PD-L1, описанными в настоящей публикации, может быть полезным для лечения T-клеточных дисфункциональных расстройств.
II. Определения
«Аллерген» или «иммуноген» представляет собой любую молекулу, которая запускает иммунный ответ. В используемом в настоящем описании смысле термин охватывает либо саму антигенную молекулу, либо ее источник, такой как пальцевое зерно, перхоть животных, яд насекомых или пищевой продукт. Указанный термин отличается от термина «антиген», который относится к молекуле, которая может специфично узнаваться иммуноглобулином или T-клеточным рецептором. Любое чужеродное вещество, способное индуцировать иммунный ответ, является потенциальным аллергеном. Известно, что множество различных химических веществ как природного, так и синтетического происхождения являются аллергенными. Сложные природные органические химические вещества, особенно белки, вероятно, вызывают опосредованную антителами аллергию, тогда как простые органические соединения, неорганические химические вещества и металлы более предпочтительно вызывают опосредованную T-клетками аллергию. В некоторых случаях один и тот же аллерген может быть ответственным за более чем один тип аллергии. Воздействие аллергена может осуществляться при вдыхании, инъекции или контакте с кожей.
«Дисфункция» в контексте иммунной дисфункции относится к состоянию пониженной иммунной реактивности при антигенной стимуляции. Термин включает общие элементы истощения и/или анергии, при которой может происходить узнавание антигена, но формируемый в результате иммунный ответ является неэффективным, чтобы бороться с инфекцией или ростом опухоли.
«Толерантность» или «иммунологическая толерантность» означает неспособность иммунной системы формировать защитный иммунный ответ по отношению к конкретному антигену. Толерантность может быть природной или аутотолерантностью, когда организм не атакует свои собственные белки и антигены, или она может быть индуцированной, возникающей в результате обработки иммунной системы. Центральная толерантность возникает в процессе развития лимфоцитов и действует в тимусе и костном мозге. В ходе этого процесса T- и B-лимфоциты, которые узнают собственные антигены, уничтожаются до того, как они разовьются в полностью иммунокомпетентные клетки. Указанный процесс является наиболее активным во время развития плода, но продолжается на протяжении жизни по мере образования незрелых лимфоцитов. Периферическая T-клеточная толерантность относится к функциональной нечувствительности к аутоантигенам, которые присутствуют в периферических тканях, и имеет место после того, как T- и B-клетки созревают и поступают на периферию. Такие процессы включают подавление аутореактивных клеток «регуляторными» T-клетками и формирование гипореактивности (анергии) в лимфоцитах, которые встречаются с антигеном, в отсутствие костимулирующих сигналов, которые сопровождают воспаление. «Приобретенная» или «индуцированная толерантность» относится к адаптации иммунной системы к внешним антигенам, характеризуемой отсутствием специфичной реактивности лимфоидных тканей на данный антиген, который в ином случае, вероятно, может индуцировать опосредованный клетками или гуморальный иммунитет. У взрослых толерантность может быть индуцирована клинически посредством многократного введения очень больших доз антигена или малых доз, которые ниже порога, необходимого для стимуляции иммунного ответа, например, посредством внутривенного или подъязычного введения растворимых антигенов. Иммуносупрессия также способствует индукции толерантности. Нарушение аутотолерантности может приводить к аутоиммунитету.
«Усиление T-клеточной функции» означает, что T-клетку индуцируют, заставляют или стимулируют так, чтобы она имела длительно действующую или усиленную биологическую функцию, или обновляют или реактивируют истощенные или неактивные T-клетки. Примеры усиления T-клеточной функции включают: повышенную секрецию γ-интерферона из T-клеток CD8+, повышенную пролиферацию, повышенную реактивность по отношению к антигену (например, элиминация вирусов или патогенов) по сравнению с уровнями перед вмешательством. В одном варианте осуществления изобретения уровень усиления составляет, по меньшей мере, 50%, альтернативно 60%, 70%, 80%, 90%, 100%, 120%, 150%, 200%. Способ измерения такого усиления известен специалисту в данной области.
«T-клеточное дисфункциональное расстройство» представляет собой расстройство или состояние T-клеток, характеризуемое пониженной реактивностью по отношению к антигенной стимуляции. В конкретном варианте T-клеточное дисфункциональное расстройство представляет собой расстройство, которое специфично ассоциировано с несоответствующей повышенной передачей сигнала через PD-1. В другом варианте T-клеточное дисфункциональное расстройство представляет собой расстройство, при котором T-клетки являются анергическими или обладают пониженной способностью секретировать цитокины, пролиферировать или проявлять цитолитическую активность. В конкретном аспекте пониженная реактивность приводит к неэффективному контролю патогена или опухоли, экспрессирующей иммуноген. Примеры T-клеточных дисфункциональных расстройств, характеризуемых нарушением функции T-клеток, включают неразрешенную острую инфекцию, хроническую инфекцию и опухолевый иммунитет.
«Хроническая инфекция» относится к инфекции, при которой инфекционный агент (например, патогены, такие как вирусы, бактерии, паразитические простейшие, грибы или тому подобное) индуцировал иммунный ответ у инфицированного хозяина, но который не был удален или элиминирован из организма данного хозяина как во время острой инфекции. Хронические инфекции могут быть персистирующими, латентными или медленно текущими. В то время как острые инфекции обычно разрешаются иммунной системой в течение нескольких суток или недель (например, грипп), персистирующие инфекции могут продолжаться на относительно низком уровне в течение месяцев, лет, десятилетий или всей жизни (например, гепатит B). Напротив, латентная инфекция характеризуется длительным периодом бессимптомной активности, сменяемым периодом быстро нарастающей выраженной инфекции и повышенных уровней патогена (например, простой герпес). Наконец, медленно текущая инфекция представляет собой инфекцию, характеризуемую постепенным и непрерывным увеличением симптомов заболевания, таких как длительный инкубационный период, с последующим затянутым и прогрессирующим течением болезни, начиная после появления клинических симптомов. В отличие от латентных и персистирующих инфекций, медленно текущая инфекция может не начинаться с началом острого периода размножения вируса (например, пикорнавирусная инфекция, виснавирус, скрепи, болезнь Крейцфельдта-Якоба). Примерами инфекционных агентов, способных индуцировать хроническую инфекцию, являются вирусы (например, цитомегаловирус, вирус Эпштейн-Барр, вирус гепатита B, вирус гепатита C, вирус простого герпеса типов I и II, вирус иммунодефицита человека типов 1 и 2, вирус папилломы человека, лимфотрофические вирусы T-лимфоцитов человека типов 1 и 2, вирус ветряной оспы и тому подобное), бактерии (например, Mycobacterium tuberculosis, Listeria spp., Klebsiella pneumoniae, Streptococcus pneumoniae, Staphylococcus aureus, Borrelia spp., Helicobacter pylori и тому подобное), паразитические простейшие (например, Leishmania spp., Plasmodium falciparum, Schistosoma spp., Toxoplasma spp., Trypanosoma spp., Taenia carssiceps и тому подобное) и грибы (например, Aspergillus spp., Candida albicans, Coccidioides immitis, Histoplasma capsulatum, Pneumocystis carinii и тому подобное). Дополнительные инфекционные агенты включают прионы или неправильно свернутые белки, которые поражают головной мозг или структуру нейронов в результате дальнейшего распространения неправильного фолдинга белка в таких тканях, что приводит к образованию амилоидных бляшек, которые вызывают гибель клеток, повреждение ткани и возможную смерть. Примеры заболевания, возникающего в результате прионной инфекции, включают: болезнь Крейцфельдта-Якоба и ее варианты, синдром Герстманна-Штаусслера-Шейнкера (GSS), фатальную семейную бессонницу (sFI), куру, скрепи, коровью губчатую энцефалопатию (BSE) у крупного рогатого скота (также известную как «коровье бешенство») и различные другие формы энцефалопатии у животных [например, трансмиссивная энцефалопатия норок (TME), хронический вастинг-синдром (CWD) у белохвостого оленя, лося и чернохвостого оленя, губчатая энцефалопатия кошек, энцефалопатия экзотических копытных животных (EUE) антилопы ньяла, антилопы бейза и большого куду, губчатая энцефалопатия страуса].
«Опухолевый иммунитет» относится к процессу, при котором опухоли ускользают от узнавания и элиминации иммунной системой. Таким образом, в качестве терапевтической концепции, опухолевый иммунитет «лечится», когда такое ускользание ослабляют, и опухоли узнаются и атакуются иммунной системой. Примеры узнавания опухоли включают связывание опухоли, сокращение опухоли и удаление опухоли.
«Антагонист негативного костимулирующего B7» («BNCA») представляет собой агент, который снижает, блокирует, ингибирует, отменяет или препятствует негативному костимулирующему сигналу, опосредованному прямо или опосредованному через белки клеточной поверхности, экспрессируемые на T-лимфоцитах, представителем семейства B7. В одном аспекте BNCA может либо отдельно, либо в сочетании с антителами к PD-1 согласно изобретению делать дисфункциональную T-клетку недисфункциональной. В другом аспекте BNCA может представлять собой агент, который ингибирует синтез нуклеиновой кислоты или белка, экспрессию, передачу сигнала и/или процессинг после экспрессии негативной костимулирующей молекулы B7. В еще одном аспекте BNCA представляет собой антитело, антигенсвязывающий фрагмент антитела, олигопептид BNCA, РНК-и BNCA или малую молекулу BNCA, которая снижает, блокирует, ингибирует, отменяет или препятствует сигнальной трансдукции негативной костимулирующей молекулой B7. Примеры негативных костимулирующих молекул B7 включают: CTLA-4, PD-L1, PD-1, B7.1 (экспрессируемый на T-клетках), PD-L2, B7-H3 и B7-H4.
Позитивный костимулирующий агонист представляет собой молекулу, которая увеличивает, усиливает, повышает или облегчает костимулирующий сигнал, опосредованный прямо или через белки клеточной поверхности, экспрессируемые на T-лимфоцитах. В одном аспекте позитивная костимулирующая молекула может представлять собой внеклеточный домен, растворимую конструкцию или агонистическое антитело, которое активирует позитивный костимулирующий путь. Примеры позитивных костимулирующих молекул включают молекулы надсемейства B7, например, B7.1, B7.2, CD28 и ICOS/ICOSL. Дополнительные примеры включают костимулирующие молекулы семейства TNFR, например, OX40/OX40L, 41-BB/41-BBL, CD27/CD27L, CD30/CD30L и HVEM/LIGHT.
«Малая молекула» или «малая органическая молекула» представляет собой молекулу, которая имеет молекулярную массу ниже примерно 500 дальтон.
«Интерферирующая РНК», «РНК-и», представляет собой РНК длиной 10-50 нуклеотидов, которая снижает экспрессию гена-мишени, при этом части нити в достаточной степени комплементарны (например, имеют, по меньшей мере, 80% идентичность с геном-мишенью). Способ интерференции РНК относится к специфичному для мишени подавлению экспрессии гена (т.е. «сайленсингу гена»), происходящему на посттранскрипционном уровне (например, на уровне трансляции), и включает все посттранскрипционные и транскрипционные механизмы опосредованного РНК ингибирования экспрессии гена, такие как механизмы, описанные в публикации P.D. Zamore, Science 296: 1265 (2002) и Hannan and Rossi, Nature 431: 371-378 (2004). Как используется в настоящем описании, РНК-и может быть в форме малой интерферирующей РНК (миРНК), короткой шпилечной РНК (кшРНК) и/или микро-РНК (микро-РНК). Такие молекулы РНК-и часто представляют собой двунитевые комплексы РНК, которые могут быть экспрессированы в форме отдельных комплементарных или частично комплементарных нитей РНК. Способы конструирования двунитевых комплексов РНК хорошо известны в данной области. Например, описание конструирования и синтеза подходящих кшРНК и миРНК можно найти в публикации Sandy et al., BioTechniques 39: 215-224 (2005).
«Малая интерферирующая РНК» или миРНК представляет собой дуплекс двунитевой РНК (днРНК) длиной от 10 до 50 нуклеотидов, который снижает экспрессию гена-мишени, в котором части первой нити в достаточной степени комплементарны (например, имеют, по меньшей мере, 80% идентичность с геном-мишенью). миРНК специально конструируют так, чтобы избежать противовирусного ответа, характеризуемого повышенным синтезом интерферона, ингибированием неспецифичного синтеза белка и распадом РНК, который часто приводит к суициду и гибели клетки, ассоциированной с использованием РНК-и в клетках млекопитающих. Paddison et al., Proc. Natl. Acad. Sci. USA 99(3): 1443-8. (2002).
Термин «шпилька» относится к образующей петлю структуре РНК из 7-20 нуклеотидов. «Короткая шпилечная РНК» или кшРНК представляет собой однонитевую РНК длиной от 10 до 50 нуклеотидов, характеризуемую изгибом в виде шпильки, которая снижает экспрессию гена-мишени, при этом части нити РНК в достаточной степени комплементарны (например, имеют, по меньшей мере, 80% идентичность с геном-мишенью). Термин «стебель-петля» относится к спариванию оснований между двумя областями одной и той же молекулы с образованием двойной спирали, которая заканчивается короткой неспаренной петлей, давая структуру в форме леденца на палочке.
«Микро-РНК» (ранее известная как «stRNA») представляет собой однонитевую РНК длиной примерно от 10 до 70 нуклеотидов, которая сначала транскрибируется в виде пре-микро-РНК, характеризуемой структурой «стебель-петля», которая затем процессируется в зрелую микро-РНК после дополнительного процессинга через индуцируемый РНК комплекс сайленсинга (RISC).
«Интерферирующая РНК BNCA» или «РНК-и BNCA» связывается, предпочтительно специфично, с нуклеиновой кислотой BNCA и снижает ее экспрессию. Это значит, что экспрессия негативной костимулирующей молекулы B7 ниже в присутствии BNCA-РНК-и по сравнению с экспрессией негативной костимулирующей молекулы B7 в контроле, когда BNCA-РНК-и отсутствует. BNCA-РНК-и может быть идентифицирована и синтезирована с использованием известных способов (Shi Y., Trends in Genetics 19(1): 9-12 (2003), WO2003056012, WO2003064621, WO2001/075164, WO2002/044321.
«Олигопептид BNCA» означает олигопептид, который связывается, предпочтительно специфично, с негативным костимулирующим полипептидом B7, включая рецептор, лиганд или компонент передачи сигнала, соответственно, которые описаны в настоящей публикации. Такие олигопептиды могут быть синтезированы химически с использованием известной методики синтеза олигопептидов или могут быть получены и очищены с использованием методики рекомбинантов. Такие олигопептиды обычно имеют длину, по меньшей мере, примерно 5 аминокислот, альтернативно, по меньшей мере, длину примерно 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100 аминокислот или больше. Такие олигопептиды могут быть идентифицированы без излишнего экспериментирования с использованием хорошо известных способов. В этом отношении следует отметить, что методика скрининга олигопептидных библиотек в отношении олигопептидов, которые способны специфично связываться с полипептидом-мишенью, хорошо известны в данной области (см., например, патенты США № 5556762, 5750373, 4708871, 4833092, 5223409, 5403484, 5571689, 5663143; публикации PCT № WO 84/03506 и WO84/03564; Geysen et al., Proc. Natl. Acad. Sci. U.S.A., 81: 3998-4002 (1984); Geysen et al., Proc. Natl. Acad. Sci. U.S.A., 82: 178-182 (1985); Geysen et al., in Synthetic Peptides as Antigens, 130-149 (1986); Geysen et al., J. Immunol. Meth. 102: 259-274 (1987); Schoofs et al., J. Immunol. 140: 611-616 (1988), Cwirla, S.E. et al. Proc. Natl. Acad. Sci. USA, 87: 6378 (1990); Lowman, H.B. et al. Biochemistry, 30: 10832 (1991); Clackson, T. et al. Nature, 352: 624 (1991); Marks, J.D. et al., J. Mol. Biol., 222: 581 (1991); Kang, A.S. et al. Proc. Natl. Acad. Sci. USA, 88: 8363 (1991), и Smith, G. P., Current Opin Biotechnol., 2: 668 (1991).
«Низкомолекулярный антагонист BNCA» или «малая молекула BNCA» представляет собой органическую молекулу, отличную от олигопептида или антитела, как определено в настоящем описании, которая ингибирует, предпочтительно специфично, негативный костимулирующий полипептид B7. Такое ингибирование передачи негативного костимулирующего сигнала B7 предпочтительно делает дисфункциональные T-клетки отвечающими на антигенную стимуляцию. Пример малых молекул BNCA можно идентифицировать и химически синтезировать с использованием известной методики (см., например, публикации PCT № WO2000/00823 и WO2000/39585). Такие малые молекулы BNCA обычно имеют размер менее чем примерно 2000 дальтон, альтернативно менее чем примерно 1500, 750, 500, 250 или 200 дальтон, способны связываться, предпочтительно специфично, с негативным стимулирующим полипептидом B7, как описано в настоящей публикации, и могут быть идентифицированы без излишнего экспериментирования с использованием хорошо известной методики. В этом отношении следует отметить, что методика скрининга библиотек органических молекул в отношении молекул, которые способны связываться с полипептидом-мишенью, хорошо известны в данной области (см., например, публикации PCT № WO00/00823 и WO00/39585).
Термин «антибиотик» включает любую молекулу, которая специфично ингибирует или прекращает рост микроорганизмов, таких как вирусы, бактерии, грибы и простейшие, но не являются летальными для хозяина при вводимой концентрации и в используемых интервалах введения доз. Как используется в настоящем описании, термин антибиотик включает антибактериальное средство, противовирусное средство, противогрибковое средство и противопротозойное средство. В конкретном аспекте антибиотик является нетоксичным для хозяина при вводимой концентрации и в интервалах дозирования. Антибактериальные антибиотики или антибактериальные средства могут быть в широком смысле классифицированы либо как бактерицидные (т.е. непосредственно убивающие), либо как бактериостатические (т.е. предотвращающие деление) средства. Бактерицидные антибиотики можно дополнительно классифицировать как антибиотики узкого спектра (т.е. действующие только на небольшой класс подгруппы бактерий, например, грамотрицательных, и т.д.) или широкого спектра (т.е. действующие на широкий класс). Примеры антибиотиков включают: (i) аминогликозиды, например, амикацин, гентамицин, канамицин, неомицин, нетилмицин, стрептомицин, тобрамицин, паромицин, (ii) ансамицины, например, гелданамицин, гербимицин, (iii) карбацефемы, например, лоракарбеф, (iv) карбапенемы, например, эртапенум, дорипенем, имипенем/циластатин, меропенем, (v) цефалоспорины (первого поколения), например, цефадроксил, цефазолин, цефалотин, цефалексин, (vi) цефалоспорины (второго поколения), например, цефлаклор, цефамандол, цефокситин, цефпрозил, цефуроксим, (vi) цефалоспорины (третьего поколения), например, цефиксим, цефдинир, цефдиторен, цефоперазон, цефотаксим, цефподоксим, цефтазидим, цефтибутен, цефтизоксим, цефтриаксон, (vii) цефалоспорины (четвертого поколения), например, цефепим, (viii) цефалоспорины (пятого поколения), например, цефтобипрол, (ix) гликопептиды, например, тейкопланин, ванкомицин, (x) макролиды, например, акситромицин, кларитромицин, диритромицин, эритромицин, рокситромицин, тролеандомицин, телитромицин, спектиномицин, (xi) монобактамы, например, акстреонам, (xii) пенициллины, например, амоксициллин, ампициллин, акслоциллин, карбенициллин, клоксациллин, диклоксациллин, флуклоксациллин, мезлоциллин, метициллин, нафцилин, оксациллин, пенициллин, пеперациллин, тикарциллин, (xiii) полипептидные антибиотики, например, бацитрацин, колистин, полимиксин B, (xiv) хинолоны, например, ципрофлоксацин, эноксацин, гатифлоксацин, левофлоксацин, лемефлоксацин, моксифлоксацин, норфлоксацин, орфлоксацин, тровафлоксацин, (xv) сульфонамиды, например, мафенид, пронтосил, сульфацетамид, сульфаметизол, сульфаниламид, сульфасалазин, сульфизоксазол, триметоприм, триметоприм-сульфаметоксазол (TMP-SMX), (xvi) тетрациклины, например, демеклоциклин, доксициклин, миноциклин, окситетрациклин, тетрациклин и (xvii) другие, такие как арспенамин, хлорамфеникол, клиндамицин, линкомицин, этамбутол, фосфомицин, фусидовая кислота, фуразолидон, изониазид, линезолид, метронидазол, мупироцин, нитрофурантоин, платензимицин, пиразинамид, хинупристин/далфопристин, рифампин/рифампицин или тинидазол.
Термин «противовирусное средство» включает любую молекулу, которая ингибирует или прекращает рост, болезнетворность и/или жизнеспособность вирусов. Термин включает лекарственные средства против ретровирусов, такие как (1) ингибиторы обратной транскриптазы, включая, например: (a) ингибиторы обратной транскриптазы, являющиеся аналогами нуклеозидов (NRTI) (например, ацикловир (ZOVIRAX®, ZOVIR®), цидофовир, азидотимидин/зидовудин (AZT, RETROVIR®), диданозин (ddI, VIDEX®; зальцитабин (ddC, HIVID®); ставудин (d4T, ZERIT®; ламивудин (3TC, EPIVIR®); абакавир (ZIAGEN®); эмтрицитабин (EMTRIVA®); бривудин (HELPIN®); энтекавир (BARACLUDE®); идоксуридин; вирамидин (тарибавирин, Valeant Pharmacueticals), ингибитор полимеразы, являющийся нуклеозидным аналогом цитидина, PCI-6130 и варианты пролекарства (например, R7128), Pharmasset/Roche; ингибитор, являющиеся нуклеозидным аналогом, Merck/Isis Pharmaceuticals - MK-0608, (b) ингибиторы обратной транскриптазы, являющиеся нуклеотидными аналогами (NtRTI) (например, тенофовир (VIREAD®); адефовир (PREVEON®, HEPSERA®; фомивирсен (VITRAVENE®); (c) ненуклеозидные аналоги обратной транскриптазы, (NNRTI), эфавиренц (SUSTIVA®, STOCRIN®); невирапин (VIRAMUNE®), делавирдин (RESCRIPTOR®), этравирин (INTELENCE®), ловирид; ненуклеозидный ингибитор РНК-зависимой РНК-полимеразы HCV, ViroChem Pharma - VCH-759, ненуклеозидный ингибитор полимеразы HCV, Pfizer - PF-868554; и (d) ингибиторы полимеразы, включая: РНК-зависимую РНК-полимеразу вируса гепатита C, Boehringer Ingelheim - BILB-1941, ингибитор РНК-полимеразы Roche - R1626; ACH-0137171 - ингибитор репликазы Achillion Pharmaceuticals, R7128 - ингибитор полимеразы Roche/Pharmasset, ABT-333 и ABT-072 - ингибиторы полимеразы Abbott, BI 207127 - ингибитор полимеразы Boehringer Ingelheim, PSI-7851 - ингибитор полимеразы Pharmasset, ANA598 - ингибитор полимеразы Anadys Pharmaceuticals, MK-3281 - ингибитор полимеразы Merck, IDX184 - ингибитор полимеразы Idenix, GSK 625433 - ингибитор полимеразы Glaxo Smith Kline, INX-189 - ингибитор полимеразы Inhibitex, NM283 - ингибитор полимеразы Idenix, HCV796 - ингибитор полимеразы Wyeth, GL60667 и GS9190 - ингибиторы полимеразы Gilead, PF-008685540 - ингибитор полимеразы Pfizer, VCH759, VCH916, VX222 и VX759 - ингибиторы полимеразы Virochem, IDX184 и IDX375 - ингибиторы полимеразы Idenix, BMS650032 - ингибитор полимеразы Bristol Myers Squibb; (2) ингибиторы протеазы, включая, например: саквинавир (FOROVASE®/INVIRASE®), ритонавир (NORVIR®), индинавир (CRIXIVAN®), нелфинавир (VIRACEPT®), ампренавир (AGENERASE®), лопинавир (KALETRA®), атазанавир (REYATAZ®), фосампренавир (LEXIVA®), типранавир (APTIVUS®), дарунавир (PREZISTA®), телаправир (VX-950); ингибиторы протеаз HCV второго поколения Vertex Pharmaceuticals - VX-500 и VX-813; ингибитор протеазы NS3/4A Intermune/Roche - ITMN-191/R-7227, боцепревир, ингибитор протеазы Schering-Plough - SCH 503034, ингибитор протеазы NS3/4A HCV Medivir/Tibotec - TMC435/TMC435350, ACH-1625 - ингибитор протеазы Achillion Pharmaceuticals, ACH-806 - ингибитор протеазы Achillion/Gilead, BI201335 и BILN 2061 - ингибиторы протеазы Boehringer Ingelheim, SCH 900518/SP900518 (нарлапревир) - ингибитор протеазы Schering-Plough, MK-7009 - ингибитор протеазы Merck, BMS-650032, BMS-790052 и BMS-791325 - ингибиторы протеазы Bristol Myeres Squibb, R7227 - ингибитор протеазы Roche, PHX1766 - ингибитор протеазы Phenomix, AVL-181 - ингибитор протеазы Avila Therapeutics, биливердин, CTS-1027 - ингибитор протеазы Roche Biosciences, VX985 - ингибитор протеазы Vertex, VCH-759 и VCH-917 - ингибиторы протеазы Virochem/Vertex, IDX-136 и 316 - ингибиторы протеазы Idenix, ABT-450 - ингибитор протеазы Abbott, VBY 376 - ингибитор протеазы Virobay; (3) ингибиторы интегразы, включая, например: ралтегравир (ISENTRESS®), элвитегравир; (4) комбинированная терапия ингибиторами нуклеозидными аналогами/нуклеотидными аналогами, атрипла (тенофовир + эмбрицитабин + эфавиренц), комбивир (ламивудеин + зидовудин), (5) ингибиторы проникновения и слияния, включая, например: маравирок, энфувиртид, докозанол, антитело к CD4, антитело к gp120, антитело к CCR5, антагонисты NS5a HCV: (a) A-831, A-689 и AZD 2836 Arrow Therapeutics, (b) BMS-790052 и BMS-824393 Bristol Myers Squibb, (c) GSK-625433 Glaxo Smith Kline, (d) антагонисты NS4a ACH-1095; (5) ингибиторы созревания, включая, например: бевиримат и вивекон; (6) ингибиторы высвобождения вирусов, включая, например: занамивир (RELENZA®), оселтамивир (TAMIFLU®), арбидол; (7) усилители иммунного ответа, включая, например, интерферон-α (например, BLX-883 и BLX-883 CR Biolex Therapeutics, белерофон Nautilus Biotech, IFN-α длительного действия, IFN-α SR LG Life Sciences, IFN-α2b CR длительного действия и IFN-α2b XL Flamel Technologies, пегилированный IFN-α (например, ПЭГ-IFN-α-2a, PEGASYS®; ПЭГ-IFN-α-2b, PEGINTRON®), слитый белок IFN-α2b-сывороточный альбумин человека (ALBUFERON®); интерферон-β, включая IFN-β-1b (BETASERON®), интерферон-γ, интерферон-λ, пегилированный интерферон-λ (например, ПЭГ-rIL-29 ZymoGenetics/Novo Nordisk), интерферон-ω/лейкоцитарный интерферон II (например, Intarcia Therapeutics), агонисты toll-подобного рецептора 7, включая имиквимод, исаторибин и их пролекарственные варианты (например, ANA-975 и ANA-971) Anadys Pharmaceuticals, оглуфанид (IM862, L-Glu-L-Trp-OH) и их варианты, конъюгированные с липидами или гликозилом, Implicit Bioscience, NOV-205 (например, Molixan® - пептидное противовирусное средство Novelos Therapeutics, Inc.), противовирусный EHC18 Enzo Biochem, гамма-D-глутамил-L-триптофан (например, SCV-07, SciClone Pharmaceuticals/Verta), алоферон (например, алоферон-1-HGVSGHGQHGVHG, алоферон-2-GVSGHGQHGVHG), CPG 10101 - агонист TLR-9 Coley Pharmaceuticals/Actilon; (8) противовирусные синергетические усилители, т.е. мало проявляющие или не проявляющие противовирусных свойств по отдельности, но усиливающие эффект других противовирусных средств - например, хлорохин, сок грейпфрута, гидроксимочевина, лефлуномид, микофеноловая кислота, ресвератрол, ритонавир; а также другие противовирусные лекарственные средства, такие как амантадин, эдоксудин, фамцикловир (FAMVIR®), пенцикловир, фаскарнет, фосфонет, ганцикловир (CYTOVENE®, CYMEVENE®, VITRASERT®), гардасил, ибацитабин, имуновир, мороксидин, нексавир, перамивир, плеконарил, подофиллотоксин, рибавирин, римантадин, трифлуридин, тризивир, тромантадин, трувада, валацикловир, валганцикловир, видарабин, и усилители интерферона, такие как EMZ702 Transition Therapeutics, дигидрохлорид гистамина (например, Ceplene® + IFN-α); и (9) разнообразные или неклассифицированные противовирусные средства, такие как: KPE-02003002 (артенимол) Kemin Pharmaceuticals, митохинон - агонист антиоксиданта коэнзима Q10 Antipodean Pharmaceuticals, ингибиторы альфа-глюкозидазы I (например, MX-3253 - целгосивир Migenix Pharmaceuticals, кастаноспермин, антагонисты глюкокортикоидов (например, ингибиторы IRES HCV, мифепристон, VGX-410C VGX Pharmaceuticals), печеночные агонисты (например, PYN17 Phynova Pharmaceuticals), противовирусные средства на основе традиционной терапии растительными средствами, например, PYN18 Phynova Pharmaceuticals, ингибиторы каспазы (например, LB-84451 - LG Life Sciences, эмрикасан - PF-03491390/IDN-6556 Pfizer), аналоги циклоспорина, которые ингибируют репликацию вирусов, предотвращая связывание с циклофилином A (например, SDZ NIM 911 Novartis, Debio-025 Debiopharm),
Термин «противогрибковое средство» включает любую молекулу, которая ингибирует или прекращает рост, болезнетворность и/или жизнеспособность грибов. Термин включает, например, (1) полиеновые противогрибковые средства, такие как натамиин, римоцидин, филипин, нистатин, амфотерицин B, кандицин; (2) имидазолы, такие как миконазол, кетоконазол (LOTRIMIN®), эконазол, бифоназол, бутоконазол, фентиконазол, изоконазол, оксиконазол, сертаконазол (ERTACZO®), сулконазол, тиоконазол, (3) триазолы, такие как флуконазол, итраконазол, исавуконазол, равуконазол, посаконазол, вориконазол, терконазол; (4) аллиламины, такие как тербинафин (LAMISIL®), аморолфин, нафтифин (Naftin®), бутенафин (LOTRIMIN ULTRA®); (5) эхинокандины, такие как анидулафунгин, каспофунгин, микафунгин, и другие вещества с противогрибковыми свойствами, такие как бензойная кислота, цикклопикс, флуцитозин, гризеофульвин, генциановый фиолетовый, галопрогин, толнафтат (TINACTIN®, DESENEX®, AFTATE®), ундециленовая кислота, масло чайного дерева - ISO 4730 (масло Melaleuca, типа терпинен-4-ола), цитронелловое масло, сорго лимонное, апельсиновое масло, пальмарозовое масло, пачули, лимонный мирт, нимовое масло, кокосовое масло.
Термин «противопротозойное средство» или «средство против простейших» включает любую молекулу, которая ингибирует или прекращает рост, болезнетворность и/или жизнеспособность простейших организмов. Примеры противопротозойных средств включают: (1) противомалярийные средства, например, хинин, хинимакс, хинидин, хинимакс, хлорохин (ARALEN®), гидроксихлорохин (PLAQUENIL®), амодиахин, пириметамин (DARAPRIM®), сульфадоксин, прогуанил, мефлохин (LARIAM®), галофантрин, примахин, артемезинин и его производные (например, артеметер, артенсунат, дигидроартемизинин, артеэтер), клиндамицин и их сочетания; (2) ингибиторы протеазы и лекарственные средства бензнидазол, бупарваквон, карбарсон, клиохинол, дисульфирам, эфлорнитин, эметин, фуразолидон, меглумин антимониат, меларсопрол, метронидазол (FLAGYL®), милтефосин, нифуртимокс, нитазоксанид, орнидазол, сульфат паромомицина, пентамидин, пириметамин (DARAPRIM®), секнидазол, тинидазол.
Термин «вакцина», используемый в настоящем описании, относится к любому непатогенному иммуногену, который в случае прививки хозяину индуцирует защитный иммунитет против конкретного патогена. Вакцины могут быть в разных формах. Вакцины могут представлять собой целые организмы, которые имеют общие важные антигены с патогеном, но сами по себе не являются патогенными (например, вакцина коровьей оспы). Вакцины также могут быть получены из убитых (например, вакцина против полиомиелита Солка) или ослабленных организмов (утративших способность вызывать заболевание - например, вакцина против полиомиелита Сэбина). Вакцины также могут быть получены из очищенных макромолекул, выделенных из патогенного организма. Например, токсоидные вакцины (например, против столбняка и дифтерии), содержащие неактивную форму растворимого бактериального токсина - приводящие к продукции антител против токсинов, а не к иммунитету против интактных бактерий. Вакцины на основе субъединиц (например, гепатита B) содержат только один иммуногенный белок, выделенный из представляющего интерес патогена. Вакцины на основе конъюгата гаптена, в которых некоторые углеводные или полипептидные эпитопы, выделенные из представляющего интерес патогена, связаны с иммуногенным носителем, таким как столбнячный анатоксин. В указанных методиках по существу используют эпитопы в качестве гаптенов, чтобы индуцировать продукцию антител, которые затем узнают такой же эпитоп в нативном патогене. Однако для максимальной эффективности такие вакцины должны включать как B-клеточные, так и T-клеточные эпитопы, и T-клеточные эпитопы необходимо выбирать так, чтобы они могли быть узнаваемыми, презентированными и вызывать ответ иммунных систем хозяев.
В ДНК-вакцинах используют способность клеток-хозяев захватывать и экспрессировать ДНК, кодирующую патогенные белки, которую инъецируют внутримышечно.
Примерами противовирусных вакцин, которые можно использовать в сочетании с антителами к PD-L1 в способах, описанных в настоящей публикации, являются: HCV-вакцина (вирасом) Pevion Biotech., TG4040 (MVA-HCV Transgene viron, предназначенная для усиления клеточного (цитотоксических T-лимфоцитов CD4+ и CD8+) иммунного ответа против NS3, NS4 и NS5B, CHRONVAC® - ДНК-вакцина N53/4a с оптимизированными кодонами Inovio Biomedical, HCV/CpG-вакцины Novartis, GI-5005 - HCV-вакцина Globeimmune, смесь синтетических пептидов IC41, имеющих HCV-эпитопы для T-клеток CD4 и CD8, в сочетании с поли-L-аргинином, Intercell.
Ответы хозяина на иммуногены могут быть усилены, если их вводят в смеси с адъювантами. Иммунные адъюванты функционируют одним или более из следующих путей: (1) продлевают срок удерживания иммуногена, (2) увеличивают эффективный размер иммуногена (и, следовательно, стимулируют фагоцитоз и презентацию макрофагам), (3) стимулируют приток макрофагов или других иммунных клеток к месту инъекции или (4) стимулируют локальную продукцию цитокинов и других иммунологических активностей. Примеры адъювантов включают: полный адъювант Фрейнда (CFA), соли алюминия и полученные из микобактерий белки, такие как мурамилди- или трипептиды.
Термин «антитело» включает моноклональные антитела (включая полноразмерные антитела, которые имеют Fc-область иммуноглобулина), композиции антител с полиэпитопной специфичностью, полиспецифичные антитела (например, биспецифичные антитела, диатела и одноцепочечные молекулы, а также фрагменты антител (например, Fab, F(ab’)2 и Fv). Термин «иммуноглобулин» (Ig) используют в настоящем описании взаимозаменяемо с термином «антитело».
Основная 4-цепочечная единица антитела представляет собой гетеротетрамерный гликопротеин, состоящий из двух идентичных легких (L) цепей и двух идентичных тяжелых (H) цепей. IgM-антитело состоит из 5 основных гетеротетрамерных единиц вместе с дополнительным полипептидом, называемым J-цепью, и содержит 10 антигенсвязывающих участков, тогда как IgA-антитела содержат 2-5 основных 4-цепочечных единиц, которые могут полимеризоваться с образованием поливалентных блоков в сочетании с J-цепью. В случае IgG 4-цепочечная единица обычно составляет примерно 150000 дальтон. Каждая L-цепь связана с H-цепью одной ковалентной дисульфидной связью, тогда как две H-цепи связаны друг с другом одной или более дисульфидными связями, в зависимости от изотипа H-цепи. Каждая H- и L-цепь также имеет регулярно расположенные внутрицепочечные дисульфидные мостики. Каждая H-цепь имеет на N-конце вариабельный домен (VH), за которым следуют три константных домена (CH) для каждой α- и γ-цепей и четыре CH-домена для μ- и ε-изотипов. Каждая L-цепь имеет на N-конце вариабельный домен (VL), за которым следует константный домен на ее другом конце. VL расположена вдоль VH, а CL расположена вдоль первого константного домена тяжелой цепи (CH1). Полагают, что конкретные аминокислотные остатки образуют зону контакта между вариабельными доменами легкой цепи и тяжелой цепи. Спаривание VH и VL вместе создает один антигенсвязывающий участок. Структуру и свойства различных классов антител, см., например, в публикации Basic and Clinical Immunology, 8th Edition, Daniel P. Sties, Abba I. Terr and Tristram G. Parsolw (eds), Appleton and Lange, Norwalk, CT, 1994, page 71 and Chapter 6. L-цепь любого вида позвоночных может быть отнесена к одному из двух явно отличающихся типов, называемых каппа и лямбда, на основании аминокислотных последовательностей их константных доменов. В зависимости от аминокислотной последовательности константного домена тяжелых цепей (CH) иммуноглобулины могут быть отнесены к разным классам или изотипам. Существует пять классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, имеющие тяжелые цепи, обозначаемые α, δ, ε, γ и μ, соответственно. Классы γ и α дополнительно делят на подклассы на основании относительно небольших различий в последовательности CH и функции, например, у человека экспрессируются следующие подклассы: IgG1, IgG2A, IgG2B, IgG3, IgG4, IgA1 и IgA1.
«Выделенным» антителом является антитело, которое было идентифицировано, отделено и/или извлечено из компонентов среды, в которой оно получено (например, природной или рекомбинантной). Предпочтительно, выделенный полипептид не ассоциирован со всеми другими компонентами среды, в которой он получен. Загрязняющими компонентами среды его получения, такими как компоненты из рекомбинантных трансфицированных клеток, являются вещества, которые могут мешать исследовательским, диагностическим или терапевтическим применениям антитела, и могут включать ферменты, гормоны и другие белковые или небелковые растворенные вещества. В предпочтительных вариантах осуществления изобретения полипептид будет очищен: (1) в степени, составляющей более чем 95 мас.% антитела, которую определяют, например, способом Лоури, и в некоторых вариантах более чем 99 мас.%, (2) в такой степени, которая достаточна для получения, по меньшей мере, 15 остатков N-концевой или внутренней аминокислотной последовательности с использованием секвенатора с вращающимся цилиндром или (3) до гомогенности по оценке в SDS-PAGE в восстанавливающих или не восстанавливающих условиях с использованием окраски Кумасси синим или, предпочтительно, серебром. Выделенное антитело включает антитело, находящееся in situ в рекомбинантных клетках, так как, по меньшей мере, один компонент из природной среды антитела не будет присутствовать. Однако обычно выделенный полипептид или антитело могут быть получены, по меньшей мере, с помощью одной стадии очистки.
«Вариабельная область» или «вариабельный домен» антитела относится к аминоконцевым доменам тяжелой или легкой цепи антитела. Вариабельные домены тяжелой цепи и легкой цепи могут быть названы «VH» и «VL», соответственно. Такие домены обычно являются наиболее вариабельными частями антитела (относительно других антител такого же класса) и содержат антигенсвязывающие участки.
Термин «вариабельный» относится к тому факту, что некоторые части вариабельных доменов в значительной степени различаются по последовательности среди антител. V-домен опосредует связывание антигена и определяет специфичность конкретного антитела по отношению к его конкретному антигену. Однако вариабельность неравномерно распределена на протяжении вариабельных доменов. Напротив, она сконцентрирована в трех участках, называемых гипервариабельными областями (HVR), в вариабельных доменах как легкой цепи, так и тяжелой цепи. Более высоко консервативные части вариабельных доменов называют каркасными областями (FR). Каждый из вариабельных доменов нативных тяжелой и легкой цепей содержит четыре области FR, в основном принимающие конфигурацию β-слоев, соединенных тремя HVR, которые образуют петли, связывающие, а в некоторых случаях образующие часть бета-слоистой структуры. HVR в каждой цепи удерживаются вместе в непосредственной близости областями FR и с HVR из другой цепи вносят вклад в образование антигенсвязывающего участка антител (см. Kabat et al., Sequences of Immunological Interest, Fifth Edition, National Institutes of Health, Bethesda, MD. (1991)). Константные домены непосредственно не вовлечены в связывание антитела с антигеном, но проявляют различные эффекторные функции, такие как участие антитела в зависимой от антител клеточной токсичности.
Термин «моноклональное антитело», используемый в настоящем описании, относится к антителу, полученному из популяции по существу гомогенных антител, т.е. отдельные антитела, составляющие популяцию, являются идентичными, за исключением возможных природных мутаций и/или посттрансляционных модификаций (например, изомеризации, амидирования), которые могут присутствовать в минорных количествах. Моноклональные антитела являются высоко специфичными, будучи направленными против одного антигенного участка. В отличие от препаратов поликлональных антител, которые обычно содержат разные антитела, направленные против разных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты на антигене. Кроме своей специфичности, моноклональные антитела имеют преимущество, состоящее в том, что они синтезируются в культуре гибридом, не содержат примесей других иммуноглобулинов. Определение «моноклональное» указывает на природу антитела как антитела, полученного из, по существу, гомогенной популяции антител, и его не следует рассматривать как требующее получения антитела каким-либо конкретным способом. Например, моноклональные антитела, используемые согласно настоящему изобретению, могут быть получены разными способами, включая, например, способ на основе гибридом (например, Kohler and Milstein, Nature, 256:495-97 (1975); Hongo et al., Hybridoma, 14 (3): 253-260 (1995), Harlow et al., Antibodies: A Laboratory Manual, (Cold Spring Harbor Laboratory Press, 2nd ed. 1988); Hammerling et al., in: Monoclonal Antibodies and T-Cell Hybridomas 563-681 (Elsevier, N.Y., 1981)), способы на основе рекомбинантной ДНК (см., например, патент США № 4816567), способы на основе фагового дисплея (см., например, Clackson et al., Nature, 352: 624-628 (1991); Marks et al., J. Mol. Biol. 222: 581-597 (1992); Sidhu et al., J. Mol. Biol. 338(2): 299-310 (2004); Lee et al., J. Mol. Biol. 340(5): 1073-1093 (2004); Fellouse, Proc. Natl. Acad. Sci. USA 101(34): 12467-12472 (2004); and Lee et al., J. Immunol. Methods 284 (1-2): 119-132 (2004) и способы получения антител человека или антител, подобных антителам человека, у животных, которые имеют части или полные локусы иммуноглобулинов человека, или гены, кодирующие последовательности иммуноглобулинов человека (см., например, WO 1998/24893; WO 1996/34096; WO 1996/33735; WO 1991/10741; Jakobovits et al., Proc. Natl. Acad. Sci. USA 90: 2551 (1993); Jakobovits et al., Nature 362: 255-258 (1993); Bruggemann et al., Year in Immunol. 7:33 (1993); патенты США №№ 5545807; 5545806; 5569825; 5625126; 5633425; и 5661016; Marks et al., Bio/Technology 10: 779-783 (1992); Lonberg et al., Nature 368: 856-859 (1994); Morrison, Nature 368: 812-813 (1994); Fishwild et al., Nature Biotechnol. 14: 845-851 (1996); Neuberger, Nature Biotechnol. 14: 826 (1996); и Lonberg and Huszar, Intern. Rev. Immunol. 13: 65-93 (1995).
Термин «голое антитело» относится к антителу, которое не конъюгировано с цитотоксическим остатком или радиоактивной меткой.
Термины «полноразмерное антитело», «интактное антитело» или «целое антитело» используют взаимозаменяемо по отношению к антителу по существу в его интактной форме, в противоположность фрагменту антитела. В частности, целые антитела включают антитела с тяжелыми и легкими цепями, включая Fc-область. Константные домены могут представлять собой константные домены с нативной последовательностью (например, константные домены с нативной последовательностью человека) или их варианты по аминокислотной последовательности. В некоторых случаях интактное антитело может иметь одну или более эффекторных функций.
«Фрагмент антитела» содержит часть интактного антитела, предпочтительно антигенсвязывающую и/или вариабельную область интактного антитела. Примеры фрагментов антитела включают фрагменты Fab, Fab’, F(ab’)2 и Fv; диатела, линейные антитела (см. патент США 5641870, пример 2; Zapata et al., Protein Eng. 8(10): 1057-1062 [1995]); одноцепочечные молекулы антител и полиспецифичные антитела, образованные из фрагментов антител. Расщепление антител папаином дает два идентичных антигенсвязывающих фрагмента, называемых «Fab»-фрагментами, и остальной фрагмент «Fc», обозначение которого отражает способность легко кристаллизоваться. Fab-фрагмент состоит из полной L-цепи вместе с доменом вариабельной области H-цепи (VH) и первого константного домена одной тяжелой цепи (CH1). Каждый Fab-фрагмент является моновалентным по отношению к связыванию антигена, т.е. он имеет один антигенсвязывающий участок. Обработка антитела пепсином дает один большой F(ab’)2-фрагмент, который приблизительно соответствует двум связанным дисульфидом Fab-фрагментам, имеющим разную антигенсвязывающую активность, и еще способен перекрестно связывать антиген. Fab’-фрагменты отличаются от Fab-фрагментов наличием нескольких дополнительных остатков на карбоксильном конце домена CH1, включая один или более цистеинов из шарнирной области антитела. Fab’-SH в настоящем описании является обозначением Fab’, в котором остаток(ки) цистеина константных доменов несут свободную тиольную группу. F(ab’)2-фрагменты антител исходно были получены в виде пары Fab’-фрагментов, между которыми присутствовали цистеины шарнира. Также известны другие химические соединения фрагментов антител.
Fc-фрагмент содержит части карбоксильных концов обеих H-цепей, удерживаемые вместе дисульфидами. Эффекторные функции антител определяются последовательностями в Fc-области, области, которая также распознается Fc-рецепторами (FcR), найденными на некоторых типах клеток.
Фрагмент «Fv» является минимальным фрагментом антитела, который содержит полный сайт узнавания и связывания антигена. Такой фрагмент состоит из димера одного домена вариабельной области тяжелой цепи и одного домена вариабельной области легкой цепи в тесной нековалентной ассоциации. В результате фолдинга таких двух доменов образуются шесть гипервариабельных петель (по 3 петли из каждой H и L цепи), которые предоставляют аминокислотные остатки для связывания антигена и придают антителу специфичность связывания антигена. Однако даже один вариабельный домен (или половина Fv, содержащая только три HVR, специфичных по отношению к антигену) обладает способностью узнавать и связывать антиген, хотя обычно с более низкой аффинностью, чем полный участок связывания.
«Одноцепочечные Fv», также сокращенно называемые «sFv» или «scFv», представляют собой фрагменты антител, которые содержат VH- и VL-домены антитела, связанные в одной полипептидной цепи. Предпочтительно, sFv-полипептид дополнительно содержит полипептидный линкер между доменами VH и VL, который позволяет sFv образовывать структуру, необходимую для связывания антигена. Обзор, посвященный sFv, см. в публикации Pluckthun, The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds. Springer-Verlag, New York, pp. 269-315 (1994).
«Функциональные фрагменты» антител согласно изобретению содержат часть интактного антитела, обычно включая антигенсвязывающую или вариабельную область интактного антитела или Fc-область антитела, которая сохраняет или имеет модифицированную способность связывать FcR. Примеры фрагментов антител включают линейное антитело, молекулы одноцепочечных антител и полиспецифичные антитела, образованные из фрагментов антител.
Термин «диатела» относится к небольшим фрагментам антител, полученным посредством конструирования sFv-фрагментов (см. предыдущий абзац) с короткими линкерами (примерно 5-10 остатков) между доменами VH и VL, так чтобы добиться межцепочечного, а не внутрицепочечного спаривания V-доменов, с получением при этом бивалентного фрагмента, т.е. фрагмента, имеющего два антигенсвязывающих участка. Биспецифичные диатела являются гетеродимерами двух «скрещенных» sFv-фрагментов, в которых домены VH и VL двух антител присутствуют в разных полипептидных цепях. Диатела более подробно описаны, например, в EP 404097, WO 93/11161, Hollinger et al., Proc. Natl. Acad. Sci. USA 90: 6444-6448 (1993).
Моноклональные антитела согласно изобретению, в частности, включают «химерные» антитела (иммуноглобулины), в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям в антителах, полученных от конкретного вида или относящихся к конкретному классу или подклассу антител, при этом остальная часть цепи (цепей) идентична или гомологична соответствующим последовательностям в антителах, полученных от другого вида или относящихся к другому классу или подклассу антител, а также фрагменты таких антител, при условии, что они проявляют требуемую биологическую активность (патент США № 4816567; Morrison et al., Proc. Natl. Acad. Sci. USA 81: 6851-6855 (1984)). Представляющие интерес химерные антитела согласно изобретению включают приматизированные (PRIMATIZED®) антитела, в которых антигенсвязывающая область антитела получена из антитела, продуцируемого, например, при иммунизации макак представляющим интерес антигеном. Используемый в настоящем описании термин «гуманизированное антитело» используют для подгруппы «химерных антител».
«Гуманизированные» формы антител животных, отличных от человека (например, мышей), представляют собой химерные антитела, которые содержат минимальную последовательность, полученную из иммуноглобулина животного, отличного от человека. В одном варианте осуществления изобретения гуманизированное антитело представляет собой иммуноглобулин человека (реципиентное антитело), в котором остатки из HVR (определение приведено ниже) реципиента заменены остатками из HVR вида, отличного от человека (донорное антитело), такого как мышь, крыса, кролик или примат, отличный от человека, обладающей требуемой специфичностью, аффинностью и/или емкостью. В некоторых случаях остатки каркаса (FR) иммуноглобулина человека заменяют соответствующими остатками животного, отличного от человека. Кроме того, гуманизированные антитела могут содержать остатки, которые не встречаются ни в реципиентном антителе, ни в донорном антителе. Такие модификации могут быть осуществлены для того, чтобы дополнительно повысить эффективность антитела, например, аффинность связывания. Как правило, гуманизированное антитело будет содержать по существу все из, по меньшей мере, одного и обычно двух вариабельных доменов, в которых все или по существу все гипервариабельные петли соответствуют петлям последовательности иммуноглобулина животного, отличного от человека, и все или по существу все области FR являются областями FR из последовательности иммуноглобулина человека, хотя области FR могут содержать одну или более замен отдельных остатков FR, которые улучшают эффективность антитела, например, аффинность связывания, изомеризацию, иммуногенность и т.д. Количество таких аминокислотных замен в FR обычно составляет не более 6 в H-цепи и не более 3 в L-цепи. Гуманизированное антитело необязательно также будет содержать, по меньшей мере, часть константной области иммуноглобулина (Fc), обычно константной области иммуноглобулина человека. Более подробное описание см. в публикациях Jones et al, Nature 321:522-525 (1986); Riechmann et al., Nature 332:323-329 (1988); и Presta, Curr. Op. Struct. Biol. 2:593-596 (1992). См. также, например, публикации Vaswani and Hamilton, Ann. Allergy Asthma & Immunol. 1:105-115 (1998); Harris, Biochem. Soc. Transactions 23:1035-1038 (1995); Hurle and Gross, Curr. Op. Biotech., 5:428-433 (1994); и патенты США №№ 6982321 и 7087409.
«Человеческим антителом» является антитело, которое имеет аминокислотную последовательность, соответствующую аминокислотной последовательности антитела, продуцированного в организме человека и/или полученного с использованием любого способа получения человеческих антител, который описан в данной публикации. Такое определение человеческого антитела специально включает гуманизированное антитело, содержащее антигенсвязывающие остатки животного, отличного от человека. Человеческие антитела могут быть получены с использованием различных способов, известных в данной области, включая библиотеки в фаговом дисплее. Hoogenboom and Winter, J. Mol. Biol., 227:381 (1991); Marks et al., J. Mol. Biol., 222:581 (1991). Также подходящими для получения человеческих моноклональных антител являются способы, описанные в публикациях Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p. 77 (1985); Boerner et al., J. Immunol., 147(1):86-95 (1991). См. также van Dijk and van de Winkel, Curr. Opin. Pharmacol., 5: 368-74 (2001). Человеческие антитела также могут быть получены введением антигена трансгенному животному, которое было модифицировано для получения таких антител в ответ на антигенную стимуляцию, но эндогенные локусы у которых были сделаны недееспособными, например, иммунизированная ксеномышь (см., например, патенты США №№ 6075181 и 6150584 в отношении методики XENOMOUSE™). См. также, например, публикацию Li et al., Proc. Natl. Acad. Sci. USA, 103:3557-3562 (2006) в отношении человеческих антител, созданных с использованием методики гибридом B-клеток человека.
Термин «гипервариабельная область», «HVR» или «HV» при использовании в настоящем описании относится к областям вариабельного домена антитела, которые являются гипервариабельными по последовательности и/или образуют структурно ограниченные петли. Как правило, антитела содержат шесть HVR; три в VH (H1, H2, H3) и три в VL (L1, L2, L3). В нативных антителах H3 и L3 проявляют наибольшее разнообразие шести HVR, и в частности, полагают, что H3 играет уникальную роль в придании высокой специфичности антителам. См., например, публикации Xu et al., Immunity 13:37-45 (2000); Johnson and Wu, в Methods in Molecular Biology 248:1-25 (Lo, ed., Human Press, Totowa, NJ, 2003). Действительно, природные антитела камелид, состоящие только из тяжелой цепи, являются функциональными и стабильными в отсутствие легкой цепи. См., например, публикации Hamers-Casterman et al., Nature 363:446-448 (1993); Sheriff et al., Nature Struct. Biol. 3:733-736 (1996).
Используют несколько вариантов определения границ HVR, и они рассматриваются в настоящем описании. Определяющие комплементарность области (CDR) согласно системе Kabat основаны на вариабельности последовательностей и наиболее широко используются (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)). Вместо этого Chothia рассматривает положение структурных петель (Chothia and Lesk, J. Mol. Biol. 196:901-917 (1987)). HVR AbM представляют собой компромисс между HVR согласно Kabat и структурными петлями согласно Chothia и используются в компьютерной программе для моделирования антител AbM Oxford Molecular. «Контактные» HVR основаны на анализе имеющихся кристаллических структур комплексов. Остатки для каждой из таких HVR указаны ниже.
HVR могут содержать следующие «расширенные HVR»: 24-36 или 24-34 (L1), 46-56 или 50-56 (L2) и 89-97 или 89-96 (L3) в VL и 26-35 (H1), 50-65 или 49-65 (H2) и 93-102, 94-102 или 95-102 (H3) в VH. Остатки вариабельных доменов пронумерованы согласно Kabat et al., выше, для каждого из приведенных определений.
Выражение «нумерация остатков вариабельного домена согласно Кабату» или «нумерация положений аминокислот согласно Кабату» и его варианты относятся к системе нумерации, используемой для вариабельных доменов тяжелой цепи или вариабельных доменов легкой цепи при обобщении данных об антителах в публикации Kabat et al., выше. При использовании такой системы нумерации реальная линейная аминокислотная последовательность может содержать меньше или может содержать дополнительные аминокислоты, что соответствует укорочению или инсерции в FR или HVR вариабельного домена. Например, вариабельный домен тяжелой цепи может содержать инсерцию одной аминокислоты (остаток 52a согласно нумерации Кабата) после остатка 52 в H2 и встроенные остатки (например, остатки 82a, 82b и 82c и т.д. согласно нумерации Кабата) после остатка 82 FR тяжелой цепи. Нумерация остатков согласно Кабату может быть определена для данного антитела в результате выравнивания областей гомологии последовательности антитела со «стандартной» последовательностью, пронумерованной по Кабату.
Остатки «каркаса» или «FR» представляют собой другие остатки вариабельного домена, отличные от остатков HVR, которая определена в настоящем описании.
«Консенсусным каркасом человека» или «акцепторным каркасом человека» является каркас, который имеет наиболее широко встречающиеся аминокислотные остатки при селекции каркасных последовательностей VL или VH иммуноглобулина человека. В основном, селекция последовательностей VL или VH иммуноглобулина человека осуществляется из подгруппы последовательностей вариабельных доменов. Обычно подгруппа последовательностей представляет собой подгруппу, описанную в публикации Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991). Примерами подгруппы в случае VL могут быть подгруппа каппа I, каппа II, каппа III или каппа IV согласно Kabat et al., выше. Кроме того, в случае VH подгруппой может быть подгруппа I, подгруппа II или подгруппа III согласно Kabat et al., выше. Альтернативно, консенсусный каркас человека может быть получен из описанного выше, в котором конкретные остатки изменены, например, когда остаток каркаса человека выбирают на основе его гомологии с донорным каркасом путем выравнивания последовательности донорного каркаса с коллекцией различных каркасных последовательностей человека. Акцепторный каркас человека, «полученный из» каркаса иммуноглобулина человека или консенсусного каркаса человека, может содержать такую же аминокислотную последовательность или он может содержать изменения существующей аминокислотной последовательности. В некоторых вариантах осуществления количество изменений существующих аминокислот составляет 10 или меньше, 9 или меньше, 8 или меньше, 7 или меньше, 6 или меньше, 5 или меньше, 4 или меньше, 3 или меньше, или 2 или меньше.
«Консенсусный каркас подгруппы III VH» содержит консенсусную последовательность, полученную из аминокислотных последовательностей в подгруппе III вариабельных областей тяжелой цепи согласно Kabat et al., выше. В одном варианте осуществления аминокислотная последовательность консенсусного каркаса подгруппы III VH содержит, по меньшей мере, часть или полностью каждую из следующих последовательностей:

«Консенсусный каркас подгруппы каппа I VL» содержит консенсусную последовательность, полученную из аминокислотных последовательностей в подгруппе I вариабельной области легкой цепи каппа согласно Kabat et al., выше. В одном варианте осуществления аминокислотная последовательность консенсусного каркаса подгруппы I VH содержит, по меньшей мере, часть или полностью каждую из следующих последовательностей:
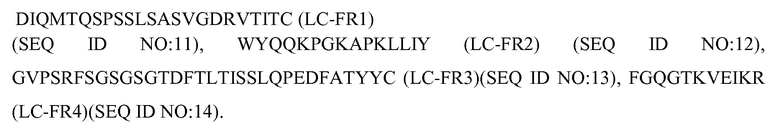
«Аминокислотная модификация» в конкретном положении, например, Fc-области, относится к замене или делеции конкретного остатка или инсерции, по меньшей мере, одного аминокислотного остатка рядом с конкретным остатком. Инсерция «рядом» с конкретным остатком означает инсерцию в пределах одного-двух остатков от него. Инсерция может быть N-концевой или C-концевой по отношению к конкретному остатку. Предпочтительной аминокислотной модификацией согласно изобретению является замена.
Антитело с «созревшей аффинностью» представляет собой антитело с одним или более изменениями в одной или более его HVR, которые приводят к повышению аффинности антитела к антигену по сравнению с исходным антителом, которое не имеет такого изменения (изменений). В одном варианте осуществления антитела с созревшей аффинностью имеют наномолярные или даже пикомолярные аффинности по отношению к антигену-мишени. Антитела с созревшей аффинностью получают способами, известными в данной области. Например, Marks et al., в Bio/Technology 10:779-783 (1992) описывают созревание аффинности в результате перетасовки доменов VH и VL. Случайный мутагенез остатков HVR и/или каркаса описан например, в публикациях: Barbas et al., Proc Nat. Acad. Sci. USA 91:3809-3813 (1994); Schier et al., Gene 169:147-155 (1995); Yelton et al., J. Immunol. 155:1994-2004 (1995); Jackson et al., J. Immunol. 154(7):3310-9 (1995); и Hawkins et al., J. Mol. Biol. 226:889-896 (1992).
Используемый в настоящем описании термин «специфично связывается с» или является «специфичным для» относится к измеряемым и воспроизводимым взаимодействиям, таким как связывание между мишенью и антителом, которое является определяющим показателем наличия мишени в гетерогенной популяции молекул, включающей биологические молекулы. Например, антителом, которое специфично связывается с мишенью (которая может быть эпитопом), является антитело, которое связывает такую мишень с большей аффинностью, авидностью, легче и/или с большей продолжительностью, чем оно связывается с другими мишенями. В одном варианте осуществления степень связывания антитела с неродственной мишенью составляет менее чем примерно 10% от связывания антитела с данной мишенью, как измерено, например, с помощью радиоиммуноанализа (РИА). В некоторых вариантах осуществления антитело, которое специфично связывается с мишенью, имеет константу диссоциации (Kd) ≤1 мкМ, ≤100 нМ, ≤10 нМ, ≤1 нМ или ≤0,1 нМ. В некоторых вариантах осуществления антитело специфично связывается с эпитопом на белке, который является консервативным в белке, полученном от разных видов. В другом варианте осуществления специфичное связывание может включать, но не обязательно, единственное связывание.
«Блокирующее» антитело или «антагонистическое» антитело представляет собой антитело, которое ингибирует или снижает биологическую активность антигена, с которым оно связывается. В некоторых вариантах осуществления блокирующие антитела или антагонистические антитела в значительной степени или полностью ингибируют биологическую активность антигена. Антитела к PD-L1 согласно изобретению блокируют передачу сигнала через PD-1, так что восстанавливается функциональный ответ T-клеток после дисфункционального состояния на стимуляцию антигеном.
«Агонистическое» или активирующее антитело представляет собой антитело, которое усиливает или инициирует передачу сигнала антигеном, с которым оно связывается. В некоторых вариантах осуществления агонистические антитела вызывают или активируют передачу сигнала в отсутствие природного лиганда.
Термин «твердая фаза» описывает неводную матрицу, на которой может быть закреплено антитело согласно настоящему изобретению. Примеры твердых фаз согласно настоящему изобретению включают твердые фазы, образованные частично или полностью из стекла (например, стекла с контролируемым размером пор), полисахаридов (например, агарозы), полиакриламидов, полистирола, поливинилового спирта и силиконов. В некоторых вариантах осуществления, в зависимости от контекста, твердая фаза может представлять собой лунку планшета для анализа; в других вариантах твердая фаза представляет собой колонку для очистки (например, колонку для аффинной хроматографии). Указанный термин также включает прерывистую твердую фазу из дискретных частиц, такую как твердые фазы, описанные в патенте США № 4275149.
«Эффекторные функции антитела» относятся к таким биологическим активностям, которые свойственны Fc-области (Fc-области с нативной последовательностью или Fc-области с вариантом аминокислотной последовательности) антитела, и которые варьируют в зависимости от изотипа антитела. Примеры эффекторных функций антител включают: связывание C1q и комплемент-зависимую цитотоксичность; связывание рецептора Fc; зависимую от антител опосредованную клетками цитотоксичность (ADCC); фагоцитоз; понижающую регуляцию рецепторов клеточной поверхности (например, B-клеточного рецептора) и активацию B-клеток. «Пониженная или минимизированная» эффекторная функция антитела означает функцию, которая снижена, по меньшей мере, на 50% (альтернативно на 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99%) по сравнению с антителом дикого типа или немодифицированным антителом. Определение эффекторной функции антитела можно легко осуществить, и функция может быть измерена специалистом в данной области. В предпочтительном варианте осуществления нарушены эффекторные функции антител в связывании комплемента, комплемент-зависимой цитотоксичности и зависимой от антител цитотоксичности. В некоторых вариантах осуществления изобретения эффекторная функция устранена в результате мутации в константной области, которая исключает гликозилирование, например, «мутация с утратой эффекторной функции». В одном аспекте мутация с утратой эффекторной функции представляет собой мутацию N297A или DANA (D265A + N297A) в CH2-области. Shields et al., J. Biol. Chem. 276(9): 6591-6604 (2001). Альтернативно, дополнительные мутации, приводящие к пониженной эффекторной функции или к ее устранению, включают: K322A и L234A/L235A (LALA). Альтернативно, эффекторная функция может быть понижена или устранена за счет способа получения, такого как экспрессия в клетках-хозяевах, не способных к гликозилированию (например, E. coli) или в которых имеет место измененная картина гликозилирования, которая является неэффективной или менее эффективной при стимулировании эффекторной функции (например, Shinkawa et al., J. Biol. Chem. 278(5): 3466-3473 (2003).
«Зависимая от антител опосредованная клетками цитотоксичность» или ADCC относится к форме цитотоксичности, при которой секретируемый Ig, связанный на Fc-рецепторах (FcR), присутствует на некоторых цитотоксических клетках (например, природных клетках-киллерах (NK), нейтрофилах и макрофагах), что позволяет таким цитотоксическим эффекторным клеткам специфично связываться с несущей антиген клеткой-мишенью и затем убивать клетку-мишень цитотоксинами. Антитела «вооружают» цитотоксические клетки и необходимы для того, чтобы убить клетку-мишень посредством такого механизма. Первичные клетки для опосредования ADCC, NK-клетки, экспрессируют только FcγRIII, тогда как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Экспрессия Fc на гематопоэтических клетках суммирована в таблице 3 на странице 464 в публикации Ravetch and Kinet, Annu. Rev. Immunol. 9: 457-92 (1991). Чтобы оценить ADCC-активность представляющей интерес молекулы, можно осуществить анализ ADCC in vitro, такой как анализ, описанный в патенте США № 5500362 или 5821337. Применимые эффекторные клетки для таких анализов включают мононуклеарные клетки периферической крови (PBMC) и природные клетки-киллеры (NK). Альтернативно или дополнительно, ADCC-активность представляющей интерес молекулы можно оценить in vivo, например, в животной модели, такой как модель, описанная в публикации Clynes et al. PNAS USA 95:652-656 (1998).
Если в описании не указано иное, то нумерация остатков в тяжелой цепи иммуноглобулина представляет собой нумерацию согласно указателю EU, как описано в публикации Kabat et al., выше. «Указатель EU, согласно Кабату» относится к нумерации остатков IgG1-антитела EU человека.
Термин «Fc-область» в настоящем описании используют для определения C-концевой области тяжелой цепи иммуноглобулина, включая Fc-области с нативной последовательностью и варианты Fc-области. Хотя границы Fc-области тяжелой цепи иммуноглобулина могут варьировать, Fc-область тяжелой цепи IgG человека обычно определяют участком от аминокислотного остатка в положении Cys226 или от Pro230 до его карбоксильного конца. C-концевой лизин (остаток 447 согласно системе нумерации EU) Fc-области может быть удален, например, во время получения или очистки антитела, или при рекомбинантном конструировании нуклеиновой кислоты, кодирующей тяжелую цепь антитела. Соответственно, композиция интактных антител может содержать популяции антител со всеми удаленными остатками K447, популяции антител без удаления остатков K447 и популяции антител, имеющие смесь антител с остатком K447 и без него. Подходящие Fc-области с нативными последовательностями для применения в антителах согласно изобретению включают IgG1, IgG2 (IgG2A, IgG2B), IgG3 и IgG4 человека.
Термины «Fc-рецептор» или «FcR» описывают рецептор, который связывается с Fc-областью антитела. Предпочтительным FcR является FcR человека с нативной последовательностью. Кроме того, предпочтительным FcR является FcR, который связывает IgG-антитело (гамма-рецептор) и который включает рецепторы подклассов FcγRI, FcγRII и FcγRIII, включая аллельные варианты и альтернативно сплайсируемые формы указанных рецепторов. Рецепторы FcγRII включают FcγRIIA («активирующий рецептор») и FcγRIIB («ингибирующий рецептор»), которые имеют сходные аминокислотные последовательности, которые отличаются главным образом своими цитоплазматическими доменами. Активирующий рецептор FcγRIIA содержит в своем цитоплазматическом домене основанный на тирозине мотив активации иммунорецептора (ITAM). Ингибирующий рецептор FcγRIIB содержит в своем цитоплазматическом домене основанный на тирозине мотив ингибирования иммунорецептора (ITIM) (см. M. Daëron, Annu. Rev. Immunol. 15:203-234 (1997)). Обзор, посвященный FcR, представлен в публикациях Ravetch and Kinet, Annu. Rev. Immunol. 9: 457-92 (1991); Capel et al., Immunomethods 4: 25-34 (1994); и de Haas et al., J. Lab. Clin. Med. 126: 330-41 (1995). Другие FcR, включая FcR, которые будут идентифицированы в будущем, включены в данном описании в термин «FcR».
Термин «Fc-рецептор» или «FcR» также включает неонатальный рецептор, FcRn, который отвечает за перенос материнских IgG в плод (Guyer et al., J. Immunol. 117: 587 (1976) и Kim et al., J. Immunol. 24: 249 (1994)). Способы измерения связывания с FcRn известны (см., например, Ghetie and Ward, Immunol. Today 18: (12): 592-8 (1997); Ghetie et al., Nature Biotechnology 15 (7): 637-40 (1997); Hinton et al., J. Biol. Chem. 279 (8): 6213-6 (2004); WO 2004/92219 (Hinton et al.). Связывание с FcRn in vivo и время полужизни в сыворотке полипептидов, с высокой аффинностью связывающих FcRn человека, можно анализировать, например, у трансгенных мышей или в трансфицированных линиях клеток человека, экспрессирующих FcRn человека, или у приматов, которым вводят полипептиды, имеющие варианты области Fc. В WO 2004/42072 (Presta) описаны варианты антител с повышенным или уменьшенным связыванием с FcR. См. также, например, Shields et al., J. Biol. Chem. 9(2): 6591-6604 (2001).
«Эффекторными клетками» являются лейкоциты, которые экспрессируют один или более FcR и осуществляют эффекторные функции. В одном аспекте эффекторные клетки экспрессируют, по меньшей мере, FcγRIII и осуществляют ADCC-эффекторную функцию. Примеры лейкоцитов человека, которые опосредуют ADCC, включают мононуклеарные клетки периферической крови (PBMC), природные клетки-киллеры (NK), моноциты, цитотоксические T-клетки и нейтрофилы. Эффекторные клетки могут быть выделены из их природного источника, например крови. Эффекторные клетки обычно представляют собой лимфоциты, ассоциированные с эффекторной фазой, и функционируют, продуцируя цитокины (хелперные T-клетки), убивая клетки, инфицированные патогенами (цитотоксические T-клетки), или секретируя антитела (дифференцированные B-клетки).
«Комплемент-зависимая цитотоксичность» или «CDC» относится к лизису клетки-мишени в присутствии комплемента. Активация классического пути комплемента инициируется связыванием первого компонента системы комплемента (C1q) с антителами (соответствующего подкласса), которые связаны со своим антигеном. Чтобы оценить активацию комплемента, можно осуществить анализ CDC, например, как описано в публикации Gazzano-Santoro et al., J. Immunol. Methods 202: 163 (1996). Варианты антител с измененной аминокислотной последовательностью Fc-области и повышенной или пониженной способностью связывать C1q описаны в патенте США № 6194551B1 и в WO99/51642. Содержание указанных патентных публикаций специально включено в настоящее описание путем ссылки. См. также Idusogie et al., J. Immunol. 164: 4178-4184 (2000).
Сайт N-гликозилирования в IgG находится в положении Asn297 в домене CH2. Настоящее изобретение также относится к композициям антигенсвязывающего, гуманизированного антитела, имеющего Fc-область со сниженной эффекторной функцией или не обладающего эффекторной функцией. Одним из способов достижения этого является замена A297N, которая, как показано ранее, отменяет связывание комплемента и эффекторную функцию («мутация с утратой эффекторной функции») антитела к CD20. Idusogie et al., выше. В результате такой мутации при продуцировании антител к PD-L1 согласно настоящему изобретению, содержащих такую Fc-мутацию, в клетках млекопитающих, таких как CHO, антитела не будут подвергаться гликозилированию, что, в свою очередь, приводит к пониженной или минимальной эффекторной функции. Альтернативно, эффекторная функция антитела может быть исключена без CH2-замены в результате экспрессии в клетках, отличных от клеток млекопитающих, таких как E. coli.
«Аффинность связывания» обычно относится к силе суммарных нековалентных взаимодействий между одним сайтом связывания молекулы (например, антитела) и его партнером по связыванию (например, антигеном). Если не указано иное, используемая в настоящем описании «аффинность связывания» относится к присущей молекулам аффинности связывания, которая отражает взаимодействие 1:1 между членами связывающейся пары (например, антителом и антигеном). Аффинность молекулы X по отношению к ее партнеру Y, как правило, может быть представлена константой диссоциации (Kd). Аффинность может быть измерена обычными способами, известными в данной области, включая способы, описанные в настоящей публикации. Низко аффинные антитела обычно связывают антиген медленно и имеют тенденцию легко диссоциировать, тогда как высоко аффинные антитела обычно связывают антиген быстрее и имеют тенденцию дольше оставаться связанными. В данной области известны различные способы измерения аффинности связывания, любой из которых можно использовать для целей настоящего изобретения. Конкретные иллюстративные варианты и примеры измерения аффинности связывания описаны ниже.
В одном варианте осуществления «Kd» или «значение Kd» согласно настоящему изобретению измеряют с помощью анализа связывания радиоактивно меченного антигена (РИА), осуществляемого с Fab-вариантом антитела и молекулой антигена, как описано на примере следующего анализа, в котором измеряют аффинность связывания в растворе Fab для антигена посредством уравновешивания Fab с минимальной концентрацией (125I)-меченного антигена в присутствии серии немеченого антигена для титрования, затем улавливая связанный антиген на покрытом антителом к Fab планшете (Chen, et al., (1999) J. Mol. Biol. 293:865-881). Чтобы создать условия для анализа, планшеты для микротитрования (Dynex) покрывают в течение ночи 5 мкг/мл улавливающего антитела к Fab (Cappel Labs) в 50 мМ карбонате натрия (pH 9,6), а затем блокируют 2% (мас./об.) бычьим сывороточным альбумином в PBS в течение двух-пяти часов при комнатной температуре (примерно 23°C). В не адсорбирующем планшете (Nunc №269620), 100 пМ или 26 пМ [125I]-антигена смешивают с серийными разведениями представляющего интерес Fab (в соответствии с оценкой антитела к VEGF, Fab-12, в публикации Presta et al., (1997) Cancer Res. 57:4593-4599). Затем представляющий интерес Fab инкубируют в течение ночи; однако инкубация может продолжаться в течение более длительного периода (например, 65 часов), чтобы гарантировать достижение равновесия. После этого смеси переносят в улавливающий планшет для инкубации при комнатной температуре в течение одного часа. Затем раствор удаляют и планшет промывают восемь раз 0,1% твин-20 в PBS. После высыхания планшетов добавляют по 150 мкл/лунку сцинтиллятора (MicroScint-20; Packard) и планшеты подвергают счету в гамма-счетчике Topcount (Packard) в течение десяти минут. Концентрации каждого Fab, дающего связывание, которое меньше или равно 20% от максимального связывания, выбирают для использования в анализах конкурентного связывания.
Согласно другому варианту осуществления Kd измеряют, используя анализы поверхностного плазмонного резонанса с применением устройства BIACORE®-2000 или BIACORE®-3000 (BIAcore, Inc., Piscataway, N.J.), при 25°C с помощью чипов CM5 с иммобилизованным антигеном на уровне примерно 10 единиц ответного сигнала (RU). Кратко, биосенсорные чипы из карбоксиметилированного декстрана (CM5, BIAcore Inc.) активируют гидрохлоридом N-этил-N’-(3-диметиламинопропил)карбодиимида (EDC) и N-гидроксисукцинимидом (NHS) согласно инструкциям поставщика. Антиген разбавляют 10 мМ ацетатом натрия, pH 4,8, до концентрации 5 мкг/мл (~0,2 мкМ) перед инъецированием со скоростью потока 5 мкл/минуту, чтобы достичь приблизительно 10 единиц ответного сигнала (RU) от связанного белка. После инъекции антигена инъецируют 1 М этаноламина, чтобы блокировать не вступившие в реакцию группы. Для кинетических измерений двукратные серийные разведения Fab (от 0,78 нМ до 500 нМ) инъецируют в PBS с 0,05% поверхностно-активным веществом твин-20 (PBST) при 25°C со скоростью потока примерно 25 мкл/мин. Скорости ассоциации (kon) и скорости диссоциации (koff) вычисляют, используя простую модель связывания Лэнгмюра «один к одному» (компьютерная программа для оценки BIAcore®, версия 3.2), посредством одновременной подгонки сенсограмм ассоциации и диссоциации. Равновесную константу диссоциации (Kd) вычисляют в виде отношения koff/kon. См., например, Chen et al., J. Mol. Biol. 293:865-881 (1999). Если скорость образования комплекса превышает 106M-1 сек-1 по данным указанного выше анализа поверхностного плазмонного резонанса, то скорость образования комплекса можно определить, используя методику гашения флуоресценции, которая позволяет измерять увеличение или уменьшение интенсивности испускания флуоресценции (возбуждение=295 нм; эмиссия=340 нм, полоса пропускания 16 нм) при 25°C, 20 нМ антитела против антигена (Fab-форма) в PBS, pH 7,2, в присутствии возрастающих концентраций антигена, причем измерения проводят на спектрометре, таком как спектрофотометр, оборудованный устройством для остановки потока (Aviv Instruments), или спектрофотометр SLM-Aminco™ серии 8000 (ThermoSpectronic), в кювете с перемешиванием содержимого.
«Скорость образования комплекса» или «скорость ассоциации» или «kon» согласно настоящему изобретению также можно определить, как описано выше, с использованием системы BIACORE®-2000 или BIACORE®-3000 (BIAcore, Inc., Piscataway, NJ) при 25°C с помощью чипов CM5 с иммобилизованным антигеном на уровне примерно 10 единиц ответного сигнала (RU). Кратко, биосенсорные чипы из карбоксиметилированного декстрана (CM5, BIAcore Inc.) активируют гидрохлоридом N-этил-N’-(3-диметиламинопропил)карбодиимида (EDC) и N-гидроксисукцинимидом (NHS) согласно инструкциям поставщика. Антиген разбавляют 10 мМ ацетатом натрия, pH 4,8, до концентрации 5 мкг/мл (~0,2 мкМ) перед инъецированием со скоростью потока 5 мкл/мин, чтобы достичь приблизительно 10 единиц ответного сигнала (RU) от связанного белка. После инъекции антигена добавляют 1М этаноламина, чтобы блокировать не вступившие в реакцию группы. Для кинетических измерений двукратные серийные разведения Fab (от 0,78 нМ до 500 нМ) инъецируют в PBS с 0,05% твин-20 (PBST) при 25°C со скоростью потока примерно 25 мкл/мин. Скорости ассоциации (kon) и скорости диссоциации (koff) вычисляют, используя простую модель связывания Лэнгмюра «один к одному» (компьютерная программа для оценки BIAcore, версия 3.2), посредством одновременной подгонки сенсограмм ассоциации и диссоциации. Равновесную константу диссоциации (Kd) вычисляют в виде отношения koff/kon. См., например, Chen, Y., et al., (1999) J. Mol. Biol. 293:865-881. Однако если скорость образования комплекса превышает 106 M-1 сек-1 по данным указанного выше анализа поверхностного плазмонного резонанса, то скорость образования комплекса предпочтительно определяют, используя методику гашения флуоресценции, которая позволяет измерять увеличение или уменьшение интенсивности испускания флуоресценции (возбуждение=295 нм; эмиссия=340 нм, полоса пропускания 16 нм) при 25°C 20 нМ антитела против антигена (Fab-форма) в PBS, pH 7,2, в присутствии возрастающих концентраций антигена, причем измерения проводят на спектрометре, таком как спектрофотометр, оборудованный устройством для остановки потока (Aviv Instruments), или спектрофотометр SLM-Aminco серии 8000 (ThermoSpectronic), в кювете с перемешиванием содержимого.
Фраза «в значительной степени сниженный» или «в значительной степени отличающийся», используемая в настоящем описании, означает достаточно высокую степень различия между двумя числовыми значениями (обычно одно ассоциировано с определенной молекулой, а другое ассоциировано с эталонной молекулой/молекулой для сравнения), так что специалист в данной области может считать различие между двумя значениями статистически значимым в контексте биологического свойства, измеряемого указанными значениями (например, значениями Kd). Различие между указанными двумя значениями составляет, например, больше, чем примерно 10%, больше, чем примерно 20%, больше, чем примерно 30%, больше, чем примерно 40% и/или больше, чем примерно 50% от значения для эталонной молекулы/молекулы для сравнения.
Термин «по существу сходный» или «по существу такой же», используемый в настоящем описании, означает достаточно высокую степень сходства между двумя числовыми значениями (например, одно ассоциировано с антителом согласно изобретению, а другое ассоциировано с эталонным антителом/антителом для сравнения), так что специалист в данной области может считать различие между двумя значениями небольшим или биологически и/или статистически не значимым в контексте биологического признака, измеряемого указанными значениями (например, значениями Kd). Различие между двумя указанными значениями составляет, например, меньше, чем примерно 50%, меньше, чем примерно 40%, меньше, чем примерно 30%, меньше, чем примерно 20% и/или меньше, чем примерно 10% от значения для эталонного/сравниваемого антитела.
«Идентичность аминокислотных последовательностей в процентах (%)» и «гомологию» по отношению к пептидной, полипептидной последовательности или последовательности антитела определяют в виде процентного содержания аминокислотных остатков в выбранной для исследования последовательности, которые идентичны аминокислотным остаткам в конкретной пептидной или полипептидной последовательности, после выравнивания последовательностей и введения пробелов, если это необходимо, чтобы достичь максимальной идентичности последовательностей в процентах, и не принимая во внимание какие-либо консервативные замены как часть идентичности последовательностей. Выравнивания в целях определения идентичности аминокислотных последовательностей в процентах можно достичь различными путями, которые известны специалисту в данной области, например, с использованием общедоступной компьютерной программы, такой как компьютерная программа BLAST, BLAST-2, ALIGN или MEGALIGN™ (DNASTAR). Специалисты в данной области могут определить подходящие параметры для измерения выравнивания, включая любые алгоритмы, необходимые для достижения максимального выравнивания на протяжении всей длины сравниваемых последовательностей. Однако для целей настоящего изобретения значения идентичности аминокислотных последовательностей в % получают, используя компьютерную программу для сравнения последовательностей ALIGN-2, автором которой является Genentech, Inc. Исходный текст ALIGN-2 был подан вместе с документацией для пользователя в Бюро охраны авторских прав США, Washington D.C., 20559, где он зарегистрирован с номером регистрации Бюро охраны авторских прав США TXU510087. Программа ALIGN-2 общедоступна в Genentech, Inc., South San Francisco, California. Программа ALIGN-2 может быть компилирована для применения в операционной системе UNIX, предпочтительно цифровой UNIX V4.0D. Все параметры для сравнения последовательностей устанавливаются программой ALIGN-2 и не варьируют.
В ситуациях, когда ALIGN-2 применяют для сравнений аминокислотных последовательностей, идентичность аминокислотной последовательности в % для данной аминокислотной последовательности A по сравнению или по отношению к данной аминокислотной последовательности B (что альтернативно может быть перефразировано как данная аминокислотная последовательность A, которая имеет или содержит определенную идентичность аминокислотных последовательностей в % по сравнению или по отношению к данной аминокислотной последовательности B) рассчитывают следующим образом:
100×дробь X/Y
где X означает количество аминокислотных остатков, оцененных как идентичные совпадения программой выравнивания последовательностей ALIGN-2 при выравнивании указанной программой A и B, и где Y означает общее количество аминокислотных остатков в B. Будет понятно, что в том случае, когда длина аминокислотной последовательности A не равна длине аминокислотной последовательности B, идентичность аминокислотной последовательности A по сравнению с B в % не будет равна идентичности аминокислотной последовательности B по сравнению с A в %.
Если не указано иное, все значения идентичности аминокислотных последовательностей в %, используемые в настоящем описании, получены, как описано в непосредственно предшествующем абзаце, с использованием компьютерной программы ALIGN-2.
«Выделенная» молекула нуклеиновой кислоты, кодирующая антитела согласно изобретению, представляет собой молекулу нуклеиновой кислоты, которая идентифицирована и отделена, по меньшей мере, от одной загрязняющей молекулы нуклеиновой кислоты, с которой она обычно ассоциирована в среде, в которой она продуцируется. Предпочтительно, выделенная нуклеиновая кислота свободна от ассоциации со всеми компонентами, ассоциированными со средой ее образования. Выделенные молекулы нуклеиновых кислот, кодирующие полипептиды и антитела согласно изобретению, имеют другую форму, отличную от той формы и окружения, в которых она встречается в природе. Поэтому выделенные молекулы нуклеиновой кислоты отличаются от нуклеиновой кислоты, кодирующей полипептиды и антитела согласно изобретению, существующей в клетках в естественных условиях.
Термин «регуляторные последовательности» относится к последовательностям ДНК, необходимым для экспрессии функционально связанной кодирующей последовательности в организме конкретного хозяина. Регуляторные последовательности, которые подходят для прокариот, например, включают промотор, необязательно последовательность оператора и участок связывания рибосомы. Эукариотические клетки, как известно, используют промоторы, сигналы полиаденилирования и энхансеры.
Нуклеиновая кислота является «функционально связанной», когда она размещена в функциональной взаимосвязи с другой последовательностью нуклеиновой кислоты. Например, ДНК для препоследовательности или секреторного лидера является функционально связанной с ДНК для полипептида, если она экспрессируется в виде пребелка, который принимает участие в секреции полипептида; промотор или энхансер является функционально связанным с кодирующей последовательностью, если он влияет на транскрипцию последовательности; или участок связывания рибосомы является функционально связанным с кодирующей последовательностью, если он расположен так, чтобы способствовать трансляции. Как правило, «функционально связанные» означает, что последовательности ДНК, которые связаны, являются соседними и, в случае секреторного лидера, являются соседними и находятся в рамке считывания. Однако энхансеры не должны быть соседними. Связывание осуществляют лигированием в подходящих сайтах рестрикции. Если таких сайтов не существует, то используют синтетические олигонуклеотидные адаптеры или линкеры, согласно обычной практике.
Термин «меченный эпитопом» при использовании в настоящем описании относится к химерному полипептиду, содержащему полипептид или антитело, описанные в настоящей публикации, слитые с «полипептидной меткой». Полипептидная метка имеет достаточное количество остатков, чтобы обеспечить эпитоп, против которого может быть получено антитело, но еще является достаточно короткой, чтобы она не мешала активности полипептида, с которым она слита. Полипептидная метка предпочтительно также довольно уникальна, так что антитело по существу перекрестно не взаимодействует с другими эпитопами. Подходящие полипептидные метки обычно имеют, по меньшей мере, шесть аминокислотных остатков и обычно примерно от 8 до 50 аминокислотных остатков (предпочтительно примерно от 10 до 20 аминокислотных остатков).
Используемый в настоящем описании термин «иммуноадгезин» означает антитело-подобные молекулы, которые сочетают специфичность связывания гетерологичного белка («адгезию») с эффекторными функциями константных доменов иммуноглобулина. Структурно иммуноадгезины включают слияние аминокислотной последовательности с требуемой специфичностью связывания, которая отличается от сайта узнавания и связывания антигена антитела (т.е. является «гетерологичной»), и последовательности константного домена иммуноглобулина. Адгезиновая часть молекулы иммуноадгезина обычно представляет собой непрерывную аминокислотную последовательность, содержащую, по меньшей мере, участок связывания рецептора или лиганда. Последовательность константного домена иммуноглобулина в иммуноадгезине может быть получена из любого иммуноглобулина, такого как IgG-1, IgG-2 (включая IgG2A и IgG2B), IgG-3 или подтипы IgG-4, IgA (включая IgA-1 и IgA-2), IgE, IgD или IgM. Слияния Ig предпочтительно включают замену доменом полипептида или антитела, описанного в настоящей публикации, по меньшей мере, одной вариабельной области в молекуле Ig. В конкретном предпочтительном варианте осуществления слияние иммуноглобулина включает области шарнира, CH2 и CH3, или области шарнира, CH1, CH2 и CH3 молекулы IgG1. Описание получения слияний иммуноглобулина см. также в патенте США № 5428130, выданном 27 июня 1995. Например, иммуноадгезины, пригодные в качестве второго лекарственного средства, используемого для комбинированной терапии согласно изобретению, включают полипептиды, которые содержат внеклеточную часть или PD-1-связывающую часть PD-L1 или PD-L2, или наоборот, слитые с константным доменом последовательности иммуноглобулина.
«Слитый белок» и «слитый полипептид» относятся к полипептиду, имеющему две части, ковалентно связанные вместе, где каждая из частей представляет собой полипептид, обладающий другим свойством. Свойством может быть биологическое свойство, такое как активность in vitro или in vivo. Свойством также может быть простое химическое или физическое свойство, такое как связывание с молекулой-мишенью, катализ реакции и т.д. Две части могут быть связаны непосредственно одной пептидной связью или через пептидный линкер, в рамке считывания друг с другом.
«Стабильный» препарат представляет собой препарат, в котором имеющийся белок по существу сохраняет свои физическую и химическую стабильность и целостность при хранении. Различные аналитические способы для измерения стабильности белка имеются в данной области и описаны в публикациях Peptide and Protein Drug Delivery, 247-301, Vincent Lee Ed., Marcel Dekker, Inc., New York, Pubs. (1991) и Jones, A. Adv. Drug Delivery Rev. 10: 29-90 (1993). Стабильность может быть измерена при выбранной температуре в течение выбранного периода времени. Для быстрого скрининга препарат можно хранить при 40°C в течение от 2 недель до 1 месяца, и в выбранной временной точке измеряют стабильность. В том случае, когда препарат необходимо хранить при 2-8°C, как правило, препарат должен быть стабильным при 30°C или 40°C в течение, по меньшей мере, 1 месяца и/или стабильным при 2-8°C в течение, по меньшей мере, 2 лет. В том случае, когда препарат необходимо хранить при 30°C, как правило, препарат должен быть стабильным в течение, по меньшей мере, 2 лет при 30°C и/или стабильным при 40°C в течение, по меньшей мере, 6 месяцев. Например, степень агрегации во время хранения можно использовать в качестве показателя стабильности белка. Таким образом, «стабильный» препарат может представлять собой препарат, в котором менее чем примерно 10% и предпочтительно менее чем примерно 5% белка присутствует в виде агрегата в препарате. В других вариантах осуществления можно определить любое увеличение в образовании агрегата во время хранения препарата.
«Перерастворенный» препарат представляет собой препарат, который был получен растворением лиофилизированного препарата белка или антитела в разбавителе, так чтобы диспергировать белок по всему объему. Перерастворенный препарат подходит для введения (например, подкожного введения) пациенту с целью лечения представляющим интерес белком, и в некоторых вариантах осуществления изобретения может представлять собой препарат, который подходит для парентерального или внутривенного введения.
«Изотоничный» препарат представляет собой препарат, который по существу имеет такое же осмотическое давление, как и кровь человека. Изотоничные препараты, как правило, будут иметь осмотическое давление примерно от 250 до 350 мОсмоль. Термин «гипотоничный» описывает препарат с осмотическим давлением ниже осмотического давления крови человека. Соответственно, термин «гипертоничный» используют для описания препарата с осмотическим давлением выше осмотического давления крови человека. Изотоничность можно измерить, используя, например, осмометр давления пара или осмометр криоскопического типа. Препараты согласно настоящему изобретению являются гипертоничными в результате добавления соли и/или буфера.
«Носители», используемые в настоящем описании, включают фармацевтически приемлемые носители, эксципиенты или стабилизаторы, которые являются нетоксичными для клетки или млекопитающего, подвергаемого его воздействию, в применяемых дозах и концентрациях. Часто физиологически приемлемым носителем является водный раствор, забуференный по pH. Примеры физиологически приемлемых носителей включают такие буферы, как фосфат, цитрат и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту; низкомолекулярный (менее чем примерно 10 остатков) полипептид; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как EDTA; сахарные спирты, такие как маннит или сорбит; солеобразующие противоионы, такие как натрий; и/или неионогенные поверхностно-активные вещества, такие как TWEEN™, полиэтиленгликоль (ПЭГ), и плюроники (PLURONICS™).
«Вкладыш в упаковку» относится к инструкциям, обычно вкладываемым в коммерческие упаковки лекарственных средств, которые содержат информацию о показаниях, применении, дозе, введении, противопоказаниях, других лекарственных средствах, сочетаемых с упакованным продуктом, и/или предупреждениях, касающихся применения таких лекарственных средств и т.д.
Термин «фармацевтически приемлемая кислота» включает неорганические и органические кислоты, которые являются нетоксичными в концентрации и в том виде, в котором они приготовлены. Например, подходящие неорганические кислоты включают хлористоводородную, перхлорную, бромистоводородную, йодистоводородную, азотную, серную, сульфоновую, сульфиновую, сульфаниловую, фосфорную, угольную и т.д. Подходящие органические кислоты включают алкил-(с прямой и разветвленной цепью)карбоновые, ароматические, циклические, циклоалифатические, арилалифатические, гетероциклические, насыщенные, ненасыщенные, моно-, ди- и трикарбоновые кислоты, включая например, муравьиную, уксусную, 2-гидроксиуксусную, трифторуксусную, фенилуксусную, триметилуксусную, трет-бутилуксусную, антраниловую, пропионовую, 2-гидроксипропионовую, 2-оксопропионовую, малоновую, циклопентанпропионовую, 3-фенилпропионовую, масляную, бутандикислоту, бензойную, 3-(4-гидроксибензоил)бензойную, 2-ацетоксибензойную, аскорбиновую, коричную, лаурилсерную, стеариновую, муконовую, миндальную, янтарную, памовую, фумаровую, яблочную, малеиновую, гидроксималеиновую, малоновую, молочную, лимонную, винную, гликолевую, гликоновую, глюконовую, пировиноградную, глиоксиловую, щавелевую, мезиловую, янтарную, салициловую, фталевую, пальмовую, пальмеиновую, тиоциановую, метансульфоновую, этансульфоновую, 1,2-этандисульфоновую, 2-гидроксиэтансульфоновую, бензолсульфоновую, 4-хлорбензолсульфоновую, нафталин-2-сульфоновую, п-толуолсульфоновую, камфорсульфоновую, 4-метилбицикло[2.2.2]-окт-2-ен-1-карбоновую, глюкогептоновую, 4,4’-метиленбис-3-(гидрокси-2-ен-1-карбоновую кислоту), гидроксинафтоевую кислоту.
Термин «фармацевтически приемлемые основания» включает неорганические и органические основания, которые являются нетоксичными в концентрации и в том виде, в котором они приготовлены. Например, подходящие основания включают основания, образованные из образующих неорганические основания металлов, таких как литий, натрий, калий, магний, кальций, аммоний, железо, цинк, медь, марганец, алюминий, N-метилглюкамин, морфолин, пиперидин, и органические нетоксичные основания, включая первичные, вторичные и третичные амины, замещенные амины, циклические амины и основные ионообменные смолы [например, N(R’)4+ (где R’ независимо означает H или C1-4-алкил, например, аммоний, трис)], например, изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин, этаноламин, 2-диэтиламиноэтанол, тиметамин, дициклогексиламин, лизин, аргинин, гистидин, кофеин, прокаин, гидрабамин, холин, бетаин, этилендиамин, глюкозамин, метилглюкамин, теобромин, пурины, пиперазин, пиперидин, N-этилпиперидин, полиаминные смолы и тому подобное. Особенно предпочтительными органическими нетоксичными основаниями являются изопропиламин, диэтиламин, этаноламин, триметамин, дициклогексиламин, холин и кофеин. Дополнительные фармацевтически приемлемые кислоты и основания, применимые в настоящем изобретении, включают кислоты и основания, которые получены из аминокислот, например, гистидина, глицина, фенилаланина, аспарагиновой кислоты, глутаминовой кислоты, лизина и аспарагина.
«Фармацевтически приемлемые» буферы и соли включают буферы и соли, полученные из кислотно- и основно-аддитивных солей описанных выше кислот и оснований. Конкретные буферы и/или соли включают гистидин, сукцинат и ацетат.
«Фармацевтически приемлемый сахар» представляет собой молекулу, которая при объединении с представляющим интерес белком по существу предотвращает или снижает химическую и/или физическую нестабильность белка при хранении. Когда препарат предназначен для лиофилизации и затем перерастворения, «фармацевтически приемлемые сахара» также известны как «криопротекторы». Примеры сахаров и их соответствующих сахарных спиртов включают: аминокислоту, такую как глутамат натрия или гистидин; метиламин, такой как бетаин; лиотропную соль, такую как сульфат магния; полиол, такой как трехосновные или имеющие большую молекулярную массу сахарные спирты, например, глицерин, декстран, эритритол, глицерин, арабит, ксилит, сорбит и маннит; пропиленгликоль; полиэтиленгликоль; плюроники (PLURONICS®); и их сочетания. Дополнительные примеры криопротекторов для лиофилизации включают глицерин, а также желатин и сахара меллибиозу, мелецитозу, рафинозу, маннотриозу и стахиозу. Примеры восстанавливающих сахаров включают глюкозу, мальтозу, лактозу, мальтулозу, изомальтулозу и лактолозу. Примеры не восстанавливающих сахаров включают не восстанавливающие гликозиды полигидроксисоединений, выбранных из сахарных спиртов, и другие полиспирты с неразветвленной цепью. Предпочтительными сахарными спиртами являются моногликозиды, особенно соединения, полученные восстановлением дисахаридов, таких как лактоза, мальтоза, лактулоза и мальтулоза. Боковая гликозидная группа может быть либо глюкозидной, либо галактозидной. Дополнительными примерами сахарных спиртов являются глюцит, мальтит, лактит и изомальтулоза. Предпочтительными фармацевтически приемлемыми сахарами являются не восстанавливающие сахара трегалоза или сахароза. Фармацевтически приемлемые сахара добавляют к препарату в «защищающем количестве» (например, перед лиофилизацией), которое означает, что белок по существу сохраняет свою физическую и химическую стабильность и целостность во время хранения (например, после перерастворения и хранения).
«Разбавитель», представляющий интерес для настоящего изобретения, является фармацевтически приемлемым разбавителем (безопасным и нетоксичным для введения человеку) и применимым для получения жидкого препарата, такого как препарат, перерастворенный после лиофилизации. Примерами разбавителей являются стерильная вода, бактериостатическая вода для инъекции (BWFI), раствор с забуференным pH (например, фосфатно-солевой буфер), стерильный физиологический раствор, раствор Рингера или раствор декстрозы. В альтернативном варианте осуществления разбавители могут включать водные растворы солей и/или буферы.
«Консервант» представляет собой соединение, которое может быть добавлено к препаратам согласно изобретению, чтобы снизить бактериальную активность. Добавление консерванта может, например, облегчать получение многоразового (содержащего множество доз) препарата. Примеры возможных консервантов включают хлорид октадецилдиметилбензиламмония, хлорид гексаметония, хлорид бензалкония (смесь хлоридов алкилбензилдиметиламмония, в которых алкильные группы являются длинноцепочечными соединениями) и хлорид бензетония. Другие типы консервантов включают ароматические спирты, такие как фенол, бутиловый и бензиловый спирт, алкилпарабены, такие как метил- или пропилпарабен, катехин, резорцин, циклогексанол, 3-пентанол и м-крезол. Наиболее предпочтительным консервантом для настоящего изобретения является бензиловый спирт.
«Лечение» относится к клиническому вмешательству с целью изменения естественного течения процесса в организме индивидуума или в клетке, подвергаемой лечению, и лечение можно осуществлять либо для профилактики, либо во время протекания клинической патологии. Требуемые эффекты лечения включают профилактику возникновения или рецидивов заболевания, предотвращение метастазов, снижение скорости прогрессирования заболевания, ослабление или облегчение патологического состояния и ремиссию или улучшенный прогноз. В некоторых вариантах осуществления антитела согласно изобретению используют для замедления развития заболевания или расстройства. Субъект успешно «подвергается лечению», например, с использованием апоптозных антител к PD-L1 согласно изобретению, если происходит ослабление одного или более симптомов, ассоциированных с T-клеточным дисфункциональным расстройством.
Термин «эффективное количество» относится, по меньшей мере, к количеству, эффективному в дозах и в течение необходимых периодов времени в отношении достижения требуемого или указанного эффекта, включая терапевтический или профилактический результат. Например, эффективное количество антител к PD-L1 согласно настоящему изобретению представляет собой, по меньшей мере, минимальную концентрацию, которая приводит к ингибированию передачи сигнала от PD-L1 либо через PD-1 на T-клетках, либо B7.1 на других АПК или и на тех и на других.
«Терапевтическое эффективное количество» представляет собой, по меньшей мере, минимальную концентрацию, необходимую для получения измеряемого улучшения или предотвращения конкретного заболевания. Терапевтически эффективное количество согласно настоящему изобретению может варьировать в зависимости от таких факторов, как состояние болезни, возраст, пол и масса пациента и способность антитела вызывать требуемый ответ у индивидуума. Терапевтически эффективное количество также представляет собой такое количество, при использовании которого любые токсические или вредные эффекты антитела перевешиваются терапевтически полезными эффектами. Например, терапевтически эффективное количество антител к PD-L1 согласно настоящему изобретению представляет собой, по меньшей мере, минимальную концентрацию, которая приводит к подавлению, по меньшей мере, одного симптома T-клеточного дисфункционального расстройства.
«Профилактически эффективное количество» относится к количеству, эффективному в дозах и в течение необходимого периода времени в отношении достижения требуемого профилактического результата. Например, профилактически эффективное количество антител к PD-L1 согласно настоящему изобретению, по меньшей мере, равно минимальной концентрации, которая предотвращает или ослабляет развитие, по меньшей мере, одного симптома T-клеточного дисфункционального расстройства.
«Хроническое» введение относится к введению лекарственного средства (средств) в длительном режиме, в противоположность неотложному типу введения, так чтобы поддерживать начальный терапевтический эффект (активность) в течение длительного периода времени. «Периодическое» введение означает лечение, которое не осуществляют постоянно без перерыва, а которое является циклическим по характеру.
«Млекопитающее» для целей лечения относится к любому животному, классифицируемому как млекопитающее, включая человека, домашних и сельскохозяйственных животных и животных в зоопарках, спортивных животных или комнатных животных, таких как собаки, лошади, кролики, коровы, свиньи, хомячки, песчанки, мыши, хорьки, крысы, кошки и т.д. Предпочтительно, млекопитающим является человек.
Термин «фармацевтический препарат» относится к препарату, который находится в такой форме, которая обеспечивает эффективную биологическую активность активного ингредиента и которая не содержит дополнительных компонентов, которые являются неприемлемо токсичным для субъекта, которому будет введен препарат. Такие препараты являются стерильными.
«Стерильный» препарат является асептическим или не содержит никаких живых микроорганизмов и их спор.
Термин «примерно», используемый в настоящем описании, относится к обычному диапазону ошибки для соответствующего значения, хорошо известному специалисту в данной области техники.
«Аутоиммунным расстройством» является заболевание или расстройство, возникающее и направленное против собственных тканей или органов пациента, или его косегрегация или проявление, или возникающее в результате состояние. Аутоиммунное заболевание может быть органо-специфичным заболеванием (т.е. иммунный ответ специфично направлен против системы органов, такой как эндокринная система, гематопоэтическая система, кожа, сердечно-легочная система, желудочно-кишечная система и система печени, почечная система, щитовидная железа, уши, нейромышечная система, центральная нервная система и т.д.) или системным заболеванием, которое может поражать множество систем органов (например, системная красная волчанка (СКВ), ревматоидный артрит (РА), полимиозит и т.д.). Предпочтительные заболевания включают аутоиммунные ревматологические расстройства (такие как, например, РА, синдром Шегрена, склеродерма, волчанка, такая как СКВ и волчаночный нефрит, полимиозит-дерматомиозит, криоглобулинемия, синдром антифосфолипидных антител и псориатический артрит), аутоиммунные желудочно-кишечные расстройства и расстройства печени (такие как, например, воспалительные заболевания кишечника (например, язвенный колит и болезнь Крона), аутоиммунный гастрит и пернициозная анемия, аутоиммунный гепатит, первичный билиарный цирроз, первичный склерозирующий холангит и целиакия), васкулиты (такие как, например, ANCA-негативный васкулит и ANCA-ассоциированный васкулит, включая васкулит Чарга-Штраусс, гранулематоз Вегенера и микроскопический полиангиит), аутоиммунные неврологические расстройства (такие как, например, рассеянный склероз, синдром опсоклонуса-миоклонуса, бульбоспинальный паралич, нейрооптикомиелит, болезнь Паркинсона, болезнь Альцгеймера и аутоиммунные полиневропатии), почечные расстройства (такие как, например, гломерулонефрит, синдром Гудпасчера и болезнь Бергера), аутоиммунные дерматологические расстройства (такие как, например, псориаз, крапивная лихорадка, крапивница, вульгарный пемфигус, буллезный пемфигоид и кожная красная волчанка), гематологические расстройства (такие как, например, тромбоцитопеническая пурпура, тромботическая тромбоцитопеническая пурпура, посттрансфузионная пурпура и аутоиммунная гемолитическая анемия), атеросклероз, увеит, аутоиммунные заболевания органов слуха (такие как, например, болезнь внутреннего уха и потеря слуха), болезнь Бехчета, синдром Рейно, трансплантат органа и аутоиммунные эндокринные расстройства (такие как, например, связанные с диабетом аутоиммунные заболевания, такие как инсулинозависимый сахарный диабет (IDDM), болезнь Аддисона и аутоиммунное заболевание щитовидной железы (например, диффузный токсический зоб и тиреоидит)). Более предпочтительные заболевания включают, например, РА, язвенный колит, ANCA-ассоциированный васкулит, волчанку, рассеянный склероз, синдром Шегрена, диффузный токсический зоб, IDDM, пернициозную анемию, тиреоидит и гломерулонефрит.
Термин «цитотоксическое средство», используемый в настоящем описании, относится к веществу, которое ингибирует или предотвращает функцию клеток и/или вызывает разрушение клеток. Термин включает радиоактивные изотопы (например, 211At, 131I, 125I, 90Y, 186Re, 188Re, 153Sm, 212Bi, 32P и радиоактивные изотопы Lu) и токсины, такие как низкомолекулярные токсины или ферментативно активные токсины бактериального, грибкового, растительного или животного происхождения, или их фрагменты.
«Химиотерапевтическим средством» является химическое соединение, применимое для лечения злокачественной опухоли. Примеры химиотерапевтических средств включают алкилирующие агенты, такие как тиотепа и циклофосфамид (CYTOXAN®); алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метилмеламины, включая алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилоломеламин; ацетогенины (в частности, буллатацин и буллатацинон); дельта-9-тетрагидроканнабинол (дронабинол, MARINOL®); бета-лапахон; лапахол; колхицины; бетулиновую кислоту; камптотецин (включая синтетический аналог топотекан (HYCAMTIN®), CPT-11 (иринотекан, CAMPTOSAR®), ацетилкамптотецин, скополектин и 9-аминокамптотецин); бриостатин; пеметрексед; каллистатин; CC-1065 (включая его синтетические аналоги адозелезин, карзелезин и бизелезин); подофиллотоксин; подофиллиновую кислоту; тенипозид; криптофицины (в частности, криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги KW-2189 и CB1-TM1); элеутеробин; панкратистатин; TLK-286; CDP323; пероральный ингибитор интегрина альфа-4; саркодиктиин; спонгистатин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, холофосфамид, эстрамустин, ифосфамид, мехлорэтамин, гидрохлорид оксида мехлорэтамина, мелфалан, новембихин, фенестерин, преднимустин, трофосфамид, урамустин; нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин и ранимнустин; антибиотики, такие как энедииновые антибиотики (например, калихеамицин, в частности, калихеамицин гамма II и калихеамицин омега II (см., например, Nicolaou et al., Agnew. Chem Intl. Ed. Engl., 33: 183-186 (1994)); динемицин, включая динемицин A; эсперамицин; а также хромофор неокарциностатина и родственные хромофоры хромопротеинов - энедииновые антибиотики), аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карцинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин (включая ADRIAMYCIN®, морфолинодоксорубицин, цианоморфолинодоксорубицин, 2-пирролинодоксорубицин, липосомный инъекционный доксорубицин-HCl (DOXIL®) и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, такие как митомицин C, микофеноловую кислоту, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат, гемцитабин (GEMZAR®), тегафур (UFTORAL®), капецитабин (XELODA®), эпотилон и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пурина, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидина, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин и иматиниб (производное 2-фениламинопиримидина), а также другие ингибиторы c-Kit; средства, подавляющие функции надпочечников, такие как аминоглутетимид, митотан, трилостан; компенсатор фолиевой кислоты, такой как фролиновая кислота; ацеглатон; гликозид альдофосфамида; аминолевулиновую кислоту; энилурацил; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демеколцин; диазиквон; элфорнитин; ацетат эллиптиния; этоглуцид; нитрат галлия; гидроксимочевину; лентинан; лонидаинин; майтансиноиды, такие как майтансин и ансамитоцины; митогуазон; митоксантрон; мопиданмол; нитраэрин; пентостатин; фенамет; пирарубицин; лозоксантрон; 2-этилгидразид; прокарбазин; полисахаридный комплекс PSK® (JHS Natural Products, Eugene, OR); разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновую кислоту; триазиквон; 2,2’,2”-трихлортриэтиламин; трихотецены (в частности, токсин T-2, верракурин A, роридин A и ангуидин); уретан; виндезин (ELDISINE®, FILDESIN®); дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид («Ara-C»); тиотепа; таксоиды, например паклитаксел (TAXOL®), препарат паклитаксела на основе сконструированных связанных с альбумином наночастиц (ABRAXANE™) и доксетаксел (TAXOTERE®); хлорамбуцил; 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин (VELBAN®); платину; этопозид (VP-16); ифосфамид; митоксантрон; винкристин (ONCOVIN®); оксалиплатин; лейковорин; винорелбин (NAVELBINE®); новантрон; эдатрексат; дауномицин; аминоптерин; ибандронат; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноиды, такие как ретиноевая кислота; фармацевтически приемлемые соли, кислоты или производные любого агента, указанного выше; а также сочетания двух или более указанных выше средств, такие как CHOP, сокращенное название комбинированной терапии циклофосфамидом, доксорубицином, винкристином и преднизолоном, и FOLFOX, сокращенное название схемы лечения оксалиплатином (ELOXATIN™) в сочетании с 5-FU и лейковорином. Особенно предпочтительным химиотерапевтическим средством, применимым в сочетании с антителами к PD-L1 согласно изобретению, особенно для лечения опухолевого иммунитета, является гемцитабин.
Также в указанное определение включены противогормональные средства, которые действуют, регулируя, уменьшая, блокируя или ингибируя эффекты гормонов, которые могут стимулировать рост злокачественной опухоли, и часто их используют в форме системного лечения или лечения на уровне целого организма. Они сами могут быть гормонами. Примеры включают антиэстрогены и избирательные модуляторы рецепторов эстрогена (SERM), включая, например, тамоксифен (включая тамоксифен NOLVADEX®), ралоксифен (EVISTA®), дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен (FARESTON®); антипрогестероны; понижающие регуляторы рецептора эстрогена (ERD); антагонисты рецептора эстрогена, такие как фулвестрант (FASLODEX®); средства, которые функционируют, подавляя или прекращая работу яичников, например, агонисты рилизинг-гормона лютеинизирующего гормона (LHRH), такие как ацетат лейпролида (LUPRON® и ELIGARD®), ацетат гозерелина, ацетат бузерелина и триптерелин; антиандрогены, такие как флутамид, нилутамид и бикалутамид; и ингибиторы ароматазы, которые ингибируют фермент ароматазу, которая регулирует продукцию эстрогена в надпочечниках, такие как, например, 4(5)-имидазолы, аминоглутетимид, ацетат мегестрола (MEGASE®), эксеместан (AROMASIN®), форместан, фадрозол, ворозол (RIVISOR®), летрозол (FEMARA®) и анастрозол (ARIMIDEX®). Кроме того, такое определение химиотерапевтических средств включает бисфосфонаты, такие как клодронат (например, BONEFOS® или OSTAC®), этидронат (DIDROCAL®), NE-58095, золедроновую кислоту/золедронат (ZOMETA®), алендронат (FOSAMAX®), памидронат (AREDIA®), тилудронат (SKELID®) или ризедронат (ACTONEL®); а также троксацитабин (1,3-диоксолановый нуклеозидный аналог цитозина); антисмысловые олигонуклеотиды, в частности, олигонуклеотиды, которые ингибируют экспрессию генов в путях передачи сигналов, вовлеченных в аномальную пролиферацию клеток, таких как, например, PKC-альфа, Raf, H-Ras и рецептор эпидермального фактора роста (EGF-R); вакцины, такие как вакцина THERATOPE® и вакцины для генной терапии, например, вакцина ALLOVECTIN®, вакцина LEUVECTIN® и вакцина VAXID®; ингибитор топоизомеразы 1 (например, LURTOTECAN®); антиэстроген, такой как фулвестрант; ингибитор Kit, такой как иматиниб или EXEL-0862 (ингибитор тирозинкиназы); ингибитор EGFR, такой как эрлотиниб или цетуксимаб; анти-VEGF-ингибитор, такой как бевацизумаб; аринотекан; rmRH (например, ABARELIX®); лапатиниб и дитозилат лапатиниба (низкомолекулярный двойной ингибитор тирозинкиназ ErbB-2 и EGFR, также известный как GW572016); 17AAG (производное гелданамицина, то есть ядовитое вещество белок теплового шока (Hsp) 90) и фармацевтически приемлемые соли, кислоты или производные любого из указанных выше средств.
«Ингибирующее рост средство» относится к соединению или композиции, которая ингибирует рост клетки, который зависит от активации рецептора либо in vitro, либо in vivo. Таким образом, ингибирующее рост средство включает средство, которое в значительной степени уменьшает процентное содержание зависимых от рецептора клеток в S-фазе. Примеры ингибирующих рост средств включают средства, которые блокируют прохождение клеточного цикла (в другом месте, отличном от S-фазы), такие как средства, которые индуцируют задержку в G1-фазе и задержку в M-фазе. Классические блокаторы M-фазы включают барвинок и алкалоиды барвинка (винкристин и винбластин), таксаны и ингибиторы топоизомеразы II, такие как доксорубицин, эпирубицин, даунорубицин, этопозид и блеомицин. Средства, которые задерживают в G1, также распространяют свое действие на задержку в S-фазе, например, ДНК-алкилирующие агенты, такие как тамоксифен, преднизон, дакарбазин, мехлорэтамин, цисплатин, метотрексат, 5-фторурацил и ara-C. Дополнительную информацию можно найти в The Molecular Basis of Cancer, Mendelsohn and Israel, eds., Chapter 1, озаглавленная «Cell cycle regulation, oncogenes, and antineoplastic drugs», Murakami et al. (WB Saunders: Philadelphia, 1995), особенно на p. 13. Таксаны (паклитаксел и доцетаксел) являются противоопухолевыми лекарственными средствами, полученными из тиса. Доцетаксел (TAXOTERE®, Rhone-Poulenc Rorer), полученный из Европейского тиса, является полусинтетическим аналогом паклитаксела (TAXOL®, Bristol-Myers Squibb).
Термин «цитокин» является родовым названием белков, высвобождаемых одной популяцией клеток, которые действуют на другую клетку в качестве межклеточных медиаторов. Примерами таких цитокинов являются лимфокины, монокины; интерлейкины (IL), такие как IL-1, IL-1α, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-11, IL-12, IL-13, IL-15...IL35, включая rIL-2 PROLEUKIN®; фактор некроза опухоли, такой как TNF-α или TNF-β; и другие полипептидные факторы, включая LIF и лиганд kit (KL), хотя термин «интерлейкин» в настоящее время по существу стал синонимом цитокина. Используемый в данном описании термин «цитокин» включает белки из природных источников или из культуры рекомбинантных клеток и биологически активные эквиваленты цитокинов с нативной последовательностью, включая синтетически полученные низкомолекулярные единицы и их фармацевтически приемлемые производные и соли. Цитокины могут быть классифицированы по близости положения предполагаемой мишени, при этом аутокрин относится к действию на ту же самую клетку, из которой он секретирован, паракрин относится к действию, ограниченному непосредственной близлежащей областью, в которую секретируется цитокин, и эндокрин относится к действию в отдаленных областях организма. Иммунные цитокины также могут быть классифицированы по тому, как усиливают ли они ответ типа I (например, IFN-γ, TGF-β и т.д.), который способствует клеточному иммунитету, или ответ типа II (IL-4, IL-10, IL-13 и т.д.), который способствует опосредованному антителом или гуморальному иммунитету. Иммунные цитокины играют важную роль в костимуляции, созревании, пролиферации, активации, воспалении, росте, дифференцировке, продукции и секреции цитокинов, жизнеспособности различных иммунных клеток.
Термин «гормон» относится к полипептидным гормонам, которые обычно секретируются железистыми органами с протоками. К гормонам относятся, например, гормон роста, такой как гормон роста человека, N-метионил-гормон роста человека и бычий гормон роста; паратиреоидный гормон; тироксин; инсулин; проинсулин; релаксин; эстрадиол; гормонозамещающая терапия; андрогены, такие как калустерон, пропионат дромостанолона, эпитиостанол, мепитиостан или тестолактон; прорелаксин; гликопротеиновые гормоны, такие как фолликулостимулирующий гормон (FSH), тиреостимулирующий гормон (TSH) и лютеинизирующий гормон (LH); пролактин; плацентарный лактоген, мышиный гонадотропин-ассоциированный пептид, гонадотропин-высвобождающий гормон; ингибин; активин; мюллерово ингибирующее вещество и тромбопоэтин. Используемый в настоящем описании термин гормон включает белки из природных источников или из культуры рекомбинантных клеток и биологически активные эквиваленты гормона с нативной последовательностью, включая синтетически полученные низкомолекулярные единицы и их фармацевтически приемлемые производные и соли.
III. Способы осуществления изобретения
A. Гуманизация с использованием фагового дисплея
Варианты с привитыми гипервариабельными областями, описанные в настоящей публикации, создавали посредством мутагенеза по Kunkel нуклеиновой кислоты, кодирующей акцепторные последовательности человека, с использованием отдельного олигонуклеотида для каждой гипервариабельной области. Kunkel et al., Methods Enzymol. 154:367-382 (1987). Соответствующие изменения могут быть введены в каркас и/или гипервариабельную область с использованием стандартной методики, чтобы скорректировать и восстановить правильные взаимодействия гипервариабельная область-антиген.
Фаг(мидный) дисплей (также называемый в настоящем описании фаговым дисплеем) можно использовать в качестве удобного и быстрого способа создания и скрининга множества различных возможных вариантов антител в библиотеке, созданной путем рандомизации последовательностей. Однако специалисту доступны другие способы получения и скрининга измененных антител.
Фаг(мидный) дисплей (также называемый в настоящем описании в некоторых контекстах фаговым дисплеем) можно использовать в качестве удобного и быстрого способа создания и скрининга множества различных возможных вариантов антител в библиотеке, созданной путем рандомизации последовательностей. Однако специалисту доступны другие способы получения и скрининга измененных антител.
Методика фаг(мидного) дисплея обеспечила эффективное средство для создания и отбора новых белков, которые связываются с лигандом, таким как антиген. Использование методики фаг(мидного) дисплея позволяет создавать большие библиотеки белковых вариантов, которые можно быстро отбирать в отношении таких последовательностей, которые связываются с молекулой-мишенью с высокой аффинностью. Нуклеиновые кислоты, кодирующие варианты полипептидов, обычно сливают с последовательностью нуклеиновой кислоты, кодирующей белок оболочки вируса, такой как белок гена III или белок гена VIII. Разработаны моновалентные системы фагмидного дисплея, в которых последовательность нуклеиновой кислоты, кодирующую белок или полипептид, сливают с последовательностью нуклеиновой кислоты, кодирующей часть белка гена III. (Bass, S., Proteins, 8:309 (1990); Lowman and Wells, Methods: A Companion to Methods in Enzymology, 3:205 (1991)). В моновалентной системе фагмидного дисплея слияние генов экспрессируется на низких уровнях, а также экспрессируются белки гена III дикого типа, так что инфекционность частиц сохраняется. Способы создания пептидных библиотек и скрининга таких библиотек описаны во многих патентах (например, в патенте США № 5723286, патенте США № 5432018, патенте США № 5580717, патенте США № 5427908 и в патенте США № 5498530).
Библиотеки антител или антигенсвязывающих полипептидов получены несколькими способами, включая изменение одного гена посредством инсерции случайных последовательностей ДНК или клонированием семейства родственных генов. Способы демонстрации антител или антигенсвязывающих фрагментов с использованием фаг(мидного) дисплея описаны в патентах США №№ 5750373, 5733743, 5837242, 5969108, 6172197, 5580717 и 5658727. Затем проводят скрининг библиотеки в отношении экспрессии антител или антигенсвязывающих белков с требуемыми характеристиками.
Способы замены выбранных аминокислот в матричной нуклеиновой кислоте хорошо разработаны в данной области, некоторые из которых описаны в данной публикации. Например, остатки гипервариабельной области могут быть заменены с использованием способа Kunkel. См., например, Kunkel et al., Methods Enzymol. 154:367-382 (1987).
Последовательность олигонуклеотидов содержит один или более сконструированных наборов для изменяемых остатков гипервариабельной области. Набор кодонов представляет собой набор разных триплетных нуклеотидных последовательностей, используемых для кодирования требуемых вариантов аминокислот. Наборы кодонов могут быть представлены с использованием символов для обозначения конкретных нуклеотидов или эквимолярных смесей нуклеотидов в соответствии с ИЮБ, как показано ниже.
Наборы олигонуклеотидов или праймеров могут быть синтезированы с использованием стандартных способов. Набор олигонуклеотидов может быть синтезирован, например, посредством твердофазного синтеза, включая последовательности, которые представляют все возможные комбинации нуклеотидных триплетов, которые дает набор кодонов и которые будут кодировать требуемую ограниченную группу аминокислот. Синтез олигонуклеотидов с выбранной «вырожденностью» нуклеотидов в определенных положениях хорошо известен в данной области. Такие наборы олигонуклеотидов, имеющих определенные наборы кодонов, могут быть синтезированы с использованием коммерческих синтезаторов нуклеиновых кислот (доступных, например, от Applied Biosystems, Foster City, CA) или могут быть получены коммерчески (например, от Life Technologies, Rockville, MD). Поэтому набор синтезированных олигонуклеотидов, имеющих конкретный набор кодонов, обычно будет содержать множество олигонуклеотидов с разными последовательностями, причем различие определяется набором кодонов в полной последовательности. Олигонуклеотиды, используемые согласно изобретению, имеют последовательности, которые обеспечивают гибридизацию с матричной нуклеиновой кислотой вариабельного домена, а также могут содержать сайты для ферментов рестрикции в целях клонирования.
В одном способе последовательности нуклеиновых кислот, кодирующие варианты аминокислот, могут быть созданы опосредованным олигонуклеотидами мутагенезом. Такой способ хорошо известен в данной области и описан в публикации Zoller et al. Nucleic Acids Res. 10:6487-6504 (1987). Кратко, последовательности нуклеиновых кислот, кодирующие варианты аминокислот, создают гибридизацией набора олигонуклеотидов, кодирующих требуемые наборы кодонов, с матрицей ДНК, причем матрица представляет собой однонитевую форму плазмиды, содержащей последовательность матрицы нуклеиновой кислоты вариабельной области. После гибридизации используют ДНК-полимеразу, чтобы синтезировать полную вторую комплементарную нить матрицы, которая соответственно будет содержать олигонуклеотидный праймер и будет содержать наборы кодонов, которые обеспечивает набор олигонуклеотидов.
Как правило, используют олигонуклеотиды длиной, по меньшей мере, 25 нуклеотидов. Оптимальный олигонуклеотид будет иметь от 12 до 15 нуклеотидов, которые полностью комплементарны матрице с любой стороны от нуклеотида(ов), кодирующего мутацию(ии). Это гарантирует то, что олигонуклеотид будет правильно гибридизоваться с однонитевой молекулой ДНК-матрицы. Олигонуклеотиды легко синтезируют с использованием способов, известных в данной области, таких как способ, описанный в публикации Crea et al., Proc. Nat’l. Acad. Sci. USA, 75:5765 (1978).
ДНК-матрицу создают с помощью таких векторов, которые получены либо из векторов на основе бактериофага M13 (подходящими являются коммерчески доступные векторы M13mp18 и M13mp19), либо из векторов, которые содержат участок начала репликации однонитевого фага, как описано в публикации Viera et al., Meth. Enzymol., 153:3 (1987). Таким образом, ДНК, которую необходимо подвергнуть мутациям, можно встроить в один из таких векторов, чтобы создать однонитевую матрицу. Получение однонитевой матрицы описано в разделах 4.21-4.41 Sambrook et al., выше.
Чтобы изменить нативную последовательность ДНК, олигонуклеотид гибридизуют с однонитевой матрицей в подходящих условиях гибридизации. Затем добавляют полимеризующий ДНК фермент, обычно ДНК-полимеразу T7 или фрагмент Кленова ДНК-полимеразы I, чтобы синтезировать комплементарную нить матрицы, используя олигонуклеотид в качестве праймера для синтеза. Гетеродуплексную молекулу образуют таким образом, что одна нить ДНК кодирует мутантную форму гена 1, а другая нить (исходная матрица) кодирует нативную неизмененную последовательность гена 1. Такой гетеродуплексной молекулой затем трансформируют подходящую клетку-хозяина, обычно прокариотическую, такую как E. coli JM101. После выращивания клеток их помещают на чашки с агарозой и проводят скрининг с использованием олигонуклеотидного праймера, радиоактивно меченного 32-фосфатом, чтобы идентифицировать бактериальные колонии, которые содержат мутантную ДНК.
Описанный непосредственно выше способ может быть модифицирован так, чтобы создать гомодуплексную молекулу, в которой обе нити плазмиды содержат мутацию(ии). Модификации заключаются в следующем: однонитевой олигонуклеотид отжигают с однонитевой матрицей, как описано выше. Смесь трех дезоксирибонуклеотидов, дезоксирибоаденозина (dATP), дезоксирибогуанозина (dGTP) и дезоксириботимидина (dTT), объединяют с модифицированным тиодезоксирибоцитозином, названным dCTP-(aS) (который может быть получен от Amersham). Такую смесь добавляют к комплексу матрица-олигонуклеотид. После добавления ДНК-полимеразы к данной смеси создают нить ДНК, идентичную матрице, за исключением мутированных оснований. Кроме того, такая новая нить ДНК будет содержать dCTP-(aS) вместо dCTP, который служит для ее защиты от расщепления эндонуклеазами рестрикции. После того как в матричной нити двунитевого гетеродуплекса делают одноцепочечный разрыв соответствующим ферментом рестрикции, матричную нить можно расщепить нуклеазой ExoIII или другой подходящей нуклеазой в другой области, отличной от области, содержащей сайт(сайты), которые необходимо подвергнуть мутациям. Затем реакцию останавливают, чтобы оставить молекулу, которая является однонитевой только частично. Затем образуют полный двунитевой гомодуплекс ДНК, используя ДНК-полимеразу в присутствии всех четырех дезоксирибонуклеотидтрифосфатов, АТФ и ДНК-лигазы. Такой гомодуплексной молекулой трансформируют подходящую клетку-хозяина.
Как указано ранее, последовательность набора олигонуклеотидов имеет достаточную длину, чтобы гибридизоваться с матричной нуклеиновой кислотой, а также, но не обязательно, может содержать сайты рестрикции. Матрица ДНК может быть создана с помощью таких векторов, которые получены либо из векторов на основе бактериофага M13, либо из векторов, которые содержат участок начала репликации однонитевого фага, как описано в публикации Viera et al., Meth. Enzymol., 153:3 (1987). Таким образом, ДНК, которую необходимо подвергнуть мутациям, должна быть встроена в один из таких векторов, чтобы создать однонитевую матрицу. Получение однонитевой матрицы описано в разделах 4.21-4.41 Sambrook et al., выше.
Согласно другому способу библиотека может быть создана благодаря получению наборов выше и ниже расположенных олигонуклеотидов, причем каждый набор имеет множество олигонуклеотидов с разными последовательностями, а разные последовательности определяются наборами кодонов, представленными в последовательности олигонуклеотидов. Наборы выше и ниже расположенных олигонуклеотидов, наряду с последовательностью матричной нуклеиновой кислоты вариабельного домена, можно использовать в полимеразной цепной реакции, чтобы создать «библиотеку» продуктов ПЦР. Продукты ПЦР могут быть названы «кассетами нуклеиновых кислот», так как они могут быть слиты с другими родственными или неродственными последовательностями нуклеиновых кислот, например, для белков оболочки вируса и доменов димеризации, с использованием разработанных способов молекулярной биологии.
Последовательность праймеров ПЦР включает один или более сконструированных наборов кодонов для доступных для растворителя и имеющих высокое разнообразие положений в гипервариабельной области. Как описано выше, набор кодонов представляет собой набор разных триплетных нуклеотидных последовательностей, используемых для кодирования требуемых вариантов аминокислот. Выбранные антитела, которые удовлетворяют требуемым критериям, которые отобраны на соответствующих стадиях скрининга/селекции, могут быть выделены и клонированы с использованием стандартных способов получения рекомбинантов.
B. Получение рекомбинантов
Изобретение также относится к выделенной нуклеиновой кислоте, кодирующей антитела к PD-L1, векторам и клеткам-хозяевам, содержащим такую нуклеиновую кислоту, и способам рекомбинации для получения антитела.
Для рекомбинантного получения антитела выделяют кодирующую его нуклеиновую кислоту и встраивают в реплицируемый вектор для дальнейшего клонирования (амплификации ДНК) или для экспрессии. ДНК, кодирующую моноклональное антитело, легко выделяют и секвенируют, используя обычные способы (например, используя олигонуклеотидные зонды, которые способны специфично связываться с генами, кодирующими тяжелые и легкие цепи антитела). Имеется множество подходящих векторов. Выбор вектора отчасти зависит от используемой клетки-хозяина. Как правило, предпочтительные клетки-хозяева имеют либо прокариотическое, либо эукариотическое (обычно от млекопитающих) происхождение.
1. Получение антител в прокариотических клетках
a) Конструирование векторов
Полинуклеотидные последовательности, кодирующие полипептидные компоненты антител согласно изобретению, могут быть получены с использованием стандартных способов рекомбинации. Требуемые полинуклеотидные последовательности могут быть выделены и секвенированы из продуцирующих антитела клеток, таких как клетки гибридомы. Альтернативно, полинуклеотиды могут быть синтезированы с использованием синтезатора нуклеотидов или способов ПЦР. После получения последовательности кодирующие полипептиды встраивают в рекомбинантный вектор, способный реплицироваться и экспрессировать гетерологичные полинуклеотиды в прокариотических хозяевах. Множество векторов, которые доступны и известны в данной области, можно использовать для целей настоящего изобретения. Отбор подходящего вектора, главным образом, будет зависеть от размера нуклеиновых кислот, встраиваемых в вектор, и конкретной клетки-хозяина, которую необходимо трансформировать вектором. Каждый вектор содержит различные компоненты, в зависимости от его функции (амплификация или экспрессия гетерологичного полинуклеотида, или и то и другое) и его совместимости с конкретной клеткой-хозяином, в которой он находится. Компоненты вектора обычно включают, без ограничения: участок начала репликации, маркерный ген для селекции, промотор, участок связывания с рибосомой (RBS), сигнальную последовательность, вставку гетерологичной нуклеиновой кислоты и последовательность терминации транскрипции.
Как правило, плазмидные векторы, содержащие репликон и регуляторные последовательности, которые происходят от вида, совместимого с клеткой-хозяином, используют с такими хозяевами. Вектор обычно несет сайт репликации, а также маркерные последовательности, которые способны обеспечивать фенотипическую селекцию в трансформированных клетках. Например, E. coli обычно трансформируют, используя pBR322, плазмиду, получаемую из вида E. coli. pBR322 содержит гены, кодирующие резистентность к ампициллину (Amp) и тетрациклину (Tet), и поэтому обеспечивает простые способы идентификации трансформированных клеток. pBR322, ее производные или другие плазмиды микроорганизмов или бактериофаги также могут содержать или могут быть модифицированы так, чтобы они содержали промоторы, которые могут быть использованы микроорганизмом для экспрессии эндогенных белков. Примеры производных pBR322, используемых для экспрессии конкретных антител, подробно описаны Carter et al. в патенте США № 5648237.
Кроме того, фаговые векторы, содержащие репликон и регуляторные последовательности, которые совместимы с микроорганизмом-хозяином, могут быть использованы в качестве трансформирующих векторов для таких хозяев. Например, бактериофаг, такой как GEM.TM.-11, может быть использован для получения рекомбинантного вектора, который можно использовать для трансформации чувствительных клеток-хозяев, таких как E. coli LE392.
Экспрессирующий вектор согласно изобретению может содержать две или более пар промотор-цистрон, каждая из которых кодирует полипептидные компоненты. Промотор представляет собой нетранслируемую регуляторную последовательность, расположенную выше (5’) от цистрона, которая модулирует его экспрессию. Прокариотические промоторы обычно делят на два класса, индуцируемые и конститутивные. Индуцируемым промотором является промотор, который инициирует повышенные уровни транскрипции цистрона, находящегося под его контролем, в ответ на изменения условий культивирования, например, присутствие или отсутствие питательного вещества или изменение температуры.
Хорошо известно большое количество промоторов, узнаваемых различными возможными клетками-хозяевами. Выбранный промотор может быть функционально связан с ДНК цистрона, кодирующей легкую или тяжелую цепь, посредством извлечения промотора из исходной ДНК с помощью расщепления ферментами рестрикции и встраивания выделенной промоторной последовательности в вектор согласно изобретению. Как нативную промоторную последовательность, так и многие гетерологичные промоторы можно использовать для управления амплификацией и/или экспрессией генов-мишеней. В некоторых вариантах осуществления изобретения используют гетерологичные промоторы, поскольку они обычно обеспечивают более высокую транскрипцию и более высокие уровни экспрессированного гена-мишени по сравнению с нативным промотором полипептида-мишени.
Промоторы, подходящие для использования в случае прокариотических хозяев, включают промотор PhoA, промоторные системы β-лактамазы и лактозы, промоторную систему триптофана (trp) и гибридные промоторы, такие как промотор tac или trc. Однако подходящими также являются и другие промоторы, которые являются функциональными в бактериях (такие как другие известные бактериальные или фаговые промоторы). Их нуклеотидные последовательности опубликованы, поэтому специалист может лигировать их оперативно с цистронами, кодирующими легкие и тяжелые цепи мишени (Siebenlist et al. (1980) Cell 20: 269), используя линкеры или адапторы, чтобы получить любые требуемые сайты рестрикции.
В одном аспекте каждый цистрон в рекомбинантном векторе содержит компонент в виде последовательности сигнала секреции, который управляет перемещением экспрессированных полипептидов через мембрану. Как правило, сигнальная последовательность может быть компонентом вектора, или она может быть частью ДНК полипептида-мишени, которую встраивают в вектор. Сигнальная последовательность, выбранная для цели настоящего изобретения, должна представлять собой последовательность, которая узнается и процессируется (т.е. отщепляется сигнальной пептидазой) в клетке-хозяине. Для прокариотических клеток-хозяев, которые не узнают и не процессируют сигнальные последовательности, нативные по отношению к гетерологичным полипептидам, сигнальную последовательность заменяют выбранной прокариотической сигнальной последовательностью, например, из группы, состоящей из лидеров щелочной фосфатазы, пенициллиназы, Ipp или термостабильного энтеротоксина II (STII), LamB, PhoE, PeIB, OmpA и MBP. В одном варианте осуществления изобретения сигнальными последовательностями, используемыми в обоих цистронах системы экспрессии, являются сигнальные последовательности STII или их варианты.
В другом аспекте продуцирование иммуноглобулинов согласно изобретению может происходить в цитоплазме клетки-хозяина, и поэтому не требуется присутствия сигнальных последовательностей секреции в каждом цистроне. В этом отношении легкие и тяжелые цепи иммуноглобулинов экспрессируются, подвергаются фолдингу и сборке с образованием функциональных иммуноглобулинов в цитоплазме. Некоторые штаммы-хозяева (например, штаммы E. coli trxB-) обеспечивают условия в цитоплазме, которые благоприятны для образования дисульфидной связи, таким образом обеспечивая правильный фолдинг и сборку экспрессированных субъединиц белка. Proba and Pluckthun Gene, 159:203 (1995).
Настоящее изобретение относится к системе экспрессии, в которой количественное соотношение экспрессированных полипептидных компонентов можно модулировать, чтобы максимизировать выход секретированных и правильно собранных антител согласно изобретению. Такое модулирование осуществляют, по меньшей мере частично, благодаря одновременному модулированию интенсивности трансляции полипептидных компонентов. Один из способов модулирования интенсивности трансляции описан Simmons et al. в патенте США № 5840523. В способе используют варианты области инициации трансляции (TIR) в цистроне. Для данной TIR может быть создана серия вариантов аминокислотных последовательностей или последовательностей нуклеиновых кислот с определенным диапазоном интенсивностей трансляции, таким образом обеспечивая удобные средства регулирования указанного фактора для получения требуемого уровня экспрессии конкретной цепи. Варианты TIR могут быть созданы обычными способами мутагенеза, которые приводят к изменениям кодонов, которые могут изменять аминокислотную последовательность, хотя предпочтительными являются молчащие изменения в нуклеотидной последовательности. Изменения в TIR могут включать, например, изменения количества или расположения последовательностей Шайна-Далгарно наряду с изменениями сигнальной последовательности. Одним из способов создания мутантных сигнальных последовательностей является создание «банка кодонов» в начале кодирующей последовательности, который не изменяет аминокислотную последовательность сигнальной последовательности (т.е. изменения являются молчащими). Это может быть осуществлено за счет изменения третьего положения нуклеотида в каждом кодоне; кроме того, некоторые аминокислоты, такие как лейцин, серин и аргинин, имеют множественные первые и вторые положения, которые могут дополнительно осложнять создание банка. Такой способ мутагенеза подробно описан в публикации Yansura et al. (1992) METHODS: A Companion to Methods in Enzymol. 4:151-158.
Предпочтительно создают набор векторов с диапазоном интенсивности TIR для каждого цистрона. Такой ограниченный набор обеспечивает сравнение уровней экспрессии каждой цепи, а также выхода требуемых продуктов в виде антител при различных комбинациях силы TIR. Силу TIR можно определить количественным анализом уровня экспрессии репортерного гена, как подробно описано Simmons et al. в патенте США № 5840523. На основании сравнения интенсивности трансляции отбирают требуемые отдельные TIR, которые можно объединять в экспрессирующих векторных конструкциях согласно изобретению.
b) Прокариотические клетки-хозяева.
Прокариотические клетки-хозяева, подходящие для экспрессии антител согласно изобретению, включают Archaebacteria и Eubacteria, такие как грамотрицательные или грамположительные организмы. Примеры применимых бактерий включат Escherichia (например, E. coli), Bacilli (например, B. subtilis), Enterobacteria, виды Pseudomonas (например, P. aeruginosa), Salmonella typhimurium, Serratia marcescans, Klebsiella, Proteus, Shigella, Rhizobia, Vitreoscilla или Paracoccus. В одном варианте осуществления используют грамотрицательные клетки. В одном варианте для изобретения используют клетки E. coli в качестве хозяев. Примеры штаммов E. coli включат штамм W3110 (Bachmann, Cellular and Molecular Biology, vol. 2 (Washington, D.C: American Society for Microbiology, 1987), pp. 1190-1219; ATCC депозит № 27325) и его производные, включая штамм 33D3, имеющий генотип W3110 ΔfhuA (ΔtonA)ptr3 lac Ig lacL8 ΔompTΔ(nmpc-fepE) degP41 kanR (патент США № 5639635). Также подходящими являются другие штаммы и их производные, такие как E. coli 294 (ATCC 31446), E. coli B, E. coli 1776 (ATCC 31537) и E. coli RV308 (ATCC 31608). Приведенные примеры являются иллюстративными, а не ограничивающими. Способы конструирования производных любой из указанных выше бактерий, имеющих определенные генотипы, известны в данной области и описаны, например, в публикации Bass et al., Proteins, 8:309-314 (1990). Как правило, необходимо отбирать подходящие бактерии, принимая во внимание способность репликона к репликации в клетках бактерии. Например, E. coli, Serratia или виды Salmonella могут подходить для использования в качестве хозяина, когда используют хорошо известные плазмиды, такие как pBR322, pBR325, pACYC177 или pKN410, для обеспечения репликона.
Обычно клетка-хозяин должна секретировать минимальные количества протеолитических ферментов, и желательно могут быть введены дополнительные ингибиторы протеаз в культуру клеток.
c) Продукция антител
Клетки-хозяева трансформируют описанными выше экспрессирующими векторами и культивирует в подходящей питательной среде, модифицированной соответствующим образом для индукции промоторов, селекции трансформантов или амплификации генов, кодирующих требуемые последовательности. Трансформация означает введение ДНК в прокариотического хозяина так, чтобы ДНК была реплицируемой либо в виде внехромосомного элемента, либо в виде интегрированного в хромосому элемента. В зависимости от используемой клетки-хозяина трансформацию осуществляют, используя стандартные способы, подходящие для таких клеток. Обработку кальцием, используя хлорид кальция, обычно применяют в случае бактериальных клеток, которые имеют прочные барьеры в виде клеточных стенок. В другом способе трансформации используют полиэтиленгликоль/ДМСО. В еще одном способе используют электропорацию.
Прокариотические клетки, используемые для получения антител согласно изобретению, выращивают в средах, известных в данной области и подходящих для культивирования выбранных клеток-хозяев. Примеры подходящих сред включают бульон Луриа (LB) плюс необходимые добавки питательных веществ. В некоторых вариантах осуществления среда также содержит агент для селекции, выбранный на основе конструкции экспрессирующего вектора, избирательно позволяющий расти прокариотическим клеткам, содержащим экспрессирующий вектор. Например, в среду добавляют ампициллин для роста клеток, экспрессирующих ген резистентности к ампициллину.
Любые другие необходимые добавки, кроме источников углерода, азота и неорганического фосфата, также могут быть включены в подходящих концентрациях посредством введения по отдельности или в виде смеси с другой добавкой или средой, такой как комплексный источник азота. Необязательно культуральная среда может содержать один или более восстановителей, выбранных из группы, состоящей из глутатиона, цистеина, цистамина, тиогликоллата, дитиоэритритола и дитиотреитола.
Прокариотические клетки-хозяева культивируют при подходящих температурах. Для роста E. coli, например, предпочтительная температура находится в диапазоне примерно от 20°C до примерно 39°C, более предпочтительно примерно от 25°C до примерно 37°C, еще более предпочтительно примерно 30°C. Значение pH среды может быть любым в диапазоне pH примерно от 5 до примерно 9, главным образом, в зависимости от организма-хозяина. Для E. coli pH предпочтительно составляет примерно от 6,8 до примерно 7,4 и более предпочтительно примерно 7,0.
Если в экспрессирующем векторе согласно изобретению используют индуцируемый промотор, то экспрессию белка индуцируют в условиях, подходящих для активации промотора. В одном аспекте изобретения используют промоторы PhoA для регулирования транскрипции полипептидов. Соответственно, трансформированные клетки-хозяева культивируют в ограниченной по фосфату среде для индукции. Предпочтительно, ограниченной по фосфату средой является среда C.R.A.P (см., например, Simmons et al., J. Immunol. Methods (2002), 263:133-147). Можно использовать множество других индукторов в соответствии с используемой векторной конструкцией, как известно в данной области.
Экспрессированные белки антител согласно настоящему изобретению секретируются и извлекаются из периплазмы клеток-хозяев. Извлечение белка обычно заключается в разрушении микроорганизма, как правило, такими способами, как осмотический шок, обработка ультразвуком или лизис. После разрушения клеток продукты распада клеток или целые клетки могут быть удалены центрифугированием или фильтрованием. Белки могут быть дополнительно очищены, например, методом аффинной хроматографии на смоле. Альтернативно, белки могут быть транспортированы в культуральную среду и выделены из нее. Клетки могут быть удалены из культуры, а супернатант культуры может быть отфильтрован и сконцентрирован для дополнительной очистки полученных белков. Экспрессированные полипептиды могут быть затем выделены и идентифицированы с использованием широко известных способов, таких как электрофорез в полиакриламидном геле (PAGE) и Вестерн-блот-анализ.
Альтернативно, продуцирование антител осуществляют в больших количествах способом ферментации. Доступны различные крупномасштабные способы ферментации с подпиткой для получения рекомбинантных белков. Крупномасштабные ферментеры имеют емкость, по меньшей мере, 1000 литров, предпочтительно имеют емкость примерно от 1000 до 100000 литров. В таких ферментерах используют лопастные мешалки для распределения кислорода и питательных веществ, особенно глюкозы (предпочтительный источник углерода/энергии). Ферментация в малом масштабе обычно относится к ферментации в ферментере, объемная емкость которого составляет не более чем примерно 100 литров и может составлять примерно от 1 литра до примерно 100 литров.
В ходе процесса ферментации индукцию экспрессии белка обычно инициируют после того, как клетки были выращены в подходящих условиях до требуемой плотности, например, до OD550, составляющей примерно 180-220, на такой стадии клетки находятся в ранней стационарной фазе. Можно использовать множество индукторов в соответствии с используемой векторной конструкцией, которые известны в данной области и описаны выше. Клетки можно выращивать в течение более коротких периодов перед индукцией. Клетки обычно индуцируют примерно в течение 12-50 часов, хотя можно использовать более длительные или более короткие периоды времени индукции.
Чтобы повысить выход продукции и качество антител согласно изобретению, можно модифицировать различные условия ферментации. Например, чтобы улучшить правильную сборку и фолдинг секретируемых полипептидов антител, можно использовать дополнительные векторы, сверхэкспрессирующие белки-шапероны, такие как белки Dsb (DsbA, DsbB, DsbC, DsbD и/или DsbG) или FkpA (пептидилпролил-цис,транс-изомераза с активностью шаперона) для котрансфекции прокариотических клеток-хозяев. Показано, что белки-шапероны облегчают правильный фолдинг и растворимость гетерологичных белков, продуцируемых в бактериальных клетках-хозяевах. Chen et al. (199) J Bio Chem 274:19601-19605; Georgiou et al., патент США № 6083715; Georgiou et al., патент США № 6027888; Bothmann and Pluckthun (2000) J. Biol. Chem. 275:17100-17105; Ramm and Pluckthun (2000) J. Biol. Chem. 275:17106-17113; Arie et al. (2001) Mol. Microbiol. 39:199-210.
Чтобы минимизировать протеолиз экспрессированных гетерологичных белков (особенно белков, которые являются протеолитически чувствительными), для настоящего изобретения можно использовать некоторые штаммы-хозяева, дефицитные по протеолитическим ферментам. Например, штаммы клеток-хозяев могут быть модифицированы для осуществления генетической(их) мутации(ий) в генах, кодирующих известные бактериальные протеазы, такие как протеаза III, OmpT, DegP, Tsp, протеаза I, протеаза Mi, протеаза V, протеаза VI и их сочетания. Некоторые дефицитные по протеазе штаммы E. coli доступны и описаны, например, в публикациях Joly et al. (1998), выше; Georgiou et al., патент США № 5264365; Georgiou et al., патент США № 5508192; Hara et al., Microbial Drug Resistance, 2:63-72 (1996).
Штаммы E. coli, дефицитные по протеолитическим ферментам и трансформированные плазмидами, сверхэкспрессирующими один или более белков-шаперонов, могут быть использованы в качестве клеток-хозяев в системе экспрессии, кодирующей антитела согласно изобретению.
d) Очистка антител
Белок антитела, полученный согласно изобретению, дополнительно очищают, чтобы получить препараты, которые по существу являются гомогенными, для дальнейших анализов и применений. Можно использовать стандартные способы очистки белков, известные в данной области. Примерами подходящих способов очистки являются следующие способы: фракционирование на иммуноаффинных или ионообменных колонках, преципитация этанолом, обращенно-фазная ВЭЖХ, хроматография на диоксиде кремния или на катионообменной смоле, такой как, DEAE, хроматофокусировка, SDS-PAGE, преципитация сульфатом аммония и гель-фильтрация с использованием, например, сефадекса G-75.
В одном аспекте белок A, иммобилизованный на твердой фазе, используют для иммуноаффинной очистки продуктов в виде полноразмерных антител согласно изобретению. Белок A представляет собой белок клеточной стенки с молекулярной массой 41 кД из Staphylococcus aureus, который связывается с высокой аффинностью с областью Fc антител. Lindmark et al. (1983) J. Immunol. Meth. 62:1-13. Твердой фазой, на которой иммобилизуют белок A, предпочтительно является колонка, имеющая стеклянную поверхность или поверхность из диоксида кремния, более предпочтительно стеклянная колонка с контролируемым размером пор или колонка с кремниевой кислотой. В некоторых применениях колонка покрыта реагентом, таким как глицерин, чтобы попытаться предотвратить неспецифичную адгезию загрязняющих веществ. Затем твердую фазу промывают, чтобы удалить примеси, неспецифично связанные с твердой фазой. Наконец, представляющее интерес антитело извлекают с твердой фазы элюированием.
2. Продуцирование антител в эукариотических клетках
Для эукариотической экспрессии компоненты вектора обычно включают, без ограничения, один или более из указанных ниже компонентов: сигнальную последовательность, участок начала репликации, один или более маркерных генов, энхансерный элемент, промотор и последовательность терминации транскрипции.
a) Компонент - сигнальная последовательность
Вектор для использования в эукариотическом хозяине также может содержать вставку, которая кодирует сигнальную последовательность или другой полипептид, имеющий специфичный сайт расщепления на N-конце зрелого белка или полипептида. Выбранная гетерологичная сигнальная последовательность предпочтительно представляет собой последовательность, которая узнается и процессируется (т.е. отщепляется сигнальной пептидазой) клеткой-хозяином. Для экспрессии в клетках млекопитающих имеются сигнальные последовательности млекопитающих, а также вирусные лидеры секреции, например, сигнал простого герпеса gD.
ДНК для такой области предшественника лигируют в рамке считывания с ДНК, кодирующей антитела согласно изобретению.
b) Компонент – участок начала репликации
Как правило, компонент, представленный участком начала репликации, не является необходимым для экспрессирующих векторов млекопитающих (источник SV40 обычно можно использовать только потому, что он содержит ранний промотор).
c) Компонент - ген для селекции
Экспрессирующие и клонирующие векторы могут содержать ген для селекции, также называемый селектируемым маркером. Обычно селектируемые гены кодируют белки, которые (a) придают резистентность к антибиотикам или другим токсинам, например, к ампициллину, неомицину, метотрексату или тетрациклину, (b) комплементируют ауксотрофные дефициты или (c) снабжают необходимыми питательными веществами, не доступными из сложных сред, например ген, кодирующий D-аланинрацемазу для Bacilli.
В одном примере схемы селекции используют лекарственное средство для задержки роста клетки-хозяина. Те клетки, которые успешно трансформированы гетерологичным геном, продуцируют белок, придающий резистентность к лекарственному средству, и таким образом выживают в режиме селекции. В примерах такой доминантной селекции используют лекарственные средства неомицин, микофеноловую кислоту и гигромицин.
Другим примером подходящих селектируемых маркеров для клеток млекопитающих являются маркеры, которые обеспечивают возможность идентификации клеток, компетентных в отношении поглощения нуклеиновой кислоты, кодирующей антитела согласно изобретению, такие как гены DHFR, тимидинкиназы, металлотионеина-I и -II, предпочтительно гены металлотионеинов приматов, аденозиндезаминазы, орнитиндекарбоксилазы и т.д.
Например, клетки, трансформированные селектируемым геном DHFR, сначала идентифицируют культивированием всех трансформантов в культуральной среде, которая содержит метотрексат (Mtx), конкурентный антагонист DHFR. Подходящей клеткой-хозяином при использовании DHFR дикого типа является линия клеток яичника китайского хомячка (CHO), дефицитных по активности DHFR (например, ATCC CRL-9096).
Альтернативно, клетки-хозяева (особенно хозяева дикого типа, которые содержат эндогенную DHFR), трансформированные или котрансфицированные последовательностями ДНК, кодирующими антитело, белок DHFR дикого типа и другой селектируемый маркер, такой как аминогликозид-3’-фосфотрансфераза (APH), можно отбирать по росту клеток в среде, содержащей агент для селекции, соответствующий селектируемому маркеру, такой как аминогликозидный антибиотик, например, канамицин, неомицин или G418. См. патент США № 4965199.
d) Промоторный компонент
Экспрессирующие и клонирующие векторы обычно содержат промотор, который распознается организмом-хозяином и функционально связан с нуклеиновой кислотой, кодирующей требуемые последовательности антител. Практически все эукариотические гены имеют AT-богатую область, расположенную примерно на 25-30 оснований выше сайта инициации транскрипции. Другой последовательностью, обнаруживаемой на 70-80 оснований выше страта транскрипции многих генов, является область CNCAAT, где N может быть любым нуклеотидом. На 3’-конце большинства эукариотических генов находится последовательность AATAAA, которая может быть сигналом для добавления поли-A-хвоста к 3’-концу кодирующей последовательности. Все такие последовательности могут быть встроены в эукариотические экспрессирующие векторы.
Другими промоторами, подходящими для применения в прокариотических хозяевах, являются промотор phoA, промоторные системы лактамазы и лактозы, промотор щелочной фосфатазы, промоторная система триптофана (trp) и гибридные промоторы, такие как промотор tac. Однако подходящими являются и другие известные бактериальные промоторы. Промоторы для применения в бактериальных системах также будут содержать последовательность Шайна-Далгарно (S.D.), функционально связанную с ДНК, кодирующей полипептид антитела.
Транскрипция полипептидов антител с векторов в клетках-хозяевах млекопитающих регулируется, например, промоторами, полученными из геномов вирусов, таких как вирус полиомы, поксвирус птиц, аденовирус (такой как аденовирус 2), вирус бычьей папилломы, вирус саркомы птиц, цитомегаловирус, ретровирус, вирус гепатита-B и наиболее предпочтительно вирус обезьян 40 (SV40), гетерологичными промоторами млекопитающих, например, промотором актина или промотором иммуноглобулина, промоторами теплового шока, при условии, что такие промоторы совместимы с системами клеток-хозяев.
Ранний и поздний промоторы вируса SV40 легко получают в виде рестрикционного фрагмента SV40, который также содержит участок начала репликации вируса SV40. Немедленно ранний промотор цитомегаловируса человека легко получают в виде фрагмента рестрикции HindIII E. Система для экспрессии ДНК в хозяевах-млекопитающих с использованием вируса бычьей папилломы в качестве вектора описана в патенте США № 4419446. Модификация такой системы описана в патенте США № 4601978. См. также Reyes et al., Nature 297:598-601 (1982) в отношении экспрессии кДНК β-интерферона человека в мышиных клетках под контролем промотора тимидинкиназы из вируса простого герпеса. Альтернативно, в качестве промотора можно использовать длинный концевой повтор вируса саркомы Рауса.
e) Компонент - энхансерный элемент
Транскрипцию ДНК, кодирующей антитела согласно настоящему изобретению, высшими эукариотами часто увеличивают встраиванием последовательности энхансера в вектор. В настоящее время известно много энхансерных последовательностей генов млекопитающих (глобина, эластазы, альбумина, α-фетопротеина и инсулина). Однако обычно используют энхансер из вируса эукариотических клеток. Примеры включают энхансер SV40, расположенный с поздней стороны от участка начала репликации (100-270 п.н.), энхансер раннего промотора цитомегаловируса, энхансер вируса полиомы, расположенный с поздней стороны от участка начала репликации, и аденовирусные энхансеры. См. также Yaniv, Nature 297:17-18 (1982) в отношении усиливающих элементов для активации эукариотических промоторов. Энхансер может быть сплайсирован в вектор в положении 5’- или 3’- по отношению к последовательности, кодирующей антитело, но предпочтительно расположен в сайте с 5’-стороны от промотора.
f) Компонент для терминации транскрипции
Экспрессирующие векторы, используемые в эукариотических клетках-хозяевах (дрожжей, грибов, насекомых, растений, животных, человека или нуклеированных клетках из других многоклеточных организмов), также могут содержать последовательности, необходимые для терминации транскрипции и для стабилизации мРНК. Такие последовательности обычно доступны из 5’- и иногда 3’-нетранслируемых областей эукариотических или вирусных ДНК или кДНК. Указанные области содержат нуклеотидные участки, транскрибируемые в виде полиаденилированных фрагментов в нетранслируемой части мРНК, кодирующей антитело. Одним из применимых компонентов для терминации транскрипции является область полиаденилирования бычьего гормона роста. См. WO94/11026 и описанные в заявке экспрессирующие векторы.
g) Селекция и трансформация клеток-хозяев
Подходящими клетками-хозяевами для клонирования или экспрессии ДНК в векторах согласно изобретению являются клетки высших эукариот, описанные в настоящей публикации, включая клетки-хозяева позвоночных. Размножение клеток позвоночных в культуре (культуре ткани) стало рутинной процедурой. Примерами применимых линий клеток-хозяев млекопитающих являются линия клеток почки обезьяны CV1, трансформированных SV40 (COS-7, ATCC CRL 1651); линия клеток эмбриональной почки человека (клетки 293 или 293, субклонированные для роста в суспензионной культуре, Graham et al., J. Gen. Virol. 36:59 (1977)); клетки почки сирийского хомячка (BHK, ATCC CCL 10); клетки яичника китайского хомячка/-DHFR (CHO, Urlaub et al., Proc. Natl. Acad. Sci. USA 77:4216 (1980)); клетки Сертоли мышей (TM4, Mather, Biol. Reprod. 23:243-251 (1980); клетки почки обезьяны (CV1 ATCC CCL 70); клетки почки африканской зеленой обезьяны (VERO-76, ATCC CRL-1587); клетки карциномы шейки матки человека (HELA, ATCC CCL 2); клетки почки собаки (MDCK, ATCC CCL 34); клетки печени крыс Buffalo (BRL 3A, ATCC CRL 1442); клетки легкого человека (W138, ATCC CCL 75); клетки печени человека (Hep G2, HB 8065); клетки опухоли молочной железы мыши (MMT 060562, ATCC CCL51); клетки TRI (Mather et al., Annals N.Y. Acad. Sci. 383:44-68 (1982)); клетки MRC 5; клетки FS4; и линия клеток гепатомы человека (Hep G2).
Клетки-хозяева трансформируют описанными выше экспрессирующими или клонирующими векторами для продукции антител и культивируют в обычных питательных средах, соответствующим образом модифицированных для индукции промоторов, селекции трансформантов или амплификации генов, кодирующих требуемые последовательности.
h) Культивирование клеток-хозяев
Клетки-хозяева, используемые для получения антитела согласно изобретению, можно культивировать во многих средах. Коммерчески доступные среды, такие как среда Хама F10 (Sigma), минимальная питательная среда ((MEM), (Sigma), RPMI-1640 (Sigma) и модифицированная по Дульбекко среда Игла ((DMEM), Sigma), подходят для культивирования клеток-хозяев. Кроме того, любую из сред, описанных в публикациях Ham et al., Meth. Enz. 58:44 (1979), Barnes et al., Anal. Biochem. 102:255 (1980), патентах США №№ 4767704, 4657866, 4927762, 4560655 или 5122469, WO 90/03430, WO 87/00195 или в патенте США Re. 30985, можно использовать в качестве культуральной среды для клеток-хозяев. Любая из указанных сред может быть дополнена при необходимости гормонами и/или другими факторами роста (такими как инсулин, трансферрин или эпидермальный фактор роста), солями (такими как хлориды и фосфаты натрия, кальция, магния), буферами (такими как HEPES), нуклеотидами (такими как аденозин и тимидин), антибиотиками (такими как лекарственное средство GENTAMYCIN™), микроэлементами (определяемыми как неорганические соединения, обычно присутствующие в конечных концентрациях в микромолярном диапазоне) и глюкозой или эквивалентным источником энергии. Любые другие необходимые добавки также могут быть включены в соответствующих концентрациях, которые могут быть известны специалистам в данной области. Условия культивирования, такие как температура, pH и тому подобное, представляют собой условия, используемые ранее в случае клеток-хозяев, отобранных для экспрессии, и условия будут известны специалисту в данной области.
i) Очистка антител
При использовании рекомбинантных способов антитело может быть получено внутриклеточно, в периплазматическом пространстве или непосредственно секретировано в среду. Если антитело получают внутриклеточно, то в качестве первой стадии частицы продуктов распада, либо клетки-хозяева, либо лизированные фрагменты извлекают центрифугированием или ультрацентрифугированием. Carter et al. (Bio/Technology 10:163-167 (1992)) описали способ выделения антител, которые секретируются в периплазматическое пространство E. coli. Кратко, пастообразную массу клеток размораживают в присутствии ацетата натрия (pH 3,5), EDTA и фенилметилсульфонилфторида (PMSF) в течение примерно 30 минут. Продукты распада клеток могут быть удалены центрифугированием. Когда антитело секретируется в среду, супернатанты из таких экспрессирующих систем обычно сначала концентрируют, используя коммерчески доступный фильтр для концентрирования белков, например, устройство для ультрафильтрации Amicon или Millipore Pellicon. На любой из указанных выше стадий может быть включен ингибитор протеазы, такой как PMSF, чтобы ингибировать протеолиз, и могут быть включены антибиотики, чтобы предотвратить рост случайных примесей.
Композиция антител, полученных из клеток, может быть очищена например, с использованием хроматографии на гидроксилапатите, гель-электрофореза, диализа и аффинной хроматографии, причем аффинная хроматография является предпочтительным способом очистки. Пригодность белка A в качестве аффинного лиганда зависит от вида и изотипа любого Fc-домена иммуноглобулина, который присутствует в антителе. Белок A можно использовать для очистки антител, которые основаны на иммуноглобулинах человека, содержащих тяжелые цепи 1, 2 или 4 (Lindmark et al., J. Immunol. Meth. 62:1-13 (1983)). Белок G рекомендуется для всех мышиных изотипов и для 3 человека (Guss et al., EMBO J. 5:1567-1575 (1986)). Матрицей, с которой связывают аффинный лиганд, наиболее часто является агароза, но имеются и другие матрицы. Механически стабильные матрицы, такие как стекло с контролируемым размером пор или поли(стиролдивинил)бензол, обеспечивают возможность более высоких скоростей потока и более коротких периодов времени обработки, чем можно достичь в случае агарозы. Если антитело содержит домен CH3, то для очистки пригодной является смола Bakerbond ABX™ (J. T. Baker, Phillipsburg, NJ). Также доступны другие способы очистки белка, такие как фракционирование на ионообменной колонке, преципитация этанолом, обращенно-фазная ВЭЖХ, хроматография на диоксиде кремния, хроматография на гепарин-SEPHAROSE™, хроматография на анионообменной или катионообменной смоле (например, на колонке с полиаспарагиновой кислотой), хроматофокусировка, SDS-PAGE и преципитация сульфатом аммония, в зависимости от антитела, которое необходимо извлечь.
После любой стадии (стадий) предварительной очистки смесь, содержащую представляющее интерес антитело и примеси, можно подвергнуть хроматографии, основанной на гидрофобном взаимодействии при низком pH, используя буфер для элюирования со значением pH в диапазоне примерно 2,5-4,5, предпочтительно осуществляемой при низких концентрациях соли (например, 0-0,25М соли).
C. Получение антител
1) Поликлональные антитела
Поликлональные антитела обычно вырабатываются у животных при многократных подкожных (п/к) или внутрибрюшинных (в/б) инъекциях соответствующего антигена и адъюванта. Может быть полезным конъюгирование соответствующего антигена с белком, который является иммуногенным для иммунизируемого вида, например, с гемоцианином морского блюдечка «замочная скважина» (KLH), сывороточным альбумином, бычьим тиреоглобулином или ингибитором трипсина сои, с использованием бифункционального или дериватизирующего агента, например, сложного эфира малеимидобензоилсульфосукцинимида (конъюгирование через остатки цистеина), N-гидроксисукцинимида (через остатки лизина), глутаральдегида, янтарного ангидрида, SOCl2 или R1N=C=NR, где R и R1 независимо означают низшие алкильные группы. Примеры адъювантов, которые можно использовать, включают полный адъювант Фрейнда и адъювант MPL-TDM (монофосфориллипид A, синтетический дикориномиколат трегалозы). Специалист в данной области может выбрать протокол иммунизации без излишнего экспериментирования.
Животных иммунизируют против антигена, иммуногенных конъюгатов или производных, комбинируя, например, 100 мкг или 5 мкг белка или конъюгата (для кроликов или мышей, соответственно) с 3 объемами полного адъюванта Фрейнда и инъецируя раствор внутрикожно в нескольких местах. Спустя один месяц животных подвергают бустер-иммунизации, используя от 1/5 до 1/10 исходного количества пептида или конъюгата в полном адъюванте Фрейнда, посредством подкожной инъекции в нескольких местах. Через семь-четырнадцать дней у животных берут кровь и анализируют сыворотку в отношении титра антител. Животных подвергают бустер-иммунизации вплоть до выхода титра на плато. Конъюгаты также могут быть получены в культуре рекомбинантных клеток в виде слияний белков. Также агрегирующие агенты, такие как квасцы, подходят для усиления иммунного ответа.
2) Моноклональные антитела
Моноклональные антитела получают из популяции по существу гомогенных антител, т.е. отдельные антитела, составляющие популяцию, являются идентичными, за исключением возможных природных мутаций и/или посттрансляционных модификаций (например, изомеризации, амидирования), которые могут присутствовать в минорных количествах. Таким образом, определение «моноклональное» указывает на характер антитела, не являющегося смесью разных антител.
Например, моноклональные антитела могут быть получены с использованием способа на основе гибридом, впервые описанного в публикации Kohler et al., Nature, 256:495 (1975), или могут быть получены способами на основе рекомбинантной ДНК (патент США № 4816567).
В способе на основе гибридом мышь или другого подходящего животного-хозяина, например хомячка, иммунизируют, как описано выше, чтобы вызвать появление лимфоцитов, которые продуцируют или способны продуцировать антитела, которые будут специфично связываться с белком, используемым для иммунизации. Альтернативно, лимфоциты можно иммунизировать in vitro. Затем лимфоциты сливают с клетками миеломы, используя подходящий агент для слияния, такой как полиэтиленгликоль, с образованием гибридомной клетки (Goding, Monoclonal Antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986)).
Иммунизирующий агент обычно будет содержать антигенный белок или его слитый вариант. Как правило, используют либо лимфоциты периферической крови («PBL»), если требуются клетки человеческой природы, либо используют клетки селезенки или клетки лимфатических узлов, если требуются в качестве источников млекопитающие, отличные от человека. Затем лимфоциты сливают с иммортализованной клеточной линией, используя подходящее средство для слияния, такое как полиэтиленгликоль, с образованием гибридомной клетки. Goding, Monoclonal Antibodies: Principles and Practice, Academic Press (1986), pp. 59-103.
Иммортализованные линии клеток обычно представляют собой трансформированные клетки млекопитающих, в частности, клетки миеломы грызунов, быка или человека. Обычно используют линии клеток миеломы крысы или мыши. Полученные таким образом клетки гибридомы высевают и выращивают в подходящей культуральной среде, которая предпочтительно содержит одно или более веществ, которые ингибируют рост или жизнеспособность не слитых исходных клеток миеломы. Например, если в исходных клетках миеломы отсутствует фермент гипоксантингуанинфосфорибозилтрансфераза (HGPRT или HPRT), то в культуральную среду для гибридом обычно будут включать гипоксантин, аминоптерин и тимидин (среда HAT), и такие вещества предотвращают рост HGPRT-дефицитных клеток.
Предпочтительными иммортализованными клетками миеломы являются клетки, которые эффективно сливаются, поддерживают на стабильно высоком уровне продукцию антител отобранными продуцирующими антитела клетками и чувствительны к среде, такой как среда HAT. Среди таких клеток предпочтительными являются линии клеток миеломы мышей, такие как линии, полученные из опухолей мышей MOPC-21 и MPC-11, доступные от Salk Institute Cell Distribution Center, San Diego, California USA, и клетки SP-2 (и их производные, например, X63-Ag8-653), доступные от Американской коллекции типов культур, Manassas, Virginia USA. Линии клеток миеломы человека и гетеромиеломы мыши-человека также были описаны для получения моноклональных антител человека (Kozbor, J. Immunol., 133:3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., New York, 1987)).
Культуральную среду, в которой выращивают клетки гибридомы, анализируют в отношении продукции моноклональных антител, направленных против антигена. Предпочтительно, специфичность связывания моноклональных антител, продуцируемых клетками гибридомы, можно определить с помощью иммунопреципитации или анализом связывания in vitro, таким как радиоиммуноанализ (РИА) или твердофазный иммуноферментный анализ (ELISA).
Культуральную среду, в которой культивируют клетки гибридомы, можно анализировать в отношении присутствия моноклональных антител, направленных против антигена. Предпочтительно, аффинность и специфичность связывания моноклонального антитела можно определить с помощью иммунопреципитации или анализом связывания in vitro, таким как радиоиммуноанализ (РИА) или твердофазный иммуноферментный анализ (ELISA). Такие способы и анализы известны в данной области. Например, аффинность связывания можно определить анализом по Скэтчарду (Scatchard), как описано в публикации Munson et al., Anal. Biochem., 107:220 (1980).
После идентификации клеток гибридомы, которые продуцируют антитела требуемой специфичности, аффинности и/или активности, клоны могут быть субклонированы способами лимитирующего разведения и выращены стандартными способами (Goding, выше). Подходящие культуральные среды для указанной цели включают, например, среду D-MEM или RPMI-1640. Кроме того, клетки гибридомы могут быть выращены in vivo в виде опухолей у млекопитающего.
Моноклональные антитела, секретируемые подклонами, соответствующим образом отделяют от культуральной среды, асцитной жидкости или сыворотки обычными способами очистки иммуноглобулинов, например, хроматографией с использованием белок A-сефарозы, гидроксилапатита, гель-электрофорезом, диализом или аффинной хроматографией.
Моноклональные антитела также могут быть получены способами на основе рекомбинантной ДНК, такими как способы, описанные в патенте США № 4816567, и как описано выше. ДНК, кодирующую моноклональные антитела, легко выделяют и секвенируют, используя обычные способы (например, используя олигонуклеотидные зонды, которые способны специфично связываться с генами, кодирующими тяжелые и легкие цепи мышиных антител). Клетки гибридомы служат в качестве предпочтительного источника такой ДНК. После выделения ДНК может быть помещена в экспрессирующие векторы, которые затем трансфицируют в клетки-хозяева, такие как клетки E. coli, клетки обезьян COS, клетки яичника китайского хомячка (CHO) или клетки миеломы, которые в ином случае не продуцируют белок иммуноглобулина, чтобы синтезировать моноклональные антитела в таких рекомбинантных клетках-хозяевах. Обзорные статьи, касающиеся рекомбинантной экспрессии в бактериях ДНК, кодирующей антитело, включают Skerra et al, Curr. Opinion in Immunol., 5:256-262 (1993) и Pluckthun, Immunol. Revs. 130:151-188 (1992).
В следующем варианте осуществления антитела могут быть выделены из фаговых библиотек антител, созданных с использованием способа, описанного в публикации McCafferty et al., Nature, 348:552-554 (1990). В публикациях Clackson et al., Nature, 352:624-628 (1991) и Marks et al., J. Mol. Biol., 222:581-597 (1991) описано выделение мышиных и человеческих антител, соответственно, с использованием фаговых библиотек. В последующих публикациях описано получение высоко аффинных (нМ-диапазон) антител человека с помощью перетасовки цепей (Marks et al., Bio/Technology, 10:779-783 (1992)), а также комбинаторной инфекции и рекомбинации in vivo в качестве методики конструирования очень больших фаговых библиотек (Waterhouse et al., Nucl. Acids. Res., 21:2265-2266 (1993)). Таким образом, указанные способы являются приемлемой альтернативой традиционным способам на основе продуцирующих моноклональные антитела гибридом для выделения моноклональных антител.
ДНК также может быть модифицирована, например, подстановкой кодирующей последовательности константных доменов тяжелой и легкой цепей человека вместо гомологичных мышиных последовательностей (патент США № 4816567; Morrison, et al., Proc. Natl. Acad. Sci. USA, 81:6851 (1984)) или ковалентным связыванием с кодирующей иммуноглобулин последовательностью всей или части последовательности, кодирующей неиммуноглобулиновый полипептид. Обычно такими неиммуноглобулиновыми полипептидами заменяют константные домены антитела, или ими заменяют вариабельные домены одного антигенсвязывающего участка антитела, чтобы создать химерное бивалентное антитело, содержащее один антигенсвязывающий участок, обладающий специфичностью по отношению к одному антигену, и другой антигенсвязывающий участок, обладающий специфичностью по отношению к другому антигену.
Моноклональные антитела, описанные в настоящей публикации, могут быть моновалентными, причем получение таких антител хорошо известно в данной области. Например, один из способов заключается в рекомбинантной экспрессии легкой цепи и модифицированной тяжелой цепи иммуноглобулина. Тяжелую цепь обычно укорачивают в любой точке в Fc-области, так чтобы предотвратить поперечное связывание тяжелой цепи. Альтернативно, важные остатки цистеина могут быть заменены другим аминокислотным остатком или делетированы, чтобы предотвратить поперечное связывание. Способы in vitro также являются подходящими для получения моновалентных антител. Конструирование антител для получения их фрагментов, в частности Fab-фрагментов, можно осуществить, используя обычные способы, известные в данной области.
Химерные или гибридные антитела также могут быть получены in vitro с использованием известных способов химического синтеза белков, включая способы с использованием поперечно сшивающих агентов. Например, иммунотоксины могут быть сконструированы с использованием реакции дисульфидного обмена или путем образования тиоэфирной связи. Примеры подходящих реагентов для этой цели включают иминотиолат и метил-4-меркаптобутиримидат.
3) Гуманизированные антитела.
Антитела согласно изобретению могут дополнительно включать гуманизированные или человеческие антитела. Гуманизированные формы антител животных, отличных от человека (например, мышей), представляют собой химерные иммуноглобулины, цепи иммуноглобулинов или их фрагменты (такие как Fv, Fab, Fab’, F(ab’)2 или другие антигенсвязывающие подпоследовательности антител), которые содержат минимальную последовательность, происходящую из не принадлежащего человеку иммуноглобулина. Гуманизированные антитела включают иммуноглобулины человека (реципиентное антитело), в которых остатки из определяющей комплементарность области (CDR) (HVR, как использовано в настоящем описание) реципиента заменены остатками из CDR вида, отличного от человека (донорное антитело), такого как мышь, крыса или кролик, обладающей требуемой специфичностью, аффинностью и емкостью. В некоторых случаях остатки каркаса Fv иммуноглобулина человека заменяют соответствующими не принадлежащими человеку остатками. Гуманизированные антитела также могут содержать остатки, которые не встречаются ни в реципиентном антителе, ни в импортируемой CDR или каркасных последовательностях. Как правило, гуманизированное антитело будет содержать по существу целиком, по меньшей мере, один и обычно два вариабельных домена, в которых все или по существу все области CDR соответствуют областям CDR не принадлежащего человеку иммуноглобулина, и все или по существу все области FR являются областями FR консенсусной последовательности иммуноглобулина человека. Гуманизированное антитело необязательно также будет содержать, по меньшей мере, часть константной области иммуноглобулина (Fc), обычно константной области иммуноглобулина человека. Jones et al., Nature 321: 522-525 (1986); Riechmann et al., Nature 332: 323-329 (1988) и Presta, Curr. Op. Struct. Biol. 2: 593-596 (1992).
Способы гуманизации не принадлежащих человеку антител хорошо известны в данной области. В общем, гуманизированное антитело имеет один или более аминокислотных остатков, введенных в него из источника, который отличается от человека. Указанные не принадлежащие человеку аминокислотные остатки часто называют «импортируемыми» остатками, которые обычно берут из «импортируемого» вариабельного домена. Гуманизацию можно по существу выполнить, следуя способу Винтера и соавторов (Jones et al., Nature, 321:522-525 (1986); Riechmann et al., Nature, 332:323-327 (1988); Verhoeyen et al., Science, 239:1534-1536 (1988)), или заменой CDR или последовательностями CDR грызунов соответствующих последовательностей антитела человека. Соответственно, такие «гуманизированные» антитела являются химерными антителами (патент США № 4816567), где значительно меньшая часть, чем интактный вариабельный домен человека, была заменена соответствующей последовательностью вида, отличного от человека. На практике гуманизированные антитела обычно представляют собой антитела человека, в которых некоторые остатки CDR и, возможно, некоторые остатки FR заменены остатками из аналогичных участков антител грызунов.
Выбор вариабельных доменов человека, как легкой, так и тяжелой цепи, используемых для получения гуманизированных антител, очень важен для снижения антигенности. Согласно так называемому способу «оптимальной подгонки» последовательность вариабельного домена антитела грызуна подвергают скринингу по сравнению с полной библиотекой известных последовательностей вариабельных доменов человека. Последовательность человека, которая наиболее близка последовательности грызуна, затем берут в качестве каркаса человека (FR) для гуманизированного антитела. Sims et al., J. Immunol., 151:2296 (1993); Chothia et al., J. Mol. Biol., 196:901 (1987). В другом способе используют конкретный каркас, полученный из консенсусной последовательности полностью человеческих антител конкретной подгруппы легких или тяжелых цепей. Один и тот же каркас можно использовать для нескольких разных гуманизированных антител. Carter et al., Proc. Natl. Acad. Sci. USA, 89:4285 (1992); Presta et al., J. Immunol., 151:2623 (1993).
Кроме того, важно, чтобы антитела были гуманизированы с сохранением высокой аффинности по отношению к антигену и других благоприятных биологических свойств. Для достижения указанной цели, согласно предпочтительному способу, гуманизированные антитела получают, проводя анализ исходных последовательностей и различных концептуальных гуманизированных продуктов с использованием трехмерных моделей исходных и гуманизированных последовательностей. Трехмерные модели иммуноглобулинов общедоступны и известны специалистам в данной области. Доступны компьютерные программы, которые иллюстрируют и показывают возможные трехмерные конформационные структуры выбранных для исследования последовательностей иммуноглобулина. Исследование таких изображений позволяет проанализировать вероятную роль остатков в функционировании выбранной для исследования последовательности иммуноглобулина, т.е. анализировать остатки, которые влияют на способность выбранного для исследования иммуноглобулина связывать соответствующий ему антиген. Таким образом, могут быть выбраны и объединены остатки FR из реципиентных и импортируемых последовательностей так, чтобы достичь требуемых характеристик антитела, таких как повышенная аффинность по отношению к антигену(ам)-мишени. В общем, остатки CDR непосредственно и в наибольшей степени влияют на связывание антигена.
Рассматриваются различные формы гуманизированного антитела. Например, гуманизированное антитело может представлять собой фрагмент антитела, такой как Fab, который необязательно конъюгирован с одним или более цитотоксическими средствами для того, чтобы создать иммуноконъюгат. Альтернативно, гуманизированное антитело может представлять собой интактное антитело, такое как интактное IgG1-антитело.
4) Антитела человека
В качестве альтернативы гуманизации могут быть созданы антитела человека. Например, в настоящее время можно получать трансгенных животных (например, мышей), которые способны после иммунизации продуцировать полный репертуар антител человека в отсутствие продукции эндогенных иммуноглобулинов. Например, описано, что гомозиготная делеция гена соединяющей области тяжелой цепи (JH) антитела у химерных и мутантных по зародышевой линии мышей приводит к полному ингибированию продукции эндогенных антител. Перенос ряда генов иммуноглобулина зародышевой линии человека в таких мутантных по зародышевой линии мышей будет приводить к продукции антител человека при антигенной стимуляции. См., например, Jakobovits et al., Proc. Natl. Acad. Sci. USA, 90:2551 (1993); Jakobovits et al., Nature, 362:255-258 (1993); Bruggermann et al., Year in Immuno., 7:33 (1993), патент США № 5591669 и WO 97/17852.
Альтернативно, можно использовать фаговый дисплей для получения антител человека и фрагментов антител in vitro из репертуара генов вариабельных (V) доменов иммуноглобулина от неиммунизированных доноров. McCafferty et al., Nature 348:552-553 (1990); Hoogenboom and Winter, J. Mol. Biol. 227: 381 (1991). Согласно указанному способу гены V-доменов антител клонируют в рамке с геном либо основного, либо минорного белка оболочки нитчатого бактериофага, такого как M13 или fd, и они презентируются в виде функциональных фрагментов антител на поверхности фаговой частицы. Поскольку нитчатая частица содержит однонитевую копию ДНК фагового генома, то селекция на основе функциональных свойств антитела также приводит к селекции гена, кодирующего антитело, проявляющее такие свойства. Таким образом, фаг имитирует некоторые свойства B-клетки. Фаговый дисплей может быть выполнен в разных формах, обзор которых приведен, например, в публикации Johnson, Kevin S. and Chiswell, David J., Curr. Opin Struct. Biol. 3:564-571 (1993). Для фагового дисплея можно использовать несколько источников участков V-генов. Clackson et al. (Nature, 352:624-628 (1991)) выделили ряд разнообразных антител против оксазолона из небольшой случайной комбинаторной библиотеки V-генов, полученной из селезенок иммунизированных мышей. Можно сконструировать репертуар V-генов неиммунизированных людей-доноров и можно выделить антитела к ряду разнообразных антигенов (включая аутоантигены), по существу, следуя, например, способу, описанному в публикациях Marks et al., J. Mol. Biol. 222:581-597 (1991) или Griffith et al., EMBO J. 12:725-734 (1993). См. также патенты США №№ 5565332 и 5573905.
Способы Cole et al. и Boerner et al. также доступны для получения человеческих моноклональных антител (Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p. 77 (1985) и Boerner et al., J. Immunol., 147(1): 86-95 (1991)). Подобным образом антитела человека могут быть получены введением локусов иммуноглобулина человека в трансгенных животных, например, мышей, у которых эндогенные гены иммуноглобулинов были частично или полностью инактивированы. При стимуляции наблюдают продукцию антител человека, которая очень похожа на продукцию антител, наблюдаемую у людей во всех отношениях, включая реаранжировку генов, сборку и репертуар антител. Такой способ описан, например, в патентах США №№ 5545807, 5545806, 5569825, 5625126, 5633425, 5661016 и в следующих научных публикациях: Marks et al., Bio/Technology 10: 779-783 (1992); Lonberg et al., Nature 368: 856-859 (1994); Morrison, Nature 368: 812-13 (1994), Fishwild et al., Nature Biotechnology 14: 845-51 (1996), Neuberger, Nature Biotechnology 14: 826 (1996) и Lonberg and Huszar, Intern. Rev. Immunol. 13: 65-93 (1995).
Наконец, антитела человека также могут быть образованы in vitro активированными B-клетками (см. патенты США 5567610 и 5229275).
5) Фрагменты антител
В некоторых случаях существуют преимущества использования фрагментов антител, а не целых антител. Меньший размер фрагментов обеспечивает быстрый клиренс и может приводить к улучшенному доступу к солидным опухолям.
Разработаны различные способы получения фрагментов антител. Традиционно такие фрагменты получали в результате протеолитического расщепления интактных антител (см., например, Morimoto et al., J. Biochem. Biophys. Method. 24:107-117 (1992); и Brennan et al., Science, 229:81 (1985)). Однако в настоящее время такие фрагменты могут непосредственно продуцироваться рекомбинантными клетками-хозяевами. Fab-, Fv- и ScFv-фрагменты антител могут быть экспрессированы и секретированы из E. coli, таким образом обеспечивая простое получение больших количеств таких фрагментов. Фрагменты антител могут быть выделены из фаговых библиотек антител, обсуждаемых выше. Альтернативно, Fab’-SH-фрагменты могут быть непосредственно извлечены из клеток E. coli и химически связаны с образованием F(ab’)2-фрагментов (Carter et al., Bio/Technology 10:163-167 (1992)). Согласно другому способу F(ab’)2-фрагменты могут быть выделены непосредственно из культуры рекомбинантных клеток-хозяев. Fab- и F(ab’)2-фрагменты с увеличенным временем полужизни in vivo описаны в патенте США № 5869046. В других вариантах осуществления предпочтительное антитело представляет собой одноцепочечный Fv-фрагмент (scFv). См. WO 93/16185, патент США № 5571894 и патент США № 5587458). Фрагмент антитела также может представлять собой «линейное антитело», например такое, как описано в патенте США 5641870. Такие линейные фрагменты антител могут быть моноспецифичными или биспецифичными.
6) Зависимая от антител опосредованная ферментами пролекарственная терапия (ADEPT)
Антитела согласно настоящему изобретению также можно использовать в ADEPT посредством конъюгирования антитела с активирующим пролекарство ферментом, который превращает пролекарство (например, пептидил-содержащее химиотерапевтическое средство, см. WO 81/01145) в активное противоопухолевое средство. См., например, WO 88/07378 и патент США № 4975278.
Ферментным компонентом иммуноконъюгата, применимым для ADEPT, является любой фермент, способный активировать пролекарство таким образом, чтобы превратить его в его более активную цитотоксическую форму.
Ферменты, которые применимы в способе согласно настоящему изобретению, включают, без ограничения, гликозидазу, глюкозооксидазу, лизозим человека, глюкуронидазу человека, щелочную фосфатазу, применимую для превращения фосфатсодержащих пролекарств в свободные лекарственные средства; арилсульфатазу, применимую для превращения сульфатсодержащих пролекарств в свободные лекарственные средства; цитозиндезаминазу, применимую для превращения нетоксичного 5-фторцитозина в противоопухолевое лекарственное средство 5-фторурацил; протеазы, такие как протеаза Serratia, термолизин, субтилизин, карбоксипептидазы (например, карбоксипептидаза G2 и карбоксипептидаза A) и катепсины (такие как катепсины B и L), которые применимы для превращения пептидсодержащих пролекарств в свободные лекарственные средства; D-аланилкарбоксипептидазы, применимые для превращения пролекарств, которые содержат D-аминокислотные заменители; расщепляющие углеводы ферменты, такие как β-галактозидаза и нейраминидаза, применимые для превращения гликозилированных пролекарств в свободные лекарственные средства; β-лактамазу, применимую для превращения пролекарств, полученных с использованием β-лактамов, в свободные лекарственные средства; и пенициллинамидазы, такие как пенициллин-V-амидаза или пенициллин-G-амидаза, применимые для превращения лекарственных средств, полученных дериватизацией на атомах азота их амина феноксиацетильной или фенилацетильной группами, соответственно, в свободные лекарственные средства. Альтернативно, антитела с ферментативной активностью, также известные в данной области как «абзимы», можно использовать для превращения пролекарств согласно изобретению в свободные активные лекарственные средства (см., например, Massey, Nature 328: 457-458 (1987)). Конъюгаты антитело-абзим могут быть получены, как описано в настоящей публикации, для доставки абзима к популяции опухолевых клеток.
Указанные выше ферменты могут быть ковалентно связаны с полипептидом или антителами, описанными в настоящей публикации, способами, известными в данной области, такими как способы с использованием гетеробифункциональных поперечно сшивающих агентов, обсуждаемых выше. Альтернативно, слитые белки, содержащие, по меньшей мере, антигенсвязывающую область антитела согласно изобретению, связанную, по меньшей мере, с функционально активной частью фермента согласно изобретению, могут быть сконструированы с использованием способа рекомбинантной ДНК, хорошо известного в данной области (см., например, Neuberger et al., Nature 312: 604-608 (1984)).
7) Биспецифичные и полиспецифичные антитела
Биспецифичными антителами (BsAb, бс-Ат) являются антитела, которые обладают специфичностями связывания, по меньшей мере, двух разных эпитопов, включая эпитопы на одном и том же или на разных белках. Альтернативно, одно плечо может связывать антиген-мишень, а другое плечо можно комбинировать с плечом, которое связывается с запускающей молекулой на лейкоците, такой как молекула T-клеточного рецептора (например, CD3) или Fc-рецепторы для IgG (FcγR), такие как FcγR1 (CD64), FcγRII (CD32) и FcγRIII (CD16), так чтобы сфокусировать и локализовать защитные клеточные механизмы на клетке, экспрессирующей антиген-мишень. Такие антитела могут быть получены из полноразмерных антител или фрагментов антител (например, биспецифичные F(ab’)2-антитела).
Биспецифичные антитела также можно использовать для того, что локализовать цитотоксические средства в клетках, которые экспрессируют антиген-мишень. Такие антитела имеют одно плечо, которое связывает требуемый антиген, и другое плечо, которое связывает цитотоксическое средство (например, сапорин, анти-интерферон-α, алкалоид барвинка, цепь A рицина, метотрексат или меченный радиоактивным изотопом гаптен). Примеры известных биспецифичных антител включают анти-ErbB2/анти-FcgRIII (WO 96/16673), анти-ErbB2/анти-FcgRI (U.S.P. 5837234), анти-ErbB2/анти-CD3 (U.S.P. 5821337).
Способы получения биспецифичных антител известны в данной области. Традиционно получение полноразмерных биспецифичных антител основано на коэкспрессии двух пар тяжелая цепь-легкая цепь иммуноглобулина, причем две тяжелые цепи имеют разные специфичности. Millstein et al., Nature, 305:537-539 (1983). Вследствие случайного выбора тяжелых и легких цепей иммуноглобулина такие гибридомы (квадромы) продуцируют возможную смесь 10 разных молекул антител, из которых только одна имеет правильную биспецифичную структуру. Очистка правильной молекулы, которую обычно осуществляют, используя стадии аффинной хроматографии, является довольно громоздкой, а выходы продукта низкими. Аналогичные способы описаны в WO 93/08829 и в публикации Traunecker et al., EMBO J., 10:3655-3659 (1991).
Согласно другому способу вариабельные домены антител с требуемыми специфичностями связывания (участки связывания антитело-антиген) сливают с последовательностями константных доменов иммуноглобулина. Слияние предпочтительно осуществляют с константным доменом тяжелой цепи иммуноглобулина, содержащим, по меньшей мере, часть шарнирной области, областей CH2 и CH3. Предпочтительно иметь первую константную область тяжелой цепи (CH1), содержащую сайт, необходимый для связывания легкой цепи, присутствующий, по меньшей мере, в одном из слияний. ДНК, кодирующие слияния тяжелой цепи иммуноглобулина и, в случае необходимости, легкой цепи иммуноглобулина, встраивают в отдельные экспрессирующие векторы и котрансфицируют в подходящий организм хозяина. Это обеспечивает большую гибкость при корректировке взаимных соотношений трех полипептидных фрагментов в таких вариантах осуществления, когда неравные соотношения трех полипептидных цепей, используемых в конструкции, дают оптимальные выходы. Однако можно встраивать кодирующие последовательности для двух или всех трех полипептидных цепей в один экспрессирующий вектор в том случае, когда экспрессия, по меньшей мере, двух полипептидных цепей в равных соотношениях дает высокие выходы или когда соотношения не имеют особого значения.
В предпочтительном варианте осуществления указанного способа биспецифичные антитела состоят из гибридной тяжелой цепи иммуноглобулина с первой специфичностью связывания в одном плече и гибридной пары тяжелой цепи - легкой цепи иммуноглобулина (обеспечивающей вторую специфичность связывания) в другом плече. Обнаружено, что такая асимметричная структура облегчает отделение требуемого биспецифичного соединения от нежелательных комбинаций цепей иммуноглобулина, так как наличие легкой цепи иммуноглобулина только в одной половине биспецифичных молекул обеспечивает простой способ разделения. Такой способ описан в WO 94/04690. Более подробное описание создания биспецифичных антител см., например, в публикации Suresh et al., Methods in Enzymology, 121: 210 (1986).
Согласно другому способу, описанному в WO 96/27011 или U.S.P. 5731168, область контакта между парой молекул антител может быть сконструирована так, чтобы максимизировать процент гетеродимеров, которые извлекают из культуры рекомбинантных клеток. Предпочтительная область контакта включает, по меньшей мере, часть области CH3 константного домена антитела. В указанном способе одну или более небольших боковых цепей аминокислот из области контакта первой молекулы антитела заменяют более крупными боковыми цепями (например, тирозин или триптофан). Создают компенсирующие «впадины», имеющие размер идентичный или сходный с размером большой боковой цепи(цепей), на области контакта второй молекулы антитела, заменяя большие боковые цепи аминокислот меньшими боковыми цепями (например, аланин или треонин). Это обеспечивает механизм увеличения выхода гетеродимера по сравнению с другими нежелательными конечными продуктами, такими как гомодимеры.
Способы создания биспецифичных антител из фрагментов антител описаны в литературе. Например, биспецифичные антитела могут быть получены с использованием химического связывания. В публикации Brennan et al., Science 229: 81 (1985) описан способ, в котором интактные антитела протеолитически расщепляют, чтобы создать F(ab’)2-фрагменты. Полученные фрагменты восстанавливают в присутствии агента, образующего комплексы дитиола, арсенита натрия, чтобы стабилизировать соседние дитиолы и предотвратить образование межмолекулярного дисульфида. Затем созданные Fab’-фрагменты превращают в производные тионитробензоата (TNB). Один из Fab’-TNB-производных затем снова превращают в Fab’-TNB-производное с образованием биспецифичного антитела. Полученные биспецифичные антитела можно использовать в качестве агентов для избирательной иммобилизации ферментов.
Fab’-фрагменты могут быть непосредственно извлечены из E. coli и химически связаны с образованием биспецифичных антител. В публикации Shalaby et al., J. Exp. Med. 175: 217-225 (1992) описано получение полностью гуманизированной молекулы биспецифичного антитела на основе F(ab’)2. Каждый Fab’-фрагмент отдельно секретировался из клеток E. coli, и его подвергали химическому связыванию in vitro с образованием биспецифичного антитела. Образованное таким образом биспецифичное антитело способно связываться с клетками, сверхэкспрессирующими рецептор ErbB2, и нормальными T-клетками человека, а также запускать литическую активность цитотоксических лимфоцитов человека против мишеней опухоли молочной железы человека.
Также описаны различные способы получения и выделения бивалентных фрагментов антител непосредственно из культуры рекомбинантных клеток. Например, были получены бивалентные гетеродимеры с использованием лейциновых молний. Kostelny et al., J. Immunol., 148(5): 1547-1553 (1992). Пептиды лейциновой молнии из белков Fos и Jun связывали с Fab’-частями двух разных антител посредством слияния генов. Гомодимеры антител восстанавливали в шарнирной области с образованием мономеров, а затем снова окисляли с образованием гетеродимеров антител. Способ «диател», описанный в публикации Hollinger et al., Proc. Natl. Acad. Sci. USA, 90: 6444-6448 (1993), обеспечил альтернативный механизм получения биспецифичных/бивалентных фрагментов антител. Фрагменты содержат вариабельный домен тяжелой цепи (VH), связанный с вариабельным доменом легкой цепи (VL) линкером, который является слишком коротким, чтобы обеспечить возможность спаривания между двумя доменами на одной и той же цепи. Соответственно, домены VH и VL одного фрагмента вынуждены спариваться с комплементарными доменами VL и VH другого фрагмента, образуя тем самым два антигенсвязывающих участка. Также сообщалось о другой методике получения биспецифичных/бивалентных фрагментов антител с использованием димеров одноцепочечного Fv (sFv). См. Gruber et al., J. Immunol., 152:5368 (1994).
Рассматриваются антитела с более чем двумя валентностями. Например, могут быть получены триспецифичные антитела. Tutt et al. J. Immunol. 147: 60 (1991).
Типичные биспецифичные антитела могут связываться с двумя разными эпитопами на данной молекуле. Альтернативно, плечо против белка можно объединять с плечом, которое связывается с запускающей молекулой на лейкоците, такой как молекула T-клеточного рецептора (например, CD2, CD3, CD28 или B7) или Fc-рецепторы для IgG (FcγR), такие как FcγRI (CD64), FcγRII (CD32) и FcγRIII (CD 16), так чтобы сфокусировать и локализовать защитные клеточные механизмы на клетке, экспрессирующей конкретный белок. Биспецифичные антитела также можно использовать для того, чтобы локализовать цитотоксические средства в клетках, которые экспрессируют конкретный белок. Такие антитела имеют связывающее белок плечо и плечо, которое связывает цитотоксическое средство или хелатор радионуклида, такой как EOTUBE, DPTA, DOTA или TETA. Другое представляющее интерес биспецифичное антитело связывает представляющий интерес белок и, кроме того, связывает тканевой фактор (TF).
8) Поливалентные антитела
Поливалентное антитело может быть быстрее интернализовано (и/или подвергнуто катаболизму) клеткой, экспрессирующей антиген, с которым связываются антитела, чем бивалентное антитело. Антитела согласно настоящему изобретению могут представлять собой поливалентные антитела (которые не относятся к классу IgM) с тремя или более антигенсвязывающими участками (например, тетравалентные антитела), которые могут быть легко получены посредством рекомбинантной экспрессии нуклеиновой кислоты, кодирующей полипептидные цепи антитела. Поливалентное антитело может содержать домен димеризации и три или более антигенсвязывающих участка. Предпочтительный домен димеризации содержит (или состоит из) Fc-область или шарнирную область. По такому плану антитело будет содержать Fc-область и три или более антигенсвязывающих участка, аминоконцевых по отношению к Fc-области. Предпочтительное поливалентное антитело согласно изобретению содержит (или состоит из) от трех до примерно восьми, но предпочтительно четыре антигенсвязывающих участка. Поливалентное антитело содержит, по меньшей мере, одну полипептидную цепь (и предпочтительно две полипептидных цепи), причем полипептидная цепь(цепи) содержит два или более вариабельных домена. Например, полипептидная цепь(цепи) может содержать VD1-(X1)n-VD2-(X2)n-Fc, где VD1 означает первый вариабельный домен, VD2 означает второй вариабельный домен, Fc означает одну полипептидную цепь Fc-области, X1 и X2 представляют аминокислоту или полипептид, и n равно 0 или 1. Например, полипептидная цепь(цепи) может содержать: цепь VH-CH1-гибкий линкер-VH-CH1-Fc-область или цепь VH-CH1-VH-CH1-Fc-область. Поливалентное антитело согласно изобретению предпочтительно дополнительно содержит, по меньшей мере, два (и предпочтительно четыре) полипептида вариабельного домена легкой цепи. Поливалентное антитело согласно изобретению может, например, содержать примерно от двух до примерно восьми полипептидов вариабельного домена легкой цепи. Полипептиды вариабельного домена легкой цепи, предусмотренные в настоящем изобретении, содержат вариабельный домен легкой цепи и необязательно дополнительно содержат домен CL.
9) Гетероконъюгаты антител
Гетероконъюгированные антитела также входят в объем настоящего изобретения. Гетероконъюгированные антитела состоят из двух ковалентно связанных антител. Например, одно из антител в гетероконъюгате может быть связано с авидином, а другое с биотином. Такие антитела, например, были предложены для того, чтобы направить клетки иммунной системы к нежелательным клеткам-мишеням (U.S.P. 4676980), и для лечения ВИЧ-инфекции (WO 91/00360, WO 92/200373 и EP 03089). Предполагается, что антитела могут быть получены in vitro с использованием известных способов химического синтеза белков, включая способы с использованием поперечно сшивающих агентов. Например, иммунотоксины могут быть сконструированы с использованием реакции дисульфидного обмена или путем образования тиоэфирной связи. Примеры подходящих реагентов для такой цепи включают иминотиолат и метил-4-меркаптобутиримидат и реагенты, описанные, например, в патенте США № 4676980. Гетероконъюгированные антитела могут быть получены с использованием любых обычных способов поперечного связывания. Подходящие поперечно сшивающие агенты хорошо известны в данной области и описаны в патенте США № 4676980 наряду с рядом способов образования поперечных сшивок.
10) Конструирование эффекторных функций
Может быть желательной модификация антитела согласно изобретению в отношении эффекторной функции Fc, например, чтобы модифицировать (например, повысить или исключить) антителозависимую опосредованную клетками цитотоксичность (ADCC) и/или комплемент-зависимую цитотоксичность (CDC) антитела. В предпочтительном варианте осуществления Fc-эффекторную функцию антител к PD-L1 уменьшают или исключают. Этого можно добиться введением одной или более аминокислотных замен в Fc-область антитела. Альтернативно или дополнительно, остаток(ки) цистеина можно вводить в Fc-область, обеспечивая тем самым возможность образования межцепочечной дисульфидной связи в данной области. Созданное таким образом гомодимерное антитело может иметь улучшенную способность к интернализации и/или повышенному опосредованному комплементом цитолизу клеток и антителозависимой клеточной цитотоксичности (ADCC). См. Caron et al., J. Exp Med. 176:1191-1195 (1992) и Shopes, B. J. Immunol. 148:2918-2922 (1992). Гомодимерные антитела с повышенной противоопухолевой активностью также могут быть получены с использованием гетеробифункциональных поперечно сшивающих агентов, которые описаны в публикации Wolff et al., Cancer Research 53:2560-2565 (1993). Альтернативно, может быть сконструировано антитело, которое имеет двойные Fc-области и в связи с этим обладает повышенной способностью к зависимому от комплемента лизису и ADCC. См. Stevenson et al. Anti-Cancer Drug Design 3:219-230 (1989).
Чтобы увеличить время полужизни антитела в сыворотке, можно включить в антитело (в частности, во фрагмент антитела) эпитоп связывания рецептора спасения, как описано, например, в патенте США 5739277. Используемый в данном описании термин «эпитоп связывания рецептора спасения» относится к эпитопу Fc-области молекулы IgG (например, IgG1, IgG2, IgG3 или IgG4), который ответственен за увеличение времени полужизни молекулы IgG в сыворотке in vivo.
11) Другие модификации аминокислотной последовательности
Предполагается модификация(ии) аминокислотной последовательности антител, описанной в настоящей публикации. Например, может быть желательным улучшение аффинности связывания и/или других биологических свойств антитела. Варианты аминокислотной последовательности антитела получают введением соответствующих изменений нуклеотидов в нуклеиновую кислоту антитела или в ходе синтеза пептидов. Такие модификации включают, например, делеции и/или инсерции и/или замены остатков в аминокислотных последовательностях антитела. Осуществляют любое сочетание делеции, инсерции и замены, чтобы достичь конечной конструкции, при условии, что конечная конструкция обладает требуемыми характеристиками. Аминокислотные изменения также могут изменять посттрансляционный процессинг антитела, например, изменять количество или положение сайтов гликозилирования.
Применимый способ идентификации определенных остатков или областей антитела, которые являются предпочтительными местами для мутагенеза, называют «мутагенезом на основе сканирования аланином», который описан в Cunningham and Wells (1989) Science, 244:1081-1085. В данном случае остаток или группу остатков-мишеней идентифицируют (например, заряженные остатки, такие как arg, asp, his, lys и glu) и заменяют нейтральными или отрицательно заряженными аминокислотами (наиболее предпочтительно аланином или полиаланином), чтобы повлиять на взаимодействие аминокислот с антигеном. Те положения аминокислот, которые проявляют функциональную чувствительность к заменам, затем улучшают введением дополнительных или других вариантов в сайты замены. Таким образом, хотя сайт для введения варианта аминокислотной последовательности определяют предварительно, природа мутации per se не нуждается в предварительном определении. Например, чтобы проанализировать эффективность мутации в данном участке, проводят сканирование аланином или случайный мутагенез в кодоне или области-мишени и осуществляют скрининг экспрессированных вариантов антител в отношении требуемой активности.
Инсерции в аминокислотной последовательности включают слияния на амино- и/или карбоксильном конце, диапазон длины которых составляет от одного остатка до полипептидов, содержащих сто или более остатков, а также инсерции внутри последовательности одного или нескольких аминокислотных остатков. Примеры концевых инсерций включают антитело с N-концевым остатком метионила или антитело, слитое с цитотоксическим полипептидом. Другие инсерционные варианты молекулы антитела включают слияние N- или C-конца антитела с ферментом (например, для ADEPT) или полипептидом, который увеличивает время полужизни антитела в сыворотке.
Другим типом варианта является вариант с аминокислотной заменой. Такие варианты имеют, по меньшей мере, один аминокислотный остаток в молекуле антитела, замененный другим остатком. Участки, представляющие наибольший интерес для основанного на заменах мутагенеза, включают гипервариабельные области, но также предполагаются изменения FR. Консервативные замены показаны в таблице A ниже под заголовком «предпочтительные замены». Если такие замены приводят к изменению биологической активности, то могут быть введены более существенные изменения, показанные в таблице A под заголовком «примеры замен» или дополнительно описанные ниже при описании классов аминокислот, и продукты подвергают скринингу.
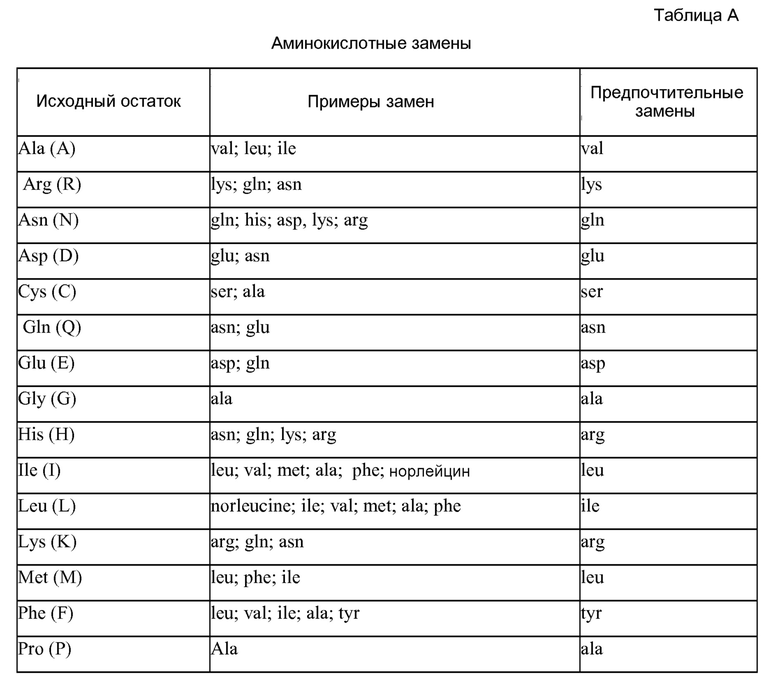

Существенные модификации биологических свойств антитела осуществляют посредством отбора замен, которые в значительной степени отличаются по своему влиянию на сохранение (a) структуры полипептидного остова в области замены, например, в виде складчатой или спиральной конформации, (b) заряда или гидрофобности молекулы в сайте-мишени, или (c) объема боковой цепи. Встречающиеся в природе остатки делят на группы на основании сходства в свойствах их боковых цепей:
(1) гидрофобные: норлейцин, met, ala, val, leu, ile;
(2) нейтральные гидрофильные: cys, ser, thr;
(3) кислые: asp, glu;
(4) основные: asn, gln, his, lys, arg;
(5) остатки, которые влияют на ориентацию цепи: gly, pro; и
(6) ароматические: trp, tyr, phe.
Неконсервативные замены повлекут за собой обмен представителя одного из указанных классов с представителем другого класса.
Любой остаток цистеина, не вовлеченный в поддержание правильной конформации антитела, также может быть заменен, обычно серином, чтобы повысить стабильность молекулы к окислению и предотвратить аномальное поперечное связывание. Наоборот, цистеиновая связь(и) может быть добавлена в антитело, чтобы повысить его стабильность (особенно когда антитело представляет собой фрагмент антитела, такой как Fv-фрагмент).
Особенно предпочтительный тип варианта с заменами включает замену одного или более остатков гипервариабельной области исходного антитела (например, гуманизированного антитела или антитела человека). Как правило, полученный в результате вариант(ты), отобранный для дальнейшей разработки, будет иметь улучшенные биологические свойства по сравнению с исходным антителом, из которого он был получен. Подходящий способ создания таких вариантов с заменами заключается в созревании аффинности с использованием фагового дисплея. Кратко, несколько участков гипервариабельной области (например, 6-7 участков) подвергают мутациям, чтобы создать все возможные аминокислотные замены в каждом участке. Созданные таким образом варианты антител представляют в моновалентной форме на частицах нитчатого фага в виде слияний с продуктом гена III M13, упакованного в каждой частице. Затем проводят скрининг вариантов в фаговом дисплее в отношении их биологической активности (например, аффинности связывания), как описано в данной публикации. Чтобы идентифицировать участки гипервариабельной области – вероятные кандидаты для модификации, можно осуществить мутагенез на основе сканирования аланином для выявления остатков гипервариабельной области, которые вносят существенный вклад в связывание антигена. Альтернативно или дополнительно, может быть полезным анализ кристаллической структуры комплекса антиген-антитело, чтобы идентифицировать точки контакта между антителом и его мишенью (например, PD-L1, B7.1). Такие контактирующие остатки и соседние остатки являются кандидатами для замены в соответствии со способами, предлагаемыми в настоящем изобретении. После создания таких вариантов панель вариантов подвергают скринингу, который описан в данной публикации, и антитела с лучшими свойствами в одном или более соответствующих анализах могут быть отобраны для дальнейшей разработки.
Другой тип аминокислотного варианта антитела изменяет исходную картину гликозилирования антитела. Под изменением подразумевают удаление одного или более углеводных остатков, встречающихся в антителе, и/или добавление одного или более сайтов гликозилирования, которые не присутствуют в антителе.
Гликозилирование антител обычно является либо N-связанным, либо O-связанным. N-связанное относится к присоединению углеводного фрагмента к боковой цепи остатка аспарагина. Трипептидные последовательности аспарагин-X-серин и аспарагин-X-треонин, где X означает любую аминокислоту за исключением пролина, представляют собой узнаваемые последовательности для ферментативного присоединения углеводного фрагмента к боковой цепи аспарагина. Таким образом, присутствие любой из указанных трипептидных последовательностей в полипептиде создает потенциальный сайт гликозилирования. O-связанное гликозилирование относится к присоединению одного из сахаров N-ацетилгалактозамина, галактозы или ксилозы к гидроксиаминокислоте, чаще всего серину или треонину, хотя также могут быть использованы 5-гидроксипролин или 5-гидроксилизин.
Добавление сайтов гликозилирования к антителу обычно сопровождается изменением аминокислотной последовательности, так что она содержит одну или более описанных выше трипептидных последовательностей (в случае сайтов N-связанного гликозилирования). Изменение также можно осуществить добавлением или заменой одного или более остатков серина или треонина в последовательности исходного антитела (в случае сайтов O-связанного гликозилирования).
Молекулы нуклеиновых кислот, кодирующие варианты аминокислотных последовательностей антител согласно настоящему изобретению, получают различными способами, известными в данной области. Такие способы включают, без ограничения, выделение из природного источника (в случае встречающихся в природе вариантов аминокислотной последовательности) или получение опосредованным олигонуклеотидами (или сайт-специфичным) мутагенезом, мутагенезом на основе ПЦР и кассетным мутагенезом ранее полученных имеющих варианты или не имеющих вариантов версий.
12) Другие модификации антител
Антитела согласно настоящему изобретению могут быть дополнительно модифицированы так, чтобы они содержали дополнительные небелковые молекулы, которые известны в данной области и легко доступны. Предпочтительно молекулами, подходящими для дериватизации антитела, являются водорастворимые полимеры. Не ограничивающие примеры водорастворимых полимеров включают, без ограничения, полиэтиленгликоль (ПЭГ), сополимеры этиленгликоля/пропиленгликоля, карбоксиметилцеллюлозу, декстран, поливиниловый спирт, поливинилпирролидон, поли-1,3-диоксолан, поли-1,3,6-триоксан, сополимер этилен/малеиновый ангидрид, полиаминокислоты (либо гомополимеры, либо случайные сополимеры) и декстран или поли(н-винилпирролидон)полиэтиленгликоль, гомополимеры пропиленгликоля, сополимеры полипропиленоксид/этиленоксид, полиоксиэтилированные полиолы (например, глицерин), поливиниловый спирт и их смеси. Пропионовый альдегид полиэтиленгликоля может иметь преимущества при производстве благодаря его стабильности в воде. Полимер может иметь любую молекулярную массу и может быть разветвленным или неразветвленным. Количество полимеров, присоединенных к антителу, может варьировать, и если присоединяют более одного полимера, то они могут быть одинаковыми или разными молекулами. Как правило, количество и/или тип полимеров, используемых для дериватизации, можно определить на основе рассмотрения ряда факторов, включая, без ограничения, конкретные свойства или функции улучшаемого антитела, будет ли производное антитела использовано в терапии при определенных состояниях и т.д. Такие способы и другие подходящие препараты описаны в Remington: The Science and Practice of Pharmacy, 20th Ed., Alfonso Gennaro, Ed., Philadelphia College of Pharmacy and Science (2000).
D. Фармацевтические препараты
Терапевтические препараты готовят для хранения смешиванием активного ингредиента, имеющего требуемую степень чистоты, с необязательными фармацевтически приемлемыми носителями, эксципиентами или стабилизаторами (Remington: The Science and Practice of Pharmacy, 20th Ed., Lippincott Williams and Wiklins, Pub., Gennaro Ed., Philadelphia, PA 2000). Приемлемые носители, эксципиенты или стабилизаторы являются нетоксичными для реципиентов в применяемых дозах и концентрациях и включают буферы, антиоксиданты, включая аскорбиновую кислоту, метионин, витамин E, метабисульфит натрия; консерванты, средства для изотоничности, стабилизаторы, комплексы с металлами (например, комплексы Zn-белок); хелатирующие средства, такие как EDTA и/или неионогенные поверхностно-активные вещества.
Когда терапевтическим средством является фрагмент антитела, предпочтительным является наименьший ингибирующий фрагмент, который специфично связывается со связывающим доменом белка-мишени. Например, на основании последовательностей вариабельной области антитела могут быть сконструированы фрагменты антител или даже пептидные молекулы, которые сохраняют способность связывать последовательность белка-мишени. Такие пептиды могут быть синтезированы химически и/или получены с использовании методики рекомбинантной ДНК (см., например, Marasco et al., Proc. Natl. Acad. Sci. USA 90: 7889-7893 [1993]).
Буферы используют для контроля pH в диапазоне, который оптимизирует терапевтическую эффективность, особенно если стабильность зависит от pH. Буферы предпочтительно присутствуют в концентрациях в диапазоне примерно от 50 мМ до примерно 250 мМ. Подходящие буферные средства для использования в настоящем изобретении включают как органические, так и неорганические кислоты и их соли. Например, цитрат, фосфат, сукцинат, тартрат, фумарат, глюконат, оксалат, лактат, ацетат. Кроме того, буферы могут состоять из гистидина и солей триметиламина, таких как трис.
Консерванты добавляют, чтобы замедлить рост микроорганизмов, и консерванты обычно присутствуют в диапазоне 0,2-1,0% (масс./об.). Подходящие консерванты для использования в настоящем изобретении включают хлорид октадецилдиметилбензиламмония; хлорид гексаметония; галогениды бензалкония (например, хлорид, бромид, йодид), хлорид бензетония; тимеросал, фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехин; резорцин; циклогексанол, 3-пентанол и м-крезол.
Средства для тоничности, иногда известные как «стабилизаторы», присутствуют для регуляции или поддержания тоничности жидкости в композиции. В случае использования с крупными заряженными биомолекулами, такими как белки и антитела, их часто называют «стабилизаторами», так как они могут взаимодействовать с заряженными группами боковых цепей аминокислот, тем самым снижая вероятность внутримолекулярных и межмолекулярных взаимодействий. Средства для тоничности могут присутствовать в любом количестве от 0,1 мас.% до 25 мас.%, предпочтительно от 1 до 5%, в расчете на относительные количества других ингредиентов. Предпочтительные средства для тоничности включают многоатомные сахарные спирты, предпочтительно трехатомные или сахарные спирты более высокой атомности, такие как глицерин, эритрит, арабит, ксилит, сорбит и маннит.
Дополнительные эксципиенты включают агенты, которые могут служить в качестве одного или более из следующих средств: (1) наполнителей, (2) усилителей растворимости, (3) стабилизаторов и (4) и средств, предотвращающих денатурацию или адгезию на стенке емкости. Такие эксципиенты включают: многоатомные сахарные спирты (перечисленные выше); аминокислоты, такие как аланин, глицин, глутамин, аспарагин, гистидин, аргинин, лизин, орнитин, лейцин, 2-фенилаланин, глутаминовая кислота, треонин и т.д.; органические сахара или сахарные спирты, такие как сахароза, лактоза, лактит, трегалоза, стахиоза, манноза, сорбоза, ксилоза, рибоза, рибит, миоинозитоза, миоинозит, галактоза, галактит, глицерин, циклитолы (например, инозит), полиэтиленгликоль; содержащие серу восстановители, такие как мочевина, глутатион, тиоктовая кислота, тиогликолят натрия, тиоглицерин, α-монотиоглицерин и тиосульфат натрия; низкомолекулярные белки, такие как сывороточный альбумин человека, бычий сывороточный альбумин, желатин или другие иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; моносахариды (например, ксилоза, манноза, фруктоза, глюкоза; дисахариды (например, лактоза, мальтоза, сахароза); трисахариды, такие как рафиноза; и полисахариды, такие как декстрин или декстран.
Неионогенные поверхностно-активные вещества или детергенты (также известные как «увлажнители») присутствуют для того, чтобы помочь солюбилизировать терапевтическое средство, а также чтобы защитить терапевтический белок от индуцированной встряхиванием агрегации, что также позволяет препарату подвергаться воздействию сдвигового поверхностного натяжения без денатурации активного терапевтического белка или антитела. Неионогенные поверхностно-активные вещества присутствуют в диапазоне примерно от 0,05 мг/мл до примерно 1,0 мг/мл, предпочтительно примерно от 0,07 мг/мл до примерно 0,2 мг/мл.
Подходящие неионогенные поверхностно-активные вещества включают полисорбаты (20, 40, 60, 65, 80 и т.д.), полиоксамеры (184, 188 и т.д.), полиолы PLURONIC®, TRITON®, моноэфиры полиоксиэтиленсорбитана (TWEEN®-20, TWEEN®-80 и т.д.), лауромакрогол 400, полиоксил-40-стеарат, полиоксиэтиленированное и гидрированное касторовое масло 10, 50 и 60, моностеарат глицерина, сложный эфир жирной кислоты и сахарозы, метилцеллюлозу и карбоксиметилцеллюлозу. Анионогенные детергенты, которые могут быть использованы, включают лаурилсульфат натрия, сульфосукцинат диоктилнатрия и сульфонат диоктилнатрия. Катионогенные детергенты включают хлорид бензалкония или хлорид бензетония.
Чтобы использовать препараты для введения in vivo, они должны быть стерильными. Препарат можно сделать стерильным фильтрованием через стерильные фильтрующие мембраны. Терапевтические композиции согласно изобретению обычно помещают в емкость, имеющую стерильное входное отверстие, например, мешок для внутривенного раствора или флакон, имеющий пробку, прокалываемую иглой для подкожной инъекции.
Путь введения соответствует известным и приемлемым способам, таким как однократный болюс или многократные болюсы или инфузия в течение длительного периода времени подходящим способом, например, инъекция или инфузия подкожным, внутривенным, внутрибрюшинным, внутримышечным, внутриартериальным, внутрь пораженной ткани или внутрисуставным путями, местное введение, ингаляция или введение в виде средств длительного высвобождения или пролонгированного высвобождения.
Препарат согласно изобретению также может содержать более одного активного соединения, которое необходимо для лечения конкретного состояния, предпочтительно соединения с дополняющими активностями, которые не оказывают неблагоприятного влияния друг на друга. Альтернативно или дополнительно, композиция может содержать цитотоксическое средство, цитокин или ингибирующее рост средство. Такие молекулы соответственно присутствуют в сочетании в количествах, которые являются эффективными для предполагаемой цели.
Активные ингредиенты также могут быть заключены в микрокапсулы, приготовленные, например, способами коацервации или полимеризации на границе фаз, например, микрокапсулы из гидроксиметилцеллюлозы или желатиновые микрокапсулы и микрокапсулы из поли(метилметакрилата), соответственно, в коллоидные системы доставки лекарственных средств (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие способы описаны в Remington's Pharmaceutical Sciences 18th edition, выше.
Стабильность белков и антител, описанных в настоящей публикации, может быть повышена за счет использования нетоксичных «водорастворимых солей поливалентных металлов». Примеры включают Ca2+, Mg2+, Zn2+, Fe2+, Fe3+, Cu2+, Sn2+, Sn4+, Al2+ и Al3+. Примеры анионов, которые могут образовывать водорастворимые соли с указанными выше катионами поливалентных металлов, включают анионы, образованные неорганическими кислотами и/или органическими кислотами. Такие водорастворимые соли имеют растворимость в воде (при 20°C), составляющую, по меньшей мере, примерно 20 мг/мл, альтернативно, по меньшей мере, примерно 100 мг/мл, альтернативно, по меньшей мере, примерно 200 мг/мл.
Подходящие неорганические кислоты, которые можно использовать, чтобы образовать «водорастворимые соли поливалентных металлов», включают хлористоводородную, уксусную, серную, азотную, тиоциановую и фосфорную кислоту. Подходящие органические кислоты, которые можно использовать, включают алифатические карбоновые кислоты и ароматические кислоты. Алифатические кислоты в рамках данного определения можно определить как насыщенные или ненасыщенные C2-9-карбоновые кислоты (например, алифатические моно-, ди- и трикарбоновые кислоты). Например, типичные монокарбоновые кислоты в рамках настоящего определения включают насыщенные C2-9-монокарбоновые кислоты уксусную, пропионовую, масляную, валериановую, капроновую, энантовую, каприловую, пеларгоновую и каприоновую, и ненасыщенные C2-9-монокарбоновые кислоты акриловую, пропиоловую, метакриловую, кротоновую и изокротоновую кислоты. Примеры дикарбоновых кислот включают насыщенные C2-9-дикарбоновые кислоты малоновую, янтарную, глутаровую, адипиновую и пимелиновую, тогда как ненасыщенные C2-9-дикарбоновые кислоты включают малеиновую, фумаровую, цитраконовую и мезаконовую кислоты. Примеры трикарбоновых кислот включают насыщенные C2-9-триккрбоновые кислоты трикарбаллиловую и 1,2,3-бутантрикарбоновую кислоту. Кроме того, карбоновые кислоты в рамках настоящего определения также могут содержать одну или две гидроксильных группы для образования гидроксикарбоновых кислот. Примеры гидроксикарбоновых кислот включают гликолевую, молочную, глицериновую, тартроновую, яблочную, винную и лимонную кислоту. Ароматические кислоты в рамках настоящего определения включают бензойную и салициловую кислоту.
Широко применяемые водорастворимые соли поливалентных металлов, которые можно использовать, чтобы помочь стабилизировать инкапсулированные полипептиды согласно настоящему изобретению, включают, например: (1) соли металлов, образованные неорганическими кислотами: галогениды (например, хлорид цинка, хлорид кальция), сульфаты, нитраты, фосфаты и тиоцианаты; (2) соли металлов, образованные алифатическими карбоновыми кислотами (например, ацетат кальция, ацетат цинка, пропионат кальция, гликолят цинка, лактат кальция, лактат цинка и тартрат цинка); и (3) соли металлов, образованные ароматическими карбоновыми кислотами: бензоаты (например, бензоат цинка) и салицилаты.
E. Способы лечения
Для профилактики или лечения заболевания подходящая доза активного средства будет зависеть от типа заболевания, подвергаемого лечению, как описано выше, тяжести и течения заболевания, от того, вводят ли средство в профилактических или терапевтических целях, предыдущей терапии, истории болезни пациента и реакции на средство, и решения лечащего врача. Средство соответствующим образом вводят пациенту за один раз или на протяжении серии введений.
В конкретном варианте осуществления изобретение относится к костимуляции в результате ослабления передачи сигнала через PD-1, в частности, в результате применения PD-L1-антител, которые предотвращают связывание с PD-1 и/или B7.1, а также к терапевтическому лечению T-клеточных дисфункциональных расстройств.
1. Инфекции
PD-1 и его лиганды (“PD-1:PD-L”) играют важную роль в регуляции иммунной защиты от патогенов, которые вызывают острые и хронические инфекции. Передача сигнала PD-1:PD-L играет ключевую роль в регуляции баланса между эффективной иммунной защитой от микроорганизмов и опосредованным иммунной системой повреждением ткани. Например, хотя у нокаутированных по PD-1 мышей клиренс аденовирусной инфекции происходит быстрее, чем у их аналогов дикого типа, у них развивается более тяжелое повреждение клеток печени. Iwai et al., J. Exp. Med. 198: 39-50 (2003). В мышиной модели герпесного стромального кератита блокирующее антитело к PD-L1 усиливало кератит, увеличивая экспансию HSV-1-специфичных эффекторных T-клеток CD4, продукцию IFN-γ и жизнеспособность таких клеток. Jun et al., FEBS Lett. 579: 6259-64 (2005).
Микроорганизмы, которые вызывают хроническую инфекцию, используют путь передачи сигнала PD-1:PD-L для ускользания от иммунных ответов хозяина, что приводит к хроническим инфекциям. Вирусы, которые вызывают хроническую инфекцию, могут приводить специфичные для вируса T-клетки к нефункциональному состоянию и, таким образом, к молчанию противовирусного T-клеточного ответа. Barber et al., Nature 439: 682-87 (2006); Wherry et al., J. Virol. 78: 5535-45 (2004). Истощение T-клеток или анергия T-клеток CD8+ является важной причиной неэффективной борьбы с вирусами во время хронических инфекций и является характерным признаком хронических LCMV-инфекций у мышей, а также инфекций ВИЧ, HBV, HCV и HTLV у человека и инфекции SIV у приматов. По-видимому, существует иерархическая прогрессирующая утрата функции в случае фенотипа истощаемых вирусом T-клеток CD8+, при этом сначала происходит утрата цитотоксичности и продукции IL-2 с последующей утратой продукции цитокинов эффекторов.
PD-1 подвергается повышающей регуляции при активации, и экспрессия поддерживается на высоком уровне истощенными популяциями T-клеток CD8+ у мышей с хронической инфекцией LCMV. Barber et al., см. выше. Введение антител, которые блокировали связывание PD-1:PD-L1, приводили к усиленным T-клеточным ответам и значимому снижению вирусной нагрузки. У стойко инфицированных мышей с неэффективным ответом TH CD4+ блокада PD-1:PD-L1 восстанавливала T-клетки CD8+ после дисфункционального состояния, приводя к пролиферации, секреции цитокинов, уничтожению инфицированных клеток и сниженной вирусной нагрузке, что убедительно указывает терапевтический подход к лечению хронических вирусных инфекций.
В результате выявление роли PD-1:PD-L в случае LCMV вызвало большой интерес к целенаправленному воздействию на такой путь с целью лечения хронической инфекции у человека. Экспрессия PD-1 является высокой на ВИЧ-специфичных [Petrovas et al., J. Exp. Med. 203: 2281-92 (2006); Day et al., Nature 443: 350-54 (2006); Traumann et al., Nat. Med. 12: 1198-202 (2006)], HBV-специфичных [Boettler et al., J. Virol. 80: 3532-40 (2006); Boni et al., J. Virol. 81: 4215-25 (2007)] и HCV-специфичных T-клетках [Urbani et al., J. Virol. 80: 11398-403 (2006)]. PD-L1 также подвергается повышающей регуляции на моноцитах CD14+ периферической крови и миелоидных ДК у пациентов с хронической HBV-инфекцией [Chen et al., J. Immunol. 178: 6634-41 (2007); Geng et al., J. Viral Hepat. 13: 725-33 (2006)], и на клетках CD14+ и T-клетках у пациентов с ВИЧ [Trabattoni et al., Blood 101: 2514-20 (2003)]. Блокирование взаимодействий PD-1:PD-L1 in vitro восстанавливало после истощения ВИЧ-специфичные, HBV-специфичные, HCV-специфичные и SIV-специфичные T-клетки CD8+ и CD4+ и восстанавливало пролиферацию и продукцию цитокинов. Petrovas et al., J. Exp. Med. 203: 2281-92 (2006); Day et al., выше; Trautmann et al., выше; Boni et al., выше; Urbani et al., выше; Velu et al., J. Virol. 81: 5819-28 (2007).
Степень экспрессии PD-1 также может быть полезным диагностическим маркером вирус-специфичных T-клеток CD8+, показывающим степень истощения T-клеток и тяжесть заболевания. Уровень экспрессии PD-1 на ВИЧ-специфичных T-клетках CD8+ коррелирует с вирусной нагрузкой, снижением количества CD4+ и сниженной способностью T-клеток CD8+ к пролиферации в ответ на ВИЧ-антиген in vitro. В соответствии с наблюдениями in vivo существует прямая корреляция между экспрессией PD-1 на ВИЧ-специфичных T-клетках CD4+ и вирусной нагрузкой. D'Souza et al., J. Immunol. 179: 1979-87 (2007). Пациенты с длительным отсутствием прогрессирования заболевания имеют функциональные ВИЧ-специфичные T-клетки памяти CD8+ с заметно более низкой экспрессией PD-1, в отличие от типичных пациентов с прогрессированием заболевания, экспрессия PD-1 у которых подвергается значительной повышающей регуляции, что коррелирует с пониженным количеством T-клеток CD4+, пониженным функционированием ВИЧ-специфичных эффекторных T-клеток памяти CD8+ и повышенной вирусной нагрузкой в плазме. Zhang et al., Blood 109: 4671-78 (2007).
Путь PD-1:PD-L также вовлечен в хроническое течение бактериальных инфекций. Helicobacter pylori вызывает хронический гастрит и язвы желудка и двенадцатиперстной кишки и является фактором риска для развития рака желудка. Во время инфекции H. pylori T-клеточные ответы являются недостаточными для освобождения от инфекции, приводя к персистирующей инфекции. После воздействия H. pylori in vitro или in vivo PD-L1 подвергается повышающей регуляции на эпителиальных клетках желудка. Эпителиальные клетки желудка экспрессируют молекулы MHC класса II и, как считают, выполняют важную функцию АПК во время инфекции H. pylori. Антитела к PD-L1, которые блокируют взаимодействие PD-1 с PD-L1, усиливают пролиферацию T-клеток и продукцию IL-2 в культурах эпителиальных клеток желудка, подвергнутых воздействию H. Pylori, и T-клеток CD4. Блокирование PD-L1 либо антителами, либо миРНК предотвращало образование регуляторных T-клеток, что свидетельствует о том, что PD-L1 может стимулировать подавление T-клеток и персистирующие инфекции, контролируя динамическое равновесие между регуляторными и эффекторными T-клетками во время инфекции H. pylori. Beswick et al., Infect. Immun. 75: 4334-41 (2007).
Паразитические черви также используют путь PD-1:PD-L1 для индукции макрофагов, которые подавляют иммунный ответ. Во время инфекций Taenia crassiceps (т.е. ленточного червя) у мышей PD-1 и PD-L2 подвергаются повышающей регуляции на активированных макрофагах, и T-клетки CD4+ экспрессируют PD-1. Блокирование PD-1, PD-L1 или PD-L2 значимо уменьшало подавление пролиферации T-клеток in vitro макрофагами от инфицированных ленточными червями мышей. Terrazas et al., Int. J. Parasitol. 35: 1349-58 (2005). Во время инфекции Shistosoma mansoni у мышей макрофаги экспрессируют высокие уровни PD-L1 и более умеренные уровни PD-L2. Анти-PD-L1 устраняет способность таких макрофагов подавлять пролиферацию T-клеток in vitro, тогда как анти-PD-L2 не оказывал такого влияния. Экспрессия PD-L1 на макрофагах от инфицированных мышей снижалась через 12 недель инфекции, коррелируя с отменой T-клеточной анергии. Smith et al., J. Immunol. 173: 1240-48 (2004).
2. Опухолевый иммунитет
Эмпирические доказательства опухолевого иммунитета включают (i) наблюдение спонтанной ремиссии, (ii) присутствие регистрируемого, но неэффективного иммунного ответа хозяина на опухоли, (iii) повышенное распространение первичных и вторичных злокачественных новообразований у иммунодефицитных пациентов, (iv) выявление повышенных уровней антител и T-лимфоцитов у пациентов с опухолями и (v) наблюдение того, что испытуемых животных можно иммунизировать против различных типов опухолей.
Исследования показали, что большинство опухолей у человека экспрессируют ассоциированные с опухолями антигены (TAA), которые могут узнаваться T-клетками и, следовательно, потенциально способны индуцировать иммунный ответ. Boon et al., Immunol. Today 16: 334-336 (1995). Ранняя фаза клинических испытаний была начата с вакцинации пациентов со злокачественными опухолями с использованием TAA или профессиональных антигенпрезентирующих клеток, на которые импульсно воздействовали TAA. Dudley et al., Science 298: 850-854 (2002); Gajewski et al., Clin. Cancer Res. 7: 895s-901s (2001); Marincola et al., Adv. Immunol. 74: 181-273 (2000); Peterson et al., J. Clin. Oncol. 21: 2342-2348 (2003). Во многих таких испытаниях была достигнута индукция специфичных для опухолевых антигенов T-клеток CD8+. Mackensen et al., Eur. Cytokine Netw. 10: 329-336 (1999); Peterson et al., выше. Также был проведен адоптивный перенос специфичных для опухолевых антигенов T-клеток пациентам и выявлен хоминг увеличенной популяции цитотоксических T-лимфоцитов (CTL) в места опухолей. Meidenbauer et al., J. Immunol. 170: 2161-2169 (2003). Однако несмотря на инфильтрацию опухоли иммунными эффекторными клетками, рост опухоли редко подвергается контролю.
Полностью установлено, что микроокружение опухоли может защищать опухолевые клетки от уничтожения иммунной системой. Ganss et al., Cancer Res. 58: 4673-4681 (1998); Singh et al., J. Exp. Med. 175: 139-146 (1992). Обнаружено, что растворимые факторы, а также связанные с мембранами молекулы, включая трансформирующий фактор роста β (TGF-β), интерлейкин (IL)-10, простагландин E2, FASL, лиганды CTLA-4, родственный фактору некроза опухоли индуцирующий апоптоз лиганд (TRAIL) и лиганд рецептора запрограммированной гибели 1 (PD-L1, aka B7-H1) экспрессируются опухолями и, как полагают, опосредуют ускользание от иммунной системы. Таким образом, блокада таких негативных регулирующих иммунитет сигналов на опухолевых клетках является многообещающим способом усиления специфичного для опухоли T-клеточного иммунитета (CD8+) in vivo.
Экспрессия PD-L1 на многих опухолях является компонентом такого подавления и может действовать во взаимодействии с другими иммунодепрессивными сигналами. PD-L1 негативно регулирует передачу сигнала T-клеточного рецептора. Показана экспрессия PD-L1 in situ на широком множестве солидных опухолей, включая злокачественные опухоли молочной железы, легкого, ободочной кишки, яичника, меланому, злокачественные опухоли мочевого пузыря, печени, слюнных желез, желудка, глиомы, злокачественные опухоли щитовидной железы, тимуса, эпителия, головы и шеи. Brown et al., J. Immunol. 170: 1257-66 (2003); Dong et al., Nat. Med. 8: 793-800 (2002); Hamanishi et al., PNAS 104: 3360-65 (2007); Strome et al., Cancer Res. 63: 6501-5 (2003); Inman et al., Cancer 109: 1499-505 (2007); Konishi et al., Clin. Cancer Res. 10: 5094-100 (2004); Nakanishi et al., Cancer Immunol. Immunother. 56: 1173-82 (2007); Nomi et al., Clin. Cancer Res. 13: 2151-57 (2004); Thompson et al., PNAS 101: 1714-79 (2004); Wu et al., Acta Histochem. 108: 19-24 (2006).
Иммунологическое окрашивание также показывает экспрессию PD-1:PD-L на различных злокачественных опухолях.
Интересно, что злокачественная опухоль также была охарактеризована как хроническое воспалительное заболевание. Coussens et al., Nature 420: 860-867 (2002). Хотя до 15% злокачественных опухолей во всем мире имеют непосредственно инфекционное происхождение [Kuper et al., J. Intern. Med. 248: 171-183 (2000)], многие опухоли являются родственными хроническому раздражению и воспалению. Zou et al, Ntu. Rev. Cancer 5: 263-274 (2005).
Исследования, относящиеся к влиянию экспрессии PD-L1 на опухолях на исход заболевания, показывают, что экспрессия PD-L1 строго коррелирует с неблагоприятным прогнозом в случае рака почки, яичника, мочевого пузыря, молочной железы, желудка и поджелудочной железы, но вероятно не в случае мелкоклеточного рака легкого. Hamanishi et al., Proc. Natl. Acad. Sci. USA 104: 3360-65 (2007); Inman et al., Cancer 109: 1499-505 (2007); Konishi et al., Clin. Cancer Res. 10: 5094-100 (2004); Nakanishi et al., Cancer Immunol. Immunother. 56: 1173-82 (2007); Nomi et al., Clin. Cancer Res. 13: 2151-57 (2007); Thompson et al., Proc. Natl. Acad. Sci. USA 101: 1714-79 (2004); Wu et al., Acta Histochem. 108: 19-24 (2006). Кроме того, такие исследования свидетельствуют о том, что более высокие уровни экспрессии PD-L1 на опухолях могут способствовать прогрессированию стадии опухоли и инвазии в более глубокие структуры ткани.
Путь PD-1:PD-L также может играть роль в гематологических злокачественных новообразованиях. PD-1 или PD-L1 редко экспрессируются B-клеточными злокачественными новообразованиями, но PD-L2 сверхэкспрессируется в злокачественных опухолях из клеток мантийной зоны. Brown et al., см. выше; Rosenwald et al., J. Exp. Med. 198: 851-62 (2003). PD-L1 экспрессируется на клетках множественной миеломы, но не на нормальных плазматических клетках. Экспансия T-клеток в ответ на клетки миеломы усиливается in vitro при блокаде PD-L1. Liu et al., Blood 110: 296-304 (2007). PD-L1 экспрессируется на некоторых первичных T-клеточных лимфомах, особенно анапластических крупноклеточных T-лимфомах, и PD-L1 экспрессируется на ассоциированной сети фолликулярных дендритных клеток. Dorfman et al., Am. J. Surg. Pathol. 30: 802-10 (2006). Анализ на микроматрицах дополнительно свидетельствует о том, что ассоциированные с опухолями T клетки отвечают на сигналы PD-1 in situ при лимфоме Ходжкина. Chemnitz et al., Blood 110: 3226-33 (2007). PD-1 и PD-L1 экспрессируются на T-клетках CD4+ в случае опосредованного HTLV-1 T-клеточного лейкоза взрослых и лимфомы. Shimauchi et al., Int. J. Cancer 121: 2585-90 (2007). Такие опухолевые клетки являются гипореактивными в отношении сигналов TCR, и блокада PD-1 увеличивала в них экспрессию TNF-α, но не экспрессию IFN-γ. Исследования на животных моделях показывают, что экспрессия PD-L1 на опухолях ингибирует активацию T-клеток и лизис опухолевых клеток, а в некоторых случаях приводит к повышенной, специфичной для опухоли гибели T-клеток. Dong et al., Nat. Med. 8: 793-800 (2006); Hirano et al., Cancer Res. 65: 1089-96 (2005).
Таким образом, подавление передачи сигнала через PD-L1 антителами к PD-L1 согласно изобретению с тем, чтобы усилить T-клеточную функцию, является перспективным с точки зрения ослабления опухолевого иммунитета и в результате может быть эффективным способом лечения злокачественной опухоли.
F. Комбинированная терапия
Способ согласно изобретению можно сочетать с известными способами лечения хронической инфекции или злокачественной опухоли, либо в виде объединенных или дополнительных стадий лечения, либо в виде дополнительных компонентов терапевтического препарата.
1. Злокачественная опухоль:
Усиление иммунной функции хозяина для борьбы с опухолями является предметом возрастающего интереса. Традиционные способы включают (i) усиление АПК, например, (a) инъекцию в опухоль ДНК, кодирующей чужеродные аллоантигены MHC, или (b) трансфекцию опухолевых клеток биопсии генами, которые повышают вероятность иммунного узнавания антигенов (например, иммуностимулирующие цитокины, GM-CSF, костимулирующие молекулы B7.1, B7.2) опухоли, (iii) адоптивную клеточную иммунотерапию или лечение активированными специфичными для опухоли T-клетками. Адоптивная клеточная иммунотерапия включает выделение инфильтрующих опухоль T-лимфоцитов хозяина, размножение популяции in vitro, например, в результате стимуляции IL-2 или опухолью, или и тем и другим. Кроме того, выделенные T-клетки, которые являются дисфункциональными, также могут быть активированы посредством применения in vitro антител к PD-L1 согласно изобретению. T-клетки, которые активированы таким образом, затем могут быть снова введены хозяину.
Традиционные терапии злокачественной опухоли включают следующие способы: (i) лучевую терапию (например, радиотерапию, рентгенотерапию, облучение) или применение ионизирующего излучения для того, чтобы убить злокачественные клетки и уменьшить размер опухолей. Лучевая терапия может быть применена либо наружно посредством наружной лучевой радиотерапии (EBRT), либо внутренне посредством брахитерапии; (ii) химиотерапию или применение цитотоксических лекарственных средств, которые в общем поражают быстро делящиеся клетки; (iii) целенаправленную терапию или средства, которые специфично воздействуют на белки, регуляция которых нарушена в злокачественных клетках (например, ингибиторы тирозинкиназы иматиниб, гефитиниб; моноклональные антитела, фотодинамическая терапия); (iv) иммунотерапию или усиление иммунного ответа хозяина (например, вакцина); (v) гормональную терапию или блокаду гормонов (например, когда опухоль является чувствительной к гормонам), (vi) ингибирование ангиогенеза или блокаду образования и роста кровеносных сосудов и (vii) паллиативную терапию или лечение, направленное на улучшение качества лечения, чтобы уменьшить боль, тошноту, рвоту, диарею и геморрагию. Лекарственные средства против боли, такие как морфин и оксикодон, противорвотные средства, такие как ондансетрон и апрепитант, могут позволить осуществлять более агрессивные схемы лечения.
При лечении злокачественной опухоли можно осуществлять любые описанные ранее традиционные способы лечения иммунитета злокачественных опухолей до, после или одновременно с введением антител к PD-L1 согласно изобретению. Кроме того, антитела к PD-L1 согласно изобретению можно вводить до, после или одновременно с обычными способами лечения злокачественной опухоли, такими как введение связывающихся с опухолями антител (например, моноклональных антител, конъюгированных с токсинами моноклональных антител) и/или введение химиотерапевтических средств.
2. Инфекция:
При лечении инфекции (например, острой и/или хронической) введение антител к PD-L1 согласно изобретению можно сочетать с традиционными способами лечения в дополнение или вместо стимуляции естественной иммунной защиты хозяина от инфекции. Природная иммунная защита хозяина от инфекции включает, без ограничения, воспаление, повышенную температуру, опосредованную антителами защиту хозяина, опосредованную T-лимфоцитами защиту хозяина, включая секрецию лимфокинов и цитотоксические T-клетки (особенно во время вирусной инфекции), опосредованный комплементом лизис и опсонизацию (облегченный фагоцитоз) и фагоцитоз. Способность антител к PD-L1 согласно изобретению повторно активировать дисфункицональные T-клетки может быть особенно полезной для лечения хронических инфекций, в частности, инфекций, при которых опосредованный клетками иммунитет необходим для полного выздоровления.
a. Бактерии
В случае инфекций, возникающих в результате бактериальной инфекции, антитела к PD-L1 согласно изобретению можно сочетать с одновременным, предварительным или последующим введением стандартных терапевтических средств для лечения бактериальной инфекции. Бактериальные инфекции в настоящее время наиболее часто лечат антибактериальными антибиотиками, но эффективной также может быть сыворотка, содержащая специфичные для патогена антитела от иммунизированных хозяев.
В случае бактерий, которые являются патогенными в результате секреции токсинов (токсогенные бактерии), вакцинация неактивным токсином и/или введение терапевтических средств, которые блокируют токсичность токсинов, являются особенно эффективными (например, поликлональная сыворотка, антитела, антибиотики и т.д.). Такие организмы включают Clostridium spp., bacillus spp., Corynebacterium spp., Vibrio chloerae, Bordetella pertussis, Staphylococcus spp., Streptococcus spp. Грамотрицательные бактерии, которые также обычно отвечают на такую традиционную терапию, включают энтеробактерии (например, Escherichia, Klebsiella, Proteus, Yersinia, Erwina), Salmonella и Pseudomonas aeruginosa. Инкапсулированные бактерии, которые резистентны к фагоцитозу и опсонизации и, следовательно, часто предотвращают более значительную стимуляцию иммунного клиренса, включают: Streptococcus spp., Haemophilus spp. Neisseria spp., Klebsiella spp. и Bacterioides fragillis.
Бактерии, которые ускользают от системы защиты хозяина посредством внедрения в клетки, так что они ускользают от антитела в сыворотке и комплемента после конкретного заражения. Клиренс таких инфекций почти полностью зависит от опосредованного T-лимфоцитами иммунитета, и такие инфекции особенно склонны к превращению в хронические инфекции. Конкретные примеры включают Salmonella (S. typhi, S. choleraesuis, S. enteritidis), Legionella spp., Listeria spp., Brucella spp. и Mycobacterium, включая M. tuberculosis, M. avium и M. leprae.
Спирохеты, включая Treponema spp., Borrelia spp. и Leptospira spp., представляют собой бактерии, которые вызывают персистирующие и латентные инфекции. Treponema palladium, патоген, вызывающий заболевание сифилис, является передаваемым половым путем заболеванием, которое может иметь тяжелые патологические последствия, если остается не вылеченным. Заболевание прогрессирует, проходя отдельные стадии. Начальной клинической стадией является язва или твердый шанкр на стадии внедрения трепонем. Затем следует период спирохетемии и метастатического распространения микроорганизмов, который продолжается, включая повторяющиеся циклы инфекции, и разрешается в состояние, известное как вторичный сифилис. После разрешения вторичного сифилиса заболевание вступает в бессимптомный латентный период, который может завершаться третичным сифилисом, который является серьезным и часто летальным состоянием. Третичный сифилис может проявляться (i) на сердце в виде аортита с образованием аневризмы и вторичной недостаточностью клапана аорты, (ii) в центральной нервной системе (сухотка спинного мозга, паралитическая деменция), (iii) глазах (интерстициальный кератит) или (iv) ушах (нервная глухота). Невенерические формы напоминают клинические проявления венерических форм, но передаются, главным образом, посредством прямого контакта и плохой гигиены. Такие формы включают фрамбезию (T. pallidum subp. pertenue), пинту (T. carateum) и беджель (T. pallidum subsp. endemicum).
Средства для лечения сифилиса включают пенициллин (например, пенициллин G), тетрациклин, доксициклин, цефтриаксон и азитромицин. Антитела к PD-L1 согласно изобретению могут быть наиболее предпочтительно введены для лечения латентного периода инфекции.
Болезнь Лайма, вызываемая Borrelia burgdorferi, передается человеку через укусы клещей. Заболевание вначале проявляется в виде локализованной сыпи с последующими подобными гриппу симптомами, включая недомогание, повышенную температуру, головную боль, ригидность затылочных мышц и артралгии. Последние проявления могут включать блуждающий артрит и полиартрит, неврологические и сердечные составляющие с парезом черепно-мозгового нерва и радикулопатией, миокардитом и аритмиями. Некоторые случаи болезни Лайма становятся персистирующими, приводя к необратимому повреждению, аналогичному повреждению при третичном сифилисе.
Современная терапия болезни Лайма, главным образом, включает введение антибиотиков. Резистентные к антибиотикам штаммы можно лечить гидроксихлорохином или метотрексатом. Невосприимчивых к антибиотикам пациентов с невропатической болью можно лечить габапентином. Миноциклин может быть полезным при поздней/хронической болезни Лайма с неврологическими или другими воспалительными проявлениями. Антитела к PD-L1 наиболее предпочтительно можно вводить для лечения латентного периода инфекции.
Другие формы боррелиоза, такие как формы, возникающие в результате инфекции B. recurentis, B. hermsii, B. turicatae, B. parikeri, B. hispanica, B. duttonii и B. persica, а также лептоспироз (например, L. interrogans), обычно разрешаются спонтанно, если титры в крови не достигают концентраций, вызывающих внутрипеченочную обструкцию.
b. Вирус
В случае инфекций вирусной природы антитела к PD-L1 согласно изобретению можно сочетать с одновременным, предварительным или последующим применением стандартных терапевтических средств для лечения вирусных инфекций. Такие стандартные терапевтические средства могут варьировать в зависимости от типа вируса, хотя почти во всех случаях эффективным может быть введение сыворотки человека, содержащей специфичные для вируса антитела (например, IgA, IgG).
1) Вирус гриппа
Инфекция вирусом гриппа приводит к повышенной температуре, кашлю, миалгии, головной боли и недомоганию, которые часто возникают при сезонных эпидемиях. Грипп также ассоциирован с рядом постинфекционных расстройств, таких как энцефалит, миоперикардит, синдром Гудпасчера и синдром Рея. Инфекция вирусом гриппа также подавляет нормальную легочную антибактериальную защиту, так что при выздоровлении пациента от гриппа имеется повышенный риск развития бактериальной пневмонии.
Поверхностные белки вируса гриппа имеют заметную вариабельность по антигенам в результате мутации и рекомбинации. Таким образом, цитолитические T-лимфоциты являются основным средством хозяина для элиминации вируса после инфекции. Вирус гриппа классифицируют на три основных типа: A, B и C. Вирус гриппа A является уникальным в том смысле, что он инфицирует как человека, так и многих других животных (например, свиней, лошадей, птиц и тюленей) и является главной причиной пандемического гриппа. Также, в том случае, когда клетка инфицирована двумя разными штаммами вируса гриппа A, сегментированные РНК-геномы двух исходных типов вируса смешиваются во время репликации, создавая гибридную реплику, что приводит к новым эпидемическим штаммам. Вирус гриппа B не реплицируется у животных и, следовательно, имеет меньшую генетическую вариабельность, а вирус гриппа C имеет только один серотип.
Большинство обычных терапевтических средств являются паллиативными, уменьшающими симптомы, возникающие в результате инфекции, тогда как иммунный ответ хозяина фактически устраняет заболевание. Однако некоторые штаммы (например, вируса гриппа A) могут вызывать более серьезное заболевание и смерть. Грипп типа A можно лечить как клинически, так и профилактически путем введения ингибиторов циклических аминов амантадина и римантадина, которые ингибируют репликацию вирусов. Однако клиническая применимость таких лекарственных средств ограничена вследствие относительно большой частоты развития побочных реакций, их узкого противовирусного спектра (только вирус гриппа A) и склонности вируса к резистентности. Введение сывороточного IgG-антитела к основным поверхностным белкам вируса гриппа, гемагглютинину и нейраминидазе, может предотвращать легочную инфекцию, тогда как IgA слизистой оболочки требуется для предотвращения инфекции верхних дыхательных путей и трахеи. Наиболее эффективным современным средством лечения гриппа является вакцинация посредством введения вируса, инактивированного формалином или β-пропиолактоном.
2) Вирус кори
После инкубационного периода в течение 9-11 дней у хозяев, инфицированных вирусом кори, развивается повышенная температура, кашель, насморк и конъюнктивит. В течение 1-2 дней развивается эритематозная, макулопапулезная сыпь, которая быстро распространяется по всему телу. Поскольку инфекция также подавляет клеточный иммунитет, то для хозяина существует повышенный риск развития бактериальных суперинфекций, включая средний отит, пневмонию и постинфекционный энцефаломиелит. Острая инфекция ассоциирована со значительным уровнем заболеваемости и смертности, особенно у молодых людей при плохом питании.
Лечение кори заключается в пассивном введении суммарного IgG человека, который может предотвращать инфекцию у неиммунизированных субъектов, даже если его принимать вплоть до одной недели после воздействия. Однако предварительная иммунизация живым ослабленным вирусом представляет собой наиболее эффективный способ лечения и предотвращает заболевание более чем у 95% иммунизированных людей. Так как существует один серотип такого вируса, то одна иммунизация или инфекция обычно приводит к защите от последующей инфекции на протяжении всей жизни.
У небольшой части инфицированных хозяев корь может развиваться в SSPE, который является хроническим прогрессирующим неврологическим расстройством, возникающим в результате персистирующей инфекции центральной нервной системы. SSPE вызывают клональные варианты вируса кори с дефектами, которые влияют на сборку и отпочковывание вирионов. У таких пациентов может быть желательной реактивация T-клеток антителами к PD-L1 согласно изобретению с целью облегчения выведения вирусов.
3) Вирус гепатита B
Вирус гепатита B (HB-V) является наиболее инфекционным из известных передающихся с кровью патогенов. Он является основной причиной острого и хронического гепатита и карциномы печени, а также продолжающейся в течение всей жизни хронической инфекции. После инфицирования вирус реплицируется в гепатоцитах, которые затем также сбрасывают поверхностный антиген HBsAg. Выявление избыточных уровней HBsAg в сыворотке используют в качестве стандартного способа диагностики инфекции вирусом гепатита B. Острая инфекция может разрешаться или она может развиваться в хроническую персистирующую инфекцию.
Современные средства для лечения в случае хронической инфекции HBV включают α-интерферон, который увеличивает экспрессию человеческого лейкоцитарного антигена (HLA) класса I на поверхности гепатоцитов, тем самым облегчая их узнавание цитотоксическими T- лимфоцитами. Соответственно, нуклеозидные аналоги ганцикловир, фамцикловир и ламивудин также проявили некоторую эффективность при лечении HBV-инфекции в клиническом испытании. Дополнительные средства для лечения HBV включают пегилированный α-интерферон, аденфовир, энтекавир и телбивудин. Хотя пассивный иммунитет можно придать посредством парентерального введения сывороточных антител к HBsAg, вакцинация инактивированным или рекомбинантным HBsAg также придает резистентность к инфекции. Для терапевтической пользы антитела к PD-L1 согласно изобретению можно сочетать с традиционными способами лечения инфекций гепатита B.
4) Вирус гепатита C
Инфекция вирусом гепатита C (HC-V) может приводить к хронической форме гепатита и в результате к циррозу печени. Хотя симптомы сходны с симптомами инфекций гепатита B, четко выраженным отличием от HB-V является то, что инфицированные хозяева могут не иметь симптомов на протяжении 10-20 лет. Лечение инфекции HC-V включает введение комбинации α-интерферона и рибавирина. Многообещающим возможным средством для лечения инфекции HC-V является ингибитор протеазы телапревир (VX-960). Дополнительные средства для лечения включают: антитело к PD-1 (MDX-1106, Medarex), бавитуксимаб (антитело, которое связывает анионный фосфолипид фосфатидилсерин зависимым от B2-гликопротеина I образом, Peregrine Pharmaceuticals), антитело (антитела) против белка оболочки E2 вируса HPV (например, ATL 6865 - Ab68 + Ab65, XTL Pharmaceuticals) и Civacir® (поликлональный человеческий иммуноглобулин против HCV). Для терапевтической пользы антитела к PD-L1 согласно изобретению можно сочетать с одним или более указанными средствами для лечения инфекций гепатита C.
Ингибиторы протеазы, полимеразы и NS5A, которые могут быть использованы в сочетании с антителами к PD-L1 согласно изобретению для специфичного лечения инфекции гепатита C, включают следующие средства, указанные в таблице B.
5) Вирус иммунодефицита человека (ВИЧ)
ВИЧ атакует клетки CD4+, включая T-лимфоциты, моноциты-макрофаги, фолликулярные дендритные клетки и клетки Лангерганса, и происходит истощение популяции клеток хелперов/индукторов CD4+. В результате хозяин приобретает тяжелую недостаточность опосредованного клетками иммунитета. Инфекция ВИЧ приводит к СПИДу, по меньшей мере, у 50% людей и передается при половом контакте, в результате введения инфицированной крови или продуктов крови, при искусственном оплодотворении инфицированной спермой, пользовании содержащими кровь иглами или шприцами и в результате передачи от инфицированной матери ребенку во время родов.
У хозяина, инфицированного ВИЧ, симптомы могут не наблюдаться или может развиваться острое заболевание, которое напоминает мононуклеоз - повышенная температура, головная боль, больное горло, недомогание и сыпь. Симптомы могут прогрессировать до прогрессирующей дисфункции иммунной системы, включая хроническое повышение температуры, ночную потливость, потерю массы, необъяснимую диарею, экзему, псориаз, себорейный дерматит, опоясывающий герпес, кандидоз ротовой полости и волосистую лейкоплакию ротовой полости. Оппортунистические инфекции у хозяина паразитов распространены у пациентов, у которых инфекции развиваются в СПИД.
Лечение ВИЧ заключается в противовирусной терапии, применении нуклеозидных аналогов, зидовудина (AST) отдельно или в сочетании с диданозином или зальцитабином, дидезоксиинозина, дидезоксицитидина, ламивудина, ставудина; ингибиторов обратной транскриптазы, таких как делавирдин, невирапин, ловирид, и ингибиторов протеиназы, таких как саквинавир, ритонавир, индинавир и нелфинавир. Для терапевтической пользы антитела к PD-L1 согласно изобретению можно сочетать с традиционными способами лечения ВИЧ-инфекций.
6) Цитомегаловирус
Цитомегаловирусная (CMV) инфекция часто ассоциирована с персистирующей, латентной и рецидивирующей инфекцией. CMV инфицирует и остается латентным в моноцитах и клетках-предшественниках моноцитов и гранулоцитов. Клинические симптомы CMV включают подобные мононуклеозу симптомы (т.е. повышенную температуру, увеличенные желез, недомогание) и тенденцию к развитию аллергической кожной сыпи на антибиотики. Вирус распространяется при прямом контакте. Вирус попадает в мочу, слюну, сперму и в меньшей степени в другие жидкости организма. Передача также может происходить от инфицированной матери плоду или новорожденному и при переливании крови и трансплантациях органов. Инфекция CMV приводит к общему нарушению клеточного иммунитета, характеризуемому нарушенными реакциями бласттрансформации с неспецифичными митогенами и специфичными CMV-антигенами, пониженной цитотоксической способностью и увеличением количества CD8-лимфоцитов и лимфоцитов CD4+.
Средства для лечения CMV-инфекции включают противовирусные средства ганцикловир, фоскарнет и цидовир, но такие лекарственные средства обычно назначают только пациентам с ослабленным иммунитетом. Для терапевтической пользы антитела к PD-L1 согласно изобретению можно сочетать с традиционными средствами лечения цитомегаловирусных инфекций.
7) Вирус Эпштейн-Барр
Вирус Эпштейн-Барр (EBV) может приводить к персистирующей и латентной инфекциям и, главным образом, атакует B-клетки. Инфекция EBV приводит к клиническому состоянию инфекционного мононуклеоза, который включает повышенную температуру, больное горло, часто с экссудатом, генерализованную лимфоаденопатию и спленомегалию. Также имеет место гепатит, который может развиваться в желтуху.
Хотя обычные способы лечения EBV-инфекций представляют собой способы, снимающие симптомы, EBV ассоциирован с развитием некоторых злокачественных опухолей, таких как лимфома Беркитта и носоглоточная злокачественная опухоль. Таким образом, удаление вирусной инфекции до появления таких осложнений может быть весьма полезным. Для терапевтической пользы антитела к PD-L1 согласно изобретению можно сочетать с традиционными способами лечения инфекции вирусом Эпштейн-Барр.
8) Вирус герпеса
Вирус простого герпеса (HSV) передается при прямом контакте с инфицированным хозяином. Прямая инфекция может быть бессимптомной, но обычно приводит к появлению волдырей, содержащих инфекционные частицы. Заболевание проявляется в виде циклов активных периодов заболевания, при этом поражения появляются и исчезают, так как вирусы латентно инфицируют нервный ганглий с последующими вспышками заболевания. Поражения могут быть на лице, гениталиях, глазах и/или руках. В некоторых случаях инфекция также может вызывать энцефалит.
Лечение герпетических инфекций направлено, главным образом, на разрешение вспышек симптомов и включает противовирусные лекарственные средства системного действия, такие как: ацикловир (например, Zovirax®), валацикловир, фамцикловир, пенцикловир, и местные лекарственные средства, такие как докозанол (Abreva®), тромантадин и зилактин. Клиренс латентных герпетических инфекций может иметь важное клиническое значение. Для терапевтической пользы антитела к PD-L1 согласно изобретению можно сочетать с традиционными способами лечения инфекций вируса герпеса.
9) HTLV
Человеческий T-лимфотрофический вирус (HTLV-1, HTLV-2) передается при половом контакте, грудном вскармливании или через зараженную кровь. Вирус активирует подгруппу TH-клеток, называемых Th1-клетками, приводя к их сверхпролиферации и сверхпродукции Th1-родственных цитокинов (например, IFN-γ и TNF-α). Это, в свою очередь, приводит к подавлению Th2-лимфоцитов и снижению продукции цитокинов Th2 (например, IL-4, IL-5, IL-10 и IL-13), вызывая снижение способности инфицированного хозяина формировать адекватный иммунный ответ на проникающие микроорганизмы, когда для клиренса требуется Th2-зависимый ответ (например, паразитические инфекции, продуцирование антител слизистой оболочки и гуморальных антител).
HTLV-инфекции вызывают оппортунистические инфекции, приводящие к бронхоэктазии, дерматиту и суперинфекциям Staphylococcus spp. и Strongyloides spp., в результате вызывающим смерть от полимикробного сепсиса. HTLV-инфекция также может непосредственно приводить к T-клеточному лейкозу/лимфоме взрослых и заболеванию с прогрессирующей демиелинизацией верхних мотонейронов, известному как HAM/TSP. Клиренс латентных HTLV-инфекций может иметь важное клиническое значение. Для терапевтической пользы антитела к PD-L1 согласно изобретению можно сочетать с традиционными способами лечения HTLV-инфекций.
10) HPV
Вирус папилломы человека (HPV) главным образом поражает кератиноциты и встречается в двух формах: кожной и генитальной. Полагают, что передача осуществляется при прямом контакте и/или половым путем. Как кожная, так и генитальная HPV-инфекция может приводить к бородавкам и латентным инфекциям и иногда к рекуррентным инфекциям, которые находятся под контролем иммунитета хозяина, который контролирует симптомы и блокирует появление бородавок, но при этом у хозяина сохраняется способность передавать инфекцию другим.
Инфекция HPV также может приводить к некоторым злокачественным опухолям, таким как рак шейки матки, заднего прохода, вульвы, полового члена и рак полости рта и глотки. Не существует известных способов излечения от HPV-инфекции, но современное лечение заключается в местном применении имиквимода, который стимулирует иммунную систему для атаки пораженной области. Клиренс латентных HPV-инфекций может иметь большое клиническое значение. Для терапевтической пользы антитела к PD-L1 согласно изобретению можно сочетать с традиционными способами лечения HPV-инфекций.
c. Грибы
Грибковые инфекции или микозы могут приводить либо к первичной инфекции, либо к оппортунистической колонизации эндогенной флорой хозяев с ослабленной иммунной системой. Иммунитет против микозов, в основном, является клеточным, и в него вовлечены нейтрофилы, макрофаги, лимфоциты и, вероятно, природные клетки-киллеры (NK). Микозы обычно не чувствительны к непосредственному уничтожению антителами и комплементом. Системные инвазивные микозы, возникающие в результате первичной инфекции, включают бластомикоз, кокцидиоидомикоз, гистоплазмоз и паракокцидиоидомикоз. В случае хронических инфекций, возникающих в результате грибковых инфекций, антитела к PD-L1 согласно изобретению можно вводить до, одновременно или после любого из обычных известных средств для лечения таких микозов.
Бластомикозом, вызываемым Blastomyces dermatitis, заражаются через дыхательные пути, и он приводит к первичной легочной инфекции или гематогенно-диссеминированному заболеванию, поражающему преимущественно кожу, кости и мочеполовой тракт у мужчин. Первичное воздействие может быть бессимптомным или оно может вызывать гриппоподобный синдром. Такое заболевание может проявляться в хронической вялотекущей форме. Заболевание также ассоциировано с ослабленным иммунитетом, таким как у пациентов, больных СПИДом. Традиционная терапия инфекции B. dermatitis включает интраконазол, кетоконазол или внутривенную инъекцию амфотерицина B.
Кокцидиоидомикозом, вызываемым Coccidioides immitis, заражаются через дыхательные пути, и он может вызывать первичную легочную инфекцию, прогрессирующее заболевание легких или гематогенно-диссеминированное заболевание, поражающее преимущественно кожу, подкожные ткани, кости, суставы и мозговые оболочки. Первичное воздействие может быть бессимптомным (60%) или ассоциированным с гриппоподобным синдромом. Может иметь место пневмония, плеврит и образование полостей в легком. Метастатические проявления включают поражения кожи, включая узелки, язвы, свищевые ходы из более глубоких участков и веррукозные гранулемы, повреждения костей, суставов, влагалищ сухожилий и мозговых оболочек, включая менингит. Заболевание также ассоциировано с ослабленным иммунитетом, таким как у пациентов, больных СПИДом. Лечение кокцидиоидомикоза включает кетоконазол, интраконазол и флуконазол, особенно для длительной поддерживающей терапии в случае неменингеального заболевания. Менингеальные формы обычно лечат посредством интратекального введения амфотерицина B.
Гистоплазмоз, вызываемый Histoplasma capsulatum, является заболеванием ретикулоэндотелиальной системы, которым заражаются через дыхательные пути и в случае которого в макрофагах находятся очень мелкие дрожжи. Гистоплазмоз может вызывать первичную легочную инфекцию, прогрессирующее заболевание легких или гематогенно-диссеминированное заболевание, в которое вовлечена преимущественно ретикулоэндотелиальная система, поверхности слизистой оболочки и надпочечники. Реактивация латентных инфекций часто происходит у пациентов с ослабленным иммунитетом, таких как пациенты, больные СПИДом. Первичное воздействие может быть бессимптомным или ассоциированным с гриппоподобным синдромом, включая пневмонию, плеврит, образование полостей в легком и медиастинальную аденопатию. Метастатические места включают ретикулоэндотелиальную систему (гепатоспленомегалия, лимфаденопатия, анемия, лейкопения и тромбоцитопения), слизистые оболочки (ороназофарингеальные изъязвления), желудочно-кишечный тракт (мальабсорбция) и недостаточность надпочечников. Хотя большинство первичных инфекций разрешается спонтанно, при ассоциации с ослабленным иммунитетом, таким как у пациентов, больных СПИДом, возникают рецидивы, и инфекция ассоциирована с гематогенной пневмонией, РДСВ (ARDS), синдромом диссеминированной внутрисосудистой коагуляции (DIC, ДВС), гематогенно распространяемыми папулопустулами и менингитом. Гистоплазмоз лечат амфотерицином B (особенно у пациентов с ослабленным иммунитетом в острой фазе заболевания с гематогенной диссеминацией), интраконазолом и кетоконазолом.
Паракокцидиоидомикоз, вызываемый Paracoccidioides brasiliensis, является приобретаемым при дыхании микозом, который может вызывать первичную легочную инфекцию или гематогенно диссеминированное заболевание, поражающее преимущественно кожу, слизистые оболочки, ретикулоэндотелиальную систему и надпочечники. Инфекция сначала может быть бессимптомной, но спящей, а затем пробуждается. Для лечения такой инфекции используют кетоконазол, интраконазол и сульфонамиды.
Системные инвазивные микозы, вызываемые оппортунистическими патогенами, которые возникают у хозяев с ослабленной иммунной системой, включают кандидамикоз, криптококкоз, аспергиллез, мукормикоз и пневмоцистоз. Благодаря повышению иммунного ответа при ослабленной иммунной системе антитела к PD-L1 согласно изобретению также могут иметь терапевтическую ценность при лечении таких состояний, особенно в сочетании с обычными средствами лечения.
Лечение кандидамикоза (вызванного Candida albicans, C. tropicalis, C. glabrata), криптококкоза (вызванного Cryptococcus neoformans), аспергиллеза (вызванного Aspergillus flavus, A. fumigatus, A. tereus и A. niger) и мукормикоза (вызванного Rhizopus arrhizus, Rhizomuco, Absidia, Cunninghamella, Mortierella, Saksenaea spp.) можно осуществлять одним или более из следующих средств: имидазолом, кетоконазолом, интраконазолом, флуконазолом, амфотерицином B с флуцитозином или без него. Пневмоцистоз (вызываемый Pneumocystis carnii), классификация которого недавно изменена как заболевания, вызываемого не простейшими, а грибами, лечат триметопримом-сульфаметоксолом (TMP-SMZ) и внутривенно изетионатом пентамидина, а также дапсоном, TMP-дапсоном, триметрексатом, клиндамицином-примахином и атовагноном.
Классификация микроспоридиоза, вызываемого паразитами Microsporidia, недавно изменена как заболевания, вызываемого не простейшими, а грибами. Они являются одноклеточными организмами, которые имеют митосомы вместо митохондрий. Организмы, которые могут вызывать заболевание у людей, включают: Enterocytozoon bieneusi, Encephalitozoon hellem, Encephalitozoon intestinalis, Encephalitozoon cuniculi, Pleistophora spp, Trachipleistophora hominis, Trachipleistophora anthropophthera, Nosema connori, Nosema ocularum, Brachiola vesicularum, Vittaforma corneae, Microsporidium ceylonensis, Microsporidium africanum, Brachiola algerae.
Полагают, что инфекции передаются человеку при прямом контакте с животными, через зараженную воду или от другого инфицированного хозяина. После инфицирования клеток-хозяев спороплазма растет, делится и образует многоядерный плазмодий, который может иметь сложные жизненные циклы, включая как бесполое, так и половое размножение. Аутоинфекция последующими поколениями и хронические изнуряющие заболевания часто характеризуют микроспоридиальные инфекции.
Клинические проявления заболевания могут варьировать в зависимости от вида и иммунного статуса хозяина и включают конъюнктивит (например, V. corneae), хроническую диарею, мальабсорбцию и истощение (например, E. bieneusi, E. intestinalis).
Лечение глазного, кишечного и диссеминированного микроспороза включает введение албендазола. Местное применение фумагиллина также можно эффективно использовать для лечения микроспоридиального кератоконъюнктивита. Другие лекарственные средства включают противоглистные средства (например, албендазол), антибиотики (например, фумагиллин), иммуномодуляторы (например, талидомид), противопротозойные средства (например, метронидазол).
d. Простейшие
Заболевания, возникающие в результате паразитических расстройств, такие как малярия, шистосомоз и лейшманиоз, относятся к наиболее распространенным и важным проблемам здоровья в развивающихся странах. Такие заболевания представляют собой особую проблему, так как они могут ускользать от иммунитета хозяина различными способами, включая: 1) существование внутри клеток хозяина (например, лейшмании), 2) быстрое изменение поверхностных антигенов (например, трипаносомы) и 3) «маскировка» собственных клеток в виде клеток хозяина посредством презентирования антигенов хозяина (например, шистосоматоз). Применение иммунодепрессивных лекарственных средств для лечения злокачественной опухоли и вместе с трансплантацией органов, а также глобальная распространенность СПИДа могут приводить к реактивации латентных или субклинических инфекций Plasmodium spp., Toxoplasma spp., Leishmania spp., Cryptosporidium spp., Trypanosoma spp. и гельминтами.
В случае хронических инфекций в результате инфекций, вызванных простейшими паразитами, антитела к PD-L1 согласно изобретению можно комбинировать путем введения в сочетании, перед или после стандартных противопротозойных лекарственных средств.
Малярия, вызываемая паразитами рода Plasmodium (например, P. ovale, P. malariae, P. falciparum, P. vivax), начинает инфекционный цикл в виде спорозоита, который развивается в кишечнике самок малярийного комара. После переноса человеку такие спорозоиты проникают и размножаются в клетках печени, не индуцируя воспалительной реакции. Потомки таких организмов, называемые мерозоитами, затем проникают в эритроцитарные клетки и инициируют клиническую фазу заболевания, обычно характеризуемую перемежающейся лихорадкой. В тех регионах мира, где инфекция является эндемической, почти все жители являются носителями длительных хронических инфекций низкого уровня от низкой до средней патогенности, с возрастающими уровнями IgG-антител, обеспечивающими защиту от проникновения мерозоитов в эритроциты.
Имеющиеся в настоящее время противомалярийные лекарственные средства как для лечения клинического заболевания, так и для профилактики включают: артеметер-лумефантрин (терапия, например, Coarte®® и Riamet®), артесунат-амодиахин (терапия), артесунат-мефлохин (терапия), артесунат-сульфадоксин/пириметамин (терапия), атовахон-прогуанил, (терапия и профилактика, например, Malarone®), хинин (терапия), хлорохин (терапия и профилактика), котрифазид (терапия и профилактика), доксициклин (терапия и профилактика), мефлохин (терапия и профилактика, например, Lariam®), примахин (терапия только P. vivax и P. ovale; не для профилактики), прогуанил (профилактика), сульфадоксин-пириметамин (терапия и профилактика), гидроксихлорохин (терапия и профилактика, например, Plaquenil®).
Благодаря реактивации анергических T-клеток, антитела к PD-L1 согласно изобретению могут быть особенно полезным терапевтически средством, способствующим клиренсу малярийных паразитов.
Токсоплазмоз, вызываемый паразитами рода Toxoplasma, часто является бессимптомным, но в небольшой части может развиваться клиническое заболевание, диапазон которого может быть от доброкачественной лимфоаденопатии до острых или летальных инфекций центральной нервной системы. Источники инфекции включают цисты в сырой или плохо проваренной свинине или баранине и ооциты, выходящие в экскременты инфицированных кошек. Инфекция проникает в организм человека обычно через желудочно-кишечный тракт, и простейшие могут проникать и пролиферировать (в виде тахизоитов) практически в каждой клетке организма. Такие тахизоиты могут продуцировать цисты, заполненные небольшими, медленно растущими инфекционными частицами (брадизоиты), которые сохраняют жизнеспособность в течение длительных периодов времени, приводя к латентной хронической инфекции. Хозяева с ослабленной иммунной системой, такие как хозяева, принимающие иммунодепрессанты или страдающие от ВИЧ, особенно склонны к заболеванию токсоплазмозом.
Лекарственные средства, которые используют для лечения первичного токсоплазмоза, включают следующие средства: пириметамин, как в сочетании с антибиотиками (например, сульфадиазином, клиндамицином, спирамицином и миноциклином), так и без антибиотиков. Латентный токсоплазмоз можно лечить антибиотиком атоваквоном вместе с клиндамицином или без клиндамицина.
Лейшманиоз, вызываемый паразитами рода Leishmania, инфицирует макрофаги кожи и внутренних органов и передается человеку мошками. Так как в сыворотке имеются низкоспецифичные антитела или специфичные антитела отсутствуют, то основным путем клиренса инфекции, по-видимому, является опосредованный клетками иммунитет, обусловленный активированными T-клетками. Лейшманиоз в странах Старого Света, также известный как кожный лейшманиоз, вызывают несколько видов Leishmania: L. tropica, L. major и L. aethiopica. Лейшманиоз в странах Нового Света вызывают различные подвиды L. Mexicana и L. braziliensis. Такие паразиты индуцируют сильный опосредованный клетками иммунный ответ, но исход клинического заболевания, отчасти, также приводит к гуморальному ответу хозяина. Если у хозяина формируется подавленный или неадекватный клеточный ответ, то результатом является диффузный хронический кожный лейшманиоз, в случае которого мало надежды на спонтанное выздоровление (например, L. aethiopica, L. Mexicana). Если у хозяина формируется чрезмерный клеточный ответ, то результатом является люпоидный или рецидивирующий лейшманиоз с персистирующими, не склонными к изъязвлению лимфоидными бугорками по краю первичных поражений (например, L. tropica). Рецидивирующий лейшманиоз может проявляться через 1-10 лет после начального поражения. Существуют две формы заболевания, кожная и висцеральная, при этом кожная форма проявляется в поражениях кожи, при которых опосредованный клетками иммунитет является решающим для клиренса. В случае висцеральной формы опосредованный клетками иммунитет не достаточен или отсутствует, и заболевание клинически проявляется в виде поликлональной B-клеточной гипергаммаглобулинемии, лейкопении, спленомегалии и повышенной продукции TNF-α.
Милтефозин (например, Impavido®) и парамиоцин являются современными средствами для лечения как кожного, так и висцерального лейшманиоза.
Криптоспоридиоз вызывают инфекции простейшими рода Cryptosporidia, и причиной может быть прямой контакт человека с экскрементами инфицированных хозяев. Инфекция слизистой ткани человека может приводить к диарее. Заболевание обычно проявляется в виде острой инфекции, но она может стать хронической, особенно у людей с ослабленной иммунной системой. Лечение обычно является паллиативным, особенно восполнение потери жидкости, но успешными для выведения инфекции были паромомицин, азитромицин и сывороточный Ig (например, Lactobin-R®).
Трипаносомоз, вызываемый паразитом Trypanosoma (например, T. Brucei, подвиды gambiense, rodesiense), инфицирует людей и крупный рогатый скот при укусах мухи цеце. Проблема, которую создает этот патоген, обусловлена тем, что последующие поколения популяций презентируют разные поверхностные антигены. Инфекции характеризуются повышенными уровнями неспецифичных и не защищающих сывороточных иммуноглобулинов.
Лечение трипаносомоза включает внутривенное введение следующих средств: пентамидина (в случае T.b. gambiense), внутривенного сурамина (в случае T.b. rhodesiense), эфлорнитина, меларсопрола с нифуртимоксом и без него.
Глистные инфекции, вызываемые трематодами (например, Schistosoma spp.), цестодами и нематодами, приводят к общим иммунным ответам эозинофилии и выработке реагиновых антител, ответам, которые зависят от T-клеток.
Шистосомоз (также известный как бильгарция) вызывают Shistosoma mansoni, S. japonicum, S. haematobium и S. mekongi), которые начинают свой жизненный цикл в виде яиц в воде, из которых затем выходят мирацидии, которые проникают в улиток и дают множество поколений спороцист. Спороцисты, в свою очередь, дают начало вилохвостым церкариям, которые могут попадать в кровоток человека в виде шистосомул, которые мигрируют сначала в легкие, а затем в печень. Такие трематоды в конечном итоге спариваются и откладывают яйца в брыжеечные венулы. Хотя многие из таких яиц перемещаются в кишечник и экскретируются, некоторые задерживаются в подслизистой оболочке, воротных венулах печени и других органах тела. Гранулематозное воспаление, ассоциированное с задержанными яйцами, является определяющим симптомом хронического шистосомоза.
Лечение шистосомоза включает введение празиквантела (Praziquantel®), сурьмы, оксамниквина (S. mansoni) и миразида (Mirazid®).
Инфекции цестодами можно классифицировать на две группы, в случае одной в кишечнике присутствуют взрослые ленточные черви, такие как Diphyllobothrium latum и Taenia saginata, которые имеют ограниченный негуморальный иммунный эффект. Вторая группа описывает мигрирующие инцистирующиеся в тканях личинки ленточных червей, таких как Hymenolepis nana, Echinococcus granulosus и Taenia solium, которые индуцируют сильные парентеральные реакции хозяина и защитные антитела в сыворотке. Большинство серьезных цестодных инфекций у человека представляют собой эхинококкоз, который в случае внедрения в печень, легкие, головной мозг, почки или другие части тела может приводить к образованию гидатид.
Лечение эхинококкоза включает введение метронидазола, албендазола и хирургическое вмешательство, такое как удаление, аспирация, марсупиализация или оментопексия.
Нематоды являются наиболее широко варьирующими и широко распространенными гельминтами, которые инфицируют людей, вызывая такие расстройства, как трихинеллез, аскаридоз, филяриоз и стронгилоидоз. Трихинеллез, вызываемый Trichinella spiralis, может возникать в результате проглатывания личинки T. spiralis в сыром мясе или плохо проваренном мясе, таком как свинина. У человека инфекции вызывают сильный гуморальный ответ с повышенным IgM, с последующей продукцией IgG, затем быстрым удалением поврежденных антителами червей T-лимфоцитами.
Единственным известным средством для лечения, убивающим взрослых червей в кишечнике, является тиабендазол, тогда как известного средства, убивающего личинки, не существует.
Аскарида, также известная как гигантский круглый червь (Ascaris lumbricoides), является распространенным паразитом у людей, попадающим в организм при проглатывании загрязненных фекалиями веществ. Хотя у пациентов в течение очень длительных периодов могут не проявляться симптомы, пока личиночные стадии перемещаются по организму, они могут вызывать висцеральное повреждение, перитонит и воспаление, увеличение печени или селезенки, токсичность и пневмонию.
Лечение аскаридоза включает введение мебендазола (например, Vermox®), пиперазина, памоата пирантела (например, Antimint®®, Pin-Rid®, Pin-X®), албендазола, тиабендазола с пиперазином или без пиперазина, гексилрезорцинола, сантонина и масла Chenopodium. Антитела к PD-L1 согласно изобретению можно вводить в сочетании, перед или после введения таких терапевтических средств для лечения аскаридоза.
Филяриоз, вызываемый нематодами филяриями, передается человеку переносчиками насекомыми. Onchocerca volvulus, который вызывает онхоцеркоз или речную слепоту, передается при укусах мошек. Инфекционные личинки поселяются подкожно и развиваются во взрослых нематод, индуцируют фиброгенный ответ хозяина и дают большое количество микрофилярий, которые распространяются подкожно и по всему глазу, индуцируя затем кератит или ретинит, который затем приводит к утрате прозрачности роговицы. Лимфатический филяриоз возникает в результате инфекции Brugia spp. и Wuchereria spp. С течением времени рубцевание лимфатической ткани, особенно в паху, может препятствовать дренированию, приводя к обезображивающему состоянию слоновости.
Первичным лечением филяриоза является введение антибиотика ивермектина, абендазола и цитрата диэтилкарбамазина (DEC, Hetrazan®) вместе с ивермектином или албендазолом или без них. Другие средства для лечения включают доксициклин, который убивает симбиотические бактерии Вольбахия.
Стронгилоидоз, вызываемый паразитами рода Strongyloides (например, S. stercoralis, S. fulleborni), представляет собой заболевание, которым человек заражается через загрязненную фекалиями почву. Стронгилоиды могут существовать как в цикле свободноживущих организмов (рабдитовидные личинки, созревающие во взрослых червей), так и в цикле паразитов (филяриевидные личинки, созревающие во взрослых червей), которые проникают в кожу, перемещаются в легкие, затем в глотку и, в конце концов, поселяются в кишечнике. Также известно, что имеет место аутоинфекция Strongyloides, которая по существу является вторичной инфекцией последующими поколениями филяриевидных личинок.
Инфекции могут быть бессимптомными или могут характеризоваться болью в желудочно-кишечном тракте и диареей, синдромом Леффлера в легких (т.е. эозинофилией) и крапивницей. Также может иметь место эозинофилия крови. Так как персистирующая инфекция Strongyloides может имитировать пептическую язву, заболевание желчного пузыря и болезнь Крона, распространен ошибочный диагноз. Особенно это является проблемой у хозяев с ослабленным иммунитетом.
Известными средствами для лечения стронгилоидоза являются ивермектин, албендазол или тиабендазол, но поскольку такие лекарственные средства убивают только взрослых червей, необходимо повторное введение.
e. Вакцинация
Вакцинацию или введение антигенного вещества с целью индукции иммунитета к заболеванию обычно используют для предотвращения или ослабления эффектов инфекции патогеном. Можно использовать усиление иммунитета хозяина на нежелательные антигены, встречающиеся не только на инфекционных патогенах, но также на ткани хозяина, которая поражается заболеванием (например, злокачественной ткани). Традиционно вакцины получают из ослабленных или убитых целых патогенов, но они также могут представлять собой пептиды, презентирующие эпитопы на интактном патогене, которые специфично распознаются молекулами главного комплекса гистосовместимости (MHC) класса I или класса II человека. Пептидными антигенами, представляющими особый интерес, являются антигены, которые специфично распознаются T-клетками.
Недавно было показано, что сочетание терапевтической вакцинации с введением блокады PD-L1 на истощенных T-клетках CD8+ приводило к усиленной функции и вирусному контролю в мышиной модели хронической инфекции. Ha et al., J. Exp. Med. 205(3): 543-555 (2008). В результате, антитела к PD-L1, описанные в настоящей публикации, также можно сочетать с антигенной вакцинацией (например, введение перед, одновременно или после) для лечения инфекции (например, острой и хронической), возникающей в результате проникновения вирусов, бактерий, грибов или простейших, а также опухолевого иммунитета.
G. Фармацевтические дозы:
Дозы и требуемая концентрация лекарственного средства в фармацевтических композициях согласно настоящему изобретению могут варьировать в зависимости от конкретного предполагаемого применения. Определение соответствующей дозы или пути введения хорошо известно специалисту в данной области. Эксперименты на животных обеспечивают надежные указания для определения эффективных доз для терапии человека. Межвидовое масштабирование эффективных доз можно осуществлять, следуя принципам, установленным Mordenti J. И Chappell, W. (“The Use of Interspecies Scaling in Toxicokinetics”, в Toxicokinetics and New Drug Development, Yacobi et al., Eds, Pergamon Press, New York 1989, pp.42-46).
Когда используют введение in vivo полипептидов или антител, описанных в настоящей публикации, нормальные дозовые количества могут варьировать примерно от 10 нг/кг до примерно 100 мг/кг массы тела млекопитающего или больше в сутки, предпочтительно примерно от 1 мг/кг/сутки до 10 мг/кг/сутки, в зависимости от пути введения. Руководство по конкретным дозам и способам доставки представлено в литературе; см., например, патенты США №№ 4657760, 5206344 или 5225212. В объеме изобретения предусмотрено, что разные препараты будут эффективными в случае разных способов лечения и разных расстройств, и что введение, предназначенное для лечения конкретного органа или ткани, может требовать доставки таким образом, который отличается от доставки к другому органу или ткани. Кроме того, дозы можно вводить посредством одного или нескольких отдельных введений, или посредством непрерывной инфузии. В случае многократных введений на протяжении нескольких суток или больше, в зависимости от состояния, лечение продолжают до тех пор, пока не происходит требуемое подавление симптомов заболевания. Однако могут быть полезными другие схемы дозирования. Успешность такой терапии легко контролировать, используя обычные методики и анализы.
H. Введение препарата
Препараты согласно настоящему изобретению, включая без ограничения перерастворяемые и жидкие препараты, вводят млекопитающему, нуждающемуся в лечении антителами к PD-L1, предпочтительно человеку, известными способами, такими как внутривенное введение в виде болюса или непрерывная инфузия в течение определенного периода времени, внутримышечный, внутрибрюшинный, интрацереброспинальный, подкожный, внутрисуставной, интрасиновиальный, интратекальный, пероральный, местный или ингаляционный пути.
В предпочтительных вариантах осуществления препараты вводят млекопитающему подкожно (т.е. под кожу). Для таких целей препарат можно инъецировать с использованием шприца. Однако имеются другие устройства для введения препарата, такие как инъекционные устройства (например, устройства INJECT-EASE™ и GENJECT™); ручки-инжекторы (такие как GENPEN™); автоинжекторные устройства, безыгольные устройства (например, MEDIJECTOR™ и BIOJECTOR™); и системы доставки на основе кожного пластыря.
В конкретном варианте осуществления настоящее изобретение относится к наборам устройств для введения одной дозы. Такие наборы содержат емкость с водным препаратом терапевтического белка или антитела, включая однокамерные или многокамерные предварительно заполненные шприцы. Типичные предварительно заполненные шприцы доступны от Vetter GmbH, Ravensburg, Germany.
Подходящая доза («терапевтически эффективное количество») белка будет зависеть, например, от состояния, подвергаемого лечению, тяжести и течения заболевания, от того, вводят ли белок для профилактических или терапевтических целей, от предыдущей терапии, истории болезни пациента и ответа на антитело к PD-L1, формы применяемого препарата и решения лечащего врача. Антитело к PD-L1 соответствующим образом вводят пациенту за один раз или на протяжении серии обработок, и его можно вводить пациенту в любое время после диагностики. Антитело к PD-L1 можно вводить в виде единственного средства для лечения или вместе с другими лекарственными средствами или способами терапии, применимыми для лечения рассматриваемого состояния.
В случае антител к PD-L1 начальная выбранная доза может быть в диапазоне примерно 0,1-20 мг/кг для введения пациенту, которое может быть в форме одного или более отдельных введений. Однако могут быть применимы другие схемы дозирования. Успешность такой терапии легко контролировать, используя обычные методики.
Изделия производства
В другом варианте осуществления изобретения предлагается изделие производства, которое содержит препарат и предпочтительно инструкции по его применению. Изделие производства содержит емкость. Походящие емкости включают, например, бутылки, флаконы (например, флаконы с двойной камерой), шприцы (такие как шприцы с одной или с двумя камерами) и лабораторные пробирки. Емкость может быть изготовлена из множества материалов, таких как стекло или пластмасса. В емкости находится препарат. На этикетке, которая находится на емкости или прикреплена к емкости, могут быть приведены указания по перерастворению и/или применению. На ярлыке дополнительно может быть указано, что препарат применим или предназначен для подкожного введения и/или для лечения T-клеточного дисфункционального расстройства. Емкость, в которой содержится препарат, может представлять собой флакон для многократного применения, который позволяет осуществлять многократные введения (например, 2-6 введений) перерастворенного препарата. Изделие производства может дополнительно содержать вторую емкость, содержащую подходящий разбавитель (например, BWFI). После смешивания разбавителя и лиофилизированного препарата конечная концентрация белка в перерастворенном препарате обычно будет составлять, по меньшей мере, 50 мг/мл. Изделие производства может дополнительно содержать другие материалы, желательные с коммерческой точки зрения и точки зрения пользователя, включая другие буферы, разбавители, наполнители, иглы, шприцы и вкладыши в упаковку с инструкциями по применению.
Изобретение будет более полно понятно при обращении к следующим примерам. Однако их не следует считать ограничивающими объем изобретения. Все упоминания публикаций на протяжении описания непосредственно включены в настоящее описание путем ссылки.
В другом варианте осуществления изобретение относится к изделию производства, содержащему препараты, описанные в настоящей публикации, для введения с помощью автоинжекторного устройства. Автоинжектор может быть описан как инъекционное устройство, которое после активации будет доставлять свое содержимое без необходимости в дополнительном действии пациента или осуществляющего введение персонала. Такие устройства особенно подходят для самолечения терапевтическими препаратами, когда частота доставки должна быть постоянной и временной период доставки больше, чем несколько месяцев.
ПРИМЕР 1
Идентификация антител к PD-L1 в фаговых библиотеках
Сортировка и скрининг библиотек для идентификации антител к PD-L1
Слияния PD-L1-Fc человека (R&D Systems, № в каталоге 156-B7) и мыши (R&D Systems, № в каталоге 1019-B7) использовали в качестве антигенов для сортировки библиотек вариантов. В частности, фаговые библиотеки сортировали сначала против антигена человека, затем против антигена мыши, человека и мыши в последующих трех раундах. 96-луночные иммунологические планшеты Nunc Maxisorp® покрывали в течение ночи при 4°C антигеном-мишенью (10 мкг/мл) и блокировали в течение 1 часа при комнатной температуре блокирующим фаг буфером PBST (фосфатно-солевой буфер (PBS) и 1% (масс./об.) бычий сывороточный альбумин (БСА) и 0,05% (об./об.) твин-20). Фаговые библиотеки антител VH (см., например, Lee et al., J. Immunol. Meth. 284: 119-132, 2004) и VH/VL (см. Liang et al., J. Mol. Biol. 366: 815-829, 2007) добавляли в планшеты с антигеном по отдельности и инкубировали в течение ночи при комнатной температуре. На следующий день покрытые антигеном планшеты промывали десять раз PBT (PBS с 0,05% твина-20) и связанный фаг элюировали 50 мМ HCl и 500 мМ NaCl в течение 30 минут и нейтрализовали равным объемом 1 М основания трис (pH 7,5). Извлеченные фаги амплифицировали в клетках E. coli XL-1 Blue. Во время последующих раундов селекции инкубацию несущего антитело фага с покрытыми антигеном планшетами уменьшали до 2-3 часов, а жесткость промывки планшета постепенно увеличивали.
После 4 раундов пэннинга наблюдали значительное обогащение. Собирали 96 клонов при сортировке каждой из библиотек VH и VH/VL, чтобы определить, связываются ли они специфично как с человеческими, так и с мышиными PD-L1-Fc. Вариабельные области таких клонов секвенировали в ПЦР, чтобы идентифицировать клоны с уникальными последовательностями.
Исходные представляющие интерес клоны переводили в форму IgG клонированием областей VL и VH отдельных клонов в векторах LPG3 и LPG4 (Lee et al., см. выше), соответственно, временной экспрессией в клетках млекопитающих CHO и очисткой на колонке с белком A. Антитела на фаге 13 оценивали в отношении их способности блокировать взаимодействие между растворимым слитым белком PD-1-Fc и человеческим или мышиным PD-L1, экспрессированным в клетках 293 (значения IC50 указаны в таблице 1 - верхняя половина). YW243.55, антитело с наименьшим значением IC50 в отношении блокирования связывания PD-L1 человека с PD-1, выбирали для последующего созревания аффинности, чтобы повысить его аффинность к человеческому и мышиному PD-L1 (таблица 1). Антитело со сравнимой перекрестной реактивностью против видов приматов и мышей (а также сохраняющее аффинность к антигену человека) может представлять собой особенно ценное терапевтическое средство, поскольку то же самое антитело, которое было хорошо охарактеризовано в экспериментальных моделях, можно применять в клинических испытаниях на человеке. Это позволяет избежать неоднозначных результатов от применения специфичного для модели заменителя.
Конструирование библиотек для улучшения аффинности клонов, полученных из библиотеки VH
Фагмида pW0703 (полученная из фагмиды pV0350-2b (Lee et al., J. Mol. Biol 340: 1073-1093 (2004)), содержащая стоп-кодон (TAA) во всех положениях CDR-L3 и представляющая в виде дисплея моновалентный Fab на поверхности бактериофага M13, служила в качестве матрицы библиотеки для прививки вариабельных доменов тяжелой цепи (VH) представляющих интерес клонов из библиотеки VH для созревания аффинности. Для созревания аффинности использовали методики как жесткой, так и мягкой рандомизации. В случае жесткой рандомизации одну библиотеку легкой цепи с выбранными положениями трех CDR легкой цепи рандомизировали, используя аминокислоты, предназначенные для имитации природных антител человека, и создаваемая вырожденность ДНК соответствовала описанной Lee et al. (J. Mol. Biol. 340, 1073-1093 (2004)). В случае мягкой рандомизации мишенями были остатки в положениях 91-94 и 96 CDR-L3, 28-31 и 34-35 CDR-Hl, 50, 52 и 53-58 CDR-H2, 95-99 и 100A CDR-H3; и для рандомизации выбирали два разных сочетания петель CDR, L3/H1/H2 и L3/H3. Для достижения условий мягкой рандомизации, которые обеспечивали введение мутаций с частотой приблизительно 50% в выбранных положениях, синтезировали мутагенную ДНК с использованием смесей оснований 70-10-10-10, где более предпочтительными были нуклеотиды дикого типа (Gallop et al., Journal of Medicinal Chemistry 37: 1233-1251 (1994)).
Сортировка фагов для улучшения аффинности
Фаговые клоны, идентифицированные ранее, подвергали сортировке на планшетах в первом раунде с последующими пятью или шестью раундами сортировки в растворе. Сортировку библиотек осуществляли по отношению к PD-L1-Fc человека и мыши отдельно (R&D Systems, № в каталоге 156-B7, № в каталоге 1019-B7, соответственно). В случае использовании в качестве мишени PD-L1-Fc человека, в первом раунде сортировки на планшетах три библиотеки сортировали отдельно, используя покрытый мишенью планшет (планшет NUNC Maxisorp®), с внесением фага примерно 3 O.D./мл в 1% БСА и 0,05% твин-20 на 2 часа при комнатной температуре. После первого раунда сортировки на планшете осуществляли сортировку в растворе, чтобы повысить жесткость отбора. В случае сортировки в растворе 1 O.D./мл фага, полученного в результате размножения после первого раунда сортировки, инкубировали с 20 нМ биотинилированного белка-мишени (концентрация на основе значения IC50 исходного фагового клона) в 100 мкл буфера, содержащего 1% реагент Superblock (Pierce Biotechnology) и 0,05% твин-20, в течение 30 минут при комнатной температуре. Затем смесь разбавляли в 10 раз 1% реагентом Superblock и вносили по 100 мкл/лунку в покрытые нейтравидином лунки (5 мкг/мл) на 15 минут при комнатной температуре, осторожно встряхивая, так что биотинилированная мишень связывает фаг. Лунки промывали 10 раз PBS-0,05% твин-20. Чтобы определить фоновое связывание, использовали контрольные лунки, содержащие фаг с мишенями, которые не были биотинилированы, которые улавливали на покрытых нейтравидином планшетах. Связанный фаг элюировали, используя 0,1 N HCl, в течение 20 минут, нейтрализовали 1/10 объема 1 М трис, pH 11, титровали и размножали для следующего раунда. Затем осуществляли еще пять раундов сортировки в растворе наряду с применением двух способов повышения жесткости отбора. Первый способ предназначен для селекции в отношении скорости ассоциации посредством снижения концентрации биотинилированного белка-мишени от 4 нМ до 0,5 нМ, а второй способ предназначен для селекции в отношении скорости диссоциации посредством добавления избыточного количества небиотинилированного белка-мишени (100-2000-кратного), чтобы исключить из конкуренции более слабые связывающие компоненты, либо при комнатной температуре, либо при 37°C. Также снижали внесение фага (0,1-0,5 O.D/мл), чтобы уменьшить фоновое связывание фага. В случае использования в качестве мишени PD-L1-Fc мыши, способ сортировки фага подобен способу, описанному выше для антигена PD-L1-Fc человека, с небольшими модификациями. В частности, использовали 100 нМ биотинилированного мышиного PD-L1-Fc для пэннинга в растворе сразу после первого раунда пэннинга на планшете. В четырех последующих раундах пэннинга в растворе концентрацию биотинилированной мишени снижали с 10 нМ до 1 нМ и добавляли 200-500-кратный избыток небиотинилированной мишени при комнатной температуре.
Затем проводили дополнительный скрининг клонов с созревшей аффинностью, используя способ ELISA для высокопроизводительного скрининга аффинности, описанный в следующем примере.
ELISA для высокопроизводительного скрининга аффинности (конкуренция в одном пятне)
Собирали колонии из седьмого и шестого раундов скрининга в случае мишени PD-L1 человека и мыши, соответственно. Колонии выращивали в течение ночи при 37°C в 150 мкл/лунку среды 2YT с добавлением 50 мкг/мл карбенициллина и 1×1010/мл KO7 в 96-луночном планшете (Falcon). Из того же планшета собирали колонию XL-1-инфицированного исходного фага в качестве контроля. 96-луночные планшеты Nunc Maxisorp® покрывали 100 мкл/лунку белка PD-L1-Fc человека и мыши (2 мкг/мл) по отдельности в PBS при 4°C в течение ночи или при комнатной температуре в течение 2 часов. Планшеты блокировали, используя 65 мкл 1% БСА, в течение 30 минут и 40 мкл 1% твин-20 еще в течение 30 минут.
Супернатант фага разбавляли 1:10 в буфере для ELISA (твердофазного иммуноферментного анализа) (PBS с 0,5% БСА, 0,05% твин-20) с добавлением или без добавления 10 нМ белка-мишени в общем объеме 100 мкл и инкубировали, по меньшей мере, в течение 1 часа при комнатной температуре в F-планшете (NUNC). 75 мкл смеси с белком-мишенью или без него переносили одновременно в покрытые белком-мишенью планшеты. Планшеты осторожно встряхивали в течение 15 минут, чтобы обеспечить возможность улавливания несвязанного фага с покрытым белком-мишенью планшетом. Планшет промывали, по меньшей мере, пять раз, используя PBS-0,05% твин-20. Связывание количественно оценивали, добавляя конъюгированное с пероксидазой хрена (HRP) антитело к M13 в буфере для ELISA (1:5000) и инкубируя в течение 30 минут при комнатной температуре. Планшеты промывали PBS-0,05% твин-20, по меньшей мере, пять раз. Затем в лунку добавляли 100 мкл/лунку смеси 1:1 субстрата пероксидазы 3,3’,5,5’-тетраметилбензидина (TMB) и раствора пероксидазы B (H2O2) (Kirkegaard-Perry Laboratories (Gaithersburg, MD)) и инкубировали в течение 5 минут при комнатной температуре. Реакцию останавливали добавлением в каждую лунку 100 мкл 1М фосфорной кислоты (H3PO4) и оставляли для инкубации на 5 минут при комнатной температуре. OD (оптическую плотность) желтой окраски в каждой лунке определяли, используя стандартное считывающее устройство для планшетов ELISA, при 450 нм. Снижение OD (%) вычисляли с помощью следующего уравнения.
Снижение OD450нм (%)=[(OD450нм лунок с конкурентом)/(OD450нм лунки без конкурента)]×100
При сравнении со снижением OD450нм (%) в лунке с исходным фагом (100%) клоны, которые имели снижение OD450нм (%) меньше, чем 50%, как в случае человеческой, так и в случае мышиной мишени, отбирали для анализа последовательности. Уникальные клоны отбирали для получения фага, чтобы определить аффинность связывания (IC50 фага) по отношению к PD-L-Fc человека и мыши посредством сравнения с исходными клонами.
Материалы
hPD-1-Fc, hPD-L1-Fc, hB7.1-Fc, mPD-1-Fc, mPD-L1-Fc и mB7.1 приобретали у R & D Systems. Клетки 293, экспрессирующие hPD-L1, были созданы в Genentech с использованием стандартных способов. F(ab’)2 козы против Fc IgG человека приобретали у Jackson ImmunoResearch Laboratories.
Конъюгирование белков
Белки PD-1-Fc и B7.1-Fc биотинилировали, используя сульфо-NHS-LC-LC-биотин EZ-Link (Pierce), в течение 30 минут при комнатной температуре, как описано производителем. Избыток не вступившего в реакцию биотина удаляли, используя колонки для быстрого центрифугирования с высокой емкостью (Quick Spin High Capacity) с сефадексом G50 (Roche), как описано производителем.
F(ab’)2 козы против Fc IgG человека метили рутением, используя MSD-сульфо-метку-эфир NHS (Meso Scale Discovery), как описано производителем, и избыток не вступившей в реакцию сульфо-метки удаляли, используя колонку для быстрого центрифугирования с высокой емкостью с сефадексом G50.
ECL-анализ связывания с клетками для тестирования фаговых антител
Концентрации антител, приводящие к 50% ингибированию (IC50) связывания hPD-1-Fc с hPD-L1-экспрессирующими клетками 293, измеряли электрохемилюминесцентным (ECL) анализом связывания с клетками. Экспрессирующие hPD-L1 клетки 293 промывали фосфатно-солевым буфером (PBS) и высевали по 25000 клеток на лунку в 25 мкл PBS на 96-луночный планшет High Bind (Meso Scale Discovery). Клетки в планшете инкубировали при комнатной температуре, чтобы обеспечить клетке возможность прикрепиться к углеродной поверхности планшета. В каждую лунку добавляли 25 мкл 30% FBS и инкубировали планшет в течение 30 минут с умеренным встряхиванием, чтобы блокировать участки неспецифического связывания. Планшет три раза промывали PBS на устройстве для промывки микропланшетов для ELISA (ELx405 Select, Bio-Tek Instruments) в условиях мягкого диспергирования и аспирации. Избыток PBS в лунках удаляли, промокая планшет бумажными полотенцами. В каждую лунку добавляли 12,5 мкл антител в 2-кратной концентрации в 3% FBS в PBS (буфер для анализа), а затем 12,5 мкл раствора 4 мкг/мл (2-кратная концентрация) hPD-1-биотина в буфере для анализа и планшет инкубировали в течение одного часа с осторожным встряхиванием. Планшет 3 раза промывали PBS на устройстве для промывки микропланшетов и промокали планшет бумажными полотенцами. Добавляли 25 мкл раствора стрептавидина-рутения (Meso Scale Discovery) в концентрации 2 мкг/мл и инкубировали в буфере для анализа при комнатной температуре в течение 30 минут с осторожным встряхиванием. Промывали 3 раза PBS на устройстве для промывки микропланшетов и промокали планшет на бумажных полотенцах. Добавляли 150 мкл 1X буфера для регистрации MSD без поверхностно-активного вещества (Meso Scale Discovery). Регистрировали излучаемое люминесцентное свечение при 620 нм на считывающем устройстве Sector Imager 6000 (Meso Scale Discovery). Значения ECL анализировали для концентраций тестируемых антител, используемых в анализе, применяя подгонку нелинейным методом наименьших квадратов по четырем параметрам, чтобы получить значения IC50 каждого конкурента в анализе.
Результаты и обсуждение:
Были выбраны пятнадцать уникальных фаговых антител, полученных из YW243.55, которые связывают как человеческий, так и мышиный PD-L1, и преобразованы в полноразмерные IgG1-антитела для дальнейшей оценки. Последовательности вариабельных областей легкой и тяжелой цепи таких антител показаны на фигурах 11A и B.
Пятнадцать преобразованных антител тестировали в отношении их способности блокировать связывание PD-1 с клетками 293, экспрессирующими либо человеческий, либо мышиный PD-L1, используя электрохемилюминесцентный (ECL) анализ связывания с клетками. (таблица 1 - нижняя половина: в таблице 1 в графе «формат 1» описано связывание растворимого человеческого PD-1-Fc с клетками 293, трансфицированными человеческим PD-L1; в графе «формат 2» описано связывание мышиного PD-1-Fc с клетками 293, трансфицированными мышиным PD-L1, и в графе «формат 3» описано связывание человеческого PD-1 с клетками 293, трансфицированными мышиным PD-L1. Хотя все пятнадцать антител с улучшенной аффинностью имели значимую перекрестную реактивность по отношению к мышиному PD-L1, YW243.55S70 было выбрано в качестве основного кандидата для рассмотрения на основании его способности блокировать связывание как человеческого, так и мышиного PD-L1 с PD-1 (таблица 1: значения IC50 49 пМ и 22 пМ, соответственно).
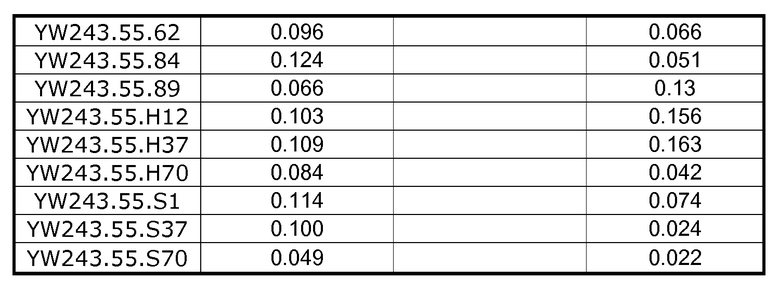
ПРИМЕР 2
Характеристика антител к PD-L1 (BIAcore)
Аффинности связывания фаговых антител к PD-L1 YW243.55 и YW243.55S70 против рекомбинантного человеческого и мышиного PD-L1 измеряли на основе поверхностного плазмонного резонанса (SRP), используя прибор BIAcore™-3000. Рекомбинантным человеческим PD-L1-Fc (R&D Systems, № в каталоге 156-B7) и рекомбинантным мышиным PD-L1-Fc (R&D Systems, № в каталоге 1019-B7) непосредственно покрывали биосенсорные чипы CM5, достигая примерно 500 единиц сигнала (RU). Для измерения кинетики двукратные серийные разведения (от 3,9 нМ до 500 нМ) инъецировали в буфере PBT (PBS с 0,05% твина-20) при 25°C со скоростью потока 30 мкл/мин. Скорость ассоциации (kon) и скорость диссоциации (koff) вычисляли, используя простую модель связывания Ленгмюра «один к одному» (компьютерная программа оценки BIAcore, версия 3.2). Равновесную константу диссоциации (Kd) рассчитывали в виде отношения koff/kon.
Измеренные аффинности связывания клонов фаговых антител к PD-L1 YW243.55 и YW243.55.S70 указаны ниже в таблице 2.
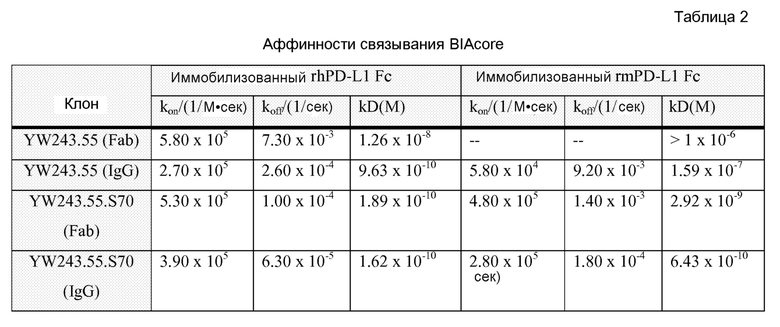
ПРИМЕР 3A
Специфичность антител к PD-L1 для PD-L1 человека, макака-резус и мыши - FACS и анализ связывания радиолиганда с клетками
В данном примере показана специфичность антитела к PD-L1 согласно изобретению для PD-L1 человека, макака-резус и мыши. Кроме того, показана аффинность антитела по отношению к PD-L1 мыши и человека, экспрессированному на клеточной мембране трансфицированных клеток 293.
Человеческий и мышиный PD-L1 стабильно трансфицировали в клетки 293. Клетки собирали и высевали по 150000 клеток на лунку в 96-луночный планшет для исследований связывания.
Кровь макак-резус получали из Юго-западного фонда биомедицинских исследований (San Antonio, Texas). Кровь разбавляли равным объемом PBS и наслаивали на 96% фикол-пак (GE Healthcare) для отделения мононуклеарных клеток. Лизировали эритроциты, используя буфер для лизиса эритроцитов (Qiagen), и мононуклеарные клетки культивировали в течение ночи, используя 1,5×106 клеток/мл, с 5 нг/мл PMA плюс 1 мкМ иономицина в 6-луночных чашках. Культуральная среда представляла собой среду RPMI 1640 с 10% фетальной бычьей сыворотки, 20 мкМ HEPES и разведениями 1:100 следующих добавок фирмы Gibco: Gluta-MAX, пируват натрия, пенициллин/стрептомицин и заменимые аминокислоты. Клетки собирали на следующий день и аликвоты разносили в 96-луночный планшет для исследований связывания (примерно 120000 клеток на лунку).
PD-L1-антитело YW243.55.S70 или контрольное антитело герцептин (Herceptin®) титровали, начиная с 10 мкг/мл, используя трехкратные серийные разведения, и связывали с клетками в объемах по 50 мкл в течение 25 минут на льду. Клетки промывали и затем связывали с антителом против IgG человека-PE (Caltag) в концентрации 20 мкг/мл в течение 25 минут на льду. Клетки макак-резус также совместно окрашивали CD3-ФИТЦ и CD4-APC (BD Biosciences), чтобы отличить T-клетки CD4+.
Все образцы исследовали, используя прибор Beckman Dickinson FACSCalibur, и анализировали среднюю интенсивность флуоресценции по данным связывания PD-L1 как функцию концентрации антитела к PD-L1, используя компьютерную программу Tree Star, Inc. FlowJo®; значения EC50 (концентрация антитела, ассоциированная с полумаксимальным связыванием) вычисляли, используя Kaleidagraph. Кроме того, проводили исследования равновесного связывания, чтобы определить точные значения аффинностей (Kd) для связывания YW24355S70 с человеческим и мышиным PD-L1, экспрессированным на клетках 293 (пример 3B). Такие значения суммированы ниже в таблице 3.

ПРИМЕР 3B
Измерение аффинности антител к PD-L1 по отношению к человеческому и мышиному PD-L1 - анализ равновесного связывания радиолиганда с клетками
Клетки 293, трансфицированные человеческим или мышиным PD-L1, культивировали в среде для роста, которая состояла из среды RPMI 1640 с добавлением 10% фетальной бычьей сыворотки (FBS), 2 мМ L-глутамина, 1X пенициллина-стрептомицина, при 37 градусах по Цельсию в присутствии 5% CO2. Клетки промывали буфером для связывания (50:50 DMEM/F12 с добавлением 2% FBS и 50 мМ Hepes, pH 7,2) и высевали в 96-луночные планшеты примерно по 230000 клеток в 0,2 мл буфера для связывания. Антитело к PD-L1, YW243.55.S70.hIgG, йодировали, используя способ Iodogen. Радиоактивно меченные антитела к PD-L1 очищали от свободного 125I-NA гель-фильтрацией, используя колонку NAP-5; очищенное антитело имело удельную активность 17,41 мккюри/мкг. Конкурентные реакционные смеси объемом 50 мкл, содержащие фиксированную концентрацию йодированного антитела и понижающиеся концентрации серийно разведенного немеченого антитела, помещали в 96-луночные планшеты. Стабильно трансфицированные линии клеток 293, экспрессирующие человеческий PD-L1 и мышиный PD-L1, культивировали в среде для роста, которая состояла из смеси сред 50:50 DMEM/F12 с добавлением 10% фетальной бычьей сыворотки (FBS), 2 мМ L-глутамина, 1X пенициллина-стрептомицина, при 37°C в 5% CO2. Клетки промывали буфером для связывания (50:50 DMEM/F12 с 2% FBS, 50 мМ HEPES, pH 7,2, и 2 мМ азида натрия) и добавляли при плотности приблизительно 200000 клеток в 0,2 мл буфера для связывания к 50 мкл конкурентных реакционных смесей. Конечная концентрация йодированного антитела в каждой конкурентной реакционной смеси с клетками составляла ~150 пМ (~120000 имп./мин на 0,25 мл), и конечная концентрация немеченого антитела в конкурентной реакционной смеси с клетками варьировала, начиная с 500 нМ, и затем включая еще 10 концентраций, снижающихся в 2 раза. Конкурентные реакционные смеси с клетками инкубировали в течение 2 часов при комнатной температуре. Конкурентную реакционную смесь с клетками для каждой концентрации немеченого антитела анализировали в трех повторах. После 2-часовой инкубации конкурентные реакционные смеси переносили в планшет с фильтром Millipore Multiscreen и промывали 4 раза буфером для связывания, чтобы отделить свободное йодированное антитело от связанного. Фильтры подвергали счету в гамма-счетчике Wallac Wizard 1470 (PerkinElmer Life and Analytical Sciences Inc. Wellesley, MA). Данные связывания оценивали, используя компьютерную программу NewLigand (Genentech), в которой используется алгоритм подгонки Munson и Robard, чтобы определить аффинность связывания антитела. Musson et al., Anal. Biochem. 107: 220-39 (1980).
Значения Kd, которые определяли в анализе по Скатчарду, подтверждали значения EC50 для связывания антитела к PD-L1 с человеческим и мышиным PD-L1, как показано в таблице 3.
ПРИМЕР 4
Избирательность и аффинность антител к PD-L1 (IC50)
В данном примере показан анализ избирательности и аффинности связывания (в виде IC50), используемый для оценки полноразмерных антител к PD-L1 согласно настоящему изобретению в отношении их способности блокировать связывание PD-L1 как с PD-1, так и с B7.1.
Способы:
ELISA связывания hB7.1-Fc-биотин и hPD-1-Fc-биотин с hPD-L1-Fc (формат 4):
384-луночный планшет Nunc Maxisorp покрывали, используя по 25 мкл раствора 250 нг/мл hPD-L1-Fc в PBS, в течение ночи. Лунки промывали три раза 0,05% твина в PBS (буфер для промывки) на устройстве для промывки микропланшетов и блокировали лунки 0,5% БСА в PBS. В каждую лунку добавляли 12,5 мкл раствора антител в 2-кратной концентрации в 0,05% твине, 0,5% БСА в PBS (разбавитель для анализа) и затем 12,5 мкл раствора hB7.1-Fc-биотин в разбавителе для анализа в концентрации 250 нг/мл (2-кратная концентрация) и инкубировали планшет в течение полутора часов со встряхиванием. Лунки промывали шесть раз буфером для промывки и добавляли 25 мкл стрептавидина-HRP (1:40000 в разбавителе для анализа, GE Healthcare). Планшет инкубировали в течение 30 минут со встряхиванием и лунки шесть раз промывали буфером для промывки. Добавляли 25 мкл субстрата TMB (Kirkegaard and Perry Laboratories) на один час и реакцию останавливали, добавляя 25 мкл 1 М фосфорной кислоты. Регистрировали оптическую плотность при 450 нм и анализировали значения IC50 ECL-анализом связывания с клетками, как описано в примере 1.
Форматы 5, 6, 7:
В случае связывания hPD-1-Fc-биотина с hPD-L1-Fc (формат 5) использовали формат анализа, сходный с описанным выше анализом, за исключением того, что для связывания использовали hPD-1-Fc-биотин вместо hB7.1-Fc-биотина. Время взаимодействия с субстратом TMB составляло 17 минут.
В случае связывания mB7.1-Fc-биотина с mPD-L1-Fc (формат 6) формат сходен с форматом 5, за исключением того, что для покрывания планшета использовали mPD-L1-Fc вместо hPD-L1-Fc и для связывания использовали mB7.1-Fc-биотин вместо hB7.1-Fc-биотина. Время взаимодействия с субстратом TMB составляло 7 минут.
В случае связывания mPD-1-Fc-биотина с mPD-L1-Fc (формат 7) формат сходен с описанным выше ELISA для мыши, за исключением того, что для связывания использовали mPD-1-Fc-биотин вместо mB7.1-Fc-биотина. Время взаимодействия с субстратом TMB составляло 5 минут.
Результаты:
Оценка IC50 фагового антитела к PD-L1 с созревшей аффинностью YW243.55.S70 для блокирования взаимодействий между указанными связывающимися парами, приведена в таблице 4. Антитело YW243.55.S70 было способно блокировать связывание человеческого PD-L1 с hB7.1 Fc с полумаксимальной ингибирующей концентрацией 38 пМ, т.е. с концентрацией относительно сравнимой с его значением IC50 для блокирования взаимодействия PD-L1/PD-1 (42 пМ). Исследования Biacore, в которых измеряли способность YW243.55S70 блокировать взаимодействия PD-L1 с PD-1 и B7.1, согласуются с полученными результатами ELISA (данные не показаны).
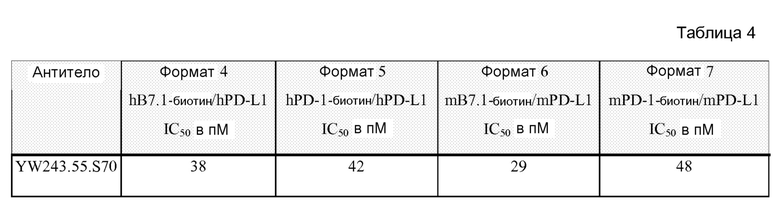
ПРИМЕР 5
Усиление активности T-клеток CD4+ и CD8+ in vitro антителом к PD-L1 YW243.55.S70
Анализ PMEL/B16 in vitro
В данном примере показано влияние антител к PD-L1 согласно изобретению на активацию трансгенных по T-клеточному рецептору T-клеток CD8+ PMEL, которое измеряли по усилению продукции γ-IFN в ответ на пептид меланоцитов gp100. В таком способе T-клетки CD8+ получают от трансгенных по TCR мышей PMEL, T-клетки CD8+ которых экспрессируют TCR, специфичный для пептида gp100. После очистки T-клеток CD8+ осуществляли множественные раунды стимуляции, чтобы получить и размножить активированные T-клетки CD8+, которые затем, в свою очередь, будут вызывать повышающую регуляцию экспрессии PD-1. Параллельно, клетки меланомы B16 обрабатывали IFN-γ, чтобы повысить экспрессию ими PD-L1. Затем клетки совместно культивировали в присутствии антитела к PD-L1 и оценивали влияние на продукцию IFN-γ. Клетки B16 выбирали для третичной стимуляции, поскольку они эндогенно экспрессируют низкие уровни пептида gp100 (в противоположность экзогенному применению пептида). Кроме того, поскольку такие клетки также не экспрессируют PD-L2, B7.1 или B7.2, минимизировано влияние дополнительной нерегулируемой передачи сигнала к PD-L1 (например, передачи сигнала через CD28 или CTLA-4 или PD-L2-индуцированной передачи сигнала через PD-1).
Анализ PMEL:
Как показано на фигуре 3, антитела к PD-L1 усиливают как процентное содержание продуцирующих IFN-γ T-клеток CD8+ PMEL, так и средние уровни IFN-γ, продуцированного в ответ на указанные количества пептида gp100.
Анализ D.011.10 in vitro :
Сходный анализ с использованием овальбумин-специфичных трансгенных по TCR T-клеток CD4+ показывает повышенную пролиферацию T-клеток в присутствии антитела к PD-L1 после предварительной стимуляции пептидом овальбумина, чтобы индуцировать экспрессию PD-1 (фиг.4). При конечной стимуляции использовали облученные B-клетки A20, которые экспрессируют PD-L1, для презентации указанных концентраций пептида овальбумина T-клеткам DO.11.10. Примечательно, что вклад оси PD-1/PD-L1 является более выраженным при более низких степенях стимуляции рецептора антигена, на уровнях, которые ближе отражают физиологически значимую величину стимуляции.
Материалы и способы:
Анализ PMEL
Первичная стимуляция (0-4 день)
Селезенку и кишечные лимфатические узлы собирали от трансгенных по T-клеточному рецептору мышей PMEL. Органы измельчали до получения суспензий отдельных клеток и лизировали эритроциты. T-клетки CD8+ выделяли, используя набор для выделения T-клеток CD8+ и устройство для разделения клеток AutoMACS (Miltenyi Biotec) согласно инструкциям производителя.
Селезенку выделяли у нетрансгенной, совпадающей по полу мыши, измельчали до получения суспензии отдельных клеток и лизировали эритроциты. Клетки импульсно обрабатывали 0,1 мкг/мл пептида gp100 в течение двух часов при 37°C и промывали.
Клетки совместно культивировали в 96-луночном планшете с плоским дном, используя 200000 T-клеток CD8+ PMEL и 75000 импульсно обработанных gp100 спленоцитов, в течение 4 суток. Культуральная среда представляла собой среду Дульбекко, модифицированную по способу Исков, + 10% фетальной бычьей сыворотки + 20 мкМ HEPES и разведения 1:100 следующих добавок от Gibco: Gluta-MAX, пируват натрия, пенициллин/стрептомицин и заменимые аминокислоты.
Вторичная стимуляция (4-7 день)
Культуры PMEL осаждали центрифугированием и среду аспирировали, используя многоканальную пипетку. Добавляли свежую среду и перемешивали, чтобы промыть клетки, затем снова центрифугировали. Большую часть среды удаляли и добавляли антитела (Herceptin®, YW243.55.S70 или без добавления антитела) до конечной концентрации 10 мкг/мл. Условия создавали в лунках в двух повторах, так чтобы в конечной точке можно было оценить среднюю продукцию IFN-γ.
Клетки DC-1 импульсно обрабатывали 0,1 мкг/мл пептида gp100 в течение 2 часов при 37°C и промывали. Импульсно обработанные gp100 клетки DC-1 добавляли к промытым культурам PMEL по 40000 клеток/лунку. PMEL и DC-1 + антитело культивировали совместно в течение 3 суток.
Третья стимуляция (7-8 день)
За сутки до третьей стимуляции на 6 день клетки меланомы B16 инкубировали с 20 нг/мл мышиного IFN-γ (R&D Systems) в течение ночи, чтобы повысить экспрессию клетками PD-L1.
На 7 день культуры PMEL осаждали центрифугированием и среду аспирировали, используя многоканальную пипетку. Добавляли свежую среду и перемешивали, затем снова центрифугировали. Большую часть среды удаляли и добавляли антитела до конечной концентрации 10 мкг/мл.
После стимуляции в течение ночи с использованием IFN-γ клетки B16 промывали и делили на три группы для двухчасовой инкубации либо без gp100, либо в присутствии gp100 в концентрации 1 нг/мл (низкая концентрация gp100) и в присутствии gp100 в концентрации 10 нг/мл (высокая концентрация gp100). Клетки промывали, затем добавляли к промытым культурам PMEL + антитело по 40000 клеток на лунку и инкубировали вместе в течение ночи.
Внутриклеточное окрашивание IFN-γ на 8 день
Добавляли Golgi-Plug (BD Biosciences) в последние 5 часов культивирования согласно инструкциям производителя. Внутриклеточное окрашивание IFN-γ осуществляли, используя набор, содержащий раствор для фиксации/пермеабилизации Cytofix/Cytoperm BD Biosciences, согласно инструкциям производителя, и все окрашивающие антитела также от BD Biosciences. Клетки окрашивали поверхностно, используя CD8a-PE и Thy1.1-ФИТЦ, и внутриклеточно окрашивали, используя IFN-γ-APC в насыщающих концентрациях.
Все образцы исследовали, используя устройство FACSCalibur Beckman Dickinson, и данные анализировали, используя компьютерную программу Tree Star, Inc. FLOWJO™.
Анализ D011.10 in vitro
Собирали селезенки и кишечные лимфатические узлы трансгенных мышей D011.10, измельчали до получения суспензий одиночных клеток и лизировали эритроциты. Клетки инкубировали в течение 72 часов при плотности 1×106 клеток на мл в 6-луночных чашках с 0,3 мкМ пептида овальбумина. Культуральная среда представляла собой среду RPMI 1640 + 10% фетальной бычьей сыворотки + 20 мкМ HEPES и разведения 1:100 следующих добавок от Gibco: Gluta-MAX, пируват натрия, пенициллин/стрептомицин и заменимые аминокислоты.
После первичной стимуляции клетки собирали и очищали T-клетки CD4+, используя набор для очистки мышиных T-клеток CD4 согласно инструкциям производителя (Miltenyi Biotec). Очищенные T-клетки CD4+ затем оставляли на ночь.
На следующий день клетки собирали, промывали и инкубировали вместе с облученными (10000 рад) клетками A20. Совместное культивирование осуществляли в 96-луночных планшетах с U-образным дном в лунках в трех повторах, содержащих по 50000 T-клеток CD4+ и 40000 клеток A20, с титруемыми количествами пептида овальбумина и антителом в конечной концентрации 20 мкг/мл. Через 48 часов культуры импульсно обрабатывали в течение ночи 3H-тимидином (1 мккюри/лунку) и замораживали на следующий день. Позже планшеты размораживали, клетки собирали на устройстве для сбора клеток и регистрацию проводили на бета-счетчике.
ПРИМЕР 6
Повышенная пролиферация T-клеток CD8+ человека в смешанной реакции лимфоцитов под влиянием анти-PD-L1
На фигуре 5 показана способность анти-PD-L1 (например, YW243.55.S1) усиливать пролиферацию T-клеток CD8 человека в ответ на клетки от несовпадающего по MHC донора. Осуществляли обогащение отвечающих T-клеток CD8+ из цельной крови донора A, сначала используя RosetteSep® для T-клеток CD8+ (StemCell Technologies) согласно инструкциям производителя. Затем клетки разбавляли равным объемом фосфатно-солевого буфера (PBS) и разделяли градиентным центрифугированием после нанесения на фикол-пак плюс (GE Healthcare). После разделения клетки окрашивали CD8-APC (BD Biosciences) и обнаружили, что они на 78% представлены T-клетками CD8+. Клетки флуоресцентно метили, используя 2,5 мкМ индикаторного красителя CFSE (Molecular Probes).
Для того чтобы клетки служили в качестве аллогенных антигенпрезентирующих клеток (АПК), мононуклеарные клетки сначала выделяли из цельной крови донора B и затем истощали по T-клеткам CD3+. Кровь разбавляли равным объемом PBS и мононуклеарные клетки выделяли после градиентного центрифугирования на фиколе. Клетки окрашивали CD3-ФИТЦ (BD Biosciences), промывали и затем инкубировали с анти-ФИТЦ-микрошариками (Miltenyi Biotec). Затем осуществляли истощение по CD3-ФИТЦ-позитивным клеткам на сепараторе клеток AutoMACS (Miltenyi Biotec). Затем клетки облучали, используя 2500 рад в цезиевом облучателе.
Клетки совместно инкубировали в 96-луночном планшете с плоским дном, используя 150000 T-клеток CD8+ и 150000 АПК, в течение 5 суток с антителами в концентрации 10 мкг/мл. Культуральная среда представляла собой среду RPMI 1640 + 10% фетальной бычьей сыворотки + 20 мкМ HEPES и разведения 1:100 следующих добавок от Gibco: Gluta-MAX, пируват натрия, пенициллин/стрептомицин и заменимые аминокислоты.
На 5 день клетки собирали, промывали и окрашивали CD8-биотином и затем стрептавидином-PerCp (BD Biosciences). Образцы исследовали на устройстве FACSCalibur Beckman Dickinson и данные анализировали, используя компьютерную программу Tree Star, Inc. FlowJo.
Наблюдали приблизительно 45% усиление пролиферации T-клеток CD8 в ответ на клетки от несовпадающего по MHC донора в присутствии анти-PD-L1.
ПРИМЕР 7
Влияние блокады PD-L1 в модели инфекции LCMV in vivo
Показано, что T-клетки в условиях хронической стимуляции подвергаются повышающей регуляции и способствуют экспрессии ингибирующего рецептора PD-1. Лигирование PD-1 любым из его лигандов PD-L1 и PD-L2 вносит вклад в рефрактерное состояние хронически активированной T-клетки, ослабляя ее ответ на узнаваемый антиген. У мышей, персистентно инфицированных вирусом лимфоцитарного хориоменингита (LCMV), блокада PD-1 или его лиганда PD-L1 достаточна для того, чтобы восстановить хронически невосприимчивые T-клетки, усиливая величину и функциональное качество противовирусного T-клеточного ответа. Подобным образом, у людей, хронически инфицированных ВИЧ или HCV, наблюдают T-клетки, невосприимчивые к стимуляции, активность которых может быть повышена in vitro в результате блокады PD-1 или PD-L1. Следовательно, активность блокады PD-L1 в модели LCMV свидетельствует о терапевтической возможности повышения противовирусного и противоопухолевого иммунитета.
В случае экспериментов in vivo по исследованию LCMV у мышей, авторы преобразовывали гуманизированное антитело к PD-L1 (YW243.55S70), клонируя полученные из фага последовательности вариабельных областей тяжелой и легкой цепи выше константных доменов тяжелой цепи IgG2a мыши и легкой цепи каппа мыши. Чтобы предотвратить опосредованную антителами цитотоксичность клеток, экспрессирующих PD-L1, в результате ингибирования связывания рецептора Fcγ, аминокислоты в положениях 265 (аспарагиновая кислота) и 297 (аспарагин) заменяли на аланин (DANA). Shields, RL et al. J. Biol. Chem. 2001 276(9): 6591-6604. Чтобы тестировать способность антитела к PD-L1 повышать противовирусный иммунитет при хронической инфекции, мышей инфицировали в 0 день, используя 2×106 бляшкообразующих единиц (БОЕ) LCMV клона 13 или штамма LCMV Armstrong в качестве контроля для сравнения. Схема дизайна эксперимента показана на фигуре 6. Инфекция клоном 13 приводит к хронической инфекции, характеризуемой T-клетками, количество которых увеличивается, но которые не способны эффективно осуществлять клиренс вируса, тогда как LCMV Armstrong подвергается клиренсу в течение 8-10 дней инфекции. На 14 день мышей начинали обрабатывать либо анти-PD-L1, либо контрольным mIgG, доставляемым в дозах 10 мг/кг 3 раза в неделю. На 21 и 28 день осуществляли анализ функции T-клеток CD8 и вирусных титров в крови и тканях.
В соответствии с опубликованными данными (Barber et al., Nature 439: 682-7 (2006) приведенный пример показывает способность антитела к PD-L1 усиливать ответ цитотоксических лимфоцитов на LCMV после 2-недельной обработки при хронической инфекции LCMV. На фигуре 7A показан % T-клеток CD8, которые экспрессируют CD107a на своей поверхности в ответ на LCMV-специфичный пептид gp33. Экспрессия на плазматической мембране CD107a, в норме экспрессируемого внутриклеточно, сопровождает процесс дегрануляции и поэтому служит в качестве суррогатного маркера дегрануляции. По сравнению с ответом клеток в случае острой инфекции LCMV Armstrong, клетки животных, инфицированных хроническим штаммом, клоном 13, имеют нарушенную дегрануляцию (группа контрольного Ig), тогда как блокада PD-L1 способна восстанавливать дегрануляцию CD8+ до уровней, сравнимых с уровнями, наблюдаемыми при инфекции Armstrong. Подобным образом, на фигуре 7B показан повышенный % IFN-γ-продуцирующих T-клеток CD8 в ответ на gp33 LCMV в группе, обработанной анти-PD-L1, по сравнению с группой, обработанной контрольным Ig.
Затем тестировали влияние антитела к PD-L1 на уменьшение количества или истребление вируса LCMV в крови и тканях. Графики на фигуре 8A показывают log-титры вирусов в указанной ткани у животных, обработанных контрольным Ig и PD-L1, на 21 и 28 день после инфекции клоном 13 LCMV. Обработку антителом начинали на 14 день после инфекции. Блокада PD-L1 приводила к высоко значимому уменьшению титров вируса в крови, печени, головном мозге, легком и почке. Поразительно, что у 3 из 5 мышей α-PD-L1-антитело снижало титры LCMV в крови до уровней ниже уровня регистрации (<1×10-5). В последующем эксперименте сравнимого дизайна удаление вируса из крови и печени наблюдали у 5/5 мышей, обрабатываемых в течение 2 недель анти-PD-L1 в дозах либо 10 мг/кг, либо 2 мг/кг 3 раза в неделю (данные не показаны). На нижнем графике показана кинетика снижения титра вирусов в крови и показано среднее снижение 96,8% в группе, обработанной анти-PD-L1, на 28 день по сравнению с контролем. Полученные данные подтверждают важность пути PD-1/PD-L1 в ингибировании T-клеточных ответов при хронических инфекциях и согласуются с данными о влиянии блокады PD-L1 in vitro на T-клетки, полученными для человеческих клеток с хроническими инфекциями, такими как гепатит C и ВИЧ.
Материалы и способы:
Определение продукции IFN-гамма в процентах T-клетками CD8 в ответ на пептид gp33 LCMV
Селезенки выделяли у инфицированных мышей и получали суспензию из отдельных клеток посредством измельчения органов в полной среде: IMDM (Invitrogen Inc., Carlsbad, CA), содержащей 10% инактивированной нагреванием фетальной бычьей сыворотки, 2 мМ L-глутамина, 100 ед./мл пенициллина/стрептомицина и 10 мМ 2-меркаптоэтанола. Эритроциты лизировали, используя буфер для лизиса ACK (0,15 М NH4Cl, 10 мМ KHCO3, 0,1 мМ EDTA). Чтобы измерить антиген-специфичные ответы T-клеток CD8, спленоциты промывали в полной среде и повторно стимулировали in vitro в течение 4 часов пептидом GP33 LCMV (KAVYNFATC, ProImmune Inc., Bradenton, FL). 1×106 спленоцитов инкубировали в 96-луночных планшетах с плоским дном с 100 нг/мл пептида GP33 в присутствии 100 единиц/мл человеческого интерлейкина-2 (Sigma-Aldrich, St. Louis, MO), 1 мкл/мл брефелдина A и 1 мкл/мл (разведение 1:1000) монензина (BD pharmingen) и анти-CD107a-ФИТЦ (клон ID4B, BD Biosciences, San Jose, CA). После инкубации клетки промывали один раз в PBS, содержащем 2% фетальной бычьей сыворотки, и маркеры клеточной поверхности окрашивали, используя конъюгированные с флуорохромом антитела: анти-CD8-APC (клон 53.67, BD Biosciences, San Jose, CA) анти-CD4-PerCp-Cy5.5 (клон RM4-5, BD Biosciences, San Jose, CA) и анти-PD-1-PE (клон J43, BD Biosciences, San Jose, CA). Окрашивание внутриклеточного IFN-γ осуществляли с использованием набора Cytofix Cytoperm Plus (BD Biosciences, San Jose, CA) согласно инструкциям производителя, используя анти-IFN-γ-PE-Cy7 (клон XMG1.2, Bioscience Inc. San Diego, CA). Чтобы определить количество GP33-специфичных T-клеток CD8, свежие спленоциты окрашивали пентамерами GP33 (H2-Db, связанные с APC, ProImmune Inc., Bradenton, FL) согласно инструкциям производителя. Данные собирали, используя BD FACSAria (BD Biosciences, San Jose, CA), и анализировали с помощью компьютерной программы FlowJo (Tree Star Inc. Ashland OR).
Определение титров вируса LCMV:
Клетки фибросаркомы MC57 инфицировали 10-кратными серийными разведениями LCMV-содержащей крови или гомогената ткани в полной среде IMDM. Затем реакционную смесь инкубировали в течение 2-6 часов при 37°C в инкубаторе для культуры ткани, затем наслаивали среду DMEM, содержащую 1% метилцеллюлозы. После этого инкубировали в течение 3-5 суток, затем слой метилцеллюлозы удаляли аспирацией. Клетки фиксировали PBS/4% параформальдегидом, затем делали проницаемыми, используя 0,5% тритон-X, в течение 20 минут, промывали в PBS, затем блокировали в 10% FCS в течение 1 часа при умеренном качании. Окрашивание LCMV осуществляли с использованием VL4-антитела (1 час), промывали 2×, затем обрабатывали антителом против Ig крысы-HRP (1:400) в блокирующем буфере. Затем 3 раза промывали с последующим добавлением в лунки субстрата o-фенилендиамина (SIGMA P8806-50TAB 3 мг/таблетку) для проявления.
ПРИМЕР 8
Блокада PD-L1 в злокачественной опухоли
В настоящее время очевидно, что многие опухоли используют экспрессию лигандов PD-1 в качестве средства для ослабления противоопухолевых T-клеточных ответов. Несколько злокачественных опухолей человека охарактеризованы как опухоли, которые экспрессируют повышенные уровни PD-L1 как на опухолях, так и на инфильтрующих опухоли лейкоцитах, и такая повышенная экспрессия PD-L1 часто ассоциирована с худшим прогнозом. В моделях на мышиных опухолях показано сходное увеличение экспрессии PD-L1 в опухолях и показана роль пути PD-1/PD-L1 в ингибировании опухолевого иммунитета.
В настоящем примере описан эксперимент, демонстрирующий влияние блокирования PD-L1 на ортотопический опухолевый рост клеток карциномы прямой и ободочной кишки мышей MC38.Ova у сингенных мышей C57B6 (фигура 9A). Такие клетки экспрессируют овальбумин в результате ретровирусной трансдукции и экспрессируют PD-L1, но не экспрессируют PD-L2 на клеточной поверхности, как показано при анализе проточной цитометрией (гистограмма - фигура 10A). Мышам подкожно инокулировали 0,5 миллионов клеток MC38.Ova в 0 день. В 1 день или на 14 день (когда опухоли достигали среднего размера 250 мм3) мышей по 10 мышей/группу обрабатывали 10 мг/кг анти-PD-L1 (YW243.55S70-мышиный IgG2a-DANA), контрольного Ig или блокирующего антитела к CTLA4 (UC10-4F10-11) 3 раза в неделю в течение исследования. Блокада PD-L1 либо при раннем вмешательстве, либо при позднем вмешательстве является высоко эффективной в качестве единственного терапевтического средства для предотвращения опухолевого роста. Напротив, в случае блокады CTLA4, другой ингибирующей молекулы, экспрессируемой на T-клетках, не выявлено доказательство ингибирования опухолевого роста. Полученные результаты свидетельствуют об уникальной роли оси PD-1/PD-L1 по сравнению с CTLA4/B7 в подавлении противоопухолевого иммунного ответа и подтверждают возможность лечения злокачественных опухолей человека антителами, которые блокируют взаимодействие PD-L1 с PD-1 и B7.1.
Модель сингенных опухолей MC38.Ova: способы. В 0 день 70 животным подкожно инокулировали 0,5 миллионов клеток MC38.Ova в 100 микролитрах HBSS+матригель. Начиная с 1 дня, 20 мышей распределяли в 2 группы обработки (см. ниже: группа 1 или группа 2). В случае остальных 40 мышей давали возможность опухолям расти вплоть до 14 дня. Из этих 40 мышей 30 мышей со сходным размером опухолей распределяли на 3 группы обработки (группы 3-5). Опухоли измеряли и мышей взвешивали 2 раза в неделю. Мышей, которых не отбирали в указанные ниже группы обработки из-за отличающихся по объему опухолей, подвергали эвтаназии:
Группа 1: антитело к gp120, 10 мг/кг в/б, 100 мкл, 1 день, 3 раза/неделю
Группа 2: антитело к PD-L1, 10 мг/кг в/б, 100 мкл, 1 день, 3 раза/неделю
Группа 3: антитело к gp120, 10 мг/кг в/б, 100 мкл, 14 день, 3 раза/неделю
Группа 4: антитело к PD-L1, 10 мг/кг в/б, 100 мкл, 14 день, 3 раза/неделю
Группа 5: антитело к CTLA-4, 10 мг/кг в/б, 100 мкл, 14 день, 3 раза/неделю.
***В группах 1 и 2 введение дозы начинали в 1 день; в группах 3, 4 и 5 - на 14 день.
ПРИМЕР 9
Сочетания анти-PD-L1 с другими средствами для обеспечения противоопухолевого эффекта или повышающей иммунитет терапии - модель MC38.Ova
В 0 день 150 животным подкожно инокулировали 0,5 миллиона клеток MC38.Ova в 100 микролитрах HBSS + матригель. Давали возможность вырасти опухолям у мышей. Мышей взвешивали и измеряли 2 раза/неделю вплоть до 11 дня (когда объем опухолей составлял 100-200 мм3). На 11 день после измерения опухолей мышей распределяли на 12 групп обработки, указанных ниже. Мышей, не отобранных в указанные ниже группы обработки вследствие отличающихся по объему опухолей, подвергали эвтаназии. Обработку гемцитабином (группа 4) начинали на 12 день, тогда как обработку антителом в остальных группах начинали на 14 день. Все объемы составляли 100 мкл в инертном растворителе, дополнительные подробности приведены ниже:
Группа 1: антитело к gp120, 10 мг/кг в/б, 100 мкл, 3 раза/неделю ×5, n=10
Группа 2: антитело к PD-L1, 10 мг/кг в/б, 100 мкл, 3 раза/неделю ×5, n=10
Группа 3: антитело к VEGF, 5 мг/кг в/б, 100 мкл, 2 раза/неделю ×5, n=10
Группа 4: гемцитабин, 40 мг/кг в/б, 100 мкл, 12, 16, 20 день, n=10
Группа 5: антитело к PD-L1 + антитело к gp120, n=10
Группа 6: антитело к PD-L1 + антитело к VEGF, n=10
Группа 7: антитело к PD-L1 + гемцитабин, n=10
Группа 8: антитело к gp120 + гемцитабин, n=10
Группа 9: антитело к gp120 + анти-VEGF, n=10
День 12: У мышей из группы 1 ретроорбитально при анестезии брали кровь (100 микролитров) для анализа CBC.
День 14 и день 22: У мышей из группы 4 ретроорбитально при анестезии брали кровь (100 микролитров) для анализа CBC.
День 19: У всех мышей, за исключением группы 4, ретроорбитально при анестезии брали кровь (100 микролитров) для анализа CBC.
День 26: У всех мышей, за исключением группы 4, ретроорбитально при анестезии брали кровь (100 микролитров) для анализа PK.
Опухоли измеряли и мышей взвешивали 2 раза в неделю. Животных, у которых наблюдали потерю массы >15%, взвешивали ежедневно и подвергали эвтаназии, если они теряли >20% массы тела. Мыши подлежали эвтаназии, когда объемы опухолей превышали 3000 мм3 или спустя 3 месяца, если опухоли не образовывались.
Данное исследование показывает (фигура 10), что блокада PD-L1 более эффективна, чем α-VEGF и индуктивная схема введения гемцитабина отдельно.
ПРИМЕР 10
Экспрессия антитела к PD-L1 в клетках млекопитающих
Данный пример иллюстрирует получение потенциально гликозилированных форм антитела к PD-L1 посредством экспрессии рекомбинантов в клетках млекопитающих.
Вектор pRK5 (см. EP 307247, опубликованный 15 марта 1989) используют в качестве экспрессирующего вектора. Необязательно, ДНК, кодирующую легкую и/или тяжелую цепь антитела, лигируют в pRK5 с применением выбранных ферментов рестрикции для обеспечения инсерции такой ДНК, используя такие способы лигирования, как способы, описанные Sambrook et al., см. выше.
В одном варианте выбранными клетками-хозяевами могут быть клетки 293. Клетки 293 человека (ATCC CCL 1573) выращивают до слияния в планшетах для культуры ткани в такой среде, как DMEM с добавлением фетальной сыворотки теленка и, необязательно, питательных компонентов и/или антибиотиков. Примерно 10 мкг ДНК, кодирующей pRK5-антитело, смешивают примерно с 1 мкг ДНК, кодирующей ген РНК VA [Thimmappaya et al., Cell, 31: 543 (1982)] и растворяют в 500 мкл 1 мМ трис-HCl, 0,1 мМ EDTA, 0,227 М CaCl2. К полученной смеси по каплям добавляют 500 мкл 50 мМ HEPES (pH 7,35), 280 мМ NaCl, 1,5 мМ NaPO4 и дают возможность образоваться осадку в течение 10 минут при 25°C. Осадок суспендируют, добавляют к клеткам 293 и дают возможность осесть в течение примерно четырех часов при 37°C. Культуральную среду отсасывают и добавляют 2 мл 20% глицерина в PBS на 30 секунд. Затем клетки 293 промывают бессывороточной средой, добавляют свежую среду и клетки инкубируют в течение примерно 5 суток.
Приблизительно через 24 часа после трансфекции культуральную среду удаляют и заменяют либо культуральной средой (без добавок), либо культуральной средой, содержащей 200 мккюри/мл 35S-цистеина и 200 мккюри/мл 35S-метионина. После 12-часовой инкубации собирают кондиционированную среду, концентрируют центрифугированием с использованием фильтра и наносят на 15% SDS-гель. Обработанный гель можно высушить и экспонировать с пленкой в течение выбранного периода времени, чтобы выявить присутствие антитела. Культуры, содержащие трансфицированные клетки, можно подвергнуть дополнительной инкубации (в бессывороточной среде) и тестировать среду в выбранном биоанализе.
В альтернативном способе антитело можно вводить в клетки 293 временно, используя способ на основе сульфата декстрана, описанный Somparyrac et al. (Proc. Natl. Acad. Sci., 12: 7575 (1981)). Клетки 293 выращивают до максимальной плотности в роллерной (вращающейся) колбе и добавляют 700 мкг ДНК, кодирующей pRK5-антитело. Клетки из роллерной колбы сначала концентрируют центрифугированием и промывают PBS. Осадок ДНК-декстран инкубируют на осадке клеток в течение четырех часов. Клетки обрабатывают 20% глицерином в течение 90 секунд, промывают средой для культуры ткани и снова вносят в роллерную колбу, содержащую среду для культуры ткани, 5 мкг/мл бычьего инсулина и 0,1 мкг/мл бычьего трансферрина. Примерно через четыре дня кондиционированную среду центрифугируют и фильтруют, чтобы удалить клетки и продукты распада клеток. Затем образец, содержащий экспрессированное антитело, можно концентрировать и очистить любым выбранным способом, таким как диализ и/или колоночная хроматография.
В другом варианте осуществления антитело может быть экспрессировано в клетках CHO. ДНК, кодирующую антитело, лигированную в pRK5, можно трансфицировать в клетки CHO, используя известные реагенты, такие как CaPO4 или DEAE-декстран. Как описано выше, культуры клеток можно инкубировать и среду заменить на культуральную среду (без добавок) или среду, содержащую радиоактивную метку, такую как 35S-метионин. После определения наличия антитела культуральную среду можно заменить бессывороточной средой. Предпочтительно, культуры инкубируют в течение примерно 6 суток, а затем собирают кондиционированную среду. Среду, содержащую экспрессированное антитело, затем можно концентрировать и очистить любым выбранным способом.
Меченные эпитопом варианты антитела также могут быть экспрессированы в клетках-хозяевах CHO. ДНК, кодирующую антитело, лигированную в pRK5, можно выделить из pRK5-вектора в результате субклонирования. Вставку субклона можно подвергнуть ПЦР, чтобы слить в рамке с выбранной эпитопной меткой, такой как полигистидиновая метка, в экспрессирующем бакуловирусном векторе. Затем вставку ДНК, кодирующей меченное полигистидином антитело, можно субклонировать в управляемом векторе SV40, содержащем селектируемый маркер, такой как DHFR, для селекции стабильных клонов. Наконец, клетки CHO можно трансфицировать (как описано выше) управляемым вектором SV40. Можно осуществить мечение, как описано выше, чтобы подтвердить экспрессию. Затем культуральную среду, содержащую экспрессированное меченное полигистидином антитело, можно концентрировать и очистить любым выбранным способом, таким как аффинная хроматография с использованием Ni2+-хелата.
Антитело также может быть экспрессировано в клетках CHO и/или COS способом на основе временной экспрессии или в клетках CHO другим способом, обеспечивающим стабильную экспрессию.
Стабильную экспрессию в клетках CHO осуществляют, используя следующий способ. Белки экспрессируют в виде IgG-конструкции (иммуноадгезин), в которой последовательности, кодирующие растворимые формы (например, внеклеточные домены) соответствующих белков, сливают с последовательностью константной области IgG1, содержащей домены шарнира, CH2 и CH2, и/или они имеют меченную полигистидином форму.
После ПЦР-амплификации соответствующие ДНК субклонируют в экспрессирующем векторе CHO, используя стандартную методику, которая описана Ausubel et al. (Current Protocols of Molecular Biology, Unit 3.16, John Wiley and Sons (1997)). Экспрессирующие векторы CHO конструируют так, чтобы они имели совместимые сайты рестрикции с 5’- и 3’-стороны от представляющей интерес ДНК, чтобы обеспечить удобный челночный перенос кДНК. Вектор, используемый для экспрессии в клетках CHO, представляет собой вектор, описанный Lucas et al. (Nucl. Acids Res. 24:9 (1774-1779 (1996)), и в нем использован ранний промотор/энхансер SV40 для управления экспрессией представляющей интерес кДНК и ген дегидрофолатредуктазы (DHFR). Экспрессия DHFR позволяет осуществлять селекцию в отношении стабильного удерживания плазмиды после трансфекции.
Двенадцать микрограммов требуемой плазмидной ДНК вводят приблизительно в 10 миллионов клеток CHO, используя коммерчески доступные реагенты для трансфекции SUPERFECT® (Quiagen), DOSPER® или FUGENE® (Boehringer Mannheim). Клетки выращивают, как описано Lucas et al., см. выше. Примерно 3×107 клеток замораживают в ампуле для дальнейшего выращивания и получения, как описано ниже.
Ампулы, содержащие плазмидную ДНК, размораживают, помещая их на водяную баню, и перемешивают вихревым встряхиванием. Содержимое переносят пипеткой в центрифужную пробирку, содержащую 10 мл среды, и центрифугируют при 1000 об/мин в течение 5 минут. Супернатант аспирируют и клетки ресуспендируют в 10 мл селективной среды (0,2 мкМ профильтрованного PS20 с 5% 0,2 мкМ подвергнутой диафильтрации фетальной бычьей сыворотки). Затем аликвоты клеток вносят в роллерные колбы объемом 100 мл, содержащие 90 мл селективной среды. Через 1-2 дня клетки переносят в роллерную колбу объемом 250 мл, содержащую 150 мл селективной ростовой среды, и инкубируют при 37°C. Спустя еще 2-3 дня роллерные колбы объемом 250 мл, 500 мл и 2000 мл засевают, используя 3×105 клеток/мл. Среду для клеток заменяют свежей средой посредством центрифугирования и ресуспендирования в среде для продуцирования. Хотя можно использовать любую подходящую для CHO среду, в настоящее время используют среду для продуцирования, описанную в патенте США № 5122469, выданном 16 июня 1992. 3-Литровую роллерную колбу для продуцирования засевают, используя 1,2×106 клеток/мл. В 0 день определяют количество клеток и pH. В 1 день берут образец из роллерной колбы и начинают барботировать профильтрованным воздухом. На 2 день берут образец из роллерной колбы, температуру изменяют до 33°C и добавляют 30 мл раствора глюкозы в концентрации 500 г/л и 0,6 мл 10% противопенного средства (например, 35% полидиметилсилоксановой эмульсии, Dow Corning 365 Medical Grade Emulsion). В ходе продуцирования pH при необходимости корректируют, поддерживая его значение около 7,2. Через 10 дней, или когда жизнеспособность упадет ниже 70%, культуру клеток собирают центрифугированием и фильтрованием через 0,22 мкм-фильтр. Фильтрат либо хранят при 4°C, либо сразу наносят на колонки для очистки.
В случае меченых поли-His-конструкций белки очищают, используя Ni-NTA-колонку (Qiagen). Перед очисткой к кондиционированной среде добавляют имидазол до концентрации 5 мМ. Кондиционированную среду с помощью насоса загружают на Ni-NTA-колонку объемом 6 мл, уравновешенную при 4°C 20 мм Hepes-буфером, pH 7,4, содержащим 0,3 М NaCl и 5 мМ имидазола, с расходом 4-5 мл/мин. После загрузки колонку промывают дополнительным количеством буфера для уравновешивания и белок элюируют буфером для уравновешивания, содержащим 0,25 М имидазол. Затем высоко очищенный белок обессоливают в буфере для хранения, содержащем 10 мМ Hepes, 0,14 М NaCl и 4% маннита, pH 6.8, с использованием колонки G25 Superfine (Pharmacia) объемом 25 мл и хранят при -80°C.
Конструкции иммуноадгезинов (Fc-содержащих) очищают из кондиционированной среды следующим образом. Кондиционированную среду с помощью насоса загружают на колонку с белком A объемом 5 мл (Pharmacia), которая уравновешена 20 мМ Na-фосфатным буфером, pH 6.8. После загрузки колонку тщательно промывают буфером для уравновешивания перед элюированием с использованием 100 мМ лимонной кислоты, pH 3,5. Элюированный белок сразу же нейтрализуют, собирая фракции по 1 мл в пробирки, содержащие 275 мкл 1 М трис-буфера, pH 9. Затем в высокой степени очищенный белок обессоливают в буфере для хранения, как описано выше для поли-His-меченных белков. Гомогенность оценивают в SDS-полиакриламидных гелях и секвенированием N-концевых аминокислот способом расщепления по Эдману.
Пример 11
Экспрессия антитела к PD-L1 в E. coli
Данный пример иллюстрирует получение негликозилированной формы антитела к PD-L1 посредством экспрессии рекомбинантов в E. coli.
Последовательность ДНК, кодирующую антитело к PD-L1, сначала амплифицируют, используя выбранные ПЦР-праймеры. Праймеры должны содержать сайты для ферментов рестрикции, которые соответствуют сайтам для ферментов рестрикции в выбранном экспрессирующем векторе. Можно использовать множество экспрессирующих векторов. Примером подходящего вектора является pBR322 (полученная из E. coli; см. Bolivar et al., Gene, 2: 95 (1977)), которая содержит гены резистентности к ампициллину и тетрациклину. Вектор расщепляют ферментом рестрикции и дефосфорилируют. Затем ПЦР-амплифицированные последовательности лигируют в вектор. Вектор предпочтительно может содержать последовательности, которые кодируют ген резистентности к антибиотикам, промотор trp, полигистидиновый лидер (включая первые шесть кодонов STII, полигистидиновую последовательность и сайт расщепления энтерокиназы), область, кодирующую NPOR, терминатор транскрипции лямбда и ген argU.
Затем смесь для лигирования используют для трансформации выбранного штамма E. coli, используя способы, описанные Sambrook et al., см. выше. Трансформанты идентифицируют по их способности расти на чашках с LB, а затем отбирают резистентные к антибиотикам колонии. Плазмидную ДНК можно выделить и подтвердить с помощью рестрикционного анализа и секвенирования ДНК.
Отобранные клоны можно выращивать в течение ночи в жидкой культуральной среде, такой как бульон LB, с добавлением антибиотиков. Затем ночную культуру можно использовать для посева культуры в большом масштабе. Затем клетки выращивают до требуемой оптической плотности, при которой промотор экспрессии отключается.
После культивирования клеток еще в течение нескольких часов клетки могут быть собраны центрифугированием. Осадок клеток, полученный при центрифугировании, можно солюбилизировать, используя различные средства, известные в данной области, и затем солюбилизированное антитело можно очистить, используя металлохелатную колонку, в условиях, которые обеспечивают тесное связывание антитела.
Антитело к PD-L1 также может быть экспрессировано в E. coli в меченной поли-His форме с использованием следующего способа. ДНК, кодирующую антитело, сначала амплифицируют, используя выбранные ПЦР-праймеры. Праймеры содержат сайты ферментов рестрикции, которые соответствуют сайтам ферментов рестрикции в выбранном экспрессирующем векторе, и другие полезные последовательности, обеспечивающие эффективную и надежную инициацию трансляции, быструю очистку на металлохелатной колонке и протеолитическое удаление энтерокиназой. Затем ПЦР-амплифицированные меченные поли-His последовательности лигируют в экспрессирующий вектор, который используют для трансформации хозяина E. coli штамма 52 (W3110 fuhA(tonA)lon galE rpoHts(htpRts) clpP(lacIq). Трансформанты сначала выращивают в LB, содержащей 50 мг/мл карбенициллина, при 30°C со встряхиванием вплоть до достижения O.D.600 3-5. Затем культуры разбавляют в 50-100 раз в среде CRAP (полученной смешиванием 3,57 г (NH4)2SO4, 0,71 г цитрата натрия-2H2O, 1,07 г KCl, 5,36 г дрожжевого экстракта Difco, 5,36 г hycase SF Sheffield в 500 мл воды, а также 110 мМ MPOS, pH 7,3, 0,55% (масс./об.) глюкозы и 7 мМ MgSO4) и выращивают в течение приблизительно 20-30 часов при 30°C и встряхивании. Отбирают образцы для подтверждения экспрессии в анализе с использованием SDS-PAGE, и основную массу культуры центрифугируют, чтобы осадить клетки. Осадки клеток замораживают вплоть до очистки и рефолдинга.
Пастообразную массу E. coli из объема ферментации от 0,5 до 1 л (осадки 6-10 г) ресуспендируют в 10 объемах (масс./об.) раствора, содержащего 7 М гуанидин, 20 мМ трис-буфер, pH 8. Добавляют твердый сульфит натрия и тетратионат натрия до конечных концентраций 0,1 М и 0,02 М, соответственно, и раствор перемешивают в течение ночи при 4°C. Указанная стадия приводит к получению денатурированного белка с блокированием всех остатков цистеина посредством обработки сульфитом. Раствор центрифугируют при 40000 об/мин в ультрацентрифуге Beckman в течение 30 мин. Супернатант разбавляют 3-5 объемами буфера для металлохелатной колонки (6 М гуанидин, 20 мМ трис, pH 7,4) и фильтруют через 0,22-микронные фильтры для осветления. В зависимости от условия осветленный экстракт наносят на металлохелатную колонку Ni-NTA Qiagen, уравновешенную буфером для металлохелатной колонки. Колонку промывают дополнительным буфером, содержащим 50 мМ имидазол (Calbiochem, Utrol grade), pH 7,4. Белок элюируют буфером, содержащим 250 мМ имидазол. Фракции, содержащие требуемый белок, объединяют и хранят при 4°C. Концентрацию белка оценивают по его оптической плотности при 280 нм, используя коэффициент экстинкции, рассчитанный на основе аминокислотной последовательности.
Белки подвергают рефолдингу, медленно разбавляя образец в свежеприготовленном буфере для рефолдинга: 20 мМ трис, pH 8,6, 0,3 М NaCl, 2,5 М мочевина, 5 мМ цистеин, 20 мМ глицин и 1 мМ EDTA. Объемы для рефолдинга выбирают так, чтобы конечная концентрация белка составляла от 50 до 100 микрограмм/мл. Раствор для рефолдинга осторожно перемешивают при 4°C в течение 12-36 часов. Реакцию рефолдинга гасят добавлением ТФУК до конечной концентрации 0,4% (pH примерно 3). Перед дальнейшей очисткой белка раствор фильтруют через 0,22-микронный фильтр и добавляют ацетонитрил до конечной концентрации 2-10%. После рефолдинга белок подвергают хроматографии на колонке с обращенной фазой Poros R1/H, используя подвижный буфер 0,1% ТФУК и элюируя градиентом ацетонитрила от 10 до 80%. Аликвоты фракций с оптической плотностью A280 анализируют в SDS-полиакриламидных гелях и объединяют фракции, содержащие гомогенный, подвергнутый рефолдингу белок. Как правило, подвергнутые правильному рефолдингу формы большинства белков элюируются при наименьших концентрациях ацетонитрила, поскольку такие формы являются наиболее компактными, и их гидрофобные внутренние области защищены от взаимодействия с обращенно-фазной смолой. Агрегированные формы обычно элюируются при более высоких концентрациях ацетонитрила. Кроме отделения подвергнутых неправильному фолдингу белков от требуемой формы, стадия обращенно-фазной хроматографии также позволяет удалять эндотоксин из образцов.
Фракции, содержащие требуемые подвергнутые фолдингу антитела к PD-L1, объединяют и ацетонитрил удаляют с использованием слабого потока азота, направленного в раствор. Препараты белков готовят в 20 мМ Hepes, pH 6,8, с добавлением 0,14 М хлорида натрия и 4% маннита посредством диализа или гель-фильтрации с использованием смол G25 Superfine (Pharmacia), уравновешенных в буфере для приготовления препарата, и стерильно фильтруют.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ ЛЕЧЕНИЯ РАКА С ПРИМЕНЕНИЕМ АНТАГОНИСТОВ АКСИАЛЬНОГО СВЯЗЫВАНИЯ PD-1 И VEGF АНТАГОНИСТОВ | 2013 |
|
RU2689760C2 |
| СПОСОБЫ ЛЕЧЕНИЯ РАКА С ИСПОЛЬЗОВАНИЕМ АНТАГОНИСТОВ, СВЯЗЫВАЮЩИХСЯ С КОМПОНЕНТАМИ СИГНАЛЬНОГО ПУТИ PD-1, И ТАКСАНОВ | 2014 |
|
RU2719487C2 |
| ЛЕЧЕНИЕ ВИРУСА ГРИППА А H7N9 | 2015 |
|
RU2682049C2 |
| СПОСОБЫ ЛЕЧЕНИЯ РАКА С ИСПОЛЬЗОВАНИЕМ АНТАГОНИСТОВ, СВЯЗЫВАЮЩИХ С ОСЬЮ PD-1, И ИНГИБИТОРОВ TIGIT | 2014 |
|
RU2702108C2 |
| АНТИТЕЛА ПРОТИВ NOTCH2 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2009 |
|
RU2580029C2 |
| АНТИТЕЛА ПРОТИВ BV8 И ИХ ПРИМЕНЕНИЕ | 2010 |
|
RU2559542C2 |
| СПОСОБЫ ЛЕЧЕНИЯ РАКА С ИСПОЛЬЗОВАНИЕМ АНТАГОНИСТОВ, СВЯЗЫВАЮЩИХ С ОСЬЮ PD-1, И ИНГИБИТОРОВ TIGIT | 2014 |
|
RU2825390C2 |
| МОНОКЛОНАЛЬНОЕ АНТИТЕЛО К PD-L1 | 2017 |
|
RU2665790C1 |
| АНТИТЕЛА К OX40L И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2006 |
|
RU2426744C2 |
| АПОПТОТИЧЕСКИЕ АНТИТЕЛА ПРОТИВ IgE | 2008 |
|
RU2500686C2 |

















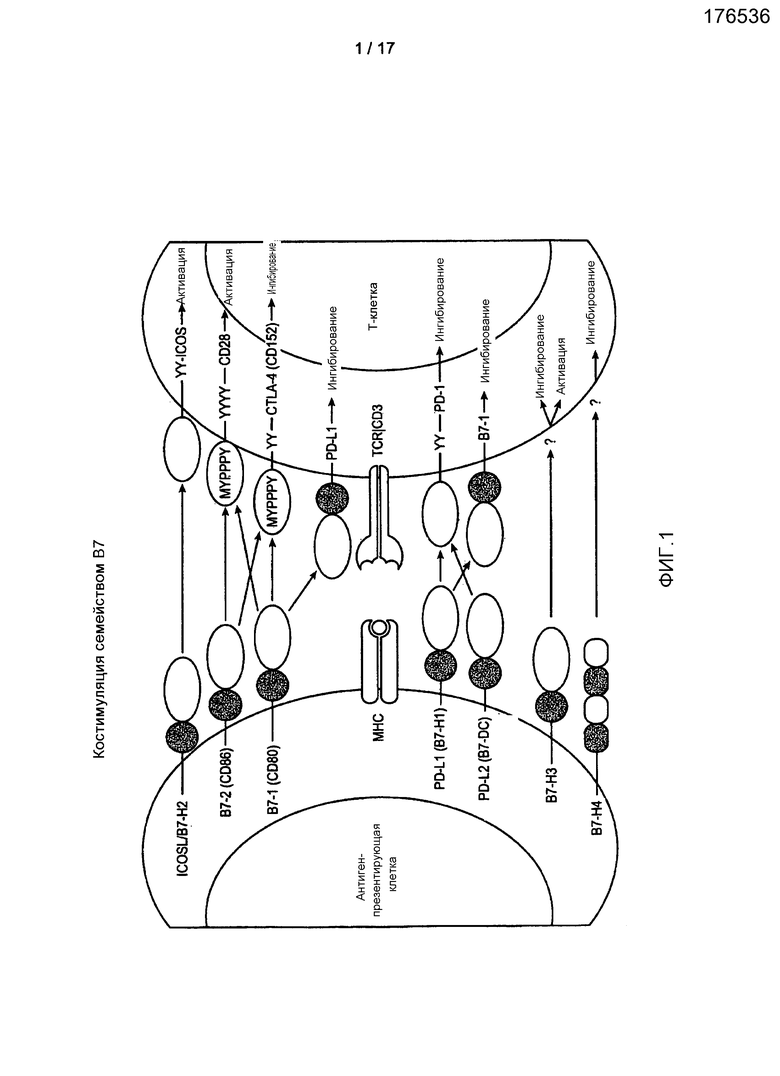
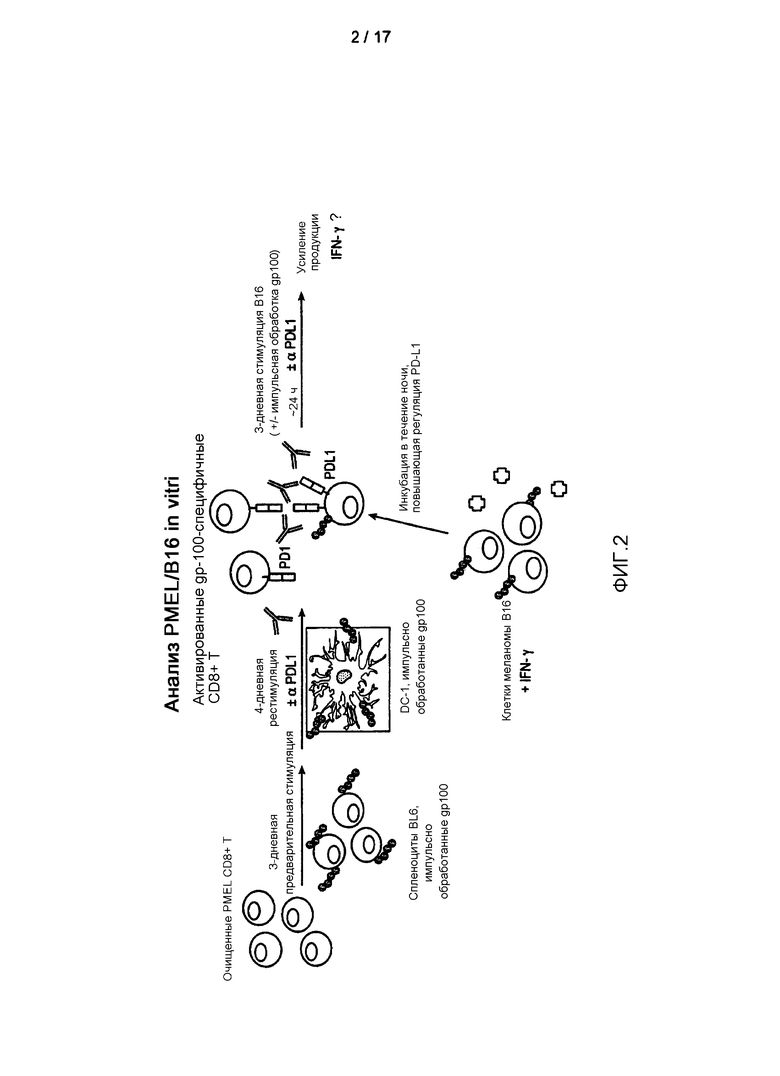
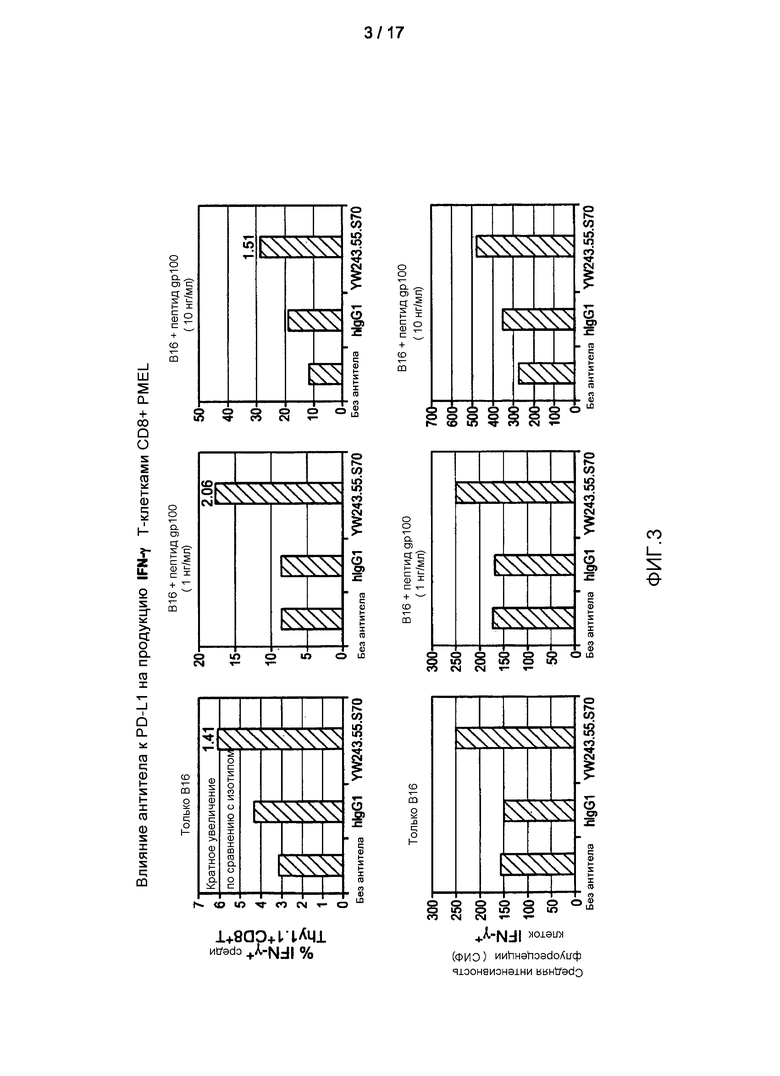

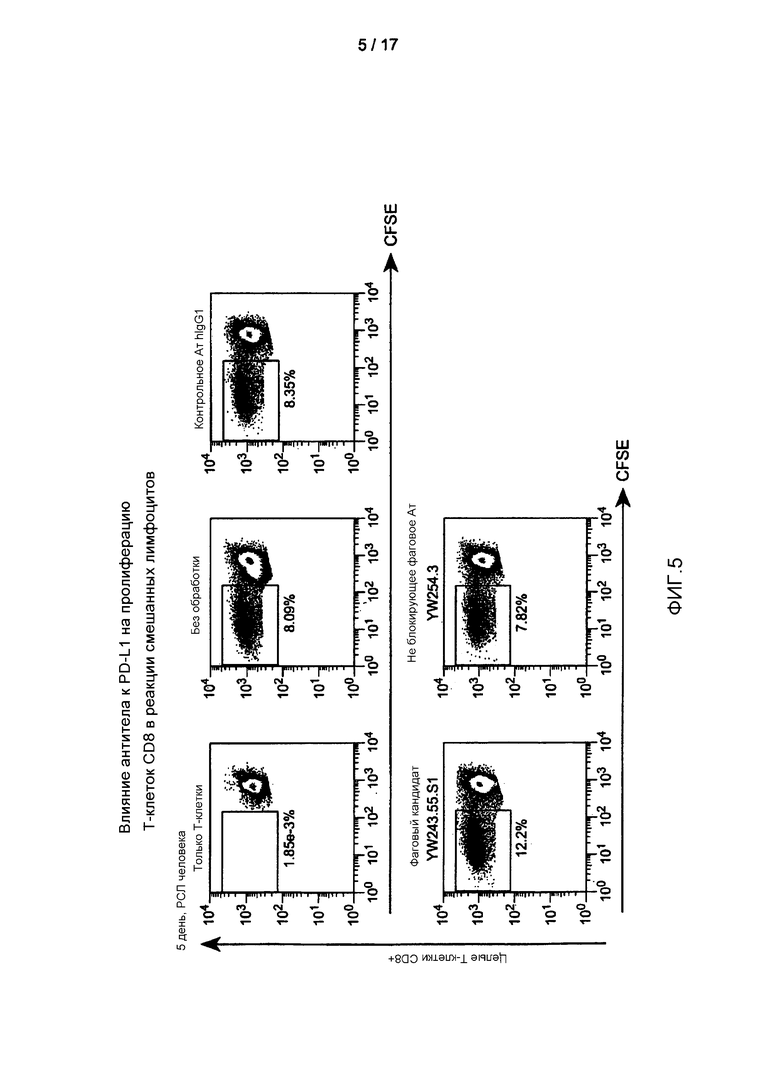
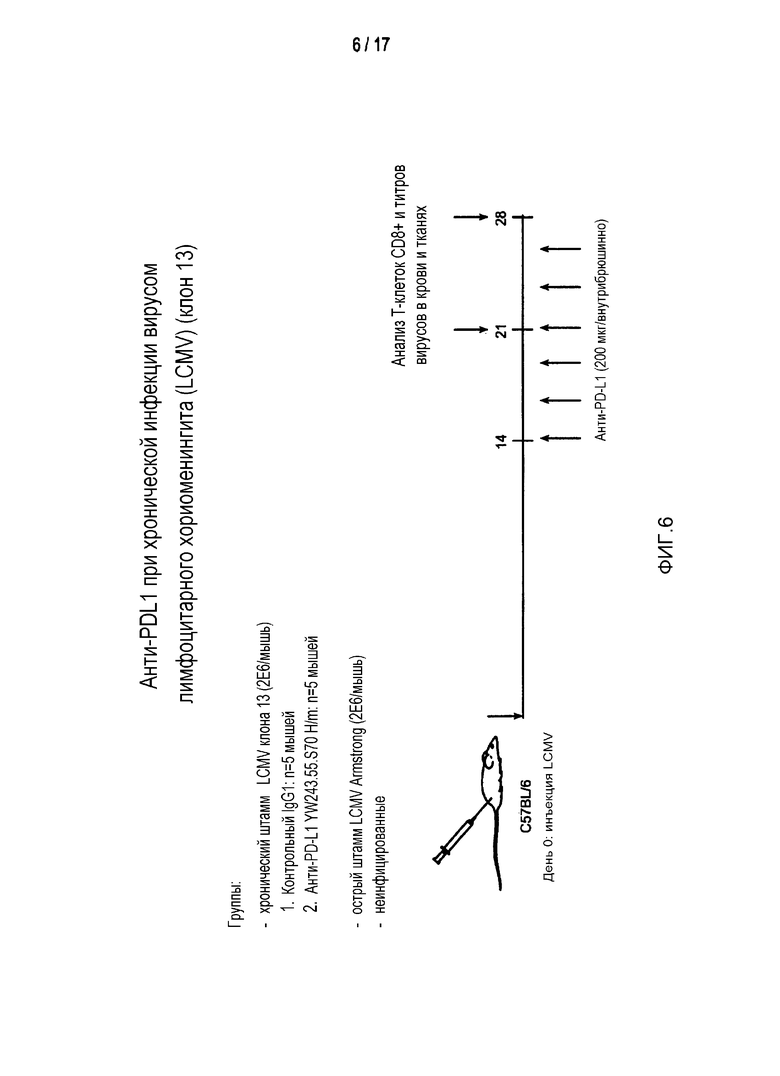
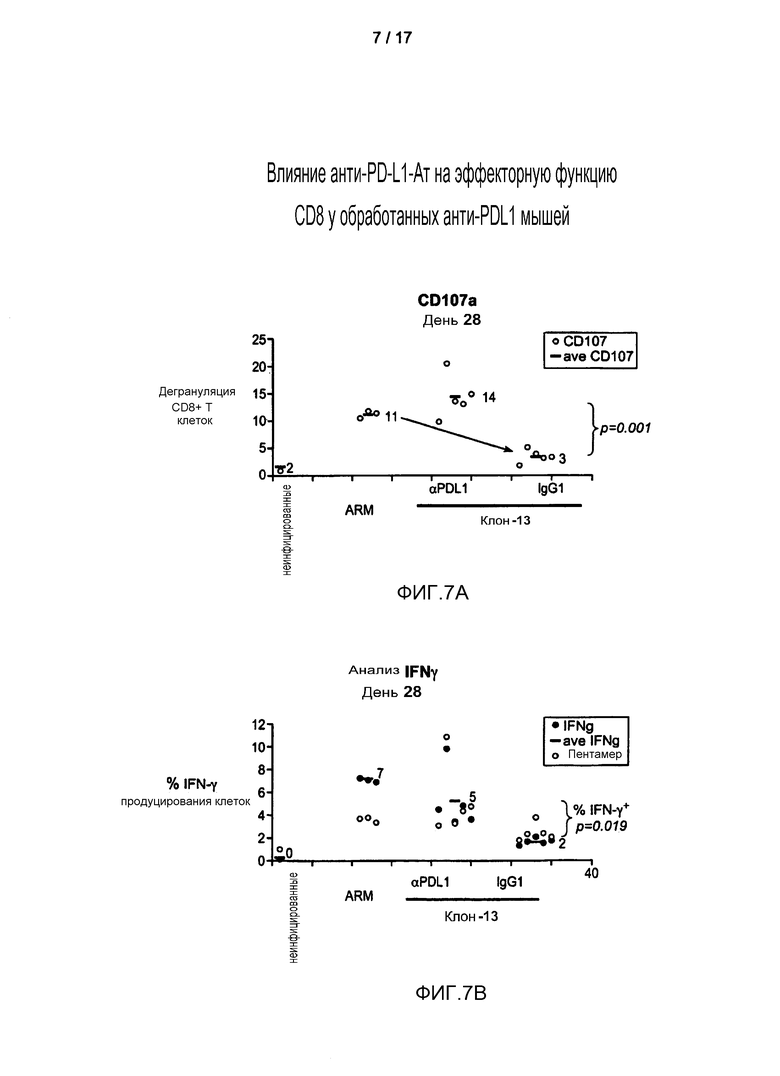
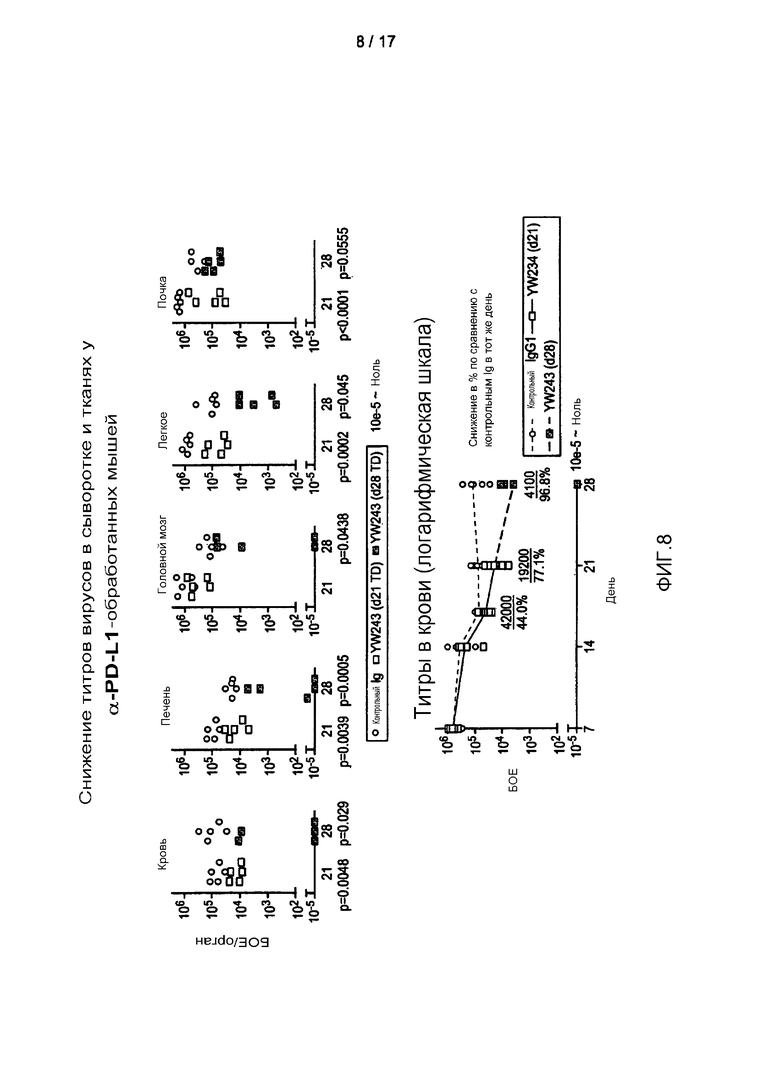
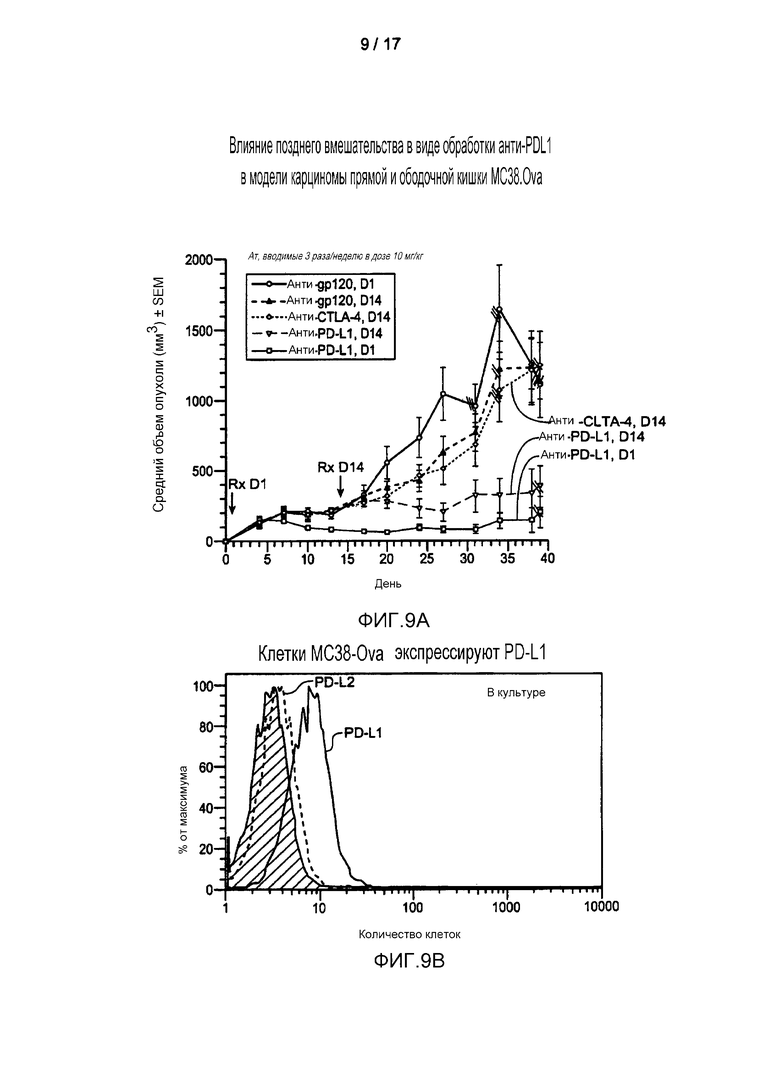
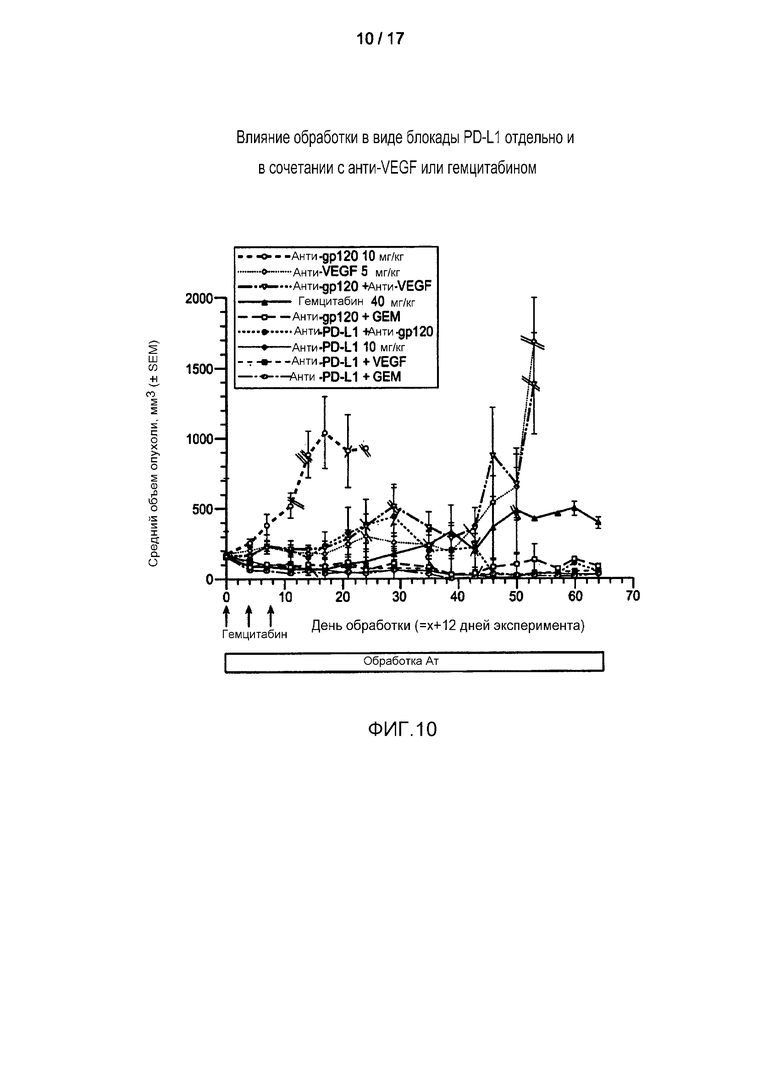
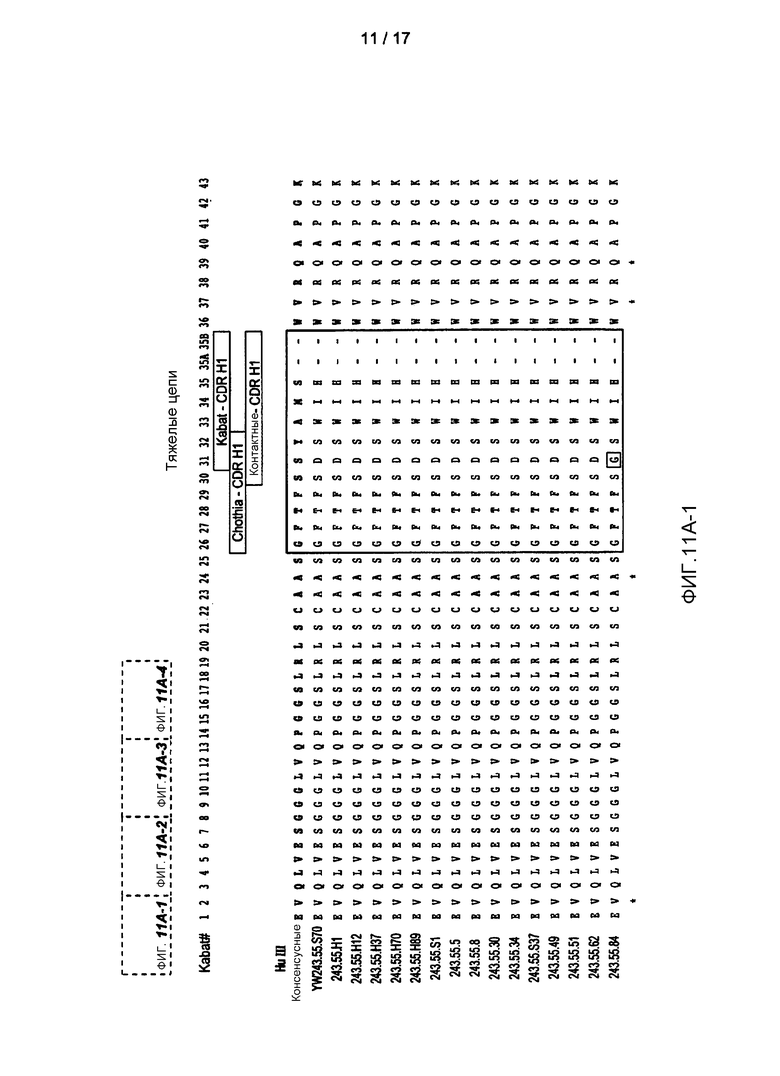



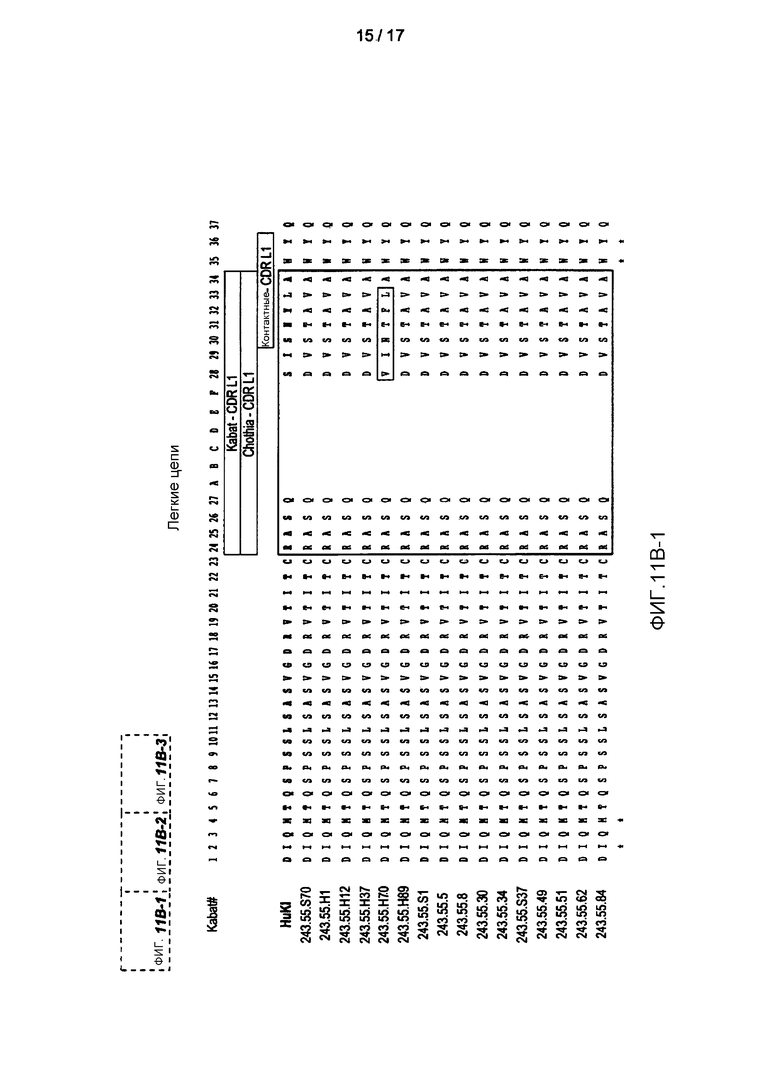
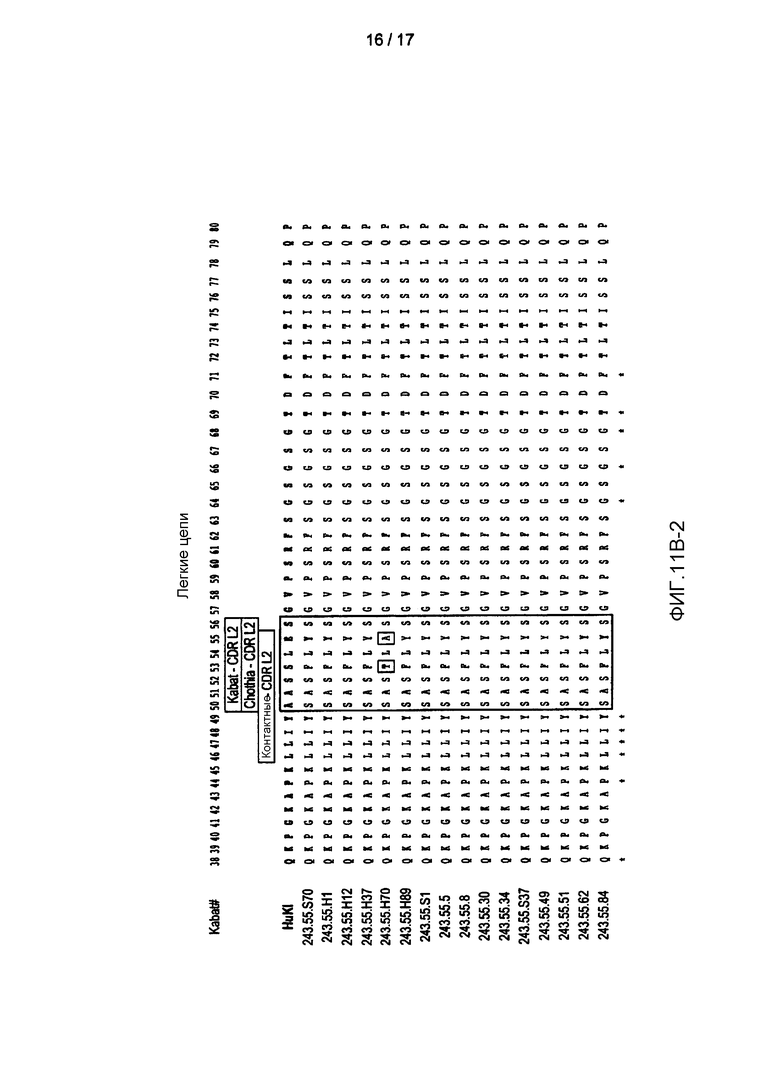
Настоящее изобретение относится к иммунологии. Предложено выделенное антитело к PD-L1 и его антигенсвязывающий фрагмент, охарактеризованные аминокислотными последовательностями гипервариабельных участков (HVR) в составе вариабельных областей тяжелой цепи и легкой цепи. Кроме того, описана выделенная нуклеиновая кислота, кодирующая антитело; экспрессионный вектор; клетка-хозяин и способ получения антитела или его антигенсвязывающего фрагмента. Также рассмотрена композиция, содержащая эффективное количество антитела к PD-L1 или антигенсвязывающего фрагмента; изделие производства, содержащее емкость с терапевтически эффективным количеством композиции; и способы лечения злокачественной опухоли и инфекции. Данное изобретение может найти дальнейшее применение в терапии. 11 н. и 49 з.п. ф-лы, 11 ил., 4 табл., 11 пр.
1. Выделенное антитело к PD-L1 или его антигенсвязывающий фрагмент, включающие последовательности вариабельных областей тяжелой цепи и легкой цепи, где
(а) тяжелая цепь содержит HVR-H1, HVR-H2 и HVR-H3, где
(i) HVR-H1 содержит аминокислотную последовательность SEQ ID NO: 15;
(ii) HVR-H2 содержит аминокислотную последовательность SEQ ID NO: 16;
(iii) HVR-H3 содержит аминокислотную последовательность SEQ ID NO: 3; и
(b) легкая цепь содержит HVR-L1, HVR-L2 и HVR-L3, где
(i) HVR-L1 содержит аминокислотную последовательность SEQ ID NO: 17;
(ii) HVR-L2 содержит аминокислотную последовательность SEQ ID NO: 18;
(iii) HVR-L3 содержит аминокислотную последовательность SEQ ID NO: 19.
2. Антитело или антигенсвязывающий фрагмент по п.1, содержащие:
(a) каркасные последовательности вариабельной области тяжелой цепи, расположенные между HVR согласно формуле: (НС-FR1)-(HVR-H1)-(HC-FR2)-(HVR-H2)-(HC-FR3)-(HVR-H3)-(HC-FR4), и
(b) каркасные последовательности вариабельной области легкой цепи, расположенные между HVR согласно формуле: (LC-FR1)-(HVR-L1)-(LC-FR2)-(HVR-L2)-(LC-FR3)-(HVR-L3)-(LC-FR4).
3. Антитело или антигенсвязывающий фрагмент по п.2, где каркасные последовательности вариабельной области легкой цепи представляют собой консенсусный каркас VL каппа I.
4. Антитело или антигенсвязывающий фрагмент по п.2 или 3, где одна или более каркасных аминокислотных последовательностей вариабельной области легкой цепи содержат следующие последовательности:
LC-FR1 содержит аминокислотную последовательность SEQ ID NO: 11;
LC-FR2 содержит аминокислотную последовательность SEQ ID NO: 12;
LC-FR3 содержит аминокислотную последовательность SEQ ID NO: 13;
LC-FR4 содержит аминокислотную последовательность SEQ ID NO: 14.
5. Антитело или антигенсвязывающий фрагмент по п.4, где каркасные аминокислотные последовательности вариабельной области легкой цепи содержат следующие последовательности:
LC-FR1 содержит аминокислотную последовательность SEQ ID NO: 11;
LC-FR2 содержит аминокислотную последовательность SEQ ID NO: 12;
LC-FR3 содержит аминокислотную последовательность SEQ ID NO: 13;
LC-FR4 содержит аминокислотную последовательность SEQ ID NO: 14.
6. Антитело или антигенсвязывающий фрагмент по п.4 или 5, где каркасные последовательности вариабельной области тяжелой цепи представляют собой консенсусный каркас VH подгруппы III.
7. Антитело или антигенсвязывающий фрагмент по любому из пп.4-6, где одна или более каркасных последовательностей вариабельной области тяжелой цепи включают следующие последовательности:
HC-FR1 содержит аминокислотную последовательность SEQ ID NO: 4;
HC-FR2 содержит аминокислотную последовательность SEQ ID NO: 5;
HC-FR3 содержит аминокислотную последовательность SEQ ID NO: 6;
HC-FR4 содержит аминокислотную последовательность SEQ ID NO: 7.
8. Антитело или антигенсвязывающий фрагмент по п.7, где каркасные аминокислотные последовательности вариабельной области тяжелой цепи содержат следующие последовательности:
HC-FR1 содержит аминокислотную последовательность SEQ ID NO: 4;
HC-FR2 содержит аминокислотную последовательность SEQ ID NO: 5;
HC-FR3 содержит аминокислотную последовательность SEQ ID NO: 6;
HC-FR4 содержит аминокислотную последовательность SEQ ID NO: 7.
9. Антитело или антигенсвязывающий фрагмент по любому из пп.1-8, где
(а) аминокислотная последовательность вариабельной области тяжелой цепи имеет по меньшей мере 90% идентичности аминокислотной последовательности вариабельной области тяжелой цепи SEQ ID NO: 20, и
(b) аминокислотная последовательность вариабельной области легкой цепи имеет по меньшей мере 90% идентичности аминокислотной последовательности вариабельной области легкой цепи SEQ ID NO: 21.
10. Антитело или антигенсвязывающий фрагмент по п.9, где аминокислотная последовательность вариабельной области легкой цепи имеет по меньшей мере 95% идентичности аминокислотной последовательности вариабельной области легкой цепи SEQ ID NO: 21.
11. Антитело или антигенсвязывающий фрагмент по п.9, где аминокислотная последовательность вариабельной области легкой цепи имеет по меньшей мере 99% идентичности аминокислотной последовательности вариабельной области легкой цепи SEQ ID NO: 21.
12. Антитело или антигенсвязывающий фрагмент по п.9, где аминокислотная последовательность вариабельной области легкой цепи содержит аминокислотную последовательность вариабельной области легкой цепи SEQ ID NO: 21.
13. Антитело или антигенсвязывающий фрагмент по любому из пп.9-12, где аминокислотная последовательность вариабельной области тяжелой цепи имеет по меньшей мере 95% идентичности аминокислотной последовательности вариабельной области тяжелой цепи SEQ ID NO: 20.
14. Антитело или антигенсвязывающий фрагмент по любому из пп.9-12, где аминокислотная последовательность вариабельной области тяжелой цепи имеет по меньшей мере 99% идентичности аминокислотной последовательности вариабельной области тяжелой цепи SEQ ID NO: 20.
15. Антитело или антигенсвязывающий фрагмент по любому из пп.9-12, где аминокислотная последовательность вариабельной области тяжелой цепи содержит аминокислотную последовательность вариабельной области тяжелой цепи SEQ ID NO: 20.
16. Выделенное антитело к PD-L1 или его антигенсвязывающий фрагмент, включающие аминокислотную последовательность вариабельной области тяжелой цепи SEQ ID NO: 20 и аминокислотную последовательность вариабельной области легкой цепи SEQ ID NO: 21.
17. Антитело или антигенсвязывающий фрагмент по любому из пп.1-16, дополнительно содержащие константную область человека.
18. Антитело или антигенсвязывающий фрагмент по п.17, где константная область выбрана из группы, состоящей из IgG1, IgG2, IgG3 и IgG4.
19. Антитело или антигенсвязывающий фрагмент по п.18, где константная область получена из IgG1.
20. Антитело или антигенсвязывающий фрагмент по любому из пп.1-19, обладающие пониженной или минимальной эффекторной функцией.
21. Антитело или антигенсвязывающий фрагмент по п.20, где минимальная эффекторная функция является результатом Fc-мутации с утратой эффекторной функции.
22. Антитело или антигенсвязывающий фрагмент по п.21, где Fc-мутация с утратой эффекторной функции представляет собой мутацию N297A.
23. Антитело или антигенсвязывающий фрагмент по п.21, где Fc-мутация с утратой эффекторной функции представляет собой мутацию D265A/N297A.
24. Антитело или антигенсвязывающий фрагмент по п.20, где минимальная эффекторная функция является результатом отсутствия гликозилирования.
25. Композиция для лечения злокачественной опухоли, содержащая эффективное количество антитела к PD-L1 или антигенсвязывающего фрагмента по любому из пп.1-24 и по меньшей мере один фармацевтически приемлемый носитель.
26. Выделенная нуклеиновая кислота, кодирующая антитело по любому из пп.1-24.
27. Экспрессионный вектор, содержащий нуклеиновую кислоту по п.26.
28. Клетка-хозяин для экспрессии антитела по любому из пп.1-24, содержащая вектор по п.27.
29. Клетка-хозяин по п.28, которая представляет собой эукариотическую клетку.
30. Клетка-хозяин по п.29, которая представляет собой клетку млекопитающего.
31. Клетка-хозяин по п.30, которая представляет собой клетку яичника китайского хомячка (СНО).
32. Способ получения антитела к PD-L1 или его антигенсвязывающего фрагмента, включающий культивирование клетки-хозяина по любому из пп.28-31 в условиях, подходящих для экспрессии вектора, кодирующего антитело к PD-L1 или его антигенсвязывающий фрагмент, и извлечение указанных антитела или его антигенсвязывающего фрагмента.
33. Изделие производства для лечения злокачественной опухоли, содержащее емкость, содержащую терапевтически эффективное количество композиции по п.25 и вкладыш в упаковку, в котором указано применение.
34. Способ лечения злокачественной опухоли, включающий введение терапевтически эффективного количества антитела по любому из пп.1-24 нуждающемуся в этом пациенту.
35. Способ лечения злокачественной опухоли, включающий введение терапевтически эффективного количества композиции по п.25 нуждающемуся в этом пациенту.
36. Способ по п.34 или 35, где злокачественная опухоль выбрана из группы, состоящей из: рака молочной железы, легкого, ободочной кишки, яичника, меланомы, рака мочевого пузыря, почки, печени, слюнной железы, желудка, глиом, рака щитовидной железы, вилочковой железы, эпителиального рака, раков головы и шеи, рака желудка и поджелудочной железы.
37. Способ по п.34 или 35, дополнительно включающий введение химиотерапевтического средства.
38. Способ по п.37, где злокачественная опухоль выбрана из группы, состоящей из: рака молочной железы, легкого, ободочной кишки, яичника, меланомы, рака мочевого пузыря, почки, печени, слюнной железы, желудка, глиом, рака щитовидной железы, вилочковой железы, эпителиального рака, раков головы и шеи, рака желудка и поджелудочной железы.
39. Способ по п.37 или 38, где химиотерапевтическое средство представляет собой антитело к VEGF.
40. Способ по п.39, где антитело к VEGF представляет собой бевацизумаб.
41. Способ по п.37 или 38, где химиотерапевтическое средство представляет собой FOLFOX.
42. Способ по п.41, где FOLFOX представляет собой комбинацию оксалиплатина, 5-фторурацила и лейковорина.
43. Способ по п.37 или 38, где химиотерапевтическое средство представляет собой оксалиплатин.
44. Способ по п.37 или 38, где химиотерапевтическое средство представляет собой ингибитор RAF.
45. Способ лечения инфекции, включающий введение терапевтически эффективного количества антитела по любому из пп.1-24 нуждающемуся в этом пациенту.
46. Способ по п.45, дополнительно включающий введение антибиотика.
47. Способ по п.46, где антибиотик представляет собой противовирусное средство.
48. Способ по п.47, где противовирусное средство представляет собой ингибитор обратной транскриптазы.
49. Способ по п.48, где ингибитор обратной транскриптазы представляет собой ингибитор полимеразы.
50. Способ по п.47, где противовирусное средство представляет собой ингибитор протеазы.
51. Способ по п.45, дополнительно включающий введение по меньшей мере одной вакцины.
52. Способ по любому из пп.45-51, где инфекция является хронической.
53. Способ по п.52, где хроническая инфекция является персистирующей.
54. Способ по п.52, где хроническая инфекция является латентной.
55. Способ по п.52, где хроническая инфекция является медленной.
56. Способ по любому из пп.45-55, где инфекция вызвана патогеном, выбранным из группы, состоящей из бактерий, вирусов, грибов и простейших.
57. Способ по п.56, где патоген представляет собой бактерию, и способ дополнительно включает введение антибактериального средства.
58. Способ по п.56, где патоген представляет собой вирус, и способ дополнительно включает введение противовирусного средства.
59. Способ по п.56, где патоген представляет собой гриб, и способ дополнительно включает введение противогрибкового средства.
60. Способ по п.56, где патоген представляет собой простейшее, и способ дополнительно включает введение противопротозойного средства.
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| BARBER D | |||
| L | |||
| et al., "Restoring function in exhausted CD8 T cells during chronic viral infection" Nature (2005), 439(7077): 682-687 | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| BUTTE M | |||
| J | |||
| et al., "Programmed death-1 ligand 1 interacts specifically with the B7-1 costimulatory molecule to inhibit T cell responses", Immunity (2007), 27(1), 111-122 | |||
| ЖУКОВА О | |||
| Б | |||
| и др., "Модуляция программируемой гибели лимфоцитов периферической крови при хронической вирусной инфекции." Цитология (2007), 49(1), 26-31. | |||
Авторы
Даты
2017-11-17—Публикация
2009-12-08—Подача