Родственная заявка
Настоящая заявка является родственной заявке на патент США №61/362329, поданной 8 июля 2010 года, содержание которой включено в настоящую заявку по всей полноте посредством ссылки.
Область техники
Настоящее изобретение в целом относится к области терапии, в частности, к области терапии простого герпеса и опоясывающего герпеса, более конкретно к способам снижения частоты рецидивов, отсрочки рецидивов и/или предотвращения рецидивов лабиального герпеса (простуды на губах), генитального герпеса (герпеса гениталий) и опоясывающего герпеса (опоясывающего лишая) путем местного введения полиэтиленгликоля (ПЭГ) или композиции, содержащей ПЭГ.
Уровень техники
В настоящем описании приведен ряд публикаций для более подробного описания и раскрытия изобретения и уровня техники, к которой относится изобретение. Каждая из указанных публикаций включена в настоящее описание во всей полноте посредством ссылки в том же объеме, как если бы было указано, что каждая индивидуальная заявка конкретно и отдельно включена посредством ссылки.
В настоящем описании, включая формулу изобретения, которая следует после описания, если в контексте явно не подразумевается иное, следует понимать, что слово «содержать» и его варианты, такие как «содержит» и «содержащий», означает включение указанного числового значения или стадии, или группы числовых значений или стадий, но не исключение любых других числовых значений или стадий, или групп числовых значений или стадий.
Необходимо отметить, что используемые в настоящем описании и прилагаемой формуле изобретения формы единственного числа включают ссылки на множество объектов, если в контексте явно не указано иное. Таким образом, например, ссылка на «фармацевтический носитель» охватывает смеси двух или более указанных носителей и т.д.
Диапазоны в настоящем описании часто выражены в виде «примерно» от одного конкретного значения и/или «примерно» до другого конкретного значения. Если диапазон выражен таким образом, то другой вариант реализации включает диапазон от одного конкретного значения и/или до другого конкретного значения. Аналогично, если значения выражены в виде приблизительных значений с использованием определения «примерно», следует понимать, что конкретное значение соответствует другому варианту реализации.
Настоящее описание включает информацию, которая может быть полезной для понимания настоящего изобретения. При этом будет неправильным предположение о том, что любая информация, приведенная здесь, относится к уровню техники или имеет непосредственное отношение к заявленному изобретению или что конкретно или косвенно указанные публикации относятся к уровню техники.
Семейство вирусов герпеса
Семейство вирусов герпеса представляет собой крупное семейство ДНК-вирусов, также известное как герпесвирусы. Существует ряд различных вирусов этого семейства, которые вызывают заболевания у человека, включая вирус простого герпеса 1 (ВПГ-1); вирус простого герпеса 2 (ВПГ-2); вирус ветряной оспы (VZV); вирус Эпштейна-Барр (ВЭБ); цитомегаловирус (ЦМВ); розеоловирус; и вирус герпеса, связанный с саркомой Капоши (KSHV).
Вирусы простого герпеса (ВПГ-1 и ВПГ-2) и вирус ветряной оспы (VZV) принадлежат к одному подсемейству вирусов (альфа-герпесвирусы).
Вирус простого герпеса (ВПГ)
Вирусы простого герпеса имеют диаметр от 140 до 180 нм и, таким образом, относятся к крупным вирусам. Они содержат икосаэдрический капсид, который содержит линейную двухцепочечную ДНК. Капсид окружен оболочкой вируса; этот факт вызывает чувствительность вирусов к мылам, моющим средствам и слабым дезинфицирующим средствам.
Примерно 80% населения по всему миру имеют положительные результаты анализа на антитела к ВПГ (см., например, Уитли (Whitley), 1990), а следовательно, вирус простого герпеса распространен по всему миру. В Соединенных Штатах частота повторного заболевания лабиальным герпесом по оценкам составляет примерно от 20% до 40%, и примерно 100 миллионов случаев фиксируют по стране каждый год (см., например, Янг с соавторами (Young, et al.), 1988). В Швейцарии примерно 70% взрослого населения имеют положительные результаты анализа на антитела к ВПГ-1 и примерно 20% - на антитела к ВПГ-2 (см., например, Бюнзли с соавторами (Buenzli et al.), 2004).
ВПГ-1 переносится при контакте со слюной или с зараженным человеком или объектами, в то время как ВПГ-2 переносится при непосредственном контакте со слизистыми оболочками. ВПГ-1, как правило, приобретается в младенчестве через слизистую оболочку полости рта, где он вызывает гингивостоматит (очень болезненное воспаление полости рта). Впоследствии вирусы мигрируют по аксонам ЦНС (центральной нервной системы), где они остаются в латентном состоянии в тригеминальном (гассеровом) ганглии. После реактивации (эндогенный рецидив), которая может быть вызвана психическим стрессом, изоляцией, лихорадкой, травмами, менструацией, другими инфекциями или иммуносупрессивной терапией, вирусы таким же образом мигрируют в периферические органы, где могут вызывать простуду на губах (лабиальный герпес). На губах плотность нервных окончаний очень высока, и эти эпителиальные слои важны для репродуцирования вируса.
Несмотря на существующий иммунитет, возможность возникновения рецидивов сохраняется, так как вирус мигрирует по нервным путям и не попадает в межклеточное пространство. Это означает, что иммунная система не может атаковать вирусы. В результате возможны некоторые осложнения; в том числе герпетический кератоконъюнктивит или приводящий к высокой смертности герпетический энцефалит (без проведения лечения смертность достигает 80%).
Первоначальное инфицирование ВПГ-2, как правило, происходит во время полового акта, и инфекция затрагивает мочеполовые пути. Эта инфекция может возникать, даже если хозяин имеет положительные результаты исследования на ВПГ-1. Вирус ВПГ-2 остается латентным в пояснично-крестцовых ганглиях или в периферических тканях, где он вызывает симптомы так называемого генитального герпеса. Неврологические осложнения являются редкими и более безвредными по сравнению с инфекцией ВПГ-1. Тем не менее существует одно осложнение, приводящее к высокой смертности: инфекция новорожденных (герпес новорожденных).
Лабиальный герпес
Лабиальный герпес представляет собой заболевание, вызываемое вирусом простого герпеса (ВПГ). Существует два типа вирусов простого герпеса, которые называются ВПГ-1 и ВПГ-2, каждый из которых принадлежит к роду простых вирусов семейства вирусов герпеса.
Инкубационный период лабиального герпеса составляет, как правило, от 2 до 12 дней. Первые признаки и симптомы реактивации лабиального герпеса включают чувство натяжения кожи, гиперчувствительность кожи; раздражение, жжение и/или зуд с последующей реэпителизацией; образование корок (часто заполненных гноем) и эрозий. В редких случаях может происходить воспаление лимфоузлов.
В дополнение к неврологическим исследованиям и диагностике внутренних органов существует возможность определения вируса в крови при помощи исследования антител. Тем не менее подтверждение конкретного типа вируса происходит только в тяжелых формах. Даже в случае системных и диссеминированных инфекций ВПГ обнаружение антител ВПГ-IgG и ВПГ-IgM невозможно или возможно только на очень поздних стадиях.
Литический цикл ВПГ в клетках эпителия включает связывание с клеткой, утрату оболочки, транскрипцию вируса, репликацию ДНК в ядре, сборку частиц и выведение из клетки. В результате этого процесса запускается первичная инфекция. Некоторые вирусы поступают в терминали сенсорных нейронов и возвращаются обратно в ядро, где становятся латентными. Клетки эпителия повторно инфицируются в результате антероградного транспорта вирусных частиц, выделяемых нейроном. Это повторное инфицирование приводит к бессимптомному вирусовыделению или повторным повреждениям.
Существующие способы лечения лабиального герпеса
Для ослабления лабиального герпеса доступен ряд противовирусных средств. «Золотым стандартом», тем не менее является ацикловир, нуклеозидный аналог гуанина. Вследствие его низкой биодоступности были разработаны некоторые другие противовирусные средства (например, пенцикловир и его производные, фамцикловир и валацикловир и т.д.). Молекула ацикловира превращается (только в инфицированных клетках) в ацикловира монофосфат под действием вирусной тимидинкиназы. Эта киназа более эффективно вступает в реакцию фосфорилирования по сравнению с клеточной тимидинкиназой. Впоследствии монофосфатная форма ацикловира превращается в трифосфатную форму (ацикловира трифосфат) под действием клеточной тимидинкиназы.
В случае незначительных или редких проявлений лабиального герпеса достаточным является применение 5% крема ацикловира. Этот крем наносят непосредственно на пораженный герпесом участок 5 раз в день, как правило, в течение 5 дней, и период лечения не должен превышать 10 дней.
Существующий способ лечения эпизодических вспышек лабиального герпеса приведен ниже:
Существующий способ виростатической супрессивной терапии частых рецидивов рецидивирующего лабиального герпеса приведен ниже:
Приведенные выше способы лечения являются очень дорогими, особенно если требуется длительное лечение, в этом случае ухудшается соблюдение больным схемы лечения. Кроме того, за последние годы увеличилось количество вирусов, устойчивых к действию ацикловира, что также может снижать эффективность лечения.
Следовательно, существует большая потребность в альтернативных способах лечения инфекций ВПГ и заболеваний и нарушений, связанных с, стимулируемых или вызываемых вирусными инфекциями простого герпеса (ВПГ), включая, например, лабиальный герпес.
Авторы настоящего изобретения неожиданно обнаружили, что полиэтиленгликоль (ПЭГ) при местном применении на губах и окружающей коже лица пациента снижает частоту рецидивов, вызывает отсрочку рецидивов и/или предотвращает рецидивы лабиального герпеса.
Было описано множество способов лечения лабиального герпеса. Как правило, лечение включает применение состава, содержащего один или более терапевтических агентов (например, один или более агентов для лечения лабиального герпеса и/или вызывающей его вирусной инфекции). В некоторых случаях состав дополнительно содержит полиэтиленгликоль (ПЭГ).
Тем не менее в каждом случае ПЭГ используют в качестве вспомогательного компонента состава, а не вследствие его терапевтической ценности. Ни в одной работе не встречались предположения о том, что полиэтиленгликоль как таковой подходит или является эффективным для терапии вирусных инфекций, в том числе для снижения частоты рецидивов, отсрочки рецидивов и/или предотвращения рецидивов лабиального герпеса, генитального герпеса или опоясывающего герпеса.
Также, в каждом случае состав предназначен для лечения острого лабиального герпеса (например, для лечения симптомов лабиального герпеса; для снижения тяжести симптомов; для снижения длительности рецидива; для ускорения излечения и т.д.). В каждом случае состав вводят при возникновении рецидива (т.е. в продромальной фазе) или во время рецидива (т.е. в острой фазе). Ни в одной работе не встречались предположения о том, что указанные составы следует вводить в качестве профилактических средств, даже если симптомы отсутствуют, для снижения частоты рецидивов, отсрочки рецидивов и/или предотвращения рецидивов.
Например, в международной публикации WO 2008/087034 A2 описаны составы, содержащие циклодекстрин, и их применение для лечения вирусных инфекций, включая лечение простуды на губах. См., например, стр.3, строки 23-24 заявки. Составы могут содержать, например, полиэтиленгликоль, в качестве возможного дополнительного компонента. См., например, стр.15-16 заявки. Но в указанном документе отсутствуют идеи или предположения о том, что полиэтиленгликоль как таковой подходит или является эффективным для терапии вирусных инфекций, таких как лабиальный герпес. В указанном документе отсутствуют идеи или предположения о том, что полиэтиленгликоль как таковой подходит или является эффективным для снижения частоты рецидивов, отсрочки рецидивов и/или предотвращения рецидивов лабиального герпеса, генитального герпеса или опоясывающего герпеса.
Аналогично, в патенте США №4762715 описаны губные помады, содержащие определенные противогерпетические агенты (гепарин и сульфат цинка) для лечения лабиального герпеса. В Примере 1 патента описано получение губной помады с применением смеси ПЭГ 1000; ПЭГ 4000; ПЭГ 400; полиоксиэтиленсорбитана моностеарата; полиоксиэтиленсорбитана моноолеата; гепарина натрия; и гептагидрата сульфата цинка. Но в указанном документе отсутствуют идеи или предположения о том, что полиэтиленгликоль как таковой подходит или является эффективным для терапии вирусных инфекций, таких как лабиальный герпес.В указанном документе отсутствуют идеи или предположения о том, что полиэтиленгликоль как таковой подходит или является эффективным для снижения частоты рецидивов, отсрочки рецидивов и/или предотвращения рецидивов лабиального герпеса, генитального герпеса или опоясывающего герпеса. Вместо этого полиэтиленгликоль выбран в качестве предпочтительного носителя, что часто имеет место в случае фармацевтических составов.
Краткое описание чертежей
На Фигуре 1 приведена столбчатая диаграмма, иллюстрирующая снижение числа вспышек (рецидивов) лабиального герпеса у пациентов, исследуемых согласно настоящему изобретению. Приведены % пациентов и суммарный % пациентов для 100%, 90%+, 80%+, 70%+ и 60%+ снижения числа вспышек (рецидивов).
Краткое описание изобретения
Один из аспектов изобретения относится к способу снижения частоты рецидивов, отсрочки рецидивов и/или предотвращения рецидивов лабиального герпеса, генитального герпеса или опоясывающего герпеса у пациента, включающему местное введение указанному пациенту терапевтически эффективного количества: полиэтиленгликоля или композиции, содержащей полиэтиленгликоль (ПЭГ), описанных в настоящей заявке.
Другой аспект настоящего изобретения относится к полиэтиленгликолю (ПЭГ), описанному в настоящей заявке, для применения в терапии.
Другой аспект изобретения относится к полиэтиленгликолю (ПЭГ), описанному в настоящей заявке, для применения в способе снижения частоты рецидивов, отсрочки рецидивов и/или предотвращения рецидивов лабиального герпеса, генитального герпеса или опоясывающего герпеса путем местного введения.
Другой аспект изобретения относится к применению полиэтиленгликоля (ПЭГ), описанного в настоящей заявке, для получения лекарственного средства для снижения частоты рецидивов, отсрочки рецидивов и/или предотвращения рецидивов лабиального герпеса, генитального герпеса или опоясывающего герпеса путем местного введения.
Другой аспект изобретения относится к составу, подходящему для местного введения, содержащему ПЭГ, описанный в настоящей заявке.
Специалистам в данной области техники должно быть очевидным, что признаки и предпочтительные варианты реализации одного из аспектов изобретения также относятся к другим аспектам изобретения.
Подробное описание изобретения
Авторы настоящего изобретения неожиданно обнаружили, что полиэтиленгликоль (ПЭГ) при местном нанесении на губы пациента эффективен для снижения частоты рецидивов, отсрочки рецидивов и/или предотвращения рецидивов лабиального герпеса.
Как показали клинические исследования, описанные в настоящей заявке, местное введение ПЭГ два раза в день на губы пациентов, у которых происходило по меньшей мере 8 рецидивов лабиального герпеса в год, вызывало значительное снижение частоты рецидивов. Полагают, что во многих случаях профилактическая терапия задерживает появление рецидивов на неопределенно длительный срок.
Не желая быть связанными какой-либо конкретной теорией, полагают, что в эффективность ПЭГ могут вносить вклад его гигроскопические свойства. Установлено, что регулярная (профилактическая) терапия с применением ПЭГ изменяет свойства кожи таким образом, что в результате структура кожи меньше подходит для репликации, пролиферации и/или проявления активности вируса. В общих чертах, гигроскопический ПЭГ связывает воду; если его наносят на губы, кожу или влажную поверхность, ПЭГ связывает воду соответствующей матрицы. Также очевидно, что ПЭГ связывает не только воду, но также другие компоненты, возможно, глицерин, белки и т.д., которые растворены в воде (происходит эффект «вымывания»). Установлено, что если ПЭГ применять регулярно, он оказывает положительное действие на состав кожи, другими словами, является эффективным для снижения частоты рецидивов, отсрочки рецидивов и/или предотвращения рецидивов, например, лабиального герпеса.
В дополнение к исключительной эффективности ПЭГ обладает другими важными преимуществами. ПЭГ используют в широком ряде применений от промышленного производства до медицины, и в настоящее время известны тщательно проработанные способы его получения, очистки и хранения. ПЭГ является исключительно безопасным для человека и внесен в перечень веществ, признанных полностью безвредными (GRAS). Можно ожидать, что местное введение ПЭГ может иметь незначительные нежелательные побочные эффекты или вообще не иметь их. В противоположность этому, все традиционные противовирусные агенты (ацикловир, валацикловир, фамцикловир, фоскамет или пенцикловир) оказывают системное действие и вызывают ряд нежелательных побочных эффектов (например, тошноту, рвоту, диарею, потерю аппетита, боли в желудке, головные боли, головокружения, отеки рук или ног и т.д.). В дополнение можно ожидать, что стоимость подходящих составов, содержащих ПЭГ, будет ниже по сравнению со стоимостью составов с аналогичным действием, содержащих традиционные системные противовирусные агенты. Наконец, можно ожидать, что, применяя ПЭГ, пациенты будут строго соблюдать схему лечения (практически наверняка строже по сравнению с применением традиционных системных противовирусных агентов).
Во избежание неясностей, авторы настоящего изобретения не утверждают, что способы, описанные в настоящей заявке, предотвращают вирусную инфекцию (например, предотвращают инфекции ВПГ-1, ВПГ-2 или VZV). В действительности, способы, описанные в настоящей заявке, подходят для терапии заболеваний и нарушений, связанных с, стимулируемых или вызываемых вирусной инфекцией (т.е. заболеваний и нарушений, связанных с, стимулируемых или вызываемых инфекциями ВПГ-1, ВПГ-2 или VZV). Таким образом, способы, описанные в настоящей заявке, можно охарактеризовать как симптоматическое лечение в смысле предотвращения и/или ослабления симптомов вирусной инфекции (например, инфекций ВПГ-1, ВПГ-2 или VZV).
Полиэтиленгликоль (ПЭГ)
Полиэтиленгликоль (ПЭГ), также известный как полиэтиленоксид (ПЭО) и полиоксиэтилен (ПОЭ), представляет собой олигомер или полимер этиленоксида.
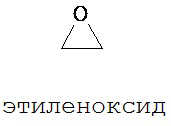
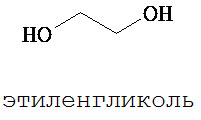
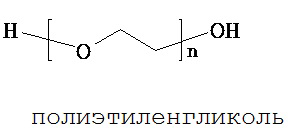
Полиэтиленгликоль (ПЭГ) имеет химическую формулу HO-(CH2CH2O)m-H, где индекс «т» представляет собой целое число больше 1. Проще говоря, каждая молекула полимера имеет молекулярную массу, составляющую 18+44(m). Тем не менее общеизвестно, что трудно получать образец ПЭГ даже с умеренным значением «m», который является «монодисперсным», т.е. в котором «m» является одинаковым для всех полимерных молекул образца полимера. В действительности конкретный образец ПЭГ, как правило, содержит диапазон различных полимерных молекул (каждая из которых имеет различное значение «m»), каждая из которых имеет определенное содержание (выраженное, например, в виде доли от общего числа, доли от общей массы). Конкретное распределение полимерных молекул (т.е. количество, по числу или по массе, полимерных молекул с различными молекулярными массами) обуславливает многие химические и физические свойства образца полимера.
Двумя способами описания распределения полимерных молекул являются «среднечисловая молекулярная масса (Mn)» и «среднемассовая молекулярная масса (Mn)», которые рассчитывают при помощи следующих формул, где N и М означают, соответственно, число и молекулярную массу каждой частицы L
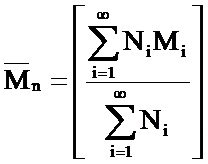
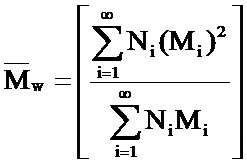
Mw всегда больше Mn за исключением того случая, когда все молекулы полимера являются одинаковыми (и образец является «монодисперсным»), и Mw равна Mn. Соотношение (Mw/Mn) называется индексом полидисперсности (P) и является мерой ширины диапазона молекулярных масс.
В одном из вариантов реализации ПЭГ, применяемый согласно настоящему изобретению, имеет среднемассовую молекулярную массу (Mw), составляющую примерно от 200 до 20000.
В одном из вариантов реализации диапазон составляет примерно от 300 до 20000.
В одном из вариантов реализации диапазон составляет примерно от 200 до 15000. В одном из вариантов реализации диапазон составляет примерно от 300 до 15000.
В одном из вариантов реализации диапазон составляет примерно от 300 до 10000. В одном из вариантов реализации диапазон составляет примерно от 300 до 10000.
В одном из вариантов реализации ПЭГ, применяемый согласно настоящему изобретению, имеет среднемассовую молекулярную массу (Mw), составляющую примерно от 200 до 1000.
В одном из вариантов реализации диапазон составляет примерно от 200 до 800. В одном из вариантов реализации диапазон составляет примерно от 300 до 800.
В одном из вариантов реализации диапазон составляет примерно от 200 до 700. В одном из вариантов реализации диапазон составляет примерно от 300 до 700.
В одном из вариантов реализации диапазон составляет примерно от 200 до 600. В одном из вариантов реализации диапазон составляет примерно от 300 до 600.
В одном из вариантов реализации диапазон составляет примерно от 200 до 500. В одном из вариантов реализации диапазон составляет примерно от 300 до 500.
В одном из вариантов реализации ПЭГ, применяемый согласно настоящему изобретению, имеет среднемассовую молекулярную массу (Mw), составляющую примерно 400.
В одном из вариантов реализации ПЭГ, применяемый согласно настоящему изобретению, имеет среднемассовую молекулярную массу (Mw), составляющую примерно от 1000 до 20000.
В одном из вариантов реализации диапазон составляет примерно от 1000 до 15000. В одном из вариантов реализации диапазон составляет примерно от 1000 до 12000. В одном из вариантов реализации диапазон составляет примерно от 1000 до 10000. В одном из вариантов реализации диапазон составляет примерно от 1000 до 9000.
В одном из вариантов реализации диапазон составляет примерно от 4000 до 20000. В одном из вариантов реализации диапазон составляет примерно от 4000 до 15000. В одном из вариантов реализации диапазон составляет примерно от 4000 до 12000. В одном из вариантов реализации диапазон составляет примерно от 4000 до 10000. В одном из вариантов реализации диапазон составляет примерно от 4000 до 9000.
В одном из вариантов реализации диапазон составляет примерно от 6000 до 20000. В одном из вариантов реализации диапазон составляет примерно от 6000 до 15000. В одном из вариантов реализации диапазон составляет примерно от 6000 до 12000. В одном из вариантов реализации диапазон составляет примерно от 6000 до 10000. В одном из вариантов реализации диапазон составляет примерно от 6000 до 9000.
В одном из вариантов реализации диапазон составляет примерно от 7000 до 20000. В одном из вариантов реализации диапазон составляет примерно от 7000 до 15000. В одном из вариантов реализации диапазон составляет примерно от 7000 до 12000. В одном из вариантов реализации диапазон составляет примерно от 7000 до 10000. В одном из вариантов реализации диапазон составляет примерно от 7000 до 9000.
В одном из вариантов реализации ПЭГ, применяемый согласно настоящему изобретению, имеет среднемассовую молекулярную массу (Mw), составляющую примерно 8000.
В одном из вариантов реализации ПЭГ, применяемый согласно настоящему изобретению, представляет собой смесь двух или более полимеров ПЭГ с различными молекулярно-массовыми распределениями.
Одной из причин объединения полимеров ПЭГ с различными молекулярно-массовыми распределениями является достижение желаемой вязкости (например, ПЭГ или композиции, содержащей ПЭГ).
В одном из вариантов реализации ПЭГ, применяемый согласно настоящему изобретению, представляет собой смесь двух или более полимеров ПЭГ с различными молекулярно-массовыми распределениями, где два из указанных двух или более полимеров ПЭГ выбраны из полимеров ПЭГ, описанных выше (например, ПЭГ со среднемассовой молекулярной массой (Mw), составляющей примерно от 300 до 800; и ПЭГ со среднемассовой молекулярной массой (Mw), составляющей примерно от 6000 до 10000).
В одном из вариантов реализации ПЭГ, применяемый согласно настоящему изобретению, представляет собой смесь двух или более полимеров ПЭГ с различными молекулярно-массовыми распределениями, где один из указанных двух или более полимеров ПЭГ представляет собой:
(a) ПЭГ со среднемассовой молекулярной массой (Mw), составляющей примерно от 200 до 1000;
а другой из указанных двух или более полимеров ПЭГ представляет собой:
(b) ПЭГ со среднемассовой молекулярной массой (Mw), составляющей примерно от 1000 до 20000.
В одном из вариантов реализации ПЭГ, применяемый согласно настоящему изобретению, представляет собой смесь двух полимеров ПЭГ с различными молекулярно-массовыми распределениями.
В одном из вариантов реализации ПЭГ, применяемый согласно настоящему изобретению, представляет собой смесь:
(a) ПЭГ со среднемассовой молекулярной массой (Mw), составляющей примерно от 200 до 1000; и
(b) ПЭГ со среднемассовой молекулярной массой (Mw), составляющей примерно от 1000 до 20000.
В одном из вариантов реализации приведенной выше смеси (а) представляет собой ПЭГ со среднемассовой молекулярной массой (Mw), составляющей примерно от 200 до 800. В одном из вариантов реализации приведенной выше смеси (а) представляет собой ПЭГ со среднемассовой молекулярной массой (Mw), составляющей примерно от 200 до 700. В одном из вариантов реализации приведенной выше смеси (а) представляет собой ПЭГ со среднемассовой молекулярной массой (Mw), составляющей примерно от 200 до 600.
В одном из вариантов реализации приведенной выше смеси (а) представляет собой ПЭГ со среднемассовой молекулярной массой (Mw), составляющей примерно от 200 до 500.
В одном из вариантов реализации приведенной выше смеси (а) представляет собой ПЭГ со среднемассовой молекулярной массой (Mw), составляющей примерно от 300 до 1000. В одном из вариантов реализации приведенной выше смеси (а) представляет собой ПЭГ со среднемассовой молекулярной массой (Mw), составляющей примерно от 300 до 800. В одном из вариантов реализации приведенной выше смеси (а) представляет собой ПЭГ со среднемассовой молекулярной массой (Mw), составляющей примерно от 300 до 700. В одном из вариантов реализации приведенной выше смеси (а) представляет собой ПЭГ со среднемассовой молекулярной массой (Mw), составляющей примерно от 300 до 600. В одном из вариантов реализации приведенной выше смеси (а) представляет собой ПЭГ со среднемассовой молекулярной массой (Mw), составляющей примерно от 300 до 500.
В одном из вариантов реализации приведенной выше смеси (а) представляет собой ПЭГ со среднемассовой молекулярной массой (Mw), составляющей примерно 400.
В одном из вариантов реализации приведенной выше смеси (b) представляет собой ПЭГ со среднемассовой молекулярной массой (Mw), составляющей примерно от 1000 до 15000.
В одном из вариантов реализации приведенной выше смеси (b) представляет собой ПЭГ со среднемассовой молекулярной массой (Mw), составляющей примерно от 1000 до 12000.
В одном из вариантов реализации приведенной выше смеси (b) представляет собой ПЭГ со среднемассовой молекулярной массой (Mw), составляющей примерно от 1000 до 10000.
В одном из вариантов реализации приведенной выше смеси (b) представляет собой ПЭГ со среднемассовой молекулярной массой (Mw), составляющей примерно от 1000 до 9000.
В одном из вариантов реализации приведенной выше смеси (b) представляет собой ПЭГ со среднемассовой молекулярной массой (Mw), составляющей примерно от 4000 до 20000.
В одном из вариантов реализации приведенной выше смеси (b) представляет собой ПЭГ со среднемассовой молекулярной массой (Mw), составляющей примерно от 4000 до 15000.
В одном из вариантов реализации приведенной выше смеси (b) представляет собой ПЭГ со среднемассовой молекулярной массой (Mw), составляющей примерно от 4000 до 12000.
В одном из вариантов реализации приведенной выше смеси (b) представляет собой ПЭГ со среднемассовой молекулярной массой (Mw), составляющей примерно от 4000 до 10000.
В одном из вариантов реализации приведенной выше смеси (b) представляет собой ПЭГ со среднемассовой молекулярной массой (Mw), составляющей примерно от 4000 до 9000.
В одном из вариантов реализации приведенной выше смеси (b) представляет собой ПЭГ со среднемассовой молекулярной массой (Mw), составляющей примерно от 6000 до 20000.
В одном из вариантов реализации приведенной выше смеси (b) представляет собой ПЭГ со среднемассовой молекулярной массой (Mw), составляющей примерно от 6000 до 15000.
В одном из вариантов реализации приведенной выше смеси (b) представляет собой ПЭГ со среднемассовой молекулярной массой (Mw), составляющей примерно от 6000 до 12000.
В одном из вариантов реализации приведенной выше смеси (b) представляет собой ПЭГ со среднемассовой молекулярной массой (Mw), составляющей примерно от 6000 до 10000.
В одном из вариантов реализации приведенной выше смеси (b) представляет собой ПЭГ со среднемассовой молекулярной массой (Mw), составляющей примерно от 6000 до 9000.
В одном из вариантов реализации приведенной выше смеси (b) представляет собой ПЭГ со среднемассовой молекулярной массой (Mw), составляющей примерно от 7000 до 20000.
В одном из вариантов реализации приведенной выше смеси (b) представляет собой ПЭГ со среднемассовой молекулярной массой (Mw), составляющей примерно от 7000 до 15000.
В одном из вариантов реализации приведенной выше смеси (b) представляет собой ПЭГ со среднемассовой молекулярной массой (Mw), составляющей примерно от 7000 до 12000.
В одном из вариантов реализации приведенной выше смеси (b) представляет собой ПЭГ со среднемассовой молекулярной массой (Mw), составляющей примерно от 7000 до 10000.
В одном из вариантов реализации приведенной выше смеси (b) представляет собой ПЭГ со среднемассовой молекулярной массой (Mw), составляющей примерно от 7000 до 9000.
В одном из вариантов реализации приведенной выше смеси (b) представляет собой ПЭГ со среднемассовой молекулярной массой (Mw), составляющей примерно 8000.
Например, в одном из вариантов реализации ПЭГ, применяемый согласно настоящему изобретению, представляет собой смесь двух или более полимеров ПЭГ с различными молекулярно-массовыми распределениями, где один из указанных двух или более полимеров ПЭГ представляет собой:
(a) ПЭГ со среднемассовой молекулярной массой (Mw), составляющей примерно от 200 до 600;
а другой из указанных двух или более полимеров ПЭГ представляет собой:
(b) ПЭГ со среднемассовой молекулярной массой (Mw), составляющей примерно от 4000 до 12000.
Например, в одном из вариантов реализации ПЭГ, применяемый согласно настоящему изобретению, представляет собой смесь:
(a) ПЭГ со среднемассовой молекулярной массой (Mw), составляющей примерно от 200 до 1000; и
(b) ПЭГ со среднемассовой молекулярной массой (Mw), составляющей примерно от 1000 до 12000.
Например, в одном из вариантов реализации ПЭГ, применяемый согласно настоящему изобретению, представляет собой смесь:
(a) ПЭГ со среднемассовой молекулярной массой (Mw), составляющей примерно от 200 до 1000; и
(b) ПЭГ со среднемассовой молекулярной массой (Mw), составляющей примерно от 1000 до 10000.
Например, в одном из вариантов реализации ПЭГ, применяемый согласно настоящему изобретению, представляет собой смесь:
(a) ПЭГ со среднемассовой молекулярной массой (Mw), составляющей примерно от 200 до 600; и
(b) ПЭГ со среднемассовой молекулярной массой (Mw), составляющей примерно от 4000 до 12000.
Например, в одном из вариантов реализации ПЭГ, применяемый согласно настоящему изобретению, представляет собой смесь:
(a) ПЭГ со среднемассовой молекулярной массой (Mw), составляющей примерно от 200 до 600; и
(b) ПЭГ со среднемассовой молекулярной массой (Mw), составляющей примерно от 6000 до 10000.
Например, в одном из вариантов реализации ПЭГ, применяемый согласно настоящему изобретению, представляет собой смесь:
(a) ПЭГ со среднемассовой молекулярной массой (Mw), составляющей примерно 400; и
(b) ПЭГ со среднемассовой молекулярной массой (Mw), составляющей примерно 8000.
В одном из вариантов реализации массовое соотношение компонента (а) и компонента (b) составляет примерно от 1:1 до 20:1 (например, от 50 масс.% (а) и 50 масс.% (b) до 95,25 масс.% (а) и 4,75 масс.% (b)).
В одном из вариантов реализации диапазон составляет примерно от 1:1 до 20:1. В одном из вариантов реализации диапазон составляет примерно от 1:1 до 10:1. В одном из вариантов реализации диапазон составляет примерно от 1:1 до 8:1. В одном из вариантов реализации диапазон составляет примерно от 1:1 до 6:1.
В одном из вариантов реализации диапазон составляет примерно от 3:1 до 20:1. В одном из вариантов реализации диапазон составляет примерно от 3:1 до 10:1. В одном из вариантов реализации диапазон составляет примерно от 3:1 до 8:1. В одном из вариантов реализации диапазон составляет примерно от 3:1 до 6:1.
В одном из вариантов реализации диапазон составляет примерно от 5:1 до 20:1. В одном из вариантов реализации диапазон составляет примерно от 5:1 до 10:1. В одном из вариантов реализации диапазон составляет примерно от 5:1 до 8:1. В одном из вариантов реализации диапазон составляет примерно от 5:1 до 6:1.
В одном из вариантов реализации массовое соотношение компонента (a) и компонента (b) составляет примерно 5,67:1 (например, 85 масс.% (a) и 15 масс.% (b)).
Композиция, содержащая ПЭГ
Термин «композиция, содержащая ПЭГ», используемый в настоящем описании, относится к композиции, содержащей ПЭГ, которая имеет форму (например, состава, препарата, медикамента), подходящую для местного введения (например, на губы и/или вокруг губ пациента, подвергающегося лечению).
В одном из вариантов реализации композиция, содержащая ПЭГ, содержит примерно от 0,1 до 100% ПЭГ от общей массы композиции.
В одном из вариантов реализации диапазон составляет примерно от 1 до 100% ПЭГ по массе.
В одном из вариантов реализации диапазон составляет примерно от 5 до 100% ПЭГ по массе.
В одном из вариантов реализации диапазон составляет примерно от 10 до 100% ПЭГ по массе.
В одном из вариантов реализации диапазон составляет примерно от 20 до 100% ПЭГ по массе.
В одном из вариантов реализации диапазон составляет примерно от 30 до 100% ПЭГ по массе.
В одном из вариантов реализации диапазон составляет примерно от 40 до 100% ПЭГ по массе.
В одном из вариантов реализации диапазон составляет примерно от 50 до 100% ПЭГ по массе.
В одном из вариантов реализации диапазон составляет примерно от 55 до 100% ПЭГ по массе.
В одном из вариантов реализации диапазон составляет примерно от 60 до 100% ПЭГ по массе.
В одном из вариантов реализации диапазон составляет примерно от 65 до 100% ПЭГ по массе.
В одном из вариантов реализации диапазон составляет примерно от 70 до 100% ПЭГ по массе.
В одном из вариантов реализации диапазон составляет примерно от 75 до 100% ПЭГ по массе.
В одном из вариантов реализации диапазон составляет примерно от 80 до 100% ПЭГ по массе.
В одном из вариантов реализации диапазон составляет примерно от 85 до 100% ПЭГ по массе.
В одном из вариантов реализации диапазон составляет примерно от 90 до 100% ПЭГ по массе.
В одном из вариантов реализации диапазон составляет примерно от 91 до 100% ПЭГ по массе.
В одном из вариантов реализации диапазон составляет примерно от 92 до 100% ПЭГ по массе.
В одном из вариантов реализации диапазон составляет примерно от 93 до 100% ПЭГ по массе.
В одном из вариантов реализации диапазон составляет примерно от 94 до 100% ПЭГ по массе.
В одном из вариантов реализации диапазон составляет примерно от 95 до 100% ПЭГ по массе.
В одном из вариантов реализации диапазон составляет примерно от 96 до 100% ПЭГ по массе.
В одном из вариантов реализации диапазон составляет примерно от 97 до 100% ПЭГ по массе.
В одном из вариантов реализации диапазон составляет примерно от 98 до 100% ПЭГ по массе.
В одном из вариантов реализации диапазон составляет примерно от 99 до 100% ПЭГ по массе.
В одном из вариантов реализации диапазон составляет примерно от 1 до 90% ПЭГ по массе.
В одном из вариантов реализации диапазон составляет примерно от 5 до 90% ПЭГ по массе.
В одном из вариантов реализации диапазон составляет примерно от 10 до 90% ПЭГ по массе.
В одном из вариантов реализации диапазон составляет примерно от 20 до 90% ПЭГ по массе.
В одном из вариантов реализации диапазон составляет примерно от 30 до 90% ПЭГ по массе.
В одном из вариантов реализации диапазон составляет примерно от 40 до 90% ПЭГ по массе.
В одном из вариантов реализации диапазон составляет примерно от 50 до 90% ПЭГ по массе.
В одном из вариантов реализации диапазон составляет примерно от 55 до 90% ПЭГ по массе.
В одном из вариантов реализации диапазон составляет примерно от 60 до 90% ПЭГ по массе.
В одном из вариантов реализации диапазон составляет примерно от 65 до 90% ПЭГ по массе.
В одном из вариантов реализации диапазон составляет примерно от 70 до 90% ПЭГ по массе.
В одном из вариантов реализации диапазон составляет примерно от 75 до 90% ПЭГ по массе.
В одном из вариантов реализации диапазон составляет примерно от 80 до 90% ПЭГ по массе.
В одном из вариантов реализации диапазон составляет примерно от 85 до 90% ПЭГ по массе.
В одном из вариантов реализации диапазон составляет примерно от 1 до 80% ПЭГ по массе.
В одном из вариантов реализации диапазон составляет примерно от 5 до 80% ПЭГ по массе.
В одном из вариантов реализации диапазон составляет примерно от 10 до 80% ПЭГ по массе.
В одном из вариантов реализации диапазон составляет примерно от 20 до 80% ПЭГ по массе.
В одном из вариантов реализации диапазон составляет примерно от 30 до 80% ПЭГ по массе.
В одном из вариантов реализации диапазон составляет примерно от 40 до 80% ПЭГ по массе.
В одном из вариантов реализации диапазон составляет примерно от 50 до 80% ПЭГ по массе.
В одном из вариантов реализации диапазон составляет примерно от 55 до 80% ПЭГ по массе.
В одном из вариантов реализации диапазон составляет примерно от 60 до 80% ПЭГ по массе.
В одном из вариантов реализации диапазон составляет примерно от 65 до 80% ПЭГ по массе.
В одном из вариантов реализации диапазон составляет примерно от 70 до 80% ПЭГ по массе.
В одном из вариантов реализации диапазон составляет примерно от 75 до 80% ПЭГ по массе.
В одном из вариантов реализации композиция, содержащая ПЭГ, содержит по меньшей мере примерно 50% ПЭГ от общей массы композиции.
В одном из вариантов реализации количество составляет по меньшей мере 60% по массе.
В одном из вариантов реализации количество составляет по меньшей мере 70% по массе.
В одном из вариантов реализации количество составляет по меньшей мере 75% по массе.
В одном из вариантов реализации количество составляет по меньшей мере 80% по массе.
В одном из вариантов реализации количество составляет по меньшей мере 85% по массе.
В одном из вариантов реализации количество составляет по меньшей мере 90% по массе.
В одном из вариантов реализации количество составляет по меньшей мере 91% по массе.
В одном из вариантов реализации количество составляет по меньшей мере 92% по массе.
В одном из вариантов реализации количество составляет по меньшей мере 93% по массе.
В одном из вариантов реализации количество составляет по меньшей мере 94% по массе.
В одном из вариантов реализации количество составляет по меньшей мере 95% по массе.
В одном из вариантов реализации количество составляет по меньшей мере 96% по массе.
В одном из вариантов реализации количество составляет по меньшей мере 97% по массе.
В одном из вариантов реализации количество составляет по меньшей мере 98% по массе.
В одном из вариантов реализации количество составляет по меньшей мере 99% по массе.
В одном из вариантов реализации композиция, содержащая ПЭГ, содержит 100% ПЭГ от общей массы композиции.
В одном из вариантов реализации композиция, содержащая ПЭГ, содержит ПЭГ, описанный в настоящей заявке, и фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество.
ПЭГ в качестве единственного активного агента
В одном из вариантов реализации композиция, содержащая ПЭГ, характеризуется тем, что она содержит ПЭГ в качестве единственного активного агента. Указанные композиции можно точно описать, как не содержащие любые дополнительные активные агенты (т.е. композиция не содержит любые дополнительные активные агенты; композиция дополнительно не содержит другой активный агент).
Примеры активных агентов включают противовирусные средства, антибиотики, анальгетики, антисептики, противогрибковые средства и противовоспалительные агенты.
В одном из вариантов реализации композиция, содержащая ПЭГ, характеризуется тем, что она содержит ПЭГ в качестве единственного противовирусного агента. Указанные композиции можно точно описать, как не содержащие любые дополнительные противовирусные агенты (т.е. композиция не содержит любые дополнительные противовирусные агенты; композиция дополнительно не содержит другой противовирусный агент).
В указанном контексте термин «противовирусный агент» описывает и охватывает агенты для лечения, например, лабиального герпеса, генитального герпеса и опоясывающего герпеса, а также агенты для лечения основной вирусной инфекции, например, ВПГ-1, ВПГ-2 и VZV.
В одном из вариантов реализации композиция, содержащая ПЭГ, не содержит ацикловир, валацикловир, фамцикловир, фоскамет и пенцикловир (т.е. композиция дополнительно не содержит ацикловир, валацикловир, фамцикловир, фоскамет или пенцикловир).
ПЭГ совместно с дополнительными активными агентами
В одном из вариантов реализации композиция, содержащая ПЭГ, дополнительно содержит один или более дополнительных активных агентов (например, противовирусных средств, антибиотиков, анальгетиков, антисептиков, противогрибковых средств, противовоспалительных агентов).
В одном из вариантов реализации композиция, содержащая ПЭГ, дополнительно содержит один или более дополнительных противовирусных агентов.
В указанном контексте термин «противовирусный агент» также описывает и охватывает агенты для лечения, например, лабиального герпеса, генитального герпеса и опоясывающего герпеса, а также агенты для лечения основной вирусной инфекции, например, ВПГ-1, ВПГ-2 и VZV.
В одном из вариантов реализации композиция, содержащая ПЭГ, дополнительно содержит один или более агентов, выбранных из ацикловира, валацикловира, фамцикловира, фоскамета и пенцикловира.
В одном из вариантов реализации композиция, содержащая ПЭГ, дополнительно содержит один или более дополнительных активных агентов, отличных от противовирусных средств (например, антибиотики, анальгетики, антисептики, противогрибковые средства, противовоспалительные агенты).
Применение в способах терапии
Один из аспектов настоящего изобретения относится к ПЭГ, описанному в настоящей заявке, для применения в терапии.
Один из аспектов настоящего изобретения относится к ПЭГ, описанному в настоящей заявке, для применения в способе снижения частоты рецидивов, отсрочки рецидивов и/или предотвращения рецидивов лабиального герпеса, генитального герпеса или опоясывающего герпеса путем местного введения.
Один из аспектов настоящего изобретения относится к ПЭГ, описанному в настоящей заявке, для применения в способе снижения частоты рецидивов лабиального герпеса, генитального герпеса или опоясывающего герпеса путем местного введения.
Один из аспектов настоящего изобретения относится к ПЭГ, описанному в настоящей заявке, для применения в способе отсрочки рецидивов лабиального герпеса, генитального герпеса или опоясывающего герпеса путем местного введения.
Один из аспектов настоящего изобретения относится к ПЭГ, описанному в настоящей заявке, для применения в способе предотвращения рецидивов лабиального герпеса, генитального герпеса или опоясывающего герпеса путем местного введения.
Один из аспектов настоящего изобретения относится к ПЭГ, описанному в настоящей заявке, для применения в способе снижения частоты рецидивов, отсрочки рецидивов и/или предотвращения рецидивов лабиального герпеса путем местного введения.
Один из аспектов настоящего изобретения относится к ПЭГ, описанному в настоящей заявке, для применения в способе снижения частоты рецидивов лабиального герпеса путем местного введения.
Один из аспектов настоящего изобретения относится к ПЭГ, описанному в настоящей заявке, для применения в способе отсрочки рецидивов лабиального герпеса путем местного введения.
Один из аспектов настоящего изобретения относится к ПЭГ, описанному в настоящей заявке, для применения в способе предотвращения рецидивов лабиального герпеса путем местного введения.
Один из аспектов настоящего изобретения относится к ПЭГ, описанному в настоящей заявке, для применения в способе снижения частоты рецидива, отсрочки рецидивов и/или предотвращения рецидивов генитального герпеса путем местного введения.
Один из аспектов настоящего изобретения относится к ПЭГ, описанному в настоящей заявке, для применения в способе снижения частоты рецидива генитального герпеса путем местного введения.
Один из аспектов настоящего изобретения относится к ПЭГ, описанному в настоящей заявке, для применения в способе отсрочки рецидивов генитального герпеса путем местного введения.
Один из аспектов настоящего изобретения относится к ПЭГ, описанному в настоящей заявке, для применения в способе предотвращения рецидивов генитального герпеса путем местного введения.
Один из аспектов настоящего изобретения относится к ПЭГ, описанному в настоящей заявке, для применения в способе снижения частоты рецидива, отсрочки рецидивов и/или предотвращения рецидивов опоясывающего герпеса путем местного введения.
Один из аспектов настоящего изобретения относится к ПЭГ, описанному в настоящей заявке, для применения в способе снижения частоты рецидива опоясывающего герпеса путем местного введения.
Один из аспектов настоящего изобретения относится к ПЭГ, описанному в настоящей заявке, для применения в способе отсрочки рецидивов опоясывающего герпеса путем местного введения.
Один из аспектов настоящего изобретения относится к ПЭГ, описанному в настоящей заявке, для применения в способе предотвращения рецидивов опоясывающего герпеса путем местного введения.
Применение для получения лекарственных средств
Один из аспектов настоящего изобретения относится к применению ПЭГ, описанного в настоящей заявке, для получения лекарственного средства для снижения частоты рецидива, отсрочки рецидивов и/или предотвращения рецидивов лабиального герпеса, генитального герпеса или опоясывающего герпеса путем местного введения.
Один из аспектов настоящего изобретения относится к применению ПЭГ, описанного в настоящей заявке, для получения лекарственного средства для снижения частоты рецидива лабиального герпеса, генитального герпеса или опоясывающего герпеса путем местного введения.
Один из аспектов настоящего изобретения относится к применению ПЭГ, описанного в настоящей заявке, для получения лекарственного средства для отсрочки рецидивов лабиального герпеса, генитального герпеса или опоясывающего герпеса путем местного введения.
Один из аспектов настоящего изобретения относится к применению ПЭГ, описанного в настоящей заявке, для получения лекарственного средства для предотвращения рецидивов лабиального герпеса, генитального герпеса или опоясывающего герпеса путем местного введения.
Один из аспектов настоящего изобретения относится к применению ПЭГ, описанного в настоящей заявке, для получения лекарственного средства для снижения частоты рецидива, отсрочки рецидивов и/или предотвращения рецидивов лабиального герпеса.
Один из аспектов настоящего изобретения относится к применению ПЭГ, описанного в настоящей заявке, для получения лекарственного средства для снижения частоты рецидива лабиального герпеса путем местного введения.
Один из аспектов настоящего изобретения относится к применению ПЭГ, описанного в настоящей заявке, для получения лекарственного средства для отсрочки рецидивов лабиального герпеса путем местного введения.
Один из аспектов настоящего изобретения относится к применению ПЭГ, описанного в настоящей заявке, для получения лекарственного средства для предотвращения рецидивов лабиального герпеса путем местного введения.
Один из аспектов настоящего изобретения относится к применению ПЭГ, описанного в настоящей заявке, для получения лекарственного средства для снижения частоты рецидива, отсрочки рецидивов и/или предотвращения рецидивов генитального герпеса путем местного введения.
Один из аспектов настоящего изобретения относится к применению ПЭГ, описанного в настоящей заявке, для получения лекарственного средства для снижения частоты рецидива генитального герпеса путем местного введения.
Один из аспектов настоящего изобретения относится к применению ПЭГ, описанного в настоящей заявке, для получения лекарственного средства для отсрочки рецидивов генитального герпеса путем местного введения.
Один из аспектов настоящего изобретения относится к применению ПЭГ, описанного в настоящей заявке, для получения лекарственного средства для предотвращения рецидивов генитального герпеса путем местного введения.
Один из аспектов настоящего изобретения относится к применению ПЭГ, описанного в настоящей заявке, для получения лекарственного средства для снижения частоты рецидива, отсрочки рецидивов и/или предотвращения рецидивов опоясывающего герпеса путем местного введения.
Один из аспектов настоящего изобретения относится к применению ПЭГ, описанного в настоящей заявке, для получения лекарственного средства для снижения частоты рецидива опоясывающего герпеса путем местного введения.
Один из аспектов настоящего изобретения относится к применению ПЭГ, описанного в настоящей заявке, для получения лекарственного средства для отсрочки рецидивов опоясывающего герпеса путем местного введения.
Один из аспектов настоящего изобретения относится к применению ПЭГ, описанного в настоящей заявке, для получения лекарственного средства для предотвращения рецидивов опоясывающего герпеса путем местного введения.
Способы терапии
Один из аспектов настоящего изобретения относится к способу снижения частоты рецидива, отсрочки рецидивов и/или предотвращения рецидивов лабиального герпеса, генитального герпеса или опоясывающего герпеса у пациента, включающему местное введение указанному пациенту терапевтически эффективного количества: ПЭГ или композиции, содержащей ПЭГ, описанных в настоящей заявке.
Один из аспектов настоящего изобретения относится к способу снижения частоты рецидива, отсрочки рецидивов и/или предотвращения рецидивов лабиального герпеса у пациента, включающему местное введение указанному пациенту терапевтически эффективного количества: ПЭГ или композиции, содержащей ПЭГ, описанных в настоящей заявке.
Один из аспектов настоящего изобретения относится к способу снижения частоты рецидива лабиального герпеса у пациента, включающему местное введение указанному пациенту терапевтически эффективного количества: ПЭГ или композиции, содержащей ПЭГ, описанных в настоящей заявке.
Один из аспектов настоящего изобретения относится к способу отсрочки рецидивов лабиального герпеса у пациента, включающему местное введение указанному пациенту терапевтически эффективного количества: ПЭГ или композиции, содержащей ПЭГ, описанных в настоящей заявке.
Один из аспектов настоящего изобретения относится к способу предотвращения рецидивов лабиального герпеса у пациента, включающему местное введение указанному пациенту терапевтически эффективного количества: ПЭГ или композиции, содержащей ПЭГ, описанных в настоящей заявке.
Один из аспектов настоящего изобретения относится к способу снижения частоты рецидива, отсрочки рецидивов и/или предотвращения рецидивов генитального герпеса у пациента, включающему местное введение указанному пациенту терапевтически эффективного количества: ПЭГ или композиции, содержащей ПЭГ, описанных в настоящей заявке.
Один из аспектов настоящего изобретения относится к способу снижения частоты рецидива генитального герпеса у пациента, включающему местное введение указанному пациенту терапевтически эффективного количества: ПЭГ или композиции, содержащей ПЭГ, описанных в настоящей заявке.
Один из аспектов настоящего изобретения относится к способу отсрочки рецидивов генитального герпеса у пациента, включающему местное введение указанному пациенту терапевтически эффективного количества: ПЭГ или композиции, содержащей ПЭГ, описанных в настоящей заявке.
Один из аспектов настоящего изобретения относится к способу предотвращения рецидивов генитального герпеса у пациента, включающему местное введение указанному пациенту терапевтически эффективного количества: ПЭГ или композиции, содержащей ПЭГ, описанных в настоящей заявке.
Один из аспектов настоящего изобретения относится к способу снижения частоты рецидива, отсрочки рецидивов и/или предотвращения рецидивов опоясывающего герпеса у пациента, включающему местное введение указанному пациенту терапевтически эффективного количества: ПЭГ или композиции, содержащей ПЭГ, описанных в настоящей заявке.
Один из аспектов настоящего изобретения относится к способу снижения частоты рецидива опоясывающего герпеса у пациента, включающему местное введение указанному пациенту терапевтически эффективного количества: ПЭГ или композиции, содержащей ПЭГ, описанных в настоящей заявке.
Один из аспектов настоящего изобретения относится к способу отсрочки рецидивов опоясывающего герпеса у пациента, включающему местное введение указанному пациенту терапевтически эффективного количества: ПЭГ или композиции, содержащей ПЭГ, описанных в настоящей заявке.
Один из аспектов настоящего изобретения относится к способу предотвращения рецидивов опоясывающего герпеса у пациента, включающему местное введение указанному пациенту терапевтически эффективного количества: ПЭГ или композиции, содержащей ПЭГ, описанных в настоящей заявке.
Нарушения, поддающиеся лечению
Повторимся, во избежание неясностей, что авторы настоящего изобретения не утверждают, что способы, описанные в настоящей заявке, предотвращают вирусную инфекцию (например, предотвращают инфекции ВПГ-1, ВПГ-2 или VZV). В действительности, способы, описанные в настоящей заявке, подходят для терапии заболеваний и нарушений, связанных с, стимулируемых или вызываемых вирусной инфекцией (т.е. заболеваний и нарушений, связанных с, стимулируемых или вызываемых инфекциями ВПГ-1, ВПГ-2 или VZV). Таким образом, способы, описанные в настоящей заявке, можно описывать как симптоматическое лечение в смысле предотвращения и/или ослабления симптомов вирусной инфекции (например, инфекций ВПГ-1, ВПГ-2 или VZV).
Способы, описанные в настоящей заявке, в частности, подходят для терапии лабиального герпеса (также называемого ротовой герпес), генитального герпеса (также называемого герпес гениталий) и опоясывающего герпеса (также называемого опоясывающий лишай).
Способы, описанные в настоящей заявке, в частности, подходят для терапии лабиального герпеса (также называемого ротовой герпес), например, рецидивирующего лабиального герпеса.
В одном из вариантов реализации (например, применения в способах терапии, применения для получения лекарственных средств, способов терапии) лечение представляет собой снижение частоты рецидива лабиального герпеса.
В одном из вариантов реализации (например, применения в способах терапии, применения для получения лекарственных средств, способов терапии) лечение представляет собой отсрочку рецидивов лабиального герпеса.
В одном из вариантов реализации (например, применения в способах терапии, применения для получения лекарственных средств, способов терапии) лечение представляет собой предотвращение рецидивов лабиального герпеса.
Термин «рецидив» заболевания или нарушения (например, лабиального герпеса, генитального герпеса, опоясывающего герпеса) используют в настоящем описании в традиционном значении, которое относится к повторному проявлению указанного заболевания или нарушения, например, к повторному проявлению признаков и симптомов указанного заболевания или нарушения.
Термин «рецидив лабиального герпеса» используют в настоящем описании в традиционном значении, которое относится к повторному проявлению лабиального герпеса, например, к повторному проявлению признаков и симптомов лабиального герпеса, таких как эритема, папула, пузырьки, образование язв, эрозии, отеки и т.д.
Вирусы простого герпеса (ВПГ-1 и ВПГ-2), а также вирус ветряной оспы (VZV) принадлежат к одному подсемейству вирусов (альфа-герпесвирусы). Следовательно, композиции и способы, описанные в настоящей заявке, также могут подходить для лечения и/или предотвращения других нарушений, связанных с ВПГ-1, ВПГ-2 и VZV, включая герпетический панацирий, герпетический гингивостоматит, герпес борцов, герпетический кератоконъюнктивит, герпетический энцефалит, герпетический менингит, простой герпес новорожденных, герпетический сикоз и герпетиформная экзема.
Терапевтически эффективное количество
Термин «терапевтически эффективное количество», используемый в настоящем описании, относится к количеству ПЭГ или композиции, содержащей ПЭГ, которое является эффективным для достижения некоторого желаемого терапевтического действия с приемлемым соотношением польза/риск при введении в соответствии с желательной схемой лечения.
Способы введения
ПЭГ или композицию, содержащую ПЭГ, описанные в настоящей заявке, вводят местно.
Термин «местное введение» используют в самом широком смысле, термин включает введение на поверхность тела, которая, как правило, открыта для воздействия внешней среды и включает не только кожу, но также носовой канал и горло и гениталии. Таким образом, местное введение может включать нанесение на кожу, нанесение в носовой канал, нанесение в полость рта (включая гортань) и нанесение на гениталии (например, совместно с терапией генитального герпеса).
В одном из вариантов реализации ПЭГ или композицию, содержащую ПЭГ, описанные в настоящей заявке, вводят местно на одном или более участках проявления активной вирусной инфекции (например, на простуду на губах или участок, имеющий другой физический симптом «рецидива», свидетельствующий об активной вирусной инфекции), или участке, где признаки активной инфекции отсутствуют, но известно о возможности ее появления (например, повторного рецидива) или предполагается возможность ее появления.
В одном из вариантов реализации ПЭГ или композицию, содержащую ПЭГ, описанные в настоящей заявке, вводят местно на губы и/или вокруг губ пациента, подвергающегося лечению (например, совместно с терапией лабиального герпеса).
В одном из вариантов реализации ПЭГ или композицию, содержащую ПЭГ, описанные в настоящей заявке, вводят местно на (например, по меньшей мере на часть поверхности; по существу на всю поверхность; на всю поверхность) губы и окружающую кожу лица (например, в пределах <1 см от границы губ) пациента, подвергающегося лечению (например, совместно с терапией лабиального герпеса).
Например, в одном из вариантов реализации ПЭГ или композицию, содержащую ПЭГ, описанные в настоящей заявке, вводят местно по меньшей мере на часть поверхности губ и окружающей кожи лица в пределах <1 см от границы губ пациента, подвергающегося лечению (например, совместно с терапией лабиального герпеса).
В одном из вариантов реализации ПЭГ или композицию, содержащую ПЭГ, описанные в настоящей заявке, вводят местно на всю поверхность губ пациента, подвергающегося лечению (например, совместно с терапией лабиального герпеса).
В одном из вариантов реализации ПЭГ или композицию, содержащую ПЭГ, описанные в настоящей заявке, вводят местно на всю поверхность губ и окружающую кожу лица пациента, подвергающегося лечению (например, совместно с терапией лабиального герпеса).
В одном из вариантов реализации ПЭГ или композицию, содержащую ПЭГ, описанные в настоящей заявке, вводят местно на (например, по меньшей мере на часть поверхности; по существу на всю поверхность; на всю поверхность) гениталий и окружающей кожи (например, в области лобка и/или паха) пациента, подвергающегося лечению (например, совместно с терапией генитального герпеса).
Частота дозирования
ПЭГ или композицию, содержащую ПЭГ, описанные в настоящей заявке, можно вводить согласно любой соответствующей терапевтической схеме.
Например, ПЭГ или композицию, содержащую ПЭГ, можно вводить от одного до пяти раз в день, например, один раз в день, два раза в день, три раза в день и т.д. В предпочтительном варианте реализации ПЭГ или композицию, содержащую ПЭГ, вводят два раза в день.
Если во время терапии происходит рецидив, то в течение рецидива ПЭГ или композицию, содержащую ПЭГ, можно вводить от 1 до 10 раз в день. Например, ПЭГ или композицию, содержащую ПЭГ, можно вводить от 3 до 7 раз в день во время рецидива. В предпочтительном варианте реализации ПЭГ или композицию, содержащую ПЭГ, вводят 5 раз в день во время рецидива.
Продолжительность терапии
Во многих отношениях ПЭГ или композиция, содержащая ПЭГ, описанные в настоящей заявке, действуют в качестве профилактических средств, то есть снижают частоту рецидива, задерживают рецидивы и/или предотвращают рецидивы, например, лабиального герпеса, генитального герпеса или опоясывающего герпеса.
Следовательно, ПЭГ или композицию, содержащую ПЭГ, описанные в настоящей заявке, можно вводить в течение продолжительного времени (далее называемого периодом введения), а при желании, неограниченно долго.
Например, ПЭГ или композицию, содержащую ПЭГ, описанные в настоящей заявке, можно вводить (например, один раз в день, два раза в день, три раза в день и т.д.) в течение периода (например, периода введения), составляющего по меньшей мере 4 недели.
В одном из вариантов реализации период введения составляет по меньшей мере 6 недель.
В одном из вариантов реализации период введения составляет по меньшей мере 8 недель.
В одном из вариантов реализации период введения составляет по меньшей мере 10 недель.
В одном из вариантов реализации период введения составляет по меньшей мере 3 месяца.
В одном из вариантов реализации период введения составляет по меньшей мере 4 месяца.
В одном из вариантов реализации период введения составляет по меньшей мере 6 месяцев.
В одном из вариантов реализации период введения составляет по меньшей мере 8 месяцев.
В одном из вариантов реализации период введения составляет по меньшей мере 1 год.
В одном из вариантов реализации период введения составляет по меньшей мере 2 года.
В одном из вариантов реализации период введения составляет от 4 недель до 1 года.
В одном из вариантов реализации период введения составляет от 6 недель до 1 года.
В одном из вариантов реализации период введения составляет от 8 недель до 1 года.
В одном из вариантов реализации период введения составляет от 10 недель до 1 года.
В одном из вариантов реализации период введения составляет от 3 месяцев до 1 года.
В одном из вариантов реализации период введения составляет от 4 месяцев до 1 года.
В одном из вариантов реализации период введения составляет от 6 месяцев до 1 года.
В одном из вариантов реализации период введения составляет от 6 месяцев до 2 лет.
В одном из вариантов реализации период введения составляет от 8 месяцев до 2 лет.
В одном из вариантов реализации период введения составляет от 1 года до 2 лет.
Например, в качестве терапии рецидивирующего лабиального герпеса ПЭГ или композицию, содержащую ПЭГ, описанные в настоящей заявке, можно вводить два раза в день на всю поверхность губ и окружающую кожу лица в пределах <1 см от границы губ в течение неограниченного периода (например, периода введения) для снижения частоты рецидива, отсрочки рецидивов и/или предотвращения рецидивов.
В качестве альтернативы терапию можно прерывать любым числом периодов отдыха. Например, терапию можно проводить в течение первого периода введения, затем прерывать на первый период отдыха, затем возобновлять в течение второго периода введения, снова прерывать на второй период отдыха и т.д., где каждый период введения может иметь одинаковую или отличающуюся продолжительность, и каждый период отдыха может иметь одинаковую или отличающуюся продолжительность.
Отдельно отметим, что начало терапии не обязательно связано с возникновением любого клинического случая. Например, терапию необязательно начинать на ранней продромальной фазе до появления симптомов острого состояния. Напротив, терапию можно начинать в любое время, предпочтительно перед возникновением рецидива (например, до начала продромальной фазы, до проявления острых симптомов и т.д.).
Дозировка
Специалистам в данной области техники будет очевидным, что соответствующие дозировки ПЭГ или композиции, содержащей ПЭГ, могут изменяться от пациента к пациенту. Определение оптимальной дозировки, как правило, включает нахождение приемлемого баланса терапевтического благоприятного действия и любых рисков или вредных побочных эффектов. Выбранная дозировка зависит от ряда факторов, включающих, но не ограничивающихся ими, время введения, продолжительность лечения, введение других лекарственных средств, соединений и/или веществ, используемых в комбинации, тяжесть нарушения, особенности, пол, возраст, массу тела, состояние, общее состояние здоровья и анамнез пациента. Количество ПЭГ или композиции, содержащей ПЭГ, определяется исключительно выбором лечащего врача, ветеринара или клинического врача, несмотря на то, что, как правило, дозировку выбирают для достижения локальных концентраций в месте действия, которые приводят к достижению желаемого действия, не вызывая значительных вредных или опасных побочных эффектов.
В целом, подходящая доза ПЭГ находится в диапазоне примерно от 0,02 до 2 г, как правило, примерно от 0,05 до 0,5 г, например, составляет примерно 0,2 г за одно введение.
Субъект/пациент
Субъект/пациент может представлять собой млекопитающее, предпочтительно человека, например, мужчину или женщину.
В одном из вариантов реализации субъект/пациент представляет собой человека, инфицированного ВПГ-1, ВПГ-2 и/или VZV.
В одном из вариантов реализации субъект/пациент представляет собой человека, инфицированного ВПГ-1 и/или ВПГ-2.
В одном из вариантов реализации субъект/пациент представляет собой человека, инфицированного VZV.
В одном из вариантов реализации субъект/пациент представляет собой человека, который страдал и/или страдает от лабиального герпеса, генитального герпеса или опоясывающего герпеса.
В одном из вариантов реализации субъект/пациент представляет собой человека, который страдал и/или страдает от лабиального герпеса, т.е. который страдает от рецидивирующего лабиального герпеса или у которого можно ожидать проявление рецидивирующего лабиального герпеса.
В одном из вариантов реализации субъект/пациент представляет собой человека, который страдал и/или страдает от генитального герпеса, т.е. который страдает от рецидивирующего генитального герпеса или у которого можно ожидать проявление рецидивирующего генитального герпеса.
В одном из вариантов реализации субъект/пациент представляет собой человека, который страдал и/или страдает от опоясывающего герпеса, т.е. который страдает от рецидивирующего опоясывающего герпеса или у которого можно ожидать проявление рецидивирующего опоясывающего герпеса.
В одном из вариантов реализации субъект/пациент представляет собой человека, подверженного риску рецидива лабиального герпеса, генитального герпеса или опоясывающего герпеса.
В одном из вариантов реализации субъект/пациент представляет собой человека;
подверженного риску рецидива лабиального герпеса.
В одном из вариантов реализации субъект/пациент представляет собой человека, подверженного риску рецидива генитального герпеса.
В одном из вариантов реализации субъект/пациент представляет собой человека, подверженного риску рецидива опоясывающего герпеса.
Комбинированные терапии
Терапии, описанные в настоящей заявке, можно применять отдельно или в качестве части комбинированной терапии, в которой проводят совместно два или более способов терапии, например, последовательно или одновременно. Например, ПЭГ или композицию, содержащую ПЭГ, описанные в настоящей заявке, также можно применять в комбинированной терапии, например, совместно с другими агентами. Примеры дополнительных способов лечения и терапий включают, но не ограничиваются ими, лечение одним или более агентов, выбранных из ацикловира, валацикловира, фамцикловира, фоскамета и пенцикловира.
Один из аспектов настоящего изобретения относится к применению ПЭГ в комбинации с одним или более (например, с 1, 2, 3, 4 и т.д.) дополнительными терапевтическими агентами. Выбор конкретной комбинации зависит от решения лечащего врача, который выбирает дозировку с учетом профессиональных знаний и схем дозирования, известных квалифицированным специалистам.
Агенты (т.е. ПЭГ или композицию, содержащую ПЭГ, описанные в настоящей заявке, совместно с одним или более другими агентами) можно вводить одновременно или последовательно с применением индивидуальных различающихся схем дозирования и при помощи различных способов.
Агенты (т.е. ПЭГ или композицию, содержащую ПЭГ, описанные в настоящей заявке, совместно с одним или более другими агентами) можно вводить в состав совместно в одну лекарственную форму или в качестве альтернативы индивидуальные агенты можно вводить в состав по отдельности и объединять в наборе, возможно совместно с инструкцией по применению.
Наборы
Один из аспектов изобретения относится к набору, содержащему (a) ПЭГ или композицию, содержащую ПЭГ, описанные в настоящей заявке, например, предпочтительно содержащиеся в подходящем контейнере и/или в подходящей упаковке;
и (b) инструкцию по применению, например, письменные инструкции по введению ПЭГ или композиции, содержащей ПЭГ.
Письменные инструкции также могут включать список показаний, для которых применение активного ингредиента является подходящим способом лечения.
Составы
Несмотря на то, что существует возможность отдельного введения ПЭГ, может быть предпочтительным его введение в виде фармацевтического состава (например, композиции, препарата, медикамента), содержащего ПЭГ совместно с одним или более другими фармацевтически приемлемыми ингредиентами, хорошо известными специалистам в данной области техники, включающими, но не ограничивающимися ими, фармацевтически приемлемые носители, разбавители, вспомогательные вещества, адъюванты, наполнители, буферы, консерванты, антиоксиданты, смазывающие вещества, стабилизаторы, солюбилизаторы, поверхностно активные вещества (например, увлажнители), маскирующие агенты, красители, ароматизаторы, подсластители, эфирные масла и увлажняющие средства. Составы могут дополнительно содержать другие активные агенты, например, другие терапевтические или профилактические агенты.
Тем не менее в одном из вариантов реализации композиция, содержащая ПЭГ, описанная в настоящей заявке, характеризуется тем, что она содержит ПЭГ в качестве единственного активного агента. Указанные составы можно точно описать, как не содержащие любые дополнительные активные агенты. В другом варианте реализации композиция, содержащая ПЭГ, описанная в настоящей заявке, характеризуется тем, что она содержит ПЭГ в качестве единственного противовирусного агента. Указанные составы можно точно описать, как не содержащие любые дополнительные противовирусные агенты.
В качестве альтернативы в одном из вариантов реализации композиция, содержащая ПЭГ, описанная в настоящей заявке, характеризуется тем, что он дополнительно содержит один или более дополнительных противовирусных агентов, например один или более агентов, выбранных из ацикловира, валацикловира, фамцикловира, фоскамета и пенцикловира. Кроме того, в одном из вариантов реализации композиция, содержащая ПЭГ, описанная в настоящей заявке, характеризуется тем, что она дополнительно содержит один или более дополнительных активных агентов, таких как антибиотики, анальгетики, антисептики, противогрибковые средства и противовоспалительные агенты.
В одном из вариантов реализации композиция, содержащая ПЭГ, описанная в настоящей заявке, по существу не содержит воду (т.е. содержит ПЭГ, но по существу не содержит воду).
В одном из вариантов реализации композиция, содержащая ПЭГ, содержит менее 5% воды от общей массы состава.
В одном из вариантов реализации композиция, содержащая ПЭГ, содержит менее 1% воды от общей массы состава.
В одном из вариантов реализации композиция, содержащая ПЭГ, дополнительно содержит воду (т.е. содержит ПЭГ и воду) (например, от 1 до 20%, от 1 до 10%, от 1 до 5% воды от общей массы состава).
Таким образом, в одном из вариантов реализации композиция содержит:
(a) полиэтиленгликоль, описанный в настоящей заявке; и
(b) воду.
В одном из вариантов реализации композиция, содержащая ПЭГ, содержит от 1 до 20% воды от общей массы состава.
В одном из вариантов реализации композиция, содержащая ПЭГ, содержит от 1 до 10% воды от общей массы состава.
В одном из вариантов реализации композиция, содержащая ПЭГ, содержит от 1 до 5% воды от общей массы состава.
Как правило, композиция, содержащая ПЭГ, содержит примерно от 1% до 100% ПЭГ от общей массы состава.
В других вариантах реализации диапазон составляет примерно от 20% до 100% или примерно от 50% до 100%, или примерно от 70% до 100%, или примерно от 80% до 100% от общей массы состава.
В других вариантах реализации диапазон составляет примерно от 20% до 90% или примерно от 50% до 90%, или примерно от 70% до 90%, или примерно от 80% до 90% от общей массы состава.
В одном из вариантов реализации композиция, содержащая ПЭГ, состоит по существу из ПЭГ.
Термин «фармацевтически приемлемый», используемый в настоящем описании, относится к соединениям, ингредиентам, веществам, композициям, лекарственным формам и т.д., которые по результатам тщательных медицинских обследований, подходят для применения для взаимодействия с тканями исследуемого субъекта (например, человека), не вызывая избыточную токсичность, раздражение, аллергический ответ или другие проблемы или осложнения, и имеют приемлемое соотношение польза/риск. Каждый носитель, разбавитель, вспомогательное вещество и т.д. также должны быть «приемлемыми» с точки зрения совместимости с другими ингредиентами состава.
Подходящие носители, разбавители, вспомогательные вещества и т.д. можно найти в традиционных фармацевтических изданиях, например, в Remington’s Pharmaceutical Sciences. 18th edition. Mack Publishing Company, Easton, Pa., 1990; и Handbook of Pharmaceutical Excipients, 5th edition, 2005.
Составы можно получать при помощи любых способов, хорошо известных в области фармацевтики. Указанные способы включают стадию приведения во взаимодействие соединения и носителя, который содержит один или более вспомогательных ингредиентов. В целом, составы получают путем однородного и тщательного приведения во взаимодействие соединения и носителей.
Подходящие составы могут иметь форму жидкостей, растворов (например, водных, неводных), суспензий (например, водных, неводных), эмульсий (например, типа масло-вводе или вода-в-масле), эликсиров, сиропов, капель, настоек, гелей, паст, мазей, кремов, лосьонов, масел, бальзамов, губных помад, масок для лица, пен, спреев, распыляемых составов, аэрозолей, влажных салфеток (например, где состав нанесен на твердый носитель) или пластырей (например, где состав нанесен на твердый носитель и клейкое вещество).
Составы (в частности, содержащие воду составы) могут дополнительно содержать один или более консервантов для продления срока хранения продукта. Тем не менее составы на безводной основе часто можно получать без необходимости введения консервантов, что снижает стоимость, упрощает получение состава и предотвращает возникновение возможных нежелательных реакций у потребителя.
Многие вирусные инфекции, в частности, рецидивирующие инфекции, подвержены стимулируемым УФ-излучением обострениям (т.е. к обострениям, стимулируемым воздействием солнечного света). Соответственно, добавление УФ-фильтров в составы может быть особенно полезным для дополнительного снижения или предотвращения обострений.
Следовательно, состав может дополнительно содержат один или более солнцезащитных компонентов, описанных в настоящей заявке, например, по меньшей мере один УФА-фильтр и/или по меньшей мере один УФБ-фильтр и/или по меньшей мере один неорганический пигмент.
УФБ-фильтры, например, могут быть растворимы в масле или в воде. Примеры растворимых в масле УФБ-фильтров включают: 3-бензилиденкамфору и ее производные, например, 3-(4-метилбензилиден)камфору; производные 4-аминобензойной кислоты, предпочтительно 2-этилгексил-4-(диметиламино)бензоат, амил-4-(диметиламино)бензоат; сложные эфиры коричной кислоты, предпочтительно 2-этилгекси-4-метоксициннамат, изопентил-4-метоксициннамат; сложные эфиры салициловой кислоты, предпочтительно 2-этилгексилсалицилат, 4-изопропилбензилсалицилат, гомоментилсалицилат; производные бензофенона, предпочтительно 2-гидрокси-4-метоксибензофенон, 2-гидрокси-4-метокси-4’-метилбензофенон, 2,2’-дигидрокси-4-метоксибензофенон; сложные эфиры бензальмалоновой кислоты, предпочтительно ди(2-этилгексил)-4-метоксибензальмалонат; и 2,4,6-трианилино(п-карбо-2’-этил-1’-гексилокси)-1,3,5-триазин. Примеры растворимых в воде УФБ-фильтров включают: 2-фенилбензимидазол-5-сульфокислоту и ее соли; например соли натрия, калия или триэтаноламмония; производные сульфокислот и бензофенонов, предпочтительно 2-гидрокси-4-метоксибензофенон-5-сульфокислоту и ее соли; и производные сульфокислот и 3-бензилиденкамфоры, такие как, например, 4-(2-оксо-3-борнилиденметил)бензолсульфокислота, 2-метил-5-(2-оксо-3-борнилиденметил)сульфокислота и ее соли.
УФА-фильтры, например, можно выбирать из: производных дибензоилметана, в частности, 1-(4’-трет-бутилфенил)-3-(4’-метоксифенил)пропан-1,3-диона и 1-фенил-3-(4’-изопропилфенил)пропан-1,3-диона.
Дополнительные примеры УФ-фильтров включают п-аминобензойную кислоту, ее соли и производные (этиловый, изобутиловый, глицериловый сложные эфиры; п-диметиламинобензойную кислоту); антранилаты (о-аминобензоаты; метиловый, ментиловый, фениловый, бензиловый, фенилэтиловый, линалиловый, терпиниловый и циклогексениловый сложные эфиры); салицилаты (октиловый, амиловый, фениловый, бензиловый, ментиловый (гомосалат), глицериловый и дипропиленгликолевый сложные эфиры); производные коричной кислоты (ментиловый и бензиловый сложные эфиры, альфа-фенил-циннамонитрил; бутилциннамоилпируват); производные дигидроксикоричной кислоты (умбеллиферон, метилумбеллиферон, метилацетоумбеллиферон); производные камфор (3-бензилиден, 4-метилбензилиден, полиакриламидометилбензилиден, бензалкония метосульфат, бензилиденкамфорсульфокислоту и терефталидендикамфорсульфокислоту); производные тригидроксикоричной кислоты (эскулетин, метилэскулетин, дафнетин и глюкозиды, эскулин и дафнин); углеводороды (дифенилбутадиен, стильбен); дибензальацетон и бензальацетофенон; нафтолсульфонаты (натриевые соли 2-нафтол-3,6-дисульфокислоты и 2-нафтол-6,8-дисульфокислоты); дигидроксинафтойную кислоту и ее соли; о- и п-гидроксидифенилдисульфонаты; производные кумарина (7-гидрокси, 7-метил, 3-фенил); диазолы (2-ацетил-3-броминдазол, фенилбензоксазол, метилнафтоксазол, различные арилбензотиазолы); соли хинина (бисульфат, сульфат, хлорид, олеат и таннат); производные хинолина (соли 8-гидроксихинолина, 2-фенилхинолина); гидрокси- или метоксизамещенные бензофеноны; мочевую и виломочевую кислоты; танин и его производные; гидрохинон; бензофеноны (оксибензон, сулизобензон, диоксибензон, бензорезорцинол, 2,2’,4,4’ -тетрагидробензофенон, 2,2’ -дигидрокси-4,4’ -диметоксибензофенон, октабензон), производные дибензоилметана, авобензон, 4-изопропилдибензоилметан, бутилметоксидибензоилметан, 4-изопропилдибензоилметан, октокрилен и дрометризола трисилоксан.
Дополнительные примеры УФ-фильтров включают N,N,N-триметил-4-(2-оксоборн-3-илиденметил)анилиния метилсульфат; гомосалат (INN); оксибензон (INN); 2-фенилбензимидазол-5-сульфокислоту или ее калиевые, натриевые или триэнатоламиновые соли; 3,3’-(1,4-фенилендиметилен)-бис(7,7-диметил-2-оксобицикло-[2,2,1]гепт-1-илметансульфокислоту) или ее соль; 1-(4-трет-бутилфенил)-3-(4-метоксифенил)пропан-1,3-дион; альфа-(2-оксоборн-3-илиден)толуол-4-сульфокислоту или ее соль; 2-этилгексиловый эфир 2-циано-3,3-дифенилакриловой кислоты (октокрилен); полимер N-{(2 и 4)-[(2-оксоборн-3-илиден)метил]бензил}акриламида; октилметоксициннамат; этоксилированный этил-4-аминобензоат (ПЭГ-25 РАВА); изопентил-4-метоксициннамат (изоамил-п-метоксициннамат); 2,4,6-трианилино-(п-карбо-2’-этилгексил-1’-окси)-1,3,5-триазин(октилтриазон); 2-(2Н-бензотриазол-2-ил)-4-метил-6-(2-метил-3-(1,3,3,3-тетраметил-1-(триметилсилил)окси)дисилоксанил)пропил)фенол (дрометризола трисилоксан); 4,4-((6-(((1,1-диметилэтил)амино)карбонил)фенил)амино)-1,3,5-триазин-2,4-диил)диимино)бис-, бис-(2-этилгексиловый) эфир) бензойной кислоты; 3-(4’-метилбензилиден)-d-l камформу (4-метилбензилиденкамформу); 3 -бензилиденкамфору (3 -бензилиденкамфору); 2-этилгексилсалицилат (октилсалицилат); этил-2-гексил-4-диметиламинобензоат (октилдиметил-РАВА); 2-гидрокси-4-метоксибензофенон-5-сульфокислоту (бензофенон-5) или ее натриевую соль; 2,2’-метилен-бис-6-(2Н-бензотриазол-2-ил)-4-(тетраметилбутил)-1,1,3,3-фенол; мононатриевую соль 2,2’-бис-(1,4-фенилен)-1Н-бензимидазол-4,6-дисульфокислоты); (1,3,5)-триазин-2,4-бис((4-(2-этилгексилокси)-2-гидрокси)фенил)-6-(4-метоксифенил); диметикодиэтилбензальмалонат (№ CAS 207574-74-1); диоксид титана; и гексил-2-[-4-(диэтиламино)-2-гидроксибензоил]бензоат, гексиловый эфир (диэтиламиногидроксибензоил)бензойной кислоты; № CAS 302776-68-7).
Примеры неорганических пигментов, которые обычно применяют в косметике для защиты кожи от УФ-лучей, включают оксиды титана, цинка, железа, циркония, кремния, марганца, алюминия, церия и их смеси.
Составы могут дополнительно содержать один или более антиоксидантов, описанных в настоящей заявке. Антиоксиданты могут быть выбраны, например, из: аминокислот (например, глицина, гистидина, тирозина, триптофана) и их производных, имидазолов (например, урокановой кислоты) и их производных, пептидов, таких как D,L-карнозин, D-карнозин, L-карнозин, и их производных (например, ансерина), каротеноидов, каротенов (например, α-каротена, β-каротена, ликопена) и их производных, хлорогеновой кислоты и ее производных, липоевой кислоты и ее производных (например, тиоредоксина, глутатиона, цистеина, цистина, цистамина и гликозилового, N-ацетилового, метилового, этилового, пропилового, амилового, бутилового и лаурилового, пальмитоилового, олеилового, γ-линолеилового, холестерилового и глицерилового сложных эфиров) и ее солей, дилаурилтиодипропионата, дистеарилтиодипропионата, тиодипропановой кислоты и ее производных (сложных эфиров, простых эфиров, пептидов, липидов, нуклеотидов, нуклеозидов и солей) и сульфоксиминов (например, бутионин-сульфоксиминов, гомоцистеин-сульфоксимин-бутионинсульфонов, пента-, гекса- и гептатион-сульфоксиминов) в очень низких переносимых дозах (например, от пмоль до мкмоль/кг), а кроме того хелатообразующих (образующих хелаты с металлами) агентов (например, α-гидроксижирных кислот, пальмитиновой кислоты, фитиновой кислоты, лактоферрина), α-гидроксикислот (например, лимонной кислоты, молочной кислоты, яблочной кислоты), гуминовой кислоты, желчной кислоты, экстрактов желчи, билирубина, биливердина, ЭДТА, ЭГТА и ее производных, ненасыщенных жирных кислот и их производных (например, γ-линоленовой кислоты, линолевой кислоты, олеиновой кислоты), фолиевой кислоты и ее производных, витамина C и его производных (например, аскорбилпальмитата, Mg аскорбилфосфата, аскорбилацетата), токоферолов и их производных (например, витамина E ацетата), витамина A и его производных (витамина A пальмитата) и кониферилбензоата бензойной смолы, рутиновой кислоты и ее производных, α-гликозилрутина, феруловой кислоты, фурфурилиденглюкоцитола, карнозина, бутилгидрокситолуола, бутилгидроксианизола, нордигидрогваевой кислоты, нордигидрогваяретовой кислоты, тригидроксибутирофенона, мочевой кислоты и ее производных, маннозы и ее производных, цинка и его производных (например, ZnO, ZnSO4), селена и его производных (например, метионина селена), стильбенов и их производных (например, стильбена оксида, транс-стильбена оксида) и производных указанных активных ингредиентов, которые подходят согласно настоящему изобретению (солей, сложных эфиров, простых эфиров, сахаров, нуклеотидов, нуклеозидов, пептидов и липидов).
В одном из вариантов реализации состав содержит:
(a) полиэтиленгликоль, описанный в настоящей заявке; и
(b) не содержит или содержит один или более фармацевтически приемлемых носителей, разбавителей и вспомогательных веществ.
В одном из вариантов реализации состав содержит:
(a) полиэтиленгликоль, описанный в настоящей заявке; и
(b) не содержит или содержит один или более фармацевтически приемлемых носителей, разбавителей, вспомогательных веществ, адъювантов, наполнителей, буферов, консервантов, антиоксидантов, смазок, стабилизаторов, солюбилизаторов, поверхностно активных веществ, маскирующих агентов, красителей, ароматизаторов, подсластителей, эфирных масел и увлажнителей.
В одном из вариантов реализации состав содержит:
(a) полиэтиленгликоль, описанный в настоящей заявке; и
(b) один или более солнцезащитных компонентов.
В одном из вариантов реализации состав содержит:
(a) полиэтиленгликоль, описанный в настоящей заявке;
(b) один или более солнцезащитных компонентов; и
(c) не содержит или содержит один или более фармацевтически приемлемых носителей, разбавителей и вспомогательных веществ.
В одном из вариантов реализации состав содержит:
(a) полиэтиленгликоль, описанный в настоящей заявке;
(b) один или более солнцезащитных компонентов; и
(c) не содержит или содержит один или более фармацевтически приемлемых носителей, разбавителей, вспомогательных веществ, адъювантов, наполнителей, буферов, консервантов, антиоксидантов, смазок, стабилизаторов, солюбилизаторов, поверхностно активных веществ, маскирующих агентов, красителей, ароматизаторов, подсластителей, эфирных масел и увлажнителей.
В одном из вариантов реализации состав содержит:
(a) полиэтиленгликоль, описанный в настоящей заявке;
(b) один или более солнцезащитных компонентов; и
(c) воду.
В одном из вариантов реализации состав содержит:
(a) полиэтиленгликоль, описанный в настоящей заявке;
(b) один или более солнцезащитных компонентов;
(c) воду; и
(d) не содержит или содержит один или более фармацевтически приемлемых носителей, разбавителей и вспомогательных веществ.
В одном из вариантов реализации состав содержит:
(a) полиэтиленгликоль, описанный в настоящей заявке;
(b) один или более солнцезащитных компонентов;
(c) воду; и
(d) не содержит или содержит один или более фармацевтически приемлемых носителей, разбавителей, вспомогательных веществ, адъювантов, наполнителей, буферов, консервантов, антиоксидантов, смазок, стабилизаторов, солюбилизаторов, поверхностно активных веществ, маскирующих агентов, красителей, ароматизаторов, подсластителей, эфирных масел и увлажнителей.
Гели B одном из вариантов реализации состав представляет собой композицию в форме геля.
Гели, как правило, получают путем введения гелеобразующего агента (диспергированная фаза) в растворитель (непрерывная фаза) с получением вязкого желеобразного продукта. Например, известно, что 2% желатин в воде образует плотный гель. Указанные гели, как правило, получают путем охлаждения раствора гелеобразующего агента в растворителе, при котором гелеобразующий агент образует группы субмикроскопических кристаллических частиц, которые удерживают основную часть растворителя во внутреннем пространстве между частицами.
Гели содержат ПЭГ, описанный в настоящей заявке. В одном из вариантов реализации гель содержит ПЭГ, описанный в настоящей заявке, в концентрации, составляющей примерно от 0,1% до 100% от общей массы геля. В других вариантах реализации диапазон составляет примерно от 50% до 100% по массе или примерно от 60% до 100% по массе, или примерно от 70% до 100% по массе, или примерно от 80% до 100% по массе, или примерно от 90% до 100% по массе от общей массы геля.
Гель может дополнительно содержать один или более загустителей или гелеобразующих агентов, описанных в настоящей заявке. Примеры подходящих гелеобразующих агентов включают простые эфиры целлюлозы, такие как метилцеллюлоза, гидроксиэтилцеллюлоза или карбоксиметилцеллюлоза, и растительные гидроколлоиды, такие как альгинат натрия, трагакантовая камедь или аравийская камедь.
Гель может дополнительно содержать один или более растворителей, например, один или более полиолов, описанных в настоящей заявке. Примеры полиолов, подходящих для применения в качестве сорастворителей, включают этиленгликоль, пропиленгликоль, глицерин, пентаэритрит, 1,2-пропандиол, диметилполисиланол, монометиловый эфир, моноэтиловый эфир, монобутиловый эфир и диэтиленгликоль.
Гель может дополнительно содержать один или более безводных растворителей, описанных в настоящей заявке. Примеры подходящих безводных растворителей включают низшие алкильные спирты (в частности, С1-С6 спирты), пирролидоны и летучие силиконы; например, метанол, этанол, изопропиловый спирт, этоксидигликоль, 1-метил-2-пирролидон, полидиметилсилоксан, полиорганические силоксаны и другие кремнийсодержащие полимеры.
Гели, в частности, подходят для доставки ПЭГ или композиции, содержащей ПЭГ, в место активной вспышки вирусной инфекции. Например, гели можно наносить на простуду вокруг рта потребителя, а также на участки кожи с признаками вирусной инфекции или вокруг них. Более того, указанные гели можно наносить до появления признаков активной инфекции для предотвращения поражения кожи.
Гели на водной основе обладают рядом недостатков для определенных применений, заключающихся в том, что они легко смываются жидкостями организма (например, слюной) или поступающими извне водными средами (например, принимаемыми перорально растворенными лекарственными средствами). Гели на безводной основе часто обладают преимуществами, так как они остаются на месте нанесения в течения более продолжительного периода времени и тем самым сохраняют длительную активность в месте нанесения.
Гели на безводной основе обладают важным преимуществом, заключающимся в том, что они обладают окклюзионным действием. Как отмечалось выше, гели на водной основе страдают от эффекта выпаривания (т.е. водный растворитель быстро испаряется, и в результате оставшиеся компоненты могут легко смываться). В гелях на безводной основе, тем не менее отсутствие водного растворителя значительно снижает или полностью устраняет эффект выпаривания. Напротив, возникает окклюзионное действие, и взаимодействие активных компонентов геля и кожи сохраняется в течение длительного периода, что повышает эффективность геля.
Предпочтительно гель имеет вязкость в диапазоне примерно от 1 сП до 30000 сП, например, примерно от 100 сП до 20000 сП при 25°C. При необходимости или при желании вязкость геля можно регулировать путем добавления других компонентов, например, воды, загустителей и т.д., описанных в настоящей заявке.
Гель может дополнительно содержать один или более компонентов, подходящих для получения лучше переносимых и не раздражающих слизистые оболочки носового канала гелей. Таким образом, в одном из вариантов реализации состав представляет собой композицию в форме геля для носа (т.е. геля, который подходит для введения в нос или носовой канал млекопитающего). Например, гели для носа предпочтительно содержат один или более электролитов, подходящих для повышения содержания солей в геле для носа. Жидкости организма, включая жидкости, заполняющие слизистые оболочки носового канала, имеют определенный электролитный баланс, и изменение электролитного баланса может вызывать раздражение. Таким образом, гели для носа предпочтительно содержат одну или более солей в концентрации, подходящей для поддержания естественного электролитного баланса слизистых оболочек носового канала. В некоторых вариантах реализации композиции в виде гелей для носа содержат хлорид натрия.
Гель может дополнительно содержать один или более дополнительных компонентов, таких как вещества, способствующие всасыванию, увлажнители, эмульгаторы, масла, жиры, парафины, загустители, солюбилизаторы, кислоты и основания. Примеры дополнительных компонентов включают поликарбофил, полиакриловую кислоту, полиакрилаты, поливинилпирролидон и алкилцеллюлозы (такие как метилцеллюлоза, этилцеллюлоза, пропилцеллюлоза или бутилцеллюлоза).
В одном из вариантов реализации состав имеет форму геля (например, спрея для носа, спрея для горла):
(a) содержащего полиэтиленгликоль, описанный в настоящей заявке;
(b) не содержащего или содержащего один или более загустителей или гелеобразующих агентов;
(c) не содержащего или содержащего незначительное количество воды;
(d) не содержащего или содержащего один или более других растворителей (отличных от воды);
(e) не содержащего или содержащего один или более электролитов, подходящих для повышения содержания солей в геле;
(f) не содержащего или содержащего одно или более веществ, способствующих всасыванию;
(g) не содержащего или содержащего один или более консервантов;
(h) не содержащего или содержащего один или более красителей; и
(i) не содержащего или содержащего один или более ароматизаторов.
Спреи
В одном из вариантов реализации состав представляет собой композицию в форме спрея, например, спрея для носа или спрея для горла.
Указанные составы особенно подходят для доставки композиции, содержащей ПЭГ, в участки организма, доставка местного геля в которые может быть неудобной или недостаточно эффективной. Понимают, что спрей для носа относится композиции в форме спрея, которую можно распылять в одну или обе ноздри млекопитающего и которая безопасна при взаимодействии со слизистой оболочкой носового канала. Понимают, что спрей для горла относится к композиции в форме спрея, которую можно распылять в рот млекопитающего, и которая безопасна при взаимодействии со всеми поверхностями рта и горла. В целом, спрей для горла преимущественно проходит сквозь ротовую полость потребителя (т.е. основная часть спрея не обязательно вступает в контакт с языком, небом или внутренними поверхностям щек) и наносится в область горла.
Спрей содержат ПЭГ, описанный в настоящей заявке. В одном из вариантов реализации спрей содержит ПЭГ, описанный в настоящей заявке, в концентрации, составляющей примерно от 0,1% до 100% от общей массы спрея. В других вариантах реализации диапазон составляет примерно от 50% до 100% по массе, или примерно от 60% до 100% по массе, или примерно от 70% до 100% по массе, или примерно от 80% до 100% по массе, или примерно от 90% до 100% от общей массы спрея.
В конкретных вариантах реализации спреи дополнительно содержат один или более полиолов. Полиолы, такие как глицерин, особенно подходят с учетом возможности связывания воды. Используемый в настоящем описании термин «полиол» относится к любому органическому соединению, содержащему две или более гидроксильных групп, и включает, например, полимеры и мономеры с гидроксильными функциональными группами, доступными для прохождения органических реакций. Примеры подходящих полиолов включают этиленгликоль, пропиленгликоль, глицерин, пентаэритрит, 1,2-пропандиол, диметилполисиланол, монометиловый эфир этиленгликоля, моноэтиловый эфир этиленгликоля, монобутиловый эфир этиленгликоля и диэтиленгликоль. Один или более полиолов можно включать в состав спрея в концентрации в диапазоне примерно от 0,1% до 30% по массе, примерно от 1% до 30% по массе, примерно от 5% до 30% по массе или примерно от 5% до 20% по массе.
Спреи предпочтительно представляют собой составы на водной основе, которые содержат по меньшей мере один водный растворитель. В одном из вариантов реализации спреи содержат воду в качестве основного растворителя. Тем не менее другие растворители (например, спирты) также можно применять.
Спреи могут дополнительно содержать другие компоненты, например, компоненты, подходящие для получения состава, который возможно вводить в нос или горло. Например, спреи могут содержать консерванты, красители, вещества, способствующие всасыванию, ароматизаторы и т.д. Спреи могут содержать дополнительные компоненты, такие как носители, кислоты, основания и т.д.
В одном из вариантов реализации состав имеет форму спрея (например, спрея для носа, спрея для горла):
(a) содержащего полиэтиленгликоль, описанный в настоящей заявке;
(b) не содержащего или содержащего один или более других полиолов (отличных от полиэтиленгликоля);
(c) не содержащего или содержащего незначительное количество воды;
(d) не содержащего или содержащего один или более других растворителей (отличных от воды) (например, спирты);
(e) не содержащего или содержащего один или более консервантов;
(f) не содержащего или содержащего один или более красителей;
(g) не содержащего или содержащего одно или более веществ, способствующих всасыванию; и
(h) не содержащего или содержащего один или более ароматизаторов.
Бальзамы
В одном из вариантов реализации состав представляет собой композицию в форме бальзама, например, бальзама, который подходит для нанесения на губы или вокруг губ млекопитающего (например, в форме бальзама для губ).
В одном из вариантов реализации бальзам предложен в форме помады (например, губной помады).
Бальзам может представлять собой, например, косметическое средство, такое как губная помада или блеск для губ. Бальзам может быть окрашен (например, представлять собой цветную губную помаду) или по существу бесцветным. Бальзам может содержать или не содержать отдушку или ароматизатор.
Бальзамы содержат ПЭГ, описанный в настоящей заявке. В одном из вариантов реализации бальзам содержит ПЭГ, описанный в настоящей заявке, в концентрации, составляющей примерно от 0,1% до 90% от общей массы бальзама. В других вариантах реализации диапазон составляет примерно от 50% до 90% по массе, или примерно от 60% до 90% по массе, или примерно от 70% до 90% от общей массы бальзама.
Бальзамы, как правило, содержат один или более компонентов, образующих основу, которая составляет основную массу бальзама. Например, твердые губные помады могут содержать природные или синтетические воски, жирные спирты или сложные эфиры жирных кислот в качестве компонентов, образующих основу. Конкретными примерами основ, которые подходят для применения в бальзамах, являются жидкие масла (например, парафиновые масла, касторовое масло, цетостеариловый спирт и изопропилмиристат), полутвердые компоненты (например, вазелин и ланолин), твердые компоненты (например, пчелиный воск, церезин и микрокристаллические воски и озокерит) и тугоплавкие воски (например, карнаубский воск и канделильский воск). Все приведенные выше компоненты, образующие основу, можно описать как единую группу «восковых компонентов». Таким образом, применительно к бальзаму восковой компонент представляет собой любое из приведенных выше веществ, которое можно применять для получения основной массы бальзама, и который подобно всем воскам, как правило, является твердым или полутвердым при температуре окружающей среды, но по меньшей мере размягчается при температурах, сопоставимых со средней температурой тела человека (т.е. примерно при 37°C).
В предпочтительном варианте реализации бальзам дополнительно содержит один или более солнцезащитных компонентов, описанных в настоящей заявке, например, по меньшей мере один УФА-фильтр и/или по меньшей мере один УФБ-фильтр и/или по меньшей мере один неорганический пигмент, описанные в настоящей заявке.
Примеры других компонентов, которые можно включать в состав бальзамов, включают пигменты и другие красители, ароматизаторы, эфирные масла, увлажнители, консерванты и любые другие косметические безопасные компоненты, которые могут быть полезными.
В одном из вариантов реализации состав имеет форму бальзама (например, бальзама для губ, помады для губ, блеска для губ):
(a) содержащего полиэтиленгликоль, описанный в настоящей заявке;
(b) не содержащего или содержащего один или более компонентов, образующих основу;
(c) не содержащего или содержащего один или более солнцезащитных компонентов;
(d) не содержащего или содержащего один или более красителей;
(e) не содержащего или содержащего один или более ароматизаторов;
(f) не содержащего или содержащего одно или более эфирных масел;
(g) не содержащего или содержащего один или более увлажнителей; и
(h) не содержащего или содержащего один или более консервантов.
Эмульсии
В одном из вариантов реализации состав представляет собой композицию в форме эмульсии.
Указанные составы могут быть по природе липофильными (т.е. на основе жиров) или по природе гидрофильными (т.е. на водной основе) и могут иметь различные формы (например, кремов на основе эмульсии, лосьонов и т.д.). Эмульсии, применяемые для получения липофильных и гидрофильных составов включают эмульсии типа масло-в-воде (М/В), эмульсии типа вода в масле (В/М), эмульсии типа вода-в-масле-в-воде (В/М/В), эмульсии типа масло-в-воде-в-масле (М/В/М), липофильные дисперсии и гидрофильные дисперсии. Эмульсии могут содержать, например, жиры, масла, воски или другие жирные компоненты, а также воду и один или более эмульгаторов, которые, как правило, применяют в указанном типе составов.
Масляная фаза эмульсии может быть выбрана, например, из: минеральных масел и минеральных восков; масел, таких как триглицериды капроновой кислоты, каприловой кислоты или касторовое масло; жиров, восков и других природных и синтетических жирных компонентов, предпочтительно, сложных эфиров жирных кислот и спиртов с низким числом атомов углерода, например, изопропанола, пропиленгликоля или глицерина, или сложных эфиров жирных спиртов и алкановых кислот с низким числом атомов углерода или с жирными кислотами; алкилбензоата; силиконовых масел, таких как диметилполисилоксаны, диэтилполисилоксаны, дифенилполисилоксаны и их смешанные формы. Масляная фаза фаза эмульсии может быть выбрана, например, из: сложных эфиров насыщенных и/или ненасыщенных разветвленных и/или неразветвленных алканкарбоновых кислот с длиной цепи, составляющей от 3 до 30 атомов углерода, и насыщенных и/или ненасыщенных разветвленных и/или неразветвленных спиртов с длиной цепи, составляющей от 3 до 30 атомов углерода; сложных эфиров ароматических карбоновых кислот и насыщенных и/или ненасыщенных разветвленных и/или неразветвленных спиртов с длиной цепи, составляющей от 3 до 30 атомов углерода. Указанные сложноэфирные масла, например, могут быть выбраны из изопропилмиристата, изопропилпальмитата, изопропилстеарата, изопропилолеата, н-бутилстеарата, н-гексиллаурата, н-децилолеата, изооктилстеарата, изононилстеарата, изононилизононаноата, 2-этилгексилпальмитата, 2-этилгексиллаурата, 2-гексилдецилстеарата, 2-октилдодецилпальмитата, олеилолеата, олеилэруката, эруцилолеата, эруцилэруката и синтетических, полусинтетических и натуральных смесей указанных сложных эфиров, например, масла жожоба. В дополнение, масляная фаза может быть выбрана, например, из: разветвленных и неразветвленных углеводородов и углеводородных восков, силиконовых масел, диалкильных эфиров, группы, состоящей из насыщенных или ненасыщенных разветвленных или неразветвленных спиртов, и триглицеридов жирных кислот, а именно триглицеридных сложных эфиров насыщенных и/или ненасыщенных разветвленных и/или неразветвленных алканкарбоновых кислот с длиной цепи, составляющей от 8 до 24, в частности 12-18 атомов углерода. Триглицериды жирных кислот могут быть выбраны, например, из: группы, состоящей из синтетических, полусинтетических и натуральных масел, например, оливкового масла, подсолнечного масла, соевого масла, арахисового масла, рапсового масла, миндального масла, пальмового масла, кокосового масла, косточкового пальмового масла и т.д.
Любые смеси указанных масел и восковых компонентов также можно применять. Например, может обладать преимуществами применение восков, например, цетилпальмитата, в качестве единственного липидного компонента масляной фазы. Масляная фаза также может содержать циклические или линейные силиконовые масла или состоять по существу из указанных масел, несмотря на то, что предпочтительно включать компонент масляной фазы в дополнение к силиконовому маслу или маслам.
Водная фаза, например, может содержать спирты, диолы или полиолы с низким числом атомов углерода и простые эфиры, предпочтительно, этанол, изопропанол, пропиленгликоль, глицерин, этиленгликоль, моноэтиловый или монобутиловый эфир этиленгликоля, монометиловый, моноэтиловый или монобутиловый эфир пропиленгликоля, монометиловый или моноэтиловый эфир диэтиленгликоля и аналогичные продукты, а также спирты с низким числом атомов углерода, например, этанол, изопропанол, 1,2-пропандиол, глицерин. В дополнение водная фаза может дополнительно содержать один или более загустителей, например, выбранных из: диоксида кремния, силикатов алюминия, полисахаридов и их производных, например, гиалуроновой кислоты, ксантановой камеди, гидроксипропилметилцеллюлозы, предпочтительно выбранных из группы, состоящей из полиакрилатов, предпочтительно полиакрилатов, выбранных из группы так называемых карбополов.
Эмульсии содержат ПЭГ, описанный в настоящей заявке. В одном из вариантов реализации эмульсия содержит ПЭГ, описанный в настоящей заявке, в концентрации, составляющей примерно от 0,1% до 100% от общей массы эмульсии. В других вариантах реализации диапазон составляет примерно от 50% до 100% по массе или примерно от 60% до 100% по массе, или примерно от 70% до 100% по массе, или примерно от 80% до 100% по массе, или примерно от 90% до 100% от общей массы эмульсии.
Кремы, лосьоны и т.д., получаемые с применением эмульсий, гидрофильных дисперсий или липофильных дисперсий, могут содержать различные дополнительные компоненты. Например, композиции могут дополнительно содержать один или более солнцезащитных компонентов, описанных в настоящей заявке, и/или один или более антиоксидантов, описанных в настоящей заявке, а также консерванты, солюбилизаторы, отдушки, кондиционеры и/или увлажнители.
Комбинации
Очевидно, что конкретные признаки настоящего изобретения, которые для большей ясности описаны в отдельных вариантах реализации, также можно объединять в одном варианте реализации. В противоположность этому различные признаки изобретения, которые для краткости описаны в одном варианте реализации также могут быть предложены отдельно или в любой подходящей подкомбинации. Все комбинации вариантов реализации включены в рамки настоящего изобретения и описаны в настоящей заявке в том же объеме, как и в случае, если бы любая и каждая комбинация была описана индивидуально и явно. В дополнение любые подкомбинации также включены в рамки настоящего изобретения и описаны в настоящей заявке в том же объеме, как и в случае, если бы любая и каждая субкомбинация была описана индивидуально и явно.
Примеры
Описанное в настоящей заявке исследование было частью одноцентрового плацебо-контролируемого рандомизированного двойного слепого исследования Фазы 1/11 лечения рецидивирующего лабиального герпеса путем местного введения мази.
Задача исследования
Основной задачей было определение числа рецидивов лабиального герпеса в течение шести месяцев профилактически и интенсивного лечения.
Оценка
Рецидив определяли по признакам и симптомам рецидивирующего лабиального герпеса, таким как эритема, папулы, пузырьки, образование язв, эрозии, отеки и т.д.
Максимальную площадь очага инфекции оценивали путем измерения длины и ширины очага. Произведением этих величин является площадь (мм2).
Продолжительность рецидива лабиального герпеса оценивали путем определения числа дней от появления первых продромальных признаков простуды на губах (чувства натяжения кожи, гиперчувствительности кожи, раздражения, жжения и зуда) до полного излечения. Излечение определяли как удаление корок (остаточная эритема может сохраняться) и/или исчезновение всех симптомов. Итоговый результат (излечение кожи или исчезновение всех симптомов) записывали и принимали за конечную точку рецидива.
Уровень боли/дискомфорта во время рецидива герпеса оценивали по 100 мм визуальной аналоговой шкале (ВАШ). Пациенты ежедневно отмечали на ВАШ уровень боли, ощущаемой в течение дня. Пациенты записывали уровень боли на протяжении всего периода лечения рецидива (14 дней).
Выбор субъектов
Набирали группу из 20 пациентов. Для исследования отбирали мужчин и женщин, имеющих историю рецидивирующего лабиального герпеса (по меньшей мере восемь рецидивов за последний год без ограничения максимального числа рецидивов).
Пациентов выбирали для исследования, если они удовлетворяли следующим критериям включения:
(1) возраст от 18 до 50 лет;
(2) медицинская история лабиального герпеса с очагами на губах или в области рта (<1 см от границы губ);
(3) по меньшей мере восемь рецидивов лабиального герпеса за последний год перед включением в исследование;
(4) возможность и желание участвовать в исследовании; и
(5) добровольное письменное информированное согласие.
Пациенты, которые удовлетворяли любому из приведенных ниже критериев, исключали из исследования:
(1) женщины детородного возраста, не использующие одобренных приемлемых с точки зрения медицины способов контрацепции (например, хирургических, внутриматочных противозачаточных средств, пероральных противозачаточных средств, средств двойной барьерной контрацепции, систем доставки гормонов, таких как имплантаты или инъецируемые препараты, презервативов или противозачаточных колец) (каждый в комбинации с противозачаточными кремами, пенами и т.д.);
(2) беременные или кормящие женщины или женщины, планирующие беременность во время исследования;
(3) медицинская история иммуносуппрессии в результате радиотерапии, химиотерапии, применения иммуномодулирующих лекарственных средств или ВИЧ;
(4) участие в других клинических исследованиях за 30 дней до начала исследования;
(5) медицинская история любых тяжелых заболеваний, таких как гепатит, почечная или печеночная дисфункция, сердечнососудистая(ые), желудочно-кишечная(ые) злокачественная(ые) опухоль(и), или психиатрические нарушения и т.д., которые могут влиять на оценку результатов или проведение исследования;
(6) прием или применение противовирусных средств или других запрещенных в исследовании сопутствующих лекарственных средств за 30 дней до начала исследования или намерение принимать указанные лекарственные средства во время исследования;
(7) использование противовоспалительных лекарственных средств и стероидов во время исследования;
(8) герпетиформная экзема или любая история других заболеваний кожи, которые провоцируют герпетиформную экзему;
(9) любые аномальные состояния кожи вокруг рта;
(10) известные или предполагаемые аллергические или нежелательные ответы на ПЭГ;
(11) невозможность следования протоколу исследования;
(12) медицинская история алкогольной и/или наркотической зависимости за 12 месяцев до участия в исследовании.
Дизайн исследования
Пациентам не сообщали о химическом составе мазей, применяемых в исследовании; в частности, им не сообщали о применении или содержании ПЭГ или любых других ингредиентов.
Первое нанесение мази, содержащей ПЭГ, проводили в центре проведения исследования во время второго посещения. После первого нанесения пациента наблюдали в течение 30 минут для подтверждения его/ее безопасности и хорошего самочувствия. Если у пациента происходил острый рецидив рецидивирующего лабиального герпеса во время 2 посещения, то мазь, содержащую ПЭГ, затем вводили пять раз в день в течение 14 дней (интенсивное дозирование) на всю поверхность губ. Каждый раз примерно 1,5 см мази наносили на верхнюю губу и 1,5 см на нижнюю губу (общая масса составляла примерно 0,2 г). Через 14 дней мазь, содержащую ПЭГ, наносили два раза в день в течение 6 месяцев (14 дней лечения острой инфекции включены в эти 6 месяцев) на всю поверхность губ (профилактическое дозирование). В случае отсутствия рецидива во время 2 посещения (отсутствие видимых признаков или симптомов, таких как чувство натяжения кожи, гиперчувствительность кожи, раздражение, жжение и зуд, вызванных лабиальным герпесом), мазь, содержащую ПЭГ, наносили два раза в день в течение 6 месяцев на всю поверхность губ.
Каждый пациент все последующие нанесения проводил самостоятельно дома. В течение 48 часов после первого нанесения исследователи связывались с пациентом по телефону для получения информации об ощущениях после введения, комфорте, дискомфорте, нежелательных реакциях и общем состоянии здоровья. Для проверки соблюдения протокола исследования и определения любых симптомов герпеса во время исследования пациентов просили отмечать все применения и любые симптомы (чувство натяжения кожи, гиперчувствительность кожи, раздражение, жжение и зуд) в дневнике (пациенты ставили крест за каждое нанесение). В дополнение пациентов просили заполнять визуальную аналоговую шкалу (ВАШ) для описания уровня боли в конце каждого дня при остром рецидиве герпеса.
Все рецидивы подвергали лечению мазью, содержащей ПЭГ, при появлении первых симптомов (продромальных симптомов, таких как: чувство натяжения кожи, гиперчувствительность кожи, раздражение, жжение и зуд) 5 раз в день в течение 14 дней.
Во время острой фазы (рецидива) пациентов просили прийти в центр проведения исследования для посещения на 1 день (в течение 24 часов после появления первых симптомов), 5 день, 10 день и 14 день. На 15 день возвращались к профилактической схеме и наносили мазь два раза в день до проявления следующего рецидива или до конца исследования (6 месяцев). Во время профилактического периода пациентам требовалось посещать центр проведения исследования каждые 60 дней для проведения контрольной экспертизы и получения исследуемого лекарственного средства.
Скрининговый визит (посещение 1). Заинтересованных пациентов приглашали в центр проведения исследования для подробного обсуждения исследования в собеседовании о медицинском значении исследования и для передачи пациенту информационного листка, который содержал все детали исследования. После подписания информированного согласия в центре проведения исследования исследователи узнавали у пациента о числе рецидивов герпеса, которые происходили за последний год. Подходящих пациентов включали в число участников исследования и им последовательно присваивали номера.
Медицинское обследование и первое нанесение (посещение 2). Проводили медицинский осмотр участвующих в исследовании пациентов, и исследователи собирали и записывали следующие данные и проводили следующие оценки: (1) медицинская история, в частности в отношении рецидивирующего лабиального герпеса, на также включая аллергии, в частности аллергии на ПЭГ; (2) полный медицинский осмотр, включая обследование кожи (в частности, области вокруг рта), ушей, носа, горла, шеи и щитовидной железы, сердечнососудистой и легочной системы, лимфоузлов, нервной системы и мышечной и скелетной системы, включая определение основных показателей жизнедеятельности (кровяное давление, пульс); (3) для женщин детородного возраста проводили тест на мочи на беременность; для продолжения исследования требовался отрицательный результат.
Первую дозу мази, содержащей ПЭГ, вводили пациенту в центре проведения исследования (под наблюдением исследователей) и пациентов наблюдали в течение по меньшей мере 30 минут для подтверждения их безопасности и хорошего самочувствия. Если не происходило нежелательных реакций, то пациентов отпускали и просили вводить все оставшиеся дозировки соответствующим образом до возникновения рецидива. В этом случае пациентов просили вернуться в центр проведения исследования в течение 24 часов с того момента, как они почувствовали любые продромальные признаки, такие как чувство натяжения кожи, гиперчувствительность кожи, раздражение, жжение и зуд.
Пациентам выдавали дневники пациентов и проводили инструктаж по заполнению дневника во время всего периода исследования. В дневник пациента необходимо было вводить записи обо всех нанесениях мази, содержащей ПЭГ, а также о любых симптомах лабиального герпеса (например, о видимых признаках, таких как эритема, пузырьки, папулы и т.д., а также об ощущениях, таких как раздражение, жжение, зуд и т.д.) и любых других изменениях самочувствия (нежелательных явлениях). От пациентов требовалось помечать соответствующие графы дневника и оставлять заметки о боли/дискомфорте на губах и о нежелательных явлениях в случае их появления. Во время рецидива лабиального герпеса пациентов просили отмечать в дневниках каждый день уровень боли/дискомфорта на 100 мм визуальной аналоговой шкале (ВАШ).
Телефонный звонок (в течение 48 часов после первого нанесения). В течение 48 часов после первого нанесения мази, содержащей ПЭГ, исследователи связывались с пациентом по телефону для получения информации об ощущениях после введения, комфорте, дискомфорте, нежелательных явлениях и общем состоянии здоровья.
Встречи или контрольные посещения с двухмесячными интервалами (посещения 3, 4 и 5). Во время каждой встречи/контрольного посещения, которые проводили через 60±5 дней (посещение 3), 120±5 дней (посещение 4), 180±5 дней (посещение 5) после посещения 2 исследователи изучали губы пациента для определения любых аномалий и узнавали у пациентов об ощущениях после нанесения мази, о соблюдении протокола исследования и о возникновении любых нежелательных явлений со времени последнего посещения.
Пациенты также приносили с собой дневники, в которых исследователи проверяли соблюдение протокола исследования и любые другие записи. Если пациент не мог прийти в центр проведения исследования вследствие недомогания посещение заменяли в виде исключения телефонным звонком.
В случае появления острого рецидива во время запланированного посещения процедура была аналогична процедуре, описанной для посещения 1a.
Посещение 5 представляло собой посещение для заключительной экспертизы (конец исследования). В дополнение к оценкам, описываемым для контрольных посещений, заключительная экспертиза включала полный медицинский осмотр, включая обследование кожи (в частности, области вокруг рта), ушей, носа, горла, шеи и щитовидной железы, сердечнососудистой и легочной системы, лимфоузлов, нервной системы и мышечной и скелетной системы, включая определение основных показателей жизнедеятельности (кровяное давление, пульс).
Дополнительные посещения. В случае рецидива лабиального герпеса пациентов просили прийти в центр проведения исследования сразу после того, как они почувствуют любые продромальные признаки и симптомы на губах. Во время острой фазы рецидива пациенты приходили в центр проведения исследования на 1, 5, 10 и 14 день (±24 часа) после появления первых признаков и симптомов, и их просили продолжать записи в дневниках.
Посещение 1а (первый день острой фазы, в течение 24 часов). Как только пациенты определяли первые симптомы лабиального герпеса (чувство натяжения кожи, гиперчувствительность кожи, раздражение, жжение и зуд), они должны были позвонить исследователям, чтобы договориться о посещении центра проведения исследования в течение 24 часов. Во время этого посещения исследователи проводили экспертизу, которая включала: выявление пораженного участка, измерение очага, оценка состояния очага (эритема, папула, пузырьки, язвы, эрозии, твердые корки, шелушение, остаточный отек, исцеление и боль). Пациенты также должны были принести с собой дневник и отдать исследователям, которые оценивали данные и проверяли соблюдение протокола исследования. Исследователи также спрашивали об ощущениях пациента после приема мази, содержащей ПЭГ, и о любых возможных проблемах.
В случае повторного рецидива пациенты должны были прийти в центр проведения исследования в течение 24 часов с появления первых симптомов рецидивирующего лабиального герпеса (чувство натяжения кожи, гиперчувствительность кожи, раздражение, жжение и зуд), как описано выше. Если возникали побочные эффекты, пациент должен был в кратчайшие сроки прийти в центр проведения исследования для обследования.
Посещение 2a (5 день острой фазы, ±1 день). Использовали ту же процедуру, что и во время посещения 1 а.
Посещение 3a (10 день острой фазы, ±1 день). Использовали ту же процедуру, что и во время посещения 1 а.
Посещение 4a (14 день острой фазы, ±1 день). Последнее посещение во время острой фазы. Исследователи подтверждали исчезновение очага и, таким образом, завершение рецидива. Если рецидив заканчивался быстрее чем за 14 дней, мазь, содержащую ПЭГ, все равно вводили пять раз в день до истечения 14 дней. Причиной являлось возможное протекание бессимптомной репликации вируса. Таким образом, пациентов просили продолжать нанесение мази, содержащей ПЭГ, до истечения 14 дней. Даже если рецидив 5 не завершался в течение 14 дней, мазь, содержащую ПЭГ, начинали вводить два раза в день до возникновения следующего рецидива или до завершения исследования.
Мазь, содержащая ПЭГ
Мазь, содержащая ПЭГ, применяемая в исследовании, содержала 85 масс.% ПЭГ 400 (название по МНКИ ПЭГ-8) и 15 масс.% ПЭГ 8000 (название по МНКИ ПЭГ-180), мазь 10 получали в соответствии с руководством по надлежащей производственной практике (GMP).
Качество ПЭГ подтверждали при помощи стандартов, приведенных в статьях Европейской Фармакопеи, касающихся Macrogol 400 и Macrogol 8000, соответственно (см., например, статью «Macrogols», Европейская Фармакопея 5.0, 01/2005:1444, стр.1950-15 1951). Типичные характеристики Macrogol 400 и Macrogol 8000 обобщены в следующей таблице.
Среднемассовая молекулярная масса ПЭГ 400 составляла не менее 95,0% и не более 105,0% от номинального значения 400.
Среднемассовая молекулярная масса ПЭГ 8000 составляла не менее 87,5% и не более 112,5% от номинального значения 8000.
Пациентам не сообщали, что содержалось в исследуемой мази. Местное введение
Пациентам вводили мазь, содержащую ПЭГ, которую наносили непосредственно на всю поверхность губ (1,5 см мази на верхнюю губу и 1,5 см на нижнюю губу) таким образом, чтобы губы были полностью покрыты мазью. Было важно, чтобы отсутствовали повреждения, очаги поражения или другие аномалии (не связанные с лабиальным герпесом) на губах или на коже (<1 см от границы губ).
Первую дозу пациенты вводили в центре проведения исследования под контролем исследователей. В профилактический период пациенты наносили лекарственное средство два раза в день дома. В острой фазе пациенты наносили лекарственное средство пять раз в день дома.
Введение сопутствующих лекарственных средств
Введение следующих лекарственных средств запрещалось во время исследования и за 30 дней до начала исследования: иммуномодулирующие лекарственные средства; цитостатики; любые противовирусные средства; пластыри от простуды на губах Compeed™; противовоспалительные лекарственные средства; стероиды; косметика для губ (например, губная помада, солнцезащитные средства для губ, бальзам для губ и т.д.). Все другие лекарственные средства, необходимые для поддержания хорошего самочувствия субъекта были разрешены, но были отмечены в индивидуальной регистрационной карте исследователями.
Оценка
Определение числа рецидивов. Для каждого индивидуального пациента отмечали любой рецидив герпеса, возникающий в течение 6 месяцев профилактического лечения ПЭГ.
Определение максимальной площади очага. Площадь очага определяли как произведение его длины и ширины. Для их измерения использовали штангенциркуль или линейку.
Результаты выражали в мм2 совместно с текущей стадией. Максимальную площадь очага определяли во время каждого дополнительного посещения при рецидиве герпеса.
Определение продолжительности. Для определения продолжительности рецидива определяли число дней от появления первых продромальных признаков простуды на губах (чувства натяжения кожи, гиперчувствительности кожи, раздражения, жжения и зуда) до полного излечения. Излечение определяли по потере корок (при этом могла сохраняться остаточная эритема) и/или исчезновению всех симптомов. Итоговый результат (излечение кожи или исчезновение всех симптомов) записывали и принимали за конечную точку рецидива.
Определение уровня боли/дискомфорта. Для определения уровня боли во время рецидива использовали 100 мм визуальную аналоговую шкалу (ВАШ) (где 0 означал отсутствие боли, а 10 означал невыносимую боль). Во время рецидива (14 дней) пациенты ставили отметки на ВАШ в конце каждого дня об уровне боли, которую они ощущали за последние 24 часа (определяли уровень только для простуды). ВАШ прилагалась к дневнику каждого пациента; в каждое из «дополнительных посещений» пациенты приносили заполненные дневники в центр проведения исследования, где дневники оценивали исследователи.
Для более точного описания симптомов (и определения степени тяжести) пациенты также должны были отмечать свои ощущения (продромальные признаки), что проиллюстрировано в следующей таблице.
Нежелательные явления
Самочувствие пациентов определяли при помощи нейтральных вопросов («Как ваше самочувствие?»). Исследователи требовали сообщать обо всех нежелательных явлениях, возникавших в течение исследования. По степени выраженности нежелательные явления разделяли на слабо выраженные (едва заметное незначительное нарушение самочувствия), умеренно выраженные (ощутимый дискомфорт, но переносимый без осуществления неотложной помощи) или сильно выраженные (невыносимый дискомфорт, требующий осуществления неотложной помощи).
Нежелательное явление (АЕ) определяли как любое неблагоприятное медицинское явление у пациента или субъекта клинического исследования, которому вводят мазь, содержащую ПЭГ, и которое не обязательно связано причинно-следственными связями с лечением. Нежелательное явление, таким образом, может представлять собой любой неблагоприятный и неожиданный признак (включая аномальные данные лабораторного исследования), симптом или заболевание, совпадающие по времени с применением мази, содержащей ПЭГ, но не обязательно связанные с применением мази, содержащей ПЭГ.
Серьезное нежелательное явление (SAE) определяли как любое неблагоприятное медицинское явление, которое при введении любой дозы: приводило к смерти; угрожало жизни; требовало госпитализации или продления текущей госпитализации; приводило к постоянной или значительной потере трудоспособности/недееспособности; являлось врожденной аномалией/пороком развития (относится к врожденной аномалии потомства субъекта или субъекта, которому вводили мазь, содержащую ПЭГ); представляло собой любое важное медицинское явление и любое явление, не включенное в предложенный выше список, которое могло подвергать риску субъекта или могло требовать внешнее воздействие для предотвращения одного из исходов, перечисленных выше.
Любое другое медицинское важное состояние, которое непосредственно не угрожает жизни или не приводит к смерти или госпитализации, но может подвергать риску субъекта или требовать внешнее воздействие для предотвращения одного из исходов, перечисленных выше, также, как правило (т.е. на основании медицинских и научных исследований), рассматривают как серьезное. Указанные состояния включают, например:
интенсивное домашнее лечение от аллергических бронхоспазмов; определенные отклонения лабораторных показателей (например, дискразию крови); конвульсии, которые не приводят к госпитализации; развитие медикаментозной зависимости или злоупотребления лекарственным средствами.
Беременность, как таковую, не классифицировали как нежелательное явление. Тем не менее нежелательные явления, связанные с беременностью, фиксировали наряду с другими нежелательными явлениями. Беременность подтверждали при помощи достоверных лабораторных исследований. Беременных субъектов было необходимо немедленно исключать из клинического исследования.
Досрочное окончание исследования
Досрочное окончание исследования способа лечения по любой причине полностью подтверждали документально. Прилагались все обоснованные усилия для соблюдения пациентом протокола исследования и продолжения участия пациента в исследовании. Исследователи проверяли соблюдение пациентом протокола исследования во время каждого контрольного посещения, изучая дневник, в котором пациент должен был отмечать графы о проведенных введениях исследуемого лекарственного средства. Пациентам разрешалось добровольно отказываться от дальнейшего участия в исследовании в любое время без объяснения причин и без ущерба для дальнейшего лечения. Исследователям разрешалось исключать пациентов из исследования по причинам безопасности. Пациентов в обязательном порядке исключали из исследования, если: возникала беременность; возникали значительные проблемы безопасности; или пациенты не соблюдали протокол исследования.
Результаты
Согласно предложенному выше описанию для исследования отбирали 20 пациентов. Четырех пациентов исключили по ходу исследования, т.е. 16 пациентов завершили исследование.
4 пациентов исключили из исследования по следующим причинам: (1) пациент не вернулся в центр проведения исследования, последующее наблюдение стало невозможным; (2) пациент посчитал, что участие в исследовании отнимает очень много времени; пациент утратил подвижность в результате перелома ноги; (3) пациент посчитал, что исследование накладывает слишком много ограничений на повседневную жизнь;
лечение вызывало сухость губ, и пациент пришел к выводу о низкой эффективности; и (4) пациент прекратил участие в исследовании вследствие нежелательного явления (лишай и зуд).
Данные о числе рецидивов лабиального герпеса за год до исследования и во время исследования приведены в следующей таблице.
Среди 16 пациентов, закончивших исследование 8 (50%) сообщили об отсутствии рецидивов во время шестимесячного исследования.
Среди 16 пациентов, закончивших исследование 12 (75%) сообщили о 0-1 рецидивах во время шестимесячного исследования.
Среди 16 пациентов, закончивших исследование 13 (81%) сообщили о 0-2 рецидивах во время шестимесячного исследования.
Среди 16 пациентов, закончивших исследование все (100%) сообщили о 0-4 рецидивах во время шестимесячного исследования.
Повторимся, что всех пациентов отбирали с учетом возникновения по меньшей мере восьми рецидивов за последний год без ограничения максимального числа рецидивов.
У 13 пациентов (81%) лечение в течение шестимесячного исследования приводило по меньшей мере к двукратному снижению числа рецидивов за год.
У 12 пациентов (75%) лечение в течение шестимесячного исследования приводило по меньшей мере к четырехкратному снижению числа рецидивов за год.
У 8 пациентов (50%) лечение в течение шестимесячного исследования приводило более чем к четырехкратному снижению числа рецидивов за год (при этом у одного пациента число рецидивов за год снизилось более чем в десять раз).
Результаты также проиллюстрированы графически на Фигуре 1, на которой приведена столбчатая диаграмма, иллюстрирующая снижение числа вспышек (рецидивов) лабиального герпеса у пациентов описанного в настоящей заявке исследования. % пациентов и суммарный % пациентов приведены для 100%, 90%+, 80%+, 70%+ и 60%+ снижения числа вспышек (рецидивов).
Из приведенных данных очевидно, что лечение мазью, содержащей ПЭГ, очень сильно снижало число рецидивов лабиального герпеса в год.
Оценки пациентами удобства использования во время профилактической фазы (по шкале от 1 до 10, где более высокое значение соответствует более высокой удовлетворенности, значения приведены в следующей таблице) были одобрительными. 62% (10/16) пациентов оценили удобство использования 8 баллами или выше. 81% (13/16) пациентов оценили удобство использования 5 баллами или выше.
Оценки пациентами удобства использования во время острой фазы (по шкале от 1 до 10, где более высокое значение соответствует более высокой удовлетворенности, значения приведены в следующей таблице) были одобрительными. 88% (7/8) пациентов, которые оценивали этот показатель, оценили удобство использования 5 баллами или выше.
Удовлетворенность лекарственным средством (по шкале от 1 до 10, где более высокое значение соответствует большей удовлетворенности, значения приведены в следующей таблице) была очень благоприятной. 50% (8/16) пациентов оценили удовлетворенность максимально возможными 10 баллами. 94% (15/16) пациентов оценили удовлетворенность 5 баллами или выше.
В дополнение, общая удовлетворенность лечением у пациентов (по шкале от 1 до 10, где более высокое значение соответствует большей удовлетворенности, значения приведены в следующей таблице) была очень благоприятной. 81% (13/16) пациентов оценили удовлетворенность 5 баллами или выше.
Дополнительные данные, не приведенные в настоящем описании, показывают, что положительное действие ПЭГ существенно не снижается, если состав разбавляют до 20% содержания по массе компонентов, отличных от ПЭГ. В частности, в параллельном исследовании, где мазь, содержащую ПЭГ, заменяли на мазь, состоящую из 80 масс.% ПЭГ (в виде смеси 85 масс.% ПЭГ 400 и 15 масс.% ПЭГ 8000) и 20 масс.% других компонентов, отличных от ПЭГ, частота рецидивов лабиального герпеса значительно снижалась, но не до такой степени, о которой сообщается в настоящем описании для неразбавленного ПЭГ.
Вышеизложенное описывает принципы, предпочтительные варианты реализации и принципы действия настоящего изобретения. Тем не менее изобретение не следует рассматривать как ограниченное конкретными обсуждаемыми вариантами реализации. Напротив, вышеописанные варианты реализации следует рассматривать как иллюстративные, но не ограничивающие, и должно быть очевидным, что специалисты в данной области техники могут проводить различные изменения указанных вариантов реализации в пределах объема изобретения.
Ссылки
Ряд публикаций приведен в настоящем описании для более полного описания и раскрытия изобретения и уровня области техники, к которой изобретение относится. Полный список цитируемых публикаций приведен ниже. Каждая из указанных публикаций включена в настоящую заявку по всей полноте посредством ссылки в той же степени, как и в случае, если бы каждая индивидуальная публикация была конкретно и индивидуально включена посредством ссылки.
Buenzli, D., et al., 2004, "Seroepidemiology of herpes simplex virus type 1 and 2 in western and southern Switzerland in adults aged 25-74 in 1992-93: a population-based study", BMC Infect. Dis., Vol.4, No.10.
Lukas, В., et al., 1988, "Antiherpetically active lipstick and the use thereof for the treatment of disorders of the lips and other areas of the face caused by human herpes viruses". United States patent number 4,762,715 granted 09 August 1988.
Vitins, P., et al., 2008, "Cyclodextrin Formulations", международная опубликованная заявка на патент WO 2008/087034 A2, опубликованная 24 июля 2008 года.
Whitley, R.J., 1990, "Herpes simplex viruses", in Virology. (Fields, B.N., et al., eds., Raven Press, New York, USA), pp.1852-1854.
Young, T.B., et al., 1988, "Cross-sectional study of recurrent herpes labialis". Am.J. Epidemiol., Vol.127, pp.612-625.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ГЕРПЕС-ВИРУСНОЙ ИНФЕКЦИИ | 2003 |
|
RU2241443C1 |
| ВАКЦИНЫ ПРОТИВ ВИРУСА ПРОСТОГО ГЕРПЕСА 2 ТИПА: КОМПОЗИЦИИ И СПОСОБЫ ЗАПУСКА ИММУННОГО ОТВЕТА | 2010 |
|
RU2585961C9 |
| СПОСОБ ТЕРАПЕВТИЧЕСКОГО ВОЗДЕЙСТВИЯ НА ЛИЦ, ИНФИЦИРОВАННЫХ ВИРУСОМ ГЕРПЕСА | 2007 |
|
RU2359720C2 |
| ПРИМЕНЕНИЕ ЛИОФИЛИЗИРОВАННОГО ПРЕПАРАТА АЛЛОФИБРОБЛАСТОВ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, ВЫЗВАННЫХ ВИРУСОМ ГЕРПЕСА | 2012 |
|
RU2483739C1 |
| СПОСОБ ВЫБОРА ТЕРАПИИ ПРИ ГЕРПЕСЕ | 2000 |
|
RU2215292C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ГЕРПЕСА | 1998 |
|
RU2165264C2 |
| ЛЕЧЕНИЕ ВИРУСНЫХ ИНФЕКЦИЙ | 2012 |
|
RU2545918C1 |
| КОМПОЗИЦИИ С ВЫСОКОЙ ПРОНИКАЮЩЕЙ СПОСОБНОСТЬЮ И СПОСОБЫ ЛЕЧЕНИЯ ИНДУЦИРОВАННЫХ ПАТОГЕНАМИ НАРУШЕНИЙ ТКАНЕЙ | 2012 |
|
RU2586969C2 |
| СПОСОБ ВАКЦИНОТЕРАПИИ ГЕРПЕТИЧЕСКОЙ ИНФЕКЦИИ | 2012 |
|
RU2514034C2 |
| МЕСТНОЕ ПРИМЕНЕНИЕ АНТИТЕЛА К HSV | 2015 |
|
RU2703903C2 |

Изобретение относится к области фармацевтической промышленности, а именно к способу снижения частоты рецидивов лабиального герпеса у пациента, который включает местное введение в качестве активного агента терапевтически эффективного количества полиэтиленгликоля (ПЭГ), который либо (i) представляет собой ПЭГ со среднемассовой молекулярной массой 200-800, либо (ii) представляет собой смесь (a) ПЭГ со среднемассовой молекулярной массой 200-800 и (b) ПЭГ со среднемассовой молекулярной массой 1000-15000, при этом массовое соотношение (а) к (b) составляет от 3:1 до 20:1, где указанный способ осуществляют на протяжении, по меньшей мере, 4 недель; местное введение проводят 1-5 раз в день на губах и/или вокруг губ пациента. Изобретение обеспечивает уменьшение или предотвращение рецидивов лабиального герпеса. 52 з.п. ф-лы, 1 пр., 9 табл., 1 ил.
1. Способ снижения частоты рецидивов лабиального герпеса у пациента, включающий местное введение в качестве активного агента терапевтически эффективного количества полиэтиленгликоля,
где указанный способ осуществляют на протяжении по меньшей мере 4 недель;
где указанное местное введение проводят от одного до пяти раз в день;
где указанное местное введение проводят на губах и/или вокруг губ указанного пациента; и причем либо:
(i) указанный полиэтиленгликоль представляет собой полиэтиленгликоль, имеющий среднемассовую молекулярную массу (Mw) от 200 до 800;
либо:
(ii) указанный полиэтиленгликоль представляет собой смесь двух полиэтиленгликолей:
(a) полиэтиленгликоля со среднемассовой молекулярной массой (Mw) от 200 до 800; и
(b) полиэтиленгликоля со среднемассовой молекулярной массой (Mw) от 1000 до 15000; при этом массовое соотношение компонента (а) к компоненту (b) составляет от 3:1 до 20:1.
2. Способ по п. 1, характеризующийся тем, что:
указанный полиэтиленгликоль представляет собой полиэтиленгликоль, имеющий среднемассовую молекулярную массу (Mw) от 200 до 800.
3. Способ по п. 1, характеризующийся тем, что:
указанный полиэтиленгликоль представляет собой полиэтиленгликоль, имеющий среднемассовую молекулярную массу (Mw) от 300 до 700.
4. Способ по п. 1, характеризующийся тем, что:
указанный полиэтиленгликоль представляет собой полиэтиленгликоль, имеющий среднемассовую молекулярную массу (Mw) от 300 до 500.
5. Способ по п. 2, характеризующийся тем, что количество полиэтиленгликоля составляет от 90 до 100 мас. %.
6. Способ по п. 3, характеризующийся тем, что количество полиэтиленгликоля составляет от 90 до 100 мас. %.
7. Способ по п. 4, характеризующийся тем, что количество полиэтиленгликоля составляет от 90 до 100 мас. %.
8. Способ по п. 1, характеризующийся тем, что:
указанный полиэтиленгликоль представляет собой смесь двух полиэтиленгликолей:
(a) полиэтиленгликоля со среднемассовой молекулярной массой (Mw) от 200 до 800; и
(b) полиэтиленгликоля со среднемассовой молекулярной массой (Mw) от 1000 до 15000;
при этом массовое соотношение компонента (а) к компоненту (b) составляет от 3:1 до 20:1.
9. Способ по п. 1, характеризующийся тем, что:
указанный полиэтиленгликоль представляет собой смесь двух полиэтиленгликолей:
(a) полиэтиленгликоля со среднемассовой молекулярной массой (Mw) от 300 до 700; и
(b) полиэтиленгликоля со среднемассовой молекулярной массой (Mw) от 4000 до 15000;
при этом массовое соотношение компонента (а) к компоненту (b) составляет от 3:1 до 20:1.
10. Способ по п. 1, характеризующийся тем, что:
указанный полиэтиленгликоль представляет собой смесь двух полиэтиленгликолей:
(a) полиэтиленгликоля со среднемассовой молекулярной массой (Mw) от 300 до 500; и
(b) полиэтиленгликоля со среднемассовой молекулярной массой (Mw) от 4000 до 15000;
при этом массовое соотношение компонента (а) к компоненту (b) составляет от 3:1 до 20:1.
11. Способ по п. 8, характеризующийся тем, что количество полиэтиленгликоля составляет от 85 от 100 мас. %.
12. Способ по п. 9, характеризующийся тем, что количество полиэтиленгликоля составляет от 85 до 100 мас. %.
13. Способ по п. 10, характеризующийся тем, что количество полиэтиленгликоля составляет от 85 до 100 мас. %.
14. Способ по любому из пп. 1-13, характеризующийся тем, что указанный способ осуществляют на протяжении по меньшей мере 8 недель.
15. Способ по любому из пп. 1-13, характеризующийся тем, что указанный способ осуществляют на протяжении по меньшей мере 3 месяцев.
16. Способ по любому из пп. 1-13, характеризующийся тем, что указанный способ осуществляют на протяжении по меньшей мере 6 месяцев.
17. Способ по любому из пп. 1-13, характеризующийся тем, что указанный способ осуществляют на протяжении по меньшей мере 1 года.
18. Способ по любому из пп. 1-13, характеризующийся тем, что указанное местное введение проводят от одного до трех раз в день.
19. Способ по п. 14, характеризующийся тем, что указанное местное введение проводят от одного до трех раз в день.
20. Способ по п. 15, характеризующийся тем, что указанное местное введение проводят от одного до трех раз в день.
21. Способ по п. 16, характеризующийся тем, что указанное местное введение проводят от одного до трех раз в день.
22. Способ по п. 17, характеризующийся тем, что указанное местное введение проводят от одного до трех раз в день.
23. Способ по любому из пп. 1-13, характеризующийся тем, что указанное местное введение проводят по меньшей мере на части губ и коже лица в пределах <1 см от границы губ указанного пациента.
24. Способ по п. 14, характеризующийся тем, что указанное местное введение проводят по меньшей мере на части губ и коже лица в пределах <1 см от границы губ указанного пациента.
25. Способ по п. 15, характеризующийся тем, что указанное местное введение проводят по меньшей мере на части губ и коже лица в пределах <1 см от границы губ указанного пациента.
26. Способ по п. 16, характеризующийся тем, что указанное местное введение проводят по меньшей мере на части губ и коже лица в пределах <1 см от границы губ указанного пациента.
27. Способ по п. 17, характеризующийся тем, что указанное местное введение проводят по меньшей мере на части губ и коже лица в пределах <1 см от границы губ указанного пациента.
28. Способ по п. 18, характеризующийся тем, что указанное местное введение проводят по меньшей мере на части губ и коже лица в пределах <1 см от границы губ указанного пациента.
29. Способ по п. 19, характеризующийся тем, что указанное местное введение проводят по меньшей мере на части губ и коже лица в пределах <1 см от границы губ указанного пациента.
30. Способ по п. 20, характеризующийся тем, что указанное местное введение проводят по меньшей мере на части губ и коже лица в пределах <1 см от границы губ указанного пациента.
31. Способ по п. 21, характеризующийся тем, что указанное местное введение проводят по меньшей мере на части губ и коже лица в пределах <1 см от границы губ указанного пациента.
32. Способ по п. 22, характеризующийся тем, что указанное местное введение проводят по меньшей мере на части губ и коже лица в пределах <1 см от границы губ указанного пациента.
33. Способ по любому из пп. 1-13, характеризующийся тем, что терапевтически эффективное количество составляет от 0,02 до 2 г за одно введение.
34. Способ по п. 14, характеризующийся тем, что терапевтически эффективное количество составляет от 0,02 до 2 г за одно введение.
35. Способ по п. 15, характеризующийся тем, что терапевтически эффективное количество составляет от 0,02 до 2 г за одно введение.
36. Способ по п. 16, характеризующийся тем, что терапевтически эффективное количество составляет от 0,02 до 2 г за одно введение.
37. Способ по п. 17, характеризующийся тем, что терапевтически эффективное количество составляет от 0,02 до 2 г за одно введение.
38. Способ по п. 18, характеризующийся тем, что терапевтически эффективное количество составляет от 0,02 до 2 г за одно введение.
39. Способ по п. 19, характеризующийся тем, что терапевтически эффективное количество составляет от 0,02 до 2 г за одно введение.
40. Способ по п. 20, характеризующийся тем, что терапевтически эффективное количество составляет от 0,02 до 2 г за одно введение.
41. Способ по п. 21, характеризующийся тем, что терапевтически эффективное количество составляет от 0,02 до 2 г за одно введение.
42. Способ по п. 22, характеризующийся тем, что терапевтически эффективное количество составляет от 0,02 до 2 г за одно введение.
43. Способ по п. 23, характеризующийся тем, что терапевтически эффективное количество составляет от 0,02 до 2 г за одно введение.
44. Способ по п. 24, характеризующийся тем, что терапевтически эффективное количество составляет от 0,02 до 2 г за одно введение.
45. Способ по п. 25, характеризующийся тем, что терапевтически эффективное количество составляет от 0,02 до 2 г за одно введение.
46. Способ по п. 26, характеризующийся тем, что терапевтически эффективное количество составляет от 0,02 до 2 г за одно введение.
47. Способ по п. 27, характеризующийся тем, что терапевтически эффективное количество составляет от 0,02 до 2 г за одно введение.
48. Способ по п. 28, характеризующийся тем, что терапевтически эффективное количество составляет от 0,02 до 2 г за одно введение.
49. Способ по п. 29, характеризующийся тем, что терапевтически эффективное количество составляет от 0,02 до 2 г за одно введение.
50. Способ по п. 30, характеризующийся тем, что терапевтически эффективное количество составляет от 0,02 до 2 г за одно введение.
51. Способ по п. 31, характеризующийся тем, что терапевтически эффективное количество составляет от 0,02 до 2 г за одно введение.
52. Способ по п. 32, характеризующийся тем, что терапевтически эффективное количество составляет от 0,02 до 2 г за одно введение.
53. Способ по п. 33, характеризующийся тем, что терапевтически эффективное количество составляет от 0,02 до 2 г за одно введение.
| WO 1996024367 A1, 15.08.1996 | |||
| Lawrence Corey et al | |||
| Устройство для видения на расстоянии | 1915 |
|
SU1982A1 |
| US 4762715 A, 09.08.1988. | |||
Авторы
Даты
2018-02-05—Публикация
2011-07-08—Подача