1. ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Согласно 35 USC §119(e), в данной заявке заявлен приоритет предварительной заявки US 61/643764, поданной 7 мая 2012 года, содержание которой включено в данное описание изобретения посредством ссылки во всей ее полноте.
2. ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Были разработаны фармацевтические композиции, богатые омега-3 полиненасыщенными жирными кислотами (PUFA), для лечения ряда клинических показаний, включающих различные расстройства липидного спектра крови, включая гипертриглицеридемию и смешанные дислипидемии. Монотерапия статинами широко используется для лечения гиперхолистеринемии и других расстройств липидного спектра крови.
В многочисленных исследованиях сообщалось об увеличенных преимуществах комбинированного лечения статинами и омега-3 PUFA различных сердечнососудистых расстройств (см. Nakamura et al., 1999, Int. J. Clin. Lab Res. 29:22-25 и Davidson et al., 1997, Am J Cardiol 80: 797-798). Для повышения удобства пациента и соблюдения пациентом режима и схемы лечения были описаны двойные композиции, содержащие статины и омега-3 PUFA в этерифицированной форме, но известно, что некоторые статины плохо растворимы в таких композициях (смотри, например, US 7642287), и в продаже такая двойная композиция отсутствует.
Следовательно, в данной области техники существует потребность в композициях, объединяющих статины и омега-3 PUFA в одной пероральной стандартной лекарственной форме и обеспечивающих улучшенную растворимость и биодоступность. Такие фармацевтические композиции могли бы повысить удобство пациента и могли бы обеспечить лечение с улучшенной эффективностью, меньшим количеством эксципиентов и лучшим соблюдением пациентом режима и схемы лечения, чем обеспечивается при введении двух активных веществ в отдельных стандартных лекарственных формах.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Авторы изобретения обнаружили, что некоторые статины обладают неожиданно более высокой растворимостью в системе растворителей на основе свободных PUFA-кислот, композиции PUFA, в которой каждая разновидность PUFA присутствует по существу в форме свободной кислоты, по сравнению с их растворимостью в системе растворителей на основе этиловых эфиров PUFA, композиции PUFA, в которой каждая разновидность PUFA присутствует по существу в этерифицированной форме. Таким образом, в настоящем описании изобретения предлагаются фармацевтические композиции, пероральные стандартные лекарственные формы, дозированные наборы и способы лечения, включающие по меньшей мере один статин, растворенный в системе растворителей на основе свободных PUFA-кислот. В типичных воплощениях статин представляет собой розувастатин. В некоторых воплощениях статин представляет собой аторвастатин, правастатин, ловастатин, симвастатин, аторвастатин, флувастатин или питавастатин.
В первом аспекте предлагаются фармацевтические композиции, содержащие по меньшей мере один статин, растворенный в системе растворителей на основе свободных PUFA-кислот.
В различных воплощениях по меньшей мере 90% всех полиненасыщенных жирных кислот в системе растворителей на основе свободных PUFA-кислот присутствует в форме свободной кислоты. В некоторых воплощениях по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, даже по меньшей мере 99% всех полиненасыщенных жирных кислот в системе растворителей на основе свободных PUFA-кислот присутствует в форме свободной кислоты.
В типичных воплощениях система растворителей на основе свободных PUFA-кислот содержит по меньшей мере один, обычно несколько разновидностей омега-3 PUFA, где каждая из разновидностей омега-3 PUFA присутствует по существу в форме свободной кислоты. В различных воплощениях композиция содержит ЕРА (эйкозапентаеновую кислоту), DHA (докозагексаеновую кислоту) и DPA (n-3) (докозапентаеновую кислоту), каждую по существу в форме свободной кислоты.
В некоторых воплощениях по меньшей мере 80% масс. статина растворено в системе растворителей на основе свободных PUFA-кислот (менее 20% масс. статина не растворяется в этой системе растворителей), в то время как в конкретных воплощениях по меньшей мере 90% масс. статина растворено в системе растворителей на основе свободных PUFA-кислот (менее 10% масс. статина не растворяется в этой системе растворителей).
В различных воплощениях один или более статинов растворены в системе растворителей на основе свободных PUFA-кислот в количестве, которое обеспечивает введение терапевтического количества статина в удобном количестве пероральных стандартных доз, где количество пероральных стандартных доз также является достаточным для доставки терапевтической дозы омега-3 PUFA.
В некоторых воплощениях один или более статинов присутствуют в фармацевтической композиции в количестве по меньшей мере примерно 5 мг, по меньшей мере примерно 10 мг, по меньшей мере примерно 15 мг, по меньшей мере примерно 20 мг, по меньшей мере примерно 25 мг, по меньшей мере примерно 30 мг, по меньшей мере примерно 40 мг, по меньшей мере примерно 50 мг, по меньшей мере примерно 60 мг, по меньшей мере примерно 70 мг, по меньшей мере примерно 80 мг, по меньшей мере примерно 90 мг, по меньшей мере примерно даже 100 мг, по меньшей мере примерно 110 мг, и в конкретном воплощении по меньшей мере примерно 120 мг на миллилитр или на грамм системы растворителей на основе свободных PUFA-кислот.
В отдельных воплощениях один или более статинов присутствуют в фармацевтической композиции в количестве от примерно 2 мг до примерно 80 мг, от примерно 5 мг до примерно 60 мг, или от примерно 10 мг до примерно 40 мг, или от примерно 20 мг до примерно 30 мг на миллилитр или на грамм системы растворителей на основе свободных PUFA-кислот. В различных воплощениях по меньшей мере один статин выбран из группы, состоящей из розувастатина, правастатина, ловастатина, симвастатина, аторвастатина, флувастатина и питавастатина.
В другом аспекте предлагаются пероральные стандартные лекарственные формы, содержащие фармацевтические композиции по изобретению. В некоторых воплощениях фармацевтическая композиция инкапсулирована в мягкую желатиновую капсулу. В различных воплощениях пероральная стандартная лекарственная форма дополнительно содержит по меньшей мере одно покрытие на наружной стороне мягкой желатиновой капсулы. В некоторых воплощениях каждое из по меньшей мере одного покрытия выбрано из группы, состоящей из целлюлозы ацетата тримеллитата, целлюлозы ацетата фталата и поли(этилакрилат-метилакрилат)а.
В некоторых воплощениях в мягкой желатиновой капсуле инкапсулированы 1-100 мг статина, растворенного примерно в 250 мг, примерно 500 мг или примерно 1000 мг системы растворителей на основе свободных PUFA-кислот. В некоторых воплощениях в мягкой желатиновой капсуле инкапсулированы 2-40 мг статина, растворенного примерно в 250 мг, примерно 500 мг или примерно в 1000 мг системы растворителей на основе свободных PUFA-кислот.
В других аспектах описания изобретения предлагаются способы лечения расстройств липидного спектра крови, включающие введение эффективного количества фармацевтической композиции по изобретению. В некоторых воплощениях расстройства липидного спектра крови выбраны из группы, состоящей из гипертриглицеридемии, гиперхолистеринемии, ишемической болезни сердца (ИБС), гипертриглицеридемии, смешанных дислипидемий, сердечной недостаточности, инфаркта миокарда, сердечных аритмий, ишемической деменции, гипертензии, нефропатии, ретинопатии, сердечнососудистого заболевания и атеросклеротического заболевания.
4. КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На ФИГ. 1 представлены данные, показывающие растворимость аторвастатина кальция в буферах с различными pH; и
На ФИГ. 2 представлены данные, показывающие растворимость розувастатина кальция в буферах с различными pH.
5. ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
5.1. Обзор
Известно, что статины плохо растворимы в композициях омега-3 PUFA, в которых PUFA присутствуют по существу в этерифицированной форме ("системы растворителей на основе этиловых эфиров PUFA"). Смотри, например, US 7642287. Авторы настоящего изобретения обнаружили, что некоторые статины неожиданно обладают значительно более высокой растворимостью в композициях на основе PUFA, где каждая разновидность PUFA присутствует по существу в форме свободной кислоты ("система растворителей на основе свободных PUFA-кислот"), по сравнению с их растворимостью в системе растворителей на основе этиловых эфиров PUFA. Соответственно, в данном описании изобретения предлагаются фармацевтические композиции, пероральные стандартные лекарственные формы и дозированные наборы, содержащие по меньшей мере один статин, растворенный в системе растворителей на основе свободных PUFA-кислот, и способы применения этих композиций и стандартных пероральных лекарственных форм для лечения расстройств липидного спектра крови. В типичных воплощениях статин представляет собой розувастатин. В некоторых воплощениях статин представляет собой аторвастатин, правастатин, ловастатин, симвастатин, аторвастатин, флувастатин или питавастатин.
5.2. Фармацевтические композиции
В первом аспекте предлагаются фармацевтические композиции, содержащие по меньшей мере один статин, растворенный в системе растворителей на основе свободных PUFA-кислот. В типичных воплощениях система растворителей на основе свободных PUFA-кислот содержит по меньшей мере один, обычно несколько разновидностей омега-3 PUFA, где каждая разновидность омега-3 PUFA присутствует по существу в форме свободной кислоты. В некоторых воплощениях статин представляет собой розувастатин. В различных воплощениях статин представляет собой аторвастатин, правастатин, ловастатин, симвастатин, аторвастатин, флувастатин или питавастатин.
В некоторых воплощениях фармацевтической композиции статин растворен в системе растворителей на основе свободных PUFA-кислот с получением по существу однородной композиции.
В некоторых воплощениях статин полностью растворен в системе растворителей на основе свободных PUFA-кислот. В различных воплощениях статин по существу растворен (то есть по меньшей мере примерно 90% статина растворено в системе растворителей на основе свободных PUFA-кислот и примерно 10% статина или менее не растворено в системе растворителей на основе свободных PUFA-кислот). В некоторых воплощениях по меньшей мере примерно 70% статина растворено в системе растворителей на основе свободных PUFA-кислот. В некоторых воплощениях по меньшей мере примерно 80%, 85%, 90%, 95%, даже по меньшей мере примерно 96%, 97%, 98%, 99%, даже по меньшей мере примерно 99,5% статина растворено в системе растворителей на основе свободных PUFA-кислот. В некоторых воплощениях статин менее чем нам 30%, менее чем на 20%, менее чем на 15%, менее чем на 10% или менее чем на 5% не растворен в системе растворителей на основе свободных PUFA-кислот.
В некоторых воплощениях в фармацевтической композиции не требуются значительные количества других соединений кроме полиненасыщенных жирных кислот - таких как поверхностно-активные соединения, гидрофильные или гидрофобные растворители, масла или их комбинации (отдельно и вместе, "не-PUFA солюбилизаторы") - для растворения статина в системе растворителей на основе свободных PUFA-кислот.
Предпочтительно, статин растворен в фармацевтической композиции без использования каких-либо не-PUFA солюбилизаторов.
Если они имеются, не-PUFA солюбилизаторы присутствуют в количествах 50% или менее (масс./масс.) в расчете на общую массу системы растворителей на основе свободных PUFA-кислот, 40% или менее, 30% или менее, 20% или менее, 10% или менее, или 5% или менее. В различных воплощениях массовое соотношение полиненасыщенных жирных кислот к не-PUFA солюбилизаторам составляет по меньшей мере примерно 1:1, по меньшей мере 5:1 или по меньшей мере 10:1. В некоторых воплощениях система растворителей на основе свободных PUFA-кислот не содержит не-PUFA солюбилизаторы.
В различных воплощениях фармацевтическая композиция содержит статин, растворенный в системе растворителей на основе свободных PUFA-кислот, где статин присутствует в системе растворителей на основе свободных PUFA-кислот в соотношении массы-к-объему (масс./об.) примерно 1:5000; примерно 1:4500; примерно 1:4000; примерно 1:3500; примерно 1:3000; примерно 1:2500; примерно 1:2000; примерно 1:1500; примерно 1:1000; примерно 1:800; примерно 1:700; примерно 1:500; примерно 1:400: примерно 1:300; примерно 1:250, примерно 1:125, примерно 1:100; примерно 1:80; примерно 1:50; или в соотношениях, промежуточных между вышеперечисленными значениями.
В ряде воплощений по меньшей мере один статин растворен в системе растворителей на основе свободных PUFA-кислот, где статин присутствует в соотношении массы-к-массе (масс./масс.) относительно системы растворителей на основе свободных PUFA-кислот примерно 1:5000; примерно 1:4500; примерно 1:4000; примерно 1:3500; примерно 1:3000; примерно 1:2500; примерно 1:2000; примерно 1:1500; примерно 1:1000; примерно 1:800; примерно 1:700; примерно 1:500; примерно 1:400: примерно 1:300; примерно 1:250, примерно 1:125, примерно 1:100; примерно 1:80; примерно 1:50, или в соотношениях, промежуточных между этими значениями.
В некоторых воплощениях фармацевтическая композиция содержит статин, растворенный в системе растворителей на основе свободных PUFA-кислот, где статин растворен в системе растворителей на основе свободных PUFA-кислот в концентрации по меньшей мере примерно 0,1 мг/мл системы растворителей, 0,2 мг/мл, 0,5 мг/мл, 1 мг/мл, 2 мг/мл, 5 мг/мл, 7,5 мг/мл, 10 мг/мл, 15 мг/мл, 20 мг/мл, 30 мг/мл, 40 мг/мл, 50 мг/мл, 75 мг/мл, 100 мг/мл, 120 мг/мл, 150 мг/мл или 200 мг/мл, или в концентрациях, промежуточных между этих значений. В различных воплощениях фармацевтическая композиция содержит статин, растворенный в системе растворителей на основе свободных PUFA-кислот, где статин растворен в системе растворителей на основе свободных PUFA-кислот в концентрации по меньшей мере примерно 0,1 мг/г системы растворителей, 0,2 мг/г системы растворителей, 0,5 мг/г системы растворителей, 1 мг/г системы растворителей, 2 мг/г системы растворителей, 5 мг/г системы растворителей, 7,5 мг/г системы растворителей, 10 мг/г системы растворителей, 15 мг/г системы растворителей, 20 мг/г системы растворителей, 30 мг/г системы растворителей, 40 мг/г системы растворителей, 50 мг/г системы растворителей, 75 мг/г системы растворителей, 100 мг/г системы растворителей, 120 мг/г системы растворителей, 150 мг/г системы растворителей или 200 мг/г системы растворителей, или в концентрациях, промежуточных между этих значений.
5.2.1. Система растворителей на основе свободных PUFA-кислот
Система растворителей на основе свободных PUFA-кислот содержит по меньшей мере один, обычно несколько разновидностей омега-3 PUFA, каждый из которых присутствует по существу в форме свободной кислоты.
В типичных воплощениях система растворителей на основе свободных PUFA-кислот содержит эйкозапентаеновую кислоту (С20:5 n-3) ("ЕРА", известную также как тимнодоновая кислота) по существу в форме свободной кислоты. В различных воплощениях система растворителей на основе свободных PUFA-кислот содержит докозагексаеновую кислоту (С22:6 n-3) ("DHA", известную также как цервоновая кислота) по существу в форме свободной кислоты. В отдельных воплощениях система растворителей на основе свободных PUFA-кислот содержит докозапентаеновую кислоту (С22:5 n-3) ("DPA," известную также как клупанодовая кислота по существу в форме свободной кислоты.
В типичных воплощениях система растворителей на основе свободных PUFA-кислот содержит ЕРА по существу в форме свободной кислоты в количестве по меньшей мере примерно 40% ("40% (площадь/площадь)"), рассчитанном как процент от площади на ГХ (газовая хроматография) - хроматограмме всех жирных кислот в системе растворителей на основе свободных PUFA-кислот. В различных воплощениях система растворителей на основе свободных PUFA-кислот содержит ЕРА в количестве по меньшей мере примерно 41% (площадь/площадь), 42% (площадь/площадь), 43% (площадь/площадь), 44% (площадь/площадь), 45% (площадь/площадь), 46% (площадь/площадь), 47% (площадь/площадь), 48% (площадь/площадь), 49% (площадь/площадь) или по меньшей мере примерно 50% (площадь/площадь). В некоторых воплощениях система растворителей на основе свободных PUFA-кислот содержит ЕРА по существу в форме свободной кислоты в количестве по меньшей мере примерно 51% (площадь/площадь), по меньшей мере примерно 52% (площадь/площадь), по меньшей мере примерно 53% (площадь/площадь), по меньшей мере примерно 54% (площадь/площадь), по меньшей мере примерно 55% (площадь/площадь), по меньшей мере примерно 56% (площадь/площадь), по меньшей мере примерно 57% (площадь/площадь), по меньшей мере примерно 58% (площадь/площадь), даже по меньшей мере примерно 59% (площадь/площадь), по меньшей мере примерно 60% (площадь/площадь), по меньшей мере примерно 61% (площадь/площадь), 62% (площадь/площадь), 63% (площадь/площадь), 64% (площадь/площадь), или 65% (площадь/площадь).
В ряде воплощений система растворителей на основе свободных PUFA-кислот содержит ЕРА по существу в форме свободной кислоты в количестве по меньшей мере примерно 70% (площадь/площадь), по меньшей мере примерно 75% (площадь/площадь), по меньшей мере примерно 80% (площадь/площадь), по меньшей мере примерно 85% (площадь/площадь), 90% (площадь/площадь), 91% (площадь/площадь), 92% (площадь/площадь), 93% (площадь/площадь), 94% (площадь/площадь), даже по меньшей мере примерно 95% (площадь/площадь), 96% (площадь/площадь), 97% (площадь/площадь), 98% (площадь/площадь) или 99% (площадь/площадь).
В некоторых воплощениях система растворителей на основе свободных PUFA-кислот содержит ЕРА по существу в форме свободной кислоты в количестве от примерно 45 до примерно 65% (площадь/площадь). В конкретных воплощениях ЕРА присутствует, по существу в форме свободной кислоты, в количестве от примерно 50 до примерно 60% (площадь/площадь). В различных воплощениях ЕРА присутствует, по существу в форме свободной кислоты, в количестве от примерно 52 до примерно 58,0% (площадь/площадь). В некоторых воплощениях ЕРА присутствует, по существу в форме свободной кислоты, в количестве от примерно 55% (площадь/площадь) до примерно 56% (площадь/площадь). В некоторых воплощениях ЕРА присутствует в количестве примерно 55% (площадь/площадь).
В различных воплощениях система растворителей на основе свободных PUFA-кислот содержит ЕРА, по существу в форме свободной кислоты, в количестве от примерно 50% (масс./масс.) до примерно 60% (масс./масс.), рассчитанном как процент от массы всех жирных кислот в системе растворителей на основе свободных PUFA-кислот ("% (масс./масс.)"). В некоторых воплощениях ЕРА присутствует по существу в форме свободной кислоты в количестве примерно 55% (масс./масс.).
В некоторых воплощениях система растворителей на основе свободных PUFA-кислот содержит DHA, по существу в форме свободной кислоты, в количестве по меньшей мере примерно 13% (площадь/площадь). В различных воплощениях система растворителей на основе свободных PUFA-кислот содержит DHA, по существу в форме свободной кислоты, в количестве по меньшей мере примерно 14% (площадь/площадь), по меньшей мере примерно 15% (площадь/площадь), по меньшей мере примерно 16% (площадь/площадь), по меньшей мере примерно 17% (площадь/площадь), по меньшей мере примерно 18% (площадь/площадь), по меньшей мере примерно 19% (площадь/площадь) или по меньшей мере примерно 20% (площадь/площадь). В отдельных воплощениях система растворителей на основе свободных PUFA-кислот содержит DHA, по существу в форме свободной кислоты, в количестве по меньшей мере примерно 21% (площадь/площадь), по меньшей мере примерно 22% (площадь/площадь), по меньшей мере примерно 23% (площадь/площадь), по меньшей мере примерно 24% (площадь/площадь), даже по меньшей мере примерно 25% (площадь/площадь).
В ряде воплощений система растворителей на основе свободных PUFA-кислот содержит DHA, по существу в форме свободной кислоты, в количестве по меньшей мере примерно 30% (площадь/площадь), 35% (площадь/площадь), даже по меньшей мере примерно 40% (площадь/площадь).
В различных воплощениях система растворителей на основе свободных PUFA-кислот содержит DHA, по существу в форме свободной кислоты, в количестве от примерно 13% (площадь/площадь) до примерно 25% (площадь/площадь). В некоторых воплощениях DHA присутствует, по существу в форме свободной кислоты, в количестве от примерно 15% (площадь/площадь) до примерно 25% (площадь/площадь). В некоторых воплощениях DHA присутствует, по существу в форме свободной кислоты, в количестве от примерно 17% (площадь/площадь) до примерно 23% (площадь/площадь). В некоторых воплощениях DHA присутствует, по существу в форме свободной кислоты, в количестве от примерно 19% (площадь/площадь) до примерно 20% (площадь/площадь).
В различных воплощениях системы растворителей на основе свободных PUFA-кислот содержат DHA, по существу в форме свободной кислоты, в количестве от примерно 15% (масс./масс.) до примерно 25% (масс./масс.). В некоторых воплощениях DHA присутствует, по существу в форме свободной кислоты, в количестве от примерно 17% (масс./масс.) до примерно 23% (масс./масс.). В некоторых воплощениях DHA присутствует, по существу в форме свободной кислоты, в количестве примерно 20% (масс./масс.).
В некоторых воплощениях система растворителей на основе свободных PUFA-кислот содержит DPA, по существу в форме свободной кислоты, в количестве по меньшей мере примерно 1% (площадь/площадь). В различных воплощениях система растворителей на основе свободных PUFA-кислот содержит DPA, по существу в форме свободной кислоты, в количестве по меньшей мере примерно 1,5% (площадь/площадь), 2% (площадь/площадь), 2,5% (площадь/площадь), 3% (площадь/площадь), 3,5% (площадь/площадь), 4% (площадь/площадь), 4,5% (площадь/площадь), даже по меньшей мере примерно 5% (площадь/площадь). В отдельных воплощениях система растворителей на основе свободных PUFA-кислот содержит DPA, по существу в форме свободной кислоты, в количестве по меньшей мере примерно 6% (площадь/площадь), по меньшей мере примерно 7% (площадь/площадь), по меньшей мере примерно 8% (площадь/площадь), или по меньшей мере примерно 9% (площадь/площадь).
В ряде воплощений система растворителей на основе свободных PUFA-кислот содержит DPA, по существу в форме свободной кислоты, в количестве от примерно 1% (площадь/площадь) до примерно 8% (площадь/площадь). В некоторых воплощениях система растворителей на основе свободных PUFA-кислот содержит DPA, по существу в форме свободной кислоты, в количестве от примерно 2% (площадь/площадь) до примерно 7% (площадь/площадь). В отдельных воплощениях система растворителей на основе свободных PUFA-кислот содержит DPA, по существу в форме свободной кислоты, в количестве от примерно 3% (площадь/площадь) до примерно 6% (площадь/площадь). В конкретных воплощениях система растворителей на основе свободных PUFA-кислот содержит DPA, по существу в форме свободной кислоты, в количестве от примерно 4% (площадь/площадь) до примерно 5% (площадь/площадь).
В различных воплощениях система растворителей на основе свободных PUFA-кислот содержит DPA, по существу в форме свободной кислоты, в количестве не менее чем примерно 1% (масс./масс.). В различных воплощениях система растворителей на основе свободных PUFA-кислот содержит DPA, по существу в форме свободной кислоты, в количестве от примерно 1% (масс./масс.) до примерно 8% (масс./масс.). В конкретных воплощениях система растворителей на основе свободных PUFA-кислот содержит DPA, по существу в форме свободной кислоты, в количестве не более чем примерно 10% (масс./масс.).
В ряде воплощений система растворителей на основе свободных PUFA-кислот содержит ЕРА и DHA, каждая из которых находится по существу в форме свободной кислоты.
В различных воплощениях система растворителей на основе свободных PUFA-кислот содержит ЕРА и DHA, каждая из которых находится по существу в форме свободной кислоты, в общем количестве по меньшей мере примерно 60% (площадь/площадь). В различных воплощениях система растворителей на основе свободных PUFA-кислот содержит ЕРА и DHA, каждая из которых находится по существу в форме свободной кислоты, в суммарном количестве по меньшей мере примерно 61% (площадь/площадь), 62% (площадь/площадь), 63% (площадь/площадь), 64% (площадь/площадь), 65% (площадь/площадь), 66% (площадь/площадь), 67% (площадь/площадь), 68% (площадь/площадь), 69% (площадь/площадь) или по меньшей мере примерно 70% (площадь/площадь). В конкретных воплощениях система растворителей на основе свободных PUFA-кислот содержит ЕРА и DHA, каждая из которых находится по существу в форме свободной кислоты, в суммарном количестве по меньшей мере примерно 71% (площадь/площадь), 72% (площадь/площадь), 73% (площадь/площадь), 74% (площадь/площадь), 75% (площадь/площадь), 76% (площадь/площадь), 77% (площадь/площадь), 78% (площадь/площадь), 79% (площадь/площадь), даже по меньшей мере примерно 80% (площадь/площадь). В некоторых воплощениях система растворителей на основе свободных PUFA-кислот содержит ЕРА и DHA, каждая из которых находится по существу в форме свободной кислоты, в суммарном количестве по меньшей мере примерно 81% (площадь/площадь), 82% (площадь/площадь), по меньшей мере примерно 83% (площадь/площадь), 84% (площадь/площадь), даже по меньшей мере примерно 85% (площадь/площадь).
В различных воплощениях система растворителей на основе свободных PUFA-кислот содержит ЕРА и DHA, каждая из которых находится по существу в форме свободной кислоты, в суммарном количестве от примерно 70% (масс./масс.) до примерно 80% (масс./масс.). В некоторых воплощениях система растворителей на основе свободных PUFA-кислот содержит примерно 75% (масс./масс.) ЕРА плюс DHA, каждая из которых находится по существу в форме свободной кислоты.
В некоторых воплощениях система растворителей на основе свободных PUFA-кислот содержит ЕРА и DHA, каждая из которых находится по существу в форме свободной кислоты, в массовых соотношениях по меньшей мере примерно 2:1, 2,1:1, 2,2:1, 2,3:1, 2,4:1, 2,5:1, 2,6:1, 2,7:1, 2,8:1, 2,9:1, даже по меньшей мере примерно 3:1. В некоторых воплощениях система растворителей на основе свободных PUFA-кислот содержит ЕРА и DHA, каждая из которых находится по существу в форме свободной кислоты, в массовом соотношении примерно 2,75:1.
В различных воплощениях система растворителей на основе свободных PUFA-кислот содержит ЕРА, DHA и DPA, каждая из которых находится по существу в форме свободной кислоты, в суммарном количестве по меньшей мере примерно 61% (площадь/площадь). В типичных воплощениях система растворителей на основе свободных PUFA-кислот содержит ЕРА, DHA и DPA, каждая из которых находится по существу в форме свободной кислоты, в суммарном количестве по меньшей мере примерно 62% (площадь/площадь), 63% (площадь/площадь), 64% (площадь/площадь), 65% (площадь/площадь), 66% (площадь/площадь), по меньшей мере примерно 67% (площадь/площадь), по меньшей мере примерно 68% (площадь/площадь), по меньшей мере примерно 69% (площадь/площадь) или по меньшей мере примерно 70% (площадь/площадь). В некоторых воплощениях система растворителей на основе свободных PUFA-кислот содержит ЕРА, DHA и DPA, каждая из которых находится по существу в свободной форме кислоты, в суммарном количестве по меньшей мере примерно 71% (площадь/площадь), 72% (площадь/площадь), 73% (площадь/площадь), 74% (площадь/площадь), 75% (площадь/площадь), 76% (площадь/площадь), 77% (площадь/площадь), 78% (площадь/площадь), 79% (площадь/площадь), 80% (площадь/площадь), даже по меньшей мере примерно 81% (площадь/площадь), 82% (площадь/площадь), 83% (площадь/площадь), 84% (площадь/площадь), 85% (площадь/площадь), 86% (площадь/площадь), 87% (площадь/площадь), даже по меньшей мере примерно 88% (площадь/площадь).
В различных воплощениях система растворителей на основе свободных PUFA-кислот содержит ЕРА, DHA и DPA, каждая из которых находится по существу в форме свободной кислоты, в суммарном количестве от примерно 70% (площадь/площадь) до примерно 90% (площадь/площадь).
В конкретном ряде воплощений, ЕРА, по существу в форме свободной кислоты, присутствует в количестве от примерно 55% (площадь/площадь) до примерно 56%) (площадь/площадь); DHA, по существу в форме свободной кислоты, присутствует в количестве от примерно 19% (площадь/площадь) до примерно 20% (площадь/площадь); и DPA, по существу в форме свободной кислоты, присутствует в количестве от примерно 4% (площадь/площадь) до примерно 5% (площадь/площадь). В некоторых воплощениях ЕРА, по существу в форме свободной кислоты, присутствует в количестве от примерно 55% (масс./масс.) до примерно 56% (масс./масс.); DHA, по существу в форме свободной кислоты, присутствует в количестве от примерно 19% (масс./масс.) до примерно 20% (масс./масс.); и DPA, по существу в форме свободной кислоты, присутствует в количестве от примерно 4% (масс./масс.) до примерно 5% (масс./масс.).
В некоторых воплощениях система растворителей на основе свободных PUFA-кислот представляет собой сложную смесь, содержащую несколько разновидностей омега-3 PUFA и несколько разновидностей омега-6 PUFA, каждая из которых присутствует по существу в форме свободной кислоты.
В некоторых воплощениях система растворителей на основе свободных PUFA-кислот содержит ЕРА, DHA, DPA и дополнительно содержит одну или более разновидностей омега-3 полиненасыщенных жирных кислот, выбранных из группы, состоящей из а-линоленовой кислоты (С18:3 n-3), мороктиновой кислоты (С18:4 n-3, также известной как стеаридоновая кислота), эйкозатриеновой кислоты (С20:3 n-3), эйкозатетраеновой кислоты (С20:4 n-3) и генэйкозапентаеновой кислоты (С21:5 n-3), каждая из которых находится по существу в форме свободной кислоты.
В конкретных воплощениях система растворителей на основе свободных PUFA-кислот содержит ЕРА, DHA, DPA и мороктиновую кислоту, каждая из которых находится по существу в форме свободной кислоты. В ряде воплощений система растворителей на основе свободных PUFA-кислот содержит ЕРА, DHA, DPA, мороктиновую кислоту и генэйкозапентаеновую кислоту, каждая из которых находится по существу в форме свободной кислоты. В конкретных воплощениях система растворителей на основе свободных PUFA-кислот содержит ЕРА, DHA, DPA, мороктиновую кислоту, генэйкозапентаеновую кислоту и эйкозатетраеновую кислоту, каждая из которых находится по существу в форме свободной кислоты. В отдельных воплощениях система растворителей на основе свободных PUFA-кислот содержит ЕРА, DHA, DPA, α-линоленовую кислоту (С18:3 n-3), мороктиновую кислоту (С18:4 n-3), эйкозатриеновую кислоту (С20:3 n-3), эйкозатетраеновую кислоту (С20:4 n-3) и генэйкозапентаеновую кислоту (С21:5 n-3), каждая из которых находится по существу в форме свободной кислоты.
В различных воплощениях сумма омега-3 жирных кислот - определенная как сумма альфа-линоленовой кислоты (С18:3 n-3), мороктиновой кислоты (С18:4 n-3), эйкозатриеновой кислоты (С20:3 n-3), эйкозатетраеновой кислоты (С20:4 n-3), эйкозапентаеновой кислоты (ЕРА) (С20:5 n-3), генэйкозапентаеновой кислоты (С21:5 n-3), докозапентаеновой кислоты (С22:5 n-3) и докозагексаеновой кислоты (DHA) (С22:6 n-3), каждая из которых присутствует по существу в форме свободной кислоты - составляет от примерно 80% (площадь/площадь) до примерно 95% (площадь/площадь) всех жирных кислот в системе растворителей на основе свободных PUFA-кислот. В ряде воплощений сумма омега-3 жирных кислот составляет от примерно 80 до примерно 95% (масс./масс.) всех жирных кислот в системе растворителей на основе свободных PUFA-кислот.
В различных воплощениях система растворителей на основе свободных PUFA-кислот дополнительно содержит одну или более разновидностей омега-6 PUFA, каждая из которых присутствует по существу в форме свободной кислоты.
В некоторых воплощениях система растворителей на основе свободных PUFA-кислот содержит одну или более разновидностей омега-6 PUFA, выбранных из группы, состоящей из линолевой кислоты (С18:2 n-6), гамма-линоленовой кислоты (С18:3 n-6), эйкозадиеновой кислоты (С20:2 n-6), дигомо-гамма-линоленовой кислоты (С20:3 n-6) ("ДГЛК"), арахидоновой кислоты (С20:4 n-6) ("АА") и докозапентаеновой кислоты (С22:5 n-6, также известной как кислота Осбонда).
В конкретных воплощениях система растворителей на основе свободных PUFA-кислот содержит линолевую кислоту (С18:2 n-6), гамма-линоленовую кислоту (С18:3 n-6), эйкозадиеновую кислоту (С20:2 n-6), дигомо-гамма-линоленовую кислоту (С20:3 n-6) ("ДГЛК"), арахидоновую кислоту (С20:4 n-6) ("АА") и докозапентаеновую кислоту (С22:5 n-6), каждая из которых присутствует по существу в форме свободной кислоты.
В различных воплощениях АА, по существу в форме свободной кислоты, присутствует в количестве не более чем примерно 5% (площадь/площадь) от жирных кислот в системе растворителей на основе свободных PUFA-кислот. В некоторых воплощениях АА, по существу в форме свободной кислоты, составляет не более чем примерно 4,5% (площадь/площадь) жирных кислот в системе растворителей на основе свободных PUFA-кислот. В конкретных воплощениях АА, по существу в форме свободной кислоты, присутствует в количестве не более чем примерно 4% (площадь/площадь) от жирных кислот в системе растворителей на основе свободных PUFA-кислот.
В некоторых воплощениях АА, по существу в форме свободной кислоты, присутствует в количестве не более чем примерно 5% (масс./масс.) жирных кислот в системе растворителей на основе свободных PUFA-кислот. В некоторых воплощениях АА, по существу в форме свободной кислоты, составляет не более примерно 4,5% (масс./масс.) жирных кислот в системе растворителей на основе свободных PUFA-кислот. В конкретных воплощениях АА присутствует, по существу в форме свободной кислоты, в количестве не более чем примерно 4% (масс./масс.) жирных кислот в системе растворителей на основе свободных PUFA-кислот.
В некоторых воплощениях сумма омега-6 полиненасыщенных жирных кислот - определенная как сумма линолевой кислоты (С18:2 n-6), гамма-линоленовой кислоты (С18:3 n-6), эйкозадиеновой кислоты (С20:2 n-6), дигомо-гамма-линоленовой кислоты (С20:3 n-6), арахидоновой кислоты (С20:4 n-6) и докозапентаеновой кислоты (С22:5 n-6), каждая из которых присутствует по существу в форме свободной кислоты - составляет не более чем примерно 10% (площадь/площадь) жирных кислот в системе растворителей на основе свободных PUFA-кислот. В некоторых воплощениях сумма омега-6 полиненасыщенных жирных кислот составляет не более чем примерно 10% (масс./масс.) от жирных кислот в системе растворителей на основе свободных PUFA-кислот.
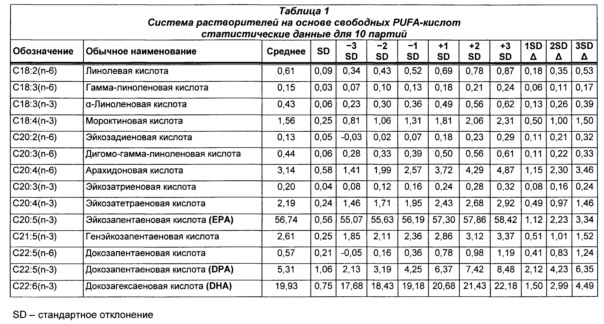
В конкретных воплощениях система растворителей на основе свободных PUFA-кислот приведена в Таблице 1, где каждая разновидность PUFA, указанный в ней, присутствует по существу в форме свободной кислоты и в диапазоне от примерно -3SD (стандартное отклонение) до примерно +3SD от соответствующего указанного среднего значения. В некоторых воплощениях каждая из разновидностей PUFA, указанных в ней, присутствует по существу в форме свободной кислоты и в диапазоне от примерно -2SD до примерно +2SD от соответствующего указанного среднего значения. В некоторых воплощениях каждая из разновидностей PUFA, указанных в ней, присутствует по существу в форме свободной кислоты и в диапазоне от примерно -1SD до примерно +1SD от соответствующего указанного среднего значения. В отдельных воплощениях каждая из разновидностей PUFA, указанных в ней, присутствует по существу в форме свободной кислоты и в количестве, приближенном к среднему количеству, соответственно указанному в Таблице 1.
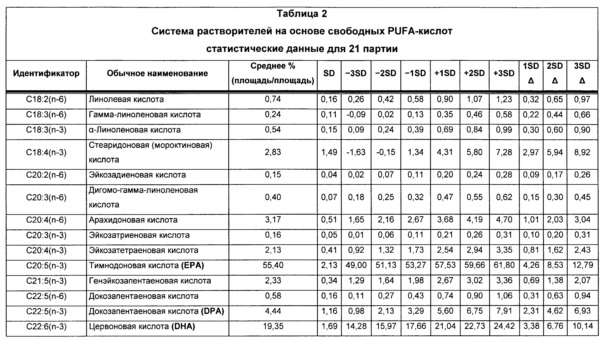
В некоторых воплощениях система растворителей на основе свободных PUFA-кислот приведена в Таблице 2, где каждая разновидность PUFA, указанный в ней, присутствует по существу в форме свободной кислоты и в диапазоне от примерно -3SD до примерно +3SD от соответствующего указанного среднего значения. В некоторых воплощениях каждая из разновидностей присутствует по существу в форме свободной кислоты и в диапазоне от примерно -2SD до примерно +2SD от соответствующего среднего значения, указанного в Таблице 2. В некоторых воплощениях каждая из разновидностей PUFA присутствует по существу в форме свободной кислоты и в диапазоне от примерно -1SD до примерно +1SD от соответствующего указанного среднего значения. В отдельных воплощениях каждая разновидность PUFA, указанный в ней, присутствует по существу в форме свободной кислоты и в количестве, приблизительно равном среднему количеству, соответственно указанному в Таблице 2.
В некоторых воплощениях полиненасыщенные жирные кислоты, не являющиеся омега-3 и омега-6 полиненасыщенными жирными кислотами, присутствуют в количестве не более чем примерно 5% (площадь/площадь). В различных воплощениях полиненасыщенные жирные кислоты, не являющиеся омега-3 и омега-6 полиненасыщенными жирными кислотами, присутствуют в количестве не более чем примерно 5% (масс/масс).
В ряде воплощений по меньшей мере примерно 90% каждой разновидности омега-3 PUFA, присутствующих в системе растворителей на основе свободных PUFA-кислот, присутствует в форме свободной кислоты. В некоторых воплощениях по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере даже 99% каждой разновидности омега-3 PUFA, присутствующих в системе растворителей на основе свободных PUFA-кислот, присутствует в форме свободной кислоты. В типичных воплощениях по меньшей мере 90% суммарного содержания омега-3 полиненасыщенных жирных кислот в системе растворителей на основе свободных PUFA-кислот присутствует в форме свободной кислоты. В некоторых воплощениях по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, даже по меньшей мере 99% от суммарного содержания омега-3 полиненасыщенных жирных кислот в системе растворителей на основе свободных PUFA-кислот присутствует в форме свободной кислоты.
В различных воплощениях по меньшей мере 90% каждой разновидности омега-6 PUFA, присутствующих в системе растворителей на основе свободных PUFA-кислот, присутствует в форме свободной кислоты. В некоторых воплощениях по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, даже по меньшей мере 99% каждой разновидности омега-6 PUFA в системе растворителей на основе свободных PUFA-кислот присутствует в форме свободной кислоты. В типичных воплощениях по меньшей мере 90% от суммарного содержания омега-6 полиненасыщенных жирных кислот в системе растворителей на основе свободных PUFA-кислот присутствует в форме свободной кислоты.
В различных воплощениях по меньшей мере 90% от суммарного содержания полиненасыщенных жирных кислот в системе растворителей на основе свободных PUFA-кислот присутствует в форме свободной кислоты. В некоторых воплощениях по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, даже по меньшей мере 99% от суммы полиненасыщенных жирных кислот в системе растворителей на основе свободных PUFA-кислот присутствует в форме свободной кислоты.
Система растворителей на основе свободных PUFA-кислот содержит, в типичных воплощениях, не более чем примерно 3% (площадь/площадь) насыщенных жирных кислот и не более чем примерно 5% (площадь/площадь) мононенасыщенных жирных кислот. В различных воплощениях система растворителей на основе свободных PUFA-кислот содержит не более чем примерно 3% (масс./масс.) насыщенных жирных кислот и не более чем примерно 5% (масс./масс.) мононенасыщенных жирных кислот.
В типичных воплощениях система растворителей на основе свободных PUFA-кислот успешно дополнительно содержит антиоксидант. В некоторых воплощениях антиоксидант представляет собой бутилированный гидроксианизол (БГА). В некоторых воплощениях антиоксидант представляет собой альфа-токоферол. В некоторых воплощениях альфа-токоферол присутствует в количестве от примерно 0,20 до примерно 0,40% (масс./масс.). В различных воплощениях альфа-токоферол присутствует в количестве от примерно 0,25 до примерно 0,35% (масс./масс.). В конкретных воплощениях альфа-токоферол присутствует в количестве от примерно 0,27 до примерно 0,33% (масс./масс.). В типичных воплощениях система растворителей на основе свободных PUFA-кислот содержит не более чем примерно 0,1 млн-1 этилкарбамата. В некоторых воплощениях система растворителей на основе свободных PUFA-кислот содержит не более чем 0,1 млн-1 этилкарбамата. В различных воплощениях система растворителей на основе свободных PUFA-кислот содержит менее 0,1 млн-1 этилкарбамата.
5.2.2. Статины
В различных воплощениях по меньшей мере один статин присутствует в фармацевтической композиции в количестве по меньшей мере примерно 2 мг, по меньшей мере примерно 2,5 мг, по меньшей мере примерно 5 мг, по меньшей мере примерно 10 мг, по меньшей мере примерно 15 мг, по меньшей мере примерно 20 мг, по меньшей мере примерно 25 мг, по меньшей мере примерно 30 мг, по меньшей мере примерно 40 мг, по меньшей мере примерно 50 мг, по меньшей мере примерно 60 мг, по меньшей мере примерно 70 мг, по меньшей мере примерно 80 мг, по меньшей мере примерно 90 мг, даже по меньшей мере примерно 100 мг, по меньшей мере примерно 110 мг и в конкретном воплощении по меньшей мере примерно 120 мг на миллилитр или на грамм системы растворителей на основе свободных PUFA-кислот.
В отдельных воплощениях по меньшей мере один статин присутствует в фармацевтической композиции в количестве от примерно 2 мг до примерно 80 мг, от примерно 5 мг до примерно 60 мг, или от примерно 10 мг до примерно 40 мг, или от примерно 20 мг до примерно 30 мг на миллилитр или на грамм системы растворителей на основе свободных PUFA-кислот.
В различных воплощениях по меньшей мере один статин выбирают из группы, состоящей из розувастатина, правастатина, ловастатина, симвастатина, аторвастатина, флувастатина и питавастатина.
В типичных воплощениях по меньшей мере один статин растворен в системе растворителей на основе свободных PUFA-кислот в количестве, которое обеспечивает введение терапевтического количества статина в удобном количестве пероральных стандартных доз, и это количество пероральных стандартных доз также является достаточным для доставки терапевтической дозы омега-3 PUFA.
Розувастатин реализуется под названием Crestor® фирмой Astra Zeneca, Wilmington, Del. В типичных воплощениях розувастатин растворяют в системе растворителей на основе свободных PUFA-кислот в количестве, которое обеспечивает ежесуточное введение, в удобном количестве пероральных доз, 5 мг, 10 мг, 20 мг, 30 мг, 40 мг, 50 мг, 60 мг, 70 мг, 80 мг, даже 90 мг или 100 мг. В конкретных воплощениях розувастатин растворяют в системе растворителей на основе свободных PUFA-кислот в количестве 2,5 мг, 5 мг, 10 мг, 15 мг, 20 мг, 25 мг, 30 мг, 35 мг, 40 мг, даже 45 мг или 50 мг на миллилитр или на грамм системы растворителей на основе PUFA. В некоторых воплощениях розувастатин растворяют в системе растворителей на основе свободных PUFA-кислот в количестве 1,25 мг, 2,5 мг, 5 мг, 7,5 мг, 10 мг, 12,5 мг, 15 мг, 17,5 мг, 20 мг, 22,5 мг, даже 25 мг на миллилитр или на грамм системы растворителей на основе PUFA.
Аторвастатин, который реализуется под названием Lipitor® фирмой Pfizer, New York, N.Y., является гидрофобным и известен как синтетический статин. В некоторых воплощениях аторвастатин растворяют в системе растворителей на основе свободных PUFA-кислот в количестве, которое обеспечивает ежесуточное введение, в удобном количестве пероральных доз, от 2,5 до 100 мг, от 5 до 80 мг и от 10 до 40 мг.
В конкретных воплощениях аторвастатин растворяют в системе растворителей на основе свободных PUFA-кислот в количестве 2,5 мг, 5 мг, 10 мг, 15 мг, 20 мг, 25 мг, 30 мг, 35 мг, 40 мг, даже 45 мг или 50 мг на миллилитр или на грамм системы PUFA-растворителей. В некоторых воплощениях аторвастатин растворяют в системе растворителей основе свободных PUFA-кислот в количестве 1,25 мг, 2,5 мг, 5 мг, 7,5 мг, 10 мг, 12,5 мг, 15 мг, 17,5 мг, 20 мг, 22,5 мг, даже 25 мг на миллилитр или на грамм системы PUFA-растворителей.
Правастатин, который реализуется как Pravachol® фирмой Bristol-Myers Squibb, Princeton, N.J., является гидрофильным. Введенный в качестве монотерапии, правастатин лучше абсорбируется без пищи. В некоторых воплощениях правастатин растворяют в системе растворителей на основе свободных PUFA-кислот в количестве, которое обеспечивает ежесуточное введение, в удобном количестве пероральных доз, от 2,5 до 80 мг, от 5 до 60 мг или от 10 до 40 мг.
В конкретных воплощениях правастатин растворяют в системе растворителей на основе свободных PUFA-кислот в количестве 2,5 мг, 5 мг, 10 мг, 15 мг, 20 мг, 25 мг, 30 мг, 35 мг, 40 мг, даже 45 мг или 50 мг на миллилитр или на грамм системы PUFA-растворителей. В некоторых воплощениях правастатин растворяют в системе растворителей на основе свободных PUFA-кислот в количестве 1,25 мг, 2,5 мг, 5 мг, 7,5 мг, 10 мг, 12,5 мг, 15 мг, 17,5 мг, 20 мг, 22,5 мг, даже 25 мг на миллилитр или на грамм системы PUFA-растворителей.
Ловастатин, который реализуется под названием Mevacor® фирмой Merck, Whitehouse Station, N.J., является гидрофобным. В некоторых воплощениях ловастатин растворяют в системе растворителей на основе свободных PUFA-кислот в количестве, которое обеспечивает ежесуточное введение, в удобном количестве пероральных доз, от 2,5 до 100 мг, от 5 до 80 мг, или от 10 до 40 мг.
В конкретных воплощениях ловастатин растворяют в системе растворителей на основе свободных PUFA-кислот в количестве 2,5 мг, 5 мг, 10 мг, 15 мг, 20 мг, 25 мг, 30 мг, 35 мг, 40 мг, даже 45 мг или 50 мг на миллилитр или на грамм системы PUFA-растворителей. В некоторых воплощениях ловастатин растворяют в системе растворителей на основе свободных PUFA-кислот в количестве 1,25 мг, 2,5 мг, 5 мг, 7,5 мг, 10 мг, 12,5 мг, 15 мг, 17,5 мг, 20 мг, 22,5 мг, даже 25 мг на миллилитр или на грамм системы PUFA-растворителей.
Симвастатин, который реализуется под названием Zocor® фирмой Merck, Whitehouse Station, N.J., является гидрофобным. В некоторых воплощениях симвастатин растворяют в системе растворителей на основе свободных PUFA-кислот в количестве, которое обеспечивает ежесуточное введение, в удобном количестве пероральных доз, от 1 до 80 мг в сутки, от 2 до 60 мг или от 5 до 40 мг в сутки.
В конкретных воплощениях симвастатин растворяют в системе растворителей на основе свободных PUFA-кислот в количестве 2,5 мг, 5 мг, 10 мг, 15 мг, 20 мг, 25 мг, 30 мг, 35 мг, 40 мг, даже 45 мг или 50 мг на миллилитр или на грамм системы PUFA-растворителей. В некоторых воплощениях симвастатин растворяют в системе растворителей на основе свободных PUFA-кислот в количестве 1,25 мг, 2,5 мг, 5 мг, 7,5 мг, 10 мг, 12,5 мг, 15 мг, 17,5 мг, 20 мг, 22,5 мг, даже 25 мг на миллилитр или на грамм системы PUFA-растворителей.
Флувастатин, который реализуется под названием Lescol® фирмой Novartis, East Hanover, N.J., является гидрофильным и известен как синтетический статин. В различных воплощениях флувастатин растворяют в системе растворителей на основе свободных PUFA-кислот в количестве, которое обеспечивает ежесуточное введение, в удобном количестве пероральных доз, от 5 до 160 мг, от 10 до 120 мг, и от 20 до 80 мг.
В конкретных воплощениях флувастатин растворяют в системе растворителей на основе свободных PUFA-кислот в количестве 2,5 мг, 5 мг, 10 мг, 15 мг, 20 мг, 25 мг, 30 мг, 35 мг, 40 мг, даже 45 мг или 50 мг на миллилитр или на грамм системы PUFA-растворителей. В некоторых воплощениях флувастатин растворяют в системе растворителей на основе свободных PUFA-кислот в количестве 1,25 мг, 2,5 мг, 5 мг, 7,5 мг, 10 мг, 12,5 мг, 15 мг, 17,5 мг, 20 мг, 22,5 мг, даже 25 мг на миллилитр или на грамм системы PUFA-растворителей.
Питавастатин реализуется под названием Livalo® фирмой Kowa Pharmaceuticals America, Inc., Montgomery, Alabama and Lilly USA, Indianapolis, Indiana. Дозировка питавастатина в фармацевтической композиции может составлять от 2,5 до 80 мг, от 2,5 до 60 мг, или от 5 до 40 мг.
В конкретных воплощениях питавастатин растворяют в системе растворителей на основе свободных PUFA-кислот в количестве 2,5 мг, 5 мг, 10 мг, 15 мг, 20 мг, 25 мг, 30 мг, 35 мг, 40 мг, даже 45 мг или 50 мг на миллилитр или на грамм системы PUFA-растворителей. В некоторых воплощениях питавастатин растворяют в системе растворителей на основе свободных PUFA-кислот в количестве 1,25 мг, 2,5 мг, 5 мг, 7,5 мг, 10 мг, 12,5 мг, 15 мг, 17,5 мг, 20 мг, 22,5 мг, даже 25 мг на миллилитр или на грамм системы PUFA-растворителей.
В типичных воплощениях фармацевтическая композиция содержит статин, который является более растворимым в системе растворителей на основе свободных PUFA-кислот, чем в системе растворителей на основе этиловых эфиров PUFA. В некоторых воплощениях фармацевтическая композиция содержит гидрофобный статин, который является более растворим в системе растворителей на основе свободных PUFA-кислот, чем в системе растворителей на основе этиловых эфиров PUFA. В некоторых воплощениях фармацевтическая композиция содержит гидрофобный статин, который является более растворимым в системе растворителей на основе свободных PUFA-кислот, чем в системе растворителей на основе этиловых эфиров PUFA.
5.3. Пероральные стандартные лекарственные формы
В другом аспекте фармацевтическая композиция соответствующим образом упакована в стандартные лекарственные формы для перорального введения.
В конкретных воплощениях лекарственная форма представляет собой капсулу. В некоторых воплощениях лекарственная форма представляет собой твердую желатиновую капсулу. В других воплощениях лекарственная форма представляет собой мягкую желатиновую капсулу.
В различных воплощениях капсула содержит желатин типа А. В некоторых воплощениях капсула содержит желатин типа В. В некоторых воплощениях капсула содержит желатин как типа А, так и типа В. Источники коллагена для получения желатина типа А или типа В включают, без ограничения ими, крупный рогатый скот, свиней и рыбу.
В различных воплощениях капсула представляет собой мягкую желатиновую капсулу, в которой по меньшей мере примерно 1% (масс./масс.) желатина представляет собой желатин типа А. В некоторых воплощениях по меньшей мере примерно 2% (масс./масс.), 3% (масс./масс.), 4%, (масс./масс.), 5% (масс./масс.), 6% (масс./масс.), 7% (масс./масс.), 8% (масс./масс.), 9% (масс./масс.) или по меньшей мере примерно 10% (масс./масс.) желатина представляет собой желатин типа А. В отдельных воплощениях по меньшей мере примерно 15% (масс./масс.), 20% (масс./масс.), 25% (масс./масс.), 30% (масс./масс.), 35% (масс./масс.), 40% (масс./масс.), 45% (масс./масс.), даже по меньшей мере примерно 50% (масс./масс.), 55% (масс./масс.), 60% (масс./масс.), 65% (масс./масс.), 70% (масс./масс.), 75% (масс./масс.), 80% (масс./масс.), 85% (масс./масс.), 90% (масс./масс.), 95% или более желатина представляет собой желатин типа А.
В конкретных воплощениях желатин капсулы состоит по существу из желатина типа А.
В отдельных воплощениях присутствует достаточно желатина типа А, так чтобы капсула при отсутствии наружного покрытия, такого как описано ниже, распадается в течение периода времени не более 30 минут в очищенной воде при 37°C после хранения в течение по меньшей мере 3 месяцев при 40°C. В некоторых воплощениях капсула представляет собой мягкую желатиновую капсулу, содержащую достаточно желатина типа А, так что капсула, не имеющая покрытия, распадается в течение периода времени не более 30 минут в очищенной воде при 37°C после хранения в течение по меньшей мере 6 месяцев при 40°C.
В различных воплощениях капсула представляет собой мягкую желатиновую капсулу, содержащую достаточно желатина типа А, так что капсула, когда она не покрыта оболочкой, распадается в течение периода времени не более 30 минут в очищенной воде при 37°C после хранения в течение по меньшей мере 3 месяцев при 30°C. В некоторых воплощениях капсула представляет собой мягкую желатиновую капсулу, содержащую достаточно желатина типа А, так что капсула, когда она не покрыта оболочкой, распадается в течение периода времени не более 30 минут в очищенной воде при 37°C после хранения в течение по меньшей мере 6 месяцев при 30°C. В некоторых воплощениях капсула представляет собой мягкую желатиновую капсулу, содержащую достаточно желатина типа А, так что капсула в непокрытом состоянии распадается в течение не более 30 минут в очищенной воде при 37°C после хранения в течение по меньшей мере 9 месяцев при 30°C. В некоторых воплощениях капсула представляет собой мягкую желатиновую капсулу, содержащую достаточно желатина типа А, так что капсула, если она не покрыта дополнительно оболочкой, распадается в течение периода времени не более 30 минут в очищенной воде при 37°C после хранения в течение по меньшей мере 12 месяцев при 30°C.
В некоторых воплощениях желатин типа А представляет собой свиной желатин типа А.
В некоторых воплощениях капсула представляет собой желатиновую капсулу с уменьшенным поперечным сшиванием, такую как описана в патенте США 7485323, включенном в данное описание изобретения посредством ссылки во всей его полноте. В ряде воплощений капсулы изготавливают из веществ, которые не являются животными субпродуктами, таких как альгинат, агар-агар, каррагинан, пектин, конжак, гуаровая камедь, пищевой крахмал, модифицированный кукурузный крахмал, картофельный крахмал и тапиока. Неживотные источники веществ, которые можно использовать для изготовления капсул, описаны в патентной публикации US 2011/0117180, включенной в данное описание изобретения посредством ссылки. В некоторых воплощениях используют капсулы Vegicaps® (Catalent).
В некоторых воплощениях капсула содержит химически модифицированный желатин. В различных воплощениях химически модифицированный желатин представляет собой сукцинилированный желатин.
В конкретных воплощениях капсульной пероральной стандартной лекарственной формы капсула не покрыта оболочкой. В ряде воплощений капсулу покрывают оболочкой.
В конкретных воплощениях покрытой оболочкой капсулы эта капсула покрыта оболочкой на наружной стороне капсулы, что приводит к высвобождению инкапсулированной фармацевтической композиции зависящим от времени образом. В различных воплощениях высвобождение фармацевтической композиции задерживается по меньшей мере на 15 минут после приема внутрь. В конкретных воплощениях высвобождение фармацевтической композиции задерживается по меньшей мере на 30 минут после приема внутрь. В других воплощениях высвобождение композиции жирных кислот задерживается от примерно 30 минут до примерно 60 минут после приема внутрь. В различных покрытых оболочкой воплощениях покрытие выбирают из целлюлозы ацетата тримеллитата, целлюлозы ацетата фталата и поли(этилакрилат-метилакрилат)а. В некоторых воплощениях покрытие представляет собой нейтральный полиакрилат, такой как поли(этилакрилатметилметакрилат), такой как Eudragit NE 30-D (Evonik Industries AG), который имеет среднюю молекулярную массу примерно 800000.
В некоторых воплощениях капсулы покрыты оболочкой, как описано в US 5792795 и 5948818, описания которых включены в данное описание изобретения посредством ссылки. В некоторых воплощениях лекарственную форма представляет собой покрытую оболочкой мягкую желатиновую капсулу, содержащую свиной желатин типа А, как описано в патенте US 7960370, включенном в данное описание изобретения посредством ссылки.
В различных воплощениях пероральная стандартная лекарственная форма содержит от примерно 100 мг до примерно 2000 мг фармацевтической композиции, описанной в данном описании изобретения. В некоторых воплощениях пероральная лекарственная форма содержит примерно 250 мг фармацевтической композиции. В некоторых воплощениях пероральная лекарственная форма содержит примерно 500 мг фармацевтической композиции. В некоторых воплощениях пероральная лекарственная форма содержит примерно 750 мг фармацевтической композиции. В некоторых воплощениях пероральная лекарственная форма содержит примерно 1000 мг фармацевтической композиции. В других воплощениях пероральная лекарственная форма содержит примерно 1500 мг фармацевтической композиции. В некоторых воплощениях стандартная лекарственная форма содержит нецелочисленные массовые количества фармацевтической композиции, обычно от 100 мг до 2000 мг.
В некоторых воплощениях лекарственная форма инкапсулирует PUFA в количестве от примерно 50 мг до примерно 5000 мг, от примерно 75 мг до примерно 2500 мг, или от примерно 100 мг до примерно 1000 мг, например примерно 75 мг, примерно 100 мг, примерно 125 мг, примерно 150 мг, примерно 175 мг, примерно 200 мг, примерно 225 мг, примерно 250 мг, примерно 275 мг, примерно 300 мг, примерно 325 мг, примерно 350 мг, примерно 375 мг, примерно 400 мг, примерно 425 мг, примерно 450 мг, примерно 475 мг, примерно 500 мг, примерно 525 мг, примерно 550 мг, примерно 575 мг, примерно 600 мг, примерно 625 мг, примерно 650 мг, примерно 675 мг, примерно 700 мг, примерно 725 мг, примерно 750 мг, примерно 775 мг, примерно 800 мг, примерно 825 мг, примерно 850 мг, примерно 875 мг, примерно 900 мг, примерно 925 мг, примерно 950 мг, примерно 975 мг, примерно 1000 мг, примерно 1025 мг, примерно 1050 мг, примерно 1075 мг, примерно 1100 мг, примерно 1025 мг, примерно 1050 мг, примерно 1075 мг, примерно 1200 мг, примерно 1225 мг, примерно 1250 мг, примерно 1275 мг, примерно 1300 мг, примерно 1325 мг, примерно 1350 мг, примерно 1375 мг, примерно 1400 мг, примерно 1425 мг, примерно 1450 мг, примерно 1475 мг, примерно 1500 мг, примерно 1525 мг, примерно 1550 мг, примерно 1575 мг, примерно 1600 мг, примерно 1625 мг, примерно 1650 мг, примерно 1675 мг, примерно 1700 мг, примерно 1725 мг, примерно 1750 мг, примерно 1775 мг, примерно 1800 мг, примерно 1825 мг, примерно 1850 мг, примерно 1875 мг, примерно 1900 мг, примерно 1925 мг, примерно 1950 мг, примерно 1975 мг, примерно 2000 мг, примерно 2025 мг, примерно 2050 мг, примерно 2075 мг, примерно 2100 мг, примерно 2125 мг, примерно 2150 мг, примерно 2175 мг, примерно 2200 мг, примерно 2225 мг, примерно 2250 мг, примерно 2275 мг, примерно 2300 мг, примерно 2325 мг, примерно 2350 мг, примерно 2375 мг, примерно 2400 мг, примерно 2425 мг, примерно 2450 мг, примерно 2475 мг или примерно 2500 мг.
В различных воплощениях фармацевтическая композиция, представленная в стандартной лекарственной форме, является стабильной при комнатной температуре (примерно от 23°C до 27°C, или примерно при 25°C) и относительной влажности примерно 60% в течение по меньшей мере шести месяцев, по меньшей мере одного года или по меньшей мере двух лет. Под термином "стабильный" подразумевается, что солюбилизированный статин не осаждается из раствора в сколько-нибудь заметной степени, например в количествах менее 10%, предпочтительно менее 5% от первоначально растворенного статина.
5.4. Дозированные наборы
В другом аспекте большое количество стандартных лекарственных форм, которые описаны выше, могут быть успешно упакованы вместе в дозированном наборе для повышения легкости применения и соблюдения пациентом режима и схемы лечения.
В некоторых воплощениях набор для дозирования представляет собой флакон. В других воплощениях множество лекарственных форм упаковано в блистерные упаковки, множество таких блистерных упаковок возможно может быть упаковано вместе в коробку или другую ограждающую конструкцию. Обычно, либо во флаконе, либо в одной или более блистерных упаковках, количество стандартных лекарственных форм является достаточным для 30 суток, 60 суток или 90 суток дозирования. Таким образом, в отдельных воплощениях, когда стандартная лекарственная форма представляет собой капсулу, в которую инкапсулирован приблизительно один грамм фармацевтической композиции, как описано выше в данном описании изобретения, дозированный набор содержит 30, 60, 90, 120, 150, 180, 240, 270, или 300 таких капсул.
В различных воплощениях множество стандартных лекарственных форм упаковывают в атмосфере инертного газа, такого как азот или благородный газ, или упаковывают в вакууме.
5.5. Дозировка и введение
В типичных воплощениях фармацевтическую композицию вводят от 1 до 4 раз в сутки, например два раза в сутки, где каждая доза содержит от 1 до 10 стандартных доз, таких как капсулы, которые описаны в данном описании изобретения. В типичных воплощениях введение представляет собой пероральное введение, хотя можно использовать другие пути введения.
В некоторых воплощениях вводят по меньшей мере примерно 2 г фармацевтической композиции в сутки. В некоторых воплощениях вводят по меньшей мере примерно 3 г фармацевтической композиции в сутки. В некоторых воплощениях вводят по меньшей мере примерно 4 г фармацевтической композиции в сутки. Обычно фармацевтическое средство вводят в виде нескольких стандартных лекарственных форм, таких как описанные выше. Таким образом, в некоторых воплощениях ежесуточно вводят по меньшей мере 2 стандартные лекарственные формы, каждая из которых содержит 1 г фармацевтической композиции. В различных воплощениях ежесуточно вводят по меньшей мере 3 стандартные лекарственные формы, каждая из которых содержит 1 г фармацевтической композиции. В конкретных воплощениях ежесуточно вводят по меньшей мере 4 стандартные лекарственные формы, каждая из которых содержит 1 г фармацевтической композиции.
5.6. Способы лечения
В другом аспекте представлены способы лечения расстройства липидного спектра крови, включающие введение фармацевтической композиции или композиций, как описано в данном описании изобретения, обычно в виде стандартных лекарственных форм, которые описаны в данном описании изобретения, в количестве и в течение периода времени, достаточного для лечения расстройства липидного спектра крови. Расстройства липидного спектра крови включают, без ограничения ими, гипертриглицеридемию, дислипидемии, гиперхолистеринемию, ишемическую болезнь сердца (ИБС), сердечную недостаточность, инфаркт миокарда, аритмию сердца, ишемическую деменцию, гипертензию, расстройства коагуляции, нефропатию, ретинопатию, сосудистое заболевание, атеросклеротическое заболевание и родственные состояния. Способы по изобретению также направлены на лечение, и/или предупреждение, и/или уменьшение кардиологических явлений, сердечнососудистых явлений и симптомов.
Данная комбинация статина и омега-3 жирных кислот в одной композиции может обеспечить больший эффект, чем любой ожидаемый объединенный или аддитивный эффект двух лекарственных средств отдельно. Кроме того, объединенный или аддитивный эффект двух лекарственных средств может зависеть от начального уровня липидного параметра в крови субъекта.
В некоторых воплощениях после лечения согласно настоящему изобретению у субъекта обнаруживается улучшение одного или более параметров, ассоциированных с расстройством липидного спектра крови. Неограничивающими примерами таких улучшенных параметров являются пониженные уровни триглицеридов по сравнению с исходным уровнем или плацебо-контролем; пониженные уровни Аро В (аполипопротеин) по сравнению с исходным уровнем или плацебо-контролем; пониженные уровни Аро CIII по сравнению с исходным уровнем или плацебо-контролем; повышенные уровни HDL-C (холестерин липопротеинов высокой плотности) по сравнению с исходным уровнем или плацебо-контролем; снижение уровней LDL-C (холестерин липопротеинов низкой плотности) по сравнению с исходным уровнем или плацебо-контролем; снижение уровней не-HDL-C по сравнению с исходным уровнем или плацебо-контролем; снижение уровней VLDL (липопротеин очень низкой плотности) по сравнению с исходным уровнем или плацебо-контролем; повышение уровней Аро А-I по сравнению с исходным уровнем или плацебо-контролем; повышение соотношения Аро A-I/Apo В по сравнению с исходным уровнем или плацебо-контролем; снижение уровней липопротеина по сравнению с исходным уровнем или плацебо-контролем; уменьшение количества частиц LDL по сравнению с исходным уровнем или плацебо-контролем; уменьшение размера частиц LDL по сравнению с исходным уровнем или плацебо-контролем; снижение холестерина ремнантно-подобных частиц по сравнению с исходным уровнем или плацебо-контролем; снижение окисленного LDL по сравнению с исходным уровнем или плацебо-контролем; снижение глюкозы в плазме (FPG) натощак по сравнению с исходным уровнем или плацебо-контролем; снижение гемоглобина А (HbA) по сравнению с исходным уровнем или плацебо-контролем; снижение резистентности к инсулину в модели гомеостаза по сравнению с исходным уровнем или плацебо-контролем; снижение липопротеина, ассоциированного с фосфолипазой А2, по сравнению с исходным уровнем или плацебо-контролем; снижение молекулы межклеточной адгезии-1 по сравнению с исходным уровнем или плацебо-контролем; снижение интерлейкина-2 по сравнению с исходным уровнем или плацебо-контролем; снижение ингибитора активатора плазминогена-1 по сравнению с исходным уровнем или плацебо-контролем; снижение высокочувствительного С-реактивного белка (hsCRP) по сравнению с исходным уровнем или плацебо-контролем; повышение ЕРА в фосфолипидах сыворотки по сравнению с исходным уровнем или плацебо-контролем; повышение ЕРА в мембранах эритроцитов по сравнению с исходным уровнем или плацебо-контролем; снижение уровня арахидоновой кислоты (АА) в сыворотке или в плазме по сравнению с исходным уровнем или плацебо-контролем; повышение в плазме или мембранах эритроцитов соотношения ЕРА/арахидоновая кислота (АА); и повышение соотношения омега-3:омега-6.
Измерения параметров, ассоциированных с расстройством липидного спектра крови могут быть выполнены с использованием способов, известных в данной области техники. Могут быть выполнены измерения для определения исходных уровней одного или более параметров, ассоциированных с расстройством липидного спектра крови, до лечения или во время курса лечения.
Например, могут быть взяты образцы для анализа на триглицериды, общий холестерин, HDL-C и сахар в крови натощак из сыворотки или плазмы и проанализированы с использованием стандартных фотометрических методов. VLDL-TG (трилицериды липопротеинов очень высокой плотности), LDL-C и VLDL-C могут быть рассчитаны или определены с использованием фракционирование сывороточных липопротеинов посредством препаративного ультрацентрифугирования и последующего количественного анализа посредством рефрактометрии или при помощи методики аналитического ультрацентрифугирования. Аро AI, Аро В и hsCRP могут быть определены в сыворотке с использованием стандартных нефелометрических методик. Липопротеин (а) может быть определен в сыворотке с использованием стандартных методик турбидиметрического иммуноанализа. Количество и размер частиц LDL можно определять, используя спектрометрию ядерного магнитного резонанса (ЯМР). Ремнантные липопротеины и LDL-фосфолипазу А2 можно определять в EDTA-плазме или сыворотке и в сыворотке, соответственно, используя методики ферментативного иммуноразделения. Уровни окисленного LDL, молекулы межклеточной адгезии-1 и интерлейкина-2 могут быть определены в сыворотке с использованием стандартных методик иммуноферментного анализа. Эти методики подробно описаны в методических руководствах, например в Tietz Fundamentals of Clinical Chemistry, 6th Ed. (Burtis, Ashwood and Borter Eds.), WB Saunders Company.
В некоторых воплощениях субъект воздерживается от пищи в течение вплоть до 12 часов перед отбором образца крови, например примерно 10 часов.
5.6.1. Лечение тяжелой гипертриглицеридемии (≥500 мг/дл)
В различных воплощениях данный способ представляет собой способ лечения тяжелой (≥500 мг/дл) гипертриглицеридемии, включающий пероральное введение фармацевтической композиции, описанной в данном описании изобретения, пациенту, имеющему уровни триглицерида в сыворотке или в плазме до лечения выше или равные 500 мг/дл, в количестве и в течение периода времени, эффективных для снижения триглицеридов в сыворотке или в плазме ниже уровней до лечения.
В некоторых воплощениях способ включает введение фармацевтической композиции в количестве и в течение периода времени, эффективных для снижения уровней триглицеридов в сыворотке или в плазме по меньшей мере примерно на 5%, 6%, 7%, 8% или по меньшей мере примерно на 9% ниже уровней до лечения. В некоторых воплощениях композицию вводят в количестве и в течение периода времени, эффективных для снижения уровней триглицеридов в сыворотке или в плазме по меньшей мере на 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18% или 19% ниже уровней до лечения. В конкретных воплощениях композицию вводят в количестве и в течение периода времени, эффективных для снижения уровней триглицеридов в сыворотке или в плазме по меньшей мере примерно на 20% ниже уровней до лечения. В различных воплощениях фармацевтическую композицию вводят в количестве и в течение периода времени, эффективных для снижения триглицеридов в сыворотке или в плазме по меньшей мере примерно на 25%, 30%, 35%, 40%, 45%, даже по меньшей мере примерно на 50% ниже уровней до лечения.
В ряде воплощений фармацевтическую композицию вводят в количестве и в течение периода времени, эффективных для снижения уровней триглицеридов в сыворотке или в плазме по меньшей мере примерно на 50 мг/дл, 60 мг/дл, 70 мг/дл, 80 мг/дл, 90 мг/дл, даже по меньшей мере примерно 100 мг/дл. В некоторых воплощениях композицию вводят в количестве и в течение периода времени, эффективных для снижения уровней триглицеридов в сыворотке или в плазме по меньшей мере примерно на 110 мг/дл, 120 мг/дл, 130 мг/дл, 140 мг/дл, даже по меньшей мере примерно на 150 мг/дл. В конкретных воплощениях фармацевтическую композицию вводят в количестве и в течение периода времени, эффективных для снижения уровней триглицеридов в сыворотке или в плазме по меньшей мере примерно на 160 мг/дл, 170 мг/дл, 180 мг/дл, даже по меньшей мере примерно на 190 мг/дл или 200 мг/дл.
В некоторых воплощениях фармацевтическую композицию, описанную в данном описании изобретения, вводят в количестве и в течение периода времени, достаточных для снижения не-HDL-холестерина на по меньшей мере примерно 1%, по меньшей мере примерно 2%, по меньшей мере примерно 3%, 4%, 5%, даже по меньшей мере примерно на 7%, 8%, 9%, или на по меньшей мере примерно 10% ниже уровней до лечения. В некоторых воплощениях фармацевтическую композицию вводят в количестве и в течение периода времени, эффективных для снижения не-HDL-холестерина по меньшей мере примерно на 15%, по меньшей мере примерно на 20%, по меньшей мере примерно на 25%, по меньшей мере примерно на 30%, по меньшей мере примерно на 35%, по меньшей мере примерно на 40% ниже уровней до лечения.
В различных воплощениях фармацевтическую композицию вводят в количестве и в течение периода времени, эффективных для повышения уровней HDL-C по меньшей мере примерно на 1% выше уровней до лечения. В некоторых воплощениях фармацевтическую композицию вводят в количестве и в течение периода времени, достаточных для повышения HDL-C по меньшей мере примерно на 2%, 3%, 4%, даже по меньшей мере примерно на 5%, 6%, 7%, 8%, 9% или на 10% выше уровней до лечения.
В некоторых воплощениях фармацевтическую композицию вводят в количестве и в течение периода времени, эффективных для снижения соотношения общий холестерин:HDL-C ("ТС/HDL") по меньшей мере примерно на 1% ниже уровней до лечения. В некоторых воплощениях фармацевтическую композицию вводят в количестве и в течение периода времени, достаточных для снижения соотношения ТС/HDL по меньшей мере примерно на 2%, 3%, 4%, 5%, 6%, 7%, 8%, даже по меньшей мере примерно на 9% или по меньшей мере примерно на 10% ниже уровней до лечения.
В некоторых воплощениях фармацевтическую композицию вводят в количестве и в течение периода времени, эффективных для снижения уровней VLDL-C по меньшей мере примерно на 5%, 6%, 7%, 8%, 9% или по меньшей мере примерно на 10% ниже уровней до лечения. В некоторых воплощениях фармацевтическую композицию вводят в количестве и в течение периода времени, достаточных для снижения уровней VLDL-C по меньшей мере примерно на 11%, 12%, 13%, 14%, 15%, 16%, 17%, даже по меньшей мере примерно на 18%, 19% или 20% ниже уровней до лечения. В конкретных воплощениях фармацевтическую композицию вводят в количестве и в течение периода времени, достаточных для снижения уровней VLDL-C по меньшей мере примерно на 21%, 22%, 23%, 24%, даже по меньшей мере примерно на 25% ниже уровней до лечения.
В ряде воплощений фармацевтическую композицию вводят в количестве и в течение периода времени, эффективных для снижения уровней ApoCIII. В некоторых воплощениях фармацевтическую композицию вводят в количестве и в течение периода времени, достаточных для снижения уровней ApoCIII по меньшей мере примерно на 1%, 2%, 3%, 4%, 5%, 6%, 7%, даже по меньшей мере примерно на 8%, 9% или 10% ниже уровней до лечения.
В некоторых воплощениях фармацевтическую композицию вводят в количестве и в течение периода времени, эффективных для повышения уровней ЕРА в плазме по меньшей мере на 100% выше уровней до лечения. В некоторых воплощениях фармацевтическую композицию вводят в количестве и в течение периода времени, эффективных для повышения уровней ЕРА в плазме по меньшей мере примерно на 200%, 250%, 300%, даже по меньшей мере примерно на 350%, 400%, 450% или по меньшей мере примерно на 500% выше уровней до лечения. В отдельных воплощениях фармацевтическую композицию вводят в течение периода времени и в количестве, эффективных для повышения уровней ЕРА в плазме по меньшей мере примерно на 550%, 600%, 650%, даже по меньшей мере примерно на 700% выше уровней до лечения.
В различных воплощениях фармацевтическую композицию вводят в количестве и в течение периода времени, эффективных для повышения уровней DHA в плазме по меньшей мере примерно на 50% выше уровней до лечения. В конкретных воплощениях фармацевтическую композицию вводят в количестве и в течение периода времени, эффективных для повышения уровней DHA в плазме по меньшей мере примерно на 55%, 60%, 65%, 70%, даже по меньшей мере примерно на 75%, 80%, 85% или 90% выше уровней до лечения.
В ряде воплощений фармацевтическую композицию вводят в количестве и в течение периода времени, эффективных для повышения уровней DPA в плазме по меньшей мере примерно на 50% выше уровней до лечения. В некоторых воплощениях фармацевтическую композицию вводят в количестве и в течение периода времени, эффективных для повышения уровней DPA в плазме по меньшей мере примерно на 55%, 60%, 65%, 70%, 75%, даже по меньшей мере примерно на 80%, 85%, 90%, 95% или 100% выше уровней до лечения. В отдельных воплощениях фармацевтическую композицию вводят в количестве и в течение периода времени, эффективных для повышения уровней DPA в плазме по меньшей мере примерно на 110%, 120%, даже по меньшей мере примерно на 125% выше уровней до лечения.
В ряде воплощений фармацевтическую композицию вводят в количестве и в течение периода времени, эффективных для снижения концентрации арахидоновой кислоты (АА) в плазме по меньшей мере примерно на 5% ниже уровней до лечения. В некоторых воплощениях фармацевтическую композицию вводят в количестве и в течение периода времени, эффективных для снижения концентрации арахидоновой кислоты (АА) в плазме по меньшей мере примерно на 6%, 7%, 8%, 9%, 10%, даже по меньшей мере примерно на 11%, 12%, 13%, 14%, даже по меньшей мере примерно на 15%, 16%, 17%, 18%, 19%, 20%, или 21%, 22%, 23%, 24% даже по меньшей мере примерно на 25%) ниже уровней до лечения.
В некоторых воплощениях фармацевтическую композицию вводят в количестве и в течение периода времени, эффективных для снижения концентрации арахидоновой кислоты в плазме по меньшей мере примерно на 25 мкг/мл. В некоторых воплощениях фармацевтическую композицию вводят в количестве и в течение периода времени, достаточных для снижения уровней АА в плазме по меньшей мере примерно на 50 мкг/мл, 55 мкг/мл, 60 мкг/мл, 65 мкг/мл, даже по меньшей мере примерно на 70 мкг/мл, 75 мкг/мл, 80 мкг/мл, 85 мкг/мл, 90 мкг/мл, даже по меньшей мере примерно на 95 мкг/мл или 100 мкг/мл.
В некоторых воплощениях эффективное количество составляет по меньшей мере примерно 2 г в сутки. В различных воплощениях эффективное количество составляет по меньшей мере примерно 3 г в сутки. В конкретных воплощениях эффективное количество составляет по меньшей мере примерно 4 г в сутки. В типичных воплощениях эффективное количество составляет примерно 2 г в сутки. В некоторых воплощениях эффективное количество составляет примерно 4 г в сутки.
В типичных воплощениях фармацевтическую композицию вводят в течение по меньшей мере 30 суток. В некоторых воплощениях фармацевтическую композицию вводят в течение по меньшей мере 60 суток. В конкретных воплощениях фармацевтическую композицию вводят в течение по меньшей мере 90 суток, 120 суток, 180 суток, 240 суток или по меньшей мере 360 суток. В некоторых воплощениях фармацевтическую композицию вводят неограниченно.
В некоторых воплощениях фармацевтическую композицию вводят ежесуточно. В других воплощениях фармацевтическую композицию вводят через сутки.
В конкретных воплощениях суточную дозу фармацевтической композиции вводят в одной суточной дозе. В других воплощениях фармацевтическую композицию вводят раздельными дозами, при этом суточную дозу делят на два введения, три введения или даже четыре введения в течение суток.
В некоторых воплощениях фармацевтическую композицию вводят с пищей. В некоторых воплощениях фармацевтическую композицию вводят с пищей с низким содержанием жиров. В других воплощениях фармацевтическую композицию вводят без пищи. В некоторых воплощениях фармацевтическую композицию вводят натощак.
5.6.2. Лечение гипертриглицеридемии (200-500 мг/дл)
В другом ряду лечение воплощениях предлагаются способы лечения пациентов, которые имеют уровни триглицеридов в сыворотке или в плазме до лечения от примерно 200 мг/дл до примерно 500 мг/дл. В некоторых воплощениях пациенты уже получают лечение статином; у этих пациентов уровнями триглицеридов в сыворотке или в плазме до лечения являются уровни, измеренные во время лечения статином, до введения фармацевтических композиций, описанных в данном описании изобретения.
Способ включает пероральное введение фармацевтической композиции, описанной в данном описании изобретения, пациенту, имеющему уровни триглицеридов в сыворотке или в плазме до лечения от примерно 200 мг/дл до примерно 500 мг/дл, в количестве и в течение периода времени, эффективных для снижения триглицеридов в сыворотке или в плазме ниже уровней до лечения.
В некоторых воплощениях фармацевтическую композицию, описанную в данном описании изобретения, вводят в количестве и в течение периода времени, достаточных для снижения сыворотке или уровней триглицеридов в плазме по меньшей мере примерно на 5% ниже уровней до лечения. В различных воплощениях фармацевтическую композицию вводят в количестве и в течение периода времени, достаточных для снижения сыворотке или уровней триглицеридов в плазме по меньшей мере примерно на 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, даже по меньшей мере примерно на 16%, 17%, 18%, 19%, или по меньшей мере примерно на 20% ниже уровней до лечения.
В некоторых воплощениях фармацевтическую композицию, описанную в данном описании изобретения, вводят в количестве и в течение периода времени, достаточных для снижения не-HDL-холестерина по меньшей мере примерно на 1%, по меньшей мере примерно на 2%, по меньшей мере примерно на 3%, 4%, 5%, даже по меньшей мере примерно на 7%, 8%, 9%, или по меньшей мере примерно на 10% ниже уровней до лечения. В некоторых воплощениях фармацевтическую композицию вводят в количестве и в течение периода времени, достаточных для снижения не-HDL-холестерина по меньшей мере примерно на 15%, по меньшей мере примерно на 20%, по меньшей мере примерно на 25%, по меньшей мере примерно на 30%, по меньшей мере примерно на 35%, по меньшей мере примерно на 40% ниже уровней до лечения.
В ряде воплощений фармацевтическую композицию вводят в количестве и в течение периода времени, достаточных для повышения уровней HDL-C по меньшей мере примерно на 1%, 2%, 3%, 4%, 5%, 6%, 7%, даже по меньшей мере примерно на 8%, 9% или 10% или более выше уровней до лечения.
В некоторых воплощениях фармацевтическую композицию вводят в количестве и в течение периода времени, эффективных для повышения уровней ЕРА в плазме по меньшей мере на 100% выше уровней до лечения. В некоторых воплощениях фармацевтическую композицию вводят в количестве и в течение периода времени, эффективных для повышения уровней ЕРА в плазме по меньшей мере примерно на 200%, 250%, 300%, даже по меньшей мере примерно на 350%, 400%, 450% или по меньшей мере примерно на 500% выше уровней до лечения. В отдельных воплощениях фармацевтическую композицию вводят в течение периода времени и в количестве, эффективных для повышения уровней ЕРА в плазме по меньшей мере примерно на 550%, 600%, 650%, даже по меньшей мере примерно на 700% выше уровней до лечения.
В различных воплощениях фармацевтическую композицию вводят в количестве и в течение периода времени, эффективных для повышения уровней DHA в плазме по меньшей мере примерно на 50% выше уровней до лечения. В конкретных воплощениях фармацевтическую композицию вводят в количестве и в течение периода времени, эффективных для повышения уровней DHA в плазме по меньшей мере примерно на 55%, 60%, 65%, 70%, даже по меньшей мере примерно на 75%, 80%, 85% или 90% выше уровней до лечения.
В ряде воплощений фармацевтическую композицию вводят в количестве и в течение периода времени, эффективных для повышения уровней DPA в плазме по меньшей мере примерно на 50% выше уровней до лечения. В некоторых воплощениях фармацевтическую композицию вводят в количестве и в течение периода времени, эффективных для повышения уровней DPA в плазме по меньшей мере примерно на 55%, 60%, 65%, 70%, 75%, даже по меньшей мере примерно на 80%, 85%, 90%, 95% или 100% выше уровней до лечения. В отдельных воплощениях фармацевтическую композицию вводят в количестве и в течение периода времени, эффективных для повышения уровней DPA в плазме по меньшей мере примерно на 110%, 120%, даже по меньшей мере примерно на 125% выше уровней до лечения.
В ряде воплощений фармацевтическую композицию вводят в количестве и в течение периода времени, эффективных для снижения концентрации арахидоновой кислоты (АА) в плазме по меньшей мере примерно на 5% ниже уровней до лечения. В некоторых воплощениях фармацевтическую композицию вводят в количестве и в течение периода времени, эффективных для снижения концентрации арахидоновой (АА) в плазме по меньшей мере примерно на 6%, 7%, 8%, 9%, 10%, даже по меньшей мере примерно на 11%, 12%, 13%, 14%, даже по меньшей мере примерно на 15%, 16%, 17%, 18%, 19%, 20%, или на 21%, 22%, 23%, 24% даже по меньшей мере примерно на 25% ниже уровней до лечения.
В некоторых воплощениях фармацевтическую композицию вводят в количестве и в течение периода времени, эффективных для снижения концентрации арахидоновой кислоты в плазме по меньшей мере примерно на 25 мкг/мл. В некоторых воплощениях фармацевтическую композицию вводят в количестве и в течение периода времени, достаточных для снижения уровней АА в плазме по меньшей мере примерно на 50 мкг/мл, 55 мкг/мл, 60 мкг/мл, 65 мкг/мл, даже по меньшей мере примерно на 70 мкг/мл, 75 мкг/мл, 80 мкг/мл, 85 мкг/мл, 90 мкг/мл, даже по меньшей мере примерно на 95 мкг/мл или 100 мкг/мл.
В различных воплощениях фармацевтическую композицию, описанную в разделе 5.2 в данном описании изобретения, вводят в стандартных лекарственных формах, как описано в разделе 5.3 выше.
В различных воплощениях фармацевтическую композицию вводят в количестве по меньшей мере примерно 1 грамм в сутки. В некоторых воплощениях фармацевтическую композицию вводят в количестве по меньшей мере примерно 2 г/сутки. В некоторых воплощениях фармацевтическую композицию вводят в количестве по меньшей мере примерно 3 г/сутки. В конкретных воплощениях фармацевтическую композицию вводят в количестве по меньшей мере примерно 4 г/сутки. В типичных воплощениях фармацевтическую композицию вводят в количестве примерно 2 г/сутки. В некоторых воплощениях фармацевтическую композицию вводят в количестве примерно 3 г/сутки или примерно 4 г в сутки.
5.6.3. Лечение первичной гиперлипидемии или смешанной дислипидемии
В ряде воплощений, относящихся к лечению, предлагаются способы лечения пациентов с первичной гиперлипидемией или смешанной дислипидемией. Способ включает пероральное введение фармацевтической композиции, описанной в данном описании изобретения, пациенту с первичной гиперлипидемией или смешанной дислипидемией, в количестве и в течение периода времени, эффективных для снижения одного или более из повышенного уровня общего холестерина, повышенного LDL-C, повышенного АроВ, не-HDL-C и повышенных уровней триглицеридов, и/или для повышения HDL-C.
В различных воплощениях фармацевтическую композицию вводят в количестве по меньшей мере примерно 1 грамм в сутки. В некоторых воплощениях фармацевтическую композицию вводят в количестве по меньшей мере примерно 2 г/сутки. В некоторых воплощениях фармацевтическую композицию вводят в количестве по меньшей мере примерно 3 г/сутки. В конкретных воплощениях фармацевтическую композицию вводят в количестве по меньшей мере примерно 4 г/сутки. В типичных воплощениях фармацевтическую композицию вводят в количестве от примерно 2 г/сутки. В некоторых воплощениях фармацевтическую композицию вводят в количестве от примерно 3 г/сутки или примерно 4 г в сутки.
5.6.4. Лечение для повышения соотношений ЕРА:АА в плазме
Также предлагаются способы повышения соотношения ЕРА:АА. Эти способы включают введение фармацевтической композиции, описанной в разделе 5.2 в данном описании изобретения, пациенту, имеющему соотношение ЕРА:АА ниже примерно 0,25, в количестве и в течение периода времени, достаточных для повышения соотношения ЕРА:АА у пациента по меньшей мере до примерно 0,25. В некоторых воплощениях фармацевтическую композицию вводят в количестве и в течение периода времени, достаточных для повышения соотношения ЕРА:АА у пациента по меньшей мере примерно до 0,3, по меньшей мере примерно до 0,35, по меньшей мере примерно до 0,40, по меньшей мере примерно до 0,45, по меньшей мере примерно до 0,50, даже до уровня по меньшей мере примерно 0,55, 0,60, 0,61, 0,62, 0,63, 0,64 или 0,65.
В некоторых воплощениях способ включает введение фармацевтической композиции в количестве и в течение периода времени, эффективных для повышения уровней ЕРА в плазме по меньшей мере на 100% выше уровней до лечения. В некоторых воплощениях фармацевтическую композицию вводят в количестве и в течение периода времени, эффективных для повышения уровней ЕРА в плазме по меньшей мере примерно на 200%, 250%, 300%, даже по меньшей мере примерно на 350%, 400%, 450% или по меньшей мере примерно на 500% выше уровней до лечения. В отдельных воплощениях фармацевтическую композицию вводят в течение периода времени и в количестве, эффективных для повышения уровней ЕРА в плазме по меньшей мере примерно на 550%, 600%, 650%, даже по меньшей мере примерно на 700% выше уровней до лечения.
В различных воплощениях фармацевтическую композицию вводят в количестве и в течение периода времени, эффективных для повышения уровней DHA в плазме по меньшей мере примерно на 50% выше уровней до лечения. В конкретных воплощениях фармацевтическую композицию вводят в количестве и в течение периода времени, эффективных для повышения уровней DHA в плазме по меньшей мере примерно на 55%, 60%, 65%, 70%, даже по меньшей мере примерно на 75%, 80%, 85% или 90% выше уровней до лечения.
В ряде воплощений фармацевтическую композицию вводят в количестве и в течение периода времени, эффективных для снижения концентрации арахидоновой кислоты (АА) в плазме по меньшей мере примерно на 5% ниже уровней до лечения. В некоторых воплощениях фармацевтическую композицию вводят в количестве и в течение периода времени, эффективных для снижения концентрации арахидоновой кислоты (АА) в плазме по меньшей мере примерно на 6%, 7%, 8%, 9%, 10%), даже по меньшей мере примерно на 11%, 12%, 13%, 14%, даже по меньшей мере примерно на 15%, 16%, 17%, 18%, 19%, 20%, или 21%, 22%, 23%, 24%, даже по меньшей мере примерно на 25% ниже уровней до лечения.
В некоторых воплощениях фармацевтическую композицию вводят в количестве и в течение периода времени, эффективных для снижения концентрации арахидоновой кислоты в плазме по меньшей мере примерно на 25 мкг/мл. В некоторых воплощениях фармацевтическую композицию вводят в количестве и в течение периода времени, достаточных для снижения уровней АА в плазме по меньшей мере примерно на 50 мкг/мл, 55 мкг/мл, 60 мкг/мл, 65 мкг/мл, даже по меньшей мере примерно на 70 мкг/мл, 75 мкг/мл, 80 мкг/мл, 85 мкг/мл, 90 мкг/мл, даже по меньшей мере примерно на 95 мкг/мл или 100 мкг/мл.
В различных воплощениях фармацевтическую композицию, описанную в разделе 5.2 в данном описании изобретения, вводят в стандартных лекарственных формах, как описано в разделе 5.3 выше.
В различных воплощениях фармацевтическую композицию вводят в количестве по меньшей мере примерно 1 грамм в сутки. В некоторых воплощениях фармацевтическую композицию вводят в количестве по меньшей мере примерно 2 г/сутки. В некоторых воплощениях фармацевтическую композицию вводят в количестве по меньшей мере примерно 3 г/сутки. В конкретных воплощениях фармацевтическую композицию вводят в количестве по меньшей мере примерно 4 г/сутки. В типичных воплощениях фармацевтическую композицию вводят в количестве примерно 2 г/сутки. В некоторых воплощениях фармацевтическую композицию вводят в количестве от примерно 3 г/сутки или примерно 4 г в сутки.
5.6.5. Лечение для снижения уровней ApoCIII в сыворотке или в плазме
Также предлагаются способы повышения уровней ApoCIII в сыворотке или в плазме пациента независимо от уровней триглицеридов в плазме пациента до лечения. Эти способы включают введение фармацевтической композиции, описанной в разделе 5.2 в данном описании изобретения, пациенту, нуждающемуся в снижении уровней ApoCIII, в количестве и в течение периода времени, достаточных для снижения уровней ApoCIII в сыворотке или в плазме пациента. В типичных воплощениях пациент имеет риск сердечнососудистого заболевания.
В некоторых воплощениях фармацевтическую композицию вводят в количестве и в течение периода времени, достаточных для снижения уровней ApoCIII по меньшей мере примерно на 1%, 2%, 3%, 4%, 5%, 6%, 7%, даже по меньшей мере примерно на 8%, 9% или 10% ниже уровней до лечения.
5.6.6. Другие способы лечения
В другом аспекте фармацевтические композиции, описанные в данном описании изобретения, применяют для лечения других расстройств, включая одно или более из неалкогольного стеатогепатита (NASH), гиперглипопротеинемии, включая гиперглипопротеинемию типа III, и метаболического синдрома.
В некоторых воплощениях фармацевтическую композицию применяют для снижения резистентности к ингибиторам агрегации тромбоцитов, таким как Plavix, включая применение в способах, описанных в патентной заявке US 13/620312, раскрытие которой включено в данное описание изобретения посредством ссылки во всей ее полноте.
6. ПРИМЕРЫ
Пример 1: Растворимость статинов в буферах с разным pH
50 мг аторвастатина добавляли к 5 мл воды, 0,1 н. NaCl, 0,1 н. NaOH, 0,1 н. HCl (pH 1,2), кислого фталатного буфера (pH 2,2), кислого фталатного буфера (pH 4.0), нейтрализованного фталатного буфера (pH 5,0), фосфатного буфера (pH 7,0) или щелочного боратного буфера (pH 9,0). Растворы обрабатывали ультразвуком в течение 10 минут и оставляли стоять в течение ночи. Аликвоты растворов образцов центрифугировали и аликвоту супернатанта из каждого образца анализировали на растворимость аторвастатина. Затем образцы оставляли стоять в течение 1 недели, когда их опять анализировали для определения растворимости аторвастатина. Результаты измерений растворимости представлены в Таблице 3.
50 мг розувастатина добавляли к 5 мл воды, 0,1 н. NaCl, 0,1 н. NaOH, 0,1 н. HCl (pH 1,2), кислого фталатного буфера (pH 2,2), кислого фталатного буфера (pH 4,0), нейтрализованного фталатного буфера (pH 5,0), фосфатного буфера (pH 7,0) или щелочного боратного буфера (pH 9,0). Растворы обрабатывали ультразвуком в течение 10 минут и оставляли стоять в течение ночи. Аликвоты растворов образцов центрифугировали и аликвоту супернатанта из каждого образца анализировали на растворимость розувастатина. Затем образцы оставляли стоять в течение 1 недели, когда их опять анализировали для определения растворимости розувастатина. Результаты измерений растворимости представлены в Таблице 3.
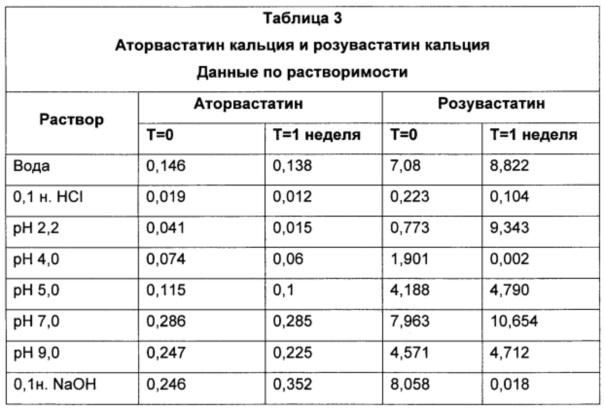
Результаты показали, что розувастатин обнаруживал значительную растворимость в воде в начале отсчета времени с максимальной растворимостью примерно при pH 7,0. Аторвастатин обнаруживал более низкую общую растворимость в воде, чем розувастатин, но растворимость также демонстрировала максимум при pH 7,0.
Пример 2: Растворимость статинов в системе растворителей на основе свободных PUFA-кислот
Каждый из образцов 20-30 мг аторвастатина и 20-30 мг розувастатина растворяли в 2 г системы растворителей на основе свободных PUFA-кислот. Состав системы растворителей приведен в Таблице 4 ниже (партия 37225).
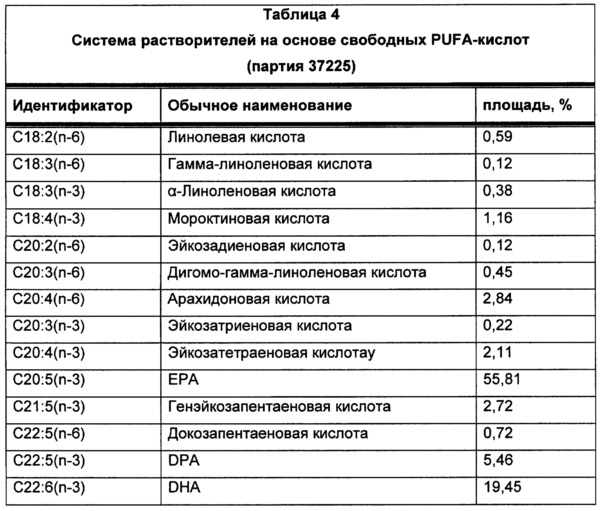
Измеряли исходную растворимость, результаты измерения растворимости представлены в Таблице 5.

Пример 3: Растворимость статинов в системе растворителей на основе омега-3 этиловых эфиров
Каждый из 20 мг аторвастатина и 20 мг розувастатина добавляли к 2 г содержимого, извлеченного из капсулы Lovaza, где разновидности PUFA присутствуют по существу в форме этиловых эфиров. Затем образцы обрабатывали ультразвуком в течение 1 часа и инкубировали в течение ночи, после чего они демонстрировали избыток нерастворенных твердых веществ. Образцы центрифугировали и супернатант анализировали посредством ВЭЖХ на соответствующий статин. Результаты измерения растворимости показаны в Таблице 6. Как видно из сравнения Таблицы 5 с Таблицей 6, аторвастатин и розувастатин солюбилизировались в значительно более высокой степени в системе растворителей на основе свободных PUFA-кислот, чем в системе растворителей на основе этиловых эфиров PUFA.

Пример 4: Сравнение растворимости и стабильности статинов, растворенных в свободных омега-3 жирных кислотах и в этиловых эфирах омега-3 жирных кислот
Растворимость аторвастатина кальция, розувастатина кальция, симвастатина, питавастатина кальция и правастатина натрия оценивали как в системе растворителей на основе свободных PUFA-кислот (смотри Таблицу 4), так и в системе растворителей на основе этиловых эфиров PUFA (Lovaza).
Для этого исследования готовили десять флаконов, так что 5 флаконов содержали 2 мл масла Lovaza и 5 флаконов содержали 2 мл системы растворителей на основе свободных PUFA-кислот. Примерно 20 мг каждого статина добавляли в один флакон с маслом Lovaza и в один флакон с системой растворителей на основе свободных PUFA-кислот. Флаконы, содержащие образцы, помещали в атмосферу азота, затем герметично закрывали. Затем флаконы обрабатывали ультразвуком в течение 1 часа или до тех пор, пока содержимое не становилось прозрачным. После обработки ультразвуком во флаконы, которые оставались прозрачными, добавляли дополнительные 20 мг аликвоты соответствующего статина и их опять помещали в атмосферу азота. Процесс повторяли до тех пор, пока все флаконы не содержали нерастворенный статин, за исключением правастатина натрия в растворителе на основе свободных PUFA-кислот, который после добавления примерно 313 мг правастатина натрия по-прежнему оставался прозрачным. Образцы оставляли стоять в течение ночи, после чего во всех образцах наблюдалось содержание нерастворенных статинов. Образцы центрифугировали и супернатант анализировали на соответствующий статин посредством ВЭЖХ. Результаты анализа показаны в Таблице 7 ниже.
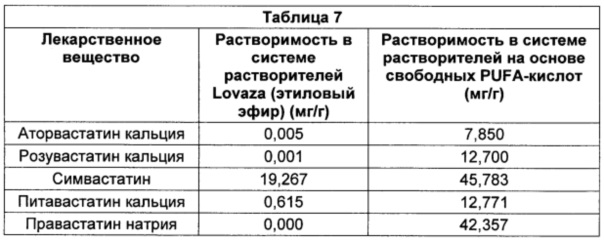
Все протестированные статины демонстрировали заметно более высокую растворимость в системе растворителей на основе свободных PUFA-кислот по сравнению с системой растворителей на основе этиловых эфиров PUFA.
Пример 5: Изучение стабильности статинов, растворенных в омега-3 свободных жирных кислотах
Стабильность аторвастатина кальция и розувастатина кальция, солюбилизированных в системе растворителей на основе свободных PUFA-кислот, оценивали в течение четырех недель в условиях хранения при 25°C, относительной влажности (RH) 60%.
Получали параллельно три партии композиций путем добавления достаточного количества системы растворителей на основе свободных PUFA-кислот к (1) 2,0 г аторвастатина кальция, (2) 2,0 г розувастатина кальция и (3) без статина (контроль), до заполнения 200 мл сосуда с последующим помещением раствора в атмосферу азота и закупориванием сосуда. Затем композиции перемешивали, пока не наблюдалось полное растворение, используя магнитную мешалку, и обрабатывали ультразвуком в течение 30-60-секундных интервалов, заботясь о сохранении азота в свободном объеме над раствором во время обработки.
Каждый раствор статин-система растворителей и контрольную систему растворителей аликвотировали в девять отдельных флаконов на 20 мл из боросиликатного стекла типа I, которые затем помещали в атмосферу азота, укупоривали с помощью покрытой тефлоном пробки для сывороток и герметизировали обжатием. Флаконы покрывали фольгой для защиты от света и хранили при 25°C, 60% RH.
Один флакон каждой из трех композиций извлекали в каждый момент времени для тестирования. Для измерения значения кислотного числа, перекисного числа и абсорбции жиров и жирных масел следовали методикам, приведенным в фармакопее США для капсул с этиловыми эфирами омега-3-кислот. Результаты показаны в Таблицах 8 и 9 ниже.
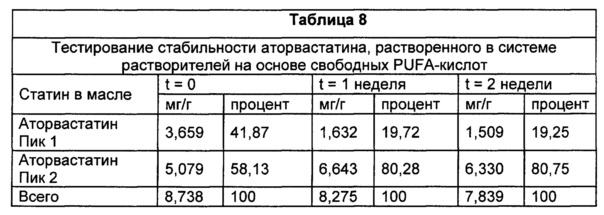
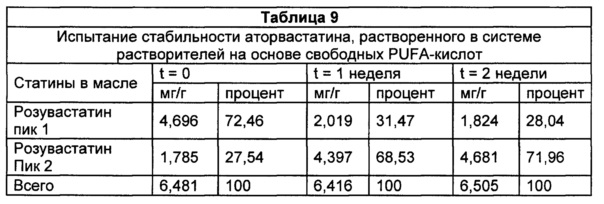
Было показано, что после регулирования pH два пика восстановились до единственного пика исходного статина. Значительного разрушения не наблюдалось.
Все публикации, патенты, патентные заявки и другие документы, приведенные в данной заявке, тем самым включены в данное описание изобретения посредством ссылки во всей своей полноте для всех целей в той же степени, как если бы каждая отдельная публикация, патент, патентная заявка или другой документ были индивидуально указаны как включенные посредством ссылки для всех целей.
Хотя были иллюстрированы и описаны различные конкретные воплощения, следует понимать, что могут быть произведены различные изменения без отклонения от сущности и объема изобретения(й).
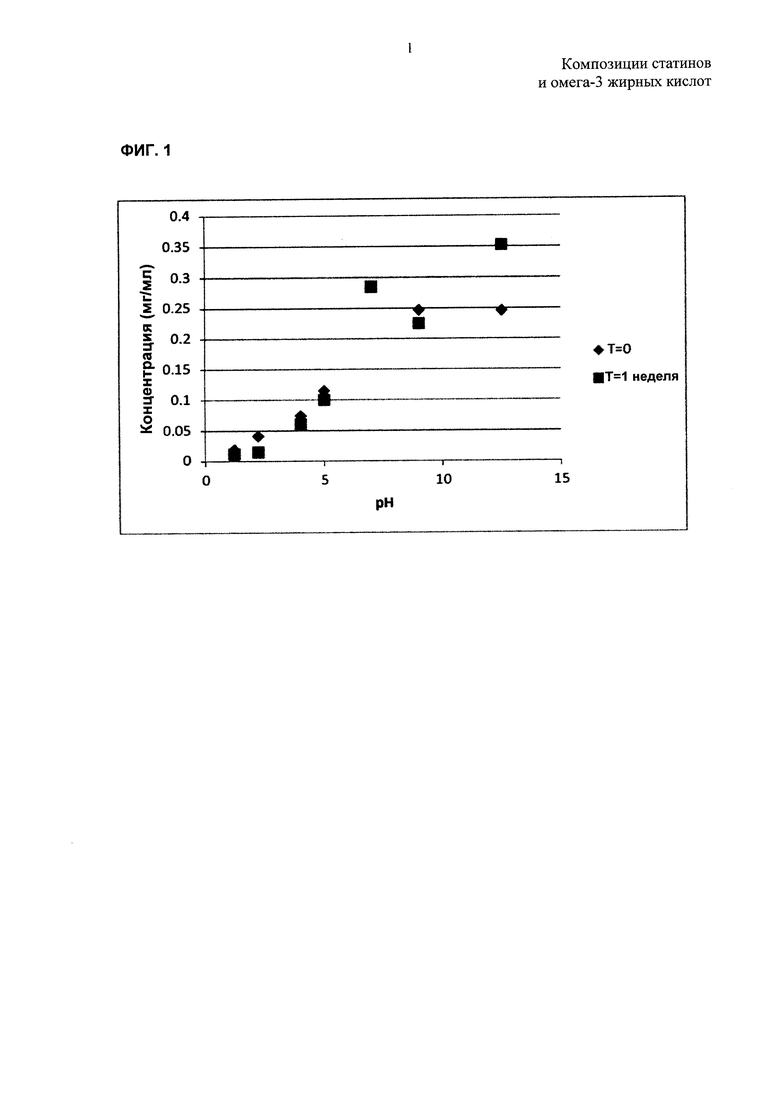
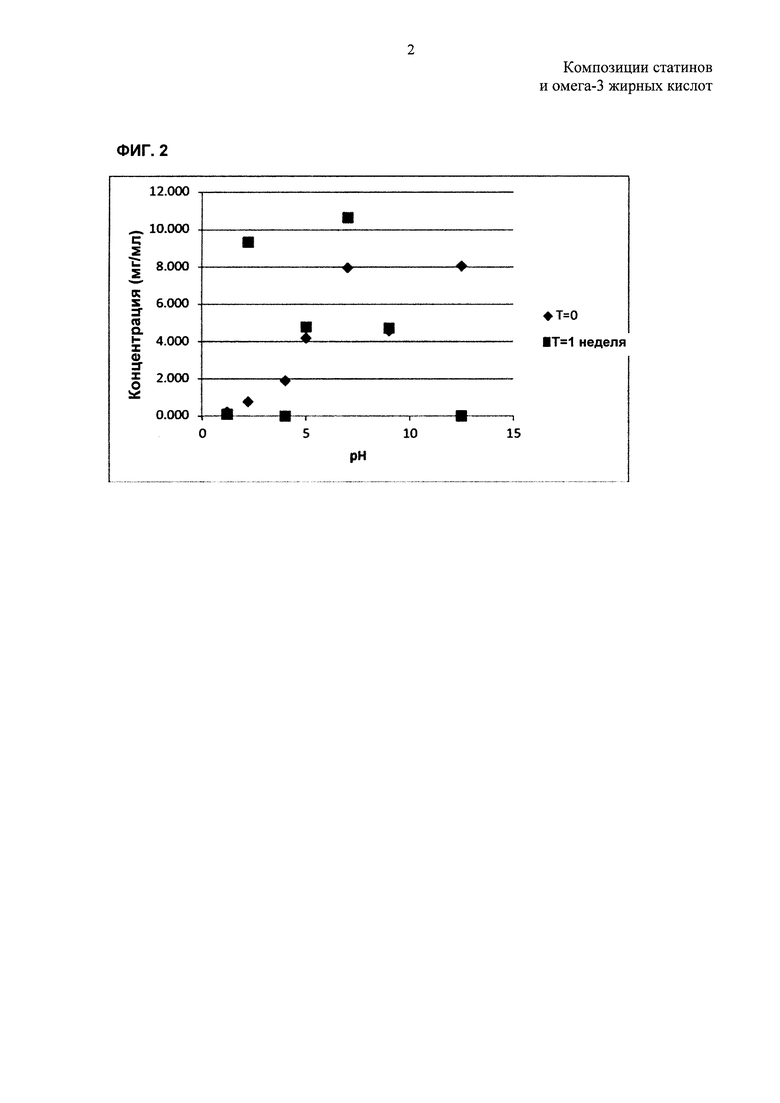
Группа изобретений относится к области медицины, в частности к фармакологии, и описывает фармацевтическую композицию для лечения расстройств липидного спектра крови и пероральную стандартную лекарственную форму, представляющую собой капсулу, содержащую указанную фармацевтическую композицию. Фармацевтическая композиция характеризуется тем, что содержит статин, растворенный в системе растворителей на основе свободных полиненасыщенных жирных кислот (PUFA) и содержит от 50% до 60% эйкозапентаеновой кислоты (ЕРА), от 15% до 25% докозагексаеновой кислоты (DHA), и от 1% до 8% докозапентаеновой кислоты (DPA). Изобретения могут быть использованы для лечения расстройств липидного спектра крови.
2 н. и 16 з.п. ф-лы, 2 ил., 9 табл.
1. Фармацевтическая композиция для лечения расстройств липидного спектра крови, содержащая статин, растворенный в системе растворителей на основе свободных полиненасыщенных жирных кислот (PUFA), где система растворителей на основе свободных PUFA содержит от 50% до 60% эйкозапентаеновой кислоты (ЕРА), от 15% до 25% докозагексаеновой кислоты (DHA), и от 1% до 8% докозапентаеновой кислоты (DPA) (С22:5 n-3), где статин растворен в указанной фармацевтической композиции без использования каких-либо не-PUFA солюбилизаторов, представляющих собой поверхностно-активные соединения, гидрофильные или гидрофобные растворители, масла или их комбинации и где статин выбран из группы, состоящей из: правастатина, ловастатина, симвастатина, аторвастатина, флувастатина, розувастатина и питавастатина.
2. Фармацевтическая композиция по п. 1, где система растворителей на основе свободных PUFA содержит от 50% до 60% ЕРА, от 17% до 23% DHA, и от 1% до 8% DPA.
3. Фармацевтическая композиция по п. 1, где система растворителей на основе свободных PUFA содержит примерно 55% ЕРА.
4. Фармацевтическая композиция по п. 1, где система растворителей на основе свободных PUFA содержит примерно 20% DHA.
5. Фармацевтическая композиция по п. 1, где в системе растворителей являются нерастворенными не более чем примерно 10 мас.% статина.
6. Фармацевтическая композиция по п. 1, где статин растворен в системе растворителей на основе свободных PUFA в концентрации по меньшей мере примерно 5 мг статина на грамм системы растворителей.
7. Фармацевтическая композиция по п. 6, где статин растворен в системе растворителей на основе свободных PUFA в концентрации по меньшей мере примерно 10 мг/г.
8. Фармацевтическая композиция по п. 7, где статин растворен в системе растворителей на основе свободных PUFA в концентрации по меньшей мере примерно 20 мг/г.
9. Фармацевтическая композиция по п. 1, где система растворителей на основе свободных PUFA содержит не более чем примерно 10% омега-6 жирных кислот в форме свободных кислот.
10. Фармацевтическая композиция по п. 1 для применения в лечении расстройства липидного спектра крови, выбранного из группы, состоящей из: гипертриглицеридемии, гиперлипидемии, гиперхолистеринемии, смешанной дислипидемии и атеросклероза.
11. Композиция по п. 10, где лечение включает введение по меньшей мере 2 г фармацевтической композиции ежесуточно.
12. Композиция по п. 11, где лечение включает введение по меньшей мере примерно 10 мг статина ежесуточно.
13. Пероральная стандартная лекарственная форма, представляющая собой капсулу, содержащую фармацевтическую композицию по п. 1.
14. Пероральная стандартная лекарственная форма по п. 13, где капсула представляет собой мягкую желатиновую капсулу.
15. Пероральная стандартная лекарственная форма по п. 14, где мягкая желатиновая капсула содержит свиной желатин типа А.
16. Пероральная стандартная лекарственная форма по п. 13, дополнительно содержащая покрытие на наружной стороне капсулы.
17. Пероральная стандартная лекарственная форма по п. 16, где покрытие представляет собой сополимер поли(этилакрилат-метилметакрилат).
18. Пероральная стандартная лекарственная форма по п. 16, где капсула содержит от 2,5 мг до 40 мг статина, растворенного примерно в 1 г системы растворителей на основе свободных PUFA.
| US 2006211763 A1, 21.09.2006 | |||
| US 7642287 B2, 01.05.2010 | |||
| US 5502077 A, 03.26.1996 | |||
| US 6284268 B1, 09.04.2001. |
Авторы
Даты
2018-02-15—Публикация
2013-05-07—Подача