Изобретение относится к области фармацевтики и может быть использовано при лечении заболеваний печени различного генеза как в человеческой, так и ветеринарной медицине.
Гепатопротекторные средства предназначены для нормализации функции и метаболизма печени при ее поражениях, ускорения регенерации и восстановления функциональной активности гепатоцитов. Они находят применение для патогенетической терапии острых, хронических гепатитов, а также цирроза печени и жирового гепатоза токсической, лекарственной и алкогольной этиологии. Менее эффективны гепатопротекторные препараты при вирусном гепатите.
Фармакологические средства, оказывающие положительное влияние на гепатоциты при патологии печени, подразделяются по механизму действия на несколько основных групп. Первую группу представляют антиоксиданты - растительные полифенолы (легалон, силибор, катерген, фламин, конвафлавин), витамины (α-токоферол, ретинол, пантотеновая кислота, витогепат), тиолы (цистеин, N-ацетилцестиин, малотилат). Во вторую группу входят средства, осуществляющие репарацию мембран гепатоцитов (препараты фосфолипидов - эсенциале, липостабил). Третью группу представляют стимуляторы регенерации паренхимы печени (кальция пангамат, метилметионинсульфония хлорид, метионин, уридин, цитидин, оротовая кислота). Таким образом, круг веществ с гепатозащитными свойствами достаточно велик, однако в соответствии с современной классификацией лекарственных средств из их числа выделяют сравнительно небольшую группу гепатопротекторов, обладающих избирательным терапевтическим влиянием на печень. К ним относят препараты, содержащие в качестве активных компонентов вещества флавоноидной природы (силимарин, катерген и другие) («Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ» // под общ. ред. Члена-корреспондента РАМН, профессора ред. Р.У. Хабриева. - М.: ОАО «Издательство «Медицина», 2005, - 832 с.).
Широко применяемый во многих странах мира силимарин, представляющий собой смесь различных флавоноидов (силибинин, силикристин, силидианин, изосилибинин и дегидросилибинин), выделяемых из лекарственного сырья расторопши пятнистой (Silybummarianum), является активным компонентом многих препаратов, используемых для профилактики и лечения заболеваний печени.
Сложность терапевтического применения субстанции силимарина связана с ее низкой растворимостью в воде и в биологических жидкостях, что затрудняет разработку инъекционных препаратов на ее основе. Поэтому известные лекарственные препараты на основе силимарина выпускаются, как правило, в виде таблеток, гранул, драже или капсул, которые предназначены для перорального введения. Они обладают недостаточной биодоступностью и низкой терапевтической активностью вследствие малой скорости высвобождения и низкой всасываемости в желудочно-кишечном тракте, а также наличием различного рода побочных эффектов.
Из таблетированных форм силимарина наиболее известен препарат «Карсил» (синонимы: Левасил, Гепарсил, Легалон, Силибор, Силимарин Гексал) - см. Машковский М.Д. Лекарственные средства. - М., издание пятнадцатое, Новая волна, 2005, т. 1. с. 526-527), который согласно инструкции предупреждает разрушение клеточных мембран печени и нормализует обмен веществ, стимулирует синтез белков, а также фосфолипидов (особенных сложных липидов, содержащих в себе остаток фосфорной кислоты), необходимых для восстановления гепатоцитов, препятствует проникновению в клетки печени токсинов (сайт Интернет: http://carsil.ru/, 2017 г.). Однако при применении «Карсила», содержащего в своем составе помимо силимарина лактозу и сахарозу, необходимо соблюдать осторожность при назначении его пациентам с галактоземией, недостаточностью лактозы, синдромом мальабсорбции глюкозы-галактозы, глюкозо-изомальтозным дефицитом. Входящие в состав препарата другие компоненты могут также оказать негативное воздействие на организм: сорбитол может вызывать расстройство стула и гастропатию, пшеничный крахмал опасен для больных целиакией, глицерин может вызывать головную боль и диарею (см. Григорьев П.Я. и др. Диагностика и лечение хронического гепатита и цирроза печени. - Советская медицина, 1985, No 12, с. 61-67 или Блинков И.Л. и др. Опыт клинического применения гепатопротективного средства Легалон. Симпозиум «Клиническое значение препарата Легалон». – М., 1981, с 113-123). Аналогичным препаратом является «Дарсил» (ДАРСИЛ® Инструкция по применению, ресурсы Интернет http://compendium.com.ua/info/83070/darsil-sup-sup-, 2017 г.) Данный препарат является дженериком своего предшественника «Карсила» и обладает теми же нежелательными последствиями.
Известны стабильные растворы флавоноидов, в том числе содержащие силимарин, используемые в препаратах для наружного применения при лечении дерматологических заболеваний (патент США US 2010227826 от 09.09.2010 г., MercierMichel F.). Однако для их растворения в данных композициях используются органические растворители в дозах, не приемлемых для инъекционного применения.
Известна инъекционная лекарственная форма для лечения и профилактики заболеваний печени у животных (прототип - патент на изобретение РФ №2504347, опубликован 20.01.2014 г.), содержащая силимарин (гидрофобные экстракты расторопши пятнистой), органический растворитель, солюбилизатор, консервант и сорастворитель при следующем соотношении компонентов, мас. %: силимарин - 1-10, органический растворитель - 5-50, солюбилизатор - 3-30, консервант - 0,01-1, сорастворитель - остальное. При этом указанная лекарственная форма содержит: в качестве органического растворителя – диметилацетамид, или 1-метил-2-пирролидон, или солюфор Р, или транскутол, или пропиленгликоль, или этиленгликоль, или глицероформаль, или диметилсульфоксид; в качестве солюбилизатора - кремофор EL или кремофор ELP, или кремофор RH40, или твин 80, или солютол HS15; в качестве консерванта - бензиловый спирт или парабены; в качестве сорастворителя -дистиллированную воду или раствор смеси водорастворимых витаминов.
Основным недостатком данной лекарственной формы является то, что она представляет собой водную дисперсию (мицелярная форма), которую формируют такие фармацевтические субстанции, как органические растворители, применяемые для растворения гидрофобного активного вещества силимарина (диметилацетамид, 1-метил-2-пирролидон, солюфор P (2-пирролидон), транскутол, пропиленгликоль и др.), и солюбилизаторы, используемые для стабилизации дисперсии (кремофор EL, или кремофор ELP и др.). Однако указанные растворители, входящие в состав дисперсии, несмотря на то, что являются фармакопейными, представляют собой токсичные вещества, которые ограничивают применение препарата в связи с тем, что не у всех млекопитающих есть переносимость к данным компонентам. Введение в препарат солюбилизаторов приводит к повышению аллергенной активности препарата, что так же ограничивает спектр его применения. Кроме того, сама дисперсия обладает довольно низкой стабильностью в отношении активного вещества силимарина, концентрация которого в препарате напрямую зависит от его растворимости в органическом растворителе.
Таким образом, проблема повышения эффективности терапевтического действия препаратов на основе силимарина с инъекционным введением в настоящее время остается актуальной.
Техническим результатом заявляемого изобретения является повышение терапевтической активности и биодоступности фармацевтической композиции на основе силимарина, снижение побочных эффектов данного лекарственного препарата при терапевтических манипуляциях.
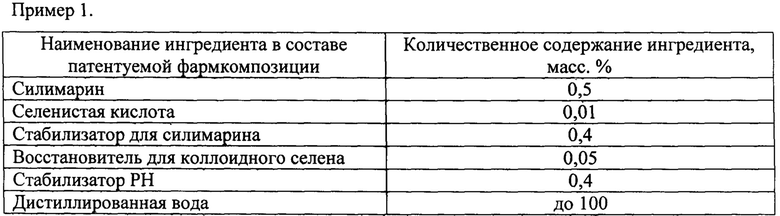
Технический результат достигается тем, что гепатопротекторная инъекционная фармацевтическая композиция на основе силимарина и наночастиц селена содержит силимарин, дистиллированную воду и согласно изобретению дополнительно содержит наночастицы селена, восстановленные из селенистой кислоты с образованием коллоидного селена, при этом в качестве восстановителя для коллоидного селена используют цистеин, или аскорбиновую кислоту, или тиосульфат натрия, или меркаптоэтанол, кроме того, содержит в качестве стабилизатора рН гидроксид натрия, или гидроксид калия, или аргинин, кроме того, содержит стабилизатор для силимарина, в качестве которого используют янтарную, или фумаровую, или яблочную, или лимонную, или щавелевую кислоту, при следующем соотношении компонентов, масс. %:
Новым является то, что введение в активно действующее вещество «силимарин» наночастиц селена впервые предложено для повышения терапевтической активности патентуемого лекарственного препарата, при этом сочетание наночастиц селена и силимарина вызывает усиление гепатопротекторного эффекта за счет синергизма данных ингредиентов. Повышение биодоступности данной композиции и снижение ее побочных эффектов при терапевтических манипуляциях осуществлено за счет разработки стабильной водорастворимой субстанции силимарина (инъекционной формы силимарина) без использования органических растворителей и солюбилизаторов. В результате синтеза препарата происходит восстановление наночастиц селена из селенистой кислоты благодаря восстановителю для коллоидного селена, в качестве которого используют цистеин, или аскорбиновую кислоту, или тиосульфат натрия, или меркаптоэтанол. Образующиеся наночастицы селена создают комплекс с силимарином, который остается стабильным в водной среде при подобранной авторами изобретения оптимальной концентрациии стабилизатора и рН, равным 8,3-8,8.
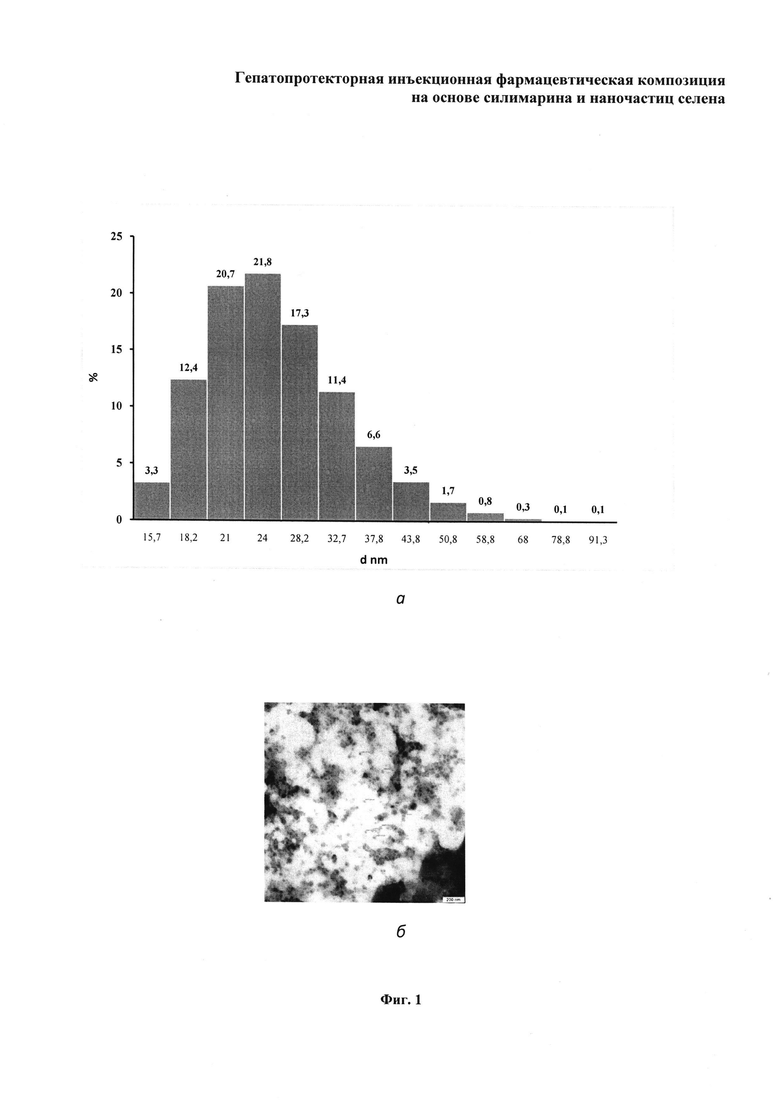
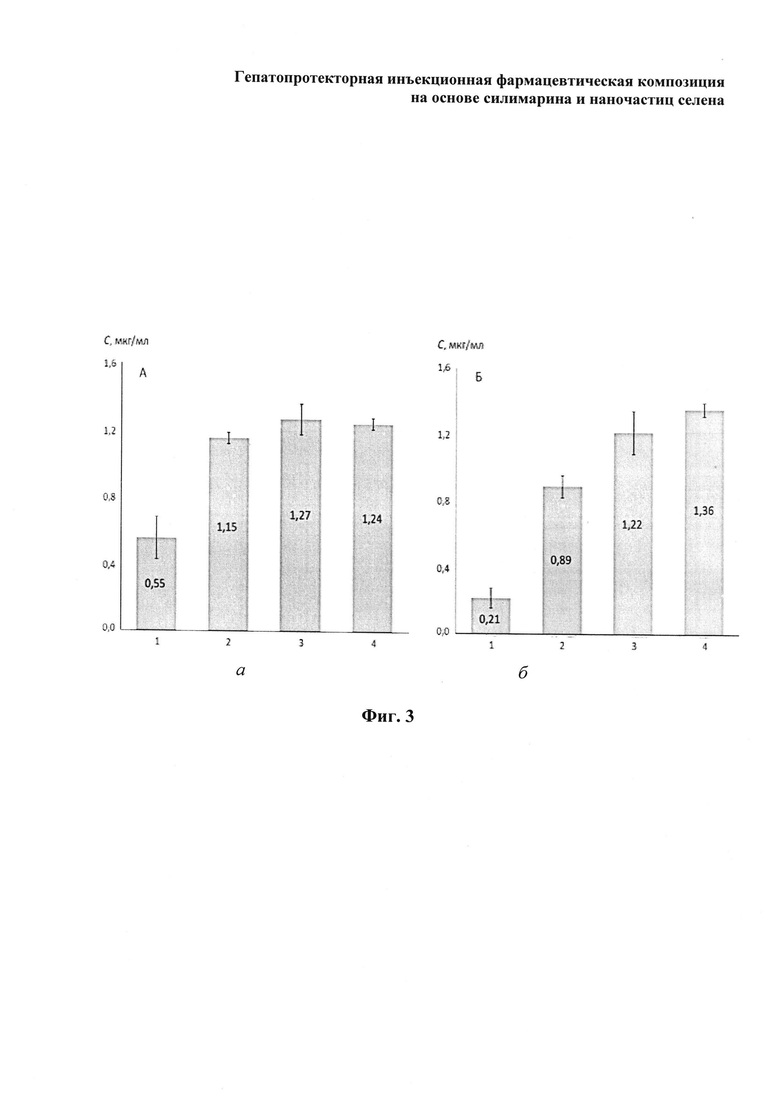
На фиг. 1 изображены: а - гистограмма распределения размера наночастиц селена, измеренного методом динамического рассеяния света (ДРС) в патентуемой гепатопротекторной инъекционной фармацевтической композиции, б - фотография, полученная с использованием трансмиссионного электронного микроскопа, на которой показано электронно-микроскопическое изображение распределения наночастиц селена в патентуемой фармкомпозиции. На фиг. 2 изображена гистограмма, отражающая концентрации глутатиона, определенные в печени мышей в экспериментальных группах. На фиг. 3 изображена гистограмма, отражающая концентрации формазана, определенные в отношении онкологических линий клеток: а - SPEV-2, б - Нер-2 (вертикальные штрихи означают доверительные интервалы для среднеарифметических при уровне значимости 95%).
Способ получения патентуемой фармацевтической композиции состоит в следующем. В дистиллированной воде объемом 60 мл растворяют 0,4-2,0 г гидроксида натрия (NaOH), или гидроксида калия (KОН), или аргинина, используемого в качестве стабилизатора рН, затем вносят навеску стабилизатора для силимарина, в качестве которого используют янтарную, или фумаровую, или яблочную, или лимонную, или щавелевую кислоту, в количестве 0,4-2,0 г, тщательно перемешивают до полного растворения кислоты. В полученный раствор вносят навеску силимарина в количестве 0,5-3 г, перемешивают до полного растворения. Далее готовят навеску, содержащую 0,01-0,1 г селенистой кислоты, которую растворяют в 10 мл дистиллированой воды и вносят в реакционную смесь, тщательно перемешивают и измеряют рН, который должен быть в интервале 8,3-8,8 (при необходимости доводят рН до требуемого значения стабилизатором рН). Объем раствора доводят до 90 мл дистиллированой водой и при перемешивании приливают 10 мл водного раствора, содержащего 0,05-0,4 г восстановителя для коллоидного селена, в качестве которого используют цистеин, или аскорбиновую кислоту, или тиосульфат натрия, или меркаптоэтанол. После завершения реакции образовавшийся коллоидный раствор разливают по флаконам и лиофильно высушивают.
Селен в патентуемой фармацевтической композиции находится в наноразмерном состоянии, что подтверждено путем электронного микроскопирования. Диаметр d синтезированных наночастиц определяли с использованием трансмиссионного электронного микроскопа Libra 120 (CarlZeiss, Germany) и методом динамического рассеяния света (ДРС) на анализаторе ZetasizerNano-ZS (Malvern, UK), как описано в работе (KhlebtsovN.G., DykmanL.A. OpticalpropertiesandbiomedicalapplicationSofplasm Onicnanoparticles.J. Quant. Spectrosc. Radiat. Transfer, 2010, 111: 1-35 (doi:10.1016/j.jqsrt.2009.07.012). На фиг. 1(a) с приведенной гистограммой распределения размера наночастиц селена в патентуемой фармкомпозиции, измеренного методом динамического рассеяния света (ДРС), показано, что по результатам метода ДРС размер 97% всех наночастиц селена в фармкомпозиции находится в пределах d~16-44 нм. Следует отметить, что полученная взвесь конъюгата селеновых наночастиц с силимарином, приобретая красно-коричневую окраску и становясь прозрачной с отсутствием видимой опалесценции, в течение длительного времени сохраняет стабильность: после хранения при 15°C-45°C в течение восьми недель раствор не имеет видимого осадка. Таким образом, достигнутая стабилизация коллоидной взвеси селена силимарином сопровождается увеличением ее степени дисперсности (уменьшением значений d), характерным для коллоидных систем подобного типа, что подтверждается также результатами электронно-микроскопических наблюдений (фиг. 1б).
Определение концентрации силимарина как основного активного (действующего) вещества в конечном препарате проводили методом высокоэффективной жидкостной хроматографии. Хроматографический анализ выполняли на жидкостном хроматографе «Стайер» (ЗАО «Аквилон», Россия) с использованием спектрофотометрического детектора А288. Для разделения компонентов использовали колонку OnixMonolithic С 18 производства ЗАО «Аквилон» по лицензии фирмы MerckKGaA (Германия) (Скорость потока - 0,9 см3/мин; Элюэнт - ацетонитрил «для жидкостной хроматографии» - 1% раствор уксусной кислоты в соотношении 2:3 по объему). Результаты показали, что активное вещество в препарате в процессе синтеза не разрушалось и концентрация силимарина составляла 0,5-3 масс. %, что соответствовало его концентрации в препарате.


Введение в фармкомпозицию силимарина в концентрации ниже чем 0,5 масс. % приводит к тому, что в результате нехватки силимарина в реакционной смеси происходит образование избытка незащищенных частиц селена и селен выпадает в осадок в виде аморфного селена. Введение в фармкомпозицию силимарина в концентрации выше чем 3 масс. % приводит к тому, что данная концентрация силимарина близка к насыщенному раствору, начальный раствор не стабилен и силимарин выпадает в осадок. Введение в фармкомпозицию селенистой кислоты в концентрации ниже чем 0,01 масс. % приводит к тому, что при синтезе фармкомпозиции в результате нехватки наночастиц образуется осадок несвязавшегося силимарина. Введение в фармкомпозицию селенистой кислоты в концентрации выше чем 0,1 масс. % приводит к тому, что при синтезе фармкомпозиции происходит выпадение красного осадка аморфного селена. Введение в фармкомпозицию восстановителя для коллоидного селена в концентрации ниже чем 0,05 масс. % приводит к тому, что в процессе реакции в связи с нехваткой восстановителя образуется осадок из смеси силимарина и аморфного селена. Введение в фармкомпозицию восстановителя для коллоидного селена в концентрации выше чем 0,4 масс. %, восстановитель в процессе реакции выпадает в осадок в виде белых кристаллов. Введение в фармкомпозицию стабилизатора рН в концентрации ниже чем 0,4 масс. % приводит к тому, что при изменении баланса стабилизатора РН и стабилизатора для силимарина изменяется рН реакционной смеси, при этом в данном случае происходит увеличение рН более 8,8 с образованием аморфного селена. Введение в фармкомпозицию стабилизатора рН в концентрации выше чем 2,0 масс. % приводит к тому, что при изменении баланса стабилизатора РН и стабилизатора для силимарина изменяется рН реакционной смеси, при этом в данном случае происходит снижение рН ниже 8,3 и выпадает в осадок силимарин.
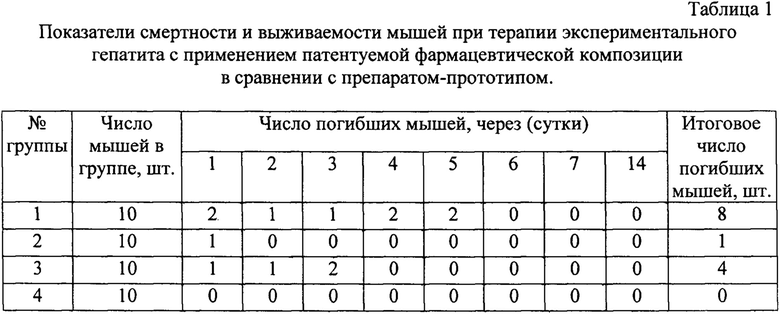
Для определения гепатопротекторных свойств патентуемой фармацевтической композиции на основе силимарина и наночастиц селена была изучена его эффективность при лечении экспериментального гепатита в сравнении с препаратом-прототипом. При проведении эксперимента было сформировано 4 группы экспериментальных животных (белые нелинейные мыши) по 10 голов в каждой (таблица 1). Для моделирования экспериментального поражения печени был использован четыреххлористый углерод как эффективный токсикологический агент (Slater T.F. (1981) Activation of carbontetrachloride: chemical principles and biological significance. In: McBrien D.C.H., Slater T.F. (Eds.), Free Radicals, Lipid Peroxidation and Cancer, Academic Press, London, pp. 243-270.; Renner H. (1985) The limited relevance of models used for testing human hepatic diseases and their prevention. In: Keppler E., Popper H., Bianchi L., and Reutter W. (Eds.), Mechanisms of Hepatocyte Injury and Death, MTP Press Ltd., Lancaster, pp. 311-320.), который, в зависимости от дозы, продолжительности воздействия, или времени наблюдения, вызывает множество эффектов, которые в целом являются токсичными и обозначаются общим термином CCl4. При низких дозах четыреххлористого углерода преобладают переходные эффекты, такие как потеря ионов кальция клетками (Са2 + секвестр), нарушение липидного гомеостаза, выделение цитокинов и апоптоз, с последующей регенерацией. Другие эффекты, которые связаны, с более высокими дозами четыреххлористого углерода или его длительным воздействием, вызывают жировую дистрофию, фиброз, цирроз печени, а в ряде случаев рак. Кроме того, в остротоксичных дозах, когда некроз клеток печени превышает ее регенеративную способность, происходит летальная печеночная недостаточность (Berger L.M., Bhatt H., Combes B., and Estabrock R.W. (1986) CCl4-induced toxicity in isolated hepatocytes: The importance of direct solvent injury. Hepatology 6: 36-45).
Объем четыреххлористого углерода для провокации острого токсического гепатита в группах экспериментальных животных вводили в 1/16 от летальной дозы. При этом мышам в 1-3 группах внутрибрюшинно вводили 50% раствор четыреххлористого углерода на оливковом масле в объеме 1,22 мл/кг живой массы. Эксперимент проводили в течение 14 дней. Лечение животных 1-й группы не проводили (положительный контроль). Второй группе животных проводили терапию гепатита с использованием патентуемой фармкомпозиции в значении компонентов по примеру 1. Препарат вводили ежедневно со второго по тринадцатый день. Третьей группе животных проводили терапию гепатита препаратом-прототипом, уравновешенным по концентрации силимарина с патентуемой фармкомпозицией, применяемой во второй группе. Препарат вводили со второго дня ежедневно до конца эксперимента. Четвертой группе - фоновой - инъекции с четыреххлористым углеродом и препаратом с силимарином не проводились (отрицательный контроль, условно здоровые животные).
В ходе изучения гепатопротекторных свойств патентуемой фармацевтической композиции на модели острого токсического гепатита выявлено, что смертность лабораторных животных за 14 дней эксперимента составила в первой группе 80%, во второй 10%, в третьей группе - 40% и в четвертой (фоновой) признаков интоксикации и гибели животных не отмечалось (таблица 1).
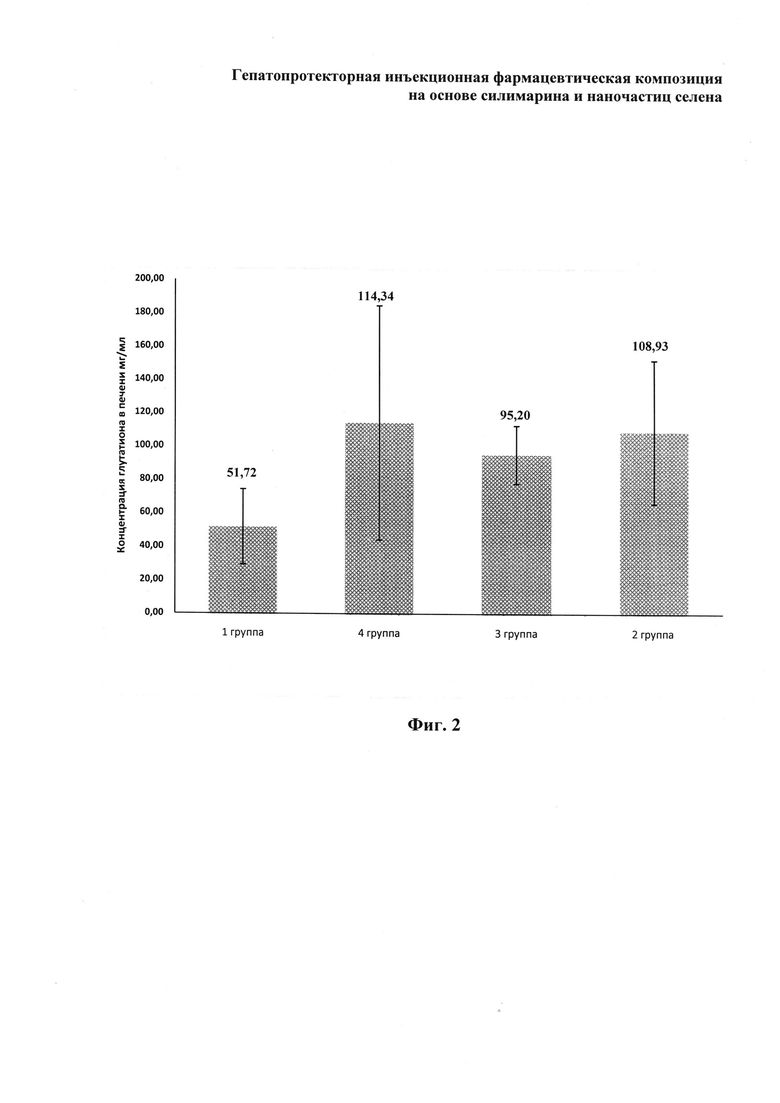
Через 14 суток после начала эксперимента осуществляли умерщвление животных в экспериментальных группах методом транслокации шейных позвонков с последующим взятием биологических материалов, в которых определяли концентрацию глутатиона. Глутатион является одним из основных антиоксидантов в гепатоцитах печени. Он защищает гепатоциты от свободных радикалов и в целом определяет их окислительно-восстановительный потенциал. Соотношение восстановленной и окисленной форм глутатиона в клетке является одним из важнейших параметров, который показывает уровень окислительного стресса. Поэтому уровень глутатиона в печени прямо пропорционален ее способности противостоять окислительному стрессу (способности нейтрализовать токсины).
Для определения концентрации глутатиона печень извлекали и гомогенизировали в 10% трихлоруксусной кислоте из расчета 10 мл на 1 г печени. Взвесь печени центрифугировали при 3000 об/мин в течение 15 минут. К 500 мкл супернатанта добавляли 2 мл 0.3 М раствора Na2HPO4*2H2O и 200 мкл 5,50 -dithiobis (2-nitrobenzoic acid) в 1% sodiumcitrate (0.4 mg/mL). Спектр поглощения измеряли при 412 нм, на спектрофотометре Genesis 10S-UV-VIS (USA). В качестве стандарта использовали глутатион (Sigma).
При анализе концентрации глутатиона в печени через 14 суток после начала эксперимента (фиг. 2) выявлено, что его концентрация резко снижается в группе 1, не получающей лечение. Данный факт указывает на закономерное истощение глутатиона в ответ на окислительный стресс, вызванный введением гепатотоксина. Вместе с этим, во 2-й и 3-й группах мышей, которым применяли препараты с силимарином, концентрация глутатиона была достоверно выше, и находилась на одном уровне с интактными животными 4-й группы. Это объясняется тем, что силимарин, входящий в состав препаратов, обладает ярко выраженными антиоксидантными свойствами и препятствует истощению глутатиона в гепатоцитах в ответ на воздействие данного ксенобиотика. Таким образом, в ходе эксперимента показано, что концентрация глутатиона как одного из основных токсиннейтрализующих компонентов печени у условно здоровых животных является более высокой по сравнению с животными, имеющими поражения печени, при лечении которых препаратами с силимарином уровень глутатиона возрастает по мере выздоровления. При этом, как видно на фиг. 2, эффективность патентуемой фармкомпозиции является более высокой по сравнению с препаратом-прототипом. Проведенные исследования подтвердили гепатопротекторные свойства патентуемой фармкомпозиции при острой патологии печени, вызванной токсическим действием четыреххлористого углерода.
Помимо исследований, подтверждающих гепатопротекторные свойства патентуемой фармкомпозиции, были проведены эксперименты по изучению ее эффективности в отношении онкологических линий клеток. Исследования проводились с использованием клеточных культур SPEV-2 (клетки почки эмбриона свиньи, несущие онковирусы) и Нер-2 (клетки карциномы гортани). В отношении каждой из указанных клеточных культур SPEV-2 и Нер-2 эксперименты проводили следующим образом. Клетки выращивали в пластиковых матрасах на среде Игла, модифицированной по способу Дульбекко (DMEM) (Biologicallndustries, Израиль), содержащей L-глутамин, 15 mMHEPES, 10% фетальной коровьей сыворотки и антибиотики (20 мкг пенициллина с активностью 1000000 ед. и 25 мкл гентамицина с активностью 1000 ед. на 100 мл среды). Культивирование проводили в СО2-инкубаторе при температуре 37°C в атмосфере, содержащей 5% СО2. Клетки отделяли от пластика обработкой раствором Трипсин/Версена при температуре 37°C в течение 10-15 мин, затем осаждали центрифугированием при 900 g в течение 20 мин. Осадок ресуспендировали в фосфатно-солевом буфере при рН 7,2-7,4 и повторно центрифугировали при указанном выше режиме. После ресуспендирования клеток в полной DMEM их вносили в лунки культурального планшета при концентрации 1×105 клеток на лунку. Затем в лунки одного культурального планшета (1) вносили патентуемую фармкомпозицию в дозе 8 мкг по силимарину на лунку. Для сравнения активности патентуемого препарата с его основой в лунки другого культурального планшета (2) вносили исходные селеновые наночастицы (исходный коллоидный раствор селена, раствор наночастиц селена), которые получали добавлением к 67 мл раствора селенистой кислоты 40 мл раствора L-цистеина, полученная взвесь при этом приобретала красно-коричневую окраску. В лунки третьего культурального планшета (3) вносили препарат-прототип, уравновешенный по концентрации силимарина с патентуемой фармкомпозицией, применяемой в культуральном планшете (1). Лунки четвертого культурального планшета (4) содержали клетки, культивированные без внесения препарата с силимарином (контроль). Жизнеспособность культивируемых клеток определяли по их способности восстанавливать нитротетразолевый синий до формазана в тесте МТТ с определением концентрации формазана. Как показано на фиг. 3 (а и б), в результате проведенной работы было установлено, что внесение к клеточным культурам патентуемой фармкомпозиции приводило к уменьшению дыхательной активности клеток, что выявляется в снижении концентрации формазана на 55,6% у клеток линии SPEV-2 (фиг. 3а). Более интенсивная ответная реакция на введение патентуемой фармкомпозиции наблюдалась у клеток линии Нер-2 (фиг. 3б) - препарат вызывал уменьшение количества жизнеспособных клеток (концентрации формазана) на 84,6%, притом что раствор наночастиц селена снижал этот показатель у данной линии только на 34,6%. Учитывая полученные результаты, усиление цитотоксического действия при конъюгации селеновых наночастиц с силимарином в патентуемой фармкомпозиции можно объяснить синергетическим эффектом в результате конъюгирования этих компонентов.
Опираясь на полученные результаты, можно отметить, что разработанная лекарственная форма обладает ярко выраженными гепатопротекторными свойствами и по терапевтической эффективности превосходит известные препараты. Кроме того, отсутствие поверхностно-активных веществ в разработанной фармацевтической композиции снижает аллергенную реакцию препарата и делает его более безопасным по сравнению с препаратами-аналогами. Кроме того, патентуемая фармкомпозиция эффективна в отношении снижения жизнеспособности онкологических линий клеток.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА НА ОСНОВЕ СИЛИМАРИНА И НАНОСЕЛЕНА ОКАЗЫВАЮЩЕГО ИНГИБИРУЮЩЕЕ ДЕЙСТВИЕ НА РОСТ ОПУХОЛЕВЫХ КЛЕТОК | 2014 |
|
RU2549494C1 |
| ИНЪЕКЦИОННАЯ ЛЕКАРСТВЕННАЯ ФОРМА ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ЗАБОЛЕВАНИЙ ПЕЧЕНИ У ЖИВОТНЫХ | 2012 |
|
RU2504347C1 |
| Инъекционная лекарственная форма для лечения и профилактики заболеваний печени у животных | 2021 |
|
RU2800150C2 |
| СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА ВНУТРИКЛЕТОЧНОЙ ДОСТАВКИ БИОЛОГИЧЕСКИ АКТИВНЫХ НИЗКОМОЛЕКУЛЯРНЫХ СОЕДИНЕНИЙ, НА ОСНОВЕ НАНОЧАСТИЦ | 2014 |
|
RU2557987C1 |
| СРЕДСТВО ВНУТРИКЛЕТОЧНОЙ ДОСТАВКИ БИОЛОГИЧЕСКИ АКТИВНОГО ВЫСОКОМОЛЕКУЛЯРНОГО СОЕДИНЕНИЯ НА ОСНОВЕ НАНОЧАСТИЦ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2014 |
|
RU2541121C1 |
| ИММУНОСТИМУЛИРУЮЩАЯ КОМПОЗИЦИЯ ДЛЯ ЖИВОТНЫХ | 2012 |
|
RU2485964C1 |
| ГЕПАТОПРОТЕКТОРНАЯ И АНТИГЕПАТОТОКСИЧЕСКАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ ПЕЧЕНИ, ВКЛЮЧАЮЩИЙ ВВЕДЕНИЕ УКАЗАННОЙ КОМПОЗИЦИИ | 2008 |
|
RU2381800C1 |
| АНТИОКСИДАНТНОЕ СРЕДСТВО С ГЕПАТОПРОТЕКТОРНЫМ ЭФФЕКТОМ НА ОСНОВЕ НАНОСТРУКТУРИРОВАННОГО СЕЛЕНА И СПОСОБЫ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2013 |
|
RU2557992C1 |
| ФАРМАЦЕВТИЧЕСКАЯ ГЕПАТОПРОТЕКТОРНАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ | 2008 |
|
RU2391989C2 |
| КОМБИНИРОВАННОЕ СРЕДСТВО, СОДЕРЖАЩЕЕ УДХК, ГИМЕКРОМОН И СИЛИМАРИН (ВАРИАНТЫ) | 2017 |
|
RU2738444C2 |
Изобретение относится к химико-фармацевтической промышленности и представляет собой гепатопротекторную инъекционную фармацевтическую композицию на основе силимарина и наночастиц селена, включающую силимарин, дистиллированную воду, отличающуюся тем, что дополнительно содержит наночастицы селена, восстановленные из селенистой кислоты с образованием коллоидного селена, при этом в качестве восстановителя для коллоидного селена используют цистеин, или аскорбиновую кислоту, или тиосульфат натрия, или меркаптоэтанол, кроме того, содержит в качестве стабилизатора pH гидроксид натрия, или гидроксид калия, или аргинин, кроме того, содержит стабилизатор для силимарина, в качестве которого используют янтарную, или фумаровую, или яблочную, или лимонную, или щавелевую кислоту. Изобретение позволяет повысить терапевтическую активность и биодоступность фармацевтической композиции на основе силимарина, снизить побочные эффекты данного лекарственного препарата при терапевтических манипуляциях. 3 ил., 1 табл., 3 пр.
Гепатопротекторная инъекционная фармацевтическая композиция на основе силимарина и наночастиц селена, включающая силимарин, дистиллированную воду, отличающаяся тем, что дополнительно содержит наночастицы селена, восстановленные из селенистой кислоты с образованием коллоидного селена, при этом в качестве восстановителя для коллоидного селена используют цистеин, или аскорбиновую кислоту, или тиосульфат натрия, или меркаптоэтанол, кроме того, содержит в качестве стабилизатора РН гидроксид натрия, или гидроксид калия, или аргинин, кроме того, содержит стабилизатор для силимарина, в качестве которого используют янтарную, или фумаровую, или яблочную, или лимонную, или щавелевую кислоту, при следующем соотношении компонентов, масс. %:
| ИНЪЕКЦИОННАЯ ЛЕКАРСТВЕННАЯ ФОРМА ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ЗАБОЛЕВАНИЙ ПЕЧЕНИ У ЖИВОТНЫХ | 2012 |
|
RU2504347C1 |
| US 2010227826 A1, 09.09.2010 | |||
| АНТИОКСИДАНТНОЕ СРЕДСТВО С ГЕПАТОПРОТЕКТОРНЫМ ЭФФЕКТОМ НА ОСНОВЕ НАНОСТРУКТУРИРОВАННОГО СЕЛЕНА И СПОСОБЫ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2013 |
|
RU2557992C1 |
| WO 2016149685 A1, 22.09.2016 | |||
| WO 2017011471 A1, 19.01.2017. | |||
Авторы
Даты
2018-02-15—Публикация
2017-10-05—Подача