Область техники
Данное изобретение относится к областям медицины человека и ветеринарии, косметики и тканевой инженерии, в особенности к области систем высвобождения везикулярного типа, содержащих эпидермальный фактор роста (EGF) в их композиции. Везикулы по изобретению имеют улучшенную терапевтическую эффективность в отношении свободного EGF.
Предшествующий уровень техники
Системы для доставки лекарственного средства на основе везикулярных систем, обычно липосом, составленные из амфифильных молекул, которые включают терапевтически активное вещество, составляют одну из наиболее широко используемых систем в фармацевтической отрасли, так как они обеспечивают повышенную устойчивость для действующего начала, повышают его проницаемость через биологические мембраны и позволяют медленное высвобождение активного ингредиента без потребности в повторных введениях.
EGF является одним из основных факторов роста, который стимулирует пролиферацию клеток и подвижность во время тканевой регенерации. Он также помогает поддерживать тканевой гомеостаз посредством регулирования эпителиальной пролиферации клеток и миграции. Кроме того, EGF индуцирует ангиогенез, что обеспечивает нутритивную поддержку ткани (Hudson and McCawley, Microsc. Res. Tech. 1998, 43: 444-455; Koivisto et al., Exp. Cell Res. 2006, 312: 2791-2805; Liang et al., Wound Repair Regen. 2008, 16:691-698). Этот фактор роста имеет множество применений в фармацевтической области (Wong et al., Biotechnol. Genet. Eng. Rev. 2001, 18: 51-71; Girdler et al., Am. J. Clin. Oncol. 1995, 18: 403-406; Haedo et al., Rev. Esp. Enferm. Dig. 1996, 88: 409-413; Majima, Ophthalmologica 1998, 212:250-256); в косметике (Hasegawa and Yamamoto, Mech. Ageing. Dev. 1992, 66: 107-114, Патент США №5,618,544) и в тканевой инженерии (Christopher et al., Biomacromolecules 2011, 12: 3139-3146).
Были разработаны EGF составы, использующие различные липосомальные системы. Некоторыми примерами является интеграция EGF в однослойные липосомы, содержащие фосфатидилглицерин (PG), фосфатидилхолин (PC) и холестерин (Brown et al., Ann. Surg. 1988, 208: 788-794). Также сообщалось о включении EGF в многослойные липосомы, содержащие PC, холестерин и гиалуроновую кислоту (Yerushalmi, et al., Arch. Biochem. Biophys. 1994, 313: 267-273) или содержащие холестерин и дипальмитоилфосфатидилхолин (DPPC) (Alemdaroğlu et al., J. Biomed. Mater. Res. A 2008, 85A: 271-283; Degim et al., Int. Wound. J. 2011, 8: 343-354). Другим классом липосом, о котором было сообщено, являются мультивезикулярные липосомы, содержащие диолеилфосфатидилхолин (DOPC), димиристоилфосфатидилглицерин (DMPG), холестерин и триолеин (Li et al., Arch. Pharm. Res. 2005, 28: 988-994). Но с другой стороны сообщалось о липосомах, которые содержат катионные липиды, конъюгированные с EGF (Kikuchi et al., Biochem. Biophys. Res. Commun. 1996, 227: 666-671); покрытые полиэтиленгликолем (ПЭГ) липосомы, которые также содержат холестерин и диолеилфосфатидилэтаноламин (DOPE) в комбинации с PC или DPPC (Li et al., Int. J. Pharm. 2003, 258: 11-19). Также было сообщено о липосомах, содержащих DPPC и лизофосфатидилхолин (LPC) (Saddi et al., The Angle Orthodontist 2008, 78: 604-609; Alves et al., Life Sci. 2009, 85: 693-699). EGF составы с применением липосомальных систем также были защищены патентами, такими как патент, раскрывающий гелевую композицию EGF/липосома, и способы, содержащие удерживание EGF в липосомах, содержащих нейтральные и отрицательно заряженные фосфолипиды (патент США No. 4944948); гелевая композиция липосом и способы, которые применяют отрицательно заряженные липосомы и EGF и включают в себя отрицательно заряженные липиды, такие как PG, PC и холестерин (международная заявка на патент No. WO 9009782). Другая заявка на патент относится к топическому нанесению EGF для предотвращения диабетической ампутации стопы, и в ней применяются липосомы, содержащие PC и дезоксихолат натрия. Эта заявка на патент ограничена применением любого типа липосом/ниосом EGF для местного лечения хронических ишемических повреждений диабетической стопы степеней IV и V (международная заявка на патент No. WO 2007/073704). В предшествующем уровне техники не была обнаружена интеграция EGF в везикулярные системы на основе холестерина и катионных поверхностно-активных веществ.
Традиционные способы получения липосом, такие как выпаривание тонких пленок (Agrawal et al., J. Liposome Res. 2005, 15: 141-155), дегидратация-регидрация (Kirby and Gregoriadis, Nat. Biotechnol. 1984, 2: 979-984), замораживание-оттаивание (Ristori et al., Biophys. J. 2005, 88: 535-547) и экструдирование (MacDonald et al., Biochim. Biophys. Acta 1991, 1061: 297-303) имеют некоторые недостатки. Некоторые из этих недостатков связаны с использованием больших количеств растворителей, которые трудно элиминировать впоследствии, или с высокими температурами, требуемыми для некоторых из этих способов, ограничивая их применением термически стабильных веществ. С другой стороны размер и наноструктурирование материала трудно контролировать, и эти способы имеют низкую воспроизводимость во время масштабирования (многостадийные способы). Другой проблемой в приготовлении липосомальных средств является их плохая устойчивость.
Обработка материалов сжатыми текучими средами (CFs) или плотными газами, как в жидком, так и в суперкритическом состоянии, в качестве растворителей, имела большие ожидания на академическом и промышленном уровнях, для приготовления микро- или наноструктурированных материалов, таких как зернистые материалы, везикулярные системы, композитные частицы, структурированные поверхности, и т.д., с большей структурной гомогенностью, чем была достигнута общепринятой обработкой (Holmes et al., Chem. Eur. J. 2003, 9: 2144-2150; Cooper, Adv. Mater. 2001, 13: 1111-1114; Cooper, Adv. Mater. 2003, 15: 1049-1059 и Woods et al., J. Mater. Chem. 2004, 14: 1663-1678). CF или плотный газ является веществом, которое при нормальных условиях давления и температуры существует в виде газа, но увеличением давления может быть конвертировано в жидкости или сверхкритические жидкие среды и быть использовано в качестве растворительной среды для химической и материальной обработки. Наиболее часто применяемым CF является диоксид углерода (CO2), классифицируемый как зеленый растворитель, так как он является нетоксичным, невоспламеняемым, легким в удалении, не оставляет остатков в частицах, является недорогим и легким в регенерировании. С ранних 90-х разработали ряд методологий, которые применяют CFs для приготовления тонкодисперсных материалов, с микро-, субмикро и наноразмерными размерами частиц (Jung и Perrut, J. Supercrit. Fluid, 2001, 20: 179-219). Сольватирующая сила CFs может быть модифицирована температурными и композиционными изменениями в случае общепринятых жидких растворителей и также посредством изменений давления, которые переносятся в растворах намного быстрее. Следовательно, эти способы осаждения в общем имеют возможность достижения очень высоких степеней пересыщения в очень короткие интервалы времени, стимулируя нуклеацию при росте кристалла и тем самым получение микро- или наночастиц с очень узким распределением размеров, при этом контролируя внутреннюю структуру и супрамолекулярную организацию.
Один из способов для получения микро- или наноструктурированных материалов с CFs является способом, называемым сброс давления экспандированного органического раствора DELOS-SUSP (Международная заявка на патент No. WO 2006/079889; патент No. EP 1843836; Cano-Sarabia et al., Langmuir 2008, 24: 2433-2437), который основан на сбросе давления органического раствора предварительно экспандированного посредством CF, генерируя или микро-, или нанодисперсую систему посредством упомянутого сброса давления. В этом способе CF действует как сорастворитель, при этом являясь полностью поддающимся смешению при некоторых условиях давления и температуры с органическим раствором растворенного вещества, которое должно быть стабилизировано в виде микро- или нанодисперсной системы. Указанная стабилизация достигается в присутствии добавок в среду, обычно водную, в которую происходит сброс давления экспандированного раствора. Добавки могут являться эмульгаторами, ионными и не ионными детергентами, поверхностными агентами, коллоидными стабилизаторами и протекторами. Применяя этот способ могут быть получены микро- и/или нанодисперсные системы, такие как липосомы, эмульсии или суспензии. Липосомы или везикулы составлены из холестерина и других мембранных агентов, таких как фосфолипиды и поверхностно-активные вещества, и для их приготовления требуется растворение холестерина и/или других липидов в экспандированном органическом растворе и сброс его давления в водный раствор поверхностно-активного вещества.
Для возможной включения активных веществ в везикулы или липосомы посредством DELOS-SUSP и для генерирования соответствующих везикул требуется растворить активный ингредиент в исходном экспандированном растворе или в водном растворе, в который осуществляется сброс давления указанного экспандированного раствора, и в обоих случаях это растворение должно быть осуществлено в присутствии липидов, детергентов или поверхностно-активных агентов.
Среди катионных поверхностно-активных веществ широко применяются в фармацевтике и косметике вещества типа четвертичного аммония (QUATs). В фармацевтической области они были применены посредством топического, офтальмического, орального, буккального и назального путей. Ранее сообщалось о приготовлении нановезикул холестерин:цетилтриметиламмония бромид (CTAB) с применением технологии DELOS-SUSP. Один пример включения водорастворимых соединений посредством этой технологии описан в источнике "Липосомы и другие везикулярные системы: структурные особенности, способы приготовления и применение в наномедицине" (Progress in Molecular Biology and Translational Science, Elsevier, 2011, vol.104, pp. 1-52), где везикулы холестерин:CTAB применены в качестве носителя для инкапсуляции и введения антибиотика гентамицина. Необходимо подчеркнуть, что сообщаемые инкапсуляции гентамицина являются очень низкими (<2%). Этот тип носителя никогда не применялся для включения белков. Известно, что ионные детергенты являются агентами, которые вызывают денатурирование белка (Akin et al., Anal. Biochem. 1985, 145:170-176; Andersen etal., J. Mol. Biol. 2009, 391: 207-226). Недавно с помощью рамановской спектроскопии было продемонстрировано денатурирование человеческого сывороточного альбумина после добавления CTAB (Vlasova and Saletsky, Laser Phys. 2011, 21: 239-244). Денатурация, как правило, сопровождается потерей функциональных свойств белка.
Вследствие всех вышеупомянутых причин все еще представляет интерес предоставление новых систем высвобождения EGF, легких в стандартизации, с высокой гомогенностью на структурном уровне и в их физико-химических свойствах, что улучшает фармацевтические и фармакологические свойства и/или увеличивает терапевтическую активность EGF.
Краткое описание изобретения
Данное изобретение относится к везикулам в качестве системы доставки лекарственного средства, которые содержат EGF, катионное поверхностно-активное вещество и холестерин или одно из его производных и имеют большую терапевтическую эффективность, чем ранее описанные системы.
Данное изобретение также относится к способу приготовления указанных везикул, содержащих EGF, катионное поверхностно-активное вещество и холестерин или его производные, который включает: a) приготовление водного раствора EGF и катионного поверхностно-активного вещества, b) растворение холестерина или одного из его производных в органическом растворителе, экспандированном с CF, c) синтез везикул сбросом давления раствора, полученного в результате стадии b), на раствор, полученный в результате стадии a).
Фармацевтическая композиция, характеризуемая содержанием везикул, которые включают в себя EGF, катионное поверхностно-активное вещество и холестерин или его производные, и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, также является задачей изобретения. Другой задачей изобретения является применение указанных везикул для получения лекарственных средств и косметических средств.
Фармацевтические композиции по этому изобретению, которые содержат везикулы EGF с другими компонентами, пригодны в качестве лекарственных средств для ускорения способа заживления диабетических язв стоп и других комбинированных ран, таких как среди прочего, венные язвы, язвы-пролежни, ожоги; для восстановления структур передней камеры в поврежденных глазах, при систематическом воспалении слизистой оболочки и во всех заболеваниях желудочно-кишечного тракта, для которых имеет место необходимость в регенерации слизистой оболочки и подслизистой оболочки. В частности, было обнаружено, что эти везикулы обладают значительно большей терапевтической эффективностью для заживления диабетических язв стоп и венных язв, чем везикулы, описанные в предшествующем уровне техники. Изобретение также относится к косметическому продукту, характеризуемому содержанием везикул EGF, катионного поверхностно-активного вещества и холестерина или его производных.
Краткое описание фигур
Фиг. 1. Схематическое представление оборудования для получения везикул, содержащих EGF, катионное поверхностно-активное вещество и холестерин или производное холестерина, где: C - Коллектор; H - Теплообменник; P - Насос; R - Реактор; V - Вентиль; RD - Разрывной диск; ST - Перемешиватель; FL - Фильтр; TI - Индикатор температуры; PI - Индикатор давления; PIC - Регулятор индикатора давления; F - Расходомер.
Фиг. 2. Распределение размеров частиц динамическим рассеянием света (DLS) везикул при сохранении постоянным соотношения CTAB:холестерин постоянным при 1М:1М и варьировании соотношения EGF:холестерин (0 мкМ:1Μ (--°--), 5 мкМ:1Μ (--▼--), 15 мкМ:1Μ (--◊--), 25 мкМ:1Μ (--|--) и 40 мкМ:1Μ (--*--) (A); и при сохранении отношения бромид тетрадецилметиламмония (цетримид):холестерин постоянным при 1M:1Μ и варьировании соотношения EGF:холестерин (0 мкМ:1Μ (--*--), 5 мкМ:1Μ (--°--), 15 мкМ:1Μ (-*--), 25 мкМ:1Μ (-|-) и 40 мкМ:1Μ (--°--) (Β).
Фиг. 3. Изображения крио-трансмиссионной электронной микроскопии (Cryo-TEM) везикул EGF с композицией холестерин:CTAB:EGF (A), холестерин:цетримид:EGF (B), композиции холестерин:бензалкония хлорид (BKC):EGF (C) и β-ситостерин:CTAB:EGF (D) с QUATs:холестерин или β-ситостерин с соотношением 1M:1M и EGF:холестерин или β-ситостерин с соотношением 5 мкМ:1М.
Фиг. 4. Специфическая биологическая активность различных средств EGF в испытании пролиферации клеток, где подвергаются сравнению свободный EGF, липосомы DPPC:холестерин (с соотношением DPPC:холестерин 1M:1M и EGF:холестерин 25 мкМ:1М) и везикулы CTAB:холестерин (A) и везикулы цетримид:холестерин (B) при сохранении соотношения QUATs:холестерин 1M:1M постоянным и варьировании соотношения EGF:холестерин (5 мкМ:1М, 15 мкМ:1Μ и 25 мкМ:1М).
Фиг. 5. Профиль протеолитической деградации после подвергания воздействию трипсина при 37°C в течение различных временных интервалов свободного EGF и различных везикулярных средств при сохранении постоянным соотношения CTAB:холестерин (A) и соотношения цетримид:холестерин (B) при 1M:1M и варьировании соотношения EGF:холестерин (5 мкМ:1Μ, 15 мкМ:1Μ и 25 мкМ:1Μ).
Фиг. 6. Фотографии развития заживления диабетической язвы стопы, соответствующие пациенту JLG в начале лечения(A), после 4 недель (B) и 8 недель (C) лечения с составом для топического распыления, содержащим везикулы с соотношением CTAB:холестерин 1M:1Μ и соотношением EGF:холестерин 5 мкМ:1Μ с концентрацией эквивалента EGF 15 мкг/мл.
Фиг. 7. Фотографии развития заживления диабетической язвы стопы, соответствующие пациенту ZEM в начале лечения(A), после 4 недель (B) и 8 недель (C) лечения. В течение первых 4 недель лечение осуществляли посредством инфильтрации с парентеральным составом, содержащим везикулы с соотношением BKC:холестерин 1M:1Μ и соотношением EGF:холестерин 5 мкМ:1Μ, с эквивалентной концентрацией EGF 75 мкг/мл. Другие 4 недели, до завершения 8 недель, лечение осуществляли посредством применения состава для топического распыления, содержащего везикулы с соотношением CTAB:холестерин 1M:1Μ и соотношением EGF:холестерин 5 мкМ:1Μ с эквивалентной концентрацией EGF 15 мкг/мл.
Подробное описание изобретения
Данное изобретение предоставляет везикулы, которые характеризуются содержанием эпидермального фактора роста (EGF), катионного поверхностно-активного вещества и холестерина или его производных. В варианте осуществления изобретения катионное поверхностно-активное вещество является веществом типа четвертичного аммония.
В контексте данного изобретения термин "EGF" относится к любому варианту молекул EGF, который сохраняет их биологическую активность; например, к укороченным на C-конце молекулам (Calnan et al., Gut 2000, 47: 622-627) или укороченным N-конце молекулам (Svodoca et. al., Biochim. Biophys. Acta 1994, 1206: 35-41; Shin et al., Peptides 1995, 16: 205-210). EGF могут быть получены технологией рекомбинантных ДНК с применением дрожжей, подобных Saccharomyces (Valdés et al., Biotecnol. Apl. 2009, 26: 1-9) или Pichia pastoris (Research Journal of International Studies 2009, 10:36-46); с применением бактерий, таких как Escherichia coli (Yoon et al., Biotechnol. Bioprocess Eng. 1997, 2: 86-89; Abdull Razis et al., Appl. Biochem. Biotechnol. 2008, 144: 249-261); или способами химического синтеза (Shin et al., Peptides 1995, 16:205-210). Объект EGF по изобретению также содержит любой вариант, полученный ранее описанными способами, после того как он будет модифицирован любой процедурой из предшествующего уровня техники, такой как: аминокислотная замена (Shiah et al., J. Biol. Chem. 1992, 267: 24034-24040; Lahti et al., FEBS Lett. 2011, 585: 1135-1139; Международная заявка на патент No. WO 2007/065464) и конъюгация с полиэтиленгликолем (Thomas et al., Bioconjugate Chem. 2001, 12: 529-537; Lee et al., Pharm. Res. 2003, 20: 818-825), или любым другим способом химической или генетической модификации.
Термин "катионное поверхностно-активное вещество" относится к поверхностно-активным веществам с по меньшей мере одним положительным зарядом в молекуле и также включает в себя комбинацию одного или более катионных поверхностно-активных веществ. Например, в соответствии с данным изобретением могут быть применены катионные поверхностно-активные вещества типа соли третичного амина, соли четвертичного аммония и алкиламмония в насыщенных и ненасыщенных гетероциклических соединениях.
В изобретении термин "катионное поверхностно-активное вещество типа четвертичного аммония (QUATs)" относится к соли четвертичного аммония, в которой по меньшей мере один азотный заместитель является длинной цепью. Соединения, такие как CTAB, цетримид и BKC или их смесь, включены в состав QUATs. В предпочтительном варианте осуществления данного изобретения применяемое катионное поверхностно-активное вещество является поверхностно-активным веществом, приемлемым в фармацевтике. QUATs, также как и остальные катионные поверхностно-активные вещества, могут быть получены из коммерчески доступных источников с фармацевтическими и косметическими уровнями качества.
В данном изобретении термин "везикулы" относится к коллоидальным микрочастицам и наночастицам, которые имеют размер между 25 нм и 5 мкм и образуются одним или более бислоев амфифильных молекул, которые содержат водную фазу. В одном варианте осуществления изобретения везикулы имеют молярное соотношение катионного поверхностно-активного вещества к холестерину (или его производным) в пределах от 10M:1Μ до 1M:5Μ и молярное соотношение EGF к холестерину (или его производным), которое находится в пределах от 0,5 мкМ:1Μ до 100 мкМ:1М.
Термин "производные" холестерина в данном изобретении относится к молекулам семейства стероидов, обычно полученных из молекулы-предшественника холестерина и имеющих липофильный характер.
В одном варианте осуществления изобретения везикулы, содержащие EGF, характеризуются тем, что имеют однослойную структуру и приблизительный средний размер между 25 и 500 нм, предпочтительно между 50 и 300 нм. В конкретном варианте осуществления изобретение относится к везикулам, в которых EGF включен в бислой везикул. Приблизительный размер и морфологию везикул оценивают посредством Cryo-TEM и распределение размера везикул характеризуется посредством DLS.
Неожиданно, везикулы по изобретению продемонстрировали значительное возрастание биологической активности EGF (измеренной in vitro) по сравнению со свободным EGF и EGF в липосомах холестерин:DPPC. Кроме того, такие везикулы способны к защите EGF от повреждения протеазой, что является очень важной особенностью для достижения достаточной биодоступности EGF в месте воздействия; тем самым увеличивая его терапевтическую эффективность.
В данном изобретении впервые были синтезированы везикулы EGF, которые улучшают некоторые из фармацевтических и фармакологических свойств этого фактора роста, такие как его активность и устойчивость. Было продемонстрировано, что степень включения EGF в структуру везикул остается стабильной в течение по меньшей мере одного года. Дополнительно, они могут повышать проницаемость через биологические мембраны.
Везикулы по изобретению имеют дополнительное преимущество противомикробного и противогрибкового эффекта, который является желательным в композиции, применяемой в лечении комбинированных ран и других поражений, подверженных лечению с EGF.
В варианте осуществления изобретения везикулы, содержащие EGF, получены посредством технологии CF. В конкретном варианте осуществления технология CF, которую применяют для получения везикул, включает в себя способ, содержащий a) приготовление водного раствора EGF и катионного поверхностно-активного вещества, b) растворение холестерина или его производных в органическом растворителе, экспандированном с CF, и c) синтез везикул сбросом давления раствора, полученного в результате стадии b), на растворы, полученные в результате стадии a). В предпочтительном варианте осуществления катионное поверхностно-активное вещество, применяемое на стадии a), является веществом типа четвертичного аммония.
Изобретение также предоставляет способ приготовления везикул, которые содержат EGF, катионное поверхностно-активное вещество и холестерин или его производные, характеризуемый содержанием следующего: a) приготовление водного раствора EGF и катионного поверхностно-активного вещества, b) растворение холестерина или его производных в органическом растворителе, экспандированном с CF, и c) синтез везикул сбросом давления раствора, полученного в результате стадии b), на раствор, полученный в результате стадии a). В одном варианте осуществления изобретения вышеописанный способ включает в себя катионное поверхностно-активное вещество типа четвертичного аммония.
В одном варианте осуществления изобретения органический растворитель на стадии b) вышеупомянутого способа является растворителем, выбранным из группы, образованной одноатомными спиртами, такими как: этанол, метанол, 1-пропанол, 2-пропанол, 1-бутанол, 1-гексанол, 1-октанол и трифторэтанол; полиатомные спирты, такие как: пропиленгликоль, ПЭГ 400 и 1,3-пропандиол; кетоны, такие как ацетон, метилэтилкетон и метилизобутилкетон; этилендиамин, ацетонитрил, этилацетат и их смеси. В любом случае, какой бы ни была природа органического растворителя, липидный компонент должен являться растворимым в нем и дополнительно указанный растворитель обязательно должен поддаваться смешению c CF и водой. Кроме того, выбранный органический растворитель должен иметь относительно низкую токсичность.
Относительная концентрация EGF и поверхностно-активного вещества в исходном буферном растворе и концентрация холестерина в органическом растворителе определяются требуемым соотношением холестерин:катионное поверхностно-активное вещество:EGF в итоговой везикуле. В целом, соотношение холестерин:катионное поверхностно-активное вещество:EGF может влиять на физико-химические и биологические свойства различных полученных везикул.
В другом варианте осуществления изобретения CF, применяемый в способе, описанном ранее, представляет собой компонент, выбранный между CO2, этаном, пропаном, гидрохлорфторуглеродами (например, CFC-22) и гидрофторуглеродами (например, HFC-134A). Предпочтительно, CF на стадии b) представляет собой CO2, считаемый экологическим растворителем, так как он является нетоксичным, невоспламеняющимся, некорродирующим, не является вредным для окружающей среды и кроме того является широко распространенным в природе.
В одном варианте осуществления изобретения способ приготовления EGF везикул выполняется в устройстве, показанном на фиг. 1. Оно состоит из реактора высокого давления (R), в который добавляется раствор холестерина в этаноле в концентрации (C1) при атмосферном давлении и рабочей температуре (T=TW). На второй стадии, сжатый CO2 добавляется до достижения рабочего давления (P=PW), при этом вырабатывая объемное расширение раствора до молярной доли XCO2. Добавление осуществляется через вентиль V-1 с применением насоса P1 при сохранении остальных вентилей закрытыми. Система поддерживается при давлении Pw и температуре Tw в течение установленного промежутка времени для обеспечения полной гомогенизации и теплового баланса. После этого времени V-4 открывают для соединения реактора R с фильтром FL, который был предварительно приведен под давление с N2 до Pw при сохранении остальных вентилей закрытыми. Открытие V-6 позволяет сброс давления объемно экспандированного раствора на водный раствор EGF с концентрацией (C2) и поверхностно-активное вещество с концентрацией (C3), прокачанные через P2. В этой итоговой стадии поток N2, добавляемый через V-2 при Pw, применяется в качестве поршня для продавливания экспандированного раствора и поддержания постоянного давления внутри реактора во время стадии сброса давления. Наличие фильтра FL позволяет сбор любого осадка, который может образоваться во время способа. Сформированные везикулы собирают в контейнер C и впоследствии хранят в стеклянных флаконах при 4°C. Когда сброс давления окончен, V-6 и V-2 закрывают и происходит сброс давления оборудования посредством повторного открытия V-6.
В одном варианте осуществления изобретения взаимоотношение между количеством CF и органического растворителя соответствует молярной доле CF приблизительно от 0,3 до 0,95; предпочтительно от 0,5 до 0,8. В конкретном варианте осуществления растворение холестерина (или его производных) в CF выполняется в реакторе при давлении Pw приблизительно от 1 до 30 МПа и Tw приблизительно от 10 до 70°C. Предпочтительно приблизительная температура реактора составляет между 10 и 50°C.
В способе по изобретению EGF растворяют в водном растворе, содержащем катионное поверхностно-активное вещество, концентрация которого выше его критической концентрации мицеллообразования.
Неожиданно, везикулы холестерин:QUATs:EGF, синтезированные с применением способа, описанного выше, имеют выходы включения EGF в везикулу очень близкие к 100%, что значительно выше, чем ожидаемые выходы для включения любой растворимой в воде молекулы, принимая во внимание ранее сообщаемые результаты для гентамицина. Эти выходы везикул холестерин:QUATs:EGF также заметно выше, чем полученные для включения других белков со структурными свойствами, подобными EGF, как растворимый в воде белок альбумин бычьей сыворотки (БСА). Это происходит даже, когда ранее описанная процедура DELOS-SUSP применяется для указанного включения БСА, при этом получен выход включения только 42%.
Более того, также неожиданным образом эти выходы включения EGF в везикулы холестерин:QUATs были однозначно больше, чем выходы, полученные для везикул холестерин:DPPC:EGF, даже если для их приготовления применяется способ DELOS-SUSP.
Другим аспектом данного изобретения является фармацевтическая композиция, содержащая везикулы, содержащие EGF, катионное поверхностно-активное вещество и холестерин или его производные и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество. Фармацевтически приемлемое вспомогательное вещество или вспомогательные вещества, которые формируют часть фармацевтической композиции по данному изобретению, могут усилить активность везикулы. Альтернативно, они могут содействовать манипулированию и обработке композиции по данному изобретению. Везикулы EGF по данному изобретению могут быть сформулированы в нескольких фармацевтических формах, таких как инъецируемая, спрей, гели, вязкие растворы, кремы, мази, трансдермальные пластыри, депо, ингаляционные составы и другие известные специалисту в данной области.
Разнообразные вспомогательные вещества могут быть смешаны во время синтеза везикул по этому изобретению или после этого для образования подходящего материала для вышеупомянутой формы дозировки. Обычно вспомогательные вещества; такие как солюбилизаторы или растворители, поверхностно-активные вещества, pH модификаторы, антиоксиданты, разбавители, матричные системы, комплексообразующие агенты, загустители, диспергаторы, увлажнители, красители, ароматизаторы, консерванты, усилители проницаемости и другие могут быть применены для обычных целей и в типичных количествах без воздействия на характеристики композиции по данному изобретению, как известно специалисту в данной области (Remington’s Pharmaceutical Sciences (1995)). Дополнительные примеры вспомогательных веществ, которые могут быть применены в фармацевтических составах везикулы EGF можно найти в Handbook of Pharmaceutical Excipients (6th edition).
В варианте осуществления данного изобретения фармацевтическая композиция имеет форму для контролируемого или пролонгированного высвобождения. Формы пролонгированного или контролируемого высвобождения обычно включают в себя матричные системы, ионообменные смолы или индивидуальные барьеры для контроля диффузии везикул EGF.
В одном варианте осуществления изобретения приготовление фармацевтических композиций везикул EGF обусловлено способом концентрации-диафильтрации с применением устройства, известного в этой технической отрасли. Фармацевтические композиции изобретения могут быть введены разнообразными путями, среди них: системный, внутриочаговый, мукозальный, топический, трансдермальный, офтальмический или в виде ингаляционного состава.
В другом аспекте данное изобретение содержит применение везикул EGF, катионного поверхностно-активного вещества и холестерина или его производных в получении лекарственного средства. В варианте осуществления изобретения указанное лекарственное средство предназначено для лечения заболеваний, для которых требуется содействие способам заживления и тканевой регенерации в любом млекопитающем виде; где катионные поверхностно-активные вещества, холестерин и EGF, образующие указанные везикулы, приемлемы в фармацевтике. В предпочтительном варианте осуществления млекопитающее является человеком.
Указанное медицинское применение содержит введение эффективного количества указанных везикул для лечения заболевания, для которого требуется экзогенное введение EGF для регулирования способов пролиферации, роста и миграции эпителиальных клеток или для индуцирования ангиогенеза. В целом, считается, что эффективная концентрация для введения везикул EGF по данному изобретению (или композиции, содержащей их) должна составлять от 1,0 до 200 мкг/мл эквивалентов EGF, предпочтительно от 5,0 до 100 мкг/мл эквивалентов EGF в расчете на введение. Объем и частота введения зависит от типа повреждения, его размера и применяемого устройства для введения, как хорошо известно специалистам в данной области. Также может являться подходящим введение требуемой дозы в двух, трех, четырех или более частей дозы в соответствующие интервалы в течение дня.
Точная дозировка и частота введения зависит от конкретного состояния, подвергаемого лечению и его тяжести, возраста, веса, пола, степени заболевания и общего физического состояния пациента, также как и от каких-либо других сопутствующих лекарственных средств, вводимых индивиду, как хорошо известно специалистам в данной области. Дополнительно, очевидно, что эффективное суточное количество может снижаться или возрастать в зависимости от того, как пациент отвечает на лекарственное лечение и/или оценки, сделанной врачом, который прописал лекарственное средство по данному изобретению. Таким образом, суточные эффективные количества, приведенные выше, должны считаться указаниями или рекомендациями.
В одном варианте осуществления изобретения лекарственное средство, произведенное с везикулами по изобретению, применяется для лечения комбинированных ран любой периферический мягкой ткани. В конкретном варианте осуществления комбинированная рана является диабетической язвой стопы. В другом конкретном варианте осуществления лекарственное средство применяется для лечения венных язв, язв-пролежней или ожогов.
В другом варианте осуществления изобретения лекарственное средство применяется для лечения заболевания, такого как синдром расстройства дыхания у взрослых. Лекарственное средство, произведенное с везикулами по изобретению, также пригодно для лечения поражений пищеварительного тракта, таких как язвенный колит, дуоденальные язвы и дистальный колит. В другом варианте осуществления лекарственное средство применяется для лечения поражения глаза.
Косметический продукт, характеризуемый содержанием везикул EGF, катионного поверхностно-активного вещества и холестерина или его производных и по меньшей мере одного приемлемого вспомогательного вещества для косметики или дермальной фармацевтики также является частью данного изобретения. В этом аспекте изобретения катионные поверхностно-активные вещества, холестерин (или его производные) и EGF являются приемлемыми в фармацевтике и косметике. Везикулы EGF по данному изобретению могут быть сформулированы в разнообразные косметические или дермальные фармацевтические формы в виде твердых, жидких и полутвердых форм, таких как и без ограничения ими: инъекции, распыляемые спреем жидкости, гели, кремы, множественные эмульсии, водные дисперсии, виды молочка, бальзамы, лосьоны, пены, сыворотки, мази, трансдермальные пластыри, обтирания, депо, благоухания, порошки, пластинки, ингаляционные составы и тому подобное, во всех случаях, включая ополаскивающие и стойкие составы.
В целом, косметическая или дермальная фармацевтическая композиция изобретения может содержать вспомогательные вещества, такие как, но без ограничения ими, солюбилизаторы или растворители, поверхностно-активные вещества, pH модификаторы, антиоксиданты, разбавители, матричные системы, комплексообразующие агенты, загустители, диспергаторы, увлажнители, гелеобразующие полимеры, загустители, смягчители, стабилизаторы, поглотители запаха, хелатирующие агенты, растительные экстракты, эфирные масла, экстракты из морских водорослей, агенты из способа биоферментации, минеральные соли, клеточные экстракты и солнечные фильтры (фотозащитные агенты органической или минерально природы, активные против A и/или Β ультрафиолетовых лучей), пигменты или красители, ароматизаторы, консерванты, усилители проницаемости и другие, и их смеси, при условии, что они физически и химически совместимы с другими компонентами композиции по данному изобретению. Эти вспомогательные вещества могут быть применены для обычных целей в типичных количествах без воздействия на характеристики композиции по данному изобретению, как известно специалисту в данной области (дополнительные примеры описаны в CTFA Cosmetic Ingredient Handbook, Twelfth Edition (2008)). Такие дополнительные адъюванты могут иметь синтетическое или натуральное происхождение, как например растительные экстракты или могут происходить из способа биоферментации.
Следовательно, применение везикул EGF, ранее описанное для получения косметического продукта, также является задачей данного изобретения. В варианте осуществления изобретения косметический продукт предназначен для предотвращения одряхления и старения кожи.
Примеры
Следующие примеры продемонстрированы в иллюстративных целях и не должны рассматриваться в качестве ограничений изобретения.
Пример 1. Синтез везикул холестерин:DPPC:EGF с применением технологии сжатой текучей среды
Сначала раствор 12 мг холестерина и 24 мг DPPC в 1,2 мл этанола вводили в реактор высокого давления в объеме 6 мл при атмосферном давлении и температуре (Tw=35°C). Добавляли сжатый CO2, вызывая объемное расширение раствора до достижения молярной доли XCO2=0,7 и рабочего давления Pw=10 МПа. Систему оставляли при перемешивании в течение приблизительно 60 минут при 10 МПа и 35°C, до достижения полной гомогенизации и теплового баланса. В конечном счете давление экспандированного органического раствора снижалось от рабочего давления до атмосферного давления на 24 мл водного раствора EGF с требуемой концентрацией (между 15 мкМ и 40 мкМ). В этом последнем этапе поток N2 при 10 МПа применяется в качестве поршня для продавливания объемного экспандированного раствора для поддержания постоянного рабочего давления в реакторе во время сброса давления.
Впоследствии, везикулы переносили в герметически запаиваемый контейнер и хранили вплоть до применения при 5±3°C.
В результате получали везикулы DPPC:холестерин (1:1) с EGF, включенным с концентрацией между 15 мкМ и 40 мкМ. Физические свойства, средний размер, распределение размеров частиц и Z-потенциал показаны в таблице 1. Средний размер, распределение размеров частиц и Z-потенциал определяли посредством DLS.
Можно увидеть, что разнообразные средства везикул не имеют проблем, связанных с кратковременной устойчивостью и имеют относительно маленький средний размер и коэффициент полидисперсности (PDI), что делает их привлекательными с фармацевтической точки зрения. Однако, абсолютный Z-потенциал являлся очень маленьким (<+10 мВ), намного ниже значений, которые, как считается, позволяют коллоидальную устойчивость дисперсных систем, которые обычно имеют абсолютные значения выше 30 мВ (Carrion et al, J. Colloid. Interface Sci. 1994, 164: 78-87). Эта особенность указывает на то, что долговременная устойчивость этой везикулярной системы может быть сниженной.
Пример 2. Синтез везикул холестерин:CTAB:EGF с применением технологии сжатой текучей среды
Сначала раствор 76 мг холестерина в 2,88 мл этанола вводили в реактор высокого давления, который имеет объем 6 мл, при атмосферном давлении и рабочей температуре (Tw=35°C). Добавляли сжатый CO2, вырабатывая объемное расширение раствора до достижения молярной доли XCO2=0,7 и рабочего давления Pw=10 МПа. Для достижения полной гомогенизации и теплового баланса систему оставляли в состоянии покоя в течение приблизительно 60 минут при 10 МПа и 35°C. В заключение, давление в экспандированном органическом растворе было сброшено от рабочего давления до атмосферного давления на 24 мл раствора CTAB в воде mQ (C=2,83 мг/мл), содержащем EGF с требуемой концентрацией (между 1 и 40 мкМ). В этом последнем этапе поток N2 при 10 МПа применяли в качестве поршня для продавливания холестерина в раствор этанола для поддержания постоянного рабочего давления в реакторе во время сброса давления. Затем везикулы переносили в герметически запаиваемый контейнер и хранили вплоть до применения при 5±3°C.
Морфологию везикул оценивали с помощью cryo-TEM, в соответствии с процедурой, которая была описана ранее (Progress in Molecular Biology and Translational Science, Elsevier, 2011, vol.104, pp. 1-52).
Получали везикулы CTAB:холестерин (1:1) c EGF, включенным c концентрацией между 1 мкМ и 40 мкМ. Результаты для физических свойств, среднего размера и Z-потенциала показаны в таблице 2; распределение размеров частиц на фиг. 2A и размер и морфология с помощью cryo-TEM на фиг. 3A. Как можно увидеть в таблице 2, различные составы, с варьирующимися пропорциями EGF:холестерин, являлись стабильными. Z-потенциалы всех средств были позитивными и намного выше + 30 мВ, что прогнозирует повышенную долговременную устойчивость. Также может быть отмечено возрастание среднего размера и PDI с возрастанием пропорции EGF:холестерин. На Фиг. 2A наблюдали очень высокогомогенное распределение размера частиц, имеющих средний диаметр, не превышающий 200 нм. Фиг. 3A показывает, что относительно морфологии везикул, исследуемой с помощью cryo-TEM, преобладали сфероидальные формы с однослойной структурой. Упомянутые характеристики различных средств везикул делают их привлекательными с фармацевтической точки зрения.
(EGF:холестерин)
Пример 3. Синтез везикул холестерин:цетримид:EGF с применением технологии сжатой текучей среды
Эти везикулы синтезировали образом, подобным примеру 2, но в этом случае, применяли водный раствор цетримида с концентрацией 2,61 мг/мл. Получали везикулы цетримид:холестерин (1:1) с EGF, включенным c концентрацией между 1 мкМ и 40 мкМ. Результаты для физических свойств, среднего размера и Z-потенциала показаны в таблице 3; распределение размеров частиц можно наблюдать на Фиг. 2B, и размер и морфология с помощью cryo-TEM показаны на Фиг. 3B. Как можно увидеть в таблице 3, все средства являлись стабильными при маленьких средних размерах и значениях PDI. Средний размер, распределение размеров частиц и Z-потенциал определяли посредством DLS. Z-потенциал всех средств был позитивным и намного выше + 30 мВ, что прогнозирует высокую долговременную устойчивость. Фиг. 2B демонстрирует, что распределения размеров частиц являлись крайне однородными, и их средний диаметр не превышал 200 нм. Фиг. 3B демонстрирует, что преобладали сфероидальные формы с однослойной структурой в соответствии с cryo-TEM. Различные везикулярные средства также имеют особенности, которые делают их очень привлекательными с фармацевтической точки зрения.
(мВ) (±SD)*
Пример 4. Синтез везикул холестерин:BKC:EGF с применением технологии сжатой текучей среды
Эти везикулы синтезировали образом, подобным примеру 2, но в этом примере с одной стороны использовали раствор 81,46 мг холестерина в 2,88 мл этанола и с другой стороны использовали водный раствор 3,0 мг/мл BKC и EGF с требуемой концентрацией. Получали везикулы BKC:холестерин (1:1) с EGF, включенным c концентрацией 5 мкМ. Результаты для физических свойств, среднего размера и Z-потенциала показаны в таблице 4. Можно наблюдать, что средство везикул является стабильным и имеет относительно маленький средний размер и PDI. Средний размер, распределение размеров частиц и Z-потенциал определяли посредством DLS. Более того, подобно вышеупомянутым средствам везикул, которые содержали в их композиции катионное поверхностно-активное вещество типа четвертичного аммония, они имели позитивные значения Z-потенциала намного выше, чем + 30 мВ, что прогнозирует для них высокую долговременную устойчивость. Фиг. 3C демонстрирует, что преобладали сфероидальные формы с однослойной структурой в соответствии с исследованием везикулярной морфологии, выполненным с помощью cryo-TEM. Эти везикулы также имеют свойства, которые делают их очень привлекательными с фармацевтической точки зрения.
(мВ) (±SD)*
Пример 5. Синтез везикул холестерин:CTAB:BSA с применением технологии сжатой текучей среды
Эти везикулы синтезировали образом, подобным примеру 2, в этом случае белок БСА использовали в водном растворе. Получали везикулы CTAB:холестерин (1:1) с БСА, включенным c концентрацией 0,37 мкМ, соответствующей 25 мкг/мл. Результаты для физических свойств, среднего размера и Z-потенциала показаны в таблице 5. Можно увидеть, что средство везикул является стабильным, и они имеют относительно маленький средний размер и PDI. Средний размер, распределение размеров частиц и Z-потенциал определяли посредством DLS. Они также проявляли позитивные значения Z-потенциала намного выше + 30 мВ, что прогнозирует высокую долговременную устойчивость.
(BSA:холестерин)
Пример 6. Определение эффективности включения белка в везикулы
Для определения эффективности включения EGF в везикулы применяли способ ультрацентрифугирования для отделения свободных везикул EGF. Из различных оцениваемых везикулярных суспензий отбирали 1,0 мл; помещали во флаконы и центрифугировали при высокой скорости (100000×g) в течение 60 мин при 4°C. Впоследствии определяли содержание белка супернатанте (свободный EGF) твердофазным иммуноферментным анализом (ELISA) (Vazquez et al., Biotecnol. Apl. 1990, 7: 42-49). Эффективность включения EGF в везикулы определяли по следующему выражению:
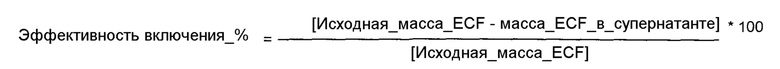
Результаты показаны в таблице 6. Показаны результаты эффективности включения EGF в везикулы с композицией DPPC:холестерин (полученной в примере 1), композицией CTAB:холестерин (полученной в примере 2) и композицией цетримид:холестерин (полученной в примере 3). Также оценивали эффект концентрации EGF (отношение EGF:холестерин). Значения высокой эффективности EGF-включения (почти 100%) можно наблюдать в системах QUATs:холестерин для широкого диапазона концентраций EGF (отношение EGF:холестерин). Однако, результаты эффективности включения EGF в систему DPPC:холестерин были очень низкими, так как максимальная эффективность включения не превышала 10% для наивысшей концентрации EGF.
В конкретном случае для везикул, содержащих БСА, следовали той же процедуре, как описано для EGF, за исключением того, что количественное определение белка выполняли способом бицинхониновой кислоты (Микро-BCA) (Smith et al., Anal. Biochem. 1985, 150: 76-85). Эффективность включения БСА в везикулы CTAB:холестерин, приготовленные, как описано в примере 5, составляла только 42±5%. При сравнении эффективности включения БСА с инкорпорацией EGF (показанной в таблице 6) в везикулы с той же композицией CTAB:холестерин можно наблюдать, что инкорпорация EGF была значительно выше.
Пример 7. Воспроизводимость синтеза везикул холестерин:CTAB:EGF технологией сжатой текучей среды
С целью тестирования робастности и воспроизводимости методологии, применяемой для синтеза везикул EGF, определяли средний размер частиц, PDI, Z-потенциал и эффективность включения EGF в нескольких партиях из 5 мкМ:1Μ и 15 мкМ:1Μ композиций EGF:холестерин, приготовленных в различные даты. В таблицах 7 и 8 показаны полученные результаты. Средний размер частиц, PDI и Z-потенциал определяли посредством DLS. Эффективность включения EGF определяли, как описано в примере 6.
(10/02/2012)
(Дата)
(29/10/10)
(24/02/11)
(28/02/11)
(29/06/11)
(30/06/11)
12/07/11
Из представленных в таблицах 7 и 8 значений можно сделать вывод, что везикулы имеют схожие свойства независимо от даты приготовления, что позволяет утверждать, что способ DELOS-SUSP является воспроизводимым и надежным для приготовления везикул EGF.
Пример 8. Увеличение масштаба синтеза везикул холестерин:CTAB:EGF с применением технологии сжатой текучей среды
Везикулы синтезировали как в примере 2, но во в 50 раз большем масштабе. Сначала раствор 3,8 г холестерина в 144 мл этанола вводили в реактор высокого давления объемом 300 мл при атмосферном давлении и рабочей температуре (Tw=35°C). Добавляли сжатый CO2, вырабатывая объемное расширение раствора до достижения молярной доли XCO2=0,7 и рабочего давления Pw=10 МПа. Для достижения полной гомогенизации и теплового баланса систему оставляли в покое в течение приблизительно 60 минут при 10 МПа и 35°C. В заключение, давление экспандированного жидкого раствора снижали от рабочего давления до атмосферного давления на 1200 мл раствора CTAB в воде mQ (C=2,83 мг/мл), содержащей EGF с требуемой концентрацией (5 и 12 мкМ). В этом последнем этапе применяли поток N2 с 10 МПа в качестве поршня для проталкивания холестерина в раствор этанола для поддержания постоянного рабочего давления внутри реактора во время сброса давления. Затем везикулы переносили в герметически запаиваемый контейнер и хранили вплоть до применения при 5±3°C. Получали везикулы CTAB:холестерин (1:1) с EGF, включенным c концентрацией 5 мкМ и 12 мкМ. Результаты физических свойств, среднего размера, PDI и Z-потенциала показаны в таблице 9. Средний размер частиц, PDI и Z-потенциал определяли посредством DLS.
Таблица 9 демонстрирует, что везикулы EGF:CTAB:холестерин стабильны в пропорциях 5 мкМ:1Μ и 12 мкМ:1М. Можно увидеть, что в увеличенном в масштабе способе полученные частицы имеют физико-химические характеристики, сравнимые с полученными в масштабе 6 мл (Пример 2). В обоих случаях средние размеры полученых частиц составляют менее 200 нм.
Пример 9. Биологическая активность везикул, оцениваемая по анализу пролиферации клеток в мышиных фибробластах A31 3T3
Биологическую активность везикул EGF, приготовленных как описано в примерах 1-3, определяли с применением анализа пролиферации клеток (Mire-Sluis and Page, J. Immunol. Methods 1995, 187: 191-199). В этом случае оценивали способность свободных EGF, липосом EGF и различных везикул, содержащих EGF, увеличивать пролиферацию клеток линии A31 3T3 мышиных фибробластов. Биологическую активность различных везикулярных суспензий оценивали нанесением соответствующего разбавления суспензии непосредственно на тестируемые клетки, таким образом, что абсорбция образцов попадала в пределы кривой для рабочего референсного материала, который предварительно откалибровали относительно междунароного референсного материала EGF 91/550, предоставленного National Institute for Biological Standards and Control (NIBSC, Соединенное Королевство).
С целью сравнения активности разнообразных средств везикул EGF со свободным EGF рассчитывали специфическую активность различных средств по результатам биологической активности, посредством следующего выражения:
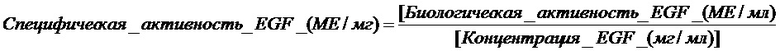
Биологическая активность измерена посредством описанного анализа, и концентрация белка приведена в виде номинального значения (в мг/мл) эквивалентной концентрации EGF в различных средствах везикул.
В качестве контроля в анализе пролиферации клеток использовали холостые везикулы (без добавления EGF) в соответствии с различными тестируемыми вариантами. В этих образцах при разбавлениях ниже, чем используемые для везикул с EGF, не было детектировано ни цитотоксического эффекта, ни возрастания пролиферации. Фиг. 4A демонстрирует, что везикулы EGF с композицией CTAB:холестерин проявляют повышенную специфическую активность по сравнению со свободным EGF и EGF в везикулах с композицией DPPC:холестерин. На Фиг. 4B, также наблюдали результат, подобный предшествующему, когда использовали цетримид вместо CTAB в композиции везикул, приготовленных посредством той же процедуры. Целью этой оценки было определение того, если биологическая функция EGF подвержена воздействию компонентов или способа синтеза указанных везикул. Однако, для везикул с композицией QUATs:холестерин было обнаружено неожиданное возрастание специфической биологической активности EGF.
Пример 10. Протеазная устойчивость EGF, интегрированного в везикулы QUATs:холестерин
Применяли везикулы EGF с композициями QUATs:холестерин (1:1), приготовленные как в примерах 2 и 3 по данному изобретению. Этот эксперимент выполняли для оценки способности везикул QUATs:холестерин к сохранению устойчивости интегрированного EGF против протеаз. Известно, что хронические раны, такие как диабетические язвы стопы, имеют протеолитическую окружающую среду, которая может воздействовать на биодоступность лекарственных средств, применяемых для их лечения (Bennett and Schultz, Am. J. Surg. 1993, 166: 74-81).
Для этой оценки использовали трипсин в качестве модельной протеазы. Ферментативную реакцию проводили в буфере Tris-HCl с pH 8,5 и концентрацией 20 мМ, содержащем конечную концентрацию трипсина 0,5 мкг/мл. Конечная концентрация свободного EGF или эквивалента EGF в различных везикулярных средствах составляла 125 пг/мл. Инкубирование образцов выполняли в течение промежутков времени 4, 8, 16 или 24 часов при 37°C. Трифторуксусную кислоту (TFA) с конечной концентрацией 0,1% (об./об.) использовали для остановки ферментативной реакции.
После остановки реакции образцы разбавляли в абсолютном метаноле до конечной концентрации метанола 80% (об./об.), перемешивали и центрифугировали в настольной центрифуге при 10000 об./мин в течение 5 минут. В заключение, супернатанты центрифугирования фильтровали через поликарбонатные фильтры с размером пор 0,2 мкм и затем вносили в систему ВЭЖХ (Merck, Германия). Стандарт EGF и образцы везикул анализировали с применением обращенно-фазовой колонки C18 (Vydac, Хесперия, Калифорния, США) и детектировали при 226 нм. Для того чтобы это выполнить применяли линейный градиент Β от 20% до 40% в течение 28 минут. Подвижная фаза A состоит из 0,1% TFA/вода, и подвижная фаза Β состоит из 0,05% TFA/ацетонитрил. Анализируемый инъекционный объем составлял 5,0 мл, что соответствует приблизительно 20 мкг EGF. Применяемая скорость потока составляла 1,0 мл/минута. Концентрацию EGF в образцах подсчитывали посредством интерполяции с применением калибровочной кривой EGF в области под главным пиком и концентраций EGF в известных образцах из хроматограмм, полученных при 226 нм. Процент EGF, остающегося в каждом образце после инкубирования с трипсином, рассчитывали с применением следующего выражения:
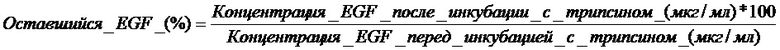
Фиг. 5A демонстрирует, что везикулы EGF с композицией CTAB:холестерин проявляют повышенную устойчивость против трипсина по сравнению со свободным EGF во время промежутка времени 24 часа. Подобным образом, Фиг. 5B, демонстрирует, что везикулы EGF с композицией цетримид:холестерин демонстрируют свойства, подобные описанным ранее. Не было обнаружено значительных различий среди различных оцениваемых загрузок EGF (отношение EGF:холестерин).
Результаты устойчивости к протеазам EGF, включенного в везикулы QUATs:холестерин, показали, что везикулы EGF обладают гораздо большей устойчивостью, чем свободный EGF.
Пример 11. Демонстрация противомикробной активности везикул QUATs:холестерин
Оценивали суспензии везикул, содержащих QUATs:холестерин, для определения того, демонстрировали ли они противомикробную активность. Эту активность определяли с применением способа агаровой диффузии (Manual of Clinical Microbiology. 6th ed. Washington, DC: ASM; 1995). Эффективность различных суспензий испытывали против грамположительных бактерий (Bacillus subtilis, Staphylococcus aureus), грамотрицательных бактерий (E. coli, Proteus mirabilis) и против грибов (Candida albicans, Aspergillus niger) с применением технологии лунок в нутриентных агаровых планшетах. Эти микроорганизмы идентифицировали, и они были предоставлены коллекцией микроорганизмов BCCM/LMG (Бельгия). Бактерии выращивали в течение ночи при 37°C в триптоновом соевом бульоне (Oxoid) и грибы инкубировали в течение 72 часов при 2°C в декстрозном бульоне Сабуро (Oxoid). Эти суспензии использовали в качестве инокулятов. Конечный инокулят с применением 100 мкл суспензии, содержащей 108 колоний-образующих единиц/мл бактерий или 104 спор/мл грибов, наносили на планшеты с триптоновым соевым агаром и декстрозным агаром Сабуро (Oxoid), соответственно. Диск (6 мм в диаметре) пропитывали каждой из различных везикулярных суспензий, которые должны быть тестированы. Ципрофлоксацин и флуконазол (100 мкг/мл) применяли в качестве позитивных контролей для бактерий и грибов, соответственно. Аналитические планшеты инкубировали при 37°C в течение 24 часов для бактерий и 28°C в течение 72 часов для грибов, в зависимости от того, какое время инкубирования требовалось для видимого роста. Таблица 10 демонстрирует, что различные везикулярные суспензии обладали противомикробным эффектом против грамположительных бактерий и грибов. В целом, микроорганизмы были более чувствительными к везикулярным суспензиям композиции цетримид:холестерин, чем к суспензиям CTAB:холестерин. Некоторые везикулярные суспензии демонстрировали противобактериальную и противогрибковую активность против некоторых микроорганизмов, сравнимую с ципрофлоксацином и флуконазолом, соответственно.
Пример 12. Получение жидкого распылительного состава, содержащего везикулы EGF
Везикулярную суспензию CTAB:холестерин (1:1) с композицией EGF:холестерин 5 мкМ:1Μ, полученную как в примере 2, с эквивалентной концентрацией EGF 25 мкг/мл разбавляли до эквивалентной концентрации EGF 15 мкг/мл в 10 мМ натрий-фосфатного буфера с pH 7,2. Этот конечный раствор также содержит 17% (об./об.) глицерина, 10% (об./об.) этанола, 0,02% (мас./об.) бутилгидрокситолуола (BHT), 0,18% (мас./об.) метилпарабена и 0,02% (мас./об.) пропилпарабена. Полученную в результате дисперсию фильтровали через ацетатцеллюлозные стерилизующие фильтры 0,2 мкм и распределяли в стеклянные флаконы в атмосфере азота.
Пример 13. Получение гелевого состава, содержащего везикулы EGF
Везикулярную суспензию цетримид:холестерин (1:1) с композицией EGF:холестерин 5 мкМ:1Μ, полученную как в примере 3, с эквивалентной концентрацией EGF 25 мкг/мл, разбавляли до эквивалентной концентрации 15 мкг/мл. Этот состав содержит 10 мМ буфер Трис-HCl pH 7,2 и карбомер (Карбопол 940) для конечной концентрации 1,25% (мас./об.); глицерин, 3% (мас./об.) и 20 мМ L-метионин. Кроме того, состав содержит 0,02% (мас./об.) BHT и в качестве противомикробного консерванта 0,18% (мас./об.) метилпарабена и 0,02% (мас./об.) пропилпарабена.
Пример 14. Получение парентерального состава, содержащего везикулы EGF
Везикулярную суспензию BKC:холестерин (1:1) с композицией EGF:холестерин 5 мкМ:1Μ, полученную как в примере 4, с эквивалентной концентрацией EGF 25 мкг/мл, вводили в ячейку ультрафильтрационного устройства с тангенциальным потоком Sartocon Slice 200. Для ультрафильтрации везикул использовали кассеты с мембранами Hydrosart® с размером пор 30 кДа. Способ концентрации-диафильтрации проводили при температуре 25±3°C и максимум падения давления на входе кассеты поддерживали ниже 4 бар. Во время способа суспензию концентрировали в 5 раз (конечная эквивалентная концентрация EGF 125 мкг/мл). После этапа концентрации везикулы разбавляли в 10 мМ натрий-фосфатном буфере с pH 7,2 до эквивалентной концентрации 75 мкг/мл EGF. Этот состав также содержит 20 мМ L-метионина и 0,02% (мас./об.) BHT. Полученную в результате суспензию фильтровали через стерилизующий фильтр 0,2 мкм и распределяли в стеклянные флаконы в атмосфере азота.
Пример 15. Сравнение фармакодинамического эффекта липосом и везикул, содержащих EGF, в животных моделях заживления ран
Экспериментальная методология
Для оценки фармакологической эффективности составов, приведенных ниже, создавали экспериментальную модель хронической язвы общей толщины на спине крыс. Использовали крыс Спраг-Доули весом 250-270 грамм, которых случайно распределяли для формирования 7 экспериментальных групп из 10 животных в каждой. Крыс внутрибрюшинно анестезировали с комбинацией кетамин/ксилазин в тщательно депилированный спинной отдел. Создавали две симметричные билатеральные ретроскапулярные язвы диаметром 8 мм и общей толщиной вплоть до верхнего пояса, который не задействовали. Начинали непосредственное нанесение триамцинолонацетонида в виде компрессов раз в день во время первых трех дней для остановки заживления и индуцирования характеристических изменений хронического характера. После 7 дней нарушение способа заживления и хронический характер язв подтверждали отсутствием зернистости ткани и гипертрофии эпителиальных краев. С этого момента начинали применение исследуемых видов лечения, как описано ниже.
Группа 1: без лечения (солевой раствор). Они подвергались тем же условиям обработки и манипулирования, что и остальные из группы. Стерильный физиологический солевой раствор наносили в распыленной форме.
Группа 2: пустые липосомы DPPC-холестерин.
Группа 3: пустые везикулы CTAB-холестерин.
Группа 4: пустые везикулы цетримид холестерин.
Группа 5: липосомы DPPC-холестерин, нагруженные с EGF c концентрацией 25 мг/мл.
Группа 6. Везикулы CTAB-холестерин, нагруженные с EGF с 25 мг/мл.
Группа 7. Везикулы цетримид-холестерин, нагруженные с EGF с 25 мг/мл.
Раны очищали ежедневно. После их очистки каждой группе вводили суспензию, указанную для каждого случая. Нанесение суспензии выполняли два раза в день в течение 14 дней. Экспериментальные системы обрабатывали местным нанесением суспензий везикул или липосом распылением. Всех животных подвергали вскрытию и отбору пробы через 14 дней после начала лечения, установленного для каждой группы. Образцы фиксировали в 10% нейтральном формалине и через 72 часа делили пополам, для дальнейшего включения в парафин. Применяемыми красителями являлись: гематоксилин-эозин, реакция с трихромом по Мэллори, ретикулярный метод Верхоева и Гомори. Образцы анализировали вслепую два независимых исследователя.
Результаты
Не было необходимости исключать контаминированные язвы; таким образом, 20 поражений использовали для каждой из 6 экспериментальных групп. Вкратце, было подтверждено, что все фармацевтические воспроизведения везикул EGF в значительной степени стимулировали общий способ заживления при сравнении с группами со свободными EGF везикулам (холостые), липосомами, нагруженными с EGF с 25 мкг/мл, и экспериментальной контрольной группой, обработанной с солевым раствором. Представленные данные отражают среднее двух независимых исследований, осуществленных в различное время. Для осуществления сравнений применяли U-критерий Манна-Уитни и критерий Стьюдента. Все параметры удовлетворяли критериям нормального распределения. Исследованные параметры и результаты показаны в таблице 11.
инфильтрат (степени 1-5)
Эксперимент демонстрирует, что везикулы CTAB-холестерин и цетримид-холестерин, нагруженные с EGF, оказывали мощный заживляющий эффект. Противовоспалительный эффект, наблюдаемый для групп 6 и 7, является заметным по сравнению с другими лечениями. Возможно, что эффект стимуляции фибро-ангиогенеза и сокращения связан с уменьшением баланса иммуно-воспалительных клеток, инфильтрирующих неодерму. Подобным образом, отмеченный эффект стимуляции эпителиальной миграции был доказан, посредством демонстрирования наличия расслоенного эпидермиса при помощи микроскопа. Ответ, полученный для группы, обрабатываемой с EGF-нагруженными липосомами, был меньше, чем эффект, детектированный в группах 6 и 7. Преимущество лечений, включающих суспензии везикул, нагруженных с EGF, наносимых группам 6 и 7, также выявляли в схожем эксперименте, где хронический характер в ранах был индуцирован местным нанесением метилглиоксаля.
Пример 16. Лечения на основе местного нанесения везикул, содержащих EGF пациентам с диабетическими язвами стопы
В клинических случаях большинство из подвергаемых лечению поражений превышали 90% вероятности требуемой ампутации в соответствии со шкалой Университета Техаса. Лечения вводили топически.
Общая характеристика подвергаемых лечению пациентов
Они имели сахарный диабет типов I или II с длительным развитием и подвергались лекарственному лечению с инсулином, сульфонилмочевиной или бигуанидами в качестве оральных гипогликемических агентов. Они имели личную историю плохого рубцевания, тогда как некоторые из них испытали предшествующую контралатеральную ампутацию. Все подвергаемые лечению повреждения нижних конечностей соответствовали ишемической или невропатической диабетической стопе. Поражения в целом классифицировали как хронические, комплексные и резистентные. Промежуток времени развития поражений варьировался между менее чем одним месяцем и семью годами. Размер подвергаемых лечению поражений варьировался между 20 и 80 квадратными сантиметрами. Глубина в некоторых поражениях задействовала даже надкостницу. С анатомической точки зрения подвергаемые лечению поражения находились в латеральной, пяточной и/или плюсневой областях. Всех пациентов, получавших первые лечения, помещали в больницу, поскольку процедуры экзереза проводятся под анестезией, а также необходима парентеральная антибиотическая терапия. При заживлении или общей зернистости раны указывающей на эпителиальную миграцию, пациентов подвергали амбулаторному режиму и последующему наблюдению в чередующиеся дни для обработки и лекарственного лечения. После полной эпителизации за каждым пациентом наблюдали в течение 12 месяцев после заживления. Для этой цели осуществляли оценку наступления рецидивов, регистрацию нежелательных реакций и оценку общего состояния пациента
гранулированный в течение 7 лет без признаков сокращения/эпителизации
Лечение проводили для каждого пациента как описано ниже:
Пациент JLG. Мужчина, возраст 56 лет, контролируемый с инсулином и без каких-либо других клинически проявляемых осложнений диабета. Имеет обширное фронтальное повреждение с ишемическим компонентом, что продолжается два года после трансплюсневой ампутации. Не имеют место зернистость и способы эпителизации после проведения противомикробной и озонной терапий в течение двух лет. После выполнения хирургической чистки и стимуляции краев, начинали лечение в чередующиеся дни с применением состава для топического распыления, описанного в примере 12, содержащего везикулы EGF:CTAB:холестерин. На восьмой неделе лечения была достигнута полная эпителизация повреждения. Результаты показаны на Фиг. 6.
Пациент OFS. Женщина, курильщик, страдающий ожирением, с историей кровяной гипертензии, контролируемой с оральными гипогликемическими агентами. Быстро прогрессирующий некроз мягкой ткани и сухожилий развивается от локального укуса насекомого. Выполняли хирургический экзерез некротического материала. Начинали противомикробную терапию и повреждение обрабатывали в чередующиеся дни. Так как через 14 дней после вмешательства способ зернистости был неактивным и медленным, начинали нанесение лечения через день с применением состава для топического распыления, описанного в примере 12, содержащего везикулы EGF:CTAB:холестерин. На восьмую неделю лечения была достигнута полная эпителизация повреждения.
Пациент AVL. Мужчина, возраст 52 года, контролируемый с глибенкламидом, невропатическое подошвенное повреждение стопы Шарко, которое гранулировано в течение 7 лет без признаков сокращения/эпителизации. После хирургической чистки и стимуляции краев, начинали лечение через день с применением топического состава в гелеобразной форме, описанного в примере 13, содержащего везикулы EGF:цетримид:холестерин. На восьмую неделю лечения была достигнута полная эпителизация повреждения.
Пациент PAT. Мужчина, возраст 47 лет, без других сопутствующих патологий или клинически проявляемых осложнений диабета, даже после того, как было детектировано периферическое артериальное заболевание. В результате локальной травмы развился трансметатарзальный абсцесс, который привел к колликвационному некрозу почти всего переднего отдела стопы с заметными воспалительными признаками. Выполняли трансплюсневую ампутацию и начинали антибиотическую терапию. В результате ампутации остаточное основание неудовлетворительно прогрессировало после 30 дней, при этом нужно было провести обширные санации раневой полости из-за наличия ишемических микробляшек; начинали вмешательство с топическим составом в гелеобразной форме, описанным в примере 13, содержащим везикулы EGF:цетримид:холестерин. Состав наносили на края и поверхность раны. Выполняли лечения через день и продолжали их в течение 4 недель. С первого введения наличие ишемических бляшек было исключено, и начинала развиваться продуктивная и кровянистая зернистая ткань, что позже облегчало нанесение свободного кожного трансплантата частичной толщины.
Пациент GMA. Мужчина, возраст 69 лет, контролируемый с инсулином и без клинически проявляемых осложнений диабета. Пациент имеет фронтальное остаточное повреждение, которое продолжается шесть месяцев после трансплюсневой ампутации. Не было способов зернистости и эпителизации после 3 месяцев противомикробной и озоновой терапии. После выполнения хирургической чистки лечение осуществляли через день с составом для топического распыления, описанным в примере 12, содержащим везикулы EGF:CTAB:холестерин. На шестой неделе лечения была достигнута полная эпителизация повреждения.
Пример 17. Лечения на основе инфильтрации везикул EGF у пациентов с диабетическими язвами стопы
В клинических случаях у большинства из подвергаемых лечению поражений вероятности требуемой ампутации превышали 90% в соответствии со шкалой Университета Техаса. Лечения вводили инфильтрацией. Общие свойства подвергаемых лечению пациентов соответствовали описанным в примере 16.
Парентеральный состав, на который ссылались в примере 14, в котором применяли везикулы EGF:BKC:холестерин, использовали для инфильтрирующего лечения. Сущность этого лечения состоит в внутриочаговой и внутренней инъекции в непосредственной близости от очага в края и основание повреждения в равноотстоящие точки. Материал вносили направлением иглы в основание язвы или глубины клина под углом 15-45 градусов, всегда включая дермально-эпидермальное соединение для стимулирования сокращения. В каждую точку наносили 100 и 1000 мкл в зависимости от клинического внешнего вида ткани и ее особенностей. Это выполняли от двух до трех раз в неделю. Поражения, подвергаемые лечению, и демографические свойства подвергаемой лечению популяции описаны в таблице 13. Во всех подвергаемых лечению случаях частичные или полные ампутации были предотвращены.
Лечение, проводимое для каждого пациента, описано ниже:
Пациент HCJQ. Ишемический, без дистального пульса и с окклюдированием из подколенного участка. Повреждение является латеральной ампутацией остаточного основания пятого пальца, демонстрирующей экспонированные капсулы и сухожилие с однозначным ишемическим некрозом. Повреждение классифицировали, как имеющее степень IV в соответствии со шкалой Вагнера. Его размер составлял 10×4 сантиметра. Лечение устанавливали на шестой день ампутации, когда в ампутационном остаточном основании были обнаружены клиническая атония и цианоз, прогрессирующие таким образом в течение пяти дней, несмотря на все систематическое и локальные фармакологические меры. Инфильтрации инициировали после хирургической санации некротического материала, предполагая улучшение локального микроокружения и содействие развитию зернистости ткани. Это впервые наблюдали после пятого сеанса инфильтрации. Пациент получал в общем 12 сеансов инфильтрации. Лечение содействовало наличию продуктивной и кровянистой зернистой ткани. Наблюдали интенсивную центрипетальную эпителиальную миграцию, хотя не имело место заметного сокращения краев. Через 38 дней после начала лечения повреждение было полностью эпителизовано без нужды в трансплантате. Не имело место острых или замедленных нежелательных реакций. В 12 месяцев в повреждении не было локальных рецидивов.
Пациент OFW. Невропатический, 81 день развития с трансплюсневым ампутационным остаточным основанием, классифицируемый как Вагнер IV во время поступления. Размер повреждения составлял 14×7 квадратных сантиметров. Дистальные пульсы прощупывались с ABI 0,9, несмотря на признаки дизестезии. Лечение устанавливали, когда в течение 42 дней локальных обработок и нанесения компрессов физиологического солевого раствора повреждение демонстрировало очень слабый зернистый ответ. Начинали инфильтрации и выполняли их ежедневно во время первой недели лечения, чтобы спасти локальные клетки. Впоследствии схему продолжали 2 раза в неделю в течение трех недель. С этой схемой была достигнута полностью продуктивная и кровянистая зернистость. Ткань покрывали с кожным трансплантатом частичной толщины, полученным из контралатеральной передней части бедра. Подобно пациенту, описанному ранее, лечение было хорошо переносимым и через год после повреждения было все еще эпителизовано.
Пациент JIFM. Женщина, бывший курильщик, возраст 61 год, ABI 0,4 в левой нижней конечности, демонстрирует некротизированный фасциит в плюсневой и подошвенной области стопы. Повреждение классифицируется как имеющее степень V по шкале Вагнера. Пациента подвергали лечению хирургически; осуществляли эксцизию всей некротической ткани и/или контаминированной мягкой ткани и кости. Устанавливали систематическую поливалентную антибиотическую терапию. Через 48 часов после операции проводили первое обследование повреждения, выполняли локальную чистку и начинали инфильтрирующее лечение с везикулами. В течение первых 10 дней, устанавливали режим лечения повреждения атакующими дозами везикул EGF, который впоследствии мог быть снижен до двух сеансов инфильтрации в течение 5 недель. Лечение помогало сохранить стопу без каких-либо других терапевтических альтернатив. Пациент имел нормальную походку и удовлетворительную моторику дистального отдела конечности.
Пример 18. Лечения на основе комбинированного нанесения инфильтрирующих и топических везикул EGF пациентам с диабетическими язвами стопы
В клинических случаях большинство из подвергаемых лечению поражений имели превышающую 90% вероятность требуемой ампутации в соответствии со шкалой, установленной Университетом Техаса. Лечения вводили, комбинируя топический и инфильтрирующий пути. Общие характеристики пациентов, подвергаемых лечению соответствуют описанным в примере 16.
Для комбинированного лечения сначала применяли инфильтрацию с применением парентерального состава, содержащего везикулы EGF (упоминаемые в примере 14). Впоследствии, для топического нанесения альтернативно применяли спрей, описанный в примере 12, и гель, описанный в примере 13.
Демографические характеристики подвергаемой лечению популяции и поражения описаны в таблице 14. Во всех подвергаемых лечению случаях были предотвращены частичная и полная ампутации.
Ниже описано лечение, осуществленное для каждого из пациентов.
Пациент AFG. Мужчина с долгой историей диабета и историей плохой приверженности лечению. Пациент демонстрирует подколенную окклюзионную модель с отсутствием дистальных пульсов. Повреждение дебютирует как фликтена, которая является контаминированной и быстро переходит к вызыванию некроза всех мягких тканей пяточного отдела. Во время первой хирургической обработки мягкие ткани удаляли. Через пять дней была необходима другая операция, которая привела к полному удалению костного материала. Устанавливали интенсивную поливалентную антибиотическую терапию и через 20 дней после первой операции начинали инфильтрирующее лечение с везикулами EGF. Устанавливали ежедневный сеанс лечения и локальной обработки в течение первых двух недель. За этим следовали обработки и лечение через день с нанесением топического гелеобразного состава, описанного в примере 13, содержащего везикулы EGF:цетримид:холестерин, приготовленные в соответствии с примером 3, на края и поверхность раны в течение следующих 8 недель. После 10 недель лечения повреждение было полностью эпителизовано.
Пациент LATR. Ишемический, с отсутствием дистальных пульсов и с макрососудистым заболеванием обеих нижних конечностей. ABI составляет 0,6, без возможности реваскуляризационной операции из-за кальцификации. Предшествующую контралатеральную ампутацию выполняли три года назад. Имеет тромбоз мелких артерий в четвертом и пятом пальцах, оба из которых ампутированы с обширным глубоким латеральным клином. Через две недели после операции ампутационное остаточное основание демонстрировало признаки атонии и было резистентным к зернистости. Следовательно, на третью неделю начинали лечение с везикулами первоначально инфильтрирующим лечением с дозой между 25 и 125 мкг EGF в расчете на инъекционную точку, расположенную на краях и основании хирургической области. Этот метод лечения применяли до тех пор, пока все полости и каналы не заполнились зернистой тканью, что происходит приблизительно после трех недель. Впоследствии было решено продолжать лечение топически, посредством применения геля с композицией, описанной в примере 13, содержащей везикулы EGF:цетримид:холестерин. Лечение выполняли на края и поверхность раны, особенно фокусируясь на кожноэпителиальной границе ран для стимулирования реэпителизации. Лечение выполняли через день до полной эпителизации на 5 неделе.
Пациент ZEM. Женщина, 57 лет возраст, с повреждением по Вагнеру степени III и признаками невропатии, подошвенное повреждение было гранулировано уже 7 лет, но не было признаков сокращения/эпителизации после хирургической чистки и стимуляции краев, инфильтрирующее лечение осуществляли с дозой 75 мкг эквивалента EGF в расчете на инъекционную точку, с применением состава, описанного в примере 14, содержащего везикулы EGF:BKC:холестерин, наносимого на края хирургической области. Этот метод лечения применяли в течение первых четырех недель через день. Впоследствии, было решено продолжать применение лечения через день с составом для топического распыления, описанным в примере 12, содержащим везикулы EGF:CTAB:холестерин. Везикулы EGF распыляли на края и поверхность повреждения; с особым акцентом на кожно-эпителиальную границу ран для стимулирования реэпителизации, лечение выполняли через день до полной эпителизации за 8 недель. Развитие способа заживления показано на Фиг. 7.
Пациент JLHB. Невропатический, развилось обширное инфекционное повреждение как последствие сухого ожога на стопе правой нижней конечности. Это в конечном счете привело к трансплюсневой ампутации, к чему добавился 10-сантиметровый латеральный клин. Лечение начинали с внутривенными антибиотиками и систематическими локальными обработками каждые 48 часов. Повреждение демонстрировало тенденцию к очень медленной грануляции и атонии краев через 20 дней после операции. Начинали инфильтрирующее лечение с везикулами, нагруженными с 75 мкг EGF через день в остаточном основании, а также в клине. На третью неделю лечения начинали нанесение через день с составом для топического распыления, описанным в примере 12, содержащим везикулы EGF:CTAB:холестерин, достигающим глубокой области латерального клина. Лечение комбинацией ускоряло общую зернистость и спонтанную эпителизацию над областью более чем 60 квадратных сантиметров.
Пример 19. Демонстрация терапевтической эффективности применения везикул EGF в летальной модели острого повреждения легких (ALI) или синдрома расстройства дыхания у взрослых (ARDS) у крыс.
Использовали самцов крыс Спраг-Доули с весом тела между 250 и 280 граммами. Повреждение легких индуцировали под общей анестезией (кетамин/ксилазин) интратрахеальным вливанием комбинации липополисахарида (LPS)-зимозана. Сразу после этого животных случайно распределяли на три экспериментальных группы из 12 животных в каждой.
Группа A: подвергаемые лечению с физиологическим солевым раствором.
Группа B: подвергаемые лечению со спреем EGF в физиологическом солевом растворе c концентрацией 25 мкг/мл/кг.
Группа C: подвергаемые лечению с везикулами холестерин:BKC:EGF, описанными в примере 4 с эквивалентной концентрацией 25 мкг/мл EGF и вводимыми также как в группе B.
Животным позволяли развиваться без какого-либо лечения до появления первых симптомов. Через шесть часов после нанесения LPS/зимозан крысы демонстрировали учащенное дыхание, связанное с форсированным выдыханием. С этой точки зрения животные демонстрировали артериальное насыщение PO2 65% и очевидный дыхательный ацидоз.
Следовательно, лечения начинали приблизительно через 8 часов после того, как токсины были влиты. Эксперимент был направлен на оценку эффекта лечения с обоими составами EGF исключительно в острой фазе ARDS. Лечения выполняли орофациальной маской, приспособленной от аппарата для ингаляционной терапии. Лечения выполняли два раза в день. Животных также подвергали лечению раз в день с гидрокортизонацетатом (10 мг/кг) в качестве вспомогательного лечения.
Через 72 часа после начала лечения исследование останавливали. Выживающих животных анестезировали и подвергали глубокой бронхоальвеолярной промывке в 5 мл стерильного солевого раствора для цитологического и биохимического исследования, а также отбору артериальной крови для определения параметров газа крови. Затем легкие инсуфлировали с 10 мл 10% нейтрального формалина и подвергали гистологии.
Таблица 15 демонстрирует результаты ежедневной смертности в расчете на группу. Как можно увидеть, лечение EGF распылением контролировало развитие острого повреждения легких. Заметно, что лучший эффект с точки зрения выживаемости был в группе, которая получала EGF, включенный в везикулы. Это предполагает, что пролонгированное занятие множества рецепторов EGF оказывает более стабильный фармакологический эффект, чем EGF в виде частиц в простом жидком аэрозоле в физиологическом солевом растворе.
Результаты бронхоальвеолярной промывки подтверждали защиту альвеолярной стенки и септального капиллярного эндотелия, предоставляемую EGF. Более того, наблюдали, что защита, предоставляемая лечением с EGF, включенным в везикулы, включает в себя улучшенную вентиляционную емкость, что выражается в большей доле артериального PO2 и поддерживании артериального pH очень близким к нормальному. Эти данные показаны в таблице 16.
Гистологический анализ легких каждой группы продемонстрировал, что лечение с EGF, в особенности в группе, получившей везикулярный состав, защищает паренхиму легких. Это было продемонстрировано наличием относительного сохранения соотношения альвеолы/перегородка, уменьшением отека проницаемой перегородочной стенки, а также наличием геморрагических очагов и эозинофильного материала в альвеолярном просвете. Меньшая воспалительная реакция была обнаружена у животных, подвергаемых лечению с составом включенного в везикулу EGF, по сравнению с получившими физиологический солевой раствор. Эксперимент позволяет сделать вывод, что вмешательство с везикулами холестерин:BKC:EGF, описанными в примере 4, оказывает более интенсивный/пролонгированный фармакологический эффект на паренхиму легких, подвергающуюся воздействию известных индукторов ALI. Предоставленная защита охватывает не только структурную целостность легкого, но также представляет существенную коррекцию функциональных параметров.
Пример 20. Добровольно-испытательное лечение с везикулами EGF тяжелобольного пациента с синдромом расстройства дыхания у взрослых (ARDS)
Описание случая: Пациент AGJ, мужчина, возраст 75 лет, без патологической медицинской истории, страдает от абдоминальной травмы, прогрессирующей в септический шок. ARDS происходит как относящееся к развитию осложнение, приводящее к вентиляционному затруднению с диспноэ и цианозом, резистентными к кислородной терапии, низкому насыщению (11 мм.рт.ст.) и изменениям pH крови. Радиологическое изображение демонстрирует ватоподобные пятна на паренхиме обоих легких. Было решено начать лечение с положительным давлением в конце выдоха и другими стандартными лекарственными средствами. Для того чтобы защитить паренхиму легких в острой экссудативной фазе, вводили везикулы холестерин:BKC:EGF, описанные в примере 4 с дозой 200 мг эквивалентов EGF на литр медицинского кислорода два раза в день. Эти меры позволяли благоприятное и прогрессирующее развитие пациента до нормальной, предотвращающей фиброзирующий альвеолит фазы. На третий день лечения положительное давление вентиляции могло быть приостановлено, и на пятый день ватоподобное изображение было полностью устранено.
Пример 21. Демонстрация терапевтической эффективности применения EGF-везикулы для пациентов с дистальным язвенным колитом слева
Демонстрацию выполняли на группе из 8 пациентов с диагнозом дистальный язвенный колит, после того как были выполнены несколько колоноскопий и биопсий. Пациенты получали специальное медицинское питание, а также фармакологическое лечение с азулфидином или сульфасалазином. Из-за того, что эта группа оставалась клинически активной в течение более чем 12 месяцев и резистентной ко всем фармакологическим вмешательствам, включая кортикоиды, их наблюдали в добровольно-испытательном лечении с введением малой клизмой везикул холестерин:цетримид:EGF, описанных в примере 3. Для этого везикулы холестерин:цетримид:EGF вводили в физиологическом солевом растворе с эквивалентной концентрацией EGF 50 мкг/мл в объеме 20 мл. Клизмы применяли при лежачем положении на левом боку каждую ночь перед временем сна. В 7 дней после начала клизм, ассоциированных с другими предыдущими медицинскими мерами, были устранены мелены, боль и общее систематическое недомогание. После 10 дней лечения выполняли колоноскопию, при этом обнаруживая существенное уменьшение мукозального воспаления, заживление большинства поражений и значительное уменьшение индекса Марка. Лечение прекращали через 21 день после начала, кода повторяли колоноскопии, при этом подтверждая эффект заживления и уменьшения воспаления, обусловленного лечением с клизмами, содержащими везикулы холестерин:цетримид:EGF. Биопсии, отобранные у 8 пациентов через 21 день после начала лечения, демонстрировали исчезновение криптита.
Пример 22. Добровольно-испытательное применение везикул EGF для устранения мукозальных поражений, вызванных химиотерапией против рака
Пациент QED, мужчина, возраст 32 года, у которого развилось геморрагическое воспаление слизистой оболочки в мочевом пузыре и нижних частях мочевых путей, как последствие терапии циклофосфамидом и бусульфаном, после трансплантации костного мозга. После 72 часов гематурии и существенной протеинурии (400 мг/24 часа) пациент получал вместе с общими медицинскими мерами поддержки цистолизис, посредством чего осуществляли вливание физиологического солевого раствора, содержащего везикулы холестерин:CTAB:EGF, приготовленные как в примере 2 при эквивалентной концентрации 150 мкг/мл EGF. В конце первых 24 часов были детектированы только следовые количества красных кровяных клеток в моче и протеинурия 170 мг/24 часа.
Пациент IRT, женщина, возраст 27 лет, развивалось воспаление слизистой оболочки верхних частей желудочно-кишечного тракта в курсе полихимиотерапии для лечения неходжкинской лимфомы. Была обнаружена резко выраженная клиническая картина, включая афтозные проявления, сиалорею и даже гематемезис, вздутие живота, общее недомогание, жар и другие симптомы. Способ начинали регулировать фармакологическими мерами, которые включали ингибиторы протонного насоса, мукопротекторы, восстановление объема крови и анальгезирующие парентеральные опиоиды. Через двадцать четыре часа после начала клинической картины пациент получал оральные нанесения солевого раствора, содержащего везикулы холестерин:цетримид:EGF, приготовленные как в примере 3, с эквивалентной концентрацией EGF 50 мкг/мл. С применением назогастрального катетера вливали объем 250 мл этого раствора каждые четыре часа. Гематемезис прекращался через 24 часа после начала гастрального орошения, также как и вздутие и острый парез. Подобным образом, постепенно снижали потребность в объемной поддержке и других мерах регулирования.
Пример 23. Синтез везикул β-ситостерин:CTAB:EGF с применением технологии сжатой текучей среды
Эти везикулы синтезировали образом, подобным примеру 2, но в этом случае использовали с одной стороны раствор 77,71 мг β-ситостерина в 2,88 мл этанола и с другой стороны водный раствор 2,83 мг/мл CTAB и EGF в требуемой концентрации. Везикулы CTAB: β-ситостерин (1:1) получали с EGF, включенным c концентрацией 5 мкМ. Результаты для физических свойств, среднего размера и Z-потенциала показаны в таблице 17. Можно наблюдать, что средство везикул является стабильным и имеет относительно маленький средний размер и PDI. Средний размер, распределение размеров частиц и Z-потенциал определяли посредством DLS. Кроме того, подобно везикулярным средствам, показанным в предыдущих примерах, которые содержат в их композиции катионное поверхностно-активное вещество типа четвертичного аммония, они имеют позитивные значения Z-потенциала намного выше, чем + 30 мВ, что прогнозирует их высокую долговременную устойчивость. Фиг. 3D демонстрирует, что сфероидальные формы с однослойной структурой преобладают в соответствии с исследованием морфологии везикулы, выполненной с помощью cryo-TEM. Эти везикулы также обладают свойствами, которые делают их привлекательными с фармацевтической точки зрения.
(мВ) (+SD)*
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ЛИПИДНЫХ НАНОЧАСТИЦ ДЛЯ ДОСТАВКИ ЛЕКАРСТВЕННОГО СРЕДСТВА | 2012 |
|
RU2647476C2 |
| МНОГОСЛОЙНАЯ ВЕЗИКУЛЯРНАЯ КОМПОЗИЦИЯ | 2006 |
|
RU2385711C2 |
| ПРИМЕНЕНИЕ МЕСТНОЙ КОМПОЗИЦИИ, СОДЕРЖАЩЕЙ ЭПИДЕРМАЛЬНЫЙ ФАКТОР РОСТА (ЕGF), ДЛЯ ПРОФИЛАКТИКИ АМПУТАЦИИ ПО ПОВОДУ ДИАБЕТИЧЕСКОЙ СТОПЫ | 2006 |
|
RU2394590C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЛИПОСОМ | 1999 |
|
RU2216315C2 |
| ОДНОРАЗОВАЯ СИСТЕМА ДЛЯ СТЕРИЛЬНОГО ПОЛУЧЕНИЯ ЧАСТИЦ ИЗ ЛИПИДОВ И НУКЛЕИНОВЫХ КИСЛОТ | 2012 |
|
RU2642640C2 |
| ПОЛУЧЕННЫЕ ИЗ ЛИЗАТА ТРОМБОЦИТОВ ЧЕЛОВЕКА ВНЕКЛЕТОЧНЫЕ ВЕЗИКУЛЫ ДЛЯ ПРИМЕНЕНИЯ В МЕДИЦИНЕ | 2017 |
|
RU2735139C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ В ВИДЕ МИКРОСФЕР ДЛЯ ПРОФИЛАКТИКИ АМПУТАЦИИ КОНЕЧНОСТЕЙ ПРИ ДИАБЕТЕ | 2007 |
|
RU2426528C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ КОНТРОЛИРОВАННОГО ВЫСВОБОЖДЕНИЯ ТРЕПРОСТИНИЛА | 2019 |
|
RU2796305C2 |
| КОМПОЗИЦИИ ВНЕКЛЕТОЧНЫХ ВЕЗИКУЛ (EV) РАСТИТЕЛЬНОГО ПРОИСХОЖДЕНИЯ И ИХ ПРИМЕНЕНИЯ | 2020 |
|
RU2812553C2 |
| УВЛАЖНЯЮЩАЯ КОМПОЗИЦИЯ И СПОСОБ УВЛАЖНЕНИЯ КОЖИ | 1994 |
|
RU2125866C1 |
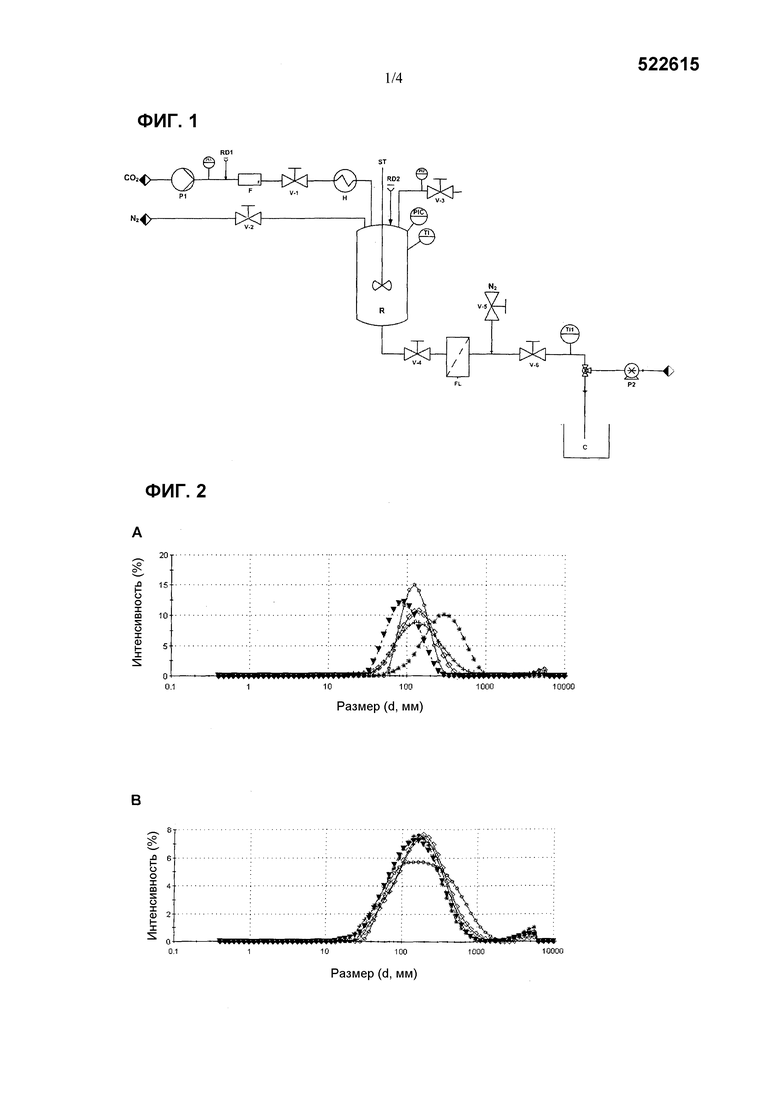
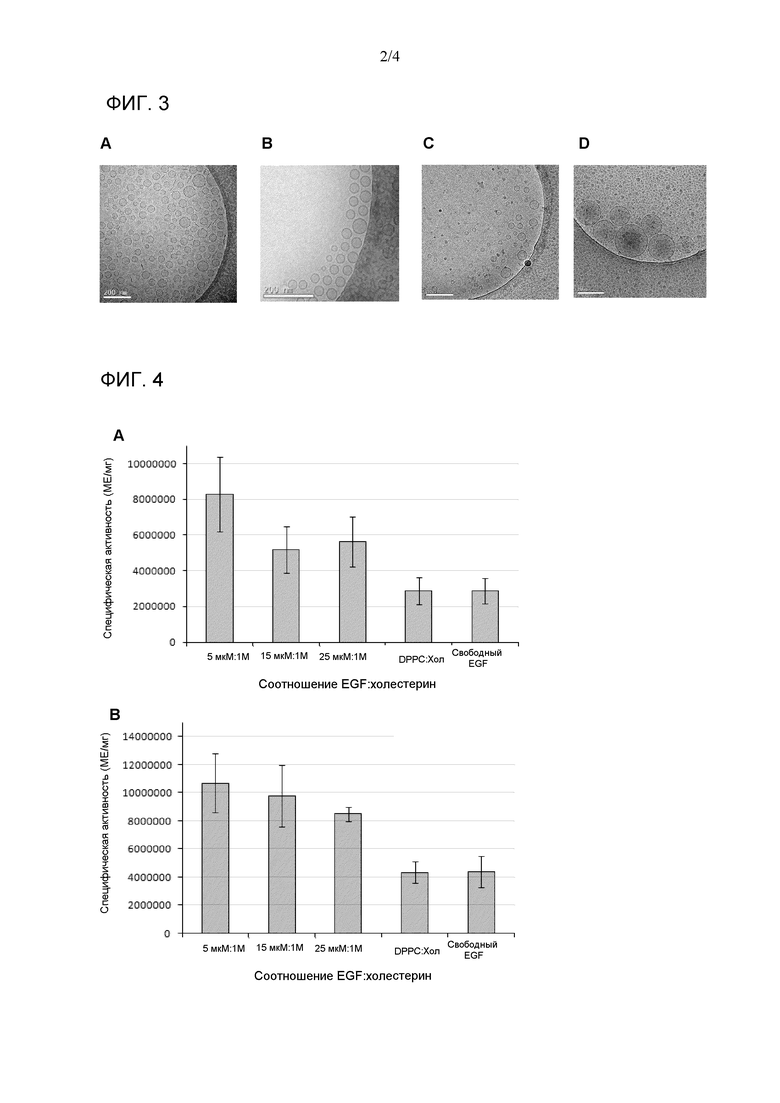
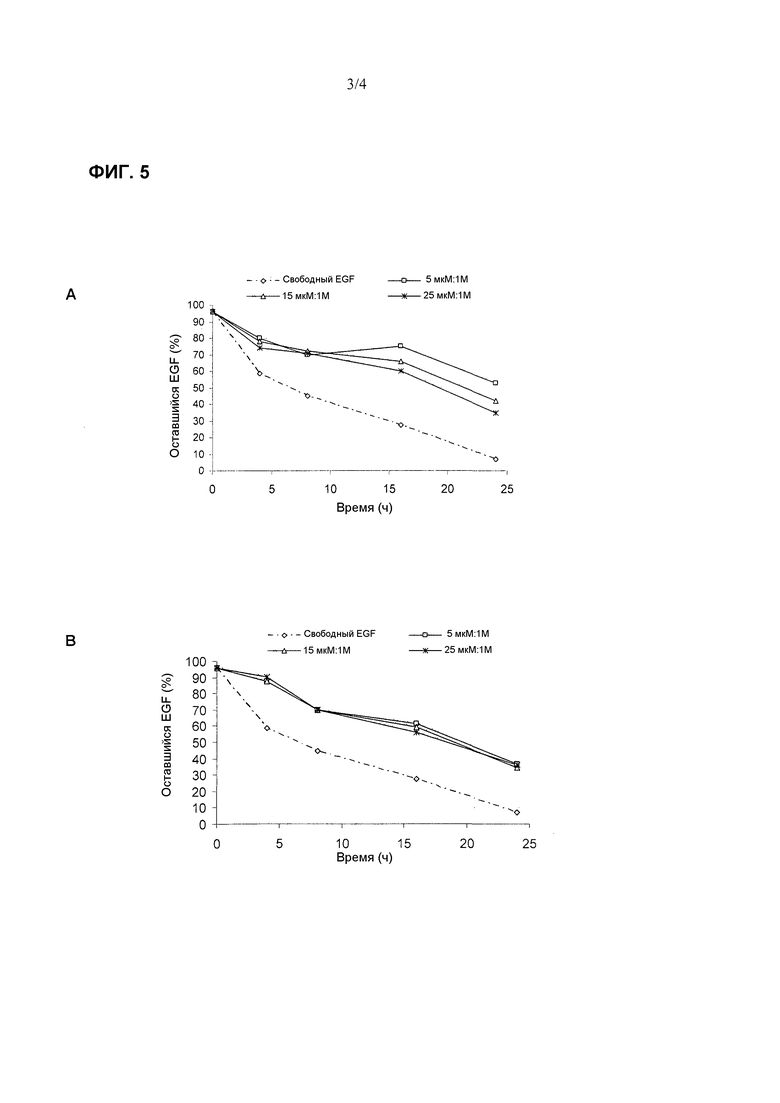
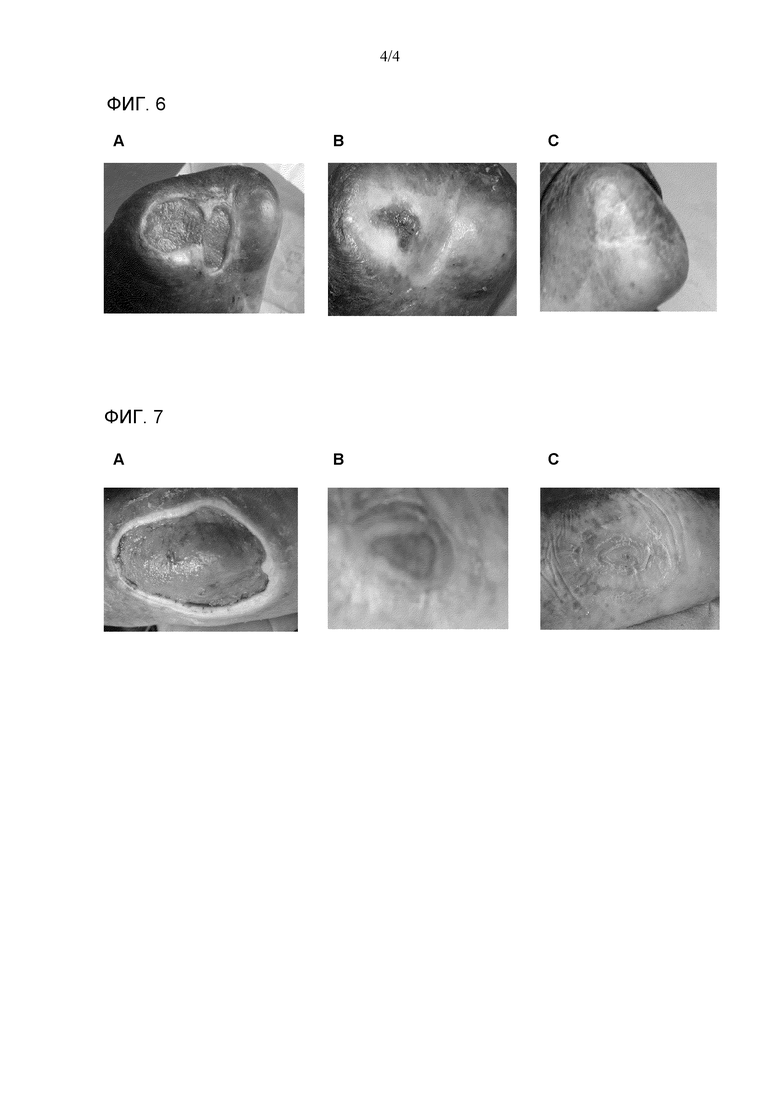
Группа изобретений относится к медицине, а именно к фармакологии, и может быть использована для получения новых систем доставки лекарственных средств. Везикула по изобретению содержит эпидермальный фактор роста (EGF), катионное поверхностно-активное вещество и холестерин или его производные. Способ получения везикулы включает стадии приготовления водного раствора EGF и катионного поверхностно-активного вещества, растворение холестерина или его производных в органическом растворителе и синтез везикулы сбросом давления раствора. Фармацевтическая композиция по изобретению содержит везикулу и фармацевтически приемлемое вспомогательное вещество. Применение везикулы по изобретению касается получения лекарственного средства для лечения ран, синдрома расстройства дыхания и поражений пищеварительного тракта, а также получения косметического продукта. Косметический продукт по изобретению предназначен для предотвращения старения кожи. Использование изобретений позволяет улучшить терапевтическую эффективность EGF за счет длительной стабильности везикул и высокого включения EGF в них. 6 н. и 21 з.п. ф-лы, 17 табл., 7 ил., 23 пр.
1. Везикула, содержащая эпидермальный фактор роста (EGF), катионное поверхностно-активное вещество и холестерин или его производные.
2. Везикула по п. 1, где катионное поверхностно-активное вещество является веществом типа четвертичного аммония.
3. Везикула по п. 2, где катионное поверхностно-активное вещество типа четвертичного аммония является поверхностно-активным веществом, выбранным из группы, состоящей из цетилтриметиламмония бромида (СТАВ), цетримида и бензалкония хлорида (ВКС).
4. Везикула по пп. 1-3, где молярное соотношение между катионным поверхностно-активным веществом и холестерином или его производными находится в пределах от 10 М : 1 М до 1 М : 5 М и молярное соотношение между EGF и холестерином или его производными находится в пределах от 0,5 мкМ : 1 М до 100 мкМ : 1 М.
5. Везикула по п. 1, которая характеризуется тем, что имеет однослойную структуру и приблизительный средний размер между 25 и 500 нм, предпочтительно между 50 и 300 нм.
6. Везикула по п. 1, где EGF включен в везикулярный бислой.
7. Везикула по п. 1, которая получена технологией сжатой текучей среды (CF).
8. Везикула по п. 7, где технология CF включает в себя способ, содержащий:
a) приготовление водного раствора EGF и катионного поверхностно-активного вещества,
b) растворение холестерина или его производных в органическом растворителе, экспандированном с CF,
c) синтез везикулы сбросом давления раствора, полученного в результате стадии b), на раствор, полученный в результате стадии а).
9. Везикула по п. 8, где катионное поверхностно-активное вещество является веществом типа четвертичного аммония.
10. Способ получения везикулы, содержащей EGF, катионное поверхностно-активное вещество и холестерин или его производные, характеризуемый содержанием следующего:
a) приготовление водного раствора EGF и катионного поверхностно-активного вещества,
b) растворение холестерина или его производных в органическом растворителе, экспандированном с CF,
c) синтез везикулы сбросом давления раствора, полученного в результате стадии b), на раствор, полученный в результате стадии а).
11. Способ по п. 10, где катионное поверхностно-активное вещество является веществом типа четвертичного аммония.
12. Способ по п. 10, где органический растворитель стадии b) является растворителем, выбранным из группы, состоящей из одноатомных спиртов, полиатомных спиртов, кетонов, этилендиамина, ацетонитрила, этилацетата и их смеси.
13. Способ по п. 10, где CF является соединением, выбранным из диоксида углерода, этана, пропана, гидрохлорфторуглеродов и гидрофторфторуглеродов.
14. Способ по пп. 10-13, где соотношение между количеством CF и органическим растворителем соответствует примерной молярной доле CF от 0,3 до 0,95, предпочтительно от 0,5 до 0,8.
15. Способ по пп. 10-13, где растворение холестерина или его производных в CF осуществляется в реакторе с примерным давлением от 1 до 30 МПа и примерной температурой приблизительно от 10 до 70°С, предпочтительно между 10 и 50°С.
16. Способ по п. 10, где EGF растворен в водном растворе, содержащем катионное поверхностно-активное вещество с концентрацией выше его критической концентрации мицеллообразования.
17. Фармацевтическая композиция для лечения ран, синдрома расстройства дыхания и поражений пищеварительного тракта, содержащая везикулу по любому из пп. 1-9, и, по меньшей мере, одно фармацевтически приемлемое вспомогательное вещество.
18. Фармацевтическая композиция по п. 17, которая может быть введена системным, внутриочаговым, мукозальным, топическим, трансдермальным, офтальмическим путями или в виде ингаляционного состава.
19. Применение везикулы по любому из пп. 1-9 для получения лекарственного средства для лечения ран, синдрома расстройства дыхания и поражений пищеварительного тракта.
20. Применение по п. 19, где лекарственное средство применяется для лечения комбинированных ран периферических мягких тканей.
21. Применение по п. 20, где комбинированная рана является диабетической язвой стопы.
22. Применение по п. 20, где комбинированная рана является венной язвой, пролежнем или ожогом.
23. Применение по п. 19, где лекарственное средство применяется для лечения расстройства дыхания у взрослых.
24. Применение по п. 19, где поражения пищеварительного тракта представляют собой воспаление слизистой оболочки, язвенного колита, дуоденальной язвы или дистального колита.
25. Применение по п. 19, где лекарственное средство применяется для лечения поражений глаз.
26. Косметический продукт для предотвращения старения кожи, содержащий везикулу по любому из пп. 1-9 и по меньшей мере одно вспомогательное вещество.
27. Применение везикулы по любому из пп. 1-9 для получения косметического продукта для предотвращения старения кожи.
| US 4944948, 31.07.1990 | |||
| LANIO M.E | |||
| et al | |||
| Humoral immune response against epidermal growth factor encapsulated in dehydration rehydration vesicles of different phospholipid composition//J Liposome Res | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| ELIZONDO E et al | |||
| Nfluence of the preparation route on the supramolecular organization of lipids in a vesicular system//J Am Chem Soc | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
Авторы
Даты
2018-04-04—Публикация
2013-08-02—Подача