Настоящее изобретение относится к способу получения липосом, к образованным посредством такого способа липосомам и их применению, в частности, в фармацевтической области.
Известно много направлений использования липосом, включая применение в фармацевтической области и в косметике, где они выполняют функцию переносчиков лекарств и других реагентов, пригодных для нанесения на кожу.
Для получения липосом известны различные способы. Так, например, они могут быть получены способом дегидратации/регидратации, в соответствии с которым липид растворяют в органическом растворителе, таком как хлороформ, дихлорметан или спирт, такой как метанол или этанол. Затем раствор высушивают с использованием, например, роторного испарителя, после чего на стенке испарительной колбы образуется пленка липида. Добавление к сухой пленке воды или водного раствора, такого как буфер, приводит к образованию многослойных липосом. Образованием именно этого продукта завершается первая стадия образования везикул с использованием различных методик. Последующая обработка может приводить к дегидратации/регидратации везикул, или ДРВ (DRV) (Kirby and Gregoriadis, Biotechnology (1984) 2, 979-984). Альтернативно, при последующей обработке ультразвуком липидной суспензии получают однослойные липосомы (A.D.Bangham et al., J. Mol. Biol. 13, 238 (1965)).
Другие известные в технике способы включают детергентную обработку (Y. Kagawa et al. , J. Biol. Chem. (1971) 246, 5477), выпаривание с обращением фаз (F. Szoka and D.Рараhadjopoulos, Proc. Natl. Acad. Sci, USA (1978) 75, 4194) и введение эфира (D.Deamer et al., Biochim. Biophys. Acta, (1976) 433, 629), а также лиофилизацию (см., например, работу Ohsawa et al., Chem. Pharm. Bull, (1984) 32, 2442-5 and Kirby and Gregoriadis (1984) supra.) и методы замораживания - оттаивания (D.D.Lasic "Liposomes: From Physics to Application, Elsevier, 1993, p. 98).
В зависимости от применяемого для образования липосом способа получают липосомы разного размера и с различающимися характеристиками. Липосомы могут использоваться для инкапсулирования материалов, таких как биологически активные продукты, в частности фармацевтические средства, включая вакцины, а также нефармацевтические средства, такие как продукты, воздействующие на кожу, в частности препараты для искусственного загара и другие средства макияжа. Методики инкапсулирования варьируют в зависимости от природы инкапсулируемого реагента и размера и свойств образованных липосом.
Размер липосом важен с точки зрения их применения. В некоторых случаях нужны крупные липосомы, в тех случаях, например, когда инкапсулируются частицы, включающие микроорганизмы, такие как бактерии, для получения, например, вакцин, как описано в документе WO 95/09619.
Однако во многих случаях предпочтительны мелкие липосомы. Это связано с тем, что мелкие липосомы не так быстро удаляются ретикуло-эндотелильной системой (РЭС), и в меньшей степени, чем крупные липосомы (с размерами свыше 200 нм). Захват везикул в РЭС возрастает с увеличением их размера. Кроме того, крупные липосомы при их внутримышечной инъекции не способны эффективно достичь регионарных лимфатических узлов и доставить в них вакцины и другие средства (Gregoriadis G. , Liposomes as Drug Carriers: Recent Trends and Progress, Wiley Chichester, 1988).
Липосомные препараты, содержащие различные лекарственные средства, могут быть оптимизированы с точки зрения содержания лекарственного ингредиента, стабильности, картины биологического распределения и уровня поступления в клетку путем изменения физико-химических параметров липосом, таких как температура фазового перехода, размер липосом, характер распределения препарата по размеру, величина поверхностного заряда, гидратация поверхности соединениями, несущими гидрофильные группы, и характер распределения по размеру частиц.
Размер липосом представляет собой параметр, который определяет фракцию, захватываемую РЭС (Senior et al., Biochem., Biophys., Acta (1985) 839. 1-8: Nagayasu et al. , Biol. Pharm. Bull. (1995) 18 (7), 1020-1023). Мелкие липосомы могут быть получены при использовании гомогенизаторов под высоким давлением (Talsma et al., Drug Development and Industrial Pharmacy (1989) 15 (2) 197-207, Vemuri S. et al., Drug Development and Industrial Pharmacy (1990) 16 (15), 2243-2256), но при этом используют большие количества липидов, для того чтобы добиться приемлемой величины коэффициента отношения включенного лекарственного средства к липидной массе. При использовании другого подхода (Gresoriadis et al. , Int. J. Pharm. 65 (1990) 235-242) в псевдоожиженном слое многослойных дегидратированных-регидратированных везикул (ДРВ) в присутствии неинкапсулированного лекарственного средства получают везикулы с размером менее 200 нм, сохраняющие количество первоначально включенных растворенных веществ.
Показан стабилизирующий эффект на везикулы, возникающий при добавлении сахара после получения липосом (Crowe L.M. et al., Arch. Biochem. Biophys. 242 (1985) 240-247, Hauser et al., Biochem. Biophys. Acta (1987) 897, 331-334), в том случае, например, когда липосомы, содержащие лекарственное средство, лиофильно высушивают для хранения и затем подвергают повторной гидратации.
Авторы настоящего изобретения нашли усовершенствованный способ получения липосом, и в частности мелких липосом, который позволяет сократить количество стадий процесса и получать при этом стабильные липосомы с высокоэффективной инкапсулирующей способностью.
Согласно изобретению предлагается способ получения липосомного препарата, содержащего реагент, который включает следующие стадии:
(i) образование пустых липосом;
(ii) смешивание липосом, полученных на стадии (i), с раствором сахара и указанного реагента и
(iii) высушивание смеси, полученной на стадии (ii).
При повторной гидратации высушенного материала, полученного на стадии (iii), образуются липосомы, содержащие включенный в них реагент. При получении таким способом липосом увеличение их размера относительно липосом, образуемых на стадии (i), происходит в значительно меньшей степени, чем в случае липосомных препаратов, которые не содержат сахара. И в этом случае указанные выше процессы экструзии, обработки в псевдоожиженном слое или гомогенизации могут быть исключены.
Установлено, что в ходе сушки с использованием соответствующих концентраций сахаров, до определенной степени снижается уровень слияния и агрегации липосом при образовании аморфной стеклоподобной массы (Crowe et al., Arch. Biochem. Biophys. , 242 (1985) 240-247), а также взаимодействие сахаров с основной группой фосфолипидов (Crowe et al., Cryobiology, 31 (1994) 355-366). В ранних исследованиях дегидратированные/регидратированные везикулы (ДРВ) получали без использования cахаров в качестве стабилизаторов, при этом процедура основывалась на индукции слияния/агрегации образующихся мелких однослойных везикул при контролируемой регидратации (Kirby, Gregoriadis, 1984). В этой связи, можно было предположить, что общая стабилизация мелких однослойных везикул за счет добавления соответствующих количеств cахаров будет сопровождаться при восстановлении исходных MOB (SUV) очень низкой величиной включения.
Однако оказалось, что это не так. Хотя, как и в случае всех липосом, степень включения реагента зависит в некоторой мере от характеризующего систему коэффициента отношения липид:реагент, тем не менее ожидается, что уровень инкапсулирования реагента в липосомы, достигаемый при использовании способа по настоящему изобретению, будет вполне приемлемым.
Кроме того, применение липосом в качестве системы доставки лекарств налагает определенные требования к их физической и химической стабильности. Липосомы в виде водной дисперсии подвергаются гидролизу и физическим изменениям в процессе хранения, включая подтекание инкапсулированных лекарственных средств, а также изменение размеров в результате агрегации или слияния. Однако ожидается, что физическая и химическая стабильность липосом, получаемых по способу настоящего изобретения, будет хорошей.
Таким образом, настоящий способ дает возможность получать мелкие липосомы с высокой загрузкой, которые, как отмечалось выше, будут особенно полезны при создании фармацевтических композиций. Кроме того, заявленный способ может использоваться для приготовления инкапсулированных материалов разных типов.
Однако способ согласно настоящему изобретению будет особенно полезен при изготовлении липосом для применения в фармацевтической области. В этом случае используемые в рамках данного способа реагенты будут включать биологически активный материал, такой как фармацевтический ингредиент или лекарственное средство. Для этой цели получаемые на стадии (i) липосомы должны представлять собой мелкие однослойные везикулы со средним размером, например, в диапазоне от 25 нм до 90 нм, предпочтительно в диапазоне от 50 нм до 90 нм и наиболее предпочтительно от 70 нм до 90 нм. В конечном итоге, получаемые в рамках этого способа липосомы будут иметь все еще небольшой размер, в среднем менее 500 нм и обычно от 100 до 200 нм.
Имеющиеся на стадии (i) липосомы представляют собой пустые липосомы, получаемые посредством любого традиционного способа, например с помощью описанного выше классического способа. При этом любые образованные липосомы, в случае если их средний размер слишком велик для целевого использования, могут быть уменьшены с помощью известных в технике способов, например ультразвука, гомогенизации, экструзии или техники псевдоожиженного слоя.
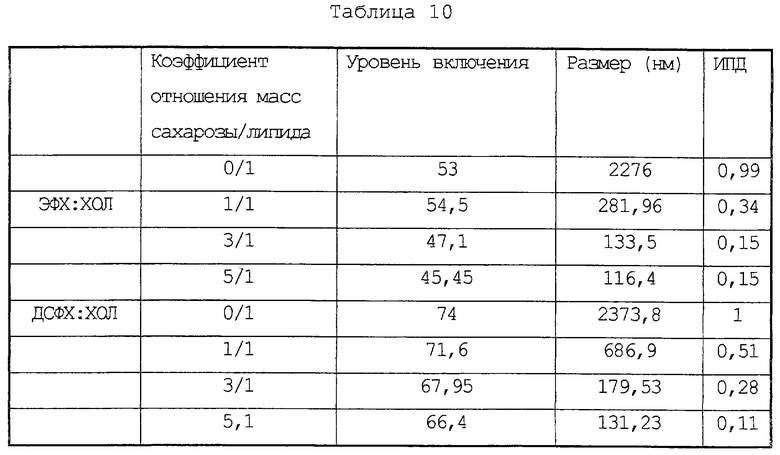
Для получения липосом используют известные в технике липиды. Они включают, например, лецитины, такие как, например, фосфатидилхолин (ФХ), дипальмитоилфосфатидилхолин (ДПФХ), дистеароилфосфатидилхолин (ДСФХ), или заряженные липиды, в частности анионные липиды, такие как фосфатидиновая кислота, или катионные липиды, такие как стеариламин, необязательно в присутствии холестерина. Предпочтительным липидом является ДСФХ. Выбор липида зависит, в определенной мере, от природы активного средства и от цели использования липосом.
Приемлемые для использования на стадии (ii) растворы сахаров включают водные растворы моносахаридов, таких как глюкоза и фруктоза, дисахаридов, таких как лактоза или сахароза, а также полисахаридов. Особенно предпочтительным для использования в способе настоящего изобретения сахаром является дисахарид, такой как сахароза или лактоза, или моносахарид, такой как глюкоза. В особенности, в качестве сахара предпочтительна сахароза.
В предпочтительном варианте на стадии (ii) используют такое количество сахара, чтобы отношение массы сахара к массе липида составляло от 1:1 до 6:1 (вес/вес) и более предпочтительно - в диапазоне от 1:1 до 5:1 (вес/вес). Было обнаружено, что чем большее количество сахара используют, тем меньше увеличение размера липосом, получаемых после регидратации, в сравнении с имевшимися на стадии (i). Однако при этом уровень включения реагента может быть ниже. Таким образом, правильный выбор используемых в данном способе коэффициентов указанных соотношений будет зависеть от их целевого использования, при этом необходимо определять нужный баланс между степенью включения реагента при данном содержании липтида и размером липосомы. Разница между этими параметрами находит отражение в определенной вариабельности воздействия конкретного реагента на образование липосом, что будет пояснено ниже. В приемлемом варианте количество имеющегося сахара менее 10% (вес/объем) от всей композиции.
Кроме того, было показано, что увеличение объема используемого в рамках данного способа сахарного раствора при снижении его концентрации может способствовать повышению уровня включения. Приемлемые концентрации растворов сахаров находятся в диапазоне от 20 до 200 мМ, предпочтительно от 30 до 150 мМ.
Далее, было также обнаружено, что если последующую регидратацию проводить при повышенных температурах, например от 30 до 80oС, в частности от 40 до 65oС, и в особенности примерно при 60oС, то уровень включения может быть повышен. Показана эффективность такой процедуры в случае липосом, включающих ФХ и холестерин (ХОЛ), которые обычно образуются при комнатной температуре. Однако при использовании в рамках такого способа повышенных температур может наблюдаться некоторое увеличение размера липосом в сравнении с их исходными значениями, что нужно принимать во внимание при выборе условий, практикуемых для получения липосом в каждом конкретном случае.
К числу других факторов, которые, как было показано, также влияют на уровень включения, относятся индивидуальная природа реагента, такого как инкапсулируемое лекарственное средство, и, в частности, растворимость и количество такого реагента. При этом в некоторых случаях растворимость реагента может лимитировать то его количество, которое может быть растворено на стадии (ii) и далее включено в липосому. К числу других факторов, влияющих на количество включаемых реагентов, относятся взаимодействия реагента с липидами липосомы, а также проницаемость липосомы для реагента.
В случае наличия в растворе, используемом на стадии (ii) реакции, высоких концентраций реагента процент его включения может быть снижен. В этой связи, по экономическим причинам может быть выгодно снижать количество применяемого реагента.
Условия, выбираемые для целей получения липосом желательных размеров и нагрузки, включают коэффициент отношения массы сахара к массе липида, природу липида, концентрацию используемого раствора сахара, количество включенного в раствор реагента и температуру регидратации, которые могут быть определены для каждого конкретного реагента с помощью обычных процедур.
Указанная выше стадия (iii) может проводиться с использованием традиционных способов, например с помощью лиофильной сушки, распылительной сушки, флэш-кристаллизации, высушивания в воздушном потоке (например, в псевдоожиженном слое), вакуумной сушки, сушки в печи или посредством любого другого известного в технике способа. И хотя механические свойства продуктов, получаемых описанными способами, могут различаться, при том что продукт распылительной сушки будет представлять собой дискретный и зачастую текучий порошок, тогда как лиофильная сушка дает твердую лепешку, свойства липосом при регидратации с точки зрения их стабильности и способности к нагрузке реагентом будут в целом сходными.
Распылительная сушка может оказаться предпочтительной для ряда приложений, включая приготовление фармацевтических композиций, поскольку она позволяет получать продукт с приемлемыми для дальнейшей обработки механическими свойствами.
Продукт, получаемый при лиофильной сушке, включает блочную пористую массу, обладающую относительно слабыми механическими характеристиками. С помощью размалывания этой массы ей могут быть приданы лучшие механические свойства, однако имеется риск возникновения повреждений на такой дополнительной стадии.
Распылительная сушка может дать продукт с хорошими механическими характеристиками, который может быть доставлен ингаляцией или введен парентерально после разбавления водой.
Последующая стадия регидратации может быть осуществлена в ходе процесса производства или альтернативно композиция может поставляться в сухом виде и дальше подвергаться регидратации уже в сайте предполагаемого введения, например, в больнице или в фармацевтическом отделении, когда инкапсулированное лекарственное средство должно быть доставлено пациентам.
Образуемые липосомы отличаются хорошей стабильностью, что определяет длительный срок годности продукта. Это свойство важно, например, для косметических продуктов, гигиенических принадлежностей и фармацевтических средств.
Как отмечалось выше, указанный способ особенно хорошо подходит для получения относительно мелких липосом с высокой степенью нагрузки реагентом. Это особенно желательно для применения в фармацевтической области, в частности для доставки материалов, таких как полимерные или белковые лекарственные средства, ДНК-содержащие вакцины, векторы для генной терапии или химические лекарственные средства. Приемлемые химические средства включают антибиотики, такие как окситетрациклины, β-лактамные антибиотики, такие как пенициллины, в частности пенициллин G, ампициллин или амоксициллин, или цефалоспорины, а также противораковые средства, гормоны, иммунотерапевтические препараты, противовирусные средства, противовоспалительные соединения и др.
На основе получаемых с помощью вышеописанного способа липосомных продуктов могут быть приготовлены фармацевтические композиции, например, при объединении их с фармацевтически приемлемыми носителями или наполнителями. Такие композиции могут быть пригодны для целей перорального, парентерального, и, в частности, внутривенного, или местного введения, например, на поверхность кожи или слизистой. Особенно полезной в рамках настоящего изобретения является композиция, пригодная для введения с помощью аэрозольного распылителя или ингалятора. Было обнаружено, что для этой цели приемлемы нейтральные липосомы липидной природы с высоким фазовым переходом, такие как липосомы, образуемые из смесей ДСФХ и холестерина. При осуществлении процесса в соответствии со способом настоящего изобретения, проведение экструзии перед сушкой может стать необязательной процедурой.
Ниже изобретение пояснено с помощью прилагаемых чертежей, при этом:
фиг.1 представляет собой график, демонстрирующий изменение размера дипальмитоилфосфатидилхолиновых (ДПФХ) и холестериновых (ХОЛ) липосом при их обработке ультразвуком и при лиофильной сушке с 0,0357 М сахарозы и затем регидратации;
фиг.2 представляет собой график, иллюстрирующий влияние молярности раствора сахарозы на распределение размеров ФХ:ХОЛ липосом, включающих FITC-альбумин (% распределения:интенсивность), получаемых после лиофильной сушки и регидратации, при использовании способа по настоящему изобретению;
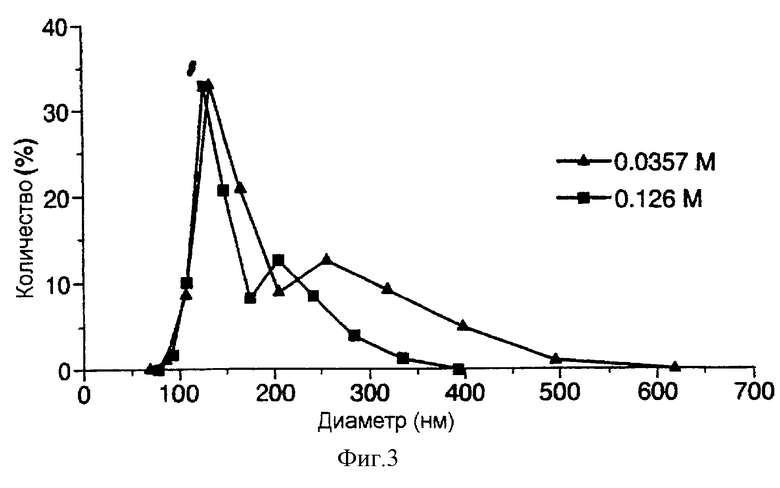
фиг. 3 представляет собой график, демонстрирующий влияние молярности раствора сахарозы на распределение размеров, получаемых после регидратации ФХ:ХОЛ липосом, включающих эпидермальный ростовой фактор (EGF) при использовании способа по настоящему изобретению;
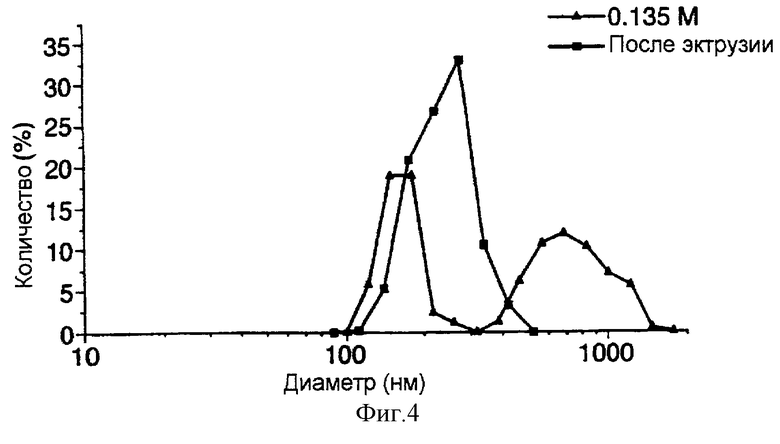
фиг. 4 представляет собой график, иллюстрирующий в сравнительном аспекте данные по распределению размеров экструдированных и регидратированных ФХ:ХОЛ липосом, содержащих FITC-альбумин, которые были получены по способу настоящего изобретения;
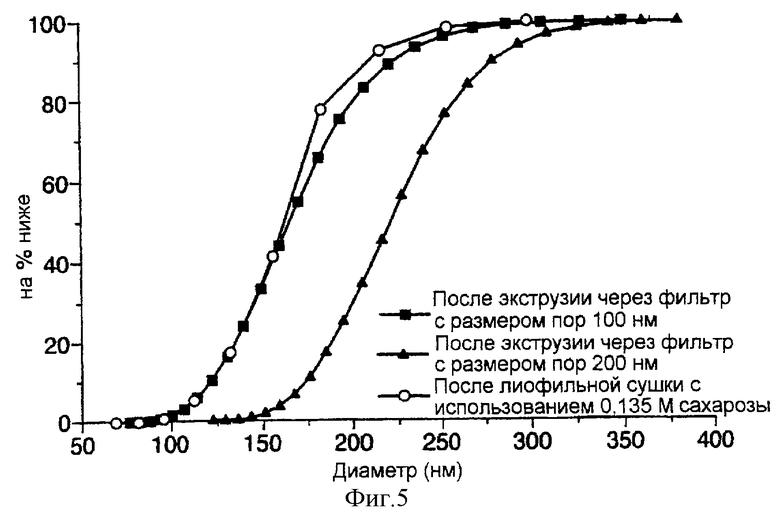
фиг. 5 представляет собой график, иллюстрирующий распределение размеров экструдированных и лиофильно высушенных липосом, полученных по способу настоящего изобретения, которые содержат в инкапсулированном виде карбоксифлуоресцеин (КФ);
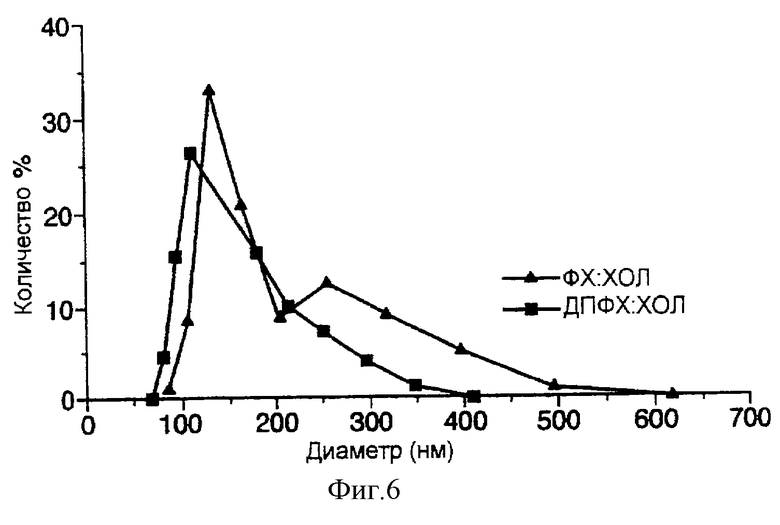
фиг. 6 представляет собой график, иллюстрирующий распределение размеров различных липосомных композиций по настоящему изобретению.
В приведенных ниже примерах фосфатидилхолин яйца (ФХ), дипальмитоилфосфатидилхолин (ДПФХ) и дистеарилфосфатидилхолин (ДСФХ) получают от Липоид ГмбХ (Lipoid GmbH, Ludwigshafen, Germany), холестерин, карбоксифлуоресцеин (КФ), альбумин, меченный флуоресцеинизотиоцианатом (FITC-альбумин), рибофлавин, даунорубицин, доксорубицин, Тритон Х-100, сахарозу, глюкозу и додецилсульфат натрия (ДСН, SDS) получают от компании Сигма (Sigma, Лондон). Эпидермальный фактор роста (ЭФР, EGF) был любезно предоставлен Центром Биологических Исследований, Гавана, Куба (Centre of Biological Sciences). Na125I, С14-меченый гидроксипропил-β-циклодекстрин и С14-меченый пенициллин были приобретены у компании Амершам Интернешнл, Великобритания (Amersham International, Amersham, UK). Мечение ЭФР с помощью 125I выполняют по хлораминатному методу. Все другие реагенты имеют аналитическую степень чистоты.
Пример 1
Способ с использованием лиофильной сушки
ДРВ липосомы, содержащие растворенное вещество, получают следующим образом. Растворяют в хлороформе различные смеси липидов, в частности, смеси ФХ:ХОЛ и ДПФХ:ХОЛ в молярном соотношении 1:1. После выпаривания растворителя в роторном испарителе при температуре 37oС образуется пленка на стенке сферической круглодонной колбы. Многослойные везикулы (МСВ) получают при диспергировании липидной пленки в дважды дистиллированной воде при температурах, превышающих температуру фазового перехода липидов (>Тс) (которая в ряде случаев соответствует комнатной температуре). Суспензию обрабатывают ультразвуком соответствующим образом до получения мелких однослойных везикул (MOB), которые далее подвергают центрифугированию для удаления частиц металла.
Зачем суспензию MOB переносят во флакон, содержащий в растворе желательное количество выбранного лекарственного средства (либо FITC-альбумин (1 мг), КФ (1 мг), гндроксипропил-β-циклодекстрин (2 мг), либо ЭФР (150 мкг)), куда также добавляют 0,0357 М сахарозу и воду для достижения нужной молярности раствора сахарозы.
Затем препарат замораживают и высушивают при температуре ниже 0oС в течение достаточного периода времени (в соответствии с нужным конечным объемом). Затем высушенную лепешку подвергают контролируемому процессу регидратации при температуре >Тс (например, при температуре 60oС) в течение 15 минут при добавлении 100 мкл дистиллированной воды. Далее препарат разбавляют с помощью ФБР до получения раствора с относительной плотностью, позволяющей осуществлять отделение свободного лекарственного средства посредством ультрацентрифугирования.
Размер липосом после регидратации определяют с помощью фотонной корреляционной спектроскопии на приборе Аутосайзер 2С-Малверн (Autosizer 2C-Malvern, Malvern Instruments, UK), снабженном 25 мВт гелий/неоновым лазером. С помощью указанного оборудования получают данные относительно среднего диаметра и распределения размеров липосом.
Средние значения диаметров Z, кумулятивный индекс полидисперсности и дифференциальное распределение вычисляют как функцию молярности раствора сахарозы или той фракции, куда были экструдированы ДРВ в соответствии с их размерами. Для анализа препаратов, характеризующихся большим размером (до 6 микрон), используют прибор Mastersizer (Malvern).
Параметры, характеризующие уровень включения лекарственных средств, определяют после ультрацентрифугирования липосом при 40000хg. Величину инкапсулированного материала вычисляют в виде процента от общего количества использованного КФ, FITC-альбумина, ЭФР или гидроксипропил-β-циклодекстрина.
Общее и инкапсулированное количество карбоксифлуоресцеина и FITC-альбумина измеряют с помощью метода флуоресцентной фотометрии при λ эмиссии, равной 486 нм, и при λ возбуждения, равной 514 нм - для КФ, и при λ эмиссии, равной 495 нм, и при λ возбуждения, равной 520 нм для FITC-альбумина, в осадке после центрифугирования, растворенном в Тритоне или ДСН (до конечной концентрации 5%). Эмиссию углерода-14 из меченного гидроксипропил-β-циклодекстрина определяют при измерении уровня радиоактивности в сцинтилляционном счетчике для β частиц.
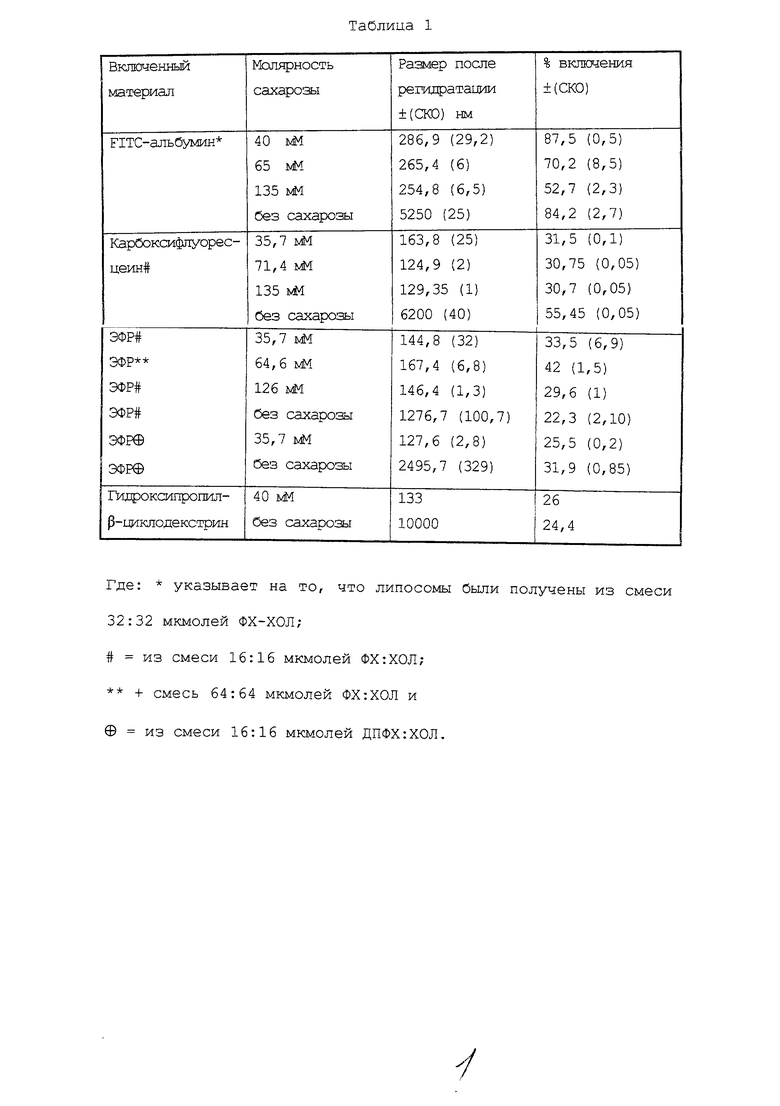
Полученные результаты представлены в Таблице 1.
Полученные результаты показывают, что при умеренной степени стабилизации сахарозой восстановление, допускающее определенную степень слияния (фиг.1), ведет к весьма высокому проценту включения. Хотя и в присутствии, и в отсутствие 40 мМ сахарозы достигается близкий процент включения (87% и 84% соответственно), в препаратах, получаемых с использованием сахарозы, конечный размер липосом будет меньше.
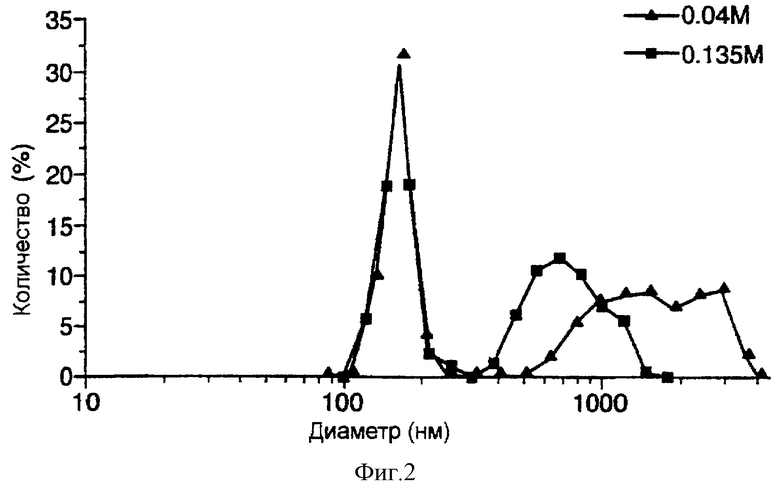
При варьировании молярности раствора сахарозы в различных препаратах липосом, содержащих FITC-альбумин (Таблица 1), может быть получена различная картина распределения по размерам (фиг.2), хотя при повышении молярности уровень включения снижается.
Инкапсулирование ЭФП и КФ проводят в присутствии сахарозы с разной молярностью. При этом процент включения соответствует значениям, получаемым с другими препаратами, содержащими те же количества липидов, но без добавления сахарозы в процедуре их образования (см. Таблицу 1). В этом случае молярность сахарозы не влияет на процент включения, однако оказывает воздействие на размеры липосом и на картину распределения размеров (фиг.3).
В Таблице 1 приведены средние значения диаметров Z ДРВ липосом, образующихся в присутствии или в отсутствие сахарозы. Результаты указывают на то, что при использовании сахарозы высокой молярности достигается меньший размер везикул, что также соответствует более узкому распределению их размеров и сказывается на умеренных значениях процента включения. Процент включения является величиной, пропорциональной размеру и ширине пика распределения размеров.
При двух разных значениях молярности сахарозы измерения могут дать практически равные значения двух средних диаметров двух популяций везикул, имеющих различную ширину пика распределения (фиг.3).
Для липосом, которые получают в присутствии 35,70 мМ и 126 мМ сахарозы и которые включают ЭФР, значения двух средних диаметров после регидратации составляют (144,8±32) нм и (146,4±1,3) нм соответственно.
При оценке картины распределения размеров видно, что указанный пик уже в препаратах, получаемых с использованием 126 мМ сахарозы. Снижение размера липосом и сужение пика распределения размеров в препаратах липосом, получаемых с использованием сахарозы высокой молярности (свыше 36 мМ), не сопровождается уменьшением величины включения. Было показано, с использованием растворов сахарозы двух разных концентраций (35,7 мМ и 135 мМ), что в случае 135 мМ сахарозы образуются липосомы, включающие то же самое количество, что и в альтернативном варианте (примерно до 30%), но с более узким пиком распределения размеров (PDI=0,13).
Пример 2
Сравнение липосом согласно изобретению с экструдированными липосомами
Для сравнения с имеющимся в технике способом экструзии способа по настоящему изобретению, который также ведет к снижению размера везикул, авторы использовали экструдер для обработки ДРВ липосом, получаемых без применения сахарозы. При этом липосомы, образующиеся в соответствии с процедурой примера 1, сравнивают с липосомами, получаемыми при экструзии.
ДРВ липосомы, получаемые без сахарозы, экструдируют под высоким давлением с использованием соответствующего держателя фильтра. Перед удалением невключенного растворенного материала липосомы пропускают через поликарбонатные мембраны с размерами пор 1,2 мкм, 0,4 мкм, 0,2 мкм и 0,1 мкм. На каждой стадии экструзии материал пропускают пять раз через одни и те же мембраны.
Далее ультрацентрифугированием отделяют свободный растворенный материал от экструдированных везикул. Осадок суспендируют в 1 мл ФБР (рН 7,4).
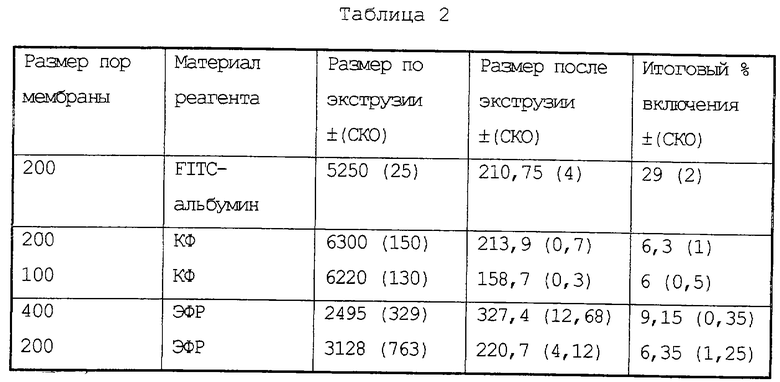
Затем, как описано в примере 1, определяют размер липосом. Данные по распределению размеров липосом сравнивают с данными для аналогичных липосом, полученных по способу примера 1. Результаты представлены на фиг.4 и 5. Было показано, что экструдированные липосомы характеризуются более узким пиком распределения размеров везикул.
Уровень включения материала в сравниваемые липосомы измеряют до и после экструзии. Результаты представлены в Таблице 2.
В Таблице 2 приведены данные по значению средних размеров диаметра и величине включения. Они указывают на то, что экструдированные липосомы характеризуются низким уровнем включения и узким диапазоном распределения размеров (PDI<0,1). Низкий уровень включения в сочетании с необходимостью введения дополнительной процедуры (экструзии) для получения мелких липосом серьезно снижает практическую применимость этого способа.
На фиг. 5 показано перекрытие пиков распределения размера липосом, включающих КФ (6% уровень включения), и лиофилизированных липосом, которые были получены в присутствии 135 мМ сахарозы и содержат 30% КФ в инкапсулированном виде.
Узкий диапазон распределения размера везикул, получаемых экструзией, представляет собой фактор не первостепенной важности, поскольку соответствующий процент включения в них весьма низок.
Пример 3
Распределение по размеру липосом согласно изобретению
Применение фосфолипидов с высокой температурой фазового перехода может улучшить рассматриваемую методику в том, что касается диапазона разброса размеров. Этого удалось достичь при составлении композиции по процедуре примера 1 в присутствии 35,71 мМ сахарозы при использовании липосом на основе эквимолярных количеств ДПФХ:ХОЛ, включающих ЭФР. Уровень включения ЭФР составлял 25%. Однако эти липосомы характеризуются более узким диапазоном разброса размеров (среднее значение Z=128 нм), чем соответствующий препарат на основе ФХ:ХОЛ. Результаты представлены на фиг.6. Таким образом, по всей видимости, в этом случае для достижения цели сужения диапазона разброса размеров предпочтительно выбирать липиды с высокой температурой фазового перехода.
Пример 4
Высокоэффективное включение рибофлавина в мелкие липосомы
Для получения мелких однослойных везикул (MOB) ультразвуком используют смесь эквимолярных количеств фосфатидилхолина (390 мкмоль) и холестерина. Затем MOB смешивают с рибофлавином (12 мг) и возрастающими количествами сахарозы (0-5 мг на мг общего количества липидов). Смесь высушивают распылением и затем регидратируют. Уровень включения используемого средства определяют в суспендированном осадке, полученном после центрифугирования. Размер MOB в готовых препаратах везикул определяют методом фотокорреляционной спектроскопии на приборе Мастерсайзер (Mastersizer). Полученные результаты представлены в Таблице 3.
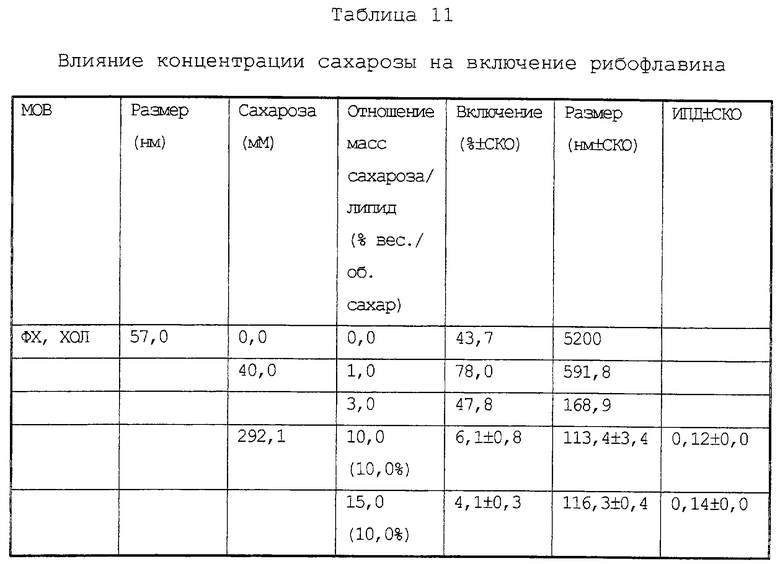
Видно, что распылительная сушка мелких липосом (MOB) в присутствии лекарственного средства и сахарозы (1 мг/1 мг липида) приводит к получению относительно мелких липосом, включающих примерно половинное количество (47,5%) от всего использованного средства. При увеличении количества сахарозы размер везикул еще больше снижается, но при сопутствующем снижении уровня включения.
Пример 5
Липосомы, содержащие глюкозу
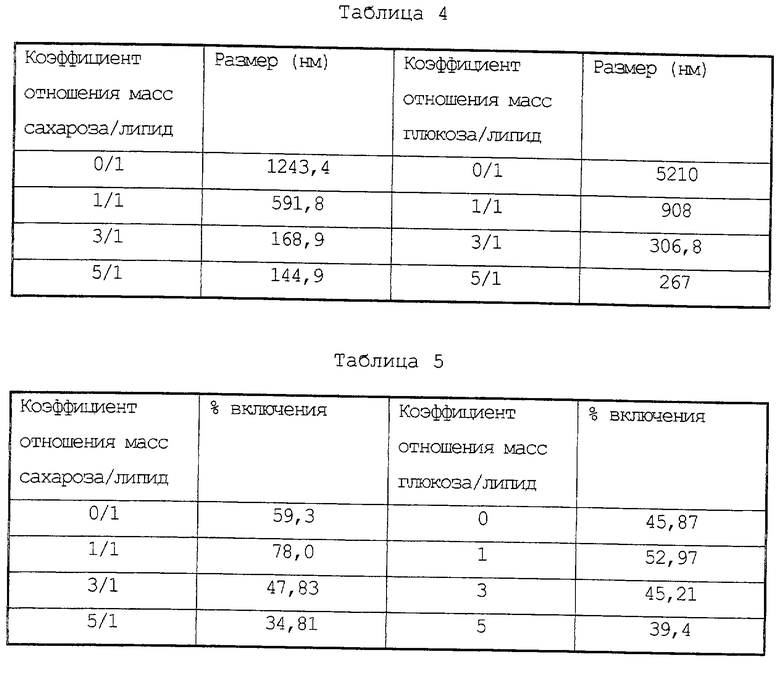
Повторяют процедуру примера 1, но используют в качестве активного ингредиента рибофлавин в количестве, создающем концентрацию в растворе 1 мг (в общем объеме 1 мл) и с использованием, в некоторых случаях, глюкозы вместо сахарозы. Размер липосом при гидратации измеряют по способу, описанному в примере 1. Эффективность инкапсулирования рибофлавина вычисляют при определении общего и инкапсулированного количества рибофлавина методом люминесцентной фотометрии при длине волны эмиссии, равной 480 нм, и при длине волны возбуждения, равной 520 нм. Полученные результаты представлены в Таблицах 4 и 5.
С точки зрения качества, добавление глюкозы к MOB липосомам вместо сахарозы оказывает стабилизирующее воздействие. Включение рибофлавина характеризуется величинами примерно одного порядка для обоих липидов с соотношениями к сахару, равными 3 г/г и 5 г/г глюкозы или сахарозы (Таблица 5).
Липосомы, полученные при добавлении эквивалентного количества глюкозы, характеризуются большим размером везикул при регидратации в сравнении с образцами, приготовленными в присутствии сахарозы (Таблица 4).
Пример 6
Влияние температуры регидратации на образование липосом
Повторяют способ примера 1 с использованием липосом на основе эквимолярных количеств ФХ: ХОЛ раствора сахарозы (68,7 мМ) и 5 мг 14С-пенициллина (пенициллина G) в качестве активного ингредиента. Однако в этом случае регидратацию проводят при разных температурах. В частности, некоторые препараты регидратируют при комнатной температуре, тогда как другие нагревают при 60oС в течение 15 минут. Эффективность включения определяют после ультрацентрифугирования полученных липосом при 40000хg и затем величину радиоактивности 14С-пенициллина выражают в виде процента от общего количества в супернатанте и в осадке. Результаты представлены в Таблице 6.
В указанной выше таблице, как и в последующих таблицах, AV обозначает средний размер липосом - СРР, SD обозначает среднее квадратичное отклонение - СКО и PDI обозначает распределение липосом по размерам или индекс полидисперсности - ИПД.
Липосомы, регидратацию которых приводили при комнатной температуре, демонстрируют лишь незначительное увеличение размеров от 68 нм (обработанных ультразвуком MOB) до размеров в среднем 90 нм, но характеризуются средним уровнем инкапсулирования всего 6,5% от исходного количества внесенного пенициллина. И только при высоких концентрациях сахарозы может быть достигнута приемлемая степень инкапсулирования. Везикулы размером 100 нм демонстрируют уровень инкапсулирования до 14%.
Нагревание аналогичных препаратов на стадии регидратации приводит к получению везикул большего размера. При этом липосомы со средним диаметром 230 нм могут инкапсулировать 24% от исходного количества добавленного 14С-пенициллина (при соотношении, равном 3 г сахарозы/г липида). Повышение количества сахарозы через увеличение коэффициента отношения масс сахара/липида от 3 до 5 ведет к некоторому увеличению размера везикул, которые при этом характеризуются меньшим процентом включения.
Пример 7
Инкапсулирование 14С-пенициллина при различных концентрациях сахарозы
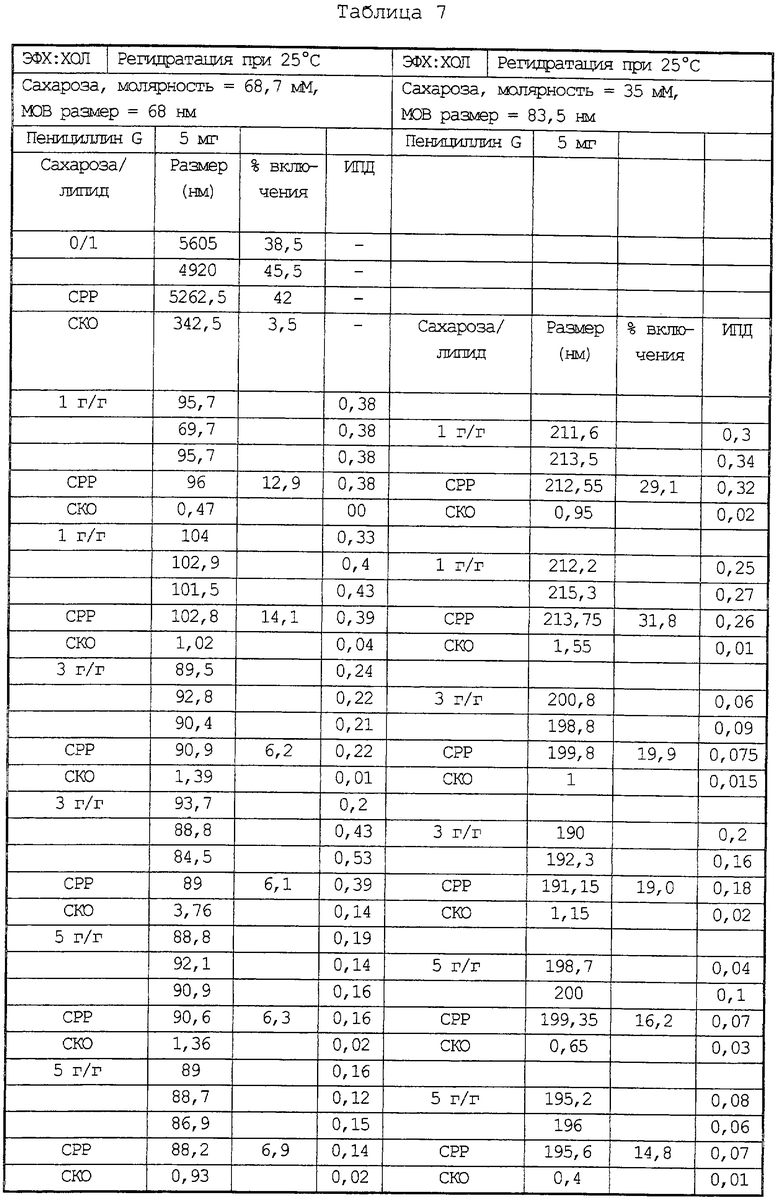
Повторяют способ примера 6 с использованием липосом на основе эквимолярных количеств ФХ:ХОЛ и 14С-пенициллина (5 мг) в качестве активного ингредиента, но при добавлении раствора сахарозы либо большей молярности (68,78 мМ), либо при большем разбавлении (35 мМ).
Полученные результаты приведены в Таблице 7 и так же, как ранее в Таблице 6, показаны данные при регидратации при 25oС.
Липосомы, получаемые с использованием раствора сахарозы низкой молярности, имеют средний размер около 200 нм, что больше, чем в случае проведения процедуры с введением раствора сахара высокой молярности. Однако в этом случае уровень включения выше, а индекс полидисперсности ниже.
В этой связи можно полагать, что снижение молярности сахарозы в процедуре приготовления липосом представляет собой лучшую альтернативу, чем использование высоких температур (см., в частности, пример 6) на стадии регидратации с целью увеличения величины включения. При этом, хотя использование раствора сахарозы низкой молярности дает аналогичный процент включения, липосомы сохраняют меньшие размеры.
Пример 8
Получение ДСФХ липосом
Повторяют способ примера 6 с использованием для получения липосом эквимолярных количеств ДСФХ и холестерина. Этот эксперимент проводят при добавлении раствора сахарозы высокой молярности (71 мМ) и пенициллина (5 мг).
Результаты представлены в Таблице 8.
Приведенные результаты показывают, что увеличение количества сахарозы ведет к снижению уровня включения 14С-пенициллина и снижению среднего диаметра. Липосомы на основе ДСФХ:ХОЛ демонстрируют более высокие уровни включения и меньший размер в сравнении с липосомами на основе ФХ:ХОЛ. Это может быть связано с высокой температурой фазового перехода (Тс) ДСФХ, определяющей большую стабильность при нагревании.
Пример 9
Инкапсулирование доксорубицина
Эксперимент по получению липосом, содержащих доксорубицин, проводят в условиях, указанных в Таблице 9.
Размер регидратированных липосом определяют по способу, описанному в предыдущих примерах. Уровень включения доксорубицина определяют после ультрацентрифугирования, как указано выше. Количество общего и инкапсулированного доксорубицина измеряют методом флуоресцентной фотометрии при длине волны эмиссии 490 нм и длине волны возбуждения 560 нм. Результаты приведены в Таблице 10.
Доксорубицин хорошо включается в мелкие липосомы. Липосомы на основе эквимолярных количеств ФХ: ХОЛ, приготовленные с использованием сахарозы в соотношении 5 г на 1 г липида, имеют размер 116 нм и характеризуются эффективностью инкапсулирования в 45%. Повышение коэффициента соотношения сахарозы и липида не сказывается существенным образом на проценте инкапсулирования. Замена ФХ на ДСФХ приводит к получению липосом, имеющих более высокий процент инкапсулирования.
Пример 10
Влияние увеличения концентрации сахарозы
Повторяют способ примера 4 с использованием повышенных концентраций сахарозы. Сахароза в указанных концентрациях вводилась вместе с рибофлавином, данные по которым, а также значения размеров полученных липосом приведены в Таблице 11.
Приведенные результаты показывают, что при высоких коэффициентах отношения масс сахарозы/липида, в частности при избытке 10% (вес/объем) сахарозы, величина включения низкая, хотя отмечается хороший стабилизирующий эффект на размер липосом.
Пример 11
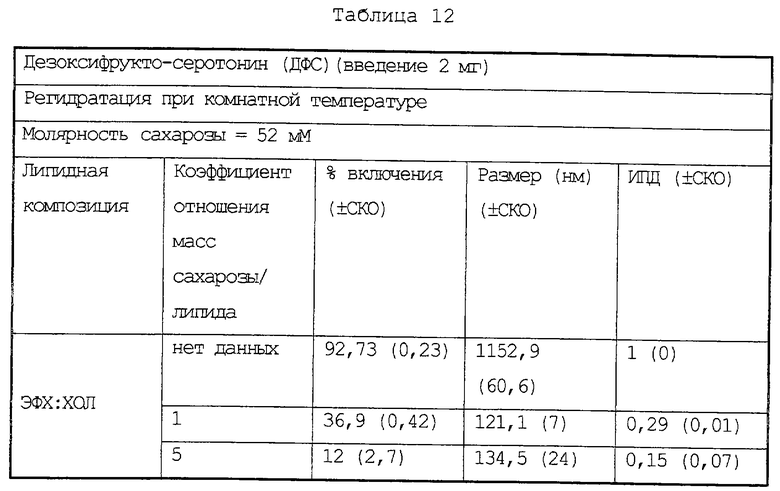
Инкапсулирование дезоксифрукто-серотонина (ДФС)
Липосомы, содержащие ДФС, получают в условиях, указанных в Таблице 12. В этой таблице также приведены данные по величине включения и размерам после регитратации.
В этом примере удается получить хорошие результаты по включению, равно как и приемлемый уровень стабилизации размеров.




Изобретение относится к области медицины и касается способа получения липосом. Изобретение заключается в том, что предлагаемый способ получения композиции реагента включает стадии (i) образования пустых липосом; (ii) смешивания липосом, полученных на стадии (i), с раствором сахара и реагента и (iii) высушивания смеси, полученной на стадии (ii). В целом композиция включает менее 10% (вес/объем) сахарозы. Изобретение обеспечивает получение мелких липосом с высокой инкапсулирующей активностью. Оно может стать особенно полезным в производстве фармацевтических препаратов, позволяет сократить количество стадий процесса и получить при этом стабильные липосомы с высокоэффективной инкапсулирующей способностью. 3 с. и 19 з.п.ф-лы, 6 ил., 12 табл.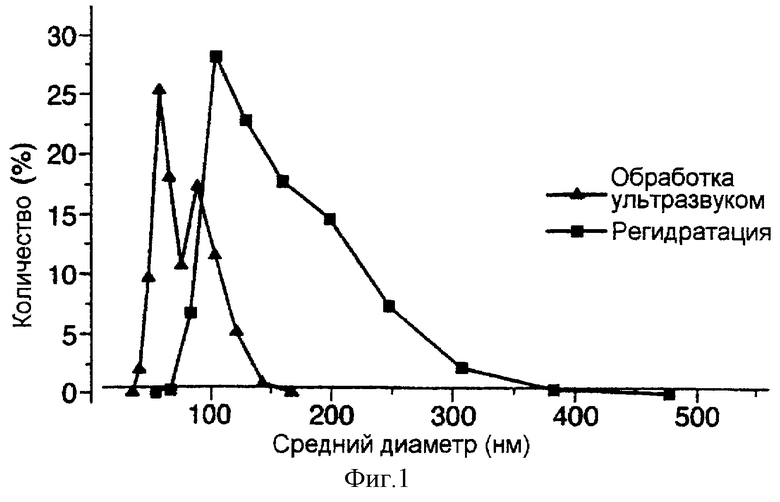
| Бесколесный шариковый ход для железнодорожных вагонов | 1917 |
|
SU97A1 |
| ЛИПОСОМАЛЬНОЕ ПРОТИВОВИРУСНОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО ДЛЯ ПЕРОРАЛЬНОГО ПРИМЕНЕНИЯ | 1996 |
|
RU2123328C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЛИПОСОМ, СОДЕРЖАЩИХ ВОДОРАСТВОРИМЫЕ НИЗКОМОЛЕКУЛЯРНЫЕ СОЕДИНЕНИЯ | 1991 |
|
RU2014071C1 |
| Бесколесный шариковый ход для железнодорожных вагонов | 1917 |
|
SU97A1 |
| US 5094785 A, 10.03.1992. | |||
Авторы
Даты
2003-11-20—Публикация
1999-06-16—Подача