Область техники
Настоящее изобретение относится к композициям внеклеточных везикул (EV) растительного происхождения и их терапевтическим применениям.
Уровень техники
Внеклеточные везикулы (EV) представляют собой гетерогенную популяцию частиц, высвобождаемых практически всеми живыми клетками. Они получены почти от всех типов клеток млекопитающих, а также от низших эукариот, прокариот и растений, и очищены из жидкостей организма. Они включают в основном микровезикулы, высвобождаемые через почкование плазматической мембраны, и экзосомы, полученные из эндосомального компартмента. Внеклеточные везикулы называют «частицами», «микрочастицами», «нановезикулами», «микровезикулами» и «экзосомами» [Yáñez-Mó M. et al., Biological properties of extracellular vesicles and their physiological functions. J. Extracell. Vesicles, 2015, May 14; 4: 27066 doi: 10.3402/jev.v4.27066; Lötvall J. et al., Minimal experimental requirements for definition of extracellular vesicles and their functions: a position statement from the International Society for Extracellular Vesicles. J. Extracell. Vesicles, 201, Dec. 22; 3: 26913. doi: 10.3402/jev.v3.26913; Harrison P. et al., Extracellular Vesicles in Health and Disease. CRC Press, pages 1-5, 2014].
EV содержат сложный и разнообразный груз белков цитоплазмы, поверхностных рецепторов, некоторых взаимодействующих с липидами белков, молекул ДНК и РНК. Путем переноса такого груза EV играют ключевую роль как медиаторы внеклеточной коммуникации.
EV, происходящие из съедобных растений, в их нативной форме, не нагруженные экзогенными молекулами, будут в настоящем описании называться «нативными EV».
Нативные EV как известно эффективны для лечения лейкоза [WO2016166716A1] и колита [Ju S. et al., Grape exosome-like nanoparticles induce intestinal stem cells and protect mice from DSS-induced colitis. Mol. Ther., 2013, Jul; 21(7): 1345-57. doi: 10.1038/mt.2013.64.] путем перорального введения.
Нативные нановезикулы, происходящие из винограда, грейпфрута, имбиря и моркови, демонстрируют противовоспалительное действие при хроническом воспалении кишечника [Zhang M. et al., Edible ginger-derived nanoparticles: A novel therapeutic approach for the prevention and treatment of inflammatory bowel disease and colitis-associated cancer. Biomaterials. 2016, Sept.;101: 321-40. doi:10.1016/j.biomaterials.2016.06.018; Ju S. et al., Grape exosome-like nanoparticles induce intestinal stem cells and protect mice from DSS-induced colitis. Mol. Ther., 2013, Jul; 21(7): 1345-57. doi: 10.1038/mt.2013.64].
В WO2017/052267 раскрывается применение вводимых топически нативных EV, происходящих из съедобных растений, для способствования улучшению состояния кожи с точки зрения образования морщин, увлажненности, осветления, пролиферации эпителиальных клеток и отложения коллагена.
Насколько известно авторам изобретения, в известном уровне техники не раскрывается влияние полученных из растений EV на ангиогенез и жизнеспособность бактерий при местном применении на ранах и поражениях кожи, характеризующихся ишемией и нарушением ангиогенеза или повышенной подверженностью бактериальной инфекции.
Так как EV по своей природе защищают и переносят свой груз в клетки-мишени, они представляют собой полезную альтернативу синтетическим и экзогенным частицам, таким как липосомы, катионные наночастицы, нановезикулы EV-миметики и везикулы на основе полипептидов, для транспортировки терапевтических агентов. EV могут использовать свой естественный механизм действия и преодолевать некоторые ограничения собранных частиц, включая иммуногенность, токсичность, введение экзогенных частиц, ограниченное поглощение клетками и химическую сборку частиц.
В последние годы исследовались многие методы переноса различных молекул (РНК, ДНК, лекарства) в EV. EV-ассоциированные нуклеиновые кислоты защищены от разлагающих ферментов, присутствующих в среде микроокружения, и могут быть доставлены к клеткам-мишеням. Методы, нацеленные на введение молекул в EV, включают электропорацию, ультразвуковую обработку, трансфекцию, инкубацию, экструзию клеток, опосредованную сапонином пермеабилизацию и замораживание-оттаивание.
В WO2017/004526A1 раскрывается применение микровезикул, полученных из винограда и грейпфрута, в качестве носителей для miR18a и miR17, используемых в качестве противораковых лекарственных средств, или для изотопных индикаторов, используемых для диагностики.
Для того, чтобы преодолеть ограничения и недостатки известного уровня техники, настоящее изобретение предоставляет композицию, включающую популяцию внеклеточных везикул (EV) растительного происхождения, а также способ загрузки одной или нескольких биологически активных молекул в популяцию внеклеточных везикул (EV) растительного происхождения, определенные в прилагаемой формуле изобретения в независимых пунктах. Зависимые пункты идентифицируют другие выгодные особенности заявляемых композиции и способа. Предмет прилагаемой формулы изобретения образует неотъемлемую часть настоящего описания.
Подробное описание изобретения
Настоящее изобретение относится к композиции, включающей популяцию внеклеточных везикул (EV) растительного происхождения, причем внеклеточные везикулы (EV) растительного происхождения в указанной популяции заключены в или разграничены липидной двухслойной мембраной и характеризуются тем, что они имеют диаметр от 10 до 500 нм, содержание белка в диапазоне от 1 до 55 нг/109 EV, содержание РНК в диапазоне от 10 до 60 нг/1010 EV, и которые, кроме того, характеризуются тем, что они показывают проангиогенную и антибактериальную активность, для применения в терапевтическом лечении заболевания или состояния, выбранного из группы, включающей язвы, дерматиты, повреждения роговицы, глазные болезни, повреждения слизистых оболочек и инфекционные поражения.
При использовании в настоящем описании термин «внеклеточные везикулы растительного происхождения» или «EV растительного происхождения» относится к наночастицам, происходящим и полученным из клеток растений, которые разграничены или заключены в фосфолипидный бислой, и которые переносят липиды, белки, нуклеиновые кислоты и другие молекулы, происходящие из клеток. Обычно внеклеточные везикулы имеют диаметр в диапазоне 10-1000 нм.
В настоящем изобретении используется выбранная популяции внеклеточных везикул (EV) растительного происхождения, которые имеют диаметр от 10 до 500 нм, предпочтительно в диапазоне от 20 до 400 нм, даже предпочтительнее в диапазоне от 25 до 350 нм. Внеклеточные везикулы растительного происхождения, используемые в настоящем изобретении, могут представлять собой нативные EV или сконструированные EV, как показано в последующих примерах.
Выражения «содержание белка» и «содержание РНК» охватывают содержание как внутри, так и в мембранах EV, используемых в настоящем изобретении.
Примеры липидов EV, используемых в настоящем изобретении, включают, но без ограничения, 24-пропилиденхолестерин, бета-ситостерин, кампестерин, дипальмитин, эйкозанол и/или стеарат глицидилового спирта.
В еще одном предпочтительном воплощении изобретения популяцию EV получают из растения, выбранного из группы, включающей: семейство Rutaceae, такое как род Citrus, семейство Rosaceae, такое как Malus pumila; семейство Vitaceae, такое как Vitis vinifera; семейство Brassicaceae, такое как Anastatica hierochuntica; семейство Selaginellaceae, такое как Selaginella lepidophylla; семейство Asteraceae, такое как Calendula officinalis; семейство Oleaceae, такое как Olea europaea; семейство Xanthorrhoeaceae, такое как Aloe vera; семейство Nelumbonaceae, такое как Nelumbo; семейство Araliaceae, такое как подрод Panax; семейство Lamiaceae, такое как Lavandula; семейство Hypericaceae, такое как Hypericum perforatum; семейство Pedaliaceae, такое как Harpagophytum procumbens; семейство Ginkgoaceae, такое как Ginkgo biloba; семейство Piperaceae, такое как Piper kadsura или Piper futokadsura; семейство Rubiaceae, такое как Hedyotis diffusa. Неограничивающими примерами растений рода Citrus являются лимон, апельсин, танжерин, клементин, бергамот, помпиа.
Объем изобретения включает как композиции, содержащие EV, происходящие из одного вида растений, так и композиции, содержащие EV, происходящие из нескольких видов растений.
EV, используемые в настоящем изобретении, отличаются тем, что они показывают проангиогенную и антибактериальную активность.
В рамках настоящего описания выражение «проангиогенное действие» предназначено для обозначения стимулирования пролиферации эндотелиальных клеток или образования сосудов эндотелиальными клетками и увеличения высвобождения проангиогенных медиаторов in vitro или in vivo. Ангиогенез является фундаментальным биологическим процессом, и его ухудшение вовлекается в патогенез ряда заболеваний, включая ишемические язвы, такие как пролежни, артериальные язвы, венозные язвы, диабетические язвы, экссудативные язвы, дисметаболические язвы, травматические язвы, ожоги, фистулы, псориаз, кератоз, кератит, трещины, повреждения слизистой оболочки (такие как травматические повреждения из-за протеза и подобные, диабетические, повреждения слизистой рта, декубитальные, повреждения слизистой оболочки гениталий), повреждения роговицы/глазные болезни (включая язвы, травматические повреждения, дегенеративные повреждения, стирания, химические травмы, проблемы с контактными линзами, повреждения от ультрафиолетового излучения, кератит), болезнь сухого глаза, конъюнктивит, дерматит (включая акне, экзему, себорейный дерматит, атопический дерматит, контактный дерматит, дисгидротическую экзему, нейродерматит, герпетиформный дерматит), андрогенную алопецию, чесотку, клеточное повреждение, вызванное проапоптозными лекарствами, направленными на лечение предраковых повреждений (например, актинического кератоза). Соответственно, EV, используемые в настоящем изобретении, особенно применимы при лечении таких заболеваний. Нативные внеклеточные везикулы растительного происхождения с проангиогенным действием, используемые в настоящем изобретении, предпочтительно происходят из растений Citrus: лимона, апельсина, танжерина, клементина, бергамота, помпиа; из семейтва Rutaceae, таких как Citrus; из семейства Rosaceae, таких как Malus pumila; из семейства Vitaceae, таких как Vitis vinifera; из семейства Brassicaceae, таких как Anastatica hierochuntica; из Selaginella lepidophylla; из семейства Asteraceae, таких как Calendula officinalis; из семейства Oleaceae, таких как Olea europaea; из семейства Xanthorrhoeaceae, таких как Aloe vera, из семейства Nelumbonaceae, таких как Nelumbo; из семейства Araliaceae, таких как подрод Panax; из семейства Lamiaceae, таких как Lavandula; из семейства Hypericaceae, таких как Hypericum perforatum; из семейства Pedaliaceae, таких как Harpagophytum procumbens; из семейства Ginkgoaceae, таких как Ginkgo biloba; семейства Piperaceae, таких как Piper kadsura или Piper futokadsura; семейства Rubiaceae, таких как Hedyotis diffusa.
В настоящем описании выражение «антимикробное действие» предназначено для указания на любое действие, способное убить микробов, микробицидное или способное подавлять рост микробов, биостатическое. Бактериальные инфекции являются распространенными и вызывают заболевания и осложнения ран, в том числе при поражениях слизистой оболочки (таких как травматические повреждения из-за протеза и т.п., диабетические, повреждения ротовой полости, декубитальны, повреждения слизистой оболочки гениталий), инфекционные повреждения (такие как вирусные инфекции, герпетические инфекции, бактериальные инфекции), язвы (включая диабетические, артериальные, венозные, дисметаболические, экссудиативные, ишемические язвы, пролежни), ожоги, фистулы, повреждения роговицы/глазные болезни (включая язвы, травматические повреждения, дегенеративные повреждения, стирания, химические травмы, проблемы с контактными линзами, повреждения от ультрафиолетового излучения, кератит), болезнь сухого глаза, конъюнктивит, дерматит (включая акне, экзему, себорейный дерматит, атопический дерматит, контактный дерматит, дисгидротическую экзему, нейродерматит, герпетиформный дерматит), травматические язвы, клеточное повреждение, вызванное проапоптозными лекарствами, направленными на лечение предраковых повреждений (например, актинического кератоза). Соответственно, EV, используемые в настоящем изобретении, особенно применимы при лечении таких заболеваний.
Внеклеточные везикулы растительного происхождения с антимикробным действием, используемые в настоящем изобретении, предпочтительно происходят из цитрусовых растений: лимона, апельсина, танжерина, клементина, бергамота, помпиа; из семейтва Rutaceae, таких как Citrus; из семейства Rosaceae, таких как Malus pumila; из семейства Vitaceae, таких как Vitis vinifera; из семейства Brassicaceae, таких как Anastatica hierochuntica; из Selaginella lepidophylla; из семейства Asteraceae, таких как Calendula officinalis; из семейства Oleaceae, таких как Olea europaea; из семейства Xanthorrhoeaceae, таких как Aloe vera, из семейства Nelumbonaceae, таких как Nelumbo; из семейства Araliaceae, таких как подрод Panax; из семейства Lamiaceae, таких как Lavandula; из семейства Hypericaceae, таких как Hypericum perforatum; из семейства Pedaliaceae, таких как Harpagophytum procumbens; из семейства Ginkgoaceae, таких как Ginkgo biloba; семейства Piperaceae, таких как Piper kadsura или Piper futokadsura; семейства Rubiaceae, таких как Hedyotis diffusa.
Как указано выше, объем изобретения также включает способ загрузки одной или нескольких отрицательно заряженных биологически активных молекул в популяцию внеклеточных везикул (EV) растительного происхождения, определенных выше. Получающиеся EV, нагруженные одной или несколькими отрицательно заряженными биологически активными молекулами, в настоящем описании ниже будут называться «нагруженными EV».
Способ по изобретению основан на образовании мостика при помощи поликатионного вещества между отрицательно заряженными EV и отрицательно заряженными биологически активными молекулами. Выражение «отрицательно заряженные биологически активные молекулы» включает, но без ограничения, лекарства, молекулы нуклеиновых кислот и жирорастворимые молекулы, такие как жирорастворимые витамины. Молекулы нуклеиновых кислот включает, но без ограничения, молекулы ДНК и РНК, включая микроРНК, мРНК, тРНК, рРНК, миРНК, регуляторную РНК, некодирующую и кодирующую РНК, фрагменты ДНК, ДНК-плазмиды). Нагруженные EV, полученные способом по изобретению, способны защищать свой груз - биологически активные молекулы от деградации и переносить их к клеткам-мишеням. Биологически активные молекулы-груз предпочтительно имеют терапевтический потенциал.
Способ по изобретению включает контактирование популяции внеклеточных везикул (EV) растительного происхождения, определенных выше, с поликатионным веществом и отрицательно заряженной биологически активной молекулой и совместную инкубацию. После совместной инкубации EV очищают от поликатионного вещества и оставшихся отрицательно заряженных активных молекул.
В первом воплощении EV сначала приводят в контакт и совместно никубируют с поликатионным веществом для возможности связывания поликатионного вещества с поверхностью EV, и затем смесь EV и поликатионного вещества вводят в контакт и совместно инкубируют с отрицательно заряженной активной молекулой.
Во втором воплощении поликатионное вещество и отрицательно заряженные активные молекулы смешивают и затем добавляют к EV.
Согласно предпочтительному воплощению поликатионное вещество выбирают из группы, включающей протамин, полилизин, катионные декстраны, их соли и их комбинации. Предпочтительной солью протамина является гидрохлорид протамина.
Как указано выше, после нагрузки EV очищают. Подходящие методы очистки включают, но без ограничения, ультрацентрифугирование в градиенте, ультрафильтрацию, диафильтрацию, фильтрацию в тангенциальном потоке, способы на основе осаждения, способы на основе хроматографии, концентрирование, методы на основе иммуноаффинного захвата и методы выделения на основе микрофлюидов.
Как будет поясняться в следующем далее экспериментальном разделе, авторы изобретения нагружали EV молекулами синтетической микроРНК и затем подтверждали анализом ОТ-ПЦР, что молекулы микроРНК введены в EV. С помощью количественного ОТ-ПЦР и конфокальной микроскопии авторы также подтвердили, что нагруженные микроРНК EV способны эффективно переносить свой груз в клетки-мишени. Использование микроРНК млекопитающих, отсутствующей в растениях, позволяет эффективно оценить нагрузку. Кроме того, показано, что микроРНК, перенесенные в клетки-мишени, являются биологически активными и влияют на экспрессию целевой микроРНК в клетках.
Как указано выше, нагруженные EV, полученные способом по настоящему изобретению, можно использовать для переноса нескольких отрицательно заряженных биологически активных молекул посредством EV. Например, микроРНК вовлекаются в различные важные ключевые пути как физиологических, так и патологических процессов. Некоторые микроРНК, например, описаны в литературе как вовлеченные в ангиогенез при раке и в регенеративные процессы. Как демонстрация эффективности способа, EV эффективно нагружают прорегенеративными микроРНК, такими как miR-21 и miR-126, и антиогенными и противоопухолевыми микроРНК или ингибиторами микроРНК. Нагруженные EV показывают и усиливают эффективность по сравнению с нативными EV.
Соответственно способ по настоящему изобретению можно использовать для получения нагруженных EV с усиленными терапевтическими эффектами, включая проангиогенные и антибактериальные свойства, или для добавления новой терапевтической активности нативным EV для прорегенеративных целей, которые включают, но без ограничения, антиангиогенные действия.
С другой стороны, способ по настоящему изобретению можно использовать для получения EV, нагруженных специфически модулированными биологическими эффектами, например, удаленным проангиогенным действием без воздействия на антибактериальные свойства и наоборот.
Способ по настоящему изобретению можно использовать для модуляции внутренних биологических эффектов EV для того, чтобы получить нагруженные EV со специально подобранной и конкретно требуемой биологической активностью.
Способ по настоящему изобретению можно использовать для получения нагруженных EV, которые содержат одну или несколько экзогенных молекул, или нагруженных EV, обогащенных биологически активными эндогенными соединениями. Необязательно способ по настоящему изобретению можно использовать для улучшения эффективности нагрузки EV с использованием любого протокола, направленного на введение молекул внутрь EV, включая электропорацию, обработку ультразвуком, трансфекцию, инкубацию, экструзию клеток, опосредуемую сапонином пермеабилизацию и циклы замораживание-оттаивание. Как пример, авторы изобретения показывают, что нагрузка EV на основе протамина, ассоциированная с электропорацией, способна увеличивать нагрузку.
Способ по настоящему изобретению также можно использовать в комбинации с нагрузкой EV растительного происхождения, нагруженных жирорастворимыми молекулами.
Соответственно, настоящее изобретение охватывает загрузку EV растительного происхождения для усиления их нативного действия на клеточную регенерацию. Благоприятное действие EV растительного происхождения может быть усилено путем загрузки жирорастворимых молекул, таких как витамины-антиоксиданты. Жирорастворимые молекулы в их нативной или модифицированной форме эффективно внедряют в EV. Таким образом, EV растительного происхождения для усиления их благоприятного действия можно нагрузить молекулами антиоксидантов, такими как витамины А и Е.
Нативные и нагруженные EV можно вводить несколькими путями в зависимости от места назначения. Для восстановления кожи и наружных слизистых оболочек EV можно вводить местно, в то время как пероральное введение предпочтительно для достижения пищеварительной системы.
Соответственно, композиция по настоящему изобретению, которая включает популяцию EV растительного происхождения, описанных выше, причем EV являются или нативными или нагруженными экзогенными или эндогенными отрицательно заряженными биологически активными молекулами, может быть предоставлена в виде фармацевтической композиции, составленной, например, для местного нанесения, локальной инъекции или перорального введения, или может быть предоставлена в виде препарата пищевой добавки.
Композиция по изобретению может дополнительно включать подходящие матрицы для того, чтобы вызывать регулируемое высвобождение EV в поврежденную или больную ткань, стабилизировать EV и/или усиливать их терапевтическое действие.
Подходящие матрицы, используемые в настоящем изобретении, способны инкапсулировать EV и высвобождать их регулированным путем в случае инъекции или наружного применения, или способны действовать как инертный носитель биологически активных молекул. Подходящие матрицы включают, но без ограничения, каркасы, пленки, гидрогели, гидроколлоиды, мембраны, пены, нановолокна, гели и губки. Для облегчения доставки EV-матрицы композиция может быть объединена с медицинскими устройствами, такими как пластыри, хирургические нити, марля.
Обычно композиции по настоящему изобретению, составленные для наружного применения или локальной инъекции, особенно применимы для способствования восстановлению тканей, когда ткань страдает от нарушенного ангиогенеза или подвергается воздействию бактериальной инфекции. Изобретение относится к применимости внеклеточных везикул растительного происхождения в качестве терапевтического местного лечения, способствующего терапевтическому воздействию на поврежденные ткани и восстановлению клеток, например, когда поврежденные ткани показывают нарушенный ангиогенез или подвергаются воздействию микробных инфекций.
Композиции согласно настоящему изобретению, включающие нативные или нагруженные EV растительного происхождения, причем EV обладают проангиогенной активностью, особенно применимы для терапевтического лечения язв, таких как пролежни, артериальные язвы, венозные язвы, ишемические язвы, диабетические язвы, экссудативные язвы, дисметаболические язвы, ожоги, фистулы, трещины, и болезней кожи, включая псориаз, дераматит, акне, экзему, себорейный дерматит, атопический дерматит, контактный дерматит, дисгидротическую экзему, нейродерматит, герпетиформный дерматит, кератоз, кератит, повреждение роговицы/глазные болезни (включая язвы, травматические повреждения, дегенерационные повреждения, стирание, химические повреждения, проблемы с контактными линзами, повреждения, вызванные ультрафиолетовым излучением, кератит), болезнь сухого глаза, конъюнктивит, андрогенную алопецию, чесотку.
Композиции согласно настоящему изобретению, включающие нативные или нагруженные EV растительного происхождения, причем EV обладают антибактериальной активностью, особенно применимы для лечения повреждений слизистой оболочки (таких как травматические повреждения из-за протеза и подобные, диабетические, повреждения ротовой полости, декубитальные, повреждения слизистой оболочки гениталий), инфекционных повреждений (таких как вирусные инфекции, герпетические инфекции, бактериальные инфекции), язв (включая диабетические, артериальные, венозные, дисметаболические, экссудативные, ишемические язвы, пролежни), ожогов, фистул, трещин, повреждений роговицы и глазных болезней (включая язвы, травматические повреждения, дегенерационные повреждения, повреждения стирания, химические повреждения, повреждения, вызванные ультрафиолетовым излучением, кератит), болезни сухого глаза, конъюнктивита, дерматита (включая акне, экзему, себорейный дерматит, атопический дерматит, контактный дерматит, дисгидротическую экзему, нейродерматит, герпетиформный дерматит), клеточных повреждений, вызванных проапоптозными лекарствами, способствующими лечению предраковых повреждений (например, актинического кератоза).
Доза фармацевтической композиции по настоящему изобретению может изменяться в зависимости от различных факторов, включая активность определенного используемого соединения, возраст пациента, массу тела, общее состояние здоровья, пол, питание, время введения, путь введения, скорость экскреции, комбинацию лекарственных средств и тяжесть определенного заболевания, которое предотвращают или от которого лечат, и может быть соответственно определена специалистом в данной области техники в зависимости от состояния пациента, массы тела, тяжести заболевания, формы лекарственного средства, пути введения и периода введения.
Фармацевтическая композиция согласно настоящему изобретению может быть составлена в виде пилюль, таблеток с сахарным покрытием, капсул, жидкостей, гелей, сиропа, взвесей или суспензий.
Фармацевтическая композиция согласно настоящему изобретению, составленная для локальной доставки, эффективна для усиления регенерации тканей и восстановления клеток. Система доставки гарантирует местную эффективность и регулируемое высвобождение EV со временем в месте повреждения. Кроме того, система доставки также может гарантировать устойчивость и хранение препарата EV. Такие фармацевтические композиции для локальной доставки нативных или нагруженных EV могут содержать гидроколлоидные/гидрогелевые матрицы, подходящие для места и вида повреждения, которое лечат. Состав предназначен для усиления восстановления клеток и/или тканей. Содержащие матрицу композиции можно отрегулировать для соответствия требованиям интересующего повреждения (присутствие экссудата, ожог, сухое повреждение, язва слизистой оболочки, хирургический шов). Сама матрица также может поддерживать терапевтическое действие EV и повязки и усиливать устойчивость EV. Матрицы могут быть твердыми/желатиновыми или жидкими при комнатной температуре и предпочтительно включают гидроколлоидные/гидрогелевые матрицы. Матрицы могут быть созданы из нескольких соединений (или их химических модификаций) и/или их комбинации и включать, но без ограничения, хитозан, желатин, гидроксиапатит, коллаген, целлюлозу, гиалуроновую кислоту, фибрин, альгинат, циклодекстрин, крахмал, декстран, агарозу, хондроитина сульфат, пуллулан, протамин, пектин, глицерофосфат и гепарин, синтетические полимеры, такие как полиэтиленгликоль (ПЭГ), полигликолевая кислота (PGA), поливиниловый спирт [ПВС], поликапролактон [PCL], поли(D,L-молочная кислота) (PDLLA), поли(N-изопропилакриламид) [PNIPAAm], и сополимеры, такие как сополимер D,L-молочной и гликолевой кислот (PDLLGA). Такие молекулы можно использовать в их нативной или химически модифицированной форме. Такие компоненты можно использовать отдельно или в комбинации.
Кроме того, фармацевтические композиции по изобретению, составленные для локальной доставки нативных или нагруженных EV, могут содержать подходящие эксципиенты, консерванты, растворители или разбавители, согласно обычному методу. Эксципиенты, консерванты, растворители или разбавители включают, но без ограничения, лактозу, агар, декстозу, сахарозу, гликоль, сорбит, триклозан, бензиловый спирт, маннит, пропиленгликоль, ксилит, эритрит, мальтит, крахмал, парабены, аравийскую камедь, альгинат, желатин, фосфат кальция, силикат кальция, целлюлозу, метилцеллюлозу, салициловую кислоту, микрокристаллическую целлюлозу, сорбиновую кислоту, креолин, поливинилпирролидон, катионы четвертичного аммония, лимонную кислоту, уксусную кислоту, аскорбиновую кислоту, борную кислоту, альгиновую кислоту, метилгидроксибензоат, глицерин, пропилгидроксибензоат, пиритион цинка, тальк, сульфиты, стеарат магния, бензойную кислоту, минеральные масла, пропионовую кислоту, хлорбутанол, наполнители, сухие разбавители, связующие, смачиватели, дезинтеграторы, поверхностно-активные вещества, пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло, этилолеат, витепсол, макрогол, твин, масло какао, лауриновый жир, глицерожелатин, очищенную воду, масла, воски, жирные кислоты, жирные спиртокислоты, эфиры жирных кислот, поверхностно активные вещества, гумектанты, загустители, антиоксиданты, стабилизаторы вязкости, хелатообразователи, буферы, низшие спирты, витамины, УФ-блокаторы, отдушки, красители, антибиотики, бактерициды или противогрибковые средства и т.п.. Такие молекулы могут использоваться в их нативной форме или с химическими модификациями. Такие компоненты могут использоваться отдельно или в комбинации.
Нативную или нагруженную популяцию EV, объединенную с матрицей или без нее, можно также использовать в качестве активных соединений в препарате пищевой добавки, подходящей в качестве съедобной диетической добавки. Терапевтические свойства EV могут поддерживать восстановление клеток в желудочно-кишечном тракте.
Соответственно, изобретение также охватывает съедобный препарат, содержащий нативные или нагруженные EV растительного происхождения, предпочтительно полученные из растений из семейства Brassicaceae, таких как Anastatica hierochuntica; из Selaginella lepidophylla; из семейства Asteraceae, таких как Calendula officinalis; из семейства Oleaceae, таких как Olea europaea; из семейства Xanthorrhoeaceae, таких как Aloe vera, из семейства Nelumbonaceae, таких как Nelumbo; из семейства Araliaceae, таких как Subgenus Panax; из семейства Lamiaceae, таких как Lavandula; из семейства Hypericaceae, таких как Hypericum perforatum; из семейства Pedaliaceae, таких как Harpagophytum procumbens; из семейства Ginkgoaceae, таких как Ginkgo biloba; семейства Piperaceae, таких как Piper kadsura или Piper futokadsura; семейства Rubiaceae, таких как Hedyotis diffusa.
Препарат пищевой добавки может быть получен в нескольких формах для перорального введения, включая порошки, гранулы, таблетки, капсулы, суспензии, эмульсии, сиропы, аэрозоли. Кроме того, диетическая добавка по настоящему изобретению может содержать различные питательные вещества, витамины, минералы (электролиты), корригенты, такие как синтетические ароматизаторы и природные ароматизаторы, красители, пектиновую кислоту и ее соль, альгиновую кислоту и ее соль, органические кислоты, защитные коллоидные загустители, регуляторы рН, стабилизаторы, консерванты, глицерин, спирт, карбонизаторы, используемые в газированных напитках, и т.д. Такие компоненты могут использоваться отдельно или в комбинации.
Препарат пищевой добавки по изобретению также может содержать подходящие эксципиенты, консерванты, растворители или разбавители, известные специалистам в данной области техники. Эксципиенты, консерванты, растворители или разбавители включают, но без ограничения, лактозу, агар, декстозу, сахарозу, гликоль, сорбит, триклозан, бензиловый спирт, маннит, пропиленгликоль, ксилит, эритрит, мальтит, крахмал, парабены, аравийскую камедь, альгинат, желатин, фосфат кальция, силикат кальция, целлюлозу, метилцеллюлозу, салициловую кислоту, микрокристаллическую целлюлозу, сорбиновую кислоту, креолин, поливинилпирролидон, катионы четвертичного аммония, лимонную кислоту, уксусную кислоту, аскорбиновую кислоту, борную кислоту, альгиновую кислоту, метилгидроксибензоат, глицерин, пропилгидроксибензоат, пиритион цинка, тальк, сульфиты, стеарат магния, бензойную кислоту, минеральные масла, пропионовую кислоту, хлорбутанол, наполнители, сухие разбавители, связующие, смачиватели, дезинтеграторы, поверхностно-активные вещества, пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло, этилолеат, витепсол, макрогол, твин, масло какао, лауриновый жир, глицерожелатин, очищенную воду, масла, воски, жирные кислоты, жирные спиртокислоты, эфиры жирных кислот, гумектанты, загустители, антиоксиданты, стабилизаторы вязкости, хелатообразователи, буферы, низшие спирты, витамины, УФ-блокаторы, отдушки, красители, антибиотики, бактерициды или противогрибковые средства т.п.. Такие молекулы могут использоваться в их нативной форме или с химическими модификациями. Такие компоненты могут использоваться отдельно или в комбинации.
ПРИМЕРЫ
Следующий далее экспериментальный раздел приводится только для пояснения и не предназначен для ограничения объема изобретения, определенного в прилагаемой формуле изобретения. В следующем далее экспериментальном разделе делается ссылка на прилагаемые чертежи, описанные ниже.
Фигура 1 показывает характеристикм нативных EV растительного происхождения в экспериментальном примере 1 для EV, полученных из а) лимона, В) апельсина, С) винограда, D) Anastatica hierochuntica и E) Selaginella lepidophylla. Характерное изображение при анализе наночастиц (Nanosight) и фотографии просвечивающей электронной микроскопии EV (исходные увеличения ×40000 и ×120000) показывают размер, типичный для EV.
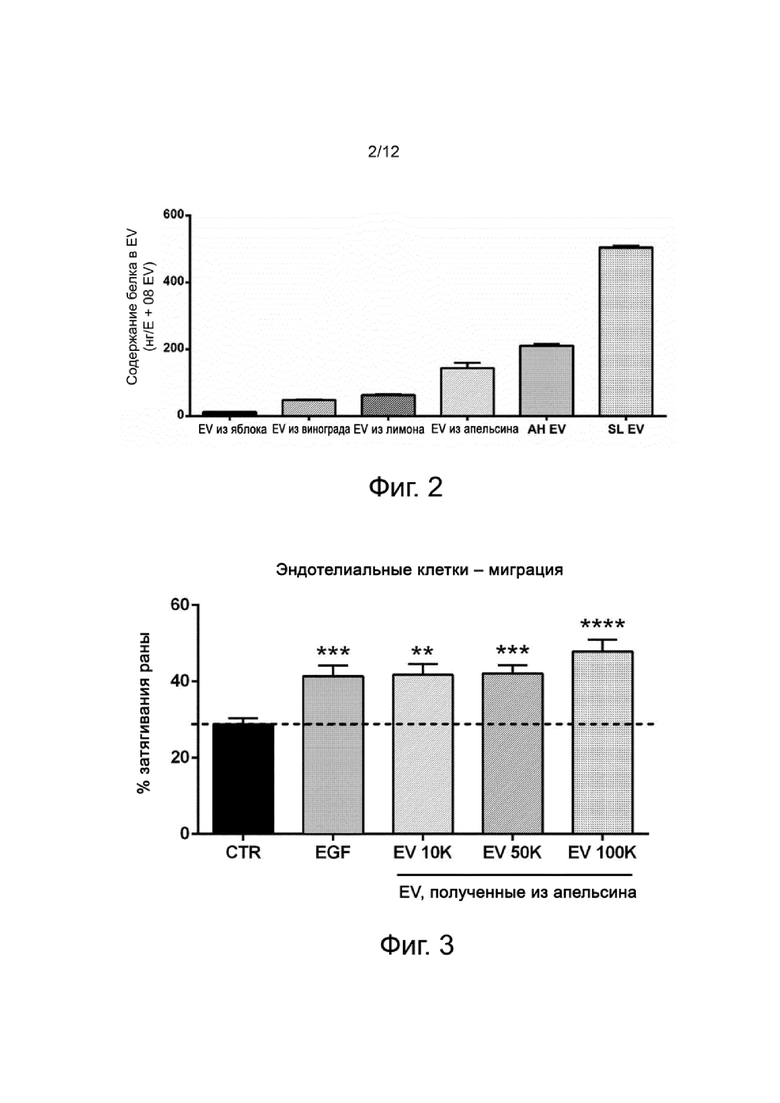
Фигура 2 показывает содержание белка нативных EV растительного происхождения в экспериментальном примере 1, выраженное в нанограммах (нг) белка в 108 EV, выделенных из яблока, лимона, апельсина, винограда, Anastatica hierochuntica и Selaginella lepidophylla.
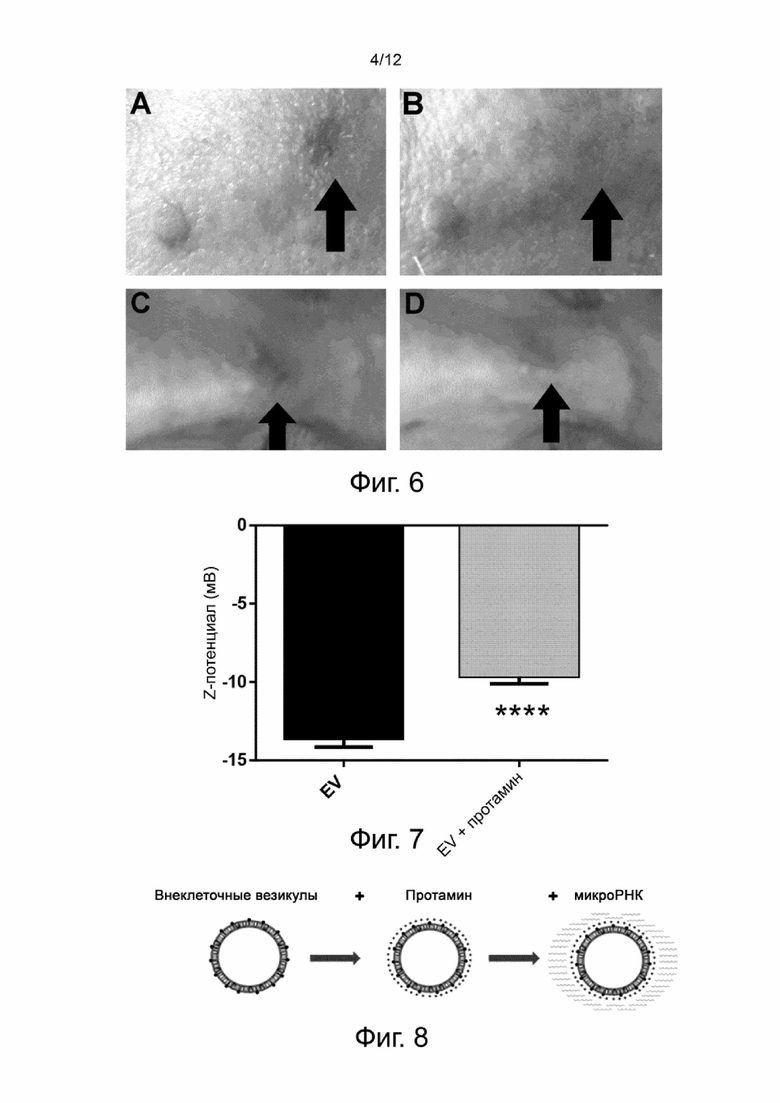
Фигура 3 показывает результаты способствования миграции эндотелиальных клеток in vitro, опосредованной нативными EV растительного происхождения, в экспериментальном примере 2. Диаграмма показывает процент затягивания ран (среднее ± SEM) по сравнению с контрольными клетками (CTR), измеренного по скретч-тесту. Клетки обрабатывают тремя различными дозами нативных полученных из апельсина EV: 10000 EV/клетка (EV 10k), 50000 EV/клетка (EV 50k), 100000 EV/клетка (EV 100k). Выполняют N=4 экспериментов для каждого указанного набора данных, и используют 10-мкМ фактор роста эндотелия (EGF) в качестве положительного контроля. Статистическую значимость вычисляют, сравнивая каждое условие с CTR. p: * < 0,05; ** < 0,01; *** < 0,005; **** <0,001.
Фигура 4 показывает результаты способности нативных EV растительного происхождения в эксперментальном примере 2 способствовать ангиогенезу. Эндотелиальные клетки стимулируют EV, полученными из лимона, апельсина, винограда, Anastatica hierochuntica (АН) и Selaginella lepidophylla (SL) (100000 EV/клетка), и выполняют анализ образования трубочек. Выполняют N=4 экспериментов для каждого набора данных, и используют 10-мкМ фактор роста эндотелия сосудов (VEGF) в качестве положительного контроля. Статистическую значимость вычисляют, сравнивая каждое условие с CTR. p: * < 0,05; ** < 0,01; *** < 0,005; **** <0,001.
Фигура 5 показывает результаты способствования нативных EV растительного происхождения в эксперментальном примере 2 пролиферации клеток на стимулированных гипоксией эндотелиальных клетках. Эндотелиальные клетки инкубируют в условиях гипоксии в течение 24 час и затем обрабатывают тремя различными дозами полученных из апельсина EV (10000 (10k) или 30000 (30k) или 50000 (50k) или 100000 (10 k) EV/клетка) в течение еще 24 час. Пролиферацию проверяют путем включения BrdU, и выполняют анализ, сравнивая кратность изменения против контрольных клеток (CTR). EGF, 10 мкМ, используют в качестве положительного контроля. (CTR+). Статистическую значимость вычисляют, сравнивая каждое условие с CTR. p: * < 0,05; ** < 0,01; *** < 0,005; **** <0,001.
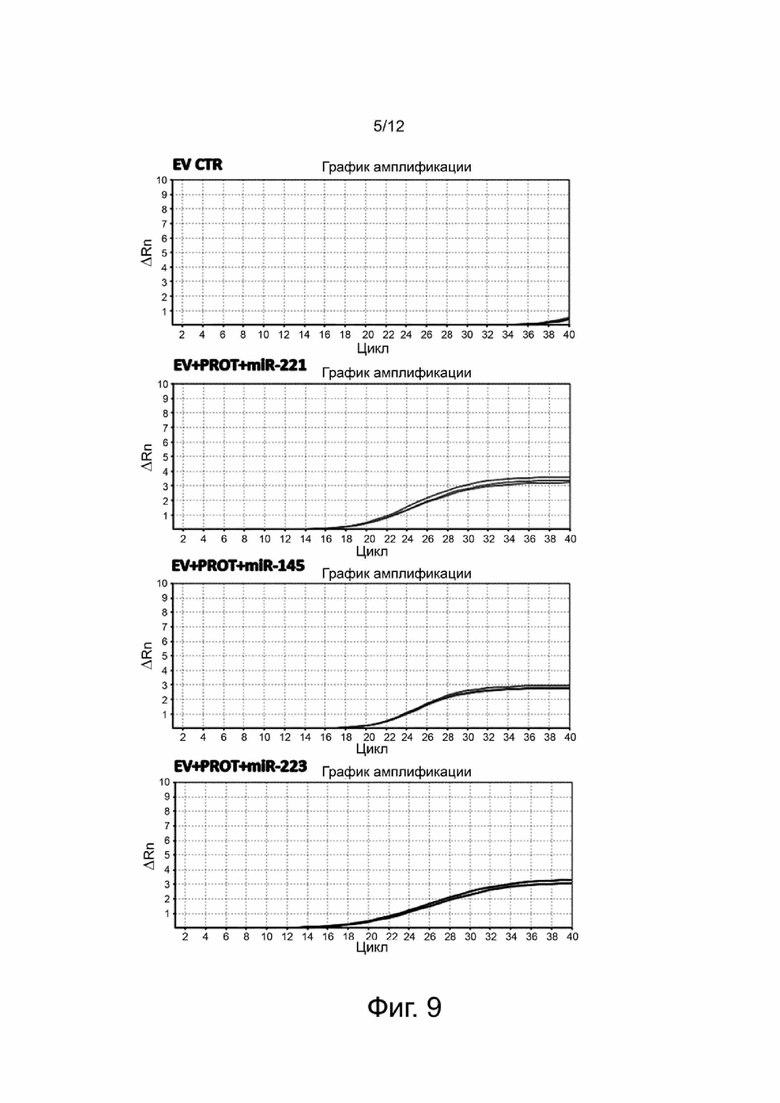
Фигура 6 показывает результаты терапевтического действия на человека in vivo нативных EV растительного происхождения в экспериментальном примере 4. Нативные EV, полученные из апельсина, используют для лечения повреждения кожи, вызванного ингенол мебутатом (ингенол-3-ангелат, пикато), используемого для локального лечения предраковых повреждений, актинического кератоза. Показаны характерные изображения повреждений ткани: повреждение до (фигура 6А) и через три дня после (фигура 6В) обработки EV растительного происхождения в сравнении с необработанным повреждением до (фигура 6С) и через три дня (фигура 6D).
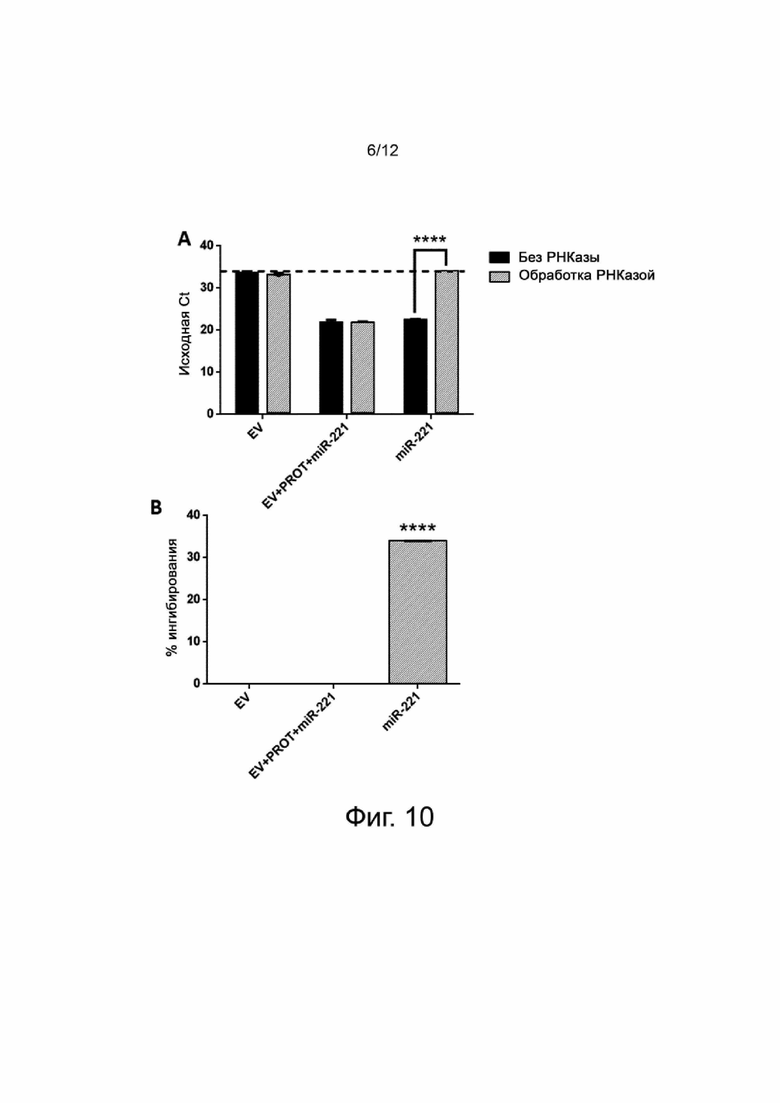
Фигура 7 показывает результаты измерений заряда EV в экспериментальном примере 5. Измеряют Z-потенциал (мВ), показатель заряда частицы, в нативных EV (EV), полученных из апельсина, и EV, сконструированных с протамином, 1,0 мкг/мл (EV+протамин). Результаты получены из трех экспериментов при трехкратном повторе. p: **** <0,001.
Фигура 8 иллюстрирует способ модификации EV в экспериментальном примере 5. Изобретение состоит в использовании положительно заряженной молекулы (подобной протамину) в качестве мостика для связывания отрицательно зараженных биологически активных молекул (например, микроРНК) для концентрирования молекул на поверхности EV.
Фигура 9 показывает результаты присутствия микроРНК в нагруженных EV в экспериментально примере 5. Диаграмма амплификации получена анализом ОТ-ПЦР нативных полученных из апельсина EV (EV CTR), EV, сконструированных с протамином и синтетической микроРНК человека, miR-145, miR-221 или miR-223 (EV+PROT+ miR-145/ miR-221/miR-223). Экспрессия микроРНК представлена как ΔRn, величина сигнала, полученного от амплификации микроРНК, против числа циклов.
Фигура 10 показывает результаты защиты сконструированных молекул (микроРНК) после обработки РНКазой в экспериментальном примере 5. Полученные из апельсина EV, сконструированные с помощью микроРНК miR-221, обрабатывают физиологической концентрацией РНКазы (0,2 мкг/мл), и оценивают экспрессию количественной ОТ-ПЦР в контрольных нативных EV, нагруженных EV как EV, сконструированных с протамином и микроРНК (EV+PROT+ miR-221), и свободной микроРНК (miR-221). Данные приводятся как исходная Ct (А) и процент ингибирования относительно необработанных образцов (В). p: **** <0,001.
Фигура 11 показывает внедрение EV в клетки-мишени с использованием конфокальной микроскопии в экспериментальном примере 6. Эндотелиальные клетки (ТЕС) обрабатывают флуоресцентно меченными нагруженными полученными из апельсина EV (30000 EV/клетки) в течение различного времени (30 мин, 6 часов) и анализируют с помощью конфокальной микроскопии для детекции их вторжения в клетки-мишени. Приводятся характерные микроснимки клеток, обработанных окрашенными EV (EV CTR) или меченными EV в течение 30 минут и 6 часов. Мембрану EV, микроРНК, клеточные ядра окрашивают красным PKH26, зеленым FITC, синим DAPI, соответственно. (Исходное увеличение ×630).
Фигура 12 показывает прямой перенос нагруженной микроРНК в клетки-мишени и ее функциональность в экспериментальном примере 6. Эндотелиальные клетки (ТЕС) культивируют с нормальной средой (CTR), нативными полученными из апельсина EV (EV), нагруженными полученными из апельсина EV, сконструированными с протамином и микроРНК miR-221 (EV+PROT+миметик-221) или скремблированной микроРНК (EV+PROT+скрембл) или анти-miR-29a (EV+PROT+анти-mir-29a) (30000 EV/клетка). A) Перенос микроРНК (miR-221) в клетки-мишени оценивают анализом количественной ОТ-ПЦР с использованием RNU6B в качестве микроРНК «домашнего хозяйства» и клеток, культивированных без стимулов, в качестве контроля. Данные приводятся в виде величин as RQ и сравниваются с CTR. B) Действие на мишень коллаген 4A3 микроРНК после обработки EV, сконструированными с микроРНК (анти-mir-29a). Оценка активности микроРНК на ее мишени мРНК коллагена4 изоформы A3 через 72 часа. Клетки инкубируют совместно с нагруженными EV, сконструированными с анти-miR-29a (EV+PROT+анти-mir-29a) (30000 EV/клетка) или нормальной средой (CTR), и экспрессию коллагена 4A3 оценивают ОТ-ПЦР. Данные приводятся в виде величин RQ. Данные приводятся в виде величин RQ и сравниваются с CTR. p: *** < 0,005.
Фигура 13 показывает анализ размеров нагруженных EV, сконструированных с уменьшающимися дозами протамина, в экспериментальном примере 7. Анализ наноразмерности контрольных нативных EV, полученных из апельсина (EV CTR), нагруженных EV, сконструированных с протамином (начальная доза 1,0 мкг/мл) и меньшими дозами: 1,0 нг/мл, 0,1 нг/мл, 0,01 нг/мл. После совместной инкубации с микроРНК (miR-221) анализ EV оценивается как средний A) и мода B) размер нагруженных EV. Данные сравнивают с EV CTR (нативные EV). p: * < 0,05.
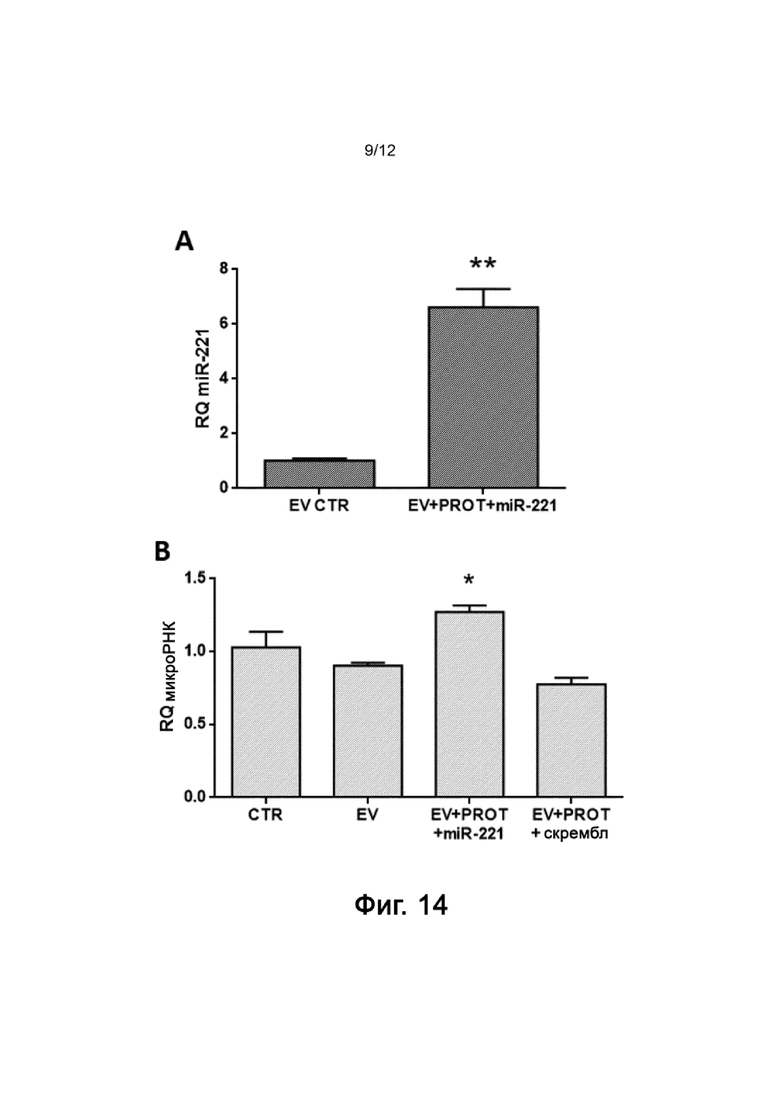
Фигура 14 показывает результаты экспрессии микроРНК в нагруженных EV после конструирования и включения в клетки-мишени с использованием низких доз протамина в экспериментальном примере 7. А) Нагруженные полученные из апельсина EV конструируют с меньшей дозой протамина (1,0 нг/мл) и микроРНК miR-221 и анализируют на содержание в них экзогенной микроРНК. Данные, полученные анализом ОТ-ПЦР, показаны в величинах RQ с использованием RNU6B в качестве гена «домашнего хозяйства» и нормализованы с нативными EV (EV CTR). p: ** < 0,01. B) Нагруженные полученные из апельсина EV конструируют с протамином (1,0 нг/мл) и микроРНК miR-221 или скремблом и инкубируют совместно с эндотелиальными клетками (TEC) в течение 24 часов. Наличие нагруженной микроРНК измеряют в клетках-мишенях ОТ-ПЦР и представляют в виде RQ в клетках, культивированных с нормальной средой (CTR), нормальными нативными EV (EV) или нагруженными EV, сконструированными с использованием протамина и скремблированной микроРНК (EV+PROT+скрембл) или miR-221 (EV+PROT+miR-221). p: * < 0,05.
Фигура 15 показывает улучшение терапевтического действия нативных EV растительного происхождения после конструирования с прорегенеративной микроРНК в экспериментальном примере 8. Диаграмма иллюстрирует усиленную миграцию кератиноцитов и показывает процент затягивания ран (среднее ± SEM) при сравнении с контрольными клетками (CTR). Клетки обрабатывают тремя различными дозами нативных полученных из апельсина EV: 10000 EV/клетка (EV 10k), 50000 EV/клетка (EV 50k), 100000 EV/клетка (EV 100k); и дозой 5000 EV/клетка нагруженных EV плюс протамин (1,0 нг/мл) (EV + P) и нагруженных EV плюс протамин и miR-21 (EV + miR-21). EGF (10 мкМ) используют в качестве положительного контроля. Выполняют N=4 экспериментов для каждого набора данных. Статистическую значимость вычисляют при сравнении каждого условия с CTR.
Фигура 16 показывает приобретение новых биологических функции нагруженными EV после конструирования с микроРНК в экспериментальном примере 9. Нагруженные полученные из апельсина EV, сконструированные с несколькими антиангиогенными микроРНК, испытывают на образование клеток эндотелия сосудов (ТЕС) с использованием анализа на ангиогенез. ТЕС культивируют с нормальной средой (CTR), нативными EV (EV), нагруженными EV, сконструированными с протамином (EV+с протамин), или нагруженными EV, модифицированнми протамином (1,0 нг/мл) и синтетической ангиогенной микроРНК (анти-miR для проангиогенных микроРНК и miR для антиангиогенных микроРНК). Скремблы являются контрольными микроРНК. После 24-часовой обработки измеряют общую длину сосудов, и приводят процент общей длины по сравнению с нормальными клетками (CTR). p: * < 0,05, ** < 0,01, *** < 0,005, **** <0,001.
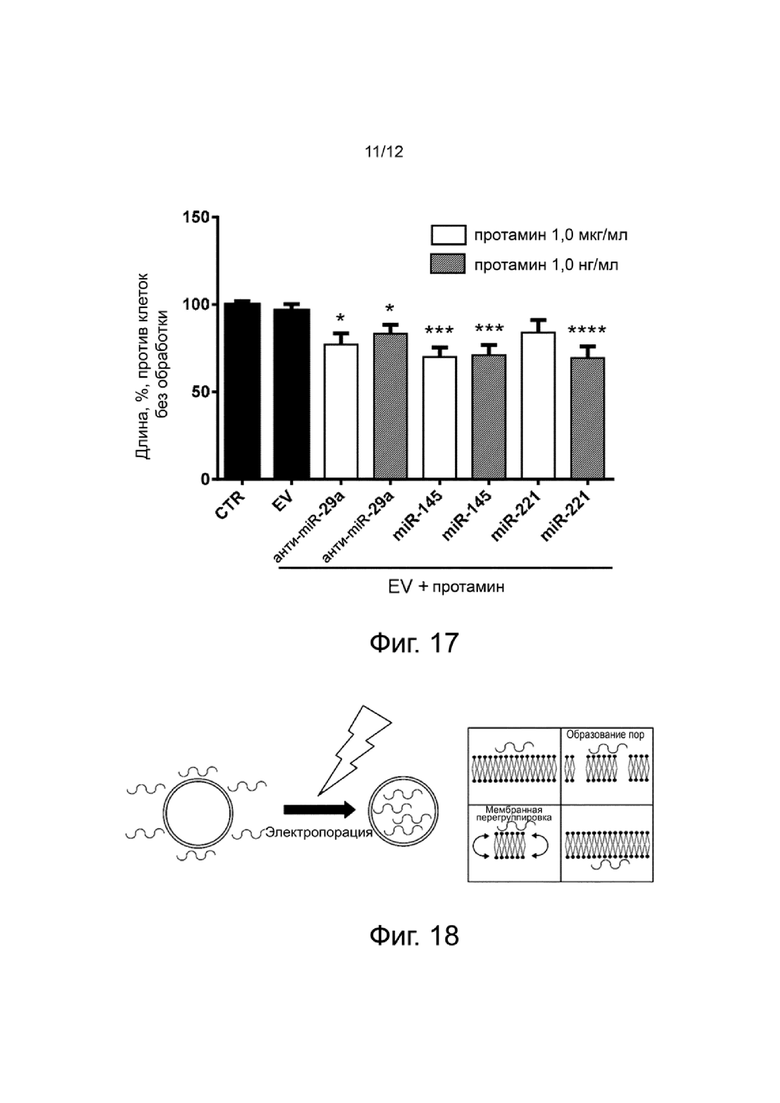
Фигура 17 показывает результаты по биологической активности нагруженных EV, сконструированных с двумя различными дозами протамина, в экспериментальном примере 10. Полученные из апельсина EV конструируют с начальным (1,0 мкг/мл) или меньшим (1,0 нг/мл) количеством протамина и различными антиангиогенными микроРНК (анти-imiR-29a, miR-145, miR-221). Нагруженные EV используют для обработки эндотелиальных клеток (TEC), и образование сосудов оценивают при сравнении с контрольными клетками (CTR) и клетками, культивированными с нативными EV (EV). Общую длину приводят в виде процента относительно контрольных клеток. p: * < 0,05, *** < 0,005, **** <0,001.
Фигура 18 иллюстрирует усиление молекулярной интернализации с использованием метода модификации, описанного в настоящей заявке на патент, и добавлением обычного способа трансфекции в экспериментальном примере 11. Связывание отрицательно заряженной молекулы (такой как микроРНК) с EV увеличивает число молекул на поверхности EV и увеличивает их нагрузку после протокола трансфекции, такого как электропорация. Действительно, увеличенное число молекул на поверхности EV допускает усиленную нагрузку внутри EV после перегруппировки на мембране, которая благоприятствует продвижению микроРНК внутрь EV.
Фигура 19 показывает результаты усиления конструирования с использованием комбинации метода модификации, описанного в настоящей заявке на патент, и добавления обычного способа трансфекции в экспериментальном примере 11. Эндотелиальные клетки (ТЕС) стимулируют в течение 24 часов, и измеряют образование сосудов с использованием анализа на ангиогенез. Стимулами являются нормальная среда (CTR), нативные полученные из апельсина EV (EV), нагруженные EV, сконструированные с использованием протамина (1,0 нг/мл) и микроРНК miR-221 (EV+PROT+miR-221), электропорированные miR-221 EV (EV + электропорированные miR-221) и электропорированные нагруженные EV после модификации протамином (1,0 нг/мл) и микроРНК miR-221 (EV + PROT - электропорированные miR-221). Образование сосудов оценивают как процент образования сосудов по сравнению с нормальными клетками (CTR). p: * < 0,05, ** < 0,01.
Материалы и методы
Выделение внеклеточных везикул
Внеклеточные везикулы выделяют из сока растений. Плоды отжимают, и сок последовательно фильтруют с использованием пор в порядке уменьшения для удаления волокон. Затем EV очищают ультрацентрифугированием. Для дифференциального ультрацентрифугирования сок сначала центрифугируют при 1500 g в течение 30 минут для удаления дебриса и других загрязнителей. Затем EV очищают первым центрифугированием при 10000 g с последующим ультрацентрифугированием при 100000 g в течение 1 часа при 4°C (Beckman Coulter Optima L-90K, Fullerton, CA, USA). Конечный осадок ресуспендируют с помощью забуференного фосфатом физиологического раствора с добавлением 1% ДМСО и фильтруют через фильтры 0,22 микрона для стерилизации. Внеклеточные везикулы используют или хранят при -80°C в течение длительного времени. Очищенные EV характеризуют с помощью анализа траекторий наночастиц и электронной микроскопии.
Анализ траекторий наночастиц (NTA)
Анализ траекторий наночастиц (NTA) используют для определения размера и профиля EV с использованием системы NanoSight LM10 (NanoSight Ltd., Amesbury, UK), снабженной лазером 405 нм, и аналитической программы NTA 3.1. Броуновские движения EV, присутствующих в образце, подвергнутых воздействию лазерного источника излучения, регистрируют камерой и преобразуют в параметры размера и концентрации с помощью NTA через уравнение Стокса-Эйнштейна. Уровни камеры для всех измерений равны 16, и для каждого образца записано пять видеороликов длительностью 30 с. Коротко, очищенные EV и сконструированные EV разводят (1:1000 и 1:200, соответственно) в 1 мл свободного от везикул физиологического раствора (Fresenius Kabi, Runcorn, UK). Настройки NTA после сбора данных оптимизируют и поддерживают постоянными во всех образцах, и затем каждое видео анализируют для измерения средней EV, режима и концентрации.
Просвечивающая электронная микроскопия
Просвечивающую электронную микроскопию EV выполняют, нагружая EV на сетки 200 меш из никеля и формвара с углеродным покрытием (Electron Microscopy Science, Hatfield, PA) в течение 20 мин. Затем EV фиксируют раствором, содержащим 2,5% глутарового альдегида и 2% сахарозы, и после повторных промывок в дистиллированной воде образцы отрицательно окрашивают NanoVan (Nanoprobes, Yaphank, NK, USA) и проверяют с помощью электронного микроскопа Jeol JEM 1010.
Культивирование клеток
Эндотелиальные клетки микрососудов человека (НМЕС) получают путем иммортализации обезьяним вирусом 40 первичных эндотелиальных клеток микрососудов в коже человека. НМЕС культивируют в базальной среде для эндотелия с добавлением набора bullet kit (EBM, Lonza, Basel, Switzerland) и 1 мл Mycozap CL (Lonza, Basel, Switzerland).
Иммортализованные кератиноциты человека (HaCat) культивируют в DMEM (Lonza, Basel, Switzerland) с добавлением 10% фетальной бычьей сыворотки (FBS, Thermo Fisher Scientific, Waltham, MA, USA) при 37°C с 5% CO2. Клетки высевают при плотности 3,5×102 клетки/см2, используя 1 мл среды/см2, и пересевают, когда конфлюентность клеток составляет 70-80%. Коротко, пробирки «матрасы» промывают буферным физиологическим раствором HEPES, инкубируют с трипсином в течение 6 мин и затем трипсин нейтрализуют средой, содержащей 10% FBS. Если клетки за 7 мин разделились не полностью, инкубацию с трипсином повторяют.
Эндотелиальные клетки, полученные из клеток рака почек человека (ТЕС), выделяют из образцов рака почек светлоклеточного типа с использованием анти-CD105 Ab в сочетании с магнитными гранулами путем магнитного сортинга клеток с использованием системы MACS (Miltenyi Biotec, Auburn, CA, USA). Клеточные линии TEC устанавливают и поддерживают в культуре в базальной полной среде Endogro (Merck Millipore, Billerica, MA, USA). TEC предварительно характеризуют как эндотелиальные клетки по морфологии, положительному окрашиванию на антиген vWF, CD105, CD146 и кадгерин сосудистого эндотелия и отрицательному окрашиванию на цитокератин и десмин.
Анализ на белки
Белки экстрагируют из EV буфером RIPA (150 нM NaCl, 20 нM трис-HCl, 0,1% додецилсульфата натрия, 1% дезоксихолата, 1% тритона X-100, pH 7,8) с добавлением коктейля протеазы и ингибиторов фосфатазы (Sigma-Aldrich, St. Louis, Missouri, USA). Содержание белков определяют количественно с помощью набора для анализа белков BCA Protein Assay Kit (Thermo Fisher Scientific, Waltham, Massachusetts, USA), следуя протоколу изготовителя. Коротко, по 10 мкл образца распределяют в лунки 96-луночного планшета, и общие концентрации белков определяют с использованием линейной стандартной кривой, установленной с бычьим сывороточным альбумином (BSA).
Скретч-анализ in vitro
Кератиноциты (НаСаТ) и эндотелиальные клетки (НМЕС) высевают при плотности ~50×103 клетки /лунка в 24-луночные планшеты в DMEM с добавлением 10% FCS. Когда клетки достигают полной конфлюентности, их оставляют в среде без FCS в течение ночи. На следующий день наносят царапины стерильным наконечником. Перед стимуляцией (t=0) получают микроснимки лунки с использованием микроскопа Leica (Leica, Wetzlar, Germany). Затем клетки стимулируют DMEM с 10% FBS или EGF как положительным контролем (CTR +) или EV (10000 (10k) или 50000 (50k) или 100000 (100k) EV/клетки-мишени). Явление «затягивание раны» контролируют в течение 48 час с использованием микроскопа Leica, и изображения анализируют с помощью программы ImageJ (Bethesda, MD, USA), наблюдая уменьшение площади раны в клетках, стимулированных EV, при сравнении с клетками, не стимулированными EV.
Анализ на ангиогенез in vitro
Образование in vitro капилляроподобных структур исследуют на матригеле с пониженным содержанием фактора роста (BD Bioscience, Franklin Lakes, NJ, USA) в 24-луночных планшетах. HMEC или TEC (25000 клетки/лунка) высевают в лунки с покрытием из матригеля в среде DMEM или EndoGRO MV-VEGF, соответственно, содержащей EV (50000 или 30000 EV/клетки-мишени). Обработку выполняют при трехкратном повторе. Организацию клеток на матригеле визуализируют с помощью Nikon Eclipse TE200. После инкубации в течение 24 час фазово-контрастные изображения (увеличение ×10) регистрируют и измеряют общую протяженность сетевых структур с использованием программы ImageJ. Общую протяженность в поле зрения вычисляют в пяти произвольно выбранных полях и выражают в виде процента к соответствующему контролю.
Анализ на пролиферацию in vitro
НМЕС высевают в 96-луночные планшеты при плотности 2000 клетки/лунка и оставляют до слияния.
Культуральную среду заменяют на DMEM и оставляют на ночь. Затем планшет закрывают в гипоксической камере, заполненной следующей газовой смесью: 5% CO2, 1% O2, 94% N. Гипоксическую камеру помещают в инкубатор с CO2 на 24 часа. Затем планшет извлекают из гипоксической камеры, клетки обрабатывают в одной DMEM (CTR), с положительным контролем (10 нг/мл EGF, CTR+), увеличивающимися дозами нативных EV растительного происхождения (10000, 30000, 50000 и 100000 EV/клетка). Каждое условие выполняют четырехкратно. Затем в каждую лунку добавляют 10 мкл маркирующего раствора BrdU (колориметрический анализ с BrdU, Roche), и планшет инкубируют в течение ночи. Следующую процедуру выполняют согласно инструкции изготовителя BrdU для анализа. Измеряют оптическую плотность считывающим устройством для ELISA при 370 нм. Вычисляют среднюю оптическую плотность для каждого условия. Оптическая плотность прямо пропорциональна скорости пролиферации. Все средние значения оптической плотности нормализуют к среднему необработанного контроля (CTR), используемого в качестве контрольного образца. Результаты показывают относительную скорость пролиферации при сравнении с CTR, для которых равна 1.
Измерение заряда EV
Анализ выполняют с помощью наноинструмента Zeta-sizer (Malvern Instruments, Malvern, UK). Все образцы анализируют при 25°C в фильтрованном (отсечение = 200 нм) физилогическом растворе. Дзета-потенциал (плоскость скольжения) генерируется на расстоянии x от частицы, указывая на степень электростатического отталкивания между соседними частицами в дисперсии, заряженными аналогично. Отрицательный дзета-потенциал указывает на высокую степень дисперсии частиц.
Конструирование EV с помощью протамина
EV смешивают с протамином (1,0 мкг/мл) (Sigma-Aldrich, St. Louis, MO) и совместно инкубируют при 37°C в течение 5-30 минут для возможности связывания с поверхностью EV. Используют различные дозы протамина (1,0 нг/мл, 0,1 нг/мл, 0,01 нг/мл). Затем к смеси добавляют отрицательно заряженные молекулы синтетической микроРНК (100 пмоль/мл) (миметики микроРНК или анти-miR, Qiagen, Hilden, Germany), и совместно инкубируют при 37°C в течение 3 часов. Смесь разбавляют физиологическим раствором и хранят при 4°C в течение ночи. Ультрацентрифугирование при 100000 g в течение 2 часов при 4°C (Beckman Coulter Optima L-90K, Fullerton, CA, USA) позволяет удалить молекулы свободной микроРНК и протамина, и осадок ресуспендируют в забуференном фосфатом физиологическом растворе с добавлением 1% DMSO и фильтруют с помощью 0,22-микронных фильтров для стерилизации.
Обработка РНКазой
EV обрабатывают РНКазой А (Thermo Fisher Scientific, Waltham, MA, USA), используя концентрацию 0,2 мкг/мл, в течение 30 минут при 37°C. Ингибитор РНКазы (Thermo Fisher Scientific, Waltham, MA, USA) используют для остановки реакции, как описано в протоколе изготовителя, и EV промывают с использованием ультрацентрифугирования при 100000 g в течение 1 часа при 4°C (Beckman Coulter Optima L-90K, Fullerton, CA, USA).
Конфокальная микроскопия
Для внедрения EV их метят красным мембранным флуоресцентным красителем для мембран PKH26 (Sigma-Aldrich, St. Louis, MO) и конструируют с миРНК, меченной зеленым флуоресцентным (FITC) (Qiagen, Hilden, Germany). Меченные EV используют для обработки TEC, высеянных в 24-луночные планшеты (30000 клетки/лунка), в течение различного времени (30 мин, 1 час, 3 часа, 6 час, 18 час, 24 час). Поглощение EV анализируют с использованием конфокального микроскопа (Zeiss LSM 5 Pascal, Carl Zeiss, Oberkochen, Germany).
Экстрагирование РНК
Извлекают тотальную РНК из EV и клеток, используя набор miRNeasy Mini Kit (Qiagen, Hilden, Germany), согласно протоколу изготовителя. Концентрацию РНК в образцах определяют количественно с использованием спектрофотометра (mySPEC, VWR, Radnor, PA, USA).
Анализ на микроРНК и мРНК с помощью ОТ-ПЦР
Для анализа на микроРНК используют набор miScript SYBR Green PCR Kit (Qiagen, Hilden, Germany). Коротко, образцы РНК обратно транскрибируют с использованием набора miScript Reverse Transcription Kit, и затем используют кДНК для детекции и количественного определения интересующих микроРНК. Эксперименты проводят три раза с использованием 3 нг кДНК для каждой реакции, как описано в протоколе изготовителя (Qiagen). Для анализа на мРНК получают кДНК с использованием набора для обратной транскрипции кДНК High-Capacity cDNA Reverse Transcription Kit (Applied Biosystems). Добавляют пять нанограммов кДНК к мастер-микс для ПЦР SYBR GREEN (Applied Biosystems) и загружают для проведения ПЦР в 96-луночную систему QuantStudio 12K Flex для ПЦР в реальном времени (РT-ПЦР) (Thermo Fisher Scientific, Waltham, MA, USA). Используют GAPDH в качестве гена «домашнего хозяйства». Кратность изменения (Rq) экспрессии микроРНК среди всех образцов вычисляют как 2-ΔΔCt по сравнению с контрольными образцами.
Электропорация внеклеточных везикул
Электропорацию выполняют на системе Neon Transfection System (Thermo Fisher Scientific, Waltham, MA, USA), следуя протоколу изготовителя. Для каждой электропорации объем образца фиксируется при 200 мкл.
Эксперименты in vivo
Используют ингенол мебутат (ингенол-3-ангелат, пикато) для топического лечения предраковых повреждений, вызванных актиническим кератозом. Лекарство наносят в течение 3 дней на повреждения от актинического кератоза, удаляя предраковое повреждение, но вызывая образование апоптозных участков ткани. После лечения нативные полученные из апельсина EV вводят местно на один поврежденный участокткани, в то время как один необработанный участок ткани у того же пациента используют в качестве контроля. Действие EV растительного происхождения оценивают через 3-7 дней после обработки.
Статистический анализ
Анализ данных осуществляют с помощью программного обеспечения Graph Pad Demo, версия 6.01. Результаты выражают как среднее ± среднеквадратическая ошибка (SEM). Используют односторонний дисперсионный анализ (ANOVA) для обоснования статистических различий между группами, в то время как для сравнения двух образцов используют t-критерий Стъюдента. Авторы использовали p < 0,05 как минимаьный уровень значимости. p: * < 0,05, ** < 0,01, *** < 0,005, **** <0,001.
Результаты/Примеры
Пример 1
Для исследования осуществимости способа по настоящему изобретению авторы изобретения использовали нативные EV, выделенные в чистом виде из различных растений, включая лимон, апельсин, виноград, Anastatica hierochuntica и Selaginella lepidophylla. EV выделяли микрофильтрацией и дифференциальным ультрацентрифугированием или фильтрацией в тангенциальном потоке, и они отображают размер в диапазоне 25-350 нм с помощью анализа наноразмерности (фигура 1). Кроме того, все нативные EV растительного происхождения демонстрируют округлую морфологию, ограниченную электронно-плотной мембраной, как показывает анализ электронной микроскопией (фигура 1).
Для того, чтобы проверить содержание EV растительного происхождения, измеряют содержание белка в нативных EV, выделенных из яблока апельсина, лимона, винограда, Anastatica hierochuntica и Selaginella lepidophylla, используя анализ с ВСА. Результаты приводятся на фигуре 2 и показывают неоднородное содержание белка для EV, показанное в таблице 1.
Таблица 1. Содержание белка в EV
Кроме того, более глубокий анализ показывает, что нативные EV растительного происхождения содержат белки, характерные для везикул, такие как HSP70, HSP80, глицеральдегид-3-фосфатдегидрогеназа (G3PD) и фруктозобисфосфат-альдолаза 6 (FBA6); и растительные белки, такие как пателлин-3-подобные и клатрин тяжелая цепь.
Кроме того, содержание липидов в нативных EV растительного происхождения показывает груз липидов в количестве, изменяющемся в зависимости от растения, включающий 24-пропилиденхолестерин, бета-ситостерен, стеарат глицидилового спирта, дипалмитин, кампестерин, эйкозанол, эйкозан, гексадекан, гексадеканол, октадекан, октадеканол, тетрадекан, тетрадеканол, валенсен и стеарат.
Пример 2
Проверяют способность нативных EV растительного происхождения способствовать миграции клеток и ангиогенезу. Создавая царапину на монослое эндотелиальных клеток, авторы изобретения наблюдали значительно более высокую скорость миграции эндотелиальных клеток, используя различные дозы нативных EV растительного происхождения, по сравнению с отрицательным контролем (CTR) (фигура 3), демонстрируя, что нативные EV растительного происхождения могут способствовать миграции эндотелиальных клеток и поддерживать ангиогенез.
Кроме того, путем анализа на ангиогенез оценивают способность нативных EV растительного происхождения способствовать образованию сосудов, подтверждая их действие на образование сосудов in vitro. Результаты, приведенные на фигуре 4, показывают, что испытываемые нативные EV растительного происхождения значимо промотируют образование новых сосудов путем стимуляции эндотелиальных клеток, промотируя таким образом ангиогенез.
Кроме того, проверяют способность нативных EV растительного происхождения промотировать клеточную пролиферацию эндотелиальных клеток in vitro после гипоксического повреждения. Различные дозы нативных полученных из апельсина EV значительно промотируют скорость клеточной пролиферации по сравнению с отрицательным контролем (CTR), демонстрируя благоприятное действие EV на эндотелиальные клетки (фигура 5).
Пример 3
Нативные EV растительного происхождения анализируют на их антимикробную активность. Большинству патогенных бактерий, ассоциированных с инфекционными повреждениями у людей, требуется значение рН >6, и их рост подавляется при более низком значении рН, колеблющемся от 4 до 5. Нанесение нативных EV растительного происхождения на поверхность повреждения создает кислую среду, неблагоприятную для роста и размножения патогенных бактерий, таких как Pseudomonas aeruginosa, Staphylococcus aureus, Escherichia coli, Klebsiella spp., Proteus spp., Citrobacter spp., S. epidermidis, S. pyogenes, стрептококки и энтерококки. Применение EV растительного происхождения эффективно при очистке от патогенных бактерий из загрязненных или инфицированных повреждений путем понижения рН. Действительно, обработка нативными EV растительного происхождения восстанавливает средний поверхностный рН кожи (обычно колеблющийся от примерно 4,2 до 5,6), регулируя наружную инфекцию, повышая естественную антимикробную активность кожи. Кроме того, показано, что снижение pH усиливает антимикробную активность других лекарственных средств против как грамположительных, так и грамотрицательных бактерий.
Пример 4
Нативные EV растительного происхождения анализируют на их терапевтическое действие in vivo. Нативные EV растительного происхождения используют для лечения поражения кожи, вызванного ингенол мебутатом (ингенол-3-ангелатом, пикато) у добровольца. Названное вещество является индуктором гибели клеток и применяется для местного лечения предракового повреждения актинического кератоза. Результаты, иллюстрируемые на фигуре 6, показывают пораженный участок до (фигура 6А) и после лечения (фигура 6В) в течение трех дней нативными EV растительного происхождения в сравнении с необработанным пораженным участком, которое показано подобным образом до (фигура 6С) и через три дня (фигура 6D). Нативные EV растительного происхождения показывают терапевтическое действие в проапоптозном пораженным участком, вызванном ингенол мебутатом, способствуя регенерации ткани через три дня в сравнении с необработанным пораженным участок.
Пример 5
Для того, чтобы модифицировать EV растительного происхождения способом на основе взаимодействия зарядов, нативные EV растительного происхождения анализируют на их поверхностный заряд. Анализ дзета-потенциала выполняют на различных препаратах, показывая, что нативные EV, полученные из апельсина, отображают отрицательный заряд -13,59 ± 1,83 мВ (фигура 7). Другие нативные EV растительного происхождения показывают подобный отрицательный заряд. Представляет интерес, что полученные из апельсина EV, инкубированные совместно с положительно заряженным линкером протамином и промытые ультрацентрифугированием, демонстрируют значительное увеличение своего заряда, что предполагает модификацию их поверхности (фигура 7).
Для того, чтобы исследовать метод загрузки отрицательно заряженных молекул на поверхность EV с использованием положительно заряженного линкера, нагруженные EV растительного происхождения, модифицированные с использованием протамина, смешивают с молекулами микроРНК, как иллюстрируется на фигуре 8. Как пример, нагруженные полученные из апельсина EV с использованием протамина смешивают с различными миметиками микроРНК (miR-145, miR-221, miR-223), и анализ ОТ-ПЦР демонстрирует явное накопление микроРНК в нагруженных EV относительно контрольных нативных EV (фигура 9), что предполагает эффективное связывание молекул с EV. Интересно, что микроРНК, ассоциированные с EV, защищены от деградации физиологической концентрацией РНКазы, присутствующей в биологических жидкостях, придавая таким образом биологическую устойчивость. Фигура 10A показывает полную инактивацию свободной микроРНК РНКазой, в то время как микроРНК, связанная с EV, защищена от инактивации при сравнении с нативными EV, которые не экспрессируют микроРНК. Процент ингибирования микроРНК во всех образцах показан на фигуре 10B.
Пример 6
Для того, чтобы понять, возможно ли эффективно перенести нагруженные молекулы в клетки-мишени, анализируют перенос нагруженных молекул в клетки-мишени, опосредуемый нагруженными EV растительного происхождения. Сначала полученные из апельсина EV нагружают PKH26 (красный флуоресцентный краситель) и конструируют с меченной флуоресцентным FITC синтетической микроРНК. Нагруженные EV инкубируют совместно с эндотелиальными клетками человека, полученными из карциномы почки (TEC), в течение различного времени (30 мин, 1 час, 3 часа, 6 час, 18 час, 24 часа). Анализ конфокальной микроскопией показывает, что малые нуклеиновые кислоты, присутствующие на поверхности EV, не изменяют их поглощения клетками-мишенями. Фигура 11 показывает контрольные клетки (CTR), с меченными ядрами, и что обработка нагруженными EV увеличивает флуоресцентный сигнал в клетках-мишенях уже после 30-минутной совместной инкубации с наибольшим поглощением через 6 часов (фигура 11). Кроме того, эффективный перенос нагруженными EV также демонстрируется детекцией поглощения клетками-мишенями. С этой целью TEC обрабатывают нагруженными полученными из апельсина EV, модифицированными миметиком 221 микроРНК, и анализируют ОТ-ПЦР через 24 часа (доза 30000 EV/клетка). Как видно на фигуре 12A, микроРНК эффективно переносятся в клетки-мишени через EV. Также проверяют функциональность нагруженных молекул в клетках-мишенях. С этой целью клетки TEC стимулируют нагруженными полученными из апельсина EV, сконструированными с анти-miR-29a, и измеряют экспрессию гена-мишени мРНК в клетках-мишенях с помощью экспериментов с количественной ОТ-ПЦР. Результаты демонстрируют, что микроРНК, перенесенные к клеткам-мишеням EV, также функциональны и индуцируют значительное увеличение своего гена-мишени коллагена 4 А3 (фигура 12B).
Пример 7
Для того, чтобы более глубоко исследовать применение положительно заряженного линкера, оценивают различные дозы протамина для нагрузки EV растительного происхождения. Положительно заряженные молекулы, такие как протамин, могут образовывать мицеллы вокруг отрицательно заряженных молекул, таких как микроРНК. Затем полученные из апельсина EV инкубируют совместно со снижающимися дозами протамина и представленной отрицательно заряженной молекулой микроРНК miR-221-3p. Анализ размеров EV выполняют с помощью Nanosight, измеряющего средний и типовой размер нагруженных EV. Результаты показывают, что начальное количество протамина (1,0 мкг/мл) вызывает увеличение как среднего, так и типового размера со значительным различием в среднем (фигура 13). Однако такое изменение размера EV отсутствует, когда EV инкубируют совместно с меньшими дозами протамина (1,0 нг/мл, 0,1 нг/мл, 0,01 нг/мл). Результаты предполагают, что избыточная начальная доза протамина приводит к образованию мицелл большего размера, чем у обычных нативных EV, присутствующих в препарате EV. Для того, чтобы подтвердить, что меньшие дозы положительно заряженного линкера являются достаточными для возможности взаимодействия с отрицательно заряженными молекулами, измеряют экспрессию нагруженных молекул микроРНК в нагруженных EV растительного происхождения, и оценивают их перенос в клетки-мишени. Анализ количественный ОТ-ПЦР нагруженных полученных из апельсина EV, сконструированных с характерной микроРНК (miR-221-3p) с использованием меньшей дозы протамина (1,0 нг/мл), показывает, что микроРНК эффективно связывается с EV (фигура 14a). Более того, нагруженные полученные из апельсина EV, модифицированные меньшей дозой протамина (1,0 нг/мл), способны эффективно переносить микроРНК к клеткам-мишеням, как показывает анализ РТ-ПЦР клеток-мишеней, обработанных нагруженными EV (фигура 14b).
Пример 8
Как характерный пример способа модификации для дополнительного улучшения нативной активности EV растительного происхождения, используют модификацию EV растительного происхождения для улучшения их нативной активности при способствовании затягиванию раны кератиноцитами. В указанных экспериментах нагруженные полученные из апельсина EV конструируют с микроРНК miR-21 с использованием протамина в качестве положительно заряженного линкера. Кератиноциты человека обрабатывают тремя различными дозами нативных EV, нагруженных EV, инкубированных совместно с одним протамином (EV + P), как контролем, и нагруженных EV с протамином и miR-21 (EV + miR-21). EV + P и EV + miR-21 используют в промежуточной дозе (50k). Измерение затягивания раны при каждом условии используют в качестве параметра активности EV. Диаграмма на фигуре 15 показывает, что EV + P способствуют затягиванию раны так же, как такие же дозы нативных EV, в то время как EV + miR-21 способствуют статистически значимому увеличению затягивания раны так же, как двойная доза нативных EV (EV 100k). Результаты показывают, что метод модификации можно использовать для усиления терапевтического действия нативных EV растительного происхождения.
Пример 9
Метод модификации также можно использовать для изменения биологической активности нативных EV растительного происхождения. EV растительного происхождения можно сконструировать с отрицательно заряженными молекулами, что обеспечивает иные или новые биологические эффекты. Как характерный пример, полученные из апельсина EV модифицируют различными антиангиогенными микроРНК, и оценивают их способность ингибировать ангиогенез анализом на ангиогенез in vitro на клетках ТЕС. В частности, нагруженные EV конструируют с миметиками антиангиогенных микроРНК (miR-221, miR-223, miR-145) и анти-микроРНК для проангиогенных микроРНК (miR-29, miR-126, miR-31), и оценивают их действие на образование сосудов на эндотелиальных клетках через 24 часа после обработки (фигура 16). Результаты показывают, что нагруженные полученные из апельсина EV, сконструированные с антиангиогенными молекулами, способны существенно ингибировать ангиогенез эндотелиальных клеток in vitro.
Пример 10
Терапевтическое действие нагруженных EV растительного происхождения оценивают с использованием различных доз положительно заряженного линкера. Как характерный пример, нагруженные полученные из апельсина EV конструируют с двумя различными дозами протамина (1 мкг/мл, 1 нг/мл) и тремя различными дозами антиангиогенных микроРНК (анти-mir-29, miR-145 и miR-221-3p). Нагруженные EV используют для стимуляции эндотелиальных клеток (TEC) в течение 24 часов, и оценивают их активность анализом на ангиогенез. Результаты, приведенные на фигуре 17, показывают, что активность нагруженных EV, сконструированных с меньшей дозой протамина, равно или более эффективна, что показывает применимость различных доз положительно заряженного линкера для эффективной модификации нативных EV растительного происхождения.
Пример 11
Метод модификации EV растительного происхождения с отрицательно заряженными молекулами можно дополнительно улучшить по протоколам трансфекции. Действительно, связь отрицательно заряженных молекул (например, микроРНК) с поверхностью EV через положительно заряженный линкер (например, протамин) может облегчить их вхождение в EV. Тесная близость отрицательно заряженных молекул с EV может усилить их нагрузку после протокола трансфекции, такой как электропорация, как иллюстрирует фигура 18. Положительно заряженный линкер путем образования мостика между отрицательно заряженными EV и отрицательно заряженными молекулами концентрирует молекулы на поверхности EV и благоприятствует повороту внутрь (фигура 18). Мембранная перегруппировка, полученная с помощью стратегий ниых, чем электропорация, таких как обработка ультразвуком, механическая экструзия клеток, опосредуемая сапонином пермеабилизация и циклы замораживание-оттаивание, также показаны для осуществления нагрузки EV.
Для проверки этой гипотезы полученные из апельсина EV модифицируют с использованием протамина и miR-221-3p, и оценивают их способность ингибировать образование сосудов. Фигура 19 показывает, что использование протокола трансфекции, такой как электропорация, на нагруженных EV способно увеличить их ингибирующую активность на образование сосудов на эндотелиальных клетках.
| название | год | авторы | номер документа |
|---|---|---|---|
| ВНЕКЛЕТОЧНЫЕ ВЕЗИКУЛЫ ДЛЯ ИНГАЛЯЦИИ | 2019 |
|
RU2799315C2 |
| СПОСОБ АДРЕСНОГО ВОЗДЕЙСТВИЯ НА ЭКЗОСОМЫ | 2018 |
|
RU2781640C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ВКЛЮЧАЮЩАЯ микроРНК-100, И ЕЕ ПРИМЕНЕНИЕ В МОДУЛИРОВАНИИ РОСТА КРОВЕНОСТЫХ СОСУДОВ И ВОСПАЛЕНИЯ ЭНДОТЕЛИЯ | 2010 |
|
RU2586531C2 |
| ВЕЩЕСТВА И СПОСОБЫ МОДУЛЯЦИИ ЗАЖИВЛЕНИЯ СУХОЖИЛИЙ | 2015 |
|
RU2699706C2 |
| ВЕЗИКУЛЫ, СОДЕРЖАЩИЕ ИНГИБИТОР PTEN, И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2800729C2 |
| КОМПОЗИЦИИ, СОДЕРЖАЩИЕ КЛЕТОЧНЫЕ ВЕЗИКУЛЫ, И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2824136C2 |
| ВНЕКЛЕТОЧНЫЕ ВЕЗИКУЛЫ, ПРОИСХОДЯЩИЕ ИЗ МЕЗЕНХИМАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК | 2019 |
|
RU2805066C2 |
| СПОСОБ ДИАГНОСТИКИ И/ИЛИ ПРОГНОЗИРОВАНИЯ ОСТРОГО ПОВРЕЖДЕНИЯ ПОЧЕК | 2010 |
|
RU2629591C2 |
| СПОСОБЫ ОБНАРУЖЕНИЯ ПАТОЛОГИЧЕСКИХ ИЗМЕНЕНИЙ В ОРГАНЕ ИЛИ СИСТЕМЕ ОРГАНОВ | 2012 |
|
RU2626540C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ПОЛИКИСТОЗНОЙ БОЛЕЗНИ ПОЧЕК | 2016 |
|
RU2742300C2 |






Изобретение относится к фармацевтической промышленности, а именно к применению популяции внеклеточных везикул (EV) растительного происхождения в терапевтическом лечении нарушенного ангиогенеза. Применение популяции внеклеточных везикул (EV) растительного происхождения, полученных из растения, выбранного из группы, включающей апельсин, лимон, виноград, Anastatica hierochuntica (AH) и Selaginella lepidophylla (SL), причем внеклеточные везикулы (EV) в указанной популяции ограничены липидной двухслойной мембраной и имеют диаметр в диапазоне от 25 до 350 нм, и содержание белка в диапазоне от 1 до 55 нг/109 EV, в терапевтическом лечении нарушенного ангиогенеза. Вышеописанные применяемые везикулы растительного происхождения эффективны для терапевтического лечения нарушенного ангиогенеза. 7 з.п. ф-лы, 19 ил., 1 табл., 11 пр.
1. Применение популяции внеклеточных везикул (EV) растительного происхождения, полученных из растения, выбранного из группы, включающей апельсин, лимон, виноград, Anastatica hierochuntica (AH) и Selaginella lepidophylla (SL), причем внеклеточные везикулы (EV) в указанной популяции ограничены липидной двухслойной мембраной и имеют диаметр в диапазоне от 25 до 350 нм, и содержание белка в диапазоне от 1 до 55 нг/109 EV, в терапевтическом лечении нарушенного ангиогенеза.
2. Применение по п.1, где популяция применяется в терапевтическом лечении нарушенного ангиогенеза при заболевании или состоянии, выбранном из группы, включающей язву, псориаз, дерматит, акне, экзему, себорейный дерматит, атопический дерматит, контактный дерматит, дисгидротическую экзему, нейродерматит, герпетиформный дерматит, кератоз, кератит, повреждение роговицы, травматическое повреждение, дегенеративное повреждение, стирание, химическую травму, проблему с контактными линзами, повреждение от ультрафиолетового излучения, кератит, конъюнктивит, болезнь сухого глаза, андрогенную алопецию, зуд и повреждения слизистых.
3. Применение по п.2, причем язвы выбирают из группы, включающей пролежни, артериальные язвы, венозные язвы, диабетические язвы, ишемические язвы, экссудативные язвы, дисметаболические язвы, травматические язвы, ожоги, фистулы, трещины.
4. Применение по п.2, причем повреждения слизистых выбирают из группы, включающей травматические повреждения из-за протеза, диабетические, повреждения ротовой полости, декубитальные или повреждения слизистой оболочки гениталий.
5. Применение по любому из пп.1-4, причем EV являются нативными EV или EV, нагруженными одной или несколькими отрицательно заряженными про-рененеративными биологически активными молекулами, выбранными из группы, включающей лекарства, нуклеиновые кислоты и липофильные витамины.
6. Применение по п.1, где EV нагружены одной или более несколькими отрицательно заряженными про-регенеративными нуклеиновыми кислотами, выбранными из микроРНК, мРНК, тРНК, рРНК, миРНК, регуляторной РНК, некодирующей и кодирующей РНК, фрагментов ДНК и ДНК-плазмид.
7. Применение по любому из пп.1-6, где EV составлены в фармацевтическую композицию для топического применения, локальной инъекции или перорального введения, или составленная как препарат пищевой добавки.
8. Применение по любому из пп.1-7, где EV получены из апельсина.
| EP 3354257 A1, 01.08.2018 | |||
| ТЕЛЕВИЗИОННАЯ ПЕРЕДАЮЩАЯ АНТЕННА | 0 |
|
SU237209A1 |
| LOPATINA T | |||
| et al | |||
| Platelet-derived growth factor regulates the secretion of extracellular vesicles by adipose mesenchymal stem cells and enhances their angiogenic potential | |||
| // Cell Commu Signal, 2014,12(1):26 | |||
| EP 3357501 A1, 08.08.2018 | |||
| STEFANIA RAIMONDO et all | |||
| Citrus limon-derived | |||
Авторы
Даты
2024-01-30—Публикация
2020-03-12—Подача