Изобретение относится к области криобиологии и может быть использовано на лабораторных животных в научных учреждениях.
Данный способ направлен на создание и практическое внедрение протокола безопасной и эффективной криоконсервации сосудистых трансплантатов (аллотрансплантатов), в котором не используются токсичные криопротекторные или витрифицирующие растворы, а также программные методы заморозки, жидкий азот и т.д.; кроме того, предлагаемый нами способ направлен на нивелирование потенциальных рисков, связанных с забором трупного биоматериала и подготовкой его к радиационной стерилизации. В частности, общеизвестно, что радиационная стерилизация донорского биоматериала трупного происхождения в замороженном состоянии позволяет предотвратить структурные повреждения ткани, вызванные экспозицией гамма-облучением в дозе 25 кГр или выше. Под модификацией сосудистых аллотрансплантатов in vitro в данном способе понимается их децеллюляризация - процесс удаления клеточных элементов потенциального трансплантата, выступающих в качестве основных антигенных детерминант.
Актуальность предлагаемого способа связана со все более нарастающей потребностью в качественном и безопасном донорском сосудистом материале, а также в резком увеличении количества трансплантаций как во всем мире, так и в Российской Федерации. Поэтому возможность оперативно и безопасно сохранять (криоконсервировать) и стерилизовать донорские сосудистые трансплантаты, полученные в результате массового забора, будет способствовать улучшению качества оказания медицинских услуг в ближайшей и отдаленной перспективе и позволит снизить финансовые и временные затраты и риски, в частности облегчит и ускорит доступ обслуживающего персонала медицинских центров к донорским сосудам, в т.ч. биоинженерным, для трансплантации без необходимости длительной предварительной подготовки или каких-либо дополнительных манипуляций. Это позволит, как минимум, частично решить проблемы деградации сосудистого доступа для гемодиализа, отсутствия донорского аутологичного сосудистого материала, приемлемого для формирования шунтов, проблемы некротических изменений сосудистых аллотрансплантатов трупного происхождения, связанных с процессами декомпенсации кровообращения и аутолиза тканей и т.д. Отметим, что аутологичные подкожная вена с лучевой артерией и другими сосудами конечностей являются наиболее предпочтительными аллотрансплантатами для создания шунтов, а бедренные артерии маргинального происхождения являются биоматериалом выбора для использования в виде сосудистых аллотрансплантатов. Одной из перспективных альтернатив аутологичному шунтированию является использование децеллюляризованных каркасов кровеносных сосудов; в частности, их преимущество перед синтетическими аналогами состоит в том, что структура нативного сосуда максимально приспособлена к гидродинамическим нагрузкам в условиях физиологического кровотока, а межклеточный матрикс обладает всеми необходимыми свойствами для направленного развития пересаженных клеток, как in vitro, так и in vivo, в сторону формирования сосуда.
Что же касается радиационной стерилизации донорских сосудистых трансплантатов, то ее необходимость продиктована главным образом тем, что сосудистые аллотрансплантаты трупного происхождения могут содержать высокорезистентные споровые формы анаэробных и аэробных микроорганизмов, в том числе возбудителей раневой инфекции, сохраняющиеся после физико-химической обработки. Однако большинство современных способов криоконсервации сосудистых трансплантатов имеют ряд ограничений и недостатков, а разработанного безопасного протокола стерилизации применительно к децеллюлялизированным сосудистым аллотрансплантатам в настоящее время не существует.
Так, например, большинство современных способов криоконсервации сосудистых трансплантатов основаны на применении методов контролируемой программной заморозки с длительной многоступенчатой процедурой охлаждения (со средней скоростью 1,5°С/мин.), при этом используют жидкий азот, его пары и устройства для его применения (UA 6417 U, 20050515 RU, и UA 79341 С2, 20070611 RU), а также токсичные криопротекторные смеси с антибиотиками, в частности диметилсульфоксид, глицерол, этиленгликоль, пропиленгликоль и поливинилпирролидон (как компания Cryolife), (BY 14577 С1, 20110630 RU). Отдельно стоит упомянуть способ криоконсервации, осуществляющийся путем сочетания охлаждения до -196°С и гипербарии инертными газами (ксенон, криптон, аргон) при давлении 1,5 атмосфер (RU 2268590 C1, 20060127).
Недостатками подобных способов являются: отсутствие единого подхода и стандартизации протоколов; использование дорогостоящих программных замораживателей, требующих подготовленного персонала, организации отдельного помещения и подвода жидкого азота; использование токсичных криопротекторных смесей имеющих выраженный цитотоксический эффект, использование которых обуславливает общее ухудшение свойств сосудистых трансплантатов. Рутинно используемый диметилсульфоксид в неполной мере препятствует повреждению клеточных структур в процессе замораживания-отогрева из-за неравномерного распределения. Кроме того, к недостаткам подобных способов криоконсервации можно отнести: высокие температурные градиенты и ими обусловленные градиенты давления во время криоконсервации, неравномерный «фронт кристаллизации»; использование жидкого азота и риски связанные с этим; отсутствие возможности обработки большого объема аллотрансплантатов за единицу времени; зачастую низкая скорость всех процедур; невозможность обработки аллотрансплантатов большой длины, с большим количеством бифуркаций; отсутствие специализированной упаковки и креплений для сосудистых аллотрансплантатов, в том числе для их удобной радиационной стерилизации.
Известен также способ, частично совпадающий с предлагаемым нами по принципу криопротекторного действия на сосуды, а именно использование контролируемой ледяной нуклеации, заключающейся в образовании кристаллов льда за пределами биологической ткани (RU 2178865 С2, 20020127 [RU] Способ криоконсервации заготовленной ткани млекопитающих или культивированного эквивалента ткани и устройство для его осуществления). Этот способ основан на использовании т.н. зародышей льда, которые помещаются во внеклеточное пространство, и затем ткань медленно замораживается с скоростью -10°С/мин до температуры -70°С. При этом температуру поддерживают постоянной в течение времени, достаточного для установления физического и биологического равновесия используемого раствора криоконсерванта в указанной ткани.
Недостатком данного способа являются: неравномерный «фронт кристаллизации»; сложная обработка большого объема аллотрансплантатов за единицу времени; низкая скорость всех процедур; невозможность обработки аллотрансплантатов большой длины, с большим количеством бифуркаций; отсутствие специализированной упаковки и креплений для аллотрансплантатов, в том числе для их удобной радиационной стерилизации.
Наиболее близким по технической сущности к предлагаемому способу является способ консервирования биологических органов в специальной камере под давлением и с дистиллированной водой. Способ заключается в том, что биологический объект помещают в объем дистиллированной воды и охлаждают до температуры -22°С в течение 1,5 часов под давлением до 2200 атм (0,224 ГПа). Это обеспечивает последовательный переход воды из одного фазового состояния в другое и дальнейшую стабилизацию многофазной системы и мешает образованию экстра- и интрацеллюлярных кристаллов льда, являющихся основным деструктивным фактором при криоконсервировании, и не предполагает применение криопротекторов, оказывающих цитотоксическое воздействие на трансплантат (RU 2362299 С1, МПК A01N 1/02 (2006.01). Способ консервирования биологических органов).
Недостатками данного способа являются: отсутствие данных по клиническим испытаниям; необходимость в использовании сложного оборудования; невысокая скорость процесса; ориентированность под паренхиматозные органы; сравнительно невысокая надежность и продолжительность консервации, что можно объяснить недостаточно сниженным клеточным метаболизмом из-за применения температур выше -22°С. Кроме того, для корректного осуществления данного способа требуются точные диаграммы фазовых переходов воды с указанием всех точек перехода и значений основных параметров - температуры и давления, т.е. требуются эмпирические данные, варьирующиеся и зависящие в той или иной степени от дизайна конкретного эксперимента.
Техническим результатом предлагаемого нами способа является эффективная и безопасная криоконсервация сосудистых трансплантатов человеческого или животного происхождения, значительно оптимизирующая их дальнейший процессинг - радиационную стерилизацию в замороженном состоянии и последующую децеллюляризацию, при этом не используются токсичные криопротекторные вещества и программные методы заморозки. Способ позволяет оптимизировать временные затраты и позволяет обрабатывать более 10-ти донорских сосудистых аллотрансплантатов (в виде артерий и вен с широким диапазоном внутренних диаметров), в частности, за счет использования схемы фиксации оригинальной конструкции.
Указанный технический результат достигается тем, что способ основан на использовании одного и того же вещества - полидиметилсилоксана (далее по тексту - ПДМС) в качестве перспективного хладоносителя для замораживания аллотрансплантатов путем погружения в объем ПДМС температурой -80°С со скоростью охлаждения -10°С/сек, в качестве теплоносителя для размораживания аллотрансплантатов в объеме ПДМС температуры +25°С и в качестве нетоксичного криопротектора для защиты от холодового цитолиза и во избежание образования экстрацеллюлярных кристаллов льда; также способ включает в себя схему фиксации сосудистых аллотрансплантатов оригинальной конструкции, в которой используют стерильные одноразовые полые подложки из медицинского пластика или многоразовые подложки из силикона, диаметр которых подбирается исходя из диаметра сосудистого аллотрансплантата, но обязан быть на 15% меньше его внутреннего диаметра; способ включает в себя два варианта упаковки для обработки множества сосудистых аллотрансплантатов от одного донора (для 3-х и 10-ти сосудов) и вариант индивидуальной упаковки для сосудов от разных доноров на подложках; индивидуальная упаковка состоит из специально подготовленной стерильной пробирки (50 мл) с отверстием на дне и с портом в крышке и двух заслонках на концах подложки; упаковка для обработки множества (до 3-х) сосудистых аллотрансплантатов от одного донора в вертикальном расположении состоит из: 1) промежуточного пластикового контейнера (объемом в 50 мл), при этом контейнер имеет крышку с вмонтированным портом для вакуумизации, а на дне контейнера на одинаковом расстоянии друг от друга сделаны три порта для подложек; 2) прозрачной емкости из полиакрила объемом в 1 л в которую и устанавливается промежуточный резервуар с подложками. Для этого варианта упаковки возможно использование любого материала подложек. Элементы упаковки можно сделать самому из доступных материалов, а именно пластиковой емкости для вакуумной фильтрации объемом в 1 литр и пластиковой банки на 50 мл. Для этого все необходимые порты можно высверлить под диаметр закрепляемых подложек, на их концы рекомендуется закреплять крышки, чтобы сосуды не спадали. Если порт для вакуумизации сделать затруднительно, то можно использовать внешний самозапаивающийся пакет для вакуумизации всей упаковки. Упаковка для обработки множества (до 10-ти) сосудистых аллотрансплантатов от одного донора в горизонтальном расположении состоит из двух держателей со специально подготовленными сквозными каналами для подложек и прозрачными крышками для надевания на эти держатели. Использование для данной упаковки пластиковых подложек связано с тем, что они легко и безопасно устанавливаются в держатель и не спадают.
Описание способа
Важно отметить, что используемый в способе полидиметилсилоксан разрешен для использования в области медицины и фармакологии, так ПДМС разной вязкости и модификаций широко используется в медицинской практике, в ряде лекарственных препаратов (''Энтеросгель'', ''Эспумизан'', ''Дисфлатил'', ''Демитикон'', ''Adatosil-5000'' и др.). Основные аргументы в пользу применения ПДМС основаны на его сильной гидрофобности, химической инертности, биосовместимости и способности оставаться в жидком состоянии при сверхнизких температурах (до -100°С для ПДМС-1 при температуре стеклования: -128°С). Помимо этого, его отличает газопроницаемость, высокое сопротивление сдвигу и разрыву, устойчивость к радиационной стерилизации в дозах до 30 кГр. Несмотря на то что ПДМС используется для охлаждения и для нагрева сосудистых аллотрансплантатов, тем не менее, в данном способе для этих целей применяют фракции ПДМС разной вязкости - 25 сантистокс для размораживания и 1 сантистокс для заморозки. Это связано с тем, что более вязкая модификация ПДМС может быть подвергнута различным методам стерилизации, в частности, паровой и ультрафиолетовой, тогда как менее вязкий ПДМС позволяет быстрее и равномернее охлаждать сосудистый аллотрансплантат.
1) Забор трупного материала. Для удобства дальнейшей обработки изымаются бедренные артерии с умеренными признаками аутолиза у двух трупных доноров средней возрастной группы в течение 5 часов (до 12 часов) после фиксации летального исхода. После забора проводится морфометрия сосудов и предварительно оценивается на месте их внутренний и внешний диаметр, эластичность, а также наличие атеросклеротических повреждений. Сосуды после морфометрии сортируются по длине и диаметру, а также, при возможности, производится оценка уровня их инициальной контаминации, что позволяет более точно настроить стерилизующую дозу. После этого сосуды помещаются в стерильные контейнеры объемом 100 мл, содержащие раствор Кустодиола (Dr. F. Koehler Chemie GmbH, Германия), охлажденный до температуры 4°С. Описываемый в патенте способ позволяет производить забор сосудов любой длины и диаметра. Обычно критериями исключения являются наличие бифуркаций, атеросклеротических и иных повреждений сосудистой стенки, бляшек и кальцинации на более чем 40% внутренней площади сосуда. Все основные работы с материалом проводятся в течение суток.
2) Подготовка и охлаждение объема ПДМС. Перед началом всех процедур стерилизуется необходимый объем ПДМС-25 (вязкостью в 25 сантистокс) и производится фильтрация нового ПДМС-1 (не рекомендуется повторное использование одного и того же объема). Охлаждение ПДМС жидким азотом или его парами не рекомендуется, так как требует постоянного подливания азота в специальную тару, создает ограничения по времени самого процесса, увеличивает риски внештатных ситуаций и перемораживает сам раствор. Поэтому ПДМС предварительно охлаждается в низкотемпературном морозильнике до температуры -80°С (ориентировочное время охлаждения составляет 30 минут, в зависимости от ряда параметров - вязкости, температуры стеклования и т.д.). Количество охлажденного ПДМС зависит от количества сосудистых аллотрансплантатов и типа их упаковки. В случае проведения основных работ в боксе, необорудованным низкотемпературным морозильником, охлажденный объем ПДМС рекомендуется помещать в криоконтейнер на слой сухого льда и транспортировать в лабораторию с контролем за температурой.
3) Крепление аллотрансплантатов в упаковках. Упакованные сосуды транспортируются в лабораторию и достаются из пробирок, предварительно обработанных спиртом в условиях ламинарного потока. Затем для каждого сосуда подбирается стерильная полая подложка из пластика или силикона (в зависимости от дальнейшей упаковки, допускается также использование медных или алюминиевых подложек, кроме того, подложки могут быть изготовлены из гидрогеля, застывающего при околонулевой температуре) с длиной, равной длине сосудистого аллотрансплантата, но с диаметром на 15% меньше внутреннего диаметра сосуда, т.н. «свободная» подложка. На каждой подложке фиксируется ярлык с информацией о сосуде, времени забора и доноре.
Примечание. Такая «свободная» подложка создает поддерживающий каркас во время заморозки без излишнего напряжения для коллагеновых волокон, не дает аллотрансплантатам спадаться и замерзать в неестественном виде. Во время разморозки «свободная» подложка позволяет снимать аллотрансплантаты уже на первой минуте и мануально промывать со стороны просвета, что сильно ускоряет скорость и равномерность разморозки. Необходимость наличия полости в структуре подложки обусловлена тем, что в таком случае повышается скорость охлаждения на 50% и более (в сравнении с цельной подложкой). Помимо этого, силиконовые подложки могут имитироваться с использованием силиконовых перфузионных трубок, а пластиковые - стерильными пипетками. Также несмотря на то что подложки из меди, алюминия и серебра обладают большей теплопроводностью, они имеют большую удельную теплоемкость, что при условии одинаковых параметров конвективного теплообмена нивелирует их преимущества.
3.1) Крепление в упаковке на 10 аллотрансплантатов. После маркировки все сосуды на пластиковых подложках фиксируются на двух пенопластовых держателях со специально подготовленными сквозными каналами для подложек и устанавливают крышки на каждую сторону. На каждой крышке дублируется информация с ярлыков, так чтобы можно было вытаскивать нужный сосуд из упаковки с минимальными манипуляциями. После проверки надежности упаковки берется такой же контейнер, в котором предварительно охлаждается объем ПДМС и заполняется ПДМС с вязкостью в 1 сантистокс комнатной температуры. Затем в него опускается вся упаковка с подложками и помещается в холодильник на 1 час.
3.2) Крепление в упаковке на 3 аллотрансплантата. Упаковка на три аллотрансплантата предполагает их вертикальное расположение в один ряд, для этого требуется закрепить сосудистые аллотрансплантаты на любых подложках и обязательно установить на нижнюю часть подложки заслонку чтобы аллотрансплантаты не спадали, это можно сделать либо силиконовым кольцом, либо крышкой, либо сквозным проколом. Затем закрепленные аллотрансплантаты устанавливаются в промежуточный контейнер объемом в 50-100 мл через три порта на дне его и подложки соединяются между собой проволочным соединением. При возможности в крышку промежуточного контейнера монтируется порт для вакуумизации, в этом случае крайне важно проверять общую герметичность упаковки на каждом этапе. В конце полученная конструкция опускаются в прозрачную емкость из полиакрила объемом в 1 литр со стерильным / фильтрованным ПДМС с вязкостью в 1 сантистокс комнатной температуры и помещается в общую камеру медицинского холодильника на 1 час минимум. В случае разных доноров в каждой упаковке следует размещать сосуды только от одного донора.
3.3) Крепление в индивидуальной упаковке аллотрансплантатов. Сосудистые аллотрансплантаты от разных доноров на силиконовых подложках опускаются в предварительные стерильные пробирки без отверстия на дне через порт на их крышках, порт сделан ровно по центру, не допускается чтобы закрепленный аллотрансплантат упирался в дно пробирки и изгибался, требуется максимально ровное его расположение без контакта со стенками пробирки. После этого на нижний конец подложки устанавливается заслонка чтобы аллотрансплантат не спадал во время транспортировки, нижней заслонкой может быть стерильная игла или проволока, проходящая через просвет силиконовой трубки на небольшом расстоянии от аллотрансплантата. Затем устанавливается верхняя заслонка в виде любой подходящей по диаметру крышки или также иглы, или проволоки чтобы вся подложка не опускалась на дно пробирки. В конце на пробирках дублируется информация с ярлыков и в них заливается стерильный / фильтрованный ПДМС с вязкостью в 1 сантистокс комнатной температуры. Все пробирки с ПДМС предварительно выдерживаются 1 час при температуре +4°С в отдельной камере медицинского холодильника. После выдерживания подложки устанавливаются на окончательные, основные пробирки с отверстием на дне для дальнейшей обработки. По желанию оператора предварительные пробирки могут использоваться для дополнительной медикаментозной обработки аллотрансплантатов любыми криопротекторными и радиопротекторными растворами без объема ПДМС с использованием двойного центрифугирования, для этого также можно сделать два маркера на крышке пробирки с указанием верхней и нижней полусфер.
Примечание. Использование для данной упаковки силиконовых подложек связано с тем, что их легче оптимизировать под фактическую длину аллотрансплантата.
Если планируются дальнейшая радиационная стерилизация упаковки, то сосуды размещаются на подложках особым способом в один ряд, не перекрывая друг друга или в два ряда зигзагом перпендикулярно развертке стерилизующего луча, в зависимости от их количества и типа упаковки.
Примечание: выдерживание аллотрансплантатов в объеме ПДМС после их установки в упаковку приводит к тому, что температура сосудов плавно опускается и они покрываются ПДМС так чтобы во время замораживания скорость и равномерность была выше. Тем более что чем ниже стартовая температура замораживания (но до точки замерзания), тем быстрее происходит переход критической отметки в -35°С.
4) Организация зоны охлаждения. За это время следует организовать зону для охлаждения упаковки в условиях -80°С с минимальными перепадами температур. Для этого отдельную секцию низкотемпературного медицинского морозильника освобождается от любого содержимого.
Для двух типов упаковки (на три и на один аллотрансплантат), ввиду намного меньшего объема ПДМС и его быстрого нагрева от воздуха комнатной температуры обеспечиваются минимальные перепады температур во избежание образования воздушной ''подушки'' вокруг сосуда и тепловой деформации во время криоконсервации. Для этого в отдельную секцию низкотемпературного медицинского морозильника помещается специально подготовленный короб из теплоизоляционного материала (например, Cryogel-Z) под размер секции морозильника, предварительно охлажденный до -80°С и ниже (при возможности). Во время открытия дверцы морозильника теплоизоляционный короб выдвигается одним из операторов вперед чтобы ограничить приток теплого воздуха из помещения в зону заморозки, также используется короб с передней стенкой в виде крышки, которая может изолировать секцию с упаковкой во время хранения и защищать от притока воздуха во время открытия морозильника.
В случае невозможности организации зоны охлаждения и рабочего пространства в морозильнике она создается в ламинарном шкафу с использованием теплоизоляции и охлаждения металлического контейнера по контуру с использованием сухого льда или, что предпочтительнее, жидкого азота с обязательным контролем за температурой с помощью термопары, в этом случае необходимо следить, что температура ПДМС не падала ниже - 100°С и не поднималась выше -70°С. Также следует понимать, что в этом случае сложнее организовать изолированную зону обработки с постоянной температурой и все процедуры следует осуществлять более четко и оперативно.
5) Заморозка
5.1) Заморозка в упаковке на 10 аллотрансплантатов от одного донора. Для данного типа упаковки используется пластиковый или стальной контейнер такого объема, который позволит разместить в нем упаковку с запасом по высоте не менее 5 сантиметров. Контейнер содержит предварительно фильтрованный и охлажденный до -80°С ПДМС с вязкостью в 1 сантистокс. Контейнер помещается в изолированную зону низкотемпературного медицинского морозильника. Процедуру заморозки рекомендуется осуществлять двум операторам. Упаковка с сосудами берется первым оператором с двух сторон двумя пинцетами или с использованием перчаток для низкотемпературной работы, вторым же оператором регулируется открытие и закрытие дверцы морозильника. Упаковка аккуратно помещается оператором в контейнер с ПДМС в морозильнике так чтобы вещество покрывало все подложки и оставалось не менее 5 сантиметров до поверхности. В первые 30 секунд требуется поднимать и опускать упаковку в объеме ПДМС, не доходя до границы раздела водной и воздушной фаз, в оставшиеся 30 секунд упаковку следует перемещать по объему ПДМС вправо и влево, не поднимая и не касаясь дна.
5.2) Заморозка в упаковке для 3-х аллотрансплантатов от одного донора. Для данного типа упаковки используются две одинаковые емкости из полиакрила, в одну из них, пустую, устанавливается резервуар с аллотрансплантатами на подложках, а во вторую наливается 800 мл охлажденного до -80°С ПДМС с вязкостью в 1 сантистокс. Вторая емкость помещается в низкотемпературный морозильник, в секцию для охлаждения на 10 минут с открытой крышкой. Затем обе емкости устанавливаются рядом друг с другом в зоне охлаждения морозильника, крышка с подложками раскручивается и аккуратно переносится от одной емкости в другую, устанавливаясь на ней путем медленного закручивания до упора. Емоксть с подложками в объеме ПДМС продвигается вглубь морозильника для хранения или для временного ожидания дальнейшей обработки и при возможности изолируется от остальной секции с обязательной дополнительной маркировкой. Пустая емкость убирается и утилизируется.
5.3) Заморозка в индивидуальной упаковке аллотрансплантатов. Перед началом работы ПДМС с вязкостью в 1 сантистокс предварительно помещается в пластиковый или в металлический контейнер объемом не менее 5 литров и глубиной не менее 10 сантиметров и охлаждается до нужной температуры в зоне охлаждения. Для заморозки крышка с подложкой достается из предварительной пробирки и оперативно погружается в объем ПДМС в контейнере с использованием охлажденных криоперчаток и перемещается по этому объему плавными волнистыми движениями на глубине не менее 3 сантиметров до поверхности и охватывая всю площадь контейнера в течение 1 минуты. Затем крышка с подложкой сразу же помещается в пустую, основную пробирку с отверстием на дне и завинчивается на ней. В данном случае отверстие на дне необходимо для простоты дальнейшей вакуумизации.
Примечание: во всех случаях упаковки процесс замораживания сопровождается интенсивным перемещением аллотрансплантата по объему ПДМС. Это продиктовано тем фактом, что в условиях холодильника наиболее интенсивный теплообмен происходит в первый 40 секунд, далее процесс замедляется, из-за уменьшения разности температур хладноносителя и сосуда снижается эффективность конвективного теплообмена, ввиду низкой теплопроводности тканей аллотрансплантата на нем самом наблюдается значительный градиент температур (на 10-й секунде расчета, он составляет 14°С), в следствии этого значительно уменьшается тепловой поток через внешнюю поверхность сосуда и падает скорость охлаждения. Также важную роль играет интенсивность конвекции, это можно наблюдать на графике температур, до 40 секунды из-за разности температур хладоносителя и его приграничного к аллотрансплантату слоя возникает разность плотностей, отсюда в приграничном слое образуются восходящие потоки хладоносителя, они увеличивают интенсивность теплообмена, с охлаждением поверхности аллотрансплантата, роль данного эффекта уменьшается. После этого необходимо аккуратно продвинуть контейнер вглубь секции морозильника, закрыть дверцу и оставить упаковку на 2 минуты.
6) Хранение. После охлаждения упаковки она остается в морозильнике пока не будет подготовлен криоконтейнер с теплоизоляцией для транспортировки к месту радиационной стерилизации, но не более чем на сутки и без открывания крышки морозильника или с установкой листа теплоизоляции так, чтобы он закрывал контейнер от контакта с теплым воздухом при открытии дверцы.
Если дальнейшие процедуры необходимо отложить, то упакованные сосуды остаются на хранение в медицинском морозильнике, но предварительно достаются из контейнера с ПДМС и помещаются в самозапаивающийся стерильный пакет. Хранение при температуре -80°С - это более удобный, безопасный и дешевый вариант, чем использование жидкого азота; помимо этого, во время дальнейшего охлаждения аллотрансплантата до -140°С и ниже часто происходят повреждения его структуры из-за фазовых переходов, в частности, коллагена 1-го типа. Аналогичные повреждения могут происходить при перепадах температур и нагреве до -40°С и выше. Хранение же в самом ПДМС показало худшие результаты в сравнении с хранением в открытой пробирке.
7) Холодовая цепь и подготовка к стерилизации всех типов упаковок.
Перед началом стерилизации данные об уровне инициальной контаминации сосудов после их забора и вся информация о возможных происшествиях, способствующих увеличению этого уровня (контакты с потенциально загрязненными поверхностями в случае мануальных процедур или падения) передается оператору. Уровень инициальной контаминации сосудов дает оператору возможность задать нужную стерилизующую дозу на установке линейного ускорителя электронов. Далее разрабатывается, организуется и проверяется холодовую цепь - ряд организационных и практических процедур, обеспечивающих оптимальный температурный режим транспортировки упаковки с сосудами без подъема температуры выше -70°С. А также предварительно проводятся тесты упаковки и криоконтейнера на перепады температур во время транспортировки и во время стерилизации, а также тест на фактический уровень дозовой нагрузки в разных местах криоконтейнера. Ввиду того, что датчики не могут работать при температуре -80°С в криоконтейнере проводится имитация объема сухого льда по весу. Тест на перепады температур делается без датчиков, но с термопарой, которая использует отдельный канал в криоконтейнере для закрепления на уровне выше сухого льда. Термопара вытаскивается перед помещением криоконтейнера на конвейер линейного ускорителя электронов и помещается обратно после прохождения процедуры стерилизации. Так же следует помнить, что время необходимое оператору на запуск систему составляет 30 минут, поэтому время транспортировки следует рассчитывать заранее исходя из этих данных. Индивидуальные упаковки размещаются на одном уровне так чтобы сухой лед не перекрывал прохождение стерилизующего луча. Вакуумизация проходит напрямую через крышку с портом либо с упаковкой в отдельный пакет.
8) Вакуумизация упаковки
8.1) Вакуумизация для упаковки на 10 и 3 аллотрансплантата. Упаковка оперативно помещается в самозапаивающийся пакет с портом для вакуумизации прямо на слое сухого льда внутри криоконтейнера без присутствия ПДМС в нем. Упаковки на три аллотрансплантата располагаются в один ряд у стенки криоконтейнера, закреплясь так, чтобы они не сбивались в кучу и не падали. В случае упаковки на три аллотрансплантата с портом для вакуумизации пакет не используется.
8.2) Вакуумизация индивидуальной упаковки. Каждая пробирка упаковывается в стерильный вакуумный пакет, и процедура вакуумизации проводится на слое сухого льда с минимальными потерями температур. Затем пробирка помещается в держатель для пробирок большего диаметра. Все последующие пробирки помещаются туда с вертикальным размещением в один ряд или зигзагом. Пакет для вакуумизации может быть изготовлен самостоятельно с клапаном для отсоса воздуха со стороны дна пробирки. Важность вакуумизация продиктована тем, что в этом случае гарантировано меньшее возникновение свободных радикалов во время стерилизации, отсутствие же ПДМС в жидком виде вокруг сосудов также может способствовать возникновению большого количества нежелательных пузырей воздуха от неизбежного встряхивания контейнера во время транспортировки и перемещения по конвейеру.
8.3) Стерилизация для всех типов упаковки сосудов.
После вакуумизации в криоконтейнер помещается температурный датчик, проводится его герметизация и отправка на процедуру радиационной стерилизации. Рекомендуемый режим работы установки радиационной стерилизации - это облучение в течение 15 минут с энергией электронов 7,5 МэВ и током пучка 700 мкА, при котором поверхностная доза облучения объекта в зависимости от скорости конвейера составляет от 24 до 30 кГр. При одностороннем облучении в отработанном режиме работы установки, описанной в выше, упаковки с сосудами для реализации доз облучения сосудов на глубине 3,5-4,0 г/см2 в диапазоне 15-25 кГр, поверхностная доза облучения упаковки, как показывают расчеты, должна составлять 37 кГр. В свою очередь, при двустороннем облучении упаковки (двойном облучении упаковки сначала с одной стороны, потом с другой) поверхностная доза облучения упаковки должна быть уменьшена как минимум вдвое и не превышать 19 кГр. При этом радиационное воздействие на аллотрансплантаты в дозах 15-25 кГр (Dст - Dмакс) является эффективным для достижения стерильности. При дозах, превышающих 35 кГр, возможна деструкция волокнистого остова биоматериала, исключающая допустимость его применения для трансплантологии, а также возникают риски неконтролируемого возникновения перекрестных сшивок и ухудшения свойств ПДМС, который покрывает все сосуды.
После стерилизации упаковка с сосудистыми аллотрансплантатами отправляется на хранение в условиях температуры -80°С или же подвергается разморозке для дальнейшей обработки. Сама радиационная стерилизация в замороженном состоянии является безопасной и рутинной процедурой для передовых медицинских компаний, занимающихся криоконсервацией сосудистых аллотрансплантантов и их доставкой по всему миру (Cryolife Inc.). При радиационной стерилизации перечисленные объекты следует рассматривать как медицинские изделия, вопросы радиационной стерилизации которых регламентируются рядом ГОСТов: ГОСТ ISO 11137-1-2011, ГОСТ Р ИСО 11137-2-2008 и т.д.
9) Разморозка
Разморозка стерильных сосудистых аллотрансплантатов проводится в условиях ламинарного потока. Перед началом разморозки подготавливается стерильный контейнер со стерильным ПДМС вязкостью в 25 сантистокс комнатной температуры, магнитную мешалку с якорем, стерильный градусник, нагревательный столик. Криоконтейнер после стерилизации обрабатывается со всех сторон спиртом и помещается на пол ламинарного бокса, после этого вскрывается и по мере обработки достаются и открываются пакеты с упаковками.
9.1) Для упаковки на десять аллотрансплантатов. Закрепленные подложки с сосудами достаются по одной штуке и помещаются в контейнер с ПДМС. Подложка фиксируется оператором в перчатке или пинцетом и интенсивно перемещается по объему ПДМС до тех пор, пока сосуд сам не сойдет с подложки, после этого сосуд осторожно достается из контейнера и упаковывается. Приблизительное время разморозки одного сосуда составляет 3-5 минут. Температура ПДМС проверяется оператором после каждой разморозки и при необходимости корректируется с помощью нагрева контейнера на нагревательном столике. Магнитная мешалка не используется для данного типа упаковки. Также по желанию оператора могут доставаться только те сосудистые аллотрансплантаты, которые нужны в данный момент с отправкой остальных на хранение в пакете после его запаивания.
9.2) Для упаковки на ипм аллотрансплантата. Из пакета достается по одной упаковке с тремя аллотрансплантатами и в ламинарном шкафу откручивается крышка с подложками. Затем крышка помещается на такую же емкость с ПДМС комнатной температуры и с магнитным якорем на дне. Емкость устанавливается на магнитную мешалку с ее включением на минимальные обороты. Размораживание в данном типе упаковки протекает в течение 5 минут. После мануальной проверки плотности ткани на подложках аллотрансплантаты снимаются с подложек и упаковываются. Если есть возможность установки дополнительного нагревательного элемента сбоку от емкости или подключения перфузионного насоса для постоянного притока теплого ПДМС и оттока охлажденного, то это рекомендуется сделать.
9.3) Для индивидуальной упаковки аллотрансплантатов. Из пакета, по очереди, оператором достается каждая упаковка, раскручивается крышка с подложкой и вынимается нижняя заслонка. Затем крышка с подложкой помещается в контейнер с ПДМС и начинает интенсивно перемещаться по объему ПДМС до тех пор, пока сосуд сам не сойдет с подложки, после этого сосуд осторожно достается из контейнера и упаковывается. Для всех типов упаковки после размораживания сосудистые аллотрансплантаты помещаются в стерильные пробирки, содержащие стерильный раствор Кустодиола с добавлением 50 U/мл пенициллина - стрептомицина (500 mg/mL) с дублированием всей информации с ярлыка. Размораживание путем прямого контакта аллотрансплантата покрытого и замороженного в ПДМС в объеме такого же ПДМС с другой вязкостью обеспечивает быструю передачу тепла, а активное его перемешивание позволяет создавать постоянные теплопритоки с окружающей средой и играет ключевую роль в ускоренном и безопасном нагреве, а также выполняет опосредованную антиоксидантную функцию. Отдельно требуется сказать, что температура вспышки ПДМС вязкостью в 1 сантистокс, присутствующего в замороженном аллотрансплантате и на его стенках, достигает 38°С, что также влияет на выбор температуры ПДМС-25. После изложенных процедур рекомендуется отдельно отмывать сосудистые аллотрансплантаты от остатков ПДМС.
В случае невозможности подбора подложек под диаметр сосудистого аллотрансплантата рекомендуется использовать следующий дополнительный способ крепления - на концы сосуда следует закрепить наконечники из пластика и растянуть его по всей длине, затем в таком виде аккуратно опустить в объем ПДМС, держа за наконечники пинцетом и затем упаковать в пакет для дальнейшей обработки вакуумизации, стерилизации, хранения. Пакеты с такими замороженными сосудами следует упаковывать в криоконтейнер особенно осторожно, рекомендуется помещать их дополнительно в пластиковые емкости и уже их располагать в ряд в криоконтейнер.
Пример осуществления способа.
В Центре биомедицинских технологий ФМБЦ им. А.И. Бурназяна была проведена серия экспериментов по криоконсервированию и стерилизации сосудистых аллотрансплантатов трупного происхождения разного диаметра и длины (от 5 до 12 см) от, в обшей сложности, 40-ка доноров средней и старшей возрастных групп обоих полов в течение 5 часов после фиксации летального исхода с последующим проведением гистологического анализа и проверки физико-механических свойств. Критериями исключения из эксперимента были наличие бифуркаций, атеросклеротических и иных повреждений сосудистой стенки, бляшек и кальцинации на более чем 40% внутренней площади сосуда.
Эксперимент 1
Каждому эксперименту предшествовало математическое моделирование процесса охлаждения и нагрева в разных условиях (на разных типах подложек, полых и сплошных, из алюминия, меди, пластика, медицинской стали с диаметрами 3, 4, 6 мм) в присутствии ПДМС разной вязкости (1, 5, 25 сантисток). Для моделирования была создана модель, используемая в системе автоматизированного проектирования (САПР / CAD) с заданными теплофизическими свойствами сосуда и ПДМС. Моделирование производилось в программном комплексе Ansys. Также были рассмотрены различные условия среды охлаждения, в частности использование металлической и пластиковой емкости для хладоносителя. Было выявлено, что в лучшем случае сосуд охлаждается с комнатной температуры до температуры - 51,8°С за 10 секунд и затем доходит до - 80°С за 15-30 секунд в зависимости от тактики охлаждения и перемещения сосуда по объему ПДМС. Подтверждение данных математического моделирования было осуществлено за счет охлаждения бедренной артерии трупного происхождения с закреплением между слоями сосуда термодатчика и фиксированием скорости охлаждения тканей в объеме ПДМС. В частности, использовались специально смонтированные датчики температуры с кабельным выводом на базе термометров сопротивления Pt100 Honeywell класса «А», ГОСТ 6651-2009 с диапазоном измерений от -100 до +450°С.
Эксперимент 2
Перед началом основной серии экспериментов дополнительно оценивались экзоцеллюлярные и эндоцеллюлярные протекторные свойства ПДМС и его цитотоксичность во время криоконсервации путем двух независимых тестов. Для первого использовалось замораживание в парах жидкого азота суспензии мезенхимальных стволовых клеток онтодентального происхождения (в концентрации 1×106 /мл) и контрольной суспензии с использованием рутинного протокола с 10% ДМСО («Sigma Ald.», США) и реополиглюкина («Биохимик», Россия). Проверялось жизнеспособность клеток после замораживания, их метаболическая активность, а также встраиваемость и проникновение ПДМС в клеточную мембрану. Использовалась методика лантаноидного контрастирования клеток с последующей визуализацией на сканирующем электронном микроскопе, а также химическое микрокартирование в программном комплексе AZtec. Для второго теста применялось цикличное замораживание бедренной артерии с проведением гистологического исследования ее среза после каждого цикла. Результаты обоих тестов продемонстрировали отсутствие проникновения ПДМС в мембрану клеток, а, следовательно, и его эндоцеллюлярное действие, однако результаты показали выраженное экзоцеллюлярное протекторное действие ПДМС, подтвержденное электронной микроскопией и гистологическим исследованием. Что касается результатов циклической заморозки, то рутинное гистологическое окрашивание гематоксилином - эозином сегментов бедренной артерии показало отсутствие закономерности между числом циклов замораживания, количеством клеток и целостностью экстрацеллюлярного матрикса, что свидетельствуют об отсутствии ярко выраженного эффекта холодового цитолиза и повреждения слоев сосуда.
Эксперимент 3
После математического моделирования процесса охлаждения и его тестирования был проведен опыт по изолированной заморозке 30-ти участков бедренных артерий длинной не менее 10 см от 30-ти трупных доноров старшей возрастной группы обоих полов (65-85 лет) в объеме ПДМС вязкостью в 1 сантистокс. После процедуры разморозки в этом же хладоносителе, аллотрансплантаты были подвергнуты проверке их физико-механических свойств на разрывной машине Instron в термостатической камере BioPuls. В каждой группе вычислялись следующие параметры: относительная деформация при физиологическом и хирургическом уровнях напряжения, модуль Юнга при физиологическом и хирургическом уровнях напряжения и максимальное напряжение, возникающее в сосуде до разрыва. По результатам было проведено моделирование режима их стерилизации в замороженном виде. Проверки физико-механических свойств и ограниченное гистологическое исследование показали соответствие параметров, размороженных аллотрансплантатов с нативными сосудами. Была выявлена критическая важность использования подложек, чей диаметр не превышает внутренний диаметр сосудов, а также их хранение в сухом виде без погружения в объем ПДМС.
Эксперимент 4
Сегменты бедренной артерии от 10-ти трупных доноров средней и старшей возрастных групп обоих полов криоконсервировали в объеме ПДМС вязкостью в 1 и 25 сантистокс с температурой -80°С с различными вариациями условий (с и без вакуумизации, с погружением в объем ПДМС и с его покрытием, с дополнительным центрифугированием и без) и подвергали стерилизационному облучению в дозах 30 кГр. В качестве контроля использовались группы с применением коктейля криопротекторов и радиопротекторов на основе ДМСО, глицерина и поливиннилпирролидона. Использовался метод оценки динамической вязкости и прочности оболочек сосудов на разрыв с использованием экспериментального измерительного стенда и разрывной машины Instron. Была выявлена критическая важность вакуумизации упаковки с аллотрансплантатами, предпочтительное использование криоконсервации на подложке с покрытием ПДМС вместо помещения и оставления в его объеме во время транспортировки и стерилизации, важность правильной укладки образцов в криоконтейнер согласно геометрии развертки стерилизующего луча и нецелесообразность центрифугирования для образцов с выраженным аутолизом. В итоге показатели лучшей группы аллотрансплантатов были сравнимы с нативными образцами и в ряде случаев опережали их по пиковым показателям прочности отдельных слоев сосудов. Было продемонстрировано опосредованное радиопротекторное действие ПДМС, а также его эффективность и безопасность для радиационной стерилизации криоконсерванных сосудистых аллотрансплантатов в объеме ПДМС-1 низкой вязкости за счет его гляцифобности, а также скорости и равномерности процесса охлаждения. Также стоит заметить, что протекторный эффект ПДМС-1 во время радиационной стерилизации частично схож с действием глицерола.
Предлагаемый способ обеспечивает оперативную, безопасную и производительную криоконсервацию сосудистых аллотрансплантатов человеческого или животного происхождения перед их радиационной стерилизацией в замороженном виде и дальнейшей децеллюляризацией.
Под оперативной криоконсервацией понимается скорость процедуры, приближенная к т.н. витрификации в жидком азоте, а именно быстрое одноэтапное охлаждение от комнатной температуры до -80°С в течение 1 минуты. Под безопасной криоконсервацией понимается процедура включающая в себя полное или приемлемое сохранение асептических свойств, механических характеристик, параметров биосовместимости и биологической активности сосудистых аллотрансплантатов после их криоконсервации и размораживания за счет использования в качестве теплоносителя, хладоносителя и непроникающего криопротектора одного и того же вещества - полидиметилсилоксана (ПДМС), который приводит к формированию аморфного межклеточного льда во время криоконсервации - главного деструктивного фактора и отказа от применения криопротекторов, которые в эффективной концентрации оказывают цитотоксическое воздействие на трансплантат, а также жидкого азота и дорогостоящих программных методов заморозки. Под производительной криоконсервацией понимается, то что способ позволяет оптимизировать временные и финансовые затраты и позволяет обрабатывать более 10-ти сосудистых аллотрансплантатов (в виде артерий и вен с широким диапазоном внутренних диаметров) с безопасным и удобным креплением и упаковкой, а также имеет иные решения для крепления и упаковки аллотрансплантатов в зависимости от их количества и типа донорства. Это позволяет сделать рутинный забор сосудов для нужд тканевой инженерии более эффективным, так как создают возможность комплексной одновременной криоконсервации и разморозки большого объема материала и, кроме того, упрощают сам процесс. Способ также имеет адаптацию протоколов криоконсервации, упаковки, крепления и размораживания для удобства и безопасности дальнейшей радиационной стерилизации. Способ позволяет минимизировать повреждающий эффект радиации за счет опосредованного радиопротекторного действия ПДМС и его гидрофобности, условий сверхнизких температур, полученных оперативно и безопасно, наличия вакуумизации упаковки и размораживания с антиоксидантным воздействием. Помимо этого, децеллюляризация сосудистых аллотрансплантатов после их стерилизации предполагает их многоэтапную отмывку и не нуждается в сохранении донорского клеточного материала, поэтому данный способ полностью соответствует заявленным требованиям к материалу для децеллюляризации, даже в случае наличия остатков ПДМС на стенках сосудов после всех процедур. Однако полученные результаты позволяют сохранять и более сложные аллотрансплантаты с клеточным материалом реципиента, что нуждается в проведении дополнительных доклинических исследований.
Практическая реализация способа способствует улучшению качества оказания медицинских услуг в ближайшей и отдаленной перспективе, в частности доступа обслуживающего персонала частных и государственных медицинских центров к донорскому материалу, в т.ч. биоинженерному, для трансплантации без необходимости в его длительной предварительной подготовки.
При проведении анализа научно-технической литературы и периодики, а также после проведения патентных исследований на территории РФ и за ее пределами не обнаружена аналогичная заявляемой совокупность технический решений, основанных на использовании ПДМС для охлаждения и разогрева биологических тканей, позволяющая получить технический результат, который ранее не достигался известными средствами, а, следовательно, заявленное изобретение соответствует критерию «новизна».
Краткое описание чертежей.
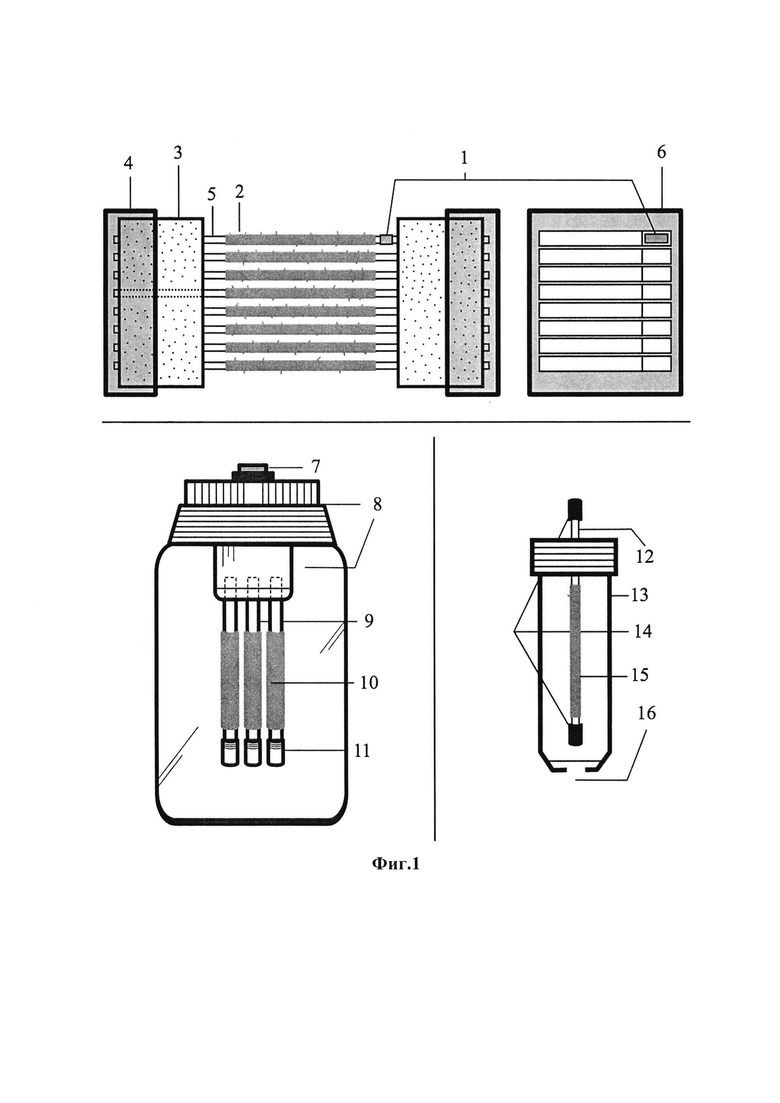
Сущность упаковок и крепления поясняется чертежом, где на фиг. 1 в разрезе приведены три варианта упаковки и крепления аллотрансплантатов.
Для схемы крепления аллотрансплантатов от одного донора (до 10-ти)
1 - ярлыки с информацией об аллотрансплантатах
2 - сосудистые аллотрансплантаты
3 - держатель из пенопласта для упаковки
4 - крышка для держателя из прозрачного пластика
5 - полая стерильная подложка из пластика
6 - крышка для держателя с ярлыками (вид сбоку)
Для схемы крепления аллотрансплантатов от одного донора (до 3-х)
7 - порт для вакуумизации
8 - крышка и промежуточная емкость
9 - подложки из пластиковых или силиконовых трубок с диаметром меньше на 15% просвета аллотрансплантатов
10 - сосудистые аллотрансплантаты
11 - заслонки для блокировки аллотрансплантата
Для схемы индивидуального крепления аллотрансплантатов.
12 - подложка из силиконовой трубки с диаметром меньше на 15% просвета аллотрансплантантов
13 - пробирка на 50 мл
14 - заслонки для блокировки аллотрансплантата
15 - сосудистый аллотрансплантат
16 - порт для вакуумизации на дне пробирки
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения гомографта сердечно-сосудистой системы методом криоконсервации | 2021 |
|
RU2783910C2 |
| СПОСОБ ПОЛУЧЕНИЯ БЕСКЛЕТОЧНОГО МАТРИКСА ДЕРМЫ ДЛЯ ПОСЛЕДУЮЩЕЙ РЕКОНСТРУКЦИИ ОБШИРНЫХ ДЕФЕКТОВ МЯГКИХ ТКАНЕЙ | 2018 |
|
RU2704489C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДЕЦЕЛЛЮЛЯРИЗИРОВАННЫХ МАТРИКСОВ ПАРЕНХИМАТОЗНЫХ ОРГАНОВ ЛАБОРАТОРНЫХ ЖИВОТНЫХ | 2016 |
|
RU2653489C2 |
| СПОСОБ ПОЛУЧЕНИЯ БЕСКЛЕТОЧНОГО МАТРИКСА АМНИОТИЧЕСКОЙ МЕМБРАНЫ ДЛЯ ПОСЛЕДУЮЩЕЙ РЕКОНСТРУКЦИИ ДЕФЕКТОВ ТКАНЕЙ | 2020 |
|
RU2751353C1 |
| Способ сохранения бактерий в фекальной микробиоте и бактериальных культур, выращенных на плотных агаризованных питательных или дифференциальных средах в условиях низких температур с использованием составной среды для заморозки | 2019 |
|
RU2737321C1 |
| УСТРОЙСТВО ДЛЯ ДВУХСТОРОННЕЙ ДЕЦЕЛЛЮЛЯРИЗАЦИИ СОСУДИСТЫХ ГРАФТОВ РАЗЛИЧНОГО ДИАМЕТРА И СПОСОБ ОПТИМИЗАЦИИ ЕГО РАБОТЫ (ВАРИАНТЫ) | 2016 |
|
RU2671476C2 |
| Способ криоконсервации аутологичных вагинальных лактобацилл | 2022 |
|
RU2802074C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ АЛЛОГЕННЫХ ТРАНСПЛАНТАТОВ ПРИСЕРДЕЧНЫХ СОСУДОВ С КЛАПАНАМИ | 2010 |
|
RU2445940C1 |
| Способ оптимизации криоконсервации овариальной ткани для долгосрочного хранения | 2022 |
|
RU2794963C1 |
| СПОСОБ КРИОКОНСЕРВАЦИИ МУЛЬТИПОТЕНТНЫХ МЕЗЕНХИМАЛЬНЫХ СТРОМАЛЬНЫХ КЛЕТОК | 2010 |
|
RU2433173C1 |
Изобретение относится к области криоконсервации биологического материала, в частности сосудистых аллотрансплантатов. Предлагаемый способ криоконсервации сосудистых аллотрансплантатов включает сверхбыстрое охлаждение аллотрансплантатов до температуры -80 С° и хранение при этой температуре, при этом аллотрансплантаты крепятся на стерильные силиконовые или пластиковые полые подложки с диаметром на 15% меньше внутреннего диаметра сосудов и предварительно охлаждаются до +4°С, а для криоконсервации в качестве хладагента и непроникающего криопротектора применяется полидиметилсилоксан (ПДМС) вязкостью в 1 сСт с температурой -80°С. Охлаждение и замораживание проходит со скоростью -10°С/сек путем погружения и перемещения в объеме ПДМС в течение 1 мин. Для индивидуальной упаковки аллотрансплантатов на подложках используется стерильная пробирка на 50 мл с отверстием на дне и портом в крышке и двух заслонках на концах подложки. Для упаковки 3-х аллотрансплантатов используется промежуточный пластиковый контейнер объемом в 50 мл, имеющий крышку с портом для вакуумизации и с тремя портами для подложек на дне, на одинаковом расстоянии друг от друга, который устанавливается в вертикальном положении в прозрачную емкость из полиакрила объемом в 1 л. Для упаковки 10-ти аллотрансплантатов используют два держателя со сквозными каналами для подложек в горизонтальном положении и прозрачными крышками для закрепления на эти держатели. Хранятся аллотрансплантаты в выбранной упаковке с покрытием ПДМС. Разогрев аллотрансплантатов осуществляют на подложках в объеме ПДМС вязкостью в 25 сСт с температурой +25°С за 5 мин. Для безопасной радиационной стерилизации каждая упаковка с аллотрансплантатами вакуумизируется. Предлагаемый способ криоконсервации донорских сосудистых аллотрансплантатов позволяет избежать образования экстрацеллюлярных кристаллов льда, применения криопротекторов, оказывающих цитотоксическое воздействие на трансплантат, исключить использование программных методов замораживания с применением жидкого азота и обеспечить оптимизацию их дальнейшего процессинга – радиационной стерилизации и децеллюляризации. 1 ил.
Способ эффективной и безопасной криоконсервации донорских сосудистых аллотрансплантатов, обеспечивающий оптимизацию их дальнейшего процессинга - радиационной стерилизации и децеллюляризации, включающий: сверхбыстрое охлаждение аллотрансплантатов до температуры -80°С, хранение при этой температуре и отказ от применения токсичных криопротекторов и программной заморозки, отличающийся тем, что аллотрансплантаты крепятся на стерильные силиконовые или пластиковые полые подложки с диаметром на 15% меньше внутреннего диаметра сосудов и предварительно охлаждаются до +4°С; для криоконсервации аллотрансплантатов на подложках в качестве хладагента и непроникающего криопротектора применяется полидиметилсилоксан (ПДМС) вязкостью в 1 сСт с температурой -80°С, охлаждение проходит путем погружения и перемещения в его объеме в течение 1 минуты со скоростью замораживания примерно -10°С/сек; для индивидуальной упаковки аллотрансплантатов на подложках используется стерильная пробирка на 50 мл с отверстием на дне и портом в крышке и двух заслонках на концах подложки; для упаковки 3-х аллотрансплантатов используется промежуточный пластиковый контейнер объемом в 50 мл, имеющий крышку с портом для вакуумизации и с тремя портами для подложек на дне, на одинаковом расстоянии друг от друга, который устанавливается в вертикальном положении в прозрачную емкость из полиакрила объемом в 1 л; для упаковки 10-ти аллотрансплантатов используют два держателя со сквозными каналами для подложек в горизонтальном положении и прозрачными крышками для закрепления на эти держатели; хранятся аллотрансплантаты в выбранной упаковке с покрытием ПДМС; разогреваются аллотрансплантаты на подложках в объеме ПДМС вязкостью в 25 сСт с температурой +25°С за 5 мин; для безопасной радиационной стерилизации каждая упаковка с аллотрансплантатами вакуумизируется.
| СПОСОБ КОНСЕРВИРОВАНИЯ БИОЛОГИЧЕСКИХ ОРГАНОВ | 2007 |
|
RU2362299C1 |
| Способ стерилизации сосудистых аллотрансплантантов с одновременным консервированием | 1977 |
|
SU651815A1 |
| СПОСОБ КРИОКОНСЕРВАЦИИ ЗАГОТОВЛЕННОЙ ТКАНИ МЛЕКОПИТАЮЩИХ ИЛИ КУЛЬТИВИРОВАННОГО ЭКВИВАЛЕНТА ТКАНИ И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1996 |
|
RU2178865C2 |
| СПОСОБ КОНСЕРВАЦИИ ВЕНОЗНОГО БИОПРОТЕЗА | 1997 |
|
RU2134963C1 |
| WO 2000060935 A1, 19.10.2000 | |||
| WO 1989001286 A1, 23.02.1989. | |||
Авторы
Даты
2018-04-17—Публикация
2017-02-15—Подача