Данная заявка притязает на приоритет по дате подачи предварительной патентной заявки США 61/49249 «АНТИ-PSGL-I-АНТИТЕЛА И ИХ ПРИМЕНЕНИЕ», поданной 13 июня 2011 г. Все раскрытия и содержание указанной предварительной заявки включены в настоящую заявку посредством отсылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящей заявкой предлагаются антитела, которые специфически связываются с гликопротеиновым лигандом-1 P-селектина (PSGL-1), полинуклеотиды, кодирующие такие антитела, векторы экспрессии, содержащие такие полинуклеотиды, клетки-хозяева, содержащие такие векторы экспрессии, и родственные композиции. Также предлагаются способы лечения расстройства или расстройства, вызванного или ассоциированного с повышенной пролиферацией и/или числом активированных Т-клеток, такого как псориаз, с применением анти-PSGL-1 антител.
УРОВЕНЬ ТЕХНИКИ
Воспалительные реакции на инфекцию или травму инициируются прилипанием лейкоцитов к стенке сосуда (McEver et al., 1997, J. Clin. Invest., 100 (3): 485-492). Селектины представляют семью гликопротеинов, которые при воспалении осуществляют первичное взаимодействие лейкоцит-эндотелий и лейкоцит-тромбоцит. Семейство селектинов, которое состоит из L-селектина, Е-селектина и P-селектина, содержит домены лектина с терминальными NH2-группами, за которыми следует домен, подобный EGF, согласованные дупликации, трансмембранный домен и цитоплазматический концевой сегмент. Лектиновые домены селектинов взаимодействуют со специфическими гликоконъюгатными лигандами для облегчения адгезии клеток. L-селектин, экспрессированный на большей части лейкоцитов, связывается с лигандами на некоторых клетках эндотелия и других лейкоцитах. Е-селектин, экспрессированный на активированных цитокином клетках эндотелия, также связывается с лигандами на большинстве лейкоцитов.
Гликопротеиновый лиганд-1 P-селектина («PSGL-1»), также известный как SELPLG или CD162 (кластер дифференциации 162), является гликопротеиновым лигандом типа человеческого муцина для всех трех селектинов (Constantin, Gabriela, 2004, Drugs News Perspect, 17(9): 579-585; McEver et al., 1997, J. Clin. Invest., 100(3): 485-492). PSGL-1 является гомодимером, состоящим из двух связанных дисульфидом субъединиц 120-kD, и экспрессирован на поверхности моноцитов, лимфоцитов, гранулоцитов и некоторых стволовых клеток CD34+. PSGL-1 по-видимому вносит вклад в патологическое пополнение лейкоцитов при многих воспалительных расстройствах, т.к. он облегчает адгезию селектинов, что предполагает возможное применение ингибиторов PSGL-1, таких как антитела к PSGL-1, в качестве противовоспалительных лекарств.
Были разработаны несколько анти-PSGL-1 антител (см., например, International Application Pub. No. WO 2005/110475, опубликовано 24 ноября, 2005; International Application Pub. No. WO 2003/013603, опубликовано 20 февраля, 2003; Constantin, Gabriela, 2004, Drugs News Perspect, 17(9): 579-585).
РАСКЫТИЕ ИЗОБРЕТЕНИЯ
В одном аспекте здесь предложены антитела и полученные из антитела антигенсвязывающие фрагменты, которые специфически связываются с PSGL-1. В одном варианте здесь предложено моноклональное антитело, которое иммуноспецифически связывается с человеческим PSGL-1, содержащее: (i) вариабельную область легкой цепи («VL»), содержащую последовательность аминокислот SEQ ID NO: 3; (ii) тяжелую цепь, содержащую вариабельную область тяжелой цепи («VH»), содержащую последовательность аминокислот SEQ ID NO: 4; и (iii) константную область человеческого IgG4, в которой серин замещен на пролин в положении аминокислоты 228 тяжелой цепи, пронумерованной согласно индексу EU (гамма G1 иммуноглобулин) (см. Edelman et al., 1969, Proc. Natl. Acad. Sci. USA, 63(1): 78-85). В конкретном варианте предложено моноклональное антитело, которое иммуноспецифически связывается с человеческим PSGL-1, содержащее (i) легкую цепь, содержащую последовательность аминокислот SEQ ID NO: 1; и (ii) тяжелую цепь, содержащую последовательность аминокислот SEQ ID NO: 2. В другом конкретном варианте предложено моноклональное антитело, которое иммуноспецифически связывается с человеческим PSGL-1, содержащее (i) тяжелую цепь, состоящую из SEQ ID NO: 2; и (ii) легкую цепь, состоящую из SEQ ID NO: 1. В другом конкретном варианте предложено моноклональное антитело, которое иммуноспецифически связывается с человеческим PSGL-1, содержащее тяжелую цепь, содержащую последовательность аминокислот SEQ ID NO: 2, и дополнительно легкую цепь. В конкретном варианте любые указанные моноклональные антитела подвергают очистке.
В другом аспекте предложена фармацевтическая композиция, содержащая любые из рассмотренных моноклональных антител и фармацевтически приемлемый носитель. В конкретном варианте фармацевтическая композиция включает очищенные моноклональные антитела.
В одном варианте предложен фармацевтический препарат, включающий любые из рассмотренных моноклональных антител в водном растворе, содержащем цитрат натрия, хлорид натрия и моногидрат лимонной кислоты. В конкретном варианте фармацевтический препарат представляет собой водный раствор, содержащий 9.1 мМ дигидрата цитрата натрия, 150 мМ хлорида натрия и 0.9 мМ лимонной кислоты. В другом конкретном варианте моноклональные антитела содержатся в фармацевтическом препарате в концентрации 0.267 мМ. В конкретном варианте фармацевтический препарат представляет собой водный раствор, содержащий 2.676 г/л натрия, 8.766 г/л хлорида натрия, 0.2 г/л полисорбата 80 и 0.189 г/л лимонной кислоты. В другом конкретном варианте моноклональные антитела присутствуют в фармацевтическом препарате в концентрации 40 г/л. В конкретном варианте все рассмотренные выше водные растворы имеют pH 6.0.
В другом аспекте предложены полинуклеотиды, клонирующие описанные здесь антитела или их антигенсвязывающие фрагменты. В конкретном варианте предложены изолированные полинуклеотиды, которые кодируют тяжелую цепь антитела, содержащую SEQ ID NO: 2. В одном варианте вектор экспрессии включает указанные выше изолированные полинуклеотиды. В некоторых вариантах вектор экспрессии включает также полинуклеотиды, кодирующие легкую цепь антитела, содержащую SEQ ID NO: 1. В конкретном варианте вектор экспрессии представляет собой вектор экспрессии млекопитающих. В другом аспекте предложены клетки-хозяева, содержащие указанный вектор экспрессии. В конкретном варианте клетка-хозяин включает (а) первую нуклеиновую кислоту, кодирующую SEQ ID NO: 2, эффективно связанную с промоторной областью указанной клетки-хозяина; и (b) вторую нуклеиновую кислоту, кодирующую SEQ ID NO: 1, эффективно связанную с промоторной областью указанной клетки-хозяина. В другом конкретном варианте первая и вторая нуклеиновые кислоты клетки-хозяина находятся в том же самом векторе экспрессии или в разных векторах экспрессии.
В другом аспекте предложен способ получения любых рассмотренных выше антител, включающий культивирование любой из указанных выше клеток-хозяев, так что первая и вторая указанные нуклеиновые кислоты экспрессированы указанной клеткой и указанные тяжелая и легкие цепи собираются вместе с образованием указанного антитела.
В другом аспекте предложена тяжелая цепь антитела, содержащая SEQ ID NO: 2 или фрагмент тяжелой цепи антитела, содержащий аминокислоты 1-228 последовательности SEQ ID NO: 2. В конкретном варианте предложена тяжелая цепь антитела, содержащая SEQ ID NO: 2. В другом конкретном варианте предложен фрагмент тяжелой цепи антитела, содержащий аминокислоты 1-228 последовательности SEQ ID NO: 2. Также здесь предложен способ получения указанной тяжелой цепи, включающий культивирование любой из указанных клеток-хозяев и экспрессирование клеткой указанной тяжелой цепи и выделение указанной тяжелой цепи. В конкретном варианте способ получения любого из указанных антител включает получение тяжелой цепи согласно указанному способу получения тяжелой цепи, выделение указанной тяжелой цепи и образование комплекса указанной тяжелой цепи с легкой цепью антитела, содержащей SEQ ID NO: 1.
В другом аспекте предложен комплект, включающий первый контейнер, содержащий любое из указанных моноклональных антител. В конкретном варианте первый контейнер представляет собой ампулу с указанным моноклональным антителом в виде лиофилизованного в вакууме стерильного порошка, и кроме этого комплект включает второй контейнер, содержащий фармацевтически приемлемую жидкость. Также предложено устройство для инъекции любого из указанных моноклональных антител. В конкретном варианте устройство для инъекции представляет собой шприц.
В другом аспекте предложены способы профилактики и/или лечения заболевания или нарушения, ассоциированного или вызванного (целиком или частично) возросшим числом активированных Т-клеток по сравнению со здоровыми людьми или с людьми, не страдающими конкретной болезнью или нарушением. В конкретном варианте предложен способ лечения воспалительного заболевания, включающий введение пациенту терапевтически эффективного количества указанных выше моноклональных антител. В другом конкретном варианте способ лечения воспалительного заболевания включает введение пациенту терапевтически эффективного количества любой из указанных фармацевтических композиций. В конкретном варианте воспалительное нарушение является аутоиммунным заболеванием. В другом конкретном варианте воспалительное нарушение представляет собой псориаз. В другом конкретном варианте воспалительное нарушение представляет собой пятнистый псориаз. В другом конкретном варианте воспалительное нарушение представляет собой бляшечный псориаз от умеренной до тяжелой формы. В другом конкретном варианте воспалительное нарушение представляет собой эритродермический псориаз. В другом конкретном варианте воспалительное нарушение представляет собой псориатический артрит. В другом конкретном варианте воспалительное нарушение представляет собой ревматоидный артрит. В другом конкретном варианте, воспалительное нарушение представляет собой болезнь Крона. В другом конкретном варианте воспалительное нарушение представляет собой анкилозирующий спондилит. В другом конкретном варианте воспалительное нарушение представляет собой диабет.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На фиг. 1 показаны данные капиллярного гель-электрофореза в невосстанавливающих условиях (CGE) для h15A7 and 15А7Н. Стрелка показывает пик, соответствующий половине молекулы антитела.
На фиг. 2 показано связывание 15А7Н и контрольного антитела с активированными CD4+Т-клетками человека. Значения (nM) получены с использованием одноцентровой четырехпараметровой модели аппроксимации из графика зависимости средней интенсивности флуоресценции (MFI) от концентрации антител.
На фиг. 3 показана объединенная зависимость «доза - ответ» для антител 15А7Н в транс-vivo DTH в образцах мононуклеаров периферической крови (РВМС) у доноров. Объединенное среднее ± SEM для 4 доноров после обработки антителами в количестве 0.03, 0.1, 0.3, 1 и 10 мг/кг или от фармацевтического носителя, pbmc: только РВМС, V: фармацевтический носитель, 0.03, 0.1, 0.3,1 и 10 мг/кг антител 15А7Н. Процент ингибирования утолщения подушечки стопы определяли по реакции на обработку 0.03, 0.1, 0.3, 1 и 10 мг/кг антител 15А7Н.
На фиг. 4 показаны концентрации антител 15А7Н в плазме за двадцать четыре часа у мыши C57BL/6 после однократной внутрибрюшинной инъекции. Показана зависимость объединенных уровней в плазме для 2 антител (среднее ± SEM, n=4) у экспериментальных животных от процента ингибирования утолщения подушечки стопы в анализе транс-vivo DTH.
На фиг. 5 показана зависимость концентрации 15А7Н в плазме от времени у мышей C57BL/6. Четырем сателлитным мышам вводили и.п. дозы 0.03, 0.1, 0.3, 1 и 10 мг/кг антител 15А7Н. Образцы крови отбирали через 1, 3, 5 и 24 час.
На фиг. 6 показана CDC активность 15А7Н и контрольных антител, которые были протестированы при различных концентрациях (5, 0.5, 0.05, 0.005 и 0.0005 мкг/мл).
На фиг. 7А показана последовательность аминокислот тяжелой цепи антитела 15А7Н (SEQ ID NO: 2). Вариабельная область тяжелой цепи (SEQ ID NO: 4) выделена жирным шрифтом. Гипервариабельные участки (CDR) (CDR1 (SEQ ID NO: 8), CDR2 (SEQ ID NO: 9) и CDR3 (SEQ ID NO: 10)) показаны в рамке. Показаны также каркасные области (FR1 (SEQ ID NO: 17), FR2 (SEQ ID NO: 18), FR3 (SEQ ID NO: 19) и FR4 (SEQ ID NO: 20)). Показана константная область. Последовательность аминокислот в шарнирном участке (SEQ ID NO: 12) показана в рамке. Замещенный пролин в положении аминокислоты 228 на шарнирном участке показан курсивом.
На фиг. 7В показана последовательность аминокислот легкой цепи антител 15А7Н (SEQ ID NO: 1. Вариабельная область тяжелой цепи (SEQ ID NO: 3) выделена жирным шрифтом. CDR (CDR1 (SEQ ID NO: 5), CDR2 (SEQ ID NO: 6) и CDR3 (SEQ ID NO: 7)) показаны в рамке. Показаны также каркасные области (FR1 (SEQ ID NO: 13), FR2 (SEQ ID NO: 14), FR3 (SEQ ID NO: 15) и FR4 (SEQ ID NO: 16)). Показана константная область.
Таблица 1: перечень SEQ ID NO и соответствующих последовательностей

ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
Предложены антитела, которые специфично связываются с PSGL-1. Также предложены изолированные нуклеиновые кислоты, кодирующие такие антитела. Предложены векторы и клетки-хозяева, содержащие нуклеиновые кислоты, кодирующие такие антитела или их антигенсвязывающие фрагменты. Также предложены способы получения таких антител, клеток, например, клеток СНО, антител, произведенных такими клетками, и способы очистки полученных антител. Также предложен метод лечения и/или профилактики описанного здесь нарушения или заболевания (например, воспалительного состояния), включающий введение описанных здесь антител или полученных из антител антигенсвязывающих фрагментов, которые иммуноспецифически связываются с PSGL-1. В конкретном варианте антитела представляют собой IgG4 моноклональные антитела 15А7Н, описанные ниже в примерах 1-4.
Антитела
Предложены моноклональные антитела, которые иммуноспецифически связываются с человеческим гликопротеиновым лигандом-1 Р-селектина («PSGL-1»). В конкретном варианте предложены моноклональные антитела, которые иммуноспецифически связываются с человеческим PSGL-1, включающие: (i) вариабельную область легкой («VL») цепи, содержащей последовательность аминокислот SEQ ID NO: 3; (ii) содержащую тяжелую цепь вариабельную область тяжелой («VH») цепи, включающей последовательность аминокислот SEQ ID NO: 4; и (iii) константную область человеческого IgG4, которая содержит аминокислотное замещение серина на пролин в положении аминокислоты 228 тяжелой цепи, пронумерованной согласно индексу EU. Неограничивающие примеры константных областей организма человека широко известны на предшествующем уровне, см. Kabat et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242. Предпочтительно, чтобы антитела связывались с PSGL-1 и селективно индуцировали апоптоз активированных Т-клеток (относительно других клеток, которые экспрессируют PSGL-1). В конкретном варианте связывание антител с PSGL-1 не препятствует взаимодействию Р-селектина с PSGL-1, функции, ассоциированной с PSGL-1, и эффективной локализации активированных Т-клеток и нейтрофилов в целевых тканях.
В конкретном варианте антитела, которые иммуноспецифически связываются с PSGL-1, представляют собой полноразмерный иммуноглобулин G класса 4 (IgG4) и предпочтительно содержат последовательность тяжелой цепи SEQ ID NO: 2 и даже более предпочтительно содержат последовательность легкой цепи SEQ ID NO: 1 (причем последнее антитело является моноклональным антителом 15А7Н).
Также предложены антигенсвязывающие фрагменты антител, содержащие последовательности вариабельных областей SEQ ID NO: 3 и SEQ ID NO: 4, и по меньшей мере часть константной области тяжелой цепи человека, содержащую шарнирный участок человеческого IgG4 вплоть до или включая замещение серина на пролин в положении аминокислоты 228 тяжелой цепи человека, пронумерованной согласно индексу EU. В конкретном варианте полученные из антител антигенсвязывающие фрагменты представляют фрагмент F(ab')2.
Описанные здесь антитела или полученные из антител антигенсвязывающие фрагменты предпочтительно выделять и наиболее предпочтительно очищать.
Использованные здесь и далее, если не указано иное, термины «иммуноспецифически связывается», «специфически связывается» и «специфически распознает» являются аналогичными в контексте антител и полученных из антител антигенсвязывающих фрагментов, используются взаимозаменяемо и относятся к связыванию антител либо полученных из антител антигенсвязывающих фрагментов через центр, объединяющий антиген с его эпитопом, как понятно специалисту. В одном конкретном варианте антитело или полученный из антитела антигенсвязывающий фрагмент, которые специфически связываются с антигеном, могут также связываться с другими пептидами или полипептидами, хотя обычно с меньшим сродством, как определяется, например, иммуноанализом на приборах Biacore™, KinExA 3000 (Sapidyne Instruments, Boise, ID), или другими известными методами анализа. В конкретном варианте антитело или полученный из антитела антигенсвязывающий фрагмент, который иммуноспецифически связывается с антигеном, связывается с антигеном с константой связывания Kа, которая по меньшей мере в 102, 102.5, 103, 104 или больше раз превышает константу Ka для связывания антитела или полученного из антитела антигенсвязывающего фрагмента с другим антигеном. В другом конкретном варианте, антитело или полученный из антитела антигенсвязывающий фрагмент, которые иммуноспецифически связываются с антигеном, не вступают в перекрестные реакции путем связывания с другими белками. В конкретных вариантах описанные здесь антитело или полученный из антитела антигенсвязывающий фрагмент специфически связываются с нативной изоформой или нативным вариантом PSGL-1 (т.е. встречающимися в природе изоформой или вариантом PSGL-1 животного, которые можно выделить из животного или предпочтительно человека). В особых вариантах описанные здесь антитело или полученный из антитела антигенсвязывающий фрагмент иммуноспецифически связываются с человеческим PSGL-1 или его фрагментом. В конкретных вариантах описанные здесь антитело или полученный из антитела антигенсвязывающий фрагмент специфически связываются с человеческим PSGL-1 и/или PSGL-1 яванской макаки или его фрагментом.
Последовательность аминокислот SEQ ID NO: 11 представляет собой непроцессированный человеческий PSGL-1, учетный номер ААА74577.1 в GenBank™, GI:902797. В конкретных вариантах описанное здесь антитело иммуноспецифически связывается с PSGL-1, как определяется, например, с помощью ELISA или другого известного специалистам антигенсвязывающего анализа или анализа, описанного здесь.
В конкретных аспектах предложены здесь антитела, которые специфически связываются с человеческим PSGL-1 и/или PSGL-1 яванской макаки, то есть иммуноглобулин G (включающий тяжелую цепь гамма-изотипа) класса 4 (IgG4), который является тетрамером и состоит из двух идентичных связанных дисульфидной связью, причем каждый из них включает тяжелую цепь и легкую цепь. Предпочтительно, чтобы антитело включало тяжелую цепь с последовательностью SEQ ID NO: 2. Более предпочтительно, чтобы антитело включало тяжелую цепь с последовательностью SEQ ID NO: 2 и легкую цепь из SEQ ID NO: 1. В конкретном варианте легкая цепь описанного здесь антитела представляет собой легкую каппа-цепь.
В конкретных вариантах описанное здесь антитело включает тяжелую цепь, содержащую или состоящую из последовательности аминокислот SEQ ID NO: 2. В конкретных вариантах описанное здесь антитело включает легкую цепь, содержащую или состоящую из последовательности аминокислот SEQ ID NO: 1, и включает тяжелую цепь, содержащую или состоящую из последовательности аминокислот SEQ ID NO: 2. В конкретных вариантах описанное здесь антитело включает легкую цепь, содержащую или состоящую из последовательности аминокислот SEQ ID NO: 1. В конкретных вариантах описанное здесь антитело включает тяжелую цепь, содержащую или состоящую из последовательности аминокислот SEQ ID NO: 2.
В конкретном варианте предложенные антитела представляют собой моноклональные антитела IgG4, которые специфически связываются с PSGL-1. Известно, что антитела IgG4 подвергаются обработке по методу, называемому Fab arm exchange, также известному как перетасовка антител IgG4, при котором повышенная восприимчивость дисульфидных связей шарнирного участка нативного IgG к редукции дает возможность разделения тяжелых цепей и беспорядочной повторной ассоциации с образованием смешанной популяции молекул IgG4 со случайными парами тяжелых и легких цепей (Aalberse et al., 1999. Int Arch Allergy Immunol 118:187-189 Labrijn, et al., 2009, Nat Biotechnol 27:767-771; Schuurman et al., 2001. Mol Immunol 38:1-8; van der Neut Kolfschoten et al., 2007. Science 317:1554-1557).
Было показано, что замена серина на пролин в положении 241 по нумерации Kabat (Kabat et al. 1991, Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242) или в положении 228 согласно индексу EU (Edelman et al., 1969, Proc. Natl. Acad. Sci. USA, 63(1): 78-85) в шарнирном участке человеческого IgG4 приводит к заметному уменьшению связывания между цепями за счет дисульфидов, что приводит к уменьшению количества «половинных молекул» IgG4 и пониженной гетерогенности/перетасовки молекул IgG4 (Bloom et al. 1997, Protein Sci, 6:407-415; Angal et al., 1993, Molecular Immunology, 30(1): 105-108)). Также опубликованы данные о том, что такая мутация шарнирного участка может уменьшить перетасовку IgG4 и увеличить время жизни молекул IgG4 in vivo (Labrijn, et al., 2009, Nat Biotechnol 27:767-771; Stubenrauch, et al., 2010, Drug Metab Dispos 38:84-91). Van der Neut Kolfschoten et al. сообщил, что в реакцию обмена Fab ключей в основном вовлекается домен CH3 антитела IgG4, а не шарнирный участок (см. Van der Neut Kolfschoten et al, 2007, Science, 317:1554-1557 («Van der Neut Kolfschoten») page 1555, col. 2). Van der Neut Kolfschaten опубликовал данные, согласно которым замена домена CH3 антитела IgG1 на домен CH3 в IgG4 активирует обмена Fab ключей в IgG1, в то время как обмен CH3 в IgG4 ингибирует обмена Fab ключей в IgG4 (см. стр. 1555 и фигуру 2D).
В конкретном варианте предложены антитела IgG4 или их антигенсвязывающие фрагменты, которые специфически связываются с PSGL-1 и которые включают одно или несколько замещений аминокислот в шарнирном участке IgG4, причем указанное антитело или антигенсвязывающий фрагмент сохраняют специфическое связывание с указанным PSGL-1 и перетасовка IgG4 уменьшается по сравнению с антителом, содержащим шарнирный участок IgG4 без одного или нескольких указанных замещений аминокислот. В конкретном варианте шарнирный участок IgG4 имеет только одно замещение аминокислоты. Примером «шарнирного участка IgG4» является область тяжелой цепи в антителе IgG4 между доменами CH1 и CH2, состоящими из последовательности аминокислот SEQ ID NO: 12, как показано в работе Angal et al., 1993, Molecular Immunology, 30(1): 105-108.
В конкретном варианте уменьшение перетасовки IgG4 определяют путем детектирования пониженного количества половинных молекул антитела или arm обмена полученных из описанного здесь антитела, в котором имеется одно или несколько замещений аминокислот в шарнирном участке, по сравнению с количеством половинных молекул антитела или обмена ключей, полученных из молекул IgG4 с шарнирным участком IgG4 без одного или нескольких замещений аминокислот. Для определения количества половинных и биспецифических молекул антител годится хорошо известный анализ предшествующего уровня. См., например, Van der Neut Kolfschoten et al, 2007, Science, 317:1554-1557 с примерами анализа для детектирования биспецифических антител.
В конкретном варианте предложены моноклональные антитела IgG4, которые специфически связываются с PSGL-1, включая замещение серина на пролин в положении аминокислоты 228 тяжелой цепи, пронумерованной согласно индексу EU.
В конкретном варианте описанные здесь антитела включают легкую цепь с последовательностью аминокислот SEQ ID NO: 1 и тяжелую цепь, содержащую пролин в положении 228 тяжелой цепи, пронумерованной согласно индексу EU.
В конкретном варианте моноклональные антитела, которые иммуноспецифически связываются с человеческим IgG4, включают: (i) легкую цепь с последовательностью аминокислот SEQ ID NO: 1; и (ii) тяжелую цепь, включающую константную область человеческого IgG4, содержащую одно или несколько аминокислотных замещений в шарнирном участке IgG4, причем указанные антитела сохраняют специфическое связывание с указанным PSGL-1 и перетасовка IgG4 уменьшается по сравнению с антителами, включающими шарнирный участок IgG4 без одного или нескольких указанных замещений аминокислот.
В конкретном варианте моноклональные антитела, которые иммуноспецифически связываются с человеческим IgG4, включают: (i) легкую цепь с последовательностью аминокислот SEQ ID NO: 1; и (ii) тяжелую цепь, включающую константную область человеческого IgG4, в котором серии замещен на пролин в положении аминокислоты 228 тяжелой цепи, пронумерованной согласно индексу EU, или положении 241 согласно системе нумерации Kabat (Kabat et al. 1991, Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242; and Edelman et al., 1969, Proc. Natl. Acad. Sci. USA, 63(1): 78-85).
В конкретном варианте моноклональные антитела, которые иммуноспецифически связываются с человеческим IgG4, включают: (i) область VL цепи, содержащей последовательность аминокислот SEQ ID NO: 3; (ii) область VH цепи, содержащей последовательность аминокислот SEQ ID NO: 4; и (iii) константную область человеческого IgG4, содержащую шарнирный участок IgG4, включая одно или несколько замещений аминокислот в шарнирном участке, причем указанные антитела сохраняют специфическое связывание с PSGL-1 и перетасовка IgG4 уменьшается по сравнению с антителами, включающими шарнирный участок IgG4 без указанного одного или нескольких замещений аминокислот.
В конкретном варианте моноклональные антитела, которые иммуноспецифически связываются с человеческим IgG4, включают: (i) содержащую тяжелую цепь область VH цепи, содержащей последовательность аминокислот SEQ ID NO: 4, и (ii) константную область человеческого IgG4, в которой серии замещен на пролин в положении аминокислоты 228 тяжелой цепи, пронумерованной согласно индексу EU.
В конкретном варианте моноклональные антитела, которые иммуноспецифически связываются с человеческим IgG4, включают: (i) область VL цепи, содержащей последовательность аминокислот SEQ ID NO: 3; (ii) содержащую тяжелую цепь область VH цепи, содержащую последовательность аминокислот SEQ ID NO: 4; и (iii) константную область тяжелой цепи человеческого IgG4, в которой серии замещен на пролин в положении аминокислоты 228 тяжелой цепи, пронумерованной согласно индексу EU.
В некоторых вариантах описанные моноклональные антитела IgG4 включают VH CDR с указанной последовательностью аминокислот (например, см. таблицу 3) и VL с указанной последовательностью аминокислот (например, см. таблицу 2), причем антитела иммуноспецифически связываются с PSGL-1 и имеют мутацию в шарнирном участке, которая уменьшает перетасовку IgG4 (например, замещение серина на пролин в положении аминокислоты 228 в тяжелой цепи, пронумерованной согласно индексу EU). В конкретном варианте моноклональные антитела IgG4 иммуноспецифически связываются с PSGL-1 и включают тяжелую цепь, включающую (а) область VH цепи, содержащую SEQ ID NO: 8, 9 и 10; и (b) константную область тяжелой цепи человеческого IgG4, содержащую замещение серина на пролин в положении аминокислоты 228 в тяжелой цепи, пронумерованной согласно индексу EU. Более предпочтительно, чтобы антитела включали также легкую цепь, содержащую область VL цепи с SEQ ID NO: 5, 6, и 7.
В таблице 2 ниже представлены VL CDR (в частности VL CDR1, VL CDR2, и VL CDR3) последовательности аминокислот 15А7Н. В таблице 2 ниже представлены VH CDR (в частности VH CDR1, VH CDR2 и VH CDR3) последовательности аминокислот 15А7Н. В конкретных вариантах описанные антитела, которые иммуноспецифически связываются с человеческим PSGL-1 (SEQ ID NO: 11), содержат последовательности VL CDR, представленные в таблице 2. В конкретных вариантах описанные антитела, которые иммуноспецифически связываются с человеческим PSGL-1 (SEQ ID NO: 11), содержат последовательности VH CDR, выбранные из представленных в таблице 3.


В конкретном варианте описанные антитела иммуноспецифически связываются с человеческим PSGL-1 и содержат: (i) вариабельную область легкой («VL») цепи, содержащую VL CDR1, VL CDR2, и VL с последовательностями аминокислот SEQ ID NO: 5, SEQ ID NO: 6 и SEQ ID NO: 7, соответственно; (ii) вариабельную область тяжелой («VH») цепи, содержащую VH CDR1, VH CDR2 и VH CDR3 с последовательностями аминокислот SEQ ID NO: 8, SEQ ID NO: 9 и SEQ ID NO: 10, соответственно; и (iii) константную области тяжелой цепи человеческого IgG4, содержащую шарнирный участок IgG с одним или несколькими замещениями аминокислот в шарнирном участке, причем указанные антитела сохраняют специфическое связывание с указанным PSGL-1 и перетасовка IgG4 уменьшена по сравнению с антителами, содержащими шарнирный участок IgG4 без указанных одного или нескольких замещений аминокислот.
В конкретном варианте описанные антитела иммуноспецифически связываются с человеческим PSGL-1 и содержат: (i) область VL цепи с последовательностью аминокислот SEQ ID NO: 3; (ii) область VH цепи, содержащую VH CDR1, VH CDR2 и VH CDR3, с последовательностями аминокислот SEQ ID NO: 8, SEQ ID NO: 9 и SEQ ID NO: 10 соответственно; (iii) константную области тяжелой цепи человеческого IgG4, содержащую шарнирный участок IgG с одним или несколькими замещениями аминокислот в шарнирном участке, причем указанные антитела сохраняют специфическое связывание с указанным PSGL-1 и перетасовка IgG4 уменьшена по сравнению с антителами, содержащими шарнирный участок IgG4 без указанных одного или нескольких замещений аминокислот.
В конкретном варианте описанные антитела иммуноспецифически связываются с человеческим PSGL-1 и содержат: (i) область VL цепи с последовательностью аминокислот SEQ ID NO: 3; (ii) область VH цепи, содержащую VH CDR1, VH CDR2 и VH CDR3, с последовательностями аминокислот SEQ ID NO: 8, SEQ ID NO: 9 и SEQ ID NO: 10 соответственно, и (iii константную область тяжелой цепи человеческого IgG4, в которой серии замещен на пролин в положении 228 тяжелой цепи, пронумерованной согласно индексу EU.
В конкретном варианте описанные антитела иммуноспецифически связываются с человеческим PSGL-1 и содержат: (i) область VL цепи, содержащую VL CDR1, VL CDR2 и VL CDR3, с последовательностями аминокислот SEQ ID NO: 5, SEQ ID NO: 6 и SEQ ID NO: 7 соответственно; (ii) область VH цепи с последовательностью аминокислот SEQ ID NO: 4; и (iii) константную области тяжелой цепи человеческого IgG4, содержащую шарнирный участок IgG4 с одним или несколькими замещениями аминокислот в шарнирном участке, причем указанные антитела сохраняют специфическое связывание с указанным PSGL-1 и перетасовка IgG4 уменьшена по сравнению с антителами, содержащими шарнирный участок IgG4 без одного или нескольких указанных замещений аминокислот.
В конкретном варианте описанные антитела иммуноспецифически связываются с человеческим PSGL-1 и содержат: (i) область VL цепи, содержащую VL CDR1, VL CDR2 и VL CDR3, с последовательностями аминокислот SEQ ID NO: 5, SEQ ID NO: 6 и SEQ ID NO: 7 соответственно; (ii) тяжелую цепь, содержащую область VH цепи с последовательностью аминокислот SEQ ID NO: 4; и (iii) константную область тяжелой цепи человеческого IgG4, в которой серии замещен на пролин в положении 228 тяжелой цепи, пронумерованной согласно индексу EU.
В конкретном варианте описанные антитела, которые иммуноспецифически связываются с человеческим PSGL-1, например, полипептидами человеческого PSGL-1 с SEQ ID NO: 11, включают каркасные области (например, каркасные области домена VL и домена VH). Неограничивающие примеры человеческих каркасных областей описаны в литературе, например, см. Kabat et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242).
В таблице 4 ниже представлены последовательности аминокислот в VL каркасе (FR) (в частности последовательности VL FR1, VL FR2, VL FR3 и VL FR4) в антителах 15А7Н. В таблице 5 ниже представлены последовательности аминокислот VH FR (в частности последовательности VH FR1, VH FR2, VH FR3 и VH FR4) в антителах 15А7Н.


В некоторых вариантах описанные выше антитела IgG4 с мутацией в шарнирном участке, которая уменьшает перетасовку IgG4, содержат VL FR с описанной здесь последовательностью аминокислот (см. таблицу 4). В конкретных вариантах описанные здесь антитела содержат область VL цепи, включающую FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4 из таблиц 1 и 3.
В некоторых вариантах описанные выше антитела IgG4 с мутацией в шарнирном участке, которая уменьшает перетасовку IgG4, содержат VH FR с описанной здесь последовательностью аминокислот (см. таблицу 5). В конкретных вариантах описанные здесь антитела содержат область VH цепи, включающую FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4 из таблиц 2 и 4.
В другом конкретном варианте описанные здесь моноклональные антитела IgG4 содержат (i) область VL цепи, включающую VL FR1, VL FR2, VL FR3 и VL FR4, с последовательностями аминокислот SEQ ID NO: 13, 14, 15 и 16 соответственно; и (ii) область VH цепи, включающую VH FR1, VH FR2, VH FR3 и VH FR4, с последовательностями аминокислот SEQ ID NO: 17, 18, 19 и 20 соответственно и имеют мутацию в шарнирном участке, которые уменьшают перетасовку IgG4. В конкретном варианте описанные здесь антитела содержат область VL цепи, включающую VL FR1, VL FR2, VL FR3 и VL FR4, с последовательностями аминокислот SEQ ID NO: 13, 14, 15 и 16 соответственно. В другом конкретном варианте описанные здесь антитела содержат область VH цепи, включающей VH FR1, VH FR2, VH FR3 и VH FR4, с последовательностями аминокислот SEQ ID NO: 17, 18, 19 и 20 соответственно.
В конкретных вариантах можно модифицировать гликозилирование константной области описанных здесь антител. Например, можно получить негликозилированную константную область антитела или константную область антитела, содержащую мутацию или замещение одного или несколько центров гликозилирования, для исключения гликозилирования в одном или нескольких центрах.
Гликозилирование может протекать как N-связанное (или аспарагин-связанное) или O-связанное. N-связанное гликозилирование включает модифицирование углевода в NH2-группе боковой цепи аспарагиновой аминокислоты в полипептиде. O-связанное гликозилирование включает модифицирование углевода в гидроксильной группе боковой цепи серина, треонина или гидроксилизина.
В некоторых вариантах негликозилированные антитела можно получить в бактериальных клетках без использования оборудования для гликозилирования. На предыдущем уровне техники были описаны клетки, полученные в адаптированном оборудовании для гликозилирования, которые можно использовать в качестве клеток-хозяев, в которых для экспрессирования описанных здесь рекомбинантных антител получают антитела с измененным гликозилированием. См., например, Shields, R.L. et al. (2002) J. Biol. Chem. 277:26733-26740; Umana et al. (1999) Nat. Biotech. 17:176-1, а также European Patent No: EP 1,176,195; PCT Publications WO 03/035835; WO 99/54342.
В некоторых вариантах в Fc-области описанных здесь антител можно провести одну или несколько операций модифицирования обычно для изменения одного или нескольких функциональных свойств антител, таких как время жизни сыворотки, фиксация комплемента, связывание Fc-рецептора и/или антигензависимая клеточно-опосредованная цитотоксичность. Такое модифицирование известно в литературе и описано, например, в Международной патентной заявке публикация № WO 2008/153926 А2. Примеры такого модифицирования включает, но не ограничиваются этим: 1) изменение числа цистеиновых остатков в шарнирном участке для облегчения ассемблирования легких и тяжелых цепей или увеличения или уменьшения стабильности антител; 2) мутирование одной или нескольких аминокислот в области поверхности раздела СН2-СН3 домена Fc-шарнирного участка антитела для уменьшения времени биологической жизни антитела; 3) замену одной или нескольких аминокислот, выбранных из остатков аминокислот 234, 235, 236, 237, 297, 318, 320 и 322 согласно индексу EU от Kabat, на различные остатки аминокислот, так что изменяется сродство антитела к эффекторному лиганду, но сохраняется антигенсвязывающая способность исходного антитела; и/или 4) модифицирование одной или нескольких аминокислот в следующих положениях: 238, 239, 248, 249, 252, 254, 255, 256, 258, 265, 267, 268, 269, 270, 272, 276, 278, 280, 283, 285, 286, 289, 290, 292, 293, 294, 295, 296, 298, 301, 303, 305, 307, 309, 312, 315, 320, 322, 324, 326, 327, 329, 330, 331, 333, 334, 335, 337, 338, 340, 360, 373, 376, 378, 382, 388, 389, 398, 414, 416, 419, 430, 434, 435, 437, 438 или 439 согласно индексу EU по Kabat для увеличения способности антител регулировать антигензависимую клеточно-опосредованную цитотоксичность (ADCC) и/или для увеличения сродства антител к Fcγ-рецептору. Здесь предложены антитела и полученные из антител антигенсвязывающие фрагменты, которые иммуноспецифически связываются с PSGL-1 и могут модулировать активность PSGL-1. В некоторых вариантах предложенные здесь антитела и полученные из антител антигенсвязывающие фрагменты иммуноспецифически связываются с PSGL-1, но не ингибируют связывание PSGL-1 с P-селектином и индуцируют апоптоз активированных Т-клеток. Активность PSGL-1 можно сравнить с активностью любого PSGL-1, известного или описанного на предшествующем уровне техники, например, с активацией Т-клеток при воспалительной реакции. Активность PSGL-1 или функцию PSGL-1 применяют здесь взаимозаменяемо. В некоторых аспектах активность PSGL-1 индуцируется лигандом PSGL-1 (например, P-селектином), связанным с PSGL-1.
В некоторых вариантах описанные здесь анти-PSGL-l антитела или полученные из антител антигенсвязывающие фрагменты не блокируют или не ингибируют связывание P-селектина с PSGL-1.
В конкретном варианте описанные здесь анти-PSGL-1 антитела или полученные из антител антигенсвязывающие фрагменты уменьшают накопление лейкоцитов при воспалительной реакции.
В некоторых аспектах описанные здесь антитела или полученные из антител антигенсвязывающие фрагменты уменьшают или ингибируют выживание клеток, которые экспрессируют PSGL-1 и реагируют на индукцию PSGL-1 (например, клетки, которые размножаются в ответ на стимулирование лиганда PSGL-1, индукцию PSGL-1 или связывание с селектином), например, индуцируют апоптоз активированных Т-клеток. Анализы на выживание клеток описаны на предшествующем уровне и легко доступны специалистам. Например, жизнестойкость клеток можно проверить с помощью красителя трипановый синий или других известных в литературе маркеров на гибель клеток или их жизнеспособность (например, аннексин-1, пропидий иодид (PI) или 7-AAD, см. Gerber A, Bohne M, Rasch J, Struy H, Ansorge S, Gollnick H., 2000. Изучение связывания аннексина V с лимфоцитами после экстракорпоральной фотоиммунотерапии является легким тестом на апоптоз (Dermatology. 2000; 201(2):111-7, Coder, D.M. 2001. Assessment of Cell Viability. Current Protocols in Cytometry. 9.2.1-9.2.14, and Muppidi, J., Porter, M. and Siegel, R.M. 2004. Measurement of Apoptosis and Other Forms of Cell Death. Current Protocols in Immunology. 59:3.17.1-3.17.36.).
В конкретных вариантах описанные здесь антитела специфически связываются с PSGL-1 и полностью или частично ингибируют выживание активированных Т-клеток, как показывают способы, описанные здесь или известные специалистам уже на предшествующем уровне техники (см. например, эксклюзионный анализ с трипаном голубым, см. Coder, D.M. 2001. Assessment of Cell Viability. Current Protocols in Cytometry. 9.2.1-9.2.14). В некоторых вариантах термин «ингибируют» или «ингибирование» означает снижение или предотвращение выживания активированных Т-клеток. Выживание активированных Т-клеток можно уменьшить примерно на 10%, примерно 20%, примерно 30%, примерно 40%, примерно 50%, примерно 60%, примерно 70%, примерно 80%, примерно 90%, примерно 100%, примерно 125%, примерно 150% или более по сравнению с контролем (например, с выживанием Т-клеток в отсутствие описанных здесь антител или в присутствии неспецифических антител).
В некоторых аспектах описанные здесь анти-PSGL-1 антитела способны индуцировать апоптоз (т.е. программированную гибель клеток) активированных Т-клеток, которые могут экспрессировать PSGL-1. Анализы апоптоза описаны в литературе и легко осуществляются специалистами (см., например, Muppidi, J., Porter, M. and Siegel, R.M. 2004. Measurement of Apoptosis and Other Forms of Cell Death. Current Protocols in Immunology. 59:3.17.1-3.17.36). Термин «индуцируют» или «индуцирование» означает инициирование апоптоза или его усиление выше контрольного уровня. Апоптоз активированных Т-клеток можно индуцировать примерно на 10%, примерно 20%, примерно 30%, примерно 40%, примерно 50%, примерно 60%, примерно 70%, примерно 80%, примерно 90%, примерно 100%, примерно 125%, примерно 150% или более по сравнению с контролем (например, апоптоз активированных Т-клеток в отсутствие описанных здесь антител или в присутствии неспецифических антител).
Т-клетки и линии Т-клеток, которые применяют для описанных здесь анализов на активность PSGL-1, легко доступны (например, ARR, DU.528, Jurkat, H-SB2, RPMI 8402, CML-T1, Karpas 45, KE-37/SKW-3, SUP-T1, SUP-T3, MOLT 3/4, P12-Ichikawa, PF-382, CCRF-CEM, HPB-ALL, K-T1, TALL-1, MOLT 16/17, TALL-104, DND-41, Loucy, MOLT 13, Peer/Be13, HUT 78/H9, HUT 102, MT-1, DEL, JB6, Karpas 299, SU-DHL1, 12H5, 3DO54.8, 3DO11.10, 8DO51.15 или 3DO18.3) либо могут быть легко идентифицированы способами, известными в литературе (см., например, Thornton, А.М. 2003. Fractionation of Τ and В Cells Using Magnetic Beads. Current Protocols in Immunology. 55:3.5A.1-3.5A.11., Hathcock, K. 2001. Τ Cell Enrichment by Cytotoxic Elimination of В Cells and Accessory Cells. Current Protocols in Immunology. 00:3.3.1-3.3.5., Horgan, K., Shaw, S. and Boirivant, M. 2009. Immunomagnetic Purification of Τ Cell Subpopulations. Current Protocols in Immunology. 85:7.4.1-7.4.9., and Kanof, M.E. 2001. Purification of Τ Cell Subpopulations. Current Protocols in Immunology. 00:7.3.1-7.3.5). В конкретных вариантах клетки или линии клеток, используемые в размножении клеток, могут экспрессировать PSGL-1 эндогенно или рекомбинантно. Клетки или линии клеток, применяемые в анализе на жизнеспособность клеток, могут экспрессировать PSGL-1 эндогенно или рекомбинантно и вызывают изменение жизнеспособности клеток в ответ на связывание с лигандом PSGL-1 или анти-PSGL-1 антителами. Клетки или линии клеток, применяемые в анализах на апоптоз, могут экспрессировать PSGL-1 эндогенно или рекомбинантно и вызывают изменения апоптоза в ответ на связывание с лигандом PSGL-1 или анти-PSGL-1 антителами. Предпочтительно, чтобы клетки или линии клеток были от человека, (см., например, ARR, DU.528, Jurkat, H-SB2, RPMI 8402, CML-T1, Karpas 45, KE-37/SKW-3, SUP-T1, SUP-T3, MOLT 3/4, P12-Ichikawa, PF-382, CCRF-CEM, HPB-ALL, K-T1, TALL-1, MOLT 16/17, TALL-104, DND-41, Loucy, MOLT 13, Peer/Be13, HUT 78/H9, HUT 102, MT-1, DEL, JB6, Karpas 299, или SU-DHL1).
Способы определения иммуноспецифического связывания антитела с его целевым антигеном легко доступны и описаны в литературе. Например, сродство и способность антитела связываться с целевым антигеном можно определить с помощью многих способов анализа in vitro (биохимические и иммунологические анализы), известных на предшествующем уровне техники, таких как равновесные способы (например, твердофазный анализ иммуноабсорбентный (ELISA), радиоиммунный анализ (RIA)), кинетические способы (например, анализ Biacore™) или другие способы, такие как анализ непрямого связывания, анализ конкурирующего ингибирования, резонансный перенос энергии флуоресценции (FRET), иммуноосаждение, гель-электрофорез и хроматография (например, гель-фильтрация). В этих и других способах используют метки на одном или нескольких изучаемых компонентах и/или разнообразные способы детектирования, включая, но не ограничиваясь этим: хромогенные, флуоресцентные, люминесцентные или изотопные метки. В некоторых вариантах можно не использовать метки, например, в системах Biacore™ используют природное явление поверхностного плазмонного резонанса (SPR) для получения данных в реальном времени без применения меток.
В конкретном варианте описанные здесь антитела выделяют. В конкретном варианте описанные здесь антитела очищают. В особенном варианте описанные здесь антитела представляют собой моноклональные антитела.
В особом варианте предложенные здесь антитела или полученные из антител антигенсвязывающие фрагменты были модифицированы способом, применимым для широкомасштабного производства. Этот способ может включать клонирование последовательности полинуклеотидов, кодирующей необходимые домены анти-PSGL-1 антител, такие как один или несколько CDR или FR, в подходящий вектор экспрессии, который также содержит последовательность полинуклеотидов, кодирующую подходящие константные области для получения целых антител. Последовательности полинуклеотидов, предлагаемые векторами экспрессии, представляют собой последовательности нуклеотидов, которые можно оптимизировать для увеличения выхода антител и достижения максимальной стабильности в условиях производства культур клеток и способов очистки.
Полинуклеотиды
В некоторых аспектах здесь предложены полинуклеотиды, содержащие последовательности нуклеотидов, кодирующие описанные здесь антитела или полученные из антител антигенсвязывающие фрагменты, которые иммуноспецифически связываются с антигеном PSGL-1, и векторы, включающие такие полинуклеотиды для рекомбинантной экспрессии в клетках-хозяевах (например, в микробах типа Е. coli и клетках млекопитающих, таких как клетки гибридомы мышей, клетки СНО и фибробласты 3Т3). Здесь предложены полинуклеотиды, содержащие последовательности нуклеотидов, кодирующие любое антитело или полученный из антитела антигенсвязывающий фрагмент, а также векторы, содержащие такие последовательности полинуклеотидов, например, векторы экспрессии для их эффективной экспрессии в клетках-хозяевах, например, клетках млекопитающих. В конкретном варианте предложенные и описанные здесь полинуклеотиды, содержащие последовательности нуклеотидов, кодирующие любые антитела или полученные из антител антигенсвязывающие фрагменты, выделяют и очищают.
В конкретных аспектах здесь предложены полинуклеотиды, содержащие последовательности нуклеотидов, кодирующие антитела или полученные из антител антигенсвязывающие фрагменты, которые иммуноспецифически связываются с PSGL-1 и содержат описанную здесь последовательность аминокислот.
В конкретных вариантах описанный здесь полинуклеотид кодирует тяжелую цепь с последовательностью аминокислот SEQ ID NO: 2.
Полинуклеотиды могут содержать последовательности нуклеотидов, кодирующие тяжелую цепь, включающую описанные здесь VH FR и CDR антитела (см., например, таблицы 2 и 4), и также включает мутацию на шарнирном участке, что уменьшает перетасовку IgG4.
Также здесь предложены полинуклеотиды, кодирующие тяжелую цепь антител с последовательностью SEQ ID NO: 2, которые оптимизируют, например, с помощью оптимизации кодон/RNA, замещения разнородными последовательностями сигналов и исключением нестабильных элементов мРНК. Также здесь предложены полинуклеотиды, кодирующие легкую цепь антител, содержащую SEQ ID NO: 1, которые оптимизируют путем, например, оптимизации кодон/РНК, замещения разнородными последовательностями сигналов и исключением нестабильных элементов мРНК. Способы получения оптимизированных нуклеиновых кислот, кодирующих антитело или полученный из антитела антигенсвязывающий фрагмент, для рекомбинантной экспрессии путем введения изменений кодонов и/или исключения областей ингибирования мРНК можно осуществить с помощью способов оптимизации, описанных, например, в патентах США 5965726; 6174666; 6291664; 6414132 и 6794498. Например, потенциальные сплайс-сайты и элементы нестабильности (например, элементы, богатые А/Т или A/U) в РНК можно подвергнуть мутации без изменения аминокислот, закодированных в последовательность нуклеиновых кислот, с целью увеличения стабильности РНК при рекомбинантной экспрессии. Изменения используют вырожденность генетического кода, например, использование альтернативного кодона для идентичной аминокислоты. В некоторых вариантах бывает желательно изменить один или несколько кодонов для кодирования консервативной мутации, например, близкую к первоначальной аминокислоту с аналогичной химической структурой и свойствами и/или функцией. Такие способы могут повысить экспрессию анти-PSGL-1 антител или их антигенсвязывающих фрагментов по сравнению с экспрессией анти-PSGL-1 антител, закодированных в полинуклеотиды, которые не были оптимизированы. Более того, можно сконструировать последовательность нуклеотидов, следующую за использованием предпочтительного кодона в клетке хозяина, например, использование кодона Е. coli или кодона СНО.
Оптимизированная последовательность нуклеотидов, кодирующая описанные здесь антитела или полученные из антител антигенсвязывающие фрагменты, может быть гибридизирована с неоптимизированной последовательностью полинуклеотидов, кодирующей описанные здесь антитела или полученные из антител антигенсвязывающие фрагменты. В конкретных вариантах оптимизированная последовательность нуклеотидов, кодирующая описанные здесь антитела или полученные из антител антигенсвязывающие фрагменты гибридизируется в очень жестких условиях в описанную здесь неоптимизированную последовательностью полинуклеотидов, кодирующую антитела или полученные из антител антигенсвязывающие фрагменты. В конкретном варианте оптимизированная последовательность нуклеотидов, кодирующая описанные здесь антитела или полученные из антител антигенсвязывающие фрагменты, гибридизируется в очень жестких, промежуточных или менее жестких условиях гибридизации в неоптимизированную последовательностью полинуклеотидов, кодирующую описанные здесь антитела или полученные из антител антигенсвязывающие фрагменты. Данные об условиях гибридизации описаны, например, в патентной заявке США публикация №2005/0048549 (например, параграфы 72-73), которая включена здесь ссылкой во всей полноте.
Последовательность нуклеотидов в полученных полинуклеотидах можно получать и определять любыми известными в литературе способами. Последовательность нуклеотидов, кодирующую описанные здесь антитела или полученные из антител антигенсвязывающие фрагменты, и модифицированные версии антител или полученных из антител антигенсвязывающих фрагментов можно определять хорошо известными на предшествующем уровне способами, т.е. с помощью кодонов нуклеотидов, известных тем, что кодируют конкретные аминокислоты, которые ассемблируются с образованием нуклеиновой кислоты, которая кодирует антитела или полученные из антител антигенсвязывающие фрагменты. Такой полинуклеотид, кодирующий антитело, можно ассемблировать из химически синтезированных олигонуклеотидов (например, описанных в работе Kutmeier et al., 1994, BioTechniques 17:242), и способ включает, например, синтез перекрывающихся олигонуклеотидов, содержащих части последовательности, кодирующей антитела или полученные из антител антигенсвязывающие фрагменты, отжиг и сшивание этих олигонуклеотидов и затем амплификацию сшитых олигонуклеотидов с помощью ПЦР. Хорошо известны различные способы получения синтетических генов из олигонуклеотидов.
Альтернативно полинуклеотиды, кодирующие описанные здесь антитела или полученные из антител антигенсвязывающие фрагменты можно получить из нуклеиновой кислоты из подходящего источника (например, гибридомы) способами, хорошо известными с предшествующего уровня техники (например, ПЦР и другими способами молекулярного клонирования). Например, можно провести ПЦР амплификацию с использованием синтетических затравок, способных гибридизироваться в 3' и 5' концы известной последовательности с использованием геномной ДНК, полученной из клеток, продуцирующих нужные антитела, например, клеток гибридомы. Такие способы ПЦР амплификации можно использовать для получения нуклеиновых кислот, содержащих последовательность, кодирующую легкую цепь и/или тяжелую цепь антитела. Такие способы ПЦР амплификации можно использовать для получения нуклеиновых кислот, содержащих последовательность, кодирующую вариабельную область легкой цепи и/или вариабельную область тяжелой цепи антитела. Амплифицированные нуклеиновые кислоты можно клонировать в векторы экспрессии в клетках-хозяевах для дальнейшего клонирования, например, для получения химерных и гуманизированных антител. Константная область обычно находится в положении каппа или лямбда легкой цепи антитела, а для тяжелой цепи антитела она может быть, без ограничений, любым изотипом IgG (например, человеческим IgG1, IgG2, IgG3 или IgG4) или другими иммуноглобулинами, включая аллельные варианты.
Если клон, содержащий нуклеиновую кислоту, кодирующую конкретное антитело, не доступен, но известна последовательность молекул антител, можно химически синтезировать нуклеиновую кислоту, кодирующую иммуноглобулин, и клонировать в репликабельные векторы клонирования с использованием любых известных специалистам способов..
ДНК, кодирующую описанные здесь антитела или полученные из антител антигенсвязывающие фрагмент, можно легко выделить и секвенсировать с помощью традиционных процедур (например, с использованием олигонуклеотидных проб, способных специфически связываться с нуклеиновыми кислотами, кодирующими тяжелую и легкую цепи антител). Сразу после выделения ДНК помещают в векторы экспрессии, которые затем трансфектируют в прокариотические или эукариотические клетки-хозяева типа клеток E. coli, дрожжей (Pichia, Saccharomyces), COS клеток обезьян, клеток яичника китайского хомячка (СНО), клеток миеломы (NS0), клеток насекомых или растений, которые иначе не продуцируют иммуноглобулиновые протеины, для синтеза антител или полученных из антител антигенсвязывающих фрагментов в рекомбинантных клетках-хозяевах.
Клетки-хозяева и рекомбинантная экспрессия антител
В некоторых аспектах здесь предложены клетки-хозяева, рекомбинантно экспрессирующие описанные здесь антитела или полученные из антител антигенсвязывающие фрагменты, относящиеся к векторам экспрессии. Здесь предложены векторы экспрессии, содержащие полинуклеотиды из последовательностей нуклеотидов, кодирующих описанные здесь антитела или полученные из антител антигенсвязывающие фрагменты для рекомбинантной экспрессии в прокариотические и эукариотические клетки-хозяева, предпочтительно клетки млекопитающих. Также здесь предложены клетки-хозяева, содержащие такие векторы экспрессии для рекомбинантного экспрессирования описанных здесь антител или полученных из антител антигенсвязывающих фрагментов. В конкретном аспекте предложены способы получения описанных здесь антител или полученных из антител антигенсвязывающих фрагментов, включающие экспрессирование таких антител или полученных из антител антигенсвязывающих фрагментов из клеток-хозяев.
Рекомбинантная экспрессия описанных здесь антител или полученных из антител антигенсвязывающих фрагментов, которые иммуноспецифически связываются с антигеном PSGL-1, включает создание вектора экспрессии, содержащего полинуклеотиды, кодирующие антитела или полученные из антител антигенсвязывающие фрагменты. После получения полинуклеотидов, кодирующих описанные здесь антитела или полученные из антител антигенсвязывающие фрагменты, вектор получения антител или полученных из антител антигенсвязывающих фрагментов можно получить по технологии рекомбинантной ДНК с использованием хорошо известных методик. Таким образом, здесь описаны способы получения антител или полученных из антител антигенсвязывающих фрагментов путем экспрессии полинуклеотидов, содержащих антитела или полученные из антител антигенсвязывающие фрагменты, кодирующие последовательности нуклеотидов. Можно использовать хорошо известные специалистам в данной области способы для создания векторов экспрессии, содержащих кодирующие антитела последовательности или полученные из антител антигенсвязывающие фрагменты, кодирующие последовательности, и соответствующие контрольные сигналы транскрипции и трансляции. Эти способы включают, например, методику in vitro рекомбинантной ДНК, синтетические методики и генетическую рекомбинацию in vivo. Также предложены способные к репликации векторы, содержащие последовательности нуклеотидов, кодирующие описанные здесь антитела, легкую или тяжелую цепь антитела, вариабельные домены тяжелой или легкой цепи антитела или полученного из антитела антигенсвязывающего фрагмента, оперативно связанных с промотором, в частности, промотором, обеспечивающим экспрессию в клетке млекопитающего. Такие векторы могут включать последовательность нуклеотидов, кодирующую константную область молекулы антитела (см., например, Международные публикации №№ WO 86/05807 и WO 89/01036 и патент США №5122464), и вариабельные домены антитела можно клонировать в такой вектор для экспрессии всей тяжелой, всей легкой цепи или обеих - тяжелой и легкой цепей. Векторы экспрессии включают плазмиды, ретровирусы, космиды, полученные из EBV эписомы, искусственные хромосомы и т.п. Вектор экспрессии и контрольные секвенции экспрессии выбирают по признаку совместимости с клетками-хозяевами. Рекомбинантный вектор экспрессии может также кодировать сигнальный белок, который облегчает секрецию цепей антитела из клетки-хозяина. Сигнальный белок может быть сигнальным белком иммуноглобулина, гетерологичным белком из неиммуноглобулинового протеина или искусственным белком.
Вектор экспрессии переносят в клетку-хозяина традиционными способами, известными с предшествующего уровня техники (например, такими как трансфекция с участием липосом, трансфекция через поликатионы, слияние протобластов, микроинъекции, осаждение фосфатом кальция, электропорация, перенос вирусными векторами), и трансфектированные клетки затем культивируют известными способами для получения описанных здесь антител или полученных из антител антигенсвязывающих фрагментов. Таким образом, здесь предложены клетки-хозяева, содержащие полинуклеотиды, кодирующие описанные здесь антитела или полученные из антител антигенсвязывающие фрагменты, функционально связанные с гетерологичным промотором. Для экспрессии целых молекул иммуноглобулина, как описано ниже, в некоторых вариантах для экспрессии антител с двойными цепями можно коэкспрессировать векторы, кодирующие как тяжелые, так и легкие цепи. В некоторых вариантах клетки-хозяева содержат векторы, содержащие полинуклеотиды, кодирующие как тяжелые, так и легкие цепи описанных здесь антител или их антигенсвязывающих фрагментов. В некоторых вариантах клетки-хозяева содержат два различных вектора, причем первый вектор содержит нуклеотиды, кодирующие тяжелую цепь описанных здесь антител или их фрагментов (например, антигенсвязывающих фрагментов), и второй вектор содержит полинуклеотиды, кодирующие легкую цепь описанных здесь антител или их фрагментов (например, антигенсвязывающих фрагментов). В других вариантах первые клетки-хозяева содержат первый вектор, содержащий полинуклеотиды, кодирующие тяжелую цепь описанных здесь антител или их фрагментов, а вторые клетки-хозяева содержат второй вектор, содержащий полинуклеотиды, кодирующие легкую цепь описанных здесь антител.
Разнообразие систем хозяин-вектор экспрессии можно использовать для экспрессирования молекул описанных антител или полученных из антител антигенсвязывающих фрагментов (см., например, патенты США №№807715 и 7604800). Такие экспрессирующие системы представляют собой среду, с помощью которой можно получить и затем очистить нужные кодирующие последовательности, но также представляют собой клетки, которые после превращения или трансфекции в соответствующие нуклеотиды, кодирующие последовательности, могут экспрессировать описанные здесь антитела или полученные из антител антигенсвязывающие фрагменты in situ. Они включают, но не ограничиваются этим, микроорганизмы типа бактерий (например, Е. coli и В. subtilis), трансформированных векторами экспрессии рекомбинантного бактериофага ДНК, плазмиды ДНК или космиды ДНК, содержащие последовательности, кодирующие антитела, или последовательности, кодирующие полученные из антител антигенсвязывающие фрагменты; дрожжи (например, Saccharomyces, Pichia), трансформированные рекомбинантными векторами экспрессии дрожжей, содержащими последовательности, кодирующие антитела, или последовательности, кодирующие полученные из антител антигенсвязывающие фрагменты, кодирующие последовательности; системы клеток насекомых, инфицированных рекомбинантными векторами экспрессии вирусов (например, бакуловирусами), содержащих последовательности, кодирующие антитела, или последовательности, кодирующие полученные из антител антигенсвязывающие фрагменты; системы клеток растений (например, зеленых водорослей Chlamydomonas reinhardtii), инфицированных рекомбинантными векторами экспрессии вирусов (например, вируса мозаики цветной капусты, CaMV; вируса табачной мозаики, TMV) или транформированных с помощью рекомбинантных векторов экспрессии плазмид (например, Ti плазмиды), содержащих последовательности, кодирующие антитела, или последовательности, кодирующие полученные из антител антигенсвязывающие фрагменты; или системы клеток млекопитающих (например, клетки MDCK, HEK 293, NSO, PER.C6, VERO, CRL7030, HsS78Bst, HeLa и NIH 3Т3), собирающие рекомбинантные экспрессионные конструкции, содержащие промоторы и/или гены-усилители, полученные из генома клеток млекопитающих (например, промотор металлотионеин, промотор иммуноглобулин, промотор актин) или из вирусов млекопитающих (например, поздний промотор аденовируса; промотор 7.5K вируса коровьей оспы, CMV, Simian Virus 40). Другими регуляторными элементами экспрессии в эукариотических клетках являются сигналы полиаденилирования, такие как BGH polyA, SV40 поздний или ранний polyA. Альтернативно можно использовать сигналы полиаденилирования иммуноглобулина или других генов. В другом конкретном варианте для экспрессии описанных здесь антител или их антигенсвязывающих фрагментов используют эукариотические клетки, особенно в случае экспрессии описанных здесь моноклональных антител IgG4. Например, клетки млекопитающих, такие как клетки яичника китайского хомяка (СНО) в конъюгации с вектором, таким как главный интермедиат промоторного элемента промежуточного раннего гена цитомегаловируса человека, являются эффективной системой экспрессии антител (Foecking et al., 1986, Gene 45:101; and Cockett et al., 1990, Bio/Technology 8:2). В некоторых вариантах описанные здесь антитела продуцируются клетками СНО или NS0. В конкретном варианте экспрессия последовательностей нуклеотидов, кодирующих описанные здесь антитела или полученные из антител антигенсвязывающие фрагменты, которые иммуноспецифически связываются с антигеном PSGL-1, регулируются конститутивным промотором, индуцированным промотором или специфическим тканевым промотором.
В бактериальных системах можно найти много векторов экспрессии в зависимости от применения экспрессируемой молекулы антитела. Например, когда для создания фармацевтических композиций молекул антител или полученных из антител антигенсвязывающих фрагментов нужно получить большое количество таких антител или полученных из антител антигенсвязывающих фрагментов, желательны векторы, которые направляют экспрессию с образованием высокой концентрации легко очищаемых гибридных белков.
Кроме того, можно выбрать штамм клетки-хозяина, который модулирует экспрессию внедренных последовательностей или модифицирует или процессирует гены нужного специфического типа. Такое модифицирование (например, гликозилирование) и процессирование белков может быть важным для функционирования белков. Различные клетки-хозяева имеют характеристические и специфические механизмы пост-трансляционного процессинга и модифицирования белков и генов. Линии соответствующих клеток или клеток-хозяев можно выбирать для правильного модифицирования и процессинга экспрессируемого чужого белка. В этой связи можно использовать эукариотические клетки-хозяева, которые обладают необходимыми клеточными механизмами для надлежащего процессинга первичного транскрипта, гликозилирования и фосфорилирования генов. Такие клетки млекопитающих включают, но не ограничиваются этим, СНО, VERO, BHK, Hela, COS, MDCK, HEK 293, NIH 3Т3, W138, ВТ483, Hs578T, НТВ2, BT2O и T47D, NS0 (линия клеток миеломы мышей, которая не продуцирует эндогенно иммуноглобулиновые цепи), клетки CRL7O3O и HsS78Bst. В некоторых вариантах описанные здесь антитела или полученные из антител антигенсвязывающие фрагменты получают в клетках млекопитающих, таких как клетки СНО.
Для длительного получения с высоким выходом антител или полученных из антител антигенсвязывающих фрагментов предпочтительна стабильная экспрессия. Например, можно создать линии клеток млекопитающих, которые стабильно экспрессируют молекулы. Вместо использования векторов экспрессии, которые содержат вирусные источники репликации, клетки-хозяева можно трансформировать с помощью ДНК под контролем соответствующих элементов регуляции экспрессии (такими как промоторы, гены-усилители, последовательности, терминаторы транскрипции, сайты полиаденилирования и т.п.) и выбранным маркером. После введения чужой ДНК клеткам дают расти 1-2 суток в неселективной среде и затем переводят в селективную среду. Выбранный маркер в рекомбинантной плазмиде придает устойчивость к селекции и позволяет клеткам стабильно интегрировать плазмиду в свои хромосомы. После клонирования одной клетки их размножают для получения линии клеток. Этот способ можно успешно использовать для создания линий клеток, которые экспрессируют молекулы антител или полученных из антител антигенсвязывающих фрагментов. Такие линии клеток можно использовать конкретно в поиске и оценке композиций, которые непосредственно или косвенно взаимодействуют с молекулами антител.
Можно использовать много систем селекции, включая, но не ограничиваясь этим, гены тимидинкиназы простого вируса герпеса (Wigler et al., 1977, Cell 11:223), гипоксантин-гуанинфосфорибозилтрансферазы (Szybalska & Szybalski, 1992, Proc. Natl. Acad. Sci. USA 48:202) и аденин-фосфорибозилтрансферазы (Lowy et al., 1980, Cell 22:8-17), которые можно использовать в tk-, hgprt- или aprt-клетках соответственно. Кроме того, устойчивость к антиметаболиту можно использовать как основу для селекции следующих генов: dhfr, который придает устойчивость к метотрексату (Wigler et al., 1980, Natl. Acad. Sci. USA 77:357; O'Hare et al., 1981, Proc. Natl. Acad. Sci. USA 78:1527); gpt, который придает устойчивость к микофеноловой кислоте (Mulligan & Berg, 1981, Proc. Natl. Acad. Sci. USA 78:2072); neo, который придает устойчивость к аминогликозиду G-418 (Wu and Wu, 1991, Biotherapy 3:87-95; Tolstoshev, 1993, Ann. Rev. Pharmacol. Toxicol. 32:573-596; Mulligan, 1993, Science 260:926-932; and Morgan and Anderson, 1993, Ann. Rev. Biochem. 62:191-217; May, 1993, TIB TECH 11(5):I55-2 15); и hygro, который придает устойчивость к гигромицину (Santerre et al., 1984, Gene 30:147). Способы, известные из предшествующего уровня в технологии рекомбинантной ДНК, обычно применяют для селекции нужного рекомбинантного клона, и такие способы описаны, например, в работах Ausubel et al. (eds.), Current Protocols in Molecular Biology. John Wiley & Sons, NY (1993); Kriegler, Gene Transfer and Expression. A Laboratory Manual, Stockton Press, NY (1990); and in Chapters 12 and 13, Dracopoli et al. (eds.), Current Protocols in Human Genetics, John Wiley & Sons, NY (1994); Colberre-Garapin et al., 1981, J. Mol. Biol. 150:1, которые включены здесь ссылкой во всей полноте.
Уровень экспрессии молекул антител или полученных из антител антигенсвязывающих фрагментов можно повысить путем амплификации вектора (обзор см. Bebbington and Hentschel, The use of vectors based on gene amplification for the expression of cloned genes in mammalian cells in DNA cloning, Vol. 3 (Academic Press, New York, 1987)). Если амплифицируют маркер в векторной системе, экспрессирующей антитела или полученные из антител антигенсвязывающие фрагменты, то при повышении уровня ингибитора в культуре клеток-хозяев увеличивается число копий гена маркера. Поскольку область амплификации ассоциируют с генами антител или полученных из антител антигенсвязывающих фрагментов, получают также большее количество антител или полученных из антител антигенсвязывающих фрагментов (Crouseet al., 1983, Mol. Cell. Biol. 3:257).
Клетки-хозяева можно котрансфектировать с двумя или несколькими описанными здесь векторами инспекции, причем первый вектор клонирует полипептиды, полученные из тяжелой цепи, и второй вектор кодирует полипептиды, полученные из легкой цепи. Оба вектора содержат также идентичные или различные маркеры селекции, которые обеспечивают достаточную экспрессию полипептидов тяжелой и легкой цепей. Клетки-хозяева можно трансфектировать различными количествами двух или более векторов экспрессии.
Альтернативно можно использовать один вектор, который кодирует и способен к экспрессии как полипептидов тяжелой цепи, так и полипептидов легкой цепи. Кодирующие последовательности тяжелой и легкой цепей могут содержать кДНК или геномную ДНК. Вектор экспрессии может быть моноцистронным или полицистронным. Например, конструкция бицистронной нуклеиновой кислоты может содержать в следующем порядке промотор, тяжелую цепь описанных здесь антител и легкую цепь описанных здесь антител. В таком векторе экспрессии транскрипцию обеих цепей стимулирует промотор, в то время как трансляция мРНК из тяжелой цепи может протекать по кэп-зависимому механизму сканирования, а трансляция мРНК из легкой цепи по кэп-независимому механизму, например, IRES.
В некоторых вариантах молекулы антител или полученные из антител антигенсвязывающие фрагменты получают путем культивирования клеток-хозяев в течение времени, достаточного для высокой экспрессии молекул в клетках-хозяевах. В некоторых вариантах молекулы экспрессируют клетки млекопитающих, например, клетки СНО в среде без сыворотки или в химически определенной среде. В некоторых вариантах молекулы антител или полученные из антител антигенсвязывающие фрагменты выделяют из культурной среды в виде секретируемых полипептидов или лизатов клеток-хозяев, если они, например, были экспрессированы без секреторного сигнала.
Полученные рекомбинантной экспрессией молекулы описанных здесь антител или полученных из антител антигенсвязывающих фрагментов очищают любым способом, известным с предыдущего уровня техники для очистки молекул иммуноглобулина, например, хроматографически (например, методом ионообменной хроматографии, аффинной хроматографии, в частности аффинной по специфическому антигену после протеина А, и эксклюзионной хроматографии), центрифугированием, методом дифференциальной растворимости, осаждения, фильтрации, обращенно-фазовой ВЭЖХ или любым другим стандартным методом очистки белков для получения практически однородных и биологически активных препаратов молекул. Кроме того, описанные здесь антитела или полученные из антител антигенсвязывающие фрагменты для облегчения очистки можно сконденсировать с разнородными последовательностями полипептидов.
В конкретных вариантах описанные здесь антитела или полученные из антител антигенсвязывающие фрагменты выделяют или очищают. Например, в одном варианте антитела или полученные из антител антигенсвязывающие фрагменты получают по существу свободными от клеточного материала, компонентов среды и/или химических предшественников. Термин «по существу свободный от клеточного материала» включает способы получения молекул антител или полученных из антител антигенсвязывающих фрагментов, в которых антитела или полученные из антител антигенсвязывающие фрагменты отделяют от клеточных компонентов клеток, от которых их изолируют или получают рекомбинантно. Если антитела или полученные из антител антигенсвязывающие фрагменты получают рекомбинантно, то обычно они по существу свободны от культурной среды, т.е. культурная среда содержит менее примерно 20%, 10%, 2%, 1%, 0.5% или 0.1 об. % от препарата белка. В случае, когда антитела или полученные из антител антигенсвязывающие фрагменты получают химическим синтезом, они обычно по существу свободны от содержат химических предшественников или других химических веществ, т.е. их отделяют от химических предшественников или других химических веществ, которые участвуют в синтезе белка. Соответственно такие препараты антител или полученных из антител антигенсвязывающих фрагментов содержат менее примерно 30%, 20%, 10%, 5% (в расчете на сухую массу) химических предшественников или соединений, отличных от рассматриваемых целевых антител или полученных из антител антигенсвязывающих фрагментов.
Фармацевтические композиции
Здесь предложены композиции, фармацевтические композиции, содержащие описанные здесь антитела или полученные из антител антигенсвязывающие фрагменты. В конкретных аспектах описанные здесь композиции используют in vitro, in vivo или ex vivo. В особых вариантах здесь предложены фармацевтические композиции, содержащие описанные здесь антитела или полученные из антител антигенсвязывающие фрагменты и фармацевтически приемлемый носитель или эксципиент.
Терапевтические композиции из предложенных здесь антител или полученных из антител антигенсвязывающих фрагментов можно готовить для хранения путем смешения антител нужной степени чистоты с физиологически приемлемыми носителями, эксципиентами или стабилизаторами (Remington's Pharmaceutical Sciences (1990) Mack Publishing Co., Easton, PA; Remington: The Science and Practice of Pharmacy. 21st ed. (2006) Lippincott Williams & Wilkins, Baltimore, MD) в виде лиофилизованных составов или водных растворов. Приемлемые носители, эксципиенты или стабилизаторы не токсичны для пациентов в применяемых дозах и концентрациях и включают буферные растворы типа фосфата, цитрата, дигидрата цитрата натрия и других органических кислот и/или неионных поверхностно-активных веществ, таких как TWEEN™, PLURONICS™ или полиэтиленгликоль (PEG).
Описанные здесь композиции могут также включать более одного активного соединения (например, молекул антител или описанных здесь антител), что необходимо для лечения конкретного показателя. В некоторых вариантах композиции содержат предложенные здесь антитела или полученные из антител антигенсвязывающие фрагменты и одно или несколько активных соединений с дополнительной активностью, которые не оказывают отрицательного воздействия друг на друга. Такие молекулы присутствуют в количествах, которые эффективны для решения поставленной задачи. Например, описанные здесь антитела или полученные из антител антигенсвязывающие фрагменты можно объединять с одним или несколькими другими терапевтическими реагентами. Такую комбинированную терапию проводят периодически, одновременно или последовательно.
Композиции для введения in vivo могут быть стерильными. Стерилизацию легко осуществить фильтрацией, например, через стерильные мембраны.
В конкретных аспектах предложенные здесь фармацевтические композиции содержат терапевтически эффективные количества антител или полученных из антител антигенсвязывающих фрагментов и необязательно одно или несколько дополнительных профилактических или терапевтических реагентов в фармацевтически приемлемом носителе. Такие фармацевтические композиции используют для предупреждения и/или лечения нарушений или болезней, таких как псориаз или один или несколько его симптомов. Термин «терапевтически эффективное» означает такое количество, которое безопасно или достаточно для профилактики или лечения заболевания. Использованные здесь термины «лечить», «леченый», «лечение» используют здесь для обозначения положительного или желательного клинического результата у больного. Положительные или желательные клинические результаты включают, но не ограничиваются этим, ослабление симптомов, уменьшение степени заболевания, стабилизированное (т.е. не ухудшающееся) состояние, остановка или замедление прогрессирования болезни, ослабление болезни или временное улучшение состояния и ремиссию (частичную или полную), определяемые или не определяемые. «Лечение» может также означать более длительное выживание по сравнению с ожидаемым выживанием при отсутствии лечения.
Фармацевтические носители, пригодные для введения предложенных здесь антител или полученных из антител антигенсвязывающих фрагментов, включают любые носители, известные специалистам в данной области как пригодные для конкретного способа введения. В одном варианте антитела или полученные из антител антигенсвязывающие фрагменты вводят в состав подходящих фармацевтических препаратов, таких как стерильные растворы или суспензии для парентерального введения.
Кроме того, описанные здесь антитела или полученные из антител антигенсвязывающие фрагменты могут служить единственным фармацевтически активным компонентом композиции или могут быть объединены с другими активными компонентами (такими как один или несколько других профилактических или терапевтических реагентов).
В композициях предложенные здесь антитела или полученные из антител антигенсвязывающие фрагменты смешивают с подходящим фармацевтическим носителем. Концентрации молекул антител или полученных из антител антигенсвязывающих фрагментов в композициях могут, например, быть эффективными для доставки больному после введения такого количества, которое предупреждает и/или лечит описанное здесь нарушение или болезнь (например, воспалительное заболевание) или его симптом.
В одном варианте композиции составляют для введения одной дозы. Для составления композиции навеску соединения растворяют, суспендируют или смешивают иным способом с выбранным носителем в эффективной концентрации, в результате которой наступает облечения заболевания или ослабление одного или нескольких симптомов.
В конкретных аспектах предложенные здесь антитела или полученные из антител антигенсвязывающие фрагменты вводят в фармацевтически приемлемый носитель в эффективном количестве, достаточном для оказания терапевтически полезного эффекта при отсутствии нежелательных побочных эффектов для пациента или сведению их к пренебрежимо малому эффекту. Терапевтически эффективную концентрацию можно определить эмпирически путем тестирования соединений в системах in vitro и in vivo рутинными способами с последующей экстраполяцией результатов на дозы для людей.
Концентрация антител или полученных из антител антигенсвязывающих фрагментов в фармацевтической композиции будет зависеть, например, от физико-химических характеристик антител или полученных из антител антигенсвязывающих фрагментов, режима введения и введенного количества, а также других факторов, известных специалистам в данной области.
В другом варианте фармацевтические композиции обеспечивают дозу от примерно 0.001 мг до примерно 100 мг антител или полученных из антител антигенсвязывающих фрагментов на килограмм массы тела в сутки. Стандартные фармацевтические лекарственные формы готовят так, чтобы они обеспечили примерно от 0.001 мг до 100 мг и/или комбинацию с другими необязательными существенными ингредиентами на стандартную лекарственную форму. В конкретном варианте антитела или полученные из антител антигенсвязывающие фрагменты вводят в состав рецептуры в концентрации 40 мг/мл.
Антитела или полученные из антител антигенсвязывающие фрагменты можно вводить сразу или разделить на более мелкие дозы для введения через определенные интервалы времени. Понятно, что точная доза и продолжительность лечения зависят от вида болезни или нарушения, описанных здесь, и их определяют эмпирически по известным планам тестирования или экстраполяцией результатов тестирования in vivo или in vitro. Следует отметить, что концентрации и дозы можно также варьировать в зависимости от тяжести заболевания или нарушения. Далее надо понимать, что для каждого пациента необходимо установить конкретный режим дозирования во времени согласно индивидуальной потребности и профессиональному заключению лица, которое вводит композиции или санкционирует их введение.
Предложены фармацевтические композиции для введения людям и животным в стандартной лекарственной форме, такой как стерильный раствор для парентерального введения или суспензия, содержащая нужные количества описанных здесь антител или полученных из антител антигенсвязывающих фрагментов. В одном варианте антитела или полученные из антител антигенсвязывающие фрагменты составляют и вводят в стандартной лекарственной формы или множества лекарственных форм. Использованные здесь формы со стандартной дозой означают физические дискретные единицы, пригодные для людей и животных и упакованные индивидуально, как принято в данной области. Каждая стандартная доза содержит предварительно определенное количество антител или полученных из антител антигенсвязывающих фрагментов, достаточное для достижения желаемого терапевтического эффекта, в сочетании с необходимым фармацевтическим носителем, средой или разбавителем. Примеры форм со стандартной дозой включают ампулы и шприцы. Формы со стандартной дозой можно вводить частями или несколькими дозами. Форма со множеством доз представляет собой множество идентичных форм со стандартной дозой, упакованных в один контейнер для введения в виде стандартных доз. Примеры форм со множеством доз включают пробирки или бутылки емкостью в пинту или галлон. Следовательно, форма со множеством доз включает множество форм со стандартной дозой, которые не разделены в упаковке.
В некоторых вариантах описанные здесь антитела или полученные из антител антигенсвязывающие фрагменты входят в состав жидких фармацевтических композиций. Жидкие фармацевтические композиции можно готовить путем растворения, диспергирования или другого способа смешения описанных здесь антител с носителем, таким как, например, вода, насыщенный солевой раствор, водная декстроза, глицерин, гликоли, этанол и т.п., с образованием раствора или суспензии. При желании фармацевтическая композиция для введения может также содержать небольшие количества нетоксичных вспомогательных веществ, таких как увлажняющие вещества, эмульгаторы, солюбилизаторы и буферные растворы для поддержания pH и т.п.
Реальные способы приготовления таких лекарственных форм известны или будут очевидны специалистам в данной области, например, см. Remington's Pharmaceutical Sciences (1990) Mack Publishing Co., Easton, PA; Remington: The Science and Practice of Pharmacy, 21st ed. (2006) Lippincott Williams & Wilkins, Baltimore, MD.
Можно приготовить лекарственные формы дозирования или композиции, содержащие антитела в количестве 0.005%-99.9%, остальное - нетоксичный носитель. Способы изготовления таких композиций известны специалистам в данной области.
В одном варианте парентеральное введение представляет собой подкожные, внутримышечные либо внутривенные инъекции. Препараты для инъекции можно готовить традиционно либо в виде водных растворов или суспензий, либо в виде твердых форм, пригодных для растворения или суспендирования в жидкости перед инъекцией, либо в виде эмульсий. Препараты для введения, растворы и эмульсии содержат также один или несколько эксципиентов. Подходящими эксципиентами являются, например, вода, солевой раствор, декстроза, глицерин или этанол. Кроме того, при желании фармацевтические композиции для введения могут содержать также небольшие количества нетоксичных вспомогательных веществ, таких как увлажняющие вещества или эмульгаторы, буферы для поддержания pH, стабилизаторы, ускорители растворения и другие реагенты такого типа. Другие пути введения могут включать введение в кишечник, внутримозговое введение, назальное введение, внутриартериальное введение, внутрисердечное введение, внутрикостную инфузию, интратекальное введение, внутривенную инфузию, подкожную имплантацию или инъекцию, внутримышечное введение, интраректальное введение, интравагинальное введение, внутрижелудочное введение, интратрахеальное введение, внутрилегочное введение и внутрибрюшинное введение.
Препараты для парентерального введения включают стерильные растворы, готовые для инъекции, стерильные сухие растворимые вещества, такие как лиофилизованные порошки, готовые для объединения с растворителем непосредственно перед использованием, включая стерильные суспензии, готовые для инъекции, стерильные сухие нерастворимые вещества, готовые для объединения со средой непосредственно перед использованием, и стерильные эмульсии. Растворы могут быть водными либо неводными.
При внутривенном введении подходящие носители включают физиологический солевой раствор или фосфатный буферный раствор (PBS), воду и растворы, содержащие загустители и солюбилизирующие реагенты, такие как глюкоза, полиэтиленгликоль и полипропиленгликоль и их смеси.
Фармацевтически приемлемые носители, применяемые в препаратах для парентерального введения, включают водные среды, неводные среды, противомикробные среды, изотонические среды, буферы, антиоксиданты, местные анестетики, суспендирующие и диспергирующие реагенты, эмульгаторы, секвестирующие или хелатирующие реагенты и другие фармацевтически приемлемые вещества. Фармацевтические носители включают также этиловый спирт, полиэтиленгликоль и пропиленгликоль для сред, смешивающихся с водой, а также гидроксид натрия, соляную кислоту, лимонную кислоту или молочную кислоту для установки pH.
Например, эффективным способом введения является внутривенная или внутриартериальная инфузия стерильного водного раствора, содержащего антитела. Другим вариантом является стерильный водный или масляный раствор или суспензия, содержащие активный материал, вводимый инъекцией и необходимый для получения желаемого фармакологического эффекта.
В конкретном варианте фармацевтический препарат включает цитрат натрия, хлорид натрия, лимонную кислоту, полисорбат 80 и воду. В другом варианте фармацевтический препарат включает цитрат натрия, хлорид натрия и лимонную кислоту. В конкретном варианте фармацевтический препарат содержит 9.1 мМ цитрата натрия, 150 мМ хлорида натрия и 0.9 мМ лимонной кислоты. В конкретном варианте фармацевтический препарат включает описанные здесь антитела и конъюгат в концентрации 0.267 мМ. В конкретном варианте фармацевтический препарат содержит 2.676 г/л цитрата натрия, 8.766 г/л хлорида натрия, 0.2 г/л полисорбата 80 и 0.189 г/л лимонной кислоты. В другом варианте фармацевтический препарат включает описанные здесь антитела или полученные из антител антигенсвязывающие фрагменты в концентрации 40 г/л. Предпочтительно, чтобы указанные фармацевтические препараты имели pH 6.0.
В других вариантах фармацевтические композиции представляют собой лиофилизованные порошки, которые можно подготовить для введения в виде растворов, эмульсий и других смесей. Их можно также подготовить и представить в виде твердых веществ или гелей.
Лиофилизованный порошок готовят путем растворения предложенных здесь антител в подходящем растворителе. В некоторых вариантах лиофилизованный порошок является стерильным. Растворитель может содержать эксципиент, который повышает стабильность, или другой фармакологический компонент порошка или восстановленного раствора, приготовленного из порошка. Используемые эксципиенты включают, но не ограничиваются этим, декстрозу, сорбит, фруктозу, кукурузный сироп, ксилит, глицерин, глюкозу, сахарозу или другие подходящие реагенты. Растворитель может также содержать буфер типа цитрата, фосфата натрия или калия или другие буферы, известные специалистам в данной области, например, в одном варианте с примерно нейтральным рН. Последующая фильтрационная стерилизация раствора и затем лиофилизация в стандартных условиях, известных специалистам в данной области, приводят к нужному составу. В одном варианте полученный раствор дозируют в пробирки для лиофилизации. Каждая пробирка содержит одну дозу или много доз соединения. Лиофилизованный порошок можно хранить в соответствующих условиях, например, от примерно 4°С до комнатной температуры.
Восстановление этого лиофилизованного порошка водой для инъекций дает препарат для парентерального введения. Для восстановления лиофилизованный порошок добавляют к стерильной воде или другому подходящему носителю. Точное количество зависит от соединения. Такое количество определяют эмпирически.
Терапевтические способы
Описанные здесь антитела и полученные из антител антигенсвязывающие фрагменты используют в лечении нарушений и заболеваний, ассоциированных или вызванных (в целом или частично) повышенной пролиферацией и/или числом активированных Т-клеток по сравнению с пролиферацией и/или числом активированных Т-клеток у здоровых индивидуумов или индивидуумов, не страдающих конкретным нарушением или заболеванием. Такие болезни и нарушения известны специалистам в данной области или могут быть установлены специалистом. В конкретном варианте описанные здесь антитела и полученные из антител антигенсвязывающие фрагменты применяют в лечении воспалительных заболеваний или нарушений. В одном варианте воспалительное заболевание является аутоиммунным. В конкретном варианте воспалительным заболеванием или нарушением является псориаз, бляшечный псориаз, псориатический артрит, ревматоидный артрит, болезнь Крона и анкилозный спондилит.
Неограничивающие примеры нарушений и болезней, которые можно лечить с помощью антител и полученных из описанных здесь антител антигенсвязывающих фрагментов, включают псориаз, болезнь Крона, анкилозирующий спондилит, артрит (в том числе ревматоидный артрит, юношеский ревматоидный артрит, остеоартрит и псориатический артрит), сахарный диабет, множественный склероз, энцефаломиелит, миастению гравис, системную красную волчанку, аутоиммунный тироидит, дерматит (включая атопический дерматит и экзематозный дерматит), синдром Шегрена, афтозную язву, ирит, конъюнктивит, кератоконъюнктивит, диабет 1 типа, воспаление кишечника, язвенный колит, астму, аллергическую астму, кожную красную волчанку, склеродерму, вагинит, проктит, лекарственную сыпь, обратные лепроматозные реакции, узловатую лепрозную эритему, аутоиммунный увеит, аллергический энцефаломиелит, острую некротизирующую энцефалопатию, идиопатическую билатеральную прогрессирующую нейросенсорную тугоухость, апластическую анемия, врожденную апластическую анемию, идиопатическую тромбоцитопению, полихондрит, грануломатоз Вегенера, хронический активный гепатит, синдром Стивенса-Джонсона, идиопатические афты, красный плоский лишай, болезнь Гревса, саркоидоз, первичный билиарный цирроз печени, задний увеит, интерстициальный фиброз легких, аллергии типа атопической аллергии, AIDS и Т-клеточные новообразования типа лейкемии и лимфомы.
Кроме того, антитела и полученные из антител антигенсвязывающие фрагменты применяют в лечении нарушений и заболеваний, связанных или вызванных (в целом или частично) повышенной пролиферацией и/или числом активированных Т-клеток по сравнению с пролиферацией и/или числом активированных Т-клеток у здоровых индивидуумов или индивидуумов, не страдающих конкретным нарушением или заболеванием. Неограничивающие примеры нарушений и болезней, которые можно предупреждать и/или лечить с помощью описанных здесь антител и полученных из антител антигенсвязывающих фрагментов, включают реакцию «трансплантат против хозяина» и случаи отторжения трансплантата (включая отторжение трансплантата с использованием аллогенных или ксеногенных тканей), например, трансплантации костного мозга, трансплантации печени, трансплантации почки или трансплантации любого органа или ткани.
Соответственно здесь предложены способы предупреждения и лечения описанных здесь заболеваний и нарушений с использованием описанных здесь антител и полученных из антител антигенсвязывающих фрагментов. В конкретном варианте такие способы включают введение пациенту терапевтически эффективного количества описанных здесь антител и полученных из антител антигенсвязывающих фрагментов. В конкретных вариантах антитело, вводимое для лечения описанных здесь нарушений или заболеваний, представляет собой 15А7Н.
В одном варианте «лечение» нарушения или заболевания означает ослабление по меньшей мере одного измеряемого физического параметра, связанного с нарушением или болезнью, необязательно ощущаемой пациентом. В еще одном варианте «лечение» означает ингибирование прогрессирования нарушения или болезни физически, например, путем стабилизации ощущаемого симптома, физиологически, например, путем стабилизации физического параметра, или по обоим вариантам.
В конкретных вариантах описанные здесь способы лечения предлагают уменьшение или ослабление развития описанных здесь нарушения или болезни, их тяжести и/или длительности. В еще одних специфических вариантах описанные здесь способы лечения уменьшают один или нескольких симптомов описанных здесь нарушений или болезней.
В конкретном варианте благодаря введению терапевтически эффективного количества описанных здесь антител и полученных из антител антигенсвязывающих фрагментов описанный здесь способ лечения нарушения или болезни дает по меньшей мере один, два, три, четыре или более следующих эффектов: (i) уменьшение или ослабление тяжести нарушения или болезни и/или одного или нескольких связанных с ними симптомов; (ii) уменьшение длительности действия одного или нескольких симптомов, связанных с нарушением или болезнью; (iii) предупреждение рецидива нарушения или болезни; (iv) регрессия нарушения или болезни и/или одного или нескольких связанных с ними симптомов; (v) уменьшение необходимости госпитализации пациента; (vi) уменьшение срока госпитализации; (vii) увеличение выживаемости пациента; (viii) ингибирование прогрессирования нарушения или болезни и/или одного или нескольких связанных с ними симптомов; (ix) увеличение или улучшение терапевтического эффекта от другой терапии; (х) ослабление нарушения или болезни или излечение; (xi) снижение смертности; (xii) уменьшение срочности госпитализации; (xiii) предотвращение развития или начала проявления одного или нескольких симптомов, связанных с нарушением или болезнью.
В одном варианте «предупреждение» нарушения или болезни означает прекращение или частичное ингибирование начала проявления или развития нарушения или болезни.
В конкретном варианте болезнью или нарушением, которое лечат описанными здесь способами, является псориаз. Общепринято, что ключевую роль в патогенезе псориаза играют Т-лимфоциты. В конкретном варианте способ лечения псориаза включает введение больному терапевтически эффективного количества описанных здесь антител и полученных из антител антигенсвязывающих фрагментов. В другом конкретном варианте способ ослабления или предотвращения одного или нескольких симптомов псориаза включает введение больному терапевтически эффективного количества описанных здесь антител и полученных из антител антигенсвязывающих фрагментов. Симптомы псориаза включают, но не ограничиваются этим, красные бляшки на коже, покрытые серебристыми чешуйками, повышенное образование бляшек на коже, небольшие пятна на коже, сухая кожа, поврежденная кожа, включая пустулы, зудящую кожу, утолщенные, ямчатые или рельефные ногти, опухшие или ригидные суставы.
В другом варианте нарушением или болезнью, которые лечат описанными здесь способами, является бляшечный псориаз. Бляшечный, или обычный, псориаз является наиболее распространенной формой псориаза и характеризуется резко разделенными эритемными бляшками на коже, покрытыми серебристыми чешуйками. Возникает предрасположенность к распространению поражений на разгибательные поверхности конечностей, пояснично-крестцовую область и кожу головы. Соответствующие гистопатологические наблюдения включают заметную воспалительную клеточную инфильтрацию дермы и эпидермиса, повышенное число дилатированных сосудов и значительно утолщение эпидермиса с неупорядоченной дифференциацией кератиноцитов и гиперкератоз. Примерно одна треть пациентов с бляшечным псориазом входят в категорию лиц с умеренной или тяжелой болезнью и, следовательно, являются кандидатами для терапии наряду с местным лечением.
В конкретном варианте способ лечения бляшечного псориаза включает введение больному терапевтически эффективного количества описанных здесь антител и полученных из антител антигенсвязывающих фрагментов. В другом конкретном варианте способ ослабления или предупреждения одного или нескольких симптомов бляшечного псориаза включает введение больному терапевтически эффективного количества описанных здесь антител и полученных из антител антигенсвязывающих фрагментов. Симптомы бляшечного псориаза включают, но не ограничиваются этим, красные бляшки на коже, покрытые серебристыми чешуйками, повышенное образование бляшек на коже, небольшие пятна на коже, сухую кожу, поврежденную кожу, включая пустулы, зудящую кожу, утолщенные, ямчатые или рельефные ногти, опухшие или ригидные суставы.
В другом варианте болезнью, которую лечат описанными здесь способами, является хронический бляшечный псориаз. В конкретном варианте способ лечения хронического бляшечного псориаза включает введение больному терапевтически эффективного количества описанных здесь антител и полученных из антител антигенсвязывающих фрагментов. В другом конкретном варианте описанный здесь способ ослабления или предупреждения одного или нескольких симптомов хронического бляшечного псориаза включает введение больному терапевтически эффективного количества описанных здесь антител и полученных из антител антигенсвязывающих фрагментов. Симптомы хронического бляшечного псориаза включают, но не ограничиваются этим, единичные или множественные красноватые бляшки на коже размером от кукурузного зерна и более в любой области тела, включая, но не ограничиваясь этим, колени, локти, пояснично-крестцовую область, кожу головы и ногти.
В другом варианте болезнью, которую лечат описанными здесь способами, является каплевидный псориаз. В другом конкретном варианте способ лечения каплевидного псориаза включает введение больному терапевтически эффективного количества описанных здесь антител и полученных из антител антигенсвязывающих фрагментов. В другом конкретном варианте способ предупреждения или ослабления одного или нескольких симптомов каплевидного псориаза включает введение больному терапевтически эффективного количества описанных здесь антител и полученных из антител антигенсвязывающих фрагментов. Симптомы каплевидного псориаза включают, но не ограничиваются этим, появление точечных чешуйчатых бляшек на коже в форме капель воды с последующей инфекцией типа стрептококковой инфекции горла.
В другом варианте нарушением или болезнью, которые лечат описанными здесь способами, является обратный псориаз. В конкретном варианте способ лечения обратного псориаза (называемого также изгибным псориазом и псориазом сгибательных поверхностей) включает введение больному терапевтически эффективного количества описанных здесь антител и полученных из антител антигенсвязывающих фрагментов. В другом конкретном варианте способ предупреждения или ослабления одного или нескольких симптомов обратного псориаза включает введение больному терапевтически эффективного количества описанных здесь антител и полученных из антител антигенсвязывающих фрагментов. Симптомы обратного псориаза включают, но не ограничиваются этим, гладкие и обычно мокнущие участки кожи, которые покраснели и воспалились, в отличие от чешуйчатости, характерной для бляшечного псориаза, на одной или нескольких следующих частях тела: в подмышках, в паху, под грудью и на других участках кожи около гениталий и ягодиц.
В другом варианте нарушением или болезнью, которые лечат описанными здесь способами, является пустулезный псориаз. В конкретном варианте способ лечения пустулезного псориаза (называемого также изгибный псориаз и псориаз сгибательных поверхностей) включает введение больному терапевтически эффективного количества описанных здесь антител и полученных из антител антигенсвязывающих фрагментов. В другом конкретном варианте способ предупреждения или ослабления одного или нескольких симптомов пустулезного псориаза включает введение больному терапевтически эффективного количества описанных здесь антител и полученных из антител антигенсвязывающих фрагментов. Симптомы пустулезного псориаза включают, но не ограничиваются этим, наполненные гноем волдыри разного размера и локализации, но в основном на руках и ногах.
В другом варианте нарушением или болезнью, которые лечат описанными здесь способами, является эритродермический псориаз. В конкретном варианте способ лечения эритродермического псориаза (называемого также изгибный псориаз и псориаз сгибательных поверхностей) включает введение больному терапевтически эффективного количества описанных здесь антител и полученных из антител антигенсвязывающих фрагментов. В другом конкретном варианте способ предупреждения или ослабления одного или нескольких симптомов эритродермического псориаза включает введение больному терапевтически эффективного количества описанных здесь антител и полученных из антител антигенсвязывающих фрагментов. Симптомы эритродермического псориаза включают, но не ограничиваются этим, периодическое покраснение на большой площади кожи и отшелушивание кожи в виде пластинок, а не более мелких чешуек. Покраснение и шелушение кожи часто сопровождается зудом и болью, учащением пульса и колеблющейся температурой тела.
В другом варианте, нарушением или болезнью, которые лечат описанными здесь способами, является ревматоидный артрит. В конкретном варианте способ лечения ревматоидного артрита включает введение больному терапевтически эффективного количества описанных здесь антител и полученных из антител антигенсвязывающих фрагментов. В другом конкретном варианте описанный способ предупреждения или ослабления одного или нескольких симптомов ревматоидного артрита включает введение больному терапевтически эффективного количества описанных здесь антител и полученных из антител антигенсвязывающих фрагментов. Симптомы ревматоидного артрита включают, но не ограничиваются этим, усталость, потерю аппетита, слабый жар, опухшие гланды, слабость, боль в суставах -локтевых, плечевых, бедренных, коленных, голеностопных, пальцах ног, челюстях, руках, ногах, пальцах и/или шее, утреннюю скованность, боль в груди и грудной клетке (плеврит), жжение в глазах, зуд, выделения, подкожные узелки, оцепенение, покалывание или жжение в руках и ногах.
В другом варианте нарушением или болезнью, которые лечат описанными здесь способами, является болезнь Крона. В конкретном варианте способ лечения болезни Кроана включает введение больному терапевтически эффективного количества описанных здесь антител и полученных из антител антигенсвязывающих фрагментов. В другом конкретном варианте описанный способ предупреждения или ослабления одного или нескольких симптомов болезни Крона включает введение больному терапевтически эффективного количества описанных здесь антител и полученных из антител антигенсвязывающих фрагментов. Симптомы болезни Крона включают, но не ограничиваются этим, спастическую абдоминальную (область живота) боль, жар, усталость, потерю аппетита, боль при дефекации (тенезм), стойкий водянистый стул, непроизвольную потерю веса, запор, воспаление глаз, свищи (обычно вокруг ректальной области, могут вызвать выделение гноя, слизи или стула), боль в суставах, воспаление печени, язвы во рту, аноректальное кровотечение и стул с кровью, припухлость кожи или болячки (язвы) и опухшие десны.
В другом варианте нарушением или болезнью, которые лечат описанными здесь способами, является анкилозный спондилит. В конкретном варианте способ лечения анкилозного спондилита включает введение больному терапевтически эффективного количества описанных здесь антител и полученных из антител антигенсвязывающих фрагментов. В другом конкретном варианте способ предупреждения или ослабления одного или нескольких симптомов анкилозного спондилита включает введение больному терапевтически эффективного количества описанных здесь антител и полученных из антител антигенсвязывающих фрагментов. Симптомы анкилозного спондилита включают, но не ограничиваются этим, частые боли и скованность в нижней части спины и ягодицах, в позвоночнике и/или области шеи и боль и болезненность, распространяющуюся на ребра, лопатки, бедра и пятки; воспаление глаз (иридоциклит и увеит), вызывающее покраснение, боль в глазах, потерю зрения, мушки перед глазами и светобоязнь, усталость и тошноту.
В другом варианте нарушением или болезнью, которые лечат описанными здесь способами, является сахарный диабет. В конкретном варианте способ лечения сахарного диабета включает введение больному терапевтически эффективного количества описанных здесь антител и полученных из антител антигенсвязывающих фрагментов. В другом конкретном варианте способ предупреждения или ослабления одного или нескольких симптомов сахарного диабета включает введение больному терапевтически эффективного количества описанных здесь антител и полученных из антител антигенсвязывающих фрагментов. Симптомы диабета включают, но не ограничиваются этим, потерю веса, полиурию (частое мочеиспускание), полидипсию (повышенная жажда), полифагию (повышенный голод), сердечно-сосудистые заболевания, диабетическую ретинопатию, диабетическую нейропатию, гиперосмоляное некетотическое состояние и диабетический кетоацидоз.
В отдельных вариантах описанные здесь антитела и полученные из антител антигенсвязывающие фрагменты вводят пациенту, который ранее получал или продолжает получать один или несколько других видов терапии.
В отдельных вариантах описанные здесь антитела и полученные из антител антигенсвязывающие фрагменты вводят пациенту, который ранее получал или продолжает получать один или несколько других видов терапии. В других особых вариантах описанные здесь антитела и полученные из антител антигенсвязывающие фрагменты вводят пациенту, который, как предполагают, устойчив или не поддается лечению противовоспалительными средствами.
В некоторых аспектах здесь предложены способы цитоза Т-клеток у больного, причем указанные способы включают введение указанному больному эффективного количества описанных здесь антител и полученных из антител антигенсвязывающих фрагментов. В других аспектах здесь предложены способы индуцирования апоптоза активированных Т-клеток у больного, причем указанный способ включает введение указанному больному эффективного количества описанных здесь антител и полученных из антител антигенсвязывающих фрагментов.
В некоторых вариантах описанные здесь антитела и полученные из антител антигенсвязывающие фрагменты или их фармацевтические композиции можно вводить больному любым подходящим способом. Неограничивающие примеры способов введения включают внутривенную инфузию, подкожную инъекцию или имплантацию, внутримышечное, интратекальное, внутрибрюшинное введение, введение в прямую кишку, интравагинальное, интраназальное, внутрижелудочное, интратрахеальное или внутрилегочное введение и/или любой другой способ физической доставки, описанный здесь или известный в данной области. В одном варианте антитела и полученные из антител антигенсвязывающие фрагменты или их фармацевтические композиции вводят больному систематически (например, парентерально). В другом варианте антитела или их фармацевтические композиции вводят больному локально (например, внутритуморально). Каждую дозу можно вводить одним и тем же способом или разными способами. В некоторых вариантах описанные здесь антитела и полученные из антител антигенсвязывающие фрагменты можно вводить многими способами одновременно или последовательно с другими дозами тех же или других описанных здесь антител.
При лечении болезни или ее симптома антитела и полученные из антител антигенсвязывающие фрагменты обычно вводят после начала болезни или появления ее симптомов. Для предупреждения симптомов болезни антитела и полученные из антител антигенсвязывающие фрагменты обычно вводят до появления симптомов.
Дозы и частоту введения описанных здесь антител и полученных из антител антигенсвязывающих фрагментов или их фармацевтических композиций определяют в зависимости от способа предупреждения болезни и/или ее лечения с целью минимизировать побочные эффекты. Точную дозу описанных здесь антител и полученных из антител антигенсвязывающих фрагментов или их фармацевтических композиций для введения конкретному пациенту может установить врач-практик в свете факторов, относящихся к больному, нуждающемуся в лечении. Следует принять во внимание тяжесть болезненного состояния, общее состояние здоровья пациента, возраст и массу тела, диету, время и частоту введения, комбинации с другими терапевтическими реагентами или лекарствами, чувствительность к реакции и переносимость/ответ на терапию.
Дозы и частоту введения описанных здесь антител и полученных из антител антигенсвязывающих фрагментов или их фармацевтических композиций можно установить за время, достаточное для достижения нужной концентрации антител и полученных из антител антигенсвязывающих фрагментов или поддержания желательного эффекта.
Точная доза, применяемая в препарате, также зависит от способа введения и тяжести воспалительного нарушения или болезни, и ее следует установить, опираясь на опыт врачей-практиков и обстоятельства каждого пациента.
Эффективные дозы можно определять экстраполяцией кривых доза-реакция, полученных in vitro или на тестовых системах модельных животных.
В одном варианте доза описанных здесь антител и полученных из антител антигенсвязывающих фрагментов, которую вводят пациенту для предупреждения и/или лечения описанной здесь болезни или нарушения, обычно составляет от 0.001 мг/кг до 100 мг/кг массы тела пациента. В другом варианте подходящая доза антител или полученных из антител антигенсвязывающих фрагментов, терапевтически эффективных для предупреждения и/или лечения описанных здесь болезни или нарушения, находится в интервале от 0.01 мг/кг до 100 мг/кг массы тела пациента.
В конкретных вариантах термин «эффективное количество» описанных здесь антител или полученных из антител антигенсвязывающих фрагментов относится к количеству описанных здесь антител или полученных из антител антигенсвязывающих фрагментов, которое достаточно для достижения по меньшей мере одного, двух, трех, четырех или более следующих эффектов: (i) уменьшение или ослабление тяжести болезни или нарушения, описанных здесь, и/или одного или нескольких связанных с ними симптомов; (ii) уменьшение длительности действия одного или нескольких симптомов, связанных с нарушением или болезнью; (iii) предупреждение рецидива болезни или нарушения; (iv) регрессия болезни или нарушения и/или одного или нескольких связанных с ними симптомов; (v) уменьшение необходимости госпитализации пациента; (vi) уменьшение срока госпитализации; (vii) увеличение выживаемости пациента; (viii) ингибирование прогрессирования болезни или нарушения и/или одного или нескольких связанных с ними симптомов; (ix) усиление или улучшение терапевтического эффекта другой терапии; (х) ослабление болезни или нарушения или излечение; (xi) уменьшение смертности; (xii) уменьшение срочности госпитализации; (xiii) предупреждение развития или начала проявления одного или нескольких симптомов, связанных с болезнью или нарушением и (xiv) улучшение качества жизни с помощью хорошо известных способов в данной области, например, это следует из данных анкетирования. В некоторых вариантах используемый здесь термин «эффективное количество» означает количество описанных здесь антител для достижения конкретного результата, описанного в разделе 6 ниже. В некоторых вариантах эффективное количество антител или полученных из антител антигенсвязывающих фрагментов составляет от примерно 0.01 мг до примерено 1000 мг.
В некоторых вариантах для предупреждения и/или лечения описанных здесь нарушения или болезни одну дозу описанных здесь антител или полученных из антител антигенсвязывающих фрагментов вводят пациенту однократно или несколько раз.
В особых вариантах антитела или полученные из антител антигенсвязывающие фрагменты или их фармацевтические композиции вводят больному циклами в соответствии с представленными здесь способами предупреждения и/или лечения нарушения или болезни, причем антитела или полученные из антител антигенсвязывающие фрагменты или фармацевтические композиции вводят некоторое время с последующим периодом отдыха (т.е. описанные здесь антитела или полученные из антител антигенсвязывающие фрагменты или фармацевтические композиции не вводят в течение некоторого периода времени).
Предложенные здесь антитела или полученные из антител антигенсвязывающие фрагменты, применяемые для предупреждения и/или лечения описанных здесь нарушения или болезни, можно вводить до, одновременно или после введения одного или нескольких дополнительных терапевтических средств (например, реагентов). Использование термина «в комбинации» не ограничивает порядок введения пациенту антител или полученных из антител антигенсвязывающих фрагментов и одного или нескольких дополнительных терапевтических средств. В конкретных вариантах терапевтические средства можно вводить периодически или последовательно.
В другом конкретном варианте для предупреждения и/или лечения описанных здесь болезни или нарушения описанные здесь антитела или полученные из антител антигенсвязывающие фрагменты применяют в комбинации с некоторым количеством другого терапевтического средства (такого, как, например, противовоспалительный реагент). В конкретном варианте такая комбинированная терапия дает синергический эффект. В других вариантах такая комбинация приводит к аддитивному эффекту.
В конкретном варианте антитела или полученные из антител антигенсвязывающих фрагменты и дополнительная терапия позволяют использовать пониженные дозы (например, меньше оптимальных) антител или полученных из антител антигенсвязывающих фрагментов и/или дополнительной терапии и/или вводить больному описанные здесь антитела или полученные из антител антигенсвязывающие фрагменты или дополнительную терапию с меньшей частотой. В некоторых вариантах возможность применять пониженные дозы описанных здесь антител или полученных из антител антигенсвязывающих фрагментов и/или дополнительной терапии и/или с меньшей частотой вводить больному антитела или полученные из антител антигенсвязывающие фрагменты или указанную дополнительную терапию приводит к уменьшению токсичности, связанной с введением антител или полученных из антител антигенсвязывающих фрагментов или указанной дополнительной терапии соответственно без понижения эффективности антител или указанной дополнительной терапии соответственно в предупреждении и/или лечении описанных здесь нарушения или болезни. В некоторых вариантах введение описанных здесь антител или полученных из антител антигенсвязывающих фрагментов в комбинации с дополнительной терапией приводит к повышенной эффективности описанных здесь антител или полученных из антител антигенсвязывающих фрагментов и/или указанной дополнительной терапии в предупреждении и/или лечении описанных здесь нарушения или болезни. В некоторых вариантах введение описанных здесь антител или полученных из антител антигенсвязывающих фрагментов и одного или нескольких видов дополнительной терапии позволяет избежать или уменьшить отрицательные или нежелательные побочные эффекты, ассоциированные с использованием любой одной терапии.
В конкретном варианте субъектами введения описанных здесь антител или полученных из антител антигенсвязывающих фрагментов являются животные (например, яванская макака или человек). В предпочтительном варианте субъектами введения описанных здесь антител или полученных из антител антигенсвязывающих фрагментов является человек. В конкретном варианте у субъектов, которым вводят антитела или полученные из антител антигенсвязывающие фрагменты, наблюдаются один или несколько симптомов описанных здесь болезней или нарушений.
Способы с использованием клеток
Здесь предложены способы индуцирования или усиления апоптоза в клетках, экспрессирующих PSGL-1, включающие контактирование клеток с эффективным количеством описанных здесь антител. В одном варианте клетки являются иммунными. В конкретном варианте клетки являются Т-клетками. В более конкретном варианте клетки являются активированными Т-клетками. Способы детектирования апоптоза описаны в литературе, и специалист их легко осуществит. В конкретных вариантах способ индуцирования или усиления апоптоза активированных Т-клеток, экспрессирующих PSGL-1, включает контактирование клеток с эффективным количеством описанных здесь антител, причем эффективное количество является достаточным для индуцирования или усиления апоптоза, о чем свидетельствуют способы, известные специалистам в данной области.
Здесь предложены способы уменьшения или ингибирования выживания клеток, экспрессирующих PSGL-1, которые включают контактирование клеток с эффективным количеством описанных здесь антител. В одном варианте клетки являются иммунными. В конкретном варианте клетки являются Т-клетками. В более конкретном варианте клетки являются активированными Т-клетками. Анализы на выживание клеток описаны в литературе, и специалист их легко осуществит. Например, жизнеспособность клеток можно определить с помощью подкрашивания трипаном-голубым или с помощью известных других маркеров гибели клеток (например, окрашивание на Annexin-5) или маркеров жизнеспособности (например, пропидиум иодид или 7-AAD). В конкретных вариантах способ уменьшения или ингибирования выживания активированных Т-клеток, экспрессирующих PSGL-1, включает контактирование клеток с эффективным количеством описанных здесь антител, причем эффективное количество уменьшает или ингибирует выживание клеток, что определяется способами, известными специалистам в данной области (например, анализ с помощью трипана голубого, пропидиум иодида или 7-AAD).
Наборы
Здесь предложена фармацевтическая упаковка или набор, включающий один или несколько контейнеров, заполненных одним или несколькими компонентами описанной здесь фармацевтической композиции, такими как описанные здесь антитела или полученные из антител антигенсвязывающие фрагменты. Необязательно к таким контейнерам может быть приложена инструкция в форме, установленной правительственным агентством и регулирующей производство, применение или продажу фармацевтических или биологических продуктов, которая отражает одобрение агентством производства, применения или продажи для введения человеку.
В специфическом варианте предложен набор, включающий первый контейнер, содержащий описанные здесь антитела или полученные из антител антигенсвязывающие фрагменты. В конкретном варианте набор включает первый контейнер, который представляет собой пробирку с указанными антителами или полученными из антител антигенсвязывающими фрагментами в форме лиофилизованного стерильного порошка под вакуумом, и второй контейнер, содержащий фармацевтически приемлемую жидкость.
В конкретном варианте здесь предложено устройство для инъекции, содержащее описанные здесь антитела или полученные из антител антигенсвязывающие фрагменты. В конкретном варианте устройство для инъекции содержит антитела в стерильном растворе. В конкретном варианте предложенное здесь устройство для инъекции представляет собой шприц.
Также предложены наборы, которые можно использовать указанными выше способами. В одном варианте набор содержит в одном или нескольких контейнерах описанные здесь антитела или полученные из антител антигенсвязывающие фрагменты, предпочтительно очищенные антитела. В конкретном варианте описанный здесь набор содержит практически изолированный PSGL-1 в качестве контроля. В другом конкретном варианте описанные здесь наборы содержат также контрольные антитела, которые не реагируют с PSGL-1. В еще одном конкретном варианте описанные здесь наборы включают один или несколько элементов для детектирования связывания антител или полученных из антител антигенсвязывающих фрагментов с PSGL-1 (например, антитела или полученные из антител антигенсвязывающие фрагменты можно объединить с детектируемым субстратом, таким как флуоресцирующее соединение, фермент, радиоактивное соединение или люминесцентное соединение, или с вторыми антителами, которые распознают первые антитела или полученные из антител антигенсвязывающие фрагменты, можно объединить с детектируемым веществом). В конкретных вариантах набор может включать рекомбинантно полученный или химически синтезированный PSGL-1. Входящий в комплект PSGL-1 можно также нанести на твердый носитель. В более конкретных вариантах детектирующие вещества в описанной выше работе включают твердый носитель с нанесенным PSGL-1. Такой набор также включает не связанные меченые репортерные антитела против человеческого иммуноглобулина. В этом варианте связывание антител или полученных из антител антигенсвязывающих фрагментов с PSGL-1 можно детектировать путем связывания указанных меченых репортерных антител.
ПРИМЕРЫ
Примеры этого раздела представлены для иллюстрации, но не для ограничения вариантов.
Пример 1: получение анти-PSGL-1 моноклональных антител
Антитела h15A7 содержат вариабельные области тяжелой и легкой цепи гуманизированного 15А7, описанные в Международной Заявке пуб. № WO 2005/110475, опубликованной 24 ноября 2005 г., которая включена здесь ссылкой во всей полноте. Антитела h15A7 представляют собой антитела изотипа IgG4 с легкой цепью каппа-типа. Мутация Ser228→Pro228 была осуществлена полимеразной цепной реакцией (ПЦР) с использованием мутагенных праймеров в шарнирном участке h15A7. Полученный шарнирный мутант h15A7 обозначен здесь как 15А7Н. Остальная последовательность белков в 15А7Н идентична таковой в h15A7. Последовательность аминокислот в 15А7Н показана на фигуре 7 А-В и обозначена SEQ ID NO: 1 и 2. Последовательности генов, кодирующих антитела, в тяжелой и легкой цепях были введены в эукариотические векторы экспрессии, полученные из вектора pAD-CMV1 (описан в ЕР 393 438).
Мутант 15А7Н получали способами, известными специалистам. Коротко говоря, рекомбинантые векторы экспрессии, кодирующие помимо тяжелой и легкой цепей в 15А7Н также векторы отбора дигидрофолатредуктазы (DHFR) и неомицин фосфотрансферазы соответственно, были трансфектированы в суспензию с клетками-хозяевами CHO-DG44. Отбор стабильно трансфектированных клеток занимает двое суток после трансфекции в отобранную среду гипоксантина без тимидина и добавления антибиотика G418. После выделения клеток после первичной селекции индуцируют амплификацию генов на основе DHFR путем добавления метотрексата. Путем нанесения клеток разработали способ получения линии моноклональных клеток 15А7Н с использованием клеток-хозяев CHO-DG44. Для получения антител 15А7Н клетки размножали в инокуляте производственного биореактора. Производственный биореактор работал в периодическом режиме в течение 8-14 суток. Для поддержания продуцирования клеток и увеличения длительности периода наработки клеточной культуры на стадии размножения добавили питательную среду. Бульон клеточной культуры отделяли центрифугированием и полным фильтрованием до конца для эффективного удаления клеток и направляли не содержащую клеток культуральную жидкость (CCF) на дальнейшую очистку продукта. После удаления клеток белок очищали аффинной хроматографией на белке А и анионо- и катионообменной хроматографией. Кроме того, провели две жесткие стадии клиренса вируса, стадию инактивации вируса при низком pH и стадию нанофильтрации для удаления вируса.
Чистоту 15А7Н определяли методом капиллярного гель-электрофореза. Образцы денатурировали с помощью додецилсульфата натрия (SDS) и разделяли по размеру в капилляре, заполненном буферным гелем, который действует как просеивающая среда. В восстановленных образцах дисульфидные связи восстанавливают 2-меркаптоэтанолом, что дает отдельные пики для тяжелой и легкой цепей антитела. К невосстановленным образцам добавляли йодацетамид в качестве алкилирующего реагента во избежание любой фрагментации во время приготовления образца и для того, чтобы основной пик IgG оставался интактным.
Пробы с образцами вводили электрокинетически и детектировали мобилизованные белки по УФ-поглощению при 200 нм с использованием УФ-детектора. Для восстановленных образцов определяли скорректированную по времени площадь (ТСА %) суммы тяжелой и легкой цепи (% LC+HC). Указанные значения для невосстановленных образцов представляют собой ТСА % основного пика IgG.
Пониженное количество половинных молекул антитела определяли с помощью капиллярного гель-электрофореза в невосстановительных условиях (CGE) (фигура 1), и было показано, что мутация Ser228→Pro228 заметно понизила образование межцепочечных дисульфидных связей на шарнирном участке. Количество половинных молекул антитела уменьшилось с ~8-10% для h15A7 до менее 1% для 15А7Н.
Состав препаратов 15А7Н приведены в таблице 6.
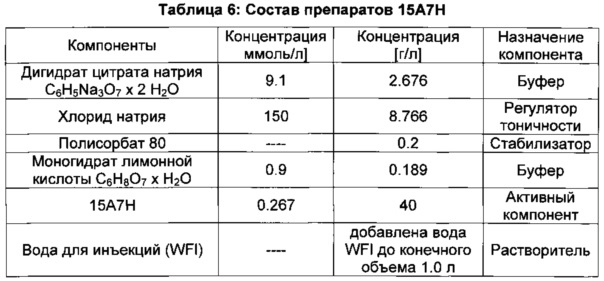
pH препарата 6.0.
Пример 2: Связывание антител 15А7Н с активированными первичными Т-клетками человека
Антитела 15А7Н были изучены на связывание с первичными активированными Т-клетками CD4+ человека.
МАТЕРИАЛЫ И МЕТОДЫ
Культура клеток и активация Т-клеток. Для получения «активированных клеток CD4+ Т» Т-Клетки CD4+ периферической крови культивировали при 37°С и 1×106 в RPMI питательной среде и стимулировали в течение 2 суток с добавкой 20 мкг/мл I PHA-L (Sigma, Catalog#L2769). Клетки инкубировали еще четыре-пять суток при 37°C с 20 нг/мл IL-2 (системы R&D, каталог #RD202-IL).
Анализ связывания клеток. Активированные клетки CD4+T человека сосчитали и высеяли на культуральный планшет с 96 коническими лунками при 1×105 клеток/100 мкл в буфере FACS (Falcon BD, Catalog # 353263) и инкубировали на льду в течение 30 мин.
Контроль в виде антител против лизоцима изотипа IgG4, h15A7 и 15А7Н разбавили до 90 мкг/мл в буфере FACS в круглодонной чашке для разведения (Falcon, Catalog # 353077). Приготовили одиннадцать 3-кратных разбавлений для каждого вида антител по чашке при начальной концентрации 30 мкг/мл.
Отцентрифугированные образцы дуплицированных клеток снова суспендировали в 100 мкл среды для каждого антитела до начальной концентрации 30 мкг/мл. Клетки инкубировали на льду в течение 60 мин. Клетки осадили центрифугированием, промыли буферным раствором и затем добавили 100 мкл разведенных вторичных козьих антител F(ab)2 против человеческого Ig конъюгированных с R-PE. Вторичные козьи антитела F(ab')2 против человеческого Ig конъюгированные с R-PE (запасной раствор 1.05 мг/мл BD Biosciences, Catalog # 554655) ранее разбавили в соотношении 1:800 в буфере FACS. Клетки инкубировали на льду 30 мин в темноте, затем осадили центрифугированием и дважды промыли буфером для промывки. Клетки заново суспендировали в 150 мкл буфера для промывки и зафиксировали добавлением 50 мкл буфера фиксации BD цитофикс/цитоперм (BD Biosciences, Catalog # 554655).
Образцы анализировали на приборе BD FACS Array Bioanalyzer. Для каждого образца клеток накапливали примерно 5000 замеров с использованием проточного цитомера BD FACS с воротами на «лимфоциты», установленными согласно SSC и FSC, и среднего значения флуоресценции, определенного для каждого образца.
Анализ данных: способность антилизоцимных антител IgG4, h15A7 и 15А7Н к связыванию с активированными клетками CD4+ Τ определяли из зависимости концентрации антител от среднего индекса флуоресценции (MFI) для дубликата каждого образца с использованием XLfit (модель: один сайт на одну дозу, 205). Значения ЕС50 определяли для каждой кривой связывания.
РЕЗУЛЬТАТЫ
Связывание с активированными Т-клетками человека: методами проточной цитометрии определяли связывание 15А7Н с активированными клетками CD4+ Т. Фигура 2 показывает, что 15А7Н связывается с ЕС50 при концентрации 0.22 нМ.
Данные по связыванию агрегатов для многих доноров демонстрируют связывание 15А7Н с активированными клетками CD4+ Τ при среднем значении ЕС50, равном 0.22+/-0.02. Значения ЕС50 для 4 доноров использовали для расчета среднего +/- SEM. Антитела h15A7 тестировали в тех же условиях и связывали с активированными клетками CD4+ Τ при среднем значении ЕС50, равном 0.27+/-0.05. Поэтому 15А7Н и h15A7 показали сравнимое связывание с активированными Т-клетками (см. таблицу 7).
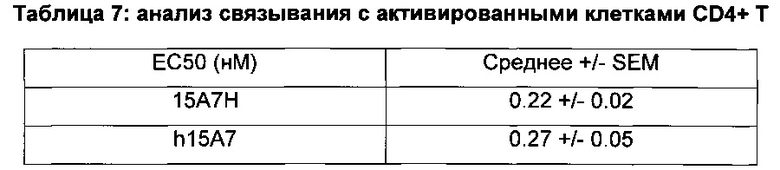
Пример 3: In-vivo активность 15А7Н trans-vivo человека на модели гиперчувствительности замедленного типа мышей
Тестировали 15А7Н в модели транс-vivo гиперчувствительности замедленного типа (DTH) у самок мышей C57BL/6. Вводили и.п. дозы по 0.03, 0.10, 0.3, 1 и 10 мг/кг 15А7Н в буферном растворе. Антитела h15A7 тестировали в тех же условиях.
МАТЕРИАЛЫ И МЕТОДЫ
Транс Vivo анализ: Самки мышей C57BL/6 от Harlan Sprague Dawley, Inc. (Indianapolis, Indiana) 6-8 недельного возраста использовали в течение четырех недель. Всех мышей помещали в непатогенную среду и обрабатывали согласно указаниям NIH. Все опыты с животными были одобрены Institutional Animal Care и Use Committee (Институтской Комиссией по Уходу и Использованию Животных (IACUC)), и их проводили в соответствии с руководством NIH "Guiding Principles for Research Involving Animals and Human Beings."
Кровь отбирали венепункцией у нормальных людей- доноров с хорошей реакцией на столбняк. Отбирали по 100 мл цельной крови, помещали в трубки СРТ Vacutainer tubes (Becton Dickinson, Franklin Lakes, NJ) и центрифугировали при 1800 RCF в течение 30 мин. Отделили светлый слой, содержащий одноядерные клетки и тромбоциты, трижды промыли и снова суспендировали в забуференном фосфатной физиологическом растворе (PBS) и подсчитывали клетки. Примеси тромбоцитов минимизировали многократной промывкой PBS буфером. Соотношение тромбоцитов и РВМС составляло не более 1:1. Клетки немедленно ввели в подушку стопы мышей.
Анатоксин столбняка, адсорбированный на фосфате алюминия (ТТ-Tetguard), использовали в концентрации 0.25 Lf в месте укола (единица Lf представляет собой величину флоккуляции - количество анатоксина, которое смешивается с одной международной единицей антитоксина и дает оптимальную флоккулирующую смесь).
Раствор 7-10 Х 106 РВМС, смешанного с 0.25 Lf единицами ТТ в объеме 50 мкл, ввели в подушки задних стоп мышей. Толщину подушки стопы измеряли до введения и через 24 часа после введения с помощью индикаторного толщиномера (Mitutoyo, Aurora, IL). Толщину до введения вычитали из толщины, измеренной через 24 часа после введения, и получали изменение толщины лапы. Все измерения выражены в дюймах.
Тестирование 15А7Н и h15A7: Запасной раствор 15А7Н и h15A7 (10 мг/мл) растворили в среде, содержащей 25 мМ цитрата натрия и 115 мМ хлорида натрия с 0.04% Tween 80, pH 5.97. Мышам вводили и.п. дозы по 0.2 мл среды или 15А7Н или h15A7 с концентрацией 0.03, 0.1, 0.3, 1 и 10 мг/кг за час до введения PBMCs с ТТ или без него в подушку стопы. Каждую дозу антител 15А7Н и h15A7 тестировали на РВМС от четырех разных доноров, и на один опыт с одним донором использовали одну мышь. Группы обработки с помощью 5А7Н и h15A7 сравнивали с группой, обработанной средой.
Статистика: Все приведенные значения являются средними ± SEM, если не указано иное. Изменения толщины подушки стопы в группе с применением лекарств сравнивали с данными для группы, обработанной средой. Величины дельта толщины лапы для 4 доноров собрали и рассчитали среднее ± SEM значение. Процент ингибирования толщины лапы рассчитали следующим образом: 100 Χ (Δ толщины лапысред - Δ толщины лапылек) / (Δ толщины лапысред - Δ толщины лапыРВМС). Величину эффектов ингибирования протестировали с помощью однофакторного дисперсионного анализа с ранжированием по Крускалу-Уоллису (ANOVA). Величину p менее 0.05 считали статистически значимой.
Концентрации 15А7Н и h15A7 в плазме мышей C57BL/6: В плазме самок мышей C57BL/6 определили концентрации 15А7Н и h15A7 при 0.03, 0.1, 0.3, 1 и 10 мг/кг через 24 часа после внутрибрюшинного введения. Образцы плазмы отобрали после окончания эксперимента у животных, участвующих в экспериментах по транс-vivo DTH. Для всех образцов проводили биоанализ.
Фармакинетическое исследование 15А7Н на сателлитных животных: сателлитные самки мышей C57BL/6, получающие внутрибрюшинные дозы 15А7Н (такие же дозы, как описано выше) использовали для сбора данных особенно интересных с точки зрения концентраций 15А7Н в плазме. Эти мыши не получали человеческих РВМС или анатоксина столбняка. Образцы отбирали у этих «PK» мышей через 1, 3, 5 и 24 часа после введения дозы. Первая группа PK мышей, получивших дозу, состояла из 6 особей. В пределах каждой группы у подгруппы из 3 мышей отбирали образцы через 1 и 5 часов и в другой подгруппе из 3 мышей через 3 и 24 часа.
Биоанализ 15А7 и 15А7Н: Сэндвичевый иммуноанализ проводили на приборе ELISA для количественной оценки концентрации h15A7 или 15А7Н в плазме мышей. Коротко говоря, для связывания либо h15A7 либо 15А7Н в разбавленном образце плазмы использовали 96-луночные микропланшеты, покрытые PSGL-1. После промывки связанные h15A7 или 15А7Н детектировали с помощью меченных биотином моноклональных антител против человеческого IgG4 и меченного ферментом (пероксидаза хрена, HRP) стрептавидина. Количество окрашенного продукта, образовавшегося при реакции с субстратом, определяли фотометрически, и оно увеличивалось с увеличением концентрации h15A7 или 15А7Нв образце. Концентрации h15A7 или 15А7Н, соответствующие определенному значению оптического поглощения, рассчитывали путем аппроксимации данных нелинейной стандартной кривой. Интервал калибровочных образцов включал от 0.04 до 1.2 нг/мл. Образцы разбавляли по меньшей мере 1:100. Таким образом, нижний предел количественной оценки h15A7 или 15А7Н в цельной плазме составлял 4 нг/мл. При использовании более высоких факторов разбавления верхний предел количественной оценки может подняться до 2.4 мг/мл (1:2000000).
Из-за небольшой разницы в референтных результатах по реакционной способности h15A7 и 15А7Н по данным ELISA использовали две калибровочные кривые и два комплекта качественного контроля. Образцы от животных, получавших h15A7, анализировали с помощью калибровочной кривой для h15A7, а образцы от животных, получавших 15А7Н, анализировали по калибровочной кривой для 15А7Н.
РЕЗУЛЬТАТЫ
TPAHC-VIVO DTH: На фигуре 3 показан полный отклик на дозу антител 15А7Н в транс-vivo DTH у 4 доноров PBMCs, как следует из процента ингибирования DTH после лечения с помощью 15А7Н. При введении мышам и.п. дозы в момент времени - 1 час при 0.03, 0.1, 0.3, 1 и 10 мг/кг как h15A7, так и 15А7Н ингибировали транс-vivo DTH в зависимости от дозы. В таблице 8 показан ответ на дозу и процент ингибирования 15А7Н и h15A7 в транс-vivo DTH. Одна доза 15А7Н или h15A7 при 0.3 мг/кг и выше показала значительное ингибирование транс-vivo DTH. Величина ED50 для h15A7 и 15А7Н в этом анализе составила 0.09 и 0.1 мг/кг соответственно, n=4 донорам.
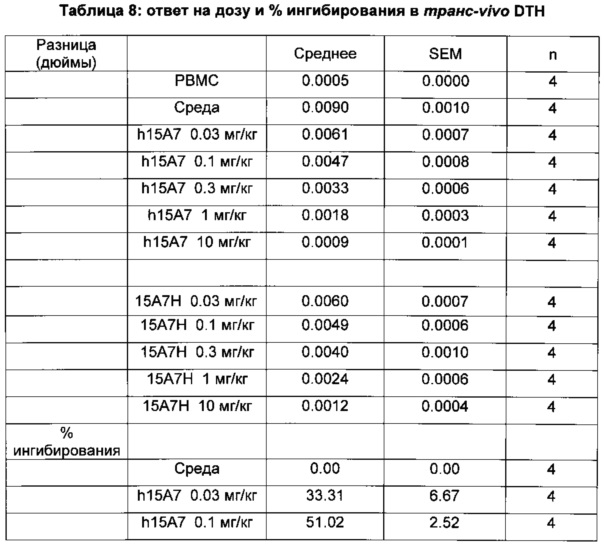

КОНЦЕНТРАЦИИ СОЕДИНЕНИЙ В ПЛАЗМЕ: Концентрации 15А7Н в плазме как у сателлитных мышей (для фармакокинетического (PK) анализа), так и мышей для DTH-анализа суммированы на фигуре 5. На фигуре 4 показана зависимость итоговых концентраций 15А7Н в плазме за 24 часа от % ингибирования по данным DTH-анализа. Отметим, что средние концентрации за 24 часа после введения дозы для PK- и DTH-мышей для данной концентрации дозы были весьма близки. Это предполагает, что хотя PK- и DTH-мышей обрабатывали по-разному (только мыши DTH получали РВМС и анатоксин столбняка), фармакокинетика 15А7Н в обоих случаях была весьма схожей. Концентрации как h15A7, так и 15А7Н в плазме колебались только в чрезвычайно узком интервале за все время исследования (измерения концентраций за время 1-24 часа после введения дозы).
PK-PD: В таблицах 9 и 10 показаны концентрации в плазме за двадцать четыре часа (PK) для антител h15A7 и 15А7Н и соответствующие проценты ингибирования trans-vivo DTH (PD) при одних и тех же дозах. На фигуре 3 сопоставлены соотношения PK-PD для 15А7Н в модели транс-vivo DTH. Рассчитанные величины ED50 для h15A7 и 15А7Н составили 687 и 770 нг/мл соответственно, n=4 доноров.


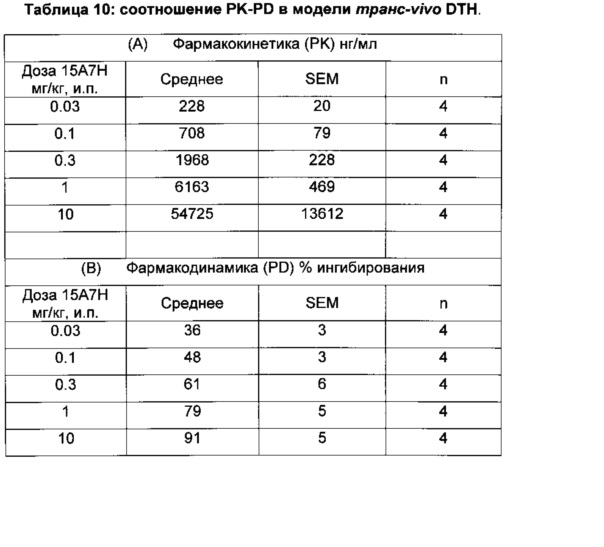
ВЫВОДЫ
Однократная доза 15А7Н или h15A7 с 0.3 мг/кг и выше показала значительный процент ингибирования транс vivo DTH. Величины ED50 для h15A7 и 15А7Н в анализе транс-vivo DTH составили 0.09 и 0.1 мг/кг соответственно. Во время исследования концентрации в плазме как h15A7 так и 15А7Н колебались только в узком интервале.
Пример 4: Оценка комплемент-зависимой цитотоксичности CDC
С целью выяснения, обладает ли 15А7Н CDC-активностью, для измерения CDC-активности при различных концентрациях использовали анализы с высвобождением лактатдегидрогеназы.
МАТЕРИАЛЫ И МЕТОДЫ
Клетки Ramos (получены от АТСС; cat # CRL-1596) использовали в качестве целевых клеток и культивировали в полной среде DMEM (Invitrogen, Carlsbad, СА; Catalog number 11995) с 0.5 мг/мл генетицина (Invitrogen, Carlsbad, СА; Catalog number 10131). В качестве источника белков комплемента использовали кроличью плазму (Accurate Chemical & Scientific Corp., Westbury, NY; catalog number: AIC4000-1). В качестве среды для анализа использовали среду Cedarlane Cytotoxicity (Accurate Chemical & Scientific Corp., Westbury, NY; Catalog Number: CL95100).
CDC-активность определяли по высвобождению LDH из целевых клеток с использованием Cytotoxicity Detection KitPLUS (LDH) (Roche Applied Science, Indianapolis, IN; Catalog Number: 04 744 934 001). Анти-человеческий мышиный CD20, очищенный от гибридомы 1F5 (АТСС), Birmingham, AL; Catalog Number: 6140-01) использовали в анализе для активации комплемента в качестве антитела позитивного контроля. Человеческий IgG4 к (Sigma-AIdrich, St. Louis, МО; Catalog Number: I4639) использовали в качестве изотипического контроля. Образцы и контроли готовили следующим образом (все образцы были в двойной повторности):
- Образцы: 100 мкл стандартного комплемента кролика (разбавлен 1:6 в среде анализа) + 50 мкл целевых клеток (клетки Ramos в средах анализов) + 50 мкл разбавления антител
- Контроль фона: 200 мкл среды анализа
- Контроль максимального высвобождения: 50 мкл целевых клеток + 100 мкл стандартного комплемента кролика + 50 мкл среды анализа
- Контроль спонтанного высвобождения: 50 мкл целевых клеток + 100 мкл стандартного комплемента кролика + 50 мкл среды анализа
Планшет инкубировали при 37°С во влажном CO2 - инкубаторе в течение 3 час. За 30 мин до конца инкубации (после 2.5 час инкубации) добавили 10 мкл раствора лизиса (из комплекта для детектирования цитотоксичности) до объема образца для контроля максимального высвобождения. В конце инкубации планшет центрифугировали при 200 г в течение 10 мин при комнатной температуре и перенесли 100 мкл не содержащего клеток верхнего слоя в соответствующие лунки 96-луночного плоскодонного планшета для детектирования лактатдегидрогеназы (LDH). 100 мкл реакционной смеси (из комплекта для детектирования цитотоксичности) добавили в каждую лунку и планшет инкубировали при комнатной температуре в течение 15-30 мин в темноте. В конце второй инкубации реакцию остановили путем добавления 50 мкл стоп-раствора (из комплекта для детектирования цитотоксичности). Поглощение измеряли на планшетном ридере SpectraMAX Plus (Molecular Devices, Sunnyvale, CA) при длине волны 490-492 нм. CDC% рассчитали по формуле ([высвобождение, индуцированное антителами] - [контроль спонтанного высвобождения])/ ([Максимальное высвобождение] - [контроль спонтанного высвобождения]) × 100%.
РЕЗУЛЬТАТЫ
CDC-активность 15А7Н тестировали в условиях, оптимизированных для CDC-отклика анти-CD20 с клетками Ramos. Как показано на фигуре 6 и в таблице 11, протестировали различные концентрации антител на CDC-активность при фиксированном разведении комплемента 1:12. CDC-активность не наблюдалась для 15А7Н, h15A7 или для отрицательного контроля IgG4. Анти-человеческий CD20 мышей продемонстрировал четкий отклик на дозу антител.
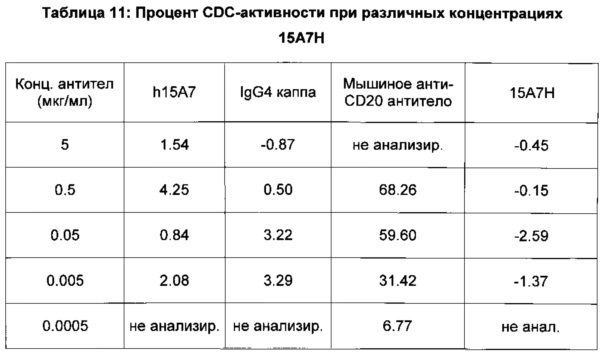
ВЫВОДЫ
В анализах, проведенных на клетках Ramos, 15А7Н не обладает CDC-активностью вплоть до концентрации антител 5 мкг/мл при разбавлении комплемента 1:12.
Пример 5: Клиническое исследование
15А7Н вводили субъектам внутривенным введением однократных возрастающих доз 125 мкг/кг, 500 мкг/кг, 1000 мкг/кг и 2000 мкг/кг, а другим субъектам подкожным введением однократных доз 500 мкг/кг и 1000 мкг/кг. Дозирование было адаптировано. Использовали 15А7Н, несуспендированные в составе, описанном в таблице 6. После введения проводили клинические лабораторные тесты (например, гематологический, биохимический и анализ мочи), например, еженедельно, способами, известными в данной области. Определяли также фармакокинетические параметры, например, еженедельно, известными специалистам способами.
Все публикации, патенты и патентные заявки, процитированные в данной заявке, включены ссылками во всей полноте, и было показано, что каждая отдельная публикация и патентная заявка была включена ссылкой. Хотя приведенное изобретение было подробно описано с помощью иллюстраций и примеров в целях ясности понимания, специалисты в данной области легко увидят, что в свете выводов из данного изобретения возможно провести некоторые изменения и модифицирования, не отклоняясь от идеи или объема приложенной формулы.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА ПРОТИВ KIT И ИХ ПРИМЕНЕНИЯ | 2013 |
|
RU2681730C2 |
| ЧЕТЫРЕХВАЛЕНТНЫЕ АНТИТЕЛА К PSGL-1 И ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2766000C2 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА, КОТОРЫЕ СВЯЗЫВАЮТСЯ С hGM-CSF, И СОДЕРЖАЩИЕ ИХ КОМПОЗИЦИИ МЕДИЦИНСКОГО НАЗНАЧЕНИЯ | 2008 |
|
RU2517596C2 |
| АНТИТЕЛА | 2005 |
|
RU2482131C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ПСОРИАЗА | 2008 |
|
RU2475265C2 |
| Анти-LAG-3 антитела | 2016 |
|
RU2760582C2 |
| АНТИТЕЛА ПРОТИВ PD-1 И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2788616C2 |
| АНТИТЕЛА ПРОТИВ ЧЕЛОВЕЧЕСКОГО VISTA И ИХ ПРИМЕНЕНИЕ | 2017 |
|
RU2746994C2 |
| ПЕПТИД ИЛИ ПЕПТИДНЫЙ КОМПЛЕКС, СВЯЗЫВАЮЩИЙСЯ С альфа2-ИНТЕГРИНОМ, СПОСОБЫ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ УКАЗАННОГО ВЕЩЕСТВА | 2011 |
|
RU2588668C2 |
| АНТИТЕЛА ПРОТИВ БЕЛКА РЕЦЕПТОРА С-МЕТ | 2011 |
|
RU2608644C2 |









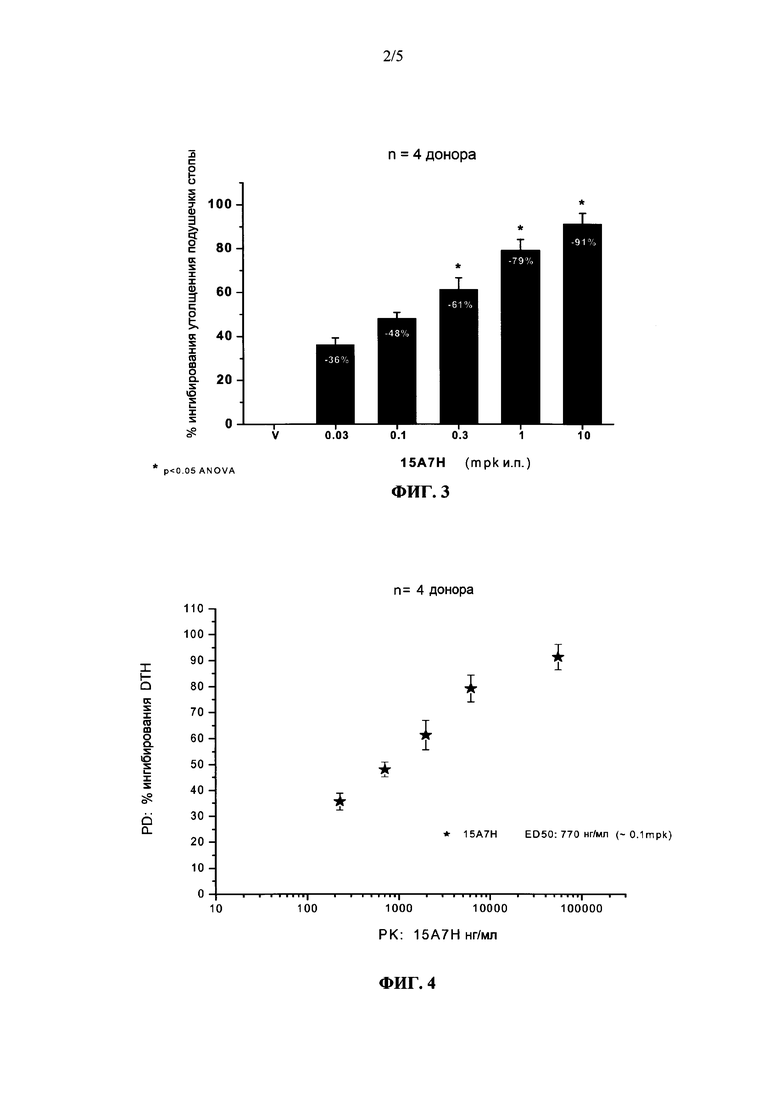
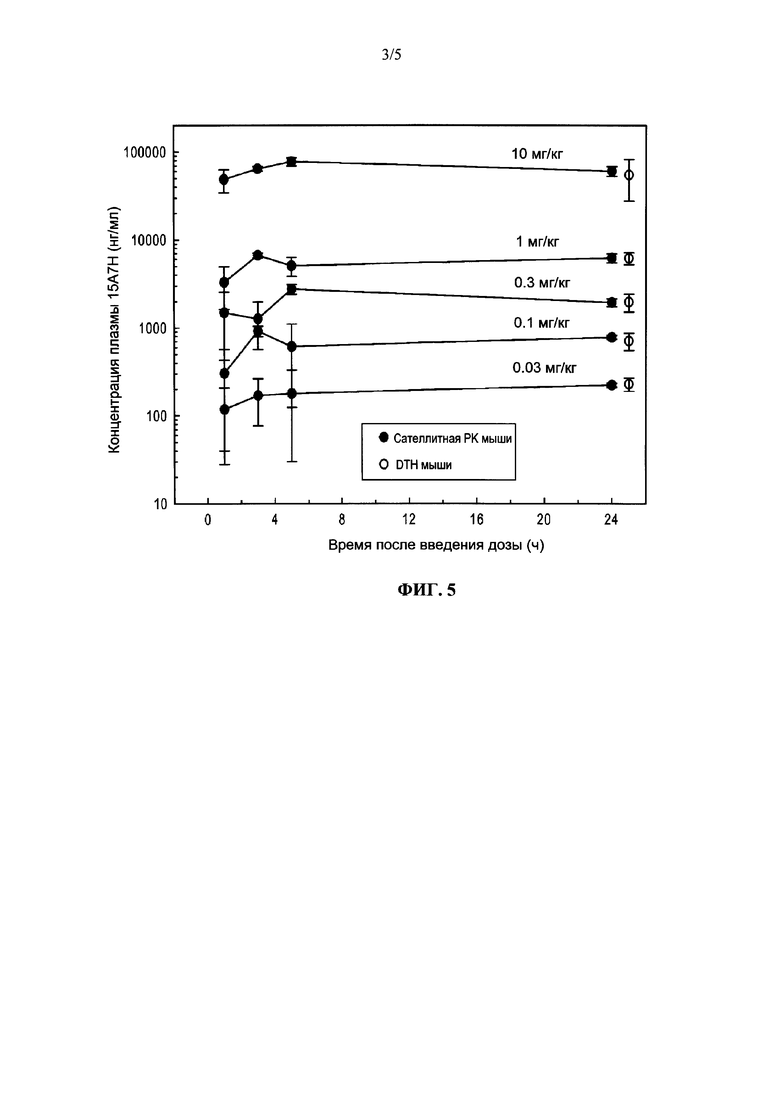


Изобретение относится к области биохимии, в частности к моноклональному антителу, которое иммуноспецифически связывается с человеческим PSGL-1, фармацевтической композиции для лечения нарушения или заболевания, ассоциированного или вызванного повышенной пролиферацией и/или повышенным числом активированных Т-клеток, его содержащей, а также к способу лечения воспалительного нарушения с их использованием. Также раскрыты наборы для лечения нарушения или заболевания, ассоциированного или вызванного повышенной пролиферацией и/или повышенным числом активированных Т-клеток, содержащие вышеуказанное антитело. Изобретение позволяет эффективно лечить воспалительные нарушения. 9 н. и 9 з.п. ф-лы, 7 ил., 11 табл., 4 пр.
1. Моноклональное антитело, которое иммуноспецифически связывается с человеческим PSGL-1, содержащее:
(i) вариабельный участок легкой цепи («VL»), содержащий аминокислотную последовательность SEQ ID NO: 3;
(ii) вариабельный участок тяжелой цепи («VH»), содержащий аминокислотную последовательность SEQ ID NO: 4; и
(iii) константную область человеческого IgG4, в которой серин замещен на пролин в положении аминокислоты 228 тяжелой цепи, пронумерованной согласно индексу EU.
2. Моноклональное антитело по п. 1, которое является очищенным.
3. Моноклональное антитело, которое иммуноспецифически связывается с человеческим PSGL-1, содержащее:
(i) легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 1; и
(ii) тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 2.
4. Моноклональное антитело по п. 3, которое является очищенным.
5. Моноклональное антитело, которое иммуноспецифически связывается с человеческим PSGL-1, содержащее:
(i) тяжелую цепь, состоящую из SEQ ID NO: 2; и
(ii) легкую цепь, состоящую из SEQ ID NO: 1.
6. Моноклональное антитело по п. 5, которое является очищенным.
7. Моноклональное антитело, которое иммуноспецифически связывается с человеческим PSGL-1 и содержит тяжелую цепь, содержащую:
(i) область VH цепи, содержащую SEQ ID NO: 8, 9 и 10;
(ii) константную область тяжелой цепи человеческого IgG4, в которой серин замещен на пролин в положении аминокислоты 228 тяжелой цепи, пронумерованной согласно индексу EU; и
легкую цель, содержащую:
область VL цепи, которая содержит SEQ ID NO: 5, 6 и 7.
8. Моноклональное антитело по п. 7, которое является очищенным.
9. Фармацевтическая композиция для лечения нарушения или заболевания, ассоциированного или вызванного повышенной пролиферацией и/или повышенным числом активированных Т-клеток, содержащая эффективное количество моноклонального антитела по любому из пп. 1-8 и фармацевтически приемлемый носитель.
10. Фармацевтическая композиция по п. 9, в которой моноклональное антитело является очищенным.
11. Набор для лечения нарушения или заболевания, ассоциированного или вызванного повышенной пролиферацией и/или повышенным числом активированных Т-клеток, содержащий
первый контейнер;
моноклональное антитело по любому из пп. 1-8 или фармацевтическую композицию по п. 9 или 10, которые содержатся в первом контейнере.
12. Набор для лечения нарушения или заболевания, ассоциированного или вызванного повышенной пролиферацией и/или повышенным числом активированных Т-клеток, содержащий
устройство для инъекции, представляющее собой шприц;
моноклональное антитело по любому из пп. 1-8.
13. Способ лечения воспалительного нарушения, включающий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества моноклональных антител по любому из пп. 1-8 или фармацевтической композиции по п. 9 или 10.
14. Способ по п. 13, в котором воспалительное нарушение представляет собой аутоиммунное заболевание.
15. Способ по п. 13, в котором воспалительное нарушение представляет собой: псориаз, бляшечный псориаз, хронический бляшечный псориаз, каплевидный псориаз, обратный псориаз, пустулезный псориаз, эритродермический псориаз, псориатический артрит, ревматоидный артрит, болезнь Крона, анкилозирующий спондилит, отторжение трансплантата, реакцию «трансплантат против хозяина», язвенный колит, множественный склероз, аллергию, атопический дерматит, астму или диабет 1 типа.
16. Способ лечения воспалительного нарушения, включающий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества фармацевтической композиции по п. 9 или 10.
17. Способ по п. 16, в котором воспалительное нарушение представляет собой аутоиммунное заболевание.
18. Способ по п. 16, в котором воспалительное нарушение представляет собой: псориаз, бляшечный псориаз, хронический бляшечный псориаз, каплевидный псориаз, обратный псориаз, пустулезный псориаз, эритродермический псориаз, псориатический артрит, ревматоидный артрит, болезнь Крона, анкилозирующий спондилит, отторжение трансплантата, реакцию «трансплантат против хозяина», язвенный колит, множественный склероз, аллергию, атопический дерматит, астму или диабет 1 типа.
| WO 2005110475 A2, 24.11.2005 | |||
| US 2009093002 A1, 09.04.2009 | |||
| Способ управления мобильным терминалом и мобильный терминал | 2015 |
|
RU2681341C2 |
| РОЙТ А., БРОСТОФФ ДЖ., МЕЙЛ Д | |||
| Иммунология | |||
| Пер | |||
| с англ | |||
| - М.: Мир, 2000, стр.151. | |||
Авторы
Даты
2018-04-17—Публикация
2012-06-12—Подача