ОБЛАСТЬ ТЕХНИКИ
Изобретение относится к кремнийорганическим полимерам в форме частиц, содержащим сложные эфиры бензойной кислоты, для применения в препаратах для местного нанесения, оказывающих защитное действие от солнечного света или другого излучения.
УРОВЕНЬ ТЕХНИКИ
Для людей, которые в значительной степени подвергаются воздействию причиняющего вред солнечного света, постоянно существует большая потребность в агентах, обеспечивающих защиту от солнечного излучения. Вред может быть немедленным и длительным с проявлениями от солнечного ожога, высыпания и повреждения клеток и тканей до преждевременного появления морщин и рака кожи. По этой причине ранее было разработано большое количество солнцезащитных веществ, защищающих от вредного воздействия УФ-А и/или УФ-В и даже излучения с меньшей длиной волны. Эти вещества обычно, или отдельно, или в комбинации друг с другом, включают в косметические или фармацевтические препараты, которые хорошо известны и широко используются.
Большинство УФ-фильтров, используемых в солнцезащитных композициях, представляют собой мономерные соединения, и существует риск того, что такие соединения могут проникать через кожный барьер, что является крайне нежелательным явлением. Таким образом, основные недостатки использования обычных солнцезащитных средств представляют собой побочные реакции, включающие кожные проблемы, такие как реакции на аллерген, фотоконтактные реакции и высушивание или стягивание кожи. Субъективное раздражение, связанное с ожогом или жжением без реально существующей эритемы, является наиболее распространенной жалобой, связанной с чувствительностью, при использовании солнцезащитных средств. Такое раздражение наиболее часто наблюдается в области глаз. Однако более распространенным побочным эффектом является хронический объективный контактный дерматит от раздражения. Индивиды с уже имеющимися экзематозными состояниями имеют большую предрасположенность к сенсибилизации, связанной с ослабленным кожным барьером. Дополнительно, некоторые антибиотики, противозачаточные средства, диуретики, антигистаминные средства и антидепрессанты являются одними из широко используемых лекарственных средств, которые могут увеличивать чувствительность к солнечным лучам. Кроме того, некоторые из этих кожных проблем вызваны продуктами распада, образующимися при воздействии солнечного света на солнцезащитные средства.
Осуществлялись попытки устранить риск проникновения через кожу путем заключения в капсулу УФ-фильтра по меньшей мере одного типа, который присутствует в солнцезащитном составе. Например, УФ-фильтры на основе полисилоксанов, которые могут быть или линейными, или циклическими, описаны в WO 93/04665, WO 94/06404, ЕР 538431, ЕР 392883 и ЕР 358584. В присутствии этих полисилоксанов риск проникновения через кожу меньше, но иногда сложно включить полисилоксаны в солнцезащитные композиции вследствие проблем несовместимости. Патентная заявка WO 2005/053631 относится к микрокапсулам с активностью УФ-фильтра, причем по меньшей мере один тип способного к сшиванию хромофора с активностью фильтра УФ-А, и/или УФ-В, и/или УФ-С и необязательно по меньшей мере один тип способного к сшиванию мономера, у которого нет активности фильтра УФ-А, и/или УФ-В, и/или УФ-С, подвергают реакции сшивания в отсутствие неспособных к сшиванию хромофоров с активностью фильтра УФ-А, и/или УФ-В, и/или УФ-С. Указанное изобретение также относится к солнцезащитным композициям, содержащим указанные микрокапсулы.
Ранее в данной области техники также описаны некоторые УФ-поглотители в форме частиц. Например, патентная заявка WO2005/120440 относится к частицам, содержащим неорганический каркас и органические соединения, ковалентно связанные с каркасом посредством спейсерных групп, которые характеризуются тем, что органические соединения находятся внутри частиц и необязательно также на поверхности частиц. Указанное изобретение также относится к составам и композициям, содержащим указанные частицы.
Патентная заявка WO 2009/101016 и Walenzyk, Т. et al., International Journal of Cosmetic Science (2005), 27(3), 177-189, относятся к частицам, которые могут быть получены по реакции неорганических наночастиц с органическими молекулами, содержащими функциональные группы, и их применению в качестве УФ-поглотителей для косметических или дерматологических целей.
В WO 2006/100225 были получены и описаны некоторые сложные эфиры бензойной кислоты, а также их применение в качестве фотохимических прекурсоров поглотителей ультрафиолетового излучения, способы, косметические или фармацевтические композиции, композиции для личной гигиены и промышленные композиции, связанные с ними. Некоторые функционализированные силаном прекурсоры агентов, защищающих от ультрафиолетовых лучей, также описаны в US 4328346. Эти соединения подвергаются фотохимическому превращению в присутствии солнечного света, который усиливает их способность защищать от УФ-излучения.
В документе WO 2011/045389 описаны некоторые силилированные полимерные сложные эфиры бензойной кислоты в форме частиц, характеризующиеся повышенной фотостабильностью и повышенной устойчивостью на коже, поскольку они обладают важным физическим свойством - значительной герметичностью, что предотвращает высвобождение сложных эфиров бензойной кислоты и продуктов их фотопревращения, обеспечивая большую безопасность как для потребителя солнцезащитных средств, так и для окружающей среды. Однако скорость превращения при обычных дозах излучения в условиях реального солнечного света была недостаточно высокой, чтобы обеспечить наилучшую защиту для потребителей. Дополнительно, синтез некоторых из этих соединений требовал использования токсичных исходных веществ, а также дорогих и длительных стадий очисток, а выход не достаточно высокий для их производства в промышленном масштабе. Кроме того, присутствие стандартных УФ-фильтров в солнцезащитных составах приводило к низким степеням превращений этих соединений, что дополнительно уменьшало их защитную эффективность.
Таким образом, желательно разработать новые солнцезащитные соединения с более высокой способность защищать от УФ-излучения, более высокими скоростями превращений, способностью превращаться в присутствии дополнительных УФ-фильтров, которые можно получить с помощью экономически эффективных и более простых синтетических подходов.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Авторы настоящего изобретения разработали новые моносилилированные полимерные сложные эфиры бензойной кислоты в форме частиц, пригодные в качестве перспективных фотозащитных агентов от УФ-излучения, которые имеют особенное преимущество, заключающееся в более быстром и более эффективном превращении даже в присутствии стандартных УФ-фильтров в готовом солнцезащитном препарате. Это позволяет им эффективно действовать, несмотря на эффекты внутреннего фильтра, создаваемые обычными фильтрами, а следовательно, компенсировать потерю эффективности защиты, которая обычно наблюдается для стандартных УФ-фильтров.
В отличие от других моносилилированных полимерных сложных эфиров бензойной кислоты, известных на данный момент, соединения по данному изобретению характеризуются наличием силилированной цепи, присоединенной к ацильному кольцу бензойной группы, а не к фенильному кольцу сложноэфирной группы, и наличием иминной или карбаматной группы в качестве линкера между сложным эфиром бензойной кислоты и указанной силилированной цепью.
В дополнение к этому, указанные соединения можно синтезировать из альдегидов с помощью короткого синтетического пути с нетоксичными исходными соединениями, которые также доступные и дешевые. Этот синтез дает соединения с высокой степенью чистоты, а также более высокие выходы при более низкой себестоимости.
Полимеры по данному изобретению также демонстрируют перспективную УФ-защиту, зависящую от времени воздействия солнца и интенсивности солнечного излучения. Таким образом, композиции, содержащие такие соединения, представляют более безопасный способ принятия солнечных ванн, чем традиционные солнцезащитные продукты, поскольку защитное действие увеличивается с увеличением времени воздействия солнца и интенсивности излучения.
Полимеры по данному изобретению способны поглощать ультрафиолетовое излучение непосредственно и, возможно, фотохимически превращаются in situ в другое защитное соединение с более высокой УФ-защитой.
В первом аспекте настоящее изобретение относится к способу получения перспективного кремнийорганического фотозащитного полимера, включающему реакцию мономера формулы (I):
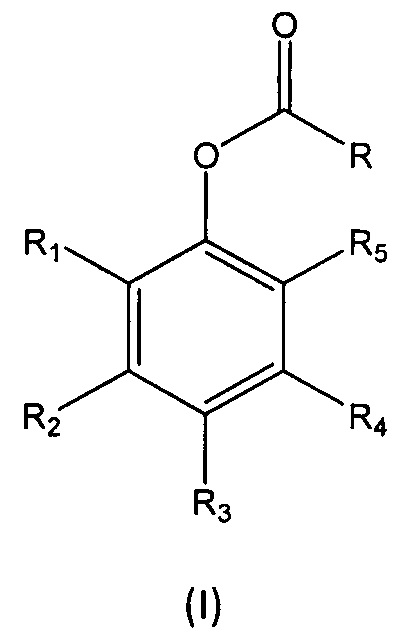
где
R выбран из группы, состоящей из (i), (ii) и (iii):
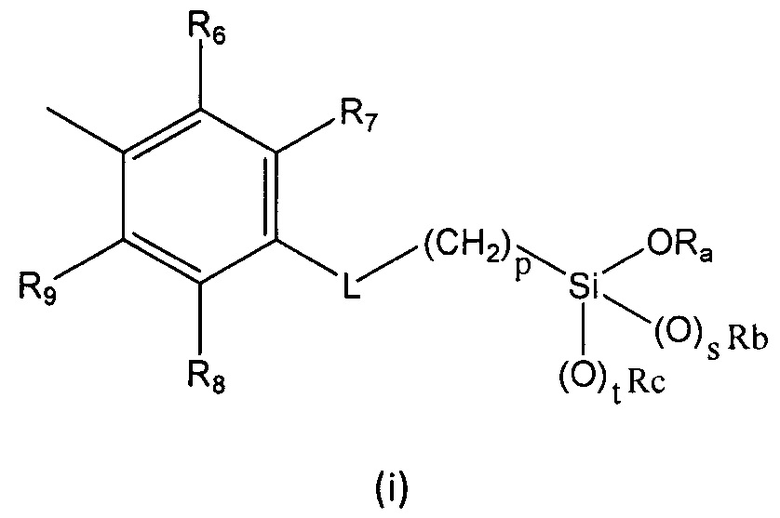
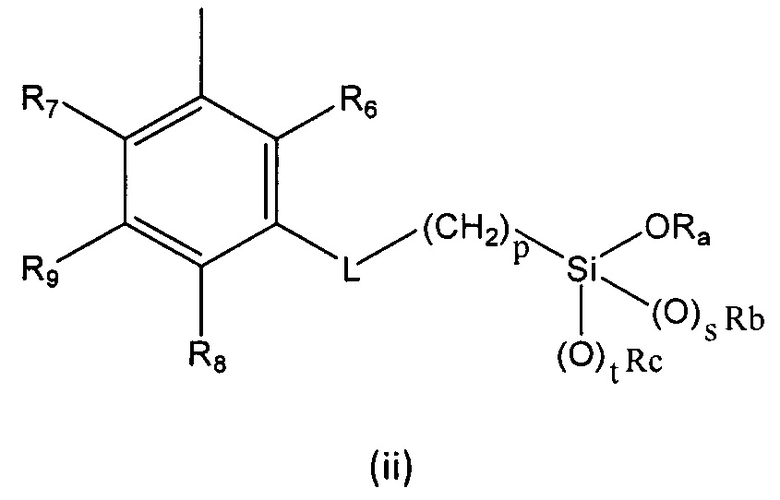
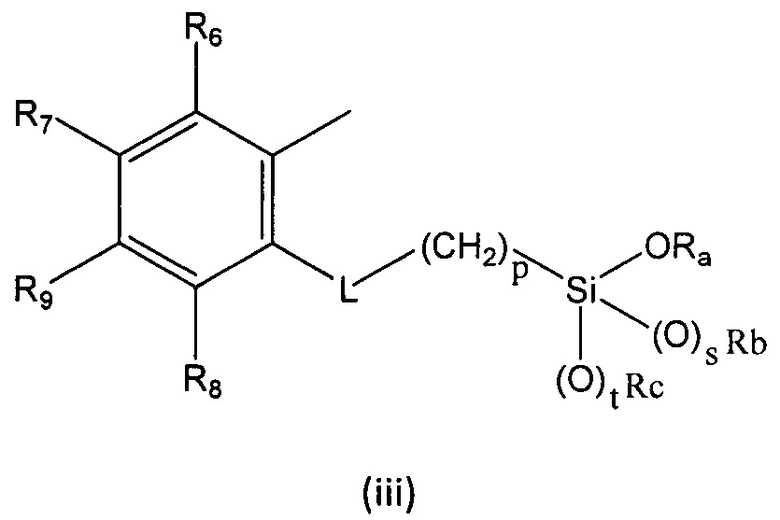
где
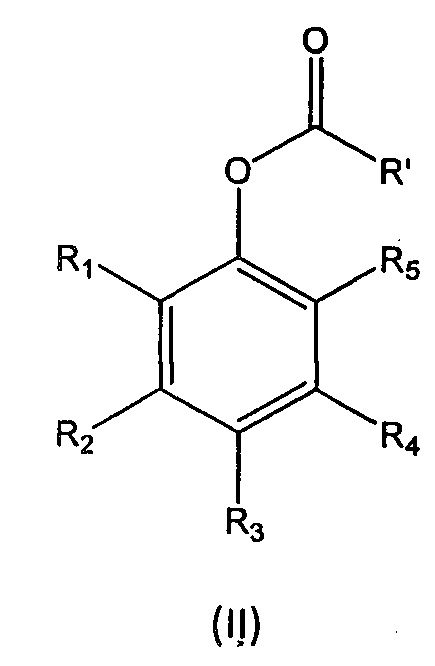
R1, R2, R3, R4 и R5 независимо выбраны из группы, состоящей из Н, линейного или разветвленного (С1-С6)алкила, (С3-С6)циклоалкила, OR10, NH2, NHR11, NR12R13, COOH, COOR14, CONH2, CONHR15, CONR16R17, SO2NH2, SO2NHR18 и SO2NR19R20, при условии, что по меньшей мере один из R1, R2, R3, R4 и R5 не является Н, а по меньшей мере один из R1 и R5 представляет собой Н;
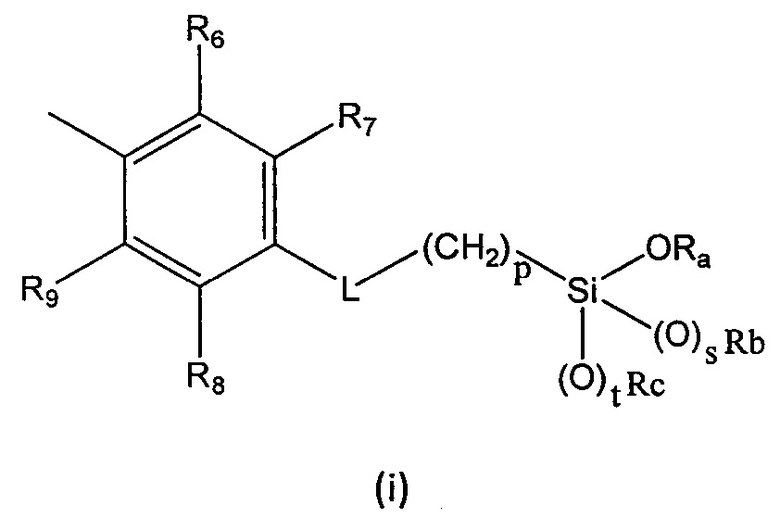
R6, R7, R8 и R9 независимо выбраны из водорода, линейного или разветвленного (С1-С6)алкила, (С3-С6)циклоалкила, OR'1, NH2, NHR2' и NR3'R4';
R10 представляет собой линейный или разветвленный (С1-С6)алкил или (С3-С6)циклоалкил;
R11 представляет собой линейный или разветвленный (С1-С6)алкил или (С3-С6)циклоалкил;
R12 представляет собой линейный или разветвленный (С1-С6)алкил или (С3-С6)циклоалкил;
R13 представляет собой линейный или разветвленный (С1-С6)алкил или (С3-С6)циклоалкил; или R12 и R13 вместе с атомом азота, к которому они присоединены, образуют пирролидиновое, пиперидиновое или морфолиновое кольцо;
R14 представляет собой линейный или разветвленный (С1-С6)алкил или (С3-С6)циклоалкил;
R15 представляет собой линейный или разветвленный (С1-С6)алкил или (С3-С6)циклоалкил;
R16 представляет собой линейный или разветвленный (С1-С6)алкил или (С3-С6)циклоалкил;
R17 представляет собой линейный или разветвленный (С1-С6)алкил или (С3-С6)циклоалкил; или R16 и R17 вместе с атомом азота, к которому они присоединены, образуют пирролидиновое, пиперидиновое или морфолиновое кольцо;
R18 представляет собой линейный или разветвленный (С1-С6)алкил или (С3-С6)циклоалкил;
R19 представляет собой линейный или разветвленный (С1-С6)алкил или (С3-С6)циклоалкил;
R20 представляет собой линейный или разветвленный (С1-С6)алкил или (С3-С6)циклоалкил; или R19 и R20 вместе с атомом азота, к которому они присоединены, образуют пирролидиновое, пиперидиновое или морфолиновое кольцо;
L представляет собой линкер, выбранный из:
-CH=N-
-(CH2)-O-C(O)-NH-
Ra представляет собой линейный или разветвленный (С1-С6)алкил, линейный или разветвленный (С2-С6)алкенил, (С3-С6)циклоалкил или фенил;
Rb представляет собой линейный или разветвленный (С1-С6)алкил, линейный или разветвленный (С2-С6)алкенил, (С3-С6)циклоалкил или фенил;
Rc представляет собой линейный или разветвленный (С1-С6)алкил, линейный или разветвленный (С2-С6)алкенил, (С3-С6)циклоалкил или фенил;
R'1 представляет собой линейный или разветвленный (С1-С6)алкил или (С3-С6)циклоалкил;
R'2 представляет собой линейный или разветвленный (С1-С6)алкил или (С3-С6)циклоалкил;
R'3 представляет собой линейный или разветвленный (С1-С6)алкил или (С3-С6)циклоалкил;
R'4 представляет собой линейный или разветвленный (С1-С6)алкил или (С3-С6)циклоалкил; или R'3 и R'4 вместе с атомом азота, к которому они присоединены, образуют пирролидиновое, пиперидиновое или морфолиновое кольцо;
p равен целому числу, выбранному из 2, 3 и 4;
s равен целому числу, выбранному из 0 и 1;
t равен целому числу, выбранному из 0 и 1;
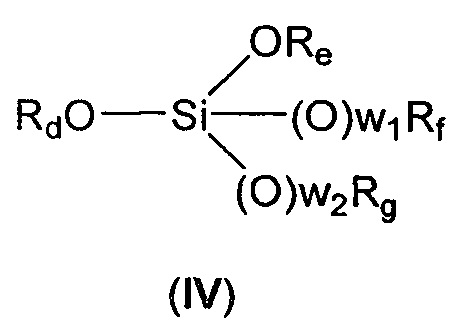
с соединением формулы (IV):
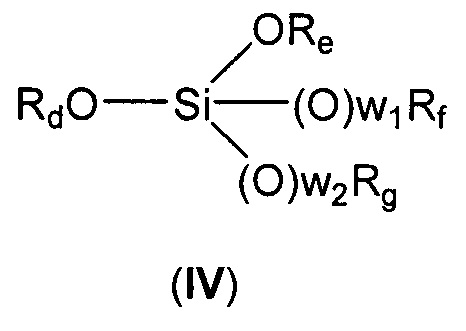
где
Rd представляет собой линейный или разветвленный (С1-С6)алкил;
Re, Rf и Rg независимо представляют собой линейный или разветвленный (С1-С6)алкил, линейный или разветвленный (С2-С6)алкенил, (С3-С6)циклоалкил или фенил,
w1 и w2 независимо равны 0 или 1,
в смеси алканол/вода.
Во втором аспекте настоящее изобретение относится к перспективному кремнийорганическому фотозащитному полимеру, получаемому как описано выше, который характеризуется тем, что он находится в форме микро- или наночастиц.
В третьем аспекте настоящее изобретение относится к применению перспективного кремнийорганического фотозащитного полимера, описанного выше, для получения косметической или дерматологической композиции для защиты организма человека или животного от УФ-излучения.
В четвертом аспекте настоящее изобретение относится к применению фотозащитного полимера, описанного выше, в качестве фотохимического прекурсора УФ-поглотителей.
В пятом аспекте настоящее изобретение относится к применению фотозащитного полимера, описанного выше, для получения косметической или дерматологической композиции для нанесения на поверхность тела человека или животного, которая характеризуется эффективной УФ-защитой, зависящей от времени воздействия солнца и интенсивности солнечного излучения.
В шестом аспекте настоящее изобретение относится к фотозащитному полимеру, описанному выше, для применения для защиты организма человека или животного от УФ-излучения.
В седьмом аспекте настоящее изобретение относится к косметической или дерматологической композиции, содержащей перспективный кремнийорганический фотозащитный полимер, описанный выше.
В восьмом аспекте настоящее изобретение относится к мономеру формулы (I):
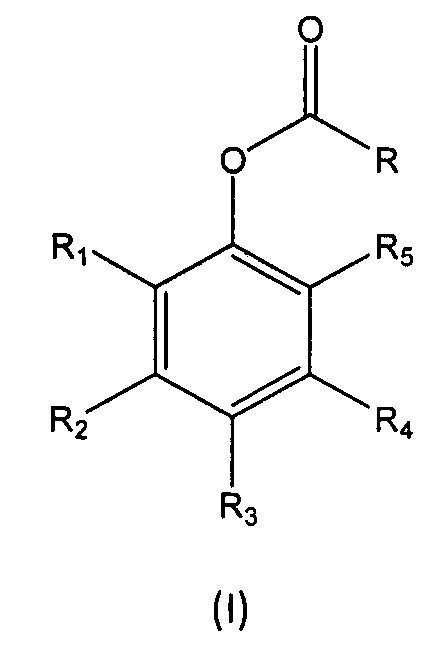
где
R выбран из группы, состоящей из (i), (ii) и (iii):
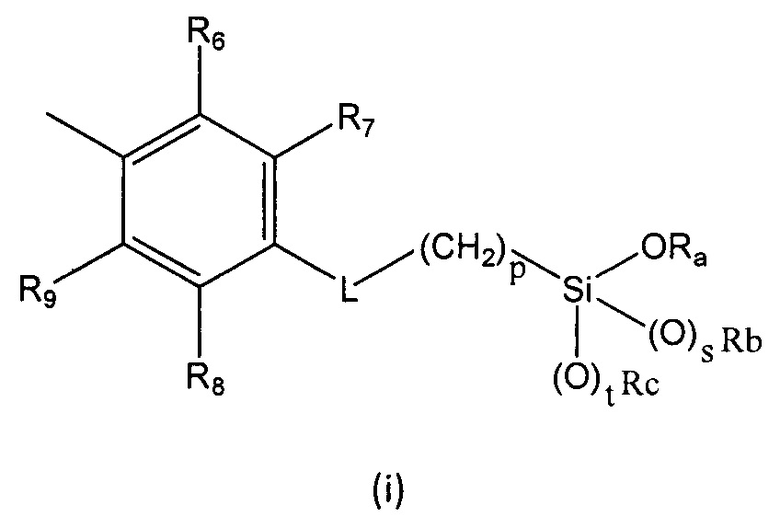
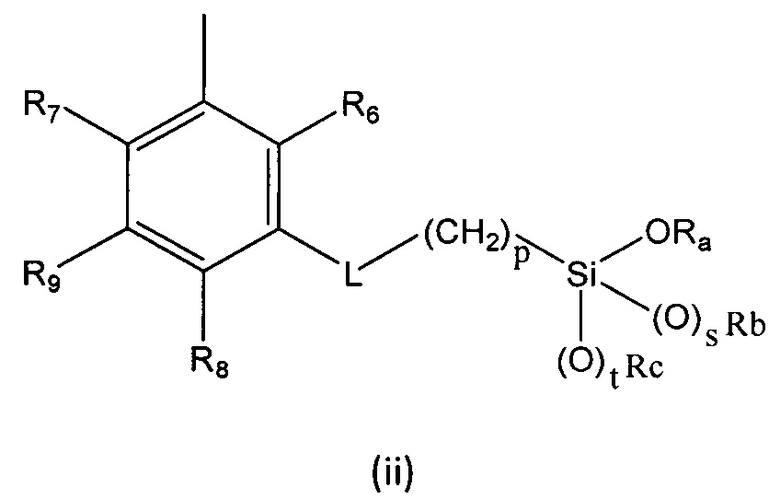
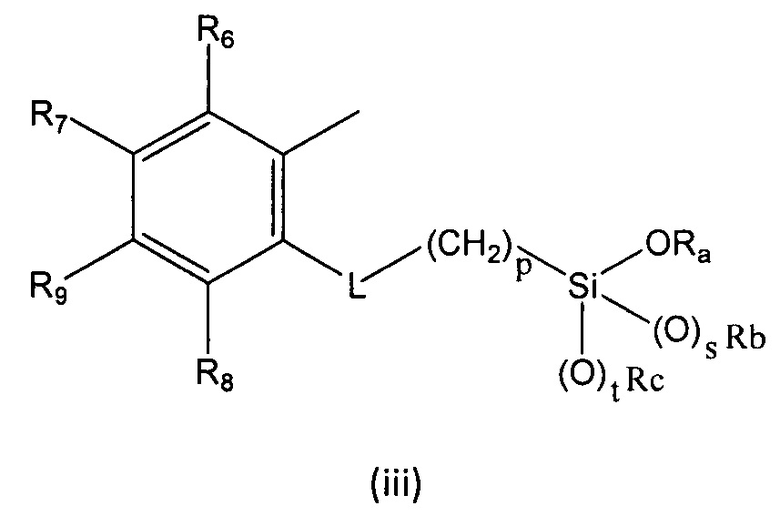
где
R1, R2, R3, R4 и R5 независимо выбраны из группы, состоящей из Н, линейного или разветвленного (С1-С6)алкила, (С3-С6)циклоалкила, OR10, NH2, NHR11, NR12R13, COOH, COOR14, CONH2, CONHR15, CONR16R17, SO2NH2, SO2NHR18 и SO2NR19R20, при условии, что по меньшей мере один из R1, R2, R3, R4 и R5 не является Н, а по меньшей мере один из R1 и R5 представляет собой Н;
R6, R7, R8 и R9 независимо выбраны из водорода, линейного или разветвленного (С1-С6)алкила, (С3-С6)циклоалкила, OR'1, NH2, NHR2' и NR3'R4';
R10 представляет собой линейный или разветвленный (С1-С6)алкил или (С3-С6)циклоалкил;
R11 представляет собой линейный или разветвленный (С1-С6)алкил или (С3-С6)циклоалкил;
R12 представляет собой линейный или разветвленный (С1-С6)алкил или (С3-С6)циклоалкил;
R13 представляет собой линейный или разветвленный (С1-С6)алкил или (С3-С6)циклоалкил; или R12 и R13 вместе с атомом азота, к которому они присоединены, образуют пирролидиновое, пиперидиновое или морфолиновое кольцо;
R14 представляет собой линейный или разветвленный (С1-С6)алкил или (С3-С6)циклоалкил;
R15 представляет собой линейный или разветвленный (С1-С6)алкил или (С3-С6)циклоалкил;
R16 представляет собой линейный или разветвленный (С1-С6)алкил или (С3-С6)циклоалкил;
R17 представляет собой линейный или разветвленный (С1-С6)алкил или (С3-С6)циклоалкил; или R16 и R17 вместе с атомом азота, к которому они присоединены, образуют пирролидиновое, пиперидиновое или морфолиновое кольцо;
R18 представляет собой линейный или разветвленный (С1-С6)алкил или (С3-С6)циклоалкил;
R19 представляет собой линейный или разветвленный (С1-С6)алкил или (С3-С6)циклоалкил;
R20 представляет собой линейный или разветвленный (С1-С6)алкил или (С3-С6)циклоалкил; или R19 и R20 вместе с атомом азота, к которому они присоединены, образуют пирролидиновое, пиперидиновое или морфолиновое кольцо;
L представляет собой линкер, выбранный из:
-CH=N-
-(CH2)-O-C(O)-NH-
Ra представляет собой линейный или разветвленный (С1-С6)алкил, линейный или разветвленный (С2-С6)алкенил, (С3-С6)циклоалкил или фенил;
Rb представляет собой линейный или разветвленный (С1-С6)алкил, линейный или разветвленный (С2-С6)алкенил, (С3-С6)циклоалкил или фенил;
Rc представляет собой линейный или разветвленный (С1-С6)алкил, линейный или разветвленный (С2-С6)алкенил, (С3-С6)циклоалкил или фенил;
R'1 представляет собой линейный или разветвленный (С1-С6)алкил или (С3-С6)циклоалкил;
R'2 представляет собой линейный или разветвленный (С1-С6)алкил или (С3-С6)циклоалкил;
R'3 представляет собой линейный или разветвленный (С1-С6)алкил или (С3-С6)циклоалкил;
R'4 представляет собой линейный или разветвленный (С1-С6)алкил или (С3-С6)циклоалкил; или R'3 и R'4 вместе с атомом азота, к которому они присоединены, образуют пирролидиновое, пиперидиновое или морфолиновое кольцо;
p равен целому числу, выбранному из 2, 3 и 4;
s равен целому числу, выбранному из 0 и 1;
t равен целому числу, выбранному из 0 и 1;
или его энантиомерным формам, или его косметически или дерматологически приемлемым солям.
В девятом аспекте настоящее изобретение относится к способу получения мономера формулы (I), описанного выше, в случае если L представляет собой группу -CH=N-, включающему реакцию соединения формулы (II):
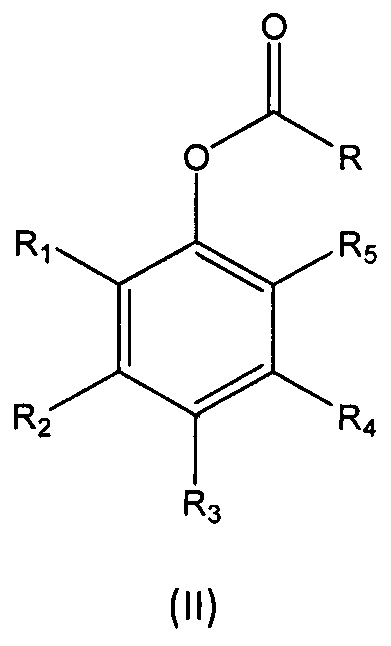
где
R1, R2, R3, R4 и R5 независимо выбраны из группы, состоящей из Н, линейного или разветвленного (С1-С6)алкила, (С3-С6)циклоалкила, OR10, NH2, NHR11, NR12R13, COOH, COOR14, CONH2, CONHR15, CONR16R17, SO2NH2, SO2NHR18 и SO2NR19R20, при условии, что по меньшей мере один из R1, R2, R3, R4 и R5 не является Н, а по меньшей мере один из R1 и R5 представляет собой Н;
R10 представляет собой линейный или разветвленный (С1-С6)алкил или (С3-С6)циклоалкил;
R11 представляет собой линейный или разветвленный (С1-С6)алкил или (С3-С6)циклоалкил;
R12 представляет собой линейный или разветвленный (С1-С6)алкил или (С3-С6)циклоалкил;
R13 представляет собой линейный или разветвленный (С1-С6)алкил или (С3-С6)циклоалкил; или R12 и R13 вместе с атомом азота, к которому они присоединены, образуют пирролидиновое, пиперидиновое или морфолиновое кольцо;
R14 представляет собой линейный или разветвленный (С1-С6)алкил или (С3-С6)циклоалкил;
R15 представляет собой линейный или разветвленный (С1-С6)алкил или (С3-С6)циклоалкил;
R16 представляет собой линейный или разветвленный (С1-С6)алкил или (С3-С6)циклоалкил;
R17 представляет собой линейный или разветвленный (С1-С6)алкил или (С3-С6)циклоалкил; или R16 и R17 вместе с атомом азота, к которому они присоединены, образуют пирролидиновое, пиперидиновое или морфолиновое кольцо;
R18 представляет собой линейный или разветвленный (C1-С6)алкил или (С3-С6)циклоалкил;
R19 представляет собой линейный или разветвленный (С1-С6)алкил или (С3-С6)циклоалкил;
R20 представляет собой линейный или разветвленный (С1-С6)алкил или (С3-С6)циклоалкил; или R19 и R20 вместе с атомом азота, к которому они присоединены, образуют пирролидиновое, пиперидиновое или морфолиновое кольцо;
и
R' выбран из (i'), (ii') и (iii'):
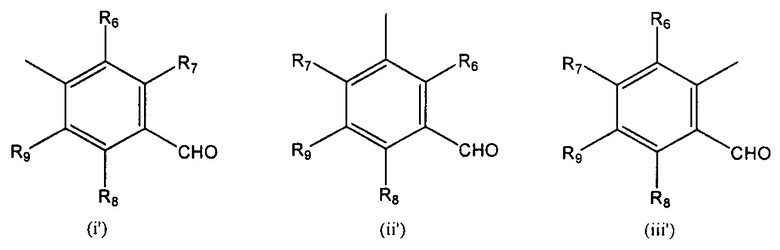
где
R6, R7, R8 и R9 независимо выбраны из водорода, линейного или разветвленного (С1-С6)алкила, (С3-С6)циклоалкила, OR'1, NH2, NHR2' и NR3'R4'; с соединением формулы (III):
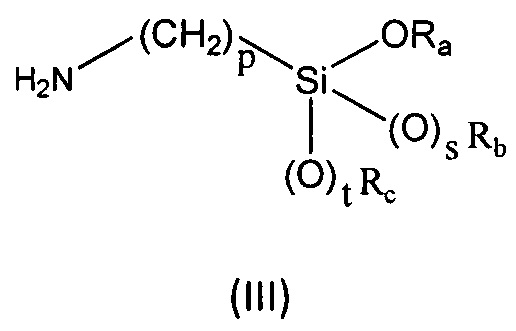
где
Ra представляет собой линейный или разветвленный (С1-С6)алкил, линейный или разветвленный (С2-С6)алкенил, (С3-С6)циклоалкил или фенил;
Rb представляет собой линейный или разветвленный (С1-С6)алкил, линейный или разветвленный (С2-С6)алкенил, (С3-С6)циклоалкил или фенил;
Rc представляет собой линейный или разветвленный (С1-С6)алкил, линейный или разветвленный (С2-С6)алкенил, (С3-С6)циклоалкил или фенил;
p равен целому числу, выбранному из 2, 3 и 4;
s равен целому числу, выбранному из 0 и 1;
t равен целому числу, выбранному из 0 и 1.
В десятом аспекте настоящее изобретение относится к способу получения мономера формулы (I), описанного выше, в случае если L представляет собой группу -CH2-O-C(O)-NH-, включающему:
а) реакцию восстановления соединения формулы (II), описанного выше, в присутствии восстанавливающего агента, для получения соединение формулы (V):
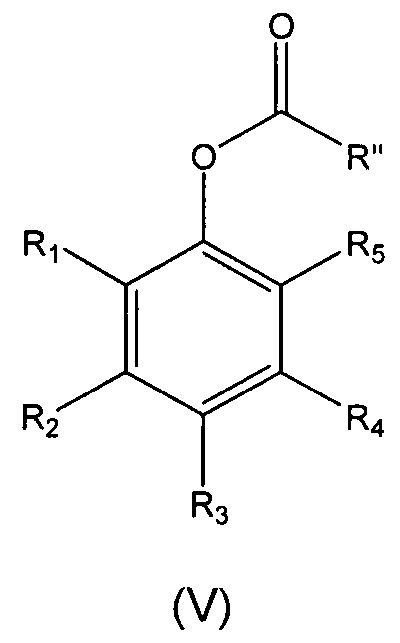
где
R1-R5 являются такими, как определено выше; и
R'' выбран из (I''), (ii") и (iii'):
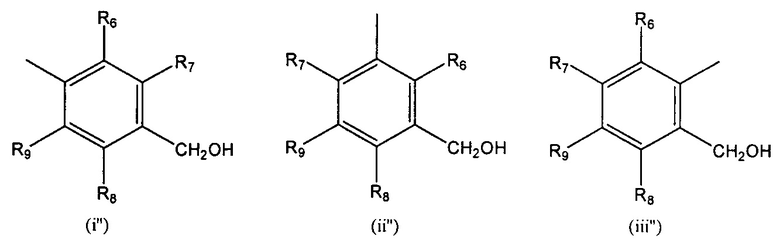
и
b) реакцию соединения формулы (V), описанного выше, с соединением формулы (VI):
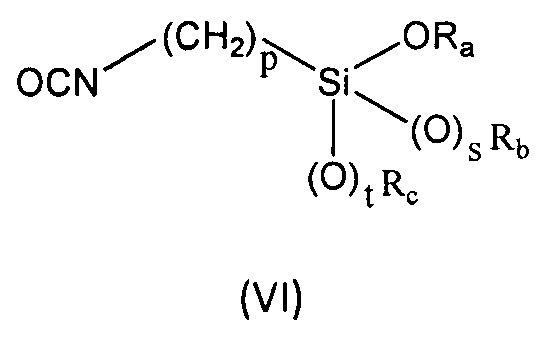
где
Ra представляет собой линейный или разветвленный (С1-С6)алкил, линейный или разветвленный (С2-С6)алкенил, (С3-С6)циклоалкил или фенил;
Rb представляет собой линейный или разветвленный (С1-С6)алкил, линейный или разветвленный (С2-С6)алкенил, (С3-С6)циклоалкил или фенил;
Rc представляет собой линейный или разветвленный (С1-С6)алкил, линейный или разветвленный (С2-С6)алкенил, (С3-С6)циклоалкил или фенил;
p равен целому числу, выбранному из 2, 3 и 4;
s равен целому числу, выбранному из 0 и 1;
t равен целому числу, выбранному из 0 и 1.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1 иллюстрирует спектр в УФ и видимой областях частиц 3-(диэтиламино)фенил-4-((3-(триэтоксисилил)пропилимино)метил)бензоата.
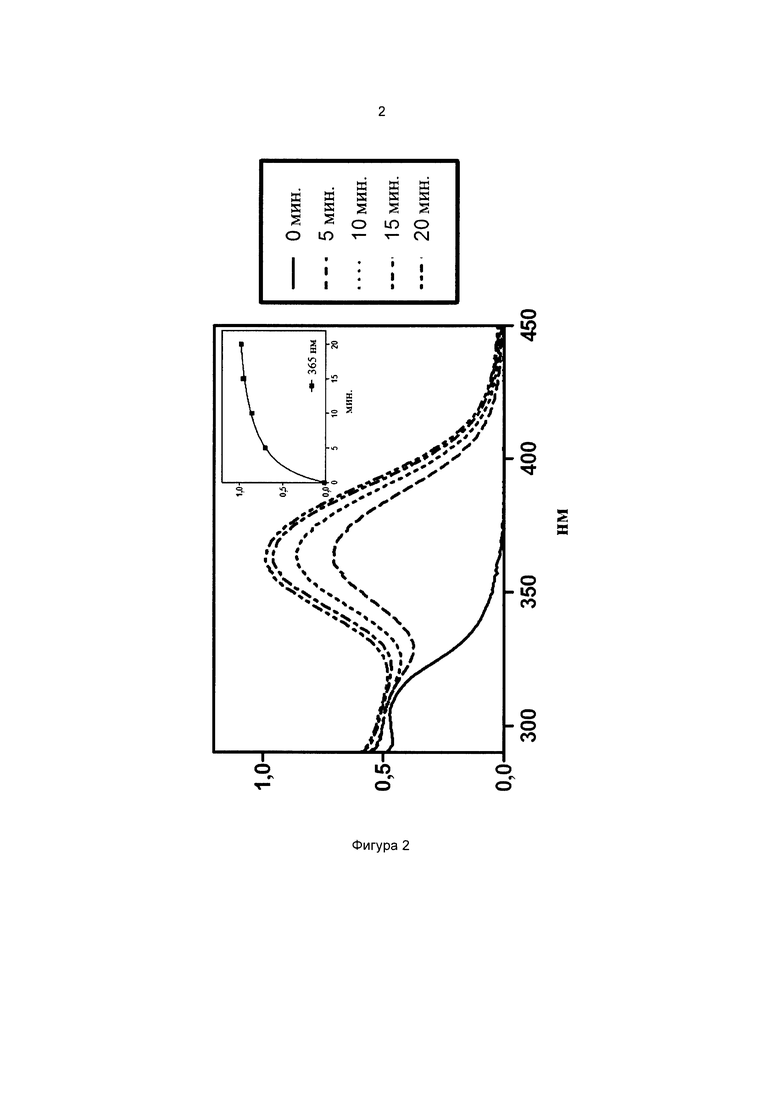
Фиг. 2 иллюстрирует спектр в УФ и видимой областях частиц 3-(диэтиламино)фенил-4-((3-(триэтоксисилил)пропилкарбамоилокси)метил)бензоата.
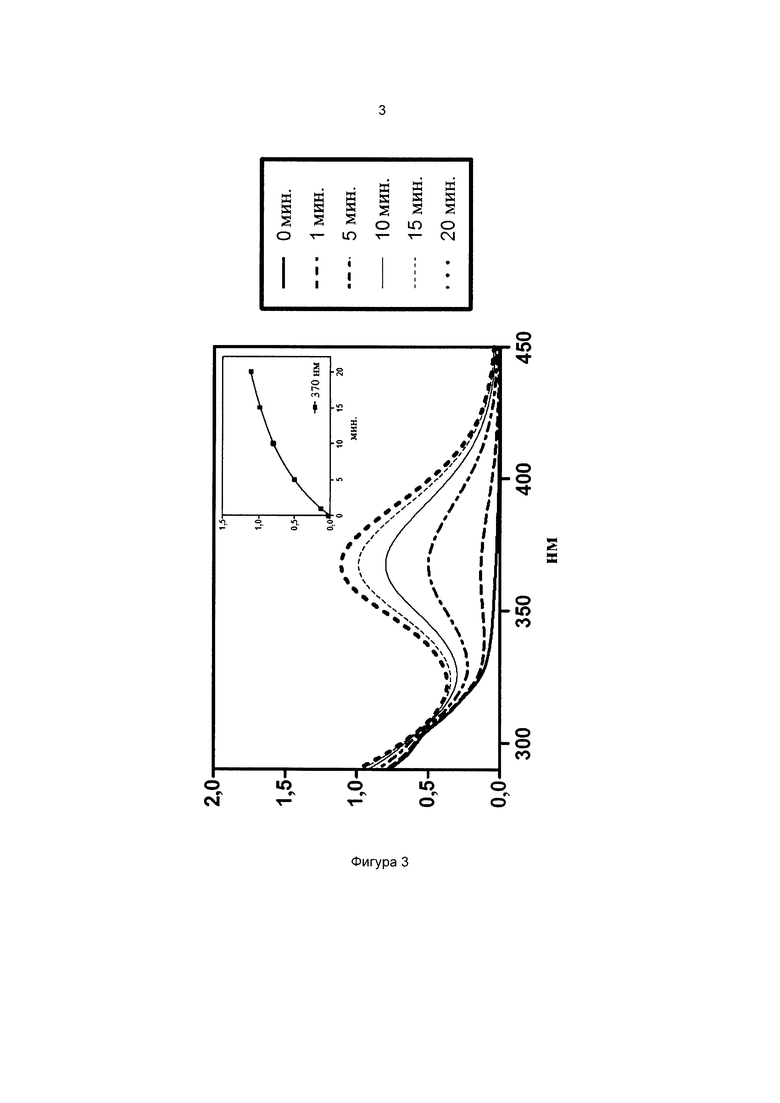
Фиг. 3 иллюстрирует спектр в УФ и видимой областях частиц 3-(диметиламино)фенил-4-((3-(триэтоксисилил)пропилкарбамоилокси)метил)бензоата.
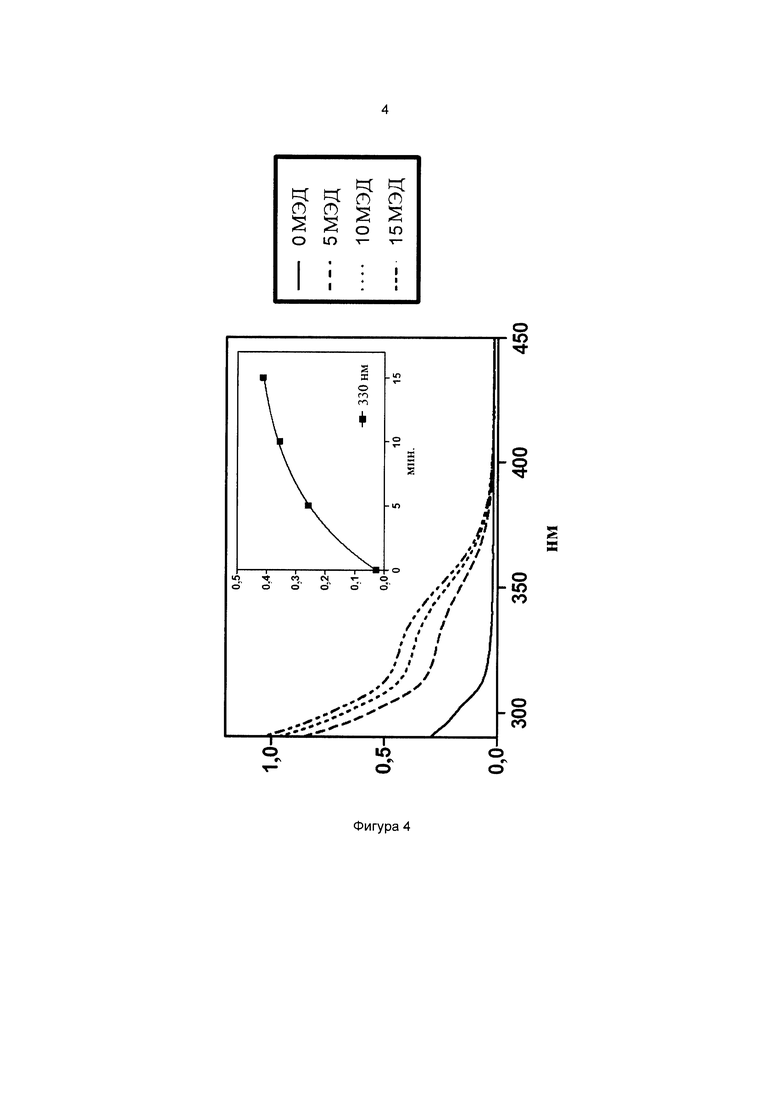
Фиг. 4 иллюстрирует спектр в УФ и видимой областях частиц 3-метоксифенил-4-((3-(триэтоксисилил)пропилкарбамоилокси)метил)бензоата.
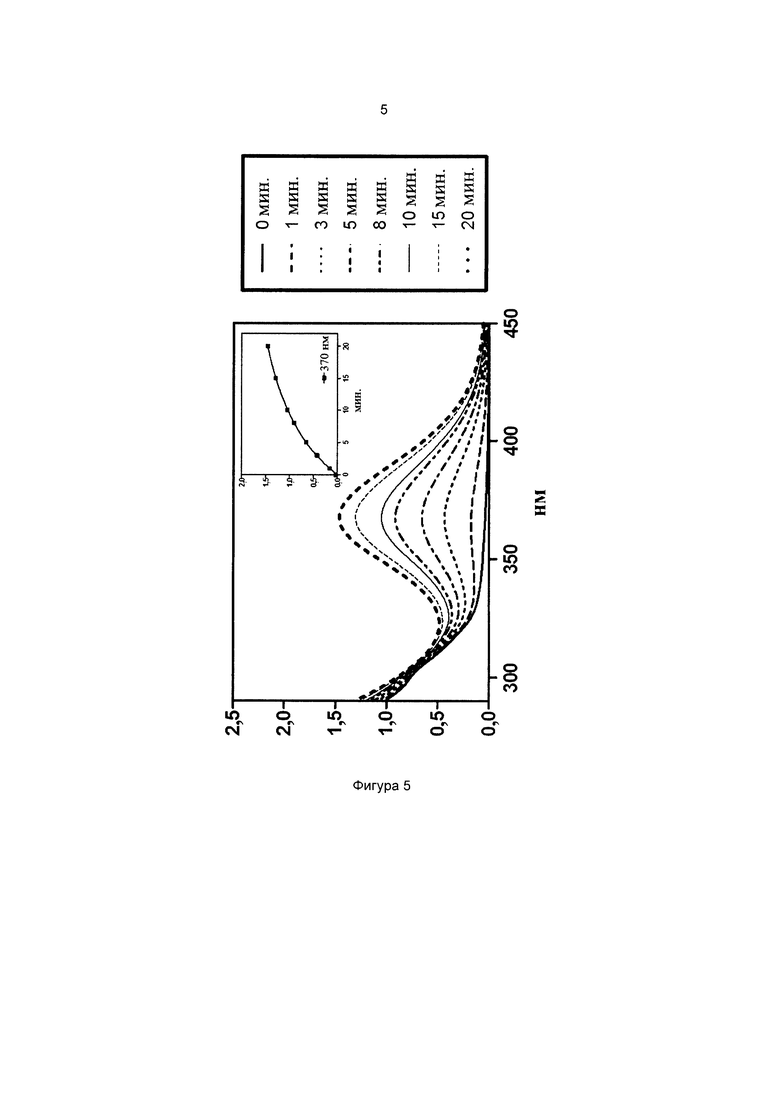
Фиг. 5 иллюстрирует спектр в УФ и видимой областях частиц 3-(диметиламино)фенил-4-((3-(триэтоксисилил)пропилимино)метил)бензоата.
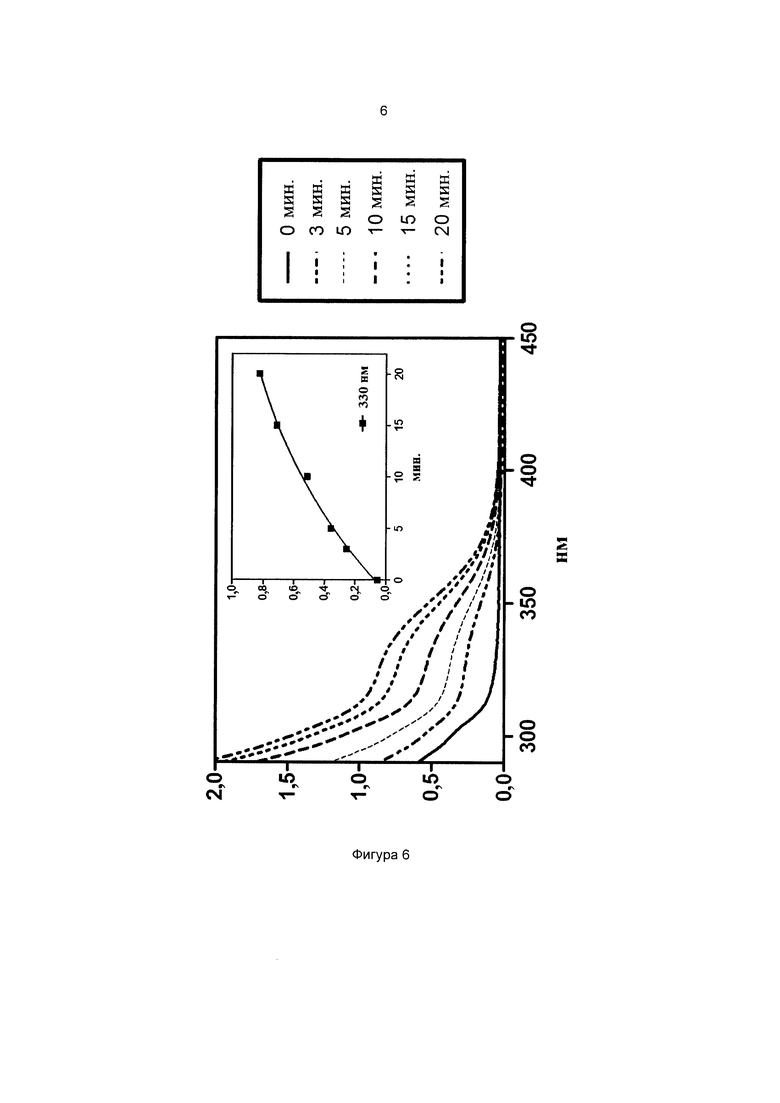
Фиг. 6 иллюстрирует спектр в УФ и видимой областях частиц 3-метоксифенил-4-((3-(триэтоксисилил)пропилимино)метил)бензоата.
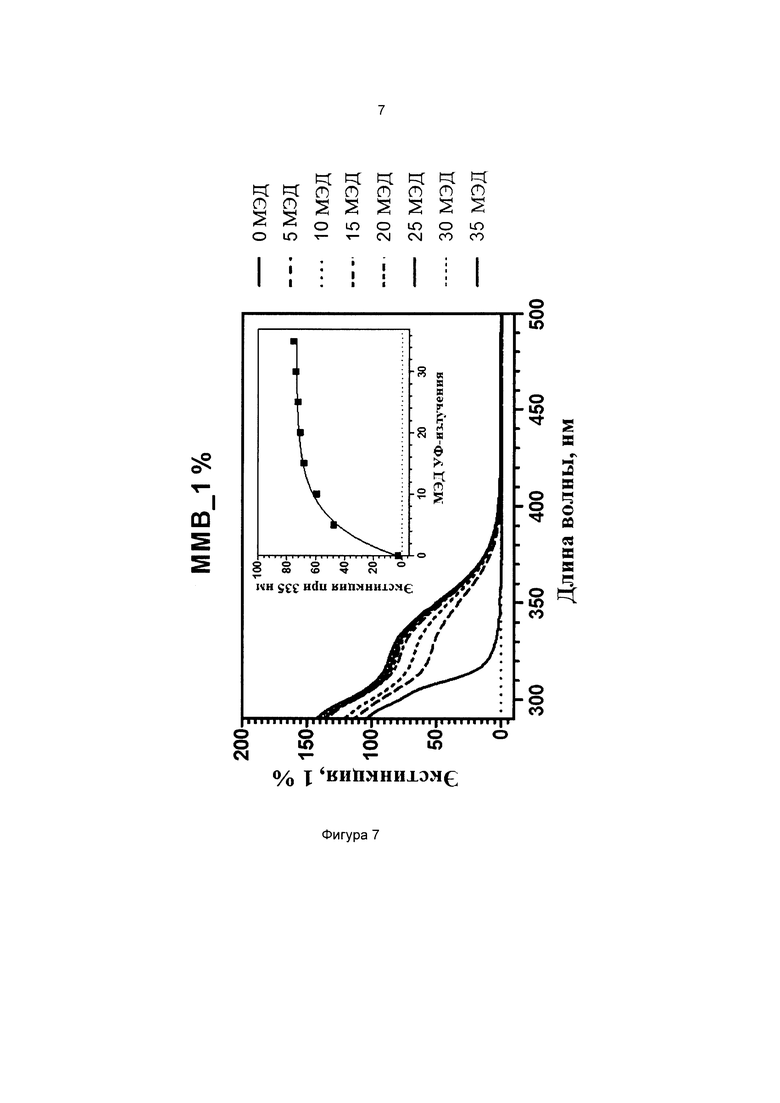
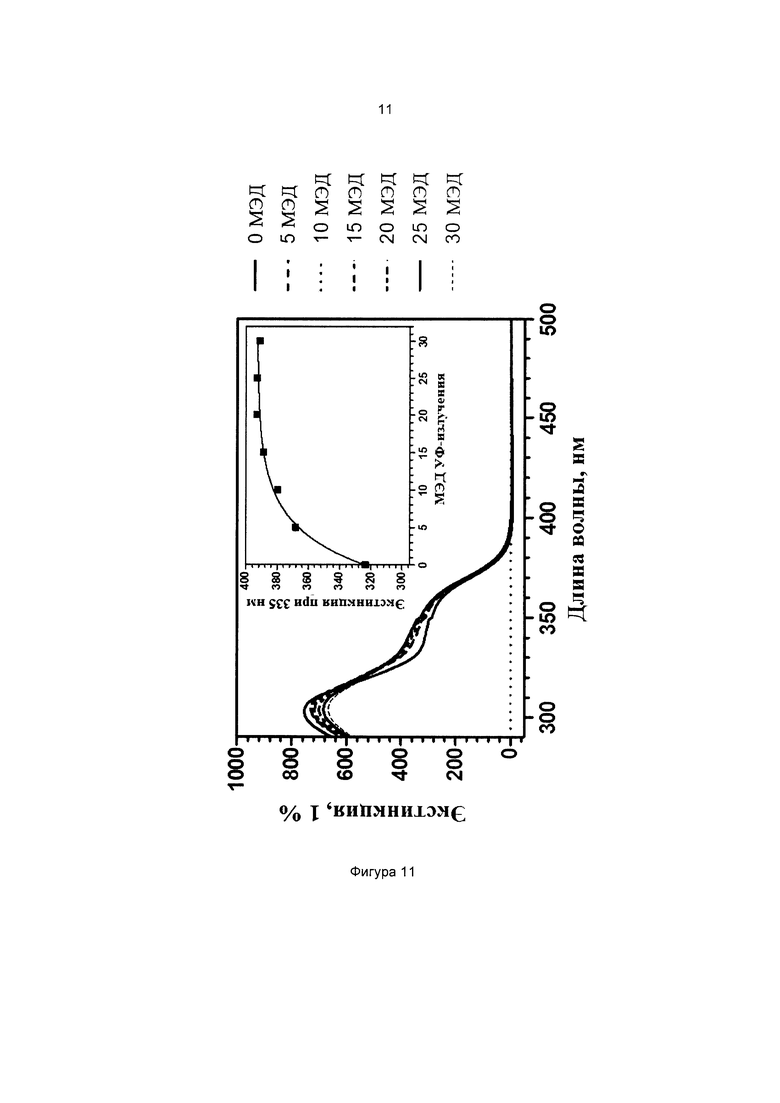
Фиг. 7 иллюстрирует кинетику фотопревращения прекурсора 3-метоксифенил-4-((3-(триэтоксисилил)пропилимино)метил)бензоата (соединение 6).
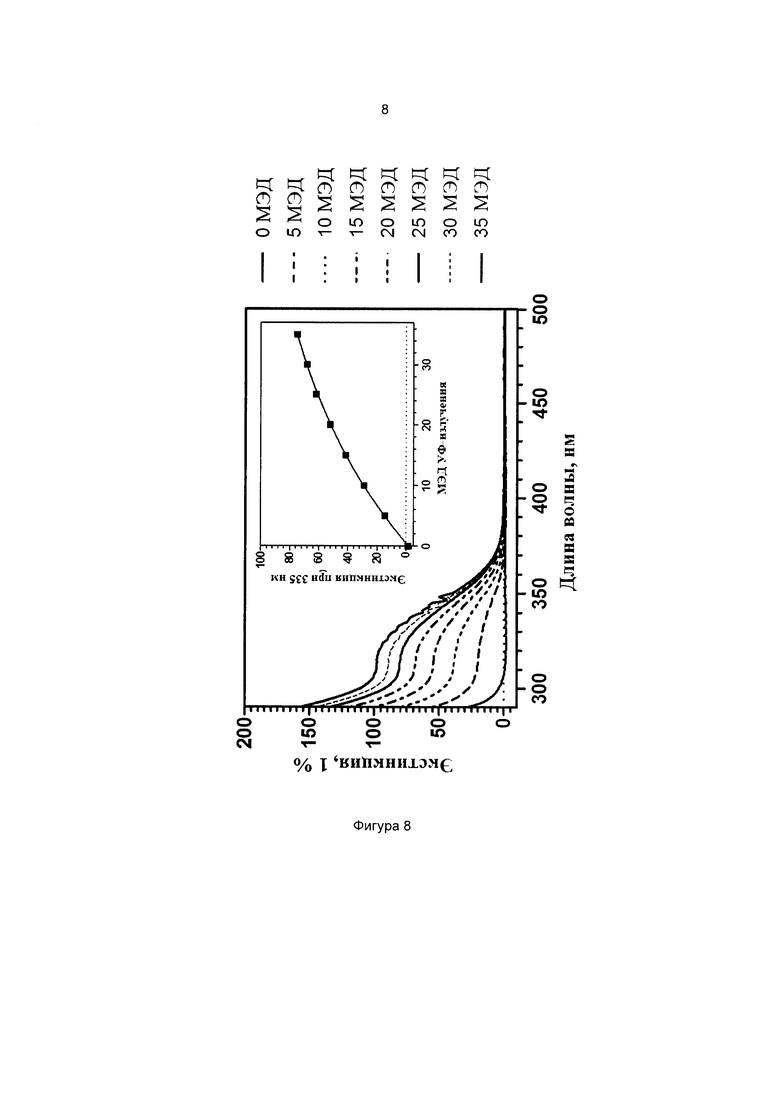
Фиг. 8 иллюстрирует кинетику фотопревращения прекурсора 3-(3-(триэтоксисилил)пропилокси)фенилбензоата (соединение сравнения А).
Фиг. 9 иллюстрирует кинетику фотопревращения прекурсора 3; (диэтиламино)фенил-4-((3-(триэтоксисилил)пропилкарбамоилокси) метил)бензоата (соединение 1).
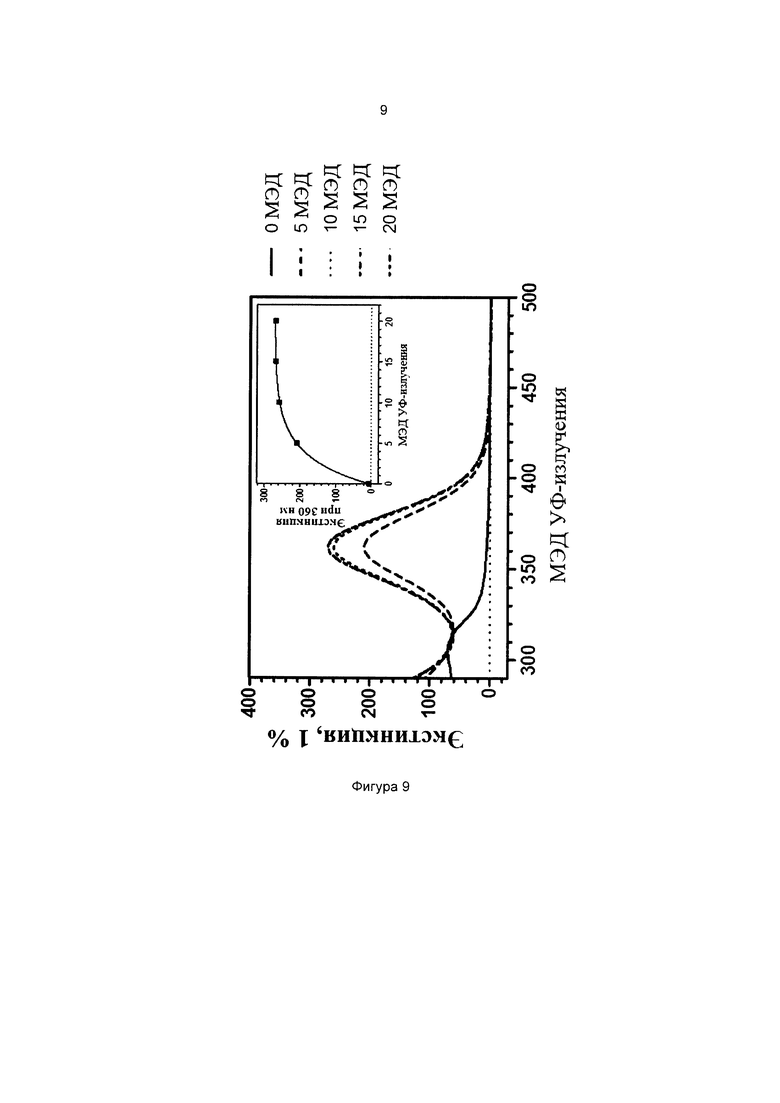
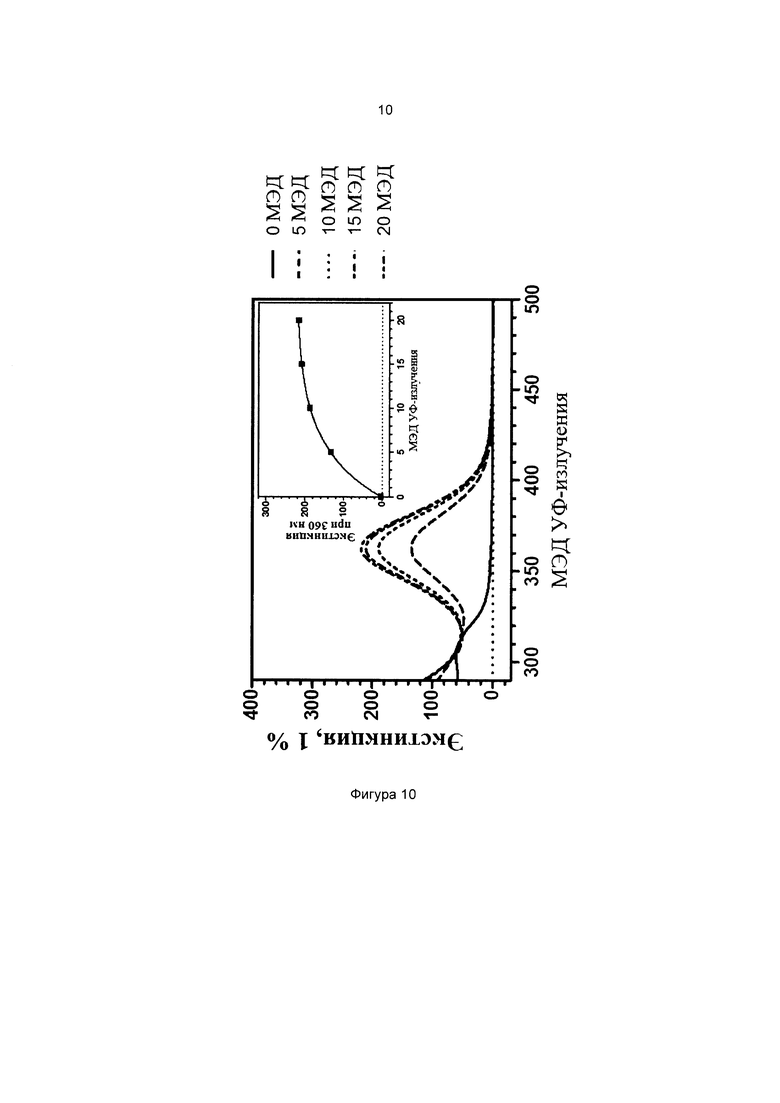
Фиг. 10 иллюстрирует кинетику фотопревращения прекурсора 3-(бис(3-(триэтоксисилил)пропил)амино)фенилбензоата (соединение сравнения В).
Фиг. 11 иллюстрирует кинетику фотопревращения прекурсора 3-метоксифенил-4-((3-(триэтоксисилил)пропилимино)метил)бензоата (соединение 6) в присутствии дополнительных УФ-фильтров.
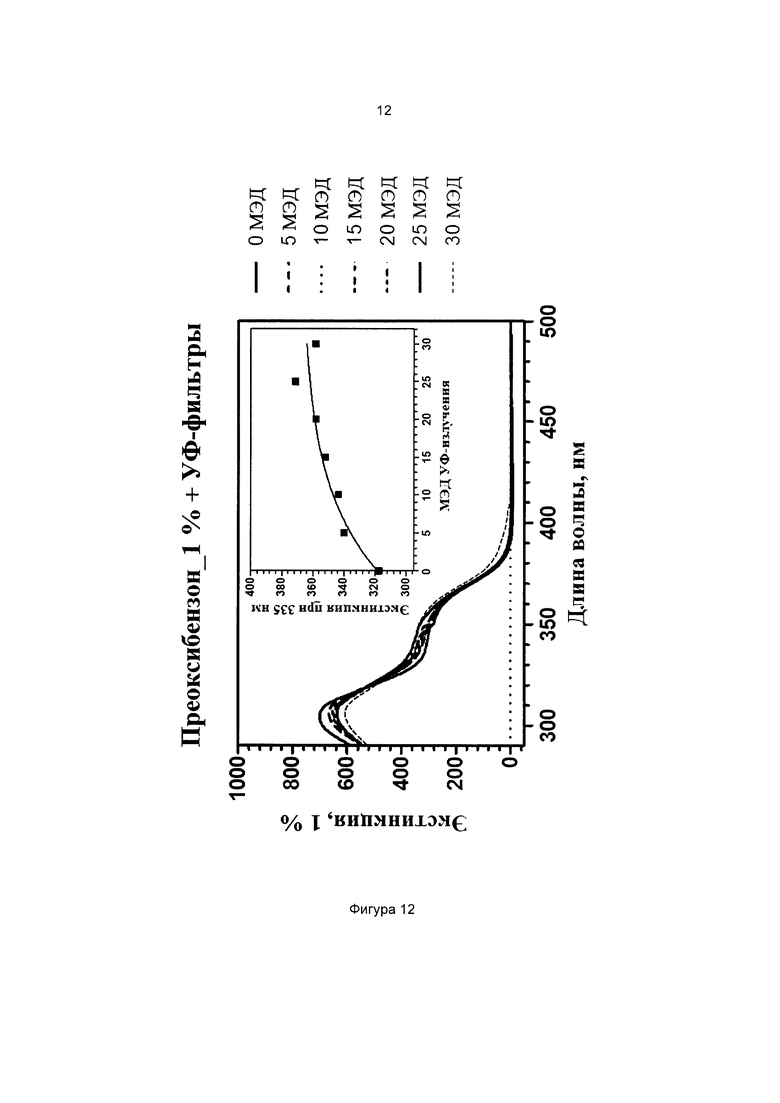
Фиг. 12 иллюстрирует кинетику фотопревращения прекурсора 3-(3-(триэтоксисилил)пропилокси)фенилбензоата (соединение сравнения А) в присутствии дополнительных УФ-фильтров.
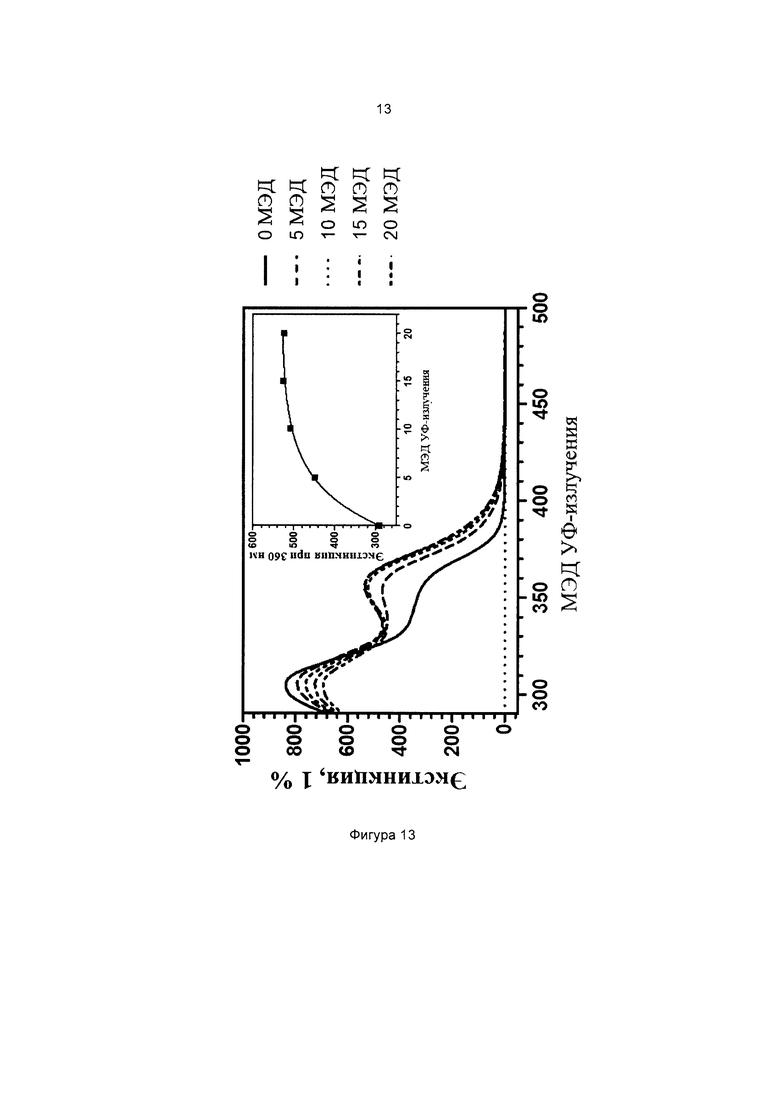
Фиг. 13 иллюстрирует кинетику фотопревращения прекурсора 3; (диэтиламино)фенил-4-((3-(триэтоксисилил)пропилкарбамоилокси)метил)бензоата (соединение 1) в присутствии дополнительных УФ-фильтров.
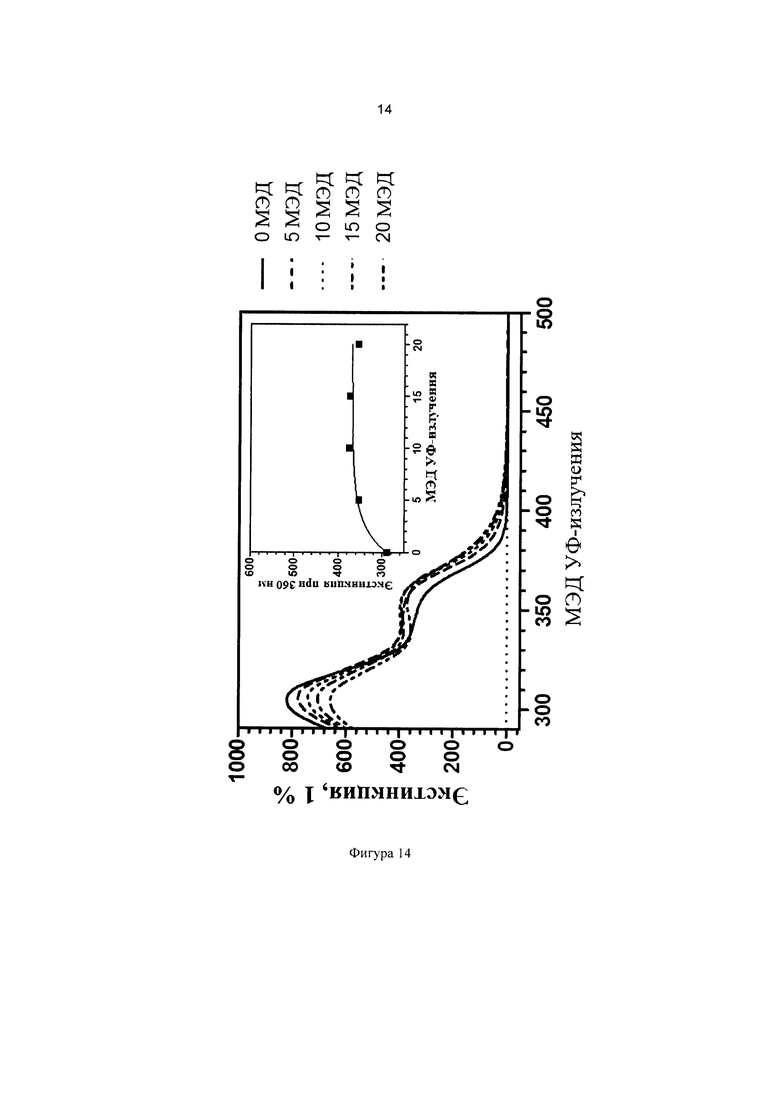
Фиг. 14 иллюстрирует кинетику фотопревращения прекурсора 3-(бис(3-(триэтоксисилил)пропил)амино)фенилбензоата (соединение сравнения В) в присутствии дополнительных УФ-фильтров.
На всех чертежах ось ординат представляет поглощение или экстинкцию 1%, а ось абсцисс представляет длину волны в нм. Маленькие графики на фигурах изображают определение кинетики поглощения при выбранной длине волны, которая указана.
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В контексте настоящего изобретения следующие термины имеют значение, определенное ниже.
«С1-С6 алкил» относится к линейному или разветвленному углеводородному радикалу состоящему из 1-6 атомов углерода, который является насыщенным, и который присоединен к оставшейся части молекулы одинарной связью, например, метил, этил, 1-пропил, 2-пропил, 1-бутил, трет-бутил, 1-пентил и т.д. Алкильные радикалы могут быть необязательно замещены одним или более заместителями, такими как арил, галоген, гидрокси, алкокси, карбокси, циано, карбонил, ацил, амино, нитро, меркапто, алкилтио и т.д., при условии, что они не влияют на процесс полимеризации.
«С2-С6 алкенил» относится к алкильному радикалу, описанному выше, содержащему от 2 до 6 атомов углерода и имеющему одну или более ненасыщенных связей.
«С3-С6 циклоалкил» относится к стабильному 3-6-членному моноциклическому радикалу, который является насыщенным или частично насыщенным, и который состоит только из атомов углерода и водорода, такому как циклогексил или адамантил. Циклоалкильные радикалы могут быть необязательно замещены одним или более заместителями, такими как алкил, галоген, гидрокси, амино, циано, нитро, алкокси, карбокси и т.д., при условии, что они не влияют на процесс полимеризации.
Термин «алканол» относится к линейному или разветвленному углеводородному радикалу, содержащему от 1 до 6 атомов углерода и гидроксильную группу.
Термин «косметически или дерматологически приемлемые соли» в контексте данного изобретения необходимо понимать как любую соль, которая является физиологически переносимой (обычно это означает, что она нетоксичная, в частности, из-за противоиона) при применении или использовании, в частности, для людей и/или млекопитающих. Примеры таких солей включают соли присоединения кислоты и соли присоединения основания. Соли присоединения кислоты включают соли присоединения неорганической кислоты, такие как, например, гидрохлорид, гидробромид, гидроиодид, сульфат, нитрат, фосфат, и соли присоединения органической кислоты, такие как, например, ацетат, малеат, фумарат, цитрат, оксалат, сукцинат, тартрат, малат, манделат, метансульфонат и п-толуолсульфонат. Примеры солей присоединения основания включают соли неорганических оснований, такие как, например, натриевые, калиевые, кальциевые, аммониевые, магниевые, алюминиевые и литиевые соли, и соли органических оснований, такие как, например, соли этилендиамина, этаноламина, N,N-диалкиленэтаноламина, триэтаноламина, глюкамина и основных аминокислот.
В первом аспекте настоящее изобретение относится к способу (в дальнейшем способ 1) получения перспективного кремнийорганического фотозащитного полимера, включающему реакцию мономера формулы (I), описанного выше, с соединением формулы (IV), описанным выше, в смеси алканол/вода.
В предпочтительном варианте реализации изобретения в мономере формулы (I), используемом в способе 1 по данному изобретению, R1, R3, R4 и R5 представляют собой Н.
В другом предпочтительном варианте реализации изобретения R2 выбран из OR10, NH2, NHR11 и NR12R13, где R10, R11, R12 и R13 представляют собой линейную (С1-С6) алкильную группу. Еще более предпочтительно R2 выбран из OR10 и NR12R13, где R10, R12 и R13 также представляют собой линейную (С1-С6) алкильную группу, более предпочтительно метильную или этильную группу.
Еще более предпочтительно в мономере формулы (I), используемом в способе (1), R1, R3, R4 и R5 представляют собой Н, a R2 выбран из OR10, NH2, NHR11 и NR12R13, где R10, R11, R12 и R13 представляют собой линейную (С1-С6) алкильную группу. Еще более предпочтительно R2 выбран из OR10 и NR12R13, где R10, R12 и R13 также представляют собой линейную (С1-С6) алкильную группу, наиболее предпочтительно метильную или этильную группу.
В другом предпочтительном варианте реализации изобретения каждый из R6-R9 представляет собой Н.
В дополнительном предпочтительном варианте реализации изобретения p равен 3.
В другом предпочтительном варианте реализации изобретения каждый из s и t равен 1.
В другом предпочтительном варианте реализации изобретения Ra, Rb и Rc представляют собой линейную (С1-С6) алкильную группу, более предпочтительно этильную группу.
В другом предпочтительном варианте реализации изобретения R представляет собой (i).
В другом предпочтительном варианте реализации изобретения в мономере формулы (I), используемом в способе 1 по данному изобретению, R1, R3-R5 представляют собой Н; R6-R9 представляют собой Н; R2 выбран из OR10, NH2, NHR11 и NR12R13, более предпочтительно из OR10 и NR12R13, где R10, R11, R12 и R13 представляют собой линейную (C1-C6) алкильную группу, более предпочтительно метильную или этильную группу; p равен 3; s и t равны 1; и Ra, Rb и Rc представляют собой линейную (С1-С6) алкильную группу. В конкретном варианте этого предпочтительного варианта реализации изобретения R представляет собой (i). Установлено, что эти соединения обеспечивают наилучшую эффективность превращения, а следовательно, повышенный уровень фотозащиты.
В другом предпочтительном варианте реализации изобретения мономер формулы (I), используемый в способе 1 по данному изобретению, выбран из группы, состоящей из:
- 3-(диэтиламино)фенил-4-((3-(триэтоксисилил)пропилкарбамоилокси)метил)бензоата
- 3-(диметиламино)фенил-4-((3-(триэтоксисилил)пропилкарбамоилокси)метил)бензоата
- 3-метоксифенил-4-((3-(триэтоксисилил)пропилкарбамоилокси)метил)бензоата
- 3-(диэтиламино)фенил-4-((3-(триэтоксисилил)пропилимино)метил)бензоата
- 3-(диметиламино)фенил-4-((3-(триэтоксисилил)пропилимино)метил)бензоата
- 3-метоксифенил-4-((3-(триэтоксисилил)пропилимино)метил)бензоата.
В конкретном варианте реализации изобретения в силане формулы (IV), используемом в способе 1 по данному изобретению, Rd, Re, Rf и Rg независимо представляют собой линейный или разветвленный (С1-С6) алкил, более предпочтительно они все представляют собой линейный (С1-С6) алкил, еще более предпочтительно они представляют собой этильную группу.
В другом предпочтительном варианте реализации изобретения в силане формулы (IV), используемом в способе 1 по данному изобретению, каждый из w1 и w2 равен 1.
Еще более предпочтительно силан формулы (IV) представляет собой тетраэтоксисилан (ТЭОС).
В конкретном варианте реализации изобретения способ 1 осуществляют в присутствии азотсодержащего основного соединения, выбранного из группы, состоящей из аммиака, моноалкиламина, диалкиламина, триалкиламина, моноалканоламина, диалканоламина и триалканоламина. Как алкильная, так и алканольная группы являются линейными или разветвленными, содержащими от 1 до 6 атомов углерода. Азотсодержащее основное соединение предпочтительно представляет собой аммиак.
Во втором аспекте настоящее изобретение относится к перспективному кремнийорганическому фотозащитному полимеру, который получают согласно способу 1 по данному изобретению.
Фотозащитные полимеры по данному изобретению, получаемые как указано в данном описании, находятся в форме микро- или наночастиц. Кроме того, такие частицы гомогенные, имеют сферическую или квазисферическую форму и в значительной степени герметичны.
В контексте настоящего изобретения под термином «форма микро- или наночастиц» понимают частицы со средним размером менее 100 мкм. Указанные частицы обычно имеют средний размер от 10 нм до 10 мкм, предпочтительно от 100 до 1500 нм.
Получение частиц с помощью способа 1 по данному изобретению имеет преимущество в том, что продукт может был получен в форме суспензии, содержащей от около 1 до 25% твердого вещества, состоящего из герметичных сферических или квазисферических частиц, которые можно непосредственно использовать в косметических или дерматологических композициях по настоящему изобретению. Как упомянуто выше, герметичность представляет собой важное физическое свойство полимеров по данному изобретению, поскольку высвобождение сложных эфиров бензойной кислоты или продуктов их фотопревращения минимизировано.
Фотозащитная активность возникает вследствие in situ превращения в солнцезащитные полимеры 2-гидроксибензофенона посредством фотоперегруппировки Фриса фрагмента сложного эфира бензойной кислоты в фрагмент 2-гидроксибензофенона, как с иллюстративной целью показано на Схеме 1:
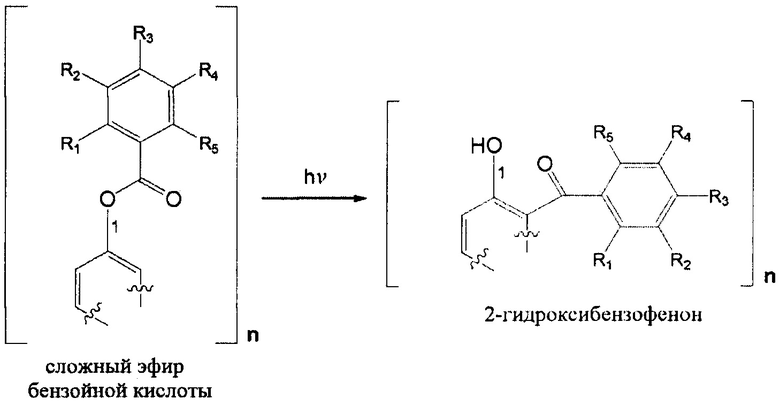
где R1-R5, а n представляют собой количество мономерных единиц, составляющих полимер.
Эти фотозащитные полимеры демонстрируют перспективную УФ-защиту, зависящую от времени воздействия солнца и дозы солнечного излучения, поглощенной полимером. Это перспективное УФ-защитное свойство подтверждается их способностью защищать от УФ-В и УФ-А. Степень фотоперегруппировки Фриса указывает на количество полученного УФ-излучения спектра В.
Следовательно, композиции, содержащие такие фотозащитные полимеры, обеспечивают более безопасный способ принятия солнечных ванн, чем традиционные солнцезащитные продукты, поскольку защитное действие увеличивается с увеличением времени воздействия солнца и дозы излучения.
Следовательно, в другом аспекте настоящее изобретение относится к использованию фотозащитного полимера, описанного выше, для получения косметической или дерматологической композиции для защиты организма человека или животного от УФ-излучения.
В другом аспекте настоящее изобретение относится к применению фотозащитного полимера, описанного выше, в качестве фотохимического прекурсора УФ-поглотителей.
В другом аспекте настоящее изобретение относится к применению фотозащитного полимера, описанного выше, для получения косметической или дерматологической композиции для нанесения на поверхность тела человека или животного, которая характеризуется эффективной УФ-защитой, зависящей от времени воздействия солнца и интенсивности солнечного излучения.
В другом аспекте настоящее изобретение относится к фотозащитному полимеру, описанному выше, для применения с целью защиты организма человека или животного от УФ-излучения.
Другой аспект настоящего изобретения относится к косметической или дерматологической композиции, содержащей перспективный кремнийорганический фотозащитный полимер, описанный выше, или смесь полимеров.
Настоящее изобретение также относится к косметической или дерматологической композиции, упомянутой ранее, содержащей эффективное количество полимера, описанного выше, или смеси полимеров, подвергающихся фотохимическому превращению in situ с образованием солнцезащитного соединения с усиленной способностью защищать от УФ-излучения.
В конкретном варианте реализации изобретения содержание фотозащитных полимеров в косметической или дерматологической композиции колеблется от 0,01% до 40% по массе в пересчете на общую массу композиции. Количество предпочтительно находится в интервале от 0,05 до 25% по массе, более предпочтительно в интервале от 0,1 до 15% по массе.
Косметическая или дерматологическая композиция по данному изобретению также может содержать по меньшей мере одно дополнительное органическое солнцезащитное соединение для поглощения УФ-В и УФ-А лучей. В предпочтительном варианте реализации изобретения указанное дополнительное солнцезащитное соединение выбрано из авобензона, 2-этилгексил-п-метоксициннамата, оксибензона, октилдиметил-п-аминобензойной кислоты, диоксибензона, этил-4-[бис(гидроксипропил)]аминобензоата, 2-этилгексил-2-циан-3,3-дифенилакрилата, 2-этилгексилсалицилата, глицерил-п-аминобензоата, 3,3,5-триметилциклогексилсалицилата, метилантранилата, п-диметиламинобензойной кислоты, 2-этилгексил-п-диметиламинобензоата, 2-фенилбензимидазол-5-сульфоновой кислоты, 2-п-диметиламинофенил-5-сульфонийбензоксазоловой кислоты, сулисобензона, гексил-2-(4-диэтиламино-2-гидроксибензоил)бензоата, 2-(4-метилбензилиден)камфоры и 4-изопропилдибензоилметана.
Кроме того, композиция по данному изобретению может дополнительно содержать обычные вспомогательные вещества и добавки, такие как консерванты, антиоксиданты, жиры, масло, воду, органические растворители, кремнийорганические вещества, загустители, смягчители, эмульгаторы, противовспенивающие агенты, увлажнители, ароматизаторы, поверхностно-активные вещества, наполнители, комплексообразующие агенты, анионные, катионные, неионогенные или амфотерные полимеры или их смеси, распыляющие вещества, подкисляющие или подщелачивающие агенты, красители, окрашивающие агенты, пигменты, нанопигменты или любой другой ингредиент, который обычно включают в состав косметических средств, в частности используемый для получения солнцезащитных композиций.
Необходимые количества косметических и дерматологических вспомогательных веществ и добавок легко могут быть выбраны специалистом в данной области техники в зависимости от требуемого продукта и будут проиллюстрированы в примерах, но не ограничиваясь ими. В предпочтительном варианте реализации изобретения содержание вспомогательных веществ и/или добавок в косметической или дерматологической композиции колеблется от 0,01% до 40% по массе в пересчете на общую массу композиции. Данное количество предпочтительно находится в интервале от 0,05 до 25% по массе, более предпочтительно в интервале от 0,1 до 15% по массе.
В другом конкретном варианте реализации изобретения косметическая или дерматологическая композиция по данному изобретению содержит полимер в соответствии со вторым аспектом изобретения или смесь полимеров, причем содержание полимеров колеблется от 0,01% до 40% по массе в пересчете на общую массу композиции, предпочтительно от 0,05% до 25%, а более предпочтительно от 0,01% до 15%, солнцезащитное соединение, которое выбрано из авобензона, 2-этилгексил-п-метоксициннамата, оксибензона, октилдиметил-п-аминобензойной кислоты, диоксибензона, этил-4-[бис(гидроксипропил)]аминобензоата, 2-этилгексил-2-циан-3,3-дифенилакрилата, 2-этилгексилсалицилата, глицерил-п-аминобензоата, 3,3,5-триметилциклогексилсалицилата, метилантранилата, п-диметиламинобензойной кислоты, 2-этилгексил-п-диметиламинобензоата, 2-фенилбензимидазол-5-сульфоновой кислоты, 2-п-диметиламинофенил-5-сульфонийбензоксазоловой кислоты, сулисобензона, гексил-2-(4-диэтиламино-2-гидроксибензоил)бензоата, 2-(4-метилбензилиден)камфоры и 4-изопропилдибензоилметана, при этом содержание солнцезащитного соединения колеблется от 0,01% до 40% по массе в пересчете на общую массу композиции, предпочтительно от 0,05% до 25%, а более предпочтительно от 0,01% до 15%, для нанесения на поверхность тела человека или животного.
Косметическая или дерматологическая композиция по данному изобретению может, в частности, быть представлена в форме кремов, мазей, молочка, суспензий, порошков, масел, лосьонов, гелей, карандашей, пен, эмульсий, дисперсий, спреев, аэрозолей, губных помад, основ под макияж, средств макияжа, сыпучих или спрессованных порошков, румян, теней для век, туши для ресниц и бровей, лаков для ногтей и неперманентных окрашивающих композиций для волос.
В другом аспекте настоящее изобретение относится к мономеру формулы (I) в соответствии с восьмым аспектом изобретения.
В предпочтительном варианте реализации изобретения R1, R3, R4 и R5 представляют собой Н.
В другом предпочтительном варианте реализации изобретения R2 выбран из OR10, NH2, NHR11 и NR12R13, где R10, R11, R12 и R13 представляют собой линейную (С1-С6) алкильную группу. Еще более предпочтительно R2 выбран из OR10 и NR12R13, где R10, R12 и R13 также представляют собой линейную (С1-С6) алкильную группу, более предпочтительно метильную или этильную группу.
В другом предпочтительном варианте реализации изобретения каждый из R6-R9 представляет собой Н.
В дополнительном предпочтительном варианте реализации изобретения p равен 3.
В другом предпочтительном варианте реализации изобретения каждый из s и t равен 1.
В другом предпочтительном варианте реализации изобретения Ra, Rb и Rc представляют собой линейную (C1-C6) алкильную группу, более предпочтительно этильную группу.
В другом предпочтительном варианте реализации изобретения R представляет собой (i).
В другом предпочтительном варианте реализации изобретения R1, R3-R5 представляют собой Н; R6-R9 представляют собой Н; R2 выбран из OR10, NH2, NHR11 и NR12R13, более предпочтительно из OR10 и NR12R13, где R10, R11, R12 и R13 представляют собой линейную (С1-С6) алкильную группу, более предпочтительно метильную или этильную группу; p равен 3; s и t равны 1; и Ra, Rb и Rc представляют собой линейную (С1-С6) алкильную группу. В конкретном варианте этого предпочтительного варианта реализации изобретения R представляет собой (i).
В другом предпочтительном варианте реализации изобретения мономер формулы (I) выбран из группы, состоящей из:
- 3-(диэтиламино)фенил-4-((3-(триэтоксисилил)пропилкарбамоилокси)метил)бензоата
- 3-(диметиламино)фенил-4-((3-(триэтоксисилил)пропилкарбамоилокси)метил)бензоата
- 3-метоксифенил-4-((3-(триэтоксисилил)пропилкарбамоилокси)метил)бензоата
- 3-(диэтиламино)фенил-4-((3-(триэтоксисилил)пропилимино)метил)бензоата
- 3-(диметиламино)фенил-4-((3-(триэтоксисилил)пропилимино)метил)бензоата
- 3-метоксифенил-4-((3-(триэтоксисилил)пропилимино)метил)бензоата.
В другом аспекте настоящее изобретение относится к способу получения мономера формулы (I), описанного выше, в случае если линкер L представляет собой группу -CH=N-, включающему реакцию соединения формулы (II) с соединением формулы (III) в соответствии с девятым аспектом изобретения.
Эта реакция между альдегидной группой соединения формулы (II) и аминогруппой соединения формулы (III) дает иминную группу (-CH=N-), а также стехиометрическое количество воды. Для того, чтобы удалить воду и предотвратить изменение направления реакции, можно использовать любой способ удаления воды, известный специалистам в данной области. В конкретном варианте реализации изобретения эту реакцию проводят в присутствии агента, удаляющего воду, такого как, например, безводный сульфат магния.
Настоящее изобретение также относится к способу получения мономера формулы (I), описанного выше, в случае если линкер L представляет собой группу -(CH2)-O-C(O)-NH-, включающему реакцию восстановления соединения формулы (II) в присутствии восстанавливающего агента для получения соединения формулы (V) и реакцию соединения формулы (V) с соединением формулы (VI) в соответствии с десятым аспектом изобретения.
Для синтеза мономера формулы (I) можно использовать любой восстанавливающий агент, известный специалистам в данной области техники для реакций такого типа. В конкретном варианте реализации изобретения восстанавливающий агент представляет собой боргидрид натрия.
Соединения формул (II) и (III) получают из имеющихся в продаже исходных реагентов с помощью традиционных известных способов органической химии, как описано в примерах, представленных в настоящем описании. Например, соединение формулы (II) можно получить в соответствии со следующей схемой реакции [заместители R1-R9 не показаны]:
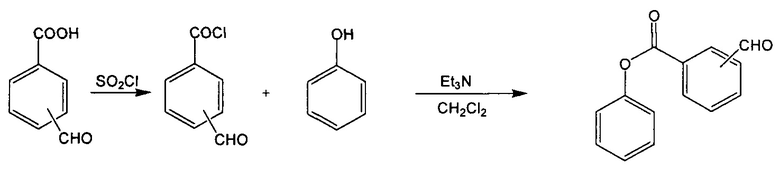
Косметически или дерматологически приемлемые соли мономеров формулы (I) синтезируют из исходного соединения, которое содержит основный или кислотный фрагмент, с помощью традиционных химических способов. Как правило, такие соли получены, например, путем взаимодействия этих соединений в форме свободных кислот или оснований со стехиометрическим количеством соответствующего основания или кислоты в воде, или в органическом растворителе, или в их смеси. Как правило, предпочтительно использование неводных сред, таких как простой эфир, этилацетат, этанол, изопропанол или ацетонитрил.
Следующие примеры приведены для дополнительной иллюстрации некоторых вариантов реализации изобретения и не должны рассматриваться как ограничивающие объем изобретения каким-либо способом.
Примеры
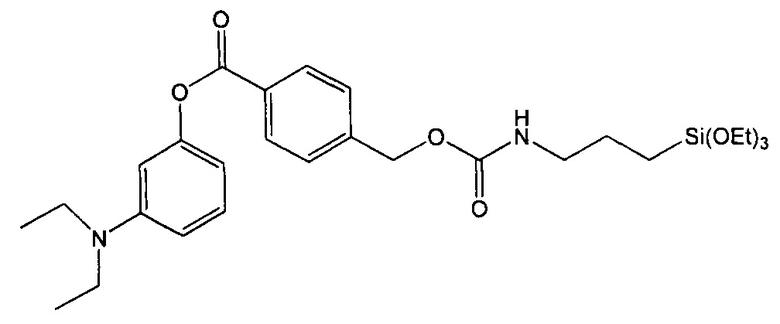
Пример 1. Синтез 3-(диэтиламино)фенил-4-((3-(триэтоксисилил)пропилкарбамоилокси)метил)бензоата (соединение 1)
Стадия 1. Синтез 4-формилбензоилхлорида
0,92 г (6,13 ммоль) 4-формилбензойной кислоты суспендировали в 50 мл безводного толуола. Добавляли 16 мл тионилхлорида (0,22 моль), и полученную суспензию нагревали при 130°С в течение 3 часов под атмосферой азота, затем охлаждали до комнатной температуры, и растворитель испаряли при пониженном давлении. Дополнительно добавляли 50 мл толуола и выпаривали при пониженном давлении для удаления, возможно, оставшегося тионилхлорида. Этот процесс повторяли дважды. Полученное твердое вещество использовали непосредственно без дополнительной очистки.
Стадия 2. Синтез 3-(диэтиламино)фенил-4-формилбензоата
1,01 г (6,13 ммоль) 3-(диэтиламино)фенола суспендировали в 50 мл дихлорметана и растворяли, добавляя 0,85 мл (6,13 ммоль) триэтиламина. Полученный раствор перемешивали в течение 30 минут, а затем по каплям добавляли раствор, содержащий 4-формилбензоилхлорид в дихлорметане (6,13 ммоль ацилхлорида в 20 мл растворителя). Полученный раствор перемешивали при комнатной температуре в течение 5 часов, затем экстрагировали насыщенным водным раствором карбоната натрия (3×40 мл), сушили над сульфатом магния, и испаряли растворитель при пониженном давлении. Полученное коричневатое твердое вещество перекристаллизовывали из циклогексана, что давало желтоватое твердое вещество (выход 50%, чистота, оцененная с помощью ВЭЖХ, 95%).
1Н-ЯМР (CDCl3): 10,15 м.д. (с, 1Н), 8,37 м.д. (д, 2Н), 8,02 м.д. (д, 2Н), 7,24 м.д. (т, 1Н), 6,57 м.д. (дд, 1Н), 6,47 м.д. (м, 2Н), 3,35 м.д. (кв, 4Н), 1,23 м.д. (т, 6Н).
Стадия 3. Синтез 3-(диэтиламино)фенил-4-(гидроксиметил)бензоата
2,00 г (6,72 ммоль) 3-(диэтиламино)фенил-4-формилбензоата суспендировали в 50 мл безводного этанола и небольшими порциями на ледяной бане добавляли 0,80 г (3 экв.) боргидрида натрия. После прекращения добавления раствор перемешивали при комнатной температуре в течение 30 минут. Затем добавляли 30 мл воды, и перемешивание продолжали в течение получаса. Добавляли хлороформ (3×50 мл), органическую фазу отделяли и сушили над сульфатом магния, растворитель испаряли при пониженном давлении, что давало необходимый продукт в виде желтого твердого вещества (выход 90%).
1Н-ЯМР (CDCl3): 8,20 м.д. (д, 2Н), 7,49 м.д. (д, 2Н), 7,24 м.д. (т, 1Н), 6,57 м.д. (дд, 1Н), 6,47 м.д. (м, 2Н), 4,80 м.д. (с, 2Н), 3,35 м.д. (кв, 4Н), 1,23 м.д. (т, 6Н).
Стадия 4. Синтез 3-(диэтиламино)фенил-4-((3-(триэтоксисилил)пропилкарбамоилокси)метил)бензоата
1,15 г (3,84 ммоль) 3-(диэтиламино)фенил-4-(гидроксиметил)бензоата растворяли в 100 мл хлороформа и добавляли 2,85 мл (3 экв.) 3-(триэтоксисилил)пропилизоцианата и 1,60 мл (3 экв.) триэтиламина. Полученный раствор нагревали с обратным холодильником в течение 48 часов. После охлаждения до комнатной температуры растворитель испаряли при пониженном давлении, а избыток реагентов отгоняли под вакуумом, что давало требуемый продукт в виде масла (количественный выход).
1Н-ЯМР (CDCl3): 8,20 м.д. (д, 2Н), 7,49 м.д. (д, 2Н), 7,24 м.д. (т, 1Н), 6,57 м.д. (дд, 1Н), 6,47 м.д. (м, 2Н), 5,19 м.д. (с, 1Н), 4,80 м.д. (с, 2Н), 3,85 м.д. (кв, 6Н), 3,35 м.д. (кв, 4Н), 3,20 м.д. (т, 2Н), 1,61 м.д. (м, 2Н), 1,23 м.д. (т, 9Н), 1,18 м.д. (т, 6Н), 0,69 м.д. (м, 2Н).
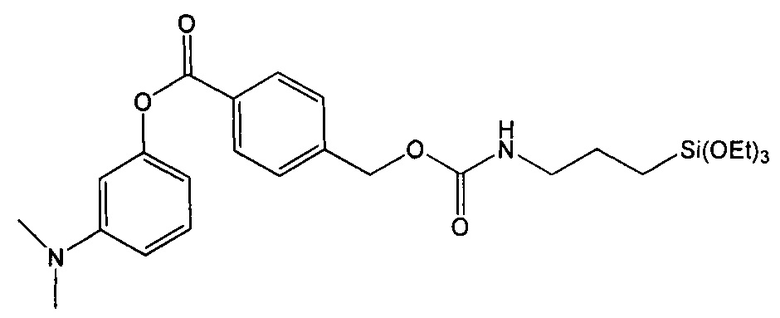
Пример 2. Синтез 3-(диметиламино)фенил-4-((3-(триэтоксисилил)пропилкарбамоилокси)метил)бензоата (соединение 2)
Стадия 1. Синтез 4-формилбензоилхлорида
0,92 г (6,13 ммоль) 4-формилбензойной кислоты суспендировали в 50 мл безводного толуола. Добавляли 16 мл тионилхлорида (0,22 моль), и полученную суспензию нагревали при 130°С в течение 3 часов под атмосферой азота, затем охлаждали до комнатной температуры, и растворитель испаряли при пониженном давлении. Дополнительно добавляли 50 мл толуола и выпаривали при пониженном давлении для удаления, возможно, оставшегося тионилхлорида. Этот процесс повторяли дважды. Полученное твердое вещество использовали непосредственно без дополнительной очистки.
Стадия 2. Синтез 3-(диметиламино)фенил-4-формилбензоата
0,84 г (6,13 ммоль) 3-(диметиламино)фенола суспендировали в 50 мл дихлорметана и растворяли, добавляя 0,85 мл (6,13 ммоль) триэтиламина. Полученный раствор перемешивали в течение 30 минут, а затем по каплям добавляли раствор, содержащий 4-формилбензоилхлорид в дихлорметане (6,13 ммоль ацилхлорида в 20 мл растворителя). Полученный раствор перемешивали при комнатной температуре в течение 5 часов, затем экстрагировали насыщенным водным раствором карбоната натрия (3×40 мл), сушили над сульфатом магния, и испаряли растворитель при пониженном давлении. Полученное коричневатое твердое вещество перекристаллизовывали из циклогексана, что давало желтоватое твердое вещество (выход 60%, чистота, оцененная с помощью ВЭЖХ, 95%).
1Н-ЯМР (CDCl3): 10,14 м.д. (с, 1Н), 8,37 м.д. (д, 2Н), 8,02 м.д. (д, 2Н), 7,26 м.д. (т, 1Н), 6,64 м.д. (дд, 1Н), 6,54 м.д. (дд+т, 2Н), 2,97 м.д. (с, 6Н).
Стадия 3. Синтез 3-(диметиламино)фенил-4-(гидроксиметил)бензоата
2,00 г (7,43 ммоль) 3-(диметиламино)фенил-4-формилбензоата суспендировали в 50 мл безводного этанола, и небольшими порциями на ледяной бане добавляли 0,80 г (3 экв.) боргидрида натрия. После прекращения добавления раствор перемешивали при комнатной температуре в течение 30 минут. Затем добавляли 30 мл воды, и перемешивание продолжали в течение получаса. Добавляли хлороформ (3×50 мл), органическую фазу отделяли и сушили над сульфатом магния, растворитель испаряли при пониженном давлении, что давало необходимый продукт в виде желтого твердого вещества (выход 90%).
1Н-ЯМР (CDCl3): 8,20 м.д. (д, 2Н), 7,49 м.д. (д, 2Н), 7,26 м.д. (т, 1Н), 6,64 м.д. (дд, 1Н), 6,54 м.д. (дд+т, 2Н), 4,80 м.д. (с, 2Н), 2,97 м.д. (с, 6Н).
Стадия 4. Синтез 3-(диметиламино)фенил-4-((3-(триэтоксисилил)пропилкарбамоилокси)метил)бензоата
1,03 г (3,84 ммоль) 3-(диметиламино)фенил-4-(гидроксиметил)бензоата растворяли в 100 мл хлороформа и добавляли 2,85 мл (3 экв.) 3-(триэтоксисилил)пропилизоцианата и 1,60 мл (3 экв.) триэтиламина. Полученный раствор нагревали с обратным холодильником в течение 48 часов. После охлаждения до комнатной температуры растворитель испаряли при пониженном давлении, а избыток реагентов отгоняли под вакуумом, что давало требуемый продукт в виде масла (количественный выход).
1Н-ЯМР (CDCl3): 8,20 м.д. (д, 2Н), 7,49 м.д. (д, 2Н), 7,26 м.д. (т, 1Н), 6,64 м.д. (дд, 1Н), 6,54 м.д. (дд+т, 2Н), 4,80 м.д. (с, 2Н), 3,20 м.д. (т, 2Н), 2,97 м.д. (с, 6Н), 1,61 м.д. (м, 2Н), 1,23 м.д. (т, 9Н), 0,69 м.д. (м, 2Н).
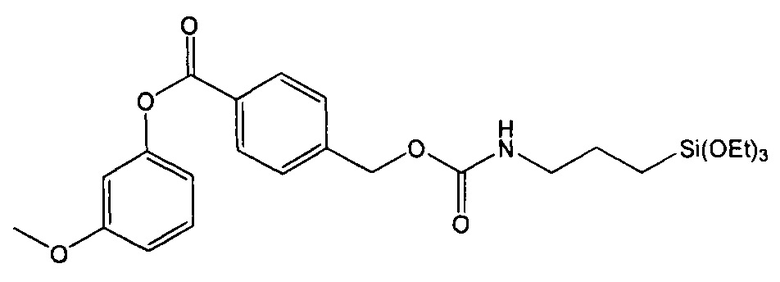
Пример 3. Синтез 3-метоксифенил-4-((3-(триэтоксисилил)пропилкарбамоилокси)метил)бензоата (соединение 3)
Стадия 1. Синтез 4-формилбензоилхлорида
0,92 г (6,13 ммоль) 4-формилбензойной кислоты суспендировали в 50 мл безводного толуола. Добавляли 16 мл тионилхлорида (0,22 моль), и полученную суспензию нагревали при 130°С в течение 3 часов под атмосферой азота, затем охлаждали до комнатной температуры, и растворитель испаряли при пониженном давлении. Дополнительно добавляли 50 мл толуола и выпаривали при пониженном давлении для удаления, возможно, оставшегося тионилхлорида. Этот процесс повторяли дважды. Полученное твердое вещество использовали непосредственно без дополнительной очистки.
Стадия 2. Синтез 3-метоксифенил-4-формилбензоата
0,76 г (6,13 ммоль) 3-метоксифенола суспендировали в 50 мл дихлорметана и растворяли, добавляя 0,85 мл (6,13 ммоль) триэтиламина. Полученный раствор перемешивали в течение 30 минут, а затем по каплям добавляли раствор, содержащий 4-формилбензоилхлорид в дихлорметане (6,13 ммоль ацилхлорида в 20 мл растворителя). Полученный раствор перемешивали при комнатной температуре в течение 5 часов, затем экстрагировали насыщенным водным раствором карбоната натрия (3×40 мл), сушили над сульфатом магния, и испаряли растворитель при пониженном давлении. Получали белое твердое вещество с чистотой 96%, что оценено с помощью ВЭЖХ (выход 90%).
1Н-ЯМР (CDCl3): 10,14 м.д. (с, 1Н), 8,37 м.д. (д, 2Н), 8,02 м.д. (д, 2Н), 7,34 м.д. (т, 1Н), 6,84 м.д. (тд, 2Н), 6,78 м.д. (т, 1Н), 3,83 м.д. (с, 3Н).
Стадия 3. Синтез 3-метоксифенил-4-(гидроксиметил)бензоата
2,00 г (7,75 ммоль) 3-метоксифенил-4-формилбензоата суспендировали в 50 мл безводного этанола, и небольшими порциями на ледяной бане добавляли 0,80 г (3 экв.) боргидрида натрия. После прекращения добавления раствор перемешивали при комнатной температуре в течение 30 минут. Затем добавляли 30 мл воды, и перемешивание продолжали в течение получаса. Добавляли хлороформ (3×50 мл), органическую фазу отделяли и сушили над сульфатом магния, растворитель испаряли при пониженном давлении, что давало необходимый продукт в виде желтого твердого вещества (выход 90%).
1H-ЯМР (CDCl3): 8,20 м.д. (д, 2Н), 7,50 м.д. (д, 2Н), 7,34 м.д. (т, 1Н), 6,84 м.д. (тд, 2Н), 6,78 м.д. (т, 1Н), 4,8 м.д. (с, 2Н), 3,83 м.д. (с, 3Н).
Стадия 4. Синтез 3-метоксифенил-4-((3-(триэтоксисилил)пропилкарбамоилокси)метил)бензоата
0,99 г (3,84 ммоль) 3-метоксифенил-4-(гидроксиметил)бензоата растворяли в 100 мл хлороформа и добавляли 2,85 мл (3 экв.) 3-(триэтоксисилил)пропилизоцианата и 1,60 мл (3 экв.) триэтиламина. Полученный раствор нагревали с обратным холодильником в течение 48 часов. После охлаждения до комнатной температуры растворитель испаряли при пониженном давлении, а избыток реагентов отгоняли под вакуумом, что давало требуемый продукт в виде масла (количественный выход).
1Н-ЯМР (CDCl3): 8,20 м.д. (д, 2Н), 7,50 м.д. (д, 2Н), 7,34 м.д. (т, 1Н), 6,84 м.д. (тд, 2Н), 6,78 м.д. (т, 1Н), 4,8 м.д. (с, 2Н), 3,83 м.д. (с, 3Н), 3,20 м.д. (т, 2Н), 1,61 м.д. (м, 2Н), 1,23 м.д. (т, 9Н), 0,69 м.д. (м, 2Н).
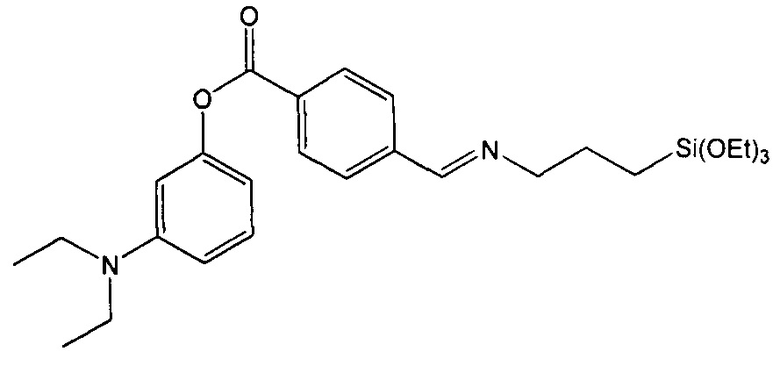
Пример 4. Синтез 3-(диэтиламино)фенил-4-((3-(триэтоксисилил)пропилимино)метил)бензоата (соединение 4)
Стадия 1. Синтез 4-формилбензоилхлорида
0,92 г (6,13 ммоль) 4-формилбензойной кислоты суспендировали в 50 мл безводного толуола. Добавляли 16 мл тионилхлорида (0,22 моль), и полученную суспензию нагревали при 130°С в течение 3 часов под атмосферой азота, затем охлаждали до комнатной температуры, и растворитель испаряли при пониженном давлении. Дополнительно добавляли 50 мл толуола и выпаривали при пониженном давлении для удаления, возможно, оставшегося тионилхлорида. Этот процесс повторяли дважды. Полученное твердое вещество использовали непосредственно без дополнительной очистки.
Стадия 2. Синтез 3-(диэтиламино)фенил-4-формилбензоата
1,01 г (6,13 ммоль) 3-(диэтиламино)фенола суспендировали в 50 мл дихлорметана и растворяли, добавляя 0,85 мл (6,13 ммоль) триэтиламина. Полученный раствор перемешивали в течение 30 минут, а затем по каплям добавляли раствор, содержащий 4-формилбензоилхлорид в дихлорметане (6,13 ммоль ацилхлорида в 20 мл растворителя). Полученный раствор перемешивали при комнатной температуре в течение 5 часов, затем экстрагировали насыщенным водным раствором карбоната натрия (3×40 мл), сушили над сульфатом магния, и испаряли растворитель при пониженном давлении. Полученное коричневатое твердое вещество перекристаллизовывали из циклогексана, что давало желтоватое твердое вещество (выход 50%, чистота, оцененная с помощью ВЭЖХ, 95%).
1Н-ЯМР (CDCl3): 10,15 м.д. (с, 1Н), 8,37 м.д. (д, 2Н), 8,02 м.д. (д, 2Н), 7,24 м.д. (т, 1Н), 6,57 м.д. (дд, 1Н), 6,47 м.д. (м, 2Н), 3,35 м.д. (кв, 4Н), 1,23 м.д. (т, 6Н).
Стадия 3. Синтез 3-(диэтиламино)фенил-4-((3-(триэтоксисилил)пропилимино)метил)бензоата
50 мг (0,17 ммоль) 3-(диэтиламино)фенил-4-формилбензоата суспендировали в 20 мл хлороформа и добавляли 37 мг (0,17 ммоль) 3-(аминопропил)триэтоксисилана, а затем 100 мг безводного сульфата магния. Полученную суспензию перемешивали при комнатной температуре в течение 24 часов под атмосферой азота. Неочищенный продукт отфильтровывали, и растворитель удаляли при пониженном давлении, что давало оранжевое масло (количественный выход).
1Н-ЯМР (CDCl3): 8,36 м.д. (с, 1Н), 8,24 м.д. (д, 2Н), 7,85 м.д. (д, 2Н), 7,21 м.д. (т, 1Н), 6,57 м.д. (дд, 1Н), 6,47 м.д. (м, 2Н), 3,84 м.д. (кв, 6Н), 3,67 м.д. (т, 2Н), 3,35 м.д. (кв, 4Н), 1,86 м.д. (м, 2Н), 1,23 м.д. (т, 9Н), 1,17 м.д. (т, 6Н), 0,69 м.д. (м, 2Н).
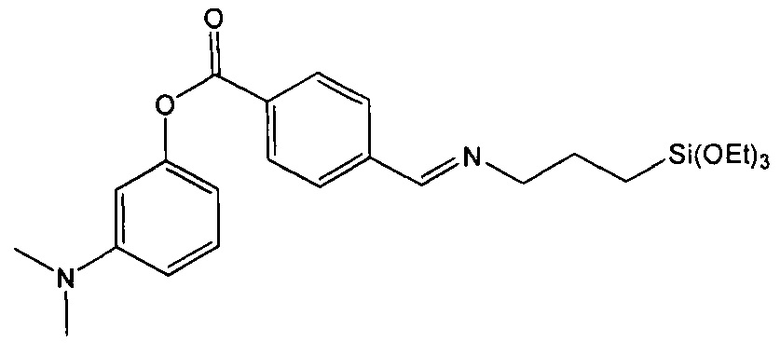
Пример 5. Синтез 3-(диметиламино)фенил-4-((3-(триэтоксисилил)пропилимино)метил)бензоата (соединение 5)
Стадия 1. Синтез 4-формилбензоилхлорида
0,92 г (6,13 ммоль) 4-формилбензойной кислоты суспендировали в 50 мл безводного толуола. Добавляли 16 мл тионилхлорида (0,22 моль), и полученную суспензию нагревали при 130°С в течение 3 часов под атмосферой азота, затем охлаждали до комнатной температуры, и растворитель испаряли при пониженном давлении. Дополнительно добавляли 50 мл толуола и выпаривали при пониженном давлении для удаления, возможно, оставшегося тионилхлорида. Этот процесс повторяли дважды. Полученное твердое вещество использовали непосредственно без дополнительной очистки.
Стадия 2. Синтез 3-(диметиламино)фенил-4-формилбензоата
0,84 г (6,13 ммоль) 3-(диметиламино)фенола суспендировали в 50 мл дихлорметана и растворяли, добавляя 0,85 мл (6,13 ммоль) триэтиламина. Полученный раствор перемешивали в течение 30 минут, а затем по каплям добавляли раствор, содержащий 4-формилбензоилхлорид в дихлорметане (6,13 ммоль ацилхлорида в 20 мл растворителя). Полученный раствор перемешивали при комнатной температуре в течение 5 часов, затем экстрагировали насыщенным водным раствором карбоната натрия (3×40 мл), сушили над сульфатом магния, и испаряли растворитель при пониженном давлении. Полученное коричневатое твердое вещество перекристаллизовывали из циклогексана, что давало желтоватое твердое вещество (выход 60%, чистота, оцененная с помощью ВЭЖХ, 95%).
1Н-ЯМР (CDCl3): 10,14 м.д. (с, 1Н), 8,37 м.д. (д, 2Н), 8,02 м.д. (д, 2Н), 7,26 м.д. (т, 1Н), 6,64 м.д. (дд, 1Н), 6,54 м.д. (дд+т, 2Н), 2,97 м.д. (с, 6Н).
Стадия 3. Синтез 3-(диметиламино)фенил-4-((3-(триэтоксисилил)пропилимино)метил)бензоата
50 мг (0,19 ммоль) 3-(диэтиламино)фенил-4-формилбензоата суспендировали в 20 мл хлороформа и добавляли 41 мг (0,19 ммоль) 3-(аминопропил)триэтоксисилана, а затем 100 мг безводного сульфата магния. Полученную суспензию перемешивали при комнатной температуре в течение 24 часов под атмосферой азота. Неочищенный продукт отфильтровывали, и растворитель удаляли при пониженном давлении, что давало оранжевое масло (количественный выход).
1Н-ЯМР (CDCl3): 8,36 м.д. (с, 1Н), 8,24 м.д. (д, 2Н), 7,85 м.д. (д, 2Н), 7,27 м.д. (т, 1Н), 6,63 м.д. (дд, 1Н), 6,55 м.д. (м, 2Н), 3,85 м.д. (кв, 6Н), 3,67 м.д. (т, 2Н), 2,97 (с, 6Н), 1,86 м.д. (м, 2Н), 1,23 м.д. (т, 9Н), 0,70 м.д. (м, 2Н).
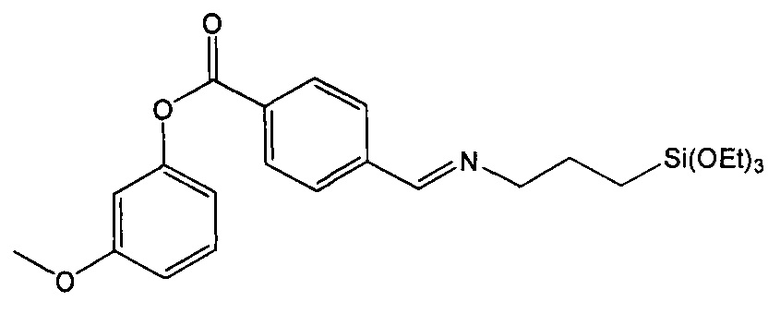
Пример 6. Синтез 3-метоксифенил-4-((3-(триэтоксисилил)пропилимино)метил)бензоата (соединение 6)
Стадия 1. Синтез 4-формилбензоилхлорида
0,92 г (6,13 ммоль) 4-формилбензойной кислоты суспендировали в 50 мл безводного толуола. Добавляли 16 мл тионилхлорида (0,22 моль), и полученную суспензию нагревали при 130°С в течение 3 часов под атмосферой азота, затем охлаждали до комнатной температуры, и растворитель испаряли при пониженном давлении. Дополнительно добавляли 50 мл толуола и выпаривали при пониженном давлении для удаления, возможно, оставшегося тионилхлорида. Этот процесс повторяли дважды. Полученное твердое вещество использовали непосредственно без дополнительной очистки.
Стадия 2. Синтез 3-метоксифенил-4-формилбензоата
0,76 г (6,13 ммоль) 3-метоксифенола суспендировали в 50 мл дихлорметана и растворяли, добавляя 0,85 мл (6,13 ммоль) триэтиламина. Полученный раствор перемешивали в течение 30 минут, а затем по каплям добавляли раствор, содержащий 4-формилбензоилхлорид в дихлорметане (6,13 ммоль ацилхлорида в 20 мл растворителя). Полученный раствор перемешивали при комнатной температуре в течение 5 часов, затем экстрагировали насыщенным водным раствором карбоната натрия (3×40 мл), сушили над сульфатом магния, и испаряли растворитель при пониженном давлении. Получали белое твердое вещество с чистотой 96%, что оценено с помощью ВЭЖХ (выход 90%).
1Н-ЯМР (CDCl3): 10,14 м.д. (с, 1Н), 8,37 м.д. (д, 2Н), 8,02 м.д. (д, 2Н), 7,34 м.д. (т, 1Н), 6,84 м.д. (тд, 2Н), 6,78 м.д. (т, 1Н), 3,83 м.д. (с, 3Н).
Стадия 3. Синтез 3-метоксифенил-4-((3-(триэтоксисилил)пропилимино)метил)бензоата
50 мг (0,20 ммоль) 3-метоксифенил-4-формилбензоата суспендировали в 20 мл хлороформа и добавляли 43 мг (0,20 ммоль) 3-(аминопропил)триэтоксисилана, а затем 100 мг безводного сульфата магния. Полученную суспензию перемешивали при комнатной температуре в течение 24 часов под атмосферой азота. Неочищенный продукт отфильтровывали, и растворитель удаляли при пониженном давлении, что давало оранжевое масло (количественный выход).
1Н-ЯМР (CDCl3): 8,36 м.д. (с, 1Н), 8,24 м.д. (д, 2Н), 7,85 м.д. (д, 2Н), 7,32 м.д. (т, 1Н), 6,83 м.д. (м, 2Н), 6,79 м.д. (т, 1Н), 3,83 м.д. (кв+с, 6Н+3Н ОМе), 3,67 м.д. (т, 2Н), 1,86 м.д. (м, 2Н), 1,23 м.д. (т, 9Н), 0,70 м.д. (м, 2Н).
Пример 7. Получение частиц
7.1. Параметры частиц
Частицы, полученные в соответствии со способами, описанными ниже, характеризовали с помощью распределения по размерам, спектроскопии в УФ и видимой областях и ВЭЖХ.
7.1.1 Морфология частиц
Распределение частиц по размерам указывает на то, что частицы являются монодисперсными с размером 370±70 нм.
7.1.2. Спектроскопия в УФ и видимой областях
3%-ю суспензию частиц в ПЭГ-300 (30 мг/мл) помещали на пластину из ПММА в концентрации 1,3 мг/см2. Частицы интенсивно поглощают в области УФ-В и незначительно в области УФ-А, когда спектр в УФ и видимой областях регистрировали на шаровом фотометре в режиме диффузного пропускания.
7.1.3. ВЭЖХ-анализ
Герметичность частиц определяли путем экстракции растворителями при высокой температуре, экстракты анализировали с помощью ВЭЖХ. Частицы (200 мг) и 100 мл смеси метанола и воды (80:20) нагревали с обратным холодильником в аппарате Сокслета в течение 5 часов. Образцы растворителя анализировали с помощью ВЭЖХ при следующих условиях:
- Оборудование: жидкостный хроматограф HP 1090
- Колонка: Kromasil С18 5 мкм 15×0,46 для обратно-фазовой хроматографии
- Подвижная фаза: ацетонитрил/вода 80:20
- Поток: 1,0 мл/мин
- Обнаружение: поглощение при 254 нм
На хроматограммах частиц обнаружено только мертвое время растворителя, следовательно, это указывает на то, что частицы в значительной степени герметичны.
7.2. Фотопревращение частиц
Частицы, суспендированные в ПЭГ-300, облучали при 35°С в фотохимическом реакторе Luzchem ICH-2, оснащенном 16 УФ-В лампами (интенсивность излучения 70 Вт/м2).
7.2.1 Спектроскопия в УФ и видимой областях
3%-ю суспензию частиц в ПЭГ-300 наносили на пластину из ПММА в концентрации 1,3 мг/см2. Ход фотопревращения контролировали, измеряя диффузное пропускание образца в диапазоне от 280 до 400 нм.
Спектр частиц указывает на то, что облученные частицы поглощают как области УФ-В, так и УФ-А.
7.2.2. ВЭЖХ-анализ
ВЭЖХ-анализ облученных микрокапсул выполняли так же, как и необлученных микрокапсул (2.4).
На хроматограммах частиц обнаружено только мертвое время растворителя, следовательно, это указывает на то, что частицы в значительной степени герметичны.
7.3. Получение:
частиц 3-(диэтиламино)фенил-4-((3-(триэтоксисилил)пропилимино)метил)бензоата (Р1);
частиц 3-(диэтиламино)фенил-4-((3-(триэтоксисилил)пропилкарбамоилокси)метил)бензоата (Р2);
частиц 3-(диметиламино)фенил-4-((3-(триэтоксисилил)пропилкарбамоилокси)метил)бензоата (Р3);
частиц 3-метоксифенил-4-((3-(триэтоксисилил)пропилкарбамоилокси)метил)бензоата (Р4);
частиц 3-(диметиламино)фенил-4-((3-(триэтоксисилил)пропилимино)метил)бензоата (Р5);
частиц 3-метоксифенил-4-((3-(триэтоксисилил)пропилимино)метил)бензоата (P6).
Частицы Р1 получены следующим образом. Смесь этанола (3,8 мл, 0,082 ммоль) и деионизированной воды (1,4 мл, 0,078 ммоль) нагревали на водяной бане при 40°C с перемешиванием. Смесь тетраэтоксисилана (ТЭОС, 396 мг, 1,903 ммоль) и 3-(диэтиламино)фенил-4-((3-(триэтоксисилил)пропилимино)метил)бензоата (150 мг, 0,326 ммоль) нагревали без перемешивания на той же бане. Когда температура смеси этанол/вода достигла 40°С, добавляли 1,7 мл 30%-ого аммиака (0,011 ммоль), и перемешивание усиливали, чтобы обеспечить гомогенность смеси. Когда температура снова достигла 40°С, добавляли раствор ТЭОС и 3-(3-(триэтоксисилил)пропокси)фенилбензоата и перемешивали в течение 15 секунд. Полученную суспензию оставляли на 1 час при 40°С, затем центрифугировали и промывали водой (25 мл × 3). В конце, частицы ресуспендировали в водном растворе, содержащем 0,5% масс. ПВП k-90 и ГПМЦ в качестве стабилизаторов. Содержание хромофора в частицах составляло 50% масс. в расчете на 3-(диэтиламино)фенил-4-метилбензоат.
Частицы Р2-Р6 были получены из подходящих реагентов в соответствии со способом синтеза, описанным выше. Для всех соединений с помощью ВЭЖХ оценивали герметичность. Подробности получения и анализа приведены в Таблице 1.
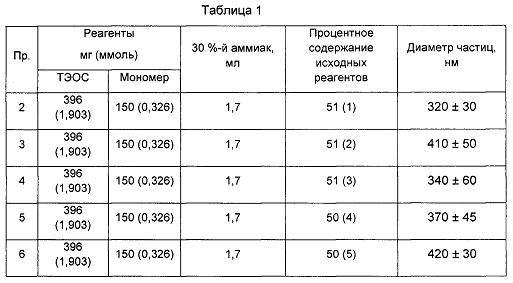
(1) в расчете на 3-(диэтиламино)фенил-4-метилбензоат
(2) в расчете на 3-(диметиламино)фенил-4-метилбензоат
(3) в расчете на 3-метоксифенил-4-метилбензоат
(4) в расчете на 3-(диметиламино)фенил-4-метилбензоат
(5) в расчете на 3-метоксифенил-4-метилбензоат
Пример 8. Приготовление солнцезащитной композиции
Солнцезащитную композицию готовили с использованием частиц Р1 в качестве активного ингредиента.
Компоненты композиции представлены в следующей таблице.

Объединяли ингредиенты фазы В. Смесь перемешивали и нагревали до 70-75°С. Объединяли ингредиенты фазы А. Смесь нагревали до 70-75°С при перемешивании. При перемешивании добавляли фазу В к фазе А. Добавляли консерванты. Смесь перемешивали, давали остыть до комнатной температуры.
Пример 9 (сравнительный). Изучение фотопревращения 3-метоксифенил-4-((3-(триэтоксисилил)пропилимино)метил)бензоата (соединение 6) и 3-(3-(триэтоксисилил)пропилокси)фенилбензоата.
Степень фотопревращения прекурсора 3-метоксифенил-4-((3-(триэтоксисилил)пропилимино)метил)бензоата (соединение 6 по настоящему изобретению) сравнивали со степенью фотопревращения прекурсора 3-(3-(триэтоксисилил)пропилокси)фенилбензоата, описанного ранее в данной области техники (соединение сравнения А).
Эти прекурсоры растворяли в этаноле в концентрации 1% (масса/объем) (10 мг/л) и подвергали воздействию искусственного солнечного излучения с использованием SUNTEST ATLAS XLS+, оснащенного фильтром дневного света (290-800 нм, 765 Вт/м2). Фиг. 7 и фиг. 8 иллюстрируют степень фотопревращения соединения 6 по данному изобретению и соединения сравнения А, соответственно. Вставки на каждом графике иллюстрируют кинетику фотопревращения при 335 нм.
Следующая таблица показывает конечное значение экстинкции для каждого прекурсора после того, как его подвергали действию искусственного солнечного излучения, а также время полупревращения (t50, количество МЭД, необходимое для достижения 50% конечного значения экстинкции).
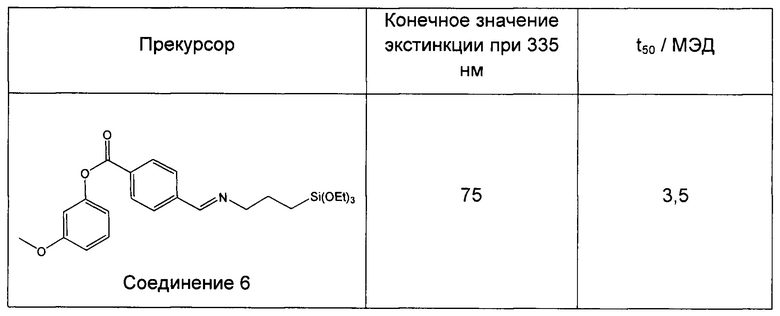
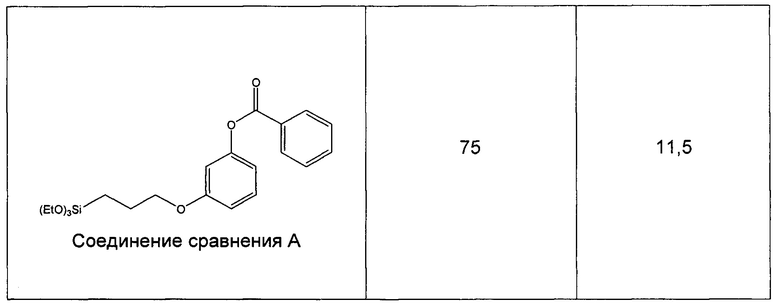
Как можно наблюдать, превращение соединения 6 в 3,3 раза быстрее, чем превращение соединения А. Таким образом, введение силилированной цепи а ацильное кольцо ускоряет его фотопревращение.
Пример 10 (сравнительный). Изучение фотопревращения 3-(диэтиламино)фенил-4-((3-(триэтоксисилил)пропилкарбамоилокси)метил)бензоата (соединение 1) и 3-(бис(3-(триэтоксисилил)пропил)амино)фенилбензоата (соединение сравнения В).
Степень фотопревращения прекурсора 3-(диэтиламино)фенил-4-((3-(триэтоксисилил)пропилкарбамоилокси)метил)бензоата (соединение 1 по настоящему изобретению) сравнивали со степенью фотопревращения прекурсора 3-(бис(3-(триэтоксисилил)пропил)амино)фенилбензоата, описанного ранее в данной области техники (соединение сравнения В).
Эти прекурсоры растворяли в этаноле в концентрации 1% (масса/объем) (10 мг/л) и подвергали воздействию искусственного солнечного излучения с использованием SUNTEST ATLAS XLS+, оснащенного фильтром дневного света (290-800 нм, 765 Вт/м2). Фиг. 9 и фиг. 10 иллюстрируют степень фотопревращения соединения 1 по данному изобретению и соединения сравнения В, соответственно. Вставки на каждом графике иллюстрируют кинетику фотопревращения при 360 нм.
Следующая таблица показывает конечные значения экстинкции для каждого прекурсора, после того, как его подвергали действию искусственного солнечного излучения, а также параметр t50, который обозначает МЭД (минимальную эритемную дозу) излучения, необходимую для достижения 50% конечного значения экстинкции для каждого прекурсора.
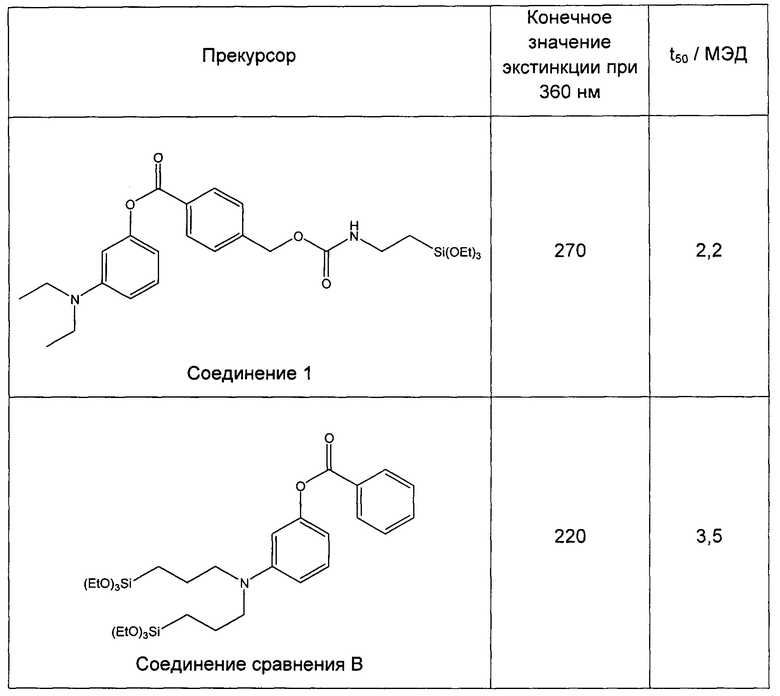
Из результатов, приведенных выше, можно сделать вывод, что введение силилированной цепи в ацильное кольцо дает как увеличение экстинкции на 22% после превращения, так и увеличение скорости превращения на 60%.
Пример 11 (сравнительный). Фотопревращение 3-метоксифенил-4-((3-(триэтоксисилил)пропилимино)метил)бензоата (соединение 6) и 3-(3-(триэтоксисилил)пропилокси)фенилбензоата (соединение сравнения А) в присутствии дополнительных имеющихся в продаже солнцезащитных средств
Готовили этанольный раствор (а), содержащий имеющиеся в продаже УФ-фильтры тиносорб S (3,7 мг/л) и 4-МВС (4,9 мг/л) и соединение 6 по данному изобретению (10 мг/л). Для сравнения также готовили этанольный раствор (b), содержащий имеющиеся в продаже УФ-фильтры тиносорб S (3,7 мг/л) и 4-МВС (4,9 мг/л) и соединение сравнения А (10 мг/л).
Оба раствора подвергали воздействию искусственного солнечного излучения с использованием SUNTEST ATLAS XLS+, оснащенного фильтром дневного света (290-800 нм, 765 Вт/м2).
Фиг. 11 и 12 иллюстрируют спектры поглощения растворов (а) и (b), соответственно. Можно наблюдать, что конечное значение экстинкции при 335 нм является более высоким для состава, содержащего соединение 6, чем для состава, содержащего соединение сравнения А. Следовательно можно сделать вывод, что введение силилированной цепи в ацильное кольцо дает прекурсор с лучшей способностью усиливать свое солнцезащитное действие в присутствии дополнительных УФ-фильтров.
Пример 12 (сравнительный). Фотопревращение 3-(диэтиламино)фенил-4-((3-(триэтоксисилил)пропилкарбамоилокси)метил)бензоата (соединение 1) и 3-(бис(3-(триэтоксисилил)пропил)амино)фенилбензоата (соединение сравнения В) в присутствии дополнительных имеющихся в продаже солнцезащитных средств
Готовили этанольный раствор (с), содержащий имеющиеся в продаже УФ-фильтры тиносорб S (3,7 мг/л) и 4-МВС (4,9 мг/л) и соединение 1 по данному изобретению (10 мг/л). Для сравнения также готовили этанольный раствор (d), содержащий имеющиеся в продаже УФ-фильтры тиносорб S (3,7 мг/л) и 4-МВС (4,9 мг/л) и соединение сравнения В (10 мг/л).
Оба раствора подвергали воздействию искусственного солнечного излучения с использованием SUNTEST ATLAS XLS+, оснащенного фильтром дневного света (290-800 нм, 765 Вт/м2). Фиг. 13 и 14 иллюстрируют спектры поглощения растворов (с) и (d), соответственно.
Можно наблюдать, что конечное значение экстинкции при 365 нм является более высоким для состава, содержащего соединение 1, тогда как в составе, содержащем соединение сравнения В, экстинкция при 365 нм остается практически постоянной после 20 МЭД излучения. Следовательно можно сделать вывод, что введение силилированной цепи в ацильное кольцо дает прекурсор с лучшей способностью усиливать защитное действие в области УФ-А в присутствии дополнительных УФ-фильтров.
Изобретение относится к кремнийорганическим полимерам в форме частиц, содержащим сложные эфиры бензойной кислоты, способам их получения, косметической или дерматологической композиции, содержащей их, а также к их применению для защиты организма человека или животного от УФ-излучения. Предложен способ получения перспективного кремнийорганического фотозащитного полимера, включающий реакцию мономера формулы (I), где R представляет собой фрагмент формулы (i), где R1, R3, R4, R5, R6, R7, R8 и R9 представляют H; R2 выбран из OR10 и NR12R13; R10, R12 и R13 представляет собой (С1-С6)алкил; L представляет собой линкер, выбранный из -CH=N- и -(CH2)-О-C(О)-NH-; Ra, Rb и Rc представляет собой (С1-С6)алкил; p=3; s и t равны 1; с соединением формулы (IV), где Rd, Re, Rf и Rg представляют собой (С1-С6)алкил; w1 и w2 равны 1; в смеси алканол/вода. Предложен также получаемый предлагаемым способом полимер и варианты его применения, а также варианты получения мономера (I). Технический результат – предложенный способ позволяет экономически эффективно получить новые солнцезащитные соединения, имеющие улучшенную способность защищать от УФ-излучения. 10 н. и 5 з.п. ф-лы, 14 ил., 4 табл., 12 пр.
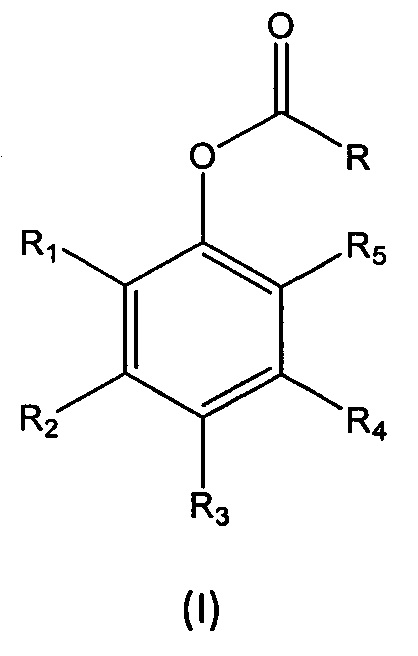
1. Способ получения перспективного кремнийорганического фотозащитного полимера, включающий реакцию мономера формулы (I):
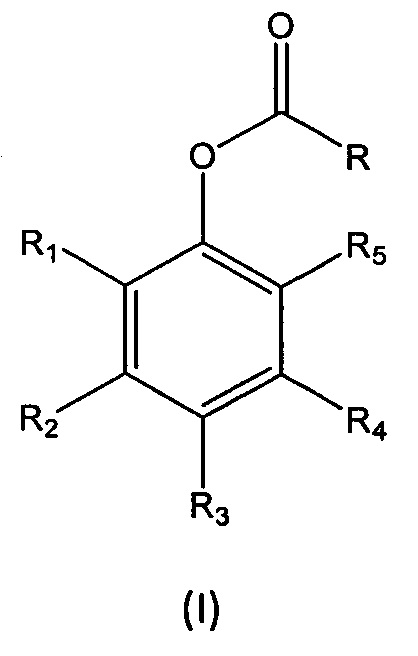
где
R представляет собой (i):
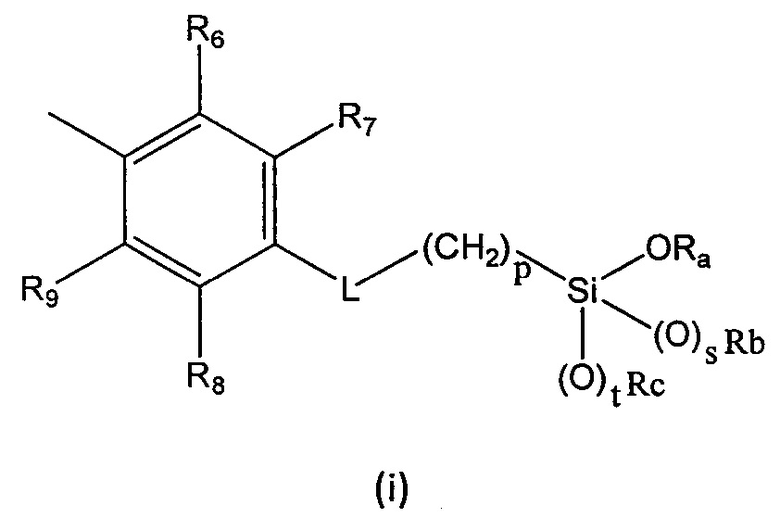
где
R1, R3, R4, R5, R6, R7, R8 и R9 представляют H;
R2 выбран из OR10 и NR12R13;
R10, R12 и R13 представляют собой (С1-С6)алкил;
L представляет собой линкер, выбранный из:
-CH=N- и -(CH2)-О-C(О)-NH-
Ra, Rb и Rc представляют собой (С1-С6)алкил;
p=3;
s и t равны 1,
с соединением формулы (IV):
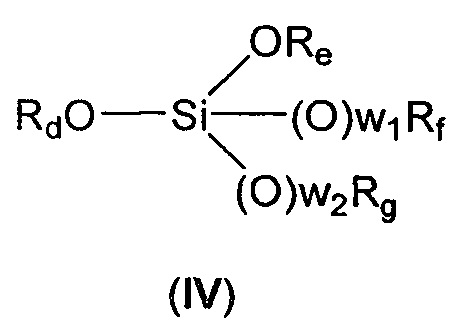
где
Rd, Re, Rf и Rg представляют собой (С1-С6)алкил,
w1 и w2 равны 1,
в смеси алканол/вода.
2. Способ по п. 1, дополнительно характеризующийся присутствием азотсодержащего основного соединения, выбранного из группы, состоящей из аммиака, моноалкиламина, диалкиламина, триалкиламина, моноалканоламина, диалканоламина и триалканоламина, причем как алкильная, так и алканольная группы являются линейными или разветвленными, содержащими от 1 до 6 атомов углерода.
3. Способ по пп. 1, 2, отличающийся тем, что смесь алканол/вода представляет собой смесь этанол/вода.
4. Перспективный кремнийорганический фотозащитный полимер, получаемый с помощью способа, описанного в любом из пп. 1-3, характеризующийся тем, что представлен в форме микро- или наночастиц.
5. Применение перспективного кремнийорганического фотозащитного полимера по п. 4 для получения косметической или дерматологической композиции для защиты организма человека или животного от УФ-излучения.
6. Применение фотозащитного полимера по п. 4 в качестве фотохимического прекурсора УФ-поглотителей.
7. Применение фотозащитного полимера по п. 4 для получения косметической или дерматологической композиции для нанесения на поверхность тела человека или животного, которая характеризуется эффективной УФ-защитой, зависящей от времени воздействия солнца и интенсивности солнечного излучения.
8. Фотозащитный полимер по п. 4 для применения с целью защиты организма человека или животного от УФ-излучения.
9. Косметическая или дерматологическая композиция, содержащая перспективный кремнийорганический фотозащитный полимер по п. 4 или смесь полимеров.
10. Косметическая или дерматологическая композиция по п. 9, содержащая эффективное количество кремнийорганического полимера или смеси полимеров, подвергающихся фотохимическому превращению in situ с образованием солнцезащитных соединений с усиленной защитной способностью.
11. Косметическая или дерматологическая композиция по п. 9 или 10, характеризующаяся тем, что содержание полимеров колеблется от 0,01% до 40% по массе в пересчете на общую массу композиции.
12. Косметическая или дерматологическая композиция по любому из пп. 9-11, дополнительно содержащая солнцезащитное соединение, выбранное из авобензона, 2-этилгексил-л-метоксициннамата, оксибензона, октилдиметил-л-аминобензойной кислоты, диоксибензона, этил-4-[бис(гидроксипропил)]аминобензоата, 2-этилгексил-2-циан-3,3-дифенилакрилата, 2-этилгексилсалицилата, глицерил-п-аминобензоата, 3,3,5-триметилциклогексилсалицилата, метилантранилата, п-диметиламинобензойной кислоты, 2-этилгексил-п-диметиламинобензоата, 2-фенилбензимидазол-5-сульфоновой кислоты, 2-п-диметиламинофенил-5-сульфонийбензоксазоловой кислоты, сулисобензона, гексил-2-(4-диэтиламино-2-гидроксибензоил)бензоата, 2-(4-метилбензилиден)камфоры и 4-изопропилдибензоилметана.
13. Мономер формулы (I):
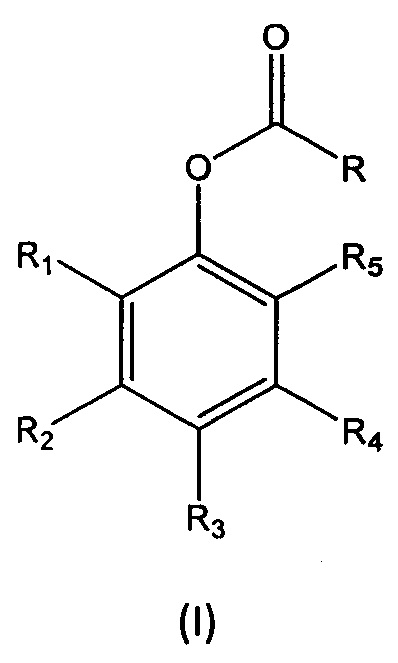
где
R представляет собой (i):
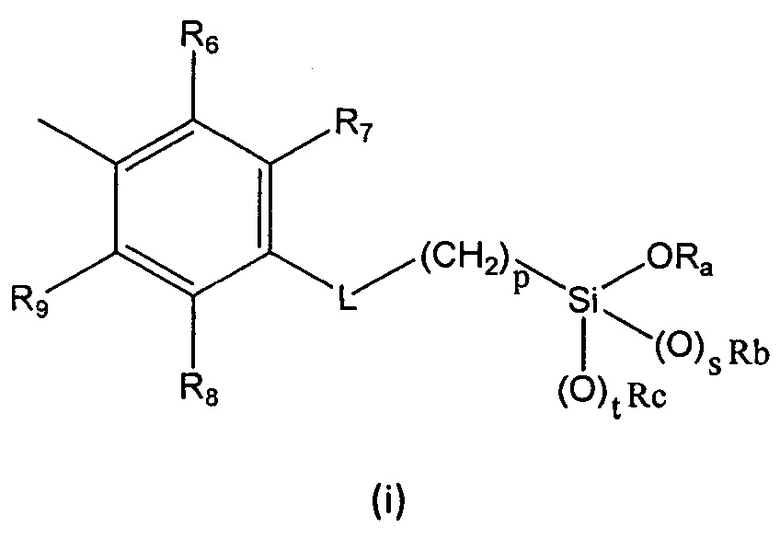
где
R1, R3, R4, R5, R6, R7, R8 и R9 представляют собой H,
R2 выбран из OR10 и NR12R13;
R10, R12 и R13 представляют собой (С1-С6)алкил;
L представляет собой линкер, выбранный из:
-CH=N- и -(CH2)-О-C(О)-NH-
Ra, Rb и Rc представляют собой (С1-С6)алкил;
p=3;
s и t равны 1,
или его энантиомерные формы, или его косметически или дерматологически приемлемые соли.
14. Способ получения мономера формулы (I), описанного выше, в случае если L представляет собой группу -CH=N-, включающий реакцию соединения формулы (II):
где
R1, R3, R4, R5, R6, R7, R8 и R9 представляют собой H,
R2 выбран из OR10 и NR12R13;
R10, R12 и R13 представляют собой (С1-С6)алкил
и
R' представляет собой (i'):
где
R6, R7, R8 и R9 представляют собой Н,
с соединением формулы (III):
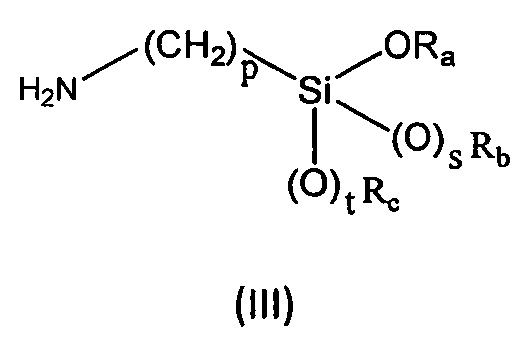
где
Ra, Rb, Rc, представляют собой (С1-С6)алкил;
p=3;
s и t равны 1.
15. Способ получения мономера формулы (I), описанного выше, в случае если L представляет собой группу -CH2-O-C(O)-NH-, включающий:
а) реакцию восстановления соединения формулы (II), описанного выше, в присутствии восстанавливающего агента, для получения соединение формулы (V):
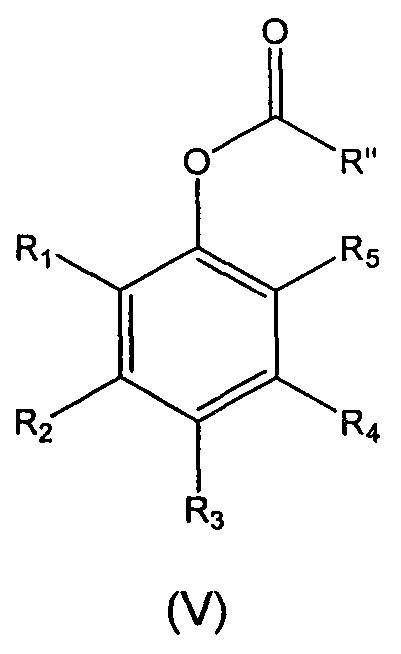
где
R1, R3, R4, R5, R6, R7, R8 и R9 представляют собой H;
R2 выбран из OR10 и NR12R13;
R10, R12 и R13 представляют собой (С1-С6)алкил;
R'' представляет собой (I''):
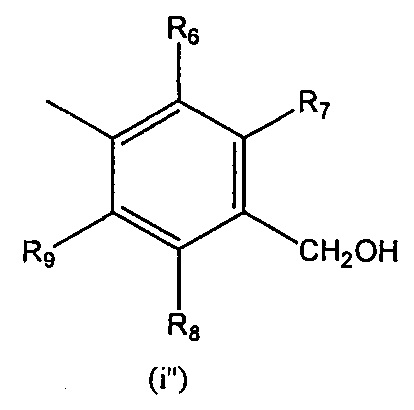
и
b) реакцию соединения формулы (V), описанного выше, с соединением формулы (VI):
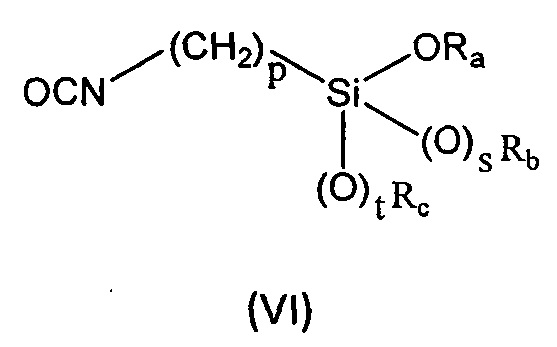
где
Ra, Rb и Rc представляют собой (С1-С6)алкил;
p=3;
s и t равны 1.
| RU 2012119907 A, 20.11.2013 | |||
| Захват для полуосей с грибовидной головкой | 1972 |
|
SU471277A1 |
| СЛОЖНОЭФИРНЫЕ СОЕДИНЕНИЯ БЕНЗОЙНОЙ КИСЛОТЫ, КОМПОЗИЦИЯ (ВАРИАНТЫ) И СПОСОБ ПОЛУЧЕНИЯ КОМПОЗИЦИИ (ВАРИАНТЫ) | 2006 |
|
RU2485936C2 |
| ОРГАНОСИЛ(ОКС)АНЫ, СОДЕРЖАЩИЕ ИХ КОСМЕТИЧЕСКИЕ КОМПОЗИЦИИ, И СПОСОБ ЗАЩИТЫ КОЖИ И/ИЛИ ВОЛОС ОТ УЛЬТРАФИОЛЕТОВОГО ИЗЛУЧЕНИЯ | 1995 |
|
RU2133119C1 |
Авторы
Даты
2018-04-25—Публикация
2015-05-18—Подача