ОБЛАСТЬ ТЕХНИКИ
Изобретение относится к области фармацевтической химии и фармакотерапии, особенно к соединениям тиено[3,2-d]пиримидин-4-он, способу их получения, фармацевтической композиции, содержащей такое соединение и их применению.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Диабет является распространенным метаболическим заболеванием. Он характеризуется аномально высокой концентрацией глюкозы в плазме, наблюдаемой в состоянии натощак или во время теста на толерантность к глюкозе и гипергликемии. Всемирная организация здравоохранения делит диабет на тип 1 и тип 2 в соответствии с клиническими формами, и большинство больных диабетом страдают от сахарного диабета 2 типа (СД 2 типа). Сахарный диабет 2 типа, также известный как инсулиннезависимый сахарный диабет, сопровождается высокими сосудистыми осложнениями, такими как ишемическая болезнь сердца, инсульт, высокое кровяное давление, заболевание почек, заболевание периферических сосудов, неврологические заболевания и ретинопатия. Это нарушение обмена веществ стало проблемой общественного здравоохранения. В мире насчитывается почти 194 млн. больных сахарным диабетом согласно опросу Всемирной организации здравоохранения и это количество увеличится до 366 миллионов к 2030 году. Усиление секреции инсулина β-клетками поджелудочной железы является основным средством для лечения СД 2 типа, однако, в дополнение к терапевтическим эффектам, существуют некоторые побочные эффекты, такие как: низкий уровень сахара в крови, увеличение веса, сердечно-сосудистая патология и смерть β-клеток и тому подобное.
Исследования показали, что осложнения у больных СД 2 типа снижаются на 35%, если количество гликозилированного гемоглобина A1c (HbA1c) уменьшается на 1%. Поэтому уменьшение осложнений и неблагоприятных побочных эффектов, является главной темой при лечении диабета 2 типа. Клинически проверенными мишенями при лечении диабета, являются рецепторы, активируемые пероксисомными пролифераторами α/γ (PPAR), глюкагоноподобный пептид-1 (GLP-1), дипептидилпептидаза IV (DPPIV, DPP4) и тому подобное. Ингибиторы DPPIV стали новым выбором для лечения диабета 2 типа, и до сих пор являются относительно безопасными и эффективными лекарственными средствами, вводят ли их отдельно или в комбинации.
Дипептидилпептидаза IV (DPPIV, также известная как T-клеточный антиген CD26) представляет собой сериновую протеазу с высокой специфичностью, в форме димера. Она имеет два состояния, одним из которых является трансмембранная протеаза, включающая 766 аминокислот, широко распространенная в почках, ворсинках стенки кишечника, клеточных мембранах, гепатоцитах, эндотелии сосудов, T-клетках, B-клетках, и NK-клетках (Natural killer, натуральные киллеры). При другом состоянии она существует в плазме в растворенной форме. Наиболее важным действием для фермента DPPIV является гидролиз полипептидов, которые содержат аланин или пролиновую цепь в N-конце пептидной цепи, например, гидролиз GLP-1. Если активность DPPIV может быть ингибирована, то содержание GLP-1 in vivo может быть косвенно улучшено, что может вызвать серию физиологических действий in vivo и назначение лечения диабета 2 типа будет достигнуто.
В настоящее время наиболее широко используемыми лекарственными средствами являются антидиабетические лекарственные средства, для лечения диабета 2 типа, связанные с GLP-1, такие как (a) аналоги GLP-1, устойчивые к DPPIV; (b) низкомолекулярные агонисты рецептора GLP-1; и (c) ингибиторы DPPIV. В качестве нового перорального сахароснижающего агента ингибитор DPPIV может предотвратить быстрое расщепление гормона инкретина и улучшить уровень GLP-1 после приема пищи с небольшими побочными эффектами и хорошими эффектами. Недавние исследования показали, что ингибиторы DPPIV могут снизить уровень гликозилированного гемоглобина A1c, при введении отдельно или в сочетании с другими антидиабетическими агентами. Кроме того, риск развития гипогликемии мал, поэтому ингибиторы DPPIV уже привлекают все больше и больше внимания со стороны фармацевтических фирм.
Исследования ингибиторов DPPIV уже сделали большой прорыв. Теперь лекарственные средства на рынке включают ситаглиптин от Merck, вилдаглиптин от Novartis, саксаглиптин от Bristol-Myers Squibb, алоглиптин от Takeda, линаглиптин от Boehringer Ingelheim и тому подобное. Поскольку сериновая протеиназа имеет также другие семейства, то, во-первых, должны быть рассмотрены проблемы их селективности и, во-вторых, следует избегать побочных эффектов. Таким образом, изучение ингибиторов DPPIV по-прежнему является большой проблемой.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Одной из задач настоящего изобретения является создание новых соединений тиено[3,2-d]пиримидин-4-он с DPPIV-ингибирующей активностью, со структурой, общая формула которой показана в виде следующей формулы (I).
Другой задачей настоящего изобретения является создание способа синтезирования новых соединений тиено[3,2-d]пиримидин-4-он с использованием 6,7-замещенного 2,4-диметокси тиенил [3,2-d]пиримидина в качестве исходного вещества.
Еще одной задачей настоящего изобретения является создание фармацевтической композиции, содержащей соединение тиено[3,2-d]пиримидин-4-он.
Следующей задачей настоящего изобретения является обеспечение применения соединения тиено[3,2-d]пиримидин-4-он при изготовлении лекарственного средства для лечения диабета.
Соединения согласно настоящему изобретению могут быть использованы в качестве не-пептидного низкомолекулярного ингибитора для DPPIV и могут достигнуть своего назначения при лечении диабета 2 типа путем ингибирования активности DPPIV, косвенно увеличивая содержание GLP-1 in vivo и вызывая ряд физиологических действий in vivo. Следовательно, соединения могут быть разработаны в качестве новых перспективных препаратов для лечения диабета 2 типа.
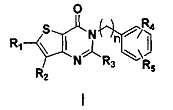
где
n представляет собой целое число от 1 до 3;
R1 и R2 являются одинаковыми или различными и не являются водородом одновременно, и каждый из R1 и R2 независимо представляет собой H, галоген, CBr2H, CCl2H, CF2H, циано, CF3, альдегидную группу, (CH2)mOR6, (CH2)mNR6R7, 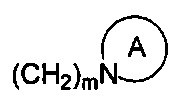 , (CH2)mCOOR8, CONR9R10 или
, (CH2)mCOOR8, CONR9R10 или  , где
, где
R1 и R2 могут быть связаны вместе с образованием C3-C6-алкилидена, но не обязательно;
m представляет собой целое число от 0 до 3;
R6 и R7 являются одинаковыми или различными, и каждый из R6 и R7 независимо выбран из H, линейного или разветвленного, насыщенного или ненасыщенного C1-C6 углеводородного остатка, C3-C7 циклического углеводородного остатка, алкокси C1-C3, 4-7-членной гетероциклической группы, С1-С4 алкилоил RCO, С5-С7 ароил ArCO, С1-С4 алкилсульфонила RSO2, С5-С7 арилсульфонила ArSO2, C5-C7 ароилметилена, 5-7 членного гетероароилметилена, бензила, пиридиндиметилена, C5-C7 арила Ar или 5-7-членного гетероарила; где линейный или разветвленный, насыщенный или ненасыщенный C1-C6 углеводородный остаток замещен одним или несколькими заместителями, выбранными из метилсульфонила, циклопропила, гидрокси, C1-C3 алкокси, C1-C3 алкоксикарбонила и эпоксипропила, но не обязательно; гетероциклическая группа содержит 1-3 гетероатома, выбранных из O, S и N, метилен гетероциклической группы замещен на карбонил или сульфонил, но не обязательно, или гетероциклическая группа замещена одним или несколькими заместителями, выбранными из галогена, линейного или разветвленного C1-C6 углеводородного остатка, циано, нитро, амино, гидрокси, гидроксиметила, трифторметила, трифторметокси, карбоксила, C1-C4 алкокси, C1-C4 алкоксикарбонила, меркапто, C1-C4 ацила и C5-C7 арила Ar, но не обязательно; арил или бензил замещены одним или несколькими заместителями, выбранными из галогена, линейного или разветвленного С1-С6 углеводородного остатка, циано, нитро, амино, гидрокси, гидроксиметила, трифторметила, трифторметокси, карбоксила, С1-С4 алкокси, меркапто, С1-С4 ацила и С5-С7 арила Ar, но не обязательно; гетероарил содержит 1-3 гетероатома, выбранных из O, S и N, в сочетании с фенилом или С5-С7 гетероарилом, но не обязательно, или замещен одним или несколькими заместителями, выбранными из галогена, линейного или разветвленного С1-С6 углеводородного остатка, циано, нитро, амино, гидрокси, гидроксиметила, трифторметила, трифторметокси, карбоксила, С1-С4 алкокси, меркапто, С1-С4 ацила и С5-С7 арила Ar;
R8 выбран из H, линейного или разветвленного, насыщенного или ненасыщенного С1-С6 углеводородного остатка, С3-С7 циклического углеводородного остатка;
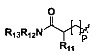
R9 и R10 являются одинаковыми или различными, и каждый независимо выбран из Н, 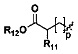 ,
,  , линейного или разветвленного, насыщенного или ненасыщенного С1-С6 углеводородного остатка, С3-С7 циклического углеводородного остатка, С4-С7 гетероциклической группы, С5-С7 ароилметилена, 5-7 членного гетероароилметилена, бензила, пиридиндиметилена, С5-С7 арила Ar или 5-7 членного гетероарила; где линейный или разветвленный насыщенный или ненасыщенный С1-С6 углеводородный остаток замещен одним или несколькими заместителями, выбранными из метилсульфонила, циклопропила, гидрокси, C1-C3 алкокси, C1-C3 алкоксикарбонила, и эпоксипропила, но не обязательно; гетероциклическая группа содержит 1-3 гетероатома, выбранных из O, S и N, метилен гетероциклической группы замещен карбонилом или сульфонилом, но не обязательно, или гетероциклическая группа замещена одним или несколькими заместителями, выбранными из галогена, линейного или разветвленного С1-С6 углеводородного остатка, циано, нитро, амино, гидрокси, гидроксиметила, трифторметила, трифторметокси, карбоксила, С1-С4 алкокси, меркапто, С1-С4 ацила и С5-С7 арила Ar, но не обязательно; арил или бензил замещены одним или несколькими заместителями, выбранными из галогена, линейного или разветвленного С1-С6 углеводородного остатка, циано, нитро, амино, гидрокси, гидроксиметила, трифторметила, трифторметокси, карбоксила, С1-С4 алкокси, меркапто, С1-С4 ацила и С5-С7 арила Ar, но не обязательно; гетероарил содержит 1-3 гетероатома, выбранных из O, S и N, в сочетании с фенилом или С5-С7 гетероарилом, но не обязательно, или замещен одним или несколькими заместителями, выбранными из галогена, линейного или разветвленного С1-С6 углеводородного остатка, циано, нитро, амино, гидрокси, гидроксиметила, трифторметила, трифторметокси, карбоксила, С1-С4 алкокси, меркапто, С1-С4 ацила и С5-С7 арила Ar;
, линейного или разветвленного, насыщенного или ненасыщенного С1-С6 углеводородного остатка, С3-С7 циклического углеводородного остатка, С4-С7 гетероциклической группы, С5-С7 ароилметилена, 5-7 членного гетероароилметилена, бензила, пиридиндиметилена, С5-С7 арила Ar или 5-7 членного гетероарила; где линейный или разветвленный насыщенный или ненасыщенный С1-С6 углеводородный остаток замещен одним или несколькими заместителями, выбранными из метилсульфонила, циклопропила, гидрокси, C1-C3 алкокси, C1-C3 алкоксикарбонила, и эпоксипропила, но не обязательно; гетероциклическая группа содержит 1-3 гетероатома, выбранных из O, S и N, метилен гетероциклической группы замещен карбонилом или сульфонилом, но не обязательно, или гетероциклическая группа замещена одним или несколькими заместителями, выбранными из галогена, линейного или разветвленного С1-С6 углеводородного остатка, циано, нитро, амино, гидрокси, гидроксиметила, трифторметила, трифторметокси, карбоксила, С1-С4 алкокси, меркапто, С1-С4 ацила и С5-С7 арила Ar, но не обязательно; арил или бензил замещены одним или несколькими заместителями, выбранными из галогена, линейного или разветвленного С1-С6 углеводородного остатка, циано, нитро, амино, гидрокси, гидроксиметила, трифторметила, трифторметокси, карбоксила, С1-С4 алкокси, меркапто, С1-С4 ацила и С5-С7 арила Ar, но не обязательно; гетероарил содержит 1-3 гетероатома, выбранных из O, S и N, в сочетании с фенилом или С5-С7 гетероарилом, но не обязательно, или замещен одним или несколькими заместителями, выбранными из галогена, линейного или разветвленного С1-С6 углеводородного остатка, циано, нитро, амино, гидрокси, гидроксиметила, трифторметила, трифторметокси, карбоксила, С1-С4 алкокси, меркапто, С1-С4 ацила и С5-С7 арила Ar;
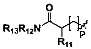
p представляет собой целое число от 0 до 2;
R11, R12 и R13 являются одинаковыми или различными, каждый из которых независимо выбран из H, линейного или разветвленного, насыщенного или ненасыщенного С1-С6 углеводородного остатка, С3-С7 циклического углеводородного остатка, фенила или бензила; где фенил или бензил являются замещенными одним или несколькими заместителями, выбранными из галогена, линейного или разветвленного C1-C3 углеводородного остатка, циано, нитро, амино, гидрокси, гидроксиметила, трифторметила, трифторметокси, карбоксила и С1-С4 алкокси, но не обязательно;
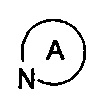
 представляет собой 3-7-членную азотсодержащую гетероциклическую группу, гетероциклическая группа, дополнительно содержит 1-3 гетероатома, выбранных из O, S и N, и метилен гетероциклической группы замещен на карбонил или сульфонил, но не обязательно, а гетероциклическая группа замещена 1-5 заместителями, выбранными из H, линейного или разветвленного С1-С6 углеводородного остатка, галогена, циано, нитро, амино, гидрокси, гидроксиметила, трифторметила, трифторметокси, карбоксила, ациламино, карбоксилатной группы, С1-С4 алкоксикарбонила, меркапто, С1-С4 алкокси и гидроксиамино, но не обязательно;
представляет собой 3-7-членную азотсодержащую гетероциклическую группу, гетероциклическая группа, дополнительно содержит 1-3 гетероатома, выбранных из O, S и N, и метилен гетероциклической группы замещен на карбонил или сульфонил, но не обязательно, а гетероциклическая группа замещена 1-5 заместителями, выбранными из H, линейного или разветвленного С1-С6 углеводородного остатка, галогена, циано, нитро, амино, гидрокси, гидроксиметила, трифторметила, трифторметокси, карбоксила, ациламино, карбоксилатной группы, С1-С4 алкоксикарбонила, меркапто, С1-С4 алкокси и гидроксиамино, но не обязательно;
R3 выбран из NR14R15 или 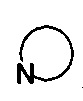 , где R14 и R15 одинаковы или различны, и каждый из R14 и R15 независимо представляет собой H, линейный или разветвленный, насыщенный или ненасыщенный С1-С6 углеводородный остаток и гидрокарбоксил, С3-С7 циклический углеводородный остаток, С1-С6 углеводородный остаток амино, С1-С6 углеводородный остаток амино гидрокси, С1-С6 углеводородный остаток амидино, С1-С6 углеводородный остаток гуанидил, бензил, С5-С7 арил Ar или 5-7-членный гетероарил, и гетероарил содержит 1-3 гетероатома, выбранных из O, S и N, в сочетании с фенилом или С5-С7 гетероарилом, но не обязательно, или замещен одним или несколькими заместителями, выбранными из галогена, линейного или разветвленного С1-С6 углеводородного остатка, циано, нитро, амино, гидрокси, гидроксиметила, трифторметила, трифторметокси, карбоксила, С1-С4 алкокси, меркапто, С1-С4 ацила и С5-С7 арила Ar;
, где R14 и R15 одинаковы или различны, и каждый из R14 и R15 независимо представляет собой H, линейный или разветвленный, насыщенный или ненасыщенный С1-С6 углеводородный остаток и гидрокарбоксил, С3-С7 циклический углеводородный остаток, С1-С6 углеводородный остаток амино, С1-С6 углеводородный остаток амино гидрокси, С1-С6 углеводородный остаток амидино, С1-С6 углеводородный остаток гуанидил, бензил, С5-С7 арил Ar или 5-7-членный гетероарил, и гетероарил содержит 1-3 гетероатома, выбранных из O, S и N, в сочетании с фенилом или С5-С7 гетероарилом, но не обязательно, или замещен одним или несколькими заместителями, выбранными из галогена, линейного или разветвленного С1-С6 углеводородного остатка, циано, нитро, амино, гидрокси, гидроксиметила, трифторметила, трифторметокси, карбоксила, С1-С4 алкокси, меркапто, С1-С4 ацила и С5-С7 арила Ar;
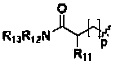
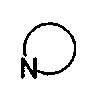 представляет собой 3-7-членную азотсодержащую гетероциклическую группу, и гетероциклическая группа дополнительно содержит 1-4 гетероатома, выбранных из O, S и N, и замещена 1-5 заместителями, выбранными из Н, линейного или разветвленного С1-С6 углеводородного остатка, галогена, циано, нитро, амино, гидрокси, гидроксиметила, трифторметила, трифторметокси, карбоксила, ациламино, карбоксилатной группы, С1-С4 алкокси карбонила, меркапто, амидино, гуанидила и гидроксиамино;
представляет собой 3-7-членную азотсодержащую гетероциклическую группу, и гетероциклическая группа дополнительно содержит 1-4 гетероатома, выбранных из O, S и N, и замещена 1-5 заместителями, выбранными из Н, линейного или разветвленного С1-С6 углеводородного остатка, галогена, циано, нитро, амино, гидрокси, гидроксиметила, трифторметила, трифторметокси, карбоксила, ациламино, карбоксилатной группы, С1-С4 алкокси карбонила, меркапто, амидино, гуанидила и гидроксиамино;
R4 и R5 являются одинаковыми или различными, и каждый из R4 и R5 независимо представляет собой Н, галоген, линейный или разветвленный C1-C6 углеводородный остаток, циано, нитро, амино, гидрокси, гидрокси метил, трифторметил, трифторметокси, карбоксил, С1-С4 алкокси, меркапто, С1-С4 ацил, С1-С4 сульфонил, С1-С4 сульфонил амино, аминоацил или сульфонил, замещенный С1-С4 линейным или разветвленным алкилом;
галоген представляет собой фтор-, хлор-, бром- или йод-.
Одним предпочтительным воплощением формулы (I) соединения по настоящему изобретению является следующее тиено[3,2-d]пиримидин-4-он соединение, энантиомер, диастереоизомер, рацемат и их смеси, или его фармацевтически приемлемая соль, где:
n представляет собой 1;
R1 и R2 являются одинаковыми или различными и не являются водородом одновременно, каждый из которых независимо представляет собой H, галоген, CBr2H, CCl2H, CF2H, циано, CF3, альдегидную группу, (CH2)mOR6, (CH2)mNR6R7, 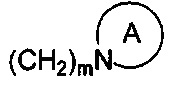 , (CH2)mCOOR8, CONR9R10 или
, (CH2)mCOOR8, CONR9R10 или  , где
, где
R1 и R2 могут быть связаны вместе с образованием С3-С6 алкилидена, но не обязательно;
m представляет собой целое число от 0 до 3;
R6 и R7 являются одинаковыми или различными, и каждый из R6 и R7 независимо выбран из Н, линейного или разветвленного С1-С6 алкила, С3-С7 циклоалкила, C1-C3 алкокси, 4-7-членной гетероциклической группы, С1-С4 алкилоила RCO, С5-С7 ароила ArCO, С1-С4 алкилсульфонила RSO2, С5-С7 арилсульфонила ArSO2, С5-С7 ароилметилена, 5-7-членного гетероароилметилена, бензила, пиридиндиметилена, С5-С7 арила Ar или 5-7-членного гетероарила; где линейный или разветвленный С1-С6 алкил замещен одним или несколькими заместителями, выбранными из метилсульфонила, циклопропила, гидрокси, C1-C3 алкокси, C1-C3 алкоксикарбонила и эпоксипропила, но не обязательно; гетероциклическая группа содержит 1-3 гетероатома, выбранных из O, S и N; арил или бензил замещены одним или несколькими заместителями, выбранными из галогена, линейного или разветвленного С1-С6 алкил, циано, нитро, амино, гидрокси, гидроксиметила, трифторметила, трифторметокси, карбоксила, С1-С4 алкокси, меркапто, С1-С4 ацила и С5-С7 арила Ar, но не обязательно; гетероарил содержит 1-3 гетероатома, выбранных из O, S и N, в сочетании с фенилом или C5-C7 гетероарилом, но не обязательно, или замещен одним или несколькими заместителями, выбранными из галогена, линейного или разветвленного C1-C6 углеводородного остатка, циано, нитро, амино, гидрокси, гидроксиметила, трифторметила, трифторметокси, карбоксила, C1-C4 алкокси, меркапто, C1-C4 ацила и C5-C7 арила Ar;
R8 выбран из H, линейного или разветвленного С1-С6 алкила;
R9 и R10 являются одинаковыми или различными, каждый из которых независимо выбран из Н,  ,
,  , линейного или разветвленного С1-С6 алкила, С3-С7 циклоалкила, 4-7-членной гетероциклической группы, С5-С7 ароилметилена, 5-7-членного гетероароилметилена, бензила, пиридиндиметилена, С5-С7 арила Ar или 5-7-членного гетероарила; где линейный или разветвленный С1-С6 алкил замещен одним или несколькими заместителями, выбранными из метилсульфонила, циклопропила, гидрокси, C1-C3 алкокси, C1-C3 алкоксикарбонила, и эпоксипропила, но не обязательно; гетероциклическая группа содержит 1-3 гетероатома, выбранных из O, S и N, и метилен гетероциклической группы замещен карбонилом или сульфонилом, но не обязательно, или гетероциклическая группа является замещенной одним или несколькими заместителями, выбранными из галогена, линейного или разветвленного С1-С6 алкил, циано, нитро, амино, гидрокси, гидроксиметила, трифторметила, трифторметокси, карбоксила, С1-С4 алкокси, меркапто, С1-С4 ацила и С5-С7 арила Ar, но не обязательно; арил или бензил может быть замещен одним или несколькими заместителями, выбранными из галогена, линейного или разветвленного С1-С6 алкила, циано, нитро, амино, гидрокси, гидроксиметила, трифторметила, трифторметокси, карбоксила, С1-С4 алкокси, меркапто, С1-С4 ацила и С5-С7 арила Ar; гетероарил содержит 1-3 гетероатома, выбранных из O, S и N, в сочетании с фенилом или С5-С7 гетероарилом, но не обязательно, или замещен одним или несколькими заместителями, выбранными из галогена, линейного или разветвленного С1-С6 алкила, циано, нитро, амино, гидрокси, гидроксиметила, трифторметила, трифторметокси, карбоксила, С1-С4 алкокси, меркапто, С1-С4 ацила и С5-С7 арила Ar;
, линейного или разветвленного С1-С6 алкила, С3-С7 циклоалкила, 4-7-членной гетероциклической группы, С5-С7 ароилметилена, 5-7-членного гетероароилметилена, бензила, пиридиндиметилена, С5-С7 арила Ar или 5-7-членного гетероарила; где линейный или разветвленный С1-С6 алкил замещен одним или несколькими заместителями, выбранными из метилсульфонила, циклопропила, гидрокси, C1-C3 алкокси, C1-C3 алкоксикарбонила, и эпоксипропила, но не обязательно; гетероциклическая группа содержит 1-3 гетероатома, выбранных из O, S и N, и метилен гетероциклической группы замещен карбонилом или сульфонилом, но не обязательно, или гетероциклическая группа является замещенной одним или несколькими заместителями, выбранными из галогена, линейного или разветвленного С1-С6 алкил, циано, нитро, амино, гидрокси, гидроксиметила, трифторметила, трифторметокси, карбоксила, С1-С4 алкокси, меркапто, С1-С4 ацила и С5-С7 арила Ar, но не обязательно; арил или бензил может быть замещен одним или несколькими заместителями, выбранными из галогена, линейного или разветвленного С1-С6 алкила, циано, нитро, амино, гидрокси, гидроксиметила, трифторметила, трифторметокси, карбоксила, С1-С4 алкокси, меркапто, С1-С4 ацила и С5-С7 арила Ar; гетероарил содержит 1-3 гетероатома, выбранных из O, S и N, в сочетании с фенилом или С5-С7 гетероарилом, но не обязательно, или замещен одним или несколькими заместителями, выбранными из галогена, линейного или разветвленного С1-С6 алкила, циано, нитро, амино, гидрокси, гидроксиметила, трифторметила, трифторметокси, карбоксила, С1-С4 алкокси, меркапто, С1-С4 ацила и С5-С7 арила Ar;
p представляет собой целое число от 0 до 2;
R11, R12 и R13 являются одинаковыми или различными, и каждый из R11, R12 и R13 независимо выбран из Н, линейного или разветвленного С1-С6 алкила, С3-С7 циклоалкила, фенила или бензила; фенил или бензил замещен одним или несколькими заместителями, выбранными из галогена, линейного или разветвленного C1-C3 алкила, циано, нитро, амино, гидрокси, гидроксиметила, трифторметила, трифторметокси, карбоксила, и С1-С4 алкокси, но не обязательно;
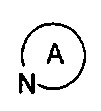 представляет собой 3-7-членную азотсодержащую гетероциклическую группу, гетероциклическая группа дополнительно содержит 1-3 гетероатома, выбранных из O, S и N, и метилен гетероциклической группы замещен карбонилом или сульфонилом, но не обязательно, и замещен 1-5 заместителями, выбранными из H, линейного или разветвленного С1-С6 углеводородного остатка, галогена, циано, нитро, амино, гидрокси, гидроксиметила, трифторметила, трифторметокси, карбоксила, ациламино, карбоксилатной группы, С1-С4 алкоксикарбонила, меркапто, С1-С4 алкокси и гидроксиамино, но не обязательно;
представляет собой 3-7-членную азотсодержащую гетероциклическую группу, гетероциклическая группа дополнительно содержит 1-3 гетероатома, выбранных из O, S и N, и метилен гетероциклической группы замещен карбонилом или сульфонилом, но не обязательно, и замещен 1-5 заместителями, выбранными из H, линейного или разветвленного С1-С6 углеводородного остатка, галогена, циано, нитро, амино, гидрокси, гидроксиметила, трифторметила, трифторметокси, карбоксила, ациламино, карбоксилатной группы, С1-С4 алкоксикарбонила, меркапто, С1-С4 алкокси и гидроксиамино, но не обязательно;
R3 выбран из NR14R15 или  , где R14 и R15 одинаковые или различные, и каждый из R14 и R15 независимо представляет собой H, линейный или разветвленный C1-C6 алкил и алкокси, C3-C7 циклоалкил, C1-C6 алкиламино, C1-C6 алкиламино гидрокси, C1-C6 алкил амидино, C1-C6 алкил гуанидил, бензил, C5-C7 арил Ar или 5-7-членный гетероарил, и гетероарил содержит 1-3 гетероатома, выбранных из O, S и N, в сочетании с фенилом или С5-С7 гетероарилом, но не обязательно, или замещен одним или несколькими заместителями, выбранными из галогена, линейного или разветвленного С1-С6 алкила, циано, нитро, амино, гидрокси, гидроксиметила, трифторметила, трифторметокси, карбоксила, С1-С4 алкокси, меркапто, С1-С4 ацила и С5-С7 арила Ar;
, где R14 и R15 одинаковые или различные, и каждый из R14 и R15 независимо представляет собой H, линейный или разветвленный C1-C6 алкил и алкокси, C3-C7 циклоалкил, C1-C6 алкиламино, C1-C6 алкиламино гидрокси, C1-C6 алкил амидино, C1-C6 алкил гуанидил, бензил, C5-C7 арил Ar или 5-7-членный гетероарил, и гетероарил содержит 1-3 гетероатома, выбранных из O, S и N, в сочетании с фенилом или С5-С7 гетероарилом, но не обязательно, или замещен одним или несколькими заместителями, выбранными из галогена, линейного или разветвленного С1-С6 алкила, циано, нитро, амино, гидрокси, гидроксиметила, трифторметила, трифторметокси, карбоксила, С1-С4 алкокси, меркапто, С1-С4 ацила и С5-С7 арила Ar;
 представляет собой 3-7-членную азотсодержащую гетероциклическую группу, и гетероциклическая группа дополнительно содержит 1-4 гетероатома, выбранных из О, S и N, и замещена 1-5 заместителями, выбранными из Н, линейного или разветвленного С1-С6-алкила, галогена, циано, нитро, амино, гидрокси, гидроксиметила, трифторметила, трифторметокси, карбоксила, ациламино, карбоксилатной группы, С1-С4 алкоксикарбонила, меркапто, амидино, гуанидила и гидроксиамино;
представляет собой 3-7-членную азотсодержащую гетероциклическую группу, и гетероциклическая группа дополнительно содержит 1-4 гетероатома, выбранных из О, S и N, и замещена 1-5 заместителями, выбранными из Н, линейного или разветвленного С1-С6-алкила, галогена, циано, нитро, амино, гидрокси, гидроксиметила, трифторметила, трифторметокси, карбоксила, ациламино, карбоксилатной группы, С1-С4 алкоксикарбонила, меркапто, амидино, гуанидила и гидроксиамино;
R4 и R5 являются одинаковыми или различными, и каждый из R4 и R5 независимо представляет собой H, галоген, линейный или разветвленный С1-С6 углеводородный остаток, циано, нитро, амино, гидрокси, гидрокси метил, трифторметил, трифторметокси, карбоксил, С1-С4 алкокси, меркапто, С1-С4 ацил, С1-С4 сульфонил, С1-С4 сульфониламино, аминоацил или сульфонил, замещенный С1-С4 линейным или разветвленным алкилом;
галоген представляет собой фтор-, хлор-, бром- или йод-.
Одним предпочтительным воплощением соединения формулы (I) по настоящему изобретению является следующее соединение тиено[3,2-d]пиримидин-4-он, энантиомер, диастереоизомер, рацемат и их смеси, или его фармацевтически приемлемая соль, где:
n=1;
R1 и R2 одинаковые или различные, и не являются водородом одновременно, каждый из которых независимо является Н, галогеном, CBr2H, CCl2H, CF2H, циано, CF3, альдегидной группой, (CH2)mOR6, (CH2)mNR6R7, 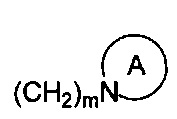 , (CH2)mCOOR8, CONR9R10, или
, (CH2)mCOOR8, CONR9R10, или  , где
, где
R1 и R2 могут быть связаны вместе с образованием C3-C6 алкилидена, но не обязательно;
m представляет собой целое число от 0 до 3;
R6 и R7 являются одинаковыми или различными, и каждый из R6 и R7 независимо выбраны из Н, линейного или разветвленного C1-C3 алкила, С3-С5 циклоалкила, C1-C3 алкокси, 4-7-членной гетероциклической группы, C1-C3 алкилоила RCO, С5-С7 ароила ArCO, C1-C3 алкилсульфонила RSO2, С5-С7 арилсульфонила ArSO2, С5-С7 ароилметилена, 5-7-членного гетероароилметилена, бензила, пиридиндиметилена, С5-С7 арила Ar или 5-7-членного гетероарила; где линейный или разветвленный C1-C3 ал кил замещен одним или несколькими заместителями, выбранными из метилсульфонила, циклопропила, гидрокси, C1-C3 алкокси, C1-C3 алкоксикарбонила и эпоксипропила, но не обязательно; гетероциклическая группа содержит 1-3 гетероатома, выбранных из O, S и N; арил или бензил замещены заместителем, выбранным из галогена, линейного или разветвленного C1-C3 алкила, амино, гидрокси, гидроксиметила, трифторметила, трифторметокси и, но необязательно; гетероарил содержит 1-3 гетероатома, выбранных из O, S и N;
R8 выбран из Н, линейного или разветвленного C1-C3 алкила и С3-С5 циклоалкила;
R9 и R10 являются одинаковыми или различными, каждый из которых независимо выбран из H,  ,
,  , линейного или разветвленного С1-С5 алкила, С3-С7 циклоалкила, 4-7-членной гетероциклической группы, С5-С7 ароилметилена, 5-7-членного гетероароилметилена, бензила, пиридиндиметилена, С5-С7 арила Ar или 5-7-членного гетероарила; где линейный или разветвленный C1-C3 алкил замещен одним или несколькими заместителями, выбранными из метилсульфонила, циклопропила, гидрокси, C1-C3 алкокси, C1-C3 алкоксикарбонила и эпоксипропила, но не обязательно; гетероциклическая группа содержит 1-3 гетероатома, выбранных из O, S и N, метилен гетероциклической группы замещен карбонилом или сульфонилом, но не обязательно, или гетероциклическая группа замещена одним или несколькими заместителями, выбранными из галогена, линейного или разветвленного C1-C3 алкила, амино, гидрокси, гидроксиметила, трифторметила и трифторметокси, но не обязательно; арил или бензил может быть замещен одним или несколькими заместителями, выбранными из галогена, линейного или разветвленного C1-C3 алкила, амино, гидрокси, гидроксиметила, трифторметила, и трифторметокси; гетероарил содержит 1-3 гетероатома, выбранных из O, S и N;
, линейного или разветвленного С1-С5 алкила, С3-С7 циклоалкила, 4-7-членной гетероциклической группы, С5-С7 ароилметилена, 5-7-членного гетероароилметилена, бензила, пиридиндиметилена, С5-С7 арила Ar или 5-7-членного гетероарила; где линейный или разветвленный C1-C3 алкил замещен одним или несколькими заместителями, выбранными из метилсульфонила, циклопропила, гидрокси, C1-C3 алкокси, C1-C3 алкоксикарбонила и эпоксипропила, но не обязательно; гетероциклическая группа содержит 1-3 гетероатома, выбранных из O, S и N, метилен гетероциклической группы замещен карбонилом или сульфонилом, но не обязательно, или гетероциклическая группа замещена одним или несколькими заместителями, выбранными из галогена, линейного или разветвленного C1-C3 алкила, амино, гидрокси, гидроксиметила, трифторметила и трифторметокси, но не обязательно; арил или бензил может быть замещен одним или несколькими заместителями, выбранными из галогена, линейного или разветвленного C1-C3 алкила, амино, гидрокси, гидроксиметила, трифторметила, и трифторметокси; гетероарил содержит 1-3 гетероатома, выбранных из O, S и N;
p представляет собой целое число от 0 до 2;
R11, R12 и R13 являются одинаковыми или различными, и каждый из R11, R12 и R13 независимо выбран из Н, линейного или разветвленного C1-C3 алкила, С3-С7 циклического углеводородного остатка, фенила или бензила; фенил или бензил замещен одним или несколькими заместителями, выбранными из галогена, линейного или разветвленного C1-C3 алкила, амино, гидрокси, гидроксиметила, трифторметила, трифторметокси, но необязательно;
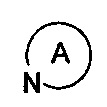 представляет собой 3-7-членную азотсодержащую гетероциклическую группу, гетероциклическая группа дополнительно содержит 1-3 гетероатома, выбранных из O, S и N, и метилен гетероциклической группы замещен карбонилом или сульфонилом, но не обязательно, и замещена 1-2 заместителями, выбранными из H, линейного или разветвленного C1-C3 алкила, галогена, амино, гидрокси, гидроксиметила, трифторметил, трифторметокси, С1-С4 алкоксикарбонила, и С1-С4 алкокси, но не обязательно;
представляет собой 3-7-членную азотсодержащую гетероциклическую группу, гетероциклическая группа дополнительно содержит 1-3 гетероатома, выбранных из O, S и N, и метилен гетероциклической группы замещен карбонилом или сульфонилом, но не обязательно, и замещена 1-2 заместителями, выбранными из H, линейного или разветвленного C1-C3 алкила, галогена, амино, гидрокси, гидроксиметила, трифторметил, трифторметокси, С1-С4 алкоксикарбонила, и С1-С4 алкокси, но не обязательно;
R3 выбран из NR14R15 или 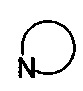 , где R14 и R15 одинаковые или различные, и каждый из R14 и R15 независимо представляет собой H, линейный или разветвленный C1-C3 алкил и алкокси, С3-С5 циклоалкил, C1-C3 алкиламино, C1-C3 алкиламино гидрокси, C1-C3 алкил амидино, C1-C3 алкил гуанидил, бензил, С5-С7 арил Ar или 5-7-членный гетероарил, и гетероарил содержит 1-3 гетероатома, выбранных из O, S и N;
, где R14 и R15 одинаковые или различные, и каждый из R14 и R15 независимо представляет собой H, линейный или разветвленный C1-C3 алкил и алкокси, С3-С5 циклоалкил, C1-C3 алкиламино, C1-C3 алкиламино гидрокси, C1-C3 алкил амидино, C1-C3 алкил гуанидил, бензил, С5-С7 арил Ar или 5-7-членный гетероарил, и гетероарил содержит 1-3 гетероатома, выбранных из O, S и N;
 представляет собой 3-7-членную азотсодержащую гетероциклическую группу, и указанная гетероциклическая группа дополнительно содержит 1-4 гетероатома, выбранных из O, S и N, и замещена 1-3 заместителями, выбранными из H, линейного или разветвленного С1-С6 алкил, галоген, циано, нитро, амино, гидрокси, гидроксиметила, трифторметила, трифторметокси, карбоксила, ациламино, карбоксилатной группы, С1-С4 алкоксикарбонила, меркапто, амидино, гуанидила и гидроксиамино;
представляет собой 3-7-членную азотсодержащую гетероциклическую группу, и указанная гетероциклическая группа дополнительно содержит 1-4 гетероатома, выбранных из O, S и N, и замещена 1-3 заместителями, выбранными из H, линейного или разветвленного С1-С6 алкил, галоген, циано, нитро, амино, гидрокси, гидроксиметила, трифторметила, трифторметокси, карбоксила, ациламино, карбоксилатной группы, С1-С4 алкоксикарбонила, меркапто, амидино, гуанидила и гидроксиамино;
R4 и R5 являются одинаковыми или различными, и каждый из R4 и R5 независимо представляет собой Н, галоген, линейный или разветвленный С1-С6 алкил, циано, нитро, амино, гидрокси, гидрокси метил, трифторметил, трифторметокси, карбоксил, С1-С4 алкокси, меркапто, С1-С4 ацил, С1-С4 сульфонил, С1-С4 сульфониламино, аминоацил или сульфонил, замещенный С1-С4 линейным или разветвленным алкилом;
галоген представляет собой фтор-, хлор-, бром- или йод-.
Еще одним предпочтительным воплощением соединения формулы (I) по настоящему изобретению является следующее соединение тиено[3,2-d]пиримидин-4-он, энантиомер, диастереоизомер, рацемат и их смеси, или его фармацевтически приемлемая соль, где:
R3 представляет собой NR10(CH2)kNH2, NR10(CH2)kOH, NR10(CH2)kNHCNHNH2, NR10(CH2)kCNHNH2 или NR10(CH2)kNHOH;
где k представляет собой целое число от 0 до 4;
n, R1, R2 и R4-R15 такие, как указано выше.
Еще одним предпочтительным воплощением соединения формулы (I) по настоящему изобретению является следующее соединение тиено[3,2-d]пиримидин-4-он, энантиомер, диастереоизомер, рацемат и их смеси, или его фармацевтически приемлемая соль, где:
R3 представляет собой  ;
;
где  представляет собой азиридинил, азациклобутил, пирролидинил, пиперидил, азациклогептил, морфолинил, пиперазинил, гомопиперазинил, тиоморфолинил, тиоморфолинил с S в цикле, замещенным сульфоксидом или сульфоном, имидазолидинилом, пиразинилом или гексагидропиримидинилом, и замещен 1-3 заместителями, выбранными из H, линейного или разветвленного C1-C3 алкил, галогена, циано, нитро, амино, гидрокси, гидроксиметила, трифторметила, трифторметокси, карбоксила, ациламино, карбоксилатной группы, меркапто, амидино, гуанидила и гидроксиамино;
представляет собой азиридинил, азациклобутил, пирролидинил, пиперидил, азациклогептил, морфолинил, пиперазинил, гомопиперазинил, тиоморфолинил, тиоморфолинил с S в цикле, замещенным сульфоксидом или сульфоном, имидазолидинилом, пиразинилом или гексагидропиримидинилом, и замещен 1-3 заместителями, выбранными из H, линейного или разветвленного C1-C3 алкил, галогена, циано, нитро, амино, гидрокси, гидроксиметила, трифторметила, трифторметокси, карбоксила, ациламино, карбоксилатной группы, меркапто, амидино, гуанидила и гидроксиамино;
n, R1, R2 и R4-R15 определены выше.
Четвертым предпочтительным воплощением соединения формулы по настоящему изобретению является следующее тиено[3,2-d]пиримидин-4-он соединение, энантиомер, диастереоизомер, рацемат и их смеси, или его фармацевтически приемлемая соль, где:
R3 представляет собой  и замещен 1-3 заместителями, выбранными из Н, циано, амино, гидрокси, трифторметила, амидина, гуанидила, карбоксилатной группы и гидроксамино;
и замещен 1-3 заместителями, выбранными из Н, циано, амино, гидрокси, трифторметила, амидина, гуанидила, карбоксилатной группы и гидроксамино;
n, R1, R2,  и R4-R15 определены выше. Четвертым предпочтительным воплощением соединения формулы (I) по настоящему изобретению является следующее соединение тиено[3,2-d]пиримидин-4-он, энантиомер, диастереоизомер, рацемат и их смеси, или его фармацевтически приемлемая соль, где:
и R4-R15 определены выше. Четвертым предпочтительным воплощением соединения формулы (I) по настоящему изобретению является следующее соединение тиено[3,2-d]пиримидин-4-он, энантиомер, диастереоизомер, рацемат и их смеси, или его фармацевтически приемлемая соль, где:
n=1,
R1 и R2 являются одинаковыми или различными и не являются водородом одновременно, каждый из R1 и R2 независимо является H, галогеном, CBr2H, CCl2H, CF2H, циано, CF3, альдегидной группой, (CH2)mOR6, (CH2)mNR6R7, 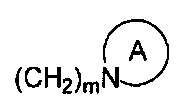 , (CH2)mCOOR8, CONR9R10 или
, (CH2)mCOOR8, CONR9R10 или  , где
, где
m представляет собой целое число от 0 до 3;
R6 и R7 являются одинаковыми или различными, и каждый из R6 и R7 независимо выбран из H, линейного или разветвленного C1-C3 алкил, С3-С5 циклоалкила, C1-C3 алкокси, 4-6-членной гетероциклической группы, C1-C3 алкилоила RCO, С5-С7 ароила ArCO, бензила и С5-С7 арила Ar; линейный или разветвленный C1-C3 алкил замещен одним или несколькими заместителями, выбранными из метилсульфонила, C1-C3 алкокси и C1-C3 алкоксикарбонила, но не обязательно; гетероциклическая группа содержит один гетероатом, выбранный из O, S и N;
R8 выбран из H и линейного или разветвленного C1-C3 алкила;
R9 и R10 являются одинаковыми или различными, каждый из которых независимо выбран из H, 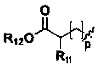 ,
,  , линейного или разветвленного С1-С5 алкила, С3-С6 циклоалкила, 4-6 членной гетероциклической группы, С5-С7 ароилметилена, 5-7-членного гетероароилметилена, бензила, пиримидиндиметилена, С5-С7 арила Ar или 5-7-членного гетероарила; причем линейный или разветвленный C1-C3 алкил замещен одним или несколькими заместителями, выбранными из метилсульфонила, циклопропила, гидрокси, C1-C3 алкокси, C1-C3 алкоксикарбонила и эпоксипропила, но не обязательно; гетероциклическая группа содержит 1-2 гетероатома, выбранных из О, S и N; арил или бензил могут быть замещены одним или несколькими заместителями, выбранными из галогена, линейного или разветвленного C1-C3 алкила, гидрокси, гидроксиметила, трифторметила и трифторметокси; гетероарил содержит 1-2 гетероатома, выбранных из O, S и N;
, линейного или разветвленного С1-С5 алкила, С3-С6 циклоалкила, 4-6 членной гетероциклической группы, С5-С7 ароилметилена, 5-7-членного гетероароилметилена, бензила, пиримидиндиметилена, С5-С7 арила Ar или 5-7-членного гетероарила; причем линейный или разветвленный C1-C3 алкил замещен одним или несколькими заместителями, выбранными из метилсульфонила, циклопропила, гидрокси, C1-C3 алкокси, C1-C3 алкоксикарбонила и эпоксипропила, но не обязательно; гетероциклическая группа содержит 1-2 гетероатома, выбранных из О, S и N; арил или бензил могут быть замещены одним или несколькими заместителями, выбранными из галогена, линейного или разветвленного C1-C3 алкила, гидрокси, гидроксиметила, трифторметила и трифторметокси; гетероарил содержит 1-2 гетероатома, выбранных из O, S и N;
p представляет собой целое число от 0 до 2;
R11, R12 и R13 являются одинаковыми или различными, и каждый из R11, R12 и R13 независимо выбран из Н, линейного или разветвленного C1-C3 алкила, фенила или бензила; фенил или бензил замещен одним или несколькими заместителями, выбранными из галогена, линейного или разветвленного C1-C3 алкила и гидроксила, но не обязательно;
 представляет собой азиридинил, азациклобутил, пирролидинил, пиперидил, азациклогептил, морфолинил, пиперазинил, гомопиперазинил, тиоморфолинил, тиоморфолинил, имеющий S в цикле, замещенным сульфоксидом или сульфоном, имидазолидинилом, пиразинилом, гексагидропиримидинилом
представляет собой азиридинил, азациклобутил, пирролидинил, пиперидил, азациклогептил, морфолинил, пиперазинил, гомопиперазинил, тиоморфолинил, тиоморфолинил, имеющий S в цикле, замещенным сульфоксидом или сульфоном, имидазолидинилом, пиразинилом, гексагидропиримидинилом 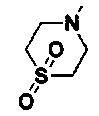 , и замещен 1-2 заместителями, выбранными из H, линейного или разветвленного C1-C3 алкила, галогена, гидрокси и С1-С4 алкоксикарбонила, но не обязательно;
, и замещен 1-2 заместителями, выбранными из H, линейного или разветвленного C1-C3 алкила, галогена, гидрокси и С1-С4 алкоксикарбонила, но не обязательно;
R4 и R5 являются одинаковыми или различными, и каждый из R4 и R5 независимо представляет собой Н, галоген, метил, этил, циано, гидрокси, карбоксил, метоксил, этоксил или аминоацил;
галоген представляет собой фтор-, хлор-, бром- или йод-;
R3 такой, как указано выше.
Четвертым предпочтительным воплощением соединения формулы (I) по настоящему изобретению является следующее соединение тиено[3,2-d]пиримидин-4-он, энантиомер, диастереоизомер, рецемат и их смеси, или его фармацевтически приемлемая соль, где:
n=1,
R1 и R2 являются идентичными или различными и не являются водородом одновременно, каждый из которых независимо Н, галоген, (CH2)mCOOR8, CONR9R10 или  , где
, где
m представляет собой целое число от 0 до 3;
R8 выбран из Н или линейного или разветвленного C1-C3 алкила;
R9 и R10 являются одинаковыми или различными, каждый из которых независимо выбран из Н, линейного или разветвленного C1-C3 алкила, С3-С6 циклоалкила, С4-С6 гетероциклической группы, фенила или 5-7-членного гетероарила; причем линейный или разветвленный C1-C3 алкил замещен C1-C3 алкоксикарбонилом, но не обязательно; гетероциклическая группа содержит один гетероатом, выбранный из O, S и N; гетероарил содержит один гетероатом, выбранный из O, S и N.
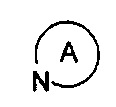 представляет собой пирролидинил, пиперидил, морфолинил, пиперазинил, гомопиперазинил или тиоморфолинил и замещен 1-2 заместителями, выбранными из Н, линейного или разветвленного C1-C3 алкила, галогена, гидрокси и С1-С4 алкоксикарбонила, но не обязательно;
представляет собой пирролидинил, пиперидил, морфолинил, пиперазинил, гомопиперазинил или тиоморфолинил и замещен 1-2 заместителями, выбранными из Н, линейного или разветвленного C1-C3 алкила, галогена, гидрокси и С1-С4 алкоксикарбонила, но не обязательно;
R3 представляет собой пирролидинил, пиперидил, морфолинил, пиперазинил, гомопиперазинил или тиоморфолинил и замещен циано, амино или гидроксилом;
R4 и R5 являются одинаковыми или различными, и каждый из R4 и R5 независимо представляет собой H, фтор-, хлор-, бром-, метил, этил, циано или гидроксил.
Предпочтительно, четвертое предпочтительное воплощение соединения формулы (I) по настоящему изобретению представляет собой следующее соединение тиено[3,2-d]пиримидин-4-он, энантиомер, дистереоизомер, рецемат и их смеси, или его фармацевтически приемлемую соль, где:
R1 и R2 являются одинаковыми или различными и не являются водородом одновременно, каждый из которых независимо является H, галогеном, (CH2)mCOOR8, CONR9R10 или  , где
, где
m представляет собой 0;
R8 выбран из Н или линейного или разветвленного C1-C3 алкила;
R9 и R10 являются одинаковыми или различными, каждый из которых независимо выбран из H, линейного или разветвленного C1-C3 алкила, циклопропила, тетрагидропиран-4-ила или пиридинила; причем линейный или разветвленный C1-C3 алкил замещен C1-C3 алкоксикарбонилом, но не обязательно;
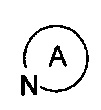 в
в  представляет собой пиперидил и замещен 1-2 заместителями, выбранными из Н, линейного или разветвленного C1-C3 алкила, галогена, гидрокси и С1-С4 алкоксикарбонила, но не обязательно;
представляет собой пиперидил и замещен 1-2 заместителями, выбранными из Н, линейного или разветвленного C1-C3 алкила, галогена, гидрокси и С1-С4 алкоксикарбонила, но не обязательно;
R3 представляет собой пирролидинил, пиперидил, морфолинил или пиперазинил и замещен циано, амино или гидроксилом;
R4 и R5 являются одинаковыми или различными, и каждый из R4 и R5 независимо представляет собой Н, фтор, хлор, бром, метил, этил, циано или гидроксил.
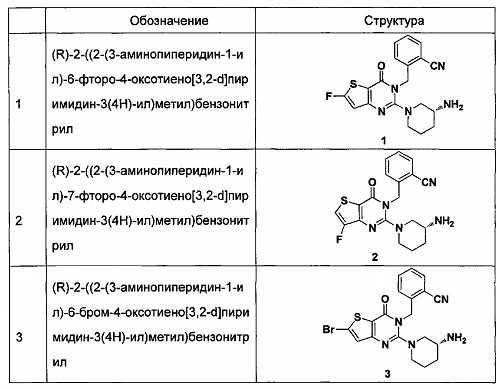
В частности, соединение тиено[3,2-d]пиримидин-4-он, энантиомер, диастереоизомер, рацемат и их смеси, и его фармацевтически приемлемую соль по настоящему изобретению выбирают из одного из следующих соединений:
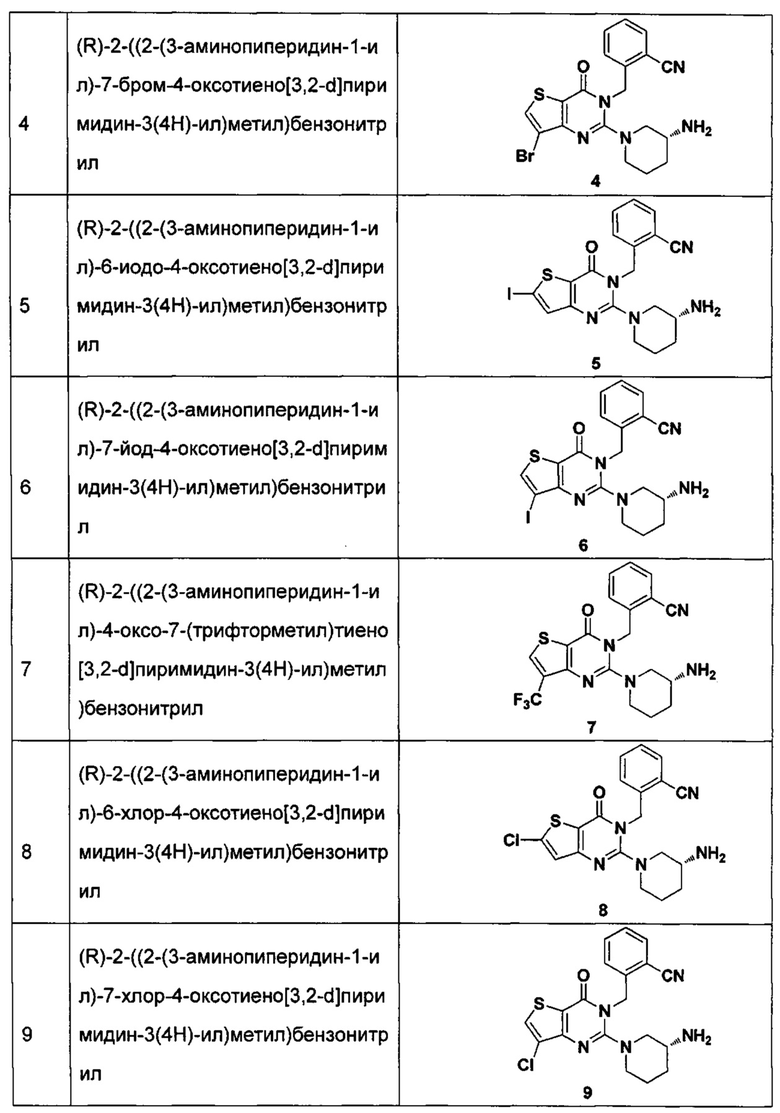
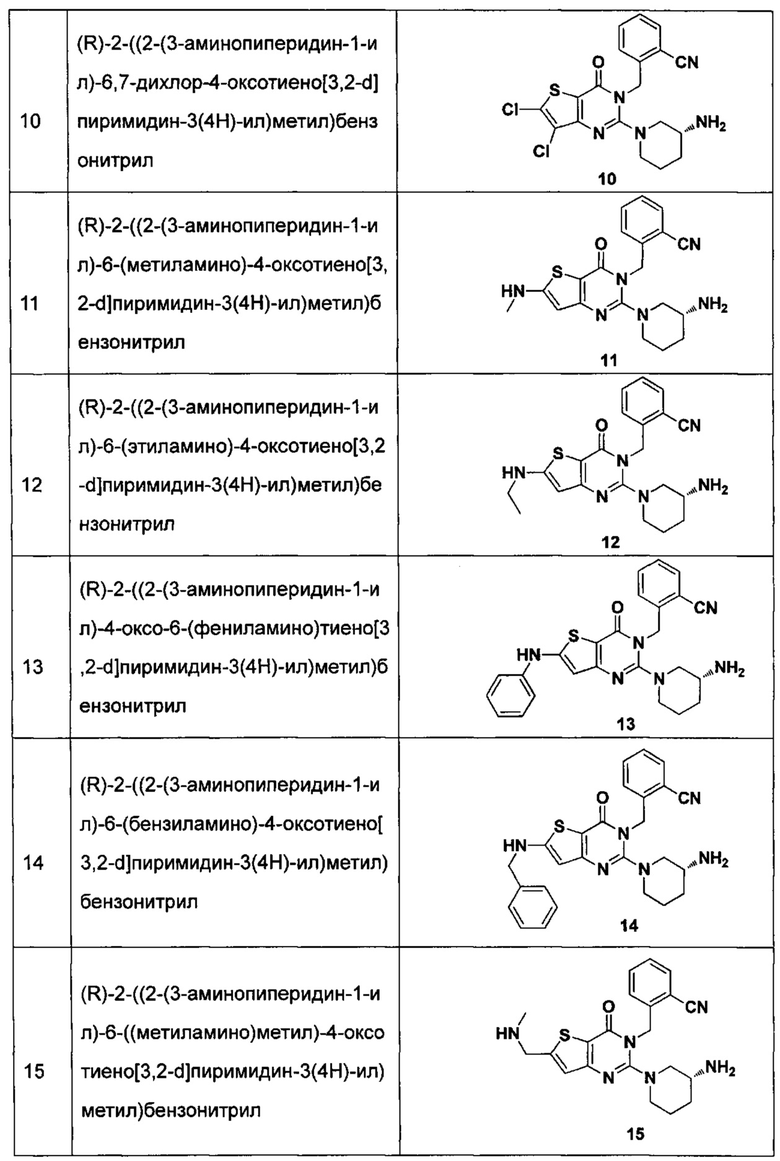
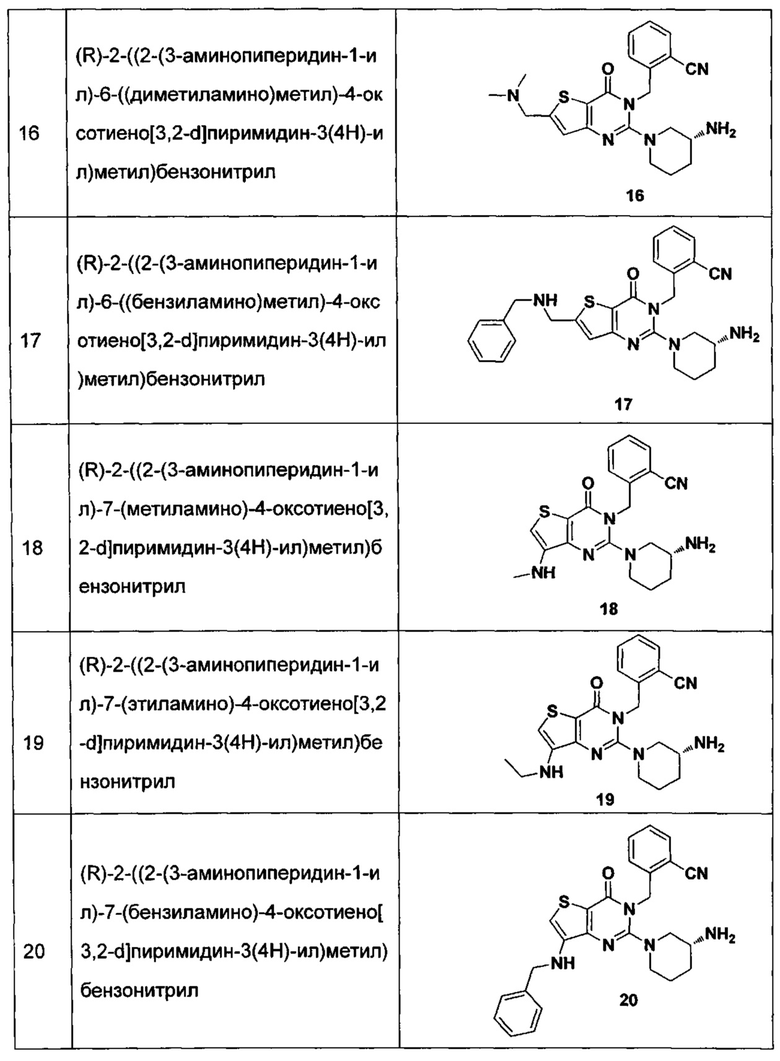
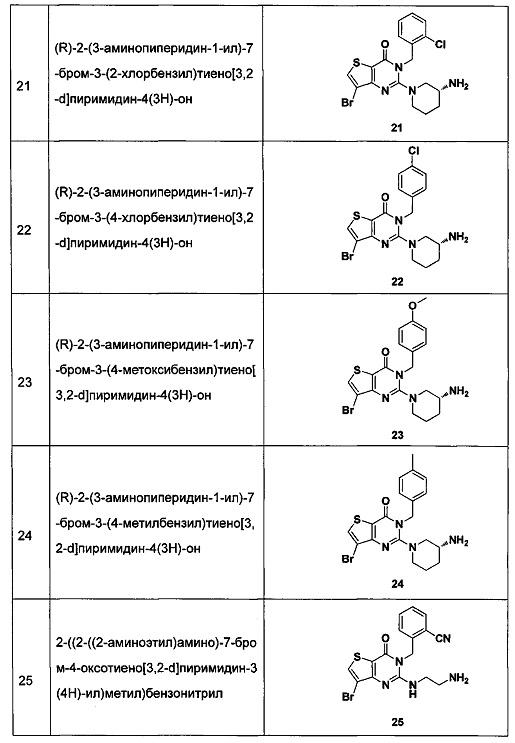
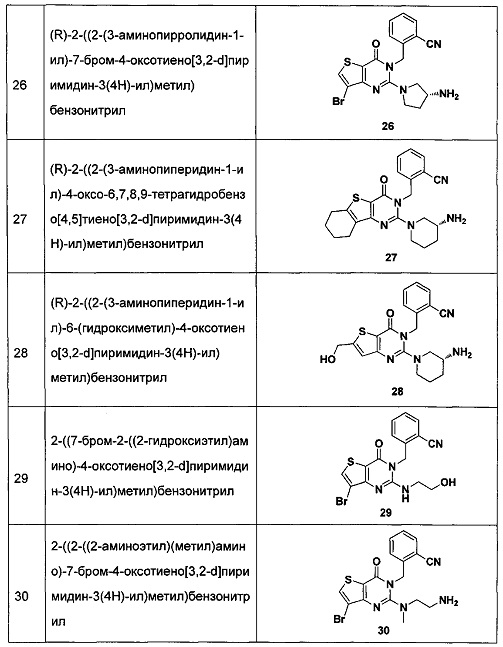
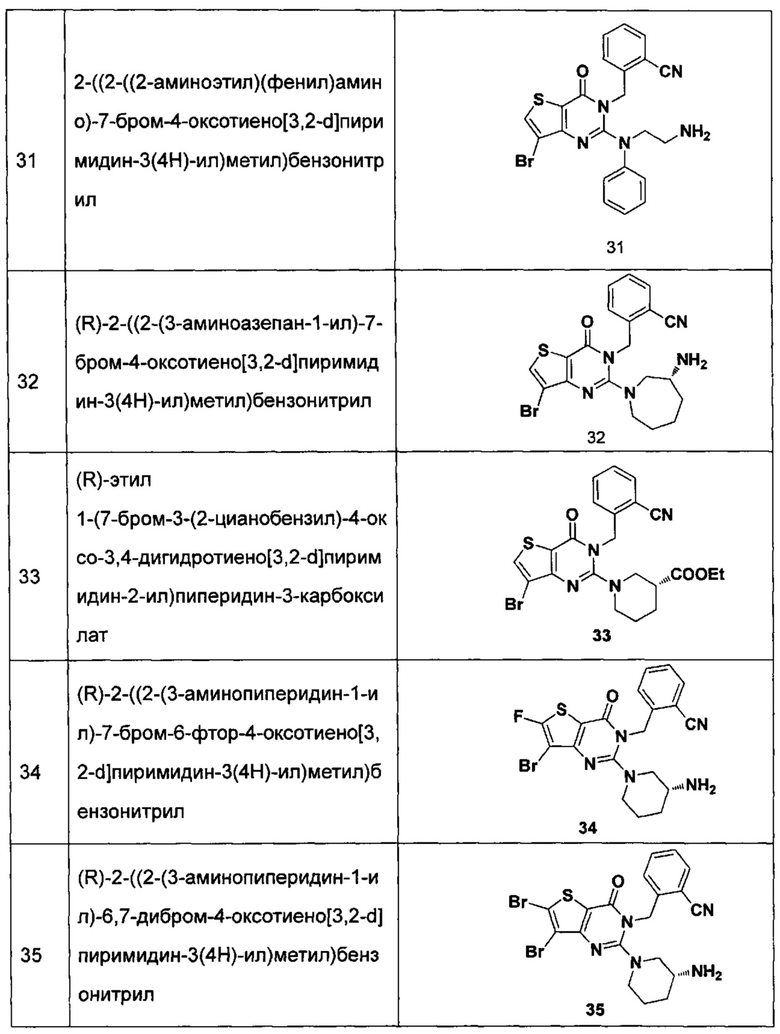
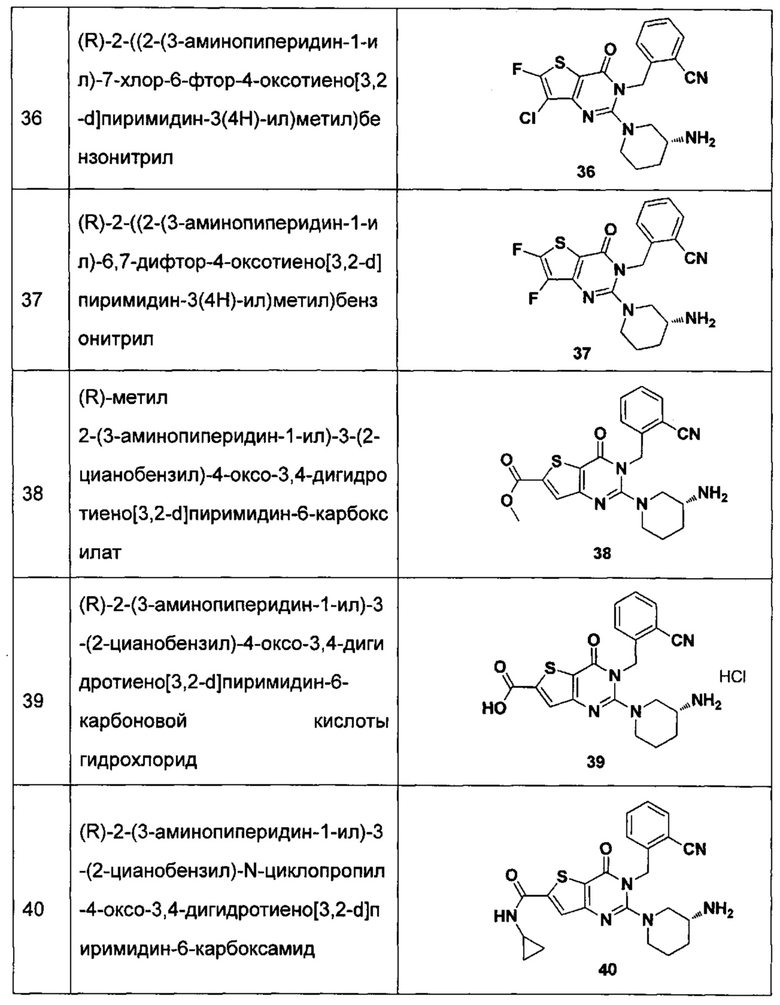
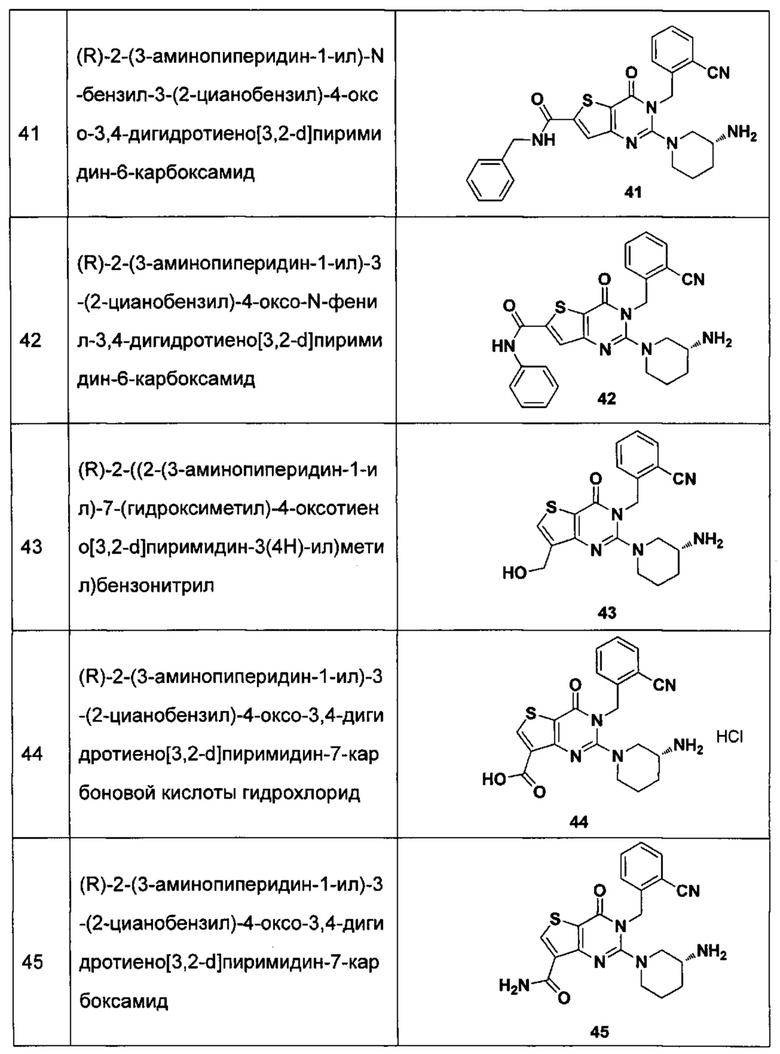
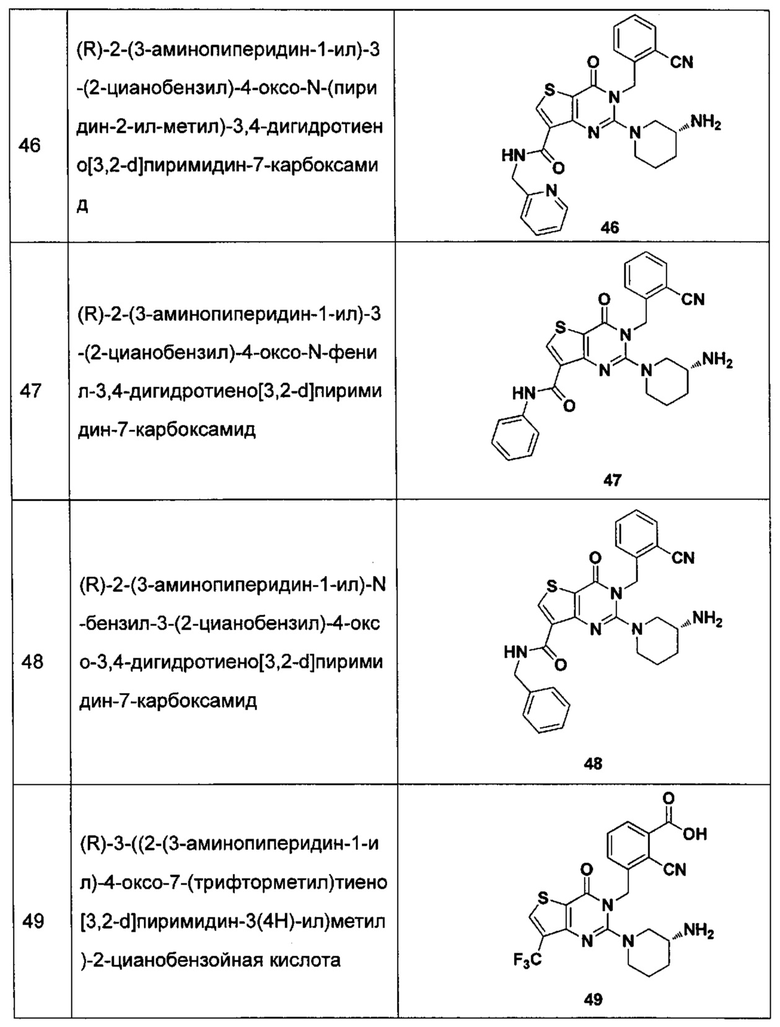
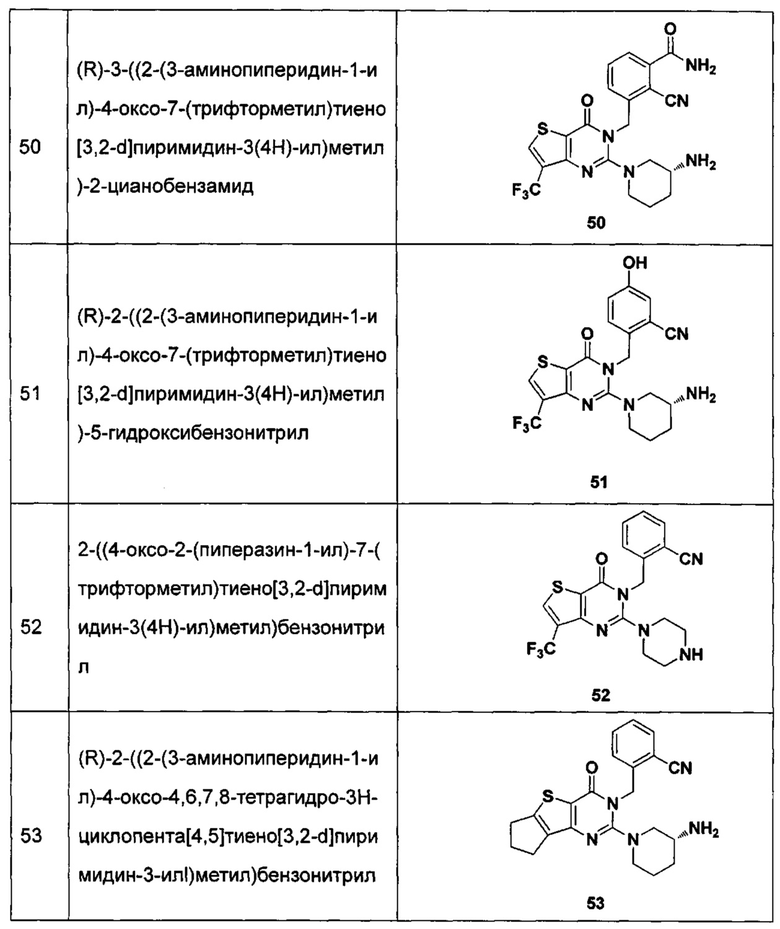
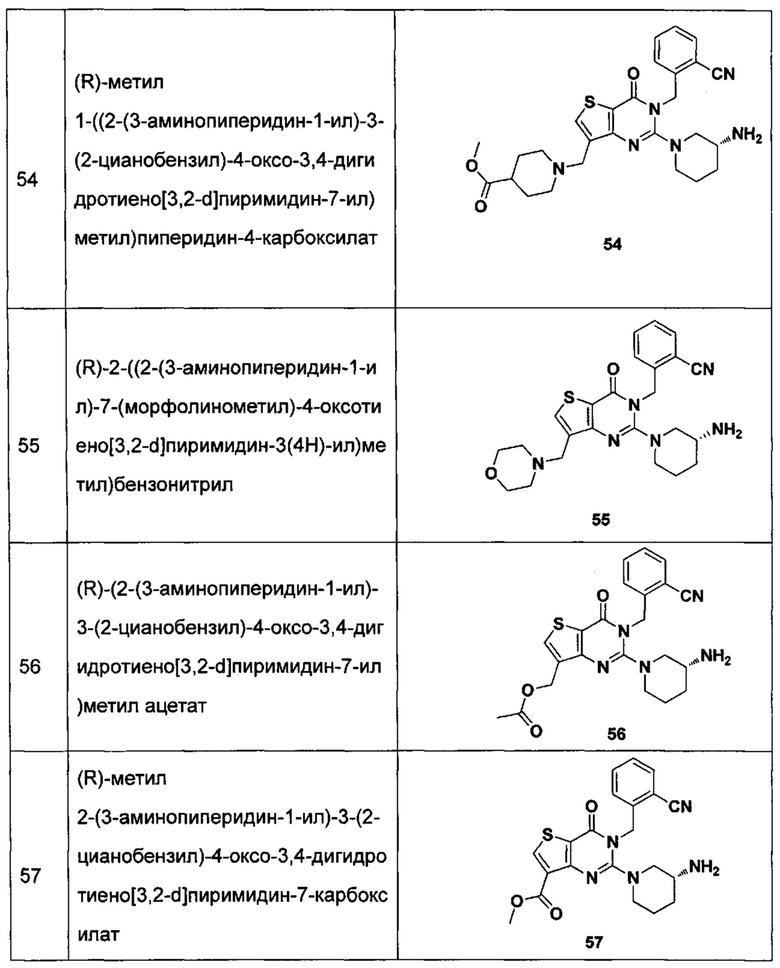
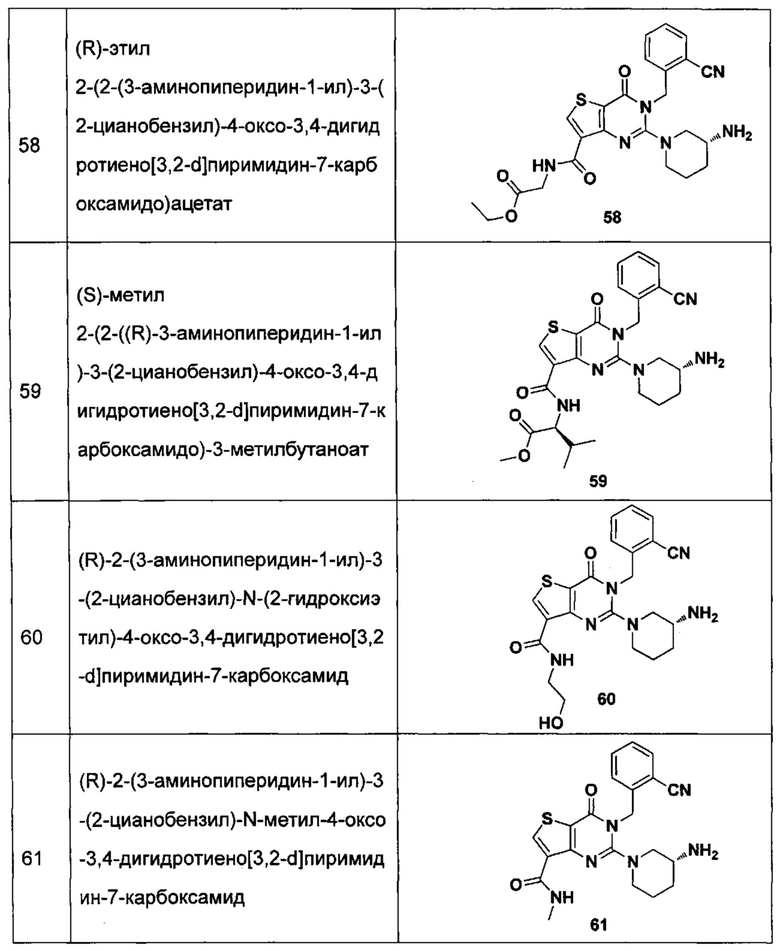
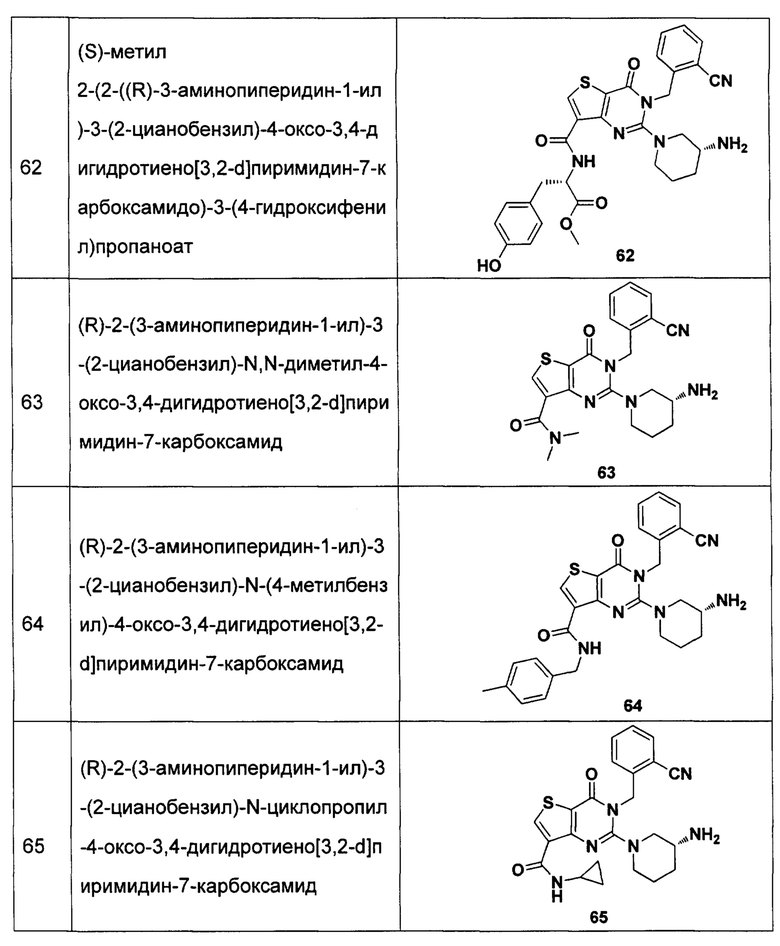
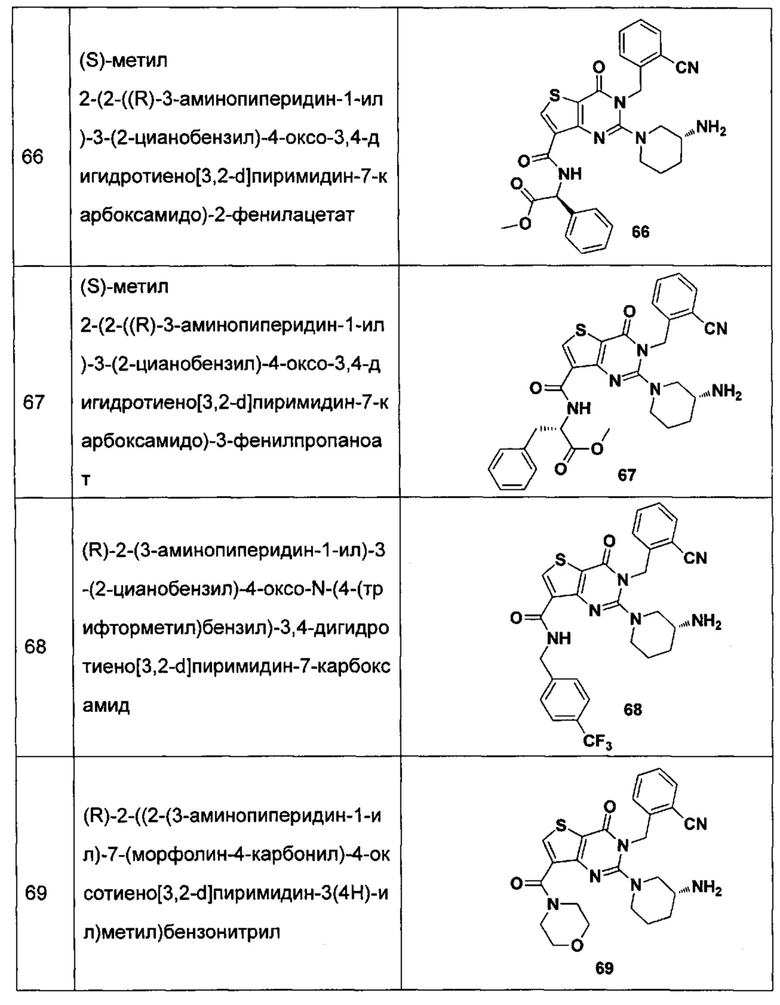
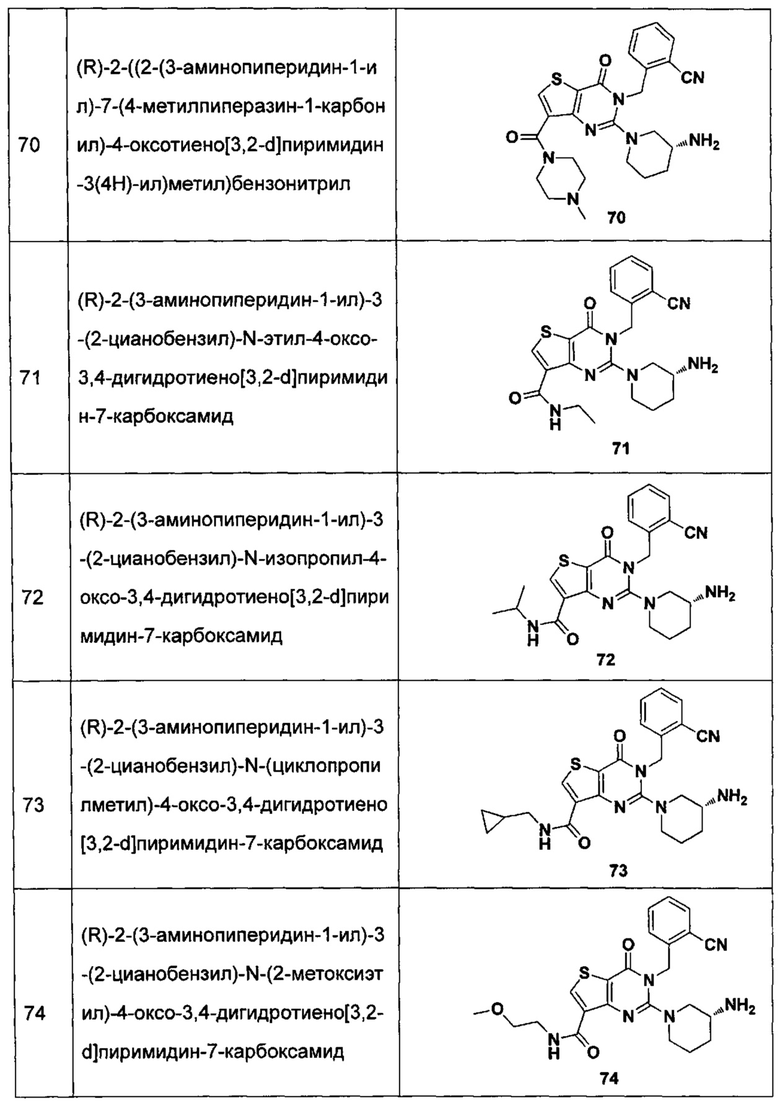
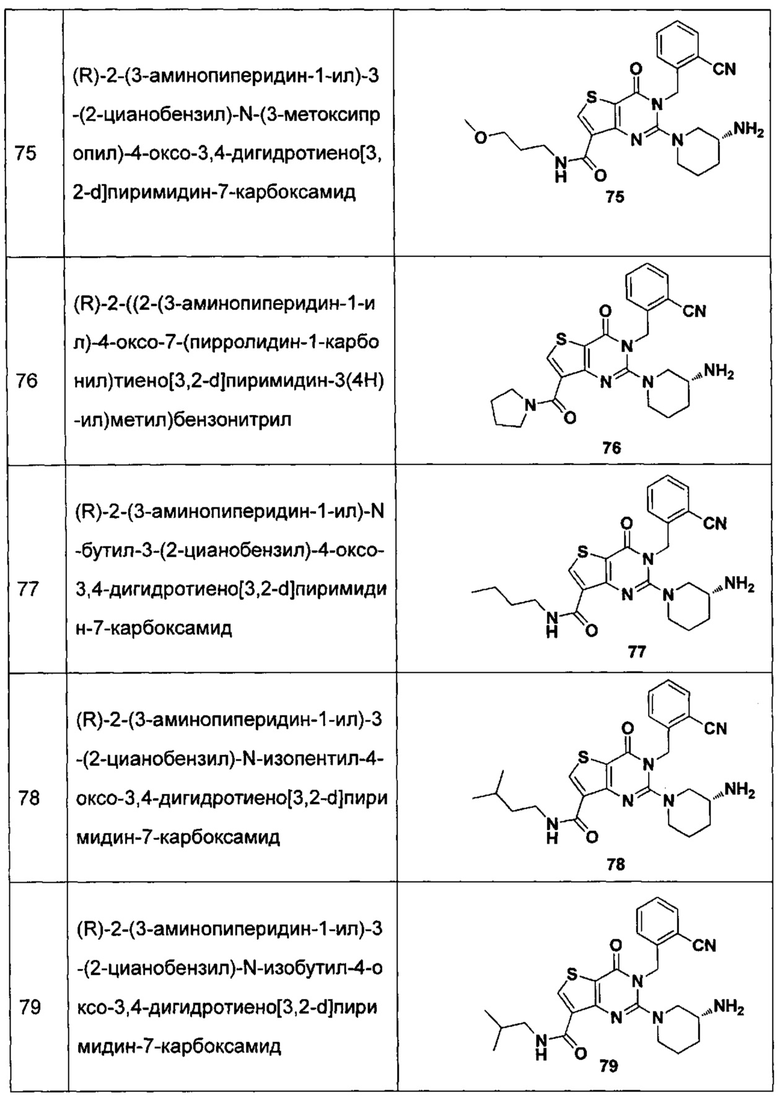
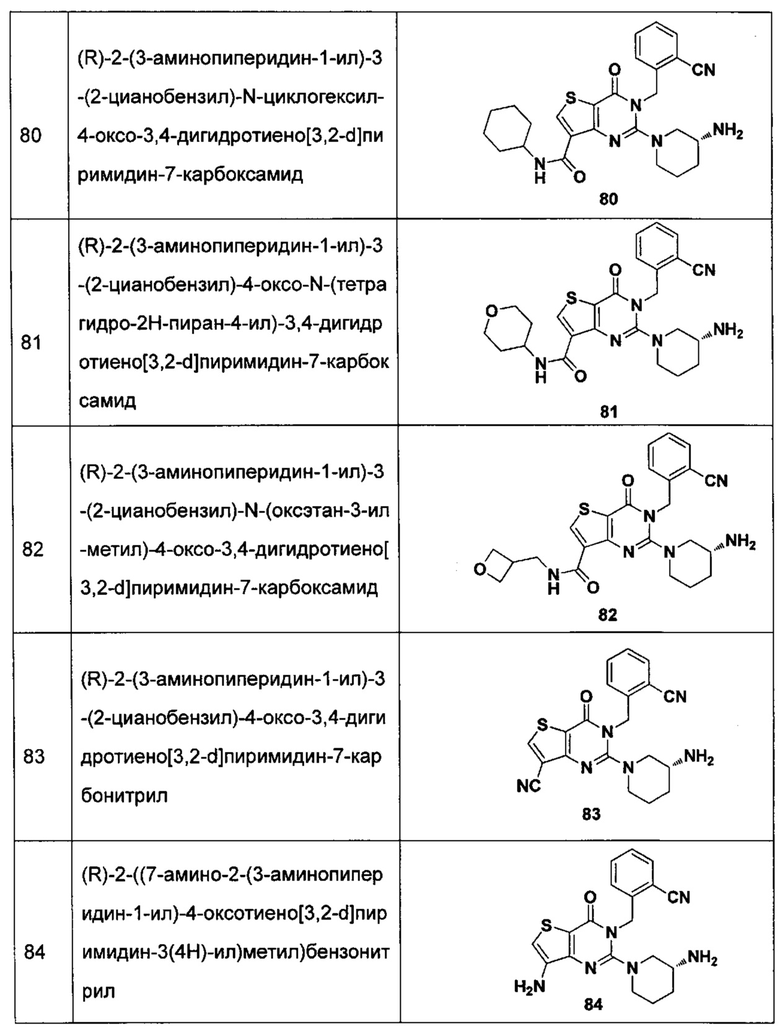
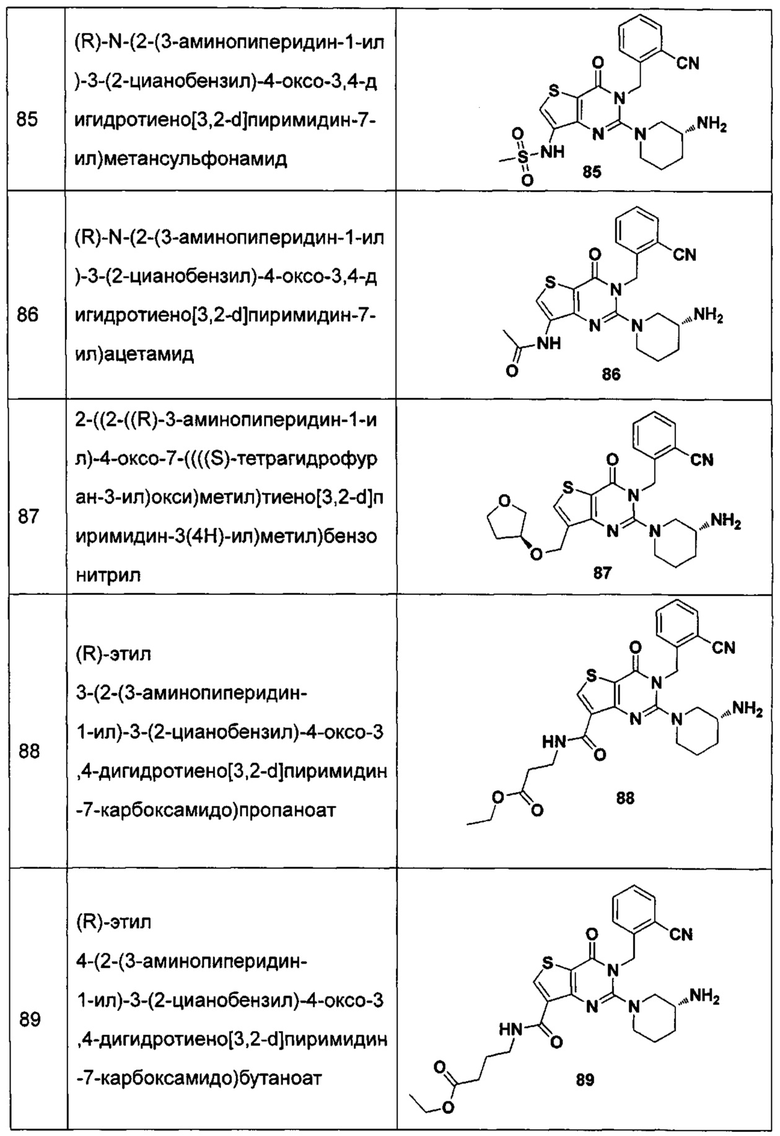
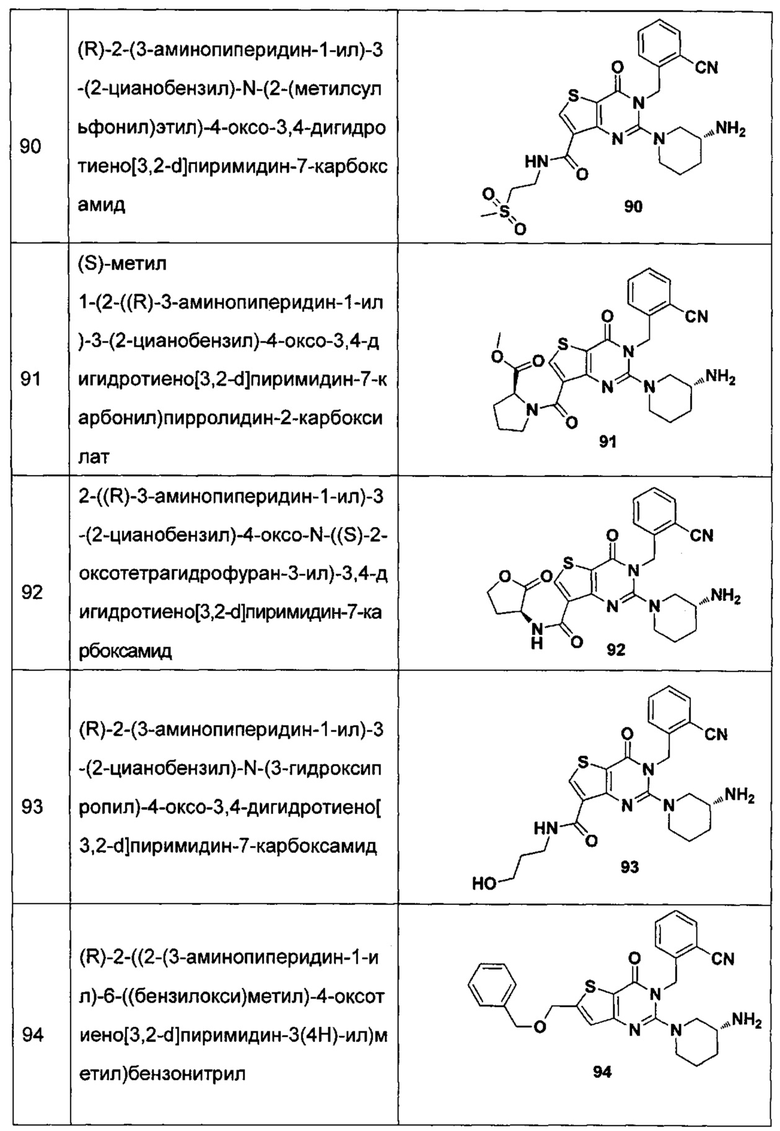
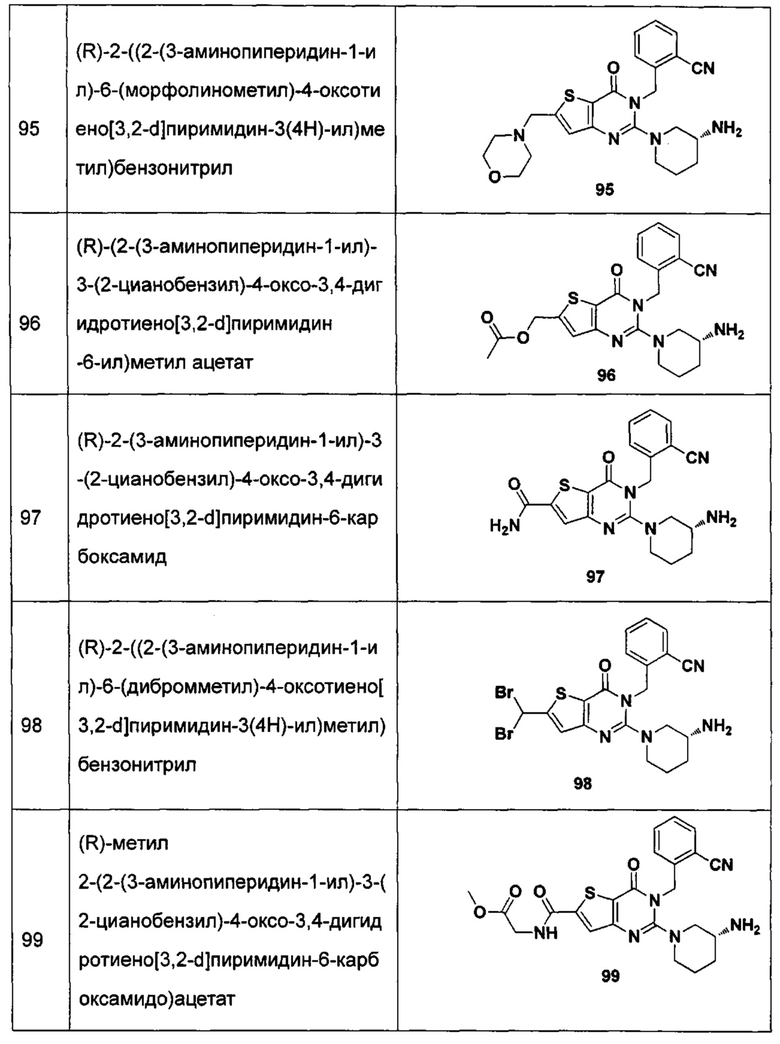
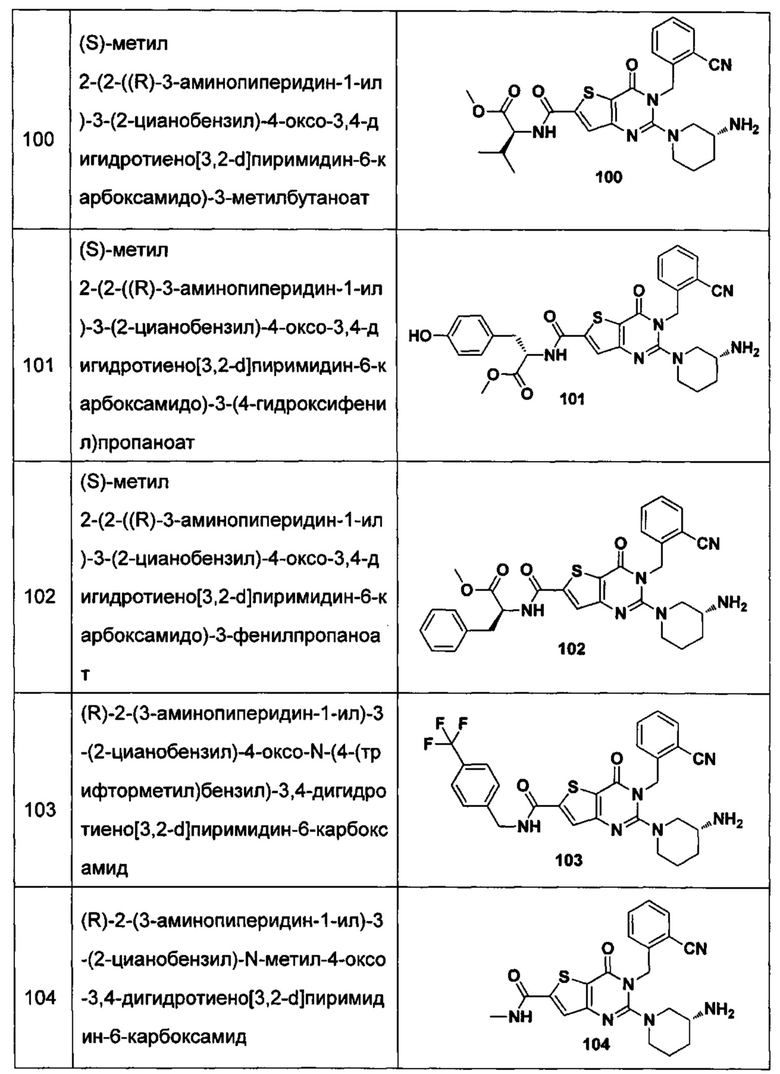
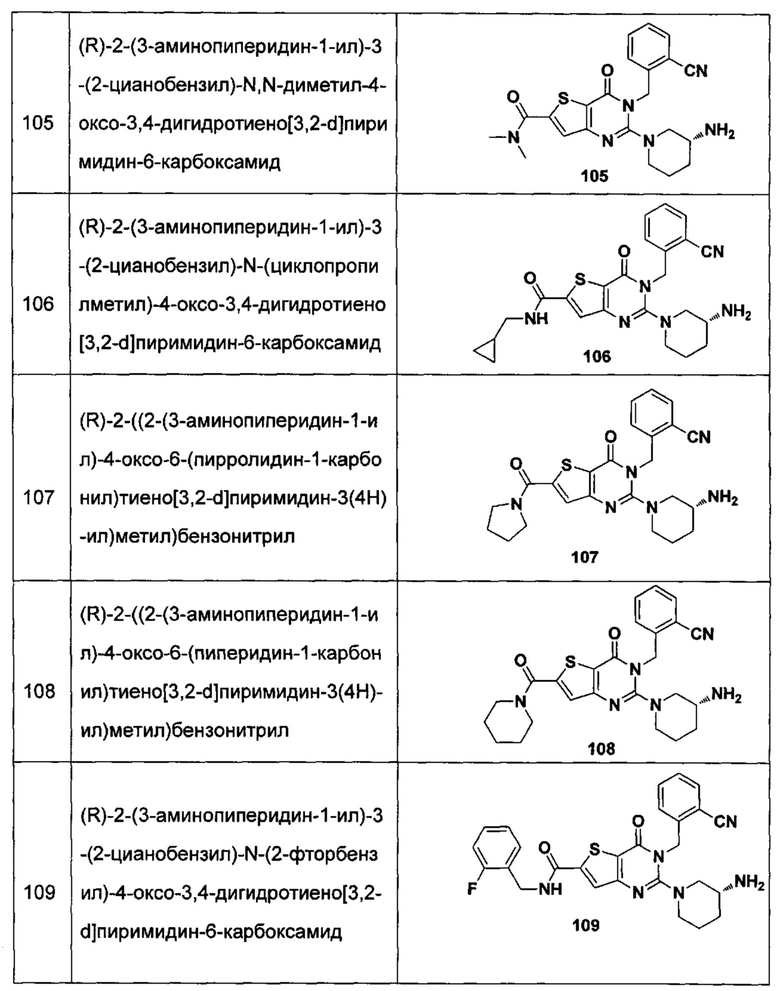
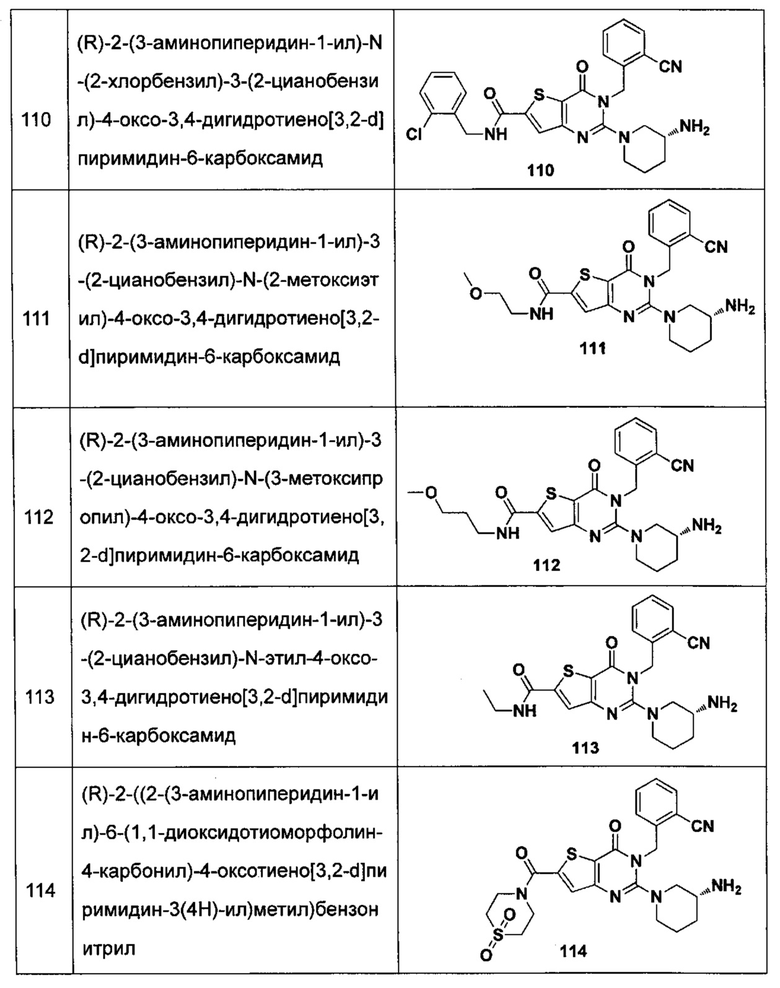
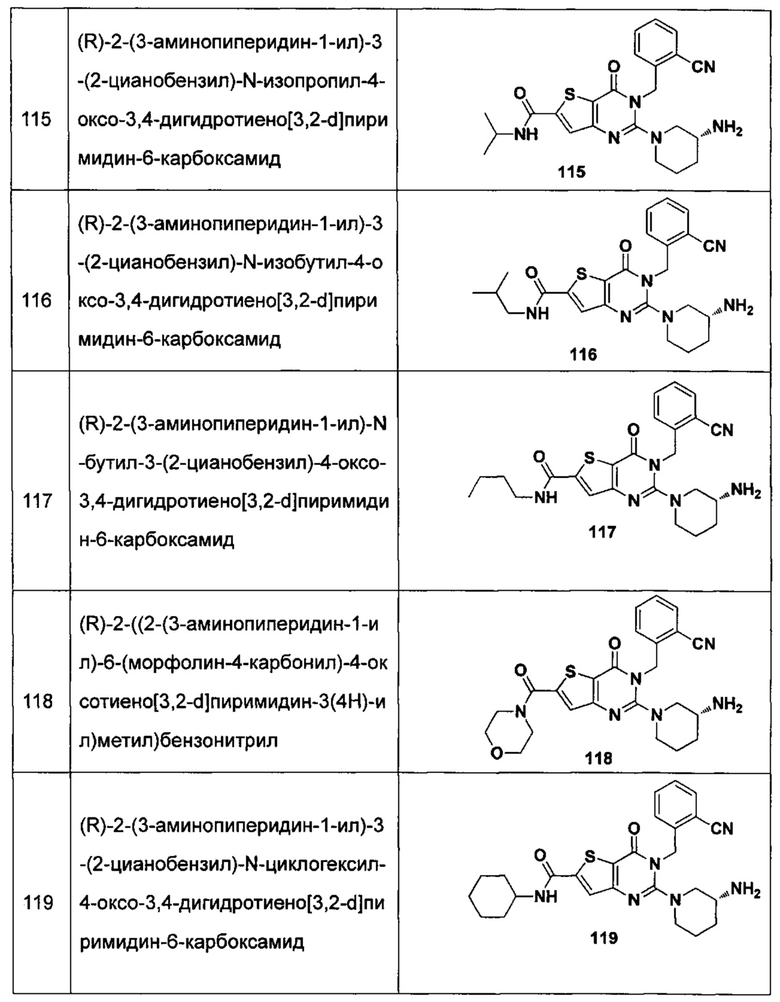
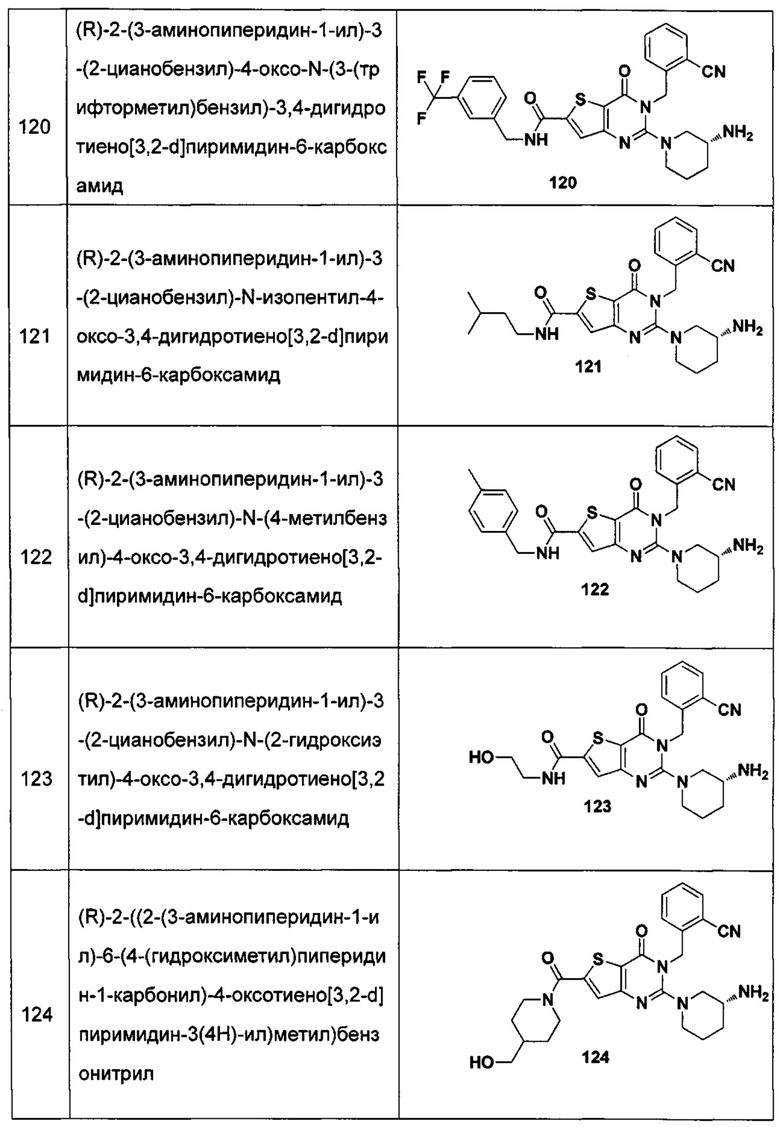
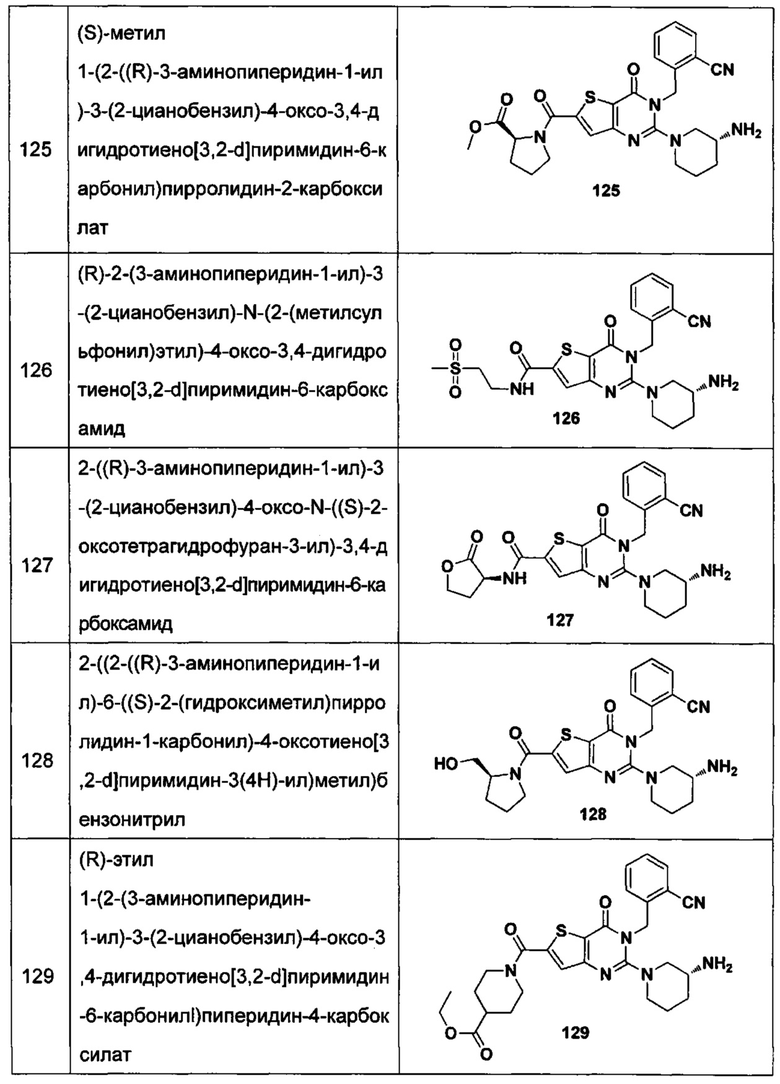
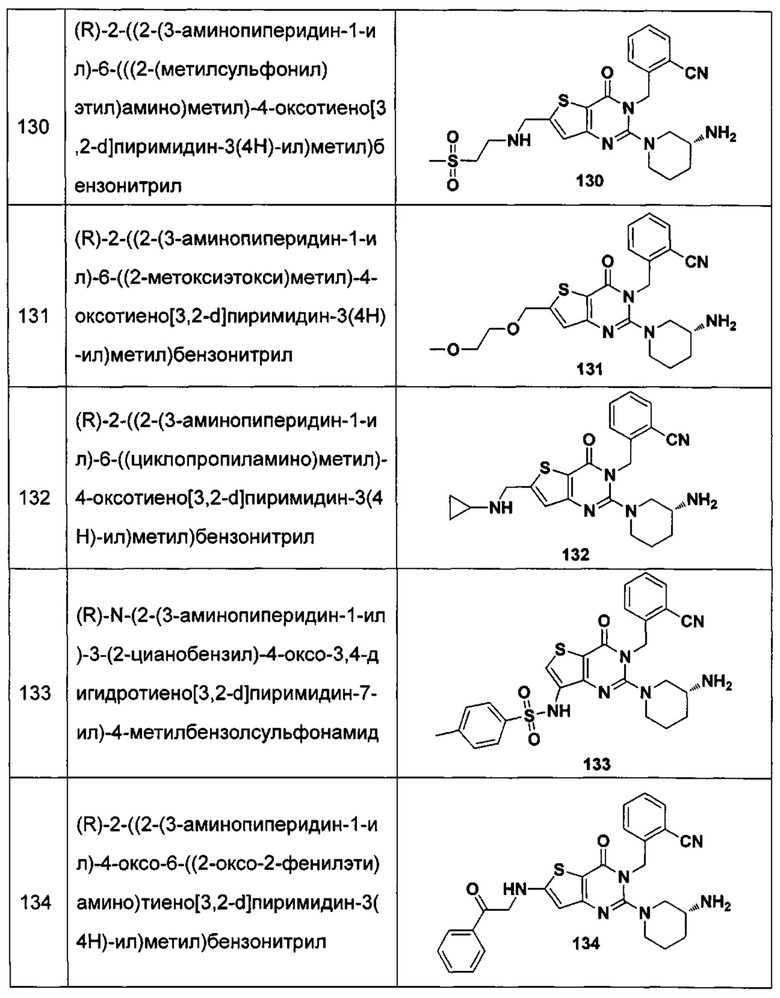
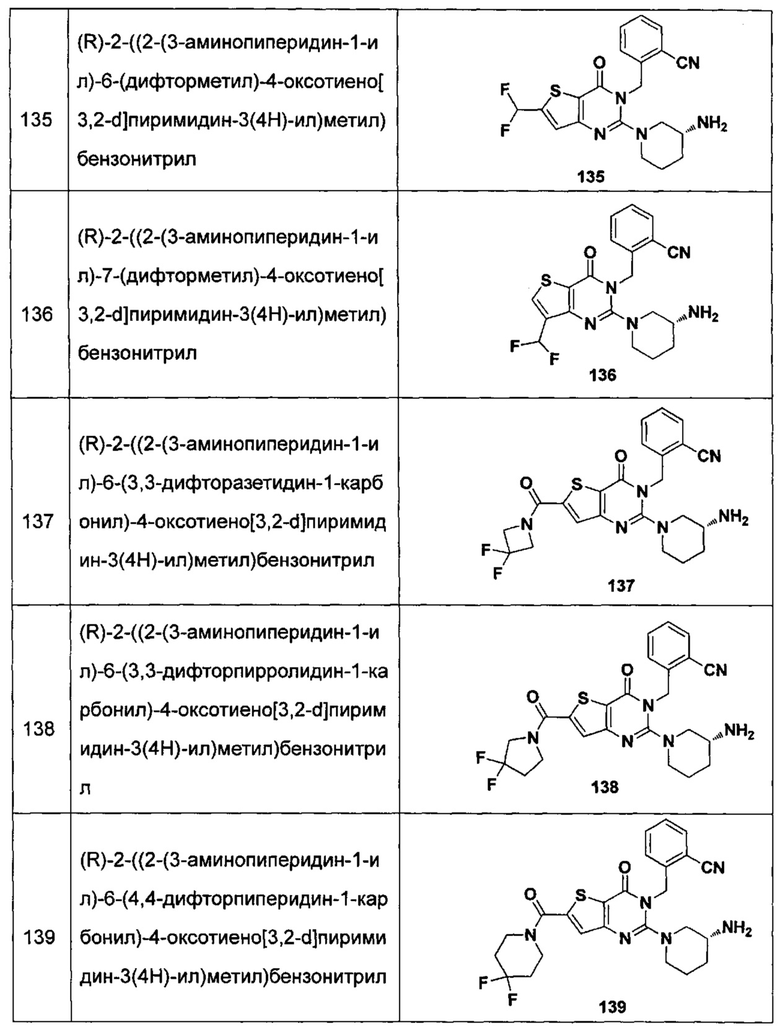
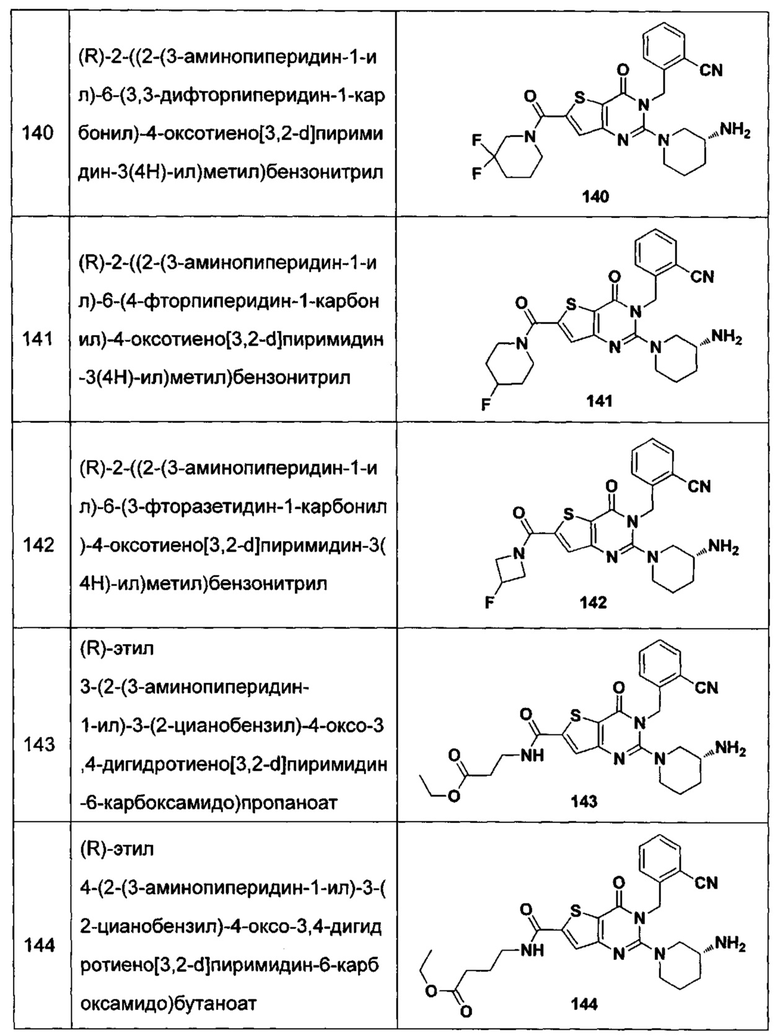
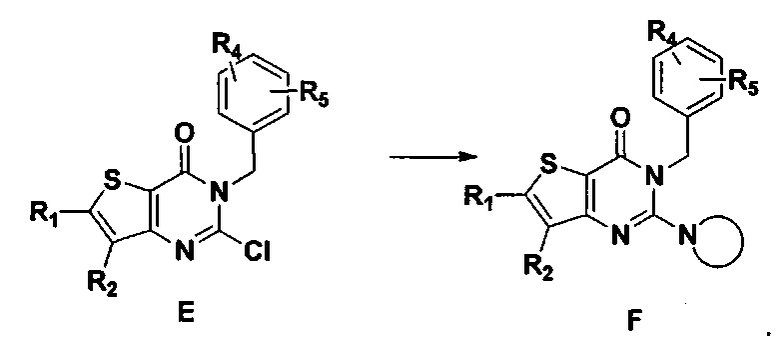
В соответствии с другим объектом настоящего изобретения, предложен способ получения тиено[3,2-d]пиримидин-4-он соединения, энантиомера, диастереоизомера, рацемата и их смесей, или его фармацевтически приемлемой соли, где R1, R2, R4 и R5 определены такими, как указано выше, в частности,
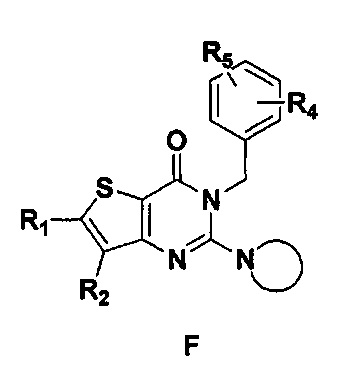
где тиено[3,2-d]пиримидин-4-он соединение, имеющее структурную формулу F, энантиомер, диастереоизомер, рацемат и их смеси, или его фармацевтически приемлемую соль синтезируют с помощью 2,4-диметокситиенил[3,2-d]пиримидина, 7-бром-2,4-диметокситиенил[3,2-d] пиримидина и 7-метил-2,4-диметокситиенил[3,2-d]пиримидина в качестве исходного вещества, и выполняют замещение, хлорирование, гидролиз, замещение бензила и амино замещение на 6,7 позиции.
Стратегия синтеза показана на следующем пути реакции:
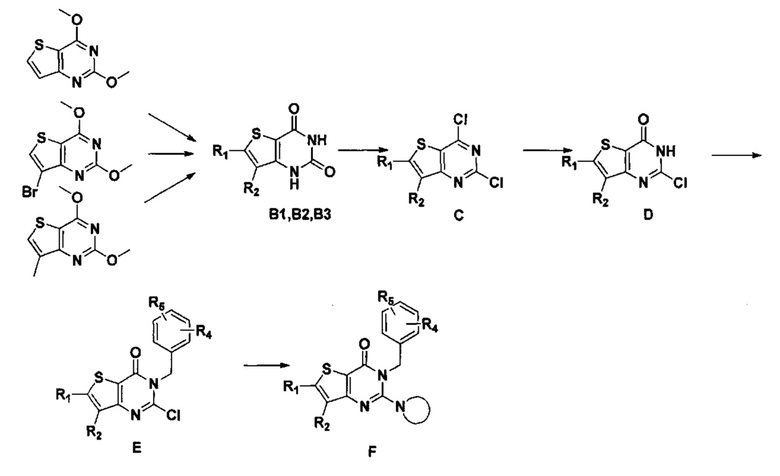
Конкретные стадии синтеза представлены ниже:
1) синтез 6,7-замещенного-тиено[3,2-d]пиримидин-2,4-дион соединения, B1, B2 и B3:
2,4-диметокситиено[3,2-d]пиримидин, 7-бром-2,4-диметокситиено[3,2-d] пиримидин или 7-метил-2,4-диметокситиено[3,2-d]пиримидин растворяют в тетрагидрофуране, замещенном тетрагидрофуране или диэтиловом эфире и перемешивают в течение 15-30 минут при -78°C, а затем по каплям добавляют 1-3 эквивалента 2,5 М раствора н-бутил лития в н-гексане и перемешивают в течение 1-2 часов при -78°C, а затем по каплям добавляют замещающий реагент (F реагент, йодный реагент, реагент кислота борная, реагент N,N-диметилформамид и тому подобное). После добавления реакционную смесь перемешивают еще в течение 15-30 минут, а затем 1 час при комнатной температуре. После этого реакционный раствор выливают в насыщенный раствор NH4Cl и экстрагируют с помощью органического растворителя, а затем 6,7-замещенный-2,4-диметокситиено[3,2-d]пиримидин, соединение A1, A2 или A3 получают путем колоночной хроматографии;
6,7-замещенный-2,4-диметокситиено[3,2-d]пиримидин, соединение A1, A2 или A3, растворяют в органической кислоте и добавляют 4 эквивалента йодида. После перемешивания в течение 1-5 часов с обратным холодильником, реакционную смесь выливают в ледяную воду и перемешивают в течение 30 минут, в осадок выпадает большое количество твердых частиц. Твердые частицы фильтруют аспирацией, промывают водой и сушат, получая в результате продукт 6,7-замещенный-тиено[3,2-d] пиримидин-2,4-дион, соединение B1 или B2;
стратегия синтеза представлена ниже:
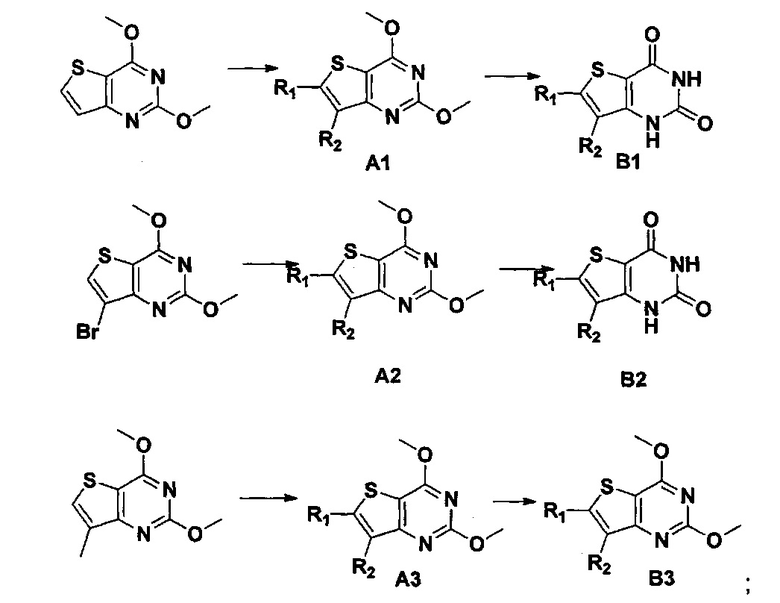
2) синтез 6,7-замещенного-2,4-дихлортиено[3,2-d]пиримидина, соединения C:
6,7-замещенный-тиено[3,2-d]пиримидин-2,4-дион, соединение B1, B2 или B3, растворяют в хлорокиси фосфора. После нагревания с обратным холодильником в течение 2-18 часов, реакционный раствор выливают в ледяную воду и перемешивают в течение 30 минут, а затем в осадок выпадает большое количество твердых частиц. Твердые частицы фильтруют аспирацией, промывают водой и сушат, получая в результате продукт 6,7-замещенный-2,4-дихлортиено[3,2-d]пиримидин, соединение C;
стратегия синтеза представлена ниже:
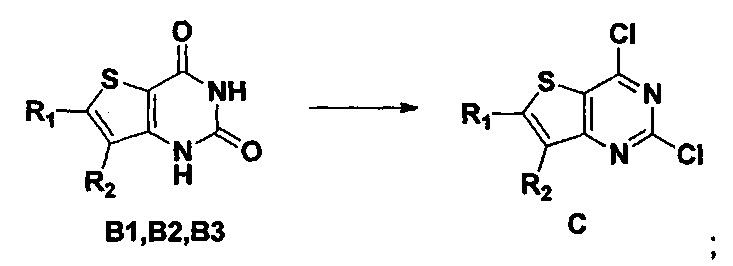
3) синтез 6,7-замещенного-2-хлортиено[3,2-d]пиримидин-4-он соединения D:
6,7-замещенный-2,4-дихлортиено[3,2-d]пиримидин соединение C растворяют в органическом растворителе, соответствующее количество водного раствора щелочи добавляют в атмосфере азота и перемешивают в течение 2-18 часов при комнатной температуре. Органический растворитель выпаривают из реакционного раствора и при перемешивании добавляют кислоту для доведения pH до нейтрального, а затем большое количество твердых частиц выпадает в осадок. Твердые частицы фильтруют аспирацией, промывают водой и сушат, получая в результате продукт 6,7-замещенный-2-хлортиено[3,2-d]пиримидин-4-он соединение D;
стратегия синтеза представлена ниже:
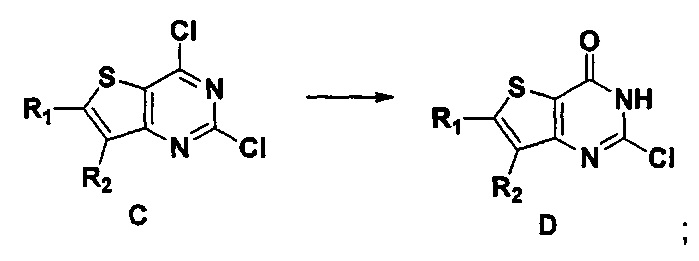
4) синтез 6,7-замещенного-3-замещенного
бензил-2-хлортиено[3,2-d]пиримидин-4-он соединения E;
6,7-замещенный-2-хлортиено[3,2-d]пиримидин-4-он соединение D растворяют в смеси диметилового эфира этиленгликоля и ДМФ (N,N-диметилформамид), при -10~5°C добавляют 60% NaH, а затем добавляют безводный бромид лития, и затем добавляют замещенный бензил бромид или бензил хлорид и реакцию проводят в течение 4-18 часов при температуре 40-100°C. После охлаждения добавляют соответствующее количество воды, и большое количество твердых частиц выпадает в осадок. Твердые частицы фильтруют аспирацией, промывают водой и сушат, получая в результате продукт 6,7-замещенный-3-замещенный бензил-2-хлортиено[3,2-d] пиримидин-4-он, соединение E;
стратегия синтеза представлена ниже:
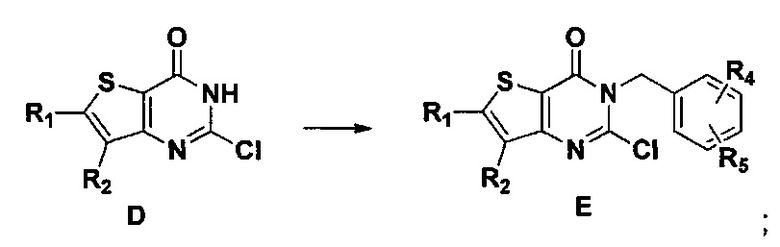
5) синтез 6,7-замещенного-3-замещенного бензил-2-замещеннсто аминотиено[3,2-d]пиримидин-4-он, соединения F:
6,7-замещенный-3-замещенный бензил-2-хлортиено[3,2-d]пиримидин-4-он, соединение E, растворяют в органическом растворителе и добавляют 1-4 эквивалента щелочи, а затем добавляют  и реакцию проводят в течение 1-16 часов при 60-130°C. Реакционный раствор экстрагируют и 6,7-замещенный-3-замещенный бензил-2-замещенный аминотиено[3,2-d] пиримидин-4-он, соединение F, получают путем колоночной хроматографии;
и реакцию проводят в течение 1-16 часов при 60-130°C. Реакционный раствор экстрагируют и 6,7-замещенный-3-замещенный бензил-2-замещенный аминотиено[3,2-d] пиримидин-4-он, соединение F, получают путем колоночной хроматографии;
конкретная стратегия синтеза представлена ниже:
В приведенных выше способах получения кислота, используемая на каждом этапе, может быть органической кислотой или неорганической кислотой, органической кислотой может быть уксусная кислота, трифторуксусная кислота или муравьиная кислота, неорганической кислотой может быть соляная кислота, серная кислота или фосфорная кислота; щелочь может быть неорганической щелочью или органической щелочью, неорганическую щелочь выбирают из карбоната натрия, карбоната калия, карбоната цезия, бикарбоната натрия, фосфата калия, дигидрофосфата калия, гидроксида натрия, гидроксида лития и гидроксида калия, органическую щелочь выбирают из триэтиламина, пиридина, диазабицикло (DBU, диазабициклоундецен) и N,N-диизопропилэтиламина (DIPEA); органический растворитель на стадии 3) и стадии 5) может быть выбран из ТГФ (тетрагидрофуран), ацетонитрила, ацетона, 1,4-диоксана, спиртов, диэтилового эфира, N,N-диметилформамида, диметилового эфира этиленгликоля, N,N-диметилформамида и диметилсульфоксида; реагентом F на стадии 1) может быть DAST (диэтиламиносеры трифторид), йодным реагентом может быть йод или NIS (N-йодсукцинимид); и реагентом борной кислоты может быть триэтилборат.
Другой аспект настоящего изобретения относится к фармацевтической композиции для лечения диабета, и фармацевтическая композиция содержит тиенил[3,2-d]пиримидин-4-он соединение формулы (I), или его фармацевтически приемлемые соли и по меньшей мере один фармацевтически приемлемый носитель, и может быть применена при лечении in vivo, и имеет биосовместимость. Фармацевтическая композиция может быть получена в различных формах, основанных на различных путях введения. Фармацевтическая композиция по настоящему изобретению может быть применена для лечения диабета.
Фармацевтическая композиция, предложенная в настоящем изобретении, может находиться в различных формах, таких как таблетки, капсулы, гранулы, сироп, раствор, суспензия, аэрозоль и тому подобное, и может находиться в подходящем твердом или жидком носителе или разбавителе и подходящих стерилизованных средствах для инъекций или капельного введения. Фармацевтическая композиция может также содержать отдушку, ароматизирующий агент и т.д., а идеальная их пропорция такова, что соединение формулы (I) в качестве активного ингредиента составляет более 65 масс. %, а остальное составляет 0,5-40 масс. %, или предпочтительно 1-20 масс. % или наиболее предпочтительно 1-10 масс. % фармацевтически приемлемого носителя, разбавителя или раствора или солевого раствора.
Соединение структурной формулы (I), описанное выше, может быть клинически применено для млекопитающих, включая человека и животных, с введением через рот, нос, кожу, легкие, или желудочно-кишечный тракт, предпочтительно через рот. Предпочтительно суточная доза составляет 0,01-200 мг/кг массы тела при одноразовом использовании, или 0,01-100 мг/кг массы тела в разделенной дозировке. Независимо от пути введения, лучшая доза для индивидуума должна быть определена на основе конкретного лечения. Обычно наиболее подходящую дозу определяют, постепенно увеличивая дозу, начиная от малой дозы.
Соединение формулы (I) может достигнуть своего назначения при лечении сахарного диабета 2 типа путем ингибирования активности DPPIV, косвенно увеличивая содержание GLP-1 in vivo и индуцируя серии физиологических действий in vivo.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фигура 1-фигура 6 показывают активность DPPIV в плазме ICR (Institute of cancer research) мыши после однократного введения в соответствии с воплощениями настоящего изобретения.
Фигура 7-фигура 10 показывают кривую глюкозотолерантного теста и площадь под кривой после однократного введения в соответствии с воплощениями настоящего изобретения.
Фигура 11-фигура 12 показывают кривую глюкозотолерантного теста и площадь под кривой после однократного введения DC291009 несколькими дозами в соответствии с воплощениями настоящего изобретения.
Фигура 13 показывает кривую зависимости концентрация-время в плазме метаболита М1 после введения DC291407 крысам через желудочный зонд и путем внутривенной инъекции в соответствии с воплощениями настоящего изобретения, где A представляет собой кривую зависимости концентрация-время в плазме метаболита М1 после введения крысам 20 мг/кг DC291407 через желудочный зонд, и B является кривой зависимости концентрация-время в плазме метаболита М1 после введения крысам 10 мг/кг DC291407 путем внутривенной инъекции.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение будет дополнительно проиллюстрировано в следующих примерах. Эти примеры предназначены для иллюстрации настоящего изобретения, но не ограничивают изобретение каким-либо образом. Все параметры в примерах, а также в остальной части описания, описаны в расчете на массу, если не указано иное.
Данные анализа для образцов определяли с помощью следующих приборов, при этом данные ядерного магнитного резонанса (ЯМР) определяли на Gemini-300, Bruker АМХ-400 или INVOA-600 спектрометре ядерного магнитного резонанса с использованием ТМС (тетраметилсилан) в качестве внутреннего стандарта, при этом единица химического сдвига м.д. и единица константы связи Гц; и масс-спектрометрические данные определяли на Finnigan МАТ-711, МАТ-95 и LCQ-DECA масс-спектрометре или lonSpec 4,7 Тесла масс-спектрометре.
Силикагель 200-300 меш (Qindao Haiyang Chemical Co.) использовали при колоночной хроматографии. Силикагельной пластиной для ТСХ (тонкослойная хроматография) была готовая пластина для тонкослойной хроматографии HSGF-254, производимая Yantai Chemical Со. Интервал кипения петролейного эфира был 60-90°C. Были использованы ультрафиолетовый свет и йод для развития цвета. Нормальные реагенты и лекарственные средства, используемые в примерах, были приобретены у CHINA National Medicines Co., LTD, если не указано иное. Реагенты и растворители, используемые в экспериментах, были определены на основе конкретной реакции.
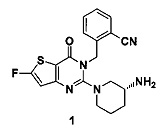
Пример 1: синтез соединения 1
Путь синтеза:
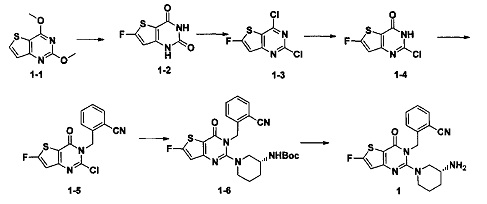
Синтез соединения 1-2:
Соединение 1-1 (2 г, 10,2 ммоль) растворяли в 50 мл ТГФ и перемешивали в течение 15 минут при -78°C в атмосфере азота. По каплям добавляли 6,1 мл 2,5 М (15,3 ммоль) н-бутил лития в н-гексане и перемешивали в течение 1 часа при -78°C. NFSI (N-фторбензолсульфонимид, 6,42 г, 20,4 ммоль) раствор в ТГФ (10 мл) добавляли по каплям, перемешивали в течение 15 минут при -78°C, а затем перемешивали в течение 30 минут при комнатной температуре. Добавляли 50 мл насыщенного раствора хлорида аммония. Экстракцию проводили с использованием этилацетата. 1,56 г белого твердого вещества получали с помощью колоночной хроматографии.
Белое твердое вещество растворяли в 40 мл ледяной уксусной кислоты, и NaI (4,3 г, 29 ммоль). Реакцию проводили в течение 2 часов при 80°C. Реакционный раствор выливали в ледяную воду и перемешивали в течение 30 минут. В осадок выпадало большое количество твердых частиц. Твердые частицы фильтровали аспирацией, промывали водой и сушили, получая в результате продукт 1-2 (1,34 г) с выходом 71%. MS: 187,0 [М+Н]+.
Синтез соединения 1-3:
Соединение 1-2 (1,34 г, 7,2 ммоль) растворяли в 20 мл оксихлорида фосфора и нагревали с обратным холодильником в течение ночи. Реакционный раствор выливали в 200 мл ледяной воды и перемешивали в течение 30 минут. В осадок выпадало большое количество твердых частиц. Твердые частицы фильтровали аспирацией, промывали водой и сушили, получая в результате продукт 1-3 (1,12 г) с выходом 69,7%. MS: 224,9 [М+Н]+.
Синтез соединения 1-4:
Соединение 1-3 (1,12 г, 5,0 ммоль) растворяли в 20 мл ТГФ. Добавляли 25 мл 1 М раствора гидроксида натрия и перемешивали в атмосфере азота в течение ночи. ТГФ удаляли путем выпаривания и значение pH доводили до 7 добавлением 1 М раствора соляной кислоты. В осадок выпадало большое количество твердых частиц. Твердые частицы фильтровали аспирацией, промывали водой и сушили, получая в результате продукт 1-4 (0,97 г) с выходом 95%. MS: MS: 206,9 [М+Н]+.
Синтез соединения 1-5:
Соединение 1-4 (0,97 г, 4,75 ммоль) растворяли в 40 мл смеси диметилового эфира и ДМФ (N,N-диметилформамид) (2:1, об./об.). При 0°C добавляли 60% NaH (0,247 г, 6,18 ммоль) и перемешивали в течение 30 минут. Добавляли 1 г безводного бромида лития и перемешивали в течение 15 минут при комнатной температуре. Затем добавляли 1 г 2-цианобензил бромида и реакцию проводили при 70°C в течение ночи. Добавляли 100 мл воды, и в осадок выпадало большое количество твердых частиц. Твердые частицы фильтровали аспирацией, промывали водой и сушили, получая в результате продукт 1-5 (1,37 г) с выходом 90%. MS: 322,0 [М+Н]+.
Синтез соединения 1-6:
Соединение 1-5 (1,37 г, 4,3 ммоль) растворяли в 1,4-диоксане и добавляли (R)-3-Boc аминопиперидине (0,946 г, 4,73 ммоль). Добавляли 1,5 мл DIPEA (N,N-диизопропилэтиламин) (0,946 г, 4,73 ммоль) и перемешивали в течение 1 часа при 120°C. Экстракцию проводили с использованием этилацетата, а затем растворитель удаляли с помощью роторного испарителя. Соединение 1-6 (1,87 г) получали путем колоночной хроматографии с выходом 90%. MS: 322,0 [М+Н]+.
Синтез соединения 1:
Соединение 1-6 (1,87 г, 3,87 ммоль) растворяли в 40 мл ДХМ (дихлорметан). Добавляли 15 мл ТФУ (трифторуксусная кислота) и перемешивали в течение 4 ч при комнатной температуре. Растворитель удаляли на роторном испарителе и остаток растворяли в 50 мл этилацетата. Смесь промывали насыщенным раствором карбоната калия и затем промывали насыщенным раствором хлорида натрия. Растворитель удаляли на роторном испарителе и затем соединение 1 (1,32 г) получали с помощью колоночной хроматографии (ДХМ: СН3ОН=5:1) с выходом 90%. MS: 384,1 [М+Н]+. 1H-ЯМР (400 Гц, CDCl3): δ 1,25 (1H, m), 1,67 (1Н, m), 1,76 (1H, m), 1,96 (1Н, m), 2,67 (1H, m), 2,88 (2Н, m), 3,21 (1Н, m), 3,39 (1H, m), 5,52 (2Н, s), 7,03 (1H, d, J=8), 7,20 (1H, d, J=8,2), 7,31 (1Н, t, J=8), 7,46 (1H, t, J=8), 7,62 (1H, d, J=7,2).
Пример 2: синтез соединения 2
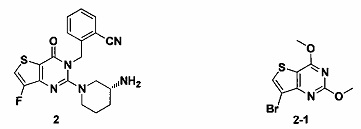
Соединение 2 синтезировали в соответствии со способом синтеза, описанным в Примере 1, где соединение 2-1 использовали вместо соединения 1-1 в Примере 1. MS: 384,1 [М+Н]+. 1H-ЯМР (400 Гц, CDCl3): δ 1,25 (1H, m), 1,67 (1Н, m), 1,76 (1Н, m), 1,96 (1H, m), 2,67 (1Н, m), 2,88 (2Н, m), 3,21 (1Н, m), 3,39 (1H, m), 5,52 (2H, s), 7,03 (1H, d, J=8), 7,31 (1H, t, J=8), 7,46 (1H, t, J=8), 7,62 (1H, d, J=7,2), 7,75 (1H, d, J=8,2).
Пример 3: синтез соединения 3
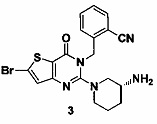
Соединение 3 синтезировали в соответствии с методом синтеза, описанным в Примере 1, где NBS (N-бромсукцинимид) использовали вместо NFSI, использованного при синтезе соединения 1-2 в Примере 1. MS: 446.0 [М+Н]+. 1H-ЯМР (400 Гц, CDCl3): δ 1,25 (1H, m), 1,67 (1Н, m), 1,76 (1Н, m), 1,96 (1Н, m), 2,67 (1H, m), 2,88 (2Н, m), 3,21 (1H, m), 3,39 (1H, m), 5,52 (2Н, s), 7,03 (1H, d, J=8), 7,14 (1H, s), 7,31 (1Н, t, J=8), 7,46 (1H, t, J=8), 7,62 (1H, d, J=7,2).
Пример 4: синтез соединения 4
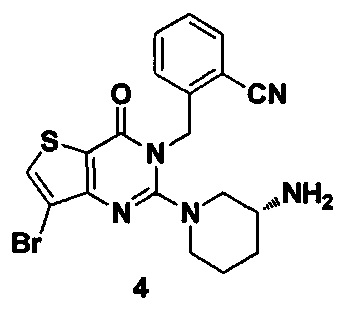
Путь синтеза:
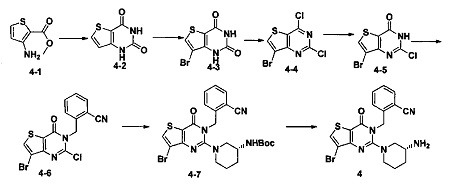
Синтез 4-2:
Соединение 4-1 (4 г) и мочевину (10 г) загружали в 100 мл грушевидную колбу и равномерно смешивали. Смесь нагревали до 180°C в течение 4 часов и добавляли 100 мл воды. В осадок выпадало большое количество твердых частиц. Твердые частицы фильтровали аспирацией, промывали водой и сушили, получая в результате продукт 4-2 (3,5 г) с выходом 81,7%. MS: 169,0 [M+H]+.
Синтез 4-3:
3,5 г соединения 4-2 растворяли в 60 мл ледяной уксусной кислоты. Добавляли 6,66 г брома и нагревали с обратным холодильником в течение 24 часов. Реакционный раствор выливали в ледяную воду, и в осадок выпадало большое количество твердых частиц. Твердые частицы фильтровали аспирацией, промывали водой и сушили, получая в результате продукт 4-3 (4,1 г) с выходом 80%. MS: 248,9 [М+Н]+.
Соединение 4 синтезировали из соединения 4-4 в соответствии со способом синтеза, описанном в Примере 1. MS: 446,0 [М+Н]+. 1H-ЯМР (400 Гц, CDCl3): δ 1,25 (1H, m), 1,67 (1Н, m), 1,76 (1Н, m), 1,96 (1Н, m), 2,67 (1H, m), 2,88 (2Н, m), 3,21 (1Н, m), 3,39 (1H, m), 5,52 (2Н, s), 7,03 (1H, d, J=8), 7,31 (1Н, t, J=8), 7,46 (1H, t, J=8), 7,62 (1H, d, J=7,2), 7,68 (1H, s).
Пример 5: синтез соединения 5
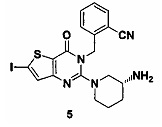
Соединение 5 синтезировали в соответствии с методом синтеза, описанном в Примере 1, где использовали йод вместо NFSI, использованного при синтезе соединения 1-2 в Примере 1. MS: 492,0 [М+Н]+. 1H-ЯМР (400 Гц, CDCl3): δ 1,25 (1H, m), 1,67 (1Н, m), 1,76 (1Н, m), 1,96 (1H, m), 2,67 (1H, m), 2,88 (2Н, m), 3,21 (1Н, m), 3,39 (1Н, m), 5,52 (2Н, s), 7,03 (1Н, d, J=8), 7,16 (1Н, s), 7,31 (1Н, t, J=8), 7,46 (1H, t, J=8), 7,62 (1H, d, J=7,2).
Пример 6: синтез Соединения 6
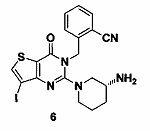
Путь синтеза:
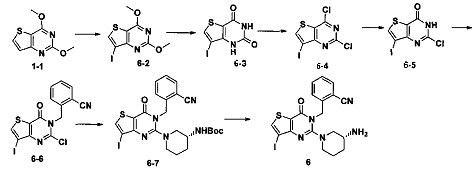
Синтез 6-2:
Соединение 1-1 (2 г, 10,2 ммоль) растворяли в 100 мл CCl4. Добавляли бис(трифторацетокси)йодбензол (5,2 г, 12,2 ммоль) и йод (5,7 г, 22,4 ммоль) и перемешивали при комнатной температуре в течение ночи. Растворитель удаляли с помощью роторного испарителя и соединение 7-2 (1,2 г) получали с помощью колоночной хроматографии с выходом 36,7%. MS: 322,9 [М+Н]+.
Соединение 6 синтезировали из соединения 6-3 в соответствии с Примером 1. MS: 492,0 [М+Н+]. 1H-ЯМР (400 Гц, CDCl3): δ 1,25 (1H, m), 1,67 (1Н, m), 1,76 (1Н, m), 1,96 (1Н, m), 2,67 (1Н, m), 2,88 (2Н, m), 3,21 (1Н, m), 3,39 (1H, m), 5,52 (2Н, s), 7,03 (1H, d, J=8), 7,31 (1Н, t, J=8), 7,46 (1H, t, J=8), 7,62 (1H, d, J=7,2), 7,69 (1H, s).
Пример 7: синтез соединения 7
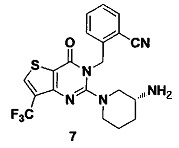
Путь синтеза:
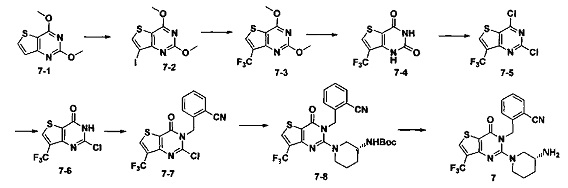
Синтез 7-2:
Соединение 7-1 (2 г, 10,2 ммоль) растворяли в 100 мл CCl4. Добавляли бис(трифторацетокси)йодбензол (5,2 г, 12,2 ммоль) и йод (5,7 г, 22,4 ммоль) и перемешивали при комнатной температуре в течение ночи. Растворитель удаляли на роторном испарителе и соединение 7-2 (1,2 г) получали с помощью колоночной хроматографии с выходом 36,7%. MS: 322,9 [М+Н]+.
Синтез 7-3:
Соединение 7-2 (1,2 г, 3,72 ммоль) растворяли в смеси NMP (N-метилпирролидин) и ДМФ (25 мл, 1:1). Добавляли 10% CuI, 10% фенантролина и KF (0,42 г, 0,745 ммоль). Реакцию проводили при 60°C в течение 24 часов. Соединение 7-3 (0,68 г) получали путем экстракции и хроматографии на колонке с выходом 69%. MS: 265,0 [М+Н]+.
Соединение 7 синтезировали из соединения 7-4 в соответствии со способом синтеза, описанном в Примере 1. MS: 434,1 [М+Н]+. 1H-ЯМР (400 Гц, CDCl3): δ 1,25 (1H, m), 1,67 (1Н, m), 1,76 (1Н, m), 1,96 (1Н, m), 2,67 (1H, m), 2,88 (2Н, m), 3,21 (1Н, m), 3,39 (1Н, m), 5,52 (2Н, s), 7,03 (1Н, d, J=8), 7,31 (1Н, t, J=8), 7,46 (1Н, t, J=8), 7,62 (1H, d, J=7,2), 7,76 (1H, s).
Пример 8: синтез соединения 8
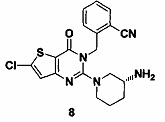
Путь синтеза:
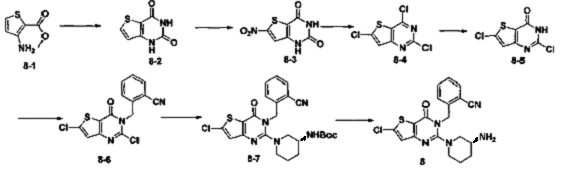
Синтез 8-2:
Соединение 8-2 синтезировали в соответствии с синтезом соединения 4-2.
Синтез 8-3:
Соединение 8-2 (10 г, 59,5 ммоль) добавляли в 30 мл смеси серной кислоты и азотной кислоты (1:1) при 0°C. Реакцию проводили при 0°C в течение 30 минут и перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор выливали в ледяную воду и перемешивали в течение 30 минут. В осадок выпадало большое количество твердых частиц. Твердые частицы фильтровали аспирацией, промывали водой и сушили, получая в результате продукт 8-3 (6,8 г) с выходом 53,6%. MS: 213,9 [М+Н]+.
Синтез 8-4:
Соединение 8-3 (6,8 г, 31,9 ммоль) растворяли в 40 мл фенил фосфорилхолина и реакцию проводили при 180°C в течение 4 часов. Реакционный раствор выливали в ледяную воду и перемешивали в течение 30 минут. В осадок выпадало большое количество твердых частиц. Твердые частицы фильтровали аспирацией и продукт 8-4 (3 г) получали с выходом 39,3% путем колоночной хроматографии. MS: 238,9 [М+Н]+.
Соединение 8 синтезировали из соединения 8-5 в соответствии с методом синтеза, описанным в Примере 1. MS: 400.0 [М+Н]+. 1H-ЯМР (400 Гц, CDCl3): δ 1,25 (1Н, m), 1,67 (1Н, m), 1,76 (1Н, m), 1,96 (1Н, m), 2,67 (1Н, m), 2,88 (2Н, m), 3,21 (1Н, m), 3,39 (1Н, m), 5,52 (2Н, s), 7,03 (1Н, d, J=8), 7,15 (1Н, s), 7,31 (1Н, t, J=8), 7,46 (1H, t, J=8), 7,62 (1H, d, J=7,2).
Пример 9: синтез соединения 9
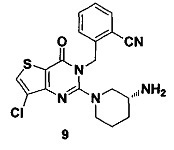
Путь синтеза:
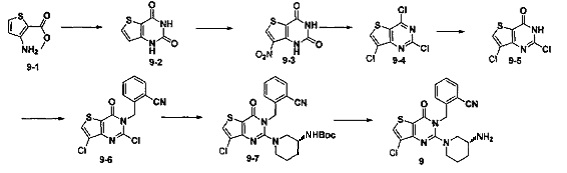
Соединение 9 синтезировали в соответствии с синтезом соединения 8. MS: 400.0 [М+Н]+. 1H-ЯМР (400 Гц, CDCl3): δ 1,25 (1H, m), 1,67 (1H, m), 1,76 (1Н, m), 1,96 (1Н, m), 2,67 (1Н, m), 2,88 (2Н, m), 3,21 (1Н, m), 3,39 (1Н, m), 5,52 (2Н, s), 7,03 (1H, d, J=8), 7,31 (1Н, t, J=8), 7,46 (1H, t, J=8), 7,62 (1H, d, J=7,2), 7,68 (1H, s).
Пример 10: синтез соединения 10
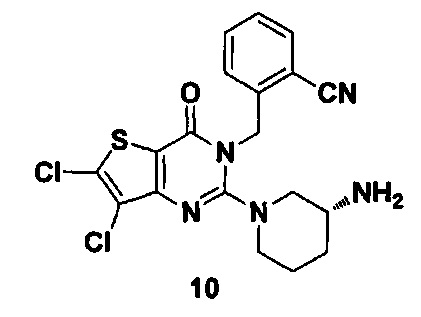
Путь синтеза:
Соединение 10 синтезировали в соответствии с синтезом соединения 8. MS: 434.0 [М+Н]+. 1H-ЯМР (400 Гц, CDCl3): δ 1,25 (1H, m), 1,67 (1Н, m), 1,76 (1Н, m), 1,96 (1Н, m), 2,67 (1H, m), 2,88 (2Н, m), 3,21 (1Н, m), 3,39 (1H, m), 5,52 (2Н, s), 7,03 (1H, d, J=8), 7,31 (1Н, t, J=8), 7,46 (1H, t, J=8), 7,62 (1H, d, J=7,2).
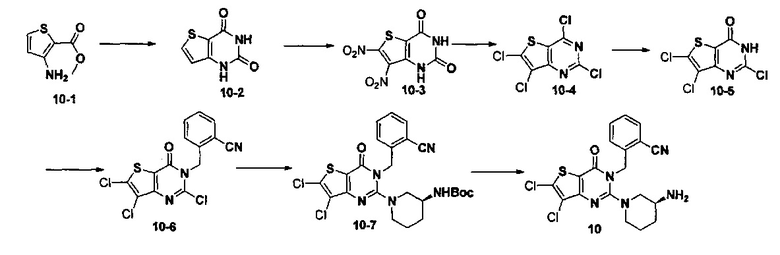
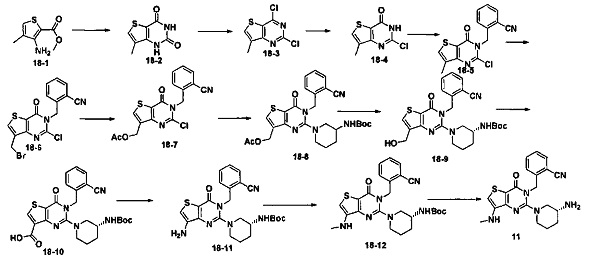
Пример 11: синтез соединения 11
Путь синтеза:
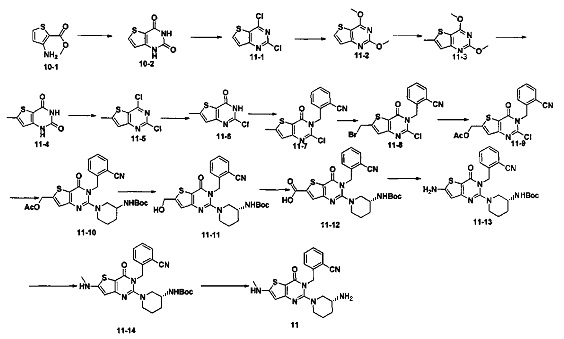
Синтез соединения 11-2:
Соединение 11-1 (1 г, 4,9 ммоль) растворяли в 30 мл абсолютного метанола. Добавляли 4 эквивалента NaOMe и нагревали с обратным холодильником в течение 2 часов. Когда реакция была завершена, добавляли 30 мл воды, и в осадок выпадало большое количество твердых частиц. Соединение 11-2 получали фильтрованием аспирацией с выходом 99%. MS: 197,1 [М+Н]+.
Соединение 11-3 синтезировали в соответствии с синтезом соединения 1-2, где йодметан использовали для замены NFSI.
Соединение 11-7 синтезировали в соответствии с синтезом соединения 1-5.
Синтез соединения 11-8:
Соединение 11-7 (500 мг, 1,6 ммоль) растворяли в 20 мл CCl4. Добавляли 1,5 эквивалент NBS (N-бромсукцинимид) и каталитическое количество перекиси бензоила и нагревали с обратным холодильником в течение ночи. Когда реакция была завершена, смесь экстрагировали с использованием дихлорметана. После промывали водой, соединение 11-8 (250 мг) получали путем колоночной хроматографии с выходом 40%. MS: 393,9 [М+Н]+.
Синтез соединения 11-9:
Указанное выше соединение 11-8 растворяли в ацетонитриле. Добавляли 2 эквивалента ацетата натрия и каталитическое количество 18-краун-эфира и нагревали с обратным холодильником в течение 5 часов. После экстрагировали этилацетатом, промывали водой и выделяли с помощью колоночной хроматографии, белое твердое вещество (соединение 11-9, 170 мг) получали с выходом 72%. MS: 374,1 [М+Н]+.
Синтез соединения 11-10:
См. синтез соединения 1-6.
Синтез соединения 11-11:
Соединение 11-10 (200 мг 0,372 ммоль) растворяли в метаноле. Добавляли 2 эквивалента 10% водного раствора гидроксида натрия и перемешивали в течение 10 минут. После экстрагировали этилацетатом и выпаривали досуха, пенообразное твердое вещество 11-11 (180 мг) получали с выходом 98%. MS: 496,2 [М+Н]+.
Синтез соединения 11-12:
Соединение 11-11 (180 мг) растворяли в 20 мл ацетона и 2,5 эквивалента 2,7 М реагента Джонса по каплям добавляли на ледяной бане. После добавления смесь перемешивали при комнатной температуре в течение 1 часа. После экстрагировали этилацетатом, промывали водой и выпаривали досуха, пенообразное твердое вещество (соединение 11-12,166 мг) получали с выходом 90%. MS: 510,2 [M+H]+.
Синтез соединения 11-13:
Соединение 11-12 (166 мг) растворяли в 20 мл толуола. Добавляли 1,5 эквивалента дифенилфосфорилазида и нагревали с обратным холодильником в течение 1 часа. Добавляли 5 мл воды и нагревали с обратным холодильником еще в течение 1 часа. Далее экстрагировали этилацетатом и выделяли с помощью колоночной хроматографии, соединение 11-13 (109 мг) получали с выходом 70%. MS: 481,2 [М+Н]+.
Синтез соединения 11-14:
Соединение 11-13 (109 мг) растворяли в 5 мл ДМФ. Добавляли 1,5 эквивалента йодметана и 2 эквивалента карбоната цезия и перемешивали в течение ночи при комнатной температуре. После экстрагировали этилацетатом, промывали водой и выпаривали досуха, соединение 11-14 (96 мг) получали с выходом 85%. MS: 495,2 [М+Н]+.
Соединение 11 синтезировали в соответствии с синтезом соединения 1. MS: 395,1 [М+Н]+. 1H-ЯМР (400 Гц, CDCl3): δ 1,25 (1H, m), 1,67 (114, m), 1,76 (114, m), 1,96 (1Н, m), 2,67 (1H, m), 2,73 (3H, s), 2,88 (2Н, m), 3,21 (1Н, m), 3,39 (1H, m), 5,52 (2Н, s), 6,50 (1H, s), 7,03 (1Н, d, J=8), 7,31 (1Н, t, J=8), 7,46 (1Н, t, J=8), 7,62 (1H, d, J=7,2).
Пример 12: синтез соединения 12
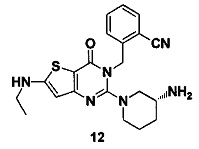
Соединение 12 синтезировали в соответствии с синтезом соединения 11, где йодэтан использовали вместо йодметана. MS: 409,1 [М+Н]+. 1H-ЯМР (400 Гц, CDCl3): δ 1,14 (3H, t), 1,25 (1H, m), 1,67 (1H, m), 1,76 (1H, m), 1,96 (1H, m), 2,67 (1H, m), 2,75 (2H, m), 2,88 (2H, m), 3,21 (1H, m), 3,39 (1H, m), 5,52 (2H, s), 6,50 (1H, s), 7,03 (1H, d, J=8), 7,31 (1H, t, J=8), 7,46 (1H, t, J=8), 7,62 (1H, d, J=7,2).
Пример 13: синтез соединения 13
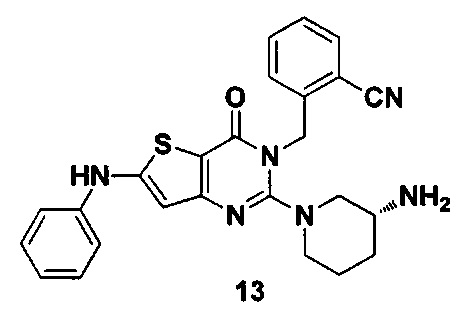
Соединение 13 синтезировали в соответствии с синтезом Соединения 11, где йодбензол использовали вместо йодметана и к реакционному раствору добавляли каталитическое количество Pd2(dba)3 (трис(дибензилиденацетон)дипалладий), ксантфос (Xantphos) (4,5-бис(дифенилфосфино)-9,9-ди-метилксантен) и 2 эквивалента CsCO3. MS: 457,0 [М+Н]+. 1H-ЯМР (400 Гц, CDCl3): δ 1,25 (1H, m), 1,67 (1Н, m), 1,76 (1Н, m), 1,96 (1Н, m), 2,67 (1H, m), 2,88 (2Н, m), 3,21 (1Н, m), 3,39 (1H, m), 5,52 (2Н, s), 6,60 (1H, s), 7,03 (9Н, m).
Пример 14: синтез соединения 14
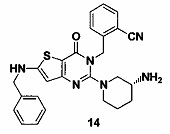
Соединение 14 синтезировали в соответствии с синтезом соединения 11, где бензил бромид использовали вместо йодметана. MS: 470,1 [М+Н]+. 1H-ЯМР (400 Гц, CDCl3): δ 1,25 (1H, m), 1,67 (1Н, m), 1,76 (1Н, m), 1,96 (1Н, m), 2,67 (1H, m), 2,88 (2Н, m), 3,21 (1Н, m), 3,39 (1H, m), 4,98 (2Н, s), 5,52 (2Н, s), 6,60 (1H, s), 7,03 (9Н, m).
Пример 15: синтез соединения 15
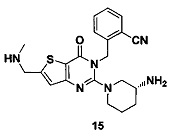
Путь синтеза:
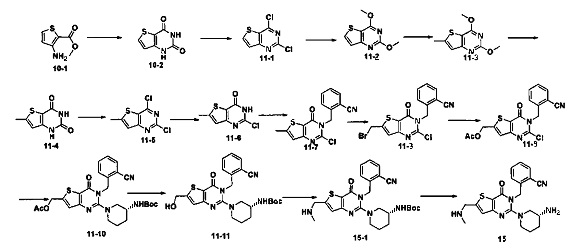
Синтез соединения 15-1:
Соединение 11-11 (200 мг) растворяли в тетрагидрофуране. Добавляли 1,1 эквивалента метилсульфонилхлорида и 1,2 эквивалента триэтиламина и перемешивали при комнатной температуре в течение 30 минут. Добавляли 2М раствора метиламина в тетрагидрофуране и перемешивали при комнатной температуре в течение 4 часов. После этого экстрагировали этилацетатом, промывали водой и выделяли путем колоночной хроматографии, соединение 15-1 (164 мг) получали с выходом 80%. MS: 509,2 [М+Н]+.
Соединение 15 синтезировали в соответствии с синтезом соединения 1 в Примере 1. MS: 409,0 [М+Н]+. 1H-ЯМР (400 Гц, CDCl3): δ 1,25 (1H, m), 1,67 (1Н, m), 1,76 (1Н, m), 1,96 (1Н, m), 2,67 (1H, m), 2,78 (3H, s), 2,88 (2Н, m), 3,21 (1Н, m), 3,39 (1Н, m), 3,52 (2Н, s), 5,52 (2Н, s), 6,50 (1Н, s), 7,03 (1Н, d, J=8), 7,31 (1Н, t, J=8), 7,46 (1H,t, J=8), 7,62 (1H,d, J=7,2).
Пример 16: синтез соединения 16
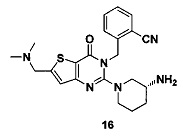
Соединение 16 синтезировали в соответствии со способом синтеза соединения 15, где гидрохлорид диметиламина использовали вместо раствора метиламина в тетрагидрофуране. MS: 423,0 [М+Н]+. 1H-ЯМР (400 Гц, CDCl3): δ 1,25 (1H, m), 1,67 (1H, m), 1,76 (1Н, m), 1,96 (1Н, m), 2,67 (1H, m), 2,78 (6Н, s), 2,88 (2Н, m), 3,21 (1Н, m), 3,39 (1H, m), 3,52 (2Н, s), 5,52 (2Н, s), 6,50 (1H, s), 7,03 (1H, d, J=8), 7,31 (1Н, t, J=8), 7,46 (1H, t, J=8), 7,62 (1H, d, J=7,2).
Пример 17: синтез Соединения 17
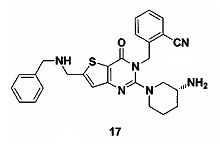
Соединение 17 синтезировали в соответствии со способом синтеза соединения 15, где бензиламин использовали вместо раствора метиламина в тетрагидрофуране. MS: 485,0 [М+Н]+. 1H-ЯМР (400 Гц, CDCl3): δ 1,25 (1H, m), 1,67 (1H, m), 1,76 (1H, m), 1,96 (1H, m), 2,67 (1H, m), 2,88 (2Н, m), 3,21 (1Н, m), 3,39 (1H, m), 3,52 (2Н, s), 4,98 (2Н, s), 5,52 (2Н, s), 6,60 (1H, s), 7,03 (9Н, m).
Пример 18: синтез Соединения 18
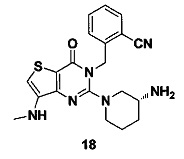
Путь синтеза:
Соединение 18 синтезировали в соответствии с методом синтеза, описанным в Примере 11. MS: 395,1 [М+Н]+. 1H-ЯМР (400 Гц, CDCl3): δ 1,25 (1H, m), 1,67 (1H, m), 1,76 (1H, m), 1,96 (1Н, m), 2,67 (1H, m), 2,73 (3H, s), 2,88 (2Н, m), 3,21 (1Н, m), 3,39 (1Н, m), 5,52 (2Н, s), 7,03 (1Н, d, J=8), 7,15 (1Н, s), 7,31 (1Н, t, J=8), 7,46 (1H, t, J=8), 7,62 (1H, d, J=7,2).
Пример 19: синтез соединения 19
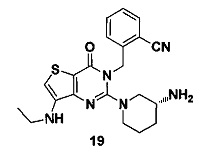
Соединение 19 синтезировали в соответствии со способом синтеза, описанным в Примере 18. MS: 409.1 [М+Н]+. 1H-ЯМР (400 Гц, CDCl3): δ 1,14 (3H, t), 1,25 (1Н, m), 1,67 (1H, m), 1,76 (1H, m), 1,96 (1H, m), 2,67 (1H, m), 2,70 (2H, m), 2,88 (2H, m), 3,21 (1H, m), 3,39 (1H, m), 5,52 (2H, s), 7,03 (1H, d, J=8), 7,15 (1H, s), 7,31 (1H, t, J=8), 7,46 (1H, t, J=8), 7,62 (1H, d, J=7,2).
Пример 20: синтез соединения 20
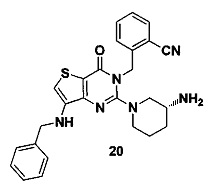
Соединение 20 синтезировали в соответствии со способом синтеза, описанным в Примере 18. MS: 470,1 [М+Н]+. 1H-ЯМР (400 Гц, CDCl3): δ 1,25 (1Н, m), 1,67 (1Н, m), 1,76 (1H, m), 1,96 (1H, m), 2,67 (1H, m), 2,88 (2Н, m), 3,21 (1Н, m), 3,39 (1H, m), 4.98 (2Н, s), 5,52 (2Н, s), 7,13 (10Н, m).
Пример 21: синтез соединения 21
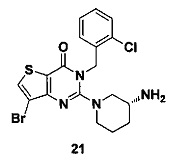
Соединение 21 синтезировали в соответствии со способом синтеза соединения 4, где o-хлорбензил бромид был использован вместо o-цианобензил бромида. MS: 455,0 [М+Н]+. 1H-ЯМР (400 Гц, CDCl3): δ 1,25 (1H, m), 1,67 (1Н, m), 1,76 (1Н, m), 1,96 (1Н, m), 2,67 (1H, m), 2,88 (2H, m), 3,21 (1Н, m), 3,39 (1H, m), 5,52 (2Н, s), 7,13 (1H, d, J=5,6), 7,21 (1Н, t, J=5,6), 7,36 (1Н, t, J=5,6), 7,52 (1H, d, J=4.8), 7,68 (1H, s).
Пример 22: синтез соединения 22
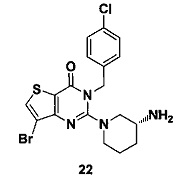
Соединение 22 синтезировали в соответствии со способом синтеза соединения 4, где p-хлорбензил бромид использовали вместо o-цианобензил бромида. MS: 455,0 [М+Н]+. 1H-ЯМР (400 Гц, CDCl3): δ 1,25 (1H, m), 1,67 (1H, m), 1,76 (1H, m), 1,96 (1H, m), 2,67 (1H, m), 2,88 (2Н, m), 3,21 (1Н, m), 3,39 (1H, m), 5,52 (2Н, s), 7,3 (4Н, m), 7,70 (1H, s).
Пример 23: синтез соединения 23
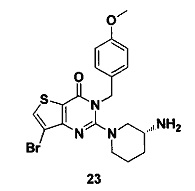
Соединение 23 синтезировали в соответствии со способом синтеза соединения 4, где p-метоксибензил бромид использовали вместо o-цианобензил бромида. MS: 451,0 [М+Н]+. 1H-ЯМР (400 Гц, CDCl3): δ 1,25 (1H, m), 1,67 (1H, m), 1,76 (1H, m), 1,96 (1H, m), 2,67 (1H, m), 2,88 (2Н, m), 3,21 (1H, m), 3,39 (1H, m), 3,62 (3H, s), 5,52 (2Н, s), 6,8 (2Н, d, J=3,6), 7,2 (2Н, d, J=3,6), 7,70 (1H, s).
Пример 24: синтез соединения 24
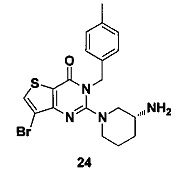
Соединение 24 синтезировали в соответствии со способом синтеза соединения 4, где p-метилбензил бромид использовали вместо o-цианобензил бромида. MS: 435,0 [М+Н]+. 1H-ЯМР (400 Гц, CDCl3): δ 1,25 (1H, m), 1,67 (1H, m), 1,76 (1Н, m), 1,96 (1H, m), 2,34 (3H, s), 2,67 (1H, m), 2,88 (2Н, m), 3,21 (1Н, m), 3,39 (1H, m), 5,52 (2H, s), 7,1 (414, m), 7,80 (1Н, s).
Пример 25: синтез соединения 25

Соединение 25 синтезировали в соответствии со способом синтеза соединения 4, где 2-Boc аминоэтиламин использовали вместо R-3Boc аминопиперидина. MS: 406.0 [М+Н]+. 1H-ЯМР (400 Гц, CDCl3): δ 2,76 (2Н, t), 3,1 (2Н, t), 5,52 (2Н, s), 7,03 (1Н, d, J=8), 7,31 (1Н, t, J=8), 7,46 (1Н, t, J=8), 7,62 (1H, d, J=7,2), 7,68 (1H,s).
Пример 26: синтез соединения 26
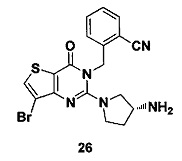
Соединение 26 синтезировали в соответствии со способом синтеза соединения 4, где R-3Boc аминопирролидин использовали вместо R-3Boc аминопиперидина. MS: 432,0 [М+Н]+. 1H-ЯМР (400 Гц, CDCl3): δ 1,69 (1H, m), 1,94 (1Н, m), 2,52 (1H, m), 2,65 (1H, m), 2,75 (2Н, m), 3,1 (1Н, m), 5,52 (2Н, s), 7,03 (1H, d, J=8), 7,31 (1Н, t, J=8), 7,46 (1H, t, J=8), 7,62 (1H, d, J=7,2), 7,68 (1H, s).
Пример 27: синтез соединения 27
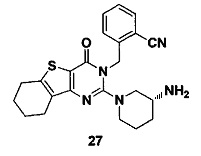
Путь синтеза:
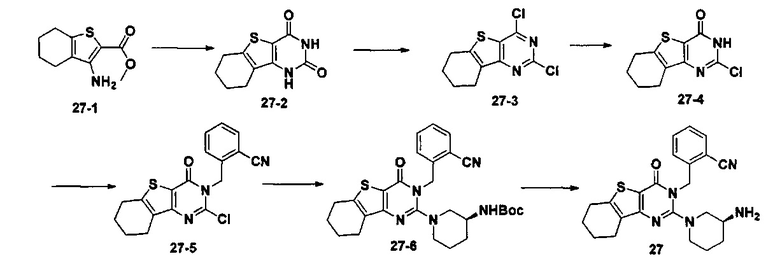
Соединение 27-1 использовали для замещения соединения 4-1 в примере 4, и соединения 27-2, 27-3, 27-4, 27-5, 27-6 и 27 синтезировали в соответствии со способами синтеза соединений 4-2, 4-4, 4-5, 4-6, 4-7, и 4, соответственно, получая таким образом соединение 27. MS: 420.1 [М+Н]+. 1H-ЯМР (400 МГц, CDCl3): δ 7,69-7,60 (m, 2Н), 7,52-7,31 (m, 2Н), 5,56-5,52 (m, 1Н), 5,44-5,40 (m, 1Н), 3,35-3,25 (m, 3H), 3,02-2,85 (m, 5Н), 2,74-2,68 (m, 3H), 2,21 (t, J=7,6 Гц, 1Н), 2,02-1,97 (m, 2Н), 1,64-1,58 (m, 3H).
Пример 28: синтез соединения 28
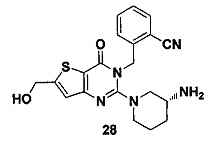
Путь синтеза:
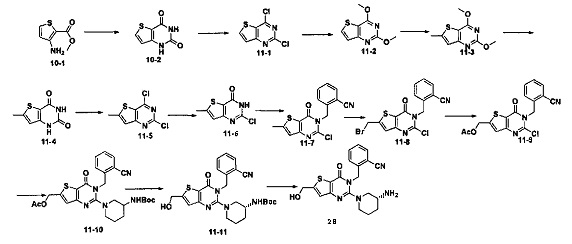
Соединение 28 синтезировали из соединения 11-11 в соответствии с синтезом соединения 1 из реакции соединения 1-6. MS: 396.0 [М+Н]+. 1H-ЯМР (400 Гц, CDCl3): δ 1,25 (1H, m), 1,67 (1Н, m), 1,76 (1Н, m), 1,96 (1Н, m), 2,67 (1H, m), 2,88 (2Н, m), 3,21 (1Н, m), 3,39 (1H, m), 3,89 (2Н, s), 5,52 (2Н, s), 6,50 (1H, s), 7,03 (1Н, d, J=8), 7,31 (1Н, t, J=8), 7,46 (1Н, t, J=8), 7,62 (1H, d, J=7,2).
Пример 29: синтез соединения 29
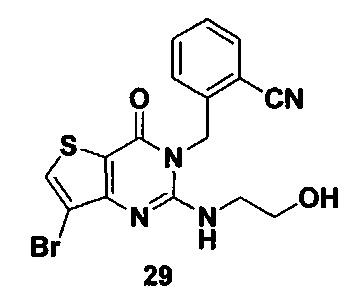
Соединение 29 синтезировали в соответствии со способом синтеза соединения 4, где 2-аминоэтанол использовали вместо R-3Boc аминопиперидина. MS: 406,9 [М+Н]+.
Пример 30: синтез соединения 30
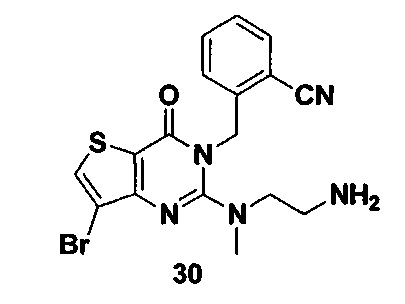
Соединение 30 синтезировали в соответствии со способом синтеза соединения 4, где N1-метил-N2-BOC этилендиамин использовали вместо R-3Boc аминопиперидина. MS: 420.0 [М+Н]+.
Пример 31: синтез соединения 31
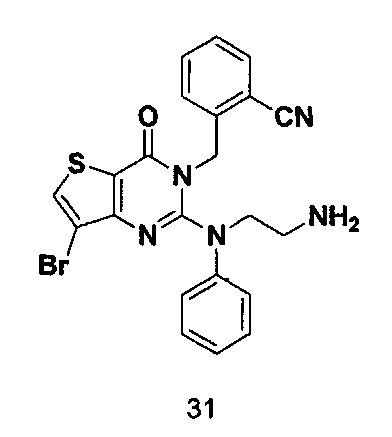
Соединение 31 синтезировали в соответствии со способом синтеза соединения 4, где трет-бутиловый эфир [(2-аминофенил)этил]-карбаминовой кислоты использовали вместо R-3Boc аминопиперидина. MS: 482,0 [М+Н]+.
Пример 32: синтез соединения 32
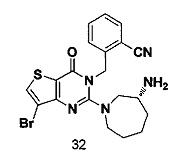
Соединение 32 синтезировали в соответствии со способом синтеза соединения 4, где R-3Boc аминоциклогептиламин использовали вместо R-3Boc аминопиперидина. MS: 460,0 [М+Н]+.
Пример 33: синтез соединения 33
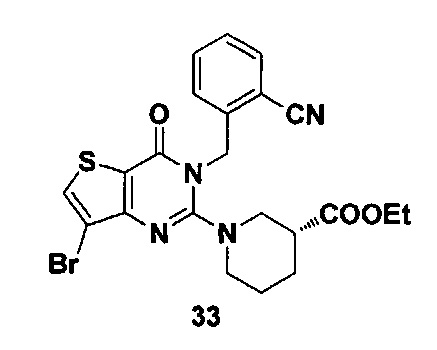
Соединение 33 синтезировали в соответствии со способом синтеза соединения 4, где этил 3-пиперидинкарбоксилат использовали вместо R-3Boc аминопиперидина. MS: 503,0 [М+Н]+.
Пример 34: синтез соединения 34

Соединение 34 синтезировали в соответствии со способом синтеза соединения 1, где соединение 34-2 использовали вместо соединения 1-2. MS: 464.0 [M+H]+. 1H-ЯМР (400 Гц, CDCl3): δ 1,25 (1H, m), 1,67 (1Н, m), 1,76 (1Н, m), 1,96 (1Н, m), 2,67 (1H, m), 2,88 (2Н, m), 3,21 (1Н, m), 3,39 (1H, m), 5,52 (2Н, s), 7,03 (1H, d, J=8), 7,31 (1Н, t, J=8), 7,46 (1H, t, J=8), 7,62 (1H, d, J=7,2).
Пример 35: синтез соединения 35

Соединение 35 синтезировали в соответствии со способом синтеза соединения 1, где соединение 35-2 использовали вместо соединения 1-2. MS: 523,9 [M+H]+. 1H-ЯМР (400 Гц, CDCl3): δ 1,25 (1Н, m), 1,67 (1Н, m), 1,76 (1Н, m), 1,96 (1Н, m), 2,67 (1Н, m), 2,88 (2Н, m), 3,21 (1Н, m), 3,39 (1Н, m), 5,59 (2Н, s), 7,08 (1H, d, J=8), 7,36 (1H, t, J=8), 7,42 (1H, t, J=8), 7,67 (1H, d, J=7,2).
Пример 36: синтез соединения 36

Соединение 36 синтезировали в соответствии со способом синтеза соединения 1, где соединение 36-2 использовали вместо соединения 1-2. MS: 418.0 [M+H]+. 1H-ЯМР (400 Гц, CDCl3): δ 1,25 (1Н, m), 1,67 (1Н, m), 1,76 (1Н, m), 1,96 (1Н, m), 2,67 (1H, m), 2,88 (2Н, m), 3,21 (1Н, m), 3,39 (1Н, m), 5,59 (2Н, s), 7,04 (1H, d, J=8), 7,33 (1H, t, J=8), 7,40 (1H, t, J=8), 7,61 (1H, d, J=7,2).
Пример 37: синтез соединения 37

Соединение 37 синтезировали в соответствии со способом синтеза соединения 1, где соединение 37-2 использовали вместо соединения 1-2. MS: 402,1 [M+H]+. 1H-ЯМР (400 Гц, CDCl3): δ 1,25(1H, m), 1,67 (1H, m), 1,76 (1Н, m), 1,96 (1H, m), 2,67 (1H, m), 2,88 (2Н, m), 3,21 (1Н, m), 3,39 (114, m), 5,59 (214, s), 7,07 (1H, d, J=8), 7,35 (1H, t, J=8), 7,42 (1H, t, J=8), 7,65 (1H, d, J=7,2).
Пример 38: синтез соединения 38
Путь синтеза:
Синтез 38-1:
Соединение 11-12 (100 мг) растворяли в ДМФ. Добавляли 1,5 эквивалента йодометана и 2 эквивалента CsCO3 и перемешивали при комнатной температуре в течение 1 часа. После экстрагировали этилацетатом, промывали водой и выпаривали досуха, получая сырое соединение 38-1 (100 мг).
Соединение 38 синтезировали в соответствии со способом синтеза соединения 1. 1H-ЯМР (CDCl3-d3): δ=7,761 (s, 1Н), 7,610 (d, 1Н), 7,493 (t, 1Н), 7,320 (t, 1Н), 7180 (d, 1H), 5,500 (quartet, 2Н), 3,895 (s, 3H), 3,680 (d, 2H), 3,355 (m, 1H), 3,010 (m, 2H), 2,150 (m, 1H), 1,894 (m, 2H), 1,644 (m, 1H); ЖХ-масс-спектрометрия (жидкостная хроматография с масс-спектрометрией) m/z (отношение массы к заряду) 424.1 [M+H]+.
Пример 39: синтез соединения 39
Путь синтеза:
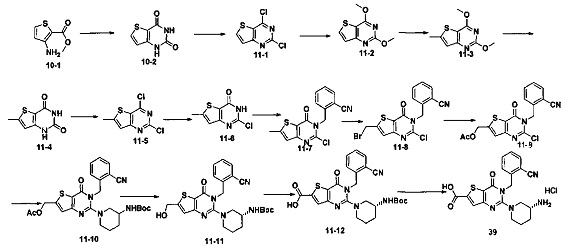
Соединение 11-12 (100 мг, 0,237 ммоль) растворяли в 20 мл HCl в диэтиловом эфире и перемешивали при комнатной температуре в течение 1 часа. После выпаривали досуха, получали соединение 39 (70 мг) с выходом 80%. MS: 410.1 [M+H]+.
Пример 40: синтез соединения 40

Путь синтеза:
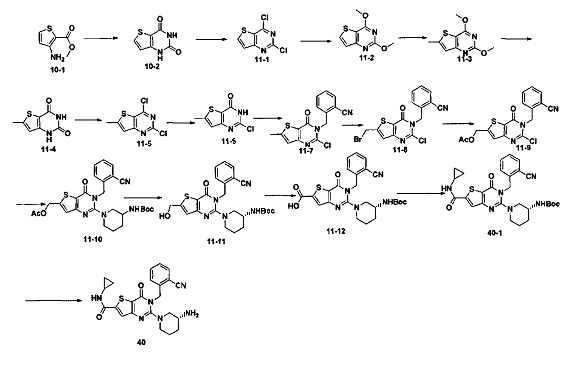
Соединение 11-12 (100 мг) растворяли в 10 мл ДХМ. Добавляли 1,5 эквивалента циклопропиламина, 2 эквивалента EDCI (1-этил-3-(3-диметиламинопропил)карбодиимид), 3,5 эквивалента HOBt (гидроксибензотриазол) и каталитическое количество DMAP (4-диметиламинопиридин) и перемешивали в течение ночи при комнатной температуре. После экстрагировали дихлорметаном и выделяли с помощью колоночной хроматографии, соединение 40-1 (75 мг) получали с выходом 70%. MS: 549.2 [M+H]+.
Соединение 40 синтезировали в соответствии с последней стадией синтеза соединения 1. MS: 449,2 [M+H]+.
Пример 41: синтез соединения 41
Соединение 41 синтезировали в соответствии с синтезом соединения 40, где бензиламин использовали вместо циклопропиламина, используемого в синтезе соединения 40. MS: 499,2 [M+H]+.
Пример 42: синтез соединения 42
Соединение 41 синтезировали в соответствии с синтезом соединения 40, где фениламин используют вместо циклопропиламина, используемого в синтезе соединения 40. MS: 485,1 [M+H]+.
Пример 43: синтез соединения 43
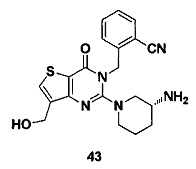
Путь синтеза:
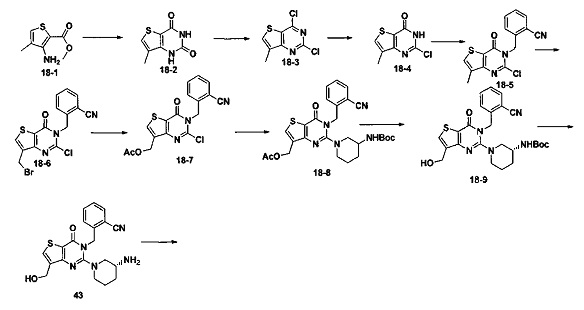
Соединение 43 получали в соответствии с синтезом соединения 28. 1H-ЯМР (CDCl3): δ 7,64 (m, 2Н), 7,52 (t, J=7,6 Гц, 1Н), 7,37 (t, J=7,6 Гц, 1H), 7,23 (m, 1H), 5,25-5,72 (m, 2H), 4.72 (m, 2H), 3,51 (m, 2H), 3,31 (m, 3H), 1,95 (m, 2H), 1,75 (m, 1H), 1,56 (m, 1H); ЖХ-масс-спектрометрия m/z 396,1 [M+H]+.
Пример 44: синтез соединения 44
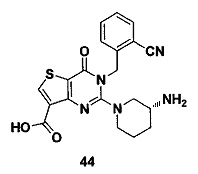
Путь синтеза:
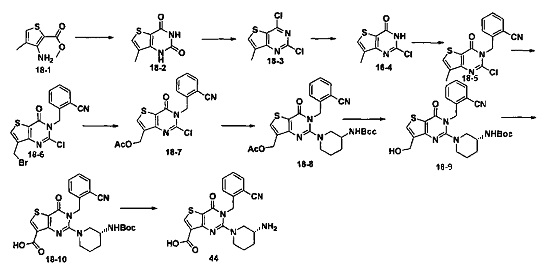
Соединение 44 синтезировали в соответствии со способом синтеза соединения 39. MS: 410.1 [M+H]+.
Пример 45: синтез соединения 45
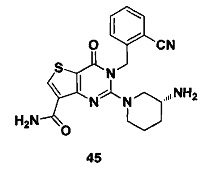
Путь синтеза:
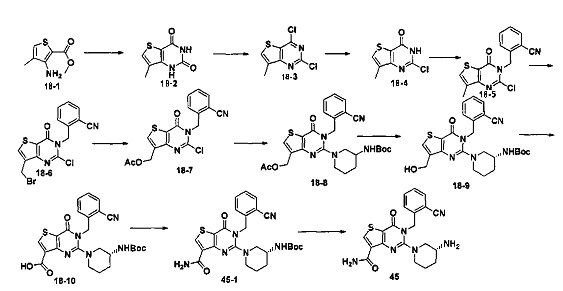
Синтез 45-1:
Соединение 18-10 (100 мг) растворяли в 20 мл ацетонитрила. Добавляли 1,5 эквивалента ди-трет-бутилдикарбоната, 1,5 эквивалента карбоната аммония и 1,5 эквивалента пиридина и перемешивали в течение ночи при комнатной температуре. После экстрагировали этилацетатом, промывали 1М соляной кислотой, промывали водой, выпаривали досуха и выделяли с помощью колоночной хроматографии, получая белое пенообразное твердое вещество 45-1 (80 мг) с выходом 81%. MS: 509.1 [M+H]+.
Соединение 45 синтезировали в соответствии со способом синтеза соединения 1. MS: 409.1 [M+H]+.
Пример 46: синтез соединения 46
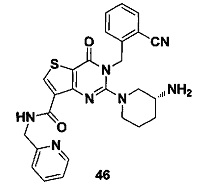
Путь синтеза:
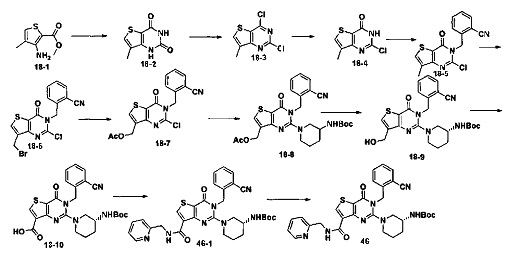
Соединение 46 получали в соответствии со способом синтеза соединения 40, где пиридин 2-метиленамин использовали вместо циклопропиламина, используемого в синтезе соединения 40. MS: 450.1 [M+H]+.
Пример 47: синтез соединения 47
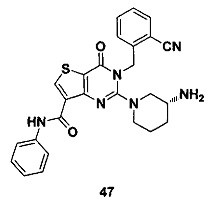
Соединение 47 синтезировали в соответствии с синтезом соединения 46, где фениламин используют вместо пиридин 2-метиленамина, используемого в синтезе соединения 46. MS: 484.2 [M+H]+.
Пример 48: синтез соединения 48
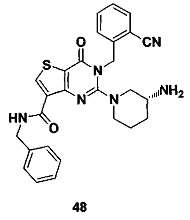
Соединение 48 синтезировали в соответствии с синтезом соединения 46, где бензиламин используют вместо пиридин 2-метиленамина, используемого в синтезе соединения 46. MS: 499.2 [M+H]+.
Пример 49: синтез соединения 49
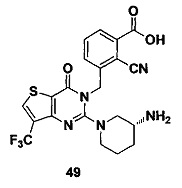
Соединение 49 получали в соответствии с синтезом соединения 7, где 3-бромметил-2-циано бензойную кислоту использовали вместо 2-бромметил бензонитрила, используемого в синтезе соединения 7. MS: 478.1 [M+H]+.
Пример 50: синтез соединения 50
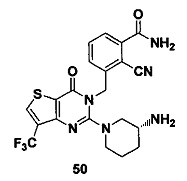
Соединение 50 получали в соответствии с синтезом соединения 7, где 3-бромметил-2циано бензамид использовали вместо 2-бромметил бензонитрила, используемого в синтезе соединения 7. MS: 477,1 [M+H]+.
Пример 51: синтез соединения 51
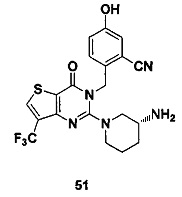
Соединение 51 получали в соответствии с синтезом соединения 7, где 2-бромметил-5-гидрокси бензонитрил использовали вместо 2-бромметил бензонитрила, используемого в синтезе соединения 7. MS: 450.1 [M+H]+.
Пример 52: синтез соединения 52
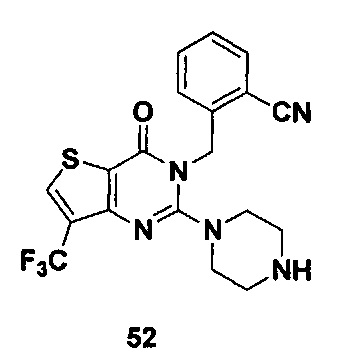
Соединение 52 получали в соответствии с синтезом соединения 7, где 4-Вос пиперазин использовали вместо R-3Boc аминопиперидинила, используемого в синтезе соединения 7. MS: 420,1 [M+H]+.
Пример 53: синтез соединения 53
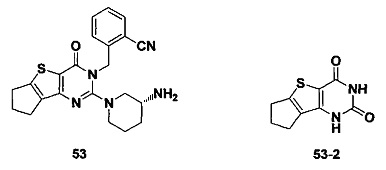
Соединение 53 синтезировали в соответствии со способом синтеза соединения 27, где соединение 53-2 использовали вместо соединения 27-2. MS: 406,2 [M+H]+.
Пример 54: синтез соединения 54
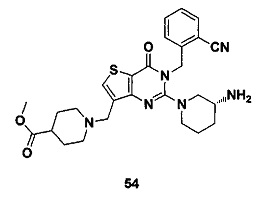
Соединение 54 получали в соответствии с синтезом соединения 18, где метил-пиперидин-4-карбоксилат используют вместо раствора метиламина в тетрагидрофуране при синтезе соединения 18. MS: 521,2 [M+H]+.
Пример 55: синтез соединения 55
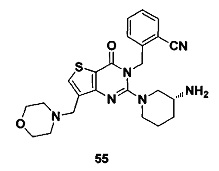
Соединение 55 синтезировали в соответствии с синтезом соединения 18, где морфолин использовали вместо раствора метиламина в тетрагидрофуране при синтезе соединения 18. MS: 465,2 [M+H]+.
Пример 56: синтез соединения 56
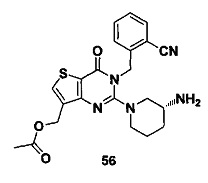
Путь синтеза:
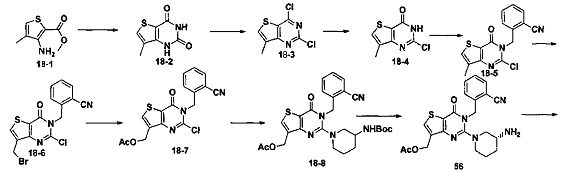
Соединение 56 синтезировали в соответствии с синтезом соединения 1, после получения соединения 18-8. MS: 465,2 [M+H]+.
Пример 57: синтез соединения 57
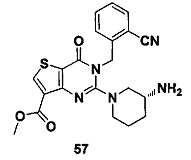
Путь синтеза:
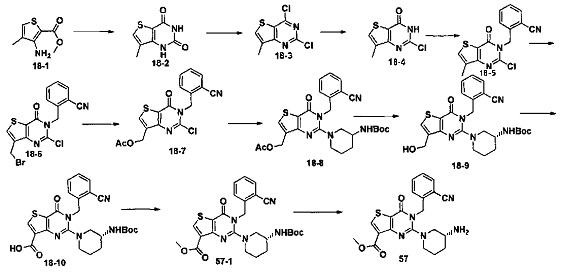
Соединение 57 синтезировали в соответствии с синтезом соединения 38. 1H ЯМР (CDCl3): δ 8.52 (s, 1Н), 7,65 (dd, J=7,6 Гц, 1Н), 7,50 (m, 1Н), 7,36 (m, 1Н), 7,18 (d, J=8 Гц, 1Н), 5,25-5,72 (m, 2Н), 3,91 (s, 3H), 3,71 (m, 1Н), 3,60 (m, 1Н), 3,39 (m, 2Н), 3,22 (m, 1Н), 2,30 (m, 1Н), 2,00 (m, 1Н), 1,82 (m, 1Н), 1,57 (m, 1Н); ЖХ-масс-спектрометрия m/z 424.1 [M+H]+.
Пример 58: синтез соединения 58
Соединение 58 синтезировали в соответствии с синтезом соединения 46, где этил глициновый эфир используют вместо 2-пиридин метиленамина, используемого в синтезе соединения 46. 1H-ЯМР (CDCl3): δ 8.55 (m, 1Н), 7,60 (m, 1Н), 7,48 (m, 1Н), 7,32 (m, 1Н), 7,12 (m, 1Н), 5,43 (m, 2Н), 4.20 (m, 4Н), 3,20 (m, 2Н), 3,05 (m, 1Н), 2,87 (m, 2Н), 2,00 (m, 1Н), 1,76 (m, 1Н), 1,65 (m, 1Н), 1,35 (m, 1Н), 1,26 (m, 3H); ЖХ-масс-спектрометрия m/z 495,2 [M+H]+.
Пример 59: синтез соединения 59
Соединение 59 синтезировали в соответствии с синтезом соединения 58, где метиловый эфир валина использовали вместо этилового эфира глицина, используемого в синтезе соединения 58. 1H-ЯМР (CDCl3): δ 9.42 (d, J=8.8 Гц, 1Н), 8.61 (s, 1Н), 7,66 (dd, J=7,6 Гц, 1Н), 7,53 (m, 1Н), 7,37 (m, 1Н), 7,16 (d, J=8 Гц, 1Н), 5,55 (m, 2Н), 4.88 (m, 1Н), 3,76 (s, 3H), 3,55 (m, 1Н), 3,25 (m, 2Н), 2,98 (m, 2Н), 2,05 (m, 1Н), 1,90 (m, 1Н), 1,66 (m, 1Н), 1,50 (m, 1Н), 1,01 (m, 6Н); ЖХ-масс-спектрометрия m/z 523,2 [M+H]+.
Пример 60: синтез соединения 60
Соединение 60 синтезировали в соответствии с синтезом соединения 58, где этаноламин использовали вместо этилового эфира глицина, используемого в синтезе соединения 58. 1H-ЯМР (CDCl3): δ 8.57 (m, 1Н), 7,62 (m, 1Н), 7,51 (m, 1Н), 7,35 (m, 1Н), 7,17 (m, 1Н), 5,43 (m, 2Н), 3,75 (m, 2Н), 3,60 (m, 2Н), 3,3 (m, 2Н), 3,12 (m, 2Н), 2,80 (m, 1Н), 2,05 (m, 1Н), 1,72 (m, 2Н), 1,52 (m, 1H); ЖХ-масс-спектрометрия m/z 453,2 [M+H]+.
Пример 61: синтез соединения 61
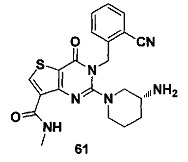
Соединение 61 синтезировали в соответствии с синтезом соединения 58, где метиламина гидрохлорид использовали вместо этилового эфира глицина, используемого в синтезе соединения 58. 1H-ЯМР (CDCl3): δ 8.56 (m, 1Н), 7,62 (m, 1Н), 7,51 (m, 1Н), 7,35 (m, 1Н), 7,17 (m, 1Н), 5,45 (m, 2Н), 3,48 (m, 1Н), 3,33 (m, 1Н), 3,19 (m, 2Н), 2,99 (s, 3H), 2,86 (m, 1Н), 2,03 (m, 1Н), 1,86 (m, 1Н), 1,70 (m, 1Н), 1,491 (m, 1Н); ЖХ-масс-спектрометрия m/z 423,2 [M+H]+.
Пример 62: синтез соединения 62
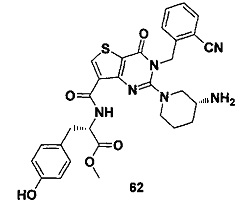
Соединение 62 синтезировали в соответствии с синтезом соединения 58, где тирозин метил эфир использовали вместо этилового эфира глицина, используемого в синтезе соединения 58. 1H-ЯМР (CDCl3): δ 9.32 (m, 1Н), 8.57 (m, 1Н), 7,50 (m, 2Н), 7,31 (m, 1Н), 7,14 (m, 1Н), 6.75 (m, 4Н), 5,30 (m, 3H), 3,73 (m, 3H), 3,20 (m, 6Н), 2,86 (m, 1Н), 1,98 (m, 1Н), 1,65 (m, 2Н), 1,44 (m, 1Н); ЖХ-масс-спектрометрия m/z 587,2 [M+H]+.
Пример 63: синтез соединения 63
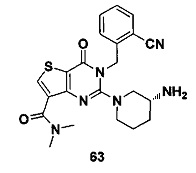
Соединение 63 синтезировали в соответствии с синтезом соединения 58, где диметиламина гидрохлорид использовали вместо этилового эфира глицина, используемого в синтезе соединения 58. MS: 437,2 [M+H]+.
Пример 64: синтез соединения 64
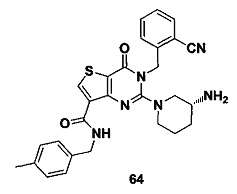
Соединение 64 синтезировали в соответствии с синтезом соединения 58, где 4-метилбензиламин использовали вместо этилового эфира глицина, используемого в синтезе соединения 58. 1H-ЯМР (CDCl3): δ 9.19 (m, 1Н), 8.62 (m, 1Н), 7,63 (m, 1Н), 7,50 (m, 1Н), 7,30 (m, 3H), 7,15 (m, 3H), 5,49 (s, 2Н), 4.60 (d, J=6.4 Гц, 2Н), 3,02 (m, 2Н), 2,85 (m, 1Н), 2,55 (m, 2Н), 1,85 (m, 1Н), 1,65 (m, 1Н), 1,50 (m, 1Н), 1,33 (m, 1Н); ЖХ-масс-спектрометрия m/z 499.2 [M+H]+.
Пример 65: синтез соединения 65
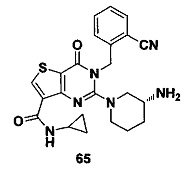
Соединение 65 синтезировали в соответствии с синтезом соединения 58, где циклопропиламин использовали вместо этилового эфира глицина, используемого в синтезе соединения 58. MS: 449.2 [M+H]+.
Пример 66: синтез соединения 66
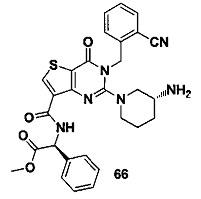
Соединение 66 синтезировали в соответствии с синтезом соединения 58, где метиловый эфир 2-фенилглицина использовали вместо этилового эфира глицина, используемого в синтезе соединения 58. 1H-ЯМР (CDCl3): δ 9.85 (d, J=6.6 Гц, 1Н), 8.58 (s, 1Н), 7,64 (d, J=7,8 Гц, 1Н), 7,50 (m, 3H), 7,35 (m, 4Н), 7,16 (m, J=6.9 Гц, 1Н), 5,54 (m, 2Н), 5,29 (m, 1Н), 3,76 (s, 3H), 3,46 (m, 1Н), 3,20 (m, 1Н), 3,01 (m, 1Н), 2,85 (m, 2Н), 1,98 (m, 1Н), 1,81 (m, 1Н), 1,55 (m, 2Н); ЖХ-масс-спектрометрия m/z 557,2 [M+H]+.
Пример 67: синтез соединения 67
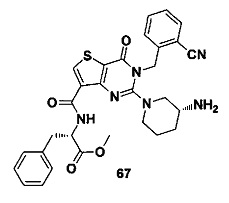
Соединение 67 синтезировали в соответствии с синтезом соединения 58, где метилфенилаланин эфир использовали вместо этилового эфира глицина, применяемого при синтезе соединения 58. 1H-ЯМР (CDCl3): δ 9.31 (m, 1Н), 8.62 (m, 1Н), 7,51 (m, 2Н), 7,29 (m, 5Н), 7,07 (m, 2Н), 5,46 (m, 2Н), 5,28 (m, 1Н), 3,79 (m, 3H), 3,22 (m, 4Н), 3,02 (m, 1Н), 2,91 (m, 2Н), 1,92 (m, 3H), 1,47 (m, 1Н); ЖХ-масс-спектрометрия m/z 571,2 [M+H]+.
Пример 68: синтез соединения 68
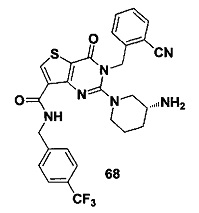
Соединение 68 синтезировали в соответствии с синтезом соединения 58, где p-трифторметил бензиламин использовали вместо этилового эфира глицина, применяемого при синтезе соединения 58. 1H-ЯМР (CDCl3): δ 9.31 (m, 1Н), 8.62 (m, 1Н), 7,51 (m, 6Н), 7,35 (m, 1Н), 7,14 (m, 1Н), 5,50 (m, 2Н), 4.75 (m, 2Н), 3,11 (m, 2Н), 2,90 (m, 1Н), 2,66 (m, 2Н), 1,85 (m, 1Н), 1,65 (m, 1Н), 1,55 (m, 1Н), 1,36 (m, 1Н); ЖХ-масс-спектрометрия m/z 567,2 [M+H]+.
Пример 69: синтез соединения 69
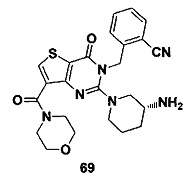
Соединение 69 синтезировали в соответствии с синтезом соединения 58, где морфолин использовали вместо этилового эфира глицина, применяемого при синтезе соединения 58. 1H-ЯМР (CDCl3): δ 7,91 (s, 1Н), 7,62 (d, J=7,6 Гц, 1Н), 7,53 (m, 1Н), 7,35 (m, 1Н), 7,23 (d, J=7,6 Гц, 1Н), 5,50 (m, 2Н), 3,6 (m, 11Н), 3,07 (m, 1Н), 2,95 (m, 1Н), 2,10 (m, 1Н), 1,83 (m, 2Н), 1,61 (m, 1Н); ЖХ-масс-спектрометрия m/z 479.2 [M+H]+.
Пример 70: синтез соединения 70
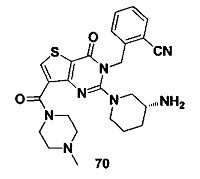
Соединение 70 синтезировали в соответствии с синтезом соединения 58, где 4-метилпиперазин использовали вместо этилового эфира глицина, применяемого при синтезе соединения 58. 1H-ЯМР (CDCl3): δ 7,96 (s, 1Н), 7,59 (d, J=7,6 Гц, 1Н), 7,51 (m, 1Н), 7,34 (m, 1Н), 7,24 (d, J=8.0 Гц, 1Н), 5,40 (m, 2Н), 3,30 (m, 10H), 3,07 (m, 2Н), 2,82 (m, 1Н), 2,54 (s, 3H), 2,02 (m, 1Н), 1,78 (m, 2Н), 1,62 (m, 1Н); ЖХ-масс-спектрометрия m/z 492,2 [M+H]+.
Пример 71: синтез соединения 71
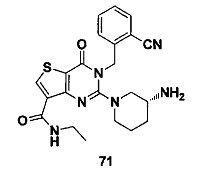
Соединение 71 синтезировали в соответствии с синтезом соединения 58, где этиламин гидрохлорид использовали вместо этилового эфира глицина, применяемого при синтезе соединения 58. MS: 437,2 [M+H]+.
Пример 72: синтез соединения 72
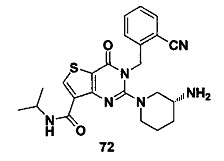
Соединение 72 синтезировали в соответствии с синтезом соединения 58, где изопропиламин использовали вместо этилового эфира глицина, применяемого при синтезе соединения 58. MS: 451,2 [M+H]+.
Пример 73: синтез соединения 73
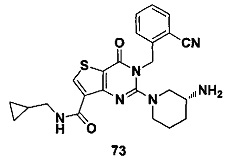
Соединение 73 синтезировали в соответствии с синтезом соединения 58, где циклопропилметиламин использовали вместо этилового эфира глицина, применяемого при синтезе соединения 58. MS: 463,2 [M+H]+.
Пример 74: синтез соединения 74
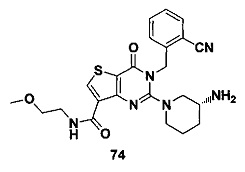
Соединение 74 синтезировали в соответствии с синтезом соединения 58, где 2-метоксил этиламин использовали вместо этилового эфира глицина, применяемого при синтезе соединения 58. MS: 467,2 [M+H]+.
Пример 75: синтез соединения 75
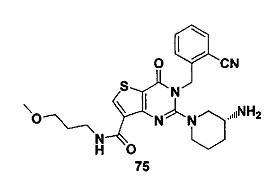
Соединение 75 синтезировали в соответствии с синтезом соединения 58, где 3-метоксил пропиламин использовали вместо этилового эфира глицина, применяемого при синтезе соединения 58. 1H-ЯМР (CDCl3): δ 8.98 (m, 1Н), 8.60 (m, 1Н), 7,68 (m, 1Н), 7,55 (m, 1Н), 7,38 (m, 1Н), 7,16 (m, 1Н), 5,54 (s, 2Н), 3,52 (m, 4Н), 3,41 (m, 1Н), 3,34 (m, 3H), 3,21 (m, 1Н), 3,12 (m, 1Н), 2,91 (m, 1Н), 2,78 (m, 1Н), 2,04 (m, 1Н), 1,85 (m, 1Н), 1,36 (m, 1Н); ЖХ-масс-спектрометрия m/z 481,2 [M+H]+.
Пример 76: синтез соединения 76
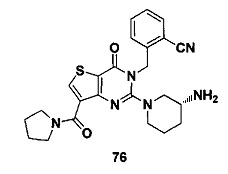
Соединение 76 синтезировали в соответствии с синтезом соединения 58, где пирролидин использовали вместо этилового эфира глицина, применяемого при синтезе соединения 58. MS: 463,2 [M+H]+.
Пример 77: синтез соединения 77
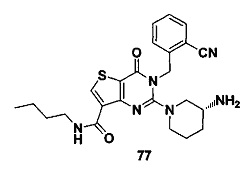
Соединение 77 синтезировали в соответствии с синтезом соединения 58, где н-бутиламин использовали вместо этилового эфира глицина, применяемого при синтезе соединения 58. 1H-ЯМР (CDCl3): δ 8,84 (m, 1Н), 8,60 (m, 1Н), 7,66 (m, 1Н), 7,53 (m, 1Н), 7,38 (m, 1Н), 7,16 (m, 1Н), 5,56 (s, 2Н), 3,50 (m, 3H), 3,20 (m, 2Н), 2,92 (m, 2Н), 2,01 (m, 2Н), 1,63 (m, 3H), 1,45 (m, 3H), 0,96 (m, 3H); ЖХ-масс-спектрометрия m/z 465,2 [M+H]+.
Пример 78: синтез соединения 78
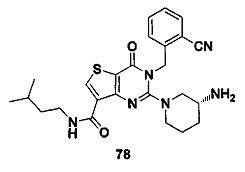
Соединение 78 синтезировали в соответствии с синтезом соединения 58, где изопентиламин использовали вместо этилового эфира глицина, применяемого при синтезе соединения 58. 1H-ЯМР (CDCl3): δ 8.85 (m, 1Н), 8.60 (m, 1Н), 7,66 (m, 1Н), 7,53 (m, 1Н), 7,38 (m, 1Н), 7,16 (m, 1Н), 5,55 (m, 2Н), 3,52 (m, 2Н), 3,35 (m, 1Н), 3,15 (m, 2Н), 2,91 (m, 1Н), 2,77 (m, 1Н), 2,01 (m, 1Н), 1,85 (m, 1Н), 1,71 (m, 2Н), 1,54 (m, 2Н), 1,40 (m, 1Н), 0.95 (m, 6Н); ЖХ-масс-спектрометрия m/z 479,2 [M+H]+.
Пример 79: синтез соединения 79
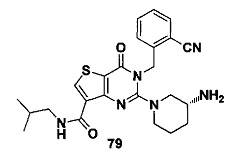
Соединение 79 синтезировали в соответствии с синтезом соединения 58, где изобутиламин использовали вместо этил глицин эфира, применяемого при синтезе соединения 58. MS: 465,2 [M+H]+.
Пример 80: синтез соединения 80
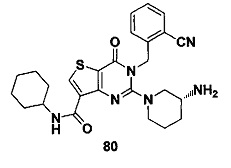
Соединение 80 синтезировали в соответствии с синтезом соединения 58, где циклогексиламин использовали вместо этилового эфира глицина, применяемого при синтезе соединения 58. 1H-ЯМР (CDCl3): δ 8.82 (d, J=8.1 Гц, 1Н), 8.58 (s, 1Н), 7,66 (d, J=7,5 Гц, 1Н), 7,53 (m, 1Н), 7,38 (m, 1Н), 7,14 (d, J=7,5 Гц, 1Н), 5,55 (m, 2Н), 3,98 (m, 1Н), 3,40 (m, 1Н), 3,19 (m, 2Н), 2,91 (m, 2Н), 2,05 (m, 4H), 1,75 (m, 4Н), 1,45 (m, 3H), 1,25 (m, 3H); ЖХ-масс-спектрометрия m/z 491,2 [M+H]+.
Пример 81: синтез соединения 81
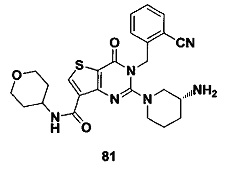
Соединение 81 синтезировали в соответствии с синтезом соединения 58, где 4-аминогексагидропиран использовали вместо этилового эфира глицина, применяемого при синтезе соединения 58. MS: 493,2 [M+H]+.
Пример 82: синтез соединения 82
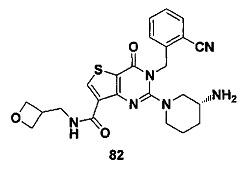
Соединение 82 синтезировали в соответствии с синтезом соединения 58, где 3-аминометил эпоксипропан использовали вместо этилового эфира глицина, применяемого при синтезе соединения 58. MS: 479.2 [M+H]+.
Пример 83: синтез соединения 83
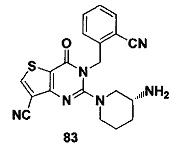
Путь синтеза:
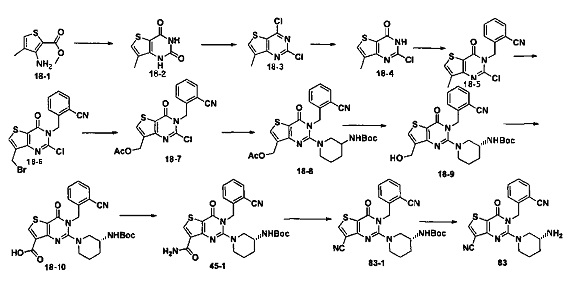
Синтез соединения 83-1:
Соединение 45-1 (100 мг) растворяли в 8 мл ДМФ. Добавляли 1,2 эквивалента трихлортриазина и перемешивали в течение 1 часа при комнатной температуре. После экстрагировали этилацетатом, промывали водой и выпаривали досуха, получая сырой продукт 83-1 (95 мг).
Соединение 83 синтезировали в соответствии с синтезом соединения 1. MS: 391,1 [M+H]+.
Пример 84: синтез соединения 84
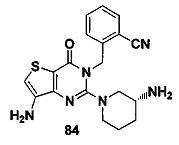
Путь синтеза:
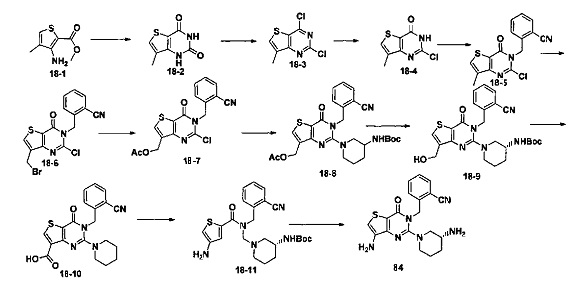
Соединение 84 синтезировали в соответствии с синтезом соединения 1, после получали соединение 18-11. MS: 381,1 [M+H]+.
Пример 85: синтез соединения 85
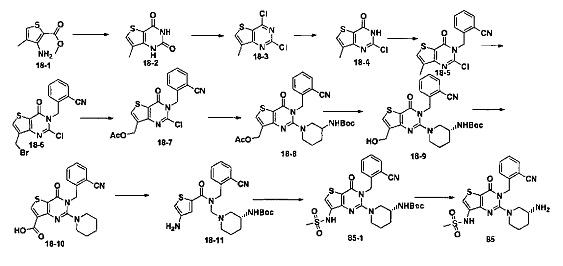
Синтез соединения 85-1:
Соединение 18-11 (100 мг) растворяли в тетрагидрофуране. Добавляли 1,1 эквивалента метилсульфонилхлорида и 1,2 эквивалента триэтиламина и перемешивали в течение 1 часа при комнатной температуре. После экстрагировали этилацетатом, промывали водой и выпаривали досуха, получая 95 мг сырого продукта 85-1.
Соединение 85 синтезировали в соответствии с синтезом соединения 1. MS: 459.1 [M+H]+.
Пример 86: синтез соединения 86
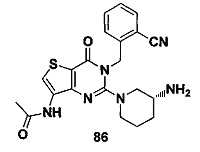
Соединение 86 синтезировали в соответствии с синтезом соединения 85, где ацетилхлорид использовали вместо метилсульфонилхлорида, используемого в синтезе соединения 85-1. MS: 423,2 [M+H]+.
Пример 87: синтез соединения 87
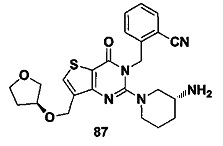
Путь синтеза:
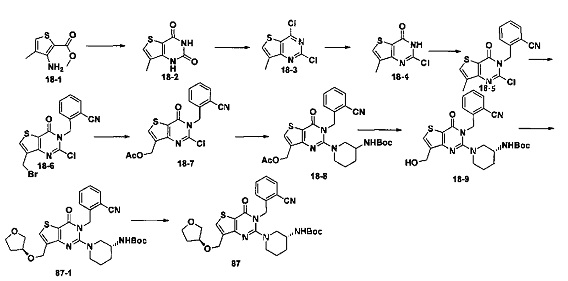
Соединение 87 синтезировали в соответствии с синтезом соединения 15, где S-3-гидрокситетрагидрофуран использовали вместо раствора метиламина в тетрагидрофуране. MS: 466.2 [M+H]+.
Пример 88: синтез соединения 88
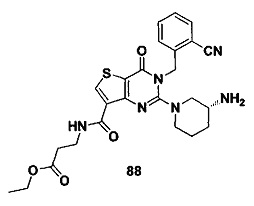
Соединение 88 синтезировали в соответствии с синтезом соединения 58, где использовали этиловый эфир аланина вместо этилового эфира глицина, используемого в синтезе соединения 58. MS: 509,2 [M+H]+.
Пример 89: синтез соединения 89
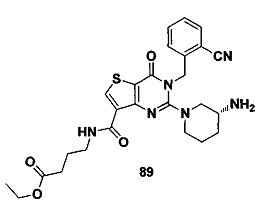
Соединение 89 синтезировали в соответствии с синтезом соединения 58, где этил 4-амино бутаноат использовали вместо этилового эфира глицина, используемого в синтезе соединения 58. MS: 523,2 [M+H]+.
Пример 90: синтез соединения 90
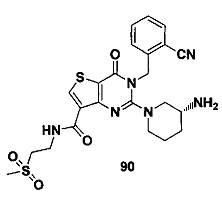
Соединение 90 синтезировали в соответствии с синтезом соединения 58, где 4-мезил этиламин был использован вместо этилового эфира глицина, применяемого при синтезе соединения 58. MS: 515,2 [M+H]+.
Пример 91: синтез соединения 91
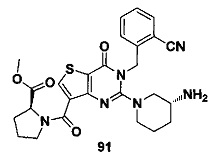
Соединение 91 синтезировали в соответствии с синтезом соединения 58, где был использован метиловый эфир пролина вместо этилового эфира глицина, применяемого при синтезе соединения 58. MS: 521,2 [M+H]+.
Пример 92: синтез соединения 92
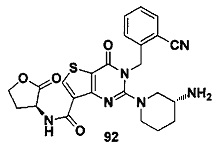
Соединение 92 синтезировали в соответствии с синтезом соединения 58, где 8-2-карбонил-4-аминотетрагидрофуран использовали вместо этилового эфира глицина, применяемого при синтезе соединения 58. MS: 493,2 [M+H]+.
Пример 93: синтез соединения 93
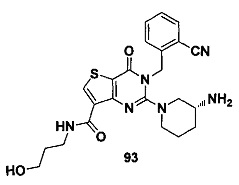
Соединение 93 синтезировали в соответствии с синтезом соединения 58, где был использован 3-гидроксипропиламин вместо этилового эфира глицина, используемого в синтезе соединения 58. MS: 467,2 [M+H]+.
Пример 94: Синтез соединения 94
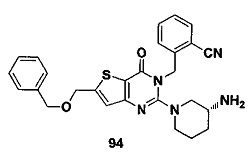
Соединение 94 синтезировали в соответствии с синтезом соединения 15, где бензиловый спирт был использован вместо раствора метиламина в тетрагидрофуране, используемого в синтезе соединения 15-1. MS: 486.2 [M+H]+.
Пример 95: синтез соединения 95
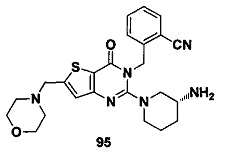
Соединение 95 синтезировали в соответствии с синтезом соединения 15, где морфолин используют вместо раствора метиламина в тетрагидрофуране, используемого в синтезе соединения 15-1. MS: 465,2 [M+H]+.
Пример 96: синтез соединения 96
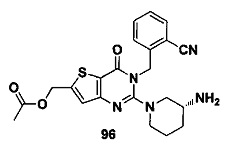
Путь синтеза:
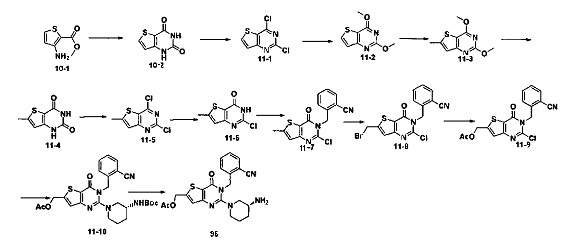
Соединение 96 синтезировали в соответствии с синтезом соединения 56. 1H-ЯМР (CDCl3-d3): δ=7,632 (d, 1Н), 7,482 (t, 1Н), 7,327 (t, 1Н), 7,167 (s, 1Н), 7,080 (d, 1H), 5,515 (quartet, 2H), 5,267 (s, 2H), 3,365 (t, 1H), 3,204 (s, 1H), 3,055 (m, 1H), 2,893 (m, 1H), 2,357 (m, 1H), 2,108 (s, 3H), 2,022 (m, 1H), 1,781 (m, 1H), 1,576 (m, 2H); ЖХ-масс-спектрометрия m/z 438,2 [M+H]+.
Пример 97: синтез соединения 97
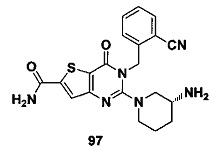
Путь синтеза:
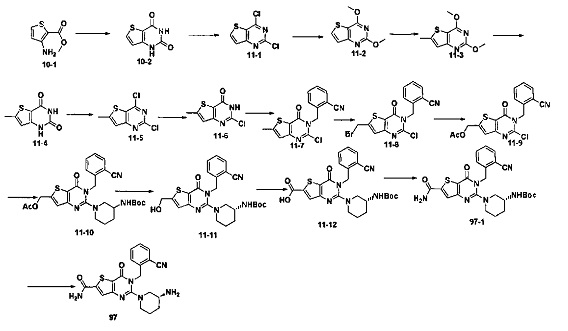
Соединение 97 синтезировали в соответствии с синтезом соединения 45, MS: 409,1 [M+H]+.
Пример 98: синтез соединения 98
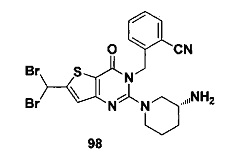
Путь синтеза:
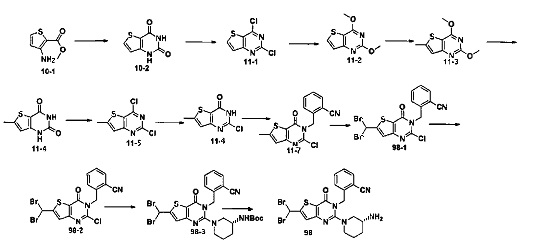
Синтез соединения 98-1:
Соединение 11-7 (1 г) растворяли в CCl4. Добавляли 2,5 эквивалента NBS (N-бромсукцинимид) и каталитическое количество перекиси бензоила и нагревали с обратным холодильником в течение ночи. После экстрагировали дихлорметаном, промывали водой, соединение 98-1 (740 мг) получали с помощью колоночной хроматографии с выходом 51%. MS: 471,8 [M+H]+.
Соединение 98 синтезировали в соответствии с синтезом соединения 1. 1H-ЯМР (CDCl3-d3): δ=7,603 (m, 1Н), 7,499 (m, 1Н), 7,369 (s, 1Н), 7,324 (t, 1Н), 7,184 (d, 1Н), 6.820 (m, 1Н), 5,485 (quartet, 2H), 5,293 (s, 1Н), 3,594 (m, 2Н), 3,270 (m, 1Н), 3,022 (m, 1Н), 2,908 (m, 2Н), 2,105 (m, 1Н), 1,825 (m, 2Н), 1,603 (m, 1Н); ЖХ-масс-спектрометрия m/z 538.0 [M+H]+.
Пример 99: синтез соединения 99
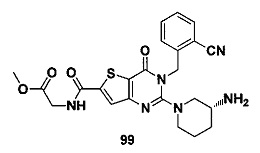
Соединение 99 было получено в соответствии с синтезом соединения 40, где метиловый эфир глицина использовали вместо циклопропиламина, используемого в синтезе соединения 40. 1H-ЯМР (CDCl3-d3): δ=7,756 (s, 1Н), 7,630 (d, 1Н), 7,537 (t, 1Н), 7,368 (t, 1Н), 7,218 (d, 1Н), 5,442 (quartet, 2Н), 4.114 (s, 2Н), 3,730 (s, 3H), 3,590 (d, 1Н), 3,493 (d, 1Н), 3,323 (d, 1Н), 3,180 (m, 2Н), 2,958 (m, 1Н), 2,096 (s, 1Н), 1,820 (d, 1Н), 1,690 (d, 1Н); ЖХ-масс-спектрометрия m/z481,2 [M+H]+.
Пример 100: синтез соединения 100
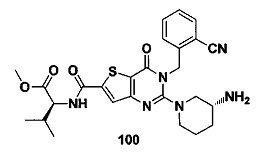
Соединение 100 синтезировали в соответствии с синтезом соединения 99, где метиловый эфир валина используют вместо метилового эфира глицина, используемого в синтезе соединения 99. 1H-ЯМР (CDCl3-d3): δ=7,812 (s, 1Н), 7,540 (d, 1Н), 7,469 (t, 1Н), 7,277 (t, 1Н), 7,194 (d, 1Н), 5,450 (quartet, 2Н), 4.593 (quartet, 1Н), 3,723 (s, 3H), 3,608 (d, 1H), 3,344 (d, 1H), 3,000 (m, 2H), 2,280 (m, 1H), 2,100 (s, 1H), 1,880 (d, 1H), 1,910 (m, 1H); 1,797 (s, 1H), 0.980 (t, 6H), 0.900 (d, 1H); ЖХ-масс-спектрометрия m/z 523,2 [M+H]+.
Пример 101: синтез соединения 101
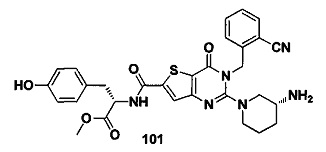
Соединение 101 синтезировали в соответствии с синтезом соединения 99, где метиловый эфир тирозина использовали вместо метилового эфира глицина, используемого в синтезе соединения 99. 1H-ЯМР (CDCl3-d3): δ=7,580 (d, 1Н), 7,548 (s, 1Н), 7,479 (t, 1Н), 7,315 (t, 1Н), 7,258 (s, 1Н), 7,153 (d, 1Н), 6.940 (d, 2Н), 6.710 (d, 2Н), 5,400 (quartet, 2Н), 4.861 (quartet, 1Н), 3,711 (s, 3H), 3,495 (d, 1Н), 3,410 (s, 1Н), 3,200 (m, 2Н), 3,100 (m, 2Н), 2,946 (m, 1Н), 2,028 (s, 1Н), 1,742 (s, 2Н); 1,600 (s, 1Н); ЖХ-масс-спектрометрия m/z 587,2 [M+H]+.
Пример 102: синтез соединения 102
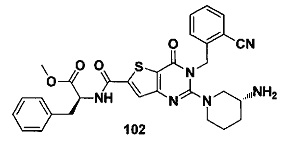
Соединение 102 синтезировали в соответствии с синтезом соединения 99, в котором метиловый эфир фенилаланина использовали вместо метилового эфира глицина, используемого в синтезе соединения 99. 1H-ЯМР (CDCl3-d3): δ=7,733 (s, 1Н), 7,540 (d, 1Н), 7,439 (t, 1Н), 7,214 (m, 7Н), 5,410 (quartet, 2Н), 4.930 (quartet, 1Н), 3,677 (s, 3H), 3,620 (d, 2Н), 3,390 (s, 1Н), 3,210 (m, 2Н), 3,007 (s, 1Н), 2,941 (s, 1H), 2,071 (s, 1H), 1,947 (s, 1H); 1,771 (s, 1H), 1,538 (s, 1H); ЖХ-масс-спектрометрия m/z 571,2 [M+H]+.
Пример 103: синтез соединения 103
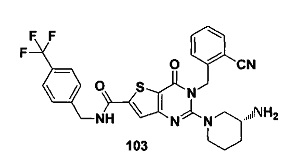
Соединение 103 синтезировали в соответствии с синтезом соединения 99, где п-трифторметил-бензиламина использовали вместо метилового эфира глицина, используемого в синтезе соединения 99. 1H-ЯМР (CDCl3-d3): δ=7,792 (s, 1Н), 7,528 (d, 1Н), 7,445 (m, 5Н), 7,260 (t, 1H), 7,154 (d, 1H), 5,354 (quartet, 2H), 4.549 (s, 2H), 3,518 (s, 2H), 3,340 (s, 1H), 3,014 (s, 1H), 2,889 (s, 1H), 2,009 (s, 1H), 1,830 (s, 1H), 1,717 (s, 1H), 1,532 (s, 1H); ЖХ-масс-спектрометрия m/z 567,2 [M+H]+.
Пример 104: синтез соединения 104
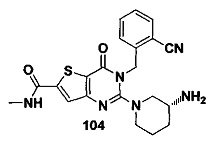
Соединение 104 синтезировали в соответствии с синтезом соединения 99, где гидрохлорид метиламина использовали вместо метилового эфира глицина, используемого в синтезе соединения 99. 1H-ЯМР (CDCl3-d3): δ=7,684 (s, 1Н), 7,625 (d, 1Н), 7,530 (t, 1Н), 7,363 (t, 1Н), 7,210 (d, 1Н), 5,440 (quartet, 2Н), 3,587 (d, 1Н), 3,471 (m, 1Н), 3,305 (m, 1Н), 3,177 (m, 2Н), 2,912 (s, 3H), 2,105 (d, 1Н), 1,789 (m, 1Н), 1,680 (m, 2Н); ЖХ-масс-спектрометрия m/z 423,2 [M+H]+.
Пример 105: синтез соединения 105
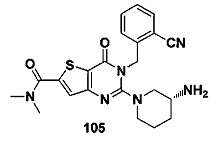
Соединение 105 синтезировали в соответствии с синтезом соединения 99, где диметиламина гидрохлорид использовали вместо метилового эфира глицина, используемого в синтезе соединения 99. 1H-ЯМР (CDCl3-d3): δ=7,600 (d, 1Н), 7,484 (t, 1Н), 7,403 (s, 1Н), 7,314 (t, 1Н), 7,161 (d, 1Н), 5,490 (quartet, 2Н), 3,538 (d, 2Н), 3,279 (m, 1Н), 3,140 (d, 6Н), 3,026 (s, 1H), 2,948 (t, 1H), 2,069 (s, 1H), 1,850 (s, 2H), 1,600 (m, 1H); ЖХ-масс-спектрометрия m/z 437,2 [M+H]+.
Пример 106: синтез соединения 106

Соединение 106 синтезировали в соответствии с синтезом соединения 99, где циклопропилметиламин использовали вместо метилового эфира глицина, используемого в синтезе соединения 99. 1H-ЯМР (CDCl3-d3): δ=7,710 (s, 1Н), 7,650 (d, 1Н), 7,535 (t, 1Н), 7,374 (t, 1Н), 7,170 (d, 1Н), 5,487 (quartet, 2Н), 3,450 (d, 2Н), 3,274 (d, 2Н), 3,160 (s, 1Н), 2,987 (m, 1H), 2,902 (t, 1H), 2,036 (s, 1H), 1,794 (s, 1H), 1,667 (m, 1H), 1,553 (d, 1H), 1,084 (s, 1H), 0.540 (m, 2H), 0.278 (m, 2H); ЖХ-масс-спектрометрия m/z 463,2 [M+H]+.
Пример 107: синтез соединения 107
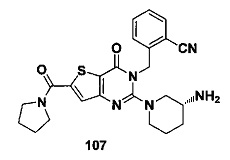
Соединение 107 синтезировали в соответствии с синтезом соединения 99, где пирролидин использовали вместо метилового эфира глицина, используемого в синтезе соединения 99. 1H-ЯМР (CDCl3-d3): δ=7,620 (d, 1Н), 7,529 (s, 1Н), 7,492 (t, 1Н), 7,327 (t, 1Н), 7,121 (d, 1Н), 5,495 (t, 2Н), 3,740 (t, 3H), 3,450 (d, 1Н), 3,264 (m, 1Н), 3,084 (d, 1H), 2,962 (t, 1H), 2,872 (m, 1H), 2,864 (t, 1H), 1,970 (m, 5H), 1,790 (m, 1H), 1,600 (m, 2H); ЖХ-масс-спектрометрия m/z 463,2 [M+H]+.
Пример 108: синтез соединения 108
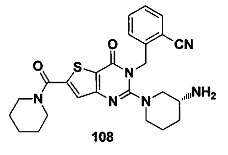
Соединение 108 синтезировали в соответствии с синтезом соединения 99, где пиперидин был использован вместо метилового эфира глицина, используемого в синтезе соединения 99. 1H-ЯМР (CDCl3-d3): δ=7,644 (d, 1Н), 7,504 (t, 1Н), 7,344 (t, 1Н), 7,310 (s, 1Н), 7,116 (d, 1Н), 5,523 (quartet, 2Н), 3,630 (s, 4Н), 3,390 (d, 1Н), 3,249 (s, 1Н), 3,088 (d, 1H), 2,940 (m, 2H), 2,013 (m, 1H), 1,824 (s, 1H), 1,650 (d, 8H); ЖХ-масс-спектрометрия m/z 477,2 [M+H]+.
Пример 109: синтез соединения 109
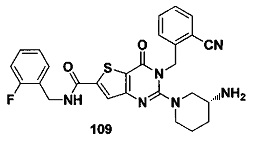
Соединение 109 синтезировали в соответствии с синтезом соединения 99, где 2-фторбензиламин использовали вместо метилового эфира глицина, используемого в синтезе соединения 99. 1H-ЯМР (CDCl3-d3): δ=7,632 (s, 1Н), 7,572 (d, 1Н), 7,453 (t, 1Н), 7,385 (t, 1Н), 7,298 (t, 1Н), 7,192 (m, 1H), 7,094 (t, 1H), 7,035 (t, 1H), 6.966 (t, 1H), 5,542 (t, 2H), 4.595 (d, 2H), 3,436 (d, 1H), 3,253 (s, 1H), 3,012 (m, 2H), 2,815 (d, 1H), 1,991 (s, 1H), 1,719 (s, 1H), 1,566 (s, 2H); ЖХ-масс-спектрометрия m/z 517,2 [M+H]+.
Пример 110: синтез соединения 110
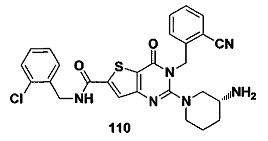
Соединение 110 синтезировали в соответствии с синтезом соединения 99, где 2-хлорбензиламин был использован вместо метилового эфира глицина, используемого в синтезе соединения 99. 1H-ЯМР (CDCl3-d3): δ=7,666 (s, 1Н), 7,584 (d, 1Н), 7,440 (m, 2Н), 7,308 (m, 2Н), 7,179 (m, 2Н), 7,105 (d, 1H), 5,442 (t, 2H), 4.635 (d, 2H), 3,409 (d, 1H), 3,203 (s, 1H), 3,052 (d, 1H), 2,928 (t, 1H), 2,824 (t, 1H), 1,967 (s, 1H), 1,717 (s, 1H), 1,532 (m, 2H); ЖХ-масс-спектрометрия m/z 533,1 [M+H]+.
Пример 111: синтез соединения 111
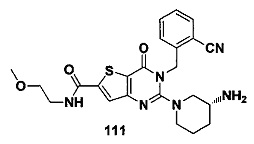
Соединение 111 синтезировали в соответствии с синтезом соединения 99, где 2-метоксиэтиламин был использован вместо метилового эфира глицина, используемого в синтезе соединения 99. 1H-ЯМР (CDCl3-d3): δ=7,590 (d, 2Н), 7,458 (t, 1Н), 7,303 (t, 1Н), 7,058 (d, 1Н), 5,421 (s, 2Н), 3,497 (m, 3H), 3,309 (m, 5Н), 3,040 (m, 2Н), 2,755 (m, 2Н), 1,927 (m, 1Н), 1,710 (m, 1Н), 1,589 (m, 1Н), 1,341 (m, 1Н); ЖХ-масс-спектрометрия m/z 467,2 [M+H]+.
Пример 112: синтез соединения 112
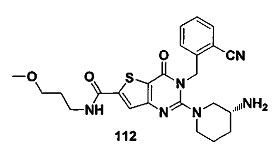
Соединение 112 синтезировали в соответствии с синтезом соединения 99, где 3-метоксилпропиламин был использован вместо метилового эфира глицина, используемого в синтезе соединения 99. 1H-ЯМР (CDCl3-d3): δ=7,695 (d, 1Н), 7,646 (s, 1Н), 7,568 (t, 1Н), 7,411 (t, 1Н), 7,178 (d, 1H), 5,525 (s, 2Н), 3,567 (m, 5Н), 3,406 (m, 3H), 3,169 (m, 2Н), 2,903 (m, 2Н), 2,045 (m, 1Н), 1,918 (m, 2Н), 1,816 (m, 1Н), 1,699 (m, 1H), 1,481 (m, 1H); ЖХ-масс-спектрометрия m/z 481,2 [M+H]+.
Пример 113: синтез соединения 113
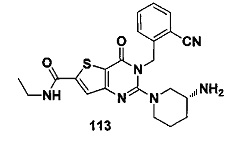
Соединение 113 синтезировали в соответствии с синтезом соединения 99, где этиламина гидрохлорид был использован вместо метилового эфира глицина, используемого в синтезе соединения 99. 1H-ЯМР (CDCl3-d3): δ=7,697 (t, 2Н), 7,570 (t, 1Н), 7,568 (t, 1Н), 7,413 (t, 1Н), 7,175 (d, 1H), 5,521 (s, 2Н), 3,416 (m,3H), 3,157 (m, 2H), 2,889 (m, 2H), 2,040 (m, 1H), 1,811 (m, 1H), 1,682 (m, 1H), 1,445 (m, 1H), 1,270 (s, 3H); ЖХ-масс-спектрометрия m/z 437,2 [M+H]+.
Пример 114: синтез соединения 114
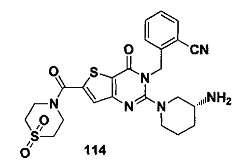
Соединение 114 синтезировали в соответствии с синтезом соединения 99, где 1,1-ди-O-тиоморфолин был использован вместо метилового эфира глицина, используемого в синтезе соединения 99. 1H-ЯМР (CDCl3-d3): δ=7,664 (d, 1Н), 7,542 (t, 1Н), 7,422 (s, 1Н), 7,384 (t, 1Н), 7,172 (d, 1H), 5,495 (t, 2Н), 4.192 (s, 4Н), 3,425 (d, 1Н), 3,079 (m, 5Н), 2,903 (m, 3H), 2,021 (m, 1Н), 1,811 (m, 1Н), 1,670 (m, 1Н), 1,491 (m, 1Н); ЖХ-масс-спектрометрия m/z 527,1 [M+H]+.
Пример 115: синтез соединения 115
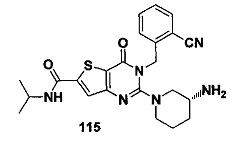
Соединение 115 синтезировали в соответствии с синтезом соединения 99, где изопропиламин был использован вместо метилового эфира глицина, используемого в синтезе соединения 99. MS: 451,2 [M+H]+.
Пример 116: синтез соединения 116
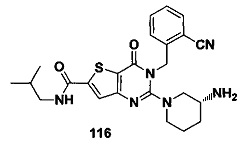
Соединение 116 синтезировали в соответствии с синтезом соединения 99, где изобутиламин использован вместо метилового эфира глицина, используемого в синтезе соединения 99. 1H-ЯМР (CDCl3-d3): δ=7,713 (s, 1Н), 7,555 (d, 1Н), 7,473 (t, 1Н), 7,296 (t, 1Н), 7,158 (d, 1H), 5,426 (t, 2Н), 3,576 (d, 1H), 3,482 (s, 1H), 3,201 (m,3H), 3,020 (m, 1H), 2,854 (m, 1H), 2,82 (m, 1H), 1,905 (m, 1H), 1,762 (s, 2H), 1,583 (s, 1H), 0.915 (d, 6H); ЖХ-масс-спектрометрия m/z 465,2 [M+H]+.
Пример 117: синтез соединения 117
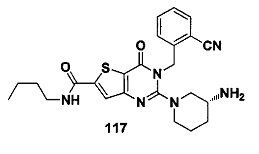
Соединение 117 синтезировали в соответствии с синтезом соединения 99, где н-бутиламин был использован вместо метилового эфира глицина, используемого в синтезе соединения 99. 1H-ЯМР (CDCl3-d3): δ=7,713 (s, 1Н), 7,564 (d, 1Н), 7,483 (t, 1Н), 7,307 (t, 1Н), 7,183 (d, 1H), 5,434 (quartet, 2Н), 3,577 (m, 2H), 3,373 (m, 3H), 3,044 (m, 1H), 2,898 (m, 1H), 2,092 (s, 1H), 1,833 (d, 2H), 1,587 (m, 3H), 1,354 (m, 2H), 0.881 (t, 3H); ЖХ-масс-спектрометрия m/z 465,2 [M+H]+.
Пример 118: синтез соединения 118
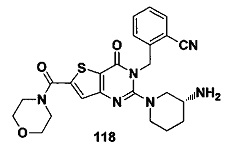
Соединение 118 синтезировали в соответствии с синтезом соединения 99, где морфолин был использован вместо метилового эфира глицина, используемого в синтезе соединения 99. 1H-ЯМР (CDCl3-d3): δ=7,620 (d, 1Н), 7,505 (t, 1Н), 7,368 (s, 1Н), 7,340 (t, 1Н), 7,172 (d, 1H), 5,498 (quartet, 2Н), 3,721 (s, 8H), 3,486 (m, 2H), 3,197 (m, 1H), 3,064 (m, 1H), 2,954 (m, 1H), 2,058 (m, 1H), 1,821 (m, 2H), 1,616 (m, 1H); ЖХ-масс-спектрометрия m/z 479.2 [M+H]+.
Пример 119: синтез соединения 119
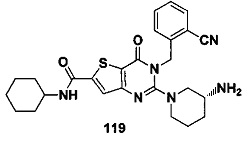
Соединение 119 синтезировали в соответствии с синтезом соединения 99, где циклогексан был использован вместо метилового эфира глицина, используемого в синтезе соединения 99. 1H-ЯМР (CDCl3-d3): δ=7,673 (s, 1Н), 7,568 (d, 1Н), 7,483 (t, 1Н), 7,304 (t, 1Н), 7,169 (d, 1H), 5,446 (quartet, 2Н), 3,864 (s, 1H), 3,540 (m, 2H), 3,261 (m, 1H), 3,026 (s, 1H), 2,877 (m, 1H), 2,060 (m, 1H), 1,948 (s, 2H), 1,789 (m, 4H), 1,610 (d, 2H), 1,338 (m, 4H), 1,162 (m, 1H); ЖХ-МАСС-СПЕКТРОМЕТРИЯ m/z 491,2 [M+H]+.
Пример 120: синтез соединения 120
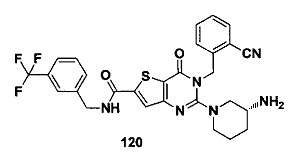
Соединение 120 синтезировали в соответствии с синтезом соединения 99, где 3-трифторметилбензиламин используют вместо метилового эфира глицина, используемого в синтезе соединения 99. 1H-ЯМР (CDCl3-d3): δ=7,693 (s, 1Н), 7,597 (s, 1Н), 7,520 (d, 2Н), 7,425 (t, 2Н), 7,332 (t, 1H), 7,284 (d, 1H), 7,140 (d, 2H), 5,368 (m, 2H), 4.576 (s, 1H), 3,522 (s, 2H), 3,292 (s, 1H), 2,987 (s, 1H), 2,853 (s, 1H), 2,010 (s, 1H), 1,761 (d, 1H), 1,519 (s, 1H); ЖХ-масс-спектрометрия m/z 567,2 [M+H]+.
Пример 121: синтез соединения 121
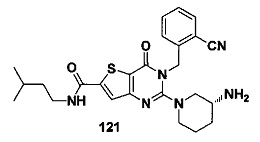
Соединение 121 синтезировали в соответствии с синтезом соединения 99, где изопентиламин был использован вместо метилового эфира глицина, используемого в синтезе соединения 99. 1H-ЯМР (CDCl3-d3): δ=7,673 (s, 1Н), 7,572 (d, 1Н), 7,483 (t, 1Н), 7,310 (t, 1Н), 7,168 (d, 1H), 5,442 (quartet, 2Н), 3,501 (m, 2H), 3,410 (quartet, 2Н), 3,219 (s, 1Н), 3,047 (s, 1Н), 2,872 (s, 1Н), 2,067 (s, 1H), 1,773 (s, 2Н), 1,610 (m, 2Н), 1,500 (quartet, 2Н), 0.890 (d, 6Н); ЖХ-масс-спектрометрия m/z 479.2 [M+H]+.
Пример 122: синтез соединения 122
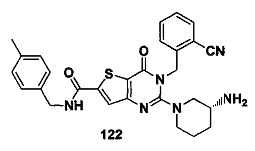
Соединение 122 синтезировали в соответствии с синтезом соединения 99, где 4-метилбензиламин был использован вместо метилового эфира глицина, используемого в синтезе соединения 99. 1H-ЯМР (CDCl3-d3): δ=7,645 (s, 1Н), 7,520 (d, 1Н), 7,420 (t, 1Н), 7,264 (t, 1Н), 7,194 (d, 2Н), 7,110 (d, 1Н), 7,010 (d, 2Н), 5,390 (quartet, 2Н), 4.469 (s, 2Н), 3,482 (m, 2Н), 3,244 (m, 1Н), 2,936 (s, 1Н), 2,828 (s, 1Н), 2,218 (s, 3H), 2,004 (s, 1Н), 1,738 (m, 2Н), 1,510 (s, 1Н); ЖХ-масс-спектрометрия m/z 513,2 [M+H]+.
Пример 123: синтез соединения 123
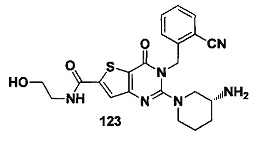
Соединение 123 синтезировали в соответствии с синтезом соединения 99, где 2-гидроксиэтиламин был использован вместо метилового эфира глицина, используемого в синтезе соединения 99. 1H-ЯМР (CDCl3-d3): δ=7,580 (d, 2Н), 7,459 (t, 1Н), 7,288 (t, 1Н), 7,080 (d, 1Н), 5,400 (quartet, 2Н), 3,669 (m, 2Н), 3,452 (m, 2Н), 3,317 (m, 1Н), 3,094 (m, 2Н), 2,845 (quartet, 2Н), 1,923 (m, 1Н), 1,705 (s, 1Н), 1,575 (m, 1Н), 1,401 (m, 1Н); ЖХ-масс-спектрометрия m/z 453,2 [M+H]+.
Пример 124: синтез соединения 124
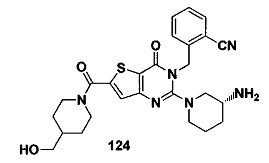
Соединение 124 синтезировали в соответствии с синтезом соединения 99, где 4-гидроксиметил пиперидин был использован вместо метилового эфира глицина, используемого в синтезе соединения 99. 1H-ЯМР (CDCl3-d3): δ=7,690 (d, 1Н), 7,580 (m, 1Н), 7,417 (t, 1Н), 7,328 (s, 1Н), 7,231 (d, 1Н), 5,524 (quartet, 2Н), 4.130 (quartet, 1Н), 3,794 (s, 5Н), 3,500 (m, 1Н), 3,354 (m, 1Н), 3,164 (m, 1Н), 3,068 (quartet, 1Н), 2,940 (t, 1Н), 2,106 (m, 1Н), 1,856 (m, 4Н), 1,680 (m, 2Н), 1,271 (m, 3H); ЖХ-масс-спектрометрия m/z 507,2 [M+H]+.
Пример 125: синтез соединения 125
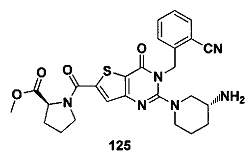
Соединение 125 синтезировали в соответствии с синтезом соединения 99, где метиловый эфир L-пролина был использован вместо метилового эфира глицина, используемого в синтезе соединения 99. 1H-ЯМР (CDCl3-d3): δ=7,600 (d, 2Н), 7,490 (m, 1Н), 7,321 (t, 1Н), 7,139 (d, 1Н), 5,484 (t, 2Н), 4.637 (quartet, 1Н), 3,900 (m, 2Н), 3,735 (s, 3H), 3,535 (d, 1Н), 3,392 (m, 1Н), 3,084 (m, 2Н), 2,917 (t, 1Н), 2,280 (m, 1Н), 2,078 (m, 4Н), 1,800 (m, 1Н), 1,623 (m, 2Н); ЖХ-масс-спектрометрия m/z521,2 [M+H]+.
Пример 126: синтез соединения 126
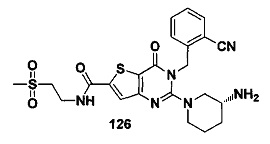
Соединение 126 синтезировали в соответствии с синтезом соединения 99, где 2-метилсульфонил этиламин был использован вместо метилового эфира глицина, используемого в синтезе соединения 99. 1H-ЯМР (CDCL3-d3): δ=7,705 (s, 1Н), 7,680 (d, 1Н), 7,570 (t, 1Н), 7,402 (t, 1Н), 7,221 (d, 1H), 5,494 (quartet, 2Н), 3,918 (t, 2Н), 3,452 (m, 4Н), 3,377 (m, 1Н), 3,171 (m, 2Н), 3,057 (s, 3H), 3,078 (d, 1Н), 1,849 (m, 1Н), 1,696 (m, 2H); ЖХ-масс-спектрометрия m/z 515,1 [M+H]+.
Пример 127: синтез соединения 127
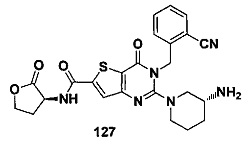
Соединение 127 синтезировали в соответствии с синтезом соединения 99, где S-2-карбонил-4-амино тетрагидрофуран был использован вместо метилового эфира глицина, используемого в синтезе соединения 99. MS: 493,2 [M+H]+.
Пример 128: синтез соединения 128
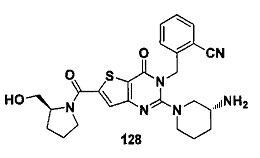
Соединение 128 синтезировали в соответствии с синтезом соединения 99, где L-пролин был использован вместо метилового эфира глицина, используемого в синтезе соединения 99. 1H-ЯМР (CDCl3-d3): δ=7,638 (d, 1Н), 7,554 (s, 1H), 7,510 (t, 1H), 7,348 (t, 1H), 7,145 (d, 1H), 5,494 (quartet, 2H), 4.402 (s, 1H), 3,736 (m, 5H), 3,410 (d, 1H), 3,289 (s, 1H), 3,137 (m, 1H), 3,000 (m, 2H), 2,068 (m, 3H), 1,834 (m, 3H), 1,633 (s, 2H); ЖХ-масс-спектрометрия m/z 493,2 [M+H]+.
Пример 129: синтез соединения 129
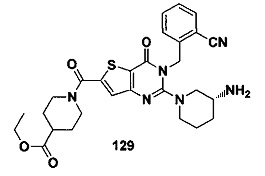
Соединение 129 синтезировали в соответствии с синтезом соединения 99, где метил-пиперидин-4-карбоксилат был использован вместо метилового эфира глицина, используемого в синтезе соединения 99. 1H-ЯМР (CDCl3-d3): δ=7,628 (d, 1Н), 7,500 (t, 1Н), 7,337 (m, 2Н), 7,145 (d, 1H), 5,506 (quartet, 2Н), 4.143 (quartet, 2Н), 3,454 (m, 2Н), 3,373 (s, 1Н), 3,093 (m, 4Н), 2,934 (m, 1Н), 2,590 (m, 1Н), 2,009 (m, 3H), 1,743 (m, 5Н), 1,251 (t, 3H); ЖХ-масс-спектрометрия m/z 549.2206 [M+H]+.
Пример 130: синтез соединения 130
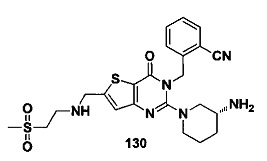
Соединение 130 синтезировали в соответствии с синтезом соединения 15, где 2-метилсульфонил этиламин был использован вместо раствора метиламина в тетрагидрофуране, используемого в синтезе соединения 15-1. MS: 501,2 [M+H]+.
Пример 131: синтез соединения 131
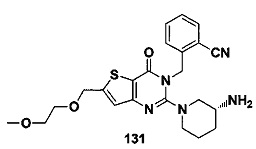
Соединение 131 синтезировали в соответствии с синтезом соединения 15, где 2-метоксильных-этанол был использован вместо раствора метиламина в тетрагидрофуране, используемого в синтезе соединения 15-1. MS: 454.2 [M+H]+.
Пример 132: синтез соединения 132
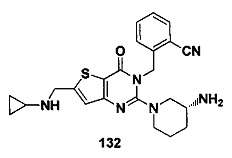
Соединение 132 синтезировали в соответствии с синтезом соединения 15, где циклопропиламин был использован вместо раствора метиламина в тетрагидрофуране, используемого при синтезе соединения 15-1. MS: 435,2 [M+H]+.
Пример 133: синтез соединения 133
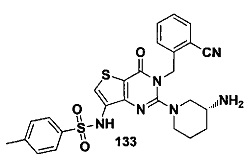
Соединение 133 синтезировали в соответствии с синтезом соединения 85, где хлорид пара-толуолсульфонил был использован вместо метилсульфонилхлорида. MS: 535,2 [M+H]+.
Пример 134: синтез соединения 134
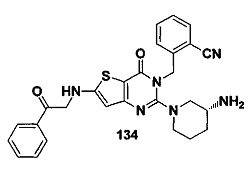
Соединение 134 синтезировали в соответствии с синтезом соединения 11, где бром-ацетофенон был использован вместо йодметана, используемого в синтезе соединения 11. MS: 499,2 [M+H]+.
Пример 135: синтез соединения 135
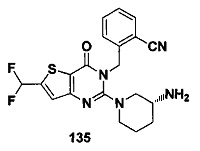
Путь синтеза:
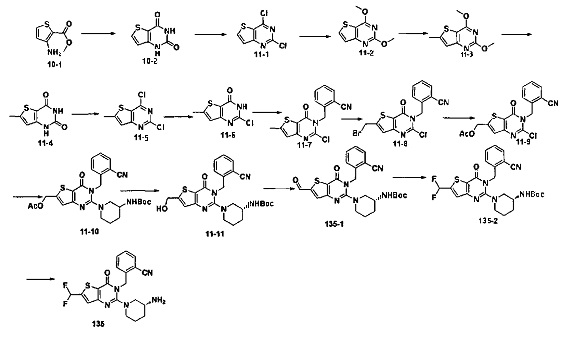
Синтез соединения 135-1:
Соединение 11-11 (100 мг) растворяли в 10 мл дихлорметана. Добавляли 1,1 эквивалента периодинана Десс-Мартина и перемешивали при комнатной температуре в течение 2 часов. После экстрагировали дихлорметаном, промывали водой и выпаривали, чтобы удалить растворитель, соединение 135-1 (80 мг) получали путем колоночной хроматографии с выходом 80%. MS: 494.2 [M+H]+.
Синтез соединения 135-2:
Соединение 135-1 (80 мг) растворяли в дихлорметане, и добавляли биэтиламиносеры трифторид при -78°C в атмосфере азота. Смесь нагревали до комнатной температуры и перемешивали в течение ночи. Реакционный раствор выливали в насыщенный и охлажденный на льду раствор бикарбоната натрия и перемешивали в течение 15 минут. После экстрагировали дихлорметаном и промывали водой, соединение 135-2 (56 мг) получали с помощью колоночной хроматографии с выходом 67%. MS: 516,2 [M+H]+.
Соединение 135 синтезировали в соответствии с синтезом соединения 1. MS: 416,1 [M+H]+.
Пример 136: синтез соединения 136
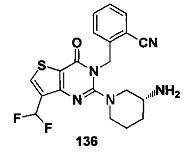
Путь синтеза:
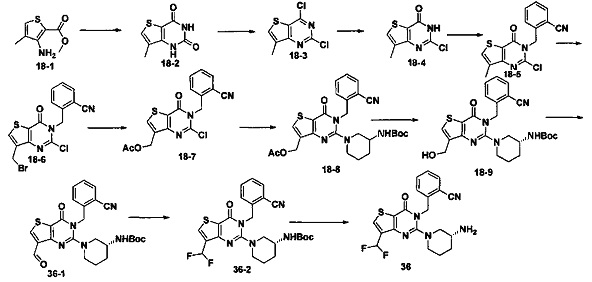
Соединение 136 синтезировали в соответствии с синтезом соединения 135, 1H ЯМР (CDCl3): δ=8.05 (s, 1Н), 7,66 (m, 1Н), 7,51 (m, 1Н), 7,36 (m, 1Н), 6.85-7,13 (m, 2Н), 5,52 (m, 2Н), 3,42 (m, 1Н), 3,26 (m, 1Н), 3,15 (m, 1Н), 2,96 (m, 2Н), 2,01 (m, 1Н), 1,79 (m, 1Н), 1,62 (m, 2Н); ЖХ-масс-спектрометрия m/z 416.1 [M+H]+.
Пример 137: синтез соединения 137
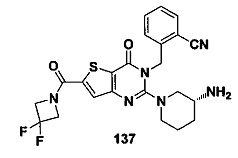
Путь синтеза:
Соединение 137 синтезировали в соответствии с синтезом соединения 99, где был использован 3,3-дифторазетидин вместо метилового эфира глицина, используемого в синтезе соединения 99. ЖХ-масс-спектрометрия m/z 485,1 [M+H]+.
Пример 138: синтез соединения 138
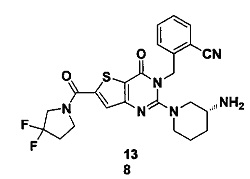
Путь синтеза:
Соединение 138 синтезировали в соответствии с синтезом соединения 99, где был использован 3,3-дифтортетрагидропирролидин вместо метилового эфира глицина, используемого в синтезе соединения 99. ЖХ-масс-спектрометрия m/z 499.2 [M+H]+.
Пример 139: синтез соединения 139
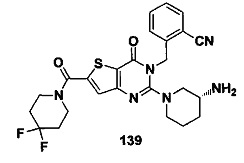
Путь синтеза:
Соединение 139 синтезировали в соответствии с синтезом соединения 99, где был использован 4,4-дифторпиперидин вместо метилового эфира глицина, используемого в синтезе соединения 99. ЖХ-масс-спектрометрия m/z 513,2 [M+H]+.
Пример 140: синтез соединения 140
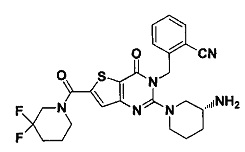
Путь синтеза:
Соединение 140 синтезировали в соответствии с синтезом соединения 99, где был использован 3,3-дифторпиперидин вместо метилового эфира глицина, используемого в синтезе соединения 99. ЖХ-масс-спектрометрия m/z 513,2 [M+H]+.
Пример 141: синтез соединения 141
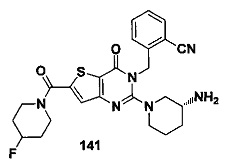
Путь синтеза:
Соединение 141 синтезировали в соответствии с синтезом соединения 99, где был использован 4-фторпиперидин вместо метилового эфира глицина, используемого в синтезе соединения 99. ЖХ-масс-спектрометрия m/z 495,2 [M+H]+.
Пример 142: синтез соединения 142
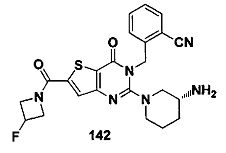
Путь синтеза:
Соединение 142 синтезировали в соответствии с синтезом соединения 99, где был использован 3-фторазетидин вместо метилового эфира глицина, используемого в синтезе соединения 99. ЖХ-масс-спектрометрия m/z 467,2 [M+H]+.
Пример 143: синтез соединения 143
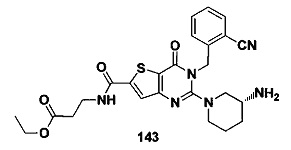
Путь синтеза:
Соединение 143 синтезировали в соответствии с синтезом соединения 99, где был использован этиловый эфир аланина вместо метилового эфира глицина, используемого в синтезе соединения 99. ЖХ-масс-спектрометрия m/z 509.2 [M+H]+.
Пример 144: синтез соединения 144
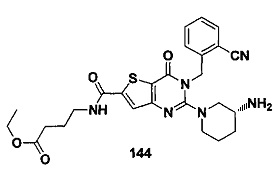
Путь синтеза:
Соединение 144 синтезировали в соответствии с синтезом соединения 99, где этил-4-аминобутаноат был использован вместо метилового эфира глицина, используемого в синтезе соединения 99. ЖХ-масс-спектрометрия m/z 523,2 [M+H]+.
Экспериментальный пример
Пример 1: тесты активности in vitro
Метод скрининга: скрининг активности дипептидил пептидазы IV (DPPIV), дипептидил пептидазы 7 (DPP 7), скрининг активности дипептидил пептидазы 8 (DPP 8) и скрининг активности дипептидил пептидазы 9 (DPP 9).
Приборы: микропланшетный ридер (PerkinElmer, USA).
Материалы: DPPIV человека, полученный внеклеточный фрагмент протеазы DPPIV (aa29-766), был экспрессирован и очищен в нашей лаборатории с применением бакуловирусной системы экспрессии Bac-to-Bac (приобретено у компании GIBCO) в соответствии с обычной экспериментальной технологией; DPP 8 человека была получена в клетках насекомых в нашей лаборатории с применением бакуловирусной системы экспрессии Bac-to-Bac (приобретено у компании GIBCO) в соответствии с обычной экспериментальной технологией; DPP 9 человека была получена в клетках насекомых в нашей лаборатории с применением бакуловирусной системы экспрессии Bac-to-Bac (приобретено у компании GIBCO) в соответствии с обычной экспериментальной технологией; а субстрат Ala-Pro-AMC был синтезирован в GL Biochem (Shanghai) Ltd.
Принцип теста активности: DPPIV, DPP 8 и DPP 9 могут специфически гидролизовать субстрат Ala-Pro-AMC с образованием продукта АМС, и АМС возбуждают УФ светом с длиной волны 355 нм для генерации излучения с длиной волны 460 нм. Линейное изменение величины флуоресценции при 460 нм в единицу времени было динамически измерено и активность DPPIV получали путем вычислений. Ситаглиптин (CAS: 486460-32-6, синтезирован в соответствии с обычным в данной области экспериментальным методом, см: Journal of Medicinal Chemistry 48 (2005) 141-151), положительное лекарственное средство Алоглиптин (3 мг/кг, CAS: 850649-62-6, синтезирован в соответствии с обычным в данной области экспериментальным методом, см: Journal of Medicinal Chemistry 50 (2007) 2297-2300), и положительное лекарственное средство LAF237 (15 мг/кг, Вилдаглиптин, CAS: 274901-16-5, синтезирован в соответствии с обычным в данной области экспериментальным методом, см: Journal of Medicinal Chemistry 46 (2003) 2774-2789) были использованы как контрольные соединения в данном эксперименте.
Обработка образца: образец растворяли в ДМСО и хранили при низкой температуре. Концентрацию ДМСО (диметилсульфоксид) в конечной системе регулировали таким образом, чтобы не влиять на обнаруженную активность.
Активность образца испытывали в одной концентрации, выбранной при предварительном скрининге, например, 20 мкг/мл. Для образца, который показал активность в определенных условиях, например, степень ингибирования (% ингибирования) была больше 50, соотношение зависимости между активностью и дозой, то есть значение IC50, определяли путем нелинейной подгонки активности образца к концентрации образца. Программой обеспечением для расчета был Graphpad Prism 4 и моделью, используемой для подгонки, была сигмоидальная кривая дозозависимости с изменяемым наклоном. Для большинства моделей скрининга ингибиторов, нижняя и верхняя часть подгоночной кривой были установлены 0 и 100. В общем, каждый образец в тесте был проверен дважды или более (n≥2) и результаты были представлены стандартным отклонением (SD) или стандартной ошибкой (SE).
Экспериментальные результаты:
Результаты активности соединений были показаны в таблице 1, показано, что соединения по изобретению обладают хорошей ингибирующей DPPIV активностью.
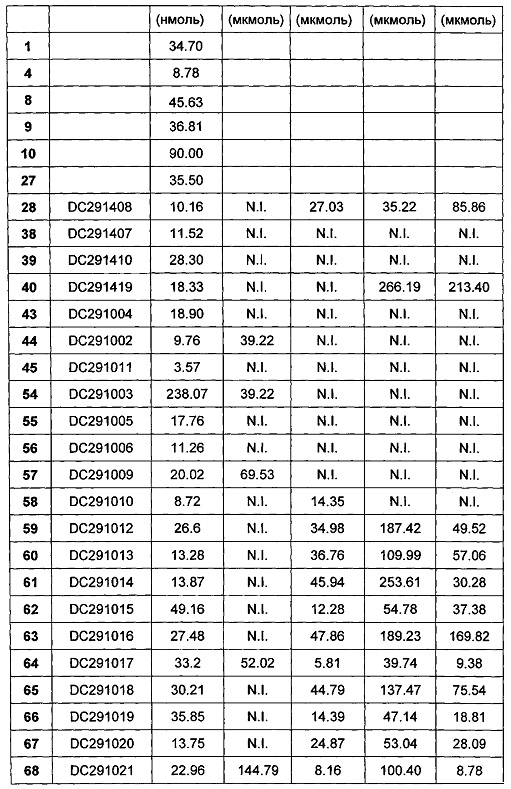
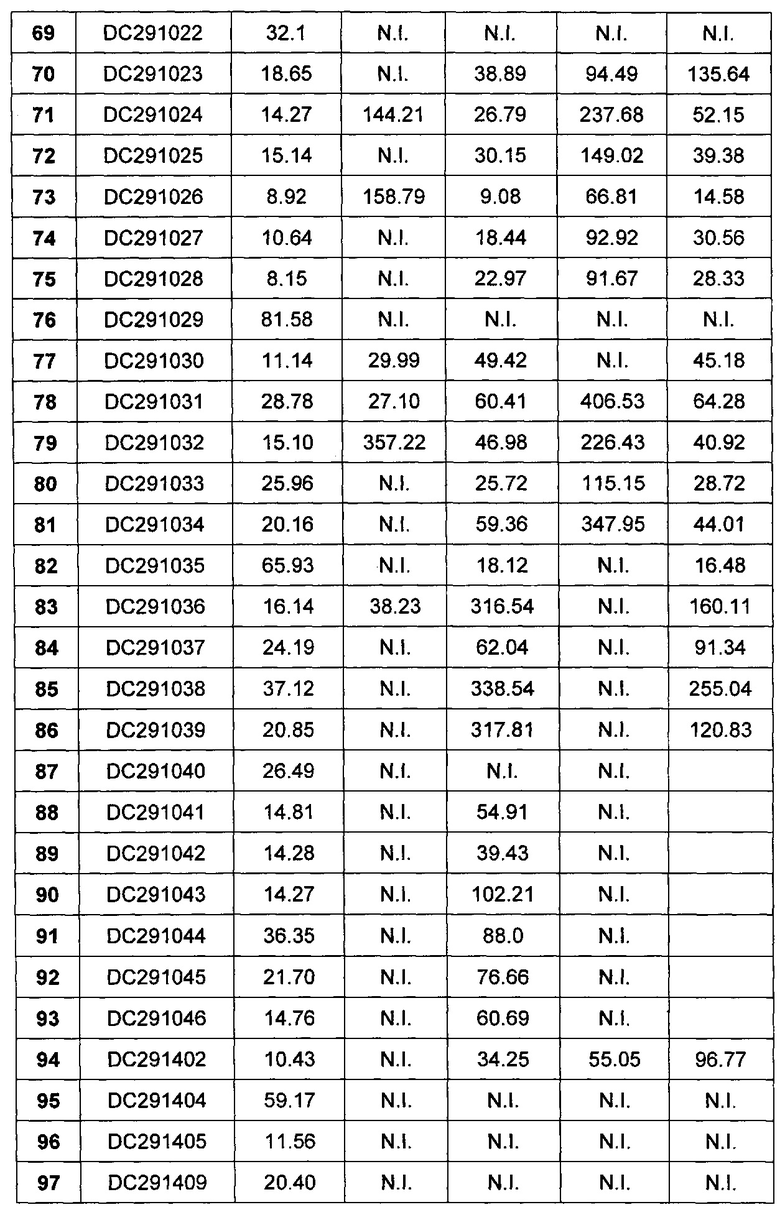
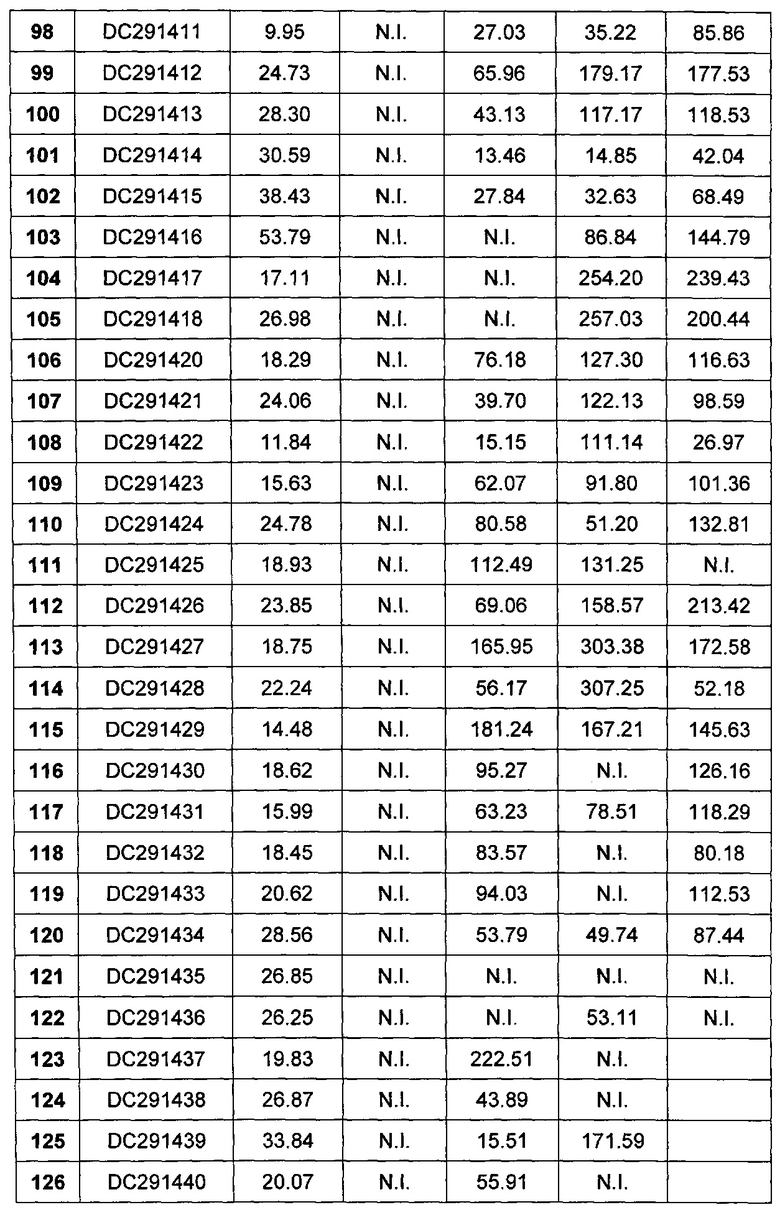
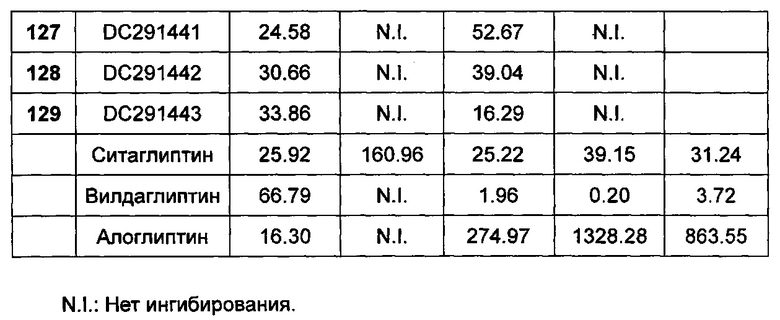
Пример 2: Изучение ингибирующей DPPIV активности in vivo
Животные: ICR мыши (в возрасте 8-10 недель; пол: самцы; вес тела 25 г-30 г, приобретены у Shanghai SLAC Laboratory Animal Center - Шанхайского центра по содержанию лабораторных животных).
Этапы: ICR мыши голодали в течение ночи и им через рот вводили исследуемые соединения (3 мг/кг), положительное лекарственное средство Алоглиптин (3 мг/кг), или положительное лекарственное средство LAF237 (3 мг/кг). При этом группу растворителя использовали как пустой контроль. Кровь брали из орбитального венозного сплетения мыши перед введением и через 30, 60, 2 ч, 4 ч, 6 ч, 8 ч и 240 ч после введения соответственно и помещали в пробирку Эппендорфа (Qizhong Industrial (Shanghai) co., Ltd.), обработанную антикоагулянтом. Плазму получали центрифугированием и определяли DPPIV активность.
Результаты: 23 соединения были выбраны для эксперимента по определению активности DPPIV у ICR мыши in vivo в соответствии с результатами испытаний активности DPPIV и селективности in vitro. Результаты испытаний показаны на Фигуре 1, Фигуре 2, Фигуре 3, Фигуре 4, Фигуре 5 и Фигуре 6. После однократной дозы, производные DC могут значительно снизить DPPIV активность в плазме крови ICR мыши, при этом гипогликемическая активность in vivo 11 соединений, включая DC291004, DC291005, DC291009, DC291010, DC291402, DC291405, DC291407, DC291408, DC291411, DC291041 и DC291422 (3 мг) сравнима с таковой для Алоглиптина (3 мг), и лучше, чем таковая для Вилдаглиптина (LAF237, 15 мг).
Пример 3: Гипогликемический эффект in vivo
Острое гипогликемическое действие однократной дозы, введенной через рот, на нормальную ICR мышь.
Животное: ICR мышь (возраст 8-10 недель, пол: мужской, вес: 25-30 г, приобретена у Шанхайского центра по содержанию лабораторных животных).
Этапы:
1. За два дня до эксперимента потребление пищи записывали и рассчитывали ежедневное потребление пищи для каждого животного;
2. Животные голодали в течение ночи (была предоставлена 1/3 суточного потребления пищи, около 2 г);
3. Глюкозу в крови измеряли на второй день. В соответствии с уровнем глюкозы в крови, животных случайным образом разделяли на 4 группы по 8 мышей в каждой группе: контрольная группа с растворителем (0.5% метилцеллюлозы, МЦ), группа с исследуемым соединением (3 мг/кг), контрольная группа с положительным лекарственным средством Алоглиптином (3 мг/кг), контрольная группа с положительным лекарственным средством LAF237 (15 мг/кг);
4. Лекарственное средство вводили через зонд (1 мышь/мин). Через 6 часов измеряли уровень глюкозы в крови. Глюкозу вводили через желудочный зонд в соответствии с весом тела (2,5 г/кг). Уровень глюкозы в крови контролировали через 30 мин, 60 мин, 90 мин, и 120 мин после введения.
Результаты: 20 соединений выбраны для перорального теста толерантности к глюкозе (ПТТГ) in vivo для ICR мыши в соответствии с результатами активности DPPIV в плазме ICR мыши и результаты тестов показаны на Фигуре 7, Фигуре 8, Фигуре 9, Фигуре 10, Фигуре 11 и Фигуре 12. После однократной дозы производные DC могут дозозависимо значительно улучшить толерантность к глюкозе у ICR мыши, при этом гипогликемическая способность in vivo 7 соединений, включая DC291004, DC291009, DC291402, DC291407, DC291411, DC291034 и DC291036 сравнима с таковой для Алоглиптина (Фигуры 7-10). Кроме этого пероральные тесты толерантности к глюкозе были проведены для соединений DC291009 и DC291407 после многократного введения одной дозы. Результаты показали, что гипогликемическая способность in vivo соединения DC291009 или соединения DC291407 сравнима с таковой для Алоглиптина (Фигуры 11-12).
Пример 4: Экспериментальный метод оценки безопасности
Самцы нормальных ICR мышей, массой тела 28-34 г (приобретены у Шанхайского центра по содержанию лабораторных животных), были случайным образом разделены на модельную группу и группу с препаратом в зависимости от веса тела по 4 мыши в каждой группе. После раздела на группы каждое соединение вводили один раз через желудочный зонд в соответствии с дозой 100 мг/кг в одно и то же время. После этого мышей в каждой группе наблюдали последовательно в течение одной недели, и контролировали потребление пищи и вес мыши. Экспериментальные результаты были следующими.
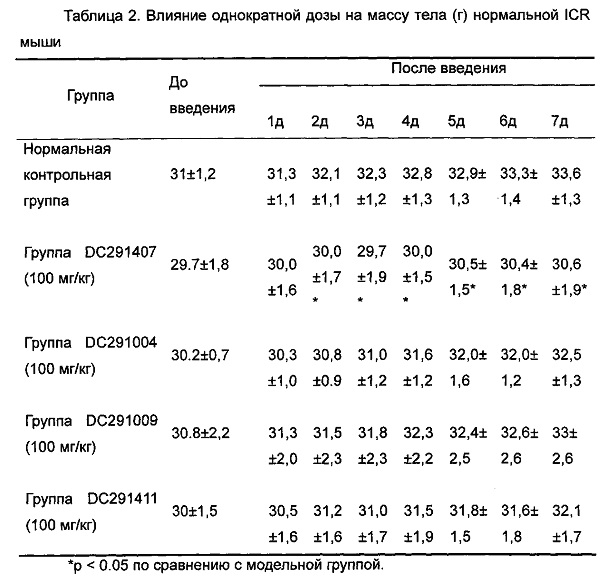
Как видно из таблицы 2, что по сравнению с нормальной контрольной группой, вес ICR мыши начал показывать значительное статистическое различие (p<0,05) по сравнению с контрольной группой со второго дня после однократной дозы DC291407 (100 мг/кг), которое продолжалось до 7 дней после введения (т.е. до конца эксперимента). Тем не менее, масса тела не постоянно снижалась в течение этого периода и оставалась около 30,0 г, что существенно не отличалось от веса в нормальной контрольной группе и других групп с лекарственными средствами. Таким образом, было сделано предположение, что DC291407 возможно не влияет на массу тела. Не было существенных статистических различий между другими группами и нормальной контрольной группой.
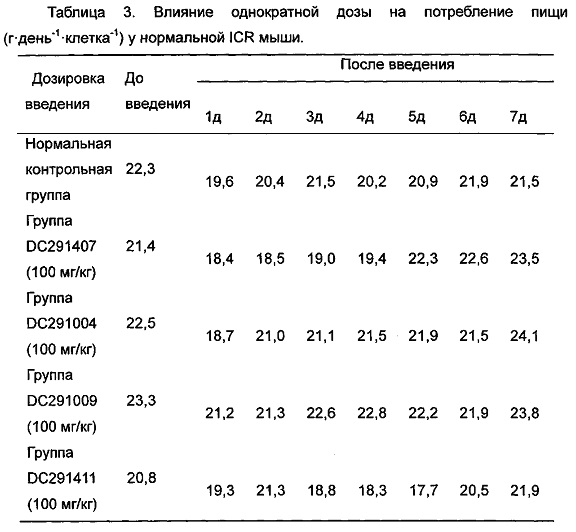
Как видно из таблицы 3, из-за высокой дозы введенного лекарственного средства, потребление пищи мышью в каждой группе существенно снизилось через один день после введения, а затем начало восстанавливаться и последовательно восстановилось до уровня перед введением, на 7 день после введения.
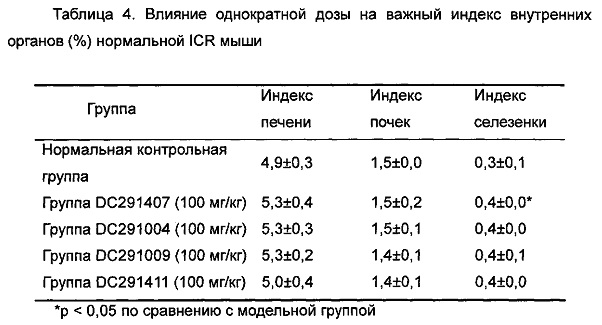
Как видно из таблицы 4, на 7-й день после введения, индекс печени и индекс селезенки ICR мыши, получавшей препарат, в каждой группе увеличивается до определенной степени. Однако было статистически значимое различие между индексом селезенки группы DC29147 и нормальной контрольной группы, в то время как не было статистически значимых различий между другими группами. Индекс почки группы DC291407 или DC291004 существенно не отличался от индекса нормальной контрольной группы, а индекс почки группы DC291411 или DC291009 был несколько ниже, чем у нормальной контрольной группы. Тем не менее, статистически значимого различия не было.
Экспериментальное заключение
Результаты испытаний показали, что после введения DC291407 (100 мг/кг) было статистически значимое различие между весом на второй день после введения и на 7-й день после введения, и весом в нормальной контрольной группе, в то время как значение не сильно отличалось от значения в любой другой группе, поэтому, возможно, не было никакого практического значения. Кроме того по сравнению с нормальной контрольной группой индекс селезенки был значительно увеличен на 7-й день после введения, в то время как значение его не сильно отличается от значения в каждой другой группе, таким образом, биологическое значение не было очевидным. Для других групп препаратов DC291004 (100 мг/кг), DC291009 (100 мг/кг) и DC291411 (100 мг/кг) по сравнению с нормальной контрольной группой не было статистически значимых различий, как для массы тела, так и для индекса внутренних органов, а индекс печени и индекс селезенки немного увеличились на 7 день после введения. Суммируя, получаем, что DC291407, DC291004, DC291009 и DC291411 в этом эксперименте не отражают очевидную острую токсичность.
Пример 5: Изучение фармакокинетики
Концентрацию метаболита M1 (4071001), метаболита M2 (407002), или метаболита M3 (407003) в плазме определяли способом ЖХ-тандемной масс-спектрометрии (жидкостная хроматография с тандемной масс-спектрометрией) после введения DC291407 крысам через желудочный зонд и внутривенной инъекции.
Как показано на Фигуре 13, после введения 20 мг/кг DC291407 здоровым крысам Sprague-Dawley (SD, крысы Спрага-Доули) (полученным от Шанхайского центра по содержанию лабораторных животных) через желудочный зонд, плазма в основном содержала метаболит гидролиза M1 (специально деметилированный продукт из DC291407). Кроме этого, относительно низкая концентрация M2 (специально ацетилированный M1) (менее 20 нг/мл) была определена в образцах, собранных через 1 час после введения, и прототип соединения и метаболит М3 (специально ацетилированный DC291407) не могут быть обнаружены в плазме.
После введения крысам в вену 10 мг/кг DC291407, плазма в основном содержала метаболит гидролиза M1. Кроме того, были обнаружены относительно низкая концентрация соединения прототипа и M2, а метаболит М3 не может быть обнаружен в плазме.
После нормализации дозы абсолютная биодоступность составила 22,1% после введения крысам через желудочный зонд 20 мг/кг DC291407, на основании AUC (площадь под кривой) метаболита M1.
Для ЖХ-тандемной масс-спектрометрии использовали трехквадрупольный масс-спектрометр 6460 от Agilent.
Конкретная схема введения является следующей:
Шесть здоровых самцов крыс Sprague-Dawley (SD, крысы Спрага-Доули) весом 180-220 г случайным образом были разделены на 2 группы. Крысам в каждой группе вводили тестируемое соединение через желудочный зонд или с помощью внутривенной инъекции соответственно. Подробности приведены в следующей таблице:
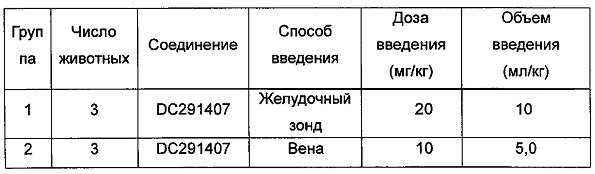
Соединение растворяли в 6,7% ДМСО / 6,7% Tween / 86,6% физиологического раствора.
Крысы голодали в течение 12 часов и могли пить воду ad libitum. Через 2 часа после введения дозы, крысы были обеспечены пищей все вместе. Точка времени для сбора образцов крови, и обработка образцов были такими как указано ниже.
Внутрижелудочное введение: 0,25, 0,5, 1,0, 2,0, 3,0, 4,0, 6,0, 8,0 и 24 ч после введения;
Внутривенное введение: 5 мин, 0,25, 0,5, 1,0, 2,0, 4,0, 6,0, 8,0 и 24 ч после введения. В указанное выше время брали по 0,3 мл венозной крови из ретробульбарного венозного сплетения крысы и помещали в пробирку с гепарином. После центрифугирования при 11000 об/мин в течение 5 мин плазму отделяли и замораживали при -20°C в холодильнике. 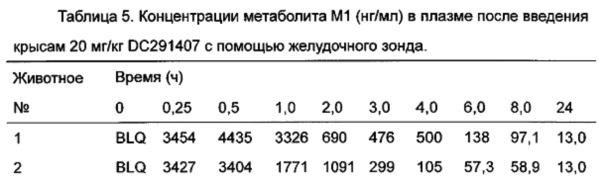

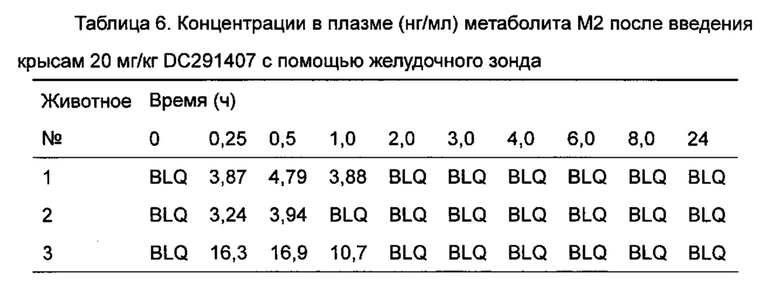
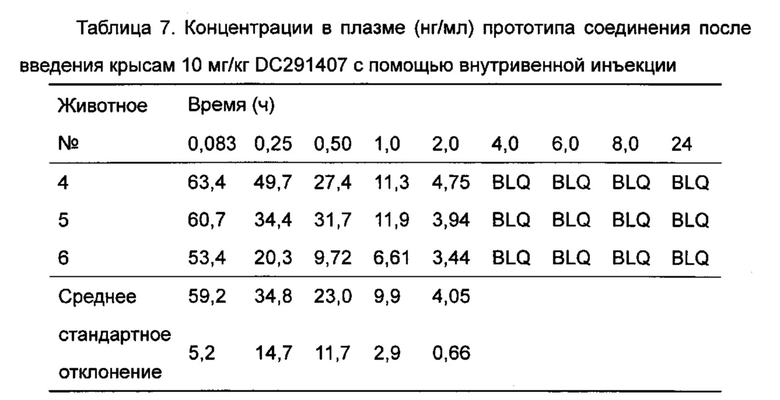

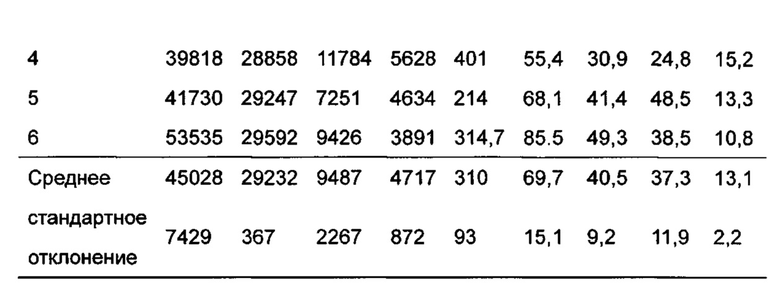
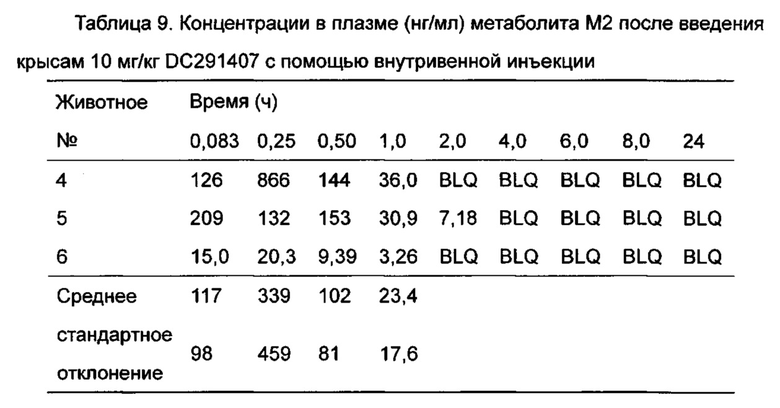
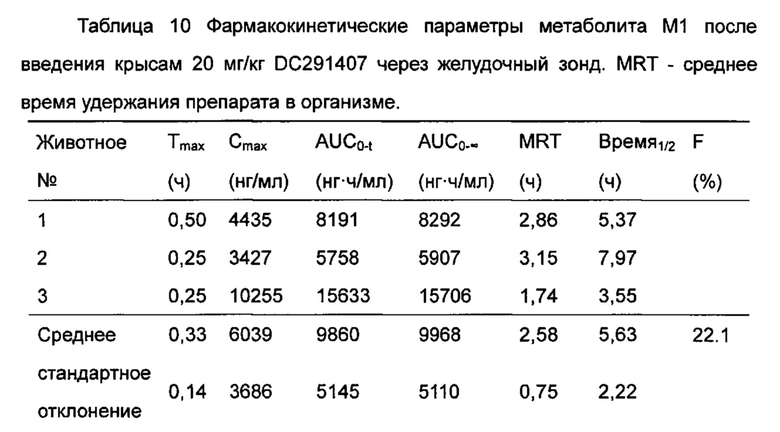

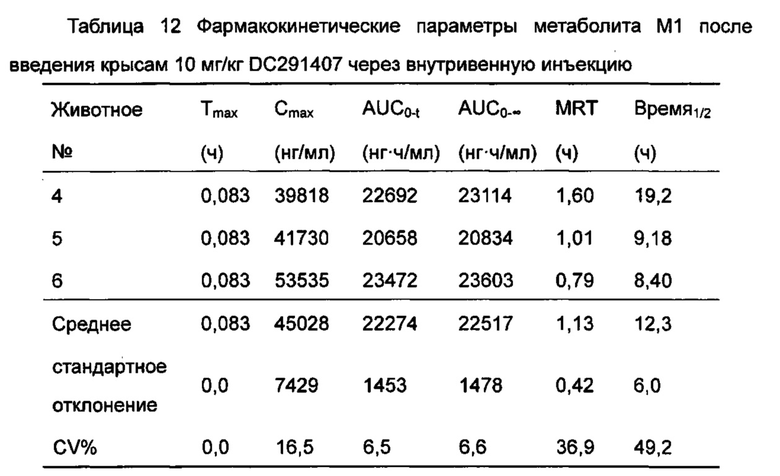
Как можно видеть из таблиц от таблицы 5 до таблицы 12, после введения крысам 20 мг/кг DC291407 через желудочный зонд, плазма в основном содержит метаболит гидролиза M1. Кроме того, относительно низкая концентрация M2 (ниже 20 нг/мл) была обнаружена в образцах, собранных в течение одного часа после введения, и прототип соединения и метаболит М3 не могут быть обнаружены. После введения крысам 10 мг/кг DC291407 через внутривенную инъекцию, плазма в основном содержит метаболит гидролиза M1. Кроме того, относительно низкая концентрация прототипа соединения и M2 могут быть обнаружены, в то время как метаболит М3 не может быть обнаружен.
После нормализации дозировки, абсолютная биодоступность составила 22,1%, период полураспада 5,63 ч и AUC была 9860 нг⋅ч/мл после введения крысам 20 мг/кг DC291407 через желудочный зонд, на основании AUC метаболита M1.
| название | год | авторы | номер документа |
|---|---|---|---|
| СОЕДИНЕНИЯ 1-(3-АМИНОПРОПИЛ)-ЗАМЕЩЕННОГО ЦИКЛИЧЕСКОГО АМИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ПРИМЕНЕНИЯ | 2014 |
|
RU2671179C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2667498C2 |
| ИНДАЗОЛЬНЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗЫ FGFR, ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ | 2015 |
|
RU2719428C2 |
| ФТОРИРОВАННОЕ СОЕДИНЕНИЕ ЦИКЛОПРОПИЛАМИНА, СПОСОБ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ЕЕ ИСПОЛЬЗОВАНИЕ | 2017 |
|
RU2746323C2 |
| ФТОРЗАМЕЩЕННЫЕ ЦИКЛИЧЕСКИЕ АМИНОСОЕДИНЕНИЯ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ИХ ПРИМЕНЕНИЯ | 2013 |
|
RU2605931C2 |
| ИНГИБИТОР FGFR И ЕГО МЕДИЦИНСКОЕ ПРИМЕНЕНИЕ | 2018 |
|
RU2771311C2 |
| ХИНОЛИНОВЫЕ СОЕДИНЕНИЯ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЯ В КАЧЕСТВЕ ЛЕКАРСТВЕННОГО СРЕДСТВА, ИНГИБИРУЮЩЕГО ТРАНСПОРТЕР УРАТОВ | 2016 |
|
RU2715229C2 |
| Производное индола, используемое в качестве ингибитора CRTH2 | 2017 |
|
RU2756270C2 |
| БЕНЗОПРОИЗВОДНЫЕ С ШЕСТИЧЛЕННЫМ КОЛЬЦОМ В КАЧЕСТВЕ ИНГИБИТОРА DPP-4 И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2702644C2 |
| СОЕДИНЕНИЯ НА ОСНОВЕ ИЗОТИАЗОЛО[5,4-d]ПИРИМИДИНА В КАЧЕСТВЕ ИНГИБИТОРА IRAK4 | 2019 |
|
RU2801942C2 |
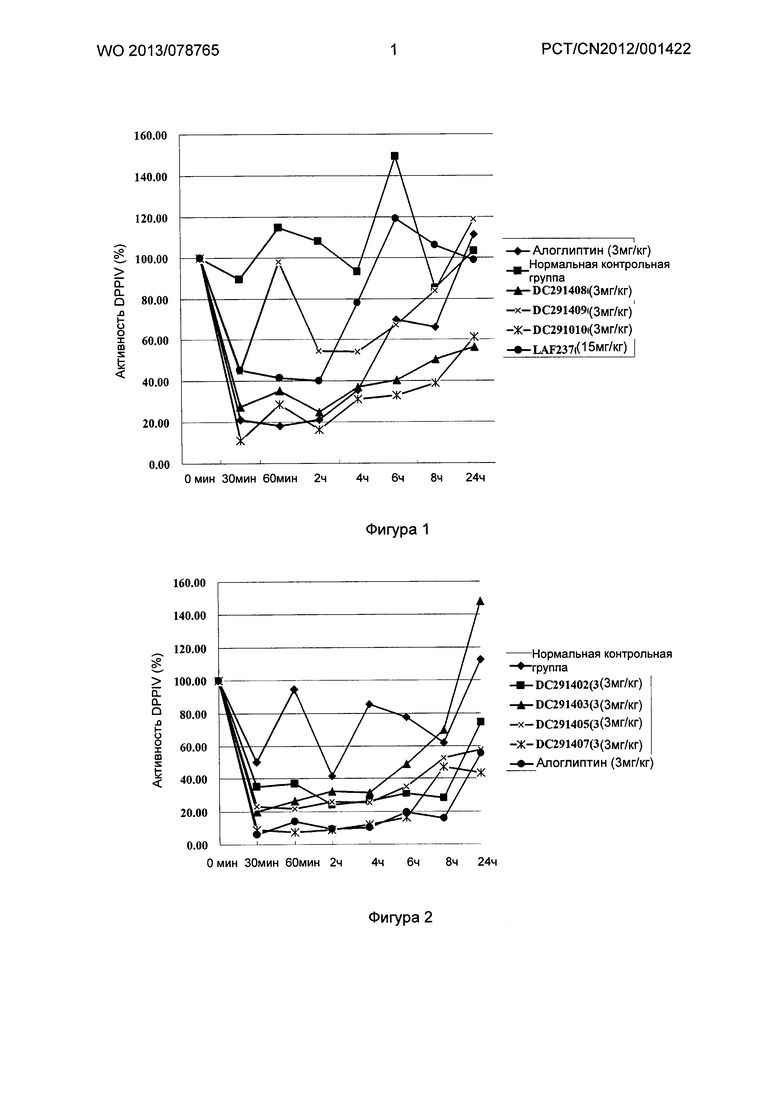
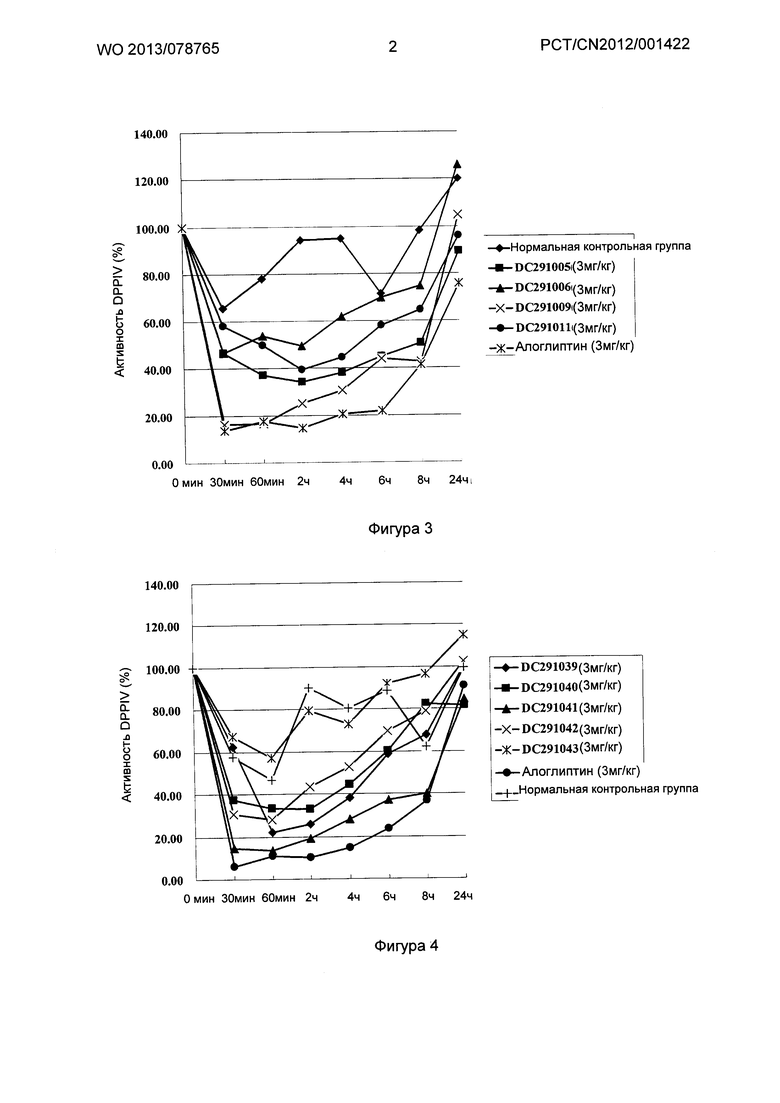
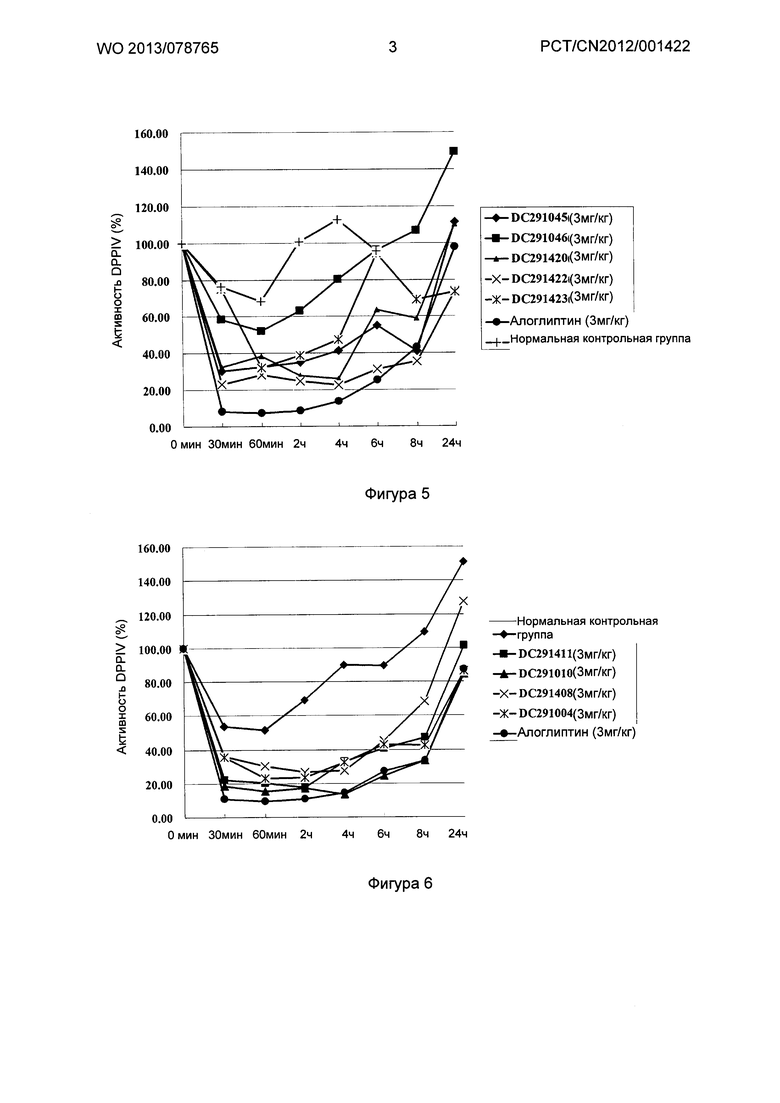
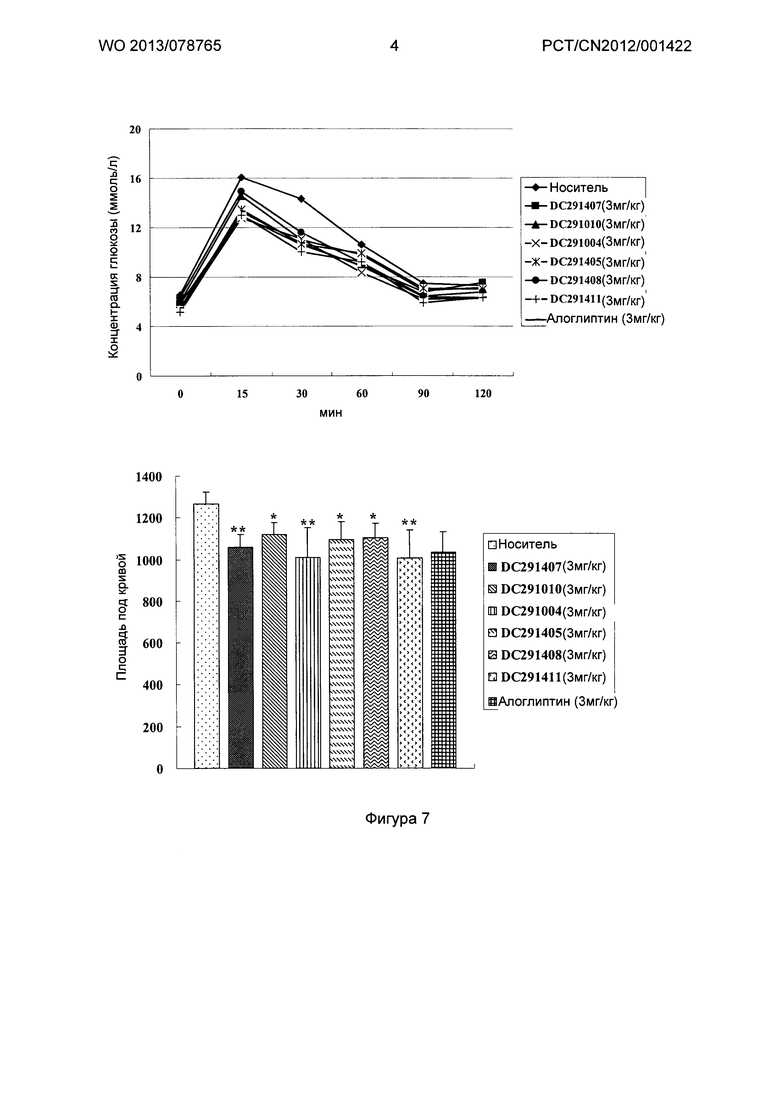
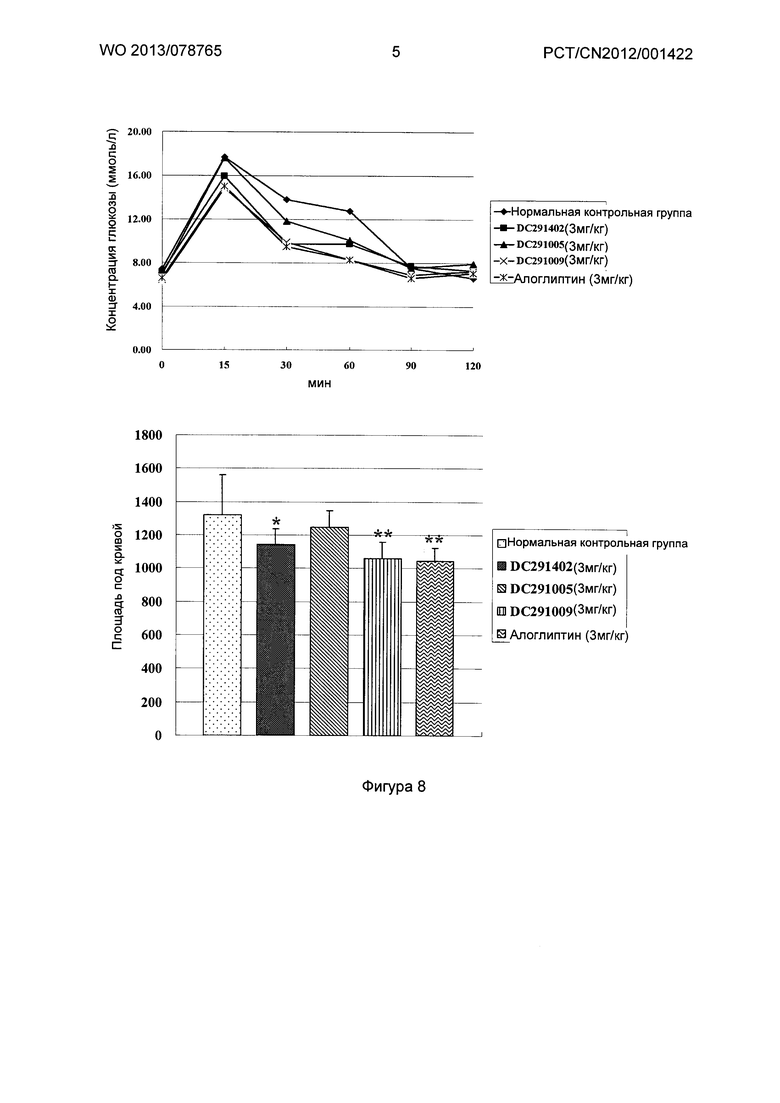
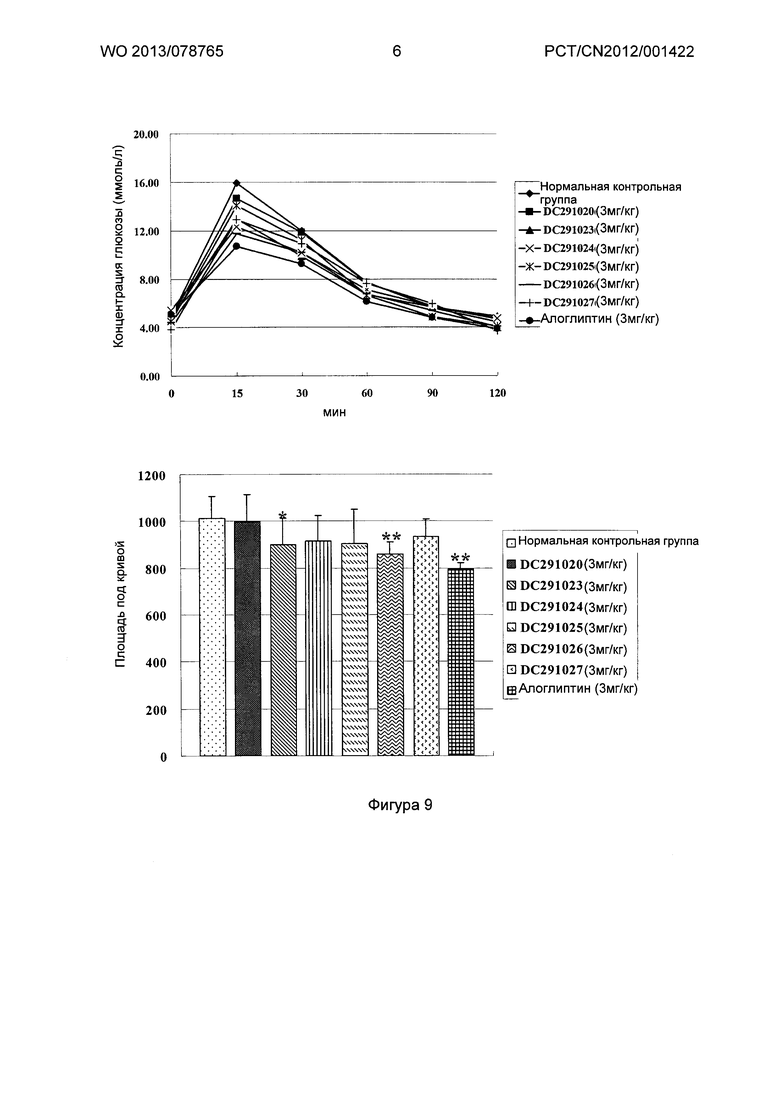
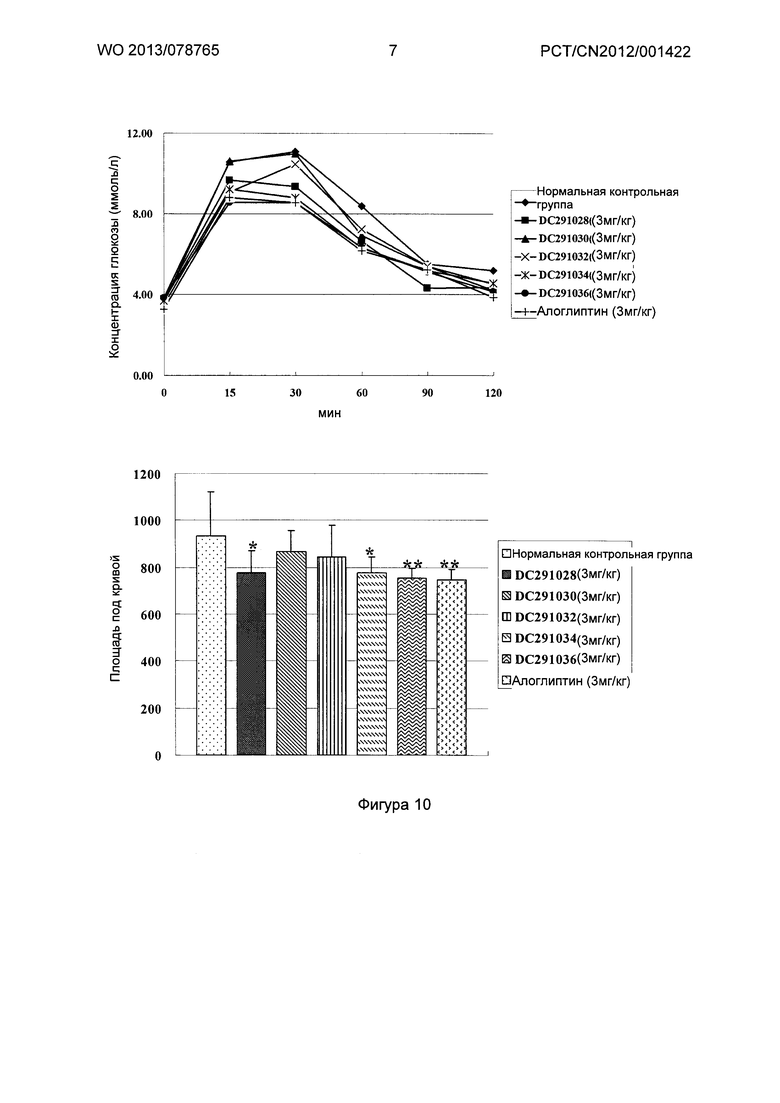
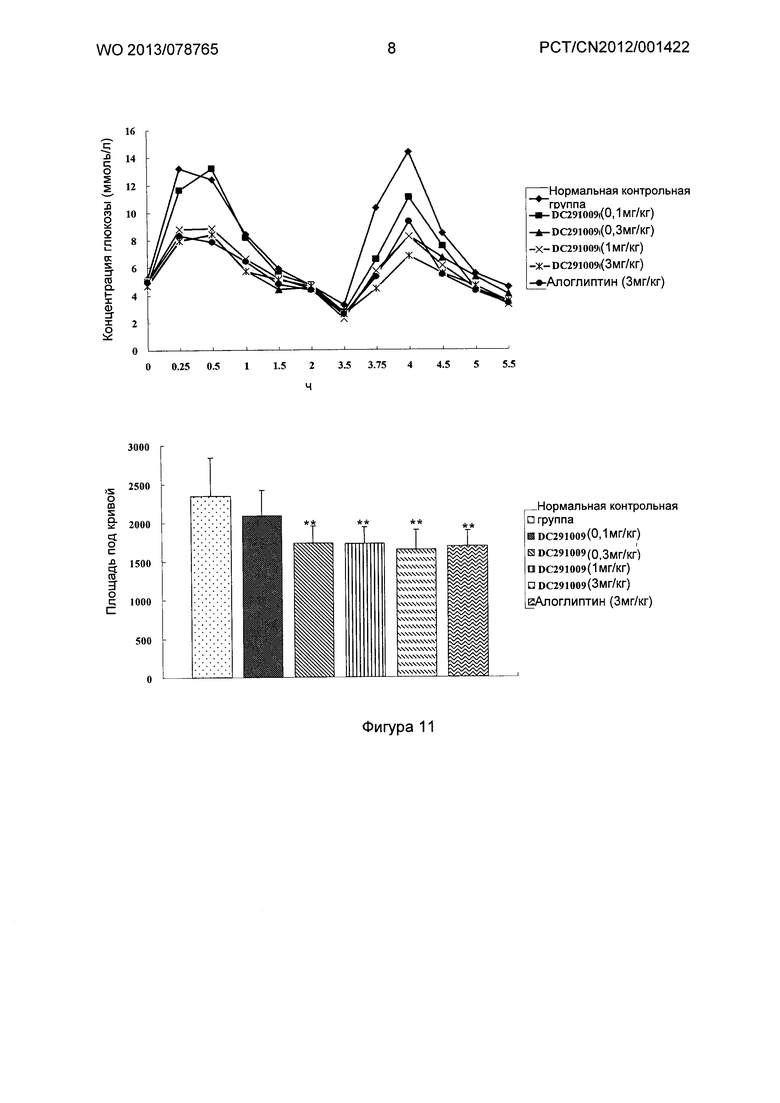
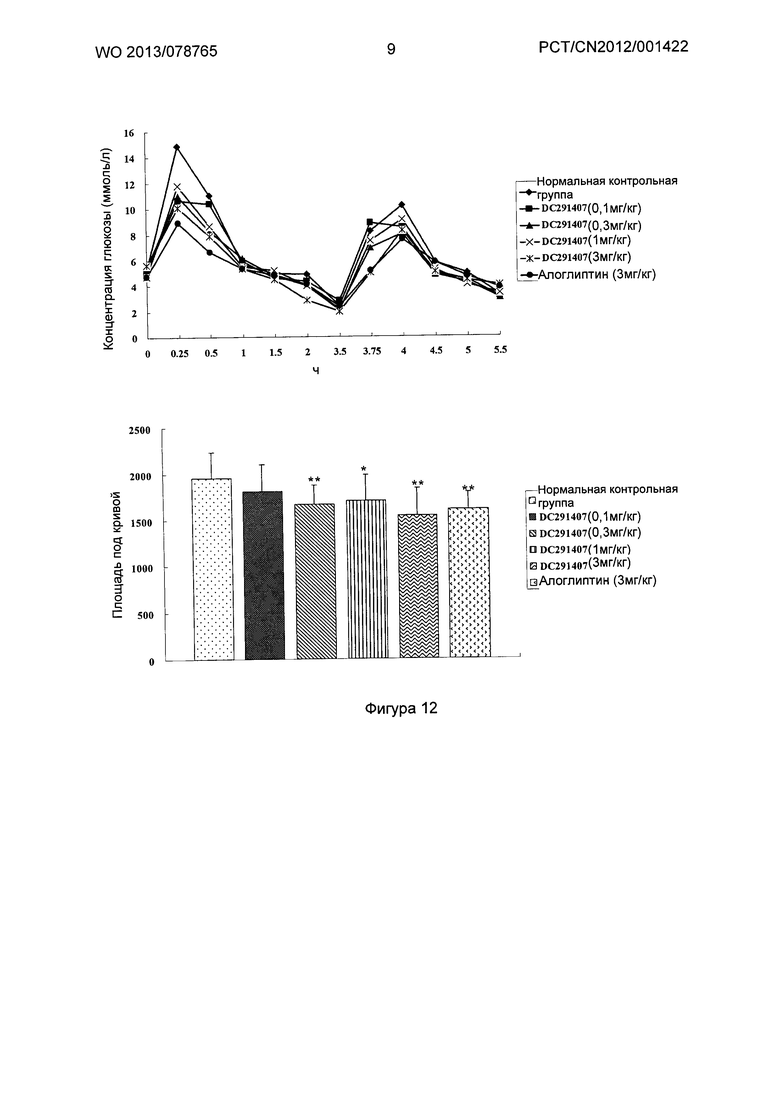
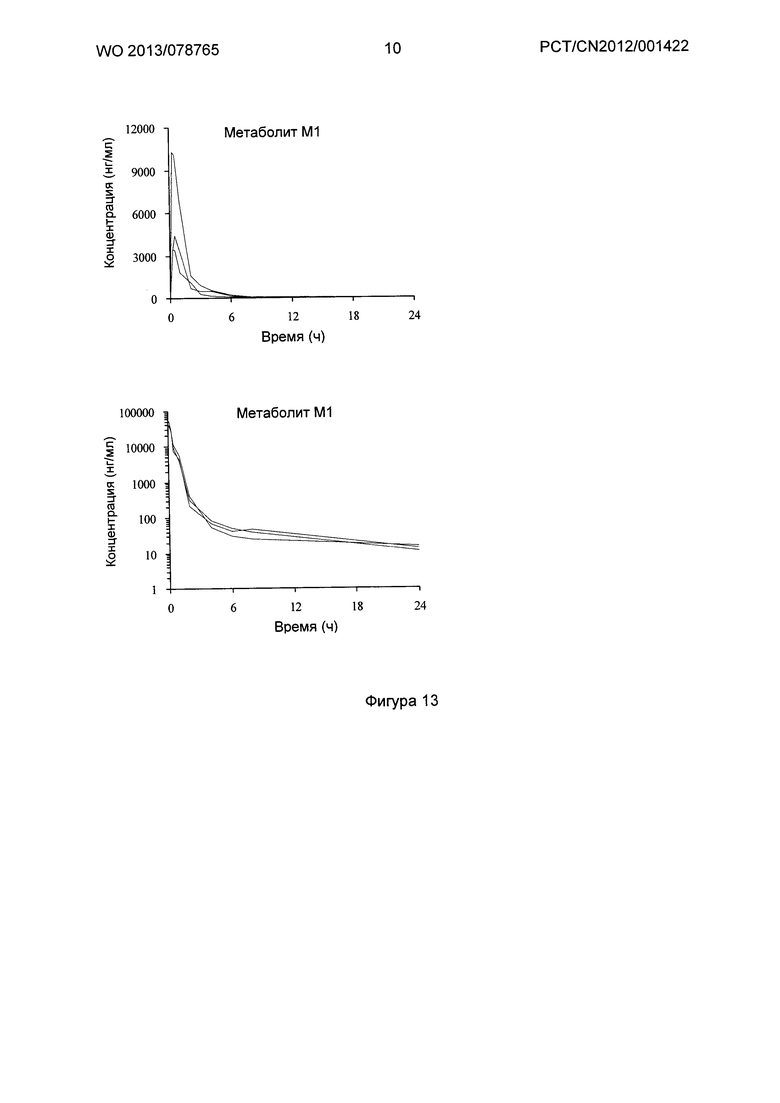
Изобретение относится к новым соединениям тиенил[3,2-d]пиримидин-4-она общей формулы (I)
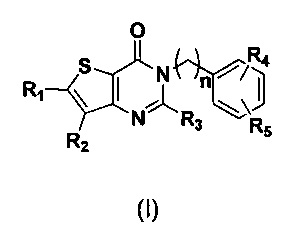 , фармацевтическим композициям на их основе и их фармакологическому применению. Технический результат: получены новые соединения, являющиеся ингибиторами DPPIV, которые могут быть применены в качестве лекарственных средств для лечения диабета. 4 н. и 11 з.п. ф-лы, 12 табл., 149 пр., 13 ил.
, фармацевтическим композициям на их основе и их фармакологическому применению. Технический результат: получены новые соединения, являющиеся ингибиторами DPPIV, которые могут быть применены в качестве лекарственных средств для лечения диабета. 4 н. и 11 з.п. ф-лы, 12 табл., 149 пр., 13 ил.
1. Соединение тиено[3,2-d]пиримидин-4-он структурной формулы I, его энантиомер, диастереоизомер, рацемат и их смеси, и его фармацевтически приемлемая соль,
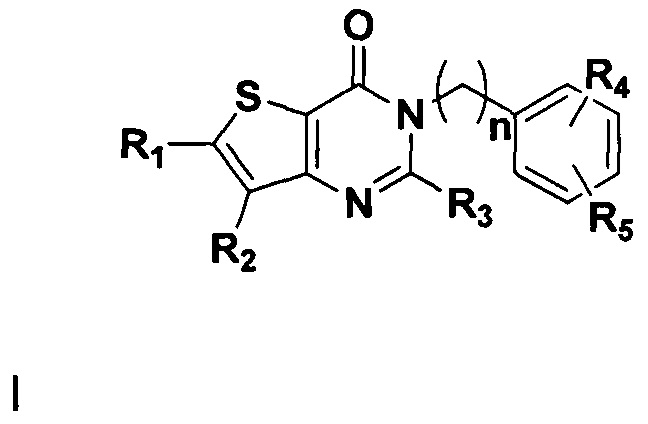
где
n представляет собой целое число от 1 до 3;
R1 и R2 являются одинаковыми или различными и одновременно не являются водородом, каждый из R1 и R2 независимо представляет собой Н, галоген, CBr2H, CCl2H, CF2H, циано, CF3, (CH2)mOR6, (CH2)mNR6R7, 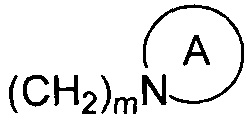 , (CH2)mCOOR8, CONR9R10 или
, (CH2)mCOOR8, CONR9R10 или  ,
,
где
R1 и R2 могут быть связаны вместе, образуя С3-С6 алкилиден, но не обязательно;
m представляет собой целое число от 0 до 3;
R6 и R7 являются одинаковыми или различными, и каждый из R6 и R7 независимо выбраны из Н, линейного или разветвленного, насыщенного или ненасыщенного С1-С6 углеводородного остатка, С3-С7 циклического углеводородного остатка, 4-7-членной гетероциклической группы, С1-С4 алкилоил RCO, С5-С7 ароил ArCO, С1-С4 алкилсульфонил RSO2, С5-С7 арилсульфонил ArSO2, С5-С7 ароилметилен, бензила, С5-С7 арила Ar; причем линейный или разветвленный, насыщенный или ненасыщенный С1-С6 углеводородный остаток замещен одним или несколькими заместителями, выбранными из метилсульфонила, циклопропила, гидрокси, С1-С3 алкокси, но не обязательно; гетероциклическая группа содержит 1-3 гетероатома О;
R8 выбран из Н, линейного или разветвленного, насыщенного или ненасыщенного С1-С6 углеводородного остатка;
R9 и R10 являются одинаковыми или различными, и каждый из R9 и R10 независимо выбран из Н, 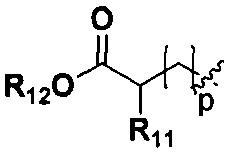 , линейного или разветвленного, насыщенного или ненасыщенного С1-С6 углеводородного остатка, С3-С7 циклического углеводородного остатка, С4-С7 гетероциклической группы, С5-С7 ароилметилена, 5-7-членного гетероароилметилена, бензила, пиридиндиметилена, С5-С7 арила Ar; где линейный или разветвленный, насыщенный или ненасыщенный С1-С6 углеводородный остаток замещен одним или несколькими заместителями, выбранными из метилсульфонила, циклопропила, гидрокси, С1-С3 алкокси, но не обязательно; гетероциклическая группа содержит 1-3 гетероатома О, метилен гетероциклической группы замещен на карбонил, но не обязательно; арил или бензил замещен одним или несколькими заместителями, выбранными из галогена, но не обязательно; гетероарил содержит 1-3 гетероатома N;
, линейного или разветвленного, насыщенного или ненасыщенного С1-С6 углеводородного остатка, С3-С7 циклического углеводородного остатка, С4-С7 гетероциклической группы, С5-С7 ароилметилена, 5-7-членного гетероароилметилена, бензила, пиридиндиметилена, С5-С7 арила Ar; где линейный или разветвленный, насыщенный или ненасыщенный С1-С6 углеводородный остаток замещен одним или несколькими заместителями, выбранными из метилсульфонила, циклопропила, гидрокси, С1-С3 алкокси, но не обязательно; гетероциклическая группа содержит 1-3 гетероатома О, метилен гетероциклической группы замещен на карбонил, но не обязательно; арил или бензил замещен одним или несколькими заместителями, выбранными из галогена, но не обязательно; гетероарил содержит 1-3 гетероатома N;
р представляет собой целое число от 0 до 2;
R11 и R12 являются одинаковыми или различными, каждый из которых независимо выбран из Н, линейного или разветвленного, насыщенного или ненасыщенного С1-С6 углеводородного остатка, фенила или бензила; где фенил или бензил замещен одним или несколькими заместителями, выбранными из гидрокси, но не обязательно;
 представляет собой 3-7-членную азотсодержащую гетероциклическую группу, гетероциклическая группа дополнительно содержит 1-3 гетероатома, выбранных из О, S и N, и метилен гетероциклической группы замещен на карбонил или сульфонил, но не обязательно, и гетероциклическая группа замещена 1-5 заместителями, выбранными из Н, линейного или разветвленного С1-С6 углеводородного остатка, галогена, гидрокси, гидроксиметила, карбоксила, карбоксилатной группы, С1-С4 алкоксикарбонила, но не обязательно;
представляет собой 3-7-членную азотсодержащую гетероциклическую группу, гетероциклическая группа дополнительно содержит 1-3 гетероатома, выбранных из О, S и N, и метилен гетероциклической группы замещен на карбонил или сульфонил, но не обязательно, и гетероциклическая группа замещена 1-5 заместителями, выбранными из Н, линейного или разветвленного С1-С6 углеводородного остатка, галогена, гидрокси, гидроксиметила, карбоксила, карбоксилатной группы, С1-С4 алкоксикарбонила, но не обязательно;
R3 выбран из NR14R15 или 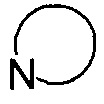 , где R14 и R15 одинаковы или различны, и каждый из R14 и R15 независимо представляет собой Н, линейный насыщенный С1-С6 углеводородный остаток, С1-С6 углеводородный остаток амино, С5-С7 арил Ar;
, где R14 и R15 одинаковы или различны, и каждый из R14 и R15 независимо представляет собой Н, линейный насыщенный С1-С6 углеводородный остаток, С1-С6 углеводородный остаток амино, С5-С7 арил Ar;
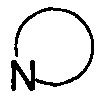 представляет собой 3-7-членную азотсодержащую гетероциклическую группу, и гетероциклическая группа дополнительно содержит 1-4 гетероатома, выбранных из N, и замещена 1-5 заместителями, выбранными из Н, линейного или разветвленного С1-С6 углеводородного остатка, амино, карбоксилатной группы;
представляет собой 3-7-членную азотсодержащую гетероциклическую группу, и гетероциклическая группа дополнительно содержит 1-4 гетероатома, выбранных из N, и замещена 1-5 заместителями, выбранными из Н, линейного или разветвленного С1-С6 углеводородного остатка, амино, карбоксилатной группы;
R4 и R5 являются одинаковыми или различными, и каждый из R4 и R5 независимо представляет собой Н, галоген, линейный или разветвленный С1-С6 углеводородный остаток, циано, гидрокси, карбоксил, С1-С4 алкокси;
галоген представляет собой фтор-, хлор-, бром- или йод-.
2. Соединение тиено[3,2-d]пиримидин-4-он, энантиомер, диастереоизомер, рацемат и их смеси, и его фармацевтически приемлемая соль по п. 1, где в общей формуле I:
n представляет собой 1;
R1 и R2 являются одинаковыми или различными и одновременно не являются водородом, каждый из которых независимо представляет собой Н, галоген, CBr2H, CCl2H, CF2H, циано, CF3, (CH2)mOR6, (CH2)mNR6R7, 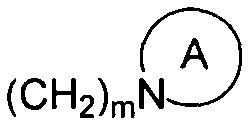 , (CH2)mCOOR8, CONR9R10 или
, (CH2)mCOOR8, CONR9R10 или  ,
,
где
R1 и R2 могут быть связаны вместе с образованием С3-С6 алкилидена, но не обязательно;
m представляет собой целое число от 0 до 3;
R6 и R7 являются одинаковыми или различными, и каждый из R6 и R7 независимо выбран из Н, линейного или разветвленного С1-С6-алкила, С3-С7 циклоалкила, 4-7-членной гетероциклической группы, С1-С4 алкилоила RCO, С5-С7 ароила ArCO, С1-С4 алкилсульфонила RSO2, С5-С7 арилсульфонила ArSO2, С5-С7 ароилметилена, бензила, С5-С7 арила Ar; причем линейный или разветвленный С1-С6 алкил замещен одним или несколькими заместителями, выбранными из метилсульфонила, циклопропила, гидрокси, С1-С3 алкокси, но не обязательно; гетероциклическая группа содержит 1-3 гетероатома О;
R8 выбран из Н, линейного или разветвленного С1-С6 алкила;
R9 и R10 являются одинаковыми или различными, каждый из которых независимо выбран из Н, 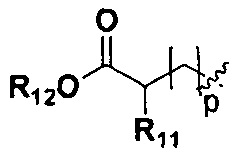 , линейного или разветвленного С1-С6 алкила, С3-С7 циклоалкила, 4-7-членной гетероциклической группы, С5-С7 ароилметилена, 5-7-членного гетероароилметилена, бензила, пиридиндиметилена, С5-С7 арила Ar; причем линейный или разветвленный С1-С6 алкил замещен одним или несколькими заместителями, выбранными из метилсульфонила, циклопропила, гидрокси, С1-С3 алкокси, С1-С3 алкоксикарбонила и эпоксипропила, но не обязательно; гетероциклическая группа содержит 1-3 гетероатома О, метилен гетероциклической группы замещен на карбонил, но не обязательно, арил или бензил может быть замещен одним или несколькими заместителями, выбранными из галогена, гетероарил содержит 1-3 гетероатома N;
, линейного или разветвленного С1-С6 алкила, С3-С7 циклоалкила, 4-7-членной гетероциклической группы, С5-С7 ароилметилена, 5-7-членного гетероароилметилена, бензила, пиридиндиметилена, С5-С7 арила Ar; причем линейный или разветвленный С1-С6 алкил замещен одним или несколькими заместителями, выбранными из метилсульфонила, циклопропила, гидрокси, С1-С3 алкокси, С1-С3 алкоксикарбонила и эпоксипропила, но не обязательно; гетероциклическая группа содержит 1-3 гетероатома О, метилен гетероциклической группы замещен на карбонил, но не обязательно, арил или бензил может быть замещен одним или несколькими заместителями, выбранными из галогена, гетероарил содержит 1-3 гетероатома N;
р представляет собой целое число от 0 до 2;
R11 и R12 являются одинаковыми или различными, и каждый из R11 и R12 независимо выбран из Н, линейного или разветвленного С1-С6 алкила, фенила или бензила; фенил или бензил замещен одним или несколькими заместителями, выбранными из гидрокси, но не обязательно;
 представляет собой 3-7-членную азотсодержащую гетероциклическую группу, гетероциклическая группа дополнительно содержит 1-3 гетероатома, выбранных из О, S и N, и метилен гетероциклической группы замещен карбонилом или сульфонилом, но не обязательно, и замещен 1-5 заместителями, выбранными из Н, линейного или разветвленного С1-С6 углеводородного остатка, галогена, циано, амино, гидрокси, гидроксиметила, карбоксила, карбоксилатной группы, С1-С4 алкоксикарбонила, но не обязательно;
представляет собой 3-7-членную азотсодержащую гетероциклическую группу, гетероциклическая группа дополнительно содержит 1-3 гетероатома, выбранных из О, S и N, и метилен гетероциклической группы замещен карбонилом или сульфонилом, но не обязательно, и замещен 1-5 заместителями, выбранными из Н, линейного или разветвленного С1-С6 углеводородного остатка, галогена, циано, амино, гидрокси, гидроксиметила, карбоксила, карбоксилатной группы, С1-С4 алкоксикарбонила, но не обязательно;
R3 выбран из NR14R15 или 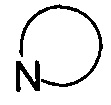 , причем R14 и R15 одинаковые или различные, и каждый из R14 и R15 независимо представляет собой Н, линейный С1-С6 алкил, С1-С6 алкиламино, С5-С7 арил Ar;
, причем R14 и R15 одинаковые или различные, и каждый из R14 и R15 независимо представляет собой Н, линейный С1-С6 алкил, С1-С6 алкиламино, С5-С7 арил Ar;
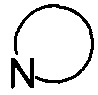 представляет собой 3-7-членную азотсодержащую гетероциклическую группу, и гетероциклическая группа дополнительно содержит 1-4 гетероатома, выбранных из N, и замещена 1-5 заместителями, выбранными из Н, линейного или разветвленного С1-С6 алкила, амино, карбоксилатной группы;
представляет собой 3-7-членную азотсодержащую гетероциклическую группу, и гетероциклическая группа дополнительно содержит 1-4 гетероатома, выбранных из N, и замещена 1-5 заместителями, выбранными из Н, линейного или разветвленного С1-С6 алкила, амино, карбоксилатной группы;
R4 и R5 являются одинаковыми или различными, и каждый из R4 и R5 независимо представляет собой Н, галоген, линейный или разветвленный С1-С6 углеводородный остаток, циано, гидрокси, карбоксил, С1-С4 алкокси;
галоген представляет собой фтор-, хлор-, бром- или йод-.
3. Соединение тиено[3,2-d]пиримидин-4-он, энантиомер, диастереоизомер, рацемат и их смеси, и его фармацевтически приемлемая соль по п. 2, где в общей формуле I:
n=1;
R1 и R2 являются одинаковыми или различными, и одновременно не являются водородом, каждый из которых независимо представляет собой Н, галоген, CBr2H, CCl2H, CF2H, циано, CF3, (CH2)mOR6, (CH2)mNR6R7,  , (CH2)mCOOR8, CONR9R10 или
, (CH2)mCOOR8, CONR9R10 или  , где
, где
R1 и R2 могут быть связаны вместе с образованием С3-С6 алкилидена, но не обязательно;
m представляет собой целое число от 0 до 3;
R6 и R7 являются одинаковыми или различными, и каждый из R6 и R7 независимо выбран из Н, линейного или разветвленного С1-С3 алкила, С3-С5 циклоалкила, 4-7-членной гетероциклической группы, С1-С3 алкилоила RCO, С5-С7 ароила ArCO, С1-С3 алкилсульфонила RSO2, С5-С7 арилсульфонила ArSO2, С5-С7 ароилметилена, бензила, С5-С7 арила Ar; где линейный или разветвленный С1-С3 алкил замещен одним или несколькими заместителями, выбранными из метилсульфонила, циклопропила, гидрокси, С1-С3 алкокси, но не обязательно; гетероциклическая группа содержит 1-3 гетероатома О;
R8 выбран из Н, линейного или разветвленного С1-С3 алкила;
R9 и R10 являются одинаковыми или различными, каждый из которых независимо выбран из Н, 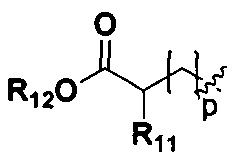 , линейного или разветвленного С1-С5 алкила, С3-С7 циклоалкила, 4-7-членной гетероциклической группы, С5-С7 ароилметилена, 5-7-членного гетероароилметилена, бензила, пиридиндиметилена, С5-С7 арила Ar; причем линейный или разветвленный С1-С3 алкил замещен одним или несколькими заместителями, выбранными из метилсульфонила, циклопропила, гидрокси, С1-С3 алкокси, но не обязательно; гетероциклическая группа содержит 1-3 гетероатома О, метилен гетероциклической группы замещен карбонилом, но не обязательно, арил или бензил может быть замещен одним или несколькими заместителями, выбранными из галогена, гетероарил содержит 1-3 гетероатома N;
, линейного или разветвленного С1-С5 алкила, С3-С7 циклоалкила, 4-7-членной гетероциклической группы, С5-С7 ароилметилена, 5-7-членного гетероароилметилена, бензила, пиридиндиметилена, С5-С7 арила Ar; причем линейный или разветвленный С1-С3 алкил замещен одним или несколькими заместителями, выбранными из метилсульфонила, циклопропила, гидрокси, С1-С3 алкокси, но не обязательно; гетероциклическая группа содержит 1-3 гетероатома О, метилен гетероциклической группы замещен карбонилом, но не обязательно, арил или бензил может быть замещен одним или несколькими заместителями, выбранными из галогена, гетероарил содержит 1-3 гетероатома N;
р является целым числом от 0 до 2;
R11 и R12 являются одинаковыми или различными, и каждый из R11 и R12 независимо выбран из Н, линейного или разветвленного С1-С3 алкила, фенила или бензила; фенил или бензил замещен одним или несколькими заместителями, выбранными из гидрокси, но необязательно;
 представляет собой 3-7-членную азотсодержащую гетероциклическую группу, гетероциклическая группа дополнительно содержит 1-3 гетероатома, выбранных из О, S и N, и метилен гетероциклической группы замещен карбонилом или сульфонилом, но не обязательно, и замещен 1-2 заместителями, выбранными из Н, линейного или разветвленного С1-С3 алкила, галогена, амино, гидрокси, гидроксиметила, С1-С4 алкокси карбонила, но не обязательно;
представляет собой 3-7-членную азотсодержащую гетероциклическую группу, гетероциклическая группа дополнительно содержит 1-3 гетероатома, выбранных из О, S и N, и метилен гетероциклической группы замещен карбонилом или сульфонилом, но не обязательно, и замещен 1-2 заместителями, выбранными из Н, линейного или разветвленного С1-С3 алкила, галогена, амино, гидрокси, гидроксиметила, С1-С4 алкокси карбонила, но не обязательно;
R3 выбран из NR14R15 или  , где R14 и R15 одинаковые или различные, и каждый из R14 и R15 независимо представляет собой Н, линейный С1-С3 алкил, С1-С3 алкиламино, С5-С7 арил Ar;
, где R14 и R15 одинаковые или различные, и каждый из R14 и R15 независимо представляет собой Н, линейный С1-С3 алкил, С1-С3 алкиламино, С5-С7 арил Ar;
 представляет собой 3-7-членную азотсодержащую гетероциклическую группу, и указанная гетероциклическая группа дополнительно содержит 1-4 гетероатома, выбранных из N, и замещена 1-3 заместителями, выбранными из Н, линейного или разветвленного С1-С6 алкила, амино, карбоксилатной группы;
представляет собой 3-7-членную азотсодержащую гетероциклическую группу, и указанная гетероциклическая группа дополнительно содержит 1-4 гетероатома, выбранных из N, и замещена 1-3 заместителями, выбранными из Н, линейного или разветвленного С1-С6 алкила, амино, карбоксилатной группы;
R4 и R5 являются одинаковыми или различными, и каждый из R4 и R5 независимо представляет собой Н, галоген, линейный или разветвленный С1-С6 алкил, циано, гидрокси, карбоксил, С1-С4 алкокси;
галоген представляет собой фтор-, хлор-, бром- или йод-.
4. Соединение тиено[3,2-d]пиримидин-4-он, энантиомер, диастереоизомер, рацемат и их смеси, и его фармацевтически приемлемая соль по п. 3, где в общей формуле I:
R3 представляет собой NR10(CH2)kNH2, NR10(CH2)kOH;
где k представляет собой целое число от 0 до 4;
n, R1, R2, R4-R12 и R14-R15 определены по п. 3.
5. Соединение тиено[3,2-d]пиримидин-4-он, энантиомер, диастереоизомер, рацемат и их смеси, и его фармацевтически приемлемая соль по п. 3, где в общей формуле I:
R3 является  ;
;
где  представляет собой азиридинил, азациклобутил, пиперидил, азациклогептил, морфолинил, пиперазинил, гомопиперазинил, тиоморфолинил, тиоморфолинил с S в цикле, замещенным сульфоксидом или сульфоном, и замещен 1-3 заместителями, выбранными из Н, линейного С1-С3 алкила, амино, карбоксилатной группы;
представляет собой азиридинил, азациклобутил, пиперидил, азациклогептил, морфолинил, пиперазинил, гомопиперазинил, тиоморфолинил, тиоморфолинил с S в цикле, замещенным сульфоксидом или сульфоном, и замещен 1-3 заместителями, выбранными из Н, линейного С1-С3 алкила, амино, карбоксилатной группы;
n, R1, R2, R4-R12 и R14-R15 определены по п. 3.
6. Соединение тиено[3,2-d]пиримидин-4-он, энантиомер, диастереоизомер, рацемат и их смеси, и его фармацевтически приемлемая соль по п. 5, где в общей формуле I:
R3 представляет собой  и замещен 1-3 заместителями, выбранными из Н, амино, карбоксилатной группы;
и замещен 1-3 заместителями, выбранными из Н, амино, карбоксилатной группы;
n, R1, R2,  , R4-R12 и R14-R15 определены по п. 5.
, R4-R12 и R14-R15 определены по п. 5.
7. Соединение тиено[3,2-d]пиримидин-4-он, энантиомер, диастереоизомер, рацемат и их смеси, и его фармацевтически приемлемая соль по п. 3, где в общей формуле I:
n=1,
R1 и R2 являются одинаковыми или различными и одновременно не являются водородом, каждый из R1 и R2 независимо представляет собой Н, галоген, CBr2H, CCl2H, CF2H, циано, CF3, (CH2)mOR6, (CH2)mNR6R7, 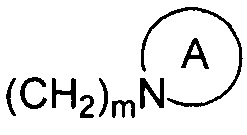 , (СН2)mCOOR8, CONR9R10 или
, (СН2)mCOOR8, CONR9R10 или  , где
, где
m представляет собой целое число от 0 до 3;
R6 и R7 являются одинаковыми или различными, и каждый из R6 и R7 независимо выбран из Н, линейного или разветвленного С1-С3 алкила, С3-С5 циклоалкила, 4-6-членной гетероциклической группы, С1-С3 алкилоила RCO, С5-С7 ароила ArCO, бензила и С5-С7 арила Ar; линейный или разветвленный С1-С3 алкил замещен одним или несколькими заместителями, выбранными из метилсульфонила, С1-С3 алкокси, но не обязательно; гетероциклическая группа содержит один гетероатом О;
R8 выбран из Н и линейного или разветвленного С1-С3 алкила;
R9 и R10 являются одинаковыми или различными, каждый из которых независимо выбран из Н, 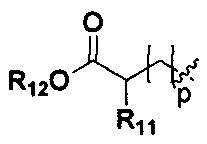 , линейного или разветвленного С1-С5 алкила, С3-С6 циклоалкила, 4-6-членной гетероциклической группы, С5-С7 ароилметилена, 5-7-членного гетероароилметилена, бензила, пиридиндиметилена, С5-С7 арила Ar; причем линейный или разветвленный С1-С3 алкил замещен одним или несколькими заместителями, выбранными из метилсульфонила, циклопропила, гидрокси, С1-С3 алкокси, но не обязательно; гетероциклическая группа содержит 1-2 гетероатома О; арил или бензил может быть замещен одним или несколькими заместителями, выбранными из галогена, гетероарил содержит 1-2 гетероатома N;
, линейного или разветвленного С1-С5 алкила, С3-С6 циклоалкила, 4-6-членной гетероциклической группы, С5-С7 ароилметилена, 5-7-членного гетероароилметилена, бензила, пиридиндиметилена, С5-С7 арила Ar; причем линейный или разветвленный С1-С3 алкил замещен одним или несколькими заместителями, выбранными из метилсульфонила, циклопропила, гидрокси, С1-С3 алкокси, но не обязательно; гетероциклическая группа содержит 1-2 гетероатома О; арил или бензил может быть замещен одним или несколькими заместителями, выбранными из галогена, гетероарил содержит 1-2 гетероатома N;
р является целым числом от 0 до 2;
R11 и R12 являются одинаковыми или различными, и каждый из R11 и R12 независимо выбран из Н, линейного или разветвленного С1-С3 алкила, фенила или бензила; фенил или бензил замещен одним или несколькими заместителями, выбранными из галогена и гидроксила, но не обязательно;
 представляет собой азиридинил, азациклобутил, пирролидинил, пиперидил, азациклогептил, морфолинил, пиперазинил, гомопиперазинил, тиоморфолинил, тиоморфолинил с S в цикле, замещенным сульфоксидом или сульфоном, имидазолидинилом, пиразинилом, гексагидропиримидинилом или
представляет собой азиридинил, азациклобутил, пирролидинил, пиперидил, азациклогептил, морфолинил, пиперазинил, гомопиперазинил, тиоморфолинил, тиоморфолинил с S в цикле, замещенным сульфоксидом или сульфоном, имидазолидинилом, пиразинилом, гексагидропиримидинилом или 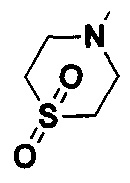 , и 1-2 заместителями, выбранными из Н, линейного или разветвленного С1-С3 алкила, галогена, гидрокси и С1-С4 алкоксикарбонила, но не обязательно;
, и 1-2 заместителями, выбранными из Н, линейного или разветвленного С1-С3 алкила, галогена, гидрокси и С1-С4 алкоксикарбонила, но не обязательно;
R4 и R5 являются одинаковыми или различными, и каждый из R4 и R5 независимо представляет собой Н, галоген, метил, этил, циано, гидрокси, карбоксил, метоксил или этоксил;
галоген представляет собой фтор-, хлор-, бром- или йод-;
R3 определен по п. 4 или 5.
8. Соединение тиено[3,2-d]пиримидин-4-он, энантиомер, диастереоизомер, рацемат и их смеси, и его фармацевтически приемлемая соль по п. 7, где в общей формуле I:
n=1,
R1 и R2 являются одинаковыми или различными и одновременно не являются водородом, каждый из которых независимо представляет собой Н, галоген, (СН2)mCOOR8, CONR9R10 или  , где
, где
m представляет собой целое число от 0 до 3;
R8 выбран из Н или линейного или разветвленного С1-С3 алкила;
R9 и R10 являются одинаковыми или различными, каждый из которых независимо выбран из Н, линейного или разветвленного С1-С3 алкила, С3-С6 циклоалкила, С4-С6 гетероциклической группы, фенила; причем линейный или разветвленный С1-С3 алкил замещен С1-С3 алкоксикарбонилом, но не обязательно; гетероциклическая группа содержит один гетероатом О; гетероарил содержит один гетероатом N;
 представляет собой пирролидинил, пиперидил, морфолинил, пиперазинил, гомопиперазинил или тиоморфолинил и замещен 1-2 заместителями, выбранными из Н, линейного или разветвленного С1-С3 алкила, галогена, гидрокси и С1-С4 алкоксикарбонила, но не обязательно;
представляет собой пирролидинил, пиперидил, морфолинил, пиперазинил, гомопиперазинил или тиоморфолинил и замещен 1-2 заместителями, выбранными из Н, линейного или разветвленного С1-С3 алкила, галогена, гидрокси и С1-С4 алкоксикарбонила, но не обязательно;
R3 представляет собой пирролидинил, пиперидил, морфолинил, пиперазинил, гомопиперазинил или тиоморфолинил и замещен циано, амино или гидроксилом;
R4 и R5 являются одинаковыми или различными, и каждый из R4 и R5 независимо представляет собой Н, фтор-, хлор-, бром-, метил, этил, циано или гидроксил.
9. Соединение тиено[3,2-d]пиримидин-4-он, энантиомер, диастереоизомер, рацемат и их смеси, и его фармацевтически приемлемая соль по п. 8, где в общей формуле I:
R1 и R2 являются одинаковыми или различными и одновременно не являются водородом, каждый из которых независимо представляет собой Н, галоген, (CH2)mCOOR8, CONR9R10 или  , где
, где
m представляет собой 0;
R8 выбран из Н или линейного или разветвленного С1-С3 алкила;
R9 и R10 являются одинаковыми или различными, каждый из которых независимо выбран из Н, линейного или разветвленного С1-С3 алкила, циклопропила, тетрагидропиран-4-ила или пиридинила; причем линейный или разветвленный С1-С3 алкил замещен С1-С3 алкоксикарбонилом, но не обязательно;
 представляет собой пиперидил и замещен 1-2 заместителями, выбранными из Н, линейного или разветвленного С1-С3 алкила, галогена, гидрокси и С1-С4 алкоксикарбонила, но не обязательно;
представляет собой пиперидил и замещен 1-2 заместителями, выбранными из Н, линейного или разветвленного С1-С3 алкила, галогена, гидрокси и С1-С4 алкоксикарбонила, но не обязательно;
R3 представляет собой пирролидинил, пиперидил, морфолинил или пиперазинил и замещен циано, амино или гидроксилом;
R4 и R5 являются одинаковыми или различными, и каждый из R4 и R5 независимо представляет собой Н, фтор-, хлор-, бром-, метил, этил, циано или гидроксил.
10. Соединение тиено[3,2-d]пиримидин-4-он, энантиомер, диастереоизомер, рацемат и их смеси, и его фармацевтически приемлемая соль по п. 1, где в общей формуле I:
R1 или R2 представляет собой (СН2)mOR6, (CH2)mNR6R7, 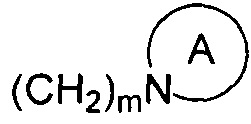 , (CH2)mCOOR8, CONR9R10 или
, (CH2)mCOOR8, CONR9R10 или  .
.
11. Соединение тиено[3,2-d]пиримидин-4-он общей структурной формулы I, энантиомер, диастереоизомер, рацемат и их смеси, и его фармацевтически приемлемая соль по п. 1, где соединение тиено[3,2-d]пиримидин-4-он является одним из следующих соединений:
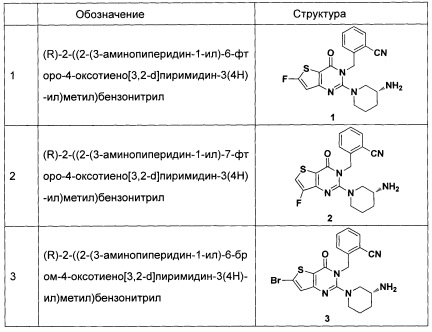
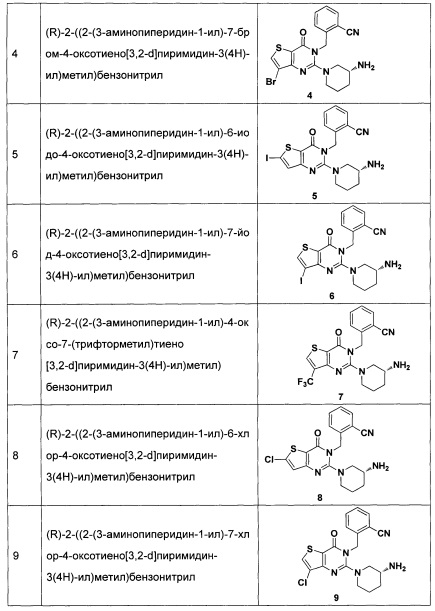
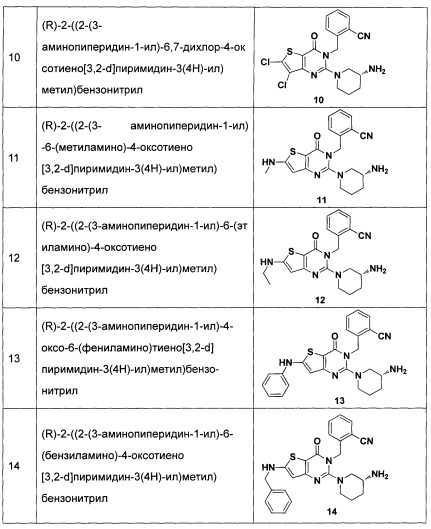
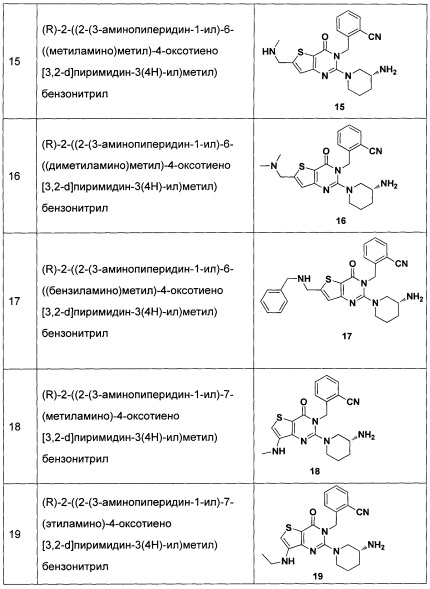
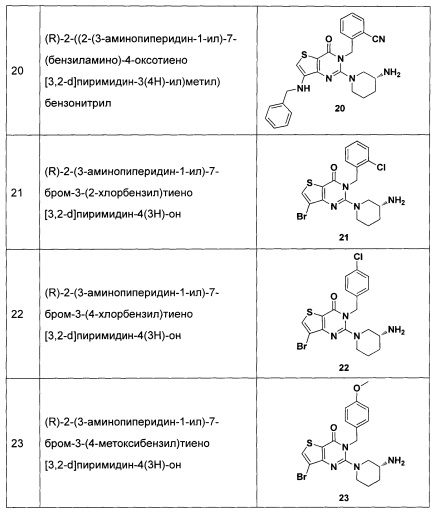
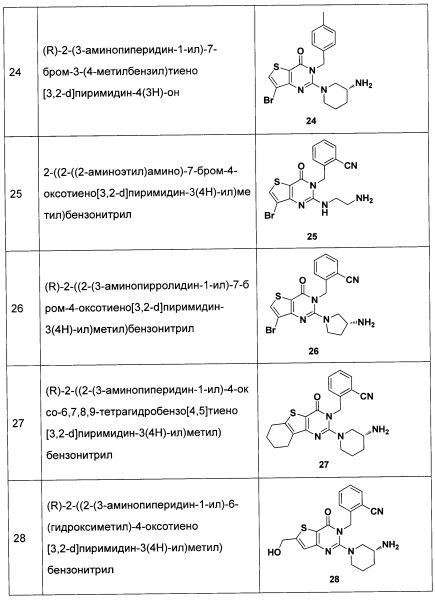
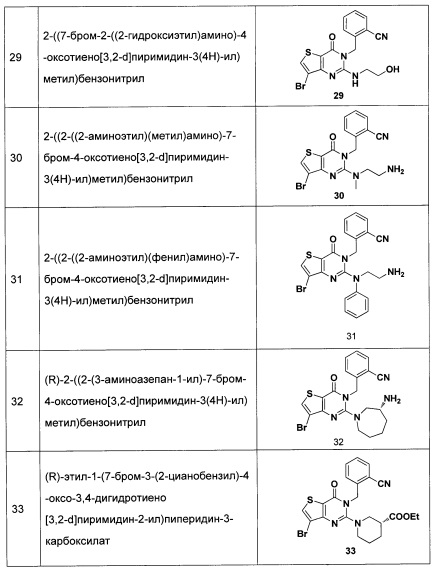
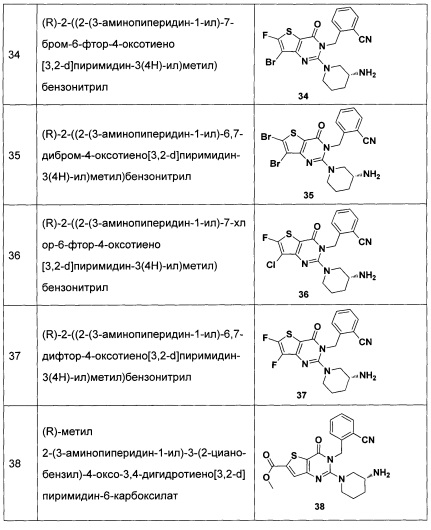
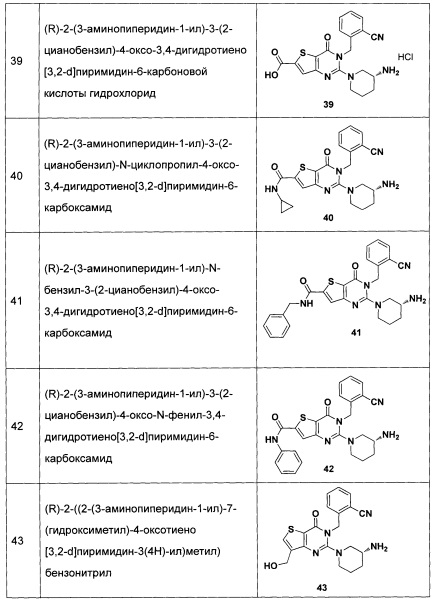
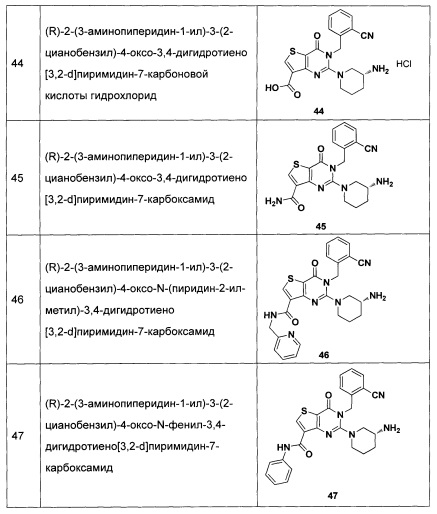
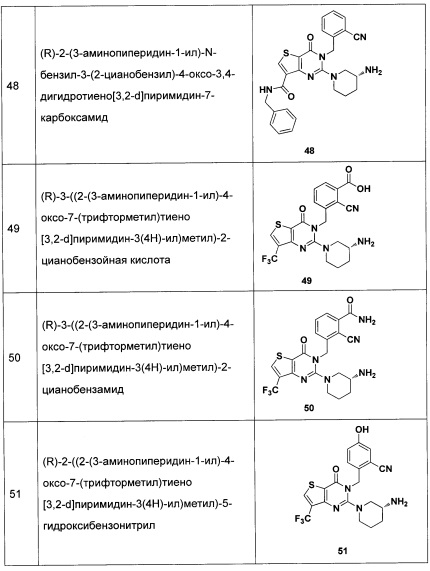
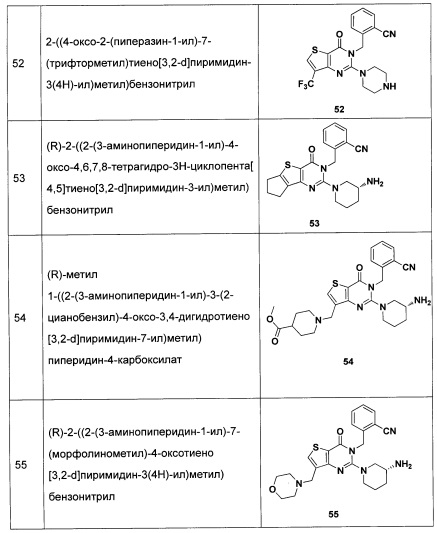
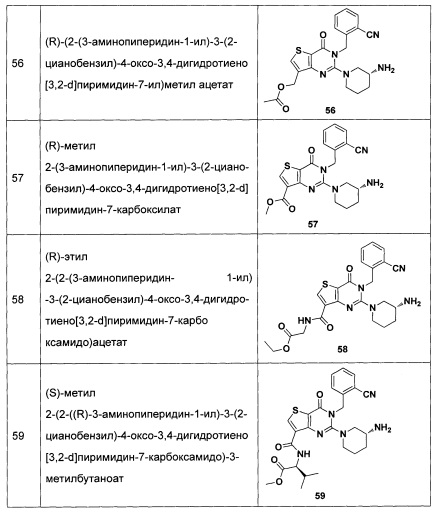
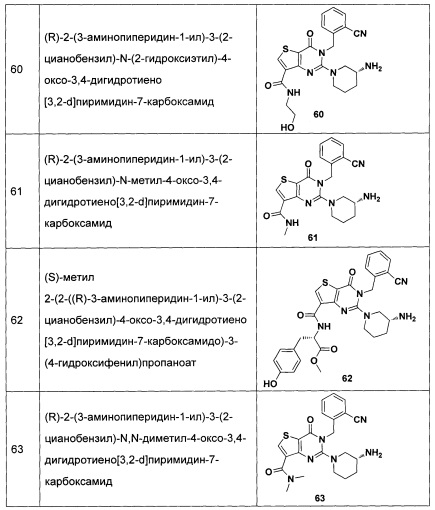
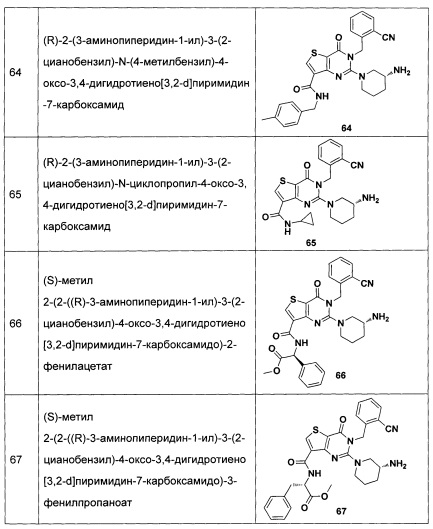
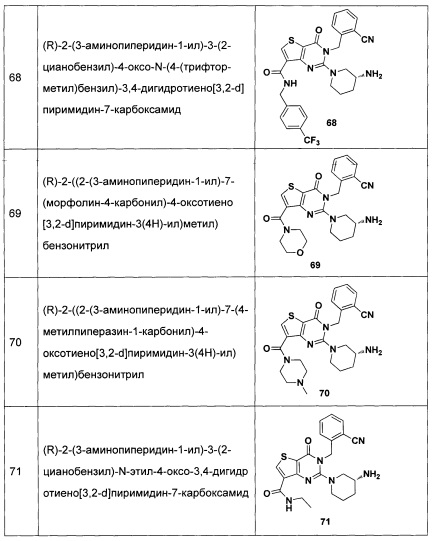
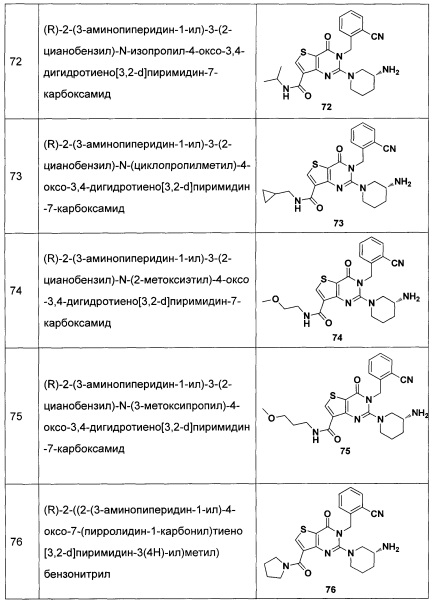
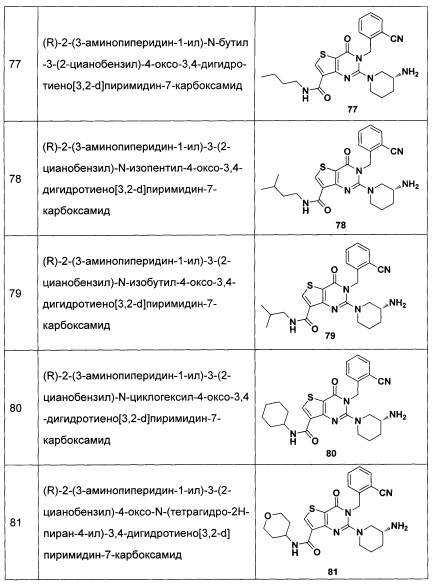
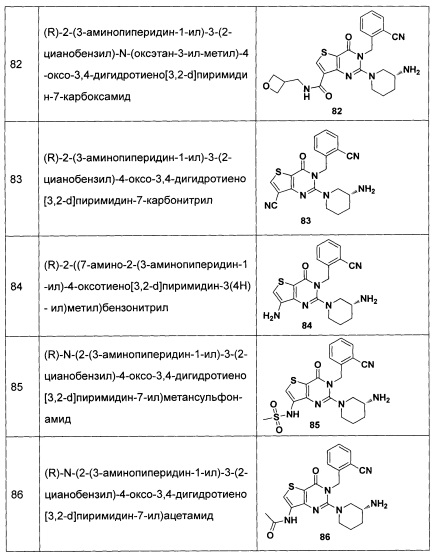
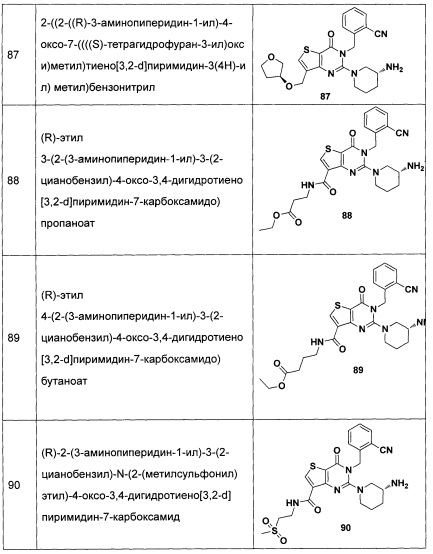
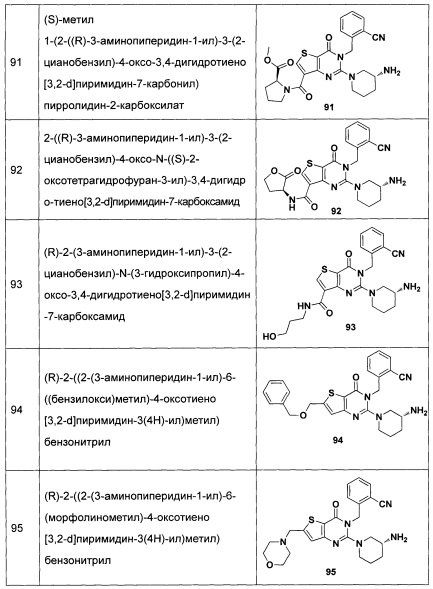
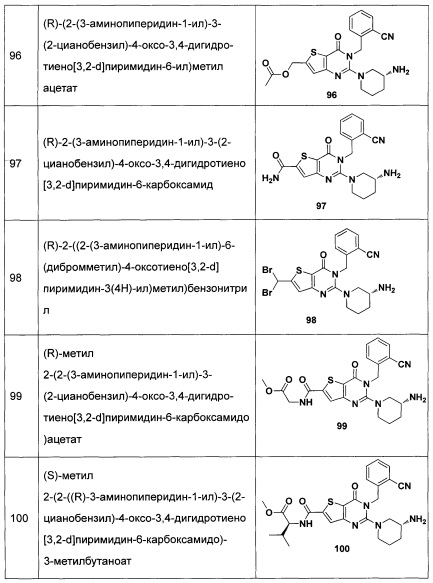
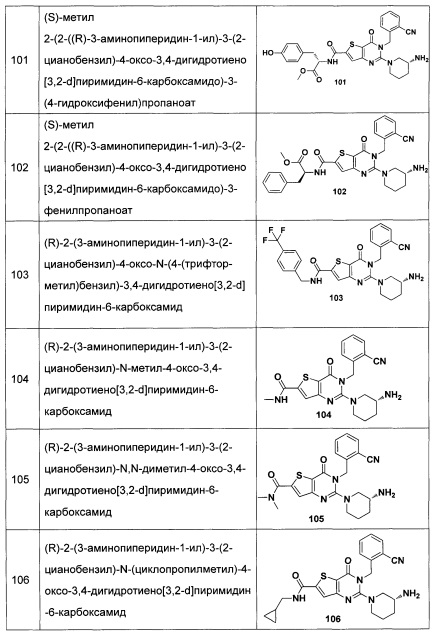
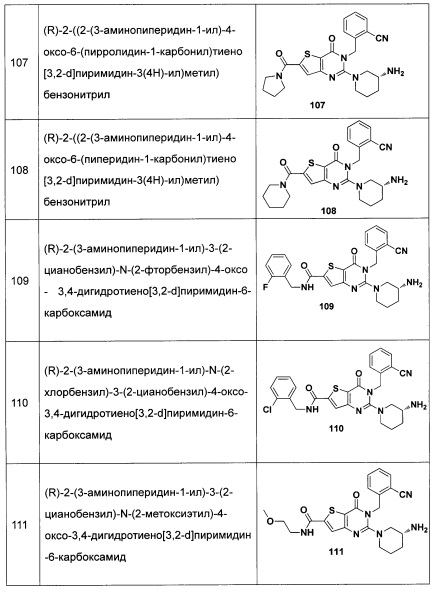
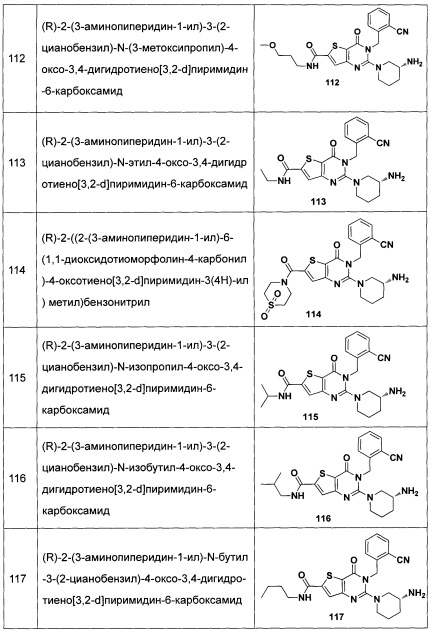
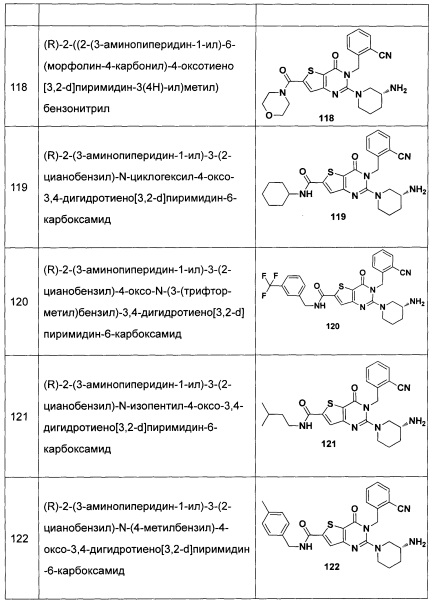
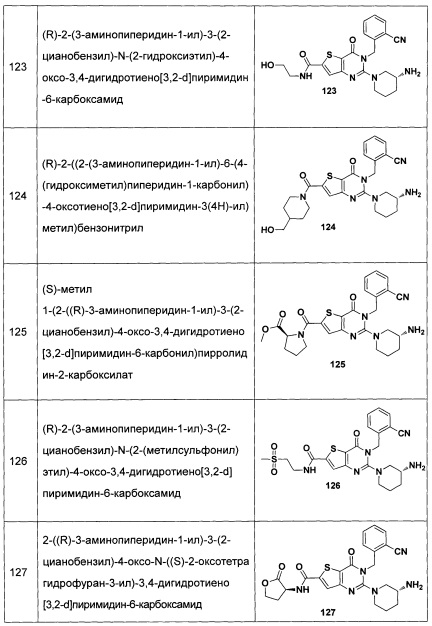
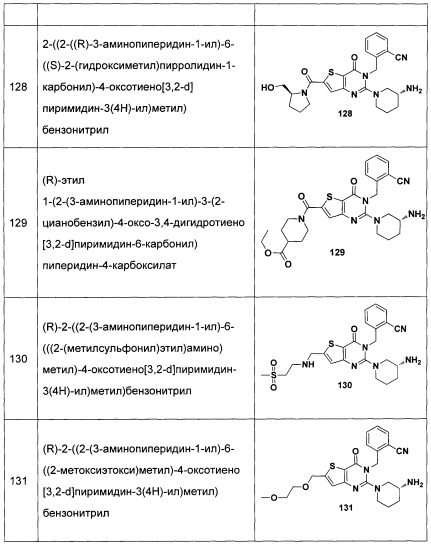
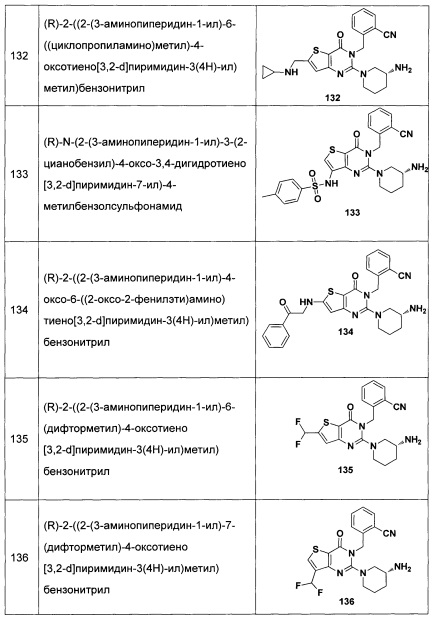
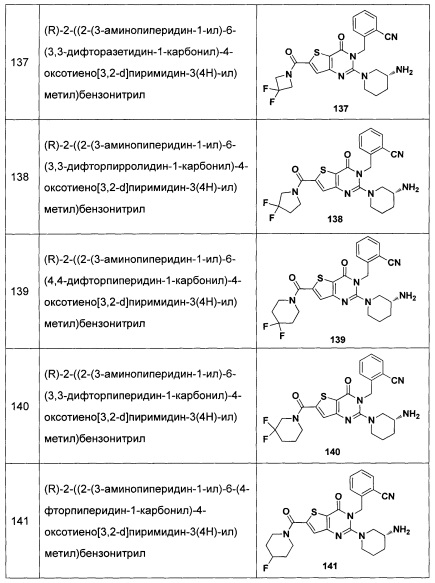
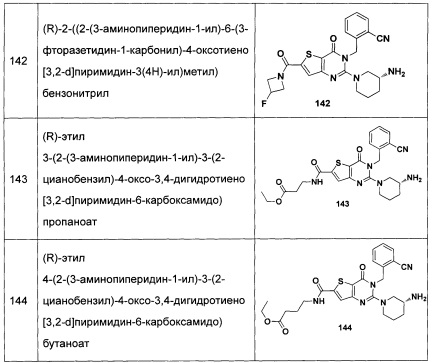
12. Соединение тиено[3,2-d]пиримидин-4-он общей структурной формулы I, его энантиомер, и его фармацевтически приемлемая соль по п. 1, где соединение тиено[3,2-d]пиримидин-4-он представляет собой одно из следующих соединений:
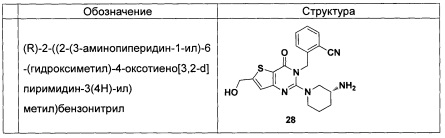
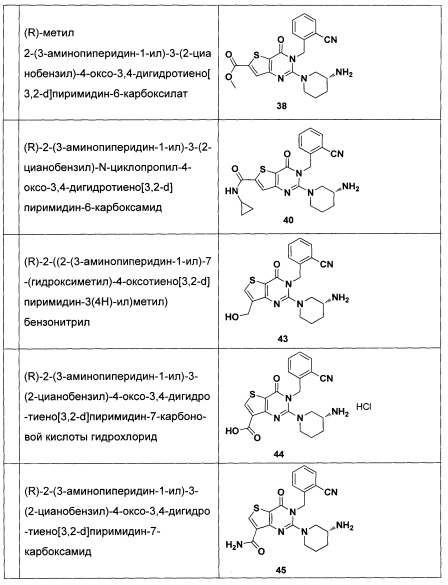
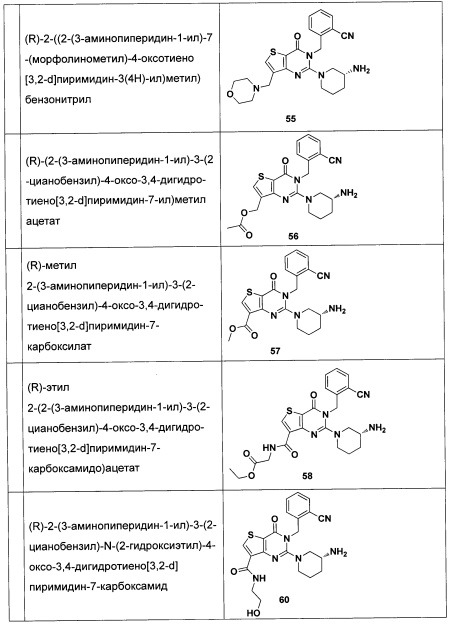
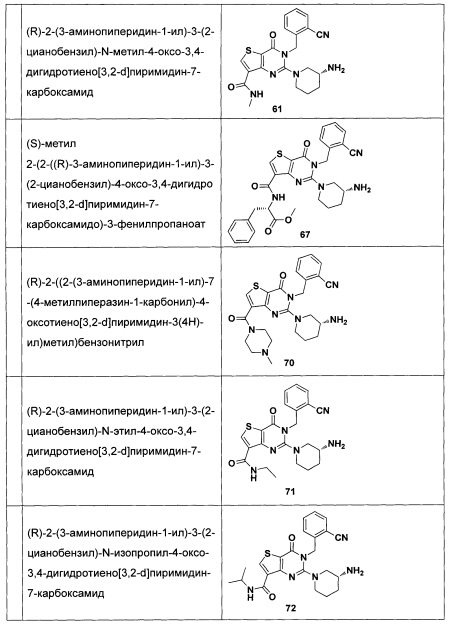
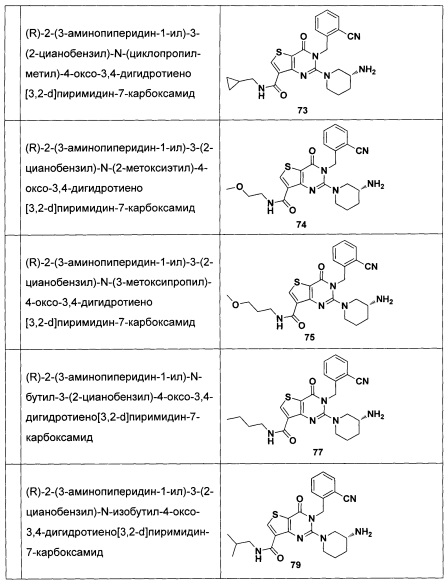
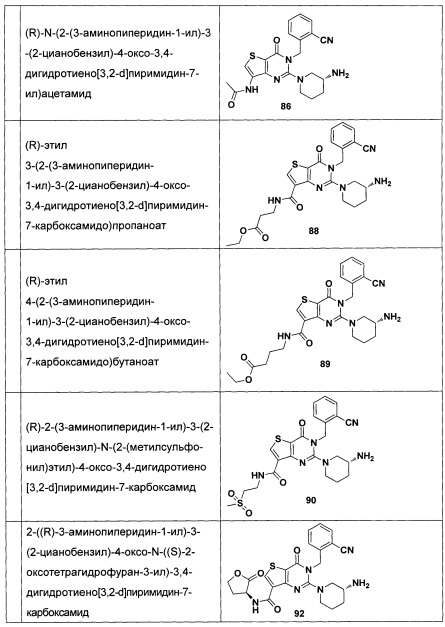
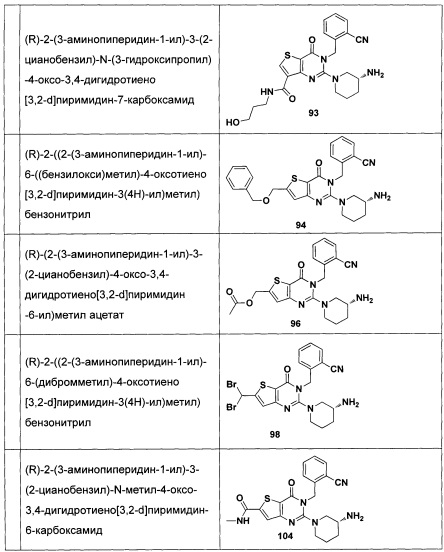
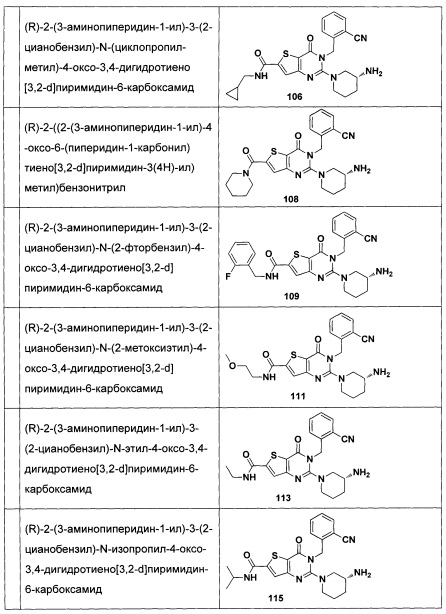
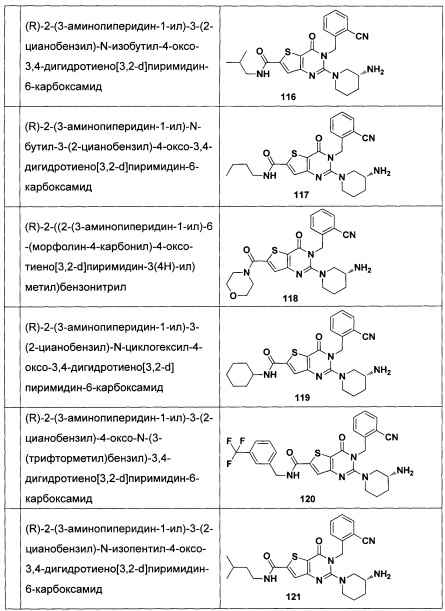
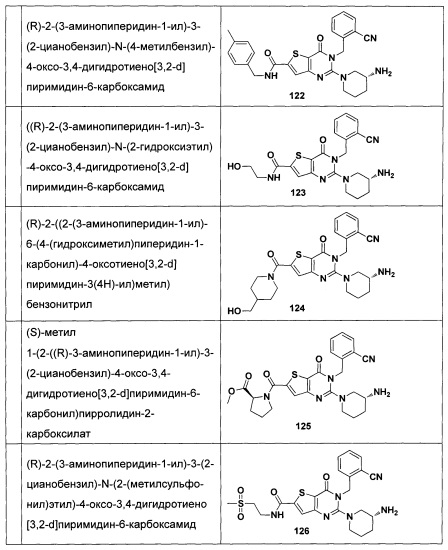
13. Фармацевтическая композиция для лечения диабета, содержащая терапевтически эффективное количество одного или более соединений тиенил[3,2-d]пиримидин-4-он, энантиомеров, диастереоизомеров, рацематов и их смесей, или его фармацевтически приемлемые соли по п. 1 в качестве эффективных ингредиентов и дополнительно включающая фармацевтически приемлемые носители.
14. Применение соединения тиенил[3,2-d]пиримидин-4-он, энантиомера, диастереоизомера, рацемата и их смесей, и его фармацевтически приемлемой соли по п. 1 при получении ингибитора DPPIV.
15. Применение соединения тиенил[3,2-d]пиримидин-4-он, энантиомера, диастереоизомера, рацемата и их смесей, и его фармацевтически приемлемой соли по п. 1 при получении лекарственного средства для лечения диабета, предпочтительно указанный диабет является диабетом 2 типа.
| Deng J et al, The highly potent and selective dipeptidyl peptidase IV inhibitors bearing a thienopyrimidine scaffold effectively treat type 2 diabetes, EUROPEAN JOURNAL OF MEDICINAL CHEMISTRY, Vol:46, Nr:1, стр.:71 - 76, 26.10.2010 | |||
| CN101817833 A, 01.09.2010 | |||
| EA 200801165 A1, 30.10.2008 | |||
| WO2004087053 A2, 14.10.2004. |
Авторы
Даты
2017-06-30—Публикация
2012-10-23—Подача