Область техники
Изобретение относится к физиологии растений и сельскому хозяйству и может быть использовано при скрининге растений винограда по признаку морозостойкости, оценке новых гибридных форм в селекции, при интродукции, сортоизучении и сортоиспытании, а также в агротехнической практике для оценки степени повреждения частей растений низкотемпературным стрессом.
Уровень техники
Разработка надежного и недорого стоящего способа быстрой оценки степени повреждения низкотемпературным стрессом растений, а также выявление морозостойких растений на ранней стадии в селекционной практике является насущной необходимостью. Большинство имеющихся методов оценки морозостойкости применимы лишь для анализа однолетних растений (например, способ отбора генетически обусловленных морозостойких форм озимых зерновых культур (заявка N 4787543/13; способ оценки морозостойкости озимой пшеницы патент РФ №2198504) [1].
В отличие от однолетних растений многолетние растения подвержены температурным флуктуациям всех сезонов года, а значит, они должны быть приспособлены к более широкому диапазону температур внешней среды. Известен способ определения морозостойкости сортов яблони АС СССР №1620061 [2]. Способ включает сбор лозы, промораживание при критической температуре, отращивание и последующую глазомерную оценку повреждений по величине некротированной ткани. Известен патент РФ№2 448 456 [3], в котором описан способ, включающий определение состояния глазков у однолетних побегов винограда. Определяют объем глазков у сортов-эталонов винограда и у соответствующего исследуемого сорта винограда, который определяют по формуле V=1/3πr2h, где r равен  диаметра основания глазка; h - высота глазка. Затем сравнивают объемы между собой, если объем глазков исследуемого сорта винограда меньше объема глазков сорта-эталона, то сорт относят к морозоустойчивому. К недостатку приведенных способов относится влияние субъективной глазомерной оценки параметров устойчивости на точность результата.
диаметра основания глазка; h - высота глазка. Затем сравнивают объемы между собой, если объем глазков исследуемого сорта винограда меньше объема глазков сорта-эталона, то сорт относят к морозоустойчивому. К недостатку приведенных способов относится влияние субъективной глазомерной оценки параметров устойчивости на точность результата.
Известны способы оценки морозоустойчивости плодовых культур, в которых используют методы оценки, основанные на измерении биохимических параметров в растительных тканях: по определению содержания спирторастворимой фракции белков - проламинов (патент 1323028), антоцианов - цианидов в коре однолетних побегов (патент 1042672), по транскрипционной активности генов разных форм дегидринов (US 20150376720, WO 2006085769), по количеству «холодного» белка с помощью иммунохимического анализа (US 5686249 А). Известен метод (патент РФ №2056737) [4], в котором диагностику морозоустойчивости плодовых культур проводят путем определения в растительной ткани, в качестве которой используют почки однолетних растений в период относительного покоя, содержания фруктозы до и после промораживания в морозильной камере до критических температур, и по отношению содержания фруктозы после промораживания к этому показателю до промораживания судят о морозоустойчивости, при этом к морозоустойчивым относят сорта, имеющие соотношение, не превышающее 1,35. Все эти методы основаны на проведении дорогостоящих биохимических анализов, требуют привлечения высококвалифицированного персонала, что делает невозможным их широкое практическое применение. До настоящего времени существует необходимость разработки дешевого метода, которым легко может овладеть человек, не имеющий специальной подготовки.
Наиболее близким аналогом предлагаемого технического решения является изобретение (патент РФ №2 514 400) [5], в котором морозоустойчивость плодовых растений оценивают способом, включающим промораживание однолетних побегов в период покоя в камере искусственного климата. При этом оценку поврежденных побегов производят не визуально, а по величине максимального квантового выхода фотохимических реакций фотосистемы 2 и относительной скорости транспорта электронов фотосистемой 2 в тканях камбия и почек, которые определяют ПАМ (пульс-амплитудной модуляции)-флуориметром. Регистрируют минимальный уровень флуоресценции и изменения этого показателя под действием актиничного света плотностью 190 μmol/(m2s) и после воздействия на объект импульса света высокой интенсивности (10000 μmol/(m2s), 450 нм). Однако этот способ обладает существенным недостатком. Использование тканей камбия для анализа фотохимической активности является технически сложной задачей, так как камбий представляет собой один слой меристематических клеток, расположенный между древесиной и лубом, который очень трудно или невозможно идентифицировать невооруженным глазом. Более того, клетки камбия, как и другие меристематические клетки, содержат не хлоропласты, а предшественники хлоропластов - пропластиды [6], что ставит под сомнение возможность анализа фотохимической активности в тканях камбия.
Измерение параметров флуоресценции хлорофилла для оценки состояния растения находит широкое применение в связи с дешевизной, простотой и надежностью метода, однако объектом измерения в подавляющем большинстве случаев являются фрагменты листьев растений. Известны технические решения для измерения уровня хлорофилла в лабораторных условиях с помощью флуориметров (патент США № US 5426306, патент США № US6624887, патент США № US 9377404) [7-10]. В патенте РФ №2199730 [11], приведена схема флуориметра и его применение для контроля листовых пластин растений и последующей подкормки растений в теплицах и на открытом грунте с учетом данных измерений параметров фотосинтеза при установке флуориметра на трактор. При этом дополнительно определяют заражение растений фитопатогенными грибами, например, мучнистой росой.
Для решения задачи измерения параметров флуоресценции в полевых условиях используются переносные устройства. Известны патенты США № US 7112806, № US 8249308 [12], в которых описываются портативные приборы для измерения флуоресценции листовых поверхностей растений, в том числе и на растущих объектах. В патенте США № US 8249308 портативный флуориметр имеет массив светодиодов со спектральным диапазоном 400-600 нм, цифровое устройство формирования изображения, запоминающее устройство для хранения библиотеки флуоресцентных изображений, с помощью которых можно определить состояние листовой пластины.
Известны переносные приборы для измерения содержания хлорофилла в листовых пластинах. Например, прибор РХ-144 измеряет флуоресценцию хлорофилла на рабочей площади 10 мм2, имеет две волны измерения, полупроводниковый фотодиод и работает на двух батареях, запоминая данные до 30 измерений [13]. Последние переносные модели ССМ-300 имеют цветной дисплей, большой объем памяти до 2 Гбайт, высокую точность измерения [14].
Одна из задач, на решение которой направлено изобретение, заключаются в создании нового способа определения морозостойкости растений винограда для ускоренного отбора морозостойких сортов, гибридов, мутантов, спонтанных клонов и для определения степени повреждения растений или их частей.
Другой задачей является повышение точности, доступности, ускорения и упрощения процесса при определении морозостойкости растений и определения степени повреждения растений или их частей непосредственно на плантации в полевых условиях.
В соответствии с предлагаемым способом высокочувствительный метод измерения индуцируемой флуоресценции хлорофилла может быть использован для оценки морозостойкости древесных растений, в том числе древесной лианы-винограда, на всех стадиях развития растений, во все сезоны, включая безлиственные периоды. Поставленные задачи решены следующим образом.
Сущность изобретения
Одним из аспектов изобретения является способ оценки и отбора морозостойких растений, в соответствии с которым, измеряют величину фотосинтетических параметров растений, при этом оценку морозостойкости растения определяют по величине кортикулярного фотосинтеза в выбранных участках хлоренхимного слоя, расположенного под внешней корой растения. Для этого предварительно удаляют участок наружной коры и фиксируют флуоресценцию хлорофилла с обнаженных хлоренхимных тканей. Данные флуоресценции обрабатывают, идентифицируют и сравнивают с данными фотохимической активности хлоренхимных тканей известных морозостойких растений
Другим аспектом изобретения является более качественная оценка поврежденных одресневевших вегетативных органов плодовых растений и винограда для их обрезки и более эффективный отбор черенков для прививки, за счет определения величин индуцируемой флуоресценции хлорофилла в хлоренхимных тканях растения. При этом измерение фотосинтеза проводят на участках растения входящих в группу, состоящую из штамба, рукавов, однолетней лозы или черенков.
Другой аспект изобретения связан с тем, что оценку величины кортикулярного фотосинтеза осуществляют по значению переменной флуоресценции хлорофилла. При этом производят измерения в диапазоне от 350 нм до 730 нм и с интенсивностью до 4000 мкмоль⋅м-2⋅с-1, без использования вспышек насыщающего света или с использованием вспышек насыщающего света интенсивностью до 200000 мкмоль⋅м-2⋅с-1.
Таким образом, предлагается использование действующего и насыщающего света в широком диапазоне интенсивности и длительности вспышек, что сделает возможным применение данного способа на растениях с разной активностью фотохимических процессов в хлоренхимных тканях одревесневших органов. В соответствии с предлагаемым способом измерение переменной флуоресценции хлорофилла можно проводить в широком диапазоне температур, во все сезоны, как в лабораторных условиях, так и в полевых условиях, что обусловлено тем, что первичные фотофизические и фотохимические процессы, связанные с поглощением и трансформацией энергии, осуществляемые ФС2 и ФС1, не зависят от температуры. При измерении флуоресценции в полевых условиях используют измерительную головку флуориметра, выполненную с возможностью ее закрепления на стволе, лозе или ветке растения, высаженного на плантации. При этом излучение от источника света флуориметра и измерение сигнала флуоресценции передают к флуориметру через световоды, закрепленные в измерительной головке.
Следующий аспект изобретения связан с созданием пополняемых баз данных значений фотосинтетической активности в хлоренхимных тканях для сравнения полученных значений флуоресценции хлорофилла в хлоренхимных тканях со значениями, полученными при анализе известных устойчивых к низким температурам сортов (сортов эталонов), растущих на той же плантации.
Для более эффективной идентификации элитных растений на плантации на них закрепляют этикетку с кодом идентификации для последующего считывания и осуществления сравнения данных. На этикетке данные формируют в стандарте штрихкода или двумерного или расширенного штрихкода, которые автоматически считывают при идентификации данных о растении в базе данных при следующих измерениях величин кортикулярного фотосинтеза. Считывание данных кода осуществляют устройством для считывания, подключенного к компьютеру, или смартфону.
Следующим аспектом изобретения является возможность использования измерений индуцируемой флуоресценции хлорофилла для прогнозирования морозостойкости растений до низкотемпературной обработки, ввиду существующей корреляцией между морозостойкостью растений и параметрами кортикулярного фотосинтеза как до, так и после промораживания.
Перечень чертежей
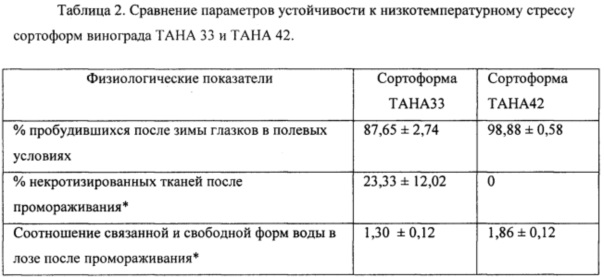
Фиг. 1 Сравнение значений максимального квантового выхода в хлоренхимных тканях кортекса в однолетних лозах: с низкой мороустойчивостью (сортоформа винограда ТАНА 33) и высокой морозоустойчивостью (сортоформа винограда ТАНА 42) до и после обработки низкими температурами.
Описание изобретения
Виноград - культура умеренного и теплого климата. Юг России - зона промышленного виноградарства, где нередки стрессовые для культуры понижения температуры. Оценку морозостойкости сортов, гибридов, саженцев желательно проводить на ранних этапах развития растений в целях сокращения материальных расходов и времени, затрачиваемых на выращивание растений для создания новых сортов в селекционной практике. Формирование органов и накопление биомассы на ранних стадиях развития древесных растений происходит медленнее по сравнению с однолетними растениями, поэтому существует проблема получения достаточного количества биологического материала для проведения анализов.
Важной задачей остается выявление поврежденных частей растений. Отдельные части растения повреждаются в разной степени в результате воздействия неблагоприятных температур. Почки и проводящие ткани, расположенные под внешней корой однолетних побегов, наиболее чувствительны к действию низких отрицательных температур. Оценка морозостойкости растений винограда на ранних этапах роста и развития и раннее выявление поврежденных низкотемпературным стрессом тканей - задачи особенно актуальные в виноградарстве. В настоящее время в сельскохозяйственной практике для определения степени повреждения собирают 20-30 однолетних вызревших побегов, которые выдерживают при температуре не меньше 10-12°С в течение 2-3 дней, затем после обследования через лупу оценивают состояние каждого глазка и тканей побега. На основании анализа данных таких зрительных обследований разрабатываются рекомендации по обрезке побегов и восстановлению поврежденных морозами кустов.
Анализ известных технических решений показал, что измерение фотохимической активности тканей является наиболее точным подходом при определении морозоустойчивости растений. Измерения флуоресценции хлорофилла листьев широко используются для определения физиологического состояния растений и оценки уровня стресса. Однако, при работе с древесными культурами, в частности с древесной лианой виноградом, часто возникает необходимость оценки морозостойкости в безлиственный период. Анализ растений в зимний период, особенно после заморозков, дает наиболее точную информацию о реакции растений на низкотемпературный стресс, а оценку жизнеспособности зимующих органов растений (в частности винограда) для обрезки важно провести до распускания почек.
В процессе исследований было обнаружено, что измерение флуоресценции хлорофилла для определения степени морозоустойчивости растения более эффективно проводить в хлоренхимных тканях, расположенных под внешней корой одревесневших органов многолетних растений. Такие измерения можно проводить во все сезоны года, включая безлиственные периоды в широком диапазоне температур.
Перед измерением предлагается удалять внешнюю кору растения с небольшого участка поверхности, что можно легко сделать с помощью скальпеля или ножа. Измерение флуоресценции хлорофилла непосредственно с обнаженной поверхности хлоренхимных тканей позволяет значительно увеличить чувствительность и точность анализа. Площадь удаленной поверхности коры может варьировать в значительных пределах, так как величина площади анализируемой поверхности не влияет на вычисляемые величины квантового выхода, представляющие собой отношения интенсивностей двух величин флуоресценции. При этом удаление участка коры не приводит к снижению жизнеспособности растения. При длительных измерениях для предотвращения высыхания необходимо покрывать участок с удаленной корой прозрачной пленкой. Для измерения максимального квантового выхода в полевых условиях анализируемый участок предлагается накрывать светонепроницаемой фольгой и выдерживать в темноте не менее 15 минут, предпочтительно на 20-30 минут и только после этого регистрировать индуцируемую флуоресценцию хлорофилла. В соответствии с предлагаемым способом для анализа могут быть использованы не только однолетние лозы, но и любые одревесневшие органы, содержащие хлоренхимные ткани под внешней корой, например. Измерения переменной флуоресценции хлорофилла можно проводить в широком диапазоне температур, во все сезоны, как в лабораторных, так и в полевых условиях, что обусловлено тем, что первичные фотофизические и фотохимические процессы, связанные с поглощением и трансформацией энергии, осуществляемые ФС2 и ФС1, мало зависят от температуры.
Оценку величины кортикулярного фотосинтеза осуществляют по значению переменной флуоресценции хлорофилла, при этом производят измерения в диапазоне от 350 нм до 700 нм и с интенсивностью до 4000 мкмоль⋅м-2⋅с-1, без использования вспышек насыщающего света или с использованием вспышек насыщающего света интенсивностью до 200000 мкмоль⋅м-2⋅с-1.
Обнаруженная положительная корреляция между морозостойкостью растений и параметрами фотосинтеза в хлоренхимных тканях под внешней корой как до, так и после промораживания, позволяет расширить применение данного способа для прогнозирования морозостойкости растений не только в весенний период, но также в летний, осенний и зимний периоды. Во всех случаях применения данного метода необходимо проводить сравнение полученных значений флуоресценции хлорофилла в хлоренхимных тканях со значениями, полученными при анализе известных устойчивых и/или чувствительных к низким температурам сортов (сортов-эталонов), растущих на той же плантации в тех же условиях, либо с ранее полученными значениями флуоресценции хлорофилла в хлоренхимных тканях сортов-эталонов предварительно занесенных в созданную базу данных.
Таким образом, сущность предлагаемого способа оценки морозоустойчивости
растений основана на существовании корреляционной зависимости между фотохимической
активностью в хлоренхимном слое одревесневших органов и морозостойкостью растений.
Для осуществления процесса измерения флуоресценции хлорофилла в хлоренхимном слое предварительно удаляют небольшой участок наружной коры растения и фиксируют флуоресценцию хлорофилла с обнаженных хлоренхимных тканей одревесневших вегетативных органов. Измерения могут быть произведены разными способами, включая переносные или лабораторные флуориметры, в том числе ПАМ (пульс-амплитудной модуляции)-флуориметры и сенсоры лазер-индуцированной флуоресценции. Измерения могут быть произведены в лабораторных условиях на собранных образцах черенков или фрагментов растений, а также в полевых условиях на растущих растениях.
Примеры осуществления способа.
Пример 1. Оценка жизнеспособности лозы винограда перед обрезкой.
Жизнеспособные побеги сохраняют фотохимическую активность в хлоренхимном слое внутренней коры, а необратимые повреждения побегов очень быстро приводят к потере фотохимической активности. Во время весенней обрезки растений винограда оценку степени повреждения и жизнеспособности лозы удобно осуществлять, измеряя фотохимическую активность в хлоренхимных тканях под корой лозы. Лоза, хлоренхимные ткани которой показывают низкие значения кортикулярного фотосинтеза, подлежит удалению. Величины пороговых значений, определяющих жизнеспособность лозы, зависят от видовой и сортовой специфичности растений. Для проведения измерений с поверхности лозы очищают слой наружной коры размером от 0.1 до 1 см2 и проводят измерения переменной флуоресценции хлорофилла. Параметры переменной флуоресценции хлорофилла измеряют с помощью ПАМ-флуориметра. Интенсивность действующего света - 190 мкМ м-2 с-1, интенсивность вспышки насыщающего света - 6000 мкМ квантов м-2 с-1, а длительность 0,6 с. Для оценки максимального квантового выхода ФС2 образцы выдерживают в темноте в течение 20 мин для темновой адаптации, оборачивая анализируемые участки веток светонепроницаемой фольгой, флуоресценцию регистрируют после действия вспышки насыщающего света. Из величин начальной флуоресценции (F0) и флуоресценции после насыщающей вспышки (Fm) вычисляют максимальный квантовый выход флуоресценции ФС2: Fv/Fm=(Fm-F0)/Fm, выражающий потенциальную эффективность первичных процессов фотосинтеза в фотосистеме 2 (ФС2). Затем образцы освещают последовательными вспышками насыщающего света на фоне действующего света и рассчитывают эффективный квантовый выход ФС2 по формуле ϕII=(F'm-Fs)/F'm, где F'm и Fs - максимальный и стационарный уровень флуоресценции хлорофилла в светоадаптированных образцах. Для измерения только эффективного квантового выхода нет необходимости в темновой адаптации.
Как видно из таблицы 1, значения квантового выхода ФС2 в хлоренхимных тканях лозы изменяются в результате обработки отрицательными температурами в зависимости от интенсивности и длительности обработки. Промораживание тканей приводит к снижению максимального квантового выхода. Значения квантового выхода хорошо коррелируют со степенью повреждений, вызванных стрессовыми обработками разной интенсивности и могут быть надежным показателем жизнеспособности ткани. Сравнение результатов анализов одних и тех же побегов, подвергнутых температурной обработке при +22°С в течение 24 часов и измеренных при +22°С и при +4°С (см. пункты 4 и 5 Таблицы 1), показывает, что в то время как значения эффективного квантового выхода заметно снижаются при понижении температуры измерения, значения максимального квантового выхода остаются неизменными. Эти результаты свидетельствует о том, что измерения максимального квантового выхода могут быть произведены в широком диапазоне температур, что позволяет использовать данный способ для идентификации побегов, подлежащих обрезке ранней весной при низких температурах.

Показаны средние значения ± стандартная ошибка. Измерения проводили не менее 4 раз.
Пример 2. Сравнение параметров кортикулярного фотосинтеза у чувствительных и устойчивых к низким температурам сортов винограда.
Сравнивали параметры кортикулярного фотосинтеза в одревесневшей однолетней лозе растений винограда гибридных форм контрастных по признаку морозостойкости, ТАНА 42 (Саперави северный (V. vinifera × V. amurensis) × Мускат кубанский (V. vinifera)) и ТАНА 33 (Антарис (V. vinifera) × Красностоп анапский (V. vinifera)), привитых на подвой Берландиери × Рипариа Кобер 5ББ, выращенных на вегетационной площадке СКЗНИИСиВ в г.Краснодар. Физиологические показатели, определяющие морозостойкость растений, приведены в таблице 2. Данные показывают относительно высокую морозостойкость сортоформы ТАНА 42 и высокую чувствительность к низким температурам сортоформы ТАНА 33. Фотохимическую активность в хлоренхимных тканях внутренней лозы оценивали по флуоресценции хлорофилла с помощью ПАМ-флуориметра. Измерения флуоресценции хлорофилла проводили по методу, описанному выше в примере 1. Измерения выявили более высокие значения фотохимической активности в более морозостойких сортах при различных температурных условиях.
На фиг. 1 приведено сравнение значений максимального квантового выхода в хлоренхимных тканях кортекса в однолетних лозах: с низкой морозоустойчивостью (сортоформа винограда ТАНА 33) и высокой морозоустойчивостью (сортоформа винограда ТАНА 42) до и после обработки низкими температурами. Промораживание проводили в лабораторных условиях при температуре -20°С в течение 24 и 48 часов. Измерения проводили не менее 4 раз.
Морозостойкие растения характеризовались более высокими значениями показателей квантового выхода флуоресценции хлорофилла при всех условиях анализа, то есть при комнатной температуре, а также после обработки низкими отрицательными температурами.
Промораживание проводили в лабораторных условиях при температуре -21°С в течение 48 часов с последующим размораживанием при 4°С в течение 24 часов.
Для последующего использования данных по максимальному квантовому выходу и данных по эффективному квантовому выходу морозостойких сортоформ их заносят в базу данных с присвоением им кода идентификации. Кроме хранения и идентификации данных о сортоформе растении на компьютере проводят дополнительную идентификацию данных элитного растении размещенного на плантации. Для этого на растении закрепляют этикетку с кодом идентификации, для последующего считывания и осуществления сравнения данных, размещенных в компьютерной базе. На этикетке данные формируют в стандарте штрихкода, двумерного или расширенного штрихкода, которые автоматически считывают при идентификации данных о растении в базе данных при следующих измерениях величин кортикулярного фотосинтеза. Считывание данных кода осуществляют устройством для считывания, подключенного к компьютеру или смартфону.
Пример 3. Оценка морозостойкости древесных растений в полевых условиях.
Для оценки морозостойкости растений/селекционного материала на растении выбирают, по крайней мере, один полностью вызревший побег, на котором очищают слой наружной коры с поверхности размером от 0.1 до 1 см2. Закрепляют выносную головку флуориметра выполненную с возможностью ее закрепления на штамбе, лозе или рукавах растения, на зону, зачищенную от коры, и регистрируют флуоресценцию. Излучение от источника света флуориметра и измерение сигнала флуоресценции передают к флуориметру через световоды, закрепленные в измерительной головке. При этом используют измерительную головку флуориметра выполненную из материалов, которые не приводят к необратимому повреждению хлоренхимных тканей растения. Для оценки максимального квантового выхода перед измерением поверхность закрывают алюминиевой фольгой для темновой адаптации. Для измерения эффективного квантового выхода оценку данных возможно проводить на свету без темновой адаптации. Закрепляют на растении идентификатор и заносят в базу данных параметры идентификатора по дате и величине зарегистрированных параметров переменной флуоресценции хлорофилла. Расчет параметров фотохимической активности фотосистемы 2 производят, как описано выше в примере 1. Сравнивая значения, полученные при измерении, со значениями, полученными для эталонных сортов или значениями в обновляемой и пополняемой базе данных, выявляют наиболее морозостойкие растения по максимальным величинам фотохимической активности в хлоренхимных тканях.
Промышленная воспроизводимость
Растения винограда, отличающиеся большей морозостойкостью, характеризуются более высоким содержанием фотосинтетических пигментов и высокой активностью фотосинтеза в хлоренхимных тканях лозы, включая максимальный квантовый выход фотосистемы 2, эффективный квантовый выход фотосистемы 2. Вследствие обработки низкими положительными и отрицательными температурами разница в параметрах, характеризующих состояние фотосинтетического аппарата, становится более заметной в растениях, контрастных по морозостойкости. Измерение параметров фотосинтеза в хлоренхимных клетках лозы позволяет осуществлять оценку степени морозоустойчивости не только в черенках в лабораторных условиях, но и при выполнении полевых измерений.
Изобретение может быть использовано в сельском хозяйстве при определении степени повреждения зимующих органов многолетних растений, в частности винограда, низкими температурами, что может использоваться при построении системы агротехнических мероприятий на последующий вегетационный период. В селекционной практике изобретение может быть использовано для определения морозостойкости гибридного материала, сортов, саженцев на ранних этапах развития растений, то есть когда наличие биологического материала для анализа ограничено.
Источники информации
1. Стаценко А.П. и др. Способ оценки морозостойкости озимой пшеницы 2198504 (20.02.2003).
2. Кравцов П.В. И др. Способ определения морозостойкости сортов яблони ас СССР № SU 1620061 (15.01.1991).
3. Малтабар Л.М. и др. Способ диагностики морозоустойчивости винограда 2 448 456 (27.04.2012).
4. Дорошенко Т.Н. и др. Способ диагностики морозоустойчивости плодовых культур. Патент РФ №2056737 (27.03.1996).
5. Юшков А.Н. и др. Способ оценки зимостойкости плодовых растений 2 514 400 (27.04.2014).
6. Медведев С.С. Физиология растений: учебник. - СПб.: БХВ-Петербург, 2012. - 512 с.
7. Kolber Z. Fast repetition rate (FRR) fluorometer and method for measuring fluorescence and photosynthetic parameters. US 5426306 (1995-06-20).
8. Mazzinghi P. Instrument for the two-channel measurement of the fluorescence of chlorophyll. EP 0434644 (1997-05-02).
9. Kramer D. Methods for determining the physiological state of a plant US 6624887 (2003-09-23).
10. Takayama K. et al. Plant health diagnostic method and plant health diagnostic device US 9377404 (2016-06-28).
11. Людекер В. и др. Система детектирования флуоресценции для определения значимых параметров растительности. Патент РФ №2199730 (27.02.2003).
12. Lussier R. Portable Intelligent Fluorescence and Transmittance Imaging Spectroscopy System US 8249308 (2012-08-21).
13. Chlorophyll-meter. Технические материалы, http://www.panomex.com/plant-test-meters/chlorophyll-meter.html.
14. Chlorophyll content determinations. Технические материалы. http://www.concordscientificdevices.com/soil-science/ccm-300-chlorophyll-content-meter-for-very-small-leaves.html.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОЦЕНКИ ЗИМОСТОЙКОСТИ ПЛОДОВЫХ РАСТЕНИЙ | 2012 |
|
RU2514400C2 |
| Способ оценки морозоустойчивости озимого ячменя | 2016 |
|
RU2643833C1 |
| Способ досимптомной детекции вирусных инфекций в растениях с помощью РАМ-флуометрии | 2023 |
|
RU2836375C1 |
| СПОСОБ ОЦЕНКИ СТЕПЕНИ ПОВРЕЖДЕНИЙ ПЛОДОВЫХ РАСТЕНИЙ МОРОЗАМИ | 2015 |
|
RU2608811C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СОСТОЯНИЯ ДРЕВОСТОЯ ПО ПОБЕГАМ КРОН | 2023 |
|
RU2824521C1 |
| Способ прогнозирования продуктивности пшеницы на основании показателей флуоресценции хлорофилла | 2022 |
|
RU2792444C1 |
| СПОСОБ ОЦЕНКИ МОРОЗОСТОЙКОСТИ РАСТИТЕЛЬНОЙ ТКАНИ ПЛОДОВЫХ КУЛЬТУР РЕЗОНАНСНЫМ МЕТОДОМ | 2008 |
|
RU2388211C2 |
| СПОСОБ ФОРМИРОВАНИЯ САЖЕНЦЕВ, ПОСАДКИ И ВЕДЕНИЯ ВИНОГРАДНЫХ РАСТЕНИЙ | 2016 |
|
RU2672818C2 |
| СПОСОБ ЭКСПРЕСС-ОЦЕНКИ МОРОЗОСТОЙКОСТИ РАСТИТЕЛЬНОЙ ТКАНИ ПЛОДОВЫХ И ЯГОДНЫХ КУЛЬТУР | 2005 |
|
RU2295852C2 |
| СПОСОБ ФЛУОРОМЕТРИЧЕСКОГО ОПРЕДЕЛЕНИЯ ПАРАМЕТРОВ ФОТОСИНТЕЗА ФОТОАВТОТРОФНЫХ ОРГАНИЗМОВ, УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ И ИЗМЕРИТЕЛЬНАЯ КАМЕРА | 2006 |
|
RU2354958C2 |
Изобретение относится к области сельского хозяйства, в частности к виноградарству и селекции. В способе измеряют величину фотохимической активности тканей растений. При этом оценку морозостойкости растения определяют по максимальной величине кортикулярного фотосинтеза хлорофилла. На выбранном участке растения или взятом от него черенке предварительно удаляют участок наружной коры растения и фиксируют флуоресценцию хлорофилла с обнаженных хлоренхимных тканей. Данные флуоресценции обрабатывают, идентифицируют и сравнивают с данными фотохимической активности хлоренхимных тканей морозостойких растений, полученными при анализе известных устойчивых и/или чувствительных к низким температурам сортов-эталонов, растущих на той же плантации в тех же условиях, либо с ранее полученными значениями флуоресценции хлорофилла в хлоренхимных тканях сортов-эталонов, предварительно занесенных в созданную базу данных. Наиболее морозостойкие растения выявляют по максимальным величинам фотохимической активности в хлоренхимных тканях. Способ обеспечивает ускоренный отбор морозостойких сортов и определение степени поврежденности растений или их частей, в том числе и в полевых условиях.12 з.п. ф-лы, 1 ил., 2 табл., 3 пр.
1. Способ оценки и отбора морозостойких растений винограда, в соответствии с которым измеряют величину фотохимической активности тканей растений, отличающийся тем, что оценку морозостойкости растения определяют по максимальной величине кортикулярного фотосинтеза хлорофилла, при этом на выбранном участке растения или взятом от него черенке предварительно удаляют участок наружной коры растения и фиксируют флуоресценцию хлорофилла с обнаженных хлоренхимных тканей, данные флуоресценции обрабатывают, идентифицируют и сравнивают с данными фотохимической активности хлоренхимных тканей морозостойких растений, полученными при анализе известных устойчивых и/или чувствительных к низким температурам сортов-эталонов, растущих на той же плантации в тех же условиях, либо с ранее полученными значениями флуоресценции хлорофилла в хлоренхимных тканях сортов-эталонов, предварительно занесенных в созданную базу данных, и выявляют наиболее морозостойкие растения по максимальным величинам фотохимической активности в хлоренхимных тканях.
2. Способ по п. 1, отличающийся тем, что для сравнения данных фотохимической активности растений используют данные, занесенные в компьютерную базу данных.
3. Способ по п. 1, отличающийся тем, что оценку морозостойкости осуществляют при оценке и отборе поврежденных частей растения для их обрезки.
4. Способ по п. 1, отличающийся тем, что оценку морозостойкости осуществляют при отборе черенков для прививки винограда.
5. Способ по п. 1, отличающийся тем, что оценку величины кортикулярного фотосинтеза осуществляют на участках растения, входящих в группу, состоящую из черенка, лозы, рукава и штамба.
6. Способ по п. 1, отличающийся тем, что для оценки максимального квантового выхода перед измерением анализируемый участок закрывают светонепроницаемой фольгой и выдерживают в темноте не менее 15 мин.
7. Способ по п. 1, отличающийся тем, что оценку величины кортикулярного фотосинтеза осуществляют по значению переменной флуоресценции хлорофилла, при этом производят измерения в диапазоне от 350 до 730 нм и с интенсивностью до 4000 мкмоль⋅м-2⋅с-1, без использования вспышек насыщающего света или с использованием вспышек насыщающего света интенсивностью до 200000 мкмоль⋅м-2⋅с-1.
8. Способ по п. 1, отличающийся тем, что измерение флуоресценции хлорофилла с обнаженных хлоренхимных тканей одревесневших органов многолетних растений проводят в лабораторных и/или полевых условиях во все сезоны.
9. Способ по п. 1, отличающийся тем, что для измерения флуоресценции хлорофилла с обнаженных хлоренхимных тканей в полевых условиях используют измерительную головку флуориметра, выполненную с возможностью ее закрепления на штамбе, лозе или рукавах виноградного растения, высаженного на плантации.
10. Способ по п. 1, отличающийся тем, что излучение от источника света флуориметра и измерение сигнала флуоресценции передают к флуориметру через световоды, закрепленные в измерительной головке.
11. Способ по п. 1, отличающийся тем, что для идентификации данных об элитном растении, размещенном на плантации, на нем закрепляют этикетку с кодом идентификации для последующего считывания значения флуоресценции хлорофилла с обнаженных хлоренхимных тканей в базе данных.
12. Способ по п. 11, отличающийся тем, что код идентификации на этикетке формируют в стандарте штрихкода или двумерного или расширенного штрихкода.
13. Способ по п. 11, отличающийся тем, что считывание данных кода осуществляют устройством для считывания, подключенного к компьютеру или смартфону.
| СПОСОБ ОЦЕНКИ ЗИМОСТОЙКОСТИ ПЛОДОВЫХ РАСТЕНИЙ | 2012 |
|
RU2514400C2 |
| ТИХОНОВ К.Г | |||
| и др | |||
| Структурные и функциональные особенности фотосинтетического аппарата хлорофиллосодержащих тканей виноградной лозы// XXI Пущинские чтения по фотосинтезу и Всероссийская конф | |||
| "Фотосинтез и фотобиотехнология | |||
| Фундаментальные и прикладные аспекты", Тезисы докл., Пущино, 1-6 июня 2015, с.87 | |||
| CADIEUX C | |||
| et al | |||
| Osmotic adjustment and photosynthetic electron transport response tocold hardening in winter and spring wheat // Plant Physiol | |||
| Biochem, Т | |||
| Прибор для получения стереоскопических впечатлений от двух изображений различного масштаба | 1917 |
|
SU26A1 |
| Способ получения древесного угля | 1921 |
|
SU313A1 |
Авторы
Даты
2018-05-04—Публикация
2016-09-30—Подача