ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение в целом относится к области здоровья свиней. Свиньи поражаются многими патогенными микроорганизмами. Борьба с инфекциями обычно осуществляется путем организации содержания, введением фармацевтических препаратов, таких как противовирусные препараты и антибиотики, или профилактики с использованием вакцин.
ЦЕЛЬ ИЗОБРЕТЕНИЯ
Существует постоянная потребность в удобных, безопасных и эффективных средствах поддержания здоровья свиней.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Для осуществления цели изобретения разработана новая вакцина для комбинированной защиты свиней от инфекций, вызванными различными патогенными микроорганизмами, причем вакцина содержит комбинацию живого аттенуированного PRRS-вируса (вируса, вызывающего репродуктивный и респираторный синдром свиней) и инактивированного антигена из Lawsonia intracellularis. PRRS-вирус и бактерии Lawsonia intracellularis вдвоем ответственны за значительные экономические потери вследствие пагубного влияния на здоровье свиней. Хотя для обоих типов микроорганизмов известны и являются коммерчески доступными лекарственные препараты, а также вакцины, не существует такой комбинированной вакцины, которая подходила бы для объединенной защиты от заражения или клинических проявлений этих патогенов, и являлась бы эффективной и хорошего качества (например, стабильной, без влияния антигенов друг на друга), и в то же самое время безопасной для использования у молодых животных. Как известно, не все предполагаемые и предлагаемые комбинации антигенов могут давать безопасную и эффективную комбинированную вакцину. В действительности, существует высокий уровень неопределенности в отношении стабильности, безопасности и эффективности комбинированной вакцины, даже когда индивидуальные (моновалентные) вакцины безопасны и эффективны.
Следует отметить, что термин «комбинация» не исключает того, что антигены представлены в комбинированной форме живого вируса PRRS и убитой целой клетки бактерии Lawsonia intracellularis только после введения целевому животному, например, путем введения двух отдельных вакцин путем инъекции в одно место.
Комитет по ветеринарным лекарственным продуктам Европейского агентства по оценке лекарственных средств (EMEA) в своей публикации «Note for guidance: requirements for combined veterinary products» (EMEA, 2000, CVMP/IWP/52/97-FINAL) заявил (страница 2/6), что «Разработка комбинированных вакцин не является простым делом. Каждая комбинация должна быть разработана и изучена по отдельности с точки зрения качества, безопасности и эффективности». Кроме того, Комитет указывает на то, что поиск хорошей комбинированной вакцины, как правило, включает в себя анализ стабильности и совместимости между отдельными компонентами в комбинированной вакцине, включая, например, консерванты, вспомогательные вещества и стабилизаторы, инактивирующие агенты и адъюванты. В верхнем параграфе на стр. 3 указывается, что «В комбинированных вакцинах наличие более одного компонента часто может вызывать взаимодействие, приводящее либо к заниженной, либо к повышенной реакции на отдельные компоненты, по сравнению с тем, когда конкретный компонент(ы) вводят индивидуально… Такие взаимодействия часто являются иммунологическими по своей природе, но также могут быть вызваны другими факторами с непрямым воздействием на иммунную систему», а также «когда адъювант используется для усиления иммунного ответа на комбинированную вакцину, могут возникнуть определенные проблемы».
Центр оценки и исследования биопрепаратов Управления по контролю за пищевыми продуктами и медикаментами Департамента здравоохранения и социальных служб США опубликовал в апреле 1997 года «Руководство для промышленности по оценке комбинированных вакцин для поддающихся профилактике болезней: производство, тестирование и клинические исследования», в котором изложено (стр.3, в разделе «Совместимость компонентов»), что «Опыт показал, что объединение моновалентных вакцин может привести к новой комбинации, которая является менее безопасной и эффективной, чем хотелось бы. Иногда компоненты инактивированных вакцин могут неблагоприятно воздействовать на один или несколько живых вакцинных компонентов», указывая на то, что, в частности, инактивированная вакцина может отрицательно повлиять на эффективность живой вакцины, что, например, произошло при объединении живой коклюшной вакцины и инактивированной полиовирусной вакцины, которое дало вакцину со сниженной противококлюшной эффективностью. Указано, что любые дополнительные компоненты в вакцине могут ухудшить безопасность и эффективность конечного продукта по сравнению с моновалентными вакцинами.
Всемирная организация здравоохранения (ВОЗ) опубликовала электронный учебный курс под названием «Основы безопасности вакцин», который в модуле 2 предусматривает комбинированные вакцины. Этот модуль начинается с фразы «Лицензированные комбинированные вакцины проходят тщательное тестирование перед одобрением национальными регулирующими органами для гарантии безопасности, эффективности и приемлемого качества продуктов». В нем также заявлено, что «Поэтому, в отношении всех комбинаций производители должны оценить действенность каждого антигенного компонента, эффективность компонентов вакцины в комбинации в отношении индукции иммунного ответа, риск возможного возникновения токсичности и реакции с другими компонентами вакцины».
Настоящее изобретение, кроме вакцины как таковой, также относится к способу защиты свиней от заражения вирусом PRRS и бактериями Lawsonia intracellularis, включающему введение указанной вакцины.
ОПРЕДЕЛЕНИЯ
Вакцина представляет собой состав, который защищает после вакцинации от заражения патогенным микроорганизмом, то есть состав, который предупреждает или уменьшает вероятность заражения микроорганизмом, либо предупреждает или ослабляет клинические проявления заболевания, возникающего в результате инфекции, как правило, путем действия на сам микроорганизм, например, посредством антител в организме вакцинированного хозяина. Вакцинация, таким образом, предупреждает или по меньшей мере снижает число случаев заражения и/или предупреждает или по меньшей мере снижает степень клинических проявлений заболевания, возникающего в результате этой инфекции.
Инактивированный антиген бактерии дикого типа представляет собой любое вещество или соединение, кроме живой бактерии как таковой, в отношении которых должен быть вызван иммунный ответ таким образом, что соответствующие вирулентные бактерии или один или несколько их вирулентных факторов будут узнаваться иммунной системой хозяина в результате этого иммунного ответа и в конечном итоге будут по меньшей мере, частично, нейтрализоваться. Типичными примерами инактивированного антигена бактерии дикого типа являются убитые целые бактерии (термин «целые» не исключает того, что бактериальные клетки, по меньшей мере частично, повреждены в процессе инактивации, или что экстракт или гомогенат убитой целой клетки бактерии фактически предложен в качестве антигена в вакцине «целые убитые клетки бактерий»), субъединицы бактерий, такие, как экспрессирующиеся на поверхности белки, и токсины. Последние два варианта могут являться или не являться рекомбинантно экспрессированными. Что касается Lawsonia intracellularis, то в данной области известны несколько типов инактивированного антигена, например, из WO2009/144088 (убитые целые клетки бактерий, примеры 1 и 2), W02005/070958 (субъединицы) и WO97/20050 (убитые целые клетки).
Живой аттенуированный вирус является вирусом, который способен реплицироваться как таковой, но не способен индуцировать полный набор симптомов заболевания, который обычно ассоциируется с его вирулентным (часто дикого типа) патогенным аналогом. Как правило, живой вирус не размножается в целевом хозяине или реплицируется со скоростью, которая не является существенно вредной для клеток-хозяев или не вызывает пагубного ответа у хозяина. Что касается вируса PRRS, в данной области известны несколько вакцин, которые содержат живой аттенуированный вирус, являющийся производным от вируса дикого типа, аттенуированного многократным пассированием в in vitro культивируемой линии клеток-хозяев, такие как, например, Porcilis® PRRS (MSD Animal Health), Ingelvac® PRRS MLV (Boehringer Ingelheim), Amervac-PRRS (Hipra Laboratories), Pyrsvac-183® (Hipra Laboratories) и Fostera® PRRS (Zoetis). В данной области были описаны другие живые аттенуированные вирусы PRRS, например, в Veterinary Microbiology, volume 138, issues 1-2, 2 July 2009, Pages 34-40; Veterinary Immunology and Immunopathology, volume 106, issues 3-4, 15 July 2005, Pages 309-319 и в Vaccine, volume 26, issues 29-30, 4 July 2008, Pages 3594-3600.
ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
В одном варианте осуществления вакцина предназначена для защиты свиней от инфекции вирусом PRRS и бактериями Lawsonia intracellularis после однократного введения. Было обнаружено преимущество в том, что свиньи были защищены от обоих патогенов даже после однократного введения дозы вакцины. Этот вариант не исключает проведения последующей вакцинации, например, через 6-12 месяцев после первой вакцинации для возобновления степени защиты. Эта последующая вакцинация отличается от повторной (бустерной) вакцинации в схеме затравочно-бустерной вакцинации, при которой защита обеспечивается только после бустерной вакцинации. В затравочно-бустерной схеме две вакцинации, как правило, проводят через 2-3 недели друг от друга.
В одном варианте осуществления вакцина содержит адъювант. Было обнаружено, что адъювант, который, как правило, используется для улучшения иммунного ответа на инактивированные антигены, не оказывает отрицательного влияния на живой аттенуированный вирус PRRS и не увеличивает реакционную способность другого антигена, несмотря на то, что ВОЗ явно предупреждает об этом типе влияния и реакционной способности в курсе «Основы безопасности вакцин» (см. выше) в последних двух строчках на 1-й странице курса, (раздел «Комбинированные вакцины»). В дополнительном варианте осуществления адъювант содержит минеральное масло, такое как, например, нелетучие насыщенные углеводороды, которые можно приобрести от ExxonMobil® (Marcol® 52).
В еще одном варианте осуществления инактивированный антиген Lawsonia intracellularis содержит убитые целые клетки бактерий Lawsonia intracellularis, предпочтительно, при такой антигенной нагрузке, чтобы вакцина содержала антиген Lawsonia intracellularis, соответствующий 1×107 бактерий Lawsonia intracellularis на дозу. Более высокая антигенная нагрузка, которая не исключается в этом варианте осуществления, может оказывать положительное влияние на уровень защиты и длительность иммунитета.
Что касается нагрузки PRRS-вируса в вакцине, в одном варианте осуществления вакцина содержит 4,0 log10 (4 единицы 10 log) TCID50 аттенуированного вируса PRRS на дозу. Более высокая антигенная нагрузка, которая не исключается в этом варианте осуществления, может оказывать положительное влияние на уровень защиты и длительность иммунитета.
Изобретение будет далее объяснено с помощью следующего примера и фигур.
В примере 1 описано исследование комбинированной вакцины с вирусом PRRS и Lawsonia.
На фиг.1 показана температура тела после заражения (ДПЗ=дни после заражения).
На фиг.2 показан средний прирост веса в день (ADWG) после заражения.
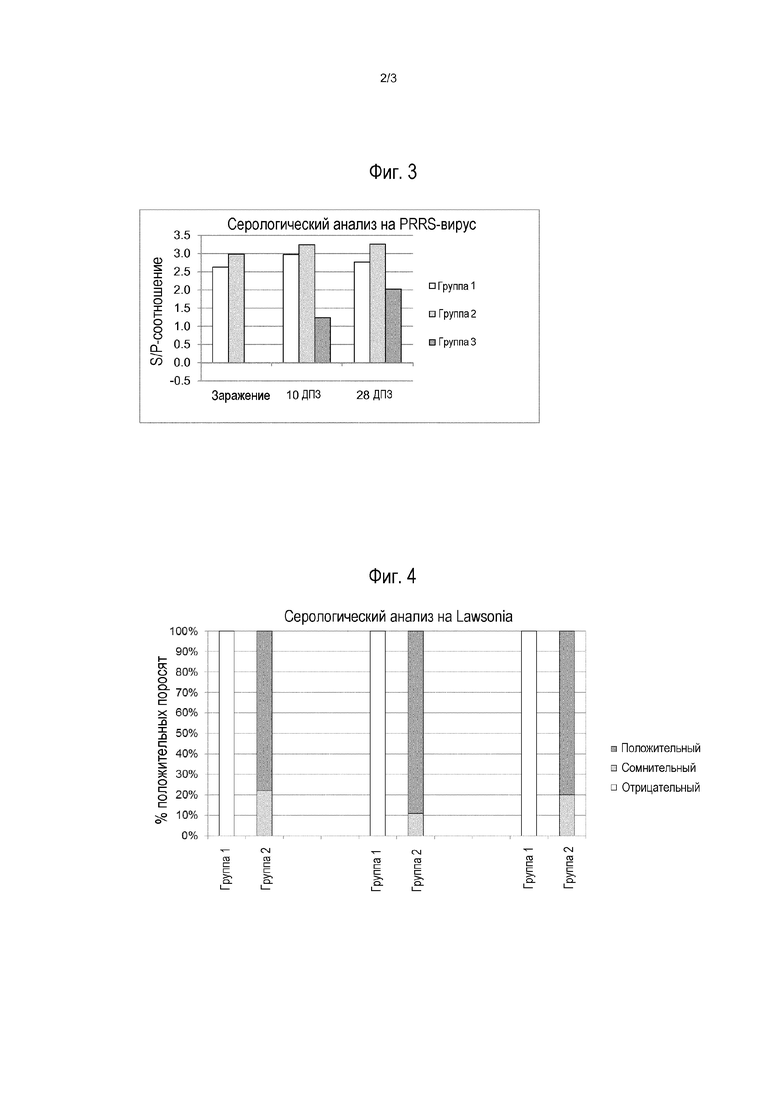
На фиг.3 показаны серологические данные по вирусу PRRS после заражения.
На фиг.4 показаны серологические данные по Lawsonia после заражения.
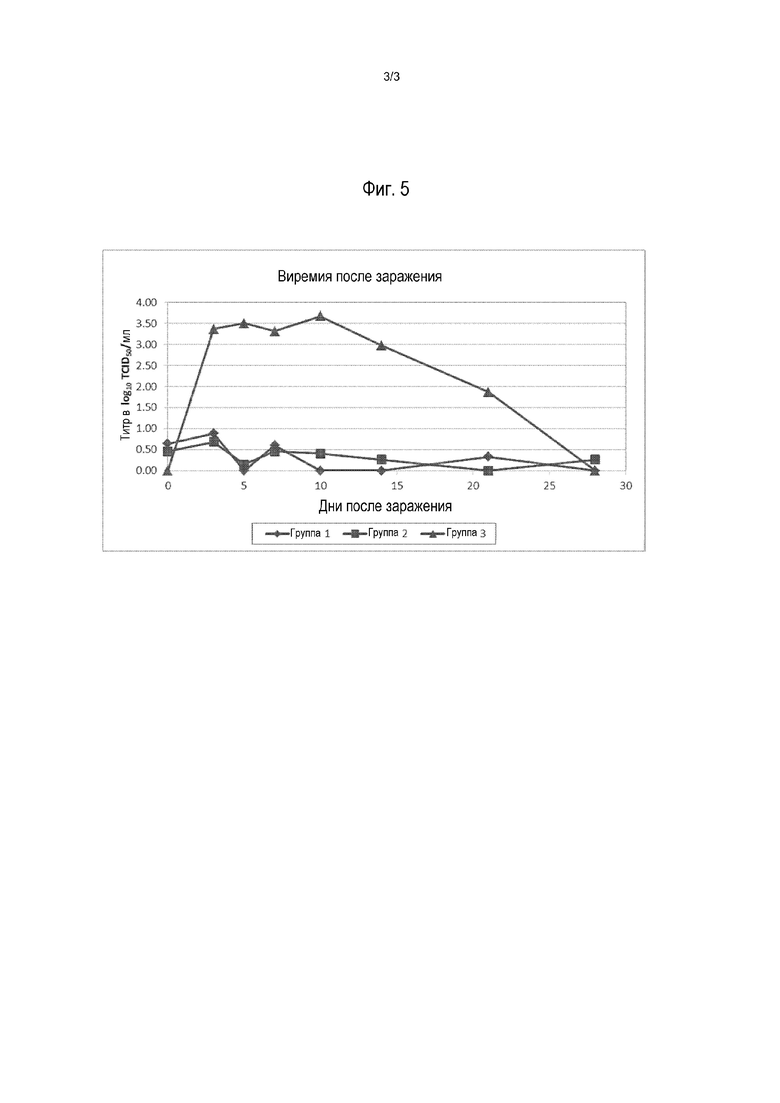
На фиг.5 показана виремия вируса PRRS после заражения.
В примере 2 описано второе исследование комбинированной вакцины с вирусом PRRS и Lawsonia.
ПРИМЕР 1
СХЕМА ИССЛЕДОВАНИЯ
В этом исследовании использовали потомство пяти свиноматок (23 поросенка). Когда поросятам было приблизительно две недели, их были вакцинированы следующим образом:
- Первую группу (группа 1, 8 животных) вакцинировали внутримышечно лиофилизированной PRRS-вакциной Porcilis® (доступной от MSD Animal Health, Boxmeer, The Netherlands), растворенной с использованием Diluvac Forte® (MSD Animal Health). Одна доза содержала рассчитанное количество 4 log10 TCID50 вируса в 2 мл (инъецируемой дозе) и вводилась в правую сторону шеи.
- Вторую группу (группа 2, 9 животных) вакцинировали той же PRRS-вакциной, растворенной в готовой для использования вакцине против Lawsonia intracellularis (см. WO 2009/127684, пример 2 для антигенов: убитые целые клетки, в этом эксперименте представленные в виде эмульсии масло-в-воде, содержащей 12,5% об/об (= объем масла относительно общего объема вакцины) минерального масла Marcol 52 (ExxonMobil), 0,75% вес/объем ацетата витамина Е и 0,80% полисорбата 80 (Tween 80; Sigma Aldrich) и воду для инъекций). Вакцины смешивали при комнатной температуре и оставляли на 30 минут перед введением. Одна доза содержала рассчитанное количество 4 log10 TCID50 вируса и 2×107 бактериальных клеток в 2 мл (инъецируемой дозе) и вводилась в правую сторону шеи.
- Поросята в третьей группе (группа 3, 6 животных) не были вакцинированы, а служили в качестве невакцинированного контроля при заражении. Заражение проводили через 4 недели после вакцинации с использованием вирулентного PRRS-вируса интраназальным путем.
После вакцинации и заражения всех поросят осматривали ежедневно на наличие клинических симптомов. Температуру тела измеряли за один день до и в день заражения, а затем ежедневно в течение десяти дней. Вес тела определяли в день перед заражением, через десять дней после заражения и за один день до конца эксперимента (на 27-й день после заражения). Образцы крови собирали во время заражения и на третий, пятый, седьмой, десятый, 14-й, 21-й и 28-й день после заражения.
ЭКСПЕРИМЕНТАЛЬНЫЕ ПРОЦЕДУРЫ
Ветеринарный осмотр
За день до вакцинации поросят обследовали на предмет общего состояния здоровья.
Наблюдение за клиническими симптомами
Начиная со дня прибытия всех свиней ежедневно осматривали на наличие клинических симптомов. Начиная со дня заражения вели индивидуальный учет возможных системных реакций, таких как потеря аппетита, нежелание двигаться, тенденция к лежанию, вялость или сонливость, дрожание, ощетинивание и, возможно, отек, особенно, вокруг глаз, рвота и понос или тахипноэ, и брюшное дыхание.
Измерение температуры тела
Температуру тела всех животных измеряли за день до и в день заражения и затем ежедневно в течение 10 дней (в одно и то же время суток).
Измерение веса тела
Вес тела поросят измеряли в день перед заражением, через 10 и 27 дней после заражения.
Отбор проб крови
Образцы крови от всех свиноматок отбирали за день до вакцинации, чтобы подтвердить отрицательный статус. У поросят образцы крови отбирали во время заражения и на третий, пятый, седьмой, десятый, 14-й, 21-й и 28-й день после заражения. Образцы сыворотки были исследованы на возможное присутствие вируса PRRS и возможное наличие PRRS-специфичных антител и Lawson-специфичных антител.
РЕЗУЛЬТАТЫ
Клинические симптомы
В ходе эксперимента не наблюдалось никаких клинических симптомов после вакцинации или заражения. Несмотря на то что минеральное масло является очень сильным адъювантом, в частности, для свиней, который может привести к тяжелым местным реакциям, по-видимому, использование этого адъюванта является безопасным для новой комбинированной вакцины. Поэтому, полагают, что для любых более мягких адъювантов безопасность при их использовании не будет представлять вообще никакой проблемы.
Температура тела
Для каждой группы рассчитывали среднюю температуру тела перед заражением, измеренную за один день до и в день заражения. На фиг.1 показано повышение средней температуры тела до 10-го дня после заражения относительно средней температуры тела до заражения. На 2-й день после заражения только в группе невакцинированных контрольных поросят средняя температура тела повышалась на 1°С Во всех остальных временных точках после заражения повышение не регистрировалось ни в группе вакцинированных, ни в группе контрольных поросят.
Вес тела и набор веса
В начале эксперимента поросят распределяли по группам случайным образом, независимо от веса и пола. Как видно из фиг.2, тенденция состояла в том, что комбинированная вакцина из группы 2 обеспечивает такой же ADWG (средний суточный прирост веса), как и моновалентная вакцина против PRRS, более высокий, чем в контрольной группе.
Серологический анализ PRRS
Только свиньи, которые получали вакцину PRRS, давали положительный ответ при заражении. Как видно на фиг.3 (результаты указаны как «соотношение образец относительно положительного сигнала или S/P-соотношение» при использовании ELISA-набора PRRS X3 от IDEXX), антигены Lawsonia, по-видимому, не влияют отрицательно на титр анти-PRRS антител. Наоборот, по-видимому, наблюдается неожиданный положительный эффект на титр анти-PRRS антител, поскольку в каждый момент времени титр анти-PRRS антител был выше для животных, которые получали комбинированную вакцину. Из этого следует, что антигены Lawsonia по какой-то еще неизвестной причине усиливают иммунный ответ против живого вируса PRRS.
Серологический анализ на Lawsonia intracellularis
На фиг.4 приведены результаты серологического анализа на Lawsonia. Видно, что животные из 1-й группы оставались отрицательными на протяжении всего эксперимента. Из животных в группе 2, 80-90% показали хорошую сероконверсию, сопоставимую с конверсией, которая соответствует защищенным от заражения вирулентными бактериями Lawsonia животным.
Виремия PRRS после заражения
Как известно, виремия является одним из основных показателей защиты от заражения вирусом PRRS и результатом клинического заболевания. Результаты приведены на фиг.5. В обеих группах 1 и 2 наблюдалось очень большое и сопоставимое снижение виремии.
ПРИМЕР 2
СХЕМА ИССЛЕДОВАНИЯ
Это исследование было разработано, чтобы подтвердить, что настоящая комбинированная вакцина не зависит от типа адъюванта и типа штамма живого PRRS. Для этого использовались альтернативные адъюванты Diluvac Forte (который можно приобрести от MDS Animal Health, Boxmeer, The Netherlands) и Карбопол (который можно приобрести, как Карбопол 974Р от Lubrizol, Cleveland, Ohio, USA). Альтернативным штаммом PRRS является штамм 2-го типа (вместо штамма 1-го типа, используемого в примере 1), который присутствует в коммерчески доступной вакцине Prime Pac PRRS (которую можно приобрести от Merck Animal Health, Millsboro, Delaware, USA).
Потомство нескольких свиноматок использовали, чтобы разделить 15 поросят по 3 группам воздействия из пяти поросят. Примерно в 1-недельном возрасте поросят из групп 1 и 2 вакцинировали лиофилизированной инактивированной вакциной против Lawsonia (теми же антигенами, что и в примере 1, но в настоящее время лиофилизированными и, поэтому, в комбинации с лиофильным стабилизатором), восстановленной в Diluvac Forte (DF) или Карбополе (0,8% вес/объем), как указано в таблице 1 ниже. Вакцины вводили внутримышечно в левую сторону шеи. Примерно в 5-недельном возрасте поросят ревакцинировали двумя различными штаммами живого PRRS и антигенами Lawsonia, объединенными в одной вакцине, путем восстановления антигенов либо в DF, либо в Карбополе (0,8% вес/объем). Вакцину Prime Pac PRRS (содержащую PRRS 2-го типа) растворяли таким образом, чтобы она содержала 4 log10 TCID50 вируса в 2 мл, и вакцину Porcilis PRRS (содержащую PRRS 1-го типа) растворяли таким образом, чтобы она содержала 4 log10 TCID50 вируса в 2 мл. Для второй вакцинации вакцины вводили внутримышечно в правую сторону шеи. Поросят из 3-й группы не были вакцинированы и служили в качестве невакцинированной контрольной группы.
Схема вакцинации
После первой вакцинации поросят осматривали ежедневно на наличие клинических симптомов. Образцы крови от всех поросят собирали перед первой вакцинацией, перед второй вакцинацией и на второй, четвертой и шестой неделе после второй вакцинации. Образцы сыворотки проверяли на наличие антител против вируса PRRS и бактерий Lawsonia intracellularis.
РЕЗУЛЬТАТЫ
В ходе эксперимента не наблюдалось никаких клинических проявлений. Все животные были отрицательными по антителам против Lawsonia и PRRS в день второй вакцинации. Через шесть недель после второй вакцинации все животные, за исключением контрольных, были положительными по антителам, специфичным к Lawsonia и PRRS. Это доказывает, что комбинированная вакцина была безопасна и обеспечивала эффективную иммунизацию против бактерий Lawsonia intracellularis и вируса PRRS.
| название | год | авторы | номер документа |
|---|---|---|---|
| ВАКЦИНЫ, СОДЕРЖАЩИЕ ПАТОГЕНЫ СВИНЕЙ, ДЛЯ АССОЦИИРОВАННОГО НЕСМЕШАННОГО ПРИМЕНЕНИЯ | 2018 |
|
RU2756767C2 |
| КОМБИНИРОВАННАЯ ВАКЦИНА ДЛЯ СВИНЕЙ | 2017 |
|
RU2761453C2 |
| ВАКЦИНА ДЛЯ ЗАЩИТЫ ОТ LAWSONIA INTRACELLULARIS, MYCOPLASMA HYOPNEUMONIAE, ЦИРКОВИРУСА СВИНЕЙ | 2009 |
|
RU2496520C2 |
| Способ профилактического лечения свиней | 2017 |
|
RU2780233C2 |
| ВАКЦИНА ДЛЯ ЗАЩИТЫ ОТ LAWSONIA INTRACELLULARIS | 2009 |
|
RU2523561C2 |
| ВАКЦИНА ПРОТИВ LAWSONIA INTRACELLULARIS И СВИНОГО ЦИРКОВИРУСА 2-ГО ТИПА | 2014 |
|
RU2672251C1 |
| ВАКЦИНА НА ОСНОВЕ Lawsonia И СПОСОБЫ ЕЕ ПРИМЕНЕНИЯ | 2006 |
|
RU2420310C2 |
| ВАКЦИНА ДЛЯ ВНУТРИКОЖНОГО ПРИМЕНЕНИЯ ПРОТИВ ИНФЕКЦИИ ВИРУСА PCV2 И PRRS | 2017 |
|
RU2746127C2 |
| СХЕМА ВАКЦИНАЦИИ "ПРАЙМ-БУСТ" | 2019 |
|
RU2817873C2 |
| ВАКЦИНА ПРОТИВ ЦИРКОВИРУСА СВИНЕЙ 2 ТИПА | 2014 |
|
RU2712155C2 |

Группа изобретений относится к ветеринарии и касается вакцины, включающей в комбинации живой аттенуированный вирус PRRS и инактивированный антиген Lawsonia intracellularis, для защиты свиней от заражения вирусом PRRS и бактериями Lawsonia intracellularis. Изобретение также относится к способу защиты свиней от заражения вирусом PRRS и бактериями Lawsonia intracellularis с использованием данной вакцины. Группа изобретение обеспечивает защиту свиней от клинического заболевания, к которому приводит заражение вирусом PRRS и бактериями Lawsonia intracellularis, после однократного введения. 3 н. и 7 з.п. ф-лы, 5 ил., 1 табл., 2 пр.
1. Вакцина, содержащая в комбинации живой аттенуированный вирус PRRS и инактивированный антиген Lawsonia intracellularis, для защиты свиней от заражения вирусом PRRS и бактериями Lawsonia intracellularis.
2. Вакцина, содержащая в комбинации живой аттенуированный вирус PRRS и инактивированный антиген Lawsonia intracellularis, для защиты свиней от клинического заболевания, к которому приводит заражение вирусом PRRS и бактериями Lawsonia intracellularis.
3. Вакцина по п. 1 или 2, отличающаяся тем, что вакцина предназначена для защиты свиней от заражения вирусом PRRS и бактериями Lawsonia intracellularis после однократного введения вакцины.
4. Вакцина по п. 1 или 2, отличающаяся тем, что вакцина содержит адъювант.
5. Вакцина по п.4, отличающаяся тем, что адъювант содержит минеральное масло.
6. Вакцина по п. 1 или 2, отличающаяся тем, что инактивированный антиген Lawsonia intracellularis содержит убитые целые клетки бактерий Lawsonia intracellularis.
7. Вакцина по п.6, отличающаяся тем, что вакцина содержит антиген Lawsonia intracellularis, соответствующий 1×107 бактерий Lawsonia intracellularis на дозу.
8. Вакцина по п. 1 или 2, отличающаяся тем, что вакцина содержит 4,0 log10 TCID50 аттенуированного вируса PRRS на дозу.
9. Способ защиты свиней от заражения вирусом PRRS и бактериями Lawsonia intracellularis, включающий введение животному вакцины, содержащей в комбинации живой аттенуированный вирус PRRS и инактивированный антиген Lawsonia intracellularis.
10. Способ по п.9, отличающийся тем, что способ приводит к защите после однократного введения вакцины.
| WO2007116032 A1, 18.10.2007 | |||
| WO2009127684 A1, 22.10.2009 | |||
| WO2008073464 A2, 19.06.2008 | |||
| WO 2006099561 A1, 21.09.2006 | |||
| WO 2010048252 A1, 29.04.2010 | |||
| WO 2009144088 A2, 03.12.2009. |
Авторы
Даты
2018-05-29—Публикация
2014-12-02—Подача