Настоящее изобретение относится к области вакцинации; более конкретно, изобретение относится к способу вакцинации для защиты животного-мишени от инфекции или заболевания, вызываемого вирусом.
Инфекции патогенными вирусами и вызываемые ими заболевания известны с самого начала цивилизации, поражая как людей, так и животных, часто оказывая серьезное воздействие на здоровье и благополучие. С 1800-х годов вирусным инфекциям противодействует активная иммунизация. Такая вакцинация включает введение животному-мишени аттенуированной или убитой формы вирусного патогена. Вакцина на основе аттенуированного вируса (также известная как модифицированная живая вакцина) содержит реплицирующийся, но относительно безвредный вирус, который за счет своей репликации в животном-мишени вызывает защитный иммунный ответ против соответствующей патогенной формы вируса.
Поскольку большинство вирусов являются относительно простыми структурами, использование одного антигена из их антигенного профиля иногда может быть достаточным для создания защитного иммунного ответа. Такая субъединичная вакцина может быть изготовлена путем экстракции из вируса или его культуры, или путем рекомбинантной экспрессии специфического антигена. Альтернативно, вирусный антиген может быть доставлен животному-мишени и экспрессироваться внутри него с помощью живого рекомбинантного микроорганизма-носителя, который действует как вектор. Примерами вирусных векторов являются аденовирус для использования у людей и вирус герпеса индеек для кур.
Вариантом использования вирусных векторных вакцин является использование вакцин из частиц репликона (RP; см. Lundstrom, 2014, Vaccines, vol. 6, p. 2392-2415). Это вирусоподобные частицы, но они содержат дефектный вирусный геном и, как правило, гетерологичный ген. Эти частицы репликона содержат РНК, упакованную в частицы (т.е. они инкапсулированы), так что они могут проникать в клетку-мишень животного-хозяина и выполнять один раунд амплификации вирусного генома без способности образовывать новые частицы. Частица репликона не распространяется из инфицированной клетки, поскольку в ней отсутствуют необходимые структурные последовательности, кодирующие белок. Как таковые, они больше похожи на вирусы дикого типа, чем на другие репликонные вакцины, такие как вакцины с голой РНК или вакцины, содержащие РНК, запускаемую из плазмиды ДНК (Hikke, 2017, Anu. Rev. Anim. Biosci. 2017, 5;10.1-10.21). Геном RP обычно экспрессирует гетерологичный ген, кодирующий иммунопротекторный антиген. В производстве RP были использованы несколько РНК-содержащих вирусов, таких как вирусы с положительной цепью Flaviviridae, Picornaviridae и Arteriviridae, или РНК-содержащие вирусы с отрицательной цепью, такие как Bunyavirus, Parahabdovirus и Rhabdovirus. Наиболее широко используются и наиболее широко изучаются частицы репликона РНК-содержащего Альфавируса (Vander Veen et al., 2012, Anim. Health. Res. Rev., vol. 13, p. 1-9; и: Kamrud et al., 2010, J. Gen. Virol., vol. 91, p. 1723-1727), которые таким образом предпочтительны по практическим соображениям. Также полагают, что RP Альфавируса являются некоторым образом более сильными имунопотенциаторами, чем другие RP, известные в данной области техники, и основанные на других вирусах, таких как буниавирус. Несколько видов Альфавируса применяли для разработки RP вакцин, например: вирус венесуэльского энцефалита лошадей (VEEV) (Pushko et al., 1997, Virology, vol. 239, p. 389-401), вирус Синдбис (Bredenbeek et al., 1993, J. of Virol., vol. 67, p. 6439-6446) и вирус леса Семлики (Liljestrom &Garoff, 1991, Biotechnology (NY), vol. 9, p. 1356- 1361).
RP могут вызывать слизистые и системные иммунные ответы после иммунизации у животного-мишени (Davis et al., 2002, IUBMB Life, vol. 53, p. 209-211). RP вакцины (на основе VEE) также являются основной нескольких лицензированных USDA вакцин, которые включают: вакцину против эпизоотической диареи свиней, РНК (Код продукта 19U5.P1), вакцину против свиного гриппа, РНК (Код продукта 19A5.D0), вакцину против птичьего гриппа, РНК (Код продукта 19O5.D0) и рецептурный препарат, РНК частицу (Код продукта 9PP0.00). Также: Wang et al., 2018, Vaccine, vol. 36, p. 683-690.
Для инактивированной и субъединичной вакцины обычно используют иммуностимуляторы для достижения оптимальной эффективности. В качестве эксципиента, такой адъювант должен быть фармацевтически приемлемым и рентабельным. Хорошо известными адъювантами являются соли алюминия и масла. Масляные адъюванты могут быть минерального или не минерального происхождения, при этом минеральные масла обычно разрешены только для использования в ветеринарии.
В ветеринарной практике вакцинацию обычно проводят скоту или домашним животным. В секторе животноводства экономия операций является важной проблемой, поскольку это, как правило, операции с большими объемами и низкой маржой. Следовательно, вакцинация в животноводстве должна быть эффективной и доступной. Таким образом, эффективность оценивается с точки зрения количества вакцинаций, которые необходимо сделать для достижения сильной иммунной защиты, и широты получаемой защиты. Этот последний аспект особенно актуален для вирусных вакцин, поскольку вирусы могут быстро мутировать и возникать как новый вариант. В результате известные вирусные вакцины со временем могут потерять эффективность.
Поэтому оптимизация вирусной вакцинации с точки зрения эффективности и широты защиты является постоянной проблемой в области вакцинации животных.
Хорошо известной практикой повышения эффективности вакцинации является введение вакцины более одного раза. В случае такой повторной вакцинации первое введение обычно называют первичной вакцинацией, а последующую вакцинацию(и) называют бустерной вакцинацией(ями). В такой схеме вакцинации «прайм-буст» два или более введения могут быть выполнены с использованием одного и того же вакцинного продукта, и в этом случае схема называется гомологичной схемой вакцинации «прайм-буст». Например, два или более введения вакцины, содержащей живую аттенуированную форму вируса, или вакцины, содержащей инактивированный вирус. Альтернативно, вакцинации могут быть проведены с применением разных вакцин, предназначенных для защиты от одного и того же патогена или заболевания. В этом случае речь идет о гетерологичной схеме вакцинации «прайм-буст». Обзор представлен в: Kardani et al., 2016 (Vaccine, vol. 34, p. 413-423), в котором описано, что большинство гетерологичных схем вакцинации «прайм-буст» применяют комбинирование первичной вакцинации вакциной, содержащей аттенуированный вирус, с последующей через некоторое время одной или несколькими бустерами вакциной, содержащей инактивированный вирус.
Вирус эпизоотической диареи свиней (PEDV), Коронавирус, впервые наблюдался среди кормящих и откормочных свиней в Англии в 1971; они являются «классическими» штаммами, такими как CV777. Позднее в Азии в 2010 г. возникли вспышки высоковирулентных штаммов PEDV, вызвавшие высокую смертность, и в настоящее время PEDV является одним из основных патогенов, несущих большие экономические потери в свиноводстве в Азии. Азиатский штамм PEDV был обнаружен в Соединенных Штатах Америки в апреле 2013 года и распространился на Канаду и Южную Америку.
У свиней степень тяжести заболевания варьируется и зависит от эпидемиологического статуса стада. В частности, молочные свиньи очень восприимчивы, и у них обычно наблюдается водянистая диарея, обезвоживание и метаболический ацидоз с высокой смертностью. С другой стороны, у кормящих свиней и свиней-производителей наблюдаются диарея, анорексия и депрессия с высокой заболеваемостью, но низкой смертностью.
Вакцины против PEDV были описаны, также для применения в гетерологичных схемах вакцинации «прайм-буст» живой+инактивированной вакциной, в WO 2016/007576 и WO 2016/007955. Однако гомологичная схема «прайм-буст» из 2 x инактивированных PEDV вакцин была описана как высокоэффективная: Paudel et al., 2014 (Vet. Quart., vol. 34, p. 194-200).
Вирус свиного репродуктивного и респираторного синдрома (PRRSV), Артеривирус, впервые был зарегистрирован в 1987 году, а в начале 1990-х годов стал пандемическим. Вирус вызывает значительные убытки в свиноводстве из-за нарушений репродуктивной функции и задержки роста. PRRSV играет важную роль в возникновении многофакторного респираторного заболевания у свиней. Клиническими симптомами являются абортированные, мертворожденные или мумифицированные плоды, а также цианоз уха и вульвы. У новорожденных и отъемных свиней вирус вызывает респираторный дистресс с повышенной восприимчивостью к вторичным респираторным инфекциям. Однако субклинические инфекции также распространены. Вирус также весьма разнообразен: существует два различных варианта описываемых видов: генотип 1 (ранее известный как европейский) и генотип 2 (ранее известный как североамериканский), и расхождение штаммов внутри этих двух генотипов велико.
Вакцины против PRRSV на основе инактивированного вируса были описаны и коммерчески доступны. Однако вакцины на основе аттенуированного вируса считаются более эффективными. Примеры включают: Porcilis™ PRRS (MSD Animal Health), Ingelvac PRRS™ MLV (Boehringer Ingelheim) и Fostera™ PRRS (Zoetis).
Целью настоящего изобретения является преодоление недостатка предшествующего уровня техники и удовлетворение потребности в данной области путем предоставления схемы вакцинации, которая может улучшить иммунную защиту вакцины против инфекции или заболевания, вызванного вирусным патогеном.
Неожиданно было обнаружено, что эта цель может быть достигнута, и, следовательно, один или более недостатков предшествующего уровня техники могут быть преодолены путем применения гетерологичной схемы вакцинации «прайм-буст» с использованием вакцины, содержащей живую аттенуированную форму вируса и вакцины, содержащей RP, кодирующий гетерологичный вирусный антиген. Когда эти две вакцины вводили животному-мишени в определенном порядке, было обнаружено, что полученный иммунный ответ у животного-мишени имеет улучшенную силу и/или широту по сравнению с ответом от любой из отдельных вакцин.
Примечательно, что это улучшение не наблюдалось, когда эти вакцины вводились в обратном порядке, или даже когда одна из двух вакцины вводилась повторно по гомологической схеме «прайм-буст».
Точно неизвестно, как и почему этот выбор типов вакцин и их введение в этой комбинированной схеме и в этом конкретном порядке могут вызвать это улучшение. Хотя изобретатели не хотят быть связанными какой-либо теорией или моделью, которая могла бы объяснить эти открытия, они предполагают, что наблюдаемое улучшение в виде увеличения высоты и/или широты иммунного ответа может быть результатом того факта, что первичная вакцинация с живым аттенуированным вирусом может запускать полный или, по меньшей мере, тщательно продуманный набор иммунных ответов, включая, например, врожденный иммунный ответ, и что поэтому бустерная вакцинация RP лучше отвечает (иммунная система должным образом подготовлена), даже позволяя вакцинацию на основе тех генов, которые отключены в живой вакцине, чтобы сделать эту вакцинацию безопасной. Первичное вакцинирование RP часто дает только умеренный иммунный ответ из-за менее инфекционной/менее иммуностимулирующей природы RP. Таким образом, текущая схема обеспечивает преимущество адекватного инициирования хорошего иммунного ответа с помощью относительно безопасной (но, возможно, не столь эффективной) живой вакцины, одновременно обеспечивая хороший иммунный ответ против тех генов (т.е. соответствующих белков), которые отсутствуют в живой вакцине по соображениям безопасности, и/или любых других генов. Это означает, что текущая схема считается особенно предпочтительной для тех патогенов, которые, по всей видимости, нуждаются в живой вакцине для достаточной стимуляции иммунной системы, но которые при использовании (безопасной) живой вакцины на себе (либо однократной, либо многоразовой вакцины) не приводят к максимально возможной степени защиты от этого патогена. Примерами таких патогенов могут быть, например, патогены свиней PRRSv, PEDV, ASF (африканская чума свиней).
Открытие этого улучшения иммунного ответа может быть применяться для предпочтительного использования несколькими путями: например, оно может увеличить силу или начало иммунного ответа при вакцинации вакциной, содержащей живую аттенуированную форму вируса. Альтернативно, оно может увеличить широту иммунного ответа от вакцины, содержащей RP, такой как, например, вакцина на основе частицы репликона РНК-содержащего Альфавируса. Для обоих это относится даже к повторному введению любой из одиночных вакцин.
Кроме того, его можно применять для расширения иммунного ответа на вакцинацию либо вакциной, содержащей живую аттенуированную форму вируса, либо вакциной, содержащей RP, через введение в качестве бустерной вакцинации RP, который кодирует один или более антигенов из варианта видов вируса, использованных при первичной вакцинации. Кроме того, при бустерной вакцинации можно использовать более одного типа RP. Это может помочь обеспечить более широкий спектр иммунной защиты, в том числе против вариантов вируса. Кроме того, это может помочь сохранить защиту лицензированной вакцины, содержащей живой аттенуированный вирус, даже если патогенный вирус, находящийся в настоящее время в природе, претерпел мутации, которые в противном случае заставили бы его избежать иммунного ответа на вакцину, содержащую живой аттенуированный вирус.
Еще одно преимущество состоит в том, что RP вакцины могут быть созданы довольно быстро, что добавляет гибкости разработке способов вакцинации согласно изобретению.
Все эти полезные применения приносят большую пользу в области вакцинации, что стало возможным благодаря настоящему изобретению.
Это вовсе не было очевидным из какого-либо описания в предшествующем уровне техники, поскольку вакцина, содержащая RP, была описана только сравнительно недавно, а гетерологичные схемы вакцинации «прайм-буст», использующие схему вакцинации, как заявлено в настоящем документе, еще не описаны. Следовательно, не было никаких причин ожидать, что такое улучшение иммунного ответа может произойти от применения способа вакцинации согласно изобретению. Таким образом, у изобретателей не было предложения выбрать именно эти типы вакцин; или применить эти типы вакцины в схеме вакцинации «прайм-буст»; или применять эти типы вакцин в такой схеме вакцинации в этом конкретном порядке.
Поэтому, в одном аспекте, изобретение относится к способу вакцинации для защиты животного-мишени от инфекции или заболевания, вызванного вирусом, где способ включает
- введение указанному животному-мишени вакцины, содержащей живой аттенуированной формы указанного вируса, затем
- введение указанному животному-мишени вакцины, содержащей частицу репликона (RP), кодирующую один или более антигенов из указанного вируса.
«Способ вакцинации» относится к процедуре вакцинаций по схеме, такой как схема вакцинации «прайм-буст», против конкретного патогена, а именно: вируса определенных видов.
Следовательно, термины «прайм» и «буст», также известные как «первичная» и «бустерная» и «бустер» могут применяться для обозначения вакцинаций, применяемых в способе вакцинации по изобретению, где прайм или первичная является ранней вакцинацией животного-мишени против этого вирус, и буст, бустер или бустерная является вакцинацией против этого вируса, которую проводят после. Любая из первичных и бустерных вакцинаций может быть проведена один или более раз.
Вакцинации способа вакцинации по настоящему изобретению разделены по времени периодом, достаточным для иммунной системы животного-мишени, чтобы инициировать ответ на первичную вакцинацию. Этот период может сильно варьироваться, например примерно от 1 недели до многих лет. Это определяется характеристиками вируса и/или его болезни, против которой проводится вакцинация. Также этот интервал зависит от характеристик животного-мишени, таких как продолжительность жизни животного-мишени.
«Животным-мишенью» по изобретению является человек или животное, не являющееся человеком. Животное-мишень может потребовать получить пользу от вакцинации против инфекции или заболевания, вызванного вирусом, от которого данный способ вакцинации намеревается защитить.
Возраст, вес, пол, иммунологический статус и другие параметры животного-мишени, подлежащего вакцинации, не имеют решающего значения, хотя очевидно, что благоприятно проводить вакцинацию здоровых животных-мишеней и проводить вакцинацию как можно раньше в начале жизни.
Способ вакцинации по настоящему изобретению позволяет защитить животное-мишень на одном или нескольких этапах их жизненного цикла, например, грудного ребенка с помощью защитного молозива, младенца в первые периоды жизни, растущего животного, выращиваемого или откармливаемого на убой, беременной матери, которая затем может дать молозиво грудному потомству, пожилого животного-мишени с аттенуированной иммунной системой и т. д.
Термин «содержит» (а также варианты, такие как «содержать», «содержащий» и «включенный»), используемый здесь, относится ко всем элементам и в любой возможной комбинации, мыслимой для изобретения, которые охватываются или включены в текстовый раздел, абзац, пункт формулы и т. д., в котором используется этот термин, даже если такие элементы или комбинации явно не перечисляются; и не относится к исключению любого из таких элементов или комбинаций. Следовательно, любой такой текстовый раздел, абзац, пункт формулы и т. д. также может относиться к одному или нескольким вариантам осуществления, в которых термин «содержит» (или его варианты) заменен такими терминами, как «состоит из», «состоящий из» или «по существу состоит из».
«Введение» вакцины по способу вакцинации по изобретению животному-мишени может быть выполнено с использованием любого возможного способа и пути. Как правило, оптимальный способ введения будет определяться типом применяемой вакцины, а также характеристиками животного-мишени и вирусного заболевания, для защиты от которого она предназначена. Например: поскольку вакцина, содержащая живой аттенуированный вирус, содержит репликативный антиген, ее можно вводить с использованием метода массового применения, такого как применение питьевой воды или распыления. Альтернативно, для обеих, вакцины, содержащей живую аттенуированную форму вируса, и вакцины, содержащей RP, возможны несколько путей парентерального слизистого, местного или энтерального введения. Все они хорошо известны в данной области техники, см., например, «Veterinary vaccinology» (P. Pastoret et al. ed., 1997, Elsevier, Amsterdam, ISBN 0444819681).
«Вакциной» является хорошо известная композиция, обладающая лечебным действием и содержащая иммунологически активный компонент и фармацевтически приемлемый носитель. Носитель может быть жидким или твердым (в виде частиц). «Иммунологически активным компонентом» по изобретению в соответствующих вакцинах является вирус в живой аттенуированной форме или RP, кодирующий вирусный антиген. Вакцины стимулируют иммунную систему животного-мишени и вызывают иммунологический ответ. Ответ может исходить от врожденной и/или приобретенной иммунной системы животного-мишени и может быть клеточного и/или гуморального типа.
Вакцины в способе вакцинации по изобретению обеспечивают «защиту», или являются «защитой», «от инфекции или заболевания» за счет снижения у вакцинированного животного-мишени тяжести последующего заражения вирусом по изобретению. Например, уменьшая количество или продолжительность репликации вируса в животном-мишени, или сокращая или уменьшая количество, интенсивность или тяжесть поражений, вызванных инфекцией. Кроме того, или, следовательно, способ вакцинации эффективен для уменьшения или облегчения (клинических) симптомов заболевания, которое может быть вызвано такой инфекцией или репликацией, или ответом животного-мишени на эту инфекцию или репликацию. Точно так же, способ вакцинации обеспечивает защиту потомству вакцинированных животных-мишеней за счет пассивной иммунизации, обеспечиваемой антителами, полученными от матери, например, при потребления молозива или при резорбции яичного желтка.
Эффективность вакцины можно определить, например, путем отслеживания иммунологического ответа после вакцинации и заражения инфекцией, например, путем отслеживания признаков заболевания животного-мишени, клинических оценок или путем повторного выделения вирусного патогена и сравнения этих результатов с реакцией на провокационную вакцинацию, наблюдаемую у ложно-вакцинированных животных-мишеней.
Для вакцин в способе вакцинации по изобретению доза или количество иммунологически активного компонента могут быть определены хорошо известными способами, например: живой аттенуированный вирус или RP может быть титрован, например у животных, в оплодотворенных яйцеклетках или в подходящих клетках-хозяевах в культуре. Затем результат выражают, например, в виде бляшкообразующих единиц (бое), TCID50 или EID50 на миллилитр вакцины или в количестве RP/мл. Альтернативно, антиген можно количественно определить с помощью серологического или биохимического теста, такого как ELISA или AlphaLisa™, и выразить его в относительных единицах по сравнению с соответствующим эталонным стандартом. Все это хорошо известно в данной области техники.
Способ вакцинации по изобретению может применяться в качестве профилактического, метафилактического или терапевтического лечения.
«Вирус» для изобретения относится к определенному виду вирусов для изобретения. Обычно виды вирусов определяются и таксономически характеризуются путем отнесения к комбинации фенотипических характеристик, таких как морфология, тип нуклеиновой кислоты, способ репликации, организмы-хозяева, а также по типу заболевания, которое вирус может вызвать.
Вакцина, содержащая живую аттенуированную форму вируса, и вакцина, содержащая RP, используемые в способе вакцинации по изобретению, относятся к вирусу для изобретения в том смысле, что живая вакцина включает аттенуированную форму этого вида вируса, а RP кодирует хотя бы один антигенный белок от этого вида вируса.
Специалисту будет понятно, что используемые здесь таксономические названия, такие как название вида вируса, относятся к таксономической группе, к которой в настоящее время отнесен микроорганизм. Однако эта таксономическая классификация может измениться со временем, поскольку новые идеи могут привести к переклассификации в новую или другую таксономическую группу. Однако, поскольку при этом изменяется не сам микроорганизм или его антигенный репертуар, а только его научное название или классификация, такие переклассифицированные микроорганизмы остаются в пределах объема изобретения.
Ссылка на вид вируса для изобретения включает любой вирус внутри этого вида, включая любой вирус, который является вариантом внутри этих видов вируса, например, в отношении вариации серотипа, биотипа, патотипа или генотипа внутри этих видов. Информацию о вирусах и заболеваниях можно получить, например, из таких справочников, как Fields Virology, 6th ed., ISBN: 9781451105636, и "The Merck veterinary manual", 10th ed., 2010, C.M. Kahn edt., ISBN: 091191093X.
Живая аттенуированная форма определенных видов вируса может быть получена несколькими способами: для многих вирусных заболеваний человека или животных вакцины на основе живой аттенуированной формы такого вируса уже доступны. Примеры лицензированной вакцины на основе живой аттенуированной формы вируса слишком многочисленны, чтобы приводить их, как в медицине, так и в ветеринарии. Они могут быть применены в способе вакцинации по изобретению. Специалист в данной области техники более чем способен оценить, и каким образом вакцина, содержащая живую аттенуированную форму вируса, может быть включена в способ вакцинации по настоящему изобретению, и при необходимости внести любые стандартные изменения или оптимизации. См. P. Pastoret et al., выше.
Альтернативно, патогенная или аттенуированная форма вируса определенного вида вируса может быть получена из различных источников, например в качестве полевого изолята из организма в дикой природе или на ферме, или из различных лабораторий, (депозитарных) учреждений или (ветеринарных) университетов. Если аттенуированная форма вируса недоступна, патогенная форма этого вируса может быть подвергнута способам ее ослабления, например, путем пассирования in vivo или in vitro, или с помощью методов in vitro, таких как химический или физический мутагенез, или с помощью технологии рекомбинантной ДНК. Затем уровень ослабления можно оценить in vitro и in vivo. Все это хорошо известно в данной области техники.
«Частицы репликона РНК-содержащего Альфавируса (RP)» хорошо известны как одноцикловая инфекционная альфавирусная структура, которая является дефектной по репликации из-за отсутствия структурных генов белка в ее геноме. Геном может кодировать гетерологичный ген из своего 26S субгеномного промотора. RP может выполнять один цикл репликации и таким образом доставлять и экспрессировать гетерологичный антиген иммунной системе животного-мишени.
Согласно настоящему изобретению ген, кодируемый RP, является геном, который обычно является гетерологичным (т.е. не нативным) по отношению к виду родительского вируса, от которого получена структура репликона.
RP, кодирующий гетерологичный вирусный ген определенного вида вируса, может уже быть доступен, например, коммерчески доступная RP вакцина РНК-содержащего Альфавируса. Альтернативно, он может быть получен с использованием хорошо известных способов путем включения гетерологичной нуклеиновой кислоты, кодирующей иммунопротекторный антиген, в каркас вирусного репликона, такой как, например, от ТС-83 VEE Альфавируса. Ген(ы) вирусного антигена затем может быть экспрессирован с (26S-Альфавирусного) субгеномного промотора, и транскрибированный РНК репликон может быть упакован в RP через экспрессию структурных белков упаковывающими клеточными линиями или через котрансфекцию в подходящие клетки-хозяева РНК репликона и одной или нескольких «хелперных» РНК, кодирующих структурные белки. Создание VEE TC-83 РНК частиц репликона описана, например, в US 9,441,247 и US 8,460,913. Общие молекулярно-биологические методы, включающие клонирование, трансфекцию, рекомбинацию, селекцию и амплификацию, например, очень подробно объясняются в стандартных учебниках, таких как Sambrook & Russell: «Molecular cloning: a laboratory manual» (2001, Cold Spring Harbour Laboratory Press; ISBN: 0879695773); Ausubel et al., in: Current Protocols in Molecular Biology (J. Wiley and Sons Inc., NY, 2003, ISBN: 047150338X); C. Dieffenbach & G. Dveksler: «PCR primers: a laboratory manual» (CSHL Press, ISBN 0879696540); и «PCR protocols», by: J. Bartlett and D. Stirling (Humana press, ISBN: 0896036421).
Вакцина, содержащая RP, может быть существующей вакциной против выбранных видов вирусов. Альтернативно, такая RP вакцина может быть разработана на основе существующих или недавно созданных RP с использованием хорошо известных методов.
RP по настоящему изобретению «кодируют один или более антигенов» вируса по настоящему изобретению. Этого можно добиться разными способами. Например, такие RP могут кодировать полицистронную рамку считывания или могут кодировать отдельные гены, например с использованием одной или нескольких дополнительных копий субгеномного промотора, чтобы обеспечить экспрессию отдельного дополнительного белка(ов).
Альтернативно или дополнительно, вакцина, содержащая RP по изобретению, может содержать более одного типа RP, например, кодирующих один или более гетерологичных антигенов.
Гетерологичный антиген(ы), кодируемый RP по изобретению, происходит «от» видов вируса по изобретению, при этом термин «от» указывает на то, что нуклеиновая кислота, кодирующая указанный антиген, произошла от вируса этого вида. Нуклеиновая кислота могла быть получена из образца вируса или его части или могла быть синтезирована на основе информации о последовательности от этого вируса. Впоследствии кодирующая последовательность нуклеиновой кислоты могла быть подвергнута генетическим манипуляциям, чтобы получить модификацию, усечение и/или удлинение аминокислотной последовательности экспрессируемого белкового антигена.
Подробности вариантов осуществления и дополнительных аспектов изобретения будут описаны ниже.
Способ вакцинации по настоящему изобретению особенно полезен в ветеринарной практике из-за относительно низкой стоимости его компонентов, простоты применения и усиленного и/или широкого иммунного ответа, который он может вызвать.
Следовательно, в варианте осуществления способа вакцинации по изобретению животным-мишенью является животное (не являющееся человеком), имеющее ветеринарную ценность. Предпочтительно, животным, имеющим ветеринарную ценность, является животное, выбранное из крупного рогатого скота, свиней, коз, овец, оленей, собак, кошек, лошадей и птиц. Более предпочтительно, животное выбрано из крупного рогатого скота, свиней, овец, собак, кошек, лошадей и птиц. Еще более предпочтительно, животное выбирают из свиней, собак, кошек и птиц. Еще более предпочтительно, животное выбирают из свиней и птиц. Наиболее предпочтительным, животным является свинья.
В варианте осуществления способа вакцинации по изобретению, вирусом является вирус, имеющий значение в ветеринарной практике. Предпочтительно, вирусом является патоген животного. Более предпочтительно, вирусом является патоген животного, выбранного из крупного рогатого скота, свиней, коз, овец, оленей, собак, кошек, лошадей и птиц. Более предпочтительно, вирусом является патоген животного, выбранного из крупного рогатого скота, свиней, овец, собак, кошек, лошадей и птиц. Еще более предпочтительно, вирусом является патоген животного, выбранного из свиней, собак, кошек и птиц. Еще более предпочтительно, вирусом является патоген животного, выбранного из свиней и птиц. Наиболее предпочтительно, вирусом является патоген свиней.
В настоящем изобретении, «свинья» относится к животным семейства Suidae, и предпочтительно к животным рода Sus, например: дикая или домашняя свинья, кабан, бабирусса или бородавочник. Сюда также входят свиньи, обозначенные произвольным наименованием, относящимся к их полу, возрасту или размеру, например: свиноматка, хряк, домашняя свинья, подсвинок, отъемыш, откормочное животное, откормочное животное, кормящее животное или (молочный) поросенок.
В варианте осуществления способа вакцинации по изобретению, где животным-мишенью является свинья, свинью предпочтительно выбирают из свиноматки, молочного поросенка, свиней на откорме, кормящих свиней и свиней на откорме.
В варианте осуществления способа вакцинации по изобретению, в котором вирусом является патоген свиней, вирус предпочтительно выбран из: вируса эпизоотической диареи свиней, вируса репродуктивного и респираторного синдрома свиней, вируса псевдобешенства, цирковируса свиней, парвовируса свиней, вируса классической чумы свиней, вируса африканской чумы свиней, вируса свиного гриппа, свиного респираторного коронавируса, вируса ящура, вируса трансмиссивного гастроэнтерита, вирус цитомегаловируса свиней, ротавируса свиней, вируса оспы свиней и вируса везикулярного стоматита.
В варианте осуществления способа вакцинации по изобретению, где вирусом является патоген свиней, вирус предпочтительно принадлежит к виду из отряда Nidovirales. Более предпочтительно, вирус принадлежит к виду семейства Arteriviridae или семейства Coronaviridae. Еще более предпочтительно вирус принадлежит к видам PEDV или PRRSV.
В варианте осуществления способа вакцинации по изобретению, вирусом является PEDV, и RP кодирует PEDV шиповидный белок.
В варианте осуществления способа вакцинации по изобретению, вирусом является PRRSV, и RP кодирует PRRSV GP5 белок (Гликопротеин 5, также называемый: основной оболочечный белок или ORF 5 белок).
В варианте осуществления способа вакцинации по изобретению, где вирусом является PEDV, животным-мишенью является беременная свиноматка.
В варианте осуществления способа вакцинации по изобретению, где вирусом является PRRSV, животным-мишенью является свинья; свинья может быть любого возраста, от дня рождения и старше. Свиньей может быть беременная свиноматка.
Для способа вакцинации по изобретению, вакцинация проводится способом, который совместим с характеристиками вакцины и животного-мишени.
Следовательно, в варианте осуществления способа вакцинации по изобретению вакцина, содержащая живую аттенуированную форму вируса, вводится через слизистые оболочки. Предпочтительно, введение через слизистую оболочку осуществляется с помощью питьевой воды, спрея, глазных капель, интраназального или перорального пути.
В варианте осуществления способа вакцинации по изобретению, где вирусом является PRRSV, вакцина, содержащая живую аттенуированную форму PRRSV, предпочтительно вводится парентерально; более предпочтительно внутримышечно, внутрикожно или подкожно.
В варианте осуществления способа вакцинации по изобретению, вакцина, содержащая RP, вводится парентерально, инъекцией в кожу или через кожу. Предпочтительно, парентеральное введение является внутримышечным, внутривенным, внутрибрюшинным, внутрикожным, подслизистым или подкожным. Более предпочтительным путем парентерального введения является внутримышечный, внутрикожный или подкожный путь.
Схема способа вакцинации по изобретению предпочтительно интегрирована в существующие схемы вакцинации других вакцин, которые могут потребоваться животному-мишени, чтобы уменьшить стресс для животного-мишени и снизить затраты на рабочую силу. Эти другие вакцины можно вводить одновременно, параллельно или последовательно, способом, совместимым с их зарегистрированным использованием.
Первичную и бустерную вакцинации для способа вакцинации по изобретению вводят в дозе и объеме, которые являются иммунологически эффективными и приемлемыми для животного-мишени.
Доза живого аттенуированного вируса на животное-мишень предпочтительно составляет от 10 до 1×10^8 инфекционных вирусов; она может быть измерена в БОЕ, TCID50 или EID50, в зависимости от того, какой способ является наиболее подходящим для конкретного вида вируса.
Доза RP на животное-мишень предпочтительно составляет от 1×10^2 до 1×10^12 RP. Она может быть измерена в TCID50 или RP/мл.
Объем вводимой вакцинации составляет от 0,01 до 10 мл на одно введение животному-мишени.
Все это хорошо известно в данной области техники.
По изобретению, перечисленные диапазоны также включают указанные конечные точки.
Как указано, способ вакцинации по изобретению особенно предпочтителен, когда бустерная вакцинация RP кодирует антиген вируса, который является вариантом внутри вида живого аттенуированного вируса, используемого для первичной вакцинации, поскольку это расширяет иммунный ответ от животного-мишени.
Следовательно, в варианте осуществления способа вакцинации по изобретению, по меньшей мере, один вирусный антиген, кодируемый RP, происходит от вируса, который является вариантом внутри видов живого аттенуированного вируса.
По изобретению термин «вариант» используется в отношении видов вируса, от которого должен защищать способ вакцинации по изобретению. Таким вариантом является вирус того же вида, что и вирус, который используется в аттенуированной форме для первичной вакцинации, но не тот же вирус. В этом контексте «не тот же» может относиться к незначительной разнице, например, когда вариант вируса принадлежит к другому штамму или изоляту, или может относиться к более выраженному различию, например когда вариант вируса отличается по своему серотипу, биотипу, патотипу и/или генотипу. Различие также может быть результатом генетических манипуляций с одним или несколькими гетерологичными генами, кодируемыми RP.
Как описано, очень выгодным в этом отношении также является использование различных типов RP в бустерной RP вакцине, например, использование RP, кодирующих более одного антигена видов вируса по изобретению, или использование более одного типа RP, например, где каждый кодирует разные антигены вируса по изобретению или кодирует один и тот же антиген, но из разных вариантов вируса; или даже где каждый из них кодирует несколько гетерологичных антигенов.
Следовательно, в варианте осуществления вакцинации по изобретению вакцина, содержащая RP, содержит RP, которые кодируют более одного антигена видов вируса по изобретению.
В варианте способа осуществления вакцинации по изобретению, вакцина, содержащая RP, включает, по меньшей мере, один дополнительный RP, кодирующий один или более антигенов из видов вирусов по изобретению. Предпочтительно, разные RP кодируют разные антигены видов вируса по изобретению. Альтернативно, или дополнительно, RP кодируют тот же антиген, но из вариантов среди видов вируса по изобретению.
В варианте осуществления способа вакцинации по изобретению, одна или обе вакцины содержат дополнительное иммуностимулирующее соединение.
Предпочтительно дополнительное иммуностимулирующее соединение выбрано из цитокина, иммуностимулирующей нуклеиновой кислоты, содержащей неметилированный CpG, и адъюванта.
Такие иммуностимулирующие молекулы хорошо известны в данной области.
В варианте осуществления способа вакцинации по изобретению, иммуностимулирующей нуклеиновой кислотой, содержащей неметилированный CpG является одна или несколько, выбранных из WO 2012/089.800 (X4 семейство), WO 2012/160.183 (X43 семейство), и WO 2012/160.184 (X23 семейство).
В варианте осуществления способа вакцинации по изобретению, одна или обе вакцины содержат адъювант. Предпочтительно, адъювантом является масляный адъювант.
В предпочтительном варианте осуществления, одна или обе вакцины содержат адъювант на основе минерального масла.
В альтернативном предпочтительном варианте осуществления, одна или обе вакцины содержат адъювант на основе не минерального масла.
По изобретению «минеральное масло» означает, что соответствующее масло происходит из минерального источника, обычно из нефти; «не минеральное масло» имеет синтетическое, полусинтетическое, животное или растительное происхождение.
В варианте осуществления способа вакцинации по изобретению, вакцина, содержащая RP, включает масляный адъювант, где масляный адъювант включает минеральное масло и одно или несколько не минеральных масел. Более предпочтительно, масляный адъювант бустерной RP вакцины включает жидкое парафиновое масло и ацетат витамина Е. Еще более предпочтительно вакцина, содержащая RP, включает адъювант Xsolve™.
В варианте осуществления способа вакцинации по изобретению, вакцина, содержащая RP, включает масляный адъювант, где масляный адъювант включает более одного не минерального масла. Более предпочтительно, масляный адъювант бустерной RP вакцины включает сквалан и ацетат витамина Е. Еще более предпочтительно, вакцина, содержащая RP, включает адъювант SVEA™.
Для изобретения: жидкое парафиновое масло имеет номер CAS: 8042-47-5; сквалан имеет номер CAS 111-01-3; и ацетат витамина E имеет номер CAS: 58-95-7. В варианте осуществления, ацетатом витамина E является dl-α-токоферолацетат.
В варианте осуществления способа вакцинации по изобретению, масляный адъювант составляется с одной или обеими вакцинами в виде эмульсии воды и масла. Предпочтительно, эмульсией является эмульсия «масло в воде». В альтернативном предпочтительном варианте осуществления, эмульсией является эмульсия «вода в масле».
В варианте осуществления способа вакцинации по изобретению, где вакцина, содержащая RP, включает масляный адъювант, адъювант предпочтительно комбинируют с RP незадолго до введения, например в течение 1 дня, 6 часов, 4 часов или в течение 2 часов до введения, в указанном порядке предпочтения.
В способе вакцинации по изобретению, одна или обе вакцины могут содержать один или более дополнительных эксципиентов, которые помогают, например, в составлении, стабилизации или доставке этой вакцины. Примерами являются стабилизаторы, консерванты и модификаторы вязкости.
В варианте осуществления способа вакцинации по изобретению, одна или обе вакцины включают дополнительный эксципиент, выбранный из стабилизаторов, консервантов и модификаторов вязкости.
Предпочтительным стабилизатором является один или более стабилизаторов, выбранных из декстрана, глицерина, желатина, аминокислот, антиоксидантов и буферов.
Предпочтительным консервантом является один или более консервантов, выбранных из тиомерсала, феноксиэтанола, формальдегида и антибиотиков.
Предпочтительным модификатором вязкости является один или более модификаторов, выбранных из поливинилпирролидона и Gantrez™.
В варианте осуществления способа вакцинации по изобретению, вакцина, содержащая живую аттенуированную форму вируса, содержит модификатор вязкости, выбранный из поливинилпирролидона и Gantrez™.
По изобретению, Gantrez™ (Ashland, Covington, KY, USA) представляет собой семейство полимеров и сополимеров винилового эфира.
В варианте осуществления способа вакцинации по изобретению, за вакцинацией вакциной, содержащей живую аттенуированную форму вируса, следует вакцинация вакциной, содержащей RP, в течение периода времени от 1 недели до 80 лет.
Предпочтительно, период времени составляет от 1 недели до 3 лет, от 1 недели до 2 лет, от 1 недели до 1 года, от 1 недели до 6 месяцев, от 1 недели до 3 месяцев, от 1 недели до 2 месяцев, от 1 недели до 1 месяца, от 1 недели до 4 недель, от 1 недели до 3 недель или даже от 1 недели до 2 недель в этом порядке предпочтения.
Предпочтительно, период времени выбирается из: 2 лет, 1 года, 6 месяцев, 4 месяцев, 3 месяцев, 2 месяцев, 1 месяца, 4 недель, 3 недель, 2 недель и 1 недели.
В предпочтительном варианте осуществления способа вакцинации по изобретению, за вакцинацией вакциной, содержащей живую аттенуированную форму вируса, следует вакцинация вакциной, содержащей RP, в течение периода времени, по меньшей мере, одной недели. Более предпочтительно в течение периода времени, выбранного из: по крайней мере, двух недель, по крайней мере, трех недель, по крайней мере, 4 недель, по крайней мере, 1 месяца, по крайней мере, 2 месяцев, по крайней мере, 3 месяцев, по крайней мере, 6 месяцев, по крайней мере, 1 года и, по крайней мере, 2 лет.
В варианте осуществления способа вакцинации по изобретению, вирусом, на котором основана RP вакцина, является альфавирус, и предпочтительно, его разновидностью является VEEV.
Предпочтительно VEEV происходит из штамма TC-83.
В варианте осуществления способа вакцинации по изобретению, применяют одно или несколько из условий, выбранных из группы, состоящей из:
- животным-мишенью является животное, имеющее ветеринарную ценность. Предпочтительно, животным, имеющим ветеринарную ценность, является животное, выбранное из крупного рогатого скота, свиней, коз, овец, оленей, собак, кошек, лошадей и птиц. Более предпочтительно, животное выбрано из крупного рогатого скота, свиней, овец, собак, кошек, лошадей и птиц. Еще более предпочтительно, животное выбирают из свиней, собак, кошек и птиц. Еще более предпочтительно, животное выбирают из свиней и птиц. Наиболее предпочтительным, животным является свинья;
- вирусом является вирус, имеющий значение в ветеринарной практике. Предпочтительно, вирусом является патоген животного. Более предпочтительно, вирусом является патоген животного, выбранного из крупного рогатого скота, свиней, коз, овец, оленей, собак, кошек, лошадей и птиц. Более предпочтительно, вирусом является патоген животного, выбранного из крупного рогатого скота, свиней, овец, собак, кошек, лошадей и птиц. Еще более предпочтительно, вирусом является патоген животного, выбранного из свиней, собак, кошек и птиц. Еще более предпочтительно, вирусом является патоген животного, выбранного из свиней и птиц. Наиболее предпочтительно, вирусом является патоген свиней;
- где животным-мишенью является свинья, свинью предпочтительно выбирают из свиноматки, молочного поросенка, свиней на откорме, кормящих свиней и свиней на откорме;
- вирусом является патоген свиней, вирус предпочтительно выбран из: вируса эпизоотической диареи свиней, вируса репродуктивного и респираторного синдрома свиней, вируса псевдобешенства, цирковируса свиней, парвовируса свиней, вируса классической чумы свиней, вируса африканской чумы свиней, вируса свиного гриппа, свиного респираторного коронавируса, вируса ящура, вируса трансмиссивного гастроэнтерита, вирус цитомегаловируса свиней, ротавируса свиней, вируса оспы свиней и вируса везикулярного стоматита;
- вирус предпочтительно принадлежит к виду из отряда Nidovirales. Более предпочтительно, вирус принадлежит к виду семейства Arteriviridae или семейства Coronaviridae. Еще более предпочтительно вирус принадлежит к видам PEDV или PRRSV;
- вирусом является PEDV, и RP кодирует PEDV шиповидный белок.
- вирусом является PRRSV, и RP кодирует один или более из PRRSV гликопротеинов, такой как, например, GP5 белок;
- вирусом является PEDV, животным-мишенью является беременная свиноматка.
- вирусом является PRRSV, животным-мишенью является свинья; свинья может быть любого возраста, от дня рождения и старше. Свиньей может быть беременная свиноматка.
- введение через слизистую оболочку осуществляется с помощью питьевой воды, спрея, глазных капель, интраназального или перорального пути;
- вирусом является PRRSV, вакцина, содержащая живую аттенуированную форму PRRSV, предпочтительно вводится парентерально; более предпочтительно внутримышечно, внутрикожно или подкожно;
- вакцина, содержащая RP, вводится парентерально, инъекцией в кожу или через кожу. Предпочтительно, парентеральное введение является внутримышечным, внутривенным, внутрибрюшинным, внутрикожным, подслизистым или подкожным. Более предпочтительным путем парентерального введения является внутримышечный, внутрикожный или подкожный путь;
- по меньшей мере, один вирусный антиген, кодируемый RP, происходит из вируса, который является вариантом видов живого аттенуированного вируса;
- вакцина, содержащая RP, содержит RP, которые кодируют более одного антигена видов вируса по изобретению;
- вакцина, содержащая RP, включает, по меньшей мере, один дополнительный RP, кодирующий один или более антигенов из видов вирусов по изобретению. Предпочтительно, разные RP кодируют разные антигены видов вируса по изобретению. Альтернативно, или дополнительно, RP кодируют тот же антиген, но из вариантов среди видов вируса по изобретению;
- одна или обе вакцины содержат дополнительное иммуностимулирующее соединение. Предпочтительно дополнительное иммуностимулирующее соединение выбрано из цитокина, иммуностимулирующей нуклеиновой кислоты, содержащей неметилированный CpG, и адъюванта. Предпочтительно, иммуностимулирующей нуклеиновой кислотой, содержащей неметилированный CpG является одна или несколько, выбранных из WO 2012/089.800 (X4 семейство), WO 2012/160.183 (X43 семейство), и WO 2012/160.184 (X23 семейство);
- одна или обе вакцины содержат адъювант. Предпочтительно, адъювантом является масляный адъювант;
- одна или обе вакцины содержат адъювант на основе минерального масла. В альтернативном предпочтительном варианте осуществления, одна или обе вакцины содержат адъювант на основе не минерального масла;
- вакцина, содержащая RP, включает масляный адъювант, где масляный адъювант включает минеральное масло и одно или несколько не минеральных масел. Более предпочтительно, масляный адъювант бустерной RP вакцины включает жидкое парафиновое масло и ацетат витамина Е. Еще более предпочтительно вакцина, содержащая RP, включает адъювант Xsolve™;
- вакцина, содержащая RP, включает масляный адъювант, где масляный адъювант включает более одного не минерального масла. Более предпочтительно, масляный адъювант бустерной RP вакцины включает сквалан и ацетат витамина Е. Еще более предпочтительно, вакцина, содержащая RP, включает адъювант SVEA™;
- ацетатом витамина E является dl-α-токоферолацетат;
- масляный адъювант составляется с одной или обеими вакцинами в виде эмульсии воды и масла. Предпочтительно, эмульсией является эмульсия «масло в воде». В альтернативном предпочтительном варианте осуществления, эмульсией является эмульсия «вода в масле»;
- адъювант комбинируют с RP незадолго до введения, например в течение 1 дня, 6 часов, 4 часов или в течение 2 часов до введения;
- одна или обе вакцины включают дополнительный эксципиент, выбранный из стабилизаторов, консервантов и модификаторов вязкости. Предпочтительным стабилизатором является один или более стабилизаторов, выбранных из декстрана, глицерина, желатина, аминокислот, антиоксидантов и буферов. Предпочтительным консервантом является один или более консервантов, выбранных из тиомерсала, феноксиэтанола, формальдегида и антибиотиков. Предпочтительным модификатором вязкости является один или более модификаторов, выбранных из поливинилпирролидона и Gantrez™;
- вакцина, содержащая живую аттенуированную форму вируса, содержит модификатор вязкости, выбранный из поливинилпирролидона и Gantrez™;
- за вакцинацией вакциной, содержащей живую аттенуированную форму вируса, следует вакцинация вакциной, содержащей RP, в течение периода времени от 1 недели до 80 лет. Предпочтительно, период времени составляет от 1 недели до 3 лет, от 1 недели до 2 лет, от 1 недели до 1 года, от 1 недели до 6 месяцев, от 1 недели до 3 месяцев, от 1 недели до 2 месяцев, от 1 недели до 1 месяца, от 1 недели до 4 недель, от 1 недели до 3 недель или даже от 1 недели до 2 недель в этом порядке предпочтения. Предпочтительно, период времени выбирается из: 2 лет, 1 года, 6 месяцев, 4 месяцев, 3 месяцев, 2 месяцев, 1 месяца, 4 недель, 3 недель, 2 недель и 1 недели;
- за вакцинацией вакциной, содержащей живую аттенуированную форму вируса, следует вакцинация вакциной, содержащей RP, в течение периода времени, по меньшей мере, одной недели. Более предпочтительно в течение периода времени, выбранного из: по крайней мере, двух недель, по крайней мере, трех недель, по крайней мере, 4 недель, по крайней мере, 1 месяца, по крайней мере, 2 месяцев, по крайней мере, 3 месяцев, по крайней мере, 6 месяцев, по крайней мере, 1 года и, по крайней мере, 2 лет; и
- вирусом, на котором основана вакцина, содержащая RP РНК-содержащего Альфавируса, является VEEV. Предпочтительно VEEV происходит из штамма TC-83.
В варианте осуществления вакцинации по изобретению животным-мишенью является свинья, вирусом является PEDV, свиньей является беременная свиноматка, вакцина, содержащая живую аттенуированную форма вируса, включает модификатор вязкости, и вирусом вакцины, содержащий RP РНК-содержащего Альфавируса является VEEV.
В варианте осуществления способа вакцинации по изобретению, животным-мишенью является свинья, вирусом является PRRSV, вирусом вакцины, содержащий RP РНК-содержащего Альфавируса является VEEV, и вакцина, содержащая RP, содержит масляный адъювант.
Способ вакцинации по изобретению также может быть сформулирован в другом формате, например: с помощью схемы вакцинации, которую он воплощает, или с помощью медицинского применения каждой вакцины, используемой в этом способе.
Следовательно, в дополнительном аспекте изобретение относится к схеме вакцинации «прайм-буст» для защиты животного-мишени от инфекции или заболевания, вызываемого вирусом, где схема вакцинации включает введение указанному животному-мишени вакцины, содержащей живую аттенуированную форма указанного вируса с последующим введением животному-мишени вакцины, содержащей RP, кодирующие один или более антигенов из указанного вируса.
В дополнительном аспекте изобретение относится к вакцине, содержащей живую аттенуированную форма вируса, для использования в схеме вакцинации «прайм-буст» для защиты животного-мишени от инфекции или заболевания, вызванного указанным вирусом, где указанная схема включает:
- вакцинацию вакциной, содержащей живую аттенуированную форму вируса, за которой следует
- вакцина, содержащая RP, кодирующие один или более антигенов указанного вируса.
В дополнительном аспекте изобретение относится к вакцине, содержащей RP, кодирующие один или более антигенов вируса, для использования в схеме вакцинации «прайм-буст» для защиты животного-мишени от инфекции или заболевания, вызванного указанным вирусом, где указанная схема включает:
- вакцинацию вакциной, содержащей живую аттенуированную форму указанного вируса, за которой следует
- вакцинация вакциной, содержащей RP.
В другом аспекте изобретение относится к применению живой аттенуированной формы вируса для производства вакцины для защиты животного-мишени от инфекции или заболевания, вызванного указанным вирусом, где указанную вакцину вводят по схеме вакцинации «прайм-буст», где указанная схема включает:
- введение вакцины, содержащей живую аттенуированную форму вируса, за которой следует
- введение вакцины, содержащей RP, кодирующие один или более антигенов указанного вируса.
И в еще одном аспекте изобретение относится к применению RP, кодирующих один или более антигенов вируса, для производства вакцины для защиты животного-мишени от инфекции или заболевания, вызванного указанным вирусом, где указанную вакцину вводят по схеме вакцинации «прайм-буст», где указанная схема включает:
- введение вакцины, содержащей живую аттенуированную форму указанного вируса, за которой следует
- введение вакцины, содержащей RP.
В предпочтительных вариантах этих дополнительных аспектов изобретения один или более или все признаки этих дополнительных аспектов, такие как схема вакцинации «прайм-буст», вирус, вакцина, содержащая живой аттенуированный вирус, вакцина, содержащая RP, временной интервал между первичной и бустерной вакцинациями, защита, животного-мишени, инфекция, заболевание и введение, все являются такими, как определены в любом одном или нескольких вариантах осуществления, как описано в настоящем документе.
Для изобретения, использование живой аттенуированной формы вируса или RP для производства по изобретению осуществляется способом, позволяющим использовать произведенные вакцины в медицинских целях. Обычно это касается использования оборудования и ингредиентов, которые являются фармацевтически приемлемыми, и соответствия нормам качества, таким как стандарты надлежащей производственной практики. Это означает, что различные этапы производственного процесса будут контролироваться соответствующими тестами, например, иммунологическими тестами на качество и количество антигенов; микробиологическими тестами на стерильность и отсутствие посторонних агентов; и, наконец, исследованиями на животных для подтверждения эффективности и безопасности вакцины. После завершения этих тестов вакцина может быть выпущена в продажу.
Все это хорошо известно специалисту в данной области техники, а общие методы и соображения, относящиеся к приготовлению вакцины, описаны, например, в правительственных постановлениях, таких как European Pharmacopoeia, 9 и 21 CFR, и в справочниках, таких как P. Pastoret et al. (выше) и «Remington: the science and practice of pharmacy» (2000, Lippincot, USA, ISBN: 683306472).
Вакцины для использования в способе вакцинации по изобретению, вакцина, содержащая живую аттенуированную форму вируса, и вакцина, содержащая RP, могут поставляться на рынок отдельно, а затем могут использоваться в способе вакцинации по изобретению. Альтернативно, вакцины могут поставляться в комбинации, которая облегчает их использование в способе вакцинации по изобретению.
Следовательно, в дополнительном аспекте изобретение относится к набору из частей, содержащему, по меньшей мере, два контейнера, где, по меньшей мере, один контейнер содержит вакцину, содержащую живую аттенуированную форму вируса, как определено в изобретении, и, по меньшей мере, один контейнер содержит вакцину, содержащую RP, кодирующие вирусный антиген, как определено в изобретении.
В предпочтительных вариантах осуществления набора из частей настоящего изобретения один или более или все признаки набора из частей определены в любом одном или нескольких вариантах осуществления, как описано в настоящем документе.
В предпочтительном варианте осуществления, по меньшей мере, один контейнер, содержащий вакцину, содержащую живую аттенуированную форму вируса, содержит указанную вакцину в виде лиофилизата, который может быть разбавлен разбавителем незадолго до введения.
В предпочтительном варианте осуществления, по меньшей мере, один контейнер, содержащий вакцину, содержащую RP, содержит указанную вакцину в виде лиофилизата, который может быть разбавлен разбавителем незадолго до введения.
В альтернативном варианте осуществления, по меньшей мере, один контейнер, содержащий вакцину, содержащую RP, содержит указанную вакцину в водном растворе; водный раствор, предпочтительно содержит буфер; и водный раствор с указанной вакциной предпочтительно хранить охлажденным или замороженным до использования. В одном варианте осуществления, водный раствор с указанной вакциной представляет собой раствор восстановленного RP, полученного при смешивании лиофилизата RP и подходящего водного разбавителя.
В варианте осуществления, в котором, по меньшей мере, один контейнер содержит вакцину, содержащую RP, в виде лиофилизата, набор из частей по изобретению может включать дополнительный контейнер, который может содержать подходящий разбавитель для восстановления лиофилизированной вакцины, содержащей RP. В предпочтительном варианте осуществления, разбавителем является водный раствор, предпочтительно содержащий буфер и/или стабилизатор и воду фармацевтически приемлемого качества.
В альтернативном предпочтительном варианте осуществления разбавителем является эмульсия «масло-в-воде» для восстановления и адъювирования вакцины, содержащей RP.
В варианте осуществления набора из частей по изобретению, набор содержит инструкции по использованию набора и/или его составных частей. В предпочтительных вариантах осуществления, инструкции по применению предоставляются на одной или нескольких составляющих частей набора или вместе с ними; либо предоставляются в виде ссылки на инструкции в электронной форме, например информацию, которую можно просмотреть или загрузить с веб-сайта в Интернете от производителя или дистрибьютора набора.
В одном варианте осуществления, набор из частей представляет собой коробку, содержащую, по меньшей мере, два контейнера и содержащую инструкции по применению, которые отображаются на носителе информации (например, карточке или листовке), находящейся на коробке, вместе с ней или внутри нее.
В варианте осуществления набора из частей, набор также может быть предложением составляющих частей (относящихся к коммерческой продаже), например, на веб-сайте в Интернете, для использования в способе вакцинации по настоящему изобретению.
Для специалиста в данной области техники вполне доступна дальнейшая оптимизация способа, вакцины, применения, схемы и набора по настоящему изобретению. Обычно это включает в себя точную настройку эффективности вакцин и их введения для адаптации к конкретным условиям, которые могут быть применимы. Это может быть сделано адаптацией дозы, объема, содержания антигена или адъюванта вакцины или адаптацией пути или способа введения. Вся такая точная настройка может быть выполнена с использованием обычных методов и материалов, известных в данной области техники.
В любом из описанных выше вариантов осуществления настоящего изобретения предпочтительно использование частиц репликона РНК-содержащего Альфавируса.
Далее изобретение будет описано с помощью следующих, не ограничивающих, примеров.
ПРИМЕРЫ
Пример 1: Гомологичная вакцинация «прайм-буст» от PRRSV
Существующая PRRSV живая вакцина Porcilis® PRRS основана на европейском изоляте PRRSV, штамм DV, генотип 1 PRRSV. Было обнаружено, что иногда она является неэффективной при тестировании против гетерологичного контрольного штамма, что является общей проблемой для всех вакцин на основе аттенуированного живого PRRSV. Были исследованы различные способы повышения эффективности этой вакцинации, такие как гомологичная схема вакцинации «прайм-буст».
В эксперименте вакцинация-заражение применяли 3 группы по 16 свиней в возрасте приблизительно 5 недель, и PRRSV-антитело отрицательных на день 1 вакцинации. Две группы получали вакцинацию живым аттенуированным вирусом Porcilis PRRS, либо один, либо два раза с 2-недельным интервалом. Одна группа оставалась не вакцинированной. Всех свиней заражали инфекцией PRRSV свежего немецкого изолята генотипа 1, через 4,5 недели после вакцинации, соответственно после первой вакцинации. Доза заражения составляла 5,3 Log10 TCID50 вируса, по 2 мл на животное (1 мл в каждую ноздрю). Образцы крови брали в дни вакцинации и в 0, 4, 7, 10, 14 и 20 дни после заражения. Вирусемию PRRSV определяли как ЦПЭ на клетках PAM, как описано ниже.
На фигуре 1 представлены результаты вирусемии для 3 групп. Как ясно видно, не было значительной разницы в эффекте использования одной или двух вакцинаций аттенуированной живой вакциной PRRSV.
Следовательно, для PRRSV, применение гомологичной схемы вакцинации «прайм-буст» не может улучшить иммунную защиту однократной вакцинации.
Пример 2: PRRSV - вакцинация «прайм-буст», исходные эксперименты
Введение
В этом эксперименте применяли способ вакцинации по настоящему изобретению с вариантом бустерной вакцинации: вакциной на основе живого аттенуированного вируса является Porcilis® PRRS, которая относится к PRRSV типа 1, штамму DV, а также вакцина, содержащая RP РНК-содержащего Альфавируса. В качестве вируса заражения используют штамм Sc3 PRRSV 1 типа.
Применяемые RP РНК-содержащего Альфавируса основаны на штамме TC-83 VEEV, и экспрессируют более одного вирусного антигена: один тип RP (далее: RP1) создан для кодирования генов штамма Sc3 PRRSV: E, GP2, GP3 и GP4, приводя к экспрессии нативного E-GP2-GP3-GP4 тетрамера. Другой тип RP (далее: RP2) создан для кодирования генов штамма Sc3 PRRSV: GP5 и M, приводя к экспрессии нативного GP5-M димера. В каждом случае (RP1 и RP2), каждый из гетерологичных генов находится под транскрипционным контролем их собственной субгеномной промоторной последовательности. В RP1, присутствуют четыре отдельных субгеномных промоторных последовательности; в RP2, две отдельных субгеномных промоторных последовательности.
Дизайн исследования
40 поросят, сероотрицательных для анти-PRRSV антител, делили на 4 группы по 10 животных. Когда поросята из групп 1-3 достигали возраста примерно 5 недель, они получали первичную вакцинацию внутримышечным (ВМ) путем вакциной на основе живого аттенуированного вируса Porcilis® PRRSV; животные из группы 4 служили в качестве не вакцинированных контрольных животных. Через 3 недели после первичной вакцинации, группы 2 и 3 получали бустерную вакцинацию вакциной, содержащей 2 типа RP РНК-содержащего Альфавируса. Через примерно 4,5 недель после первичной вакцинации, т.е. 11 дней после бустерной вакцинации, всех животных заражали современным вирулентным генотипом 1 штамма Sc-3, интраназальным путем. Образцы крови собирали в день первичной вакцинации и через 7, 15 и 23 дня после, а также в день заражения (= день 32 дпв) и через 4, 7, 11, 17 и 21 день после. Из этих образцов выделяли сыворотку, и образцы, полученные после заражения, использовали для определения эффективности вакцины при разных способах вакцинации через измерение вирусемии заразного штамма.
Материалы и методы
Лечение:
Применяли рекомендованный путь вакцинации для Porcilis® PRRS, т.е. внутримышечное введение, также для вакцины, содержащей RP РНК-содержащего Альфавируса. Для заражения применяли естественный путь заражения, назальный. Образцы крови брали для отслеживания соответствующих параметров заражения PRRSV: вирусемии и серологии.
Тестируемые изделия:
Вирусом для заражения является PRRSV штамм Sc-3, разведенный до 0,5x 10^5,0 TCID50/мл.
Разбавителем для лиофилизированной Porcilis® PRRS вакцины является 10 мМ ФРФБ. Его применяют непосредственно перед применением с получением титра 0,5×10^5,0 TCID50/мл.
Титрование проводили на первичных альвеолярных макрофагах (PAM) свиней через считывание ЦПЭ через 5-7 дней.
Разбавителем для RP является Xsolve™50 эмульсия «масло в воде», также применяемая непосредственно перед применением, для получения титра 0,5×10^8,0 TCID50/мл для каждой вакцины, содержащей RP1 или RP2 РНК-содержащего Альфавируса.
Если РС классифицируются как ГМО, все материалы, образцы и животные должны обрабатываться и храниться на соответствующем уровне биологической защиты.
Тестируемые животные:
Стандартные поросята в возрасте около 5 недель на день вакцинации, смешанного пола и отрицательные на антитела против PRRSV до вакцинации. Поросятам давали 5 дней акклиматизации между транспортировкой в испытательную лабораторию и днем вакцинации. Использовали только клинически здоровых свиней; свиней идентифицировали с помощью пронумерованных ушных бирок. В ходе эксперимента за всеми животными ежедневно наблюдали за общим состоянием здоровья. Все наблюдения регистрировали, и при необходимости проводили консультации с ответственным ветеринаром.
Все вакцинации проводили ВМ по 2 мл/животное, заражение проводили ИН по 2 мл/животное.
Таблица 1: Схема эксперимента из Примера 2
TCID50
1·10^8 TCID50
1·10^8 TCID50
1·10^8 TCID50
Отбор образцов
Образцы крови брали из яремной вены на 0, 7, 15 и 23 день после первичной вакцинации (дпв), а также на 0 (= 32 дпв), 4, 7, 11, 17 и 21 день после заражения (дпз). Последний образец крови брали во время эвтаназии в конце эксперимента. Кровь собирали в вакуумный контейнер без антикоагулянта. Образцам крови давали возможность свернуться при комнатной температуре в течение 1 часа, затем центрифугировали в течение 10 минут при 3000 x g и сыворотку собирали и хранили замороженной при температуре ниже -20°C до использования.
Определение вирусемии
Вирусемию PRRSV (и для вакцины, содержащей живую аттенуированную форму вируса, и для вируса для оценки) определяли количественным анализом РНК PRRSV в сыворотке с применением РВ-кПЦР в режиме реального времени с применением наборов праймеров, специфических для PRRSV генотипа 1, и набора iTaq™ Universal SYBR® Green One-Step Kit (BioRad).
Серология
Сыворотки тестировали на антитела против PRRSV с применением коммерческого набора ELISA: IDEXX™ PRRS X3 (IDEXX Laboratories, Westbrook, ME, USA). Сыворотку инкубировали в лунках для микротитрования, покрытых рекомбинантным антигеном PRRSV. Связанные специфичные к PRRSV антитела затем определяли с использованием конъюгированных с пероксидазой хрена анти-свиных антител и хромогена. Результаты рассчитывали как отношение образца к положительному (S/P). Образцы с отношениями S/P ≥0,4 классифицировали как положительные, и образцы с отношениями S/P <0,4 классифицировали как отрицательные в отношении PRRSV специфических антител.
Результаты и выводы
Эксперимент считается действительным, поскольку все образцы сыворотки до вакцинации были PRRSV-Ab отрицательными, а образцы сыворотки группы 4 были PRRSV-Ab отрицательными до заражения.
Результаты определения вирусемии представлены на фигуре 2, которая представляет оценку количественной ПЦР, составленную для каждой группы.
Не вакцинированные свиньи (группа 4) показали самый высокий уровень вируса PRRS в их сыворотке, что и было ожидаемым. Также, как и ожидалось, вакцинация «прайм-буст» с двумя RP РНК-содержащего Альфавируса на 21 дпв не приводит к обнаружению уровней вирусемии PRRSV в сыворотке (например, см. группу 3, фигура 2).
У животных, получавших как первичную, так и бустерную вакцинацию вакциной, содержащей RP1 и RP2 РНК-содержащего Альфавируса (группа 3), наблюдаемые уровни вирусемии были почти такими же высокими, как уровни, обнаруженные у не вакцинированных животных.
Очевидно, что гомологичная схема «прайм-буст» с вакциной, содержащей RP РНК-содержащего Альфавируса, не обеспечивает адекватной защиты от PRRSV, даже когда они кодированы множеством антигенов вируса для оценки.
Хорошее снижение вирусемии обеспечила живая аттенуированная вакцина (группа 1). Однако группа, получавшая вакцинацию по гетерологичной схеме вакцинации «прайм-буст» по изобретению (группа 2), показала лучшую защиту от заражения инфекцией из всех; т.е. во все моменты времени имела самые низкие уровни определяемого PRRSV в образцах сыворотки после контрольного заражения.
Пример 3: PRRSV - вакцинация «прайм-буст», расширенный эксперимент
Введение
Были организованы дальнейшие эксперименты, чтобы повторить и расширить замечательные результаты, полученные в экспериментах, описанных в Примере 2. В этой схеме были добавлены группы для проверки эффекта отдельных вакцин, содержащих RP1 или RP2 РНК-содержащего Альфавируса в качестве бустерной вакцинации. Кроме того, была добавлена одна группа для тестирования обратного порядка вакцинации в способе вакцинации по настоящему изобретению.
Дизайн исследования
Дизайн исследования в этом примере был по существу таким же, как в примере 2, за исключением дополнительных тестовых групп. Схема эксперимента Примера 3 суммирована в Таблице 2. Все группы получали контрольное заражение штаммом Sc-3 PRRSV через 5 недель после первичной вакцинации, то есть через 2 недели после бустерной вакцинации.
Таблица 2: Схема эксперимента из примера 3
Материалы и методы
Вакцинации и заражение были в основном такими же, как и в примере 2. Что касается времени заражения, то заражение проводили через 5 недель после начала вакцинации, а не через 4,5 недели, как в Примере 2. Были добавлены две группы, группы 3 и 4, которые получали одну вакцину, содержащую RP1 или RP2 РНК- содержащего Альфавируса в качестве бустерной вакцинации.
Результаты и выводы
Результаты представлены на фигуре 3. Лучшим моментом времени для сравнения результатов является вирусемия (в значениях Ct) через 4 дня после заражения.
Снова тестирование был действительным, на основании сероотрицательности анти-PRRSV антител до вакцинации. Также, не вакцинированная группа 6 ответила, как и ожидалось, после заражения. Подобная вирусемия, как и в группе 6, была обнаружена в группах, получавших однократную вакцинацию аттенуированным живым вирусом (MLV: модифицированная живая вакцина; группа 1), и в группе 4, получавшей бустерную вакцинацию RP1 вакциной (E-GP2-3-4). Немного лучше, чем не вакцинированная группа, была группа 5, получавшая вакцинацию способом вакцинации по настоящему изобретению, но в обратном порядке.
Однако лучше всего были группы, получавшие в качестве бустерной вакцину, включающую только RP2 РНК-содержащего Альфавируса или в комбинации с RP1. Группа 2, получавшая в качестве бустерной вакцину, содержащую RP1 и RP2 РНК-содержащего Альфавируса, имела значительно пониженную вирусемию после заражения, но группа 3, получившая в качестве бустерной вакцинации вакцину, содержащую RP2 РНК-содержащего Альфавируса после вакцины, содержащей живой аттенуированный PRRSV, имела самый низкий уровень вирусемии из всех.
Разница в вирусемии через 4 дня после заражения между группами 3 (способ вакцинации по настоящему изобретению с RP2) и 5 (в обратном порядке) составляет около 5 пунктов Cq, что соответствует разнице в вирусной нагрузке 2^5. Таким образом, вирусемия вирусом для оценки может быть уменьшена в 32 раза при применении правильного способа вакцинации по изобретению.
Аналогичным образом, при рассмотрении улучшения защиты при вакцинации между однократной вакциной живым аттенуированным вирусом (группа 1) и группой 3 (способ вакцинации по настоящему изобретению) разница в обнаруженной вирусемии составляет 8 пунктов Cq, что в 256 раз меньше вирусемии, что имеет важное значение на местах с точки зрения борьбы с болезнями и распространением PRRSV в стаде.
Также это представляет расширение иммунной защиты от штамма PRRSV DV при первичной вакцинации до штамма PRRSV Sc3 вируса для оценки за счет использования вакцины, содержащей RP РНК-содержащего Альфавируса, кодирующих гены Sc3.
Пример 4: PEDV - эксперимента с вакцинацией «прайм-буст»
Наряду с экспериментами, проведенными для PRRSV, аналогичные эксперименты были выполнены с использованием способа вакцинации по настоящему изобретению для защиты свиней от заражения PEDV.
Введение
В этом эксперименте была проверена эффективность вакцинации беременных свиноматок для защиты их потомства после кормления от инфекции и болезни PEDV с использованием способа вакцинации по настоящему изобретению. Для вакцины, состоящей из живого аттенуированного вируса, был использован штамм PEDV S-INDELIowa 106. Это один из двух типов активно развивающихся штаммов PEDV (Lin et al., 2016, Virus Res., vol. 226, p. 20-39). Вакцина на основе RP РНК-содержащего Альфавируса содержит RP, кодирующие шиповидный белок вирулентного US изолята PEDV, который является не-S-INDEL штаммом.
Дизайн исследования
14 беременных свиноматок были произвольно разделены на четыре группы обработки, включая 3 вакцинированные группы и одну не вакцинированную контрольную группу (группа 4). Все вакцинированные свиноматки (группы 1-3) получили три вакцинации за 6, 3 и 1 неделю до опороса. Вакцинацию для первой и второй вакцинаций свиноматок в группах 2 и 3 проводили вакциной, включающей живой аттенуированный вирус PEDV штамма S-INDELIowa 106, смешанный с одним из двух различных адгезивов для слизистых оболочек. Свиноматки в группе 1 получали две первичные вакцинации вакциной RP, кодирующей ген шиповидных отростков PEDV не-S-INDEL штамма. В качестве третьей вакцинации все свиноматки в группах 1-3 получали повторную вакцинацию вакциной RP РНК-содержащего Альфавируса, кодирующими ген шиповидных отростков PEDV. Обзор экспериментальных групп представлен в таблице 3.
Молочных поросят, рожденных от разных групп свиноматок, внутрижелудочно заражали вирулентным штаммом PEDV. Эффективность вакцины оценивали по способности вакцины снижать смертность поросят и поддерживать прибавку в весе у поросят. Также оценивали иммунный ответ в отношении PEDV-специфических, полученных от матери антител (MDA) у поросят.
Таблица 3: Схема эксперимента из примера 4
(TCID или копии)
(PED-RP)
(Gantrez)
(PVP)
(Контроль)
Материалы и методы
Тестируемые изделия:
Вакцина на основе RP РНК-содержащего Альфавируса:
Вакцина, содержащая RP РНК-содержащего Альфавируса, основана на конструкции репликона из VEEV штамма TC-83. Она сконструирована так, чтобы содержать кодирующую последовательность шиповидного белка из US вирулентного PEDV штамма AH2012 (см. номер доступа GenBank KC210145). Она была составлена при 10^8 RP/мл, для 1 мл доз, без адъюванта, для ВМ IM вакцинации.
RP титруют на монослойных клеточных культурах Vero в 96-луночных планшетах, при 10-кратном серийном разведении. Планшеты инкубируют при 37ºC в течение 18-24 ч. Затем планшеты промывают, фиксируют и окрашивают первичным антителом, затем конъюгированным вторичным антителом. Клетки исследуют с применением флуоресцентного микроскопа. Отдельные антиген-положительные клетки считают. Титр, выраженный как RP/мл, рассчитывают из известных объемов разведения и инокуляции, и усредняют для дублированных лунок.
Аттенуированная живая вакцина:
Вакцина для группы 2:
10^6 TCID50 на дозу PEDV S-INDELIowa 106, перенос 36 смешивают с Gantrez™ (1:1 об./об. соотношение), 5% сахарозой и 20 мМ HEPES pH 7,3, непосредственно до вакцинации перорально.
Вакцина для группы 3:
10^6 TCID50 на дозу PEDV S-INDELIowa 106, перенос 36 смешивают с поливинилпирролидоном (PVP) (1:1 об./об. соотношение), 5% сахарозой и 20 мМ HEPES pH 7,3, непосредственно до вакцинации перорально.
PEDV S-INDEL Iowa 106 вирус титруют на 96-луночных планшетах с конфлюентными клетками Vero. Планшеты инкубируют при 37°C с 5% CO2 и наблюдают ежедневно на цитопатологический эффект после заражения в течение 2-3 дней и/или тестируют с применением IFA окрашивания анти-PEDV специфическими антителами свиней (USDA-NVSL, Ames, IA) с последующим FITC конъюгированным вторичным антителом в конце периода инкубации. PEDV титры рассчитывают как Log10 TCID50 на мл, с применением способа Спирмана/Карбера.
Вирус для оценки и характеристики элиминации вирусов:
Заражение проводят внутрижелудочно молочным поросятам в возрасте от 3 до 5 дней изолятом PEDV штамма Colorado 2013 в дозе 10^5 TCID50 на свинью.
Вирус для оценки титруют на клетках Vero, аналогично живому аттенуированному вирусу PEDV.
Выделение фекалий
PEDV РНК экстракцию и определение PEDV вирусемии проводят с применением кРВ-ПЦР согласно Chen et al. (2014, J. Clin. Microbiol., vol. 52, p. 234-243). Набор MagMAX™ Pathogene RNA/DNA Kit (Life Technologies, Carlsbad, CA, USA) и инструмент Kingfisher 96 (Thermo Scientific, Waltham, MA, USA) применяют согласно инструкциям производителя. кРВ-ПЦР проводят с применением набора Path-ID Multiplex One-Step RT-PCR (Life Technologies) и проводят на ABI 7500 Fast instrument™ (Life Technologies).
Серология
PEDV-специфические нейтрализующие антитела в сыворотке, молозиве и молоке свиноматок и пассивные антитела в сыворотке поросят определяли с помощью теста нейтрализации флуоресцентного фокуса (FFN).
PEDV антитела в сыворотке против части S1 PEDV шиповидного белка PEDV штамма контрольного заражения определяли с помощью ELISA антител: планшеты для микротитрования покрывали 100 мкл шиповидного белка PEDV (рекомбинантный димер S1 из штамма PEDV Colorado 2013; 0,25 мкг/мл). Сыворотку разводили 1:900 в ФРФБ/1% АБС и добавляли в покрытые лунки с последующей инкубацией в течение 1 часа при 37°C. После двух промываний ФРФБ/0,05% Tween20 в лунки добавляли 100 мкл конъюгата анти-свиных IgG HRPO кролика, разведенного 1:10000 в ФРФБ/1% АБС/0,5% Tween20, и планшеты инкубировали в течение 1 часа при 37°С. После трех промывок ФРФБ/0,05% Tween20 в каждую лунку добавляли 100 мкл/лунку субстрата TMB «super slow»™ с последующей инкубацией при комнатной температуре в течение 10 минут в темноте. Реакции останавливали добавлением 100 мкл 25% серной кислоты на лунку. Оптическую плотность (OD) при 450 нм измеряли с помощью ELISA ридера. Сыворотки свиней, естественным образом инфицированных PEDV, были включены в качестве положительного контроля.
Результаты и выводы
Результаты представлены в таблицах 4-6 ниже.
У поросят, рожденных от беременных свиноматок в группах 2 и 3, которые были вакцинированы способом вакцинации по настоящему изобретению, процент смертности значительно снизился по сравнению с поросятами, рожденными от не вакцинированных свиноматок (группа 4), и по сравнению с группой, получавшей гомологичную RP вакцинацию «прайм-буст» (группа 1).
Свиноматки, перорально первично вакцинированные гетерологичным способом вакцинации (группы 2 и 3), имели значительно более высокие уровни PEDV-специфических антител в сыворотке по сравнению со свиноматками, вакцинированными гомологичной RP вакцинацией «прайм-буст» (группа 1) и не вакцинированными контрольными свиноматками (группа 4).
Поросята, рожденные от свиноматок 2 и 3 групп, имели значительно более высокий PEDV-специфический нейтрализующий MDA по сравнению с поросятами, рожденными от свиноматок 1 и 4 групп. Уровни антител IgA у поросят от свиноматок 2 группы были значительно выше, чем во всех других вакцинированных группах.
Таблица 4: Заболеваемость, смертность и потеря веса у поросят, демонстрируемая по помету
(PED-RP)
(Gantrez)
(PVP)
(Контроль)
Таблица 5: Ответ PEDV-специфических антител по FFN и IgA ELISA после вакцинации у свиноматок
Таблица 6: PEDV-специфические материнские антитела у поросят до заражения
(PEDV-RP)
(Gantrez)
(PVP)
(Контроль)
УСЛОВНЫЕ ОБОЗНАЧЕНИЯ НА ЧЕРТЕЖАХ
Фигура 1
Результаты вирусемии PRRSV групп, тестированных в эксперимента из примера 1.
Фигура 2
Результаты определения PRRSV вирусемии из экспериментов, описанных в примере 2, в виде оценок кПЦР на группу.
Фигура 3
Результаты определения PRRSV вирусемии из экспериментов, описанных в примере 3, в виде оценок кПЦР на группу.
| название | год | авторы | номер документа |
|---|---|---|---|
| ВАКЦИНАЦИЯ ЧАСТИЦАМИ РЕПЛИКОНА И МАСЛЯНЫМ АДЪЮВАНТОМ | 2018 |
|
RU2806690C2 |
| Способ профилактического лечения свиней | 2017 |
|
RU2780233C2 |
| ВАКЦИНА ДЛЯ ВНУТРИКОЖНОГО ПРИМЕНЕНИЯ ПРОТИВ ИНФЕКЦИИ ВИРУСА PCV2 И PRRS | 2017 |
|
RU2746127C2 |
| ВАКЦИНА К ВИРУСУ СВИНОГО ГРИППА A | 2018 |
|
RU2787596C2 |
| ВАКЦИНЫ ПРОТИВ FMDV НА ОСНОВЕ РЕКОМБИНАНТНОГО АДЕНОВИРУСНОГО ВЕКТОРА И ИХ ПРИМЕНЕНИЕ | 2017 |
|
RU2725495C2 |
| КОМБИНИРОВАННАЯ ВАКЦИНА ДЛЯ СВИНЕЙ | 2017 |
|
RU2761453C2 |
| ВАКЦИНА ПРОТИВ МИКОПЛАЗМЫ И PRRSV | 2007 |
|
RU2408386C2 |
| КОМБИНИРОВАННЫЕ ВАКЦИНЫ ДЛЯ ПРОФИЛАКТИКИ ВИРУСНЫХ ИНФЕКЦИЙ СВИНЕЙ | 2012 |
|
RU2628313C2 |
| ПОЛИВАЛЕНТНАЯ ВАКЦИНА ДЛЯ ЖИВОТНЫХ СЕМЕЙСТВА КОШАЧЬИХ | 2018 |
|
RU2797538C2 |
| ЭФФЕКТИВНАЯ ВАКЦИНАЦИЯ ПРОТИВ ЕВРОПЕЙСКИХ ШТАММОВ ВИРУСА РЕПРОДУКТИВНОГО И РЕСПИРАТОРНОГО СИНДРОМА (PRRS) ДО ОТЛУЧЕНИЯ ОТ МАТЕРИ | 2017 |
|
RU2755345C2 |
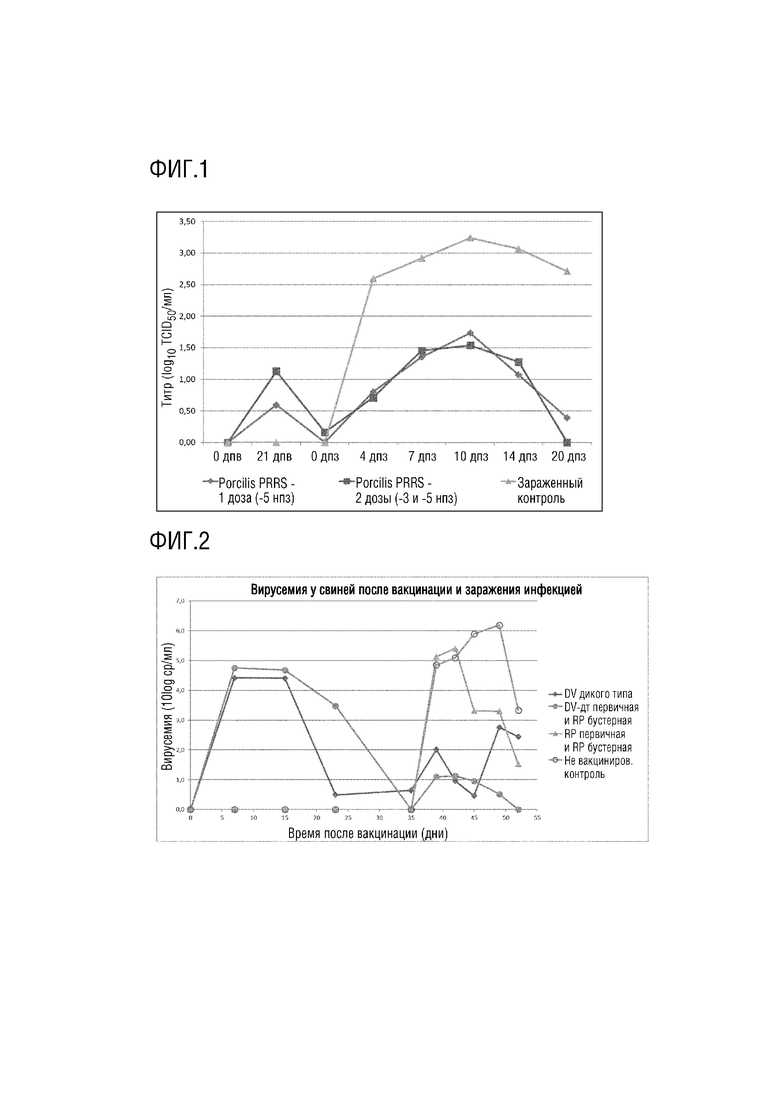
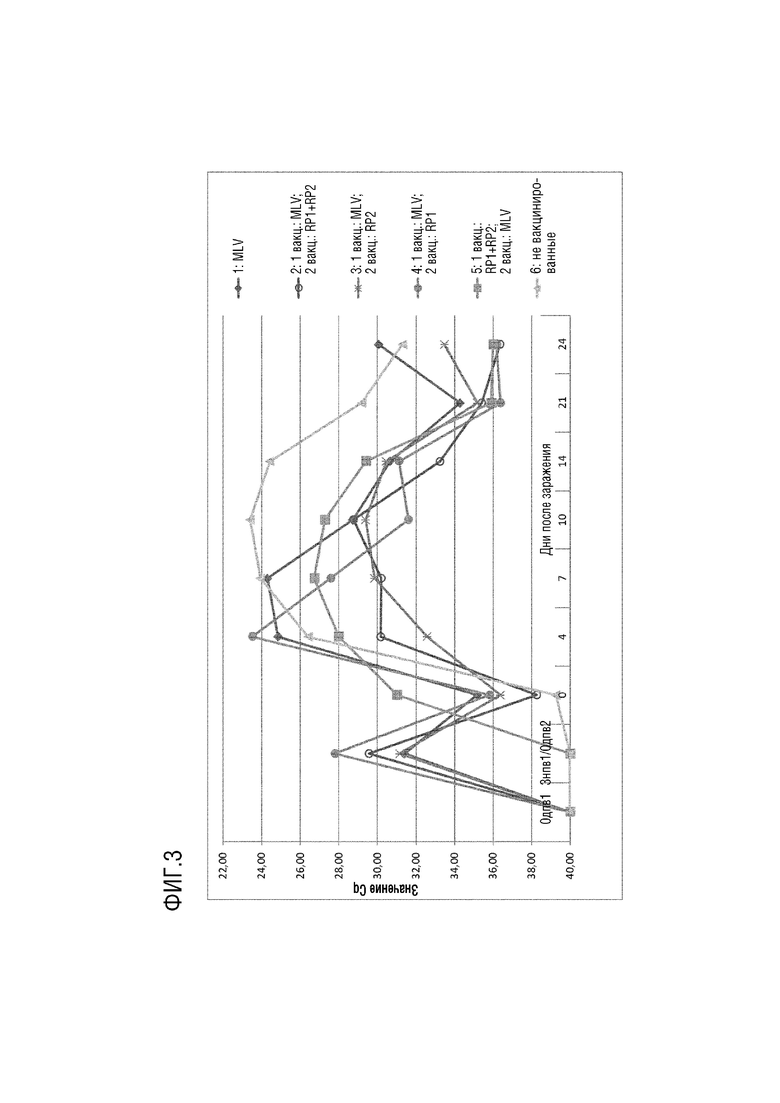
Изобретение относится к биотехнологии. Описан способ вакцинации для защиты животного-мишени от инфекции или заболевания, вызванного вирусом, где животным-мишенью является свинья и где вирус выбран из вируса эпизоотической диареи свиней (PEDV) и вируса репродуктивного и респираторного синдрома свиней (PRRSV), причем способ включает введение указанному животному-мишени вакцины, содержащей живую аттенуированную форму указанного вируса, с последующим введением указанному животному-мишени вакцины, содержащей частицы репликона (RP), кодирующие один или более антигенов из указанного вируса. Изобретение обеспечивает улучшенную защиту свиней от заболеваний, вызванных вирусом эпизоотической диареи свиней (PEDV) и вирусом репродуктивного и респираторного синдрома свиней (PRRSV). 3 з.п. ф-лы, 3 ил., 6 табл., 4 пр.
1. Способ вакцинации для защиты животного-мишени от инфекции или заболевания, вызванного вирусом, где животным-мишенью является свинья и где вирус выбран из вируса эпизоотической диареи свиней (PEDV) и вируса репродуктивного и респираторного синдрома свиней (PRRSV), причем способ включает
- введение указанному животному-мишени вакцины, содержащей живую аттенуированную форму указанного вируса, с последующим
- введением указанному животному-мишени вакцины, содержащей частицы репликона (RP), кодирующие один или более антигенов из указанного вируса.
2. Способ по п. 1, где вакцина, содержащая RP, содержит по меньшей мере один дополнительный RP, кодирующий один или более антигенов из указанного вируса.
3. Способ по п. 1 или 2, где по меньшей мере один вирусный антиген, кодируемый RP, происходит из вируса, который является вариантом видов живого аттенуированного вируса.
4. Способ по любому из пп. 1-3, где одна или обе вакцины содержат адъювант.
| Kardani, Kimia, Azam Bolhassani, and Sepideh Shahbazi | |||
| Нивелир для отсчетов без перемещения наблюдателя при нивелировании из средины | 1921 |
|
SU34A1 |
| А.А | |||
| Петров, В.Н | |||
| Лебедев и др | |||
| Перспективы разработки и применения вакцин на основе РНК-репликона вируса венесуэльского энцефаломиелита лошадей против особо опасных вирусных | |||
Авторы
Даты
2024-04-22—Публикация
2019-12-19—Подача