Изобретение относится к клинической медицине, а именно к гепатологии, трансплантологии и может быть использовано для лечения печеночной недостаточности.
В экономически развитых странах хронические заболевания печени (хронический гепатит, цирроз печени) входят в число шести основных причин смерти пациентов от 35 до 60 лет, составляя 14-30 случаев на 100 тысяч населения. Ежегодно в мире умирают 40 миллионов человек от цирроза печени. Возрастание медицинской и социальной значимости хронических заболеваний печени требует разработки новых более эффективных технологий лечения и профилактики этих заболеваний на основе достижений современной биологической и медицинской науки.
Известны суммарные РНК, выделенные из лейкоцитов, дрожжей, микробных и растительных клеток, которые используются для неспецифической стимуляции иммунитета и лечения вирусных инфекций, а также воспалительных процессов [SV Total RNA isolation system. Technical Manual. 08.2016. Phomega Corporation].
К настоящему времени в арсенале лечебных средств имеется две разновидности препаратов, в состав которых входит ксеногенная РНК. Действующим веществом в препаратах первой группы (НКАД, Нуклеинат натрия, Ридостин, Полирибонат, Виталанг 2) является одна или двуспиральная высоко или низкомолекулярная РНК, выделенная из дрожжей Sacharomyces cerevisiae.
Препараты дрожжевой РНК обладают неспецифическим иммунотропным действием: регулируют миграцию Т лимфоцитов, активируют гуморальный иммунитет и функциональную активность макрофагов [Кактурский Л.В., Шабанова М.Е., Большакова Г.Б. Изменение состава грануляционной ткани при заживлении экспериментального инфаркта миокарда под влиянием препарата НКАД // Тез. 7 Всесоюзной конф. по регенерации и клеточному делению, М., 1985, с. 17; Земсков В.М., Земсков A.M., Караулов А.В. Низкомолекулярная РНК - естественный модулятор иммунологического гомеостаза // Практический врач, 1995, №1, с. 6-9; Ямковая Т.В., Ямковой В.И., Панин Л.Е. Выделение и анализ биологической активности высокополимерной РНК из пекарских дрожжей // Бюлл. СО РАМН, 2012, №6, с. 60-68; Ридостин - инструкция к препарату ООО «Вектор Фарм. Россия»].
К препаратам другой группы относят высоко или низкомолекулярные РНК, выделенные из различных органов крупного рогатого скота [Витвицкий В.М., Ушаков И.В., Сидляров Д.П., Апросин Ю.Д. Средство, стимулирующее репарирование повреждений, обладающее ткане-, органо- и стадиеспецифичностью и противовирусной активностью. // Патент РФ №2238756 С1, 2003].
В отличие от дрожжевых препаратов эти РНК оказывают исключительно органоспецифическое стимулирующее действие только на гомологичные органы реципиента, независимо от их видовой принадлежности.
Известен способ коррекции хронической печеночной недостаточности в эксперименте при моделировании токсического цирроза печени (затравка CCl4) у мышей путем внутрибрюшинного введения им цитоплазматической РНК, выделенной из печени здоровых крыс [Чернух A.M., Вышепан Е.Д., Разумова И.Л. и др. Особенности течения экспериментального цирроза печени под влиянием печеночной РНК Бюлл. экспер. биологии и медицины 1970, №10, с. 12-15]. В этом исследовании, выполненном на мышах, авторы использовали экзогенную РНК из печени здоровых крыс, исходя из представлений о видовой неспецифичности РНК.
Было констатировано, что введение мышам органоспецифичной цитоплазматической РНК из печени крыс достоверно уменьшило гибель животных и число очагов некроза в ткани печени, а также достоверно увеличило не только митотическую активность гепатоцитов, но и количество междольковых соединительнотканных волокон. Отсутствие полного восстановительного (регенерационного) эффекта от применения тканеспецифичной (печеночной) РНК для лечения фиброзирующего типа печеночной недостаточности предопределило тот факт, что в клинике препараты РНК, полученные из ткани печени, стали для повышения лечебного эффекта сочетать с органоспецифическими препаратами РНК, выделенными из других органов - желудка, селезенки, надпочечников, поджелудочной железы и др. Однако ввиду малой клинической эффективности этот метод, основанный на применении комплекса органных РНК, в настоящее время не находит широкого применения.
Основной недостаток применения органоспецифических РНК от здоровых доноров, прежде всего печеночных РНК, состоит в том, что в тканях органов здоровых животных из-за стабильного равновесного состояния и отсутствия необходимости выработки в них факторов, индуцирующих процессы быстрого роста и развития, имеет место низкий уровень пролиферативной (митотической) активности клеток и поэтому выделенная из них РНК имеет низкий регенерационный потенциал. Кроме того РНК, выделенная из печени, обладает только органоспецифической активностью и не способна участвовать в компенсаторной поддержке других систем организма (почки, легкие), активно участвующих в процессе восстановительной регенерации печени.
Костный мозг, будучи центральным органом иммуногенеза и системы крови в организме, обладает универсальными регуляторными свойствами и его клетки относятся к быстро реагирующим и быстро развивающимся клеткам, содержат постоянно самообновляющийся пул стволовых/прогениторных клеток, постоянно продуцируют цитокины и факторы роста, оказывая регуляторное воздействие на клетки различных паренхиматозных органов и поэтому именно их предпочитают использовать для индукции процессов регенерации.
Известен способ лечения печеночной недостаточности путем применения универсальных регуляторов восстановительных процессов в органах - мультипотентных мезенхимальных стромальных клеток костного мозга (ММСК КМ) от здорового донора, который является наиболее близким аналогом предлагаемого изобретения [Люндуп А.В., Крашенинников М.Е., Онищенко Н.А. Применение аллогенных мезенхимальных клеток костного мозга в лечении хронических заболеваний печени, Сборник материалов Всероссийской конференции «Клеточные исследования и технологии в современной биомедицине», Тула, 2009, с. 6-8], который выбран в качестве прототипа.
Известный способ основан на выделении из костного мозга донора - ММСК КМ, культивировании их для увеличения клеточной массы в течение 3-4 недель и внутривенном введении реципиенту с поврежденной печенью. ММСК КМ после введения реципиенту корригируют клинические и морфологические проявления печеночной недостаточности путем индукции митотической активности клеток печени, а также путем активации дефиброзирующих процессов в печени (фибролитический эффект) [Люндуп А.В. «Применение мезенхимальных стромальных клеток костного мозга для коррекции фиброзирующего повреждения печени» (экспериментальное исследование), автореферат диссертации канд. мед. наук, Москва, 2011, 26 с.]. Эффективность применения ММСК КМ, для коррекции и лечения печеночной недостаточности обусловлена тем, что эти клетки обладают высоким регенерационным потенциалом, так как являются стволовыми/прогениторными (малодифференцированными) активно пролиферирующими клетками и в процессе своей жизнедеятельности выделяют комплекс высокоактивных регуляторных рост стимулирующих и паракринных факторов.
Эти факторы, корригируют взаимодействия в системе мезенхимальных клеток организма, в том числе системе мезенхимальных клеток поврежденной печени (купферовских клеток, звездчатых клеток, фибробластов, лейкоцитов), восстанавливают их нарушенное взаимодействие между собой и с паренхиматозными клетками печени (гепатоцитами), обеспечивая, таким образом, регуляцию процессов восстановительной регенерации печени.
Однако внедрение в клиническую практику клеточных технологий для лечения заболеваний печени продолжает оставаться на стадии пилотных исследований. Даже применение аутологичных стволовых/прогениторных клеток не получает единодушной поддержки и не находит широкого клинического применения из-за опасности малигнизации и генетических мутаций стволовых/прогениторных клеток после трансплантации в организме реципиента, а также из-за быстрой гибели этих клеток при получении их от аллогенного или ксеногенного донора.
В настоящее время из ММСК КМ выделено несколько микро РНК (микро РНК-188, микро РНК-21) для ускорения процессов остеогенной дифференцировки ММСК КМ и заживления костных переломов [Li C.J., Cheng P., Liang M.K., Chen Y.S., Lu Q., Wang J.Y. et al., MicroRNA-188 regulates age-related switch between osteoblast and adipocyte differentiation. J Clin. Invest. 2015 Apr., 125(4): 1509-22. doi: 10.1172/JCI177716. Epub 2015, Mar 9; / Sun Y., Xu L., Huang S., Hou Y., Liu Y. et al., Mir-21 overexpressing mesenchymal stem cells accelerate fracture healing in a rat closed femur fracture model. Biomed Res. Int. 2015; 2015: 412327. doi: 10.1155/2015/412327. Epub 2015, Mar., 23].
Описания исследований по выделению и применению микро РНК из ММСК КМ для лечения печеночной недостаточности в литературе отсутствуют.
Кроме того, следует иметь ввиду, что регулирование процесса восстановительной регенерации в печени не может осуществляться какой либо одной микро РНК (их в настоящее время идентифицировано в организме свыше 1800 типов), т.к. печень представляет собой гистологически сложный орган, состоящий из 5 типов клеток различного происхождения (гепатоциты, купферовские клетки, клетки Ито - звездчатые клетки, эндотелиальные клетки, лейкоциты) и выполняет комплекс важнейших гомеостатических функций (синтетическая, детоксикационная, пищеварительная, выделительная, иммунорегуляторная и др.), взаимодействуя с другими системами организма.
Техническая проблема заключается в повышении качества, надежности и безопасности применения клеточной терапии с использованием стволовых/прогениторных ММСК КМ при лечении (коррекции) печеночной недостаточности.
Технический результат, достигаемый при осуществлении предлагаемого изобретения, заключается в повышении эффективности лечения печеночной недостаточности за счет возможности многократного применения препарата, выделенного из ММСК КМ (аллогенного или ксеногенного) донора, а также в предупреждении осложнений, связанных с применением биотехнологических методов коррекции и профилактики печеночной недостаточности стволовыми/прогениторными клетками - (малигнизация и генетические мутации при имплантации ММСК КМ, быстрая гибель аллогенных и ксеногенных клеток костного мозга) путем использования биологически активного комплекса, содержащего в себе все типы РНК, в том числе все типы регуляторных белок - некодирующихмикро РНК, способного осуществить перенос «регенерационной информации» клеткам поврежденного органа - печени, индуцируя в ней процесс ускоренной и эффективной восстановительной регенерации.
Нами во избежание негативных последствий применения терапии ММСК КМ для повышения качества и безопасности применения биотехнологических методов регенерационной терапии предложено использовать не ММСК КМ, а выделенный из них комплекс биологически активных компонентов, включающий в себя все типы РНК, в том числе все типы регуляторных микро РНК, способных осуществить перенос содержащейся в них «регенерационной информации» клеткам поврежденного органа (печени) и тем самым активизировать (индуцировать) в них восстановительные процессы.
Достоинством предлагаемого изобретения, позволяющим по существу достигнуть более выраженного и надежного лечебного эффекта является:
- отказ от необходимости поиска антиген совместимого донора для получения и использования ММСК КМ, так как суммарная РНК, выделенная из ММСК КМ здорового донора, обладает иммуно-неспецифичными (видо-неспецифичными) свойствами и может быть получена из ММСК КМ как аутологичного, так и аллогенного и ксеногенного донора;
- возможность проводить (курсовую терапию) путем парентерального многократного применения препарата суммарной РНК до полного выздоровления или ремиссии;
- возможность обеспечить компенсаторную поддержку регенерации печени, стимулируя адаптационную и регенерационную поддержку другим органам (почки, легкие), относящимся к единой системе детоксикации организма;
- возможность обеспечения безопасности проведения регенерационной терапии препаратом суммарной РНК из ММСК КМ, так как введенная РНК, являясь химическим веществом, не может стать объектом малигнизации, генетических мутации, а также утратить свою регуляторную активность.
- возможность проводить эффективную регенерационную терапию различных органов и систем в организме, т.к. суммарная РНК, выделенная из ММСК КМ, сохраняет универсальность регуляторных свойств этих клеток
Сущность изобретения заключается в следующем.
Нами предложено применение суммарной РНК ММСК КМ млекопитающего, например человека или крупного рогатого скота, для лечения (коррекции) печеночной недостаточности.
Применение суммарной РНК из ММСК КМ млекопитающего (человека) для лечения печеночной недостаточности проводят следующим образом.
Для лечения (коррекции) печеночной недостаточности используют не ММСК КМ донора, а биологически активный комплекс, выделенный из этих клеток. Комплекс содержит суммарную (общую) РНК, в состав которой входят все типы регуляторных РНК (прежде всего микро РНК), обеспечивающие перенос «регенерационной информации», содержащейся в ММСК КМ, клеткам поврежденной печени.
Приводим способ получения суммарной РНК ММСК КМ на примере экспериментального животного - крысы, который аналогичен таковому у человека.
Получение биологически активного комплекса суммарной РНК ММСК КМ начинают с получения мононуклеарной фракции клеток из аспирата костного мозга. Для этого под эфирным наркозом из костномозгового канала болынеберцовых и бедренных костей крысы получали клетки костного мозга путем аспирации их шприцем с иглой 18G, содержащим среду для забора (0,5 мл фосфатно-буферного раствора с 50 ЕД/мл гепарина и 0,25 мг/л гентамицина).
Суспензию клеток КМ центрифугировали при 1500 об/мин (350g) 5 мин, осадок клеток ресуспендировали в растворе для лизиса эритроцитов (114 мМ NH4Cl, 7,5 мМ КНСОз, 100 мкМ EDTA) в течение 3 мин и повторно центрифугировали. Гемолизированный супернатант удаляли отсасыванием, а клеточный осадок ресуспендировали в среде DMEM (ПанЭко, Россия), содержащей 10% телячью эмбриональную сыворотку («HyClonegold», USA), инсулин 0,4 мкМ и 0,25 мг/л гентамицина.
Выделенные клетки, представляли собой фракцию, преимущественно мононуклеарных клеток костного мозга (первичная культура), которые затем высевали в количестве 2,0-2,5 млн. кл/мл в культуральные флаконы.
Затем культуральные флаконы помещали в СО2-инкубатор с 5% концентрацией СО2 и 95% содержанием атмосферного воздуха с повышенной влажностью. Через 2 сут после выделения первичной культуры не прикрепившуюся клеточную взвесь удаляли, а оставшиеся клетки с фибробластоподобной морфологией продолжали культивировать. Замену культуральной среды на свежую, осуществляли каждые 3-4 сут. После образования субконфлюэнтного монослоя клетки однократно отмывали раствором Версена, затем снимали раствором Версена с 0,25% трипсина, ресуспендировали в ростовой среде и разливали в новую культуральную посуду. Для работы использовали клетки после 2-го пассажа, в концентрации 2,5-3,0×106 клеток /мл.
Клеточный материал, представляющий собой прикрепившиеся к пластику распластанные фибробластоподобные клетки - ММСК КМ считался пригодным как для применения при лечении печеночной недостаточности по способу прототипу, так и для получения суммарной РНК при лечении печеночной недостаточности по предлагаемому способу, так как выделенная фракция ММСК КМ сохраняла популяционную активность и не содержала погибшие клетки. Гомогенность культуры ММСК КМ была подтверждена иммуногистохимическим исследованием путем выявления в них коллагена I типа с помощью кроличьих моноклональных антител («Имтэк»).
Далее приступали к выделению суммарной РНК из полученной культуры ММСК КМ (суммарный выход ММСК обычно составлял 8-10×106 клеток) по методике ExtractRNA, разработанной фирмой «Евроген» (Россия). Культуру ММСК КМ после 2-го пассажа снимали раствором Версена с 0,25% трипсина, дважды отмывали средой ДМЕМ без добавок, каждый раз центрифугируя при комнатной температуре при скорости 1500 об/мин в течение 5 мин и удаляли надосадочную жидкость.
Далее к выделенной культуре ММСК (в камере Горяева предварительно подсчитывали количество клеток) добавляли реагент ExtractRNA из расчета 1 мл реагента на 1×106 клеток, инкубировали 15 мин (периодически пипетируя) и центрифугировали при 13400 об/мин 10 мин для удаления нерастворенных фрагментов. Супернатант переносили в новую пробирку и приступали к разделению фаз. Для этого добавляли 0,2 мл хлороформа на каждый 1 мл реагента ExtractRNA, инкубировали смесь в течение 5 мин при комнатной температуре, периодически встряхивая образец; затем образец центрифугировали при 13400 об/мин в течение 15 мин при комнатной температуре.
В ходе центрифугирования происходило разделение смеси на три фазы: нижнюю - органическую фенол хлороформную фазу желтоватого оттенка, интерфазу белого цвета и верхнюю бесцветную водную фазу. РНК находится в верхней водной фазе, которую аккуратно собирали и переносили в чистую пробирку.
Затем приступали к непосредственному выделению РНК. Для этого в водную фазу добавляли 0,5 мл 100% изопропанола на каждый 1 мл использованного реагента (ExtractRNA). Полученную смесь инкубировали при комнатной температуре в течение 10 мин и центрифугировали при 13400 об/мин в течение 10 мин при комнатной температуре. Затем аккуратно отбирали супернатант, оставляя осадок РНК на дне пробирки. Далее аккуратно, по стенке пробирки, добавляли 2 мл 75% этанола на каждый 1 мл изопропанола, использованного ранее. Полученный образец центрифугировали на максимальной скорости (13400 об/мин) в течение 5 мин. Удаляли этанол пипеткой и осадок выделенной РНК растворяли в 1 мл дистиллированной воды и определяли концентрацию РНК в 100 мкл образца на спектрофотометре при длине волны 260 нм. Из каждых 8-10 млн исходно использованных ММСК в 1 мл определялось 750-950 мкг РНК. Далее из этого концентрированного раствора РНК готовили рабочие растворы РНК требуемой концентрации для введения в организм с целью коррекции печеночной недостаточности.
Суммарная РНК, выделенная из ММСК КМ представляет собой биотехнологический продукт высокой степени очистки, который вводят в эффективном количестве парентерально (внутрибрюшинно, подкожно, внутримышечно или интрапортально в паренхиму печени).
Для экспериментального животного - (крысы) рабочий раствор РНК содержал 75-95 мкг РНК/мл (к 0,5 мл концентрированного раствора РНК добавляли 9,5 мл дистиллированной воды). Введение РНК осуществляют в дозе 15-45 мкг на 100 г веса животного (или 150-450 мкг/кг веса животного) трехкратно с интервалами в 1-3 сут между первым и вторым введениями и 2-5 сут между последующими введениями внутрибрюшинно или в паренхиму печени. Т.е. крысе массой 400 г вводят 0,2-0,6 мл рабочего раствора РНК в сутки трехкратно по выше указанной схеме
Использование эффективного количества суммарной РНК, выделенной из ММСК КМ, для человека будет зависеть от массы тела пациента, степени тяжести печеночной недостаточности, особенностей ответной реакции организма на вводимый биологически активный комплекс. Для человека суточная доза суммарной РНК будет находиться в диапазоне 1,0-3,0 мг РНК в сутки (или 1000-3000 мкг РНК в сутки или 16-48 мкг/кг), т.е. эффективная доза РНК для человека будет приблизительно в 10 раз меньше на единицу массы тела, чем у крысы, т.к. известно, что интенсивность метаболизма в организме крысы, которая характеризуется отношением поверхности тела к его массе, приблизительно в 10 раз выше, чем у человека (Л. Проссер, Ф. Браун «Сравнительная физиология животных», 1967, Изд. Мир, 768 с.; В.И. Шумаков, Е.Ш. Штенгольд, Н.А. Онищенко «Консервация органов», Москва, Медицина, 1975, 250 с.).
Для усиления биорегуляторного воздействия и закрепления лечебного эффекта суммарную РНК, выделенную из ММСК КМ, целесообразно вводить в указанной дозе, по меньшей мере, трехкратно с интервалом в 1-3 суток между первым и вторым введениями и 2-5 суток между последующими введениями, количество которых может достигать 10 и более, что необходимо для обеспечения эффективной индукции (активации) перепрограммирования процессов регенерации печени в организме больного с патологического (фиброзирующего) типа на восстановительный. Приготовление рабочего раствора РНК и получение эффективного количества суммарной РНК для человека требует выделения не 8-10 млн ММСК из костного мозга (как для крысы), а 80-100 млн. ММСК из костного мозга здорового человека или животного (особи крупного рогатого скота), из которых, по выше описанной методике выделения суммарной РНК, удается получить в 1 мл водного раствора 8-10 мг (или 8000-10000 мкг/мл) суммарной РНК из ММСК. Рабочий раствор РНК для человека (10 мл) содержал 800-1000 мкг РНК/мл и его готовили, добавляя к 0,5 мл полученного (концентрированного) раствора РНК 9,5 мл дистиллированной воды. Для доставки в организм человека необходимой (терапевтической) дозы РНК достаточно ввести 1,2-3,6 мл рабочего раствора РНК, т.е. 1-3 мг РНК.
Для доказательства возможности применения предлагаемого биологически активного комплекса по заявленному назначению и достижения при этом указанного технического результата приводим следующие данные.
Сравнительное изучение эффективности коррекции печеночной недостаточности по известному способу (внутривенное введение ММСК КМ) и по предлагаемому способу (внутрибрюшинное введение или введение в паренхиму печени суммарной РНК, выделенной из ММСК КМ) выполняли на модели хронической печеночной недостаточности (ХПН).
Для этого создавали модель хронического фиброзирующего повреждения печени у крыс путем длительной (в течение 42 дней) затравки четыреххлористым углеродом (CCL4) по описанной ниже методике. Длительным введением раствора CCL4 достигалось развитие хронического токсического гепатита и стимуляция заместительного регенерационного ответа печени (развитие склероза и фиброза печени). Метод поддается высокой степени стандартизации и является «классической» моделью для изучения регенерации печени при хроническом токсическом повреждении.
Моделирование хронического токсического фиброзирующего повреждения печени проводили на белых крысах самцах породы Вистар (вес к началу затравки 250-300 г, n=85), содержащихся в виварии на смешанном рационе питания со свободным доступом к воде.
Затравку крыс CCL4 проводили под кратковременным эфирным наркозом в интервале между 9-ю и 12-ю часами дня, что исключало суточные колебания митотической активности клеток печени. Подкожные инъекции 60% раствора CCL4 на персиковом масле проводили 2 раза в неделю (понедельник, четверг) в течение 6 недель (42 сут) в дозе 0,3 мл раствора на 100 г веса животного. Первая инъекция проводилась в дозе 0,5 мл 60% раствора CCL4 на 100 г веса животного. Суммарная курсовая доза чистого CCL4 составляла 3,5 мл на 100 г веса животного.
Через трое суток после завершения моделирования ХПН (на 46 сутки от начала моделирования ХПН) всех животных разделили на 3 группы: 1 группа - контроль (ХПН без применения терапии, n=35); 2 группа - ХПН и внутривенное введение ММСК КМ в хвостовую вену в дозе 2,5×106 кл/мл на крысу двукратно с интервалом в 7 сут, т.е. на 4 и 11 сут после завершения моделирования ХПН (группа сравнения, n=20). 3 группа - ХПН и введение суммарной РНК из ММСК (основная группа, n=30). 3 группа состояла из двух подгрупп: 3.1 (n=15), в которой проводилось внутрибрюшинное введение РНК в дозе 15 мкг на 100 г веса животного (крысы), и 3.2 (n=15), в которой проводилось введение РНК в паренхиму печени в дозе 45 мкг на 100 г веса животного (крысы). Инъекции осуществляли трехкратно с интервалом в 1-3 сут между первым и вторым введением и 2-5 сут для последующих введений после завершения моделирования ХПН.
Результаты оценивали в трех группах опытов на 1, 30, 90, 180 и 270 сутки после проведения терапии с помощью биохимических, гистологических и морфометрических методов.
Биохимическими методами исследовали кровь на содержание аланин - аминотрансферазы (АлАТ), аспарагин - аминотрансферазы (АсАТ) и щелочную фосфатазу (ЩФ). Для этого у крысы под эфирным наркозом надсекали кончик хвоста, пипеткой забирали 28-32 мкл крови, капали на специальные тест-полоски Reflotron™, которые сразу же устанавливали в биохимический анализатор Reflotron™ («Roche», Швейцария) (Принцип измерения - рефлексионная фотометрия, точность измерения - ±0.5%, воспроизводимость - <=0.2%, линейность: ±0.05%).
Для гистологического исследования печени животных забивали под эфирным наркозом декапитацией, извлекали фрагмент средней доли печени, разрезали его на кусочки размерами 3×4×5 мм и помещали в раствор Буэна (через 24 часа раствор Буэна меняли на 70% этанол) для фиксации. После завершения фиксации кусочки промывали в проточной воде в течение 2-3 ч, обезвоживали в спиртах восходящей концентрации и заливали в парафин. Парафиновые срезы толщиной 4-5 мкм наклеивали влажным способом на стекла с поли-L-лизиновым покрытием («Thermo», США). Затем препараты высушивали в течение 48 ч в термостате при 37°С, депарафинировали, регидратировали и окрашивали срезы гематоксилин-эозином и по Маллори (на соединительную ткань).
Морфометрический анализ срезов фрагмента средней доли печени был произведен с помощью морфометрической программы ImageScopeM (ООО «Системы для микроскопии и анализа», Россия). Исследуемые изображения получены с использованием микроскопа Leica DM1000 и камеры Leica LTDCH9435 DFC 295 (Leica Camera AG, Германия).
Данным методом определяли:
1. Наличие цирроза (подсчет количества ложных долек).
2. Долю соединительной ткани (в процентном соотношении к общей площади среза печени), кровеносных сосудов и желчных протоков в %.
3. Выраженность жировой дистрофии (оценивали 10 полей зрения среза каждого образца).
4. Количество двуядерных гепатоцитов (на 10 полей зрения среза при увеличении ×400).
5. Количество гепатоцитов с внутриядерными липидными включениями.
Приводим результаты сравнительного исследования эффективности применения ММСК КМ и РНК из ММСК КМ для восстановительной регенерации поврежденной печени. Так как результаты исследования морфофункциональных показателей в подгруппах 3.1 и 3.2 достоверно не различались (в подгруппе 3.2 отмечалась лишь тенденция к повышению темпа регенерационного процесса), они были объединены в общую группу 3
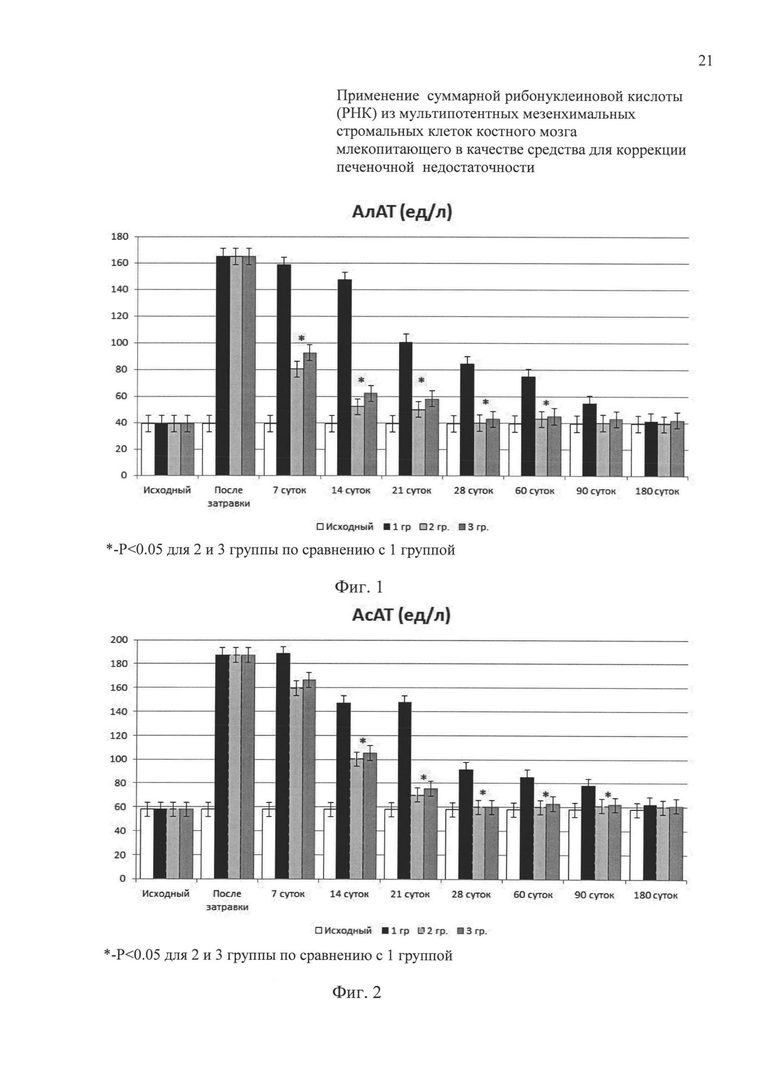
На фиг. 1 представлена динамика АлАТ у крыс с печеночной недостаточностью без лечения (1 группа) и с применением ММСК КМ (2 группа) или суммарной РНК из ММСК КМ (3 группа).
На фиг. 2. представлена динамика АсАТ у крыс с печеночной недостаточностью без лечения (1 группа) и с применением ММСК КМ (2 группа) или суммарной РНК из ММСК КМ (3 группа).
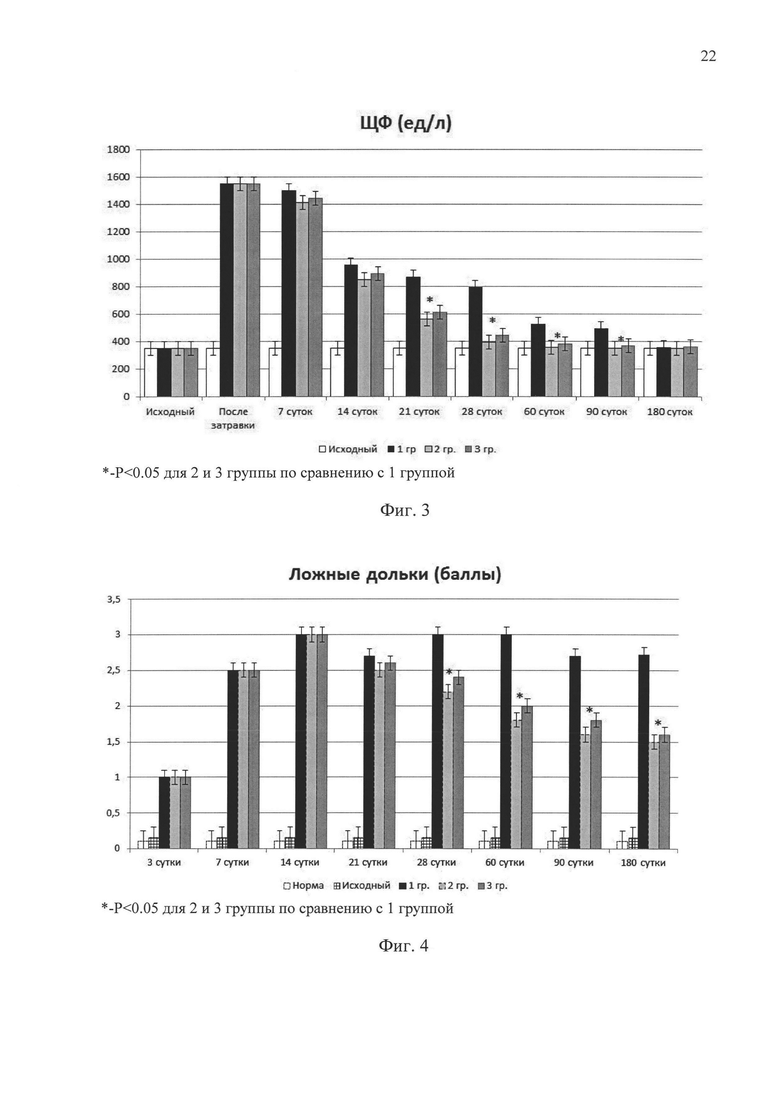
На фиг. 3 представлена динамика ЩФ у крыс с печеночной недостаточностью без лечения (1 группа) и с применением ММСК КМ (2 группа) или суммарной РНК из ММСК КМ (3 группа).
На фиг. 4 представлена динамика формирования ложных долек у крыс с печеночной недостаточностью без лечения (1 группа) и с применением ММСК КМ (2 группа) или суммарной РНК из ММСК КМ (3 группа).
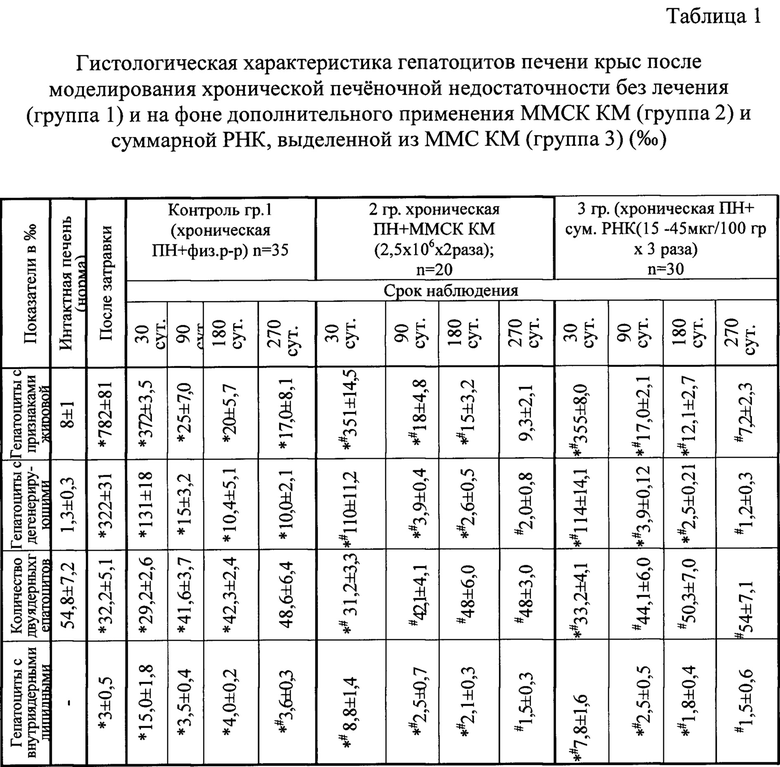
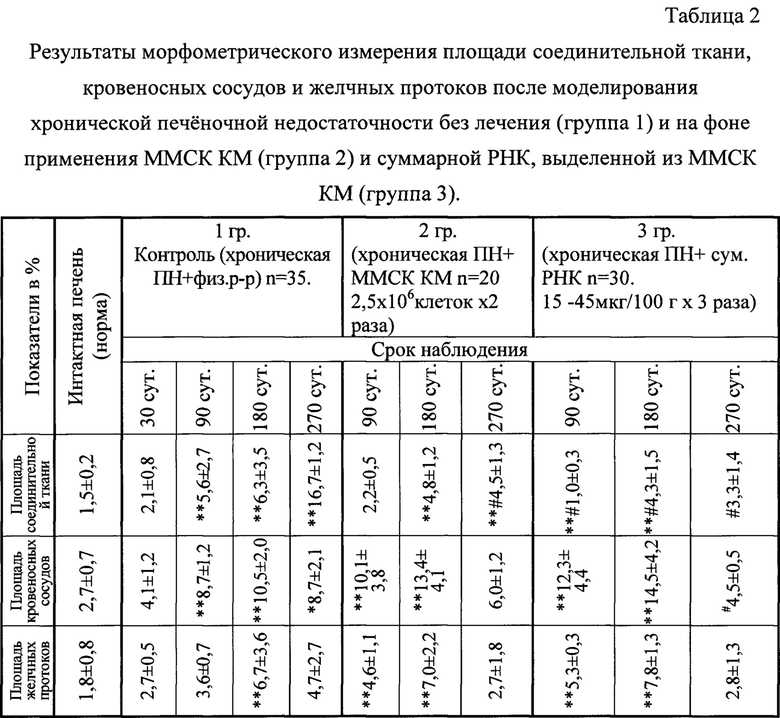
Результаты гистологического и морфометрического исследования представлены в таблицах 1 и 2 соответственно.
Обозначения:
* - p<0,05 по сравнению с нормой;
* - p<0,05 по сравнению с 30 сутками в контрольной группе.
Обозначения:
** - p<0,05 по сравнению с 30 сутками в контрольной группе;
# - p<0,05 по сравнению с аналогичным сроком в контрольной группе.
Исследование динамики восстановительных процессов в печени в трех группах опытов показали, что сразу после затравки CCL4 во всех трех группах имело место достоверное повышение ферментов цитолитического повреждения - печени - АлАТ, АсАТ и ЩФ - (фиг. 1, 2, 3). Однако в отличие от 1 контрольной группы во 2 и 3 группах уже на седьмые сутки после окончания затравки происходило достоверное снижение в крови ферментов цитолиза, как после первого внутривенного введения ММСК КМ (2 группа), так и после двукратного внутрибрюшинного введения или введения в паренхиму печени суммарной РНК из ММСК КМ (3 группа).
К 14 суткам (уже после второго введения ММСК КМ) во 2 группе и после третьего введения суммарной РНК из ММСК КМ в 3 группе, а также к 21 суткам во 2 группе и в 3 группе происходило дальнейшее достоверное снижение уровня цитолитических ферментов печени по сравнению с 1 контрольной группой к этим срокам.
К 28 суткам наблюдения значения АлАТ, AcAT и ЩФ во 2 и 3 группах продолжали снижаться, приближаясь к исходному уровню, тогда как в 1 группе показатели оставались достоверно на более высоком уровне по сравнению с исходными значениями. На протяжении всего этого срока наблюдения достоверных различий в уровне печеночных ферментов между 2 и 3 группой выявлено не было.
Продолжая динамическое наблюдение за содержанием ферментов цитолиза в крови в течение 180 суток, было установлено (фиг. 1, 2, 3), что во 2 и 3 группах значения АлАТ, АсАТ и ЩФ снижались до исходных значений уже к 28-30 дню, тогда как в 1 контрольной группе значения этих показателей нормализовались только через 6 месяцев (к 180 суткам наблюдения).
При гистологической оценке динамики репаративных процессов в печени у животных этих 3-х групп было установлено, что восстановление морфологических показателей печени во всех исследуемых группах происходит в более замедленном темпе, чем восстановление биохимических показателей (ферменты) (таблицы 1, 2).
Так из таблицы 1 следует, что количество гепатоцитов с признаками жировой дистрофии и с дегенерирующими ядрами, а также количество двуядерных гепатоцитов и гепатоцитов с внутриядерными липидными включениями в 1 контрольной группе не нормализуется ни к 180, ни к 270 дню наблюдения.
Во 2 группе (с двукратным введением ММСК КМ) и в 3 группе (с 3-кратным введением суммарной РНК из ММСК КМ) восстановление морфологических показателей происходит более активно: к 180 суткам не все исследуемые показатели возвратились к исходным значениям, но уже на 270 сутки все исследуемые показатели в этих группах не отличались от значений в интактной печени (норма).
В таблице 2 представлены результаты морфометрического определения удельной площади соединительной ткани, пощади кровеносных сосудов и желчных протоков в срезах ткани печени в трех группах опытов при динамическом наблюдении в течение 270 сут. Из таблицы видно, что в 1 контрольной группе на 270 сутки исследуемые показатели были достоверно выше не только по сравнению с интактными животными, но и по сравнению с 30 сутками у животных этой же группы, свидетельствуя об усилении процессов склерозирования ткани печени. Во 2 и 3 группах имеет место постепенная нормализация исследуемых показателей и к 270 суткам они в плотную приближаются к значениям у интактных животных, причем часть из этих показателей имеет достоверно более низкие значения, чем аналогичные показатели в 1 - контрольной группе к 270 суткам наблюдения.
Достоверных различий в динамике исследуемых показателей во 2 и 3 группах обнаружено не было, хотя в 3 группе имела место тенденция к более выраженному снижению площади соединительной ткани и площади кровеносных сосудов, что может быть связано с 3-кратным введением суммарной РНК из ММСК КМ в течение первого месяца после моделирования печеночной недостаточности. Подсчет ложных долек в течение 180 сут (в баллах) также подтвердил (фиг. 4), что во 2 и 3 группах имеет место процесс дефиброзирования ткани печени, тогда как в 1-группе он практически отсутствует. Достоверные различия в содержании ложных долек в печени животных 2 и 3 групп не выявлены.
Таким образом, с помощью биохимических, морфологических и морфометрических исследований ткани печени в динамике после моделирования ХПН нами установлено, что двукратное внутривенное введение ММСК КМ (2 группа) и 3-кратное внутрибрюшинное введение или введение в паренхиму печени суммарной РНК из ММСК КМ (3 группа) на всех исследуемых сроках обеспечивают постепенную коррекцию нарушенных показателей печени и индуцируют в ней восстановительные процессы по сравнению с 1 контрольной группой.
Также констатировали, что достоверные различия в динамике восстановления биохимических и морфологических показателей печени во 2 и 3 группах отсутствовали. Этот факт свидетельствует о том, что двукратное внутривенное введением ММСК КМ (суммарная доза 5,0×106 кл. на животное) и 3-кратное внутрибрюшинное введение или введение в паренхиму печени суммарной РНК из ММСК КМ (суммарная доза 45 мкг на 100 г животного в подгруппе 3.1 и суммарная доза 135 мкг на 100 г животного в подгруппе 3.2) идентичны по своему биологическому регенераторному воздействию на печень.
Учитывая сходство патогенетических механизмов развития печеночной недостаточности в клинике и при создании ее адекватной модели в эксперименте (как показано выше), представленные результаты эксперимента могут быть правомерно экстраполированы на человека.
Таким образом, применение суммарной РНК из ММСК КМ для лечения (коррекции) печеночной недостаточности будет способствовать безопасной восстановительной регенерации печени, т.к. препарат суммарной РНК не несет в своей структуре малигнизирующих и мутационных свойств, не обладает иммуноспецифичностью и пригоден для курсового применения.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ коррекции печеночной недостаточности в эксперименте | 2017 |
|
RU2650209C1 |
| СПОСОБ ЛЕЧЕНИЯ ПЕЧЕНОЧНОЙ НЕДОСТАТОЧНОСТИ | 2017 |
|
RU2655528C1 |
| Способ коррекции хронической печёночной недостаточности | 2020 |
|
RU2739996C1 |
| Способ лечения острой печеночной недостаточности | 2018 |
|
RU2701792C1 |
| Способ лечения острой печёночной недостаточности | 2020 |
|
RU2744846C1 |
| СПОСОБ И ТРАНСПЛАНТАТ ДЛЯ ЛЕЧЕНИЯ ПЕЧЕНОЧНОЙ НЕДОСТАТОЧНОСТИ | 2010 |
|
RU2425645C1 |
| СПОСОБ И ТРАНСПЛАНТАТ ДЛЯ ЛЕЧЕНИЯ ПЕЧЕНОЧНОЙ НЕДОСТАТОЧНОСТИ | 2010 |
|
RU2425646C1 |
| Способ лечения печеночной недостаточности | 2016 |
|
RU2618989C1 |
| СПОСОБ И ТРАНСПЛАНТАТ ДЛЯ ЛЕЧЕНИЯ ПЕЧЕНОЧНОЙ НЕДОСТАТОЧНОСТИ | 2010 |
|
RU2425648C1 |
| СПОСОБ И ТРАНСПЛАНТАТ ДЛЯ ЛЕЧЕНИЯ ПЕЧЕНОЧНОЙ НЕДОСТАТОЧНОСТИ | 2010 |
|
RU2425647C1 |
Изобретение относится к медицине, а именно к гепатологии, трансплантологии, и может быть использовано для коррекции печеночной недостаточности у субъекта. Для этого применяют суммарную РНК, выделенную из мультипотентных мезенхимальных стромальных клеток костного мозга млекопитающего. Изобретение позволяет повысить эффективность лечения печеночной недостаточности и предупредить развитие осложнений, связанных с применением биотехнологических методов коррекции и профилактики печеночной недостаточности стволовыми/прогениторными клетками. 2 з.п. ф-лы, 2 табл., 4 ил.
1. Применение суммарной РНК из мультипотентных мезенхимальных стромальных клеток костного мозга млекопитающего в качестве средства для коррекции печеночной недостаточности.
2. Применение по п. 1, в котором указанным млекопитающим является человек.
3. Применение по п. 1, в котором указанным млекопитающим является крупный рогатый скот.
| СПОСОБ И ТРАНСПЛАНТАТ ДЛЯ ЛЕЧЕНИЯ ПЕЧЕНОЧНОЙ НЕДОСТАТОЧНОСТИ | 2010 |
|
RU2425645C1 |
| СПОСОБ ЛЕЧЕНИЯ ПЕЧЕНОЧНОЙ НЕДОСТАТОЧНОСТИ | 2015 |
|
RU2586952C1 |
| US 2016074437 A1, 17.03.2016 | |||
| LIU Y et al., Precise regulation of mir-210 is critical for the cellular homeostasis maintenance and transplantation efficacy enhancement of mesenchymal stem cells in acute liver failure therapy, Cell Transplant | |||
| Автомобиль-сани, движущиеся на полозьях посредством устанавливающихся по высоте колес с шинами | 1924 |
|
SU2017A1 |
Авторы
Даты
2018-05-29—Публикация
2017-08-08—Подача