Изобретение относится к экспериментальной и клинической медицине, а именно к гепатологии, хирургии печени, а также к трансплантологии, может быть использовано для лечения (коррекции), а также профилактики острой печеночной недостаточности (ОПН), развивающейся у пациентов после выполнения следующих операций:
- обширной (субтотальной, расширенной) резекции печени (до 60-70% общей массы печени в пределах здоровой ткани), когда оставшаяся малая часть здоровой паренхимы печени, не способна обеспечить поддержание печеночного гомеостаза в организме и предотвратить летальность от ОПН в раннем послеоперационном периоде;
- трансплантации доли печени донора с минимально допустимой массой реципиентам с нефункционирующей собственной печенью.
Клинические проявления ОПН, названные синдромом малого остатка функционирующей печени, развиваются остро уже к концу первых суток после операции резекции печени и наблюдаются у 13-25,8% пациентов, перенесших резекцию, причем показатель смертности у этой категории больных в раннем послеоперационном периоде достигает 7% [Котельникова Л.П., Будянская И.М. - Профилактика и лечение осложнений после резекции печени Вестник хирургии им. И.И. Грекова. - 2012; - 171(3); - с. 67-71]. Выше изложенное, может наблюдаться и при трансплантации реципиенту доли печени минимально допустимой массы.
Развитие ОПН в раннем послеоперационном периоде после обширной резекции печени у пациента (или у реципиента после трансплантации минимально допустимой массы резецированной доли печени) связывают с резкой гиперфункцией сохранившихся клеток в малом остатке печени, которая ингибирует выполнение этими клетками других жизненно важных функций - обновление структур и пролиферацию клеток для быстрого восстановления исходных размеров (массы) печени и поддержания ею печеночного гомеостаза в организме.
Гистологически синдром малого остатка печени после ее обширной резекции проявляется в течение первых 30 часов усилением клеточного повреждения (апоптоз и/или некроз клеток [Panis Y., McMullan D.M., Emond J.C. Progressive necrosis after hepatectomy and the pathophysiology of liver failure after massive resection // Surgery. - 1997. - 121.-142-9.] и развитием временного блока митотической активности гепатоцитов при выходе их из Go - периода клеточного цикла, а также отсутствием экспрессии Ki-67 - маркера пролиферативной активности клеток, т.е. проявляется торможением пролиферативных процессов в оставшейся ткани печени в ответ на ее стрессорное повреждение [Ельчанинов А.В. Молекулярные и клеточные механизмы регенерации печени после субтотальной резекции в эксперименте. - Автореферат дисс. докт. мед. наук, - Москва. - 2017, - 41 с.]
Отмечено также, что отчетливые признаки пролиферативной активности клеток печени после субтотальной резекции (увеличение митотической и пролиферативной активности) появляются лишь через 48 часов после выполнения этой операции [Ельчанинов А.В., 2017, см. выше] и эта запоздалая, отодвинутая во времени, активация процессов восстановления исходной массы в малом остатке печени лежит в основе развития клиники тяжелой ОПН и летальных исходов у пациентов после субтотальной/расширенной резекции печени.
Выше изложенное, указывает на существующую в клинике настоятельную необходимость эффективного лечения ОПН и предотвращения летальных исходов в раннем послеоперационном периоде после обширной резекции печени за счет эффективной индукции в клетках малого остатка оперированной печени состояния ранней адаптивной готовности к быстрому и продуктивному наращиванию массы клеток для восстановления исходных размеров и функции печени путем ранней индукции в сохранившихся клетках этого органа высокого уровня пролиферативной и митотической активности. В настоящее время пока не предложены эффективные и доступные методы лечения ОПН и профилактики летальности как после обширной резекции печени, так и после трансплантации реципиенту доли печени минимально допустимого размера.
Для лечения ОПН, и прежде всего для осуществления детоксикации организма, во второй половине прошлого века стали широко применять аппаратные эфферентные методы терапии: диализно-фильтрационные методы (гемодиализ, ультрафильтрация, гемофильтрация, гемодиафилътрация); выведение токсинов через естественные или искусственные полупроницаемые мембраны - перитонеальный диализ; сорбционные методы (гемосорбция, плазмаферез, плазмосорбция, осаждение токсинов на углях и искусственных смолах: гемо-, плазмосорбция; лимфологические методы лечения (лимфосорбция, лимфодиализ, лимфофильтрация, лимфаферез, эндолимфатическое введение лекарственных средств) [Чикотеев С.П., А.Н. Плеханов / Очерки хирургии печени и поджелудочной железы / монография // Иркутск. - 2002, - 259 с.].
В настоящее время в клинической практике стали дополнительно использовать молекулярные абсорбирующие рециркуляторные системы (MARS) и модули для сепарации и адсорбции фракционированной плазмы (FPSA) - системы Prometheus. [Stadlbauer V. et al. Effect of extracorporeal liver support by MARS and Prometheus on serum cytokines in acute-on-chronic liver failure // Critical Care. - 2006. - №6 (10). - p. 1-8.; Gonwa T.A. Should MARS and PROMETHEUS be Used in Patients with Liver Disease //Seminars in Dialysis. - 2014. - Vol. 27. - p. 228-231].
Однако, эти методы, как и все аппаратные эфферентные методы, сопровождаются удалением из плазмы больного не только токсических веществ, но и биологически активных факторов, регулирующих регенерацию и пролиферацию гепатоцитов в поврежденной печени. В результате частота летальных исходов после применения эфферентных методов снизилась незначительно, а эффективность применения этих методов при ОПН была признана недостаточной. Это обстоятельство послужило основанием для разработки новых биотехнологических методов интенсивной терапии ОПН после обширной резекции печени, основанных на применении экстрактов из ткани печени крыс с 70% резекцией или экстрактов из ткани печени неонатальных поросят [Гальперин Э.И., Дюжева Т.Г., Платонова Л.В. и др. Уменьшение повреждения печени при ее обширной резекции и токсическом поражении. // Анналы хирургической гепатологии. - 2008. - т. 13, №1. - с. 51-55]. Предложенные методы, несмотря на эффективность их применения в эксперименте, пока не получили одобрения для применения в клинике, т.к. при использовании экстрактов из нативных тканей животных всегда существует потенциальная опасность заражения пациента их кровяными инфекциями, а изготовление высокоэффективного медикаментозного препарата из экстракта животных тканей предполагает идентификацию химического переносчика биологических эффектов и выделение его из тканевого экстракта, чего авторами не было предпринято.
В последние годы стал известен новый биотехнологический способ лечения ОПН после субтотальной резекции печени, который осуществляется путем имплантации в остаток печени сразу после резекции клеточно-инженерных конструкций, состоящих из со-культивированных аллогенных клеток печени и аутологичных мультипотентных мезенхимальных стромальных клеток костного мозга (ММСК КМ) в составе биополимерного гетерогенного коллагенсодержащего гидрогеля (БГКГ). Этот метод индуцирует восстановительные процессы в остатке печени путем усиления в нем митотической и пролиферативной активности клеток [Shagidulin М., Onishchenko N., Krasheninnikov М. et al., Transplantation liver cells and multipotent mesenchymal stromal cells for correction and treatment of hepatic failure//Medimond. International Proceedings. - 2010, p. 83-86; Шагидулин М.Ю., Онищенко H.A., Крашенинников M.E. и др. Выживание клеток печени, иммобилизированных на 3-D матриксах при моделировании печеночной недостаточности // Вестник трансплантологии и искусственных органов, - 2011, т. XIII, №3. с. 59-66].
Несмотря на эффективность применения - предложенный метод не лишен технических и организационных недостатков, затрудняющих его применение, особенно в клинике, так как нет регламентирующих документов, позволяющих использование клеточного материала в клинической практике. Кроме того, этот метод, предусматривает выделение, краткосрочное сохранение и последующее применение аллогенных клеток печени из заранее заготовленной донорской печени, а также заблаговременное выделение и длительное культивирование (в течение 3-4 недель) ММСК КМ пациента, для наращивания клеточной массы и последующей их трансплантации в печень.
Известен и другой биотехнологический способ индукции восстановительных процессов в поврежденной печени, который, однако, был предназначен для лечения хронической печеночной недостаточности (ХПН), когда в печени уже сформированы все признаки ее хронического повреждения. Способ обеспечивает постепенное (в течение нескольких месяцев) восстановление структуры и функции поврежденных клеток, а также восстановление гистологических характеристик ткани печени, которое достигается за счет многократного (по крайней мере, трехкратного) парентерального введения в организм суммарной РНК (общей РНК), выделенной из предварительно культивированных в течение 3-4-х недель ММСК КМ здорового донора (RU 2655761, C1; RU 2650209, C1; RU 2655528, С1). В результате применения суммарной РНК, выделенной из ММСК КМ, а не самих ММСК КМ, этот способ позволяет избежать развития известных опасных осложнений, связанных с применением стволовых/прогениторных клеток костного мозга (малигнизация и мутация клеток); кроме того, предложенный способ позволяет использовать только биологически активный комплекс этих клеток, содержащий в себе все типы РНК (в том числе все типы регуляторных белок - не кодирующих микро-РНК), что позволяет осуществлять непосредственный перенос регенерационной информации клеткам хронически поврежденного органа - печени, индуцируя в них процесс эффективной репаративной регенерации.
Однако известный способ, предполагающий использование суммарной рибонуклеиновой кислоты (РНК) из мультипотентных мезенхимальных стромальных клеток костного мозга млекопитающих в качестве средства для коррекции печеночной недостаточности, не лишен, недостатков, препятствующих его широкому и эффективному использованию для лечения ОПН после обширной резекции печени (или трансплантации доли печени минимально допустимого размера).
Прежде всего, указанный выше известный способ относится к лечению ХПН, вызванной хроническим токсическим повреждением печени. К недостаткам относится также сложность и длительность сроков получения ММСК КМ из костного мозга (из мононуклеарной фракции) сначала путем краткосрочного культивирования (3-4 суток) для выделения этих клеток из мононуклеарной фракции клеток костного мозга, а затем путем длительного культивирования ММСК КМ в течение 3-4 недель для наращивания клеточной массы с применением дорогостоящих сред и последующего получения из клеточной массы биотехнологического продукта - суммарной РНК, что существенно повышает себестоимость метода. Мононуклеарная фракция клеток костного мозга содержит 3 типа ядросодержащих клеток: гемопоэтические клетки (преобладающий тип клеток в костном мозге), стромальные клетки (в костном мозге их содержится менее 0,5-1,5%) и клетки сосудистого происхождения (менее 0,5-1,0%).
Кроме того, предложенная схема использования суммарной РНК оказалась непригодной для лечения ОПН, т.к. применение суммарной РНК по известной схеме обеспечивает лишь постепенную (в течение нескольких месяцев) инволюцию и устранение признаков деструкции паренхиматозных и непаренхиматозных структур ткани печени, сформировавшихся в процессе ее длительного хронического токсического повреждения, тогда как для успешного лечения ОПН в клинике после субтотальной резекции уже в первые часы послеоперационного периода необходимо обеспечить устранение индуцированного стрессом апоптоза и некроза клеток печени, раннего и опасного ингибирования митотической и пролиферативной активности клеток в остатке печени, а также требуется уже в первые сутки достигнуть раннего и максимально ускоренного темпа наращивания дополнительных количеств здоровых клеток в остатке здоровой ткани печени для быстрого преодоления дефицита ткани печени (ее критической массы) после операции, ускоренного восстановления печеночного гомеостаза и предотвращения гибели пациента.
Техническая проблема заключается в разработке эффективного, обладающего низкой себестоимостью, доступного способа лечения и профилактики ОПН, развивающейся после хирургической операции, в результате которой формируется критический дефицит функционирующей ткани печени.
Технический результат, достигаемый при осуществлении предлагаемого способа, заключается в:
- сокращении сроков лечения/профилактики ОПН при одновременном повышении их эффективности, профилактике развития летальных исходов путем заблаговременного обеспечения у оперируемого пациента требуемого уровня активации митотической и пролиферативной активности клеток в оставшейся или трансплантированной части печени в раннем послеоперационном периоде за счет осуществления предоперационного и раннего послеоперационного применения препарата суммарной РНК в оригинальных дозах и в строго выверенные, биологически значимые временные интервалы;
- снижении себестоимости лечебной или профилактической процедур, их упрощении за счет получения клеточного материала (без длительного двухэтапного культивирования) для выделения суммарной РНК из здорового костного мозга (аутогенного или аллогенного) за счет использования не ММСК КМ, а гемопоэтической мононуклеарной фракции клеток костного мозга (КМ).
Разработанная нами схема применения суммарной РНК позволяет устранить развитие периода ингибирования (блокирования) митотической и пролиферативной активности клеток печени в первые сутки после субтотальной резекции печени, оптимизировать темп ускоренного преодоления критической массы функционирующего остатка печени и тем самым предотвратить летальность после обширной резекции печени (или после трансплантации минимально допустимой массы печени) путем создания условий для максимально ранней пред- и -послеоперационной адаптивной перестройки в малом остатке здоровой печени, способной уже в первые - вторые сутки после операции затормозить процессы клеточного стрессорного повреждения и обеспечить высокий темп митотической и пролиферативной активности сохранившихся жизнеспособных клеток в малом остатке печени.
В предлагаемом нами способе лечения ОПН, исходным материалом для получения суммарной РНК служит некультивируемая фракция гемопоэтических мононуклеарных клеток КМ (аутологичных или аллогенных) здорового донора, причем в качестве донора мононуклеарных клеток КМ (при резекции печени) может стать сам пациент, но только до резекции у него печени, так как операция обширной резекции уже в ранний период (первые сутки) ингибирует регенераторные процессы как в печени, так и в КМ.
Следует также отметить, что применение фракции мононуклеарных клеток КМ, основным компонентом которых являются клетки гемопоэтического ряда, для индукции регенераторных процессов как в печени, как и в других органах, остается перспективным направлением регенерационной медицины, т.к. КМ, будучи центральным органом иммуногенеза и системы крови в здоровом организме, проявляет универсальные регуляторные свойства, поскольку его клетки относятся к быстро реагирующим и быстро развивающимся клеткам.
Кроме того, КМ содержит постоянно самообновляющийся пул стволовых/прогениторных клеток, которые способны продуцировать цитокины, факторы роста, и паракринно образующиеся тканеспецифические факторы, оказывающие регуляторное воздействие на клетки различных паренхиматозных органов, в том числе печени.
Именно поэтому клетки КМ продолжают использовать для индукции процессов регенерации. Однако внедрение в клиническую практику клеточных технологий, основанных на применении клеток КМ, и прежде всего, фракции мононуклеарных клеток для лечения заболеваний печени, продолжает уже длительное время оставаться на стадии пилотных исследований из-за их недостаточной эффективности в организме реципиента после трансплантации, а также из-за опасности развития таких нежелательных осложнений как «реакция трансплантат против хозяина», которая развивается при использовании аллогенных мононуклеарных клеток костного мозга, поскольку их основным компонентом являются клетки гемопоэтического ряда.
Для исключения опасности возникновения нежелательных осложнений при использовании клеток костного мозга в предложенном нами способе лечения ОПН применяются не гемопоэтические клетки КМ, входящие в состав мононуклеарных клеток костного мозга, а выделенный из них комплекс биологически активных компонентов, включающий в себя все типы РНК, в том числе все типы регуляторных микро РНК с высокой проникающей способностью, способных осуществить быстрый перенос содержащейся в них «регенерационной и сигнальной информации» клеткам поврежденного органа (печени), и тем самым ускоренно активизировать в них восстановительные процессы.
Суммарная РНК, выделенная из клеток лимфоидной ткани - т.е. из клеток, входящих в состав мононуклеарной фракции клеток КМ, тимуса, селезенки и циркулирующих в крови лимфоцитов, не обладает иммуногенной активностью, но в отличие от тканевых (тканеспецифичных) РНК обладает способностью регулировать рост и развитие клеток в тканях различного гистотипа [Бабаева А.Г., Тишевская Н.В., Геворкян Н.М. / О мофогенетических свойствах РНК лимфоидных и стволовых клеток при восстановительных процессах//Москва,2016, ФГБНУ НИИМЧ, 269 с.]
Причем «адресный» перенос регенерационной информации в поврежденный орган, по - видимому, осуществляют содержащиеся в суммарной РНК многочисленные микроРНК, в том числе микроРНК, качественно одинаковые с микроРНК, экспрессирующимися в поврежденном (или неадекватно функционирующем) органе.
Таким образом, достоинствами предлагаемого способа лечения/профилактики ОПН после обширной резекции печени (или после трансплантации минимально допустимой массы резецированной доли печени), позволяющем обеспечить клиническую доступность метода и по существу достигнуть выраженного и надежного лечебного эффекта является:
- отказ от использования ММСК КМ для получения суммарной РНК и использование для этих целей суммарной мононуклеарной фракции клеток костного мозга, что позволяет исключить необходимость длительного и дорогостоящего культивирования клеток, а также существенно снизить себестоимость метода и сократить период подготовки клеток для выделения РНК;
- заблаговременное предоперационное (за 44-52 часа до операции) и раннее послеоперационное (через 3-4 часа после операции) введение общей РНК, выделенной из мононуклеарных клеток костного мозга здорового донора, что позволяет уже в предоперационном периоде и в раннем послеоперационном периоде затормозить деструктивные процессы и активировать адаптационные процессы в ткани печени, и тем самым обеспечить максимально раннюю регенерационную поддержку печени, а также в максимально короткие сроки преодолеть критическую массу остатка печени после обширной резекции, устранить возможность летальных исходов;
- возможность при необходимости проводить повторные парентеральные введения препарата суммарной РНК до полного восстановления показателей массы и функции резецированной или трансплантированной печени.
- возможность обеспечить раннюю компенсаторную поддержку процессам пролиферации клеток не только в печени, но и адаптационную поддержку других органов (почки, легкие), относящихся к единой системе детоксикации организма и участвующих в поддержании печеночного гомеостаза, а также в снижении опасности возникновения летальных исходов;
- возможность обеспечения безопасности проведения регенерационной терапии препаратом суммарной РНК из мононуклеарной фракции клеток КМ, т.к. введенная РЖ, являясь химическим веществом, не может индуцировать «реакцию трансплантат против хозяина», а так же утратить свою регуляторную активность;
- возможность проводить эффективную регенерационную терапию различных органов и систем в организме, т.к. суммарная РНК, выделенная из мононуклеарной фракции клеток КМ здорового донора сохраняет универсальность регуляторных свойств этих клеток, и будучи биохимическим препаратом, с высокой проникающей активностью обладает более выраженным регуляторным воздействием, чем сами мононуклеарные клетки, функция которых проявляется в зависимости от состояния иммунной системы в организме.
Сущность изобретения заключается в следующем.
Для коррекции, а также профилактики острой печеночной недостаточности в эксперименте после хирургической операции, в результате которой формируется критический дефицит функционирующей ткани печени, (далее хирургической операции) не менее чем за 50-58 часов до выполнения хирургической операции из костного мозга донора выделяют мононуклеарную фракцию клеток КМ. Затем из полученной фракции выделяют суммарную РНК. Последнюю вводят экспериментальному животному - крысе внутрибрюшинно или внутривенно в дозе 50-60 мкг/100 г веса экспериментального животного двукратно: сначала за 44-52 часа до выполнения операции, а затем через 3-4 часа после нее.
Хирургической операцией может быть обширная резекция печени.
Хирургической операцией может также быть трансплантация доли/сегмента печени с минимально допустимой массой.
При этом введение суммарной РНК, может быть выполнено у пациента и реципиента с сохранением не адекватно функционирующей печени, а также у реципиента после удаления собственной печени.
Предлагаемый способ обеспечивает адаптивную перестройку метаболизма в предоперационном периоде, торможение процессов клеточного апоптоза и некроза, вызванного операционным стрессом, а также усиление послеоперационной активации морфорегуляторной активности собственных клеток костного мозга и клеток печени, как экспериментального животного, так и пациента в клинике.
Способ осуществляется следующим образом.
Для лечения ОПН после обширной резекции печени (или после трансплантации минимально допустимой массы доли печени) применяют не аутологичные или аллогенные мононуклеарные клетки КМ, а биологически активный комплекс, выделенный из мононуклеарных клеток КМ, либо здорового аллогенного донора, либо пациента (аутологичного донора) до резекции печени.
Комплекс содержит суммарную не иммуногенную РНК здорового организма, в состав которой входят все РНК, в том числе все типы регуляторных РНК (прежде всего микро РНК), обеспечивающие перенос «регенерационной и сигнальной информации» клеткам КМ и клеткам поврежденной печени пациента для ускоренного преодоления в его организме критической массы печени после обширной резекции.
Суммарная РНК не обладает иммуногенной активностью и поэтому может быть использована также в организме реципиента после трансплантации донорской печени.
Выполнение способа начинают с заблаговременного получения мононуклеарной фракции клеток из аспирата КМ животного (за 50-58 часов до выполнения резекции печени). Для этого под эфирным наркозом из костномозгового канала большеберцовых и бедренных костей крысы-донора получали клетки КМ путем аспирации их шприцом с иглой 18G, содержащим среду для забора (0.5 мл фосфатно-буферного раствора с 50 ЕД/мл гепарина и 0.25 мг/л гентамицина).
Суспензию клеток КМ центрифугировали при 1500 об/мин (350g) 5 минут, осадок клеток ресуспендировали в растворе для лизиса эритроцитов и тромбоцитов (114 мМ NH4CL, 7,5 тМ KHCO3,100 мкМ EDTA) в течение 3 минут и повторно центрифугировали. Гемолизированный супернатант удаляли отсасыванием, а клеточный осадок ресуспендировали в среде DMEM (ПанЭко, Россия), содержащей 10% телячью эмбриональную сыворотку («HyClonegold», USA), инсулин 0.4 мкМ, 0.25 мг/л гентамицина.
Выделенные клетки представляли собой мононуклеарную фракцию, преимущественно гемопоэтических клеток КМ, суммарный выход которых колебался от 0,8-1.5×10 клеток. Далее приступали к выделению суммарной РНК из полученных мононуклеарных клеток КМ по методике Extract RNA, разработанной фирмой «ЕВРОГЕН» (Россия). К полученной фракции мононуклеарных клеток добавляли реагент Extract RNA из расчета 1 мл реагента на 1×106 клеток (в камере Горяева предварительно подсчитывали количество клеток), инкубировали смесь 15 минут периодически пипетируя) и центру фугировали при 13400 об/мин 10 минут для удаления нерастворенных фрагментов. Супернатант переносили в новую пробирку и приступали к разделению фаз. Для этого добавляли 0.2 мл хлороформа на каждый 1 мл реагента Extract RNA, инкубировали смесь в течение 5 мин при комнатной температуре, периодически встряхивая образец; затем образец центруфугировали при 13400 об/мин в течение 15 минут при комнатной температуре.
В ходе центруфугирования происходило разделение смесей на три фазы: нижнюю-органическую фенол - хлороформную фазу желтоватого оттенка, интерфазу белого цвета и верхнюю бесцветную водную фазу. РНК находится в верхней водной фазе, которую аккуратно собирали и переносили в чистую пробирку.
Затем приступали к непосредственному выделению РНК. Для этого в водную фазу добавляли 0.5 мл 100% изопропанола на каждый 1 мл использованного реагента (Extract RNA). Полученную смесь инкубировали при комнатной температуре в течение 10 минут и центрифугировали при 13400 об/мин в течение 10 минут при комнатной температуре. Затем аккуратно, по стенке пробирки, добавляли 2 мл 75% этанола на каждый 1 мл изопропанола, использованного ранее. Полученный образец центрифугировали на максимальной скорости (13400 об/мин) в течение 5 минут. Удаляли этанол пипеткой и осадок, выделенной РНК, растворяли в 1 мл воды и определяли концентрацию РНК в 100 мкл образца на спектрофотометре при длине волны 260 нм. Из каждых 4-6 млн исходно использованных мононуклеарных клеток КМ в 1 мл определялось 380-500 мкг РНК. Далее из этого концентрированного раствора РНК готовили рабочие растворы РНК, требуемой концентрации для введения в организм оперированного животного с целью превентивного лечения ОПН. Суммарная РНК, выделенная из мононуклеарных клеток КМ, представляет собой биотехнологический продукт высокой степени очистки, который вводят парентерально (внутрибрюшинно или внутривенно).
Для экспериментального животного - (крысы) рабочий раствор РНК содержал 76-100 мкг РНК/мл (к 1.0 мл концентрированного раствора РНК добавляли 4 мл дистиллированной воды). Введение РНК осуществляют в дозе 50-60 мкг на 100 г веса животного двукратно: за 44-52 часа до выполнения хирургической операции и через 3-4 часа после выполнения операции обширной резекции печени (или трансплантации реципиенту доли печени минимально допустимой массы) внутрибрюшинно или внутримышечно, т.е. крысе массой 400 г двукратно вводят по 200-240 мкг общей РНК в виде 2.0-2.4 мл рабочего раствора РНК при содержании в нем 100 мкг РНК/мл или 2.6-3.15 мл рабочего раствора РНК при содержании в нем 76 мкг РНК/мл по указанной выше схеме.
Приводим пример осуществления предлагаемого способа лечения ОПН после обширной резекции печени.
Эффективность предлагаемого способа превентивного лечения ОПН в результате возникновения малого остатка печени в организме после обширной резекции печени (или после трансплантации минимально допустимой массы резецированной доли печени) - изучали на модели субтотальной резекции печени. Для этого у крыс, наркотизированных ингаляционно диэтиловым эфиром, с соблюдением правил асептики и антисептики вскрывали брюшную полость, выводили печень в рану и последовательно накладывали лигатуры на основания серединной, левой боковой и правой верхней долей печени, после чего их удаляли (всего 70-75% общей массы печени). Операцию проводили всегда в утренние часы (в период с 10 до 12 часов), когда суточный ритм митотической активности клеток печени минимален, с соблюдением биоэтических принципов гуманного использования животных в соответствии с «Биоэтической концепцией трех R» (replacement, reduction, refinement), которая является общепринятым мировым стандартом.
Затем всех оперированных животных (n=35) разделили на две группы: 1 группа (n=15)-контроль без применения специальной терапии; и 2 группа (п=20) опытная, которая включала две подгруппы: с внутрибрюшинным введением РНК в дозе 50 мкг/100 г веса животного (подгруппа 2.1, n=10); и с внутривенным введением РНК в дозе 60 мкг/100 веса животного (подгруппа 2.2, n=10), причем РНК вводили двукратно - за 44-52 часа до выполнения операции обширной резекции печени и через 3-4 часа после завершения операции моделирования субтотальной резекции печени. Результаты экспериментов оценивали в 2-х группах животных, выживших после выполнения им обширной резекции печени (70-75%). Всего из 35 крыс, у которых моделировали ОПН, погибло 10 животных в течение 5-ти первых суток после резекции печени, (общая летальность составила 21%). Однако все животные, погибшие после субтотальной резекции, относились к контрольной группе (без профилактической терапии, n=15) и внутри этой группы летальность составила 66.6%. У выживших животных в контрольной и опытной группах функциональное состояние печени исследовали в динамике параллельно с оценкой степени развития восстановительных процессов печени в течение первых 28-ти суток после выполнения субтотальной резекции печени. Для этого, с соблюдением биоэтических принципов гуманного использования животных, животных выводили из эксперимента путем внутрибрюшинного введения раствора тиопентала натрия в дозировке, вызывающей остановку дыхания, и проводили исследования крови, а так же морфологическое исследование оперированной печени через 24 ч, 48 ч, 72 ч, на 5, 7, 10, 14, 18, 21 и 28-е сутки после выполнения субтотальной резекции. Для оценки состояния восстановительных процессов в резецированной печени использовали биохимические, гистологические и иммуногистохимические методы, а так же проводили взвешивание печени (контроль восстановления массы печени) в динамике наблюдения. Так как результаты исследований в подгруппах 2.1 и 2.2 достоверно не различались между собой они были объединены в общую группу 2.
Биохимеческими методами исследовали кровь на содержание аланин - аминотрансферазы (АлАТ), аспарагин - аминотрансферазы (АсАТ) и щелочной фосфатазы (ЩФ). Для этого у крысы забрали 28-32 мкл крови, капали на специальные тест-полоски Reflotron™, которые сразу же устанавливали в биохимический анализатор Reflotron™, («Roche», Швейцария) (Принцип измерения - рефлексионная фотометрия, точность измерения - ±0,5%, воспроизводимость - <=0.2%, линейность: ±0,05%).
Затем вскрывали брюшную полость, эксплантировали печень и взвешивали ее. Для гистологического исследования печени извлекали фрагмент оставшейся доли печени, разрезали его на кусочки размерами 3×4×5 мм и помещали в раствор Буэна (через 24 часа раствор Буэна меняли на 70% этанол) для фиксации. После завершения фиксации кусочки промывали в проточной воде в течение 3 ч, обезвоживали в спиртах восходящей концентрации и заливали в парафин. Парафиновые срезы толщиной 4-5 мкм наклеивали влажным способом на стекла с поли-L-лизиновым покрытием («Thermo», США). Затем препараты высушивали в течение 48 ч в термостате при 37°С, депарафинировали, регидратировали и окрашивали срезы гематоксилином и эозином. В гистологических препаратах срезов ткани печени в 30 полях зрения определяли количество митотически делящихся клеток (в  - промилле), а так же рассчитывали митотический индекс (МИ). Выраженность пролиферативной активности гепатоцитов печени оценивали так же иммуногистохимически с помощью антител Ki-67, являющихся маркерами ядерного антигена пролиферирующих клеток, и рассчитывали пролиферативный индекс (ПИ). Достоверность различия исследуемых показателей в сравниваемых группах оценивали с помощью параметрического критерия t-Стьюдента при p<0.05.
- промилле), а так же рассчитывали митотический индекс (МИ). Выраженность пролиферативной активности гепатоцитов печени оценивали так же иммуногистохимически с помощью антител Ki-67, являющихся маркерами ядерного антигена пролиферирующих клеток, и рассчитывали пролиферативный индекс (ПИ). Достоверность различия исследуемых показателей в сравниваемых группах оценивали с помощью параметрического критерия t-Стьюдента при p<0.05.
Приводим результаты сравнительного изучения эффективности применения суммарной РНК, выделенной из фракции мононуклеарных клеток аллогенного КМ крыс, полученного предоперационно для профилактики летальных исходов при ОПН после обширной (70-75%) резекции печени.
В таблице представлены результаты сравнительного исследования содержания цитолитических ферментов печени в сыворотке крови крыс после субтотальной резекции в контрольной группе (без профилактической терапии) и в опытной группе, в которой вводили суммарную РНК из мононуклеарных клеток КМ по указанной схеме.
В таблице представлены результаты исследования АсАТ, АлАТ и ЩФ в сыворотке крови крыс после моделирования обширной резекции печени в контрольной группе (введение физиологического раствора) (n=15) и в опытной группе (n=20) (введение РНК по предлагаемой схеме).
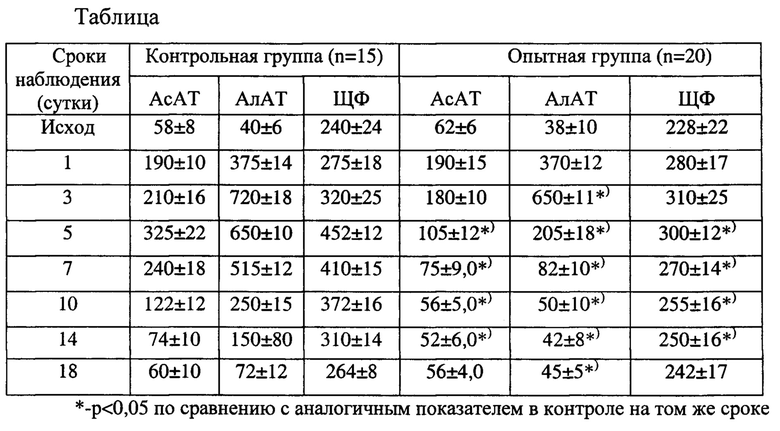
Из таблицы видно, что в контроле показатели цитолиза (АлАТ, АсАТ и ЩФ) у выживших животных резко и неуклонно нарастали в течение первых 5 суток, затем стабилизировались и начиная с 10-14 суток возникала отчетливая тенденция их нормализации. В опытной группе показатели цитолиза нарастали лишь в течение 1 и 2-х суток; к 3-м суткам намечалась отчетливая тенденция к снижению цитолитической активности, а на 5-е сутки снижение цитолитической активности становилось для всех исследованных печеночных ферментов АлАТ, АсАТ и ЩФ - достоверным. В результате в опытной группе нормализация в крови исследуемых показателей наступала к 7-10 суткам, тогда как в контрольной группе только к 18-м суткам.
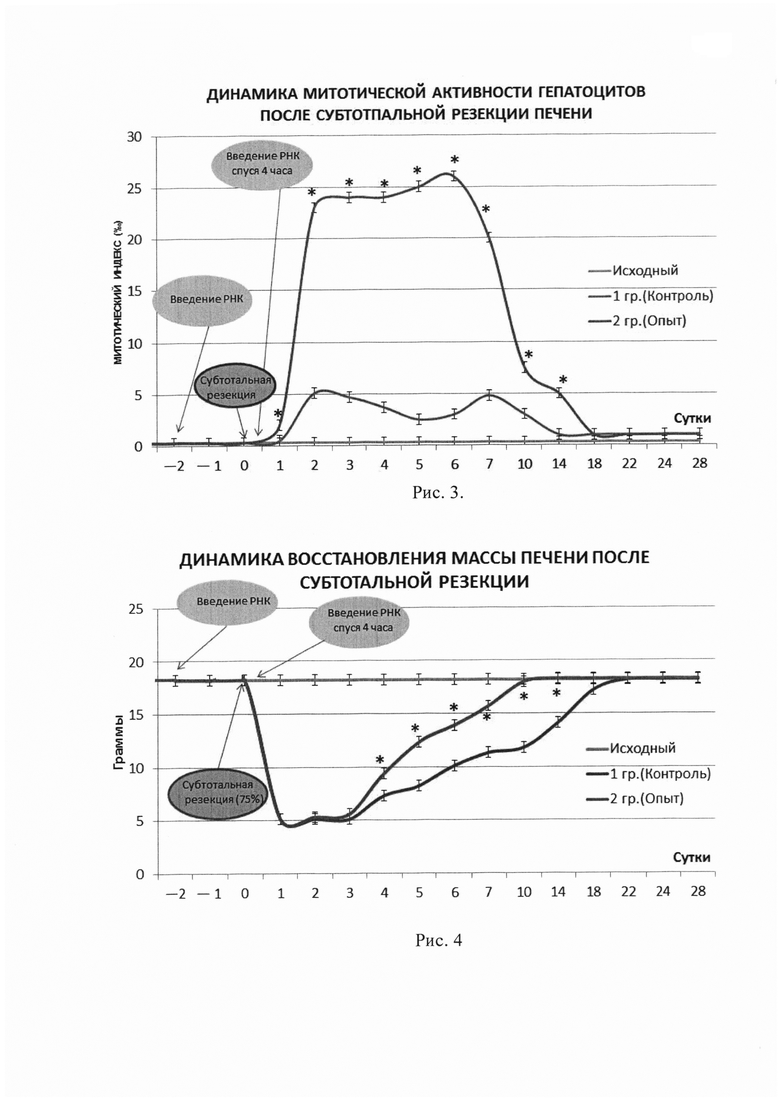
Исследование митотическое активности гепатоцитов из резецированной печени позволило установить ее активацию через 48 часов и в 1-ой контрольной группе и во 2-опытной группе по сравнению с исходным уровнем: исходный уровень митотической активности, оцениваемый до резекции печени по митотическому индексу (МИ), составил 0,2-0,3 промилле -  - (1-2 митоза на 30 полей зрения), тогда как в 1 (контрольной) группе МИ через 48 час после субтотальной резекции составил 5,181
- (1-2 митоза на 30 полей зрения), тогда как в 1 (контрольной) группе МИ через 48 час после субтотальной резекции составил 5,181 (на 7334 клетки определялось 38 митозов), а во второй опытной группе с введением РНК из мононуклеарной фракции клеток КМ на этом же сроке МИ составил 23,45
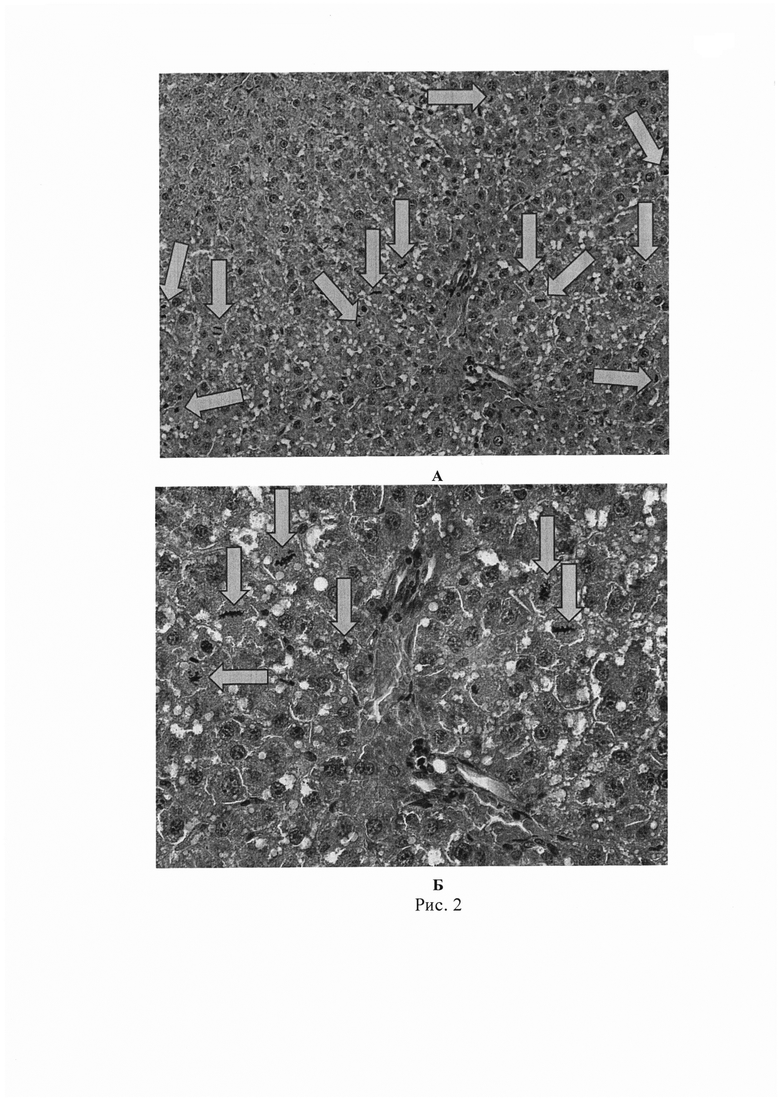
(на 7334 клетки определялось 38 митозов), а во второй опытной группе с введением РНК из мононуклеарной фракции клеток КМ на этом же сроке МИ составил 23,45 (на 9678 клеток определялось 227 митозов), т.е. во второй группе МИ был приблизительно в 5 раз выше, чем в первой контрольной группе. Приведенные изменения митотической активности гепатоцитов в печени крыс 1 и 2 групп через 48 часов после резекции печени были установлены на основании подсчета митотически делящихся гепатоцитов в 30 полях зрения, однако уже в каждом поле зрения гистологических препаратов во 2 - опытной (введение РНК по схеме) группе выявлялось существенно большее количество митотически делящихся гепатоцитов. На рис. 1а и б представлен гистологический препарат печени крысы из контрольной группы через 48 часов после резекции 70-75% массы печени и двукратного введения физиологического раствора; препарат окрашен гематоксилином и эозином; а - увеличение 200; б - увеличение 400. Стрелка указывает, что в поле зрения выявлен только. один митотически делящийся гепатоцит. На рис. 2 представлен гистологический препарат печени крысы из опытной группы через 48 часов после субтотальной резекции печени и двукратного внутривенного введения препарата суммарной РНК в дозе 50 мкг/100 г веса животного по предложенной схеме. Препарат окрашен гематоксилином и эозином; а - увеличение 200; б - увеличение 400. Стрелки указывают на многочисленные митотически делящиеся гепатоциты, находящиеся в разных фазах клеточного цикла и все они в одном поле зрения. Кроме того мы установили, что в опытной группе высокий уровень митотической активности гепатоцитов сохраняется в течение 7 последующих суток, тогда как в контроле митотическая активность гепатоцитов в течение 14 суток после субтотальной резекции печени остается на достоверно более низком уровне, чем в опытной группе. Эти данные представлены на рис. 3, который отражает динамику сравнительного изучения митотической активности гепатоцитов (митотического индекса) в 1 и 2 группах опытов в течение 28 суток после субтотальной резекции печени. Достоверное и длительное (в течение 14 суток) сохранение более высокого уровня митотической и пролиферативной активность клеток в остатке резецированной печени в опытной группе по сравнению с контролем, ускоряет также темп индукции восстановительных процессов в ней, что находит отражение в ускоренном восстановлении исходной массы печени после резекции у животных 2 группы. На рис. 4 представлена динамика восстановления массы печени после резекции в двух группах опытов: в 1 - контрольной (двукратное введение физиологического раствора) и во 2 - опытной (двукратное введение РНК по схеме). Из рисунка 4 видно, что уже на 3 сутки во 2 группе намечается тенденция к увеличению массы печени после резекции, а на 5, 7, 10, 14 и 18 сутки уже отчетливо выявляются достоверные различия в восстановлении массы печени в 1 и 2 группах: во 2 группе темп восстановления массы печени (темп преодоления критической массы) в течение первых 10 суток был существенно на более высоком уровне, чем в контроле, в результате чего уже на 7-10 сутки после резекции масса печени во 2 группе практически не отличалась от исходных значений. В 1-контрольной группе восстановление массы печени происходило в более медленном темпе, особенно в первые две недели после резекции, в результате масса печени только к 18-20 суткам приближалась к исходным значениям и полностью восстанавливалась лишь на 22-24 сутки наблюдения. Нами отмечено также, что более высокий темп восстановления массы печени во 2 группе коррелировал с более высоким темпом восстановления функциональных показателей печени (АлАТ, АсАТ, ЩФ) в этой группе (см. таблицу).
(на 9678 клеток определялось 227 митозов), т.е. во второй группе МИ был приблизительно в 5 раз выше, чем в первой контрольной группе. Приведенные изменения митотической активности гепатоцитов в печени крыс 1 и 2 групп через 48 часов после резекции печени были установлены на основании подсчета митотически делящихся гепатоцитов в 30 полях зрения, однако уже в каждом поле зрения гистологических препаратов во 2 - опытной (введение РНК по схеме) группе выявлялось существенно большее количество митотически делящихся гепатоцитов. На рис. 1а и б представлен гистологический препарат печени крысы из контрольной группы через 48 часов после резекции 70-75% массы печени и двукратного введения физиологического раствора; препарат окрашен гематоксилином и эозином; а - увеличение 200; б - увеличение 400. Стрелка указывает, что в поле зрения выявлен только. один митотически делящийся гепатоцит. На рис. 2 представлен гистологический препарат печени крысы из опытной группы через 48 часов после субтотальной резекции печени и двукратного внутривенного введения препарата суммарной РНК в дозе 50 мкг/100 г веса животного по предложенной схеме. Препарат окрашен гематоксилином и эозином; а - увеличение 200; б - увеличение 400. Стрелки указывают на многочисленные митотически делящиеся гепатоциты, находящиеся в разных фазах клеточного цикла и все они в одном поле зрения. Кроме того мы установили, что в опытной группе высокий уровень митотической активности гепатоцитов сохраняется в течение 7 последующих суток, тогда как в контроле митотическая активность гепатоцитов в течение 14 суток после субтотальной резекции печени остается на достоверно более низком уровне, чем в опытной группе. Эти данные представлены на рис. 3, который отражает динамику сравнительного изучения митотической активности гепатоцитов (митотического индекса) в 1 и 2 группах опытов в течение 28 суток после субтотальной резекции печени. Достоверное и длительное (в течение 14 суток) сохранение более высокого уровня митотической и пролиферативной активность клеток в остатке резецированной печени в опытной группе по сравнению с контролем, ускоряет также темп индукции восстановительных процессов в ней, что находит отражение в ускоренном восстановлении исходной массы печени после резекции у животных 2 группы. На рис. 4 представлена динамика восстановления массы печени после резекции в двух группах опытов: в 1 - контрольной (двукратное введение физиологического раствора) и во 2 - опытной (двукратное введение РНК по схеме). Из рисунка 4 видно, что уже на 3 сутки во 2 группе намечается тенденция к увеличению массы печени после резекции, а на 5, 7, 10, 14 и 18 сутки уже отчетливо выявляются достоверные различия в восстановлении массы печени в 1 и 2 группах: во 2 группе темп восстановления массы печени (темп преодоления критической массы) в течение первых 10 суток был существенно на более высоком уровне, чем в контроле, в результате чего уже на 7-10 сутки после резекции масса печени во 2 группе практически не отличалась от исходных значений. В 1-контрольной группе восстановление массы печени происходило в более медленном темпе, особенно в первые две недели после резекции, в результате масса печени только к 18-20 суткам приближалась к исходным значениям и полностью восстанавливалась лишь на 22-24 сутки наблюдения. Нами отмечено также, что более высокий темп восстановления массы печени во 2 группе коррелировал с более высоким темпом восстановления функциональных показателей печени (АлАТ, АсАТ, ЩФ) в этой группе (см. таблицу).
В совокупности полученные результаты позволяют заключить, что двукратное введение РНК в дозе 50-60 мкг/100 грамм веса животного по указанной схеме позволяет эффективно лечить ОПН: в более быстром темпе нормализовать показатели функции печени и исключить возникновение летальных исходов после субтотальной резекции за счет более высокого темпа пролиферативной активности клеток печени, позволяющей в более короткие сроки превысить критические значения массы печени, и достигнуть адекватных значений функционирующей массы печени, способной обеспечить ускоренное восстановление печеночного гомеостаза в организме. Введение суммарной РНК донора реципиенту, получившему при трансплантации долю печени минимально допустимого размера, этот способ индукции восстановительных процессов в трансплантате может явиться патогенетическим средством коррекции массы трансплантата без опасения индукции иммунной гистонесовместимости, т.к. сумарная РНК видонеспецифична, но обладает выраженной морфорегуляторной активностью именно для тех органов (в данном примере печени), для которых в организме после резекции оказывается сниженным уровень нормального (не измененного) тканеспецифического антигена.
Таким образом, выделение и применение суммарной РНК из мононуклеарной фракции клеток КМ у пациента с исходно не нарушенным гомеостазом в организме или у практически здорового донора в соответствии с предлагаемым способом лечения ОПН поле обширной (субтотальной) резекции печени будет способствовать ранней и ускоренной восстановительной регенерации печени как после обширной резекции, так и у реципиента после трансплантации доли печени минимально допустимого объема, и позволит ускоренно нормализовать печеночный гомеостаз в организме, а также избежать летальных осложнений. Препарат суммарной РНК не несет в своей структуре малигнезирующих и мутационных свойств, не способен индуцировать «реакцию трансплантат против хозяина», не обладает иммуногенной активностью и пригоден для многократного применения.
Предлагаемый способ позволяет ускоренно преодолеть критический дефицит массы оставшейся печени и индуцировать максимально быстрый темп восстановления адекватной массы функционирующей печени, достаточной для восстановления печеночного гомеостаза и профилактики летальных исходов.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ лечения острой печёночной недостаточности | 2020 |
|
RU2744846C1 |
| СПОСОБ ЛЕЧЕНИЯ ПЕЧЕНОЧНОЙ НЕДОСТАТОЧНОСТИ | 2017 |
|
RU2655528C1 |
| Способ коррекции печеночной недостаточности в эксперименте | 2017 |
|
RU2650209C1 |
| Применение суммарной рибонуклеиновой кислоты (РНК) из мультипотентных мезенхимальных стромальных клеток костного мозга млекопитающего в качестве средства для коррекции печеночной недостаточности | 2017 |
|
RU2655761C1 |
| Способ коррекции хронической печёночной недостаточности | 2020 |
|
RU2739996C1 |
| СПОСОБ И ТРАНСПЛАНТАТ ДЛЯ ЛЕЧЕНИЯ ПЕЧЕНОЧНОЙ НЕДОСТАТОЧНОСТИ | 2010 |
|
RU2425648C1 |
| СПОСОБ И ТРАНСПЛАНТАТ ДЛЯ ЛЕЧЕНИЯ ПЕЧЕНОЧНОЙ НЕДОСТАТОЧНОСТИ | 2010 |
|
RU2425645C1 |
| СПОСОБ И ТРАНСПЛАНТАТ ДЛЯ ЛЕЧЕНИЯ ПЕЧЕНОЧНОЙ НЕДОСТАТОЧНОСТИ | 2010 |
|
RU2425646C1 |
| СПОСОБ И ТРАНСПЛАНТАТ ДЛЯ ЛЕЧЕНИЯ ПЕЧЕНОЧНОЙ НЕДОСТАТОЧНОСТИ | 2010 |
|
RU2425647C1 |
| Способ лечения фиброза печени аллогенной трансплантацией мультипотентных мезенхимальных стромальных клеток (ММСК) лабораторных животных | 2022 |
|
RU2802673C1 |

Изобретение относится к медицине, а именно к экспериментальной и клинической медицине. Не менее чем за 50-58 часов до выполнения хирургической операции из костного мозга донора выделяют мононуклеарную фракцию клеток костного мозга. Затем из полученной фракции выделяют суммарную РНК и вводят ее экспериментальному животному - крысе внутрибрюшинно или внутривенно в дозе 50-60 мкг/100 г веса экспериментального животного двукратно, сначала за 44-52 часа до выполнения операции, а затем через 3-4 часа после нее. Способ позволяет сократить сроки лечения или профилактики острой печеночной недостаточности при одновременном повышении эффективности, профилактике развития летальных исходов путем заблаговременного обеспечения у оперируемого пациента требуемого уровня активации митотической и пролиферативной активности клеток. 3 з.п. ф-лы, 1 табл, 4 ил.
1. Способ лечения острой печеночной недостаточности в эксперименте после хирургической операции, в результате которой формируется критический дефицит функционирующей ткани печени, - хирургической операции, отличающийся тем, что не менее чем за 50-58 часов до выполнения хирургической операции из костного мозга донора выделяют мононуклеарную фракцию клеток костного мозга, затем из полученной фракции выделяют суммарную РНК и вводят ее экспериментальному животному - крысе внутрибрюшинно или внутривенно в дозе 50-60 мкг/100 г веса экспериментального животного двукратно, сначала за 44-52 часа до выполнения операции, а затем через 3-4 часа после нее.
2. Способ по п. 1, отличающийся тем, что хирургической операцией является обширная резекция печени.
3. Способ по п. 1, отличающийся тем, что хирургической операцией является трансплантация доли печени с минимально допустимой массой и удаление печени у реципиента.
4. Способ по п. 1, отличающийся тем, что хирургической операцией является трансплантация доли печени с минимально допустимой массой и сохранение нефункционирующей печени у реципиента.
| Способ коррекции печеночной недостаточности в эксперименте | 2017 |
|
RU2650209C1 |
| КОЖЕВНИКОВ Ю | |||
| А | |||
| и др | |||
| Эффективность клеточной трансплантации при лечении печеночной недостаточности в эксперименте, Сибирский научный медицинский журнал, 2007, 2, 34-37 | |||
| ЧЕРНУХ A.M | |||
| и др | |||
| Особенности течения экспериментального цирроза печени под влиянием печеночной РНК | |||
| Бюлл | |||
| экспер | |||
| биологии и медицины, 1970, N10, с | |||
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
| HAGA H | |||
| et al | |||
| Extracellular Vesicles from Bone Marrow-Derived Mesenchymal Stem Cells Improve Survival from Lethal Hepatic Failure in Mice | |||
| Stem Cells Transl Med | |||
| Автомобиль-сани, движущиеся на полозьях посредством устанавливающихся по высоте колес с шинами | 1924 |
|
SU2017A1 |
Авторы
Даты
2019-10-01—Публикация
2018-10-30—Подача