Перечень последовательностей
Настоящая заявка зарегистрирована вместе с перечнем последовательностей в электронном формате. Перечень последовательностей представлен в виде файла под названием BIOL0218WOSEQ_ST25.txt, созданного 28 января 2014 года, размером 16 Кб. Информация о перечне последовательностей в электронном формате в полном объеме включена в настоящий документ посредством ссылки.
Область техники
В настоящем документе представлены способы, соединения и композиции для снижения экспрессии мРНК и белка аполипопротеина С-III (АроCIII), снижения уровня триглицеридов и повышения уровней липопротеина высокой плотности (HDL) или активности HDL у пациентов с дислипидемией Фредриксона I типа. В настоящем документе представлены также соединения и композиции для применения при лечении дислипидемии Фредриксона I типа или родственных заболеваний.
Уровень техники
Липопротеины представляют собой глобулярные мицеллоподобные частицы, которые состоят из неполярного ядра из ацилглицеринов и холестериновых эфиров, окруженного амфифильной оболочкой из белка, фосфолипида и холестерина. Липопротеины классифицируют на пять широких категорий по их функциональным и физическим свойствам: хиломикроны, липопротеины очень низкой плотности (VLDL), липопротеины средней плотности (IDL), липопротеины низкой плотности (LDL) и липопротеины высокой плотности (HDL). Хиломикроны переносят пищевые липиды из кишечника в ткани. VLDL, IDL и LDL переносят триацилглицерины и холестерин печени к тканям. HDL переносят эндогенный холестерин от тканей к печени.
Аполипопротеин С-III (называемый также АРОС3, АРОС-III, АроCIII и АРО С-III) входит в состав HDL и богатых на триглицериды (TG) липопротеинов. Повышенные уровни АроCIII связаны с повышенными уровнями TG и такими заболеваниями как сердечно-сосудистые заболевания, метаболический синдром, ожирение и диабет (Chan et al., Int J Clin Pract, 2008, 62: 799-809; Onat et at., Atherosclerosis, 2003, 168: 81-89; Mendivil et al., Circulation, 2011, 124: 2065-2072; Mauger et al., J. Lipid Res, 2006. 47: 1212-1218; Chan et al., Clin. Chem, 2002. 278-283; Ooi et al., Clin. Sci, 2008. 114: 611-624; Davidsson et al., J. Lipid Res. 2005. 46: 1999-2006; Sacks et al., Circulation, 2000. 102: 1886-1892; Lee et al., Arterioscler Thromb Vase Biol, 2003.23: 853-858). АроCIII замедляет клиренс богатых на TG липопротеинов путем ингибирования липолиза из-за подавления липопротеинлипазы (LPL) и препятствуя связыванию липопротеина с гликозаминогликановой матрицей клеточной поверхности (Shachter, Curr. Opin. Lipidol, 2001, 12, 297-304). Поскольку АроCIII ингибирует LPL, что приводит к снижению липолиза TG, то стало неожиданностью, что ингибирование АроCIII имеет благоприятный эффект у субъектов с дефицитом LPL (LPLD).
LPLD характеризуется неспособностью пораженных болезнью индивидуумов вырабатывать функционально активную LPL. LPL вырабатывается, преимущественно, в скелетной мускулатуре, жировой ткани и сердечной мышце и выполняет множество, ключевых функций, среди которых катаболизм богатых на TG липопротеинов (например, VLDL) и хиломикронов (СМ). Выделение TG из СМ (и VLDL) в нормальном состоянии защищает от избыточного повышения массы СМ и TG после приема пищи. LPL при LPLD является дисфункциональной, и спустя более 12 часов после приема пищи все еще существует и заметна гиперTG и хиломикронемия.
Для классификации у пациентов первичных (генетических) причин дислипидемии, такой как гипертриглицеридемия, используют систему Фредриксона. Тип I по Федриксону (известный также как LPLD или синдром семейной хиломикронемии (FCS)) обычно обусловлен мутациями либо гена LPL, либо кофактора этого гена АроС-II, что приводит к неспособности пораженных болезнью индивидуумов вырабатывать функционально активную LPL (т.е. LPLD). У пациентов присутствуют мутации, которые являются либо гомозиготными (имеющими одинаковые мутации в каждой аллели), или компаунд-гетерозиготными (имеющими разные мутации в каждой аллели) Распространенность этой болезни составляет приблизительно 1 на 1000000 человек общего населения и гораздо больше в Южной Африке и Восточном Квебеке из-за эффекта основателя.
В настоящее время пациенты с болезнью Фредриксона I типа, FCS, LPLD минимально или вовсе не реагируют на лекарства, понижающие TG, такие как статины, фибраты и никотиновая кислота (Tremblay et al., J Clin Lipidol, 2011, 5: 37-44; Brisson et al., Pharmacogenet Genom, 2010, 20: 742-747). Клиническое ведение пациентов с болезнью Фредриксона I типа, FCS, LPLD состоит, главным образом, в существенном снижении содержания жиров во всех продуктах до значения гораздо менее 20% от общего потребления калорий, а также применения TG средней длины цепи, которые абсорбируются в портальной системе и поэтому напрямую не поступают в плазму. Такой пожизненный диетический режим представляет собой существенную сложность для пациентов. Даже если пациенты соблюдают диету и тщательно наблюдаются в клинике по липидным заболеваниям диетологом и группой врачей, уровни TG зачастую не снижаются ниже порога повышенного риска панкреатита. Недавно в Европе был одобрен продукт генной терапии (GlyberaR) для лечения взрослых пациентов с LPLD, страдающих от тяжелых или многократных приступов панкреатита, несмотря на ограничение потребления жиров. Пациентам, проходившим лечение с GlyberaR необходимо введение иммунодепрессивного лекарства до и после лечения GlyberaR. GlyberaR распространяют только через специализированные центры с опытом лечения LPLD и только специально обученными врачами для обеспечения постоянной безопасности лечения (http://www.uniqure.com/products/glybera/).
Соответственно, все еще существует необходимость в обеспечении пациентов дислипидемией Фредриксона I типа, FCS, LPLD, новыми возможностями лечения. Антисмысловая технология развивается как эффективное средство снижения экспрессии определенных генных продуктов, и может быть подтверждена ее уникальная полезность в ряде терапевтических, диагностических и исследовательских применений для модулирования АроCIII. Авторы настоящего изобретения ранее открыли композиции и способ ингибирования АроCIII при помощи антисмысловых соединений, которые описаны в US 20040208856 (патент США 7598227), US 20060264395 (патент США 7750141), WO 2004/093783 и WO 2012/149495, которые включены в настоящий документ посредством ссылки. Антисмысловой олигонуклеотид, нацеленный на АроCIII, был испытан в I фазе клинических испытаний и показал свою безопасность. В настоящее время этот антисмысловой олигонуклеотид, нацеленный на АроCIII, проходит II фазу клинических испытаний для оценки его эффективности при лечении диабета или гипертриглицеридемии.
Сущность изобретения
В некоторых вариантах реализации изобретения предложен способ лечения, предупреждения, замедления или облегчения дислипидемии Фредриксона I типа, FCS. LPLD, включающий введение животному терапевтически эффективного количества соединения, содержащего специфический ингибитор АроCIII. В некоторых вариантах реализации предложен специфический ингибитор АроCIII для применения при лечении, предупреждении, замедлении или облегчении дислипидемии Фредриксона I типа, FCS, LPLD.
В некоторых вариантах реализации изобретения предложен способ снижения уровней триглицеридов у животного с дислипидемией Фредриксона I типа, FCS, LPLD, включающий введение животному терапевтически эффективного количества соединения, содержащего специфический ингибитор АроCIII.
В некоторых вариантах реализации изобретения предложен способ повышения уровней HDL и/или улучшения отношения TG к HDL у животного с дислипидемией Фредриксона I типа, FCS, LPLD, включающий введение животному терапевтически эффективного количества соединения, содержащего специфический ингибитор АроCIII.
В некоторых вариантах реализации изобретения предложен способ предупреждения, замедления или облегчения сердечно-сосудистого и/или метаболического заболевания, расстройства, патологического состояния или его симптома у животного с дислипидемией Фредриксона I типа, FCS, LPLD, включающий введение животному терапевтически эффективного количества соединения, содержащего специфический ингибитор АроCIII.
В некоторых вариантах реализации изобретения предложен способ предупреждения, замедления или облегчения панкреатита или его симптома у животного с дислипидемией Фредриксона I типа, FCS, LPLD, включающий введение животному терапевтически эффективного количества соединения, содержащего специфический ингибитор АроCIII.
В некоторых вариантах реализации изобретения специфический ингибитор АроCIII представляет собой нуклеиновую кислоту, пептид, антитело, малую молекулу или другой агент, способный подавлять экспрессию АроCIII. В некоторых вариантах реализации нуклеиновая кислота представляет собой антисмысловое соединение. В некоторых вариантах реализации антисмысловое соединение представляет собой олигонуклеотид, нацеленный на АроCIII. В некоторых вариантах реализации олигонуклеотид представляет собой модифицированный олигонуклеотид, нацеленный на АроCIII. В некоторых вариантах реализации изобретения модифицированный олигонуклеотид имеет последовательность азотистых оснований, содержащую по меньшей мере 8 смежных азотистых оснований последовательности азотистых оснований SEQ ID NO: 3. В некоторых вариантах реализации модифицированный олигонуклеотид состоит из последовательности азотистых оснований SEQ ID NO: 3.
В некоторых вариантах реализации изобретения предложен способ снижения уровней триглицеридов у животного с дислипидемией Фредриксона I типа, FCS, LPLD, включающий введение животному терапевтически эффективного количества соединения, содержащего модифицированный олигонуклеотид, имеющий последовательность SEQ ID NO: 3, при этом модифицированный олигонуклеотид содержит: сегмент гэп, состоящий из 10 связанных дезоксинуклеозидов, сегмент 5'-крыла, состоящий из 5 связанных нуклеозидов, и сегмент 3'-крыла, состоящий из 5 связанных нуклеозидов; при этом сегмент гэп находится непосредственно возле и между сегментом 5'-крыла и сегментом 3'-крыла, причем каждый нуклеозид каждого сегмента крыла содержит 2'-O-метоксиэтилсахар, причем каждый цитозин представляет собой 5'-метилцитозин, и каждая межнуклеозидная связь представляет собой тиофосфатную связь.
В некоторых вариантах реализации изобретения предложен способ повышения уровней HDL и/или улучшения отношения TG к HDL у животного с дислипидемией Фредриксона I типа, FCS, LPLD, путем введения животному терапевтически эффективного количества соединения, содержащего модифицированный олигонуклеотид, имеющий последовательность SEQ ID NO: 3, причем модифицированный олигонуклеотид содержит: сегмент гэп, состоящий из 10 связанных дезоксинуклеозидов, сегмент 5'-крыла, состоящий из 5 связанных нуклеозидов, и сегмент 3'-крыла, состоящий из 5 связанных нуклеозидов; при этом сегмент гэп находится непосредственно возле и между сегментом 5'-крыла и сегментом 3'-крыла, причем каждый нуклеозид каждого сегмента крыла содержит 2'-O-метоксиэтилсахар, причем каждый цитозин представляет собой 5'-метилцитозин, и каждая межнуклеозидная связь представляет собой тиофосфатную связь.
В некоторых вариантах реализации изобретения предложен способ предупреждения, замедления или облегчения сердечно-сосудистого и/или метаболического заболевания, расстройства, патологического состояния или его симптома у животного с дислипидемией Фредриксона I типа, FCS, LPLD, путем введения животному терапевтически эффективного количества соединения, содержащего модифицированный олигонуклеотид, имеющий последовательность SEQ ID NO: 3, при этом модифицированный олигонуклеотид содержит: сегмент гэп, состоящий из 10 связанных дезоксинуклеозидов, сегмент 5'-крыла, состоящий из 5 связанных нуклеозидов и сегмент 3'-крыла, состоящий из 5 связанных нуклеозидов; при этом сегмент гэп находится непосредственно возле и между сегментом 5'-крыла и сегментом 3'-крыла, причем каждый нуклеозид каждого сегмента крыла содержит 2'-O-метоксиэтилсахар, причем каждый цитозин представляет собой 5'-метилцитозин, и каждая межнуклеозидная связь представляет собой тиофосфатную связь.
В некоторых вариантах реализации изобретения предложен способ предупреждения, замедления или облегчения панкреатита или его симптома у животного с дислипидемией Фредриксона I типа, FCS, LPLD, путем введения животному терапевтически эффективного количества соединения, содержащего модифицированный олигонуклеотид, имеющий последовательность SEQ ID NO: 3, при этом модифицированный олигонуклеотид содержит: сегмент гэп, состоящий из 10 связанных дезоксинуклеозидов, сегмент 5'-крыла, состоящий из 5 связанных нуклеозидов и сегмент 3'-крыла, состоящий из 5 связанных нуклеозидов; при этом сегмент гэп находится непосредственно возле и между сегментом 5'-крыла и сегментом 3'-крыла, причем каждый нуклеозид каждого сегмента крыла содержит 2'-O-метоксиэтилсахар, причем каждый цитозин представляет собой 5'-метилцитозин, и каждая межнуклеозидная связь представляет собой тиофосфатную связь.
В некоторых вариантах реализации изобретения специфический ингибитор АроCIII представляет собой нуклеиновую кислоту, пептид, антитело, малую молекулу или другой агент, способный подавлять экспрессию АроCIII. В некоторых вариантах реализации нуклеиновая кислота представляет собой антисмысловое соединение, нацеленное на АроCIII. В некоторых вариантах реализации антисмысловое соединение представляет собой антисмысловой олигонуклеотид. В некоторых вариантах реализации антисмысловой олигонуклеотид представляет собой модифицированный олигонуклеотид. В некоторых вариантах реализации изобретения модифицированный олигонуклеотид имеет последовательность азотистых оснований, содержащую по меньшей мере 8 смежных азотистых оснований ISIS 304801, AGCTTCTTGTCCAGCTTTAT (SEQ ID NO: 3). В некоторых вариантах реализации модифицированный олигонуклеотид по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 98% или по меньшей мере на 100% комплементарен SEQ ID NO: 1, SEQ ID NO: 2 или SEQ ID NO: 4.
Подробное описание изобретения
Следует понимать, что и представленное выше общее описание, и следующее подробное описание являются лишь иллюстративными и пояснительными, и они не ограничивают настоящее описание. В настоящем документе использование единственного числа включает множественное число, если специально не указано иное. При использовании в настоящем документе, термин «или» означает «и/или», если не указано иное. Кроме того, использование термина «включая», а также других форм, таких как «включает» и «включенный», не является ограничивающим. Также, такие термины как «элемент» или «компонент» охватывают как элементы и компоненты, содержащие одну единицу, так и элементы и компоненты, которые содержат более одной субъединицы, если специально не указано иное.
Названия разделов, используемые в настоящем документе, предназначены лишь для организационных целей, и их не следует толковать как ограничение описанного объекта изобретения. Все документы или части документов, цитируемые в настоящей заявке, включая, но не ограничиваясь ими, патенты, патентные заявки, статьи, книги и монографии, в явной форме включены в настоящий документ посредством ссылки в отношении фрагментов этих документов, рассматриваемых в настоящем документе, а также в полном объеме.
Определения
При отсутствии конкретных определений, номенклатура, используемая в связи с ними, а также в связи с приемами и методиками аналитической химии, синтетической органической химии, а также медицинской и фармацевтической химии, описанная в настоящем документе, является общеизвестной и общепринятой в данной области техники. Для химического синтеза и химического анализа могут быть использованы стандартные методики. Где это допустимо, все патенты, заявки, опубликованные заявки и другие публикации, номера доступа GENBANK и связанная информация о последовательностях, которую можно получить из таких баз данных как Национальный центр биотехнологической информации (NCBI), а также другие данные, упомянутые в тексте настоящего описания, включены в настоящий документ посредством ссылки в отношении фрагментов указанных документов, рассматриваемых в настоящем документе, а также в полном объеме.
Если не указано иное, следующие термины имеют следующие значения:
«2'-O-метоксиэтил» (также 2'-МОЕ, 2'-O(СН2)2-ОСН3 и 2'-O-(2-метоксизтил» относится к О-метоксиэтил-модификации в 2'-положении фуранозного кольца. Сахар с 2'-O-метоксиэтил-модификацией представляет собой модифицированный сахар.
«2'-O-метоксиэтилнуклеотид» обозначает нуклеотид, включающий модифицированный 2'-O-метоксиэтилсахарный фрагмент.
«3'-сайт-мишень» относится к нуклеотиду целевой нуклеиновой кислоты, который комплементарен 3'-основному нуклеотиду конкретного антисмыслового соединения.
«5'-сайт-мишень» относится к нуклеотиду целевой нуклеиновой кислоты, который комплементарен 5'-основному нуклеотиду конкретного антисмыслового соединения.
«5-метилцитозин» обозначает цитозин, модифицированный метильной группой, присоединенной в 5'-положении. 5-метилцитозин представляет собой модифицированное азотистое основание.
«Около» обозначает в пределах ±10% от значения. Например, если указано, что «маркер может быть увеличен на около 50%», то подразумевается, что маркер может быть увеличен на значение в диапазоне 45%-55%.
«Активный фармацевтический агент» обозначает вещество или вещества в фармацевтической композиции, которые обеспечивают благоприятный терапевтический эффект при введении индивидууму. Например, в некоторых вариантах реализации изобретения антисмысловой олигонуклеотид, нацеленный на АроCIII, представляет собой активный фармацевтический агент.
«Активная область мишени» или «область-мишень» означает область, на которую нацелено одно или более активных антисмысловых соединений. «Активные антисмысловые соединения» обозначают антисмысловые соединения, которые снижают уровни целевой нуклеиновой кислоты или уровни белка.
«Введенные одновременно» относится к совместному введению двух агентов любым способом, при котором фармакологическое действие обоих средств проявляется у пациента одновременно. При одновременном введении не требуется, чтобы оба агенты были введены в одной фармацевтической композиции, в одной лекарственной форме или одним способом введения. Действие обоих средств не обязательно должно проявляться одновременно. Их действие должно лишь перекрываться в течение определенного периода времени, и оно не обязательно должно иметь одинаковую протяженность по времени.
«Введение» обозначает предоставление фармацевтического агента индивидууму и включает, но не ограничивается этим, введение медицинским специалистом или самостоятельное введение.
«Агент» обозначает активное вещество, которое может обеспечивать благоприятный терапевтический эффект при введении животному. «Первый агент» обозначает терапевтическое соединение согласно настоящему изобретению. Например, первый агент может быть антисмысловым олигонуклеотидом, нацеленным на АроCIII. «Второй агент» обозначает второе терапевтическое соединение согласно настоящему изобретению (например, второй антисмысловой олигонуклеотид, нацеленный на АроCIII) и/или не-АроCIII терапевтическое соединение.
«Облегчение» относится к снижению по меньшей мере одного показателя, признака или симптома ассоциированного заболевания, расстройства или патологического состояния. Тяжесть показателей может быть определена субъективными или объективными оценками, известными специалистам в данной области.
«Животное» относится к человеку или животному, не являющемуся человеком, включая, но не ограничиваясь ими, мышей, крыс, кроликов, собак, котов, свиней и приматов, не являющихся человеком, включая, но не ограничиваясь ими, обезьян и шимпанзе.
«Антисмысловая активность» обозначает любую обнаруживаемую или измеримую активность, которая относится к гибридизации антисмыслового соединения с его целевой нуклеиновой кислотой. В некоторых вариантах реализации антисмысловая активность представляет собой снижение количества или экспрессии целевой нуклеиновой кислоты или белка, кодируемого такой целевой нуклеиновой кислотой.
«Антисмысловое соединение» обозначает олигомерное соединение, которое способно подвергаться гибридизации с целевой нуклеиновой кислотой путем образования водородных связей. Примеры антисмысловых соединений включают одноцепочечные и двухцепочечные соединения, такие как антисмысловые олигонуклеотиды, миРНК, кшРНК, оцРНК и замещающие соединения.
«Антисмысловое ингибирование» обозначает снижение уровней целевой нуклеиновой кислоты или уровней белка-мишени в присутствии антисмыслового соединения, комплементарного целевой нуклеиновой кислоте, по сравнению с уровнями целевой нуклеиновой кислоты или уровнями белка-мишени в отсутствие антисмыслового соединения.
«Антисмысловой олигонуклеотид» обозначает одноцепочечный олигонуклеотид, имеющий последовательность азотистых оснований, которая допускает гибридизацию с соответствующей областью или сегментом целевой нуклеиновой кислоты. При использовании в настоящем документе термин «антисмысловой олигонуклеотид» включает фармацевтически приемлемые производные соединений, описанных в настоящем документе.
«АроА5», «аполипопротеин А-V» или «АроА-V» обозначает последовательность любой нуклеиновой кислоты или белка, кодирующую АроА5.
«АроСII», «аполипопротеин С-II» или «АроС2» обозначает последовательность любой нуклеиновой кислоты или белка, кодирующую АроСII. Белок АроCII является компонентом хиломикронов и частиц VLDL, и он активирует LPL для гидролиза TG.
«АроCIII», «аполипопротеин С-III» или «АроС3» обозначает последовательность любой нуклеиновой кислоты или белка, кодирующую АроCIII. Например, в некоторых вариантах реализации АроCIII включает последовательность ДНК, кодирующую АроCIII, последовательность РНК, транскрибированную из ДНК, кодирующей АроCIII (включая геномную ДНК, содержащую интроны и экзоны), последовательность мРНК, кодирующую АроCIII, или пептидную последовательность, кодирующую АроCIII.
«Специфический ингибитор АроCIII» относится к любому агенту, способному специфически ингибировать экспрессию мРНК АроCIII и/или экспрессию или активность белка АроCIII на молекулярном уровне. Например, специфические ингибиторы АроCIII включают нуклеиновые кислоты (в том числе антисмысловые соединения), пептиды, антитела, малые молекулы и другие агенты, способные ингибировать экспрессию мРНК АроCIII и/или белка АроCIII. В некоторых вариантах реализации нуклеиновая кислота представляет собой антисмысловое соединение. В некоторых вариантах реализации антисмысловое соединение представляет собой олигонуклеотид, нацеленный на АроCIII. В некоторых вариантах реализации изобретения олигонуклеотид, нацеленный на АроCIII, представляет собой модифицированный олигонуклеотид, нацеленный на АроCIII. В некоторых вариантах реализации олигонуклеотид, нацеленный на АроCIII, имеет последовательность, представленную в SEQ ID NO: 3, или другую последовательность, например, описанную в патенте США 7598227, в патенте США 7750141, публикации РСТ WO 2004/093783 или WO 2012/149495, которые включены в настоящий документ посредством ссылки. В некоторых вариантах реализации изобретения за счет специфического модулирования уровня мРНК АроCIII и/или экспрессии белка АроCIII, специфические ингибиторы АроCIII могут влиять на компоненты липогенного пути. Точно так же, в некоторых вариантах реализации специфические ингибиторы АроCIII могут влиять на другие молекулярные процессы у животного.
«мРНК АроCIII» обозначает мРНК, кодирующую белок АроCIII.
«Белок АроCIII» обозначает любую белковую последовательность, кодирующую АроCIII.
«Атеросклероз» обозначает затвердевание артерий, поражающее крупные и средние артерии, и характеризуется наличием жировых отложений. Жировые отложения называют «атеромами» или «бляшками», которые состоят, в основном, из холестерина и других жиров, кальция и рубцовой ткани, и они повреждают выстилку артерий.
«Бициклический сахар» обозначает фуранозное кольцо, модифицированное мостиковым присоединением двух не геминальных кольцевых атомов. Бициклический сахар представляет собой модифицированный сахар.
«Бициклическая нуклеиновая кислота» или «БцНА» относится к нуклеозиду или нуклеотиду, в котором фуранозная часть нуклеозида или нуклеотида содержит мостик, связывающий два атома углерода в фуранозном кольце, образуя, таким образом, бициклическую кольцевую систему.
«Кэп-структура» или «концевой кэп-фрагмент» обозначает химические модификации, которые были внедрены в любой конец антисмыслового соединения.
«Сердечно-сосудистое заболевание» или «сердечно-сосудистое расстройство» относится к группе патологических состояний, связанных с сердцем, кровеносными сосудами или системе кровообращения. Примеры сердечно-сосудистых заболеваний включают, но не ограничиваются ими, аневризму, стенокардию, аритмию, атеросклероз, цереброваскулярное заболевание (инсульт), коронарную болезнь сердца, гипертонию, дислипидемию, гиперлипидемию, гипертриглицеридемию и гиперхолестеринемию.
«Химически отличная область» относится к области антисмыслового соединения, которая каким-либо образом химически отличается от другой области того же антисмыслового соединения. Например, область, имеющая 2'-O-метоксиэтилнуклеотиды является химически отличной от области, имеющей нуклеотиды без 2'-O-метоксиэтил-модификаций.
«Химерное антисмысловое соединение» означает антисмысловое соединение, которое имеет по меньшей мере две химически отличные области.
«Холестерин» представляет собой молекулу стерина, содержащуюся в клеточных мембранах всех животных тканей. В плазме крови животных холестерин транспортируется липопротеинами, содержащими липопротеин очень низкой плотности (VLDL), липопротеин средней плотности (IDL), липопротеин низкой плотности (LDL) и липопротеин высокой плотности (HDL). «Холестерин в плазме» относится к сумме эстерифицированного и/или неэстерифицированного холестерина всех липопротеинов (VDL, IDL, LDL, HDL), содержащегося в плазме или сыворотке.
«Ингибитор абсорбции холестерина» обозначает агент, который подавляет абсорбцию экзогенного холестерина, получаемого с пищей.
«Совместное введение» обозначает введение индивидууму двух или более агентов. Два или более агентов могут быть в одной фармацевтической композиции или могут быть в отдельных фармацевтических композициях. Каждый из двух или более агентов может быть введен таким же или другим способом введения. Совместное введение включает параллельное или последовательное введение.
«Комплементарность» обозначает способность спаривания между азотистыми основаниями первой нуклеиновой кислоты и второй нуклеиновой кислоты. В некоторых вариантах реализации изобретения комплементарность между первой и второй нуклеиновой кислотой может быть между двумя цепочками ДНК, между двумя цепочками РНК или между цепочками ДНК и PHK. B некоторых вариантах реализации некоторые азотистые основания в одной цепочке соответствуют связанному водородной связью комплементарному основанию в другой цепочке. В некоторых вариантах реализации все азотистые основания в одной цепочке соответствуют связанному водородной связью комплементарному основанию в другой цепочке. В некоторых вариантах реализации первая нуклеиновая кислота представляет собой антисмысловое соединение, а вторая нуклеиновая кислота представляет собой целевую нуклеиновую кислоту. В некоторых вариантах реализации антисмысловой олигонуклеотид представляет собой первую нуклеиновую кислоту, а целевая нуклеиновая кислота представляет собой вторую нуклеиновую кислоту.
«Смежные азотистые основания» обозначает азотистые основания, расположенные непосредственно рядом друг с другом.
«Стерически затрудненный этил» или «cEt» относится к бициклическому нуклеозиду, имеющему радикал фуранозного сахара, который содержит метил(метиленокси)(4'-СН(СН3)-O-2')-мостик между 4' и 2' атомами углерода.
«Перекрестно реагирующее» обозначает олигомерное соединение, которое нацелено на одну последовательность нуклеиновой кислоты, может гибридизоваться с другой последовательностью нуклеиновой кислоты. Например, в некоторых случаях антисмысловой олигонуклеотид, нацеленный на человеческий АроCIII, может перекрестно реагировать с мышиным АроCIII. При этом перекрестное реагирование олигомерного соединения с последовательностью нуклеиновой кислоты, отличной от предназначенной цели, зависит от степени комплементарности соединения с последовательностью нецелевой нуклеиновой кислоты. Чем выше комплементарность между олигомерным соединением и нецелевой нуклеиновой кислотой, тем более вероятно олигомерное соединение будет перекрестно реагировать с этой нуклеиновой кислотой.
«Курс лечения» обозначает способ, который восстанавливает здоровье или представляет собой предписанное лечение болезни.
«Коронарная болезнь сердца (КБС)» означает сужение мелких кровяных сосудов, которые поставляют кровь и кислород в сердце, что зачастую приводит к атеросклерозу.
«Дезоксирибонуклеотид» обозначает нуклеотид, имеющий водород в 2' положении сахарной части нуклеотида. Дезоксирибонуклеотиды могут быть модифицированы любым из множества заместителей.
«Сахарный диабет» или «диабет» представляет собой синдром, характеризующийся нарушенным метаболизмом и патологически высоким содержанием сахара в крови (гипергликемией) из-за недостаточного содержания инсулина или сниженной чувствительности к инсулину. Характерные симптомы представляют собой избыточное выделение мочи (полиурия) из-за высокого содержания глюкозы в крови, избыточную жажду и повышенное потребление жидкости (полидипсия) в попытке компенсировать усиленное мочевыделение, расплывчатое зрение из-за того, что высокое содержание глюкозы в крови влияет на оптические свойства глаз, необъяснимую потерю веса и летаргию.
«Диабетическая дислипидемия» или «диабет 2 типа с дислипидемией» означает состояние, характеризующееся диабетом 2 типа, сниженным содержанием HDL-C, повышенным уровнем триглицеридов и повышенным уровнем мелких плотных частиц LDL.
«Разбавитель» обозначает ингредиент в композиции, которые не обладает фармакологической активностью, но является фармацевтически необходимым или желательным. Например, разбавитель в композиции для инъекций может быть жидкостью, например, солевым раствором.
«Дислипидемия» относится к нарушению метаболизма липидов и/или липопротеинов, включая избыточную выработку или дефицит липидов и/или липопротеинов. Дислипидемия может проявляться в повышении содержания липидов, таких как хиломикрон, холестерин и триглицериды, а также липопротеинов, таких как холестерин липопротеинов низкой плотности (LDL). Пример дислипидемии представляет собой хиломикронемия или гипертриглицеридемия.
«Лекарственная форма» означает форму, в которой представлен фармацевтический агент, например, пилюлю, таблетку или другую лекарственную форму, известную в данной области техники. В некоторых вариантах реализации изобретения лекарственная форма представляет собой ампулу, содержащую лиофилизированный антисмысловой олигонуклеотид. В некоторых вариантах реализации лекарственная форма представляет собой ампулу, содержащую восстановленный антисмысловой олигонуклеотид.
«Доза» обозначает определенное количество фармацевтического агента, обеспечиваемое при разовом введении или в течение определенного периода времени. В некоторых вариантах реализации доза может быть введена одним, двумя или более болюсами, таблетками или инъекциями. Например, в некоторых вариантах реализации в которых желательно подкожное введение, для требуемой дозы необходим объем который трудно ввести за одну инъекцию, поэтому можно использовать две или более инъекций для достижения требуемой дозы. В некоторых вариантах реализации фармацевтический агент вводят инфузией в течение продолжительного периода времени или непрерывно. Дозы могут быть определены как количество фармацевтического агента в час, день, неделю или месяц. Дозы также могут быть указаны в мг/кг или г/кг.
«Эффективное количество» или «терапевтически эффективное количество» обозначает количество активного фармацевтического агента, достаточное для достижения желаемого физиологического результата у индивидуума, нуждающегося в таком агенте. Эффективное количество может варьироваться у различных индивидуумов в зависимости от состояния здоровья и физического состояния индивидуума, подлежащего лечению, таксономической группы индивидуумов, подлежащих лечению, состава композиции, оценки медицинского состояния индивидуума и других релевантных факторов.
«Фибраты» представляют собой агонисты рецептора, активируемого пролифератором пероксисом, α (PPAR-α), которые действуют через факторы транскрипции, регулирующие различные стадии метаболизма липидов и липопротеинов. Взаимодействуя с PPAR-α, фибраты влияют на различные кофакторы и регулируют генную экспрессию. В итоге фибраты эффективно снижают уровень TG в крови натощак, а также постпрандиальный уровень TG и концентрацию ремнантных частиц TRL. Фибраты также обладают слабым эффектом понижения LDL-C и повышения HDL-C. Снижение экспрессии и уровней АроС-III представляет собой закономерный эффект агонистов PPAR-α (Hertz et al. J Biol Chem, 1995, 270(22): 13470-13475). При лечении метаболического синдрома фибратами было описано 36% снижение уровней АроС-III в плазме (Watts et al. Diabetes, 2003, 52: 803-811). Однако фибраты были неэффективными при лечении LPLD субъектов с гипертриглицеридемией.
Систему «Фредриксона» используют для классификации первичных (генетических) причин дислипидемии на несколько подгрупп или типов. Типы дислипидемии, которые могут быть восприимчивы к лечению при помощи соединений, описанных в настоящем документе, включают, но не ограничиваются ими, дислипидемию Фредриксона I типа, FCS, LPLD.
«Болезнь Фредриксона типа I» известна также как «дефицит липопротеинлипазы», «LPLD», «синдром семейной хиломикронемии» или «FCS» и существует в нескольких формах: тип 1а (известный также как синдром Бюргера-Грютца) представляет собой дефицит липопротеинлипазы, обычно из-за недостатка LPL или измененного АроС-II; тип Ib (известный также как дефицит семейного апопротеина СП) представляет собой патологическое состояние, обусловленное недостатком активатора липопротеинлипазы, апопротеина С-II; и тип Ic представляет собой хиломикронемию в результате циркулирующего ингибитора липопротеинлипазы. Тип I представляет собой редко» расстройство, которое обычно встречается в детстве. Оно характеризуется значительным увеличением хиломикронов и чрезвычайно повышенными уровнями TG (которые всегда достигают значений гораздо выше 1000 мг/дл и нередко поднимаются до 10000 мг/дл или более) с эпизодами боли в животе, рецидивирующим острым панкреатитом, сыпной кожной ксантомой и гепатоспленомегалией. У пациентов редко развивается атеросклероз, возможно из-за того, что частицы липопротеина в их плазме слишком крупные для вхождения в артериальную интиму (Nordestgaard et al., J Lipid Res, 1988, 29: 1491-1500; Nordestgaard et al., Arteriosclerosis, 1988, 8: 421-428). Тип I обычно обусловлен мутациями либо гена LPL, либо кофактора этого гена АроС-II, что приводи ! к неспособности пораженных болезнью индивидуумов вырабатывать достаточно функционально активный LPL. Пациенты являются либо гомозиготными для таких мутаций, либо компаунд-гетерозиготными. Болезнь Фредриксона типа I также может быть обусловлена мутациями в GPIHBP1, АРОА5, LMF1 или других генах, что приводит к дисфункциональности LPL. Brunzell, в: Pagon RA, Adam MP, Bird TD, Dolan CR, Fong CT, Stephens K, ред. GeneReviews™ [Интернет]. Сиэтл (штат Вашингтон): Университет Вашингтона, Сиэтл; 1993-2013. 12 окт. 1999 [обновлено 15 дек. 2011]. Кроме того, в некоторых случаях болезнь Фредриксона типа I может быть вызвана наличием ингибиторов LPL (например, анти-LPL антител) в организме индивидуума, что приводит к дисфункциональности LPL. Распространенность болезни Фредриксона типа I составляет приблизительно 1 на 1000000 человек общего населения и гораздо больше в Южной Африке и Восточном Квебеке из-за эффекта основателя. Пациенты минимально или совсем не реагируют на TG-понижающие лекарства (Tremblay et al., J Clin Lipidol, 2011, 5: 37-44; Brisson et al., Pharmacogenet Genom, 2010, 20: 742-747), и поэтому применяют ограничение потребления жиров до 20 грамм/сутки или менее для контролирования симптомов этого редкого расстройства.
«Болезнь Фредриксона типа II» представляет собой наиболее распространенную форму первичной гиперлипидемии. Ее дополнительно классифицируют на тип IIa и тип IIb, в основном, в зависимости от наличия повышения VLDL в дополнение к холестерину LDL (LDL-C). Тип Па (семейная гиперхолестеринемия) может быть спорадической (из-за пищевых факторов), полигенной или истинно семейной в результате мутации либо гена рецептора LDL на хромосоме 19 (0,2% популяции), либо гена аполипопротеина В (ароВ) (0,2%). Семейная форма характеризуется сухожильной ксантомой, ксантелазмой и преждевременным сердечно-сосудистым заболеванием. Распространенность этого заболевания составляет около 1 на 500 для гетерозигот и 1 на 1000000 для гомозигот. Тип IIb (известный также как семейная комбинированная гиперлипопротеинемия) представляет собой смешанную гиперлипидемию (высокие уровни холестерина и TG), обусловленную повышенными уровнями LDL-C и VLDL. Высокие уровни VLDL обусловлены сверхвыработкой субстратов, включая TG, ацетил СоА, и повышением синтеза В-100. Они также могут быть обусловлены сниженным клиренсом LDL. Распространенность в популяции составляет около 10%.
«Болезнь Фредриксона типа III» (известная также как дисбеталипопротеинемия) представляет собой ремнантную гиперлипидемию или семейная гиперлипопротеинемия III типа (Fern et al., J Clin Pathol, 2008, 61: 1174-118). Она обусловлена богатым на холестерин VLDL (β-VLDL). Как правило, пациенты с таким патологическим состоянием имеют повышенные уровни холестерина и TG в плазме из-за ухудшенного клиренса хиломикрона и ремнантов VLDL (например, IDL). Ухудшенный клиренс обусловлен дефектом в аполипопротеине Е (ароЕ). Нормально функционирующий ароЕ, который содержится на ремнантах, обеспечивает связывание с рецептором LDL и удаление из системы кровообращения. Накопление ремнантов у пораженных болезнью индивидуумов может приводить к ксантоматозу и преждевременной болезни коронарной артерии и/или периферических сосудов. Наиболее распространенная причина типа III представляет собой наличие ароЕ генотипа Е2/Е2. Ее распространенность составляет, по оценкам, приблизительно 1 на 10000.
«Болезнь Фредриксона типа IV» (известная также как семейная гипертриглицеридемия) представляет собой автосомальное доминантное патологическое состояние, возникающее у приблизительно 1% популяции. Уровни TG повышены в результате избыточной выработки VLDL печенью или из-за гетерозиготного дефицита LPL, но почти всегда уровни TG составляют менее 1000 мг/дл. Уровни холестерина в сыворотки обычно находятся в диапазоне нормальных пределов. Это расстройство является гетерогенным, а фенотип сильно зависит от внешних факторов, в частности, от потребления углеводов и этанола.
При «болезни Фредриксона типа V» отмечают высокие уровни VLDL и хиломикронов. Болезнь характеризуется генными вариантами-носителями нефункционального LPL, что связано с активностью LPL, составляющей по меньшей мере 20% (т.е. частичный дефицит LPL, по сравнению с болезнью Фредриксона типа I). У таких пациентов наблюдают похожую на молоко плазму и тяжелую гипертриглицеридемию из-за хиломикронов и VLDL. Уровни TG неизменно выше 1000 мг/дл, а уровни общего холестерина всегда повышены. Уровень LDL-C обычно низкий. Болезнь всегда связана с повышенным риском острого панкреатита, непереносимости глюкозы и гиперурикемии. Симптомы обычно возникают во взрослом возрасте (>35 лет) и, несмотря на относительную редкость заболевания, оно гораздо более распространено, чем в случае гомозиготных или компаунд-гетерозиготных пациентов с дефицитом LPL.
«Полная комплементарность» или «100% комплементарность» означает, что каждое азотистое основание последовательности азотистых оснований первой нуклеиновой кислоты имеет комплементарное азотистое основание во второй последовательности азотистых оснований второй нуклеиновой кислоты. В некоторых вариантах реализации изобретения первая нуклеиновая кислота представляет собой антисмысловое соединение, а вторая нуклеиновая кислота представляет собой целевую нуклеиновую кислоту.
«Гэп-мер» обозначает химерное антисмысловое соединение, в котором внутренняя область, имеющая множество нуклеозидов, которые поддерживают расщепление РНКазы Н, расположена между внешними областями, имеющими один или несколько нуклеозидов, причем нуклеозиды, составляющие внутреннюю область, являются химически отличными от нуклеозида или нуклеозидов, составляющих внешние области. Внутренняя область может быть упомянута как «гэп» или «сегмент гэп», а внешние области могут быть упомянуты как «крылья» или «сегменты крыльев».
«С расширенным гэп» обозначает химерное антисмысловое соединение, имеющее сегмент гэп из 12 или более смежных 2'-дезоксирибонуклеотидов, расположенных между и непосредственно рядом с 5' и 3' сегментами крыльев, имеющими от одного до шести нуклеозидов.
«Генетический скрининг» означает изучение генотипических вариантов или мутаций у животного. В некоторых случаях мутация может приводить к фенотипическому изменению у животного. В некоторых случаях фенотипическое изменение представляет собой или приводит к заболеванию, расстройству или патологическому состоянию животного. Например, мутации в генах LPL или АроС-II могут приводить к дислипидемии Фредриксона I типа, FCS, LPLD. Генетически/ скрининг может быть выполнен любыми известными в данной области техники методиками, например, секвенированием гена LPL или АроС-II, или мРНК для обнаружения мутаций. Последовательность исследуемого животного сравнивают с последовательностью нормального животного для определения наличия каких-либо мутаций в последовательности. Альтернативно, например, идентификацию мутаций в гене LPL или АроС-Н, или в мРНК можно выполнить при помощи ПЦР амплификации и гелевого или матричного анализа.
«Глюкоза» представляет собой моносахарид, используемый клетками в качестве источника энергии и воспалительного посредника. «Глюкоза в плазме» относится к содержанию глюкозы в плазме.
«Липопротеин высокой плотности» или «HDL» относится к макромолекулярному комплексу липидов (холестерина, триглицеридов и фосфолипидов) и белков (аполипопротеины (аро) и ферменты). Поверхность HDL содержит, главным образом, аполипопротеины А, С и Е. Функция некоторых из этих апопротеинов заключается в направлении HDL из периферических тканей в печень. Уровни HDL в сыворотке могут зависеть от глубинных генетических причин (Weissglas-Volkov and Pajukanta, J Lipid Res, 2010, 51: 2032-2057). Эпидемиологические исследования показали, что повышенные уровни HDL защищают от сердечно-сосудистых заболеваний или коронарной болезни сердца (Gordon et al., Am. J. Med. 1977. 62: 707-714). Такое действие HDL не зависит от концентраций триглицеридов и LDL. В клинической практике низкое содержание HDL в плазме более часто связано с другими расстройствами, а не с повышенным содержанием триглицеридов в плазме, например, с центральным типом ожирения, инсулинорезистентностью, сахарным диабетом 2 типа и заболеванием почек (хронической почечной недостаточностью или нефротической протеинурией) (Kashyap. Am. J. Cardiol. 1998. 82: 42U-48U).
«Холестерин липопротеина высокой плотности» или «HDL-С» обозначает холестерин, связанный с частицами липопротеина высокой плотности. Концентрацию HDL-С в сыворотке (или в плазме) обычно определяют в мг/дл или в нмоль/л. «HDL-С» и «HDL-С в плазме» означает содержание HDL-С в сыворотке и плазме, соответственно.
«Ингибитор редуктазы HMG-СоА» обозначает агент, который действует за счет ингибирования фермента редуктазы HMG-CoA, такой как аторвастатин, розувастатин, флувастатин, ловастатин, правастатин и симвастатин.
«Гибридизация» обозначает соединение молекул комплементарных нуклеиновых кислот. В некоторых вариантах реализации изобретения молекулы комплементарной нуклеиновой кислоты содержат антисмысловое соединение и целевую нуклеиновую кислоту.
«Гиперхолестеринемия» означает патологическое состояние, характеризующееся повышенным холестерином или циркулирующим холестерином (в плазме), LDL-холестерином и VLDL-холестерином, согласно указаниям Заключения экспертной группы Национальной холестериновой образовательной программы (NCEP) по определению, оценке и лечению высокого уровня холестерина у взрослых людей (см. Arch. Int. Med. (1988) 148, 36-39).
«Гиперлипидемия» или «гиперлипемия» представляет собой патологическое состояние, характеризующееся повышенным содержанием липидов в сыворотке или циркулирующих липидов (в плазме). Это состояние проявляется в патологически высоких концентрациях жиров. Липидные фракции в системе кровообращения представляют собой холестерин, липопротеины низкой плотности, липопротеины очень низкой плотности, хиломикроны и триглицериды. Классификации гиперлипидемий по Фредриксону основана на каскаде TG и содержании богатых на холестерин липопротеиновых частиц, измеренном электрофорезом или ультрацентрифугированием и обычно используемом для характеристики основных причин гиперлипидемий, таких как гипертриглицеридемия (Fredrickson and Lee, Circulation, 1965, 31: 321-327; Fredrickson et al., New Eng J Med, 1967, 276 (1): 34-42).
«Гипертриглицеридемия» обозначает патологическое состояние, характеризующееся повышенными уровнями триглицеридов. Гипертриглицеридемия представляет собой следствие повышенной выработки и/или сниженного или замедленного катаболизма богатых на триглицерид (TG) липопротеинов: VLDL и, в меньшей степени, хиломикронов (СМ). Ее этиология включает первичные (т.е. генетические причины) и вторичные (другие первопричины, такие как диабет, метаболический синдром/инсулинорезистентность, ожирение, физическая инертность, табакокурение, избыточное употребление алкоголя и пищи с очень высоким содержанием углеводов) факторы или, более часто, комбинацию обоих факторов (Yuan et al. CMAJ, 2007, 176: 1113-1120). Гипертриглицеридемия представляет собой общий клинический признак, связанный с повышенным риском кардиометаболических заболеваний (Hegele et al. 2009, Hum Mol Genet, 18: 4189-4194; Hegele and Pollex 2009, Mol Cell Biochem, 326: 35-43), а также возникновения острого панкреатита в самых тяжелых формах (Toskes 1990, Gastroenterol Clin North Am, 19: 783-791; Gaudet et al. 2010 Atherosclerosis Supplements, 11: 55-60; Catapano et al. 2011, Atherosclerosis, 217S: S1-S44; Tremblay et al. 2011, J Clin Lipidol, 5: 37-44). Примеры кардиометаболических заболеваний включают, но не ограничиваются ими, диабет, метаболический синдром/инсулинорезистентность и генетические расстройства, такие как синдром семейной хиломикронемии (FCS), семейная комбинированная гиперлипидемия и семейная гипертриглицеридемия. Содержание TG выше предельного значения (150-199 мг/дл) обычно встречается у всей популяции, и оно является распространенным компонентом состояний метаболического синдрома/инсулинорезистентности. Это же относится к высоким уровням TG (200-499 мг/дл), за исключением того, что при увеличении содержания TG в плазме возрастает этиологическое значение первопричинных генетических факторов. Очень высокие уровни TG (>500 мг/дл) наиболее часто связаны также с повышенным содержанием СМ, и они сопровождаются повышенным риском острого панкреатита. Риск панкреатита считается клинически значимым, если уровни TG превышают 880 мг/дл (>10 ммоль), а в руководстве Европейского общества по изучению атеросклероза/Европейского общества кардиологии (EAS/ESC) от 2011 года указано, что обязательными являются действия по предотвращению острого панкреатита (Catapano et al. 2011, Atherosclerosis, 217S: S1-S44). В соответствии с руководством EAS/ESC от 2011 года, гипертриглицеридемия является причиной приблизительно 10% случаев панкреатита, а развитие панкреатита может происходить при уровнях TG 440-880 мг/дл. На основании данных, полученных в клинических испытаниях, демонстрирующих, что повышенные уровни TG представляют собой независимый фактор риска для атеросклеротических CVD, в руководствах экспертной группы III Национальной холестериновой образовательной программы по лечению взрослых людей (NCEP 2002, Circulation, 106: 3143-421) и Американской ассоциации по диабету (ADA 2008, Diabetes Care, 31: S12-S54.), рекомендовано, чтобы для снижения сердечно-сосудистого риска целевой уровень TG составлял менее 150 мг/дл.
«Идентификация» или «диагностирование» животного с указанным заболеванием, расстройством или патологическим состоянием обозначает определение при помощи известных способов склонности к указанному заболеванию, расстройству или патологическому состоянию или факта его наличия.
«Идентификация» или «диагностирование» у животного дислипидемии Фредриксона 1 типа обозначает, что у субъекта идентифицирована предрасположенность или наличие дислипидемии Фредриксона I типа (a, b или с), FCS, LPLD. Идентификаций у субъектов болезни Фредриксона I типа, FCS, LPLD может быть осуществлена изучением истории болезни субъекта в сочетании с любыми известными в дачной области техники методиками скрининга, например, генетического скрининга или скрининга на ингибиторы LPL. Например, пациента с документированной историей болезни с содержанием TG натощак более 750 мг/дл затем исследуют путем скрининга на наличие мутаций в гене LPL или в генах, влияющих на LPL, таких как АроС2, АроА5, GPIHBP1 или LMF1.
«Идентификация» или «диагностирование» у животного метаболического или сердечно-сосудистого заболевания означает определение субъекта, предрасположенного к или страдающего метаболическим заболеванием, сердечно-сосудистым заболеванием или метаболическим синдромом; или определение субъекта, имеющего любой симптом метаболического заболевания, сердечно-сосудистого заболевания или метаболического синдрома, включая, но не ограничиваясь ими, гиперхолестеринемию, гипергликемия» гиперлипидемию, гипертриглицеридемию, гипертонию, повышенную инсулинорезистентность, пониженную чувствительность к инсулину, увеличенную массу тела и/или увеличенное содержание жира в организме, или любую их комбинацию. Такая идентификация может быть выполнена любым способом, включая, но не ограничиваясь ими, стандартные клинические испытания или оценки, такие как измерение холестерина в сыворотке или циркулирующего холестерина (в плазме), измерение глюкозы в сыворотке или циркулирующей глюкозы (в плазме), измерение триглицеридов в сыворотке или циркулирующих триглицеридов (в плазме), измерение кровяного давления, измерение содержания жира в организме, измерение массы тела и т.п.
«Улучшенный сердечно-сосудистый исход» означает снижение возникновения нежелательных сердечно-сосудистых явлений или их риска. Примеры нежелательных сердечно-сосудистых явлений включают, без ограничения, смерть, повторный инфаркт, инсульт, кардиогенный шок, отек легких, остановку сердца и атриальную аритмию.
«Непосредственно рядом» означает, что между элементами, расположенными непосредственно рядом, не существует промежуточных элементов, например, между областями, сегментами, нуклеотидами и/или нуклеозидами.
«Увеличение HDL» или «повышение HDL» означает повышение уровня HDL у животного после введения по меньшей мере одного соединения согласно настоящему изобретению, по сравнению с уровнем HDL у животного, которому не вводили ни одного соединения.
«Индивидуум» или «субъект», или «животное» означает человека или животное, не являющееся человеком, выбранное для лечения или терапии.
«Вызывает», «ингибирует», «потенцирует», «повышает», «увеличивает», «снижает», «уменьшает» или подобные термины означают количественное различие между двумя состояниями. Например, «количество, эффективное для ингибирования активности или экспрессии АроCIII», обозначает, что уровень активности или экспрессии АроCIII в обработанном образце отличается от уровня активности или экспрессии АроCIII в необработанном образце. Такие термины применяют, например, к уровням экспрессии и уровням активности.
«Ингибирование экспрессии или активности» относится к снижению или блокированию экспрессии или активности РНК или белка и не обязательно обозначает полное исключение экспрессии или активности.
«Инсулинорезистентность» определяют как состояние, при котором нормальные количества инсулина недостаточны для получения нормального ответа на инсулин от жировых, мышечных и печеночных клеток. Инсулинорезистентность в жировых клетках приводит к гидролизу запасенных триглицеридов, что повышает содержание свободных жирных кислот в плазме крови. Инсулинорезистентность в мышцах снижает поглощение глюкозы, а инсулинорезистентность в печени снижает запас глюкозы, и оба эффекта приводят к повышению глюкозы в крови. Высокие уровни инсулина и глюкозы в плазме из-за инсулинорезистентности зачастую приводят к метаболическому синдрому и диабету 2 типа.
«Чувствительность к инсулину» представляет собой меру эффективности переработки глюкозы в организме индивидуума. Индивидуум с высокой чувствительностью к инсулину эффективно перерабатывает глюкозу, тогда как индивидуум с низкой чувствительностью к инсулину перерабатывает глюкозу неэффективно.
«Межнуклеозидная связь» относится к химической связи между нуклеозидами. «Внутривенное введение» обозначает введение в вену.
«Связанные нуклеозиды» означает соседние нуклеозиды, связанные друг с другом.
«Понижение содержания липидов» обозначает снижение одного или более липидов у субъекта. «Повышение содержания липидов» обозначает увеличение содержания липидов (например, HDL) у субъекта. Понижение или повышение уровне липидов может возникать при введении одной или более доз с течением времени.
«Терапия для понижения содержания липидов» или «агент для понижения содержания липидов» означает терапевтический режим, предоставленный субъекту для снижения содержания одного или более липидов у субъекта. В некоторых вариантах реализации изобретения терапия для понижения содержания липидов предоставлена для снижения одного или более из СЕТР, АроВ, общего холестерина, LDL-C, VLDL-C, IDL-С, не-HDL-C, триглицеридов, мелких плотных частиц LDL и Lp(a) у субъекта. Примеры терапии для понижения содержания липидов включают статины, фибраты, ингибиторы МТР.
«Липопротеин», такой как VLDL, LDL и HDL, относится к группе белков, находящихся в сыворотке, плазме и лимфе, которые важны для транспорта липидов. Химический состав каждого липопротеина отличается тем, что HDL имеет более высокое содержание белка по сравнению с липидом, a VLDL имеет более низкое содержание белка по сравнению с липидом.
«Липопротеинлипаза» или «LPL» относится к ферменту, который гидролизует TG, находящиеся в липопротеинах, таких как СМ или VLDL, в свободные жирные кислоты и моноацилглицерины. Для действия LPL при гидролизе TG в качестве кофактора необходим ароС-II. LPL вырабатывается, в основном, в скелетных мышцах, жировой ткани и сердечной мышце. Гидролиз и удаление TG из СМ и VLDL обычно защищает от избыточного повышения массы СМ и TG после приема пищи.
«Дефицит липопротеинлипазы», «недостаток липопротеинлипазы», «дефицит LPL» или «LPLD» известен также как «дислипидемия Фредриксона I типа», «хиломикронемия», «синдром семейной хиломикронемии» или «FCS». Хотя субъекты с LPLD обычно имеют недостаток LPL или активности LPL, необходимой для эффективного расщепления жирных кислот, таких как TG, эти субъекты все еще могут иметь минимальную активность LPL или экспрессировать минимальное количество LPL. В некоторых случаях субъект с LPLD может экспрессировать LPL или иметь активность LPL, составляющую примерно или не более чем 20%, 19%, 18%, 17%, 16%, 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2% или 1% активности. В других случаях субъект с LPLD не имеет измеримой LPL или активности LPL. В одном из вариантов реализации изобретения LPLD включает субъектов с «гиперлипопротеинемией типа Ia» (известной также как «болезнь Фредриксона типа Ia») и относится к неспособности субъектов вырабатывать достаточное количество функциональных ферментов липопротеинлипазы, необходимое для эффективного расщепления жирных кислот, таких как TG. Неспособность к разложению TG приводит к гипертриглицеридемии у субъекта и зачастую к тому, что в течение более 12 часов после приема пищи все еще сохраняется гипертриглицеридемия и хиломикронемия, наблюдаемые как липемия. Тип Ia зачастую обусловлен одной или более мутациями в гене LPL. Как описано в настоящем документе, LPLD включает также субъектов, которые имеют дисфункциональную липопротеинлипазу, такую как у субъектов с «гиперлипопротеинемией типа Ib» (также известной как «болезнь Фредриксона типа Ib») и с «гиперлипопротеинемией типа 1 с» (известной также как «болезнь Фредриксона типа Ic»). Тип Ib обусловлен недостатком активатора липопротеинлипазы апопротеина С-II. Тип Ic обусловлен циркулирующим ингибитором липопротеинлипазы. Как и при болезни типа 1а, субъекты типа 1b/1с страдают от неспособности расщеплять TG, что приводит к гипертриглицеридемии, при этом гиперTG и хиломикронемия все еще содержатся и наблюдаются как липемия зачастую спустя более 12 часов после приема пищи. В некоторых вариантах реализации изобретения LPLD связан с по меньшей мере одной мутацией в гене LPL, такой как P207L, G188L или D9N, или с другими мутациями, повреждающими LPL (Brunzell, в: Pagon RA, Adam MP, Bird TD, Dolan CR, Fong CT, Stephens K, ред. GeneReviews™ [Интернет]. Сиэтл (штат Вашингтон): Университет Вашингтона, Сиэтл; 1993-2013. 12 окт. 1999 [обновлено 15 дек. 2011]).
«Холестерин липопротеина низкой плотности (LDL-C)» обозначает холестерин, который содержится в частицах липопротеина низкой плотности. Концентрацию LDL-C в сыворотке (или в плазме) обычно определяют в мг/дл или в нмоль/л. «LDL-С в сыворотке» и «LDL-С в плазме» означает содержание LDL-С в сыворотке и плазме, соответственно.
«Основные факторы риска» относятся к факторам, которые способствуют высокому риску конкретного заболевания или патологического состояния. В некоторых вариантах реализации изобретения основные факторы риска коронарной болезни сердца включают, без ограничения, табакокурение, гипертонию, низкое содержание HDL-C, семейный анамнез коронарной болезни сердца, возраст и другие факторы, описанные в настоящем документе.
«Метаболическое расстройство» или «метаболическое заболевание» относится к патологическому состоянию, характеризующемуся изменением или нарушением метаболической функции. «Метаболический» и «метаболизм» представляют собой термины, общеизвестные в данной области техники, и обычно включают весь диапазон биохимических процессов, происходящих в живом организме. Метаболические расстройства включают, но не ограничиваются ими, гипергликемию, преддиабет, диабет (типа 1 и типа 2), ожирение, инсулинорезистентность, метаболический синдром и дислипидемию на фоне диабета 2 типа.
«Метаболический синдром» обозначает состояние, характеризующееся объединением липидных и нелипидных сердечно-сосудистых факторов риска метаболического происхождения. В некоторых вариантах реализации изобретения метаболический синдром определяют по наличию любых 3 из следующих факторов: окружность талии более 102 см у мужчин или более 88 см у женщин; содержание триглицеридов в сыворотке по меньшей мере 150 мг/дл; содержание HDL-С менее 40 мг/дл у мужчин или менее 50 мг/дл у женщин; кровяное давление по меньшей мере 130/85 мм рт.ст.; и содержание глюкозы натощак по меньшей мере 110 мг/дл. Эти детерминанты могут быть легко измерены в клинической практике (JAMA, 2001, 285: 2486-2497).
«Не совпадающий» или «не комплементарный нуклеозид» относится к случаю, когда азотистое основание первой нуклеиновой кислоты не может спариваться с соответствующим азотистым основанием второй или целевой нуклеиновой кислоты.
«Смешанная дислипидемия» означает патологическое состояние, характеризующееся повышенным уровнем холестерина и повышенным уровнем триглицеридов.
«Модифицированная межнуклеозидная связь» относится к замещению или любому изменению природной межнуклеозидной связи. Например, тиофосфатная связь представляет собой модифицированную межнуклеозидную связь.
«Модифицированное азотистое основание» относится к любому азотистому основанию, отличному от аденина, цитозина, гуанина, тимидина или урацила. Например, 5-метилцитозин представляет собой модифицированное азотистое основание. «Немодифицированное азотистое основание» обозначает пуриновые основания аденин (А) и гуанин (G), а также пиримидиновые основания тимин (Т), цитозин (С) и урацил (U).
«Модифицированный нуклеозид» обозначает нуклеозид, имеющий по меньшей мере один модифицированный сахарный фрагмент и/или модифицированное азотистое основание.
«Модифицированный нуклеотид» обозначает нуклеотид, имеющий по меньшей мере один модифицированный сахарный фрагмент, модифицированную межнуклеозидную связь и/или модифицированное азотистое основание.
«Модифицированный олигонуклеотид» означает олигонуклеотид, содержащий по меньшей мере один модифицированный нуклеотид.
«Модифицированный сахар» относится к замещению или изменению относительно природного сахара. Например, сахар с 2'-O-метоксиэтил-модификацией представляет собой модифицированный сахар.
«Мотив» обозначает схему химически отличных областей в антисмысловом соединении.
«Природная межнуклеозидная связь» обозначает 3'-5' фосфодиэфирную связь
«Природный сахарный фрагмент» обозначает сахар, который встречается в ДНК (2'-Н) или РНК (2'-ОН).
«Никотиновая кислота» или «ниацин» описан как вещество, снижающее приток жирных кислот в печень и секрецию VLDL печенью. Этот эффект частично опосредован влиянием гормоночувствительной липазы в жировой ткани. Основные области действия никотиновой кислоты - печень и жировая ткань. Было описано, что в печени никотиновая кислота ингибирует диацетилглицерин-ацилтрансферазу-2 (DGAT-2), что приводит к снижению секреции частиц VLDL из печени, что также отражается на снижении содержания частиц IDL и LDL, кроме того, никотиновая кислота повышает HDL-С и аро А1, главным образом, путем стимуляции выработки аро А1 в печени, и было также показано, что она снижает концентрации VLDL-АроCIII у пациентов с гиперлипидемией (Wahlberg et al. Acta Med Scand 1988; 224: 319-327). Точно установлено влияние никотиновой кислоты на липолиз и мобилизацию жирных кислот в адипоцитах. Однако никотиновая кислота не эффективна при лечении LPLD субъектов с гипертриглицеридемией.
«Нуклеиновая кислота» относится к молекулам, состоящим из мономерных нуклеотидов. Нуклеиновая кислота включает рибонуклеиновые кислоты (РНК), дезоксирибонуклеиновые кислоты (ДНК), одноцепочечные нуклеиновые кислоты (оцДНК), двухцепочечные нуклеиновые кислоты (дцДНК), малые интерферирующие рибонуклеиновые кислоты (миРНК) и микроРНК (микроРНК). Нуклеиновая кислота может также содержать комбинацию этих элементов в одной молекуле.
«Азотистое основание» обозначает гетероциклический фрагмент, способный спариваться с основанием другой нуклеиновой кислоты.
«Комплементарность азотистого основания» относится к азотистому основанию, которое способно к спариванию оснований с другим азотистым основанием. Например, аденин (А) в ДНК комплементарен тимину (Т). Например, аденин (А) в РНК комплементарен урацилу (U). В некоторых вариантах реализации комплементарное азотистое основание относится к азотистому основанию антисмыслового соединения, которое способно к спариванию оснований с азотистым основанием его целевой нуклеиновой кислоты. Например, если азотистое основание в определенном положении антисмыслового соединения способно к образованию водородных связей с азотистые основанием в определенном положении целевой нуклеиновой кислоты, то этот олигонуклеотид и целевую нуклеиновую кислоту считают комплементарным по этой паре азотистых оснований.
«Последовательность азотистых оснований» обозначает порядок смежных азотистых оснований, независимый от какого-либо сахара, связи или модификации азотистого основания.
«Нуклеозид» обозначает азотистое основание, связанное с сахаром.
«Нуклеозид-миметик» включает такие структуры, используемые для замены сахара или сахара и основания, и не обязательно связи в одном или нескольких положениях олигомерного соединения; например, нуклеозид-миметики, имеющие морфолино, циклогексенил, циклогексил, тетрагидропиранил, бицикло- или трицикло-сахарные миметики, такие как нефуранозные сахарные звенья.
«Нуклеотид» обозначает нуклеозид, имеющий фосфатную группу, ковалентно связанную с сахарной частью нуклеозида.
«Нуклеотид-миметик» включает такие структуры, используемые для замены нуклеозида и связи в одном или нескольких положениях олигомерного соединения, как, например, пептидные нуклеиновые кислоты или морфолиновые соединения (морфолиновые соединения, связанные при помощи -N(H)-C(=O)-O- или другой не фосфодиэфирной связи).
«Олигомерное соединение» или «олигомер» обозначает полимер из связанных мономерных субъединиц, который способен гибридизоваться с некоторой областью молекулы нуклеиновой кислоты. В некоторых вариантах реализации изобретения олигомерные соединения представляют собой олигонуклеозиды. В некоторых вариантах реализации изобретения олигомерные соединения представляют собой олигонуклеотиды. В некоторых вариантах реализации изобретения олигомерные соединения представляют собой антисмысловые соединения. В некоторых вариантах реализации изобретения олигомерные соединения представляют собой антисмысловые олигонуклеотиды. В некоторых вариантах реализации изобретения олигомерные соединения представляют собой химерные олигонуклеотиды.
«Олигонуклеотид» обозначает полимер из связанных нуклеозидов, каждый из которых может быть модифицированным или не модифицированным, независимо друг от друга.
«Парентеральное введение» обозначает введение инъекцией или инфузией. Парентеральное введение включает подкожное введение, внутривенное введение, внутримышечное введение, внутриартериальное введение, внутрибрюшинное введение или внутричерепное введение, например, интратекальное или интрацеребровентрикулярное введение. Введение может быть непрерывным, хроническим, кратковременным или периодическим.
«Пептид» обозначает молекулу, образованную связыванием по меньшей мере двух аминокислот амидными связями. Пептид относится к полипептидам и белкам.
«Фармацевтическое средство» обозначает вещество, которое обеспечивает благоприятный терапевтический эффект при введении пациенту. Например, в некоторых вариантах реализации изобретения фармацевтический агент представляет собой антисмысловой олигонуклеотид, нацеленный на АроCIII.
«Фармацевтическая композиция» или «композиция» обозначает смесь веществ, пригодную для введения индивидууму. Например, фармацевтическая композиция может содержать один или более активных агентов и фармацевтический носитель, такой как стерильный водный раствор.
«Фармацевтически приемлемый носитель» обозначает среду или разбавитель, который не взаимодействует со структурой соединения. Некоторые из таких носителей обеспечивают возможность составления фармацевтических композиций, таких как, например, таблетки, пилюли, драже, капсулы, жидкости, гели, сиропы, взвеси, суспензии и пастилки для перорального приема пациентом. Некоторые из таких носителей обеспечивают возможность составления фармацевтических композиций для инъекций, инфузий или местного применения. Например, фармацевтически приемлемый носитель может представлять собой стерильный водный раствор.
«Фармацевтически приемлемое производное» или «соли» включает производные соединений, описанных в настоящем документе, такие как сольваты, гидраты, сложные эфиры, пролекарства, полиморфы, изомеры, меченные изотопами разновидности фармацевтически приемлемые соли и другие производные, известные в данной области техники.
«Фармацевтически приемлемые соли» обозначает физиологически и фармацевтически приемлемые соли антисмысловых соединений, то есть соли, которые сохраняют желаемую биологическую активность исходного соединения и не наделяют его нежелательным токсикологическим действием. Термин «фармацевтически приемлемая соль» или «соль» включает соль, полученную из фармацевтически приемлемых нетоксичных кислот или оснований, включая неорганические или органические кислоты и основания. «Фармацевтически приемлемые соли» соединений, описанных в настоящем документе, могут быть получены по общеизвестным в данной области техники способам. Обзор фармацевтически приемлемых солей представлен в публикации Stahl и Wermuth, Handbook of Pharmaceutical Salts: Properties, Selection and Use (Wiley-VCH, Вайнхайм, Германия, 2002). Натриевые соли антисмысловых олигонуклеотидов являются пригодными и приемлемыми для терапевтического введения людям. Соответственно, в одном из вариантов реализации изобретения соединения, описанные в настоящем документе, представлены в форме натриевой соли.
«Тиофосфатная связь» обозначает связь между нуклеозидами, где фосфодиэфирная связь модифицирована заменой одного из немостиковых атомов кислорода атомом серы. Тиофосфатная связь представляет собой модифицированную межнуклеозидную связь.
«Часть» обозначает определенное количество смежных (то есть связанных) азотистых оснований нуклеиновой кислоты. В некоторых вариантах реализации изобретения часть представляет собой определенное количество смежных азотистых оснований целевой нуклеиновой кислоты. В некоторых вариантах реализации часть представляет собой определенное количество смежных азотистых оснований антисмыслового соединения.
«Предупреждение» относится к замедлению или предотвращению возникновения или развития заболевания, расстройства или состояния в течение периода времени от нескольких минут до бесконечности. Предупреждение означает также снижение риска развития заболевания, расстройства или патологического состояния.
«Пролекарство» обозначает терапевтический агент, который получен в неактивной форме, которая превращается в активную форму (т.е. лекарство) внутри организма или его клеток под действием эндогенных ферментов или других химических веществ или условий.
«Повышение» означает увеличение количества. Например, повышение уровня HDL в плазме означает увеличение количества HDL в плазме.
«Отношение TG к HDL» обозначает уровни TG относительно уровней HDL. Возникновение высоких уровней TG и/или низких уровней HDL связано с заболеваемостью, исходом и смертностью из-за сердечно-сосудистых заболеваний. «Улучшение отношения TG к HDL» обозначает снижение уровней TG и/или повышение уровней HDL.
«Снижение» означает уменьшение до меньшей степени, размера, количества или числа. Например, снижение уровня триглицеридов в плазме означает уменьшение количества триглицеридов в плазме.
«Область» или «целевую область» определяют как часть целевой нуклеиновой кислоты, имеющую по меньшей мере одну идентифицируемую структуру, функцию или характеристику. Например, целевая область может включать 3' нетранслируемую область (UTR), 5' нетранслируемую область, экзон, интрон, экзон-интронное сочленение, кодирующую область, область инициации трансляции, область обрыва трансляции или другую определенную область нуклеиновой кислоты. Структурно определенные области для АроCIII могут быть получены по номеру доступа из базы данных последовательностей, такой как NCBI, и такая информация включена в настоящий документ путем ссылки. В некоторых вариантах реализации изобретения целевая область может охватывать последовательность от 5'-сайта-мишени любого целевого сегмента в пределах целевой области от 3'-сайта-мишени другого целевого сегмента в пределах целевой области.
«Рибонуклеотид» обозначает нуклеотид, имеющий гидрокси-группу в 2' положении сахарной части нуклеотида. Рибонуклеотиды могут быть модифицированы любым из множества заместителей.
«Второй агент» или «второй терапевтический агент» означает агент, который может быть использован в комбинации с «первым агентом». Второй терапевтический агент может включать, но не ограничивается ими, миРНК или антисмысловые олигонуклеотиды, в том числе антисмысловые олигонуклеотиды, нацеленные на АроCIII. Второй агент также может включать анти-АроCIII антитела, ингибиторы пептида АроCIII, ингибиторы DGAT1, агенты для понижения холестерина, агенты для понижения липидов, агенты для понижения глюкозы и противовоспалительные агенты.
«Сегменты» определяют как более мелкие, субфрагменты областей целевой нуклеиновой кислоты. Например, «целевой сегмент» обозначает последовательность нуклеотидов целевой нуклеиновой кислоты, на которую нацелено одно или несколько антисмысловых соединений. «Сайт-мишень 5'» относится к 5'-основному нуклеотиду целевого сегмента. «Сайт-мишень 3'» относится к 3'-основному нуклеотиду целевого сегмента.
«Укороченные» или «усеченные» версии антисмысловых олигонуклеотидов или целевых нуклеиновых кислот, представленных в настоящем документе, имеют один, два или более удаленных нуклеозидов.
«Побочные эффекты» обозначают физиологические реакции, приписываемые лечению, которые отличны от желаемого действия. В некоторых вариантах реализации изобретения побочные эффекты включают реакции в точке инъекции, патологии при испытании функции печени, патологии функции почек, печеночную токсичность, почечную токсичность, патологии центральной нервной системы, миопатию и дискомфорт. Например, повышенные уровни аминотрансферазы в сыворотке могут указывать на печеночную токсичность или аномалию функции печени. Например, повышенный билирубин может указывать на печеночную токсичность или патологию функции печени.
«Одноцепочечный олигонуклеотид» означает олигонуклеотид, который не гибридизован с комплементарной цепью.
«Специфически гибридизуемое» относится к антисмысловому соединению, имеющему достаточную степень комплементарности с целевой нуклеиновой кислотой для инициации желаемого эффекта, одновременно демонстрирующему минимальное влияние или отсутствие влияния на нецелевые нуклеиновые кислоты в условиях, в которых необходимо специфическое связывание, то есть при физиологических условиях в случае анализов in vivo и при терапевтическом лечении.
«Статин» обозначает агент, который подавляет активность редуктазы HMG-CoA. Статины снижают синтез холестерина в печени путем конкурентного ингибирования активности редуктазы HMG-CoA. Снижение внутриклеточной концентрации холестерина вызывает экспрессию рецептора LDL на поверхности гепатоцита, что приводит к повышению экстракции LDL-С из крови и к снижению концентрации циркулирующего LDL-С и других липопротеинов, содержащих аро-В, включая частицы, богатые на TG. Независимо от их действия на LDL-С и рецептор LDL, статины понижают концентрацию в плазме и уровни клеточной мРНК АроС-III (Ooi et al. Clinical Sci, 2008, 114: 611-624). Поскольку статины значительно снижают смертность, а также главные параметры последствий сердечно-сосудистых заболеваний, то эти лекарства представляют собой первоочередной выбор для снижения и общего риска сердечнососудистого заболевания, и умеренно повышенных уровней TG. Более эффективные статины (аторвастатин, розувастатин и питавастатин) демонстрируют достоверное снижение уровней TG, особенно при высоких дозах и у пациентов с повышенными TG. Однако статины были неэффективными при лечении LPLD субъектов с гипертриглицеридемией.
«Подкожное введение» обозначает введение непосредственно под кожу.
«Субъект» обозначает человека или животного, не являющегося человеком, выбранного для лечения или терапии.
«Симптом сердечно-сосудистого заболевания или расстройства» означает явление, которое возникает в результате и сопутствует сердечно-сосудистому заболеванию или расстройству и служит его признаком. Например, симптомы сердечнососудистого заболевания или расстройства представляют собой стенокардию; боль в груди; одышку; учащенное сердцебиение; слабость; головокружение; тошноту; потоотделение; тахикардию; брадикардию; аритмию; мерцательную аритмию; опухание нижних конечностей; цианоз; усталость; обморок; онемение лица; онемение конечностей, хромоту или судороги мышц; вздутие живота; или лихорадку.
«Таргетинг» или «нацеленный» обозначает процесс разработки и выбора антисмыслового соединения, которое будет специфически гибридизоваться с целевой нуклеиновой кислотой и вызывать желаемый эффект.
«Целевая нуклеиновая кислота», «целевая РНК» и «целевой РНК транскрипт», все эти термины относятся к нуклеиновой кислоте, на которую могут быть нацелены антисмысловые соединения.
«Терапевтическое изменение образа жизни» означает изменение питания и образа жизни, направленное на снижение массы жировой/адипозной ткани и/или холестерина. Такое изменение может снижать риск развития сердечного заболевания и может включать рекомендации по диетическому употреблению общих суточных калорий, общих жиров, насыщенных жиров, полиненасыщенных жиров, мононенасыщенных жиров, углеводов, белков, холестерина, нерастворимых волокон, а также рекомендации по физической активности.
«Лечение» относится к введению соединения согласно изобретению для обеспечения изменения или облегчения заболевания, расстройства или состояния.
«Триглицерид» или «TG» обозначает липид или нейтральный жир, состоящий из глицерина, связанного с тремя молекулами жирной кислоты.
«Диабет 2 типа» (известный также как «сахарный диабет 2 типа», «сахарный диабет, 2 тип», «инсулинонезависимый диабет (NIDDM)», «диабет на фоне ожирения» или «диабет взрослого возраста») представляет собой метаболическое расстройство, которое характеризуется, главным образом, инсулинорезистентностью, относительным дефицитом инсулина и гипергликемией.
«Немодифицированный нуклеотид» обозначает нуклеотид, состоящий из природных азотистых оснований, сахарных фрагментов и межнуклеозидных связей. В некоторых вариантах реализации изобретения немодифицированный нуклеотид представляет собой нуклеотид РНК (то есть β-D-рибонуклеозид) или нуклеотид ДНК (то есть β-D-дезоксирибонуклеозид).
«Сегмент крыла» обозначает один или множество нуклеозидов, модифицированных для влияния на свойства олигонуклеотида, такие как усиленная ингибирующая активность, повышенная аффиность связывания целевой нуклеиновой кислоты или устойчивость к разложению нуклеазами in vivo.
Некоторые варианты реализации изобретения
В некоторых вариантах реализации изобретения предложен способ снижения уровней АроCIII у животного с дислипидемией Фредриксона I типа, FCS, LPLD, включающий введение животному терапевтически эффективного количества соединения, содержащего специфический ингибитор АроCIII. В некоторых вариантах реализации уровни АроCIII снижают в печени, жировой ткани, сердце, скелетных мышцах или тонком кишечнике.
В некоторых вариантах реализации изобретения предложен способ лечения, предупреждения, замедления или облегчения дислипидемии Фредриксона I типа, FCS, LPLD у животного, включающий введение животному терапевтически эффективного количества соединения, содержащего специфический ингибитор АроCIII. В некоторых вариантах реализации происходит облегчение сердечно-сосудистого и/или метаболического заболевания или расстройства, или его симптома, или риска его возникновения, связанного с дислипидемией Фредриксона I типа, FCS, LPLD.
В некоторых вариантах реализации изобретения предложен способ лечения, предупреждения, замедления или облегчения панкреатита у животного с дислипидемией Фредриксона I типа, FCS, LPLD, включающий введение животному терапевтически эффективного количества соединения, содержащего специфический ингибитор АроCIII. В некоторых вариантах реализации происходит облегчение панкреатита или его симптома, или риска его возникновения.
В некоторых вариантах реализации предложен способ снижения уровней TG у животного с дислипидемией Фредриксона I типа, FCS, LPLD, включающий введение животному терапевтически эффективного количества соединения, содержащего специфический ингибитор АроCIII.
В некоторых вариантах реализации изобретения уровень TG у животного составляет по меньшей мере ≥1200 мг/дл, ≥1100 мг/дл, ≥1000 мг/дл, ≥900 мг/дл, ≥880 мг/дл, ≥850 мг/дл, ≥800 мг/дл, ≥750 мг/дл, ≥700 мг/дл, ≥650 мг/дл, ≥600 мг/дл, ≥550 мг/дл, ≥500 мг/дл, ≥450 мг/дл, ≥440 мг/дл, ≥400 мг/дл, ≥350 мг/дл, ≥300 мг/дл, ≥250 мг/дл, ≥200 мг/дл, ≥150 мг/дл. В некоторых вариантах реализации в истории болезни животного уровни TG составляют ≥880 мг/дл, уровни TG натощак составляют ≥750 мг/дл и/или уровни TG составляют ≥440 мг/дл после соблюдения диеты.
В некоторых вариантах реализации изобретения соединение обеспечивает снижение уровня TG (постпрандиального или натощак) по меньшей мере на 90%, по меньшей мере на 80%, по меньшей мере на 70%, по меньшей мере на 60%, по меньшей мере на 50%, по меньшей мере на 45%, по меньшей мере на 40%, по меньшей мере на 35%, по меньшей мере на 30%, по меньшей мере на 25%, по меньшей мере на 20%, по меньшей мере на 15%, по меньшей мере на 10%, по меньшей мере на 5% или по меньшей мере на 1% относительно исходного уровня TG. В некоторых вариантах реализации уровень TG (постпрандиальный или натощак) составляет ≤1900 мг/дл, ≤1800 мг/дл, ≤1700 мг/дл, ≤1600 мг/дл, ≤1500 мг/дл, ≤1400 мг/дл, ≤1300 мг/дл, ≤1200 мг/дл, ≤1100 мг/дл, ≤1000 мг/дл, ≤900 мг/дл, ≤800 мг/дл, ≤750 мг/дл, ≤700 мг/дл, ≤650 мг/дл, ≤600 мг/дл, ≤550 мг/дл, ≤500 мг/дл, ≤450 мг/дл, ≤400 мг/дл, ≤350 мг/дл, ≤300 мг/дл, ≤250 мг/дл, ≤200 мг/дл, ≤150 мг/дл или ≤100 мг/дл.
В некоторых вариантах реализации предложен способ повышения уровней HDL и/или улучшения отношения TG к HDL у животного с дислипидемией Фредриксона I типа, FCS, LPLD, включающий введение животному терапевтически эффективного количества соединения, содержащего специфический ингибитор АроCIII. В некоторых вариантах реализации соединение обеспечивает повышение уровня HDL (постпрандиального или натощак) по меньшей мере на 90%, по меньшей мере на 80%, по меньшей мере на 70%, по меньшей мере на 60%, по меньшей мере на 50%, по меньшей мере на 45%, по меньшей мере на 40%, по меньшей мере на 35%, по меньшей мере на 30%, по меньшей мере на 25%, по меньшей мере на 20%, по меньшей мере на 15%, по меньшей мере на 10%, по меньшей мере на 5% или по меньшей мере на 1% от исходного уровня HDL.
В некоторых вариантах реализации изобретения соединение обеспечивает снижение АроCIII на около 81%, снижение TG на около 69%, снижение VLDL АроCIII на около 80%, повышение HDL на около 78%, снижение не-HDL-C на около 58% и/или снижение АроВ на около 13%.
В некоторых вариантах реализации изобретения предложен способ предупреждения, замедления или облегчения сердечно-сосудистого и/или метаболического заболевания, расстройства, патологического состояния или его симптома у животного с дислипидемией Фредриксона I типа, FCS, LPLD, включающий введение животному терапевтически эффективного количества соединения, содержащего специфический ингибитор АроCIII. В некоторых вариантах реализации изобретения соединение обеспечивает предупреждение, замедление или облегчение сердечнососудистого и/или метаболического заболевания, расстройства, патологического состояния или его симптома у животного с дислипидемией Фредриксона типа I, FCS, LPLD путем снижения уровней TG, повышения уровней HDL у животного и/или путем улучшения отношения TG к HDL.
В некоторых вариантах реализации изобретения предложен способ предупреждения, замедления или облегчения панкреатита или его симптома у животного с дислипидемией Фредриксона I типа, FCS, LPLD, включающий введение животному терапевтически эффективного количества соединения, содержащего специфический ингибитор АроCIII. В некоторых вариантах реализации изобретения соединение обеспечивает предупреждение, замедление или облегчение панкреатита его симптома у животного с дислипидемией Фредриксона типа I, FCS, LPLD путем снижения уровней TG, повышения уровней HDL у животного и/или путем улучшения отношения TG к HDL.
В некоторых вариантах реализации изобретения предложен способ предупреждения, замедления или облегчения панкреатита или его симптома у животного с дислипидемией Фредриксона I типа, FCS, LPLD, включающий введение животному терапевтически эффективного количества соединения, содержащего специфический ингибитор АроCIII. В некоторых вариантах реализации изобретения соединение обеспечивает предупреждение, замедление или облегчение панкреатита его симптома у животного с дислипидемией Фредриксона типа I, FCS, LPLD путем снижения уровней TG, повышения уровней HDL у животного и/или путем улучшения отношения TG к HDL.
В некоторых вариантах реализации предложен способ предупреждения, лечения, облегчения, замедления возникновения или снижения риска сердечно-сосудистого заболевания, расстройства или патологического состояния у животного с дислипидемией Фредриксона I типа, FCS, LPLD, включающий введение животному терапевтически эффективного количества соединения, содержащего специфический ингибитор АроCIII. В некоторых вариантах реализации изобретения соединение обеспечивает предупреждение, лечение, облегчение, замедление возникновения или снижение риска сердечно-сосудистого заболевания, расстройства или патологического состояния у животного с дислипидемией Фредриксона типа I, FCS, LPLD путем снижения уровней TG, повышения уровней HDL и/или путем улучшения отношения TG к HDL.
В некоторых вариантах реализации изобретения предложен способ снижения уровней СЕТР, VLDL, VLDL АроCIII, холестерина, хиломикронов и/или АроВ у животного с дислипидемией Фредриксона I типа, FCS, LPLD, включающий введение животному терапевтически эффективного количества соединения, содержащего специфический ингибитор АроCIII. В некоторых вариантах реализации АроВ представляет собой АроВ-48 или АроВ-100. В некоторых вариантах реализации количество АроВ-48 отражает количество хиломикронов у животного. В некоторых вариантах реализации холестерин представляет собой общий холестерин или холестерин не-HDL.
В некоторых вариантах реализации изобретения предложен способ повышения ApoA1, PON1, клиренса жиров, клиренса хиломикрон-триглицеридов (CM-TG) и/или HDL у животного с дислипидемией Фредриксона I типа, FCS, LPLD, включающий введение животному терапевтически эффективного количества соединения, содержащего специфический ингибитор АроCIII. В некоторых вариантах реализации предложен способ улучшения отношения TG к HDL у животного с дислипидемией Фредриксона I типа, FCS, LPLD, включающий введение животному терапевтически эффективного количества соединения, содержащего специфический ингибитор АроCIII.
В некоторых вариантах реализации изобретения предложен способ лечения взрослых пациентов с дислипидемией Фредриксона I типа, FCS, LPLD, страдающих от тяжелых или многократных приступов панкреатита, включающий введение пациенту терапевтически эффективного количества соединения, содержащего специфический ингибитор АроCIII. В некоторых вариантах реализации пациент страдает от панкреатита, несмотря на ограничение потребления жиров.
В некоторых вариантах реализации изобретения предложен способ идентификации субъекта, страдающего от дислипидемии Фредриксона I типа, FCS, LPLD, включающий генетический скрининг субъекта. В некоторых вариантах реализации изобретения предложен способ идентификации субъекта, имеющего риск дислипидемии Фредриксона I типа, FCS, LPLD, включающий генетический скрининг субъекта. В некоторых вариантах реализации генетический скрининг выполняют анализом последовательности гена или транскрипта РНК, кодирующего LPL или АроС-II. В некоторых вариантах реализации субъекта исследуют путем генетического скрининга на наличие по меньшей мере одной мутации в гене LPL, такой как P207L, G188L, D9N или другие мутации, которые повреждают LPL (Brunzell, в: Pagon RA, Adam MP, Bird TD, Dolan CR, Fong CT, Stephens К, ред. GeneReviews™ [Интернет]. Сиэтл (штат Вашингтон): Университет Вашингтона, Сиэтл; 1993-2013. 12 окт. 1999 [обновлено 15 дек. 2011]).
В некоторых вариантах реализации изобретения предложен способ идентификации субъекта, страдающего от дислипидемии Фредриксона I типа, FCS, LPLD, включающий исследование субъекта на наличие антител, ингибирующих LPL. В некоторых вариантах реализации предложен способ идентификации субъекта на риск возникновения дислипидемии Фредриксона I типа, FCS, LPLD, включающий исследование субъекта на наличие антител, ингибирующих LPL.
В некоторых вариантах реализации изобретения уровень экспрессии LPL у субъекта с LPLD является необнаруживаемым. В некоторых вариантах реализации уровень LPL у субъекта с LPLD является обнаруживаемым. В некоторых вариантах реализации уровень LPL у субъекта с LPLD составляет не более 25%, не более 24%, не более 23%, не более 22%, не более 21%, не более 20%, не более 19%, не более 18%, не более 17%, не более 16%, не более 15%, не более 14%, не более 13%, не более 12%, не более 11%, не более 10%, не более 9%, не более 8%, не более 7%, не более 6%, не более 5%, не более 4%, не более 3%, не более 2% или не более 1% от уровня LPL у субъекта без LPLD.
В некоторых вариантах реализации изобретения уровень активности LPL у субъекта с LPLD является необнаруживаемым. В некоторых вариантах реализации изобретения уровень активности LPL у субъекта с LPLD является обнаруживаемым. В некоторых вариантах реализации уровень активности LPL у субъекта с LPLD составляет не более 25%, не более 24%, не более 23%, не более 22%, не более 21%, не более 20%, не более 19%, не более 18%, не более 17%, не более 16%, не более 15%, не более 14%, не более 13%, не более 12%, не более 11%, не более 10%, не более 9%, не более 8%, не более 7%, не более 6%, не более 5%, не более 4%, не более 3%, не более 2% или не более 1% от уровня активности LPL у субъекта без LPLD. В некоторых вариантах реализации нуклеиновая кислота АроCIII имеет любую из последовательностей, перечисленных в GENBANK с номером доступа NM_000040.1 (включена в настоящий документ как SEQ ID NO: 1), с номером доступа GENBANK NT 033899.8, усеченной по нуклеотидам с 20262640 по 20266603 (включена в настоящий документ как SEQ ID NO: 2), и с номером доступа GENBANK NT_035088.1, усеченная по нуклеотидам с 6238608 по 6242565 (включена в настоящий документ как SEQ ID NO: 4).
В некоторых вариантах реализации изобретения специфический ингибитор АроCIII представляет собой нуклеиновую кислоту, пептид, антитело, малую молекулу или другой агент, способный подавлять экспрессию АроCIII. В некоторых вариантах реализации нуклеиновая кислота представляет собой антисмысловое соединение, нацеленное на АроCIII. В некоторых вариантах реализации антисмысловое соединение представляет собой антисмысловой олигонуклеотид. В некоторых вариантах реализации антисмысловой олигонуклеотид представляет собой модифицированный олигонуклеотид. В некоторых вариантах реализации модифицированный олигонуклеотид имеет последовательность, комплементарную SEQ ID NO: 1, SEQ ID NO: 2 или SEQ ID NO: 4. В некоторых вариантах реализации модифицированный олигонуклеотид по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 98% или по меньшей мере на 100% комплементарен SEQ ID NO: 1, SEQ ID NO: 2 или SEQ ID NO: 4.
В некоторых вариантах реализации изобретения модифицированный олигонуклеотид имеет последовательность азотистых оснований, содержащую по меньшей мере 8 смежных азотистых оснований антисмыслового олигонуклеотида, комплементарного АроCIII. В некоторых вариантах реализации изобретения модифицированный олигонуклеотид имеет последовательность азотистых оснований, содержащую по меньшей мере 8 смежных азотистых оснований ISIS 304801 (SEQ ID NO: 3). В некоторых вариантах реализации модифицированный олигонуклеотид имеет последовательность азотистых оснований ISIS 304801 (SEQ ID NO: 3). В некоторых вариантах реализации модифицированный олигонуклеотид, нацеленный на АроCIII, имеет последовательность, отличную от SEQ ID NO: 3. В некоторых вариантах реализации модифицированный олигонуклеотид имеет последовательность азотистых оснований, содержащую по меньшей мере 8 смежных азотистых оснований последовательности, выбранной из любой последовательности, описанной в патенте США 7598227, патенте США 7750141, публикации РСТ WO 2004/093783 или публикации РСТ WO 2012/149495, которые включены в настоящий документ посредством ссылки. В некоторых вариантах реализации модифицированный олигонуклеотид имеет последовательность, выбранную из любой последовательности, описанной в патенте США 7598227, патенте США 7750141, публикации РСТ WO 2004/093783 или публикации РСТ WO 2012/149495, которые включены в настоящий документ посредством ссылки.
В некоторых вариантах реализации модифицированный олигонуклеотид состоит из одноцепочечного модифицированного олигонуклеотида.
В некоторых вариантах реализации изобретения модифицированный олигонуклеотид состоит из 12-30 связанных нуклеозидов.
В некоторых вариантах реализации модифицированный олигонуклеотид состоит из 20 связанных нуклеозидов. В некоторых вариантах реализации модифицированный олигонуклеотид состоит 20 связанных нуклеозидов и последовательности азотистых оснований ISIS 304801 (SEQ ID NO: 3).
В некоторых вариантах реализации изобретения соединение содержит по меньшей мере одну модифицированную межнуклеозидную связь. В некоторых вариантах реализации межнуклеозидная связь представляет собой тиофосфатную межнуклеозидную связь. В некоторых вариантах реализации каждая межнуклеозидная связь представляет собой тиофосфатную межнуклеозидную связь.
В некоторых вариантах реализации соединение содержит по меньшей мере один нуклеозид, содержащий модифицированный сахар. В некоторых вариантах реализации по меньшей мере один модифицированный сахар представляет собой бициклический сахар. В некоторых вариантах реализации по меньшей мере один модифицированный сахар содержит 2'-О-метоксиэтил.
В некоторых вариантах реализации соединение содержит по меньшей мере один нуклеозид, содержащий модифицированное азотистое основание. В некоторых вариантах реализации модифицированное азотистое основание представляет собой 5-метилцитозин.
В некоторых вариантах реализации изобретения соединение содержит модифицированный олигонуклеотид, содержащий: (i) сегмент гэп, состоящий из связанных дезоксинуклеозидов; (ii) сегмент 5'-крыла, состоящий из связанных нуклеозидов; (iii) сегмент 3'-крыла, состоящий из связанных нуклеозидов, при этом сегмент гэп расположен непосредственно возле и между сегментом 5'-крыла и сегментом 3'-крыла, и причем каждый нуклеозид каждого сегмента крыла содержит модифицированный сахар.
В некоторых вариантах реализации изобретения соединение содержит модифицированный олигонуклеотид, содержащий: (i) сегмент гэп, состоящий из 8-12 связанных дезоксинуклеозидов; (ii) сегмент 5'-крыла, состоящий из 1-5 связанных нуклеозидов; (iii) сегмент 3'-крыла, состоящий из 1-5 связанных нуклеозидов, при этом сегмент гэп расположен непосредственно возле и между сегментом 5'-крыла и сегментом 3'-крыла, причем каждый нуклеозид каждого сегмента крыла содержит 2'-O-метоксиэтилсахар, причем каждый цитозин представляет собой 5'-метилцитозин, и каждая межнуклеозидная связь представляет собой тиофосфатную связь.
В некоторых вариантах реализации изобретения соединение содержит модифицированный олигонуклеотид, содержащий: (i) сегмент гэп, состоящий из десяти связанных дезоксинуклеозидов; (ii) сегмент 5'-крыла, состоящий из пяти связанных нуклеозидов; (iii) сегмент 3'-крыла, состоящий из пяти связанных нуклеозидов, при этом сегмент гэп расположен непосредственно возле и между сегментом 5'-крыла и сегментом 3'-крыла, причем каждый нуклеозид каждого сегмента крыла содержит 2'-O-метоксиэтилсахар, причем каждый цитозин представляет собой 5'-метилцитозин, и каждая межнуклеозидная связь представляет собой тиофосфатную связь.
В некоторых вариантах реализации изобретения предложен способ снижения риска сердечно-сосудистого заболевания у животного с дислипидемией Фредриксона I типа, FCS, LPLD путем введения животному терапевтически эффективного количества соединения, содержащего модифицированный олигонуклеотид, состоящий из 12-30 связанных нуклеозидов, причем модифицированный олигонуклеотид комплементарен нуклеиновой кислоте АроCIII, и при этом модифицированный олигонуклеотид обеспечивает снижение уровней TG, повышение уровней HDL и/или улучшение отношения TG к HDL. В некоторых вариантах реализации нуклеиновая кислота АроCIII представляет собой SEQ ID NO: 1, SEQ ID NO: 2 или SEQ ID NO: 4. В некоторых вариантах реализации модифицированный олигонуклеотид по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 98% или на 100% комплементарен SEQ ID NO: 1, SEQ ID NO: 2 или SEQ ID NO: 4. В некоторых вариантах реализации изобретения модифицированный олигонуклеотид содержит по меньшей мере 8 смежных азотистых оснований антисмыслового олигонуклеотида, нацеленного на АроCIII. В дополнительных вариантах реализации модифицированный олигонуклеотид содержит по меньшей мере 8 смежных азотистых оснований последовательности азотистых оснований ISIS 304801 (SEQ ID NO: 3).
В некоторых вариантах реализации изобретения предложен способ предупреждения, лечения, облегчения или уменьшения по меньшей мере одного симптома сердечно-сосудистого заболевания у животного с дислипидемией Фредриксона I типа, FCS, LPLD, включающий введение животному терапевтически эффективного количества соединения, содержащего модифицированный олигонуклеотид, состоящий из 12-30 связанных нуклеозидов и комплементарный нуклеиновой кислоте АроCIII. В некоторых вариантах реализации нуклеиновая кислота АроCIII представляет собой либо SEQ ID NO: 1, SEQ ID NO: 2 или SEQ ID NO: 4. В некоторых вариантах реализации модифицированный олигонуклеотид по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 98% или на 100% комплементарен SEQ ID NO: 1, SEQ ID NO: 2 или SEQ ID NO: 4. В дополнительных вариантах реализации модифицированный олигонуклеотид, введенный животному, обеспечивает предупреждение, лечение, облегчение или уменьшение по меньшей мере одного симптома сердечно-сосудистого заболевания путем снижения уровней TG, повышения уровней HDL и/или улучшения отношения TG к HDL. В некоторых вариантах реализации изобретения модифицированный олигонуклеотид содержит по меньшей мере 8 смежных азотистых оснований антисмыслового олигонуклеотида, нацеленного на АроCIII. В дополнительных вариантах реализации модифицированный олигонуклеотид содержит по меньшей мере 8 смежных азотистых оснований ISIS 304801 (SEQ ID NO: 3).
В дополнительных вариантах реализации изобретения симптомы сердечнососудистого заболевания включают, но не ограничиваются ими, стенокардию; боль в груди; одышку; учащенное сердцебиение; слабость; головокружение; тошноту; потоотделение; тахикардию; брадикардию; аритмию; мерцательную аритмию; опухание нижних конечностей; цианоз; усталость; обморок; онемение лица; онемение конечностей, хромоту или судороги мышц; вздутие живота; или лихорадку.
В некоторых вариантах реализации изобретения предложен способ снижения уровней TG, повышения уровней HDL и/или улучшения отношения TG к HDL у животного с дислипидемией Фредриксона I типа, FCS, LPLD, путем введения животному терапевтически эффективного количества соединения, содержащего модифицированный олигонуклеотид, нацеленный на АроCIII. В дополнительных вариантах реализации предложен способ предупреждения, лечения, облегчения или уменьшения по меньшей мере одного симптома сердечно-сосудистого и/или метаболического заболевания, расстройства, патологического состояния или его симптома у животного путем введения животному соединения, состоящего из модифицированного олигонуклеотида, нацеленного на АроCIII, таким образом, снижая уровни TG, повышая уровни HDL и/или улучшая отношение TG к HDL у животного.
В некоторых вариантах реализации изобретения предложен способ снижения уровней TG, повышения уровней HDL и/или улучшения отношения TG к HDL у животного с дислипидемией Фредриксона I типа, FCS, LPLD, путем введения животному терапевтически эффективного количества соединения, состоящего из последовательности азотистых оснований ISIS 304801 (SEQ ID NO: 3). В дополнительных вариантах реализации предложен способ предупреждения, лечения, облегчения или уменьшения по меньшей мере одного симптома сердечно-сосудистого и/или метаболического заболевания, расстройства, патологического состояния или его симптома у животного путем введения животному соединения, состоящего из последовательности азотистых оснований ISIS 304801 (SEQ ID NO: 3), таким образом, снижая уровни TG, повышая уровни HDL и/или улучшая отношение TG к HDL у животного.
В некоторых вариантах реализации изобретения предложен способ снижения уровней TG, повышения уровней HDL и/или улучшения отношения TG к HDL у животного с дислипидемией Фредриксона I типа, FCS, LPLD, путем введения животному терапевтически эффективного количества модифицированного олигонуклеотида, имеющего последовательность ISIS 304801 (SEQ ID NO: 3), при этом модифицированный олигонуклеотид содержит: (i) сегмент гэп, состоящий из десяти связанных дезоксинуклеозидов; (ii) сегмент 5'-крыла, состоящий из пяти связанных нуклеозидов; (iii) сегмент 3'-крыла, состоящий из пяти связанных нуклеозидов, причем сегмент гэп находится непосредственно возле и между сегментом 5'-крыла и сегментом 3'-крыла, причем каждый нуклеозид каждого сегмента крыла содержит 2'-O-метоксиэтилсахар, причем каждый цитозин представляет собой 5'-метилцитозин, и каждая межнуклеозидная связь представляет собой тиофосфатную связь.
В некоторых вариантах реализации изобретения предложен способ предупреждения, замедления, лечения, облегчения или уменьшения по меньшей мере одного симптома сердечно-сосудистого и/или метаболического заболевания, расстройства, патологического состояния или его симптома у животного с дислипидемией Фредриксона I типа, FCS, LPLD, путем введения животному терапевтически эффективного количества модифицированного олигонуклеотида, нацеленного на АроCIII, при этом модифицированный олигонуклеотид этого соединения содержит: (i) сегмент гэп, состоящий из десяти связанных дезоксинуклеозидов; (ii) сегмент 5'-крыла, состоящий из пяти связанных нуклеозидов; (iii) сегмент 3'-крыла, состоящий из пяти связанных нуклеозидов, причем сегмент гэп находится непосредственно возле и между сегментом 5'-крыла и сегментом 3'-крыла, причем каждый нуклеозид каждого сегмента крыла содержит 2'-O-метоксиэтилсахар, причем каждый цитозин представляет собой 5'-метилцитозин, и каждая межнуклеозидная связь представляет собой тиофосфатную связь.
В некоторых вариантах реализации изобретения предложен способ предупреждения, замедления, лечения, облегчения или уменьшения по меньшей мере одного симптома сердечно-сосудистого и/или метаболического заболевания, расстройства, патологического состояния или его симптома у животного с дислипидемией Фредриксона I типа, FCS, LPLD, путем введения животному терапевтически эффективного количества модифицированного олигонуклеотида, имеющего последовательность ISIS 304801 (SEQ ID NO: 3), при этом модифицированный олигонуклеотид этого соединения содержит: (i) сегмент гэп, состоящий из десяти связанных дезоксинуклеозидов; (ii) сегмент 5'-крыла, состоящий из пяти связанных нуклеозидов; (iii) сегмент 3'-крыла, состоящий из пяти связанных нуклеозидов, причем сегмент гэп находится непосредственно возле и между сегментом 5'-крыла и сегментом 3'-крыла, причем каждый нуклеозид каждого сегмента крыла содержит 2'-O-метоксиэтилсахар, причем каждый цитозин представляет собой 5'-метилцитозин, и каждая межнуклеозидная связь представляет собой тиофосфатную связь.
В некоторых вариантах реализации изобретения предложен способ снижения уровней TG, повышения уровней HDL и/или улучшения отношения TG к HDL у животного с дислипидемией Фредриксона I типа, FCS, LPLD, путем введения животному терапевтически эффективного количества соединения, содержащего модифицированный олигонуклеотид, состоящий из 12-30 связанных нуклеозидов, причем модифицированный олигонуклеотид комплементарен нуклеиновой кислоту АроCIII. В некоторых вариантах реализации нуклеиновая кислота АроCIII представляет собой либо SEQ ID NO: 1, SEQ ID NO: 2 или SEQ ID NO: 4. В некоторых вариантах реализации модифицированный олигонуклеотид по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 98% или на 100% комплементарен SEQ ID NO: 1, SEQ ID NO: 2 или SEQ ID NO: 4.
В некоторых вариантах реализации изобретения предложен способ предупреждения, замедления, лечения, облегчения или уменьшения по меньшей мере одного симптома сердечно-сосудистого и/или метаболического заболевания, расстройства, патологического состояния или его симптома у животного с дислипидемией Фредриксона I типа, FCS, LPLD, путем введения животному соединения, содержащего терапевтически эффективное количество модифицированного олигонуклеотида, состоящего из 12-30 связанных нуклеозидов, при этом модифицированный олигонуклеотид комплементарен нуклеиновой кислоте АроCIII и обеспечивает снижение уровней TG и/или повышение уровней HDL у животного. В некоторых вариантах реализации нуклеиновая кислота АроCIII представляет собой либо SEQ ID NO: 1, SEQ ID NO: 2 или SEQ ID NO: 4. В некоторых вариантах реализации модифицированный олигонуклеотид по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 98% или на 100% комплементарен SEQ ID NO: 1, SEQ ID NO: 2 или SEQ ID NO: 4.
В некоторых вариантах реализации животное представляет собой человека.
В некоторых вариантах реализации изобретения сердечно-сосудистое заболевание представляет собой аневризму, стенокардию, аритмию, атеросклероз, цереброваскулярное заболевание, коронарную болезнь сердца, гипертонию, дислипидемию, гиперлипидемию, гипертриглицеридемию или гиперхолестеринемию. В некоторых вариантах реализации дислипидемия представляет собой гипертриглицеридемию или хиломикронемию (например, FCS). В некоторых вариантах реализации метаболическое заболевание представляет собой диабет, ожирение или метаболический синдром.
В некоторых вариантах реализации изобретения животное с дислипидемией Фредриксона I типа, FCS, LPLD имеет риск панкреатита. В некоторых вариантах реализации снижение уровней АроCIII в печени и/или тонком кишечнике обеспечивает предупреждение панкреатита. В некоторых вариантах реализации снижение уровней TG, повышение уровней HDL и/или улучшение отношения TG к HDL обеспечивает предупреждение панкреатита.
В некоторых вариантах реализации изобретения снижение уровней АроCIII в печени и/или тонком кишечнике животного с дислипидемией Фредриксона I типа, FCS, LPLD обеспечивает улучшение клиренса постпрандиальных TG. В некоторых вариантах реализации повышение уровней HDL и/или улучшение отношения TG к HDL обеспечивает улучшение клиренса постпрандиальных TG у животного с дислипидемией Фредриксона I типа, FCS, LPLD. В некоторых вариантах реализации снижение уровней АроCIII в печени и/или тонком кишечнике обеспечивает снижение постпрандиальных триглицеридов у животного с дислипидемией Фредриксона I типа, FCS, LPLD;. В некоторых вариантах реализации повышение уровней HDL и/или улучшение отношения TG к HDL обеспечивает снижение постпрандиальных TG.
В некоторых вариантах реализации изобретения снижение уровней АроCIII в печени и/или тонком кишечнике животного с дислипидемией Фредриксона I типа, FCS, LPLD обеспечивает улучшение отношения HDL к TG.
В некоторых вариантах реализации изобретения соединение вводят парентерально. В дополнительных вариантах реализации парентеральное введение является подкожным.
В некоторых вариантах реализации соединение вводят совместно со вторым агентом или терапией. В некоторых вариантах реализации изобретения второй агент представляет собой агент, понижающий АроCIII, агент, понижающий Аро С-II, агент, понижающий DGAT1, агент, повышающий LPL, агент, понижающий холестерин, агент, понижающий липиды не-HDL, агент, понижающий LPL, агент, понижающий TG, агент, понижающий холестерин, агент, повышающий HDL, рыбий жир, ниацин (никотиновую кислоту), фибрат, статин, DCCR (соль диазоксида), агент, понижающий глюкозу, или противодиабетические агенты. В некоторых вариантах реализации вторая терапия представляет собой диета с ограничением потребления жиров.
В некоторых вариантах реализации агенты, понижающие АроCIII, включают антисмысловой олигонуклеотид АроCIII, отличный от первого агента, фибрата или антисмыслового олигонуклеотида Аро В.
В некоторых вариантах реализации агент, понижающий DGAT1, представляет собой LCQ908.
В некоторых вариантах реализации изобретения агенты, повышающие LPL, включают агенты генной терапии, которое повышают уровень LPL (например, GlyberaR, нормальные копии АроС-II, GPIHBP1, АРОА5, LMF1 или других генов, которые при мутации могут приводить к дисфункциональности LPL).
В некоторых вариантах реализации изобретения агенты, понижающие глюкозу, и/или противодиабетические агенты включают, но не ограничиваются ими, агонист PPAR, ингибитор дипептидилпептидазы (IV), аналог GLP-1, инсулин или аналог инсулина, стимулятор секреции инсулина, ингибитор SGLT2, аналог человеческого амилина, бигуанид, ингибитор альфа-глюкозидазы, метформин, сульфонилмочевину, росиглитазон, меглитинид, тиазолидиндион, ингибитор альфа-глюкозидазы и т.п. Сульфонилмочевина может представлять собой ацетогексамид, хлорпропамид, толбутамид, толазамид, глимепирид, глипизид, глибурид или гликлазид. Меглитинид может представлять собой натеглинид или репаглинид. Тиазолидиндион может представлять собой пиоглитазон или росиглитазон. Альфа-глюкозидаза может представлять собой акарбозу или миглитол.
В некоторых вариантах реализации изобретения агенты, понижающие холестерин или липиды, включают, но не ограничиваются ими, статины, усилители экскреции желчных кислот, никотиновую кислоту и фибраты. Статины могут представлять собой аторвастатин, флувастатин, ловастатин, правастатин, розувастатин и симвастатин, и т.п. Усилители экскреции желчной кислоты могут представлять собой колесевелам, холестирамин, колестипол и т.п. Фибраты могут представлять собой гемфиброзил, фенофибрат, клофибрат и т.п. Терапевтическое изменение образа жизни может представлять собой диету с ограниченным потреблением жиров.
В некоторых вариантах реализации изобретения агенты, повышающие HDL, включают лекарства, ингибирующие белок переноса холестериновых эфиров (СЕТР) (такие как торцетрапиб), агонисты рецептора, активируемого пролифератором пероксисом, Аро-А1, пиоглитазон и т.п.
В некоторых вариантах реализации соединение и второй агент вводят одновременно или последовательно.
В некоторых вариантах реализации соединение представлено в форме соли. В дополнительных вариантах реализации соединение дополнительно содержит фармацевтически приемлемый носитель или разбавитель.
В некоторых вариантах реализации предложено соединение, содержащее специфический ингибитор АроCIII, для применения при получении лекарственного средства для лечения, предупреждения, замедления или облегчения дислипидемии Фредриксона I типа, FCS, LPLD.
В некоторых вариантах реализации предложено соединение, содержащее специфический ингибитор АроCIII, для применения при получении лекарственного средства для снижения уровней АроCIII у животного с дислипидемией Фредриксона I типа, FCS, LPLD. В некоторых вариантах реализации происходит снижение уровней АроCIII в печени или тонком кишечнике.
В некоторых вариантах реализации изобретения предложено применение соединения, содержащего специфический ингибитор АроCIII, при получении лекарственного средства для снижения уровней TG, повышения уровней HDL и/или улучшения отношения TG к HDL у животного с дислипидемией Фредриксона I типа. FCS, LPLD.
В некоторых вариантах реализации изобретения предложено применение соединения, содержащего специфический ингибитор АроCIII, при получении лекарственного средства для предупреждения, лечения, облегчения или уменьшения по меньшей мере одного симптома сердечно-сосудистого или метаболического заболевания путем снижения уровней TG, повышения уровней HDL и/или улучшения отношения TG к HDL у животного с дислипидемией Фредриксона I типа, FCS, LPLD.
В некоторых вариантах реализации предложено соединение, содержащее специфический ингибитор АроCIII, для применения при получении лекарственного средства для лечения животного с дислипидемией Фредриксона I типа, FCS, LPLD, имеющего риск или страдающего от панкреатита.
В некоторых вариантах реализации изобретения специфический ингибитор АроCIII, используемый при получении лекарственного средства, представляет собой нуклеиновую кислоту, пептид, антитело, малую молекулу или другой агент, способный подавлять экспрессию АроCIII. В некоторых вариантах реализации нуклеиновая кислота представляет собой антисмысловое соединение. В некоторых вариантах реализации антисмысловое соединение представляет собой модифицированный олигонуклеотид, нацеленный на АроCIII. В некоторых вариантах реализации изобретения модифицированный олигонуклеотид имеет последовательность азотистых оснований, содержащую по меньшей мере 8 смежных азотистых оснований ISIS 304801 (SEQ ID NO: 3). В некоторых вариантах реализации модифицированный олигонуклеотид по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 98% или по меньшей мере на 100% комплементарен SEQ ID NO: 1, SEQ ID NO: 2 или SEQ ID NO: 4.
В некоторых вариантах реализации предложено соединение, содержащее специфический ингибитор АроCIII, для применения при лечении, предупреждении, замедлении или облегчении дислипидемии Фредриксона I типа, FCS, LPLD.
В некоторых вариантах реализации предложено применение соединения, содержащего специфический ингибитор АроCIII, для снижения уровней АроCIII у животного с дислипидемией Фредриксона I типа, FCS, LPLD. В некоторых вариантах реализации происходит снижение уровней АроCIII в печени или тонком кишечнике.
В некоторых вариантах реализации изобретения предложено применение соединения, содержащего специфический ингибитор АроCIII, для снижения уровней TG, повышения уровней HDL и/или улучшения отношения TG к HDL у животного с дислипидемией Фредриксона I типа, FCS, LPLD.
В некоторых вариантах реализации изобретения предложено применение соединения, содержащего специфический ингибитор АроCIII, для предупреждения, лечения, облегчения или уменьшения по меньшей мере одного симптома сердечнососудистого заболевания путем снижения уровней TG, повышения уровней HDL и/или улучшения отношения TG к HDL у животного с дислипидемией Фредриксона I типа, FCS, LPLD.
В некоторых вариантах реализации предложено соединение, содержащее специфический ингибитор АроCIII, для лечения животного с дислипидемией Фредриксона I типа, FCS, LPLD, имеющего риск или страдающего от панкреатита.
В некоторых вариантах реализации изобретения используемый специфический ингибитор АроCIII представляет собой нуклеиновую кислоту, пептид, антитело, малую молекулу или другой агент, способный подавлять экспрессию АроCIII. В некоторых вариантах реализации нуклеиновая кислота представляет собой антисмысловое соединение. В некоторых вариантах реализации антисмысловое соединение представляет собой модифицированный олигонуклеотид, нацеленный на АроCIII. В некоторых вариантах реализации изобретения модифицированный олигонуклеотид имеет последовательность азотистых оснований, содержащую по меньшей мере 8 смежных азотистых оснований ISIS 304801 (SEQ ID NO: 3). В некоторых вариантах реализации модифицированный олигонуклеотид по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 98% или по меньшей мере на 100% комплементарен SEQ ID NO: 1, SEQ ID NO: 2 или SEQ ID NO: 4.
В некоторых вариантах реализации изобретения предложена композиция, содержащая специфический ингибитор АроCIII, для применения для: снижения уровней TG у животного с дислипидемией Фредриксона I типа, FCS, LPLD; повышения уровней HDL и/или улучшения отношения TG к HDL у животного с дислипидемией Фредриксона I типа, FCS, LPLD; предупреждения, замедления или облегчения сердечно-сосудистого и/или метаболического заболевания, расстройства, патологического состояния или его симптома у животного с дислипидемией Фредриксона I типа, FCS, LPLD; и/или предупреждения, замедления или облегчения панкреатита или его симптома у животного с дислипидемией Фредриксона I типа, FCS, LPLD. В некоторых вариантах реализации специфический ингибитор АроCIII представляет собой нуклеиновую кислоту, пептид, антитело, малую молекулу или другой агент, способный ингибировать экспрессию АроCIII. В некоторых вариантах реализации нуклеиновая кислота представляет собой антисмысловое соединение. В некоторых вариантах реализации антисмысловое соединение представляет собой модифицированный олигонуклеотид, нацеленный на АроCIII. В некоторых вариантах реализации изобретения модифицированный олигонуклеотид имеет последовательность азотистых оснований, содержащую по меньшей мере 8 смежных азотистых оснований ISIS 304801 (SEQ ID NO: 3). В некоторых вариантах реализации модифицированный олигонуклеотид по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 98% или по меньшей мере на 100% комплементарен SEQ ID NO: 1, SEQ ID NO: 2 или SEQ ID NO: 4.
В некоторых вариантах реализации предложена композиция для снижения уровней TG у животного с дислипидемией Фредриксона I типа, FCS, LPLD; повышения уровней HDL и/или улучшения отношения TG к HDL у животного с дислипидемией Фредриксона I типа, FCS, LPLD; предупреждения, замедления или облегчения сердечнососудистого и/или метаболического заболевания, расстройства, патологического состояния или его симптома у животного с дислипидемией Фредриксона I типа, FCS, LPLD; и/или предупреждения, замедления или облегчения панкреатита или его симптома у животного с дислипидемией Фредриксона I типа, FCS, LPLD, содержащая специфический ингибитор АроCIII. В некоторых вариантах реализации специфический ингибитор АроCIII представляет собой нуклеиновую кислоту, пептид, антитело, малую молекулу или другой агент, способный ингибировать экспрессию АроCIII. В некоторых вариантах реализации нуклеиновая кислота представляет собой антисмысловое соединение. В некоторых вариантах реализации антисмысловое соединение представляет собой модифицированный олигонуклеотид, нацеленный на АроCIII. В некоторых вариантах реализации изобретения модифицированный олигонуклеотид имеет последовательность азотистых оснований, содержащую по меньшей мере 8 смежных азотистых оснований ISIS 304801 (SEQ ID NO: 3). В некоторых вариантах реализации модифицированный олигонуклеотид по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 98% или по меньшей мере на 100% комплементарен SEQ ID NO: 1, SEQ ID NO: 2 или SEQ ID NO: 4.
Антисмысловые соединения
Олигомерные соединения включают, но не ограничиваются ими, олигонуклеотиды, олигонуклеозиды, аналоги олигонуклеотидов, олигонуклеотид-миметики, антисмысловые соединения, антисмысловые олигонуклеотиды и миРНК. Олигомерное соединение может быть «антисмысловым» для целевой нуклеиновой кислоты, что означает, что оно способно подвергаться гибридизации с целевой нуклеиновой кислотой путем водородного связывания.
Антисмысловые соединения, представленные в настоящем документе, относятся к олигомерным соединениям, способным подвергаться гибридизации с целевой нуклеиновой кислотой путем водородного связывания. Примеры антисмысловых соединений включают одноцепочечные и двухцепочечные соединения, такие как антисмысловые олигонуклеотиды, миРНК, кшРНК и микроРНК.
В некоторых вариантах реализации изобретения антисмысловое соединение имеет последовательность азотистых оснований, которая при прочтении в направлении от 5' к 3' содержит обратный комплемент сегмента-мишени целевой нуклеиновой кислоты, на который он нацелен. В некоторых таких вариантах реализации антисмысловой олигонуклеотид имеет последовательность азотистых оснований, которая при прочтении в направлении от 5' к 3' содержит обратный комплемент сегмента-мишени целевой нуклеиновой кислоты, на который он нацелен.
В некоторых вариантах реализации антисмысловое соединение, нацеленное на нуклеиновую кислоту АроCIII, имеет длину 12-30 нуклеотидов. Другими словами, антисмысловые соединения состоят из 12-30 связанных азотистых оснований. В других вариантах реализации антисмысловое соединение содержит модифицированный олигонуклеотид, состоящий из 8-80, 10-80, 12-50, 15-30, 18-24, 19-22 или 20 связанных азотистых оснований. В некоторых таких вариантах реализации антисмысловое соединение содержит модифицированный олигонуклеотид, состоящий из 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79 или 80 связанных азотистых оснований, или в диапазоне, определяемом любыми двумя из представленных выше значений. В некоторых вариантах реализации антисмысловое соединение представляет собой антисмысловой олигонуклеотид.
В некоторых вариантах реализации антисмысловое соединение содержит укороченный или усеченный модифицированный олигонуклеотид. Укороченный или усеченный модифицированный олигонуклеотид может иметь один или более нуклеозидов, удаленных с 5'-конца (5'-усечение), один или более нуклеозидов, удаленных с 3'-конца (3'-усечение), или один или более нуклеозидов, удаленных из центральной части. Альтернативно, удаленные нуклеозиды могут быть распределены в модифицированном олигонуклеотиде, например, в антисмысловом соединении, имеющем один нуклеозид, удаленный с конца 5', и один нуклеозид, удаленный с конца 3'.
При наличии одного дополнительного нуклеозида в удлиненном олигонуклеотиде, этом дополнительный нуклеозид может быть расположен в центральной части, на 5' или 3' конце олигонуклеотида. При наличии двух или более дополнительных нуклеозидов, добавленные нуклеозиды могут быть соседними относительно друг друга, например, в олигонуклеотиде, имеющем два нуклеозида, добавленных к центральной части, к 5'-концу (5'-присоединение) или, альтернативно, к 3'-концу (3'-присоединение) олигонуклеотида. Альтернативно, добавленные нуклеозиды могут быть распределены в антисмысловом соединении, например, в олигонуклеотиде, имеющем один нуклеозид, добавленный к 5'-концу, и одну субъединицу, добавленную к 3'-концу.
Можно увеличивать или уменьшать длину антисмыслового соединения, такого как антисмысловой олигонуклеотид, и/или внедрять несовпадающие основания без устранения активности. Например, в публикации Woolf et al. (Proc. Natl. Acad. Sci. USA 89: 7305-7309, 1992) были испытаны серии антисмысловых олигонуклеотидов из 13-25 азотистых оснований на их способность вызывать расщепление целевой РНК в модели инъекции ооцита. Антисмысловые олигонуклеотиды длиной 25 азотистых оснований с 8 или 11 не совпадающими основаниями вблизи концов антисмысловых олигонуклеотидов были способны направлять специфическое расщепление целевой мРНК, хотя и в меньшей степени, чем антисмысловые олигонуклеотиды, не содержащие несовпадений. Точно так же, целевое специфическое расщепление было достигнуто при помощи антисмысловых олигонуклеотидов из 13 азотистых оснований, включая олигонуклеотиды с 1 или 3 несовпадениями.
В публикации Gautschi et al (J. Natl. Cancer Inst. 93: 463-471, март 2001) продемонстрировали способность олигонуклеотида, имеющего 100% комплементарность с мРНК bcl-2 и имеющего 3 несовпадения с мРНК bcl-xL, снижать экспрессию bcl-2 и bel-xL in vitro и in vivo. Более того, этот олигонуклеотид показал эффективное противоопухолевое действие in vivo.
Ученые Maher и Dolnick (Nuc. Acid. Res. 16: 3341-3358, 1988) исследовали серию последовательных антисмысловых олигонуклеотидов из 14 азотистых оснований, а также антисмысловые олигонуклеотиды из 28 и 42 азотистых оснований, содержащих последовательность из двух или трех последовательных антисмысловых олигонуклеотидов, соответственно, на их способность блокировать трансляцию человеческого DHFR в анализе ретикулоцитов кроликов. Каждый из трех антисмысловых олигонуклеотидов из 14 азотистых оснований по отдельности был способен подавлять трансляцию, хотя и на более слабом уровне, чем антисмысловые олигонуклеотиды из 28 или 42 азотистых оснований.
Мотивы антисмысловых соединений
В некоторых вариантах реализации изобретения антисмысловые соединения, нацеленные на нуклеиновую кислоту АроCIII, содержат химически модифицированные субъединицы, расположенные в таких последовательностях, или мотивах, чтобы обеспечивать такие свойства антисмысловых соединений, как усиленная ингибирующая активность, повышенная аффиность связывания целевой нуклеиновой кислоты или устойчивость к расщеплению под действием нуклеаз in vivo.
Химерные антисмысловые соединения обычно содержат по меньшей мере одну область, модифицированную так, чтобы обеспечивать повышенную устойчивость к нуклеазному расщеплению, повышенное клеточное поглощение, повышенную аффинность связывания целевой нуклеиновой кислоты и/или повышенную ингибирующую активность. Вторая область химерного антисмыслового соединения может необязательно служить в качестве субстрата для клеточной эндонуклеазы РНКазы Н, которая расщепляет цепь РНК дуплекса РНК : ДНК.
Антисмысловые соединения, имеющие мотив гэп-мера, считают химерными антисмысловыми соединениями. В гэп-мере внутренняя область, содержащая множество нуклеотидов, которые поддерживают расщепление РНКазы Н, расположена между внешними областями, содержащими множество нуклеотидов, которые являются химически отличными от нуклеозидов внутренней области. В случае если антисмысловой олигонуклеотид имеет мотив гэп-мера, то сегмент гэп обычно служит в качестве субстрата для эндонуклеазного расщепления, тогда как сегменты крыльев содержат модифицированные нуклеозиды. В некоторых вариантах реализации изобретения области гэп-мера дифференцируются по типу сахарных фрагментов, составляющих каждую отдельную область. Типы сахарных фрагментов, которые используют для дифференциации областей гэп-мера, могут в некоторых вариантах реализации включать β-D-рибонуклеозиды, β-D-дезоксирибонуклеозиды, 2'-модифицированные нуклеозиды (такие 2'-модифицированные нуклеозиды могут включать, среди прочих, 2'-МОЕ и 2'-O-СН3) и модифицированные нуклеозиды с бициклическим сахаром (такие модифицированные нуклеозиды с бициклическим сахаром могут включать нуклеозиды с мостиком 4'-(СН2)n-O-2', где n=1 или n=2). Предпочтительно, каждая отдельная область содержит одинаковые сахарные фрагменты. Мотив крыло-гэп-крыло зачастую описывают как «Х-Y-Z», где «X» представляет собой длину 5'-крыла, «Y» представляет собой длину области гэп, и «Z» представляет собой длину 3'-крыла. При использовании в настоящем документе гэп-мер, описанный как «X-Y-Z», имеет такую конфигурацию, что сегмент гэп расположен сразу возле каждого из сегмента 5'-крыла и сегмента 3'-крыла. Следовательно, между сегментом 5'-крыла и сегментом гэп, или между сегментом гэп и сегментом 3'-крыла нет промежуточных нуклеотидов. Любые антисмысловые соединения, описанные в настоящем документе, могут иметь мотив гэп-мера. В некоторых вариантах реализации изобретения X и Z являются одинаковыми; других вариантах реализации они различные. В предпочтительном варианте реализации Y содержит от 8 до 15 нуклеотидов. X, Y или Z могут иметь 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30 или более нуклеозидов. Следовательно, гэп-меры включают, но не ограничиваются ими, например, 5-10-5, 4-8-4, 4-12-3, 4-12-4, 3-14-3, 2-13-5, 2-16-2, 1-18-1, 3-10-3, 2-10-2, 1-10-1, 2-8-2, 6-8-6, 5-8-5, 1-8-1, 2-6-2, 2-13-2, 1-8-2, 2-8-3, 3-10-2, 1-18-2 или 2-18-2.
В некоторых вариантах реализации изобретения антисмысловое соединение содержит мотив «олигомера крыла», имеющий конфигурацию крыло-гэп или гэп-крыло, то есть конфигурацию X-Y или Y-Z, как описано выше для конфигурации гэп-мера. Следовательно, конфигурации олигомера крыла включают, но не ограничиваются ими, например, 5-10, 8-4, 4-12, 12-4, 3-14, 16-2, 18-1, 10-3, 2-10, 1-10, 8-2, 2-13 или 5-13.
В некоторых вариантах реализации изобретения антисмысловые соединения, нацеленные на нуклеиновую кислоту АроCIII, имеют мотив гэп-мера 5-10-5.
В некоторых вариантах реализации антисмысловое соединение, нацеленное на нуклеиновую кислоту АроCIII, имеет расширенный мотив гэп.
Целевые нуклеиновые кислоты, целевые области и нуклеотидные последовательности
Нуклеотидные последовательности, кодирующие АроCIII, включают, без ограничения, следующие: GENBANK с номером доступа NM_000040.1 (включена в настоящий документ как SEQ ID NO: 1), GENBANK с номером доступа NT_033899.8, усеченная по нуклеотидам с 20262640 по 20266603 (включена в настоящий документ как SEQ ID NO: 2) и GENBANK с номером доступа NT_035088.1, усеченная по нуклеотидам с 6238608 по 6242565 (включена в настоящий документ как SEQ ID NO: 4).
Следует понимать, что последовательность, представленная в каждой SEQ ID NO в Примерах, содержащихся в настоящем документе, является независимой от любых модификаций сахарного фрагмента, межнуклеозидной связи или азотистого основания. Поэтому антисмысловые соединения, определенные номером SEQ ID NO, могут независимо содержать одну или более модификаций сахарного фрагмента, межнуклеозидной связи или азотистого основания. Антисмысловые соединения, описанные номером Isis (Isis No), указывают комбинацию последовательности азотистого основания и мотива.
В некоторых вариантах реализации целевая область является структурно определенной областью целевой нуклеиновой кислоты. Например, целевая область может охватывать 3' нетранслируемую область (UTR), 5' нетранслируемую область, экзон, интрон, экзон-интронное сочленение, кодирующую область, область инициации трансляции, область обрыва трансляции или другую определенную область нуклеиновой кислоты. Структурно определенные области для АроCIII могут быть получены по номеру доступа из базы данных последовательностей, такой как NCBI, и такая информация включена в настоящий документ посредством ссылки. В некоторых вариантах реализации изобретения целевая область может охватывать последовательность от 5'-сайта-мишени любого целевого сегмента в пределах целевой области от 3'-сайта-мишени другого целевого сегмента в пределах целевой области.
В некоторых вариантах реализации «целевой сегмент» представляет собой более мелкий субфрагмент целевой области нуклеиновой кислоты. Например, целевой сегмент может быть последовательностью нуклеотидов целевой нуклеиновой кислоты, на которую нацелено одно или более антисмысловых соединений. «Сайт-мишень 5'» относится к 5'-основному нуклеотиду целевого сегмента. «Сайт-мишень 3'» относится к 3'-основному нуклеотиду целевого сегмента.
Целевая область может содержать один или более целевых сегментов. Несколько целевых сегментов в пределах целевой области могут перекрываться. Альтернативно, они могут не перекрываться. В некоторых вариантах реализации изобретения целевые сегменты в пределах целевой области разделены не более чем около 300 нуклеотидами. В некоторых вариантах реализации целевые сегменты в пределах целевой области разделены количеством нуклеотидов, которое составляет или примерно равно, или не превышает, или примерно не превышает 250, 200, 150, 100, 90, 80, 70, 60, 50, 40, 30, 20 или 10 нуклеотидов целевой нуклеиновой кислоты, или находится в диапазоне, определенном любыми из двух предшествующих значений. В некоторых вариантах реализации целевые сегменты в пределах целевой области разделены не более чем или примерно не более чем 5 нуклеотидами целевой нуклеиновой кислоты. В некоторых вариантах реализации целевые сегменты являются смежными. Подразумеваются целевые области, определенные диапазоном, содержащим первоначальную нуклеиновую кислоту, то есть любой из 5' сайтов-мишеней или 3' сайтов-мишеней, перечисленных в настоящем документе.
Таргетинг включает определение по меньшей мере одного целевого сегмента, с которым гибридизуется антисмысловое соединение, с получением желаемого эффекта. В некоторых вариантах реализации изобретения желаемый эффект представляет собой снижение уровней целевой нуклеиновой кислоты мРНК. В некоторых вариантах реализации желаемый эффект представляет собой снижение уровней белка, кодируемого целевой нуклеиновой кислотой, или фенотипическое изменение, связанное с целевой нуклеиновой кислотой.
Подходящие целевые сегменты могут находиться в 5' нетранслируемой области, кодирующей области, 3' нетранслируемой области, интроне, экзоне или экзон-интронном сочленении. Целевые сегменты, содержащие инициирующий кодон или стоп-кодон, также являются подходящими целевыми сегментами. Подходящий целевой сегмент может специально не содержать некоторую структурно определенную область, такую как инициирующий кодон или стоп-кодон.
Определение соответствующих целевых сегментов может включать сравнение последовательности целевой нуклеиновой кислоты с другими последовательностями генома. Например, для определения областей сходства среди различных нуклеиновых кислот может быть использован алгоритм BLAST. Это сравнение может предотвращать выбор последовательностей антисмысловых соединений, которые могут гибридизоваться неспецифическим образом с последовательностями, отличными от выбранной целевой нуклеиновой кислоты (то есть нецелевыми или с побочными последовательностями).
В пределах активной целевой области может наблюдаться изменение активности (например, по результатам определения процентного снижения уровней целевой нуклеиновой кислоты) антисмысловых соединений. В некоторых вариантах реализации изобретения снижение уровней мРНК АроCIII является показателем ингибирования экспрессии АроCIII. Снижение уровней белка АроCIII также является показателем ингибирования экспрессии целевой мРНК. Кроме того, показателем ингибирования экспрессии АроCIII могут быть фенотипические изменения. Например, повышение уровня HDL, снижение уровня LDL или снижение уровня TG представляют собой фенотипические изменения, которые можно оценивать на подавление экспрессии АроCIII. Могут быть оценены другие фенотипические показатели, например, симптомы, связанные с сердечно-сосудистым или метаболическим заболеванием; например, стенокардия; боль в груди; одышка; учащенное сердцебиение; слабость; головокружение; тошнота; потоотделение; тахикардия; брадикардия; аритмия; мерцательная аритмия; опухание нижних конечностей; цианоз; усталость; обморок; онемение лица; онемение конечностей, хромота или судороги мышц; вздутие живота; или лихорадка.
Гибридизация
В некоторых вариантах реализации изобретения гибридизация происходит между антисмысловым соединением, описанным в настоящем документе, и нуклеиновой кислотой АроCIII. Наиболее общий механизм гибридизации включает водородное связывание (например, Уотсона-Крика, Хугстина или обратное водородное связывание Хугстина) между комплементарными азотистыми основаниями молекул нуклеиновых кислот.
Гибридизация может происходить при различных условиях. Обязательными условиями является зависимость от последовательностей, и они определяются природой и составом молекул нуклеиновых кислот, подлежащих гибридизации.
Способы определения возможности специфической гибридизации последовательности с целевой нуклеиновой кислотой хорошо известны в данной области техники (Sambrook и Russell, Molecular Cloning: A Laboratory Manual, 3е изд., 2001, CSHL Press). В некоторых вариантах реализации антисмысловые соединения, представленные в настоящем документе, могут специфически гибридизоваться с нуклеиновой кислотой АроCIII.
Комплементарность
Антисмысловое соединение и целевая нуклеиновая кислоты комплементарны друг другу, если достаточное количество азотистых оснований антисмыслового соединения может быть связано водородной связью с соответствующими азотистыми основаниями целевой нуклеиновой кислоты, так что возникает желаемый эффект (например, антисмысловое ингибирование целевой нуклеиновой кислоты, такой как нуклеиновая кислота АроCIII).
Антисмысловое соединение может гибридизоваться в одном или более сегментах нуклеиновой кислоты АроCIII, так что промежуточные или соседние сегменты не участвуют в гибридизации (например, петлевая структура, не совпадающая или шпилечная структура).
В некоторых вариантах реализации антисмысловые соединения, представленные в настоящем документе, или их определенные части комплементарны или по меньшей мере на 70%, 75%, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% комплементарны нуклеиновой кислоте АроCIII, целевой области, целевому сегменту или определенной их части. Процент комплементарности антисмыслового соединения целевой нуклеиновой кислоте может быть определен стандартными способами.
Например, антисмысловое соединение, в котором 18 из 20 азотистых оснований антисмыслового соединения комплементарны целевой области и, следовательно, будут специфически гибридизоваться, представляет 90 процентов комплементарности. В этом примере оставшиеся не комплементарные азотистые основания могут быть сгруппированы или чередоваться с комплементарными азотистыми основаниями, и не обязательно должны быть смежными друг с другом или с комплементарными азотистыми основаниями. Поэтому антисмысловое соединение длиной 18 азотистых основание, имеющее 4 (четыре) не комплементарные азотистые снования, к которым примыкают две области полной комплементарности с целевой нуклеиновой кислотой, имеет общую комплементарность с целевой нуклеиновой кислотой 77,8%, и, следовательно, входит в границы объема настоящего изобретения. Процент комплементарности антисмыслового соединения с областью целевой нуклеиновой кислоты может быть определен обычным способом при помощи программ BLAST (программ для обнаружения сходства последовательностей белков путем их локального выравнивания) и программ PowerBLAST, известных в данной области техники (Altschul et al., J. Mol. Biol., 1990, 215, 403 410; Zhang и Madden, Genome Res., 1997, 7, 649 656). Процент гомологичности, идентичности или комплементарности последовательности может быть определен, например, при помощи программы Gap (Wisconsin Sequence Analysis Package, версия 8 для Unix, Genetics Computer Group, University Research Park, Мэдисон, штат Висконсин), с настройками по умолчанию, в которых используется алгоритм Smith и Waterman (Adv. Appl. Math., 1981, 2, 482-489).
В некоторых вариантах реализации изобретения антисмысловые соединения, представленные в настоящем документе, или их определенные части, полностью комплементарны (т.е. комплементарны на 100%) целевой нуклеиновой кислоте или ее определенной части. Например, антисмысловое соединение может быть полностью комплементарно нуклеиновой кислоте АроCIII или ее целевой области, или целевому сегменту, или целевой последовательности. При использовании в настоящем документе «полностью комплементарно» обозначает, что каждое азотистое основание антисмыслового соединения может участвовать в точном спаривании оснований с соответствующими азотистыми основаниями целевой нуклеиновой кислоты. Например, антисмысловое соединение из 20 азотистых оснований полностью комплементарно целевой последовательности длиной 400 азотистых оснований, если существует соответствующая часть из 20 азотистых оснований целевой нуклеиновой кислоты, которая полностью комплементарна указанному антисмысловому соединению. Термин «полностью комплементарна» может быть использован также в отношении определенной части первой и/или второй нуклеиновой кислоты. Например, часть из 20 азотистых оснований антисмыслового соединения, состоящего из 30 азотистых оснований, может быть «полностью комплементарна» целевой последовательности длиной 400 азотистых оснований. Часть из 20 азотистых оснований олигонуклеотида, состоящего из 30 азотистых оснований, полностью комплементарна целевой последовательности, если целевая последовательность имеет соответствующую часть из 20 азотистых оснований, в которой каждое азотистое основание комплементарно части из 20 азотистых оснований указанного антисмыслового соединения. В то же время целое антисмысловое соединение из 30 азотистых оснований может быть или не быть полностью комплементарным к целевой последовательности, в зависимости от того, являются ли оставшиеся 10 азотистых оснований антисмыслового соединения также комплементарными целевой последовательности.
Некомплементарное азотистое основание(-ия) может быть расположено на 5'-конце или 3'-конце антисмыслового соединения. Альтернативно, некомплементарное азотистое основание(-ия) может быть расположено внутри антисмыслового соединения. При наличии двух или более некомплементарных азотистых оснований они могут быть смежными (т.е. связанными) или несмежными. В одном из вариантов реализации изобретения некомплементарное азотистое основание расположено в сегменте крыла гэп-мера антисмыслового олигонуклеотида.
В некоторых вариантах реализации изобретения антисмысловые соединения, которые имеют длину или содержат до 12, 13, 14, 15, 16, 17, 18, 19 или 20 азотистых оснований, содержат не более 4, не более 3, не более 2 или не более 1 некомплементарного азотистого основания(-ий) относительно целевой нуклеиновой кислоты, такой как нуклеиновая кислота АроCIII или ее определенная часть.
В некоторых вариантах реализации антисмысловые соединения, которые имеют длину или содержат до 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 азотистых оснований, содержат не более 6, не более 5, не более 4, не более 3, не более 2 или не более 1 некомплементарного азотистого основания(-ий) относительно целевой нуклеиновой кислоты, такой как нуклеиновая кислота АроCIII или ее определенная часть.
Антисмысловые соединения, представленные в настоящем документе, включают также те, которые комплементарны части целевой нуклеиновой кислоты. При использовании в настоящем документе «часть» относится к определенному количеству смежных (то есть связанных) азотистых оснований в пределах области или сегмента целевой нуклеиновой кислоты. «Часть» может также относиться к определенному количеству смежных азотистых оснований антисмыслового соединения. В некоторых вариантах реализации антисмысловые соединения комплементарны части целевого сегмента, состоящей из по меньшей мере 8 азотистых оснований. В некоторых вариантах реализации антисмысловые соединения комплементарны части целевого сегмента, состоящего из по меньшей мере 10 азотистых оснований. В некоторых вариантах реализации антисмысловые соединения комплементарны части целевого сегмента, состоящего из по меньшей мере 12 азотистых оснований. В некоторых вариантах реализации антисмысловые соединения комплементарны части целевого сегмента, состоящего из по меньшей мере 15 азотистых оснований. Также подразумеваются антисмысловые соединения, которые комплементарны части целевого сегмента, состоящее из по меньшей мере 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или более азотистых оснований, или в диапазоне между любыми из двух этих значений.
Идентичность
Антисмысловые соединения, представленные в настоящем документе, также могут иметь определенный процент идентичности с конкретной нуклеотидной последовательностью, SEQ ID NO или последовательностью соединения, представленной номером Isis, или их частью. При использовании в настоящем документе антисмысловое соединение является идентичным к последовательности, описанной в настоящем документе, если оно имеет такую же способность к спариванию азотистых оснований. Например, РНК, которая содержит урацил вместо тимидина в описанной последовательности ДНК, считается идентичной к этой последовательности ДНК, поскольку и урацин, и тимидин спариваются с аденином. Подразумеваются также укороченные и удлиненные версии антисмысловых соединений, описанных в настоящем документе, а также соединения, имеющие неидентичные основания по сравнению с антисмысловыми соединениями, представленными в настоящем документе. Неидентичные основания могут быть соседними друг к другу или могут быть распределены в антисмысловом соединении. Процент идентичности антисмыслового соединения рассчитывают по количеству оснований, имеющих идентичное спаривание оснований, по сравнению с последовательностью, с которой его сравнивают.
В некоторых вариантах реализации изобретения антисмысловые соединения или их части по меньшей мере на 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичны одному или нескольким антисмысловым соединениям или последовательностям SEQ ID NO, или их частям, описанным в настоящем документе.
Модификации
Нуклеозид представляет собой комбинацию основания и сахара. Азотистое основание как часть (известная также как основание) нуклеозида обычно представляет собой фрагмент гетероциклического основания. Нуклеотиды представляют собой нуклеозиды, которые дополнительно содержат фосфатную группу, ковалентно связанную с сахарной частью нуклеозида. Для тех нуклеозидов, которые содержат пентафуранозный сахар, фосфатная группа может быть связана с 2', 3' или 5' гидроксильным фрагментом сахара. Олигонуклеотиды образуются посредством ковалентного связывания соседних нуклеозидов друг с другом с образованием линейного полимерного олигонуклеотида. В пределах олигонуклеотидной структуры фосфатные группы обычно упоминают как образующие межнуклеозидные связи олигонуклеотида.
Модификации антисмысловых соединений включают замещения или изменения межнуклеозидных связей, сахарных фрагментов или азотистых оснований. Модифицированные антисмысловые соединения зачастую являются предпочтительными по сравнению с нативными формами из-за желаемых свойств, таких как, например, усиленное клеточное поглощение, усиленная аффинность к целевой нуклеиновой кислоте, увеличенная устойчивость в присутствии нуклеаз или увеличенная ингибирующая активность.
Химически модифицированные нуклеозиды также могут быть использованы для увеличения связывающей аффинности укороченного или усеченного антисмыслового олигонуклеотида к его целевой нуклеиновой кислоте. Следовательно, зачастую могут быть получены сравнимые результаты с более короткими антисмысловыми соединениями, которые содержат такие химически модифицированные нуклеозиды.
Модифицированные межнуклеозидные связи
Природная межнуклеозидная связь РНК и ДНК представляет собой фосфодиэфирную связь 3' с 5'. Антисмысловые соединения, имеющие одну или несколько модифицированных, то есть не встречающихся в природе межнуклеозидиы:. связей, зачастую выбирают вместо антисмысловых соединений, имеющих природные межнуклеозидные связи из-за желаемых свойств, таких как, например, усиленное клеточное полощение, усиленная аффиность к целевым нуклеиновым кислотам и увеличенная устойчивость в присутствии нуклеаз.
Олигонуклеотиды, имеющие модифицированные межнуклеозидные связи, включают межнуклеозидные связи, которые сохраняют атом фосфора, а также межнуклеозидные связи без атома фосфора. Типичные межнуклеозидные связи, содержащие фосфор, включают, но не ограничиваются ими, фосфодиэфиры, фосфотриэфиры, метилфосфонаты, фосфорамидаты и тиофосфаты. Хорошо известны способы получения фосфоросодержащих и не содержащих фосфор связей.
В некоторых вариантах реализации изобретения антисмысловые соединения, нацеленные на нуклеиновую кислоту АроCIII, содержат одну или более модифицированных межнуклеозидных связей. В некоторых вариантах реализации модифицированные межнуклеозидные связи представляют собой тиофосфатные связи. В некоторых вариантах реализации каждая межнуклеозидная связь антисмыслового соединения представляет собой тиофосфатную межнуклеозидную связь.
Модифицированные сахарные фрагменты
Антисмысловые соединения согласно настоящему изобретению могут необязательно содержать один или несколько нуклеозидов, в которых модифицирована сахарная группа. Такие нуклеозиды с модифицированным сахаром могут обеспечивать улучшенную устойчивость к действию нуклеаз, увеличенную связывающую аффинность или какое-либо другое преимущественное биологическое свойство антисмысловых соединений. В некоторых вариантах реализации нуклеозиды содержат химически модифицированные рибофуранозные кольцевые фрагменты. Примеры химически модифицированных рибофуранозных колец включают, без ограничения, добавление групп заместителей (включая 5' и 2' группы заместителей, связывание мостиком негеминальных кольцевых атомов с образованием бициклических нуклеиновых кислот (БцНК), замену рибозильного кольцевого атома кислорода на S, N(R) или C(R1)(R2) (R, R1 и R2 независимо представляют собой Н, С1-С12 алкил или защитную группу) и их комбинации. Примеры химически модифицированных сахаров включают 2'-F-5'-метил-замещенный нуклеозид (см. Международную заявку РСТ WO 2008/101157, опубликованную 8/21/08, где описаны другие 5', 2'-бис-замещенные нуклеозиды) или замену рибозильного кольцевого атома кислорода на S с дополнительным замещением в 2'-положении (см. опубликованную заявку на патент США US 2005-0130923, опубликованную 16 июня 2005), или, альтернативно, 5'-замещение БцНК (см. Международную заявку РСТ WO 2007/134181, опубликованную 11/22/07, в которой БНК замещена, например, 5'-метальной или 5'-винильной группой).
Примеры нуклеозидов, имеющих модифицированные сахарные фрагменты, включают, без ограничения, нуклеозиды, содержащие 5'-винил, 5'-метил (R или S), 4'-S, 2'-F, 2'-ОСН3, 2'-ОСН2СН3, 2'-OCH2CH2F и 2'-0(СН2)2ОСН3 группы заместителей. Заместитель в 2' положении также может быть выбран из аллила, амино, азидо, тио, О-аллила, О-С1-С10 алкила, OCF3, OCH2F, O(CH2)2SCH3, O(CH2)2-O-N(Rm)(Rn), O-СН2-C(=O)-N(Rm)(Rn) и O-CH2-C(=O)-N(R1)-(CH2)2-N(Rm)(Rn), где каждый R1, Rm и Rn независимо представляет собой Н или замещенный или незамещенный C1-С10 алкил.
При использовании в настоящем документе «бициклические нуклеозиды» относятся к модифицированным нуклеозидам, содержащим бициклический сахарный фрагмент. Примеры бициклических нуклеиновых кислот (БцНК) включают, без ограничения, нуклеозиды, содержащие мостик между 4' и 2' рибозильными кольцевыми атомами. В некоторых вариантах реализации изобретения антисмысловые соединения, представленные в настоящем документе, содержат один или более нуклеозидов БцНК, при этом мостик содержит одну из формул: 4'-(СН2)-O-2' (БНК); 4'-(CH2)-S-2'; 4'-(СН2)2-O-2' (ENA); 4'-СН(СН3)-O-2' и 4'-СН(СН2ОСН3)-O-2' (и их аналоги, см. патент США 7399845, выданный 15 июля 2008); 4'-С(СН3)(СН3)-O-2' (и его аналоги, см. PCT/US2008/068922, опубликованную как WO/2009/006478 8 января 2009); 4'-СН2-N(OCH3)-2' (и его аналоги, см. PCT/US2008/064591, опубликованную как WO/2008/150729 11 декабря 2008); 4'-CH2-O-N(CH3)-2' (см. заявку на патент США US2004-0171570, опубликованную 2 сентября 2004); 4'-CH2-N(R)-O-2', где R представляет собой Н, C1-C12 алкил или защитную группу (см. патент США 7427672, выданный 23 сентября 2008); 4'-СН2-С(Н)(СН3)-2' (см. публикацию Chattopadhyaya et al., J. Org. Chem., 2009, 74, 118-134); и 4'-CH2-C(=CH2)-2' (и его аналоги, см. PCT/US2008/066154, опубликованную как WO 2008/154401 8 декабря 2008).
Дополнительные бициклические нуклеозиды описаны в опубликованных литературных источниках (см., например: Srivastava et al., J. Am. Chem. Soc., 2007, 129(26) 8362-8379; Frieden et al., Nucleic Acids Research, 2003, 21, 6365-6372; Elayadi et al., Curr. Opinion Invens. Drugs, 2001, 2, 558-561; Braasch et al., Chem. Biol., 2001, 8, 1-7; Orum et al., Curr. Opinion Mol. Ther., 2001, 3, 239-243; Wahlestedt et al., Proc. Natl. Acad. Sci. U.S.A., 2000, 97, 5633-5638; Singh et al., Chem. Commun., 1998, 4, 455-456; Koshkin et al., Tetrahedron, 1998, 54, 3607-3630; Kumar et al., Bioorg. Med. Chem. Lett., 1998, 8, 2219-2222; Singh et al., J. Org. Chem., 1998, 63, 10035-10039; патенты США №: 7399845; 7053207; 7034133; 6794499; 6770748; 6670461; 6525191; 6268490; публикации патентов США №: US 2008-0039618; US 2007-0287831; US 2004-0171570; патентные заявки США с серийными номерами: 12/129154; 61/099844; 61/097787; 61/086231; 61/056564; 61/026998; 61/026995; 60/989574; международные заявки WO 2007/134181; WO 2005/021570; WO 2004/106356; WO 94/14226; и международные заявки РСТ №: PCT/US2008/068922; PCT/US2008/066154; и PCT/US2008/064591). Каждый из представленных выше бициклических нуклеозидов может быть получен с одной или несколькими стереохимическими конфигурациями сахара, включая, например, α-L-рибофуранозу и β-D-рибофуранозу (см. международную заявку РСТ PCT/DK98/00393, опубликованную 25 марта 1999 года как WO 99/14226).
При использовании в настоящем документе «моноциклические нуклеозиды» относятся к нуклеозидам, содержащим модифицированные сахарные фрагменты, которые не являются бициклическими сахарными фрагментами. В некоторых вариантах реализации изобретения сахарный фрагмент или аналог сахарного фрагмента нуклеозида может быть модифицированным или замещенным в любом положении.
При использовании в настоящем документе «4'-2' бициклический нуклеозид» или «бициклический нуклеозид в направлении 4'-2'» относится к бициклическому нуклеозиду, содержащему фуранозное кольцо, которое содержит мостик, соединяющий два атома углерода фуранозного кольца, который соединяет 2' атом углерода и 4' атом углерода сахарного кольца.
В некоторых вариантах реализации изобретения бициклические сахарные фрагменты нуклеозидов БцНК включают, но не ограничиваются ими, соединения, имеющие по меньшей мере один мостик между 4' и 2' атомами углерода пентафуранозного сахарного фрагмента, включая, без ограничения, мостики, содержащие 1 или от 1 до 4 связанных групп, независимо выбранных из причем каждый мостик независимо включает 1 или от 1 до 4 связанных групп, независимо выбранных из -[C(Ra)(Rb)]n-, -C(Ra)=C(Rb)-, -C(Ra)=N-, -C(=NRa)-, -C(=O)-, -C(=S)-, -O-, -Si(Ra)2-, -S(=O)x- и -N(Ra)-; причем: x равен 0, 1 или 2; n равен 1, 2, 3 или 4; каждый Ra и Rb независимо представляет собой Н, защитную группу, гидроксил, С1-С12 алкил, замещенный C1-C12 алкил, C2-C12 алкенил, замещенный С2-С12 алкенил, С2-С12 алкинил, замещенный С2-С12 алкинил, С5-С20 арил, замещенный С5-С20 арил, гетероциклический радикал, замещенный гетероциклический радикал, гетероарил, замещенный гетероарил, С5-С7 алициклический радикал, замещенный С5-С7 алициклический радикал, галоген, OJ1, NJ1J2, SJ1, N3, COOJ1, ацил (С(=O)-Н), замещенный ацил, CN, сульфонил (S(=O)2-J1) или сульфоксил (S(=O)-J1); и
каждый J1 и J2 независимо представляет собой, Н, C1-C12 алкил, замещенный C1-С12 алкил, C2-C12 алкенил, замещенный C2-C12 алкенил, C2-C12 алкинил, замещенный С2-С12 алкинил, С5-С20 арил, замещенный С5-С20 арил, ацил (С(=O)-Н), замещенный ацил, гетероциклический радикал, замещенный гетероциклический радикал, С1-C12 аминоалкил, замещенный С1-С12 аминоалкил или защитную группу.
В некоторых вариантах реализации изобретения мостик бициклического сахарного фрагмента представляет собой -[C(Ra)(Rb)]n-, -[C(Ra)(Rb)]n-O-, -C(RaRb)-N(R)-О- или -C(RaRb)-O-N(R)-. В некоторых вариантах реализации мостик представляет собой 4'-СН2-2', 4'-(СН2)2-2', 4'-(СН2)3-2', 4'-СН2-O-2', 4'-(СН2)2-O-2', 4'-CH2-O-N(R)-2' и 4'-CH2-N(R)-O-2'-, где каждый R независимо представляет собой Н, защитную группу или С1-С12 алкил.
В некоторых вариантах реализации бициклические нуклеозиды дополнительно определены по изомерной конфигурации. Например, нуклеозид, содержащий мостик 4'-(СН2)-O-2', может быть в α-L конфигурации или β-D конфигурации. Ранее в антисмысловые олигонуклеотиды, демонстрирующие антисмысловую активность, были внедрены α-L-метиленокси (4'-СН2-O-2') БцНК (Frieden et al., Nucleic Acids Research, 2003, 21, 6365-6372).
В некоторых вариантах реализации изобретения бициклические нуклеозиды включают нуклеозиды, имеющие 4'-2' мостик, причем такие мостики включают, без ограничения, α-L-4'-(CH2)-O-2', β-D-4'-CH2-O-2', 4'-(СН2)2-O-2', 4'-CH2-O-N(R)-2', 4'-CH2-N(R)-O-2', 4'-СН(СН3)-O-2', 4'-CH2-S-2', 4'-CH2-N(R)-2', 4'-CH2-CH(CH3)-2' и 4'-(СН2)3-2', где R представляет собой Н, защитную группу или С1-С12 алкил.
В некоторых вариантах реализации бициклические нуклеозиды имеют формулу:
где:
Вх представляет собой фрагмент гетероциклического основания;
-Qa-Qb-Qc- представляет собой -CH2-N(Rc)-CH2-, -C(=O)-N(Rc)-CH2-, -CH2-O-N(Rc)-, -CH2-N(Rc)-O- или -N(Rc)-O-CH2;
Rc представляет собой C1-C12 алкил или аминозащитную группу; и
Та и Tb, каждый независимо, представляют собой Н, гидроксизащитную группу, конъюгирующую группу, реакционноспособную фосфорсодержащую группу фосфорный фрагмент или ковалентное присоединение к иммобилизующему носителю.
В некоторых вариантах реализации бициклические нуклеозиды имеют формулу:
где:
Вх представляет собой фрагмент гетероциклического основания;
Та и Tb, каждый независимо, представляют собой Н, гидроксизащитную группу, конъюгирующую группу, химически активную фосфорную группу, фосфорный фрагмент или ковалентное присоединение к иммобилизующему носителю;
Za представляет собой C1-C6 алкил, С2-C6 алкенил, С2-C6 алкинил, замещенный C1-C6 алкил, замещенный С2-C6 алкенил, замещенный С2-C6 алкинил, ацил, замещенный ацил, замещенный амид, тиол или замещенный тиол.
В одном из вариантов реализации изобретения каждая из замещенных групп независимо представляет собой моно- или полизамещенную группу с группами заместителей, независимо выбранными из галогена, оксо, гидроксила, OJc, NJcJd, SJc, N3, OC(=X)Jc и NJeC(=X)NJcJd, причем каждый Jc, Ja и Je независимо представляет собой Н, C1-C6 алкил или замещенный С1-С6 алкил, и X представляет собой О или NJc.
В некоторых вариантах реализации бициклические нуклеозиды имеют формулу:
где:
Вх представляет собой фрагмент гетероциклического основания;
Та и Tb, каждый независимо, представляют собой Н, гидроксизащитную группу, конъюгирующую группу, реакционноспособную фосфорсодержащую группу, фосфорный фрагмент или ковалентное присоединение к иммобилизующему носителю;
Zb представляет собой C1-C6 алкил, С2-C6 алкенил, С2-C6 алкинил, замещенный C1-C6 алкил, замещенный С2-C6 алкенил, замещенный С2-C6 алкинил или замещенный ацил (С(=O)-).
В некоторых вариантах реализации бициклические нуклеозиды имеют формулу:
где:
Вх представляет собой фрагмент гетероциклического основания;
Та и Tb, каждый независимо, представляют собой Н, гидроксизащитную групп, конъюгирующую группу, реакционноспособную фосфорсодержащую группу, фосфорный фрагмент или ковалентное присоединение к иммобилизующему носителю;
Rd представляет собой C1-C6 алкил, замещенный C1-C6 алкил, С2-C6 алкенил, замещенный С2-C6 алкенил, С2-C6 алкинил или замещенный С2-С6 алкинил;
каждый qa, qb, qc и qd независимо представляет собой Н, галоген, C1-C6 алкил, замещенный С1-С6 алкил, С2-C6 алкенил, замещенный С2-C6 алкенил, С2-C6 алкинил или замещенный С2-C6 алкинил, C1-C6 алкоксил, замещенный C1-C6 алкоксил, ацил, замещенный ацил, C1-C6 аминоалкил или замещенный С1-C6 аминоалкил;
В некоторых вариантах реализации бициклические нуклеозиды имеют формулу:
где:
Вх представляет собой фрагмент гетероциклического основания;
Та и Tb, каждый независимо, представляют собой Н, гидроксизащитную группу, конъюгирующую группу, реакционноспособную фосфорсодержащую группу, фосфорный фрагмент или ковалентное присоединение к иммобилизующему носителю;
qa, qb, qe и qf, каждый независимо, представляют собой водород, галоген, С1-С12 алкил, замещенный С1-С12 алкил, С2-С12 алкенил, замещенный С2-С12 алкенил, С2-С12 алкинил, замещенный С2-С12 алкинил, С1-С12 алкокси, замещенный С1-С12 алкокси, OJj, SJj, SOJj, SO2Jj, NJjJk, N3, CN, C(=O)OJj, C(=O)NJjJk, C(=O)Jj, O-C(=O)NjJk, N(H)C(=NH)NJjJk, N(H)C(=O)NJjJk или N(H)C(=S)NJjJk;
или qe и qf вместе представляют собой =C(qg)(qh);
qg и qh, каждый независимо, представляют собой Н, галоген, С1-С12 алкил или замещенный С1-С12 алкил.
Ранее был описан синтез и получение адениновых, цитозиновых, гуаниновых, 5-метилцитозиновых, тиминовых и урациловых бициклических нуклеозидов, имеющих мостик (4'-СН2-O-2'), а также их олигомеризация и распознающие свойства нуклеиновых кислот (Koshkin et al., Tetrahedron, 1998, 54, 3607-3630). Синтез бициклических нуклеозидов описан также в WO 98/39352 и WO 99/14226.
Были получены также аналоги различных бициклических нуклеозидов, которые имеют группы, образующие мостик 4' с 2', такие как 4'-СН2-O-2' и 4'-CH2-S-2' (Kumar et al., Bioorg. Med. Chem. Lett., 1998, 8, 2219-2222). Описано также получение олигодезоксирибонуклеотидных дуплексов, содержащих бициклические нуклеозиды, для применения в качестве субстратов для полимераз нуклеиновых кислот (Wengel et al., WO 99/14226). Кроме того, в данной области техники описан синтез 2'-амино-БцНК, нового конформационно ограниченного олигонуклеотидного аналога с высокой аффинностью и ограниченным рядом конформационных структур (Singh et al., J. Org. Chem., 1998, 63, 10035-10039). Кроме того, ранее были получены 2'-амино- и 2'-метиламино-БцНК и описана термическая устойчивость их дуплексов с комплементарными цепями РНК и ДНК.
В некоторых вариантах реализации бициклические нуклеозиды имеют формулу:
где:
Вх представляет собой фрагмент гетероциклического основания;
Та и Tb, каждый независимо, представляют собой Н, гидроксизащитную группу, конъюгирующую группу, реакционноспособную фосфорсодержащую группу, фосфорный фрагмент или ковалентное присоединение к иммобилизующему носителю;
каждый qi, qj, qk и ql независимо, представляют собой Н, галоген, С1-С12 алкил, замещенный С1-С12 алкил, С2-С12 алкенил, замещенный С2-С12 алкенил, С2-С12 алкинил, замещенный С2-С12 алкинил, С1-С12 алкоксил, замещенный С1-С12 алкоксил, OJj, SJj, SOJj, SO2Jj, NJjJk, N3, CN, C(=O)OJj, C(=O)NJjJk, C(=O)Jj, O-C(=O)NJjJk, N(H)C(=NH)NJjJk, N(H)C(=O)NJjJk или N(H)C(=S)NJjJk; и
qi и qj или ql и qk вместе представляют собой =C(qg)(qh), причем qg и qh, каждый независимо, представляют собой Н, галоген, С1-С12 алкил или замещенный С1-С12 алкил.
Описан один карбоциклический бициклический нуклеозид, имеющий мостик 4'-(СН2)3-2', и алкениловый аналог, мостик 4'-СН=СН-СН2-2' (Frier et al., Nucleic Acids Research, 1997, 25(22), 4429-4443 и Albaek et al., J. Org. Chem., 2006, 71, 7731-7740). Также был описан синтез и получение карбоциклических бициклических нуклеозидов, их олигомеризация и биохимические исследования (Srivastava et al., J. Am. Chem. Soc. 2007, 129(26), 8362-8379).
В некоторых вариантах реализации изобретения бициклические нуклеозиды включают, но не ограничиваются ими, (А) α-L-метиленокси (4'-СН2-O-2') БцНК, (В) β-D-метиленокси (4'-СН2-O-2') БцНК, (С) этиленокси (4'-(СН2)2-O-2') БцНК, (D) аминоокси (4'-CH2-O-N(R)-2') БцНК, (Е) оксиамино (4'-CH2-N(R)-O-2') БцНК, (F) метил(метиленокси) (4'-СН(СН3)-O-2') БцНК (также называемый стерически затрудненным этилом или cEt), (G) метилентио (4'-CH2-S-2') БцНК, (Н) метиленамино (4'-CH2-N(R)-2') БцНК, (I) метил карбоциклический (4'-СН2-СН(СН3)-2') БцНК, (J) пропилен карбоциклический (4'-(СН2)3-2') БцНК и (K) виниловый БцНК, как показано ниже.
где Вх представляет собой фрагмент основания, a R независимо представляет собой Н, защитную группу, C1-C6 алкил или C1-C6 алкокси.
При использовании в настоящем документе термин «модифицированный тетрагидропирановый нуклеозид» или «модифицированный ТГП нуклеозид» обозначает нуклеозид, имеющий шестичленный тетрагидропирановый «сахар», замещении!' пентафуранозным остатком в нормальных нуклеозидах, и он может упоминаться как заменитель сахара. Модифицированные ТГП нуклеозиды включают, но не ограничиваются ими, так называемые гекситоловые нуклеиновые кислоты (ГНК), анитоловые нуклеиновые кислоты (АНК), маннитоловые нуклеиновые кислоты (МНК) (см. Leumann, Bioorg. Med. Chem., 2002, 10, 841-854), фтор-ГНК (F-ГНК), имеющие тетрагидропирановую кольцевую систему, как показано ниже.
В некоторых вариантах реализации изобретения выбраны заменители сахара, имеющие формулу:
где:
Вх представляет собой фрагмент гетероциклического основания;
Т3 и Т4, каждый независимо, межнуклеозидная связывающая группа, связывающая тетрагидропирановый нуклеозидный аналог с олигмерным соединением или одним из Т3 и Т4, представляет собой межнуклеозидную связывающую группу, связывающую тетрагидропирановый нуклеозидный аналог с олигомерным соединением или олигонуклеотидом, а другой из Т3 и Т4 представляет собой Н, гидроксизащитную группу, связанную конъюгирующую группу или 5' или 3'-концевую группу;
q1, q2, q3, q4, q5, q6 и q7, каждый независимо, представляют собой, Н, C1-C6 алкил, замещенный C1-C6 алкил, С2-C6 алкенил, замещенный С2-C6 алкенил, С2-C6 алкинил или замещенный С2-C6 алкинил; и
один из R1 и R2 представляет собой водород, а другой выбран из галогена, замещенного или незамещенного алкокси, NJ1J2, SJ1, N3, OC(=X)J1, OC(=X)NJ1J2, NJ3C(=X)NJ1J2 и CN, причем X представляет собой О, S или NJ1, и каждый J1, J2 и J3 независимо представляет собой Н или C1-C6 алкил.
В некоторых вариантах реализации изобретения каждый q1, q2, q3, q4, q5, q6 и q7 представляет собой Н. В некоторых вариантах реализации по меньшей мере один из q1, q2, q3, q4, q5, q6 и q7 отличен от Н. В некоторых вариантах реализации по меньшей мере один из q1, q2, q3, q4, q5, q6 и q7 представляет собой метил. В некоторых вариантах реализации представлены ТГП нуклеозиды, в которых один из R1 и R2 представляет собой F. В некоторых вариантах реализации R1 представляет собой фтор, a R2 представляет собой Н; R1 представляет собой метокси, a R2 представляет собой Н, и R1 представляет собой метоксиэтокси, a R2 представляет собой Н.
В некоторых вариантах реализации изобретения заменители сахара содержат кольца, имеющие более 5 атомов и более одного гетероатома. Например, описаны нуклеозиды, содержащие морфолиносахарные фрагменты, и их применение в олигомерных соединениях (см., например: Braasch et al., Biochemistry, 2002, 41, 4503-4510; и патенты США 5698685; 5166315; 5185444; и 5034506). При использовании в настоящем документе термин «морфолино» обозначает заменитель сахара, имеющий следующую формулу:
 .
.
В некоторых вариантах реализации изобретения «морфолино» могут быть модифицированными, например, добавлением или изменением различных групп заместителей в представленной выше структуре морфолино. Такие заменители сахара в настоящем документе упоминаются как «модифицированные морфолиновые».
Без ограничения, представлены также комбинации модификаций, такие как 2'-F-5'-метилзамещенные нуклеозиды (см. международную заявку РСТ WO 2008/101157, опубликованную 8/21/08, где описаны другие 5',2'-бис-замещенные нуклеозиды), а также замена атома кислорода в остатке рибозного кольца на S и дополнительное замещение в 2'-положении (см. заявку на патент США US 2005-0130923, опубликованную 16 июня 2005), или альтернативно 5'-замещение бициклической нуклеиновой кислоты (см. международную заявку РСТ WO 2007/134181, опубликованную 11/22/07, где 4'-СН2-O-2' бициклический нуклеозид дополнительно замещен в 5'-положении на 5'-метальную или 5'-винильную группу). Также был описан синтез и получение карбоциклических бициклических нуклеозидов, их олигомеризация и биохимические исследования (см., например, Srivastava et al., J. Am. Chem. Soc. 2007, 129(26), 8362-8379).
В некоторых вариантах реализации изобретения антисмысловые соединения содержат один или более модифицированных циклогексенильных нуклеозидов, которые представляют собой нуклеозиды, имеющие шестичленный циклогексенил вместо пентафуранозного остатка в природных нуклеозидах. Модифицированные циклогексенильные нуклеозиды включают, но не ограничиваются ими, нуклеозиды, описанные в данной области техники (см., например, заявку того же заявителя РСТ WO 2010/036696, опубликованную 10 апреля 2010, Robeyns et al., J. Am. Chem. Soc., 2008, 130(6), 1979-1984;  et al., Tetrahedron Letters, 2007, 48, 3621-3623; Nauwelaerts et al., J. Am. Chem. Soc, 2007, 129(30), 9340-9348; Gu et al., Nucleosides, Nucleotides & Nucleic Acids, 2005, 24(5-7), 993-998; Nauwelaerts et al., Nucleic Acids Research, 2005, 33(8), 2452-2463; Robeyns et al., Acta Crystallographica, Section F: Structural Biology and Crystallization Communications, 2005, F61(6), 585-586; Gu et al., Tetrahedron, 2004, 60(9), 2111-2123; Gu et al., Oligonucleotides, 2003, 13(6), 479-489; Wang et al., J. Org. Chem., 2003, 68, 4499-4505; Verbeure et al., Nucleic Acids Research, 2001, 29(24), 4941-4947; Wang et al., J. Org. Chem., 2001, 66, 8478-82; Wang et al., Nucleosides, Nucleotides & Nucleic Acids, 2001, 20(4-7), 785-788; Wang et al., J. Am. Chem., 2000, 122, 8595-8602; опубликованную заявку РСТ WO 06/047842; и опубликованную заявку РСТ WO 01/049687; текст каждого документа включен в настоящий документ посредством ссылки в полном объеме). Некоторые модифицированные циклогексенильные нуклеозиды имеют Формулу X.
et al., Tetrahedron Letters, 2007, 48, 3621-3623; Nauwelaerts et al., J. Am. Chem. Soc, 2007, 129(30), 9340-9348; Gu et al., Nucleosides, Nucleotides & Nucleic Acids, 2005, 24(5-7), 993-998; Nauwelaerts et al., Nucleic Acids Research, 2005, 33(8), 2452-2463; Robeyns et al., Acta Crystallographica, Section F: Structural Biology and Crystallization Communications, 2005, F61(6), 585-586; Gu et al., Tetrahedron, 2004, 60(9), 2111-2123; Gu et al., Oligonucleotides, 2003, 13(6), 479-489; Wang et al., J. Org. Chem., 2003, 68, 4499-4505; Verbeure et al., Nucleic Acids Research, 2001, 29(24), 4941-4947; Wang et al., J. Org. Chem., 2001, 66, 8478-82; Wang et al., Nucleosides, Nucleotides & Nucleic Acids, 2001, 20(4-7), 785-788; Wang et al., J. Am. Chem., 2000, 122, 8595-8602; опубликованную заявку РСТ WO 06/047842; и опубликованную заявку РСТ WO 01/049687; текст каждого документа включен в настоящий документ посредством ссылки в полном объеме). Некоторые модифицированные циклогексенильные нуклеозиды имеют Формулу X.

где независимо для каждого из упомянутого по меньшей мере одного циклогексенильного нуклеозидного аналога Формулы X:
Вх представляет собой фрагмент гетероциклического основания;
Т3 и Т4, каждый независимо, межнуклеозидная связывающая группа, связывающая циклогексенильный нуклеозидный аналог с антисмысловым соединением или одним из Т3 и Т4, представляет собой межнуклеозидную связывающую группу, связывающую тетрагидропирановый нуклеозидный аналог с антисмысловым соединением, а другой из Т3 и Т4 представляет собой Н, гидроксизащитную группу, связанную конъюгирующую группу или 5' или 3'-концевую группу; и
q1, q2, q3, q4, q5, q6, q7, q8 и q9, каждый независимо, представляют собой Н, C1-C6 алкил, замещенный C1-C6 алкил, С2-C6 алкенил, замещенный С2-C6 алкенил, С2-С6 алкинил, замещенный С2-C6 алкинил или другую группу заместителя.
В данной области техники известны многие другие моноциклические, бициклические и трициклические кольцевые системы, и они подходят в качестве заменителей сахара, которые могут быть использованы для модификации нуклеозидов для введения в олигомерные соединения, представленные в настоящем документе (см., например, обзорную статью: Leumann, Christian J. Bioorg. & Med. Chem., 2002, 10, 841-854). Такие кольцевые системы могут подвергаться различным дополнительным замещениям для дополнительного усиления их активности.
При использовании в настоящем документе «2'-модифицированный сахар» обозначает фуранозный сахар, модифицированный в 2'-положении. В некоторых вариантах реализации изобретения такие модификации включают заместители, выбранные из: галогенида, включая, но не ограничиваясь ими, замещенный и незамещенный алкокси, замещенный и незамещенный тиоалкил, замещенный и незамещенный аминоалкил, замещенный и незамещенный алкил, замещенный и незамещенный аллил, и замещенный и незамещенный алкинил. В некоторых вариантах реализации 2'-модификации выбраны из заместителей, включающих, но не ограничиваясь ими: O[(CH2)nO]mCH3, O(CH2)nNH2, O(CH2)nCH3, O(CH2)nF, O(CH2)nONH2, OCH2C(=O)N(H)CH3 и O(CH2)nON[(CH2)nCH3]2, где n и m равны от 1 до примерно 10. Другие группы 2'-заместителей также могут быть выбраны из: C1-C12 алкила, замещенного алкила, алкенила, алкинила, алкарила, аралкила, О-алкарила или О-аралкила, SH, SCH3, OCN, Cl, Br, CN, F, CF3, OCF3, SOCH3, SO2CH3, ONO2, NO2, N3, NH2, гетероциклоалкила, гетероциклоалкарила, аминоалкиламино, полиалкиламино, замещенного силила, РНК-расщепляющей группы, репортерной группы, интеркалятора, группы для улучшения фармакокинетических свойств или группы для улучшения фармакодинамических свойств антисмыслового соединения, а также других заместителей, имеющих аналогичные свойства. В некоторых вариантах реализации изобретения модифицированные нуклеозиды содержат боковую цепь 2'-МОЕ (Baker et al., J. Biol. Chem., 1997, 272, 11944-12000). Такое 2'-MOE замещение может быть описано как обладающее улучшенной связывающей аффинностью по сравнению с немодифицированными нуклеозидами и с другими модифицированными нуклеозидами, такими как 2'-O-метил, О-пропил и О-аминопропил. Было также показано, что олигонуклеотиды, имеющие заместитель 2'-МОЕ, представляют собой антисмысловые ингибиторы генной экспрессии с перспективой применения in vivo (Martin, Helv. Chim. Acta, 1995, 78, 486-504; Altmann et al., Chimia, 1996, 50, 168-176; Altmann et al., Biochem. Soc. Trans., 1996, 24, 630-637; и Altmann et al., Nucleosides Nucleotides, 1997, 16, 917-926).
При использовании в настоящем документе «2'-модифицированный» или «2'-замещенный» относится к нуклеозиду, содержащему сахар, который содержит заместитель в 2'-положении, отличный от Н или ОН. 2'-Модифицированные нуклеозидь' включают, но не ограничиваются ими, бициклические нуклеозиды, в которых мостик, соединяющий два атома углерода сахарного кольца, соединяет 2' атом углерода и другой атом углерода сахарного кольца; а также нуклеозиды с немостиковыми 2' заместителями, такими как аллил, амино, азидо, тио, О-аллил, O-C1-С10 алкил, -OCF3, O-(СН2)2-O-СН3, 2'-O(CH2)2SCH3, O-(CH2)2-O-N(Rm)(Rn) или O-CH2-C(=O)-N(Rm)(Rn), где каждый Rm и Rn независимо представляет собой Н или замещенный или незамещенный C1-С10 алкил. 2'-Модифицированные нуклеозиды могут дополнительно содержать другие модификации, например, в других положениях сахара и/или в азотистом основании.
При использовании в настоящем документе «2'-F» относится к нуклеозиду, содержащему сахар, который содержит фтор-группу в 2'-положении сахарного кольца.
При использовании в настоящем документе каждый «2'-ОМе» или «2'-ОСН3», или «2'-O-метил», или «2'-метокси» относится к нуклеозиду, содержащему сахар, который содержит группу -ОСН3 в 2'-положении сахарного кольца.
При использовании в настоящем документе каждый «МОЕ» или «2'-МОЕ», или «2'-ОСН2СН2ОСН3», или «2'-O-метоксиэтил» относится к нуклеозиду, содержащему сахар, который содержит группу -ОСН2СН2ОСН3 в 2'-положении сахарного кольца.
Способы получения модифицированных сахаров хорошо известны специалистам в данной области техники. Некоторые иллюстративные патенты США, в которых описано получение таких модифицированных сахаров, включают, без ограничения, U.S.: 4981957; 5118800; 5319080; 5359044; 5393878; 5446137; 5466786; 5514785; 5519134; 5567811; 5576427; 5591722; 5597909; 5610300; 5627053; 5639873; 5646265; 5670633; 5700920; 5792847 и 6600032, а также международную заявку PCT/US2005/019219, зарегистрированную 2 июня 2005 и опубликованную как WO 2005/121371 22 декабря 2005, и каждый из этих документов включен в настоящий документ посредством ссылки в полном объеме.
При использовании в настоящем документе «олигонуклеотид» относится к соединению, содержащему множество связанных нуклеозидов. В некоторых вариантах реализации изобретения один или более из множества нуклеозидов являются модифицированными. В некоторых вариантах реализации олигонуклеотид содержит один или более рибонуклеозидов (РНК) и/или дезоксирибонуклеозидов (ДНК).
В нуклеотидах, имеющих модифицированные сахарные фрагменты, фрагменты азотистого основания (природные, модифицированные или их комбинации) сохраняются для гибридизации с соответствующей целевой нуклеиновой кислотой.
В некоторых вариантах реализации изобретения антисмысловые соединения содержат один или более нуклеозидов, имеющих модифицированные сахарные фрагменты. В некоторых вариантах реализации модифицированный сахарный фрагмент представляет собой 2'-МОЕ. В некоторых вариантах реализации 2'-МОЕ модифицированные нуклеозиды расположены в мотиве гэп-мера. В некоторых вариантах реализации модифицированный сахарный фрагмент представляет собой бициклический нуклеозид, имеющий мостиковую группу (4'-СН(СН3)-O-2'). В некоторых вариантах реализации (4'-СН(СН3)-O-2') модифицированные нуклеозиды расположены в крыльях мотива гэп-мера.
Модифицированные азотистые основания
Модификации или замещения азотистого основания (или основания) структурно отличаются от природных или синтетических немодифицированных азотистых оснований, сохраняя при этом функциональную взаимозаменяемость. И природные, и модифицированные азотистые основания могут участвовать в образовании водородных связей. Такие модификации азотистых оснований могут обеспечивать устойчивость к действию нуклеаз, аффинность связывания или какое-либо другое благоприятное биологическое свойство антисмысловых соединений. Модифицированные азотистые основания включают синтетические и природные азотистые основания, такие как, например, 5-метилцитозин (5-me-С). Некоторые замещения азотистых оснований, включая 5-метилцитозиновые замещения, особенно подходят для усиления аффинности связывания антисмыслового соединения с целевой нуклеиновой кислотой. Например, было показано, что 5-метилцитозиновые замещения повышают стабильность дуплекса нуклеиновой кислоты на 0,6-1,2°С (Sanghvi, Y.S., Crooke, S.T. and Lebleu, В., ред., Antisense Research and Applications, CRC Press, Boca Raton, 1993, pp. 276-278).
Дополнительные модифицированные азотистые основания включают 5-гидроксиметилцитозин, ксантин, гипоксантин, 2-аминоаденин, 6-метил и другие алкильные производные аденина и гуанина, 2-пропил и другие алкильные производные аденина и гуанина, 2-тиоурацил, 2-тиотимин и 2-тиоцитозин, 5-галогенурацил и цитозин, 5-пропинил (-C≡C-СН3) урацил и цитозин, и другие алкинильные производные пиримидиновых оснований, 6-азоурацил, цитозин и тимин, 5-урацил (псевдоурацил), 4-тиоурацил, 8-галоген, 8-амино, 8-тиол, 8-тиоалкил, 8-гидроксил и другие 8-замещенные аденины и гуанины, 5-галоген, в частности, 5-бром, 5-трифторметил и другие 5-замещенные урацилы и цитозины, 7-метилгуанин и 7-метиладенин, 2-F-аденин, 2-аминоаденин, 8-азагуанин и 8-азааденин, 7-деазагуанин и 7-деазааденин, а также 3-деазагуанин и 3-деазааденин.
Фрагменты гетероциклических оснований могут включать те, в которых пуриновое или пиримидиновое основание заменено другими гетероциклами, например, 7-деазааденин, 7-деазагуанозин, 2-аминопиридин и 2-пиридон. Азотистые основания, которые особенно подходят для повышения аффинности связывания антисмысловых соединений, включают 5-замещенные пиримидины, 6-азапиримидины и N-2, N-6 и О-6 замещенные пурины, включая 2-аминопропиладенин, 5-пропинилурацил и 5-пропинилцитозин.
В некоторых вариантах реализации изобретения антисмысловые соединения, нацеленные на нуклеиновую кислоту АроCIII, содержат одно или более модифицированных азотистых оснований. В некоторых вариантах реализации изобретения антисмысловые олигонуклеотиды с расширенным мотивом гэп, нацеленные на нуклеиновую кислоту АроCIII, содержат одно или более модифицированных азотистых оснований. В некоторых вариантах реализации модифицированное азотистое основание представляет собой 5-метилцитозин. В некоторых вариантах реализации каждый цитозин представляет собой 5-метилцитозин.
Соединения РНКи
В некоторых вариантах реализации изобретения антисмысловые соединения представляют собой интерферирующие РНК соединения (РНКи), которые включают двухцепочечные РНК соединения (также упоминаемые как малые интерферирующие РНК или миРНК) и одноцепочечные РНКи соединения (или оцРНК). Такие соединения по меньшей мере частично действуют по пути RISC для разрушения и/или изолирования целевой нуклеиновой кислоты (следовательно, включают соединения микроРНК/микроРНК-миметики). В некоторых вариантах реализации изобретения антисмысловые соединения содержат модификации, которые обеспечивают их особенную пригодность для таких механизмов.
i. Соединения оцРНК
В некоторых вариантах реализации изобретения антисмысловые соединения, включая те, которые особенно подходят для применения в качестве соединений одноцепочечных РНКи (оцРНК), содержат модифицированный 5'-терминальный конец. В некоторых таких вариантах реализации 5'-терминальный конец содержит модифицированный фосфатный фрагмент. В некоторых вариантах реализации такой модифицированный фосфат является стабилизированным (например, устойчивым к разрушению/расщеплению, по сравнению с немодифицированным 5'-фосфатом). В некоторых вариантах реализации такие 5'-концевые нуклеозиды стабилизируют 5'-фосфорный фрагменты. Некоторые модифицированные 5'-концевые нуклеозиды можно найти в данной области техники, например, в WO/2011/139702.
В некоторых вариантах реализации изобретения 5'-нуклеозид соединения оцРНК имеет Формулу IIc:
где:
T1 представляет собой необязательно защищенный фосфорный фрагмент;
Т2 представляет собой межнуклеозидную связывающую группу, которая связывает соединение Формулы IIc с олигомерным соединением;
А имеет одну из формул:
 ,
,  ,
,  ,
,  или
или 
Q1 и Q2, каждый независимо, представляют собой Н, галоген, C1-C6 алкил, замещенный C1-C6 алкил, C1-C6 алкокси, замещенный C1-C6 алкокси, С2-С6 алкенил, замещенный С2-C6 алкенил, С2-C6 алкинил, замещенный С2-C6 алкинил или N(R3)(R4);
Q3 представляет собой О, S, N(R5) или C(R6)(R7);
каждый R3, R4 R5, R6 и R7 независимо представляет собой, Н, C1-C6 алкил, замещенный C1-C6 алкил или C1-C6 алкокси;
М3 представляет собой О, S, NR14, C(R15)(R16), C(R15)(R16)C(Rl7)(R18), C(R15)=C(R17), OC(R15)(R16) или OC(R15)(Bx2);
R14 представляет собой H, C1-C6 алкил, замещенный C1-C6 алкил, C1-C6 алкокси, замещенный C1-C6 алкокси, С2-C6 алкенил, замещенный С2-C6 алкенил, С2-C6 алкинил или замещенный С2-C6 алкинил;
R15, R16, R17 и R18, каждый независимо, представляют собой Н, галоген, C1-C6 алкил, замещенный C1-C6 алкил, C1-C6 алкокси, замещенный C1-C6 алкокси, С2-C6 алкенил, замещенный С2-C6 алкенил, С2-C6 алкинил или замещенный С2-C6 алкинил;
Bx1 представляет собой фрагмент гетероциклического основания;
или при наличии Вх2, Вх2 представляет собой фрагмент гетероциклического основания, a Bx1 представляет собой Н, галоген, С1-С6 алкил, замещенный C1-C6 алкил, С1-С6 алкокси, замещенный C1-C6 алкокси, С2-C6 алкенил, замещенный С2-C6 алкенил, С2-C6 алкинил или замещенный С2-C6 алкинил;
J4, J5, J6 и J7, каждый независимо, представляют собой Н, галоген, С1-С6 алкил, замещенный С1-С6 алкил, C1-C6 алкокси, замещенный C1-C6 алкокси, С2-C6 алкенил, замещенный С2-C6 алкенил, С2-С6 алкинил или замещенный С2-С6 алкинил;
или J4 образует мостик с одним из J5 или J7, при этом указанный мостик содержит от 1 до 3 связанных бирадикальных групп, выбранных из О, S, NR19, C(R20)(R21), C(R20)=C(R21), C[=C(R20)(R21)] и С(=O), а другие два из J5, J6 и J7, каждый независимо, представляют собой Н, галоген, C1-C6 алкил, замещенный C1-C6 алкил, C1-C6 алкокси, замещенный C1-C6 алкокси, С2-C6 алкенил, замещенный С2-C6 алкенил, С2-С6 алкинил или замещенный С2-C6 алкинил;
каждый R19, R20 и R21 независимо представляет собой Н, C1-C6 алкил, замещенный C1-C6 алкил, C1-C6 алкокси, замещенный C1-C6 алкокси, С2-C6 алкенил, замещенный С2-C6 алкенил, С2-C6 алкинил или замещенный С2-C6 алкинил;
G представляет собой Н, ОН, галоген или O-[C(R8)(R9)]n-[(C=O)m-X1]j-Z;
каждый R8 и R9 независимо представляет собой Н, галоген, C1-C6 алкил или замещенный C1-C6 алкил;
X1 представляет собой О, S или N(E1);
Z представляет собой Н, галоген, C1-C6 алкил, замещенный С1-С6 алкил, С2-C6 алкенил, замещенный С2-C6 алкенил, С2-C6 алкинил, замещенный С2-C6 алкинил или N(E2)(E3);
E1, Е2 и Е3, каждый независимо, представляют собой Н, C1-C6 алкил или замещенный C1-C6 алкил;
n равен от 1 до около 6;
m равен 0 или 1;
j равен 0 или 1;
каждая замещенная группа содержит одну или более необязательно защищенных групп заместителей, независимо выбранных из галогена, OJ1, N(J1)(J2), =NJ1, SJ1, N3, CN, OC(=X2)J1, OC(=X2)N(J1)(J2) и C(=X2)N(J1)(J2);
X2 представляет собой О, S или NJ3;
каждый J1, J2 и J3 независимо представляет собой Н или C1-C6 алкил;
где если j равен 1, то Z отличен от галогена или N(Е2)(Е3); и
где указанное олигомерное соединение содержит от 8 до 40 мономерных субъединиц и способно к гибридизации с по меньшей мере частью целевой нуклеиновой кислоты.
В некоторых вариантах реализации изобретения М3 представляет собой О, СН=СН, ОСН2 или ОС(Н)(Вх2). В некоторых вариантах реализации М3 представляет собой О.
В некоторых вариантах реализации каждый J4, J5, J6 и J7 представляет собой Н. В некоторых вариантах реализации J4 образует мостик с одним из J5 или J7.
В некоторых вариантах реализации изобретения А имеет одну из формул:
 или
или 
где:
Q1 и Q2, каждый независимо, представляют собой, Н, галоген, C1-C6 алкил, замещенный С1-С6 алкил, С1-C6 алкокси или замещенный C1-C6 алкокси. В некоторых вариантах реализации изобретения каждый Q1 и Q2 представляет собой Н. В некоторых вариантах реализации каждый Q1 и Q2 независимо представляет собой Н или галоген. В некоторых вариантах реализации один из Q1 и Q2 представляет собой Н, а другой из Q1 и Q2 представляет собой F, СН3 или ОСН3.
В некоторых вариантах реализации изобретения T1 имеет формулу:

где:
Ra и Rc, каждый независимо, представляют собой защищенный гидроксил, защищенный тиол, C1-C6 алкил, замещенный C1-C6 алкил, C1-C6 алкокси, замещенный С1-C6 алкокси, защищенный амино или замещенный амино; и
Rb представляет собой О или S. В некоторых вариантах реализации изобретения Rb представляет собой О, a Ra и Rc, каждый независимо, представляют собой ОСН3, ОСН2СН3 или СН(СН3)2.
В некоторых вариантах реализации изобретения G представляет собой галоген, ОСН3, OCH2F, OCHF2, OCF3, ОСН2СН3, O(CH2)2F, OCH2CHF2, OCH2CF3, OCH2-CH-CH2. O(CH2)2-OCH3, O(CH2)2-SCH3, O(CH2)2-OCF3, O(CH2)3-N(R10)(R11), О(СН2)2-ON(R10)(R11), O(CH2)2-O(CH2)2-N(R10)(R11), OCH2C(=O)-N(R10)(R11), OCH2C(=O)-N(R12)-(CH2)2-N(R10)(R11) или O(CH2)2-N(R12)-C(=NR13)[N(Rl0)(R11)], где R10, R11, R12 и R13, каждый независимо, представляют собой Н или С1-С6 алкил. В некоторых вариантах реализации G представляет собой галоген, ОСН3, OCF3, ОСН2СН3, OCH2CF3, ОСН2-СН=СН2, O(СН2)2-ОСН3, O(CH2)2-O(CH2)2-N(CH3)2, OCH2C(=O)-N(H)CH3, OCH2C(=O)-N(H)-(CH2)2-N(CH3)2 или OCH2-N(H)-C(=NH)NH2. В некоторых вариантах реализации G представляет собой F, ОСН3 или O(СН2)2-ОСН3. В некоторых вариантах реализации G представляет собой O(СН2)2-ОСН3.
В некоторых вариантах реализации изобретения 5'-концевой нуклеозид имеет Формулу IIe:

В некоторых вариантах реализации изобретения антисмысловые соединения, включая те, которые особенно подходят для оцРНК, содержат один или более типов модифицированных сахарных фрагментов и/или природных сахарных фрагментов, расположенных вдоль олигонуклеотида или его области в определенном порядке или мотиве сахарной модификации. Такие мотивы могут содержать любые сахарные модификации, описанные в настоящем документе и/или другие известные сахарные модификации.
В некоторых вариантах реализации изобретения олигонуклеотиды содержат или состоят из области, имеющей одинаковые сахарные модификации. В некоторых таких вариантах реализации каждый нуклеозид области содержит одинаковую РНК-подобную сахарную модификацию. В некоторых вариантах реализации каждый нуклеозид области представляет собой 2'-F нуклеозид. В некоторых вариантах реализации каждый нуклеозид области представляет собой 2'-ОМе нуклеозид. В некоторых вариантах реализации каждый нуклеозид области представляет собой 2'-МОЕ нуклеозид. В некоторых вариантах реализации каждый нуклеозид области представляет собой cEt нуклеозид. В некоторых вариантах реализации каждый нуклеозид области представляет собой БНК нуклеозид. В некоторых вариантах реализации однообразная область составляет весь или, по существу, весь олигонуклеотид. В некоторых вариантах реализации эта область составляет весь олигонуклеотид, за исключением 1-4 концевых нуклеозидов.
В некоторых вариантах реализации изобретения олигонуклеотиды содержат одну или более областей чередующихся сахарных модификаций, при этом нуклеозиды, чередующиеся между нуклеотидами, имеют сахарную модификацию первого типа, а нуклеотиды имеют сахарную модификацию второго типа. В некоторых вариантах реализации нуклеозиды обоих типов представляют собой РНК-подобные нуклеозиды. В некоторых вариантах реализации чередующиеся нуклеозиды выбраны из: 2'-ОМе, 2'-F, 2'-МОЕ, БНК и cEt. В некоторых вариантах реализации чередующиеся модификации представляют собой 2'-F и 2'-ОМе. Такие области могут быть смежными или могут прерываться по-разному модифицированными нуклеозидами или конъюгированными нуклеозидами.
В некоторых вариантах реализации изобретения каждая чередующаяся область чередующихся модификаций состоит из одного нуклеозида (т.е. схема (АВ)xAy, где А представляет собой нуклеозид, имеющий сахарную модификацию первого типа, а В представляет собой нуклеозид, имеющий сахарную модификацию второго типа; х равен 1-20, и y равен 0 или 1). В некоторых вариантах реализации одна или более чередующихся областей в чередующемся мотиве содержит более одного нуклеозида определенного типа. Например, олигонуклеотиды могут содержать одну или более областей любого из следующих нуклеозидных мотивов:
ААВВАА;
АВВАВВ;
ААВААВ;
АВВАВААВВ;
АВАВАА;
ААВАВАВ;
АВАВАА;
АВВААВВАВАВАА;
ВАВВААВВАВАВАА; или
АВАВВААВВАВАВАА;
где А представляет собой нуклеозид первого типа, а В представляет собой нуклеозид второго типа. В некоторых вариантах реализации изобретения каждый А и В выбран из 2'-F, 2'-ОМе, БцНК и МОЕ.
В некоторых вариантах реализации изобретения олигонуклеотиды, имеющие такой чередующийся мотив, содержат также модифицированный 5'-концевой нуклеозид, такой как нуклеозид формулы IIc или IIe.
В некоторых вариантах реализации олигонуклеотиды содержат область, имеющую 2-2-3 мотив. Такие области содержат следующий мотив:
-(А)2-(В)х-(А)2-(С)y-(А)3-
где: А представляет собой первый тип модифицированного нуклеозида;
В и С представляют собой нуклеозиды, которые модифицированы иначе, чем А, однако В и С между собой могут иметь одинаковые или различные модификации,
х и y равны от 1 до 15.
В некоторых вариантах реализации изобретения А представляет собой 2'-ОМе модифицированный нуклеозид. В некоторых вариантах реализации оба В и С представляют собой 2'-F модифицированные нуклеозиды. В некоторых вариантах реализации А представляет собой 2'-ОМе модифицированный нуклеозид, а оба В и С представляют собой 2'-F модифицированные нуклеозиды.
В некоторых вариантах реализации изобретения олигонуклеотиды имеют следующий сахарный мотив:
5'-(Q)-(AB)xAy-(D)z
где:
Q представляет собой нуклеозид, содержащий стабилизированный фосфатный фрагмент. В некоторых вариантах реализации Q представляет собой нуклеозид. имеющий Формулу IIc или IIe;
А представляет собой первый тип модифицированного нуклеозида;
В представляет второй первый тип модифицированного нуклеозида;
D представляет собой модифицированный нуклеозид, содержащий другую модификацию, чем нуклеозид, расположенный рядом с ним. Следовательно, если y равен 0, то D должен быть модифицирован иначе, чем В, а если y равен 1, то D должен быть модифицирован иначе, чем А. В некоторых вариантах реализации D отличается и от А, и от В.
X равен 5-15;
Y равен 0 или 1;
Z равен 0-4.
В некоторых вариантах реализации изобретения олигонуклеотиды имеют следующий сахарный мотив:
5'-(Q)-(A)x-(D)z
где:
Q представляет собой нуклеозид, содержащий стабилизированный фосфатный фрагмент. В некоторых вариантах реализации Q представляет собой нуклеозид, имеющий Формулу IIc или IIe;
А представляет собой первый тип модифицированного нуклеозида;
D представляет собой модифицированный нуклеозид, содержащий модификацию, отличную от А.
X равен 11-30;
Z равен 0-4.
В некоторых вариантах реализации изобретения А, В, С и D в представленных выше мотивах выбраны из: 2'-OMe, 2'-F, 2'-МОЕ, БНК и cEt. В некоторых вариантах реализации D представляет собой концевые нуклеозиды. В некоторых вариантах реализации такие концевые нуклеозиды не предназначены для гибридизации с целевой нуклеиновой кислотой (хотя один или более могут гибридизоваться случайно). В некоторых вариантах реализации азотистое основание каждого нуклеозида D представляет собой аденин, независимо от тождественности азотистого основания в соответствующем положении целевой нуклеиновой кислоты В некоторых вариантах реализации азотистое основание каждого нуклеозида D представляет собой тимин.
В некоторых вариантах реализации изобретения антисмысловые соединения, включая те, которые особенно подходят для применения в качестве оцРНК, содержат модифицированные межнуклеозидные связи, расположенные вдоль олигонуклеотида или его области в определенном порядке или в мотиве модифицированной межнуклеозидной связи. В некоторых вариантах реализации олигонуклеотиды содержат область, имеющую чередующийся мотив межнуклеозидной связи. В некоторых вариантах реализации олигонуклеотиды содержат область, имеющую одинаково модифицированные межнуклеозидные связи. В некоторых таких вариантах реализации олигонуклеотид содержит область, которая единообразно связана тиофосфатными межнуклеозидными связями. В некоторых вариантах реализации олигонуклеотид единообразно связан тиофосфатными межнуклеозидными связями. В некоторых вариантах реализаций каждая межнуклеозидная связь олигонуклеотида выбрана из фосфодиэфира и тиофосфата. В некоторых вариантах реализации каждая межнуклеозидная связь олигонуклеотида выбрана из фосфодиэфира и тиофосфата, и по меньшей мере одна межнуклеозидная связь является тиофосфатной.
В некоторых вариантах реализации изобретения олигонуклеотид содержит по меньшей мере 6 тиофосфатных межнуклеозидных связей. В некоторых вариантах реализации изобретения олигонуклеотид содержит по меньшей мере 8 тиофосфатных межнуклеозидных связей. В некоторых вариантах реализации изобретения олигонуклеотид содержит по меньшей мере 10 тиофосфатных межнуклеозидных связей. В некоторых вариантах реализации олигонуклеотид содержит по меньшей мере один блок из по меньшей мере 6 последовательных тиофосфатных межнуклеозидных связей. В некоторых вариантах реализации олигонуклеотид содержит по меньшей мере один блок из по меньшей мере 8 последовательных тиофосфатных межнуклеозидных связей. В некоторых вариантах реализации олигонуклеотид содержит по меньшей мере один блок из по меньшей мере 10 последовательных тиофосфатных межнуклеозидных связей. В некоторых вариантах реализации олигонуклеотид содержит по меньшей мере один блок из по меньшей мере 12 последовательных тиофосфатных межнуклеозидных связей. В некоторых таких вариантах реализации по меньшей мере один такой блок расположен на 3'-конце олигонуклеотида. В некоторых таких вариантах реализации по меньшей мере один такой блок расположен в пределах 3 нуклеозидов от 3'-конца олигонуклеотида.
Олигонуклеотиды, имеющие любой из различных сахарных мотивов, описанных в настоящем документе, могут иметь любой связывающий мотив. Например, олигонуклеотиды, включая, но не ограничиваясь ими, описанные выше олигонуклеотиды, могут иметь связывающий мотив, выбранный из неограничивающей таблицы, представленной ниже:

ii. Соединения миРНК
В некоторых вариантах реализации изобретения антисмысловые соединения представляют собой двухцепочечные соединения РНКи (миРНК). В таких вариантах реализации одна или обе цепи могут содержать любой мотив модификации, описанный выше для оцРНК. В некоторых вариантах реализации соединения оцРНК могут быть ^модифицированными РНК. В некоторых вариантах реализации соединения миРНК могут содержать немодифицированные нуклеозиды РНК, но модифицированные межнуклеозидные связи.
Некоторые варианты реализации изобретения относятся к двухцепочечным композициям, в которых каждая цепь содержит мотив, определенный положением одного или более модифицированных или немодифицированных нуклеозидов. В некоторых вариантах реализации представлены композиции, содержащие первое и второе олигомерные соединения, которые являются полностью или по меньшей мере частично гибридизованными с образованием области дуплекса и дополнительно содержащие область, которая комплементарна и гибридизуется с целевой нуклеиновой кислотой. Целесообразно, если такая композиция содержит первое олигомерное соединение, которое представляет собой антисмысловую цепь, имеющую полную или частичную комплементарность целевой нуклеиновой кислоте, и второе олигомерное соединение, которое представляет собой смысловую цепь, имеющую одну или более областей комплементарности и образующую по меньшей мере одну область дуплекса с первым олигомерным соединением.
Композиции согласно некоторым вариантам реализации изобретения обеспечивают модулирование генной экспрессии путем гибридизации с целевой нуклеиновой кислотой, что приводит к потере ее обычной функции. В некоторых вариантах реализации целевая нуклеиновая кислота представляет собой АроCIII. В некоторых вариантах реализации изобретения разрушение целевой АроCIII облегчается активированным комплексом RISC, образованным с композициями согласно изобретению.
Некоторые варианты реализации изобретения относятся к двухцепочечным композициям, в которых одна из цепей пригодна, например, для воздействия на предпочтительное включение противоположной цепи в RISC (или расщепляемый) комплекс. Эти композиции подходят для целевого воздействия на выбранные молекулы нуклеиновых кислот и модулирования экспрессии одного или более генов. В некоторых вариантах реализации композиции согласно настоящему изобретению гибридизуются с частью целевой РНК, что приводит к потере нормальной функции целевой РНК.
Некоторые варианты реализации изобретения относятся к двухцепочечным композициям, в которых обе цепи содержат мотив гемимера, полностью модифицированный мотив, позиционно модифицированный мотив или чередующийся мотив. Каждая цепь композиций согласно настоящему изобретению может быть модифицирована, чтобы соответствовать конкретной роли, например, в каскаде миРНК. Применение различных мотивов в каждой цепи или одинаковых мотивов с различными химическими модификациями в каждой цепи обеспечивает возможность нацеленного внедрения антисмысловой цепи в комплекс RISC, одновременно ингибируя внедрение смысловой цепи. В рамках этой модели каждая цепь может быть независимо модифицирована для усиления ее конкретной роли. Антисмысловая цепь может быть модифицирована на 5'-конце для усиления ее роли в одной области RISC, тогда как 3'-конец может быть модифицирован иначе для усиления его роли в другой области RISC.
Молекулы двухцепочечных олигонуклеотидов могут быть молекулами двухцепочечных полинуклеотидов, содержащими самокомплементарные смысловые и антисмысловые области, причем антисмысловая область содержит последовательность нуклеотидов, которая комплементарна последовательности нуклеотидов в молекуле целевой нуклеиновой кислоты или ее части, а смысловая область имеет последовательность нуклеотидов, соответствующую последовательности целевой нуклеиновой кислоты или ее части. Молекулы двухцепочечных олигонуклеотидов могут быть собраны из двух отдельных олигонуклеотидов, где одна цепь представляет собой смысловую цепь, а другая представляет собой антисмысловую цепь, причем антисмысловая и смысловая цепи являются самокомплементарными (т.е. каждая цепь содержит последовательность нуклеотидов, которая комплементарна последовательности нуклеотидов в другой цепи; как если антисмысловая цепь и смысловая цепь образуют дуплекс или двухцепочечную структуру, например, в которой двухцепочечная область имеет от около 15 до около 30, например, около 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 пар оснований; антисмысловая цепь содержит последовательность нуклеотидов, которая комплементарна последовательности нуклеотидов в молекуле целевой нуклеиновой кислоты или ее части, а смысловая цепь содержит последовательность нуклеотидов, соответствующую последовательности целевой нуклеиновой кислоты или ее части (например, от около 15 до около 25 или более нуклеотидов молекулы двухцепочечного олигонуклеотида комплементарны целевой нуклеиновой кислоте или ее части). Альтернативно, двухцепочечный олигонуклеотид собран из одного олигонуклеотида, в котором самокомплементарные смысловые и антисмысловые области миРНК связаны при помощи линкера(-ов) на основе нуклеиновых кислот или не нуклеиновых кислот.
Двухцепочечный олигонуклеотид может быть полинуклеотидом с дуплексом, асимметричным дуплексом, шпилечной или асимметричной шпилечной вторичной структурой, имеющим самокомплементарные смысловые и антисмысловые области, причем антисмысловая область содержит последовательность нуклеотидов, которая комплементарна последовательности нуклеотидов в отдельной молекуле целевой нуклеиновой кислоты или ее части, а смысловая область имеет последовательность нуклеотидов, соответствующую последовательности целевой нуклеиновой кислоты или ее части. Двухцепочечный олигонуклеотид может быть кольцевым одноцепочечным полинуклеотидом, имеющим две или более петлевых структур и ствол, содержащий самокомплементарные смысловые и антисмысловые области, причем антисмысловая область содержит последовательность нуклеотидов, которая комплементарна последовательности нуклеотидов в молекуле целевой нуклеиновой кислоты или ее части, а смысловая область имеет последовательность нуклеотидов, соответствующую последовательности целевой нуклеиновой кислоты или ее части, и при этом кольцевой полинуклеотид может быть процессирован либо in vivo, либо in vitro с образованием активной молекулы миРНК, способной опосредовать РНКи.
В некоторых вариантах реализации изобретения двухцепочечный олигонуклеотид содержит отдельные смысловые и антисмысловые последовательности или области, причем смысловая и антисмысловая области ковалентно связаны нуклеотидными или ненуклеотидными линкерными молекулами, известными в данной области техники, или альтернативно нековалентно связаны ионными взаимодействиями, водородными связями, взаимодействиями Ван-дер-Вальса, гидрофобными взаимодействиями и/или стэкинг-взаимодействиями. В некоторых вариантах реализации двухцепочечный олигонуклеотид содержит последовательность нуклеотидов, которая комплементарна последовательности нуклеотидов гена-мишени. В другом варианте реализации двухцепочечный олигонуклеотид приводится в контакт с последовательностью нуклеотидов гена-мишени таким образом, что вызывает подавление экспрессии гена-мишени.
При использовании в настоящем документе двухцепочечные олигонуклеотиды не обязательно ограничены молекулами, содержащими только РНК, но дополнительно охватывают химически модифицированные нуклеотиды и ненуклеотиды. В некоторых вариантах реализации молекулы малой интерферирующей нуклеиновой кислоты не имеют нуклеотидов, содержащих 2'-гидрокси (2'-ОН). В некоторых вариантах реализации малые интерферирующие нуклеиновые кислоты необязательно не содержат никаких рибонуклеотидов (например, нуклеотидов, имеющих группу 2'-ОН). Однако такие двухцепочечные олигонуклеотиды, которые не требуют наличия рибонуклеотидов в молекуле для поддержания РНКи, могут иметь присоединенный линкер или линкеры, или другие присоединенные или ассоциированные группы, фрагменты или цепи, содержащие один или более нуклеотидов с группами 2'-ОН. Двухцепочечные олигонуклеотиды могут необязательно содержать рибонуклеотиды в примерно 5, 10, 20, 30, 40 или 50% нуклеотидных положениях. При использовании в настоящем документе термин миРНК является эквивалентом других терминов, используемых для описания молекул нуклеиновых кислот, которые могут опосредовать специфичные к последовательностям РНКи, например, малой интерферирующей РНК (миРНК), двухцепочечной РНК (дцРНК), микро-РНК (микроРНК), короткой шпилечной РНК (кшРНК), малого интерферирующего олигонуклеотида, малой интерферирующей нуклеиновой кислоты, малого интерферирующего модифицированного олигонуклеотида, химически модифицированной миРНК, подавляющей посттранскрипционный ген РНК (ptgsPHK), оцРНКи и других. Кроме того, при использовании в настоящем документе термин РНКи является эквивалентом других терминов, используемых для описания специфичной к последовательности РНК интерференции, таких как посттрансляционный сайленсинг гена, подавление трансляции или эпигенетика. Например, двухцепочечные олигонуклеотиды могут быть использованы для эпигенетического сайленсинга генов как на посттранскрипционном уровне, так и на предтранскрипционном уровне. В неограничивающем примере эпигенетическая регуляция генной экспрессии молекулами миРНК согласно настоящему изобретению может возникать из опосредованной миРНК модификации структуры хроматина или пути метилирования с изменением генной экспрессии (см., например, Verdel et al., 2004, Science, 303, 672-676; Pal-Bhadra et al., 2004, Science, 303, 669-672; Allshire, 2002, Science, 297, 1818-1819; Volpe et al., 2002, Science, 297, 1833-1837; Jenuwein, 2002, Science, 297, 2215-2218; и Hall et al., 2002, Science, 297, 2232-2237).
Предполагается, что соединения и композиции согласно некоторым вариантам реализации, представленным в настоящем документе, могут быть нацелены на АроCIII путем сайленсигна, опосредованного дцРНК или механизмом РНКи, включая, например, «шпилечные» или двухцепочечные молекулы эффектора РНК типа «петля на стебле», в которых одна цепь РНК с самокомплементарными последовательностями может принимать двухцепочечную конформацию, или молекулы эффектора дцРНК-дуплекса, содержащие две отдельные цепи РНК. В различных вариантах реализации изобретения дцРНК полностью состоит из рибонуклеотидов или состоит из смеси рибонуклеотидов и дезоксинуклеотидов, таких как гибриды РНК/ДНК, описанные, например, в WO 00/63364, зарегистрированном 19 апреля 2000, или в патенте США с серийным номером 60/130377, зарегистрированном 21 апреля 1999. Молекула дцРНК или эффектора дцРНК может быть одной молекулой с областью самокомплементарности, так что нуклеотиды в одном сегменте молекулы спариваются основаниями с нуклеотидами в другом сегменте молекулы. В различных вариантах реализации изобретения дцРНК, которая состоит из одной молекулы, полностью состоит из рибонуклеотидов или содержит область рибонуклеотидов, которая комплементарна области дезоксирибонуклеотидов. Альтернативно, дцРНК может содержать две различные цепи, которые имеют область комплементарности друг другу.
В различных вариантах реализации изобретения обе цепи полностью состоят из рибонуклеотидов, одна цепь полностью состоит из рибонуклеотидов, и одна цепь полностью состоит из дезоксирибонуклеотидов, или одна или обе цепи содержат смесь рибонуклеотидов и дезоксирибонуклеотидов. В некоторых вариантах реализации области комплементарности по меньшей мере на 70, 80, 90, 95, 98 или на 100% комплементарны друг другу и последовательности целевой нуклеиновой кислоты. В некоторых вариантах реализации область дцРНК, которая содержится в двухцепочечной конформации, содержит по меньшей мере 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 50, 75, 100, 200, 500, 1000, 2000 или 5000 нуклеотидов или содержит все нуклеотиды в кДНК или другой последовательности целевой нуклеиновой кислоты, представленной в дцРНК. В некоторых вариантах реализации дцРНК не содержит ни одной одноцепочечной области, таких как одноцепочечные концы, или дцРНК представляет собой шпильку. В других вариантах реализации изобретения дцРНК имеет одну или более одноцепочечных областей или выступов. В некоторых вариантах реализации гибриды РНК/ДНК содержат цепь или область ДНК, которая представляет собой антисмысловую цепь или область (например, имеет по меньшей мере 70, 80, 90, 95, 98 или 100% комплементарность целевой нуклеиновой кислоте), а цепь или область РНК, которая представляет собой смысловую цепь или область (например, имеет по меньшей мере 70, 80, 90, 95, 98 или 100% идентичность с целевой нуклеиновой кислотой), и наоборот.
В различных вариантах реализации изобретения гибрид РНК/ДНК получен in vitro при помощи ферментативных или химических способов синтеза, таких как описаны в настоящем документе или описаны и WO 00/63364, зарегистрированном 19 апреля 2000, или в патенте США с серийным номером 60/130377, зарегистрированном 21 апреля 1999. В других вариантах реализации цепь ДНК, синтезированная in vitro, связана в комплекс с цепью РНК, полученной in vivo или in vitro, до, после или одновременно с трансформацией цепи ДНК в клетку. В других вариантах реализации дцРНК представляет собой одну кольцевую нуклеиновую кислоту, содержащую смысловую и антисмысловую область, или дцРНК содержит кольцевую нуклеиновую кислоту и либо вторую кольцевую нуклеиновую кислоту, либо линейную нуклеиновую кислоту (см., например, WO 00/63364, зарегистрированный 19 апреля 2000, или патент США с серийным номером 60/130377, зарегистрированный 21 апреля 1999). Иллюстративные кольцевые нуклеиновые кислоты включают структуры типа «лассо», в которых свободная 5'-фосфорильная группа нуклеотида становится связанной с 2'-гидроксильной группой другого нуклеотида путем закольцовывания.
В других вариантах реализации изобретения дцРНК содержит один или более модифицированных нуклеотидов, в которых сахар в 2'-положении содержит галоген (такой как фтор-группа или содержит алкокси-группу (такую как метокси-группа), что увеличивает время полувыведения дцРНК in vitro или in vivo, по сравнению с соответствующей дцРНК, в которой в соответствующем 2'-положении содержится водород или гидроксильная группа. В других вариантах реализации дцРНК содержит одну или более связей между соседними нуклеотидами, которые отличны от природной фосфодиэфирной связи. Примеры таких связей включают фосфорамидные, тиофосфатные и дитиофосфатные связи. дцРНК также могут быть химически модифицированными молекулами нуклеиновых кислот, описанными в патенте США №6673661. В других вариантах реализации дцРНК содержит одну или две кэпированные цепи, как описано, например, в WO 00/63364, зарегистрированной 19 апреля 2000, или в патенте США с серийным №60/130377, зарегистрированном 21 апреля 1999.
В других вариантах реализации дцРНК может быть любой из по меньшей мере частичных дцРНК молекул, описанных в WO 00/63364, а также любой из молекул дцРНК, описанных в предварительной заявке на патент США 60/399998; и в предварительной заявке на патент США 60/419532, и PCT/US2003/033466, описание которых включено в настоящий документ посредством ссылки. Любая из дцРНК может быть экспрессирована in vitro или in vivo при помощи способов, описанных в настоящем документе, или при помощи стандартных способов, таких как описаны в WO 00/63364.
Композиции и способы составления фармацевтических композиций
Антисмысловые соединения могут быть смешаны с фармацевтически приемлемыми активными или инертными веществами для получения фармацевтических композиций или рецептур. Композиции и способы составления фармацевтических композиций зависят от ряда критериев, включая, но не ограничиваясь ими, способ введения, тяжесть заболевания или дозу, подлежащую введению.
Антисмысловые соединения, нацеленные на нуклеиновую кислоту АроCIII, могут быть использованы в фармацевтических композициях путем смешивания антисмыслового соединения с подходящим фармацевтически приемлемым разбавителем или носителем.
В некоторых вариантах реализации изобретения «фармацевтический носитель» или «вспомогательное вещество» представляет собой фармацевтически приемлемый разбавитель, суспендирующий агент или любой другой фармацевтически приемлемый инертный носитель для доставки одной или более нуклеиновых кислот животному. Вспомогательное вещество может быть жидким или твердым и может быть выбрано с учетом запланированного способа введения так, чтобы обеспечивать желаемую плотность, консистенцию и т.д. при смешивании с нуклеиновой кислотой и другими компонентами данной фармацевтической композиции. Типичные фармацевтические носители включают, но не ограничиваются ими, связующие агент (например, желатинированный маисовый крахмал, поливинилпирролидон или гидроксипропилцеллюлозу и т.д.); наполнители (например, лактозу и другие сахара, микрокристаллическую целлюлозу, пектин, желатин, сульфат кальция, этилцеллюлозу, полиакрилаты или гидрофосфат кальция и т.д.); смазывающие вещества (например, стеарат магния, тальк, диоксид кремния, коллоидный диоксид кремния, стеариновую кислоту, стеараты металлов, гидрированные растительные масла, кукурузный крахмал, полиэтиленгликоли, бензоат натрия, ацетат натрия и т.д.); разрыхлители (например, крахмал, крахмалгликолят натрия и т.д.); и смачивающие агенты (например, лаурилсульфат натрия и т.д.).
Фармацевтически приемлемые органические или неорганические вспомогательные вещества, которые не реагируют неблагоприятным образом с нуклеиновыми кислотами, подходящие для парентерального или непарентерального введения, также могут быть использованы для составления композиций согласно настоящему изобретению. Подходящие фармацевтически приемлемые носители включают, но не ограничиваются ими, воду, солевые растворы, спирты, полиэтиленгликоли, желатин, лактозу, амилозу, стеарат магния, тальк, кремниевую кислоту, вязкий парафин, гидроксиметилцеллюлозу, поливинилпирролидон и т.п.
Фармацевтически приемлемый разбавитель включает фосфатно-солевой буферный раствор (PBS). PBS представляет собой разбавитель, пригодный для применения в композициях, доставляемых парентерально. Соответственно, в одном из вариантов реализации изобретения, используемом в способах, описанных в настоящем документе, представлена фармацевтическая композиция, содержащая антисмысловое соединение, направленное на нуклеиновую кислоту АроCIII, и фармацевтически приемлемый разбавитель. В некоторых вариантах реализации фармацевтически приемлемый разбавитель представляет собой PBS. В некоторых вариантах реализации антисмысловое соединение представляет собой антисмысловой олигонуклеотид.
Фармацевтические композиции, содержащие антисмысловые соединения, охватывают любые фармацевтически приемлемые соли, сложные эфиры или соли таких сложных эфиров, или олигонуклеотид, который, при введении животному, включая человека, может обеспечивать (прямо или косвенно) биологически активный метаболит или его остаток. Соответственно, например, настоящее описание относится также к фармацевтически приемлемым солям антисмысловых соединений, пролекарствам, фармацевтически приемлемым солям таких пролекарств и другим биоэквивалентам. Применимые фармацевтически приемлемые соли включают, но не ограничиваются ими, соли натрия и калия.
Пролекарство может включать внедрение дополнительных нуклеозидов с одного или с обоих концов антисмыслового соединения, которые расщепляются под действием эндогенных нуклеаз в организме, с образованием активного антисмыслового соединения.
Конъюгированные антисмысловые соединения
Антисмысловые соединения могут быть ковалентно связаны с одним или более фрагментами или конъюгатами, которые усиливают активность, клеточное распределение или клеточное поглощение образующихся антисмысловых олигонуклеотидов. Типичные конъюгирующие группы включают холестериновые фрагменты и жировые фрагменты. Дополнительные конъюгирующие группы включают углеводы, фосфолипиды, биотин, феназин, фолат, фенантридин, антрахинон, акридин, флуоресцеины, родамины, кумарины и красители.
Антисмысловые соединения также могут быть модифицированы для получения одной или нескольких стабилизирующих групп, которые обычно присоединяются к одному или к обоим концам антисмысловых соединений для усиления свойств, таких как, например, устойчивость к действию нуклеаз. В стабилизирующие группы включены кэп-структуры. Эти концевые модификации защищают антисмысловое соединение от экзонуклеазного расщепления, и могут способствовать доставке и/или локализации в клетке. Кэп может присутствовать на 5'-конце (5'-кэп) или на 3'-конце (3'-кэп), или может присутствовать на обоих концах. Кэп-структуры хорошо известны в данной области и включают, например, инвертированные дезокси-кэпы с удаленными азотистыми основаниями. Дополнительные 3' и 5'-стабилизирующие группы, которые могут быть использованы для закрывания одного или обоих концов антисмыслового соединения, чтобы обеспечить устойчивость к действию нуклеаз, включают группы, описанные в WO 03/004602, опубликованной 16 января 2003.
Клеточная культура и обработка антисмысловыми соединениями
Влияние антисмысловых соединений на уровень, активность или экспрессию нуклеиновых кислот или белков АроCIII может быть испытана in vitro в различных типах клеток. Типы клеток, используемых для таких анализов, имеются в продаже у коммерческих поставщиков (например, American Type Culture Collection, Манассас, штат Вирджиния; Zen-Bio, Inc., Research Triangle Park, штат Северная Калифорния; Clonetics Corporation, Волкервилл, штат Мэриленд), и эти клетки выращивают в соответствии с инструкциями поставщика с использованием имеющихся в продаже реактивов (например, Invitrogen Life Technologies, Карлсбад, штат Калифорния). Иллюстративные клеточные типы включают, но не ограничиваются ими, клетки HepG2, клетки Нер3В, клетки Huh7 (гепатоцеллюлярная карцинома), первичные гепатоциты, клетки А549, фибробласты GM04281 и клетки LLC-MK2.
In vitro испытание антисмысловых олигонуклеотидов
В настоящем документе описаны способы обработки клеток антисмысловыми олигонуклеотидами, которые могут быть модифицированы соответствующим образом для обработки другими антисмысловыми соединениями.
В общем, клетки могут быть обработаны антисмысловыми олигонуклеотидами, когда клетки достигают примерно 60-80% слияния в культуре.
Один из реагентов, которые обычно используют для внедрения антисмысловых олигонуклеотидов в выращиваемые клетки, включает катионный липидный реагент трансфекции LIPOFECTIN® (Invitrogen, Карлсбад, штат Калифорния). Антисмысловые олигонуклеотиды могут быть смешаны с LIPOFECTIN® в среде OPTI-MEM® 1 (Invitrogen, Карлсбад, штат Калифорния) для достижения желаемой конечной концентрации антисмыслового олигонуклеотида и концентрации LIPOFECTIN®, которая обычно находится в диапазоне от 2 до 12 мкг/мл на 100 нМ антисмыслового олигонуклеотида.
Другой реагент, используемый для внедрения антисмысловых олигонуклеотидов в выращиваемые клетки, включает LIPOFECTAMINE 2000® (Invitrogen, Карлсбад, штат Калифорния). Антисмысловой олигонуклеотид смешивают с LIPOFECTAMINE 2000® в среде OPTI-MEM® 1 с пониженным содержанием сыворотки (Invitrogen, Карлсбад, штат Калифорния) для достижения желаемой концентрации антисмыслового олигонуклеотида и концентрации LIPOFECTAMINE®, которая обычно находится в диапазоне от 2 до 12 мкг/мл на 100 нМ антисмыслового олигонуклеотида.
Другой реагент, используемый для внедрения антисмысловых олигонуклеотидов в выращиваемые клетки, включает Cytofectin® (Invitrogen, Карлсбад, штат Калифорния). Антисмысловой олигонуклеотид смешивают с Cytofectin® в среде OPTI-MEM® 1 с пониженным содержанием сыворотки (Invitrogen, Карлсбад, штат Калифорния) для достижения желаемой концентрации антисмыслового олигонуклеотида и концентрации Cytofectin®, которая обычно находится в диапазоне от 2 до 12 мкг/мл на 100 нМ антисмыслового олигонуклеотида.
Другой реагент, используемый для введения антисмысловых олигонуклеотидов в выращиваемые клетки, включает Oligofectamine™ (Invitrogen Life Technologies, Карлсбад, штат Калифорния). Антисмысловой олигонуклеотид смешивают с Oligofectamine™ в среде Opti-MEM™-l с пониженным содержанием сыворотки (Invitrogen Life Technologies, Карлсбад, штат Калифорния) для достижения желаемой концентрации олигонуклеотида с соотношением Oligofectamine™ к олигонуклеотиду, составляющим приблизительно от 0,2 до 0,8 мкл на 100 нМ.
Другой реагент, используемый для внедрения антисмысловых олигонуклеотидов в выращиваемые клетки, включает FuGENE 6 (Roche Diagnostics Corp., Индианаполис, штат Индиана). Антисмысловое олигомерное соединение смешивают с FuGENE 6 с 1 мл не содержащей сыворотки среды RPMI для достижения желаемой концентрации олигонуклеотида с соотношением FuGENE 6 к олигомерному соединению, составляющим от 1 до 4 мкл FuGENE 6 на 100 нМ.
Другая методика, используемая для внедрения антисмысловых олигонуклеотидов в выращиваемые клетки, включает электропорацию (Sambrook и Russell в Molecular Cloning. A Laboratory Manual. Третье издание. Cold Spring Harbor Laboratory Press, Колд Спринг Харбор, штат Нью-Йорк. 2001).
Клетки обрабатывают антисмысловыми олигонуклеотидами стандартами способами. Клетки обычно собирают спустя 16-24 часа после обработки антисмысловым олигонуклеотидов, и в это время измеряют уровни РНК или белка целевых нуклеиновых кислот по способам, известным в данной области техники и описанным в настоящем документе (Sambrook и Russell в Molecular Cloning. A Laboratory Manual. Третье издание. Cold Spring Harbor Laboratory Press, Колд Спринг Харбор, штат Нью-Йорк. 2001). Как правило, при выполнении обработки в нескольких экземплярах, данные представляют как среднее значение многократных обработок.
Используемая концентрация антисмыслового олигонуклеотида варьируется от одной клеточной линии к другой. Способы определения оптимальной концентрации антисмыслового олигонуклеотида для конкретной клеточной линии хорошо известны в данной области техники (Sambrook и Russell в Molecular Cloning. A Laboratory Manual. Третье издание. Cold Spring Harbor Laboratory Press, Колд Спринг Харбор, штат Нью-Йорк. 2001). Антисмысловые олигонуклеотиды обычно используют в концентрациях, варьирующихся от 1 нМ до 300 нМ, при трансфекции с LIPOFECTAMINE2000® (Invitrogen, Карлсбад, штат Калифорния), Lipofectin® (Invitrogen, Карлсбад, штат Калифорния) или Cytofectin™ (Genlantis, Санд-Диего, штат Калифорния). При трансфекции при помощи электропорации антисмысловые олигонуклеотиды используют в более высоких концентрациях, от 625 до 20000 нМ.
Выделение РНК
Анализ РНК может быть выполнен на общей клеточной РНК или поли(А)+ мРНК. Способы выделения РНК общеизвестны в данной области техники (Sambrook и Russell в Molecular Cloning. A Laboratory Manual. Третье издание. Cold Spring Harbor Laboratory Press, Колд Спринг Харбор, штат Нью-Йорк. 2001). РНК получают по способам, общеизвестным в данной области техники, например, при помощи реагента TRIZOL® (Invitrogen, Карлсбад, штат Калифорния) по рекомендованным протоколам производителя.
Анализ ингибирования уровней или экспрессии мишени
Ингибирование уровней или экспрессии нуклеиновой кислоты АроCIII можно анализировать различными способами, известными в данной области техники (Sambrook и Russell в Molecular Cloning. A Laboratory Manual. Третье издание. Cold Spring Harbor Laboratory Press, Колд Спринг Харбор, штат Нью-Йорк. 2001). Например, уровни целевой нуклеиновой кислоты могут быть количественно определены, например, нозерн-блоттингом, конкурирующей полимеразной цепной реакцией (ПЦР) или количественной ПЦР в реальном времени. Анализ РНК может быть выполнен на общей клеточной РНК или поли(А)+ мРНК. Способы выделения РНК хорошо известны в данной области. Нозерн-блоттинг также является стандартным в данной области. Количественная ПЦР в реальном времени может быть легко осуществлена при помощи имеющейся в продаже системы обнаружения последовательностей ABI PRISM® 7600, 7700 или 7900 производства PE-Applied Biosystems, Фостер-сити, штат Калифорния, которую используют в соответствии с инструкциями производителя.
Количественный анализ ПЦР в реальном времени уровней целевой РНК
Количественное определение уровней целевой РНК может быть осуществлено количественной ПЦР в реальном времени с использованием системы обнаружения последовательностей ABI PRISM® 7600, 7700 или 7900 (PE-Applied Biosystems, Фостер-сити, штат Калифорния) по инструкциям производителя. Способы количественной ПЦР в реальном времени хорошо известны в данной области техники.
Перед ПЦР в реальном времени выделенную РНК подвергают реакции с обратной транскриптазой (RT), в результате чего образуется комплементарная ДНК (кДНК), которую затем используют как субстрат для амплификации ПЦР в реальном времени. Реакции RT и ПЦР в реальном времени выполняют последовательно в одной и той же лунке с образцом. Реактивы для RT и ПЦР в реальном времени приобретают у компании Invitrogen (Карлсбад, штат Калифорния). Реакции RT и ПЦР в реальном времени выполняют по способам, хорошо известным специалистам в данной области.
Количества гена-мишени (или целевой РНК), полученные при помощи ПЦР в реальном времени, могут быть нормализованы с использованием либо уровня экспрессии гена, экспрессия которого является постоянной, такого как циклофилин А, либо количественным определением общей РНК с помощью RIBOGREEN® (Invitrogen Inc., Карлсбад, штат Калифорния). Экспрессию циклофилина А количественно определяют при помощи ПЦР в реальном времени, которую осуществляют одновременно с мишенью, поочередно или отдельно. Общую РНК количественно определяют с использованием реагента для количественного определения РНК RIBOGREEN® (Invitrogen Inc., Карлсбад, штат Калифорния). Способы количественного определения РНК при помощи RIBOGREEN® описаны в публикации Jones, L.J., et al (Analytical Biochemistry, 1998, 265, 368-374). Для измерения флуоресценции RIBOGREEN® используют прибор CYTOFLUOR® 4000 (РЕ Applied Biosystems, Фостер-сити, штат Калифорния).
Зонды и праймеры предназначены для гибридизации с нуклеиновой кислотой АроCIII. Способы разработки зондов и праймеров для ПЦР в реальном времени хорошо известны в данной области, и могут включать применение программного обеспечения, такого как программа PRIMER EXPRESS® (Applied Biosystems, Фостер-сити, штат Калифорния).
Количества гена-мишени, полученные при помощи RT, ПЦР в реальном времени, могут быть определены либо с помощью уровня экспрессии ГАФДГ или циклофилина А, экспрессия генов которых является постоянной, либо с помощью количественного определения общей РНК с применением RiboGreenTM (Molecular Probes, Inc., Юджин, штат Орегон). Экспрессия ГАФДГ или циклофилина А может быть количественно определена при помощи RT, ПЦР в реальном времени, которую осуществляют одновременно с мишенью, поочередно или отдельно. Общую РНК количественно определяют с использованием реагента для количественного определения РНК RiboGreen™ (Molecular Probes, Inc., Юджин, штат Орегон).
Анализ уровней белка
Антисмысловое ингибирование нуклеиновых кислот АроCIII может быть определено измерением уровней белка АроCIII. Уровни белка АроCIII могут быть оценены или количественно определены различными способами, хорошо известными в данной области, такими как иммунопреципитация, вестерн-блоттинг (иммуноблоттинг), иммуноферментный твердофазный анализ (ELISA), количественные анализы белка, анализы активности белка (например, анализы активности каспазы), иммуногистохимия, иммуноцитохимия или сортировка флуоресцентно-активированных клеток (FACS) (Sambrook и Russell в Molecular Cloning. A Laboratory Manual. Третье издание. Cold Spring Harbor Laboratory Press, Колд Спринг Харбор, штат Нью-Йорк. 2001). Антитела, нацеленные на мишень, могут быть идентифицированы и получены из различных источников, таких как каталог антител MSRS (Aerie Corporation, Бирмингем, штат Мичиган), или могут быть получены стандартными способами получения моноклональных или поликлональных антител, хорошо известными в данной области. Антитела, подходящие для обнаружения человеческого и мышиного АроCIII, имеются в продаже.
In vivo исследование антисмысловых соединений
Антисмысловые соединения, например, антисмысловые олигониклеогиды испытывают на животных для оценки их способности подавлять экспрессию АроCIII и вызывать фенотипические изменения. Испытание может быть выполнено на нормальных животных или в экспериментальных моделях заболеваний. Для введения животным антисмысловые олигонуклеотиды составляют в композицию в фармацевтически приемлемом разбавителе, таком как фосфатно-солевой буферный раствор. Введение включает парентеральные способы введения. Расчет дозы антисмыслового олигонуклеотида и частоты введения доз зависит от таких факторов, как способ введения и масса тела животного. После периода лечения антисмысловыми олигонуклеотидами РНК выделяют из ткани и измеряют изменения экспрессии нуклеиновой кислоты АроCIII. Измеряют также изменения уровней белка АроCIII.
Некоторые показания
В настоящем документе идентифицировано и описано новое действие ингибирование АроCIII у пациентов с дислипидемией Фредриксона I типа, FCS, LPLD. В примере, представленном ниже, описано неожиданное снижение TG и повышение HDL среди других биомаркеров у пациентов с дислипидемией Фредриксона I типа, FCS, LPLD, у которых активность LPL мала или не обнаружена.
Не ограничиваясь какой-либо конкретной теорией, рассмотрены два возможных объяснения неожиданных результатов. Во-первых, ингибирование АроCIII может активировать остаточную активность LPL в пациентов с дислипидемией Фредриксона I типа, FCS, LPLD. Это не очень вероятное объяснение, поскольку у этих пациентов активность LPL является небольшой или необнаруживаемой, тогда как ингибирование АроCIII сильно изменяет уровни TG и HDL. Во-вторых, и наиболее вероятно, что АроCIII подавляет клиренс частиц TG, опосредованный ароЕ-опосредованными рецепторами, такими как белок, связанный с рецептором липопротеина низкой плотности 1 (LRP1) или синдекан 1. При удалении АроCIII из частиц VLDL и хиломикрона они становятся более доступными для поглощения печенью. Действительно, эти опосредованные рецепторами механизмы клиренса могут значительно усиливать клинически наблюдаемый фенотип (например, значительное снижение TG), наблюдаемый у пациентов с дислипидемией Фредриксона I типа, FCS, LPLD, проходивших лечение ингибитором АроCIII.
В некоторых вариантах реализации изобретения в настоящем документе представлены способы лечения субъекта с дислипидемией Фредриксона I типа, FCS LPLD, включающие введение одной или более фармацевтических композиций, описанных в настоящем документе. В некоторых вариантах реализации фармацевтическая композиция содержит антисмысловое соединение, нацеленное на АроCIII.
В некоторых вариантах реализации изобретения введение антисмыслового соединения, нацеленного на нуклеиновую кислоту АроCIII, субъекту с дислипидемией Фредриксона I типа, FCS, LPLD приводит к снижению экспрессии АроCIII по меньшей мере на 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 99%, или в диапазоне, определенном двумя из этих значений. В некоторых вариантах реализации экспрессия АроCIII снижается до ≤50 мг/л, ≤60 мг/л, ≤70 мг/л, ≤80 мг/л, ≤90 мг/л, ≤100 мг/л, ≤110 мг/л, ≤120 мг/л, ≤130 мг/л, ≤140 мг/л, ≤150 мг/л, ≤160 мг/л, ≤170 мг/л, ≤180 мг/л, ≤190 мг/л или ≤200 мг/л.
В некоторых вариантах реализации изобретения субъект страдает от заболевания или расстройства, связанного с дислипидемией Фредриксона I типа, FCS, LPLD. В некоторых вариантах реализации заболевание или расстройство представляет собой сердечно-сосудистое или метаболическое заболевание или расстройство. В некоторых вариантах реализации заболевание представляет собой панкреатит.
В некоторых вариантах реализации изобретения сердечно-сосудистое заболевание включает, но не ограничивается ими, аневризму, стенокардию, аритмию, атеросклероз, цереброваскулярное заболевание, коронарную болезнь сердца, гипертонию, дислипидемию, гиперлипидемию, гипертриглицеридемию, гиперхолестеринемию, инсульт и т.п. В некоторых вариантах реализации дислипидемия представляет собой хиломикронемию (например, FCS) или гипертриглицеридемию. В некоторых вариантах реализации заболевание представляет собой панкреатит, обусловленный дислипидемией.
В некоторых вариантах реализации метаболическое заболевание или расстройство включает, но не ограничивается ими, гиперглицемию, преддиабет, диабет (типа I и типа II), ожирение, инсулинорезистентность, метаболический синдром и диабетическую дислипидемию.
В некоторых вариантах реализации изобретения соединения, нацеленные на АроCIII, как описано в настоящем документе, модулируют физиологические маркеры или фенотипы панкреатита, сердечно-сосудистого или метаболического заболевания или расстройства у субъекта с дислипидемией Фредриксона I типа, FCS, LPLD. В некоторых экспериментах эти соединения могут увеличивать или снижать физиологические маркеры или фенотипы, по сравнению с животными, не проходившими лечение. В некоторых вариантах реализации увеличение или снижение физиологических маркеров или фенотипов связано с ингибированием АроCIII соединениями, описанными в настоящем документе.
В некоторых вариантах реализации изобретения физиологические маркеры или фенотип сердечно-сосудистого заболевания или расстройства могут быть определены количественно. Например, уровни TG или HDL могут быть измерены и количественно определены, например, стандартными тестами на липиды. В некоторых вариантах реализации физиологические маркеры или фенотипы, такие как HDL, могут быть увеличены на около 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 99%, или на значение в диапазоне между любыми двумя из указанных значений. В некоторых вариантах реализации физиологические маркеры фенотипа, такие как TG (постпрадниальные или натощак), могут быть снижены на около 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 99%, или на значение в диапазоне между любыми двумя из указанных значений. В некоторых вариантах реализации изобретения TG (постпрандиальные или натощак) снижаются до ≤100 мг/дл, ≤110 мг/дл, ≤120 мг/дл, ≤130 мг/дл, ≤140 мг/дл, ≤150 мг/дл, ≤160 мг/дл, ≤170 мг/дл, ≤180 мг/дл, ≤190 мг/дл, ≤200 мг/дл, ≤210 мг/дл, ≤220 мг/дл, ≤230 мг/дл, ≤240 мг/дл, ≤250 мг/дл, ≤260 мг/дл, ≤270 мг/дл, ≤280 мг/дл, ≤290 мг/дл, ≤300 мг/дл, ≤350 мг/дл, ≤400 мг/дл, ≤450 мг/дл, ≤500 мг/дл, ≤550 мг/дл, ≤600 мг/дл, ≤650 мг/дл, ≤700 мг/дл, ≤750 мг/дл, ≤800 мг/дл, ≤850 мг/дл, ≤900 мг/дл, ≤950 мг/дл, ≤1000 мг/дл, ≤1100 мг/дл, ≤1200 мг/дл, ≤1300 мг/дл, ≤1400 мг/дл, ≤1500 мг/дл, ≤1600 мг/дл, ≤1700 мг/дл, ≤1800 мг/дл или ≤1900 мг/дл.
В некоторых вариантах реализации изобретения физиологические маркеры или фенотипы метаболического заболевания или расстройства могут быть определены количественно. Например, уровни глюкозы или инсулинорезистентность могут быть измерены и количественно определены стандартными тестами, известными в данной области техники. В некоторых вариантах реализации физиологические маркеры или фенотипы, такие как уровни глюкозы или инсулинорезистентность, могут быть снижены на около 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 99%, или на значение в диапазоне между любыми двумя из указанных значений. В некоторых вариантах реализации физиологические маркеры фенотипов, такие как инсулинорезистентность, могут быть повышены на около 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 99%, или на значение в диапазоне между любыми двумя из указанных значений.
В настоящем документе представлены также способы предупреждения, лечения или облегчения симптома, связанного с заболеванием или расстройством, у субъекта с дислипидемией Фредриксона I типа, FCS, LPLD, при помощи соединения, описанного в настоящем документе. В некоторых вариантах реализации в настоящем документе представлен способ снижения скорости возникновения симптома, ассоциированного с заболеванием, связанным с дислипидемией Фредриксона I типа, FCS, LPLD. В некоторых вариантах реализации представлен способ снижения тяжести симптома, связанного с дислипидемией Фредриксона I типа, FCS, LPLD. В таких вариантах реализации указанные способы включают введение индивидууму с дислипидемией Фредриксона I типа терапевтически эффективного количества соединения, нацеленного на нуклеиновую кислоту АроCIII. В некоторых вариантах реализации заболевание или расстройстве представляет собой панкреатит или сердечно-сосудистое, или метаболическое заболевание или расстройство.
Сердечно-сосудистые заболевания или расстройства характеризуются множеством физических симптомов. Любой симптом, известный специалистам в данной области техники как связанный с сердечно-сосудистым заболеванием, можно предупреждать, лечить, облегчать или иным образом изменять, как указано в описанных выше способах. В некоторых вариантах реализации симптом быть любым из, но не ограничивается ими, стенокардии, боли в груди, одышки, учащенного сердцебиения, слабости, головокружения, тошноты, потоотделения, тахикардии, брадикардии, аритмии, мерцательной аритмии, опухания нижних конечностей, цианоза, усталости, обморока, онемения лица, онемения конечностей, хромоты или судорог мышц, вздутия живота или лихорадки.
Метаболические заболевания или расстройства характеризуются множеством физических симптомов. Любой симптом, известный специалистам в данной области техники как связанный с метаболическим заболеванием, можно предупреждать, лечить, облегчать или иным образом изменять, как указано в описанных выше способах. В некоторых вариантах реализации симптом может быть любым из, но не ограничивается ими, избыточного выделения мочи (полиурии), избыточной жажды и повышенного потребления жидкости (полидипсии), расплывчатого зрения, необъяснимой потери веса и летаргии.
Панкреатит характеризуется множеством физических симптомов. Любой симптом, известный специалистам в данной области техники как связанный с панкреатитом, можно предупреждать, лечить, облегчать или иным образом изменять, как указано в описанных выше способах. В некоторых вариантах реализации изобретения симптом может быть любым из, но не ограничивается ими, боли в животе, рвоты, тошноты и чувствительностью области живота к надавливанию.
В некоторых вариантах реализации изобретения представлены способы лечения субъекта с дислипидемией Фредриксона I типа, FCS, LPLD, включающие введение терапевтически эффективного количества одной или более фармацевтических композиций, описанных в настоящем документе. В некоторых вариантах реализации введение терапевтически эффективного количества антисмыслового соединения, нацеленного на нуклеиновую кислоту АроCIII, осуществляют путем контролирования уровней АроCIII или маркеров заболевания, связанных с дислипидемией Фредриксона I типа, FCS, LPLD, для определения реакции субъекта на антисмысловое соединение. Реакцию субъекта на введение антисмыслового соединения врач использует для определения количества и продолжительности терапевтического вмешательства.
В некоторых вариантах реализации изобретения фармацевтические композиции, содержащие антисмысловое соединение, нацеленное на АроCIII, используют для получения лекарственного средства для лечения субъекта с дислипидемией Фредриксона I типа, FCS, LPLD.
Введение
Соединения или фармацевтические композиции согласно настоящему изобретению могут быть введены многочисленными способами, в зависимости от необходимости локального или системного лечения, а также от области, подлежащей лечению. Введение может быть пероральным или парентеральным.
В некоторых вариантах реализации изобретения соединения и композиции, описанные в настоящем документе, вводят парентерально. Парентеральное введение включает внутривенную, внутриартериальную, подкожную, внутрибрюшинную или внутримышечную инъекцию или инфузию.
В некоторых вариантах реализации парентеральное введение осуществляют инфузией. Инфузия может быть хронической или непрерывной, или кратковременной, или периодическим. В некоторых вариантах реализации вводимые инфузией фармацевтические агенты доставляют при помощи насоса. В некоторых вариантах реализации инфузия является внутривенной.
В некоторых вариантах реализации парентеральное введение осуществляют инъекцией. Инъекция может быть доставлена при помощи шприца или насоса. В некоторых вариантах реализации инъекция представляет собой болюсную инъекцию. В некоторых вариантах реализации инъекцию вводят непосредственно в ткань или орган. В некоторых вариантах реализации парентеральное введение является подкожным.
В некоторых вариантах реализации изобретения композиции для парентерального введения могут содержать стерильные водные растворы, которые также могут содержать буферы, разбавители и другие подходящие добавки, такие как, но не ограничиваясь ими, усилители проницаемости, соединения носителей и другие фармацевтически приемлемые носители или вспомогательные вещества.
В некоторых вариантах реализации композиции для перорального введения соединений или композиций согласно изобретению могут содержать, но не ограничиваясь ими, фармацевтические носители, вспомогательные вещества, порошки или гранулы, микрочастицы, наночастицы, суспензии или растворы в водной или неводной среде, капсулы, желатиновые капсулы, саше, таблетки или минитаблетки. Могут быть желательными загустители, ароматизаторы, разбавители, эмульгаторы, диспергирующие добавки или связующие вещества. В некоторых вариантах реализации изобретения пероральные композиции представляют собой композиции, в которых соединения согласно изобретению вводят вместе с одним или более усилителями проницаемости, поверхностно-активными веществами и комплексонами.
Введение доз
В некоторых вариантах реализации изобретения фармацевтические композиции вводят в соответствии со схемой применения (например, дозой, частотой и продолжительностью введения доз), причем схема применения может быть выбрана для достижения желаемого эффекта. Желаемый эффект может быть, например, снижением АроCIII или предупреждением, снижением, облегчением или замедлением прогрессирования заболевания или состояния, связанного с дислипидемией Фредриксона I типа, FCS, LPLD.
В некоторых вариантах реализации изобретения переменные схемы применения подбирают для достижения желаемой концентрации фармацевтической композиции у субъекта. «Концентрация фармацевтической композиции» при использовании в отношении схемы применения может относиться к соединению, олигонуклеотиду или активному ингредиенту фармацевтической композиции. Например, в некоторых вариантах реализации дозу и частоту введения доз подбирают для обеспечения концентрации в ткани или концентрации в плазме фармацевтической композиции в количестве, достаточном для достижения желаемого эффекта.
Введение доз зависит от тяжести и восприимчивости болезненного состояния, подлежащего лечению, при этом курс лечения продолжается от нескольких дней до нескольких месяцев или до достижения исцеления или уменьшения болезненного состояния. Введение доз зависит также от эффективности лекарства и метаболизма. В некоторых вариантах реализации изобретения доза составляет от 0,01 мкг до 100 мг на кг массы тела или доза находится в диапазоне от 0,001 мг - 1000 мг, и может быть обеспечена один или более раз в сутки, еженедельно, ежемесячно или ежегодно или даже один раз в 2-20 лет. После успешного лечения может быть желательно, чтобы пациент прошел поддерживающую терапию для предупреждения рецидива болезненного состояния, при этом олигонуклеотид вводят в поддерживающих дозах в диапазоне от 0,01 мкг до 100 мг на кг массы тела от одного или более раз в сутки до одного раза в 20 лет, или доза находится в диапазоне от 0,001 мг до 1000 мг.
Некоторые комплексные терапии
В некоторых вариантах реализации изобретения первый агент, содержащий соединение, описанное в настоящем документе, вводят совместно с одним или более вторичными агентами. В некоторых вариантах реализации такие вторые агенты предназначены для лечения того же заболевания, расстройства или состояния, что и первый агент, описанный в настоящем документе. В некоторых вариантах реализации такие вторые агенты предназначены для лечения другого заболевания, расстройства или состояния, чем первый агент, описанный в настоящем документе. В некоторых вариантах реализации изобретения первый агент предназначен для лечения нежелательного побочного эффекта второго агента. В некоторых вариантах реализации вторые агенты вводят совместно с первым агентом для лечения нежелательного побочного эффекта первого агента. В некоторых вариантах реализации такие вторые агенты предназначены для лечения нежелательного побочного эффекта одной или более фармацевтических композиций, описанных в настоящем документе. В некоторых вариантах реализации вторые агенты вводят совместно с первым агентом для обеспечения комбинированного эффекта. В некоторых вариантах реализации вторые агенты вводят совместно с первым агентом для обеспечения синергетического эффекта. В некоторых вариантах реализации изобретения совместное введение первого и второго агентов обеспечивает возможность применения более низких доз, чем необходимо для достижения терапевтического или профилактического эффекта при введении этих агентов в качестве независимых терапий. В некоторых вариантах реализации первый агент вводят субъекту с неудачным лечением или невосприимчивостью ко второму агенту. В некоторых вариантах реализации изобретения первый агент вводят субъекту вместо второго агента.
В некоторых вариантах реализации изобретения одну или более композиций, описанных в настоящем документе, и один или более других фармацевтических агентов вводят одновременно. В некоторых вариантах реализации одну или более композиций согласно изобретению и один или более других фармацевтических агентов вводят в разное время. В некоторых вариантах реализации одну или более композиций, описанных в настоящем документе, и один или более других фармацевтических агентов получают вместе в составе одной композиции. В некоторых вариантах реализации одну или более композиций, описанных в настоящем документе, и один или более других фармацевтических агентов получают по отдельности.
В некоторых вариантах реализации изобретения вторые агенты включают, но не ограничиваются ими, агенты, понижающие АроCIII, ингибитор DGAT1, агент, повышающий LPL, агент, понижающий холестерин, агент, понижающий не-HDL липиды (например, LDL), агент, повышающий HDL, рыбий жир, ниацин (никотиновую кислоту), фибрат, статин, DCCR (соль диазоксида), агент, понижающий глюкозу, и/или противодиабетические агенты. В некоторых вариантах реализации первый агент вводят в комбинации с максимально переносимой дозой второго агента. В некоторых вариантах реализации первый агент вводят субъекту, который не отвечает на максимально переносимую дозу второго агента.
Примеры агентов, понижающих АроCIII, включают антисмысловые олигонуклеотиды АроCIII, отличные от первого агента, фибрата или антисмыслового олигонуклеотида Аро В.
Пример ингибитора DGAT1 представляет собой LCQ908 (Novartis Pharmaceuticals), который в настоящее время проходит клинические испытания 3 фазы для лечения синдрома семейной хиломикронемии (FCS).
Агенты, повышающие LPL, включают агенты генной терапии, которые повышают уровень LPL. Примеры таких агентов включают копии нормальных генов, которые пополняют недостаток нормального гена. Например, GlyberaR повышает уровни LPL за счет обеспечения нормальных копий гена LPL для пополнения недостатка нормального гена LPL. В других примерах агент, повышающий LPL, содержит нормальные копии АроС-II, GPIHBP1, АРОА5, LMF1 или других агентов, которые при мутации могут приводить к дисфункциональности LPL. В некоторых вариантах реализации изобретения комбинация первого агента (например, ASO АроCIII) и второго агента (например, Glybera) обеспечивает аддитивный или синергетический эффект. В некоторых вариантах реализации первый агент (например, ASO АроCIII) вводят субъекту с неудачным лечением или невосприимчивостью ко второму агенту (например, GlyberaR).
Примеры агентов, понижающих глюкозу, и/или противодиабетических агентов включают, но не ограничиваются ими, терапевтическое изменение образа жизни, агонист PPAR, ингибитор дипептидилпептидазы (IV), аналог GLP-1, инсулин или аналог инсулина, стимулятор секреции инсулина, ингибитор SGLT2, аналог человеческого амилина, бигуанид, ингибитор альфа-глюкозидазы, метформин, сульфонилмочевину, росиглитазон, меглитинид, тиазолидиндион, ингибитор альфа-глюкозидазы и т.п. Сульфонилмочевина может представлять собой ацетогексамид, хлорпропамид, толбутамид, толазамид, глимепирид, глипизид, глибурид или гликлазид. Меглитинид может представлять собой натеглинид или репаглинид. Тиазолидиндион может представлять собой пиоглитазон или росиглитазон. Альфа-глюкозидаза может представлять собой акарбозу или миглитол.
Терапия для понижения холестерина или липидов может включать, но не ограничивается ими, терапевтическое изменение уровня жизни, статины, усилители экскреции желчных кислот, никотиновую кислоту и фибраты. Статины могут представлять собой аторвастатин, флувастатин, ловастатин, правастатин, розувастатин и симвастатин, и т.п. Усилители экскреции желчной кислоты могут представлять собой колесевелам, холестирамин, колестипол и т.п. Фибраты могут представлять собой гемфиброзил, фенофибрат, клофибрат и т.п. Терапевтическое изменение образа жизни может представлять собой диету с ограниченным потреблением жиров.
Агенты, повышающие HDL, включают лекарства, ингибирующие белок переноса холестериновых эфиров (СЕТР) (такие как торцетрапиб), агонисты рецептора, активируемого пролифератором пероксисом, Аро-А1, пиоглитазон и т.п.
Некоторые группы лечения
Некоторые типы гипертриглицеридемии могут быть охарактеризованы по системе классификации Фредриксона или по системе классификации, описанной Тремблеем (Tremblay et al., J Clin Lipidol, 2011, 5: 37-44). В некоторых вариантах реализации изобретения соединения, композиции и способы, описанные в настоящем документе, подходят для лечения субъектов с дислипидемией Фредриксона I типа, FCS, LPLD.
Субъекты с дислипидемией Фредриксона I типа, FCS, LPLD имеют серьезный риск панкреатита, сердечно-сосудистого и метаболического заболевания. Для этих субъектов рецидивирующий панкреатит представляет собой наиболее изнуряющее и потенциально летальное осложнение; другие последствия включают повышенную склонность к атеросклерозу и диабету.
Субъекты с дислипидемией Фредриксона I типа, FCS, LPLD не имеют существенного количества функционально активной LPL. АроCIII играет важную роль в метаболизме TG и представляет собой независимый фактор риска сердечно-сосудистого заболевания у субъектов с функциональной или частично функциональной LPL. АроCIII в настоящее время проходит клинические испытания для лечения субъектов, не страдающих гипертриглицеридемией Фредриксона I типа. Однако поскольку путь АроCIII считался действующим по пути LPL, то ингибирование АроCIII не рассматривали как возможность лечения субъектов с дислипидемией Фредриксона I типа, FCS, LPLD.
Как показано в настоящем документе, ингибирование АроCIII неожиданно снижает уровни TG и/или повышает уровни HDL у субъектов с дислипидемией Фредриксона I типа, FCS, LPLD. Снижение TG и/или повышение HDL, в свою очередь, может обеспечивать предупреждение, лечение, замедление или облегчение заболевания, расстройства или его симптома, связанного с дислипидемией Фредриксона I типа, FCS, LPLD.
Некоторые соединения
Авторы настоящего изобретения ранее открыли композиции, содержащие антисмысловые соединения, нацеленные на АроCIII, и способы ингибирования АроCIII при помощи антисмысловых соединений, которые описаны в US 20040208856 (патент США 7598227), US 20060264395 (патент США 7750141), WO 2004/093783 и WO 2012/149495, которые включены в настоящий документ посредством ссылки. Для этих применений была разработана серия антисмысловых соединений для нацеливания на различные области РНК человеческого АроCIII с использованием опубликованных последовательностей (нуклеотиды 6238608-6242565 из последовательности GenBank с номером доступа NT_035088.1, которая представляет собой геномную последовательность, включенную в настоящий документ как SEQ ID NO: 4, и GenBank с номером доступа NM_000040.1, включенную в настоящий документ как SEQ ID NO: 1). Эти соединения представляют собой химерные олигонуклеотиды («гэп-меры») длиной 20 нуклеотидов, состоящие из центральной области «гэп», состоящей из десяти 2'-дезоксинуклеотидов, к которой с обеих сторон (направления 5' и 3') присоединены пятинуклеотидные «крылья». Крылья состоят из 2'-O-(2-метоксиэтил)-нуклеотидов, известных также как (2'-МОЕ)-нуклеотиды. Межнуклеозидные (скелетные) связи являются тиофосфатными (P=S) по всему олигонуклеотиду. Все цитозиновые остатки представляют собой 5-метилцитозин.
Антисмысловые соединения анализировали на их влияние на уровни мРНК человеческого АроCIII в клетках HepG2 при помощи количественной ПЦР в реальном времени. Некоторые соединения продемонстрировали по меньшей мере 45% ингибирование мРНК АроCIII и, следовательно, они являются предпочтительными. Некоторые соединения продемонстрировали по меньшей мере 50% ингибирование мРНК человеческого АроCIII и, следовательно, они являются предпочтительными. Некоторые соединения продемонстрировали по меньшей мере 60% ингибирование мРНК человеческого АроCIII и, следовательно, они являются предпочтительными. Некоторые соединения продемонстрировали по меньшей мере 70% ингибирование мРНК человеческого АроCIII и, следовательно, они являются предпочтительными. Некоторые соединения продемонстрировали по меньшей мере 80% ингибирование мРНК человеческого АроCIII и, следовательно, они являются предпочтительными. Некоторые соединения продемонстрировали по меньшей мере 90% ингибирование мРНК человеческого АроCIII и, следовательно, они являются предпочтительными.
Целевые области, которым комплементарны эти предпочтительные антисмысловые соединения, упоминаются как «предпочтительные целевые сегменты» и, следовательно, они являются предпочтительными для нацеливания антисмысловых соединений.
ПРИМЕРЫ
Исключение ограничения настоящего описания и включение посредством ссылки
Хотя некоторые соединения, композиции и способы, описанные в настоящем документе, были описаны со спецификой согласно некоторым вариантам реализации изобретения, следующие примеры служат лишь для иллюстрации соединений, описанных в настоящем документе, и не предназначены для их ограничения. Каждая ссылка, цитируемая в настоящей заявке, включена в настоящий документ посредством ссылки в полном объеме.
Пример 1; Клинические испытания ISIS 304801
Как описано в настоящем документе, выполнили открытое исследование на пациентах с дислипидемией Фредриксона I типа, FCS, LPLD для оценки ответа на исследуемый препарат ISIS 304801 и его фармакодинамические эффекты. ISIS 304801 ранее был описан в патенте США 7598227 и имеет последовательность 5'-AGCTTCTTGTCCAGCTTTAT-3' (SEQ ID NO: 3), начиная с положения 508 SEQ ID NO: 1 (GENBANK, номер доступа NM_000040.1) или начиная с положения 3139 SEQ ID NO: 2 (GENBANK, номер доступа NT_033899.8, усеченная по нуклеотидам с 20262640 по 20266603). ISIS 304801 имеет мотив гэп-мера МОЕ 5-10-5, содержащий сегмент гэп, состоящий из 10 связанных дезоксинуклеозидов, сегмент 5'-крыла, состоящий из 5 связанных нуклеозидов, сегмент 3'-крыла, состоящий из 5 связанных нуклеозидов, при этом сегмент гэп расположен непосредственно возле и между сегментом 5'-крыла и сегментом 3'-крыла, причем каждый нуклеозид каждого сегмента крыла содержит 2'-O-метоксиэтилсахар, причем каждый цитозин представляет собой 5'-метилцитозин, и каждая межнуклеозидная связь представляет собой тиофосфатную связь. Было показано, что ISIS 304801 эффективно ингибирует АроС-III и является переносимым при введении субъектам.
У многих пациентов, принявших участие в этом исследовании, была диагностирована дислипидемия Фредриксона I типа, FCS, LPLD. В исследование включили пациентов с дислипидемией Фредриксона I типа, FCS, LPLD, у которых в истории болезни уровни TG составляли ≥880 мг/дл, уровни TG натощак во время отбора для испытания составляли ≥750 мг/дл и/или уровни TG составляли ≥440 мг/дл после диеты, но до начала лечения.
Для увеличения экспериментальной группы могут быть проверены некоторые пациенты, страдающие от гиперTG, но не диагностированные с дислипидемией Фредриксона I типа, FCS, LPLD, на наличие дислипидемии Фредриксона I типа, FCS, LPLD. В одном из примеров пациентов с гиперTG идентифицируют по истории болезни с уровнями TG ≥880 мг/дл и/или центрифугированием липидов в их крови, определяя тот факт, что уровни TG натощак составляют ≥750 мг/дл. Пациентов с уровнями TG натощак ≥750 мг/дл дополнительно проверяют на наличие по меньшей мере одного из следующих параметров для подтверждения диагноза дислипидемии Фредриксона I типа, FCS, LPLD:
(1) гомозиготные или компаунд-гетерозиготные мутации с потерей функции в генах, таких как LPL (например, P207L, G188L, D9N), АроС2, GPIHBP1, АроС5 или LMF1, которые, как известно, вызывают дислипидемию Фредриксона I типа, FCS, LPLD;
(2) активность LPL ≤20% от нормальной; и
(3) анти-LPL антитела.
Для каждого пациента с диагностированной дислипидемией Фредриксона I типа, FCS, LPLD период участия в испытании состоит из периода отбора продолжительностью ≤8 недель (который включат жесткое соблюдение диеты в период отбора в течение 4 недель), 1 неделю периода отборочного испытания/оценки исходного состояния, период лечения продолжительностью 13 недель и период оценки после лечения продолжительностью 13 недель, что в общем составляет 35 недель участия в испытании. В исследование включают пациентов с уровнем TG ≥440 мг/дл с ограничивающей диетой. В течение всех периодов исследований записывают сопутствующие лекарственные препараты и нежелательные явления (АЕ).
Пациентам назначают строго ограничивающую диету (после выполнения отборочных процедур) на весь период участия в испытании. Спустя 28 дней ограничивающей диеты пациенты имеют исходные параметры, и их оценивают для отбора на участие в лечебной фазе испытания.
Конечные точки для оценки включают: фармакодинамические (ФД) эффекты ISIS 304801, измеренные по уровням липопротеина натощак, общего АроС-III, TG, АроС-II (общего и связанного с VLDL), аполипопротеина В-100 (ароВ-100 и/или ароВ-48). аполипопротеина А-1 (ароА-1), аполипопротеина А-2 (ароА-2), аполипопротеина Е (ароЕ), общего холестерина (ТС), холестерина липопротеинов низкой плотности (LDL-С), LDL-TG, VLDL-C, VLDL-TG, холестерина липопротеинов невысокой плотности (не-HDL-C), не-HDL-TG, HDL-С, HDL-TG, холестерина хиломикронов (СМ-С), триглицеридов хиломикронов (CM-TG), свободных жирных кислот (FFA) и глицерина; постпрандиальные характеристики и кинетика липидов, аполипопротеинов и липопротеинов; и безопасность, переносимость и фармакокинетику (ФК) ISIS 304801. Дополнительные конечные точки, подлежащие оценке, могут включать снижение СЕТР или повышение ApoA1, PON1, клиренса жиров и клиренса триглицеридов, а также улучшение соотношения HDL к TG.
Исследуемый препарат и лечение
Обеспечивают раствор исследуемого препарата ISIS 304801 (200 мг/мл, 1,0 мл), содержащийся в 2 мл стеклянных ампулах с пробкой. Ампулы предназначены только для однократного применения. Фармацевт (или квалифицированный представитель) готовит раствор ISIS 304801 и плацебо. Опытные профессионалы каждый день периода введения доз вводят по 300 мг исследуемого препарата в качестве одной подкожной (SC) инъекции в область живота, бедро или наружную часть верхней конечности.
Пациентам вводят 13 доз исследуемого препарата, введенных путем SC инъекции один раз в неделю в течение 13 недель (1, 8, 15, 22, 29, 36, 43, 50, 57, 64, 71, 78 и 85 день). Пациенты приходят на лечение на 1±0 день и на 8, 15, 22, 29, 36, 43, 50, 57, 64, 71, 78 и 85 день ±1 день. Пациенты в экстенсивной группе ФК также посещают клинику на 2 день и на 86±0 день относительно 1 и 85 дня, соответственно, для 24-часового взятия образца крови. Затем пациенты приходят в клинику на 92 и на 99 день в пределах ±1 день, на 127 день в пределах ±3 дня и на 176 день в пределах ±5 дней от запланированной даты посещения. Пациенты в постпрандиальной оценочной группе также посещают клинику на 103 день в пределах ±2 дня и на следующий день после 103 дня для 24-часового взятия образца крови.
Перед каждым посещением, в ходе которого выполняют взятие образца крови для измерений ФД (8, 15, 29, 43, 57, 71 и 85 день), пациентам назначают стандартизированную приготовленную пищу на ужин вечером перед их посещением клиники (для обеспечения равной меры потребления жиров на одного пациента и на одну временную точку), после чего они не принимают пищу. Употребление алкоголя запрещено за 48 часов до посещения клиники.
Образцы крови берут натощак и/или после приема пищи для измерения VLDL, АроС-III и других ФД маркеров на 8, 15, 29, 43, 57, 71 и 85 день (перед введением исследуемого препарата).
Пациенты в постпрандиальной группе оценки употребляют стандартизированную приготовленную пищу (обеды и ужины (предоставлены), а также инструкции для завтрака и перекусов) в течение 2 дней перед постпрандиальными измерениями. В каждый из постпрандиальных дней измерения после взятия образцов крови пациенты употребляют стандартизированную жидкую пищу, которая составляет около трети от дневной потребности в калориях и которая содержит метку со стабильным радиоизотопом, а затем выполняют серийное взятие образцов крови. Пациенты употребляют стандартизированную приготовленную пищу спустя 9 часов после приема жидкой пищи, после чего они не принимают пищу до следующего дня, когда выполняют 24-часовое взятие образца крови.
Помимо взятия образцов перед введением новой дозы, у пациентов в группе экстенсивной оценки ФК образцы крови берут в течение 24 часов после первой (1-2 день) и последней (85-86 день) дозы исследуемого препарата. Оценивают параметры ФК, такие как площадь под кривой (AUC), остаточная концентрация препарата (Cmin) и другие.
Период оценки после лечения
Пациентов наблюдают до 176 дня исследования. В это время пациентов возвращают в исследовательский центр для амбулаторных посещений клиники на 92, 99, 127 и 176 день исследования (а также на 103 день для пациентов в постпрандиальной группе оценки) для оценки безопасности и клинических лабораторных анализов (образцов крови), консультаций и контролирования диеты, записи приема сопутствующих лекарственных средств и информации о нежелательных явлениях.
Образцы крови для ФК и ФД анализов периодически собирают в течение всего периода оценки после лечения. В течение исследования в различное время выполняют лабораторные измерения химического состава сыворотки, анализы мочи, коагуляции комплемента, гематологии, иммунной функции, функции щитовидной железы и полной липидограммы.
В подгруппе пациентов выполняют постпрандиальные оценки, как описано ниже.
Постпрандиальный график приема пищи, взятия образцов и анализы
Постпрандиальную оценку метаболизма липопротеинов выполняют при помощи пищи с радиоактивной меткой, в которую добавлен меченый агент, 3Н-пальмитат (300 мкКи, Perkin Elmer Inc., Вулбридж, штат Онтарио, Канада), при помощи ультразвука введенный в жидкую пищу. Пальмитат представляет собой жирную кислоту, которая является широкораспространенным компонентом любого рациона. 3Н-пальмитатная метка излучает слабую радиоактивность, эквивалентную рентгеновским лучам. Поскольку пищевой пальмитат внедряется в хиломикроны по мере их образования в энтероцитах кишечника, то это дает возможность контролирования возникновения и клиренса вновь образованных хиломикронов из кровотока. Методика, применимая для исследования постпрандиальной кинетики возникновения и клиренса хиломикронов, является общепризнанной (Mittendorfer et al. 2003, Diabetes, 52: 1641-1648; Bickerton et al. 2007; Normand-Lauziere et al. 2010, PLoS. One, 5: e10956).
Обеспечивают жидкую пищу (похожую на молочный коктейль), содержащую небольшое количество (300 мкКи) жирных кислот с радиоактивной меткой (3Н-пальмитат). Жидкая пища обеспечивает около трети от суточной потребности в калориях. Начиная за 1 час до приема пищи и в течение 9 часов после приема пищи вводят непрерывную инфузию [U-13C]-K пальмитата (0,01 мкмоль/кг/мин. в 100 мл. 25% альбумине сыворотки человека; Cambridge Isotopes Laboratories Inc., Андовер, штат Массачусетс) и начальную (1,6 мкмоль/кг), а затем непрерывную (0,05 мкмоль/кг/мин) инфузию [1,1,2,3,3-2Н]-глицерина (Cambridge Isotopes Laboratories Inc.), как описано ранее (Normand-Lauziere et al. 2010, PLoS. One, 5: e10956). Скорости появления пальмитата и глицерина в плазме рассчитывают при помощи уравнения нестационарного состояния Стила, приняв объем распределения 90 мл/кг и 230 мл/кг, соответственно (Gastaldelli et al. 1999, J Appl. Physiol, 87: 1813-1822).
Образцы крови берут с определенными интервалами до и после приема пищи с радиоактивной меткой за несколько дней до и после фазы лечения, как показано ниже в таблице. Стандартизированную пищу дают участникам исследования спустя 9 часов после взятия образца крови. Кровь собирают в пробирки, содержащие Na2EDTA или Orlistat (30 мкг/мл, Roche, Миссиссога, Канада) для предотвращения in vitro липолиза триацилглицерина, и отдельные образцы собирают в NaF пробирки для определения глюкозы в плазме.
В каждой временно точке измеряют:
- Уровни и фракцию СМ в плазме на 3Н-метку
- Скорости возникновения [U-13C]-K пальмитата и [1,1,2,3,3-2Н]-глицерина
- Уровни и фракцию СМ в плазме на TG, ТС и ароВ
- Уровни и фракцию VLDL в плазме на аро CIII, аро CII и аро Е
- Уровни глюкозы в плазме
Для анализа профиля белков, связанных лекарством, для целей обоснования биоаналитических методов, для оценки стабильности и метаболитов или для оценки другого действия ISIS 304801 на составляющие плазмы могут быть использованы также образцы плазмы.
Результаты
Ниже представлены результаты для трех пациентов с диагностированной дислипидемией Фредриксона I типа, FCS, LPLD, принявших участие в данном исследовании. Два пациента являются гомозиготными для нуль-мутации P207L гена LPL, а один пациент является компаунт-гетерозиготным для нуль-мутаций P207L и G188E гена LPL. У всех пациентов есть определенная масса LPL, но отсутствует или находится на чрезвычайно низком уровне (<5%) активность LPL. Уровень TG у пациентов составил ≥440 мг/дл после диеты, но до начала лечения. У двух пациентов подтвержден анамнез острого панкреатита, а один пациент проходил генную терапию с GlyberaR в декабре 2007 года.
Данные о процентном изменении уровней АроCIII натощак представлены ниже в таблице. Эти результаты показывают, что лечение с ISIS 304801 снижает уровни АроС-III натощак. «Н.д.» означает, что для конкретной временной точки данные не получены.
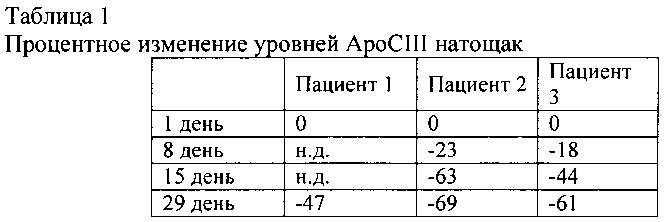
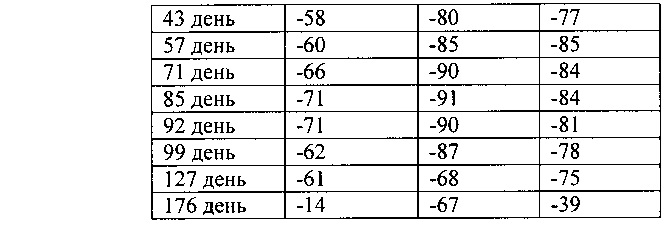
Измерили также уровни триглицеридов натощак. Данные о процентном изменении, а также об абсолютных уровнях триглицеридов натощак представлены ниже в таблицах. Эти результаты показывают, что лечение с ISIS 304801 снижает уровни триглицеридов натощак.
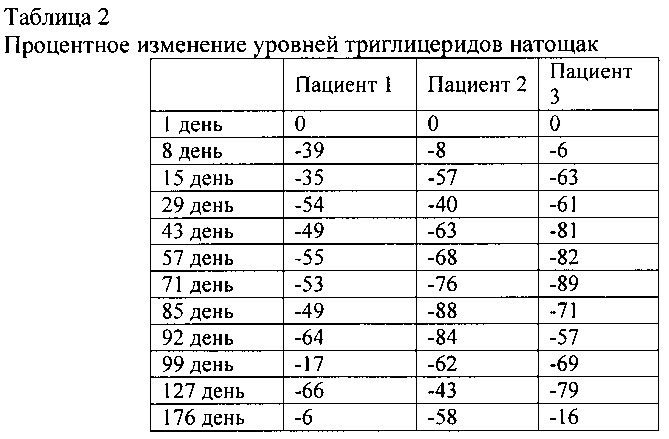

Измерили также уровни не-HDL холестерина натощак. Данные о процентном изменении, а также об абсолютных уровнях не-HDL холестерина натощак представлены ниже в таблицах. Эти результаты показывают, что лечение с ISIS 304801 снижает уровни не-HDL холестерина натощак.
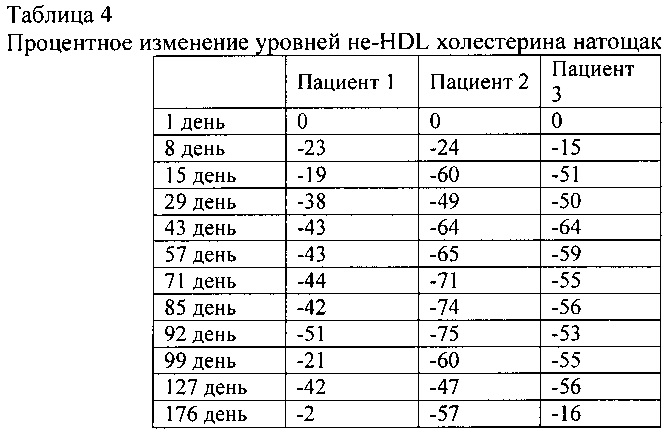
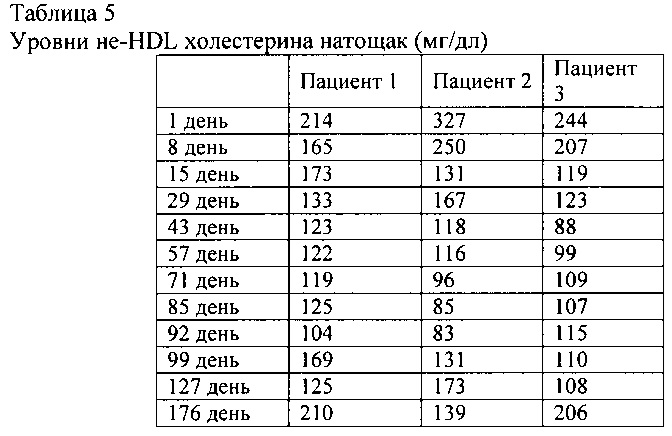
Измерили также уровни АроВ-48, которые представляют собой меру содержания хиломикронов. Данные о процентном изменении, а также об абсолютных уровнях АроВ-48 представлены ниже в таблицах. Эти результаты показывают, что лечение с ISIS 304801 снижает уровни АроВ-48 натощак.
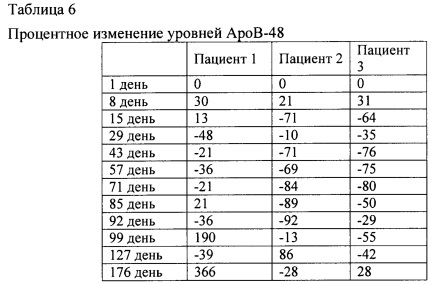

По окончании лечении измерили общее содержание липидов у пациентов с FCS натощак и сравнили его с исходным значением. Данные представлены ниже в таблицах и показывают, что лечение с ISIS 304801 улучшает общее содержание липидов у пациентов.



Оценка безопасности
Лечение с ISIS 304801 не вызвало никаких проблем с повышением ферментов в печени более чем в три раза от верхней границы нормы (ULN), патологий почечной функции, значимых клинических изменений или других лабораторных показателей, или сопутствующих серьезных нежелательных явлений (SAE) или значительных нежелательных явлений (АЕ).
Лечение было переносимым для всех пациентов, без гриппозных симптомов и с редкими слабыми локальными реакциями, которые исчезли без какого-либо лечения. Из-за реакций в местах инъекции лечение не прекращали.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ И СПОСОБЫ МОДУЛИРОВАНИЯ ЭКСПРЕССИИ АПОЛИПОПРОТЕИНА C-III | 2014 |
|
RU2650510C2 |
| КОМПОЗИЦИИ И СПОСОБЫ МОДУЛИРОВАНИЯ ЭКСПРЕССИИ АПОЛИПОПРОТЕИНА (А) | 2014 |
|
RU2699985C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ МОДУЛИРОВАНИЯ ЭКСПРЕССИИ АПОЛИПОПРОТЕИНА (А) | 2013 |
|
RU2624028C2 |
| МОДУЛЯЦИЯ ЭКСПРЕССИИ АНГИОПОЭТИН-ПОДОБНОГО БЕЛКА 3 | 2014 |
|
RU2706964C2 |
| КОМПОЗИЦИИ И СПОСОБЫ МОДУЛИРОВАНИЯ ЭКСПРЕССИИ АПОЛИПОПРОТЕИНА (A) | 2014 |
|
RU2824214C1 |
| МОДУЛИРОВАНИЕ ЭКСПРЕССИИ АПОЛИПОПРОТЕИНА С-III (АРОСIII) У ПАЦИЕНТОВ С ЛИПОДИСТРОФИЕЙ | 2016 |
|
RU2737719C2 |
| КОМПОЗИЦИИ И СПОСОБЫ МОДУЛИРОВАНИЯ ЭКСПРЕССИИ АНГИОПОЭТИН-ПОДОБНОГО БЕЛКА 3 | 2015 |
|
RU2734658C2 |
| КОМПОЗИЦИИ И СПОСОБЫ | 2014 |
|
RU2686080C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ МОДУЛИРОВАНИЯ ЭКСПРЕССИИ АПОЛИПОПРОТЕИНА (А) | 2013 |
|
RU2748495C2 |
| КОМПОЗИЦИИ ДЛЯ МОДУЛИРОВАНИЯ ЭКСПРЕССИИ SOD-1 | 2015 |
|
RU2704619C2 |





Предложенная группа изобретений относится к области биотехнологии. Предложены применение специфического ингибитора ApoCIII, включающего антисмысловое соединение, нацеленное на ApoCIII, подавляющее экспрессию ApoCIII, для i) лечения, замедления или облегчения FCS у животного или ii) замедления или облегчения панкреатита или его симптома у животного с FCS, также применения соединения, включающего модифицированный олигонуклеотид с последовательностью SEQ ID NO: 3, для лечения, замедления или облечения FCS у животного и для замедления или облегчения панкреатита или его симптома у животного с FCS. Предложенные применения указанных ингибиторов ApoCIII, подавляющих экспрессию ApoCIII, приводят к снижению уровней TG и/или повышению уровней HDL у субъекта, тем самым обеспечивая лечение, замедление или облегчение FCS у животного или замедление или облегчение панкреатита у животного с FCS. 3 н. и 21 з.п. ф-лы, 10 табл., 1 пр.
1. Применение специфического ингибитора ApoCIII для i) лечения, замедления или облегчения FCS у животного или ii) замедления или облегчения панкреатита или его симптома у животного с FCS, отличающееся тем, что специфический ингибитор ApoCIII включает антисмысловое соединение, нацеленное на ApoCIII, причем указанное антисмысловое соединение подавляет экспрессию ApoCIII.
2. Применение по п. 1, отличающееся тем, что у животного обеспечивают снижение уровней триглицеридов.
3. Применение по п. 1, отличающееся тем, что антисмысловое соединение включает модифицированный олигонуклеотид.
4. Применение по п. 3, отличающееся тем, что модифицированный олигонуклеотид имеет последовательность азотистых оснований, включающую по меньшей мере 8 смежных азотистых оснований последовательности азотистых оснований SEQ ID NO: 3.
5. Применение по п. 4, отличающееся тем, что модифицированный олигонуклеотид имеет последовательность азотистых оснований, включающую SEQ ID NO: 3.
6. Применение по п. 4, отличающееся тем, что модифицированный олигонуклеотид имеет последовательность азотистых оснований, состоящую из SEQ ID NO: 3.
7. Применение по п. 3, отличающееся тем, что последовательность азотистых оснований модифицированного олигонуклеотида по меньшей мере на 80%, по меньшей мере на 90% или на 100% комплементарна последовательности азотистых оснований SEQ ID NO: 1, SEQ ID NO: 2 или SEQ ID NO: 4.
8. Применение по п. 3, отличающееся тем, что модифицированный олигонуклеотид состоит из одноцепочечного модифицированного олигонуклеотида или двухцепочечного модифицированного олигонуклеотида.
9. Применение по п. 3, отличающееся тем, что модифицированный олигонуклеотид состоит из 12-30 связанных нуклеозидов.
10. Применение по п. 9, отличающееся тем, что модифицированный олигонуклеотид состоит из 20 связанных нуклеозидов.
11. Применение по п. 3, отличающееся тем, что модифицированный олигонуклеотид имеет по меньшей мере одну модифицированную межнуклеозидную связь, модифицированный сахарный фрагмент или модифицированное азотистое основание.
12. Применение по п. 11, отличающееся тем, что модифицированная межнуклеозидная связь модифицированного олигонуклеотида представляет собой тиофосфатную межнуклеозидную связь, модифицированный сахар представляет собой бициклический сахар или 2'-O-метоксиэтилсахар, а модифицированное азотистое основание представляет собой 5-метилцитозин.
13. Применение по п. 3, отличающееся тем, что модифицированный олигонуклеотид содержит:
(a) сегмент гэп, состоящий из связанных дезоксинуклеозидов;
(b) сегмент крыла 5', состоящий из связанных нуклеозидов;
(c) сегмент крыла 3', состоящий из связанных нуклеозидов;
причем сегмент гэп расположен непосредственно возле и между сегментом крыла 5' и сегментом крыла 3', и при этом каждый нуклеозид каждого сегмента крыла содержит модифицированный сахар.
14. Применение по п. 3, отличающееся тем, что модифицированный олигонуклеотид содержит:
(a) сегмент гэп, состоящий из 10 связанных дезоксинуклеозидов;
(b) сегмент крыла 5', состоящий из 5 связанных нуклеозидов;
(c) сегмент крыла 3', состоящий из 5 связанных нуклеозидов;
при этом сегмент гэп расположен непосредственно возле и между сегментом крыла 5' и сегментом крыла 3', и при этом каждый нуклеозид каждого сегмента крыла содержит 2'-О-метоксиэтилсахар, причем каждый цитозин представляет собой 5-метилцитозин, а каждая межнуклеозидная связь представляет собой тиофосфатную связь.
15. Применение по п. 1, отличающееся тем, что специфический ингибитор ApoCIII вводят парентерально.
16. Применение по п. 15, отличающееся тем, что парентеральное введение представляет собой подкожное введение.
17. Применение по п. 1, отличающееся тем, что специфический ингибитор ApoCIII представлен в форме соли.
18. Применение соединения, включающего модифицированный олигонуклеотид, имеющий последовательность SEQ ID NO: 3, для лечения, замедления или облечения FCS у животного, при этом модифицированный олигонуклеотид содержит:
(a) сегмент гэп, состоящий из 10 связанных дезоксинуклеозидов;
(b) сегмент крыла 5', состоящий из 5 связанных нуклеозидов;
(c) сегмент крыла 3', состоящий из 5 связанных нуклеозидов;
при этом сегмент гэп расположен непосредственно возле и между сегментом крыла 5' и сегментом крыла 3', и при этом каждый нуклеозид каждого сегмента крыла содержит 2'-O-метоксиэтилсахар, причем каждый цитозин представляет собой 5-метилцитозин, а каждая межнуклеозидная связь представляет собой тиофосфатную связь.
19. Применение соединения, включающего модифицированный олигонуклеотид, имеющий последовательность SEQ ID NO: 3, для замедления или облегчения панкреатита или его симптома у животного с FCS, при этом модифицированный олигонуклеотид содержит:
(a) сегмент гэп, состоящий из 10 связанных дезоксинуклеозидов;
(b) сегмент крыла 5', состоящий из 5 связанных нуклеозидов;
(c) сегмент крыла 3', состоящий из 5 связанных нуклеозидов;
при этом сегмент гэп расположен непосредственно возле и между сегментом крыла 5' и сегментом крыла 3', и при этом каждый нуклеозид каждого сегмента крыла содержит 2'-O-метоксиэтилсахар, причем каждый цитозин представляет собой 5-метилцитозин, а каждая межнуклеозидная связь представляет собой тиофосфатную связь.
20. Применение по п. 18 или 19, отличающееся тем, что указанное соединение вводят парентерально.
21. Применение по п. 20, отличающееся тем, что парентеральное введение представляет собой подкожное введение.
22. Применение по п. 18 или 19, отличающееся тем, что указанное соединение представлено в форме соли.
23. Применение по пп. 1, 18 или 19, дополнительно включающее фармацевтически приемлемый носитель или разбавитель.
24. Применение по пп. 1, 18 или 19, отличающееся тем, что FCS идентифицируют при помощи генетического скрининга.
| WO2004093783 A2, 04.11.2004 | |||
| BORGHEI A., AZIZI M | |||
| Familial chylomicronemia syndrome presenting with acute necrotizing pancreatitis in a five month infant | |||
| J | |||
| Nepal Paediatr | |||
| Soc | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Способ обработки медных солей нафтеновых кислот | 1923 |
|
SU30A1 |
| ZELJKO R | |||
| ET AL | |||
| Руководство по лечению дислипидемий | |||
| Атеросклероз и дислипидемии | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
Авторы
Даты
2018-07-19—Публикация
2014-02-14—Подача