Изобретение относится к области биотехнологии растений и может быть использовано для длительного хранения микрорастений малины в том ювенильном статусе, который был достигнут перед их депонированием.
Особенностью культуры in vitro является достижение растениями той степени омоложенности, которая в естественных условиях у растений не наблюдается. Процесс ювенилизации часто сопровождается фенотипическими изменениями микрорастений, среди которых изменение формы листа и уменьшение его размеров, исчезновение характерной антоциановой окраски и др. Следствием высокой степени омоложенности микрорастений является увеличение коэффициента мультипликации и частоты укоренения, что связано с более легким переходом растительных клеток в дедифференцированное состояние. Согласно нашим данным, ювенильное состояние способно сохраняться от нескольких недель до нескольких месяцев после адаптации микрорастений.
Степень омоложения микрорастений напрямую зависит от частоты пассирования культуры in vitro на стадии мультипликации и активности черенкования микропобегов при переносе на свежую питательную среду. Процесс омоложения является легкообратимым, поэтому непреднамеренное увеличение длительности 1-2 пассажей до 6 и более недель способно вернуть растения к исходному (неомоложенному) состоянию, а в процессе масштабного производства микрорастений подобные задержки с плановой пересадкой (пассированием) микрорастений неизбежны. Кроме того, поддержание ювенильного состояния культуры за счет частого пассирования в случае необходимости временного депонирования или невостребованности данной культуры является трудоемким и затратным процессом.
Как правило, для успешного формирования корневой системы микрорастений требуется редукция минерального состава питательной среды. Однако в случае необходимости временного депонирования или невостребованности данной культуры помещение в холодильник полностью укорененных растений может приводить к частичному отмиранию отдельных листьев или всей верхушки побега, что приводит к утрате товарного вида микрорастений и отрицательно сказывается на эффективности их последующей адаптации.
Ранее нами уже была показана эффективность подхода по депонированию активно растущих культур древесных видов растений в условиях низких температур и невысокого уровня освещенности, однако поведение травянистых видов растений и полукустарников (к каковым относится малина) в условиях in vitro значительно отличается от количественно-качественных характеристик древесных видов. Поэтому мы провели исследования в отношении малины.
Целью предлагаемого изобретения является решение вышеуказанных проблем, которые могут возникать на стадии мультипликации и укоренения микрорастений малины.
Поставленная цель достигается за счет того, что контейнеры с микрорастениями на стадиях мультипликации и укоренения помещаются соответственно через 5 и 14 дней после начала пассажа в холодильники с температурой 4-8°C с обеспечением подсветки растений на уровне 1000±200 люкс.
Суть изобретения состоит в том, что растения, выращиваемые на питательной среде для мультипликации, а именно на питательной среде MS (Murashige Т. & Skoog F., A revised medium for rapid growth and bioassays with tobacco tissue culture. // Physiol. Plant, 15 (1962) 473-497) с добавлением сахарозы 30 г/л, инозитола 100 мг/л, пиридоксина 0,1 мг/л, тиамина 0,1 мг/л, никотиновой кислоты 0,5 мг/л, 6-БАП 0,8 мг/л и зеатина 0,1 мг/л; или среде для укоренения, а именно на питательной среде 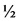 QL (Quorin М. & Lepoivre P. Elude de milieux adaptes aux cultures in vitro de Prunus // Acta Hort. 1977. V. 78. P. 437-442) с добавлением сахарозы 20 г/л, инозитола 100 мг/л, пиридоксина 0,1 мг/л, тиамина 0,1 мг/л, никотиновой кислоты 0,5 мг/л, индолилмасляной кислоты (ИМК) 0,1 мг/л, ИУК 0,1 мг/л переносят на свежую питательную среду и культивируют в стандартных условиях (22-25°C, 3000±500 люкс) в течение 5 дней (стадия мультипликации) или в течение 14 дней (стадия укоренения).
QL (Quorin М. & Lepoivre P. Elude de milieux adaptes aux cultures in vitro de Prunus // Acta Hort. 1977. V. 78. P. 437-442) с добавлением сахарозы 20 г/л, инозитола 100 мг/л, пиридоксина 0,1 мг/л, тиамина 0,1 мг/л, никотиновой кислоты 0,5 мг/л, индолилмасляной кислоты (ИМК) 0,1 мг/л, ИУК 0,1 мг/л переносят на свежую питательную среду и культивируют в стандартных условиях (22-25°C, 3000±500 люкс) в течение 5 дней (стадия мультипликации) или в течение 14 дней (стадия укоренения).
Анализ известных способов длительного поддержания качественных характеристик культуры in vitro растений, проведенный по научно-технической и патентной документации, показал, что совокупность существенных признаков заявляемого способа неизвестна из уровня техники, следовательно, он соответствует условию патентоспособности изобретения - «новизна».
Предлагаемый способ реализуется следующим образом.
1. В нестерильных условиях готовится питательная среда. В нее добавляются необходимые количества макро-, микроэлементов, хелата железа, инозитола, объем доводится дистиллированной водой, pH 5,6-5,8. В колбы добавляются навески агара. Среда разливается по колбам, укупоривается фольгой и бумагой, завязывается банковской резинкой. Автоклавирование проводится при 1 атм (=1 изб. атм) в течение 20 минут. В остывшую до 55°C среду в ламинар-боксе добавляются стерильные растворы витаминов, регуляторов роста. Полученный раствор разливается по стерильным культуральным сосудам. Все манипуляции с растительным материалом производятся в стерильных условиях ламинар-бокса. На этапе мультипликации число эксплантов в контейнерах составляет 10-12 шт., а на стадии укоренения 15-21 шт.
2. Через 5 дней (стадия мультипликации) или 14 дней (стадия укоренения) культивирования контейнеров на светокультуральных стеллажах при температуре 22-25°C и освещенности 3000±500 люкс контейнеры с растениями проверяют на наличие возможной контаминации, выбраковываются контейнеры с контаминацией или подозрением на нее, а остальные помещают в холодильники с температурой 4-8°C и уровнем освещения 1000±200 люкс.
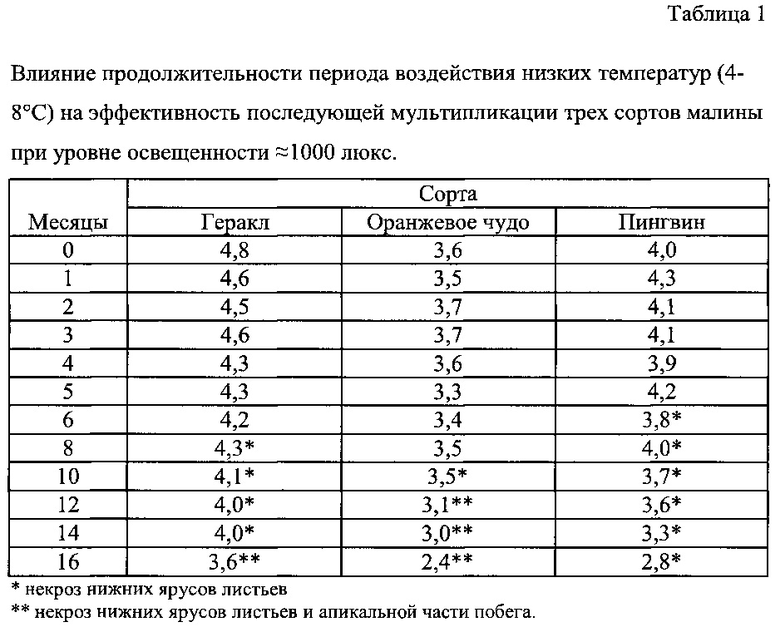
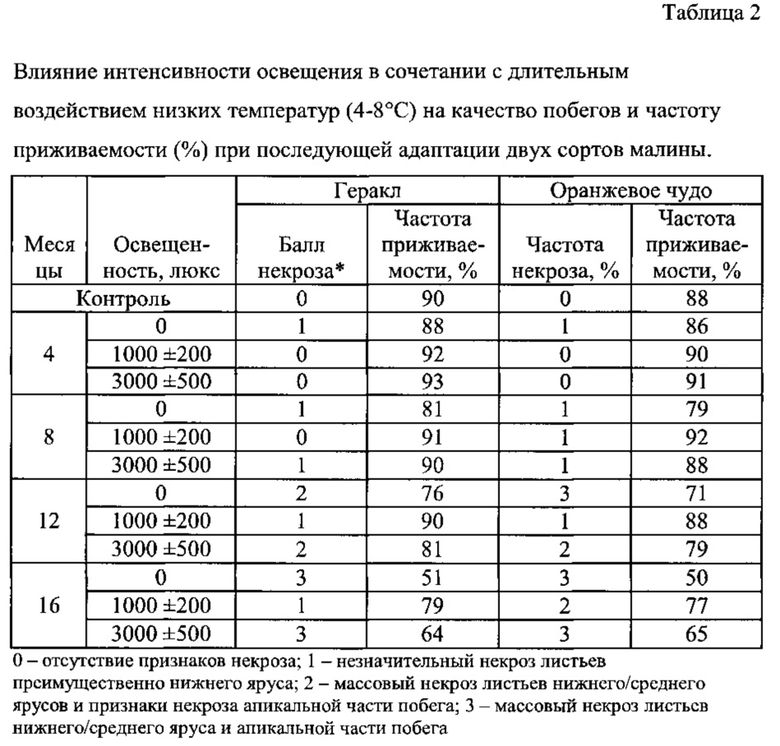
В таблицах 1 и 2 представлены результаты исследований по оценке условий и продолжительности депонирования растений на стадиях мультипликации и укоренения, обеспечивающих полное сохранение качественных характеристик культуры in vitro.
Продолжительность этапа мультипликации определяется периодом, за который растения в контейнере поглощают большую часть питательных веществ (органических и минеральных), а также регуляторов роста, некоторые из которых склоны к распаду под воздействием физических факторов внешней среды. Сокращение количества доступных питательных веществ, одновременно с накоплением в питательной среде продуктов жизнедеятельности растений, приводит к замедлению роста, а в случае большинства древесных культур это может инициировать состояние покоя, сопровождающееся изменениями на биохимическом и физиологическом уровнях. Для предотвращения подобных изменений производится регулярная пересадка растений на свежую питательную среду. Однако при возникновении временной невостребованности продукции необходимость частых пересадок приводит к заметному увеличению затрат на производство микрорастений.
Известно, что при воздействии низких температур происходит резкое сокращение активности большинства ферментов в растениях (Holaday A.S. et al. Changes in activities of enzymes of carbon metabolism in leaves during exposure of plants to low temperature // Plant Physiol. 1992. V98. P. 1105-1114) и, как следствие, резкое сокращение физиологической активности. Результаты наших исследований показали, что воздействие низких температур на микрорастения малины на стадии мультипликации позволяет сохранять основные качественные характеристики в течение 12-14 месяцев (Таблица 1). Более длительное хранение не рекомендуется, поскольку у всех трех сортов отмечалось резкое снижение частоты мультипликации после пересадки депонированных микрорастений на свежую питательную среду и культивирования в стандартных условиях. Сбрасывание листьев нижнего яруса, начало которого наблюдалось с 6-го месяца (сорт Пингвин) по 10-й месяц (сорт Оранжевое чудо) не было связано с переходом растений в состояние покоя, о чем косвенно можно судить по неизменной частоте мультипликации. При хранении микрорастений сроком более 12 месяцев у большинства сортов, за исключением Пингвина, наблюдался некроз апикальной части побега, что свидетельствует о необратимых процессах в растениях, однако в случае сорта Оранжевое чудо наличие апикального некроза через 12 и 14 месяцев депонирования не сильно сказывалось на частоте мультипликации, которая обеспечивалась за счет более легкого пробуждения пазушных и спящих почек.
Воздействие низких температур на микрорастения на стадии укоренения также обеспечивает сохранение основных качественных характеристик/товарного вида. Этиоляция побегов в случае хранения растений в отсутствие искусственного освещения ухудшали товарный вид продукции и влияли на внешний вид/качество адаптированных растений. Нами было установлено, что для сохранения товарного вида частично укоренившихся микрорастений малины, помещенных в условия низких температур, необходимо обеспечение хотя бы минимального уровня освещенности, поскольку в случае хранения микрорастений в темноте активный некроз верхушки побега (частично явившийся следствием этиоляции побегов) у обоих анализируемых сортов малины наблюдался уже через 12 месяцев хранения, а частота приживаемости снижалась на 13-15% (Таблица 2). Однако внешний вид таких адаптированных растений был значительно хуже относительно контроля. Стандартный уровень освещения 3000±500 люкс также приводил к ухудшению качества микрорастений малины обоих сортов по сравнению с растениями, хранившимися в условиях низкой освещенности 1000±200 люкс, что может быть связано с более активным протеканием физиологических процессов в растениях с более интенсивным освещением. Через 16 месяцев хранения в условиях высокого уровня освещенности некроз апикальной части побегов наблюдался у большей части растений в контейнерах, в то время как случаи отмирания верхушки побегов через такой же период хранения при низком освещении были единичными и только у сорта Оранжевое чудо. Частота приживаемости в целом коррелировала с качеством побегов и в наибольшей степени сохранялась в случае растений, хранившихся при низком уровне освещенности.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ СОХРАНЕНИЯ КАЧЕСТВЕННЫХ ХАРАКТЕРИСТИК КУЛЬТУРЫ in vitro НЕКОТОРЫХ ДРЕВЕСНЫХ ВИДОВ РАСТЕНИЙ (ЛИМОННИК КИТАЙСКИЙ, РОДОДЕНДРОН, СИРЕНЬ, БЕРЕЗА ПОВИСЛАЯ) | 2015 |
|
RU2590703C1 |
| Способ длительного депонирования in vitro растений малины ремонтантной | 2020 |
|
RU2743965C1 |
| СПОСОБ РАЗМНОЖЕНИЯ IN VITRO ШТАМБОВЫХ СОРТОВ МАЛИНЫ | 2019 |
|
RU2751250C2 |
| Способ повышения эффективности культивирования in vitro Березы повислой, Лимонника китайского, Рододендрона и Сирени | 2015 |
|
RU2619177C1 |
| СПОСОБ ПОДГОТОВКИ МИКРОПОБЕГОВ IN VITRO ЯСЕНЯ, ОСИНЫ, ИВЫ ДЛЯ ПОСЛЕДУЮЩЕГО УКОРЕНЕНИЯ В УСЛОВИЯХ EX VITRO | 2012 |
|
RU2565806C2 |
| СПОСОБ МИКРОКЛОНАЛЬНОГО РАЗМНОЖЕНИЯ И ПОЛУЧЕНИЯ ПОСАДОЧНОГО МАТЕРИАЛА ВЕЙГЕЛЫ ПРИЯТНОЙ (WEIGELA SUAVIS (КОМ.) L.H.BAILEY) И ВЕЙГЕЛЫ ЦВЕТУЩЕЙ "ВАРИЕГАТА" (WEIGELA FLORIDA "VARIEGATA" BUNGE A. DC.) | 2016 |
|
RU2634431C1 |
| Способ клонального микроразмножения флокса метельчатого | 2020 |
|
RU2743966C1 |
| Способ клонального микроразмножения тополя корейского (Populus koreana Render) | 2019 |
|
RU2704839C1 |
| СПОСОБ ХРАНЕНИЯ РАСТЕНИЙ РОДА RUBUS В УСЛОВИЯХ IN VITRO | 2018 |
|
RU2731061C2 |
| Способ микроклонального размножения винограда | 2023 |
|
RU2835624C1 |
Изобретение относится к области биотехнологии. Изобретение представляет собой способ сохранения ювенильного статуса культуры in vitro малины (Rubus idaeus), включающий перенос микрорастений малины на стадиях мультипликации или укоренения на питательные среды в условиях с пониженным уровнем освещенности и пониженной температурой, где смена освещенности и температуры происходит через 5 дней на стадии мультипликации и через 14 дней на стадии укоренения после начала очередного пассажа культивирования, при этом в качестве питательной среды на стадии мультипликации используют питательную среду MS с добавлением сахарозы 30 г/л, инозитола 100 мг/л, пиридоксина 0,1 мг/л, тиамина 0,1 мг/л, никотиновой кислоты 0,5 мг/л, 6-БАП 0,8 мг/л и зеатина 0,1 мг/л, а на стадии укоренения в качестве питательной среды используют питательную среду 1/2 QL с добавлением сахарозы 20 г/л, инозитола 100 мг/л, пиридоксина 0,1 мг/л, тиамина 0,1 мг/л, никотиновой кислоты 0,5 мг/л, индолилмасляной кислоты (ИМК) 0,1 мг/л, ИУК 0,1 мг/л, при этом уровень интенсивности освещенности снижается до 1000±200 люкс, а температура - до 4-8°С. Изобретение позволяет увеличить длительность хранения с последующей эффективной адаптацией. 2 табл.
Способ сохранения ювенильного статуса культуры in vitro малины (Rubus idaeus), включающий перенос микрорастений малины на стадиях мультипликации или укоренения на питательные среды в условиях с пониженным уровнем освещенности и пониженной температурой, отличающийся тем, что смена освещенности и температуры происходит через 5 дней на стадии мультипликации и через 14 дней на стадии укоренения после начала очередного пассажа культивирования, при этом в качестве питательной среды на стадии мультипликации используют питательную среду MS с добавлением сахарозы 30 г/л, инозитола 100 мг/л, пиридоксина 0,1 мг/л, тиамина 0,1 мг/л, никотиновой кислоты 0,5 мг/л, 6-БАП 0,8 мг/л и зеатина 0,1 мг/л, а на стадии укоренения в качестве питательной среды используют питательную среду 1/2 QL с добавлением сахарозы 20 г/л, инозитола 100 мг/л, пиридоксина 0,1 мг/л, тиамина 0,1 мг/л, никотиновой кислоты 0,5 мг/л, индолилмасляной кислоты (ИМК) 0,1 мг/л, ИУК 0,1 мг/л, при этом уровень интенсивности освещенности снижается до 1000±200 люкс, а температура - до 4-8°С.
| МОХАММЕД АБДУЛВАСИ ИБРАХИМ, Микроразмножение, длительное депанирование и криосохранение in vitro Малины красной, автореферат диссертации, Москва, 1998 | |||
| АКИМОВА С.В | |||
| и др., Влияние концентрации 6-БАП и длительности субкультивирования на этапе пролиферации на укоренение малины ремонтантной в культуре in vitro | |||
| Плодоводство и ягодоводство России, Том XXXXI, 2015, с.27-31 | |||
| КУЛЬХАНОВА Д.С., Размножение in vitro ремонтантных сортов малины | |||
| Известия Алтайского Государственного университета, N3-2, 2012, с | |||
| Устройство для усиления микрофонного тока с применением самоиндукции | 1920 |
|
SU42A1 |
Авторы
Даты
2018-07-26—Публикация
2016-03-16—Подача