Настоящая заявка испрашивает приоритет на основании предварительной заявки US 61/702296, поданной 18 сентября 2012 года, и предварительной заявки US 61/799311, поданной 15 марта 2013 года, содержание которых в полном объеме включено в данный документ в качестве ссылки для любых целей.
Область техники
Настоящее изобретение относится к везикулам грамотрицательных бактерий. В просвете везикул содержатся гетерологичные белки. Везикулы, в частности, можно использовать для получения иммуногенных композиций, таких как вакцины.
Уровень техники
Грамотрицательные бактерии во время роста могут спонтанно высвобождать везикулы наружной мембраны (OMV), образующиеся вследствие тургорного давления на клеточную оболочку. Образованию таких OMV может способствовать разрушение некоторых бактериальных компонентов, см., например, ссылки 1 и 2, например, нарушение системы Tol-Pal E. coli, приводящее к появлению штаммов, которые высвобождают везикулы в культуральную среду в процессе роста. OMV также могут образовываться в результате разрушения целых бактерий. Известные способы получения OMV включают в себя способы, в которых используется детергент (например, дезоксихолат) (3, 4), способы, в которых не используется детергент (5), обработку ультразвуком (6) и т. д.
OMV содержат иммуногенные, связанные с клеточной поверхностью периплазматические и секретируемые антигены, и используются в качестве вакцин, например, против Neisseria meningitidis серогруппы в (7). Везикулы особенно подходят для такого применения, поскольку они содержат соединения, которые действуют в качестве адъювантов, индуцирующих сильные иммунные ответы против антигенов. Таким образом, для иммунной системы везикулы больше напоминают нативную бактерию, чем очищенные антигенные белки или другие бактериальные компоненты. Следовательно, OMV являются привлекательной мишенью для вакцин и других иммуногенных композиций. Было высказано предположение, что иммуногенные свойства некоторых белковых антигенов можно усилить путем получения рекомбинантных OMV, содержащих несколько антигенов на поверхности, с использованием ClyA в качестве партнера по гибридизации (8).
Было сделано несколько попыток направить гетерологичные белки, в частности гетерологичные антигены, в OMV. Однако на сегодняшний день антигены, чужеродные по отношению к исходным бактериям, в значительной степени отсутствуют в OMV, в основном из-за проблем, связанных с транспортировкой гетерологичных белков в везикулы (11). Большинство попыток направить гетерологичные белки в OMV было основано на образовании ковалентной связи гетерологичных белков с интегральными мембранными белками. Примеры таких ковалентно-связанных гетерологичных белков включают в себя гибриды эпитопа FLAG с полноразмерной последовательностью OmpA (белок наружной мембраны A), гибриды эпитопа FLAG с полноразмерной последовательностью PagP (PhoPQ-активированный ген P) (9), а также гибриды GFP с ClyA (цитолизин) (10). Посредством ковалентных связей с мембранными белками полученные гибридные белки присоединены к внешней мембране и, таким образом, включены в состав OMV. Указанные методы имеют недостатки, в частности, обусловленные тем, что трудно осуществлять повышенную экспрессию большого количества интегрального мембранного белка без вредных последствий, свойственных трансформированной бактерии.
Направление периплазматических белков в OMV также оказалось сложной задачей. Гибридизация GFP с сигнальной последовательностью Tat (транспортер с двойным аргинином) приводит к повышенной экспрессии GFP, направляемого в периплазму, однако флуоресценция GFP в OMV лишь немного превышает фоновый уровень (11), позволяя предположить, что GFP либо не внедряются в OMV, либо не функционируют в OMV из-за неправильной укладки.
Остается потребность в разработке способа, подходящего для экспрессии гетерологичных белков, заключенных в OMV, и, в частности, способа экспрессии антигенных белков, заключенных в OMV. Также остается потребность в альтернативных или усовершенствованных OMV, в частности, для применения в составе вакцин.
Описание изобретения
Авторы настоящего изобретения обнаружили, что направленность гетерологичных белков в просвет OMV позволяет преодолеть многие проблемы, связанные с направленностью гетерологичных белков на мембрану OMV. Неожиданно авторы настоящего изобретения также обнаружили, что OMV, содержащие гетерологичные белки в просвете, при введении млекопитающему способны вызывать иммунные ответы на такие белки.
Таким образом, настоящее изобретение относится к везикулам наружной мембраны (OMV) грамотрицательной бактерии, где OMV содержат, по меньшей мере, один гетерологичный белок, который в свободной форме присутствует в просвете везикулы, причем OMV при введении млекопитающему могут вызывать иммунный ответ на указанный гетерологичный белок.
Изобретение также предлагает способ получения OMV настоящего изобретения, который включает в себя стадию экспрессии гетерологичного белка в периплазме грамотрицательной бактерии. Кроме того, изобретение предлагает OMV, полученные или которые можно получить с помощью данного способа.
Изобретение также относится к фармацевтической композиции, содержащей: (a) OMV настоящего изобретения и (b) фармацевтически приемлемый носитель.
Изобретение также предлагает способ получения иммунного ответа у млекопитающего, включающий в себя введение эффективного количества OMV грамотрицательных бактерий млекопитающим, где OMV содержат в своем просвете, по меньшей мере, один гетерологичный белок, и где иммунный ответ развивается на гетерологичный белок, содержащийся в OMV. В некоторых вариантах осуществления данного аспекта изобретения белок находится в свободной форме в просвете OMV. Изобретение также относится к способу получения иммунного ответа у млекопитающего, включающему в себя введение фармацевтической композиции настоящего изобретения млекопитающему, где иммунный ответ развивается на гетерологичный белок, содержащийся в OMV.
OMV
Настоящее изобретение предлагает везикулу наружной мембраны (OMV) грамотрицательной бактерии, где OMV содержит в своем просвете, по меньшей мере, один гетерологичный белок, который находится в свободной форме, и где OMV способен индуцировать иммунный ответ на гетерологичный белок при введении млекопитающему.
OMV, хорошо известные в данной области, спонтанно выделяются бактериями в культуральную среду. "Нативные OMV" ("NOMV" (12)), микровезикулы (MV (13)), OMV, экстрагированные с помощью детергента (DOMV), OMV, полученные из мутантов (m-OMV), и пузырьки, которые представляет собой выступы наружной мембраны, остающиеся присоединенными к бактериям до высвобождения в виде MV, ((14); (15)), являются частью настоящего изобретения и в данном описании совместно обозначаются OMV.
OMV настоящего изобретения можно получить из любой подходящей грамотрицательной бактерии. В качестве грамотрицательной бактерии обычно используют E. coli. Однако вместо E. coli можно использовать и другие грамотрицательные бактерии. Предпочтительно в настоящем изобретении используют грамотрицательные бактерии, которые не являются патогенными для человека. Например, бактерии могут быть комменсальными по отношению к организму человека. Однако в некоторых вариантах осуществления используют бактерии, которые обычно отсутствуют в организме человека. Примеры видов, подходящих для применения в настоящем изобретении, включают в себя виды, относящиеся к родам Escherichia, Shigella, Neisseria, Moraxella, Bordetella, Borrelia, Brucella, Chlamydia Haemophilus, Legionella, Pseudomonas, Yersinia, Helicobacter, Salmonella, Vibrio и др. В частности, бактерия может относиться к видам Shigella (таким как S. dysenteriae, S. flexneri, S. boydii или S. sonnei). Альтернативно она может относиться к видам Neisseria, в особенности, к непатогенным видам, таким как N. bacilliformis, N. cinerea, N. elongata, N. flavescens, N. lactamica, N. macacae, N. mucosa, N. polysaccharea, N. sicca или N. subflava, предпочтительно к виду N. lactamica. В качестве альтернативы можно использовать патогенные виды Neisseria, например, N. gonorrhoeae или N. meningitidis. В других примерах бактерия может относиться к видам Bordetella pertussis, Borrelia burgdorferi, Brucella melitensis, Brucella ovis, Chlamydia psittaci, Chlamydia trachomatis, Moraxella catarrhalis, Haemophilus influenzae (в том числе нетипируемые штаммы), Legionella pneumophila, Pseudomonas aeruginosa, Yersinia enterocolitica, Helicobacter pylori, Salmonella enterica (в том числе серовары typhi и typhimurium, а также серовары paratyphi и enteritidis), Vibrio cholerae, Proteus, Citrobacter, Serratia, Erwinia, Pasteurella и т. д. Также можно использовать фотосинтезирующие грамотрицательные бактерии. Как правило, бактерия относится к компетентному штамму. Это облегчает генетическую модификацию бактерии.
В конкретном варианте осуществления грамотрицательная бактерия относится к штамму, характеризующемуся "повышенным образованием везикул". Грамотрицательные бактерии с повышенным образованием везикул, которые легче и с более высоким выходом образуют везикулы, более однородные по своей природе, описаны в WO 02/062378. Например, везикулы можно получить из бактерий, выбранных из группы, включающей в себя Neisseria meningitidis, Neisseria lactamica, Neisseria gonorrhoeae, Helicobacter pylori, Salmonella typhi, Salmonella typhimurium, Vibrio cholerae, Shigella spp., Haemophilus influenzae, Bordetella pertussis, Pseudomonas aeruginosa и Moraxella catarrhalis.
В конкретном варианте осуществления бактерия представляет собой мутант E. coli ompA и/или мутант E. coli tolR. В некоторых вариантах осуществления в качестве бактерии используют E. coli BL21(DE3)ΔompA, E. coli BL21(DE3)ΔompAΔtolR, E. coli BL21(DE3)ΔtolR, E. coli ΔnlpI или E. coli ΔdegP. Символ Δ используется здесь для обозначения бактериального штамма, из которого удалена кодирующая последовательность гена, указанного после символа Δ. Так, бактериальный штамм, обозначаемый "ΔompA", не содержит кодирующую последовательность гена OmpA. Подобным образом бактериальный штамм, обозначаемый "ΔtolR", не содержит кодирующую последовательность гена tolR. Кодирующая последовательность может быть удалена полностью. Альтернативно кодирующая последовательность может быть удалена частично. Например, можно удалить N-концевую половину или С-концевую половину последовательности. Альтернативно гены ompA и/или tolR можно подвергнуть мутациям путем введения одной или нескольких замен и/или вставок.
Мутантные штаммы E. coli ΔtolR и E. coli ΔompA продуцируют OMV на более высоком уровне, чем E. coli дикого типа. Таким образом, мутация гена ompA и/или одного или нескольких компонентов комплекса Tol-Pal приводит к получению мутантной бактерии, продуцирующей повышенное число OMV по сравнению с соответствующим штаммом дикого типа, который несет ген ompA и/или комплекс Tol-Pal дикого типа. OmpA представляет собой интегральный мембранный белок и является наиболее распространенным из белков наружной мембраны E. coli. Поэтому тот факт, что E. coli, утратившие белок ompA, остаются жизнеспособными, является неожиданным. Действительно, согласно Murakami et al. (16), одиночный мутант E. coli ompA не способен поддерживать высвобождение везикул.
Гетерологичный белок
Гетерологичный белок настоящего изобретения направляется в периплазму и экспрессируется в периплазме грамотрицательных бактерий, в результате чего гетерологичный белок может присутствовать в просвете OMV. В некоторых вариантах осуществления гетерологичный белок присутствует в просвете OMV в свободной форме.
Белок может представлять собой полимер из аминокислот любой длины. Полимер из аминокислот может быть линейным или разветвленным, он может содержать модифицированные аминокислоты, и его аминокислотная последовательность может прерываться отличными от аминокислот элементами. Данный термин также включает в себя аминокислотный полимер, модифицированный естественным путем или в результате вмешательства; например, путем образования дисульфидных связей, дополнительного гликозилирования, частичного или полного дегликозилирования, липидизации, ацетилирования, фосфорилирования или любой другой манипуляции или модификации, такой как конъюгация с меченным компонентом. Данное определение также охватывает, например, белки, содержащие один или несколько аналогов аминокислот (включающие в себя, например, неприродные аминокислоты и т. д.), а также другие модификации, известные в данной области. Белки могут встречаться в виде отдельных цепей или ассоциированных цепей. Белки в соответствии с настоящим изобретением могут быть гликозилированными, причем характер гликозилирования может быть естественным или неестественным (т. е. характер гликозилирования полипептида может отличаться от характера гликозилирования соответствующего природного полипептида).
В данном описании термин "гетерологичный" означает, что белок получен из вида, отличного от вида бактерии, из которой получают OMV (гетерологичный организм). Как правило, белок представляет собой антиген, полученный из патогенного рода, отличного от рода бактерии, из которой получают OMV.
В конкретном варианте осуществления настоящего изобретения гетерологичный белок представляет собой иммуногенный белок, который может вызывать иммунный ответ у реципиента. В конкретном варианте осуществления иммуногенный белок и, следовательно, гетерологичный белок содержит антиген или состоит из антигена. Антиген может вызывать иммунный ответ против протиста, бактерии, вируса, грибка или любого другого патогена, в том числе многоклеточного патогенна, или паразита (или, в некоторых вариантах осуществления, против аллергена и в других вариантах осуществления против опухолевого антигена). Иммунный ответ может включать в себя гуморальный ответ (как правило, с участием IgG) и/или клеточный ответ. Полипептидный антиген, как правило, вызывает иммунный ответ, который распознает соответствующий бактериальный, вирусный, грибковый или паразитарный (или аллергенный или опухолевый) полипептид, а в некоторых вариантах осуществления полипептид может действовать как мимеотоп, вызывая иммунный ответ, который распознает бактериальный, вирусный, грибковый или паразитарный сахарид. Антиген, как правило, представляет собой поверхностный полипептид, такой как адгезин, гемагглютинин, оболочечный гликопротеин, гликопротеин шиповидных отростков и т. д.
В некоторых вариантах осуществления антиген вызывает иммунный ответ против одной из следующих бактерий:
Neisseria meningitidis: Подходящие антигены включают в себя, без ограничения, мембранные белки, такие как адгезины, аутотранспортеры, токсины, белки, связывающие железо, фактор H-связывающие белки (fHbp или 741), гепаринсвязывающий антиген Neisseria (NHBA или 287), NadA (или 961), 953/936 и bp серогруппы в Neisseria meningitides (fHbp). Сочетание трех подходящих полипептидов описано в публикации 17.
Streptococcus pneumoniae: Подходящие полипептидные антигены раскрыты в публикации 18. Они включают в себя, без ограничения, субъединицу RrgB пилуса, предшественник бета-N-ацетилгексозаминидазы (spr0057), spr0096, белок общего стресса GSP-781 GSP-781 (spr2021, SP2216), серин/треонин-киназу StkP (SP1732) и пневмококковый поверхностный адгезин PsaA.
Streptococcus pyogenes: Подходящие антигены включают в себя, без ограничения, полипептиды, описанные в публикациях 19 и 20, например, GAS25-574, такие как GAS25 (SEQ ID: 41, SEQ ID: 42), GAS40 (SEQ ID: 43, SEQ ID: 44, SEQ ID: 45, SEQ ID: 46, SEQ ID: 47, SEQ ID: 48, SEQ ID: 49, SEQ ID: 50, SEQ ID: 51, SEQ ID: 52, SEQ ID: 53, SEQ ID: 54, SEQ ID: 55, SEQ ID: 56, SEQ ID: 57, SEQ ID: 58, SEQ ID: 59, SEQ ID: 60, SEQ ID: 61, SEQ ID: 62, SEQ ID: 63, SEQ ID: 64, SEQ ID: 65, SEQ ID: 66, SEQ ID: 67, SEQ ID: 68, SEQ ID: 69, SEQ ID: 70), GAS57 (SEQ ID: 39, SEQ ID: 40, SEQ ID: 71, SEQ ID: 72, SEQ ID: 73, SEQ ID: 74; SEQ ID: 75), 88, 23, 99, 97, 24, 5, 208, 193, 67, 64, 101, 205, 268, 68, 189, 165 или 201.
Moraxella catarrhalis
Bordetella pertussis: Подходящие антигены коклюша включают в себя, без ограничения, бесклеточные или цельноклеточные коклюшные антигены, коклюшный голотоксин или анатоксин (PT), нитевидный гемагглютинин (FHA), пертактин и агглютиногены 2 и 3.
Staphylococcus aureus: Подходящие антигены включают в себя, без ограничения, полипептиды, описанные в публикации 21, такие как гемолизин, esxA, esxB, esxAB, феррихромсвязывающий белок (sta006) и/или липопротеин sta011.
Clostridium tetani: Типичным антигеном является столбнячный анатоксин.
Cornynebacterium diphtheria: Типичным антигеном является дифтерийный анатоксин.
Haemophilus influenzae: Подходящие антигены включают в себя, без ограничения, полипептиды, описанные в публикациях 22 и 23.
Pseudomonas aeruginosa
Streptococcus agalactiae: Подходящие антигены включают в себя, без ограничения, полипептиды, описанные в публикации 19, такие как 67, 80, 1523, 3, 328 или 211.
Chlamydia trachomatis: Подходящие антигены включают в себя, без ограничения, PepA, LcrE, ArtJ, DnaK, CT398, OmpH-подобный, L7/L12, OmcA, Atos, CT547, Eno, HtrA и MurG (например, описанные в публикации 24). LcrE (25) и HtrA (26) представляют собой два предпочтительных антигена.
Chlamydia pneumoniae: Подходящие антигены включают в себя, без ограничения, полипептиды, описанные в публикации 27.
Helicobacter pylori: Подходящие антигены включают в себя, без ограничения, CagA, VacA, NAP и/или уреазу (28).
Escherichia coli: Подходящие антигены включают в себя, без ограничения, антигены, полученные из энтеротоксигенной E. coli (ETEC), энтероагрегативной E. coli (EAggEC), диффузно-адгерентной E. coli (ОБЭП), энтеропатогенной E. coli (ЕРЕС), внекишечной патогенной E. coli (ExPEC) и/или энтерогеморрагической E. coli (EHEC). Штаммы ExPEC включают в себя уропатогенную E. coli (UPEC) и менингит/сепсисассоциированную E. coli (MNEC). Подходящие полипептидные антигены UPEC описаны в публикациях 29 и 30. Подходящие антигены MNEC раскрыты в публикации 31. Подходящим антигеном для нескольких типов E. coli является AcfD (32).
Bacillus anthracis
Yersinia pestis: Подходящие антигены включают в себя, без ограничения, антигены, описанные в публикациях 33 и 34.
Staphylococcus epidermidis, например, капсульный полисахарид типа I, II и/или III, который можно получить из штаммов ATCC-31432, SE-360 и SE-10.
Clostridium perfringens или Clostridium botulinums
Legionella pneumophila
Coxiella burnetii
Brucella, такие как B. abortus, B. canis, B. melitensis, B. neotomae, B. ovis, B. suis, B. pinnipediae.
Francisella, такие как F. novicida, F. philomiragia, F. tularensis.
Neisseria gonorrhoeae
Treponema pallidum
Haemophilus ducreyi
Enterococcus faecalis или Enterococcus faecium
Staphylococcus saprophyticus
Yersinia enterocolitica
Mycobacterium tuberculosis
Mycobacterium leprae
Rickettsia
Listeria monocytogenes
Vibrio cholerae
Salmonella typhi
Borrelia burgdorferi
Porphyromonas gingivalis
Klebsiella
Rickettsia prowazekii.
В некоторых вариантах осуществления антиген представляет собой антиген Chlamydia, Streptococcus, Pseudomonas, Shigella, Campylobacter, Salmonella, Neisseria или Helicobacter.
В некоторых вариантах осуществления антиген вызывает иммунный ответ против одного из нижеследующих вирусов:
Orthomyxovirus: Подходящие антигены могут представлять собой антигены вируса гриппа А, В или С, такие как гемагглютинин, нейраминидаза или матриксные белки М2. Если антиген представляет собой гемагглютинин вируса гриппа А, он может относиться к любому подтипу, такому как H1, H2, H3, H4, H5, H6, H7, H8, H9, H10, H11, H12, H13, H14, H15 или H16.
Вирусы Paramyxoviridae: Вирусные антигены включают в себя, без ограничения, антигены пневмовирусов (таких как респираторно-синцитиальный вирус, RSV), Rubulaviruses (таких как вирус эпидемического паротита), парамиксовирусов (таких как вирус парагриппа), метапневмовирусов и морбилливирусов (таких как вирус кори).
Poxviridae: Вирусные антигены включают в себя, без ограничения, антигены, полученные из ортопоксвируса, такого как Variola vera, включающего в себя, без ограничения, Variola major и Variola minor.
Picornavirus: Вирусные антигены включают в себя, без ограничения, антигены, полученные из пикорнавирусов, таких как энтеровирусы, риновирусы, гепарновирусы, кардиовирусы и афтовирусы. В одном варианте осуществления энтеровирус представляет собой полиовирус, например, полиовирус типа 1, типа 2 и/или типа 3. В другом варианте осуществления энтеровирус представляет собой энтеровирус EV71. В следующем варианте осуществления энтеровирус представляет собой вирус коксаки А или В.
Bunyavirus: Вирусные антигены включают в себя, без ограничения, антигены, полученные из ортобуньявирусов, таких как вирус калифорнийского энцефалита, флебовирусов, таких как вирус лихорадки долины Рифт, или найровирусов, таких как вирус конго-крымской геморрагической лихорадки.
Heparnavirus: Вирусные антигены включают в себя, без ограничения, антигены, полученные из гепарнавирусов, таких как вирус гепатита А (HAV), например, инактивированный вирус, вирус гепатита В, например поверхностные и/или внутренние антигены, или вирус гепатита С.
Filovirus: Вирусные антигены включают в себя, без ограничения, антигены, полученные из филовирусов, таких как вирус Эбола (в том числе эболавирус Заир, Берег Слоновой Кости, Рестон или Судан) или вирус, вызывающий марбургскую болезнь.
Togavirus: Вирусные антигены включают в себя, без ограничения, антигены, полученные из тогавирусов, таких как рубивирусы, альфавирусы или артеривирусы. К данному семейству относится вирус краснухи.
Flavivirus: Вирусные антигены включают в себя, без ограничения, антигены, полученные из флавивирусов, таких как вирус клещевого энцефалита (TBE), вирус денге (типа 1, 2, 3 или 4), вирус желтой лихорадки, вирус японского энцефалита, вирус болезни куасанурского леса, вирус энцефалита Западного Нила, вирус энцефалита Сент-Луис, вирус русского весенне-летнего энцефалита, вирус энцефалита Повассан.
Pestivirus: Вирусные антигены включают в себя, без ограничения, антигены, полученные из пестивирусов, таких как вирусы вирусной диареи крупного рогатого скота (BVDV), классической чумы свиней (CSFV) или пограничной болезни овец (BDV).
Hepadnavirus: Вирусные антигены включают в себя, без ограничения, антигены, полученные из гепаднавирусов, таких как вирус гепатита B. Композиция может содержать поверхностный антиген вируса гепатита В (HBsAg).
Другие вирусы гепатита: Композиция может содержать антиген вируса гепатита С, вируса гепатита дельта, вируса гепатита Е или вируса гепатита G.
Rhabdovirus: Вирусные антигены включают в себя, без ограничения, антигены, полученные из рабдовирусов, таких как лиссавирус (например, вирус бешенства) и везикуловирус (VSV). Примером антигена вируса бешенства является лиофилизированный инактивированный вирус.
Caliciviridae: Вирусные антигены включают в себя, без ограничения, антигены, полученные из калицивирусов, таких как вирус Норуолк (норовирус) и Норуолкподобные вирусы, например, гавайский вирус и вирус снежных гор.
Coronavirus: Вирусные антигены включают в себя, без ограничения, антигены, полученные из коронавируса SARS, вируса инфекционного бронхита птиц (IBV), вируса гепатита мышей (MHV) и вируса трансмиссивного гастроэнтерита свиней (TGEV). Антиген коронавируса может представлять собой полипептид шиповидного отростка.
Retrovirus: Вирусные антигены включают в себя, без ограничения, антигены, полученные из онковируса, лентивируса (например, такого как ВИЧ-1 или ВИЧ-2) или спумавируса, такого как gp120, gp140 или gp160.
Reovirus: Вирусные антигены включают в себя, без ограничения, антигены, полученные из ортореовируса, ротавируса, орбивируса или колтивируса.
Parvovirus: Вирусные антигены включают в себя, без ограничения, антигены, полученные из парвовируса В19.
Herpesvirus: Вирусные антигены включают в себя, без ограничения, антигены, полученные из человеческих герпесвирусов, таких как, например, вирусы простого герпеса (HSV) (например, HSV типов 1 и 2), вирус ветряной оспы (VZV), вирус Эпштейна-Барра (EBV), цитомегаловирус (ЦМВ), человеческий герпесвирус 6 (HHV6), человеческий герпесвирус 7 (HHV7) и человеческий герпесвирус 8 (HHV8).
Papovaviruses: Вирусные антигены включают в себя, без ограничения, антигены, полученные из папилломавирусов и полиомавирусов. (Человеческий) папилломавирус может включать в себя серотипы 1, 2, 4, 5, 6, 8, 11, 13, 16, 18, 31, 33, 35, 39, 41, 42, 47, 51, 57, 58, 63 или 65, и антигены могут быть получены, например, из одного или нескольких серотипов 6, 11, 16 и/или 18.
Adenovirus: Вирусные антигены включают в себя антигены, полученные из аденовируса серотипа 36 (Ad-36).
В некоторых вариантах осуществления антиген вызывает иммунный ответ против вируса, который инфицирует рыбу, такого как: вирус инфекционной анемии лосося (ISAV), вирус, вызывающий заболевание поджелудочной железы лосося (SPDV), вирус инфекционного некроза поджелудочной железы (IPNV), вирус, вызывающий болезнь американского проточного сома (CCV), вирус лимфоцистозной болезни рыб (FLDV), вирус инфекционного гемопоэтического некроза (IHNV), вирус герпеса кои, пикорна-подобный вирус лосося, вирус (также известный как пикорнаподобный вирус атлантического лосося), вирус озерного лосося (LSV), ротавирус атлантического лосося (ASR), вирус клубничной болезни форели (TSD), вирус опухоли кижуча (CSTV) или вирус вирусной геморрагической септицемии (VHSV).
Грибковые антигены могут быть получены из Dermatophytres, включающих в себя: Epidermophyton floccusum, Microsporum audouini, Microsporum canis, Microsporum distortum, Microsporum equinum, Microsporum gypsum, Microsporum nanum, Trichophyton concentricum, Trichophyton equinum, Trichophyton gallinae, Trichophyton gypseum, Trichophyton megnini, Trichophyton mentagrophytes, Trichophyton quinckeanum, Trichophyton rubrum, Trichophyton schoenleini, Trichophyton tonsurans, Trichophyton verrucosum, T. verrucosum var. album, var. discoides, var. ochraceum, Trichophyton violaceum, и/или Trichophyton faviforme; или из Aspergillus fumigatus, Aspergillus flavus, Aspergillus niger, Aspergillus nidulans, Aspergillus terreus, Aspergillus sydowi, Aspergillus flavatus, Aspergillus glaucus, Blastoschizomyces capitatus, Candida albicans, Candida enolase, Candida tropicalis, Candida glabrata, Candida krusei, Candida parapsilosis, Candida stellatoidea, Candida kusei, Candida parakwsei, Candida lusitaniae, Candida pseudotropicalis, Candida guilliermondi, Cladosporium carrionii, Coccidioides immitis, Blastomyces dermatidis, Cryptococcus neoformans, Geotrichum clavatum, Histoplasma capsulatum, Klebsiella pneumoniae, Microsporidia, Encephalitozoon spp., Septata intestinalis и Enterocytozoon bieneusi; реже встречаются common are Brachiola spp, Microsporidium spp., Nosema spp., Pleistophora spp., Trachipleistophora spp., Vittaforma spp Paracoccidioides brasiliensis, Pneumocystis carinii, Pythiumn insidiosum, Pityrosporum ovale, Sacharomyces cerevisae, Saccharomyces boulardii, Saccharomyces pombe, Scedosporium apiosperum, Sporothrix schenckii, Trichosporon beigelii, Toxoplasma gondii, Penicillium marneffei, Malassezia spp., Fonsecaea spp., Wangiella spp., Sporothrix spp., Basidiobolus spp., Conidiobolus spp., Rhizopus spp., Mucor spp., Absidia spp., Mortierella spp., Cunninghamella spp., Saksenaea spp., Alternaria spp., Curvularia spp., Helminthosporium spp., Fusarium spp, Aspergillus spp., Penicillium spp., Monolinia spp., Rhizoctonia spp., Paecilomyces spp., Pithomyces spp. и Cladosporium spp.
В некоторых вариантах осуществления антиген вызывает иммунный ответ против паразита из рода Plasmodium, такого как P. falciparum, P. vivax, P. malariae или P. ovale. Таким образом, изобретение можно использовать для иммунизации против малярии. В некоторых вариантах осуществления антиген вызывает иммунный ответ против паразитов семейства Caligidae, в частности, родов Lepeophtheirus и Caligus, например, морских вшей, таких как Lepeophtheirus salmonis или Caligus rogercresseyi.
В некоторых вариантах осуществления антиген вызывает иммунный ответ против пыльцевых аллергенов (аллергенов пыльцы деревьев, трав, сорняков и злаков); аллергенов насекомых или паукообразных (легочные аллергены, аллергены слюны и яда, например, клещевые аллергены, аллергены тараканов и мошек, аллергены яда насекомых семейства гименоптера); аллергены шерсти и перхоти животных (таких как собаки, кошки, лошади, крысы, мыши и т. д.) и пищевых аллергенов (например, глиадин). Важные пыльцевые аллергены деревьев, злаков и трав, например, относящихся к таксономическим отрядам букоцветных, маслиновых, сосновых и платановых, которые включают в себя, без ограничения, березу (Betula), ольху (Alnus), орех (Corylus), граб (Carpinus) и оливковое дерево (Olea), кедр (криптомерия и можжевельник), платан (Platanus), к отряду злакоцветных, включающему в себя травы родов плевел, тимофеевка, мятлик, бермудская трава, ежа, бухарник, канареечник, рожь и сорго, к отрядам астроцветных и крапивоцветных, включающим в себя лекарственные растения родов амброзия, полынь и постенница. Другие важные легочные аллергены включают в себя аллергены клещей домашней пыли родов Dermatophagoides и Euroglyphus, амбарных клещей, например, Lepidoglyphys, Glycyphagus и Tyrophagus, аллергены тараканов, мошек и блох, таких как Blatella, Periplaneta, Chironomus и Ctenocepphalides, и аллергены млекопитающих, таких как кошки, собаки и лошади, аллергены ядов, высвобождающихся при укусах насекомых, таких как насекомые таксономического отряда гименоптера, включающего в себя пчел (Apidae), ос (Vespidea) и муравьев (Formicoidae).
В некоторых вариантах осуществления антиген представляет собой опухолевый антиген, выбранный из группы, включающей в себя: (а) антигены рака яичка, такие как NY-ESO-1, SSX2, SCP1, а также полипептиды семейств RAGE, BAGE, GAGE и MAGE, такие как GAGE-1, GAGE-2, MAGE-1, MAGE-2, MAGE-3, MAGE-4, MAGE-5, MAGE-6 и MAGE- 12 (которые можно использовать, например, для лечения меланомы, опухолей легкого, головы и шеи, NSCLC, молочной железы, желудочно-кишечного тракта и мочевого пузыря; (b) мутантные антигены, например, р53 (ассоциированный с разными солидными опухолями, такими как рак толстой кишки, легких, головы и шеи), P21/РАН (ассоциированный, например, с меланомой, раком поджелудочной железы и толстой кишки), CDK4 (ассоциированный, например, с меланомой), MUM1 (ассоциированный, например, с меланомой), каспаза-8 (ассоциированная, например, с раком головы и шеи), CIA 0205 (ассоциированный, например, с раком мочевого пузыря), HLA-A2-R1701, бета-катенин (ассоциированный, например, с меланомой), TCR (ассоциированный, например, с Т-клеточной неходжкинской лимфомой), BCR-abl (ассоциированный, например, с хроническим миелолейкозом), триозофосфатизомераза, KIA 0205, CDC-27 и LDLR-FUT; (c) антигены, экспрессирующиеся на повышенном уровне, такие как галектин 4 (ассоциированный, например, с колоректальным раком), галектин 9 (ассоциированный, например, с болезнью Ходжкина), протеиназа 3 (ассоциированная, например, с хроническим миелолейкозом), WT1 (ассоциированный, например, с разными лейкозами), карбоангидраза (ассоциированная, например, с раком почки), альдолаза A (ассоциированная, например, с раком легких), PRAME (ассоциированный, например, с меланомой), HER-2/neu (ассоциированный, например, с раком молочной железы, толстой кишки, легких и яичников), маммаглобин, альфа-фетопротеин (ассоциированные, например, с гепатомой), KSA (ассоциированный, например, с колоректальным раком), гастрин (ассоциированный, например, с раком поджелудочной железы и желудка), каталитический белок теломераза, MUC-1 (ассоциированный, например, с раком молочной железы и яичников), G-250 (ассоциированный, например, с почечноклеточной карциномой), P53 (ассоциированный, например, с раком молочной железы, толстой кишки), а также карциноэмбриональный антиген (ассоциированный, например, с раком молочной железы, раком легких, раком желудочно-кишечного тракта, таким как колоректальный рак); (d) общие антигены, например, антигены меланомы-дифференциации меланоцитов, такие как MART-1/Melan A, gp100, MC1R, рецептор гормона, стимулирующего меланоциты, тирозиназа, родственный тирозиназе белок 1/TRP1 и родственный тирозиназе белок 2/TRP2 (ассоциированный, например, с меланомой); (e) антигены простаты, такие как PAP, PSA, PSMA, PSH-P1, PSM-P1, PSM-P2, ассоциированные, например, с раком простаты; (f) идиотипы иммуноглобулинов (ассоциированные, например, с миеломой и В-клеточными лимфомами). В некоторых вариантах осуществления опухолевые антигены включают в себя, без ограничения, p15, Hom/Mel-40, H-Ras, E2A-PRL, H4-RET, IGH-IGK, MYL-RAR, антигены вируса Эпштейна-Барра, EBNA, антигены человеческого папилломавируса (HPV), в том числе E6 и E7, антигены вирусов гепатита В и С, антигены лимфотропного Т-клеточного вируса человека, TSP-180, p185erbB2, p180erbB-3, c-met, mn-23H1, TAG-72-4, CA 19-9, CA 72-4, CAM 17.1, NuMa, K-ras, p16, TAGE, PSCA, CT7, 43-9F, 5T4, 791 Tgp72, бета-HCG, BCA225, BTAA, CA 125, CA 15-3 (CA 27.29\BCAA), CA 195, CA 242, CA-50, CAM43, CD68\KP1, CO-029, FGF-5, Ga733 (EpCAM), HTgp-175, M344, MA-50, MG7-Ag, MOV18, NB/70K, NY-CO-1, RCAS1, SDCCAG16, TA-90 (Mac-2-связывающий белок/циклофилин С-ассоциированный белок), TAAL6, TAG72, TLP, TPS и т. п.
В следующем конкретном примере гетерологичный белок представляет собой β-лактамазу (TEM1), fHbp Neisseria meningitides, двойной мутант внеклеточного холестеринзависимого стрептолизина О (Slo-dm) Streptococcus pyogenes, серин-протеазу клеточной оболочки SpyCep Streptococcus pyogenes или предполагаемый поверхностный эксклюзионный белок Spy0269 Streptococcus pyogenes.
Гетерологичный белок может представлять собой растворимый белок, периферийный мембранный белок или интегральный мембранный белок, экспрессируемый в организме, гетерологичном по отношению к организму, из которого его получают, т. е. в котором он присутствует в природе. Например, если гетерологичный белок представляет собой белок грамотрицательной бактерии, он может включать в себя цитоплазматический, периплазматический или мембранно-связанный белок нативной грамотрицательной бактерии. Однако, если гетерологичный белок присутствует в OMV, он может находиться в просвете OMV, и предпочтительно он находится в просвете OMV в свободной форме. Таким образом, гетерологичный белок может быть модифицирован по сравнению с белком дикого типа, например, путем удаления какого-либо мембранного якоря (якорей).
Термин "в просвете" OMV охватывает как белки, связанные с мембраной, но не экспонированные на поверхности, так и белки, которые находятся в просвете OMV в свободной форме. В соответствии с настоящим изобретением гетерологичный белок, как правило, находится в просвете OMV в свободной форме. Термин "находится в просвете в свободной форме" означает, что гетерологичный белок не является интегральным белком мембраны OMV. Интегральная ассоциация с мембраной описывает такую связь белков с мембраной, которая требует применения детергента или другого неполярного растворителя для отделения белка от мембраны. Обзор по мембранным якорям, обеспечивающим интегральную ассоциацию с мембраной, можно найти в публикации 35. Белок, который находится в просвете OMV в свободной форме, может быть связан с мембраной или интегральным мембранным белком путем нековалентных взаимодействий или он может быть совсем не связан с мембраной OMV. Например, белок может быть слабо или временно связан с мембраной путем гидрофобных, электростатических, ионных и/или других нековалентных взаимодействий с липидным бислоем и/или интегральным белком.
Одно из преимуществ того, что гетерологичный белок находится в просвете OMV, а не является связанным с мембраной и экспонированным, заключается в том, что он может быть защищен от деградации под действием протеаз in vivo. Данная защита, в свою очередь, может привести к более эффективной активации В-клеток.
В конкретном варианте осуществления гетерологичный белок представляет собой растворимый белок. Термин "растворимый белок" означает, что белок не связан с липидной мембраной. Растворимый белок не содержит мембранный якорь, такой как пептидный трансмембранный домен, другой пептидный домен, способный связываться с мембраной, или непептидный мембранный якорь, такой как липид.
OMV способны вызывать иммунный ответ на гетерологичный белок при введении млекопитающему. Иммунный ответ может представлять собой клеточный или гуморальный иммунный ответ. Как правило, иммунный ответ является гуморальным.
В одном варианте осуществления OMV настоящего изобретения способны вызывать иммунный ответ против патогена, из которого получен гетерологичный белок. Например, гетерологичный белок предпочтительно вызывает Т-клеточный иммунный ответ, который может нейтрализовать инфекцию и/или вирулентность патогена, из которого получен гетерологичный белок. Таким образом, гетерологичные белки, предпочтительные для применения в настоящем изобретении, представляют собой белки, которые распознаются клеточной иммунной системой при инфицировании представляющим интерес патогеном. Более предпочтительными являются гетерологичные белки, которые вызывают защитный Т-клеточный иммунный ответ против представляющего интерес патогена.
В одном варианте осуществления OMV настоящего изобретения способны индуцировать образование антител, распознающих патоген, из которого получен гетерологичный белок. Например, гетерологичный белок предпочтительно индуцирует образование антител, которые могут связываться с патогеном и предпочтительно нейтрализуют инфекцию и/или вирулентность патогена, из которого получен гетерологичный белок. Таким образом, гетерологичные белки, предпочтительные для применения в настоящем изобретении, представляют собой белки, которые распознаются антисывороткой после инфицирования представляющим интерес патогеном. Более предпочтительными являются гетерологичные белки, которые вызывают защитный иммунный ответ против представляющего интерес патогена.
В некоторых вариантах осуществления гетерологичный белок является иммуногенным, если он присутствует в OMV, но не является иммуногенным, если его вводят в очищенном виде.
В одном варианте осуществления гетерологичные белки настоящего изобретения являются функционально активными в просвете OMV и/или после высвобождения из просвета OMV (например, в результате опосредованного детергентом разрушения OMV). Функциональная активность является показателем того, что гетерологичный белок имеет правильную укладку и такую же или по существу такую же третичную и четвертичную структуру, как и тот же белок в нативном состоянии. Термин "функционально активный" означает, что гетерологичный белок сохраняет, по меньшей мере, 50% или более, по меньшей мере, одной биологической активности того же белка при экспрессии в нативном окружении (например, в организме, из которого его получают). Например, гетерологичный белок может считаться функционально активным, если он сохраняет по меньшей мере 50%, 60%, 70%, 80%, 90% или более, по меньшей мере, одной биологической активности того же белка при экспрессии в нативном окружении.
В вариантах осуществления, в которых гетерологичный белок содержит или включает в себя фрагмент белка дикого типа или его вариант, фрагмент или вариант могут быть функционально активными. Под термином "фрагмент белка дикого типа" подразумевается, что гетерологичный белок содержит или включает в себя, по меньшей мере, 7 последовательных аминокислот белка дикого типа. В некоторых вариантах осуществления указанный фрагмент содержит по меньшей мере 7, 8, 9, 10, 20, 30, 40 или более аминокислот белка дикого типа. Фрагмент может содержать по меньшей мере 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или более белка дикого типа.
Предпочтительно фрагмент представляет собой иммуногенный фрагмент гетерологичного белка. Термин "иммуногенный фрагмент" означает, что фрагмент и гетерологичный белок содержат, по меньшей мере, один общий эпитоп. Термин "эпитоп" относится к эпитопам любых видов и включает в себя как В-клеточные, так и Т-клеточные эпитопы, а также как линейные, так и прерывистые эпитопы. В одном варианте осуществления антитело, которое специфически связывается с гетерологичным белком, также специфически связывается с иммуногенным фрагментом, т. е. и гетерологичный белок, и его иммуногенный фрагмент содержат эпитоп, с которым связывается указанное антитело. Под термином "специфически связывается" подразумевается, что антитела связываются с гетерологичным белком настоящего изобретения со значительно большим сродством, чем с BSA. Предпочтительно сродство связывания с гетерологичным белком, по меньшей мере, в 100, 103, 104, 105, 106 и т. д. раз превышает сродство связывания с BSA.
Эпитопы, присутствующие в гетерологичных белках, можно определить и/или предсказать с помощью любых способов, известных в данной области. Например, можно использовать программное обеспечение для прогнозирования эпитопов, такое как EpiToolKit, которое представляет собой веб-сервер для вычислительной иммуномики (36). Указанное программное обеспечение для прогнозирования эпитопов предоставляет несколько методов прогнозирования потенциальных Т-клеточных эпитопов, связывающих как МНС класса I, так и МНС класса II.
Наличие В-клеточных эпитопов также можно предсказать с помощью любых известных в данной области методов, например, описанных в публикациях (37, 38 и 39). Данные методы позволяют предсказать наличие непрерывных линейных эпитопов и/или прерывистых эпитопов.
Под "вариантом белка дикого типа" подразумевают гетерологичный белок, содержащий или включающий в себя полноразмерный белок, например, белок с таким же числом аминокислот, как и белок дикого типа, или фрагмент белка дикого типа, который содержит одно или несколько изменений аминокислотной последовательности по сравнению с последовательностью дикого типа. Последовательность варианта может быть идентична последовательности белка дикого типа, по меньшей мере, на 50%, 60%, 70%, 80%, 90%, 95% или более. В некоторых вариантах осуществления вариант также является функционально активным.
Гетерологичный белок может быть гибридизован с партнером по гибридизации, т. е. гетерологичный белок может быть частью гибридного белка. Гибридные белки могут содержать последовательность -X-Y- или -Y-X-, где -X- представляет собой описанный выше гетерологичный белок, а -Y- представляет собой другую полипептидную последовательность. В одном конкретном варианте осуществления -Y- представляет собой белковый маркер, обеспечивающий детектирование гетерологичного белка, такой как 6xHis, FLAG, HA, GST, GFP, или другой флуоресцентный белок, и/или люцифераза, или любой подходящий полипептид, который способствует функционированию гетерологичного белка. Если гетерологичный белок является частью гибридного белка, весь гибридный белок может находиться в просвете OMV. В некоторых вариантах осуществления гибридный белок может находиться в просвете OMV в свободной форме.
OMV настоящего изобретения содержит, по меньшей мере, один гетерологичный белок в своем просвете. Так, OMV может содержать, по меньшей мере, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более гетерологичных белков, которые присутствуют в просвете предпочтительно в свободной форме. Помимо, по меньшей мере, одного гетерологичного белка в просвете OMV настоящего изобретения также может содержать, по меньшей мере, один гетерологичный белок, ассоциированный с мембраной OMV. Например, OMV настоящего изобретения может содержать, по меньшей мере, один гетерологичный белок в просвете и 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более гетерологичных белков, ассоциированных с мембраной OMV.
В конкретном варианте осуществления гетерологичные белки содержат двойной мутант внеклеточного холестеринзависимого стрептолизина О (Slo-dm) Streptococcus pyogenes и предполагаемый поверхностный эксклюзионный белок Spy0269 Streptococcus pyogenes. В другом конкретном варианте осуществления гетерологичные белки содержат двойной мутант внеклеточного холестеринзависимого стрептолизина O (Slo-dm) Streptococcus pyogenes, серин-протеазу клеточной оболочки SpyCEP Streptococcus pyogenes и предполагаемый поверхностный эксклюзионный белок Spy0269 Streptococcus pyogenes.
Способы получения OMV настоящего изобретения
Изобретение также предлагает способ получения OMV настоящего изобретения, причем способ включает в себя стадию экспрессии гетерологичного белка в периплазме грамотрицательных бактерий.
В конкретном варианте осуществления экспрессию гетерологичного белка в периплазме грамотрицательных бактерий осуществляют с использованием вектора экспрессии, содержащего последовательность нуклеиновой кислоты, кодирующую гетерологичный белок, функционально связанную с нуклеиновой кислотой, кодирующей сигнальную последовательность периплазматического белка.
Направленность гетерологичных белков можно достичь путем гибридизации сигнальной последовательности белка, который в природе присутствует в периплазме и/или OMV, с гетерологичным белком. Транспортировку белка через внутреннюю мембрану в периплазму можно осуществить, например, по одному из трех путей: SecB-зависимый (SEC), опосредованный сигналраспознающей частицей (SRP) или система перемещения с двойным аргинином (TAT). Можно использовать любой из этих путей.
Примером периплазматической сигнальной последовательности, подходящей для применения в настоящем изобретении, является сигнальная последовательность OmpA. Однако можно использовать и другие подходящие сигнальные последовательности, включающие в себя сигнальную последовательность Tat и сигнальную последовательность DsbA. Экспорт в периплазму можно оптимизировать с использованием ряда векторов, каждый из которых обеспечивает отдельный путь экспорта. Например, для оптимизации перемещения гетерологичного белка в периплазму можно использовать векторы экспрессии сигнальной последовательности ACES (40).
В некоторых вариантах осуществления нативную сигнальную последовательность гетерологичного белка заменяют сигнальной последовательностью периплазматического белка. В других вариантах осуществления гетерологичный белок гибридизуют с сигнальной последовательностью периплазматического белка без замены нативной сигнальной последовательности, если она присутствует.
Конкретные варианты осуществления данного аспекта изобретения включают в себя применение вектора экспрессии, содержащего последовательность нуклеиновой кислоты, кодирующую сигнальную последовательность OmpA, функционально связанную с нуклеиновой кислотой, кодирующей гетерологичный белок, например, плазмиды рЕТ-OmpA, показанной на фиг. 1. В данном варианте осуществления сигнальная последовательность OmpA может содержать нуклеотидную последовательность ATGAAAAAGACAGCTATCGCGATTGCAGTGGCACTGGCTGGTTTCGCTACCGTAGCGCAGG CC (SEQ ID NO: 1). В этом варианте осуществления плазмиду получают из pET21b. Однако можно использовать и любую другую подходящую основу плазмиды, известную в данной области. Подходящие основы плазмид включают в себя pGEX, pUC19, pALTR, pET, pQE, pLEX, pHAT или любой другой плазмидный вектор, способный к репликации в граммотрицательных бактериях.
Любые грамотрицательные бактерии, способные продуцировать OMV, например упомянутые в данном документе, можно трансформировать описанными выше векторами экспрессии, чтобы получить OMV, содержащие в просвете гетерологичный белок, который предпочтительно находится в свободной форме.
Способы получения OMV известны в данной области, и любой подходящий способ можно использовать для получения OMV настоящего изобретения. Указанные способы обычно включают в себя стадию получения везикул из культуры бактерий. OMV можно получить путем разрушения или блеббинга наружной мембраны бактерий с образованием везикул. OMV также можно получить из бактерий искусственным путем, например, путем экстракции OMV из менингококков «ΔGNA33» с использованием саркозила, как описано в ссылке 41. "Нативные OMV" ("NOMV" (42)), микровезикулы (MV (43)), OMV, экстрагированные с помощью детергента (DOMV), OMV, полученные из мутантов (m-OMV), и пузырьки, которые представляют собой выступы наружной мембраны, остающиеся присоединенными к бактериям до высвобождения в виде MV, ((44); (45)), являются частью настоящего изобретения и в данном описании совместно обозначаются OMV.
OMV (в том числе пузырьки, MV и NOMV) включают в себя природные мембранные везикулы, которые спонтанно образуются во время роста бактерий и высвобождаются в культуральную среду. Предпочтительно OMV настоящего изобретения представляют собой природные OMV, поскольку отделение спонтанно высвобожденных OMV от культуральной среды легче проводить, чем методы, которые включают в себя преднамеренное разрушение наружной мембраны (например, путем обработки детергентом или ультразвуком) с получением искусственно индуцированных OMV. Кроме того, они практически не содержат внутреннюю мембрану и цитоплазматические примеси. OMV, диаметр которых обычно составляет 35-120 нм по данным электронной микроскопии, например 50 нм, можно очистить от культуральной среды. В идеале очистка включает в себя отделение OMV от живых и/или интактных бактерий, например, путем фильтрования по размеру с использованием, например, фильтра 0,22 мкм, который пропускает OMV, но не пропускает интактные бактерии, или путем центрифугирования с низкой скоростью, которая позволяет осадить клетки, оставляя везикулы в суспензии. Предпочтительный способ, включающий в себя двухстадийный процесс фильтрации по размеру, описан в публикации 46.
Таким образом, в отличие от культуральной среды, OMV-содержащие композиции настоящего изобретения, как правило, практически не содержат целых бактерий, ни живых, ни мертвых. Размер OMV означает, что их можно легко отделить от целых бактерий фильтрацией, например, с помощью метода, обычно используемого для стерилизации фильтрацией.
Хотя стандартные фильтры 0,22 мкм пропускают OMV, они могут быстро засоряться другими веществами, поэтому перед использованием фильтра 0,22 мкм предпочтительно провести последовательные стадии стерилизации фильтрованием через ряд фильтров с уменьшением размера пор. Примеры предшествующих фильтров включают в себя фильтры с размером пор 0,8 мкм, 0,45 мкм и т. д.
В альтернативном варианте осуществления OMV можно получить из бактерий искусственным путем, например, путем обработки детергентом (таким как дезоксихолат или саркозил) или с помощью способов, в которых не используются детергенты (например, см. публикацию 47). Способы получения OMV включают в себя обработку бактерий детергентом на основе солей желчных кислот (таких как соли литохолевой кислоты, хенодезоксихолевой кислоты, урсодезоксихолевой кислоты, дезоксихолевой кислоты, холевой кислоты, урсохолевой кислоты и т. д., причем для обработки Neisseria предпочтительно используют дезоксихолат натрия (48 и 49)) при достаточно высоком рН, чтобы не осаждался детергент (50). Другие методы, которые позволяют получить OMV по существу в отсутствие детергента (47), включают в себя обработку ультразвуком, гомогенизацию, микропсевдоожижение, кавитацию, осмотический шок, перемалывание, френч-пресс, смешивание и т. д. Способы, в которых детергент не используется или используется в низких количествах, позволяют сохранить полезные антигены, такие как NspA (47). Пример такого способа включает в себя применение буфера для экстракции OMV с содержанием дезоксихолата примерно 0,5% или ниже, таким как примерно 0,2%, примерно 0,1%, <0,05% или нуль.
Подходящий способ получения OMV, описанный в публикации 51, включает в себя ультрафильтрацию неочищенных OMV вместо высокоскоростного центрифугирования. Данный способ может включать в себя стадию ультрацентрифугирования после проведения ультрафильтрации.
Изобретение предлагает OMV, полученные или которые можно получить с помощью описанных выше способов.
Фармацевтические композиции
Настоящее изобретение относится к фармацевтической композиции, содержащей: (a) OMV настоящего изобретения и (b) фармацевтически приемлемый носитель. Настоящее изобретение также предлагает способ получения такой композиции, включающий в себя стадию смешивания OMV настоящего изобретения с фармацевтически приемлемым носителем.
Изобретение также предлагает контейнер (например, флакон) или устройство доставки (например, шприц), предварительно заполненный фармацевтической композицией настоящего изобретения. Изобретение также относится к способу получения такого контейнера или устройства, включающему в себя введение в контейнер или устройство везикулосодержащей композиции настоящего изобретения.
Иммуногенная композиция может содержать фармацевтически приемлемый носитель, который может представлять собой любое вещество, которое само по себе не индуцирует продукцию антител, вредных для пациента, получающего композицию, и которое при введении не обладает чрезмерной токсичностью. Фармацевтически приемлемые носители могут включать в себя жидкости, такие как вода, физиологический раствор, глицерин и этанол. Такие среды также могут содержать вспомогательные вещества, такие как смачивающие или эмульгирующие средства, забуферивающие средства и т. п. Подробное описание подходящих носителей можно найти в публикации 52.
Бактерии могут поражать разные участки тела, и поэтому композиции настоящего изобретения могут быть получены в виде разных форм. Например, композиции можно получить в виде препаратов для инъекций, включающих в себя жидкие растворы или суспензии. Также можно получить твердые формы, подходящие для растворения или суспендирования в жидких средах перед инъекцией. Композиция может находиться в виде формы для местного введения, такой как мазь, крем или порошок. Кроме того, композиция может находиться в виде формы для перорального введения, такой как таблетка или капсула или сироп (необязательно ароматизированный). Композиция может быть получена в виде формы для легочного введения, такой как, например, ингалятор, с использованием мелкого порошка или спрея. Композиция может находиться в виде суппозитория или пессария. Композиция может быть получена для назального, ушного или глазного введения, например, в виде капель.
Фармацевтический носитель может включать в себя термозащитное вещество, которое может быть особенно полезным в адъювантсодержащих композициях (в частности, в композициях, которые содержат минеральный адъювант, такой как соль алюминия). Как описано в публикации 53, жидкое термозащитное вещество можно добавить к водной композиции вакцины для снижения точки замерзания, например, чтобы уменьшить температуру замерзания до температуры ниже 0°С. Как следствие, композицию можно хранить при температуре ниже 0°С, но выше точки замерзания, что позволяет уменьшить термическое разрушение. Термозащитное средство позволяет замораживать композицию, предотвращая при этом агломерацию или осаждение используемых в качестве адъювантов минеральных солей после замораживания и оттаивания, а также может защитить композицию от повышенных температур, например, выше 40°С. Исходную водную вакцину и жидкое термозащитное вещество можно смешать таким образом, чтобы жидкое термозащитное вещество составляло 1-80% от объема конечной смеси. Подходящие термозащитные вещества должны быть безопасными при введении человеку, легкосмешиваемыми с водой/растворимыми в воде и не должны приводить к разрушению других компонентов (таких как антиген и адъювант) композиции. Примеры включают в себя глицерин, пропиленгликоль и/или полиэтиленгликоль (PEG). Подходящие PEG могут иметь среднюю молекулярную массу в диапазоне 200-20000 Да. В предпочтительном варианте осуществления полиэтиленгликоль может иметь среднюю молекулярную массу приблизительно 300 Да ("PEG-300").
Композиция предпочтительно является стерильной. Предпочтительно она не содержит пирогенов. Предпочтительно композиция является забуференной и имеет рН, например, в диапазоне от 6 до 8, обычно около 7. Композиции настоящего изобретения могут быть изотоническими по отношению к организму человека.
Иммуногенные композиции содержат иммунологически эффективное количество иммуногенных везикул, а также любые другие из указанных компонентов, если это необходимо. Термин "иммунологически эффективное количество" означает, что введение такого количества индивидууму, либо в виде однократной дозы, либо в виде одной из серии доз, является эффективным для лечения или профилактики. Указанное количество варьирует в зависимости от состояния здоровья и физического состояния подлежащего лечению индивидуума, возраста, таксономической группы подлежащего лечению индивидуума (например, отличный от человека примат, примат и т. д.), способности иммунной системы индивидуума синтезировать антитела, желаемой степени защиты, композиции вакцины, оценки лечащим врачом медицинской ситуации и прочих факторов. Предположительно данное количество варьирует в относительно широком диапазоне, который может быть определен с помощью рутинных испытаний.
Предыдущая работа с везикулосодержащей вакциной (например, против менингококка) предлагает фармацевтическое, позологическое и препаративное руководство по получению композиций настоящего изобретения. Концентрация везикул в композициях настоящего изобретения, как правило, находится в диапазоне от 10 до 500 мкг/мл, предпочтительно от 25 до 200 мкг/мл и более предпочтительно она составляет примерно 50 мкг/мл или примерно 100 мкг/мл (в пересчете на общий белок везикул). Как правило, для инъекции используют объем дозы 0,5 мл.
Композицию можно вводить в сочетании с другими иммунорегуляторными средствами.
Адъюванты, которые можно использовать в композициях настоящего изобретения, включают в себя, без ограничения:
А. Минералсодержащие композиции
Минералсодержащие композиции, подходящие для применения в качестве адъювантов в данном изобретении, включают в себя минеральные соли, такие как соли алюминия и соли кальция. Изобретение включает в себя минеральные соли, такие как гидроксиды (например, оксигидроксиды), фосфаты (например, гидроксифосфаты, ортофосфаты), сульфаты и т. д. (например, см. главы 8 и 9 публикации 57), или смесей разных минеральных соединений, где соединения имеют любую подходящую форму (например, гелеобразную, кристаллическую, аморфную и т. д.), а предпочтительными являются соединения, способные к адсорбции. Минералсодержащие композиции также могут находиться в виде частицы соли металла.
Адъюванты, известные как "гидроксид алюминия", как правило, представляют собой соли оксигидроксида алюминия, которые обычно, по меньшей мере частично, являются кристаллическими. Оксигидроксид алюминия, имеющий формулу AlO(OH), можно отличить от других соединений алюминия, таких как гидроксид алюминия Al(OH)3, с помощью инфракрасной (ИК) спектроскопии, в частности, по присутствию полосы поглощения при 1070 см-1 и большого плеча при 3090-3100 см-1 (глава 9 публикации 57). Степень кристалличности адъюванта гидроксида алюминия соответствует ширине дифракционной полосы при половине высоты (WHH), причем частицы с низкой степенью кристалличности характеризуются более сильным уширением линии вследствие меньших размеров кристаллитов. Площадь поверхности увеличивается по мере увеличения WHH, и отмечено, что адъюванты с более высокими значениями WHH характеризуются более высокой способностью к адсорбции антигена. Адъюванты на основе гидроксида алюминия обычно имеют волокнистую морфологию (ее можно увидеть, например, на микрофотографии, полученной с помощью трансмиссионного электронного микроскопа). pI адъювантов на основе гидроксида алюминия обычно равен примерно 11, т. е. сам адъювант имеет положительный поверхностный заряд при физиологических значениях рН. Адсорбционная емкость адъювантов на основе гидроксида алюминия находится в диапазоне 1,8-2,6 мг белка на мг Al при рН 7,4.
Адъюванты, известные как "фосфат алюминия", как правило, представляют собой гидроксифосфаты алюминия, часто также содержащие небольшое количество сульфата (т. е. сульфат гидроксифосфата алюминия). Их можно получить осаждением, причем условия реакции и концентрации, используемые в процессе осаждения, влияют на степень замещения фосфата на гидроксил в молекуле соли. Гидроксифосфаты обычно характеризуются молярным отношением PO4/Al от 0,3 до 1,2. Гидроксифосфаты можно отличить от чистого AlPO4 по присутствию гидроксильных групп. Например, полоса в ИК-спектре при 3164 см-1 (например, при 200°C) указывает на присутствие структурных гидроксилов (гл. 9 публикации 57).
Молярное отношение PO4/Al3+ в адъюванте на основе фосфата алюминия обычно находится в диапазоне от 0,3 до 1,2, предпочтительно от 0,8 до 1,2 и более предпочтительно оно составляет 0,95±0,1. Фосфат алюминия обычно является аморфным, в особенности в случае гидроксифосфатных солей. Типичный адъювант представляет собой аморфный гидроксифосфат алюминия с молярным соотношением PO4/Al от 0,84 до 0,92, при концентрации 0,6 мг Al3+/мл. Фосфат алюминия обычно находится в виде частиц (например, пластинчатой морфологии, которую можно видеть на микрофотографии, полученной с помощью трансмиссионного электронного микроскопа). Как правило, после адсорбции антигена диаметр частиц находится в диапазоне 0,5-20 мкм (например, 5-10 мкм). Адсорбционная емкость адъювантов на основе фосфата алюминия находится в диапазоне 0,7-1,5 мг белка на мг Al+++ при рН 7,4.
Точка нулевого заряда (PZC) фосфата алюминия находится в обратной зависимости от степени замещения фосфата на гидроксил, а степень замещения может варьировать в зависимости от условий реакции и концентрации реагентов, используемых для получения соли осаждением. PZC также можно изменить путем изменения концентрации свободных ионов фосфата в растворе (больше фосфата = более кислая PZC) или путем добавления буфера, такого как гистидиновый буфер (делает PZC более основной). Фосфаты алюминия, используемые в соответствии с настоящим изобретением, как правило, имеют PZC в диапазоне от 4,0 до 7,0, более предпочтительно от 5,0 до 6,5, например, PZC может составлять примерно 5,7.
Суспензии алюминиевых солей, используемые для получения композиций настоящего изобретения, могут содержать буфер (например, фосфатный или гистидиновый или трис-буфер), но это не всегда необходимо. Предпочтительно суспензии являются стерильными и не содержат пирогенов. Суспензия может содержать свободные гидратированные фосфатионы, например, присутствующие в концентрации от 1,0 до 20 мМ, предпочтительно от 5 до 15 мМ, и более предпочтительно их концентрация оставляет примерно 10 мМ. Суспензии также могут содержать хлорид натрия.
В одном варианте осуществления адъювантный компонент включает в себя смесь как гидроксида алюминия, так и фосфата алюминия. В этом случае содержание фосфата может превышать содержание гидроксида, например, их массовое соотношение может составлять, по меньшей мере, 2:1, например, >5:1, >6:1, >7:1, >8:1, >9:1 и т. д.
Концентрация Al+++ в композиции, предназначенной для введения пациенту, предпочтительно составляет менее 10 мг/мл, например, она может быть ≤5 мг/мл, ≤4 мг/мл, ≤3 мг/мл, ≤2 мг/мл, ≤1 мг/мл и т. д. Предпочтительно концентрация находится в диапазоне от 0,3 до 1 мг/мл. Предпочтительная максимальная концентрация составляет <0,85 мг/дозу.
B. Масляные эмульсии
Композиции масляных эмульсий, подходящие для применения в качестве адъювантов в настоящем изобретении, включают в себя скваленводные эмульсии, такие как MF59 (глава 10 публикации 57; см. также публикацию 54) (5% сквалена, 0,5% твина 80 и 0,5% спана 85, измельченных до субмикронных частиц с помощью микрофлюидизатора). Кроме того, можно использовать полный адъювант Фрейнда (CFA) и неполный адъювант Фрейнда (IFA).
Известны разные подходящие эмульсии масло-в-воде, которые, как правило, содержат, по меньшей мере, одно масло и, по меньшей мере, одно поверхностно-активное вещество, причем масло (масла) и поверхностно-активное вещество (поверхностно-активные вещества) являются биоразлагаемыми (метаболизируемыми) и биосовместимыми. Диаметр капелек масла в эмульсии, как правило, составляет менее 5 мкм, предпочтительно он находится на субмикронном уровне, где указанных маленьких размеров достигают с помощью микрофлюидизатора, получая стабильные эмульсии. Капельки размером менее 220 нм являются предпочтительными, поскольку их можно подвергать стерилизации фильтрацией.
В настоящем изобретении можно использовать масла, например, животного (такие как рыбий жир) или растительного происхождения. Источники растительных масел включают в себя орехи, семена и зерна. Наиболее широкодоступны арахисовое масло, соевое масло, кокосовое масло и оливковое масло, относящиеся к ореховым маслам. Можно использовать масло жожоба, например, полученное из бобов жожоба. Масла из семян включают в себя сафлоровое масло, хлопковое масло, подсолнечное масло, кунжутное масло и т. п. В группе зерновых наиболее доступным является кукурузное масло, однако можно использовать масла и из других зерновых культур, таких как пшеница, овес, рожь, рис, полевичка абиссинская, тритикале и т. п. Эфиры жирных кислот, содержащих 6-10 атомов углерода, и глицерина или 1,2-пропандиола, хотя и не встречаются в природе в маслах из семян, могут быть получены путем гидролиза, разделения и этерификации соответствующих веществ, присутствующих в ореховых маслах и маслах из семян. Жиры и масла из молока млекопитающих являются метаболизируемыми и, следовательно, могут использоваться для осуществления настоящего изобретения. Процедуры разделения, очистки, омыления, а также другие способы, используемые для получения чистых масел из животных источников, хорошо известны в данной области. Большинство рыб содержит метаболизируемые масла, которые можно легко извлечь. Примерами рыбьих жиров, которые можно использовать в настоящем изобретении, являются масло печени трески, масло печени акулы и китовый жир, такой как спермацет. Ряд масел с разветвленными цепями синтезируют с помощью биохимических способов из 5-углеродных изопреновых элементов и, как правило, называют терпеноидами. Масло печени акулы содержит разветвленный, ненасыщенный терпеноид, известный как сквален, 2,6,10,15,19,23-гексаметил-2,6,10,14,18,22-тетракозагексаен. Другие предпочтительные масла включают в себя токоферолы (см. ниже). Особенно предпочтительными являются эмульсии масло-в- воде, содержащие сквален. Можно использовать смеси масел.
Поверхностно-активные вещества можно классифицировать по "HLB" (гидрофильно/липофильный баланс). HLB предпочтительных поверхностно-активных веществ настоящего изобретения составляет, по меньшей мере, 10, предпочтительно, по меньшей мере, 15, более предпочтительно, по меньшей мере, 16. В данном изобретении можно использовать поверхностно-активные вещества, включающие в себя, без ограничения: поверхностно-активные сложные эфиры полиоксиэтиленсорбитана (обычно называемые твинами), в особенности полисорбат 20 и полисорбат 80; сополимеры этиленоксида (ЕО), пропиленоксида (PO) и/или бутиленоксида (ВО), продаваемые под торговым наименованием DOWFAX™, такие как линейные блок-сополимеры ЕО/PO; октоксинолы, которые могут различаться по количеству повторяющихся этоксильных (окси-1,2-этандиил) групп, среди которых особый интерес представляет октоксинол-9 (тритон X-100, или трет-октилфеноксиполиэтоксиэтанол); (октилфенокси)полиэтоксиэтанол (IGEPAL CA-630/NP-40); фосфолипиды, такие как фосфатидилхолин (лецитин); простые жирные эфиры полиоксиэтилена, полученные из лаурилового, цетилового, стеарилового и олеилового спиртов (известные как поверхностно-активные вещества Brij), такие как монолауриловый эфир триэтиленгликоля (Brij 30); и сложные эфиры сорбитана (широко известные как спаны), такие как триолеат сорбитана (спан 85) и монолаурат сорбитана. Поверхностно-активные вещества, предпочтительно используемые для получения эмульсий, включают в себя твин 80 (моноолеат полиоксиэтиленсорбитана), спан 85 (триолеат сорбитана), лецитин и тритон X-100. Как указано выше, такие детергенты, как твин 80, могут способствовать термической стабильности, что видно из приведенных ниже примеров.
Можно использовать смеси поверхностно-активных веществ, такие как смеси твин 80/спан 85. Также можно использовать сочетание сложного эфира полиоксиэтиленсорбитана, такого как моноолеат полиоксиэтиленсорбитана (твин 80), и октоксинола, такого как трет-октилфеноксиполиэтоксиэтанол (тритон Х-100). Другое подходящее сочетание включает в себя лаурет 9 и сложный эфир полиоксиэтиленсорбитана и/или октоксинол.
Предпочтительно поверхностно-активные вещества используют в следующих количествах (приведенных в массовых %): сложные эфиры полиоксиэтиленсорбитана (например, твин 80) от 0,01 до 1%, предпочтительно примерно 0,1%; октил- или нонилфенокси-полиоксиэтанолы (такие как тритон X-100 или другие детергенты серии Тритон) от 0,001 до 0,1%, предпочтительно от 0,005 до 0,02%; простые эфиры полиоксиэтилена (такие как лаурет 9) от 0,1 до 20%, предпочтительно от 0,1 до 10%, в частности, от 0,1 до 1% или примерно 0,5%.
Конкретные адъюванты, представляющие собой эмульсии масло-в-воде, подходящие для применения в настоящем изобретении, включают в себя, без ограничения, такие средства, как:
- Субмикронная эмульсия сквалена, твин 80 и спан 85. Эмульсия может содержать в объемном отношении примерно 5% сквалена, примерно 0,5% полисорбата 80 и примерно 0,5% спана 85. В массовом отношении указанные количества соответствуют 4,3% сквалена, 0,5% полисорбата 80 и 0,48% спана 85. Данный адъювант известен как "MF59" (54-56) и описан более подробно в главе 10 публикации 57 и в главе 12 публикации 58. Эмульсия MF59 предпочтительно содержит цитрат-ионы, например, 10 мМ натрий-цитратный буфер.
- Эмульсия, содержащая сквален, а-токоферол и полисорбат 80. Данная эмульсия может содержать от 2 до 10% сквалена, от 2 до 10% токоферола и от 0,3 до 3% твина 80, причем массовое соотношение сквален:токоферол предпочтительно составляет ≤1 (например, 0,90), поскольку такое соотношение обеспечивает более стабильную эмульсию. Сквален и твин 80 могут присутствовать в объемном соотношении, составляющем примерно 5:2, или в массовом соотношении, составляющем примерно 11:5. Одна из таких эмульсий может быть получена путем растворения твина 80 в PBS с получением 2% раствора, с последующим смешиванием 90 мл этого раствора со смесью (5 г DL-α-токоферола и 5 мл сквалена) и микрофлуидизацией смеси. Полученная эмульсия может содержать субмикронные капельки масла, например, со средним диаметром от 100 до 250 нм, предпочтительно примерно 180 нм.
- Эмульсия сквалена, токоферола и детергента тритон (такого как тритон Х-100). Эмульсия также может содержать 3d-MPL (смотри ниже). Эмульсия может содержать фосфатный буфер.
- Эмульсия, содержащая полисорбат (такой как полисорбат 80), детергент тритон (такой как тритон Х-100) и токоферол (такой как сукцинат α-токоферола). Эмульсия может содержать эти три компонента в массовом соотношении примерно 75:11:10 (например, 750 мкг/мл полисорбата 80, 110 мкг/мл тритона Х-100 и 100 мкг/мл сукцината α-токоферола), причем указанные концентрации должны включать в себя любое поступление этих компонентов из антигенов. Эмульсия также может содержать сквален. Эмульсия может также содержать 3d-MPL (см. ниже). Водная фаза может содержать фосфатный буфер.
- Эмульсия, содержащая сквалан, полисорбат 80 и полоксамер 401 ("Pluronic™ L121"). Эмульсию можно получить в забуференном фосфатом физиологическом растворе, рН 7,4. Данную эмульсию можно использовать для доставки мурамиловых дипептидов и вместе с треонил-MDP для получения адъюванта "SAF-1" (59) (0,05-1% Thr-MDP, 5% сквален, 2,5% Pluronic L121 и 0,2% полисорбат 80). Ее также можно использовать в отсутствие Thr-MDP для получения адъюванта "AF" (60) (5% сквален, 1,25% Pluronic L121 и 0,2% полисорбат 80). Предпочтительно проводить микрофлуидизацию.
- Эмульсия, содержащая сквален, водный растворитель, простой алкильный эфир полиоксиэтилена в качестве гидрофильного неионного поверхностно-активного вещества (например, цетостеариловый эфир полиоксиэтилена (12)) и гидрофобное неионное поверхностно-активное вещество (например, сложный эфир сорбитана или сложный эфир маннита, такой как моноолеат сорбитана или "спан 80"). Эмульсия предпочтительно является термообратимой и/или содержит, по меньшей мере, 90% масляных капелек (по объему) с размером менее 200 нм (61). Эмульсия может также содержать одно или несколько из следующих веществ: альдит; криопротектор (например, сахар, такой как додецилмальтозид и/или сахароза) и/или алкилполигликозид. Такие эмульсии могут быть лиофилизированными.
- Эмульсия, содержащая 0,5-50% масла, 0,1-10% фосфолипида и 0,05-5% неионного поверхностно-активного вещества. Как описано в публикации 62, предпочтительные фосфолипидные компоненты включают в себя фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин, фосфатидилинозитол, фосфатидилглицерин, фосфатидную кислоту, сфингомиелин и кардиолипин. Капельки предпочтительно имеют субмикронные размеры.
- Субмикронная композиция типа масло-в-воде, содержащая неметаболизируемое масло (например, легкое минеральное масло) и, по меньшей мере, одно поверхностно-активное вещество (такое как лецитин, твин 80 или спан 80). В состав такой композиции могут быть включены добавки, такие как сапонин QuilA, холестерин, конъюгат сапонин-липофил (например, GPI-0100, описанный в ссылке 63, полученный путем присоединения алифатического амина к дезацилсапонину через карбоксильную группу глюкуроновой кислоты), диметилдиоктадециламмония бромид и/или N,N-диоктадецил-N,N-бис(2-гидроксиэтил)пропандиамин.
- Эмульсия, содержащая минеральное масло, неионный липофильный этоксилированный жирный спирт и неионное гидрофильное поверхностно-активное вещество, (например, этоксилированный жирный спирт и/или блок-сополимер полиоксиэтилена и полиоксипропилена) (64).
- Эмульсия, содержащая минеральное масло, неионный гидрофильный этоксилированный жирный спирт и неионное липофильное поверхностно-активное вещество (например, этоксилированный жирный спирт и/или блок-сополимер полиоксиэтилена и полиоксипропилена) (64).
- Эмульсия, в которой сапонин (например, QuilA или QS21) и стерин (например, холестерин) связаны и находятся в виде спиральных мицелл (65).
Антигены и адъюванты, входящие в состав композиции, обычно находятся в смеси в момент доставки пациенту. Эмульсии можно смешивать с антигеном в процессе производства или непосредственно перед применением, в момент доставки. Так, адъювант и антиген могут находиться отдельно в упакованной или готовой к распространению вакцине в состоянии, подходящем для получения конечной композиции в момент использования. Поскольку антиген обычно находится в водной форме, конечную вакцину получают путем смешивания двух жидкостей. Объемное отношение двух смешиваемых жидкостей может варьировать (например, от 5:1 до 1:5), но, как правило, составляет примерно 1:1.
C. Композиции сапонина (глава 22 публикации 57)
В настоящем изобретении в качестве адъювантов также можно использовать композиции сапонина. Сапонины представляют собой гетерогенную группу стерингликозидов и тритерпеновых гликозидов, которые присутствуют в коре, листьях, стеблях, корнях и даже цветках растений разных видов. Широко исследуется применение в качестве адъювантов сапонинов из коры мыльного дерева Quillaia saponaria. Сапонины также можно получить в промышленных масштабах из Smilax ornata (сарсапарель), Gypsophilla paniculata (перекати поле) и Saponaria officianalis (мыльный корень). Сапонинсодержащие адъювантные композиции включают в себя очищенные композиции, такие как QS21, а также липидные составы, такие как ISCOM. QS21 продается под торговым наименованием Stimulon™.
Композиции сапонина очищают методами ВЭЖХ и ОФ-ВЭЖХ. Конкретные охарактеризованные фракции, очищенные с помощью данных методов, включают в себя QS7, QS17, QS18, QS21, QH-А, QH-B и QH-C. Предпочтительно сапонин представляет собой QS21. Способ получения QS21 описан в публикации 66. Композиции сапонина также могут содержать стерин, такой как холестерин (67).
Сочетания сапонинов и холестеринов можно использовать для получения уникальных частиц, называемых иммуностимулирующими комплексами (ISCOM, см. главу 23 публикации 57, а также публикации 68 и 69). Как правило, ISCOM также содержат фосфолипид, такой как фосфатидилэтаноламин или фосфатидилхолин. Для получения ISCOM можно использовать любой известный сапонин. Предпочтительно ISCOM содержит один или несколько из QuilA, QHA и QHC. Необязательно в ISCOM могут отсутствовать дополнительные детергенты (70). Обзор разработок адъювантов на основе сапонина можно найти в публикациях 71 и 72.
D. Бактериальные или микробные производные
Адъюванты, подходящие для применения в настоящем изобретении, включают в себя бактериальные или микробные производные, такие как нетоксичные производные энтеробактериального липополисахарида (LPS), производные липида А, иммуностимулирующие олигонуклеотиды и АДФ-рибозилирующие токсины, а также их детоксифицированные производные.
Нетоксичные производные LPS включают в себя монофосфориллипид А (MPL) и 3-О-деацилированный MPL (3dMPL). 3dMPL представляет собой смесь 3-O-деацилированного монофосфориллипида А с 4, 5 или 6 ацилированными цепями. Предпочтительная "малая частица", образованная 3-O-деацилированным монофосфориллипидом А, описана в публикации 73. Такие "малые частицы" из 3dMPL являются достаточно маленькими, чтобы их можно было стерилизовать фильтрованием через мембраны с размером пор 0,22 мкм (73). Другие нетоксичные производные LPS включают в себя миметики монофосфориллипида А, такие как аминоалкильные производные глюкозаминидфосфата, например, RC-529 (74, 75).
Производные липида А включают в себя производные липида А Escherichia coli, такие как ОМ-174. ОМ-174 описан, например, в публикациях 76 и 77.
Иммуностимулирующие олигонуклеотиды, подходящие для применения в качестве адъювантов в настоящем изобретении, включают в себя нуклеотидные последовательности, содержащие мотив CpG (динуклеотидную последовательность, содержащую неметилированный цитозин, связанный фосфатной связью с гуанозином). Показано, что двухцепочечные РНК и олигонуклеотиды, содержащие палиндромные или поли(dG) последовательности, также обладают иммуностимулирующей активностью.
CpG могут включать в себя модификации/аналоги нуклеотидов, такие как фосфоротиоатные модификации, и могут быть двухцепочечными или одноцепочечными. В публикациях 78, 79 и 80 описаны возможные замены аналогами, например, замена гуанозина на 2'-дезокси-7-деазагуанозин. Адъювантный эффект олигонуклеотидов CpG также описан в публикациях 81-86.
Последовательность CpG может быть направлена на TLR9, такой как мотив GTCGTT или TTCGTT (87). Последовательность CpG может специфичести индуцировать иммунный ответ Th1, например, последовательность CpG-A ODN, или она может быть более специфичной в отношении индукции B-клеточного ответа, например, последовательность CpG-B ODN. CpG-A ODN и CpG-B ODN описаны в публикациях 88-90. Предпочтительно CpG представляет собой CpG-A ODN.
Предпочтительно олигонуклеотид CpG конструируют таким образом, чтобы 5'-конец был доступен для распознавания рецептором. Необязательно две олигонуклеотидные последовательности CpG могут быть соединены по 3'-концам с образованием "иммуномеров". Смотрите, например, публикации 91-93.
Особенно полезный адъювант на основе иммуностимулирующих олигонуклеотидов известен как IC-31™ (94-96). Так, адъювант, подходящий для применения в настоящем изобретении, может содержать смесь (i) олигонуклеотида (например, из 15-40 нуклеотидов), содержащего, по меньшей мере, один (предпочтительно несколько) мотив CpI (т. е. цитозин, связанный с инозином с образованием динуклеотида), и (ii) поликатионного полимера, такого как олигопептид (например, из 5-20 аминокислот), содержащий, по меньшей мере, одну последовательность (предпочтительно несколько последовательностей) трипептида Lys-Arg-Lys. Олигонуклеотид может представлять собой дезоксиолигонуклеотид, содержащий последовательность из 26 элементов 5'-(IC)13-3' (SEQ ID NO: 2). Поликатионный полимер может представлять собой пептид, содержащий аминокислотную последовательность из 11 элементов KLKLLLLLKLK (SEQ ID NO: 3). Указанное сочетание SEQ ID NO: 6 и 7 дает адъювант IC-31™.
В настоящем изобретении в качестве адъювантов можно использовать бактериальные АДФ-рибозилирующие токсины и их детоксифицированные производные. Предпочтительно белок получают из E. coli (термолабильный энтеротоксин E. coli "LT"), возбудителей холеры ("CT") или коклюша ("PT"). Применение детоксифицированных ADP-рибозилирующих токсинов в качестве мукозных адъювантов описано в публикации 97, а в качестве парентеральных адъювантов - в публикации 98. Токсин или анатоксин предпочтительно находится в виде голотоксина, содержащего обе субъединицы А и В. Предпочтительно субъединица A содержит детоксифицирующую мутацию; субъединица B предпочтительно находится в неизменном виде. Предпочтительно адъювант представляет собой детоксифицированный мутант LT, такой как LT-K63, LT-R72 и LT-G192. Применение АДФ-рибозилирующих токсинов и их детоксифицированных производных, в частности LT-K63 и LT-R72, в качестве адъювантов описано в публикациях 99-106. Подходящим для применения мутантом CT является CT-E29H (107). Многочисленные ссылки на аминокислотные замены предпочтительно основаны на выравнивании субъединиц А и В АДФ-рибозилирующих токсинов, описанном в публикации 108, специально включенной в данное описание посредством ссылки во всей своей полноте.
Е. Человеческие иммуномодуляторы
Человеческие иммуномодуляторы, подходящие для применения в качестве адъювантов в настоящем изобретении, включают в себя цитокины, такие как интерлейкины (например, IL-1, IL-2, IL-4, IL-5, IL-6, IL-7, IL-12 (109) и т. д.) (110), интерфероны (например, интерферон-γ), макрофагальный колониестимулирующий фактор и фактор некроза опухоли. Предпочтительным иммуномодулятором является IL-12.
F. Биоадгезивные и мукоадгезивные средства
Биоадгезивные и мукоадгезивные средства также можно использовать в настоящем изобретении в качестве адъювантов. Подходящие биоадгезивные средства включают в себя микросферы этерифицированной гиалуроновой кислоты (111), а мукоадгезивные средства включают в себя сшитые производные поли(акриловой кислоты), поливинилового спирта, поливинилпирролидона, полисахаридов и карбоксиметилцеллюлозы. Хитозан и его производные также можно использовать в настоящем изобретении в качестве адъювантов (112).
G. Микрочастицы
Микрочастицы также можно использовать в настоящем изобретении в качестве адъювантов. Микрочастицы (т. е. частицы, диаметр которых варьирует от ~100 нм до ~150 мкм, более предпочтительно от ~200 нм до ~30 мкм и наиболее предпочтительно от ~500 нм до ~10 мкм), полученные из биоразлагаемых и нетоксичных веществ (таких как поли(α-гидроксикислота), полигидроксимасляная кислота, полиортоэфир, полиангидрид, поликапролактон и т. д.), среди которых поли(лактид-со-гликолид) является предпочтительным, необязательно обрабатывают (например, SDS) с получением отрицательно заряженной поверхности, или (например, катионным детергентом, таким как СТАВ) с получением положительно заряженной поверхности.
H. Липосомы (главы 13 и 14 публикации 57)
Примеры липосомных композиций, подходящих для применения в качестве адъювантов, описаны в публикациях 113-115.
I. Имидазохинолоновые соединения
Примеры имидазохинолоновых соединений, подходящих для применения в качестве адъювантов в настоящем изобретении, включают в себя Imiquamod и его гомологи (например, "Resiquimod 3М"), подробно описанные в публикациях 116 и 117.
Изобретение также может включать в себя сочетания одного или нескольких указанных выше адъювантов. Например, в настоящем изобретении можно использовать следующие адъювантные композиции: (1) сапонин и эмульсия масло-в-воде (118); (2) сапонин (например, QS21) + нетоксичное производное LPS (например, 3dMPL) (119); (3) сапонин (например, QS21) + нетоксичное производное LPS (например, 3dMPL) + холестерин; (4) сапонин (например, QS21) + 3dMPL + IL-12 (необязательно + стерин) (120); (5) сочетания 3dMPL, например, с QS21 и/или эмульсиями масло-в-воде (121); (6) SAF, содержащая 10% сквалана, 0,4% твина 80™, 5% блок-полимера Pluronic L121 и thr-MDP, либо микрофлюидизированная до субмикронной эмульсии, или полученная путем встряхивания с образованием эмульсии с более крупным размером частиц. (7) Адъювантная система Ribi™ (RAS), (Ribi Immunochem), содержащая 2% сквалена, 0,2% твина 80, и один или несколько компонентов бактериальной клеточной стенки, выбранных из группы, включающей в себя монофосфориллипид A (MPL), димиколат трегалозы (TDM) и скелет клеточной стенки (CWS), предпочтительно MPL + CWS (Detox™); и (8) одна или несколько минеральных солей (таких как соль алюминия) + нетоксичное производное LPS (такое как 3dMPL).
Другие вещества, которые действуют как иммуностимулирующие агенты, описаны в главе 7 публикации 57.
Можно использовать адъювант на основе гидроксида алюминия; на этой соли, как правило, адсорбируются антигены. Скваленсодержащие эмульсии масло-в-воде с субмикронными масляными капельками также являются предпочтительными, особенно для пожилых индивидуумов. Подходящие сочетания адъювантов включают в себя сочетания адъювантов Th1 и Th2, такие как CpG и соль алюминия, или резиквимод и соль алюминия. Можно использовать сочетание соли алюминия и 3dMPL.
Иммунизация
Помимо описанных выше иммуногенных композиций настоящее изобретение также относится к способу индукции иммунного ответа у млекопитающего, включающему в себя введение млекопитающему иммуногенной композиции настоящего изобретения. Как правило, иммунный ответ представляет собой гуморальный ответ. Гуморальный ответ предпочтительно представляет собой защитный гуморальный ответ. Изобретение также предлагает композиции настоящего изобретения для применения в таких способах.
Изобретение также предлагает способ защиты млекопитающего от бактериальной инфекции и/или бактериального заболевания, включающий в себя введение млекопитающему иммуногенной композиции настоящего изобретения.
Настоящее изобретение предлагает композиции настоящего изобретения для применения в качестве лекарственных средств (например, в качестве иммуногенных композиций или в качестве вакцин). Кроме того, изобретение предлагает применение OMV настоящего изобретения в производстве лекарственного средства для предотвращения бактериальной инфекции у млекопитающего.
Млекопитающее предпочтительно представляет собой человека. Человек может быть взрослым или предпочтительно ребенком. Если вакцина предназначена для профилактического применения, человек предпочтительно является ребенком (например, малышом или младенцем); если вакцина предназначена для терапевтического применения, человек предпочтительно является взрослым. Вакцину, предназначенную для детей, также можно вводить взрослым, например, для оценки безопасности, дозировки, иммуногенности и т. д.
Эффективность терапевтического лечения можно тестировать путем мониторинга бактериальной инфекции после введения композиции настоящего изобретения. Эффективность профилактического лечения можно тестировать путем мониторинга иммунного ответа против иммуногенных белков, присутствующих в везикулах, или других антигенов после введения композиции. Иммуногенность композиций настоящего изобретения можно определить путем их введения участвующим в испытаниях индивидуумам (например, детям возрастом 12-16 месяцев) с последующим определением стандартных серологических параметров. Указанные иммунные ответы, как правило, определяют примерно через 4 недели после введения композиции и сравнивают их со значениями, определенными до введения композиции. Если вводят несколько доз композиции, после введения можно провести несколько анализов.
Композиции настоящего изобретения обычно вводят непосредственно пациенту. Непосредственную доставку можно осуществлять путем парентерального введения (например, подкожно, внутрибрюшинно, внутривенно, внутримышечно или в интерстициальное пространство ткани) или путем ректального, перорального, вагинального, местного, чрескожного, интраназального, глазного, ушного, легочного или другого мукозального введения. Предпочтительно внутримышечное введение в бедро или предплечье. Инъекцию можно осуществлять с помощью иглы (например, иглы для подкожных инъекций), однако можно использовать и безыгольную инъекцию. Типичная внутримышечная доза составляет примерно 0,5 мл.
Изобретение можно использовать для индукции системного и/или мукозального иммунитета.
Дозировочный режим может включать в себя введение однократной дозы или введение многократной дозы. Введение многократной дозы можно использовать во время первичной иммунизации и/или во время бустер-иммунизации. Введение примирующей дозы может сопровождаться введением бустер-дозы. Подходящие интервалы времени между введением примирующих доз (например, в диапазоне 4-16 недель), а также между введением примирующей дозы и бустер-дозы, можно определить с помощью рутинных методов.
Общие сведения
Термин "содержащий" охватывает значения "включающий в себя", а также "состоящий из", например, композиция, "содержащая" Х, может состоять исключительно из Х или она также может содержать другой компонент, например, X+Y.
Термин "по существу" не исключает значения "полностью", например, в композиции, которая "по существу не содержит" Y, Y может совсем отсутствовать. При необходимости фразу "по существу" можно опустить из определения настоящего изобретения.
Термин "примерно" применительно к численному значению х не является обязательным и означает, например, х±10%.
Идентичность полипептидных последовательностей предпочтительно определяют с помощью алгоритма поиска гомологии Смита-Ватермана, выполняемого в программе MPS CH (Oxford Molecular), где поиск аффинного гэпа осуществляется с использованием параметров штраф за открытие гэпа = 12 и штраф за продолжение гэпа = 1.
Краткое описание чертежей
На фиг. 1 показана карта плазмиды pET-OmpA, которая представляет собой производное плазмиды pET21b и содержит нуклеотидную последовательность, кодирующую сигнальную последовательность (SS) OmpA E. Coli, гибридизованную с представляющим интерес геном (GOI), кодирующим гетерологичный белок. SS OmpA направляет белок, кодируемый GOI, в просвет OMV.
На фиг. 2 показаны результаты электрофореза в SDS-полиакриламидном геле (SDS-PAGE) общих лизатов культур до и после индукции 1 мМ IPTG. Полосы, соответствующие SpyCEP, Slo, Bla, fHbp и Spy0269, указаны стрелками.
На фиг. 3 показаны результаты SDS-PAGE 30 мкг OMV, полученных путем ультрацентрифугирования культурального супернатанта трансформированных штаммов ΔtolR и ΔompA. Полосы, соответствующие массам SpyCEP, Slo, Bla и fHbp, указаны стрелками.
На фиг. 4 показаны результаты анализа Slo (А) и SpyCEP (B) методом вестерн-блоттинга. Пустые OMV используют в качестве отрицательного контроля. Путем сравнения хемилюминесцентных сигналов с сигналами, полученными от известных количеств очищенных белков, определяют, что в 30 мкг OMV содержится примерно 240 нг Slo-dm и 240 нг SpyCEP.
На фиг. 5 показаны результаты анализа Bla (А) и fHbp (B) методом вестерн-блоттинга. Пустые OMV используют в качестве отрицательного контроля. Путем сравнения сигналов хемолюминесценции с сигналами, полученными от известных количеств очищенных белков, определяют, что в 30 мкг OMV содержится примерно 240 нг Bla.
На фиг. 6 показаны результаты вестерн-блоттинга, демонстрирующие, что Slo и SpyCEP экспрессируются в виде люминальных компонентов OMV, а не в виде компонентов, прикрепленных к их внеклеточной поверхности. 100 мкг/мл протеиназы К добавляют к 15 мкг интактных и солюбилизированных (в 1% SDS) везикул, содержащих Slo или SpyCEP, и инкубируют 10 минут при 37°С. Деградацию белков детектируют методом Вестерн-блоттинга.
На фиг. 7 показаны результаты вестерн-блоттинга, демонстрирующие, что Bla экспрессируется в виде люминального компонента OMV, а не в виде компонента, прикрепленного к их внеклеточной поверхности. 100 мкг/мл протеиназы К добавляют к 15 мкг интактных и солюбилизированных (в 1% SDS) везикул, содержащих Bla, и инкубируют 10 минут при 37°С. Деградацию белков детектируют методом Вестерн-блоттинга.
На фиг. 8A показана SpyCEP активность SpyCEP-содержащих OMV, солюбилизированных с использованием 0,5% тритона X-100. OMV, экспрессирующие белок SpyCep, инкубируют в разных концентрациях с IL-8 в концентрации 50 мкг/мл при 37°С в течение 2 часов. Белок SpyCep дикого типа используют в качестве положительного контроля в концентрации 10 мкг/мл, а гидролиз IL-8 анализируют методом SDS-PAGE.
На фиг. 8В показана SpyCEP активность SpyCEP-содержащих OMV, солюбилизированных с использованием 1% тритона X-100. OMV, экспрессирующие белок SpyCep, инкубируют в разных концентрациях с IL-8 в концентрации 50 мкг/мл при 37°С в течение 2 часов. Белок SpyCep дикого типа используют в качестве положительного контроля в концентрации 10 мкг/мл, а гидролиз IL-8 анализируют методом SDS-PAGE.
На фиг. 9А показана Bla активность Bla-содержащих OMV и пустых OMV. Препараты OMV инкубируют с нитроцефином (0,5 мг/мл; Oxoid, Thermo Scientific, Cambridge, United Kingdom) в течение 30 мин при 37°С в темноте. Гидролиз хромогена и последующее изменение цвета супернатантов определяют сразу с помощью спектрофотометра Tecan при OD485. Ферментативную активность определяют с помощью стандартной кривой, на которой OD485 соответствует количеству гидролизованного нитроцефина. Количественное определение проводят с использованием рекомбинантной β-лактамазы (VWR).
На фиг. 9В показана гемолитическая активность OMV, содержащих Slo дикого типа (wt), и пустых OMV при инкубации с эритроцитами крови овцы, выраженная в виде отношения оптической плотности (OD 540 нм) крови, инкубированной с OMV, к оптической плотности крови, инкубированной с водой (100% гемолиз).
На фиг. 10 показано среднее геометрическое титров ELISA, полученных от 8 мышей в каждой группе иммунизаций после третьей иммунизации (49 день).
На фиг. 11 показано процентное количество нерасщепленного IL-8 в присутствии 100 нг рекомбинантного SpyCEP и разных разведений иммунной сыворотки, собранной после 3 (после 3) иммунизаций, определенное методом ELISA.
На фиг. 12A показано процентное количество нерасщепленного IL-8 в присутствии 100 нг рекомбинантного SpyCEP и разных разведений иммунной сыворотки, собранной после 2 (после 2) иммунизаций, определенное методом ELISA.
На фиг. 12В показано процентное количество нерасщепленного IL-8 в присутствии рекомбинантного SpyCEP и разных разведений иммунной сыворотки, собранной после 2 (после 2) иммунизаций, определенное методом ELISA с использованием SpyCep-содержащих OMV, или пустых OMV и SpyCep. В качестве отрицательного контроля используют PBS.
На фиг. 13 показан процент гемолиза в присутствии разных разведений иммунной сыворотки, собранной от мышей, иммунизированных рекомбинантным Slo, в качестве положительного контроля, или рекомбинантных OMV, содержащих Slo (OMV-Slo).
На фиг. 14 показан график выживания для групп из 8 мышей, иммунизированных OMV, несущими Slo и SpyCEP, полученными с использованием обработки ультразвуком до поглощения алюминиевыми квасцами или без нее. Кривые выживания мышей, иммунизированных рекомбинантными Slo и SpyCEP, адсорбированными на алюминиевых квасцах, используют в качестве контроля.
На фиг. 15А показана карта плазмиды pET-slo + spy0269.
На фиг. 15B показана карта плазмиды pET-slo + spy0269 + spycep.
На фиг. 16A показаны результаты вестерн-блоттинга, демонстрирующие, что все белки экспрессируются из бицистронных и трицистронных конструкций после индукции IPTG.
На фиг. 16В показаны результаты вестерн-блоттинга, демонстрирующие, что оба белка Slo и Spy0269 экспрессируются и присутствуют в OMV.
СПОСОБЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Пример 1. Экспрессия гетерологичных белков в OMV E. coli
Поколение ко-мутантов E. coli BL21(DE3) ΔtolR и ΔompA
Склонные к рекомбинации клетки BL21(DE3) получают с использованием высококомпетентной системы гомологичной рекомбинации (оперон red) (122). Коротко говоря, электрокомпетентные бактериальные клетки трансформируют 5 мкг плазмиды pAJD434 путем электропорации (5,9 мс при 2,5 кВ). Затем бактерии выращивают в течение 1 ч при 37°С в 1 мл бульона SOC и затем высевают на планшеты Лурия-Бертани (LB), содержащие триметоприм (100 мкг/мл). Экспрессию генов red, содержащихся в pAJD434, индуцируют путем добавления в среду 0,2% L-арабинозы.
Мутантные штаммы ΔtolR и ΔompA, которые, как известно, спонтанно продуцируют большое количество OMV, получают путем замены кодирующих последовательностей ompA и tolR на кассеты устойчивости к канамицину (kmr) и хлорамфениколу (cmr) соответственно. Вышестоящие и нижестоящие участки ompA и tolR присоединяют соответственно к генам kmr и cmr, используя метод трехстадийной ПЦР. Коротко говоря, участки, находящиеся выше и ниже гена tolR и ompA, амплифицируют из геномной ДНК BL21(DE3), используя пары специфических праймеров tolR-1/tolR-2 и tolR-3/tolR-4; ompA-1/ompA-2 и ompA-3/ompA-4 соответственно (таблица 1). Кассету kmr амплифицируют из плазмиды pUC4K, используя праймеры pUC4K-rev и pUC4K-for, а cmr амплифицируют, используя праймеры CMR-for/CMR-rev. И наконец, три амплифицированных фрагмента, каждый в количестве 100 нг, соединяют путем смешивания и проведения ПЦР с использованием 1/4 праймеров.
Линейные фрагменты, в которых ген устойчивости к антибиотикам фланкирует участки, вышестоящие и нижестоящие tolR/ompA, используют для трансформации склонного к рекомбинации штамма E. coli BL21(DE3), который делают электрокомпетентным путем трехстадийного промывания холодной водой. Трансформацию проводят путем электропорации в течение 5,9 мс при 2,5 кВ. Трансформанты отбирают путем высевания клеток на чашки с LB, содержащей 30 мкг/мл канамицина или 20 мкг/мл хлорамфеникола. Удаление генов tolR и ompA подтверждают путем ПЦР-амплификации геномной ДНК с использованием пар праймеров tolR-1/pUC4K-rev и pUC4K-for/tolR-4; ompA-1/CMR-rev и CMR-for/ompA-4.
Олигонуклеотидные праймеры
Пример 2. Конструирование плазмиды
Пять гетерологичных белков из бактерий разных видов, как грамположительных, так и грамотрицательных, принадлежащих к разным клеточным компартментам, выбирают в качестве модельных белков, чтобы определить, могут ли гетерологичные белки присутствовать в OMV E. coli в нативных конформациях. Указанные белки включают в себя: (1) периплазматическую бета-лактамазу (Bla) TEM1 из E. coli, (2) липопротеин фактор Н-связывающий белок (fHbp) из Neisseria meningitidis, (3) внеклеточный холестеринзависимый стрептолизин О (Slo, также называемый GAS25) из Streptococcus pyogenes, (4) серин-протеазу клеточной оболочки SpyCEP (также называемую GAS57) из Streptococcus pyogenes и (5) предполагаемый поверхностный эксклюзионный белок Spy0269 (также известный как GAS40) также из Streptococcus pyogenes. Нуклеотидные последовательности, кодирующие каждый из указанных пяти белков, клонируют в плазмиде pET-OmpA, используя метод полимеразного неполного удлинения праймера (PIPE) (123). Плазмида pET-OmpA (описанная, например, в (124) и (125)) представляет собой плазмиду, полученную из pET21b.
Коротко говоря, Slo-dm (двойной мутант slo, SEQ ID: 42) подвергают ПЦР-амплификации из плазмиды pET21-Slo-dm, которая содержит ген SLO-DM, с использованием праймеров GAS25-F/GAS25-R (см. таблицу 1). Ген SpyCEP (последовательность двойного мутанта также обозначают SEQ ID: 40) подвергают ПЦР-амплификации из штамма M1 GAS ISS3348 с использованием праймеров SpyCEP-F3/SpyCEP-R3, которые были сконструированы так, чтобы исключить С-концевой мотив LPXTG якоря клеточной стенки (включает в себя а. к. 1614-1647). Ген Spy0269 (SEQ ID: 44) подвергают ПЦР-амплификации из штамма M1 GAS ISS3348 с использованием праймеров spy0269-F/spy0269-R. Праймеры для амплификации гена fHbp конструируют так, чтобы исключить липобокс (который расположен на а. к. 17-25 в fHbp) и, следовательно, избежать заякоревания в мембране. Чтобы направить белки в периплазму, удаляют последовательности, кодирующие сигнальные последовательности каждого из указанных белков, и заменяют их сигнальной последовательностью (SS) OmpA E. coli (см. фиг. 1). Bla и fHbp амплифицируют из pET21b и генома Neisseria meningitidis МС58, соответственно, с использованием праймеров Bla-omp-F/Bla-omp-R и fHbp-F/fHbp-R соответственно. Плазмиду pET-OmpA амплифицируют методом ПЦР с использованием праймеров omprev/nohisflag. В результате получают плазмиды pET-21_Bla (SEQ ID:37), pET-21_slo (SEQ ID:33), pET-21_SpyCEP (SEQ ID:34), pET-21_fHbp (SEQ ID:36) и pET21_spy0269 (SEQ ID:35).
Пример 3. Экспрессия гетерологичных белков в мутантах ΔtolR и ΔompA, получение OMV и общих лизатов
Чтобы определить, можно ли поместить белки Bla, slo, SpyCEP, fHbp и Spy0269 в OMV, штаммы E. coli BL21 ΔtolR и ΔompA трансформируют плазмидами pET-21_Bla, pET-21_slo, pET-21_SpyCEP, pET-21_fHbp и pET21_spy0269. В качестве отрицательного контроля используют штаммы E. coli BL21 ΔtolR и ΔompA, трансформированные пустым вектором pET-OmpA.
Все штаммы выращивают в жидких культурах до достижения логарифмической фазы роста и индуцируют экспрессию генов путем добавления 1 мМ IPTG (изопропил-бета-D-тиогалактопиранозид). На фиг. 2 показаны результаты электрофореза в SDS-полиакриламидном геле (SDS-PAGE) общих лизатов указанных культур до и после индукции 1 мМ IPTG. Полосы, соответствующие белкам Bla, slo, SpyCEP, fHbp и Spy0269, присутствуют во всех индуцированных образцах и указаны стрелками. Таким образом, все пять тестируемых гетерологичных белков успешно индуцируются в E. coli.
В 200 мл среды LB вносят ночную культуру каждого трансформанта при OD600=0,05. Культуры выращивают до OD600=0,5 и затем индуцируют экспрессию рекомбинантного белка путем добавления 1 мМ IPTG, после чего инкубируют еще 2 часа. Для получения OMV клетки собирают центрифугированием при 8000 g в течение 20 минут. Полученный супернатант фильтруют через фильтр с размером пор 0,22 мкм (Millipore). Фильтраты подвергают высокоскоростному центрифугированию (200000 g в течение 2 часов), и осадки, содержащие OMV, ресуспендируют в PBS, содержащем ингибиторы протеазы (Roche). Для иммунизации мышей в указанные моменты времени OMV обрабатывают ультразвуком в гипотоническом буфере (10 мМ Трис, рН 7,5, 1,5 мМ MgCl2, 10 мМ KCl) с использованием 10 импульсов, каждый длительностью 30 секунд, с последующим охлаждением на льду. Общие лизаты получают из 1 мл культуры путем центрифугирования при 13000 g в течение 5 минут. Осадок ресуспендируют в буфере для загрузки образцов на SDS-PAGE, нагревают при 100°С в течение 5 минут и наносят на 4-12% полиакриламидный гель (Invitrogen). Электрофорез проводят в буфере MES (Invitrogen), после чего гели окрашивают кумасси голубым. На фиг. 3 показаны полиакриламидные гели, содержащие примерно 30 мкг OMV, полученных из штаммов ΔtolR и ΔompA, содержащих плазмиды, обеспечивающие экспрессию разных гетерологичных белков. Полосы, соответствующие массам SpyCEP, Slo, Bla и fHbp, указаны стрелками. Чтобы подтвердить идентификацию белков, полосы вырезают, обрабатывают трипсином и затем полученные в результате протеолиза пептиды анализируют методом времяпролетной масс-спектрометрии с лазерной ионизацией и десорбцией из жидкой матрицы (MALDI-TOF).
Коротко говоря, белковые полосы вырезают из геля, промывают смесью 50 мМ бикарбонат аммония - ацетонитрил (50/50, объем/объем) и сушат на воздухе. Высушенные полосы расщепляют в течение 2 ч при 37°С с помощью 12 мкл раствора модифицированного трипсина, чистого для секвенирования (модифицированный свиной трипсин со степенью чистоты для секвенирования; Promega, Madison, WI), с концентрацией 0,012 мкг/мкл в 5 мМ бикарбонате аммония. После расщепления 0,6 мкл продукта загружают на AnchorChip с предварительно нанесенной матрицей (PAC 384 HCCA; Bruker-Daltonics, Bremen, Germany) и сушат на воздухе. Полосы промывают 0,6 мкл раствора, содержащего 70% этанола и 0,1% трифторуксусной кислоты. Масс-спектры получают с помощью масс-спектрометра ULTRAFLEX MALDI-TOF (Bruker-Daltonics). Спектры подвергают внешней калибровке с использованием сочетания стандартов, присутствующих на чипе PAC (Bruker-Daltonics). Моноизотопное сравнение пептидов и поиск белков проводят автоматически с помощью лицензионной версии программного обеспечения MASCOT (Matrix Sciences, London, United Kingdom), используя локальную базу данных. Используют следующие параметры поиска MASCOT: (i) допустимое число пропущенных расщеплений = 1; (ii) вариабельная посттрансляционная модификация = окисление метионина; и (iii) допуск на расхождение между теоретической и экспериментальной массой пептида = 100 м. д. Рассматривают только значимые результаты, определенные с помощью вероятностного анализа MASCOT. С помощью программного обеспечения MASCOT полосы определяют как соответствующие белкам Bla, Slo, SpyCEP и fHbp соответственно. Полученные результаты подтверждают, что Bla, Slo, SpyCEP и fHbp могут экспрессироваться в штаммах E. coli ΔtolR и ΔompA и включаться в OMV, продуцируемые указанными штаммами.
Пример 4. Количественное определение гетерологичных белков в OMV
Чтобы определить количество гетерологичных белков, содержащихся в OMV E. coli, проводят анализ методом вестерн-блоттинга.
30 мкг OMV, содержащих гетерологичные белки, загружают на полиакриламидные гели, содержащие 4-12% SDS, наряду с повышающимися концентрациями (20-80 нг) соответствующего очищенного белка. Также загружают пустые OMV, которые используют в качестве отрицательного контроля. Затем полиакриламидные гели переносят на нитроцеллюлозный фильтр с помощью стандартных методов (126). Фильтры блокируют в течение ночи при 4°С при перемешивании в блокирующем растворе (PBS, содержащий 10% сухого обезжиренного молока и 0,05% твина) с последующей инкубацией в течение 90 минут при 37°С с сывороткой, содержащей нужное антитело (против Bla (Abeam), против slo, против SpyCEP и против fHbp), разведенной 1:1000 PBS, содержащем 3% обезжиренного молока и 0,05% твина. После трех стадий промывания с помошью PBS-твин фильтры инкубируют с антителом против мышиного иммуноглобулина (Dako), конъюгированным с пероксидазой, разведенным 1:2000 PBS, содержащим 3% обезжиренного молока и 0,05% твина, в течение часа, затем промывают еще три раза и детектируют сигнал, полученный с использованием хемилюминесцентного субстрата SuperSignal West Pico (Pierce).
На фиг. 4 и фиг. 5 показаны результаты четырех разных анализов, проведенных методом вестерн-блоттинга. Результаты анализа MALDI-TOF позволяют предположить, что все препараты OMV содержат выбранные гетерологичные белки. Путем сравнения хемилюминесцентных сигналов с сигналами, полученными от известных количеств очищенных белков, определяют, что в 30 мкг OMV содержится примерно 240 нг Slo, SpyCEP и Bla.
Пример 5. Гетерологичные белки локализованы в периплазме OMV
Как описано выше, сигнальные последовательности всех четырех гетерологичных белков заменяют сигнальной последовательностью OmpA E. Coli, чтобы направить белки в периплазму E. coli. Следовательно, важно подтвердить, что белки экспрессируются как люминальные компоненты OMV, а не как компоненты, присоединенные к внеклеточной поверхности OMV.
Чтобы проверить это, 100 мкг/мл протеиназы К (Fermentas) добавляют к 15 мкг интактных и солюбилизированных (в 1% SDS) OMV, экспрессирующих Slo-dm или SpyCEP, и затем смесь инкубируют при 37°С в течение 10 минут. После дезактивации протеиназы К с помощью 10 мМ фенилметилсульфонилфторида (PMSF; Sigma Aldrich) образцы загружают на 4-12% полиакриламидный гель и проводят анализ методом вестерн-блоттинга с использованием нужного антитела, чтобы определить присутствие гетерологичных белков.
На фиг. 6 и фиг. 7 показано, что Slo-dm, SpyCEP и Bla защищены от протеиназа K-опосредованной деградации в несолюбилизированных OMV (но не в растворенных OMV), из чего можно сделать вывод, что все они экспрессируются в виде периплазматических белков и присутствуют в просвете OMV E. coli.
Пример 6. OMV, содержащие SpyCEP, способны гидролизовать IL-8
Как описано, SpyCEP гидролизует IL-8, превращая его в неактивный фрагмент размером 6 кДа (127). Чтобы определить, сохраняет ли SpyCEP указанную гидролитическую активность в препаратах OMV, OMV, несущие белок SpyCEP, инкубируют в разных концентрациях с человеческим IL-8 (50 мкг/мл) при 37°С в течение 2 часов. Белок SpyCEP дикого типа (в концентрации 10 мкг/мл) используют в качестве положительного контроля. IL-8 инкубируют с 10 нг/мл очищенного белка GAS57 (который заведомо гидролизует IL-8) в качестве положительного контроля. Продукты гидролиза анализируют методом 18% SDS-PAGE с окрашиванием серебром. Чтобы проверить, присутствует ли внутри OMV активная форма белка SpyCEP, индуцируют истечение SpyCEP из просвета OMV путем пермеабилизации OMV с использованием 0,5% тритона X-100 при комнатной температуре в течение 20 минут (см. фиг. 8А). В другом эксперименте пермеабилизацию OMV проводят с использованием 1% тритона Х-100 (см. фиг. 8B)
Как показано на фиг. 8А и 8В, IL-8 почти полностью расщепляется после 2 часов инкубации с 30 мкг OMV, содержащих SpyCEP. Таким образом, биологическая активность SpyCEP сохраняется в OMV. Сохранение функциональной активности указывает на то, что гетерологичный белок, находящийся в OMV, имеет правильную укладку и, следовательно, содержит такие же же или по существу такие же структурные эпитопы, как и белок дикого типа в своем природном окружении. Активность, связанная с гидролизом IL-8, повышается в пермеабилизированных OMV, позволяя предположить, что внутри OMV находится активная форма SpyCEP. Сохранение функциональной активности указывает на то, что гетерологичный белок, находящийся в OMV, имеет правильную укладку и, следовательно, содержит такие же или по существу такие же антигены, как и белок дикого типа в своем природном окружении.
Пример 7. OMV, содержащие Bla и Slo
OMV, экспрессирующие Bla, инкубируют с хромогенным субстратом нитроцефином, после чего измеряют активность Bla с помощью описанных здесь методов. Препараты OMV инкубируют с нитроцефином (0,5 мг/мл; Oxoid, Thermo Scientific, Cambridge, United Kingdom) в течение 30 мин при 37°С в темноте. Гидролиз хромогена и последующее изменение цвета супернатантов определяют сразу путем измерения OD485 с помощью спектрофотометра Tecan. Ферментативную активность определяют с помощью стандартной кривой, где OD485 соответствует количеству гидролизованного нитроцефина. Количественное определение проводят с использованием рекомбинантной β-лактамазы (VWR).
На фиг. 9А показано, что активность Bla отсутствует в пустых OMV, но присутствует в Bla-содержащих OMV. Следовательно, биологическая активность Bla сохраняется в OMV. Чтобы проверить, присутствует ли внутри OMV активная форма Bla, индуцируют истечение Bla из просвета OMV путем пермеабилизации OMV с использованием 1% тритона X-100 при комнатной температуре в течение 20 минут. Как показано на фиг. 9А, активность Bla повышается в пермеабилизированных OMV, позволяя предположить, что внутри OMV находится активная форма Bla.
Гемолитическую активность Slo тестируют путем инкубации OMV, экспрессирующих форму токсина дикого типа (WT), с эритроцитами овечьей крови с помощью нижеследующего способа. Серийные разведения образцов получают в 96-луночных планшетах с U-образным дном с использованием в качестве буфера для разведения PBS+0,5% BSA. 1 мл овечьей крови промывают три раза PBS (с центрифугированием при 3000 g), после чего клетки крови суспендируют в 5 мл PBS. 50 мкл даной суспензии добавляют к 50 мкл каждого из разведенных образцов и инкубируют при 37°С в течение 30 мин. Воду используют для достижения 100% гемолиза, а PBS+0,5% BSA используют в качестве отрицательного контроля. Затем планшеты центрифугируют в течение 5 мин при 1000 g и супернатант осторожно переносят в 96-луночные плоскодонные планшеты для прочтения оптической плотности при 540 нм (128).
Как показано на фиг. 9В, отрицательный контроль, содержащий пустые OMV, не несет гемолитической активности, тогда как OMV, содержащие Slo-wt, обладают высоким уровнем гемолитической активности, который зависит от количества присутствующих OMV. Следовательно, биологическая активность Slo сохраняется в OMV. Сохранение функциональной активности Slo и Bla указывает на то, что данные гетерологичные белки, присутствующие в OMV, имеют правильную укладку и, следовательно, содержат такие же или по существу такие же антигены, что и белок дикого типа в своем природном окружении.
Пример 8. Титры антител, индуцируемых у мышей, иммунизированных Slo и SpyCEP, присутствующих в рекомбинатных OMV
Чтобы анализировать иммуногенность Slo и SpyCEP в OMV E. coli, группы, содержащие 8 самок мышей CD1 возрастом 5 недель, иммунизируют внутрибрюшинно на 0, 21 и 35 дни 25 мкг обработанных ультразвуком или необработанных ультразвуком OMV со сверхэкспрессией белков Slo или SpyCEP. Все образцы получают с использованием 2 мг/мл гидроксида алюминия в качестве адъюванта. Контрольных мышей иммунизируют PBS и адъювантом. Группы положительного контроля содержат мышей, иммунизированных 20 мкг очищенных рекомбинантных белков Slo или SpyCEP. Для тестирования иммуногенности OMV мышей также иммунизируют 25 мкг пустых OMV или 25 мкг пустых OMV плюс 20 мкг антигена Slo или SpyCEP.
Сыворотки собирают до первой иммунизации (преиммунная сыворотка) и после каждой иммунизации (сыворотки post1, post2 и post3) и определяют титры методом ELISA. ELISA проводят с использованием 96-луночных планшетов MaxiSorp (Nunc, Thermo Fisher Scientific), покрытых растворами белков Slo или SpyCEP в PBS с концентрацией 3 мкг/мл или 2 мкг/мл соответственно. Планшеты инкубируют в течение 2 ч при комнатной температуре, затем промывают три раза TPBS (0,05% твин 20 в PBS, рН 7,4) и блокируют 2% BSA (Sigma-Aldrich), 250 мкл/лунку, в течение 1 ч при комнатной температуре. Каждую стадию инкубации сопровождают трехкратным промыванием TPBS. Образцы сыворотки вначале разводят 1:500-1:1000 2% BSA в TPBS, переносят на покрытые-блокированные планшеты (200 мкл) и подвергают серийным разведениям (двукратным), после чего инкубируют в течение 2 ч при 37°С. Затем добавляют 100 мкл/лунку козлиного антитела против мышиных IgG, конъюгированного с щелочной фосфатазой, разведенного 1:2000, и оставляют на 2 ч при 30°С. Связанную щелочную фосфатазу визуализируют путем добавления 100 мкл/лунку раствора гексагидрата пара-нитрофенилфосфата динатрия (Sigma-Aldrich) в 1 М диэтаноламиновом буфере (рН 9,8) с концентрацией 3 мг/мл. После развития окраски в течение 10 мин при комнатной температуре планшеты анализируют при 405 нм на спектрофотометре для микропланшетов. Титры антител рассчитывают путем интерполяции значений OD на стандартной калибровочной кривой и выражают в виде единиц ELISA (EU) на мл.
На фиг. 10 показаны средние геометрические значения титров ELISA, полученные для каждой группы из 8 мышей после третьей иммунизации (49 день). Сыворотки мышей, иммунизированных PBS и одним адъювантом, или пустыми OMV, дают отрицательные результаты. Как показано на фиг. 10, гуморальные ответы на все пять препаратов являются статистически эквивалентными, позволяя предположить, что препараты рекомбинантных OMV способны индуцировать антитела против антигенов Slo и SpyCEP.
Пример 9. Иммунная сыворотка OMV-SpyCEP ингибирует опосредованный SpyCEP процессинг IL-8
Сыворотки, полученные от мышей, иммунизированных только PBS, пустыми OMV, OMV-SpyCEP и OMV + SpyCEP, тестируют на способность нейтрализовать IL-8-протеолитическую активность SpyCEP. Для проведения данного анализа ингибирования IL-8 SpyCEP (0,1 мкг/мл) и IL-8 (1 мкг/мл) инкубируют с пулами мышиной поликлональной сыворотки, полученными от каждой группы, содержащей 8 иммунизированных мышей, в пяти разных разведениях (1:2,5, 1:5, 1:10, 1:20 и 1:40) при температуре 37°С в течение 2 часов в PBS, содержащем 0,5 мг/мл BSA. В качестве контролей SpyCEP инкубируют только с буфером и используют сыворотку без SpyCEP. Количество нерасщепленного IL-8 определяют количественно через 2 ч методом ELISA (набор для иммуноанализа человеческого IL-8, Invitrogen) и выражают в виде процента от нерасщепленного IL-8 в реакции (инкубация с SpyCEP) по сравнению с IL-8 в контрольной реакции (инкубирование только с буфером).
На фиг. 11, 12А и 12В показан процент нерасщепленного IL-8 в присутствии 100 нг рекомбинантного SpyCEP и разных разведений иммунной сыворотки, собранной после 3 (post 3) и 2 (post 2) иммунизации соответственно, где указанный процент определяют методом ELISA.
Сыворотки мышей, иммунизированных рекомбинантным SpyCEP в качестве положительного контроля и рекомбинантными OMV, содержащими SpyCEP (OMV-SpyCEP), способны нейтрализовать протеолитическую активность SpyCEP в зависимости от дозы и дают статистически эквивалентные результаты.
Пример 10. Иммунная сыворотка OMV-Slo ингибирует Slo-опосредованный гемолиз
Сыворотки, полученные от мышей, иммунизированных только PBS, пустыми OMV, OMV-Slo, 20 мкг Slo и 0,5 мкг Slo (приблизительно соответствует количеству Slo, содержащемуся в 20 мкг OMV), тестируют на способность нейтрализовать гемолитическую активность Slo. Чтобы провести данный анализ, Slo (60 нг) инкубируют с объединенной поликлональной сывороткой 8 иммунизированных мышей из каждой группы в шести разных разведениях (1:31,25; 1:63, 1:125, 1:250; 1:500 и 1:1000) в течение 20 минут при комнатной температуре в PBS, содержащем 0,5 мг/мл BSA. 1 мл овечьей крови промывают три раза PBS (с центрифугированием при 3000 g), после чего клетки крови суспендируют в 5 мл PBS. 50 мкл данной суспензии добавляют к каждому образцу и инкубируют при 37°С в течение 30 мин. 60 нг Slo используют в качестве положительного контроля, чтобы достичь 100% гемолиза, а PBS+0,5% BSA используют в качестве отрицательного контроля. Затем планшеты центрифугируют в течение 5 мин при 1000 g, супернатант переносят в 96-луночные плоскодонные планшеты и измеряют поглощение при 540 нм (128).
На фиг. 13 показан процент гемолиза, приведенный для каждого образца при разных разведениях сывороток. Сыворотки мышей, иммунизированных рекомбинантным Slo, используемые в качестве положительного контроля, и рекомбинантными OMV, содержащими Slo (OMV-Slo), способны нейтрализовать гемолитическую активность Slo в зависимости от дозы и дают статистически эквивалентные результаты.
Пример 11. OMV, несущие чужеродные антигены в просвете, вызывают интенсивные защитные ответы
После подтверждения того, что, даже если рекомбинантные антигены находятся в просвете OMV, иммунизация такими OMV индуцирует антиген-специфические функциональные антитела, авторы, наконец, задают вопрос, может ли иммунизация также индуцировать антиген-специфический защитный иммунитет. Чтобы проверить это, самок мышей CD1 возрастом 5 недель иммунизируют внутрибрюшинно на 0, 21 и 35 дни вакцинной композицией, содержащей 25 мкг OMV, несущих Slo или SpyCEP, в гидроксиде алюминия. В качестве положительных контролей мышей также иммунизируют 25 мкг OMV, несущих Slo и SpyCEP, обработанных ультразвуком непосредственно перед поглощением на гидроксиде алюминия, а также рекомбинантным Slo, рекомбинантным SpyCEP и рекомбинантным белком М из штамма M1 (по 20 мкг каждого), каждый из которых используют в составе композиции, содержащей гидроксид алюминия. Через три недели после третьей иммунизации мышей инфицируют внутрибрюшинно 200 мкл бактериальной суспензии, содержащей около 2,5E+06 КОЕ штамма M1 3348. Мышей обследуют ежедневно в течение 6 дней после обработки и подвергают эвтаназии, когда они достигают определенных критичных значений с точки зрения гуманности, которые предварительно устанавливаются для исследования в соответствии с политикой Novartis по условиям содержания животных.
Как показано на фиг. 14, которая описывает результаты экспериментов, проводимых с использованием групп по 8 мышей в каждой, необработанные ультразвуком OMV, несущие Slo и SpyCEP, индуцируют защиту 87,5% и 75% соответственно, что сопоставимо со значениями уровня защиты 87,5% и 100%, полученными при иммунизации OMV, обработанными ультразвуком до поглощения квасцами и иммунизации. Указанные значения уровня защиты также подобны значениям, полученным при иммунизации рекомбинантными Slo и SpyCEP (81,3% и 87,5% соответственно), поглощенными на алюминиевых квасцах, замечательный результат с учетом того, что рекомбинантные OMV содержат примерно 0,2-0,4 мкг Slo и SpyCEP, что примерно в 100 раз меньше используемого для иммунизации количества рекомбинантных Slo и SpyCEP.
Пример 12. Получение бицистронной конструкции для экспрессии Spy0269 и Slo-dm и трицистронной конструкции для экспрессии Spy0269, Slo и SpyCEP в просвете OMV
Для получения бицистронной конструкции гены Slo-dm и spy0269 амплифицируют из pET-21 SLO и pET-21_spy0269 с использованием праймеров slo-fus-F/slo-fus-R3 и Spy0269-fus3/Spy0269-R соответственно. Полученные фрагменты фосфорилируют, лигируют и клонируют в плазмиде pET-OmpA, используя метод клонирования PIPE (123), с получением плазмиды pET-slo+spy0269 (SEQ ID: 38) (фиг. 15A).
Белки Slo-dm и Spy0269 клонируют в плазмиде pET-OmpA под контролем одного промотора Т7 с получением бицистронной конструкции. Лидерную последовательность OmpA клонируют выше каждого гена, так чтобы продукты экспрессии направлялись в просвет образующихся впоследствии OMV (смотри ниже).
Для получения трицистронной конструкции плазмиду pET-spy0269+slo амплифицируют с использованием праймеров nohisflag/Spy0269-fus-R, ген spycep амплифицируют из плазмиды pET-21_spycep с использованием праймеров spycep-fus-F/spycep-R3 и клонируют в плазмиде с использованием метода клонирования PIPE. Полученные фрагменты фосфорилируют, лигируют и клонируют в плазмиде pET-OmpA, используя метод клонирования PIPE (123), с получением плазмиды pET-slo+spy0269+spycep (фиг. 15В).
Полученными плазмидами трансформируют мутантные штаммы E. coli BL21 ΔompA и дикого типа с целью индукции белка и получения OMV. Экспрессию клонированных генов индуцируют путем добавления к культурам 1 мМ IPTG. Чтобы подтвердить экспрессию белка, общие лизаты анализируют методом вестер-блоттинга. На фиг. 16А панель I и панель II, показано, что все клонированные белки из бицистронных и трицистронных конструкций экспрессируются после индукции IPTG.
OMV получают с помощью описанного выше способа из штаммов ΔompA и дикого типа, содержащих бицистронную конструкцию. Результаты вестерн-блоттинга, приведенные на фиг. 16В, демонстрируют, что белки slo и Spy0269 экспрессируются и присутствуют в OMV.
Вариантные последовательности spy0269 (GAS40) описаны в SEQ ID: 43-69. Вариантные последовательности spyCEP (GAS57) описаны в SEQ ID: 71-75, а последовательности детоксифицированного или ферментативно неактивного мутанта (GAS57 D151A-S617A) описаны в SEQ ID: 39 и 40. Последовательности двойного мутанта slo(GAS25) W535F-P427L описаны в SEQ ID: 41 и 42.




| название | год | авторы | номер документа |
|---|---|---|---|
| МУТАНТНЫЕ ФОРМЫ СТРЕПТОЛИЗИНА О | 2008 |
|
RU2498994C2 |
| МЕНИНГОКОККОВЫЕ ПОЛИПЕПТИДЫ fHBP | 2009 |
|
RU2475496C2 |
| МЕНИНГОКОККОВЫЕ ПОЛИПЕПТИДЫ fHBP | 2012 |
|
RU2567003C2 |
| МУТАНТНЫЕ АНТИГЕНЫ GAS57 И АНТИТЕЛА ПРОТИВ GAS57 | 2008 |
|
RU2471497C2 |
| НАБОР ДЛЯ ПОЛУЧЕНИЯ ИММУНОГЕННОЙ КОМПОЗИЦИИ ПРОТИВ Neisseria meningitidis СЕРОЛОГИЧЕСКОЙ ГРУППЫ В | 2008 |
|
RU2498815C2 |
| УСОВЕРШЕНСТВОВАНИЯ, КАСАЮЩИЕСЯ ВЕЗИКУЛ ВНЕШНЕЙ МЕМБРАНЫ МЕНИНГОКОККОВ | 2005 |
|
RU2420312C2 |
| ВАКЦИНЫ ДЛЯ МЕНИНГОКОККА СЕРОГРУППЫ Х | 2013 |
|
RU2644340C2 |
| КОМБИНАЦИИ, ВКЛЮЧАЮЩИЕ САХАРИД ПНЕВМОКОККА СЕРОТИПА 14 | 2010 |
|
RU2549438C2 |
| ВАКЦИНА ВЕЗИКУЛ НАРУЖНЫХ МЕМБРАН (OMV), СОДЕРЖАЩАЯ БЕЛКИ НАРУЖНОЙ МЕБРАНЫ N.Meningitidis СЕРОЛОГИЧЕСКОЙ ГРУППЫ В | 2001 |
|
RU2279889C2 |
| ИММУНОГЕННАЯ КОМПОЗИЦИЯ ПРОТИВ NEISSERIA MENINGITIDIS (ВАРИАНТЫ) | 2014 |
|
RU2662968C2 |































































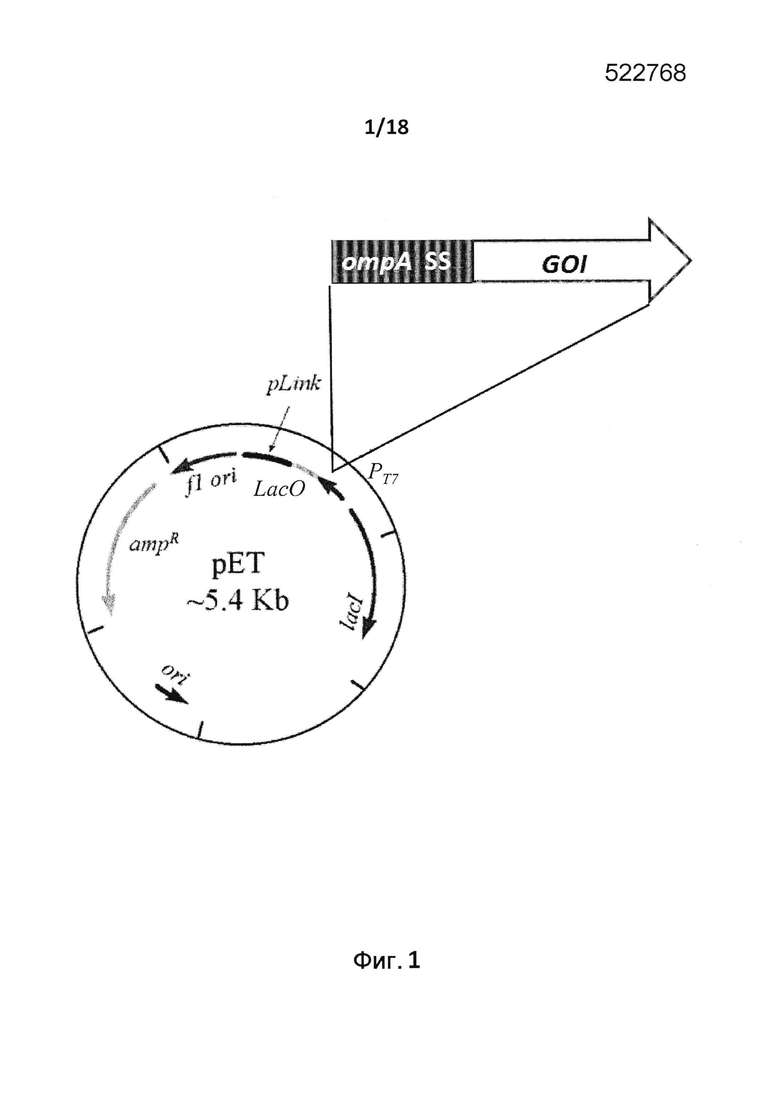
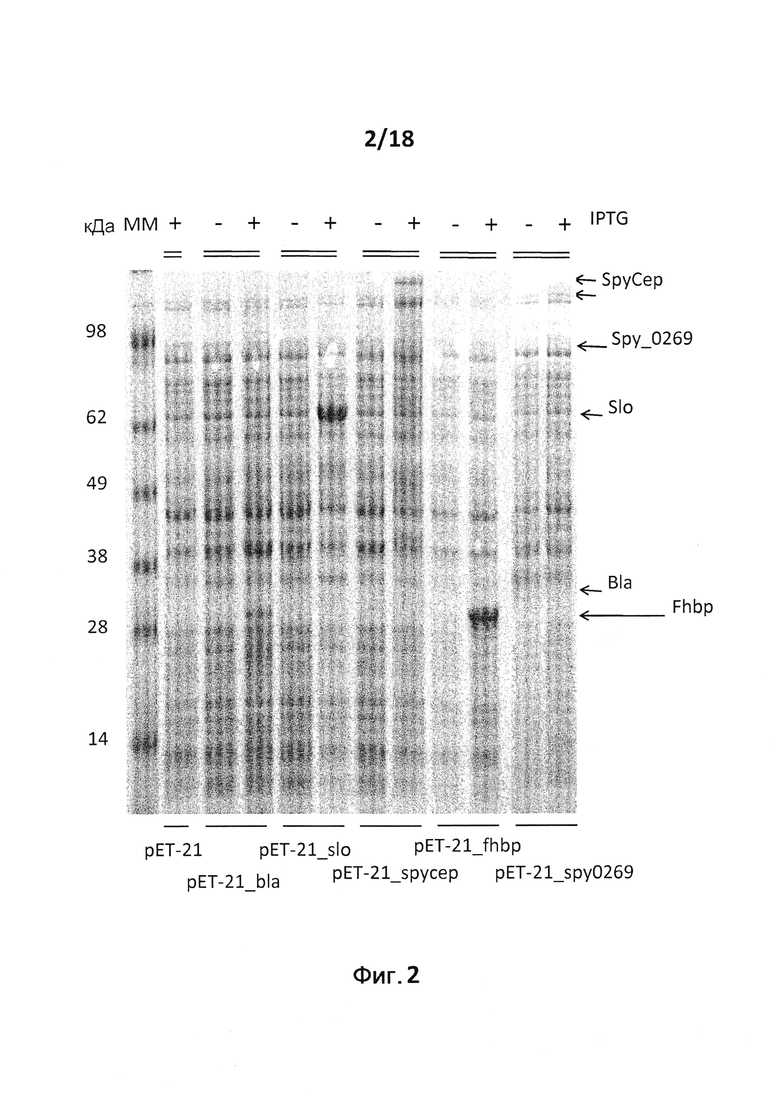
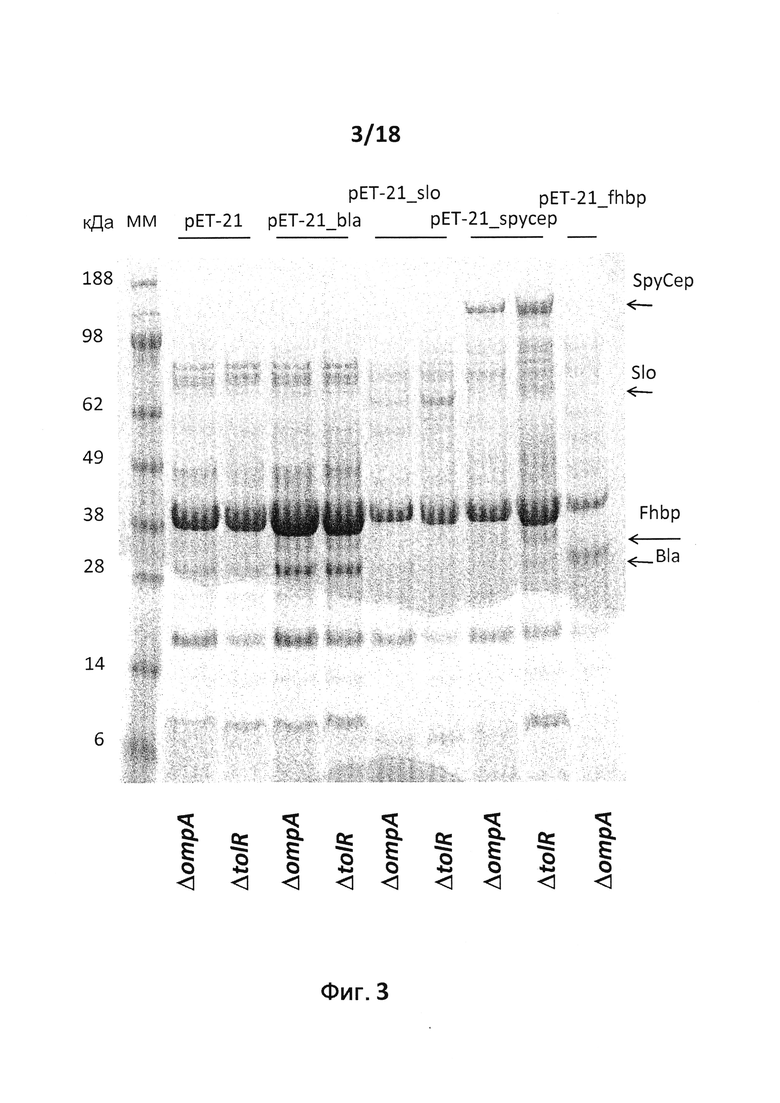
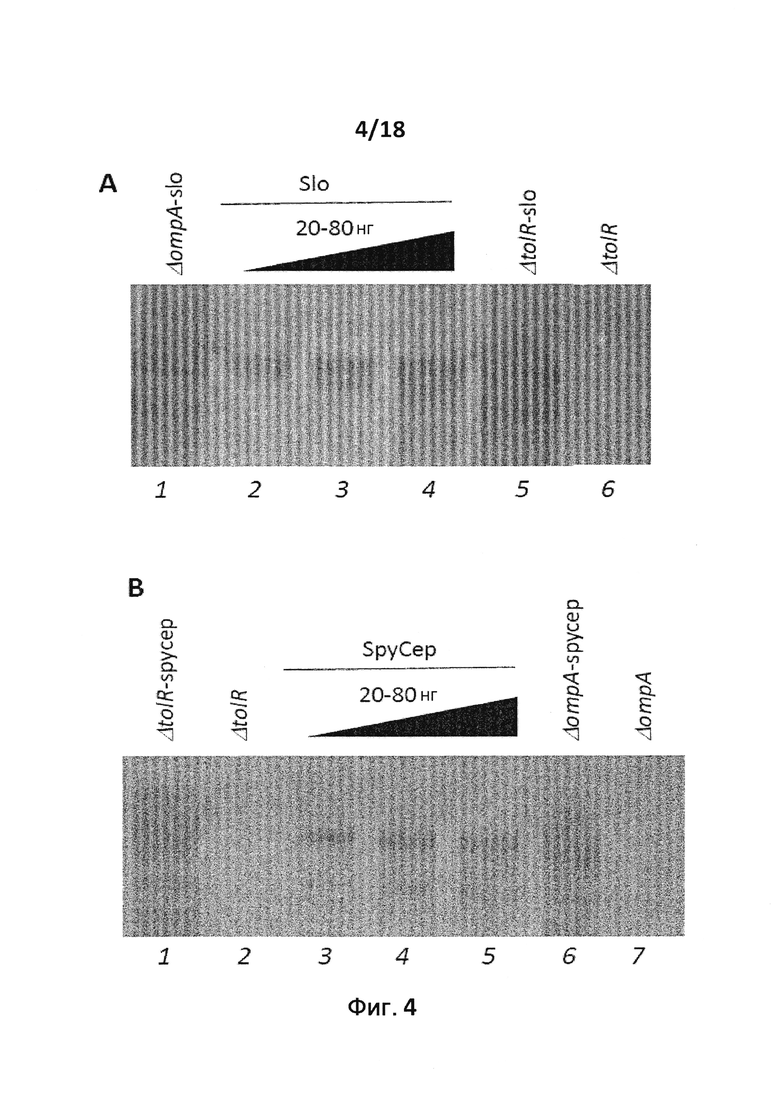
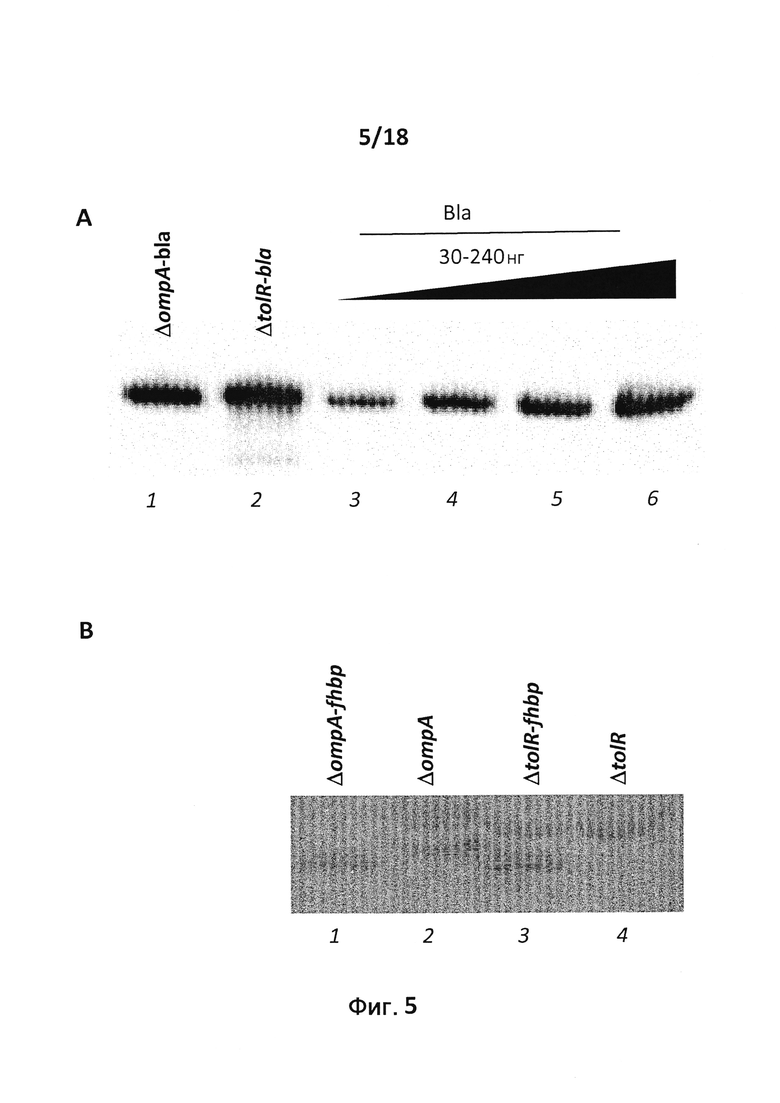
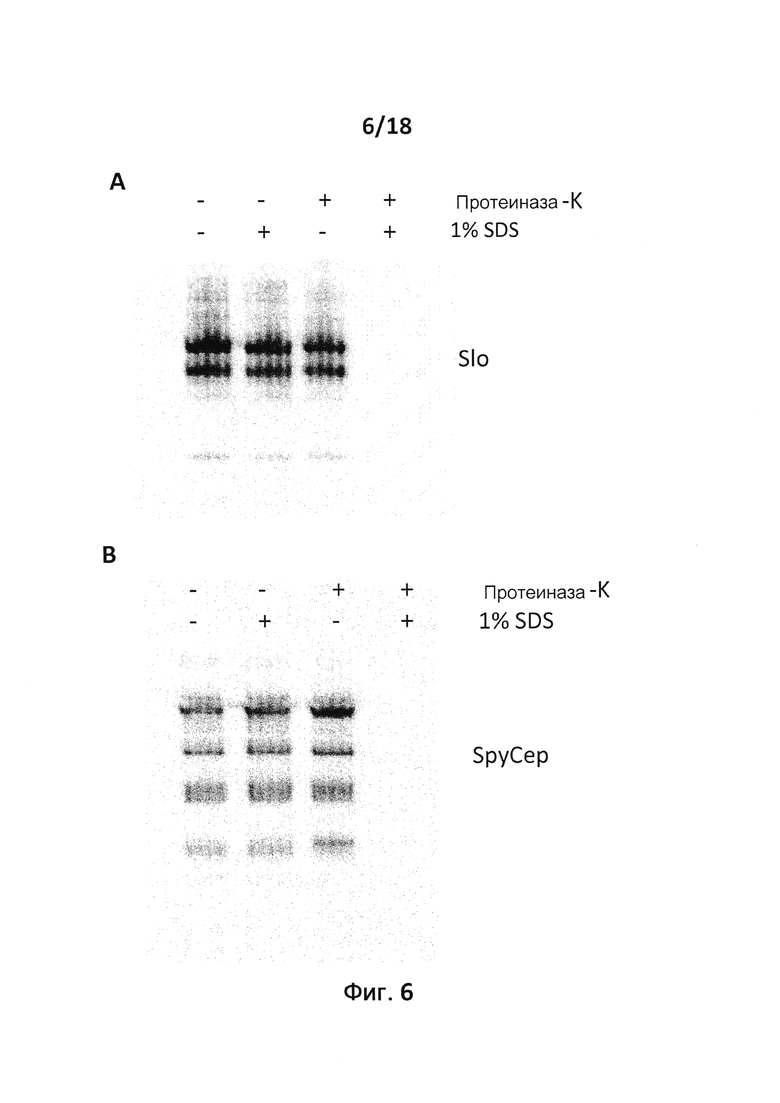
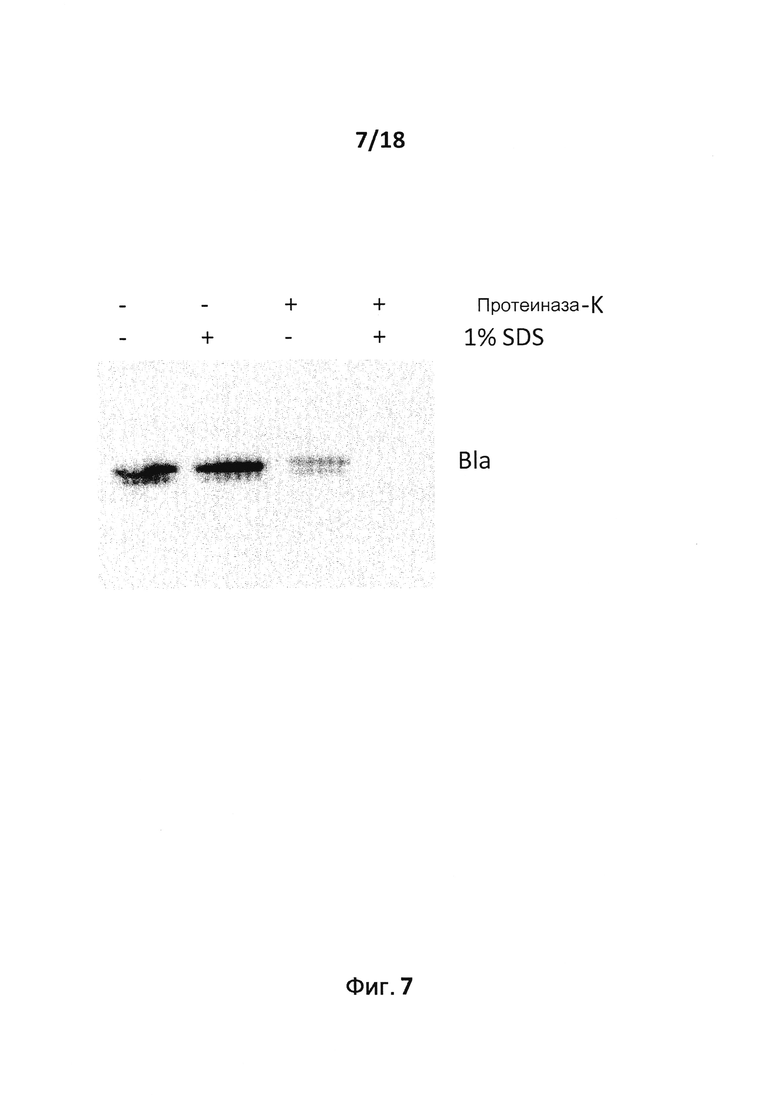
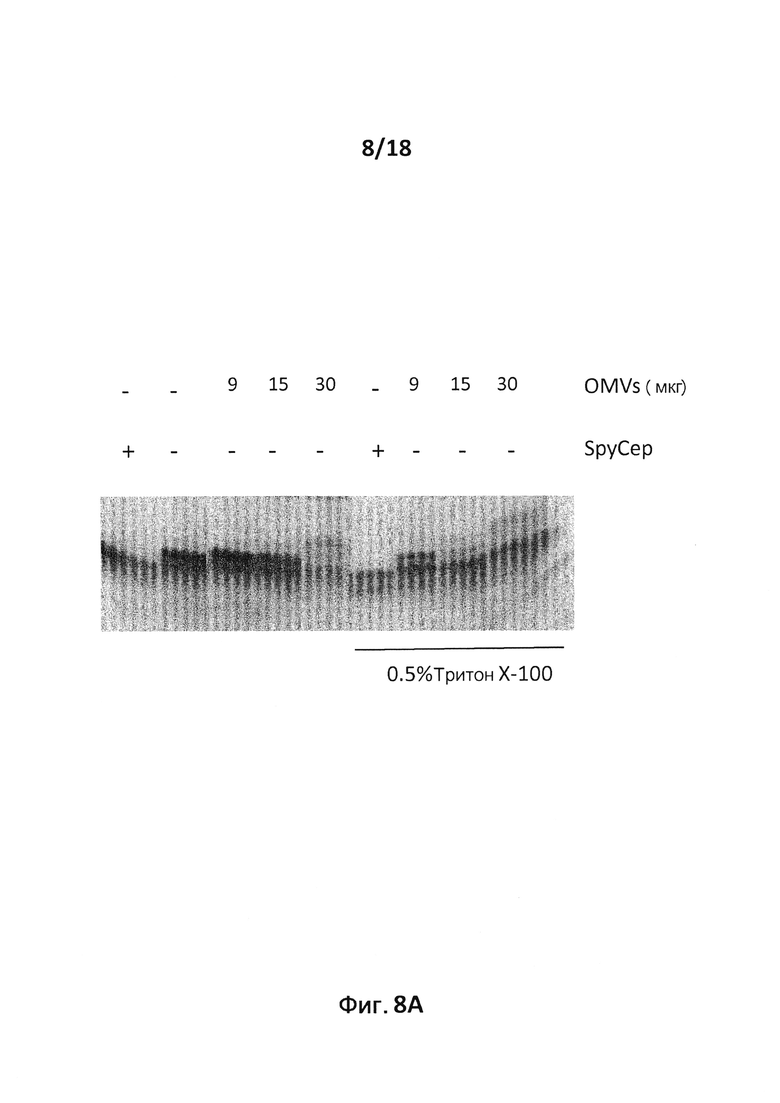
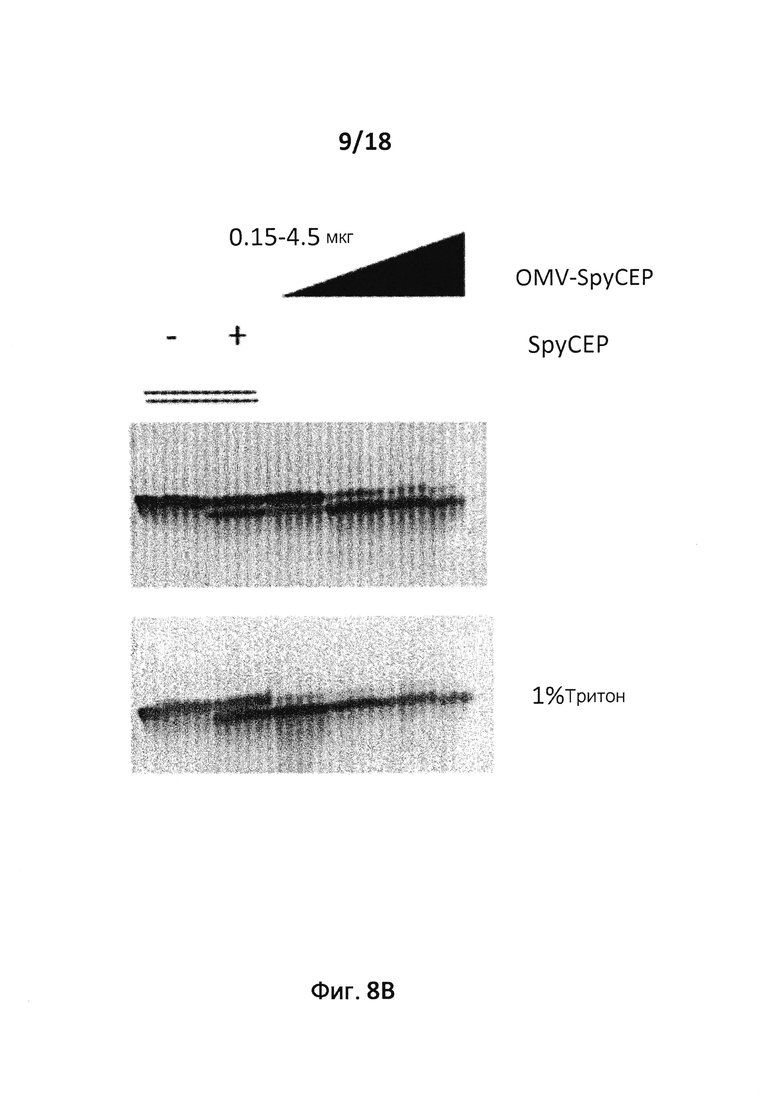
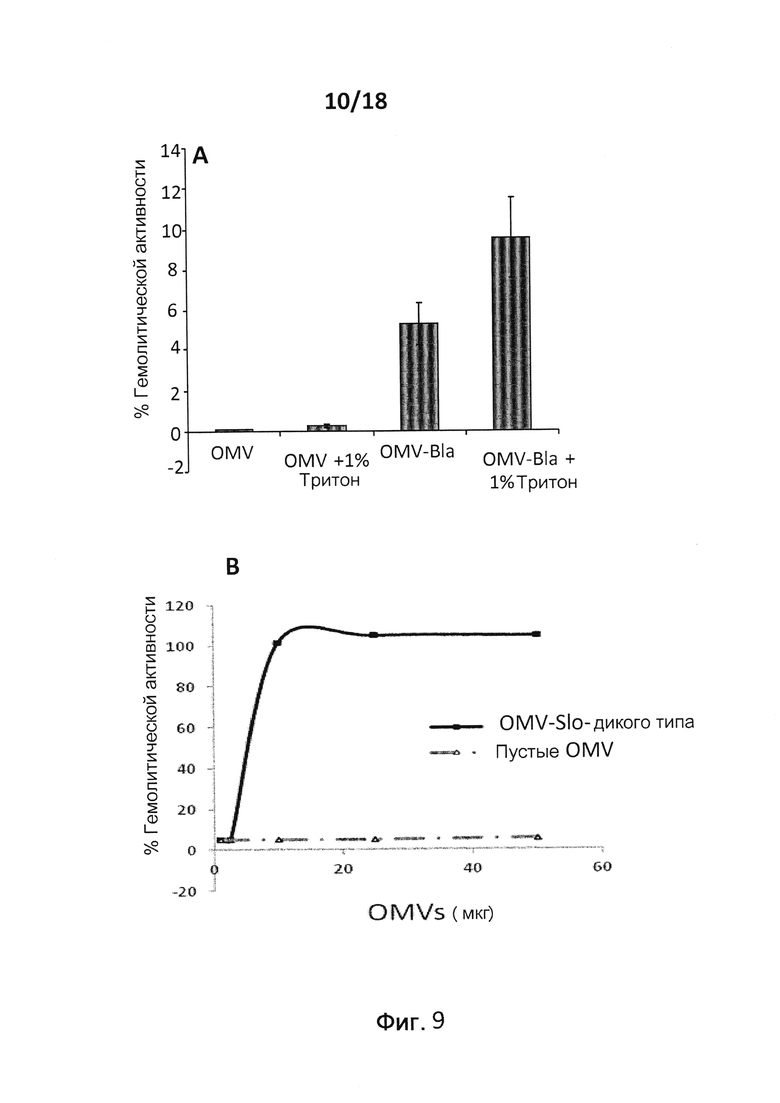
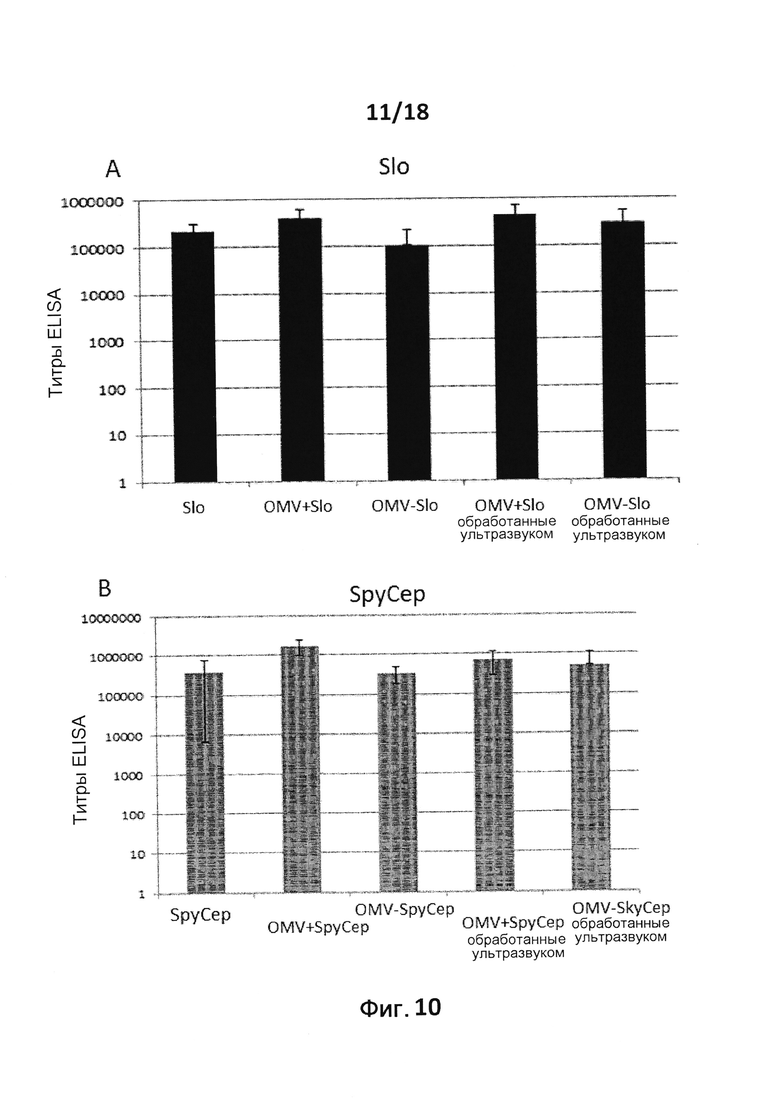
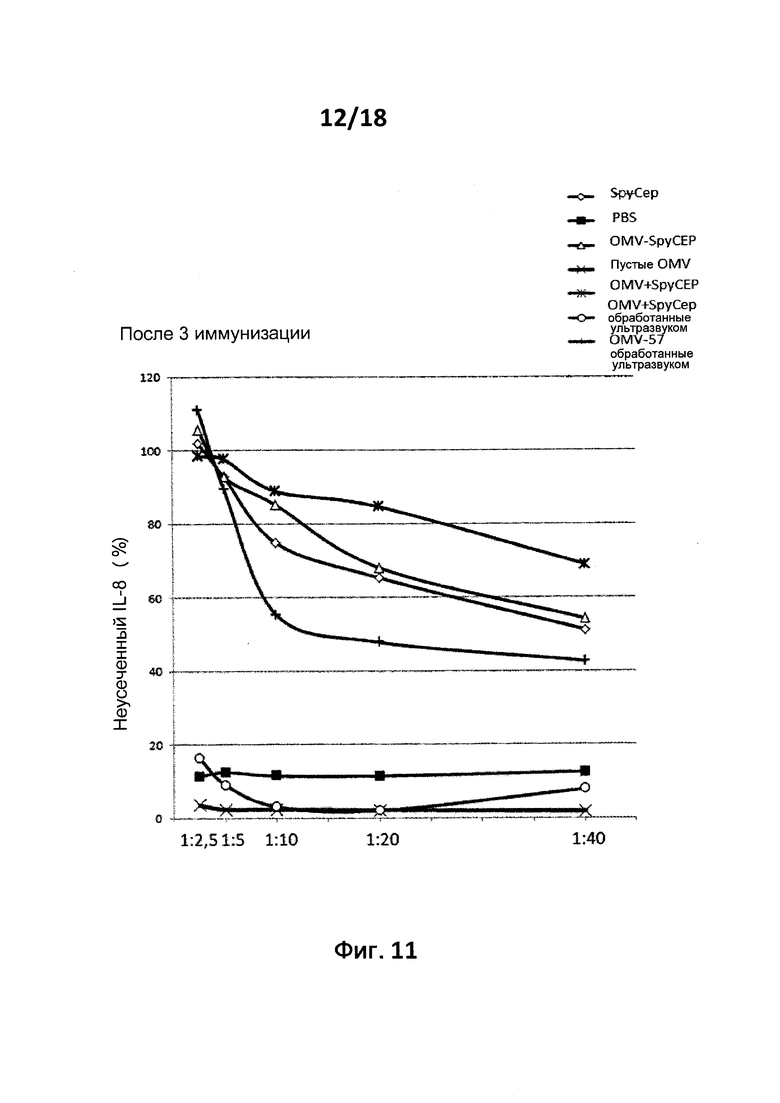
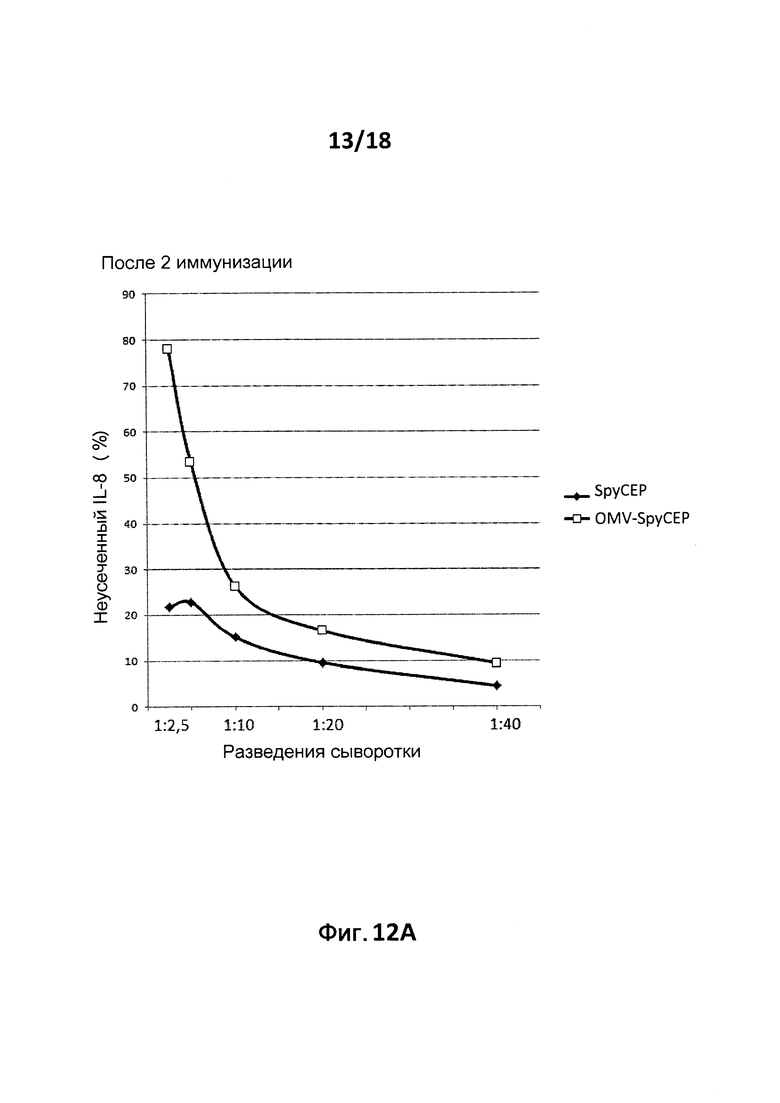
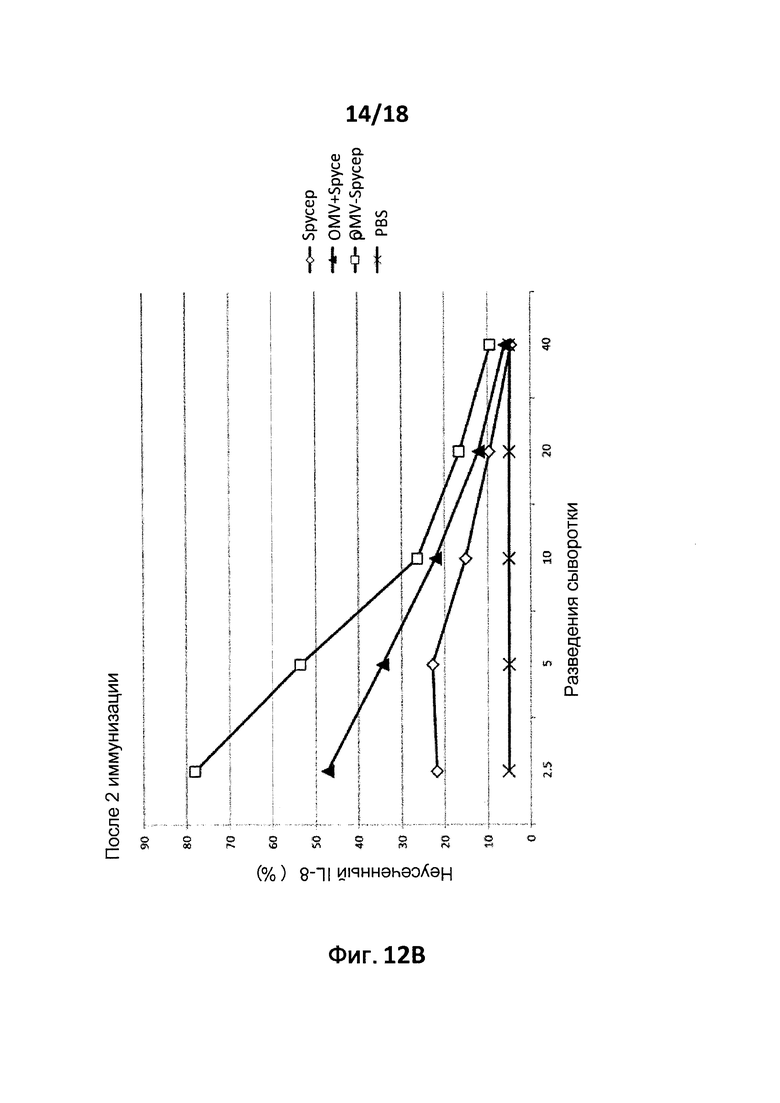
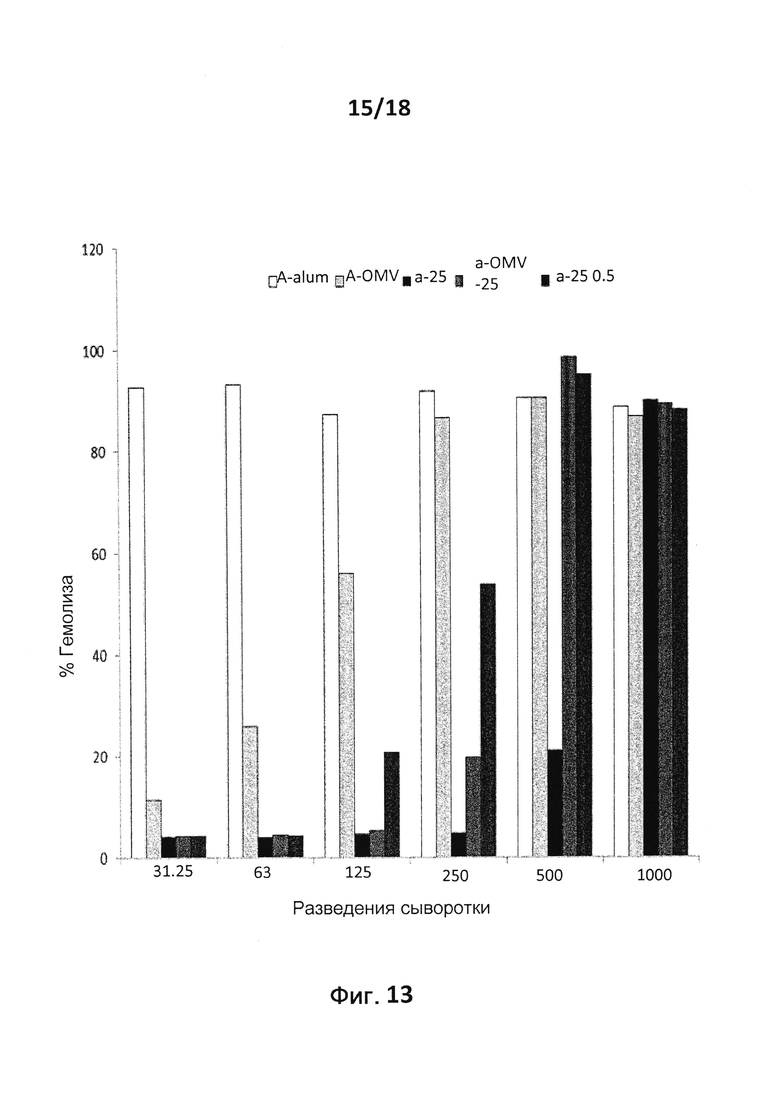
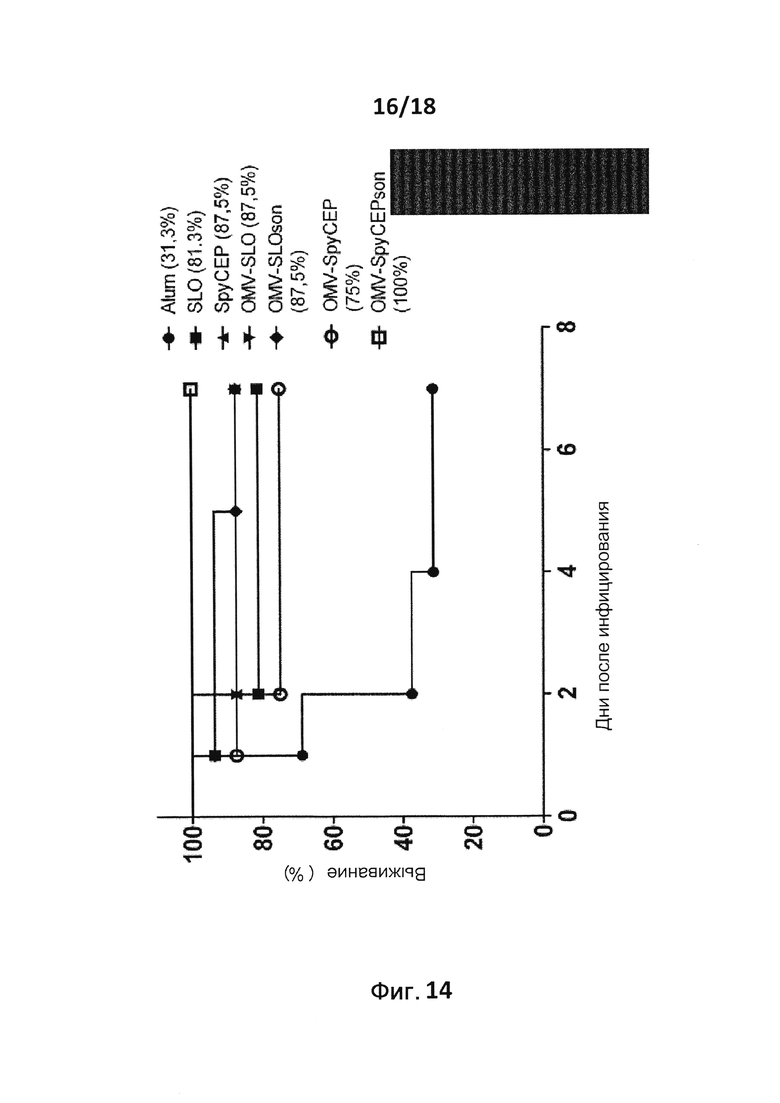
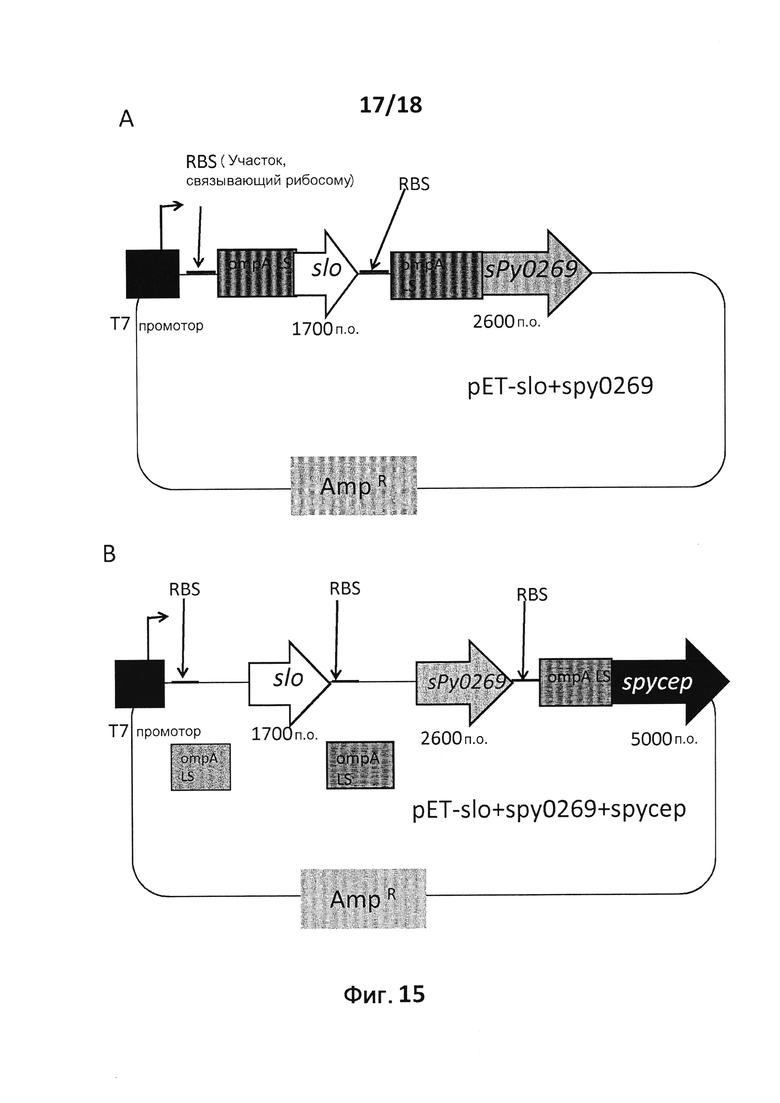
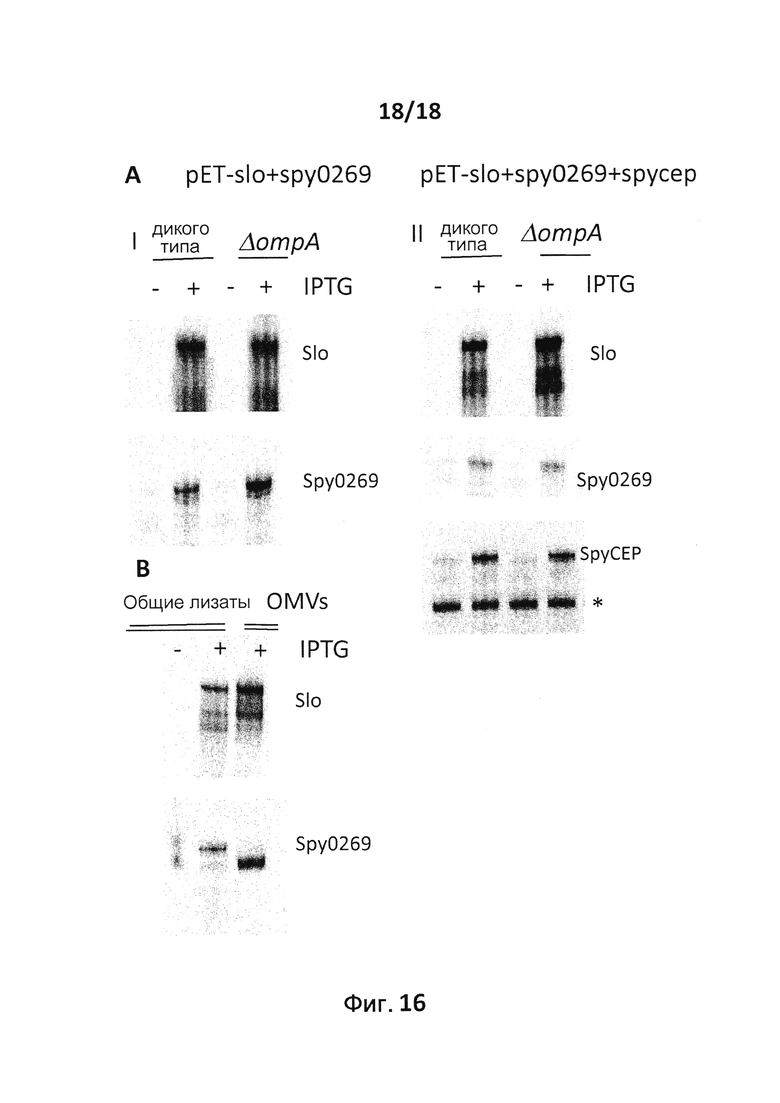
Изобретение относится к биотехнологии. Описана везикула наружной мембраны (OMV) грамотрицательной бактерии, где OMV содержит в полости по меньшей мере один гетерологичный белок, который находится в свободной форме, и где OMV вызывает иммунный ответ на гетерологичный белок при введении млекопитающему, где гетерологичный белок является функционально активным в полости OMV. Изобретение также предлагает способы получения OMV настоящего изобретения, фармацевтических композиций, содержащих OMV настоящего изобретения, в особенности иммуногенных композиций и вакцин, а также способы генерирования гуморального иммунного ответа у млекопитающего с использованием OMV. 6 н. и 29 з.п. ф-лы, 16 ил., 1 табл., 12 пр.
1. Везикула наружной мембраны (OMV) грамотрицательной бактерии, где OMV содержит в полости по меньшей мере один гетерологичный белок, который находится в свободной форме, и где OMV вызывает иммунный ответ на гетерологичный белок при введении млекопитающему, где гетерологичный белок является функционально активным в полости OMV.
2. OMV по п. 1, где гетерологичный белок представляет собой растворимый белок.
3. OMV по п. 1 или 2, где иммунный ответ представляет собой гуморальный иммунный ответ.
4. OMV по п. 1 или 2, где грамотрицательная бактерия выбрана из группы, включающей в себя E. coli, Н. menigitides, Salmonella sp. и Shigella sp.
5. OMV по п. 1, где грамотрицательная бактерия относится к штамму грамотрицательных бактерий, характеризующемуся повышенной способностью к блеббингу.
6. OMV по п. 5, где грамотрицательная бактерия относится к штамму E. coli ΔtolR или штамму E. coli ΔompA.
7. OMV по п. 1, где гетерологичный белок является антигеном.
8. OMV по п. 1, где гетерологичный белок представляет собой цитоплазматический белок или периплазматический белок гетерологичного организма.
9. OMV по любому из пп. 1, 2, 5-7, где гетерологичный белок представляет собой мембраноассоциированный белок гетерологичного организма с удаленным мембранным якорем.
10. OMV по п. 1, где гетерологичный белок представляет собой β-лактамазу (TEM1), fHbp Neisseria meningitides, двойной мутант внеклеточный холестеринзависимого стрептолизина О (Slo-dm) Streptococcus pyogenes, серин-протеазу клеточной оболочки SpyCEP Streptococcus pyogenes или предполагаемый поверхностный эксклюзионный белок Spy0269 Streptococcus pyogenes.
11. OMV по п. 1, где OMV содержит по меньшей мере два гетерологичных белка, которые присутствуют в ее полости в свободной форме.
12. OMV по п. 11, где OMV содержит по меньшей мере три гетерологичных белка, которые присутствуют в ее полости в свободной форме.
13. OMV по п. 11 или 12, где гетерологичные белки включают двойной мутант внеклеточного холестеринзависимого стрептолизина O (Slo-dm) Streptococcus pyogenes и предполагаемый поверхностный эксклюзионный белок Spy0269 Streptococcus pyogenes.
14. OMV по п. 12, где гетерологичные белки включают двойной мутант внеклеточного холестеринзависимого стрептолизина О (Slo-dm) Streptococcus pyogenes, серин-протеазу клеточной оболочки SpyCEP Streptococcus pyogenes и предполагаемый поверхностный эксклюзионный белок Spy0269 Streptococcus pyogenes.
15. Способ получения OMV по любому из пп. 1-14, где способ включает стадии (a) получения OMV по любому из пп.1-14 и (b) экспрессии гетерологичного белка в периплазме грамотрицательной бактерии.
16. Способ по п. 15, где гетерологичный белок экспрессируют в периплазме грамотрицательной бактерии с использованием вектора экспрессии, содержащего нуклеотидную последовательность, кодирующую гетерологичный белок, функционально связанную с нуклеиновой кислотой, кодирующей сигнальную последовательность периплазматического белка.
17. Способ по п. 16, где нативная сигнальная последовательность гетерологичного белка заменена сигнальной последовательностью периплазматического белка.
18. Способ по любому из пп. 15-17, дополнительно включающий стадию выделения OMV.
19. OMV, полученная или которую можно получить способом по любому из пп. 15-18, где OMV вызывает иммунный ответ на гетерологичный белок при введении млекопитающему и где гетерологичный белок функционально активен в полости OMV.
20. OMV по п. 19, где грамотрицательная бактерия выбрана из группы, включающей в себя E. coli, Н. menigitides, Salmonella sp. и Shigella sp.
21. OMV по п. 19, где грамотрицательная бактерия относится к штамму грамотрицательных бактерий, характеризующемуся повышенной способностью к блеббингу.
22. OMV по п. 21, где грамотрицательная бактерия относится к штамму E. coli ΔtolR или штамму E. coli ΔompA.
23. OMV по любому из пп. 19-22, где гетерологичный белок является антигеном.
24. OMV по любому из пп. 19-22, где гетерологичный белок представляет собой цитоплазматический белок или периплазматический белок гетерологичного организма.
25. OMV по любому из пп. 19-22, где гетерологичный белок представляет собой мембраноассоциированный белок гетерологичного организма с удаленным мембранным якорем.
26. OMV по любому из пп. 19-22, где гетерологичный белок представляет собой β-лактамазу (TEM1), fHbp Neisseria meningitides, двойной мутант внеклеточный холестеринзависимого стрептолизина О (Slo-dm) Streptococcus pyogenes, серин-протеазу клеточной оболочки SpyCEP Streptococcus pyogenes или предполагаемый поверхностный эксклюзионный белок Spy0269 Streptococcus pyogenes.
27. OMV по п. 19, где OMV содержит по меньшей мере два гетерологичных белка, которые присутствуют в ее полости в свободной форме.
28. OMV по п. 27, где OMV содержит по меньшей мере три гетерологичных белка, которые присутствуют в ее полости в свободной форме.
29. OMV по п. 27 или 28, где гетерологичные белки включают двойной мутант внеклеточного холестеринзависимого стрептолизина O (Slo-dm) Streptococcus pyogenes и предполагаемый поверхностный эксклюзионный белок Spy0269 Streptococcus pyogenes.
30. OMV по п. 28, где гетерологичные белки включают двойной мутант внеклеточного холестеринзависимого стрептолизина О (Slo-dm) Streptococcus pyogenes, серин-протеазу клеточной оболочки SpyCEP Streptococcus pyogenes и предполагаемый поверхностный эксклюзионный белок Spy0269 Streptococcus pyogenes.
31. Фармацевтическая композиция, содержащая (a) OMV по любому из пп. 1-14 или 19-30 и (b) фармацевтически приемлемый носитель, где OMV вызывает иммунный ответ на гетерологичный белок при введении млекопитающему и где гетерологичный белок функционально активен в полости OMV.
32. Фармацевтическая композиция по п. 31, где композиция представляет собой иммуногенную композицию.
33. Фармацевтическая композиция по п. 31 или 32, где композиция представляет собой вакцину.
34. Способ генерирования иммунного ответа на гетерологичный белок у млекопитающего, включающий введение эффективного количества OMV по любому из пп. 1-14 или 19-30, или фармацевтической композиции по пп. 31-33, млекопитающему.
35. Применение OMV по любому из пп. 1-14 или 19-30 или фармацевтической композиции по пп. 31-33 в терапии.
| ВАКЦИНЫ С ИСПОЛЬЗОВАНИЕМ ВЕЗИКУЛ НА ОСНОВЕ GNA 1870 ШИРОКОГО СПЕКТРА ДЕЙСТВИЯ ДЛЯ ПРОФИЛАКТИКИ ЗАБОЛЕВАНИЙ, ВЫЗЫВАЕМЫХ NEISSERIA MENINGITIDIS | 2006 |
|
RU2432962C2 |
| MURALINATH M | |||
| et al., Immunization with Salmonella enterica serovar Typhimurium-derived outer membrane vesicles delivering the pneumococcal protein PspA confers protection against challenge with Streptococcus pneumoniae, Infect Immun., 2011, 79(2): 887-94 | |||
| CHEN DJ et al., Delivery of foreign antigens by engineered outer membrane vesicle vaccines, Proc Natl Acad Sci USA, 2010, 107(7): 3099-104 | |||
| KIM JY et al., Engineered bacterial outer membrane vesicles with enhanced functionality, J Mol Biol., 2008, 380(1): 51-66 | |||
| ВАКЦИННАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ТРАНСФЕРРИН-СВЯЗЫВАЮЩИЙ БЕЛОК И HSF ИЗ ГРАМОТРИЦАТЕЛЬНЫХ БАКТЕРИЙ | 2003 |
|
RU2359696C2 |
Авторы
Даты
2018-07-31—Публикация
2013-09-18—Подача