Предметом изобретения являются добавки для гальванических батарей (аккумуляторов).
Для независимости в энергообеспечении мобильным электронным устройствам необходимы все более мощные батареи, пригодные к зарядке [аккумуляторы]. Для этих целей, помимо никель-кадмиевых и никель-металлогидридных аккумуляторов, годятся, в частности, литиевые батареи, которые по сравнению вышеназванными системами обладают существенно более высокой плотностью энергии. В будущем предстоит использовать крупные литиевые аккумуляторы также, например, и в стационарных вариантах (энергетический резерв, power back-up), а также в автомобилестроении, для тяги (гибридный или чисто электрический привод). В настоящее время для этих целей разрабатывают и применяют литиевые батареи, в которых в качестве анода используют вещество, содержащее графит. В заряженном состоянии в графитном аноде в общем случае невозможно запасти (интеркалировать) более 1 атома лития на 6 атомов углерода, что соответствует предельной стехиометрии LiC6. Из этого следует плотность (загрузки) лития максимум в 8,8 вес.%. Поэтому материал анода обусловливает нежелательное ограничение плотности энергии таких систем батарей.
Вместо литиевых интеркаляционных анодов, например, из графита в качестве материала анода можно, в принципе, также применять и металлический литий или сплав, содержащий металлический литий (например, сплавы лития с алюминием, кремнием, оловом, титаном или сурьмой). В сравнении с распространенным интеркаляционным графитовым анодом этот принцип допускает существенно более высокую удельную нагрузку литием и, следовательно, плотность энергии. К сожалению, такие системы, содержащие металлический литий, характеризуются неблагоприятными показателями безопасности и недостаточной стабильностью циклов. Это связано в первую очередь с тем, что литий при осаждении в цикле зарядки осаждается не в виде пластин, а дендритным образом, то есть он образует игольчатые выросты на поверхности анода. Этот наросший в виде дендритов литий может утратить электрический контакт с анодом, в силу чего он инактивируется в электрическом отношении, то есть он более не вносит свой вклад в производительность анода, то есть зарядная и разрядная емкость снижается. Кроме того, дендритоподобные формы лития могут проткнуть сепаратор, в результате чего в батарее может возникнуть короткое замыкание. Высвобождающаяся при этом за короткий срок энергия вызывает резкое повышение температуры, из-за чего обычные растворы электролитов, как правило горючие, содержащие органические растворители, например, сложные эфиры угольной кислоты (например, этиленкарбонат, пропиленкарбонат, этилметилкарбонат), лактоны (например, гамма-бутиролактон) или простые эфиры (например, диметоксиэтан), могут загореться. Поскольку современные литиевые батареи включают в себя лабильную фторсодержащую токопроводящую соль (LiPF6 или LiBF4), то при таких событиях дополнительно образуются опасные, едкие и токсичные продукты разложения (фтороводород и летучие органические продукты, содержащие фтор). Поэтому содержащие литий в металлическом виде аккумуляторы до сих пор изготавливают только в миниатюрном размере (например, кнопочные батарейки).
Pacific Northwest National Laboratories предложены добавки, которые могут подавлять формирование литиевых дендритов (Ji-Guang Zhang, 6th US-China EV and Battery Technology Workshop, Aug. 23, 2012). Эти добавки состоят из CsPF6 или RbPF6. Известно, что указанные гексафторфосфаты нестабильны в воде (Е. Bessler, J. Weidlein, Z. Naturforsch. 37b, 1020-5 (1982). Напротив, они разлагаются по уравнению
MPF6+H2O→POF3+2HF+MF (M = например, Cs, Rb)
Высвобождающаяся фтористоводородная кислота очень ядовита и вызывает коррозию. По этой причине изготовление и применение гексафторфосфатов требует строжайших мер безопасности. Кроме того, при экологической утилизации или повторном использовании батарей, содержащих MPF6, необходимо принимать меры, которые препятствуют высвобождению ядовитых соединений фтора, в особенности HF. Эти меры дороги и усложняют повторное применение (вторичную утилизацию) использованных батарей.
Перед изобретением была поставлена задача представить добавки к электролиту, которые препятствуют формированию дендритных литиевых структур при осаждении ионов лития в виде металлического лития, и которые к тому же нетоксичны, то есть, в частности, не формируют фторсодержащие яды, как, например, HF, POF3 и т.д. Эти добавки к электролитам должны обладать определенной минимальной растворимостью в обычных для батарей растворителях, не менее 0,001 моль/л.
Задачу решают посредством того, что в качестве компонентов электролита (добавок) применяют не содержащие фтора и растворимые в полярных органических растворителях соли натрия, калия, цезия и/или рубидия. В качестве таких добавок можно использовать, в частности, соли, образованные натрием, калием, цезием и рубидием с анионами органоборатов общей структуры 1, с анионами органофосфатов общей структуры 2 и/или с перхлорат-анионом [ClO4] 3 (М=Na, K, Rb, Cs)

X, Y и Z в формулах 1, 2 означают соединенный с атомом бора или фосфора мостик с двумя атомами кислорода, выбранный из

или
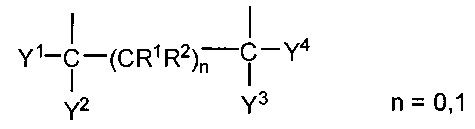
или
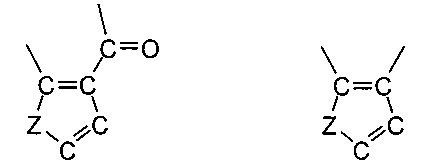
где

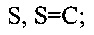
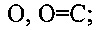
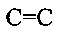
Y1 и Y2 вместе означают О, m=1, n=0, a Y3 и Y4 независимо друг от друга представляют собой Н или алкиловый остаток с 1-5 атомами углерода, или
Y1, Y2, Y3, Y4 в каждом случае независимо друг от друга означают OR (где R - это алкиловый остаток с 1-5 атомами углерода), Н или алкиловый остаток R1, R2 с 1-5 атомами углерода, и причем m, n=0 или 1.
Крайне предпочтительны соединения общих формул 1, 2 и/или 3, где М=Rb и Cs.
Неожиданно было обнаружено, что не содержащие фтора соли натрия, калия, цезия и рубидия относительно хорошо растворимы в применяемых обычно в литиевых батареях апротонных растворителях, как то: эфирах угольной кислоты, нитрилах, эфирах карбоновых кислот, сульфонах, простых эфирах и т.д. Этого не ожидали, поскольку известно, что многие соли цезия, образованные с большими, низкокоординирующими анионами, относительно тяжело растворяются в воде (А. Nadjafi, Microchim. Acta 1973, 689-96). Так, например, растворимость CSClO4 в воде при 0°С составляет 0,8, а при 25°С 1,97 г/100 мл (Wikipedia, Caesium perchlorate). В нижеследующую таблицу сведены некоторые данные о растворимости в обычных для аккумуляторов растворителях, полученные самостоятельно:
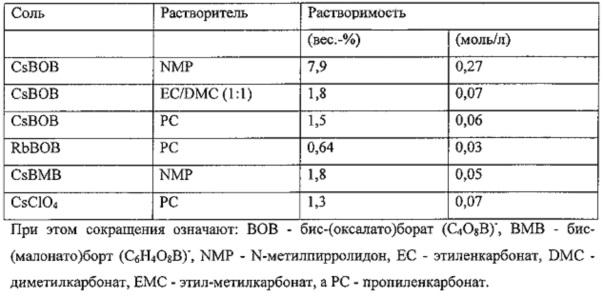
В обычных для литиевых аккумуляторов растворах электролитов, то есть, в присутствии содержащей литий проводящей соли, указанные соединения также растворимы. Неожиданно было обнаружено, что в присутствии фторной соли LiPF6 значения растворимости добавок особенно высоки:

Причина этой повышенной растворимости, возможно, состоит в том, что уже при относительно низких температурах неожиданным образом начинаются процессы обмена лигандами. По данным ЯМР уже при 25°С за несколько дней имеет место значительный обмен фторидами и оксалатами, который в случае применения CsBOB можно сформулировать следующим образом:

Было обнаружено, что растворы электролитов, которые содержат указанные свободные от фтора добавки в концентрациях от 0,0001 М до 0,1 М, предпочтительно от 0,001 М до 0,05 М, могут предотвратить формирование литиевых дендритов в гальванических батареях с анодами, которые в заряженном состоянии содержат литий или сплавы лития или же состоят из них. Добавку согласно изобретению предпочтительно применяют в литиевых аккумуляторах типа "литий/сера", "литий/воздух" или же с безлитиевыми или обедненными литием катодами типа катодов с преобразованием или вставкой.
В качестве электролитов можно применять известные специалисту виды (жидкие, гелевые, полимерные и твердые электролиты). В качестве проводящей соли используют растворимые в таких продуктах или вводимые в них иным способом соли лития с слабо координированными и устойчивыми к окислению анионами. К ним относятся, например, LiPF6, фтороалкилфосфаты лития, LiBF4, имидные соли (например, LiN(SO2CF3)2), LiOSO2CF3, метидные соли (например LiC(SO2CF3)3), LiClO4, хелатные бораты лития (например, LiBOB, LiB(C2O4)2), хелатные фторбораты лития (например, LiC2O4BF2), хелатные фосфаты лития (например, LiTOP, LiP(C2O4)3) и хелатные фторфосфаты лития (например, Li(C2O4)2PF2). Из числа этих солей лития особо предпочтительны не содержащие фтора представители, поскольку из-за применения фтора утрачиваются преимущества полностью свободных от фтора электролитов, имеющиеся у них в смысле токсичности и простоты обращения.
Электролиты содержат проводящую соль лития или комбинацию нескольких солей в концентрациях минимум 0,1 и максимум 2,5 моль/кг, предпочтительно от 0,2 до 1,5 моль/кг. Жидкие или гелеобразные электролиты дополнительно содержат органические апротонные растворители, большей частью эфиры угольной кислоты (например, этиленкарбонат, диметилкарбонат, диэтилкарбонат, фторэтиленкарбонат, пропиленкарбонат), нитрилы (ацетонитрил, адипонитрил, валеронитрил, метоксипропионитрил, сукцинонитрил), сложные эфиры карбоновых кислот (например, этилацетат, бутилпропионат), сульфоны (например, диметилсульфон, диэтилсульфон, этилметоксиэтилсульфон), лактоны (например, гамма-бутиролактон) и/или простые эфиры (например, тетрагидрофуран, дибутиловый эфир, 1,2-диметоксиэтан, диэтиленгликольдиметиловый эфир, тетраэтиленгликольдиметиловый эфир, 1,4-диоксан, 1,3-диоксолан).
Ниже приведено общее описание соединений согласно изобретению и их синтеза
Примеры
1. Синтез бис(оксалато)бората цезия (CsBOB)
В стеклянной круглодонной колбе емкостью 1 литр в 121 г воды суспендировали 38,67 г борной кислоты и 10,8 дигидрата щавелевой кислоты. Перемешивая магнитной мешалкой, по порциям добавили 102,9 г карбоната цезия (сильное вспенивание ввиду выделения СО2). По окончании добавления белую суспензию сначала выпарили в ротационном испарителе при 100°С и 400 мбар. Затем бесцветный твердый остаток размололи и окончательно высушили в течение 3 ч при 180°С и 20 мбар.
Выход: 197,3 г бесцветного порошка (97% от теоретического)
Содержание Cs: 41,0%
δ11В=7,4 ppm (раствор в d6ДМСО)
Термическая стабильность: 290°С (начало термического разложения в термогравиметрическом эксперименте в потоке Ar)
2. Получение свободного от фтора раствора электролита, содержащего CsBOB
В заполненном аргоном перчаточном боксе к 10 г 11 вес.%-ного раствора LiBOB в смеси этиленкарбоната с этилметилкарбонатом (1:1 вес/вес) добавили 0,32 г CsBOB и на протяжении 24 ч перемешивали магнитной мешалкой. Затем суспензию профильтровали методом мембранной фильтрации (0,45 мкм ПТФЭ) до прозрачного состояния.
Содержание Cs (FES) в растворе электролита: 0,05 вес.%
3. Получение раствора электролита, содержащего CSClO4
В заполненном аргоном перчаточном боксе к 10 г 10 вес.%-ного раствора LiPF6 в смеси этиленкарбоната с этилметилкарбонатом (1:1 вес/вес) добавили 0,47 г CSClO4 и на протяжении 24 ч перемешивали магнитной мешалкой. Затем суспензию профильтровали методом мембранной фильтрации (0,45 мкм ПТФЭ) до прозрачного состояния.
Содержание Cs (FES) в растворе электролита: 0,07 вес.%
Изобретение относится к электролиту для гальванического элемента. Электролит имеет анод, который в заряженном состоянии содержит металлический литий или сплавы лития или состоит из них и содержит одну или несколько добавок, выбранных из группы свободных от фтора солей цезия или рубидия. Указанный электролит содержит один или несколько органических апротонных растворителей и одну или несколько солей лития со слабо координирующими анионами. Добавка, содержащая цезий или рубидий, содержится в концентрации между 0,0001 М и 0,1 М и выбрана из группы Cs(C4O8B), Cs(C6H4O8B), Rb(C4O8B) и Rb(C6H4O8B). Также предложены литиевая батарея и применение Cs(C4O8B), Cs(C6H4O8B), Rb(C4O8B) и Rb(C6H4O8B) в концентрациях между 0,0001 М и 0,1 М в электролите. Изобретение позволяет предоставить добавки к электролиту, которые препятствуют формированию дендритных литиевых структур при осаждении ионов лития в виде металлического лития и которые не формируют фторсодержащие яды. 3 н. и 3 з.п. ф-лы, 2 табл., 3 пр.
1. Электролит для гальванического элемента, который имеет анод, который в заряженном состоянии содержит металлический литий или сплавы лития или состоит из них, содержащий одну или несколько добавок, выбранных из группы свободных от фтора солей цезия или рубидия, причем указанный электролит содержит один или несколько органических апротонных растворителей и одну или несколько солей лития со слабо координирующими анионами, а добавка, содержащая цезий или рубидий, содержится в концентрации между 0,0001 М и 0,1 М и выбрана из группы Cs(C4O8B), Cs(C6H4O8B), Rb(C4O8B) и Rb(C6H4O8B).
2. Электролит по п. 1, отличающийся тем, что соль лития выбрана из группы LiPF6, фтороалкилфосфатов лития, LiBF4, имидных солей, LiOSO2CF3, метидных солей, LiClO4, хелатных боратов лития, хелатных фторборатов лития, хелатных фосфатов лития и хелатных фторфосфатов лития.
3. Электролит по п. 1, отличающийся тем, что соль лития свободна от фтора.
4. Электролит по одному из пп. 1-3, отличающийся тем, что добавка, содержащая цезий или рубидий, содержится в концентрации между 0,001 М и 0,05 М.
5. Литиевая батарея, отличающаяся тем, что в заряженном состоянии она содержит анод на основе металлического лития или сплава лития, катод с вставкой или преобразованием лития и электролит по одному из пп. 1-4.
6. Применение Cs(C4O8B), Cs(C6H4O8B), Rb(C4O8B) и Rb(C6H4O8B) в концентрациях между 0,0001 М и 0,1 М в электролите, который содержит один или несколько органических апротонных растворителей и одну или несколько солей лития со слабо координирующими анионами, в гальванических элементах, которые имеют анод, которые в заряженном состоянии содержат металлический литий или сплав лития или состоят из него.
| JP 2010118179 A, 27.05.2010 | |||
| US 20050202320 A1, 15.09.2005 | |||
| JP 2009054354 A, 12.03.2009 | |||
| WO 2011142410 A1, 17.11.2011 (& EP 2571089) | |||
| Неводный малополярный электролит | 1991 |
|
SU1787299A3 |
| BESSLER E | |||
| et al, Borkomplexe mit Dicarbonsaeuren: Bis(oxalato)borate und Bis(malonato)borate, Chemical Sciences, Zeitschrift fuer Naturforschung, Teil B, 1982, v.37B, no | |||
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
Авторы
Даты
2018-08-31—Публикация
2013-10-09—Подача