Область техники
Изобретение относится к химии и фармакологии, конкретно к способу приготовления водорастворимой лиофилизированной формы (бис(2-тио-4,6-диоксо-1,2,3,4,5,6-гексагидропиримидин-5-ил)-(4-нитрофенил)метана), обладающей гепатопротекторной активностью и предназначенной для использования в медицинской практике для лечения заболеваний печени, а также к полученной водорастворимой лиофилизированной форме указанного соединения.
Предшествующий уровень техники
Известно соединение формулы (бис(2-тио-4,6-диоксо-1,2,3,4,5,6-гексагидропиримидин-5-ил)-(4-нитрофенил)метан) (структурная формула 1), обладающее гепатопротекторной активностью и предложенное в качестве средства для лечения заболеваний печени.

В свободном виде соединение 1 представляет собой кислоту, которая плохо растворима в воде и поэтому в таком виде неудобна для парентерального использования. Получение водорастворимой формы (бис(2-тио-4,6-диоксо-1,2,3,4,5,6-гексагидропиримидин-5-ил)-(4-нитрофенил)метана) (1) возможно путем переведения его в соль, так как это вещество дает пригодные для парентерального введения водорастворимые соли с катионами щелочных металлов, азотистыми основаниями и другими фармакологически приемлемыми катионами. Однако водные растворы солей 1 обладают низкой устойчивостью и малопригодны для длительного хранения, что ограничивает возможности использования препарата.
Распространенным способом стабилизации подобных лекарственных средств служит их лиофилизация, то есть получение сухих быстрорастворимых форм (лиофилизатов) путем низкотемпературного упаривания замороженных водно-солевых растворов [Kunal A. Gaidhani, Mallinath Harwalkar, Deepak Bhambere 1, Pallavi S. Nirgude World Journal of Pharmaceutical Research 2017 Vol 4, Issue 8, 516-543. LYOPHILIZATION / FREEZE DRYING - A REVIEW].
В составе известных лиофилизированных препаратов используются различные фармакологически приемлемые катионы; наиболее часто встречается натрий. С учетом этого, а также поскольку соединение 1 является производным барбитуровой кислоты, а барбитураты обычно также лиофилизируют в виде натриевых солей, например гексенала-натрия, тиопентала-натрия [5 - EUROPEAN PHARMACOPOEIA - 8th Ed, 2013, V. 1, 2.], в качестве наиболее близкого к настоящему изобретению технического решения рассмотрен общий способ лиофилизации с использованием натриевой соли [Пат. США В 4138486, А61K 81/00, 1980] применительно к (бис(2-тио-4,6-диоксо-1,2,3,4,5,6-гексагидропиримидин-5-ил)-(4-нитрофенил)метану). Для увеличения стабильности лиофилизатов в их состав вводят разнообразные добавки, в частности сахара, аминокислоты, соли [Патент США В 4,138,486, А61K 81/00, 1980]. Например, в WO 2005/053745, публ. 2005.06.16, Stefan A. et al. описан пример введения в состав лиофилизата трис-оксиметиламинометана, известного в качестве стабилизатора биохимических систем.
При этом следует отметить, что в известном способе трис-оксиметиламинометан использован как компонент буферной системы, а не как солеобразующий противоион. Ввиду сложности химических процессов и отсутствия опубликованных материалов не представляется возможным предсказать состав солевой формы, необходимый для получения лиофилизата (бис(2-тио-4,6-диоксо-1,2,3,4,5,6-гексагидропиримидин-5-ил)-(4-нитрофенил)метана), который бы характеризовался достаточной стабильностью при хранении.
Еще одной задачей, вытекающей из существующего уровня техники, является необходимость получения такой фармацевтической формы (бис(2-тио-4,6-диоксо-1,2,3,4,5,6-гексагидропиримидин-5-ил)-(4-нитрофенил)метана), которая обладала бы пониженной токсичностью активного вещества при сохранении целевой фармакологической активности.
Раскрытие изобретения
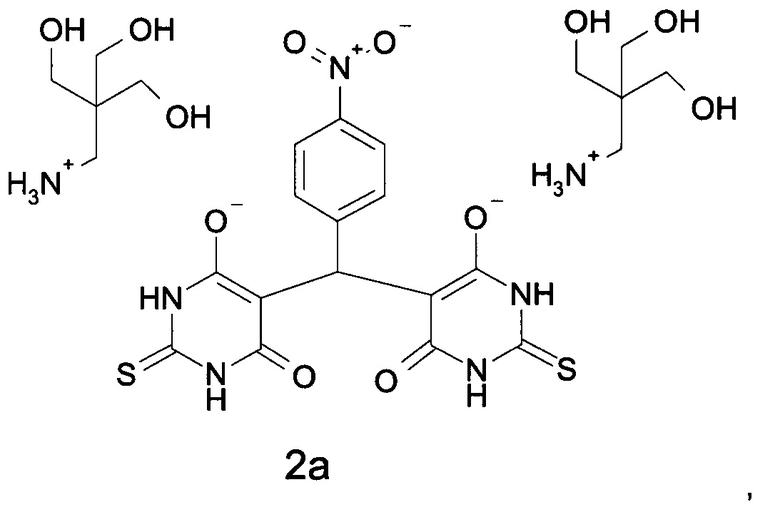
Поставленная задача решена путем получения лиофилизированной трис-оксиметиламмониевой соли соединения (бис(2-тио-4,6-диоксо-1,2,3,4,5,6-гексагидропиримидин-5-ил)-(4-нитрофенил)метана) формулы (2а), обладающей гепатопротекторной активностью и имеющей преимущество по сравнению с известными лиофилизированными солями этого соединения, например, в сравнении с соединением формулы (2b) за счет большей стабильности при хранении и меньшей токсичности.
Более конкретно, согласно изобретению поставленная задача решается путем получения лиофилизированной соли формулы 2а, где Х+ - катион трис-оксиметиламинометана:

Заявителю не известны какие-либо источники информации, в которых бы содержались сведения об идентичных технических решениях, что позволяет сделать вывод о соответствии заявленного изобретения критерию "новизна". Заявителем не выявлены какие-либо источники информации, содержащие сведения о влиянии заявленных отличительных признаков на достигаемый вследствие их реализации технический результат. Это, по мнению заявителя, свидетельствует о соответствии данного технического решения критерию «изобретательский уровень». Таким образом, по мнению заявителя, предложенная в настоящем изобретении лиофилизированная форма соединения (бис(2-тио-4,6-диоксо-1,2,3,4,5,6-гексагидропиримидин-5-ил)-(4-нитрофенил)метана) и описанный способ ее получения являются неочевидными и не следуют из существующего уровня техники.
Сущность изобретения поясняется приведенными ниже примерами получения заявленного вещества и образцов сравнения, таблицей характеристик полученных веществ, экспериментами по изучению биологических свойств и таблицами результатов экспериментов по определению биологических свойств полученных веществ, где:
Пример 1 - общая методика получения лиофилизированных солей (бис(2-тио-4,6-диоксо-1,2,3,4,5,6-гексагидропиримидин-5-ил)-(4-нитрофенил)метана), имеющих формулы (2а-с);
Пример 2 - методика определения гепатопротекторной активности;
Пример 3 - методика определения острой токсичности;
Таблица 1 - характеристики лиофилизатов (2а-с);
Таблица 2 - результаты определения гепатопротекторной активности лиофилизатов (2а-с);
Таблица 3 - результаты определения острой токсичности лиофилизатов (2а-с).
В дальнейшем изобретение поясняется подробным описанием примеров его осуществления.
Лучший вариант осуществления изобретения
Общая схема получения лиофилизатов (2а-с) приведена на Схеме 1. Процедуру проводили в соответствии с общей методикой, описанной в Примере 1.
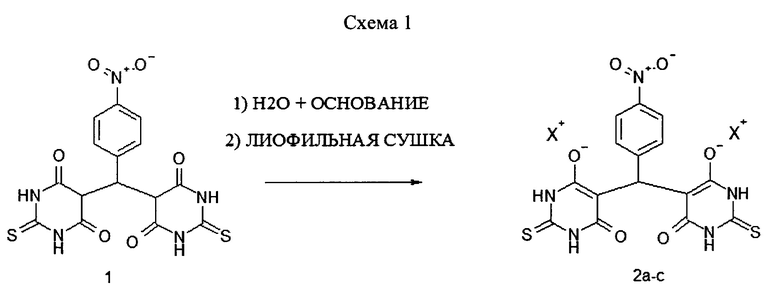
Пример 1. Общая методика получения лиофилизированных солей (бис(2-тио-4,6-диоксо-1,2,3,4,5,6-гексагидропиримидин-5-ил)-(4-нитрофенил)метана) (2а-с).
В коническую колбу вместимостью 1 л помещают 25 г (59 ммоль) (бис(2-тио-4,6-диоксо-1,2,3,4,5,6-гексагидропиримидин-5-ил)-(4-нитрофенил)метана) 1 с содержанием основного вещества не менее 99% и приливают 500 мл воды. Затем при перемешивании добавляют 10%-ный водный раствор соответствующего основания (NaOH, KOH или трис-оксиметиламинометана с чистотой 99.9%) в количестве, достаточном для полного растворения субстанции 1 (примерно 120 ммоль). После полного растворения вещества 1 количественно переносят раствор в мерную колбу вместимостью 1 л и доводят объем до метки водой. Полученный раствор с содержанием препарата 2.5% фильтруют через стерильный ацетилцеллюлозный мембранный фильтр с диаметром пор 0.4 мкм. Фильтрат разливают в стеклянные флаконы и замораживают при температуре (-20°C). Замороженный продукт помещают в камеру сушки сублимационной установки и выдерживают при давлении 0,3-0,5 мбар в течение 15-16 ч. После этого проводят досушку в течение 4 ч, выдерживая продукт при давлении 0,05 мбар.
После завершения сушки заполняют камеру азотом и флаконы с лиофилизатом закрывают резиновыми пробками.
рН 2,5%-ного водного раствора заявляемого вещества составляет 7,15 при использовании 120 ммоль трис-оксиметиламинометана, 6,90 при использовании 115 ммоль трис-оксиметиламинометана и 7,20 при использовании 122 ммоль трис-оксиметиламинометана на 25 г вещества 1.
Результаты оценки свойств лиофилизатов 2а-с после 60 суток хранения при комнатной температуре приведены в таблице 1.

Таким образом, по результатам оценки свойств лиофилизатов 2а-с после 60 суток хранения целевой продукт 2а обладает явным преимуществом перед прототипом (2b) и его аналогом (2с). Продукт 2а менее окрашен, содержит меньше примесей и имеет практически нейтральное значение рН, близкое к физиологическому.
Пример 2. Получение лекарственных форм композиции
А. Полученный раствор с содержанием препарата 1,5% фильтруют через стерильный ацетилцеллюлозный мембранный фильтр с диаметром пор 0.4 мкм. Фильтрат разливают в стеклянные флаконы и замораживают при температуре (-30°C). Замороженный продукт помещают в камеру сушки сублимационной установки и выдерживают при давлении 0,3-0,5 мбар в течение 20-24 ч. После этого проводят досушку в течение 2 ч, выдерживая продукт при давлении 0,08 мбар. После завершения сушки заполняют камеру азотом и флаконы с лиофилизатом закрывают резиновыми пробками.
Б. Проводят стерилизующую фильтрацию полученного раствора, имеющего концентрацию соединения 2а 5% мас., и в асептических условиях осуществляют под азотом его розлив в ампулы емкостью 2 мл по 1 мл в ампулу. Заполненные ампулы запаивают под азотом.
В другом варианте кассеты с ампулами помещают в сублимационную камеру, где замораживают до температуры минус 40°C со скоростью замораживания 5-10°C/ч, а затем подвергают высушиванию в вакууме. Ампулы с полученной сухой лиофилизированной формой препарата запаивают под азотом.
Композиции, подходящие для перорального введения, могут содержать (а) липидные растворы, как, например, эффективное количество соединения, растворенного в разбавителях, как, например, воде, солевом растворе, (б) капсулы, (в) суспензии в подходящей жидкости, (г) подходящие эмульсии и (д) ампулы. Композиции, пригодные для парентерального введения, включают водные и неводные, изотонические стерильные растворы для инъекций, которые могут содержать антиоксиданты, буферные вещества, бактериостатические вещества и растворители, которые делают состав совместимым с кровью предполагаемого реципиента, и водные и неводные стерильные суспензии, которые могут включать суспендирующие вещества, растворяющие вещества, вещества для сгущения, стабилизаторы и консерванты. Составы могут быть представлены в дозах для однократного приема или в герметичных дозах для многократного приема, как, например, ампулах и флаконах, и могут храниться в замороженном на холоде (лиофилизированном) состоянии, требуя только добавления стерильного жидкого вспомогательного вещества, например воды для инъекций, немедленно перед применением. Приготовленные для немедленного приема растворы для инъекций и суспензии можно приготовить из стерильных порошков, гранул и таблеток из числа ранее описанных.
В некоторых вариантах осуществления композиция составлена так, что имеет рН в диапазоне от приблизительно 6,8 до приблизительно 7,30, включая, например, рН в любом диапазоне от приблизительно 6,8 до приблизительно 7,3, от приблизительно 6,9 до приблизительно 7,2 и от приблизительно 7,0 до приблизительно 7,1. В некоторых вариантах осуществления рН составленной композиции не менее чем приблизительно 7,15. Композиция также может быть сделана изотоничной крови посредством добавления соответствующего модификатора тоничности, как, например, глицерина.
Также описываются изделия, содержащие описанные здесь композиции в соответствующей упаковке. Подходящие упаковки для композиций, описанных здесь, известны в этой области техники и включают, например, флаконы (как, например, герметичные флаконы), резервуары, ампулы, сосуды, контейнеры, гибкую упаковку (например, герметичные лавсановые или пластиковые пакеты) и подобные. Такие изделия дополнительно могут быть стерилизованы и/или герметично упакованы. Также предоставлены стандартные лекарственные формы, содержащие композиции, описанные здесь. Эти стандартные лекарственные формы могут храниться в подходящих упаковках в однократных или многоразовых дозировках и дополнительно могут быть стерилизованы и герметично упакованы.
Настоящее изобретение также описывает наборы, содержащие композиции (или стандартные лекарственные формы и/или изделия производителя), описанные здесь, и могут далее включать инструкцию(и) по способам применения композиции, как, например, применения, описанного здесь. В некоторых вариантах осуществления набор изобретения содержит упаковку, описанную здесь. В других вариантах осуществления набор изобретения содержит упаковку, описанную здесь, и вторую упаковку, содержащую буферное вещество.
Наборы, описанные здесь, могут дополнительно включать другие материалы, описанные здесь, предпочтительные с коммерческой и потребительской сторон, включая другие буфера, разбавители, фильтры, иглы, шприцы и упаковочные вставки с инструкциями для осуществления любого из способов, описанных здесь.
Также могут быть предоставлены наборы, которые содержат достаточные дозировки для достижения эффективного лечения субъекта в течение длительного периода времени, например от недели до 6 месяцев и более. Наборы могут также включать совокупность дозировок для однократного приема фармацевтической композиции и инструкций по применению, упакованных в количествах, пригодных для хранения и применения в аптеках, например аптеках больниц и аптеках готовых лекарственных форм.
Предпочтительно лиофилизированный продукт согласно изобретению упаковывают в сосуд, который может быть герметично закрыт, или герметичный сосуд, приспособленный для парентерального введения. Таким сосудом может быть, например, флакон, называемый "многодозовым", шприц, называемый "предварительно заполненный", гибкий мешок для перфузии или ампула. Многодозовый флакон обычно снабжен пробкой с перегородкой, обеспечивающей прохождение иглы шприца, и содержит количество препарата согласно изобретению, который можно извлекать в любом желаемом количестве, достаточное для того, чтобы позволить осуществить определенное число перфузий или инъекций.
Промышленная применимость
Для реализации изобретения используются известные материалы и оборудование, что обусловливает, по мнению заявителя, соответствие изобретения критерию «Промышленная применимость» (IA).
Гепатопротекторная активность
Изучение гепатопротекторной активности производных проводили на крысах линии Wistar (самцы и самки, 180-200 г, Рапполово, Санкт-Петербург).
Острый токсический гепатит у крыс вызывали внутрижелудочным введением ацетаминофена (2,5 г/кг 2 дня) или CCl4 (0.5 мл/кг). Испытуемые препараты вводили перорально в виде суспензии в оливковом масле 1 раз в сутки после формирования модельной патологии или внутривенно в дозе 25 мг/кг. Динамику веса крыс определяли на весах фирмы «Sartorius».

Лиофилизированные продукты восстанавливали путем добавления жидкого разбавителя менее чем через 2 минуты. Время восстановления лиофилизированных составов составляло 10-15 минут.
Восстановленные составы вводили соответственно интраперитонеально (IP) группам из десяти самцов мыши линии CD-1 (Crl.) весом 24+/-2 г.




Промышленная применимость
Для реализации изобретения используются известные материалы и оборудование, что обусловливает, по мнению заявителя, соответствие изобретения критерию «Промышленная применимость».
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ ПЕЧЕНИ РАЗЛИЧНОГО ГЕНЕЗА | 2009 |
|
RU2400233C1 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО С ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ (ВАРИАНТЫ) | 2015 |
|
RU2595038C1 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО С ГЕПАТОПРОТЕКТОРНОЙ АКТИВНОСТЬЮ | 2015 |
|
RU2595868C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ В ВИДЕ ЛИОФИЛИЗАТА С КОМПЛЕКСООБРАЗУЮЩИМ АГЕНТОМ ДЛЯ ПРИГОТОВЛЕНИЯ РАСТВОРА ДЛЯ ПАРЕНТЕРАЛЬНОГО ПРИМЕНЕНИЯ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2013 |
|
RU2545902C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ В ВИДЕ ЛИОФИЛИЗАТА ДЛЯ ПРИГОТОВЛЕНИЯ РАСТВОРА ДЛЯ ПАРЕНТЕРАЛЬНОГО ПРИМЕНЕНИЯ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2013 |
|
RU2545903C1 |
| УСОВЕРШЕНСТВОВАННЫЕ ЛИОФИЛИЗИРОВАННЫЕ И ФОСФАМИДНЫЕ КОМПОЗИЦИИ | 1992 |
|
RU2106138C1 |
| Фармацевтическая композиция нейропротекторного действия для парентерального применения на основе гексаметилендиамида бис-(N-моносукцинил-L-глутамил-L-лизина) в лиофилизированной лекарственной форме | 2017 |
|
RU2678203C2 |
| ФАРМАЦЕВТИЧЕСКИЙ СОСТАВ ТАКСАНА, ТВЕРДАЯ КОМПОЗИЦИЯ ТАКСАНА, СПОСОБ ПОЛУЧЕНИЯ ТВЕРДОЙ КОМПОЗИЦИИ ТАКСАНА, КОМПОЗИЦИЯ ДЛЯ СОЛЮБИЛИЗАЦИИ УКАЗАННОЙ ТВЕРДОЙ КОМПОЗИЦИИ ТАКСАНА И КОМПЛЕКТ ЭЛЕМЕНТОВ (НАБОР) ДЛЯ СОСТАВА ТАКСАНА ДЛЯ ИНЪЕКЦИЙ | 2007 |
|
RU2429837C2 |
| СТАБИЛЬНАЯ ЛИОФИЛИЗИРОВАННАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1996 |
|
RU2163801C2 |
| ПРОТИВООПУХОЛЕВЫЙ АНТРАФУРАНДИОН И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ЕГО ОСНОВЕ | 2014 |
|
RU2554939C1 |
Изобретение относится к новой водорастворимой лиофилизированной форме (бис(2-тио-4,6-диоксо-1,2,3,4,5,6-гексагидропиримидин-5-ил)-(4-нитрофенил)метана) формулы 2а, обладающей гепатопротекторной активностью и предназначенной для лечения печени, в частности гепатита. Способ получения водорастворимой лиофилизированной формы (бис(2-тио-4,6-диоксо-1,2,3,4,5,6-гексагидропиримидин-5-ил)-(4-нитрофенил)метана) формулы 2а

включает: приготовление раствора бис(2-тио-4,6-диоксо-1,2,3,4,5,6-гексагидропиримидин-5-ил)-(4-нитрофенил)метана, приготовление раствора трис-оксиметиламмония, объединение полученных растворов с получением раствора трис-оксиметиламмониевой соли формулы 2а, с последующей лиофилизацией полученного солевого раствора. Используемый для лиофилизации раствор соли 2а обычно содержит от 1,5 до 5% мас. бис(2-тио-4,6-диоксо-1,2,3,4,5,6-гексагидропиримидин-5-ил)-(4-нитрофенил)метана. Используемый для лиофилизации раствор трис-оксиметиламмониевой соли бис(2-тио-4,6-диоксо-1,2,3,4,5,6-гексагидропиримидин-5-ил)-(4-нитрофенил)метана имеет концентрацию от 2,5% мас. до 8,2% мас. и рН от 6,9 до 7,2. Лиофилизацию проводят при давлении 0,3-0,5 бар в течение 15-16 ч, с последующей досушкой в течение 2-4 ч при давлении 0,05 мбар. Полученная лиофилизированная водорастворимая форма соли, как правило, используется в фармацевтической композиции, пригодной для парентерального введения, в терапевтически или профилактически эффективном количестве в виде единичной дозы. Обычно используется лиофилизированная водорастворимая форма соли для получения лекарственного препарата, упакованного в сосуд, пригодный для парентерального введения. Сосуд представляет собой многодозовый флакон, ампулу, предварительно заполненный шприц, гибкий мешок для перфузии. Для лечения или профилактики гепатита соединение формулы 2а вводят также путем инфузии, перфузии или инъекции или перорально, например в виде суспензии в водной среде. Полученная лиофилизированная водорастворимая форма соли обладает повышенной стабильностью при хранении и пониженной токсичностью при сохранении высокой гепатопротекторной активности. 3 н. и 10 з.п. ф-лы, 5 табл.
1. Способ получения водорастворимой формы соли (бис(2-тио-4,6-диоксо-1,2,3,4,5,6-гексагидропиримидин-5-ил)-(4-нитрофенил)метана) формулы 2а
включающий:
- приготовление раствора бис(2-тио-4,6-диоксо-1,2,3,4,5,6-гексагидропиримидин-5-ил)-(4-нитрофенил)метана,
- приготовление раствора трис-оксиметиламмония,
- объединение полученных растворов с получением раствора трис-оксиметиламмониевой соли формулы 2а, с последующей лиофилизацией полученного солевого раствора.
2. Способ по п. 1, отличающийся тем, что используемый для лиофилизации раствор соли 2а содержит от 1,5 до 5% мас. бис(2-тио-4,6-диоксо-1,2,3,4,5,6-гексагидропиримидин-5-ил)-(4-нитрофенил)метана.
3. Способ по п. 1, отличающийся тем, что используемый для лиофилизации раствор трис-оксиметиламмониевой соли бис(2-тио-4,6-диоксо-1,2,3,4,5,6-гексагидропиримидин-5-ил)-(4-нитрофенил)метана имеет концентрацию от 2,5% мас. до 8,2% мас.
4. Способ по п. 1, отличающийся тем, что полученный раствор трис-оксиметиламмониевой соли соединения формулы 2а имеет рН от 6,9 до 7,2.
5. Способ по п. 1, отличающийся тем, что лиофилизацию проводят при давлении 0,3-0,5 бар в течение 15-16 ч, с последующей досушкой в течение 2-4 ч при давлении 0,05 мбар.
6. Лиофилизированная водорастворимая форма трис-оксиметиламмониевой соли бис(2-тио-4,6-диоксо-1,2,3,4,5,6-гексагидропиримидин-5-ил)-(4-нитрофенил)метана формулы 2а для фармацевтического применения при лечении гепатита.
7. Лиофилизированная водорастворимая форма соли по п. 6 для использования в фармацевтической композиции, пригодной для парентерального введения.
8. Лиофилизированная водорастворимая форма соли по п. 6 для применения в терапевтически или профилактически эффективном количестве в фармацевтической композиции в виде единичной дозы.
9. Лиофилизированная водорастворимая форма соли по п. 6 для получения лекарственного препарата, упакованного в сосуд, пригодный для парентерального введения.
10. Лиофилизированная водорастворимая форма соли по п. 9, где сосуд представляет собой многодозовый флакон, ампулу, предварительно заполненный шприц, гибкий мешок для перфузии.
11. Способ лечения или профилактики гепатита, включающий введение субъекту, нуждающемуся в таком лечении, лиофилизированной водорастворимой формы соли формулы 2а в эффективном количестве.
12. Способ лечения или профилактики гепатита по п. 11, отличающийся тем, что соединение формулы 2а вводят путем инфузии, перфузии или инъекции.
13. Способ лечения или профилактики гепатита по п. 11, отличающийся тем, что соединение формулы 2а вводят перорально, например в виде суспензии в водной среде.
| ЛЕКАРСТВЕННОЕ СРЕДСТВО С ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ (ВАРИАНТЫ) | 2015 |
|
RU2595038C1 |
| Zidar, Nace et al | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Acta Chimica Slovenica, 2011, 58(1), 151-157 (English) (реферат) Retrieved from STN 155:11909, CASREACT, REGISTRY via STN, RN 1309795-68-3P CA | |||
| Москвин А.В | |||
| и др | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Журнал общей химии, 2000, 70(5), 8877-878 | |||
| Москвин А.В | |||
| и др | |||
| Исследование азолов и азинов | |||
| CV | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Журнал общей химии, 1998, 68(5), 848-852 | |||
| Способ вязания круглой пятки па трехсистемном автомате | 1952 |
|
SU97936A1 |
| СТАБИЛИЗИРОВАННАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ В ЛИОФИЛИЗИРОВАННОЙ ФОРМЕ | 2000 |
|
RU2251411C2 |
| НОВЫЕ КОМПОЗИЦИИ АГОНИСТОВ ЭКСЕНДИНА И СПОСОБЫ ИХ ВВЕДЕНИЯ | 2000 |
|
RU2242244C2 |
Авторы
Даты
2018-09-06—Публикация
2017-10-05—Подача