Область техники
Настоящее изобретение относится к стабилизированной фармацевтической композиции в лиофилизированной форме, содержащей циклическое полипептидное соединение. Более конкретно, настоящее изобретение относится к стабилизированной фармацевтической композиции в лиофилизированной форме, содержащей циклическое полипептидное соединение или его фармацевтически приемлемую соль и стабилизатор.
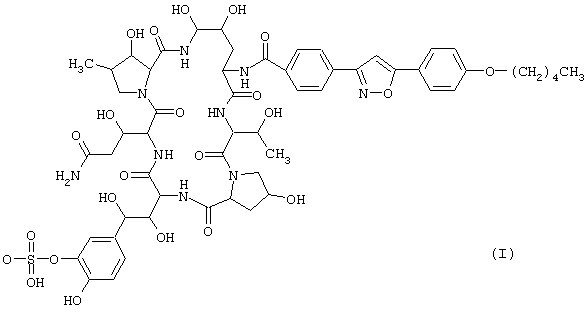
Циклическое полипептидное соединение по настоящему изобретению представлено общей формулой (I):
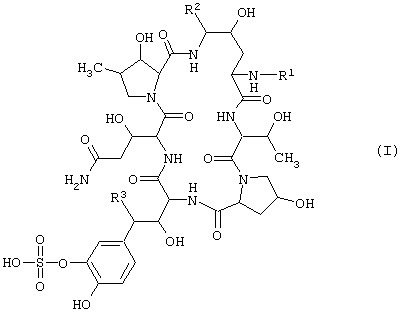
где R1 представляет атом водорода или ацильную группу, и R2 и R3 представляют одинаковые или различные, атом водорода или гидроксильную группу. Соединение обладает антимикробной активностью, в частности, противогрибковой активностью и ингибирующим β-1,3-глюкансинтазу действием, и полезно для профилактики и лечения инфекционных заболеваний различных видов, включая пневмоцистоз, например, пневмонию, вызванную carinii.
Предшествующий уровень
Среди циклических полипептидных соединений, представленных вышеуказанной формулой (I), соединение, где R1 представляет атом водорода, и R2 и R3 представляют гидроксильные группы, и соединение, где R1, R2 и R3 представляют атомы водорода, получают ферментацией, раскрытой в Европейском патенте №0462531, и способами, раскрытыми в WO 97/32975 и WO 97/47738. Соединение, где R1 представляет ацильную группу, и способ его получения раскрываются в патентах США №5376634 и 5569646 и WO 96/11210 и WO 99/40108.
Циклические полипептидные соединения (I) и их соли обычно нестабильны к воздействию света, влажности, кислот, тепла и тому подобное. Следовательно, желательна разработка фармацевтических препаратов, в которых циклические полипептидные соединения и их соли стабилизированы.
Раскрытие изобретения
Настоящее изобретение предлагает стабилизированную фармацевтическую композицию в лиофилизированной форме, содержащую циклическое полипептидное соединение (I) или его фармацевтически приемлемую соль и стабилизатор.
Далее поясняется термин "ацильная группа" R1 в формуле (I), представляющей циклическое полипептидное соединение по настоящему изобретению. В контексте настоящего описания термин "низший" означает имеющий один-шесть атомов углерода, если не указано иначе.
В качестве примеров ацильной группы можно упомянуть алифатические ацильные группы, ароматические ацильные группы, ароматические-алифатические ацильные группы и гетероциклические ацильные группы, полученные из алифатических, ароматических, ароматических-алифатических и гетероциклических карбоновых кислот.
Примеры алифатических ацильных групп включают низшие или высшие алканоильные группы такие, как формил, ацетил, пропаноил, бутаноил, 2-метилпропаноил, пентаноил, 2,2-диметилпропаноил, гексаноил, гептаноил, октаноил, нонаноил, деканоил, ундеканоил, додеканоил, тридеканоил, тетрадеканоил, пентадеканоил, гексадеканоил, гептадеканоил, октадеканоил, нонадеканоил, икозаноил и т.д.; циклоалканоильные группы такие, как циклопентаноил и циклогексаноил; низшие алкоксикарбонильные группы такие, как метоксикарбонил, этоксикарбонил, трет-бутоксикарбонил, трет-пентилоксикарбонил, гептилоксикарбонил и т.д.; низшие алкансульфонильные группы такие, как метансульфонил, этансульфонил и т.д.; низшие алкоксисульфонильные группы такие, как метоксисульфонил, этоксисульфонил и т.д., и тому подобное.
Примеры ароматических ацильных групп включают ароильные группы такие, как бензоил, толуоил, нафтоил и тому подобное.
Примеры ароматических-алифатических ацильных групп включают ар(низшие)алканоильные группы такие, как фенил (C1-С6)алканоил (например, фенилацетил, фенилпропаноил, фенилбутаноил, фенилизобутаноил, фенилпентаноил, фенилгексаноил и т.д.), нафтил(C1-C6) алканоил (например, нафтилацетил, нафтилпропаноил, нафтилбутаноил и т.д.) и тому подобное;
ар(низшие)алкеноильные группы такие, как фенил(С3-С6)алкеноил (например, фенилпропеноил, фенилбутеноил, фенилметакрилоил, фенилпентеноил, фенилгексеноил и т.д.), нафтил(С3-С6)алкеноил (например, нафтилпропеноил, нафтилбутеноил и т.д.) и тому подобное;
ар(низшие)алкоксикарбонильные группы такие, как фенил-(C1-С6)алкоксикарбонил (например, бензилоксикарбонил и т.д.), флуоренил(C1-C6)алкоксикарбонил (например, флуоренилметоксикарбонил и т.д.) и тому подобное;
арилоксикарбонильные группы такие, как феноксикарбонил, нафтоксикарбонил и т.д.;
арилокси(низшие)алканоильные группы такие, как феноксиацетил, феноксипропионил и т.д.;
арилкарбамоильные группы такие, как фенилкарбамоил и т.д.;
арилтиокарбамоильные группы такие, как фенилтиокарбамоил и т.д.;
арилглиоксилоильные группы такие, как фенилглиоксилоил, нафтилглиоксилоил и т.д.;
арилсульфонильные группы, которые могут быть необязательно замещены низшей алкильной группой, такие, как фенилсульфонил, п-толилсульфонил и т.д., и тому подобное.
Примеры гетероциклических ацильных групп включают гетероциклические карбонильные группы такие, как теноил, фуроил, никотиноил и т.д.;
гетероциклические(низшие)алканоильные группы такие, как гетероциклический ацетил, гетероциклический пропаноил, гетероциклический бутаноил, гетероциклический пентаноил, гетероциклический гексаноил и т.д.;
гетероциклические(низшие)алкеноильные группы такие, как гетероциклический пропеноил, гетероциклический бутеноил, гетероциклический пентеноил, гетероциклический гексеноил и т.д.;
гетероциклический глиоксилоил и тому подобное.
Ацильная группа радикал R1 может иметь один или более подходящий заместитель(ли). Среди вышеуказанных примеров ацильных групп, ароильная группа, которая может иметь один или более подходящий заместитель(ли), является особенно предпочтительной.
Примеры подходящих заместителей в ацильной группе включают гетероциклическую группу, замещенную арильной группой, имеющей низшую алкоксигруппу, гетероциклическую группу, замещенную арильной группой, имеющей низшую алкокси(низшую)алкоксигруппу, гетероцикличесую группу, замещенную арильной группой, имеющей низшую алкокси(высшую)алкоксигруппу, гетероциклическую группу, замещенную арильной группой, имеющей цикло(низшую)алкилоксигруппу, гетероциклическую группу, замещенную арильной группой, имеющей гетероциклическую группу, гетероциклическую группу, замещенную цикло(низшей)алкильной группой, имеющей цикло(низшую)алкильную группу, гетероциклическую группу, замещенную арильной группой, имеющей арильную группу, замещенную низшим алкокси(низшим)алкокси и гетероциклическую группу, замещенную арильной группой, имеющей гетероциклическую группу, замещенную цикло(низшей)алкильной группой.
Среди этих примеров предпочтительными являются ненасыщенная 3-8-членная гетеромоноциклическая группа, содержащая один-два атом(а) кислорода и один-три атом(а) азота и замещенная фенилом, имеющим (С4-С6) алкокси, ненасыщенная конденсированная гетероциклическая группа, содержащая один-два атом(а) серы и один-три атом(а) азота и замещенная фенилом, имеющим (С4-С6)алкокси, ненасыщенная 3-8-членная гетеромоноциклическая группа, содержащая один-два атом(а) серы и один-три атом(а) азота и замещенная фенилом, имеющим (C1-C4) алкокси (С4-С6) алкокси, ненасыщенная 3-8-членная гетеромоноциклическая группа, содержащая один-два атом(а) серы и один-три атом(а) азота и замещенная фенилом, имеющим (C1-C4) алкокси (C7-C14) алкокси, насыщенная 3-8-членная гетеромоноциклическая группа, содержащая один-четыре атом(а) азота и замещенная фенилом, имеющим (C1-C4)алкокси(С7-С14)алкокси, ненасыщенная конденсированная гетероциклическая группа, содержащая один-два атом(а) серы и один-три атом(а) азота и замещенная фенилом, имеющим цикло(С4-С6)алкилокси, ненасыщенная конденсированная гетероциклическая группа, содержащая один-два атом(а) серы и один-три атом(а) азота и замещенная фенилом, насыщенная 3-8-членная гетеромоноциклическая группа, содержащая один-два атом(а) кислорода и один-три атом(а) азота, насыщенная 3-8-членная гетеромоноциклическая группа, имеющая один-четыре атом(а) азота и замещенная цикло (С4-С6) алкилом, имеющим цикло (С4-С6) алкил, ненасыщенная 3-8-членная гетеромоноциклическая группа, имеющая один-два атом(а) серы и один-три атом(а) азота и замещенная фенилом, имеющим фенил, замещенный (C1-C4)алкокси(C1-C4) алкокси, ненасыщенная 3-8-членная гетеромоноциклическая группа, содержащая один-два атом(а) серы и один-три атом(а) азота и замещенная фенилом, имеющим насыщенную 3-8-членную гетеромоноциклическую группу, которая содержит один-четыре атом(а) азота и замещенная цикло(С4-С6)алкилом и ненасыщенная конденсированная гетероциклическая группа, содержащая один-два атом(а) серы и один-три атом(а) азота и замещенная фенилом, имеющим насыщенную 3-8-членную гетеромоноциклическую группу, которая содержит один-четыре атом(а) азота и имеет цикло (С4-С6) алкил.
Среди них особенно предпочтительными являются изоксазолильная группа, замещенная фенилом, имеющим пентилокси, имидазотиадиазолильная группа, замещенная фенилом, имеющим пентилокси, тиадиазолильная группа, замещенная фенилом, имеющим метоксигексилокси, тиадиазолильная группа, замещенная фенилом, имеющим метоксиоктилокси, тиадиазолильная группа, замещенная фенилом, имеющим метоксигептилокси, имидазотиадиазолильная группа, замещенная фенилом, имеющим циклогексилокси, имидазотиадиазолильная группа, замещенная фенилом, имеющим диметилморфолино, пиперазинильная группа, замещенная фенилом, имеющим метоксигептилокси, пиперазинильная группа, замещенная фенилом, имеющим метоксиоктилокси, пиперазинильная группа, замещенная циклогексилом, имеющим циклогексил, тиадиазолильная группа, замещенная фенилом, имеющим фенил, замещенный метоксиэтокси, тиадиазолильная группа, замещенная фенилом, имеющим фенил, замещенный метоксибутокси, тиадиазолильная группа, замещенная фенилом, имеющим фенил, замещенный этоксипропокси, имидазотиадиазолильная группа, замещенная фенилом, имеющим пиперазинил, замещенный циклогексилом, имидазотиадиазолильная группа, замещенная фенилом, имеющим пиперазинил, замещенный циклогексилом, и тому подобное.
Соответственно, особенно подходящими примерами ацильной группы R1 могут быть бензоильная группа, имеющая изоксазолил, замещенный фенилом, имеющим пентилокси, бензоильная группа, имеющая имидазотиадиазолил, замещенный фенилом, имеющим пентилокси, бензоильная группа, имеющая тиадиазолил, замещенный фенилом, имеющим метоксигексилокси, бензоильная группа, имеющая тиадиазолил, замещенный фенилом, имеющим метоксиоктилокси, бензоильная группа, имеющая тиадиазолил, замещенный фенилом, имеющим метоксигептилокси, бензоильная группа, имеющая имидазотиадиазолил, замещенный фенилом, имеющим циклогексилокси, бензоильная группа, имеющая имидазотиадиазолил, замещенный фенилом, имеющим диметилморфолино, бензоильная группа, имеющая пиперазинил, замещенный фенилом, имеющим метоксигептилокси, бензоильная группа, имеющая пиперазинил, замещенный фенилом, имеющим метоксиоктилокси, бензоильная группа, имеющая пиперазинил, замещенный циклогексилом, имеющим циклогексил, бензоильная группа, имеющая тиадиазолил, замещенный фенилом, имеющим фенил, замещенный метоксиэтокси, бензоильная группа, имеющая тиадиазолил, замещенный фенилом, имеющим фенил, замещенный метоксибутокси, бензоильная группа, имеющая тиадиазолил, замещенный фенилом, имеющим фенил, замещенный этоксипропокси, бензоильная группа, имеющая имидазотиадиазолил, замещенный фенилом, имеющим пиперазинил, замещенный циклогексилом, бензоильная группа, имеющая имидазотиадиазолил, замещенный фенилом, имеющим пиперазинил, замещенный циклогексилом, и тому подобное.
Особенно предпочтительные примеры ацильных групп R1 представлены формулами:
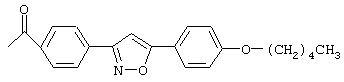
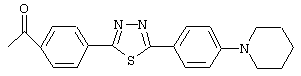
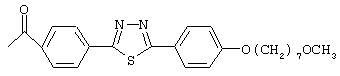
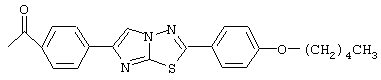
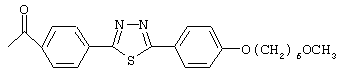
Циклические полипептидные соединения (I), имеющие вышеуказанные ацильные группы, можно получить из соединения, имеющего атом водорода в качестве R1, и гидроксильные группы в качестве R2 и R3, или соединения, имеющего атомы водорода в качестве R1, R2 и R3, согласно патентам США №5376634 и 5569646 и WO 96/11210 и WO 99/40108.
Подходящие соли циклических полипептидных соединений (I) являются растворимыми в воде и фармацевтически приемлемыми солями, включая соли оснований и кислотно-аддитивные соли. Такие соли можно получить обработкой циклического полипептидного соединения (I) соответствующим основанием или кислотой обычным способом.
В качестве солей оснований можно упомянуть соли неорганических оснований такие, как соли щелочных металлов (например, соли натрия, соли калия и т.д.), соли щелочноземельных металлов (например, соли кальция, соли магния и т.д.), соли аммония и тому подобное; соли органических оснований такие, как соли органических аминов (например, соли триэтиламина, соли диизопропилэтиламина, соли пиридина, соли пиколина, соли этаноламина, соли триэтаноламина, соли дициклогексиламина, соли N,N'-дибензилэтилендиамина и т.д.) и тому подобное.
В качестве кислотно-аддитивных солей можно упомянуть кислотно-аддитивные соли неорганических кислот (например, гидрохлориды, гидробромиды, сульфаты, фосфаты и т.д.) и кислотно-аддитивные соли органических карбоновых или сульфоновых кислот (например, формиаты, ацетаты, трифторацетаты, малеаты, тартраты, фумараты, метансульфонаты, бензолсульфонаты, толуолсульфонаты и т.д.). Кроме того, также можно упомянуть соли основных или кислых аминокислот (например, соли аргинина, аспарагиновой кислоты, глутаминовой кислоты и т.д.).
Циклические полипептидные соединения (I) по настоящему изобретению также включают возможные конформеры и пару или более стереоизомеров таких, как геометрические изомеры и оптические изомеры, которые могут существовать за счет асимметричных атомов углерода.
Предпочтительные циклические полипептидные соединения (I) представлены следующими формулами (II)-(VI):
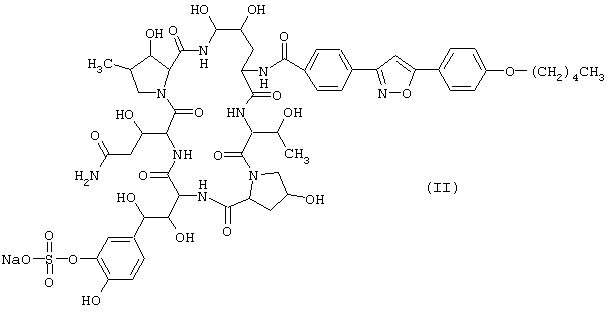
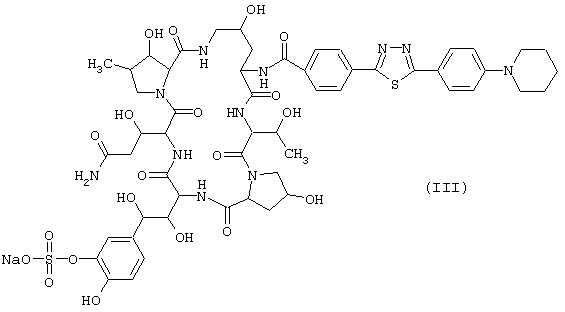
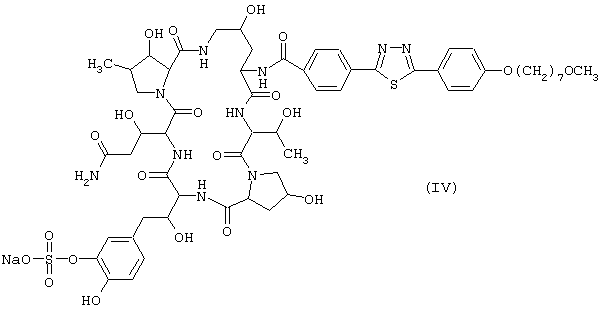
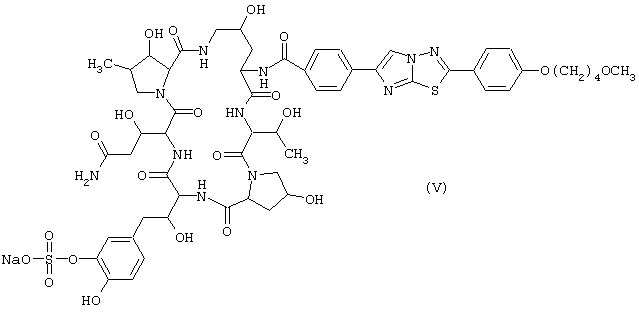
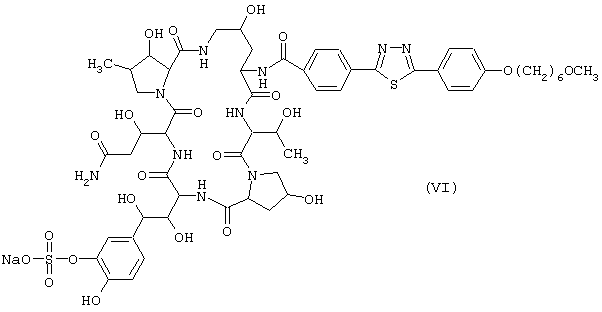
Наиболее предпочтительным является соединение, представленное формулой (II).
Количество циклического полипептидного соединения (I) или его фармацевтически приемлемой соли, содержащееся в композиции для разовой стандартной дозы по настоящему изобретению составляет 0,1-400 мг, более предпочтительно 1-200 мг, еще более предпочтительно 10-100 мг, особенно 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 70, 75, 80, 85, 90, 95 и 100 мг.
В качестве стабилизатора можно упомянуть полисахариды, дисахариды, хлорид натрия и их комбинации.
Примерами полисахарида являются декстран, крахмал, целлюлоза и гиалуроновая кислота; и примерами дисахарида являются лактоза, мальтоза и сахароза. Полисахарид или дисахарид, содержащийся в фармацевтической композиции по настоящему изобретению, могут быть α-моногидратом, α-ангидридом, β-ангидридом или их комбинацией.
Количество стабилизатора, используемое в фармацевтической композиции по настоящему изобретению, должно быть по меньшей мере достаточным для стабилизации циклического полипептидного соединения (I) или его фармацевтически приемлемой соли в композиции. Чтобы стабилизировать циклическое полипептидное соединение (I) достаточно по меньшей мере одной части по массе стабилизатора по отношению к одной части по массе циклического полипептидного соединения (I) или его фармацевтически приемлемой соли в композиции. Стабилизатор может также служить в качестве носителя или эксцепиента. Таким образом, используемое количество стабилизатора не имеет определенного верхнего предела и может быть определено с учетом массы или объема композиции по отношению к стандартной дозе соединения и тому подобное. Однако такое количество предпочтительно, составляет 0,4-50 частей по массе, более предпочтительно 0,6-20 частей по массе, еще более предпочтительно 0,8-10 частей по массе по отношению к одной части по массе циклического полипептидного соединения (I) или его фармацевтически приемлемой соли, хотя оно варьируется в зависимости от вида и используемого количества циклического полипептидного соединения (I) или его фармацевтически приемлемой соли, его препаративной формы и/или тому подобное. В частности, более предпочтительно, если используется 1-20 частей, еще более предпочтительно 2-10 частей по массе дисахарида по отношению к одной части по массе циклического полипептидного соединения (I) или его фармацевтически приемлемой соли. В частности, является более предпочтительным, если используется 0,6-20 частей, еще более предпочтительным 0,8-10 частей по массе хлорида натрия по отношению к одной части по массе циклического полипептидного соединения (I) или его фармацевтически приемлемой соли.
Фармацевтическую композицию по настоящему изобретению можно получить способами, известными в данной области, при использовании при необходимости добавок. В качестве ссылки упоминается Basic Lecture on Development of Pharmaceuticals XI 20 Production of Pharmaceuticals (второй том) (под редакцией Kyosuke Tsuda and Hisashi Nogami and опубликованной by Chizyo Shoten). Лиофилизированную композицию можно получить путем приготовления водного раствора циклического полипептидного соединения (I) или его фармацевтически приемлемой соли и стабилизатора, необязательно при добавлении регулятора рН (безводной лимонной кислоты, гидроокиси натрия и т.д.), как требуется для достижения рН 4,0-7,5, предпочтительно рН 4,5-7,0 и затем путем лиофилизации полученного раствора в ампуле обычным способом. Таким образом, стабилизированная фармацевтическая композиция в лиофилизированной форме, при растворении в очищенной воде, предпочтительно дает раствор с рН 4,0-7,5, более предпочтительно с рН 4,5-7,0. Предпочтительно, чтобы полученная таким образом композиция в лиофилизированной форме была закрыта и хранилась в темноте. Лиофилизированную композицию можно загрузить в каждую ампулу в виде раствора перед лиофилизацией или в виде лиофилизированного порошка после лиофилизации.
Поскольку циклическое полипептидное соединение не является удовлетворительно стабильным к влажности, необходимо, чтобы лиофилизированная композиция по настоящему изобретению содержала 3,4% по массе или менее воды, предпочтительно 3,0%, более предпочтительно 2,0%.
Обычно, стабилизированная фармацевтическая композиция в лиофилизированной форме растворяется в изотоническом растворе хлорида натрия, как требуется, и используется в виде инъекционного раствора. Фармацевтическую композицию по настоящему изобретению можно использовать в качестве инъекционного препарата, для которого требуются некоторые манипуляции перед применением.
Наилучший способ осуществления изобретения
Далее настоящее изобретение описывается в дополнительных деталях с помощью примеров и примеров испытаний, которые не следует рассматривать как ограничивающие объем изобретения. В примерах, соединения формул (II)-(VI) показаны как соединения (II)-(VI) соответственно.
Пример 1
Соединение (II) 25 г
Лактоза 200 г
Безводная лимонная кислота в подходящем количестве
Гидроокись натрия в подходящем количестве
Лактозу растворяли в очищенной воде (2000 мл) при нагревании ниже 50°С. После охлаждения ниже 20°С к раствору лактозы добавляли соединение (II), избегая выделения пузырьков при осторожном перемешивании. После добавления 2% водного раствора лимонной кислоты (9,5 мл) к раствору добавляли 0,4% водный раствор гидроокиси натрия (примерно 24 мл) для доведения рН до 5,5 с последующим разбавлением очищенной водой для получения заданного объема (2500 мл). Полученный раствор распределяли в 1000 ампул емкостью 10 мл по 2,5 мл в ампулу. Раствор в соответствующих ампулах лиофилизировали при использовании лиофилизатора (RL-603BS, изготовлен Kyowa Shinku Co., Ltd.) обычным способом для получения лиофилизированных композиций, каждая содержащая 25 мг соединения (II).
Пример 2
Лиофилизированные композиции, каждая содержащая 50 мг соединения (II), получают таким же способом, как в примере 1, за исключением того, что используемое количество соединения (II) составляло 50 г.
Пример 3
Лиофилизированные композиции, каждая содержащая 25 мг соединения (II), получают таким же способом, как в примере 1, за исключением того, что вместо лактозы используют 150 г мальтозы.
Пример 4
Лиофилизированные композиции, каждая содержащая 50 мг соединения (II), получают таким же способом, как в примере 1, за исключением того, что используемое количество соединения (II) составляло 50 г вместо 25 г, и вместо лактозы используют 250 г сахарозы.
Пример 5
Лиофилизированные композиции, каждая содержащая 25 мг соединения (II), получают таким же способом, как в примере 1, за исключением того, что вместо лактозы используют 25 г хлорида натрия.
Пример 6
Лиофилизированные композиции, каждая содержащая 10 мг соединения (II), получают таким же способом, как в примере 1, за исключением того, что используемое количество соединения (II) составляло 10 г вместо 25 г, и вместо лактозы используют 100 г декстрана.
Пример 7
Лиофилизированные композиции, каждая содержащая 25 мг соединения (III), получают таким же способом, как в примере 1, за исключением того, что используют 25 г соединения (III) вместо соединения (II), и вместо лактозы используют 200 г мальтозы.
Пример 8
Лиофилизированные композиции, каждая содержащая 10 мг соединения (IV), получают таким же способом, как в примере 1, за исключением того, что используют 10 г соединения (IV) вместо соединения (II), и используемое количество лактозы составляет 100 г вместо 200 г.
Пример 9
Лиофилизированные композиции, каждая содержащая 50 мг соединения (V), получают таким же способом, как в примере 1, за исключением того, что используют 50 г соединения (V) вместо соединения (II), и вместо лактозы используют 50 г хлорида натрия.
Пример 10
Лиофилизированные композиции, каждая содержащая 10 мг соединения (VI), получают таким же способом, как в примере 1, за исключением того, что используют 10 г соединения (VI) вместо соединения (II), и вместо лактозы используют 100 г декстрана.
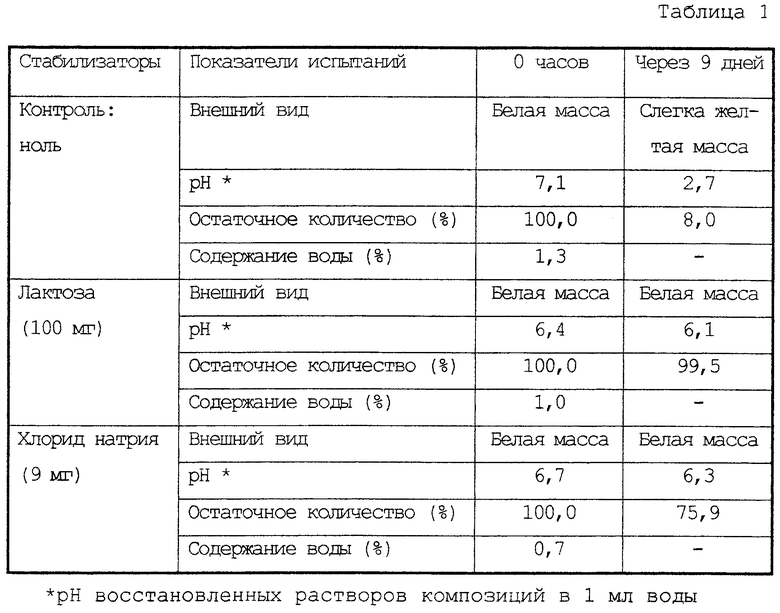
Пример 1 испытаний
Влияние стабилизатора в стабилизированных лиофилизированных композициях соединения (II)
10 мг соединения (II) и, в качестве стабилизатора, 100 мг лактозы или 9 мг хлорида натрия полностью растворяли в 1 мл воды. Полученные растворы лиофилизировали и выдерживали при 70°С в стеклянных ампулах. Через девять дней полученные композиции исследовали по их внешнему виду, остаточному количеству соединения (II) и другим показателям. В качестве контроля, использовали раствор соединения (II) без каких-либо стабилизаторов. Результаты представлены в таблице 1.
Пример 2 испытаний
Подобные опыты провели таким же способом, как в примере 1 испытаний, за исключением того, что в качестве стабилизатора использовали 100 мг мальтозы, 50 мг сахарозы или 50 мг глюкозы. Результаты представлены в таблице 2.
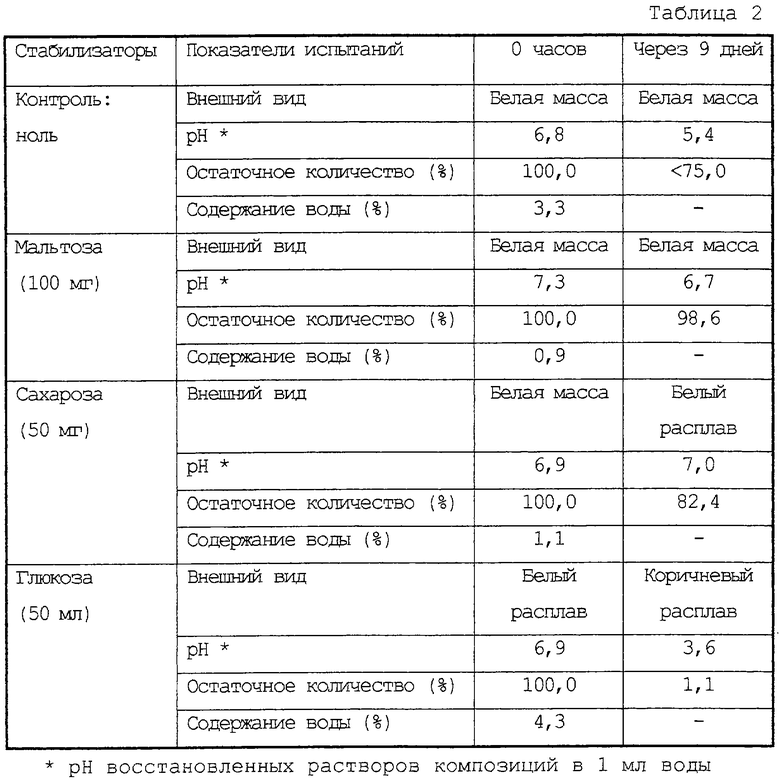
Как очевидно из таблиц 1 и 2 лиофилизированная композиция соединения (II) и лактозы, хлорида натрия, мальтозы или сахарозы была значительно стабильнее по сравнению с таковой, не содержащей какие-либо стабилизаторы или содержащей другие стабилизаторы.
Пример 3 испытаний
Зависимость стабильности лиофилизированных композиций соединения (II) от количества добавляемой лактозы
Опыты провели таким же способом, как в примере 1 испытаний, за исключением того, что в качестве стабилизатора добавляли 20 мг, 50 мг, 100 мг или 200 мг лактозы. В таблице 3 представлены результаты испытаний по наблюдению за внешним видом композиций, остаточным количеством соединения (II), внешним видом восстановленных растворов композиций в 1 мл воды и тому подобное. В связи с этим, требуется 15 секунд для восстановления композиций в 1 мл воды.
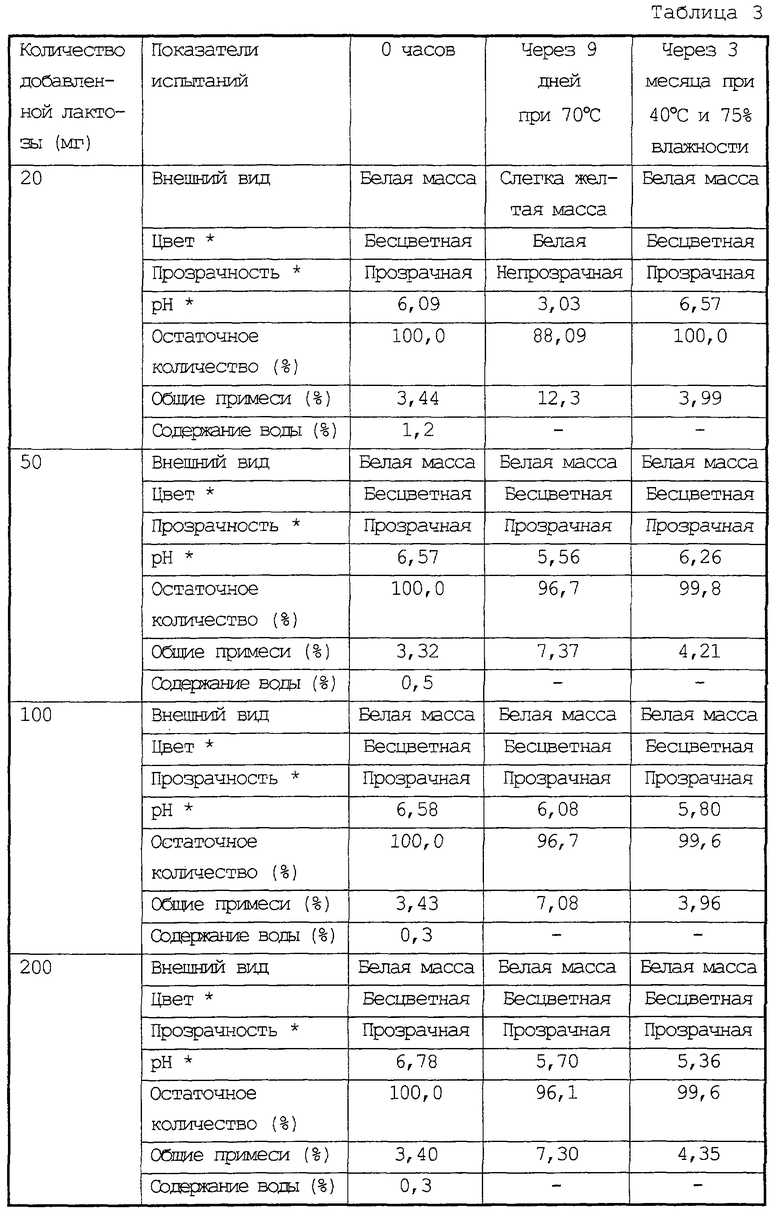
* Цвет, прозрачность и рН восстановленных растворов композиций в 1 мл воды.
Как очевидно из таблицы 3, лиофилизированные композиции 10 мг соединения (II) и различных количеств лактозы не имели проблем с их стабильностью.
Пример 4 испытаний
Стабильность лиофилизированных композиций 200 мг лактозы и соединения (II) в ампуле.
Опыты провели таким же способом, как в примере 1 испытаний, за исключением того, что использовали 12,5 мг, 25 мг, 50 мг, 75 мг или 100 мг соединения (II) с 200 мг лактозы. В таблице 4 представлены результаты опытов по остаточному количеству соединения (II) в полученных композициях и тому подобное. Рассматривая все композиции, то их внешний вид представляет белую массу, время восстановительного растворения составляло 15 сек, и что касается цвета и прозрачности восстановленных растворов композиций, то они были бесцветными и прозрачными.
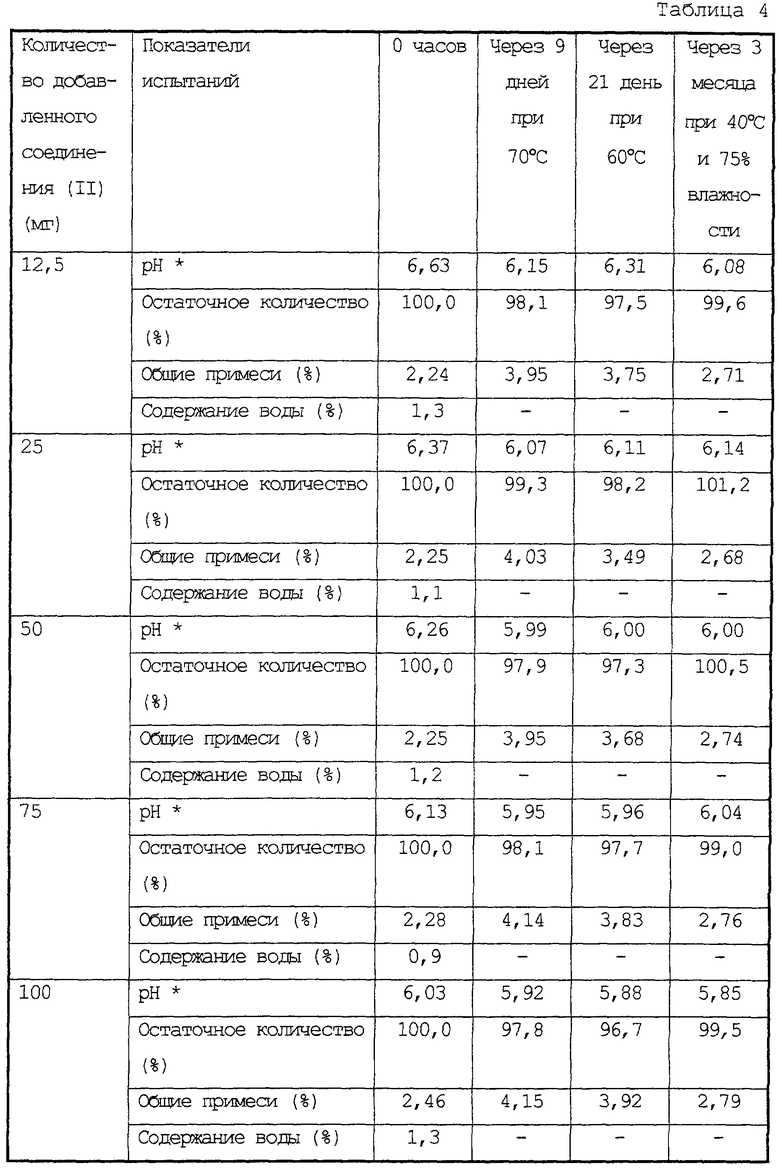
* рН восстановленных растворов композиций в 5 мл очищенной воды
Как очевидно из таблицы 4, все лиофилизированные композиции были стабильны.
Пример 5 испытаний
Испытания стабильности
Фармацевтические композиции, полученные в примерах 1 и 2, хранили при комнатной температуре. Через 18 месяцев остаточная доля соединения (II) составила 98% во всех композициях.
Пример 6 испытаний
Зависимость стабильности лиофилизированных композиций соединения (II) от значения рН раствора композиции перед лиофилизацией
10 мг соединения (II) и, в качестве стабилизатора, 100 мг лактозы полностью растворяли в 1 мл цитратного-NaOH буфера, имеющего различные значения рН между 4,0-7,0. Полученные растворы, имеющие различные значения рН, лиофилизировали и поддерживали при 70°С в стеклянных ампулах. Через девять дней полученные композиции исследовали на их рН и остаточное количество соединения (II). Результаты представлены в таблице 5.
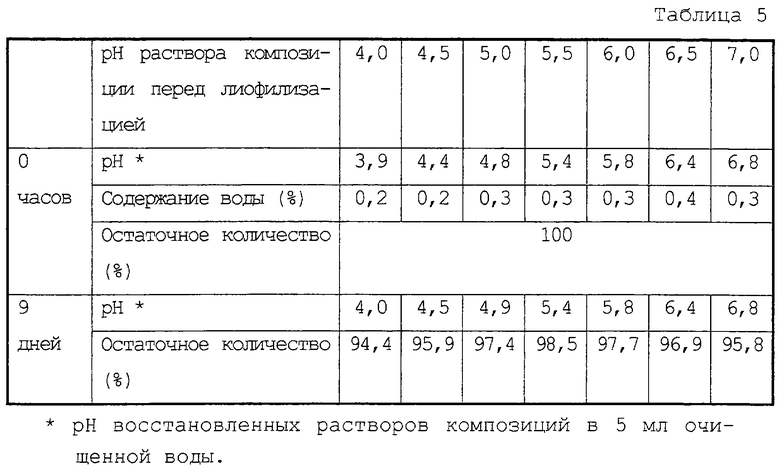
Как очевидно из таблицы 5, фармацевтическая композиция по настоящему изобретению является стабильной после лиофилизации раствора, содержащего соединение (II), по меньшей мере, при рН 4,0-7,0, предпочтительно при рН 4,5-7,0.
Пример 7 испытаний
Зависимость стабильности лиофилизированных композиций соединения (II) от содержания воды в композиции
10 мг соединения (II) и, в качестве стабилизатора, 50 мг лактозы полностью растворяли в 1 мл воды. Полученные растворы лиофилизировали и поддерживали при 70°С в стеклянных ампулах. Через девять дней полученные композиции тестировали на их рН, их содержание воды и остаточное количество соединения (II). Результаты представлены в таблице 6.
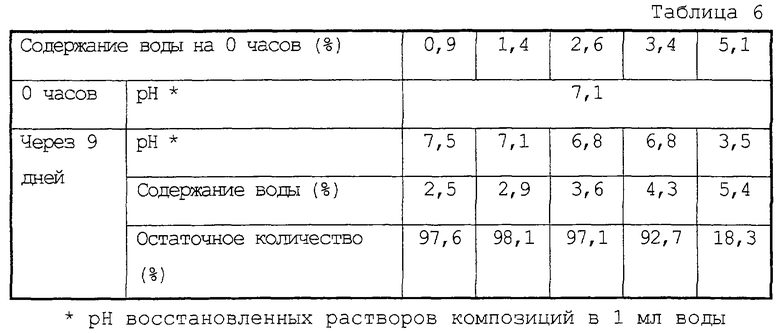
Как очевидно из таблицы 6, фармацевтическая композиция по настоящему изобретению является стабильной, содержащая примерно 3,5%, более конкретно 3,4% по массе или менее воды.
В соответствии с настоящим изобретением, предлагается композиция в лиофилизированной форме, в которой циклическое полипептидное соединение (I) или его фармацевтически приемлемая соль стабилизируются стабилизатором таким, как полисахарид, дисахарид и хлорид натрия.
Механизм стабилизации циклического полипептидного соединения (I) или его фармацевтически приемлемой соли стабилизатором таким, как полисахарид, дисахарид и хлорид натрия, еще неизвестен, но он может заключаться в том, что стабилизатор адсорбирует воду в лиофилизированных осадках, и в том, что стабилизатор служит для равномерного распределения соединения или его фармацевтически приемлемой соли в композиции.
Циклическое полипептидное соединение (I) обладает противогрибковой активностью, в частности, против следующих грибов:
Acremonium;
Absidia (например, Absidia corymbifera и т.д.);
Aspergillus (например, Aspergillus clavatus, Aspergillusflavus, Aspergillus fumigatus, Aspergillus nidulans, Aspergillus niger, Aspergillus terreus, Aspergillus versicolor и т. д.);
Blastomyces (например, Blastomyces dermatitidis и т.д.);
Candida (например, Candida albicans, Candida glabrata, Candida guilliemondii, Candida kefyr, Candida krusei, Candida parapsilosis, Candida stellatoides, Candida tropicalis, Candida utilis и т.д.);
Cladosporium (например, Cladosporium trichoides и т. д.);
Coccidioides (например, Coccidioides immitis и т.д.);
Cryptococcus (например, Cryptococcus neoformans и т.д.);
Cunninghamella (например, Cunninghamella elegans и т.д.);
Dematophyte;
Exophiala (например, Exophiala dermatitidis, Exophiala spinifera и т.д.);
Epidermophyton (например, Epidermophyton floccosum и т.д.);
Fonsecaea (например, Fonsecaea pedrosoi и т.д.);
Fusarium (например, Fusarium solani и т.д.);
Geotrichum (например, Geotrichum candiddum и т.д.);
Histoplasma (например, Histoplasma capsulatum var. capsulatum и т.д.);
Malassezia (например, Malassezia furfur и т.д.);
Microsporum (например, Microsporum canis, Microsporum gypseum и т.д.);
Mucor;
Paracoccidioides (например, Paracoccidioides brasiliensis и т.д.);
Penicillium (например, Penicillium marneffei и т.д.);
Phialophora;
Pneumocystis (например, Pneumocystis carinii и т.д.);
Pseudallescheria (например, Pseudallescheria boydii и т.д.);
Rhizopus (например, Rhizopus microsporus var. rhizopodiformis, Rhizopus oryzae и т.д.);
Saccharomyces (например, Saccharomyces cerevisiae и т.д.);
Scopulariopsis;
Sporothrix (например, Sporothrix schenchii и т.д.);
Trichophyton (например, Trichophyton mentagrophytes, Trichophyton rubrum и т.д.);
Trichosporon (например, Trichosporon asahii, Trichosporon cutaneum и т.д.).
Хорошо известно, что вышеуказанные грибы вызывают различные инфекционные заболевания на коже, волосах, ногтях, слизистой оболочке полости рта, в желудочно-кишечном тракте, бронхах, легких, эндокарде, мозге, мозговых оболочках, органах мочевыделения, области влагалища, полости рта, глазах, крови и лимфы, почках, бронхах, сердце, внешнем слуховом канале, костях, носовой полости, параназальной полости, селезенке, печени, подкожной ткани, лимфатическом протоке, области желудка и кишки, суставах, мышцах, сухожилиях, интерстициальных плазменных клетках в легких и так далее.
Следовательно, циклическое полипептидное соединение (I) по настоящему изобретению пригодно для профилактики и лечения различных инфекционных заболеваний таких, как дерматомикоз (например, трихофитоз и т.д.), отрубевидный лишай, кандидоз, криптококкоз, геотрихоз, трихоспорил, аспергиллез, пенициллиоз, фузариоз, зигомикоз, споротрихоз, хромомикоз, кокцидиоидомикоз, гистоплазмоз, бластомикоз, паракокцидиоидомикоз, псевдоаллешериоз, мицетома, грибковый кератит, отомикоз, пневмоцитоз и т.д.).
Коммерческая упаковка включает циклическое полипептидное соединение (I) по настоящему изобретению и инструкцию-вкладыш, связанную с ним, где инструкция-вкладыш указывает, что фармацевтическую композицию можно или следует использовать для профилактики или лечения инфекционного заболевания.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМБИНИРОВАННАЯ ТЕРАПИЯ, ВКЛЮЧАЮЩАЯ ИНГИБИТОРЫ SGLT И ИНГИБИТОРЫ DPP4 | 2009 |
|
RU2481106C2 |
| НОВОЕ ПОЛИПЕПТИДНОЕ СОЕДИНЕНИЕ | 1999 |
|
RU2219185C2 |
| ЛЕКАРСТВЕННЫЕ КОМПОЗИЦИИ | 1997 |
|
RU2197226C2 |
| СПОСОБ ЛЕЧЕНИЯ НАРУШЕННОЙ ТОЛЕРАНТНОСТИ К ГЛЮКОЗЕ | 2001 |
|
RU2281094C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1999 |
|
RU2203058C2 |
| ПРИМЕНЕНИЕ БЕНЗОФЕНОНОВОГО ПРОИЗВОДНОГО ИЛИ ЕГО СОЛИ И ИНГИБИТОРА TNF-α В КОМБИНАЦИИ, И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ДАННОЕ ПРОИЗВОДНОЕ ИЛИ ЕГО СОЛЬ И ИНГИБИТОР | 2009 |
|
RU2522272C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ПРЕДОТВРАЩЕНИЯ, ЛЕЧЕНИЯ ИЛИ ИНГИБИРОВАНИЯ РАЗВИТИЯ ПРОСТОЙ РЕТИНОПАТИИ И ПРЕПРОЛИФЕРИРУЮЩЕЙ РЕТИНОПАТИИ | 2000 |
|
RU2239454C2 |
| ПРИМЕНЕНИЕ ТИАЗОЛИДИНДИОНОВ ДЛЯ ПРЕДОТВРАЩЕНИЯ ИЛИ ОТДАЛЕНИЯ НАСТУПЛЕНИЯ ИНСУЛИННЕЗАВИСИМОГО САХАРНОГО ДИАБЕТА (NIDDM) | 1994 |
|
RU2195282C2 |
| ПРОИЗВОДНОЕ ПИРАЗОЛ[1,5-a]ПИРИМИДИНА | 2006 |
|
RU2390523C2 |
| 6,7-НЕНАСЫЩЕННОЕ 7-КАРБАМОИЛЗАМЕЩЕННОЕ ПРОИЗВОДНОЕ МОРФИНАНА | 2006 |
|
RU2403255C2 |
Изобретение относится к химико-фармацевтической промышленности и касается новой стабилизированной фармацевтической композиции в леофилизированной форме, включающей в качестве активного ингредиента соединение формулы (I), в качестве стабилизирующего агента дисахарид лактозу. Данные фармацевтические композиции обладают высокой стабильностью при хранении, активный ингредиент не разрушается со временем. 4 с. и 6 з.п. ф-лы, 6 табл.
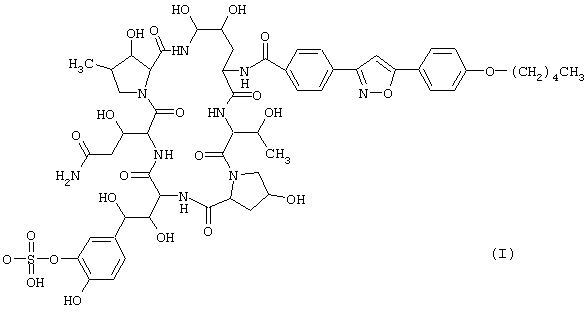
или его фармацевтически приемлемую соль в качестве активного ингредиента и лактозу.
| Приспособление в пере для письма с целью увеличения на нем запаса чернил и уменьшения скорости их высыхания | 1917 |
|
SU96A1 |
| Экономайзер | 0 |
|
SU94A1 |
| Экономайзер | 0 |
|
SU94A1 |
| Бесколесный шариковый ход для железнодорожных вагонов | 1917 |
|
SU97A1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ АНТИВИРУСНОГО ДЕЙСТВИЯ | 1991 |
|
RU2095081C1 |
Авторы
Даты
2005-05-10—Публикация
2000-06-29—Подача