Настоящее изобретение относится к области амплификации нуклеиновых кислот, например, амплификации нуклеиновых кислот для детектирования присутствия конкретных последовательностей нуклеиновых кислот в биологических образцах, таких как образцы из растений или из растительного материала или материала, полученного из растений. Способы могут использоваться качественным или количественным образом и могут также использоваться для определения того, находится ли концентрация конкретных последовательностей нуклеиновых кислот в биологических образцах ниже заданного порогового уровня.
Предлагаются способы и композиции для амплификации нуклеиновых кислот, с помощью которых нуклеиновые кислоты, включая ДНК, экстрагируются из биологического материала или из материала, содержащего такой биологический материал, с использованием экстракции с помощью щелочного раствора, предпочтительно, с минимальным механическим мацерированием образца, или даже совсем без него, и при этом щелочной экстракт непосредственно добавляют в реакционную смесь или лиофилизированный мастермикс, делая возможной амплификацию нуклеиновой кислоты, представляющей интерес, без введения дополнительной стадии нейтрализации или разбавления.
Способы и композиции может быть удобным использовать вместе с единым устройством, делающим возможным отбор образцов, предпочтительно, из части растения, и амплификацию и/или детектирование нуклеиновой кислоты (кислот), представляющей интерес, без необходимости в открывании устройства после отбора образца материала, потенциально содержащего нуклеиновую кислоту (кислоты), представляющую интерес, и/или после реакции амплификации, тем самым сводя к минимуму риск загрязнения образца любой посторонней нуклеиновой кислотой.
Уровень техники
В современной агрономии способность детектирования конкретной последовательности нуклеотидов так называемой нуклеиновой кислоты, представляющей интерес, или целевой последовательности, становится все более и более важной. Это возможность позволяет, например, быстро детектировать конкретные последовательности нуклеиновых кислот, связанные с присутствием конкретной характеристики или признака у растения, тем самым давая возможность выводить конкретные растения с конкретными сочетаниями характеристик более прямым и более эффективным образом. Такая возможность также позволяет детектировать конкретные вариантные аллели у растений.
При выведении трансгенных растений возникает необходимость в способности детектироваться присутствие биологического материала, содержащего конкретные трансгенные объекты, например, в поле, при выведении сортов растений или в коммерческой цепи (производство зерна, транспортировка зерна, хранение зерна, и тому подобное), предпочтительно, при более высокой скорости, с более низкими затратами и при большем разнообразии. Кроме того, различные трансгенные объекты могут содержать сходные или даже идентичные нуклеиновые кислоты, и часто является желательной возможность различать такие различные трансгенные объекты, содержащие сходные или идентичные нуклеиновые кислоты, требующая применения конкретных способов и инструментов детектирования этих объектов.
В дополнение к этому, все больше и больше болезней растений можно быстро и однозначно диагностировать посредством детектирования конкретных последовательностей нуклеотидов, связанных с патогенами (грибковыми, вирусными, бактериальными, нематодами или другими вредителями растений), вызывающими болезнь.
Применение детектирования конкретной последовательности нуклеотидов в биологическом материале, разумеется, не ограничивается агрономическими применениями, но также простирается на другие области, включая область медицины, криминалистику, генетическое консультирование, и тому подобное.
Разнообразные способы детектирования основываются на амплификации целевой нуклеиновой кислоты и/или ДНК, имеющей конкретную последовательность нуклеотидов, при этом самый старый способ представляет собой цепную реакцию полимеразы.
Особенный интерес представляют собой изотермические способы амплификации ДНК, включая так называемую LAMP или петлевую изотермическую амплификацию, как описано, например, в патенте США № 641027 (Eiken). Способ отличается использованием 4 различных праймеров, конкретно сконструированных для распознавания 6 различных областей на целевом гене, и процесс реакции осуществляется при постоянной температуре с использованием реакции замещения цепи. Амплификация и детектирование целевой нуклеиновой кислоты, представляющей интерес, могут быть завершены на одной единственной стадии посредством инкубирования смеси биологического образца или экстракта его нуклеиновой кислоты, праймеров, полимеразы ДНК с активностью замещения цепи и субстратов при постоянной температуре (примерно 65°C). Это обеспечивает высокую эффективность амплификации, при этом ДНК амплифицируется 109-1010 раз за 15-60 минут. Благодаря его высокой специфичности, присутствие амплифицированного продукта может указывать на присутствие целевого гена (http://loopamp.eiken.co.jp/e/lamp/index.html).
Другие изотермические способы амплификации ДНК включают так называемую реакцию амплификации с помощью никующего фермента (NEAR) (Envirologix). NEAR использует никующий фермент и цепь-замещающую полимеразу для генерирования малых фрагментов ДНК, которые вводят в реакцию удлинения ДНК; поочерёдные циклы никования и удлинения приводят к экспоненциальной амплификации. Способ описан, например, в US 2009/0017453.
Другой изотермический способ амплификации нуклеиновой кислоты и/или ДНК представляет собой так называемую рекомбиназную полимеразную амплификацию (TwistDx). Способ RPA использует рекомбиназы, которые способны к спариванию олигонуклеотидных праймеров с гомологичной последовательностью дуплексной ДНК. С помощью этого способа, синтез ДНК с помощью ДНК-полимеразы направлен на определенные точки образца ДНК. Если целевая последовательность присутствует, инициируется реакция амплификации ДНК. Рекомбиназная полимеразная амплификация с помощью описана, например, в патенте США № 7270981.
Другие изотермические способы амплификации описаны в Gill и Ghaemi, 2008, Nucleosides Nucleotides Nucleic Acids, 27(3) 224-243.
Важная стадия во всех способах амплификации нуклеиновых кислот и/или ДНК представляет собой приготовление матричных нуклеиновых кислот из биологического материала. Для автоматического осуществления реакции амплификации, предпочтительной является удобная и эффективная экстракция нуклеиновых кислот из биологических образцов, дающая достаточное количество матричных нуклеиновых кислот, и предпочтительно, в растворе без мутности. Предпочтительно, стадия экстракции должна включать только минимальную мацерацию или даже исключать механическую мацерацию биологического материала, поскольку это может вносить мутность в раствор. Щелочная экстракция матричной нуклеиновой кислоты и/или ДНК из биологических образцов может предложить такой способ с использованием только минимальной мацерации биологического образца.
Klimyuk (1993) (Plant Journal 3(3) 493-494) описывает щелочную обработку с целью быстрого приготовления растительного материала для надежного анализа PCR.
Chomczynski and Rymaszewski (2006) описывают способ экстракции на основе щелочного полиэтиленгликоля из бактерий образцов эукариотических тканей и цельной крови для непосредственной PCR (BioTechniques, 40, 454-457).
Недостаток способов щелочной экстракции заключается в том, что полученный в результате экстракт должен нейтрализоваться или разбавляться в достаточной степени перед добавлением экстракта или его аликвоты в реакционную смесь для амплификации. Такая стадия разбавления или нейтрализации дает в результате дополнительные манипуляции с образцом, увеличивает риск загрязнения образца нежелательными нуклеиновыми кислотами и/или ДНК. Кроме того, дополнительная стадия усложняет автоматическое осуществление реакции амплификации (см. также Lee et al., 2009, J. Agric. Food Chem. 2009, 57, 9400-9402).
Кроме того, имеется необходимость в автоматическом осуществлении отбора образцов, амплификации и детектировании с минимальным количеством стадий способа. Такие наборы и/или устройства для автоматического осуществления могли бы использоваться в окружающей среде вне лаборатории, в частности, если химический механизм и само его осуществление являются устойчивыми.
Современные способы детектирования для использования вне лабораторной окружающей среды представляют собой инструменты для детектирования на основе белков, такие как иммунохроматографические полоски. Инструменты для детектирования на основе белков не могут детектировать, например, трансгенные растения с молчащими генами, вызывающими появление признака, временную или специальную экспрессию белков, или не могут различать различные растения или трансгенные объекты, экспрессирующие одинаковые или сходные белки.
Настоящее изобретение предлагает решение этих проблем, как описано ниже в разделах Сущность изобретения, Подробные описания вариантов осуществления, в примерах, чертежах и в формуле изобретения.
Сущность изобретения
В одном из вариантов осуществления настоящего изобретения, предлагается композиция, пригодная для амплификации нуклеиновых кислот, содержащая смесь деоксинуклеотидов (dNTP), двухвалентных катионов, таких как дает Mg2SO4 или другие соли магния, фермента, способного к амплификации ДНК, и праймеров, пригодных для амплификации целевой нуклеиновой кислоты, такой как ДНК, представляющая интерес, отличающаяся тем, что смесь дополнительно содержит соль, содержащую аммоний в качестве катиона, и анион слабой кислоты, такой как аммоний пентаборат (NH4B5O8), предпочтительно, при конечной концентрации в пределах между 10 мМ и 100 мМ, предпочтительно, между 30 мМ и 40 мМ, и дополнительную органическую кислоту, предпочтительно, дикарбоновую кислоту, которая может быть выбрана из щавелевой кислоты, малоновой кислоты, янтарной кислоты, глутаровой кислоты, адипиновой кислоты, пимелиновой кислоты, субериновой кислоты, азелаиновой кислоты, себациновой кислоты, глюкуроновой кислоты, молочной кислоты, винной кислоты, фумаровой кислоты, малеиновой кислоты или их смеси, предпочтительно, из яблочной кислоты, предпочтительно, при конечной концентрации в пределах между 10 мМ и 40 мМ, предпочтительно, при 40 мМ. Двухвалентные катионы могут обеспечиваться Mg2SO4 и могут иметь конечную концентрацию в пределах между 1 и 10 мМ, предпочтительно, между 4 и 8 мМ. И dNTP могут иметь конечную концентрацию в пределах между 0,2 мМ и 1,4 мМ, предпочтительно, между 0,4 мМ и 0,9 мМ. Фермент, способный к амплификации ДНК, может быть выбран из ДНК I полимеразы, полимеразы Кленова, полимеразы TaqI, полимеразы ДНК со свойствами замещения цепи, phi 29 полимеразы, Bst полимеразы, Csa полимеразы, 96-7 полимеразы, Bsm полимеразы или GspSSD полимеразы.
В другом варианте осуществления настоящего изобретения, композиция, пригодная для амплификации нуклеиновых кислот, может дополнительно содержать молекулы, делающие возможным флуоресцентное детектирование амплифицированных нуклеиновых кислот или ДНК, такие как димерные красители, содержащие мономерные красители, связанные с нейтральной молекулой, которые становятся флуоресцентными только когда связываются с нуклеиновой кислотой, или интеркалирующие красители, включая N',N'-диметил-N-[4-[(E)-(3-метил-1,3-бензотиазол-2-илиден)метил]-1-фенилхинолин-1-ий-2-ил]-N-пропилпропан-1,3-диамин) или флуоресцентный краситель SYTO-81 (Invitrogen).
В другом варианте осуществления настоящего изобретения, композиция, пригодная для амплификации нуклеиновых кислот, может дополнительно содержать молекулы, делающие возможным детектирование амплифицированной нуклеиновой кислоты посредством специфичного связывания антитела или связывания посредством сродства, или посредством анализов гибридизации на основе нуклеиновых кислот или их сочетаний (известных также как иммунохроматографические анализы).
Еще в одном варианте осуществления настоящего изобретения, композиция, пригодная для амплификации нуклеиновых кислот, может дополнительно содержать детергент, предпочтительно, Triton X-100 или Tween 20, или Pluronic F-68, предпочтительно, при концентрации в пределах между 0,01% и 0,5%, предпочтительно, примерно 0,1%.
Также предлагаются композиции, пригодные для амплификации нуклеиновых кислот, дополнительно содержащие защитный агент при лиофилизации, такой как трегалоза, который может присутствовать при конечной концентрации в пределах между 0,001 и примерно 5%, и/или бетаин при концентрации в пределах между 0,05 мМ - 1 М.
Во всех вариантах осуществления настоящего изобретения, композиция, пригодная для амплификации нуклеиновой кислоты, является пригодной для амплификации нуклеиновой кислоты и/или последовательности ДНК, представляющей интерес, в биологическом образце, таком как биологический образец, полученный из растения, представляющего интерес. Нуклеиновая кислота и/или последовательность ДНК, представляющая интерес, может быть специфичной для коммерчески доступного объекта трансформации или для экспериментально доступного объекта трансформации. Нуклеиновая кислота и/или последовательность ДНК, представляющая интерес, может также быть специфичной к присутствию конкретной аллели, такой как вариантная аллель, или нуклеиновая кислота и/или последовательность ДНК, представляющая интерес, может представлять собой маркер, такой как маркер QTL. Концентрации олигонуклеотидов праймеров являются такими, как известно в данной области для различных способов амплификации нуклеиновых кислот.
В другом варианте осуществления настоящего изобретения, композиция, пригодная для амплификации нуклеиновых кислот, как описано в настоящем документе, может подвергаться воздействию лиофилизации.
Еще в одном варианте осуществления настоящего изобретения, предлагается набор, содержащий композицию, пригодную для амплификации нуклеиновых кислот, как описано в настоящем документе.
Набор может содержаться внутри устройства, указанное устройство содержит
a. средства для отбора образцов биологического материала;
b. резервуар для жидкости, содержащий щелочной экстракционный раствор;
c. соответствующие каналы для направления щелочного экстракционного раствора, при активировании, на биологический образец в реакционной смеси; и
d. необязательно, средства для детектирования амплификации нуклеиновых кислот.
Набор может также содержаться внутри картриджа, указанный картридж содержит
a) первый компонент, предпочтительно, компонент, являющийся основой, предпочтительно, покрытый на обеих сторонах прозрачными покрытиями, с формированием тем самым каналов и камер (1), и второй компонент, предпочтительно, компонент, являющийся крышкой (2), складываемые вместе для закрывания, предпочтительно, посредством совмещения двух структур вместе, предпочтительно, вокруг шарнирной секции (3); причем
b) указанные первый и второй компоненты или указанные компоненты, являющиеся основой и крышкой, содержат вставляемую и соответствующую принимающую часть (4) и (5), которые, когда первый и второй компоненты или компоненты, являющиеся основой и крышкой, совмещаются, формируют камеру A, подходящую для приема биологического образца; где камера A предпочтительно является герметичной;
c) указанный первый компонент или указанный компонент, являющийся основой, дополнительно содержит соединенный с ним резервуар (9) для жидкости, содержащий щелочной раствор; где указанный резервуар для жидкости соединен с камерой A посредством канала (10);
d) указанный первый компонент или указанный компонент, являющийся основой, дополнительно содержит, по меньшей мере, одну, предпочтительно, две камеры B (11) (12), соединенные с указанной камерой A или с указанной частью (4) камеры A, расположенной на основе, посредством, по меньшей мере, одного канала (13);
e) указанный первый компонент или указанный компонент, являющийся основой, дополнительно содержит, по меньшей мере, одну, предпочтительно, две камеры C (15) (16), каждая из них соединена с указанной, по меньшей мере, одной камерой B посредством канала (17) (18);
f) указанный первый компонент или указанный компонент, являющийся основой, дополнительно, необязательно содержит, по меньшей мере, одну, предпочтительно, две камеры D (19) (20), каждая из них соединена с указанной, по меньшей мере, одной камерой C посредством канала (21) (22);
g) указанный второй компонент или указанный компонент, являющийся крышкой, предпочтительно имеет физический доступ (23), предпочтительно, отверстие, чтобы сделать возможным взаимодействие с резервуаром (9) для жидкости;
h) указанный второй компонент или компонент, являющийся крышкой, дополнительно, необязательно содержит, по меньшей мере, одну, предпочтительно, две оптически прозрачных области над областью указанной камеры B или над областями указанных двух камер C, делая возможным мониторинг камеры B или C (24) (25);
где указанная композиция содержится в указанных камерах B.
Настоящее изобретение также предлагает способ амплификации нуклеиновой кислоты или ДНК, представляющей интерес, включающий использование композиции, пригодной для амплификации нуклеиновых кислот, как описано в настоящем документе, или набора, как описано в настоящем документе. Способ предпочтительно представляет собой изотермический способ амплификации ДНК. Матричная нуклеиновая кислота или ДНК может быть приготовлена в щелочном растворе и может дополнительно содержать ДНК-носитель.
Настоящее изобретение также предлагает способ амплификации нуклеиновой кислоты или ДНК, включающий стадии a) выделения матричной нуклеиновой кислоты или ДНК из биологического образца, такого как часть растения, орган или ткань, часть листа растения, из семян или гранулированных семян с использованием щелочного экстракционного раствора, такого как щелочной экстракционный раствор, содержащий KOH, NaOH или LiOH, предпочтительно, KOH, предпочтительно, при концентрации 25 мМ - 100 мМ, в частности, при концентрации примерно 50 мМ, и предпочтительно, с обработкой биологического образца с минимальной механической мацерацией или вообще без нее, и b) приготовления ингредиентов и условий для амплификации нуклеиновой кислоты или ДНК, где указанная выделенная матричная нуклеиновая кислота или ДНК в указанном щелочном экстракционном растворе не разбавляется или не нейтрализуется перед указанной стадией b), но вместо этого, непосредственно добавляется в реакционную смесь или в лиофилизированнный мастермикс.
Краткое описание чертежей
Фигура 1: Схематический чертеж разложенного картриджа, как описано в настоящей заявке. Панель A: вид внутренней стороны разложенного картриджа. Панель B: вид наружной стороны разложенного картриджа. Панель C: поперечное сечение A-A разложенного картриджа. (1) Верхняя опора или крышка; (2) нижняя опора или крышка; (3) шарнирная секция; (4) нижняя часть камеры A; (5) верхняя часть камеры A; (6) (7) выступающие части или защелки частей камеры A; (8) канал для транспортировки текучей среды, для распределения текучей среды на биологическом образце; (9) резервуар для жидкости, для щелочного экстракционного раствора; (10) канал для текучей среды; (11) (12) камеры B, которые могут содержать лиофилизированную реакционную смесь; (13) канал для текучей среды; (14) соединение T-образной формы; (15) (16) камеры C; (17) (18) каналы для текучей среды; (19)(20) камеры D; (21) (22) каналы для текучей среды; (23) отверстие в верхней крышке, дающее возможность для приложения давления к резервуару для жидкости; (24) (25) оптически прозрачные области; (26) отверстия и (27) выступы в крышке для смыкания верхней и нижней опор вместе.
Фигура 2: Панель A: Трехмерная репрезентация картриджа в соответствии с настоящим изобретением. Относительно ссылочных номеров, см. Фигуру 1. Панель B: отбор образца листа растения с использованием картриджа в соответствии с настоящим изобретением. Панель C: детектирование флуоресценции в реальном времени после активирования реакции посредством приведения в действие блистера с текучей средой, тем самым нагнетается буфер для экстракции нуклеиновой кислоты или ДНК на образец из листа, разбавляя лиофилизированную реакционную смесь. Картридж нагревают до постоянной температуры 65°C.
Фигура 3: Сравнение различных условий реакции для реакции LAMP. Панель 1. амплификация каталазы; Панель 2. амплификация дважды мутировавших EPSPS. А: условия для буфера А; В: условия для буфера; С: условия для буфера (см. Пример 1).
Фигура 4: Детектирование продуктов LAMP с помощью иммунохроматографических полосок.
LAMP осуществляют с помощью петлевых праймеров, меченых биотином и FAM, и детектируют на полосках HybriDetect от Milenia Biotec. Полоска 1: хлопок GHB614 (содержащий дважды мутировавший ген EPSPS); Полоска 2: хлопок дикого типа.
Фигура 5: Панель А: влияние типа органической кислоты и концентрации на реакцию LAMP. Панель В: влияние различных концентраций аммония пентабората на реакцию LAMP. Панель С: влияние детергентов на реакцию LAMP. Панель D: сравнение присутствия и отсутствия малеиновой кислоты или лимонной кислоты на реакцию LAMP (а) с 40 мМ малеиновой кислоты; (b) без органической кислоты; (с) с 40 мМ лимонной кислоты.
Подробное описание различных вариантов осуществления настоящего изобретения
Настоящее изобретение основывается на оптимизации условий реакции амплификации нуклеиновой кислоты, делающей возможной прямую ферментативную амплификацию нуклеиновой кислоты с использованием в качестве матрицы нуклеиновой кислоты и/или ДНК, экстрагированной из биологического материала с помощью щелочного раствора, без какой-либо промежуточной стадии нейтрализации или разбавления, как для предыдущего уровня техники. Прямое добавление нуклеиновой кислоты и/или ДНК также устраняет необходимость в термической денатурации нуклеиновой кислоты, чтобы сделать возможным связывание праймера, и может, таким образом, вносить вклад в эффективность детектирования нуклеиновой кислоты, представляющей интерес.
Таким образом, в одном из вариантов осуществления настоящего изобретения, описан способ амплификации нуклеиновых кислот, таких как ДНК, включающий стадии а. выделения матричной нуклеиновой кислоты или ДНК из биологического образца с использованием щелочного экстракционного раствора
b. приготовления ингредиентов и условий для амплификации ДНК,
где указанная выделенная матричная ДНК в указанном щелочном экстракционном растворе не разбавляется или не нейтрализуется перед указанной стадией b), но вместо этого непосредственно добавляется к этим ингредиентам.
Щелочной экстракционный раствор может содержать KOH, NaOH или LiOH, предпочтительно, KOH, предпочтительно, в диапазоне концентраций примерно от 25 до 100 мМ, в частности, в диапазоне концентраций около 50 мМ. Одно из преимуществ щелочной экстракции нуклеиновой кислоты и/или ДНК из биологических образцов заключается в том, что нет необходимости в переработке биологического образца с помощью механической мацерации, тем самым устраняется введение мутности в экстракты или в последующие реакционные смеси. Разумеется, определенный уровень мацерации может быть приемлемым или даже предпочтительным. Например, высечка образца листа уже вводит минимальный уровень мацерации для образца, хотя никакой дополнительной мацерации может не потребоваться. Кроме того, минимальная мацерация может включать прокол образца или сжатие образца.
Предпочтительно, экстракционный раствор также содержит ДНК-носитель, то есть, ДНК, которая не содержит нуклеиновой кислоты, представляющей интерес, и предпочтительно получается из организма, не родственного с биологическим материалом, отбираемым как образец. Для растительного материала, удобный источник ДНК-носителя представляет собой ДНК молок рыбы, хотя можно также использовать ДНК из любого другого источника. Присутствие ДНК-носителя уменьшает частоту ложных положительных событий при последующей амплификации и детектировании амплифицированной ДНК.
Чтобы сделать возможным прямое добавление щелочного экстракта, содержащего матричную нуклеиновую кислоту или матричную ДНК, к реакционной смеси, реакционная смесь имеет композицию, имеющую достаточную буферную емкость, даже без слишком сильного увеличения ионной силы реакционной смеси, так что фермент для амплификации не ингибируется.
Чтобы сделать возможной прямую амплификацию без дополнительной стадии нейтрализации или разбавления, настоящее изобретение предлагает в одном из вариантов осуществления композицию, пригодную для амплификации молекул нуклеиновой кислоты и/или ДНК, содержащую смесь двухвалентных катионов, деоксинуклеотидов (dNTP), фермента, способного к амплификации ДНК, и праймеров, пригодных для амплификации нуклеиновой кислоты и/или ДНК, представляющей интерес, отличающуюся тем, что смесь имеет достаточную буферную емкость при достаточно низкой ионной силе для достаточной нейтрализации щелочного раствора, содержащего матричную нуклеиновую кислоту или ДНК, чтобы сделать возможным функционирование фермента для амплификации. Такая композиция может, например, содержать соль, содержащую аммоний в качестве катиона, и анион слабой кислоты, и/или дополнительную органическую кислоту, предпочтительно, дикарбоновую кислоту.
Как используется в настоящем документе, слабая кислота представляет собой кислоту, которая имеет pKa примерно от 2 до 6. В одном из вариантов осуществления соль представляет собой аммоний пентаборат (NH4B5O8). В другом варианте осуществления, соль может представлять собой соль слабой кислоты и аммония в качестве катиона, при этом, при растворении в воде, достигаемое значение pH находится вблизи оптимального pH для фермента, который должен использоваться в реакции амплификации. В предпочтительном варианте осуществления, pH после растворения соли аммония составляет приблизительно 8,5.
Аммоний пентаборат в реакционной смеси может иметь конечную концентрацию в пределах между 10 мМ и 100 мМ, предпочтительно, между 30 и 40 мМ, в частности, примерно 30 мМ. Катион аммония и боратный анион можно также получить из других источников. Например, катион аммония может быть получен из сульфата аммония, а боратный анион из Трис-бората. Однако необходимо быть осторожным, чтобы поддерживать общую ионную силу буфера достаточно низкой, для того чтобы предотвратить ингибирование фермента полимеразы.
Дополнительная органическая кислота может быть выбрана из щавелевой кислоты, малоновой кислоты, янтарной кислоты, глутаровой кислоты, адипиновой кислоты, пимелиновой кислоты, субериновой кислоты, азелаиновой кислоты, себациновой кислоты, глюкуроновой кислоты, молочной кислоты, винной кислоты, фумаровой кислоты, малеиновой кислоты или их смесей, предпочтительно, при конечной концентрации в пределах между 10 и 40 мМ, предпочтительно, примерно при 40 мМ. Важно, что органическая кислота не является ингибиторной по отношению к реакции амплификации или к амплификации. Обнаружено, например, что лимонная кислота или аскорбиновая кислота могут быть ингибиторными для реакции LAMP.
Другое важное составляющее реакционной смеси для амплификации нуклеиновых кислот и/или ДНК представляет собой олигонуклеотидные праймеры. Термин "праймер", как используется в настоящем документе, охватывает любую нуклеиновую кислоту, предпочтительно, ДНК, которая способна осуществлять прайминг синтеза выделяемой нуклеиновой кислоты в способе, зависимом от матрицы, таком как PCR, NEAR, RPA, LAMP. Как правило, праймеры представляют собой олигонуклеотиды из 10-30 нуклеотидов, но могут использоваться и более длинные последовательности. Праймеры, пригодные для LAMP, могут составлять до 60 нуклеотидов. Праймеры могут быть приготовлены в двухнитевой форме, хотя однонитевая форма является предпочтительной. Праймеры распознают специфично целевую последовательность нуклеотидов нуклеиновой кислоты, представляющей интерес, и специфично гибридизуются с этой нуклеиновой кислотой, тем самым определяется специфичность анализа относительно нуклеиновой кислоты, представляющей интерес, которая должна амплифицироваться/детектироваться. Праймеры могут содержать дополнительные химические модификации, делающие возможным детектирование амплифицированной нуклеиновой кислоты или ДНК, как описано далее в настоящем документе. Точное расположение и структура праймеров также организуются с помощью способа амплификации, который должен использоваться. Например, для LAMP сконструированы 4 типа праймеров, на основе 6 различных областей целевого гена: области F3c, F2c и F1c находятся на 3' стороне, а области B1, B2 и B3 на 5' стороне:
FIP: внутренний прямой праймер (FIP) состоит из F2 области (на 3'окончании), которая является комплементарной по отношению к области F2c, и из такой же последовательности как у Flc области на 5' окончании.
Праймер F3: внешний прямой праймер состоит из F3 области, которая является комплементарной по отношению к области F3c.
BIP: внутренний обратный праймер (BIP) состоит из B2 области (на 3' окончании), которая является комплементарной по отношению к области B2c, и из такой же последовательности как у области B1c на 5' окончании.
Праймер B3: внешний обратный праймер состоит из B3 области, которая является комплементарной по отношению к области B3c.
Реакция может дополнительно оптимизироваться посредством введения так называемых петлевых праймеров (либо петлевого праймера B, либо петлевого праймера F), содержащих последовательности комплементарные к однонитевой петлевой области (либо между B1 и B2 областями, либо между F1 и F2 областями) на 5' окончании гантелеобразной структуры, они обеспечивают повышенное количество исходных точек для синтеза ДНК для способа LAMP (см. также loopamp.eiken.co.jp/e/lamp).
Еще одно важное составляющее реакционной смеси для амплификации нуклеиновых кислот и/или ДНК представляет собой ферменты для амплификации. В зависимости от используемого способа, эти ферменты включают полимеразу ДНК I, полимеразу Кленова, полимеразу TaqI, полимеразу ДНК со свойствами замещения цепи, phi 29 полимеразу, Bst полимеразу (NEB), Csa полимеразу, 96-7 полимеразу (http://www.nippongene.com), Bsm полимеразу (Fermentas), GspSSD полимеразу (Optigene) и другие.
В одном из вариантов осуществления способов по настоящему изобретению, композиция является пригодной для использования в связи с так называемым способом LAMP, как описано в настоящем документе. Однако эти композиции и способы можно также использовать в других типах амплификации, включая RPA, PCR, NEAR, и тому подобное.
Другие составляющие в реакционной смеси считаются менее критичными и включают dNTP при конечной концентрации в пределах между 0,2 мМ и 1,4 мМ и двухвалентные катионы (Mg2+, Mn2+, …) при конечной концентрации в пределах между 1-10 мМ. Mg2SO4 представляет собой пригодную для использования соль, но она может быть заменена другими солями.
Детектирование амплифицированной нуклеиновой кислоты, представляющей интерес, предпочтительно ДНК, представляющей интерес, может осуществляться любым способом, известным в данной области. Детектирование может быть специфичным или неспецифичным или представлять собой сочетание их обоих. Детектирование может основываться на колориметрическом, турбидиметрическом, люминесцентном или флуоресцентном анализе. Флуоресцентное детектирование считается очень удобным. Как правило, флуоресцентное детектирование нуклеиновой кислоты достигается с использованием флуоресцентных красителей для нуклеиновых кислот, которые могут классифицироваться на два больших класса: интеркаляторы и красители, связывающиеся с малой бороздкой, хотя имеются и другие красители, которые могут связываться с нуклеиновыми кислотами множеством способов, включая электростатическое взаимодействие между положительно заряженным красителем и отрицательно заряженной нуклеиновой кислотой. Флуоресцентные интеркаляторы представляют собой красители, которые связываются с двухнитевой ДНК или двухнитевой РНК, встраиваясь сами по себе между парой соседних оснований. Красители, связывающиеся с малой бороздкой, представляют собой красители, которые связываются с малой бороздкой двухнитевой ДНК.
Интеркаляторные красители включают этидий бромид (хорошо известный в данной области, но менее предпочтительный из-за его мутагенных или канцерогенных свойств) или асимметричных цианиновых красителей, таких как SYBR Green I, SYBR Gold или SYBR Safe. SYBR Green представляет собой N’,N’-диметил-N-[4-[(E)-(3-метил-1,3-бензотиазол-2-илиден)метил]-1-фенилхинолин-1-ий-2-ил]-N-пропилпропан-1,3-диамин). SYBR Safe описан в публикации заявки на патент США № 2005/0239096 (включенной в настоящий документ в качестве ссылки).
Публикация заявки на патент США №2006/0211029 (включенной в настоящий документ в качестве ссылки) описывает несколько димерных флуоресцентных красителей, включая EVA Green. Димерные флуоресцентные красители содержат два мономерных красителя и соответствующий линкер для формирования димерного красителя, при этом в отсутствии нуклеиновых кислот, димерный краситель принимает шпилькообразную конформацию, которая имеет низкий фоновый уровень флуоресценции или вообще ее не имеет. В присутствии нуклеиновых кислот, краситель принимает открытую неупорядоченную конформацию, которая дает возможность красителю для взаимодействия с нуклеиновой кислотой и повышения флуоресценции.
Другой флуоресцентный краситель, который может быть пригодным для использования, представляет собой SYTO-81 (Invitrogen).
Tanner et al. (2012, Biotechniques 53, 2) описывают флуоресцентные зонды для реакции LAMP, которые, когда используются вместе со сходными праймерами на чистой ДНК, дают в результате детектирование амплификации, которая, видимо, является чуть более поздней, но имеет значительно лучшее отношение сигнал/шум, чем при использовании, например, SYBR Green.
Детектирование амплифицированной нуклеиновой кислоты, представляющей интерес, может также осуществляться посредством специфичного распознавания антитела. Для этой цели, амплифицированная нуклеиновая кислота, представляющая интерес, может содержать модификации, содержащие специфичные антигены, распознаваемые специфичным антителом, которые могут вводиться, например, посредством модификации олигонуклеотидных праймеров, используемых для амплификации нуклеиновых кислот. Детектирование также может достигаться посредством анализов, основанных на сродстве (с использованием, например, стрептавидина-биотина) или анализов на основе гибридизации. Использование этого типа анализов хорошо известно в данной области (например, иммунохроматографических полосок).
Как используется в настоящем документе, биологический образец используют для указания любого биологического материала, в частности, биологического материала, содержащего нуклеиновые кислоты, или материала, содержащего такой биологический материал или полученного из него, при условии, что нуклеиновые кислоты по-прежнему могут детектироваться. Неограничивающий список биологических материалов включает сегменты листьев, сегменты стеблей, сегменты корней, семенной материал, гранулированные семена, муку, волокна, отдельные семена, хлопья из семян, насыпные семена, и тому подобное. Биологический материал может содержать грибки, бактерии, включая ризобактерии, вирусы, растения, животных, Protista, и тому подобное, или может быть получен из них.
Композиции для амплификации нуклеиновых кислот, представляющих интерес, как описано в настоящем документе, могут дополнительно содержать детергенты, такие как Triton X-100, Tween 20, Pluronic-F-68 (Invitrogen), или их сочетания, предпочтительно, при концентрации примерно 0,1%.
Удобно, когда композиции для амплификации нуклеиновых кислот, представляющих интерес, как описано в настоящем документе, приготавливаются в лиофилизированной форме. Для этой цели, композиции дополняются защитными агентами для лиофилизации, такими как трегалоза, предпочтительно, при конечной концентрации от 0,001% примерно до 5%. Предпочтительно, компоненты лиофилизируются на твердой или полутвердой основе или подложке ("матрас"), делая возможными простые манипуляции.
Композиции и способы амплификации нуклеиновой кислоты, представляющей интерес, могут использоваться в устройстве или картридже, делающем возможным отбор образцов биологического материала, экстракцию нуклеиновой кислоты или ДНК и амплификацию и детектирование без дополнительной необходимости в открывании устройства после того как имеет место отбор образца или амплификация. Тем не менее в определенных вариантах осуществления может быть преимущественным иметь возможность для открывания устройства или картриджа во время обработки, в частности, после того как имеет место реакция амплификации, например, чтобы сделать возможной конкретную форму детектирования.
Такое устройство может содержать
a. средства для отбора образцов биологического материала;
b. резервуар для жидкости, содержащий щелочной экстракционный раствор;
c. реакционную смесь, то есть, композицию, как описано в настоящем документе;
d. соответствующие каналы для направления щелочного экстракционного раствора, при активировании, на биологический образец в реакционной смеси;
e. необязательно, средства для детектирования амплификации нуклеиновых кислот.
Один из вариантов осуществления такого устройства схематически представлен на Фигурах 1 А-С.
Устройство может содержать:
- компонент, являющийся крышкой (1), и компонент, являющийся основой (2), совмещаемые вместе для закрывания, предпочтительно, посредством складывания одной структуры с другой, предпочтительно, вокруг шарнирной секции (3).
- компонент, являющийся основой, и верхний компонент, содержащие вставляемую и принимающую части камеры (4) и (5), которые, когда компонент, являющийся основой, и верхний компонент совмещаются, например, складываются вместе, формируют камеру A, пригодную для приема биологического образца, при этом, необязательно, выступающие части или защелки частей (6) и (7) камеры для образца могут использоваться для отделения биологического образца, такого как часть листа, от окружающего биологического материала. Предпочтительно, камера A является герметичной.
- Камера A может дополнительно содержать канал (8) для транспортировки текучей среды, такой как канал в форме спирали, необязательно, имеющий несколько отверстий, делающих возможным оптимальное распределение буфера для экстракции на биологическом образце.
- К одному из компонентов присоединен резервуар (9) для жидкости, содержащий щелочной экстракционный раствор. Резервуар для жидкости может представлять собой камеру, которая впрыскивает буфер, такой как блистер, описанный в WO2010/094249; WO2011/006460 или WO2009/071078. Резервуар для жидкости соединен с камерой A посредством канала (10).
- Верхний компонент или компонент, являющийся основой, предпочтительно, компонент, являющийся основой, дополнительно содержит, по меньшей мере, одну, предпочтительно, две камеры B (11) (12), соединенных, по меньшей мере, с одной частью камеры A, предпочтительно, с нижней частью (4) камеры A, посредством канала (13), указанные камеры дают возможность для приема композиции, как описано в настоящем документе, для амплификации нуклеиновых кислот, представляющих интерес. Предпочтительно, когда присутствуют две камеры B, одну из камер используют для приема композиции, пригодной для детектирования нуклеиновой кислоты, представляющей интерес, при этом другую камеру используют для приема композиции, пригодной для детектирования нуклеиновой кислоты, представляющей интерес, о которой известно, что она присутствует в биологическом образце (такой как эндогенный ген растения, образец которого отбирают), действуя при этом в качестве положительного контроля для функционирования реакции амплификации. Композиция, пригодная для детектирования нуклеиновой кислоты, представляющей интерес, может быть приготовлена в форме лиофилизированной композиции, предпочтительно, в форме матраса, содержащего лиофилизированную композицию. Это также обеспечивает взаимозаменяемость реакций амплификации, которые можно осуществлять с использованием различных матрасов, содержащих различные композиции, как описано в настоящем документе, тем самым повышая универсальность устройства. Когда присутствуют две камеры B, канал, соединяющий камеру для образца с камерами для разбавления, должен давать возможность для распределения буфера для экстракции, содержащего экстрагированную матричную ДНК, по двум камерам для разбавления, предпочтительно в равных частях. Этого можно достичь с использованием канала с соединением T-образной формы (14).
- Компонент, являющийся основой, и компонент, являющийся крышкой, предпочтительно, компонент, являющийся основой, дополнительно содержит, по меньшей мере, одну, предпочтительно, две камеры C (15) (16), соединенные, по меньшей мере, с одной камерой B посредством канала (17) (18). Когда присутствуют две камеры C, каждая камера C предпочтительно соединяется посредством канала только с одной камерой B.
- Компонент, являющийся основой, и компонент, являющийся крышкой, предпочтительно, компонент, являющийся основой, кроме того, необязательно содержит, по меньшей мере, одну, предпочтительно, две камеры D (19)(20), соединенные, по меньшей мере, с одной камерой C посредством канала (21) (22). Когда присутствуют две камеры D, каждая камера C предпочтительно соединяется посредством канала только с одной камерой D.
- Компонент, являющийся основой, и компонент, являющийся крышкой, предпочтительно содержит средства, делающие возможным физический доступ (такие как отверстие) (23), чтобы сделать возможным взаимодействие с резервуаром (9) для жидкости.
- Компонент, являющийся основой, и компонент, являющийся крышкой, дополнительно необязательно содержит, по меньшей мере, одну, предпочтительно, две оптически прозрачные области над областью указанной камеры B или указанной камеры (камер) C, делающие возможным (необязательно, флуоресцентное или колориметрическое) детектирование (24) (25).
- Каналы могут дополнительно содержать одну или несколько систем клапанов, таких, например, как системы клапанов, описанные в WO2012/048685, для направления потоков жидкости в каналах в одном направлении.
- Необязательно, компоненты, являющиеся основой и крышкой, могут содержать средства для смыкания верхней и нижней опоры вместе, такие как отверстия (26) и выступы (27) в крышке.
Как используется в настоящем документе "матрас" представляет собой тонкий инертный материал подложки, такой как силицированная минеральная вата или полимерный флис, или волокно, содержащее композицию для амплификации нуклеиновых кислот, как описано в настоящем документе. Композиция может содержаться в двух инертных подложках, или может наноситься только на одну инертную подложку. Предпочтительно, композиция является лиофилизированной. Инертная подложка должна делать возможной прохождение текучей среды буфера. Предпочтительно, инертная подложка плотно прилегает к камере картриджа, тем самым дополнительно функционируя как сито для удерживания частиц, мешающих реакции и/или детектированию.
Картридж может быть заполнен биологическим материалом. Этого можно достичь посредством защелкивания первой и второй, или верхней (1) и нижней (2) опор или крышек вместе, соединяя тем самым первую и вторую или нижнюю (4) и верхнюю (5) части камеры вместе таким образом, что биологический материал захватывается в закрытой камере A, которая может, таким образом, служить в качестве камеры для образца. Например, крышка может скользить поверх листа растения, так что при закрывании края камеры для образца высекают фрагмент листа, заключенный в камере A. Альтернативно, семена или гранулированные семена или другой материал, содержащий биологический материал или полученный из него, потенциально содержащий нуклеиновые кислоты, представляющие интерес, может вкладываться в нижнюю половину камеры для образца, и верхняя крышка может накладываться и закрываться поверх биологического материала.
Впоследствии, щелочной экстракционный раствор, содержащийся в резервуаре (9) для жидкости, направляется через канал, соединяющий резервуар для жидкости и камеру A (10). Это можно достичь посредством приложения давления к резервуару (9) для жидкости. Щелочной раствор проходит над биологическим материалом в камере A (4) (5), необязательно, через распределительное устройство (8), экстрагируя при этом нуклеиновые кислоты, такие как ДНК, присутствующие в биологическом образце.
Экстракционная текучая среда, содержащая нуклеиновые кислоты из биологического образца, направляется через канал (13), соединяющий камеру A и камеру (камеры) B (15) (16). Равное распределение экстракционной текучей среды по камерам B может быть обеспечено с помощью соединения T-образной формы (14) в канале.
В камере (камерах) B, щелочной экстракционный раствор, содержащий экстрагированные нуклеиновые кислоты и/или ДНК, проходит над матрасами, содержащими композицию для амплификации нуклеиновых кислот в соответствии с настоящим изобретением и через них. На этой стадии реакции, экстракционная текучая среда может фильтроваться, проходя через матрасы, и смешиваться с композицией для амплификации нуклеиновых кислот, разбавляя реакционную смесь, которая направляется к камере (камерам) C (21) (22) через каналы, соединяющие камеру (камеры) B и камеру (камеры) C (17) (18).
Затем картридж может подвергаться воздействию температурного режима, необходимого для амплификации нуклеиновых кислот, соответствующего используемой реакционной смеси. Когда используют изотермическую амплификацию, картридж может нагреваться в течение некоторого периода времени до постоянной температуры, такой, например, как 65°C. Обычно, реакции дают возможность для осуществления в течение периода времени примерно 5-60 минут, или 20-30 минут. Нагрев может также применяться дополнительно во время стадии экстракции нуклеиновых кислот, перед стадией амплификации.
Амплификация нуклеиновой кислоты, представляющей интерес (или контрольной нуклеиновой кислоты), может отслеживаться через область, делающую возможным оптический мониторинг камеры (камер) C (24) (25). Этот мониторинг или детектирование может либо осуществляться непрерывно, когда осуществляется реакция амплификации (в реальном времени) или может осуществляться только в конце реакции (детектирование в конечной точке). Детектирование может также осуществляться с помощью узла детектирования на основе сродства или антитела или анализа на основе гибридизации, который может встраиваться или подключаться после того как имеет место реакция амплификации.
Камера (камеры) D (19) (20) могут функционировать в качестве камер для отходов и давать возможность для улавливания любого расширения текучей среды во время нагрева. Обратный поток жидкости через каналы может предотвращаться с помощью создания пассивных клапанов в каналах.
В одном из вариантов осуществления настоящего изобретения, компонент, являющийся основой и/или компонент, являющийся крышкой, может отливаться как цельный элемент, при этом каналы отливаются в формованном компоненте. В альтернативном варианте осуществления компонент, являющийся основой, и компонент, являющийся крышкой, могут быть изготовлены посредством фрезерования каналов в материале компонента, являющегося основой, и верхнего компонента, при этом компонент, являющийся основой, и верхний компонент покрываются прозрачной пленкой покрытия. В предпочтительном варианте осуществления картридж формуется из химически инертного материала, предпочтительно, с низким сродством связывания с нуклеиновой кислотой. Картридж может формоваться из полипропилена.
Оптимизация композиции для амплификации нуклеиновых кислот, чтобы сделать возможной амплификацию без предшествующей стадии нейтрализации после экстракции нуклеиновых кислот или ДНК из биологического материала с помощью щелочного раствора, делает возможным конструирование картриджа, содержащего только один буфер, содержащийся в одном резервуаре для жидкости. Конструкция картриджа только с одним резервуаром для жидкости обеспечивает то дополнительное преимущество, что могут изготавливаться картриджи, которые являются более простыми для использования и более дешевыми при изготовлении.
Картридж может помещаться в устройство, делающее возможным приведение в действие посредством давления, предпочтительно, контролируемое приведение в действие посредством контролируемого давления резервуара для жидкости. Устройство может также делать возможным нагрев картриджа до необходимой температуры. Кроме того, устройство может сделать возможным мониторинг детектирования амплифицированных нуклеиновой кислоты, представляющей интерес, в реальном времени или мониторинг в конечный момент времени. В одном из вариантов осуществления настоящего изобретения, устройство, содержащее картридж, может быть ручным и питаться от батареек, чтобы сделать возможным обработку образцов и реакцию амплификации в картридже в точке, представляющей интерес. Точка, представляющей интерес, может представлять собой поле, зерновой элеватор, хлопковую фабрику, и тому подобное.
Будет очевидно, что рассматриваемые способы, композиции, наборы или устройства могут применяться для детектирования последовательностей нуклеиновых кислот, представляющих интерес, в любом биологическом материале, включая биологический материал, полученный из любого растения, включая кукурузу, табак, зерновые растения, включая пшеницу, овес, ячмень, рожь, рис, газонную траву, сорго, просо или растения сахарного тростника. Способы по настоящему изобретению могут также применяться к любому растению, включая, но, не ограничиваясь этим, хлопок, канолу, масличный рапс, соевые бобы, овощи, картофель, Lemna spp., Nicotiana spp., Arabidopsis, люцерну, ячмень, бобы, кукурузу, хлопок, лен, горох, рапс, рис, рожь, сафлор, сорго, соевые бобы, подсолнечник, табак, пшеницу, аспарагус, свеклу, брокколи, капусту, морковь, цветную капусту, сельдерей, огурцы, баклажаны, салат-латук, лук, масличный рапс, перец, картофель, тыкву, редис, шпинат, патиссон, томаты, цуккини, миндаль, яблоки, абрикосы, бананы, черную смородину, чернику, какао, вишню, кокосы, клюкву, финики, виноград, грейпфрут, гуаву, киви, лимон, лайм, манго, дыню, нектарины, апельсины, папайю, маракуйю, персики, арахис, грушу, ананас, фисташки, сливу, малину, клубнику, мандарины, орех грецкий и арбуз.
В зависимости от биологического образца и/или его происхождения, можно осуществлять дополнительную оптимизацию разнообразных параметров реакционных смесей, описанных в настоящем документе, и это находится в пределах компетенции специалиста в данной области.
Кроме того, будет ясно, что способы, композиции, наборы или устройства можно также применять для детектирования последовательностей нуклеиновых кислот, представляющих интерес, от животных, в биологических материалах, включая материалы от человека, млекопитающего, рыбы, крупного рогатого скота, козы, свиньи, овцы, коровы, лещади, грызунов, хомяков, мышей, крыс, морских свинок, кроликов, приматов, нематод, моллюсков, креветок, крабов, омаров, насекомых, плодовых мушек, насекомых Coleapteran, насекомых Dipteran, насекомых Lepidopteran или насекомых Homeopteran.
Способы, композиции, наборы или устройства могут также использоваться для детектирования нуклеиновых кислот от низших организмов, включая патогены, такие как фитопатогенные грибки или фитопатогенные бактерии или фитопатогенные вирусы, или животные патогены, но также, например, от бактерий, способствующих росту растений.
Будет также ясно, что способы, композиции, наборы или устройства можно применять для детектирования любых нуклеиновых кислот, представляющих интерес, включая трансгены, мутантные или вариантные аллели, маркерные последовательности, связанные с присутствием конкретного признака, такие как маркеры QTL, эндогенных последовательностей, экзогенных последовательностей, вирусных нуклеиновых кислот, патогенных нуклеиновых кислот, включая бактериальные или грибковые патогены.
Нуклеиновые кислоты детектируемые, как описано в настоящем документе, могут представлять собой ДНК или РНК. Для детектирования РНК, способы и средства, описанные в настоящем документе, могут дополнительно включать обратную транскриптазу. Способы и средства, описанные в настоящем документе, могут также адаптироваться таким образом, что амплификацию ДНК осуществляют с использованием РНК в качестве матрицы.
Предпочтительно, реакция амплификации сопровождается контрольной реакцией, то есть, реакцией амплификации нуклеиновой кислоты, амплифицирующей последовательность, которая, как известно, присутствует в экстракте нуклеиновой кислоты, полученном из биологического образца, такой как эндогенная последовательность. При использовании набора или картриджа в соответствии с настоящим изобретением, содержащего несколько камер для разбавления и реакционных камер, рекомендуется резервировать одну камеру для разбавления и одну реакционную камеру для контрольной реакции.
Способы, композиции и устройства в соответствии с настоящим изобретением можно использовать для детектирования нуклеиновых кислот, характерных для трансгенных объектов, у которых характерные последовательности нуклеотидов можно найти в заявках на патент или в файлах директивных органов, включая Объект 1143-14A (хлопок, борьба с насекомыми, не депонирован, описан в WO2006/128569); Объект 1143-51B (хлопок, борьба с насекомыми, не депонирован, описан в WO2006/128570); Объект 1445 (хлопок, стойкость к гербицидам, не депонирован, описан в US2002120964 или WO2002/034946); Объект 17053 (рис, стойкость к гербицидам, депонирован как PTA-9843, описан в WO2010/1 17737); Объект 17314 (рис, стойкость к гербицидам, депонирован как PTA-9844, описан в WO2010/1 17735); Объект 281-24-236 (хлопок, борьба с насекомыми - стойкость к гербицидам, депонирован как PTA-6233, описан в WO2005/103266 или US2005216969); Объект 3006-210-23 (хлопок, борьба с насекомыми - стойкость к гербицидам, депонирован как PTA-6233, описан в US2007143876 или WO2005/103266); Объект 3272 (кукуруза, качественный признак, депонирован как PTA-9972, описан в WO2006098952 или US2006230473); Объект 40416 (кукуруза, борьба с насекомыми - стойкость к гербицидам, депонирован как ATCC PTA-11508, описан в WO201 1/075593); Объект 43A47 (кукуруза, борьба с насекомыми - стойкость к гербицидам, депонирован как ATCC PTA-11509, описан в WO2011/075595); Объект 5307 (кукуруза, борьба с насекомыми, депонирован как ATCC PTA-9561, описан в WO2010/077816); Объект ASR-368 (полевица, стойкость к гербицидам, депонирован как ATCC PTA-4816, описан в US2006162007 или WO2004053062); Объект B16 (кукуруза, стойкость к гербицидам, не депонирован, описан в US2003126634); Объект BPS-CV127-9 (соевые бобы, стойкость к гербицидам, депонирован как NCIMB No. 41603, описан в WO2010/080829); Объект CE43-67B (хлопок, борьба с насекомыми, депонирован как DSM ACC2724, описан в US2009217423 или WO2006/128573); Объект CE44-69D (хлопок, борьба с насекомыми, не депонирован, описан в US20100024077); Объект CE44-69D (хлопок, борьба с насекомыми, не депонирован, описан в WO2006/128571); Объект CE46-02A (хлопок, борьба с насекомыми, не депонирован, описан в WO2006/128572); Объект COT102 (хлопок, борьба с насекомыми, не депонирован, описан в US2006130175 или WO2004039986); Объект COT202 (хлопок, борьба с насекомыми, не депонирован, описан в US2007067868 или WO2005054479); Объект COT203 (хлопок, борьба с насекомыми, не депонирован, описан в WO2005/054480); Объект DAS40278 (кукуруза, стойкость к гербицидам, депонирован как ATCC PTA-10244, описан в WO2011/022469); Объект DAS-59122-7 (кукуруза, борьба с насекомыми - стойкость к гербицидам, депонирован как ATCC PTA 11384, описан в US2006070139); Объект DAS-59132 (кукуруза, борьба с насекомыми - стойкость к гербицидам, не депонирован, описан в WO2009/100188); Объект DAS68416 (соевые бобы, стойкость к гербицидам, депонирован как ATCC PTA-10442, описан в WO201 1/066384 или WO2011/066360); Объект DP-098140-6 (кукуруза, стойкость к гербицидам, депонирован как ATCC PTA-8296, описан в US2009137395 или WO2008/112019); Объект DP-305423-1 (соевые бобы, качественный признак, не депонирован, описан в US2008312082 или WO2008/054747); Объект DP-32138-1 (кукуруза, система гибридизации, депонирован как ATCC PTA-9158, описан в US20090210970 или WO2009/103049); Объект DP-356043-5 (соевые бобы, стойкость к гербицидам, депонирован как ATCC PTA-8287, описан в US20100184079 или WO2008/002872); Объект EE-1 (баклажан, борьба с насекомыми, не депонирован, описан в WO2007/091277); Объект FI117 (кукуруза, стойкость к гербицидам, депонирован как ATCC 209031, описан в US2006059581 или WO 1998/044140); Объект GA21 (кукуруза, стойкость к гербицидам, депонирован как ATCC 209033, описан в US2005086719 или WO 1998/044140); Объект GG25 (кукуруза, стойкость к гербицидам, депонирован как ATCC 209032, описан в US2005188434 или WO1998/044140); Объект GHB119 (хлопок, борьба с насекомыми - стойкость к гербицидам, депонирован как ATCC PTA-8398, описан в WO2008/151780); Объект GHB614 (хлопок, стойкость к гербицидам, депонирован как ATCC PTA-6878, описан в US2010050282 или WO2007/017186); Объект GJ11 (кукуруза, стойкость к гербицидам, депонирован как ATCC 209030, описан в US2005188434 или WO1998/044140); Объект GM RZ13 (сахарная свёкла, стойкость к вирусам, депонирован как NCIMB-41601, описан в WO2010/076212); Объект H7-1 (сахарная свёкла, стойкость к гербицидам, депонирован как NCIMB 41158 или NCIMB 41159, описан в US2004172669 или WO2004/074492); Объект JOPLIN1 (пшеница, стойкость к болезням, не депонирован, описан в US2008064032); Объект LL27 (соевые бобы, стойкость к гербицидам, депонирован как NCIMB41658, описан в WO2006/108674 или US2008320616); Объект LL55 (соевые бобы, стойкость к гербицидам, депонирован как NCIMB 41660, описан в WO2006/108675 или US2008196127); Объект LLcotton25 (хлопок, стойкость к гербицидам, депонирован как ATCC PTA-3343, описан в WO2003013224 или US2003097687); Объект LLRICE06 (рис, стойкость к гербицидам, депонирован как ATCC-23352, описан в US6468747 или WO2000/026345); Объект LLRICE601 (рис, стойкость к гербицидам, депонирован как ATCC PTA-2600, описан в US20082289060 или WO2000/026356); Объект LY038 (кукуруза, качественный признак, депонирован как ATCC PTA-5623, описан в US2007028322 или WO2005061720); Объект MIR162 (кукуруза, борьба с насекомыми, депонирован как PTA-8166, описан в US2009300784 или WO2007/142840); Объект MIR604 (кукуруза, борьба с насекомыми, не депонирован, описан в US2008167456 или WO2005103301); Объект MON15985 (хлопок, борьба с насекомыми, депонирован как ATCC PTA-2516, описан в US2004-250317 или WO2002/100163); Объект MON810 (кукуруза, борьба с насекомыми, не депонирован, описан в US2002102582); Объект MON863 (кукуруза, борьба с насекомыми, депонирован как ATCC PTA-2605, описан в WO2004/011601 или US2006095986); Объект MON87427 (кукуруза, борьба с опылением, депонирован как ATCC PTA-7899, описан в WO201 1/062904); Объект MON87460 (кукуруза, стойкость к стрессам, депонирован как ATCC PTA-8910, описан в WO2009/11 1263 или US20110138504); Объект MON87701 (соевые бобы, борьба с насекомыми, депонирован как ATCC PTA-8194, описан в US2009130071 или WO2009/064652); Объект MON87705 (соевые бобы, качественный признак - стойкость к гербицидам, депонирован как ATCC PTA-9241, описан в US20100080887 или WO2010/037016); Объект MON87708 (соевые бобы, стойкость к гербицидам, депонирован как ATCC PTA9670, описан в WO2011/034704); Объект MON87754 (соевые бобы, качественный признак, депонирован как ATCC PTA-9385, описан в WO2010/024976); Объект MON87769 (соевые бобы, качественный признак, депонирован как ATCC PTA-8911, описан в US20110067141 или WO2009/102873); Объект MON88017 (кукуруза, борьба с насекомыми - стойкость к гербицидам, депонирован как ATCC PTA-5582, описан в US2008028482 или WO2005/059103); Объект MON88913 (хлопок, стойкость к гербицидам, депонирован как ATCC PTA-4854, описан в WO2004/072235 или US2006059590); Объект MON89034 (кукуруза, борьба с насекомыми, депонирован как ATCC PTA-7455, описан в WO2007/140256 или US2008260932); Объект MON89788 (соевые бобы, стойкость к гербицидам, депонирован как ATCC PTA-6708, описан в US2006282915 или WO2006/130436); Объект MS11 (масличный рапс, борьба с опылением - стойкость к гербицидам, депонирован как ATCC PTA-850 или PTA-2485, описан в WO2001/031042); Объект MS8, (масличный рапс, борьба с опылением - стойкость к гербицидам, депонирован как ATCC PTA-730, описан в WO2001/041558 или US2003188347); Объект NK603 (кукуруза, стойкость к гербицидам, депонирован как ATCC PTA-2478, описан в US2007-292854); Объект PE-7 (рис, борьба с насекомыми, не депонирован, описан в WO2008/114282); Объект RF3, (масличный рапс, борьба с опылением - стойкость к гербицидам, депонирован как ATCC PTA-730, описан в WO2001/041558 или US2003188347); Объект RT73 (масличный рапс, стойкость к гербицидам, не депонирован, описан в WO2002/036831 или US2008070260); Объект T227-1 (сахарная свёкла, стойкость к гербицидам, не депонирован, описан в WO2002/44407 или US2009265817); Объект T25 (кукуруза, стойкость к гербицидам, не депонирован, описан в US2001029014 или WO2001/051654); Объект T304-40 (хлопок, борьба с насекомыми - стойкость к гербицидам, депонирован как ATCC PTA-8171, описан в US2010077501 или WO2008/122406); Объект T342-142 (хлопок, борьба с насекомыми, не депонирован, описан в WO2006/128568); Объект TCI 507 (кукуруза, борьба с насекомыми - стойкость к гербицидам, не депонирован, описан в US2005039226 или WO2004/099447); Объект VIP 1034 (кукуруза, борьба с насекомыми - стойкость к гербицидам, депонирован как ATCC PTA-3925; описан в WO2003/052073), Объект 32316 (кукуруза, борьба с насекомыми - стойкость к гербицидам, депонирован как PTA-11507, описан в WO2011/153186A1), Объект 4114 (кукуруза, борьба с насекомыми - стойкость к гербицидам, депонирован как PTA-11506, описан в WO2011/084621), объект EE-GM3/FG72 (соевые бобы, стойкость к гербицидам, депонирован как ATCC Accession N° PTA-11041 описан в WO201 1/063413 A2), объект DAS-68416-4 (соевые бобы, стойкость к гербицидам, депонирован как ATCC Accession N° PTA-10442, WO2011/066360A1), объект DAS-68416-4 (соевые бобы, стойкость к гербицидам, депонирован как ATCC Accession N° PTA-10442, WO201 1/066384A1), объект DP-040416-8 (кукуруза, борьба с насекомыми, депонирован как ATCC Accession N° PTA-11508, WO2011/075593A1), объект DP-043A47-3 (кукуруза, борьба с насекомыми, депонирован как ATCC Accession N° PTA-11509, WO2011/075595A1), объект DP-0041 14-3 (кукуруза, борьба с насекомыми, депонирован как ATCC Accession N° PTA-11506, WO2011/084621 A1), объект DP-032316-8 (кукуруза, борьба с насекомыми, депонирован как ATCC Accession N° PTA-11507, WO201 1/084632A1), объект MON-88302-9 (масличный рапс, стойкость к гербицидам, депонирован как ATCC Accession N° PTA-10955, WO2011/153186A1), объект DAS-21606-3 (соевые бобы, стойкость к гербицидам, депонирован как ATCC Accession No. PTA-11028, WO2012/033794A2), объект MON-87712-4 (соевые бобы, качественный признак, депонирован как ATCC Accession N°. PTA-10296, WO2012/051199A2), объект DAS-44406-6 (соевые бобы, пакетированная стойкость к гербицидам, ATCC Accession N°. PTA-11336, WO2012/075426A1), объект DAS-14536-7 (соевые бобы, пакетированная стойкость к гербицидам, депонирован как ATCC Accession N°. PTA-11335, WO2012/075429A1), объект SYN-000H2-5 (соевые бобы, стойкость к гербицидам, депонирован как ATCC Accession N°. PTA-11226, WO2012/082548 A2), объект DP-061061-7 (масличный рапс, стойкость к гербицидам, депозита N° не доступен, WO2012071039A1), объект DP-073496-4 (масличный рапс, стойкость к гербицидам, N° депозита не доступен, US2012131692), объект 8264.44.06.1 (соевые бобы, пакетированная стойкость к гербицидам, депонирован как Accession N° PTA-11336, WO2012075426 A2), объект 8291,45.36.2 (соевые бобы, пакетированная стойкость к гербицидам, Accession N°. PTA-11335, WO2012075429 A2) (все заявки на патенты включаются в настоящий документ в качестве ссылок).
Следующие далее неограничивающие Примеры описывают оптимизацию реакции амплификации, чтобы сделать возможным непосредственное использование щелочного экстракта, содержащего нуклеиновую кислоту из биологических образцов, без предварительного разбавления или нейтрализации.
Если не указано иного, в Примерах, все рекомбинантные методики ДНК осуществляют в соответствии со стандартными протоколами, как описано в Sambrook et al. (1989) Molecular Cloning: A Laboratory Manual, Second Edition, Cold Spring Harbor Laboratory Press, NY и в Volumes 1 and 2, Ausubel et al. (1994) Current Protocols in Molecular Biology, Current Protocols, USA. Стандартные материалы и методы для молекулярной работы с растениями описаны в Plant Molecular Biology Labfax (1993) by R.D.D. Croy, совместная публикация BIOS Scientific Publications Ltd (UK) и Blackwell Scientific Publications, UK. Другие ссылки на стандартные методики молекулярной биологии включают Sambrook and Russell (2001) Molecular Cloning: A Laboratory Manual, Third Edition, Cold Spring Harbor Laboratory Press, NY, Volumes I and II of Brown (1998) Molecular Biology LabFax, Second Edition, Academic Press (UK). Стандартные материалы и методы для цепных реакций полимеразы можно найти в Dieffenbach ТВ Dveksler (1995) PCR Primer: A Laboratory Manual, Cold Spring Harbor Laboratory Press и в McPherson at al. (2000) PCR - Basics: From Background to Bench, First Edition, Springer Verlag, Germany.
Список последовательностей, содержащийся в файле с названием „BCS12-2016_ST25.txt", который составляет 2 килобайта (размер измеряют в Microsoft Windows®), содержит 6 последовательностей SEQ ID NO: 1 - SEQ ID NO: 6, он подается тем самым посредством электронной подачи и включается в настоящий документ в качестве ссылки.
В описании и примерах, ссылаются на следующие последовательности:
SEQ ID NO: 1: F3 олигонуклеотидный праймер
SEQ ID NO: 2: B3 олигонуклеотидный праймер
SEQ ID NO: 3: FIP олигонуклеотидный праймер
SEQ ID NO: 4: BIP олигонуклеотидный праймер
SEQ ID NO: 5: LoopF олигонуклеотидный праймер
SEQ ID NO: 6: LoopR олигонуклеотидный праймер
Приведенное выше описание настоящего изобретения, как предполагается, является иллюстративным и неограничивающим. Разнообразные изменения или модификации в описанных вариантах осуществления могут быть осуществлены специалистом в данной области. Эти можно сделать без отклонения от духа или рамок настоящего изобретения.
ПРИМЕРЫ
Пример 1: Условия для экстракции ДНК
Для экстрактации нуклеиновой кислоты или ДНК из биологических образцов, используют раствор 50 мМ KOH и 1 нг/мкл ДНК молок рыбы (Roche). При использовании 50 мМ KOH (0,28%) в качестве экстракционного раствора можно избежать присутствия KCl в реакционном буфере и тем самым поддерживать общую низкую ионную силу. Концентрация ДНК в сырых экстрактах является очень низкой. Для предотвращения неспецифичного связывания ДНК на пробирках авторы используют ДНК-носитель. В дополнение к этому ДНК-носитель предотвращает амплификацию неспецифичных продуктов в NTC (нет матричных контролей).
Диск листа хлопка, соевых бобов или канолы отбирают посредством продавливания реакционной пробирки Eppendorf через лист. Добавляют 0,5 мл указанного выше буфера для экстракции. Лист инкубируют 8 мин при 65°C без какой-либо механической обработки или прокалывают 10 раз кончиком 0,5-мл пипетки и инкубируют 5 мин при комнатной температуре. 20 мкл сырого экстракта ДНК добавляют непосредственно к лиофилизированному мастермиксу для реакции LAMP (см. Пример 2), и образцы инкубируют в устройстве для PCR в реальном времени при 65°C.
К 100 мг гранулированных семян хлопка, соевых бобов или канолы добавляют 40 мл экстракционного раствора в 50-мл реакционной пробирке. Гранулированные семена суспендируют, и образец инкубируют 5 мин при комнатной температуре. Аликвота 20 мкл супернатанта используется для реакций.
Пример 2: Условия реакции LAMP
Праймеры LAMP конструируют с использованием программного обеспечения LAMP Designer (Premier Biosoft International), и синтезируют соответствующие праймеры.
Приготавливают мастермикс, содержащий следующие компоненты:
a. 30 мМ аммония пентабората (Sigma)
b. 40 мМ яблочной кислоты (Sigma)
c. 0,8 M бетаина (5 M раствор для PCR от Sigma)
d. 5% трегалозы (Sigma)
e. 8 мМ Mg2SO4 (Sigma)
f. 0,8 мМ dNTP (Promega)
g. 0,2 мкМ F3 праймера
h. 0,2 мкМ B3 праймера
i. 1,5 мкМ FIP праймера
j. 1,5 мкМ BIP праймера
k. 0,75 мкМ LoopF праймера
1, 0,75 мкМ LoopB праймера
m. 0,4 ед./мкл полимеразы GspSSD (Optigene)
n. 0,0004 ед./мкл пирофосфатазы ApePPiase (Optigene)
o. 0,8X флуоресцентного красителя EvaGreeen® из 20X коммерчески доступного исходного раствора.
Аликвоты по 20 мкл депонируют в малых реакционных пробирках или 96-луночных матрасах и лиофилизируют два часа при 0,77 мбар в лиофилизаторе Christ Delta 1-24 LSC.
20 мкл ДНК в экстракционном растворе (см. Пример 1) непосредственно добавляют в одну лунку с лиофилизированным мастермиксом, и образцы инкубируют в устройстве для PCR в реальном времени при 65°C.
Пример 3: Сравнение буферов, известных из литературы, и буферов в соответствии с настоящим изобретением для реакций LAMP
100 мг гранулированных семян соевых бобов (содержащих трансгенный ген 2mEPSPS) экстрагируют с помощью 40 мл экстракционного раствора (50 мМ KOH, 1 нг/мкл ДНК молок рыбы) в течение 5 мин при комнатной температуре. 20 мкл экстракта добавляют в лиофилизированные мастермиксы со следующими композициями:
Буфер A:
a. 100 мМ аммония пентабората
b. 10 мМ яблочной кислоты
c. 1% трегалозы
d. 0,8 M бетаина
e. 6 мМ Mg2SO4
f. 0,4 мМ dNTP
g. 0,8 X EvaGreen®
h. 1 X праймермикса
i. 0,4 ед. GspSSD/мкл
Буфер B:
a. 30 мМ аммония пентабората
b. 40 мМ яблочной кислоты
c. 5 % трегалозы
d. 0,8 M бетаина
e. 6 мМ Mg2SO4
f. 0,4 мМ dNTP
g. 0,8 X EvaGreen®
h. 1 X праймермикса
i. 0,4 ед. GspSSD/мкл
Буфер C:
a. буфер Optigene® 10 Х
b. 50 мМ Трис-HCl pH 8,1
c. 30 мМ KCl
d. 30 мМ (NH4)2SO4
e. 0,1% Triton X-100
f. 5% трегалозы
g. 0,8 M бетаина
h. 6 мМ Mg2SO4
i. 0,4 мМ dNTP
j. 0,8 X EvaGreen®
k. 1 X праймермикса
1, 0,4 ед. GspSSD/мкл
Образцы инкубируют в устройстве для PCR в реальном времени при 65°C Результаты представлены на Фигуре 3. Панель 1: детектирование ампликона каталазы. Панель 2: детектирование ампликона 2mepsps.
Амплификация трансгенных 2mEPSPS работает лучше всего с аммоний-пентаборатным буфером B. Кроме того, результаты могут зависеть от видов растений. Для образцов масличного рапса, может быть лучшим буфер A с более высокими концентрациями аммония пентабората. Однако буфер B, видимо, является пригодным для использования буфером для различных биологических образцов.
Пример 4: Детектирование каталазы в листьях хлопка с использованием картриджа
В полученные фрезерованием прототипы картриджей отбирают образцы листьев сои или хлопка с помощью механизма пробойника, который в этом же заходе закрывает и герметизирует картридж. Экстракционный раствор для ДНК, присутствующий в блистере с алюминиевым покрытием, нагнетается через пробойник для листа с помощью контролируемого устройством выдавливания блистера. Этот экстракт, содержащий сырую ДНК, пропускают через слой фильтра, содержащий лиофилизированные реагенты LAMP. Экстракт разбавляет биологические химикалии и достигает реакционной камеры. Реакционную смесь нагревают до 65°C, начиная амплификацию ДНК на основе LAMP. Флуоресцентный интеркалирующий краситель, присутствующий в смеси, возбуждают голубым светом, и полученную в результате флуоресценцию детектируют и количественно определяют с помощью внешнего инструмента.
Образцы листьев растений экстрагируют с помощью 50 мМ KOH, 1 нг/мкл ДНК-носителя молок рыбы (Roche). Прототипы картриджей вырезают из блоков полимера POM. Экстракционную текучую среду заполняют в одноразовые алюминиевые блистеры, покрытые полипропиленом. Реакционный буфер лиофилизируют на матрасах из полипропилена. Картридж активизируют с использованием лабораторной установки, состоящей из линейного мотора для давления на блистер, нагревательного узла (65°C), светодиода (468 нм) для возбуждения флуоресценции и камеры для целей получения изображений.
Реакции LAMP для каталазы из хлопка осуществляют с использованием следующих праймеров: 0,2 мкМ F3 (GATAAGTTGCTCCAGACTCG; SEQ ID No 1), 0,2 мкМ B3 (GCATGACGAACAGGATCGTACC; SEQ ID No 2), 15 мкМ FIP (ATTGGCTGGGAGTTGCAGATAGTTATTCTCCTACTCTGATACCCA; SEQ ID No 3), 15 мкМ BIP (GCTCCC AAGTGTGCTCATCAATCTCCTCATCCCTGTGC; SEQ ID No 4), 8 мкМ LoopF (AGTTTGGCCCAAGTCTGT GCCT; SEQ ID No 5), 8 мкМ LoopR (CAATCACCACGAAGG TTTTATG; SEQ ID No 6). Реакционный буфер состоит из 30 мМ аммония пентабората, 40 мМ яблочной кислоты, 0,8M бетаина, 5% трегалозы, 8 мМ Mg2SO4, 0,8 мМ dNTP, 0,8 X Evagreen4 (Biotium, Hayward, USA), 0,4 ед./мкл GspSSD (Optigene, UK) и пирофосфатазы, 0,0004 ед./мкл.
Результаты амплификации в присутствии и отсутствии ДНК, представляющей интерес, представлены на Фигуре 5C.
Пример 5: Альтернативное детектирование с помощью детектирования посредством иммунохроматографических полосок после реакции LAMP
LAMP осуществляют с помощью биотина и меченых FAM петлевых праймеров на биологических образцах из хлопка, содержащих трансгенный объект GHB614 (содержащий область кодирования 2mEPSPS), и хлопка дикого типа в качестве отрицательного контроля и детектируют на полосках HybriDetect от Milenia Biotec. Результаты представлены на Фигуре 4.
Пример 6: Оптимизация условий реакции LAMP после щелочной экстракции ДНК
Исследуют влияние различных концентраций составляющих реакционной смеси для амплификации нуклеиновых кислот с помощью LAMP. Экстракты ДНК, полученные в соответствии с Примером 1, исследуют при различных концентрациях органической кислоты, детергента или аммония пентабората. Набор из трех образцов по четыре повторения исследуют для каждых определенных условий реакции.
Амплификация с экстракцией сырой ДНК показывает более высокий разброс по сравнению с амплификацией на очищенной ДНК, что может быть связано с присутствием каких-либо частиц в растворе.
В одном из экспериментов исследуют влияние типа дополнительной органической кислоты на реакцию LAMP. ДНК экстрагируют из листа хлопка, и целевая нуклеиновая кислота представляет собой каталазу. Результаты (Фигура 5A) показывают, что яблочная кислота дает в результате более быструю амплификацию, чем малеиновая кислота.
В другом эксперименте исследуют влияние типа дополнительной органической кислоты на реакцию LAMP. ДНК экстрагируют из листа хлопка, и целевая нуклеиновая кислота представляет собой каталазу. Результаты (Фигура 5D) показывают, что малеиновая кислота дает в результате более быструю амплификацию, чем в отсутствие малеиновой кислоты, в то время как лимонная кислота, видимо, имеет ингибиторное воздействие.
В другом эксперименте исследуют влияние концентрации аммония пентабората и яблочной кислоты на реакцию LAMP. ДНК экстрагируют из листа хлопка или семян хлопка, и целевая нуклеиновая кислота представляет собой 2mEPSPS. Результаты (Фигура 5B) показывают, что оптимальные условия для экстрактов хлопковых листьев, видимо, представляют собой A или F, как приведено в таблице, ниже.
Еще в одном эксперименте, исследуют влияние концентрации и типа детергента. ДНК экстрагируют из листа хлопка, и целевая нуклеиновая кислота представляет собой каталазу. Результаты (Фигура 5C) показывают, что имеется малое различие между детергентами или что концентрация играет критическую роль. Введение детергентов, видимо, имеет положительное влияние на частоту положительных контролей без матриц.
В итоге, настоящее изобретение направлено, по меньшей мере, на композиции, наборы, способы и применения, как описано в следующих далее пунктах:
1. Композиция, содержащая смесь деоксинуклеотидов (dNTP), двухвалентных катионов, фермента, способного осуществлять амплификацию ДНК, и праймеров, пригодных для амплификации нуклеиновой кислоты, представляющей интерес, или ДНК, представляющей интерес, отличающаяся тем, что указанная смесь имеет буферную емкость при достаточно низкой ионной силе для достаточной нейтрализации щелочного раствора, содержащего матричную нуклеиновую кислоту или ДНК, для того, чтобы сделать возможным функционирование фермента для амплификации.
2. Композиция по пункту 1, где смесь содержит соль, содержащую аммоний в качестве катиона и анион слабой кислоты, и/или органическую кислоту, предпочтительно, дикарбоновую кислоту.
3. Композиция по пункту 2, где указанная соль представляет собой аммоний пентаборат.
4. Композиция по пункту 2 или 3, где органическая кислота представляет собой яблочную кислоту.
5. Композиция по пункту 2, где органическую кислоту выбирают из щавелевой кислоты, малоновой кислоты, янтарной кислоты, глутаровой кислоты, адипиновой кислоты, пимелиновой кислоты, субериновой кислоты, азелаиновой кислоты, себациновой кислоты, глюкуроновой кислоты, молочной кислоты, винной кислоты, фумаровой кислоты, малеиновой кислоты или их смеси.
6. Композиция по любому из пунктов 2-5, где аммоний пентаборат имеет конечную концентрацию в пределах между 10 мМ и 100 мМ, предпочтительно, между 30 мМ и 40 мМ.
7. Композиция по пункту 6, где аммоний пентаборат имеет конечную концентрацию 30 мМ.
8. Композиция по любому из пунктов 2-4 или 6-7, где яблочная кислота имеет конечную концентрацию в пределах между 10 мМ и 40 мМ, предпочтительно, она составляет 40 мМ.
9. Композиция по любому из пунктов 1-8, где двухвалентные катионы обеспечиваются Mg2SO4 (или другими солями магния), который имеет конечную концентрацию в пределах между 1-10 мМ, предпочтительно, между 4-8 мМ.
10. Композиция по любому из пунктов 1-9, где dNTP имеет конечную концентрацию в пределах между 0,2 мМ - 1,4 мМ, предпочтительно, 0,4 мМ - 0,9 мМ.
11. Композиция по любому из пунктов 1-10, где фермент, способный к амплификации ДНК, выбирают из ДНК I полимеразы, полимеразы Кленова, полимеразы Taql, ДНК полимеразы со свойствами замещения цепи, phi 29 полимеразы, Bst полимеразы, Csa полимеразы, 96-7 полимеразы, Bsm полимеразы, GspSSD полимеразы.
12. Композиция по любому из пунктов 1-11, дополнительно содержащая молекулы, делающие возможным флуоресцентное детектирование амплифицированной нуклеиновой кислоты или ДНК.
13. Композиция по пункту 12, где молекулы представляют собой димерные красители, содержащие мономерные красители, связанные с помощью нейтральной молекулы, которые становятся флуоресцентными только когда связываются с нуклеиновой кислотой.
14. Композиция по пункту 12, где молекулы представляют собой интеркалирующие красители.
15. Композиция по пункту 12, где молекулы представляют собой N',N'-диметил-N-[4-[(E)-(3-метил-1,3-бензотиазол-2-илиден)-метил]-1-фенилхинолин-1-ий-2-ил]-N-пропилпропан-1,3-диамин).
16. Композиция по любому из пунктов 1-11, дополнительно содержащая молекулы, делающие возможным детектирование амплифицированной нуклеиновой кислоты посредством специфичного связывания антитела или связывания посредством сродства или посредством анализа на основе гибридизации.
17. Композиция по любому из пунктов 1-16, дополнительно содержащая детергент, такой как Triton X-100, предпочтительно, при концентрации в пределах между 0,01% и 0,5%, предпочтительно, примерно 0,1%, или Tween 20, или Pluronic F-69 или их смеси.
18. Композиция по любому из пунктов 1-17, дополнительно содержащая защитный агент для лиофилизации, предпочтительно, трегалозу, предпочтительно, при конечной концентрации примерно 5%.
19. Композиция по любому из пунктов 1-18, дополнительно содержащая бетаин при концентрации в пределах между 0,05 мМ и 1 M.
20. Композиция по любому из пунктов 1-19, дополнительно содержащая праймеры, пригодные для амплификации нуклеиновой кислоты, представляющей интерес, или последовательности ДНК, представляющей интерес, в растении, представляющем интерес.
21. Композиция по пункту 20, где указанная нуклеиновая кислота и/или последовательность ДНК, представляющая интерес, является специфичной для коммерчески доступного объекта трансформации.
22. Композиция по пункту 20, где указанная нуклеиновая кислота и/или последовательность ДНК, представляющая интерес, является специфичной для экспериментально доступного объекта трансформации.
23. Композиция по пункту 20, где указанная нуклеиновая кислота и/или последовательность ДНК, представляющая интерес, является специфичной для присутствия конкретной аллели, такой как вариантная аллель.
24. Композиция по пункту 20, где указанная нуклеиновая кислота и/или последовательность ДНК, представляющая интерес, представляет собой маркер, такой как маркер QTL.
25. Композиция по любому из пунктов 1-24, где конечная концентрация праймеров находится в пределах между 0,2 мкМ и 75 мкМ.
26. Композиция по любому из пунктов 1-25, которая лиофилизируется.
27. Композиция по любому из пунктов 1-26, которая дополнительно содержит матричную нуклеиновую кислоту или ДНК.
28. Композиция по пункту 26, которая солюбилизируется с помощью щелочного раствора, содержащего матричные нуклеиновые кислоты или ДНК.
29. Композиция по пункту 26, которая солюбилизируется с помощью щелочного раствора, содержащего матричную нуклеиновую кислоту или ДНК и ДНК-носитель.
30. Композиция по любому из пунктов 1–26, к которой матричную нуклеиновую кислоту или ДНК добавляют в щелочной раствор.
31. Набор, содержащий композицию по любому из пунктов 1-26.
32. Набор по пункту 31, содержащийся в устройстве, указанное устройство содержит
a. средства для отбора образцов биологического материала;
b. резервуар для жидкости, содержащий щелочной экстракционный раствор;
c. соответствующие каналы для направления щелочного экстракционного раствора, при активировании, на биологический образец в реакционной смеси; и
d. необязательно, средства для детектирования амплификации нуклеиновых кислот.
33. Набор по пункту 31, содержащийся в картридже, указанный картридж содержит
a) первый компонент, предпочтительно, компонент, являющийся основой, предпочтительно, покрытый на обеих сторонах прозрачными покрытиями, с формированием, тем самым, каналов и камер (1), и второй компонент, предпочтительно компонент, являющийся крышкой (2), совмещаемые вместе для закрывания, предпочтительно, посредством складывания двух структур вместе, предпочтительно, вокруг шарнирной секции (3);
b) указанные первый и второй компоненты или указанные компоненты, являющиеся основой и крышкой, содержат совмещаемые вставляемую и соответствующую принимающую части (4) и (5), которые, когда первый и второй компоненты, являющиеся основой и крышкой, совмещаются, формируют камеру A, пригодную для приема биологического образца; где камера A предпочтительно является герметичной;
c) указанный первый компонент или указанный компонент, являющийся основой, дополнительно содержат соединенный с ними резервуар (9) для жидкости, содержащий щелочной раствор; указанный резервуар для жидкости соединен с камерой A посредством канала (10);
d) указанный первый компонент или указанный компонент, являющийся основой, дополнительно содержит, по меньшей мере, одну, предпочтительно, две камеры B (11) (12), соединенные с указанной камерой A или с указанной частью (4) камеры A, расположенной на основе, посредством, по меньшей мере, одного канала (13);
e) указанный первый компонент или указанный компонент, являющийся основой, дополнительно содержит, по меньшей мере, одну, предпочтительно, две камеры C (15) (16), каждая из них соединена с указанной, по меньшей мере, одной камерой B посредством канала (17) (18);
f) указанный первый компонент или указанный компонент, являющийся основой, дополнительно, необязательно содержит, по меньшей мере, одну, предпочтительно, две камеры D (19)(20), каждая из них соединена с указанной, по меньшей мере, одной камерой C посредством канала (21) (22);
g) указанный второй компонент или указанный компонент, являющийся крышкой, предпочтительно имеет физический доступ (23), предпочтительно, отверстие, чтобы сделать возможным взаимодействие с резервуаром (9) для жидкости;
h) указанный второй компонент или компонент, являющийся крышкой, дополнительно, необязательно содержит, по меньшей мере, одну, предпочтительно, две оптически прозрачных области над областью указанной камеры B или указанных двух камер C, делая возможным мониторинг камеры B или C (24) (25);
где указанная композиция содержится в указанной камере B.
34. Набор по любому из пунктов 31-33, содержащий устройство для детектирования амплифицированной нуклеиновой кислоты на основе сродства или на основе антитела или на основе гибридизации, например, с помощью иммунохроматографических полосок.
35. Способ амплификации нуклеиновой кислоты, представляющей интерес, или ДНК, представляющей интерес, включающий применение композиции по любому из пунктов 1-26 или набора по пунктам 31-34.
36. Способ по пункту 35, отличающийся тем, что амплификация ДНК представляет собой изотермический способ амплификации.
37. Способ по любому из пунктов 35 или 36, в котором матричная нуклеиновая кислота или ДНК приготавливается в щелочном растворе.
38. Способ по любому из пунктов 35–37, в котором матричная нуклеиновая кислота или ДНК в щелочном растворе дополнительно включает ДНК-носитель.
39. Способ по любому из пунктов 35–38, в котором амплифицированная ДНК специфично детектируется посредством детектирования флуоресценции.
40. Способ по любому из пунктов 35-38, в котором амплифицированная ДНК специфично детектируется посредством специфичного распознавания антитела или посредством детектирования на основе связывания на основе сродства или детектирования на основе гибридизации или их сочетание.
41. Способ амплификации нуклеиновой кислоты, представляющей интерес, или ДНК, представляющей интерес, включающий стадии
a. выделения матричной нуклеиновой кислоты или ДНК из биологического образца с использованием щелочного экстракционного раствора
b. приготовления ингредиентов и условий для амплификации ДНК,
где указанная выделенная матричная ДНК в указанном щелочном экстракционном растворе не разбавляется или не нейтрализуется перед указанной стадией b).
42. Способ по пункту 41, в котором щелочной экстракционный раствор содержит KOH, NaOH или LiOH.
43. Способ по пункту 41, в котором щелочной экстракционный раствор содержит КОН, предпочтительно, при концентрации 25 мМ-100 мМ, в частности, при концентрации примерно 50 мМ.
44. Способ по пункту 41, в котором указанные ингредиенты составляют композицию по любому из пунктов 1-25.
45. Способ по пункту 41-43, в котором указанный биологический образец представляет собой часть растения, орган или ткань.
46. Способ по пункту 41-43, в котором указанный биологический образец представляет собой часть листа растения.
47. Способ по любому из пунктов 41-45, в котором указанный биологический образец обрабатывают без дополнительной механической мацерации.
48. Способ по любому из пунктов 41-46, в котором указанный биологический образец содержит семена, предпочтительно, гранулированные семена.
49. Способ по любому из пунктов 41-46, в котором указанный биологический образец содержит отдельные семена.
50. Способ по любому из пунктов 41-46, в котором указанный биологический образец содержит кусочки семян.
| название | год | авторы | номер документа |
|---|---|---|---|
| ГЕН АХМ1554, КОДИРУЮЩИЙ ДЕЛЬТА-ЭНДОТОКСИН, И СПОСОБЫ ЕГО ПРИМЕНЕНИЯ | 2016 |
|
RU2755282C2 |
| КОНСТИТУТИВНЫЕ ПРОМОТОРЫ СОИ | 2014 |
|
RU2714724C2 |
| ГЕНЫ ТОКСИНОВ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2014 |
|
RU2723717C2 |
| КОМБИНАЦИЯ АКТИВНЫХ СОЕДИНЕНИЙ, А ТАКЖЕ СОДЕРЖАЩАЯ КОМБИНАЦИЮ КОМПОЗИЦИЯ И ИХ ПРИМЕНЕНИЕ, СЕМЯ, ОБРАБОТАННОЕ КОМБИНАЦИЕЙ ИЛИ КОМПОЗИЦИЕЙ, И СПОСОБ БОРЬБЫ ДЛЯ ЗАЩИТЫ СЕЛЬСКОХОЗЯЙСТВЕННЫХ КУЛЬТУР | 2013 |
|
RU2615834C2 |
| ПРИМЕНЕНИЕ ИНСЕКТИЦИДОВ ДЛЯ БОРЬБЫ С ПРОВОЛОЧНИКАМИ | 2017 |
|
RU2755433C2 |
| РАСТЕНИЕ МАИСА DBN9936 И СПОСОБ ПРИМЕНЕНИЯ В ДЕТЕКТИРОВАНИИ ЕГО ПОСЛЕДОВАТЕЛЬНОСТИ НУКЛЕИНОВОЙ КИСЛОТЫ | 2016 |
|
RU2707527C2 |
| ДЕТЕКЦИЯ AAD-1 ОБЪЕКТА DAS-40278-9 | 2010 |
|
RU2577143C2 |
| СПОСОБЫ И СРЕДСТВО МОДИФИКАЦИИ РАСТИТЕЛЬНОГО ГЕНОМА В НУКЛЕОТИДНОЙ ПОСЛЕДОВАТЕЛЬНОСТИ, ШИРОКО ИСПОЛЬЗУЕМОЙ В ГЕНОМНОЙ ИНЖЕНЕРИИ РАСТЕНИЙ | 2011 |
|
RU2639512C2 |
| ЭЛИТНОЕ СОБЫТИЕ ЕЕ-GM3 И СПОСОБЫ И НАБОРЫ ДЛЯ ИДЕНТИФИКАЦИИ ТАКОГО СОБЫТИЯ В БИОЛОГИЧЕСКИХ ОБРАЗЦАХ | 2010 |
|
RU2639530C2 |
| ПРОИЗВОДНЫЕ N-ЦИКЛОАЛКИЛ-N-{ [2-(1-ЗАМЕЩЕННЫЙ ЦИКЛОАЛКИЛ)ФЕНИЛ]МЕТИЛЕН} -(ТИО)КАРБОКСАМИДА | 2014 |
|
RU2685723C1 |


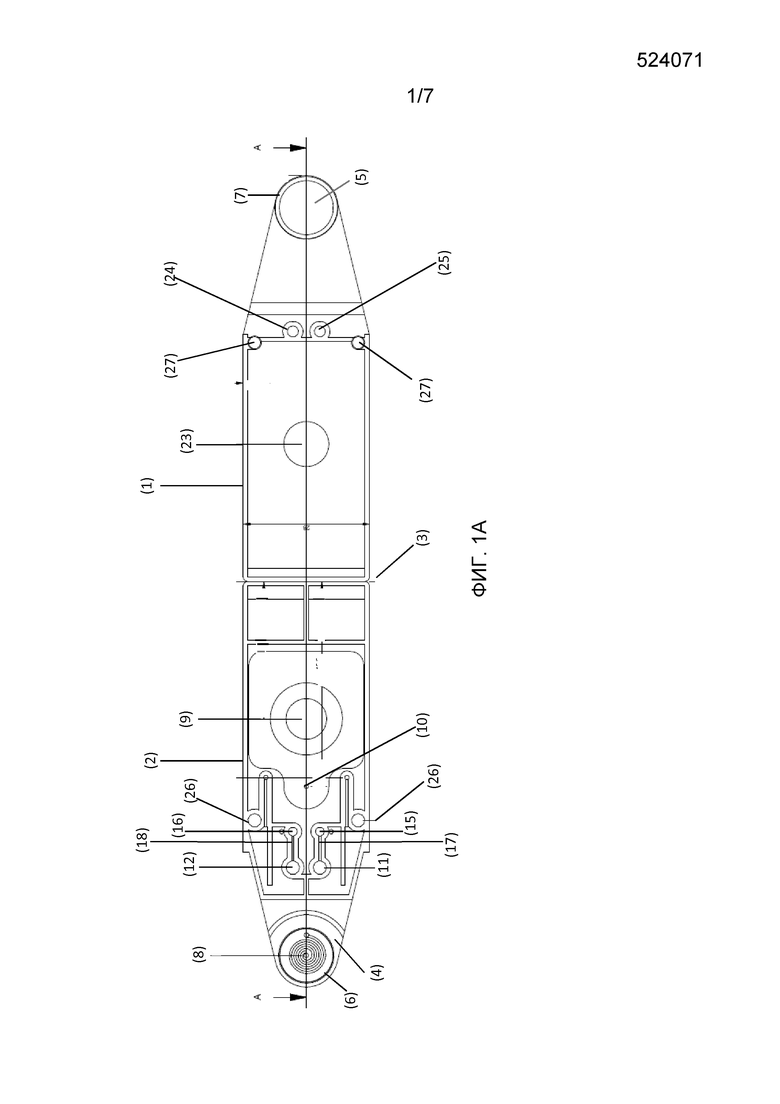
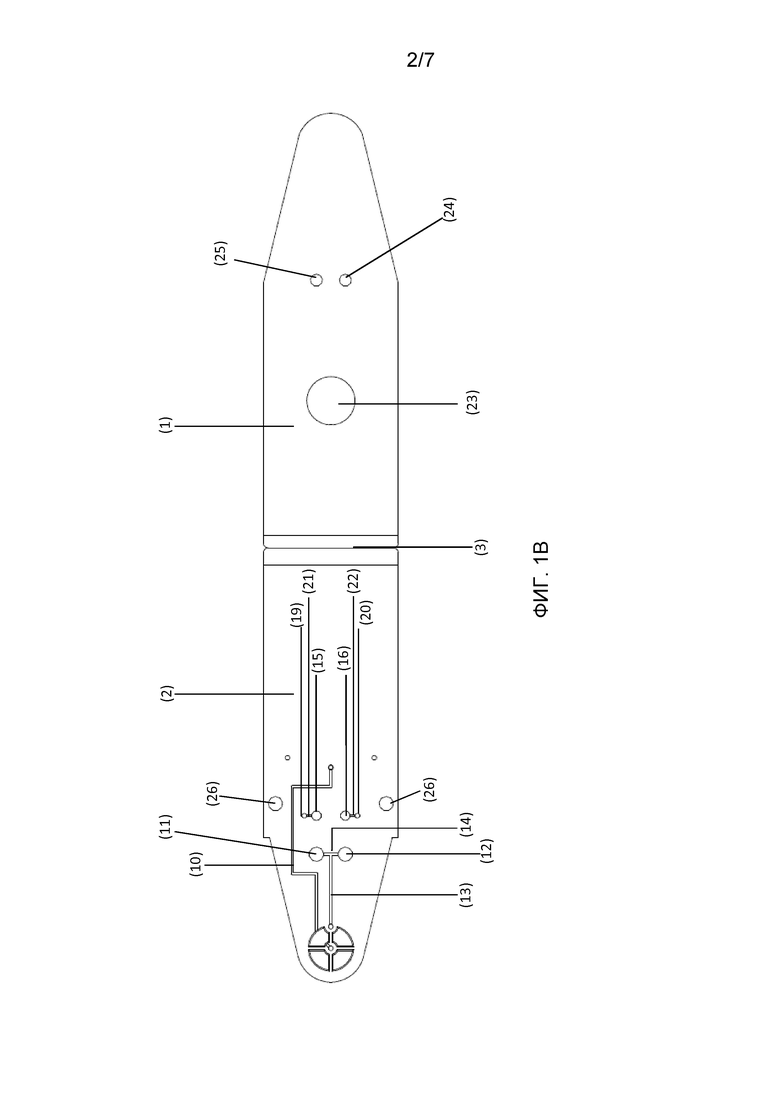
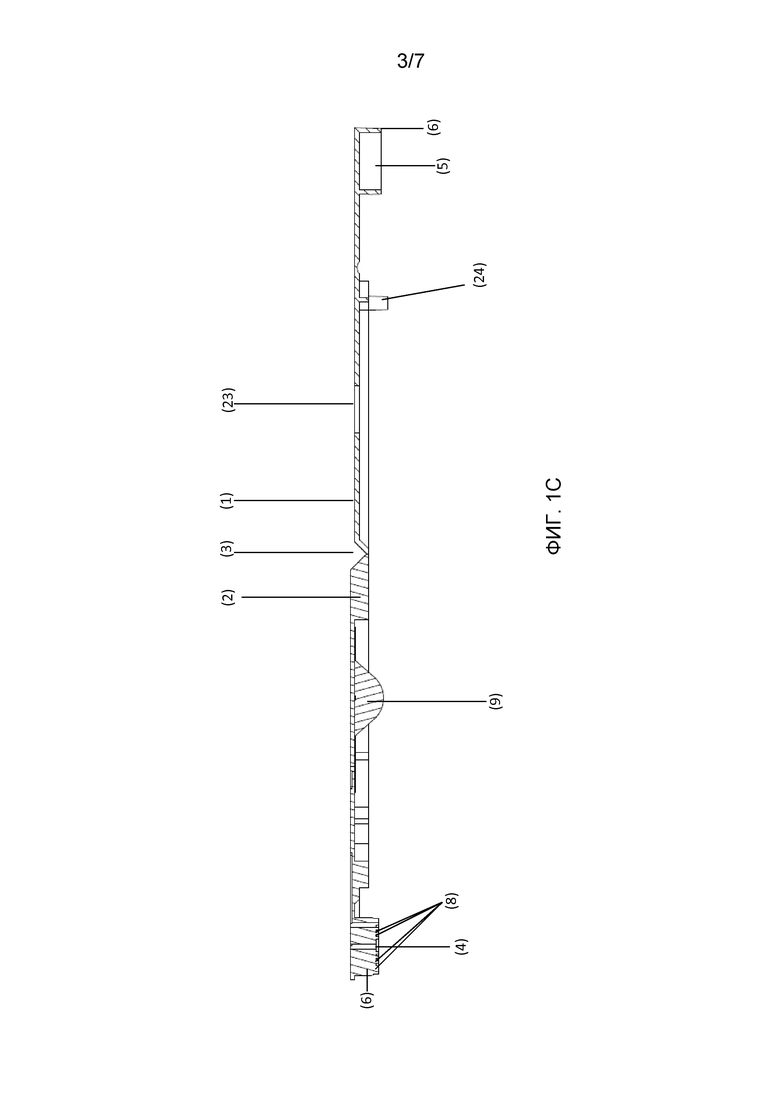
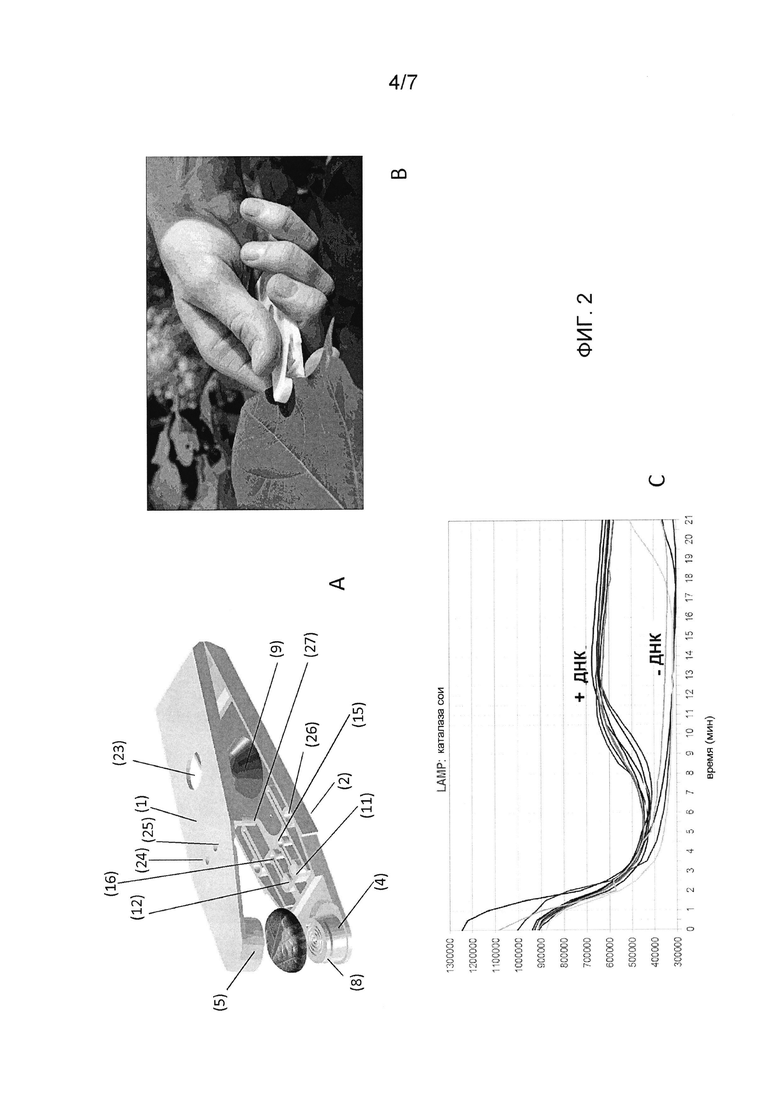
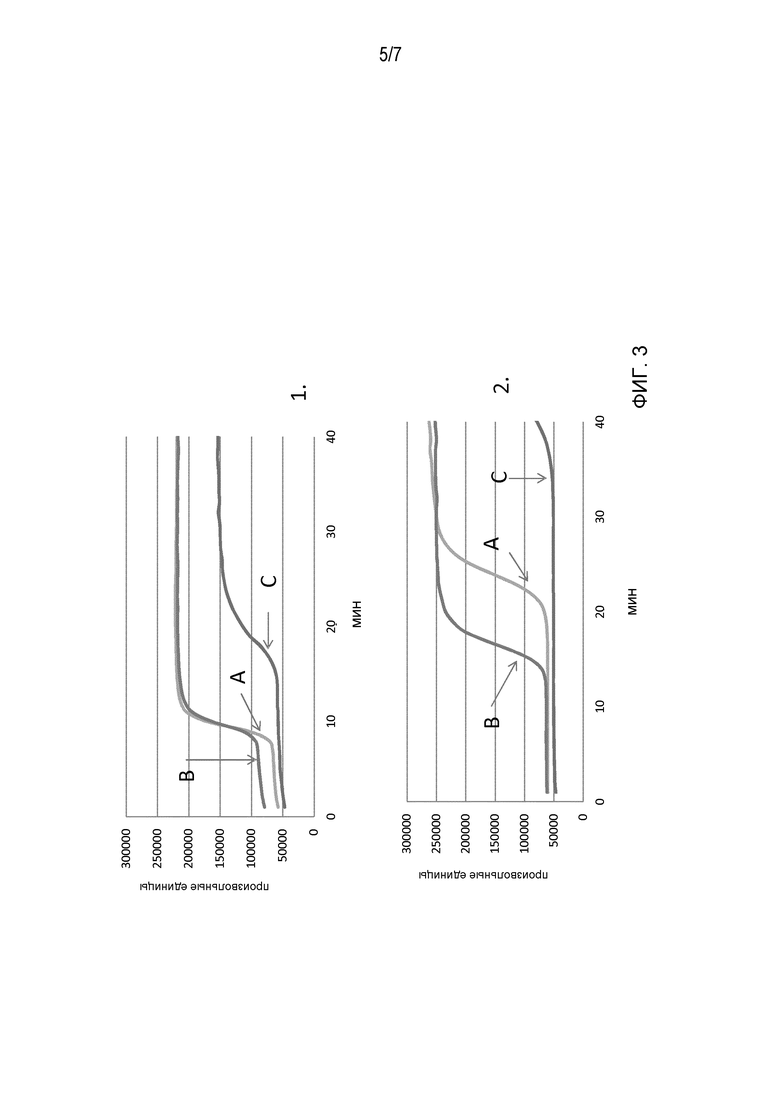

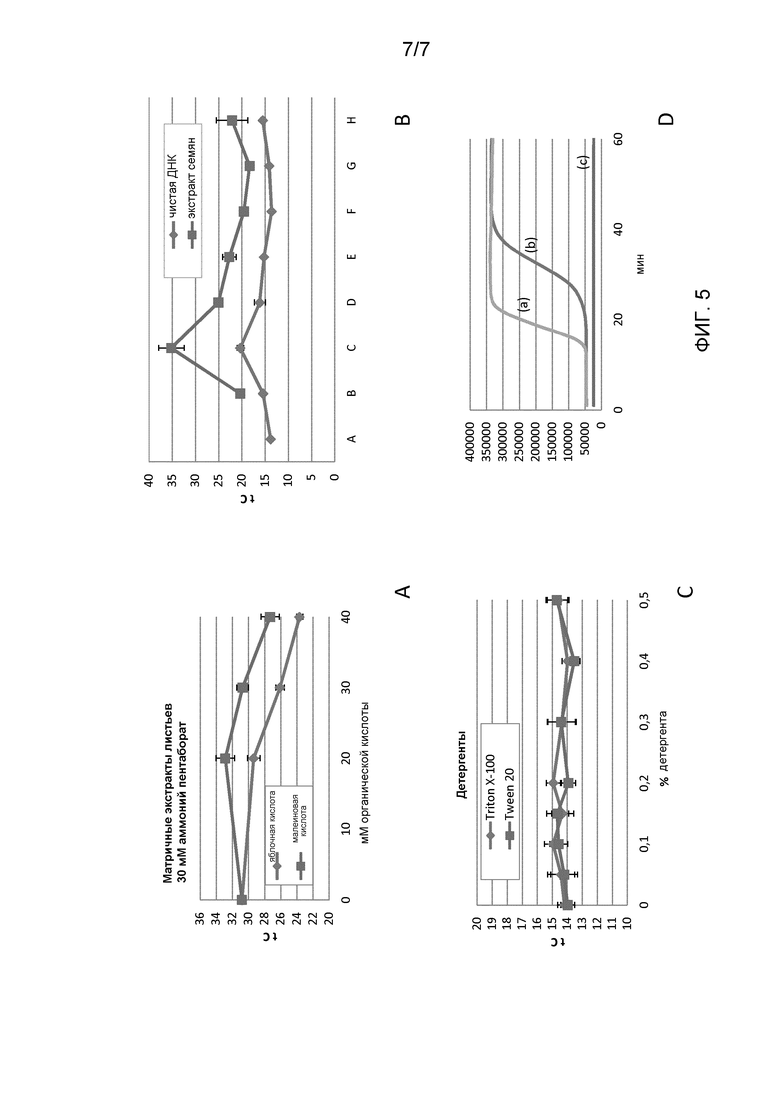
Изобретение относится к биотехнологии. Описана композиция для амплификации нуклеиновой кислоты, представляющей интерес, включающая смесь деоксинуклеотидов (dNTP), двухвалентных катионов, фермента, способного к амплификации ДНК, и праймеров, пригодных для амплификации нуклеиновой кислоты, представляющей интерес, в том числе ДНК, представляющей интерес, отличающаяся тем, что смесь содержит соль, содержащую аммоний в качестве катиона, и анион слабой кислоты, где указанная соль представляет собой аммоний пентаборат, и дикарбоновую кислоту. Также описаны наборы для амплификации нуклеиновой кислоты, представляющей интерес, включающие указанную композицию. Кроме того, описаны способы амплификации нуклеиновой кислоты, представляющей интерес, в том числе ДНК, представляющей интерес, включающие использование указанной композиции. 5 н. и 8 з.п. ф-лы, 1 табл., 5 ил., 6 пр.
1. Композиция для амплификации нуклеиновой кислоты, представляющей интерес, включающая смесь деоксинуклеотидов (dNTP), двухвалентных катионов, фермента, способного к амплификации ДНК, и праймеров, пригодных для амплификации нуклеиновой кислоты, представляющей интерес, в том числе ДНК, представляющей интерес, отличающаяся тем, что указанная смесь содержит
a. соль, содержащую аммоний в качестве катиона, и анион слабой кислоты, где указанная соль представляет собой аммоний пентаборат, и
b. дикарбоновую кислоту.
2. Композиция по п. 1, где дикарбоновая кислота представляет собой яблочную кислоту.
3. Композиция по п. 1, где дикарбоновая кислота выбрана из щавелевой кислоты, малеиновой кислоты, янтарной кислоты, глутаровой кислоты, адипиновой кислоты, пимелиновой кислоты, субериновой кислоты, азелаиновой кислоты, себациновой кислоты, глюкуроновой кислоты, винной кислоты, фумаровой кислоты, малоновой кислоты или их смеси.
4. Набор для амплификации нуклеиновой кислоты, представляющей интерес, включающий композицию по любому из пп. 1-3 и устройство, причем указанное устройство характеризуется
a. камерой для отбора образцов растительного материала;
b. резервуаром для жидкости;
c. щелочным экстракционным раствором;
d. каналами; и
e. необязательно, средством для детектирования амплификации нуклеиновых кислот.
5. Набор для амплификации нуклеиновой кислоты, представляющей интерес, включающий композицию по любому из пп. 1-3 и картридж, причем указанный картридж характеризуется
a) первым компонентом, предпочтительно, компонентом, являющимся основой (1), и вторым компонентом, предпочтительно, компонентом, являющимся крышкой (2), совмещаемыми вместе для закрывания, предпочтительно, посредством накладывания двух структур вместе, предпочтительно, вокруг шарнирной секции (3); причем
b) указанные первый и второй компоненты или указанные компоненты, являющиеся основой и крышкой, содержат вставляемые и соответствующие принимающие части (4) и (5), которые, когда первый и второй компоненты или компоненты, являющиеся основой и крышкой, совмещаются, формируют первую камеру, подходящую для приема биологического образца; где первая камера предпочтительно является герметичной;
c) указанный первый компонент или указанный компонент, являющийся основой, дополнительно содержит соединенный с ним резервуар (9) для жидкости, содержащий щелочной раствор; где указанный резервуар для жидкости соединен с указанной первой камерой посредством канала (10);
d) указанный первый компонент или указанный компонент, являющийся основой, дополнительно содержит, по меньшей мере, одну, предпочтительно, две камеры (11) (12), соединенные с указанной первой камерой или с указанной частью (4) камеры, расположенной на основе, посредством, по меньшей мере, одного канала (13);
e) указанный первый компонент или указанный компонент, являющийся основой, дополнительно содержит, по меньшей мере, одну, предпочтительно, две камеры (15) (16), каждая из них соединена с указанной, по меньшей мере, одной камерой (11) (12) посредством канала (17) (18);
f) указанный первый компонент или указанный компонент, являющийся основой, дополнительно необязательно содержит, по меньшей мере, одну, предпочтительно, две камеры (19) (20), каждая из них соединена с указанной, по меньшей мере, одной камерой (15) (16) посредством канала (21) (22);
g) указанный второй компонент или указанный компонент, являющийся крышкой, предпочтительно имеет физический доступ (23), предпочтительно, отверстие, чтобы сделать возможным взаимодействие с резервуаром (9) для жидкости;
h) указанный второй компонент или компонент, являющийся крышкой, дополнительно необязательно содержит, по меньшей мере, одну, предпочтительно, две оптически прозрачные области над областью указанной камеры (11) (12) или указанных двух камер (15) (16), делая возможным мониторинг камеры (11) (12) или (24) (25);
причем указанная композиция содержится внутри указанных(ой) камер(ы) (11) (12).
6. Способ амплификации нуклеиновой кислоты, представляющей интерес, в том числе ДНК, представляющей интерес, включающий использование композиции по любому из пп. 1-3 или набора по п. 4 или 5.
7. Способ по п. 6, отличающийся тем, что амплификация ДНК представляет собой изотермический способ амплификации.
8. Способ по любому из пп. 6 или 7, в котором матричная нуклеиновая кислота или ДНК предоставляется в щелочном растворе.
9. Способ по любому из пп. 6 или 7, в котором матричная нуклеиновая кислота дополнительно содержит ДНК-носитель.
10. Способ амплификации нуклеиновой кислоты, представляющей интерес, в том числе ДНК, представляющей интерес, включающий стадии:
a. выделения матричной нуклеиновой кислоты или ДНК из образца растения с использованием щелочного экстракционного раствора;
b. предоставления ингредиентов и условий для амплификации указанной нуклеиновой кислоты или ДНК;
где указанная выделенная матричная нуклеиновая кислота или ДНК в указанном щелочном экстракционном растворе не разбавляют или не нейтрализуют перед указанной стадией b), и причем указанные ингредиенты включают композицию по одному из пп. 1-3.
11. Способ по п. 10, в котором щелочной экстракционный раствор содержит KOH, NaOH или LiOH, или где щелочной экстракционный раствор содержит KOH при концентрации 25 мМ-100 мМ, в частности, при концентрации примерно 50 мМ.
12. Способ по п. 10, в котором указанный образец растения выбирают из части растения, органа или ткани, листа растения, семени, гранулированных семян, отдельных семян или кусочков семян.
13. Способ по любому из пп. 10-12, в котором указанный образец растения обрабатывают без механического мацерирования.
| HONG WANG et al, A simple method of preparing plant samples for PCR, Nucleic Acids Research, 1993, Vol | |||
| Выбрасывающий ячеистый аппарат для рядовых сеялок | 1922 |
|
SU21A1 |
| Печь для сжигания твердых и жидких нечистот | 1920 |
|
SU17A1 |
| CHOMCZYNSKI PIOTR et al, Alkaline polyethylene glycol-based method for direct PCR from bacteria, eukaryotic tissue samples, and whole blood, BioTechniques 40:454-458 (April 2006) | |||
| US2010151531 A1, 17.06.2010, p.1-7 | |||
| WO2008002502 A2, 03.01.2008 | |||
| СПОСОБ ПОЛУЧЕНИЯ ФИМБРИАЛЬНОГО АДГЕЗИНА | 1993 |
|
RU2077337C1 |
| КАРТРИДЖНАЯ СИСТЕМА | 2007 |
|
RU2435163C2 |
| КАРТРИДЖ, СИСТЕМА И СПОСОБ АВТОМАТИЗИРОВАННОЙ МЕДИЦИНСКОЙ ДИАГНОСТИКИ | 2006 |
|
RU2432205C2 |
Авторы
Даты
2018-09-13—Публикация
2013-10-18—Подача