Изобретение относится к биокатализаторам с липазной активностью, предназначенных для проведения этерификации жирных кислот с алифатическими спиртами, в результате которой синтезируются сложные эфиры - ценные продукты пищевой, косметической и парфюмерной промышленностей, применяемые в качестве отдушек, увлажняющих и смягчающих компонентов, сурфактантов, антиоксидантов. Химический процесс этерификации протекает в присутствии сильных кислотных катализаторов (серная и фосфорная кислота, сульфокислоты, сульфо-катиониты) в органических растворителях при повышенных давлениях и температурах (выше 150°C). Биокаталитический процесс этерификации протекает в мягких условиях, при атмосферном давлении и низких температурах (20-40°C). Биокатализаторы с липазной активностью (БЛА) обладают высокой селективностью, и проводят процессы до практически полной конверсии жирной кислоты без образования побочных продуктов и загрязняющих соединений.
Для проведения синтеза сложных эфиров жирных кислот используют БЛА, которые представляют собой либо порошки лиофильно высушенной липазы, либо гранулы твердых адсорбентов, на поверхность которых нанесена (иммобилизована) липаза. В качестве адсорбентов для иммобилизации липазы используют разнообразные носители, в том числе носители силикатной природы, которые благодаря химической инертности, высокой механической прочности и низкому гидродинамическому сопротивлению диоксида кремния (SiO2) позволяют приготовить БЛА для использования как в реакторах смешения, так и вытеснения. Показано, что диоксид кремния, а также носители силикатной природы, в том числе природные глины, являются дешевыми и эффективными носителями для приготовления активного и стабильного БЛА.
Известен способ приготовления биокатализатора [A.-F. Hsu, T.A. Foglia, S. Siya // Biotechnol. Appl. Biochem., 2000, 31, 179-183] путем иммобилизации липазы из Pseudomonas cepacia внутри силикатной матрицы, которую получают путем контролируемого гидролиза тетра-метил-о-силана в присутствии монтмориллонитовой глины. Содержание липазы в биокатализаторе составляет 1 мг/г. Приготовленный биокатализатор используют для этерификации лауриновой кислоты (С12:0) с октан-1-олом (С8) в среде изо-октана, в результате которой получают эфир - октил лаурат, продукт для косметической промышленности. Максимальное количество данного продукта составляет ~ 3-4 ммоля на 1 мг иммобилизованной липазы при 30°C за 5-18 ч. Недостатком данного способа приготовления является использование токсичных реагентов (силанов), образование в процессе гидролиза токсичных примесей (метанола, силиканола, растворимых олигомеров), а также высокая стоимость синтеза самого носителя для иммобилизации липазы. Поскольку биокатализатор получают в виде мелкого порошка, то его невозможно использовать в проточном реакторе из-за быстрого уплотнения и высокого гидродинамического сопротивления неподвижного слоя катализатора.
Известен способ приготовления биокатализатора [Bernal C., Escobar S., Wilson L., Illanes A., Mesa M. // Carbon. 2014. V. 74. P. 96-103] путем адсорбции липазы из Alcaligenes sp., на углеродсодержащих силикатах, полученных при карбонизации сахарозы, заключенной в силикатной матрице. Исходную силикатную матрицу получают путем взаимодействия жидкого стекла (мета-силиката натрия, Na2SiO3) с серной кислотой (H2SO4), в результате такого взаимодействия получают гидрогель доксида кремния, который высушивают сначала при 70°C в течение 24 ч, затем при 190°C в течение 5 ч. Карбонизацию сахарозы осуществляют в токе азота при 600°C. Приготовленный биокатализатор используют для этерификации пальмитиновой кислоты (С16:0) с аскорбиновой кислотой. Выход эфира - пальмитоил аскорбата (антиоксиданта) составляет 50% за 120 ч при 40°C. Недостатком способа является относительная сложность получения адсорбента (сушка, карбонизация), а также низкая активность биокатализатора.
Наиболее близким к предлагаемому изобретению является способ синтеза эфиров жирных кислот (каприновой, лауриновой, пальмитиновой) с цетиловым спиртом [B.C. Гамаюрова, М.Е. Зиновьева, Е.В. Елизарова // Катализ в промышленности, 2008, 3, 54-58] с участием биокатализатора - порошка лиофильно высушенной панкреатической липазы, выделенной из печени быка. Биокатализатор в количестве 1-7 мг/мл добавляют в реакционную среду, содержащую жирную кислоту (каприновую С10:0, или лауриновую С12:0, или пальмитиновую С16:0) и цетиловый спирт (гексадеканол, C16), в среде органических растворителей (гексан, бензол и их смеси). Этерификацию осуществляют как в периодическом, так и в непрерывном режимах при 25-30°C. Максимальное значение удельной активности липазы составляет 0.042 ЕА/мг. Максимальный выход цетил каприната составляет 80% за 24 ч, цетил лаурата - 72% за 48 ч, цетил пальмитата - 64% за 48 ч при 30°C. После 5-кратного использования (5 реакционных циклов, 120 ч) биокатализатора выход эфиров снижается на 3-5%. Недостатком данного способа является использование панкреатической липазы животного происхождения, трудность отделения порошкообразного биокатализатора из реакционной среды, а также относительно низкая активность и стабильность биокатализатора. Недостатком данного способа является также использование высокотоксичного бензола в качестве компонента реакционной среды.
Изобретение решает задачу разработки эффективного биокатализатора с липазной активностью (БЛА) для процесса получения сложных эфиров путем этерификации жирных кислот с алифатическими спиртами.
Технический результат - высокая активностью и стабильность БЛА в органических растворителях, где протекает реакция этерификации, с использованием широкого набора реагентов - жирных кислот и алифатических спиртов с различной длиной и строением углеродного скелета. Степень чистоты выделенного целевого продукта, контролируемая методом двумерной газовой хроматографии, составляет не менее 99.0%.
Задача решается составом биокатализатора с липазной активностью на основе липазы и носителя силикатной природы, в качестве липазы используют рекомбинантный фермент, полученный экспрессией синтетического гена зрелой липазы из Thermomyces lanuginosus в метилотрофных дрожжах Pichia pastoris, в качестве носителя силикатной природы - мезопористый силикагель или его углеродсодержащие композиты с величиной удельной поверхности 80-250 м2/г, суммарным объемом пор 0.7-1 см3/г, средним диаметром пор 10-25 нм.
Задачи решаются также способом приготовления биокатализатора с липазной активностью (БЛА) либо путем пропитки силикагеля или его углеродсодержащего композита растворами рекомбинантой липазы из Т. lanuginosus по влагоемкости, или путем адсорбции рекомбинантой липазы из Т. lanuginosus на носителях силикатной природы - мезопористом силикагеле и его углеродсодержащих композитах с последующей сушкой биокатализатора при температуре не выше 40°C.
В качестве липаз используют липазы микробиального происхождения:
1) коммерческая рекомбинантная липаза, являющаяся продуктом экспрессии гена липазы из Т. lanuginosus, клонированного в Aspergillus niger (обознач. липаза ТА),
2) коммерческая липаза из Thermus thermophilis (обознач. липаза ТТ), 3) коммерческая липаза из Thermus flavus (обознач. липаза ТФ).
В изобретении используют специально сконструированную авторами рекомбинантную липазу, являющуюся продуктом экспрессии гена зрелой липазы из Т. lanuginosus, клонированного в метилотрофных дрожжах Pichia pastoris (обознач. липаза ТП). Штамм-продуцент липазы ТП получен с помощью клонирования синтетического гена зрелой липазы из Т. lanuginosus, структура которого оптимизирована для эффективной экспрессии в клетках Pichia pastoris. Данный синтетический ген введен в состав интеграционного вектора pPICZ-alpha-A, клонирован и затем встроен в хромосому дикого штамма Pichia pastoris Х-33. В качестве адсорбента для липазы используют мезопористый силикагель, включая коммерческий силикагель марки КСК-Г и его углеродсодержащие композиты, с величиной удельной поверхности 80-250 м2/г, и объемом пор 0.7-1 см3/г, средним диаметром пор 10-25 нм.
Биокатализатор с липазной активностью готовят в виде механически прочных гранул, обладающих высокой механической прочностью, химической инертностью и высокой устойчивостью в реакционных средах органических растворителей.
Задача решается способом получения сложных эфиров жирных кислот с алифатическими спиртами с участием БЛА, приготовленного либо путем пропитки, либо путем адсорбции липазы, и высушенного в контролируемых условиях. В реакции этерификации в качестве исходных реагентов используют насыщенные жирные кислоты с количеством атомов в молекуле выше 4, например, стеариновая С18:0, и алифатические спирты с количеством атомов в молекуле выше 5, например, цетиловый спирт С16 (n-гексадеконол). Реакцию этерификации проводят в органических растворителях, представляющих смесь гексана и диэтилового эфира в соотношении 1:(1-2) при 20-40°C. Максимально достижимая концентрация жирной кислоты в реакционной среде определяется растворимостью данной кислоты в системе используемых органических растворителей и варьируется от 0.1 М до 2 M. Алифатический спирт находится в избытке, мольное соотношение «кислота: спирт» составляет 1:(1.5÷2) соответственно. В качестве органического растворителя используют смесь гексана и диэтилового эфира (гораздо менее токсичных реагентов, чем бензол в прототипе в объемном соотношении 1:(1÷2) соответственно. Для массового тестирования приготовленных биокатализаторов выбраны следующие условия: 0.2 М жирная кислота, 0.4 М алифатический спирт, 20°C. Соотношение веса реакционной среды и массы биокатализатора, называемое модулем ванны, составляет (2.5÷12):1. Для идентификации продуктов реакций используют газовую, газожидкостную и тонкослойную хроматографии. Для проведения этерификации используют реактор смешения периодического действия.
Скорость реакций этерификации определяют как титриметрически по убыли жирной кислоты, так и хроматографически. Концентрацию жирной кислоты определяют в процессе титрования с помощью раствора едкого натра с известной нормальностью, например, 0.048 н. Конверсию кислоты (x) или выход эфира (Y) рассчитывают по формуле: x, 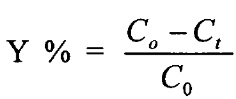 , где C0 и Ct - начальная и текущая концентрация кислоты, t - время реакции, мин. Активность приготовленных биокатализаторов выражают количеством международных единиц активности (ЕА) в расчете на 1 г биокатализатора (1 ЕА соответствует скорости реакции в мкмоль/мин). Удельную активность липазы также выражают количеством международных единиц активности (ЕА) в расчете на 1 мг белка.
, где C0 и Ct - начальная и текущая концентрация кислоты, t - время реакции, мин. Активность приготовленных биокатализаторов выражают количеством международных единиц активности (ЕА) в расчете на 1 г биокатализатора (1 ЕА соответствует скорости реакции в мкмоль/мин). Удельную активность липазы также выражают количеством международных единиц активности (ЕА) в расчете на 1 мг белка.
Для обозначения эфиров существует номенклатура ИЮПАК, например, эфир каприновой кислоты (С10:0) и изо-амилового спирта (С5) называется 3-метил-бутил деканоат. В данном изобретении эфиры обозначают схематично, например, эфир каприновой кислоты (С10:0) и изо-амилового спирта обозначают как С10|С5, где первая цифра обозначает количество атомов углерода в кислоте, вторая - в спирте.
Сущность изобретения иллюстрируется следующими примерами и таблицами.
Пример 1. Приготовление биокатализатора с липазной активностью
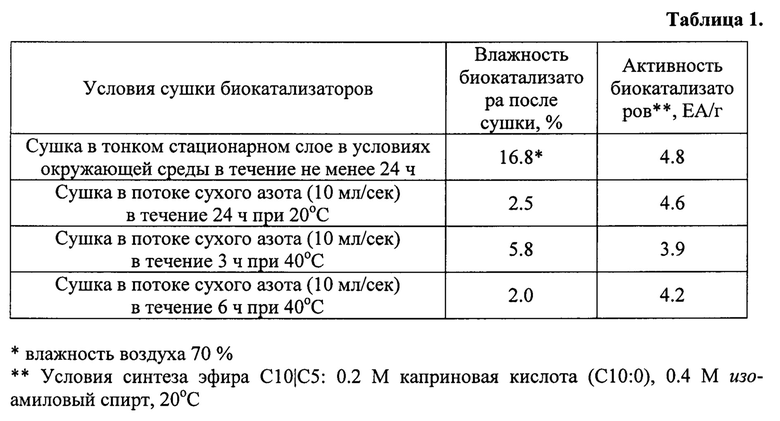
Биокатализатор с липазной активностью (БЛА) готовят следующим образом. Силикагель с величиной удельной поверхности 150 м2/г, объемом пор 0.75 см3/г и средним диаметром пор 20 нм пропитывают по влагоемкости раствором липазы ТП, объем которого соответствует объему пор, с концентрацией белка 4.6-11.0 мг/мл; выдерживают во влажном состоянии в течение 3 ч. Затем катализатор высушивают при различных условиях, приведенных в таблице 1, для того чтобы определить оптимальные условия сушки. Содержание белка в биокатализаторе рассчитывают, исходя из объема пропиточного раствора и концентрации липазы, например содержание липазы в биокатализаторах, описанных в таблице 1, составляет 3.7 мг белка в 1 г силикагеля.
Из таблицы 1 видно, что изученные условия сушки биокатализаторов не оказывают существенного влияния на их активность в реакции синтеза эфира С10|С5; также не обнаружено корреляций между влажностью биокатализатора и его активностью. При повышении температуры сушки с 20°C до 40°C активность биокатализаторов снижается в среднем на 16% (таблица 1); значит, оптимальная температура сушки катализаторов не превышает 40°C. Самый простой способ сушки заключается в сушке катализаторов в условиях окружающей среды при комнатной температуре до суховоздушного состояния.
Активность биокатализатора, высушенного в оптимальных условиях, определяют в реакции синтеза эфира С10|С16. Активность катализатора составляет 2.5 ЕА/г, что в пересчете составляет 0.5 ЕА/мг липазы, что в 12 раз выше чем в прототипе. Выход (Y) эфира С10|С16, равный 80%, достигается за 5 ч (в прототипе за 24 ч), то есть, в 5 раза быстрее чем в прототипе.
Пример 2. Приготовление биокатализатора с липазной активностью
Биокатализатор аналогичен примеру 1, только используют углеродсодержащий композитный адсорбент с величиной удельной поверхности 250 м2/г, объемом пор 0.8 см3/г и средним диаметром пор 23 нм. Содержание углерода в адсорбенте составляет 3.8 мас %. Содержание липазы в биокатализаторе составляет 3.7 мг/г.
Активность биокатализатора определяют в реакции синтеза эфиров жирных кислот с алифатическими спиртами, таких как С6|С5, С10|С5, С10|С16. Активность в реакции синтеза эфира С10|С16 составляет 2.7 ЕА/г катализатора, или 0.6 ЕА/мг липазы, что в 14 раз выше, чем в прототипе. Выход (Y) эфира С10|С16, равный 80%, достигается за 5 ч (в прототипе за 24 ч), то есть, в 5 раза быстрее чем в прототипе.
Пример 3. Приготовление биокатализатора с липазной активностью
Биокатализатор аналогичен примеру 1, только используют липазу ТА. Содержание белка в катализаторе составляет 8.0-9.9 мг/г. Активность катализаторов в реакции синтеза эфиров имеют следующие значения: для эфира С6|С5 - 9.5 ЕА/г или 1.0 ЕА/мг, для эфира С10|С5 - 13.0 ЕА/г или 1.7 ЕА/мг, для эфира С10|С16 - 16.8 ЕА/г или 2.7 ЕА/мг. Сравнение удельных активностей липазы в практически одинаковых условиях синтеза эфира С10|С16 показывает, что активность липазы в 17 раз выше чем в прототипе. Выход эфира С10|С16, равный 80%, достигается за 6 ч, что в 4 раз быстрее чем в прототипе.
Биокатализатор обладает высокой стабильностью и работает в течение 14 реакционных циклов (более 300 ч) без потери первоначальной активности, что в 3 раз дольше чем в прототипе.
Пример 4. Приготовление биокатализатора с липазной активностью
Биокатализатор аналогичен примеру 1, только используют липазу ТТ. Содержание белка составляет 8.2 мг/г. Активность биокатализатора в реакции синтеза эфира С10|С5 полностью отсутствует.
Пример 5. Приготовление биокатализатора с липазной активностью Биокатализатор аналогичен примеру 1, только используют липазу ТФ. Содержание белка составляет 8.1 мг/г. Активность биокатализатора очень низкая; за 24 ч методом тонкослойной хроматографии обнаружены следы продукта - эфира С10|С5.
Данные по активности биокатализаторов по примерам 1-5, приготовленных пропиткой по влагоемкости, представлены в таблице 2.
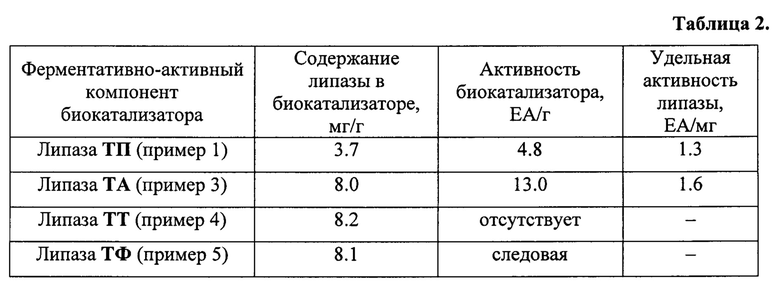
Из таблицы 2 можно сделать вывод, что рекомбинантная липаза ТП, полученная в настоящем изобретении, значительно превосходит по своим свойствам коммерческие липазы ТФ и ТТ, сравнима с лучшей коммерческой липазой ТА зарубежного производства, и может быть использована для приготовления отечественного активного и стабильного биокатализатора с липазной активностью.
Пример 6. Приготовление биокатализатора с липазной активностью
Биокатализатор с липазной активностью готовят путем адсорбции липазы ТА на мезопористом силикагеле следующим образом. Силикагель с величиной удельной поверхности 250 м2/г, объемом пор 1.0 см3/г и средним диаметром пор 18 нм заливают 10-кратным объемом буферного раствора (pH 7.0) липазы с концентрацией 10-12 мг/мл, и проводят адсорбцию фермента в течение 1 сут при периодическом перемешивании и 20°C. Затем раствор липазы удаляют и повторно заливают адсорбент раствором липазы той же концентрации, то есть адсорбцию проводят дважды в одинаковых условиях. Величина адсорбции липазы составляет 17.3 мг/г. Максимальная активность биокатализатора, измеренная в среде, содержащей 1.7 М каприновой кислоты и 3.4 М изо-амилового спирта (эфир С10|С5), составляет 140 ЕА/г. Сравнение удельных активностей липазы в одинаковых условиях синтеза эфира С10|С16 показывает, что активность липазы в примере 6, равная 0.5 ЕА/мг, в 12 раз выше чем в прототипе.
Пример 7.
Биокатализатор аналогичен примеру 6, только используют углеродсодержащий композитный адсорбент с величиной удельной поверхности 145 м2/г, объемом пор 0.85 см3/г и средним диаметром пор 18 нм. Содержание углерода в адсорбенте составляет 4.2 мас %. Величина адсорбции липазы составляет 32.6 мг/г. Максимальная активность биокатализатора, измеренная в среде, содержащей 1.7 М каприновой кислоты и 3.4 М изо-амилового спирта (эфир С10|С5), составляет 250 ЕА/г. Сравнение удельных активностей липазы в одинаковых условиях синтеза эфира С10|С16 показывает, что активность липазы в примере 6, равная 0.5 ЕА/мг, в 12 раз выше чем в прототипе.
Пример 8. Этерификация жирных кислот с алифатическими спиртами
Биокатализатор по примеру 1 используют в реакции этерификации различных жирных кислот с алифатическими спиртами, в результате синтезируются эфиры С10|С5, С10|С10, С7|С10 и С10|С16. Активность биокатализатора с реакции синтеза эфиров каприновой кислоты в ряду спиртов С5, С10 и С16, составляет, соответственно, 4.8, 3.0 и 2.5 ЕА/г. Активность биокатализатора в реакции этерификации с участием деканола С10, но с разными кислотами - энантовой С7:0 и каприновой С10:0, составляет, соответственно, 1.5 и 3.0 ЕА/г. Таким образом, в описанных условиях синтез эфира С10|С5 протекает с максимальной скоростью.
Пример 9. Этерификация жирных кислот с алифатическими спиртами
Биокатализатор по примеру 1 используют в реакции этерификации, только в реакции этерификации используют каприновую кислоту и изо-амиловый С5 и цетиловый С16 спирты. Содержание липазы составляет 7.2 мг/г. Активность биокатализатора в реакции синтеза С10|С5 и С10|С16 составляет соответственно 6.0 ЕА/г и 5.7 ЕА/г. Сравнение показывает, что удельная активность адсорбированной липазы, равная 0.4 ЕА/мг, в 10 раз выше чем в прототипе.
Пример 10. Этерификация жирных кислот с алифатическими спиртами
Биокатализатор с липазной активностью, приготовленный по примеру 6, используют для синтеза эфиров жирных кислот, только в реакции этерификации используют набор жирных кислот с количеством углеродных атомов от 2 до 18, в качестве спирта используют изо-пентанол С5 (3-метил-бутанол-1). Содержание липазы в биокатализаторе составляет 17.3 мг/г. Активность биокатализаторов в зависимости от строения углеродного скелета кислоты приведена в таблице 3. Видно, что скорость образования эфиров уксусной кислоты, например С2|С5, очень низкая, активность катализатора равна 0.6 ЕА/г. Скорость образования эфиров с участием пропилового спирта, например С10|С3 также очень низкая, активность катализатора равна 0.4 ЕА/г. Таким образом, скорость этерификации высокая, если количество атомов углерода в молекуле жирной кислоты превышает 4. Конверсия жирных кислот, приведенных с таблице 3 (исключая уксусную), равная 80-90%, достигается за 6 ч, что в 4 раза быстрее чем в прототипе.
Биокатализаторы обладают высокой операционной стабильностью и работают в течение 12 реакционных циклов (более 400 ч) без потери первоначальной активности, что в 5 раз больше чем в прототипе.
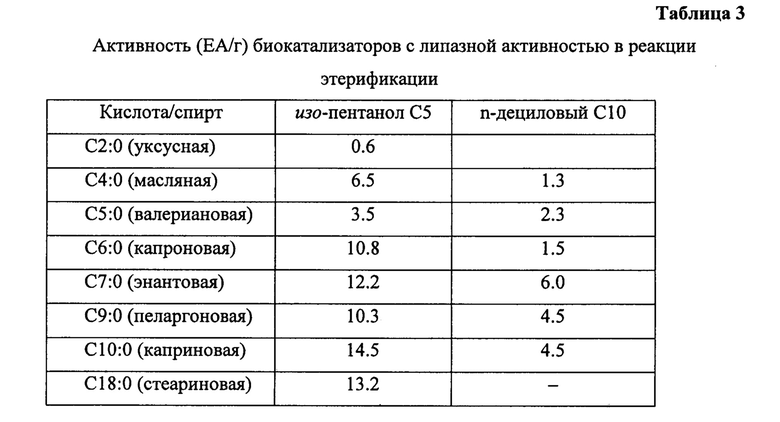
Из таблицы 3 видно, что этерификация различных жирных кислот протекает с высокой скоростью в присутствии изо-амилового спирта с образованием эфиров С(4÷18)|С5.
Пример 11. Этерификация жирных кислот с алифатическими спиртами
Биокатализатор по примеру 6 используют в реакции этерификации, только в реакции этерификации используют набор жирных кислот с количеством углеродных атомов от 4 до 10, в качестве спирта дециловый спирт C10 (n-деканол). Из таблицы 3 видно, что все изученные жирные кислоты вступают в реакцию этерификации с деканолом, однако активность биокатализаторов в 2-5 ниже чем в реакции этерификации тех же кислот в изо-пентатолом С5.
Биокатализаторы обладают высокой операционной стабильностью и работают в течение 12 реакционных циклов (более 400-500 ч) без потери первоначальной активности, что в 5 раз больше чем в прототипе.
Пример 12. Этерификация жирных кислот с алифатическими спиртами
Биокатализатор по примеру 6 используют в реакции этерификации, только в реакции этерификации используют капроновую и каприновую кислоты с количеством углеродных атомов 6 и 10, и цетиловый спирт С16 (n-гексадеканол). Активность биокатализатора в реакции синтеза С6|С16 и С10|С16 составляют соответственно 6.2 ЕА/г и 17.4 ЕА/г. Сравнение с прототипом показывает, что удельная активность адсорбированной липазы, равная 1.1 ЕА/мг, в 26 раз выше.
Из приведенных выше примеров видно, что биокатализаторы, приготовленные либо путем пропитки по влагоемкости, либо путем адсорбции рекомбинантной липазы из Т. lanuginosus на мезопористом силикагеле и его углеродсодержащих композитах, обладают высокими активностью и стабильностью в реакциях синтеза эфиров насыщенных жирных кислот с алифатическими спиртами в среде органических растворителей (смесаях гексана и диэтилового эфира). Биокатализаторы приготовлены в виде механически прочных гранул, что позволяет осуществить процессы этерификации как в периодическом в реакторах смешения, так и непрерывном режимах в проточных реакторах с неподвижным слоем.
| название | год | авторы | номер документа |
|---|---|---|---|
| Биокатализатор, способ его приготовления и способ получения сложных эфиров с использованием этого биокатализатора | 2019 |
|
RU2725474C1 |
| СПОСОБЫ ФЕРМЕНТАТИВНОЙ ПЕРЕЭТЕРИФИКАЦИИ/ЭТЕРИФИКАЦИИ, В КОТОРЫХ ИСПОЛЬЗОВАНЫ ЛИПАЗЫ, ИММОБИЛИЗОВАННЫЕ НА ГИДРОФОБНЫХ СМОЛАХ, В ПРИСУТСТВИИ ВОДНЫХ РАСТВОРОВ | 2011 |
|
RU2573929C9 |
| СПОСОБЫ И СИСТЕМА ДЛЯ ФЕРМЕНТАТИВНОГО СИНТЕЗА СЛОЖНЫХ АЛКИЛЭФИРОВ ЖИРНЫХ КИСЛОТ | 2011 |
|
RU2600879C2 |
| СПОСОБ ПОЛУЧЕНИЯ СЛОЖНЫХ МЕТИЛОВЫХ ЭФИРОВ ЖИРНЫХ КИСЛОТ С ИСПОЛЬЗОВАНИЕМ СМЕСИ ЛИПАЗ (ВАРИАНТЫ) | 2008 |
|
RU2520093C2 |
| СПОСОБ ВОССТАНОВЛЕНИЯ ПЕРЕЭТЕРИФИКАЦИОННОЙ АКТИВНОСТИ ЛИПАЗЫ И СПОСОБ ПЕРЕЭТЕРИФИКАЦИИ | 2007 |
|
RU2465329C2 |
| ШТАММ БАКТЕРИИ Escerichia coli XL1-blue/pQS-G3, ПРОДУЦЕНТ ТЕРМОСТАБИЛЬНОЙ ЛИПАЗЫ БАКТЕРИИ Geobacillus stearothermophilus G3 | 2013 |
|
RU2540873C1 |
| ЛИПАЗНЫЕ ПОРОШКОВЫЕ СОСТАВЫ | 2006 |
|
RU2412245C2 |
| Способ этерификации и переэтерификации жирового сырья | 2020 |
|
RU2751698C1 |
| БИОКАТАЛИЗАТОР, СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ И СПОСОБ ПЕРЕЭТЕРИФИКАЦИИ РАСТИТЕЛЬНЫХ МАСЕЛ С ИСПОЛЬЗОВАНИЕМ ЭТОГО БИОКАТАЛИЗАТОРА | 2013 |
|
RU2539101C2 |
| СПОСОБ ПОЛУЧЕНИЯ ГРАНУЛИРОВАННОГО БИОКАТАЛИЗАТОРА НА ОСНОВЕ ИММОБИЛИЗОВАННЫХ КЛЕТОК ДРОЖЖЕЙ ДЛЯ ПРОВЕДЕНИЯ РЕАКЦИИ ПЕРЕЭТЕРИФИКАЦИИ | 2016 |
|
RU2646104C1 |
Предложены способ получения биокатализатора для получения сложных эфиров, биокатализатор на основе рекомбинантной липазы из Thermomyces lanuginosus и способ получения сложных эфиров с использованием этого биокатализатора. Группа изобретений относится к биотехнологии и может быть использована в органическом синтезе для получения ценных продуктов пищевой, косметической и парфюмерной промышленности. Способ приготовления биокатализатора предусматривает пропитку силикагеля или его углеродсодержащего композита растворами рекомбинантной липазы из Thermomyces lanuginosus или адсорбцию липазы на мезопористом силикагеле или его углеродсодержащем композите с последующей сушкой биокатализатора. Биокатализатор представляет собой липазу Thermomyces lanuginosus, иммобилизованную на носителе. Способ получения сложных эфиров жирных кислот предусматривает этерификацию жирных кислот с алифатическими спиртами в органическом растворителе в присутствии биокатализатора в периодическом режиме в реакторе смешения. Группа изобретений позволяет повысить стабильность и ферментную активность биокатализатора в процессах этерификации широкого набора жирных кислот и алифатических спиртов. 3 н. и 3 з.п. ф-лы, 3 табл., 12 пр.
1. Способ приготовления биокатализатора для получения сложных эфиров жирных кислот с алифатическими спиртами на основе липазы, отличающийся тем, что биокатализатор готовят путем пропитки силикагеля или его углеродсодержащего композита растворами рекомбинантной липазы из Thermomyces lanuginosus по влагоемкости или путем адсорбции рекомбинантной липазы из Thermomyces lanuginosus на носителях силикатной природы - мезопористом силикагеле или его углеродсодержащих композитах с величиной удельной поверхности 80-250 м2/г, суммарным объемом пор 0,7-1 см3/г, средним диаметром пор 10-25 нм, с последующей сушкой биокатализатора при температуре не выше 40°С, в качестве липазы используют рекомбинантный фермент, полученный экспрессией синтетического гена зрелой липазы из Thermomyces lanuginosus в метилотрофных дрожжах Pichia pastoris.
2. Биокатализатор на основе рекомбинантной липазы из Thermomyces lanuginosus для получения сложных эфиров, полученный способом по п. 1.
3. Способ получения сложных эфиров путем этерификации жирных кислот с алифатическими спиртами в органическом растворителе в присутствии биокатализатора на основе липазы, отличающийся тем, что используют биокатализатор по п. 2.
4. Способ по п. 3, отличающийся тем, что в качестве жирной кислоты используют насыщенные жирные кислоты с длиной углеродного скелета 4-18 атомов углерода.
5. Способ по п. 3, отличающийся тем, что в качестве алифатического спирта используют алифатические спирты и их изомеры с длиной углеродного скелета 5-16 атомов углерода.
6. Способ по п. 3, отличающийся тем, что в качестве органического растворителя используют смесь гексана и диэтилового эфира.
| КОВАЛЕНКО Г.А., ПЕРМИНОВА Л.В | |||
| и др | |||
| Биокатализаторы с активностью термостабильной липазы для процессов биоконверсии триглицеридов растительных масел: Приготовление и свойства, Известия вузов | |||
| Прикладная химия и биотехнология, 2015, N 2 (13), с | |||
| Приспособление для соединения пучка кисти с трубкою или втулкою, служащей для прикрепления ручки | 1915 |
|
SU66A1 |
| БИОКАТАЛИЗАТОР, СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ И СПОСОБ ПЕРЕЭТЕРИФИКАЦИИ РАСТИТЕЛЬНЫХ МАСЕЛ С ИСПОЛЬЗОВАНИЕМ ЭТОГО БИОКАТАЛИЗАТОРА | 2013 |
|
RU2539101C2 |
| ГАМАЮРОВА В.С., ЗИНОВЬЕВА М.Е | |||
| Ферментативный катализ в неводных средах | |||
| Бутлеровские сообщения, 2011, т | |||
| Видоизменение пишущей машины для тюркско-арабского шрифта | 1923 |
|
SU25A1 |
| Торфодобывающая машина с вращающимся измельчающим орудием | 1922 |
|
SU87A1 |
| ГАМАЮРОВА В.С., ЗИНОВЬЕВА М.Е | |||
| и др | |||
| Синтез эфиров цетилового спирта и высших жирных кислот в неводных средах с помощью панкреатической липазы | |||
| - Катализ в промышленности, 2008, N 3, с | |||
| Видоизменение прибора для получения стереоскопических впечатлений от двух изображений различного масштаба | 1919 |
|
SU54A1 |
Авторы
Даты
2018-09-28—Публикация
2016-12-07—Подача