Изобретение относится к области биотехнологии и может быть использовано для получения термостабильных липаз, применимых в технологических процессах переработки жиров.
Липазы (EC 3.1.1.3) относятся к ферментам класса гидролаз, биологической функцией которых является расщепление триглицеридов до жирных кислот, воды и глицерина. Однако данные ферменты также могут катализировать ряд других реакций, например, переэтерификацию триглицеридов или расщепление эфиров с образованием спиртов. Многообразие свойств данных ферментов позволяет применять их в промышленности в качестве добавок к моющим средствам, для получения жиров специального назначения, а также в качестве высокоселективных катализаторов химических реакций органического синтеза [1, 2]. Применение липаз, обладающих региоселективностью, позволяет получать продукты с контролируемыми свойствами. Например, для получения жиров специального назначения в пищевой промышленности широко применяется переэтерификация пальмового масла и растительных масел с использованием термостабильных 1,3-специфичных липаз (полученных из грибов Rhizomucor miehei или Thermomyces lanuginosus) [3]. Стоит отметить, что в подобных технологических процессах используются исключительно термостабильные липазы, поскольку реакции с их участием протекают при высоких температурах (40-70°C), что вызывает термическую денатурацию фермента и, вследствие этого, потерю активности. Для повышения стабильности фермента и улучшения параметров технологического процесса липазы для подобных целей применяют в составе гетерогенных биокатализаторов [4].
В настоящее время описаны свойства ряда термостабильных липаз. В основном в промышленности используются липазы мицеллярных грибов, таких как, например, R. miehei или Т. lanuginosus, а также дрожжей (Candida antarctica и Candida rugosa) [5]. Также перспективными являются липазы, продуцируемые термофильными бактериями, относящиеся к родам Bacillus, Geobacillus, Burkholderia, Chromobacterium и Pseudomonas [6]. Как правило, бактериальные липазы имеют оптимум активности при 30-60°C и pH 6.0-9.0 [7]. В целом, липазы, продуцируемые бактериями рода Geobacillus, представляют наибольший интерес для применения, поскольку обладают высокой термостабильностью и операционной устойчивостью [8, 9].
Известен ряд рекомбинантных штаммов Е. coli, осуществляющих продукцию термостабильных липаз, полученных из бактерий рода Geobacillus. В работе [8] описаны свойства липазы бактерии Geobacillus sp. TW1, ген которой был встроен в плазмиду pET-GST и экспрессирован в штамме Е. coli BL21. Фермент обладает оптимумом активности при 40°C и pH 7.0-8.0, а при инкубации в течение 15 мин при температуре 50°C сохраняет 80% активности.
В работе [9] описана липаза с высокой операционной термостабильностью, полученная из штамма Geobacillus thermoleovorans YN, клонированная в составе вектора pCYTEX-LipA-6xhis и эксперссированная в клетках E. coli DH5α под контролем температуро-чувствительного промотора. При инкубации фермента в течение 30 мин при 50°C и pH 7.5-9.5 его активность оставалась неизменной вплоть до температуры 70°C, при которой происходило ее существенное снижение. Активность очищенной липазы была равна 3586 е.а./мг.
Наиболее близким аналогом предлагаемого изобретения - прототипом, является рекомбинантный штамм Е. coli, продуцирующий липазу ARM, полученную из бактерии Geobacillus sp. Полученный фермент отличается высокой термостабильностью, например, при 50°C и pH 8.0 время его полуинактивации составляет 90 мин. Липаза ARM обладает наибольшей активностью при pH 5.0-6.0. Для экспрессии липазы была разработана генетическая конструкция pTrcHis/ARM, где ген липазы встроен под контроль промотора tac. Плазмидная ДНК была трасформирована в клетки E. coli TOP 10. Биосинтез липазы индуцировали добавлением в среду изопропил-бета-d-тиогалактопиранозида (IPTG), затем полученный фермент выделяли с использованием аффинной хроматографии. Активность очищенной липазы составила 219.31 е.а./мг при 50°C и использовании в качестве субстрата оливкового масла (патент EP 2450458 A3, опубликован 27.06.2012 г.).
В целом, липаза ARM не обладает достаточной операционной стабильностью, что повышает себестоимость ее использования в составе гетерогенных биокатализаторов переэтерификации [10], а также имеет оптимум pH в кислых условиях. Также в составе конструкции pTrcHis/ARM, обеспечивающей экспрессию липазы, отсутствует нуклеотидная последовательность, кодирующая сигнальный пептид, что во многих случаях позволяет существенно повысить уровень экспрессии рекомбинантного белка [11].
Задачей изобретения является получение бактериального штамма-продуцента термостабильной липазы, обладающей высокой операционной стабильностью для применения в составе гетерогенных биокатализаторов в процессах переэтерификации растительных масел.
Поставленная задача решается предлагаемым штаммом Esherichia coli XL1-blue, содержащим рекомбинантную плазмиду pQS-G3, продуцирующим липазу из штамма Geobacillus stearothermophilus G3, выделенного из горячего источника Северного Прибайкалья. Липаза обладает высокой операционной стабильностью при температуре 50°C, что позволяет увеличить время ее эксплуатации в составе гетерогенных биокатализаторов переэтерификации триглицеридов. Штамм депонирован в «Коллекции бактерий, бактериофагов и грибов» Федерального бюджетного учреждения науки Государственный научный центр вирусологии и биотехнологии «Вектор» (ФБУН ГНЦ ВБ «Вектор») под номером B-1298.
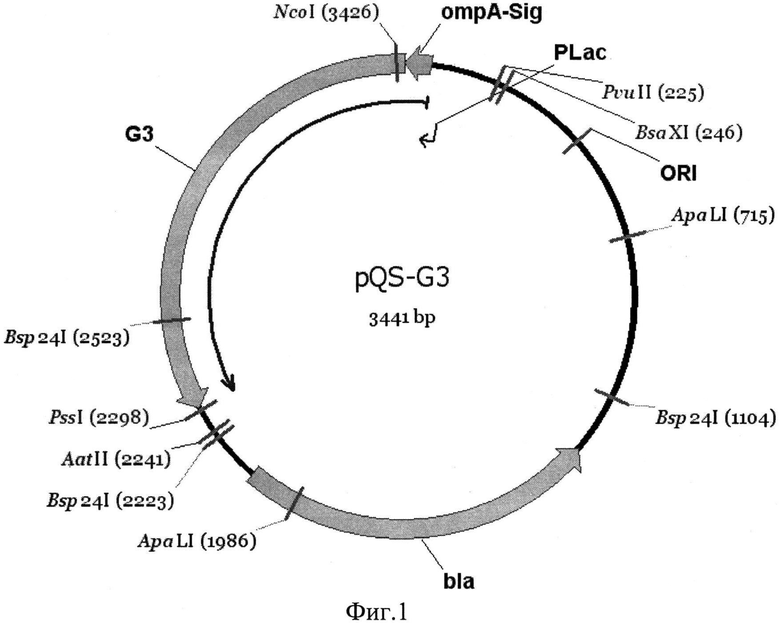
Штамм получают трансформацией клеток бактерии E. coli XL1-blue ДНК плазмиды pQS-G3 с использованием стандартных процедур [12]. Отбор трансформантов осуществляют на среде LB с ампициллином (100 мг/л). Плазмида pQS-G3 разработана на основе вектора pUC 18 и содержит репликон pMB1, ген устойчивости к ампициллину bla (кодирующий β-лактамазу), обеспечивающий отбор клеток с плазмидой, промотор лактозного оперона pLac, а также сконструированный ген, кодирующий гибридный белок, содержащий последовательность сигнального пептида внеклеточной протеазы OmpA бактерии E. coli и последовательность липазы Geobacillus stearothermophilus G3 без нативного сигнального пептида. Схема плазмиды pQS-G3 приведена на фиг.1, где: OmpA-Sig - последовательность сигнального пептида протеазы OmpA; G3 - последовательность, кодирующая липазу штамма Geobacillus stearothermophillus G3 без нативного сигнального пептида; bla - ген устойчивости к ампициллину (бета-лактамаза), PLac - промотор лактозного оперона, ORI - точка начала репликации.
Штамм Escherichia coli Xl1 blue/pQS-G3 имеет следующие характеристики.
Культурально-морфологические признаки
Штамм является факультативным аэробом. При росте на LB-агаре колонии гладкие, круглые, блестящие, сероватые, мутные, край ровный. При росте в жидких средах LB образуют интенсивную муть. Клетки прямые, палочковидной формы, подвижные, грамотрицательные.
Генетические признаки, устойчивость к антибиотикам
Штамм имеет следующие генетические признаки: recA1 endA1 gyrA96 thi-1 hsdR17 supE44 relA1 lac [F′ proAB lacIqZΔM15 Tn10 (Tetr)]. Устойчив к тетрациклину и ампициллину.
Предлагаемый рекомбинантный штамм продуцирует термостабильную липазу, обладающую высокой операционной стабильностью и предназначенную для применения в составе гетерогенных биокатализаторов в процессах переэтерификации растительных масел.
Изобретение иллюстрируется следующими примерами.
Пример 1. Получение плазмиды pQS-G3 и штамма Esherichia coli XL1-blue/pQS-G3
Для получения плазмиды pQS-G3 используют сконструированный гибридный ген, содержащий последовательности, кодирующие ген липазы Geobacillus stearothermophilus G3 и последовательность сигнального пептида внеклеточной протеазы OmpA бактерии E. coli длиной 21 аминокислотный остаток [GenBank ID ААС74043].
Последовательность гена липазы получают следующим путем: проводят выделение геномной ДНК бактерии Geobacillus stearothermophilus G3 с использованием набора GeneJET Genomic DNA Purification Kit (Fermentas), которую затем используют в качестве матрицы в реакции ПЦР. Амплификацию фрагмента гена липазы, не содержащего сигнального пептида, проводят в присутствии 20 нг ДНК в общем объеме 50 мкл, содержащего 0.2 мМ смеси четырех дезокситрифосфатов, 1.5 мМ MgCl2, 0.1 мкМ праймеров Geolip_f - 5′-ATGATYGTRCTTCTCCATGGYTTTAC-3′ и Geolip_r - 5′-TTAAGGYYGCAARCTCGCCA, буфера для Taq ДНК-полимеразы, и 0.05 е.а./мкл Taq ДНК-полимеразы («Сибэнзим»). Полученный фрагмент повторно амплифицируют в аналогичных условиях с использованием урацилсодержащих праймеров Geolip_f_in_pUC(ompA)(U) - 5′-AGCGCAGGCCAUGATYGTRCTTCTCCATGGYTTTAC-3′ и Geolip_r_in_pUC(ompA)(U) - 5′-AGGCCCTTUAAGGYYGCAARCTCGCCA-3′.
Последовательность, кодирующая сигнальный пептид протеазы OmpA, получена путем химического синтеза и клонирована в составе плазмиды pUC18 в компании "АТГ-Сервис Ген". Фрагмент полученной плазмиды pUC18-OmpA, содержащий сигнальный пептид, амплифицируют методом ПЦР с использованием урацилсодержащих праймеров pUC18(atg)OmpA_f - 5′-ACCAGCCAGUGCCACTGCAATCGCGATAGCTGTCTTTTTCATAGCTGTTTCCTGTGTG-3′ и pUC18_OmpAr - 5′-ACTGGCTGGUTTCGCTACCGTAGCGCAGGCCGACGAAAGGGCCTCGTG-3′, как описано выше.
Оба полученных ампликона очищают с использованием набора GeneJET™ PCR Purification Kit, добавляют буфер для TaqSE полимеразы ("СибЭнзим"), обрабатывают раствор ферментативным комплексом USER (New England Biolabs) и рестриктазой Mal I, инкубируют при 37°C в течение 30 мин. Для лигирования используют 50 нг обработанных фрагментов, проводят реакцию с T4 (New England Biolabs) лигазой в течение 20 мин при 22°C, согласно протоколу производителя. Полученную смесь переосаждают [13] и трансформируют ей электрокомпетентные клетки Esherichia coli XL1-blue, как описано в [12]. Полученные клетки высевают на агаризованную среду LB, содержащую ампициллин (100 мг/л), и культивируют при 37°C в течение 16 ч. Плазмидную ДНК, выделенную из полученных клонов с использованием набора GeneJET Plasmid Miniprep Kit (Fermentas), проверяют ПЦР анализом на наличие необходимой вставки ДНК.
Клоны с подтвержденной встройкой (не менее 10 штук) отбирают для оценки липазной активности. Для этого клоны культивируют в жидкой среде LB в пробирках при 37°C в течение 12 ч, после проводят индукцию биосинтеза путем добавления IPTG в концентрации 1 мМ в течение 6 ч. Полученные клетки осаждают центрифугированием при 5000 об/мин в течение 5 мин, лизируют путем обработки ультразвуком в течение 5 мин, после чего центрифугируют при 14000 об/мин при 4°C в течение 10 мин. Активность полученного супернатанта оценивают по скорости гидролиза субстрата (п-нитрофенил пальмитата) при 50°C [14] и выбирают клон с наибольшей липазной активностью.
Пример 2. Культивирование штамма Esherichia coli XL1-blue/pQS-G3 и выделение липазы
Культуру Esherichia coli XL1-blue/pQS-G3 выращивают при 37°C в течение 16 ч, после чего засевают в 5 мл жидкой среды LB и культивируют при перемешивании (250 об/мин) и температуре 37°C в течение 12 ч. Затем засевают посевной культурой колбы со средой TB (200 мл) из расчета 1:100, выращивают до оптической плотности 0,6 (λ=600 нм) при 37°C. Индукцию и лизис клеток проводят, как описано выше. Для выделения белка полученный лизат насыщают сульфатом аммония до 30%, после формирования осадка его отделяют центрифугированием при 14000 об/мин в течение 20 мин. Затем проводят повторное осаждение белка путем добавления к полученному супернатанту сульфата аммония до 80% от насыщения, осадок отделяют центрифугированием, как описано выше.
Полученный осадок очищают хроматографией на колонке с сорбентом Butyl Sepharose 4 Fast Flow (GE Healthcare). Для этого его наносят на колонку, уравновешенную 1 М (NH4)2SO4 в 0.05 М Tris pH 7.0, и проводят элюцию раствором 1 М (NH4)2SO4 в 0.05 М Tris pH 7.0 в градиенте концентрации от 100 до 0%. Фракции, обладающие липазной активностью, повторно разделяют на сорбенте Sephadex G-75 в изократическом градиенте 0.05 М Tris-HCl pH 7.0. Активность полученной липазы составила 3238 е.а./г.
Пример 3. Определение оптимума активности рекомбинантной липазы бактерии Geobacillus stearothermophilus G3 при различных температурах и ее операционной стабильности
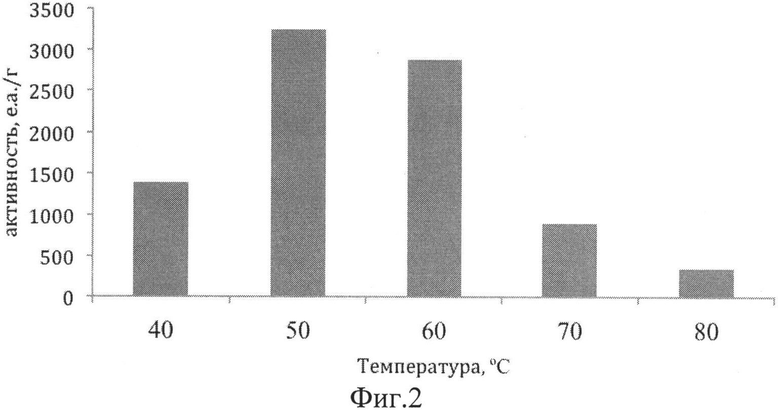
Для определения термостабильности липазы G3 при различных температурах очищенный фермент инкубируют при температурах 40-100°C в буфере 0.1 М Tris-HCl pH 8.0 в течение 15 мин, затем измеряют активность по скорости гидролиза п-нитрофенол пальмитата. Активность рекомбинантной липазы Geobacillus stearothermophillus G3 при различных температурах представлена на фиг.2. Как видно из данных, оптимум активности фермента отмечается при температуре 50°C.
Для определения pH оптимума рекомбинантной липазы G3 проводят инкубацию в буфере 0.1 М Tris-HCl при pH 5.0-9.0 и температуре 50°C в течение 15 мин, после чего определяют остаточную активность по п-нитрофенил пальмитату. Данные по активности рекомбинантной липазы Geobacillus stearothermophillus G3 при различных значениях pH и температуре 50°C приведены на фиг.3. Видно, что фермент обладает наибольшей активностью при pH 8.0-9.0.
Для определения операционной стабильности фермента очищенную липазу инкубируют в буфере 0.1 М Tris-HCl pH 8.0 при температуре 50°C в течение определенных промежутков времени, после чего измеряют остаточную активность липазы по гидролизу п-нитрофенил пальмитата. Данные по операционной стабильности рекомбинантной липазы Geobacillus stearothermophillus G3 при температуре 50°C приведены на фиг.4, из которой видно, что время полуинактивации липазы G3 при температуре 50°C составляет 145 мин.
Полученный штамм, по сравнению с остальными, продуцирует липазу бактерии Geobacillus stearothermophilus G3, обладающую высокой операционной стабильностью, при 50°C время ее полуинактивации составляет 145 мин, а также имеет щелочной оптимумом активности. Применение данной термостабильной липазы в процессах переэтерификации в составе гетерогенных биокатализаторов пищевых жиров позволит существенно увеличить время их эксплуатации, что, в конечном счете, позволяет снизить себестоимость процесса получения жиров специального назначения.
Источники информации
1. Houde A., Kademi A., Leblanc D. Lipases and their industrial applications: an overview // Appl. Biochem. Biotechnol. 2004. V.118. №1-3. P.155-170.
2. Fishman A., Basheer S., Shatzmiller S., Cogan U. Fatty-acid-modified enzymes as effective enantioselective catalysts in microaqueous organic media // Biotechnol. Lett. 1998. V.20. №6. P.535-538.
3. Fernandez-Lafuente R. Lipase from Thermomyces lanuginosus: Uses and prospects as an industrial biocatalyst // Journal of Molecular Catalysis B: Enzymatic. 2010. V.62. №3-4. P.197-212.
4. Christensen M.W., Andersen L., Husum T.L., Kirk O. Industrial lipase immobilization // European Journal of Lipid Science and Technology. 2003. V.105. №6. P.318-321.
5. Houde A., Kademi A., Leblanc D. Lipases and their industrial applications: an overview // Appl. Biochem. Biotechnol. 2004. V.118. №1-3. P.155-170.
6. Hasan F., Shah A.A., Hameed A. Industrial applications of microbial lipases // Enzyme and Microbial Technology. 2006. V.39. №2. P.235-251.
7. Gupta R., Gupta N., Rathi P. Bacterial lipases: an overview of production, purification and biochemical properties // Appl. Microbiol. Biotechnol. 2004. V.64. P.763-781.
8. Li H. Zhang X. Characterization of thermostable lipase from thermophilic Geobacillus sp. TW1 // Protein Expression and Purification. 2005. V.42, №1. P.153-159.
9. Solimana N.A., Knoll M., Abdel-Fattaha Y.R., Schmid R.D., Langeb S. Molecular cloning and characterization of thermostable esterase and lipase from Geobacillus thermoleovorans YN isolated from desert soil in Egypt // Process Biochemistry. 2007. V.42. №7. P.1090-1100.
10. Villeneuve P. Biocatalysis in lipid modification // European Journal of Lipid Science and Technology. 2013. V.115. №4. P.377-378.
11. Choi J.H. Lee S.Y. Secretory and extracellular production of recombinant proteins using Escherichia coli // Appl. Microbiol. Biotechnol. 2004. V.64. P.625-635.
12. Miller E.M., Nickoloff J.A. Escherichia coli Electrotransformation // Methods in Molecular Biology. 1995. V.47. P.105-113.
13. Sambrook J. Molecular Cloning: A Laboratory Manual, Third Edition. Cold Spring Harbor Laboratory Press. 2001. 2344 p.
14. Farneta A.M., Qasemiana L., Goujarda L., Gilb G., Guirala D., Ruaudela F., Ferrea E. A modified method based on p-nitrophenol assay to quantify hydrolysis activities of lipases in litters // Soil Biology and Biochemistry. 2010. V.42. №2. P.386-389.
| название | год | авторы | номер документа |
|---|---|---|---|
| ШТАММ БАКТЕРИИ Esherichia coli EX pQE30, ПРОДУЦЕНТ ЭНДОКСИЛАНАЗЫ БАКТЕРИИ Geobacillus stearothermophillus 22 | 2013 |
|
RU2542486C1 |
| ТЕРМОСТАБИЛЬНАЯ ЛИПАЗА ИЗ БАКТЕРИИ Thermosyntropha lipolytica, АКТИВНАЯ В ЩЕЛОЧНОЙ СРЕДЕ | 2012 |
|
RU2508402C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pEst877, ДЕТЕРМИНИРУЮЩАЯ ЭКСПРЕССИЮ ПОЛИПЕПТИДА С АКТИВНОСТЬЮ ЭСТЕРАЗЫ Psychrobacter cryohalolentis К5 НА ПОВЕРХНОСТИ КЛЕТОК ESCHERICHIA COLI, И ШТАММ БАКТЕРИЙ Escherichia coli BL21(DE3)pLysS/pEst877-ПРОДУЦЕНТ ПОЛИПЕПТИДА С АКТИВНОСТЬЮ ЭСТЕРАЗЫ Psychrobacter cryohalolentis К5 НА ПОВЕРХНОСТИ КЛЕТОК | 2013 |
|
RU2526213C1 |
| РЕКОМБИНАНТНЫЙ ШТАММ БАКТЕРИЙ BACILLUS LICHENIFORMIS - ПРОДУЦЕНТ ТЕРМОСТАБИЛЬНОЙ ЛИПАЗЫ | 2012 |
|
RU2500812C1 |
| ЛИТИЧЕСКАЯ ПРОТЕАЗА AlpB БАКТЕРИИ Lysobacter sp. XLI, ФРАГМЕНТ ДНК, КОДИРУЮЩИЙ ЛИТИЧЕСКУЮ ПРОТЕАЗУ AlpB БАКТЕРИИ Lysobacter sp. XLI, И СПОСОБ ПОЛУЧЕНИЯ ЛИТИЧЕСКОЙ ПРОТЕАЗЫ AlpB БАКТЕРИИ Lysobacter sp. XLI | 2009 |
|
RU2408725C2 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pEstPc, КОДИРУЮЩАЯ ПОЛИПЕПТИД СО СВОЙСТВАМИ ЭСТЕРАЗЫ Psychrobacter cryohalolentis K5, И ШТАММ БАКТЕРИЙ Escherichia coli - ПРОДУЦЕНТ ПОЛИПЕПТИДА СО СВОЙСТВАМИ ЭСТЕРАЗЫ Psychrobacter cryohalolentis K5 | 2011 |
|
RU2478708C1 |
| РЕКОМБИНАНТНЫЙ ШТАММ Escherichia coli, ОБЛАДАЮЩИЙ КОНСТИТУТИВНОЙ АСПАРТАЗНОЙ АКТИВНОСТЬЮ И СПОСОБ СИНТЕЗА L-АСПАРАГИНОВОЙ КИСЛОТЫ С ИСПОЛЬЗОВАНИЕМ ЭТОГО ШТАММА В КАЧЕСТВЕ БИОКАТАЛИЗАТОРА | 2013 |
|
RU2546239C1 |
| БИОКАТАЛИЗАТОР ДЛЯ ПЕРЕЭТЕРИФИКАЦИИ ЖИРОВ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2011 |
|
RU2528778C2 |
| ЛИТИЧЕСКАЯ ПРОТЕАЗА AlpA БАКТЕРИИ LYSOBACTER SP. XL1, ФРАГМЕНТ ДНК, КОДИРУЮЩИЙ ЛИТИЧЕСКУЮ ПРОТЕАЗУ AlpA БАКТЕРИИ LYSOBACTER SP. XL1, И СПОСОБ ПОЛУЧЕНИЯ ЛИТИЧЕСКОЙ ПРОТЕАЗЫ AlpA БАКТЕРИИ LYSOBACTER SP. XL1 | 2009 |
|
RU2407782C2 |
| БИОКАТАЛИЗАТОР, СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ И СПОСОБ ПЕРЕЭТЕРИФИКАЦИИ РАСТИТЕЛЬНЫХ МАСЕЛ С ИСПОЛЬЗОВАНИЕМ ЭТОГО БИОКАТАЛИЗАТОРА | 2013 |
|
RU2539101C2 |


Изобретение относится к области биотехнологии и представляет собой штамм Esherichia coli В-1298, депонированный в ФБУН ГНЦ ВБ «Вектор». Штамм получен трансформацией клеток бактерии E. coli XL1-blue ДНК плазмиды pQS-G3, разработанной на основе вектора pUC18 и содержащей репликон pMB1, ген устойчивости к ампициллину bla (кодирующий β-лактамазу), обеспечивающий отбор клеток с плазмидой, промотор лактозного оперона pLac, а также сконструированный ген, кодирующий гибридный белок, содержащий последовательность сигнального пептида внеклеточной протеазы OmpA бактерии E. coli и последовательность липазы Geobacillus stearothermophilus G3 без нативного сигнального пептида. Изобретение позволяет получать липазу, которая обладает высокой операционной стабильностью при температуре 50°C, что позволяет увеличить время эксплуатации в составе гетерогенных биокатализаторов переэтерификации триглицеридов. 4 ил., 3 пр.
Штамм бактерии Esherichia coli XL1-blue, содержащий рекомбинантную плазмиду pQS-G3, депонированный в ФБУН ГНЦ ВБ «Вектор» под регистрационным номером B-1298, предназначенный для получения термостабильной липазы бактерии Geobacillus stearothermophillus G3.
| СПОСОБ РАДИОПОДАВЛЕНИЯ КАНАЛОВ СВЯЗИ | 2011 |
|
RU2450458C1 |
| US 7319029 B2, 15.01.2008 | |||
| LI H | |||
| et.al | |||
| Characterization of thermostable lipase from thermophilic Geobacillus sp | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| РЕКОМБИНАНТНЫЙ ШТАММ ДРОЖЖЕЙ YARROWIA-LIPOLYTICA - ПРОДУЦЕНТ ЛИПАЗЫ | 2011 |
|
RU2451075C1 |
| Способ размещения упругих элементов двухкаскадного амортизатора | 1979 |
|
SU977869A1 |
Авторы
Даты
2015-02-10—Публикация
2013-09-23—Подача