ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение в основном относится к детекции и идентификации различных форм генетических маркеров и различных форм белков с потенциальной пользой в качестве прогностических маркеров. В частности, настоящее изобретение относится к одновременному применению нескольких прогностических маркеров для улучшенной оценки необходимости лечения в будущем рака предстательной железы у индивидуума с раком предстательной железы.
УРОВЕНЬ ТЕХНИКИ, ПРЕДШЕСТВУЮЩИЙ ИЗОБРЕТЕНИЮ
Определение специфического антигена простаты (PSA) в сыворотке широко используется для скрининга и ранней детекции рака предстательной железы (PCa). Как описано в статье "Polygenic Показатель риска Improves Prostate Cancer Risk Prediction: Results from the Stockholm-1 Cohort Study" Markus Aly и соавторов, опубликованной в EUROPEAN UROLOGY 60 (2011) 21-28 (включенной в настоящий документ в качестве ссылки), PSA в сыворотке, который измеряют в современных клинических иммунологических анализах, преимущественно существует в виде одной из трех "безкомплексных" форм (свободный PSA) или в виде комплекса с α1-антихимотрипсином (ACT). Показано, что соотношение свободного и общего PSA в сыворотке значительно улучшает детекцию PCa. Другие факторы, такие как возраст и подтвержденный семейный анамнез, также могут дополнительно улучшить детекцию PCa. Перспективным способом скрининга и ранней детекции рака предстательной железы является анализ генетических маркеров, ассоциированных с PCa, в частности однонуклеотидных полиморфизмов (SNP). Анализ множества SNP, ассоциированных с PCa, в комбинации с биомаркерами, как PSA, и c общей информацией о пациенте может улучшить оценку риска посредством комбинации нескольких SNP в генетический показатель.
По сравнению с настоящим изобретением ранее описаны попытки комбинирования информации из множества источников в одну алгоритмическую модель для прогноза конечных точек, риска PCa. В открытой публикации "Blood Biomarker Levels to Aid Discovery of Cancer-Related Single-Nucleotide Polymorphisms: Kallikreins and Prostate Cancer" Robert Klein с соавторами, опубликованной в Cancer Prev. Res. (2010), 3(5):611-619 (включенной в настоящий документ в качестве ссылки), авторы описывают, как биомаркеры крови могут содействовать обнаружению новых SNP, но также демонстрируют, что существует потенциальная роль для включения в прогностические модели генотипа и уровней биомаркеров. Кроме того, в этой публикации предоставлены свидетельства того, что неаддитивная комбинация генетических маркеров и биомаркеров при взаимодействии может иметь прогностическое значение при оценке риска PCa. Позже Xu и соавторы изобретения в патентной заявке WO2012/031207A2, включенной в настоящий документ в качестве ссылки, описали способ оценки риска наличия PCa у индивидуума. В этом изобретении описан способ прогноза риска наличия рака предстательной железы у индивидуума посредством использования генетической информации в 33 определенных SNP, которые косвенно можно использовать для прогноза целесообразности химиопрофилактической терапии у тестируемого индивидуума. Химиопрофилактическая терапия представляет собой проактивное лекарственное средство вводимое до диагностирования злокачественной опухоли с целью снижения вероятности возникновения злокачественной опухоли.
Хотя PSA преимущественно используют для диагностики PCa, он также описан в качестве прогностического маркера для индивидуумов, у которых диагностирован PCa. Одним из возможных способов оценки прогноза PCa у индивидуума является контроль за изменением значения PSA, как описано Collette с соавторами в открытой публикации "Prostate specific antigen: a prognostic marker of survival in good prognosis metastatic prostate cancer?", опубликованной в Eur. Urol. 2003 Aug; 44(2):182-9; обсуждение 189 (включенной в настоящий документ в качестве ссылки).
Существуют другие дополнительные маркеры, подходящие для оценки прогноза диагноза PCa, как описано EP Gelmann и SM Henshall в открытой публикации "Clinically Relevant Prognostic Markers for Prostate Cancer: The Search Goes On", опубликованной в Ann. Intern. Med. 5 May 2009; 150(9):647-649 (включенной в настоящий документ в качестве ссылки). В этой публикации в качестве потенциальных прогностических маркеров описаны гистологическая степень (индекс Глисона), экспрессия P53, экспрессия BCL2 и плотность микрососудов, хотя у них у всех существуют большие недостатки в отношении этой цели.
Современной клинической практикой (в Швеции) является использование в качестве одного из основных аргументов для решения о начале активного лечения (хирургии или лучевой терапии) рака предстательной железы, который изолирован в предстательной железе, индекса Глисона. Для этого решения также важны другие факторы, такие как возраст, не связанные с рассматриваемым заболевания, предполагаемый размер опухоли и мнение пациента. В качестве эмпирического правила подавляющее большинство пациентов с опухолями с индексом Глисона 8+ подвергают активному лечению. У пациентов с опухолями с индексом Глисона 6 активному лечению подвергают меньшую долю, а большинство оставляют под активным наблюдением. Общепризнанно, что так как пациент влияет на этот процесс принятия решения, решение имеет субъективный характер. Способ прогноза в области принятия решения об активном лечении пациента мог бы быть наиболее полезным, если предоставлять поддержку решения в пограничных случаях, т.е. для пациентов с опухолями с индексом Глисона 6-7.
Таким образом, оценка прогноза является трудной задачей, где улучшения текущего состояния техники могут привести к большой экономии для общества. Особую важность представляет оценка необходимости для индивидуума с диагнозом PCa расширенного лечения (хирургии или радиации) или возможности контролировать заболевание посредством активного наблюдения. Расширенное лечение обладает рядом серьезных побочных эффектов, включая импотенцию (преимущественно при хирургии), недержание и проблемы с желудочно-кишечным трактом (два последних преимущественно при лучевой терапии). Однако настоящее изобретение относится к прогностическим моделям для прогноза PCa посредством анализа биомаркеров и генетического профиля индивидуума с диагнозом PCa.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение основано на открытии того, что комбинация прогностических маркеров различного происхождения может улучшать способность определения необходимости для индивидуума с диагнозом PCa активного или расширенного лечения. Это может приводить к большой экономии для общества, так как более рано идентифицированные агрессивные злокачественные опухоли легче поддаются лечению.
В указанной выше патентной заявке WO2012/031207A2 не описано, как применять способ в случаях, когда данные об SNP доступны только для подмножества из 33 SNP, в частности когда пропущены данные более чем для 5%, или более чем для 10%, или более чем для 20% SNP. Это означает, что способ в WO2012/031207A2 у протестированного индивидуума в случае, если первый тест привел к получению частичного результата, может потребоваться получить второй образец для повторного тестирования генетической информации, которую не удалось получить в первом тесте. Также не описано как способ можно использовать для прогноза выбора терапии после диагноза.
Один из аспектов настоящего изобретения относится к способу на основе составленной с избыточностью комбинации данных для оценки необходимости активного лечения для индивидуума с диагнозом рак предстательной железы, включающему этапы:
1. Получения у указанного индивидуума по меньшей мере одного биологического образца;
2. Анализа в указанном биологическом образце категории SNP, ассоциированных с PCa, (SNPpc), посредством определения присутствия или отсутствия каждого из множества SNPpc;
3. Комбинирования данных, относящихся к указанной категории SNPpc, с получением комбинированного значения для SNPpc, где способ при получении комбинированного значения для SNPpc позволяет пренебречь подмножеством по меньшей мере из 5% SNPpc из категории SNPpc;
4. Определения корреляции указанного комбинированного значения для SNPpc с вероятностью необходимости активного лечения для индивидуума посредством сравнения комбинированного значения для SNPpc с предопределенным пороговым значением, установленным с использованием контрольных образцов, где у индивидуумов, у которых получены контрольные образцы, известны необходимость активного лечения или отсутствие необходимости в активном лечении.
По одному из аспектов изобретения один или несколько из этапов способа, как правило этапы 3 и 4, выполняются средствами компьютерного программного продукта при исполнении на компьютере, содержащем процессор и память.
В одном из вариантов осуществления этап 3 описанного выше способа проводят на компьютере, запрограммированном на получение или вычисление комбинированного значения для SNPpc на основе данных, полученных на этапе 2, и/или этап 4 проводят на компьютере, запрограммированном для определения корреляции комбинированного значения для SNPpc с вероятностью необходимости активного лечения для индивидуума посредством сравнения комбинированного значения для SNPpc с предопределенным пороговым значением, установленным с использованием контрольных образцов, где у индивидуумов, у которых получены контрольные образцы, известны необходимость активного лечения или отсутствие необходимости в активном лечении. Кроме того, настоящее изобретение относится к энергонезависимому материальному компьютерному носителю с исполняемыми командами для проведения таких вычислений или получения таких комбинированных значений и/или для проведения этапа определения корреляции, как описано выше.
Выбор порогового значения (или порогового уровня) зависит от множества факторов, включая в качестве неограничивающих примеров сам риск заболевания и риск, ассоциированный с неточным диагностированием индивидуума как положительного при отсутствии заболевания (ложноположительный). Выбор порогового значения более подробно описан ниже.
В одном из вариантов осуществления настоящего изобретения SNP, ассоциированные с PCa, (SNPpc), включают по меньшей мере два из rs11672691, rs11704416, rs3863641, rs12130132, rs4245739, rs3771570, rs7611694, rs1894292, rs6869841, rs2018334, rs16896742, rs2273669, rs1933488, rs11135910, rs3850699, rs11568818, rs1270884, rs8008270, rs4643253, rs684232, rs11650494, rs7241993, rs6062509, rs1041449, rs2405942, rs12621278, rs9364554, rs10486567, rs6465657, rs2928679, rs6983561, rs16901979, rs16902094, rs12418451, rs4430796, rs11649743, rs2735839, rs9623117 и rs138213197.
В одном из вариантов осуществления способ дополнительно включает анализ в указанном биологическом образце, категория биомаркеров PCa посредством определения присутствия или концентрации каждого из множества биомаркеров PCa из указанной категории биомаркеров PCa; комбинирование данных, относящихся к указанной категории биомаркеров PCa, с получением комбинированного значения для биомаркеров; комбинирование комбинированного значения для биомаркеров и комбинированного значения для SNPpc с получением общего комбинированного значения; и определение корреляции указанного общего комбинированного значения с вероятностью необходимости активного лечения для индивидуума посредством сравнения общего комбинированного значения с предопределенным значением, установленным с использованием контрольных образцов, где у индивидуумов, у которых получены контрольные образцы, известны необходимость активного лечения или отсутствие необходимости в активном лечении.
Предпочтительно, способ включает определение присутствия или концентрации по меньшей мере частично избыточных биомаркеров PCa, где по меньшей мере один, например, два биомаркера PCa выбраны из группы, состоящей из (i) PSA, (ii) общего PSA (tPSA), (iii) интактного PSA (iPSA), (iv) свободного PSA (fPSA) и (v) hK2.
Более конкретно, при получении указанного комбинированного значения для биомаркеров способ позволяет пренебречь подмножеством по меньшей мере из одного из указанных биомаркеров PCa (i)-(v) из категории биомаркеров PCa, таким как подмножество из одного, двух, трех или четырех из указанных биомаркеров PCa (i)-(v).
Кроме того, в одном из вариантов осуществления при получении комбинированного значения для SNPpc способ позволяет пренебречь по меньшей мере 10%, например 15%, например 20%, например 30% из SNPpc из категории SNPpc.
Предпочтительно, данные, относящиеся к категории биомаркеров PCa, комбинируют в соответствии с предопределенным уравнением с получением указанного комбинированного значения для биомаркеров, и/или данные, относящиеся к категории SNPpc, комбинируют в соответствии с предопределенным уравнением с получением указанного комбинированного значения для SNPpc. Также указанное комбинированное значение для биомаркеров и указанное комбинированное значение для SNPpc предпочтительно комбинируют в соответствии с предопределенным уравнением с получением указанного общего комбинированного значения.
В одном из вариантов осуществления указанный выше способ дополнительно включает этап рекомендации индивидууму активного лечения, если общее комбинированное значение превышает пороговое значение.
В одном из вариантов осуществления способ дополнительно включает анализ в указанном биологическом образце категории SNP, ассоциированных с концентрацией биомаркеров PCa, (SNPbm) посредством определения присутствия или отсутствия по меньшей мере одного SNPbm; комбинации данных, относящихся к указанным SNPbm с получением комбинированного значения для SNPbm, и включения комбинированного значения для SNPbm в общее комбинированное значение.
В одном из вариантов осуществления SNPbm включает по меньшей мере один из rs3213764, rs1354774, rs1227732, rs2736098, rs401681, rs10788160, rs11067228, rs1363120, rs888663 и rs1054564.
В одном из вариантов осуществления изобретения способ дополнительно включает анализ в указанном биологическом образце категории SNP, ассоциированных с индексом массы тела указанного индивидуума, (SNPbmi) посредством определения присутствия или отсутствия по меньшей мере одного SNPbmi; комбинации данных, относящихся к указанной категории SNPbmi с получением комбинированного значения для SNPbmi, и включения указанного комбинированного значения для SNPbmi в общее комбинированное значение.
В одном из вариантов осуществления SNPbmi включает по меньшей мере один из rs3817334, rs10767664, rs2241423, rs7359397, rs7190603, rs571312, rs29941, rs2287019, rs2815752, rs713586, rs2867125, rs9816226, rs10938397 и rs1558902.
В другом варианте осуществления изобретения способ дополнительно включает сбор семейного анамнеза, относящегося к PCa, истории лечения и данных физического обследования у указанного индивидуума; где указанный семейный анамнез, история лечения и/или данные физического обследования включают в общее комбинированное значение.
В еще одном варианте осуществления способ дополнительно включает анализ дополнительной категории биомаркеров PCa, с измерением присутствия или концентрации одного или каждого из множества биомаркеров PCa из указанной дополнительной категории биомаркеров; комбинацией данных, относящихся к указанной дополнительной категории биомаркеров PCa, с получением дополнительного комбинированного значения для биомаркеров для указанной дополнительной категории биомаркеров PCa, и включением указанного дополнительного комбинированного значения для биомаркеров в общее комбинированное значение; где комбинация данных для получения дополнительного комбинированного значения для биомаркеров составлена с избыточностью, так как дополнительная категория биомаркеров PCa содержит более одного биомаркера PCa.
В предпочтительном варианте осуществления дополнительная категория биомаркеров PCa содержит биомаркер MIC-1 и необязательно другие родственные MIC-1 биомаркеры или биомаркер MSMB и необязательно другие родственные MSMB биомаркеры.
В другом варианте осуществления способ включает анализ каждой из множества дополнительных категорий биомаркеров PCa и получения дополнительного комбинированного значения для биомаркеров для каждой из категорий биомаркеров PCa описанным выше способом. Предпочтительно анализируют по меньшей мере две дополнительных категории биомаркеров PCa, где одна дополнительная категория биомаркеров PCa содержит биомаркер MIC-1 и необязательно другие родственные MIC-1 биомаркеры, а другая дополнительная категория содержит биомаркер MSMB и необязательно другие родственные MSMB биомаркеры.
В одном из вариантов осуществления биологический образец представляет собой образец крови.
В одном из вариантов осуществления изобретения общее комбинированное значение рассчитывают способом, в котором используют неаддитивный эффект SNPbm и соответствующей концентрации биомаркеров PCa.
В одном из вариантов осуществления способа определение присутствия или отсутствия SNP проводят с использованием масс-спектрометрии MALDI.
В одном из вариантов осуществления способа определение присутствия или концентрации биомаркеров PCa проводят с использованием технологии микропанелей.
В предпочтительном варианте осуществления способа определение присутствия или отсутствия SNP (принадлежащего к любой категории SNP) включает определение количества аллелей указанного SNP. В одном из вариантов осуществления один или два аллеля соответствуют присутствию указанного SNP, а ноль аллелей соответствует отсутствию указанного SNP у указанного индивидуума; где ноль аллелей соответствует гомозиготе, отрицательной по указанному SNP, один аллель соответствует положительной гетерозиготе, а два аллеля соответствуют положительной гомозиготе.
В одном из вариантов осуществления описанный выше способ включает использование устройства для анализа ELISA, устройства для анализа микропанелей, устройства для анализа иммунопреципитации, устройства для анализа иммунофлуоресценции, устройства для радиоиммунологического анализа или устройства для масс-спектрометрии с использованием лазерной десорбции/ионизации с помощью матрицы (MALDI) для определения присутствия или концентрации биомаркера PCa.
В одном из вариантов осуществления, который можно комбинировать с указанным выше вариантом осуществления, описанный выше способ может включать использование устройства для масс-спектрометрии с использованием лазерной десорбции/ионизации с помощью матрицы (MALDI) для определения присутствия или отсутствия SNP.
Другой аспект настоящего изобретения относится к устройству для анализа для проведения этапа 2 (т.е. определения присутствия или отсутствия каждого из множества SNPpc) описанного выше способа для оценки необходимости активного лечения для индивидуума с диагнозом рак предстательной железы, содержащему твердую фазу с иммобилизованной на ней категорией лигандов, которые специфически связывается с SNPpc, и содержащую множество различных лигандов, специфически связывающихся с каждым из множества SNPpc, таких как по меньшей мере один из rs11672691, rs11704416, rs3863641, rs12130132, rs4245739, rs3771570, rs7611694, rs1894292, rs6869841, rs2018334, rs16896742, rs2273669, rs1933488, rs11135910, rs3850699, rs11568818, rs1270884, rs8008270, rs4643253, rs684232, rs11650494, rs7241993, rs6062509, rs1041449 или rs2405942, rs12621278, rs9364554, rs10486567, rs6465657, rs2928679, rs6983561, rs16901979, rs16902094, rs12418451, rs4430796, rs11649743, rs2735839, rs9623117 и rs138213197.
В одном из вариантов осуществления устройство для анализа дополнительно адаптировано для определения присутствия или концентрации по меньшей мере одного биомаркера PCa, где твердая фаза дополнительно содержит вторую категорию иммобилизованных лигандов, которая специфически связывается с биомаркером PCa и включает множество различных лигандов, специфически связывающихся с каждым из множества биомаркеров PCa, таких как по меньшей мере один из PSA, iPSA, tPSA, fPSA и hK2 и необязательно MSMB и/или MIC-1.
В одном из вариантов осуществления устройство для анализа дополнительно адаптировано для определения присутствия или отсутствия SNPbm, в случае чего твердая фаза дополнительно содержит третью категорию иммобилизованных лигандов, которая специфически связывается с SNPbm, такими как по меньшей мере один из rs1227732, rs3213764, rs1354774, rs2736098, rs401681, rs10788160, rs11067228, rs1363120, rs888663 и rs1054564.
В одном из вариантов осуществления устройство для анализа также адаптировано для определения присутствия или отсутствия SNPbmi, в случае чего твердая фаза дополнительно содержит четвертую категорию иммобилизованных лигандов, которая специфически связывается с SNPbmi, такими как по меньшей мере один из rs3817334, rs10767664, rs2241423, rs7359397, rs7190603, rs571312, rs29941, rs2287019, rs2815752, rs713586, rs2867125, rs9816226, rs10938397 и rs1558902.
В одном из вариантов осуществления описанное выше устройство для анализа включает устройство для анализа ELISA, устройство для анализа микропанелей, устройство для анализа иммунопреципитации, устройство для анализа иммунофлуоресценции, устройство для радиоиммунологического анализа или устройство для масс-спектрометрии с использованием лазерной десорбции/ионизации с помощью матрицы (MALDI) для определения присутствия или концентрации биомаркера PCa.
В одном из вариантов осуществления, который можно комбинировать с указанным выше вариантом осуществления, описанное выше устройство для анализа включает устройство для масс-спектрометрии с использованием лазерной десорбции/ионизации с помощью матрицы (MALDI) для определения присутствия или отсутствия SNP.
По дополнительному аспекту изобретения предоставлен набор для тестирования для проведения этапа 2 (т.е. определения присутствия каждого из множества SNPpc) описанного выше способа для оценки необходимости активного лечения для индивидуума с диагнозом рак предстательной железы, содержащий соответствующее устройство для анализа, как описано выше, и категорию детектирующих молекул, способных к детекции SNPpc, таких как по меньшей мере один из rs11672691, rs11704416, rs3863641, rs12130132, rs4245739, rs3771570, rs7611694, rs1894292, rs6869841, rs2018334, rs16896742, rs2273669, rs1933488, rs11135910, rs3850699, rs11568818, rs1270884, n>8008270, rs4643253, rs684232, rs11650494, rs7241993, rs6062509, rs1041449 или rs2405942, rs12621278, rs9364554, rs10486567, rs6465657, rs2928679, rs6983561, rs16901979, rs16902094, rs12418451, rs4430796, rs11649743, rs2735839, rs9623117 и rs138213197.
В одном из вариантов осуществления набор для тестирования содержит устройство для анализа, которое дополнительно адаптировано для определения присутствия или концентрации по меньшей мере одного биомаркера PCa, и вторую категорию детектирующих молекул, способную к детекции биомаркера PCa, такого как по меньшей мере один из PSA, iPSA, tPSA, fPSA и hK2 и необязательно MSMB и/или MIC-1.
В одном из вариантов осуществления набор для тестирования содержит устройство для анализа, которое дополнительно адаптировано для определения присутствия или отсутствия по меньшей мере одного SNPbm, и третью категорию детектирующих молекул, способную к детекции SNPbm, таких как по меньшей мере один из rs1227732, rs3213764, rs1354774, rs2736098, rs401681, rs10788160, rs11067228, rs1363120, rs888663 и rs1054564.
В одном из вариантов осуществления набор для тестирования содержит устройство для анализа, которое также адаптировано для определения присутствия или отсутствия SNPbmi, и четвертую категорию детектирующих молекул, способную к детекции SNPbmi, таких как по меньшей мере один из rs3817334, rs10767664, rs2241423, rs7359397, rs7190603, rs571312, rs29941, rs2287019, rs2815752, rs713586, rs2867125, rs9816226, rs10938397 и rs1558902.
В еще одном аспекте настоящего изобретения предоставлено устройство для анализа, содержащее твердую фазу с иммобилизованной на ней категорией лигандов, которая специфически связывается с SNPpc и включает множество различных лигандов, специфически связывающихся с каждым из множества различных SNPpc, выбранных по меньшей мере из одного из rs11672691, rs11704416, rs3863641, rs12130132, rs4245739, rs3771570, rs7611694, rs1894292, rs6869841, rs2018334, rs16896742, rs2273669, rs1933488, rs11135910, rs3850699, rs11568818, rs1270884, rs8008270, rs4643253, rs684232, rs11650494, rs7241993, rs6062509, rs1041449 или rs2405942, rs12621278, rs9364554, rs10486567, rs6465657, rs2928679, rs6983561, rs16901979, rs16902094, rs12418451, rs4430796, rs11649743, rs2735839, rs9623117 и rs138213197.
В одном из вариантов осуществления устройства для анализа твердая фаза дополнительно содержит вторую категорию иммобилизованных лигандов, которая специфически связывается с биомаркером PCa и включает множество различных лигандов, специфически связывающихся с каждым из множества различных биомаркеров PCa, выбранных по меньшей мере из одного из PSA, iPSA, tPSA, fPSA и hK2 и необязательно MSMB и/или MIC-1.
В дополнительном варианте осуществления устройства для анализа твердая фаза дополнительно содержит третью категорию иммобилизованных лигандов, которая специфически связывается с SNPbm, и включает один или множество различных лигандов, специфически связывающихся с одним или каждым из множества из SNPbm, выбранных по меньшей мере из одного из rs1227732, rs3213764, rs1354774, rs2736098, rs401681, rs10788160, rs11067228, rs1363120, rs888663 и rs1054564.
В дополнительном варианте осуществления устройства для анализа твердая фаза дополнительно содержит четвертую категорию иммобилизованных лигандов, которая специфически связывается с SNPbmi и включает один или множество различных лигандов, специфически связывающихся с одним или каждым из множества различных SNPbmi, выбранных по меньшей мере из одного из rs3817334, rs10767664, rs2241423, rs7359397, rs7190603, rs571312, rs29941, rs2287019, rs2815752, rs713586, rs2867125, rs9816226, rs10938397 и rs1558902.
В другом аспекте изобретения предоставлен компьютерный программный продукт, непосредственно загружаемый во внутреннюю память цифрового компьютера, характеризующийся тем, что указанный продукт содержит средства программного кода для выполнения по меньшей мере этапа 3 (т.е. комбинирования данных, относящихся к указанной категории SNPpc с получением комбинированного значения для SNPpc) и этапа 4 (т.е. определения корреляции указанного комбинированного значения для SNPpc с вероятностью необходимости активного лечения для индивидуума посредством сравнения комбинированного значения для SNPpc с предопределенным пороговым значением, установленным с использованием контрольных образцов, где у индивидуумов, у которых получены контрольные образцы, известны необходимость активного лечения или отсутствие необходимости в активном лечении) описанного выше способа для оценки необходимости активного лечения для индивидуума с диагнозом рак предстательной железы; такого как этап 1 (т.е. получения у указанного индивидуума по меньшей мере одного биологического образца), этап 2 (т.е. анализа в указанном биологическом образце категории SNPpc посредством определения присутствия или отсутствия каждого из множества SNPpc), этапа 3 и этапа 4 указанного способа.
В одном из вариантов осуществления компьютерный программный продукт дополнительно содержит средства программного кода для определения присутствия или концентрации по меньшей мере одного биомаркера PCa.
В одном из вариантов осуществления компьютерный программный продукт дополнительно содержит средства программного кода для анализа категории SNPbm посредством определения присутствия или отсутствия по меньшей мере одного SNPbm.
В одном из вариантов осуществления компьютерный программный продукт дополнительно содержит средства программного кода для анализа категории SNPbmi посредством определения присутствия или отсутствия по меньшей мере одного SNPbmi.
Дополнительный аспект изобретения относится к устройству, содержащему устройство для анализа, как описано выше, и соответствующий компьютерный программный продукт, как описано выше.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
На фигуре 1 представлены кривые ROC для линейной модели из примера 1, иллюстрирующего различие в эффективности между PSA (101) и моделью генетического показателя (102) в прогнозе необходимости активного лечения.
На фигуре 2 представлены кривые ROC для линейной модели из примера 1, иллюстрирующего различие в эффективности между PSA (301) и многопараметрической моделью (302) в прогнозе необходимости активного лечения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Для целей настоящей заявки и для ясности ниже приведены следующие определения:
В основном термин "PSA" относится к сывороточному специфическому антигену предстательной железы. PSA существует в различных формах, где термин "свободный PSA" относится к PSA, который является несвязанным или не связанным с другой молекулой, термин "связанный PSA" относится к PSA, который является связанным или образующим комплекс с другой молекулой, и, наконец, термин "общий PSA" относится к сумме свободного PSA и связанного (образующего комплекс) PSA. Термин "с/о PSA" представляет собой отношение несвязанного PSA к общему PSA. Также существуют молекулярные производные PSA, где термин "про-PSA" относится к неактивной форме-предшественнику PSA, а "интактный PSA" относится к дополнительной форме про-PSA, которая является интактной и неактивной.
Термин "диагностический анализ" относится к детекции присутствия или характера патологического состояния. Он может использоваться взаимозаменяемо со "способом диагностики". Диагностические анализы отличаются по их чувствительности и специфичности.
Термин "прогностический анализ" относится к прогнозу развития существующего состояния. Его можно взаимозаменяемо использовать со "способом прогноза". Прогностические анализы при предоставлении прогноза о наступлении конкретного события сходны с диагностическими анализами и в таких случаях могут отличаться по их чувствительности и специфичности. Одним из таких примеров является прогностический анализ по прогнозу необходимости активного лечения.
Термин "активное лечение" означает лечение пациента с PCa посредством хирургии, наружной радиации, направленной лучевой терапии, химиотерапии, гипотермической терапии, гипертермической терапии или посредством любого другого медицинского способа, используемого с целью лечения PCa.
Одной из мер применимости диагностического средства является "площадь под кривой операционных характеристик приемника", которая общеизвестна как статистика ROC-AUC. Эта широко признанная мера учитывает и чувствительность, и специфичность средства. Как правило, мера ROC-AUC находится в диапазоне от 0,5 до 1,0, где значение 0,5 означает, что средство не имеет диагностической ценности, а значение 1,0 означает, что средство обладает 100% чувствительностью и 100% специфичностью.
Термин "чувствительность" относится к доле всех индивидуумов с необходимостью активного лечения, которые верно идентифицированы как индивидуумы с необходимостью активного лечения (что эквивалентно количеству истинноположительных случаев, деленных на сумму количества истинноположительных случаев и ложноотрицательных случаев).
Термин "специфичность" относится к доле всех индивидуумов с отсутствием необходимости в активном лечении (т.е. подходящих для внимательного наблюдения), которые верно идентифицированных, как индивидуумы с отсутствием необходимости в активном лечении (что эквивалентно количеству истинноотрицательных случаев, деленных на сумму количества истинноотрицательных случаев и ложноположительных случаев).
Термин "биомаркер" относится к белку, части белка, пептиду или полипептиду, которые можно использовать в качестве биологического маркера, например, в диагностических целях.
Термин "калликреин-подобный биомаркер" относится к белковым биомаркерам, принадлежащим или родственным калликреиновому семейству белков, включающему в качестве неограничивающих примеров специфический антиген предстательной железы (PSA) в свободной форме или в форме комплекса, про-PSA (ряд изоформ PSA) и в частности в укороченной форме (-2) про-PSA, в форме интактного PSA, простатическую кислую фосфатазу (PAP) человека и калликреин 2 человека (сокращаемый в настоящей заявке как hK2, или HK2, или hk2).
Термин "однонуклеотидный полиморфизм" (SNP) относится к генетическим свойствам определенного локуса генетического кода индивидуума. SNP может быть ассоциирован с повышенным риском PCa, и, таким образом, его можно использовать для диагностического или прогностического анализов индивидуума. База данных однонуклеотидных полиморфизмов (dbSNP) представляет собой архив генетической изменчивости в пределах и в совокупности различных видов, разработанный и размещенный национальным центром биотехнологической информации (NCBI) совместно с национальным исследовательским институтом генома человека (NHGRI), где оба расположены в США. Хотя название базы данных подразумевает коллекцию только одного класса полиморфизмов (т.е., однонуклеотидных полиморфизмов (SNP)), фактически она содержит целый ряд молекулярных вариантов. Каждая уникальная поступающая запись об SNP получает ссылочный номер ID SNP ("rs#"; "кластер refSNP"). В настоящей заявке SNP в основном идентифицированы с использованием номеров rs#. Таким образом, в настоящей заявке SNP используют для обозначения ряда молекулярных вариантов, включенных в dbSNP, а не только однонуклеотидных полиморфизмов. Для целей настоящей заявки термины "SNP" и "несколько SNP" можно использовать взаимозаменяемо, и их можно использовать для описания одного и/или нескольких "однонуклеотидных полиморфизмов".
Термин "индекс массы тела" (BMI) относится к приближенному расчету жировой ткани организм человека на основе массы и роста индивидуума в соответствии с формулой BMI = масса/(рост * рост), где масса представляет собой массу индивидуума, выражаемую в килограммах, а рост представляет собой рост индивидуума, выражаемый в метрах. Как правило, полагают, что нормальное значение BMI у здорового индивидуума находится в диапазоне от 18,5 до 25, а индивидуумов с BMI>30, как правило, рассматривают как страдающих ожирением.
Термин "история болезни (анамнез)" относится к информации, относящейся к прошедшим исследованиям, диагнозам и/или лечению любого злокачественного заболевания. Одним из неограничивающих примеров истории болезни (анамнеза) является проводимое ранее у индивидуума исследование на присутствие PCa посредством биопсии предстательной железы.
Термин "категория параметров" относится к группе или семейству ассоциированных параметров, таких как ассоциированные биомаркеры или ассоциированные SNP, которые частично или полностью вырождены в отношении эффективности прогноза. Одним из примеров категории параметров является "калликреин-подобные биомаркеры", категория, которая включает, например, PSA, общий PSA (tPSA), интактный PSA (iPSA), свободный PSA (fPSA) и hk2. Другим примером категории параметров является "SNP, ассоциированные с BMI", категория, которая включает SNP, которые ассоциированы с BMI индивидуума. В прогностических моделях по настоящему изобретению могут оказаться достаточными результаты измерения (данные) для подмножества членов каждой категории, чтобы каждая категория была представлена в прогностической модели, несмотря на использование только подмножества членов соответствующих категорий. В настоящей заявке термин "категория параметров" иногда обозначают только как "категория".
Термин "комбинированное значение" относится к комбинации данных, ассоциированных с категорией параметров репрезентативным значением для указанной категории параметров. Как правило, комбинацию данных можно обрабатывать в соответствии с одним или несколькими предопределенными уравнениями. Комбинированное значение представляет собой результат вычисления комбинации данных в соответствии с одним или несколькими из предопределенных уравнений. Для различных результатов измерения (т.е. данных) применимы различные уравнения в зависимости от того какие подмножества членов категорий параметров этих данных доступны. Одним из неограничивающих примеров способа формирования комбинированного значения для конкретной категории параметров является использование среднего имеющихся результатов для членов указанной категории. В настоящей заявке термин "комбинированное значение" иногда обозначают как "показатель". Одним из неограничивающих примеров комбинированного значения является "комбинированное значение для биомаркеров". Другим неограничивающим примером комбинированного значения является "генетическое комбинированное значение" (или "генетический показатель"), а более конкретно "комбинированное значение для SNP".
Термин "составленная с избыточностью комбинация данных" относится к комбинации данных, полученной посредством множества измерений с получением комбинированного значения для одной или нескольких категорий параметров или их подмножеств, где комбинирование данных проводят так, что комбинированное значение, представляющую одну из категорий параметров, можно получать на основе подмножества данных, например, где некоторые данные потеряны или ошибочны, или на всем множестве данных.
Как используют в настоящей заявке, термин "множество" означает "два или более".
Настоящее изобретение относится к способам прогноза, способствующим указанию, оценке, детекции и/или определению необходимости рекомендации индивидууму активного лечения PCa. При желании, настоящее изобретение можно применять в определенных подгруппах для увеличения эффективности и применимости изобретения в указанных подгруппах. Хотя настоящее изобретение можно использовать для индивидуумов-мужчин общей популяции, возможно конструировать способы указания, оценки, детекции и/или определения необходимости рекомендации индивидууму активного лечения PCa с увеличенной эффективностью для определенных подгрупп, включая в качестве неограничивающих примеров индивидуумов со значением PSA ниже приблизительно 7 нг/мл (т.е. ниже предопределенного значения от 1 нг/мл до 30 нг/мл) или концентрацией свободного PSA ниже приблизительно 0,91 нг/мл (т.е. ниже предопределенного значения от 0,1 нг/мл до 3 нг/мл).
Основным принципом изобретения является использование комбинации биомаркеров и генетической информации таким образом, что комбинаторное использование оцениваемой информации об индивидууме улучшает качество прогноза.
- Сбор у указанного пациента семейного анамнеза в отношении PCa (категория HIST).
- Сбор данных физического обследования пациента, таких как масса, BMI, возраст и подобное (категория PPD)
- Получение у указанного пациента ряда биологических образцов.
- Определение или количественное определение в указанных биологических образцах присутствия или концентрации множества определенных биомаркеров (категория биомаркеров) с последующей комбинацией данных, относящихся к указанным биомаркерам, с получением комбинированного значения для биомаркеров.
- Определение или количественное определение в указанных биологических образцах генетического статуса указанных пациентов относительно множества определенных SNP, ассоциированных с PCa, (категория SNPpc) посредством определения или количественного определения присутствия или отсутствие множества определенных SNP, ассоциированных с PCa, (SNPpc), и с последующей комбинацией полученных данных, относящихся к SNP, ассоциированным с PCa, с получением комбинированного значения для SNPpc.
- Определение или количественное определение в указанных биологических образцах генетического статуса указанных пациентов относительно множества определенных SNP, ассоциированных с уровнем экспрессии биомаркеров или концентрацией биомаркеров, (категория SNPbm) посредством определения или количественного определения присутствия или отсутствия множества определенных SNP, ассоциированных с уровнем экспрессии биомаркеров или концентрацией биомаркеров, (SNPbm) с получением комбинированного значения для SNPbm.
- Комбинированное значение по меньшей мере для одной из категорий, как определено выше, используют для оценки прогноза рака предстательной железы. Как правило, комбинируют комбинированные значения по меньшей мере для двух из категорий, как определено выше, с получением общего комбинированного значения для использовании для оценки прогноза рака предстательной железы.
- Определение посредством использования указанного комбинированного значения для категории или общего комбинированного значения, отдельно или в комбинации с дополнительными данными, вероятности необходимости активного лечения PCa у пациента.
Более подробно, этап, включающий сбор семейного анамнеза, в качестве неограничивающих примеров включает определение того, страдает ли или страдал PCa любой близкородственный мужской член семьи (такой как отец, брат или сын пациента).
Как правило, собирают данные физического обследования пациента, которые получают посредством регулярного медицинского осмотра, где определяют возраст, массу, рост, BMI и подобные данные физического обследования.
Сбор биологических образцов у пациента в качестве неограничивающих примеров включает плазму, сыворотку, ДНК лейкоцитов периферической крови и мочу.
Количественное определение присутствия или концентрации биомаркеров в биологическом образце можно проводить множеством различных способов. Одним из общеупотребимых способов является использование твердофазного иммуноферментного анализа (ELISA), в котором используют антитела и калибровочную кривую для оценки присутствия и (когда возможно) концентрации выбранного биомаркера. Как видно из публикации "Association between saliva PSA and serum PSA in conditions with prostate adenocarcinoma" Shiiki N с соавторами, опубликованной в Biomarkers, 2011 Sep; 16(6):498-503, включенной в настоящий документ в качестве ссылки, анализы ELISA общеупотребимы и известны в данной области. Другим общеупотребимым способом является использование анализа микропанелей для количественного определения присутствия или концентрации биомаркеров в биологическом образце. Типичный анализ микропанелей включает плоское предметное стекло, на котором в неперекрывающихся областях на одной из сторон стекла фиксируют множество различных захватывающих реагентов (как правило, антител), каждый из которых выбран для специфического захвата одного типа биомаркеров. Биологическому образцу в течение определенного периода времени позволяют контактировать с областью, где расположены указанные захватывающие реагенты, с последующей отмывкой области захватывающих реагентов. На этой стадии, в случае, если требуемый биомаркер находился в биологическом образце, соответствующий захватывающий реагент захватывает фракцию требуемого биомаркера и удерживает ее на предметном стекле даже после отмывки. Затем в область с захватывающими реагентами (которая в этот момент потенциально содержит ассоциированные биомаркеры) добавляют набор реагентов для детекции, где указанные реагенты для детекции способны (i) связываться с биомаркером, находящимся на предметном стекле и (ii) продуцировать детектируемый сигнал (как правило, посредством конъюгации с флуоресцентным красителем). Как правило, необходимо, чтобы на предметное стекло добавляли один реагент для детекции на биомаркер. Существует множество других способов, которыми можно определить присутствие или концентрацию биомаркера, включая в качестве неограничивающих примеров, анализы иммунопреципитации, анализы иммунофлуоресценции, радиоиммунологические анализы и масс-спектрометрию с использованием лазерной десорбции/ионизации с помощью матрицы (MALDI), чтобы указать несколько примеров.
Как правило, количественное определение присутствия SNP посредством анализа биологического образца включает анализ посредством масс-спектрометрии MALDI на основе аллель-специфической достройки праймеров, даже если равным образом применимы другие способы. Это применимо к SNP любого типа, т.е. и к SNP, ассоциированным с PCa, (SNPpc), и к SNP, ассоциированным с BMI, (SNPbmi), и к SNP, ассоциированным с экспрессией/концентрацией биомаркеров, (SNPbm).
Комбинация данных может представлять собой алгоритмическую комбинацию результатов любого типа, такую как линейная комбинация данных, где линейная комбинация улучшает эффективность диагностики (например, как определяют с использованием ROC-AUC). Другие возможные способы комбинации в модель, способную обеспечивать диагностическую оценку, включают (но не ограничены ими) нелинейные полиномы, способы опорных векторов, классификаторы на основе нейронных сетей, дискриминационный анализ, способ "случайный лес", усиление градиента, частные наименьшие квадраты, гребневую регрессию, способ лассо, эластические сети, способ k ближайших соседей. Кроме того, в книге "The Elements of Statistical Learning: Data Mining, Inference, and Prediction, Second Edition" T Hastie, R Tibshirani и J Friedman, опубликованной Springer Series in Statistics, ISBN 978-0387848570 (включенной в настоящий документ в качестве ссылки) описано множество подходящих способов комбинации данных для прогноза или классификации конкретного исхода.
Подходящие биомаркеры для прогноза aPCa в качестве неограничивающих примеров включают специфический антиген предстательной железы (PSA) в любой из свободной формы или формы в комплексе, про-PSA (ряд изоформ PSA) и в частности укороченной формы (-2) про-PSA, формы интактного PSA, простатическую кислую фосфатазу (PAP) человека, калликреин 2 человека (hK2), антиген раннего рака предстательной железы (EPCA), секреторный белок предстательной железы (PSP94; также известный как бета-микросеминопротеин и MSMB), глутатион-S-трансферазу π (GSTP1) и α-метилацилкофермент-A-рацемазу (AMACR). Ассоциированные биомаркеры, которые могут быть пригодны для улучшения диагностической точности способа, включают ингибирующий макрофаги цитокин 1 (MIC-1; также известный как GDF-15).
Подходящие SNP, ассоциированные с PCa, в качестве неограничивающих примеров включают rs12621278 (хромосома 2, локус 2q31.1), rs9364554 (хромосома 6, локус 6q25.3), rs10486567 (хромосома 7, локус 7p15.2), rs6465657 (хромосома 7, локус 7q21.3), rs2928679 (хромосома 8, локус 8p21), rs6983561 (хромосома 8, локус 8q24.21), rs16901979 (хромосома 8, локус 8q24.21), rs16902094 (хромосома 8, локус 8q24.21), rs12418451 (хромосома 11, локус 11q13.2), rs4430796 (хромосома 17, локус 17q12), rs11649743 (хромосома 17, локус 17q12), rs2735839 (хромосома 19, локус 19q13.33), rs9623117 (хромосома 22, локус 22q13.1) и rs138213197 (хромосома 17, локус 17q21)
Дополнительно подходящие SNP, ассоциированные с PCa, в качестве неограничивающих примеров включают rs11672691, rs11704416, rs3863641, rs12130132, rs4245739, rs3771570, rs7611694, rs1894292, rs6869841, rs2018334, rs16896742, rs2273669, rs1933488, rs11135910, rs3850699, rs11568818, rs1270884, rs8008270, rs4643253, rs684232, rs11650494, rs7241993, rs6062509, rs1041449 и rs2405942.
Дополнительно подходящие SNP, ассоциированные с PCa, в качестве неограничивающих примеров включают rs138213197, как описано в публикации "Germline mutations in HOXB13 and prostate-cancer risk" Ewing CM с соавторами, опубликованной в N. Engl. J. Med. 2012 Jan 12;366(2):141-9 (включенной в настоящий документ в качестве ссылки), 1100delC (22q12ю.1) и I157T (22q12.1), как описано в публикации "A novel founder CHEK2 mutation is associated with increased prostate cancer risk" Cybulski C с соавторами, опубликованной в Cancer Res. 2004 Apr 15;64(8):2677-9 (включенной в настоящий документ в качестве ссылки), и 657del5 (8q21), как описано в публикации "NBS1 is a prostate cancer susceptibility gene" Cybulski C с соавторами, опубликованной в Cancer Res. 2004 Feb 15;64(4):1215-9 (включенной в настоящий документ в качестве ссылки).
Можно определить категорию параметров "SNP, ассоциированные с PCa", которая включает SNP, ассоциированные с PCa. Подходящие представители включают (но не ограничены ими) SNP, перечисленные выше.
Подмножества представителей этой категории должно быть достаточно для фактического представления категории в прогностической модели.
Подходящие SNP, ассоциированные с отличными от PCa процессами, в качестве неограничивающих примеров дополнительно включают rs3213764, rs1354774, rs2736098, rs401681, rs10788160, rs11067228, которые все ассоциированы с уровнем экспрессии PSA. Можно определить категорию параметров "SNP, ассоциированные с концентрацией PSA" или "SNP, ассоциированные с уровнем экспрессии PSA", которая включает SNP, ассоциированные с концентрацией или уровнем экспрессии PSA. Подмножества представителей этой категории должно быть достаточно для фактического представления категории в прогностической модели. SNP rs3213764 и rs1354774 конкретно ассоциированы с уровнем экспрессии свободного PSA.
Подходящие SNP, ассоциированные с отличными от PCa процессами, в качестве неограничивающих примеров включают rs1363120, rs888663, rs1227732, rs1054564, которые все ассоциированы с уровнем экспрессии цитокина-биомаркера воспаления MIC1. Можно определить категорию параметров "SNP, ассоциированные с концентрацией MIC1" или "SNP, ассоциированные с уровнем экспрессии MIC1", которая включает SNP, ассоциированные с концентрацией или уровнем экспрессии MIC1. Подмножества представителей этой категории должно быть достаточно для фактического представления категории в прогностической модели.
Можно определить категорию параметров "SNP, ассоциированные с концентрацией биомаркеров PCa" или "SNP, ассоциированные с уровнем экспрессии биомаркеров PCa", которая включает SNP, ассоциированные с концентрацией или уровнем экспрессии соответствующих биомаркеров, таких как специфический антиген предстательной железы (PSA) в любой из свободной формы или формы в комплексе, про-PSA (ряд изоформ PSA) и в частности укороченной формы (-2) про-PSA, формы интактного PSA, простатическая кислая фосфатаза (PAP) человека, калликреин 2 человека (hK2), антиген раннего рака предстательной железы (EPCA), секреторный белок предстательной железы (PSP94; также известный как бета-микросеминопротеин и MSMB), глутатион-S-трансфераза n (GSTP1), α-метилацилкофермент-A-рацемаза (AMACR) и ингибирующий макрофаги цитокин 1 (MIC-1; также известный как GDF-15). Подмножества представителей этой категории должно быть достаточно для фактического представления категории в прогностической модели.
Дополнительно подходящие SNP, ассоциированные с отличными от PCa процессами, в качестве неограничивающих примеров включают rs3817334, rs10767664, rs2241423, rs7359397, rs7190603, rs571312, rs29941, rs2287019, rs2815752, rs713586, rs2867125, rs9816226, rs10938397 и rs1558902, которые все ассоциированы с BMI индивидуума. Другие подходящие SNP, ассоциированные с BMI, описаны в публикации "Contribution of 32 GWAS-identified common variants to severe obesity in European adults referred for bariatric surgery" Magi с соавторами, опубликованной в PLoS One. 2013 Aug 7;8(8):e70735 (включенной в настоящий документ в качестве ссылки). Можно определить категорию параметров "SNP, ассоциированные с уровнем экспрессии BMI", которая включает SNP, ассоциированные с BMI индивидуума. Подмножества представителей этой категории должно быть достаточно для фактического представления категории в прогностической модели.
Предпочтительная группа SNP для использования в оценке присутствия или отсутствия агрессивного рака предстательной железы у индивидуума представляет собой rs582598, rs439378, rs2207790, rs1046011, rs10458360, rs7525167, rs10489871, rs7529518, rs4245739, rs4512641, rs10178804, rs11900952, rs1873555, rs10191478, rs6755901, rs6545962, rs721048, rs2710647, rs12612891, rs2028900, rs1009, rs12233245, rs6760417, rs10496470, rs10199796, rs12475433, rs16860513, rs12151618, rs3765065, rs13017302, rs12988652, rs871688, rs749264, rs3771570, rs4346531, rs6770955, rs12637074, rs2660753, rs13319878, rs6437715, rs2162185, rs1515542, rs2270785, rs9830294, rs1439024, rs6762443, rs888507, rs6794467, rs12490248, rs1477886, rs4833103, rs3796547, rs17779822, rs2366711, rs16849146, rs1894292, rs12640320, rs3805284, rs12500426, rs4699312, rs17021918, rs7679673, rs2047408, rs2647262, rs12506850, rs7658048, rs2078277, rs12505546, rs13113975, rs4246742, rs2736098, rs401681, rs11134144, rs10060513, rs40485, rs2087724, rs1482679, rs16901841, rs1295683, rs2070874, rs7752029, rs2018334, rs9358913, rs1140809, rs409558, rs3096702, rs9267911, rs2025645, rs9359428, rs6569371, rs2813532, rs1933488, rs712242, rs6934898, rs9456490, rs651164, rs3120137, rs9364554, rs9457937, rs10486562, rs10807843, rs7801918, rs6962297, rs2465796, rs6957416, rs7777631, rs2272316, rs6961773, rs2132276, rs13265330, rs16887736, rs2911756, rs2272668, rs2339654, rs1380862, rs9297746, rs12543663, rs10086908, rs16901922, rs1016343, rs17832285, rs16901979, rs4871779, rs10107982, rs16902094, rs620861, rs17467139, rs6983267, rs9297756, rs10094059, rs7818556, rs1992833, rs986472, rs12552397, rs4273907, rs4237185, rs753032, rs11253002, rs2386841, rs10795841, rs10508422, rs7075945, rs10508678, rs539357, rs10826398, rs3818714, rs7090755, rs10993994, rs4382847, rs1891158, rs10887926, rs10788160, rs6579002, rs10832514, rs7358335, rs1944047, rs3019779, rs10896437, rs12793759, rs7106762, rs7102758, rs2449600, rs585197, rs2509867, rs11568818, rs7125415, rs11601037, rs11222496, rs4570588, rs6489721, rs3213764, rs17395631, rs4423250, rs11168936, rs10875943, rs3759129, rs902774, rs1827611, rs4760442, rs11610799, rs6539333, rs11067228, rs7485441, rs6489794, rs4119478, rs17070292, rs2293710, rs17256058, rs1950198, rs2331780, rs7141529, rs12880777, rs17123359, rs785437, rs524908, rs12903579, rs7178085, rs7164364, rs896615, rs11634741, rs9972541, rs12594014, rs11631109, rs1558902, rs8044335, rs2738571, rs885479, rs385894, rs684232, rs4925094, rs17138478, rs11649743, rs2107131, rs7213769, rs12946864, rs306801, rs138213197, rs1863610, rs17224342, rs9911515, rs12947919, rs966304, rs17744022, rs7234917, rs1943821, rs2227270, rs1363120, rs888663, rs1227732, rs1054564, rs4806120, rs11672691, rs758643, rs3745233, rs6509345, rs2659051, rs2735839, rs1354774, rs2691274, rs6090461, rs2297434, rs6062509, rs2315654, rs2823118, rs2838053, rs398146, rs16988279, rs2269640, rs4822763, rs132774, rs747745, rs5978944, rs6530238, rs5934705, rs5935063, rs4830488, rs17318620, rs5945619, rs5945637, rs11091768, rs2473057, rs5918762, rs4844228, rs6625760 и rs17324573. Несмотря на то, что использование всего списка является предпочтительным, для использования в оценке присутствия или отсутствие агрессивного рака предстательной железы у индивидуума пригодно любое подмножество этого списка. SNP из этого списка (все или подмножество, содержащее приблизительно 95%, или 90%, или 85%, или 80%, или 75%, или 70% SNP из этого списка) можно помещать на одну и ту же твердую подложку, например на одно и то же предметное стекло, для одновременной детекции в подходящем аналитическом устройстве.
Одним из неизбежных следствий сложностей в получении точных и сравнимых оценок эффективности прогноза любой данной диагностической или прогностической модели при скрининге PCa состоит в том, что при расчете относительного улучшения нового способа по сравнению с использованием только PSA, расчетное относительное улучшение будет зависеть от множества факторов. Одним важным фактором, влияющим на расчетное относительное улучшение, является способ получения контрольной группы (т.е. известных отрицательных случаев). Например, так как проводить биопсию у индивидуумов без показаний PCa является неэтичным, контрольную группы выбирают с систематической ошибкой. Таким образом, относительное улучшение нового способа зависит от того, как произведен выбор контрольной группы. Таким образом, любое заявляемое расчетное улучшение следует рассматривать в свете такой вариации. В лучшем случае для диагностических анализов авторы оценивают, что если относительное улучшение нового способа заявлено как 15% по сравнению со значением только для PSA с использованием одного из хорошо известных способов отбора контрольной группы, указанный способ будет по меньшей мере на 10% лучше, чем значение только для PSA с использованием любого другого хорошо известного способа отбора контрольной группы. Для прогностических анализов сравнение с золотым стандартом является одинаково сложным и любое утверждение об эффективности прогностического анализа (в данном документе и в других) необходимо рассматривать в свете дисперсии, порождаемой выбором контрольной группы.
Одним возможным способом получения способа скрининга aPCa, удовлетворяющего требованиям для широкого применения, является комбинация информации из нескольких источников. На уровне общего представления это включает комбинирование значений, получаемых из анализа биомаркеров (например, значений PSA), генетических профилей (например, профиля SNP), семейного анамнеза и других источников. Комбинация сама по себе имеет вероятность обеспечить лучшую диагностическую оценку, чем любой из включаемых факторов отдельно. Описаны попытки комбинации значений в многопараметрическую модель для обеспечения лучшей диагностической оценки, как описано в других разделах настоящей заявки. Этот же подход можно применять для способов прогноза.
Алгоритм, который преобразует данные из различных категорий в одно значение, указывающее на вероятность наличия у пациента PCa, предпочтительно представляет собой нелинейную функцию, где зависимость от различных категорий используют для дальнейшего увеличения эффективности диагностики способа. Например, одной из важных зависимостей является измеряемый уровень выбранного биомаркера, комбинируемый с любым ассоциированным генетическим маркером, ассоциированным с ожидаемым уровнем экспрессии указанного биомаркера. В случаях, когда в образце, полученном у пациента, выявлена повышенная концентрация биомаркера и одновременно указанный пациент генетически предрасположен к наличию низких уровней указанных биомаркеров, важность повышенного уровня биомаркера возрастает. Подобным образом, если уровень биомаркера однозначно ниже, чем нормальный у пациента генетически предрасположенного к наличию высоких уровней указанных биомаркеров, противоречивые данные увеличивают важность интерпретации уровня биомаркера.
Алгоритм, используемый для прогноза предпочтительного лечения, может выигрывать от использования трансформированных переменных, например, при использовании значения log10(PSA). Трансформация особенно выгодна для переменных с распределением, которое явно отклоняется от нормального распределения. Возможные трансформации переменных в качестве неограничивающих примеров включают логарифм, обращение, квадрат и квадратный корень. Дополнительно является общепринятым центрировать каждую переменную относительно нулевого среднего и единичной дисперсии.
Хотя комбинирование данных можно проводить различными способами, типичный способ по настоящему изобретению можно проиллюстрировать приведенным ниже неограничивающим способом.
В типичном случае данные, относящиеся к биомаркерам, принадлежащим к категории параметров, комбинируют в соответствии с предопределенным уравнением с получением комбинированного значения, которое ассоциировано с риском, ассоциированным с самой категорией параметров. Одним неограничивающим примером является расчет среднего значения всех доступных определяемых значений (данных) для представителей категории биомаркеров и использование указанного среднего значения в качестве комбинированного значения, представляющего указанную категорию биомаркеров. Очевидно, что этот способ можно применять вне зависимости от того, как много биомаркеров является членами категории. Если доступны данные только для одного из биомаркеров, включенных в категорию, их можно использовать для представления категории биомаркеров самостоятельно. Для биомаркеров определяемым значением, как правило используемым на этапе комбинирования данных, является концентрация указанного биомаркера, выявляемая в биологическом образце. Например, для биомаркеров PSA и HK2 чаще всего она представляет собой концентрацию биомаркера в образце крови, выраженная в единицах нг/мл.
Как правило, расчет генетического показателя (т.е. генетического комбинированного значения или, более конкретно, комбинированного значения для SNP) основан на предопределенном отношении шансов для каждого отдельного SNP, включенного в категорию параметров. Для каждого SNP предварительно определяют отношение шансов, т.е. вероятность того, что индивидуум, несущий SNP (т.е. несет аллель риска, определяемый SNP), имеет исследуемое заболевание или состояние. Как правило, определение отношения шансов для SNP проводят в больших проспективных исследованиях, включающих тысячи индивидуумов с известными патологическими состояниями или заболеваниями.
Генетический показатель для индивидуума в качестве неограничивающего примера можно рассчитывать по следующему алгоритму: для тестируемого индивидуума каждый SNP обрабатывают указанным далее способом. Для каждого SNP индивидуум может нести два аллеля риска SNP (положительная гомозигота по указанному SNP) или один аллель риска (положительная гетерозигота по указанному SNP) или ни одного аллеля риска (отрицательная гомозигота по указанному SNP). Количество аллелей SNP умножают на натуральный логарифм отношения шансов для указанного SNP с получением значения оценки риска для конкретного SNP. Это означает, что у индивидуума, негативного по конкретному SNP (т.е. не несет аллелей риска SNP), вклада указанного конкретного SNP в риск нет. Эту процедуру повторяют для всех SNP, для которых доступны экспериментальные данные. Когда подсчитаны все значения оценок риска, рассчитывают средний вклад в риск для SNP, для которых доступны экспериментальные данные, и используют в качестве генетического показателя для указанного индивидуума, т.е. в качестве генетического комбинированного значения в отношении определенной категории SNP. Очевидно, что этот способ можно применять вне зависимости от того, как много SNP являются членами категории SNP.
Для дальнейшей иллюстрации типичного способа по настоящему изобретению, когда его применяют для индивидуума, приняты следующие соглашения. Определены две категории параметров, во-первых категория белковых биомаркеров (или категория биомаркеров) с представителями Prot1 и Prot2, а во-вторых генетическая категория (или более конкретно, категория SNP) с представителями Snp1, Snp2 и Snp3. В эксперимент включены 100 индивидуумов с известным состоянием C и 100 индивидуумов, для которых известно, что у них нет состояния C, взаимосвязь Prot1, Prot2, Snp1, Snp2 и Snp3 с состояниям C установлена и выражена в виде одного комбинированного значения для белковых биомаркеров для Prot1 и Prot2 и одного генетического комбинированного значения для Snp1, Snp2 и Snp3, а также одного общего комбинированного значения, которое в свою очередь ассоциировано с риском наличия состояния C. Комбинированное значение для категории белковых биомаркеров рассчитывают с использованием следующих предопределенных уравнений:
P=(Prot1+2*Prot2)/3 [если доступны данные, относящиеся к Prot1 и к Prot2 (т.е. к значению Prot1 и к значению Prot2)]
P'=Prot1 [в случае, если доступны только данные, относящиеся к Prot1 (т.е. к значению Prot1)]
P"=Prot2 [в случае, если доступны только данные, относящиеся к Prot2 (т.е. к значению Prot2)]
Таким образом, в этом гипотетическом случае в эксперименте выявлено, что (a) Prot1 и Prot2 имеют одинаковый масштаб и (b) значение Prot2 в два раза важнее для оценки, если у индивидуума присутствует состояние C, чем Prot1. Если доступны данные только для одного из белковых биомаркеров, для представления категории белковых биомаркеров их можно использовать самостоятельно.
Отношения шансов для представителей генетической категории определены предварительно и являлись следующими: Snp1=1,1; Snp2=1,2; и Snp3=1,3. Комбинированное значение для генетической категории рассчитывают как генетический показатель, описанный выше.
Затем комбинированное значение для белковых биомаркеров и генетический показатель (который в этом случае эквивалентен комбинированному значению для генетической категории или комбинированному значению для SNP) комбинируют в общее комбинированное значение в соответствии со следующим предопределенным уравнением:
Y=P+10*показатель,
где Y ассоциирован с риском наличия состояния C, P представляет собой комбинированное значение для белковых биомаркеров (и P можно заменять на P' или P", как определено выше), а показатель представляет собой генетический показатель. Все уравнения необходимо выводить на основе большой группы индивидуумов, в данном гипотетическом случае 100 + 100 индивидуумов, в которой получена взаимосвязь между Y и исследуемым заболеванием или патологическим состоянием. В данном гипотетическом случае полагают, что если
Y>5 риск наличия состояния у индивидуума C повышен, а если Y>10 риск является очень высоким.
Теперь предположим, что первого индивидуума A тестируют на Prot1, Prot2, Snp1, Snp2 и Snp3. В данном конкретном случае все определения были успешны и привели к следующим результатам:
Prot1=3 нг/мл
Prot2=6 нг/мл
Snp1 = отрицательная гомозигота т.е. отсутствие аллелей риска = 0
Snp2 = положительная гетерозигота, т.е. один аллель риска = 1
Snp3 = положительная гомозигота, т.е. два аллеля риска = 2
Комбинированное значение для категории белковых биомаркеров в этом случае представляет собой P=(3+2*6)/3=5. Комбинированное значение для генетической категории, также известной как генетический показатель, представляет собой показатель = (0*log(1,1)+1*log(1,2)+2*log(1,3))/3=0,2357. Общее комбинированное значение представляет собой Y=5+10*0,2357=7,357. Таким образом, рассчитано, что риск наличия состояния C для индивидуума A является повышенным, но не очень высоким.
Теперь дополнительно предположим, что на Prot1, Prot2, Snp1, Snp2 и Snp3 тестируют второго индивидуума B. В данном конкретном случае успешными были три измерения и привели к следующим результатам:
Prot1 = 2 нг/мл
Prot2 = ОТСУТСТВУЮЩИЕ ДАННЫЕ
Snp1 = положительная гомозигота, т.е. два аллеля риска = 2
Snp2 = ОТСУТСТВУЮЩИЕ ДАННЫЕ
Snp3 = положительная гетерозигота, т.е. один аллель риска = 1
Комбинированное значение для категории белковых биомаркеров в этом случае представляет собой P' = 2, так как доступны только результаты для Prot1. Комбинированное значение для генетической категории, также известной как генетический показатель, представляет собой показатель = (2*log(1,1)+1 *log(1,3))/2=0,2264. Общее комбинированное значение представляет собой Y=2+10*0,2264=4,264. Таким образом, рассчитано, что риск наличия состояния C для индивидуума B является низким.
Как правило, в моделях, прогнозирующих риск развития aPCa, часто определяют одно или несколько пороговых значений. Выбор порогового значения (или порогового уровня) зависит от множества факторов, включая в качестве неограничивающих примеров сам риск заболевания и риск, ассоциированный с неточной диагностикой индивидуума, у которого нет заболевания, как положительного (ложноположительный результат). Как правило, в общем случае прогностическая модель представляет собой монотонную функцию Y=f(x1, x2,.., xN), где рассчитанный риск наличия заболевания коррелирует с увеличенным значением Y. Это означает, что если пороговое значение установлено на низком уровне, тест будет давать большое количество ложноположительных результатов, но с другой стороны будет детектировать большинство индивидуумов, у которых действительно присутствует заболевание. Если пороговый уровень установлен на высокое значение, происходит обратное, когда у индивидуумов со значением Y, выше порогового уровня, с очень высокой вероятностью присутствует заболевание, но большое количество индивидуумов с заболеванием будут получать отрицательные результаты теста (т.е. большое количество ложноотрицательных результатов). Выбор порогового уровня зависит от множества факторов, включая социально-экономические последствия баланса (a) пропущенных индивидуумов с заболеванием и (b) лечения индивидуумов без заболевания.
При применении на практике, иногда случается, что одно или несколько определений завершаются неудачно в результате, например, непредвиденных технических проблем, человеческого фактора или любой другой неожиданной и необычной причины. В таких случаях массив данных, полученных для индивидуума, будет неполным. Как правило, такой неполный массив данных оценивать трудно или даже невозможно. Однако настоящее изобретение основано на измерениях большого количества признаков, из которых множество являются частично избыточными. Это означает, что даже для индивидуумов, для которых массив данных является неполным, во многих случаях возможно получить высококачественную оценку по изобретению. В частности это верно в категориях, где, например, калликреин-подобные биомаркеры коррелированы и частично избыточны. Таким образом, технически возможно применять алгоритмический двухэтапный подход, где вклад калликреиновых биомаркеров объединяют в калликреиновый показатель (или калликреиновое значение). Затем этот калликреиновый показатель на втором этапе комбинируют с другими данными (такими как генетический показатель, возраст и семейный анамнез, в качестве указания нескольких неограничивающих примеров) с получением диагностической или прогностической информации о PCa. Подобные двухэтапные способы можно применять для других классов маркеров, таких как генетические маркеры, ассоциированные с BMI, или белковые биомаркеры, родственные суперсемейству трансформирующего фактора роста бета (большому семейству структурно родственных клеточных регуляторных белков, которое включает MIC-1), в качестве указания двух неограничивающих примеров.
Свойство избыточности можно реализовывать множеством различных способов. Одним из возможных способов использования свойства избыточности является определение множества биомаркеров, представляющих биомаркеры, родственные общему полю или семейству. Одним неограничивающим примером такого поля или семейства являются калликреин-подобные биомаркеры. Можно определять более одного определенного множества (или категории) биомаркеров, и, кроме того, вне такого множества все еще можно использовать другие биомаркеры. Как правило, категории являются неперекрывающимися, т.е. любой определенный биомаркер является представителем только одной определенной категории или его используют отдельно. Затем для всех биомаркеров делается попытка определения присутствия или концентрации. В большинстве случаев определение для всех биомаркеров является успешным, но иногда одно или несколько значений теряются. Для обеспечения низкой чувствительности модели к потерянным значения, можно определять комбинированное значение для категории биомаркеров, которое можно определять с использованием всех или подмножества представителей определенной категории. Для работы на практике это требует того, чтобы представители определенной категории биомаркеров являлись по меньшей мере частично избыточными. На следующем этапе комбинированное значение для категории биомаркеров комбинируют с другими значениями биомаркеров, другими комбинированными значениями для категорий биомаркеров (если определены две или более категорий биомаркеров), генетическим показателем, ассоциированным с риском PCa, генетическим показателем, ассоциированным с другими характеристиками (такими как BMI или концентрация биомаркеров, в качестве указания двух неограничивающих примеров), семейным анамнезом, возрастом и другими носителями информации, ассоциированными с оценкой предпочтительного лечения, в общее комбинированное значение. В заключение общее комбинированное значение используют для оценки предпочтительного лечения.
Таким образом, целью комбинированного значения для категории биомаркеров является служение в качестве промежуточного значения, которое можно рассчитывать с использованием неполных данных. Предположим, что определенная категория биомаркеров включает N различных биомаркеров, обозначаемых B1, B2, B3, … BN, все родственные семейству биомаркеров B. В этом случае, может существовать N различных моделей, доступных для расчета комбинированного значения для биомаркеров семейства B, C:
C=f1(B1,B2, B3, … BN)
C=f2(B2,B3, … BN)
C=f3(B1,B3, … BN)
…
C=fN(B1,B2, B3, … BN-1),
где f1(), f2() … fN() представляют собой математические функции, использующие значения биомаркеров B1, … BN в качестве аргументов и определенным образом дающие единственное значение функции C, представляющее комбинированное значение для биомаркеров семейства B. Один из неограничивающих примеров функций f1(), … fN() включает линейные комбинации настоящих аргументов. С таким набором нескольких функций, способных к расчету C для всех случаев потери одного биомаркера, расчет общего комбинированного значения становится менее чувствительным к отсутствующим данным. Следует понимать, что когда присутствуют не все данные, оценка C может быть менее хорошего качества, но все еще быть достаточно хорошей для оценки предпочтительного лечения. Таким образом, при использовании такой стратегии для получения оценки C успешными должны быть только определения N-1 биомаркеров. Дополнительно возможно получить оценки для любого количества потерянных данных, т.е., если успешными должны быть определения N-2 биомаркеров, для оценки C можно сформировать и использовать другой набор функций f().
Таким образом, в отношении биомаркеров PCa, настоящее изобретение относится к способу, который основан на составленной с избыточностью комбинации данных, как определено в других частях настоящей заявки. Более конкретно, способ включает определение присутствия или концентрации по меньшей мере частично избыточных биомаркеров PCa, где по меньшей мере один, например, два, биомаркера PCa выбраны из группы, состоящей из (i) PSA, (ii) общего PSA (tPSA), (iii) интактного PSA (iPSA), (iv) свободного PSA (fPSA) и (v) hK2. При получении комбинированного значения для биомаркеров способ позволяет пренебречь подмножеством по меньшей мере одного из биомаркеров PCa (i)-(v). Другими словами, способ допускает возможность формирования комбинированного значения для биомаркеров из данных, относящихся не ко всем биомаркерам PCa из категории биомаркеров, более конкретно, из данных, относящихся к подмножеству самое большое из четырех указанных биомаркеров PCa. Как понятно специалисту, это эквивалентно способу, где для получения указанного комбинированного значения для биомаркеров необходимы данные, относящиеся к подмножеству самое большое из четырех указанных биомаркеров PCa. Преимуществом способа по настоящему изобретению является то, что пропуск, недостаток или потеря данных, относящихся к подмножеству указанных биомаркеров PCa, является приемлемым для получения комбинированного значения для биомаркеров.
Как понятно специалисту, настоящее изобретение относится к тому, что способ включает формирование комбинированного значения для биомаркеров из данных, относящихся ко всем биомаркерам из категории биомаркеров при условии, что данные, относящиеся ко всем биомаркерам, доступны.
В одном из вариантов осуществления способ позволяет пренебречь подмножеством из одного, двух, трех или четырех биомаркеров PCa (i) PSA, (ii) общего PSA (tPSA), (iii) интактного PSA (iPSA), (iv) свободного PSA (fPSA) и (v) hK2. Другими словами, способ допускает формирование указанного комбинированного значения для биомаркеров из данных, относящихся к подмножеству из четырех, трех, двух или одного из биомаркеров PCa (i)-(v), соответственно.
Как указано ранее в настоящей заявке, способ может дополнительно включать анализ одного или каждого из множества дополнительных категорий биомаркеров PCa, где комбинация данных для формирования каждого дополнительного комбинированного значения для биомаркеров составлена с избыточностью, где дополнительная категория биомаркеров PCa содержит более одного биомаркера PCa. При получении комбинированного значения для биомаркеров способ позволяет пренебречь определенным подмножеством биомаркеров PCa. Другими словами, способ допускает формирование комбинированного значения для биомаркеров из данных, относящихся не ко всем биомаркерам PCa из дополнительной категории биомаркеров, таких как данные, относящиеся к подмножеству из 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% или 90% биомаркеров PCa из дополнительной категории биомаркеров PCa. Как понятно специалисту, настоящее изобретение относится к тому, что способ включает формирование каждого дополнительного комбинированного значения для биомаркеров из данных, относящихся ко всем биомаркерам PCa из категории биомаркеров PCa при условии, что данные, относящиеся ко всем биомаркерам PCa, являются доступными.
Показатели генетического риска (т.е. генетические показатели или генетические комбинированные значения, более конкретно комбинированные значения для SNP) также нечувствительны к небольшим потерям данных, например, вследствие непредвиденных технических проблем, человеческого фактора или любой другой неожиданной и необычной причины. Как правило, вклад одного из snp в показатель риска не коррелирует ни с одним из других snp. В случае snp, изменение риска из-за каждого из snp является малым, но при совместном использовании нескольких SNP, ассоциированных с патологическим состоянием, изменение риска для указанного патологического состояния становится достаточно большим для влияния на эффективность модели. Предпочтительное количество snp для формирования генетического показателя составляет по меньшей мере 3 snp, более предпочтительно - 10 snp, более предпочтительно - 25 snp, еще более предпочтительно - 50 snp, более предпочтительно - 60 snp, еще более предпочтительно - 70 snp, еще более предпочтительно - 80 snp, более предпочтительно - 90 snp, еще более предпочтительно - 100 snp, еще более предпочтительно - 150 snp, еще более предпочтительно - 200 snp, еще более предпочтительно - 250 и даже еще более предпочтительно - 300 snp. Это означает, что влияние одного любого snp на общий результат, как правило, является небольшим, и пропуск нескольких snp, как правило, не изменяет общую оценку риска по генетическому показателю в любом большом способе, т.е., как правило, не изменяет комбинированное значение для SNP в значительной степени. На существующем уровне техники типичные потери данных в генетических исследованиях большого масштаба составляют порядка 1-2%, что означает, что если генетический показатель состоит из 100 различных snp, типичная генетическая характеристика индивидуума предоставляет информацию о 98-99 из этих snp. Однако модель по настоящему изобретению, по существу как описано в работе по настоящему изобретению, может выдерживать большую потерю или отсутствие данных, например, потерю 5-7% информации, или 7-15%, или даже 15-30%. В этом смысле, комбинация данных, относящихся к SNPpc, является по меньшей мере частично избыточной.
Таким образом, в отношении генетических маркеров (SNP), настоящее изобретение относится также к способу, который основан на составленной с избыточностью комбинации данных, как определено в других частях настоящей заявки. При формировании комбинированного значения для SNP способ позволяет пренебречь по меньшей мере 5% SNPpc. Другими словами, способ допускает формирование указанного комбинированного значения для SNPpc из данных, относящихся не ко всем SNPpc из категории SNPpc, более конкретно из данных, относящихся к подмножеству самое большое из 95% указанных SNPpc. Как понятно специалисту, это эквивалентно способу, где для получения указанного комбинированного значения для SNPpc, необходимы данные, относящиеся к подмножеству самое большое из 95% указанного SNPpc. Преимуществом способа по настоящему изобретению является то, что пропуск, недостаток или потеря данных, относящихся к подмножеству указанных SNPpc, является приемлемым для получения комбинированного значения для SNPpc.
Как понятно специалисту, настоящее изобретение относится к тому, что способ включает формирование комбинированного значения для SNPpc из данных, относящихся ко всем SNPpc из категории SNPpc, если данные, относящиеся ко всем SNPpc, доступны. Подобным образом, настоящее изобретение относится к тому, что способ включает формирование комбинированного значения для SNPpc из данных, относящихся к подмножеству из 99%, 98%, 97% или 96% указанных SNPpc.
В одном из вариантов осуществления способ при получении комбинированного значения для SNPpc позволяет пренебречь 6%, 7%, 8%, 9%, 10%, 15%, 20%, 25% или 30% SNPpc. Другими словами, способ допускает формирование указанного комбинированного значения для SNPpc из данных, относящихся к подмножеству из 94%, 93%, 92%, 91%, 90%, 85%, 80%, 75% или 70% SNPpc, соответственно.
Одним из неограничивающих примеров такой составленной с избыточностью комбинации данных является расчет среднего риска, относящегося к каждому из SNP, для которых существуют экспериментальные данные. Другим неограничивающим примером такой составленной с избыточностью комбинации данных является получение нескольких независимых уравнений для расчета комбинированного значения, по одному уравнению для каждого подмножества данных, которое можно использовать для получения указанного комбинированного значения.
Один подходящий способ ассоциации SNP с патологическим состоянием (например, PCa или повышенная концентрация биомаркера hk2 в крови) описан в открытой публикации "Blood Biomarker Levels to Aid Discovery of Cancer-Related Single-Nucleotide Polymorphisms: Kallikreins and Prostate Cancer" Robert Klein с соавторами, опубликованной в Cancer Prev. Res. 2010; 3:611-619 (включенной в настоящий документ в качестве ссылки). В этой публикации авторы описывают, как можно ассоциировать SNP rs2735839 с повышенным значением (свободного PSA)/(общий PSA). Кроме того, они смогли установить ассоциацию SNP rs10993994 с повышенным риском PCa, повышенным значением общего PSA, повышенным значением свободного PSA и повышенным значением hk2, и, наконец, SNP rs198977 был ассоциирован с повышенным риском PCa, повышенным значением (свободного PSA)/(общий PSA) и повышенным значением hk2.
На практике, один из общих способов для ассоциации SNP с патологическим состоянием основан на оценке клинического испытания по принципу "случай-контроль", в котором сравнивают две большие группы индивидуумов, одну контрольную группу здоровых индивидуумов и одну группу случаев с исследуемым патологическим состоянием. Всех индивидуумов в каждой группе генотипируют по большинству из известных SNP. Когда доступны все данные генотипирования, исследуют значимость отличий частот аллелей в группе случаев и в контрольной группе. В таких системах типичной единицей для описания величины эффекта является отношение шансов. Отношение шансов описывает отношение между двумя долями: долей индивидуумов в группе случаев с данным конкретным аллелем и долей индивидуумов в контрольной группе с тем же аллелем. Если частота аллеля в группе случаев значительно выше частоты аллеля в контрольной группе, отношение шансов будет более 1. Если частота аллелей в группе случаев значительно ниже частоты аллелей в контрольной группе, отношение шансов будет менее 1.
Один из предпочтительных способов комбинации информации из нескольких источников описан в открытой публикации "Polygenic Risk Score Improves Prostate Cancer Risk Prediction: Results from the Stockholm-1 Cohort Study" Markus Aly с соавторами, опубликованной в EUROPEAN UROLOGY 60 (2011) 21-28 (включенной в настоящий документ в качестве ссылки). Ассоциации SNP и PCa при биопсии оценивали с использованием теста на тренд Кохрана-Армитажа. Отношения шансов аллелей (OR) с 95% доверительными интервалами рассчитывали с использованием моделей логистической регрессии. Для каждого пациента получали показатель генетического риска посредством суммирования количества аллелей риска (0, 1 или 2) в каждом из SNP, умноженных на логарифм OR SNP. Ассоциации между диагнозом PCa и повышенными факторами риска исследовали в анализе логистической регрессии. Часть модели, относящаяся к негенетической информации, включала логарифмически трансформированный общий PSA, логарифмически трансформированное отношение свободного PSA к общему, возраст на момент биопсии и PCa в семейном анамнезе (да или нет). Для оценки прогнозируемых вероятностей PCa при биопсии использовали повторную 10-кратную перекрестную проверку. Девяносто пяти процентные доверительные интервалы для значений ROC-AUC получали с использованием нормального приближения. Все описанные значения p основаны на двусторонних гипотезах. Хотя способ Aly с соавторами описаны в рамках скрининга PCa, тот же подход можно применять для способов прогноза.
В большинстве случаев рак предстательной железы представляет собой медленно прогрессирующее заболевание. Таким образом, возможность рекомендовать индивидууму прохождение активного лечения уже до биопсии делает возможным, например, мотивацию изменения индивидуумом образа жизни при подготовке к активному лечению, которая в этом случае необходима. Прекращение курения, достижение значения BMI ниже 30 и регулярная физическая нагрузка (приблизительно 30 минут 3-6 суток в неделю), все являются факторами, которые в основном способствуют увеличению продолжительности жизни в условиях тяжелого заболевания, включая рак предстательной железы. Таким образом, если выявлено, что индивидуум подходит для активного лечения, это является причиной рекомендации указанному индивидууму прекратить курение, попытаться достичь BMI<30 и начать физическую нагрузку так, чтобы лучше перенести побочные эффекты самого лечения и для увеличения шансов восстановления после заболевания. Другим важным аспектом являются диетические ограничения. Изменяя диету развитие PCa можно замедлять или задерживать. Существуют факты, свидетельствующие, что сниженное потребление пищи может уменьшить риск дебюта PCa, что описано Song с соавторами в публикации "Whole milk intake is associated with prostate cancer-specific mortality among U.S. male physicians", опубликованной в J. Nutr. 2013 Feb; 143(2):189-96 (включенной в настоящий документ в качестве ссылки). Существуют подобные факты в отношении положительного действия потребления зеленого чая и потребления соевых продуктов. Таким образом, если выявлено, что индивидуум подходит для активного лечения, это является причиной рекомендации указанному индивидууму снизить потребление молочных продуктов и/или увеличить потребление зеленого чая и продуктов на основе сои для отсрочки или даже предотвращения прохождения активного лечения.
Пример 1
Для иллюстрации настоящего изобретения из массива данных STHLM2 извлекали массив данных, включающий 172 случая (индивидуумы, для которых известно, что они страдают aPCa, которые проходили активное лечение) и 79 контролей (индивидуумы, для которых известно, что они страдают aPCa, для которых решено продолжать активное наблюдение). Как видно на веб-странице http://sthlm2.se/ массив данных STHLM2 доступен в общем пользовании. В итоге в течение 2010-2012 годов в исследование STHLM2 были включены приблизительно 26000 мужчин, проходивших тестирование PSA в области Стокгольма. 172+79=251 индивидуумов охарактеризованы по приведенным ниже биомаркерам и SNP.
Биомаркеры:
Общий специфический антиген предстательной железы (tPSA) [нг/мл]
Интактный специфический антиген предстательной железы (iPSA) [нг/мл]
Свободный специфический антиген предстательной железы (fPSA) [нг/мл]
Калликреин 2 человека (hK2) [нг/мл]
Ингибирующий макрофаги цитокин 1 (MIC-1) [нг/мл]
Бета-микросеминопротеин (MSMB) [нг/мл]
SNP:
657del5, rs10086908, rs1016343, rs10187424, rs1041449, rs10486567, rs1054564, rs10875943, rs10896449, rs10934853, rs10993994, rs11067228, rs11135910, rs11228565, rs11568818, rs11649743, rs11650494, rs11672691, rs11704416, rs12130132, rs12409639, rs12418451, rs12500426, rs12543663, rs12621278, rs12653946, rs1270884, rs130067, rs13252298, rs13385191, rs1354774, rs1363120, rs137853007, rs138213197, rs1447295, rs1465618, rs1512268, rs1571801, rs16901979, rs16902094, rs17021918, rs17632542, rs17879961, rs1859962, rs1894292, rs1933488, rs1983891, rs2018334, rs2121875, rs2242652, rs2273669, rs2292884, rs2405942, rs2660753, rs2735839, rs2736098, rs2928679, rs3213764, rs339331, rs3771570, rs3850699, rs3863641, rs401681, rs4245739, rs4430796, rs445114, rs4643253, rs4857841, rs4962416, rs5759167, rs5919432, rs5945619, rs6062509, rs620861, rs6465657, rs6763931, rs684232, rs6869841, rs6983267, rs6983561, rs7127900, rs7210100, rs721048, rs7241993, rs7611694, rs7679673, rs7931342, rs8008270, rs8102476, rs888663, rs902774, rs9364554, rs9600079, rs9623117.
У каждого индивидуума собирали общую информацию, включая возраст и семейный анамнез (да или нет). Возраст выражали в единицах лет.
Для прогноза индивидуумов, которым следует рекомендовать активное лечение, было возможным основываться только на генетическом показателе, как иллюстрирует следующее предопределенное уравнение:
y=0,63+0,039*показатель
В этом уравнении, "показатель" представляет собой переменную генетического показателя, рассчитанную, как описано в открытой публикации "Polygenic Risk Score Improves Prostate Cancer Risk Prediction: Results from the Stockholm-1 Cohort Study" Markus Aly с соавторами, опубликованную в EUROPEAN UROLOGY 60 (2011) 21-28 (включенной в настоящий документ в качестве ссылки), содержащую подтвержденные SNP, предрасположенности к раку предстательной железы (указанные SNP, ассоциированы с предрасположенностью к раку предстательной железы или ассоциированы с уровнями биомаркеров PSA, свободного PSA, MSMB и MIC-1 в плазме), перечисленные в настоящем примере.
Полученное значение "y" сильно коррелирует с необходимостью активного лечения, как проиллюстрировано на фигуре 1. Кривые ROC на фигуре 1 представляют прогноз необходимости в активном лечении с использованием только значения PSA (101; сплошная линия) и модели, описанной в этом примере (102; пунктирная линия). Если y превышает пороговое значение, мужчине следует рекомендовать обратиться к урологу для исследования предстательной железы с использованием биопсии.
Пороговое значение зависит от компромисса между чувствительностью и специфичностью теста. Например, если используют пороговое значение 1,04, этот конкретный тест приводит к чувствительности 0,5 и специфичности 0,67. Это можно сравнивать с использованием в качестве скринингового теста только значения PSA, который приводит к чувствительности 0,5 и специфичности 0,46. Важно отметить, что для данного конкретного способа прогноза, наиболее ценной характеристикой является поддержка решения индивидуумов в "серой зоне", т.е. на уровне чувствительности 0,5-0,6.
Пример 2
Для дополнительной иллюстрации изобретения массив данных, как описано в примере 1, подвергали дополнительному анализу. Посредством комбинации информации из нескольких категорий, включая генетический показатель и концентрации биомаркеров, получили многопараметрическую модель, включающую указанные выше биомаркеры и генетический показатель, как описано в примере 1. Модель получали с использованием линейной регрессии.
Полученное значение "y" сильно коррелирует с необходимостью активного лечения, как проиллюстрировано на фигуре 2. Кривые ROC на фигуре 2 представляют прогноз необходимости в активном лечении с использованием только значения PSA (201) и модели, описанной в этом примере (202). Если y превышает пороговое значение, мужчине следует рекомендовать обратиться к урологу для исследования предстательной железы с использованием биопсии.
Пороговое значение зависит от компромисса между чувствительностью и специфичностью теста. Например, если используют пороговое значение 0,72, этот конкретный тест приводит к чувствительности 0,5 и специфичности 0,78. Это можно сравнивать с использованием в качестве скринингового теста только значения PSA, который приводит к чувствительности 0,5 и специфичности 0,46. Важно отметить, что для данного конкретного способа прогноза, наиболее ценной характеристикой является поддержка решения индивидуумов в "серой зоне", т.е. на уровне чувствительности 0,5-0,6.
Пример 3
Для дополнительной иллюстрации изобретения извлекали подмножество из массива данных из примера 1, пропуская всех индивидуумов с PSA>7 нг/мл, или, в случае пропущенного значения PSA, пропускали индивидуумов со свободным PSA>0,91 нг/мл.
Подмножество включало 144 индивидуума. В попытке прогноза прохождения индивидуумом активного лечения получали четыре различные модели.
Y1=1,4076640+0,0352188*PSA-0,0159339*возраст-0,0005042*PSA*возраст
Y2=6,420955-0,897462*показатель-0,445241*PSA-0,067727*возраст+0,081441*показатель*PSA+0,009316*показатель*возраст+0,000848*PSA*возраст
Y3=3,901443-0,408785*показатель90-0,262197*PSA-0,040232*возраст+0,045336*показатель90*PSA+0,003840*показатель90*возраст+0,001104*PSA*возраст
Y4=3,503319-0,337091*показатель-2,747459*fPSA-0,042007*возраст+1,243013*интактный+0,242149*показатель*fPSA-0,070408*показатель*интактный+0,019290*fPSA*возраст+0,205893*fPSA*интактный-0,014322*возраст*интактный,
где PSA представляет собой концентрацию PSA, fPSA - концентрацию свободного PSA, интактный - концентрацию интактного PSA, возраст - возраст индивидуума, показатель - генетический показатель и показатель 90 - генетический показатель, рассчитанный только с использованием 90% (случайно выбранных) SNP. У модели Y1 ROC-AUC=0,60, у модели Y2 ROC-AUC=0,69, у Y3 ROC-AUC=0,65 и у Y4 ROC-AUC=0,68.
Этот пример иллюстрирует четыре различных аспекта изобретения:
Первый аспект представляет собой возможность прогноза получение пациентом пользы от прохождения активного лечения вследствие включения генетического показателя (наблюдаемую при сравнении моделей Y1 и Y2).
Второй аспект представляет собой то, что модель Y2 обладает свойственной избыточностью параметра показателя и обладает хорошими характеристиками для модели Y3 при сравнении с моделью Y1 (в которой не используют никакой генетической информации), даже когда в Y3 пропущено 10% информации об SNP. Отсутствие данных, в качестве указания некоторых неограничивающих примеров, может происходить вследствие множества причин, таких как технические проблемы, отсутствие материала образца или человеческий фактор.
Третий аспект состоит в том, что белковый биомаркер PSA (принадлежащий к калликреин-подобному семейству биомаркеров) можно заменять другими представителями калликреиного семейства биомаркеров (что проиллюстрировано в модели Y4) с сохранением хорошей эффективности по сравнению с более простой моделью Y1. Следует отметить, что критерий включения для индивидуумов с отсутствием информации о значении PSA является свободный PSA < 0,91.
Четвертый аспект состоит в том, что этот пример иллюстрирует то, что можно предоставлять информацию для категорий индивидуумов, где трудно принять решение о необходимости и способах лечения. Тогда как индивидуумы с высоким значением PSA (более 7 нг/мл или даже более 30 нг/мл), как правило, являются кандидатами для активного лечения, индивидуумы с более низкими значениями PSA находятся в "серой зоне" где отношение риска и пользы определить не всегда легко.
Хотя изобретение описано в отношении его предпочтительного варианта осуществления, который составляет наилучший способ, известный авторам изобретения, следует понимать, что можно проводить различные изменения и модификации, которые очевидны специалисту в данной области, без отклонения от объема изобретения, указанного в прилагаемой формуле изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ВЫЯВЛЕНИЯ ПРИСУТСТВИЯ ИЛИ ОТСУТСТВИЯ АГРЕССИВНОГО РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ | 2013 |
|
RU2675370C2 |
| СПОСОБ ГАРМОНИЗАЦИИ РЕЗУЛЬТАТОВ АНАЛИЗА | 2019 |
|
RU2817657C2 |
| СПОСОБ ОБНАРУЖЕНИЯ СОЛИДНОЙ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ | 2015 |
|
RU2720148C2 |
| СПОСОБЫ ПРОГНОЗИРОВАНИЯ РИСКА ИНТЕРСТИЦИАЛЬНОЙ ПНЕВМОНИИ | 2014 |
|
RU2670148C2 |
| СИСТЕМЫ И СПОСОБЫ УЛУЧШЕНИЯ ДИАГНОСТИКИ ЗАБОЛЕВАНИЙ С ПРИМЕНЕНИЕМ ИЗМЕРЯЕМЫХ АНАЛИТОВ | 2018 |
|
RU2782359C2 |
| СПОСОБ ДИАГНОСТИКИ ВОЛЧАНКИ У ЧЕЛОВЕКА | 2010 |
|
RU2596391C2 |
| МАРКЕРЫ РИСКА СЕРДЕЧНО-СОСУДИСТОГО ЗАБОЛЕВАНИЯ | 2010 |
|
RU2524659C2 |
| Способ прогнозирования веса новорожденного с учетом полиморфного локуса гексокиназы 2, дифференциально экспрессирующегося в плаценте | 2021 |
|
RU2786313C1 |
| ГЕНЕТИЧЕСКИЕ МАРКЕРЫ ДЛЯ ПРОГНОЗИРОВАНИЯ ВОСПРИИМЧИВОСТИ К ТЕРАПИИ | 2014 |
|
RU2809215C2 |
| ГЕНЕТИЧЕСКИЕ МАРКЕРЫ ДЛЯ ПРОГНОЗИРОВАНИЯ ВОСПРИИМЧИВОСТИ К ТЕРАПИИ | 2014 |
|
RU2707533C2 |
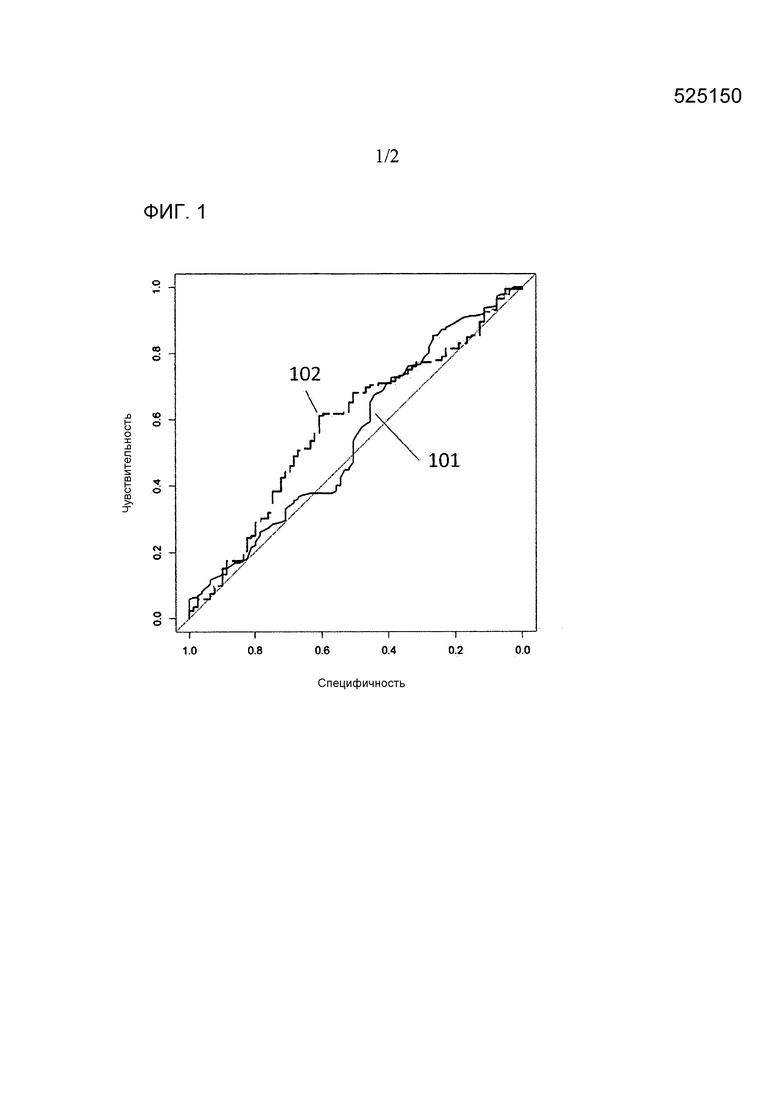
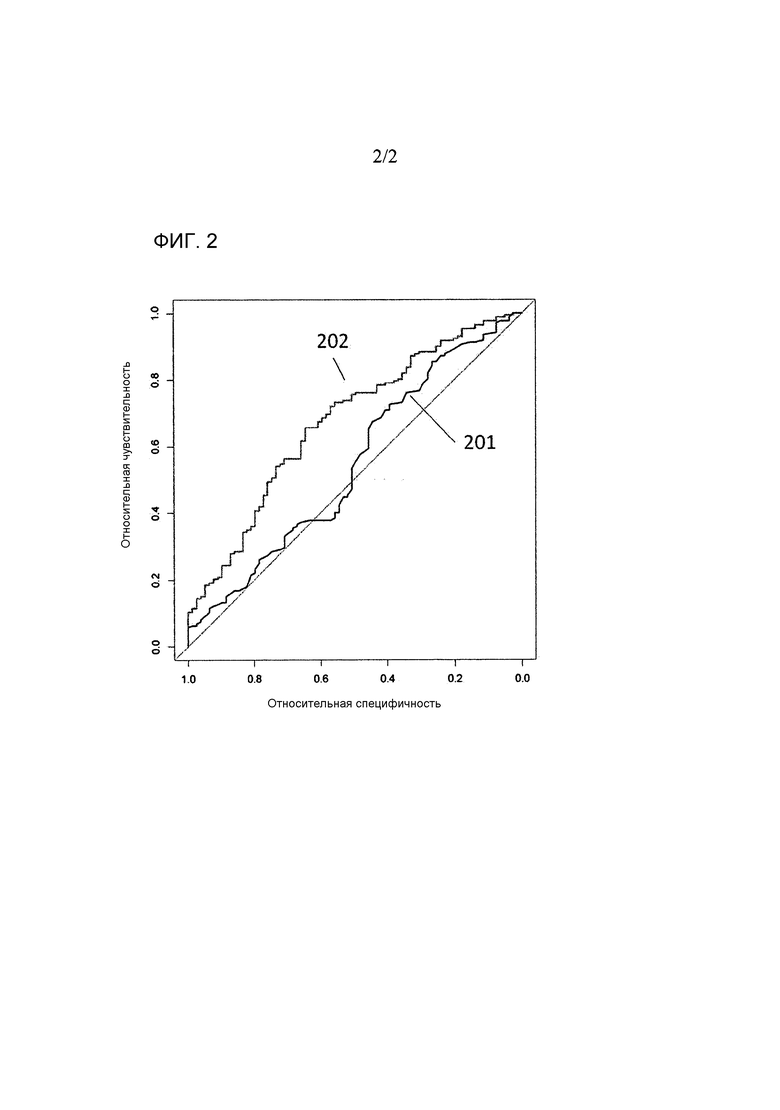
Группа изобретений относится к медицине, а именно к онкологии, и может быть использована для оценки необходимости активного лечения пациента с раком предстательной железы (РПЖ). Способ по изобретению включает этапы получения биологического образца, анализа в нем категории SNP, ассоциированных с PCa, (SNPpc), посредством определения присутствия или отсутствия одного или двух аллелей риска каждого из множества SNPpc, комбинирования данных, относящихся к указанной категории SNPpc с получением комбинированного значения для SNPpc, где способ при получении комбинированного значения для SNPpc позволяет пренебречь подмножеством по меньшей мере из 10% SNPpc из категории SNPpc, где комбинированное значение для SNPpc сформировано из данных по меньшей мере 95 SNPpc, определения корреляции указанного комбинированного значения для SNPpc с вероятностью необходимости активного лечения для индивидуума. Устройство по изобретению содержит твердую фазу с категорией иммобилизованных на ней лигандов, которая включает множество различных лигандов, специфически связывающихся с каждым из по меньшей мере 95 SNPpc, выбранных из SNPpc. Набор по изобретению содержит устройство для анализа и категорию детектирующих молекул. Использование изобретений позволяет оценить, является ли РПЖ агрессивным или медленно растущим и предсказать вероятность необходимости активного лечения. 3 н. и 17 з.п. ф-лы, 3 пр.
1. Способ на основе составленной с избыточностью комбинации данных для оценки необходимости активного лечения для индивидуума с диагнозом рак предстательной железы, включающий этапы:
1) получения у указанного индивидуума по меньшей мере одного биологического образца;
2) анализа в указанном биологическом образце категории SNP, ассоциированных с PCa, (SNPpc), посредством определения присутствия или отсутствия одного или двух аллелей риска каждого из множества SNPpc;
3) комбинирования данных, относящихся к указанной категории SNPpc, с получением комбинированного значения для SNPpc, где способ при получении комбинированного значения для SNPpc позволяет пренебречь подмножеством по меньшей мере из 10% SNPpc из категории SNPpc, где комбинированное значение для SNPpc сформировано из данных по меньшей мере 95 SNPpc;
4) определения корреляции указанного комбинированного значения для SNPpc с вероятностью необходимости активного лечения для индивидуума посредством сравнения комбинированного значения для SNPpc с предопределенным пороговым значением, установленным с использованием контрольных образцов, где у индивидуумов, у которых получены контрольные образцы, известны необходимость активного лечения или отсутствие необходимости в активном лечении, где активное лечение выбрано из группы, состоящей из лечения посредством хирургии, наружной радиации, направленной лучевой терапии, химиотерапии, гипотермической терапии, гипертермической терапии и посредством любого другого медицинского способа, используемого с целью лечения рака предстательной железы.
2. Способ по п. 1, в котором SNPpc выбраны из группы, состоящей из 657del5, rs10086908, rs1016343, rs10187424, rs1041449, rs10486567, rs1054564, rs10875943, rs10896449, rs10934853, rs10993994, rs11067228, rs11135910, rs11228565, rs11568818, rs11649743, rs11650494, rs11672691, rs11704416, rs12130132, rs12409639, rs12418451, rs12500426, rs12543663, rs12621278, rs12653946, rs1270884, rs130067, rs13252298, rs13385191, rs1354774, rs1363120, rs137853007, rs138213197, rs1447295, rs1465618, rs1512268, rs1571801, rs16901979, rs16902094, rs17021918, rs17632542, rs17879961, rs1859962, rs1894292, rs1933488, rs1983891, rs2018334, rs2121875, rs2242652, rs2273669, rs2292884, rs2405942, rs2660753, rs2735839, rs2736098, rs2928679, rs3213764, rs339331, rs3771570, rs3850699, rs3863641, rs401681, rs4245739, rs4430796, rs445114, rs4643253, rs4857841, rs4962416, rs5759167, rs5919432, rs5945619, rs6062509, rs620861, rs6465657, rs6763931, rs684232, rs6869841, rs6983267, rs6983561, rs7127900, rs7210100, rs721048, rs7241993, rs7611694, rs7679673, rs7931342, rs8008270, rs8102476, rs888663, rs902774, rs9364554, rs9600079 и rs9623117.
3. Способ по п. 1, в котором SNPpc выбраны из группы, состоящей из rs582598, rs439378, rs2207790, rs1046011, rs10458360, rs7525167, rs10489871, rs7529518, rs4245739, rs4512641, rs10178804, rs11900952, rs1873555, rs10191478, rs6755901, rs6545962, rs721048, rs2710647, rs12612891, rs2028900, rs1009, rs12233245, rs6760417, rs10496470, rs10199796, rs12475433, rs16860513, rs12151618, rs3765065, rs13017302, rs12988652, rs871688, rs749264, rs3771570, rs4346531, rs6770955, rs12637074, rs2660753, rs13319878, rs6437715, rs2162185, rs1515542, rs2270785, rs9830294, rs1439024, rs6762443, rs888507, rs6794467, rs12490248, rs1477886, rs4833103, rs3796547, rs17779822, rs2366711, rs16849146, rs1894292, rs12640320, rs3805284, rs12500426, rs4699312, rs17021918, rs7679673, rs2047408, rs2647262, rs12506850, rs7658048, rs2078277, rs12505546, rs13113975, rs4246742, rs2736098, rs401681, rs11134144, rs10060513, rs40485, rs2087724, rs1482679, rs16901841, rs1295683, rs2070874, rs7752029, rs2018334, rs9358913, rs1140809, rs409558, rs3096702, rs9267911, rs2025645, rs9359428, rs6569371, rs2813532, rs1933488, rs712242, rs6934898, rs9456490, rs651164, rs3120137, rs9364554, rs9457937, rs10486562, rs10807843, rs7801918, rs6962297, rs2465796, rs6957416, rs7777631, rs2272316, rs6961773, rs2132276, rs13265330, rs16887736, rs2911756, rs2272668, rs2339654, rs1380862, rs9297746, rs12543663, rs10086908, rs16901922, rs1016343, rs17832285, rs16901979, rs4871779, rs10107982, rs16902094, rs620861, rs17467139, rs6983267, rs9297756, rs10094059, rs7818556, rs1992833, rs986472, rs12552397, rs4273907, rs4237185, rs753032, rs11253002, rs2386841, rs10795841, rs10508422, rs7075945, rs10508678, rs539357, rs10826398, rs3818714, rs7090755, rs10993994, rs4382847, rs1891158, rs10887926, rs10788160, rs6579002, rs10832514, rs7358335, rs1944047, rs3019779, rs10896437, rs12793759, rs7106762, rs7102758, rs2449600, rs585197, rs2509867, rs11568818, rs7125415, rs11601037, rs11222496, rs4570588, rs6489721, rs3213764, rs17395631, rs4423250, rs11168936, rs10875943, rs3759129, rs902774, rs1827611, rs4760442, rs11610799, rs6539333, rs11067228, rs7485441, rs6489794, rs4119478, rs17070292, rs2293710, rs17256058, rs1950198, rs2331780, rs7141529, rs12880777, rs17123359, rs785437, rs524908, rs12903579, rs7178085, rs7164364, rs896615, rs11634741, rs9972541, rs12594014, rs11631109, rs1558902, rs8044335, rs2738571, rs885479, rs385894, rs684232, rs4925094, rs17138478, rs11649743, rs2107131, rs7213769, rs12946864, rs306801, rs138213197, rs1863610, rs17224342, rs9911515, rs12947919, rs966304, rs17744022, rs7234917, rs1943821, rs2227270, rs1363120, rs888663, rs1227732, rs1054564, rs4806120, rs11672691, rs758643, rs3745233, rs6509345, rs2659051, rs2735839, rs1354774, rs2691274, rs6090461, rs2297434, rs6062509, rs2315654, rs2823118, rs2838053, rs398146, rs16988279, rs2269640, rs4822763, rs132774, rs747745, rs5978944, rs6530238, rs5934705, rs5935063, rs4830488, rs17318620, rs5945619, rs5945637, rs11091768, rs2473057, rs5918762, rs4844228, rs6625760 и rs17324573.
4. Способ по пп. 1, 2 или 3, дополнительно включающий анализ в указанном биологическом образце категории биомаркеров PCa посредством определения присутствия или концентрации каждого из множества биомаркеров PCa из указанной категории биомаркеров PCa; комбинирование данных, относящихся к указанной категории биомаркеров PCa, с получением комбинированного значения для биомаркеров; комбинирование комбинированного значения для биомаркеров и комбинированного значения для SNPpc с получением общего комбинированного значения; и определение корреляции указанного общего комбинированного значения с вероятностью необходимости активного лечения для индивидуума посредством сравнения общего комбинированного значения с предопределенным значением, установленным с использованием контрольных образцов, где у индивидуумов, у которых получены контрольные образцы, известны необходимость активного лечения или отсутствие необходимости в активном лечении.
5. Способ по п. 4, включающий определение присутствия или концентрации по меньшей мере частично избыточных биомаркеров PCa, где по меньшей мере один, например, два биомаркера PCa выбраны из группы, состоящей из (i) PSA, (ii) общего PSA (tPSA), (iii) интактного PSA (iPSA), (iv) свободного PSA (fPSA) и (v) hK2.
6. Способ по п. 5, отличающийся тем, что способ при получении указанного комбинированного значения для биомаркеров позволяет пренебречь подмножеством по меньшей мере из одного из указанных биомаркеров PCa (i)-(v) из категории биомаркеров PCa, таким как подмножество из одного, двух, трех или четырех из указанных биомаркеров PCa (i)-(v).
7. Способ по п. 1, отличающийся тем, что способ при получении комбинированного значения для SNPpc позволяет пренебречь по меньшей мере 15%, например 20%, например 30% SNPpc из категории SNPpc.
8. Способ по п. 1, в котором указанные данные, относящиеся к указанной категории SNPpc, комбинируют в соответствии с предопределенным уравнением с получением указанного комбинированного значения для SNPpc.
9. Способ по п. 4, в котором указанные данные, относящиеся к указанной категории биомаркеров PCa, комбинируют в соответствии с предопределенным уравнением с получением указанного комбинированного значения для биомаркеров.
10. Способ по п. 4, в котором указанное комбинированное значение для биомаркеров и указанное комбинированное значение для SNPpc комбинируют в соответствии с предопределенным уравнением с получением указанного общего комбинированного значения.
11. Способ по п. 1, дополнительно включающий рекомендацию индивидууму активного лечения, если комбинированное значение для SNPpc или общее комбинированное значение превышают пороговое значение.
12. Способ по п. 1, дополнительно включающий сбор у указанного индивидуума семейного анамнеза в отношении PCa, истории лечения и данных физического обследования, где указанный семейный анамнез, историю лечения и/или данные физического обследования включают в общее комбинированное значение.
13. Способ по п. 4, дополнительно включающий анализ дополнительной категории биомаркеров PCa посредством определения присутствия или концентрации одного или каждого из множества биомаркеров PCa из указанной дополнительной категории биомаркеров; комбинации данных, относящихся к указанной дополнительной категории биомаркеров PCa, с получением дополнительного комбинированного значения для биомаркеров для указанной дополнительной категории биомаркеров PCa и включением указанного дополнительного комбинированного значения для биомаркеров в общее комбинированное значение, где комбинация данных для получения дополнительного комбинированного значения для биомаркеров составлена с избыточностью, где дополнительная категория биомаркеров PCa содержит более одного биомаркера PCa.
14. Способ по п. 13, в котором дополнительная категория биомаркеров PCa содержит биомаркер MIC-1 и необязательно другие родственные MIC-1 биомаркеры или биомаркер MSMB и необязательно другие родственные MSMB биомаркеры.
15. Способ по п. 1, в котором определение присутствия или отсутствия указанных SNP проводят с использованием масс-спектрометрии MALDI.
16. Способ по п. 1, в котором определение присутствия или концентрации указанных биомаркеров PCa проводят с использованием технологии микропанелей.
17. Устройство для анализа для проведения этапа 2 по п. 1, содержащее твердую фазу с категорией иммобилизованных на ней лигандов, которая включает множество различных лигандов, специфически связывающихся с каждым из по меньшей мере 95 SNPpc, выбранных из SNPpc, указанных в п.2 или 3.
18. Устройство для анализа по п. 17 для проведения способа по п. 4, в котором твердая фаза дополнительно содержит вторую категорию иммобилизованных лигандов, которая специфически связывается с биомаркером PCa, и включает множество различных лигандов, специфически связывающихся с каждым из множества биомаркеров PCa, таких как по меньшей мере один из PSA, iPSA, tPSA, fPSA и hK2 и необязательно MSMB и/или MIC-1.
19. Набор для тестирования для проведения этапа 2 по п. 1, содержащий устройство для анализа по п. 17 и категорию детектирующих молекул, способных к детекции по меньшей мере 95 SNPpc, выбранных из SNPpc, указанных в п.2 или 3.
20. Набор для тестирования по п. 19, содержащий устройство для анализа по п. 17 и вторую категорию детектирующих молекул, способных к детекции множества биомаркеров PCa, таких как по меньшей мере один из PSA, iPSA, tPSA, fPSA и hK2 и необязательно MSMB и/или MIC-1.
| WO2008096375 A2, 14.08.2008 | |||
| WO2012031207, 08.03.2012 | |||
| OLAMA A | |||
| et al | |||
| A meta-analysis of genome-wide association studies to identify prostate cancer susceptibility loci associated with aggressive and non-aggressive disease//Hum Mol Genet | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
Авторы
Даты
2018-10-16—Публикация
2013-11-20—Подача