Область техники, к которой относится изобретение
Изобретение относится к технологии получения фармацевтической субстанции низкомолекулярного гепарина (НМГ) щелочной деполимеризацией бензилового эфира коммерческого высокомолекулярного гепарина натрия.
Краткое описание чертежей
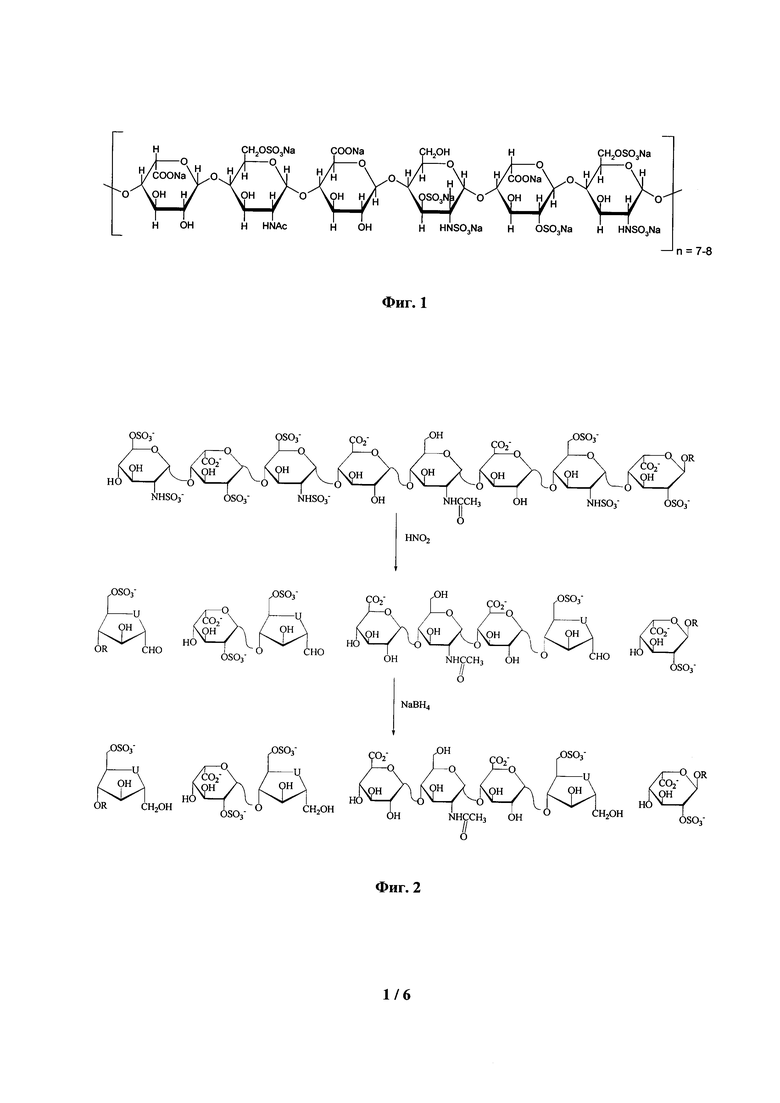
На Фиг. 1 представлена структура фрагмента молекулы высокомолекулярного гепарина.
На Фиг. 2 изображена схема получения НМГ окислительной деполимеризацией.
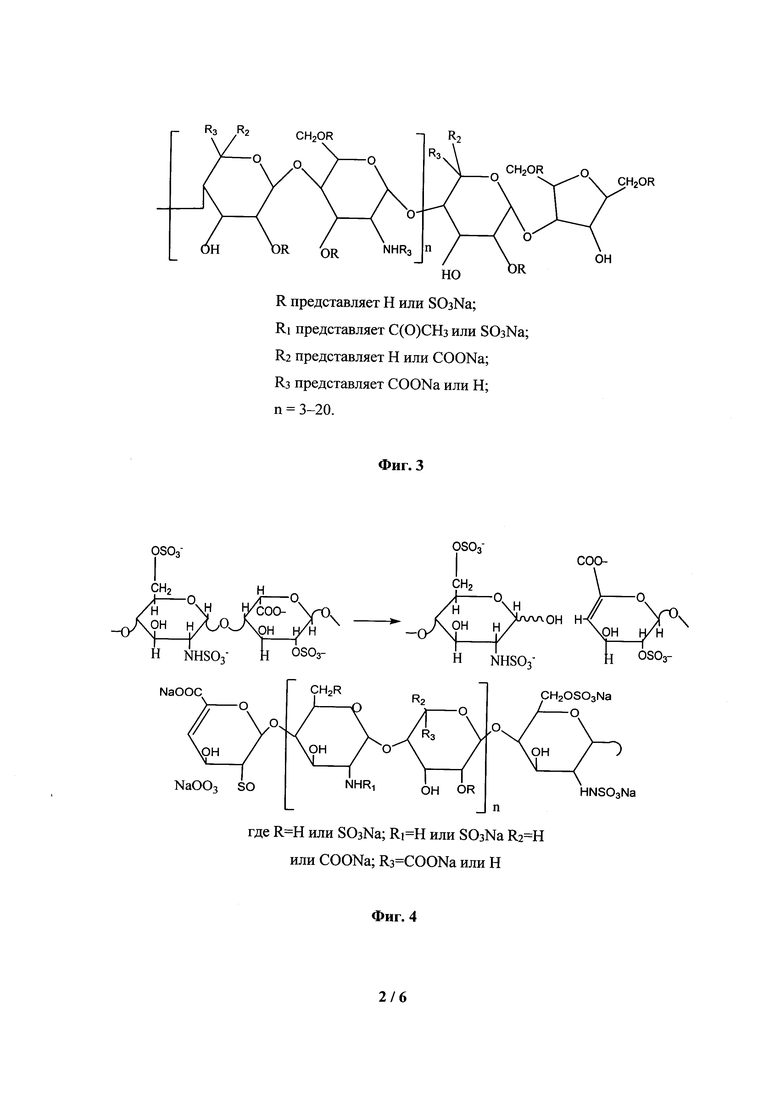
На Фиг. 3 показана структура дальтепарина.
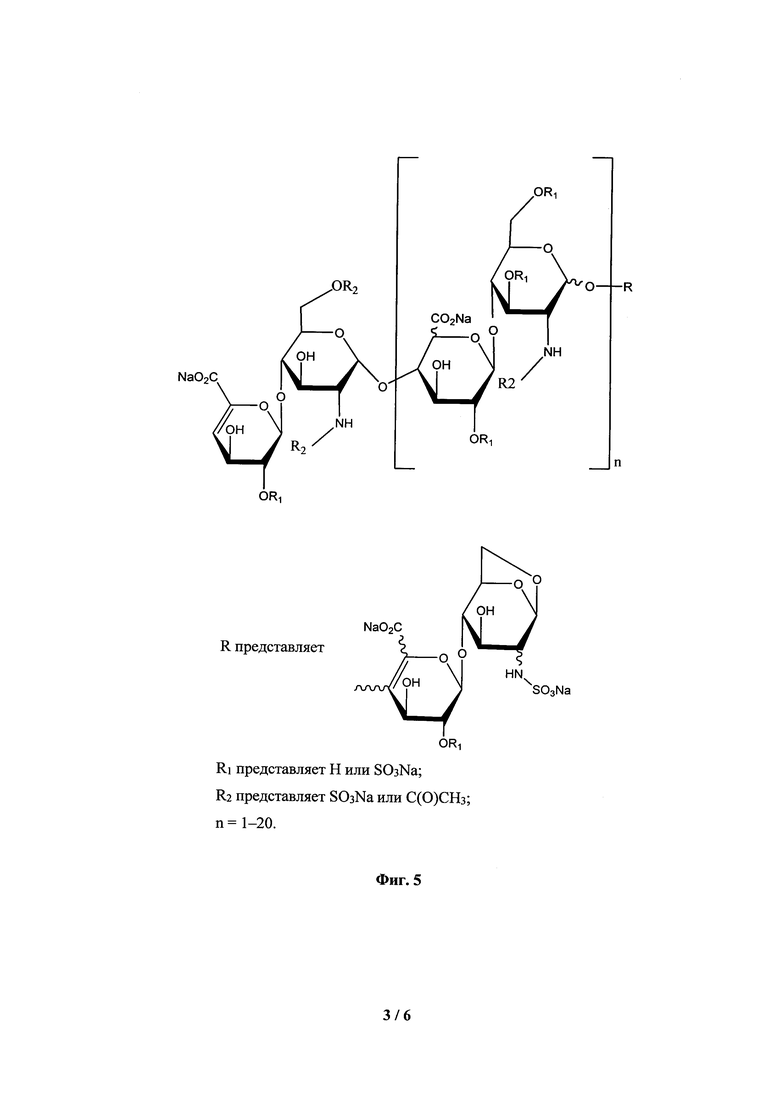
На Фиг. 4 приведена схема ферментативной деполимеризации в синтезе тинза-парина.
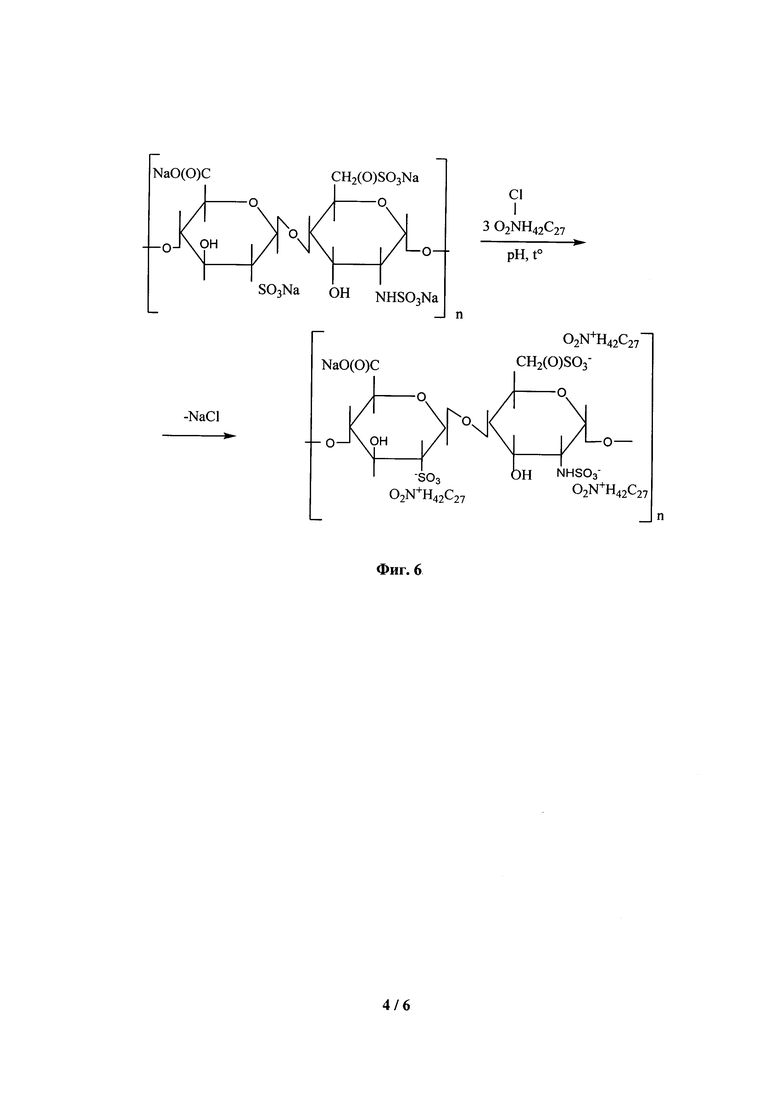
На Фиг. 5 показана структура фрагмента макромолекулы НМГ (эноксапарин), полученного щелочным гидролизом.
На Фиг. 6 изображена схема реакций, протекающих при получении гепарината бензетония.
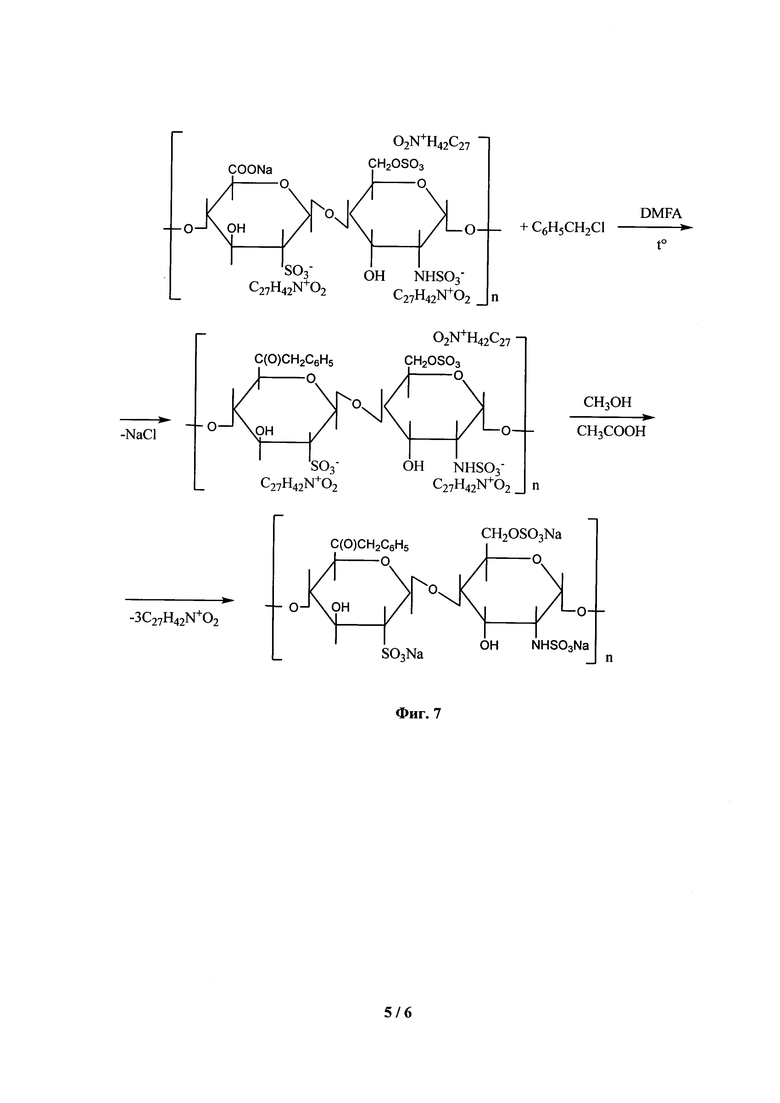
На Фиг. 7 представлена схема реакций бензилирования гепарината бензетония (ГБ) и удаления защиты сульфогрупп.
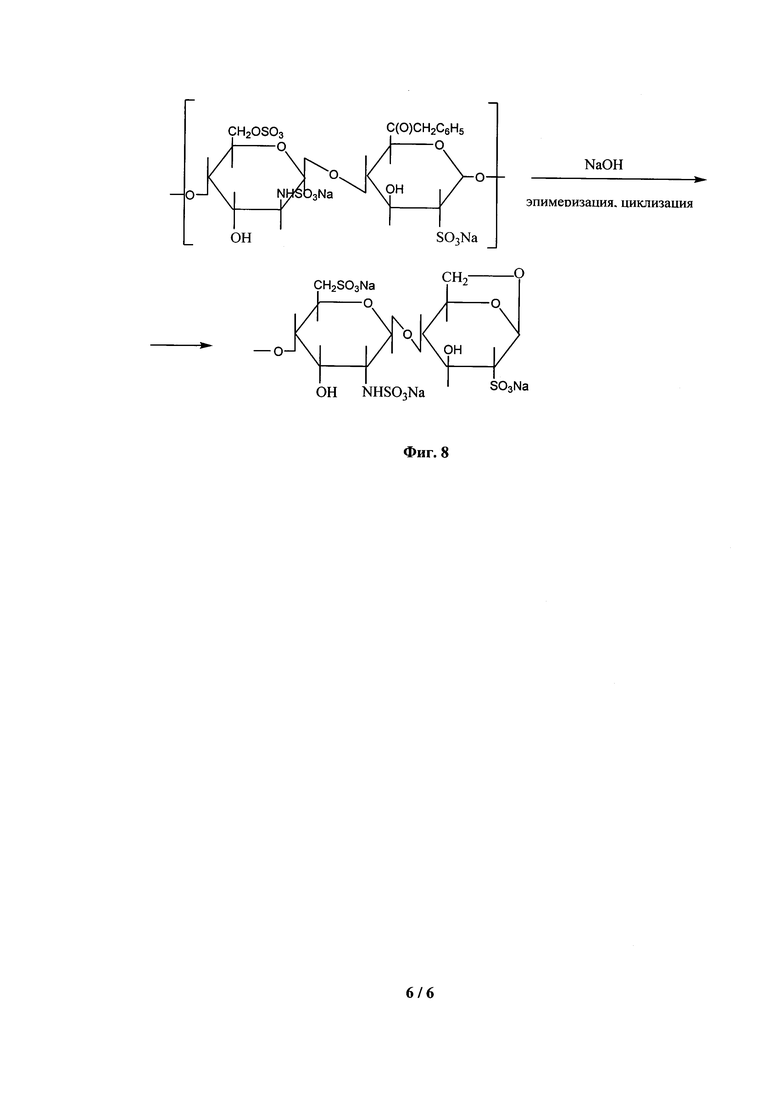
На Фиг. 8 дана схема реакций, протекающих при эпимеризации и циклизации.
Уровень техники
Гепарин - органопрепарат, получаемый из легких или мукозы - слизистой оболочки крупного рогатого скота или свиней. Он является прямым антикоагулянтом и используется для приготовления лекарственных форм, применяемых для профилактики и терапии тромбоэмболических заболеваний, тромбообразования при операциях на сердце и кровеносных сосудах, при остром инфаркте миокарда, а также для поддержания жидкого состояния крови в аппаратах искусственного кровообращения и гемодиализа.
Коммерческий нефракционированный гепарин (НФГ) представляет собой смесь сульфатированных полисахаридов различной структуры (Фиг. 1) с молекулярной массой от 3000 до 30000 Да. От длины молекулы гепарина и величины ее заряда зависит фармакокинетика и фармакодинамика лекарственного препарата, а также способность гепарина взаимодействовать с белками крови и клетками организма [1]. Наряду с несомненными преимуществами препараты НФГ обладают серьезными недостатками, такими как: возможность возникновения неконтролируемых кровотечений, аллергические реакции, остеопороз, необходимость повторных инъекций и др. [2].
Фракционирование природного гепарина известными методами (гельфильтрация, диализ и др.) дает низкий выход целевой фракции с низкой молекулярной массой и высокой антикоагулянтной активностью. Более эффективна в этом отношении так называемая контролируемая деполимеризация гепарина [3] под действием неорганических или органических веществ, ферментов или радиационного излучения. Реализуемые в настоящее время способы контролируемой деполимеризации можно свести к процессам гидролиза, окислительной, радикальной или ферментативной деструкции.
Окислительная деполимеризация НФГ заключается в обработке его водных растворов различными окислителями, из которых чаще всего используют нитрит натрия [4]. В результате действия выделяющейся азотистой кислоты на НФГ происходит разрыв гликозидных связей основной цепи [5] с образованием гидроксильных и альдегидных групп которые восстанавливают, например, боргидридом натрия [6] как схематично показано на Фиг. 2. Таким образом получают, например, дальтепарин, который имеет среднюю молекулярную массу около 6,0 кДа и ангидроманнозные концевые фрагменты (Фиг. 3).
Ферментативную деполимеризацию осуществляют при воздействии, например, микробных гепариназ (гепарин-лиазы), специфически разрушающих α-гликозидные связи между N-сульфатированным D-глюкозамин-6-сульфатом и 2-О-сульфатом идуроновой кислоты. Таким образом получают НМГ тинзапарин со средней молекулярной массой около 4,5 кДа и концевыми 2-N,6-O-дисульфо-D-глюкозаминовым и 4,5-ненасыщенным уроновокислым фрагментами [7] (Фиг. 4) В настоящее время известны способы ферментативной деполимеризации НФГ с помощью и других гепариназ [8]. К достоинствам ферментативной деполимеризации относятся мягкие условия синтеза и высокая селективность процесса.
Гидролитическая деполимеризация представляет собой специфический метод направленной деструкции НФГ, который подразумевает получение производных НФГ с их последующим щелочным гидролизом. Обычно процесс такого рода включает в себя предварительную защиту сульфогрупп НФГ реакцией с хлоридом бензетония и последующее преобразование карбоксильных групп в сложноэфирные за счет этерификации полученного продукта бензилхлоридом. Получаемый в результате бензиловый эфир гепарината бензетония осаждают, например, этанолом [9] с последующим удалением защиты с групп SO3-, и полученный неполный сложный эфир подвергают щелочному гидролизу [5]. При этом образуются молекулы НМГ с 2-O-сульфо-4-енопиранозуроновым и 2-N, 6-О-дисульфо-D-глюкозаминовым концевыми фрагментами (Фиг. 5). Таким образом получают ультранизкомолекулярный семулопарин, а также такие НМГ, как бемипарин и эноксапарин. Дополнительно деполимеризацию такого рода можно стимулировать микроволновым облучением.
Производное НФГ получают аналогичным способом - реакцией с хлоридом бензетония и последующей этерификации бензилхлоридом. Полученный продукт подвергают гидролитической деполимеризации в органических растворителях таких как: формамид, диметилформамид или метиленхлорид, а в качестве катализатора применяют сильные основания семейства фосфазенов. Считается, что процесс в неводной среде проходит в сравнительно мягких условиях, благодаря чему снижается доля побочных реакций и сохраняется биологическая активность гепарина.
Наиболее близким по технической сущности к заявляемому изобретению является способ получения, раскрытый в описании и формуле изобретения к патенту [9], включающий стадии получения бензетониевой соли гепарина, бензилирования этой соли в неводном растворителе, спиртового осаждения неполного бензилового эфира бензетониевой соли гепарина и щелочной деполимеризации этого продукта, отличающийся тем, что бензетониевую соль нефракционированного гепарина получают в 0,05-0,5 М водном растворе натрия хлорида при температуре 50-60°С, рН в интервале 8,2-8,8 и массовом соотношении гепарин/бензетоний хлорид 1/(2,35-2,70), бензилирование бензетониевой соли гепарина проводят в течение 2-3 часов в среде биполярного апротонного растворителя бензилхлоридом в соотношении гепаринат/бензилхлорид 1/(0,2-1,0), который предварительно подвергают активированию в апротонном растворителе в течение 15-20 минут, осаждение бензилового эфира гепарина проводят методом Спиро этиловым спиртом, предварительно насыщенным безводным натрия ацетатом, с последующим удалением защиты с сульфогрупп, проведение β-элиминирования бензилового эфира со степенью этерификации гепарина 9-13% 1±0,5 N щелочью NaOH при температуре 55±5°С, длительности процесса 40-60 минут и массовым соотношением реагентов бензиловый эфир/щелочь 1/(0,5-2).
Стадию бензилирования проводят в смеси апротонных растворителей. Выделение бензилового эфира бензетониевой соли проводят осаждением этанолом в присутствии соосадителя ацетата натрия, удаление защиты сульфогрупп осуществляют действием насыщенного этанольного раствора того же реактива. Процесс отмывки бензетониевой соли от примесей проводят обработкой дистиллированной водой.
Среди недостатков этого способа следует отметить:
- большой расход воды для отмывки гепарината бензетония от избытка бензетония хлорида, остаточное количество которого на последующих стадиях синтеза НМГ значительно осложняет технологический процесс и приводит к значительным потерям целевого продукта, поскольку продукты реакции представляют собой липкие тестообразные вещества;
- проведение процессов осаждения бензилового эфира бензетониевой соли и последующей процедуры удаления защиты сульфогрупп гепарина одним и тем же реагентом без выделения промежуточного продукта не приводит к получению структурированного продукта и увеличивает суммарную продолжительность процесса;
- выделение готового продукта 96%-м этанолом осложнено высокой гигроскопичностью порошка.
Целью настоящего изобретения является преодоление недостатков ближайшего аналога, в частности - снижение содержания примесей в готовом продукте, увеличение выхода полупродуктов на отдельных стадиях производства, сокращение расхода промывочной воды. Преимуществами предлагаемого технического решения являются снижение трудоемкости способа и затрат на производство готового НМГ.
Раскрытие сущности изобретения.
Цель настоящего изобретения достигается с помощью способа получения низкомолекулярного гепарина, включающего стадии:
(а) формирования защиты сульфогрупп взаимодействием высокомолекулярного гепарина с бензетония хлоридом с образованием гепарината бензетония (ГБ),
(б) этерификации полученной соли бензилированием в апротонном растворителе,
(в) выделения сложного бензилового эфира гепарина осаждением и удаления защиты сульфогрупп насыщенным раствором ацетата натрия в метиловом спирте,
(г) щелочной деполимеризации макромолекулы гепарина и
(д) формирования концевых 1,6-ангидрогрупп β-элиминированием при взаимодействии с сильным восстановителем,
в котором на стадии (а) отмывку гепарината бензетония от избытка непрореаги-ровавшего бензетония хлорида производят многократной дробной промывкой водой очищенной с применением ультразвука рабочей частоты 30-40 кГц, мощностью излучения 200-400 Вт и на стадии (в) выделение сложного бензилового эфира гепарина осаждением и удаление защиты сульфогрупп проводят как две последовательные операции, а применяемым спиртом является метанол.
Предпочтительно многократную дробную промывку с применением ультразвука осуществляют водой очищенной при массовом соотношении ГБ/вода равном 1/(50-60) и температуре 40-60°С при продолжительности каждого цикла ультразвукового воздействия 10-35 минут.
Также предпочтительно выделение неполного сложного бензилового эфира гепарината бензетония из раствора производят осаждением 1,5-2,5 объемами 8-10% метанольного раствора натрия ацетата при температуре от -2 до 4°С при перемешивании в течение 4-6 часов.
Далее предпочтительно удаление бензетониевой защиты сульфогрупп производят после отделения осадка взаимодействием с 4-6-кратным массовым количеством насыщенного метанольного раствора безводного натрия ацетата при температуре 18-24°С при перемешивании в течение 8-10 часов.
Кроме того, предпочтительно стадию щелочной деполимеризации проводят в присутствии инертного носителя перлита при массовом соотношении бензиловый эфир гепарина/перлит 1/(0,25-0,5).
В результате проведенных обширных исследований авторы изобретения неожиданно установили, что при проведении отмывки бензетония хлорида с применением ультразвука его частота и мощность имеют решающее значение для качества получаемого полупродукта. При рабочей частоте выше 40 кГЦ и мощности излучения более 400 Вт существует опасность непредсказуемой деструкции не только в полимерной цепи, но также и в отдельных звеньях моносахаридов, что приводит к потере активности готового продукта.
Природа спиртового растворителя также имеет большое значение для достижения технического результата изобретения. В ближайшем аналоге [9] для выделения полупродуктов из рабочих растворов на различных стадиях процесса применяется 96% этанол. При этом первоначально выделяется маслоподобная, липкая и вязкая гигроскопичная субстанция, которую невозможно извлечь из технологического оборудования без значительных потерь. Для получения порошка необходимо многократно перетирать это вещество с осадителем до получения аморфного порошка удовлетворительного качества.
В предлагаемом способе на стадии получения бензилового эфира бензетониевой соли процесс выделения из раствора продукта бензилирования с неудаленной бензетониевой защитой сульфогрупп осаждением метанолом проводят как отдельную операцию, причем в качестве соосадителя используют небольшое количество ацетата натрия.
В соответствии с изобретением процесс удаления бензетониевой защиты выделяют в отдельную стадию. Химизм этой реакции заключается во взаимодействии бензетониевого соединения с ацетатом натрия. В аналоге [9] процессы выделения и удаления защиты проводят многократной промывкой этанолом, насыщенным натрия ацетатом (его максимальная концентрация составляет 2,33% масс.). Для этого требуется трех-четырехкратная обработка продукта этим раствором с промежуточным выделением субстанции, т.к. в одной порции раствора реагента недостаточно.
Основомоль гепарина содержит три сульфогруппы и, в соответствии с этим, для удаления бензетониевой защиты с макромолекулы необходимо израсходовать три эквивалента натрия ацетата. В метаноле растворимость натрия ацетата составляет 16,22% масс., что в семь раз больше, чем в этаноле. Поэтому расход осадителя значительно меньший. Кроме того, неожиданно достигается существенно лучшее качество осадка.
Таким образом, техническим результатом предлагаемого изобретения является усовершенствованный способ получения низкомолекулярного гепарина с улучшенными показателями чистоты и общего выхода субстанции при существенном снижении расхода отмывочной воды и образующихся стоков.
Осуществление изобретения
Далее возможность осуществления изобретения с достижением технического результата будет показана на неограничивающих примерах.
Пример 1. Синтез гепарината бензетония
Схема превращений приведена на Фиг. 6. В стеклянную двугорлую колбу вместимостью 250 мл, помещенную в водяную баню на платформе магнитной термостатируемой мешалки, наливают 50 мл воды очищенной и при перемешивании загружают 8,4 г бензетония хлорида (Hyamine 1622, Lonza Group Ltd.). После полного растворения устанавливают рН в интервале 6,0-6,7.
В другом стакане готовят раствор 3,2 г гепарина мукозного в 30 мл 0,2 М раствора NaCl при комнатной температуре. После полного растворения гепарина устанавливают рН в интервале 8,5-8,7.
Температуру водяной бани повышают до 60±1°С и с помощью капельной воронки в реактор при перемешивании, избегая вспенивания содержимого колбы, приливают раствор гепарина в течение 30-40 минут. После прибавления всего количества раствора реакцию продолжают еще 50-60 минут. Образовавшийся осадок горячим отделяют фильтрацией на воронке Бюхнера или центрифугируют. Жидкую фазу отбрасывают, предварительно измерив ее объем и оптическую плотность для количественного определения содержания примесей.
Осадок переносят в стакан вместимостью 100 мл, прибавляют 50 мл воды очищенной и помещают его в ультразвуковую ванну (тип УЗВ, Сапфир). Экстракцию избытка непрореагировавших реагентов (отмывку) производят при температуре 40-60°С и воздействии ультразвуком с рабочей частотой 30-40 кГц и мощностью излучения 200-400 Вт при продолжительности каждого цикла ультразвукового воздействия 10-35 минут. Степень отмывки и содержание примесей в промывочной воде определяют измерением оптической плотности раствора (D270) спектрофотометрически (Cary 60 UV-Vis, Agilent) при длине волны 270 нм по калибровочному графику. Промывку повторяют до достижения оптической плотности промывной воды менее 1,5. Результаты эксперимента с применением ультразвука (УЗ) приведены в таблице 1. Как видно из этих данных удовлетворительный результат достигается уже за 7 циклов промывки, на что расходуется 430 мл воды очищенной. Промытый продукт - гепаринат бензетония (ГБ) лиофильно высушивают (лиофильная сушилка Иней-6, ФГБУН ИБП РАН). Выход ГБ составляет 8,23 г при влагосодержании 5,3%. Расход воды очищенной в расчете на 1 г порошка составляет 52,2 мл.
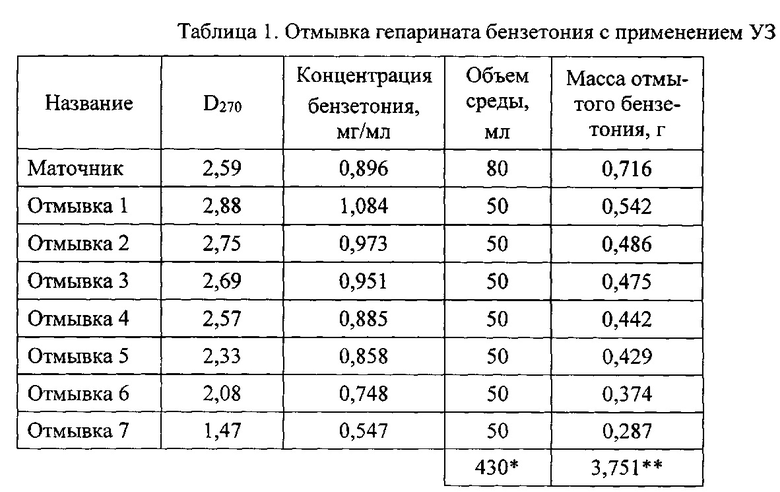
*в том числе промывочных вод 350 мл.
**в том числе с промывной водой 3,035 г.
Параллельно проводят промывку при тех же условиях без применения УЗ (таблица 2). При этом для достижения требуемого результата необходимо провести 14-15 циклов промывки, причем расход воды очищенной составляет 700 мл. Выход порошка ГБ составляет 7,9 г при влагосодержании 5,1%. Расход воды очищенной в расчете на 1 г продукта составляет 88,6 мл.
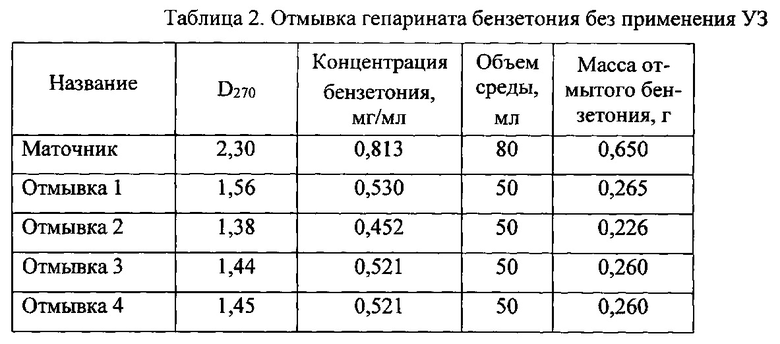
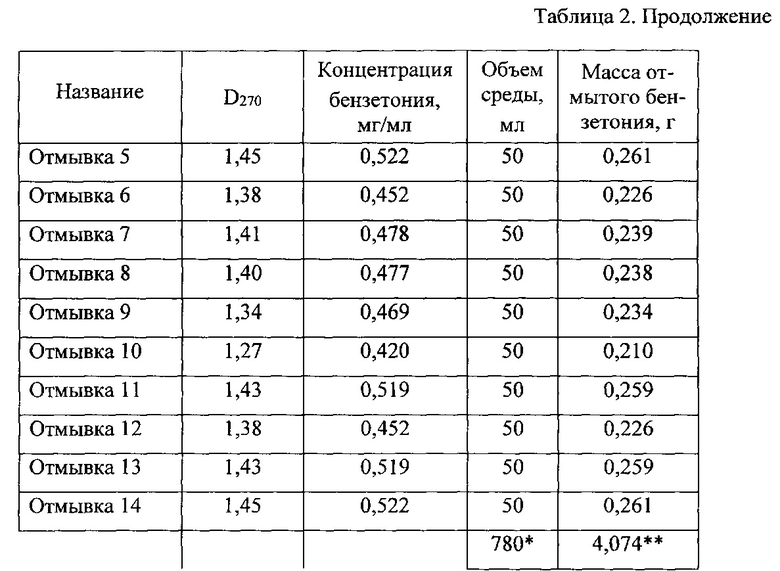
*в том числе промывочных вод 700 мл.
**в том числе с промывной водой 3,424 г.
Как видно из приведенных данных, применение отмывки с помощью УЗ обработки приводит к значительной интенсификации процесса, снижению расхода воды очищенной на отмывку ГБ, количества стоков и трудозатрат на проведение процесса в два раза.
Пример 2. Синтез неполного бензилового эфира гепарина
Схема синтеза приведена на Фиг. 7.
2.1. Синтез бензилового эфира гепарината бензетония
В трехгорлую колбу вместимостью 1 л, снабженную механической мешалкой и гидрозатвором, помещенную в термостатируемую водяную баню при температуре 37±1°С, наливают 250 мл N,N-диметилформамида (ДМФА) и прибавляют при перемешивании 45,0 г гепарината бензетония, полученного по методике изложенной в примере 1. После полного растворения ГБ в колбу с раствором с помощью капельной воронки прибавляют 40 мл бензилхлорида. Реакцию продолжают при температуре 37±1°С и перемешивании в течение 8 часов после чего содержимое колбы охлаждают до комнатной температуры. Выделение бензилового эфира гепарината бензетония из раствора производят осаждением 525 мл 9% метанольного раствора натрия ацетата при температуре 2-4°С при перемешивании в течение 4-6 часов. Осадок отделяют на воронке Бюхнера и влажным используют на стадии удаления бензетониевой защиты.
Выход влажного бензилового эфира гепарината бензетония 24,4 г с содержанием бензилового эфира гепарина 16,8 г.
2.2. Удаление защиты сульфогрупп бензилового эфира гепарината бензетония
В коническую плоскодонную колбу вместимостью 500 мл, помещенную на платформу магнитной мешалки, загружают 24.0 г влажного бензилового эфира гепарината бензетония, полученного по примеру 2.1, и приливают 100 мл насыщенного метанольного раствора безводного натрия ацетата. В колбу помещают якорь магнитной мешалки и закрывают ее притертой пробкой. Реакцию проводят при комнатной температуре при перемешивании в течение 8-10 часов. После окончания процесса осадок отделяют на воронке Бюхнера, и высушивают в вакуумном сушильном шкафу при температуре не выше 40С°.
Выход неполного бензилового эфира гепарина равен 16,2 г, что составляет 96% от теоретического.
Пример 3. Гидролиз бензилового эфира гепарина натрия
Схема синтеза приведена на Фиг. 8. В стакан вместимостью 250 мл, помещенный в водяную баню на платформе магнитной термостатируемой мешалки, наливают 75 мл воды очищенной и при перемешивании загружают 16,0 г бензилового эфира гепарина, полученного как описано в примере 2. Устанавливают температуру 60±1°С и перемешивают до полного растворения порошка. Затем в растворе устанавливают рН равным 11,0-11,1 с помощью свежеприготовленного 1 М раствора NaOH и прибавляют 8 мл 1 М раствора натрия гидроксида. Далее с помощью капельной воронки в течение 30-45 минут дозируют еще 8 мл того же раствора. Реакцию продолжают в течение 45 минут, поддерживая рН не ниже 11,0.
По окончании выдержки охлаждают реакционную массу до комнатной температуры, устанавливают рН равным 6,0±0,2 добавлением соляной кислоты (1:3), и раствор фильтруют. К прозрачному желтоватому фильтрату прибавляют 1,6 г безводного ацетата натрия и при необходимости корректируют рН до 6,0±0,2. Полученный раствор фильтруют через мембрану с размером пор 0,45 мкм, фильтрат охлаждают до температуры 0-4°С в течение 30-60 минут и осаждают продукт охлажденным метанолом (250-300 мл). Раствор помещают в холодильник и оставляют для созревания осадка на 3-4 часа. Надосадочную жидкость декантируют, а образовавшийся осадок дополнительно промывают 50-60 мл метанола. Осадок отделяют на воронке Бюхнера и высушивают в вакуумном сушильном шкафу при температуре не выше 40С°. Выход гидролизованого гепарина составляет 11,3 г, что составляет 84,3% от теоретического.
Пример 4. Боргидрирование сырца низкомолекулярного гепарина натрия
В стакан вместимостью 100 мл, снабженный мешалкой, наливают 50 мл воды очищенной и при перемешивании прибавляют 11,0 г продукта, полученного в примере 3. После полного растворения порошка устанавливают рН равным 8,4±0,2 и прибавляют 0,20 г боргидрида натрия. Реакцию продолжают в течение 50-60 мин. По окончании реакции устанавливают рН равным 4,0±0,2 добавлением соляной кислоты (1:3) при перемешивании в течение 10 минут, после чего добавлением 1 М раствора гидроксида натрия устанавливают рН равным 6,0±0,2. Полученный раствор фильтруют через мембрану с размером пор 0,45 мкм. Фильтрат охлаждают до температуры 0-4°С в течение 30-60 минут. Охлажденный фильтрат помещают в стакан вместимостью 200 мл и осаждают продукт охлажденным метанолом (150-200 мл). Раствор помещают в холодильник и оставляют для созревания осадка на 3 часа. Надосадочную жидкость декантируют, и образовавшийся осадок дополнительно промывают 30 мл метанола. Осадок отделяют на воронке Бюхнера и высушивают в вакууме при температуре не выше 40С°. Масса готового продукта составляет 9,7 г.
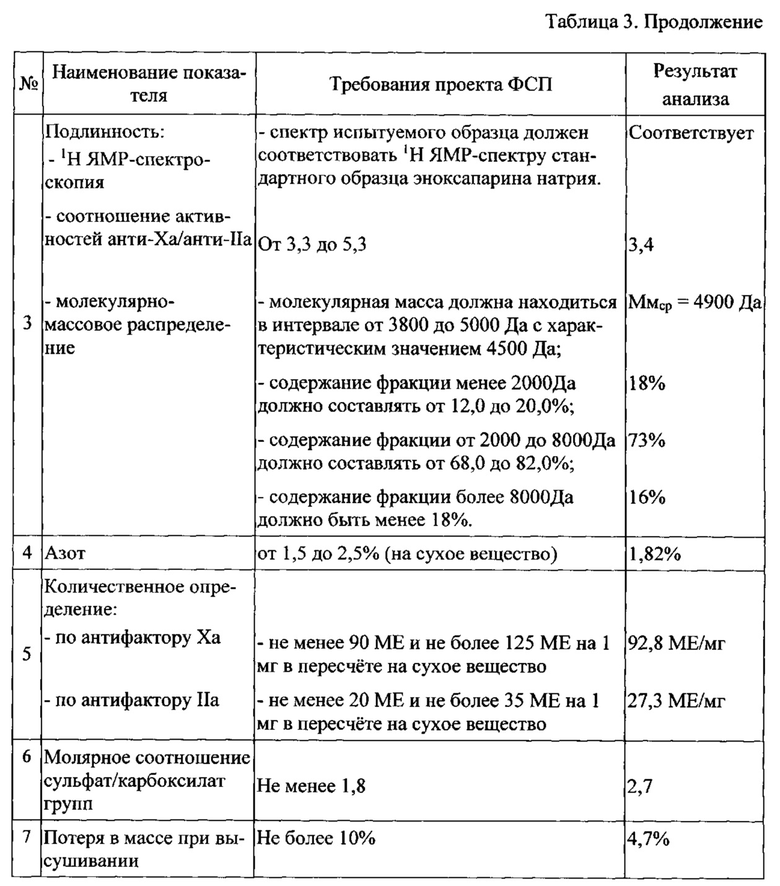
Полученная субстанция охарактеризована показателями, приведенными в таблице 3.

Литература
1. Hirsh J. et al. Clinicalof Chest Physicians Evidence-Based Parenteral Anticoagulants: American College Practice Guidelines (8th Edition) / Chest, 2008, V. 133, pp. 141S-159S.
2. Макаров B.A. и др. Применение гепаринов в клинической практике / РМЖ, 1998, №3, с. 4.
3. Кудрявцев В.Н. / Химия высоких энергий, 1993, Т. 27, №1, С. 41.
4. Авторское свидетельство SU 1570651 A3, опубл. 07.06.1990.
5.Linhardt R.J. et. al. Production and chemical processing of low molecular weight heparins / Seminars in Thrombosis and Hemostasi, 1999, V. 25, N. 3, pp. 5-16; патент US 6384021 B1, опубл. 07.05.2002.
6. Linhardt R.J. et. al. Differential anticoagulant activity of heparin fragments prepared using microbial heparinase / Journal of Biological Chemistry, 1982, V. 257, N. 13, pp. 7310-7313.
7. Патент RU 2295538 C2, опубл. 20.03.2007.
8. Патент RU 2396282 C1, опубл. 10.08.2010.
9. Патент RU 2512768 C1, опубл. 10.04.2014.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ НИЗКОМОЛЕКУЛЯРНОГО ГЕПАРИНА | 2012 |
|
RU2512768C1 |
| СПОСОБ ПОЛУЧЕНИЯ НИЗКОМОЛЕКУЛЯРНОГО ГЕПАРИНА | 2020 |
|
RU2725545C1 |
| СПОСОБ ПОЛУЧЕНИЯ НИЗКОМОЛЕКУЛЯРНОГО ГЕПАРИНА | 2016 |
|
RU2639574C2 |
| Способ получения надропарина кальция | 2020 |
|
RU2753678C1 |
| СМЕСИ ОЛИГОСАХАРИДОВ, ЯВЛЯЮЩИХСЯ ПРОИЗВОДНЫМИ ГЕПАРИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 2004 |
|
RU2346005C2 |
| СМЕСЬ ПОЛИСАХАРИДОВ, ЯВЛЯЮЩИХСЯ ПРОИЗВОДНЫМИ ГЕПАРИНА, ИХ ПОЛУЧЕНИЕ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, ИХ СОДЕРЖАЩИЕ | 2003 |
|
RU2332424C2 |
| СПОСОБ ПОЛУЧЕНИЯ КОМПОЗИЦИЙ НА ОСНОВЕ ВЫСОКОМОЛЕКУЛЯРНОГО ГЕПАРИНА С АМИНОКИСЛОТАМИ И 3-d МЕТАЛЛАМИ | 2015 |
|
RU2592975C1 |
| СПОСОБ ПОЛУЧЕНИЯ НИЗКОМОЛЕКУЛЯРНОГО ГЕПАРИНА - НАДРОПАРИНА КАЛЬЦИЯ | 2024 |
|
RU2837407C1 |
| СПОСОБ ПОЛУЧЕНИЯ НИЗКОМОЛЕКУЛЯРНОГО ГЕПАРИНА | 2007 |
|
RU2377993C2 |
| СПОСОБ ПОЛУЧЕНИЯ ГЕПАРИНА С НИЗКОЙ МОЛЕКУЛЯРНОЙ МАССОЙ И АНТИКОАГУЛЯНТНОЙ АКТИВНОСТЬЮ | 2009 |
|
RU2396282C1 |
Изобретение относится к способу получения низкомолекулярного гепарина, который может быть использован в химико-фармацевтической промышленности. Способ включает стадии:
(а) формирования защиты сульфогрупп взаимодействием высокомолекулярного гепарина с бензетония хлоридом с образованием гепарината бензетония,
(б) этерификации полученной соли бензилированием в апротонном растворителе,
(в) выделения неполного сложного бензилового эфира гепарина с удалением бензетониевой защиты сульфогрупп насыщенным раствором ацетата натрия в спирте,
(г) расщепления макромолекулы гепарина щелочной деполимеризацией и
(д) формирования концевых 1,6-ангидрогрупп β-элиминированием при взаимодействии с сильным восстановителем,
и отличается тем, что на стадии (а) отмывку гепарината бензетония от избытка непрореагировавшего бензетония хлорида производят многократной дробной промывкой водой очищенной с применением ультразвука рабочей частоты 30-40 кГц, мощностью излучения 200-400 Вт, и на стадии (в) выделение сложного бензилового эфира гепарина проводят в две последовательные операции: выделение бензилового эфира гепарината бензетония из раствора осаждением метанольным раствором ацетата натрия с последующим снятием бензетониевой защиты сульфогрупп насыщенным метанольным раствором ацетата натрия. Предложен новый эффективный способ получения низкомолекулярного гепарина с улучшенными показателями чистоты и выхода при снижении расхода воды и снижении количества отходов. 3 з.п. ф-лы, 4 пр., 3 табл., 8 ил.
1. Способ получения низкомолекулярного гепарина, включающий стадии:
(а) формирования защиты сульфогрупп взаимодействием высокомолекулярного гепарина с бензетония хлоридом с образованием гепарината бензетония (ГБ),
(б) этерификации полученной соли бензилированием в апротонном растворителе,
(в) выделения неполного сложного бензилового эфира гепарина с удалением бензетониевой защиты сульфогрупп насыщенным раствором ацетата натрия в спирте,
(г) расщепления макромолекулы гепарина щелочной деполимеризацией и
(д) формирования концевых 1,6-ангидрогрупп β-элиминированием при взаимодействии с сильным восстановителем, отличающийся тем, что на стадии (а) отмывку гепарината бензетония от избытка непрореагировавшего бензетония хлорида производят многократной дробной промывкой водой очищенной с применением ультразвука рабочей частоты 30-40 кГц, мощностью излучения 200-400 Вт, и на стадии (в) выделение сложного бензилового эфира гепарина проводят в две последовательные операции: выделение бензилового эфира гепарината бензетония из раствора осаждением метанольным раствором ацетата натрия с последующим снятием бензетониевой защиты сульфогрупп насыщенным метанольным раствором ацетата натрия.
2. Способ по п. 1 отличающийся тем, что многократную дробную промывку с применением ультразвука осуществляют водой очищенной при массовом соотношении ГБ/вода равном 1/(4-6) и температуре 40-60°C при продолжительности каждого цикла ультразвукового воздействия 10-35 минут.
3. Способ по п. 1 отличающийся тем, что выделение сложного бензилового эфира гепарината бензетония из раствора производят осаждением 1,5-2,5 объемами 8-10% метанольного раствора натрия ацетата при температуре от -2 до 4°C при перемешивании в течение 4-6 часов.
4. Способ по п. 1 отличающийся тем, что удаление бензетониевой защиты сульфогрупп производят после отделения осадка взаимодействием с 4-6-кратным массовым количеством насыщенного метанольного раствора безводного натрия ацетата при температуре 18-24°C при перемешивании в течение 8-10 часов.
| СПОСОБ ПОЛУЧЕНИЯ НИЗКОМОЛЕКУЛЯРНОГО ГЕПАРИНА | 2012 |
|
RU2512768C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГЕПАРИНА С НИЗКОЙ МОЛЕКУЛЯРНОЙ МАССОЙ И АНТИКОАГУЛЯНТНОЙ АКТИВНОСТЬЮ | 2009 |
|
RU2396282C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГЕПАРИНОВ С НИЗКОЙ МОЛЕКУЛЯРНОЙ МАССОЙ | 2005 |
|
RU2295538C2 |
Авторы
Даты
2018-10-25—Публикация
2017-12-26—Подача