Настоящее изобретение касается комбинации, включающей в качестве компонентов (а) как минимум одно соединение 3-(3-диметиламино-1-этил-2-метил-пропил)-фенола и (b) как минимум один NMDA-антагонист, фармацевтической композиции и лекарственной формы, включающей вышеупомянутую комбинацию, а также способа лечения от боли, например, воспалительной боли или невропатической боли, причем компоненты (а) и (b) вводят млекопитающему одновременно или последовательно, и компонент (а) может вводиться до или после компонента (b), и компоненты (а) или (b) вводят млекопитающему одинаковым или разными путями.
Лечение хронических и острых болевых состояний имеет чрезвычайно важное значение в медицине. В настоящее время в мире существует потребность в дополнительном средстве лечения от боли, которое бы изготавливалось не исключительно на основе опиоидов, но при этом было бы высокоэффективным. Назревшая необходимость в принятии мер в отношении ориентированного на пациента и целенаправленного лечения болевых состояний, то есть, успешного и достаточного лечения пациента от боли, задокументирована в большом количестве научных работ, появившихся в последнее время в области прикладной анальгетики и фундаментальных исследованиях по ноцицепции.
Даже если анальгетики, применяемые в настоящее время для лечения от боли, например, опиоиды, ингибиторы обратного захвата NA и 5НТ, НПВС и ингибиторы СОХ, являются анальгетически эффективными, все равно порой случаются побочные эффекты. Иногда комбинации веществ, включающие два различных медикамента, после введения демонстрируют супераддитивный терапевтический эффект. Благодаря такому супераддитивному эффекту, общая доза и, соответственно, риск нежелательных побочных эффектов могут быть снижены. Примеры комбинаций, включающих 3-(3-диметиламино-1-этил-2-метил-пропил)-фенол, раскрываются в WO 2007/128412, WO 2007/128413 и WO 2010/025931.
Таким образом, цель настоящего изобретения состояла в обеспечении других комбинаций, обладающих улучшенными свойствами. Цель настоящего изобретения также состояла в обеспечении других комбинаций, приемлемых для лечения от боли и предпочтительно демонстрирующих меньшее количество побочных эффектов по сравнению с отдельными компонентами при введении в эффективных дозах.
Было обнаружено, что комбинация, включающая (а) как минимум одно соединение 3-(3-диметиламино-1-этил-2-метил-пропил)-фенола и (b) как минимум один антагонист NMDA, демонстрирует анальгетический эффект. Если эти компоненты присутствуют в композиции в таком массовом соотношении, чтобы после введения пациентам наблюдался супераддитивный или синергетический терапевтический эффект, общая вводимая доза может быть снижена, для уменьшения количества нежелательных побочных эффектов.
Соответственно, настоящее изобретение касается фармацевтической комбинации, включающей в качестве компонентов
(а) 3-(3-диметиламино-1-этил-2-метил-пропил)-фенол формулы (I)
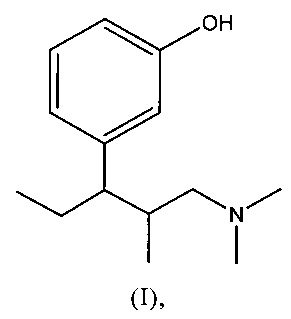
необязательно в форме одного из его чистых стереоизомеров, в частности, энантиомера или диастереомера, рацемата или в форме смеси его стереоизомеров, в частности, энантиомеров и/или диастереомеров в любом соотношении смешивания, или любой его соответствующей кислотной аддитивной соли, и
(b) как минимум один антагонист NMDA.
В одном варианте осуществления комбинации в соответствии с изобретением соединение формулы (I) выбирают из группы, к которой относятся
(1R,2R)-3-(3-диметиламино-1-этил-2-метил-пропил)-фенол,
(1S,2S)-3-(3-диметиламино-1-этил-2-метил-пропил)-фенол,
(1R,2S)-3-(3-диметиламино-1-этил-2-метил-пропил)-фенол,
(1S,2R)-3-(3-диметиламино-1-этил-2-метил-пропил)-фенол и любая их смесь.
В другом варианте осуществления комбинации в соответствии с изобретением соединение формулы (I) выбирают из группы, к которой относятся
(1R,2R)-3-(3-диметиламино-1-этил-2-метил-пропил)-фенол и
(1S,2S)-3-(3-диметиламино-1-этил-2-метил-пропил)-фенол и любая их смесь.
В еще одном варианте осуществления комбинация в соответствии с изобретением включает
(а) соединение (1R,2R)-3-(3-диметиламино-1-этил-2-метил-пропил)-фенол формулы (I'),
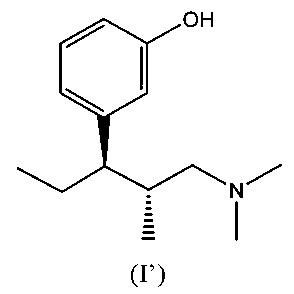
или его кислотную аддитивную соль и
(b) как минимум один антагонист NMDA.
Соединение 3-(3-диметиламино-1-этил-2-метил-пропил)-фенола формулы (I), его стереоизомеры и его соответствующие соли, а также способы его получения хорошо известны, например, из документа US 6,248,737 B1. Соответствующие части описания включены авторами путем ссылки и составляют часть данного описания.
Определение компонента (а) в контексте данного описания включает 3-(3-диметиламино-1-этил-2-метил-пропил)-фенол, его производные и его стереоизомеры в любой возможной форме, включая, в частности, сольваты и полиморфы, соли, в частности, кислотные аддитивные соли, и соответствующие сольваты и полиморфы.
Термин "производная" в контексте данного описания, в частности, включает пролекарства, такие, как эфиры и сложные эфиры активного вещества. Подходящие способы отбора и изготовления пролекарства данного вещества описываются, например, в публикации "Textbook of Drug Design and Discovery", 3rd edition, 2002, chapter 14, pages 410-458, Editors: Krogsgaard-Larsen et al., Taylor and Francis. Соответствующие части описания из вышеупомянутого источника включены путем ссылки и составляют часть данного описания.
Если компонент (а) присутствует как смесь энантиомеров, такая смесь может содержать энантиомеры в рацемической или нерацемической форме. Нерацемическая форма, например, может содержать энантиомеры в соотношении 60±5:40±5, 70±5:30±5, 80±5:20±5 или 90±5:10±5.
Соединение 3-(3-диметиламино-1-этил-2-метил-пропил)-фенола и его стереоизомеры в соответствии с компонентом (а) может присутствовать в фармацевтической композиции согласно изобретению в форме кислотной аддитивной соли, причем может применяться любая подходящая кислота, способная образовывать такую аддитивную соль.
Преобразование 3-(3-диметиламино-1-этил-2-метил-пропил)-фенола в соответствующую аддитивную соль, например, путем реакции с подходящей кислотой, может осуществляться хорошо известным специалистам в данной области способом. Подходящими кислотами, помимо прочих, являются хлористоводородная кислота, бромистоводородная кислота, серная кислота, метансульфоновая кислота, муравьиная кислота, уксусная кислота, оксалатная кислота, янтарная кислота, винная кислота, миндальная кислота, фумаровая кислота, молочная кислота, лимонная кислота, глутаминовая кислота и/или аспарагиновая кислота. Образование соли предпочтительно осуществляют в растворителе, например, диэтиловом эфире, диизопропиловом эфире, алкилацетатах, ацетоне и/или 2-бутаноне. Кроме того, триметилхлоросилан в водном растворе также является подходящим для получения гидрохлоридов.
N-метил-D-аспартатный (NMDA) рецептор является частью системы глутаматергических рецепторов нейротрансмиттеров, так называемого комплекса NMDA-рецептора/ионного канала. Он включает различные сайты связывания, расположенные внутри или снаружи ионного канала. Антагонист NMDA-рецептора или просто NMDA-антагонист представляет собой вещество, взаимодействующее с таким сайтом связывания, и обеспечивает свойства как минимум частичного ингибирования по отношению к вышеупомянутому сайту связывания.
NMDA-антагонисты хорошо известны специалистам в данной области, и к ним, в частности, относятся, помимо прочих, N-содержащие фосфоновые кислоты, такие, как норвалин (АР5), D-норвалин (D-AP5), 4-(3-фосфоно-пропил)-пиперазин-2-карбоновая кислота (СРР), D-(Е)-4-(3-фосфонопроп-2-енил)пиперазин-2-карбоновая кислота (D-СРРен), цис-4-(фосфонометил)-2-пиперидинкарбоновая кислота (Selfotel, CGS 19755), SDZ-220581, PD-134705, LY-274614 и WAY-126090; хинолиновые кислоты, такие, как кинуреновая кислота, 7-хлоро-кинуреновая кислота, 7-хлоро-тиокинуреновая кислота и 5,7-дихлоро-кинуреновая кислота, их пролекарства, такие, как 4-хлорокинуренин и 3-гидроксикинуренин; 4-аминотетрагидрохинолин-карбоксилаты, такие, как L-689,560; 4-гидроксихинолин-2(1Н)-оны, такие, как L-701,324; хиноксалиндионы, такие, как ликостинел (АСЕА-1021) и CGP-68,730A; производные 4,6-дихлоро-индол-2-карбоксилата, такие, как MDL-105,519, гавестинел (GV-150,526) и GV-196,771А; трициклические соединения, такие, как ZD-9,379 и MRZ-2/576, (+)-НА-966, производные морфинана, такие, как декстрометорфан и декстрофан; бензоморфаны, такие, как BIII-277CL; другие опиоиды, такие, как декстропропоксифен, кетобемидон, декстрометадон и D-морфин; амино-адамантаны, такие, как амантадин и мемантин; амино-алкил-циклогексаны, такие, как MRZ-2/579; ифенпродил и ифенпродилоподобные соединения, такие, как элипродил и PD-196,860; иминопиримидины; или другие NMDA-антагонисты, такие, как нитропруссид, D-циклосерин, 1-аминоциклопропан-карбоновая кислота, дизоцилпин (МК 801) и его аналоги, фенциклидин (РСР), кетамин ((R,S)-2-(2-хлорофенил)-2-(метиламино)циклогексан-1-он), (R)-кетамин, (S)-кетамин, ремацемид и его дес-глицинил-метаболит FPL-12,495, AR-R-15,896, метадон, сульфазоцин, AN19/AVex-144, AN2/AVex-73, Besonprodil, CGX-1007, EAB-318, Felbamate и NPS-1407. NMDA-антагонисты описываются, например, в публикации "Analgesics. Edited by H. Buschmann, T. Christoph, E. Friderichs, C. Maul, B. Sundermann, 2002, Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, Германия, в частности, стр. 389-428. Соответствующие части описания включены авторами путем ссылки и составляют часть данного описания.
Известно, что некоторые NMDA-антагонисты, такие, как кетамин и мемантин, могут применяться в лечении от невропатической боли. В одном варианте осуществления настоящего изобретения один или несколько из этих NMDA-антагонистов применяют в качестве компонента (b).
Также включаются стереоизомеры, соли, сольваты, полиморфы и производные компонента NMDA-антагониста, а также смеси любых из вышеперечисленных соединений.
В другом варианте осуществления комбинации в соответствии с изобретением NMDA-антагонистом в соответствии с компонентом (b) является мемантин или его кислотная аддитивная соль, такая, как аддитивная соль гидрохлорида.
В другом варианте осуществления комбинации в соответствии с изобретением NMDA-антагонистом в соответствии с компонентом (b) является кетамин или его кислотная аддитивная соль, такая, как аддитивная соль гидрохлорида.
В еще одном варианте осуществления комбинации в соответствии с изобретением NMDA-антагонистом в соответствии с компонентом (b) является (R,S)-кетамин или его кислотная аддитивная соль, такая, как аддитивная соль гидрохлорида.
В еще одном варианте осуществления комбинации в соответствии с изобретением NMDA-антагонистом в соответствии с компонентом (b) является (S)-кетамин или его кислотная аддитивная соль, такая, как аддитивная соль гидрохлорида.
Другой конкретный вариант осуществления настоящего изобретения касается комбинации, включающей (а) (1R,2R)-3-(3-диметиламино-1-этил-2-метил-пропил)-фенол или его кислотную аддитивную соль, такую, как аддитивная соль гидрохлорида, и (b) мемантин или его кислотную аддитивную соль, такую, как аддитивная соль гидрохлорида.
Еще один конкретный вариант осуществления настоящего изобретения касается комбинации, включающей (а) (1R,2R)-3-(3-диметиламино-1-этил-2-метил-пропил)-фенол или его кислотную аддитивную соль, такую, как аддитивная соль гидрохлорида, и (b) кетамин или его кислотную аддитивную соль, такую, как аддитивная соль гидрохлорида.
Еще один конкретный вариант осуществления настоящего изобретения касается комбинации, включающей (а) (1R,2R)-3-(3-диметиламино-1-этил-2-метил-пропил)-фенол или его кислотную аддитивную соль, такую, как аддитивная соль гидрохлорида, и (b) (R,S)-кетамин или его кислотную аддитивную соль, такую, как аддитивная соль гидрохлорида.
Еще один конкретный вариант осуществления настоящего изобретения касается комбинации, включающей (а) (1R,2R)-3-(3-диметиламино-1-этил-2-метил-пропил)-фенол или его кислотную аддитивную соль, такую, как аддитивная соль гидрохлорида, и (b) (S)-кетамин или его кислотную аддитивную соль, такую, как аддитивная соль гидрохлорида.
Некоторые NMDA-антагонисты включают функциональные группы, например, кислотные группы, такие, как карбоксильные группы, способные образовывать соли с 3-(3-диметиламино-1-этил-2-метил-пропил)-фенольным компонентом формулы (I), таким образом, включая оба компонента (а) и (b) в одной соли.
Таким образом, в другом варианте осуществления настоящего изобретения комбинация в соответствии с изобретением включает компоненты (а) и (b) в форме соли, образовавшейся из этих двух компонентов. Образование такой соли может быть частичным, то есть, композиция согласно изобретению включает один или оба из этих компонентов также в несолевой форме, или же образование соли может быть по сути полным.
Оба компонента (а) и (b) как часть комбинации в соответствии с изобретением могут вводиться в количестве до их максимальной дневной дозы, которая известна специалистам в данной области.
Мемантин предпочтительно вводят пациенту в дневной дозе от 1 до 20 мг.
Рацемический кетамин предпочтительно вводят пациенту в дневной дозе от 0,1 до 10 мг/кг, S-энантиомер кетамина предпочтительно вводят пациенту в дневной дозе от 1 до 10 мг/кг.
Соединение (1R,2R)-3-(3-диметиламино-1-этил-2-метил-пропил)-фенола предпочтительно вводят пациенту в дневной дозе от 25 до 1000 мг, особенно предпочтительно - в дозе от 50 до 800 мг, наиболее предпочтительно - в дозе от 100 до 600 мг.
При введении в составе комбинации в соответствии с изобретением вводимое дневное количество компонента (а) и/или компонента (b) может быть меньшим, чем соответствующая максимальная дневная доза, и может составлять, например, 75±15 мас. %, 75±10 мас. %, 75±5 мас. %, 50±15 мас. %, 50±10 мас. %, 50±5 мас. %, 25±15 мас. %, 25±10 мас. % и 25±5 мас. % для каждого из компонентов.
В другом варианте осуществления настоящего изобретения комбинация в соответствии с изобретением может содержать компоненты (а) и (b) по сути в равноэффективном соотношении.
В еще одном варианте осуществления комбинации в соответствии с изобретением компоненты (а) и (b) присутствуют в таком массовом соотношении, что образовавшаяся в результате композиция обеспечивает супрааддитивный или синергетический эффект после введения пациенту. Подходящие массовые соотношения могут определяться способами, хорошо известными специалистам в данной области.
Компоненты (а) и (b) также могут присутствовать в комбинации в соответствии с изобретением в соотношениях, отличных от равноэффективного соотношения. Например, каждый из компонентов может присутствовать в пределах от 1/50 от равноэффективного количества до 50-кратно превышающего равноэффективное количество, от 1/20 от равноэффективного количества до 20-кратно превышающего равноэффективное количество, от 1/10 от равноэффективного количества до 10-кратно превышающего равноэффективное количество, от 1/5 от равноэффективного количества до 5-кратно превышающего равноэффективное количество, от 1/4 от равноэффективного количества до 4-кратно превышающего равноэффективное количество, от 1/3 от равноэффективного количества до 3-кратно превышающего равноэффективное количество или от 1/2 от равноэффективного количества до 2-кратно превышающего равноэффективное количество.
В другом варианте осуществления настоящего изобретения компоненты (а) и (b) могут вводиться в конкретном режиме дозирования для лечения от боли, например, невропатической боли. Компоненты (а) и (b) могут вводиться одновременно или последовательно, один за другим, в любом из случаев одинаковым или различными путями.
Таким образом, другой аспект настоящего изобретения касается способа лечения от боли, характеризующегося тем, что компоненты (а) и (b) вводят млекопитающему одновременно или последовательно, причем компонент (а) может вводиться до или после компонента (b), и компоненты (а) или (b) вводят млекопитающему одинаковым или разными путями.
Термин "боль" в контексте данного описания включает, помимо прочего, воспалительную боль, невропатическую боль, острую боль, хроническую боль, висцеральную боль, мигреневую боль и раковую боль.
Подходящими способами введения, помимо прочих, являются пероральное, внутривенное, внутриартериальное, внутрибрюшинное, внутрикожное, чрескожное, интратекальное, внутримышечное, интраназальное, трансмукозальное, подкожное и ректальное введение.
Комбинации в соответствии с изобретением являются токсикологически безопасными и, таким образом, подходящими для лечения млекопитающих, в частности, человека, включая младенцев, детей и взрослых.
Таким образом, в еще одном аспекте настоящее изобретение касается фармацевтической композиции, включающей описанную авторами комбинацию согласно изобретению и один или несколько дополнительных агентов.
В еще одном аспекте настоящее изобретение касается фармацевтической лекарственной формы, включающей описанную авторами комбинацию согласно изобретению и один или несколько дополнительных агентов.
В одном варианте осуществления фармацевтическая лекарственная форма согласно изобретению является подходящей для введения перорально, внутривенно, внутриартериально, внутрибрюшинно, внутрикожно, чрескожно, интратекально, внутримышечно, интраназально, трансмукозально, подкожно или ректально.
Композиции и лекарственные формы согласно изобретению могут содержать дополнительные агенты, например, носители, наполнители, растворители, разбавители, красители и/или связующие. Выбор дополнительных агентов и их количества зависит, например, от способа введения медикамента, например, перорального, внутривенного, внутриартериального, внутрибрюшинного, внутрикожного, чрескожного, внутримышечного, интраназального или местного, например, в случаях инфекций кожи, слизистых оболочек или глаз.
Подходящими дополнительными агентами в контексте этого изобретения, в частности, являются любые вещества, известные специалистам в данной области и применяемые для изготовления галеновых препаратов. Примерами подходящих дополнительных агентов, помимо прочих, являются: вода, этанол, 2-пропанол, глицерин, этиленгликоль, пропиленгликоль, полиэтиленгликоль, полипропиленгликоль, глюкоза, фруктоза, лактоза, сахароза, декстроза, меласса, крахмал, модифицированный крахмал, желатин, сорбит, инозит, маннит, микрокристаллическая целлюлоза, метилцеллюлоза, карбоксиметилцеллюлоза, ацетат целлюлозы, шеллак, цетиловый спирт, поливинилпирролидон, парафины, воски, природные и синтетические смолы, гуммиарабик, альгинаты, декстран, насыщенные и ненасыщенные жирные кислоты, стеариновая кислота, стеарат магния, стеарат цинка, стеарат глицерина, лаурилсульфат натрия, пищевые масла, кунжутное масло, кокосовое масло, арахисовое масло, соевое масло, лецитин, лактат натрия, сложный эфир жирной кислоты полиоксиэтилена и полипропилена, сложный эфир жирной кислоты сорбита, сорбиновая кислота, бензойная кислота, лимонная кислота, аскорбиновая кислота, дубильная кислота, хлорид натрия, хлорид калия, хлорид магния, хлорид кальция, оксид магния, оксид цинка, диоксид кремния, оксид титана, диоксид титана, сульфат магния, сульфат цинка, сульфат кальция, поташ, кальция фосфат, дикальцийфосфат, бромид калия, йодид калия, тальк, каолин, пектин, кросповидон, агар и бентонит.
Фармацевтические композиции (лекарственные формы) в форме таблеток, шипучих таблеток, жевательных таблеток, драже, капсул, капель, соков или сиропов являются подходящими, например, для перорального введения. Пероральные фармацевтические композиции также могут быть в форме множества частиц, таких, как гранулы, шариков, сфер, кристаллов и т.п., необязательно спрессованных в таблетку, помещенных в капсулу, помещенных в пакет-саше или суспендированных в подходящей жидкой среде. Пероральные фармацевтические композиции также могут иметь энтеросолюбильное покрытие.
Фармацевтическими композициями, подходящими для парентерального, местного и ингаляционного введения, помимо прочих, являются растворы, суспензии, сухие композиции, легко поддающиеся восстановлению влагосодержания, и аэрозоли.
Суппозитории являются подходящими фармацевтическими композициями для ректального введения. Композиции в форме депо, в растворенной форме, например, в форме пластыря, необязательно с добавлением агентов, способствующих проникновению в кожу, являются примерами подходящих композиций для подкожного введения.
Один или оба из компонентов (а) и (b) могут присутствовать в фармацевтической композиции согласно изобретению как минимум частично в форме контролируемого высвобождения. Кроме того, любая комбинация вышеупомянутых компонентов с контролируемым высвобождением / немедленным высвобождением также может присутствовать в фармацевтической композиции согласно изобретению. Например, один или оба компонента могут высвобождаться из композиций согласно изобретению с определенной задержкой, например, при пероральном, ректальном или подкожном введении. Такие композиции особенно приемлемы для препаратов, назначаемых для введения "один раз в сутки" или "два раза в сутки", которые должны приниматься только раз в день и, соответственно, два раза в день. Приемлемые материалы контролируемого высвобождения хорошо известны специалистам в данной области.
Фармацевтические композиции согласно изобретению могут изготавливаться с применением материалов, средств, устройств и процессов, которые хорошо известны из существующего уровня техники в области производства фармацевтических композиций, как описано, например, в публикации "Remington's Pharmaceutical Sciences", A.R. Gennaro (ed.), 17th edition, Mack Publishing Company, Easton, Pa. (1985), в частности, в части 8, главы с 76 по 93.
Для получения твердой фармацевтической композиции, такой, как, например, таблетка, компоненты фармацевтической композиции гранулируют с фармацевтическим носителем, например, традиционными ингредиентами таблеток, такими, как кукурузный крахмал, лактоза, сахароза, сорбит, тальк, стеарат магния, дикальцийфосфат или фармацевтически приемлемые смолы, и фармацевтическими разбавителями, например, водой, с целью образования твердой композиции, содержащей компоненты в равномерном распределении. Термин "равномерное распределение" означает, что компоненты распределяются равномерно по всей композиции, таким образом, чтобы вышеупомянутая композиция могла быть легко разделена на одинаково эффективные дозированные единицы, такие, как таблетки, пилюли, капсулы и т.п. Затем твердую композицию разделяют на дозированные единицы. Таблетки или пилюли из фармацевтической композиции согласно изобретению также могут быть покрыты или составлены другим способом с целью обеспечения дозированной формы с контролируемым высвобождением.
Если один из компонентов должен высвобождаться перед другим компонентом, например, как минимум за 30 минут или за 1 час до него, приготавливают фармацевтические композиции, обладающие соответствующим профилем высвобождения. Примером такой композиции является осмотически запускаемая система высвобождения для достижения отсроченного высвобождения одного компонента через покрытие, которое само содержит другой компонент, который, соответственно, высвобождается раньше. В системе высвобождения этого типа, которая особенно приемлема для перорального введения, как минимум часть, предпочтительно вся поверхность системы высвобождения, предпочтительно - части, контактирующие со средой высвобождения, является/являются полупроницаемой(ыми), предпочтительно оснащенной(ыми) полупроницаемым покрытием, таким образом, чтобы поверхность(и) была/были проницаемой(ыми) для среды высвобождения, но в значительной мере, предпочтительно полностью, проницаемой(ыми) для активного ингредиента, и поверхность(и) и/или, необязательно, покрытие имеют как минимум одно отверстие для высвобождения активного ингредиента. Кроме того, именно поверхность(и), контактирующая(ие) со средой высвобождения, оснащается(ются) покрытием, содержащим и высвобождающим другой компонент. Предпочтительно это означает систему в форме таблетки, имеющую отверстие для высвобождения, осмотическое ядро из фармацевтической композиции, полупроницаемую оболочку и полимерную часть, создающую давление после набухания. Подходящим примером системы такого типа может быть система, реализуемая ALZA Corporation, США, под торговыми названиями OROS®, в частности, система OROS® Push-Pull™, система OROS® Delayed Push-Pull™, система OROS® Multi-Layer Push-Pull™, система OROS® Push-Stick, а также, в отдельных случаях, L-OROS™.
Варианты осуществления и примеры осмотически запускаемых систем высвобождения описываются, например, в патентах США 4,765,989, 4,783,337 и 4,612,008, соответствующее содержание которых включено авторами путем ссылки, и которые составляют часть описания настоящего изобретения.
Еще одним примером подходящей фармацевтической композиции является гелевая матричная таблетка, такая, как продукты, разрабатываемые Penwest Pharmaceuticals (например, под маркой TimeRX). Подходящие примеры представлены в патентах США 5,330,761, 5,399,362, 5,472,711 и 5,455,046, соответствующее содержание которых включено авторами путем ссылки, и которые составляют часть описания настоящего изобретения. Особенно подходящей является задерживающая матричная композиция с неравномерным распределением фармацевтически активной композиции, в которой, например, один компонент может распределяться во внешней области (части, которая наиболее быстро контактирует со средой высвобождения) матрицы, а другой компонент распределяется внутри матрицы. При контакте со средой высвобождения внешний матричный слой сначала (быстро) набухает и в первую очередь высвобождает первый компонент, с последующим более (значительно) задержанным высвобождением другого компонента. Примерами подходящих матриц могут быть матрицы, включающие от 1 до 80% по массе одного или нескольких гидрофильных или гидрофобных полимеров в качестве фармацевтически приемлемых образователей матрицы. Другой пример подходящей матрицы описывается в патенте США US 4,389,393, соответствующее содержание которого включено путем ссылки и составляет часть описания настоящего изобретения.
Количество фармацевтически активной комбинации согласно изобретению, вводимой пациенту, может быть разным, в зависимости от различных факторов, хорошо известных специалистам в данной области, например, массы пациента, пути введения или серьезности заболевания.
Еще один из аспектов настоящего изобретения касается описанной авторами комбинации для лечения от боли, причем боль предпочтительно выбрана из группы, которой относятся воспалительная боль, невропатическая боль, острая боль, хроническая боль, висцеральная боль, мигреневая боль и раковая боль.
В еще одном аспекте настоящее изобретение касается применения описанной авторами комбинации согласно изобретению для лечения от боли, причем к вышеупомянутой боли, помимо прочих, относятся воспалительная боль, невропатическая боль, острая боль, хроническая боль, висцеральная боль, мигреневая боль и раковая боль.
В другом аспекте настоящее изобретение касается применения описанной авторами комбинации согласно изобретению для изготовления медикамента для лечения от боли, причем к вышеупомянутой боли, помимо прочих, относятся воспалительная боль, невропатическая боль, острая боль, хроническая боль, висцеральная боль, мигреневая боль и раковая боль.
В другом аспекте настоящее изобретение касается способа лечения от боли млекопитающего, предпочтительно человека, причем способ включает введение млекопитающему эффективного количества описанной авторами комбинации согласно изобретению.
Настоящее изобретение также касается комплекта, включающего комбинацию или лекарственные формы, включающие комбинацию отдельных компонентов комбинации.
Фармакологические способы:
Тест Рэндалла-Селитто на крысах
Массовые соотношения компонентов (а) и (b), обеспечивающие супрааддитивный эффект (синергетический эффект) фармацевтической композиции согласно изобретению могут определяться при помощи теста Рэндалла и Селитто, как описывается в публикации Arch. Int. Pharmacodyn., 1957, 111: 409-419, который представляет собой тест механической ноцицепции, который может быть приспособлен для оценки механической гиперанальгезии на моделях воспалительной или невропатической боли. Соответствующие места из литературы включены авторами путем ссылки и составляют часть данного описания.
Острое воспаление вызывается интраплантарной инъекцией 0,1 мл раствора каррагенина (0,5% в дистиллированной воде) в заднюю лапу крысы. Механический ноцицептивный порог измеряют через 4 часа при помощи алгезиметра (Ugo Basile, Италия). Устройство создает механическое усилие с линейным увеличением во времени. Усилие прилагается к дорсальной поверхности воспаленной задней лапы крысы через конусовидный стилус с закругленным концом (диаметр на конце 2 мм). Ноцицептивный порог определяют как силу (в граммах), при которой крыса издает звук (перерезывающая сила 250 г). Механический ноцицептивный порог измеряют в разные моменты времени после введения медикамента или наполнителя. Антиноцицептивная и/или антигипералгезическая активность исследуемого вещества выражается в процентах от максимально возможного эффекта (% МРЕ). Размер группы n=12.
Анализ результатов в отношении супрааддитивного эффекта фармацевтической композиции согласно изобретению, содержащей компоненты (а) и (b), осуществляют путем статистического сравнения теоретического аддитивного значения ED50 с экспериментально определенным значением ED50 так называемой комбинации с фиксированным соотношением (изоболографический анализ согласно публикации Tallarida JT, Porreca F, and Cowan A. Statistical analysis of drug-drug and site-site interactions with isobolograms. Life Sci 1989; 45: 947-961).
Представленные авторами исследования взаимодействия осуществляли с применением равноэффективных доз двух компонентов, рассчитанных на основе соотношения соответствующих значений ED50 компонентов, вводимых отдельно.
Путь введения был внутривенный (i.v.) для (1R,2R)-3-(3-диметиламино-1-этил-2-метил-пропил)-фенол гидрохлорида (далее называемого тапентадол гидрохлоридом) и внутрибрюшинный (i.p.) для кетамин ((R,S)-кетамин гидрохлорида) и мемантина (мемантина гидрохлорида). Когда тапентадол гидрохлорид применяли отдельно, пиковый эффект достигался через 15 мин после введения (момент первого измерения), и рассчитанное значение ED50 составляло 1,75 (1,69-1,81) мг/кг i.v. Кетамин гидрохлорид вызывал зависящий от дозы анальгетический эффект при значении ED50 20,2 (19,0-21,3) мг/кг i. р., соответственно, с достижением пикового эффекта через 15 мин после введения. Согласно соответствующему моменту достижения пикового эффекта, (1R,2R)-3-(3-диметиламино-1-этил-2-метил-пропил)-фенол гидрохлорид вводили за 15 мин и кетамин гидрохлорид вводили за 15 мин до момента измерения в экспериментах взаимодействия (оба компонента применяли одновременно). Мемантин гидрохлорид вызывал зависящий от дозы анальгетический эффект при значении ED50 19,1 (17,0-22,0) мг/кг i. р., соответственно, с достижением пикового эффекта через 15 мин после введения. Согласно соответствующему моменту достижения пикового эффекта, (1R,2R)-3-(3-димeтилaминo-1-этил-2-метил-пропил)-фенол гидрохлорид вводили за 15 мин и мемантин гидрохлорид вводили за 15 мин до момента измерения в экспериментах взаимодействия (оба компонента применяли одновременно).
Таким образом, момент вычисления ED50 обеих комбинаций соответствовал моменту пикового эффекта соответствующего соединения. Изоболографический анализ продемонстрировал, что экспериментальные значения ED50 комбинаций были значительно ниже, чем соответствующие теоретические значения ED50. Таким образом, исследования комбинаций продемонстрировали значительное синергетическое взаимодействие (1R,2R)-3-(3-диметиламино-1-этил-2-метил-пропил)-фенол гидрохлорида с NMDA-антагонистами, кетамин гидрохлоридом и мемантин гидрохлоридом.
Результаты изоболографического анализа показаны ниже в таблице.
Экспериментальные значения ED50 тапентадола гидрохлорида (А) и кетамина гидрохлорида или А и мемантина гидрохлорида, соответственно, и изоболографический анализ взаимодействия между А и этими NMDA-антагонистами:
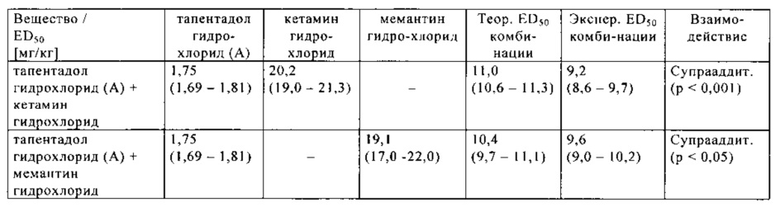
p: уровень статистической значимости
Соотношение доз A с кетамин гидрохлоридом может быть рассчитано как 1:11,5, а соотношение доз A с мемантин гидрохлоридом может быть рассчитано как 1:10,9.
Группа изобретений относится к медицине, в частности к комбинации для лечения боли, фармацевтической композиции, лекарственной форме и способу лечения боли. Комбинация включает в качестве компонентов (а) соединение 3-(3-диметиламино-1-этил-2-метил-пропил)-фенола и (b) как минимум один антагонист NMDA, выбранный из группы, состоящей из (R,S)-кетамина и (S)-кетамина, фармацевтическая композиция и лекарственная форма включают вышеупомянутую комбинацию. Способ лечения от боли, например воспалительной боли или невропатической боли, заключается в том, что компоненты (а) и (b) вводят млекопитающему одновременно или последовательно, и компонент (а) может вводиться до или после компонента (b), и компоненты (а) или (b) вводят млекопитающему одинаковым или разными путями. Осуществление изобретения позволяет получить средство для лечения боли, обладающее повышенным анальгетическим эффектом. 4 н. и 10 з.п. ф-лы, 1 табл.
1. Комбинация для лечения от боли, включающая в качестве компонентов:
(a) (1R,2R)-3-(3-диметиламино-1-этил-2-метил-пропил)-фенол формулы (I'),
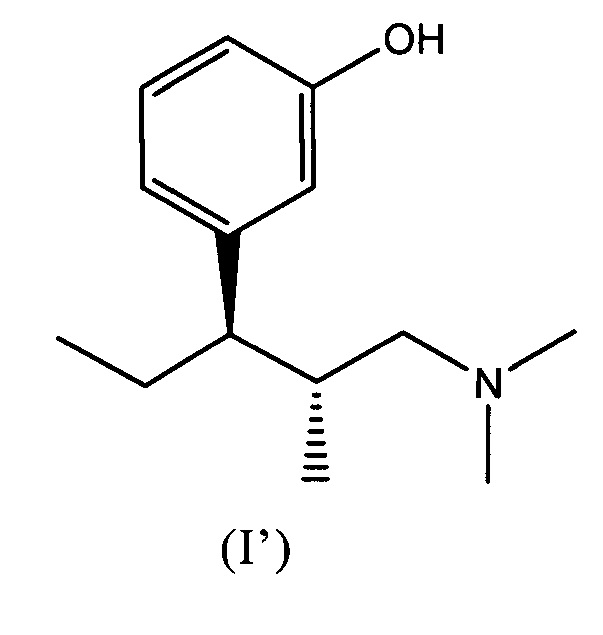
в форме его кислотной аддитивной соли гидрохлорида, и
(b) как минимум один антагонист NMDA, выбранный из группы, состоящей из (R,S)-кетамина или его кислотной аддитивной соли, (S)-кетамина или его кислотной аддитивной соли и мемантина или его кислотной аддитивной соли.
2. Комбинация по п. 1, отличающаяся тем, что компоненты (а) и (b) присутствуют в массовом соотношении 1:10,9 или 1:11,5, где образовавшаяся в результате композиция обеспечивает синергетический эффект после введения пациенту.
3. Комбинация по п. 1 или 2, где боль выбрана из воспалительной боли, невропатической боли, острой боли, хронической боли, висцеральной боли, мигреневой боли и раковой боли.
4. Комбинация по п. 3, где боль является воспалительной болью.
5. Фармацевтическая композиция для лечения от боли, включающая комбинацию по любому из пп. 1-4.
6. Фармацевтическая композиция по п. 5, дополнительно содержащая один или несколько фармацевтически приемлемых дополнительных агентов, выбранных из группы, состоящей из носителей, наполнителей, растворителей, разбавителей, красителей и/или связующих.
7. Лекарственная форма для лечения от боли, включающая комбинацию по любому из пп. 1-4.
8. Лекарственная форма по п. 7, дополнительно содержащая один или несколько фармацевтически приемлемых дополнительных агентов, выбранных из группы, состоящей из носителей, наполнителей, растворителей, разбавителей, красителей и/или связующих.
9. Лекарственная форма по п. 7 или 8, отличающаяся тем, что является приемлемой для перорального, внутривенного, внутриартериального, внутрибрюшинного, внутрикожного, чрескожного, интратекального, внутримышечного, интраназального, трансмукозального, подкожного или ректального введения.
10. Лекарственная форма по любому из пп. 7-9, отличающаяся тем, что один или оба из компонентов (а) и (b) присутствуют в форме контролируемого высвобождения.
11. Способ лечения от боли млекопитающего, включающий введение млекопитающему эффективного количества комбинации по любому из пп. 1-4.
12. Способ по п. 11, отличающийся тем, что компонент (а) и компонент (b) комбинации вводят млекопитающему одновременно или последовательно, причем соединение (а) может вводиться до или после соединения (b), и соединения (а) или (b) вводят млекопитающему одинаковым или различными путями.
13. Способ по п. 11 или 12, отличающийся тем, что боль выбрана из воспалительной боли, невропатической боли, острой боли, хронической боли, висцеральной боли, мигреневой боли и раковой боли.
14. Способ по п. 13, отличающийся тем, что боль является воспалительной болью.
| Фармакология / Д.А | |||
| Харкевич // Издание третье | |||
| Москва: "Медицина" | |||
| Кузнечная нефтяная печь с форсункой | 1917 |
|
SU1987A1 |
| Способ запрессовки не выдержавших гидравлической пробы отливок | 1923 |
|
SU51A1 |
| WO 03053427 A1, 03.07.2003 | |||
| WO 2009067703 A2, 28.05.2009. | |||
Авторы
Даты
2018-12-18—Публикация
2016-05-17—Подача