Изобретение относится к химии, а именно к N-(2,3-диметил-1Н-индол-7-ил)-2,2,2-трифторацетамиду и N-(1,2,3-триметил-1Н-индол-7-ил)-2,2,2-трифторацетамиду, которые могут быть использованы в медицинской практике в качестве средств, обладающих противомикробным действием.
Необходимость поиска новых высокоэффективных и безопасных противомикробных соединений закреплена в Российской Федерации на законодательном уровне [1]. Одним из основных современных направлений в разработке противомикробных соединений является синтез аналогов и производных уже исследованных препаратов. В настоящее время имеется более пятнадцати миллионов химических соединений с противомикробной активностью, выделенных из природных источников и полученных химическим синтезом, но лишь десятки удовлетворяют требованиям, предъявляемым по противомикробному действию и биологической безопасности [2-4]. Проблема резистентности как к антибиотикам, так и дезинфектантам, становится все более актуальной и тревожной в XXI веке. Так как бесконтрольное применение противомикробных средств в пищевой промышленности в качестве консервантов, в животноводстве и в сельском хозяйстве в качестве дезинфектантов и химиотерапевтических средств неизбежно влечет формирование устойчивости микроорганизмов к наиболее часто применяемым антимикробным препаратам. В большинстве регионов мира и в России, в том числе, получают распространение антибиотикорезистентные штаммы, как грамположительных (стафилококки, энтерококки), так и грамотрицательных бактерий (энтеробактерии, псевдомонады и др.) [5-9]. Ежегодно от инфекционной патологии в мире погибают около двадцати миллионов человек. Ежегодная заболеваемость инфекционными заболеваниями исчисляется сотнями миллионов случаев. Трудности лечения и профилактики инфекционных заболеваний, обусловленные разнообразием биологических форм возбудителей, колоссальной адаптационной способностью микроорганизмов и постоянным возникновением форм с множественной резистентностью, появлением новых видов микроорганизмов, определяют актуальность проблемы создания новых противомикробных средств [10-12]. А перспективы разработки и внедрения новых антимикробных средств выглядят довольно удручающими [1]. При проведении микробиологического мониторинга в 2013-2014 гг. был отмечен возросший удельный вес полирезистентных метицилинрезистентных штаммов S.aureus, P.aeruginosa, множественная лекарственная устойчивость семейства Enterobacteriaceae к трем и более препаратам антимикробного действия [11-14]. В современных условиях, исследования которые базируется на одном из фундаментальных принципов преодоления резистентности микроорганизмов - поиск новых соединений с антимикробной активностью и, может быть, с иным механизмом действия - несомненно, вызывают интерес [1, 13].
Замещенные аминоиндолы с аминогруппой в бензольном кольце известны как исходные соединения для получения индолиламидов, индолиленаминокетонов, пирролоиндолов, пирролохинолинов. Многие из полученных продуктов показывают различного рода биологическую активность. Так у амидов, пирролохинолинов на основе 4,7-аминоиндолов и трифторацетоуксусного эфира обнаружена достаточно высокая противомикробная активность [14, 15]. В связи с этим является важным изучение реакции 2,3-диметил- и 1,2,3-триметил-7-аминоиндолов с этиловым эфиром трифторуксусной кислоты с целью разработки способа получения соответствующих (индолил)трифторацетамидов и их лабораторное исследование на противомикробную активность.
Наиболее близким техническим решением к заявленному изобретению является способ получения трифторметилсодержащих N-(индолил)ациламидов ацилированием этиловым эфиром трифторацетоуксусной кислоты 2,3-диметил- и 1,2,3-триметил-7-аминоиндолов [16].
Недостатком известного способа является образование в реакции наряду с индолиламидами побочных енаминокетонов, при очистке от которых уменьшается выход целевого продукта.
Заявленные соединения, их противомикробные свойства и способ получения в литературе не описаны.
Технический результат заключается в получении новых соединений N-(индолил)ациламидов с высоким выходом, обладающих эффективным противомикробным действием.
Указанный технический результат достигается за счет использования в качестве ацилирующего агента более доступного соединения - этилового эфира трифторуксусной кислоты.
Сущность изобретения заключается в том, что в способе получения N-(индолил)трифторацетамидов общей формулы (1), которые по данным хроматографического и спектральных анализов, могут находиться в растворах в двух таутомерных формах: в ДМСО-d6 N-(2,3-диметил-1Н-индол-7-ил)-2,2,2-трифторацетамид (а) и N-(1,2,3-триметил-1Н-индол-7-ил)-2,2,2-трифторацетамид (преимущественно b):
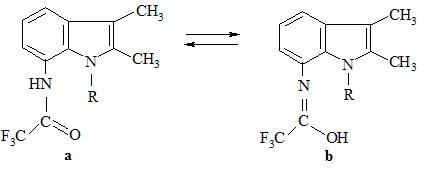 (1)
(1)
где R=H, СН3, аминоиндолы общей формулы (2)
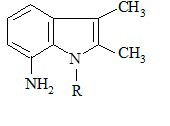 (2)
(2)
где R=H, СН3, в кипящем бензоле с каталитическими количествами ледяной уксусной кислоты подвергают взаимодействию с ацилирующим агентом.
В качестве ацилирующего агента используют этиловый эфир трифторуксусной кислоты общей формулы (3);
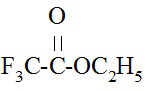 (3)
(3)
Сущность изобретения также заключается в применении N-(индолил)трифторацетамидов общей формулы (1) для получения синтетических лекарственных препаратов, обладающих эффективным противомикробным действием.
В табл. 1 показано определение минимальных подавляющих концентраций (МПК) исследуемых соединений методом серийных разведений в жидкой питательной среде; в табл. 2 - определение МПК исследуемых соединений методом серийных разведений в жидкой питательной среде.
Сведения, подтверждающие достижение технического результата, представлены в нижеследующих примерах.
Пример 1. N-(2,3-диметил-1Н-индол-7-ил)-2,2,2-трифторацетамид
В раствор 0,32 г (2 ммоль) 2,3-диметил-7-аминоиндола в 150 мл абсолютного бензола добавляют 5 мл (избыток) этилового эфира трифторуксусной кислоты, каталитическое количество ледяной уксусной кислоты и кипятят с эффективным обратным холодильником до тех пор, пока не исчезнет исходный амин (хроматографический контроль). По окончании реакции (кипячение в течение 20-30 ч) из реакционной смеси досуха отгоняют бензол, избыток эфира, следы уксусной кислоты. Твердый остаток растворяют в хлороформе и пропускают через слой оксида алюминия. Выход индолилтрифторацетамида составляет 57 % , т.пл. 119-121°С, Rf=0,12, 0,83 (бензол-этилацетат 5:1). Найдено, %: C 56,03; Н 4,19; М 256 (масс-спектрометрически). C12H11F3N2O. Вычислено, %: C 56,25; Н 4,33; М 256. УФ спектр (этанол) λmax (lg έ): 213 (4,47), 231 (4,37), 298 (3,95); спектр ЯМР1Н (ДМСО-d6): 212 (3Н, с, 3-СН3), 2,30 (3Н, с, 2-СН3), 6,92 (1Н, т, J=8 Гц, Н-5), 7,00 (1Н, д, J =8 Гц, Н-6), 7, 27 (1Н, д, J =8 Гц, Н-4), 10,57 (1Н, с, 1-Н), 10,91 (1Н. с, Н-N) м.д. Масс-спектр Jm/z (% к Jmax): 256 (100), 255 (34,13), 241 (10,61), 237 (15,82), 223 (10,81), 185 (5,61),159 (7,71), 69 (7,11), 28 (7,41), 18 (17,22).
Пример 2. N-(1,2,3-триметил-1Н-индол-7-ил)-2,2,2-трифторацетамид
Получают аналогично примеру 1 из 0,35 г (2ммоль) 1,2,3-триметил-7-аминоиндола, но для окончания реакции реакционную смесь нагревают в течении 40-50 ч. Полученный амид очищают на колонке с окисью алюминия в системе хлороформ-петролейный эфир 5:1. Выход составляет 65 %, т.пл. 126-128°С, Rf=0,21, 0,87 (бензол-этилацетат 5:1). Найдено, %: C 57,32; Н 4,70; M 270 (масс-спектрометрически). C13H13F3N2O. Вычислено, %: C 57,48, Н 4,85; M 270. УФ спектр (этанол) λmax(lg έ)): 212пл (4,40), 232 (4.73), 290 (4,15), спектр ЯМР 1Н (ДМСО-d6) (a) таутомерной формы: 2,18 (3Н, с, 3-СН3), 2,30 (3Н, с, 2-СН3), 3,69 (3Н, с, 1-СН3), 6,88 (1Н, д, J=8 Гц, Н-6), 6,99 (1Н, т, J=8 Гц, Н-5), 7,42 (1Н, д, J=8 Гц, Н-4), 11,35 (1Н, С, Н-N) м.д.; (b) таутомерной формы: 2,18 (3Н, с, 3-СН3), 2,31 (3Н, с, 2-СН3), 3,94 (3Н, с, 1-СН3), 6,99 (1Н, т, J=8 Гц, Н-5), 7,17 (1Н, д, J=8 Гц, Н-6), 7,36 (1Н, с, Н-О), 7,42 (1Н, д, J=8 Гц, Н-4) м.д. Соотношение (a) к (b) согласно интегральной интенсивности характеристических сигналов в ЯМР 1Н спектре составляет 1:3. Масс-спектр Jm/z (% к Jmax): 270 (100), 269 (18,62), 255 (16,52), 239 (6,71), 214 (24,52), 201 (8,0), 199 (15,02), 185 (6,51), 184 (10,31), 183 (8,81), 69 (10,51), 28 (10,71).
Спектры ЯМР 1Н записаны на мультиядерном спектрометре ядерного магнитного резонанса «Joel JNM-ECX400» (400 МГц) в ДМСО-d6. Электронные спектры получены на приборе «LEKI SS2109UV» в этаноле. Масс-спектры зарегистрированы на масс-спектрометре «Finnigan MAT INCOS-50» с прямым вводом образца в ионный источник при энергии ионизации 70 эВ. Названия аминам, амидам даны по правилам компьютерной программы ACD/LABS IUPAC Name Generator. Структурные формулы соединений нарисованы в компьютерной программе ISIS Draw 2,4. Очистку продуктов реакции проводили методом колоночной хроматографии. В качестве сорбента использовали оксид алюминия (нейтральный, I и II ст. акт. по Брокману). Контроль за ходом реакций, чистотой полученных соединений, определение Rf осуществляли с помощью ТСХ на пластинках Silufol UV-254 (система указана конкретно для каждого соединения в методике эксперимента).
Пример 3. Исследование противомикробной активности N-(2,3-диметил-1Н-индол-7-ил)-2,2,2-трифторацетамида и N-(1,2,3-триметил-1Н-индол-7-ил)-2,2,2-трифторацетамида
При проведении микробиологического эксперимента исследуемые соединения использовали в виде раствора (в качестве растворителя применяли «Димексид» для приготовления растворов наружного применения, производство ОАО «Марбиофарм). В качестве тест-микроорганизмов при изучении противомикробной активности соединений общей формулы (1) использовали музейные штаммы: Staphylococcus aureus 6538-Р АТСС Escherichia coli 25922 АТСС, Pseudomonas aeruginosa 27853 АТСС, Streptococcus pyogenes 19615 АТСС, Klebsiella pneumoniae 13883 АТСС, Enterococcus faecalis 19433 АТСС. Музейные штаммы, используемые в работе, получены из коллекции музея живых культур ФГБУ «НЦЭСМП» Минзрава России, Becton Dickinson France S.A.S. Определение антимикробной активности амидов общей формулы (1) проводили методом серийных разведений в бульоне (макрометодом «пробирочным») (МУК 4.2.1980-04). В качестве препарата сравнения использовался противомикробный препарат диоксидин (производное ди-N-оксихиноксалина) (производство «Биосинтез», раствор для местного применения, эндотрахеального и внутривенного введения, 10 мг/мл), широко применяемый в лечебной практике. Этот препарат обладает высокой химиотерапевтической активностью in vivo на модельных инфекциях, близких по патогенезу к патологическим процессам у человека (гнойные менингиты, пиелонефриты, септикопиемии) и вызванных штаммами анаэробных бактерий, устойчивых (в том, числе полирезистентных) к препаратам других классов, включая штаммы синегнойной палочки и метициллинустойчивых стафилококков. Диоксидин характеризуется широким антибактериальным спектром с бактерицидным действием, активен также в отношении грамположительных и грамотрицательных аэробных условно-патогенных бактерий. Показана активность диоксидина в отношении микобактерий туберкулеза. Для препарата сравнения диоксидина МПК относительно штаммов Staphylococcus spp. составляет 125,0-1000,0 мкг/мл, Escherichia coli 8,0-250,0 мкг/мл, Pseudomonas spp. 125,0-1000,0 мкг/мл, Streptococcus spp. 64,0-1000,0 мкг/мл [17].
Для оценки чувствительности микроорганизмов использовали Мюллер-Хинтон бульон (МХБ), разрешенный к применению в Российской Федерации в установленном порядке и по своим характеристикам удовлетворяющий требованиям. Внутрилабораторный контроль качества среды проводили при использовании всех сред, разрешенных к применению в Российской Федерации в установленном порядке. Концентрация суспензии исследуемого микроорганизма составляла 1,5×108 КОЕ/мл. Оптическая плотность бактериальной суспензии с концентрацией 1,5×108 КОЕ/мл при визуальном контроле соответствовала стандарту мутности 0,5 по Мак-Фарланду. В работе использовали коммерческий стандарт мутности. Бактериальную суспензию готовили из агаровых культур. Для приготовления инокулюма использовали чистую суточную культуру микроорганизмов, выросших на плотных питательных средах. Отбирали несколько однотипных, четко изолированных колоний, выросших на неселективных плотных питательных средах. Петлей переносили незначительное количество материала с верхушек колоний в пробирку со стерильным физиологическим раствором, доводя плотность инокулюма точно до 0,5 по стандарту Мак-Фарланда. Инокулюм использовали в течение 15 мин после приготовления.
Пример 4. Метод серийных разведений в бульоне - макрометод (пробирочный)
Тестирование проводили в объеме 1 мл каждого разведения исследуемого соединения с конечной концентрацией исследуемого микроорганизма примерно 5×105 КОЕ/мл. МХБ для определения чувствительности разливали по 0,5 мл в каждую пробирку. Количество пробирок составило девять штук плюс одна для постановки «отрицательного» контроля, то есть десять. Рабочий раствор исследуемого соединения готовили из основного раствора с использованием жидкой питательной среды - МХБ. Затем рабочий раствор в количестве 0,5 мл при помощи микропипетки со стерильным наконечником вносили в первую пробирку, содержащую 0,5 мл бульона. Тщательно перемешивали и новым стерильным наконечником переносили 0,5 мл раствора исследуемого соединения в бульоне во вторую пробирку, содержавшую первоначально 0,5 мл бульона. Эту процедуру повторяли, пока не был приготовлен весь необходимый ряд разведений. Из последней пробирки 0,5 мл бульона удаляли. Таким образом, получали ряд пробирок с растворами исследуемого соединения, концентрации которых отличались в соседних пробирках в 2 раза. Для инокуляции использовали стандартную микробную взвесь эквивалентную 0,5 по стандарту Мак-Фарланда, разведенную в 100 раз на МХБ, после чего концентрация микроорганизма в ней составляла примерно 106 КОЕ/мл. По 0,5 мл инокулюма вносили в каждую пробирку, содержащую по 0,5 мл соответствующего разведения исследуемого соединения, и в одну пробирку с 0,5 мл МХБ без антибиотика («отрицательный» контроль). Конечная концентрация микроорганизма в каждой пробирке составила примерно 5×105 КОЕ/мл. Инокулюм вносили в пробирки с разведениями исследуемого соединения не позднее 15-30 мин с момента приготовления. Пробирки закрывали стерильными ватно-марлевыми пробками и все, кроме пробирки «отрицательный» контроль, инкубировали в обычной атмосфере при температуре 37°С в течение 16-20 или 20-24 ч (в зависимости от вида тестируемого микроорганизма). Пробирку «отрицательный» контроль помещали в холодильник при 4°С, где хранили до учета результатов. Для определения наличия роста микроорганизма пробирки с посевами просматривали в проходящем свете. Рост культуры в присутствии исследуемого соединения сравнивали с референтной пробиркой («отрицательный» контроль), содержащей исходный инокулюм и хранившейся в холодильнике. МПК определяли по наименьшей концентрации исследуемого соединения, которая подавляет видимый рост микроорганизма.
Относительно тест-штаммов микроорганизмов N-(2,3-диметил-1Н-индол-7-ил)-2,2,2-трифторацетамид проявляет следующую активность: для S. aureus 6538-Р АТСС МПК исследуемого соединения составили 31,3 мкг/мл; E. coli 25922 АТСС - 125 мкг/мл, P. aeruginosa 27853 АТСС - 125 мкг/мл, S. pyogenes 19615 АТСС - 31,3 мкг/мл, Klebsiella pneumoniae 13883 АТСС - более 250 мкг/мл., N-(1,2,3-триметил-1Н-индол-7-ил)-2,2,2-трифторацетамид: для S. aureus 6538-Р АТСС МПК исследуемого соединения составили 62,3 мкг/мл; E.coli 25922 АТСС - 200 мкг/мл, P. aeruginosa 27853 АТСС - 125 мкг/мл, S. pyogenes 19615 АТСС - 31,3 мкг/мл, Klebsiella pneumoniae 13883 АТСС - 125 мкг/мл., Enterococcus faecalis 19433 АТСС - 125 мкг/мл, что сравнимо с противомикробной активностью препарата сравнения диоксидина. Таким образом, заявленные соединения обладают противомикробной активностью, сопоставимой с активностью препарата сравнения диоксидина.
Изобретение позволяет получить новые соединения N-(индолил)ациламидов с высоким выходом, обладающих эффективным противомикробным действием.
Источники информации:
1. Распоряжение Правительства РФ от 25 сентября 2017 г. №2045-р «О стратегии предупреждения распространения антимикробной резистентности в РФ на период до 2030 г.».
2. Антибактериальная терапия: практическое руководство / под ред. Л.С. Страчунского [и др.] // М.: Медицина, 2000. - 190 с.
3. Антибактериальная терапия : практическое руководство / под ред. Л.С. Страчунского [и др.] // М.: Медицина, 2003. - 191 с.
4. Практическое руководство по антиинфекционной химиотерапии / под ред. Л.С. Страчунского, Ю.Б. Белоусова, С.Н. Козлова // НИИАХ СГМА, 2007. - 420 с.
5. Зеленая К.В. Антибиотикорезистентность как глобальная проблема общества / К.В. Зеленая [и др.] // Научно-методический электронный журнал Концепт. - 2017. - Т. 42. - С. 38-41.
6. Эйдельштейн М.В. Антибиотикорезистентность нозокомиальных штаммов Pseudomonas aeruginosa в стационарах России: результаты многоцентрового эпидемиологического исследования «Марафон» 2013-2014 / М.В. Эйдельштейн [и др.] // Клиническая микробиология и антимикробная химиотерапия. - 2017. - Т. 19. - № 1. - С. 37-41.
7. Сухорукова М.В. Антибиотикорезистентность нозокомиальных штаммов Acinetobacter spp. в стационарах России: результаты многоцентрового эпидемиологического исследования «Марафон» 2013-2014 / М.В. Сухорукова [и др.] // Клиническая микробиология и антимикробная химиотерапия. - 2017. - Т. 19. - № 1. - С. 42-48.
8. Сухорукова М.В. Антибиотикорезистентность нозокомиальных штаммов Enterobacteriaceae в стационарах России: результаты многоцентрового эпидемиологического исследования «Марафон» 2013-2014 / М.В. Сухорукова [и др.] // Клиническая микробиология и антимикробная химиотерапия. - 2017. - Т. 19. - № 1. - С. 49-56.
9. Романов А.В. Антибиотикорезистентность нозокомиальных штаммов Staphylococcus aureus в стационарах России: результаты многоцентрового эпидемиологического исследования «Марафон» 2013-2014 / А.В. Романов [и др.] // Клиническая микробиология и антимикробная химиотерапия. - 2017. - Т.19. - № 1. - С. 57-62.
10. Козлов Р.С. Антибиотикорезистентность грамположительных возбудителей осложненных интраабдоминальных инфекций в России / Р.С. Козлов [и др.] // Клиническая микробиология и антимикробная химиотерапия. - 2015. - Т. 17. - № 3. - С. 227-234.
11. Тотолян А.А. Прошлое и настоящее Streprococcus pyogenes: некоторые факторы патогенности и их генетическое детерминирование / А.А. Тотолян // Вестник РАМН. - 2015. - № 1. - С. 63-69.
12. Розова Л.В. Антибиотикорезистентность возбудителей хронического и посттравматического остеомиелита [Текст] / Л.В. Розова, Н.В. Годовых // Клиническая микробиология и антимикробная химиотерапия. - 2016. - Т. 18. - № 1. - С. 63-68.
13. Косинец А.Н. Антибиотикорезистентность. Новые возможности антибактериального воздействия / А.Н. Косинец [и др.] // Вестник Витебского государственного медицинского университета. - 2014. - Т. 13. - № 2. - С. 70-77.
14. Степаненко И.С. Изучение противомикробной активности фторзамещенных пирролохинолинов / И.С. Степаненко, А.И. Котькин, С.А. Ямашкин // Фундаментальные исследования. - 2013. - № 8. - С. 1406-1410.
15. Алямкина Е.А. Соединения с потенциальной антибактериальной активностью на основе 4-амино-2-фенилиндола / Е.А. Алямкина, И.С. Степаненко, С.А. Ямашкин [и др.] // Вестник Московского университета. Сер. 2. Химия. - 2016. - Т. 57. - № 6. - С. 410-417.
16. Ямашкин С.А. Синтез функционально замещенных пирроло[3,2-h]хинолинов из 2,3-диметил-, 1,2,3-триметил-7-аминоиндолов / С.А. Ямашкин, Г.А. Романова, И.С. Романова, М. А. Юровская // Химия гетероциклических соединений. - 2003. - № 8. - С. 1202-1211.
17. Падейская Е.Н. Антибактериальный препарат диоксидин: особенности биологического действия и значение в терапии различных форм гнойной инфекции / Е.Н. Падейская // Инфекции и антимикробная терапия. - 2011. - Т. 3 - № 5.- С.105-155.
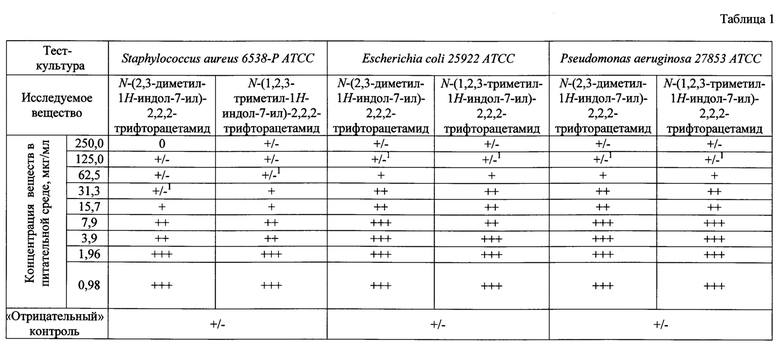
Примечание: - 1 титр активности, «+++» - обильный рост; «++» - глубинный или поверхностный рост штаммов менее обилен; «+» - рост слабый - неактивный менее 50-30%; «+/-, 0» - более 70% задержки или отсутствие роста культуры по сравнению с контролем
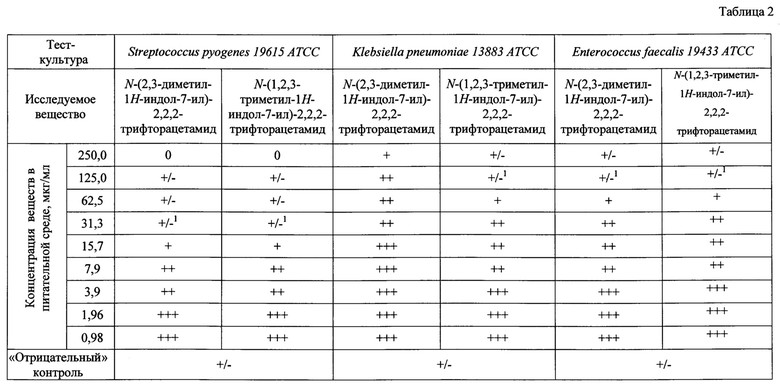
Примечание: - 1 титр активности, «+++» - обильный рост; «++» - глубинный или поверхностный рост штаммов менее обилен; «+» - рост слабый - неактивный менее 50-30%; «+/-, 0» - более 70% задержки или отсутствие роста культуры по сравнению с контролем
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения трифторацетатов замещенных 6-аминоиндолов, обладающих противомикробным действием | 2019 |
|
RU2721833C1 |
| Способ получения монохлорацетатов замещенных 5-,6-,7-аминоиндолов, обладающих противомикробным действием | 2019 |
|
RU2724605C1 |
| Способ определения типа противомикробного действия соединения, обладающего антимикробной активностью | 2018 |
|
RU2687264C1 |
| СПОСОБ ПРЕОДОЛЕНИЯ УСТОЙЧИВОСТИ К ГЕНТАМИЦИНУ У МЕТИЦИЛЛИНОРЕЗИСТЕНТНЫХ ШТАММОВ СТАФИЛОКОККА | 2013 |
|
RU2553601C2 |
| ПРОТИВОМИКРОБНОЕ СРЕДСТВО | 2014 |
|
RU2556509C2 |
| АНТИСЕПТИЧЕСКОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2017 |
|
RU2641309C1 |
| Четвертичная аммониевая соль, обладающая антимикотической и антибактериальной активностью | 2018 |
|
RU2666544C1 |
| 6-(п-ТОЛИЛ)-2-ФЕНИЛ-5-(2,2,2-ТРИХЛОРАЦЕТИЛ)-4Н-1,3-ДИОКСИН-4-ОН, ПРОЯВЛЯЮЩИЙ ПРОТИВОМИКРОБНУЮ АКТИВНОСТЬ | 2022 |
|
RU2781220C1 |
| (Е)-4-((5-(4-БРОМФЕНИЛ)-1-((2,4-ДИНИТРОФЕНИЛ)АМИНО)-2-ОКСО-1,2-ДИГИДРО-3Н-ПИРРОЛ-3-ИЛИДЕН)АМИНО)-1,5-ДИМЕТИЛ-2-ФЕНИЛ-1,2-ДИГИДРО-3Н-ПИРАЗОЛ-3-ОН, ОБЛАДАЮЩИЙ ПРОТИВОМИКРОБНОЙ АКТИВНОСТЬЮ | 2021 |
|
RU2776067C1 |
| Ионные жидкости как антимикробные препараты | 2015 |
|
RU2610208C1 |
Изобретение относится к области химии, а именно к способу получения N-(2,3-диметил-1Н-индол-7-ил)-2,2,2-трифторацетамида и N-(1,2,3-триметил-1Н-индол-7-ил)-2,2,2-трифторацетамида, которые могут найти применение для получения лекарственных препаратов, обладающих противомикробным действием. Способ заключается во взаимодействии соответствующего аминоиндола с этиловым эфиром трифторуксусной кислоты. 2 н.п. ф-лы, 2 табл., 4 пр.
1. Способ получения N-(индолил)трифторацетамидов общей формулы (1), находящихся в растворах в двух таутомерных формах N-(2,3-диметил-1H-индол-7-ил)-2,2,2-трифторацетамид и N-(1,2,3-триметил-1H-индол-7-ил)-2,2,2-трифторацетамид
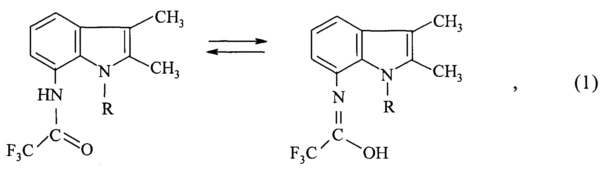
где R=H, СН3, в котором аминоиндолы общей формулы (2)

где R=H, СН3, в кипящем бензоле с каталитическими количествами ледяной уксусной кислоты подвергают взаимодействию с ацилирующим агентом - этиловым эфиром трифторуксусной кислоты общей формулы (3)

2. Применение N-(индолил)трифторацетамидов общей формулы (1), которые получают способом по п. 1 формулы изобретения, для получения лекарственных препаратов, обладающих противомикробным действием.
| WO 2013029338 A1, 07.03.2013 | |||
| С.А | |||
| Ямашкин, Е.А | |||
| Орешкина, М.А | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
Авторы
Даты
2018-12-25—Публикация
2018-07-20—Подача