Изобретение относится к области медицины, а именно к клинической микробиологии и антимикробной химиотерапии, и касается разработки и создания новых комбинаций, обеспечивающих потенцирование бактерицидного действия и эффективное подавление гнойной инфекции, вызываемой метициллинорезистентными стафилококками, на основе использования двух классов соединений, обладающих принципиально различным механизмом антимикробного действия.
Нарастание антибиотикорезистентности бактерий является серьезной, глобальной проблемой. Из известных в настоящее время более 30 видов стафилококков основное клиническое значение имеют Staphylococcus aureus и Staphylococcus epidermidis. Наиболее трудными для лечения являются инфекции, вызванные метициллинорезистентными штаммами S. aureus (MRSA) и S. epidermidis (MRSE). Повсеместная распространенность MRSA и частота их выявления постоянно растет, при этом метициллинорезистентные возбудители вызывают развитие инфекционного процесса не только у госпитализированных больных и медицинского персонала, но и среди населения в целом [Herold B.C., Immergluck L.C., Maranan M.C., Lauderdal D.S., Gaskin R.E., Boyle-Vavra S. Community-acquired methicillin-resistant Staphylococcus aureus in children with no identified predisposing risk. // J. of Am.Medical Association 1998. - 279. - Р.593-8].
Современные препараты, обладающие выраженным антистафилококковым действием линезолид, даптомицин, тигециклин, отличаются высокой стоимостью, что ограничивает их широкое использование. Гликопептидные антибиотики (ванкомицин, тейкопланин) во всех странах мира до настоящего времени остаются препаратами выбора при инфекциях, обусловленных штаммами MRSA и MRSE. Однако многие авторы отмечают снижение эффективности ванкомицина при антибактериальной терапии инфекций, вызванных метициллинорезистентными стафилококками, in vitro чувствительными к ванкомицину [Howden В.Р., Davies J.K., Johnson P.D.R., Stinear T.P, Grayson M.L. Reduced vancomycin susceptibility in staphylococcus aureus, including vancomycin-intermediate and heterogeneous vancomycin-intermediate strains: resistance mechanisms, laboratory detection, and clinical implications. Clin Microbiol Rev 2010; 3: 99-139]. Тейкопланин до настоящего времени не зарегистрирован в РФ. Это определяет необходимость в разработке новых антибиотиков и новых подходов к решению данной проблемы. Разработка новых антибактериальных препаратов требует огромных материальных и временных затрат и не всегда является эффективным способом борьбы с резистентными возбудителями, так как бактерии обладают способностью вырабатывать устойчивость к действию новых лекарственных средств. В связи с этим другим путем решения проблемы может быть поиск эффективных комбинаций уже известных лекарственных средств, обладающих синергидным действием в отношении микробных возбудителей.
Синергизм - это усиление бактерицидного действия антибиотиков при их совместном применении. Примером может служить сочетание препаратов, препятствующих синтезу клеточной стенки, и аминогликозидов. Препараты, подавляющие образование клеточной стенки (бензилпенициллин, ампициллин, ванкомицин), в отношении энтерококков в лучшем случае оказывают медленный бактерицидный эффект. Аминогликозиды действуют на эти микроорганизмы только бактериостатически. Сочетание же препарата, подавляющего синтез клеточной стенки, и аминогликозида облегчает проникновение последнего в бактериальные клетки и приводит к быстрой гибели бактерий. Указанные препараты синергидно действуют также и в отношении Staphylococcus spp.
Гентамицин, препарат группы аминогликозидов, в отношении стафилококков обладает бактерицидным действием, однако метициллинорезистентные штаммы часто характеризуются ассоциативной устойчивостью к данному антибиотику. Механизм действия связан с ингибированием рибосомальных субъединиц 30S. Доказано синергидное действие при сочетании гентамицина с пенициллинами в отношении стрептококков и энтерококков. Кроме того, хорошую эффективность показала комбинация гентамицина и ванкомицина в лечении эндокардитов, вызванных S.aureus [Le Т., Bayer A.S. Combination antibiotic therapy for infective endocarditis. // Clin. Infect. Dis. 2003. - V.36. - Р.615-21]. В другом исследовании у пациентов с бактериемией, обусловленной MSSA, комбинированная терапия гентамицином и ванкомицином сокращала продолжительность бактериемии, но не улучшала результат лечения [Korzeniowski О., Sande М.А. Combination antimicrobial therapy for Staphylococcus aureus endocarditis in patients addicted to parenteral drugs and in nonaddicts: a prospective study. // Ann. Intern. Med. - 1982. - V.97. - P. - 496-503.]. Несмотря на повышение антибактериальной эффективности, комбинацию ванкомицин и гентамицин нельзя рекомендовать для широкого применения, так как у нее существует нежелательные эффекты, а именно - нарастание нефро- и ототоксичности [Rybak M.J., Abate B.J., Kang S.L., Ruffing M.J., Lerner S.A., Drusano G.L. Prospective evaluation of the effect of an aminoglycoside dosing regimen on rates of observed nephrotoxicity and ototoxicity. // Antimicrob. Agents. Chemother. - 1999. - V.43.- P.1549-55]. В инструкции по медицинскому применению гентамицина имеются четкие указания о том, что следует избегать одновременного и/или последовательного системного или местного применения других нейро- и/или нефротоксических средств, таких как цисплатин, цефалоридин, аминогликозидные антибиотики, полимиксин В, колистин, ванкомицин.
Известен способ преодоления антибиотикорезистентности бактерий, включающий частое введение антимикробных препаратов в высоких дозах, значительно превышающих минимальные ингибирующиещие концентрации [Aguado-Garcia J.M., Martín-Herrero J.E., Lumbreras-Bermejo С.Bacterial resistance and pharmacodynamics as the prescribing antibiotics in respiratory infections. // Enferm. Infecc. Microbiol. Clin., 2004, V.22, №4, P.230-237]. Применение этого способа ограничено опасностью превысить суточную дозу антибиотика, рекомендованную инструкцией по медицинскому применению препарата, в связи с увеличением частоты развития нежелательных эффектов.
Другой известный способ преодоления лекарственной устойчивости бактерий заключается в применении антибиотиков в комбинации с ингибиторами бактериальных ферментов. Например, в целях преодоления бета-лактамазной резистентности были разработаны специальные ингибиторы бета-лактамаз: клавулановая кислота (клавуланат), сульбактам и тазобактам [Friese S. Prophylaxin in gynaecological surgery: a prospective randomized comparision between single dose profilaxis with amoxicillin clavulanate and the combination of cefuroxime and metronidazole. // Antimicrob. Chemother. - 1989.- V.24, Suppl. В. - Р.213-6]. На этой основе созданы комбинированные препараты, содержащие аминопенициллиновый или цефалоспориновый антибиотик и один из ингибиторов бета-лактамаз (амоксициллин/клавуланат, ампициллин/сульбактам, цефоперазон/сульбактам, тикарциллин/клавуланат). Недостатком данного способа является то, что указанные комбинации препаратов преодолевают резистентность микробов, обусловленную только выработкой бета-лактамаз, и не являются активными в отношении метициллинорезистентных стафилококков.
За прототип принят способ преодоления лекарственной устойчивости бактерий, включающий комбинированное применение двух антибиотиков с различным механизмом действия: пенициллина и стрептомицина, гентамицина и ампициллина [Навашин С.М. и Фомина И.П. Рациональная антибиотикотерапия. Справочник., 4-е изд., перераб. и доп. - М.: Медицина, 2002, 496 с.]. Недостаток прототипа - отсутствие активности данных комбинаций в отношении штаммов стафилококков, резистентных к метициллину.
Неэффективность или потенциальная опасность доступных антимикробных препаратов при лечении тяжелых форм гнойной инфекции, заставляет обращаться к альтернативным препаратам, к числу которых относится диоксидин.
Диоксидин (государственный регистрационный номер 82/1265/6)-производное ди-N-окиси хиноксалина: 1,4 Ди-N-окись 2,3 бис-(оксиметил) хиноксалина. Характеризуется высокой химиотерапевтической активностью in vivo (выживаемость 80-100%, стерилизующий эффект, «морфологическое» выздоровление) на модельных инфекциях, близких по патогенезу к патологическим процессам у человека и вызванных штаммами аэробных бактерий, устойчивыми (в том числе полирезистентными) к препаратам других классов, включая штаммы и метициллиноустойчивых стафилококков. Диоксидин относится к препаратам с бактерицидным типом действия. В основе механизма действия диоксидина лежит повреждение биосинтеза ДНК микробной клетки с глубокими нарушениями структуры нуклеоида уже при действии субингибирующих концентраций. Активность диоксидина существенно повышается в условиях анаэробиоза, причем величины МПК в этом случае могут быть снижены в 8-128 раз [Падейская Е.Н. Антибактериальный препарат диоксидин: особенности биологического действия и значение в терапии различных форм гнойной инфекции. // Инфекции в хирургии. - 2001, №5. - С.150-5]. Повышение активности в анаэробных условиях характерно для всех производных ди-N-окиси хиноксалина с антимикробной активностью и не описано для других классов антимикробных веществ. В этом принципиальное отличие механизма действия диоксидина от механизма действия других антимикробных препаратов. В условиях анаэробиоза, в том числе и в инфицированном организме, диоксидин (и другие ди-N-окиси) активирует свободнорадикальные процессы, индуцируя образование так называемых активных форм кислорода [Suter W., Russelet A., Knusel F. Mode of action of quindoxin and substituted quinoxaline-di-N-oxides on Escherichia coli. // Agents Chemother. - 1978. - V. 13(5). - P. 770-83].
Диоксидин не кумулирует в почках при повторных введениях [Падейская Е.Н., Шипилова Л.Д., Буданова Л.И. Фармакокинетика диоксидина, проникновение препарата в органы и ткани при однократном и повторном введении. // Хим. фарм. журнал. - 1983. - N 6 - С.667-71], что делает его комбинацию с гентамицином более безопасной, чем ванкомицин и гентамицин.
Техническим результатом изобретения является усиление действия гентамицина с помощью разрешенного для системного использования химиопрепарата диоксидин, что обеспечивает потенцирование бактерицидного эффекта в отношении метициллинорезистентных штаммов стафилококков. Данная комбинация эффективно подавляет гнойную инфекцию, но не вызывает усиления нефротоксичности, которое возникает при назначении гентамицина в сочетании с ванкомицином, так как диоксидин не вызывает изменения со стороны гломерулярного и тубулярного аппарата почек.
Результат изобретения достигается за счет синергидного взаимодействия субингибирующих концентраций используемых компонентов, а именно: гентамицина и диоксидина. Диоксидин нарушает синтез ДНК микробной клетки, что обеспечивает потенцирование бактерицидного эффекта субингибирующих концентраций используемых компонентов за счет синергидного взаимодействия.
В таблицах представлены:
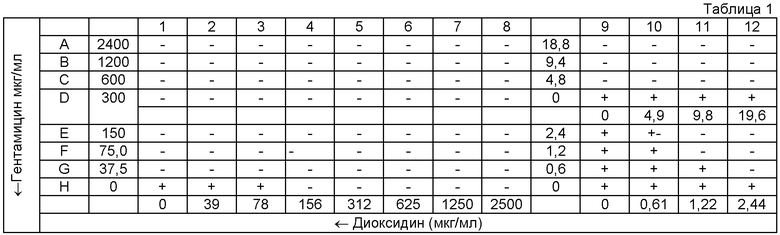
Таблица 1: схема 96-луночной микропланшеты для оценки эффекта комбинации двух антимикробных агентов методом «шахматной доски» в отношении культуры клинического штамма MRSA 8074. В таблице обозначены (здесь и далее):
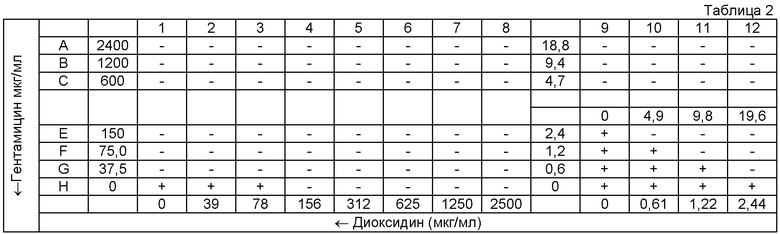
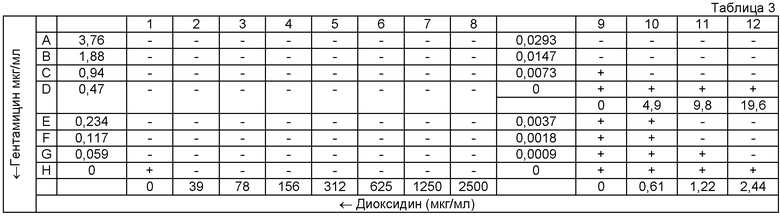
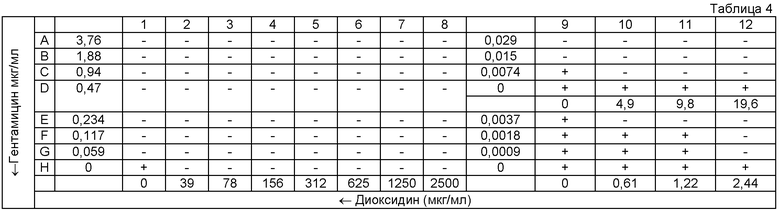
«+» - рост тест-культуры в ячейке;
«-» - отсутствие видимого роста.
Таблица 2: схема 96-луночной микропланшеты для оценки эффекта комбинации двух антимикробных агентов методом «шахматной доски» в отношении культуры клинического штамма MRSA 8785.
Таблица 3: схема 96-луночной микропланшеты для оценки эффекта комбинации двух антимикробных агентов методом «шахматной доски» в отношении культуры референс-штамма MSSA АТСС25923.
Таблица 4: схема 96-луночной микропланшеты для оценки эффекта комбинации двух антимикробных агентов методом «шахматной доски» в отношении культуры референс- штамма MSSA АТСС6538.
Таблица 5: Значения МИК (мкг/мл) и рассчитанные показатели FIC и индекс FIX для тестируемых штаммов (данные двух параллельных экспериментов).
Таблица 6: результаты определения микробного числа (lg КОЕ/мл) S. aureus (на примере клинического штамма MRSA 8785). В таблице 6 обозначены: Дио - диоксидин; Ген - гентамицин; значения МИК (в комбинации) по результатам выявления синергизма методом «шахматной доски»: МИК диоксидина - 2,5 мкг/мл; МИК гентамицина - 1,25 мкг/мл.
На фигурах представлены:
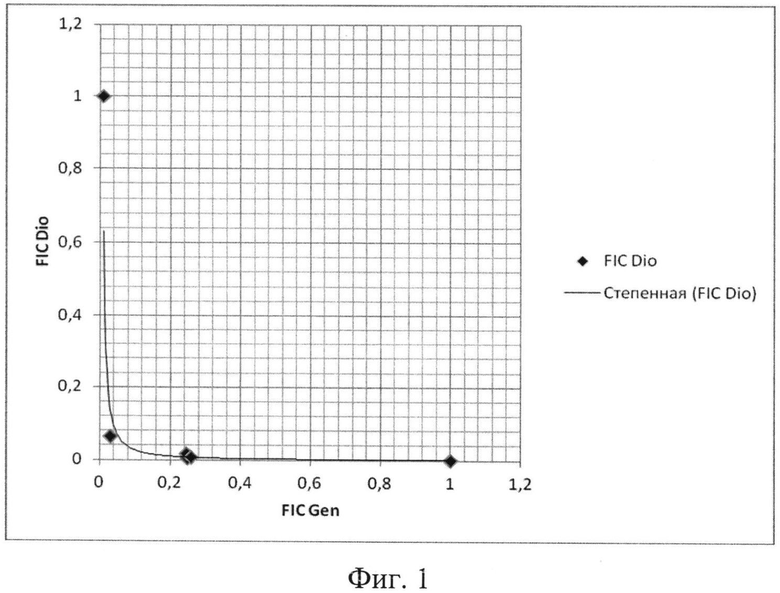
Фиг. 1: Изоболограмма для Staphylococcus aureus, построенная по результатам оценки действия комбинации антимикробных препаратов гентамицина и диоксидина методом «шахматной доски».
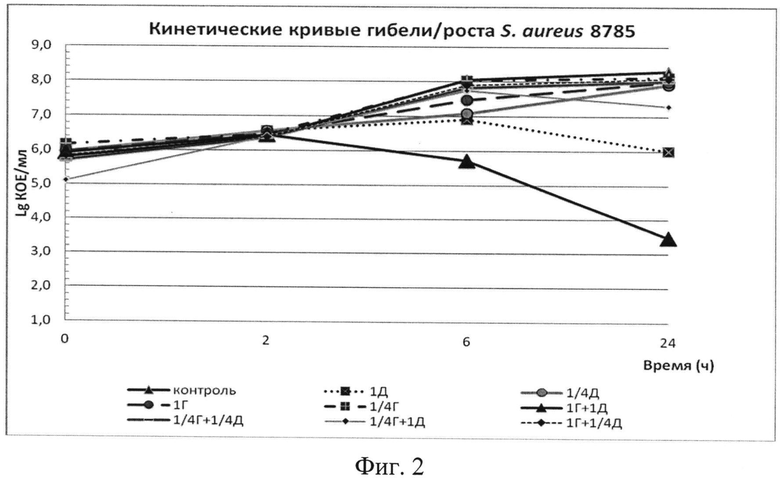
Фиг. 2. Графическое изображение синергизма субингибирующих концентраций гентамицина и диоксидина в отношении клинического метициллинорезистентного штамма S. aureus 8785.
Для подтверждения синергидного взаимодействия гентамицина с диоксидином в отношении штаммов S. aureus были проведены in vitro эксперименты по определению антимикробного действия комбинаций указанных препаратов в различных концентрациях в отношении метициллино-устойчивых и чувствительных изолятов с охарактеризованной устойчивостью к гентамицину.
Синергизм изучали с помощью метода «шахматной доски» [Berenbaum M.C. A method for testing for synergy with any number of agents. // J. Infect. Dis. - 1978. - V.137. - P.122-130] в отношении 4-x штаммов стафилококков: референсные штаммы MSSA АТСС 25923 и АТСС 6538, клинические изоляты MRSA 8074 и 8785, выделенные от пациентов с документированной инфекцией области хирургического вмешательства после эндопротезирования тазобедренного сустава, демонстрирующие резистентность к гентамицину. Все исследования проводили в дубликатах, параллельно на двух 96-луночных микропланшетах.
Для оценки взаимодействия антибиотиков использовали фракционный индекс ингибиции (FIX - the fractional inhibitory index), который вычисляли по формуле:
FIX=FIC (одного антибиотика) + FIC (второго антибиотика),
где FIC (fractional inhibitory concentrations) фракционная ингибирующая концентрация исследуемого антибиотика, которую рассчитывали как отношение величины МИК антибиотика в комбинации с МИК одного антибиотика.
Результаты вычислений FIX для определения вида взаимодействия препарата интерпретировали согласно шкале [Takashi Sugita, Mami Tajima, Tomonobu Ito et al. Antifungal activities of tacrolimus and azole agents against the eleven currently accepted malassezia species. // J. Clin. Microbiol. - 2005. - V.43. - P.2824-9]:
<0,5 синергизм
0,5-4 индифферентность
>4 антагонизм
Для оценки синергизма в каждую ячейку 96-луночной планшеты вносили по 50 микролитров (мкл) питательного бульона Мюллера-Хинтон (МХБ). Гентамицин титровали серийно двукратно вдоль оси ординат (Y), начиная с концентрации 2400 до 0 мкг/мл, второй антимикробный агент (диоксидин) титровали вдоль оси абсцисс (X), начиная с концентрации 2500 до 0 мкг/мл в соответствии с представленной схемой планшеты (табл. 1-4). Инокулюм приготовляли для каждой культуры в стерильном изотоническом растворе, с плотностью микробной суспензии, соответствующей 0,5 McFarland. В каждую ячейку 96-луночной микропланшеты вносили 100 мкл инокулюма и помещали планшету для инкубации в термостат при 37°C на 18 ч. За МИК (в мкг/мл) принимали наименьшую концентрацию антимикробного средства, при которой не наблюдалось видимого роста микроорганизма.
В соответствии с результатами, представленными на схемах А, Б, В и Г 96-луночной микропланшеты для тестируемых штаммов S. aureus были рассчитаны коэффициенты FIX (табл.5), которые во всех случаях были менее 0,5, что характерно для синергидного действия препаратов. Значения FIC, также рассчитанные на основе результатов экспериментов, использовались для построения изоболограммы (фиг.1), вогнутый характер которой также свидетельствует в пользу синергидного взаимодействия гентамицина и диоксидина.
Для подтверждения установленного методом «шахматной доски» усиления действия гентамицина в комбинации с диоксидином в отношении метициллинорезистентных стафилококков оценка синергизма указанных антимикробных средств была выполнена также методом кинетических кривых гибели/роста бактерий.
Сравнительная оценка действия различных концентраций индивидуальных препаратов и их комбинаций проводилась на основании кинетики гибели стафилококков в результате действия препаратов. Для такой оценки использовали измерения чисел КОЕ/мл в установленные периоды времени и строили кинетические кривые гибели микроорганизмов. Наклон кинетической кривой является мерой скорости гибели микроорганизмов.
Синергизм определяли как снижение КОЕ в 100 или более раз, либо на 2 Lg через 24 ч в комбинации, при сравнении с индивидуальным наиболее активным антимикробным компонентом и как 100-кратное снижение КОЕ в сравнении с начальным инокулюмом.
Потенцирование (аддитивность), или индифферентность, определяли как менее чем 10-кратное изменение в числе КОЕ на 24 ч при действии комбинации по сравнению с КОЕ при действии наиболее ативного индивидуального (антимикробного) компонента.
Антагонизм определяли как в 100 и более раз возрастание числа КОЕ на 24 ч при действии комбинации в сравнении с наиболее активным индивидуальным компонентом.
Для исследования активности антимикробных агентов гентамицина и диоксидина, каждого индивидуально, а также их комбинации в суб-МИК концентрациях, конструировали кривые гибели/роста культуры стафилококка в параллели; тест-культуру инкубировали с растворами антимикробных препаратов:
1. Гентамицин, индивидуально: в концентрациях 1,25 мкг/мл (1МИК); 0,313 мкг/мл (1/4МИК).
2. Диоксидин, индивидуально: в концентрации 2,5 мкг/мл (1МИК); 0,625 мкг/мл (1/4МИК).
3. Комбинации двух агентов: 1МИК+1МИК, 1МИК+1/4МИК (каждого агента).
4. Питательный МХБ без антибиотика для определения контрольной ОП.
Данные выражали в виде Lg КОЕ/мл в каждый промежуток времени: Lg от числа выживших колониеобразующих единиц (КОЕ/мл). Метод ингибиции культуры во времени осуществляли с помощью техники микроразведений в МХБ, в 96-луночной микропланшете. Тест-штамм протестирован против каждого антимикробного агента (гентамицина и диоксидина) индивидуально и в комбинации. Из изолированных колоний тест-штаммов готовили суспензию по стандарту мутности McFarland 0,5 с последующим разведением до концентрации 105 КОЕ/мл в 10 мл среды МХБ, содержащей соответствующую концентрацию антимикробных средств. Пробирки инкубировали при 37°C. Отбор проб осуществляли на 0 ч, 2 ч, 6 ч и 24 ч. Результаты подсчета КОЕ в точках 0 ч и 24 ч использовали для определения синергизма.
Исследование показало аналогичные результаты для всех тестируемых штаммов. Далее приводятся результаты оценки антимикробного действия исследуемых лекарственных средств в отношении клинического штамма S. aureus 8785.
Согласно результатам, представленным в табл. 6, комбинация гентамицина и диоксидина в субингибирующих концентрациях 1,25 мкг/мл и 2,5 мкг/мл соответственно демонстрирует синергизм в отношении штамма MRS А 8785, резистентного и к гентамицину; синергизм подтверждается также кинетикой гибели тест-штамма под влиянием действия комбинации гетамицина и диоксидина в концентрациях 1,25 и 2,5 мкг/мл соответственно, что отражается в характере кривой «1Г+1Д» на фиг. 2. На момент времени 24 ч под действием указанной комбинации продемонстрировано снижение КОЕ на 2,5 lg на при сравнении с индивидуальным наиболее активным антимикробным компонентом - диоксидином в концентрации 2,5 мкг/мл и более чем 100-кратное снижение КОЕ в сравнении с начальным инокулюмом.
Таким образом, заявленная комбинация гентамицина и диоксидина обеспечивает потенцирование бактерицидной активности гентамицина за счет способности диоксидина ингибировать ДНК микробной клетки и повышать бактерицидную активность в анаэробных условиях. Эти достоинства позволяют использовать предложенную комбинацию для лечения инфекций, вызванных полирезистентной стафилококковой флорой.
Список литературы
1. Herold B.C., Immergluck L.C., Maranan M.C., Lauderdal D.S., Gaskin R.E., Boyle-Vavra S. Community-acquired methicillin-resistant Staphylococcus aureus in children with no identified predisposing risk. // J. of Am. Medical Association 1998. - 279. - P.593-8.
2. Howden B.P., Davies J.K., Johnson P.D.R., Stinear T.P, Grayson M.L. Reduced vancomycin susceptibility in staphylococcus aureus, including vancomycin-intermediate and heterogeneous vancomycin-intermediate strains: resistance mechanisms, laboratory detection, and clinical implications. Clin Microbiol Rev 2010; 3:99-139.
3. Le Т., Bayer A.S. Combination antibiotic therapy for infective endocarditis. // Clin. Infect. Dis. 2003. - V.36. - Р.615-21].
4. Korzeniowski O., Sande M.A. Combination antimicrobial therapy for Staphylococcus aureus endocarditis in patients addicted to parenteral drugs and in nonaddicts: a prospective study. // Ann. Intern. Med. - 1982. - V.97. -P. - 496-503.
5. Rybak M.J., Abate B.J., Kang S.L., Ruffing M.J., Lerner S.A., Drusano G.L. Prospective evaluation of the effect of an aminoglycoside dosing regimen on rates of observed nephrotoxicity and ototoxicity. // Antimicrob. Agents. Chemother. - 1999. - V.43. - P.1549-55.
6. Aguado-Garcia J.M., Martin-Herrero J.E., Lumbreras-Bermejo C. Bacterial resistance and pharmacodynamics as the prescribing antibiotics in respiratory infections. // Enferm. Infecc. Microbiol. Clin., 2004, V.22, №4, P.230-7.
7. Friese S. Prophylaxin in gynaecological surgery: a prospective randomized comparision between single dose profilaxis with amoxicillin clavulanate and the combination of cefuroxime and metronidazole. // Antimicrob. Chemother. - 1989. - V.24, Suppl. В. - P.213-6.
8. Навашин СМ. и Фомина И.П. Рациональная антибиотикотерапия. Справочник., 4-е изд., перераб. и доп., М., Медицина, 2002, 496 с.
9. Падейская Е.Н. Антибактериальный препарат диоксидин: особенности биологического действия и значение в терапии различных форм гнойной инфекции. // Инфекции в хирургии. - 2001, №5. - С.150-5.
10. Suter W., Russelet A., Knusel F. Mode of action of quindoxin and substituted quinoxaline-di-N-oxides on Escherichia coli. // Agents Chemother. - 1978. - V.13(5). - P.770-83.
11. Падейская E.H., Шипилова Л.Д., Буданова Л.И. Фармакокинетика диоксидина, проникновение препарата в органы и ткани при однократном и повторном введении. // Хим. фарм. журнал. - 1983. - N 6 - С.667-71.
12. Berenbaum М.С A method for testing for synergy with any number of agents. // J. Infect. Dis. - 1978. - V.137. - P.122-130
13. Takashi Sugita, Mami Tajima, Tomonobu Ito et al. Antifungal activities of tacrolimus and azole agents against the eleven currently accepted malassezia species. // J. Clin. Microbiol. - 2005. - V.43. - P.2824-9.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ комплексной эмпирической антибактериальной терапии имплантат-ассоциированных ортопедических инфекций | 2015 |
|
RU2641608C2 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ЦЕМЕНТНОГО СПЕЙСЕРА ДЛЯ ЭТИОТРОПНОЙ МЕСТНОЙ АНТИБАКТЕРИАЛЬНОЙ ТЕРАПИИ ПРИ ИНФЕКЦИОННЫХ ПОРАЖЕНИЯХ КОСТЕЙ И СУСТАВОВ | 2020 |
|
RU2754075C1 |
| АНТИМИКРОБНАЯ КОМПОЗИЦИЯ ДЛЯ ФОРМИРОВАНИЯ СПЕЙСЕРА | 2019 |
|
RU2707734C1 |
| Полимерный гель для локальной антибактериальной терапии инфекционных осложнений травм и операций на опорно-двигательном аппарате и способ его приготовления | 2023 |
|
RU2822155C1 |
| СПОСОБ ЗАМЕЩЕНИЯ КОСТНЫХ ПОЛОСТЕЙ ПРИ ЛЕЧЕНИИ БОЛЬНЫХ ХРОНИЧЕСКИМ ОСТЕОМИЕЛИТОМ | 2019 |
|
RU2710252C1 |
| СПОСОБ МЕСТНОЙ АНТИБАКТЕРИАЛЬНОЙ ПРОФИЛАКТИКИ РЕЦИДИВА ПРИ ОДНОЭТАПНОМ РЕВИЗИОННОМ ЭНДОПРОТЕЗИРОВАНИИ У ПАЦИЕНТОВ С ПЕРИПРОТЕЗНОЙ ИНФЕКЦИЕЙ | 2021 |
|
RU2757263C1 |
| СПОСОБ ПОЛУЧЕНИЯ АНТИМИКРОБНОГО ГЕЛЯ | 2020 |
|
RU2746709C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АНТИМИКРОБНОЙ АКТИВНОСТИ ГЕЛЕЙ, СОДЕРЖАЩИХ АНТИБАКТЕРИАЛЬНЫЕ КОМПОНЕНТЫ | 2021 |
|
RU2763590C1 |
| СПОСОБ ЛЕЧЕНИЯ СТАФИЛОКОККОВЫХ ИНФЕКЦИЙ У МЛЕКОПИТАЮЩЕГО (ВАРИАНТЫ) | 1998 |
|
RU2234940C2 |
| СПОСОБ ПРЕОДОЛЕНИЯ ЛЕКАРСТВЕННОЙ УСТОЙЧИВОСТИ БАКТЕРИЙ И ГРИБОВ | 2007 |
|
RU2363470C1 |
Изобретение относится к области медицины, а именно к клинической микробиологии и антимикробной химиотерапии, и касается разработки и создания новых комбинаций, обеспечивающих потенцирование бактерицидного действия и эффективное подавление гнойной инфекции, вызываемой метициллинорезистентными стафилококками, на основе использования двух классов соединений, обладающих принципиально различным механизмом антимикробного действия. 2 ил., 6 табл.
Способ преодоления устойчивости к гентамицину у метициллинорезистентных штаммов стафилоккока, включающий сочетанное введение антимикробных средств, отличающийся тем, что гентамицин комбинируют с препаратом диоксидин в субингибирующих концентрациях 1,25 мкг/мл и 2,5 мкг/мл соответственно.
| Навашин С.М | |||
| и Фомина И.П | |||
| Рациональная антибиотикотерапия | |||
| Справочник., 4-е изд., перераб | |||
| и доп., М., Медицина, 2002, 496 с | |||
| Падейская Е.Н | |||
| Антибактериальный препарат диоксидин: особенности биологического действия и значение в терапии различных форм гнойной инфекции | |||
| Перекатываемый затвор для водоемов | 1922 |
|
SU2001A1 |
| - С | |||
| Деревянный коленчатый рычаг | 1919 |
|
SU150A1 |
| Suter W | |||
| et al | |||
| Mode of action | |||
Авторы
Даты
2015-06-20—Публикация
2013-10-11—Подача