Изобретение относится к способам получения пероксида лития.
Известен способ получения пероксида лития [патент РФ №2322387, МПК С01В 15/043, 2008 г.], заключающийся во взаимодействии гидроксида лития с пероксидом водорода при мольном соотношении гидроксид лития / пероксид водорода (LiOH/H2O2), равном 1,74÷2,0 и температуре в зоне синтеза 25÷35°С с последующей дегидратацией полученной тройной системы LiOH-Н2О2-Н2О, состоящей из воды и продуктов взаимодействия пероксида водорода и гидроксида лития. Дегидратацию осуществляют путем воздействия излучения сверхвысокой частоты (СВЧ) без предварительного отделения твердой фазы. Способ получения пероксида лития обеспечивает выход по литию более 99,5% весовых при высоком содержании основного вещества в получаемом продукте (до 98,4% весовых) и минимальном расходе исходных компонентов на единицу конечной продукции.
Однако указанный способ получения пероксида лития имеет ряд недостатков - довольно длительное время синтеза и высокие затраты энергии. Как следует из приведенных примеров, лимитирующей по времени стадией синтеза пероскида лития является экспозиция в течение не менее 1 часа тройной системы LiOH-H2O2-H2O перед ее дегидратацией в поле СВЧ. Время экспозиции обусловлено достижением состояния равновесия между жидкой фазой и кристаллизующейся в указанном температурном и концентрационном интервале из тройной системы LiOH-H2O2-H2O твердой фазой состава Li2O2⋅H2O. Как следует из описания и материалов работ авторов (Ю.А. Ферапонтов, М.А. Ульянова, Т.В. Сажнева. Условия кристаллизации Li2O2⋅H2O в тройной системы LiOH-H2O2-H2O. / ЖНХ. 2008. Т. 53. Вып. 10, С. 1749-1754.) при несоблюдении указанных выше технологических параметров (прежде всего содержание H2O2 в жидкой фазе от 1,6 до 2% и температурный интервал от 21 до 33°С) фигуративная точка состава твердой фазы перемещается в область, соответствующую составу Li2O2⋅H2O2⋅3H2O, что приводит к увеличению количества воды, подлежащей удалению на последней стадии дегидратации. Это приводит к уменьшению содержания основного вещества в продукте синтеза, поскольку получаемый пероксид лития довольно активно взаимодействует с водяным паром.
Причем для поддержания необходимого температурного интервала тройную системе LiOH-Н2О2-H2O необходимо охлаждать, поскольку, как хорошо известно из практики неорганического синтеза, взаимодействие пероксида водорода и гидроксида лития - ярко выраженный экзотермический процесс. Повышение температуры тройной системы LiOH-Н2О2-H2O выше указанного значения приводит к разложению перекисных продуктов, т.е. изменению концентрации Н2О2 в жидкой фазе. При этом, соответственно, меняется состав кристаллизующейся из системы твердой фаза с описанными ранее негативными последствиями.
Задачей изобретения является повышение экономичности процесса.
Задача решается тем, что в способе получения пероксида лития, включающем взаимодействие гидроксида лития с пероксидом водорода при мольном соотношении гидроксид лития / пероксид водорода равном LiOH/H2O2=1,74÷2,0 и последующей дегидратацией полученной системы путем воздействия излучения сверхвысокой частоты (СВЧ), в раствор пероксида водорода перед добавлением гидроксида лития, которой осуществляют двумя порциями с интервалом не менее 10 минут, вводят ортоборную кислоту (Н3ВО3) в следующих количествах, моль вещества/моль пероксида водорода: 0,0008÷0,0035. При этом температура в зоне синтеза находится в интервале 35÷50°С, а экспозиция полученной системы перед дегидратацией составляет не менее 30 минут.
Указанное время экспозиции обусловлено установлением равновесия между жидкой фазой и кристаллизующейся в указанном температурном и концентрационном интервале из тройной системы LiOH-Н2О2-H2O твердой фазой состава Li2O2⋅H2O.
Как отмечалось выше, для получения пероксида лития с максимальным содержанием основного вещества дегидратации необходимо подвергать систему, где в состоянии равновесия с жидкой фазой находятся твердая фаза состава Li2O2⋅H2O. Ее кристаллизация происходит при строго фиксированном содержании пероксида водорода в жидкой фазе, которое из-за разложения перекисных продуктов может уменьшаться. Для предотвращения этого явления в тройную систему LiOH-H2O2-H2O уместно введение ингибиторов разложения перекисных продуктов, что хорошо известно специалистам, работающим в данной области химии. До настоящего времени не существует строго научных основ для выбора ингибиторов разложения различных растворов пероксидных соединений, препятствующих их разложению [Г.А. Серышев. Химия и технология перекиси водорода, - Л.: Химия, - 1984. - С. 182.]. Поэтому их выбор проводят преимущественно эмпирическим путем в зависимости от состава конкретного раствора. Так как тройная система LiOH-H2O2-H2O в дальнейшем используется для синтеза пероксидных соединений щелочных металлов и далее на их основе регенеративных продуктов для средств защиты органов дыхания человека от поражающих факторов химической и биологической природы, на применяемые в качестве ингибиторов вещества накладывается ряд ограничений (по токсичности, химической устойчивости к воздействию атомарного кислорода и др.). Однозначно оценить влияние того или иного иона или их ассоциатов, содержащихся в многокомпонентной системе, на стабильность системы в целом крайне сложно. Но было отмечено, что гидроксид щелочного металла следует добавлять в раствор пероксида водорода только после полного растворения ортоборной кислоты. При этом гидроксид щелочного металла следует вводить двумя порциями, причем вторую порцию вводят в образовавшуюся жидкую фазу не менее чем через 10 минут после добавления первой порции. Такой прием обусловлен тем, что, при нейтрализации ортоборной кислоты щелочами в водных растворах не образуются ортобораты, содержащие ион (ВО3)3-, поскольку ортобораты практически полностью гидролизуются вследствие слишком малой константы образования [В(ОН)4]-. В растворе образуются тетрабораты, метабораты и соли других полиборных кислот (nB2O2⋅mH2O), не существующие в свободном состоянии (и которые по этой причине невозможно ввести в жидкую фазу в виде исходных соединений), что хорошо известно из курса неорганической химии [Карапетьянц М.X. Дракин С.И. Общая и неорганическая химия. М.: Химия 1994].
При указанном мольном соотношении исходных реагентов в температурном интервале 35÷50°С за 30 минут происходит кристаллизация моногидрата пероксида лития (Li2O2⋅H2O) - вещества, содержащего минимальное количество кристаллизационной воды.
Соответственно, с одной стороны, такие параметры синтеза приводят к отказу от операции охлаждения тройной системы LiOH-H2O2-H2O (температура в зоне синтеза не поднимается выше 50°С), с другой стороны для достижения равновесия между фазами требуется экспозиция не более 30 минут, что приводит к интенсификации процесса в целом.
Предложенный способ позволяет получать пероксид лития (до 98,5% основного вещества в продукте синтеза) с выходом по литию более 99,5% (технологические потери составляют менее 0,5%). Использование указанных технологических приемов позволяет повысить производительность процесса и снизить энергозатраты за счет отказа от охлаждения тройной системы LiOH-H2O2-H2O до температуры 25÷35°С на протяжении всего времени синтеза.
Способ осуществляют следующим образом. В реактор с мешалкой и рубашкой помещают водный раствор пероксида водорода концентрацией 30÷85%. После этого при перемешивании добавляют требуемое количество ортоборной кислоты (мольное соотношение Н3ВО3/H2O2=0,0008÷0,0035.). После чего двумя порциями с интервалом не менее 10 минут добавляют гидроксид лития таким образом, чтобы температура в зоне реакции не превышала 50°С. Мольное соотношение гидроксид лития / пероксид водорода составляет LiOH/H2O2=1,74÷2,0. После добавления всего гидроксида лития полученную систему выдерживают в реакторе при температуре 35÷50°С и непрерывном перемешивании не менее 30 минут. После этого систему подвергают дегидратации в поле СВЧ.
Пример 1.
К 100 мл 50% водного раствора пероксида водорода добавляют при постоянном перемешивании 0,381 г ортоборной кислоты (мольное соотношение Н3ВО3/Н2О2=0,0035). Затем в полученный раствор вводят двумя порциями с интервалом в 10 минут 148 г моногидрата гидроксида лития (LiOH⋅H2O). Первая порция гидроксида лития составляет 21 г. Добавление LiOH⋅H2O осуществляют таким образом, чтобы температура в зоне реакции не превышала 50°С. Мольное соотношение LiOH/H2O2=2,0. После добавления всего LiOH⋅H2O полученную смесь выдерживают в реакторе при температуре 50°С в течение 35 минут. Затем полученную суспензию делят на 5 частей и помещают в специальной посуде в СВЧ сушилку. Дегидратацию осуществляют при частоте излучения 2500 МГц, мощности 850 Вт в течение 9 минут. Конечный продукт содержит 95,1% пероксида лития. Выход по литию составляет 99,3%. Время синтеза составляет 52 минуты.
Пример 2.
К 100 мл 50% водного раствора пероксида водорода добавляют при постоянном перемешивании 0,554 г ортоборной кислоты (мольное соотношение Н3ВО3/H2O2=0,005). Затем в полученный раствор вводят двумя порциями с интервалом в 11 минут 136,8 г моногидрата гидроксида лития (LiOH⋅H2O). Первая порция гидроксида лития составляет 21 г. Добавление LiOH⋅H2O осуществляют таким образом, чтобы температура в зоне реакции не превышала 45°С. Мольное соотношение LiOH/H2O2=1,85. После добавления всего LiOH⋅H2O полученную смесь выдерживают в реакторе при температуре 45°С в течение 32 минут. Затем полученную суспензию делят на 5 частей и помещают в специальной посуде в СВЧ сушилку. Дегидратацию осуществляют при частоте излучения 2500 МГц, мощности 850 Вт в течение 8,5 минут. Конечный продукт содержит 95,7% пероксида лития. Выход по литию составляет 99,4%. Время синтеза составляет 47 минут.
Пример 3.
К 100 мл 50% водного раствора пероксида водорода добавляют при постоянном перемешивании 0,776 г ортоборной кислоты (мольное соотношение Н3ВО3/Н2О2=0,007). Затем в полученный раствор вводят двумя порциями с интервалом в 12 минут 133,1 г моногидрата гидроксида лития (LiOH⋅H2O). Первая порция гидроксида лития составляет 21 г. Добавление LiOH⋅H2O осуществляют таким образом, чтобы температура в зоне реакции не превышала 40°С. Мольное соотношение LiOH/Н2О2=1,80. После добавления всего LiOH⋅H2O полученную смесь выдерживают в реакторе при температуре 40°С в течение 31 минуты. Затем полученную суспензию делят на 5 частей и помещают в специальной посуде в СВЧ сушилку. Дегидратацию осуществляют при частоте излучения 2500 МГц, мощности 850 Вт в течение 8 минут. Конечный продукт содержит 97,8% пероксида лития. Выход по литию составляет 99,5%. Время синтеза составляет 46 минут.
Пример 4.
К 100 мл 50% водного раствора пероксида водорода добавляют при постоянном перемешивании 0,887 г ортоборной кислоты (мольное соотношение Н3ВО3/Н2О2=0,008). Затем в полученный раствор вводят двумя порциями с интервалом в 13 минут 128,6 г моногидрата гидроксида лития (LiOH⋅H2O). Первая порция гидроксида лития составляет 21 г. Добавление LiOH⋅H2O осуществляют таким образом, чтобы температура в зоне реакции не превышала 35°С. Мольное соотношение LiOH/H2O2=1,74. После добавления всего LiOH⋅H2O полученную смесь выдерживают в реакторе при температуре 35°С в течение 31 минуты. Затем полученную суспензию делят на 5 частей и помещают в специальной посуде в СВЧ сушилку. Дегидратацию осуществляют при частоте излучения 2500 МГц, мощности 850 Вт в течение 8 минут. Конечный продукт содержит 97,5% пероксида лития. Выход по литию составляет 99,4%. Время синтеза составляет 45 минут.
Пример 5.
К 100 мл 50% водного раствора пероксида водорода добавляют при постоянном перемешивании 0,5 г ортоборной кислоты (мольное соотношение Н3ВО3/Н2О2=0,0045). Затем в полученный раствор вводят двумя порциями с интервалом в 11 минут 140,5 г моногидрата гидроксида лития (LiOH⋅H2O). Первая порция гидроксида лития составляет 21 г. Добавление LiOH⋅H2O осуществляют таким образом, чтобы температура в зоне реакции не превышала 42°С. Мольное соотношение LiOH/H2O2=1,9. После добавления всего LiOH⋅H2O полученную смесь выдерживают в реакторе при температуре 42°С в течение 33 минут. Затем полученную суспензию делят на 5 частей и помещают в специальной посуде в СВЧ сушилку. Дегидратацию осуществляют при частоте излучения 2500 МГц, мощности 850 Вт в течение 8,5 минут. Конечный продукт содержит 98,5% пероксида лития. Выход по литию составляет 99,6%. Время синтеза составляет 48 минут.
Пример 6 (сравнительный).
Пероксид лития получали, соблюдая все технологические операции и мольное соотношение исходных компонентов, изложенные в Примере 4 патента РФ №2322387, МПК С01В 15/043, 2008 г. Конечный продукт содержит 95,4% пероксида лития. Выход по литию составляет 99,5%. Время синтеза составляет 87 минут.
Данные о времени синтеза пероксида лития и температурных параметрах проведения процесса по примерам 1-6 представлены в таблице.
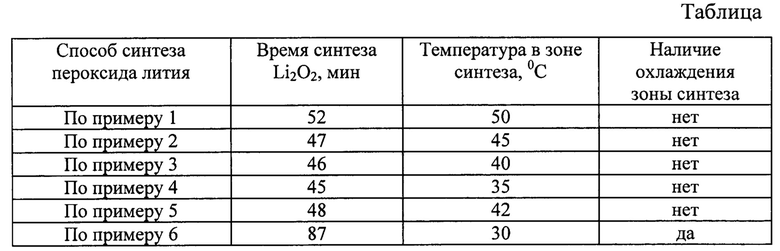
Предложенный способ получения пероксида лития обеспечивает выход по литию более 99,5% весовых при высоком содержании основного вещества в получаемом продукте (до 98,5% весовых) и минимальном времени синтеза при получении единицы конечной продукции. Следует отметить, что в предложенном способе получения пероксида лития из пероксида водорода и гидроксида лития отсутствует охлаждение зоны синтеза, сопряженное с дополнительными затратами ресурсов.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения продукта для регенерации воздуха | 2017 |
|
RU2669857C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОДУКТА ДЛЯ РЕГЕНЕРАЦИИ ВОЗДУХА | 2019 |
|
RU2703878C1 |
| Способ стабилизации щелочного раствора пероксида водорода | 2017 |
|
RU2642571C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПЕРОКСИДА ЛИТИЯ | 2010 |
|
RU2465195C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПЕРОКСИДА ЛИТИЯ | 2006 |
|
RU2322387C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОДУКТА ДЛЯ РЕГЕНЕРАЦИИ ВОЗДУХА | 2012 |
|
RU2518610C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОДУКТА ДЛЯ РЕГЕНЕРАЦИИ ВОЗДУХА | 2008 |
|
RU2367492C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОДУКТА ДЛЯ РЕГЕНЕРАЦИИ ВОЗДУХА | 2015 |
|
RU2596770C1 |
| СПОСОБ СТАБИЛИЗАЦИИ ЩЕЛОЧНОГО РАСТВОРА ПЕРОКСИДА ВОДОРОДА | 2013 |
|
RU2538836C2 |
| СПОСОБ СТАБИЛИЗАЦИИ ЩЕЛОЧНОГО РАСТВОРА ПЕРОКСИДА ВОДОРОДА | 2011 |
|
RU2500613C2 |
Изобретение относится к способам получения пероксида лития. Способ заключается во взаимодействии гидроксида лития с пероксидом водорода при мольном соотношении гидроксид лития/пероксид водорода, равном LiOH/H2O2=1,74-2,0, и последующей дегидратации полученной тройной системы LiOH-H2O2-H2O путем воздействия излучения сверхвысокой частоты (СВЧ). При этом в раствор пероксида водорода перед добавлением гидроксида лития, которое осуществляют двумя порциями с интервалом не менее 10 мин, вводят ортоборную кислоту (Н3ВО3) в количестве, моль вещества/моль пероксида водорода, равном 0,0035-0,008. Температура в зоне синтеза находится в интервале 35-50°С, а экспозиция полученной системы перед дегидратацией составляет не менее 30 мин. Способ получения пероксида лития обеспечивает выход по литию более 99,5 мас.% при высоком содержании основного вещества в получаемом продукте (до 98,5 мас.%) и минимальном времени синтеза при получении единицы конечной продукции. В методике отсутствует охлаждение зоны синтеза, связанное с дополнительными затратами ресурсов.1 табл., 6 пр.
Способ получения пероксида лития, включающий взаимодействие гидроксида лития с пероксидом водорода при мольном соотношении гидроксид лития/пероксид водорода, равном LiOH/H2O2=1,74-2,0, и последующую дегидратацию полученной системы путем воздействия излучения сверхвысокой частоты (СВЧ), отличающийся тем, что в раствор пероксида водорода перед добавлением гидроксида лития, которое осуществляют двумя порциями с интервалом не менее 10 мин, вводят ортоборную кислоту (Н3ВО3) в следующих количествах, моль вещества/моль пероксида водорода: 0,0035-0,008, при этом температура в зоне синтеза находится в интервале 35-50°C, а экспозиция полученной системы перед дегидратацией составляет не менее 30 мин.
| СПОСОБ ПОЛУЧЕНИЯ ПЕРОКСИДА ЛИТИЯ | 2010 |
|
RU2465195C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПЕРОКСИДА ЛИТИЯ | 2006 |
|
RU2322387C1 |
| Устройство регулирования процесса кондиционирования пульпы | 1983 |
|
SU1084075A1 |
| US 3185546 A, 25.05.1965 | |||
| US 3147075 A, 01.09.1964. | |||
Авторы
Даты
2019-01-22—Публикация
2017-10-09—Подача