ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к области медицины. В частности, настоящее изобретение относится к микропеллете с андрографолидом для целенаправленной доставки в кишечник и способу ее получения. Также настоящее изобретение относится к применению андрографолида и микропеллеты с андрографолидом для целенаправленной доставки в кишечник в получении препарата для лечения воспалительного заболевания кишечника.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Андрографолид (C20H30O5) представляет собой дитерпеновое лактоновое соединение, выделенное из растения Andrographis рaniculata рода Acanthaceae. Он является одним из основных действующих компонентов в Andrographis рaniculata Nees, который считается природным антибиотиком в связи с его воздействием на патогенные микроорганизмы, антипиретическим, противовоспалительным эффектами, улучшением иммунной системы организма, гепатопротекторным действием вследствие нормализации работы желчного пузыря, противоопухолевыми эффектами и т.д. Андрографолид относится к дитерпеновым лактоновым соединениям. Являясь растительным экстрактом, он обладает преимуществами в связи с меньшими побочными эффектами, лучшими противовоспалительными свойствами и является распространенным источником сырья с приемлемой ценой. Воспалительное заболевание кишечника (IBD) представляет собой рецидивирующее хроническое воспалительное заболевание кишечника, включающее главным образом язвенный колит (UC) и болезнь Крона (CD). Их точная причина и патогенез не были выяснены, и поэтому в клинической практике до сих пор отсутствуют эффективные способы лечения. Клинические проявления UC включают: повреждение кишечника, большая часть которого сначала проявляется в дистальном отделе толстой кишки и в сигмовидной кишке; главным образом длительная, диффузная боль или тупая боль в левой части живота, которая ослабляется после поноса; слизистый и гнойно-кровянистый стул, сопровождаемый позывами. Клинические проявления CD включают следующие: в основном боль в животе; колики или спастическую острую боль в левой части живота, характеризующуюся приступообразной частотой, и колики, большей частью возникающие после приема пищи; слизистый и водянистый стул, сопровождаемый запором, чередующимся с поносом. Ряд заболеваний с большей вероятностью может встречаться при CD, чем при UC, такие как стеноз кишечника, кишечная непроходимость, кишечный свищ, полип кишечника и даже раковое заболевание.
Болезнь Крона (CD) определена как одно из IBD. Как правило, симптомы воспаления, застой лимфы или лимфатический отек могут встречаться в толстом кишечнике, тонком кишечники или желудке пациента. Основное отличие между CD и UC заключается в месте воспаления и самом воспалении. Болезнь Крона может поражать любой отдел пищеварительной системы, например, тонкий кишечник, толстый кишечник, желудок и пищевод, часто встречается в терминальном отделе подвздошной кишки и прилегающем отделе толстой кишки, и восходящей ободочной кишке. UC, однако, встречается только в толстом кишечнике и прямой кишке, часто встречается в прямой кишке и сигмовидной кишке. Микроскопически болезнь Крона может поражать всю внутреннюю стенку кишечника, в то время как UC ограничен слизистой оболочкой.
Болезнь Крона является хронической и рецидивирующей болезнью. Эффективные терапевтические средства до сих пор не были разработаны вследствие неустановленной причины возникновения заболевания. К настоящему времени лекарственные средства для лечения болезни Крона главным образом включают глюкокортикоиды, составы с салициловой кислотой, иммуносупрессорные средства, антибиотики, метотрексат и биологические средства (например, инфликсимаб). Несмотря на то, что эти лекарственные средства, как оказалось, способны изменять естественное течение болезни, они не могут полностью облегчить состояние болезни и снизить частоту осложнений. Кроме того, известные препараты западной медицины, такие как глюкокортикоидные и иммуносупрессорные средства, часто вызывают сильные побочные реакции, и длительное введение, вероятно, приведет к повреждению организма. В связи с этим существует необходимость в разработке нового лекарственного препарата и его состава для лечения болезни Крона.
С другой стороны, доставка лекарственного средства в толстый кишечник в течение длительного времени считалась сложной задачей в R&D, которая определяется собственными физиологическими свойствами толстого кишечника. Хорошо известно, что толстый кишечник расположен в нижней половине пищеварительного тракта, поэтому лекарственные средства при пероральном введении с трудом достигают толстого кишечника, а использование клизмы является неудобным и болезненным. В результате этого появилась методика получения препаратов для целенаправленной доставки в толстый кишечник. Система для пероральной доставки лекарственных средств, специфических для толстого кишечника (OCSDDS), относится к сайт-специфической системе доставки лекарственных средств, которая обеспечивает прохождение лекарственного средства через верхнюю часть пищеварительного тракта, состоящую из желудка и двенадцатиперстной кишки, без какого-либо высвобождения лекарственного средства, и лекарственный препарат не высвобождается до тех пор, пока не поступит в илеоцекальный участок для оказания локальных или системных терапевтических эффектов с помощью методики доставки лекарственного средства. Широко используемые методики OCSDDS подразделяют на pH-зависимый тип и расщепляемый ферментом тип.
OCSDDS, зависимая от pH, предназначена для осуществления доставки, специфической для толстого кишечника, путем использования различной величины pH в каждой части желудочно-кишечного тракта. Как правило, значение pH в желудке здоровых людей является наиболее низким - 1~3, в двенадцатиперстной кишке - 4~6, тощей кишке - 6~7, подвздошной кишке - 7~7,5 и толстой кишке - 7~8.
В настоящее время широко используемые энтеросолюбильные материалы имеют различные значения pH, при которых должны растворяться. Первый тип начинает растворяться при значении pH ≥5,5, второй - при ≥6,0 и третий - при ≥7,0. До настоящего времени лекарственное средство изолировали с помощью стороннего энтеросолюбильного полимерного материала для нанесения покрытия в pH-зависимом препарате для целенаправленной доставки в кишечник. Можно достичь того, что лекарственное средство не будет высвобождаться в верхней половине желудочно-кишечного тракта до тех пор, пока не перейдет в илеоцекальный участок. Все китайские патенты (CN1981743, CN101209246, CN103315959) включены в эту методику. Однако, как показано в клинических исследованиях, значения pH в желудочно-кишечном тракте у разных индивидуумов значительно отличаются. Имеется расхождение между пациентами с IBD и здоровыми людьми, а значение pH в кишечнике у пациентов с колитом ниже, чем у здоровых людей. В результате при использовании этого вида полимера отдельно лекарственное средство не будет высвобождаться in vitro, а будет удаляться с калом.
В отношении пероральной доставки андрографолида при расщеплении ферментом, специфической для толстого кишечника, известный уровень техники включает следующие стадии: покрытие андрографолидом сердцевины пеллеты без активного вещества с получением микропеллеты, cодержащей лекарственное средство; и изолирование указанной микропеллеты нерастворимым в воде полимером, в котором содержатся моносахаридные порообразующие средства. Мембрана указанного полимера не отделяется в желудке и тонком кишечнике до достижения толстого кишечника. Моносахарид в мембране расщепляется с помощью ферментов толстого кишечника с образованием поры в мембране, при этом лекарственное средство постепенно растворяется и высвобождается. Несмотря на то, что эта методика устранила недостатки, связанные с различием среди индивидов в pH-зависимой OCSDDS, существует ряд проблем. Поскольку моносахарид, например, гуаровая камедь, растворяется в воде и лекарственное средство будет быстро высвобождаться из пор, образовавшихся в результате растворения моносахарида после попадания в организм, сложно обеспечить достижение толстого кишечника эффективным количеством лекарственного средства. Кроме того, молекула моносахарида является структурно ригидной. Непосредственно после встраивания в полимерные цепи она не только будет влиять на растяжимость полимерной цепи, но также нарушать целостность полимерной мембраны, что будет делать покрывающую мембрану хрупкой и легко разрушаемой. Таким образом, возрастает риск того, что мембрана может легко разрушиться во время транспортировки или в результате желудочно-кишечной перистальтики. В связи с этим, по-прежнему требуется разработка новых препаратов андрографолида для лечения IBD.
СОДЕРЖАНИЕ ИЗОБРЕТЕНИЯ
В первом аспекте целью настоящего изобретения является обеспечение нового применения андрографолида, в частности применения андрографолида в получении лекарственного препарата для лечения IBD. При этом указанное IBD включает UC и болезнь Крона.
С другой стороны, целью настоящего изобретения является обеспечение нового pH-зависимого препарата для целенаправленной доставки в кишечник. Таким образом, два типа pH-зависимых полимера используют совместно для достижения целенаправленного высвобождения in vitro при разных значениях pH в кишечнике. В частности, настоящее изобретение относится к микропеллете с андрографолидом для целенаправленной доставки в кишечник. Указанную микропеллету используют для более качественного лечения IBD, например, UC и болезни Крона. Также настоящее изобретение относится к способу получения указанного pH-зависимого препарата для целенаправленной доставки в кишечник.
Предпочтительно, настоящее изобретение относится к следующим техническим решениям:
1. Микропеллета с андрографолидом для целенаправленной доставки в кишечник, отличающаяся тем, что в состав указанной микропеллеты с андрографолидом для целенаправленной доставки в кишечник входят сердцевина пеллеты без активного вещества, слой лекарственного средства и слой энтеросолюбильного покрытия, где указанный слой лекарственного средства содержит андрографолид, полимер A, растворимый в условиях pH ≥ 7,0, и вспомогательное средство; при этом соотношение андрографолида и полимера A составляет 1:2~1:0,2 по весу; увеличение веса, приходящееся на слой лекарственного средства, составляет 20 вес. % ~ 100 вес. %, предпочтительно 30 вес. % ~ 80 вес. %; указанный слой энтеросолюбильного покрытия содержит полимер B, растворимый в условиях pH ≥ 5,5, и вспомогательное cредство; увеличение веса, приходящееся на слой энтеросолюбильного покрытия, составляет 5 вес. % ~ 30 вес. %, предпочтительно 8 вес. % ~ 20 вес. %, наиболее предпочтительно 10 вес. % ~ 18 масс. %.
2. Микропеллета по п. 1, где указанные вспомогательные средства, содержащиеся в слое лекарственного средства, включают пластификаторы, средства, уменьшающие липкость, пигменты, гидрофильные полимеры и поверхностно-активные вещества; а
указанные вспомогательные средства, содержащиеся в слое энтеросолюбильного покрытия, включают пластификаторы и средства, уменьшающие липкость, предпочтительно указанные вспомогательные средства, дополнительно включают гидрофильные полимеры и пигменты.
3. Микропеллета по п. 1, где указанный полимер A представляет собой сополимер метакриловой кислоты и метилметакрилата, а указанный полимер B представляет собой сополимер метакриловой кислоты и этилакрилата.
4. Микропеллета по п. 1, где указанный полимер A представляет собой сополимер метакриловой кислоты и метилметакрилата в соотношении 1:2, и/или указанный полимер B представляет собой сополимер метакриловой кислоты и этилакрилата в соотношении 1:1.
5. Микропеллета по п. 2, где указанный пластификатор представляет собой одно или более выбранных из группы, включающей триэтилцитрат, дибутилсебацинат, пропандиол и PEG, при этом количество пластификатора составляет 10 вес. % ~ 70 вес. % от полимера A, предпочтительно 10 вес. % ~ 20 вес. % от полимера A; указанное средство, уменьшающее липкость, представляет собой тальк, при этом количество средства, уменьшающего липкость, составляет 25 вес. % ~ 100 вес. % от полимера A, предпочтительно 30 вес. % ~ 50 вес. % от полимера A; или указанное средство, уменьшающее липкость, представляет собой глицерил моностеарат, при этом количество средства, уменьшающего липкость, составляет 2 вес. % ~ 20 вес. % от полимера A, предпочтительно 5 вес. % ~ 10 вес. % от полимера A.
6. Микропеллета по п. 1, где диаметр указанной сердцевины пеллеты без активного вещества составляет 200~600 мкм, предпочтительно 300~500 мкм, а количество сердцевины пеллеты без активного вещества составляет 10 вес. % ~ 70 вес. % от состава, предпочтительно 20 вес. % ~ 60 вес. % от состава.
7. Микропеллета по п. 2, где указанные ингредиенты присутствуют в пропорции в весовых частях: сердцевина пеллеты без активного вещества:андрографолид:полимер A:пластификатор:средство, уменьшающее липкость:поверхностно-активное вещество = 200:(10-100):(10-100):(1-15):(1-30):(0-3), предпочтительно 200:(15-66): (13-74):(2-13,5):(3-27):(0-1,32), наиболее предпочтительно 200:(20-50):(30-60):(5-10):(5-20):(0,5-1,2).
8. Способ получения микропеллет по любому пп. 1-7, включающий следующие стадии:
(1) нанесение лекарственного средства на сердцевины пеллет без активного вещества:
a) диспергирование полимера A в фармацевтическом растворителе при механическом перемешивании для обеспечения его полного растворения с получением раствора полимера A; добавление вспомогательного средства в раствор полимера A с последующим добавлением андрографолида, тщательное перемешивание с получением раствора полимера A для нанесения покрытия; и
b) отвешивание сердцевин пеллет без активного вещества, и загрузка в псевдоожиженный слой; регулирование потока воздуха для получения сердцевин пеллет без активного вещества в надлежащем псевдоожиженном состоянии; приведение в действие нагревающего устройства до достижения заданного значения температуры материала сердцевин пеллет без активного вещества, и приведение в действие перистальтического насоса для атомизации с помощью распылителя и однородного диспергирования раствора полимера А для нанесения покрытия на поверхности указанных сердцевин пеллет без активного вещества с получением микропеллет, содержащих лекарственное средство;
(2) получение слоя энтеросолюбильного покрытия:
a) диспергирование полимера В в фармацевтическом органическом растворителе или воде для обеспечения его полного растворения при механическом перемешивании с получением раствора полимера В; добавление вспомогательного средства в раствор полимера В, тщательное перемешивание с получением раствора полимера В для нанесения покрытия; и
b) загрузка указанных микропеллет, содержащих лекарственное средство, в устройство для нижнего распыления в псевдоожиженном слое и покрытие с применением устройства для нанесения покрытия в псевдоожиженном слое, при этом раствор полимера B для нанесения покрытия однородно распределяется с образованием слоя энтеросолюбильного покрытия; при этом увеличение веса, приходящееся на слой, энтеросолюбильного покрытия составляет 5 вес. % ~ 30 вес. %.
9. Способ получения по п. 8, включающий следующие стадии:
(1) нанесение лекарственного средства на сердцевины пеллет без активного вещества:
a) диспергирование полимера A в фармацевтическом этаноле с получением содержания полимера A, cоставляющего 5 вес. %, полное растворение полимера A с помощью механического перемешивания с получением раствора полимера A; продолжение однородного перемешивания, добавление в раствор полимера A пластификатора, средства, уменьшающего липкость, и поверхностно-активного вещества додецилсульфата натрия в качестве вспомогательных средств с последующим добавлением андрографолида, тщательное перемешивание с получением раствора полимера A для нанесения покрытия; и
b) отвешивание сердцевин пеллет из сахарозы без активного вещества диаметром 200~600 мкм, и загрузка в псевдоожиженный слой; регулирование потока воздуха для получения сердцевин пеллет без активного вещества в надлежащем псевдоожиженном состоянии; приведение в действие нагревающего устройства и поддержание температуры материала сердцевин пеллет без активного вещества при 25-35℃, и приведение в действие перистальтического насоса до достижения заданного значения температуры материала сердцевин пеллет без активного вещества для атомизации с помощью распылителя и однородного диспергирования раствора полимера А для нанесения покрытия на поверхности указанных сердцевин пеллет без активного вещества с получением микропеллет, содержащих лекарственное средство;
(2) получение слоя энтеросолюбильного покрытия:
a) диспергирование полимера B в фармацевтическом этаноле для обеспечения его полного растворения с помощью высокоскоростного механического перемешивания со сдвигом; добавление в раствор полимера B пластификатора и средства, уменьшающего липкость, в качестве вспомогательного средства, тщательное перемешивание с получением раствора полимера B для нанесения покрытия; и
b) загрузка указанных микропеллет, содержащих лекарственное средство, в устройство нижнего распыления в псевдоожиженном слое и покрытие с применением устройства для нанесения покрытия в псевдоожиженном слое, при этом раствор полимера B для нанесения покрытия однородно распределяется с образованием слоя энтеросолюбильного покрытия; при этом увеличение веса, приходящееся на слой энтеросолюбильного покрытия, составляет 5 вес. % ~ 30 вес. %.
10. Препарат андрографолида для целенеправленной доставки в кишечник, отличающийся тем, что микропеллета по любому из пп. 1-7 составлена в форме гранул или капсул.
11. Применение андрографолида, микропеллет по любому из пп. 1-7 или препарата для целенаправленной доставки по п. 10 в получении лекарственного препарата для лечения воспалительного заболевания кишечника (IBD).
12. Применение по п. 11, где указанное IBD представляет собой язвенный колит (UC) или болезнь Крона.
13. Применение по п. 11 или 12, где применение обеспечивает уменьшение спайкообразования в толстом кишечнике, отечности и утолщения стенки кишечника и сниженной эластичности.
14. Применение по п. 11 или 12, где применение обеспечивает сокращение язвы, геморрагического пятна и перфорации в толстом кишечнике.
15. Применение по любому из пп. 11-14, отличающееся тем, что указанный лекарственный препарат составлен в форме энтеросолюбильного препарата.
16. Применение по любому из пп. 11-14, отличающееся тем, что указанный лекарственный препарат составлен в форме микропеллет для целенаправленной доставки в кишечник.
17. Применение по п. 16, отличающееся тем, что указанные микропеллеты для целенаправленной доставки в кишечник составлены в форме гранул или капсул.
ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На фиг. 1 представлено влияние андрографолида на вес тела мыши с колитом, вызванным TNBS.
На фиг. 2 представлены снимки общих результатов наблюдений толстого кишечника в каждой группе крыс с UC, вызванным TNBS (A-F).
На фиг. 3 представлен кишечник данио-рерио в группе исследуемого лекарственного средств, модельной группе с болезнью Крона и контрольной группе с холостой пробой (участок, окруженный зеленой пунктирной линией, представляет собой кишечник данио-рерио).
На фиг. 4 показана степень уменьшения расширения просвета кишечника в модели болезни Крона после введения андрографолида в разных дозах (по сравнению с контрольной группой с холостой пробой).
На фиг. 5 представлена терапевтическая эффективность андрографолида в разных дозах в модели болезни Крона, рассчитанная на основе площади просвета кишечника.
На фиг. 6 представлено распределение нейтрофилов в ткани кишечника данио-рерио после лечения лекарственными средствами (участок, окруженный желтой пунктирной линией, представляет собой кишечник данио-рерио, и такой участок, представленный зеленым ярким пятном, представляет собой нейтрофил).
На фиг. 7 представлено общее количество высвобождения лекарственного средства в искусственном кишечном соке (фосфатный буфер, pH 6,5).
На фиг. 8 представлено общее количество высвободившегося лекарственного средства в искусственном соке толстого кишечника (фосфатный буфер, pH 7,2).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В первом аспекте настоящего изобретение указанное IBD главным образом относится к UC и болезни Крона. В результате исследования авторы настоящего изобретения сделали следующий вывод: андрографолид уменьшает спайкообразование в толстом кишечнике, отечность и утолщение стенки толстого кишечника, а также сниженную эластичность. Кроме того, андрографолид способен сокращать язвы в толстом кишечнике, геморрагическое пятно и перфорацию.
Указанное лекарственное средство по настоящему изобретению включает любое утвержденное лекарственное средство, полученное с применением андрографолида в качестве активного фармацевтического ингредиента (API). Предпочтительно указанное лекарственное средство по настоящему изобретению относится к фармацевтической композиции, содержащей андрографолид в виде одного API или в виде одного из API.
Андрографолид по настоящему изобретению относится к уровню техники и является коммерчески доступным, или его получают с помощью стандартного способа. Например, андрографолид получают следующим способом: листья Andrographis paniculata вымачивают с применением 95% (объем/объем) этанола, и полученную вымачивающую жидкость на основе этанола обесцвечивают с помощью активированного угля, затем этанол в вымачивающей жидкости на основе этанола извлекают перегонкой с получением концентрированной жидкости. Жидкости дают отстояться с получением крупного кристалла. К указанному крупному кристаллу добавляют 15-кратное количество (15×) 95% (объем/объем) этанола, растворяют путем нагревания, обесцвечивают с помощью активированного угля и фильтруют в горячем состоянии. Жидкости дают отстояться с получением светло-желтого кристалла путем перекристаллизации. Полученный кристалл очищают промыванием в дистиллированной воде, хлороформе и метаноле с получением конечного продукта андрографолида.
Андрографолид предпочтительно вводят в форме фармацевтической композиции. Указанную композицию можно использовать стандартно с одним или более видами физиологически приемлемых вспомогательных средств или носителей. Если это возможно, андрографолид выступает в качестве API и вводится непосредственно пациентам, предпочтительно API вводят непосредственно в виде фармацевтической композиции. С точки зрения совместимости с другими ингредиентами и безопасности для субъекта, указанные носители должны быть фармацевтически приемлемыми.
Указанную фармацевтическую композицию можно получить в любой из фармацевтически приемлемых дозированных форм для клинического применения, в том числе без ограничений: таблеток, например, таблеток, покрытых сахарной оболочкой, таблеток, покрытых пленочной оболочкой, и таблеток с энтеросолюбильным покрытием; капсул, например, твердых капсул, мягких капсул или капсул с энтеросолюбильным покрытием; инъекций; суппозиториев, например, суппозиториев с энтеросолюбильным покрытием; капель и т.д., предпочтительно препаратов с энтеросолюбильным покрытием, например, таблеток с энтеросолюбильным покрытием и капсул с энтеросолюбильным покрытием.
Фармацевтически приемлемые вспомогательные средства можно добавить в фармацевтические препараты при получении указанной фармацевтической композиции.
В отношении препаратов для перорального введения композиция может включать стандартные вспомогательные средства, например, связывающие средства, наполнители, разбавители, средства для таблетирования, смазывающие средства, средства для улучшения распадаемости, красители, ароматизаторы и увлажняющие средства. При необходимости таблетки можно покрывать оболочкой. Подходящие наполнители включают целлюлозу, маннит, лактозу и другие аналогичные наполнители. Подходящие средства для улучшения распадаемости включают крахмал, поливинилпирролидон (PVP) и производные крахмала (например, натрия крахмал гликолят). Подходящие смызывающие средства включают стеарат магния. Подходящие увлажняющие средства включают додецилсульфат натрия. Препараты для перорального введения можно получать с помощью стандартного способа смешивания, наполнения, таблетирования и т.д. Повторное смешивание выполняют для однородного распределения API в композициях, в которых используют большое количество наполнителей.
В отношении инъекций указанный жидкий дозированный препарат содержит андрографолид и асептические носители. Растворение или суспендирование API в жидкости зависит от типа и концентрации носителей. Как правило, раствор получают путем растворения API в одном виде носителей, стерилизации, расфасовку в подходящий флакон или ампулу и укупоривание. Фармацевтически приемлемые вспомогательные вещества, например, местные анестетики, консерванты или буферные средства можно, при необходимости, растворять в носителях. Для улучшения стабильности, после расфасовки в флакон, композицию по настоящему изобретению можно замораживать и обрабатывать в вакууме для удаления воды.
Эффективная суточная доза лекарственного препарата для лечения взрослых всегда находится в диапазоне 0,02~5000 мг при применении для предупреждения и лечения UC и болезни Крона, предпочтительно 1~1500 мг. Указанная доза, требуемая для лечения, представляет собой разовую дозу или много доз, в которых препарат вводят через соответствующие интервалы, например, дважды, трижды, четыре раза или более в сутки. Препарат по настоящему изобретению может включать 0,1 вес. % ~ 99,9 вес. % API.
Во втором аспекте по настоящему изобретению обеспечивается новый pH-зависимый препарат для целенаправленной доставки в кишечник, характеризующийся тем, что в состав указанной микропеллеты с андрографолидом для целенаправленной доставки в кишечник вхяодят сердцевина пеллеты без активного вещества, слой лекарственного средства и слой энтеросолюбильного покрытия, где указанный слой лекарственного средства содержит андрографолид, полимер A, растворимый в условиях pH ≥ 7,0, и вспомогательное средство; при этом соотношение андрографолида и полимера A составляет 1:2~1:0,2 по весу, предпочтительно 1:1,5~1:0,5 по весу; увеличение веса, приходящееся на слой лекарственного средства, составляет 20 вес. % ~ 100 вес. %, предпочтительно 30 вес % ~ 80 вес. %; указанный слой энтеросолюбильного покрытия содержит полимер B, растворимый в условиях pH ≥ 5,5, и вспомогательное cредство; увеличение веса, приходящееся на слой энтеросолюбильного покрытия, составляет 5 вес. % ~ 30 вес. %, предпочтительно 8 вес. % ~ 20 вес. %, наиболее предпочтительно 10 вес. % ~ 18 масс. %.
Где указанный полимер A представляет собой сополимер метакриловой кислоты и метилметакрилата, предпочтительно сополимер метакриловой кислоты и метилметакрилата в соотношении 1:2; а указанный полимер B представляет собой сополимер метакриловой кислоты и этилакрилата, предпочтительно сополимер метакриловой кислоты и этилакрилата в соотношении 1:1.
Предпочтительно полимер A выбран из Eudragit S100, приобретенного у Rohm Inc., Германия, а полимер B предпочтительно представляет собой полимеры серии Eudragit L, наиболее предпочтительно Eudragit L100-55.
Указанные вспомогательные средства, содержащиеся в слое лекарственного средства, включают пластификаторы, средства, уменьшающие липкость, пигменты, гидрофильные полимеры и поверхностно-активные вещества. Предпочтительно поверхностно-активные вещества выбраны из натрия додецилсульфата (SDS) или Tween-80 с добавлением количества 0~5 вес. % андрографолида, предпочтительно 1 вес. % ~ 3 вес. % андрографолида.
Указанный пластификатор представляет собой одно или более выбранных из группы, включающей триэтилцитрат, дибутилсебацинат, пропандиол и PEG, при этом количество пластификатора составляет 10 вес. % ~ 70 вес. % от полимера A, предпочтительно 10 вес. % ~20 вес. % от полимера A; указанное средство, уменьшающее липкость, представляет собой тальк, при этом количество средства, уменьшающего липкость, составляет 25 вес. % ~ 100 вес. % от полимера A, предпочтительно 30 вес. % ~ 50 вес. % от полимера A; или указанное средство, уменьшающее липкость, представляет собой глицерил моностеарат, при этом количество средства, уменьшающего липкость, составляет 2 вес. % ~ 20 вес. % от полимера A, предпочтительно 5 вес. % ~ 10 вес. % от полимера A.
Диаметр указанной сердцевины пеллеты без активного вещества составляет 200~600 мкм, предпочтительно 300~500 мкм, а количество сердцевины пеллеты составляет 10 вес. % ~ 70 вес. % от состава, предпочтительно 20 вес. % ~ 60 вес. % от состава. Указанная сердцевина пеллеты без активного вещества представляет собой стандартную сердцевину фармацевтической пеллеты, предпочтительно сердцевину пеллеты на основе сахарозы без активного вещества или сердцевину пеллеты на основе микрокристаллической целлюлозы.
Указанные ингредиенты присутствуют в пропорции в весовых частях: сердцевина пеллеты без активного вещества:андрографолид:полимер A:пластификатор:средство, уменьшающее липкость:поверхностно-активное вещество = 200:(10-100):(10-100):(1-15):(1-30):(0-3).
Предпочтительно указанные ингредиенты присутствуют в пропорции в весовых частях: сердцевина пеллеты без активного вещества:андрографолид:полимер A:пластификатор:средство, уменьшающее липкость:поверхностно-активное вещество = 200:(15-66):(13-74):(2-13,5):( 3-27):(0-1,32).
Наиболее предпочтительно указанные ингредиенты присутствуют в пропорции в весовых частях: сердцевина пеллеты без активного вещества: андрографолид: полимер A: пластификатор: средство, уменьшающее липкость: поверхностно-активное вещество = 200: (20-50):(30-60):(5-10):(5-20):(0,5-1,2).
При этом указанные вспомогательные средства, содержащиеся в слое энтеросолюбильного покрытия, включают пластификаторы и средства, уменьшающие липкость, выбранные как представлено выше. Количество пластификатора составляет 15 вес. % от полимера В, а количество средства, уменьшающего липкость, составляет 30 вес. % от полимера B.
Семь оптимизированных составов сердцевины пеллеты без активного вещества и слоя лекарственного средства изложены ниже:
(г)
(г)
(г)
(г)
Способ получения микропеллеты с андрографолидом для целенаправленной доставки в кишечник представляет собой следующее:
(1) нанесение лекарственного средства на сердцевины пеллет без активного средства:
a) диспергирование полимера A в фармацевтическом органическом растворителе для обеспечения его полного растворения путем высокоскоростного механического перемешивания со сдвигом с получением раствора полимера A; добавление в раствор полимера A пластификатора и средства, уменьшающего липкость, с последующим добавлением андрографолида, тщательное перемешивание с получением раствора полимера A для нанесения покрытия; хранение раствора для нанесения покрытия в виде однородной суспензии путем поддержания механического перемешивания при покрытии; и
b) отвешивание сердцевин пеллет без активного вещества и загрузка в псевдоожиженный слой; регулирование потока воздуха для получения сердцевин пеллет без активного вещества в надлежащем псевдоожиженном состоянии; приведение в действие нагревающего устройства до достижения заданного значения температуры материала сердцевин пеллет без активного вещества и приведение в действие перистальтического насоса для атомизации с помощью распылителя и однородного диспергирования раствора полимера А для нанесения покрытия на поверхности указанных сердцевин пеллет без активного вещества с получением микропеллет, содержащих лекарственное средство;
(2) получение слоя энтеросолюбильного покрытия:
a) диспергирование полимера В в фармацевтическом органическом растворителе или воде для обеспечения его полного растворения с помощью высокоскоростного механического перемешивания со сдвигом с получением раствора полимера В; добавление в раствор полимера В пластификатора и средства, уменьшающего липкость, тщательное перемешивание с получением раствора полимера В для нанесения покрытия; и
b) загрузка указанных микропеллет, содержащих лекарственное средство, в устройство для нижнего распыления в псевдоожиженном слое и покрытие с применением устройства для нанесения покрытия в псевдоожиженном слое, при этом раствор полимера B для нанесения покрытия однородно распределяется с образованием слоя энтеросолюбильного покрытия; при этом увеличение веса, приходящееся на слой энтеросолюбильного покрытия, составляет 5 вес. % ~ 30 вес. %.
Предпочтительно способ получения микропеллеты с андрографолидом для целенаправленной доставки в кишечник представляет собой следующее:
(1) нанесение лекарственного средства на сердцевины пеллет без активного вещества:
a) диспергирование полимера A в фармацевтическом этаноле с получением содержания полимера A, составляющего 5 вес. %, полное растворение полимера A с помощью высокоскоростного механического перемешивания со сдвигом с получением раствора полимера A; продолжение однородного перемешивания, добавление соответствующего количества пластификатора, средства, уменьшающего липкость, и поверхностно-активного вещества додецилсульфата натрия в раствор полимера A с последующим добавлением андрографолида, тщательное перемешивание с получением раствора полимера A для нанесения покрытия; выдерживание покрывающего раствора в виде однородной суспензии путем поддержания механического перемешивания при покрытии; и
b) отвешивание сердцевин пеллет из сахарозы без активного вещества диаметром 200~600 мкм и загрузка в псевдоожиженный слой; регулирование потока воздуха для получения сердцевин пеллет без активного вещества в надлежащем псевдоожиженном состоянии; приведение в действие нагревающего устройства и поддержание температуры материала сердцевин пеллет без активного вещества при 25-35℃, и приведение в действие перистальтического насоса до достижения заданного значения температуры материала сердцевин пеллет без активного вещества для атомизации с помощью распылителя и однородного диспергирования раствора полимера А для нанесения покрытия на поверхности указанных сердцевин пеллет без активного вещества с получением микропеллет, содержащих лекарственное средство;
(2) получение слоя энтеросолюбильного покрытия:
a) диспергирование полимера B в фармацевтическом этаноле для обеспечения его полного растворения с помощью высокоскоростного механического перемешивания со сдвигом; добавление в раствор полимера B, пластификатора и средства, уменьшающего липкость, тщательное перемешивание с получением раствора полимера B для нанесения покрытия; и
b) загрузка указанных микропеллет, содержащих лекарственное средство, в устройство для нижнего распыления в псевдоожиженном слое и покрытие с применением устройства для нанесения покрытия в псевдоожиженном слое, при этом раствор полимера B для нанесения покрытия однородно распределяется с образованием слоя энтеросолюбильного покрытия; при этом увеличение веса, приходящееся на слой энтеросолюбильного покрытия, составляет 5 вес. % ~ 30 вес. %.
Кроме того, настоящее изобретение также относится к препарату андрографолида для целенаправленной доставки в кишечник, а указанные препараты включают капсулы или гранулы, полученные из микропеллет, полученных стандартным способом.
Преимущества
В настоящем изобретении использовали специфическую pH-зависимую методику, а именно, совместное использование двух pH-зависимых полимеров для достижения высвобождения при целенаправленной доставке в кишечник в организмах с разными значениями pH в толстом кишечнике.
(1) Первый тип энтеросолюбильного материала, например, Eudragit L 100-55, использовали в слое энтеросолюбильного покрытия для того, чтобы удостовериться, что препарат не высвобождается в желудке при воздействии на лекарственное средство с быстрым растворением энтеросолюбильного слоя при достижении двенадцатиперстной кишки.
(2) Второй тип энтеросолюбильного материала (например, Eudragit S 100) использовали в качестве каркаса в слое лекарственного средства в виде среднего слоя, в котором однородно распределено лекарственное средство. Лекарственное вещество постепенно высвобождается в результате растворения слоя энтеросолюбильного покрытия, когда микропеллета достигает двенадцатиперстной кишки. Однако в условиях низкого pH происходит незначительно высвобождение лекарственного средства; лишь при достижении конца тонкого кишечника при pH, близком 7, лекарственное средство быстро высвобождается, поскольку Eudragit S 100 в слое лекарственного средства оказывает замедляющий эффект в условии низкого pH.
Как представлено выше, микропеллета с андрографолидом для целенаправленной доставки в кишечник по настоящему изобретению имеет трехслойную структуру: сердцевина микропеллеты без активного вещества, слой лекарственного средства и слой энтеросолюбильного покрытия. Слой энтеросолюбильного покрытия сохраняется целостным при pH ниже 5,5, когда препарат поступает в желудок. Однако после достижения двенадцатиперстной кишки, слой энтеросолюбильного покрытия растворяется в течение сравнительно короткого периода времени с раскрытием для воздействия слоя лекарственного средства. Eudragit S 100 в слое действующего вещества играет двойную роль в длительном высвобождении и кишечном растворении. Андрографолид однородно распределяется в Eudragit S 100. После достижения двенадцатиперстной кишки наружный слой растворяется. Непосредственно после раскрытия для воздействия биологических жидкостей, андрографолид начинает высвобождаться. Поскольку величина pH в двенадцатиперстной кишке является низкой, растворяется ограниченное количество Eudragit S 100 и высвобождается весьма незначительное количество лекарственных средств с очень низкой скоростью. При переносе лекарственного средства в нижнюю половину желудочно-кишечного тракта значение рН постепенно возрастает, скорость растворения Eudragit S 100 увеличивается, а скорость высвобождения лекарственного средства постепенно повышается. В результате большая часть лекарственного средства не высвобождается до достижения подвздошной кишки и толстого кишечника, где способно воздействовать на воспаление кишечника.
Диаметр указанной сердцевины пеллеты без активного вещества по настоящему изобретению составляет 200~600 мкм, что существенно меньше широко используемой в клинической практике сердцевины пеллеты микропеллеты (500~1000 мкм). Это будет полезно для повышения специфической площади поверхности, увеличения площади контакта между лекарственным средством и участком воспаления, и обеспечения того, что андрографолид проявлять свой терапевтический эффект в отношении IBD. Количество сердцевины пеллеты без активного вещества составляет приблизительно 10 вес. % ~ 70 вес % от состава.
Полимеры серии Eudragit используют в качестве пленочного материала для покрытия микропеллеты, и в состав добавляют пластификаторы и средства, уменьшающие липкость. При этом основная роль пластификатора заключается не только в снижении температуры стеклования и минимальной температуры пленкообразования, но также в повышении эластичности полимерной пленки. Основная роль средства, уменьшающего липкость, заключается в предупреждении липкости пленки, приводя к взаимному связыванию сердцевин пеллет без активного вещества. Поверхностно-активное вещество можно использовать для повышения увлажняющего эффекта по отношению к препарату.
Фармакологические эффекты андрографолида и его нового препарата доказаны при помощи следующих экспериментов.
Фармакологическое исследование 1. Фармакологическое исследование андрографолида в отношении UC, индуцированного TNBS
1. Цель
Мышиную модель IBD использовали для проведения предварительной оценки андрографолида для лечения UC и болезни Крона.
2. Материалы
2.1. Животные
Пятьдесят самцов мышей SPF Balb/c весом 18~24 г приобрели у Beijing Weitonglihua Experimental Animals Inc., номер сертификата SCX (JING) 2011-0012.
2.2. Условия выращивания
Животных выращивали в виварии при изолированном содержании, по 10 мышей в каждой клетке, при температуре 20~25℃ и относительной влажности 40~60%, со свободным доступом к воде и пище, наполнитель заменяли ежедневно.
2.3. Исследуемый препарат и реагенты
Исследуемый препарат: андрографолид, белый сухой порошок, предоставленный Tasly Modern TCM Resource Inc., номер партии 20100501, выход 98% и чистота 98%.
Лекарственное средство в качестве положительного контроля: сульфасалазин, таблетки, приобрели у Sanwei Pharmaceutical Inc., номер партии 200206C11, спецификация 250 мг/таблетка, 12 таблеток × 5.
Реагенты: 2,4,6-тринитробензолсульфоновую кислоту (TNBS) приобрели у Sigma Inc., номер партии 033K5020, спецификация 5% (вес/объем) и 10 мл/флакон.
3. Способ
3.1. Подготовка модели
5% (вес/объем) раствор TNBS разбавляли дважды дистиллированной водой и смешивали с 50% (объем/объем) этанолом в равном объеме с получением 1,5% (вес/объем) раствора TNBS. В модельной контрольной группе мышей анестезировали 1 вес. % раствором фенобарбитала в дозе 0,05 мл/10 г веса тела. После анестезии мышам вводили 1,5% (вес/объем) раствор TNBS в дозе 0,1 мл/мышь путем осторожного введения через анус устройства для промывания желудка на глубину приблизительно 3 см и продвижения в толстый кишечник, таким образом, индуцировали IBD. В группе физиологического раствора в толстый кишечник осторожно вводили физиологический раствор в дозе 0,1 мл/мышь. В контрольной группе с нормальным состоянием в толстый кишечник осторожно вводили 50% (объем/объем) этанол в дозе 0,1 мл/мышь.
3.2. Группировка и введение
Через неделю после адаптационного кормления всех животных случайным образом распределяли на 5 групп в соответствии с весом тела, по 10 мышей в группе: контрольную группу с нормальным состоянием, модельную контрольную группу, группу с низкой дозой андрографолида (20 мг/кг/сутки), группу с высокой дозой андрографолида (40 мг/кг/сутки) и группу положительного контроля (группа с сульфасалазином, 300 мг/кг/сутки). Через два часа после подготовки модели животным в каждой группе лечения перорально дважды в сутки вводили андрографолид, а в группе положительного контроля один раз в сутки. После последовательного введения в течение 7 дней брюшную полость вскрывали через 24 часа после последнего введения для исследования степени спайкообразования между толстым кишечником и другими органами. Толстый кишечник отбирали и взвешивали.
3.4. Исследуемые показатели
1. Вес тела: после получения модели, вес тела измеряли ежедневно для исследования изменений у животных.
2. Оценка воспаления: брюшную полость вскрывали 24 часа спустя после последнего введения для исследования степени спайкообразования между толстым кишечником и другими органами. Каждый сегмент толстого кишечника извлекали и взвешивали для расчета процента веса толстого кишечника по отношению к весу тела в виде индекса толстого кишечника. Формула представляет собой следующее:
скорость снижения специфического веса толстого кишечника = (индекс толстого кишечника в модельной контрольной группе - индекс толстого кишечник в группе лечения)/индекс толстого кишечника в модельной контрольной группе × 100%.
3. Гистопатологическое исследование: часть толстого кишечника отбирали для получения гистологических срезов, и стандартом для оценки в баллах было следующее:
0 баллов, симптомы воспаления отсутствуют;
1 балл, слабовыраженное воспаление без структурных изменений;
2 балла, слабовыраженная лейкоцитарная инфильтрация;
3 балла, выраженная лейкоцитарная инфильтрация, высокая объемная плотность сосудов, увеличение глубины крипт, утолщение стенки толстого кишечника и наличие поверхностных язв;
4 балла, выраженная лейкоцитарная инфильтрация, выходящая за пределы слизистого слоя, увеличение глубины крипт, уменьшение числа бокаловидных клеток, высокая объемная плотность сосудов, утолщение стенки толстой кишки и наличие обширных язв.
3.5. Статистика
Для анализа использовали компьютерную программу SPSS11.5 и данные были представлены в виде 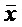 ± S. Дисперсионный анализ использовали для сравнения значимой разницы между группами. P < 0,05 указывало на статистически значимую разницу.
± S. Дисперсионный анализ использовали для сравнения значимой разницы между группами. P < 0,05 указывало на статистически значимую разницу.
4. Результаты
4.1. Влияние андрографолида на вес тела мышей с UC, индуцированным TNBS
Индекс массы тела мог в целом отражать общее состояние здоровья мышей. По сравнению с контрольной группой с нормальным состоянием рост мышей был нарушен после формирования UC посредством ректального введения TNBS, и увеличение веса тела было медленным. При лечении андрографолидом или сульфасалазином вес тела увеличивался быстрее, чем вес тела в модельной контрольной группе. Данные представлены на фиг. 1.
4.2. Влияние андрографолида на вес толстого кишечника, индексы толстого кишечника и скорость снижения специфического веса толстого кишечника
После индуцирования UC с помощью TNBS вес толстого кишечника и индексы толстого кишечника в модельной контрольной группе были выше, чем такие же показатели в контрольной группе с нормальным состоянием, указывая на успешное моделирование. Через 7 дней после введения по сравнению с модельной контрольной группой вес толстого кишечника в группе с высокой дозой андрографолида и группе сульфасалазина был значимо снижен (P < 0,01); индексы толстого кишечника в группе с высокой дозы андрографолида, группе с низкой дозой андрографолида и группе с сульфалазином были значимо снижены (P < 0,05, P < 0,01), и скорости снижения специфического веса толстого кишечника составили 33,20%, 58,96% и 47,87%. Данные представлены в таблице 1.
Таблица 1. Влияние андрографолида на вес толстого кишечника, индексы толстого кишечника и скорость снижения специфического веса толстого кишечника у мышей с колитом
По сравнению с модельной контрольной группой: *:P<0,05;**:P<0,01.
4.3. Влияние андрографолида на гистопатологические изменения в толстом кишечнике у мышей с колитом, индуцированным TNBS
После индуцирования UC с помощью TNBS возникал ряд симптомов: спайкообразование в толстом кишечнике, отечность и утолщение стенки кишечника, сниженная эластичность, поверхностный UC, геморрагическое пятно и перфорация толстого кишечника, указывающие на обширные воспалительные повреждения в толстом кишечнике. Эластичность кишечника в группах с андрографолидом и в группе с сульфасалазином была выше, чем в модельной контрольной группе, а повышение веса толстого кишечника было намного меньшим, чем повышение веса в модельной контрольной группе, указывая на то, что воспалительная реакция, такая так спайкообразование и воспалительная экссудация в толстом кишечнике, была слабее, чем такая реакция в модельной контрольной группе. Гистопатологические повреждения слизистой оболочки и стенки кишечника, вызванные язвой и кровоизлиянием и т. д., исследовали невооруженным глазом; гистопатологические повреждения в группе с высокой дозой андрографолида и в группе положительного контроля (группе с сульфасалазином) были намного меньшими, чем такие повреждения в модельной контрольной группе. Данные представлены в таблице 2.
Таблица 2. Влияние андрографолида на оценку в баллах толстого кишечника у мышей с колитом, индуцированным с помощью TNBS
По сравнению с модельной контрольной группой: *:P < 0,05;**:P < 0,01.
5. Выводы
Существует ряд способов создания животной модели колита, при этом модель с колитом, индуцированным TNBS/этанолом, была наиболее близкой к патологическим изменениям при UC в клинической практике. Этанол разрушает слизистые барьеры кишечника, и TNBS, в качестве неполного антигена, мог бы сенсибилизировать T-лимфоциты путем связывания с тканевыми белками с целью воспаления кишечника после индуцирования аутоиммунной реакции. Крысы с модельной патологией, вызванной этим способом, имеют множество сходств с клиническими симптомами пациентов с UС: изменение стула и общее морфологическое и гистологическое изменение кишечника.
В настоящем исследовании мышей с модельным колитом использовали для предварительной оценки лечебного эффекта андрографолида. Как представлено в результатах, андрографолид в высокой дозе (40 мг/кг/сутки) способен задерживать тенденцию к снижению веса тела у мышей модельной контрольной группы, по сравнению с модельной контрольной группой мог значимо снижать индексы толстого кишечника (P < 0,01), ослаблять патологические изменения в толстом кишечнике, при этом скорость снижения специфического веса толстого кишечника составила 58,96%. Учитывая упомянутые выше показатели, андрографолид оказывал значимое нормализующее влияние в отношении колита у мышей, оказывая определенный терапевтический эффект на UC и являясь эффективным в лечении болезни Крона.
Фармакологическое исследование 2. Исследование терапевтического эффекта андрографолида в отношении UC, индуцированного натриевой солью сульфата декстрана (DSS)
1. Цель
Оценивали влияние андрографолида в отношении UC, индуцированного DSS.
2. Животные
Восемьдесят четыре мыши Balb/c, со статусом SPF, из них половина самцов и половина самок, весом 18~22 г, были предоставлены Guangdong Medical Experimental Animal Center, номер сертификата SYXK(YUE) 2008-0002. Условия выращивания: 7 мышей на клетку, выращенных в группе; температура и влажность: 20-26℃ и 40-70%. Животных периодически освещали (10 ч. днем и 14 ч. ночью). Условия вивария всегда сохранялись неизменными, обеспечивая надежность результатов эксперимента. Животных содержали на полном пеллетированном корме (представленным Guangdong Medical Experimental Animal Center), со свободным доступом к пище и воде посредством бутылки для выпаивания.
3. Основные приборы и реагенты
3.1. Основные приборы
3.1.1. Электронные весы, точность: 0,001 г, Zhongshan Hengxin Electronics Inc.
3.1.2. Устройство для автоматического обезвоживания органической ткани (TS-12N, Xiaogan Hongye Medical Device Inc.).
3.1.3. Устройство для заливки органической ткани (BM-VII, Xiaogan Hongye Medical Device Inc.).
3.1.4. Устройство для получения парафиновых срезов (RM2135, Leica Inc., Германия).
3.1.5. Устройство для нанесения и обжига срезов (CS-V I, Xiaogan Hongye Medical Device Inc.).
3.1.6 Устройство для автоматического окрашивания органической ткани (RS-18 II, Xiaogan Hongye Medical Device Inc.).
3.2. Реагенты
3.2.1. Андрографолид был предоставлен Tasly Modern TCM Resource Inc., номер партии 20140508, чистота >95%.
3.2.2. Лекарственное средство положительного контроля: месалазин, таблетки с энтеросолюбильным покрытием, приобрели у Jiamusi Luling Pharmaceutical Inc., Sunflower Pharmaceutical Group, номер партии 140225.
3.2.3. Натриевую соль сульфата декстрана (DSS) приобрели у MPBIO Inc.
4. Расчет доз и группировка
4.1. Группировка: 84 мыши с карантинным статусом распределяли произвольным образом на 6 групп: модельная контрольная группа, группа положительного контроля, группа с низкой дозой исследуемого лекарственного средства при внутрижелудочном введении, группа с высокой дозой исследуемого лекарственного средства при внутрижелудочном введении, группа с низкой дозой исследуемого лекарственного средства при внутритолстокишечном введении и группа с высокой дозы исследуемого лекарственного средства при внутритолстокишечном введении, в каждой группе по 14 мышей. Все животным ежедневно выпаивали 5% раствор DSS в течение последовательных 14 дней для создания модели UC. Животным вводили лекарственное средство для лечения на 2й день после предоставления питьевой воды с 5% DSS.
4.2. Доза: в настоящем исследовании дозу введения мышам во всех группах рассчитывали на основе требований заказчика и такие же дозы утверждали для групп с внутрижелудочным и внутритолстокишечным введением. В модельной контрольной группе животных не подвергали лечению, группа положительного контроля (месалазин, таблетки с энтеросолюбильным покрытием, 227,5 мг·кг-1·сутки-1), группа с низкой дозой андрографолида при внутрижелудочном введении (60 мг·кг-1·сутки-1), группа с высокой дозой андрографолида при внутрижелудочном введении (180 мг·кг-1·сутки-1), группа с низкой дозы андрографолида при внутритолстокишечном введении (60 мг·кг-1·сутки-1) и группа с высокой дозой андрографолида при внутритолстокишечном введении (180 мг·кг-1·сутки-1).
5. Способ
5.1. Способ создания модели UC: всем животным ежедневно выпаивали раствор 5% DSS в течение последовательных 14 дней.
5.2. Способ введения: на 2й день после создания модели мышам вводили внутрижелудочно или внутритолстокишечно препарат в дозе 1 мл/100 г один раз в день в течение последовательных 14 дней.
5.3. Способ отбора образцов в эксперименте: через 2 часа после последнего введения мышей умерщвляли смещением шейного позвонка и вскрывали брюшную полость для отделения толстого кишечника. По ходу брыжейки разрезали участок стенки кишечника и ополаскивали физиологическим раствором при 4℃, и распределяли на пластиковой пластине.
5.4. Способ оценки индекса активности заболевания (DAI): индекс активности заболевания определяли на 7й и 14й дни после введения. Способ был представлен вместе со следующими тремя параметрами: проценты потери веса тела (неизмененный BW: 0 баллов, 1~5: 1 балл, 5~10: 2 балла, 10~15: 3 балла, более 15: 4 балла), вязкость стула (нормальный стул: 0 баллов, жидкий стул: 2 балла, понос: 4 балла) и стул с кровью (нормальный стул: 0 баллов, кал со скрытой кровью: 2 балла и положительный кровянистый стул: 4 балла). Суммарный балл по трем параметрам делили на 3 с получением DAI, а именно DAI = (балл показателя BW + бал характера стула + бал наличия крови в стуле)/3.
6. Исследуемые показатели
6.1. Наблюдение: общие клинические симптомы у мышей исследовали ежедневно от начала до конца эксперимента, и регистрировали стул, психическое состояние и смертность.
6.2. Вес тела: BW регистрировали еженедельно от начала до конца эксперимента.
6.3. Расчет DAI: DAI рассчитывали на 7й и 14й дни после введения для оценки активности болезни.
6.4. Для образца отбирали слизистую ткань толстого кишечника на расстоянии 8~10 см от ануса, заливали парафином и окрашивали стандартным способом с использованием HE. Повреждение слизистой оболочки толстого кишечника определяли визуально с помощью микроскопа, и гистологическое повреждение оценивали в баллах на основе следующих показателей: степени воспалительной гранулемы язвы, фиброза и патологической степени.
7. Статистические показатели
Данные выражали в виде среднего ± стандартное отклонение (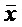 ± S). Все числовые переменные анализировали с помощью компьютерной программы SPSS13.0 с использованием однофакторного дисперсионного анализа. Анализ t-критерия использовали для внутригруппового сравнения. P < 0,05 указывало на статистически значимую разницу.
± S). Все числовые переменные анализировали с помощью компьютерной программы SPSS13.0 с использованием однофакторного дисперсионного анализа. Анализ t-критерия использовали для внутригруппового сравнения. P < 0,05 указывало на статистически значимую разницу.
8. Результаты
Через 7 дней после создания модели у мышей в модельной контрольной группе наблюдали жидкий стул, понос, стул с кровью и потерю BW, в то время как в группах лечения стул был более оформленным и частота стула с кровью была немного меньшей, чем в модельной контрольной группе. Во время эксперимента ни одна мышь не погибла.
8.1. Влияние на DAI
При сравнении активности болезни во всех группах понос возникал в группе DSS на 3й~5й дни после выпаивания DSS, и тест на скрытую кровь в кале был положительным. На 5й~7й дни невооруженным глазом наблюдали различные степени стула с кровью. Например, понос и скрытая кровь в кале встречалась на 3й~5й дни в группе положительного контроля и группе с высокой дозой андрографолида при внутритолстокишечном введении, однако после 5го дня видимого невооруженным глазом стула с кровью у мышей обнаружено не было. Через 14 дней после введения число случаев кровянистого стула и поноса в группе положительного контроля и группе с высокой дозой андрографолида при внутритолстокишечном введении было меньше, чем в модельной контрольной группе, и DAI был значимо снижен (P<0,01) по сравнению с модельной контрольной группой, а также наблюдали определенную тенденция снижения числа случаев стула с кровью и поноса в группе с высокой дозой андрографолида при внутрижелудочном введении, однако без статистически значимой разницы по сравнению с модельной контрольной группой. Данные представлены в таблице 3.
Таблица 3. Балл DAI во всех группах (x±SD)
(мг/кг)
По сравнению с модельной контрольной группой: *P<0,05,**P<0,01
9. Выводы и обсуждение
До настоящего времени механизм применения модельной патологии, индуцированной DSS, не был полностью выяснен. По-видимому, он связан со многими аспектами: дисфункцией макрофагов; нестабильностью кишечной флоры; влиянием на синтез ДНК в клетке эпителия толстого кишечника отрицательного заряда DSS; ингибированием пролиферации клетки эпителия и разрушением слизистого барьера кишечника, которые указывали на более идеальную модель для изучения IBD человека. Как представлено в результатах, частота стула с кровью, наблюдаемого невооруженным глазом, снижалась только через 7 дней после введения в группе с высокой дозой андрографолида при внутритолстокишечном введении (180 мг/кг), а стул с кровью и понос уменьшались через 14 дней после введения. Балл DAI был значимо ниже, чем в модельной контрольной группе (P<0,01), который, как было доказано, имеет определенный защитный эффект в отношении UC.
Фармакологическое исследование 3. Фармакологическое исследование андрографолида в отношении UC, индуцированного TNBS
1. Цель
Оценивали влияние андрографолида в отношении UC, индуцированного TNBS.
2. Животные
Восемьдесят четыре крысы SD со статусом SPF, из них половина самцов и половина самок, весом 180~220 г, были предоставлены Guangdong Medical Experimental Animal Center, номер сертификата SYXK(YUE) 2008-0002. Условия выращивания: 5 крыс на клетку, выращенных в группе; температура и влажность: 20-26℃ и 40-70%. Животных периодически освещали (10 ч. днем и 14 ч. ночью). Условия вивария всегда сохранялись неизменными, обеспечивая надежность результатов эксперимента. Животных содержали на полном пеллетированном рационе (представленным Guangdong Medical Experimental Animal Center), со свободным доступом к пище и воде посредством бутылки для выпаивания.
3. Основные приборы и реагенты
3.1. Основные приборы
3.1.1. Электронные весы, точность: 0,001 г, Zhongshan Hengxin Electronics Inc.
3.1.2. Устройство для автоматического обезвоживания органической ткани (TS-12N, Xiaogan Hongye Medical Device Inc.).
3.1.3. Устройство для заливки органической ткани (BM-VII, Xiaogan Hongye Medical Device Inc.).
3.1.4. Устройство для получения парафиновых срезов (RM2135, Leica Inc., Германия).
3.1.5. Устройство для нанесения и обжига срезов (CS-V I, Xiaogan Hongye Medical Device Inc.).
3.1.6. Устройство для автоматического окрашивания органической ткани (RS-18 II, Xiaogan Hongye Medical Device Inc.).
3.2. Реагенты
3.2.1. Андрографолид предоставили с номером партии 20140508, чистота >95%.
3.2.2. Лекарственное средство положительного контроля: месалазин, таблетки с энтеросолюбильным покрытием, приобрели в Jiamusi Luling Pharmaceutical Inc., Sunflower Pharmaceutical Group, номер партии 140225.
3.2.3 TNBS был приобретен в Sigma Inc., номер партии SLBG2566V.
4. Расчет доз и группировка
4.1. Группировка: для создания модели UC использовали 84 крысы с карантинным статусом. Соответствующих крыс случайным образом распределяли на 6 групп: модельная контрольная группа, группа положительного контроля, группа с низкой дозой андрографолида при внутрижелудочном введении, группа с высокой дозой андрографолида при внутрижелудочном введении, группа с низкой дозой андрографолида при внутритолстокишечном введении и группа с высокой дозой андрографолида при внутритолстокишечном введении, по 14 крыс в каждой группе.
4.2. Доза: те же дозы использовали в группах при внутрижелудочном и внутритолстокишечном введении. В модельной контрольной группе животных не подвергали лечению, группа положительного контроля (месалазин, таблетки с энтеросолюбильным покрытием, 420 мг·кг-1·сутки-1), группа с низкой дозой андрографолида при внутрижелудочном введении (30 мг·кг-1·сутки-1), группа с высокой дозой андрографолида при внутрижелудочном введении (90 мг·кг-1·сутки-1), группа с низкой дозой андрографолида при внутритолстокишечном введении (30 мг·кг-1·сутки-1) и группа с высокой дозой андрографолида при внутритолстокишечном введении (90 мг·кг-1·сутки-1).
5. Способ
5.1. Способ создания модели UC: крыс анестезировали. Латексную трубку с диаметром 2 мм осторожно вставляли в положение на расстоянии приблизительно 8 см внутрь тела крыс через анус, и TNBS в 50% растворе этанола (TNBS 125 мг/кг) вводили в просвет кишечника с помощью шприца однократно в дозе 0,5 мл/крыса. Хвост крысы поднимали на 30 секунд для полной инфильтрации средства для создания модели (т.е. TNBS) в просвет кишечника крыс.
5.2. Способ введения: ту же дозу (1 мл/100 г) использовали при внутрижелудочном и внутритолстокишечном введении, раз в сутки в течение последовательных 5 дней.
5.3. Способ отбора образцов в эксперименте: через 2 часа после последнего введения крыс умерщвляли смещением шейного позвонка и вскрывали брюшную полость для отделения толстого кишечника. По ходу брыжейки разрезали участок стенки кишечника и ополаскивали физиологическим раствором при 4℃, и распределяли на пластиковой пластине.
5.4. Способ оценки грубого морфологического повреждения толстого кишечника относился к способу оценки повреждения слизистой оболочки (Bjelkengren G, Aronsen KF, Augustsson NE, etc. Radioprotective effect of local administration of lysine vasopressin and triglycyl lysine vasopressin on the rectal mucosa in rats[J]. Acta Oncol, 1995, 34(4):487-92) для регистрации оценки повреждения слизистой оболочки: точечное кровотечение и небольшие красные пятна (< 1 мм): 1 балл, фрагментарное кровотечение и крупные красные пятна (= 1 мм): 3 балла; и эрозия и язва: 5 баллов.
6. Исследуемые показатели
6.1. Наблюдение: общие клинические симптомы у крыс исследовали ежедневно от начала до конца эксперимента.
6.2. BW регистрировали в начале эксперимента и в конце эксперимента.
6.3. Степень повреждения толстого кишечника исследовали невооруженным глазом для оценки грубого морфологического повреждения толстого кишечника, в том числе красного пятна, фрагментарного кровотечения и язвы.
7. Статистические показатели
Данные выражали в виде среднего ± стандартное отклонение (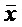 ±S). Все числовые переменные анализировали с помощью компьютерной программы SPSS13.0 с использованием однофакторного дисперсионного анализа. Анализ t-критерия использовали для внутригруппового сравнения. P < 0,05 указывало на статистически значимую разницу.
±S). Все числовые переменные анализировали с помощью компьютерной программы SPSS13.0 с использованием однофакторного дисперсионного анализа. Анализ t-критерия использовали для внутригруппового сравнения. P < 0,05 указывало на статистически значимую разницу.
8. Результаты
8.1. Влияние андрографолида на общее состояние у крыс
В модельной контрольной группе на 1й день у крыс отмечали неоформленный водянистый стул, повышенную частоту возникновения стула, сопровождаемого слизью на 2й ~ 3й дни, продолжающиеся до конца введения. В группе положительного контроля (420 мг/кг) на 1й день у крыс отмечали неоформленный водянистый стул, и большая часть симптомов водянистого стула исчезала у крыс на 5й ~ 6й дни. В группах с высокой дозой андрографолида при внутрижелудочном и внутритолстокишечном введении (90 мг/кг) в 1й день у крыс отмечали неоформленный водянистый стул, симптомы исчезали постепенно на 2й ~ 3й дни, а полностью исчезали на 4й ~ 5й дни.
8.2. Влияние андрографолида на UC
В модельной контрольной группе стенка кишечника крыс утолщалась, складки исчезали, и появлялась большая площадь некроза, во многих местах наблюдалась обширная гиперемия слизистой оболочки, отечность и язвы. В группе положительного контроля стенка кишечника утолщалась умеренно, часть складок исчезалa и появлялся небольшой участок некроза, во многих местах наблюдали гиперемию слизистой оболочки, отечность, и площадь язв снизилась по сравнению с модельной контрольной группой (P < 0,05). В группе с высокой дозой андрографолида при внутритолстокишечном введении (90 мг/кг) симптомы заболевания толстого кишечника у крыс были заметно ослаблены, заметного утолщения стенки кишечника не выявили, складки были нормальными, значительной гиперемии слизистой оболочки не наблюдали, а отечность и весьма незначительный участок некроза были заметны лишь локально. Площадь язвы была значимо снижена по сравнению с площадью в модельной контрольной группе и группе положительного контроля (P < 0,01). По сравнению с группой с высокой дозы андрографолида при внутрижелудочном введении площадь была также снижена (P < 0,05). Данные представлены в таблице 4 и на фиг. 2.
Таблица 4. Влияние андрографолида на UC у крыс при различных путях введения
(мг/кг)
По сравнению с модельной контрольной группой: *:P<0,05;**:P<0,01.
9. Выводы
В качестве неполного антигена для получения модели TNBS, главным образом, использовали в комбинации с этанолом. Механизм этой модели был изложен следующим образом: повреждение слизистой оболочки вызывали с помощью этанола, TNBS, действующего в качестве неполного антигена, инфильтрированного в ткань толстого кишечника с образованием полного антигена в результате объединения с высокополимерным веществом, таким как тканевые белки, для того, чтобы вызвать иммунный ответ (главным образом Th1-иммунный ответ), и затем приводящего к воспалению, подобному CD у человека.
Как представлено в результатах, андрографолид мог уменьшать тяжесть поноса в модели UC крыс, индуцированного TNBS, и оказывать определенное влияние на уменьшение повреждения толстого кишечника и индекса язвообразования. По сравнению с группой с высокой дозой андрографолида при внутрижелудочном введении в группе с высокой дозы андрографолида при внутритолстокишечном введении наблюдали более сильный эффект в отношении уменьшения повреждения толстого кишечника и индекса язвообразования (P < 0,05). Было подтверждено, что местное ректальное введение оказывало лучший эффект в отношении уменьшения UC, чем внутрижелудочное введение, обладая, таким образом, определенным преимуществом в использовании.
Фармакологическое исследование 4. Терапевтической эффект в модели болезни Крона у данио-рерио
1. Исследование концентрации для оценки эффективности в модели болезни Крона у данио-рерио
В воду в рыбоводческом хозяйстве с данио-рерио дикой линии AB с моделью болезнью Крона (1 л воды, полученной обратным осмосом, добавляли с 200 мг растворимой морской соли при проводимости 480~510 мкСм/см, значеним pH 6,9~7,2 и жесткостью 53,7~71,6 мг/л CaCO3) добавляли андрографолид в концентрациях 0 мкг/мл, 0,1 мкг/мл, 1 мкг/мл, 10 мкг/мл, 100 мкг/мл и 500 мкг/мл. При каждой концентрации обрабатывали 30 данио-рерио, при этом ежедневно подсчитывали число летальных случаев у данио-рерио, а погибших рыб своевременно удаляли. После обработки статистически анализировали число летальных случаев у данио-рерио в каждой группе для получения оптимальной кривой концентрация-эффект с помощью компьютерной программы JMP и расчета MNLC. При исследовании концентрации растворимость лекарственного средства в DMSO составляла приблизительно 250 мг/мл, и способом введения было растворение лекарственного средства в воде рыбоводческого хозяйства. Было обнаружено, что при концентрации ≥500 мкг/мл лекарственное средство начинало осаждаться, а токсичность и летальные случаи у данио-рерио не отмечали. В результате в настоящем исследовании были выбраны следующие четыре концентрации для оценки эффективности при болезни Крона: 50 мкг/мл, 100 мкг/мл, 250 мкг/мл и 500 мкг/мл.
2. Эффективность андрографолида в модели болезни Крона у данио-рерио
Согласно результатам упомянутого выше исследования концентрации, наблюдали 4 уровня, установленные в группе лечения для оценки эффективности в модели болезни Крона у данио-рерио, соответственно, 50 мкг/мл, 100 мкг/мл, 250 мкг/мл и 500 мкг/мл. Между тем, присутствовала группа положительного контроля (группа с введением преднизолона, преднизолон в воде рыбоводческого хозяйства в концентрации 10 мкМ), холостая контрольная группа и группа с моделью болезни Крона.
Модель болезни Крона (главным образом, воспаление) создавали при помощи TNBS (2,4,6-тринитробензолсульфоновой кислоты), и 30 данио-рерио случайным образом распределяли в каждую группу обработки. Через 48 часов после обработки данио-рерио андрографолидом (при указанных выше 4 различных концентрациях), преднизолоном (группа положительного контроля) и вспомогательным средством (группа введения вспомогательного средства), 10 данио-рерио случайным образом отбирали в каждой группе для исследования и фотографирования. Для анализа фотографий использовали компьютерную программу анализа изображений. Кроме того, толщину слизистой оболочки кишечника, диаметр просвета кишечника и площать просвета кишечника тщательно исследовали под микроскопом, и диаметр просвета кишечника, и площадь просвета кишечника анализировали количественно. Терапевтическую эффективность исследуемого лекарственного средства при болезни Крона у данио-рерио рассчитывали в каждой группе в соответствии с площадью просвета кишечника. Расчетная формула представляла собой следующее:
терапевтическая эффективность (%) = [1 - (группа введения - холостая контрольная группа)/(модельная группа - холостая контрольная группа)] × 100%
Результаты, проанализированные статистически, были выражены в виде среднего ± SE. Дисперсионный анализ использовали для сравнения в нескольких группах, и t-критерий Даннета - для сравнения между двумя группами. P < 0,05 указывало на статистически значимую разницу.
Как представлено на фиг. 3, в холостой контрольной группе и контрольной группе растворителей слизистая оболочка кишечника была гладкой, морфологически целостной, с заметным напряжением кишечника и упорядоченными складками. В модельной контрольной группе (болезнь Крона) просвет кишечника данио-рерио был расширенным, площадь просвета кишечника была увеличена, слизистая оболочка кишечника истончена и складки были неупорядоченными, уплощенными или скрытыми. После обработки препаратом положительного контроля (преднизолоном), расширение просвета кишечника у данио-рерио с болезнью Крона сокращалось, площадь просвета кишечника уменьшалась и напряжение кишечника и складки значимо восстанавливались. После обработки низкой концентрацией андрографолида (50 мкг/мл) площадь просвета кишечника у данио-рерио с болезнью Крона снижалась до определенной степени, заметного восстановления напряжения кишечника и складок не обнаруживали. Высокая концентрация андрографолида (100, 250, 500 мкг/мл), однако, могла эффективно улучшать морфологию слизистой оболочки при колите, расширение просвета кишечники значимо уменьшалось и площадь просвета кишечника была близкой к нормальной, напряжение кишечника и складки, главным образом, восстанавливались.
Как представлено на фиг. 4 и фиг. 5, после обработки препаратом положительного контроля преднизолоном площадь просвета кишечника снижалась на (76±9,3)%, т.е. терапевтическая эффективность составляла (76±9,3)%. Андрографолид (50 мкг/мл) оказывал определенный терапевтический эффект в отношении болезни Крона у данио-рерио, и площадь просвета кишечника снижалась на (38±12,9)%. Однако по сравнению с модельной контрольной группой, статистически значимая разница отсутствовала (P > 0,05). В группах с высокой концентрацией андрографолида (100, 250 и 500 мкг/мл) площади просвета кишечника данио-рерио снижались, соответственно, на (49±8,9)%, (65±14,7)% и (65±10,1)%, при этом присутствовала статистически или высоко статистически значимая разница (P<0,05 и P<0,01) по сравнению с модельной контрольной группой.
Как представлено на фиг. 6 и в таблице 5, небольшое количество нейтрофилов выявляли в ткани кишечника данио-рерио холостой контрольной группы и контрольной группе растворителей. В модельной контрольной группе (болезнь Крона) просвет кишечника был значительно расширен, ткань просвета кишечника была инфильтрирована большим количеством нейтрофилов и воспаление было заметным. Преднизолон в качестве лекарственного средства положительного контроля мог значимо снижать количество нейтрофилов в ткани при болезни Крона. На основе числа нейтрофилов, инфильтрировавших просвет кишечника, коэффициент регрессии воспаления составил (72±4,14)%, при этом отмечали высоко статистически значимую разницу (p < 0,001) по сравнению с группой модели болезни Крона. Андрографолид в различных концентрациях (50, 100, 250 и 500 мкг/мл) мог значительно снижать инфильтрацию нейтрофилов в ткани просвета кишечника данио-рерио при болезни Крона, облегчать регрессию воспаления. Коэффициенты регрессии воспаления в ткани при болезни Крона составили (45±3,74)%, (46±3,74)%, (63±4,42)% и (79±8,98)%, соответственно, при этом отмечалась высоко статистически значимая разница (p < 0,001) по сравнению с группой модели болезни Крона.
Таблица. 5. Флуоресцентная оценка нейтрофилов в модели болезни Крона у данио-рерио (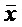 ±SE, n = 10)
±SE, n = 10)
По сравнению с модельной контрольной группой, * P < 0,001.
Фармакологическое исследование 5. Фармакологическое исследование рН-зависимого препарата для целенаправленной доставки в кишечник
Эксперимент c высвобождением in vitro
Определяли высвобождение in vitro из микропеллет, которые получали с использованием двух составов, выбранных из оптимизированных составов, упомянутых выше. Иными словами, 150 мг микропеллет с андрографолидом для целенаправленной доставки в кишечник помещали в капсулу для измерения высвобождения in vitro. Использовали способ растворения согласно Китайской фармакопее при скорости вращения 100 об./мин. с растворами солей с различным pH (1000 мл) в качестве среды высвобождения. Согласно требованию Китайской фармакопеи, после отбора образца использовали HPLC для измерения высвобожденного количества лекарственного средства в течение различного периода времени. Результаты были представлены на фиг. 7 и фиг. 8. При этом состав №1 имел самую высокую скорость высвобождения, а состав №7 имел самую низкую скорость высвобождения. Для других составов скорости высвобождения находились между самой быстрой скоростью высвобождения и самой низкой скоростью высвобождения.
Примеры
1. Пример получения таблеток и капсул с андрографолидом с энтеросолюбильным покрытием
Пример 1-1. Получение таблеток с энтеросолюбильным покрытием
Экстракция андрографолида: листья Andrographis paniculata вымачивали с использованием 95% (объем/объем) этанола, и полученную вымачивающую жидкость на основе этанола обесцвечивали с помощью активированного угля, затем этанол в вымачивающей жидкости на основе этанола извлекали перегонкой с получением концентрированной жидкости. Жидкости давали настояться с получением крупного кристалла. К указанному крупному кристаллу добавляли 15-кратное количество (15×) 95% (объем/объем) этанола, растворяли путем нагревания, обесцвечивали с помощью активированного угля и фильтровали в горячем состоянии. Полученной жидкости давали настояться с получением светло-желтого кристалла путем перекристаллизации. Полученный кристалл очищали промыванием в дистиллированной воде, хлороформе и метаноле с получением конечного продукта андрографолида.
Соответствующее количество вспомогательного средства добавляли к указанному выше андрографолиду с получением таблеток с энтеросолюбильным покрытием при помощи стандартного способа.
Пример 1-2. Получение капсул с энтеросолюбильным покрытием
Способ экстракции был таким же, как в примере 1-1.
Соответствующее количество вспомогательного средства добавляли к указанному выше андрографолиду с получением таблеток с энтеросолюбильным покрытием при помощи стандартного способа.
Пример 1-3. Получение гранул
андрографолид 100 г
микрокристаллическая целлюлоза 50 г
лактоза 50 г
крахмал 50 г
сахароза 250 г
для получения 500 г гранул.
Способ:
способ экстракции был таким же, как в примере 1-1. Кроме того, андрографолид и другие вспомогательные средства в составах просеивали с помощью сетчатого фильтра 100 меш, тщательно смешивали с получением мягкого материала при использовании соответствующего количества воды, гранулировали до 14 меш и сортировали.
Пример 1-4. Получение суппозитория с энтеросолюбильным покрытием
Материалы тщательно смешивали в соответствии с примером 1-3, в них добавляли матрикс с получением суппозитория с энтеросолюбильным покрытием при помощи стандартного способа.
2. Примеры и примеры получения рН-зависимых микропеллет с андрографолидом для целенаправленной доставки в кишечник
Необходимо отметить, что процент в следующих примерах и примерах получения относится к проценту по весу.
Пример 2-1
Микропеллету с андрографолидом для целенаправленной доставки в кишечник составляли из сердцевины пеллеты без активного вещества, слоя лекарственного средства и слоя энтеросолюбильного покрытия, где указанный слой лекарственного составляли по следующей рецептуре (г):
катор
Где указанная сердцевина пеллеты без активного вещества представляла собой сердцевину пеллеты из сахарозы без активного вещества с диаметром 600 мкм; указанный пластификатор представлял собой триэтилцитрат; указанное средство, уменьшающее липкость, представляло собой тальк и указанное поверхностно-активное вещество представляло собой SDS (доцецилсульфат натрия).
Слой энтеросолюбильного покрытия включал Eudragit L100-55, пластификатор и средство, уменьшающее липкость, при этом и пластификатор, и средство, уменьшающее липкость, выбирали, как указано для слоя лекарственного средства. Количество пластификатора составляло 15% от Eudragit L100-55, количество средства, уменьшающего липкость, составляло 30% от Eudragit L100-55, а увеличения веса покрытия составляло 5%.
Пример 2-2
Микропеллету с андрографолидом для целенаправленной доставки в кишечник составляли из сердцевины пеллеты без активного вещества, слоя лекарственного средства и слоя энтеросолюбильного покрытия, где указанный слой лекарственного составляли по следующей рецептуре (г):
Где указанная сердцевина пеллеты без активного средства представляла собой сердцевину из микрокристаллической целлюлозы диаметром 200 мкм; указанный пластификатор представлял собой дибутилсебацинат; указанное средство, уменьшающее липкость, представляло собой глицерил моностеарат и указанное поверхностно-активное вещество представляло собой Tween-80.
Слой энтеросолюбильного покрытия включал Eudragit L100-55, пластификатор и средство, уменьшающее липкость, а также пластификатор и средство, уменьшающее липкость, выбирали, как указано для слоя лекарственного средства. Количество пластификатора составляло 15% от Eudragit L100-55, количество средства, уменьшающего липкость, составляло 30% от Eudragit L100-55, а увеличение веса, приходящееся на слой покрытия, составляло 30%.
Пример 2-3
Микропеллету с андрографолидом для целенаправленной доставки в кишечник составляли из сердцевины пеллеты без активного вещества, слоя лекарственного средства и слоя энтеросолюбильного покрытия, где указанный слой лекарственного составляли по следующей рецептуре (г):
Где указанная сердцевина пеллеты без активного вещества представляла собой сердцевину пеллеты из сахарозы без активного вещества диаметром 400 мкм; указанный пластификатор представлял собой пропандиол; указанное средство, уменьшающее липкость, представляло собой порошок талька и указанное поверхностно-активное вещество представляло собой SDS.
Слой энтеросолюбильного покрытия включал Eudragit L100-55, пластификатор и средство, уменьшающее липкость, а пластификатор и средство, уменьшающее липкость, выбирали, как указано для слоя лекарственного средства. Количество пластификатора составляло 15% от Eudragit L100-55, количество средства, уменьшающего липкость, составляло 30% от Eudragit L100-55, а увеличение веса, приходящееся на слой покрытия, составляло 8%.
Пример 2-4
Микропеллету с андрографолидом для целенаправленной доставки в кишечник составляли из сердцевины пеллеты без активного вещества, слоя лекарственного средства и слоя энтеросолюбильного покрытия, где указанный слой лекарственного средства составляли по следующей рецептуре (г):
Где указанная сердцевина пеллеты без активного вещества представляла собой сердцевину пеллеты из сахарозы без активного вещества диаметром 500 мкм; указанный пластификатор представлял собой пропандиол и указанное средство, уменьшающее липкость, представляло собой порошок талька.
Слой энтеросолюбильного покрытия включал L30D-55, пластификатор и средство, уменьшающее липкость, а пластификатор и средство, уменьшающее липкость, выбирали, как указано для слоя лекарственного средства. Количество пластификатора составляло 15% от Eudragit L30D-55, количество средства, уменьшающего липкость, составляло 30% от Eudragit L30D-55, а увеличение веса, приходящееся на слой покрытия, составляло 20%.
Пример 2-5
Микропеллету с андрографолидом для целенаправленной доставки в кишечник составляли из сердцевины пеллеты без активного вещества, слоя лекарственного средства и слоя энтеросолюбильного покрытия, где указанный слой лекарственного средства составляли по следующей рецептуре (г):
Где указанная сердцевина пеллеты без активного вещества представляла собой сердцевину пеллеты из сахарозы без активного вещества диаметром 500 мкм; указанный пластификатор представлял собой PEG и указанное средство, уменьшающее липкость, представляло собой порошок талька.
Слой энтеросолюбильного покрытия включал L100-55, пластификатор и средство, уменьшающее липкость, а пластификатор и средство, уменьшающее липкость, выбирали, как указано для слоя лекарственного средства. Количество пластификатора составляло 15% от Eudragit L100-55, количество средства, уменьшающего липкость, составляло 30% от Eudragit L100-55, а увеличение веса, приходящееся на слой покрытия, составляло 28%.
Пример 2-6
Микропеллету с андрографолидом для целенаправленной доставки в кишечник составляли из сердцевины пеллеты без активного вещества, слоя лекарственного средства и слоя энтеросолюбильного покрытия, где указанный слой лекарственного средства составляли по следующей рецептуре (г):
Где указанная сердцевина пеллеты без активного вещества представляла собой сердцевину пеллеты из сахарозы без активного вещества диаметром 500 мкм; указанный пластификатор представлял собой PEG и указанное средство, уменьшающее липкость, представляло собой порошок талька.
Слой энтеросолюбильного покрытия включал Eudragit L100-55, пластификатор и средство, уменьшающее липкость, а пластификатор и средство, уменьшающее липкость, выбирали, как указано для слоя лекарственного средства. Количество пластификатора составляло 15% от Eudragit L100-55, количество средства, уменьшающего липкость, составляло 30% от Eudragit L100-55, а увеличение веса, приходящееся на слой покрытия, составляло 15%.
Пример 2-7
Микропеллету с андрографолидом для целенаправленной доставки в кишечник составляли из сердцевины пеллеты без активного вещества, слоя лекарственного средства и слоя энтеросолюбильного покрытия, где указанный слой лекарственного средства составляли по следующей рецептуре (г):
Где указанная сердцевина пеллеты без активного вещества представляла собой сердцевину пеллеты из сахарозы без активного вещества диаметром 500 мкм; указанный пластификатор представлял собой триэтилцитрат и указанное средство, уменьшающее липкость, представляло собой порошок талька.
Слой энтеросолюбильного покрытия включал Eudragit L100-55, пластификатор и средство, уменьшающее липкость, а пластификатор и средство, уменьшающее липкость, выбирали, как указано для слоя лекарственного средства. Количество пластификатора составляло 15% от Eudragit L100-55, количество средства, уменьшающего липкость, составляло 30% от Eudragit L100-55, а увеличение веса, приходящееся на слой покрытия, составляло 15%.
Пример 2-8
Микропеллету с андрографолидом для целенаправленной доставки в кишечник составляли из сердцевины пеллеты без активного вещества, слоя лекарственного средства и слоя энтеросолюбильного покрытия, где указанный слой лекарственного средства составляли по следующей рецептуре (г):
Где указанная сердцевина пеллеты без активного вещества представляла собой сердцевину пеллеты из сахарозы без активного вещества диаметром 600 мкм; указанный пластификатор представлял собой триэтилцитрат; указанное средство, уменьшающее липкость, представляло собой порошок талька и указанное поверхностно-активное вещество представляло собой SDS.
Слой энтеросолюбильного покрытия включал Eudragit L100-55, пластификатор и средство, уменьшающее липкость, а пластификатор и средство, уменьшающее липкость, выбирали, как указано для слоя лекарственного средства. Количество пластификатора составляло 15% от Eudragit L100-55, количество средства, уменьшающего липкость, составляло 30% от Eudragit L100-55, а увеличение веса, приходящееся на слой покрытия, составляло 8%.
Пример 2-9
Микропеллету с андрографолидом для целенаправленной доставки в кишечник составляли из сердцевины пеллеты без активного вещества, слоя лекарственного средства и слоя энтеросолюбильного покрытия, где указанный слой лекарственного средства содержал андрографолид, полимер A, растворимый в условиях pH≥7,0; указанное соотношение андрографолида и полимера A составляло 1:2 по весу; увеличения веса слоя действующего вещества составило 20%.
Указанный слой энтеросолюбильного покрытия содержал полимер B, растворимый в условиях pH ≥ 5,5, а увеличение веса, приходящееся на слой энтеросолюбильного покрытия, составило 8%. Пластификатор и средство, уменьшающее липкость, в указанном слое энтеросолюбильного покрытия были такими же, как и в слое лекарственного средства, и соотношение количества полимера B и количества пластификатора и средства, уменьшающего липкость, в указанном слое энтеросолюбильного покрытия было таким же, как соотношение количества полимера A и количества пластификатора и средства, уменьшающего липкость, в слое лекарственного средства.
Где указанный полимер A представлял собой сополимер метакриловой кислоты и метилметакрилата, а указанный полимером B представлял собой сополимер метакриловой кислоты и этилакрилата.
Указанный выше пластификатор представлял собой триэтилцитрат, а средство, уменьшающее липкость, представляло собой тальк.
Пример 2-10
Микропеллету с андрографолидом для целенаправленной доставки в кишечник составляли из сердцевины пеллеты без активного вещества, слоя лекарственного средства и слоя энтеросолюбильного покрытия, где указанный слой лекарственного средства содержал андрографолид, полимер A, растворимый в условиях pH ≥ 7,0; указанное соотношение андрографолида и полимера A составляло 1:0,2 по весу; увеличение веса, приходящееся на слоя лекарственного средства, составляло 100%; указанный слой энтеросолюбильного покрытия содержал полимер B, растворимый в условиях pH ≥ 5,5, а увеличение веса, приходящееся на слой энтеросолюбильного покрытия, составляло 20%.
Указанный полимер A представлял собой сополимер метакриловой кислоты и метилметакрилата в соотношении 1:2, а указанный полимер B представлял собой сополимер метакриловой кислоты и этилакрилата в соотношении 1:1.
Указанный выше пластификатор представлял собой дибутилсецинат, а средство, уменьшающее липкость, представляло собой глицерил моностеарат.
Пример 2-11
Микропеллету с андрографолидом для целенаправленной доставки в кишечник составляли из сердцевины пеллеты без активного вещества, слоя лекарственного средства и слоя энтеросолюбильного покрытия, где указанный слой лекарственного средства содержал андрографолид, полимер A, растворимый в условиях pH ≥ 7,0; указанное соотношение андрографолида и полимера A составляло 1:1,5 по весу; увеличение веса, приходящееся на слой лекарственного средства, составляло 30%; указанный слой энтеросолюбильного покрытия содержал полимер B, растворимый в условиях pH ≥ 5,5, а увеличение веса, приходящееся на слой энтеросолюбильного покрытия, составляло 10%. Пластификатор и средство, уменьшающее липкость, в указанном слое энтеросолюбильного покрытия были такими же, как и в слое лекарственного средства, и соотношение количества полимера B и количества пластификатора и средства, уменьшающего липкость, в указанном слое энтеросолюбильного покрытия было таким же, как соотношение количества полимера A и количества пластификатора и средства, уменьшающего липкость, в слое лекарственного средства.
Указанный полимер A представлял собой сополимер метакриловой кислоты и метилметакрилата в соотношении 1:2, а указанный полимер B представлял собой сополимер метакриловой кислоты и этилакрилата в соотношении 1:1.
Пример 2-12
Микропеллету с андрографолидом для целенаправленной доставки в кишечник составляли из сердцевины пеллеты без активного вещества, слоя лекарственного средства и слоя энтеросолюбильного покрытия, где указанный слой лекарственного средства содержал андрографолид, полимер A, растворимый в условиях pH ≥ 7,0, пластификатор, средство, уменьшающее липкость, пигмент, гидрофильный полимер и поверхностно-активное вещество; указанное соотношение андрографолида и полимера A составляло 1:2 по весу; увеличение веса, приходящееся на слой лекарственного средства, составляло 100%; указанный пластификатор выбирали из триэтилцитрата, составляющего 10% от полимера A; указанное средство, уменьшающее липкость, выбирали из талька, составляющего 25% от полимера A.
Указанный слой энтеросолюбильного покрытия содержал полимер B, растворимый в условиях pH ≥ 5,5, а увеличение веса, приходящееся на слой энтеросолюбильного покрытия, составляло 20%. Пластификатор и средство, уменьшающее липкость, в указанном слое энтеросолюбильного покрытия были такими же, как и в слое лекарственного средства, и соотношение количества полимера B и количества пластификатора и средства, уменьшающего липкость, в указанном слое энтеросолюбильного покрытия было таким же, как соотношение количества полимера A и количества пластификатора и средства, уменьшающего липкость, в слое лекарственного средства.
Указанный полимер A представлял собой сополимер метакриловой кислоты и метилметакрилата в соотношении 1:2, а указанный полимер B представлял собой сополимер метакриловой кислоты и этилакрилата в соотношении 1:1.
Указанный выше пластификатор представлял собой триэтилцитрат, а средство, уменьшающее липкость, представляло собой тальк.
Пример 2-13
Микропеллету с андрографолидом для целенаправленной доставки в кишечник составляли из сердцевины пеллеты без активного вещества, слоя лекарственного средства и слоя энтеросолюбильного покрытия, где указанный слой лекарственного средства содержал андрографолид, полимер A, растворимый в условиях pH ≥ 7,0, пластификатор и средство, уменьшающее липкость; указанное соотношение андрографолида и полимера A составляло 1:0,5 по весу; увеличение веса, приходящееся на слой лекарственного средства, составляло 80%; указанный пластификатор выбирали из дибутилсебацината, составляющего 70% от полимера A; указанное средство, уменьшающее липкость, выбирали из талька, составляющего 100% от полимера A.
Указанный слой энтеросолюбильного покрытия содержал полимер B, растворимый в условиях pH ≥ 5,5, а увеличение веса, приходящееся на слой энтеросолюбильного покрытия, составляло 18%. Пластификатор и средство, уменьшающее липкость, в указанном слое энтеросолюбильного покрытия были такими же, как и в слое лекарственного средства, и соотношение количества полимера B и количества пластификатора и средства, уменьшающего липкость, в указанном слое энтеросолюбильного покрытия было таким же, как соотношение количества полимера A и количества пластификатора и средства, уменьшающего липкость, в слое лекарственного средства.
Указанный полимер A представлял собой сополимер метакриловой кислоты и метилметакрилата в соотношении 1:2, а указанный полимер B представлял собой сополимер метакриловой кислоты и этилакрилата в соотношении 1:1.
Пример 2-14
Микропеллету с андрографолидом для целенаправленной доставки в кишечник составляли из сердцевины пеллеты без активного вещества, слоя лекарственного средства и слоя энтеросолюбильного покрытия, где указанный слой лекарственного средства содержал андрографолид, полимер A, растворимый в условиях pH ≥ 7,0, пластификатор и средство, уменьшающее липкость; указанное соотношение андрографолида и полимера A составляло 1:1 по весу; увеличение веса, приходящееся на слой лекарственного средства, составляло 50%; указанный пластификатор выбирали из пропандиола, составляющего 20% от полимера A; указанное средство, уменьшающее липкость, выбирали из талька, составляющего 30% от полимера A.
Указанный слой энтеросолюбильного покрытия содержал полимер B, растворимый в условиях pH ≥ 5,5, а увеличение веса, приходящееся на слой энтеросолюбильного покрытия, составляло 15%. Пластификатор и средство, уменьшающее липкость, в указанном слое энтеросолюбильного покрытия были такими же, как и в слое лекарственного средства, и соотношение количества полимера B и количества пластификатора и средства, уменьшающего липкость, в указанном слое энтеросолюбильного покрытия было таким же, как соотношение количества полимера A и количества пластификатора и средства, уменьшающего липкость, в слое лекарственного средства.
Указанный полимер A представлял собой сополимер метакриловой кислоты и метилметакрилата в соотношении 1:2, а указанный полимер B представлял собой сополимер метакриловой кислоты и этилакрилата в соотношении 1:1.
Пример 2-15
Микропеллету с андрографолидом для целенаправленной доставки в кишечник составляли из сердцевины пеллеты без активного вещества, слоя лекарственного средства и слоя энтеросолюбильного покрытия, где указанный слой лекарственного средства содержал андрографолид, полимер A, растворимый в условиях pH ≥ 7,0, пластификатор и средство, уменьшающее липкость; указанное соотношение андрографолида и полимера A составляло 1:1,5 по весу; увеличение веса, приходящееся на слой лекарственного средства, составляло 60%; указанный пластификатор выбирали из PEG, составляющего 50% от полимера A; указанное средство, уменьшающее липкость, выбирали из талька, составляющего 80% от полимера A.
Указанный слой энтеросолюбильного покрытия содержал полимер B, растворимый в условиях pH ≥ 5,5, а увеличение веса, приходящееся на слой энтеросолюбильного покрытия, составляло 16%. Пластификатор и средство, уменьшающее липкость, в указанном слое энтеросолюбильного покрытия были такими же, как и в слое лекарственного средства, и соотношение количества полимера B и количества пластификатора и средства, уменьшающего липкость, в указанном слое энтеросолюбильного покрытия было таким же, как соотношение количества полимера A и количества пластификатора и средства, уменьшающего липкость, в слое лекарственного средства.
Указанный полимер A представлял собой сополимер метакриловой кислоты и метилметакрилата в соотношении 1:2, а указанный полимер B представлял собой сополимер метакриловой кислоты и этилакрилата в соотношении 1:1.
Пример 2-16
Микропеллету с андрографолидом для целенаправленной доставки в кишечник составляли из сердцевины пеллеты без активного вещества, слоя лекарственного средства и слоя энтеросолюбильного покрытия, где указанный слой лекарственного средства содержал андрографолид, полимер A, растворимый в условиях pH ≥ 7,0, пластификатор и средство, уменьшающее липкость; указанное соотношение андрографолида и полимера A составляло 1:1,5 по весу; увеличение веса, приходящееся на слоя лекарственного средства, составляло 60%; указанный пластификатор выбирали из PEG, составляющего 50% от полимера A; указанное средство, уменьшающее липкость, выбирали из талька, составляющего 20% от полимера A.
Указанный слой энтеросолюбильного покрытия содержал полимер B, растворимый в условиях pH ≥ 5,5, а увеличение веса, приходящееся на слой энтеросолюбильного покрытия, составляло 16%. Пластификатор и средство, уменьшающее липкость, в указанном слое энтеросолюбильного покрытия были такими же, как и в слое лекарственного средства, и соотношение количества полимера B и количества пластификатора и средства, уменьшающего липкость, в указанном слое энтеросолюбильного покрытия было таким же, как соотношение количества полимера A и количества пластификатора и средства, уменьшающего липкость, в слое лекарственного средства.
Указанный полимер A представлял собой сополимер метакриловой кислоты и метилметакрилата в соотношении 1:2, а указанный полимер B представлял собой сополимер метакриловой кислоты и этилакрилата в соотношении 1:1.
Пример 2-17
Микропеллету с андрографолидом для целенаправленной доставки в кишечник составляли из сердцевины пеллеты без активного вещества, слоя лекарственного средства и слоя энтеросолюбильного покрытия, где указанный слой лекарственного средства содержал андрографолид, полимер A, растворимый в условиях pH ≥ 7,0, пластификатор и средство, уменьшающее липкость; указанное соотношение андрографолида и полимера A составляло 1:1,5 по весу; увеличение веса, приходящееся на слой лекарственного средства, составляло 60%; указанный пластификатор выбирали из PEG, составляющего 50% от полимера A; указанное средство, уменьшающее липкость, выбирали из талька, составляющего 20% от полимера A.
Указанный слой энтеросолюбильного покрытия содержал полимер B, растворимый в условиях pH ≥ 5,5, а увеличение веса, приходящееся на слой энтеросолюбильного покрытия, составляло 16%. Пластификатор и средство, уменьшающее липкость, в указанном слое энтеросолюбильного покрытия были такими же, как и в слое лекарственного средства, и соотношение количества полимера B и количества пластификатора и средства, уменьшающего липкость, в указанном слое энтеросолюбильного покрытия было таким же, как соотношение количества полимера A и количества пластификатора и средства, уменьшающего липкость, в слое лекарственного средства.
Указанный полимер A представлял собой сополимер метакриловой кислоты и метилметакрилата в соотношении 1:2, а указанный полимер B представлял собой сополимер метакриловой кислоты и этилакрилата в соотношении 1:1.
Микропеллеты в указанных выше примерах получали следующим способом.
Пример получения 2-1
(1) нанесение лекарственного средства на сердцевины пеллет без активного вещества:
a) диспергирование полимера A в фармацевтическом органическом растворителе для обеспечения его полного растворения путем высокоскоростного механического перемешивания со сдвигом с получением раствора полимера A; добавление в раствор полимера A пластификатора и средства, уменьшающего липкость, с последующим добавлением андрографолида, тщательное перемешивание с получением раствора полимера A для нанесения покрытия; хранение раствора для нанесения покрытия в виде однородной суспензии путем поддержания механического перемешивания при покрытии; и
b) отвешивание сердцевин пеллет без активного вещества и загрузка в псевдоожиженный слой; регулирование потока воздуха для получения сердцевин пеллет без активного вещества в надлежащем псевдоожиженном состоянии; приведение в действие нагревающего устройства до достижения заданного значения температуры материала сердцевин пеллет без активного вещества и приведение в действие перистальтического насоса для атомизации с помощью распылителя и однородного диспергирования раствора полимера А для нанесения покрытия на поверхности указанных сердцевин пеллет без активного вещества с получением микропеллет, содержащих лекарственное средство;
(2) получение слоя энтеросолюбильного покрытия:
a) диспергирование полимера В в фармацевтическом органическом растворителе или воде для обеспечения его полного растворения с помощью высокоскоростного механического перемешивания со сдвигом с получением раствора полимера В; добавление в раствор полимера В пластификатора и средства, уменьшающего липкость, тщательное перемешивание с получением раствора полимера В для нанесения покрытия; и
b) загрузка указанных микропеллет, содержащих лекарственное средство, в устройство для нижнего распыления в псевдоожиженном слое и покрытие с примененимем устройства для нанесения покрытия в псевдоожиженном слое, при этом раствор полимера B для нанесения однородно распределяется с образованием слоя энтеросолюбильного покрытия; при этом увеличение веса, приходящееся на слой энтеросолюбильного покрытия, составляет 5%.
Пример получения 2-2
(1) нанесение лекарственного средства на сердцевины пеллет без активного вещества:
a) диспергирование полимера A в фармацевтическом органическом растворителе для обеспечения его полного растворения путем высокоскоростного механического перемешивания со сдвигом с получением раствора полимера A; добавление в раствор полимера A пластификатора и средства, уменьшающего липкость, с последующим добавлением андрографолида, тщательное перемешивание с получением раствора полимера A для нанесения покрытия; хранение покрывающего раствора в виде однородной суспензии путем поддержания механического перемешивания при покрытии; и
b) отвешивание сердцевин пеллет без активного вещества и загрузка в псевдоожиженный слой; регулирование потока воздуха для получения сердцевин пеллет без активного вещества в надлежащем псевдоожиженном состоянии; приведение в действие нагревающего устройства до достижения заданного значения температуры материала сердцевин пеллет без активного вещества и приведение в действие перистальтического насоса для атомизации с помощью распылителя и однородного диспергирования раствора полимера А для нанесения покрытия на поверхности указанных сердцевин пеллет без активного вещества с получением микропеллет, содержащих лекарственное средство;
(2) получение слоя энтеросолюбильного покрытия:
a) диспергирование полимера В в фармацевтическом органическом растворителе или воде для обеспечения его полного растворения с помощью высокоскоростного механического перемешивания со сдвигом с получением раствора полимера В; добавление в раствор полимера В пластификатора и средства, уменьшающего липкость, тщательное перемешивание с получением раствора полимера В для нанесения покрытия; и
b) загрузка указанных микропеллет, содержащих лекарственное средство, в устройство для устройство для нижнего распыления в псевдоожиженном слое и покрытие с применением устройства для нанесения покрытия в псевдоожиженном слое, при этом раствор полимера B для нанесения покрытия однородно распределяется с образованием слоя энтеросолюбильного покрытия; при этом увеличение веса, приходящееся на слой энтеросолюбильного покрытия составляет 30%.
Пример получения 2-3
(1) нанесение лекарственного средства на сердцевины пеллет без активного вещества:
a) диспергирование полимера A в фармацевтическом этаноле с получением содержания полимера A, составляющего 5 вес. %, полное растворение полимера A с помощью высокоскоростного механического перемешивания со сдвигом с получением раствора полимера A; продолжение однородного перемешивания, добавление соответствующего количества пластификатора, средства, уменьшающего липкость, и поверхностно-активного вещества додецилсульфата натрия в раствор полимера A с последующим добавлением андрографолида, тщательное перемешивание с получением раствора полимера A для нанесения покрытия; выдерживание покрывающего раствора в виде однородной суспензии путем поддержания механического перемешивания при покрытии; и
b) отвешивание сердцевин пеллет из сахарозы без активного вещества диаметром 200 мкм и загрузка в псевдоожиженный слой; регулирование потока воздуха для получения сердцевин пеллет без активного вещества в надлежащем псевдоожиженном состоянии; приведение в действие нагревающего устройства и поддержание температуры материала сердцевин пеллет без активного вещества при 25℃, и приведение в действие перистальтического насоса до достижения заданного значения температуры материала сердцевин пеллет без активного вещества для атомизации с помощью распылителя и однородного диспергирования раствора полимера А для нанесения покрытия на поверхности указанных сердцевин пеллет без активного вещества с получением микропеллет, содержащих лекарственное средство;
(2) получение слоя энтеросолюбильного покрытия:
a) диспергирование полимера B в фармацевтическом этаноле для обеспечения его полного растворения с помощью высокоскоростного механического перемешивания со сдвигом; добавление в раствор полимера B пластификатора и средства, уменьшающего липкость, тщательное перемешивание с получением раствора полимера B для нанесения покрытия; и
b) загрузка указанных микропеллет, содержащих лекарственное средство, в устройство для нижнего распыления в псевдоожиженном слое и покрытие с применением устройства для нанесения покрытия в псевдоожиженном слое, при этом раствор полимера B для нанесения покрытия однородно распределяется с образованием слоя энтеросолюбильного покрытия; при этом увеличение веса, приходящееся на слой энтеросолюбильного покрытия, составляет 8%.
Пример получения 2-4
(1) нанесение лекарственного средства на сердцевины пеллет без активного средства:
a) диспергирование полимера A в фармацевтическом этаноле с получением содержания полимера A, составляющего 5 вес. %, полное растворение полимера A с помощью высокоскоростного механического перемешивания со сдвигом с получением раствора полимера A; продолжение однородного перемешивания, добавление соответствующего количества пластификатора, средства, уменьшающего липкость, и поверхностно-активного вещества додецилсульфата натрия в раствор полимера A с последующим добавлением андрографолида, тщательное перемешивание с получением раствора полимера A для нанесения покрытия; выдерживание раствора для нанесения покрытия в виде однородной суспензии путем поддержания механического перемешивания при покрытии; и
b) отвешивание сердцевин пеллет из сахарозы без активного вещества, диаметром 600 мкм и загрузка в псевдоожиженный слой; регулирование потока воздуха для получения сердцевин пеллет без активного вещества в надлежащем псевдоожиженном состоянии; приведение в действие нагревающего устройства и поддержание температуры материала сердцевин пеллет без активного вещества при 35℃, и приведение в действие перистальтического насоса до достижения заданного значения температуры материала сердцевин пеллет без активного вещества для атомизации с помощью распылителя и однородного диспергирования раствора полимера А для нанесения покрытия на поверхности указанных сердцевин пеллет без активного вещества с получением микропеллет, содержащих лекарственное средство;
(2) получение слоя энтеросолюбильного покрытия:
a) диспергирование полимера B в фармацевтическом этаноле для обеспечения его полного растворения с помощью высокоскоростного механического перемешивания со сдвигом; добавление в раствор полимера B пластификатора и средства, уменьшающего липкость, тщательное перемешивание с получением раствора полимера B для нанесения покрытия; и
b) загрузка указанных микропеллет, содержащих лекарственное средство, в устройство для нанесения покрытия в псевдоожиженном слое снизу и покрытие с применением устройства для нанесения покрытия в псевдоожиженном слое, при этом раствор полимера B для нанесения покрытия однородно распределяется с образованием слоя энтеросолюбильного покрытия; при этом увеличение веса, приходящееся на слой энтеросолюбильного покрытия, составляет 20%.
Пример получения 2-5
(1) нанесение лекарственного средства на сердцевины пеллет без активного средства:
a) диспергирование полимера A в фармацевтическом этаноле с получением содержания полимера A, составляющего 5 вес. %, полное растворение полимера A с помощью высокоскоростного механического перемешивания со сдвигом с получением раствора полимера A; продолжение однородного перемешивания, добавление соответствующего количества пластификатора, средства, уменьшающего липкость, и поверхностно-активного вещества додецилсульфата натрия в раствор полимера A с последующим добавлением андрографолида, тщательное перемешивание с получением раствора полимера A для нанесения покрытия; выдерживание раствора для нанесения покрытия в виде однородной суспензии путем поддержания механического перемешивания при покрытии; и
b) отвешивание сердцевин пеллет из сахарозы без активного вещества, диаметром 400 мкм, и загрузка в псевдоожиженный слой; регулирование потока воздуха для получения сердцевин пеллет без активного вещества в надлежащем псевдоожиженном состоянии; приведение в действие нагревающего устройства и поддержание температуры материала сердцевин пеллет без активного вещества при 32℃, и приведение в действие перистальтического насоса до достижения заданного значения температуры материала сердцевин пеллет без активного вещества для атомизации с помощью распылителя и однородного диспергирования раствора полимера А для нанесения покрытия на поверхности указанных сердцевин пеллет без активного вещества с получением микропеллет, содержащих лекарственное средство;
(2) получение слоя энтеросолюбильного покрытия:
a) диспергирование полимера B в фармацевтическом этаноле для обеспечения его полного растворения с помощью высокоскоростного механического перемешивания со сдвигом; добавление в раствор полимера B, пластификатора и средства, уменьшающего липкость, тщательное перемешивание с получением раствора полимера B для нанесения покрытия; и
b) загрузка указанных микропеллет, содержащих лекарственное средство, в устройство для нижнего распыления в псевдоожиженном слое и покрытие с применением устройства для нанесения покрытия в псевдоожиженном слое, при этом раствор полимера B для нанесения покрытия однородно распределяется с образованием слоя энтеросолюбильного покрытия; при этом увеличение веса, приходящееся на слой энтеросолюбильного покрытия, составляет 15%.
Пример получения 2-6
Микропеллеты, полученные в примерах 2-1 ~ 2-17, составляли для получения стандартных гранул и капсул.
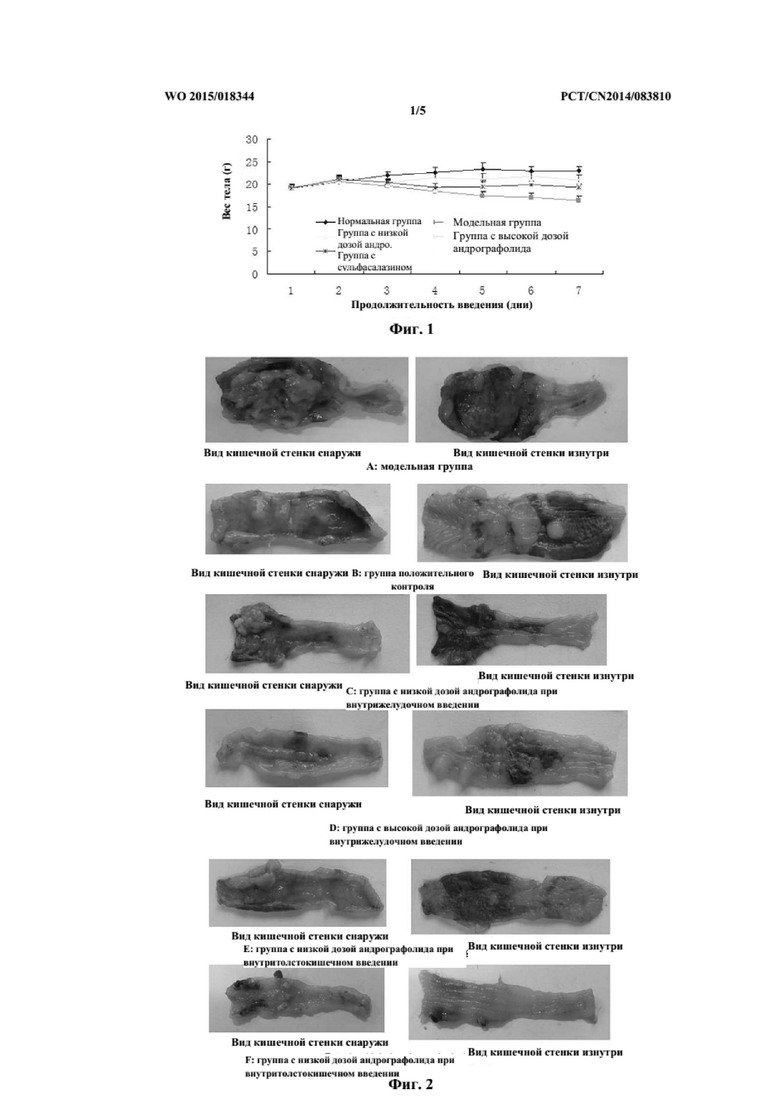

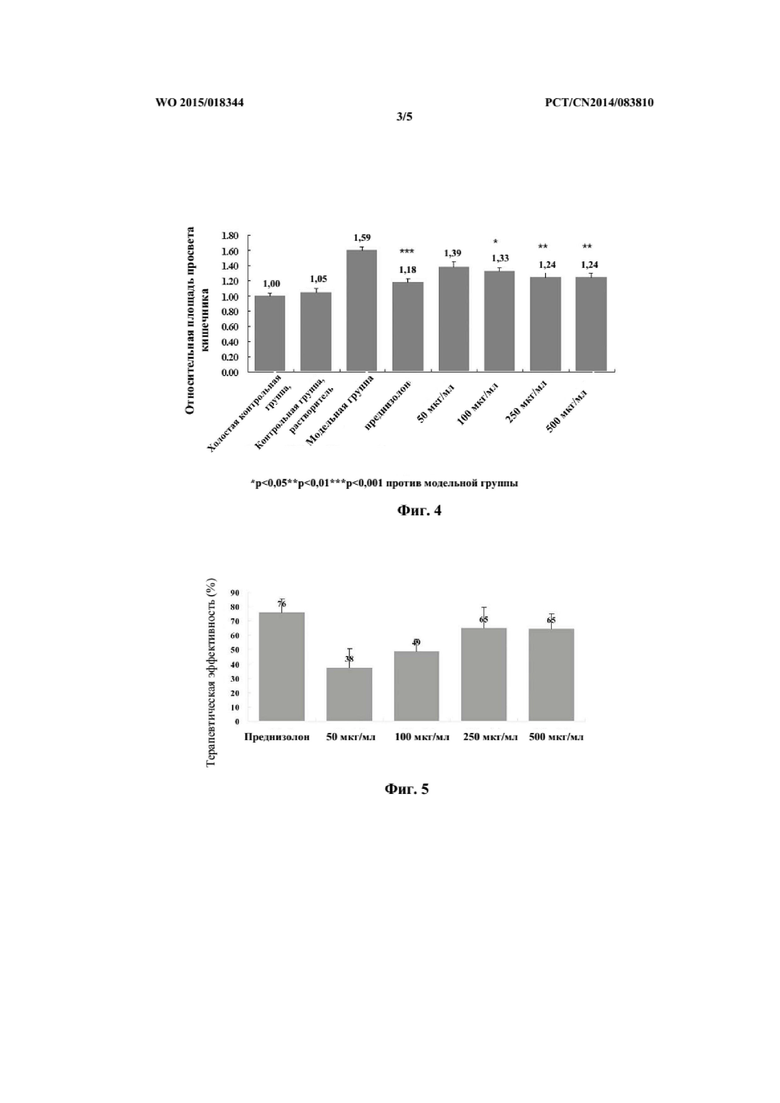
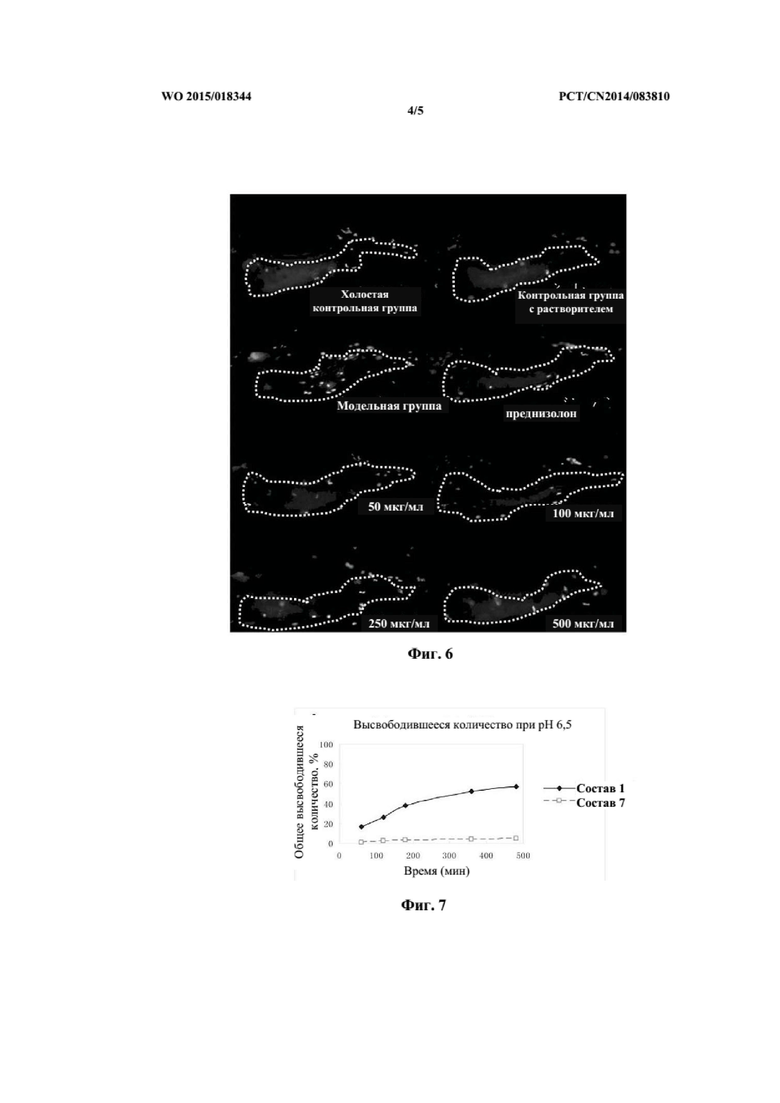

Изобретение относится к микропеллете с андрографолидом для целенаправленной доставки в кишечник и способу ее получения; кроме того, настоящее изобретение также относится к вариантам применения микропеллет с андрографолидом для целенаправленной доставки в кишечник фармацевтического препарата для лечения воспалительного заболевания кишечника. 4 н. и 24 з.п. ф-лы, 8 ил., 5 табл., 2 пр.
1. Микропеллета с андрографолидом для целенаправленной доставки в кишечник, отличающаяся тем, что в состав указанной микропеллеты с андрографолидом для целенаправленной доставки в кишечник входят сердцевина пеллеты без активного вещества, слой лекарственного средства и слой энтеросолюбильного покрытия, где указанный слой лекарственного средства содержит андрографолид, полимер А, растворимый в условиях рН≥7,0, и вспомогательное средство; при этом соотношение андрографолида и полимера А составляет 1:2-1:0,2 по весу; увеличение веса, приходящееся на слой лекарственного средства, составляет 20-100 вес. %; указанный слой энтеросолюбильного покрытия содержит полимер В, растворимый в условиях рН≥5,5, и вспомогательное средство; увеличение веса, приходящееся на слой энтеросолюбильного покрытия, составляет 5-30 вес. %,
где указанный полимер А представляет собой сополимер метакриловой кислоты и метилметакрилата, а указанный полимер В представляет собой сополимер метакриловой кислоты и этилакрилата.
2. Микропеллета по п. 1, где увеличение веса, приходящееся на слой лекарственного средства, составляет 30-80 вес. %.
3. Микропеллета по п. 1, где увеличение веса, приходящееся на слой энтеросолюбильного покрытия, составляет 8-20 вес. %.
4. Микропеллета по п. 1, где увеличение веса, приходящееся на слой энтеросолюбильного покрытия, составляет 10-18 масс. %.
5. Микропеллета по п. 1, где указанные вспомогательные средства, содержащиеся в слое лекарственного средства, включают пластификаторы, средства, уменьшающие липкость, пигменты, гидрофильные полимеры и поверхностно-активные вещества; а
указанные вспомогательные средства, содержащиеся в слое энтеросолюбильного покрытия, включают пластификаторы и средства, уменьшающие липкость.
6. Микропеллета по п. 1, где указанный полимер А представляет собой сополимер метакриловой кислоты и метилметакрилата в соотношении 1:2 и/или указанный полимер В представляет собой сополимер метакриловой кислоты и этилакрилата в соотношении 1:1.
7. Микропеллета по п. 5, где указанный пластификатор представляет собой одно или более, выбранных из группы, включающей триэтилцитрат, дибутилсебацинат, пропандиол и PEG, при этом количество пластификатора составляет 10-70 вес. % от полимера А; указанное средство, уменьшающее липкость, представляет собой тальк, при этом количество средства, уменьшающего липкость, составляет 25-100 вес. % от полимера А; или указанное средство, уменьшающее липкость, представляет собой глицерил моностеарат, при этом количество средства, уменьшающего липкость, составляет 2-20 вес. % от полимера А.
8. Микропеллета по п. 7, где количество пластификатора составляет 10-20 вес. % от полимера А.
9. Микропеллета по п. 7, где количество талька составляет 30-50 вес. % от полимера А.
10. Микропеллета по п. 7, где количество глицерил моностеарата составляет 5-10 вес. % от полимера А.
11. Микропеллета по п. 1, где диаметр указанной сердцевины пеллеты без активного вещества составляет 200-600 мкм, а количество сердцевины пеллеты без активного вещества составляет 10-70 вес. % от состава.
12. Микропеллета по п. 11, где диаметр указанной сердцевины пеллеты без активного вещества составляет 300-500 мкм.
13. Микропеллета по п. 11, где количество сердцевины пеллеты без активного вещества составляет 20-60 вес. % от состава.
14. Микропеллета по п. 5, где указанные ингредиенты присутствуют в пропорции в весовых частях: сердцевина пеллеты без активного вещества:андрографолид:полимер А:пластификатор:средство, уменьшающее липкость:поверхностно-активное вещество = 200:(10-100):(10-100):(1-15):(1-30):(0-3).
15. Микропеллета по п. 14, где указанные ингредиенты присутствуют в пропорции в весовых частях: сердцевина пеллеты без активного вещества:андрографолид:полимер А:пластификатор:средство, уменьшающее липкость:поверхностно-активное вещество = 200:(15-66):(13-74):(2-13,5):(3-27):(0-1,32).
16. Микропеллета по п. 15, где указанные ингредиенты присутствуют в пропорции в весовых частях: сердцевина пеллеты без активного вещества:андрографолид:полимер А:пластификатор:средство, уменьшающее липкость:поверхностно-активное вещество = 200:(20-50):(30-60):(5-10):(5-20):(0,5-1,2).
17. Способ получения микропеллет по любому из пп. 1-16, включающий следующие стадии:
(1) нанесение лекарственного средства на сердцевины пеллет без активного средства:
a) диспергирование полимера А в фармацевтическом растворителе при механическом перемешивании для обеспечения его полного растворения с получением раствора полимера А; добавление вспомогательного средства в раствор полимера А с последующим добавлением андрографолида, тщательное перемешивание с получением раствора полимера А для нанесения покрытия; и
b) отвешивание сердцевин пеллет без активного вещества и загрузка в псевдоожиженный слой; регулирование потока воздуха для получения сердцевин пеллет без активного вещества в псевдоожиженном состоянии; приведение в действие нагревающего устройства до достижения температуры материала сердцевин пеллет без активного вещества, равной 25-35°С, и приведение в действие перистальтического насоса для атомизации с помощью распылителя и однородного диспергирования раствора полимера А для нанесения покрытия на поверхности указанных сердцевин пеллет без активного вещества с получением микропеллет, содержащих лекарственное средство;
(2) получение слоя энтеросолюбильного покрытия:
a) диспергирование полимера В в фармацевтическом органическом растворителе или воде путем механического перемешивания для его полного растворения с получением раствора полимера В; добавление вспомогательного средства в раствор полимера В, тщательное перемешивание с получением раствора полимера В для нанесения покрытия;
b) загрузка указанных микропеллет, содержащих лекарственное средство, в устройство для нижнего распыления в псевдоожиженном слое и нанесения покрытия с помощью устройства для нанесения покрытия в псевдоожиженном слое, при этом раствор полимера В для нанесения покрытия однородно распределяется с образованием слоя энтеросолюбильного покрытия; при этом увеличение веса, приходящееся на слой энтеросолюбильного покрытия, составляет 5-30 вес. %,
где указанный полимер А представляет собой сополимер метакриловой кислоты и метилметакрилата, а указанный полимер В представляет собой сополимер метакриловой кислоты и этилакрилата.
18. Способ получения по п. 17, включающий следующие стадии:
(1) нанесение лекарственного средства на сердцевины пеллет без активного средства:
а) диспергирование полимера А в фармацевтическом этаноле с получением содержания полимера А, составляющего 5 вес. %, полное растворение полимера А путем механического перемешивания с получением раствора полимера А; продолжение однородного перемешивания, добавление в раствор полимера А пластификатора, средства, уменьшающего липкость, и поверхностно-активного вещества додецилсульфата натрия в качестве вспомогательных средств с последующим добавлением андрографолида, тщательное перемешивание с получением раствора полимера А для нанесения покрытия; и
b) отвешивание сердцевин пеллет из сахарозы без активного вещества диаметром 200-600 мкм и загрузка в псевдоожиженный слой; регулирование потока воздуха для получения сердцевин пеллет без активного вещества в псевдоожиженном состоянии; приведение в действие нагревающего устройства и поддержание температуры материала сердцевин пеллет без активного вещества при 25-35°С и приведение в действие перистальтического насоса до достижения температуры материала сердцевин пеллет без активного вещества, равной 25-35°С, для атомизации посредством распылителя и однородного диспергирования раствора полимера А для нанесения покрытия на поверхности указанных сердцевин пеллет без активного вещества с получением микропеллет, содержащих лекарственное средство;
(2) получение слоя энтеросолюбильного покрытия:
a) диспергирование полимера В в фармацевтическом этаноле путем высокоскоростного механического перемешивания со сдвигом для обеспечения его полного растворения; добавление в раствор полимера В пластификатора и средства, уменьшающего липкость, в качестве вспомогательного средства, тщательное перемешивание с получением раствора полимера В для нанесения покрытия; и
b) загрузка указанных микропеллет, содержащих лекарственное средство, в устройство нижнего распыления в псевдоожиженном слое и нанесение покрытия с применением устройства для нанесения покрытия в псевдоожиженном слое, при этом раствор полимера В для нанесения покрытия однородно распределяется с образованием слоя энтеросолюбильного покрытия; при этом увеличение веса, приходящееся на слой энтеросолюбильного покрытия, составляет 5-30 вес. %.
19. Препарат андрографолида для целенаправленной доставки в кишечник, отличающийся тем, что микропеллета по любому из пп. 1-16 составлена в форме гранул или капсул.
20. Применение микропеллет по любому из пп. 1-16 в получении лекарственного препарата для лечения воспалительного заболевания кишечника (IBD).
21. Применение по п. 20, где указанное IBD представляет собой язвенный колит (UC) или болезнь Крона.
22. Применение по п. 20, где применение обеспечивает уменьшение спайкообразования в толстом кишечнике, отечности и утолщения стенки кишечника и сниженной эластичности.
23. Применение по п. 21, где применение обеспечивает уменьшение спайкообразования в толстом кишечнике, отечности и утолщения стенки кишечника и сниженной эластичности.
24. Применение по п. 20, где применение обеспечивает сокращение язвы, геморрагического пятна и перфорации в толстом кишечнике.
25. Применение по п. 21, где применение обеспечивает сокращение язвы, геморрагического пятна и перфорации в толстом кишечнике.
26. Применение по любому из пп. 20-25, отличающееся тем, что указанный лекарственный препарат составлен в форме энтеросолюбильного препарата.
27. Применение по любому из пп. 20-25, отличающееся тем, что указанный лекарственный препарат составлен в форме микропеллет для целенаправленной доставки в кишечник.
28. Применение по п. 27, отличающееся тем, что указанные микропеллеты для целенаправленной доставки в кишечник составлены в форме гранул или капсул.
| СПОСОБ МОДИФИКАЦИИ ПРИВИТЬ^Х СОПОЛИМЕРОВ | 0 |
|
SU166094A1 |
| CN 103070843 A, 01.05.2013 | |||
| US 2013023493 A1, 24.01.2013. | |||
Авторы
Даты
2019-03-14—Публикация
2014-08-06—Подача