Изобретение относится к лекарственному средству, содержащему, по меньшей мере, один инсулин и, по меньшей мере, один агонист рецептора GLP-1, обозначаемый далее как агонист GLP-1, лекарственное средство получают и/или изготавливают таким образом, что оно включает инсулин и агонист GLP-1, каждый в заранее определенном количестве, и может быть введено в дозе, адаптированной к индивидуальной потребности пациента.
Более подробно, изобретение относится к лекарственному средству, включающему первую фармацевтическую композицию и вторую фармацевтическую композицию, и, необязательно, по меньшей мере, одну дополнительную фармацевтическую композицию, каждая из которых включает, по меньшей мере, один инсулин и, по меньшей мере, один агонист GLP-1, и содержит, по меньшей мере, один инсулин и/или, по меньшей мере, один агонист GLP-1 в различных количествах по отношению к общему весу композиции.
Более подробно, настоящее изобретение относится к лекарственному средству, которое включает первую фармацевтическую композицию и вторую фармацевтическую композицию, и, необязательно, по меньшей мере, одну дополнительную фармацевтическую композицию, первая фармацевтическая композиция включает, по меньшей мере, один инсулин, и вторая фармацевтическая композиция включает, по меньшей мере, один инсулин и, по меньшей мере, один агонист GLP-1, и, по меньшей мере, одна дополнительная фармацевтическая композиция включает, по меньшей мере, один инсулин и, по меньшей мере, одно дополнительное активное соединение.
Около 250 миллионов человек в мире страдает от сахарного диабета. Среди них для больных диабетом 1 типа, замещение недостаточной эндокринной секреции инсулина является единственным возможным лечением в настоящее время. Субъекты, страдающие диабетом, зависят от инъекций инсулина на протяжении жизни, обычно нескольких инъекций в день. Диабет 2 типа отличается от диабета 1 типа тем, что при нем не всегда отмечается недостаток инсулина, но в большем числе случаев, особенно на поздней стадии, лечение инсулином, когда это целесообразно, в комбинации с пероральным противодиабетическим средством, считают наиболее эффективной формой терапии.
У здоровых субъектов высвобождение инсулина поджелудочной железой строго связано с концентрацией глюкозы в крови. Повышенные уровни глюкозы в крови, такие как уровни, наблюдающиеся после приемов пищи, быстро уравновешиваются соответствующим увеличением секреции инсулина. В состоянии натощак уровень инсулина в плазме крови опускается до исходного значения, которое является достаточным, чтобы обеспечить непрерывное снабжение глюкозой инсулин-чувствительных органов и тканей и поддержать продукцию глюкозы в печени ночью. Замещение эндогенной секреции инсулина экзогенным инсулином, обычно подкожным введением инсулина, в целом не приближается к описанному выше качеству физиологической регуляции глюкозы в крови. Часто встречаются случаи, когда глюкоза в крови резко отклоняется от диапазона нормальных значений, либо вверх либо вниз, и, в наиболее тяжелых формах такие случаи могут быть опасны для жизни. Кроме того, несмотря на то, что уровни глюкозы в крови, которые являются повышенными на протяжении нескольких лет без проявления начальных симптомов, создают значительный риск для здоровья. Крупномасштабное исследование DCCT, проведенное в США (The Diabetes Control и Complications Trial Research Group (1993) N. Engl. J. Med. 329, 977-986), однозначно показало, что хронически повышенные уровни глюкозы в крови ответственны за развитие поздних диабетических осложнений. Поздние диабетические осложнения представляют собой микро- и макроваскулярное повреждение, которое проявляется в определенных обстоятельствах в виде ретинопатии, нефропатии или нейропатии и приводит к слепоте, почечной недостаточности, и потере конечностей, и, кроме того, ассоциируется с повышенным риском сердечно-сосудистых нарушений. Из сказанного можно сделать заключение, что улучшенная терапия диабета должна быть направлена, главным образом, на поддержание уровня глюкозы в крови настолько точно, насколько возможно в пределах физиологической нормы. Согласно концепции усиленной инсулиновой терапии, указанное поддержание уровня глюкозы в крови может быть достигнуто с помощью инъекций, несколько раз в день, быстродействующих и медленно действующих препаратов инсулина. Быстродействующие композиции принимают во время приемов пищи, чтобы компенсировать увеличение глюкозы в крови после приема пищи. Медленно действующие базальные инсулины предназначены для обеспечения базового запаса инсулина, особенно ночью, не вызывая гипогликемии.
Инсулин представляет собой полипептид, состоящий из 51 аминокислоты, которые разделены на 2 аминокислотные цепи: цепь A, состоящая из 21 аминокислоты, и цепь B, состоящая из 30 аминокислот. Цепи соединены друг с другом 2 дисульфидными мостиками. Препараты инсулина применяют для лечения диабета в течение многих лет. В указанных препаратах используют не только встречающиеся в природе инсулины, но также, в последнее время, производные инсулина и аналоги инсулина.
Аналоги инсулина представляют собой аналоги встречающихся в природе инсулинов, а именно инсулина человека или инсулина животных, который отличается заменой, по меньшей мере, одного природного аминокислотного остатка другими аминокислотами и/или добавлением/делецией, по меньшей мере, одного аминокислотного остатка в соответствующем, идентичном в других отношениях природном инсулине. Обсуждаемые аминокислоты также могут быть аминокислотами, которые не встречаются в природе.
Производные инсулина представляют собой производные встречающегося в природе инсулина или аналога инсулина, которые получают путем химической модификации. Химическая модификация может заключаться, например, в добавлении одной или более определенных химических групп и к одной или более аминокислотам. В общих чертах, активность производных инсулина и аналогов инсулина в некоторой степени изменена по сравнению с инсулином человека.
Аналоги инсулина с ускоренным наступлением действия описаны в EP 0214826, EP 0375437 и EP 0678522. Описанное в EP 0214826 относится, среди прочего, к заменам в положениях B27 и B28. В EP 0678522 описываются аналоги инсулина, которые содержат другие аминокислоты в положении B29, предпочтительно пролин, но не глутаминовую кислоту. В EP 0375437 включаются аналоги инсулина с лизином или аргинином в положении B28, которые необязательно также могут быть модифицированы в положениях B3 и/или A21. Ускоренную активность также демонстрируют аналоги инсулина, описанные в EP-A-0885961.
В EP 0419504 раскрываются аналоги инсулина, которые защищены от химических изменений с помощью модификации аспарагина в положении B3 и, по меньшей мере, одной другой аминокислоты в положениях A5, A15, A18 или A21.
В WO 92/00321 описываются аналоги инсулина, в которых, по меньшей мере, одна аминокислота в положениях B1-B6 замещена лизином или аргинином. Указанные инсулины, согласно WO 92/00321, обладают отсроченной активностью. Отсроченную активность также демонстрируют аналоги инсулина, описанные в EP-A 0368187 и аналоги инсулина, описанные в патентных заявках Германии 102008003568.8 и 102008003566.1.
Инсулиновые препараты, содержащие встречающиеся в природе инсулины, применяемые для замещения инсулина, которые присутствуют на рынке, отличаются по происхождению инсулина (например, бычий инсулин, свиной инсулин, инсулин человека) и также по своей композиции, в силу чего можно влиять на профиль действия (начало действия и продолжительность действия). При комбинировании различных инсулиновых продуктов можно получить широкий ряд профилей действия и установить уровни глюкозы в крови, которые близки, насколько возможно, физиологическим уровням. Технология рекомбинантной ДНК в настоящее время позволяет получение указанных модифицированных инсулинов. Они включают инсулин гларгин (Gly(A21)-Arg(B31)-Arg(B32) инсулин человека), с увеличенной продолжительностью действия. Инсулин гларгин инъецируют в виде кислого, бесцветного раствора и, в силу свойств его раствора, в диапазоне физиологических значений pH подкожной ткани, он преципитируется в виде стабильного гексамерного ассоциата. Инсулин гларгин инъецируют один раз в день, и он известен своим пологим сывороточным профилем по сравнению с другими инсулинами длительного действия и, соответственно, снижением риска ночных гипогликемий (Schubert-Zsilavecz et al., 2:125-130(2001)).
Конкретный препарат инсулина гларгин, который вызывает увеличенную продолжительность действия инсулина, описывается как прозрачный раствор с кислым значением pH.
Глюкагоноподобный пептид 1 (GLP-1) представляет собой эндокринный гормон, который увеличивает инсулиновый ответ после перорального приема глюкозы или жира. В целом, GLP-1 регулирует концентрации глюкагонов, замедляет эвакуацию из желудка, стимулирует биосинтез (Pro-)инсулина, увеличивает чувствительность к инсулину, и стимулирует инсулин-зависимый биосинтез гликогена (Holst (1999), Curr. Med. Chem 6:1005, Nauck et al. (1997) Exp Clin Endocrinol Diabetes 105:187, Lopez-Delgado et al. (1998) Endocrinology 139:2811).
Человеческий GLP-1 содержит 37 аминокислотных остатков (Heinrich et al., Endocrinol. 115:2176 (1984), Uttenthal et al., J Clin Endocrinol Metabol (1985) 61:472). Активные фрагменты GLP-1 включают амид GLP-1 (7-36) и GLP-1 (7-37).
Эксендины являются другой группой пептидов, которые способны снижать концентрации глюкозы в крови. Эксендины обладают определенным сходством последовательности с GLP-1 (7-36) (53%, Goke et al. J. Biol Chem 268, 19650-55). Эксендин-3 и эксендин-4 стимулируют увеличение клеточной продукции цАМФ в ацинарных клетках поджелудочной железы морской свинки путем взаимодействия с рецепторами эксендина (Raufman, 1996, Reg. Peptides 61:1-18). В отличие от эксендина-4, эксендин-3 вызывает увеличение высвобождения амилазы в ацинарных клетках поджелудочной железы.
Эксендин-3, эксендин-4, и агонисты эксендина были предложены для лечения диабета и предупреждения гипергликемии; они уменьшают перистальтику желудка и эвакуацию из желудка (US 5424286 и WO 98/05351).
Аналоги эксендина могут отличаться аминокислотными заменами и/или C-концевым укорочением природной последовательности эксендина-4. Аналоги эксендина такого рода описаны в WO 99/07404, WO 99/25727, WO 99/25728.
Комбинации инсулина и GLP-1 известны из WO 2004/005342 для лечения диабета.
В клинической практике количество инсулина, которое нужно ввести, корректируют с учетом индивидуальной потребности отдельных пациентов с диабетом. Отдельным пациентам, как правило, требуются различные количества инсулина и/или агониста GLP-1. Обычно заранее определенную дозу применяют путем введения определенного количества композиции, имеющей определенную концентрацию. Результатом этого является то, что композиция, которая включает инсулин и вместе с тем GLP-1, допускает введение только одного определенного соотношения инсулина и GLP-1. Вышесказанное означает, что только одно из двух количеств инсулина и GLP-1 может быть оптимально адаптировано к потребностям пациентов. Поскольку на практике правильный подбор количества вводимого инсулина является самым главным, считается, что, если вводят определенное соотношение инсулина и GLP-1, агонист GLP-1 вводят, либо в недостаточной дозе, либо в избыточной дозе и корректируют по обстоятельствам до наилучшего значения.
Известны различные системы для инъекции комбинации активных соединений. Активные соединения могут быть включены в композицию и предоставлены в устройстве, как например, в шприце-ручке. Система такого рода позволяет дозировать комбинацию, но только с фиксированным соотношением активных соединений, которое представлено в композиции. Как здесь описано, указанное условие является недостатком комбинации инсулина и агониста GLP-1, поскольку нужно вводить различные количества инсулинов и агониста GLP-1 согласно терапевтическим требованиям.
Возможно также применение двух активных соединений, которые нужно ввести, в двух отдельных препаратах, каждый включает одно из двух активных соединений, которые инъецируют независимо друг от друга, каждый с помощью одного устройства (например, шприцы-ручки). В случае инъекционной терапии, такой как, например, инъекция инсулина, соблюдение больным режима и схемы лечения является главным предварительным условием успеха лечения. В общих чертах, в случае инъекционной терапии боль, боязнь уколов и удобство транспортирования устройства для инъекций представляют собой проблему, которая может привести к уменьшению исполнительности больного. Если пациент использует два отдельных устройства для инъекций, то указанные проблемы увеличиваются.
Одно устройство для введения инсулина и агониста GLP-1 является более эффективным, по сравнению с применением двух отдельных устройств для введения инсулина и агониста GLP-1, поскольку касается пациента/пользователя. Кроме того, применение только одного устройства вместо двух устройств может уменьшить число шагов, которые должен осуществить пациент/пользователь, что снизит частоту ошибок при использовании. Указанные факты уменьшают риск нежелательных побочных эффектов.
В US 4689042, US 5478323, US 5253785 и WO 01/02039 описываются устройства для совместного введения двух инъецируемых продуктов пациенту. Указанные устройства включают два контейнера, каждый из которых содержит одну композицию. В указанных устройствах две композиции вводят с помощью иглы. Указанное введение позволяет преодолеть недостатки, вызванные применением двух отдельных устройств. В результате процесса смешивания происходит разведение концентраций двух активных соединений. Указанный процесс смешивания может неблагоприятно влиять на фармакокинетику.
Фармакокинетика инсулина, в частности инсулина гларгин, находится под влиянием разведения инсулина во вводимой композиции. Таким образом, чтобы обеспечить достоверную активность определенной дозы инсулина, концентрацию инсулина следует поддерживать постоянной насколько возможно. Дозирование должно происходить по существу с помощью объема вводимой композиции инсулина. Указанное дозирование также характерно для введения комбинации инсулина и агониста GLP-1. Если вводят комбинацию инсулина и агониста GLP-1, указанное условие может быть соблюдено, только если обе субстанции дозируют в установленном соотношении друг к другу в одной композиции. Если обе субстанции предоставляют в отдельных композициях и смешивают для инъекции в подходящем устройстве (например, устройстве, описанном в WO 01/02039), то постоянная концентрация инсулина может быть получена, только если композицию инсулина не разводят существенно композицией агониста GLP-1. Данное условие накладывает ограничения на возможность независимого дозирования инсулина и агониста GLP-1.
Один возможный раствор мог бы быть раствором для предоставления агониста GLP-1 в такой высокой концентрации, что дозированное добавление агониста GLP-1 не вызывает существенного разведения композиции инсулина (например, не более чем на 10%). Полипептиды, такие как (например, инсулин гларгин, Лантус®) или агонисты GLP-1 не могут быть концентрированными ad infinitum. Во-первых, растворимость белков ограничена, и высокие концентрации белка могут изменять реологические свойства раствора. Самой главной проблемой при использовании растворов с высокой концентрацией активного соединения является точность дозирования. При высоких концентрациях нужно вводить небольшие объемы или проводить дозирование в другом растворе. Известны устройства для точного дозирования маленьких или очень маленьких объемов. Однако, такие устройства очень дороги и, исходя из их действия, они предназначены только для использования обученным персоналом, например, в лаборатории. Поскольку, в общем, пациенты вводят сами себе инсулины и/или агонисты GLP-1, применение таких устройств для введения инсулинов и/или агонистов GLP-1 исключено. Устройства, которые описаны, например, в US 4689042, US 5478323, US 5253785 и WO 01/02039, которые позволяют пациентам вводить самим себе растворы активных соединений, непригодны для дозирования маленьких и очень маленьких объемов.
Проблемы, которые возникают в отношении инъекции комбинации инсулина и агониста GLP-1, заключаются в следующем:
- соотношение активных соединений должно быть изменяемым;
- фармакокинетика, по меньшей мере, одного активного соединения (инсулина) зависит от концентрации/разведения;
- фармакокинетика, по меньшей мере, одного другого активного соединения (агониста GLP-1) не зависит или зависит несущественно от концентрации/разведения.
Таким образом, целью настоящего изобретения является предоставление лекарственного средства, которое, по меньшей мере, частично преодолевает описанные выше недостатки существующего уровня техники. Дополнительная цель состоит в том, что по возможности должно быть только одно введение лекарственного средства в день.
Неожиданно было обнаружено, что комбинация инсулина и агониста GLP-1 демонстрирует синергические эффекты в отношении регуляции глюкозы в крови в фазы после приема пищи и после всасывания, по сравнению с применением только одного инсулина или агониста GLP-1:
- Более высокая активность из расчета комбинации дополняющих друг друга активностей в отношении уровней глюкозы натощак и после приема пищи, которые дополняют друг друга (Примеры 2 и 3). Комбинация демонстрирует уменьшение концентрации глюкозы после приема пищи (т.е. улучшенную толерантность к глюкозе), аналогичное действию одного агониста GLP-1, и дополнительно демонстрирует уменьшение концентрации глюкозы после всасывания, аналогичное действию инсулина (Пример 9).
- Уменьшение риска гипогликемии (Примеры 2-4).
- Улучшенная адаптация концентрации глюкозы в крови к нормогликемическим уровням (Пример 8).
- Улучшенная толерантность к глюкозе и снижение концентраций глюкозы после всасывания (Пример 9).
- Синергические активности комбинации в отношении концентрации глюкозы наблюдают в диапазоне концентраций агониста GLP-1 одного порядка величины (фактор 10). (Пример 6 в сравнении с Примерами 4 и 2). Только в случае относительно небольших доз GLP-1 и/или относительно больших отношений инсулина к GLP-1 преобладают активности инсулина.
- Поддержание функции β-клеток (Пример 10).
- Потеря веса/замедление увеличения веса.
- Все Примеры показывают, что агонисты GLP-1 и инсулины не демонстрируют неблагоприятных взаимодействий.
- Исходя из активностей в отношении концентрации глюкозы в крови натощак, после приема пищи и после всасывания, становится возможным уменьшение числа введений комбинации до одного раза в день.
Изобретение предоставляет лекарственное средство, включающее, по меньшей мере, один инсулин и, по меньшей мере, один агонист GLP-1, лекарственное средство получают и/или изготавливают таким образом, что оно включает инсулин и агонист GLP-1, каждый в заранее определенном количестве, и может быть введено в дозе, адаптированной к индивидуальной потребности пациента.
Лекарственное средство согласно изобретению используют в частности для лечения пациентов с сахарным диабетом, более подробно, пациентов с диабетом 1 типа или 2 типа.
Лекарственное средство согласно изобретению обеспечивает концентрацию глюкозы в крови, которая более эффективно адаптирована к нормогликемическим уровням в случае пациентов с диабетом, более подробно, с диабетом 1 типа или 2 типа.
Лекарственное средство используют предпочтительно для регулирования концентрации глюкозы в крови натощак, после приема пищи и/или после всасывания у пациентов с диабетом, более подробно, пациентов с диабетом 1 типа или 2 типа. Более предпочтительно, лекарственное средство согласно изобретению используют для регулирования концентрации глюкозы в крови после приема пищи и/или после всасывания у пациентов с диабетом, более подробно, пациентов с диабетом 1 типа или 2 типа. Регулирование в данном контексте означает, что по существу достигаются нормогликемические концентрации глюкозы в крови или, по меньшей мере, получают приближенные к ним значения. Более подробно, под нормогликемическими уровнями подразумевают концентрации глюкозы в крови в диапазоне нормальных значений (размах изменения 60-140 мг/дл, что соответствует 3,3-7,8 ммоль/л). Указанный диапазон изменения охватывает концентрации глюкозы в крови в условиях натощак, в условиях после приема пищи и в условиях после всасывания.
“После приема пищи” и “после всасывания” представляют собой термины, знакомые специалисту в области диабетологии. Более подробно, “после приема пищи” используют здесь в отношении фазы после еды и/или после нагрузки глюкозой в эксперименте. Указанная фаза характеризуется, более подробно, у здорового субъекта увеличением и последующим снижением концентрации глюкозы в крови. Более подробно, термины “после всасывания” или “фаза после всасывания” используют здесь, чтобы указать фазу, которая следует после фазы приема пищи. Фаза после приема пищи обычно продолжается до 4 часов после еды и/или нагрузки глюкозой. Фаза после всасывания обычно продолжается 8-16 часов.
Лекарственное средство согласно изобретению также используют предпочтительно для улучшения толерантности к глюкозе в лечении пациента с диабетом, более подробно, с диабетом 1 типа или 2 типа. Улучшение толерантности к глюкозе означает, что лекарственное средство согласно изобретению снижает концентрацию глюкозы в крови после приема пищи. Под улучшением толерантности к глюкозе также подразумевается, что лекарственное средство согласно изобретению снижает концентрацию глюкозы в крови после всасывания. Снижение означает, более подробно, что концентрация глюкозы в крови по существу достигает нормогликемических значений или, по меньшей мере, приближается к ним.
Лекарственное средство согласно изобретению способно снизить риск гипогликемии, которая может иметь место, например, в фазу после всасывания. Лекарственное средство согласно изобретению используют предпочтительно для предупреждения гипогликемии при лечении пациента с диабетом, более подробно, с диабетом 1 типа или 2 типа, возможно применение против гипогликемии, которая возникает, более конкретно, в фазу после всасывания.
Лекарственное средство согласно изобретению может поддерживать функцию панкреатических β-клеток. Лекарственное средство согласно изобретению используют предпочтительно для предупреждения потери функции панкреатических β-клеток у пациента с диабетом, более подробно, с диабетом 1 типа или 2 типа. Более подробно, потери функции β-клеток могут быть вызваны апоптозом.
Кроме того, лекарственное средство согласно изобретению может приводить к потере веса и/или предотвращать увеличение веса у пациентов с диабетом, более подробно, с диабетом 1 типа или 2 типа. У пациентов с диабетом, особенно с диабетом 2 типа, увеличение веса и избыточный вес являются обычными проблемами. Соответственно, введение лекарственного средства согласно изобретению может способствовать терапии благодаря лечению избыточного веса.
Следует понимать, что лекарственное средство согласно изобретению может быть использовано для лечения более чем одного из предпочтительных показателей, описанных здесь у пациента с диабетом, более подробно, с диабетом 1 типа или 2 типа. Соответственно, настоящее изобретение включает не только индивидуальные предпочтительные показатели, но также произвольные комбинации показателей. Лекарственное средство согласно изобретению, таким образом, может быть использовано для лечения одного или более из описанных здесь показателей у пациентов с диабетом, более подробно, у пациентов с диабетом 1 типа или 2 типа, например, с целью регулирования концентрации глюкозы в крови натощак, после приема пищи и/или после всасывания, для улучшения толерантности к глюкозе, для предупреждения гипогликемии, для предупреждения потери функции панкреатических β-клеток, потери веса и/или для предупреждения увеличения веса. Предпочтение отдают регулированию концентрации глюкозы в крови натощак, после приема пищи и/или после всасывания, улучшению толерантности к глюкозе и/или предупреждению гипогликемии.
Лекарственное средство согласно изобретению также может быть использовано для получения медицинского продукта для лечения одного или более описанных здесь показателей, как например, для регулирования концентрации глюкозы в крови натощак, после приема пищи и/или после всасывания, для улучшения толерантности к глюкозе, для предупреждения гипогликемии, для предупреждения потери функции панкреатических β-клеток, потери веса и/или для предупреждения увеличения веса.
По меньшей мере один инсулин и, по меньшей мере, один агонист GLP-1 также могут быть использованы для получения медицинского продукта для лечения одного или более описанных здесь показателей, как например, для регулирования концентрации глюкозы в крови натощак, после приема пищи и/или после всасывания, для улучшения толерантности к глюкозе, для предупреждения гипогликемии, для предупреждения потери функции панкреатических β-клеток, для потери веса и/или для предупреждения увеличения веса.
По меньшей мере один агонист GLP-1 и, по меньшей мере, один инсулин могут быть предоставлены вместе в одной фармацевтической композиции. В указанном случае предоставляют первую и вторую композицию и, необязательно, по меньшей мере, одну дополнительную фармацевтическую композицию, каждая включает инсулин и агонист GLP-1. Соответственно, изобретение предоставляет лекарственное средство, включающее первую фармацевтическую композицию и вторую фармацевтическую композицию, и, необязательно, по меньшей мере, одну дополнительную фармацевтическую композицию, каждая включает, по меньшей мере, один инсулин и, по меньшей мере, один агонист GLP-1, и содержит, по меньшей мере, один инсулин и/или, по меньшей мере, один агонист GLP-1 в различных весовых концентрациях по отношению к общему весу композиции.
В настоящем описании термин "необязательно, по меньшей мере, одна дополнительная фармацевтическая композиция" означает, что лекарственное средство согласно изобретению, в дополнение к первой и второй фармацевтическим композициям, может включать, по меньшей мере, одну дополнительную фармацевтическую композицию. Таким образом, лекарственное средство согласно изобретению может включать, например, 3, 4, 5, 6, 7, 8, 9, 10 или более фармацевтических композиций согласно изобретению.
Предпочтительные лекарственные средства представляют собой лекарственные средства, которые включают первую и вторую фармацевтическую композицию согласно изобретению.
Аналогичным образом предпочтительными являются лекарственные средства, которые включают первую, вторую, и третью фармацевтическую композицию согласно изобретению.
Аналогичным образом предпочтительными являются лекарственные средства, которые включают первую, вторую, третью и четвертую фармацевтическую композицию согласно изобретению.
Аналогичным образом предпочтительными являются лекарственные средства, которые включают первую, вторую, третью, четвертую и пятую фармацевтическую композицию.
Весовые количества, по меньшей мере, одного инсулина и, по меньшей мере, одного агониста GLP-1 могут быть выбраны в первой фармацевтической композиции, второй фармацевтической композиции, и, в соответствующих случаях, по меньшей мере, в одной дополнительной фармацевтической композиции таким образом, что фармацевтические композиции содержат различные соотношения инсулина и агониста GLP-1, исходя из их весовых количеств.
В указанном случае первая композиция может содержать наименьшее соотношение, и вторая композиция может содержать следующее большее соотношение. Если представлена, по меньшей мере, одна дополнительная композиция, она может содержать следующее большее соотношение. В случае, если представлена также следующая композиция, она может содержать в свою очередь следующее большее соотношение. Композиции могут содержать, таким образом, соотношения инсулина и агониста GLP-1, исходя из весовой концентрации, которые возрастают от первой ко второй композиции и, в соответствующих случаях, в следующих композициях.
Весовую концентрацию одного из двух активных соединений, т.е., по меньшей мере, одного инсулина или, по меньшей мере, одного агониста GLP-1, в первой фармацевтической композиции, во второй фармацевтической композиции, и, в соответствующих случаях, по меньшей мере, в одной дополнительной фармацевтической композиции, выбирают предпочтительно в каждом случае, так что заранее определенная доза указанного активного соединения может быть введена путем введения определенного объема первой, второй и/или, по меньшей мере, одной дополнительной композиции. Особенно предпочтительно указанное активное соединение представляет собой, по меньшей мере, один инсулин.
Весовую концентрацию оставшегося из числа двух активных соединений, т.е., по меньшей мере, одного инсулина или, по меньшей мере, одного агониста GLP-1 в первой фармацевтической композиции, во второй фармацевтической композиции, и, в соответствующих случаях, по меньшей мере, в одной дополнительной фармацевтической композиции предпочтительно выбирают так, что соотношения инсулина и агониста GLP-1, исходя из весовой концентрации, возрастают от первой ко второй и, в соответствующих случаях, в дополнительных композициях. Особенно предпочтительно указанное активное соединение представляет собой, по меньшей мере, один агонист GLP-1.
Кроме того, весовую концентрацию соединения, оставшегося из двух активных соединений в фармацевтических композициях, определяют так, что одна из фармацевтических композиций может быть выбрана таким образом, что дозу первого из двух активных соединений, которую нужно ввести, и дозу второго активного соединения, которую нужно ввести, предоставляют в определенном объеме. Таким образом, выбирают фармацевтическую композицию, которая содержит желаемое соотношение.
Теоретически возможно предоставить фармацевтическую композицию для каждого отдельного терапевтически желательного соотношения весовых концентраций, по меньшей мере, одного инсулина и, по меньшей мере, одного агониста GLP-1, чтобы получить оптимальную дозировку обоих активных соединений, адаптированную к потребностям каждого пациента.
В настоящем изобретении конкретное число фармацевтических композиций является достаточным, чтобы обеспечить дозировки двух активных соединений, требуемые на практике. Для каждого пациента задаваемый диапазон доз определяется в пределах терапевтически рационального интервала для каждого из двух активных соединений. Таким образом, доза, которую вводят, должна изменяться по существу в пределах указанного диапазона доз для конкретного пациента, без передозирования или недостаточного дозирования.
Неожиданно было обнаружено, что синергический эффект комбинации, по меньшей мере, одного инсулина и, по меньшей мере, одного агониста GLP-1 на концентрацию глюкозы в плазме крови возникает в диапазоне концентраций агониста GLP-1 одного порядка величины (фактор 10). Поскольку преимущественным является количество инсулина, которое должно быть адаптировано и точно дозировано для отдельного пациента, диапазон синергических концентраций агониста GLP-1 обеспечивается фармацевтической композицией согласно изобретению, которая содержит определенное соотношение, по меньшей мере, одного инсулина и, по меньшей мере, одного агониста GLP-1 для перекрывания терапевтического диапазона доз инсулина одновременно с ассоциированным количеством агониста GLP-1 с синергическим действием. Соотношение может быть выбрано так, что каждая желаемая доза инсулина имеет соответствующую ей дозу, по меньшей мере, одного агониста GLP-1, которая находится в пределах желаемого диапазона, например, диапазона синергического действия. Как изложено выше, соотношение первой, второй, и, в соответствующих случаях, по меньшей мере, одной дополнительной композиции лекарственного средства также может быть выбрано так, что соотношения возрастают от первой ко второй и, в соответствующих случаях, по меньшей мере, в одной дополнительной композиции. Если доза агониста GLP-1 при желаемой дозе инсулина композиции (например, первой композиции) находится вне (обычно выше) желаемого диапазона доз агониста GLP-1, тогда выбирают для использования следующую композицию (например, вторую композицию) или дополнительную композицию с большим соотношением, по меньшей мере, одного инсулина и, по меньшей мере, одного агониста GLP-1, в которой количество агониста GLP-1 при желаемой дозе инсулина находится в пределах желаемого диапазона. Соотношения первой, второй и, в соответствующих случаях, по меньшей мере, одной дополнительной композиции лекарственного средства могут быть затем выбраны так, что диапазоны доз инсулина, которые соответствуют желаемым дозам, по меньшей мере, одного агониста GLP-1, граничат друг с другом и/или перекрывают друг друга. Предпочтительно, диапазоны перекрываются. Более подробно, перекрывание означает, что можно выбрать, по меньшей мере, две композиции, каждая из которых при желаемой дозе, по меньшей мере, одного инсулина, включает количество, по меньшей мере, одного агониста GLP-1, которое находится в пределах желаемого диапазона доз.
Например, три композиции являются достаточными для регулирования дозы, по меньшей мере, одного инсулина у конкретного пациента на уровне, выбранном из диапазона 15-80 единиц инсулина, и в то же время для регулирования дозы агониста GLP-1 в количестве в пределах диапазона 10-20 мкг (см. Пример 11).
Также возможно предоставить лекарственное средство согласно изобретению, в котором соотношение выбирают так, что для каждой желаемой дозировки агониста GLP-1 существует соответствующая дозировка, по меньшей мере, одного инсулина, которая находится в пределах желаемого диапазона, например, диапазона синергического действия. Соотношения первой, второй, и, в соответствующих случаях, по меньшей мере, одной дополнительной композиции лекарственного средства также могут быть выбраны так, что диапазоны доз агониста GLP-1, которые соответствуют желаемым дозировкам, по меньшей мере, одного инсулина, граничат друг с другом и/или перекрывают друг друга. Предпочтительно, диапазоны перекрываются. Более подробно, перекрывание в данном контексте означает, что можно выбрать, по меньшей мере, две композиции, каждая из которых, при желаемой дозе, по меньшей мере, одного агониста GLP-1, включает количество, по меньшей мере, одного инсулина, которое находится в пределах желаемого интервала доз.
Предпочтительно, лекарственное средство согласно изобретению включает не более чем 10 фармацевтических композиций, которые описаны выше, более предпочтительно, не более чем 5, не более чем 4, не более чем 3 или 2 фармацевтические композиции.
Композиции согласно изобретению могут содержать, по меньшей мере, один инсулин в одинаковых или различных весовых концентрациях. Например, по меньшей мере, две композиции согласно изобретению могут содержать, по меньшей мере, один инсулин в идентичной по существу весовой концентрации.
Предпочтительно первая, вторая, и, в соответствующих случаях, дополнительные композиции включают, по меньшей мере, один инсулин в идентичной по существу весовой концентрации и, по меньшей мере, один агонист GLP-1 в различных весовых концентрациях.
Композиции согласно изобретению могут содержать, по меньшей мере, один агонист GLP-1 в одинаковой или в различных весовых концентрациях. Например, по меньшей мере, две композиции согласно изобретению могут содержать, по меньшей мере, один агонист GLP-1 в идентичной по существу весовой концентрации.
Предпочтительно также первая, вторая, и, в соответствующих случаях, дополнительная композиции включают, по меньшей мере, один агонист GLP-1 в идентичной по существу весовой концентрации и, по меньшей мере, один инсулин в различных весовых концентрациях.
Кроме первой, второй, и, в соответствующих случаях, по меньшей мере, одной дополнительной композиции, лекарственное средство согласно изобретению может включать, по меньшей мере, одну дополнительную фармацевтическую композицию, которая содержит, по меньшей мере, либо один инсулин, либо, по меньшей мере, один агонист GLP-1. Лекарственное средство согласно изобретению может также включать, по меньшей мере, одну дополнительную фармацевтическую композицию, которая содержит, по меньшей мере, один инсулин и, по меньшей мере, один агонист GLP-1 в соотношении весовых концентраций, которое является аналогичным соотношению весовых концентраций в описанной здесь первой, второй или, в соответствующих случаях, дополнительной фармацевтической композиции.
Изобретение далее предоставляет лекарственное средство, включающее первую фармацевтическую композицию и вторую фармацевтическую композицию, первая фармацевтическая композиция содержит, по меньшей мере, один инсулин и вторая фармацевтическая композиция содержит, по меньшей мере, один агонист GLP-1, лекарственное средство получают и/или изготавливают для раздельного введения первой и второй фармацевтических композиций.
В Примере 12 показано как комбинация двух или более активных соединений может быть изготовлена так, что если объединяют две или более композиции, оба активных соединения могут быть введены в любых желаемых количествах и в любых желаемых соотношениях друг к другу. При этом учитывается тот факт, что, по меньшей мере, одно из активных соединений не должно разбавляться при объединении (например, в результате смешивания непосредственно перед введением).
Настоящее изобретение предоставляет лекарственное средство, которое включает первое активное соединение и второе активное соединение, и, необязательно, по меньшей мере, одно дополнительное активное соединение, указанные активные соединения предоставляют в первой, второй, и, необязательно, по меньшей мере, в одной дополнительной композиции. Первое активное соединение представлено во всех композициях. Второе активное соединение представлено во второй композиции, и, по меньшей мере, одно дополнительное активное соединение, в соответствующих случаях, представлено необязательно, по меньшей мере, в одной дополнительной композиции. Таким образом, вторая и каждая следующая композиции включают первое активное соединение в комбинации с еще одним активным соединением.
Таким образом, настоящее изобретение предоставляет лекарственное средство, которое включает первую фармацевтическую композицию и вторую фармацевтическую композицию, и, необязательно, по меньшей мере, одну дополнительную фармацевтическую композицию, первая фармацевтическая композиция содержит, по меньшей мере, одно первое активное соединение, и вторая фармацевтическая композиция содержит, по меньшей мере, одно первое активное соединение и, по меньшей мере, одно второе активное соединение, и, по меньшей мере, одна дополнительная фармацевтическая композиция содержит, по меньшей мере, одно первое и, по меньшей мере, одно дополнительное активное соединение. Активные соединения здесь могут представлять собой любые желательные активные соединения.
Первая композиция предпочтительно включает в качестве активного соединения, по меньшей мере, только одно первое активное соединение.
Первая, вторая и, в соответствующих случаях, по меньшей мере, одна дополнительная композиции могут включать первое активное соединение в идентичной по существу весовой концентрации или в различных весовых концентрациях по отношению к общему весу композиции.
Предпочтительно, первая фармацевтическая композиция, вторая фармацевтическая композиция, и, в соответствующих случаях, по меньшей мере, одна дополнительная фармацевтическая композиция включают первое активное соединение по существу в одинаковых весовых концентрациях по сравнению с общим весом композиции. Таким образом, можно гарантировать, что может быть использовано любое желаемое соотношение первой и второй композиции и, в соответствующих случаях, любое желаемое соотношение первой и, по меньшей мере, одно дополнительной композиции, дозирование первого активного соединения происходит через общее число вводимых композиций. С помощью соотношения двух композиций возможно бесступенчатое увеличение количества активного соединения, которое представлено только во второй композиции и, в соответствующих случаях, по меньшей мере, в одной дополнительной композиции. Таким образом, в силу вышесказанного, можно легко дозировать любое желаемое количество и любое желаемое соотношение первого и второго активных соединений и, в соответствующих случаях, первого активного соединения и дополнительного активного соединения, без изменения концентрации первого активного соединения.
Первое активное соединение может представлять собой, по меньшей мере, один инсулин. Второе активное соединение может представлять собой, по меньшей мере, один агонист GLP-1. Предпочтение отдается лекарственному средству, которое включает первую фармацевтическую композицию и вторую фармацевтическую композицию, и, необязательно, по меньшей мере, одну дополнительную фармацевтическую композицию, первая фармацевтическая композиция включает, по меньшей мере, один инсулин, и вторая фармацевтическая композиция включает, по меньшей мере, один инсулин и, по меньшей мере, один агонист GLP-1, и, по меньшей мере, одна дополнительная фармацевтическая композиция включает, по меньшей мере, один инсулин и, по меньшей мере, одно дополнительное активное соединение.
Первая композиция предпочтительно включает в качестве активного соединения, по меньшей мере, только один инсулин.
Дополнительное активное соединение может представлять собой любое желаемое активное соединение. Более подробно, дополнительное активное соединение представляет собой активное соединение, которое используют для лечения пациентов с сахарным диабетом (1 типа и/или 2 типа), включая также активные соединения для лечения сопутствующих диабету нарушений.
Первая, вторая, и, в соответствующих случаях, по меньшей мере, одна дополнительная композиции могут включать инсулин по существу в одинаковой весовой концентрации или в различных весовых концентрациях по сравнению с общим весом композиции.
Предпочтительно, первая фармацевтическая композиция, вторая фармацевтическая композиция и, в соответствующих случаях, по меньшей мере, одна дополнительная фармацевтическая композиция включают инсулин по существу в одинаковых весовых концентрациях по отношению к общему весу композиции. Таким путем можно обеспечить, что любое желаемое соотношение первой и второй композиций, и в соответствующих случаях, любое желаемое соотношение первой и, по меньшей мере, одной дополнительной композиций может быть использовано, дозирование инсулина проходит посредством общего количества вводимых композиций. Посредством соотношения двух композиций можно бесступенчато увеличить количество активного соединения, которое представлено только во второй композиции, и, в соответствующих случаях, по меньшей мере, в одной дополнительной композиции. Следовательно, таким образом, можно легко дозировать любое желаемое количество и любое желаемое соотношение инсулина и агониста GLP-1 и, в соответствующих случаях, инсулина и дополнительного активного соединения, без изменения концентрации, по меньшей мере, одного инсулина.
В настоящем изобретении термин "по существу одинаковые весовые концентрации" активного соединения в двух композициях означает, что одна из двух композиций содержит активное соединение в весовой концентрации, которая является, например, не более чем на 10%, не более чем на 5%, не более чем на 1% или не более чем на 0,1% выше, чем его весовая концентрация в другой композиции.
Первое активное соединение также может представлять собой, по меньшей мере, один агонист GLP-1. Второе активное соединение может представлять собой, по меньшей мере, один инсулин. Предпочтение отдается лекарственному средству, которое включает первую фармацевтическую композицию и вторую фармацевтическую композицию, и, необязательно, по меньшей мере, одну дополнительную фармацевтическую композицию, первая фармацевтическая композиция содержит, по меньшей мере, один агонист GLP-1, и вторая фармацевтическая композиция содержит, по меньшей мере, один агонист GLP-1 и, по меньшей мере, один инсулин, и, по меньшей мере, одна дополнительная фармацевтическая композиция содержит, по меньшей мере, один агонист GLP-1 и, по меньшей мере, одно дополнительное активное соединение.
Первая композиция предпочтительно включает в качестве активного соединения, по меньшей мере, только один агонист GLP-1.
Первая, вторая, и, в соответствующих случаях, по меньшей мере, одна дополнительная композиция может включать агонист GLP-1 по существу в одинаковой весовой концентрации или в различных весовых концентрациях по отношению к общему весу композиции. Предпочтительно первая фармацевтическая композиция, вторая фармацевтическая композиция и, в соответствующих случаях, по меньшей мере, одна дополнительная фармацевтическая композиция включают, по меньшей мере, один агонист GLP-1 по существу в одинаковых весовых концентрациях по отношению к общему весу композиции.
Соответственно, настоящее изобретение предоставляет лекарственное средство, которое демонстрирует ряд преимуществ по сравнению с композициями известного уровня техники, включая отдельные композиции, каждая из которых содержит одно активное соединение, более подробно, инсулин или агонист GLP-1, указанные преимущества включают следующее:
- отношение первого активного соединения ко второму активному соединению и, в соответствующих случаях, первого активного соединения, по меньшей мере, к одному дополнительному активному соединению может быть свободно выбрано потребителем.
- Поскольку первое активное соединение представлено во всех композициях, более подробно, в одинаковых весовых концентрациях, указанное активное соединение не разбавляется, если первую композицию смешивают со второй и, в соответствующих случаях, с последующими композициями. Данный факт является важным для активных соединений, таких как инсулин, если, например, фармакокинетика зависит от концентрации/разведения.
- Объем инъекции уменьшается (см. Пример 12). Поэтому имеется уменьшение разведения второго активного соединения (например, агониста GLP-1) и, в соответствующих случаях, дополнительного активного соединения.
Изобретение дополнительно предоставляет набор, включающий лекарственное средство согласно изобретению. Набор согласно изобретению может быть предназначен для использования медицинским персоналом или субъектами без специальной медицинской подготовки, более подробно, самими пациентами или помощниками, например, их родственниками. В наборе согласно изобретению отдельные фармацевтические композиции, содержащие лекарственное средство согласно изобретению, собраны в отдельных упаковках, и таким образом пациент может выбрать композицию, соответствующую текущей потребности, и ввести количество в соответствии с потребностью. Набор согласно изобретению включает, например, лекарственное средство согласно изобретению в форме набора шприцов, стеклянных ампул и/или шприцов-ручек, которые содержат композицию согласно изобретению.
Существует ряд способов, с помощью которых может быть введено лекарственное средство согласно изобретению. Лекарственное средство может быть введено парентерально. Лекарственное средство может быть инъецировано, с возможным применением инъекционных систем с иглами или без игл. Кроме того, лекарственное средство может быть введено с помощью ингаляции. В таком случае для жидких композиций возможно ингалирование, или композиции могут быть ингалированы в форме порошка. Кроме того, лекарственное средство согласно изобретению может быть введено в виде спрея, более подробно, в виде назального спрея. Кроме того, лекарственное средство согласно изобретению может быть введено с помощью трансдермальной системы. Специалисту в данной области техники известны указанные способы введения, и он может изготовить лекарственное средство согласно изобретению таким образом, что оно может быть эффективно введено с помощью одного из способов введения. Композиции лекарственного средства согласно изобретению предпочтительно являются жидкими. Предпочтительно, кроме того, лекарственное средство согласно изобретению вводят парентерально, более подробно, с помощью инъекции.
Настоящее изобретение далее предоставляет устройство для введения лекарственного средства согласно изобретению. Указанное устройство включает фармацевтические композиции, которые охватываются лекарственным средством согласно изобретению, в отдельных контейнерах, и предоставляет фармацевтические композиции, которые должны быть дозированы независимо друг от друга. Устройство согласно изобретению может быть устройством для парентерального введения. Устройство согласно изобретению может быть устройством для инъекции с применением или без применения игл. Кроме того, устройство может быть устройством для ингаляции, и в таком случае жидкие композиции ингалируют, или композиции могут быть ингалированы в форме порошка. Кроме того, устройство может быть устройством для введения спрея, более подробно, назального спрея. Кроме того, устройство может представлять собой систему для трансдермального введения. Предпочтительно, устройство согласно изобретению является устройством для парентерального введения, более подробно, устройством для инъекций.
"Изготовление" является термином, который известен специалисту в данной области техники и который обозначает в фармакологии заключительную обработку, такую как, например, деление на части и упаковку лекарственных средств для применения конечным потребителем. В настоящем описании "изготовленный" или "изготовление" означает, более подробно, что фармацевтические композиции согласно изобретению упаковывают подходящим образом в терапевтически эффективном количестве, чтобы обеспечить описанный здесь выбор, по меньшей мере, одной из композиций лекарственного средства согласно изобретению для желаемого дозирования, по меньшей мере, одного инсулина и, по меньшей мере, одного агониста GLP-1. Более подробно, подразумевается парентеральное введение, предпочтительно, инъекция, более предпочтительно, подкожная инъекция. Подходящая упаковка представляет собой, например, шприц или стеклянный сосуд с подходящей пробкой, из которого, при необходимости могут быть взяты индивидуальные терапевтически активные дозы. Аналогичным образом, подходящими являются ручки-шприцы для введения инсулина, содержащие контейнер (например, картридж), который включает фармацевтическую композицию согласно изобретению.
"Изготовление препаративной формы" или "препаративная форма" является термином, который известен специалисту в данной области техники и который в области фармакологии относится к производству лекарственных средств и лекарственных композиций, и их изготовлению со вспомогательными веществами. В настоящем описании "изготовление препаративной формы" или "препаративная форма" означает более подробно, что композиция согласно изобретению предоставляется в подходящей форме, которая обеспечивает введение терапевтически эффективного количества активных соединений. Более подробно, препаративная форма предназначена для парентерального введения, предпочтительно, для инъекции, более предпочтительно, для подкожной инъекции.
В настоящем изобретении термин "агонист GLP-1" включает GLP-1, его аналоги и производные, эксендин-3 и его аналоги и производные, и эксендин-4 и его аналоги и производные. Композиции согласно изобретению включают одно или более веществ, выбранных независимо друг от друга из группы, включающей глюкагоноподобный пептид-1 (GLP-1), аналоги и производные GLP-1, эксендин-3, аналоги и производные эксендина-3, эксендин-4, аналоги и производные эксендина-4 и их фармакологически переносимые соли. Также включены субстанции, которые демонстрируют биологическую активность GLP-1.
Аналоги и производные GLP-1 описаны в WO 98/08871, например; эксендин-3, аналоги и производные эксендина-3, и эксендин-4 и аналоги и производные эксендина-4 могут быть найдены в WO 01/04156, WO 98/30231, US 5424286, в заявке EP 99610043.4, в WO 2004/005342 и WO 04/035623. Указанные документы включены в описание посредством ссылки. Эксендин-3 и эксендин-4, описанные в указанных документах, и их аналоги и производные, которые описаны там, могут быть использованы в композициях настоящего изобретения в качестве агонистов GLP-1. Возможно также применение любых желательных комбинаций эксендина-3 и эксендина-4, описанных в указанных документах, и аналогов и производных, описанных в них, в качестве агонистов GLP-1, по меньшей мере, один агонист GLP-1 предпочтительно независимо выбирают из группы, состоящей из эксендина-4, аналогов и производных эксендина-4 и их фармакологически переносимых солей.
Другой предпочтительный агонист GLP-1 представляет собой аналог эксендина-4, выбранный из группы, состоящей из:
H-desPro36-эксендин-4-Lys6-NH2,
H-des(Pro36,37)-эксендин-4-Lys4-NH2,
H-des(Pro36,37)-эксендин-4-Lys5-NH2 и их фармакологически переносимых солей.
Другой предпочтительный агонист GLP-1 представляет собой аналог эксендина-4, выбранный из группы, состоящей из:
desPro36 [Asp28]эксендин-4 (1-39),
desPro36 [IsoAsp28]эксендин-4 (1-39),
desPro36 [Met(O)14, Asp28]эксендин-4 (1-39),
desPro36 [Met(O)14, IsoAsp28]эксендин-4 (1-39),
desPro36 [Trp(O2)25, Asp28]эксендин-2 (1-39),
desPro36 [Trp(O2)25, IsoAsp28]эксендин-2 (1-39),
desPro36 [Met(O)14Trp(O2)25, Asp28]эксендин-4 (1-39),
desPro36 [Met(O)14Trp(O2)25, IsoAsp28]эксендин-4 (1-39), и их фармакологически переносимых солей.
Другой предпочтительный агонист GLP-1 представляет собой аналог эксендина-4, выбранный из группы, как описано в параграфе выше, в котором пептид -Lys6-NH2 присоединен к C-концам аналогов эксендина-4.
Другой предпочтительный агонист GLP-1 представляет собой аналог эксендина-4, выбранный из группы, состоящей из:
H-(Lys)6-des Pro36 [Asp28]эксендин-4(1-39)-Lys6-NH2
des Asp28Pro36, Pro37, Pro38эксендин-4(1-39)-NH2,
H-(Lys)6- des Pro36, Pro37, Pro38 [Asp28]эксендин-4(1-39)-NH2,
H-Asn-(Glu)5 des Pro36, Pro37, Pro38 [Asp28]эксендин-4(1-39)-NH2,
des Pro36, Pro37, Pro38 [Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-(Lys)6-des Pro36, Pro37, Pro38 [Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-Asn-(Glu)5-des Pro36, Pro37, Pro38 [Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-(Lys)6-desPro36[Trp(O2)25,Asp28]эксендин-4(1-39)-Lys6-NH2,
H-des Asp28 Pro36, Pro37, Pro38 [Trp(O2)25]эксендин-4(1-39)-NH2,
H-(Lys)6-desPro36, Pro37, Pro38 [Trp(O2)25, Asp28]эксендин-4(1-39)-NH2,
H-Asn-(Glu)5-des Pro36, Pro37, Pro38 [Trp(O2)25, Asp28]эксендин-4(1-39)-NH2,
des Pro36, Pro37, Pro38 [Trp(O2)25, Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-(Lys)6-des Pro36, Pro37, Pro38 [Trp(O2)25, Asp28]эксендин-4(1-39)-Lys)6-NH2,
H-Asn-(Glu)5-des Pro36, Pro37, Pro38 [Trp(O2)25, Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-(Lys)6-des Pro36 [Met(O)14, Asp28]эксендин-4(1-39)-Lys6-NH2,
des Met(O)14 Asp28 Pro 36, Pro37, Pro38 эксендин-4(1-39)-NH2,
H-(Lys)6-des Pro36, Pro37, Pro38 [Met(O)14, Asp28]эксендин-4(1-39)-NH2,
H-Asn-(Glu)5-des Pro36, Pro37, Pro38 [Met(O)14, Asp28] эксендин-4(1-39)-NH2,
des Pro36, Pro37, Pro38 [Met(O)14, Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-(Lys)6-des Pro36, Pro37, Pro38 [Met(O)14, Asp28]эксендин-4(1-39)-Lys6-NH2,
H-Asn-(Glu)5 des Pro36, Pro37, Pro38 [Met(O)14, Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-(Lys)6-des Pro36 [Met(O)14, Trp(O2)25, Asp28]эксендин-4(1-39)-Lys6-NH2,
des Asp28 Pro36, Pro37, Pro38 [Met(O)14, Trp(O2)25]эксендин-4(1-39)-NH2,
H-(Lys)6-des Pro36, Pro37, Pro38 [Met(O)14, Trp(O2)25, Asp28]эксендин-4(1-39)-NH2,
H-Asn-(Glu)5-des Pro36, Pro37, Pro38 [Met(O)14, Asp28]эксендин-4(1-39)-NH2,
des Pro36, Pro37, Pro38 [Met(O)14, Trp(O2)25, Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-(Lys)6-des Pro36, Pro37, Pro38 [Met(O)14, Trp(O2)25, Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-Asn-(Glu)5-des Pro36, Pro37, Pro38 [Met(O)14, Trp(O2)25, Asp28]эксендин-4(1-39)-(Lys)6-NH2, и их фармакологически переносимые соли.
Другой предпочтительный агонист GLP-1 выбирают из группы, состоящей из Arg34,Lys26(Nε(Y-глутамил(Nα-гексадеканоил)))GLP-1(7-37) [лираглутид] и его фармакологически переносимой соли.
Другой предпочтительный агонист GLP-1 представляет собой AVE0010. AVE0010 обладает последовательностью Pro36эксендин-4(1-39)-Lys6-NH2. Данное вещество опубликовано как SEQ ID No: 93 в WO 01/04156. Предпочтение также отдается фармакологически переносимым солям AVE0010.
Термин "по меньшей мере один агонист GLP-1" включает комбинации описанных здесь агонистов GLP-1, которые используются в композициях согласно изобретению, примеры представляют собой любые описанные комбинации двух или более агонистов GLP-1, выбранных из агонистов GLP-1, описанных в настоящем документе.
Далее независимо выбирают, по меньшей мере, один агонист GLP-1 предпочтительно из эксендина-4, Pro36эксендин-4(1-39)-Lys6-NH2, и Arg34,Lys26(Nε(Y-глутамил(Nα-гексадеканоил)))GLP-1(7-37) [лираглутида], и их фармакологически переносимых солей.
Композиции согласно изобретению включают агонист GLP-1 в количестве 10 мкг/мл - 20 мг/мл, предпочтительно 25 мкг/мл - 15 мг/мл. Для агонистов GLP-1, растворимых в кислых и нейтральных средах, значения составляют предпочтительно 20 мкг/мл - 300 мкг/мл, и для агонистов, растворимых в нейтральных и щелочных средах, они составляют предпочтительно 500 мкг/мл - 10 мг/мл. Для аналогов эксендина-4 предпочтительными являются 20 мкг/мл - 150 мкг/мл.
В настоящем описании термин "инсулин" включает не только немодифицированные инсулины, но также аналоги инсулина, производные инсулина и метаболиты инсулина. Композиции согласно изобретению включают один или более независимо выбранных веществ из группы, состоящей из инсулинов (например, немодифицированных инсулинов), аналогов инсулина, производных инсулина и метаболитов инсулина, и любых желаемых их комбинаций.
По меньшей мере один инсулин может быть независимо выбран из группы, включающей бычьи инсулины, их аналоги, производные и метаболиты, свиные инсулины, их аналоги, производные и метаболиты, и инсулин человека, его аналоги, производные и метаболиты. Предпочтительно, по меньшей мере, один инсулин выбирают независимо из инсулина человека, его аналогов, производных и метаболитов.
Кроме того, инсулин согласно изобретению может быть выбран независимо из немодифицированных инсулинов, более подробно, из бычьих инсулинов, свиных инсулинов и инсулинов человека.
По меньшей мере один инсулин может быть независимо выбран из группы, включающей бычьи инсулины, свиные инсулины и инсулины человека. Более предпочтительно, по меньшей мере, один инсулин независимо выбирают из инсулинов человека. Инсулин согласно изобретению может быть выбран из немодифицированных инсулинов, более подробно, из бычьих инсулинов, свиных инсулинов и инсулинов человека.
Производные инсулина согласно изобретению представляют собой производные встречающегося в природе инсулина и/или аналога инсулина, которые получают с помощью химической модификации. Химическая модификация может заключаться, например, в добавлении одной или более определенных химических групп к одной или более аминокислотам.
Аналоги инсулина, которые описаны в EP 0214826, EP 0375437, EP 0678522, EP 0885961, EP 0419504, WO 92/00321, патентных заявках Германии 102008003568.8 и 102008003566.1 и EP-A 0368187 могут быть частью композиций согласно изобретению. Документы EP 0214826, EP 0375437, EP 0678522, EP 0419504, WO 92/00321 и EP-A 0368187 включены в описание посредством ссылки.
Один предпочтительный аналог инсулина согласно изобретению может быть выбран из группы, состоящей из Gly(A21)-Arg(B31)-Arg(B32) инсулин человека (инсулин гларгин, Лантус); Arg(A0)-His(A8)-Glu(A15)-Asp(A18)-Gly(A21)-Arg(B31)-Arg(B32) амид инсулина человека, Lys(B3)-Glu(B29) инсулин человека; LysB28ProB29 инсулин человека (инсулин лиспро), B28 Asp инсулин человека (инсулин аспарт), инсулин человека, в котором пролин в положении B28 замещен на Asp, Lys, Leu, Val или Ala и где Lys в положении B29 может быть замещен на Pro; AlaB26 инсулин человека; des(B28-B30)инсулин человека; des(B27)инсулин человека или B29Lys(ε-тетрадеканоил),des(B30) инсулин человека (инсулин детемир).
Предпочтительное производное инсулина согласно изобретению может быть выбрано из группы, состоящей из B29-N-миристоил-des(B30) инсулин человека, B29-N-пальмитоил-des(B30) инсулин человека, B29-N-миристоил инсулин человека, B29-N-пальмитоил инсулин человека, B28-N-миристоил LysB28ProB29 инсулин человека, B28-N-пальмитоил-LysB28ProB29 инсулин человека, B30-N-миристоил-ThrB29LysB30 инсулин человека, B30-N-пальмитоил-ThrB29LysB30 инсулин человека, B29-N-(N-пальмитоил-Y-глутамил)-des(B30) инсулин человека, B29-N-(N-литохолил-Y-глутамил)-des(B30) инсулин человека, B29-N-(ω-карбоксигептадеканоил)-des(B30) инсулин человека и B29-N-(ε-карбоксигептадеканоил) инсулин человека.
Наиболее предпочтительное производное инсулина согласно изобретению выбирают из группы, состоящей из Gly(A21)-Arg(B31)-Arg(B32) инсулин человека, LysB28ProB29 инсулин человека (инсулин лизпро), B28 Asp инсулин человека (инсулин аспарт), B29Lys(ε-тетрадеканоил), desB30 инсулин человека (инсулин детемир).
Термин "по меньшей мере один инсулин" включает комбинации описанных здесь инсулинов, их аналогов, производных и метаболитов, которые используются в композициях согласно изобретению, например, любые желаемые комбинации двух или более выбранных из описанных здесь инсулинов, аналогов, производных и метаболитов.
Композиции согласно изобретению содержат 60-6000 нмоль/мл, предпочтительно 240-3000 нмоль/мл инсулина, как указано в настоящем документе. В зависимости от используемого инсулина, концентрация 240-3000 нмоль/мл соответствует приблизительно концентрации 1,4-35 мг/мл или 40-500 единиц/мл.
В системе “шприцы-ручки покрывают все” с использованием 2-10, предпочтительно 3-5 шприцов-ручек, композиции находятся в диапазоне от 20 мкг/мл агониста GLP-1 и от 100 Е/мл инсулина до 300 мкг/мл агониста GLP-1 и 500 Е/мл инсулина. Предпочтение отдается следующим диапазонам концентраций: 25 мкг/мл и 100 Е/мл, 33 мкг/мл и 100 Е/мл, 40 мкг/мл и 100 Е/мл, 66 мкг/мл и 100 Е/мл, и 75 мкг/мл и 100 Е/мл.
Желаемый диапазон доз инсулина представляет собой в частности дозировку с синергическим эффектом. При этом значения составляют от 5 до 100 Е, предпочтительно от 15 до 80 Е. Для агониста GLP-1 значения диапазона доз составляют 5 мкг - 2 мг, предпочтительно, 10 мкг - 1,8 мг, более предпочтительно, 10 мкг - 30 мкг.
[Уточненные подробности об использованных количествах и дозах]
Предпочтительной формой представления фармацевтических композиций настоящего изобретения являются жидкие композиции, подходящие в частности для парентерального введения, более предпочтительно, для инъекции, наиболее предпочтительно, для подкожной инъекции. В частности, фармацевтическая композиция настоящего изобретения подходит для однократной ежедневной инъекции.
Фармацевтическая композиция настоящего изобретения может характеризоваться кислым или физиологическим значением pH. Диапазон кислых значений pH соответствует предпочтительно диапазону значений pH 1-6,8, более предпочтительно pH 3,5-6,8, еще более предпочтительно, значения pH 3,5-4,5, наиболее предпочтительно, значениям pH 4,0-4,5. Физиологическое значение pH располагается предпочтительно в диапазоне значений pH 4,0-8,5, более предпочтительно, pH 5,0-8,5, еще более предпочтительно, pH 6,0-8,5.
Композиция согласно изобретению может включать подходящие консерванты. Примеры подходящих консервантов включают фенол, m-крезол, бензиловый спирт и/или эфиры п-оксибензойной кислоты.
Композиция согласно изобретению далее может включать подходящий буфер. Буферные вещества, которые могут быть использованы, в частности, для установления уровня pH между 4,0 и 8,5, включают, например, ацетат натрия, цитрат натрия, фосфат натрия и т.д. В других случаях физиологически приемлемые разбавленные кислоты (обычно HCl) или щелочи (обычно NaOH) применимы для установления уровня pH. Предпочтительные концентрации буферов и также соответствующих солей находятся в диапазоне 5-250 мМ, более предпочтительно, в диапазоне 10-100 мМ.
Композиция согласно изобретению может включать ионы цинка. Концентрация ионов цинка находится предпочтительно в диапазоне от 0 мкг/мл до 500 мкг/мл, более предпочтительно, от 5 мкг до 200 мкг цинка/мл.
Композиция согласно изобретению далее может включать подходящие изотонические агенты. Соответствующие примеры включают глицерин, декстрозу, лактозу, сорбит, маннит, глюкозу, NaCl, соединения кальция или соединения магния, такие как CaCl2 и т.д. Глицерин, декстроза, лактоза, сорбит, маннит и глюкоза представлены обычно в диапазоне 100-250 мМ, NaCl представлен в концентрации до 150 мМ.
Композиция согласно изобретению далее может включать сурфактант. Сурфактант может значительно увеличить стабильность кислых композиций инсулина. Используя сурфактант можно даже изготовить композиции, которые обеспечивают превосходную стабильность с учетом гидрофобной аггрегации ядер, на протяжении ряда месяцев, при температурном воздействии.
Сурфактант предпочтительно выбирают из группы, включающей неполные сложные эфиры и эфиры жирных кислот и простые эфиры многоатомных спиртов, таких как глицерин и сорбит, и полиолы, неполные сложные эфиры и эфиры жирных кислот и простые глицерина и сорбита выбирают из группы, состоящей из Span®, Tween®, Myrj®, Brij® и Cremophor®; и полиолы выбирают из группы полипропиленгликолей, полиэтиленгликолей, полоксамеров, полисорбатов, плуроников и тетроников. Предпочтительные концентрации сурфактантов находятся в диапазоне 5-200 мкг/мл, предпочтительно, 5-120 мкг/мл и еще предпочтительно, 20-75 мкг/мл.
Композиция согласно изобретению далее может включать другие добавки, такие как, например, соли, которые замедляют высвобождение, по меньшей мере, одного инсулина.
Один особенно предпочтительный объект согласно изобретению представляет собой лекарственное средство, как описано в настоящем документе, включающее, по меньшей мере, один инсулин, независимо выбранный из LysB28ProB29 инсулин человека (инсулин лиспро), B28 Asp инсулин человека (инсулин аспарт), B29Lys(ε-тетрадеканоил), desB30 инсулин человека (инсулин детемир), и инсулин гларгин (Gly(A21)-Arg(B31)-Arg(B32) инсулин человека), и включающее AVE0010 и/или его фармакологически переносимую соль. Другим особенно предпочтительным объектом является лекарственное средство, описанное в настоящем документе, включающее инсулин гларгин (Gly(A21)-Arg(B31)-Arg(B32) инсулин человека) и AVE0010 (des Pro36эксендин-4(1-39)-Lys6-NH2) и/или его фармакологически переносимую соль. Композиции указанных особенно предпочтительных лекарственных средств предпочтительно характеризуются кислым значением pH 1,0-6,8, более предпочтительно, значением pH 3,5-6,8, еще более предпочтительно, значением pH 3,5-5,0, наиболее предпочтительно, значение pH приблизительно 4,0-4,5. Кроме того, композиции указанных особенно предпочтительных лекарственных средств могут включать сурфактант, как описано здесь.
Другим объектом согласно изобретению является комбинация инсулина гларгин (Gly(A21)-Arg(B31)-Arg(B32) инсулин человека) и AVE0010 (des Pro36эксендин-4(1-39)-Lys6-NH2) и/или их фармакологически переносимых солей.
Изобретение далее предоставляет способ лечения пациента с помощью набора или лекарственного средства согласно изобретению, как описано здесь.
Способ согласно изобретению для лечения пациента включает введение лекарственного средства согласно изобретению, включающего, по меньшей мере, один инсулин и, по меньшей мере, один агонист GLP-1, лекарственное средство получают и/или изготавливают так, что оно содержит инсулин и агонист GLP-1, каждый в заранее определенном количестве и модет быть введено в дозе, адаптированной к индивидуальной потребности пациента.
Более подробно, способ включает введение лекарственного средства, содержащего первую фармацевтическую композицию и вторую фармацевтическую композицию, и, необязательно, по меньшей мере, одна дополнительная фармацевтическая композиция, каждая включает, по меньшей мере, один инсулин и, по меньшей мере, один агонист GLP-1, и включает, по меньшей мере, один инсулин и/или, по меньшей мере, один агонист GLP-1 в различных весовых концентрациях по отношению к общему весу композиции, указанный способ включает:
(a) выбор дозы, по меньшей мере, одного инсулина, который нужно ввести,
(b) выбор дозы, по меньшей мере, одного агониста GLP-1, который нужно ввести,
(c) выбор композиции, из первой, второй и, в соответствующих случаях, по меньшей мере, одной дополнительной композиций лекарственного средства, которые включают дозы из (a) и (b) в концентрации, такой что дозы из (a) и (b) представлены в одинаковом объеме, и
(d) определение и введение количества, которое соответствует дозам из (a) и (b).
Дозу согласно стадии (a) и/или стадии (b) определяют в зависимости от индивидуальных потребностей пациентов.
Стадия (c) способа лечения согласно изобретению может быть осуществлена на основе таблицы. Указанная таблица может быть частью лекарственного средства согласно изобретению. Пример 11 включает пример таблицы согласно изобретению.
Более подробно, способ лечения пациента может включать введение лекарственного средства, лекарственное средство включает первую фармацевтическую композицию и вторую фармацевтическую композицию, и, необязательно, по меньшей мере, одну дополнительную фармацевтическую композицию, первая фармацевтическая композиция включает, по меньшей мере, одно первое активное соединение, и вторая фармацевтическая композиция включает, по меньшей мере, одно первое активное соединение и, по меньшей мере, одно второе активное соединение, по меньшей мере, одна дополнительная фармацевтическая композиция включает, по меньшей мере, одно первое активное соединение и, по меньшей мере, одно дополнительное активное соединение, и способ включает следующие стадии:
(i) выбор дозы, по меньшей мере, одного первого активного соединения, которое нужно ввести, и определение общего количества первой, второй и, в соответствующих случаях, по меньшей мере, одной дополнительной композиции, так что выбранная доза, по меньшей мере, одного первого активного соединения представлена в общем количестве,
(ii) выбор дозы, по меньшей мере, одного второго активного соединения, которое нужно ввести, и определение количества второй композиции, так что выбранная доза, по меньшей мере, одного второго активного соединения представлена в количестве второй композиции,
(iii) в соответствующих случаях, выбор дозы, по меньшей мере, одного дополнительного активного соединения, которое нужно ввести, и определение количества, по меньшей мере, одной дополнительной композиции так, что выбранная доза, по меньшей мере, одного дополнительного активного соединения представлена в количестве, по меньшей мере, одной дополнительной композиции,
(iv) введение количества первой композиции пациенту, введенное количество соответствует общему количеству согласно стадии (i) минус количество второй композиции согласно стадии (ii), и, в соответствующих случаях, минус количество, по меньшей мере, одной дополнительной композиции согласно стадии (iii), и
(v) введение количества второй композиции, которое определили на стадии (ii), и, в соответствующих случаях, количества, по меньшей мере, одной дополнительной композиции, которое определили на стадии (iii), пациенту.
Первое активное соединение может представлять собой инсулин, и второе активное соединение может представлять собой агонист GLP-1. Таким образом, способ лечения пациента может включать, более подробно, введение лекарственного средства, лекарственное средство включает первую фармацевтическую композицию и вторую фармацевтическую композицию, и, необязательно, по меньшей мере, одну дополнительную фармацевтическую композицию, первая фармацевтическая композиция включает, по меньшей мере, один инсулин, и вторая фармацевтическая композиция включает, по меньшей мере, один инсулин и, по меньшей мере, один агонист GLP-1, и, по меньшей мере, одна дополнительная фармацевтическая композиция включает, по меньшей мере, один инсулин и, по меньшей мере, одно дополнительное активное соединение, и способ включает стадии:
(i) выбор дозы, по меньшей мере, одного инсулина, который нужно ввести, и определение общего количества первой, второй, и, в соответствующих случаях, по меньшей мере, одной дополнительной композиции, так что выбранная доза, по меньшей мере, одного инсулина представлена в общем количестве,
(ii) выбор дозы, по меньшей мере, одного агониста GLP-1, который нужно ввести, и определение количества второй композиции так, что выбранная доза, по меньшей мере, одного агониста GLP-1 представлена в количестве второй композиции,
(iii) в соответствующих случаях выбор дозы, по меньшей мере, одного другого активного соединения, которое нужно ввести, и определение количества, по меньшей мере, одной дополнительной композиции так, что выбранная доза, по меньшей мере, одного дополнительного активного соединения представлена в количестве, по меньшей мере, одной дополнительной композиции,
(iv) введение количества первой композиции пациенту, введенное количество соответствует общему количеству согласно стадии (i) минус количество второй композиции согласно стадии (ii), и в соответствующих случаях, минус количество, по меньшей мере, одной дополнительной композиции согласно стадии (iii), и
(v) введение количества второй композиции, которое определили на стадии (ii), и в соответствующих случаях, количества, по меньшей мере, одной дополнительной композиции, которое определили на стадии (iii), пациенту.
Первое активное соединение может представлять собой агонист GLP-1, и второе активное соединение может представлять собой инсулин. Таким образом, способ лечения пациента может включать, более подробно, введение лекарственного средства, лекарственное средство, содержащее первую фармацевтическую композицию, и вторую фармацевтическую композицию, и, необязательно, по меньшей мере, одну дополнительную фармацевтическую композицию, первая фармацевтическая композиция содержит, по меньшей мере, один агонист GLP-1, и вторая фармацевтическая композиция содержит, по меньшей мере, один агонист GLP-1 и, по меньшей мере, один инсулин, и, по меньшей мере, одна дополнительная фармацевтическая композиция содержит, по меньшей мере, один агонист GLP-1 и, по меньшей мере, одно дополнительное активное соединение, и способ включает стадии:
(i) выбор дозы, по меньшей мере, одного агониста GLP-1, который нужно ввести, и определение общего количества первой, второй, и, в соответствующих случаях, по меньшей мере, одной дополнительной композиции, так что выбранная доза, по меньшей мере, одного агониста GLP-1 представлена в общем количестве,
(ii) выбор дозы, по меньшей мере, одного инсулина, который нужно ввести, и определение количества второй композиции, так что выбранная доза, по меньшей мере, одного инсулина представлена в количестве второй композиции,
(iii) в соответствующих случаях выбор дозы, по меньшей мере, одного дополнительного активного соединения, которое нужно ввести, и определение количества, по меньшей мере, одной дополнительной композиции так, что выбранная доза, по меньшей мере, одного дополнительного активного соединения представлена в количестве, по меньшей мере, одной дополнительной композиции,
(iv) введение количества первой композиции пациенту, введенное количество соответствует общему количеству согласно стадии (i) минус количество второй композиции согласно стадии (ii), и, в соответствующих случаях, минус количество, по меньшей мере, одной дополнительной композиции согласно стадии (iii), и
(v) введение количества второй композиции, которое определили на стадии (ii), и, в соответствующих случаях, количества, по меньшей мере, одной дополнительной композиции, которое определили на стадии (iii), пациенту.
Стадии (i), (ii) и/или (iii) могут быть осуществлены на основе, по меньшей мере, одной таблицы, которая может быть частью лекарственного средства. Таблица может быть предоставлена для каждой из стадий (i), (ii) и (iii) независимо друг от друга.
Способ лечения согласно изобретению может быть использован, более подробно, для лечения пациентов с диабетом, более подробно, с диабетом I типа или II типа. Предпочтительно, способ используют для регулирования концентрации глюкозы в крови натощак, после приема пищи и/или после всасывания, для улучшения толерантности к глюкозе, для предупреждения гипогликемии, для предупреждения потери функции панкреатических β клеток, потери веса и/или для предупреждения увеличения веса.
Изобретение далее предоставляет способ создания лекарственного средства согласно изобретению, включающий составление и/или изготовление, так что лекарственное средство содержит инсулин и агонист GLP-1, каждый в заранее определенном количестве, и может быть введено в дозе, адаптированной к индивидуальной потребности пациента. В способе создания лекарственное средство предпочтительно получают и изготавливают так, что может быть получено одно из описанных здесь лекарственных средств согласно изобретению, как например, лекарственное средство согласно изобретению, включающее первую фармацевтическую композицию и вторую фармацевтическую композицию, и, необязательно, по меньшей мере, одну дополнительную фармацевтическую композицию, каждая из которых содержит, по меньшей мере, один инсулин и, по меньшей мере, один агонист GLP-1, и содержит, по меньшей мере, один инсулин и/или, по меньшей мере, один агонист GLP-1 в различных весовых концентрациях по отношению к общему весу композиции. Изобретение проиллюстрировано с помощью следующих фигур и примеров, которые не ограничивают изобретение каким бы то ни было образом.
Указатель для фигур
Фиг. 1: Дизайн исследования перорального теста на толерантность к глюкозе.
Фиг. 2: OGTT у собаки: эффект инсулина гларгин по сравнению с плацебо.
Фиг. 3: OGTT у собаки: эффект AVE0010 по сравнению с плацебо.
Фиг. 4: OGTT у собаки: эффект комбинации AVE0010/инсулин гларгин на уровень глюкозы в крови.
Фиг. 5: OGTT у собаки: эффект комбинации AVE0010/инсулин гларгин на уровни инсулина в плазме крови и с-пептида.
Фиг. 6: OGTT у собаки: эффект уменьшения дозы AVE0010 при различных соотношениях относительно инсулина гларгин в комбинированной препаративной форме.
Фиг. 7: Эффект комбинации AVE0010/инсулин гларгин на концентрацию глюкозы в крови у диабетических мышей линии db/db.
Фиг. 8: Эффект комбинации AVE0010/инсулин гларгин в пероральном тесте на толерантность к глюкозе у диабетических мышей линии db/db.
Фиг. 9: Эффект комбинации AVE0010/инсулин гларгин на апоптоз β-клеток, индуцированный цитокинами и липотоксическим эффектом, in vitro.
Фиг. 10: Система "3 шприца-ручки покрывают все".
ПРИМЕРЫ
Пример 1
Модель: Пероральный тест на толерантность к глюкозе (OGTT) у здоровых собак: сравнение комбинации инсулина гларгин/AVE0010 с двумя отдельными активными соединениями.
Животные
- Нормогликемические самцы собак породы бигль
- Вес тела: ~15 кг
- Количество в группе: n=6
Дизайн исследования (см. фигуру 1)
- Индивидуальные подкожные инъекции плацебо или проверяемой препаративной формы в момент времени 0
- 2 пероральных введения глюкозы, по 2 г глюкозы/кг веса тела, в моменты времени 30 мин и 5 часов
- Получают образцы крови для определения уровней глюкозы в крови, инсулина в плазме крови и с-пептида
Распределение по группам (n=6)
- Плацебо (препарат плацебо Лантус без API)
- Инсулин гларгин (0,3 МЕ/кг п/к, что соответствует 1,8 нмоль/кг). Инсулин гларгин представляет собой Gly(A21)-Arg(B31)-Arg(B32) инсулин человека.
- AVE0010 (10 мкг/кг п/к в препарате плацебо Лантус, что соответствует 2 нмоль/кг). AVE0010 представляет собой des Pro36эксендин-4(1-39)-Lys6-NH2.
- комбинация AVE0010/инсулин гларгин (10 мкг/кг AVE0010/0,3 МЕ/кг инсулина гларгин п/к)
Пример 2
OGTT у собаки: Эффект инсулина гларгин по сравнению с плацебо
Эксперимент осуществляли в соответствии с протоколом, описанным в Примере 1.
- повторный OGTT (2 г/кг п/о)
- самцы собак породы бигль, n=6
- среднее значение ±Sem
- плацебо=плацебо Лантус
- инсулин гларгин (0,3 Е/кг п/к)
Результаты. Данные представлены на фиг. 2. Однократное введение инсулина гларгин не предотвращает OGTT-индуцированного возрастания глюкозы в крови. Инсулин гларгин усиливает ожидаемое отсроченное снижение концентрации глюкозы в крови в фазу после всасывания.
Пример 3
OGTT у собаки: эффект AVE0010 по сравнению с плацебо
Эксперимент осуществляли в соответствии с протоколом, описанным в Примере 1.
- повторный OGTT (2 г/кг п/о)
- самцы собак породы бигль, n=6
- среднее значение ±Sem
- плацебо=Лантус плацебо
- AVE0010 (10 мкг/кг п/к)
Результаты. Данные представлены на фиг. 3. AVE0010 почти полностью предотвращает OGTT-индуцированное увеличение глюкозы в крови после приема пищи. Отсутствует эффект в отношении концентрации глюкозы в фазу после всасывания. Настоящий Пример показывает, что эффект AVE0010 на OGTT-индуцированное увеличение глюкозы в крови после приема пищи комплементарно снижающему глюкозу в крови эффекту инсулина гларгин в фазу после всасывания.
Пример 4
OGTT у собаки: эффект комбинации AVE0010/инсулин гларгин на уровень глюкозы в крови
Эксперимент осуществляли в соответствии с протоколом, описанным в Примере 1.
- повторный OGTT (2 г/кг п/о)
- самцы собак породы бигль, n=6
- среднее значение ±Sem
- плацебо=плацебо Лантус
- AVE0010 (10 мкг/кг п/к)
- инсулин гларгин (0,3 Е/кг п/к)
- AVE+Lan (= предварительно изготовленная смесь 10 мкг/кг AVE0010 и 0,3 Е/кг инсулина гларгин в одной препаративной форме)
Результат: Данные представлены на фиг. 4. Комбинация оказывает такое же действие на увеличение глюкозы после приема пищи, как AVE0010 (см. Пример 3). Гипогликемический эффект инсулина гларгин в фазу после всасывания является аналогичным, представленному, но ослабленным (см. Пример 2). Данный эффект является синергическим эффектом инсулина гларгин и AVE0010, поскольку только один AVE0010 не оказывает эффекта на уровень глюкозы, который опускается вновь после введения глюкозы, и отдельно инсулин гларгин не оказывает эффекта на уровень глюкозы после приема пищи.
Пример 5
OGTT у собаки: эффект комбинации AVE0010/инсулин гларгин на уровни инсулина и с-пептида в плазме крови
Эксперимент осуществляли в соответствии с протоколом, описанным в Примере 1.
- повторный OGTT (2 г/кг п/о)
- самцы собак породы бигль, n=6
- среднее значение ±Sem
- плацебо=Лантус плацебо
- AVE0010 (10 мкг/кг п/к)
- Инсулин гларгин (0,3 Е/кг п/к)
- AVE+Lan (= предварительно изготовленная смесь 10 мкг/кг AVE0010 и 0,3 Е/кг инсулина гларгин в одной препаративной форме)
С-пептид высвобождается в процессе превращения проинсулина в инсулин и служить в качестве секреции инсулина панкреатическими β-клетками. В тесте нагрузки глюкозой с-пептид может быть использован для определения способности поджелудочной железы реагировать.
Результаты. Данные представлены на фигурах 5a и 5b. В группе, получавшей комбинацию препаратов, постпрандиальное уменьшение инсулина сопровождается увеличенным уровнем инсулина гларгин после всасывания. Уровни с-пептида для комбинации соответствуют инсулиновой кривой AVE0010 во время фаз прандиального ответа инсулина, и инсулина гларгин во время фазы всасывания.
Пример 6
OGTT у собаки: эффект уменьшения дозы AVE0010 при различных соотношениях с инсулином гларгин в комбинированном препарате.
Эксперимент осуществляли в соответствии с протоколом, описанным в Примере 1.
- повторный OGTT (2 г/кг п/о)
- самцы собак породы бигль, n=11/6/6/6
- среднее значение ±Sem
- контроль=Лантус плацебо
- AVE+Lan (= предварительно изготовленная смесь 0,15 - 1,0 мкг/кг AVE0010 и 0,3 Е/кг инсулина гларгин в одной препаративной форме). В Примерах 2-5 использовали AVE0010 в концентрации 10 мкг/кг.
Результаты. Данные представлены на фиг. 6. Уменьшение дозы AVE0010 от 10 мкг/кг (см. в частности Пример 4) до 1 мкг/кг (т.е., на порядок), и результирующее увеличение соотношения инсулина гларгин и AVE0010, не оказывает эффекта на синергическую активность комбинации AVE0010 и инсулина гларгин (см. в частности Пример 4). Только при существенно меньших дозах AVE0010 эффект комбинации приближается к эффекту инсулина гларгин в чистом виде (см. в частности Фиг. 2). Таким образом, доза AVE0010 может быть изменена, по меньшей мере, в пределах одного порядка значений (т.е., по меньшей мере, на порядок) без потери синергического эффекта.
Пример 7
Модель: диабетические, инсулин-устойчивые мыши линии db/db. Сравнение комбинации инсулина гларгин/AVE0010 с двумя отдельными активными соединениями.
Животные
- Самки мышей линии db/db
- Возраст: 10-11 недель
- Количество в группе: n=10
Дизайн исследования
- Индивидуальная подкожная инъекция плацебо или проверяемой препаративной форме
- Забор образцов крови для определения глюкозы в крови
Распределение по группам
- Плацебо (= препарат Лантус плацебо без API)
- AVE0010 (10 мкг/кг п/к)
- Инсулин гларгин (5 МЕ/кг п/к)
- комбинация AVE0010/инсулин гларгин (предварительно изготовленная смесь 10 мкг/кг AVE0010 плюс 5 МЕ/кг инсулина гларгин п/к)
Пример 8
Эффект комбинации AVE0010/инсулин гларгин на уровень глюкозы в крови у диабетических мышей линии db/db
Эксперимент осуществляли в соответствии с протоколом, описанным в Примере 7.
- Самки мышей линии db/db в возрасте 10 недель
- n=10, среднее значение ±Sem
- Среда для лекарственного средства=Лантус плацебо
- AVE0010 (10 мкг/кг sc)
- Лантус (5 Е/кг sc)
- AVE0010/инсулин гларгин (= предварительно изготовленная смесь AVE0010 10 мкг/кг и инсулина гларгин 5 Е/кг в одной препаративной форме)
Результаты. Данные представлены на фиг. 7. У диабетических мышей линии db/db комбинация AVE0010/инсулин гларгин вызывала более быстрое и более выраженное снижение концентрации глюкозы в крови по сравнению с двумя отдельными активными соединениями. Следовательно, комбинация приближает диабетических мышей линии db/db ближе к нормогликемии, чем любое из двух активных соединений по отдельности.
Пример 9
Эффект комбинации AVE0010/инсулин гларгин в пероральном тесте на толерантность к глюкозе у диабетических мышей линии db/db
Эксперимент осуществляли в соответствии с протоколом, описанным в Примере 7. Дополнительно осуществляли OGTT (2 г/кг п/о при 30 мин).
- Самки мышей линии db/db в возрасте 11 недель
- n=10, среднее значение ±Sem
- Контроль=Лантус плацебо
- AVE0010 (10 мкг/кг п/к)
- Инсулин гларгин (5 Е/кг п/к)
- AVE0010/инсулин гларгин (= предварительно изготовленная смесь AVE0010, 10 мкг/кг, и инсулина гларгин, 5 Е/кг, в одной препаративной форме)
Результаты. Данные представлены на фиг. 8. Комбинация AVE0010/инсулин гларгин приводит к существенному улучшению толерантности к глюкозе и снижению уровней глюкозы после всасывания.
Пример 10
Эффект комбинации AVE0010/инсулин гларгин на апоптоз β-клеток, индуцированный цитокинами и липотоксическим эффектом in vitro
- Клеточная линия инсулиномы INS-1 крыс
- Инкубация с проверяемым соединением в течение 5 часов
- Следующая инкубация со смесью цитокинов в течение 22 часов (1 нг/мл IFN-γ+4 нг/мл IL-1β) или
- Следующая инкубация с 0,5 мМ FFA в течение 18 часов (пальмитаты:БСА 3:1)
Количественные показатели, используемые для измерения апаптоза, представляют собой активность каспазы-3 и фрагментацию клеточных ядер, которая коррелирует с апоптозом.
Результаты. Данные представлены на фиг. 9. AVE0010 или инсулин гларгин (гларгин, Glar) по отдельности предотвращают апоптоз на ~40-50%. Комбинация AVE0010 и инсулина гларгин предотвращает апоптоз значительно лучше. На основе указанного синергического эффекта, комбинация вызывает увеличение защиты от апоптоза, вызванного цитокинами и липотоксическим эффектом.
Пример 11
Система "3 шприца-ручки покрывают все" (Фиг. 10)
* 3 предварительно изготовленных шприца-ручки с 3 различными заранее установленными соотношениями:
- Смесь A: 100 Е инсулина гларгин+66,66 мкг AVE0010 на мл
- Смесь B: 100 Е инсулина гларгин+40 мкг AVE0010 на мл
- Смесь C: 100 Е инсулина гларгин+25 мкг AVE0010 на мл
* Применение 3 заранее изготовленных ручек-шприцов: таблица на фиг. 10, представляющей Пример, начинается с терапевтического диапазона 15-80 Е на дозу инсулина гларгин и 10-20 мкг AVE0010. Для конкретного пациента точно определяют или заранее подсчитывают дозу инсулина гларгин, которую нужно ввести. Заранее установленную дозу находят в колонке слева. В случае, если колонки СМЕСЬ A - СМЕСЬ C указывают соответствующую дозу AVE0010 в диапазоне между 10 и 20 мкг, соответствующую СМЕСЬ выбирают, дозируют и вводят. Диапазоны перекрываются: например, в случае, если требуется 26-30 Е инсулина гларгин, может быть выбрана СМЕСЬ A или СМЕСЬ B (с более высокой дозой AVE0010). То же самое применяется к СМЕСЯМ B и C. Если, например, предполагается доза 50 Е инсулина, то может быть принята доза 0,5 мл СМЕСИ B или СМЕСИ C. Указанная доза содержит 20 мкг (СМЕСЬ B) или 12,5 мкг (СМЕСЬ C) AVE0010.
* Заключение. При условии, что предполагаемый эффект AVE0010 получают в диапазоне между 10 мкг и 15 мкг, и терапевтический эффект получают в диапазоне между 15 мкг и 22 мкг, почти все пациенты, которые получают дозы инсулина гларгин 15-80 Е, также могут получить терапевтические дозы AVE0010 в количестве от 10 до 20 мкг, если они применяют один из трех предварительно изготовленных ручек-шприцов, которые содержат три различных соотношения инсулин гларгин: AVE0010 (Смесь A, B или C). Исходя из широкого диапазона возможных соотношений инсулина гларгин и AVE0010 (см. Пример 6) с синергическим эффектом, соотношения в ручках-шприцах могут быть заданы так, что для каждой дозы инсулина гларгин существует синергическая доза AVE0010, по меньшей мере, в одном шприце-ручке.
Пример 12
Настоящий пример показывает, как комбинация двух или более активных соединений может быть получена таким образом, что, если объединяют две или более композиции, оба активных соединения могут быть введены в любых желаемых количествах и в любых желаемых соотношениях друг к другу. Здесь принимается во внимание, что, по меньшей мере, одно из активных соединений не должно разводиться в результате объединения (например, в результате смешивания непосредственно перед введением).
В указанном примере обозначения "активное A" и "активное B" обозначают любые желаемые активные соединения. В частности, активное A представляет собой инсулин и активное B представляет собой агонист GLP-1. Активное A также может представлять собой агонист GLP-1, и активное B также может представлять собой инсулин.
1. Сравнительный пример
Для комбинированной терапии активным A (например, инсулином) и активным B (например, агонистом GLP-1), предоставляют контейнер 1 с композицией активного A в концентрации a мг/мл, и контейнер 2 с композицией активного B в концентрации b мг/мл.
Для введения комбинации двух активных соединений смешивают объем V1 мл из контейнера 1 и объем V2 мл из контейнера 2.
Для дозирования двух активных соединений в определенных концентрациях a и b, объемы V1 и V2, которые нужно ввести, выбирают в зависимости от количеств активных A и B, которые нужно ввести. Объемы V1 и V2 двух активных соединений определяют, исходя из количества активного соединения, как указано далее:
Количество активного A: V1⋅a мг
Количество активного B: V2⋅b мг
Концентрации активных A и B в смеси двух композиций определяют следующим образом.
Активное A: x мг/мл=V1⋅a/(V1+V2)
Активное B: y мг/мл=V2⋅b/(V1+V2)
V1+V2 представляют собой общий введенный объем. Данный факт означает, что два активных соединения разбавляют друг друга. Таким образом, с помощью указанной системы невозможно сохранить, например, концентрацию активного A (например, инсулина) на заранее установленном уровне в случае изменяющихся количеств активного B.
2. Пример изобретения
В указанном примере для комбинированной терапии активным A (например, инсулином) и активным B (например, агонистом GLP-1), предоставляют контейнер 1 с композицией активного A в концентрации a мг/мл, и контейнер 2 с композицией активного A в концентрации a мг/мл и активного B в концентрации b мг/мл. Концентрация активного A, следовательно, является одинаковой в обеих композициях.
Для введения комбинации двух активных соединений смешивают объем V3 мл из контейнера 1 и объем V2 мл из контейнера 2.
Для дозирования двух активных соединений в определенных концентрациях a и b, объемы V3 и V2 которые нужно ввести, выбирают в зависимости от количества активного A и активного B, которые нужно ввести. Объемы V3 и V2 двух активных соединений определяют, исходя из количества активного соединения, как указано далее:
Количество активного A: (V3⋅a+V2)⋅a (мг))
Количество активного B: V2⋅b мг
Концентрации активного A и активного B определяют, как указано ниже.
Активное A: a мг/мл=(V3⋅a+V2⋅a)/(V3+V2)
Активное B: z мг/мл=V2⋅b/(V3+V2)
V3+V2 представляет собой общий введенный объем. Из приведенных выше расчетов, очевидно, что концентрация активного A всегда равна a мг/мл, т.е., является постоянной, независимо от того, какое объемное отношение V3/V2 дозируют.
При сопоставлении сравнительного примера (см. раздел 1) с настоящим примером изобретения, ясно, что, при одинаковом дозированном количестве активных A и B, общий объем, предусмотренный в примере изобретения, является меньше.
Для определенной дозы (количества активного соединения) активного A, значение
в сравнительном примере составляет: V1⋅a мг
в примере изобретения оно составляет: (V3⋅a+V2⋅a) мг
Поскольку количество активного соединения является одинаковым в обоих случаях,
(V3⋅a+V2⋅a)=V1⋅a
(V3+V2) ⋅a=V1⋅a
и V3+V2=V1
или V3=V1-V2
Здесь объем V2, в котором вводят активное B, является одинаковым в обоих случаях.
Общий объем в сравнительном примере равен V1+V2
Общий объем в примере изобретения равен V3+V2
В соответствии с приведенным выше уравнением, для примера изобретения получаем, что:
V3+V2=V1-V2+V2=V1
Указанный объем V1 меньше, чем объем V1+V2 сравнительного примера.
В результате смешивания композиции с активными A и B с композицией с активным A, активное B разбавляется. Указанное разбавление меньше, чем разбавление активного B в сравнительном примере (т.е., концентрация b> концентрация z> концентрация y):
b>z
b>V2⋅b/(V3+V2)
b>b⋅V2/(V3+V2), где V2/(V3+V2) является <1, и
z>y
V2⋅b/(V3+V2)>V2⋅b/(V1+V2)
1/(V3+V2)>1/(V1+V2)
1/(V1-V2+V2)>1/(V1+V2)
1/V1>1/(V1+V2)
Таким образом, система дозирования согласно изобретению для введения изменяемых доз активных A (например, инсулин) и B (например, агонист GLP-1) обладает тремя преимуществами по сравнению со сравнительной системой:
- Концентрация активного A (например, инсулина) может поддерживаться постоянной на заранее установленном уровне
- В случае, если дозы активных A и B, которые нужно ввести, являются одинаковыми, общий объем, который нужно ввести, является меньше.
- Разведение активного B (например, агониста GLP-1) является меньше чем в сравнительном эксперименте. Соответственно, концентрацию активного B проще сохранить в пределах заранее определенного диапазона.
Настоящий пример может быть легко распространен на лекарственные средства с тремя или более активными соединениями, первое активное соединение представлено во всех композициях (предпочтительно в одинаковых весовых концентрациях) и присутствует, по меньшей мере, одно дополнительное активное соединение в каждой дополнительной композиции. Первая композиция может быть смешана с каждой дополнительной композицией в аналогичном соотношении, без разведения концентрации активного соединения в первой композиции.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМБИНАЦИЯ ИНСУЛИНА И АГОНИСТА GLP-1 | 2009 |
|
RU2532378C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ВКЛЮЧАЮЩАЯ АГОНИСТ GLP-1, ИНСУЛИН И МЕТИОНИН | 2010 |
|
RU2537239C2 |
| ПРЕПАРАТ ИНСУЛИНА, СОДЕРЖАЩИЙ МЕТИОНИН | 2010 |
|
RU2540485C2 |
| КОМПОЗИЦИИ ИНСУЛИНОВ ДЛИТЕЛЬНОГО ДЕЙСТВИЯ | 2011 |
|
RU2564104C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ ИНСУЛИНА С СИЛЬНО ЗАМЕДЛЕННЫМ ПРОФИЛЕМ ВРЕМЯ/ДЕЙСТВИЕ | 2009 |
|
RU2529952C2 |
| СТАБИЛИЗИРОВАННЫЕ СОЕДИНЕНИЯ ЭКСЕНДИНА-4 | 2003 |
|
RU2376314C2 |
| КОМПОЗИЦИИ ИНСУЛИНОВ ДЛИТЕЛЬНОГО ДЕЙСТВИЯ | 2015 |
|
RU2642662C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ АГОНИСТ ГПП-1 И МЕТИОНИН | 2010 |
|
RU2573995C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ МЕТАБОЛИЧЕСКОГО СИНДРОМА | 2011 |
|
RU2593960C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ ИНСУЛИНА С ЧРЕЗВЫЧАЙНО ЗАМЕДЛЕННЫМ ПРОФИЛЕМ ВРЕМЯ/ДЕЙСТВИЕ | 2009 |
|
RU2524423C2 |
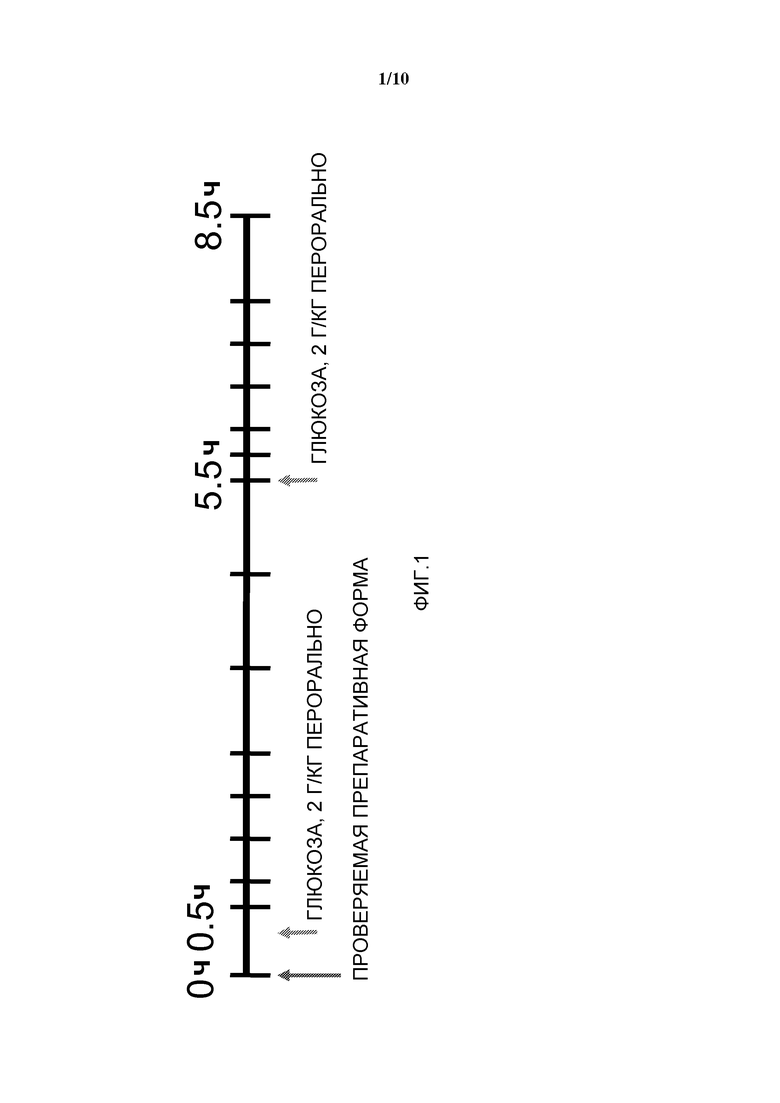
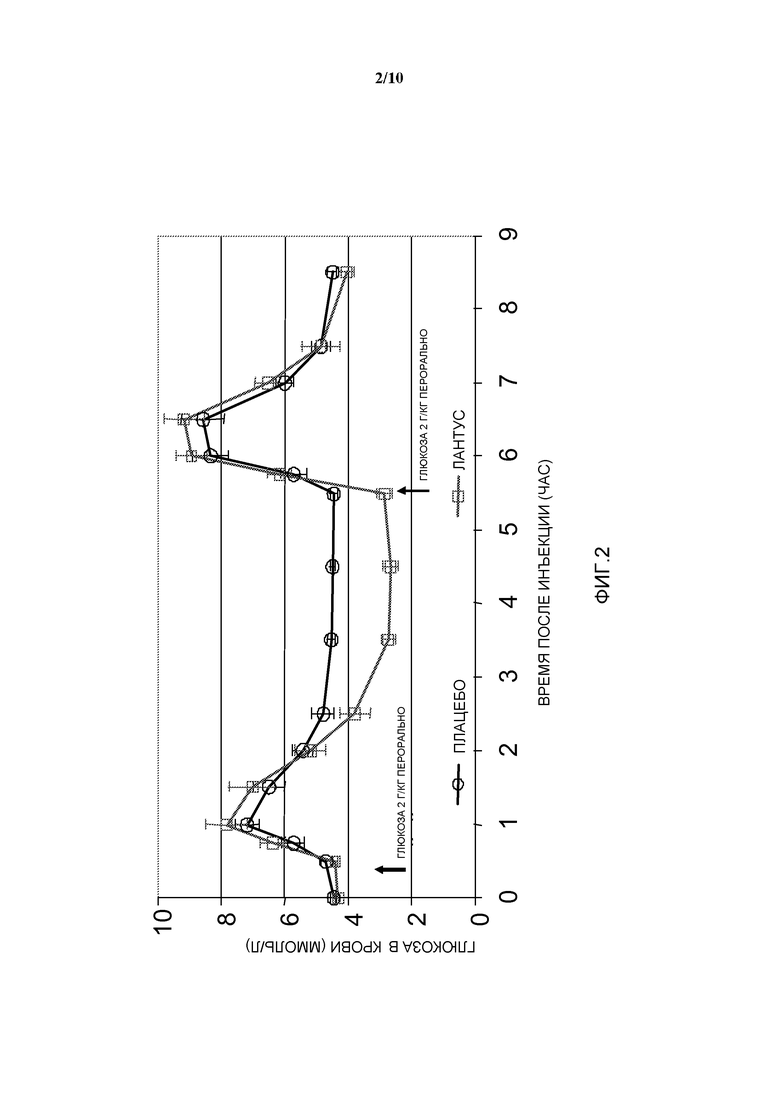
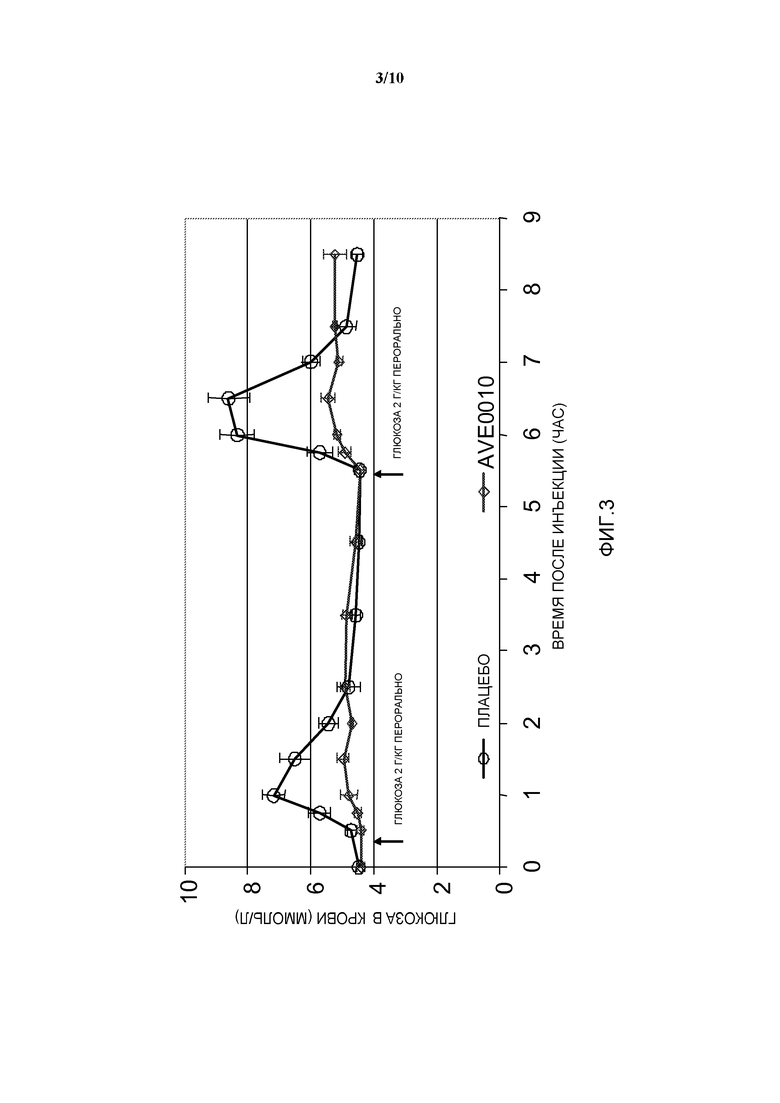
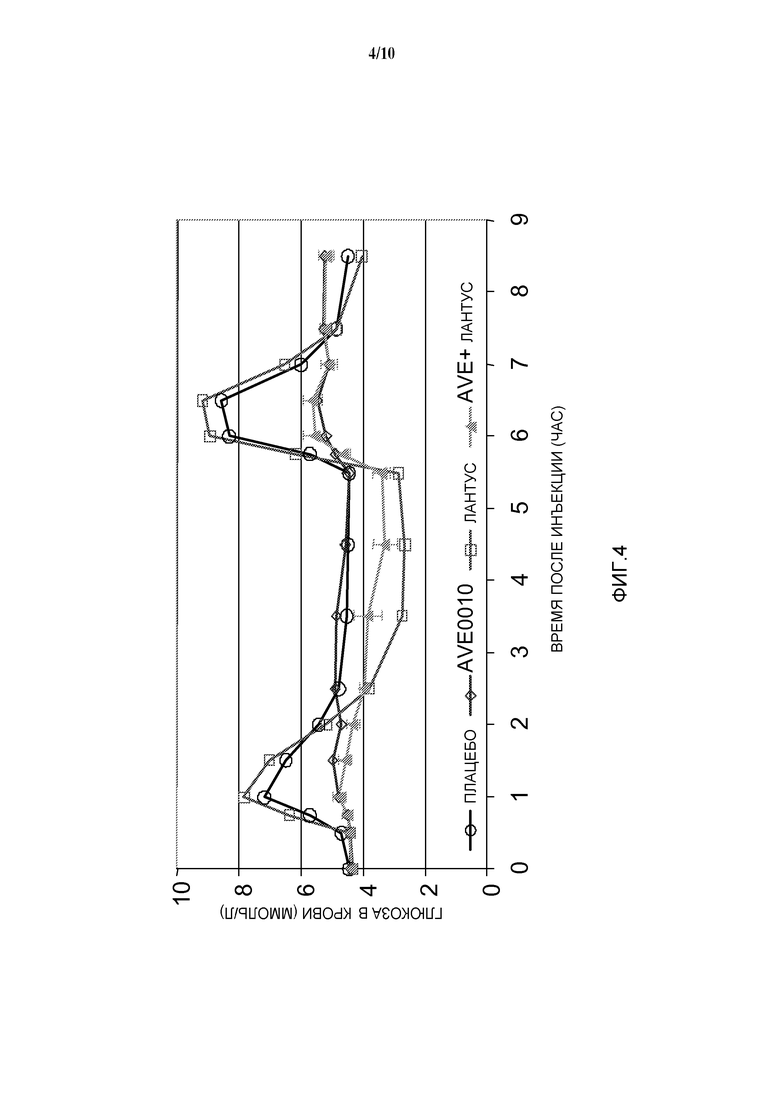
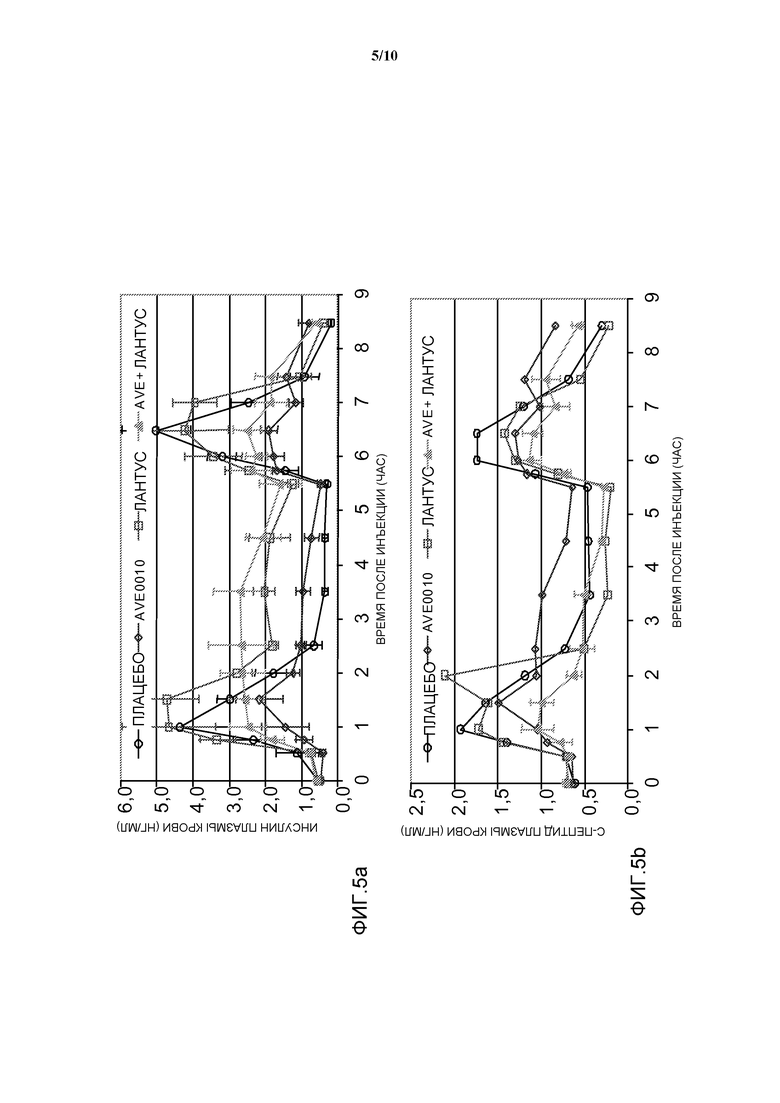
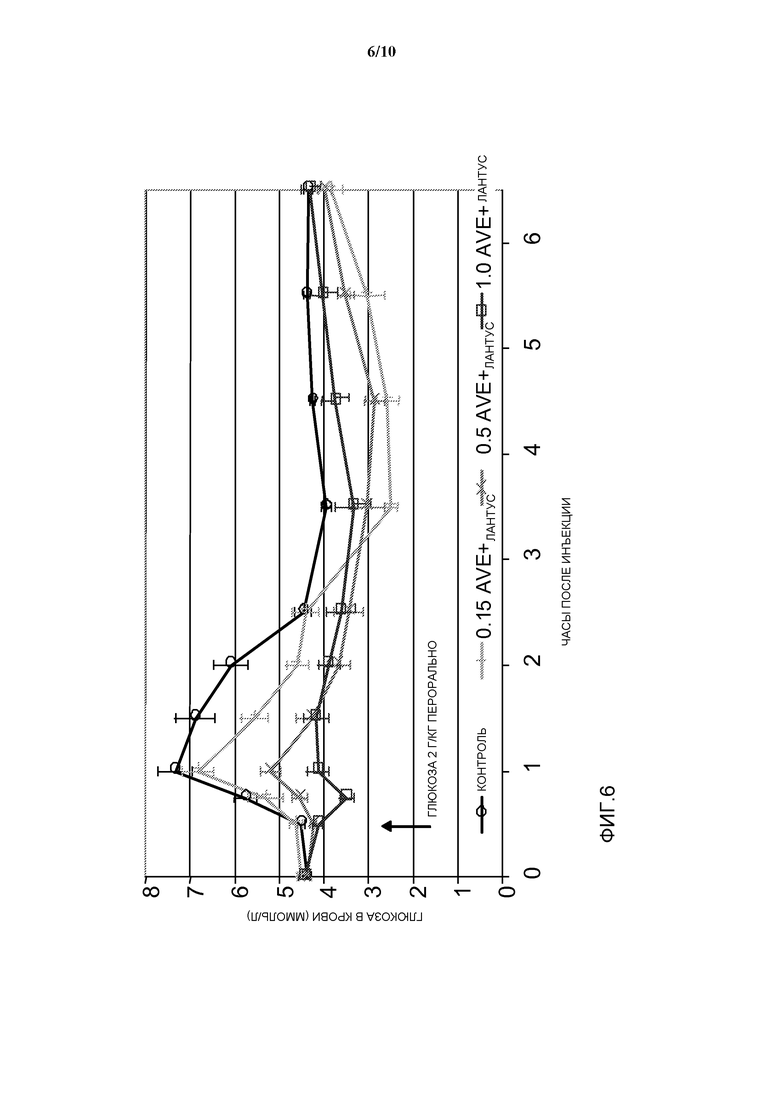
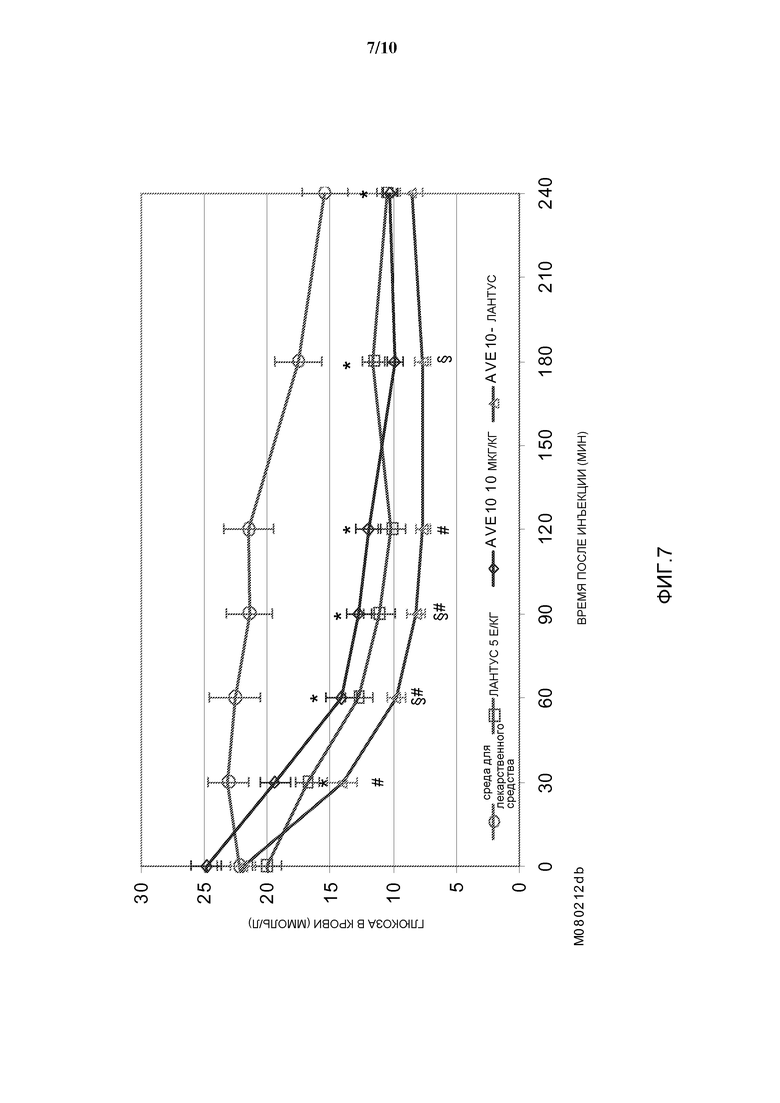
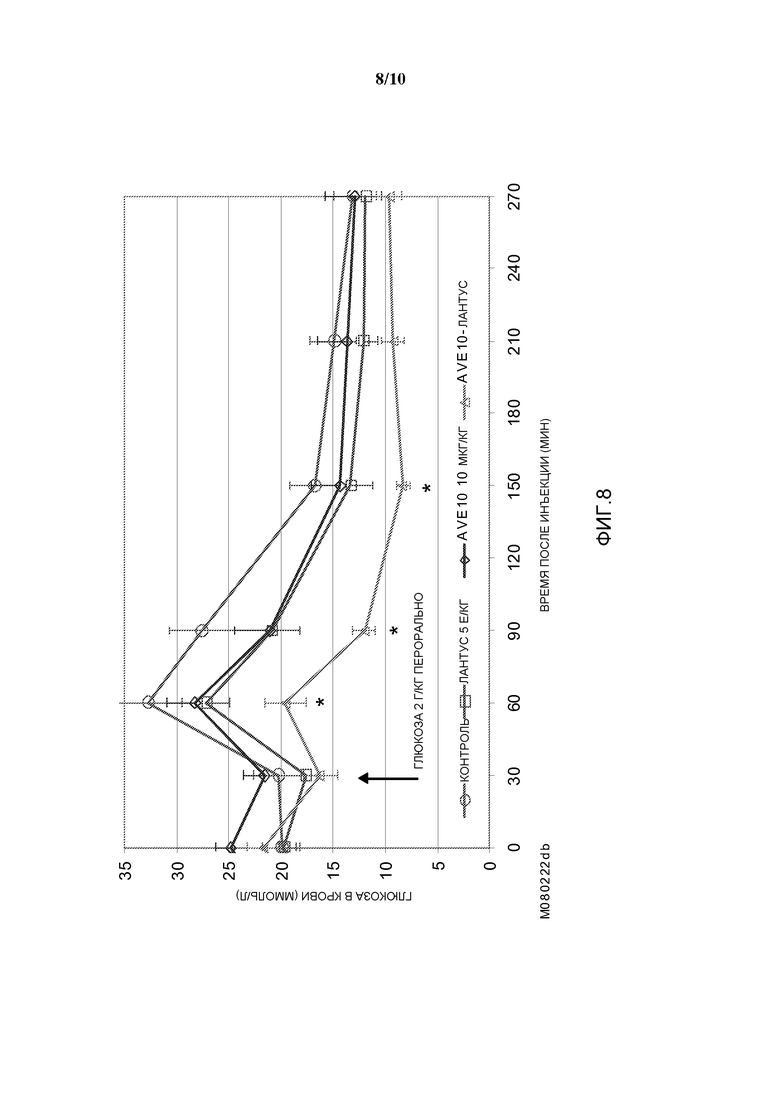
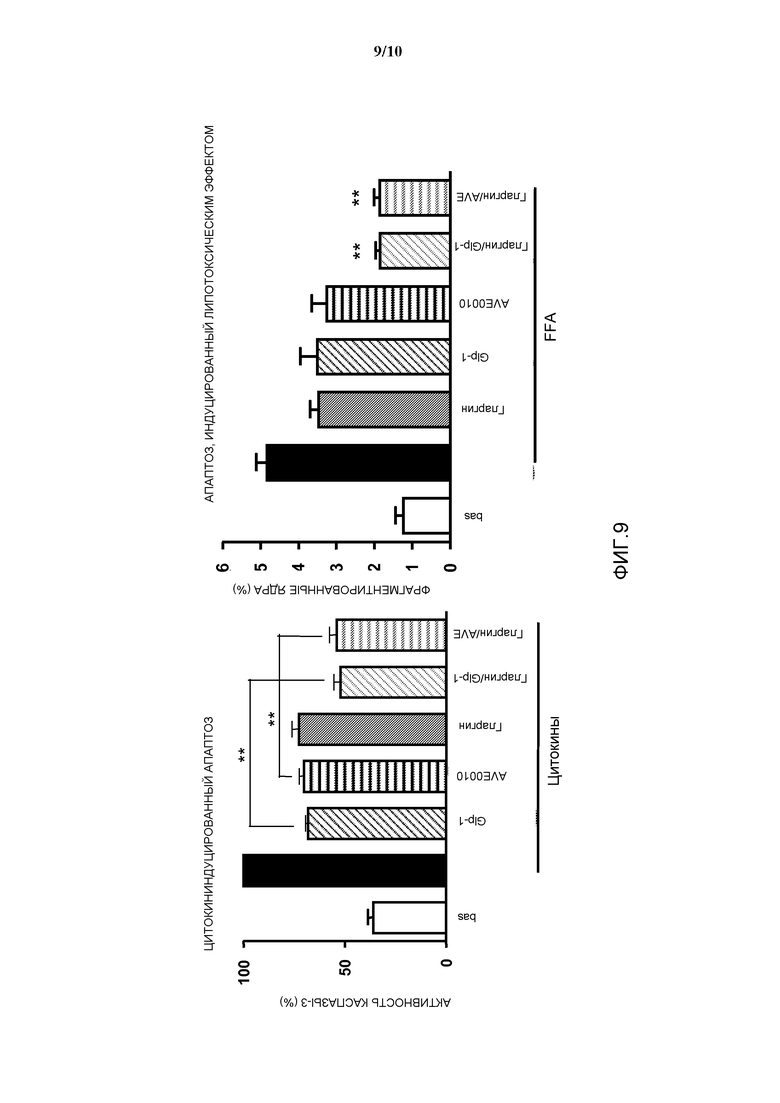
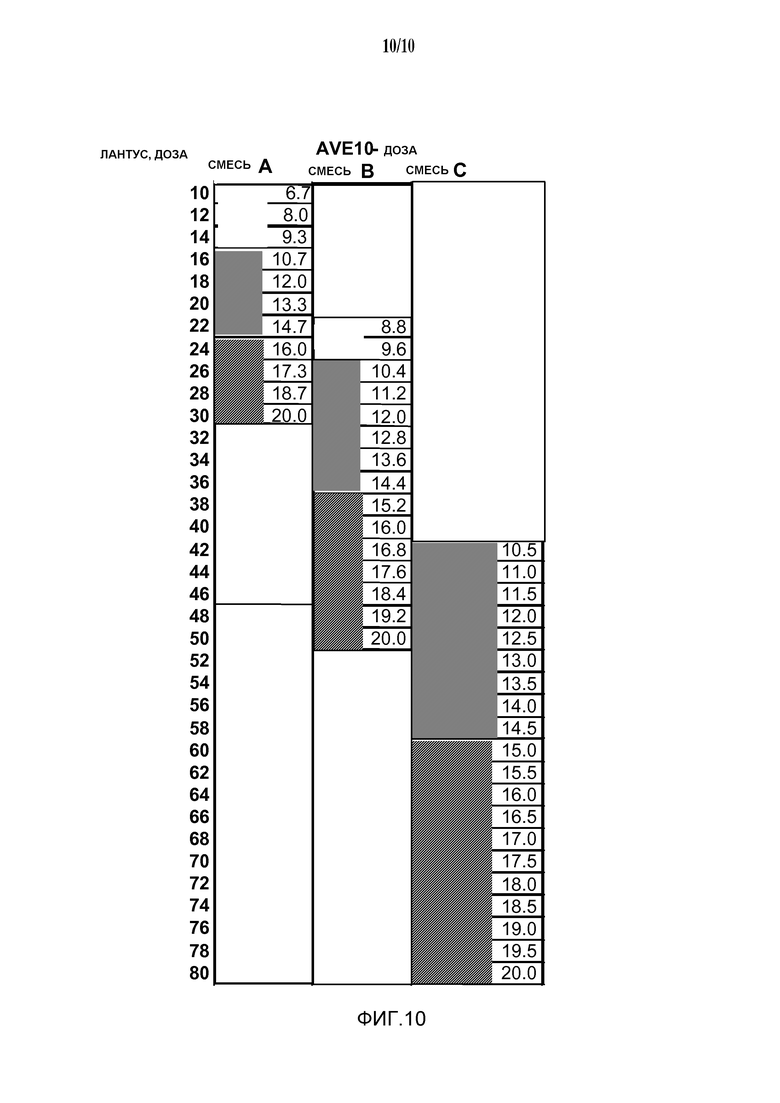
Группа изобретений относится к медицине и касается фармацевтической комбинации для лечения пациента с диабетом 1 или 2 типа, включающей (a) Gly(A21)-Arg(B31)-Arg(B32) человеческий инсулин или/и его фармацевтически переносимую соль в концентрации от 60 до 6000 нмoль/мл, и (b) desPro36Exendin-4(1-39)-Lys6NH2 или/и его фармацевтически переносимую соль в концентрации от 10 мкг/мл до 20 мг/мл. Группа изобретений также касается применения указанной фармацевтической комбинации для лечения пациента с диабетом 1 или 2 типа; набора для лечения пациента с диабетом 1 или 2 типа, содержащего указанную фармацевтическую комбинацию; фармацевтической композиции для лечения пациента с диабетом 1 или 2 типа. Группа изобретений обеспечивает синергический эффект в лечении диабета. 8 н. и 20 з.п. ф-лы, 14 пр., 10 ил.
1. Фармацевтическая комбинация для лечения пациента с диабетом 1 или 2 типа, включающая (a) Gly(A21)-Arg(B31)-Arg(B32) человеческий инсулин или/и его фармацевтически переносимую соль в концентрации от 60 до 6000 нмoль/мл, и (b) desPro36Exendin-4(1-39)-Lys6NH2 или/и его фармацевтически переносимую соль в концентрации от 10 мкг/мл до 20 мг/мл.
2. Фармацевтическая комбинация по п. 1, содержащая Gly(A21)Arg(B31)-Arg(B32) человеческий инсулин или/и его фармацевтически переносимую соль в концентрации от 40 до 500 Е/мл и desPro36Exendin-4(139)-Lys6-NH2 или/и его фармацевтически переносимую соль в концентрации от 10 до 300 мкг/мл.
3. Фармацевтическая комбинация по п. 1 или 2, включающая Gly(A21)Arg(B31)-Arg(B32) человеческий инсулин или/и его фармацевтически переносимую соль в концентрации от 100 до 500 Е/мл.
4. Фармацевтическая комбинация по любому одному из пп. 1-3, включающая Gly(A21)-Arg(B31)-Arg(B32) человеческий инсулин или/и его фармацевтически переносимую соль в концентрации 100 Е/мл.
5. Фармацевтическая комбинация по любому одному из пп. 1-4, включающая desPro36Exendin-4(1-39)-Lys6-NH2 или/и его фармацевтически переносимую соль в концентрации от 20 до 150 мкг/мл.
6. Фармацевтическая комбинация по п. 1, содержащая (a) Gly(A21)Arg(B31)-Arg(B32) человеческий инсулин или/и его фармацевтически переносимую соль в концентрации от 100 до 500 Е/мл, и (b) desPro36Exendin4(1-39)-Lys6-NH2 или/и его фармацевтически переносимую соль в концентрации от 20 до 150 мкг/мл.
7. Фармацевтическая комбинация по п. 1, содержащая (a) Gly(A21)Arg(B31)-Arg(B32) человеческий инсулин или/и его фармацевтически переносимую соль в концентрации от 100 Е/мл, и (b) desPro36Exendin-4(1-39)Lys6-NH2 или/и его фармацевтически переносимую соль в концентрации от 20 до 150 мкг/мл.
8. Применение фармацевтической комбинации по любому из пп. 1-7, для лечения пациента с диабетом 1 или 2 типа.
9. Применение фармацевтической комбинации по любому из пп. 1-7, для изготовления медицинского продукта для лечения пациента с диабетом 1 или 2 типа.
10. Набор для лечения пациента с диабетом 1 или 2 типа, содержащий фармацевтическую комбинацию по любому из пп. 1-7 и шприцы, стеклянные ампулы и/или шприцы-ручки для заполнения фармацевтической комбинацией по любому из пп. 1-7.
11. Фармацевтическая композиция для лечения пациента с диабетом 1 или 2 типа, содержащая (a) Gly(A21)-Arg(B31)-Arg(B32) человеческий инсулин или/и его фармацевтически переносимую соль в концентрации от 60 до 6000 нмоль/мл, и (b) desPro36Exendin-4(1-39)-Lys6NH2 или/и его фармацевтически переносимую соль в концентрации от 10 мкг/мл до 20 мг/мл.
12. Фармацевтическая композиция по п. 11, включающая Gly(A21)-Arg(B31)Arg(B32) человеческий инсулин или/и его фармацевтически переносимую соль в концентрации от 40 до 500 Е/мл, и desPro36Exendin-4(1-39)-Lys6-NH2 или/и его фармацевтически переносимую соль в концентрации от 10 до 300 мкг/мл.
13. Фармацевтическая композиция по п. 11 или 12, включающая Gly(A21)Arg(B31)-Arg(B32) человеческий инсулин или/и его фармацевтически переносимую соль в концентрации от 100 до 500 Е/мл.
14. Фармацевтическая композиция по любому одному из пп. 11-13, включающая Gly(A21)-Arg(B31)-Arg(B32) человеческий инсулин или/и его фармацевтически переносимую соль в концентрации 100 Е/мл.
15. Фармацевтическая композиция по любому одному из пп. 11-14, включающая desPro36Exendin-4(1-39)-Lys6-NH2 или/и его фармацевтически переносимую соль в концентрации от 20 до 150 мкг/мл.
16. Фармацевтическая композиция по п. 11, включающая (a) Gly(A21)Arg(B31)-Arg(B32) человеческий инсулин или/и его фармацевтически переносимую соль в концентрации от 100 до 500 Е/мл, и (b) desPro36Exendin4(1-39)-Lys6-NH2 или/и его фармацевтически переносимую соль в концентрации от 20 до 150 мкг/мл.
17. Фармацевтическая композиция по п. 11, включающая (a) Gly(A21)Arg(B31)-Arg(B32) человеческий инсулин или/и его фармацевтически переносимую соль в концентрации 100 Е/мл, и (b) desPro36Exendin-4(1-39)Lys6-NH2 или/и его фармацевтически переносимую соль в концентрации от 20 до 150 мкг/мл.
18. Фармацевтическая композиция по любому одному из пп. 11-17, которая является жидкой композицией.
19. Фармацевтическая композиция по любому одному из пп. 11-18, где указанная композиция включает по меньшей мере один компонент, выбранный из цинка, фармацевтически приемлемых консервантов, фармацевтически приемлемых буферов, и фармацевтически приемлемых агентов изотоничности.
20. Фармацевтическая композиция по п. 19, где фармацевтически приемлемый консервант выбран из фенола, м-крезола, бензилового спирта и эфиров п-оксибензойной кислоты.
21. Фармацевтическая композиция по п. 19 или 20, где консервантом является м-крезол.
22. Фармацевтическая композиция по любому одному из пп. 19-21, где фармацевтически приемлемый агент изотоничности выбран из глицерина, декстрозы, лактозы, сорбита, маннита, глюкозы NaCl и CaCl2.
23. Фармацевтическая композиция по любому одному из пп. 19-22, где фармацевтически приемлемым агентом изотоничности является глицерин.
24. Фармацевтическая композиция по любому одному из пп. 19-23, включающая цинк в концентрации от 5 мкг/мл до 200 мкг/мл.
25. Фармацевтическая композиция по любому одному из пп. 11-24, для применения для лечения пациента с диабетом 1 или 2 типа.
26. Применение фармацевтической композиции по любому одному из пп. 11-24 для изготовления медицинского продукта для лечения пациента с диабетом 1 или 2 типа.
27. Набор для лечения пациента с диабетом 1 или 2 типа, включающий фармацевтическую композицию по любому из пп. 11-24 и шприцы, стеклянные ампулы и/или шприцы-ручки для заполнения фармацевтической композицией по любому из пп. 11-24.
28. Способ получения композиции по любому из пп. 11-25, включающий составление и изготовление композиции.
| WO 2004005342 A1, 15.01.2004 | |||
| US 20040186046 A1, 23.09.2004 | |||
| TEWS D | |||
| et al., Enhanced protection against cytokine- and fatty acid-induced apoptosis in pancreatic beta cells by combined treatment with glucagon-like peptide-1 receptor agonists and insulin analogues | |||
| Horm Metab Res | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Самоходная косилка для лесных трав | 1954 |
|
SU102039A1 |
| PI-SUNYER FX | |||
| et al., The effects of pharmacologic agents for type 2 diabetes mellitus on body weight | |||
| Postgrad Med | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| WEYER C | |||
| et al., Long-term changes in insulin action and insulin secretion associated with gain, loss, regain and maintenance of body weight | |||
| Diabetologia | |||
| ЩИТОВОЙ ДЛЯ ВОДОЕМОВ ЗАТВОР | 1922 |
|
SU2000A1 |
Авторы
Даты
2019-03-20—Публикация
2014-08-06—Подача