Изобретение относится к водной токсикологии и предназначено для оценки токсичности жидкостей-загрязнителей в водных объектах.
Известен способ оценки токсичности жидкости, предусматривающий культивирование одноклеточных водорослей в контакте с этой жидкостью, как тест-объекта, их освещение и определение флуоресцентных характеристик, по изменению которых судят о токсичности контролируемой жидкости (см. SU №462805, МПК G01N 33/18, 1975).
Недостаток этого решения - недостаточная точность оценки анализа и его низкая оперативность.
Известен также способ оценки токсичности жидкости, предусматривающий культивирование одноклеточных водорослей в контакте с этой жидкостью, как тест-объекта, их освещение и определение флуоресцентных характеристик, по изменению которых судят о токсичности контролируемой жидкости (см. SU №1515105, МПК G01N 33/18, 1989). В качестве тест-объекта используют культуру Chlorella vulgaris, штамм S-39/64688. При этом в качестве признака позволяющего оценить токсичность контролируемой жидкости используют интенсивность люминесценции тест-объекта в различных световых состояниях. Фактически, косвенным образом оценивают выживаемость тест-объекта.
Недостаток этого решения слабая доступность данного штамма в регионах, удаленных от депозитария штаммов и отсутствие его в водах региональных бассейнов. Невозможность быстрого наращивания его биомассы в целях практического применения. Кроме того, достоверность результатов измерений недостаточно велика, в связи с использованием косвенных методов оценки выживаемости тест-объекта при воздействии жидкости, токсичность которой оценивают. Кроме того, способ не позволяет использовать современные средства измерений. Все это снижает адекватность оценки токсичности жидкости, из-за недостаточной ее оперативности и точности.
Задача изобретения - повышение адекватности оценки токсичности жидкости, ее оперативности и точности.
Технический результат, получаемый при решении поставленной задачи, выражается в том, что обеспечивается возможность использования современного измерительного прибора - проточного цитофлюориметра, при этом в качестве тест-объектов предлагаются к использованию микроводоросли, обеспечивающие: простоту культивирования и содержания в лабораторных условиях; возможность быстрого наращивания биомассы культур; имеющие высокую чувствительность к действию токсикантов и доступность (они широко распространены в морских акваториях Дальневосточного региона).
Для достижения поставленного технического результата, способ оценки токсичности жидкости, предусматривающий культивирование одноклеточных водорослей в контакте с этой жидкостью, как тест-объекта, их освещение и определение флуоресцентных характеристик, по изменению которых судят о токсичности контролируемой жидкости, отличается тем, что как тест-объект используют водоросли Attheya ussuriensis или Porphyridium purpureum или Chaetoceros muelleri или Heterosigma akashiwo, при этом подсчитывают количество живых водорослей через 24 часа, 96 часов и 7 дней, причем каждую водоросль регистрируют проточным цитофлюориметром, как объект, имеющий автофолюоресценцию по хлорофиллу а, для чего освещают водоросли лазером с длиной волны 488 нм, а их эмиссию фиксируют фильтром эмиссии с длиной волны 690 нм, причем из общего числа водорослей исключают мертвые, для чего тест-объект еще до подсчета количества водорослей окрашивают витальным красителем Propidium Iodide и выявляют водоросли имеющие флюоресценцию при освещении лазером с длиной волны 488 нм, а их эмиссию фиксируют фильтром эмиссии с длиной волны 610 нм, токсичность контролируемой жидкости рассчитывают статистически
Сопоставительный анализ признаков заявленного решения с признаками прототипа и аналогов свидетельствует о соответствии заявленного решения критерию «новизна».
При этом совокупность признаков отличительной части формулы изобретения обеспечивают повышение адекватности оценки токсичности жидкости, ее оперативности и точности, причем отличительные признаки отличительной части формулы изобретения обеспечивают решение нижеследующего комплекса функциональных задач:
Признаки «…как тест-объект используют водоросли Attheya ussuriensis или Porphyridium purpureum или Chaetoceros muelleri или Heterosigma akashiwo…» обеспечивают простоту культивирования и содержания тест-объектов в лабораторных условиях, возможность быстрого наращивания их биомассы при высокой чувствительности к действию токсикантов и их доступность (они широко распространены в морских акваториях Дальневосточного региона).
Признаки указывающие, что «подсчитывают количество живых водорослей через 24 часа, 96 часов и 7 дней» позволяют оценить динамику процесса воздействия токсичного материала.
Признаки указывающие, что «каждую водоросль регистрируют проточным цитофлюориметром, как объект, имеющий автофолюоресценцию по хлорофиллу а» обеспечивают надежный и оперативный подсчет общего количества водорослей в том числе количества живых и мертвых водорослей.
Признаки указывающие, что для регистрации водоросли проточным цитофлюориметром, «освещают водоросли лазером с длиной волны 488 нм (одним из нескольких лазеров проточного цитофлюориметра), а их эмиссию (эмиссию водорослей) фиксируют фильтром эмиссии (элементом проточного цитофлюориметра) с длиной волны 690 нм» обеспечивают работу проточного цитофлюориметра в диапазоне, в котором имеет место максимально интенсивное свечение хлорофилл а.
Признаки указывающие, что «из общего числа водорослей исключают мертвые, для чего тест-объект еще до подсчета количества водорослей окрашивают витальным красителем Propidium Iodide» обеспечивают окраску только мертвых водорослей и их свечение в ином диапазоне (соответствующем этому красителю), по сравнению с живыми.
Признаки указывающие, что «выявляют водоросли имеющие флюоресценцию при освещении лазером с длиной волны 488 нм, а их эмиссию фиксируют фильтром эмиссии с длиной волны 610 нм» обеспечивают работу проточного цитофлюориметра в диапазоне, в котором имеет место максимально интенсивное свечение красителя, попадающего в клетки погибших водорослей через их разрушенные (в результате токсического воздействия тестируемой жидкости) оболочки. При этом в живые водоросли краситель не попадает.
Признаки указывающие, что «уровень токсичности (LC50) рассчитывают статистически», позволяют по результатам замеров проточным цитофлюориметром определить уровень токсичности жидкости.
Признаки указывающие, что «токсичность контролируемой жидкости рассчитывают статистически», позволяют по результатам замеров проточным цитофлюориметром определить токсичность жидкости.
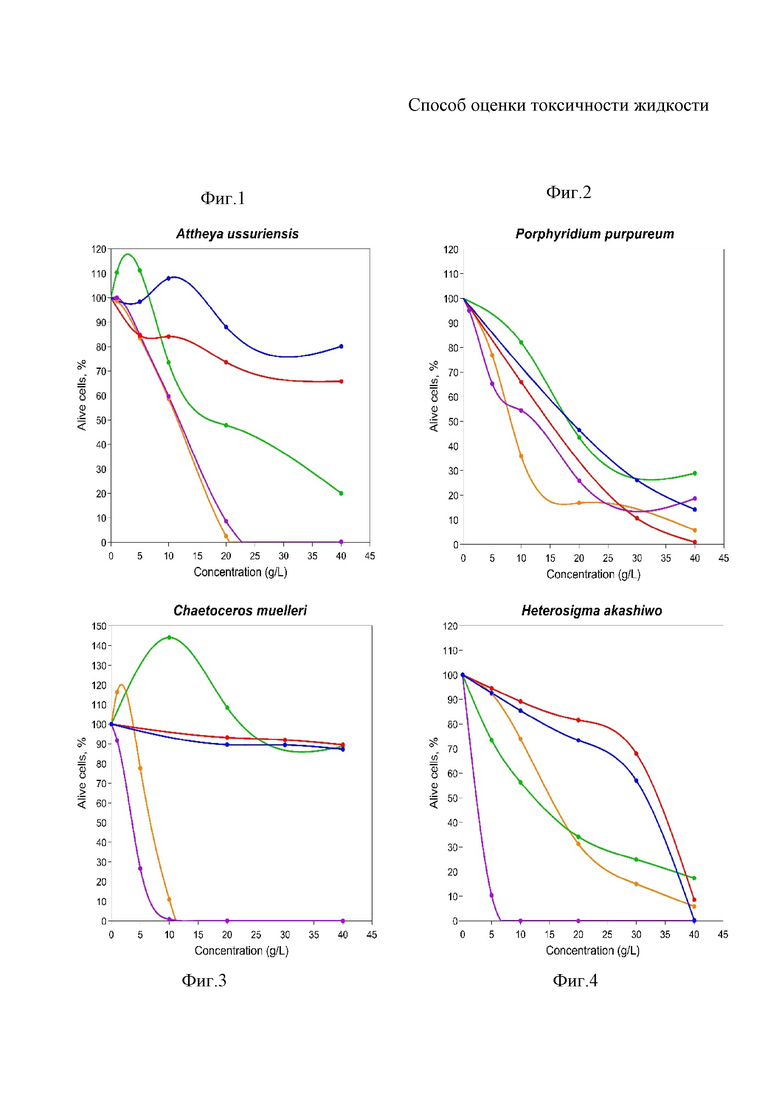
На фиг. 1 показаны графики смертности микроводоросли Attheya ussuriensis при тестировании гексана (синий), метанола (красный), дизельного топлива В0 (зеленый), биодизеля В100 (фиолетовый), смеси дизель-биодизель В20 (оранжевый) на острую токсичность (96 часов); На фиг. 2 показаны графики смертности микроводоросли Porphyridium purpureum при тестировании гексана (синий), метанола (красный), дизельного топлива В0 (зеленый), биодизеля В100 (фиолетовый), смеси дизель-биодизель В20 (оранжевый) на острую токсичность (96 часов); На фиг. 3 показаны графики смертности микроводоросли Chaetoceros muelleri при тестировании гексана (синий), метанола (красный), дизельного топлива В0 (зеленый), биодизеля В100 (фиолетовый), смеси дизель-биодизель В20 (оранжевый) на острую токсичность (96 часов); На фиг. 4 показаны графики смертности микроводоросли Heterosigma akashiwo при тестировании гексана (синий), метанола (красный), дизельного топлива В0 (зеленый), биодизеля В100 (фиолетовый), смеси дизель-биодизель В20 (оранжевый) на острую токсичность (96 часов).
Определена чувствительность выбранных культур микроводорослей к действию стандартного токсиканта бихромата калия K2Cr2O7, в таблице 1 приведены результаты исследований. Оценку чувствительности проводили по изменению численности клеток микроводорослей в контрольной и опытной пробе. Экспозиция клеток проводилась в 24-луночных планшетах, в климатстате при 20°С с циклом освещенности 12:12 (свет : темнота). Биоиспытания проводились при концентрациях K2Cr2O7 1, 2, 4, 8, 16, 32 мг/л. Для каждой концентрации и группы контроля (без токсиканта) эксперимент был проведен в 4 повторностях. Объем аликвоты микроводорослей в каждой повторности был 1,5 мл. Подсчет количества живых клеток осуществлялся с помощью проточного цитофлюориметра CytoFLEX (Beckman Coulter, USA) и программного обеспечения CytExpert v.2.0 через 96 часов (острая токсичность) и через 7 дней (хроническая токсичность). Жизнеспособность клеток оценивалась за счет окраски витальным красителем Propidium Iodide. Гейтирование (определение границ разделения клеток на графиках по данным интенсивности флюоресценции и светорассеянья) проводилось за счет определения клеток, имеющих автофлюоресценцию по хлорофиллу a (light source - laser 488 nm, emission filter - PC5.5, 690 nm) на точечной диаграмме FSC/PC5.5 и исключения из этого диапазона мертвых клеток, имеющих флюоресценцию по PI (light source - laser 488 nm, emission filter - ECD, 610 nm) на точечной диаграмме FSC/ECD. Расчет LC50 выполнен с помощью GraphPad Prism 7.04.
Таблица 1
Оценка чувствительности тест-объектов к действию бихромата калия
Способ осуществляется следующим образом:
Микроводоросли культивируются в фильтрованной (фильтр с размером пор 0,22 мкм), стерилизованной морской воде в колбах Эрленмейера при температуре 20°C, солености 33%, с циклом освещенности 12:12. Используется питательная среда f/2. Для эксперимента отбираются водоросли в экспоненциальной фазе роста, через 7-10 дней с момента последнего пересева.
В 24 луночный пластиковый планшет раскапывается по 1,5 мл водорослей и добавляется исследуемый образец в концентрациях 0,01-120 мл/л. Для каждой концентрации и группы контроля эксперимент проводится в 4 повторениях.
Подсчет количества живых клеток осуществляется через 24 часа, 96 часов, 7 дней с помощью проточного цитофлюориметра. Отделение мертвых клеток осуществляется за счет окрашивания витальным красителем Propidium Iodide (PI). Гейтирование проводилось за счет определения клеток, имеющих автофлюоресценцию по хлорофиллу a (источник света - лазер 488 нм, фильтр эмиссии - 690 нм) на точечной диаграмме и исключения из этого диапазона мертвых клеток, имеющих флюоресценцию по PI источник света - лазер 488 нм, фильтр эмиссии - 610 нм).
Основным показателем, с помощью которого оценивают уровень токсичности добавленных в среду образцов, является численность клеток водорослей. По результатам экспериментов составляют таблицу численности клеток во всех вариантах эксперимента в абсолютных единицах, а также значений численности клеток водорослей, выраженных в относительных единицах (% относительно контроля). Расчет уровня токсичности (LC50) выполняется статистически с помощью GraphPad Prism 7.04 используя t - критерий Стьюдента при сравнении параметра численности при уровне значимости р<0.05.
Результаты реализации способа приведены в таблице 2.
Оценивали уровень токсичности биодизеля, полученного из использованных фритюрных масел (B100) и смеси данного биодизеля с дизельным топливом в соотношении 20% биодизеля, 80% дизельного топлива и сравнивали уровень токсичности с чистым дизельным топливом, гексаном и метанолом.
Таблица 2
Сравнительная оценка уровня токсичности различных жидкостей
Анализы на микроводорослях в рамках заявленного способа дают статистическое преимущество перед многими тест-объектами, так как можно легко использовать большее количество клеток, требуются намного меньшие объемы проб и время тестирования, содержание запасных культур, вследствие их редкого пересевания и низкой требовательности к условиям культивирования, не требует больших затрат труда и средств. Процесс тестирования легко автоматизировать.
По результатам экспериментов для микроводорослей Attheya ussuriensis, Chaetoceros muelleri и Heterosigma akashiwo максимальный уровень токсичности показал образец чистого биодизеля B100. Для красной водоросли Porphyridium purpureum более токсичным оказался образец diesel-biodiesel blend B20.
Porphyridium purpureum как самый чувствительный из тестируемых видов по бихромату калия, гексану и метанолу, оказался самым устойчивым для B100 и B20. Кроме этого, Porphyridium purpureum и Heterosigma akashiwo показали способность к адаптации к присутствию тестируемых загрязнителей. Так для Porphyridium purpureum наблюдается увеличение LC50 для гексана и метанола на 7 дней экспозиции (хроническая токсичность) в сравнении с измерением на 96 часов (острая токсичность), а для B20 и B100 наблюдается увеличение LC50 с 24 часов на 96 часов, затем к 7 дню эксперимента проявляется хроническая токсичность и LC50 снижается. Heterosigma akashiwo в ходе эксперимента адаптируется только к B20, показывая увеличение LC50 с 24 часов на 96 часов и резкое снижение LC50 на 7 сутки. Для диатомовых водорослей Chaetoceros muelleri и Attheya ussuriensis уровень токсичности увеличивался прямо пропорционально с увеличением времени экспозиции клеток с тестируемыми веществами. Для Attheya ussuriensis B20 и B100 проявляют максимальный уровень хронической токсичности.
Тренд чувствительности используемых видов микроводорослей, предварительно определенный с помощью бихромата калия (от более чувствительного к менее чувствительному) полностью совпадает для гексана, метанола и дизельного топлива B0: Porphyridium purpureum > Heterosigma akashiwo > Attheya ussuriensis > Chaetoceros muelleri. Однако, биодизель B100 оказался напротив более токсичными для Heterosigma akashiwo и Chaetoceros muelleri и наименее токсичен для Porphyridium purpureum. Тренд чувствительности для образца B100 представлен следующим образом: Heterosigma akashiwo > Chaetoceros muelleri > Attheya ussuriensis > Porphyridium purpureum.
Уровень токсичность образца B20 во многом подобен B100. Заметное отличие наблюдается для Heterosigma akashiwo, где клетки микроводоросли показали значительно большую устойчивость к B20 по сравнению с чистым биодизелем B100.
Примечательно то, что во всех случаях уровень токсичности образцов, содержащих биодизель из отходов пищевых масел, заметно превосходит токсичность чистых гексана, метанола и дизельного топлива, что свидетельствует о низком качестве очистки исходного сырья и высокой опасности полученного биотоплива для морских гидробионтов.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ФИКОЭРИТРИНА ИЗ КРАСНОЙ МИКРОВОДОРОСЛИ | 2014 |
|
RU2548111C1 |
| СПОСОБ ПОДГОТОВКИ КОРМОВ ИЗ МИКРОВОДОРОСЛЕЙ ДЛЯ ЛИЧИНОК ДАЛЬНЕВОСТОЧНОГО ТРЕПАНГА | 2014 |
|
RU2566672C1 |
| Способ выращивания микроводоросли Porphyridium purpureum | 2016 |
|
RU2675318C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ЦИТОПРОТЕКТИВНОГО ЭФФЕКТА ИММУНОГЛОБУЛИНОВ ДЛЯ ВНУТРИВЕННОГО ВВЕДЕНИЯ ПРИ ТЕРАПИИ ЖЕНЩИН С ПРИВЫЧНЫМ НЕВЫНАШИВАНИЕМ БЕРЕМЕННОСТИ И ДИАГНОСТИРОВАННЫМ АНТИФОСФОЛИПИДНЫМ СИНДРОМОМ | 2014 |
|
RU2548754C1 |
| Штамм одноклеточной микроводоросли Eustigmatos magnus - продуцент эйкозапентаеновой кислоты | 2017 |
|
RU2661116C1 |
| Недеструктивный способ оценки цитотоксичности наночастиц с использованием микроводоросли Dunaliella salina в качестве биосенсора | 2018 |
|
RU2692675C1 |
| СПОСОБ ОЦЕНКИ ТОКСИЧНОСТИ КОМПОНЕНТОВ СРЕДЫ АЗОВСКОГО И ЧЕРНОГО МОРЕЙ | 2013 |
|
RU2519070C1 |
| Способ оценки токсичности жидкости | 1987 |
|
SU1515105A1 |
| КРИСТАЛЛООБРАЗУЮЩИЙ ШТАММ БАКТЕРИЙ BREVIBACILLUS LATEROSPORUS С ШИРОКИМ СПЕКТРОМ АНТАГОНИСТИЧЕСКОЙ АКТИВНОСТИ И ЕГО ПРИМЕНЕНИЕ | 2018 |
|
RU2701502C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ВЛИЯНИЯ ТОКСИЧНОСТИ СТОЧНЫХ ВОД НА ВОДНЫЕ СОЛЕНЫЕ СРЕДЫ | 2014 |
|
RU2541457C1 |
Изобретение относится к экологии и может быть использовано для оценки токсичности жидкостей-загрязнителей в водных объектах. Для этого культивируют одноклеточные водоросли в контакте с тестируемой жидкостью и освещают смесь лазером. Затем определяют флуоресцентные характеристики контролируемой жидкости, по изменению которых судят о токсичности загрязнителей. В качестве тест-объекта используют водоросли Attheya ussuriensis, или Porphyridium purpureum, или Chaetoceros muelleri, или Heterosigma akashiwo. Каждый образец анализирует на проточном цитофлуориметре через 24 часа, 96 часов и 7 дней как объект, имеющий автофлуоресценцию по хлорофиллу a. Водоросли освещают лазером с длиной волны 488 нм, а их эмиссию фиксируют фильтром эмиссии с длиной волны 690 нм. Тест-объект окрашивают витальным красителем Propidium Iodide для исключения мертвых водорослей до подсчета общего количества и выявляют их эмиссию при длине волны 610 нм. Токсичность рассчитывают статистически, сравнивая численность водорослей при сравнении с контрольным образцом с использованием критерия Стьюдента при уровне значимости р <0.05. Изобретение обеспечивает сокращение времени тестирования при сохранении точности результатов и уменьшении затрат труда и средств. 4 ил., 2 табл., 1 пр.
Способ оценки токсичности жидкости, предусматривающий культивирование одноклеточных водорослей в контакте с этой жидкостью как тест-объекта, их освещение и определение флуоресцентных характеристик, по изменению которых судят о токсичности контролируемой жидкости, отличающийся тем, что как тест-объект используют водоросли Attheya ussuriensis, или Porphyridium purpureum, или Chaetoceros muelleri, или Heterosigma akashiwo, при этом подсчитывают количество живых водорослей через 24 часа, 96 часов и 7 дней, причем каждую водоросль регистрируют проточным цитофлуориметром как объект, имеющий автофлуоресценцию по хлорофиллу а, для чего освещают водоросли лазером с длиной волны 488 нм, а их эмиссию фиксируют фильтром эмиссии с длиной волны 690 нм, причем из общего числа водорослей исключают мертвые, для чего тест-объект еще до подсчета количества водорослей окрашивают витальным красителем Propidium Iodide и выявляют водоросли, имеющие флуоресценцию при освещении лазером с длиной волны 488 нм, а их эмиссию фиксируют фильтром эмиссии с длиной волны 610 нм, токсичность контролируемой жидкости рассчитывают статистически.
| СПОСОБ ОЦЕНКИ ТОКСИЧНОСТИ КОМПОНЕНТОВ СРЕДЫ АЗОВСКОГО И ЧЕРНОГО МОРЕЙ | 2013 |
|
RU2519070C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ТОКСИЧНОСТИ ХИМИЧЕСКИХ ВЕЩЕСТВ В ВОДНОЙ СРЕДЕ | 1996 |
|
RU2112977C1 |
| БИОЛОГИЧЕСКИЙ СПОСОБ ОПРЕДЕЛЕНИЯ СТЕПЕНИ ОБЩЕЙ ТОКСИЧНОСТИ И ОСНОВНЫХ ТОКСИКАНТОВ ВОДНОЙ СРЕДЫ (ВАРИАНТЫ) | 1996 |
|
RU2110067C1 |
| РЯБУХИНА Е.В | |||
| и др | |||
| Биотестирование | |||
| Биологические методы определения токсичности водной среды, Ярославль 2006, стр | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| МИХЕЕВ Н.Н | |||
| Руководство по определению методом биотестирования токсичности вод, донных отложений и буровых растворов, РЭФИА, НИА-Природа, М., 2002, стр | |||
| Способ сужения чугунных изделий | 1922 |
|
SU38A1 |
Авторы
Даты
2019-03-20—Публикация
2018-04-20—Подача