ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к жидкой или сухой гранулированной композиции молокосвертывающего фермента аспарагиновой протеазы и к способу выделения интересующего молокосвертывающего фермента аспарагиновой протеазы.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Ферментативное свертывание молока молокосвертывающими ферментами, такими как химозин и пепсин, является одним из важнейших процессов при изготовлении сыров. Ферментативное свертывание молока представляет собой двухфазный процесс: первую фазу, где протеолитический фермент химозин или пепсин действует на κ-казеин с получением в результате метастабильного состояния мицеллярной структуры казеина, и вторую фазу, где молоко впоследствии коагулирует и формирует коагулят.
Молокосвертывающие ферменты желудка млекопитающих химозин (EC 3.4.23.4) и пепсин (EC 3.4.23.1) представляют собой аспарагиновые протеазы, принадлежащие к широкому классу пептидаз.
Коммерчески релевантные продукты молокосвертывающих ферментов часто представляют собой жидкие композиции, и в уровне техники описаны многочисленные и различные пути попытки стабилизировать молокосвертывающий фермент в препарате - например повысить стабильность фермента при хранении.
Например, в EP 2333056 A1 (DSM, дата подачи 12.04.2007 г.) описано, что формиат, ацетат, лактат, пропионат, малат, фумарат или пропандиол могут повысить стабильность фермента аспарагиновой протеазы в жидкой композиции/продукте.
В WO 2012/127005 A1 (DSM) описана стабильная жидкая композиция химозина, содержащая неорганическую соль в концентрации 2-100 г/кг и консервант, такой как формиат, ацетат, лактат, пропионат, малат, бензоат, сорбат или фумарат, гликоль (этандиол), пропиленгликоль (пропандиол), глицерин, эритрит, ксилит, маннит, сорбит, инозит или галактит.
Полиэтиленгликоль (ПЭГ) представляет собой полимер этиленоксида, альтернативно он может называться полиоксиэтиленом (ПОЭ). ПЭГ имеется в продаже в широком диапазоне молекулярных масс, например от 300 г/моль до 10000000 г/моль.
В US 5139943 (Genencor, опубликован 18 августа 1992 г.) описано применение ПЭГ для выделения продуцируемого микроорганизмами химозина посредством так называемой жидкостно-жидкостной двухфазной системы, где в ферментационную среду/исчерпанную питательную среду добавляют ПЭГ и неорганическую соль таким образом, чтобы сформировалась жидкостно-жидкостная (водная) двухфазная система, и затем извлекают/выделяют химозин из фазы ПЭГ. В рабочих примерах описано, что, чтобы иметь возможность получения жидкостно-жидкостной (водной) двухфазной системы, использовали около 4-5% масс./об. ПЭГ 8000 и около 10% масс/об. соли сульфата натрия.
В US 7998705 B2 (Fujifilm, опубликован 16 августа 2011 г.) описано применение ПЭГ для повышения динамической связывающей способности раствора с высоким содержанием солей (например, клеточной культуральной среды) на ионообменной хроматографической смоле и, таким образом, обеспечения возможности очистки интересующего белка. В качестве примеров интересующих белков упоминают бычий глобулин, бычий сывороточный альбумин и лизоцим, а молокосвертывающий фермент (такой как, например, химозин) явным образом не упомянут.В рабочих примерах (см., например, пример 1) описано, что наилучшее выделение белков было получено путем использования около 6% масс./об. ПЭГ (предпочтительно ПЭГ 4600) - например, использование только 0,5% ПЭГ практически не дало положительного эффекта в отношении извлечения/выделения белка.
Как известно в данной области техники, термин ПЭГилирование относится к процессу ковалентного связывания структуры полиэтиленгликоля (ПЭГ) с другой молекулой большего размера, например с терапевтическим белком (который впоследствии называют ПЭГилированным). ПЭГилирование за счет увеличения молекулярной массы молекулы может придавать несколько значительных фармакологических преимуществ по сравнению с немодифицированной формой, таких как улучшенная растворимость лекарственного средства, сниженная частота дозирования.
В US 2011/0008846 A1 (Qiagen) описано ПЭГилирование используемых в промышленности ферментов, и реннин (химозин) упомянут в качестве примера подходящего используемого в промышленности фермента среди длинного перечня упомянутых подходящих используемых в промышленности ферментов. Рабочий пример относится к ПЭГилированию только полимеразы, то есть рабочий пример, относящийся к ПЭГилированию реннина (химозина), отсутствует.
В настоящем документе может быть уместным отметить, что ни в одном из цитируемых выше документов из предшествующего уровня техники не описано, что ПЭГ может повышать стабильность молокосвертывающих ферментов аспарагиновых протеаз, таких как, например, химозины.
В DE 1492060 A1 (Nordmark-Werke GmbH, опубликован в 1969 г.) раскрыт способ получения композиции пепсина путем добавления ПЭГ с молекулярной массой 400-6000 в концентрации 1-20% масс. (соответствует от 10000 до 200000 млн-1).
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Задача, которая должна быть решена настоящим изобретением, состоит в обеспечении новой композиции молокосвертывающего фермента аспарагиновой протеазы (например, химозина), где аспарагиновая протеаза обладает повышенной стабильностью и/или активностью.
Другая задача, которая должна быть решена настоящим изобретением, состоит в обеспечении нового способа выделения аспарагиновой протеазы (например, химозина), который может обеспечить повышенную активность композиции выделенной аспарагиновой протеазы.
Решение основано на том, что авторы настоящего изобретения идентифицировали, что при добавлении ПЭГ или подобного замещенного полиоксиэтилена (например, Бридж 35) к химозину значительно повышается физическая стабильность химозина.
Структуры ПЭГ и Бридж 35 представлены на Фиг.1 в настоящем документе.
Как обсуждено в рабочих примерах в настоящем документе, рекомбинантно продуцируемый бычий химозин (CHY-MAX®, Chr. Hansen A/S) и верблюжий химозин (CHY-MAX® М, Chr. Hansen A/S) очищали с помощью хроматографии, где ПЭГ 8000 и Бридж 35 добавляли перед элюированием с колонки или ПЭГ 8000 и Бридж 35 добавляли в элюирующий буфер.
Образцы, содержащие ПЭГ 8000 или Бридж 35, обладали удельной активностью, повышенной в полтора-два раза по сравнению с контрольным образцом, очищенным без добавления ПЭГ/Бридж 35 (см. обсуждение в рабочем примере 2 в настоящем документе и фиг. 2 в настоящем документе).
Эффект значительно повышенной удельной активности ферментов химозинов был неожиданным для авторов настоящего изобретения, среди прочих причин, в связи с тем, что его можно было наблюдать сразу после выделения белка.
Эту повышенную удельную активность, наблюдаемую сразу, невозможно объяснить тем, что ПЭГ/Бридж 35 повышают стабильность ферментов, например, только при долгосрочном хранении за счет уменьшения возможных проблем, связанных с осаждением при долгосрочном хранении, поскольку значительного осаждения ферментов сразу после выделения белка в соответствии с протоколом/способом очистки, использованным в рабочих примерах настоящего документа, не происходит, то есть в контрольном эксперименте без добавления ПЭГ/Бридж 35 значительного осаждения ферментов сразу после выделения белка также не происходит.
Без ограничения теорией считают, что ПЭГ/Бридж 35 обеспечивают химозинам повышенную конформационную стабильность, и это могло бы объяснить наблюдаемую сразу повышенную удельную активность, наблюдаемую в рабочих примерах в настоящем документе.
Без ограничения теорией считают, что в предшествующем уровне техники отсутствует описание или предположение, что ПЭГ или структурно подобные полимеры могут повысить стабильность молокосвертывающих ферментов аспарагиновых протеаз, таких как, например, химозины, в частности, не описано, что можно повысить их конформационную стабильность.
Конформационная стабильность фермента проиллюстрирована на фиг. 3 в настоящем документе.
Как известно в предшествующем уровне техники, потеря конформации равнозначна потере активности фермента.
В рабочих примерах в настоящем документе также продемонстрировано, что добавление ПЭГ повышало стабильность при долгосрочном хранении жидкой и/или гранулированной композиции химозина.
Без ограничения теорией может быть так, что для молокосвертывающих ферментов аспарагиновых протеаз (таких как, например, химозины) потеря структурной конформации могла бы привести к повышенному осаждению ферментов во время, например, долгосрочного хранения, например, в жидком препарате.
Соответственно, может быть так, что ПЭГ помогает уменьшить осаждение молокосвертывающих ферментов в процессе хранения, например за счет того, что он обеспечивает конформационную стабильность ферментов.
Полиэтиленгликоль (ПЭГ) представляет собой полимер этиленоксида и может альтернативно называться полиоксиэтиленом (ПОЭ) - основанным на структуре названием ИЮПАК (Международный союз теоретической и прикладной химии) для ПЭГ является поли(оксиэтилен).
Как понятно специалисту в данной области техники в настоящем контексте, Бридж 35 может называться замещенным полиоксиэтиленом, где заместитель можно рассматривать как структуру "С12", представленную на фиг. 1 в настоящем документе.
Как понятно специалисту в данной области техники в настоящем контексте, полимеры, такие как, например, поливинилполипирролидон, поливиниловый спирт, поливинилацетат, полиакрилонитрил, полиакрилат или полиметакрилат, можно считать структурно и функционально родственными ПЭГ/Бридж 35.
Как известно в данной области техники, полимеры могут представлять собой гетерополимер или сополимер, который представляет собой полимер, образованный из двух (или более) типов мономеров, в противоположность гомополимеру, где использован только один мономер.
Как понятно специалисту в данной области техники в настоящем контексте, сополимер, образованный из следующих двух (или более) мономерных молекул: этиленоксида, винилполипирролидона, винилового спирта, винилацетата, акрилонитрила, акрилата или метакрилата, в настоящем контексте можно считать структурно и функционально родственным.
Без ограничения теорией считают, что нет значимой технической причины считать, что такие полимеры, структурно и функционально родственные ПЭГ/Бридж 35, не привели бы к релевантным для настоящего документа улучшениям стабильности молокосвертывающей аспарагиновой протеазы.
В релевантных рабочих примерах в настоящем документе использовали ПЭГ 8000 и Бридж 35, которые соответственно имеют среднюю молекулярную массу 8000 г/моль и 1225 г/моль.
В настоящем контексте считают, что релевантный в настоящем документе полимер с молекулярной массой (альтернативно называемой молекулярным весом (MW)) от 200 г/моль до 50000 г/моль может быть подходящим.
В настоящем контексте считают, что релевантный в настоящем документе полимер с числом повторяющегося мономера/элемента (так называемым числом "n") от n, равного 5 до n, равного 1250 может быть подходящим.
В качестве примера на фиг. 1 рассматривают, что Бридж 35 имеет n, равное 23.
Как известно в данной области техники, ПЭГ с n, равным 1250 имеет MW около 50000 г/моль, а ПЭГ 8000 имеет MW около 8000 г/моль и n, равное 200.
На фиг. 6 показан пример другого релевантного в настоящем документе полимера полисорбата 20, содержащего в сумме 20 мономеров этиленоксида.
В рабочем примере 4 в настоящем документе продемонстрировано, что добавление полисорбата 20 повышало стабильность тестируемых жидких композиций молокосвертывающего фермента аспарагиновой протеазы.
Как понятно специалисту в данной области техники в настоящем контексте, полисорбат 20 представляет собой полимер с числом повторяющегося мономера/элемента (так называемым числом "n") 20 в отношении характеристики (с) первого аспекта настоящего документа.
Например, используя номенклатуру фиг. 6, полисорбат 20 может, например, иметь w, x, y и z, равные 5, то есть 4 группы мономеров, где каждый имеет n, равное 5.
Соответственно, как должно быть понятно специалисту в данной области техники в настоящем контексте, такой полимер полисорбат 20 в настоящем контексте представляет собой полимер с n, равным 5×4, т.е. равным 20 в отношении характеристики (с) первого аспекта настоящего документа.
Как понятно специалисту в данной области техники в настоящем контексте, релевантным в данном контексте является число релевантных в настоящем документе мономеров (например, этиленоксида), присутствующих в полимере как таковом.
Например, общее число релевантных в настоящем документе мономеров (например, этиленоксида), присутствующих в полимере как таковом, важно, например, для релевантной в настоящем документе молекулярной массы полимера.
Соответственно, как понятно специалисту в данной области техники в настоящем контексте, термин "повторяющийся мономер" в отношении характеристики (с) первого аспекта настоящего документа относится к общему числу релевантных в настоящем документе мономеров (например, этиленоксида), присутствующих в полимере как таковом.
Как известно в данной области техники, можно наблюдать, что молокосвертывающие ферменты аспарагиновые протеазы относительно подобны по структуре.
Как известно в данной области техники, различные природные полипептидные последовательности молокосвертывающих аспарагиновых протеаз дикого типа, полученных из различных видов млекопитающих или грибов (таких как представители семейства бычьих, верблюды, овцы, свиньи или мукор), обладают относительно высоким сходством третичной структуры.
На фиг. 4 в настоящем документе представлено выравнивание последовательностей различных релевантных в настоящем документе молокосвертывающих химозинов из различных видов млекопитающих (коровы, буйвола, козы, овцы, верблюда и свиньи) - как видно на фиг. 4, они обладают близким родством последовательностей, и известно, что они обладают очень высоким сходством третичной структуры.
На фиг. 5 в настоящем документе представлено выравнивание последовательностей различных релевантных в настоящем документе имеющихся в продаже молокосвертывающих ферментов аспарагиновых протеаз из различных видов млекопитающих или грибов (верблюжьего химозина, коровьего химозина, коровьего пепсина, грибного мукорпепсина и грибного пепсина Endothia).
Можно сказать, что 5 различных последовательностей, представленных на фиг. 5, не являются высоко идентичными, но, как известно специалистам в данной области техники, все эти 5 различных молокосвертывающих ферментов аспарагиновых протеаз обладают высоким сходством третичной структуры.
Как обсуждено выше и показано в рабочих примерах в настоящем документе, релевантная в настоящем документе улучшенная/повышенная стабильность продемонстрирована для бычьего химозина и верблюжьего химозина.
Без ограничения теорией считают, что нет значимой технической причины считать, что релевантный в настоящем документе эффект улучшенной/повышенной стабильности не должен быть релевантным для молокосвертывающих ферментов аспарагиновых протеаз в целом, поскольку, как обсуждено выше, известно, что они обладают высоким сходством третичных структур, и, как понятно специалисту в данной области техники, в настоящем контексте это сходство третичных структур обеспечивает вероятность того, что описанное в настоящем документе взаимодействие полимера с ферментом с получением улучшенной стабильности должно быть общим эффектом для класса релевантных в настоящем документе структурно сходных молокосвертывающих ферментов аспарагиновых протеаз.
Соответственно, первый аспект изобретения относится к жидкой композиции молокосвертывающего фермента аспарагиновой протеазы, содержащей:
(i): молокосвертывающий фермент аспарагиновую протеазу с активностью от 25 IMCU(Международных молокосвертывающих единиц)/г композиции до 30000 IMCU/г композиции;
(ii): полимер в концентрации от 1 млн-1 до 10000 млн-1 (масс./масс.), и
(iii): соль в концентрации от 1 до 350 г/кг;
и где pH композиции составляет от 2 до 8;
и где полимер представляет собой полимер, имеющий следующие характеристики (а), (b) и (c):
(a): полимер представляет собой полимер по меньшей мере одного мономера, выбранного из группы мономеров, состоящей из: этиленоксида, винилполипирролидона, винилового спирта, винилацетата, акрилонитрила, акрилата и метакрилата; и
(b): полимер представляет собой полимер с молекулярной массой от 200 г/моль до 50000 г/моль; и
(c): полимер представляет собой полимер с числом повторяющегося мономера/элемента (так называемым числом "n") от n, равного 5 до n, равного 1250; и
(d): возможно полимер, обладающий приведенными выше характеристиками (a), (b) и (c), может представлять собой замещенный полимер, содержащий одно или более соединений-заместителей, отличных от мономеров, обладающих характеристикой (a), и, если полимер представляет собой замещенный полимер, молекулярная масса замещенного полимера как такового находится в диапазоне характеристики (b), а молекулярная масса соединения(й)-заместителя(ей) меньше молекулярной массы полимерной части замещенного полимера.
Как понятно специалисту в данной области техники в настоящем контексте, термин "IMCU/г композиции" согласно абзацу (i) первого и/или второго аспекта относится к IMCU активности фермента на грамм композиции как таковой.
То же верно для термина "г/кг" в отношении абзаца (iii) первого аспекта, то есть относится к граммам соли на кг композиции как таковой.
Может быть предпочтительным, чтобы жидкая композиция по первому аспекту имела общую массу от 10 г до 10000 кг.
Как известно специалисту в данной области техники в настоящем контексте, релевантная в настоящем документе жидкая композиция по первому аспекту, которая имеет массу 1 кг, приблизительно имеет объем 1 литр.
Как обсуждено выше, термином Бридж 35 может быть назван замещенный полиоксиэтилен, где заместитель можно рассматривать как структуру "C12", представленную на фиг. 1 в настоящем документе, и Бридж 35 имеет среднюю молекулярную массу около 1225 г/моль.
Соответственно, Бридж 35 можно рассматривать в качестве примера замещенного полимера возможной характеристики (d) первого аспекта, где соединение-заместитель представляет собой структуру "C12", представленную на фиг. 1 в настоящем документе, и молекулярная масса замещенного полимера как такового составляет 1225 г/моль, а молекулярная масса соединения-заместителя (структуры "С12") значительно меньше, чем молекулярная масса полимерной части (полимера этиленоксида с n, равным 23).
Как понятно специалисту в данной области техники в настоящем контексте, наиболее важной считают полимерную часть, обладающую характеристиками (а), (b) и (с), а возможное соединение(я)-заместитель(и) возможной характеристики (d) можно считать менее важным(и).
Как обсуждено выше, на фиг. 6 показан пример другого релевантного в настоящем документе полимера полисорбата 20, содержащего в сумме 20 мономеров этиленоксида.
Подобно Бридж 35, под замещенным полимером в настоящем контексте понимают полисорбат 20 (альтернативно называемый Твин 20). В полисорбате 20 соединениями/группами-заместителями являются сорбитановая и лауратная группы, и молекулярная масса соединений/групп-заместителей значительно меньше, чем молекулярная масса полимерной части (то есть 20 мономеров этиленоксида).
Как понятно специалисту в данной области техники в настоящем контексте, общий термин "полимер" охватывает более конкретный термин "замещенный полимер" в том смысле, что полимер может быть замещенным или незамещенным.
Как обсуждено выше, в US 5139943 использовали около 4-5% масс./об. ПЭГ 8000, чтобы было возможно получить жидкостно-жидкостную (водную) двухфазную систему, а в US 7998705 B2 использовали около 6% масс./об. ПЭГ, чтобы получить значительно повышенную динамическую связывающую способность на ионообменной хроматографической смоле.
В композиции по первому аспекту используют только от 1 млн-1 до 10000 млн-1 масс./масс. (то есть от 0,0001% до 1,0% масс./масс.) описанного в настоящем документе полимера (например, ПЭГ), то есть количество, значительно меньшее, чем требовалось в обсуждаемых выше ссылках на предшествующий уровень техники.
Соответственно, и без ограничения теорией, можно сказать, что необходимо использовать значительно меньшие количества релевантных в настоящем документе полимеров (например, ПЭГ), чтобы получить описанный в настоящем документе эффект повышенной конформационной стабильности молокосвертывающего фермента, по сравнению с количествами, используемыми в описанном выше предшествующем уровне техники.
Релевантные в настоящем документе полимеры (например, ПЭГ) могут быть описаны как технологические добавки.
Первый аспект настоящего изобретения относится к жидкой композиции, тем не менее, молокосвертывающие ферменты аспарагиновые протеазы (например, химозин) могут быть также запущены в серийное производство в виде сухой гранулированной композиции/продукта.
Соответственно, второй аспект изобретения относится к сухой гранулированной композиции молокосвертывающего фермента аспарагиновой протеазы, содержащей:
(i): молокосвертывающий фермент аспарагиновую протеазу с активностью от 25 IMCU/г композиции до 30000 IMCU/г композиции;
(ii): полимер в концентрации от 1 млн-1 до 10000 млн-1 (масс./масс.), и
(iii) соль;
и где pH композиции, суспендированной в водном растворе, составляет от 2 до 8;
и где полимер представляет собой полимер, обладающий характеристиками (а), (b) и (с) и возможно (d) согласно первому аспекту.
Как обсуждено выше, ПЭГилирование относится к процессу ковалентного связывания структуры полиэтиленгликоля (ПЭГ) с другой молекулой большего размера, например с терапевтическим белком (который впоследствии называют ПЭГилированным).
Как понятно специалисту в данной области техники в настоящем контексте, сущность настоящего изобретения как таковая не относится к ПЭГилированию.
Соответственно, и как понятно специалисту в данной области техники в настоящем контексте, жидкая и/или сухая композиция молокосвертывающего фермента аспарагиновой протеазы, как описано в настоящем документе, предпочтительно не является композицией, в которой полимер ковалентно связан с молокосвертывающим ферментом аспарагиновой протеазой.
Как обсуждено в настоящем документе, преимущество композиции молокосвертывающего фермента аспарагиновой протеазы, как описано в настоящем документе, состоит в том, что она более стабильна при хранении.
Соответственно, третий аспект изобретения относится к способу хранения молокосвертывающего фермента аспарагиновой протеазы, включающему следующие стадии:
(a): обеспечение композиции молокосвертывающего фермента аспарагиновой протеазы по первому или второму аспекту или ее релевантных в настоящем документе воплощений; и
(b): хранение композиции в течение периода от 90 суток до 2000 суток при температуре от -10°C до 50°C.
Композицию молокосвертывающего фермента аспарагиновой протеазы, как описано в настоящем документе, можно применять в соответствии с уровнем техники, например для получения интересующего пищевого или кормового продукта (такого как, например, интересующий продукт на основе молока, который может, например, представлять собой сырный продукт).
Соответственно, четвертый аспект изобретения относится к способу получения интересующего пищевого или кормового продукта, включающему добавление эффективного количества композиции молокосвертывающего фермента аспарагиновой протеазы по любому из первого или второго аспекта или любых ее релевантных в настоящем документе воплощений к пищевому или кормовому ингредиенту(ам) и выполнения дальнейших стадий изготовления с получением пищевого или кормового продукта.
Как обсуждено выше, путем применения релевантного в настоящем документе полимера, как здесь описано, возможно выделить/очистить молокосвертывающий фермент аспарагиновую протеазу с повышенной удельной активностью.
Соответственно, пятый аспект изобретения относится к способу выделения интересующего молокосвертывающего фермента аспарагиновой протеазы из водной среды, содержащей такой интересующий фермент, включающему стадии:
(i): получения образца на водной основе, состоящего из ряда компонентов, включающих аспарагиновую протеазу;
(ii): добавления полимера в концентрации от 1 млн-1 до 10000 млн-1 к образцу на водной основе со стадии (i) с получением образца, содержащего полимер; и
(iii): выделения аспарагиновой протеазы из образца, содержащего полимер, со стадии (ii) и получения, таким образом, выделенного интересующего молокосвертывающего фермента аспарагиновой протеазы;
где полимер представляет собой полимер, обладающий характеристиками (а), (b) и (с) и возможно (d) согласно первому аспекту.
Как обсуждено выше, в US5139943 использовали около 4-5% масс./об. ПЭГ 8000, чтобы было возможно получить жидкостно-жидкостную (водную) двухфазную систему, а в US 7998705 B2 использовали около 6% масс./об. ПЭГ, чтобы получить значительно повышенную динамическую связывающую способность на ионообменной хроматографической смоле.
В способе по пятому аспекту используют только от 1 млн-1 до 10000 млн-1 масс./масс. (то есть от 0,0001% до 1,0%) полимера, описанного в настоящем документе (например, ПЭГ), то есть количество, значительно меньшее, чем требовалось в обсуждаемых выше ссылках на предшествующий уровень техники.
ОПРЕДЕЛЕНИЯ
Все определения релевантных в настоящем документе терминов находятся в соответствии с тем, что должно быть понятно специалистам в данной области техники в отношении релевантного в настоящем документе технического контекста.
Термин "молокосвертывающий фермент" относится к ферменту с молокосвертывающей ферментативной активностью, то есть к активному молокосвертывающему ферменту. Молокосвертывающая активность (С) может быть выражена в Международных молокосвертывающих единицах (International Milk Clotting Units; IMCU) на мл или IMCU на г. Специалисту в данной области техники известно, как определить релевантную в настоящем документе молокосвертывающую ферментативную активность. В рабочем примере 1 в настоящем документе приведен пример стандартного способа определения молокосвертывающей ферментативной активности и удельной молокосвертывающей ферментативной активности. Как известно в данной области техники, удельную свертывающую активность (IMCU/мг общего белка) определяют путем деления свертывающей активности (IMCU/мл) на общее содержание белка (мг общего белка на мл).
Термин "млн-1" относится к миллионным долям. Как известно в данной области техники, единицу "млн-1" можно использовать для массовой доли, и термин млн-1 в настоящем документе использован по отношению к массовой доле (масс./масс.). Например, релевантный в настоящем документе полимер, например, в концентрации 500 млн-1 (масс./масс.) по отношению, например, к релевантной в настоящем документе композиции молокосвертывающего фермента аспарагиновой протеазы относится к тому, что полимер присутствует в количестве 500-кратной 1 миллионной доли грамма на грамм образца композиции, что соответствует 0,05% масс./масс. Другими словами, 1 млн-1 (масс./масс.) соответствует 0,0001% (масс./масс.), и 10000 млн-1 (масс./масс.) соответствует 1% (масс./масс.).
Термин "идентичность последовательности" относится к родственности между двумя аминокислотными последовательностями.
Для задач настоящего изобретения степень идентичности последовательности между двумя аминокислотными последовательностями определяют в соответствии с данной областью техники и предпочтительно определяют с помощью алгоритма Нидлмана-Вунша (Needleman and Wunsch, 1970, J. Mol. Biol. 48: 443-453), применяемого в программе Needle пакета программ EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, Trends Genet. 16: 276-277), предпочтительно версия 3.0.0 или более поздняя. Возможными используемыми параметрами являются: штраф за внесение пробела 10, штраф за удлинение пробела 0,5 и матрица замен EBLOSUM62 (EMBOSS версия BLOSUM62). Результат отмеченной Needle "самой длинной идентичности" (полученной с использованием опции - nobrief) используют в качестве процента идентичности и вычисляют следующим образом:
(Идентичные остатки × 100)/(Длина выравнивания - Общее число пробелов в выравнивании).
Термин "вариант" означает пептид, обладающий молокосвертывающей ферментативной активностью, содержащий изменение, то есть замену, инсерцию и/или делецию, в одном или более (нескольких) положениях. Замена означает замещение аминокислоты, занимающей положение, другой аминокислотой; делеция означает удаление аминокислоты, занимающей положение; и инсерция означает добавление 1-3 аминокислот по соседству с аминокислотой, занимающей положение.
Аминокислота может представлять собой природные или неприродные аминокислоты, например, в частности, может быть теоретически возможна замена, например, D-изомерами (или D-формами), например D-аланином.
Воплощение настоящего изобретения описано ниже только в качестве примеров.
ГРАФИЧЕСКИЕ МАТЕРИАЛЫ
Фиг. 1: Структуры ПЭГ и Бридж 35.
Фиг. 2: Показаны результаты добавления 0,1% ПЭГ 8000 или Бридж 35 в элюирующий буфер по сравнению с контрольными экспериментами без добавления ПЭГ 8000 или Бридж 35. Дополнительные подробности см., например, в рабочем примере 2 настоящего документа. На Фиг. 2А показаны данные для верблюжьего химозина, а на Фиг. 2B показаны данные для бычьего химозина.
Фиг. 3: Проиллюстрирована конформационная стабильность фермента.
Фиг. 4: Выравнивание последовательностей различных релевантных в настоящем документе молокосвертывающих химозинов из различных видов млекопитающих (коровы, буйвола, козы, овцы, верблюда и свиньи). Все последовательности Фиг. 4 общедоступны.
Фиг. 5: Выравнивание последовательностей различных релевантных в настоящем документе имеющихся в продаже молокосвертывающих ферментов аспарагиновых протеаз из различных видов млекопитающих или грибов (верблюжьего химозина, коровьего химозина, коровьего пепсина, грибного мукорпепсина и грибного пепсина Endothia). Все последовательности Фиг. 5 общедоступны.
Фиг. 6: Структура другого релевантного в настоящем документе полимера полисорбата 20, содержащего в сумме 20 мономеров этиленоксида.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Молокосвертывающий фермент аспарагиновая протеаза
Приведенное ниже обсуждение конкретных воплощений/примеров релевантных в настоящем документе молокосвертывающих ферментов аспарагиновых протеаз является релевантным для всех аспектов изобретения, обсуждаемых в настоящем документе.
В предпочтительном воплощении изобретения молокосвертывающий фермент аспарагиновая протеаза представляет собой молокосвертывающий фермент, выбранный из группы, состоящей из химозина (EC 3.4.23.4), пепсина (EC 3.4.23.1) и мукорпепсина (EC 3.4.23.23).
Предпочтительным молокосвертывающим ферментом, представляющим собой аспарагиновую протеазу, является химозин Camelius dromedarius, как описано, например, в WO 02/36752A2 (Chr. Hansen). Альтернативно в настоящем документе он может быть назван верблюжьим химозином, и общеизвестная аминокислотная последовательность зрелого полипептида представлена на Фиг. 5 в настоящем документе.
Как известно в данной области техники, получение вариантов (то есть модификаций аминокислот) интересующего фермента без значительного изменения характеристик фермента является рутинной работой для специалиста в данной области техники.
Соответственно, в предпочтительном воплощении изобретения молокосвертывающий фермент аспарагиновая протеаза представляет собой химозин Camelius dromedarius, содержащий полипептидную аминокислотную последовательность, представленную на Фиг. 5 в настоящем документе (названную "Camel_chymosin"), или вариант химозина Camelius dromedarius, содержащий полипептидную последовательность, которая обладает по меньшей мере 90% (предпочтительно по меньшей мере 95%, более предпочтительно по меньшей мере 99%) идентичностью последовательности с полипептидной аминокислотной последовательностью верблюжьего химозина, представленной на Фиг. 5 в настоящем документе.
Предпочтительный молокосвертывающий фермент аспарагиновая протеаза представляет собой бычий химозин. Альтернативно в настоящем документе он может быть назван коровьим химозином, и общеизвестная аминокислотная последовательность зрелого полипептида представлена на Фиг. 5 в настоящем документе.
Соответственно, в предпочтительном воплощении изобретения молокосвертывающий фермент аспарагиновая протеаза представляет собой бычий химозин, содержащий полипептидную аминокислотную последовательность, представленную на Фиг. 5 в настоящем документе (названную "Cow_chymosin"), или вариант бычьего химозина, содержащий полипептидную последовательность, которая обладает по меньшей мере 90% (предпочтительно по меньшей мере 95%, более предпочтительно по меньшей мере 99%) идентичностью последовательности с полипептидной аминокислотной последовательностью бычьего химозина, представленной на Фиг. 5 в настоящем документе.
Предпочтительный молокосвертывающий фермент аспарагиновая протеаза представляет собой бычий пепсин. Альтернативно в настоящем документе он может быть назван коровьим пепсином, и общеизвестная аминокислотная последовательность зрелого полипептида представлена на Фиг. 5 в настоящем документе.
Соответственно, в предпочтительном воплощении изобретения молокосвертывающий фермент аспарагиновая протеаза представляет собой бычий пепсин, содержащий полипептидную аминокислотную последовательность, представленную на Фиг. 5 в настоящем документе (названную "Cow_pepsin"), или вариант бычьего пепсина, содержащий полипептидную последовательность, которая обладает по меньшей мере 90% (предпочтительно по меньшей мере 95%, более предпочтительно по меньшей мере 99%) идентичностью последовательности с полипептидной аминокислотной последовательностью бычьего пепсина, представленной на Фиг. 5 в настоящем документе.
Предпочтительный молокосвертывающий фермент аспарагиновая протеаза представляет собой мукорпепсин (см., например, EP 0805866 B1 (Harboe et al, Chr. Hansen A/S, Denmark)). Общеизвестная аминокислотная последовательность зрелого полипептида представлена на Фиг. 5 в настоящем документе.
Соответственно, в предпочтительном воплощении изобретения молокосвертывающий фермент аспарагиновая протеаза представляет собой мукорпепсин, содержащий полипептидную аминокислотную последовательность, представленную на Фиг. 5 в настоящем документе (названную "Mucor") или вариант мукорпепсина, содержащий полипептидную последовательность, которая обладает по меньшей мере 90% (предпочтительно по меньшей мере 95%, более предпочтительно по меньшей мере 99%) идентичностью последовательности с полипептидной аминокислотной последовательностью мукорпепсина, представленной на Фиг. 5 в настоящем документе.
Предпочтительный молокосвертывающий фермент аспарагиновая протеаза представляет собой пепсин Endothia. Общеизвестная аминокислотная последовательность зрелого полипептида представлена на Фиг. 5 в настоящем документе.
Соответственно, в предпочтительном воплощении изобретения молокосвертывающий фермент аспарагиновая протеаза представляет собой пепсин Endothia, содержащий полипептидную аминокислотную последовательность, представленную на Фиг. 5 в настоящем документе (названную "Endothia"), или вариант пепсина Endothia, содержащий полипептидную последовательность, которая обладает по меньшей мере 90% (предпочтительно по меньшей мере 95%, более предпочтительно по меньшей мере 99%) идентичностью последовательности с полипептидной аминокислотной последовательностью пепсина Endothia, представленной на Фиг. 5 в настоящем документе.
Полимер
Как обсуждено выше, полимер жидкой композиции молокосвертывающего фермента аспарагиновой протеазы по первому аспекту, сухой композиции молокосвертывающего фермента аспарагиновой протеазы по второму аспекту и/или способ выделения интересующего молокосвертывающего фермента аспарагиновой протеазы по пятому аспекту представляет собой полимер, обладающий следующими характеристиками (а), (b) и (с) или возможно (d):
(a): полимер представляет собой полимер по меньшей мере одного мономера, выбранного из группы мономеров, состоящей из: этиленоксида, винилполипирролидона, винилового спирта, винилацетата, акрилонитрила, акрилата и метакрилата; и
(b): полимер представляет собой полимер с молекулярной массой от 200 г/моль до 50000 г/моль; и
(c): полимер представляет собой полимер с числом повторяющегося мономера/элемента (так называемым числом "n") от n, равного 5 до n, равного 1250; и
(d): возможно полимер, обладающий приведенными выше характеристиками (а), (b) и (с), может представлять собой замещенный полимер, содержащий одно или более соединений-заместителей, отличных от мономеров, обладающих характеристикой (а), и, если полимер представляет собой замещенный полимер, молекулярная масса замещенного полимера как такового находится в диапазоне характеристики (b), а молекулярная масса соединения(ий)-заместителя(ей) меньше молекулярной массы полимерной части замещенного полимера.
Приведенное ниже обсуждение конкретных воплощений/примеров релевантных в настоящем документе полимеров является релевантным для всех аспектов изобретения, обсуждаемых в настоящем документе.
Как понятно специалисту в данной области техники в настоящем контексте, полимер из по меньшей мере двух или более мономеров характеристики (а) представляет собой такой полимер, который в данной области техники может называться гетерополимером или сополимером, который представляет собой полимер, образованный из двух (или более) типов мономерных звеньев, в противоположность гомополимеру, где используют только один мономер, то есть полимер единственного мономера характеристики (а) представляет собой такой полимер, который в данной области техники может называться гомополимером.
В отношении характеристики (а) может быть предпочтительным, чтобы полимер представлял собой полимер из двух различных мономеров, выбранных из группы по характеристике (а).
Предпочтительно полимер представляет собой гомополимер.
В отношении возможной характеристики (d) предпочтительно, чтобы молекулярная масса соединения(ий)-заместителя(ей) была по меньшей мере в 2 раза меньше, чем молекулярная масса полимерной части замещенного полимера, более предпочтительно, чтобы молекулярная масса соединения(ий)-заместителя(ей) была по меньшей мере в 4 раза меньше, чем молекулярная масса полимерной части замещенного полимера.
Предпочтительный в настоящем документе замещенный полимер представляет собой Бридж 35, который имеет структуру, представленную на Фиг. 1 в настоящем документе.
Соединение-заместитель может представлять собой, например, С1-С25 алкил (например, С1-С25 замещенный алкил), С1-С25 алкенил (например, С1-С25 замещенный алкенил), где алкил и/или алкенил может быть, например, линейным, циклическим или разветвленным.
Как известно в данной области техники, полимеры могут, например, также содержать, например, Cl, Br и подобные соединения-заместители, то есть, например, Cl, Br могут также быть примером соединений-заместителей в настоящем документе.
Предпочтительно полимер представляет собой полимер с молекулярной массой от 750 г/моль до 30000 г/моль, такой как, например, полимер с молекулярной массой от 2000 г/моль до 20000 г/моль или такой как, например, полимер с молекулярной массой от 5000 г/моль до 15000 г/моль.
Как понятно специалисту в данной области техники в настоящем контексте, предпочтительная молекулярная масса может зависеть от конкретного типа полимера или от того, является ли он замещенным (например, подобно Бридж 35) или незамещенным.
Предпочтительно полимер представляет собой полимер с числом повторяющегося мономера/элемента (так называемым числом "n") от n, равного 20 до n, равного 500, такой как, например, полимер с числом повторяющегося мономера/элемента (так называемым числом "n") от n, равного 100 до n, равного 300.
Как и для молекулярной массы и как понятно специалисту в данной области техники в настоящем контексте, предпочтительное число "n" может зависеть от конкретного типа полимера или от того, является ли он замещенным (например, подобно Бридж 35) или незамещенным.
В настоящем контексте идентификацию оптимальной молекулярной массы и/или числа "n" для конкретного интересующего релевантного в настоящем документе полимера для получения описанного в настоящем документе улучшения стабильности в отношении, например, конкретного интересующего молокосвертывающего фермента аспарагиновой протеазы (такого как, например, бычий или верблюжий химозин) можно считать рутинной работой для специалиста в данной области техники.
Предпочтительно полимер представляет собой полиэтиленгликоль (ПЭГ), поливинилполипирролидон, поливиниловый спирт, поливинилацетат, полиакрилонитрил, полиакрилат, полиметакрилат, полисорбат или Бридж 35.
Когда полимер представляет собой полиэтиленгликоль (ПЭГ), поливинилполипирролидон, поливиниловый спирт, поливинилацетат, полиакрилонитрил, полиакрилат или полиметакрилат, предпочтительно, чтобы полимер представлял собой полимер с молекулярной массой от 1500 г/моль до 40000 г/моль, такой как, например, полимер с молекулярной массой от 2000 г/моль до 30000 г/моль или такой как, например, полимер с молекулярной массой от 5000 г/моль до 15000 г/моль.
Предпочтительно полимер представляет собой полиэтиленгликоль (ПЭГ), полисорбат 20 или Бридж 35.
В отношении ПЭГ может быть предпочтительным, чтобы полимер представлял собой полимер с молекулярной массой от 1500 г/моль до 40000 г/моль, такой как, например, полимер с молекулярной массой от 2000 г/моль до 30000 г/моль или более предпочтительно полимер с молекулярной массой от 5000 г/моль до 15000 г/моль.
Первый и/или второй аспект - жидкая и/или сухая композиция молокосвертывающего фермента аспарагиновой протеазы
Как обсуждено выше, первый аспект изобретения относится к жидкой композиции молокосвертывающего фермента аспарагиновой протеазы, содержащей:
(i): молокосвертывающий фермент аспарагиновую протеазу с активностью от 25 IMCU/г композиции до 30000 IMCU/г композиции;
(ii): полимер в концентрации от 1 млн-1 до 10000 млн-1 (масс./масс.), и
(iii): соль в концентрации от 1 до 350 г/кг;
и где pH композиции составляет от 2 до 8;
и где полимер представляет собой полимер, обладающий следующими характеристиками (а), (b) и (с) и возможно (d): [как описано в настоящем документе].
Как обсуждено выше, второй аспект изобретения относится к сухой гранулированной композиции молокосвертывающего фермента аспарагиновой протеазы, содержащей:
(i): молокосвертывающий фермент аспарагиновую протеазу с активностью от 25 IMCU/г композиции до 30000 IMCU/г композиции;
(ii): полимер в концентрации от 1 млн-1 до 10000 млн-1 (масс./масс.), и
(iii): соль;
и где pH композиции, суспендированной в воде, составляет от 2 до 8;
и где полимер представляет собой полимер, обладающий следующими характеристиками (а), (b) и (с) и возможно (d): [как описано в настоящем документе].
Как для жидкой, так и для сухой композиции предпочтительные примеры/воплощения молокосвертывающих ферментов аспарагиновых протеаз описаны выше.
Как для жидкой, так и для сухой композиции предпочтительные примеры/воплощения полимера описаны выше.
Как для жидкой, так и для сухой композиции предпочтительно, чтобы активность фермента согласно абзацу (i) составляла от 100 IMCU/г композиции до 10000 IMCU/г композиции, более предпочтительно от 500 IMCU/г композиции до 6000 IMCU/г композиции.
Как для жидкой, так и для сухой композиции предпочтительно, чтобы концентрация полимера согласно абзацу (ii) составляла от 1 млн-1 до 5000 млн-1 (масс./масс.).
Как для жидкой, так и для сухой композиции предпочтительно, чтобы концентрация полимера согласно абзацу (ii) составляла от 1 млн-1 до 3000 млн-1 (масс./масс.).
Как для жидкой, так и для сухой композиции предпочтительно, чтобы концентрация полимера согласно абзацу (ii) составляла от 10 млн-1 до 5000 млн-1 (масс./масс.), более предпочтительно составляла от 50 млн-1 до 4000 млн-1 (масс./масс.) и еще более предпочтительно составляла от 100 млн-1 до 3000 млн-1 (масс./масс.).
Может быть релевантным, чтобы концентрация полимера согласно абзацу (ii) составляла от 160 млн-1 до 5000 млн-1 (масс./масс.), как, например, от 175 млн-1 до 4000 млн-1 (масс./масс.).
Может быть релевантным, чтобы концентрация полимера согласно абзацу (ii) составляла от 5 млн-1 до 145 млн-1 (масс./масс.), как, например, от 10 млн-1 до 130 млн-1 (масс./масс.).
Для жидкой композиции соль согласно абзацу (iii) предпочтительно находится в концентрации от 10 до 300 г/кг, более предпочтительно находится в концентрации от 25 до 250 г/кг.
Как известно специалисту в данной области техники, для сухой композиции концентрация соли согласно абзацу (iii) может быть относительно высокой, как, например, от 50% (масс./масс.) до 99,9% (масс./масс.), или как, например, от 80% (масс./масс.) до 99% (масс./масс.).
Как для жидкой, так и для сухой композиции предпочтительно, чтобы соль представляла собой неорганическую соль, предпочтительно, где неорганическая соль выбрана из группы NaCl, KCl, Na2SO4, (NH4)2SO4, К2НРО4, КН2РО4, Na2HPO4 или NaH2PO4 или их комбинации.
Наиболее предпочтительно соль представляет собой NaCl.
Как жидкая, так и сухая композиции могут содержать дополнительные добавки/соединения, такие как, например, консервант.
Как известно специалисту в данной области техники, консервант может быть, как правило, добавлен в концентрации, достаточной для предотвращения роста микроорганизмов в процессе хранения продукта.
Примерами консервантов могут быть, например, слабые органические кислоты, такие как формиат, ацетат, лактат, пропионат, малат, бензоат, сорбат или фумарат. Парабены (алкиловые сложные эфиры пара-гидроксибензоата) можно также использовать в качестве консерванта. Глицерин или пропандиол также описаны в качестве консервантов.
Как для жидкой, так и для сухой композиции предпочтительно, чтобы pH составлял от 3 до 7, более предпочтительно, чтобы pH составлял от 4 до 6,5, и еще более предпочтительно, чтобы pH составлял от 5 до 6.
Предпочтительно жидкая композиция представляет собой водную композицию, например водный раствор. При использовании в настоящем документе водная композиция или водный раствор охватывает любую композицию или любой раствор, содержащие воду, например по меньшей мере 20% масс, воды, например по меньшей мере 40% масс. воды. Предпочтительно композиция согласно изобретению содержит по меньшей мере 50, 60, 70 или 80% масс. воды. Более предпочтительно композиция по изобретению содержит по меньшей мере 85, 90 или 95% масс. воды.
Как обсуждено в рабочем примере 2 в настоящем документе и как видно на Фиг. 2 в настоящем документе, в результате использования полимера, как описано в настоящем документе, было возможным получить композиции молокосвертывающего фермента аспарагиновой протеазы со значительно повышенной удельной активностью фермента.
Как видно на Фиг. 2А в настоящем документе, за счет применения полимера, как описано в настоящем документе, было возможно получить композиции верблюжьего фермента, где удельная активность ферментов была выше, чем 350 IMCU/мг общего белка, и в сравнительном эксперименте (то есть без добавления полимера) удельная активность фермента составляла только около 200 IMCU/мг общего белка.
Как видно на Фиг. 2B в настоящем документе, за счет применения полимера, как описано в настоящем документе, было возможно получить композиции бычьего фермента, где удельная активность ферментов была выше, чем 150 IMCU/мг общего белка, и в сравнительном эксперименте (то есть без добавления полимера) удельная активность фермента составляла только около 125 IMCU/мг общего белка.
Соответственно, в предпочтительном воплощении изобретения как жидкая, так и сухая композиции:
- обладают удельной активностью молокосвертывающего фермента аспарагиновой протеазы выше 300 IMCU/мг общего белка молокосвертывающего фермента аспарагиновой протеазы, более предпочтительно удельной активностью молокосвертывающего фермента аспарагиновой протеазы выше 350 IMCU/мг общего белка молокосвертывающего фермента аспарагиновой протеазы, где молокосвертывающий фермент аспарагиновая протеаза представляет собой химозин Camelius dromedarius, содержащий полипептидную аминокислотную последовательность, представленную на Фиг. 5 в настоящем документе (названную "Camel_chymosin"), или вариант химозина Camelius dromedarius, содержащий полипептидную последовательность, обладающую по меньшей мере 90% (предпочтительно по меньшей мере 95%, более предпочтительно по меньшей мере 99%) идентичностью последовательности с полипептидной аминокислотной последовательностью верблюжьего химозина, представленной на Фиг. 5 в настоящем документе; или
- обладают удельной активностью молокосвертывающего фермента аспарагиновой протеазы выше 150 IMCU/мг общего белка молокосвертывающего фермента аспарагиновой протеазы, более предпочтительно удельной активностью молокосвертывающего фермента аспарагиновой протеазы выше 165 IMCU/мг общего белка молокосвертывающего фермента аспарагиновой протеазы, где молокосвертывающий фермент аспарагиновая протеаза представляет собой бычий химозин, содержащий полипептидную аминокислотную последовательность, представленную на Фиг. 5 в настоящем документе (названную "Cow_chymosin"), или вариант бычьего химозина, содержащий полипептидную последовательность, обладающую по меньшей мере 90% (предпочтительно по меньшей мере 95%, более предпочтительно по меньшей мере 99%) идентичностью последовательности с полипептидной аминокислотной последовательностью бычьего химозина, представленной на Фиг. 5 в настоящем документе.
Может быть предпочтительным, чтобы жидкая композиция, как описано в настоящем документе, имела общую массу от 10 г до 10000 кг, такую как, например, от 100 г до 3000 кг.
Может быть предпочтительным, чтобы сухая гранулированная композиция, как описано в настоящем документе, имела общую массу от 0,25 г до 200 кг, как, например, от 0,5 г до 50 кг.
Предпочтительно, чтобы композиция представляла собой жидкую композицию молокосвертывающего фермента аспарагиновой протеазы, как описано в настоящем документе.
Третий аспект - способ хранения
Как обсуждено выше, третий аспект изобретения относится к способу хранения молокосвертывающего фермента аспарагиновой протеазы, включающему следующие стадии:
(a): обеспечение композиции молокосвертывающего фермента аспарагиновой протеазы по первому или второму аспекту или любых ее релевантных в настоящем документе воплощений; и
(b): хранение указанной композиции в течение периода от 90 суток до 2000 суток при температуре от -10°C до 50°C.
Предпочтительно температура хранения на стадии (b) представляет собой температуру от 4°C до 38°C.
Может быть предпочтительным, чтобы период хранения на стадии (b) представлял собой период от 180 суток до 500 суток.
Четвертый аспект - способ получения пищевого или кормового продукта
Как обсуждено выше, композицию молокосвертывающего фермента аспарагиновой протеазы, как описано в настоящем документе, можно применять в соответствии с данной областью техники, например для изготовления интересующего продукта на основе молока (такого как, например, сырный продукт).
Как обсуждено выше, четвертый аспект изобретения относится к способу получения пищевого или кормового продукта, включающему добавление эффективного количества композиции молокосвертывающего фермента аспарагиновой протеазы по любому из первого или второго аспекта или любых ее релевантных в настоящем документе воплощений к пищевому(ым) или кормовому(ым) ингредиенту(ам) и выполнение дальнейших стадий изготовления с получением пищевого или кормового продукта.
Предпочтительно пищевой или кормовой продукт представляет собой продукт на основе молока, и при этом способ включает добавление к молоку эффективного количества выделенного варианта полипептида химозина, как описано в настоящем документе, и выполнение дальнейших стадий изготовления с получением продукта на основе молока.
Молоко может представлять собой, например, овечье молоко, козье молоко, буйволиное молоко, молоко самки яка, молоко ламы, верблюжье молоко или коровье молоко.
Продукт на основе молока может представлять собой, например, кисломолочный продукт, творог или сыр.
Может быть предпочтительным, чтобы способ изготовления пищевого или кормового продукта по четвертому аспекту или его релевантных в настоящем документе воплощений представляет собой способ, где композицию молокосвертывающего фермента аспарагиновой протеазы сначала хранят в соответствии со способом хранения молокосвертывающего фермента аспарагиновой протеазы по третьему аспекту, а затем добавляют к пищевому(ым) или кормовому(ым) ингредиенту(ам) в соответствии со способом изготовления пищевого или кормового продукта по четвертому аспекту.
Пятый аспект - способ выделения молокосвертывающего фермента аспарагиновой протеазы
Как обсуждено выше, пятый аспект изобретения относится к способу выделения интересующего молокосвертывающего фермента аспарагиновой протеазы из водной среды, содержащей такой интересующий фермент, где способ включает стадии:
(i): получения образца на водной основе, состоящего из ряда компонентов, включая аспарагиновую протеазу;
(ii): добавления полимера в концентрации от 1 млн-1 до 10000 млн-1 к образцу на водной основе со стадии (i) с получением образца, содержащего полимер; и
(iii): выделения аспарагиновой протеазы из образца, содержащего полимер, со стадии (ii) и получение, таким образом, выделенного интересующего молокосвертывающего фермента аспарагиновой протеазы;
где полимер представляет собой полимер, обладающий характеристиками (а), (b) и (с) и возможно (d) согласно первому аспекту.
Для способа по пятому аспекту предпочтительные примеры/воплощения молокосвертывающих ферментов аспарагиновых протеаз описаны выше.
Для способа по пятому аспекту предпочтительные примеры/воплощения полимера описаны выше.
Предпочтительно, чтобы полимер был добавлен на стадии (ii) в концентрации полимера от 10 млн-1 до 5000 млн-1 (масс./масс.), более предпочтительно в концентрации от 100 млн-1 до 4000 млн-1 (масс./масс.) и еще более предпочтительно в концентрации от 300 млн-1 до 3000 млн-1 (масс./масс.).
Термин "выделение" на стадии (iii) следует понимать так, как специалист в данной области техники должен понимать его в настоящем контексте, то есть так, что полученный выделенный молокосвертывающий фермент аспарагиновая протеаза на стадии (iii) является выделенным в большей степени (то есть более чистым) по сравнению с образцом на водной основе, состоящим из ряда компонентов, включающих аспарагиновую протеазу, со стадии (i).
В качестве примера полученный на стадии (iii) выделенный молокосвертывающий фермент аспарагиновая протеаза может иметь чистоту, например, по меньшей мере 60% масс./масс. общего белка (то есть 60% масс./масс. общего белка в выделенной композиции составляет выделенный свертывающий фермент аспарагиновая протеаза). Он может быть очищен в еще большей степени, то есть по меньшей мере 90% масс./масс. общего белка.
Предпочтительно полимер представляет собой полиэтиленгликоль (ПЭГ) поливинилполипирролидон, поливиниловый спирт, поливинилацетат, полиакрилонитрил, полиакрилат, полиметакрилат или Бридж 35.
Когда полимер представляет собой полиэтиленгликоль (ПЭГ), поливинилполипирролидон, поливиниловый спирт, поливинилацетат, полиакрилонитрил, полиакрилат или полиметакрилат, предпочтительно, чтобы указанный полимер представлял собой полимер с молекулярной массой от 1500 г/моль до 40000 г/моль, такой как, например, полимер с молекулярной массой от 2000 г/моль до 30000 г/моль или такой как, например, полимер с молекулярной массой от 5000 г/моль до 15000 г/моль.
Предпочтительно полимер представляет собой полиэтиленгликоль (ПЭГ) или Бридж 35.
В отношении ПЭГ может быть предпочтительным, чтобы полимер представлял собой полимер с молекулярной массой от 1500 г/моль до 40000 г/моль, такой как, например, полимер с молекулярной массой от 2000 г/моль до 30000 г/моль или более предпочтительный полимер с молекулярной массой от 5000 г/моль до 15000 г/моль.
В предпочтительном воплощении изобретения выделенный на стадии (iii) молокосвертывающий фермент аспарагиновая протеаза представляет собой фермент, который:
- обладает удельной активностью молокосвертывающего фермента аспарагиновой протеазы выше 300 IMCU/мг общего белка молокосвертывающего фермента аспарагиновой протеазы, более предпочтительно обладает удельной активностью молокосвертывающего фермента аспарагиновой протеазы выше 350 IMCU/мг общего белка молокосвертывающего фермента аспарагиновой протеазы, где молокосвертывающий фермент аспарагиновая протеаза представляет собой химозин Camelius dromedarius, содержащий полипептидную аминокислотную последовательность, представленную на Фиг. 5 в настоящем документе (названную "Camel_chymosin"), или вариант химозина Camelius dromedarius, содержащий полипептидную аминокислотную последовательность, которая обладает по меньшей мере 90% (предпочтительно по меньшей мере 95%, более предпочтительно по меньшей мере 99%) идентичностью последовательности с полипептидной аминокислотной последовательностью верблюжьего химозина, представленной на Фиг. 5 в настоящем документе; или
- обладает удельной активностью молокосвертывающего фермента аспарагиновой протеазы выше 150 IMCU/мг общего белка молокосвертывающего фермента аспарагиновой протеазы, более предпочтительно обладает удельной активностью молокосвертывающего фермента аспарагиновой протеазы выше 165 IMCU/мг общего белка молокосвертывающего фермента аспарагиновой протеазы, где молокосвертывающий фермент аспарагиновая протеаза представляет собой бычий химозин, содержащий полипептидную аминокислотную последовательность, представленную на Фиг. 5 в настоящем документе (названную "Cow_chymosin"), или вариант бычьего химозина, содержащий полипептидную аминокислотную последовательность, которая обладает по меньшей мере 90% (предпочтительно по меньшей мере 95%, более предпочтительно по меньшей мере 99%) идентичностью последовательности с полипептидной аминокислотной последовательностью бычьего химозина, представленной на Фиг. 5 в настоящем документе.
Образец на водной основе, состоящий из ряда компонентов, включающих аспарагиновую протеазу, со стадии (i) можно получить путем рекомбинантного продуцирования молокосвертывающего фермента аспарагиновой протеазы в продуцирующей клетке-хозяине (например в эукариотической продуцирующей клетке-хозяине).
Как известно в данной области техники, перед дополнительной последующей очисткой, например, интересующего фермента обычно удаляют/отделяют продуцирующие клетки-хозяева и другой нежелательный материал в ферментационной среде (например, путем центрифугирования и/или фильтрования), то есть, с получением образца, содержащего интересующий фермент без слишком многих нежелательных компонентов, таких как, например, продуцирующие клетки-хозяева. Как известно в данной области техники, иногда этот образец может называться неочищенным первым фильтратом, этот термин может использоваться в настоящем документе, и он может быть примером релевантного в настоящем документе образца на водной основе, состоящего из ряда компонентов, включающих аспарагиновую протеазу, со стадии (i).
В WO 02/36752 A2 (Chr. Hansen) описан рекомбинантный способ продуцирования химозина Camelius dromedarius (верблюжьего химозина) с использованием клеток Aspergillus (предпочтительно Aspergillus niger) в качестве продуцирующих клеток-хозяев.
Соответственно, может быть предпочтительным, чтобы рекомбинантная продуцирующая клетка-хозяин представляла собой клетку Aspergillus (предпочтительно Aspergillus niger).
Мукорпепсин, полученный из Rhizomucor miehei, предпочтительно можно продуцировать путем использования Rhizomucor miehei в качестве продуцирующей клетки-хозяина.
Может быть предпочтительным, чтобы способ по пятому аспекту относился к способу при условии, что этот способ не является способом, в котором ПЭГ и неорганическую соль добавляют к образцу на водной основе со стадии (i) таким образом, чтобы сформировалась жидкостно-жидкостная (водная) двухфазная система, и затем извлекают/выделяют аспарагиновую протеазу из фазы ПЭГ.
Как обсуждено выше, в US 5139943 описан способ, который можно рассматривать как способ, основанный на использовании такой жидкостно-жидкостной (водной) двухфазной системы.
В предпочтительном воплощении изобретения способ по пятому аспекту представляет собой способ, где стадия выделения (iii) включает следующие стадии:
(A): нанесение образца, содержащего полимер, со стадии (ii) на твердую фазу, включающую твердую матрицу-основание, содержащую лиганды, которые содержат гидрофобную часть, для получения адсорбции интересующей аспарагиновой протеазы на лиганде; и
(B): элюирование интересующей аспарагиновой протеазы с твердой фазы для извлечения аспарагиновой протеазы и получение, таким образом, очищенного выделенного интересующего молокосвертывающего фермента аспарагиновой протеазы.
В предпочтительном воплощении изобретения способ по пятому аспекту представляет собой способ, где стадии (i)-(iii) первого аспекта включают:
(i): нанесение образца на водной основе, состоящего из ряда компонентов, включающих аспарагиновую протеазу, со стадии (i) пятого аспекта, на твердую матрицу-основание, содержащую лиганды, которые содержат гидрофобную часть для получения адсорбции интересующей аспарагиновой протеазы на лиганде;
(ii): добавление полимера на стадии (ii) пятого аспекта представляет собой добавление к элюирующему буферу; и
(iii): стадия выделения (iii) пятого аспекта включает элюирование интересующей аспарагиновой протеазы с твердой фазы для извлечения аспарагиновой протеазы и, таким образом, получения очищенного выделенного молокосвертывающего фермента аспарагиновой протеазы.
Два предпочтительных воплощения изобретения, приведенных непосредственно выше, можно рассматривать как относящиеся к методикам выделения с помощью хроматографии (например, колоночной хроматографии). Хроматография как таковая хорошо известна специалисту в данной области техники, поэтому в настоящем документе нет необходимости в более подробном описании самой методики хроматографии.
Термин "твердая матрица-основание" относится к твердому каркасному материалу, который содержит реакционноспособную функциональную группу, дающую возможность ковалентного присоединения лиганда к указанному каркасному материалу. В настоящем документе этот термин можно также называть твердой матрицей-подложкой.
Как известно в данной области техники, каркасный материал может быть неорганическим, как, например, диоксид кремния, или органическим. Органические каркасные материалы, полезные в настоящем документе, включают в качестве примеров целлюлозу и ее производные, агарозу, декстран, полимеры, такие как, например, полиакрилаты, полистирол, полиакриламид, полиметакрилат, сополимеры.
Как известно в данной области техники, примером твердой матрицы-основания может быть так называемая смола, как известно в данной области техники, этот термин можно использовать по отношению к ионообменной хроматографии (IEC).
Как известно в данной области техники, твердая матрица-основание может предпочтительно представлять собой частицы, например твердая матрица-основание может содержать частицы с размером частиц менее 750 мкм или частицы с размером частиц менее 100 мкм.
Реакционноспособные функциональные группы твердой матрицы-подложки, дающие возможность ковалентного присоединения лигандной группы, хорошо известны в данной области техники и включают, например, гидроксил, карбоксил, тиол и амино.
При использовании в настоящем документе термин "лиганд" относится к гидрофобной части (альтернативное название группы) и спейсерной группе для ковалентного присоединения лиганда к твердой матрице-основанию. Спейсерная группа может представлять собой любую группу или заместитель, способные к ковалентному присоединению выбранной группы/части к твердой матрице-основанию. Такие спейсерные группы хорошо известны в данной области техники и включают, например, алкиленовые группы, ароматические группы, алкилароматические группы, амидогруппы, аминогруппы, мочевинные группы, карбаматные группы.
Водную среду для нанесения, содержащую интересующий фермент, приводят в контакт с лигандами, как описано в настоящем документе, в условиях, дающих возможность для связывания интересующего фермента с лигандами/адсорбции интересующего фермента на лигандах. Специалисту в данной области техники известно, как отрегулировать условия (например, отрегулировать pH таким образом, чтобы его значение находилось в диапазоне 3-10, включая диапазон 4-8, и/или отрегулировать скорость тока), чтобы получить необходимый уровень адсорбции интересующего фермента на интересующем лиганде.
Сама по себе эта стадия представляет собой рутинную стадию для выполнения специалистом в данной области техники, и специалисту в данной области техники известен ряд различных лигандов, релевантных в настоящем документе (см., например, обзорную статью Yang et al, Journal of Chromatography A, 1218 (2011) 8813-8825).
Специалисту в данной области техники известен ряд методик очистки/разделения, релевантных в настоящем документе, где среду, релевантную в настоящем документе, содержащую интересующий фермент, наносят на твердую фазу, включающую твердую матрицу-основание, содержащую лиганды, релевантные в настоящем документе, с получением адсорбции интересующего фермента на лиганде, например путем использования по меньшей мере одной методики очистки, выбранной из группы, состоящей из: хроматографии, колоночной хроматографии, адсорбции на слое, адсорбции в расширенном слое (EBA), периодической адсорбции, адсорбции на мембране и ионообменной хроматографии (IEC).
В настоящем документе предпочтительным может быть использование методики очистки путем адсорбции в расширенном слое (ЕВА).
Все эти методики очистки хорошо известны специалисту в данной области техники, соответственно, для специалиста в данной области техники связывание интересующего фермента должным образом с конкретным подходящим интересующим лигандом и выполнение должным образом стадии элюирования с получением, таким образом, очищенного/выделенного интересующего фермента является рутинной работой.
Иными словами, рутинной работой для специалиста в данной области техники является идентификация подходящего растворителя, буферов и т.д. для получения должным образом адсорбции интересующего фермента на лиганде и элюирования должным образом интересующего фермента с получением, таким образом, очищенного/выделенного интересующего фермента.
Соответственно, описание этих стадий в настоящем документе в многочисленных подробностях не считают необходимым.
Как известно в данной области техники, термин "хроматография" относится к физическому способу разделения, при котором компоненты, которые необходимо разделить, распределяют между двумя фазами, одну из которых называют стационарной (стационарная фаза), тогда как другая (подвижная фаза) перемещается в определенном направлении.
Как известно в данной области техники, термин "колоночная хроматография" относится к методике разделения, при которой стационарный слой находится внутри трубки.
Как известно в данной области техники, термин "адсорбция в расширенном слое (EBA)" относится к препаративной хроматографической методике, которая дает возможность обработки вязких жидкостей и в виде частиц.
Принципы связывания белка при EBA являются такими же, как при классической колоночной хроматографии, и можно использовать обычные лиганды для ионообменной, гидрофобной и аффинной хроматографии. Если при классической колоночной хроматографии используют твердую фазу, состоящую из уплотненного слоя, при EBA используют частицы в псевдоожиженном состоянии. Смола ЕВА содержит частицы варьирующего размера и варьирующей плотности, что приводит в результате к градиенту размера частиц при расширении, и при нахождении слоя в его расширенном состоянии формируются локальные петли. Частицы, такие как целые клетки или клеточный дебрис, которые могут закупоривать колонку с уплотненным слоем, легко проходят через псевдоожиженный слой. Таким образом, ЕВА можно использовать на неочищенных культуральных бульонах или суспензиях разрушенных клеток, таким образом минуя первоначальные стадии очистки, такие как центрифугирование и фильтрование, которые могут требоваться при использовании уплотненных слоев.
Термины "адсорбция на слой", "периодическая адсорбция" и "адсорбция на мембране" хорошо известны и понятны специалисту в данной области техники в настоящем контексте.
Как известно в данной области техники, гидрофобная часть лиганда может представлять собой, например, алифатическую группу или ароматическую группу.
Алифатическая группа может представлять собой, например, алкильную группу с различными длинами, например С2-С40 алкильную группу или С4-С30 алкильную группу;
алкенильную группу с различными длинами, например С2-С40 алкенильную группу или С4-C30 алкенильную группу или, например,
алкинильную группу с различными длинами, например С2-С40 алкинильную группу или С4-С40 алкинильную группу.
Ароматическая группа может представлять собой, например, фенильную группу или бензильную группу.
В предпочтительном воплощении изобретения гидрофобная часть лиганда представляет собой бензильную группу.
В предпочтительном воплощении изобретения в настоящем документе лиганды также содержат положительно заряженную часть, то есть лиганды содержат гидрофобную часть и положительно заряженную часть.
Как известно в данной области техники, положительно заряженная часть лиганда может представлять собой, например, аминогруппу или, например, четвертичную аммониевую группу.
Предпочтительно гидрофобная часть представляет собой бензильную группу, а положительно заряженная часть представляет собой аминогруппу, то есть лиганд представляет собой бензиламин.
ПРИМЕРЫ
Пример 1: Определение удельной молокосвертывающей активности
4.1 Определение свертывающей активности
Молокосвертывающую активность определяли с использованием способа REMCAT, который представляет собой стандартный способ, разработанный Международной федерацией по молочному животноводству (способ IDF).
Молокосвертывающую активность определяют на основании времени, необходимого для видимого выпадения хлопьевидного осадка стандартного молочного субстрата, приготовленного из сухого молока низкотемпературного сгущения с низким содержанием жира, с раствором хлорида кальция 0,5 г на литр (pH примерно 6,5). Время свертывания образца молокосвертывающего фермента сравнивают с временем для эталонного стандарта, имеющего известную молокосвертывающую активность и имеющего такую же композицию фермента по Стандарту IDF 110B, в качестве образца. Образцы и эталонные стандарты измеряли в идентичных химических и физических условиях. Образцы-варианты регулировали до приблизительно 3 IMCU/мл, используя буфер, представляющий собой 84 мМ уксусную кислоту pH 5,5. Затем 200 мкл фермента добавляли к 10 мл подогретого молока (32°C) в стеклянной пробирке, помещенной в водяную баню, способную к поддержанию постоянной температуры 32°C±1°C при постоянном перемешивании.
Общую молокосвертывающую активность (активность) молокосвертывающего фермента вычисляют в Международных молокосвертывающих единицах (IMCU) на мл относительно стандарта, имеющего такую же композицию фермента, как образец, в соответствии с формулой:

Sстандарт: Молокосвертывающая активность международного эталонного стандарта для сычужного фермента.
Tстандарт: Время свертывания в секундах, полученное для стандартного разведения.
Dобразец: Коэффициент разведения для образца
Dстандарт: Коэффициент разведения для стандарта
Tобразец: Время свертывания в секундах, полученное для разведенного образца сычужного фермента от добавления фермента до выпадения хлопьевидного осадка
4.2 Определение общего содержания белка
Общее содержание белка определяли, используя набор для анализа белка Pierce ВСА Protein Assay Kit от компании Thermo Scientific, следуя инструкциям поставщика.
4.3 Вычисление удельной свертывающей активности
Удельную свертывающую активность (IMCU/мг общего белка) определяли путем деления свертывающей активности (IMCU/мл) на общее содержание белка (мг общего белка на мл).
Пример 2: Добавление ПЭГ или Бридж 35 к элюирующему буферу
Бычий химозин или верблюжий химозин экспрессировали рекомбинантным путем в Aspergillus niger (примерно так, как описано в WO 02/36752 A2).
Ферменты очищали с помощью методики твердофазного экстрагирования, применяя лиганд бензиламин, ковалентно связанный с агарозой (подобный лиганду бензиламину, описанному в WO 01/58924 A2).
96-луночный фильтрующий планшет, оборудованный 25 мкм полиэтиленовым (PE) фильтром и имеющий объем лунки 2 мл, уплотняли Fastline 1300 от Upfront Chromatography, Denmark.
Лунки заполняли смолой до получения высоты слоя 6-8 мм во всех лунках. Смолу во всех лунках уравновешивали 5 мл 20 мМ малоната натрия pH 5,7.
Супернатант из культиваций регулировали до pH 5,7 путем смешивания 3 мл супернатанта с 0,5 мл 2 М малоната натрия, pH 5,7. Затем образец 3,5 мл фильтровали через 8 мкм фильтр для удаления частиц и наносили на 96 отдельных лунок планшета. После нанесения смолу промывали 5 мл буфера из 20 мМ малоната, 500 мМ NaCl, pH 5,7, и давали возможность почти высохнуть. Смолу элюировали аликвотами по 500 мкл 20 мМ малоновой кислоты pH 2,5, 100 мМ NaCl, 5% глицерина и собирали во флаконы.
В некоторых экспериментах ПЭГ 8000 или Бридж 35 добавляли к элюирующему буферу до конечной концентрации 0,05-0,25 масс./масс. %.
В других экспериментах ПЭГ 8000 или Бридж 35 добавляли в образец перед связыванием ферментов со смолой до конечной концентрации 0,05-0,25 масс./масс. %.
В контрольных экспериментах ПЭГ 8000 или Бридж 35 не добавляли.
Сразу после сбора в элюат добавляли 1,5 М малоната динатрия для регулирования pH до 5,4-5,8.
Образцы анализировали на предмет концентрации белка и молокосвертывающей активности в пределах 1 суток после выделения.
Концентрацию белка в собранных фракциях анализировали, используя набор для анализа белка Pierce ВСА Protein Assay Kit от компании Thermo Scientific.
Результаты:
На Фиг. 2 представлены результаты добавления 0,1% ПЭГ 8000 или Бридж 35 к элюирующему буферу по сравнению с контрольными экспериментами без добавления ПЭГ 8000 или Бридж 35.
Как видно на Фиг. 2, образцы, содержащие ПЭГ 8000 или Бридж 35, обладали удельной активностью, повышенной в два раза по сравнению с контрольным образцом, очищенным без добавления ПЭГ/Бридж 35.
Подобные положительные результаты были получены в экспериментах, где ПЭГ 8000 или Бридж 35 добавляли к образцу перед связыванием ферментов со смолой.
Подобные Фиг. 2 положительные результаты были получены путем добавления 0,05 масс./масс. % ПЭГ 8000 или Бридж 35 или путем добавления 0,25 масс./масс. % ПЭГ 8000 или Бридж 35.
Выводы:
Результаты продемонстрировали, что образцы, очищенные с добавлением ПЭГ 8000 или Бридж 35, обладали удельной активностью, повышенной в два раза по сравнению с контрольным образцом, очищенным без добавления ПЭГ/Бридж 35.
Считают, что элюат/образцы содержат ПЭГ 8000/Бридж 35.
Пример 3. Добавление ПЭГ к композиции (после очистки)
Была получена жидкая композиция молокосвертывающего фермента аспарагиновой протеазы, содержащая молокосвертывающий фермент аспарагиновую протеазу с активностью около 1100 IMCU/г.
Композиции были получены для бычьего химозина, верблюжьего химозина и мукорпепсина (то есть 3 различные композиции).
К каждой из композиций добавляли ПЭГ 8000 до содержания 0,015% масс/масс.(150 млн-1 масс./масс.).
К контрольным композициям не добавляли ПЭГ 8000.
Композиции хранили при 5°C и 37°C в течение 6 месяцев и анализировали на предмет молокосвертывающей активности через регулярные интервалы.
Результаты продемонстрировали, что добавление ПЭГ повышает долгосрочную стабильность при хранении после 6 месяцев хранения тестируемых жидких композиций молокосвертывающего фермента аспарагиновой протеазы, то есть эти композиции обладали более высокой активностью в IMCU/г.
Пример 4: Добавление ПЭГ или полисорбата 20 к композиции (после очистки)
Жидкие композиции промышленных ферментов подвергают физическим воздействиям в ходе типовых процессов, таких как подача с помощью насоса, перемешивание и фильтрование через мембраны. В эти воздействия также могут вносить вклад удары жидкой композиции о стенки в частично заполненном контейнере во время перевозки. Напряжение сдвига и повышенное воздействие на фермент на границе раздела воды и воздуха может вызывать денатурацию и сопутствующую потерю активности фермента.
Физическую стабильность образца фермента или белка можно тестировать путем повторяющегося встряхивания образца в пробирке, имеющей высокое отношение свободного объема над образцом к объему образца. Стабильность различных аспарагиновых протеаз по отношению к встряхиванию исследовали путем переворачивания 2 мл образца, помещенного в пробирку с объемом 10 мл, в ротационном устройстве в течение 1 часа. Для каждого раствора относительную молокосвертывающую активность измеряли после 1 часа вертикального переворачивания и сравнивали с непереворачиваемым контролем, имеющим точно такую же композицию. Результаты выражали в виде "остаточной активности", которую получают путем деления активности переворачиваемого образца на активность непереворачиваемого контрольного образца.
Результаты:
Было обнаружено, что ПЭГ 8000, добавленный в концентрации 0,015% (150 млн-1), обладает примечательным защитным эффектом против встряхивания всех протестированных аспарагиновых протеаз (таблица x). Защитный эффект ПЭГ800 был наиболее выраженным для бычьего химозина и для верблюжьего химозина, где потеря активности без добавления ПЭГ 8000 составляла 11% и 35% соответственно. При добавлении ПЭГ 8000 к образцам бычьего химозина и верблюжьего химозина при встряхивании образцов потери активности не было. В образцах верблюжьего химозина без ПЭГ после встряхивания наблюдали белый осадок. В образцах верблюжьего химозина с добавлением ПЭГ осадок после встряхивания отсутствовал. Это позволяет предположить, что потеря активности является следствием агрегации белка при денатурации, а не адсорбции фермента на поверхности пробирки. Для мукорпепсина защитный эффект ПЭГ 8000 в отношении физической стабильности был небольшим.
Влияние ПЭГ 8000 на стабильность верблюжьего химозина по отношению к встряхиванию сравнивали с поверхностно-активными веществами: лецитином сои, полисорбатом 20 и моностеаратом глицерина. Из таблицы у видно, что эффект полисорбата 20 был подобен эффекту ПЭГ 8000. Остаточная активность в образцах верблюжьего химозина с добавлением либо лецитина сои, либо моностеарата глицерина была подобна таковой в необработанном контрольном образце (без добавления). Это позволяет предположить, что стабилизирующий эффект против встряхивания, наблюдаемый в этом примере, является не следствием предотвращения поверхностной адсорбции поверхностно-активными веществами, а признаком, связанным со структурным элементом полиоксиэтиленом, содержащимся в ПЭГ 8000 и полисорбате 20.
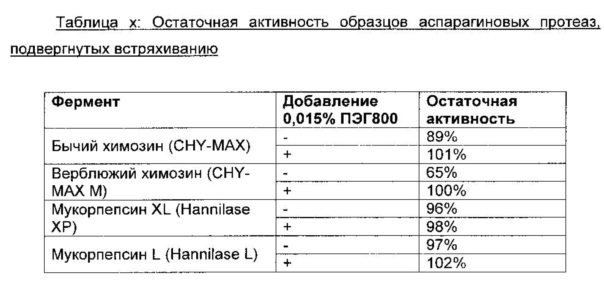
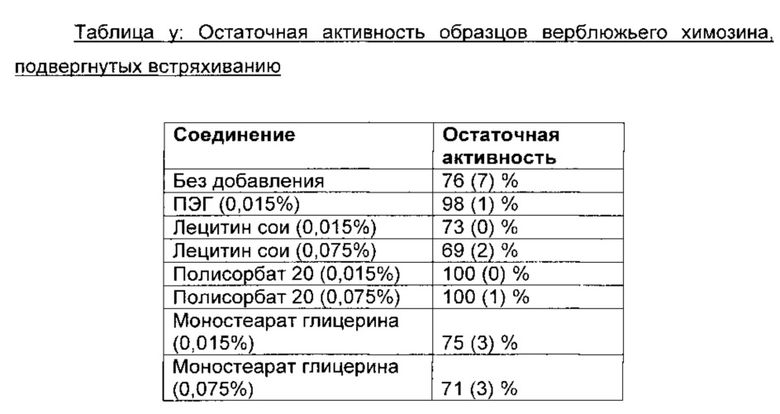
Выводы:
Результаты демонстрируют, что ПЭГ 8000 обладает стабилизирующим эффектом в отношении аспарагиновых протеаз против физических воздействий в результате встряхивания жидкого образца. Кроме того, показано, что другие соединения, содержащие структурный элемент полиоксиэтилен, такие как полисорбат 20, обладают подобными стабилизирующими эффектами.
СПИСОК ЛИТЕРАТУРЫ
1: EP 2333056 A1 (DSM, дата подачи 12.04.2007 г.)
2: WO 2012/127005 A1 (DSM)
3: US 5139943 (Genencor, опубликован 18 августа 1992 г.)
4: US 7998705 B2 (Fujifilm, опубликован 16 августа 2011 г.)
5: US 2011/0008846 A1 (Qiagen)
| название | год | авторы | номер документа |
|---|---|---|---|
| Варианты химозина с улучшенными молокосвертывающими свойствами | 2015 |
|
RU2717770C2 |
| Смеси химозинов с улучшенными молокосвертывающими свойствами | 2016 |
|
RU2741804C2 |
| Варианты химозина с улучшенными молокосвертывающими свойствами | 2015 |
|
RU2739004C1 |
| Варианты химозина с улучшенными свойствами | 2016 |
|
RU2740317C2 |
| ВАРИАНТЫ ХИМОЗИНА С УЛУЧШЕННЫМИ МОЛОКОСВЕРТЫВАЮЩИМИ СВОЙСТВАМИ | 2013 |
|
RU2683385C2 |
| Варианты химозина с улучшенными свойствами | 2016 |
|
RU2764544C2 |
| Трансформант Komagataella phaffii - продуцент рекомбинантного химозина в активной форме | 2022 |
|
RU2805486C1 |
| ПОЛУЧЕННАЯ ИЗ МИКРООРГАНИЗМА ПРОТЕАЗА УСОВЕРШЕНСТВОВАННОГО ТИПА, ОБЕСПЕЧИВАЮЩАЯ СВЕРТЫВАНИЕ МОЛОКА | 2010 |
|
RU2495931C2 |
| Трансформант Ogataea haglerorum - продуцент рекомбинантного химозина в активной форме | 2022 |
|
RU2815882C1 |
| Рекомбинантная плазмида pET32-Trex Vic, обеспечивающая синтез химерного белка прохимозина Vicugna pacos, и штамм Escherichia coli BL21(DE3)pLysE pET32-Trx Vic-продуцент химерного белка прохимозина Vicugna pacos | 2019 |
|
RU2729403C1 |
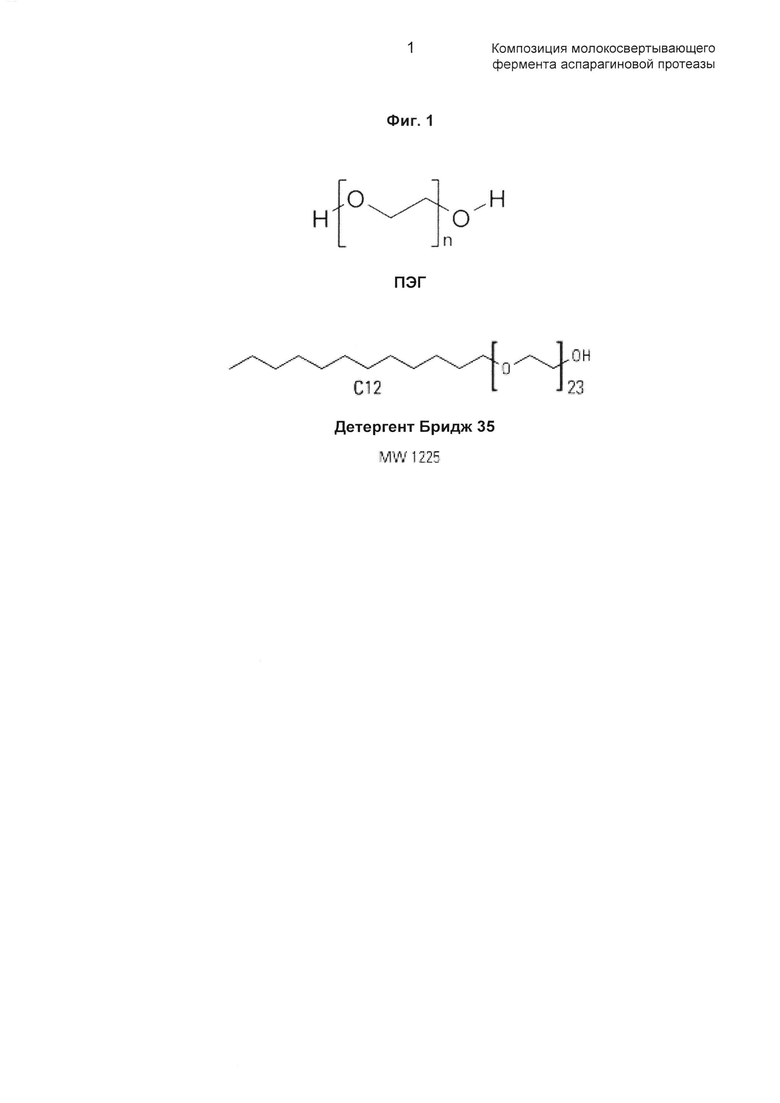
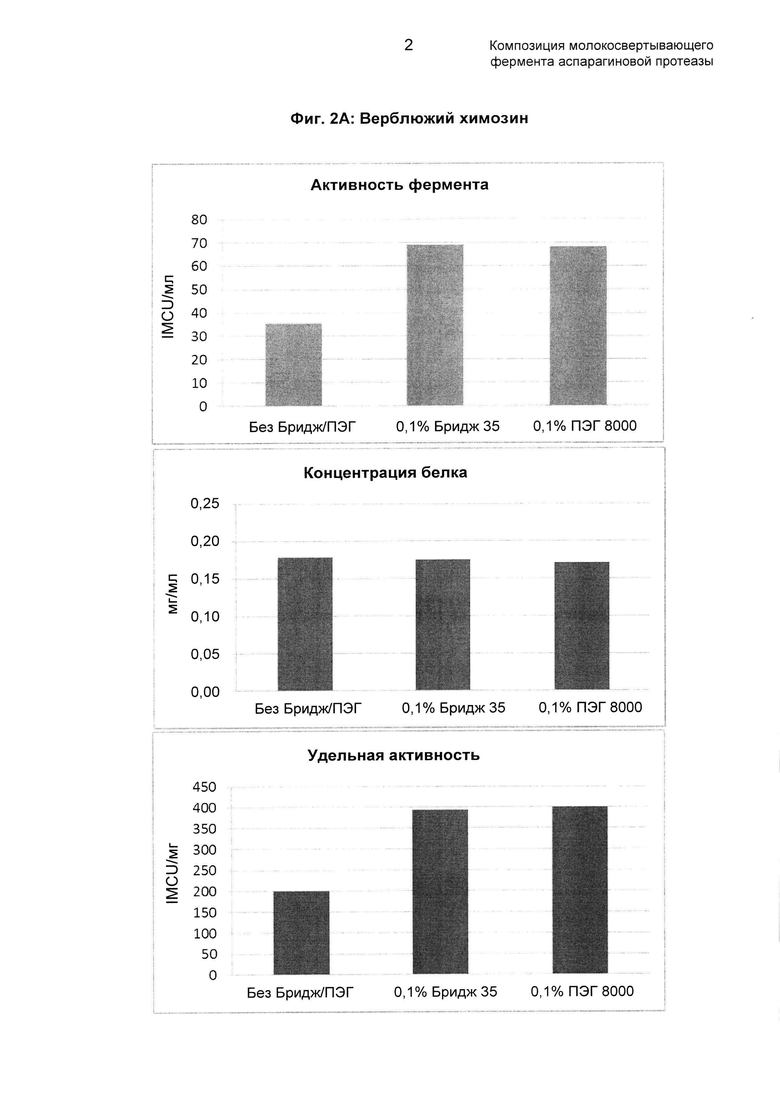
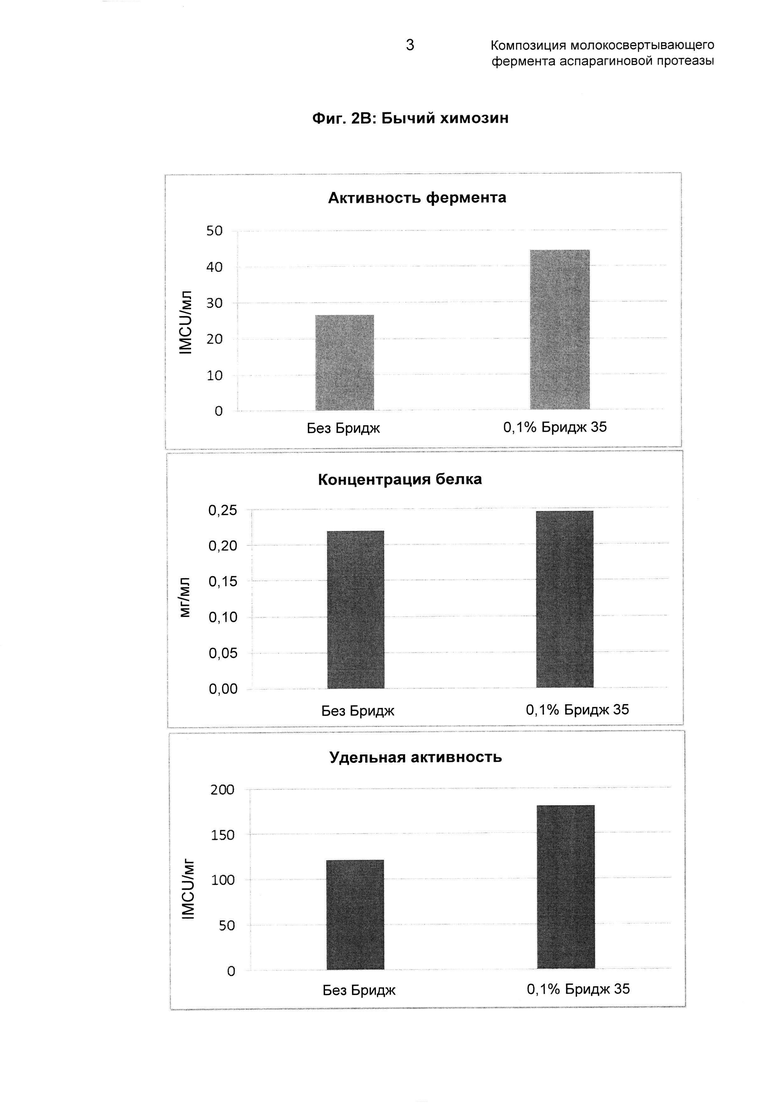
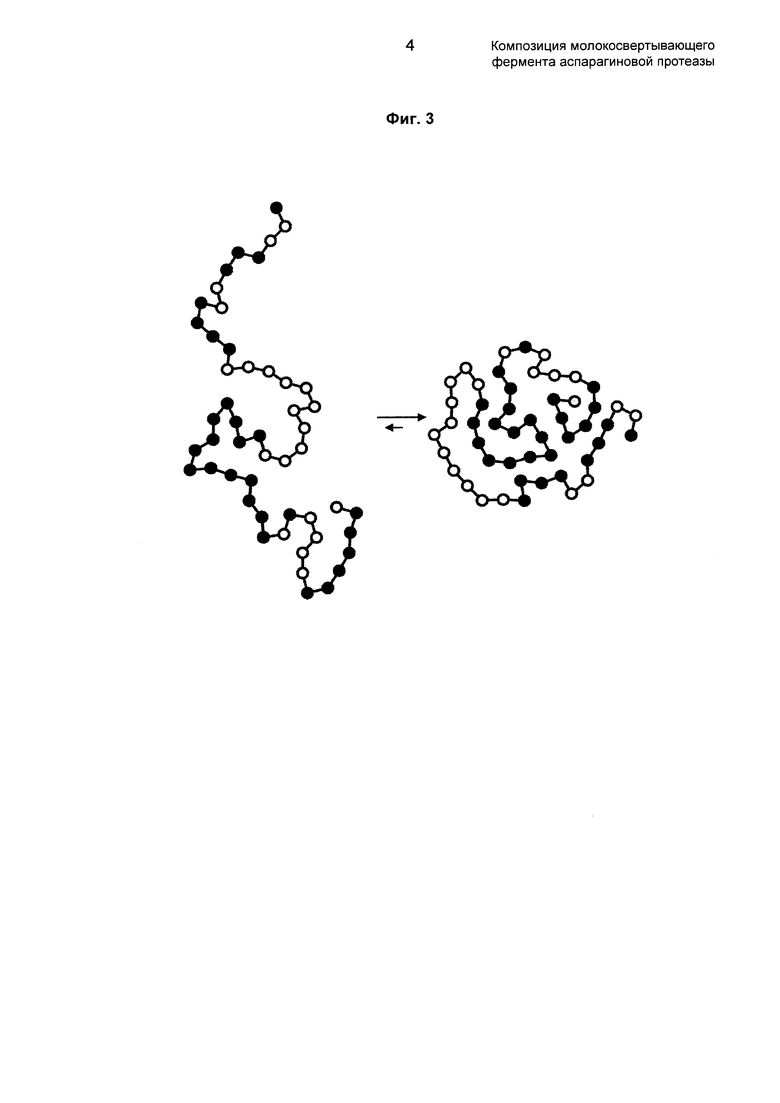


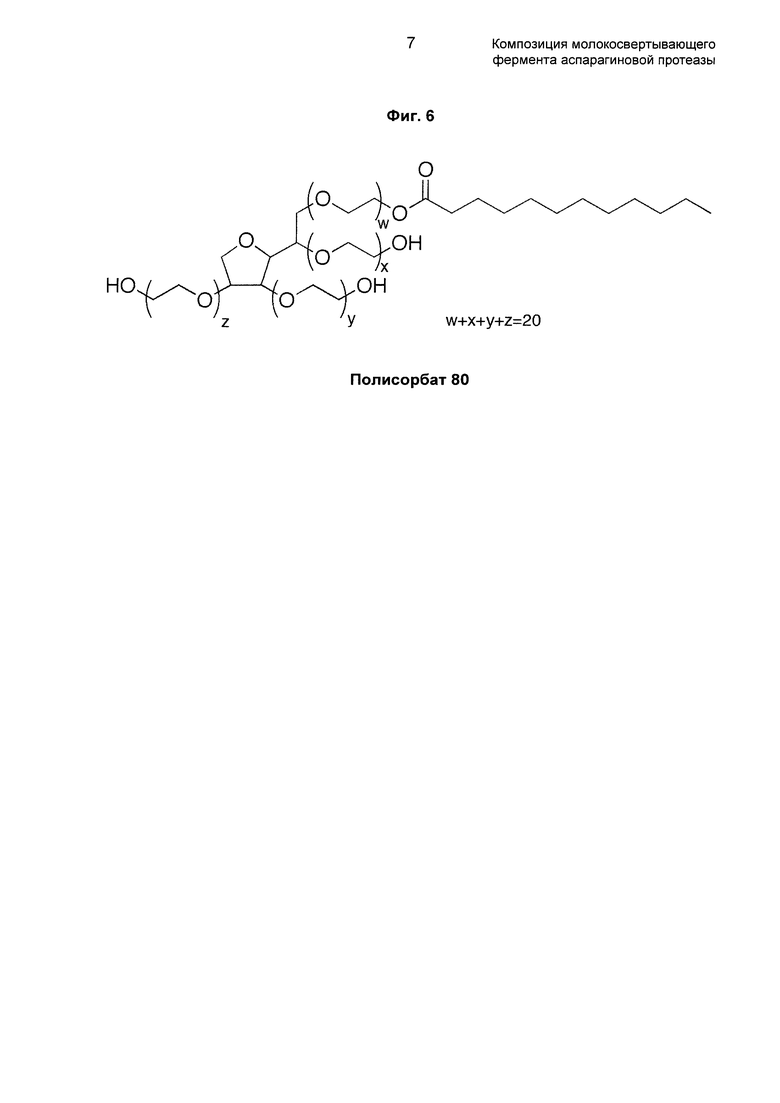
Предложены жидкая или сухая гранулированная композиция молокосвертывающего фермента аспарагиновой протеазы, а также их применение. Композиция молокосвертывающего фермента аспарагиновой протеазы содержит (i) молокосвертывающий фермент аспарагиновую протеазу с активностью от 25 IMCU (Международных молокосвертывающих единиц)/г композиции до 30000 IMCU/г композиции; (ii) полимер в концентрации от 50 млн-1 до 2500 млн-1 (масс./масс.) и (iii) соль в концентрации от 1 до 350 г/кг. При этом рН композиции составляет от 2 до 7, а соль выбрана из группы NaCl, KCl, Na2SO4, (NH4)2SO4, K2HPO4, KH2PO4, Na2HPO4 или NaH2PO4 или их комбинации. При этом полимер представляет собой полимер, обладающий следующими характеристиками (а), (b) и (с), где (a) полимер представляет собой полимер по меньшей мере одного мономера, выбранного из группы мономеров, состоящей из: этиленоксида, винилполипирролидона, винилового спирта, винилацетата, акрилонитрила, акрилата и метакрилата; (b) полимер представляет собой полимер с молекулярной массой от 200 г/моль до 50000 г/моль; (c) полимер представляет собой полимер с числом повторяющегося мономера/элемента (так называемым числом "n") от n, равного 5, до n, равного 1250; и (d) возможно полимер, обладающий приведенными выше характеристиками (а), (b) и (с), может представлять собой замещенный полимер, содержащий одно или более соединений-заместителей, отличных от мономеров, обладающих характеристикой (а), и если полимер представляет собой замещенный полимер, молекулярная масса замещенного полимера как такового находится в диапазоне характеристики (b), а молекулярная масса соединения(ий)-заместителя(ей) меньше молекулярной массы полимерной части замещенного полимера. Предложенные композиции могут быть использованы в способе получения продукта на основе молока. Предложены также способ хранения указанной композиции и способ выделения интересующего молокосвертывающего фермента аспарагиновой протеазы из водной среды, содержащей такой интересующий фермент. Изобретения обеспечивают повышенную стабильность и/или активность аспарагиновой протеазы в композициях. 5 н. и 14 з.п. ф-лы, 6 ил., 2 табл., 4 пр.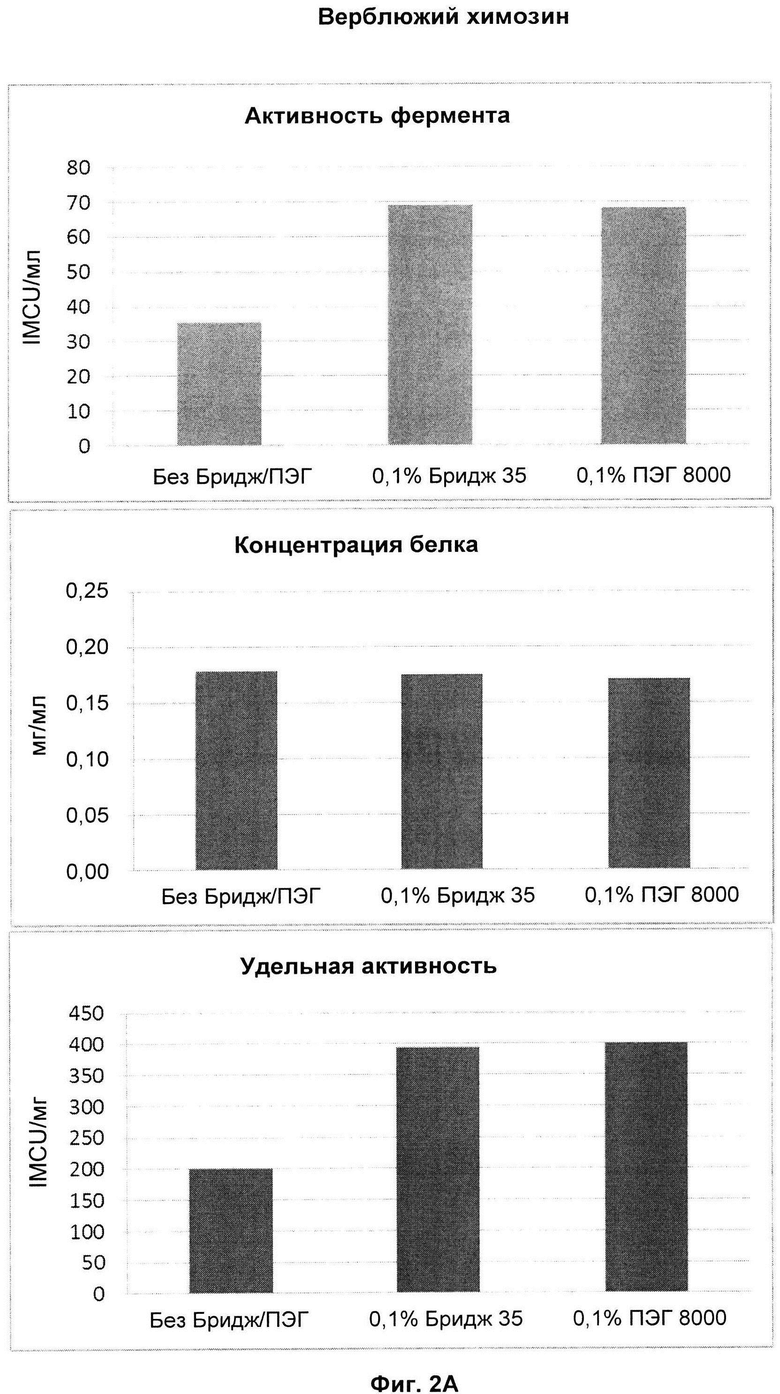
1. Жидкая композиция молокосвертывающего фермента аспарагиновой протеазы, содержащая:
(i): молокосвертывающий фермент аспарагиновую протеазу с активностью от 25 IMCU (Международных молокосвертывающих единиц)/г композиции до 30000 IMCU/г композиции;
(ii): полимер в концентрации от 50 млн-1 до 2500 млн-1 (масс./масс.) и
(iii): соль в концентрации от 1 до 350 г/кг;
и где рН композиции составляет от 2 до 7;
и где полимер представляет собой полимер, обладающий следующими характеристиками (а), (b) и (с):
(a): полимер представляет собой полимер по меньшей мере одного мономера, выбранного из группы мономеров, состоящей из: этиленоксида, винилполипирролидона, винилового спирта, винилацетата, акрилонитрила, акрилата и метакрилата; и
(b): полимер представляет собой полимер с молекулярной массой от 200 г/моль до 50000 г/моль; и
(c): полимер представляет собой полимер с числом повторяющегося мономера/элемента (так называемым числом "n") от n, равного 5, до n, равного 1250; и
(d): возможно полимер, обладающий приведенными выше характеристиками (а), (b) и (с), может представлять собой замещенный полимер, содержащий одно или более соединений-заместителей, отличных от мономеров, обладающих характеристикой (а), и если полимер представляет собой замещенный полимер, молекулярная масса замещенного полимера как такового находится в диапазоне характеристики (b), а молекулярная масса соединения(ий)-заместителя(ей) меньше молекулярной массы полимерной части замещенного полимера;
и где соль выбрана из группы NaCl, KCl, Na2SO4, (NH4)2SO4, K2HPO4, KH2PO4, Na2HPO4 или NaH2PO4 или их комбинации.
2. Сухая гранулированная композиция молокосвертывающего фермента аспарагиновой протеазы, содержащая:
(i): молокосвертывающий фермент аспарагиновую протеазу с активностью от 25 IMCU/г композиции до 30000 IMCU/г композиции;
(ii): полимер в концентрации от 50 млн-1 до 2500 млн-1 (масс./масс.), и
(iii): соль;
и где рН композиции, суспендированной в воде, составляет от 2 до 7;
и где полимер представляет собой полимер, обладающий характеристиками (а), (b) и (с) и возможно (d), где
(a): полимер представляет собой полимер по меньшей мере одного мономера, выбранного из группы мономеров, состоящей из: этиленоксида, винилполипирролидона, винилового спирта, винилацетата, акрилонитрила, акрилата и метакрилата; и
(b): полимер представляет собой полимер с молекулярной массой от 200 г/моль до 50000 г/моль; и
(c): полимер представляет собой полимер с числом повторяющегося мономера/элемента (так называемым числом "n") от n, равного 5, до n, равного 1250; и
(d): возможно полимер, обладающий приведенными выше характеристиками (а), (b) и (с), может представлять собой замещенный полимер, содержащий одно или более соединений-заместителей, отличных от мономеров, обладающих характеристикой (а), и если полимер представляет собой замещенный полимер, молекулярная масса замещенного полимера как такового находится в диапазоне характеристики (b), а молекулярная масса соединения(ий)-заместителя(ей) меньше молекулярной массы полимерной части замещенного полимера;
и где соль выбрана из группы NaCl, KCl, Na2SO4, (NH4)2SO4, K2HPO4, KH2PO4, Na2HPO4 или NaH2PO4 или их комбинации.
3. Композиция молокосвертывающего фермента аспарагиновой протеазы по п.1 или 2,
где молокосвертывающий фермент аспарагиновая протеаза представляет собой химозин Camelius dromedarius, содержащий полипептидную аминокислотную последовательность, представленную на Фиг. 5 в настоящем документе (названную "Camel_chymosin"), или вариант химозина Camelius dromedarius, содержащий полипептидную последовательность, обладающую по меньшей мере 90% (предпочтительно по меньшей мере 95%, более предпочтительно по меньшей мере 99%) идентичностью последовательности с полипептидной аминокислотной последовательностью верблюжьего химозина, представленной на Фиг. 5 в настоящем документе; или
где молокосвертывающий фермент аспарагиновая протеаза представляет собой бычий пепсин, содержащий полипептидную аминокислотную последовательность, представленную на Фиг. 5 в настоящем документе (названную "Cow_pepsin"), или вариант бычьего пепсина, содержащий полипептидную последовательность, обладающую по меньшей мере 90% (предпочтительно по меньшей мере 95%, более предпочтительно по меньшей мере 99%) идентичностью последовательности с полипептидной аминокислотной последовательностью бычьего пепсина, представленной на Фиг. 5 в настоящем документе.
4. Композиция молокосвертывающего фермента аспарагиновой протеазы по п.1 или 2, где полимер представляет собой полиэтиленгликоль (ПЭГ), поливинилполипирролидон, поливиниловый спирт, поливинилацетат, полиакрилонитрил, полиакрилат, полиметакрилат, полисорбат или Бридж 35.
5. Композиция молокосвертывающего фермента аспарагиновой протеазы по п.4, где полимер представляет собой полиэтиленгликоль (ПЭГ), полисорбат 20 или Бридж 35 и где ПЭГ имеет молекулярную массу от 5000 г/моль до 15000 г/моль.
6. Композиция молокосвертывающего фермента аспарагиновой протеазы по п.1, или 2, или 5,
где активность фермента согласно абзацу (i) составляет от 100 IMCU/г композиции до 10000 IMCU/г композиции; и
где концентрация полимера согласно абзацу (ii) составляет от 100 млн-1 до 2500 млн-1 (масс/масс); и
- где удельная активность молокосвертывающего фермента аспарагиновой протеазы выше 300 IMCU/мг общего белка молокосвертывающего фермента аспарагиновой протеазы, где молокосвертывающий фермент аспарагиновая протеаза представляет собой химозин Camelius dromedarius, содержащий полипептидную аминокислотную последовательность, представленную на Фиг. 5 в настоящем документе (названную "Camel_chymosin"), или вариант химозина Camelius dromedarius, содержащий полипептидную последовательность, обладающую по меньшей мере 90% (предпочтительно по меньшей мере 95%, более предпочтительно по меньшей мере 99%) идентичностью последовательности с полипептидной аминокислотной последовательностью верблюжьего химозина, представленной на Фиг. 5 в настоящем документе; или
- где удельная активность молокосвертывающего фермента аспарагиновой протеазы выше 150 IMCU/мг общего белка молокосвертывающего фермента аспарагиновой протеазы, где молокосвертывающий фермент аспарагиновая протеаза представляет собой бычий химозин, содержащий полипептидную аминокислотную последовательность, представленную на Фиг. 5 в настоящем документе (названную "Cow_chymosin"), или вариант бычьего химозина, содержащий полипептидную последовательность, обладающую по меньшей мере 90% (предпочтительно по меньшей мере 95%, более предпочтительно по меньшей мере 99%) идентичностью последовательности с полипептидной аминокислотной последовательностью бычьего химозина, представленной на Фиг. 5 в настоящем документе; и
где если композиция представляет собой жидкую композицию, то эта жидкая композиция имеет общую массу от 10 г до 10000 кг; и
где если композиция представляет собой сухую гранулированную композицию, то эта сухая гранулированная композиция имеет общую массу от 0,5 г до 50 кг.
7. Способ хранения композиции молокосвертывающего фермента аспарагиновой протеазы, который включает следующие стадии:
(a): обеспечение композиции молокосвертывающего фермента аспарагиновой протеазы по п.1 или 2; и
(b): хранение композиции в течение периода от 90 суток до 2000 суток при температуре от -10°С до 50°С.
8. Способ получения продукта на основе молока, включающий добавление эффективного количества композиции молокосвертывающего фермента аспарагиновой протеазы по п.1 или 2 к молоку и выполнение последующих стадий изготовления с получением продукта на основе молока; и
где молоко представляет собой овечье молоко, козье молоко, буйволиное молоко, молоко самки яка, молоко ламы, верблюжье молоко или коровье молоко; и
где продукт на основе молока представляет собой кисломолочный продукт, творог или сыр.
9. Способ по п.8, где продукт на основе молока представляет собой пищевой или кормовой продукт.
10. Способ по п.8, где композицию молокосвертывающего фермента аспарагиновой протеазы сначала хранят в соответствии со способом хранения молокосвертывающего фермента аспарагиновой протеазы по п. 7, а затем добавляют к молоку, как указано в п.8.
11. Способ выделения интересующего молокосвертывающего фермента аспарагиновой протеазы из водной среды, содержащей такой интересующий фермент, где способ включает стадии:
(i): получения неочищенного водного образца аспарагиновой протеазы;
(ii): добавления полимера в концентрации от 50 млн-1 до 2500 млн-1 к водному образцу со стадии (i) с получением образца, содержащего полимер; и
(iii): выделения аспарагиновой протеазы из образца, содержащего полимер, со стадии (ii) и получение, таким образом, выделенного интересующего молокосвертывающего фермента аспарагиновой протеазы;
где полимер представляет собой полимер, обладающий характеристиками (а), (b) и (с) и возможно (d), где
(a): полимер представляет собой полимер по меньшей мере одного мономера, выбранного из группы мономеров, состоящей из: этиленоксида, винилполипирролидона, винилового спирта, винилацетата, акрилонитрила, акрилата и метакрилата; и
(b): полимер представляет собой полимер с молекулярной массой от 200 г/моль до 50000 г/моль; и
(c): полимер представляет собой полимер с числом повторяющегося мономера/элемента (так называемым числом "n") от n, равного 5, до n, равного 1250; и
(d): возможно полимер, обладающий приведенными выше характеристиками (а), (b) и (с), может представлять собой замещенный полимер, содержащий одно или более соединений-заместителей, отличных от мономеров, обладающих характеристикой (а), и если полимер представляет собой замещенный полимер, молекулярная масса замещенного полимера как такового находится в диапазоне характеристики (b), а молекулярная масса соединения(ий)-заместителя(ей) меньше молекулярной массы полимерной части замещенного полимера.
12. Способ по п.11 при условии, что этот способ не является способом, в котором ПЭГ и неорганическую соль добавляют к водному образцу со стадии (i) таким образом, чтобы сформировалась жидкостно-жидкостная (водная) двухфазная система, и затем извлекают/выделяют аспарагиновую протеазу из фазы ПЭГ.
13. Способ по п.11, где стадия выделения (iii) включает следующие стадии:
(A): нанесение образца, содержащего полимер, со стадии (ii) на твердую фазу, включающую твердую матрицу-основание, содержащую лиганды, которые содержат гидрофобную часть, для получения адсорбции интересующей аспарагиновой протеазы на лиганде; и
(B): элюирование интересующей аспарагиновой протеазы с твердой фазы для извлечения аспарагиновой протеазы и получение, таким образом, очищенного выделенного интересующего молокосвертывающего фермента аспарагиновой протеазы.
14. Способ по п.11, где стадии (i)-(iii) в п.11 включают:
(i): нанесение водного образца аспарагиновой протеазы со стадии (i) в п. 11 на твердую фазу, включающую твердую матрицу-основание, содержащую лиганды, которые содержат гидрофобную часть, для получения адсорбции интересующей аспарагиновой протеазы на лиганде;
(ii): добавление полимера со стадии (ii) в п.11 представляет собой добавление к элюирующему буферу; и
(iii): стадия выделения (iii) в п.11 включает элюирование интересующей аспарагиновой протеазы с твердой фазы для извлечения аспарагиновой протеазы и получение, таким образом, очищенного выделенного интересующего молокосвертывающего фермента аспарагиновой протеазы.
15. Способ выделения молокосвертывающего фермента аспарагиновой протеазы по п.11,
где молокосвертывающий фермент аспарагиновая протеаза представляет собой химозин Camelius dromedarius, содержащий полипептидную аминокислотную последовательность, представленную на Фиг. 5 в настоящем документе (названную "Camel_chymosin"), или вариант химозина Camelius dromedarius, содержащий полипептидную последовательность, обладающую по меньшей мере 90% (предпочтительно по меньшей мере 95%, более предпочтительно по меньшей мере 99%) идентичностью последовательности с полипептидной аминокислотной последовательностью верблюжьего химозина, представленной на Фиг. 5 в настоящем документе; или
где молокосвертывающий фермент аспарагиновая протеаза представляет собой бычий пепсин, содержащий полипептидную аминокислотную последовательность, представленную на Фиг. 5 в настоящем документе (названную "Cow_pepsin"), или вариант бычьего пепсина, содержащий полипептидную последовательность, обладающую по меньшей мере 90% (предпочтительно по меньшей мере 95%, более предпочтительно по меньшей мере 99%) идентичностью последовательности с полипептидной аминокислотной последовательностью бычьего пепсина, представленной на Фиг. 5 в настоящем документе.
16. Способ выделения молокосвертывающего фермента аспарагиновой протеазы по п.11, где полимер представляет собой полиэтиленгликоль (ПЭГ), поливинилполипирролидон, поливиниловый спирт, поливинилацетат, полиакрилонитрил, полиакрилат, полиметакрилат, полисорбат или Бридж 35.
17. Способ выделения молокосвертывающего фермента аспарагиновой протеазы по п. 16, где полимер представляет собой полиэтиленгликоль (ПЭГ), полисорбат 20 или Бридж 35 и где ПЭГ имеет молекулярную массу от 5000 г/моль до 15000 г/моль.
18. Способ выделения молокосвертывающего фермента аспарагиновой протеазы по п.11,
где полимер добавляют на стадии (ii) в концентрации полимера от 100 млн-1 до 2500 млн-1 (масс./масс.); и
где полученный на стадии (iii) выделенный молокосвертывающий фермент аспарагиновая протеаза обладает чистотой по меньшей мере 60% масс./масс. общего белка (то есть 60% масс./масс. общего белка в выделенной композиции составляет выделенный свертывающий фермент аспарагиновая протеаза); и
где полимер представляет собой полиэтиленгликоль (ПЭГ), поливинилполипирролидон, поливиниловый спирт, поливинилацетат, полиакрилонитрил, полиакрилат, полиметакрилат или Бридж 35; и
где, когда полимер представляет собой полиэтиленгликоль (ПЭГ), поливинилполипирролидон, поливиниловый спирт, поливинилацетат, полиакрилонитрил, полиакрилат или полиметакрилат, этот полимер представляет собой полимер с молекулярной массой от 2000 г/моль до 30000 г/моль; и
где выделенный на стадии (iii) молокосвертывающий фермент аспарагиновая протеаза представляет собой фермент, который:
- обладает удельной активностью молокосвертывающего фермента аспарагиновой протеазы выше 300 IMCU/мг общего белка молокосвертывающего фермента аспарагиновой протеазы, более предпочтительно обладает удельной активностью молокосвертывающего фермента аспарагиновой протеазы выше 350 IMCU/мг общего белка молокосвертывающего фермента аспарагиновой протеазы, где молокосвертывающий фермент аспарагиновая протеаза представляет собой химозин Camelius dromedarius, содержащий полипептидную аминокислотную последовательность, представленную на Фиг. 5 в настоящем документе (названную "Camel_chymosin"), или вариант химозина Camelius dromedarius, содержащий полипептидную последовательность, обладающую по меньшей мере 90% (предпочтительно по меньшей мере 95%, более предпочтительно по меньшей мере 99%) идентичностью последовательности с полипептидной аминокислотной последовательностью верблюжьего химозина, представленной на Фиг. 5 в настоящем документе; или
- обладает удельной активностью молокосвертывающего фермента аспарагиновой протеазы выше 150 IMCU/мг общего белка молокосвертывающего фермента аспарагиновой протеазы, более предпочтительно обладает удельной активностью молокосвертывающего фермента аспарагиновой протеазы выше 165 IMCU/мг общего белка молокосвертывающего фермента аспарагиновой протеазы, где молокосвертывающий фермент аспарагиновая протеаза представляет собой бычий химозин, содержащий полипептидную аминокислотную последовательность, представленную на Фиг. 5 в настоящем документе (названную "Cow_chymosin"), или вариант бычьего химозина, содержащий полипептидную последовательность, обладающую по меньшей мере 90% (предпочтительно по меньшей мере 95%, более предпочтительно по меньшей мере 99%) идентичностью последовательности с полипептидной аминокислотной последовательностью бычьего химозина, представленной на Фиг. 5 в настоящем документе; и
где водный образец аспарагиновой протеазы со стадии (i) получают путем рекомбинантного продуцирования молокосвертывающего фермента аспарагиновой протеазы в продуцирующей клетке-хозяине (например, в эукариотической продуцирующей клетке-хозяине, такой как клетка Aspergillus); и
где способ выделения интересующего молокосвертывающего фермента аспарагиновой протеазы выполняют путем использования по меньшей мере одной методики очистки, выбранной из группы, состоящей из: хроматографии, колоночной хроматографии, адсорбции на слое, адсорбции в расширенном слое (ЕВА), периодической адсорбции, адсорбции на мембране и ионообменной хроматографии (IEC).
19. Способ выделения молокосвертывающего фермента аспарагиновой протеазы по любому из пп.13-18,
где полимер на стадии (ii) добавляют в концентрации полимера от 100 млн-1 до 2500 млн-1 (масс./масс.); и
где полученный на стадии (iii) выделенный молокосвертывающий фермент аспарагиновая протеаза обладает чистотой по меньшей мере 60% масс./масс. общего белка (то есть 60% масс./масс. общего белка в выделенной композиции составляет выделенный свертывающий фермент аспарагиновая протеаза); и
где полимер представляет собой полиэтиленгликоль (ПЭГ) с молекулярной массой от 5000 г/моль до 15000 г/моль или Бридж 35; и
где выделенный на стадии (iii) молокосвертывающий фермент аспарагиновая протеаза представляет собой фермент, который:
- обладает удельной активностью молокосвертывающего фермента аспарагиновой протеазы выше 300 IMCU/мг общего белка молокосвертывающего фермента аспарагиновой протеазы, более предпочтительно обладает удельной активностью молокосвертывающего фермента аспарагиновой протеазы выше 350 IMCU/мг общего белка молокосвертывающего фермента аспарагиновой протеазы, где молокосвертывающий фермент аспарагиновая протеаза представляет собой химозин Camelius dromedarius, содержащий полипептидную аминокислотную последовательность, представленную на Фиг. 5 в настоящем документе (названную "Camel_chymosin"), или вариант химозина Camelius dromedarius, содержащий полипептидную последовательность, обладающую по меньшей мере 90% (предпочтительно по меньшей мере 95%, более предпочтительно по меньшей мере 99%) идентичностью последовательности с полипептидной аминокислотной последовательностью верблюжьего химозина, представленной на Фиг. 5 в настоящем документе; или
- обладает удельной активностью молокосвертывающего фермента аспарагиновой протеазы выше 150 IMCU/мг общего белка молокосвертывающего фермента аспарагиновой протеазы, более предпочтительно обладает удельной активностью молокосвертывающего фермента аспарагиновой протеазы выше 165 IMCU/мг общего белка молокосвертывающего фермента аспарагиновой протеазы, где молокосвертывающий фермент аспарагиновая протеаза представляет собой бычий химозин, содержащий полипептидную аминокислотную последовательность, представленную на Фиг. 5 в настоящем документе (названную "Cow_chymosin"), или вариант бычьего химозина, содержащий полипептидную последовательность, обладающую по меньшей мере 90% (предпочтительно по меньшей мере 95%, более предпочтительно по меньшей мере 99%) идентичностью последовательности с полипептидной аминокислотной последовательностью бычьего химозина, представленной на Фиг. 5 в настоящем документе; и
где водный образец аспарагиновой протеазы со стадии (i) получают путем рекомбинантного продуцирования молокосвертывающего фермента аспарагиновой протеазы в продуцирующей клетке-хозяине (например, в эукариотической продуцирующей клетке-хозяине, такой как клетка Aspergillus); и
где способ выделения интересующего молокосвертывающего фермента аспарагиновой протеазы выполняют путем использования по меньшей мере одной методики очистки, выбранной из группы, состоящей из: хроматографии, колоночной хроматографии, адсорбции на слое, адсорбции в расширенном слое (ЕВА), периодической адсорбции, адсорбции на мембране и ионообменной хроматографии (IEC); и
где гидрофобная часть лиганда представляет собой бензильную группу; и
где молокосвертывающий фермент аспарагиновая протеаза представляет собой химозин Camelius dromedarius, содержащий полипептидную аминокислотную последовательность, представленную на Фиг. 5 в настоящем документе (названную "Camel_chymosin"), или вариант химозина Camelius dromedarius, содержащий полипептидную последовательность, обладающую по меньшей мере 90% (предпочтительно по меньшей мере 95%, более предпочтительно по меньшей мере 99%) идентичностью последовательности с полипептидной аминокислотной последовательностью верблюжьего химозина, представленной на Фиг. 5 в настоящем документе;
или где молокосвертывающий фермент аспарагиновая протеаза представляет собой бычий пепсин, содержащий полипептидную аминокислотную последовательность, представленную на Фиг. 5 в настоящем документе (названную "Cow_pepsin"), или вариант бычьего пепсина, содержащий полипептидную последовательность, обладающую по меньшей мере 90% (предпочтительно по меньшей мере 95%, более предпочтительно по меньшей мере 99%) идентичностью последовательности с полипептидной аминокислотной последовательностью бычьего пепсина, представленной на Фиг. 5 в настоящем документе.
| Расширитель для ступенчатого бурения восстающих выработок | 1987 |
|
SU1492060A1 |
| WO 2012127005 A1, 27.09.2012 | |||
| Дроссельное устройство | 1973 |
|
SU477284A1 |
| ОСАЖДЕНИЕ И ОЧИСТКА БЕЛКОВ ПОЛИЭЛЕКТРОЛИТАМИ | 2008 |
|
RU2474585C2 |
| ELLAIAH Р | |||
| ET AL | |||
| A Review on Microbial Alkaline Proteases Journal of Scientific & Industrial Research, Vol.61, September 2002, pp | |||
| Регистратор для дел | 1925 |
|
SU690A1 |
Авторы
Даты
2019-04-09—Публикация
2014-07-11—Подача