Область техники
Изобретение относится к области биотехнологии и генетической инженерии и касается получения трансформанта дрожжей Komagataella phaffii (Pichia pastoris), продуцирующего химозин Vicugna pacos и содержащего в хромосомной ДНК синтетический ген прохимозина альпака V. pacos с оптимизированными для метилотрофных дрожжей кодонами, кодирующий прохимозин альпака V. pacos.
Фермент, секретируемый трансформантом K. phaffii в культуральную жидкость во время ферментации, обладает молокосвертывающей активностью - свойством, характерным для зрелого химозина. Стадия аутокаталитической активации прохимозина в активный химозин, проводимая in vitro при кислых значениях рН, не требуется. Химозин применяется для коагуляции молока при изготовлении любых видов сычужных сыров.
Уровень техники
Химозин, или реннин (ЕС 3.4.23.4) - кислая аспарагиновая (аспартатная) эндопептидаза из класса гидролаз. Химозин обладает высокой специфичностью к связи Phe105-Met106 в молекуле каппа-казеина (k-казеин) и низкой общей протеолитической активностью и находит широкое применение в сыроделии в качестве молокосвертывающего фермента.
Эталонным молокосвертывающим ферментом считается химозин коровы.
На ранней стадии в клетках желудка крупного рогатого скота молокосвертывающий фермент синтезируется как неактивный препрохимозин с молекулярной массой 43.0 кДа. После транспортировки препрохимозина в эндоплазматический ретикулум сигнальный пептид, состоящий из 16 аминокислотных остатков, отщепляется и появляется прохимозин - каталитически неактивный зимоген, который состоит из 365 аминокислот и имеет молекулярный вес 40.78 кДа. Про-пептид играет важную роль в правильном фолдинге и транспортировке (секреции из клетки) и обеспечивает ферментативную неактивность прохимозина, блокируя активный центр. Аутокаталитическая активация прохимозина происходит при изменении рН. При рН 4.2 от прохимозина удаляются 42 аминокислотных остатка с N-конца и образуется активный химозин, состоящий из 323 аминокислотных остатков и имеющий молекулярный вес 35.6 кДа. [Critical Reviews in Biotechnology, 2010, 30:4, 243-258, DOI: 10.3109/07388551.2010.483459].
Химозин является основным действующим агентом сычужного фермента, который традиционно используется для производства сыров. Сычужный фермент, представляющий собой смесь химозина и пепсина, получают обычно из сычуга - четвертого отдела желудка телят крупного рогатого скота. Соотношение показателей высокоспецифичной молокосвертывающей и побочной протеолитической активностей определяет качественную характеристику любого молочного коагулянта [Biotechnol Appl Biochem. 1988. №. 10. Р 522-535.].
Производители молокосвертывающего ферментного препарата столкнулись с нехваткой сычугов молочных телят, основного сырья для производства сычужного фермента, со второй половины XX века. С 1961 года производство сыров выросло в 3.5 раза, и на данный момент доля на рынке сычужного фермента, получаемого из сычугов молочных телят крупного рогатого скота, составляет 20-30% [Recent Adv. In DNA and Gene Sequences. 2014, vol. 8, no. 1, p. 44-55].
Альтернативой природным химозинам животного происхождения являются их рекомбинантные аналоги, получаемые с использованием методов генной инженерии. Основное преимущество рекомбинантного химозина - низкая неспецифическая протеолитическая активность, в то время как сычужный фермент содержит 2-20% пепсина, действие которого приводит к потерям части пептидов с сывороткой. Рекомбинантный химозин получил GRAS (Generally recognized as safe) статус для использования в сыроделии, подтвержденный FDA (Food and Drug Administration), имеет кошерную сертификацию и обеспечивает гуманное отношение к животным. Промышленное производство рекомбинантного химозина осуществляют, например, такие компании как Pfizer, Chr. Hansen, Milwaukee (Chy-max, продуцент Aspergillus niger var.awamopi), DSM Food Specialties (Maxiren, продуцент Kluyveromyces lactis) [Critical Reviews in Biotechnology, 2010, 30:4, 243-258, DOI: 10.3109/07388551.2010.483459].
Первые рекомбинантные аналоги прохимозина теленка были получены в 1983 году в системах экспрессии Escherichia coli [Proc. Nat. Acad. Sci. USA, 1983, 80, 3671-3675,] и дрожжей Saccharomyces cerevisiae [Gene, 1983, 24, 1-14]. Однако, прохимозин накапливался внутри клеток в нерастворимой форме, что значительно затрудняло его выделение, очистку и превращение в активный химозин.
В 1985 году Смит демонстрирует, что, если объединить кодирующую последовательность прохимозина коровы с дрожжевым сигнальным пептидом, то клетки S. cerevisiae начинают секретировать прохимозин в культуральную среду [Science, 1985, 229, 1219-1224. https://www.jstor.org/stable/1696025].
Данный подход - введение в клетки реципиента конструкции, содержащей ген прохимозина, объединенный с сигнальным пептидом, позволяет обеспечить секрецию прохимозина из клетки, и широко используется в настоящее время для биосинтеза животного прохимозина в дрожжевых системах экспрессии Kluyveromyces lactis [BioTechnology, 1990, 8, 135-139], S. cerevisiae [Journal of Biotechnology, 2004, 114, 69-79], Komagataella phaffii (Pichia pastoris) [J Agric Food Chem., 2008, 56, 10606-10610; World J Microbiol Biotechnol., 2012, 28, 2087-2093. DOI 10.1007/s11274-012-1012-7].
Дрожжи секретируют незначительное количество собственных белков в культуральную жидкость, что облегчает выделение и очистку рекомбинантного белка.
В последние годы для получения рекомбинантного прохимозина все чаще используют системы экспрессии на базе дрожжей Komagataella phaffii {Pichia pastoris), в которых транскрипция целевого гена осуществляется под контролем сильных конститутивного промотора гена GAP или промотора гена АОХ1, индуцируемого метанолом. Экспрессионная платформа на базе метилотрофных дрожжей K. phaffii коммерчески доступна, на ее основе получают продуценты разных белков, например, ферментов, протеаз, ингибиторов протеаз, рецепторов, антител, регуляторных белков [Yeast, 2005, 22, 249-270; Journal of Biotechnology, 2015, 202, 118-134]. Процесс культивирования экономичен за счет использования дешевых сред и возможности проведения ферментации в культуре высокой плотности клеток; высокий уровень экспрессии обеспечивается наличием сильных промоторов, также эти дрожжи способны выполнять многие посттрансляционные модификации, что особенно важно для экспрессии эукариотических белков [Appl. Microbiol. Biotechnol., 2014, 98, 5301-5317. DOI 10.1007/s00253-014-5732-5].
Большинство описанных рекомбинантных штаммов K. phaffii (P. pastoris) секретируют в КЖ неактивный прохимозин, активацию которого осуществляют in vitro в кислой среде при рН 2.0-3.0 с последующей нейтрализацией до рН 6.0.
В работе [Protein Expression and Purification, 2015, 111, 75-81] описан трансформант P. pastoris GS115, который содержит ген прохимозина одногорбого верблюда в рамке с сигнальной последовательностью MFα, транскрипция которого контролируется промотором гена АОХ1. При культивировании в 5 л ферментере в оптимальных условиях продуцент через 144 ч ферментации набирает 270 г/л сырой биомассы и секретирует 0.3 мг/мл прохимозина. После активации прохимозина молокосвертывающая активность химозина составляет 4000 ед./мл.
В работе [Heliyon, 2021, 7, е07137. https://doi.org/10.1016/j.heliyon.2021.е07137] описан трансформант P. pastoris GS115, который содержит плазмиду pGAPZαA/ProchymCB с геном прохимозина двугорбого верблюда Camelus bactrianus, транскрипция которого находится под контролем конститутивного промотора pGAP. При культивировании в 10 л ферментере в богатой среде YPD и при оптимальных условиях продуцент через 96 ч ферментации секретирует 0.08 мг/мл прохимозина, количество которого не изменяется до 144 ч, при этом молокосвертывающая активность после активации фермента составляет 1412 SU/ml.
Описан трансформант K. phaffii GS115, содержащий ген прохимозина дикого кролика Oryctolagus cuniculus с оптимизированными кодонами и в рамке сигнальной последовательностью ScMFα из S. cerevisiae, транскрипция которого находится под контролем промотора гена АОХ1. При культивировании в колбах через 144 ч продуцент секретирует 0.15 мг/мл общего белка, после активации прохимозина молокосвертывающая активность химозина оставляет 1.6 IMCU/мл [Protein Expression and Purification, 2021, 183, 105874. https://doi.org/10.1016/j.pep.2021.1058741.
Исключение этапа кислотной активации целевого фермента в КЖ снижает время получения ферментного препарата и его себестоимость.
Рекомбинантный химозин в активной форме способны секретировать нитевидные грибы, такие как Trichoderma reesei и Aspergillus oryzae [J. Biotechnol. 1991, 17, 35-49; Appl. Microbiol. Biotechnol. 1993, 40, 327-332], однако культивирование грибных продуцентов в ферментере экономически затратно.
Впервые способ получения активного рекомбинантного химозина буйвола, секретируемого клетками дрожжей описан в [ЕР 2216402 A1; J. Agric. Food Chem., 2008, 56, 10606-10610. DOI:10.1021/jf802339e]. Ген прохимозина буйвола (buffalo Bubalus arnee bubalis) клонируют в интегративный экспрессионный вектор pGAPZαA (Invitrogen) с промотором гена GAP и трансформируют в клетки P. pastoris GS115. Штамм-продуцент при культивировании в колбах в среде YPD при 30°С и 300 rpm секретирует в КЖ химозин, не требующий стадии аутокаталитической активации. Молокосвертывающая активность фермента составляет 850 ед./мл КЖ через 40 ч культивирования и снижается до 720 ед./мл к 140 ч культивирования.
В работе [Protein Expression and Purification, 2013, 92, 235-244. http://dx.doi.org/10.1016/j.pep.2013.08.018] описан трансформант P. pastoris GS115, содержащий в геноме несколько копий гена прохимозина В быка с оптимизированными для дрожжей P. pastoris кодонами под контролем промотора гена АОХ1. Культивирование осуществляют при оптимальных условиях и поддержании рН среды равном 4.0 на последней стадии ферментации. Молокосвертывающая активность рекомбинантного химозина, образующегося в культуральной жидкости составляет 48 IMCU/мл КЖ.
В [Protein Expression and Purification, 2015, 111, 75-81. http://dx.doi.org/10.1016/j.pep.2015.03.012] показано, что при культивировании трансформанта P. pastoris GS115, содержащего ген прохимозина верблюда, в среде YPM (среда YP с метанолом) при кислых значениях рН 3.64, рН 3.84 или рН 4.07 в КЖ образуется фермент в активной форме, в то время как при рН более 4.25 в КЖ аккумулируется неактивный прохимозин и необходимо проводить активацию фермента, чтобы наблюдать коагуляцию молока.
В настоящее время активно исследуются новые источники рекомбинантного прохимозина различного происхождения, обладающие необходимыми свойствами и не требующие активации in vitro.
В источниках известности [RU 2729403] описано получение трансформанта Escherichia coli - продуцента рекомбинантного химерного белка прохимозина, содержащего ген прохимозина альпака V. pacos с оптимизированными для Е. coli кодонами, объединенный на N-конце с последовательностью тиоредоксина для улучшения рефолдинга. В клетках Е. coli химерный прохимозин альпака аккумулируется в тельцах включения в виде неактивного зимогена. Для выделения телец включения, солюбилизации, полуаффинной очистки и рефолдинга целевого белка требуются определенные методические приемы, время и финансовые затраты. Молокосвертывающая активность препарата рекомбинантного химерного химозина из телец включения E. coli спустя сутки и две недели после окончания процедуры рефолдинга составляет, соответственно, 535.5 УЕ/мл и 1009 УЕ/мл или, соответственно, 4.1 IMCU/мл и 7.8 IMCU/мл.
Рекомбинантный химозин альпака из клеток Е. coli характеризуется высокой специфичностью действия к k-казеину, зависимость его специфической активности от рН и концентрации CaCl2 соответствует критериям использования молокосвертывающих ферментов при производстве сычужных сыров. Порог его термоинактивации составляет 60°С, что на 10-15°С выше по сравнению с таковым рекомбинантного химозина коровы. Удельная активность рекомбинантного химозина альпака в ферментном препарате, полученном после выделения и очистки прохимозина из телец включения с последующей кислотной активацией и нейтрализацией in vitro, составляет 10070 УЕ/мг.- [Прикладная биохимия и микробиология, 2018, 54 (6), 585 -593].
Технической проблемой, на решение которой направлено заявляемое изобретение является поиск новых методов экспрессирования в дрожжах гена прохимозина альпака V. pacos, кодирующий прохимозин.
Раскрытие сущности изобретения
Техническим результатом заявляемого изобретения является расширение арсенала дрожжевых рекомбинантных микроорганизмов, продуцирующих химозин в активной форме.
Он достигается тем, что получен трансформант дрожжей Komagataella phaffii, продуцирующий активный химозин альпака Vicugna pacos, содержащий в хромосомной ДНК оптимизированный синтетический ген прохимозина альпака Vicugna pacos, нуклеотидная последовательность которого приведена в перечне последовательностей под номером SEQ ID NO: 1.
Оптимизированная последовательность нуклеотидов создана на основе аминокислотной последовательности прохимозина альпака V. pacos (NCBI Reference sequence: XP_031536138.1) с учетом данных о частоте встречаемости кодонов в геноме метилотрофных дрожжей (http://www.kazusa.or.jp/codon/P.html). Полученная последовательность (далее Vp-prochy-opt), размером 1101 п.н. приведена в перечне последовательностей под номером SEQ ID NO: 1.
Краткое описание чертежей
Фиг. 1. Экспрессионная кассета
Фиг. 2. Тест на коагуляцию молока
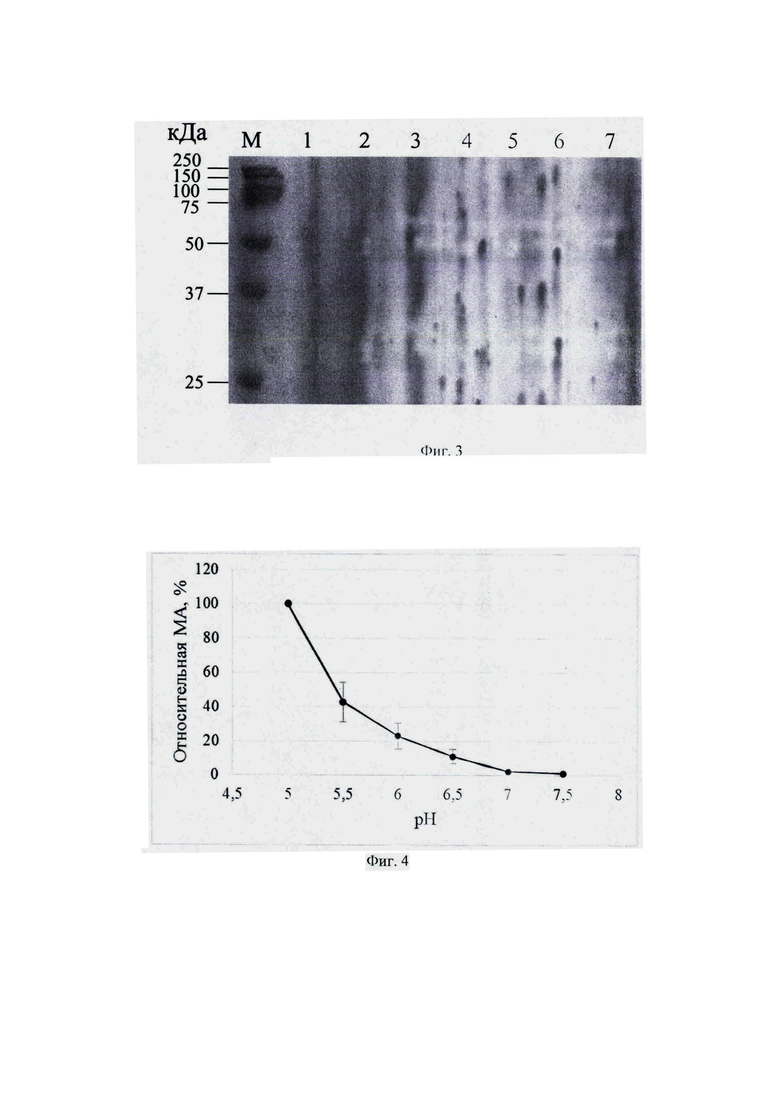
Фиг. 3. SDS-PAGE электрофорез образцов КЖ, содержащих рекомбинантный химозин.
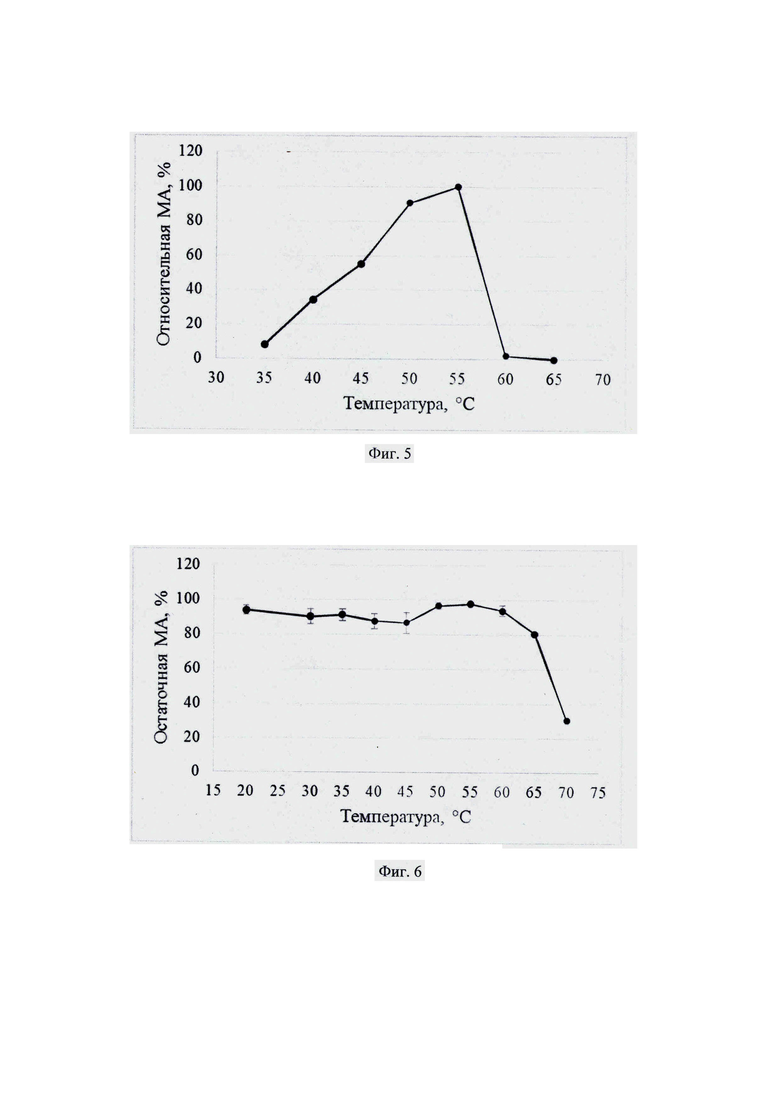
Фиг. 4. Зависимость молокосвертывающей активности (МА, %) от рН субстрата.
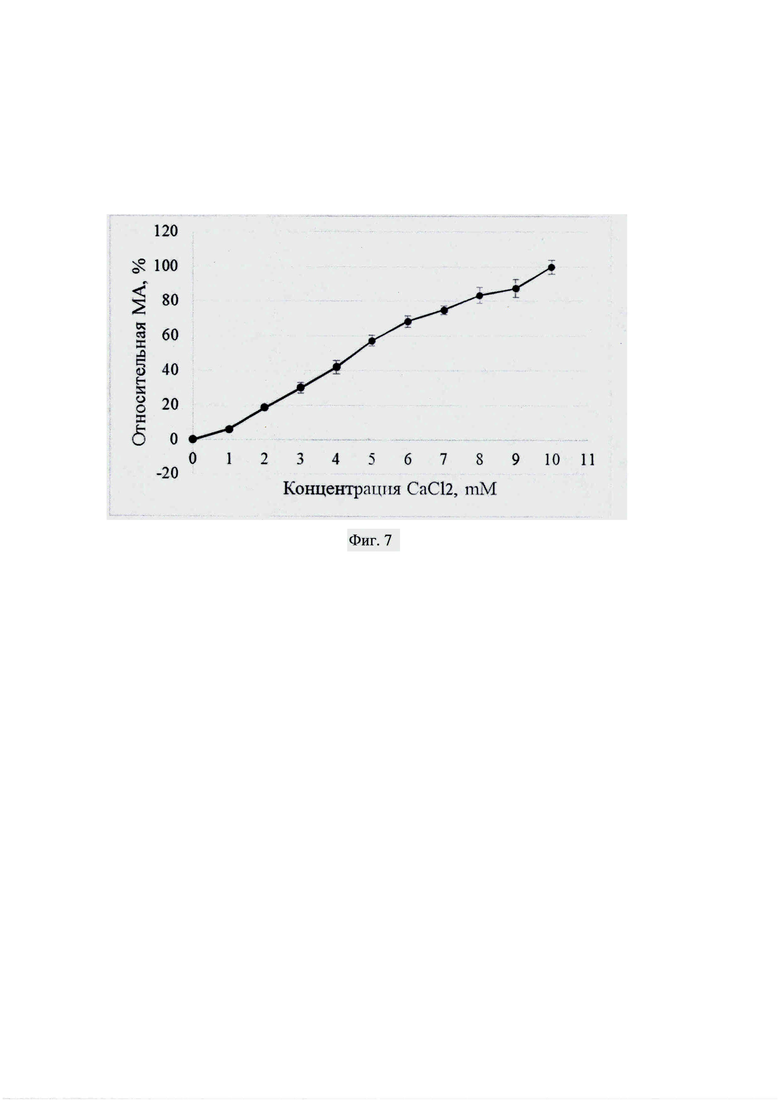
Фиг. 5. Зависимость молокосвертывающей активности (МА, %) от температуры (°С).
Фиг. 6. Зависимость молокосвертывающей активности (МА, %) от температуры прогревания фермента (термостабильность).
Фиг. 7. Зависимость молокосвертывающей активности (МА, %) от концентрации хлорида кальция (мМ).
Осуществление изобретения
Получение заявляемого трансформанта включает трансформацию в клетки дрожжей K. phaffii экспрессионной кассеты, содержащей:
- синтетический ген, нуклеотидная последовательность которого приведена в перечне последовательностей под номером SEQ ID NO: 1, названный Vp-prochy-opt и кодирующий прохимозин альпака,
- сигнальный пептид для осуществления секреции фермента в культуральную жидкость,
- промотор и терминатор гена АОХ1 из дрожжей K. phaffii,
- маркерный ген HIS4 с регуляторными элементами и, предпочтительно,
- сайт для гомологичной интеграции в хромосомную ДНК.
Конструирование экспрессионной кассеты осуществляют стандартными методами генетической инженерии [Sambrook J., Maniatis Т., Fritsch E. Molecular cloning: a laboratory manual. - N.Y.: Cold Spring Harbor Laboratory, 1989] с использованием генетических элементов, подходящих для работы с дрожжами K. phaffii.
В качестве промоторов могут быть использованы АОХ1, DAS, FLD1, ICL1, РН089, THI11, ADH1, ENO1, GUT1, GAP, TEF1, PGK1, GCW14 или другие [Appl. Microbiol. Biotechnol., 2014, 98, 5301-5317].
В качестве сигнальных пептидов используют, например, пре-про-лидерную последовательность MFα из Saccharomyces cerevisiae или последовательности PHO1, SUC2, РНА-Е, KILM1, pGKL, CLY, CLY-L8, K28 pre-pro-toxin или другие [Appl. Microbiol. Biotechnol., 2014, 98, 5301-5317].
В качестве селективных маркеров используют любые подходящие маркеры, например, гены резистентности к антибиотикам зеоцину, генетицину (G418) или бластицидину С, а также гены комплементирующие ауксотрофные мутации в геноме K. phaffii, например, HIS4, МЕТ2, ADE1, ARG4, URA3, URA5, GUT1 [Yeast, 2005, 22, 249-270].
В качестве плечей для гомологичной интеграции используют, например, последовательности генов AOX1, HIS4 [http://www.thermofisher.com/order/catalog/product/V17520] или другие последовательности, гомологичные участкам хромосомы дрожжей K. phaffii.
Интеграцию осуществляют путем как гомологичной, так и негомологичной рекомбинации. Трансформацию экспрессионной кассеты в клетки дрожжей K. phaffii осуществляют любым подходящим методом, например, методом электоропорации [http://tools.thermofisher.com/content/sfs/manuals/pich_man.pdf] или методом с использованием полиэтиленгликоля или протопластов [http://www.thermofisher.com/order/catalog/product/K173001].
Полученные трансформанты тестируют на стабильность фенотипа «прототрофность по гистидину» и на наличие целевого гена в составе хромосомной ДНК.
Исследование молокосвертывающей активности культуральной жидкости, полученной в результате культивировании сконструированного трансформанта показывает, что она содержит активную форму фермента - химозин, который образуется из прохимозина аутокаталитически без проведения in vitro кислотной активации.
Среди трансформантов отбирают наиболее продуктивный штамм K. phaffii N416 ВКПМ Y-5079 - продуцент химозина альпака V. pacos.
Пример 1. Конструирование трансформантов дрожжей K. phaffii, содержащих синтетический ген, кодирующий прохимозин из V. pacos
Последовательность гена Vp-prochy-opt с оптимизированными для метилотрофных дрожжей кодонами размером 1101 п.н., кодирующего прохимозин из альпака V. pacos, синтезируют методом, описанным в [Journal of Microbiological Methods, 2010, 81(2), 147-152], и получают ДНК последовательность, приведенную в перечне последовательностей под номером SEQ ID NO: 1.
При конструировании интегративной экспрессионной кассеты используют метод "фьюжн-ПЦР" [Gene, 1989, 77(1), 61-68].
Получают экспрессионную кассету размером 6870 п. н. (фиг. 1), в состав которой входят следующие генетические элементы:
1. Синтетический ген прохимозина Vp-prochy-opt, встроенный в рамку считывания с нуклеотидной последовательностью сигнального пептида MFα, под контролем промотора pAOX1;
2. Терминатор транскрипции tAOX1;
3. Дрожжевой селективный маркер HIS4, комплементирующий у дрожжей K. phaffii мутацию в гене HIS4;
4. Область интеграции - нуклеотидную последовательность 3'-АОХ1 локуса АОХ1.
Интегративную экспрессионную кассету трансформируют в штамм K. phaffii GS115 ВКПМ Y-2837 (his4-), который предварительно выращивают в жидкой питательной среде YP (мас. %: дрожжевой экстракт - 1, пептон - 2, вода - остальное) с добавлением глюкозы (2 мас. %) до концентрации 1×108 клеток на 1 мл. Клетки центрифугируют, промывают в ледяной стерильной воде, а затем в ледяном растворе 1М сорбитола. Затем клетки инкубируют в 25 мМ растворе дитиотрейтола в течение 15 мин. и промывают в ледяном растворе 1М сорбитола. Далее клетки ресуспендируют в ледяном растворе 1 M сорбитола в концентрации 1-5×109 клеток на 1 мл. Аликвоту, объемом 40 мкл клеточной суспензии, переносят в охлажденный эппендорф, добавляют 400 нг ДНК экспрессионной интеграционной кассеты, и инкубируют во льду 5 мин. Смесь клеток и ДНК переносят в предварительно охлажденную кювету для электропорации. Электропорацию проводят при следующих условиях: 1,5 кВ, 400 Ом, 25uF. Затем к клеткам добавляют 1 мл раствора 1М сорбитола, переносят в пробирки на 1.5 мл и инкубируют в шейкере при 30°С в течение 1 ч.
Селекцию трансформантов ведут в течение 5 суток при температуре 30°С на агаризованной среде ММ следующего состава (мас. %): Na2HPO4 - 0,6; KH2PO4 - 0,3; NaCl - 0,05; NH4Cl - 0,1; MgSO4 7H2O - 0,065; агар - 2; глюкоза - 2; CaCl2 - 0,07; биотин, мг - 0,0002; кальций пантотенат - 0,04; фолиевая кислота - 0,0002; ниацин - 0,04; р-аминобензойная к-та - 0,02; пиридоксин гидрохлорид - 0,04; рибофлавин - 0,02; тиамин гидрохлорид - 0,04; борная кислота - 0,05; CuSO4- 0,004; KJ - 0,01; FeCl3 - 0,02; натрий молибдат - 0,02; ZnSO4 - 0,04, вода - остальное.
Пример 2. Оценка продуктивности трансформантов K. phaffii с синтетическим геном прохимозина из V. pacos и доказательство биосинтеза активного химозина клетками K. phaffii, для активации которого не требуется обработка образцов культуральной жидкости кислотой
При трансформации дрожжей K. phaffii появляются как стабильные, интегративные, так и репликативные трансформанты. Отбор наиболее продуктивных трансформантов осуществляют среди стабильных трансформантов, содержащих кассету в составе хромосомной ДНК.
Тестирование на стабильность наследования признака «прототрофность по гистидину» проводят следующим образом. Трансформант K. phaffii растят в неселективных условиях, в жидкой среде YP с глюкозой (2 мас. %), в пробирках на качалке при 30°С в течение 24 ч, затем производят пять последовательных пересевов культуры из неселективных условий в пробирки со свежей средой YP, содержащей глюкозу (2 мас. %). Пробирки инкубируют на качалке при 30°С в течение 24 ч. Затем рассевают культуру до отдельных колоний на чашки Петри с агаризованной неселективной средой YP, содержащей глюкозу (2 мас. %). С помощью репликатора отбирают 100 независимых колоний и анализируют их на способность расти на селективной среде ММ и контрольной среде - ММ с гистидином (20 мкг/мл). Отсутствие колоний, не растущих на селективной среде ММ, указывает на то, что экспрессионная кассета содержится в клетках трансформантов в составе хромосомной ДНК.
Наличие целевого гена прохимозина в составе хромосомной ДНК отобранных интегративных трансформантов определяют методом ПЦР с использованием праймеров Vp-prochy-F: tctggtattaccagaatccctttgcac и Vp-prochy-R: ttatcagatggccttagcaagacccac. Наличие ПЦР-фрагментов размером 1101 п.н. подтверждает присутствие синтетического гена прохимозина в составе хромосомной ДНК полученных трансформантов. В качестве отрицательного контрольного образца используют хромосомную ДНК из штамма-реципиента K. phaffii GS115 ВКПМ Y-2837.
Исследования показывают, что стабильные трансформанты содержат ген прохимозина в хромосомной ДНК.
Отбирают 10 стабильных трансформантов, содержащих ген прохимозина в хромосомной ДНК.
Отбор трансформантов с наибольшей молокосвертывающей активностью осуществляют по результатам их культивирования в пробирках по следующей схеме:
- Посевную культуру выращивают в пробирках (50 мл) с 5 мл жидкой питательной среды YP с добавлением глюкозы (2 мас. %) при 30°С в течение 24 ч на качалке (250 об/мин). Посев ферментационной среды осуществляют в соотношении 1/10.
- Ферментацию проводят в питательной среде YP с добавлением глюкозы (2 мас. %) в течение 6 дней на качалке (250 об/мин) с температурой 30°С на стадии роста и 25°С на стадии индукции метанолом. Через 24 ч культивирования начинают индукцию метанолом, который добавляют в количестве 3 об. %, затем такое же количество метанола добавляют на 48 ч культивирования. В качестве контроля используют штамм-реципиент K. phaffii GS115 ВКПМ Y-2837. По окончании культивирования рН культуральной жидкости составляет 6.0.
Клетки трансформантов осаждают центрифугированием, а супернатант (КЖ) используют для определения молокосвертывающей активности.
Молокосвертывающую активность определяют по времени, которое необходимо для видимого выпадения хлопьевидного осадка стандартного молочного субстрата, приготовленного из сухого молока низкотемпературного сгущения с низким содержанием жира в растворе хлорида кальция (CaCl2) с концентрацией 0,5-1.5 г/л. рН раствора стандартного молочного субстрата 6.5. Время свертывания субстрата образцом молокосвертывающего фермента сравнивают с временем для эталонного стандарта, имеющего известную молокосвертывающую активность.
Молокосвертывающую активность (МА) рассчитывают по уравнению:
МА = МАст × Тст × Кобр/Кст × Тобр
где МАст - молокосвертывающая активность эталонного стандарта сычужного фермента;
Тст - продолжительность свертывания субстрата в реакции с образцом стандарта сычужного фермента, измеренная в секундах (сек);
Кобр - коэффициент разведения для образца;
Кст - коэффициент разведения для стандарта;
Тобр - продолжительность свертывания субстрата в реакции с образцом рекомбинантного фермента от добавления фермента до выпадения хлопьевидного осадка (сек).
Стандартный метод определения активности прохимозина в КЖ состоит из двух этапов. На первом этапе проводят аутокаталитическую активацию прохимозина в химозин путем титрования КЖ кислотой до рН 2.0 - 3.0, выдерживают образцы в кислой среде в течение 2 ч, затем проводят нейтрализацию до рН 6.0. На втором этапе определяют способность фермента в КЖ коагулировать молоко с низким содержанием жира.
С целью проверки наличия в КЖ активной формы фермента (химозина) до проведения кислотной активации в качестве сравнения было проведено исследование молокосвертывающей способности тех же образцов КЖ, взятых непосредственно после культивирования (без подкисления).
Для аутокаталитической активации прохимозина в химозин к 0.15 мл КЖ в пластиковой пробирке на 1.5 мл, содержащей рекомбинантный фермент, вносят 0.015 мл 1М HCl, постоянно перемешивания. рН смеси при этом составляет 2.0. Инкубируют смесь при 25°С в течение 2 ч. По истечении времени инкубации доводят рН образца до 6.0, для этого к смеси добавляют 0.0066 мл раствора 2 M Tris (рН 12.0), перемешивают и выдерживают при 25°С в течение 1 - 2 ч. В активированных таким образом образцах определяют молокосвертывающую активность. Коэффициент разведения КЖ составляет 1.144.
Для определения используют сухой молочный субстрат Nonfat dried milk powder (PanReac, AppliChem, Barcelone, Испания). В день измерения готовят 11% раствор субстрата в растворе 0.01М CaCl2, рН раствора субстрата 6.5.
Активность исследуемых образцов определяют относительно контрольного образца сычужного фермента Clerici 9604, арт. 2729, активность: 65000 УЕ/г (Caglificio Clerici Spa, Италия). Это жидкий препарат, 1 мл которого весит 1,08±0.005 г. Готовят разведения стандарта в 0,1 M ацетатном буфере, рН 5.5 с активностями от 50 УЕ/мл до 210 УЕ/мл с шагом 20 УЕ/мл.
Определение молокосвертывающей активности проводят при температуре 32°С в твердотельном термостате Гном (ДНК технология, Россия).
В пробирки на 1,5 мл добавляют 1 мл субстрата и выдерживают при 32°С в течение 10 мин. К субстрату добавляют 0,1 мл анализируемого образца или стандарта, быстро перемешивают и ставят в твердотельный термостат Гном при 32°С, одновременно включая секундомер. При появлении первых признаков коагуляции (появление хлопьев), которую фиксируют путем периодического переворачивания пробирок, регистрируют время свертывания по секундомеру. То же самое проводят с использованием разбавленных образцов стандарта с известной активностью. В качестве негативных контролей к субстрату добавляют буфер вместо фермента или КЖ штамма реципиента.
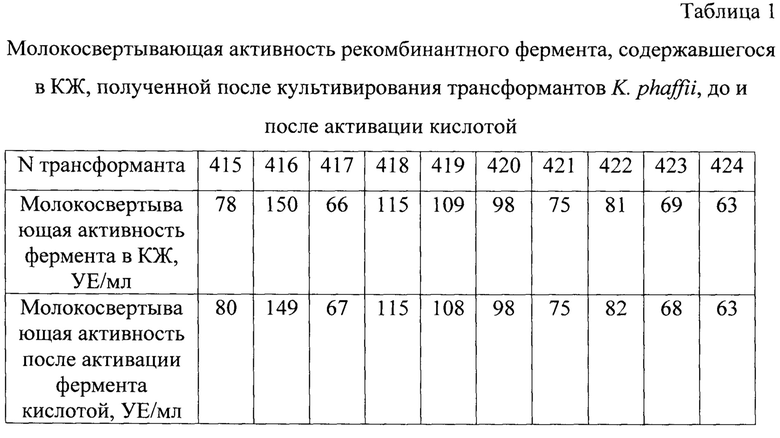
В табл. 1 приведены результаты тестирования молокосвертывающей активности рекомбинантного фермента, содержавшегося в КЖ, до подкисления и после кислотной активации (приведены средние значения трех независимых измерений). Полученные результаты показывают, что молокосвертывающая активность рекомбинантного фермента в образцах КЖ одинакова, до и после проведения кислотной активации. Это указывает, что рекомбинантный фермент изначально, до кислотной активации содержится в КЖ в активной форме, т.е. в виде зрелого химозина.
Среди проверенных трансформантов отбирают наиболее продуктивный трансформант N416, который при культивировании в пробирках продуцирует рекомбинантный химозин с активностью 150 УЕ/мл КЖ.
Результат коагуляции субстрата рекомбинантным химозином альпака V. pacos показан на фиг. 2.
Отобранный трансформант K. phaffii N416 депонируют в Биоресурсном центре Всероссийская Коллекция Промышленных Микроорганизмов (БРЦ ВКПМ) НИЦ «Курчатовский институт» (117545 Москва, 1-ый Дорожный проезд, д. 1) как штамм Komagataella phaffii N416 ВКПМ Y-5079.
Штамм K. phaffii N416 ВКПМ Y-5079 характеризуется следующими признаками:
Культурально-морфологические характеристики заявляемого штамма:
При культивировании при температуре 28°С в течение 48 часов на агаризованной среде YP (мас. %: дрожжевой экстракт - 1, пептон - 2, агар - 2, вода - остальное) с добавлением глюкозы (2 мас. %) клетки имеют овальную форму, 3 -4 мкм в диаметре. Клетки почкуются, при этом почкование истинное, многостороннее. Истинного мицелия не образуют.
Споруляция происходит при инкубации культуры на агаризованной среде следующего состава (мас. %): хлорид калия - 1.0, ацетат натрия - 0.5, глюкоза - 1.0, агар - 2.0, вода - остальное. Аски имеют тетраэдрическую форму, включают 4 аскоспоры.
На агаризованной среде YP с добавлением глюкозы (2 мас. %) колонии светло-бежевого цвета с ровным краем, матовой поверхностью, линзовидным профилем и пастообразной консистенцией.
При росте в жидкой среде YP (мас. %: дрожжевой экстракт - 1, пептон -2, вода - остальное) с добавлением глюкозы (2 мас. %), при 28°С в течение 24 ч культивирования - жидкость мутная, осадок белый, коагуляции не наблюдается, пристеночных пленок не образует.
Физиолого-биохимические признаки:
Штамм способен к росту как в аэробных, так и в анаэробных условиях.
В качестве единственного источника углерода способен использовать метанол, этанол, глюкозу, глицерин, лактат, сукцинат, не способен ассимилировать мальтозу, сахарозу, ацетат, крахмал, лактозу.
При культивировании в присутствии метанола штамм способен синтезировать рекомбинантный химозин - коагулянт молока.
Пример 3. Культивирование штамма K. phaffii N416 в 3 л ферментере
Из суточной биомассы штамма K. phaffii N416 с чашки Петри со средой YP с глюкозой (2 мас. %) готовят суспензию клеток в стерильной дистиллированной воде для определения оптической плотности (OD600). В качалочные колбы объемом 750 мл с рабочим объемом ПО мл жидкой посевной среды YP с глюкозой (2 мас. %) вносят приготовленную суспензию клеток до получения OD600, равной 0.2 единиц. Колбы инкубируют при температуре 30°С на качалке при 220 об/мин. до достижения культурой оптической плотности равной 16.9.
Основную ферментацию проводят в ферментере КФ-103 (ООО-фирма «Проинтех») объемом 3 л, содержащем 1 л среды следующего состава (табл. 2).

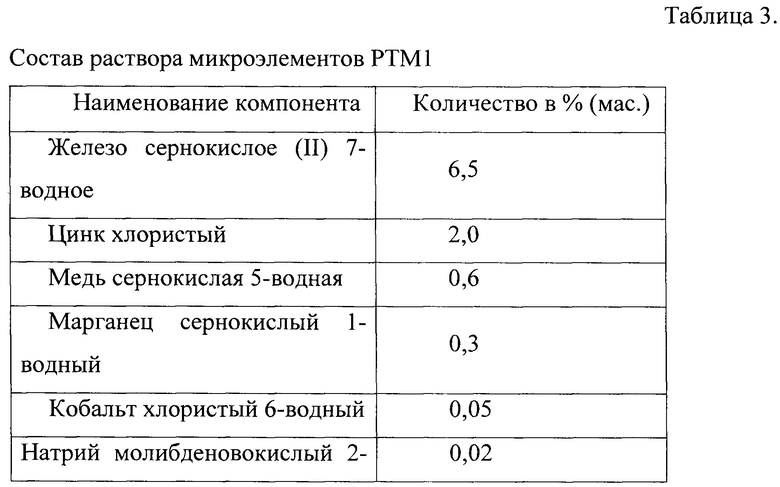
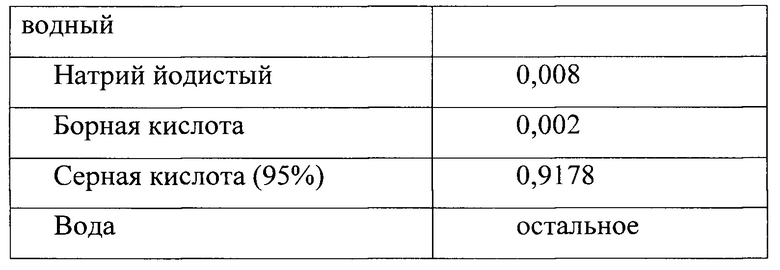
Раствор микроэлементов РТМ1 имеет состав (табл. 3).
Условия ферментации: объемная доля посевного материала 10%; температура 30°С на этапе роста, температура 25°С на этапе биосинтеза; начальное перемешивание: 500 об/мин., начальная аэрация: 1.0 л воздуха на каждый л начальной среды в мин. Уровень рН поддерживают на значении 4.6 путем титрования 25%-ным водным раствором аммиака, а значение pO2 - на уровне 25.0% (от насыщения среды воздухом) путем использования каскадной регулировки скорости вращения мешалки.
В рабочий ферментер вносят культуру, выращенную на качалке в колбах до стартового значения оптической плотности, равной 2.3. Наращивание биомассы осуществляют в два этапа. На первом этапе рост биомассы производят на глюкозе, введенной в ферментер с начальной средой (25 часов). На втором - наращивание биомассы обеспечивают путем подачи в ферментер глюкозной подпитки состава (мас. %): глюкоза - 28.6, раствор микроэлементов РТМ1 - 1.1 (об./об.), биотин - 0.0004, вода - остальное. На момент окончания глюкозной подпитки концентрация сырой биомассы составляет 127 г/л.
Далее в ферментер со скоростью 1.2 г/ч с постепенным увеличением до 7.2 г/ч подают раствор метанольной подпитки состава (мас. %): метанол - 95.9, раствор микроэлементов РТМ1 - 1.4 об./об., биотин - 0.0004, вода - остальное. Индукция метанолом продолжается в течение 134 ч.
В процессе культивирования заявляемого штамма периодически отбирают образцы КЖ для определения молокосвертывающей активности. Клетки осаждают центрифугированием, а супернатант (КЖ) используют для определения молокосвертывающей активности.
Аутокаталитическую активацию рекомбинантного фермента in vitro не проводят.
Молокосвертывающую активность определяют, как описано в примере 2, но в качестве эталонных стандартов сычужных ферментов используют Clerici 9604, арт. 2729, активность 65000 УЕ/г, (Caglificio Clerici Spa, Италия) и Naturen Extra, активность 220 IMCU/г, арт. 3954 (Chr. Hansen, Дания). Молокосвертывающую активность, соответственно, выражают в условных единицах на 1 мл препарата (УЕ/мл), если в качестве стандарта сычужного фермента используют препарат Clerici 9604, и в международных молокосвертывающих единицах (IMCU/мл), если в качестве стандарта сычужного фермента используют препарат Naturen Extra.
Соотношение «субстрат: фермент» при проведении реакции составляет 50:1.
Результаты приведены в табл. 4.
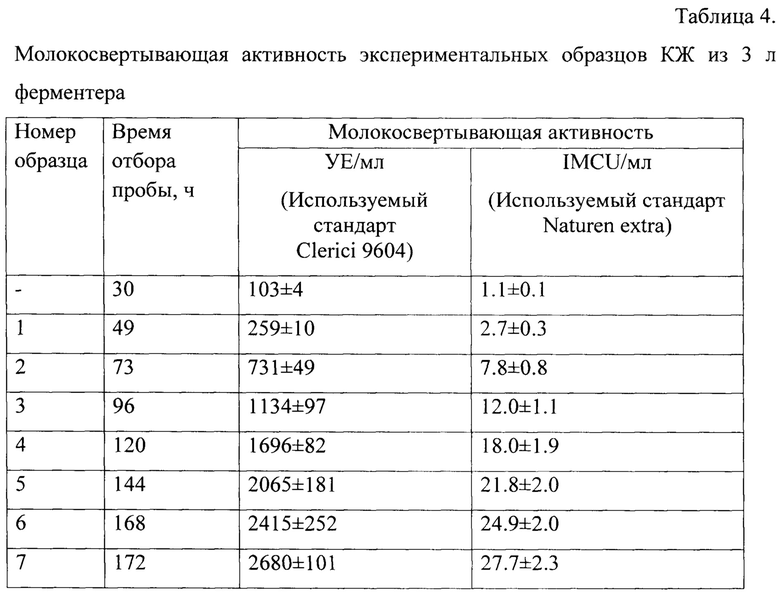
Приведенные результаты показывают, что молокосвертывающая активность полученного штамма составляет 2680±101 УЕ/мл КЖ (относительно стандарта Clerici 9604) или 27.7±2.3 IMCU/мл КЖ (относительно стандарта Naturen extra) через 172 ч культивирования.
Пример 4. Характеристика рекомбинантного химозина
Молекулярный вес химозина определяют путем электрофоретического разделения белков из образцов КЖ в 12% полиакриламидном геле в денатурирующих условиях (SDS-PAGE) в камере для вертикального электрофореза Mini-PROTEAN Tetra Bio-Rad (Bio-Rad США). Для визуализации белков используют Кумасси бриллиантовый синий R250. На фиг. 3 приведена электрофореграмма белков, содержащихся в образцах КЖ, отобранных в примере 3 (номер дорожки соответствует номеру образца), M -маркер молекулярного веса (кДа)
Установлено, что рекомбинантный химозин, синтезированный дрожжами K. phaffii, имеет молекулярный вес 55 кДа.
Для исследования биохимических свойств рекомбинантного химозина альпака из клеток K. phaffii используют образцы КЖ, полученные при культивировании штамма K. phaffii N416 в 3 л ферментере, отобранные через 96 ч и 120 ч культивирования. В качестве субстрата используют сухое обезжиренное молоко Nonfat dried milk powder (PanReac, AppliChem, Barcelone, Испания). Прогревание образцов и проведение реакций фермента с субстратом проводят в твердотельном термостате Гном. Все измерения проводятся в трех повторностях.
рН-профилъ активности рекомбинантного химозина
Готовят 11% раствор молока в 0.01 M растворе CaCl2 (рН 6.0). Для получения субстратов с рН 5.5 и рН 5.0 используют 1М раствор HCl. Для получения субстратов с рН 6.5, рН 7.0 и рН 7.5 используют 10N NaOH. Получают линейку субстратов с рН 5.0, 5.5, 6.0, 6.5, 7.0 и 7.5 и определяют в них продолжительность образования сгустка после внесения раствора исследуемого рекомбинантного химозина в количестве 0.02 мл к 1 мл раствора молока при температуре 32°С. За 100% принимают максимальное значение молокосвертывающей активности, полученное для образцов при проведении реакций в диапазоне рН от 5.0 до 7.5.
Строят график зависимости молокосвертывающей активности (%) от рН субстрата (фиг. 4).
Полученные результаты показывают, что рекомбинантный химозин альпака из дрожжей K. phaffii наиболее активен при рН 5.0.
Температурный профиль активности рекомбинантного химозина
Готовят 11% раствор молока в дистиллированной воде (рН 6.0). Перед проведением реакции пробирки на 1.5 мл с субстратом в количестве 1 мл выдерживают в течение 10 мин. при температуре реакции. К субстрату добавляют образец фермента в количестве 0.02 мл и определяют продолжительность образования сгустка при температурах от 35°С до 65°С с шагом 5°С. За 100% принимают максимальное значение молокосвертывающей активности, полученное для образцов при проведении реакций в диапазоне температур 35-65°С.
Строят график зависимости молокосвертывающей активности (%) от температуры реакции (фиг. 5).
Полученные результаты показывают, что рекомбинантный химозин альпака из клеток K. phaffii имеет оптимум температуры 55°С.
Термостабильность
Исследуемые образцы КЖ объемом 0.1 мл прогревают в диапазоне температур 30-65°С в течение 30 мин., быстро охлаждают до комнатной температуры и определяют в них остаточную молокосвертывающую активность.
В качестве субстрата используют 11% раствор молока в дистиллированной воде (рН 6.0). Перед проведением реакции пробирки на 1.5 мл с субстратом в количестве 1 мл выдерживают в течение 10 мин. при 32°С. К субстрату добавляют образец фермента в количестве 0.02 мл и определяют продолжительность образования сгустка.
Строят график зависимости остаточной молокосвертывающей активности (%) от температуры прогревания фермента (термостабильность) (фиг. 6).
Полученные результаты показывают, что в диапазоне температур прогревания 30°С - 60°С остаточная молокосвертывающая активность рекомбинантного химозина альпака из дрожжей K. phaffii практически не изменяется. Термоинактивация рекомбинантного химозина альпака начинается с 65°С, а при 70°С фермент теряет 70% активности, т.е. рекомбинантный химозин альпака из клеток K. phaffii имеет более высокую термостабильность, чем эталонные химозины коровы и верблюда.
Зависимость молокосвертывающей активности от концентрации хлорида кальция в растворе молока
Готовят субстраты 11% раствора молока с концентрацией CaCl2 в диапазоне 0-10 мМ с шагом 1 мМ.
Реакцию проводят при 32°С. К 1 мл прогретого при температуре реакции в течение 10 мин. субстрата вносят 0.02 мл образца с рекомбинантным ферментом и определяют продолжительность образования сгустка. За 100% принимают максимальное из полученных значений молокосвертывающей активности.
Строят график зависимости молокосвертывающей активности (МА, %) от концентрации хлорида кальция (мМ) (фиг. 7).
Полученные результаты показывают, что молокосвертывающая активность рекомбинантного химозина альпака из клеток K. phaffii увеличивается с повышением концентрации CaCl2 от 0 до 10 мМ. С увеличением концентрации вносимого CaCl2 до 5 мМ молокосвертывающая активность рекомбинантного химозина альпака из клеток K. phaffii возрастает на 55%, т.е. сопоставима с коагуляционной активностью коммерческого препарата рекомбинантного химозина коровы из клеток Aspergillus niger [Прикладная биохимия и микробиология, 2018, 54 (6), 585 - 593] и, следовательно, полученный рекомбинантный химозин отвечает условиям, предъявляемым к молокосвертывающему ферменту.
Таким образом, полученный штамм K. phaffii N416 ВКПМ Y-5079 продуцирует химозин альпака Vicugna pacos, молокосвертывающая активность которого составляет 2680±101 УЕ/мл КЖ (относительно стандарта Clerici 9604) или 27.7±2.3 IMCU/мл КЖ (относительно стандарта Naturen extra) через 172 ч культивирования.
Продуцируемый химозин по своим свойствам, таким как оптимальные значения рН и температуры, и коагуляционная активность полностью соответствует требованиям сыроделия.
Штамм-продуцент не содержит маркеров устойчивости к антибиотикам.
Рекомбинантный фермент секретируется штаммом-продуцентом в КЖ и содержится в ней в форме активного химозина, т.е. активация целевого фермента не требуется. Поскольку компоненты КЖ не содержат других коагулянтов, кроме рекомбинантного белка, то выделение и очистка целевого белка также не требуется, что сокращает время получения и себестоимость ферментного препарата.
Таким образом, заявляемый штамм является перспективным продуцентом химозина.
Разработка технологии получения отечественного рекомбинантного химозина для сыроделия важный шаг на пути решения проблемы импортозамещения и обеспечения экономической безопасности РФ.
--->
<?xml version="1.0" encoding="UTF-8"?>
<!DOCTYPE ST26SequenceListing PUBLIC "-//WIPO//DTD Sequence Listing
1.3//EN" "ST26SequenceListing_V1_3.dtd">
<ST26SequenceListing originalFreeTextLanguageCode="ru"
nonEnglishFreeTextLanguageCode="ru" dtdVersion="V1_3"
fileName="Трансформант Komagataella phaffii – продуцент
рекомбинантного химозина в активной форме.xml" softwareName="WIPO
Sequence" softwareVersion="2.1.2" productionDate="2022-10-17">
<ApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText></ApplicationNumberText>
<FilingDate></FilingDate>
</ApplicationIdentification>
<ApplicantFileReference>10-1.2022</ApplicantFileReference>
<ApplicantName languageCode="ru">Национальный исследовательский
центр "Курчатовский институт"</ApplicantName>
<ApplicantNameLatin>National Research Centre "Kurchatov
Institute"</ApplicantNameLatin>
<InventionTitle languageCode="ru">Трансформант Komagataella phaffii
– продуцент рекомбинантного химозина в активной
форме</InventionTitle>
<SequenceTotalQuantity>1</SequenceTotalQuantity>
<SequenceData sequenceIDNumber="1">
<INSDSeq>
<INSDSeq_length>1101</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..1101</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q1">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>tctggtattaccagaatccctttgcacaaaggaaagactttgagaaaag
ctttgaaggagcatggacttttggaggactttttgcagagacaacagtatgctgtttcttctaagtactc
ctctttgggtaaggtggctagggaaccattgacctcttacttggattctcagtactttggtaagatctac
attggtactccacctcaggagttcactgttgtttttgacactggatcttctgacttgtgggtgccatcta
tctactgcagatctaacgtttgcaaaaaccaccacagatttgaccctagaaagtcttccactttcagaaa
cttgggtaagcctttgtctattcattacggaactggttctatggagggttttttgggatacgacactgtt
acggtttctaacattgttgaccctaaccaaactgttggattgtctactgagcaacctggagaggttttca
cctactccgaatttgacggtatcctggggctggcctacccctctttggcctccgaatactctgttccagt
ttttgacaatatgatggacagacacttggttgctcaagacttgttctctgtttacatggacagaaacggt
caaggatctatgttgactttgggtgctattgacccatcttactacaccggatctttgcactgggttccag
ttactgttcaacaatactggcaattcaccgtggactctgtcactatcaacggtgttgctgttgcctgtgt
tggtggatgtcaggctattttggacactggtacctctgttttgtttggaccatcttccgacattcttaaa
attcagaaggctattggtgctactgagaacagatatggagagtttgacgttaactgtggatctttgagat
ctatgcctactgttgtcttcgagatcaatggtagagactacccattgtccccatctgcctacacatctaa
ggaccaaggtttctgcacttctggatttcaaggtgacaacaattccgagctatggatccttggtgatgtc
ttcatcagagagtattactctgtctttgacagagctaacaatcgtgtgggtcttgctaaggccatctgat
aa</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
</ST26SequenceListing>
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Трансформант Ogataea haglerorum - продуцент рекомбинантного химозина в активной форме | 2022 |
|
RU2815882C1 |
| Трансформант Komagataella phaffii, содержащий ген HAC1, продуцент рекомбинантного химозина Vicugna pacos в активной форме | 2023 |
|
RU2828277C1 |
| Рекомбинантная плазмида pET32-Trex Vic, обеспечивающая синтез химерного белка прохимозина Vicugna pacos, и штамм Escherichia coli BL21(DE3)pLysE pET32-Trx Vic-продуцент химерного белка прохимозина Vicugna pacos | 2019 |
|
RU2729403C1 |
| Способ микробиологической продукции химозина быка с использованием рекомбинантного штамма Pichia pastoris, содержащего синтетический ген варианта химозина с коэкспрессией фактора HAC1 | 2020 |
|
RU2769175C1 |
| Рекомбинатная плазмида pET21a-ProChym, обеспечивающая синтез химерного белка прохимозина В Bos taurus, и штамм Escherichia coli BL21(DE3)pLysE pET21a-ProChym - продуцент химерного белка прохимозина В Bos Taurus | 2017 |
|
RU2670071C1 |
| Трансформант Ogataea haglerorum - продуцент термостабильной α-амилазы | 2022 |
|
RU2795707C1 |
| Способ автокаталитической активации прохимозина быка при культивировании Pichia pastoris в ферментере | 2021 |
|
RU2808458C2 |
| Штамм дрожжей Komagataella phaffii с инактивированным геном HIS4 - реципиент для конструирования безмаркерных штаммов-продуцентов гетерологичных белков | 2022 |
|
RU2787584C1 |
| Способ микробиологического синтеза прохимозина быка с использованием рекомбинантного штамма Pichia pastoris, содержащего синтетический ген варианта препрохимозина с модифицированной сигнальной последовательностью секреции | 2020 |
|
RU2779307C2 |
| Рекомбинантный штамм дрожжей Ogataea haglerorum, продуцирующий бета-маннаназу Bacillus subtilis | 2020 |
|
RU2747782C1 |

Изобретение относится к области биотехнологии. Предложен трансформант дрожжей Komagataella phaffii, продуцирующий химозин альпака Vicugna pacos в активной форме и содержащий в хромосомной ДНК оптимизированный синтетический ген прохимозина альпака Vicugna pacos, нуклеотидная последовательность которого приведена в перечне последовательностей под номером SEQ ID NO: 1. Также предложен штамм K. phaffii N416 ВКПМ Y-5079 - продуцент химозина альпака Vicugna pacos в активной форме. Изобретение обеспечивает расширение арсенала дрожжевых рекомбинантных микроорганизмов, продуцирующих химозин в активной форме. 2 н.п. ф-лы, 7 ил., 4 табл., 4 пр.
1. Трансформант дрожжей Komagataella phaffii - продуцент химозина альпака Vicugna pacos в активной форме, содержащий в хромосомной ДНК оптимизированный синтетический ген прохимозина альпака Vicugna pacos, нуклеотидная последовательность которого приведена в перечне последовательностей под номером SEQ ID NO: 1.
2. Штамм K. phaffii N416 ВКПМ Y-5079 - продуцент химозина альпака Vicugna pacos в активной форме.
Авторы
Даты
2023-10-17—Публикация
2022-12-22—Подача